I. Область применения
Изобретение относится к области фармацевтики и касается создания фармацевтической композиции на основе фосфотидилхолина, метионина, витамина Е и селенита натрия - «Гепарс», обладающей гепатопротекторной активностью и нормализующей обменные процессы, и может быть использована при изготовлении лекарственного средства в виде растворов для инъекций и перорального применения для лечения и профилактики заболеваний печени.
По статистическим данным последних лет наибольшую долю от всех патологий домашних животных составляют заболевания незаразной этиологии. Это объясняется негативным воздействием промышленных и природных токсинов, лекарственных средств. Также следует отметить роль в развитии незаразной патологии неудовлетворительных условий содержания и несбалансированности рациона по питательным веществам, макро-, микроэлементам и витаминам. Анализируя работы, проводимые в данном направлении, можно отметить, что под влиянием вышеперечисленных факторов поражается, прежде всего, гепатобилиарная система.
Недостатками многих новых эффективных препаратов является плохая растворимость в воде, малое время циркуляции, низкая биодоступность и общая высокая токсичность. Одним из решений этих проблем является использование в качестве носителей действующих веществ в препаратах - мицелл. При этом к подобным структурам предъявляются жесткие требования, такие как низкая токсичность, хорошая емкость по отношению к действующему веществу, способность к направленному транспорту, контролируемое высвобождение в зоне мишени, химическая и физическая стабильность при хранении, а также приемлемая цена, сопоставимая с аналогичными препаратами.
II. Предшествующий уровень техники
На основе фосфолипидов, и в частности, фосфотидилхолина был создан ряд гепатопротекторных препаратов. Так в известных препаратах, указанного действия: «Эссенциале форте Н» (Регистрационный номер: П N011496/01) и «Фосфоглив» (Регистрационный номер: Р N002528/01) основным действующим началом служит фосфатидилхолин.
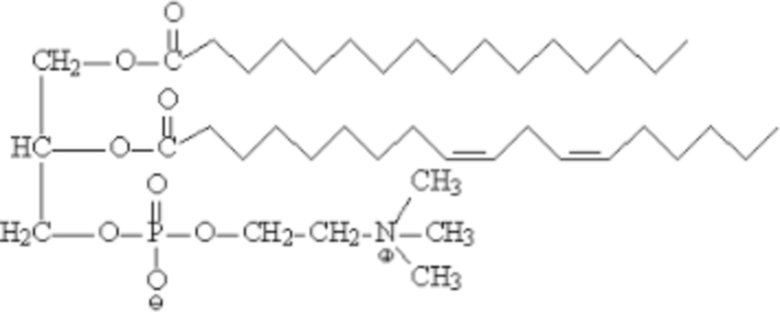
□ - фосфатидилхолин
Существуют и другие композиции гепатопротекторного действия на основе: биомассы лактобактерий Lactobacillus acidophilus и продуктов их метаболизма (RU 2290941); эссенциальных фосфолипидов и пребиотиков (RU 2318538); 2,6-диметил-3- оксипиридина адамантилкарбоксилата (RU 23325158); многокомпонентных систем из природных соединений (RU 2491062); хлоргидрата N-изопропиламида-2- бензиламиноэтансульфокислоты (RU 2614691); “Силимарин» («Силибинин» инструкция по медицинскому применению - РУ № ЛСР-002848/09 от 2009-04-09) - природная композиция, содержащаяся в плодах расторопши пятнистой и состоящая из семи флавоноидов и одного флаволигнана: силибин А, силибин В, изосилибин А, изосилибин В, силикристин, изосиликристин, силидианин, таксифолин.
По механизму действия гепатопротекторы можно разделить на несколько основных групп. Мы остановимся на трех.
Первую группу представляют антиоксиданты - растительные полифенолы, α- токоферол, ретинол, цистеин и других.
Вторую группу представляют средства, осуществляющие репарацию мембран гепатоцитов - препараты фосфолипидов - эссенциале, фосфоглив.
Третью группу представляют стимуляторы регенерации паренхимы печени - метионин, уридин, цитидин, оротовая кислота.
Следует отметить, что активность витамина Е, представителя первой группы гепатопротекторов, в значительной степени повышается в присутствии препаратов селена, которые опосредованно тоже являются антиоксидантами из-за активирования глутатионпероксидазы и ряда других ферментов (Augustyniak Agnieszka, Bartosz Grzegorz, Cipak Ana, Duburs Gunars, Horakov L'Ubica, Luczaj Wojciech, Majekova Magdalena, Odysseos Andreani D., Rackova Lucia, Skrzydlewska Elzbieta, Stefek Milan, Strosov Miriam, Tirzitis Gunars, Venskutonis Petras Rimantas, Viskupicova Jana, Vraka Panagiota S., Zarkovi Neven. Natural and synthetic antioxidants: An updated overview. // Free Radical Research. 2010, Vol. 44, Issue 10, P. 1216-1262.). Эффективность комплексного использования витамина Е и селенсодержащих препаратов была установлена для повышения устойчивости к оксидативному стрессу (Erkekoglu Pinar, Giray Belma Kocer, Kizilgtin Murat, Rachidi Walid, Hininger-Favier Isabelle, Roussel Anne-Marie, Favier Alain, and Hincal Filiz. Di(2-ethylhexyl)phthalate-induced renal oxidative stress in rats and protective e ect of selenium. // Toxicology Mechanisms and Methods, 2012; vol. 22, Issue 6: P. 415- 423.), более высокой выработки тироидных гормонов (Zhao Na; Sang Zhong-na; Tan Long; Zhang Jin-xiang; Yao Zhai-xiao; Zhang Wan-qi. Effects of selenium on thyroid function and deiodinase activities in EAT rats. // Huanjing Yu Jiankang Zazhi, vol. 27, Issue 2, P.108-110, C3 (Chinese) 2010 Huanjing Yu Jiankang Zazhi Bianjibu.), лечения сахарного диабета (Sokmen B.B., Basaraner H. and Yanardag R. Combined effects of treatment with vitamin C, vitamin E and selenium on the skin of diabetic rats. // Human and Experimental Toxicology vol. 32, Issue 4, P. 379-384.), и др.
Известны изобретения, в которых соединения селена запатентованы в качестве гепатопротекторного средства, например: «Антиоксидантное средство с гепатопротекторным эффектом на основе наноструктурированного селена и способы его получения и применения» (RU 2557992).
Известен патент, где комбинировались вещества флавоноидной природы («Силимарин») и селен (RU 2645092).
Наиболее близким по технической сути является фармацевтическая композиция для лечения и/или профилактики заболеваний печени (патент РФ №2725622, МГЖ А61К31/685, А61К31/704, А61К31/355, А61Р1/16, опубл. 03.06.2020 г., бюл. №19, содержащая фосфолипиды, глицирризиновую кислоту или глицирризинат натрия, витамин Е и воду при следующем соотношении компонентов, мг на 1 мл:
Кроме того, композиция в качестве фосфолипидов может содержать фосфатидилхолин, а в качестве витамина Е - альфа-токоферол или альфа-токоферола ацетат.
Однако, неизвестны препараты, которые совмещают в себе компоненты из всех описанных групп.
Для получения водорастворимой комбинации биологически-активных веществ было решено использовать процесс мицеллообразования - самопроизвольной ассоциации молекул поверхностно-активного вещества (ПАВ) в растворе. В результате в системе ПАВ - растворитель возникают мицеллы - ассоциаты характерного строения, состоящие из десятков дифильных молекул, имеющих длинноцепочечные гидрофобные радикалы и полярные гидрофильные группы. Образующиеся при мицеллообразовании мицеллы полидисперсные и характеризуются распределением по размерам.
Поэтому целью предлагаемого изобретения является водорастворимая фармацевтическая комбинация, состоящая из: фосфатидилхолина, витамина Е, метионина и селенита натрия, которая характеризуется низкой токсичностью, хорошей емкостью по отношению к действующему веществу, способностью к направленному транспорту, контролируемым высвобождением в зоне мишени, химической и физической стабильностью при хранении, приемлемой ценой, сопоставимой с аналогичными препаратами.
III. Сущность изобретения
Мицеллообразование характерно для различных видов ПАВ. В нашем случае ПАВ - это ТВИН-80. Мицеллообразование происходит в определенном для каждого ПАВ интервале температур, важнейшими характеристиками которого являются точка Крафта и точка помутнения. Точка Крафта - это нижний температурный предел мицеллообразования ПАВ (обычно она равна 283-293 К; при температурах ниже точки Крафта растворимость ПАВ недостаточна для образования мицелл). Точка помутнения - верхний температурный предел мицеллообразования ПАВ, обычные ее значения 323-333 К (при более высоких температурах система ПАВ - растворитель теряет устойчивость и расслаивается на две макрофазы. Мицеллы при высоких температурах (388-503 К) распадаются).
Для успешного создания композиции нами был выбран узкий диапазон температур, подходящий для основных компонентов. Он составил от 325-329 К (52-65°С). Данный интервал позволяет сохранить стабильность мицеллярной формы и обеспечить дальнейшую рентабельность рецептуры.
Получение мицеллярных растворов осуществляли в 4 стадии. На первой стадии в органическом растворителе (использовался фармакопейный растворитель 2- пирролидон) при температуре 60 градусов растворяли фосфотидилхолин и витамин Е, далее в данный раствор добавляли соответствующее поверхностно активное вещество и потом по каплям при постоянной температуре прикапывали раствор воды с метионином, селенитом натрия и бензиловым спиртом.
В таблице 1 приведены составы композиций, для подбора оптимальных действующих веществ, органических обладающие устойчивостью.
После получения композиций нами были испытаны различные условия хранения.
От качества и чистоты исходных фармацевтических субстанций в большой степени зависит качество готового препарата, следовательно, исключительно важно осуществлять надлежащее описание характеристик и спецификаций исходного материала. Обработка при высоких температурах или даже стерилизация паром готового препарата (по возможности) могут повлиять на состав прототипа. Необходимо контролировать различные условия содержания и хранения. Исходные материалы должны отвечать фармакопейным требованиям, если на них есть фармакопейные статьи, и, зачастую, могут требоваться более детальные спецификации отдельных параметров для подтверждения соответствия оригинальному лекарственному средству. При использовании компонентов из разных источников потребуется дополнительное описание характеристик и исследование сопоставимости. Прототипы были испытаны на протяжении 6 месяцев при температуре 37°С. При этом не наблюдалось выпадение осадка и расслоение раствора. Также в ходе исследований было установлено отсутствие отклонения за рамками статистической погрешности концентраций фосфотидилхолина, витамина Е, селенита натрия и метионина от исходных значений.
Наиболее важным показателем любого препарата является концентрация действующих веществ. Однако, для успешного применения его в повседневной практике, он должен обладать относительно низкой вязкостью и стабильностью в широком интервале температур. Поэтому нами были проведены исследования относительной вязкости наиболее перспективных рецептур. И установлено, что ОСП 7; 11 и 12 обладают относительной вязкостью 1,9; 2,4 и 1,3 соответственно, что позволяет их легко использовать в повседневной ветеринарной практике. Кроме этого нами были проведены исследования вязкости при 10 и 40°С и обнаружено изменение менее 35% данного показателя, при этом установлено что при 0 и 50°С данные растворы не замерзают и не расслаиваются. Проведены работы по определению водородного показателя, как самих рецептур, так и их разбавленных в отношении 1 к 100 дистиллированной водой растворов и установлено, что pH находится в интервале от 5 до 6,6, что позволит их успешно использовать.
Таким образом, получены мицеллярные формы композиции, состоящей из: витамина Е 0,2%, метионина 0,4%, селенита натрия 0,011%; и фосфотидилхолина в интервале от 1,2 до 4,75% в фармакопейном растворителе 2-пирролдидоне в интервале от 21 до 79% с применением поверхностно активного вещества ТВИН- 80 в интервале от 4 до 8% возможно создание стабильных мицеллярных форм. Установлено, что вязкость и водородный показатель позволяют применять данные рецептуры при испытаниях на лабораторных животных, и, в перспективе, на целевых животных.
Для проведения исследований на модельном гепатите нами была выбрана рецептура ОСП 7 - далее «Гепарс».
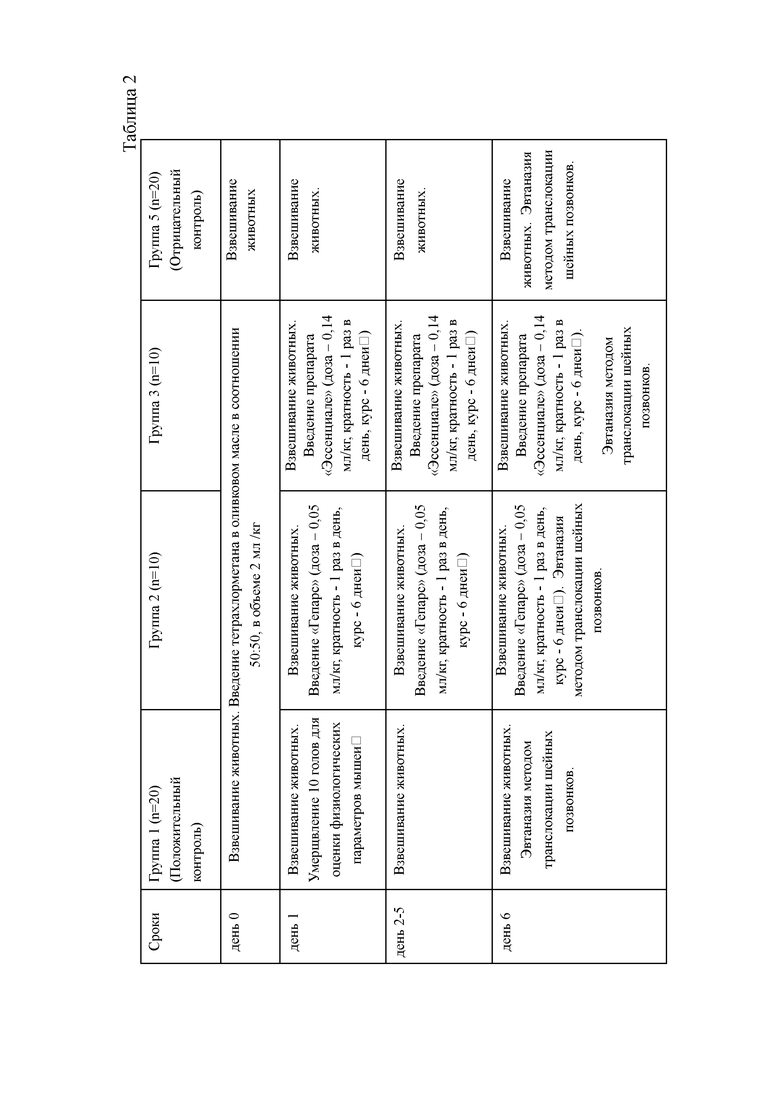
Для определения гепатопротекторных свойств препарата «Гепарс» при индуцированном тетрахлорметаном экспериментальном гепатите были сформированы 4 группы белых нелинейных мышей. Схема опыта по изучению гепатопротекторных свойств препарата «Гепарс» при индуцированном тетрахлорметаном экспериментальном гепатите у мышей представлена в таблице 2.
Первой группе из 20 голов внутрибрюшинно вводился 50% р-р тетрахлорметана в оливковом масле в объеме 1,22 мл/кг живой массы. Лечение животных этой группы не проводили. Для подтверждения гепатотоксического действия тетрахлорметана проводили эвтаназию 10 голов через сутки после инъекции.
Второй группе из 10 голов после введения тетрахлорметана проводилась терапия препаратом «Гепарс» ежедневно со второго по шестой день.
Третьей из 10 голов после введения тетрахлорметана проводилась терапия гепатита лекарственным препаратом сравнения «Эссенциале», ежедневно со второго по шестой день.
Объем тетрахлорметана для провокации гепатита вводился в 50% летальной дозе.
Четвертой группе (контрольной) - инъекции не проводились.
Эвтаназию всех выживших животных осуществляли по достижении 50% гибели животных в первой опытной группе, методом транслокации шейных позвонков под газовым наркозом (изофлуран), с последующим взятием биологических материалов.
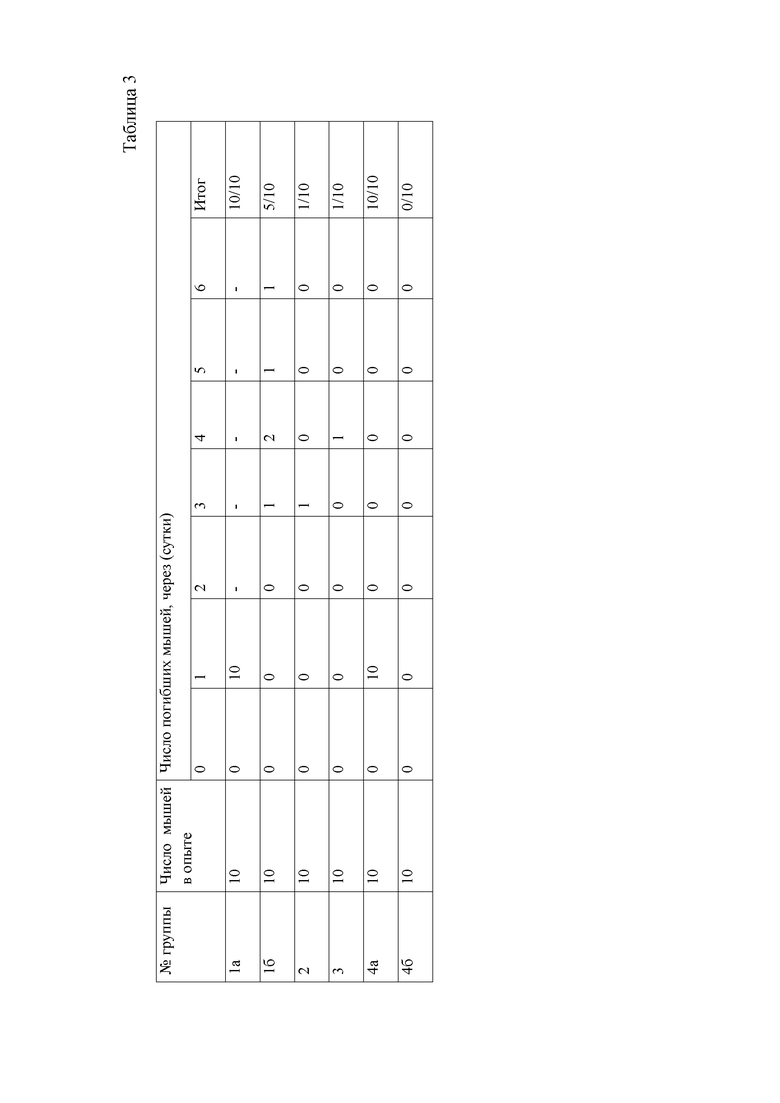
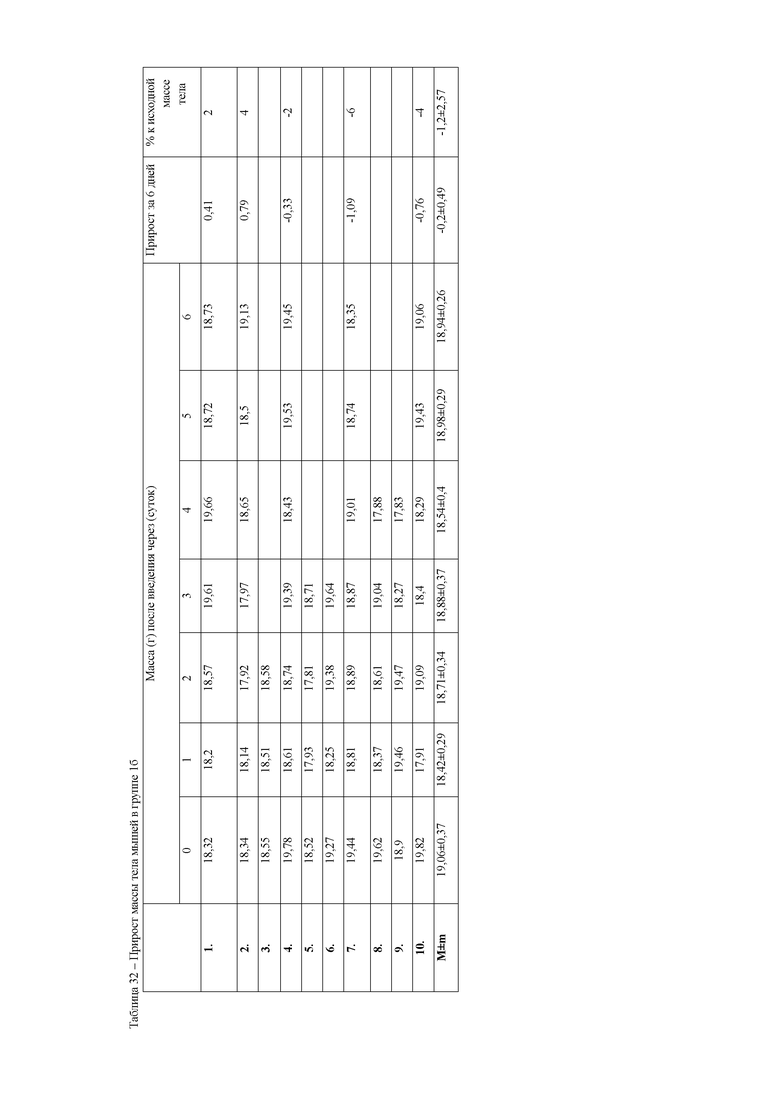
В ходе изучения гепатопротекторных свойств на модели острого токсического гепатита смертность лабораторных животных за 7 дней эксперимента, составила (таблица 3) в 16 группе 50%, во второй и третьей - 10%, в 46 группе (фоновой) признаков интоксикации и гибели животных не отмечалось.
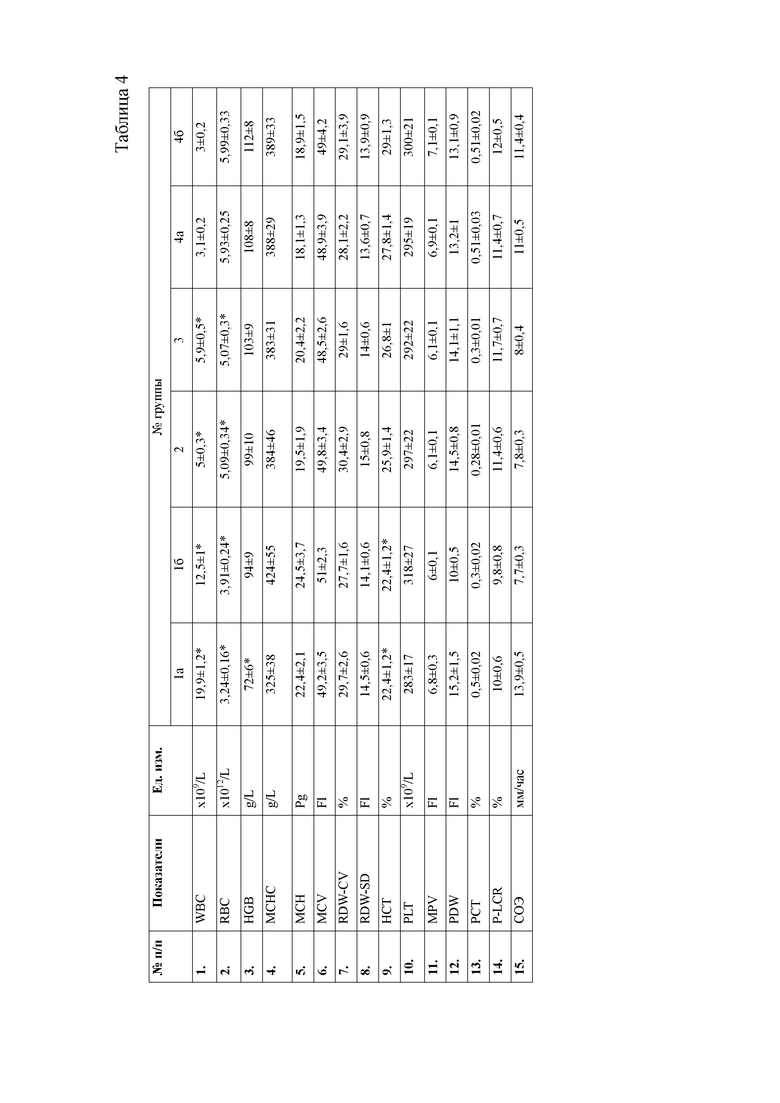
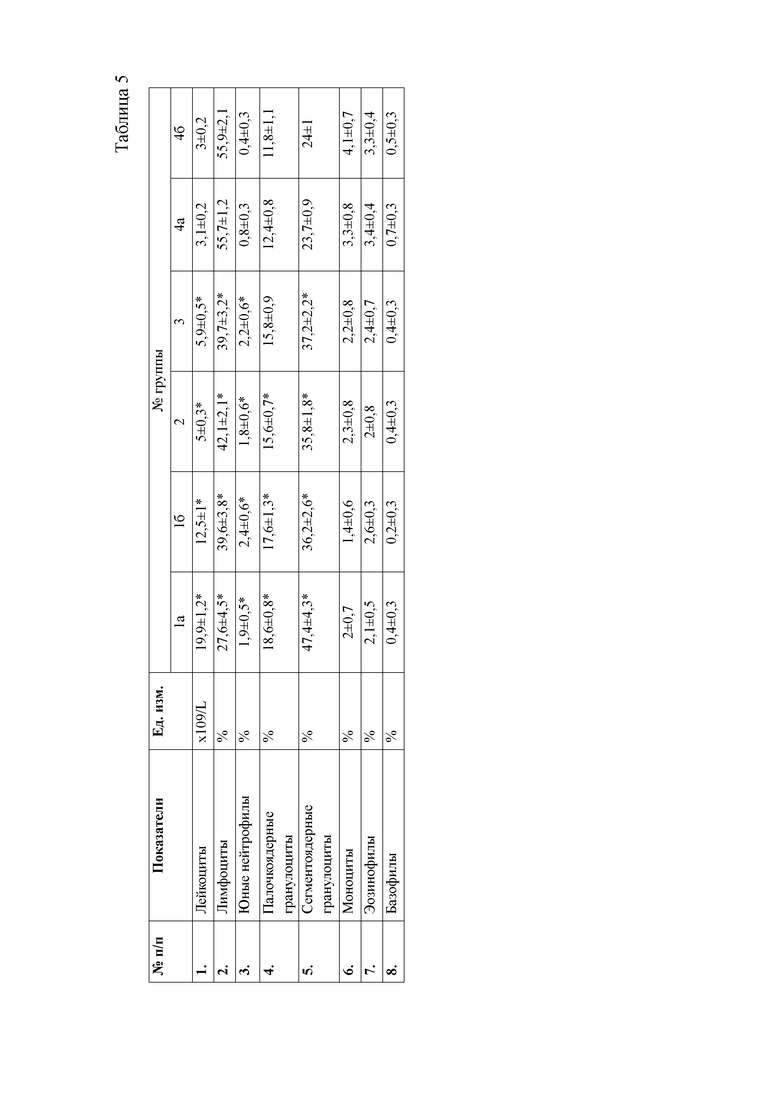
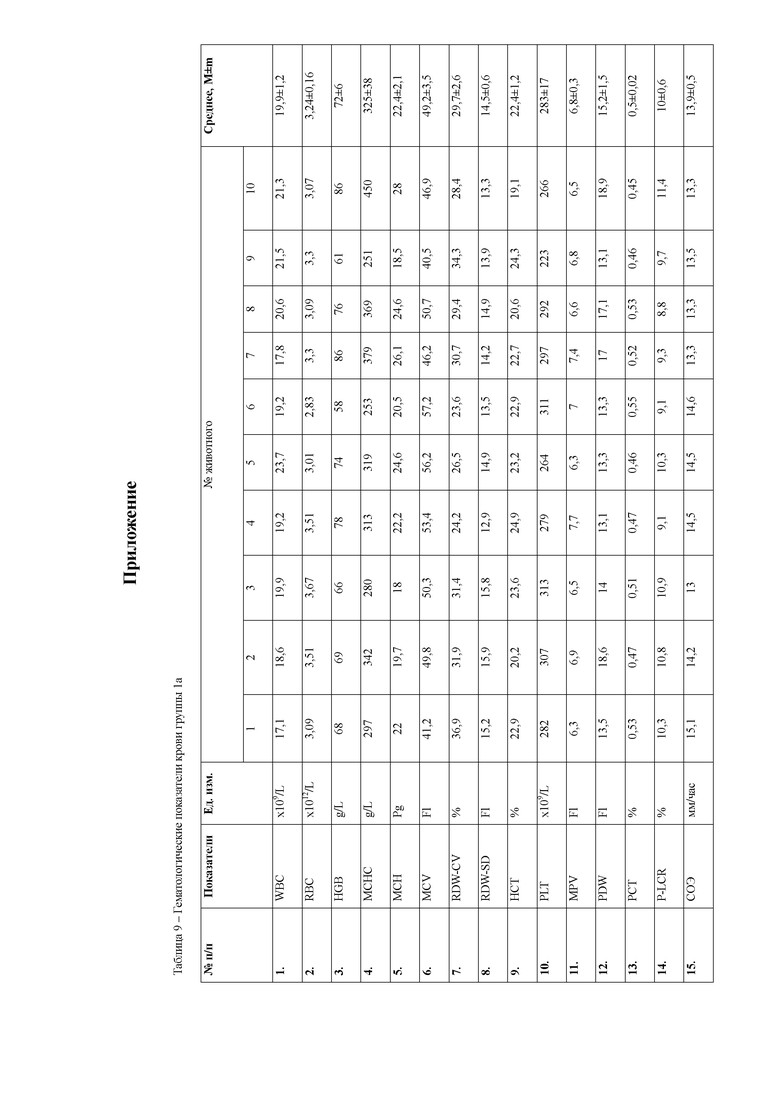
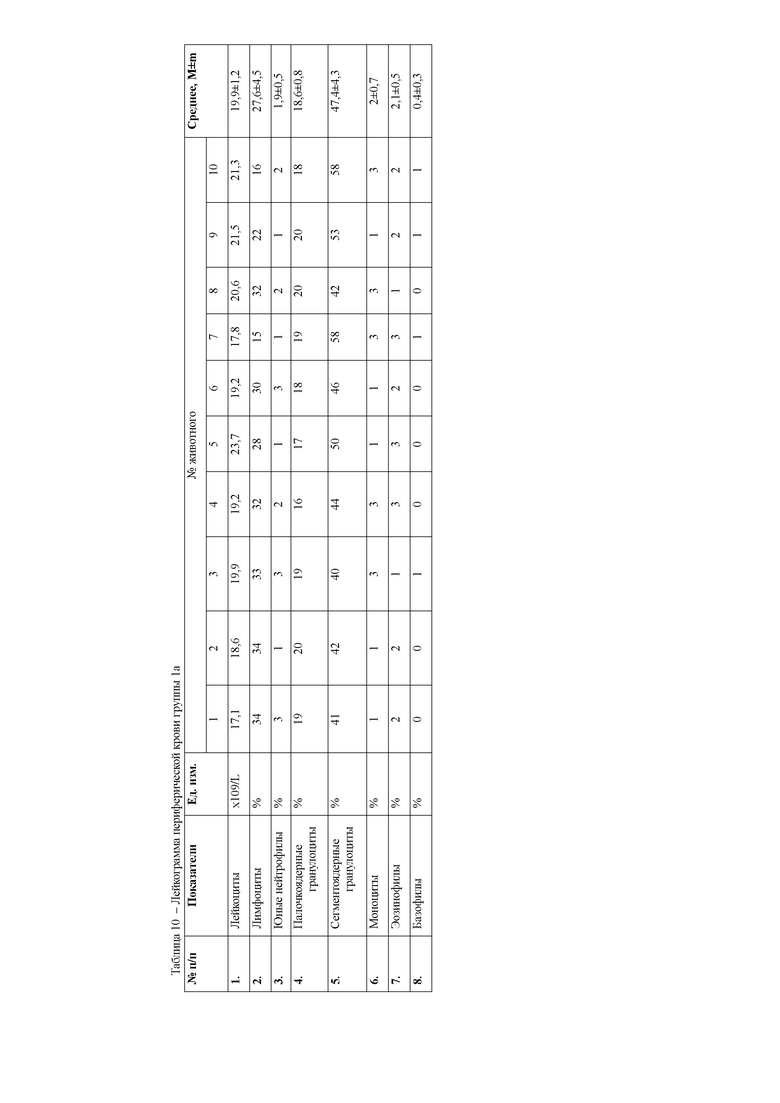
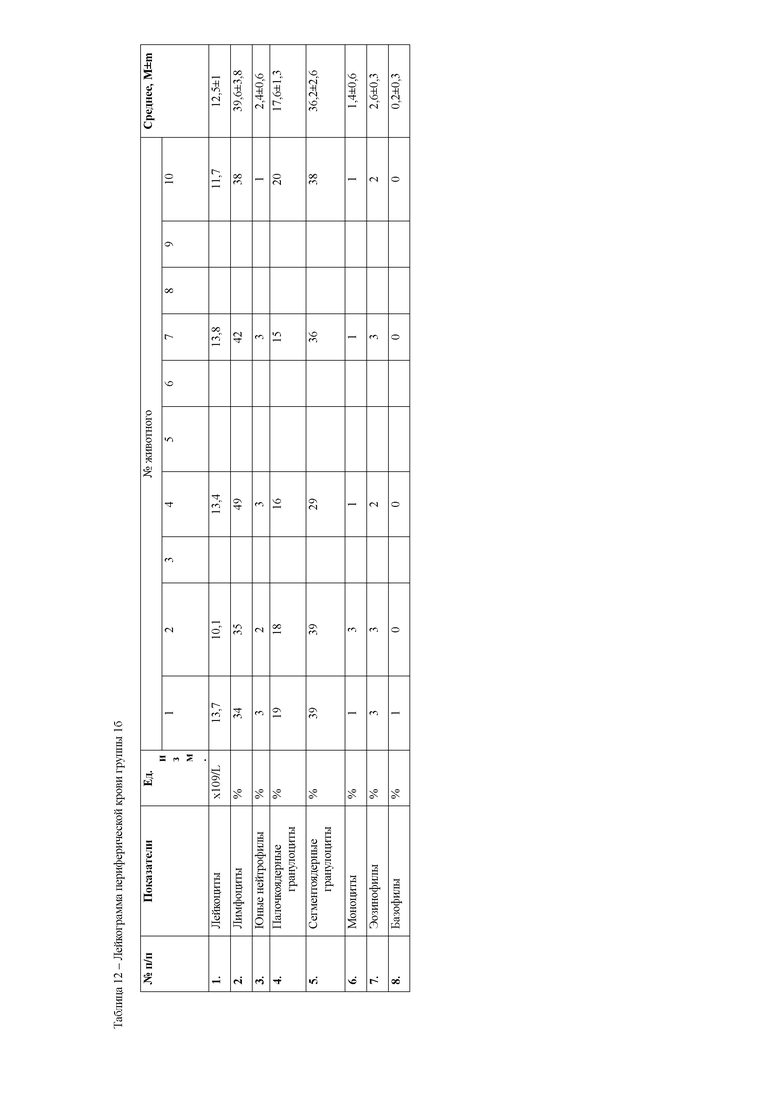
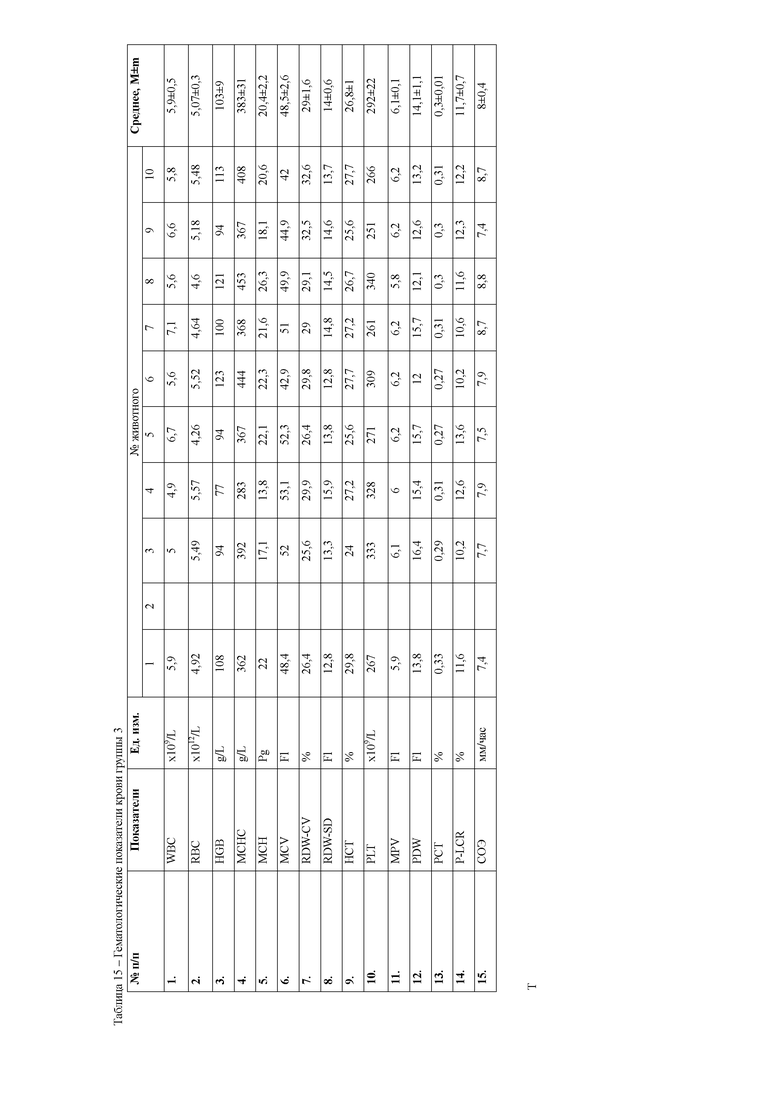
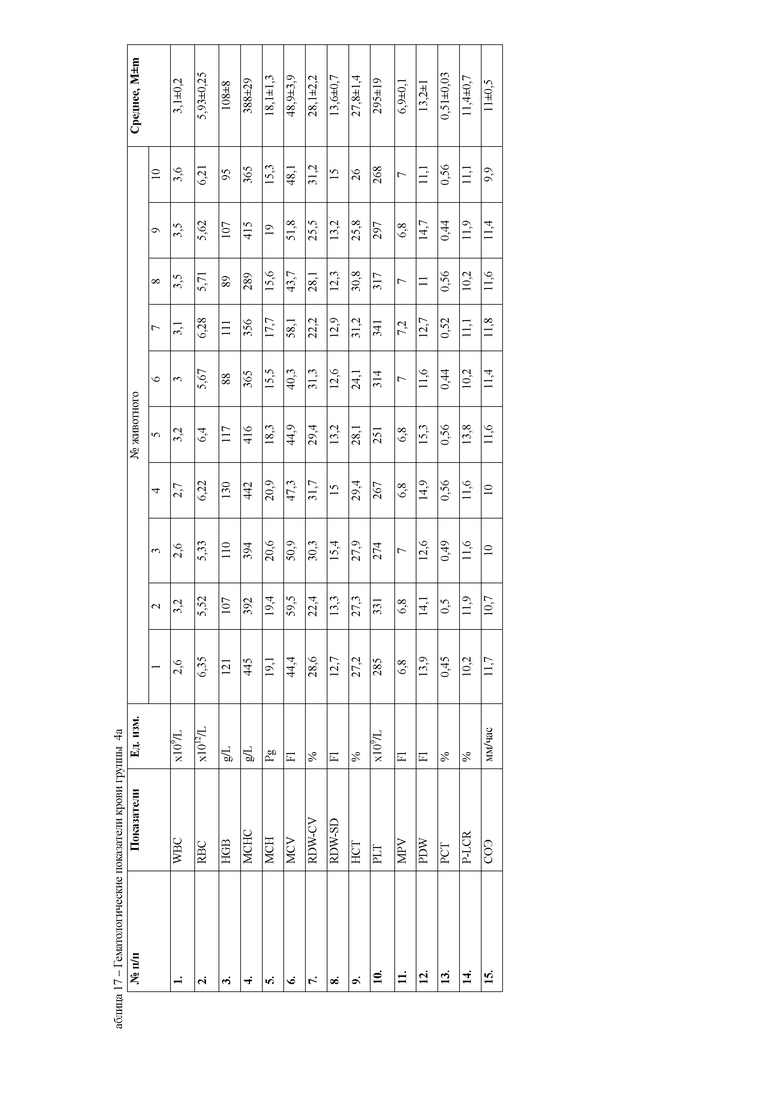
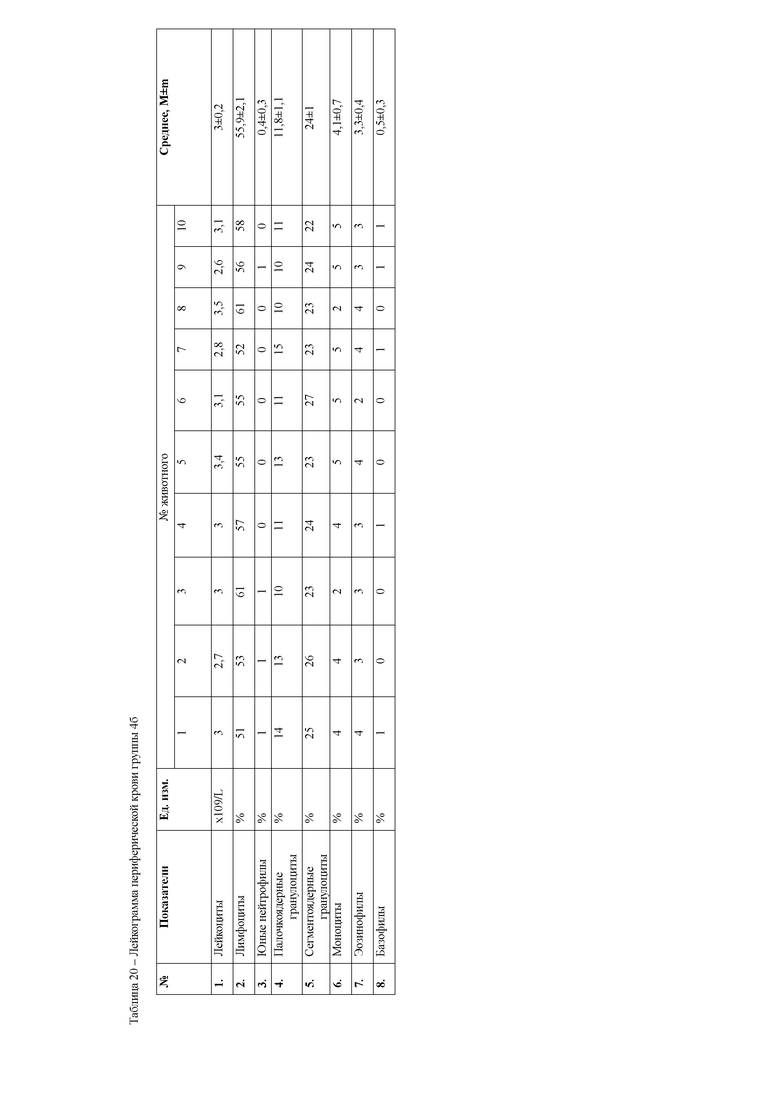
При анализе гематологических показателей периферической крови мышей через 24 часа после начала эксперимента установлено достоверное повышение общего количества лейкоцитов у мышей с индуцированным тетрахлорметаном гепатитом по сравнению с контрольными животными. Увеличение общего количества лейкоцитов возникало за счет гранулоцитарных клеток. Данный факт указывает на развитие воспалительных процессов в организме животных, в частности в печени, пораженной действием тетрахлорметана. Кроме того отмечается достоверное снижение эритроцитов и гемоглобина в периферической крови мышей первой опытной группы (таблицы 4, 5).
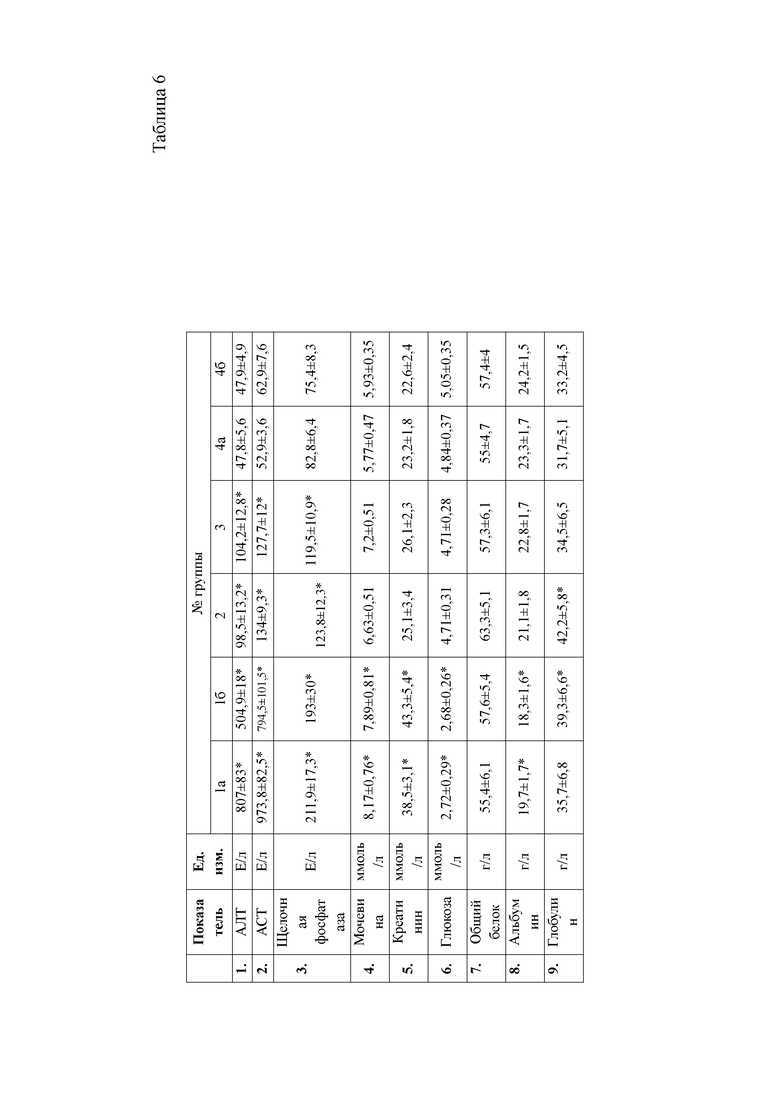
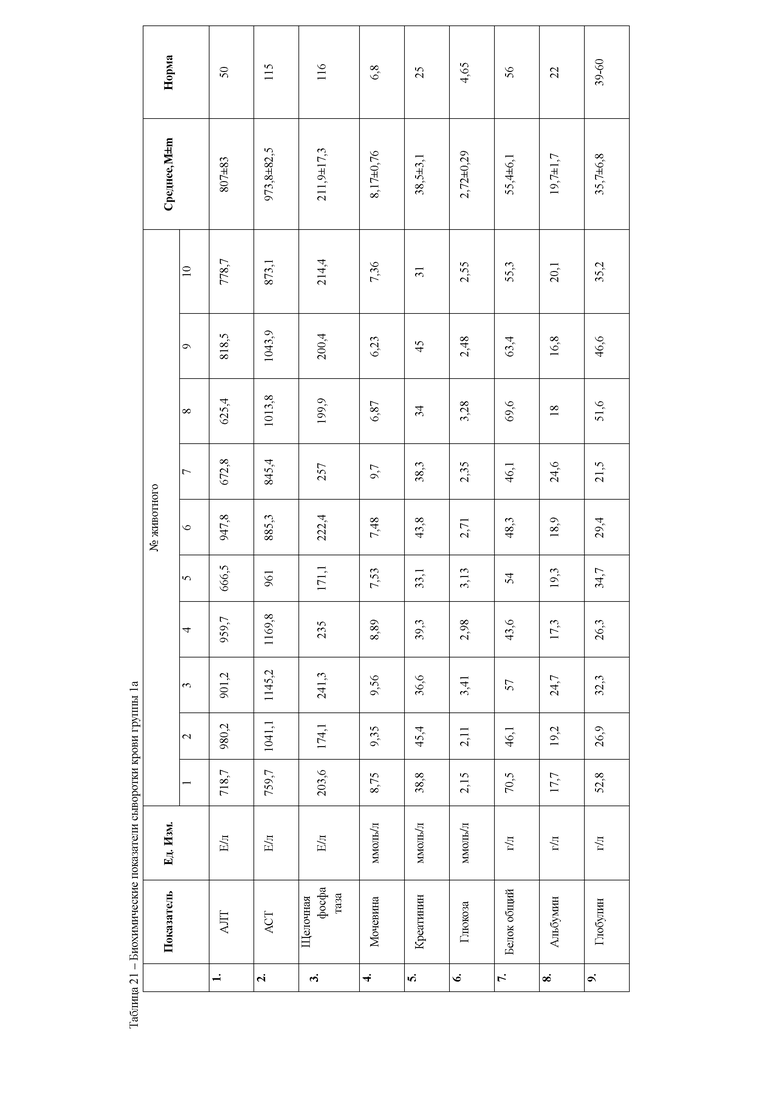
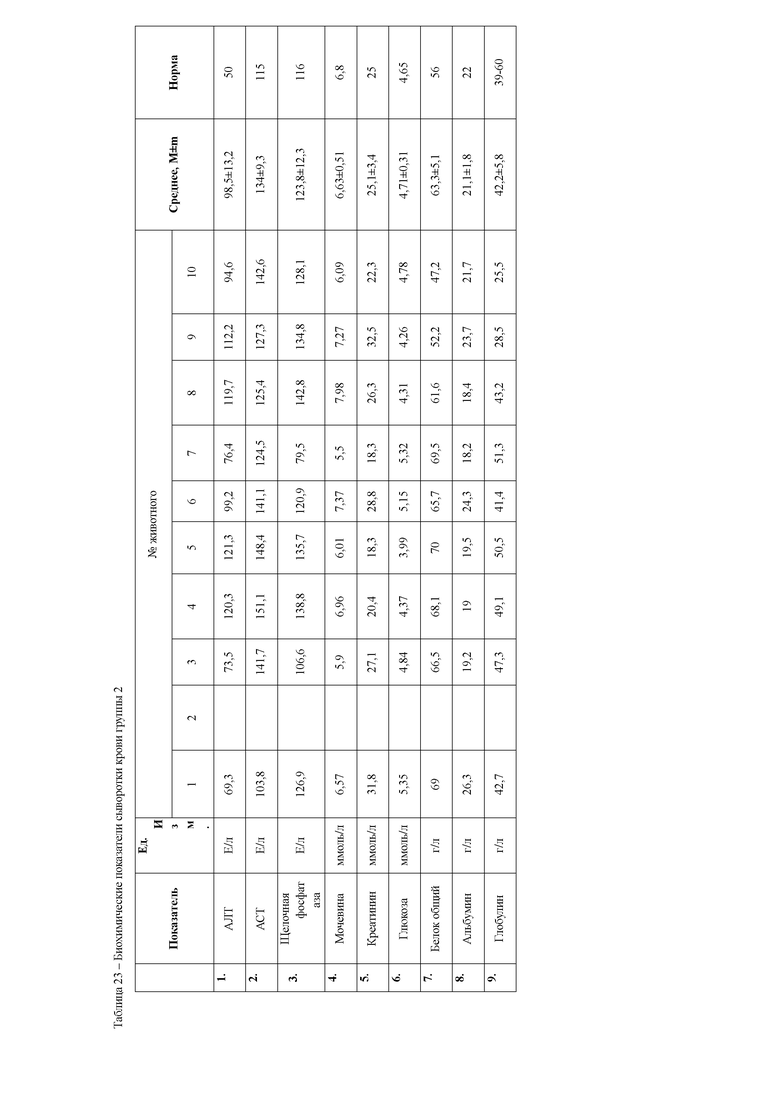
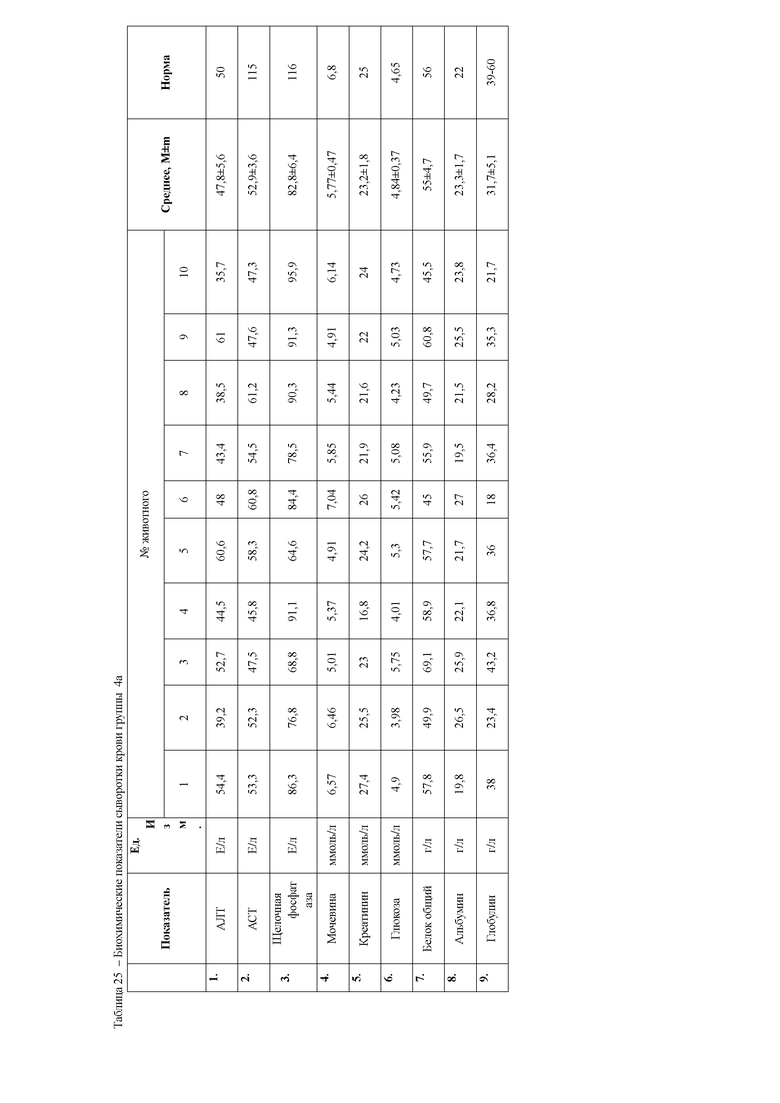
При анализе биохимических показателей сыворотки крови мышей (таблица 5) установлено достоверное повышение индикаторных ферментов печени аланиновой и аспарагиновой трансаминаз в сыворотке крови мышей через 24 часа после введения 50% раствора тетрахлорметана на оливковом масле
относительной мышей контрольной группы. Данные изменения указывают на способность четыреххлористого углерода запускать процессы перекисного окисления липидов и снижать интегральную антирадикальную активность в печени, что в свою очередь приводит к повреждению клеточных мембран центролобулярных долек печени. Следствием этого является выход цитоплазматических ферментов, к которым относятся и трансаминазы, в межклеточное пространство, откуда они поступают в кровь, где активность их резко возрастает. Наряду с этим, отмечается достоверное повышение активности щелочной фосфатазы, что указывает на процессы холестаза вследствие сдавливания желчных протоков экссудатом. Кроме того, отмечается резкое снижение концентрации глюкозы в сыворотке крови животных, что является следствием повышенных затрат энергии на компенсацию мезенхимально- дистрофических процессов в организме мышей.
Также через 24 часа после начала эксперимента у мышей группы 1а наблюдается достоверное повышение мочевины и креатинина относительно контрольной группы животных. Данные изменения свидетельствуют о функциональной недостаточности почек в ответ на действие ксенобиотика. Так, снижение антитоксической функции печени при введении тетрахлорметана привело к накоплению токсических продуктов в организме животных, которые оказывают негативное влияние на почки, что и приводит к их повреждению.
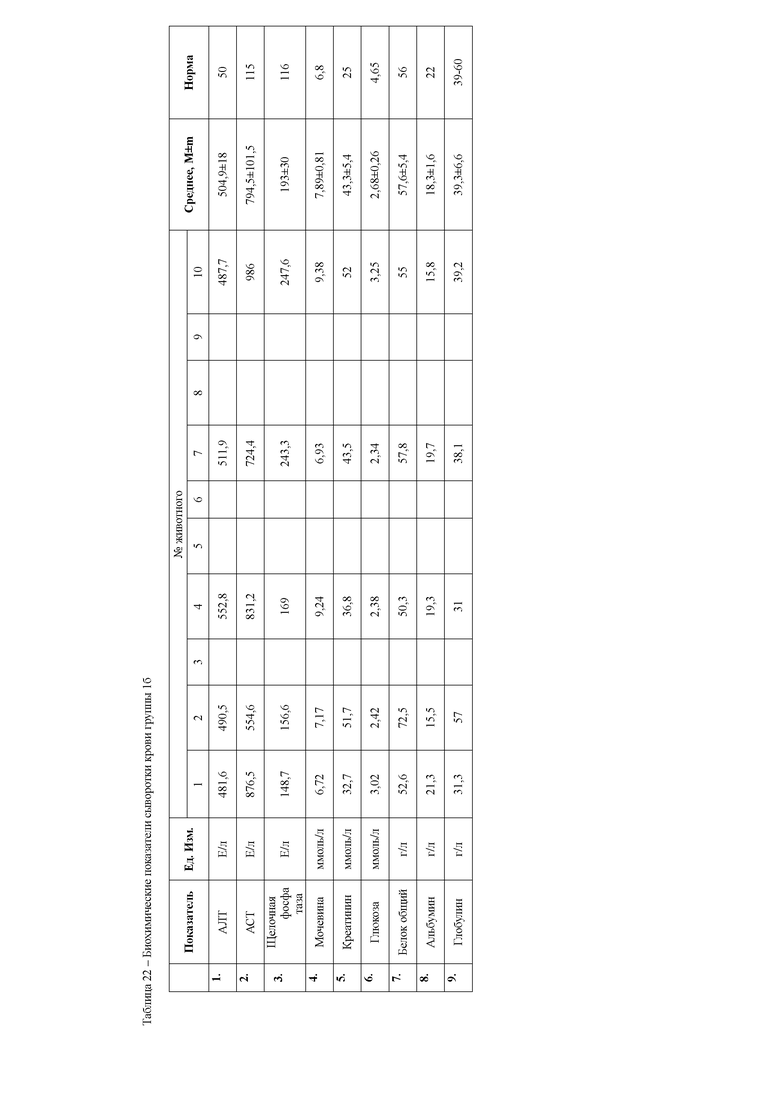
Анализ биохимических показателей сыворотки крови животных на 6сутки эксперимента (таблица 6) показал, что активность индикаторных ферментов печени, аланиновой и аспарагиновой трансаминаз во второй и третьей опытной группах, находится достоверно выше значений контрольной группы животных. Однако активность данных ферментов значительно ниже, чем в группе мышей 1 б, которым вводили ксенобиотик тетрахлорметан без проведения терапевтических мероприятий. Данный факт указывает на восстановление структурно-функциональных свойств гепатоцитов, снижение воспалительно-деструктивных процессов в печени второй и третьей опытных групп мышей под действием гепатопротекторных препаратов.
Во второй опытной группе животных, которым применяли с терапевтической целью препарат Гепарс, отмечали достоверное повышение общего белка и его фракций, относительно животных третьей опытной группы, что может быть следствием синергизма метионина и селена, способствующих повышению компенсаторных факторов организма на действие ксенобиотика. Кроме того, метионин, входящий в состав препарата, способствует удалению из печени избытка жира, играет важную роль в синтезе адреналина, креатина, и ряда других биологически важных соединений, принимает участие в обмене содержащих серу аминокислот, реакциях дезаминирования, трансметилирования, декарбоксилирования; модулирует эффект витаминов (В9, В12, С) и гормонов, активирует действие ферментов и белков. А также является мощным антиоксидантом, тем самым способствует обезвреживанию ксенобиотиков (в данном случае тетрахлорметана). Подавляет выделение гистамина, таким образом, способствует восстановлению ткани печени, путем стимуляции рециркуляции глютатиона, регулирует азотистый баланс.
Вместе с этим у животных 16 опытной группы отмечаются достоверно более низкие показатели альбуминов, при завышенных концентрациях глобулиновых фракций белка относительно контрольных животных. Данные изменения указывают на снижение альбуминсинтезирующей функции печени в организме животных на фоне применения ксенобиотика, а повышение глобулиновых фракций является следствием выброса в кровь белков острой фазы воспаления, что и указывает на наличие воспалительно-деструктивных процессов в паренхиме печени.
Снижение общего белка и альбуминов отмечается и в третьей опытной группе мышей, которым с терапевтической целью назначали препарат сравнения.
Это может быть следствием повышенных затрат энергии на восстановление функциональной активности гепатоцитов поврежденных действием ксенобиотика. Биохимические показатели сыворотки крови приведены в таблице 6.
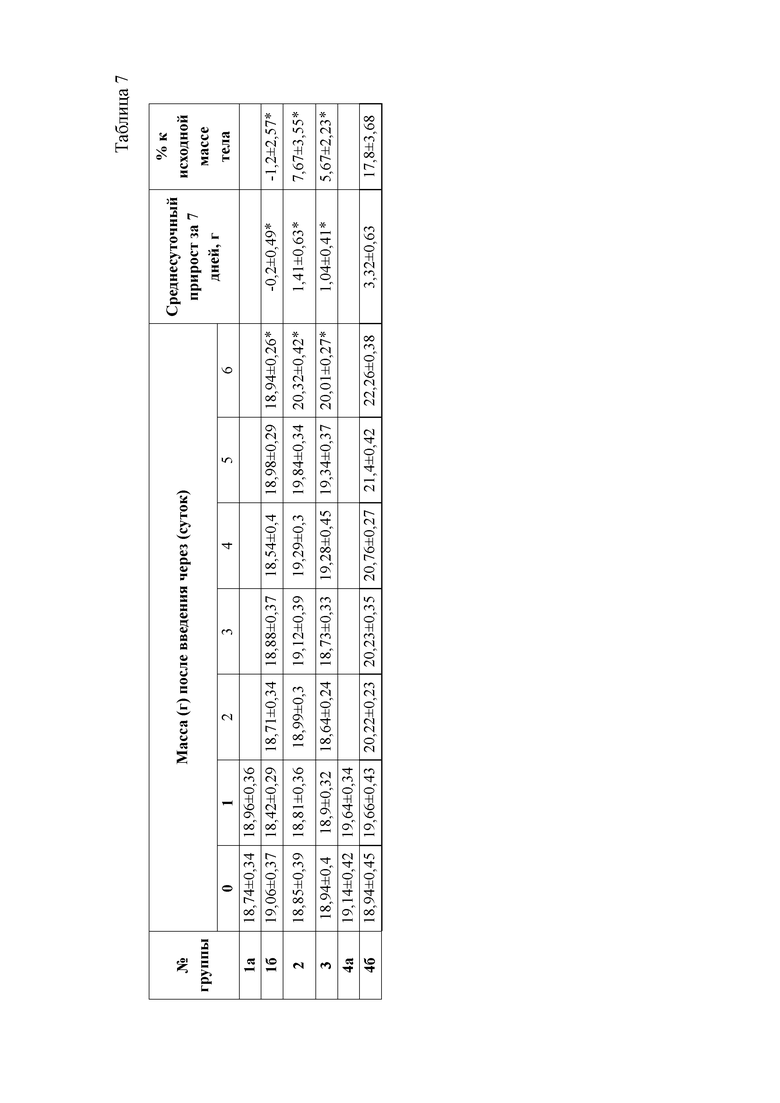
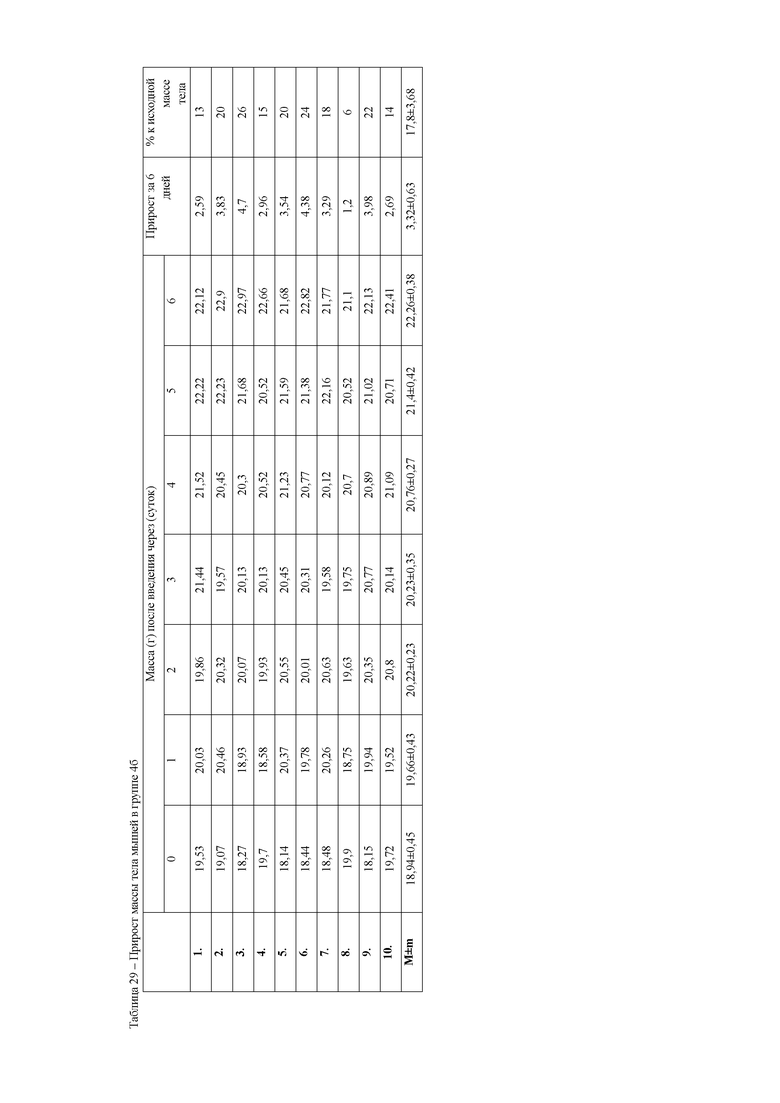
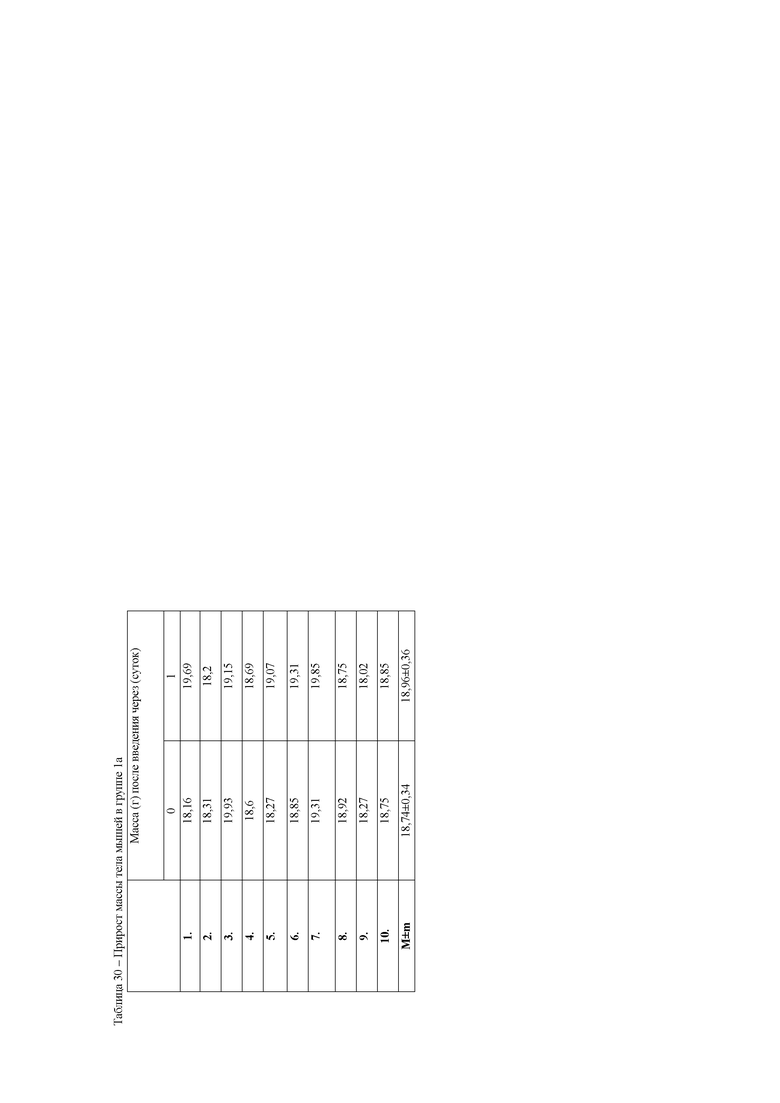
При анализе динамики прироста массы тела животных (таблица 7) установлено достоверное снижение среднесуточных привесов за 6 дней эксперимента у животных 16 группы. В данной группе массы животных оставались на первоначальном уровне. Вместе с этим, у животных второй и третьей опытных групп прирост массы тела был достоверно выше, чем в 16 группе, но значительно ниже, чем у контрольных животных. Данный факт указывает на негативное действие ксенобиотика, приводящее к нарушению обменных процессов в организме мышей.
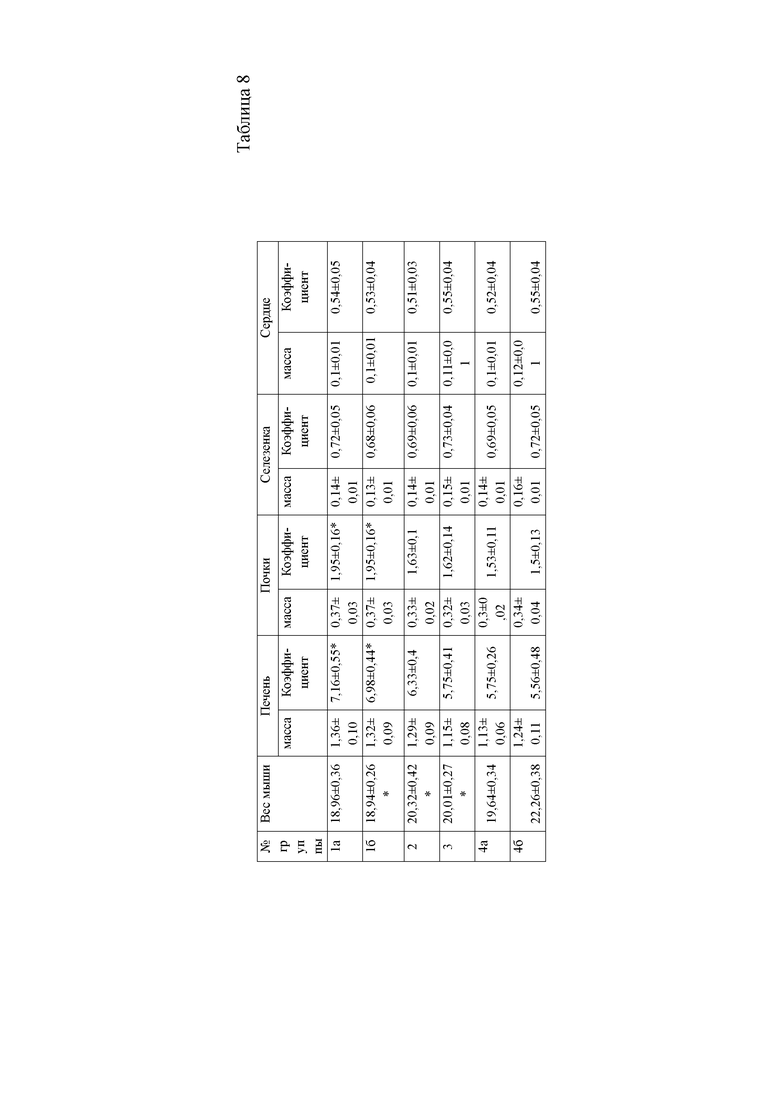
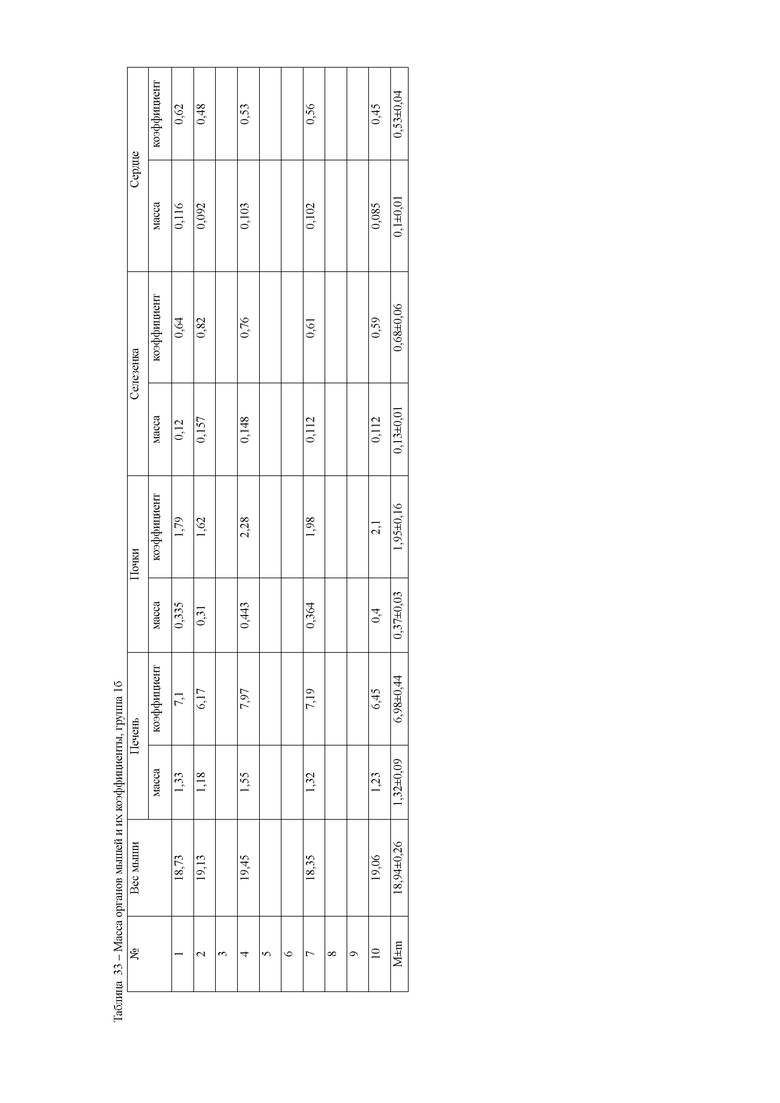
При анализе массы внутренних органов мышей достоверно установлено увеличение коэффициентов массы печени и почек в 1а и 1 группах животных относительно контрольных. Тогда как, во второй и третьей опытных группах мышей, которым после введения ксенобиотика тетрахлорметана, вводили гепатопротекторные препараты, масса органов изменялась в рамках статистической погрешности, коэффициенты органов показывали аналогичный результат. Данные показатели находились в пределах физиологических значений для данного вида животных и не отличались от контрольной группы (таблица 8).
Применение препарата «Гепарс» животным с патологией гепатобилиарной системы, вызванной действием ксенобиотика (тетрахлорметан), способствует снижению воспалительной деструктивных процессов в печени и почках и, как следствие, восстановлению их функциональной активности.
Более подробные данные экспериментов приведены в приложении.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНЪЕКЦИОННАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЙ ПЕЧЕНИ У ЖИВОТНЫХ | 2012 |
|
RU2504347C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ГИПОАВИТАМИНОЗОВ И НОРМАЛИЗАЦИИ ОБМЕНА ВЕЩЕСТВ У ПТИЦ | 2013 |
|
RU2506084C1 |
| Гепатопротекторная инъекционная фармацевтическая композиция на основе силимарина и наночастиц селена | 2017 |
|
RU2645092C1 |
| КОРМОВЫЕ ДОБАВКИ ДЛЯ СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПТИЦЫ | 2016 |
|
RU2660920C2 |
| Кормовая добавка для жвачных животных на основе наночастиц селена и аспарагината кобальта | 2023 |
|
RU2817251C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАРИТМИЧЕСКИМИ И ГЕПАТОПРОТЕКТОРНЫМИ СВОЙСТВАМИ | 2011 |
|
RU2469720C1 |
| СПОСОБ ПОВЫШЕНИЯ СОХРАННОСТИ ЩЕНКОВ ПУШНЫХ ЗВЕРЕЙ | 2008 |
|
RU2374894C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ И ОТРАВЛЕНИЙ ЖИВОТНЫХ И ПТИЦ, ПОВЫШАЮЩЕЕ ИХ ПРОДУКТИВНОСТЬ И СОХРАННОСТЬ | 1999 |
|
RU2171110C2 |
| СРЕДСТВО НА ОСНОВЕ ПРИРОДНЫХ ФОСФОЛИПИДОВ | 2008 |
|
RU2367443C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АДАПТОГЕННОЙ И ИММУНОМОДУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2013 |
|
RU2516886C1 |

















Изобретение относится к области фармацевтики. Гепатопротекторная инъекционная фармацевтическая композиция содержит фосфатидилхолин, витамин Е, метионин и селенит натрия, а также поверхностно-активное вещество ТВИН-80, органический фармакопейный растворитель 2-пирролидон, бензиловый спирт и воду, из которых образуется мицеллярная форма, при этом используется следующее соотношение веществ: фосфатидилхолин 0,24 г, витамин Е 0,02 г, метионин 0,04 г, селенит натрия 0,0011 г, бензиловый спирт 0,1 мл, 2-пирролидон 3,5 мл, ТВИН-80 0,8 мл, вода 5,3 мл. Композиция характеризуется низкой токсичностью, способностью к направленному транспорту, контролируемым высвобождением в зоне мишени, а также химической и физической стабильностью при хранении. 38 табл.
Гепатопротекторная инъекционная фармацевтическая композиция, содержащая фосфатидилхолин и витамин Е, отличающаяся тем, что содержит в качестве биологически активных веществ метионин и селенит натрия, а также поверхностно-активное вещество ТВИН-80, органический фармакопейный растворитель 2-пирролидон, бензиловый спирт и воду, из которых образуется мицеллярная форма, при этом используется следующее соотношение веществ: фосфатидилхолин - 0,24 г, витамин Е - 0,02 г, метионин - 0,04 г, селенит натрия - 0,0011 г, бензиловый спирт - 0,1 мл, 2-пирролидон - 3,5 мл, ТВИН-80 - 0,8 мл, вода 5,3 мл.
| Фармацевтическая композиция для лечения и/или профилактики заболеваний печени | 2019 |
|
RU2725622C1 |
| Аппарат для получения зерно-волокнистого алюминия | 1927 |
|
SU17987A1 |
| КОМБИНАЦИЯ КОМПОНЕНТОВ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НЕМОЩНОСТИ | 2011 |
|
RU2646830C2 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| EP 3542638 A1, 25.09.2019 | |||
| ЗВЕРКОВ И.В | |||
| и др | |||
| Сравнительная характеристика эффективности препаратов эссенциальных фосфолипидов и урсодезоксихолевой кислоты в терапии хронических заболеваний печени | |||
| РМЖ "Медицинское обозрение", N7(I) от | |||
Авторы
Даты
2021-11-29—Публикация
2020-12-25—Подача