Изобретение относится к фармакологии, а именно к биологически активным веществам, обладающим кардиопротекторными и гепатопротекторными видами активности для защиты миокарда от различных повреждающих факторов при сердечно-сосудистых патологиях и защиты ткани печени от повреждения различными токсическими веществами.
Сердечно-сосудистые заболевания являются основной причиной смертности и инвалидизации населения. Особое место в структуре сердечно-сосудистых патологий занимает внезапная смерть (Чазов Е.И., Руда М.Я. Развитие основных направлений в лечении больных инфарктом миокарда за последние 25 лет. Кардиология, 1989, т.29, №11, с.11-15), в основе которой чаще всего лежат аритмии сердца. Поэтому поиск и создание новых эффективных средств с кардиопротекторной активностью является актуальной задачей фармакологии.
Установлено, что образование свободных радикалов кислорода оказывает повреждающее действие на миокардиальную клетку, особенно при ишемии и реперфузии миокарда (Loeper J., Coy J., Bodu O. et al. Lipid peroxidation and protective enzymes during the course of myocardial infarction. Agents and actions, 1987, v.22, p.340-342). Наиболее частым осложнением ишемической болезни сердца являются аритмии (Мазур Н.А. Внезапная смерть больных ишемической болезнью сердца. М.: Медицина, 1986, 192 с.). В литературе имеются данные об экспериментальном и клиническом применении антиоксидантных средств при нарушениях ритма сердца (Кудрин А.Н., Смоленский B.C., Коган А.Х. и др. Антиоксиданты в терапии экспериментальной ишемии миокарда и ишемической болезни сердца. Кардиология, 1988, т.28, №7, с.115-121). Описаны противоаритмические свойства дибунола (Фролькис В.В., Фролькис Р.А., Дубур Г.Я. и др. Антиоксиданты как антиаритмические средства. Физиологический журнал, 1986, №1, с.24-32) при аритмиях, вызванных хлоридкальциевой и адреналиновой интоксикацией, ишемией и реперфузией миокарда, кардиопротекторные эффекты которого проявляются в противоишемической защите миокарда.
Однако применение дибунола может сопровождаться парадоксальными эффектами, когда его антиоксидантное действие трансформируется в противоположное - прооксидантное, с подавлением ферментной антиоксидантной системы митохондрий, увеличением образования кислородных радикалов, снижением функционирования цепи переноса электронов в микросомах (Kahl, R. Synthetic antioxidants: Biochemical actions and interference with radiation, toxic compounds, chemical mutagens and chemical cancerogens // Toxicology. - 1984. - Vol.33. - P.185-228.). В связи с чем необходим поиск новых лекарственных средств аналогичного действия.
Известно, что выраженность и исходы различных экзо- и эндогенных интоксикаций во многом зависят от функционального состояния печени. Как правило, функциональная недостаточность печени сопровождается нарушением обменных процессов, среди которых особое значение имеет изменение метаболизма липидов и структурной организации мембран гепатоцитов (Иванов Ю.В., Матюшин И.А., Мишнев О.Д. и др. Действие мексидола при токсическом поражении печени. Вестник новых медицинских технологий: периодический теоретический и научно-практический журнал. - 2003, №3. - С.68-70). Несмотря на многообразие этиологических факторов на субклеточном уровне, выявляются однотипные механизмы деструкции, среди которых особую роль играют процессы свободно-радикального окисления (СРО) с участием активных форм кислорода (АФК) и активных кислородных метаболитов (АКМ). Утилизация АФК и АКМ осуществляется ферментативной и неферментативной антиоксидантной системой организма, важное место в которой отводится глутатионредуктазной/глутатионпероксидазной антиоксидантной системе (Левенкова М.В., Попова Т.Н., Семенихина А.В. Некоторые регуляторные свойства глюкозо-6-фосфатдегидрогеназы из печени крыс в норме и экспериментальном токсическом гепатите. Вестник ВГУ. Серия: Химия. Биология. Фармация. - 2004, №1. - С.134-138).
Одним из распространенных факторов поражения печени остается интоксикация различными веществами. Печень является главным органом метаболизма ксенобиотиков и подвержена их токсическому влиянию. Окислительный метаболизм веществ катализируется цитохром Р450-зависимой монооксигеназной системой и другими ферментами (Пентюк А.А., Мороз Л.В., Паламарчук О.В. Поражения печени ксенобиотиками. Современные проблемы токсикологии. - 2001, №2. - С.8-16; Ляхович, В.В., Вавилин В.А., Зенков Н.К., Меньщикова Е.Б. Активированные кислородные метаболиты в монооксигеназных реакциях. Бюллетень СО РАМН. - 2005, №4 (118). - С.7-12). Синдром эндогенной интоксикации организма, обусловленный распадом клеток печеночной паренхимы и накоплением в околоклеточном пространстве токсических продуктов, приводит к нарушению клеточного метаболизма и ослаблению регуляторных и адаптационных функций органов и систем, очищающих внутреннюю среду организма - печень и лимфатическую систему. Гепатотоксины вызывают гибель клеток по механизмам как некроза, так и апоптоза. Запускают данные процессы возможно как АФК, так и АКМ, инициирующие рецептор-независимые механизмы, что ведет к активации регуляторных белков, которые останавливают митотическую активность клетки, вызывают дефрагментацию ДНК (эндонуклеазы), деградацию жизненно важных белков (каскад протеолитических ферментов, каспаз), нарушают связь с внеклеточным матриксом (Al-Shabanah O.A., El-Hadiyah T.M., Mansour М.А. Effects of volatile oil constituents of Nigella Sativa against carbon tetrachloride-induced hepatotoxicity in mice: Evidence of antioxidant effects of ip administration of thymoquinone // Abstracts of the IXth International Congress of Toxicology. 8-12 July 2001, Brisbane, Australia. Toxicology. - 2001. - V.164 (1-3). - P.1-266).
АФК и АКМ могут появляться как продукт каталитического цикла цитохрома Р450, синтазы оксида азота, NADPH-редуктазы, диафоразы и других ферментов либо вследствие участия семихинонных метаболитов ксенобиотиков в реакциях одноэлектронного переноса с кислородом, либо вследствие активации макрофагов ксенобиотиками (Пентюк А.А., Мороз Л.В., Паламарчук О.В. Поражения печени ксенобиотиками. Современные проблемы токсикологии. - 2001. - №2. - С.8-16). Механизм повреждающего действия тетрахлорметана связан с образованием свободного трихлорметильного радикала, который инициирует процессы перекисного окисления липидов в мембранах гепатоцитов, что ведет к накоплению липидных перекисей и может быть непосредственным механизмом цитолиза клеток (Ткачишин B.C. Профессиональные токсические гепатиты. Сучасна гастроентерологiя, 2003, №4 (14), с.4-7; Левенкова М.В., Попова Т.Н., Семенихина А.В. Некоторые регуляторные свойства глюкозо-6-фосфатдегидрогеназы из печени крыс в норме и экспериментальном токсическом гепатите. Вестник ВГУ. Серия: Химия. Биология. Фармация, 2004, №1, с.134-138). Это дает основание полагать, что фармакологические вещества, ингибирующие процессы СРО, должны обладать гепатозащитными свойствами (Иванов Ю.В., Матюшин И.А., Мишнев О.Д. и др. Действие мексидола при токсическом поражении печени // Вестник новых медицинских технологий: периодический теоретический и научно-практический журнал. - 2003. - №3. - С.68-70).
Известно, что наряду с традиционными гепатопротекторами карсилом (силимарином) (Pradhan SC, Girish С. Hepatoprotective herbal drug, silymarin from experimental pharmacology to clinical medicine // Indian J. Med. Res. - 2006. - Vol.124 (5). - P.491-504) и эссенциале (Кунц Э., Гундерман К.-Й., Шнайдер Э. "Эссенциальные" липиды в гепатологии (экспериментальный и клинический опыт) // Терапевтический архив. - 1994. - Т.66, №.2. - С.66-72), как гепатопротектор применяется токоферол (Falasca K, Ucciferri C, Mancino P, Vitacolonna Е, De Tullio D, Pizzigallo E, Conti P, Vecchiet J. Treatment with silybin-vitamin E-phospholipid complex in patients with hepatitis С infection // J. Med. Virol. - 2008. - Vol.80 (11). - P.1900-1906).
Однако его активность остается недостаточно высокой.
Техническим результатом изобретения является повышение кардио- и гепатопротекторной активности.
Технический результат достигается композицией, содержащей в качестве действующего начала дигидробромид 9-(2-диэтиламиноэтил)-2-(3,4-диоксифенил)имидазо[1,2-а]бензимидазола формулы I:
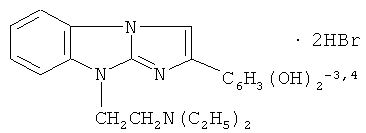
взятый в эффективном количестве.
Технический результат достигается также применением дигидробромида 9-(2-диэтиламиноэтил)-2-(3,4-диоксифенил)имидазо[1,2-а]бензимидазола формулы I в качестве средства, проявляющего кардио- и гепатопротекторную активность.
Дигидробромид 9-(2-диэтиламиноэтил)-2-(3,4-диоксифенил)имидазо-[1,2-а]бензимидазола формулы I известен как биологически активное соединение, проявляющее антиоксидантные свойства (Косолапов В.А., Спасов А.А., Анисимова В.А. Изучение антирадикальной активности новых соединений методами хемилюминесценции. Биомедицинская химия, 2005, т.51, №3, с.287-294; Анисимова В.А., Спасов А.А., Косолапов В.А. и др. Синтез и биологическая активность 9-диалкиламиноэтил-2-окси(диокси)-фенил-имидазо[1,2-а]бензимидазолов. Хим.-фарм. журнал, 2006, т.40, №10, с.3-10). Соединение I проявляет церебропротекторное действие при радиационных поражениях (Верещагин В.К., Спасов А.А., Анисимова В.А., Сеньчуков И.Д. Производное имидазо[1,2-а]бензимидазола - средство, оказывающее церебропротекторное действие при радиационных поражениях. Пат. РФ №2238938 (2004)). У соединения I выявлены также противоишемические, гемореологические и антирадикальные свойства (Анисимова В.А., Косолапов В.А., Минкин В.И. и др. Дигидробромид 2-(3,4-дигидроксифенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола и фармацевтическая композиция на его основе. Патент РФ №2391979 (2010)).
В ряду солей 9-(2-диэтиламиноэтил)-2-(3,4-диоксифенил)имидазо[1,2-а]бензимидазола не известны соединения, обладающие кардиопротекторными и гепатопротекторными свойствами.
Способы получения дигидробромида 2-(3,4-дигидроксифенил)-9-диэтил-аминоэтилимидазо[1,2-а]бензимидазола I описаны в вышеуказанных статье и патентах и заключаются в конденсации 1-диэтиламиноэтил-2-аминобензимидазола с 3,4-диметоксифенацилбромидом или 3,4-диоксифенацилхлоридом, последующей циклизации образующихся в результате конденсации галогенидов 1-диэтиламиноэтил-3-(3,4-диметокси(3,4-дигидрокси)фенацил)-2-аминобензимидазолия в 48%-ной бромистоводородной кислоте (т.кип. 127°С), в результате чего образуется искомый продукт I.
Ниже приведены примеры исследования кардиопротекторных и гепатопротекторных свойств этого соединения.
Опыты были выполнены на 242 белых неинбредных крысах массой 180-400 г и 30 кошках обоего пола массой 2,5-3,7 кг. Животные содержались на стандартном пищевом рационе в условиях вивария (температура 22-24°С, относительная влажность воздуха 40-50%) на стандартной диете с соблюдением всех правил и Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997). На момент проведения экспериментов животные были здоровыми, изменений поведения, аппетита, режима сна и бодрствования обнаружено не было.
1. Кардиопротекторная активность
Ее изучали на моделях устойчивости миокарда к действию перекисей, хлоридкальциевой и адреналиновой аритмий, а также фибрилляций желудочков при окклюзии коронарной артерии с последующей реперфузией миокарда. Препаратом сравнения служило антиоксидантное средство дибунол.
Пример 1. Изучение устойчивости миокарда к действию перекисей
Исследования были выполнены на 30 белых неинбредных крысах обоего пола массой 185-220 г, содержащихся на стандартном рационе (интактные животные), или животных с синдромом системной пероксидации, содержащихся на полунатуральной безантиоксидантной диете, разработанной Воскресенским и Виттом (Воскресенский О.Н., Витт В.В. Изменения в артериальной стенке кроликов при длительном кормлении их нативным окисленным жиром (к вопросу о безхолестериновой модели атеросклероза). Архив патологии, 1971, т.33, №6, с.51-55). Влияние на резистентность миокарда определяли по методу Диденко (Диденко В.В. Аритмии, вызываемые индукцией перекисного окисления липидов в изолированным предсердии. М., 1985, 15 с.) Соединение I (20,5 мг/кг) и препарат сравнения дибунол (22 мг/кг) вводили внутрибрюшинно (в/бр) 1 р/сутки в течение трех суток в изоэффективных антиоксидантных дозах, равных 100×МЭК50, рассчитанных по данным антиоксидантной активности веществ in vitro на модели аскорбатзависимого перекисного окисления липидов (ПОЛ). Животных декапитировали под эфирным наркозом, выделяли изолированные предсердия, которые помещали в термостатируемую ванну объемом 33 мл, t 34°C с оксигенированным раствором Кребса-Генселейта pH 7,4. Сокращения предсердий регистрировали в изотоническом режиме при диастолической нагрузке 1 г с помощью тензометрической техники (Ковалев Г.В., Спасов А.А., Симонов A.M. и др. Перспективы и результаты поиска физиологически активных веществ, влияющих на сердечно-сосудистую систему, среди производных имидазо-бензимидазолов. Материалы 3-го Всес. симп. по целенаправленному изысканию новых физиол. акт. веществ. Рига, 1979, с.40) на самописце Н-327-1. Через 40-50 мин в инкубационную среду добавляли индуктор ПОЛ перекись водорода в концентрациях от 0,1 мМ до 1 М. Определяли концентрации перекиси, вызывающие остановку сокращений изолированных предсердий.
При изучении резистентности миокарда к действию перекиси у животным с синдромом системной пероксидации было установлено (табл.1), что соединение I при трехкратном введении достоверно превосходило дибунол в случае остановки сокращений предсердий при использовании высоких концентрации окислителя.
Пример 2. Аритмии, вызванные интоксикацией хлоридом кальция
Опыты проводили на 42 белых неинбредных крысах-самцах массой 180-230 г, наркотизированных тиопенталом натрия (40 мг/кг в/бр). Соединение I (20,5 мг/кг) вводили в/в за 5 мин, а препарат сравнения дибунол (22 мг/кг) вводили в/бр в 5% р-ре Твин-80 за 60 мин в изоэффективных антиоксидантных дозах до инъекции хлорида кальция крысам на стандартном рационе (интактные) и животным с синдромом системной пероксидации на безантиоксидантной диете. Хлорид кальция вводили в/в методом биологического титрования в дозах логарифмической шкалы (Кудрин А.Н., Асланянц Ж.К. Зависимость аритмогенного действия хлорида кальция от его дозы у белых мышей и кроликов // Кровообращение. - 1974. - Т.7, №3. - С.8-14; Муравьева Т.И. Зависимость нарушений функции сердца от величины доз хлорида кальция (модель воспроизведения дифференцированных аритмий сердца) Тез. докл. Всеросс. съезда фармацевтов. Воронеж, 1981, с.531-532), а именно 20, 25, 30, 40, 50, 63, 80, 100, 125, 158, 200, 250, 320, 398 и 501 мг/кг со скоростью 3 сек независимо от объема раствора до формирования фибрилляций желудочков сердца и гибели животных. Эффективность веществ определяли по увеличению резистентности миокарда животных к дозе хлорида кальция, вызывающей гибель у 100% животных.
Было установлено, что соединение I и дибунол увеличивают резистентность миокарда к хлоридкальциевой аритмии на 37,5 и 18,5% (табл.2) у интактных животных и на 56,1% и 53,9% у животных с синдромом системной пероксидации, соответственно.
n=6
n=7
n=7
n=8
n=8
n=6
Пример 3. Аритмии, вызванные интоксикацией андреналином
Опыты проводили на 30 белых неинбредных крысах обоего пола массой 180-230 г, наркотизированных уретаном (1 мг/кг в/бр). Соединение I (20,5 мг/кг) вводили в/в за 5 мин, а препарат сравнения дибунол (22 мг/кг) вводили в/бр в 5% р-ре Твин-80 за 60 мин до инъекции адреналина крысам на стандартном рационе (интактные) и животным с синдромом системной пероксидации на безантиоксидантной диете. Адреналин вводили в/в методом биологического титрования в дозах логарифмической шкалы [Кудрин, Асланянц, 1974; Муравьева, 1981], а именно 20, 25, 30, 40, 50, 63, 80, 100, 125, 158, 200, 250, 320, 398 и 501 мг/кг со скоростью 3 сек независимо от объема раствора с интервалами 20 мин. Эффективность веществ определяли по увеличению резистентности миокарда животных к дозе адреналина, вызывающей гибель у 100% животных.
На модели адреналиновой интоксикации установлено, что соединение I и дибунол увеличивали устойчивость миокарда к интоксикации адреналином в 1,6 и 1,3 раза соответственно (табл.3).
Пример 4. Фибрилляция желудочков
Фибрилляцию желудочков вызывали перевязкой на 15 мин нисходящей ветви левой коронарной артерии (Penkoske P.A., Sobel B.E., Corr P.B. Disparate electrophysiological alterations accompanying disrhythmia due to coronary occlusion and reperfusion in the cat // Circulation. - 1978. - V.58. - P.1023-1035) с последующим восстановлением кровотока. Эксперименты выполнены на 30 кошках обоего пола массой 2,5-3,7 кг, наркотизированных этаминалом натрия (40 мг/кг в/бр). Соединение I (20,5 мг/кг) вводили в/в за 10 мин, а препарат сравнения дибунол (22 мг/кг) вводили в/бр в 5% р-ре Твин-80 за 60 мин до окклюзии коронарной артерии.
Было установлено, что в контрольной группе фибрилляции желудочков возникали в первые 2-7 мин после реперфузии зоны ишемии в 70% случаев. Соединение I и дибунол в 100% предотвращали образование фибрилляции после окклюзии коронарной артерии с последующей реперфузией (табл.4).
2. Гепатопротекторные свойства
Связь бромсульфалеина с белком, транспортировка этого комплекса и выделение в желчь напоминают биотрансформацию низкомолекулярных веществ (билирубин и др.). Поэтому ухудшение клиренса бромсульфалеина (БСФ) из крови является одним из самых ранних и наиболее чувствительных признаков нарушения поглотительно-выделительной функции печени (Хазанов А.И. Функциональная диагностика болезней печени. М.: Медицина, 1988, 304 с.).
При скрининге гепатопротекторной активности все изученные вещества улучшали поглотительно-выделительную функцию печени при интоксикации CCl4 (Таблица 5). Наименьшая МЭД была установлена у соединения I. Полученные результаты свидетельствуют о том, что оно превосходит токоферола ацетат, карсил и эссенциале по влиянию на обезвреживающую функцию печени в 6,2; 9,3 и 12,9 раза соответственно.
При изучении гепатопротекторных свойств соединения I при трехдневном профилактическом введении в дозе 2,25 мг/кг на модели острого тетрахлорметанового гепатита было установлено, что в контрольной группе тетрахлорметан в дозе 0,75 мл/кг приводил к нарушению процесса захвата клетками печени бромсульфалеина (табл.6). При этом содержание его в сыворотке было в 18,4 раза выше, чем в контроле (p<0,05), что, несомненно, свидетельствует о значительном повреждении паренхимы печени. Соединения I не влияло на клиренс бромсульфалеина клетками интактной печени, но статистически значимо нормализовало его при отравлении CCl4, почти полностью предотвращая повреждение печени тетрахлорметаном.
Гексеналовая проба отражает состояние метаболической функции микросом гепатоцитов. Этот показатель наряду с нагрузкой БСФ является важнейшим индикатором гепатодепрессивного синдрома (Пентюк А.А., Мороз Л.В., Паламарчук О.В Поражения печени ксенобиотиками. Современные проблемы токсикологии, 2001, №2, с.8-16).
При выполнении пробы с гексеналом под действием тетрахлорметана, также как и в предыдущей пробе, были обнаружены значительные отклонения от нормы. Так продолжительность сна, вызванного гексеналом, у животных с острым гепатитом увеличивалась в 2,8 раза (p<0,05) по сравнению с контролем (табл.7).
Соединение I не влияло на продолжительность сна у интактных крыс и достоверно снижало его у крыс с гепатитом, достоверно укорачивая продолжительность сна в 1,9 раза.
Повышение в крови активности АлАТ, АсАТ, ЛДГ - ферментов, специфичных для гепатоцита, рассматривается как проявление цитолитического синдрома, тогда как гиперферментемия ЩФ характерна для холестатического синдрома (Хазанов, 1988).
При изучении активности печеночноспецифичных ферментов в сыворотке крови острый токсический гепатит вызывали введением 50% масляного раствора тетрахлорметана в дозе 2,5 мл/кг. Увлечение затравочной дозы CCl4 по сравнению с предыдущей серией обусловлено тем, что только в этом случае обнаруживалась гиперферментемия. Через 24 часа животных забивали и исследовали активность ферментов. CCl4 при однократном введении в дозе 2,5 мл/кг вызывает повышение активности АлАТ и АсАТ в сыворотке крови в 5,2 и 5,1 раза (p<0,05) соответственно по сравнению с контролем (табл.8). Кроме того, под его действием статистически значимо увеличивалась активность ЛДГ (табл.9) и ЩД (табл.10) в 6,7 раза соответственно. То есть через 24 часа после затравки тетрахлорметаном у животных наблюдалась выраженная гиперферментемия АлАТ, АсАТ и ЛДГ - важнейший признак гепатоцитолиза, а также ЩФ - признак холестаза.
Соединение I не влияло на активность указанных ферментов в сыворотке крови контрольных животных и снижало гиперферментемию при остром гепатите. У животных, подвергшихся действию CCl4, под влиянием I уменьшалась активность АлАт, АсАТ (табл.8), ЛДГ (табл.9) и ЩФ (табл.10) на 25, 35, 30 и 38% (p<0,05) соответственно.
Таким образом, CCl4 при однократном введении в дозе 2,5 мл/кг вызывал развитие в печени явлений цитолиза, проявлением которого служит гиперферментемия. Соединения I при профилактическом введении в течение трех дней не влияет на структуру гепатоцитов, но значительно уменьшает их повреждение четыреххлористым углеродом.
Менее выражено CCl4 влиял на метаболические функции печени. Это, в принципе, согласуется с представлением о том, что такие показатели, как суммарное содержание белка и глюкозы в крови, изменяются только при массивных поражениях печеночной паренхимы и то, обычно, спустя длительное время (Хазанов, 1988).
Содержание белка (табл.11) через сутки после затравки животных снижалось на 19,2% (p>0,05), а показатели цинк-сульфатной пробы увеличивались на 27,7% (p>0,05). Хотя указанные изменения носили характер тенденции, они, очевидно, указывают на то, что в сыворотке уменьшается количество синтезируемых в печени альбуминов и повышается содержание γ-глобулинов (Тугаринова В.Н., Миклашевский В.Е. Моделирование, методы изучения и экспериментальная терапия патологических процессов. - М., 1967. - С.262-265), а это свидетельствует о развитии в печени мезенхимиально-воспалительного синдрома. Кроме того, у этих животных на 21,6% (p>0,05) уменьшался уровень глюкозы в крови, что рассматривается как признак гепатодепрессивного синдрома.
Соединение I не влияло на эти показатели у контрольных животных и стабилизировало их у крыс с токсическим гепатитом (Таблица 11).
Заключение
1. Соединение I обладает выраженной кардиопротекторной активностью на моделях устойчивости миокарда к действию перекисей, хлоридкальциевой и адреналиновой аритмий, фибрилляций желудочков при постишемической реперфузии миокарда, не уступая или превосходя препарат сравнения дибунол.
2. Соединение I значительно улучшает поглотительно-выделительную функцию печени и улучшает ее дезинтоксикационные способности при остром токсическом гепатите. Соединение I при профилактическом введении при остром токсическом гепатите проявляет выраженные гепатопротективные свойства. Под его влиянием в значительной степени тормозится развитие признаков цитолитического, гепатодепрессивного и мезенхимально-воспалительного, холестатического синдрома, улучшаются дезинтоксикационные функции печени. Соединение I превосходит токоферола ацетат по влиянию на обезвреживающую функцию печени в 6,2.
Таким образом, предлагаемое средство может быть использовано при изготовлении фармацевтических композиций, обладающих антиаритмическими и гепатопротекторными свойствами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИТРОМБОГЕННОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2440814C1 |
| ДИГИДРОБРОМИД 2-(3,4-ДИГИДРОКСИФЕНИЛ)-9-ДИЭТИЛАМИНОЭТИЛИМИДАЗО[1,2-a] БЕНЗИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2008 |
|
RU2391979C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОГИПОКСИЧЕСКОЙ, АКТОПРОТЕКТОРНОЙ, НООТРОПНОЙ АКТИВНОСТЯМИ И ВЛИЯЮЩЕЕ НА ФИЗИЧЕСКУЮ РАБОТОСПОСОБНОСТЬ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2011 |
|
RU2462245C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИАРИТМИЧЕСКИМ, АНТИФИБРИЛЛЯТОРНЫМ, ПРОТИВОИШЕМИЧЕСКИМ ДЕЙСТВИЕМ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2011 |
|
RU2477130C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ КАРДИОПРОТЕКТОРНЫМ ДЕЙСТВИЕМ, И ГАЛОГЕНИДЫ 1,3-ДИЗАМЕЩЕННЫХ 2-АМИНОБЕНЗИМИДАЗОЛИЯ | 2013 |
|
RU2526902C1 |
| ДИГИДРОХЛОРИД 1-(3-МОРФОЛИНОПРОПИЛ)-2-ФЕНИЛИМИДАЗО[1,2-a]-БЕНЗИМИДАЗОЛА, ПРОЯВЛЯЮЩИЙ СВОЙСТВА АНТАГОНИСТА ПУРИНОВЫХ P2Y-РЕЦЕПТОРОВ, АНТИАГРЕГАНТНУЮ И АНТИТРОМБОТИЧЕСКУЮ АКТИВНОСТЬ | 2008 |
|
RU2391345C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОСАЖДЕННОГО ПРЕПАРАТА ИЗ БЕРЕЗОВОГО ГРИБА ЧАГА | 2010 |
|
RU2425686C1 |
| АНТИТРОМБОТИЧЕСКОЕ СРЕДСТВО, ВЛИЯЮЩЕЕ НА РЕГУЛЯЦИЮ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ТРОМБОЦИТОВ | 2008 |
|
RU2377990C1 |
| ЛЕКАРСТВЕННАЯ СУБСТАНЦИЯ ДЛЯ ПОДАВЛЕНИЯ ГЕЛИКОБАКТЕРОПОДОБНЫХ ЭРОЗИВНО-ЯЗВЕННЫХ ПОВРЕЖДЕНИЙ СЛИЗИСТОЙ ОБОЛОЧКИ ЖЕЛУДКА | 2008 |
|
RU2395282C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ КАРДИОТОНИЧЕСКОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2521213C1 |
Изобретение относится к фармакологии, а именно к применению дигидробромида 9-(2-диэтиламиноэтил)-2-(3,4-диоксифенил)имидазо[1,2-а]бензимидазола формулы I:
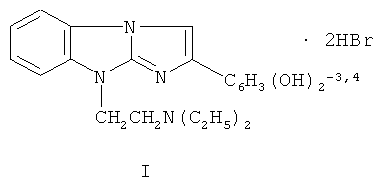
в качестве средства, обладающего антиаритмическими и гепатопротекторными свойствами. Изобретение также относится к применению дигидробромида 9-(2-диэтиламиноэтил)-2-(3,4-диоксифенил)имидазо[1,2-а]бензимидазола формулы I для изготовления фармацевтических композиций. Указанное изобретение обеспечивает повышение антиаритмической и гепатопротекторной активности. 1 з.п. ф-лы, 11 табл., 4 пр.
1. Применение дигидробромида 9-(2-диэтиламиноэтил)-2-(3,4-диоксифенил)-имидазо[1,2-а]бензимидазола формулы I:
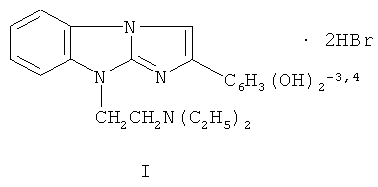
в качестве средства, обладающего антиаритмическими и гепатопротекторными свойствами.
2. Применение дигидробромида 9-(2-диэтиламиноэтил)-2-(3,4-диоксифенил)-имидазо[1,2-а]бензимидазола по п.1 для изготовления фармацевтических композиций, обладающих антиаритмическими и гепатопротекторными свойствами.
| ДИГИДРОБРОМИД 2-(3,4-ДИГИДРОКСИФЕНИЛ)-9-ДИЭТИЛАМИНОЭТИЛИМИДАЗО[1,2-a] БЕНЗИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2008 |
|
RU2391979C2 |
| ЧЕКМАН И.С | |||
| Кардиопротекторы - клинико-фармакологические аспекты | |||
| Украiнський медичнний часопис, 2003, №6(38) - ХI/ХII, с.18-25. | |||
Авторы
Даты
2012-12-20—Публикация
2011-07-13—Подача