ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
1. Область изобретения
Настоящее изобретение относится к противоопухолевому средству, полученному путем смешивания таксанового противоопухолевого средства с липосомальной композицией, в которой гемцитабин или его соли содержится в липосоме, и набору для лечения опухоли, который содержит таксановое противоопухолевое средство и липосомальную композицию, в которой гемцитабин или его соль содержится в липосоме.
2. Описание связанной области техники
Гемцитабин используют в качестве полезного лекарственного средства в химиотерапии злокачественных опухолей. Однако эффективность единственного агента гемцитабина в отношении опухоли составляет 10%, и выживаемость пациентов с раком коротка (средний период выживаемости 6,7 месяцев) (The New England Journal of Medicine, 2013, 369 (18), 1691-1703).
В химиотерапии злокачественных опухолей таксановые противоопухолевые средства, такие как паклитаксел или nab-паклитаксел, также используют в качестве применимых лекарственных средств. Однако эффективность таксанового противоопухолевого единственного агента относительно опухоли составляет 10-25%, и выживаемость пациентов с раком коротка (период выживаемости 12-15 месяцев) (Journal of Clinical Oncology, 2005, 23 (31), 7794-7803).
В клинической практике комбинированную терапию из нескольких лекарственных средств применяют с целью компенсации различий в восприимчивости к каждому противоопухолевому средству опухоли и для усиления эффективности лекарственного средства. Например, известны комбинация гемцитабина и абраксана, комбинация гемцитабина и nab-паклитаксела. Однако эффективность комбинации гемцитабина и паклитаксела у пациенток с раком молочной железы составляет 41,4% и средний период выживаемости составляет 18,6 месяцев (Journal of Clinical Oncology, 2008, 26 (24), 3950-3957). Кроме того, эффективность комбинации гемцитабина и nab-паклитаксела у пациентов с раком поджелудочной железы составляет 23% и средний период выживаемости составляет 8,5 месяцев (The New England Journal of Medicine, 2013, 369 (18), 1691-1703).
Липосомы представляют собой закрытый эндоплазматический ретикулум, состоящий из липидного бислоя мембраны из липидов, и изучали его применение в качестве носителя для системы доставки лекарственного средства. Известно, что посредством включения лекарственного средства в липосому может быть изменена стабильность в крови и распределение лекарственного средства in vivo и достижение тканей мишеней может быть улучшено (Journal of Liposome Research, 1994, 4, 667-687). Кроме того, известно, что липосомы с диаметром частиц от 100 до 200 нм легко накапливаются в раковых тканях (Drug Delivery System, 1999, 14, 433-447).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одной из причин низкого противоопухолевого эффекта единственного агента гемцитабина является, например, короткое время удержания гемцитабина в крови. Гемцитабин проявляет выраженную эффективность лекарственного средства в зависимости от времени. Однако его время удержания в крови составляет всего 20 минут и, следовательно, он не способен оказывать достаточный противоопухолевый эффект. Кроме того, другой причиной низкого противоопухолевого эффекта единственного агента гемцитабина является, например, низкая селективность гемцитабина к опухолевой ткани. В случае, когда вводят противоопухолевое средство, оно может быстро элиминироваться из крови или может распределяться в органах, иных, чем мишень. Следовательно, противоопухолевое средство не всегда эффективно накапливается в опухолевой ткани. По этой причине, множество противоопухолевых средств не могут проявлять достаточное противоопухолевое действие в отношении опухолевых тканей и часто сопровождаются нежелательным действием на нормальные ткани (побочные эффекты), вызывая тяжелую токсичность.
Одной причиной низкого противоопухолевого эффекта таксанового противоопухолевого эффекта является то, что, например, таксановая чувствительность для каждой опухоли существенно отличается и эффективность для пациента которого лечат, не увеличивается. По этой причине, необходимо использовать противоопухолевые средства с различными механизмами действия в добавление к таксановому противоопухолевому средству в комбинации.
Кроме того, нельзя сказать, что даже комбинированная терапия, описанная в Journal of Clinical Oncology, 2008, 26 (24), 3950-3957 и в The New England Journal of Medicine, 2013, 369 (18), 1691-1703, имеет достаточно высокие терапевтические эффекты.
Задачей настоящего изобретения является обеспечение противоопухолевого терапевтического средства и набора для лечения опухоли, которые обладают превосходными противоопухолевыми эффектами при сравнении с гемцитабином, таксановым противоопухолевым средством и их комбинированной терапией, которая имеется на рынке.
Авторы настоящего изобретения провели обширные исследования. В результате было обнаружено, что противоопухолевый эффект усиливается путем комбинации таксанового противоопухолевого средства с липосомальной композицией, в которой гемцитабин или его соль содержатся в липосоме, и завершили настоящее изобретение.
То есть, настоящее изобретение обеспечивает следующее.
(1) Противоопухолевое терапевтическое средство, полученное путем смешивания таксанового противоопухолевого средства с липосомальной композицией, в которой гемцитабин или его соль содержится в липосоме.
(2) Противоопухолевое терапевтическое средство по (1), в котором таксановое противоопухолевое средство представляет собой паклитаксел или его соль, или nab-паклитаксел.
(3) Противоопухолевое терапевтическое средство по (1) или (2), в котором таксановым противоопухолевым средством является nab-паклитаксел.
(4) Противоопухолевое терапевтическое средство по любому из пп. (1)-(3), в котором массовое соотношение холестеринов к общему количеству липидов, образующих липосомы, составляет от 10 моль% до 35 моль%, и осмотическое давление внутренней водной фазы липосомы составляет в 2-8 раз осмотического давления внешней водной фазы липосомы.
(5) Противоопухолевое терапевтическое средство по любому из пп. (1)-(4), в котором липосомой является одиночная пластинка.
(6) Противоопухолевое терапевтическое средство по любому из (1)-(5), в котором скорость высвобождения гемцитабина или его соли из композиции липосом в плазме составляет от 10 масс%/24 ч до 70 масс%/24 ч.
(7) Противоопухолевое терапевтическое средство по любому из (1)-(6), в котором липиды, образующие липосомы, содержат гидрогенизированный соевый фосфатидилхолин, 1,2-дистеароил-3-фосфатидилэтаноламинполиэтиленгликоль, и холестерин.
(8) Противоопухолевое терапевтическое средство по любому из (1)-(7), в котором средний диаметр частиц липосомы составляет от 2 нм до 200 нм.
(9) Набор для лечения опухоли, включающий: липосомальную композицию, в которой в липосоме содержатся гемцитабин или его соль; и таксановое противоопухолевое средство.
Кроме того, настоящее изобретение обеспечивает следующее.
(10) Средство, усиливающее противоопухолевый эффект, которое вводят в комбинации с одним или более противоопухолевыми агентами, выбираемыми из таксановых противоопухолевых агентов, включающих: композицию липосом, в которой гемцитабин или его соль содержится в липосоме.
(11) Средство, усиливающее противоопухолевый эффект, по (10), в котором таксановым противоопухолевым средством является паклитаксел или его соль или nab-паклитаксел.
(12) Средство, усиливающее противоопухолевый эффект по (10) или (11), в котором таксановым противоопухолевым средством является nab-паклитаксел.
(13) Средство, усиливающее противоопухолевый эффект, по любому из (10)-(12), в котором массовое соотношение холестеринов к общему количеству липидов, образующих липосомы, составляет от 10 моль% до 35 моль%, и осмотическое давление внутренней водной фазы липосомы составляет от 2 до 8 раз осмотического давления внешней водной фазы липосомы.
(14) Средство, усиливающее противоопухолевый эффект, по любому из (10)-(13), в котором липосомой является одиночная пластинка.
(15) Средство, усиливающее противоопухолевый эффект, по любому из (10)-(14), в котором скорость высвобождения гемцитабина или его соли из липосомальной композиции в плазме составляет от 10 масс%/24 ч до 70 масс%/24 ч.
(16) Средство, усиливающее противоопухолевый эффект, по любому из (10)-(15), в котором липиды, образующие липосомы, содержат гидрогенизированный соевый фосфатидилхолин, 1,2-дистеароил-3-фосфатидилэтаноламинполиэтиленгликоль и холестерин.
(17) Средство, усиливающее противоопухолевый эффект, по любому из (10)-(16), в котором средний диаметр частиц липосомы составляет от 2 нм до 200 нм.
Более того, настоящее изобретение обеспечивает следующее.
(18) Способ лечения опухоли, включающий: комбинацию терапевтически эффективной дозы в случае, когда липосомальная композиция, в которой в липосоме содержится гемцитабин или его соль, используют для комбинированной терапии, с терапевтически эффективной дозой в случае, когда таксановое противоопухолевое средство используют для комбинированной терапии; и введение комбинации в мишень.
(19) Способ лечения опухоли, включающий: введение терапевтически эффективной дозировки в случае, когда липосомальную композицию, в которой в липосоме содержатся гемцитабин или его соль, используют для комбинированной терапии, и терапевтически эффективная доза используемого таксанового противоопухолевого агента для комбинированной терапии для нацеливания одновременно, отдельно, непрерывно или с интервалами.
Более того, настоящее изобретение обеспечивает следующее.
(20) Применение липосомальной композиции, в которой в липосоме содержатся гемцитабин или его соль, для получения противоопухолевого терапевтического средства, полученного путем смешивания липосомальной композиции, в которой в липосоме содержатся гемцитабин или его соль, с одним или более противоопухолевыми средствами, выбираемыми из таксановых противоопухолевых агентов.
(21) Композиция липосом, в которой гемцитабин или его соль содержится в липосомах, для лечения опухоли, где композицию липосом используют так, чтобы вводить в комбинации с одним или более противоопухолевыми средствами, выбираемыми из таксановых противоопухолевых агентов.
Противоопухолевое терапевтическое средство и набор для лечения опухоли по настоящему изобретению имеет превосходные эффекты регресса опухоли и отсрочки роста опухоли при сравнении с единственным агентом гемцитабином, единственным таксановым противоопухолевым средством, или комбинированным применением гемцитабина и таксанового противоопухолевого средства.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
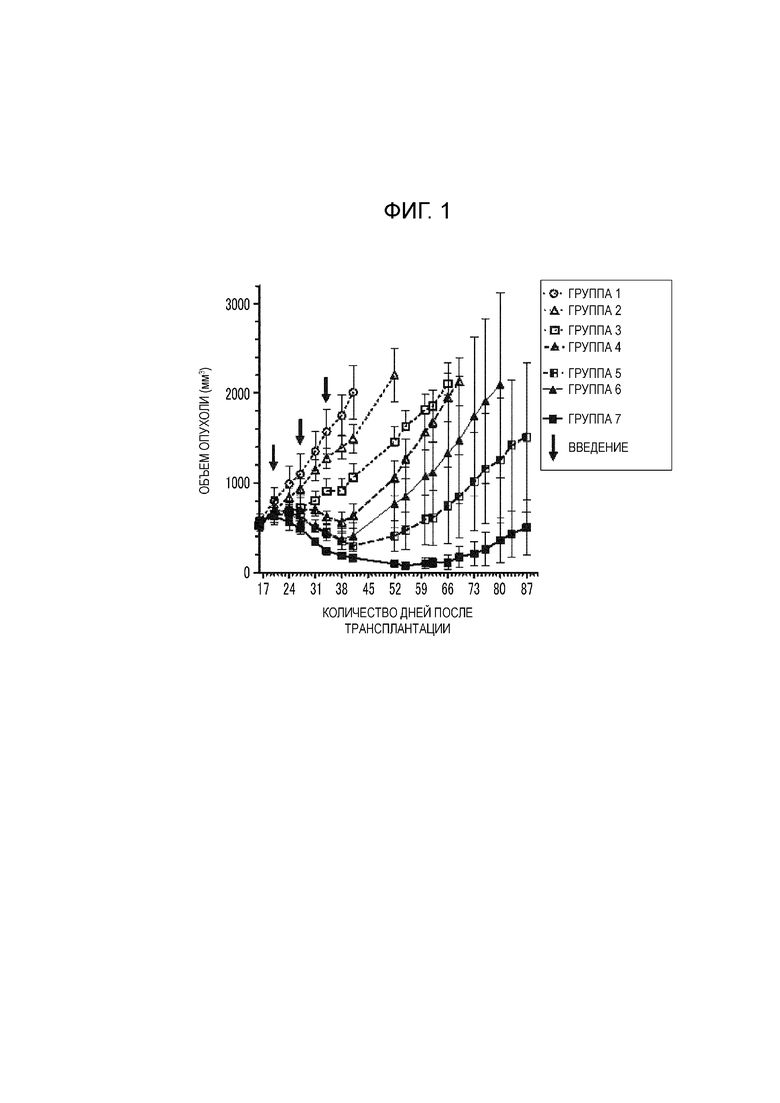
Фиг. 1 представляет график, показывающий изменение объема опухоли в модели мышей, несущих подкожную трансплантированную опухоль Capan-1.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящей спецификации числовой диапазон, представленный ʺдоʺ показывает диапазон, включающий числовые значения, обозначенные до и после ʺдоʺ в виде минимального значения и максимального значения.
В настоящем изобретении, если не указано иначе, % обозначает процент по массе.
В настоящей спецификации количество каждого компонента в композиции обозначает, если не указано иначе, общее количество множества веществ, присутствующих в композиции, в случае, когда множество веществ, соответствующих каждому компоненту, присутствует в композиции.
"Высвобождение" обозначает, что лекарственное средство, содержащееся в липосомах, проходит через липидную мембрану, образующую липосомы, и высвобождается наружу липосом.
"Скорость высвобождения" обозначает количество лекарственного средства, содержащееся в липосоме, которое проходит через липидную мембрану, образующую липосомы, и высвобождается снаружи липосом, за единицу времени.
"Удерживающая способность в крови" обозначает свойство, при котором лекарственное средство, содержащееся в липосомах, присутствует в крови в мишени, в которую вводят липосомы.
"Средний диаметр частиц липосом" обозначает объемный средний диаметр частиц липосом, присутствующих в липосомальной композиции. Средний диаметр частиц липосом, содержащихся в композиции липосом по настоящему изобретению, измеряют посредством метода динамического рассеяния света. Примеры коммерчески доступных устройств для определения с использованием динамического рассеяния света включают анализатор концентрированных частиц FPAR-1000 (производимый OTSUKA ELECTRONICS Co., LTD.), NANOTRAC UPA (производимый Nikkiso Co., Ltd.), и NANOSIZER (производимый Malvern Instruments Ltd.)
"Мишенью" является млекопитающее, такое как человек, мышь, обезьяна или домашнее животное, требующее профилактики или лечения опухоли, и предпочтительно является человек, который требует его профилактики или лечения.
Примеры "опухоли" включают рак молочной железы, рак эндометрия, рак яичника, рак предстательной железы, рак легкого, рак желудка (желудочная аденокарцинома), немелкоклеточный рак легкого, рак поджелудочной железы, плоскоклеточный рак головы и шеи, рак пищевода, рак мочевого пузыря, меланому, колоректальный рак, почечноклеточную карциному, не-Ходжкинскую лимфому и уротелиальный рак.
Далее настоящее изобретение будет описано подробно.
(Таксановое противоопухолевое средство)
Примеры таксанового противоопухолевого средства включают фармацевтическую композицию, которая содержит таксановый цикл, или соединение, которое имеет структуру, аналогичную таксановому циклу, в качестве активного компонента.
Специфические примеры таксанового прротивоопухолевого средства включают паклитаксел, доцетаксел, кабазитаксел, тезетаксел и ортатаксел и их соли или производные.
Примеры соли включают соли основных групп, таких как аминогруппы, и кислых групп, таких как гидроксильные группы и карбоксильные группы, которые обычно известны.
Примеры солей основных групп включают соли минеральных кислот, таких как соляная кислота, бромистоводородная кислота, азотная кислота и серная кислота; соли органических карбоновых кислот, таких как муравьиная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, яблочная кислота, виннокаменная кислота, аспарагиновая кислота, и трихлоруксусная кислота и трифторуксусная кислота; и соли сульфоновых кислот, таких как метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, мезитиленсульфоновая кислота и нафталансульфоновая кислота.
Примеры солей кислых групп включают соли щелочных металлов, таких как натрий и калий; соли щелочно-земельных металлов, таких как кальций и магний; соли аммония; и соли азот-содержащих органических оснований, таких как триметиламин, триэтиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, N-метилморфолин, диэтиламин, дициклогексиламин, прокаин, дибензиламин, N-бензил-β-фенетиламин, 1-эфенамин, и N,N'-дибензилэтилендиамин.
Пример производных паклитаксела включает nab-паклитаксел (альбумин-связанный паклитаксел).
В качестве таксанового противоопухолевого агента паклитаксел или его соль или nab-паклитаксел является предпочтительным и nab-паклитаксел является более предпочтительным.
Таксановое противоопухолевое средство может содержать добавки, такие как вспомогательное вещество, вяжущее вещество, смазывающее вещество, дезинтегрирующее вещество, краситель, ароматизатор, эмульгатор, поверхностно-активное вещество, растворяющее средство, суспендирующее средство, изотоническое средство, буферное средство, консервант, антиоксидант, стабилизатор и ускоритель абсорбции, которые использовали для рецептирования.
Примеры путей введения таксановых противоопухолевых средств включают метод внутривенной инъекции, метод внутриартериальной инъекции, метод интраректальной инъекции, метод интраперитонеальной инъекции, метод внутримышечной инъекции, метод инъекции в опухоль или метод инъекции в пузырь, или методы, такие как пероральное введение, трансдермальное введение и методы с использованием суппозиториев. Относительно дозировки и количества раз введения для взрослых, 0,01-1000 мг/кг лекарственного средства могут быть введены, например, один или несколько раз отдельно в сутки посредством перорального или неперорального введения (например, инъекция, инстилляция и введение в колоректальную область). Примеры лекарственных форм включают таблетки, капсулы, порошки, сиропы, гранулы, пилюли, суспензии, эмульсии, растворы, композиции порошков, суппозитории, глазные капли, назальные капли, ушные капли, пластыри, мази и инъекции.
(Липосомы)
Липосома представляет собой закрытый эндоплазматический ретикулум, образованный из двухслойной липидной мембраны с использованием липида и имеет водную фазу (внутреннюю водную фазу) в пространстве закрытого эндоплазматического ретикулума. Внутренняя водная фаза содержит воду и подобное. Липосомы обычно существуют в состоянии дисперсии в водном растворе (внешняя водная фаза) снаружи закрытого эндоплазматического ретикулума. Липосомой может быть одиночная пластинка (также называемая однослойной пластинкой или унипластинкой, со структурой одиночного слоя двухслойной мембраны), или может быть многослойная пластинка (также называемая мультипластинкой со структурой множества двухслойных мембран имеющих форму лука, в которой каждый из слоев разделен водным слоем). Однако липосома из одиночной пластинки является предпочтительной в настоящем изобретении с точки зрения безопасности и стабильности при медицинском применении.
Форма липосомы особо не ограничена, пока она является липосомой, способной содержать лекарственное средство. "Содержащий" обозначает форму, в которой лекарственное средство включают во внутреннюю водную фазу и мембрану как таковую в липосоме. Например, форма, в которой лекарственное средство содержится в закрытом пространстве, образованном из мембраны, форма, в которой лекарственное средство содержится в мембране как таковой, или их комбинация может быть использована.
Средний диаметр частиц липосом особо не ограничен, но предпочтительно составляет от 2 нм до 200 нм, более предпочтительно от 5 нм до 150 нм, еще более предпочтительно от 5 нм до 120 нм, и наиболее предпочтительно от 5 нм до 100 нм.
Предпочтительно, чтобы липосома имела сферическую форму или форму, близкую к таковой.
Компоненты, образующие липидный бислой липосомы, выбирают из липидов. Липид, растворенный в смешанном растворителе из водорастворимого органического растворителя и органического растворителя на основе сложного эфира, может быть необязательно использован в качестве липидов. Примеры липидов включают фосфолипиды, холестерины и их производные. Такие компоненты могут быть образованы из одиночного компонента или множества видов компонентов.
Примеры фосфолипидов включают натуральные или синтетические фосфолипиды, такие как фосфатидилхолин (лецитин), фосфатидилглицерин, фосфатидовая кислота, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, сфингомиелин, и кардиолипин, или вещества, гидрогенизированные с ними (например, гидрогенизированный соевый фосфатидилхолин (HSPC)). Среди таковых гидрогенизированные фосфолипиды, такие как гидрогенизированный соевый фосфатидилхолин или сфингомиелин являются предпочтительными и гидрогенизированный соевый фосфатидилхолин является более предпочтительным. В настоящем изобретении "фосфолипиды" также включают производные фосфолипидов, модифицированные фосфолипидами.
Пример липидов, иных, чем фосфолипиды, включают липиды, не содержащие фосфорной кислоты. Их примеры включают глицеролипиды, не имеющие фрагмента фосфорной кислоты в молекуле, и сфинголипиды, не имеющие фрагмента фосфорной кислоты в молекуле. В настоящем изобретении, "липиды, иные, чем фосфолипиды" также включают производные липидов, иных, чем фосфолипиды, модифицированные липидами, иными, чем фосфолипиды.
В случае вещества, в котором соединение, имеющее основную функциональную группу, связано с липидом, липид называется катионизированным липидом. Катионизированный липид может модифицировать, например, мембрану липосомы и, следовательно, может усиливать адгезивность и подобное в отношении клеток в областях мишенях.
Примеры холестеринов включают холестерин, в котором циклопентагидрофенантрен является основным скелетом и часть или все углероды являются гидрогенизированными, и их производные. Их пример включает холестерин. В случае, когда средний диаметр частиц уменьшен до менее чем или равно 100 нм, кривизна липидной мембраны увеличивается. Так как искривление мембран, расположенных в липосомах, также увеличивается, повышается вероятность вытекания водорастворимого лекарственного средства. Эффективно добавлять холестерин или подобные с целью заполнения искривления мембран из-за липидов (мембран-стабилизирующий эффект), что означает подавлять вытекание.
Ожидают, что добавление холестерина к липосомам снижает текучесть мембран липосом посредством, например, заполнения щели между мембранами липосом. В общем, желательно, чтобы холестерин обычно содержался в липосомах в количестве около 50 моль% в общем (всего липидов) моль липидных компонентов. Однако, в липосомах с высоким осмотическим давлением внутренней водной фазы оптимальный диапазон количества холестерина неизвестен.
Относительное содержание холестеринов в отношении общего количества липидов, образующих липосомы, в соответствии с настоящим изобретением составляет от 10 моль% до 35 моль%, предпочтительно от 15 мол% до 25 моль%, и более предпочтительно от 17 моль% до 21 моль%. Путем установки относительного содержания холестеринов в отношении общего количества липидов, образующих липосому, от 10 моль% до 35 моль%, возможно получить композицию липосом, в которой достигаются и простота высвобождения лекарственного средства и стабильность при хранении.
В добавление к вышеописанным компонентам гидрофильный полимер или подобные для улучшения удерживания в крови, жирная кислота, диацетилфосфат или подобные, как стабилизатор структуры мембраны, и α-токоферол или подобные в качестве антиоксиданта могут быть добавлены к липосоме. В настоящем изобретении предпочтительно не использовать добавки, такие как поверхностно-активные вещества, например, вспомогательные вещества для диспергирования, которые не позволено использовать во внутривенных инъекциях в медицинском применении.
В липосоме по настоящему изобретению фосфолипиды, липиды, иные, чем фосфолипиды, холестерины, или холестерины являются предпочтительно модифицированными гидрофильными полимерами, как фосфолипиды, липиды иные, чем фосфолипиды, холестерины и их производные.
Примеры гидрофильных полимеров включают полиэтиленгликоли, полиглицерины, полипропиленгликоли, поливиниловый спирт, стирол-ангидрид малеиновой кислоты чередующиеся сополимеры, полиинилпирролидон и синтетическую полиаминокислоту. Вышеописанные гидрофильные полимеры могут быть использованы отдельно или в комбинации двух или более из них.
Среди них, с точки зрения удержания в крови композиции полиэтиленгликоли, полиглицерины и полипропиленгликоли являются предпочтительными, и полиэтиленгликоль (PEG), полиглицерин (PG), и полипропиленгликоль (PPG) являются более предпочтительными. Полиэтиленгликоль (PEG) является более предпочтительным с точки зрения универсальности и удержания в крови.
Молекулярная масса PEG особо не ограничена, но составляет от 500 Дальтон до 10000 Дальтон, предпочтительно от 1000 Дальтон до 7000 Дальтон и более предпочтительно от 2000 Дальтон до 5000 Дальтон.
В липосомах по настоящему изобретению предпочтительно использовать липид, модифицированный PEG (PEG-модифицированный липид) вместе с основным липидом, содержащимся в липосоме. Примеры PEG-модифицированных липидов включают 1,2-дистеароил-3-фосфатидилэтаноламин-PEG2000 (производимый NOF CORPORATION), 1,2-дистеароил-3-фосфатидилэтаноламин-PEG5000 (производимый NOF CORPORATION), и 1,2-дистеароил-3-фосфатидилэтаноламин-полиэтиленгликоль, такой как дистеароилглицерин-PEG2000 (производимый NOF CORPORATION). Такие PEG-модифицированные липиды могут быть добавлены так, что содержится от 0,3 до 50 масс%, предпочтительно от 0,5 до 30 масс%, и более предпочтительно от 1 до 20 масс% в отношении общего количества липида.
В липосоме в соответствии с настоящим изобретением комбинация гидрогенизированного соевого фосфатидилхолина (липида, содержащегося в липосоме), 1,2-дистеароил-3-фосфатидилэтаноламинполиэтиленгликоля (липида, используемого вместе с основным липидом), и липида холестерина является предпочтительной.
В липосомах по настоящему изобретению предпочтительно не содержится анионного полимера (полианиона).
(Лекарственное средство)
Липосомы по настоящему изобретению содержат по меньшей мере гемцитабин или его соль в качестве лекарственного средства.
Примеры соли гемцитабина включают соли основных групп, таких как аминогруппы, и кислых групп, таких как гидроксильные группы и карбоксильные группы, которые обычно известны.
Примеры солей основных групп включают соли минеральных кислот, таких как соляная кислота, бромистоводородная кислота, азотная кислота и серная кислота; соли органических карбоновых кислот, таких как муравьиная кислота, уксусная кислота, лимонная кислота, щавелевая кислота фумаровая кислота, малеиновая кислота, янтарная кислота, яблочная кислота, виннокаменная кислота, аспарагиновая кислота и трихлоруксусная кислота и трифторуксусная кислота; и соли сульфоновых кислот, таких как метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, мезитилсульфоновая кислота и нафталансульфоновая кислота.
Примеры солей кислых групп включают соли щелочных металлов, таких как натрий и калий; соли щелочно-земельных металлов, таких как кальций и магний; соли аммония; и соли азот-содержащих органических оснований, таких как триметиламин, триэтиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, N-метилморфолин, диэтиламин, дициклогексиламин, прокаин, дибензиламин, N-бензил-?-фенэтиламин, 1-эфенамин, и N,N'-дибензилэтилендиамин.
Гидрохлорид является предпочтительным в качестве соли гемцитабина.
Содержание гемцитабина предпочтительно составляет от 0,1 до 2,0 мг/мл и более предпочтительно от 0,2 до 1,0 мг/мл в отношении липосомальной композиции.
(Лекарственное средство, содержащееся в растворенном состоянии)
Лекарственное средство (гемцитабин или его соль), содержащееся в липосомах в соответствии с настоящим изобретением, присутствует в растворенном состоянии во внутренней водной фазе липосом. Здесь, растворенное состояние расценивают как состояние, в котором лекарственное средство содержится в растворенном состоянии в случае, когда количество лекарственного средства, загруженное в отношении объема липосом, является меньшим или равным насыщающей растворимости лекарственного средства во внутренней водной фазе. Кроме того, в случае, когда кристаллы лекарственного средства не наблюдают с помощью Cryo-TEM даже при большей чем или равной насыщающей растворимости, или в случае, когда не наблюдают дифракционной картины из-за кристаллической решетки посредством измерения XRD, считают, что большая часть лекарственного средства, содержащегося в липосомах, растворяется и содержится в растворенном состоянии. В таком случае считают, что развивается улучшение растворимости из-за физико-химического окружения, создаваемого липидной мембраной или частичным включением лекарственного средства в липидную мембрану.
(Композиция липосом)
Композиция липосом по настоящему изобретению может содержать липосомы, содержащие гемцитабин или его соль, и водный раствор, в котором липосомы диспергированы.
В липосомах по настоящему изобретению осмотическое давление внутренней водной фазы липосом составляет предпочтительно от 2 до 8 раз, более предпочтительно от 2,5 до 6 раз и еще более предпочтительно от 3 до 5 раз внешней водной фазы липосом. Посредством установки осмотического давления внутренней водной фазы от 2 до 8 раз осмотического давления внешней водной фазы, возможно достичь и простоту высвобождения лекарственного средства и стабильность при хранении.
Возможно соответствующим образом добавлять водный растворитель, добавку и подобные к композиции липосом. Композиция липосом может содержать по меньшей мере один из фармацевтически приемлемых изотонических средств, стабилизаторов, антиоксидантов и регуляторов рН в отношении пути введения.
Изотонические средства особо не ограничены, но их примеры включают неорганические соли, такие как хлорид натрия, хлорид калия, гидрофосфат натрия, дигидрофосфат натрия, и дигидрофосфат калия, полиолы, такие как глицерин, маннит и сорбит, и сахариды, такие как глюкоза, фруктоза, лактоза или сахароза.
Стабилизатор особо не ограничен, но его примеры включают сахариды, такие как глицерин, маннит, сорбит, лактоза, или сахароза.
Антиоксиданты особо не ограничены, но их примеры включают аскорбиновую кислоту, мочевую кислоту, гомологи токоферола (например, витамин E или четыре изомера токоферола α, β, γ и δ) цистеин, и этилендиаминтетрауксусную кислоту (EDTA). Вышеописанный стабилизатор и антиоксидант могут быть использованы отдельно или в комбинации двух или более из них.
Примеры регуляторов pH включают гидроксид натрия, лимонную кислоту, уксусную кислоту, триэтаноламин, гидрофосфат натрия, дигидрофосфат натрия, и гидрофосфат калия.
Липосомальная композиция может содержать фармацевтически приемлемый органический растворитель, коллаген, поливиниловый спирт, поливинилпирролидон, карбоксивиниловый полимер, карбоксиметилцеллюлозу натрия, полиакрилат натрия, альгинат натрия, водорастворимый декстран, карбоксиметилкрахмал натрия, пектин, метилцеллюлозу, этилцеллюлозу, ксантановую камедь, гуммиарабик, казеин, желатин, агар, диглицерин, пропиленгликоль, полиэтиленгликоль, вазелин, парафин, стеариловый спирт, стеариновую кислоту, человеческий альбумин сыворотки (HSA), маннит, сорбит, лактозу, PBS, хлорид натрия, сахариды, разлагаемый in vivo полимер, среду без сыворотки и добавки, которые являются приемлемыми в качестве фармацевтической добавки.
В частности, липосомальная композиция по настоящему изобретению предпочтительно содержит сульфат аммония, L-гистидин, очищенный белый сахар, гидроксид натрия или соляную кислоту.
Контейнер для заполнения липосомальной композицией особо не ограничен, но является предпочтительно материалом, имеющим низкую проницаемость для кислорода. Его пример включает пакет с использованием ламинированной пленки, имеющей пластиковый контейнер, стеклянный контейнер, алюминиевую фольгу, пленку с алюминиевым напылением, пленку с напылением оксида алюминия, пленку с напылением диоксида кремния, поливиниловый спирт, сополимер этилена и винилового спирта, полиэтилентерфталат, полиэтиленнафталат, поливинилидена хлорид и подобные в качестве слоя газового барьера. Возможно устранять свет путем использованием пакета, когда необходимо, в котором используют окрашенное стекло, алюминиевую фольгу, пленку с отложением паров алюминия или подобные.
В контейнере, заполненном липосомальной композицией предпочтительно заменять газ в пространстве контейнера и в лекарственном растворе инертным газом, таким как азот, с целью предотвращения окисления, вызванного кислородом, присутствующим в пространстве в контейнере. Например, может быть проведено барботирование азота инъекционного раствора и заполнение контейнера в атмосфере азота.
(Скорость высвобождения)
В липосомальной композиции по настоящему изобретению скорость высвобождения лекарственного средства (гемцитабина или его соли) предпочтительно составляет от 10 масс%/24 ч до 70 масс%/24 ч, более предпочтительно от 20 масс%/24 ч до 60 масс%/24 ч, и еще более предпочтительно от 20 масс%/24 ч до 50 масс%/24 ч.
Так как скорость высвобождения зависит от температуры предпочтительно измерять скорость высвобождения в условиях постоянной температуры. Например, в случае людей, температура особо не ограничена, но предпочтительно измерить скорость высвобождения в диапазоне температуры тела (35°C-38°C).
В случае, когда скорость высвобождения лекарственного средства (гемцитабина или его соли) составляет менее чем 15 масс%/24 ч, не может быть получено достаточное время воздействия на организм, и во множестве случаев не может быть получена ожидаемая эффективность лекарственного средства. В зависимости от обстоятельств, липосомы, содержащие лекарственное средство, остаются в организме в течение необязательно длительного периода времени, и, следовательно, в некоторых случаях, неожиданная токсичность может осуществляться из-за накопления липосом в тканях, таких как кожа, в которой липосомы с трудом нормально распределяются. Кроме того, в случае, когда скорость высвобождения выше, чем 70 масс%/24 ч, количество воздействующего лекарственного средства на единицу времени увеличивается. Следовательно, токсичность увеличивается при увеличении максимальной концентрации в крови. Кроме того, вытекшее лекарственное средство распределяется в тканях, иных, чем область опухоли, или подвергается быстрому метаболизму, и, следовательно, удержание в крови снижается, что не является предпочтительным.
Способ измерения скорости высвобождения лекарственного средства особо не ограничен. Однако, после введения лекарственного средства определенному млекопитающему, в систему модель или подобное, кровь, плазму или подобное собирают у млекопитающего или в модельной системе каждую единицу времени и при необходимости проводят предварительную обработку или подобное. Более того, целевое лекарственное средство может быть оценено посредством способа, такого как жидкостная высокоэффективная хроматография или масс спектрометрия.
(Способ получения липосомальной композиции)
Липосомальная композиция по настоящему изобретению может быть получена посредством: стадии эмульгации липидов, растворенных в органическом растворителе, для получения липосом без пропускания через стадию сушки и отвердевания; стадии нагрузки лекарственным средством, содержащим гемцитабин или его соль в липосомах, полученных на стадии эмульгации; и стадии регуляции осмотического давления внутренней водной фазы липосомы от 2 до 8 раз осмотического давления внешней водной фазы липосомы.
Способ получения композиции липосом может включать другие стадии, такие как стадия выпаривания испарения органического растворителя с использованием стадии эмульгирования, асептической фильтрации и асептического заполнения, если необходимо.
(Стадия эмульгирования)
На стадии эмульгирования водная фаза может быть смешана с масляной фазой, в которой по меньшей мере один вид липидов растворяется в органическом растворителе, и водный раствор, содержащий липид, может быть перемешан и эмульгирован. Посредством осуществления смешивания, перемешивания и эмульгирования водной фазы и масляной фазы, в которой липид растворен в органическом растворителе, получают эмульсию, в которой масляную фазу и водную фазу эмульгируют по типу М/В. После смешивания часть или весь органический растворитель, полученный из масляной фазы, удаляют посредством стадии выпаривания, как будет описано ниже для получения липосомы. Альтернативно, часть или весь органический растворитель в масляной фазе выпаривают в процессе перемешивания и эмульгирования с образованием липосом.
В качестве метода перемешивания ультразвуковую волну или силу механического сдвига используют для уменьшения частиц. Кроме того, с целью получения однородного диаметра частиц, экструзивную обработу или обработку в микрофлюидизаторе можно проводить посредством фильтра, имеющего постоянный диаметр пор. С использованием экструдера или подобного, вторично образованные мультивезикулярные липосомы могут высвобождаться с образованием одновезикулярной липосомы. В настоящем изобретении с точки зрения упрощения стадии получения предпочтительно использовать липосомы в состоянии, в котором лекарственное средство не загружают на следующей стадии без обработки экструзией.
В настоящем изобретении средний диаметр частиц липосом, которые получают, можно регулировать посредством необязательно выбора скорости и времени перемешивания. С точки зрения получения липосом, имеющих безопасность и стабильность, предпочтительно применять сдвиг к водному раствору, содержащему липиды, со скоростью вращения выше чем, или равной 20 м/сек. Сдвиг не ограничен. Однако, специфически, предпочтительно применять сдвиг со скоростью вращения 20 м/сек до 35 м/сек и более предпочтительно применять сдвиг со скоростью вращения от 23 м/сек до 30 м/сек.
Стадия эмульгирования не ограничена, пока она является стадией эмульгирования, но предпочтительно является стадией применения высокого сдвига и образования мелких частиц на стадии эмульгирования, в которых содержится органический растворитель. Липосомы могут быть образованы путем выпаривания (удаления растворителя) органического растворителя, используемого на стадии эмульгирования, при необходимости.
Температуру жидкости на стадии эмульгирования в случае получения липосом можно соответственно контролировать. Температура жидкости в момент смешивания масляной фазы с водной фазой предпочтительно выше чем, или равна температуре перехода фаз липида, который используют. Например, в случае, когда используют липид, имеющий температуру перехода фаз от 35°C до 40°C, температура жидкости предпочтительно составляет от 35°C до 70°C.
(Масляная фаза)
Смешанный растворитель водорастворимого органического растворителя и органического растворителя на основе сложного эфира используют в качестве органического растворителя, используемого в качестве масляной фазы. В настоящем изобретении предпочтительно по существу не использовать органические растворители, такие как хлороформ, метиленхлорид, гексан, циклогексан и подобные в качестве органических растворителей, и более предпочтительно не использовать такие органические растворители совсем.
Водорастворимым органическим растворителем предпочтительно является органический растворитель, имеющий свойства необязательного смешивания с водой. Примеры водорастворимого органического растворителя включают спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, и т-бутанол, гликоли, такие как глицерин, этиленгликоль и пропиленгликоль, и полиалкиленгликоли, такие как полиэтиленгликоль. Среди них спирты являются предпочтительными. В качестве спиртов по меньшей мере один, выбираемый из этанола, метанола, 2-пропанола, и т-бутанола, является предпочтительным, по меньшей мере один, выбираемый из этанола, 2-пропанола, и t-бутанола, является более предпочтительным и этанол является еще более предпочтительным.
Растворителем на основе сложного эфира предпочтительно является сложный эфир, полученный из реакции между органической кислотой и спиртом. Примеры органического растворителя на основе сложного эфира включают этилацетат, метилацетат, изопропилацетат, т-бутилацетат, и метилпропионат. По меньшей мере один, выбираемый из этилацетата, изопропилацетата и метилпропионата, является предпочтительным и этилацетат является более предпочтительным.
Соотношение смешивания водорастворимого растворителя и органического растворителя на основе сложного эфира может быть установлено, по массовому соотношению, например, 90:10-30:70, и составляет предпочтительно от 80:20 до 40:60 и более предпочтительно от 80:20 до 70:30. Смешанный растворитель водорастворимого растворителя и органического растворителя на основе сложного эфира может дополнительно содержать водорастворимый растворитель, такой как вода или буферный раствор. Водный растворитель может быть добавлен в диапазоне от, например, 1 до 30 масс%. pH смешанного раствора может быть установлен, например, от 3 до 10, и составляет предпочтительно от 4 до 9. Органический растворитель на основе сложного эфира может содержать физиологически активные вещества, такие как различные лекарственные средства, растворимые в таких растворителях.
В случае, когда этанол используют в качестве водорастворимого органического растворителя и этилацетат используют в качестве органического растворителя на основе сложного эфира, соотношение смешивания этанола к этилацетату может быть установлено, например, от 80:20-70:30 по массовому соотношению.
Концентрация липида особо не ограничена и может быть соответствующим образом отрегулирована. Однако, в растворе с использованием смешанного раствора водорастворимого органического растворителя и органического растворителя на основе сложного эфира, в качестве растворителя, концентрация может быть установлена от 40 г/л до 250 г/л, и составляет предпочтительно от 100 г/л до 200 г/л.
(Водная фаза)
Водная фаза означает внешнюю водную фазу и внутреннюю водную фазу.
Внешняя водная фаза в настоящем изобретении обозначает водный раствор, в котором диспергированы липосомы. В случае инъекций, например, раствор, располагающийся снаружи липосом дисперсионной жидкости липосом, хранящейся упакованной во флаконе или предварительно заполненном шприце становится внешней водной фазой. Кроме того, относительно раствора, диспергированного в момент использования при введении с использованием приложенной жидкости для диспергирования или другой растворяющей жидкости, раствор, окружающий внешне липосомы в жидкости, диспергирующей липосомы, становится внешней водной фазой.
Внутренняя водная фаза в настоящем изобретении обозначает водную фазу в закрытом эндоплазматическом ретикулуме, отделенном двухслойной липидной мембраной липосом.
В случае получения липосом воду (дистиллированную воду, воду для инъекций или подобные), физиологический раствор, различные буферные растворы или водные растворы сахаридов и их смеси (водный растворитель) предпочтительно используют в качестве водных растворителей (внешняя водная фаза), в которых диспергированы липосомы. Буферный раствор не ограничен органическим типом и неорганическим типом. Однако, буферный раствор, имеющий буферное действие около концентрации ионов водорода, близких к жидкости тела, соответствующим образом используют, и их примеры включают фосфатный буферный раствор, Tris буферный раствор, цитратный буферный раствор, ацетатный буферный раствор и буферный раствор Гуда. pH водной фазы может быть установлен, например, от 5 до 9, и составляет предпочтительно от 7 до 8. Предпочтительно использовать фосфатный буферный раствор (например, pH=7,4) в качестве водного раствора (внешняя водная фаза), в котором диспергированы липосомы. В случае получения липосом внутренней водной фазой липосом может быть водный раствор, в котором диспергированы липосомы, или вода, физиологический раствор, различные буферные растворы или водные растворы сахаридов и их смеси. Вода, используемая в качестве внешней водной фазы или внутренней водной фазы, предпочтительно не содержит примесей (таких как пыль и химические вещества).
Физиологический солевой раствор обозначает раствор неорганической соли, доведенный до изотонического состояния с человеческим организмом, и может иметь буферную функцию. Примеры физиологического раствора включают солевой раствор, содержащий 0,9 масс/об% хлорида натрия, фосфатный буферный физиологический раствор (далее также называемый как PBS), и Tris-буферный физиологический раствор.
Водный раствор, содержащий липосомы, полученный посредством стадии эмульгирования, подвергали последующей обработке посредством методов, таких как центрифужная сепарация, ультрафильтрация, диализ, гель-фильтрация или лиофилизация с целью удаления компонентов, не содержащихся в липосомах, или регуляции концентрации или осмотического давления.
(Экструзионная обработка)
Экструзионная обработка обозначает стадию применения силы физического сдвига путем пропускания липосом через фильтр, имеющий поры для атомизации. В случае пропускания липосом через фильтр, атомизацию можно быстро проводить путем поддержания температуры жидкой дисперсии липосом и фильтра при температуре выше чем, или равной температуре перехода фаз мембран, образующих липосомы.
(Стадия выпаривания)
Стадия выпаривания может быть обеспечена в способе получения композиции липосом, если необходимо. В стадии выпаривания органический растворитель выпаривают из водного раствора, содержащего липосомы, полученного на стадии эмульгации. В настоящем изобретении стадия выпаривания включает по меньшей мере стадию принудительного удаления части или всего органического растворителя, полученного из масляной фазы в качестве стадии выпаривания и стадию натурального выпаривания части или всего органического растворителя в масляной фазе в процессе перемешивания и эмульгирования.
Способ выпаривания органического растворителя на стадии выпаривания особо не ограничен. Однако например, по меньшей мере одна стадия выпаривания органического растворителя посредством нагревания, стадия оставления или продолжения аккуратного перемешивания после эмульгирования и стадия осуществления вакуумной дегазации могут быть проведены.
На стадии выпаривания органического растворителя предпочтительно установить концентрацию органического растворителя, содержащегося в водном растворе, содержащем липосомы, до менее чем или равно 15 масс% в течение 30 минут с начала стадии выпаривания органического растворителя.
(Стадия нагрузки лекарственным средством)
На стадии нагрузки лекарственным средством в случае, когда лекарственное средство (гемцитабин или его соль) содержится в липосоме, лекарственное средство может быть растворено в водной среде, в которой лекарственное средство гидратируется и набухает, и может включаться во внутреннюю водную среду липосомы посредством метода, такого как нагревание при температуре выше чем или равной температуре перехода фаз, ультразвуковая обработка или экструдирование. Кроме того, лекарственное средство может быть растворено в водной фазе во время эмульгирования липидов и содержаться во внутренней водной фазе.
(Стадия регуляции осмотического давления)
Стадия регуляции осмотического давления обозначает стадию регуляции осмотического давления внутренней водной фазы и внешней водной фазы липосом. Скорость высвобождения можно регулировать посредством регуляции осмотического давления внутренней и внешней водной фазы липосом. Стадия регуляции осмотического давления особо не ограничена, но ее пример включает диализ. В способе получения по настоящему изобретению предпочтительно одновременно проводить стадию включения противоракового средства аналога нуклеиновых кислот в липосомы и стадию регуляции осмотического давления с точки зрения эффективности продукции.
Растворенные вещества во внешней водной фазе и внутренней водной фазе в жидкости, полученной после стадии нагрузки лекарственным средством, гомогенизируют, и осмотическое давление в этот момент может быть определено как осмотическое давление внутренней водной фазы липосом, которые получают. Однако, на следующей стадии регуляции осмотического давления и замены, проводимой посредством диализа, внешней водной фазы, операцию нагревания ограничивают случаем, когда растворенное вещество внутренней водной фазы достаточно удерживается, например, путем регуляции температуры до ниже чем или равной температуре перехода фаз липида. Осмотическое давление внешней водной фазы также может быть определено как осмотическое давление диализирующего раствора, используемого на конечной стадии диализа. Однако это ограничено случаем, когда достаточно проводить замену диализного раствора. Кроме того, относительно полученной жидкости липосомальной композиции также возможно получить осмотическое давление внутренней водной фазы и внешней водной фазы путем количественного определения концентрации композиции растворенного вещества внешней водной фазы и концентрации композиции растворенного вещества во внутренней водной фазе посредством центрифужного сепарирования или ультрацентрифугирования и измерения осмотического давления жидкости композиции.
Осмотическое давление внутренней водной фазы липосом предпочтительно регулируют как 2-8 раз осмотического давления внешней водной фазы липосом, более предпочтительно от 2,5 до 6 раз осмотического давления внешней водной фазы липосом, и еще более предпочтительно от 3 до 5 раз осмотического давления внешней водной фазы липосом.
Осмотическое давление может быть измерено в соответствии с методом осмометрии, описанным в Японской Фармакопее, 16е издание. Более специфически, осмолярность может быть получена путем измерения нисходящего градуса температуры замерзания воды. Кроме того, нисходящий градус температуры замерзания воды определяют по молярности растворенного вещества и осмолярность также может быть получена из молярности растворенного вещества.
Осмотическое давление внешней водной фазы оказывает обязательный эффект на живой организм при введении. В случае, когда осмотическое давление внешней водной фазы далеко от осмотического давления жидкости организма, из-за движения воды в тканях развиваются гемолиз или боль. Соответственно, осмотическое давление внешней водной фазы составляет предпочтительно от 200 мОсмоль/л до 400 мОсмоль/л, более предпочтительно от 250 мОсмоль/л до 350 мОсмоль/л, и еще более предпочтительно изотоничной с жидкостью тела.
Асептическая фильтрация
Композицию липосом предпочтительно подвергают асептической фильтрации. В результате метода фильтрации нежелательные вещества могут быть удалены из водного раствора, содержащего липосомы с использованием пористой волокнистой мембраны, обратной осмотической мембраны, мембранного фильтра или подобного. В настоящем изобретении фильтрацию предпочтительно проводят с использованием фильтра, имеющего диаметр стерилизуемых пор (предпочтительно фильтр для фильтрационной стерилизации 0,2 мкм).
С целью предотвращения влияния на средний размер частиц деформации липосом, предпочтительно проводить стадию асептической фильтрации и стадию асептического заполнения, как описано ниже, при температуре ниже чем или равной температуре перехода фаз жидкости, образующих липосомы. Например, в случае, когда температура перехода фаз жидкости составляет около 50°C, от около 0°C до 40°C является предпочтительно и от около 5°C до 30°C является более специфически предпочтительной.
(Асептическое заполнение)
Композицию липосом, полученную после асептической фильтрации, предпочтительно подвергают ацептическому заполнению для медицинского применения. Может быть применен хорошо известный метод асептического заполнения. Возможно получить подходящую композицию липосом для медицинского применения посредством асептического заполнения ею контейнера.
(Противоопухолевое терапевтическое средство)
Противоопухолевое терапевтическое средство по настоящему изобретению может содержать добавки, такие как вспомогательное вещество, вяжущее вещество, смазывающее вещество, дезинтегрирующее вещество, краситель, ароматизатор, эмульгатор, поверхностно-активное вещество, растворитель, суспендирующее средство, изотонический агент, буферный агент, консервант, антиоксидант, стабилизатор и ускоритель абсорбции, которые использовали для рецептирования.
Противоопухолевое терапевтическое средство по настоящему изобретению может быть композицией типа 1 упаковки, содержащей таксановое противоопухолевое средство и липосомальную композицию, в которой гемцитабин или его соль содержатся в липосоме, или композицию типа 2 упаковок с таксановым противоопухолевым средством и липосомальной композицией, в которой гемцитабин или его соль содержатся в липосоме. Противоопухолевым терапевтическим средством является предпочтительно композиция типа 2 упаковок, включающая таксановое противоопухолевое средство и липосомальную композицию, в которой гемцитабин или его соль содержатся в липосоме, в виде отдельных композиций.
В случае использования противоопухолевого терапевтического средства, включающего таксановое противоопухолевое средство и липосомальную композицию, в которой гемцитабин или его соль содержатся в липосомах в виде отдельных композиций, возможно вводить каждую композицию в мишень одновременно, раздельно, непрерывно или с интервалами.
Примеры путей введения противоопухолевых терапевтических средств по настоящему изобретению включают метод внутривенной инъекции, метод интраартериальной инъекции, метод интраректальной инъекции, метод интраперитонеальной инъекции, метод внутримышечной инъекции, метод инъекции в опухоль или метод инъекции в пузырь, или методы, такие как пероральное введение, чрескожное введение и метод с использованием суппозиториев.
Парентеральное введение является предпочтительным в качестве пути введения липосомальной композиции. Его примеры включают внутривенную инъекцию, такую как инстилляция, внутримышечную инъекцию, интраперитонеальную инъекцию, подкожную инъекцию, внутриглазную инъекцию и интратекальную инъекцию. Пример метода введения включает введение с использованием шприца или посредством инстилляции.
Пероральное введение является предпочтительным в качестве пути введения таксанового противоопухолевого средства.
В противоопухолевом терапевтическом средстве по настоящему изобретению, например, липосомальная композиция, в которой в липосоме содержатся гемцитабин или его соль, могут вводиться парентерально, и таксановое противоопухолевое средство может вводиться перорально.
Относительно дозировки и количества раз введения гемцитабина или его соли, содержащихся в липосомальной композиции, от 1 до 4 мг/кг гемцитабина или его соли можно вводить один или несколько раз отдельно в сутки. Например, предпочтительно вводить от 60 мг до 240 мг инъекции, предпочтительно от 120 мг до 240 мг инъекции и более предпочтительно от 180 мг до 240 мг инъекции в сутки посредством внутривенной инъекции для человека (пациента; с массой тела 60 кг). Однако дозировка и количество раз введения не ограничено.
Относительно дозировки и количества раз введения таксанового противоопухолевого средства от 0,01 мг/кг до 1000 мг/кг таксанового противоопухолевого средства можно вводить один или несколько раз отдельно в сутки.
Примеры лекарственных форм противоопухолевого терапевтического средства по настоящему изобретению включают таблетки, капсулы, суспензии, эмульсии, растворы, глазные капли, назальные капли, ушные капли и инъекции.
Опухоли, для которых противоопухолевое терапевтическое средство по настоящему изобретению может быть эффективно использовано, особо не ограничены, пока они представляют собой карциномы и саркомы, а их примеры включают рак молочной железы, рак эндометрия, рак яичников, рак предстательной железы, рак легкого, рак желудка (желудочная аденокарцинома), немелкоклеточный рак легкого, рак поджелудочной железы и плоскоклеточный рак головы и шеи, и рак поджелудочной железы является предпочтительным.
(Набор)
Набор по настоящему изобретению представляет собой набор, включающий комбинацию (a) липосомальной композиции, в которой содержатся гемцитабин или его соль и (b) таксановое противоопухолевое средство.
В наборе по настоящему изобретению (a) липосомальная композиция, в которой содержатся гемцитабин или его соль, и (b) таксановое противоопухолевое средство каждое может находиться в различных хорошо известных формах композиций и храниться в различных контейнерах, которые обычно используют в зависимости от форм композиции.
В наборе по настоящему изобретению (a) липосомальная композиция, в которой содержится гемцитабин или его соль (b) и таксановое противоопухолевое средство, могут храниться в раздельных контейнерах соответственно, или могут быть смешаны друг с другом и храниться в одном контейнере. Предпочтительно, чтобы (a) липосомальная композиция, в которой содержится гемцитабин или его соль, и (b) таксановое противоопухолевое средство, хранились в различных контейнерах соответственно.
(Средство, усиливающее противоопухолевый эффект)
Средство, усиливающее противоопухолевый эффект, по настоящему изобретению, может содержать добавки, такие как вспомогательное вещество, вяжущее вещество, смазывающее вещество, дезинтегрирующее вещество, краситель, ароматизатор, эмульгатор, поверхностно-активное вещество, растворитель, суспендирующее средство, изотоническое средство, буфер, консервант, антиоксидант, стабилизатор, и ускоритель абсорбции, которые использовали для рецептирования.
Возможно вводить средство, усиливающее противоопухолевый эффект, по настоящему изобретению и таксановое противоопухолеве средство в цель одновременно, раздельно, непрерывно или с интервалами.
Парентеральное введение является предпочтительным в качестве пути введения средства, усиливающего противоопухолевый эффект, по настоящему изобретению. Их примеры включают внутривенную инъекцию, такую как инстилляция, внутримышечную инъекцию, интраперитонеальную инъекцию, подкожную инъекцию, внутриглазную инъекцию и интратекальную инъекцию. Пример метода введения включает введение с использованием шприца или посредством инстилляции.
Относительно дозировки и количества раз введения гемцитабина или его соли, содержащихся в средстве, усиливающем противоопухолевый эффект, по настоящему изобретению, от 1 мг/кг до 4 мг/кг гемцитабина или его соли можно вводить один раз или несколько раз отдельно в сутки. Например, предпочтительно вводить от 60 до 240 мг инъекции, предпочтительно от 120 мг до 240 мг инъекции и более предпочтительно от 180 мг до 240 мг инъекции в сутки посредством внутривенной инъекции для человека (пациента; с массой тела 60 кг). Однако, дозировка и количество раз введения средства, усиливающего противоопухолевый эффект, по настоящему изобретению, не ограничены.
Опухоли, для которых средство, усиливающее противоопухолевый эффект, по настоящему изобретению может быть эффективно использовано, особо не ограничены, пока они являются карциномами и саркомами, при которых используют таксановое противоопухолевое средство. Однако их примеры включают рак молочной железы, рак эндометрия, рак яичников, рак предстательной железы, рак легкого, рак желудка (желудочная аденокарцинома), немелкоклеточный рак легкого, рак поджелудочной железы, плоскоклеточный рак головы и шеи, рак пищевода, рак мочевого пузыря, меланому, колоректальный рак, почечноклеточную карциному, не-Ходжкинскую лимфому и рак уротелия, и рак поджелудочной железы является предпочтительным.
Примеры
Далее настоящее изобретение будет описано подробно с использованием примеров. Однако настоящее изобретение не ограничено примерами.
Относительно среднего диаметра частиц, образец разводили до 1000 раз по массе с использованием 1хPBS (производимого NIPPON GENE CO., LTD.), и объем среднего диаметра частиц измеряли посредством метода динамического рассеяния света с использованием NANOTRAC UPA-UT (производимого Nikkiso Co., Ltd.)
Объем опухоли рассчитывали с использованием следующего уравнения посредством измерения большей оси (a) и меньшей оси (b) опухоли калипером.
Уравнение: (a х b2) х 0,5 (где "a" представляет собой большую ось и "b" представляет собой меньшую ось.)
(Контрольный пример 1)
a) Получение масляной фазы
16,6 г, 2,0 г, и 4,3 г гидрогенизированного соевого фосфатидилхолина, холестерина и N-(карбонилметоксиполиэтиленгликоля 2000)-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламина натриевой соли (далее также называемой как DSPE-PEG) соответственно получали так, чтобы получить молярное соотношение 76/19/5. Впоследствии к нему добавляли 405 мл органического растворителя (этанол/этилацетат=3/1) и липиды растворяли при температуре нагревания 70°C для получения масляной фазы.
b) Получение водной фазы
4 мM фосфатный буферный раствор (pH 7,78) получали и использовали в качестве водной фазы.
c) Получение липосом, не содержащих лекарственное средство
Водную фазу нагревали до 70°C и масляную фазу добавляли к ней таким образом, что объемное соотношение водной фазы/масляной фазы=8/3, и затем водную фазу и масляную фазу смешивали с использованием ротационного перемешивающего эмульгатора со скоростью вращения 20 м/с при 13000 об/мин в течение 30 минут. После этого органический растворитель и воду выпаривали путем поставки азота при нагревании смеси до выше чем, или равно температуры перехода фаз, и смесь концентрировали так, чтобы получить объем около 1/10 объема до эмульгирования, для получения липосом, не содержащих лекарственное средство. Средний диаметр частиц в этот момент составил 68,0 нм.
d) Порционное смешивание липосом, не содержащих лекарственное средство
Две партии липосом, не содержащих лекарственное средство, полученных в c), смешивали друг с другом.
e) Получение липосом, содержащих лекарственное средство
Гемцитабина гидрохлорид использовали в качестве лекарственного средства. Гемцитабина гидрохлорид покупали у TEVA. 81,63 г хлорида натрия, 29,01 г додекагидрата гидрофосфата динатрия, и 2,29 г дигидрата дигидрофосфата натрия растворяли в 948 г воды для инъекций для получения PBS. 12,98 г гемцитабина гидрохлорида, 54,01 г PBS, 75,74 г воды для инъекций Японской Фармакопеи, и 2,71 мл 8 M гидроксида натрия смешивали друг с другом в двух контейнерах для получения растворов лекарственных средств. 141,4 мл липосом, не содержащих лекарственное средство, и 2,71 мл 8 M гидроксида натрия добавляли и смешивали с каждым из растворов лекарственных средств. Осмотическое давление растворов составило 1039 мОсм/л, что является осмотическим давлением внутренних водных фаз полученных липосомальных композиций. Затем растворы нагревали при 70°C в течение 10 минут и затем охлаждали до 40°C и разводили 1016 мM сахарозы/37 мM раствора гистидина. После разведения растворы смешивали в один раствор для получения раствора, нагруженного лекарственным средством. 275 мM сахарозы/10 мM гистидина водного раствора получали в виде диализирующего раствора липосомальной композиции посредством диализа. Осмотическое давление, полученное из молярности растворенных веществ полученного раствора, составило 285 мОсм/л. Диализ проводили при комнатной температуре с использованием такого диализирующего раствора, все растворенные вещества и неконтейнированный гемцитабина гидрохлорид, присутствующий во внешней водной фазе раствора, нагруженного лекарственным средством, удаляли и внешнюю водную фазу заменяли диализирующим раствором. Липосомальную композицию, содержащую гемцитабин, имеющую концентрацию гемицитабина гидрохлорида 0,81 мг/мл, средний диаметр частиц 74,9 нм и осмотическое давление внутренней водной фазы 1039 мОсм/л, осмотическое давление внешней водной фазы 285 мОсм/л, и осмотическое давление внутренней водной фазы в отношении внешней водной фазы 3,6 раз, получали посредством вышеописанной стадии. Соотношение содержания холестеринов в отношении общего количества липидов, образующих липосомы, составило 19,3 моль%.
Осмотическое давление рассчитывали из молярности растворенных веществ.
(Контрольный пример 2)
Измерение скорости высвобождения в плазме
50 мкл липосомальной композиции разводили (по объему) в 20 раз мышиной плазмой и инкубировали при 37°C в течение 24 часов, и 100 мкл собирали в момент времени 24 часа. Впоследствии центрифужную фильтрацию проводили с использованием ультрафильтрационного фильтра (AMICON ULTRA-0.5 с 10 кДа, производимого Millipore) в условиях 7,400хg, в течение 30 минут и при 4°C. Количество лекарственного средства, содержащееся в собранном фильтрате, количественно определяли посредством ВЭЖХ, и скорость высвобождения рассчитывали по следующему выражению.
Выражение: Скорость высвобождения (%/24 ч)=(количество лекарственного средства в фильтрате после 24 часов инкубации) х 20 ÷ количество лекарственного средства, содержащегося во всех фазах липосомальной композиции х 100
Результат составил 24%/24 ч.
(Пример 1)
Фармакологический тест на модели мышей с подкожной трансплантацией опухоли Capan-1
Гемцитабин (далее также называемый, как Gem), абраксан (далее называемый как Abx), и гемцитабин-содержащую композицию липосом (далее также называемая как композиция A) использовали в качестве тестируемых веществ.
Gem получали путем растворения гемцитабина гидрохлорида (производимого TEVA) в физиологическом солевом растворе. Использовали Abx, полученный путем растворения абраксана (производимого Celgene) в физиологическом растворе. Липосомальную композицию, содержащую гемцитабин, полученную в контрольном примере 1, использовали.
1×107 клеток Capan-1 штамма человеческого рака поджелудочной железы трансплантировали подкожно в бок самкам голых мышей для получения подкожных опухолей. Эффект контроля подкожной опухоли при комбинированном введении Abx и композиции A оценивали с использованием в качестве индекса объема опухоли. В качестве тестируемых веществ, раствор сахарозы использовали в качестве группы 1, Gem использовали в качестве группы 2, композицию A использовали в качестве группы 3, Abx и Gem соответственно использовали в качестве группы 4 и группы 5, и Abx и композицию A соответственно использовали в качестве группы 6 и группы 7. Группы 1-5 были сравнительными примерами и группы 6 и 7 были примерами. Все тестируемые вещества вводили в хвостовую вену один раз в неделю с 17 дня после трансплантации всего в течение 3 недель.
Относительно дозировки каждого лекарственного средства, количество, при котором скорость потери массы не превосходила 20%, устанавливали как дозу, которая могла не достичь тяжелой минимальной массы, так что восстановление максимальной переносимой дозы (MTD) не определяли.
Состав групп и дозировок показаны в таблице 1.
[Таблица 1]
Изменение объема опухоли показано на фиг. 1.
В таблице 2 показано среднее значение объема опухоли в 38 день после трансплантации, стандартное отклонение объема опухоли в 38 день после трансплантации, скорость регресса опухоли с начала применения препарата и количество дней до достижения среднего значения объема опухоли 2000 мм3.
Тест множественного сравнения Тьюки проводили в качестве статистического анализа и значение P менее чем 5% среди групп определяли как указывающее на статистически значимые различия. Для обработки данных использовали Graphpad Prism версия 5.03.
В таблице 2 a показывает P < 0,001 при сравнении с группой 1, b показывает P <0,001 при сравнении с группой 2, c показывает P <0,05 при сравнении с группой 4, и N.R. показывает отсутствие регресса.
[Таблица 2]
a) P < 0,001 при сравнении с группой 1, b) P < 0,001 при сравнении с группой 2, c) P < 0,05 при сравнении с группой 4
N.R.: отсутствие регресса
Объем опухоли в 38 день после трансплантации в группе 6 или 7 был меньше, чем таковой в группе 4 или 5, и группа 6 продемонстрировала достоверные различия (P < 0,05) при сравнении с группой 4. Кроме того, относительно скорости регресса опухоли от начала лечения, не наблюдали регресса опухоли в группе 4. Скорость регресса опухоли в группе 6 составила 47% и скорость регресса опухоли в группе 7 составила 86%, тогда как скорость регресса опухоли в группе 5 составила 31%. Группы 6 и 7 продемонстрировали превосходный эффект регресса опухоли. Кроме того количество дней до достижения среднего объема опухоли 2000 мм3 в каждой из групп 6 и 7 составило > 87, тогда как количество дней до достижения объема опухоли 2000 мм3 в каждой из групп 4 и 5 составило 69 дней после трансплантации и 80 дней после трансплантации.
Показано из вышеописанных результатов, что композиция А имела эффект подавления роста опухолевых клеток Capan-1, трансплантированных подкожно голым мышам в комбинации с Abx, и ее эффект подавления роста был выше чем таковой комбинированного применения Gem и Abx.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОПУХОЛИ И НАБОР, СОДЕРЖАЩИЙ ЛИПОСОМАЛЬНУЮ КОМПОЗИЦИЮ ГЕМЦИТАБИНА | 2016 |
|
RU2738365C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОПУХОЛИ И НАБОР, СОДЕРЖАЩИЙ ЛИПОСОМАЛЬНУЮ КОМПОЗИЦИЮ ГЕМЦИТАБИНА | 2016 |
|
RU2768178C2 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2018 |
|
RU2734900C1 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2476216C1 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2015 |
|
RU2757110C2 |
| УЛУЧШЕННЫЕ ЛИПОСОМАЛЬНЫЕ СОСТАВЫ ЛИПОФИЛЬНЫХ СОЕДИНЕНИЙ | 2011 |
|
RU2641605C2 |
| ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ, НЕГАТИВНОГО ПО ТРЕМ РЕЦЕПТОРАМ | 2007 |
|
RU2448697C2 |
| ЛИПОСОМА, ИМЕЮЩАЯ ВНУТРЕННЮЮ ВОДНУЮ ФАЗУ, СОДЕРЖАЩУЮ СОЛЬ СУЛЬФОБУТИЛОВОГО ЭФИРА ЦИКЛОДЕКСТРИНА | 2010 |
|
RU2575793C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2005 |
|
RU2574926C2 |
| ПРИМЕНЕНИЕ ЛИПОСОМЫ МИТОКСАНТРОНА ГИДРОХЛОРИДА ДЛЯ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2021 |
|
RU2806277C1 |
Изобретение относится к области фармацевтики, а именно к липосомальной композиции, представляющей собой противоопухолевое терапевтическое средство. Липосомальная композиция содержит от 0,1 до 2,0 мг/мл гемцитабина или его гидрохлорида в липосоме, которая в свою очередь образована гидрогенизированным соевым фосфатидилхолином, 1,2-дистеароил-3-фосфатидилэтаноламинполиэтиленгликолем и холестерином, при определенном соотношении холестеринов к общему количеству липидов, образующих липосому, причем осмотическое давление внутренней водной фазы липосомы составляет от 2 до 8 раз осмотического давления внешней водной фазы липосомы. Изобретение обеспечивает создание липосом, содержащих гемцитабин или его соль в качестве лекарственного средства для лечения рака, имеющих приемлемое время высвобождения, простоту высвобождения лекарственного средства и стабильность при хранении. 3 з.п. ф-лы, 1 ил., 2 табл., 3 пр.
1. Липосомальная композиция, в которой гемцитабин или его гидрохлорид содержится в липосоме,
где отношение содержания холестеринов к общему количеству липидов, образующих липосому, составляет от 10 до 35 моль%,
где липид, образующий липосомы, содержит гидрогенизированный соевый фосфатидилхолин, 1,2-дистеароил-3-фосфатидилэтаноламинполиэтиленгликоль и холестерин,
где содержание гемцитабина составляет от 0,1 до 2,0 мг/мл в отношении липосомальной композиции,
где средний диаметр частиц липосомы составляет от 2 до 200 нм,
где осмотическое давление внутренней водной фазы липосомы составляет от 2 до 8 раз осмотического давления внешней водной фазы липосомы, и
где липосомальная композиция представляет собой противоопухолевое терапевтическое средство.
2. Липосомальная композиция по п. 1, где липосомой является одиночная пластинка.
3. Липосомальная композиция по п. 1 или 2, где скорость высвобождения гемцитабина или его соли из липосомальной композиции в плазме составляет от 10 до 70 мас.%/24 ч.
4. Липосомальная композиция по любому из пп. 1-3, где отношение содержания холестеринов к общему количеству липидов, образующих липосому, составляет от 17 до 21 моль%.
| WO 2005021012 A1, 10.03.2005 | |||
| WO 2011144745 A2, 24.11.2011 | |||
| COSCO D | |||
| et al | |||
| In vivo activity of gemcitabine-loaded PEGylated small unilamellar liposomes against pancreatic cancer // Cancer chemotherapy and pharmacology | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| - V | |||
| Нефтяной конвертер | 1922 |
|
SU64A1 |
| - N | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| - P | |||
| РУЧНАЯ КОНТОРКА | 1923 |
|
SU1009A1 |
| COSCO D | |||
| et al | |||
| Liposomes as multicompartmental carriers for multidrug delivery in | |||
Авторы
Даты
2021-12-13—Публикация
2016-11-01—Подача