Область техники
Настоящее изобретение относится к новым ингибиторам циклинзависимых протеинкиназ CDK8/19, способам их получения, фармацевтическим композициям, содержащим данные соединения, и к применению таких соединений или таких композиций для лечения заболеваний или нарушений.
Уровень техники
CDK8, наряду с близко связанной с ней по структурным и функциональным хакратеристикам изоформой CDK19, является онкогенной киназой, регулирующей транскрипцию (Xu, W. & Л, J.Y. (2011) Dysregulation of CDK8 and Cyclin С in tumorigenesis, J. Genet. Genomics 38, 439-452; Galbraith, M.D., et al. (2010) CDK8: a positive regulator of transcription, Transcription. 1, 4-12; Firestein, R. & Hahn, W.C. (2009) Revving the Throttle on an oncogene: CDK8 takes the driver seat, Cancer Res 69, 7899-7901). В противоположность более известным членам семейства CDK (таким как CDK1, CDK2 и CDK4/6), CDK8 не играет роли в регуляции клеточного цикла, однако нокаут по гену CDK8 в эмбриональных стволовых клетках приводит к остановке развития эмбриона (Adler, A.S., et al. (2012) CDK8 maintains tumor de-differentiation and embryonic stem cell pluripotency, Cancer Res. 72, 2129-2139) ввиду своей важной роли в формировании фенотипа плюрипотентных стволовых клеток (Firestein, R., et al. (2008) CDK8 is a colorectal cancer oncogene that regulates beta-catenin activity, Nature 455, 547-551). Следует отметить, что блокирование CDK8 не подавляет рост нормальных клеток (Adler, A.S., et al. (2012) CDK8 maintains tumor de-differentiation and embryonic stem cell pluripotency, Cancer Res. 72, 2129-2139, Kapoor, A., et al. (2010) The histone variant macroH2A suppresses melanoma progression through regulation of CDK8, Nature 468, 1105-1109). Роль CDK8 в канцерогенезе связана с его уникальной функцией в качестве регулятора нескольких транскрипционных факторов (Xu, W. & Л, J. Y. (2011) Dysregulation of CDK8 and Cyclin С in tumorigenesis, J. Genet. Genomics 38, 439-452). Высокая экспрессия CDK8 была выявлена при раке толстой кишки (Firestein, R., et al. (2010) CDK8 expression in 470 colorectal cancers in relation to beta-catenin activation, other molecular alterations and patient survival, Int. J. Cancer 126, 2863-2873), меланоме (Kapoor, A., et al. (2010) The histone variant macroH2A suppresses melanoma progression through regulation of CDK8, Nature 468, 1105-1109), при этом, при указанных видах рака повышенная экспрессия CDK8 наблюдается в ~50% случаев; подобная ситуация наблюдается и при раке молочной железы (Broude Е., et al. (2015) Expression of CDK8 and CDK8-interacting genes as potential biomarkers in breast cancer, Curr. Cancer Drug Targets, 15(8), 739-749). Повышенную экспрессию CDK8 связывают с неблагоприятным прогнозом при раке толстой кишки (Gyorffy, В., et al. (2010) An online survival analysis tool to rapidly assess the effect of 22,277 genes on breast cancer prognosis using microarray data of 1,809 patients, Breast Cancer Res. Treat. 123, 725-731).
Известные механизмы, ассоциированные с CDK8 при раке, включают положительное регулирование пути катенина Wnt / [бета] (Kapoor, A., et al. (2010) The histone variant macroH2A suppresses melanoma progression through regulation of CDK8, Nature 468, 1105-1109; Alarcon, C, et al. (2009) Nuclear CDKs drive Smad transcriptional activation and turnover in BMP and TGF-beta pathways, Cell 139, 757-769), транскрипцию, индуцированную фактором роста (DiDonato, J.A., et al. (2012) NF-kappaB and the link between inflammation and cancer, Immunol. Rev. 246, 379-400) и сигнальный путь TGF-бета (Acharyya, S., et al. (2012) A CXCL1 paracrine network links cancer chemoresistance and metastasis, Cell 150, 165-178). Было также показано, что CDK8 может поддерживать плюрипотентный фенотип эмбриональных стволовых клеток, и что он может ассоциироваться с фенотипом стволовых клеток рака (Firestein, R., et al. (2008) CDK8 is a colorectal cancer oncogene that regulates beta-catenin activity, Nature 455, 547-551). Химиотерапевтические препараты, вызывающие повреждения ДНК, индуцируют ФНО-а, активатор фактора транскрипции NFkB (Fabian et al. (2005) A small molecule-kinase interaction map for clinical kinase inhibitors, Nat. Biotechnol. 23, 329-336), в эндотелиальных клетках и в других стромальных элементах микроокружения опухоли. Стромальный ФНО-а действует на опухолевые клетки, где он индуцирует NFkB-опосредованную выработку цитокинов CXCL1 и CXCL2, способствующих выживанию и росту опухолевых клеток. CXCL 1/2 привлекают миелоидные клетки к опухоли путем связывания с рецептором CXCR2 на поверхности миелоидных клеток. Миелоидные клетки затем секретируют небольшие кальций-связывающие белки S 100А8 и А9, которые связаны с процессами хронического воспаления и опухолевого роста. S 100А8/9 действуют на опухолевые клетки, способствуя как их метастазированию, так и выживаемости на фоне химиотерапии (Huang, et al. (2012) MED 12 Controls the response to multiple cancer drugs through regulation of TGF-β receptor signaling, Cell 151, 937-950).
В настоящее время представляется актуальным поиск новых соединений, ингибирующих циклинзависимые протеинкиназы CDK8/19.
Описание изобретения
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи, более предпочтительно с 1-6 атомами углерода в цепи. «Разветвленная» означает, что алкильная цепь имеет один или несколько «низших алкильных» заместителей. Примеры алкильных групп включают, но не ограничиваются ими, метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, н-пентил, 2-пентил, 3-пентил, нео-пентил, н-гексил. Алкил может иметь заместители, которые могут быть одинаковыми или разными.
«Арил» означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимущественно от 6 до 10 атомов углерода. Примеры арильных групп включают, но не ограничиваются ими, фенил, нафтил, антранил и прочие. Арил может иметь заместители циклической системы, которые могут быть одинаковыми или разными. Арил может быть аннелирован с неароматической циклической системой или гетероциклом.
«Алкилокси» или «Алкокси» означает алкил-О-группу, в которой алкил определен в данном разделе. Примеры алкокси групп включают, но не ограничиваются ими, метокси, этокси, н-пропокси, изо-пропокси и н-бутокси.
«Аминогруппа» означает R'R''N-группу, замещенную или незамещенную необязательно одинаковыми заместителями R' и R''.
«Алкилсульфонил» (-S(O)2-С1-С6алкил) означает «алкил», определение которого приведено выше, присоединенный к соответствующему фрагменту молекулы через сульфонильную группу -SO2-. Примеры алкилсульфонилов, включают, но не ограничиваются ими, метилсульфонил, этилсульфонил и т.д.
«Низший алкил» означает линейный или разветвленный алкил с 1-4 атомами углерода.
«Гало» или «Галоген» (Hal) означает фтор, хлор, бром или йод.
«Гетероцикл», «гетероциклил» или «гетероциклическое кольцо» означает моноциклическую или полициклическую систему, включающую от 3 до 11 атомов углерода, в которой один или несколько атомов углерода заменены на гетероатом, такой как азот, кислород, сера. Гетероцикл может быть конденсирован с арилом или гетероарилом. Гетероцикл может иметь один или несколько заместителей, которые могут быть одинаковыми или разными. Атомы азота и серы, находящиеся в гетероцикле могут быть окислены до N-оксида, S-оксида или S-диоксида. Гетероцикл может быть насыщенным, частично ненасыщенным или ненасыщенным. Примеры гетероциклов включают, но не ограничиваются ими, азетидин, пирролидин, пиперидин, 2,8-диазаспиро[4.5]декан, пиперазин, морфолин и др.
«Гетероарил» означают ароматическую моноциклическую или полициклическую систему, включающую от 5 до 11 атомов углерода, предпочтительно от 5 до 10, в которой один или несколько атомов углерода замещены на гетероатом, такой как азот, сера или кислород. Атом азота, находящийся в гетероариле, может быть окислен до N-оксида. Гетероарил может иметь один или несколько заместителей, которые могут быть одинаковыми или разными. Представителями гетероарилов являются пирролил, фуранил, тиенил, пиридил, пиразинил, пиримидинил, пиридазинил, изооксазолил, изотиазолил, тетразолил, оксазолил, тиазолил, пиразолил, фуразанил, триазолил, 1,2,4-тиадиазолил, хиноксалинил, фталазинил, имидазо[1,2-а]пиридинил, имидазо[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил, бензотиазенил, хинолинил, имидазолил, пиразолил, тиенопиридил, хиназолинил, нафтиридинил, тиенопиримидинил, пирролопиридинил, имидазопиридил, изохинолинил, бензоазаиндолил, 1,2,4-триазинил, тиенопирролил, фуропирролил и др.
«Частично ненасыщенный» означает кольцевую систему, которая включает по меньшей мере одну двойную или тройную связь. Термин «частично ненасыщенный» относится к кольцам, имеющим множество сайтов для насыщения, но не включает арильные и гетероарильные системы, как они определены выше.
Термин «оксо», используемый в настоящем документе, относится к радикалу =O.
«Заместитель» означает химический радикал, который присоединяется к молекулярному остову (скэффолду, фрагменту).
«Сольват» означает молекулярный комплекс соединения по настоящему изобретению, включая его фармацевтически приемлемые соли, с одной или более молекулами растворителя. Такие молекулы растворителя представляют собой молекулы, обычно используемые в фармацевтике, которые известны как безвредные для реципиента, например, воду, этанол, этиленгликоль и подобные. Другие растворители можно использовать как промежуточные сольваты в получении более желательных сольватов, такие как метанол, метил-трет-бутиловый эфир, этилацетат, метилацетат, (S)-пропиленгликоль, (R)-пропиленгликоль, 1,4-бутандиол и подобные.
Термин «гидрат» относится к комплексу, в котором молекула растворителя представляет собой воду.
Сольваты и/или гидраты предпочтительно существуют в кристаллической форме.
Термин «связь», «химическая связь» или «одинарная связь» относится к химической связи между двумя атомами или двумя группировками (группами, фрагментами), если два атома, соединенные связью, рассматриваются как часть более крупной субструктуры.
Термин "защитная группа" относится к группам, которые применяются для блокирования реакционной способности функциональных групп, таких как аминогруппы, карбоксильной группы или гидроксигруппы. Примерами, без ограничения, защитных групп являются трет-бутоксикарбонил (Boc), бензилоксикарбонил (Cbz), 2-(триметилсилил)этокси) метилацеталь (SEM), триалкилсилил, алкил(диарил)силил или алкил.
Термин «эксципиент» используется в данном документе для описания любого ингредиента, отличающегося от соединения(-ий) по данному изобретению.
«Фармацевтическая композиция» обозначает композицию, включающую в себя соединение согласно изобретению и, по крайней мере, один эксципиент. Эксципиент может быть выбран из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты и им подобные. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
«Фармацевтически приемлемая соль» означает относительно нетоксичные соли соединения, заявленного в настоящем изобретении. Соли соединений, предусмотренных настоящим документом, могут быть получены из неорганических или органических кислот и оснований. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные; соли натрия, калия, аммония, кальция, магния, железа, цинка, меди, марганца и алюминия, соли первичных, вторичных и третичных аминов, замещенных аминов, в том числе природных замещенных аминов, циклических аминов, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, 2-диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин (Подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и др. готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Лечить», «лечение» и «терапия» относятся к методу смягчения или устранения биологического расстройства и/или по меньшей мере одного из сопутствующих ему симптомов. Термин «облегчить» болезнь, заболевание или состояние, означает уменьшение тяжести и/или частоты возникновения симптомов заболевания, расстройства или состояния. Кроме того, содержащиеся в данном документе ссылки на «лечение» включают ссылки на лечебную, паллиативную и профилактическую терапию.
В одном аспекте субъект лечения или пациент является млекопитающим, предпочтительно человеческим субъектом. Вышеупомянутый субъект может быть мужского или женского пола любого возраста.
Термин "нарушение" означает любое состояние, которое можно улучшить в результате лечения по настоящему изобретению. В определение данного термина входят хронические и острые нарушения или заболевания, включающие в себя патологические состояния, которые вызывают предрасположенность млекопитающего к возникновению данного нарушения. Неограничивающие примеры подлежащих лечению заболеваний включают в себя онкологические заболевания, в частности рак молочной железы, трижды негативный рак молочной железы (ТНРМЖ), рак яичника, метастатический рак яичника, рак желудка, метастатический рак желудка, рак эндометрия, слюнной железы, легкого, почки, ободочной кишки, колоректальный рак, меланому, метастатическую меланому, рак щитовидной железы, поджелудочной железы, предстательной железы или мочевого пузыря; гематоонкологические заболевания, лейкозы, острый миелоидный лейкоз и лимфоидные злокачественные новообразования; нейронные, глиальные, астроцитальные, гипоталамусные и другие гранулярные, макрофаговые, эпителиальные, стромальные и бластоцельные нарушения; воспалительные, ангиогенные и иммунологические нарушения.
«Терапевтически эффективным количеством» считается количество вводимого в процессе лечения терапевтического агента, которое избавит в определенной степени от одного или нескольких симптомов заболевания, по поводу которого проводится лечение.
В настоящем описании и в последующей формуле изобретения, если контекстом не предусмотрено иное, слова «иметь», «включать» и «содержать» или их вариации, такие как «имеет», «имеющий», «включает», «включающий», «содержит» или «содержащий», следует понимать, как включение указанного целого или группы целых, но не исключение любого другого целого или группы целых.
Подробное описание изобретения
В одном варианте осуществления, настоящее изобретение относится к соединению формулы I:
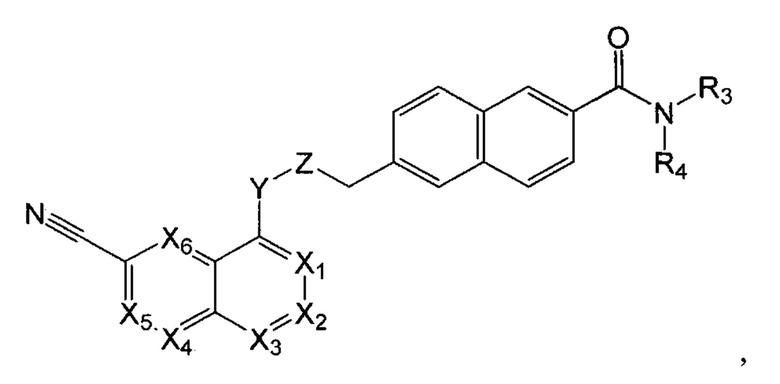
где X1 представляет собой CR1, N;
Х2 представляет собой CR2, N;
Х3, Х4, Х5, Х6 каждый независимо представляет собой СН, N;
R1 представляет собой Н, Hal, C1-С6 алкил, С3-С7 циклоалкил;
R2 представляет собой Н, Hal, C1-С6 алкил, -OR10, -NR11R12,
R3 и R4 каждый независимо представляет собой Н; C1-С6 алкил, незамещенный или замещенный одним или несколькими галогенами; C1-С6 алкокси C1-С6 алкил; С3-С7 циклоалкил, С3-С7 циклоалкил С1-С3 алкил; С6-С10 арил, незамещенный или замещенный одним или несколькими заместителями, выбранными из Hal, C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси; 5-10 членный гетероарил с 1-4 гетероатомами, выбранными из N, О и/или S, незамещенный или замещенный одним или несколькими заместителями, выбранными из Hal, C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси; 5-6 членный гетероциклил с 1-2 гетероатомами, выбранными из N, О и/или S, незамещенный или замещенный одним или несколькими заместителями, выбранными из Hal; -ОН; C1-С6 алкокси; C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси; или
R3 и R4 вместе с атомом азота, к которому они присоединены, могут представлять собой 4-7-членный гетероциклил с 1-2 гетероатомами, выбранными из N и/или О, который может быть незамещенным или замещенным одним или несколькими заместителями, выбранными из оксо группы; -ОН; C1-С6 алкокси; C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси;
Y представляет собой -N(R13)-, -О-, -S- или -С(О)-;
Z представляет собой -C(R14)2- или -С(О)-;
R10 представляет собой Н, C1-С6 алкил, C1-С6 ацил;
R11, R12 каждый независимо представляет собой Н, C1-С6 алкил, С3-С7 циклоалкил;
R13 представляет собой Н, C1-С6 алкил, C1-С6 ацил;
R14 каждый независимо представляет собой Н, C1-С6 алкил, С3-С7 циклоалкил; не включая, соединения, где X1, Х3 представляют собой N, Х2, Х4, Х5, Х6 представляют собой СН, R3 и R4 вместе с атомом азота, к которому они присоединены, представляют собой
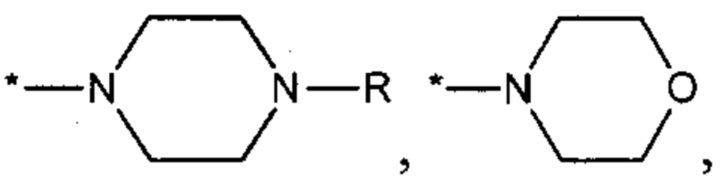 R представляет собой Н, C1-С6 алкил.
R представляет собой Н, C1-С6 алкил.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы I, где если X1 представляет собой CR1, Х2 представляет собой CR2, Х3 представляют собой N, то Х4, Х5, Х6 представляет собой СН;
если X1 представляет собой CR1, Х2, Х3 представляют собой N, то Х4, Х5, Х6 представляет собой СН;
если Х2 представляет собой CR2, X1, Х3 представляют собой N, то Х4, Х5, Х6 представляет собой СН;
если X1 представляет собой CR1, Х2, Х4 представляют собой N, то Х3, Х5, Х6 представляет собой СН;
если X1 представляет собой CR1, Х2 представляет собой CR2, Х3, Х5 представляют собой N, то Х4, Х6 представляет собой СН;
если X1 представляет собой CR1, Х2 представляет собой CR2, Х3, Х4 представляют собой N, то Х5, Х6 представляет собой СН;
если X1 представляет собой CR1, Х2 представляет собой CR2, Х3, Х6 представляют собой N, то Х4, Х5 представляет собой СН.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы I, где Y представляет собой -NH-, -О- или -S-; Z представляет собой -СН2-.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы II:
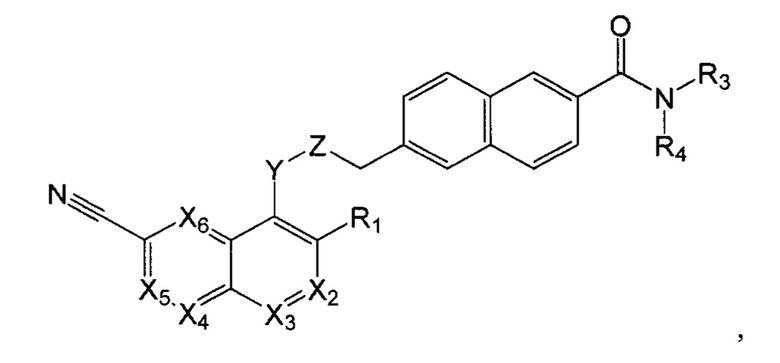
где Х2 представляет собой CR2, N;
Х3, Х4, Х5, Х6 каждый независимо представляет собой СН, N;
R1 представляет собой Н, Hal, C1-С6 алкил, С3-С7 циклоалкил;
R2 представляет собой Н, Hal, C1-С6 алкил, -OR10, -NR11R12,
R3 и R4 каждый независимо представляет собой Н; C1-С6 алкил, незамещенный или замещенный одним или несколькими галогенами; C1-С6 алкокси C1-С6 алкил; С3-С7 циклоалкил, С3-С7 циклоалкил С1-С3 алкил; С6-С10 арил, незамещенный или замещенный одним или несколькими заместителями, выбранными из Hal, C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси; 5-10 членный гетероарил с 1-4 гетероатомами, выбранными из N, О и/или S, незамещенный или замещенный одним или несколькими заместителями, выбранными из Hal, C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси; 5-6 членный гетероциклил с 1-2 гетероатомами, выбранными из N, О и/или S, незамещенный или замещенный одним или несколькими заместителями, выбранными из Hal; -ОН; C1-С6 алкокси; C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси; или
R3 и R4 вместе с атомом азота, к которому они присоединены, могут представлять собой 4-7-членный гетероциклил с 1-2 гетероатомами, выбранными из N и/или О, который может быть незамещенным или замещенным одним или несколькими заместителями, выбранными из оксо группы; -ОН; C1-С6 алкокси; C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси;
Y представляет собой -N(R13)-, -О-, -S- или -С(О)-;
Z представляет собой -C(R14)2- или -С(О)-;
R10 представляет собой Н, C1-С6 алкил, C1-С6 ацил;
R11, R12 каждый независимо представляет собой Н, C1-С6 алкил, С3-С7 циклоалкил;
R13 представляет собой Н, C1-С6 алкил, C1-С6 ацил;
R14 каждый независимо представляет собой Н, C1-С6 алкил, С3-С7 циклоалкил.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы II, где Y представляет собой -NH-, -О- или -S-; Z представляет собой -СН2-.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы I, II, где R3 и R4 каждый независимо представляет собой Н; C1-С6 алкил, незамещенный или замещенный одним или несколькими галогенами; C1-С6 алкокси С1-С6 алкил; С3-С7 циклоалкил, С3-С7 циклоалкил С1-С3 алкил; С6-С10 арил, представляющий собой фенил, незамещенный или замещенный одним или несколькими заместителями, выбранными из Hal, C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси; 5-10 членный гетероарил с 1-4 гетероатомами, выбранными из N, О и/или S, представляющий собой пиридин или пиримидин, незамещенный или замещенный одним или несколькими заместителями, выбранными из Hal, C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси; 5-6 членный гетероциклил с 1-2 гетероатомами, выбранными из N, О и/или S, представляющий собой 4-морфолинил, 1-пиперазинил, 1-пирролидинил, 1-пиперидинил, незамещенный или замещенный одним или несколькими заместителями, выбранными из Hal; -ОН; C1-С6 алкокси; C1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси; или
R3 и R4 вместе с атомом азота, к которому они присоединены, могут представлять собой 4-7-членный гетероциклил с 1-2 гетероатомами, выбранными из N и/или О, представляющий собой морфолинил, пиперазинил, пирролидинил, пиперидинил, азетидин, который может быть незамещенным или замещенным одним или несколькими заместителями, выбранными из оксо группы; -ОН; C1-С6 алкокси; С1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами, C1-С6 алкокси.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы III:
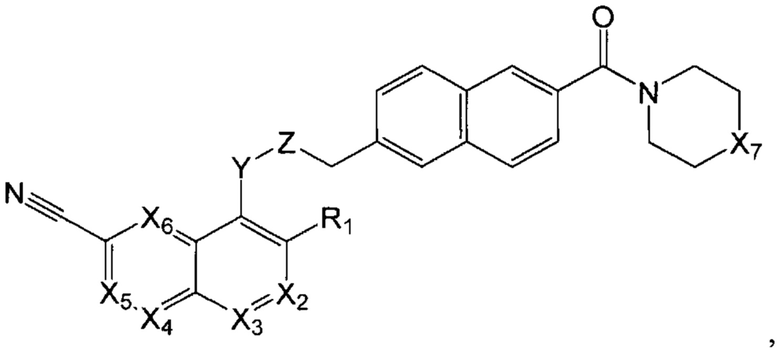
где Х2 представляет собой CR2, N;
Х3, Х4, Х5, Х6 каждый независимо представляет собой СН, N;
R1 представляет собой Н, Hal, C1-С6 алкил, С3-С7 циклоалкил;
R2 представляет собой Н, Hal, C1-С6 алкил, -OR10, -NR11R12,
Х7 представляет собой -N(R15), -О-;
Y представляет собой -N(R13)-, -О-, -S- или -С(О)-;
Z представляет собой -C(R14)2- или -С(О)-;
R10 представляет собой Н, C1-С6 алкил, C1-С6 ацил;
R11, R12 каждый независимо представляет собой Н, C1-С6 алкил, С3-С7 циклоалкил;
R15 представляет собой Н, C1-С6 алкил, незамещенный или замещенный одним или несколькими галогенами, C1-С6 алкокси.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы III, где Y представляет собой -NH-, -О- или -S-; Z представляет собой -СН2-.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы II, III, где если Х2 представляет собой CR2, Х3 представляют собой N, то Х4, Х5, Х6 представляет собой СН;
если Х2, Х3 представляют собой N, то Х4, Х5, Х6 представляет собой СН;
если Х2, Х4 представляют собой N, то Х3, Х5, Х6 представляет собой СН;
если Х2 представляет собой CR2, Х3, Х5 представляют собой N, то Х4, Х6 представляет собой СН;
если Х2 представляет собой CR2, Х3, Х4 представляют собой N, то Х5, Х6 представляет собой СН;
если Х2 представляет собой CR2, Х3, Х6 представляют собой N, то Х4, Х5 представляет собой СН.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы I.1:
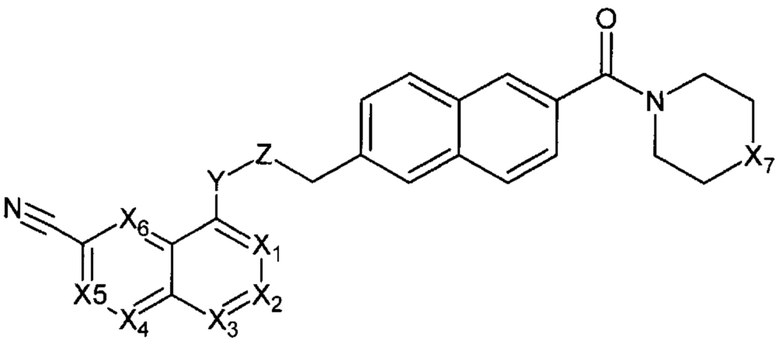
где X1 представляет собой CR1, N;
Х2 представляет собой CR2, N;
Х3, Х4, Х5, Х6 каждый независимо представляет собой СН, N;
R1 представляет собой Н, Hal, C1-С6 алкил, С3-С7 циклоалкил;
R2 представляет собой Н, Hal, C1-С6 алкил, -OR10, -NR11R12,
Х7 представляет собой -N(R15), -О-;
Y представляет собой -N(R13)-, -О-, -S- или -С(О)-;
Z представляет собой -C(R14)2- или -С(О)-;
R10 представляет собой Н, C1-C6 алкил, C1-С6 ацил;
R11, R12 каждый независимо представляет собой Н, C1-C6 алкил, С3-С7 циклоалкил;
R15 представляет собой Н, C1-С6 алкил, незамещенный или замещенный одним или несколькими галогенами;
не включая, соединения, где Х1, Х3 представляют собой N, Х2, Х4, Х5, Х6 представляют собой СН, R3 и R4 вместе с атомом азота, к которому они присоединены, представляют собой
 R представляет собой Н, C1-C6 алкил.
R представляет собой Н, C1-C6 алкил.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы I.2:
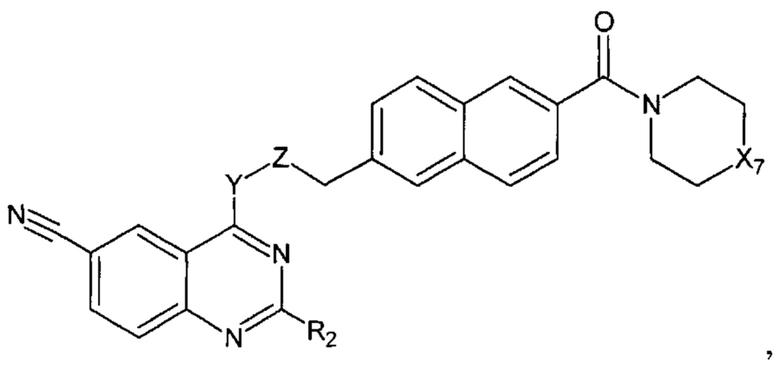
где Х7, Y, Z, R2 имеют вышеуказанные значения;
не включая, соединения, где X1, Х3 представляют собой N, Х2, Х4, Х5, Х6 представляют собой СН, R3 и R4 вместе с атомом азота, к которому они присоединены, представляют собой
 R представляет собой Н, C1-С6 алкил.
R представляет собой Н, C1-С6 алкил.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы II.1:
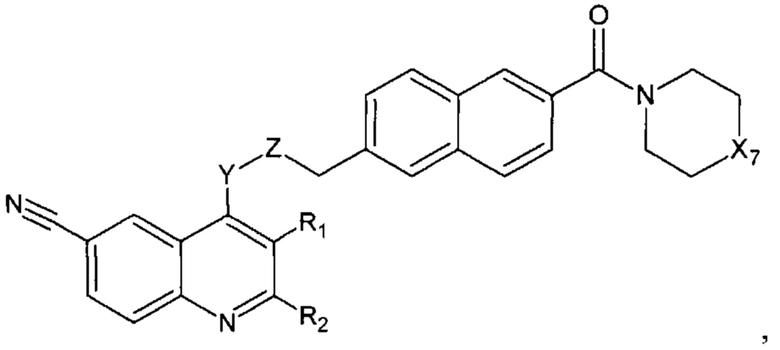
где Х7, Y, Z, R1, R2 имеют вышеуказанные значения.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы II.2:
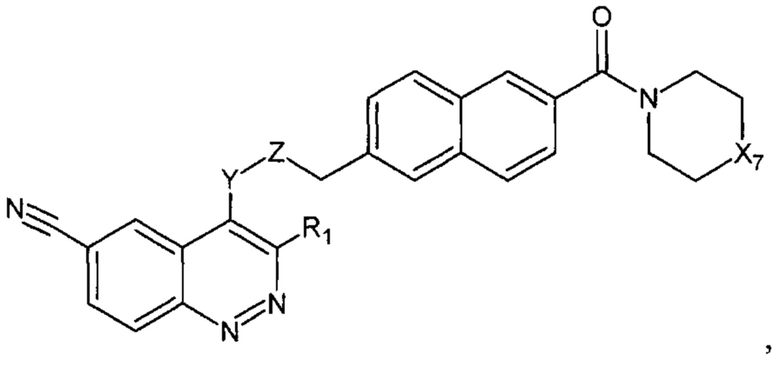
где Х7, Y, Z, R1 имеют вышеуказанные значения.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы II.3:
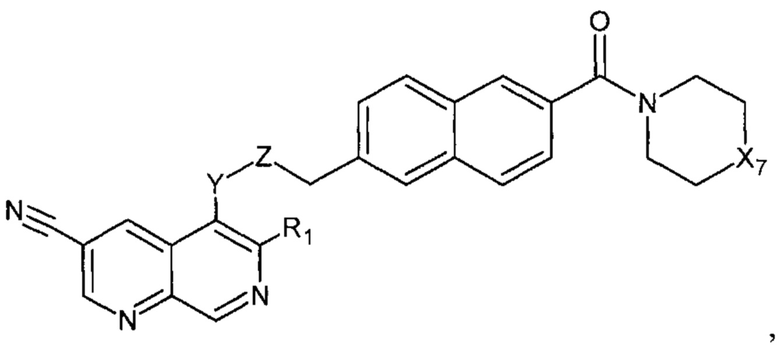
где Х7, Y, Z, R1 имеют вышеуказанные значения.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы II.4:
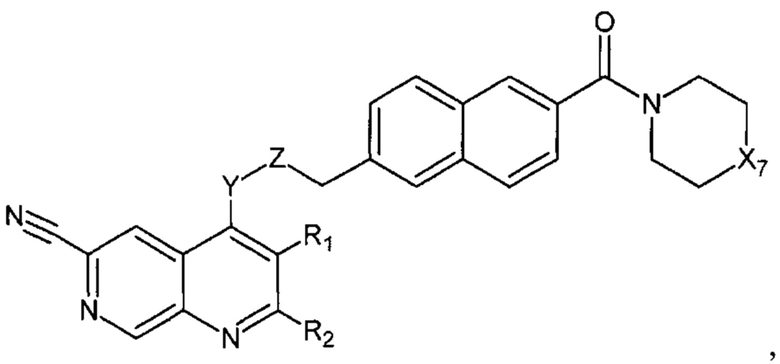
где Х7, Y, Z, R1, R2 имеют вышеуказанные значения.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы II.5:
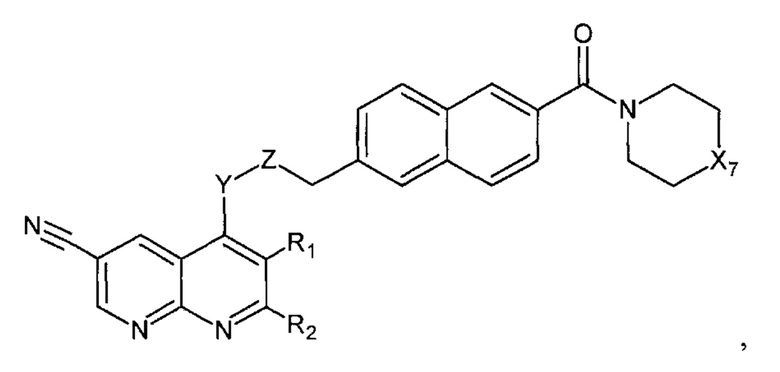
где Х7, Y, Z, R1, R2 имеют вышеуказанные значения.
В еще одном варианте осуществления настоящее изобретение относится к соединению формулы II.6:
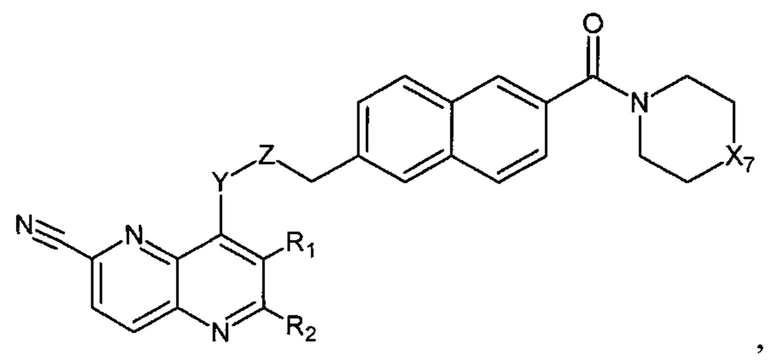
где Х7, Y, Z, R1, R2 имеют вышеуказанные значения.
Соединения, описанные в настоящем изобретении, могут быть получены в виде и/или их можно применять в виде фармацевтически приемлемых солей. Типы фармацевтически приемлемых солей включают следующие, но не ограничены ими: соли кислот, образованные при взаимодействии соединения в форме свободного основания с фармацевтически приемлемой неорганической кислотой, такой как соляная, бромистоводородная, серная, азотная, фосфорная, метафосфорная кислоты и т.п.; или с органической кислотой, такой как уксусная, пропионовая, капроновая, циклопентанпропионовая, гликолевая, пировиноградная, молочная, малоновая, янтарная, яблочная, малеиновая, фумаровая, трифторуксусная, винная, лимонная, бензойная, 3-(4-гидроксибензоил)бензойная, коричная, миндальная кислоты, метансульфокислота, этансульфокислота, 1,2-этандисульфокислота, 2-гидроксиэтандисульфокислота, бензолсульфокислота, толуолсульфокислота, 2-нафталинсульфокислота, 4-метилбицикло[2.2.2]окт-2-ен-1-карбоновая, глюкогептоновая, 4,4'-метилен-бис-3-гидрокси-2-ен-1-карбоновая, 3-фенилпропионовая, триметилуксусная, третбутилуксусная, лаурилсерная, глюконовая, глутаминовая, гидроксинафтойная, салициловая, стеариновая, муконовая кислоты и т.п.
Соответствующие противоионы фармацевтически приемлемых солей можно исследовать и идентифицировать с использованием различных методов, включая перечисленные, но не ограничиваясь ими: ионнообменную хроматографию, ионную хроматографию, капиллярный электрофорез, индукционное связывание плазмы, атомно-абсорбционную спектроскопию, масс-спектрометрию или любую их комбинацию.
Соли восстанавливают с применением по меньшей мере одной из следующих методик: фильтрация, осаждение с осадителем с последующей фильтрацией, выпариванием растворителя или в случае водных растворов лиофилизацией. Следует понимать, что упоминание фармацевтически приемлемой соли включает формы аддитивной соли растворителем или их кристаллические формы, в частности сольваты или полиморфы. Сольваты содержат стехиометрическое или нестехиометрическое количество растворителя и могут быть образованы в ходе процесса кристаллизации с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Гидраты образуются в случае, если растворителем является вода, а алкоголяты образуются в случае, когда растворителем является спирт. Сольваты соединений, описанных в настоящем патенте, могут быть легко получены или образованы в способах, описанных в настоящем изобретении. Кроме того, соединения, предусмотренные настоящим изобретением, могут существовать в несольватированной, а также в сольватированной формах. В целом, сольватированные формы рассматриваются как эквивалент несольватированных форм при описании соединений и способов, предусмотренных настоящим изобретением.
Соединения, описанные в настоящем изобретении, могут быть представлены в различных формах, включая перечисленные, но не ограничиваясь ими: бесструктурные формы, молотые формы и наночастицы. Кроме того, описанные в настоящем изобретении соединения включают кристаллические формы, также известные как полиморфы. Полиморфы включают кристаллы с различной структурой одинакового элементного состава соединения. Полиморфы, как правило, имеют различный характер рентгеновской дифракции, различные инфракрасные спектры, температуру плавления, различную плотность, твердость, кристаллическую форму, оптические и электрические свойства, стабильность и растворимость. Различные факторы, такие как растворитель для рекристаллизации, степень кристаллизации и температура хранения, могут обусловливать доминирование одной кристаллической формы.
Скрининг и определение характеристик фармацевтически приемлемых солей, полиморфов и/или сольватов можно осуществлять рядом методов, включая перечисленные, но не ограничиваясь ими: термический анализ, рентгено-дифракционный метод, спектроскопию, сорбцию пара и микроскопию. Термические методы анализа направлены на исследование термохимического разложения или термофизических процессов, включая, но не ограничиваясь, полиморфные переходы, и такие методы применяют для анализа связи между полиморфными формами, определения потери в массе, для нахождения температуры стеклования или исследования совместимости с наполнителем. Такие способы включают, без ограничения, дифференциальную сканирующую калориметрию (ДСК), модулирующую дифференциальную сканирующую калориметрию (МДСК), термогравиметрический анализ (ТГА), термогравиметрический и инфракрасный анализ (ТГ/ИК). Кристаллографические методы включают перечисленные, но не ограничиваются ими: монокристаллические и порошковые дифрактометры и синхротронные источники. Различные используемые спектроскопические методы включают перечисленные, но не ограничены ими: определение спектра Рамана (комбинационного рассеяния), FTIR, UVIS и ЯМР (жидкого и твердого состояния). Различные методы микроскопии включают перечисленные, но не ограничены ими: микроскопию в поляризованном свете, сканирующую электронную микроскопию (СЭМ) с рентгеновским анализом методом энергетической дисперсии (EDX), сканирующую электронную микроскопию в режиме естественной среды с EDX (в атмосфере газа или водяного пара), ИК-микроскопию и микроскопию комбинационного рассеяния.
В еще одном варианте осуществления настоящее изобретение относится к соединениям, выбранным из группы, включающей:
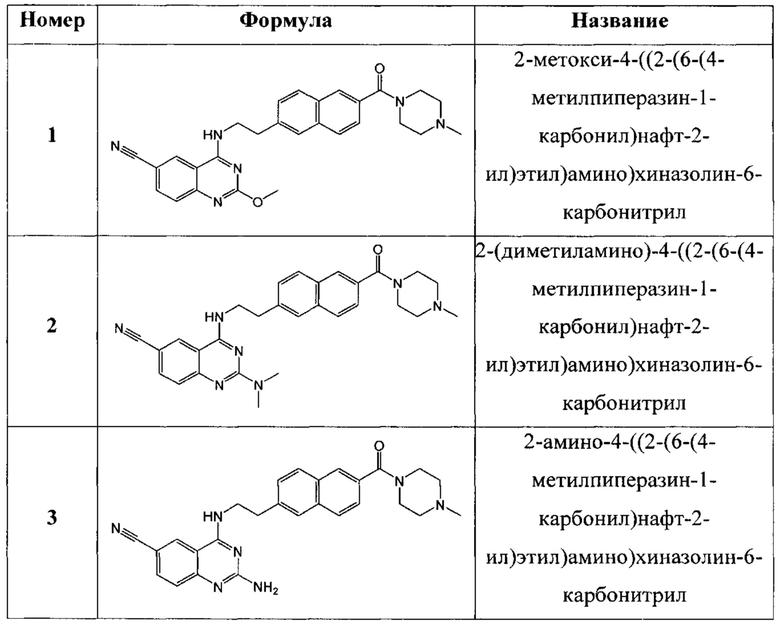
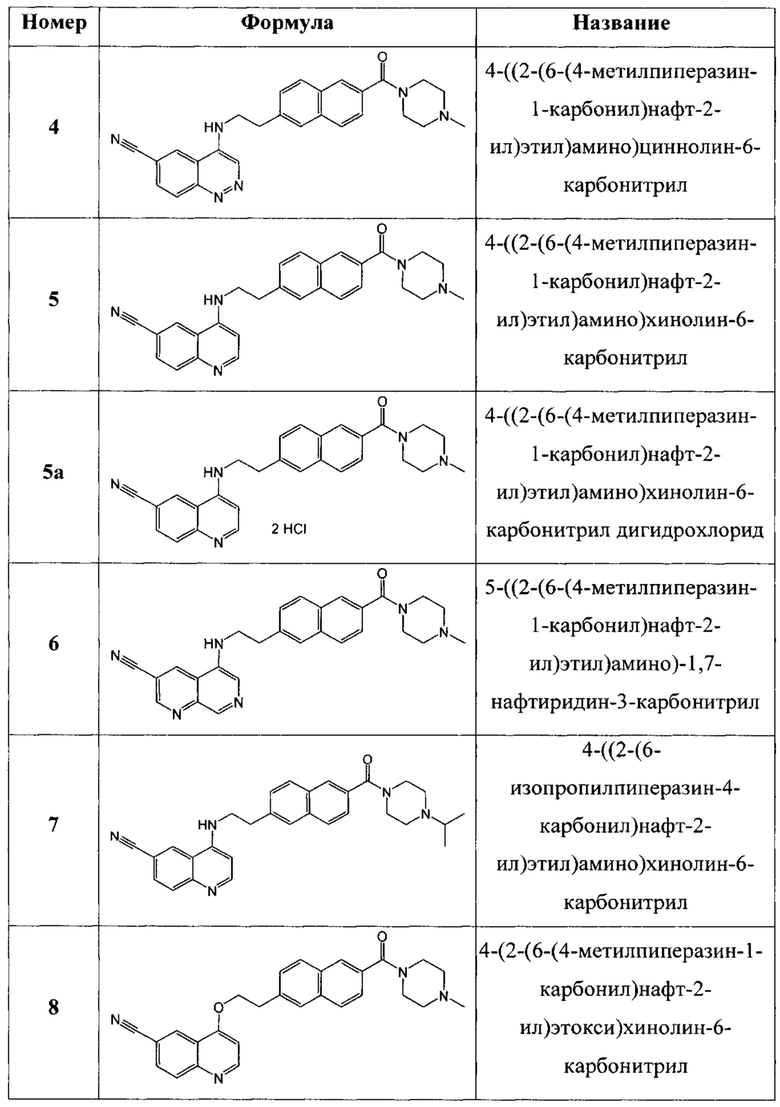
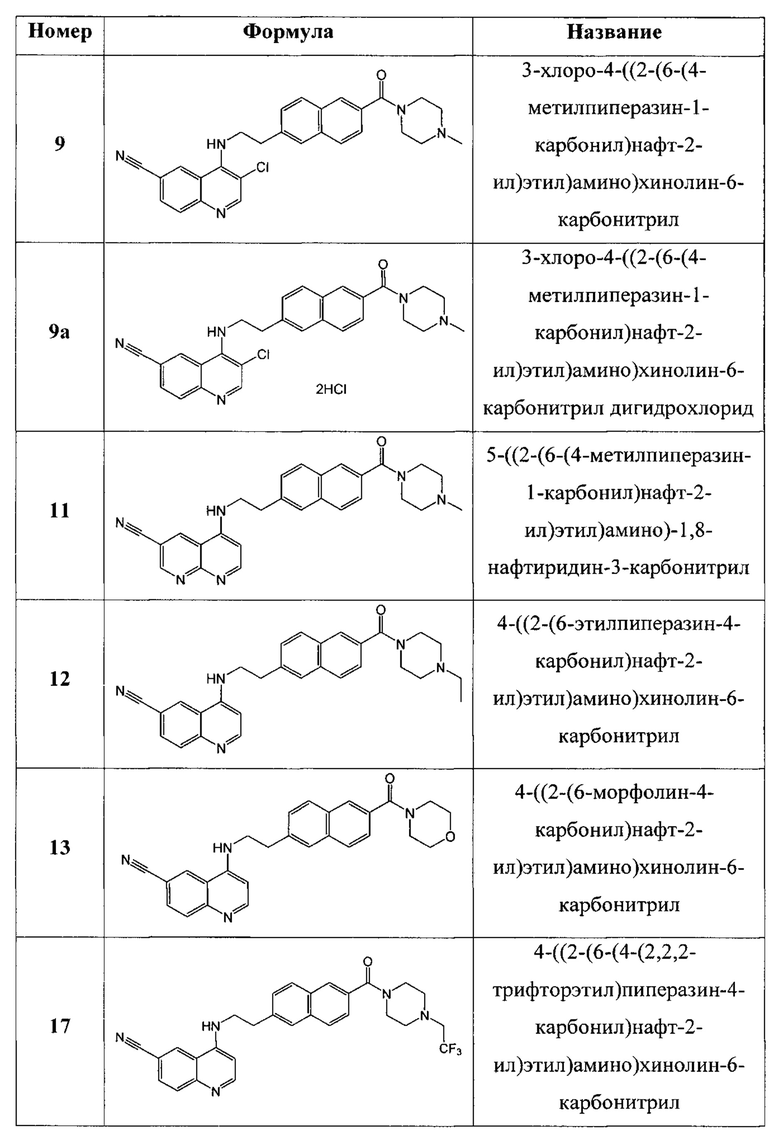
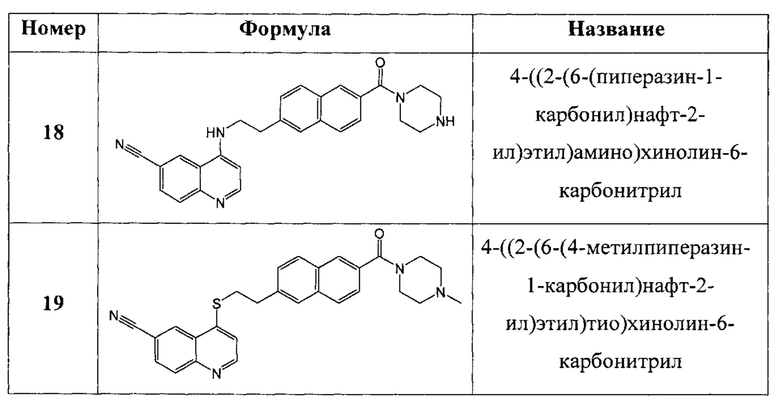
Настоящее изобретение также относится к способу ингибирования биологической активности циклинзависимых протеинкиназ CDK8/19 у субъекта, заключающемуся в контактировании циклинзависимых протеинкиназ CDK8/19 с соединением по настоящему изобретению.
В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения, описанного в настоящем документе, или его фармацевтически приемлемую соль, сольват, и один или несколько фармацевтически приемлемых эксципиентов. В еще одном варианте изобретения фармацевтическая композиция по данному изобретению предназначена для профилактики или лечения заболевания, или нарушения, опосредованного активацией циклинзависимых протеинкиназ CDK8/19. В еще одном варианте изобретения фармацевтическая композиция по данному изобретению предназначена для профилактики или лечения заболевания, или нарушения, опосредованного активацией циклинзависимой протеинкиназы CDK8/19, где заболевание, или нарушение, опосредованное активацией циклинзависимых протеинкиназ CDK8/19, представляет собой онкологическое или гематоонкологическое заболевание. В еще одном варианте осуществления изобретения фармацевтическая композиция по данному изобретению предназначена для профилактики или лечения колоректального рака, меланомы, метастатической меланомы, рака молочной железы, трижды негативного рака молочной железы (ТНРМЖ), рака предстательной железы, метастатического рака яичника, метастатического рака желудка, лейкоза, острого миелоидного лейкоза, рака поджелудочной железы (РПЖЖ).
Фармацевтическая композиция по настоящему изобретению может содержать, например, от приблизительно 10% до приблизительно 100% активных ингредиентов, предпочтительно от приблизительно 20% до приблизительно 60% активных ингредиентов. Подразумевается, что содержание активного ингредиента или ингредиентов в индивидуальной дозе каждой лекарственной формы не обязательно составляет эффективное количество, поскольку необходимое эффективное количество может достигаться при введении нескольких стандартных лекарственных форм.
Типичную композицию получают посредством смешивания соединения по настоящему изобретению и одного или нескольких эксципиентов. Примеры эксципиентов включают, но не ограничиваются ими, разбавители, носители, наполнители. Подходящие носители, разбавители, наполнители хорошо известны специалистам в данной области и включают такие вещества, как углеводы, воска, водорастворимые и/или набухающие полимеры, гидрофильные или гидрофобные вещества, желатин, масла, растворители, воду и подобное. Конкретный используемый носитель, разбавитель или наполнитель будет зависеть от средств и цели, для которой применяют соединение по настоящему изобретению. Растворители в общем случае выбирают на основании растворителей, признанных специалистами в данной области техники безопасными для введения млекопитающему. В общем случае безопасные растворители представляют собой водные растворители, такие как вода и другие растворители, которые растворимы в воде или смешиваются с водой. Подходящие водные растворители включают воду, как основной компонент, и этанол, пропиленгликоль, полиэтиленгликоли (например, PEG400, PEG300) и т.д., и их смеси. Композиции также могут включать один или более буферов, стабилизирующих агентов, поверхностно-активных веществ, увлажняющих агентов, смазывающих агентов, эмульгаторов, суспендирующих агентов, консервантов, антиокислителей, матирующих агентов, скользящих веществ, технологических добавок, красителей, подсластителей, отдушек, ароматизаторов и других известных добавок для получения хорошего внешнего вида лекарственного средства (т.е. соединения по настоящему изобретению или его фармацевтической композиции) или чтобы способствовать изготовлению фармацевтического продукта (т.е. лекарственного средства).
Фармацевтические композиции также могут включать соли, сольваты и гидраты соединений по настоящему изобретению, или стабилизированную форму соединения (например, комплекс с производным циклодекстрина или другим известным агентом комплексообразования).
Фармацевтические композиции по настоящему изобретению, как правило, пригодны для перорального введения.  прием лекарственных средств - прием лекарства через рот (лат. per os, oris), путем проглатывания лекарства. Соединения по настоящему изобретению могут также вводиться буккально, лингвально или сублингвально, так что соединение поступает в кровоток непосредственно из полости рта.
прием лекарственных средств - прием лекарства через рот (лат. per os, oris), путем проглатывания лекарства. Соединения по настоящему изобретению могут также вводиться буккально, лингвально или сублингвально, так что соединение поступает в кровоток непосредственно из полости рта.
Лекарственные формы, пригодные для перорального, буккального, лингвального или сублингвального введения, включают твердые, полутвердые и жидкие системы, такие как таблетки; гранулы; мягкие или твердые капсулы, содержащие мульти- или наночастицы, жидкости или порошки; пастилки (включая заполненные жидкостью); жевательные формы; гели; быстро растворимые лекарственные формы; пленки; суппозитории; спреи; и щечные/мукоадгезивные пластыри.
Жидкие лекарственные формы включают суспензии, растворы, сиропы и эликсиры. Такие лекарственные формы могут быть использованы как наполнители в мягких или жестких капсулах (например, из желатина или гидроксипропилметилцеллюлозы) и обычно содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло и один или более эмульгаторов и/или суспендирующих агентов. Жидкие лекарственные формы могут быть также изготовлены путем восстановления твердого вещества, например, из саше.
Соединения по настоящему изобретению могут также вводиться парентерально. Используемый в данном документе термин «парентеральное введение» фармацевтической композиции включает любой способ введения, для которого характерно физическое нарушение целостности ткани субъекта и введение фармацевтической композиции через нарушение в ткани, что обычно приводит к прямому попаданию в кровоток, в мышцу или во внутренний орган. Таким образом, парентеральное введение включает, помимо прочего, введение фармацевтической композиции путем инъекции композиции, посредством введения композиции через хирургический разрез, путем нанесения композиции с помощью проникающей в ткани нехирургической раны и т.п. В частности, предполагается, что парентеральное введение включает, помимо прочего, подкожную, внутрибрюшинную, внутримышечную, внутривенную, внутриартериальную, интратекальную, внутрижелудочковую, интрауретральную, внутричерепную, внутрисуставную инъекцию или инфузии; и почечные диализные инфузионные методики. Внутриопухолевая доставка, например, внутриопухолевая инъекция, также может оказаться полезной. Также предусмотрена региональная перфузия.
Лекарственные формы фармацевтических композиций, подходящие для парентерального введения, обычно содержат активный ингредиент в сочетании с фармацевтически приемлемым носителем, например, стерильной водой или стерильным изотоническим раствором. Такие лекарственные формы могут быть изготовлены, упакованы в форме, подходящей для болюсного введения или для непрерывного введения. Инъекционные лекарственные формы могут быть изготовлены, упакованы в стандартной лекарственной форме, например, в ампулах, или в многодозовых контейнерах, содержащих консервант. Лекарственные формы для парентерального введения включают, помимо прочего, суспензии, растворы, эмульсии в масляных или водных основах, пасты и тому подобное.
Лекарственные формы могут быть выполнены для немедленного и/или модифицированного высвобождения. Лекарственные формы с модифицированным высвобождением включают отсроченное, замедленное, пульсирующее, контролируемое, нацеленное и программируемое высвобождение.
В одном варианте настоящее изобретение относится к способу лечения заболевания или нарушения, опосредованного активацией циклинзависимых протеинкиназ CDK8/19, который включает в себя введение в терапевтически эффективном количестве соединения по настоящему изобретению или его фармацевтически приемлемой соли, или фармацевтической композиции по данному изобретению субъекту, нуждающемуся в таком лечении.
В еще одном варианте осуществления настоящее изобретение относится к способу лечения заболевания или нарушения, опосредованного активацией циклинзависимых протеинкиназ CDK8/19, представляющего собой онкологическое или гематоонкологическое заболевание, который включает в себя введение соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, или фармацевтической композиции по данному изобретению субъекту, нуждающемуся в таком лечении, в терапевтически эффективном количестве.
В еще одном варианте осуществления настоящее изобретение относится к способу лечения, описанному выше, где онкологическое или гематоонкологическое заболевание выбирают из группы, включающей колоректальный рак, меланому, метастатическую меланому, рак молочной железы, трижды негативный рак молочной железы (ТНРМЖ), рак предстательной железы, метастатический рак яичника, метастатический рак желудка, лейкоз, острый миелоидный лейкоз, рак поджелудочной железы (РПЖЖ).
Подразумевается, что соединения по данному изобретению могут использоваться в способах лечения, как описано выше, могут использоваться в лечении, как описано выше, и/или могут использоваться в производстве медикаментов для лечения, как описано выше.
Соединения, являющиеся ингибиторами CDK8/19, могут использоваться в способах лечения, описанных выше, в виде монотерапии или в сочетании с хирургией, или лучевой терапией, или лекарственной терапией.
Используемые в данном документе термины «совместное назначение», «совместно назначенный», «в комбинации с» или «в сочетании с», относящиеся к данным соединениям с одним или более другими терапевтическими агентами, как предполагается, означают, ссылаются или включают:
- одновременное введение такой комбинации соединения по данному изобретению и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы вместе в одной лекарственной форме, из которой указанные компоненты высвобождаются практически одновременно,
- одновременное введение такой комбинации соединения по данному изобретению и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы отдельно в разных лекарственных формах, введение которых происходит практически в одно и то же время указанному пациенту, после чего указанные компоненты высвобождаются практически одновременно,
- последовательное введение такой комбинации соединения по данному изобретению и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы отдельно друг от друга в отдельных лекарственных формах, которые принимаются последовательно по времени указанным пациентом со значимым временным интервалом между каждым введением, после чего указанные компоненты высвобождаются в разное время; а также
- последовательное введение такой комбинации соединения по данному изобретению и терапевтического агента пациенту, который нуждается в лечении, когда такие компоненты сформулированы вместе в единый лекарственной форме, из которой высвобождение указанных компонентов происходит контролируемым образом, после чего они одновременно, последовательно или совместно высвобождаются в одно и то же время и/или разное время, где каждая часть может быть введена одним или разными путями.
Специалистам в данной области известно, что терапевтически эффективные дозировки могут меняться при применении препаратов в комбинированном лечении. Способы для экспериментального определения терапевтически эффективных дозировок препаратов и других агентов для применения в режимах комбинированного лечения описаны в литературе. Например, применение равномерного дозирования, т.е. введение более частых и меньших доз для минимизации токсичных побочных эффектов, описано в литературе. Комбинированное лечение, кроме того, включает периодическое лечение, которое начинается и останавливается в различное время в соответствии с планом лечения пациента. В комбинированной терапии, описанной в настоящем патенте, дозировки совместно вводимых соединений, несомненно, меняются в зависимости от типа применяемого вспомогательного лекарственного средства, специфики применяемого лекарственного средства, болезни или состояния, подвергаемого лечению, и т.д.
Кроме того, соединения, описанные в настоящем изобретении, также можно применять в комбинации с процедурами, которые могут обеспечить аддитивную или синергичную пользу для пациента. Только в качестве примера ожидается, что пациенты получат терапевтическую и/или профилактическую пользу в способах, описанных в настоящем патенте, при которых фармацевтическую композицию соединения, описанного в настоящем изобретении, и/или комбинации с другими способами терапии объединяют с генетическим исследованием для определения того, является ли объект носителем мутантного гена, для которого известно, что он коррелирует с определенными болезнями или состояниями.
Вышеуказанная лекарственная терапия может включать введение одного или более противораковых агентов. Примеры противораковых агентов включают, без ограничения, любой из следующих агентов: алкилирующие агенты, алкилированные сульфонаты, нитрозомочевины или триазены; антиметаболиты; гормональные средства или антагонисты гормонов; соединения платины; противоопухолевые антибиотики; ингибиторы топоизомеразы.
Примеры антиметаболитов включают, без ограничения, аналоги фолиевой кислоты (например, метотрексат, триметрексат, пеметрексед, пралатрексат, ралтитрексед, кальция левофолинат) или аналоги пиримидина (например, цитарабин, тегафур, фторурацил, капецитабин, флоксоуридин, азацитидин, эноцитабин, кармофур, гемцитабин, сапацитабин, элацитарабин, доксифлуридин), или аналоги пурина (например, меркаптопурин, тиогуанин, пентостатин, флударабин, кладрибин, неларабин, азатиоприн, клофарабин), или аспарагиназу.
Примеры алкилирующих агентов включают, без ограничения, мехлороэтамин, циклофосфамид, хлорамбуцил, менфалан, бендамустин, гексаметилимеламине, тиотепа, бусулфан, кармустин, ломустин, ларомустин, семустин, стрептозоцин, дакарбазин, ифосфамид, импросульфан, митобронитол, митолактол, нимустин, ранимустин, темозоломид, треосульфан, карбохион, апазихион, фотемустин, алтретамин, глюфосфамид, пипоброман, трофосфамид, урамустин, эвофосфамид, VAL-083.
Примеры гормональных средств и антагонистов гормонов включают, без ограничения, преднизон, преднизолон, гидроксипрогестерона капроат, мегестрола ацетат, медроксипрогестерона ацетат, диэтилстильбестрол, эстрадиол, тамоксифен, пропионат тестостерона, флуоксиместерон, флутамид, лейпролид, абареликс, абиратерон, бикалутамид, бусерелин, калустерон, хлоротрианизен, дегареликс, дексаметазон, флуокортолон, фулвестрант, гозерелин, хистрелин, лейпрорелин, митотан, нафарелин, нандролон, нилутамид, октреотид, ралоксифен, тиреотропин-альфа, торемифен, трипторелин, диэтилстильбэстрол, аколбифен, даназол, деслорелин, эпитиостанол, ортеронел, энзалутамид, аминоглутетимид, анастрозол, эксеместан, фадрозол, летрозол, тестолактон, форместан.
Примеры соединений платины включают, без ограничения, цисплатин, карбоплатин, оксалиплатин, эптаплатин, мириплатин гидрат, лобаплатин, недаплатин, пикоплатин, сатраплатин.
Примеры противоопухолевых антибиотиков включают, без ограничения, доксорубицин, даунорубицин, идарубицин, карубицин, валрубицин, зорубицин, акларубицин, пирарубицин, неморубицин, амрубицин, эпирубицин, блеомицин, дактиномицин, пликамицин, пепломицин, митомицин С, зиностатин, стрептозоцин.
Примеры ингибиторов топоизомеразы включают, без ограничения, иринотекан, топотекан, белотекан, тенипозид, этопозид, ворелоксин, амонафид.
Примеры противораковых агентов включают, без ограничения, любой из следующих агентов: препараты, действующие на микротрубочки, такие как таксаны (например, паклитаксел, доцетаксел, кабазитаксел, тезетаксел), алкалоиды барвинка (например, винорелбин, винбластин, винкристин, виндезин, винфлунин); ингибиторы сигналинга митогенактивируемой протеинкиназы (например, U0126, PD98059, PD184352, PD0325901, ARRY-142886, SB239063, SP600125, BAY 43-9006, вортманин или LY294002); ингибиторы mTOR (например, сиролимус, темсиролимус, эверолимус, ридафоролимус); антитела (например, ритуксимаб, трастузумаб, алемтузумаб, бесилесомаб, цетуксимаб, деносумаб, ипилимумаб, бевацизумаб, пертузумаб, ниволумаб, офатумумаб, панитумумаб, тозитумомаб, катумаксомаб, элотузумаб, эпратузумаб, фарлетузумаб, могамулизумаб, нецитумумаб, нимотузумаб, обинутузумаб, окаратузумаб, ореговомаб, рамуцирумаб, рилотумумаб, силтуксимаб, тоцилизумаб, залутумумаб, занолимумаб, матузумаб, далотузумаб, онартузумаб, ракотумомаб, табалумаб, abituzumab); ингибиторы киназ (фосматаниб, энтосплетениб, эрлотиниб, иматиниб, лапатиниб, нилотиниб, пазопаниб, вемурафениб, гефитиниб, кризотиниб, дазатиниб, регорафениб, руксолитиниб, сорафениб, сунитиниб, вандетаниб, бозутиниб, акситиниб, афатиниб, алисертиб, дабрафениб, дакомитиниб, динациклиб, довитиниб, нинтеданиб, ленватиниб, линифаниб, линситиниб, маситиниб, мотесаниб, нератиниб, орантиниб, понатиниб, радотиниб, типифарниб, тивантиниб, тивозаниб, траметиниб, апатиниб, ибрутиниб, акалабрутиниб, кобиметиниб, федратиниб, бриваниб аланинат, цедираниб, кабозантиниб, икотиниб, ципатиниб, ригосертиб, пимасертиб, бупарлисиб, иделалисиб, мидостаурин, перифозин, tesevatinib); фотосенсибилизаторы (например, талапорфин, темопорфин, порфимер натрия); цитокины (например, алдеслейкин, интерферон альфа, интерферон альфа-2а, интерферон альфа-2b, целмолейкин, тасонермин, рекомбинантный интерлейкин-2, опрелвекин, рекомбинантный интерферон бета-1a); вакцины (например, пицибанил, сипулеуцел-Т, витеспен, эмепепимут-S, онкоВАКС, риндопепимут, троВАКС, MGN-1601, MGN-1703); бисантрен, децитабин, митоксантрон, прокарбазин, трабектедин, амсакрин, бросталлицин, милтефозин, ромидепсин, плитидепсин, эрибулин, иксабепилон, фосбретабулин, денилейкин дифтитокс, ибритумомаб тиуксетан, преднимустин, трастузумаб эмтанзин, эстрамустин, гемтузумаб-озогамицин, афлиберцепт, опортузумаб монатокс, цинтредекин бесудокс, эдотреотид, инотузумаб-озогамицин, наптумомаб эстафенатокс, винтафолид, брентуксимаб ведотин, бортезомиб, иксазомиб, карфилзомиб, леналидомид, талидомид, помалидомид, золедроновая кислота, ибандроновая кислота, памидроновая кислота, алитретиноин, третиноин, перетиноин, бексаротен, тамибаротен, имихимод, лентинан, мифамуртид, ромуртид, пэгаспаргаза, пентостатин, эндостатин, сизофиран, висмодегиб, вориностат, энтиностат, панобиностат, целекоксиб, циленгитид, этанидазол, ганетеспиб, идроноксил, инипариб, лонидамин, ниморазол, прокодазол, тасхинимод, телотристат, белиностат, тимальфазин, тирапазамин, тоседостат, трабедерсен, убенимекс, валсподар, гендицин, реолизин, ретаспимицин, требананиб, вирулизин.
В одном варианте настоящее изобретение относится к применению соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, или фармацевтической композиции по данному изобретению для лечения заболевания или нарушения, опосредованного активацией циклинзависимых протеинкиназ CDK8/19, у субъекта, нуждающегося в таком лечении.
В еще одном варианте осуществления настоящее изобретение относится к применению соединения, описанного в настоящем документе, или его фармацевтически приемлемой соли, или фармацевтической композиции по данному изобретению у субъекта, нуждающегося в таком лечении, для лечения заболевания или нарушения, опосредованного активацией циклинзависимых протеинкиназ CDK8/19, представляющего собой онкологическое или гематоонкологическое заболевание.
В еще одном варианте осуществления настоящее изобретение относится к применению соединения, описанному выше, или его фармацевтически приемлемой соли, или фармацевтической композиции по данному изобретению для лечения онкологического или гематоонкологического заболевания, которое выбирают из группы, включающей колоректальный рак, меланому, метастатическую меланому, рак молочной железы, трижды негативный рак молочной железы (ТНРМЖ), рак предстательной железы, метастатический рак яичника, метастатический рак желудка, лейкоз, острый миелоидный лейкоз, рак поджелудочной железы (РПЖЖ), у субъекта, нуждающегося в таком лечении. В любом из указанных выше способов лечения, субъект может быть человеком.
Соединения по настоящему изобретению будут вводиться в количестве, эффективном для лечения состояния, о котором идет речь, т.е. в дозах и в течение периодов времени, необходимых для достижения желаемого результата. Терапевтически эффективное количество может изменяться в зависимости от таких факторов, как конкретное состояние, по поводу которого проводится лечение, возраста, пола и веса пациента, а также является ли введение данных соединений самостоятельным лечением или оно проводится в комбинации с одним или более дополнительных методов лечения.
Схемы приема лекарственных средств можно регулировать, чтобы обеспечить оптимальный желаемый ответ. Например, может быть введена одна доза, несколько разделенных доз могут быть введены в течение некоторого времени, или доза может быть пропорционально уменьшена или увеличена в зависимости от остроты терапевтической ситуации. Особенно полезным является изготовление пероральных композиций в стандартной лекарственной форме для простоты введения и однородности дозирования. Стандартная лекарственная форма при использовании в данном документе, относится к физически дискретным единицам, пригодным в качестве единичных доз для пациентов/субъектов, подлежащих лечению; каждая единица содержит заданное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта в сочетании с требуемым фармацевтическим носителем.
Кроме того, необходимо понимать, что для любого конкретного пациента, конкретные схемы введения должны быть скорректированы через некоторое время согласно индивидуальной потребности и на усмотрение медицинского работника, который осуществляет введение или контролирует введение композиций, и что диапазоны концентрации, приведенные в данном описании, приведены только в качестве примера и не предназначены для ограничения объема или практики заявленных композиций. Кроме того, режим дозирования с композициями по данному изобретению может быть основан на различных факторах, включая тип заболевания, возраст, вес, пол, состояния здоровья пациента, тяжесть состояния, путь введения и конкретное используемое соединение по настоящему изобретению. Таким образом, режим дозирования может широко варьироваться, но может определяться регулярно с помощью стандартных методов. Например, дозы могут быть скорректированы на основе фармакокинетических и фармакодинамических параметров, которые могут включать клинические эффекты, такие как токсические эффекты или лабораторные значения. Таким образом, настоящее изобретение охватывает индивидуальное повышение дозы, которое определяется квалифицированным специалистом. Определение необходимой дозы и режимы хорошо известны в соответствующей области техники и будут понятны специалисту в данной области после ознакомления с идеями, раскрытыми в данном документе.
Как правило, дозы, применяемые для лечения взрослого человека, обычно находятся в диапазоне 0,02-5000 мг в день или приблизительно от 1-1500 мг в день.
При улучшении состояния пациента вводится поддерживающая доза, если это необходимо. Впоследствии, дозировка или частота введения, или то и другое могут быть уменьшены, в зависимости от симптомов, до уровня, при котором поддерживается облегченное состояние болезни, нарушения или состояния. Пациентам может, однако, потребоваться периодическое лечение в течение долгого времени при любом рецидиве симптомов.
Вышеизложенный спектр является только предположительным, поскольку количество переменных в отношении индивидуального режима лечения велико, и значительные отклонения от этих рекомендованных значений являются весьма обычными. Эти дозировки могут быть изменены в зависимости от множества переменных, не ограниченных активностью применяемого соединения, болезни или состояния, подвергаемого лечению, способа введения, потребности индивидуального субъекта, тяжести болезни или состояния, подвергаемого лечению, и мнения лечащего врача.
Все публикации, патенты и патентные заявки, указанные в этой спецификации включены в данный документ путем отсылки. Хотя вышеупомянутое изобретение было довольно подробно описано, специалистам в данной области на основе идей, раскрытых в данном изобретении, будет вполне понятно, что могут быть внесены определенные изменения и модификации без отклонения от сущности и объема прилагаемых вариантов осуществления изобретения.
Для наилучшего понимания изобретения приводятся следующие примеры. Эти примеры приведены только в иллюстративных целях и не должны толковаться как ограничивающие сферу применения изобретения в любой форме.
Соединения и процессы по настоящему изобретению будут лучше поняты в совокупности со следующими схемами синтеза, которые демонстрируют способы, с помощью которых могут быть получены соединения по настоящему изобретению. Исходные продукты могут быть получены из коммерческих источников или получены с помощью общепринятых способов из уровня техники, известных среднему специалисту. Среднему специалисту будет также очевидно, что стадии выборочного введения защиты и снятия защиты, так же как порядок проведения указанных стадий, могут быть осуществлены в различной очередности, в зависимости от природы заместителей, для успешного завершения синтеза, представленного ниже.
Сокращения, используемые в настоящем описании, включая приведенные в иллюстративных схемах и последующих примерах хорошо известны среднему специалисту. Некоторые из сокращений используют как следующие:
NMP - N-метилпирролидон
ДМФА - N,N-диметилформамид
ДМСО - диметилсульфоксид
ТГФ - тетрагидрофуран
ДМАА - N,N-диметилацетамид
DIPEA - диизопропилэтиламин
DIAD - диизопропилазадикарбоксилат
Pd(PPh3)4 - тетракис(трифенилфосфин)палладий(0)
BINAP - (±)-2,2'-бис(дифенилфосфино)-1,1'-динафталин
CDI - карбонилдиимидазол
МТБЭ - метил-трет-бутиловый эфир
NBS - N-бромсукцинимид
AIBN - Азобисизобутиронитрил
DMAP - 4-диметиламинопиридин
EDC×HCl - 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид
Препаративная очистка синтезированных соединений проводилась на хроматографе AKTA Explorer 100 Air с УФ-детектированием в диапазоне 254-360 нм. Разделение проводилось в градиентном режиме при различных соотношениях элюентов А и Б.
Примеры
Пример 1. Получение промежуточных соединений 7.2, 12.2, 13.2, 17.2.
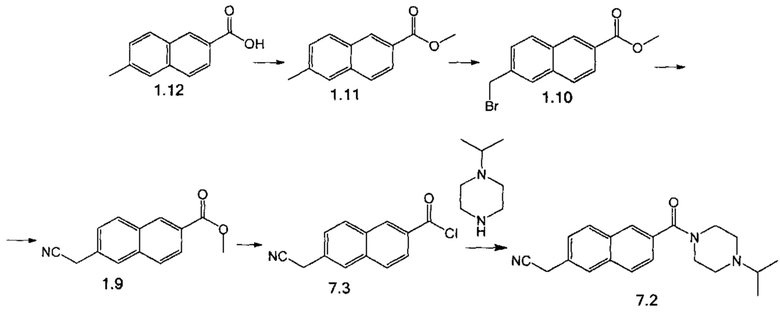
Стадия 1. К суспензии 6-метилнафталин-2-карбоновой кислоты 1.12 (10.0 г, 53.7 ммоль) в 85 мл метанола добавили по каплям SOCl2 (1.64 г, 13.8 ммоль). После выдержки при кипении в течение 1.5 ч добавили по каплям SOCl2 (660 мг, 5.5 ммоль). После перемешивания при кипении в течение 1 ч растворитель отогнали в вакууме. Продукт 1.11 получили в виде светло-желтого порошка и использовали в следующей стадии без дополнительной очистки. Выход 10.3 г (98%).
Стадия 2. К суспензии соединения 1.11 (10.0 г, 49.9 ммоль) в 43 мл четыреххлористого углерода добавили NBS (4.58 г, 25.7 ммоль) и AIBN (370 мг, 2.3 ммоль). После выдержки при температуре 78°С в течение 1.5 часа реакционную смесь охладили до 60°С и добавили еще NBS (4.58 г, 25.7 ммоль) и AIBN (370 мг, 2.3 ммоль). После выдержки в течение 1.5 ч при температуре 63.5°С реакционную смесь охладили до 35°С и прилили к ней 65 мл гексана. Смесь перемешивали 2 ч при комнатной температуре, выпавший осадок отфильтровали, промыли гексаном, смесью вода-этанол (7:3) и высушили в вакууме до постоянной массы. Продукт 1.10 получили в виде желтого порошка и использовали в следующей стадии без дополнительной очистки. Выход 7.4 г (53%).
Стадия 3. К раствору соединения 1.10 (7.4 г, 26.5 ммоль) в 70 мл метанола при кипении добавили KCN (2.07 г, 31.8 ммоль). После выдержки в течение 1.25 ч растворитель отогнали. Остаток экстрагировали дихлорметаном, растворитель отогнали в вакууме. Продукт 1.9 выделили в виде порошка светло-коричневого цвета после перекристаллизации из этанола. Выход 4.78 г (80%).
Стадия 4. К раствору LiOH×Н2О (306 мг, 7.20 ммоль) в 30 мл смеси вода-ТГФ добавили соединение 1.9 (1.50 г, 6.60 ммоль). Реакционную массу перемешивали 3 ч, растворитель отогнали. К смеси добавили 5 мл МТБЭ. Слои разделили, водный слой подкислили до рН 2-3 добавлением 0.75 мл концентрированной HCl. Осадок отфильтровали, промыли водой, высушили на воздухе, растворили в 14 мл сухого дихлорметана в атмосфере азота, добавили SOCl2 (1.40 мл, 19.3 ммоль) и 50 мкл ДМФА. Реакционную массу перемешивали при кипении в течение 3 ч. После чего растворитель отогнали досуха, добавили 5 мл толуола и снова сконцентрировали в вакууме. Получили продукт 7.3 в виде твердой коричневой массы. Выход 1.36 г (90%).
Стадия 5. К раствору 1-изопропилпиперазина (390 мг, 3.00 ммоль) и DIPEA (510 мг, 5.00 ммоль) в 20 мл дихлорметана прибавили по каплям при перемешивании и охлаждении в ледяной бане в атмосфере азота раствор соединения 7.3 (580 мг, 2.50 ммоль) в 10 мл дихлорметана. Перемешивание продолжали при 20°С в течение 3 ч, затем реакционную массу промыли водой, органический слой перемешивали с Na2SO4 и активированным углем в течение 15 мин, профильтровали через слой целита, растворитель отогнали. Получили продукт 7.2 в виде оранжевой вязкой жидкости. Выход 800 мг (99%).
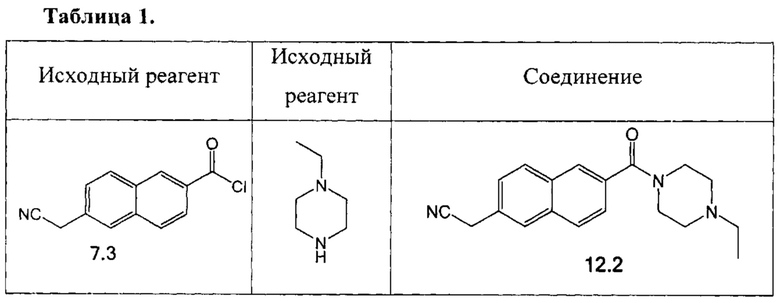
Аналогично были получены соединения 12.2, 13.2, 17.2 из соответствующих исходных реагентов, приведенные в таблице 1.
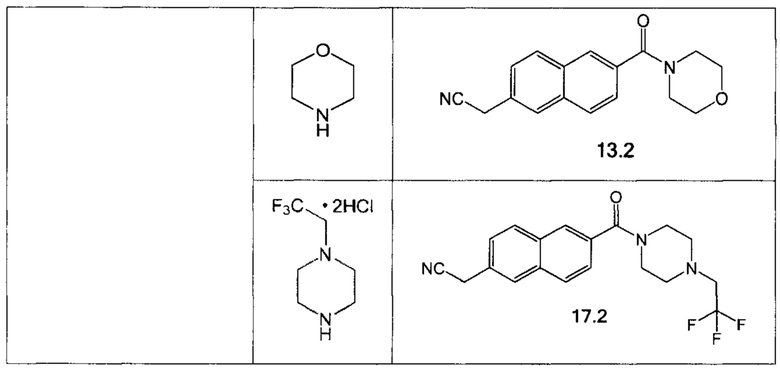
1-(2,2,2-Трифторэтил)пиперазин дигидрохлорид может быть получен по методике, описанной в Journal of Medicinal Chemistry 2007, 50(15), 3528.
Пример 2. Способ получения соединения 1.
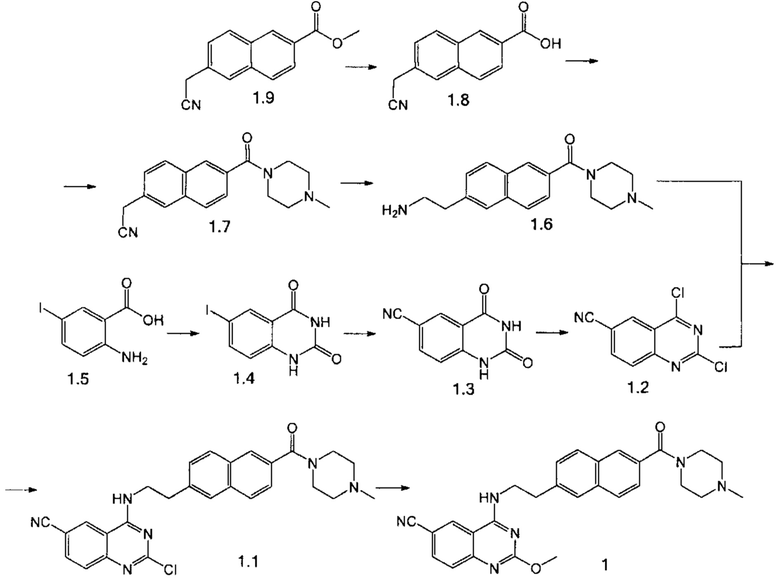
Стадия 1. К раствору LiOH (559 мг, 23.3 ммоль) в 64 мл воды и 52 мл ТГФ присыпали в течение 1.5 ч соединение 1.9 (4.78 г, 21.2 ммоль). После перемешивания в течение 4 ч при температуре 30°С отогнали ТГФ. Водный раствор промыли МТБЭ и подкислили 1М HCl до рН 2. Выпавший осадок продукта 1.8 отфильтровали, промыли водой и сушили в вакууме до постоянной массы. Выход 4.39 г (98%).
Стадия 2. К суспензии соединения 1.8 (4.39 г, 20.8 ммоль) в 44 мл сухого дихлорметана добавили SOCl2 (7.42 г, 62.4 ммоль) и ДМФА (15 мг, 0.208 ммоль). Реакционную смесь перемешивали при кипении 4 ч, растворитель отогнали, остаток растворили в 45 мл сухого дихлорметана. Полученный раствор добавили по каплям к раствору триэтиламина (2.35 г, 22.9 ммоль) и N-метилпиперазина (2.19 г, 21,84 ммоль) в 45 мл сухого дихлорметана при температуре 5°С. После выдержки 30 мин полученную смесь нагрели до комнатной температуры, промыли водой, высушили над Na2SO4, растворитель отогнали. Продукт 1.7 выделили в виде коричневой маслообразной жидкости. Выход 5.80 г (95%).
Стадия 3. К раствору соединения 1.7 (5.80 г, 19.8 ммоль) в 50 метанола прилили 50 мл 25% раствора аммиака и добавили суспензию свежеприготовленного катализатора Ni Ренея (2.90 г, 49.0 ммоль) в 20 мл метанола. После выдержки в течение 4 ч в автоклаве с водородом при давлении 10 атм реакционную смесь отфильтровали через целит, фильтрат отогнали в вакууме. Остаток экстрагировали дихлорметаном, растворитель отогнали в вакууме. Продукт 1.6 выделили в виде коричневой маслообразной жидкости. Выход 5.58 г (95%)
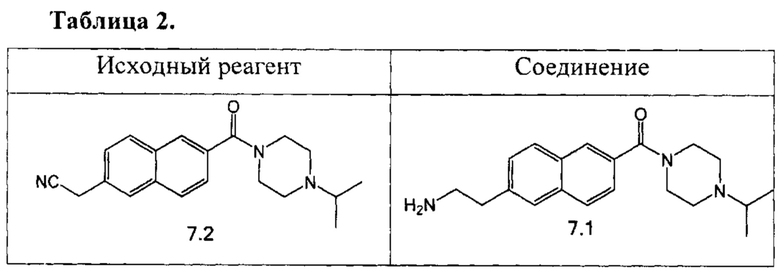
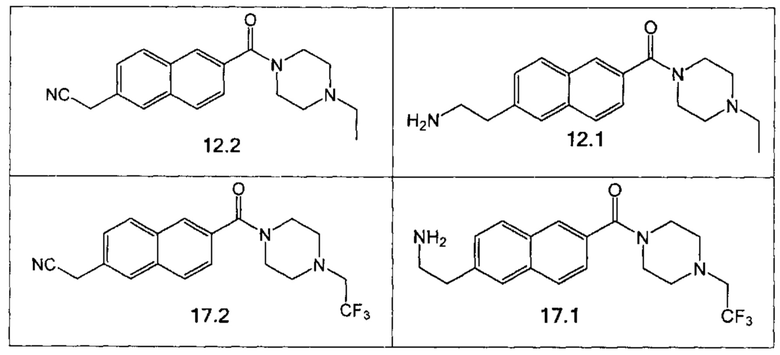
Аналогично были получены соединения 7.1, 12.1, 17.1 из соответствующих исходных реагентов, приведенные в таблице 2.
Стадия 4. К суспензии соединения 1.5 (10.0 г, 38 ммоль) в 70 мл ДМАА добавили мочевину (22.8 г, 380 ммоль). После выдержки в течение 3 ч при 160°С реакционную смесь охладили до комнатной температуры и вылили в 210 мл воды. Выпавший осадок продукта 1.4 отфильтровали, промыли водой и сушили в вакууме до постоянной массы. Выход 8.30 г (76%).
Стадия 5. К суспензии соединения 1.4 (8.30 г, 28.9 ммоль) в 30 мл ДМФА добавили Zn(CN)2 (2.77 г, 23.7 ммоль) и Pd(PPh3)4 (335 мг, 0.29 ммоль, 0.01 экв). Через реакционную массу пропускали азот в течение 15 мин, затем перемешивали 2 ч при 120°С. Горячую реакционную смесь отфильтровали через целит и промыли ДМФА. Фильтрат охладили до 5°С, выпавший осадок продукта 1.3 отфильтровали, промыли ацетонитрилом, водой и высушили в вакууме до постоянной массы. Выход 2.90 г (54%).
Стадия 6. К суспензии соединения 1.3 (2.90 г, 15.6 ммоль) в 5.8 мл толуола добавили DIPEA (5.84 г, 45.2 ммоль). К смеси добавили POCl3 (14.35 г, 93.6 ммоль) при температуре 0°С. После выдержки в течение 30 мин при 0°С и 3 часа при 90°С смесь охладили до комнатной температуры и вылили в лед. Полученную смесь довели раствором NaHCO3 до рН 8. Осадок отфильтровали и промыли водой. Продукт 1.2 выделили при помощи колоночной хроматографии на силикагеле с использованием элюента гексан-дихлорметан (1:9) в виде коричневого порошка. Выход 2.70 г (78%).
Стадия 7. К раствору соединения 1.6 (4.00 г, 13.5 ммоль) в 60 мл ацетонитрила добавили триэтиламин (3.70 г, 36.6 ммоль) и соединение 1.2 (2.70 г, 12.2 ммоль) при 0°С. После выдержки при комнатной температуре в течение 2 ч выпавший осадок продукта 1.1 отфильтровали, промыли ацетонитрилом, водой и сушили в вакууме до постоянной массы. Выход 4.86 г (82%).
Стадия 8. Суспензию пиримидина 1.1 (100 мг, 0.206 ммоль) и метилата натрия (13 мг, 0.247 ммоль) в 10 мл смеси метанол-NMP (2:1) перемешивали под давлением в закрытом сосуде при 100°С в течение 15 ч. После удаления летучих компонентов при пониженном давлении продукт 1 выделили в виде белого порошка при помощи препаративной хроматографии (Метод А). Выход 31 мг (31%).
Пример 3. Способ получения соединения 2.
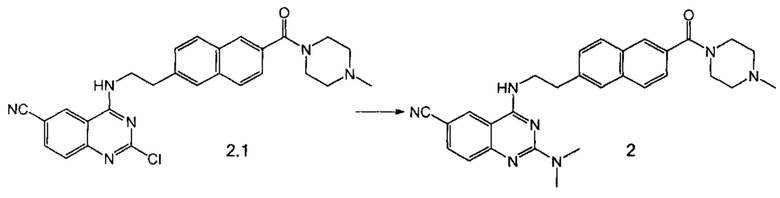
Суспензию пиримидина 2.1 (100 мг, 0.206 ммоль), диметиламина (31 мкл, 0.247 ммоль, 40% раствор в воде) и триэтиламина (30 мкл, 0.216 ммоль) в 3 мл ДМФА перемешивали под давлением в закрытом сосуде при 120°С в течение 2 ч. После концентрирования реакционной смеси продукт выделили в виде бежевого порошка при помощи препаративной хроматографии (Метод А). Выход 50 мг (52%).
Пример 4. Способ получения соединения 3.
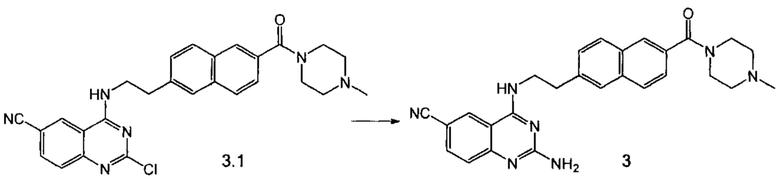
Суспензию пиримидина 3.1 (100 мг, 0.206 ммоль) в 200 мкл 25%-го водного аммиака перемешивали под давлением в закрытом сосуде при 150°С в течение 8 ч. После концентрирования реакционной смеси продукт выделили в виде белого порошка при помощи препаративной хроматографии (Метод Б). Выход 55 мг (54%).
Пример 5. Способ получения соединения 4.
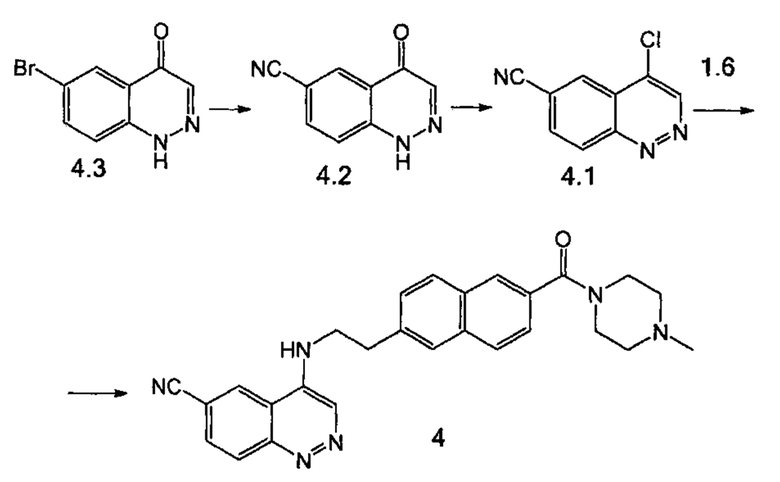
Стадия 1. Соединение 4.2 было получено аналогично соединению 1.3 (пример 2, стадия 5), используя соединение 4.3 (получено по методике, описанной в Bioorganic & Medicinal Chemistry 2006, 14 (20), 6832) вместо соединения 1.4.
Стадия 2. Соединение 4.1 было получено аналогично соединению 1.2 (пример 2, стадия 6), используя соединение 4.2 вместо соединения 1.3.
Стадия 3. К раствору амина 1.6 (212 мг, 0.713 ммоль) и триэтиламина (287 мкл, 2.06 ммоль) в 5 мл ацетонитрила при 10°С в токе азота добавили соединение 4.1 (130 мг, 0.686 ммоль). Через 10 мин повысили температуру до 60°С и выдержали при нагревании в течение 8 ч. Суспензию отфильтровали, полученный осадок промыли ацетонитрилом. Продукт 4 в виде желтого порошка выделили при помощи колоночной хроматографии на силикагеле, элюент дихлорметан-метанол (95:5). Выход 128 мг (41%).
Пример 6. Способ получения соединения 5, 5а, 7, 12, 13, 17.
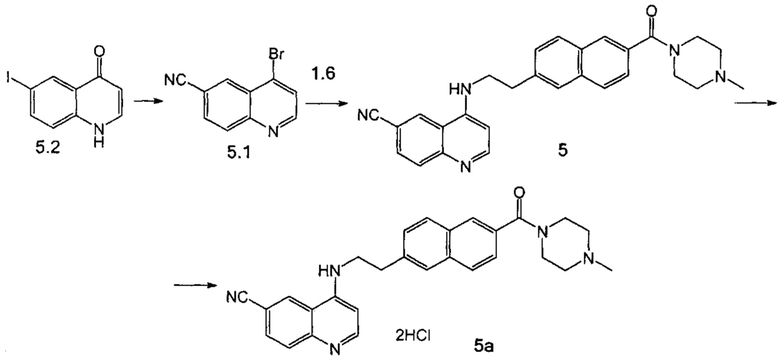
Стадия 1. Через суспензию 6-йод-4-гидроксихинолина (8.00 г, 29.5 ммоль) в 60 мл ДМФА в течение 10 мин пропускали азот, затем добавили Zn(CN)2 (4.16 г, 35.4 ммоль) и Pd(PPh3)4 (1.71 г, 1.48 ммоль, 0.05 экв.). Смесь перемешивали в атмосфере азота при 100°С в течение 2 ч. Затем реакционную смесь довели до комнатной температуры и при охлаждении ледяной баней добавили по каплям PBr3 (3 мл, 32.5 ммоль), по окончании добавления выдержали 10 мин при 0°С, а затем перемешивали в течение 1 ч при комнатной температуре. Смесь нейтрализовали насыщенным раствором Na2CO3, продукт экстрагировали дихлорметаном, сушили над Na2SO4, раствор сконцентрировали в вакууме. Продукт 5.1 выделили при помощи колоночной хроматографии на силикагеле, элюент гексан-этилацетат-дихлорметан (4:1:1) в виде белого порошка. Выход 4.28 г (62%).
Стадия 2. Через суспензию соединения 1.6 (842 мг, 2.83 ммоль), соединения 5.1 (600 мг, 2.57 ммоль) и Cs2CO3 (1.68 г, 5.15 ммоль) в 20 мл диоксана в течение 10 мин пропускали азот. Затем добавили BINAP (321 мг, 0.516 ммоль, 0.20 экв.) и ацетат палладия(II) (58 мг, 0.259 ммоль, 0.10 экв.) и перемешивали в инертной атмосфере в течение 3 ч при 100°С. После концентрирования реакционной смеси продукт 5 в виде светло-желтого порошка выделили при помощи колоночной хроматографии на силикагеле, элюент дихлорметан-метанол (95:5). Выход 640 мг (55%).
Аналогично были получены соединения 7, 12, 13, 17 из соответствующих исходных реагентов, приведенные в таблице 3.
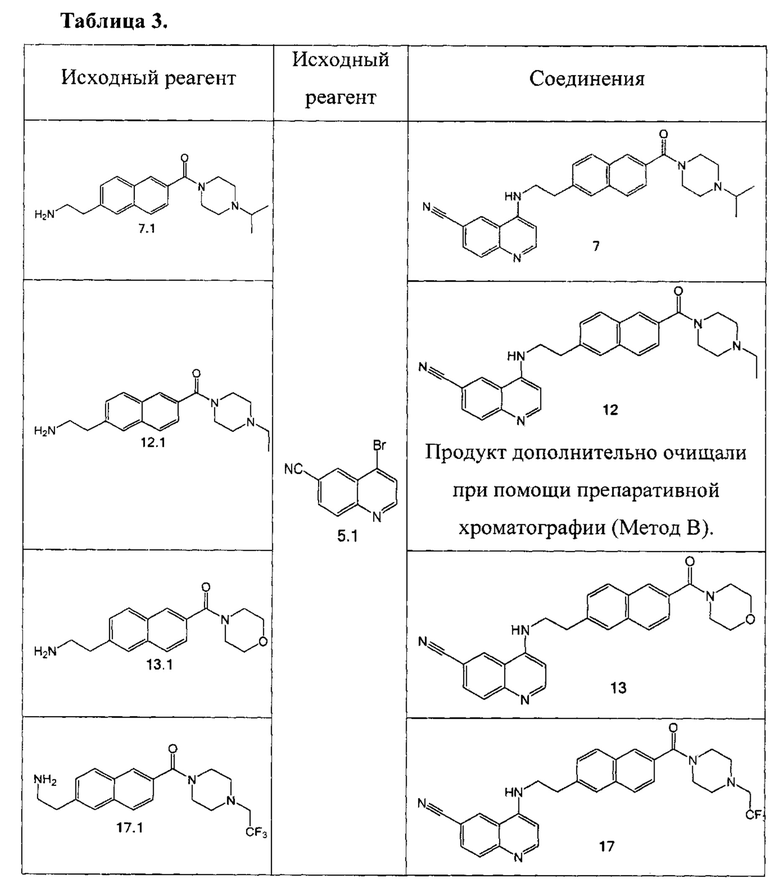
Стадия 3. К суспензии соединения 5 (495 мг, 1.10 ммоль) в 50 мл метанола добавили по каплям 4М раствор HCl в диэтиловом эфире (605 мкл, 2.42 ммоль). Через 1 ч отогнали растворители, добавили 30 мл диэтилового эфире и отфильтровали образовавшийся желтый осадок соединения 5а. Выход 422 мг (73%).
Пример 7. Способ получения соединения 6.
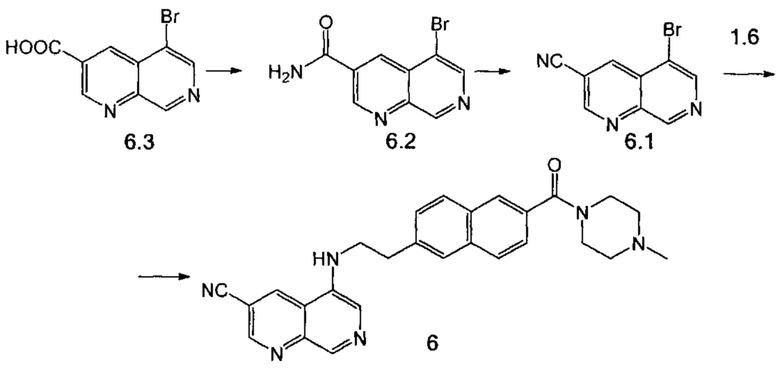
Стадия 1. К 5-бром-1,7-нафтиридин-3-карбоновой кислоте 6.3 (500 мг, 1.97 ммоль) (получена по методике, описанной в WO 2015/014768) прибавили 5 мл SOCl2 и одну каплю ДМФА. Реакционную смесь перемешивали при кипении 5 ч, после чего удалили летучие компоненты при пониженном давлении. К остатку прилили 5 мл МТБЭ, сконцентрировали, остаток сушили в вакууме роторного испарителя. Суспензию полученного порошка в 10 мл дихлорметана добавили к 20 мл 4М раствора NH3 в метаноле при 0°С. Реакционную массу перемешивали в течение 8 часов, после этого удалили летучие компоненты при пониженном давлении. Продукт реакции 6.2, выделенный в виде коричневого порошка, использовали в следующей стадии без дополнительной очистки. Выход 450 мг (90%).
Стадия 2. К раствору соединения 6.2 (300 мг, 1.19 ммоль) в 6 мл 1,4-диоксана при 0°С добавили пиридин (190 мкл, 2.38 ммоль) и трифторуксусный ангидрид (180 мкл, 1.42 ммоль). Реакционную массу перемешивали при температуре 40°С в течение 1.5 ч. Затем реакционную массу вылили в 40 мл воды и экстрагировали этилацетатом. Органический слой отделили, сушили Na2SO4 и сконцентрировали в вакууме. Продукт 6.1 в виде белого порошка выделили при помощи колоночной хроматографии на силикагеле, элюент дихлорметан-метанол (97:3). Выход 180 мг (65%).
Стадия 3. Соединение 6 было получено аналогично соединению 5 (пример 6, стадия 2), используя соединение 6.1 вместо соединения 5.1.
Пример 8. Способ получения соединения 8.
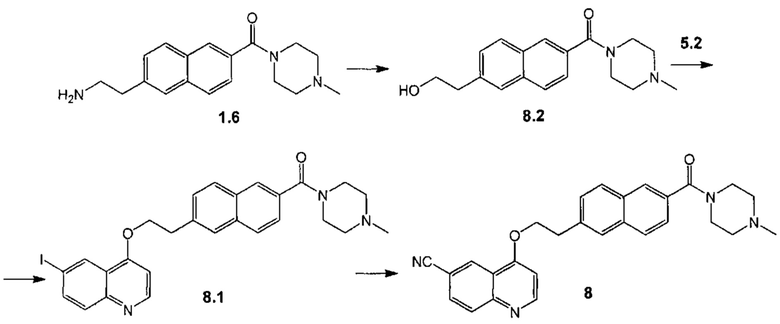
Стадия 1. К раствору соединения 1.6 (1.00 г, 3.36 ммоль) в смеси 10 мл воды и 10 мл ледяной уксусной кислоты при температуре 0°С добавили по каплям раствор нитрита натрия (230 мг, 330 ммоль) в 2.3 мл воды. Раствор выдержали при этой температуре в течение 30 мин, затем при 80°С 1 ч. Реакционную массу нейтрализовали 25% водным раствором NH3 до рН 9 и экстрагировали смесью этилацетат-метанол (9:1). Растворитель отогнали, остаток растворили в 10 мл ТГФ. В полученную смесь добавили LiOH (38 мг, 1.6 ммоль) и 10 мл воды. После 3 ч выдержки при комнатной температуре в смесь добавили 20 мл этилацетата. Реакционную смесь экстрагировали 1-бутанолом, растворитель отогнали в вакууме. Продукт 8.2 выделили при помощи колоночной хроматографии на силикагеле с использованием элюента дихлорметан-метанол (94:6) в виде желтого маслообразного остатка. Выход 650 мг (68%).
Стадия 2. К раствору соединения 8.2 (131 мг, 4.90 ммоль) в 10 мл сухого ТГФ добавили трифенилфосфин (131 мг, 0.50 ммоль) и 4-гидрокси-6-йодхинолин 5.2 (134 мг, 0.50 ммоль). Затем при температуре 0°С добавили по каплям (101 мг, 0.50 ммоль) DIAD. Реакционную массу выдержали при комнатной температуре в течение 16 часов. Растворитель отогнали в вакууме, продукт 8.1 выделили при помощи колоночной хроматографии на силикагеле с использованием элюента дихлорметан-метанол (98:2->92:8) в виде желтого маслообразного остатка. Выход 40 мг (22%).
Стадия 3. Соединение 8 было получено аналогично соединению 1.3 (пример 2, стадия 5), используя соединение 8.1 вместо соединения 1.4. Продукт дополнительно очищали при помощи препаративной хроматографии (Метод В).
Пример 9. Способ получения соединения 9.
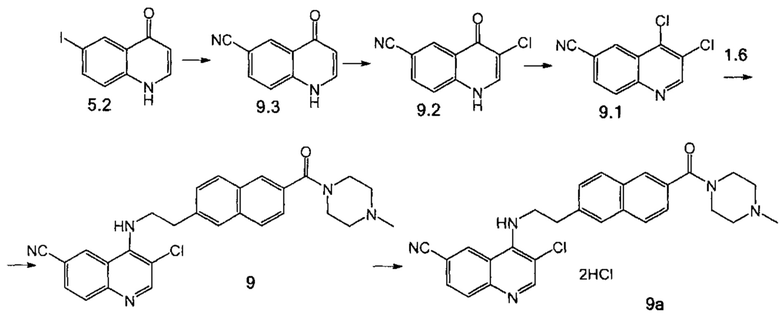
Стадия 1. Соединение 9.3 было получено аналогично соединению 1.3 (пример 2, стадия 5), используя соединение 5.2 вместо соединения 1.4.
Стадия 2. К раствору нитрила 9.3 (500 мг, 2.64 ммоль) в ледяной уксусной кислоте при 50°С добавили N-хлорсукцинимид (428 мг, 3.17 ммоль). Полученную смесь перемешивали при 65°С в течение 1 ч, охладили до 2°С, выпавший осадок отфильтровали, высушили в вакууме. Продукт 9.2 использовали с следующей стадии без дополнительной очистки. Выход 480 мг (89%).
Стадия 3. Соединение 9.2 (430 мг, 1.89 ммоль) в 5 мл POCl3 перемешивали при кипении в течение 1 ч, затем реакционную смесь вылили в лед, нейтрализовали насыщенным раствором NaHCO3, экстрагировали этил ацетатом. Объединенные органические фракции сконцентрировали в вакууме, продукт 9.1 выделили с помощью колоночной хроматографии на силикагеле с использованием элюента этилацетат-гексан (50:50). Выход 270 мг (64%).
Стадия 4. Соединение 9 было получено аналогично соединению 4 (пример 5, стадия 3), используя соединение 9.1 вместо соединения 4.1.
Стадия 5. Соединение 9а было получено аналогично соединению 5а (пример 6, стадия 3), используя соединение 9 вместо соединения 5. Продукт дополнительно очищали при помощи препаративной хроматографии (Метод Г).
Пример 10. Способ получения соединения 11.
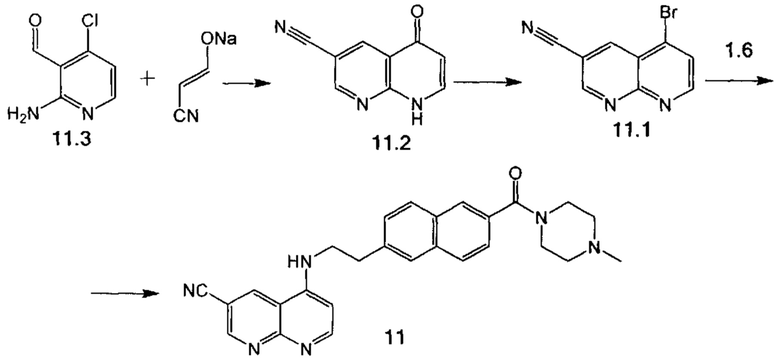
Стадия 1. 2-Амино-4-хлорникотинальдегид 11.3 (313 мг, 2.00 ммоль) (получен по методике, описанной в Journal of Medicinal Chemistry 2010, 53(8), 3330), 2-цианэтенолат натрия (получен по методике, описанной в Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry (1972-1999), 1986, 5, 747) (520 мг, 5.60 ммоль) и 8 мл уксусной кислоты перемешивали при 70°С в течение 5 ч, реакционную массу охладили, сконцентрировали в вакууме. Продукт 11.2 выделили в виде твердой серой массы при помощи колоночной хроматографии на силикагеле, элюент этилацетат, затем этилацетат-метанол (9:1). Выход 77 мг (20%).
Стадия 2. К раствору 11.2 (73 мг, 0.43 ммоль) в 1 мл ДМФА добавили PBr3 (120 мг, 0.45 ммоль). Реакционную массу перемешивали при комнатной температуре в атмосфере азота 2 ч, сконцентрировали в вакууме. Продукт 11.1 выделили в виде твердой серой массы при помощи колоночной хроматографии на силикагеле, элюент этилацетат-гексан (1:1). Выход 90 мг (70%).
Стадия 3. Соединение 11 было получено аналогично соединению 5 (пример 6, стадия 2), используя соединение 11.1 вместо соединения 5.1.
Пример 11. Способ получения соединения 18.
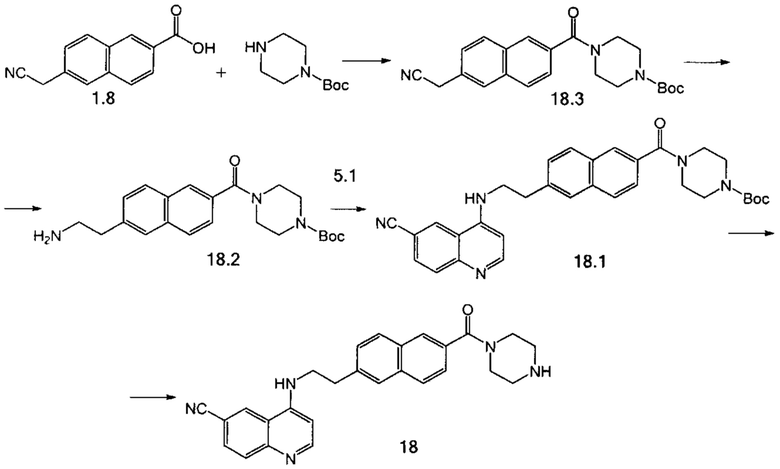
Стадия 1. Смесь кислоты 1.8 (1.00 г, 4.74 ммоль) и N-Boc-пиперазина (971 мг, 5.21 ммоль) растворили в 10 мл ДМФА и при охлаждении ледяной баней присыпали порциями CDI (922 мг, 5.69 ммоль). Реакционную смесь перемешивали при комнатной температуре 18 ч, после чего добавили 100 мл воды. Полученный осадок отфильтровывали, промывали водой. Продукт 18.3 выделили с помощью колоночной хроматографии на силикагеле с использованием элюента дихлорметан-метанол (50:1) в виде светло-желтого порошка. Выход 281 мг (16%).
Стадия 2. Соединение 18.2 было получено аналогично соединению 1.6 (пример 2, стадия 3), используя соединение 18.3 вместо соединения 1.7.
Стадия 3. Соединение 18.1 было получено аналогично соединению 5 (пример 6, стадия 2), используя соединение 18.2 вместо соединения 1.6.
Стадия 4. К раствору соединения 18.1 (71 мг, 0.133 ммоль) в 3 мл дихлорметана при охлаждении водяной баней добавили по каплям 1.5 мл 4М раствора HCl в диоксане. Через 16 часов отфильтровали выпавший осадок и промыли его дихлорметаном. Выход 48 мг (79%). Продукт реакции 18 был дополнительно очищен с помощью препаративной хроматографии (Метод В).
Пример 12. Способ получения соединения 19.
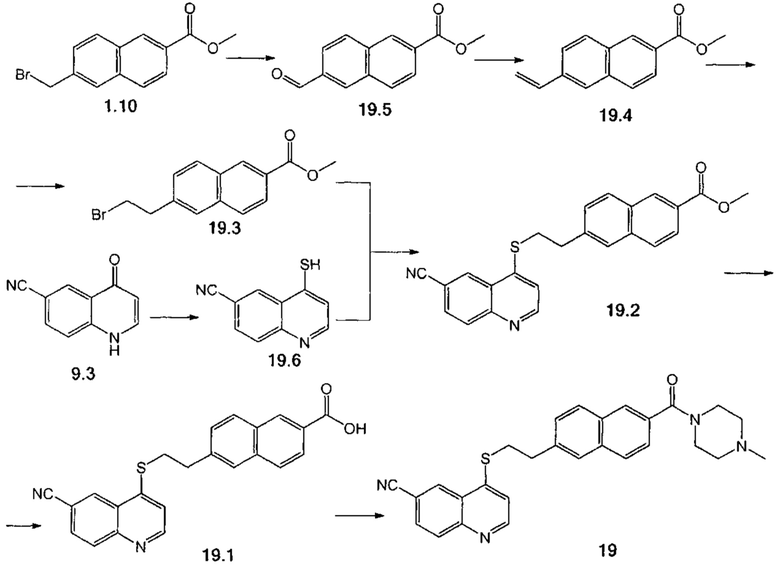
Стадия 1. К суспензии соединения 1.10 (3.00 г, 10.2 ммоль) в 20 мл смеси этанол : вода (1:1) при комнатной температуре добавили уротропин (1.58 г, 11.2 ммоль). Реакционную смесь перемешивали при кипении в течение 9 ч. После чего при комнатной температуре добавили к ней 10 мл концентрированной HCl и перемешивали 18 часов. К реакционной смеси добавили 30 мл воды, выпавший осадок продукта 19.5 отфильтровали, промыли водой и гексаном, сушили на воздухе. Выход 1.38 г (43%).
Стадия 2. Суспензию метилтрифенилфосфониййодида (5.36 г, 12.6 ммоль) в 50 мл ТГФ охладили до -60°С, затем к ней постепенно добавили 2.5М раствор бутиллития в гексане (5.60 мл, 12.6 ммоль), реакционную смесь нагрели до комнатной температуры в течение 1 ч, затем при -20°С добавили соединение 19.5 (2.50 г, 10.5 ммоль) в 35 мл ТГФ, перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь экстрагировали этилацетатом, объединенные органические фракции сконцентрировали в вакууме. Продукт 19.4 выделили с помощью колоночной хроматографии на силикагеле с использованием элюента гексан-этилацетат (97:3). Выход 2.07 г (93%).
Стадия 3. Смесь соединения 19.4 (2.00 г, 8.48 ммоль) и AIBN (280 мг, 1.69 ммоль) в четыреххлористом углероде довели до кипения, добавили 30% раствор HBr в уксусной кислоте (5 мл, 25.4 ммоль), перемешивали при кипении в течение 6 ч. Реакционную смесь экстрагировали дихлорметаном. Объединенные органические фракции сконцентрировали в вакууме. Продукт 19.3 выделили с помощью колоночной хроматографии на силикагеле с использованием элюента гексан-этилацетат (95:5). Выход 2.0 г (80%).
Стадия 4. Смесь соединения 9.3 (400 мг, 2.11 ммоль) и реагента Лавессона (864 мг, 2.11 ммоль) в 7 мл пиридина, перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь экстрагировали этилацетатом и сконцентрировали в вакууме. Продукт 19.6 выделили с помощью колоночной хроматографии на силикагеле с использованием элюента дихлорметана. Выход 350 мг (88%).
Стадия 5. Через смесь соединений 19.3 (672 мг, 2.30 ммоль), 19.6 (385 мг, 2.07 ммоль) и K2CO3 (643 мг, 4.60 ммоль) в 10 мл ДМСО пропускали аргон в течение 10 мин, после чего смесь перемешивали 10 ч при комнатной температуре. Реакционную смесь экстрагировали этилацетатом и сконцентрировали в вакууме. Продукт 19.2 выделили с помощью колоночной хроматографии на силикагеле с использованием элюента гексан-этилацетат (85:15). Выход 412 мг (50%).
Стадия 6. Соединение 19.1 было получено аналогично соединению 1.8 (пример 2, стадия 1), используя соединение 19.2 вместо соединения 1.9.
Стадия 7. К смеси соединения 19.1 (100 мг, 0.26 ммоль), N-метилпиперазина (32 мкл, 0.29 ммоль) и DMAP (3 мг, 0.03 ммоль) в 5 мл дихлорметана добавили EDC×HCl (65 мг, 0.34 ммоль). Реакционную смесь перемешивали в атмосфере азота в течение 8 ч. Реакционную смесь экстрагировали дихлорметаном и сконцентрировали в вакууме. Продукт 19 выделили при помощи колоночной хроматографии на силикагеле, элюент дихлорметан-метанол (95:5). Выход 45 мг (37%). Продукт был дополнительно очищен с помощью препаративной хроматографии (Метод В).
Пример 13. Анализ полученных соединений.
Чистота и строение полученных соединений была подтверждена методом хромато-масс-спектрометрии LC/MS и спектроскопии 1Н ЯМР (таблица 6). Применяемое оборудование приведено в таблице 4 и таблице 5.
Данные на оборудование:



Пример 14. Определение химической стабильности.
Химическую стабильность соединений, описанных в настоящем документе, определяли в плазме крови человека.
Определение стабильности в плазме крови человека приводили с использованием пулированной плазмы крови человека, взятой у десяти здоровых доноров. Исходный раствор кандидата (10 мМ в ДМСО) разводили пулированной плазмой крови до концентрации 10 мкМ (испытуемый раствор). Испытуемый раствор выдерживали в твердотельном термостате 4 часа при температуре 37°С. Методом ВЭЖХ с использованием хроматографа Agilent1200 (Agilent, США) определяли площади пиков соединений в испытуемых образцах, соответствующие начальному времени испытания (до выдерживания) и конечному времени испытания (после выдерживании в твердотельном термостате 4 часа при температуре 37°С) с предварительным осаждением белков ацетонитрилом. Хроматографический анализ проводили в градиентном режиме элюирования при скорости потока 1 мл/мин. Определяли количество вещества в образце в % после термостатирования.
Оценивали стабильность соединений. Соединения, описанные в настоящем документе, имеют значения химической стабильности более 75%, т.е. являются химически стабильными в кислой среде искусственного желудочного сока и в плазме крови человека (таблица 7).

Пример 15. Определение ферментативной стабильности.
Определение ферментативной стабильности кандидатов позволило оценить устойчивость соединений по настоящему изобретению к действию ферментов биотрансформации.
Скорость ферментативного разложения соединения определяли путем выдерживания в твердотельном термостате при температуре 37°С реакционной смеси, содержащей 0,5 мг/мл пулированных S9 фракций печени человека (XenoTech, США, cat#H0610), 10 мкм соединения, 2 мМ β-никотинамидадениндинуклеотида (Carbosynth, UK, cat#NN10871) и 4 мМ хлорида магния в 0,1М натрий-фосфатном буфере рН=7,4. Реакцию останавливали ацетонитрилом из расчета 100 мкл ацетонитрила на 100 мкл реакционной смеси. После остановки реакции образцы центрифугировали 10 минут при 10000 об/мин. Надосадочную жидкость анализировали хроматографическим методом с использованием хроматографа Agilent1200 (Agilent, США). Хроматографический анализ проводили в градиентном режиме элюирования при скорости потока 1 мл/мин. Строили график зависимости логарифма площади пика вещества от времени. Зависимый коэффициент этой прямой соответствовал константе элиминирования k, на основе которой рассчитывали период полураспада препарата t1/2 и скорость разложения CLint:
Elimination rate constant (k) = (-gradient)
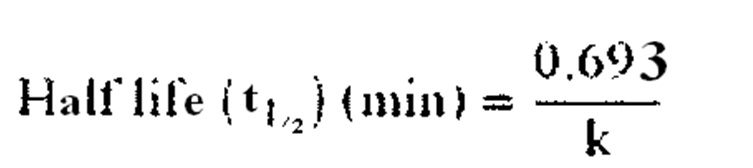
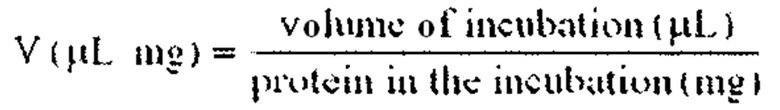
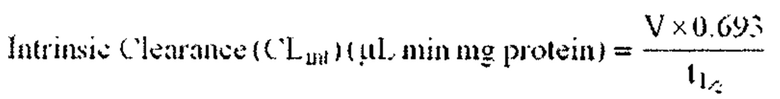
Соединения по настоящему изобретению показали достаточную устойчивость к действию ферментов биотрансформации и имели скорость ферментативного разложения Clint менее 13 мкл/мин/мг. Результаты приведены в таблице 8.

Пример 16. Определение проницаемости через монослой клеток Сасо-2.
Определение проницаемости через монослой клеток Сасо-2 позволяет оценить способность веществ проникать через биологические мембраны как посредством активного, так и пассивного транспорта.
Клетки кишечного эпителия Сасо-2 культивировали во вставках с фильтрами (с порами 0,4 мкм, BD Falcon with High Density) в течение 21 дня, после чего проверяли целостность монослоя с помощью красителя Lucifer Yellow (Sigma-Aldrich, США) по стандартному протоколу. При постановке переноса А->В (перенос «просвет кишечника» - «кровоток»), растворы исследуемых веществ вносили в буфере рН 6.5 (HBSS, 10 мМ HEPES, 15 мМ р-р Глюкозы) в концентрации 10 мкМ в верхнюю камеру; нижнюю камеру при этом заполняли буфером с рН 7.4 (HBSS, 10 мМ HEPES, 15 мМ р-р Глюкозы, 1% BSA). При постановке переноса В->А (перенос «кровоток» - «просвет кишечника»), верхнюю камеру заполняли буфером рН 6.5, а растворы исследуемых веществ вносили в буфере рН 7.4 в концентрации 10 мкМ в нижнюю камеру. В качестве контроля использовали пропранолол, как вещество высокой проницаемости.
После инкубации в течение 2 ч при 37°С в атмосфере с 5% СО2, определяли количества исследуемых веществ в верхних и нижних камерах методом ВЭЖХ с использованием хроматографа Agilent1200 (Agilent, США) с предварительным осаждением белков ацетонитрилом. Хроматографический анализ проводили в градиентном режиме элюирования при скорости потока 1 мл/мин. На хроматограммах определяли площади пиков, соответствующие соединениям. На основе значений площади пиков соединения в калибровочных стандартах, определяли концентрацию соединения в исходном растворе и в образцах из лунок верхней и нижней камер.
Проницаемость через слой клеток Рарр рассчитывали по формуле:
Papp=(C(t)*V)/(С(0)*t*Area), где
Papp - эффективная константа проницаемости, м/с
V - объем раствора (в тесте А->В - 0,8 мл, в тесте В->А - 0,2 мл), мл
Area - площадь поверхности мембраны (0,33 см2), см2
t - время выдерживания (7200 с), с
С(0) - концентрация исходного раствора, мкМ
С(t) - концентрация раствора после 2 часов (в тесте А->В - концентрация в образце из лунки нижней камеры; в тесте В->А - концентрация в образце из лунки верхней камеры), мкМ.
Коэффициент эффлюкса показал способность клеток элиминировать вещество из кровотока. Значение рассчитывали по формуле:
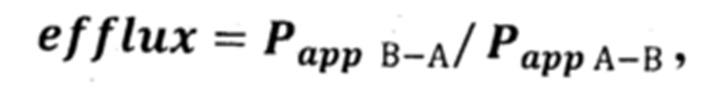 где
где
Рарр A-B - значение проницаемости прямого анализа А->В;
Рарр B-A - значение проницаемости обратного анализа В->А.
Соединения по настоящему изобретению показали высокую скорость прямого транспорта «просвет кишечника» - «кровоток», при этом коэффициент эффлюкса не превышал 2, что указывает на то, что транспортер Pgp не накладывает ограничения на биодоступность вещества. Результаты приведены в Таблице 9.

Пример 17. Антипролиферативная активность в отношении CDK8-чувствительных клеточных линий in vitro.
Антипролиферативную активность ингибиторов CDK8 по настоящему изобретению измеряли в клеточном тесте на перевиваемой культуре клеток MV4-11 (бифенотипический миеломоноцитарный лейкоз, АТСС® CRL-9591™) с помощью прижизненного красителя AlamarBlue (ThermoFisher, #DAL1100). Клетки выращивали в среде RPMI-1640 (ПанЭко, #С330п) с добавлением 10% FBS (Gibco, #16140-071), промывали и повторно высевали на питательную среду с 10% FBS (Gibco, #16140-071) в 96-луночные культуральные планшеты (Corning, #3599) в количестве ≈10×103 клеток в 100 мкл среды на лунку. Исследуемые соединения растворяли в ДМСО и разбавляли средой с 10% FBS (Gibco, #16140-071) до конечной концентрации в пределах от 0 до 100 мкМ. Разбавленные соединения в объеме 50 мкл затем добавляли в каждую лунку (конечная концентрация ДМСО составляла не более 1%) и инкубировали при 37°С в инкубаторе с 5% CO2 в течение 120 ч. По окончании инкубации добавляли в лунки по 15 мкл реагента AlamarBlue (ThermoFisher, #DAL1100), перемешивали содержимое планшетов на орбитальном шейкере (Biosan, Латвия), затем дополнительно инкубировали от 3 до 5 ч при 37°С в инкубаторе с 5% CO2. Детектировали количество живых клеток на микропланшетном спектрофотометре (Tecan Infinite M200Pro, Швейцария), измеряя флуоресцентный сигнал при длине волны возбуждения (λЕх) 540 нм и длине волны испускания (λEm) 590 нм.
Величину IC50 определяли с использованием программы Magellan 7.2 (Tecan, Швейцария), аппроксимируя экспериментальные точки по четырехпараметрической модели с оптимизацией по Левенбергу-Маркарту (таблица 10).
Величину СС50 определяли в тесте на цитотоксичность. Исследования проводили на клетках HepG2 (гепатоцеллюлярная карцинома, АТСС® НВ-8065™). Клетки рассевали в 96-луночные планшеты (Corning, #3599) в концентрации ≈20×103 клеток в 100 мкл среды на лунку и инкубировали в течение 72 ч с внесенными соединениями в диапазоне концентраций от 200 до 0.78 мкМ. Жизнеспособность клеток оценивали по методу, описанному выше. Результаты приведены в таблице 10.
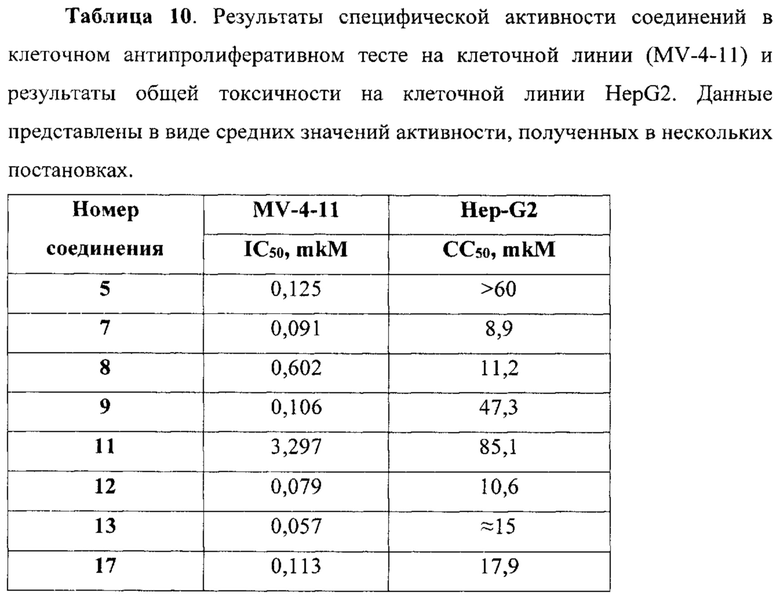
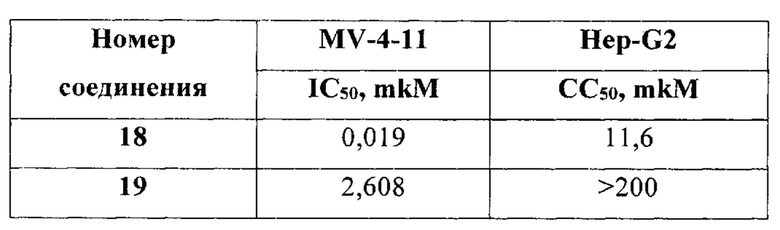
Пример 18. Аффинность соединений к рекомбинантному белку CDK8 в комплексе с Cyclin С in vitro.
Способность соединений, описанных в настоящем патенте, связываться с белком CDK8 определяли с помощью методики LanthaScreen (ThermoFisher). Детектировался сигнал FRET, пропорциональный количеству связанного с CDK8 флуоресцентно меченного лиганда (Tracer 236), который конкурирует с ингибитором за сайт связывания с АТФ.
Измерения проводили в реакционном объеме 15 мкл с использованием 384-луночного планшета (Corning, #CLS4513). Фермент CDK8/CyclinC (ThermoFisher, #PR7261B) смешивали с антителами Anti-His-tag-Biotin (ThermoFisher, #PV6090), Streptavidin-Eu (ThermoFisher, #PV6025) и добавляли полученную смесь в лунки планшета по 5 мкл. Конечные концентрации веществ составляли: CDK8/CyclinC - 5 nM, Streptavidin-Eu - 3 nM, Anti-His-tag-Biotin - 3 nM. В качестве контрольного ингибитора использовали стауроспорин, в качестве бланка использовали 0.1% раствор диметилсульфоксида (ДМСО) в реакционном буфере, содержащем 250 mM HEPES (рН 7.5), 50 mM MgCl2, 5 mM EGTA, и 0.05% Brij-35.
Исследуемые ингибиторы и контроли добавлялись в соответствующие лунки по 5 мкл. Планшет инкубировали при комнатной температуре в течение 20 минут. По истечению инкубации, в лунки добавляли по 5 мкл раствора трейсера (Alexa Fluor-647 (Kinase Tracer 236, ThermoFisher, #PV5592)). Конечная концентрация трейсера составляла 10 нМ. В качестве отрицательного контроля вместо раствора трейсера использовали реакционный буфер. Инкубировали планшет в течение 40 минут при 25 С, затем измеряли TR-FRET сигнал, согласно рекомендациям производителя, на планшетном ридере SPARK20 (Tecan, Швейцария) и пересчитывали на количество связанного с киназой трейсера. Величину IC50 определяли с использованием программы SparkControl Magellan 1.2 (Tecan, Швейцария), аппроксимируя экспериментальные точки по четырехпараметрической модели с оптимизацией по Левенбергу-Маркарту (Табл. 11).
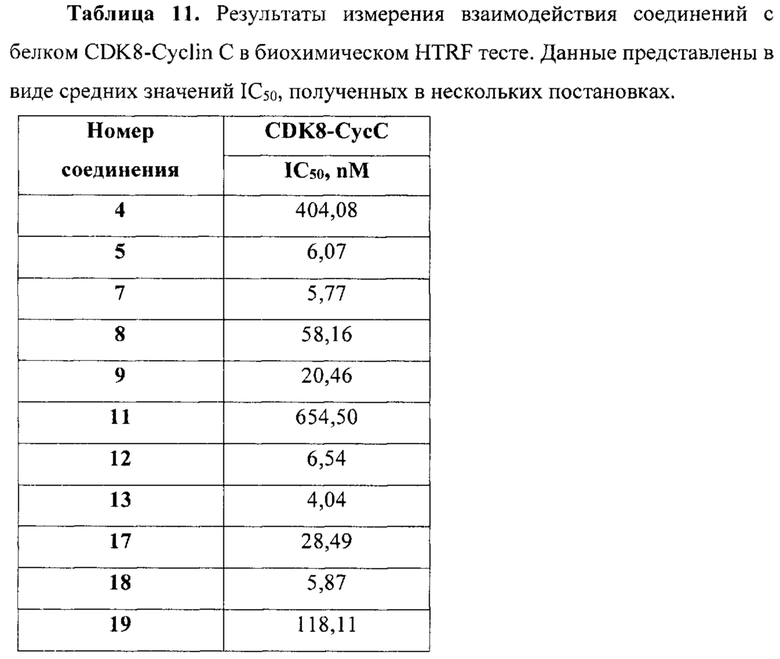
| название | год | авторы | номер документа |
|---|---|---|---|
| Новые гетероциклические соединения как ингибиторы CDK8/19 | 2018 |
|
RU2739489C2 |
| Ингибиторы CDK8/19 | 2018 |
|
RU2761824C2 |
| Ингибиторы рецептора эпидермального фактора роста | 2018 |
|
RU2786524C2 |
| НОВЫЕ ИНГИБИТОРЫ CDK8/19 | 2019 |
|
RU2754441C2 |
| КАТАЛИТИЧЕСКАЯ СИСТЕМА | 2003 |
|
RU2326123C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ | 2020 |
|
RU2830113C2 |
| НОВЫЕ ПЕПТИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2699572C2 |
| ПРОИЗВОДНЫЕ ТИЕНОПИРРОЛА ДЛЯ ПРИМЕНЕНИЯ ДЛЯ НАЦЕЛИВАНИЯ НА БЕЛКИ, КОМПОЗИЦИИ С УКАЗАННЫМИ ПРОИЗВОДНЫМИ, СПОСОБЫ И ПРИМЕНЕНИЯ | 2017 |
|
RU2771166C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ-3 ГЛИКОГЕНСИНТАЗЫ | 2011 |
|
RU2623427C2 |
| N-ЗАМЕЩЕННЫЕ АМИДЫ ИНДОЛИЛ-3-ГЛИОКСИЛОВОЙ КИСЛОТЫ ПРОТИВООПУХОЛЕВОГО ДЕЙСТВИЯ, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 2004 |
|
RU2317293C9 |
Изобретение относится к соединению формулы I или к его фармацевтически приемлемой соли, где X1 представляет собой CR1, Ν; Х2 представляет собой CR2, Ν; Х3, Х4, Х3, Х6 каждый независимо представляет собой СН, Ν; R1 представляет собой Н, Hal; R2 представляет собой Н, -OR10, -NR11R12, R3 и R4 вместе с атомом азота, к которому они присоединены, могут представлять собой 4-7-членный гетероциклил с 1-2 гетероатомами, выбранными из N и/или О, который может быть незамещенным или замещенным одним заместителем, выбранными из С1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами; Υ представляет собой -N(R13)-, -О- или -S-; Ζ представляет собой -C(R14)2- или -С(О)-; R10 представляет собой Н, C1-С6 алкил; R11, R12 каждый независимо представляет собой Н, C1-C6 алкил; R13 представляет собой Н; R14 каждый независимо представляет собой Н; не включая соединения, где Χ1, Х3 представляют собой Ν, Х2, Х4, Х5, Х6 представляют собой СН, R3 и R4 вместе с атомом азота, к которому они присоединены, представляют собой 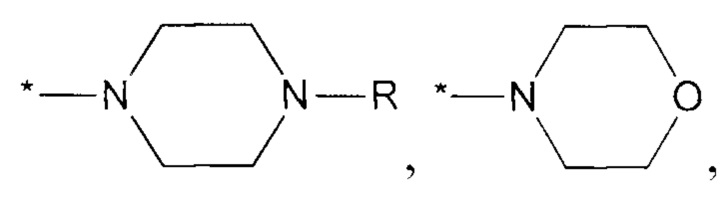 R представляет собой Η, С1-С6 алкил. Изобретение также относится к фармацевтической композиции, предназначенной для лечения заболевания или нарушения, опосредованного активацией циклинзависимых протеинкиназ CDK8/9, на основе указанных соединений. Технический результат – получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения таких заболеваний, как колоректальный рак, меланома, метастатическая меланома, рак молочной железы, трижды негативный рак молочной железы (ТНРМЖ), рак предстательной железы, метастатический рак яичника, метастатический рак желудка, лейкоз, острый миелоидный лейкоз, рак поджелудочной железы (РПЖЖ). 5 н. и 6 з.п. ф-лы, 11 табл., 18 пр.
R представляет собой Η, С1-С6 алкил. Изобретение также относится к фармацевтической композиции, предназначенной для лечения заболевания или нарушения, опосредованного активацией циклинзависимых протеинкиназ CDK8/9, на основе указанных соединений. Технический результат – получены новые соединения и фармацевтическая композиция на их основе, которые могут найти применение в медицине для лечения таких заболеваний, как колоректальный рак, меланома, метастатическая меланома, рак молочной железы, трижды негативный рак молочной железы (ТНРМЖ), рак предстательной железы, метастатический рак яичника, метастатический рак желудка, лейкоз, острый миелоидный лейкоз, рак поджелудочной железы (РПЖЖ). 5 н. и 6 з.п. ф-лы, 11 табл., 18 пр.
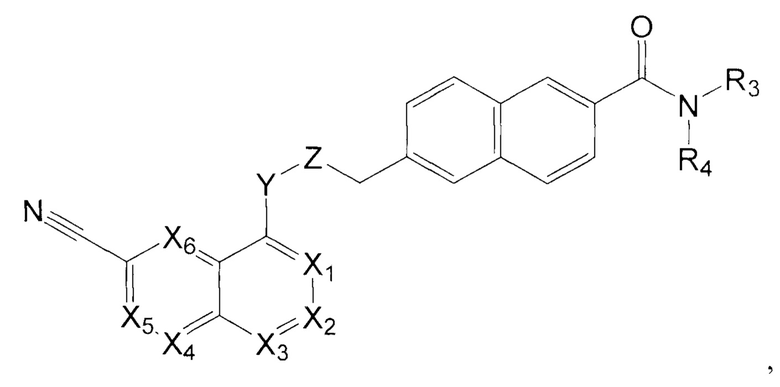
(I)
1. Соединение формулы I:
или его фармацевтически приемлемая соль,
где X1 представляет собой CR1, Ν;
Х2 представляет собой CR2, Ν;
Х3, Х4, Х3, Х6 каждый независимо представляет собой СН, Ν;
R1 представляет собой Н, Hal;
R2 представляет собой Н, -OR10, -NR11R12,
R3 и R4 вместе с атомом азота, к которому они присоединены, могут представлять собой 4-7-членный гетероциклил с 1-2 гетероатомами, выбранными из N и/или О, который может быть незамещенным или замещенным одним заместителем, выбранными из С1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами;
Υ представляет собой -N(R13)-, -О- или -S-;
Ζ представляет собой -C(R14)2- или -С(О)-;
R10 представляет собой Н, C1-С6 алкил;
R11, R12 каждый независимо представляет собой Н, C1-C6 алкил;
R13 представляет собой Н;
R14 каждый независимо представляет собой Н;
не включая соединения, где Χ1, Х3 представляют собой Ν, Х2, Х4, Х5, Х6 представляют собой СН, R3 и R4 вместе с атомом азота, к которому они присоединены, представляют собой 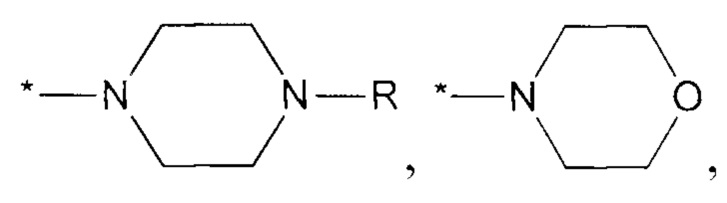 R представляет собой Η, С1-С6 алкил.
R представляет собой Η, С1-С6 алкил.
2. Соединение по п. 1, где если Χ1 представляет собой CR1, Х2 представляет собой CR2, Х3 представляют собой N, то Х4, Х5, Х6 представляет собой СН;
если Χ1 представляет собой CR1, Х2, Х3 представляют собой N, то Х4, Х5, Х6 представляет собой СН;
если Х2 представляет собой CR2, Χ1, Х3 представляют собой Ν, то Х4, Х5, Х6 представляет собой СН;
если Χ1 представляет собой CR1, Х2, Х4 представляют собой N, то Х3, Х5, Х6 представляет собой СН;
если Χ1 представляет собой CR1, Х2 представляет собой CR2, Х3, Х5 представляют собой N, то Х4, Х6 представляет собой СН;
если Χ1 представляет собой CR1, Х2 представляет собой CR2, Х3, Х4 представляют собой N, то Х5, Х6 представляет собой СН;
если Χ1 представляет собой CR1, Х2 представляет собой CR2, Х3, Х6 представляют собой N, то Х4, Х5 представляет собой СН.
3. Соединение по п. 1, представляющее собой соединение формулы II:
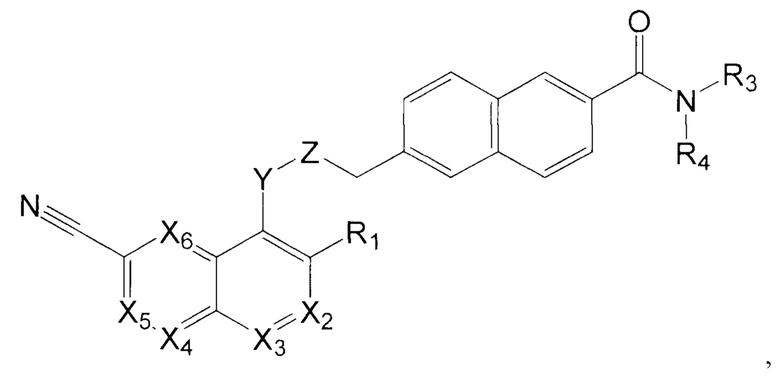
или его фармацевтически приемлемая соль,
где Х2 представляет собой CR2, Ν;
Х3, Х4, Х5, Х6 каждый независимо представляет собой СН, Ν;
R1 представляет собой Н, Hal;
R2 представляет собой Н, -OR10, -NR11R12,
R3 и R4 вместе с атомом азота, к которому они присоединены, могут представлять собой 4-7-членный гетероциклил с 1-2 гетероатомами, выбранными из N и/или О, который может быть незамещенным или замещенным одним заместителем, выбранными из С1-С6 алкила, незамещенного или замещенного одним или несколькими галогенами;
Υ представляет собой -N(R13)-, -О- или -S-;
Ζ представляет собой -C(R14)2- или -С(О)-;
R10 представляет собой Н, C1-С6 алкил;
R11, R12 каждый независимо представляет собой Н, C1-С6 алкил;
R13 представляет собой Н,
R14 каждый независимо представляет собой Н.
4. Соединение по пп. 1, 3, представляющее собой соединение формулы III:
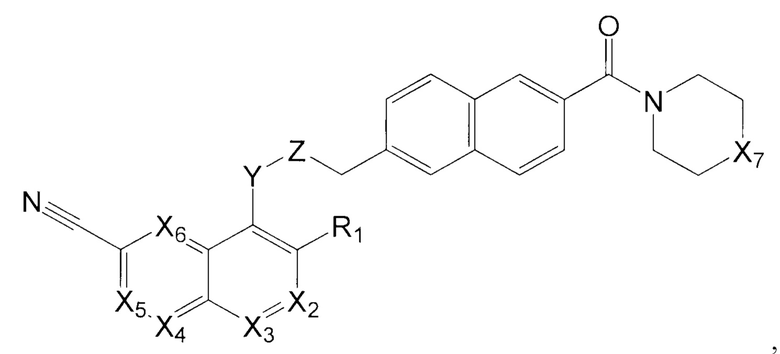
или его фармацевтически приемлемая соль,
где Х2 представляет собой CR2, N;
Х3, Х4, Х5, Х6 каждый независимо представляет собой СН, N;
R1 представляет собой Н, Hal;
R2 представляет собой Н, -OR10, -NR11R12,
Х7 представляет собой -N(R15), -О-;
Υ представляет собой -N(R13)-, -О- или -S-;
Ζ представляет собой -C(R14)2- или -С(О)-;
R10 представляет собой Н, C1-С6 алкил;
R11, R12 каждый независимо представляет собой Н, C1-С6 алкил;
R13, R14 каждый независимо представляет собой Η;
R15 представляет собой Η, C1-С6 алкил, незамещенный или замещенный одним или несколькими галогенами, C1-C6, алкокси.
5. Соединение по пп. 3, 4, где, если Х2 представляет собой CR2, Х3 представляют собой N, то Х4, Х5, Х6 представляет собой СН;
если Х2, Х3 представляют собой N, то Х4, Х5, Х6 представляет собой СН;
если Х2, Х4 представляют собой N, то Х3, Х5, Х6 представляет собой СН;
если Х2 представляет собой CR2, Х3, Х5 представляют собой N, то Х4, Х6 представляет собой СН;
если Х2 представляет собой CR2, Х3, Х4 представляют собой N, то Х5, Х6 представляет собой СН;
если Х2 представляет собой CR2, Х3, Х6 представляют собой N, то Х4, Х5 представляет собой СН.
6. Соединение по пп. 1-5, где Υ представляет собой -ΝΗ-, -О- или -S-;
Ζ представляет собой -СН2- или -С(О)-.
7. Соединение по п. 1, представляющее собой: 2-метокси-4-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)хиназолин-6-карбонитрил (1);
2-(диметиламино)-4-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)хиназолин-6-карбонитрил (2);
2-амино-4-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)хиназолин-6-карбонитрил (3);
4-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)циннолин-6-карбонитрил (4);
4-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)хинолин-6-карбонитрил (5);
4-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)хинолин-6-карбонитрил дигидрохлорид (5а);
5-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)-1,7-нафтиридин-3-карбонитрил (6);
4-((2-(6-изопропилпиперазин-4-карбонил)нафт-2-ил)этил)амино)хинолин-6-карбонитрил (7);
4-(2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этокси)хинолин-6-карбонитрил (8) 3-хлоро-4-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)хинолин-6-карбонитрил (9);
3-хлоро-4-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)хинолин-6-карбонитрил дигидрохлорид (9а);
4-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)-1,7-нафтиридин-6-карбонитрил (10);
5-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)-1,8-нафтиридин-3-карбонитрил (11);
4-((2-(6-этилпиперазин-4-карбонил)нафт-2-ил)этил)амино)хинолин-6-карбонитрил (12);
4-((2-(6-морфолин-4-карбонил)нафт-2-ил)этил)амино)хинолин-6-карбонитрил (13);
4-((3-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)пропаноил)хинолин-6-карбонитрил (14);
8-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)амино)-1,5-нафтиридин-2-карбонитрил (15);
N-(6-цианохинолин-4-ил)-2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил) ацетамид (16);
4-((2-(6-(4-(2,2,2-трифторэтил)пиперазин-4-карбонил)нафт-2-ил)этил)амино)хинолин-6-карбонитрил (17);
4-((2-(6-(пиперазин-1-карбонил)нафт-2-ил)этил)амино)хинолин-6-карбонитрил (18);
4-((2-(6-(4-метилпиперазин-1-карбонил)нафт-2-ил)этил)тио)хинолин-6-карбонитрил (19).
8. Способ ингибирования биологической активности циклинзависимых протеинкиназ CDK8/19 у субъекта, заключающийся в контактировании циклинзависимых протеинкиназ CDK8/19 с соединением по любому из пп. 1-7.
9. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп. 1-7 или его фармацевтически приемлемую соль и один или несколько фармацевтически приемлемых эксципиентов и предназначенная для профилактики или лечения заболевания или нарушения, опосредованного активацией циклинзависимых протеинкиназ CDK8/19, где заболевание или нарушение представляет собой онкологическое или гематоонкологическое заболевание, выбранное из группы, включающей колоректальный рак, меланому, метастатическую меланому, рак молочной железы, трижды негативный рак молочной железы (ТНРМЖ), рак предстательной железы, метастатический рак яичника, метастатический рак желудка, лейкоз, острый миелоидный лейкоз, рак поджелудочной железы (РПЖЖ).
10. Способ лечения заболевания или нарушения, опосредованного активацией циклинзависимых протеинкиназ CDK8/19, включающий введение в терапевтически эффективном количестве соединения по любому из пп. 1-7 или его фармацевтически приемлемой соли или фармацевтической композиции по п. 9 субъекту, нуждающемуся в таком лечении, где заболевание или нарушение представляет собой онкологическое или гематоонкологическое заболевание, выбранное из группы, включающей колоректальный рак, меланому, метастатическую меланому, рак молочной железы, трижды негативный рак молочной железы (ТНРМЖ), рак предстательной железы, метастатический рак яичника, метастатический рак желудка, лейкоз, острый миелоидный лейкоз, рак поджелудочной железы (РПЖЖ).
11. Применение соединения по любому из пп. 1-7 или его фармацевтически приемлемой соли или фармацевтической композиции по п. 9 для лечения заболевания или нарушения, опосредованного активацией циклинзависимых протеинкиназ CDK8/19, у субъекта, нуждающегося в таком лечении, где заболевание или нарушение представляет собой онкологическое или гематоонкологическое заболевание, выбранное из группы, включающей колоректальный рак, меланому, метастатическую меланому, рак молочной железы, трижды негативный рак молочной железы (ТНРМЖ), рак предстательной железы, метастатический рак яичника, метастатический рак желудка, лейкоз, острый миелоидный лейкоз, рак поджелудочной железы (РПЖЖ).
| EA 201491399 A, 30.04.2015 | |||
| СОЛИ 4-((2-(6-(4-МЕТИЛПИПЕРАЗИН-1-КАРБОНИЛ)НАФТАЛИН-2-ИЛ)ЭТИЛ)АМИНО)ХИНАЗОЛИН-6-КАРБОНИТРИЛА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2017 |
|
RU2641001C1 |
| US 20120071477 A1, 22.03.2012 | |||
| US 20080033000 A1, 07.02.2008 | |||
| Приспособление для предохранения от похищения ручного багажа | 1926 |
|
SU3927A1 |
Авторы
Даты
2021-12-28—Публикация
2018-03-01—Подача