Перекрестная ссылка на родственную заявку
[0001] По настоящей заявке испрашивается приоритет на основании предварительной заявки США № 61/983415, зарегистрированной 23 апреля 2014 года, содержание которой полностью включено в качестве ссылки.
Включение списка последовательностей в качестве ссылки
[0002] Настоящая заявка зарегистрирована вместе со списком последовательностей в электронном формате. Список последовательностей предоставлен в виде файла, озаглавленного 735042000240seqlist.txt, созданного 22 апреля 2015 года, размер которого составляет 13 килобайт. Информация в электронном формате списка последовательностей полностью включена в качестве ссылки.
Область техники
[0003] Настоящее описание в определенных аспектах относится к способам, клеткам, и композициям для получения клеток, и композициям для генетической инженерии, и клеточной терапии. В определенных вариантах осуществления предоставлены оптимизированные способы получения клеток, например, выделения, обработки, инкубации и генетической инженерия клеток и популяций клеток. Также предоставлены клетки и композиции, продуцируемые этими способами, и способы их применения. Клетки могут включать клетки иммунной системы, такие как T-клетки, и в основном включают множество отдельных популяций T-клеток или подтипов T-клеток. В определенных аспектах этими способами можно получать множество различных популяций клеток для адоптивной терапии с использованием меньшего количества этапов, и/или ресурсов, и/или с меньшими трудозатратами по сравнению с другими способами.
Уровень техники, предшествующий изобретению
[0004] Для получения клеток для терапевтического применения доступно множество способов. Например, доступны способы выделения, обработки и инженерии клеток, включая T-клетки и другие клетки иммунной системы. Доступны способы выделения таких клеток и экспрессии генетически сконструированных антигенных рецепторов, таких как высокоаффинные T-клеточные рецепторы (TCR) и химерные антигенные рецепторы (CAR). Доступны способы адоптивного переноса таких клеток индивидуумам. Для получения (например, выделения, обработки, культивирования и инженерии) клеток для применения в клеточной терапии необходимы улучшенные способы. В частности, необходимы способы получения и инженерии клеток, например, множества отдельных типов или подтипов клеток, с улучшенной эффективностью, безопасностью, вариабельностью и сохранением ресурсов. Предоставлены способы, клетки, композиции, наборы и системы, которые удовлетворяют таким требованиям.
Сущность изобретения
[0005] Предоставлены способы получения и инженерии клеток и популяций клеток и клетки и композиции, получаемые этими способами. В определенных вариантах осуществления клетки можно использовать для иммунотерапии, например, в связи со способами адоптивной иммунотерапии. В определенных аспектах предоставляемые способы включают выделение, отбор или обогащение CD4+- и CD8+-клеток или их субпопуляций из одного и того же исходного образца, такого как один образец, например, один образец после афереза, образец после лейкафереза или образец, содержащий мононуклеарные клетки периферической крови (PBMC). В определенных вариантах осуществления способы включают отбор или обогащение по меньшей мере двух популяций клеток, таких как популяция CD4+-клеток и популяция CD8+-клеток, в едином технологическом потоке, в котором после первого отбора или обогащения CD4+- или CD8+-клеток в процессе образец отрицательной фракции до проведения второго отбора другого из типов CD4+- или CD8+-клеток не отбрасывают. В определенных вариантах осуществления первый и второй отбор можно проводить одновременно или последовательно.
[0006] В определенных аспектах отбор, обогащение и/или выделение обеих популяций клеток, таких как CD4+- и CD8+-клетки, проводят одновременно, например, в одной емкости или с использованием одного устройства, или последовательно в виде части системы или устройства, в которых емкости, например, колонки, камеры, используемые при проведении первого или второго отбора, функционально связаны. В определенных вариантах осуществления одновременные и/или последовательные обогащения или отборы можно проводить в виде единого технологического потока без оперирования любой из положительных или отрицательных фракций, получаемых как часть первого и/или второго отбора или обогащения. В определенных аспектах, выделение, культивирование и/или инженерию различных популяций проводят из одной и той же исходной композиция или одного и того же исходного материала, например, из одного и того же образца.
[0007] В определенных вариантах осуществления способы включают проведение первого отбора посредством обогащения из образца, содержащего первичные T-клетки человека, одного из типов CD4+- или CD8+-клеток с получением первой популяции отобранных клеток и популяции неотобранных клеток, и проведение второго отбора из популяции неотобранных клеток посредством обогащения другого типа из CD4+-клеток или CD8+-клеток, где этим способом получают композицию клеток, содержащих клетки, обогащенные CD4+-клетками, и клетки, обогащенные CD8+-клетками.
[0008] В определенных вариантах осуществления второй отбор проводят посредством обогащения из популяции неотобранных клеток, получаемой при первом отборе, других подтипов T-клеток. Таким образом, в определенных вариантах осуществления предоставляемые способы отличаются от других способов отбора тем, что отрицательную фракцию после первого отбора не отбрасывают, а вместо этого используют в качестве основы для дополнительного отбора с обогащением другим типом клеток. В общем случае, когда субпопуляция T-клеток, обогащаемая в первом отборе, представляет собой субпопуляцию CD4+-клеток (или когда в первом отборе проводят обогащение CD4+-клеток), следует, что первый отбор разработан так, чтобы в нем не происходило обогащение клеток другого подтипа, обогащение которых проводят во втором отборе. Например, в определенных вариантах осуществления в первом отборе проводят обогащение CD4+-клеток и не проводят обогащение CD8+-клеток, а во втором отборе проводят обогащение CD8+-клеток из отрицательной фракции, полученной после первого отбора. Подобным образом, в общем случае, когда субпопуляция T-клеток, обогащаемая в первом отборе, представляет собой субпопуляцию CD8+-клеток (или когда в первом отборе проводят обогащение CD8+-клеток), следует, что первый отбор разработан так, чтобы в нем не происходило обогащения клеток другого подтипа, обогащение которых проводят во втором отборе. Например, в определенных вариантах осуществления в первом отборе проводят обогащение CD8+-клеток и не проводят обогащения CD4+-клеток, а во втором отборе проводят обогащение CD4+-клеток из отрицательной фракции, полученной после первого отбора.
[0009] В определенных вариантах осуществления способы дополнительно включают третий, четвертый и дальнейшие дополнительные отборы, в которых могут проводить обогащение клеток из популяций выбранных и/или популяций невыбранных клеток после любого предшествующего этапа отбора. Например, в определенных вариантах осуществления дополнительно проводят обогащение клеток из популяции отобранных клеток или популяции неотобранных клеток после данного этапа (например, второго этапа отбора). Например, в определенных вариантах осуществления отобранные CD8+-клетки дополнительно обогащают подтипом CD8+-клеток, таким как покоящиеся клетки или центральные клетки памяти.
[0010] В определенных вариантах осуществления предоставлен способ получения подвергнутых генетической инженерии T-клеток, включающий (a) получение инициирующей культуру композиции, где указанную композицию получают посредством проведения первого отбора в замкнутой системе, где указанный первый отбор включает проведение обогащения одного из типов CD4+-клеток и CD8+-клеток из образца, содержащего первичные T-клетки человека, таким образом, получая первую популяцию отобранных клеток и популяцию неотобранных клеток, и проведение в замкнутой системе второго отбора, где указанный второй отбор включает проведение обогащения другого типа из CD4+-клеток и CD8+-клеток из популяции неотобранных клеток, таким образом, получая вторую популяцию отобранных клеток; (b) инкубацию инициирующей культуру композиции, которая содержит клетки из первой популяции отобранных клеток и клетки из второй популяции отобранных клеток, в емкости для культивирования в стимулирующих условиях, таким образом, получая стимулированные клетки; и (d) введение генетически сконструированного антигенного рецептора в стимулированные клетки, полученные в (b), где этим способом, таким образом, получают результирующую композицию, содержащую CD4+-T-клетки и CD8+-T-клетки, экспрессирующие генетически сконструированный антигенный рецептор.
[0011] Также в определенных вариантах осуществления предоставлены способы, которые включают одновременное обогащение или отбор первой и второй популяций клеток, таких как популяции CD4+- и CD8+-клеток. В определенных вариантах осуществления способ включает приведение клеток образца, содержащего первичные T-клетки человека, в контакт с первым иммуноаффинным реагентом, который специфически связывается с CD4, и вторым иммуноаффинным реагентом, который специфически связывается с CD8, в инкубируемой композиции, в условиях, при которых иммуноаффинные реагенты специфически связываются с молекулами CD4 и CD8, соответственно, на поверхности клеток в образце, и выделение клеток, связанных с первым и/или вторым иммуноаффинными реагентами, получая, таким образом, обогащенную композицию, содержащую CD4+-клетки и CD8+-клетки. В определенном варианте осуществления способы проводят с содержанием в инкубируемой композиции концентраций первого и/или второго иммуноаффинных реагентов, которые находятся в обеспечивающих субоптимальный выход концентрациях так, что обогащенная композиция содержит менее 70%, менее 60%, менее 50%, менее 40%, менее 30%, менее 20% или менее от общего количества CD4+-клеток в инкубируемой композиции или менее 70% менее 60%, менее 50%, менее 40%, менее 30%, менее 20% или менее CD8+-клеток в инкубируемой композиции.
[0012] В определенных вариантах осуществления предоставлен способ обогащения CD4+- и CD8+-T-клеток, включающей получение обогащенной композиции CD4+- и CD8+-T-клеток, где указанную обогащенную композицию получают посредством приведения клеток образца, содержащего первичные T-клетки человека, в контакт с первым иммуноаффинным реагентом, который специфически связывается с CD4, и вторым иммуноаффинным реагентом, который специфически связывается с CD8, в инкубируемой композиции, в условиях, при которых иммуноаффинные реагенты специфически связываются с молекулами CD4 и CD8, соответственно, на поверхности клеток в образце; и выделение клеток, связанных с первым и/или вторым иммуноаффинными реагентами, получая, таким образом, обогащенную композицию, содержащую CD4+-клетки и CD8+-клетки в инициирующем культуру соотношении, где: первый и/или второй иммуноаффинные реагенты присутствуют в инкубируемой композиции в обеспечивающих субоптимальный выход концентрациях, в соответствии с чем обогащенная композиция содержит менее 70% от общего количества CD4+-клеток в инкубируемой композиции, и/или менее 70% CD8+-клеток в инкубируемой композиции, таким образом, получая композицию, обогащенную CD4+- и CD8+-T-клетками.
[0013] В определенных вариантах осуществления любого из таких предоставляемых вариантов осуществления способы проводят посредством основанного на иммуноаффинности отбора, такого как посредством контакта клеток с антителом, которое специфически связывается с поверхностным клеточным маркером, таким как CD4, CD8 или другой поверхностный клеточный маркер, такой как экспрессируется на наивных T-клетках, покоящихся T-клетках или центральных T-клетках памяти. В определенных вариантах осуществления твердая подложка представляет собой сферу, такую как гранула, такая как микрогранула или наногранула. В определенных вариантах осуществления гранула может представлять собой магнитную гранулу. В определенных вариантах осуществления твердая подложка может представлять собой колонку или другую емкость для проведения колоночной хроматографии.
[0014] В определенных вариантах осуществления у антитела существует один или несколько партнеров по связыванию, способных к формированию обратимой связи со связывающим реагентом, иммобилизованным на твердой поверхности, такой как сфера или хроматографический матрикс, где антитело обратимо иммобилизовано на твердой поверхности. В определенных вариантах осуществления клетки, экспрессирующие поверхностный клеточный маркер, связываемый антителом на указанной твердой поверхности, можно восстанавливать из матрикса посредством разрушения обратимого связывания между связывающим реагентом и партнером по связыванию. В определенных вариантах осуществления связывающий реагент представляет собой стрептавидин или аналог или мутант стрептавидина, такой как стрептавидин, его аналог или мутант, приведенные в любой из SEQ ID NO:11-16, или последовательность аминокислот, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична с последовательностью, приведенной в любой из SEQ ID NO:11-16, и сохраняет способность к связыванию с партнером по связыванию, таким как биотин или пептид. В определенных вариантах осуществления партнер по связыванию представляет собой биотин, аналог биотина или пептид, способный к связыванию со связывающим реагентом. В определенных вариантах осуществления партнер по связыванию представляет собой или содержит пептид, способный к связыванию со связывающим реагентом, такой как связывающийся со стрептавидином пептид, такой как пептид, содержащий последовательность, приведенную в любой из SEQ ID NO:1-10. В определенных вариантах осуществления способы после контакта клеток в образце с твердой подложкой, содержащей иммобилизованное на ней антитело как часть первого и/или второго отбора, включают применение конкурирующего реагента с разрушением связи между партнером по связыванию и связывающим реагентом, таким образом, отделяя выбранные клетки от твердой поверхности. В определенных вариантах осуществления конкурирующий реагент представляет собой биотин или аналог биотина.
[0015] В определенных вариантах осуществления способы позволяют получать выбранную или обогащенную композицию, содержащую выбранные или обогащенные CD4+-клетки относительно CD8+-клеток или их субпопуляции, присутствующие в инициирующем культуру соотношении. В определенных вариантах осуществления инициирующее культуру соотношение CD4+- и CD8+-клеток составляет от или приблизительно от 10:1 до или приблизительно до 1:10, от или приблизительно от 5:1 до или приблизительно до 1:5 или составляет от или приблизительно от 2:1 до или приблизительно до 1:2, например, составляет или приблизительно составляет 1:1. Выбор или отбор достаточного количества или достаточного относительного количества основанного на иммуноаффинности реагента, такого как покрытые антителами гранулы (например, магнитные гранулы) или аффинный хроматографический матрикс или матриксы, для достижения или получения инициирующего культуру соотношения в получаемой композиции, такой как инициирующая культуру композиция, содержащая клетки, с обогащенными или отобранными CD4-клетками, CD8-клетками или их субпопуляциями, находится в пределах уровня компетенции специалиста в данной области. Примеры таких способов описаны в подразделах ниже.
[0016] В определенных вариантах осуществления клетки включают клетки иммунной системы, такие как лимфоциты, например, T-клетки (например, CD4+- и CD8+-T-клетки и их отдельные субпопуляции) и NK клетки. В определенных вариантах осуществления клетки присутствуют в комбинациях множества популяций клеток или типов клеток, которые в определенных аспектах включены в композиции в конкретных соотношениях или количествах клеток или типов клеток. Также предоставлены способы оптимизации способов, такие как выбор или определение подходящих соотношений и количеств, таких как инициирующие культуру соотношения и желаемые результирующие соотношения и дозы типов и популяций клеток для применения в отношении этих способов.
[0017] Также предоставлены клетки, популяции клеток и их композиции для применения в способах и получаемые этими способами. Также предоставлены системы, устройства, аппаратура, реагенты, соединения и наборы для проведения способов. Также предоставлены терапевтические способы и применения клеток и композиций, получаемых такими способами, как способы адоптивной клеточной терапии.
[0018] В определенных вариантах осуществления предоставлены способы получения клеток для адоптивной клеточной терапии, способы получения клетки для генетической инженерии и способы получения подвергнутых генетической инженерии клеток. В определенных аспектах клетки представляют собой T-клетки, такие как CD4+- и CD8+-T-клетки и/или их подтипы. В определенных аспектах клеточная терапия представляет собой T-клеточную терапию.
[0019] В определенных вариантах осуществления способы проводят посредством (a) выделения популяции клеток из образца и (b) инкубации инициирующей культуру композиции в емкости для культивирования, содержащей популяции выделенных клеток. В определенных аспектах способы дополнительно включают генетическую инженерию инкубируемых клеток или клеток, находящихся в емкости для культивирования, например, посредством (c) введения в клетки, находящиеся в емкости для культивирования, генетически сконструированного антигенного рецептора.
[0020] В определенных вариантах осуществления способы проводят посредством (a) инкубации инициирующей культуру композиции в емкости для культивирования, содержащей множество популяций клеток в конкретном инициирующем культуру соотношении или в конкретном количестве клеток; и (b) генетической инженерии клеток, например, посредством введения в клетки, находящиеся в емкости для культивирования, генетически сконструированного антигенного рецептора.
[0021] В определенных вариантах осуществления генетически сконструированный антигенный рецептор вводят в клетки в емкости для культивирования, например в различные типы или субпопуляции клеток в емкости для культивирования, например, в CD4+- и CD8+-клетки в емкости для культивирования.
[0022] В определенных аспектах способы позволяют получать результирующую композицию, применяемую для генетической инженерии или адоптивной клеточной терапии или содержащую клетки, экспрессирующие генетически сконструированный антигенный рецептор.
[0023] В определенных вариантах осуществления выделение включает или его проводят посредством выделения из образца первичной популяции CD4+-T-клеток человека и/или первичной популяции CD8+-T-клеток человека. В определенных аспектах он включает обеднение или обогащение субпопуляции CD4+-клеток и/или обеднение или обогащение субпопуляции CD8+-клеток. Таким образом, в определенных аспектах инициирующая культуру композиция содержит выделенные первичные CD4+- и CD8+-T-клетки человека.
[0024] В определенных аспектах обогащение или обеднение проводят посредством основанного на иммуноаффинности отбора, такого как связывание с антителами или другими связывающими молекулами, распознающими поверхностные маркеры на клетках. В определенных аспектах антитело или другая молекула связаны с магнитовосприимчивой или магнитной частицей, например, гранулой. В определенных аспектах отбор включает этапы положительного и/или отрицательного отбора.
[0025] В определенных вариантах осуществления выделение популяции первичных CD8+-T-клеток человека включает обеднение или обогащение субпопуляции CD8+-клеток. В определенных вариантах осуществления выделение популяции первичных CD4+-T-клеток человека включает обеднение или обогащение субпопуляции CD4+-клеток. В определенных аспектах выделение популяции T-клеток включает обогащение TCM-клеток. В определенных аспектах выделение популяции первичных CD8+- и/или CD4+-T-клеток человека включает обогащение центральных T-клеток памяти (TCM). В определенных аспектах обогащение центральных T-клеток памяти (TCM) включает отрицательный отбор клеток, экспрессирующий поверхностный маркер, присутствующий на наивных T-клетках, такой как CD45RA, или положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти и не присутствующий на наивных T-клетках, такой как CD45RO; и/или положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти, такой как CD62L, CCR7, CD27, CD127 и/или CD44.
[0026] В определенных вариантах осуществления выделение включает (i) подвергание образца положительному отбору на основе поверхностной экспрессии CD4, приводящему к положительной и первой отрицательной фракции, где положительная фракция представляет собой популяцию выделенных CD4+-клеток; и (ii) подвергание первой отрицательной фракции отрицательному отбору на основе поверхностной экспрессии не-T-клеточного маркера и поверхностного маркера, присутствующего на наивных T-клетках, получая, таким образом, вторую отрицательную фракцию; и (iii) подвергание второй отрицательной фракции положительному отбору на основе поверхностной экспрессии маркера, присутствующего на поверхности центральных T-клеток памяти (TCM) и не присутствующего на поверхности другой субпопуляции T-клеток памяти.
[0027] В определенных аспектах маркер, присутствующий на наивных T-клетках, включает CD45RA. В определенных аспектах поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти включает CD62L, CCR7, CD27, CD127 и/или CD44.
[0028] В определенных аспектах выделение или отборы проводят в одной и той же емкости для разделения. В определенных аспектах выделение включает (i) подвергание образца первому отбору, получая, таким образом, одну из популяций первичных CD4+- и CD8+-T-клеток человека и образец с неотобранными клетками; и (ii) подвергание образца с неотобранными клетками второму отбору, получая, таким образом, другую из популяций первичных CD4+- и CD8+-T-клеток человека. В определенных аспектах популяцию первичных CD4+-T-клеток человека получают в первом отборе, а популяцию первичных CD8+-T-клеток человека получают во втором отборе. В определенных аспектах первый и/или второй отбор включает ряд этапов положительного или отрицательного отбора.
[0029] В определенных аспектах выделение одной или нескольких популяций, таких как популяция первичных T-клеток человека, популяция первичных CD4+-T-клеток человека или популяция первичных CD8+-T-клеток человека, включает положительный отбор на основе поверхностной экспрессии CD62L, CCR7, CD44 или CD27. В определенных аспектах выделение одной или нескольких популяций, таких как популяция первичных T-клеток человека, популяция первичных CD4+-T-клеток человека или популяция первичных CD8+-T-клеток человека, включает отрицательный отбор на основе поверхностной экспрессии CD45RA или положительный отбор на основе поверхностной экспрессии CD45RO.
[0030] В определенных вариантах осуществления различные виды выделения, такие как выделение множества популяций клеток, например, популяций CD4+-клеток и CD8+-клеток, проводят в одной и той же емкости для разделения. В определенных аспектах емкость для разделения представляет собой или включает трубку, систему трубок, камеру, блок, лунку, емкость для культивирования, пакет и/или колонку. В определенных аспектах емкость для разделения в течение разделения содержит клетки в автономной или стерильной среде.
[0031] В определенных вариантах осуществления инкубацию проводят в стимулирующих условиях. В определенных аспектах инициирующая культуру композиция содержит популяции первичных CD4+- и CD8+-T-клеток человека в инициирующем культуру соотношении. В определенных аспектах инициирующее культуру соотношение предназначено для получения желаемого результирующего соотношения CD4+- и CD8+-клеток (или желаемого общего количества T-клеток или количеств(а) субпопуляции(й)) после указанной инкубации или в какое-либо более позднее время, например, после инженерии, криоконсервации или во время непосредственно перед введением, например, при оттаивании у постели пациента.
[0032] В определенных вариантах осуществления желаемое результирующее соотношение составляет от или приблизительно от 5:1 до или приблизительно до 1:5 (или более чем приблизительно 1:5 и менее чем приблизительно 5:1), например, от или приблизительно от 1:3 до или приблизительно до 3:1 (или более чем приблизительно 1:3 и менее чем приблизительно 3:1), например, от или приблизительно от 2:1 до или приблизительно до 1:5 (или более чем приблизительно 1:5 и менее чем приблизительно 2:1), или составляет диапазон от или приблизительно от 2:1 до или приблизительно до 1:5. В определенных аспектах желаемое результирующее соотношение составляет или приблизительно составляет 3:1, 2,9:1, 2,8:1, 2,7:1, 2,6:1, 2,5:1, 2,4:1, 2,3:1, 2,2:1, 2,1:1, 2:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1:1, 1:1,1, 1:1,2, 1:1,3, 1:1,4, 1:1,5, 1:1,6, 1:1,7, 1:1,8, 1:1,9: 1:2, 1:2,5, 1:3, 1:3,5, 1:4, 1:4,5 или 1:5.
[0033] В определенных аспектах способ приводит к такому соотношению двух различных типов клеток или популяций, как соотношение CD4+- и CD8+-клеток в результирующей композиции, которое составляет от или приблизительно от 5:1 до или приблизительно до 1:5 (или более чем приблизительно 1:5 и менее чем приблизительно 5:1), например, от или приблизительно от 1:3 до или приблизительно до 3:1 (или более чем приблизительно 1:3 и менее чем приблизительно 3:1), например, от или приблизительно от 2:1 до или приблизительно до 1:5 (или более чем приблизительно 1:5 и менее чем приблизительно 2:1), или которое составляет или приблизительно составляет 3:1, 2,9:1, 2,8:1, 2,7:1, 2,6:1, 2,5:1, 2,4:1, 2,3:1, 2,2:1, 2,1:1, 2:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1:1, 1:1,1, 1:1,2, 1:1,3, 1:1,4, 1:1,5, 1:1,6, 1:1,7, 1:1,8, 1:1,9: 1:2, 1:2,5, 1:3, 1:3,5, 1:4, 1:4,5 или 1:5.
[0034] В определенных аспектах желаемое результирующее соотношение составляет 1:1 или приблизительно составляет 1:1.
[0035] В определенных аспектах способы приводят к желаемому результирующему соотношению или количеству(ам) клеток в результирующей композиции, приводят к соотношению или количеству в результирующей композиции, которое находится в пределах определенных допустимого отличия или диапазона погрешности такого желаемого результирующего соотношения или количества и/или приводит к такому соотношению или количеству в течение определенного процента времени, когда проводят способ, например, по меньшей мере в течение или приблизительно в течение 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более 95% времени.
[0036] В определенных аспектах допустимое отличие находится в пределах приблизительно 1%, приблизительно 2%, приблизительно 3%, приблизительно 4% приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50% от желаемого соотношения. В определенных аспектах результирующее соотношение находится в пределах 20% от желаемого соотношения и/или находится в пределах этого соотношения по меньшей мере 80% времени проведения способов.
[0037] В определенных вариантах осуществления допустимое отличие и/или желаемое результирующее соотношение или количество(а) составляют или определены посредством введения различных типов клеток, например, введением CD4+- и CD8+-клеток одному или нескольким индивидуумов во многих тестируемых соотношениях или количествах и оценки одного или нескольких параметров. В определенных аспектах определение желаемого результирующего соотношения или количества или допустимого отличия включает оценку одного или нескольких исходов после введения индивидууму. В определенных аспектах исходы включают исходы, выбранные из смягчения симптома заболевания и исходы, указывающие на безопасность и/или малую или отсутствующую токсичность.
[0038] В определенных вариантах осуществления инициирующее культуру соотношение выбрано на основе скорости пролиферации или способности к выживаемости различных выделенных типов клеток, таких как популяция первичных CD4+- и/или CD8+-T-клеток человека. В определенных вариантах осуществления инициирующее культуру соотношение выбрано, основываясь на источнике образца, например, индивидууме у которого получен образец. Например, в определенных аспектах образец получают у индивидуума и инициирующее культуру соотношение выбрано на основе заболевания или патологического состояния, присутствующего у указанного индивидуума, и/или лечебного средства, которое индивидуум получает, получал или будет получать, такого как сопутствующее лечебное средство для введения совместно с адоптивной клеточной терапией. В определенных аспектах инициирующее культуру соотношение выбрано на основе фенотипа одной или нескольких клеток или подтипов выделяемых или культивируемых клеток, такого как фенотип популяций CD4+- и/или CD8+-клеток, например, экспрессия поверхностного клеточного маркера или синтез или секреция одного или нескольких факторов, таких как цитокины или хемокины.
[0039] В определенных вариантах осуществления способы включают выбор инициирующего культуру соотношение до этапа инкубации. В определенных аспектах отбор проводят, измеряя скорость пролиферации или способности к выживаемости одной или нескольких из популяций выделенных клеток или популяций клеток, подлежащих инкубации, таких как первичные CD4+-T-клетки человека и/или выделенные первичные CD8+-T-клетки человека. В определенных аспектах отбор проводят, оценивая фенотип выделенных первичных CD4+-T-клеток человека и/или выделенных первичных CD8+-T-клеток человека. В определенных аспектах фенотип выбирали из экспрессии поверхностного маркера и секреции цитокина или другого фактора. В определенных аспектах выбор проводят посредством оценки источника образца, например, когда инициирующее культуру соотношение выбрано на основе заболевания или патологического состояния, поражающего индивидуума, у которого получают образец.
[0040] В определенных вариантах осуществления способы дополнительно включают определение промежуточных соотношения или количества клеток, например, промежуточного соотношения CD4+- и CD8+-клеток, присутствующих в емкости для культивирования в момент времени после начала указанной инкубации. В определенных аспектах способы дополнительно включают корректировку одного или нескольких параметров и/или увеличение или уменьшение времени проведения этапов инкубации и/или инженерии на основе указанного промежуточного соотношения. В одном из аспектов корректировка включает увеличение или уменьшение количества или обогащение одной или нескольких популяций клеток в емкости для культивирования, например, увеличение количества или обогащение CD4+- или CD8+-клеток в емкости для культивирования, корректировку температуры, добавление в емкость для культивирования стимулятора, корректировку концентрации одного или нескольких стимуляторов в емкости для культивирования и/или добавление и/или удаление субпопуляции клеток в емкость или из емкости для культивирования. В определенных аспектах определение и/или корректировку проводят, продолжая инкубацию композиции в стерильной или автономной среде. В определенных аспектах определение и/или корректировку проводят в автоматизированном режиме, например, под контролем компьютера, присоединенного к устройству, в котором проводят этапы.
[0041] В определенных аспектах этапы выделения, инкубации и/или инженерии проводят в стерильной или автономной среде и/или в автоматизированном режиме, например, под контролем компьютера, присоединенного к устройству, в котором проводят этапы.
[0042] В определенных аспектах популяция CD8+-клеток в инициирующей культуру композиция содержит по меньшей мере 50% центральных T-клеток памяти (TCM) или содержит менее чем 20% наивных T-клеток (TN).
[0043] В определенных вариантах осуществления образец получают у индивидуума. В определенных аспектах индивидуум представляет собой индивидуум, которому вводят указанные подвергнутые генетической инженерии клетки, например, T-клетки или клетки для адоптивной клеточной терапии, или индивидуум, нуждающийся в таком введении. В других аспектах индивидуум представляет собой индивидуума, отличного от индивидуума, которому вводят указанные подвергнутые генетической инженерии клетки, например, T-клетки или клетки для адоптивной терапии, или представляет собой индивидуума, не нуждающегося в таком лечении. Образцы представляют собой кровь и полученные из крови образцы, такие как образцы лейкоцитов, образцы после афереза, образцы после лейкафереза, образцы мононуклеарных клеток периферической крови (PBMC) и цельная кровь.
[0044] В определенных аспектах стимулирующие условия для инкубации или инженерии включают условия, в которых T-клетки инициирующей культуру композиции размножаются или разрастаются. Например, в определенных аспектах инкубацию проводят в присутствии средства, способного активировать один или несколько доменов внутриклеточной сигнализации одного или нескольких компоненты комплекса TCR, таких как дзета-цепь CD3, или способные активировать передачу активирующих сигналов через такой комплекс или компонент. В определенных аспектах инкубацию проводят в присутствии антитела к CD3, и антитела к CD28, антитела к 4-1BB, например, такие антитела связаны или присутствуют на поверхности твердой подложки, такой как гранула, и/или цитокина, такого как IL-2, IL-15, IL-7 и/или IL-21.
[0045] В определенных вариантах осуществления генетически сконструированный антигенный рецептор представляет собой или содержит T-клеточный рецептор (TCR), такой как высокоаффинный TCR, или функциональный не являющийся TCR антигенный рецептор, такой как химерный антигенный рецептор (CAR). В определенных аспектах рецептор специфически связывается с антигеном, экспрессируемым клетками, обуславливающими заболевание или патологическое состояние, подлежащее лечению. В определенных аспектах CAR содержит внеклеточный антигенраспознающий домен. В определенных аспектах он дополнительно содержит домен внутриклеточной сигнализации, содержащий содержащую ITAM последовательность и домен внутриклеточной сигнализации T-клеточной костимулирующей молекулы.
[0046] Также предоставлены клетки и композиции, включающие фармацевтические композиции, получаемые любыми из способов или вариантов осуществления, включая подвергнутые генетической инженерии клетки и клетки для адоптивной клеточной терапии. Также предоставлены способы введения таких клеток и композиций индивидуумам и применения клеток и композиций в таких способах. Например, предоставлены способы лечения, проводимые посредством получения клеток способами получения клеток и введения индивидууму клеток результирующей композиции или полученной из нее композиции. Предоставлены способы лечения, включающие введение предоставляемых клеток или композиций индивидууму. В определенных аспектах образец, из которого выделяют клетки, получают у индивидуума, которому вводят клетки. В определенных аспектах образец получают у другого индивидуума. Таким образом, способы включают аутологичные и аллогенные способы. В определенных вариантах осуществления способы обеспечивают улучшение состояния, лечение или профилактику одного или нескольких симптомов заболевания или патологического состояния у индивидуума. В определенных аспектах заболевание или патологическое состояние представляет собой злокачественную опухоль или ассоциированный с ней симптом. В определенных вариантах осуществления злокачественные опухоли включают лейкоз, лимфому, например, хронический лимфоцитарный лейкоз (CLL), ALL, неходжкинскую лимфому, острый миелолейкоз, множественную миелому, не поддающуюся лечению фолликулярную лимфому, лимфому мантийных клеток, медленно развивающуюся B-клеточную лимфому, B-клеточные злокачественные новообразования, злокачественные опухоли кишечника, легких, печени, молочной железы, предстательной железа, яичника, кожи (включая меланому), костей и злокачественную опухоль головного мозга, рак яичника, эпителиальные злокачественные опухоли, почечноклеточную карциному, аденокарциному поджелудочной железы, ходжкинскую лимфому, карциному шейки матки, колоректальный рак, глиобластому, нейробластому, саркому Юинга, медуллобластому, остеосаркому, синовиальную саркому и/или мезотелиому.
Краткое описание чертежей
[0047] Фигура 1A: предоставлено схематическое представление варианта осуществления замкнутой системы для применения в вариантах осуществления предоставляемых способов. Изображенная иллюстративная система содержит образец клеток 5, резервуар для отмывочного буфера 6, резервуар для элюирующего буфера 7, резервуар для первого Fab 18, резервуар для второго Fab 19 и насос 8, связанный последовательностью трубок и клапанов 13 с первой хроматографической колонкой 1, содержащей первый матрикс 3, функционально связанной последовательностью трубчатых соединений со второй хроматографической колонкой 2, содержащей второй матрикс 4. Вторая хроматографическая колонка 2 функционально связанна с камерой для удаления 9. Камера для удаления 9 функционально связанна с клапаном 13, посредством ряда трубчатых соединений направляющим клетки и жидкости в контейнер для отходов 10 или емкость для культивирования 12. Система заключена в оболочку 14.
[0048] Фигура 1B: предоставлено схематическое представление варианта осуществления замкнутой системы для применения в вариантах осуществления предоставляемых способов. Изображенная иллюстративная система содержит образец клеток 5, резервуар для отмывочного буфера 6, резервуар для элюирующего буфера 7, резервуар для первого Fab 18, резервуар для второго Fab 19, резервуар для третьего Fab 20 и насос 8, связанный последовательностью трубок с первой хроматографической колонкой 1, содержащей первый матрикс 3. Клапаны 13, функционально связанные с последовательностью трубок, направляют жидкости через последовательность трубок. Клапан 13, функционально связанный с первой хроматографической колонкой 1, направляет клетки и жидкости во вторую хроматографическую колонку 2, содержащую второй матрикс 4, которая функционально связана с камерой для удаления 9. Клапан 13, функционально связанный с первой хроматографической колонкой 1, также направляет клетки и жидкости в камеру для удаления 9, которая функционально связана с третьей хроматографической колонкой 15, содержащей третий матрикс 16. Третья хроматографическая колонка 15 функционально связана с камерой для удаления 9. Камеры для удаления 9 последовательностью трубчатых соединений и клапанов 13 функционально связаны с первым контейнером для отходов 10 или емкостью для культивирования 12. Система заключена в оболочку 14.
Подробное описание
[0049] Если не определено иначе, полагают, что все термины уровня техники, обозначения и другие технические и научные термины или терминология, используемые в настоящем документе, имеют такое же значение, как обычно понимают специалисты в области, к которой принадлежит заявляемый объект изобретения. В некоторых случаях, термины с обычно понимаемыми значениями для большей ясности и/или удобства указания определены в настоящем документе, и включение таких определений в настоящий документ не следует рассматривать как свидетельство существенного отличия от того, что обычно понимают в данной области.
[0050] Все публикации, включая патентные документы, научные статьи и базы данных, на которые сделаны ссылки в настоящей заявке, полностью включены в качестве ссылки для всех целей в той же степени, как если бы каждая отдельная публикация была самостоятельно включена в качестве ссылки. Если определение, приводимое в настоящем документе, отличается или иным образом не соответствует определению, приводимому в патентах, заявках, опубликованных заявках и других публикациях, которые включены в настоящий документ в качестве ссылки, определение, приводимое в настоящем документе, превалирует над определением, которое включено в настоящий документ в качестве ссылки.
[0051] Заглавия разделов, используемые в настоящем документе, сделаны исключительно в организационных целях, и их не следует рассматривать, как ограничение описываемого объекта изобретения.
I. Способы и системы для выделения, культивирования и инженерии клеток для адоптивной терапии
[0052] Предоставлены способы получения клеток, например, T-клеток, для применения в генетической инженерии и способах терапии, таких как адоптивная клеточная терапия. Конкретно, в определенных вариантах осуществления в способах используют или получают композиции, которые содержат множество различных популяций клеток или типов клеток, таких как популяции и субпопуляции выделенных CD4+- и CD8+-T-клеток. В определенных вариантах осуществления способы включают этапы выделения одной или нескольких популяций клеток, как правило, ряда популяций клеток. Как правило, клетки выделяют из образца, получаемого у индивидуума.
[0053] В определенных аспектах способы проводят, применяя одновременные или последовательные отборы или обогащения, в которых из образца, такого как образец, содержащий первичные T-клетки человека, выбирают, обогащают и/или выделяют множество различных популяций клеток, таких как CD4+- или CD8+-клетки. В определенных вариантах осуществления такие способы проводят с использованием единого технологического потока, в котором первую популяцию клеток, таких как один из типов CD4+- или CD8+-клеток, и вторую популяцию клеток, таких как другой из типов CD4+- или CD8+-клеток, выбирают, обогащают и/или выделяют без отбрасывания каких-либо клеток из первой популяции до проведения отбора второй популяции клеток. В определенных аспектах первый и второй отборы можно проводить одновременно или последовательно. В определенных вариантах осуществления способы отбора проводят в виде единого технологического потока посредством проведение первого отбора с обогащением первой популяции клеток, такой как один из типов CD4+- и CD8+-клеток из образца, такого как образец, содержащий первичные T-клетки человека, и используя невыбранные клетки после первого отбора в качестве источника клеток для второго отбора, например, другого из типов CD4+- или CD8+-клеток из образца.
[0054] В определенных вариантах осуществления можно проводить дополнительный отбор или отборы в первых или вторых отобранных клетках. В определенных вариантах осуществления дополнительный отбор обогащает субпопуляцию CD4+- или CD8+-клеток, экспрессирующих маркер на центральных T-клетках памяти (TCM), и/или обогащает субпопуляцию клеток, экспрессирующих CD62L, CD45RA, CD45RO, CCR7, CD27, CD127 или CD44.
[0055] В определенных вариантах осуществления способы отбора проводят в замкнутых системе или устройстве. В определенных вариантах осуществления в замкнутых системе или устройстве, получают композицию, такую как инициирующая культуру композиция, содержащую обогащенную или популяцию отобранных клеток, таких как обогащенные или популяции отобранных CD4+- и CD8+-клеток, в единой композиции.
[0056] Например, в определенных аспектах один или несколько этапов проводят с множеством популяций клеток, комбинированных в одной и той же композиции или присутствующих в одной и той же емкости, например, в одних и тех же замкнутых системе или устройстве или в одних и тех же емкости, блоке, или камере, например, в одной и той же колонке, например, колонке для разделения в магнитном поле, трубке, системе трубок, культуре или камере для культивирования, емкости для культивирования, блоке обработки, емкости для разделения клеток, центрифужной камере или с использованием для множества популяций клеток одних и тех же матриксов, сред и/или реагентов для разделения, например, одних и тех же магнитного или магнитовосприимчивого матрикса, частиц или гранул, одной и той же твердой подложки, например, аффинно-меченой твердой подложки, и/или одних и тех же антител и/или других партнеров по связыванию, таких как флуоресцентно меченые антитела и партнеры по связыванию. В определенных вариантах осуществления одно или несколько из емкостей, блоков или камер, таких как колонки, функционально связаны в одних и тех же замкнутых системе или устройстве так, что способы выделения, отбора и/или обогащения проходят в одном технологическом потоке, в котором популяцию неотобранных клеток после первого отбора можно использовать в качестве источника клеток для второго отбора.
[0057] В определенных вариантах осуществления выделение или обогащение одной или нескольких конкретных популяций или субпопуляций клеток, например, CD4+- и CD8+-T-клеток, для культивирования или инженерии для адоптивной терапии, предоставляет одно или несколько преимуществ. Например, инженерия клеток, обогащенных рядом различных популяций клеток или типов клеток, таких как отдельные популяции и субпопуляции CD4+- и CD8+-T-клеток, может улучшить эффективность или снизить или избежать нежелательного действия. В определенных аспектах выделение или обогащение увеличивает способность клеток, в конечном итоге вводимых индивидууму, к выживанию, росту, активации и/или пересадке in vivo или после введения индивидууму. В определенных аспектах это улучшает или усиливает одну или несколько эффекторных функций или активационный фенотип. Например, в определенных аспектах такие преимущества может обеспечивать обогащение популяции T-клеток, такой как популяция CD8+-T-клеток, центральными клетками памяти (TCM). В определенных аспектах одно или несколько таких преимуществ предоставляет комбинация двух или более выделенных популяций или подтипов, таких как популяции или субпопуляции выделенных CD8+- и CD4+-T-клеток, таких как обогащенная TCM популяция CD8+-клеток и популяция CD4+-клеток. Например, таких преимуществ в определенных аспектах можно достигать введением популяции CD4+- и CD8+-клеток по сравнению с популяцией только CD8+-клеток.
[0058] В определенных вариантах осуществления способы включают обработку получаемой композиции, содержащей множество популяций выделенных или выбранных клеток, таких как популяция выделенных или обогащенных CD4+-клеток и CD8+-клеток. В одном из вариантов осуществления обработка получаемой композиции включает инкубацию клеток в стимулирующих условиях, например, в определенных аспектах, для получения клеток для инженерии, или трансдукции, или для клеточного роста. В определенных вариантах осуществления способы включают этапы инженерии множества типов клеток, таких как CD4+-клетки и CD8+-клетки, такие как CD4+-клетки и CD8+-клетки, выделенные и находящиеся в инкубируемой композиции, такой как инициирующая культуру композиция. В определенных аспектах инженерию проводят для внесения в клетки генетически сконструированного антигенного рецептора, такого как TCR, например, высокоаффинный TCR, или функционального не являющегося TCR антигенного рецептора, такого как химерный антигенный рецептор (CAR). В определенных аспектах способы включают дополнительную обработку, такую как дополнительная инкубация, например, при или приблизительно при 37°C ± 2°C, и/или формулирование клеток и содержащих их композиций. В определенных вариантах осуществления обработка позволяет получать итоговую результирующую композицию, содержащую подвергнутые генетической инженерии клетки, такие как подвергнутые генетической инженерии CD4+-клетки и CD8+-клетки. В определенных вариантах осуществления получаемую обработанную результирующую композицию можно использовать в способах введения клеток и композиций, получаемых этими способами, пациенту, например, в связи с адоптивной клеточной терапией.
[0059] В определенных вариантах осуществления выделение или разделение проводят с использованием системы, устройства или аппарата, который осуществляет один или несколько из этапов выделения, получения, разделения, обработки, инкубации, культивирования и/или формулирования клеток этих способов. В определенных аспектах систему используют для проведения каждого из этих этапов в замкнутой или стерильной среде, например, для минимизации ошибок, манипуляций пользователя и/или загрязнения. В одном из примеров система представляет собой систему, как описано в публикации международной патентной заявке № WO2009/072003 или US 20110003380 A1. В определенных вариантах осуществления система представляет собой замкнутые устройство или систему, такие как изображены на фигуре 1A или фигуре 1B. В определенных вариантах осуществления система или устройство являются автоматизированными и/или осуществляют этапы отбора по обогащению клеток этими способами в автоматизированном режиме.
[0060] В определенных вариантах осуществления система или устройство осуществляют такое выделение, как этапы отбора или обогащения. В определенных вариантах осуществления можно использовать дополнительные систему или устройство, такие как замкнутые система или устройство, для проведения одного или нескольких других этапов, таких как этапы получения, обработки, инкубации, культивирования и/или формулирования клеток этого способа. В определенных вариантах осуществления система или устройство осуществляют один или несколько, например, все, этапы выделения, обработки, инженерии и формулирования в интегрированной или замкнутой системе и/или в автоматизированном или программируемом режиме. В определенных аспектах система или устройство включают компьютер и/или компьютерную программу, в соединении с системой или устройством, которые позволяют пользователю программировать, контролировать, оценивать результат и/или корректировать различные аспекты этапов обработки, выделения, инженерии и формулирования.
[0061] В определенных вариантах осуществления, так как обогащенную композицию, такую как инициирующая культуру композиция, предоставляемыми способами получают так, чтобы она содержала различные популяции клеток, таких как CD4+- и CD8+-клетки, получаемую композицию можно обрабатывать вместе и одновременно в тех же условиях и, в определенных аспектах, в замкнутой системе. Таким образом, в определенных аспектах способы обеспечивают процесс получения и обработки популяции выбранных, обогащенных или выделенных клеток, содержащей различные популяции клеток, такие как CD4+- и CD8+-клетки, в одном технологическом потоке. В определенных аспектах это отличается от способов на предшествующем уровне техники, включая способы на предшествующем уровне техники, в которых обрабатывают клетки для инженерии для адоптивной клеточной терапии, которые, как правило, включают раздельный технологический поток для каждой отдельной популяции клеток, например, по меньшей мере два технологических потока. Например, в определенных аспектах существующих способов, CD4+-T-клетки выделяют, обогащают и/или выбирают и обрабатывают в стимулирующих условиях для генетической инженерии отдельно, CD8+-T-клетки выделяют, обогащают и/или выбирают и обрабатывают в стимулирующих условиях для генетической инженерии отдельно, и по-отдельности обработанные и подвергнутые инженерии CD4+- и CD8+-T-клетки перед введением индивидууму рекомбинируют.
[0062] В определенных вариантах осуществления способы предоставляют одно или несколько преимуществ по сравнению с другими способами получения, выделения, инкубации и инженерии, такие как стоимость, время и/или сохранность ресурсов. Такие преимущества могут включать возможность выделять, обрабатывать, например, инкубировать и/или подвергать инженерии множество популяций клеток, находящихся в желаемом соотношении или приблизительно в желаемом соотношении, с увеличенной эффективностью и/или уменьшенными сложностью, временем, стоимостью и/или использованием ресурсов по сравнению с другими способами.
[0063] В определенных вариантах осуществления таких преимуществ достигают, оптимизируя один или несколько из этапов способа. Например, в определенных аспектах выделение, культивирование и/или инженерию различных популяций проводят с использованием того же устройства или оборудования и/или одновременно. В определенных аспектах выделение, культивирование и/или инженерию различных популяций проводят на основе одной и той же исходной композиции. В определенных аспектах такие особенности способов уменьшают количество времени, этапов способа, стоимость, сложность и/или количество ресурсов, по сравнению со способом, в котором популяции клеток выделяют, инкубируют и/или подвергают инженерии раздельно, в отдельных емкостях, с использованием раздельного оборудования, в разное время и/или начиная с различных исходных композиций.
[0064] В определенных аспектах способы выделения, инкубации и инженерии клетки приводят к результирующим композициям, в которых различные популяции клеток или типы клеток, такие как CD4+-клетки и CD8+-клетки, находятся в желаемом соотношении, или в пределах определенного уровня допустимой погрешности желаемого соотношения. Такие соотношения включают соотношения, полагаемые оптимальными для терапевтического применения, например, результирующие соотношения, полагаемые подходящими или оптимальными для введения пациенту в связи с адоптивной клеточной терапией. Также предоставлены способы введения клеток и композиций, получаемых этими способами, пациенту, например, в связи с адоптивной клеточной терапией
[0065] В определенных вариантах осуществления способы выделения или отбора проводят с достижением отбора клеток в выбранном инициирующем культуру соотношении CD4+-клеток и CD8+-клеток или их субпопуляций. В определенных аспектах такие соотношения включают соотношения, полагаемые оптимальными исходными пунктами для достижения оптимального соотношения, такого как желаемое соотношение в результирующей композиции после завершения способа или одного или нескольких этапов, например, после завершения этапа культивирования, инкубации и/или инженерии. В определенных вариантах осуществления предоставление клеток в инициирующем культуру соотношении, так как соотношение CD4+-клеток и CD8+-клеток, предусматривает различия в росте CD4+- и CD8+-T-клеток, который происходит при стимуляции или активации различными реагентами, с достижением желаемого соотношения в результирующей композиции.
[0066] В определенных вариантах осуществления способы позволяют получать подвергнутые инженерии клетки или клетки для инженерии в определенном процентном содержании или в пределах определенного процентного содержания от желаемого результирующего соотношения, или позволяют такой результат по меньшей мере в течение определенного процента времени. Как правило, желаемое результирующее соотношение составляет соотношение, которое определено как оптимальное для введения пациенту посредством адоптивного переноса. В определенных вариантах осуществления популяции или подтипы клеток, такие как CD8+- и CD4+-T-клетки, вводят с допустимым отличием или в пределах допустимого отличия от желаемой дозы всех клеток, такой как желаемая доза T-клеток. В определенных аспектах желаемая доза представляет собой желаемое количество клеток или желаемое количество клеток на единицу массы тела индивидуума, которому вводят клетки, например, клеток/кг. В определенных аспектах желаемая доза составляет или приблизительно составляет минимальное количество клеток или минимальное количество клеток на единицу массы тела. В определенных аспектах во множестве всех клеток, вводимых при желаемой дозе, отдельные популяции или подтипы находятся в желаемом результирующем соотношении или приблизительно в желаемом результирующем соотношении (таком как соотношение CD4+ и CD8+), например, в пределах определенных допустимых отличия или погрешности такого соотношения.
[0067] В определенных вариантах осуществления клетки вводят с допустимым отличием или в пределах допустимого отличия от желаемой дозы одной или нескольких отдельных популяций или подтипов клеток, такой как желаемая доза CD4+-клеток и/или желаемая доза CD8+-клеток. В определенных аспектах желаемая доза представляет собой желаемое количество клеток определенного подтипа или популяции или желаемое количество таких клеток на единицу массы тела индивидуума, которому вводят клетки, например, клеток/кг. В определенных аспектах желаем доза составляет минимальное количество клеток, или приблизительно минимальное количество клеток популяции или подтипа, или минимальное количество клеток популяции или подтипа на единицу массы тела.
[0068] Таким образом, в определенных вариантах осуществления дозировка основана на желаемой фиксированной дозе всех клеток и желаемом соотношении и/или на основе желаемой фиксированной дозе одной или нескольких, например, каждых из отдельных подтипов или субпопуляций. Таким образом, в определенных вариантах осуществления дозировка основана на желаемой фиксированной или минимальной дозе T-клеток и желаемом соотношении CD4+- и CD8+-клеток и/или основана на желаемой фиксированной или минимальной дозе CD4+ и/или CD8+-клеток.
[0069] В определенных вариантах осуществления предоставлены способы определения таких оптимальных результирующих соотношений и/или желаемых доз, и/или уровней колебаний от желаемого результирующего соотношения или желаемой дозы, которые могут быть допустимы, например, допустимого отличия. В определенных вариантах осуществления для достижения желаемого результирующего соотношения или доз(ы) (или для достижения такого соотношения в течение определенного процента времени или в пределах определенных допустимых отличий) популяции клеток комбинируют или инкубируют в соотношениях (например, в инициирующих культуру соотношениях), предназначенных для достижения желаемого результирующего соотношения для адоптивного переноса.
[0070] Также предоставлены способы определения инициирующего культуру соотношения, предназначенного для достижения желаемого результирующего соотношения или дозы с осуществлением этого в пределах определенных допустимых отличий и/или в течение определенного процента времени. Также предоставлены способы оценки промежуточных соотношений или количеств популяций клеток, например, в один или несколько периодов времени в ходе различных этапов способа, например, в течение инкубации. Также предоставлены способы коррекции различных условий, таких как условия культивирования, на основе таких оценок. В определенных аспектах корректировку проводят для обеспечения достижения конкретного результирующего соотношения или дозы или их достижения в пределах допустимых отличий.
[0071] В конкретных вариантах осуществления предоставлены оптимизированные способы получения композиции с желаемым результирующим соотношением или приблизительно желаемым результирующим соотношением популяции CD4+-T-клеток и популяции CD8+-T-клеток (например, популяции CD8+-клеток, обогащенных подтипом T-клеток, таким как центральные T-клетки памяти) и/или с желаемой дозой (например, количеством или количеством на единицу массы тела) T-клеток и/или CD4+- и CD8+-T-клеток, для внесения генетически сконструированного антигенного рецептора для применения в адоптивной клеточной терапии, где популяции клеток выделяют, инкубируют и/или подвергают инженерии в комбинации, и способ связан с увеличенной эффективностью и/или уменьшенной сложностью, временем, стоимостью и/или использованием ресурсов по сравнению со способом, котором популяции выделяют, инкубируют и/или подвергают инженерии раздельно.
[0072] Также предоставлены клетки и композиции, получаемые этими способами, включая фармацевтические композиции и составы, и наборы, системы и устройства для проведения этих способов. Также предоставлены способы использования клеток и композиций, получаемых этими способами, включая терапевтические способы, такие как способы адоптивной клеточной терапии, и фармацевтические композиции для введения индивидуумам.
A. Выделение, выделенные клетки и другие этапы обработки
[0073] В числе предоставленных вариантов осуществления находятся способы выделения множества клеток и популяций клеток из образца, а также выделенные, например обогащенные, клетки, получаемые такими способами. Выделение может включать одно или несколько из различных этапов получение и разделения клеток, включая разделение на основе одного или нескольких свойств, таких как размер, плотность, чувствительность или устойчивость к конкретным реагентам и/или аффинность, например, иммуноаффинность, к антителам или другим партнерам по связыванию. В определенных аспектах выделение проводят с использованием одного и того же устройства или оборудования последовательно в одном технологическом потоке и/или одновременно. В определенных аспектах выделение, культивирование и/или инженерию различных популяций проводят из одних и тех же исходных композиции или материала, например, из одного и того же образца.
[0074] В определенных аспектах множество популяций клеток выделяют в одних и тех же замкнутых системе или устройстве и/или в одних и тех же емкости или системе емкостей, например, в одних и тех же (или в одних и тех же их системах) блоке, камере, колонке, например, колонке для разделения в магнитном поле, трубке, системе трубок, культуре или камере для культивирования, емкости для культивирования, блоке обработки, емкости для разделения клеток, центрифужной камере. Например, в некоторых случаях выделение множества популяций клеток проводят в системе или устройстве с использованием единственных или одних и тех же емкости для выделения или разделения или системы емкостей, таких как единственные колонка или система колонок и/или одни и те же трубка или система трубок, например, без необходимости переноса популяции клеток, композиции или суспензии из одной емкости, например, системы трубок, в другую.
[0075] В определенных аспектах таких способов добиваются одним технологическим потоком, например, в замкнутой системе, используя одновременные или последовательные отборы, в которых из образца, такого как образец, содержащий первичные T-клетки человека, выбирают, обогащают и/или выделяют множество различных популяций клеток, таких как CD4+- или CD8+-клетки. В одном из вариантов осуществления образец, содержащий клетки подвергают отбору посредством одновременного обогащения обеих популяций CD4+- и CD8+-клеток. В определенных аспектах проведение разделения или выделения в одних и тех же емкости или системе емкостей, например, системе трубок, достигают посредством последовательного проведения этапов положительного и отрицательного отбора, последующего этапа подвергания отрицательной и/или положительной фракции после предыдущего этапа дополнительному отбору, где весь процесс проводят в одних и тех же трубке или системе трубок. В одном из вариантов осуществления образец, содержащий клетки для выбора подвергают последовательному отбору, где первый отбор проводят с обогащением одной из популяций CD4+- и CD8+-клеток, а невыбранные клетки после первого отбора используют в качестве источника клеток для второго отбора с обогащением другой из популяций CD4+- и CD8+-клеток. В определенных вариантах осуществления можно проводить дополнительные отбор или отборы с обогащением субпопуляций одной или обеих из популяций CD4+- или CD8+-клеток, например, центральных T-клеток памяти (TCM).
[0076] В конкретном аспекте первый этап отбора проводят с использованием гранул, меченных связывающими CD4 молекулами, такими как антитела (или вторичные реагенты, которые распознают такие молекулы), и положительные и отрицательные фракции после первого этапа отбора сохраняют с последующим дополнительным положительным или отрицательным отбором из отрицательной фракции с обогащением CD8+-клеток, например, с использованием гранул, меченных связывающими CD8 молекулами, и необязательно отбором субпопуляции клеток из фракции CD8+-клеток, например, центральные CD8+-T-клетки памяти и/или клетки, экспрессирующие один или несколько маркеров CD62L, CD45RA, CD45RO, CCR7, CD27, CD127 или CD44. В определенных вариантах осуществления порядок отборов можно обратить. В определенных вариантах осуществления отбор CD4 всегда проводят первым и во втором отборе из отрицательной фракции (CD4-) обогащают фракцию CD8+, например, посредством отрицательного отбора одного или нескольких из CD45RA+ и CD14 и/или положительного отбора одного или нескольких из CD62L, CCR7 и/или других маркеров, экспрессируемых на центральных клетках памяти.
[0077] В определенных вариантах осуществления множество популяций клеток, например, популяцию CD4+-T-клеток и популяцию CD8+-T-клеток, выделяют, например, для получения инициирующей культуру композиции, содержащей множество популяций клеток. Как правило, инициирующая культуру композиция содержит клетки в инициирующем культуру соотношении, которое предназначено для получения конкретного желаемого результирующего соотношения двух или более типов клеток, такого как конкретное соотношение CD4+-клеток и CD8+-клеток, после одного или нескольких из этапов инкубации, поддержания культуры, культивирования и/или инженерии. В определенных вариантах осуществления желаемое результирующее соотношение представляет собой соотношение, предназначенное быть оптимальным для введения клеток пациенту, например, при адоптивной клеточной терапии.
[0078] В определенных аспектах выделение множества популяций в единой или одной и той же емкости или системе емкостей для выделения или разделения, такой как одна колонка или система колонок и/или одна и та же трубка или система трубок или с использованием одного и того же матрикса для разделения или таких сред или реагентов, как один и тот же магнитный матрикс, аффинно-меченая твердая подложка или антитела или другие партнеры по связыванию, включает особенности, которые оптимизируют выделение, например, приводя к уменьшенным стоимости, времени, сложности, необходимости оперирования образцами, использованию ресурсов, реагентов или оборудования. В определенных аспектах такие особенности предпочтительны тем, что они минимизируют стоимость, время и/или сложность, ассоциированные со способами, повышают эффективность и/или позволяют избежать отрицательного воздействия на клеточный продукт, такого как отрицательное воздействие, вызываемое инфекцией, загрязнением и/или изменениями температуры.
[0079] В определенных вариантах осуществления популяции выделенных клеток, получаемые для применения в способах по настоящему документу, являются стерильными. Загрязнение продуктов разделения клеток микроорганизмами в некоторых случаях может приводить к инфекции пациента-реципиента, например, пациента-реципиента с ослабленной иммунной системой, не способного противостоять инфекции. В определенных вариантах осуществления клетки, популяции клеток и композиции получают в соответствии с условиями GMP (надлежащая производственная практика). В определенных вариантах осуществления условия GMP включают строгое серийное тестирование. В определенных вариантах осуществления доя трансплантации проводят типирование тканей, например, во избежание несоответствия лейкоцитарного антигена человека (HLA) и для предотвращения таких осложнений, как реакция "трансплантат против хозяина". В определенных вариантах осуществления предоставляемые способы снижают оперирование отдельными пользователями и автоматизируют различные этапы, которые в определенных аспектах могут увеличивать стабильность популяций и композиций выделенных клеток и снижать погрешность, таким образом, способствуя стабильности терапии и безопасности.
1. Клетки и популяции клеток
[0080] В определенных вариантах осуществления способы включают проведение отбора, выделение и/или обогащение в образце клеток, таком как образец первичных клеток человека. Как правило, популяции выделенных клеток включают множество популяций клеток, как правило, популяций клеток крови или клеток, получаемых из крови, таких как гематопоэтические клетки, лейкоциты (белые клетки крови), мононуклеарные клетки периферической крови (PBMC) и/или клетки иммунной системы, например, клетки врожденного или адаптивного иммунитета, такие как миелоидные или лимфоидные клетки, например, лимфоциты, как правило T-клетки и/или NK-клетки. В определенных вариантах осуществления образец представляет собой образец после афереза или лейкафереза. В определенных вариантах осуществления отбор, выделение и/или обогащение могут включать положительный или отрицательный отбор клеток из образца.
[0081] В определенных вариантах осуществления образец представляет собой образец, содержащий первичные T-клетки человека, такие как CD4+- и CD8+-T-клетки. В конкретных вариантах осуществления образец представляет собой образец, из которого выделяют множество T-популяций клеток, таких как популяция CD4+-клеток и популяция CD8+-T-клеток. Таким образом, в определенных вариантах осуществления выделение включает положительный отбор клеток, экспрессирующих CD4, или клеток, экспрессирующих CD8, и/или отрицательный отбор клеток, экспрессирующих маркеры, не являющиеся T-клеточными, такие как маркеры миелоидных или B-клеток, например, отрицательный отбор клеток, экспрессирующих CD14, CD19, CD56, CD20, CD11b и/или CD16.
[0082] В определенных вариантах осуществления образец представляет собой образец, содержащий множество популяций, который содержит популяцию T-клеток, такую как популяция всех T-клеток или популяция CD4+-клеток, и популяцию NK-клеток. В числе популяций T-клеток, которые можно обогащать, выделять и/или выбирать, находятся популяции нефракционированные T-клетки, нефракционированные CD4+-клетки, нефракционированные CD8+-клетки и субпопуляции CD4+- и/или CD8+-T-клеток, включая субпопуляции T-клеток, получаемые посредством обогащения или обеднения клеток конкретного подтипа или на основе профиля экспрессии конкретного поверхностного маркера.
[0083] Например, в числе подтипов T-клеток (например, CD4+- или CD8+-T-клеток), которые можно обогащать, выделять и/или выбирать, находятся подтипы, определяемые по функции, состоянию активации, зрелости, потенциалу дифференцировки, росту, рециркуляции, локализации и/или способностям к выживанию, антигенной специфичности, типу антигенного рецептора, присутствию в конкретном органе или компартменте, маркеру или профилю секреции цитокинов и/или по степени дифференцировки.
[0084] В числе подтипов и субпопуляций T-клеток и/или CD4+- и/или CD8+-T-клеток, которые можно обогащать, выделять и/или выбирать, находятся наивные T-клетки (TN), эффекторные T-клетки (Тэфф), T-клетки памяти и их подтипы, такие как стволовые T-клетки памяти (TSCM), центральные T-клетки памяти (TCM), эффекторные T-клетки памяти (TEM) или терминально дифференцированные эффекторные T-клетки памяти, инфильтрирующие опухоль лимфоциты (TIL), незрелые T-клетки, зрелые T-клетки, хелперные T-клетки, цитотоксические T-клетки, мукозальные инвариантные T-клетки (MAIT), естественные и адаптивные регуляторные T-клетки (Tрег), такие хелперные T-клетки, как TH1-клетки, TH2-клетки, TH3-клетки, TH17-клетки, TH9-клетки, TH22-клетки, фолликулярные хелперные T-клетки, альфа/бета T-клетки и дельта/гамма T-клетки.
[0085] В определенных вариантах осуществления одна или несколько из популяций T-клеток обогащенных, выделенных и/или выбранных из образца предоставляемыми способами, представляют собой клетки, которые положительны (маркер+) по одному или нескольким конкретным маркерам или экспрессируют высокие уровни (высокий уровень маркера) одного или нескольких конкретных маркеров, таких как поверхностные маркеры, или которые отрицательны (маркер-) по одному или нескольким конкретным маркерам или экспрессируют относительно низкие уровни (низкий уровень маркера) одного или нескольких маркеров. В некоторых случаях, такие маркеры представляют собой маркеры, отсутствующие или экспрессируемые на относительно низких уровнях в определенных популяциях T-клеток (таких как не являющиеся клетками памяти клетки), но присутствующие или экспрессируемые на относительно высоких уровнях в других определенных популяциях T-клеток (таких как клетки памяти). В одном из вариантов осуществления клетки (такие как CD8+-клетки или T-клетки, например, CD3+-клетки) обогащены (т.е., произведен положительный отбор) клетками, которые положительны по CD45RO, CCR7, CD28, CD27, CD44, CD127 и/или CD62L или экспрессируют их на поверхности на высоких уровнях, и/или обеднены (например, произведен отрицательный отбор) клетками, которые положительны по CD45RA или экспрессируют его на поверхности на высоких уровнях. В определенных вариантах осуществления клетки обогащены или обеднены клетками, положительными по CD122, CD95, CD25, CD27 и/или IL7-Rα (CD127) или экспрессируют их на поверхности на высоких уровнях. В определенных примерах CD8+-T-клетки обогащены клетками положительными по CD45RO (или отрицательными по CD45RA) и по CD62L.
[0086] В определенных вариантах осуществления популяция CD4+-T-клеток и субпопуляция CD8+-T-клеток, например, субпопуляция обогащенная центральными клетками памяти (TCM).
[0087] В определенных вариантах осуществления клетки представляют собой естественные киллерные (NK) клетки. В определенных вариантах осуществления клетки представляют собой моноциты или гранулоциты, например, миелоидные клетки, макрофаги, нейтрофилы, дендритные клетки, тучные клетки, эозинофилы и/или базофилы.
2. Образцы
[0088] Как правило, клетки и популяции клеток выделяют из образца, такого как биологический образец, например, образец, получаемый у индивидуума, такого как индивидуум с конкретным заболеванием или патологическим состоянием, или нуждающийся в клеточной терапии, или которому будут проводить клеточную терапию. В определенных аспектах индивидуум представляет собой человека, такого как индивидуум, который представляет собой пациента, нуждающегося в конкретном терапевтическом вмешательстве, таком как адоптивная клеточная терапия, для которой клетки выделяют, обрабатывают и/или подвергают инженерии. Таким образом, в определенных вариантах осуществления клетки представляют собой первичные клетки, например, первичные клетки человека. Образцы включают ткань, жидкость и другие образцы, получаемые непосредственно у индивидуума, а также образцы, являющиеся результатом одного или нескольких этапов обработки, таких как разделение, центрифугирование, генетическая инженерия (например, трансдукция вирусным вектором), отмывка и/или инкубация. Биологический образец может представлять собой образец, получаемый непосредственно из биологического источника, или образец, который является обработанным. Биологические образцы в качестве неограничивающих примеров включают жидкости организма, такие как кровь, плазма, сыворотка, цереброспинальная жидкость, синовиальная жидкость, моча и пот, образцы тканей и органов, включая обработанные образцы, получаемые из них.
[0089] В определенных аспектах образец представляет собой кровь или получаемый из крови образец или представляет собой продукт афереза или лейкафереза или получен из них. Иллюстративные образцы включают цельную кровь, мононуклеарные клетки периферической крови (PBMC), лейкоциты, костный мозг, тимус, тканевой биоптат, опухоль, лейкоз, лимфому, лимфоузел, ассоциированную с кишечником лимфоидную ткань, ассоциированную со слизистой лимфоидную ткань, селезенку, другие лимфоидные ткани, печень, легкое, желудок, кишечник, толстую кишку, почку, поджелудочную железу, молочную железу, кость, предстательную железу, шейку матки, семенники, яичники, миндалину или другой орган и/или полученные из них клетки. В случае клеточной терапии, например, адоптивной клеточной терапии, образцы включают образцы из аутологичных и аллогенных источников.
[0090] В определенных вариантах осуществления клетки получают из линий клеток, например, линий T-клеток. В определенных вариантах осуществления клетки получают из ксеногенного источника, например, у мыши, крысы не являющегося человеком примата и свиньи.
3. Обработка, получение и разделение клеток, не основанное на аффинности
[0091] В определенных вариантах осуществления выделение клеток или популяций включает один или несколько этапов получения и/или не основанных на аффинности этапов разделения клеток. В определенных примерах клетки отмывают, центрифугируют и/или инкубируют в присутствии одного или нескольких реагентов, например, с удалением нежелательных компонентов, обогащением желаемых компонентов, лизисом или удалением клеток чувствительных к конкретным реагентам. В определенных примерах, клетки разделяют на основе одного или нескольких свойств, таких как плотность, адгезивных свойств, размера, чувствительности и/или устойчивости к конкретным компонентам.
[0092] В определенных примерах клетки получают из циркулирующей крови индивидуума, например, посредством афереза или лейкафереза. В определенных аспектах образцы содержат лимфоциты, содержащие T-клетки, моноциты, гранулоциты, B-клетки, другие ядерные лейкоциты, эритроциты и/или тромбоциты, а в определенных аспектах содержат клетки, отличные от эритроцитов и тромбоцитов.
[0093] В определенных вариантах осуществления клетки крови, собираемые у индивидуума, отмывают, например, с удалением плазматической фракции и с помещением клеток в подходящий буфер или среды для последующих этапов обработки. В определенных вариантах осуществления клетки отмывают фосфатно-солевым буфером (PBS). В определенных вариантах осуществления в отмывочном растворе отсутствует кальций, и/или магний, и/или многие или все двухвалентные катионы. В определенных аспектах этап отмывки проводят в полуавтоматизированной "проточной" центрифуге (например, обработчик клеток Cobe 2991, Baxter) по инструкциям производителя. В определенных аспектах этап отмывки проводят посредством фильтрования тангенциальным потоком (TFF) по инструкциям производителя. В определенных вариантах осуществления клетки после отмывки ресуспендируют в различных биосовместимых буферах, например, таких как не содержащий Ca++/Mg++ PBS. В определенных вариантах осуществления компоненты образца клеток крови удаляют и клетки непосредственно ресуспендируют в средах для культивирования.
[0094] В определенных вариантах осуществления способы включают способы разделения клеток, основанные на плотности, такие как получение лейкоцитов из периферической крови посредством лизиса эритроцитов и центрифугирования в градиенте перколла или фиколла.
4. Разделение на основе аффинности и/или профиля маркеров
[0095] В определенных вариантах осуществления способы выделения включают разделение различных типов клеток на основе экспрессии или присутствия в клетке одной или нескольких конкретных молекул, таких как поверхностные маркеры, например, поверхностные белки, внутриклеточные маркеры или нуклеиновая кислота. В определенных вариантах осуществления можно использовать любой известный способ разделения на основе таких маркеров. В определенных вариантах осуществления разделение представляет собой основанное на аффинности или на иммуноаффинности разделение. Например, в определенных аспектах выделение включает разделение клеток и популяций клеток на основе экспрессии или уровня экспрессии клетками одного или нескольких маркеров, как правило, поверхностных клеточных маркеров, например, посредством инкубации с антителом или партнером по связыванию, которые специфически связываются с такими маркерами, как правило, с последующими этапами отмывки и отделения клеток со связавшимися антителами или партнерами по связыванию от клеток без связавшихся антител или партнеров по связыванию.
[0096] Такие этапы разделения могут основываться на положительном отборе, при котором клетки со связанными реагентами сохраняют для дальнейшего использования, и/или отрицательный отбор, при котором сохраняют клетки без связанного антитела или партнера по связыванию. В определенных примерах для использования сохраняют обе фракции. В определенных аспектах отрицательный отбор может быть особенно пригоден, когда антитело, которое специфически определяет тип клеток в гетерогенной популяции, отсутствует так, что разделение лучшим проводить на основе маркеров, экспрессируемых на клетках, отличных от необходимой популяции.
[0097] Разделение не обязательно приводит к 100% обогащению или удалению конкретной популяции клеток или клеток, экспрессирующих конкретный маркер. Например, положительный отбор или обогащение клеток конкретного типа, таких как клетки, экспрессирующие маркер, относится к увеличению количества или процентного содержания таких клеток, но не обязательно приводит к полному отсутствию клеток, не экспрессирующих маркер. Подобным образом, отрицательный отбор, удаление или обеднение клеток конкретного типа, таких как клетки, экспрессирующие маркер, относится к уменьшению количества или процентного содержания таких клеток, но не обязательно приводит к полному удалению всех таких клеток. Например, в определенных аспектах отбор одной из популяций CD4+- или CD8+-клеток обогащает указанную популяцию, популяцию CD4+- или CD8+-клеток, но также может оставлять определенное остаточное или небольшое процентное содержание других невыбранных клеток, которые в некоторых случаях могут включать другие популяции CD4- или CD8-клеток, все еще присутствующие в обогащенной популяции.
[0098] В определенных примерах проводят несколько раундов этапов разделения, где фракцию, полученную в результате положительного или отрицательного отбора после одного этапа, подвергают другому этапу разделения, такому как последующий положительный или отрицательный отбор. В определенных примерах, на одном этапе разделения можно обеднять клетки, экспрессирующие несколько маркеров одновременно, например, посредством инкубации клеток со множеством антител или партнеров по связыванию, где каждый специфичен к маркеру, являющемуся мишенью отрицательного отбора. Подобным образом, несколько типов клеток можно одновременно подвергать положительному отбору посредством инкубации клеток со множеством антител или партнеров по связыванию, экспрессируемых различными типами клеток.
[0099] Например, в определенных аспектах способами положительного или отрицательного отбора выделяют конкретные субпопуляции T-клеток, такие как клетки положительные по одному или нескольким поверхностным маркерам или экспрессирующие их высокие уровни, например, CD28+-, CD62L+-, CCR7+-, CD27+-, CD127+-, CD4+-, CD8+-, CD45RA+- и/или CD45RO+-T-клетки.
[0100] Например, CD3+-, CD28+-T-клетки можно выбирать посредством положительного отбора с использованием конъюгированных с CD3/CD28 магнитных гранул (например, DYNABEADS® M-450 CD3/CD28 T Cell Expander).
[0101] В определенных вариантах осуществления выделение проводят посредством обогащения конкретной популяции клеток посредством положительного отбора, или обеднения конкретной популяции клеток посредством отрицательного отбора. В определенных вариантах осуществления положительный или отрицательный отбор проводят посредством инкубации клеток с одним или несколькими антителами или другими связывающими средствами, которые специфически связываются с одним или несколькими поверхностными маркерами, экспрессируемыми (маркер+) или экспрессируемыми на относительно высоком уровне (маркервысокий) на отбираемых посредством положительного или отрицательного отбора клетках, соответственно.
[0102] В определенных вариантах осуществления T-клетки выделяют из образца PBMC посредством отрицательного отбора по маркерам, экспрессируемым на клетках, не являющихся T-клетками, таких как B-клетки, моноциты или другие лейкоциты, такие как CD14-клетки. В определенных вариантах осуществления способы включают выделение, отбор и/или обогащение CD4+- и CD8+-клеток. В одном из примеров для обогащения CD4+-клеток посредством отрицательного отбора, смесь моноклональных антител, как правило, содержит антитела к CD14, CD20, CD11b, CD16 и HLA-DR. В одном из примеров для обогащения популяции CD8+-клеток отрицательный отбор проводят посредством обеднения клеток, экспрессирующих CD14 и/или CD45RA. В определенных аспектах этап отбора CD4+-клеток или CD8+-клеток, такого как положительный отбор по CD4 и положительный отбор по CD8, используют для разделения хелперных CD4+- и цитотоксических CD8+-T-клеток. Такие отборы в определенных аспектах проводят одновременно, а в других аспектах проводят последовательно в любом порядке.
[0103] В определенных аспектах способы включают первый положительный отбор CD4+-клеток, в котором невыбранные клетки (CD4--клетки) после первого отбора используют в качестве источника клеток для второго положительного отбора с обогащением CD8+-клеток. В определенных аспектах способы включают первый положительный отбор CD8+-клеток, в котором невыбранные клетки (CD8--клетки) после первого отбора используют в качестве источника клеток для второго положительного отбора с обогащением CD4+-клеток. Такие популяции CD4+- и CD8+-клеток можно дополнительно сортировать по субпопуляциям посредством положительного или отрицательного отбора по маркерам, экспрессируемым или экспрессируемым в относительно высокой степени в одной или нескольких субпопуляциях наивных T-клеток, T-клеток памяти и/или эффекторных T-клеток.
[0104] В определенных вариантах осуществления CD4+-клетки дополнительно обогащают или обедняют наивными клетками, центральными клетками памяти, эффекторными клетками памяти и/или центральными стволовыми клетками памяти, например, посредством положительного или отрицательного отбора на основе поверхностных антигенов, ассоциированных с соответствующими популяциями. Хелперные CD4+-T-клетки сортируют по наивным клеткам, центральным клеткам памяти и эффекторным клеткам посредством идентификации популяций клеток, несущих клеточные поверхностные антигены. CD4+-лимфоциты можно получать стандартными способами. В определенных вариантах осуществления наивные CD4+-T-лимфоциты представляют собой CD45RO--, CD45RA+-, CD62L+-, CD4+-T-клетки. В определенных вариантах осуществления центральные CD4+-клетки памяти представляют собой CD62L+- и CD45RO+-клетки. В определенных вариантах осуществления эффекторные CD4+-клетки представляют собой CD62L--клетки и CD45RO-клетки.
[0105] В определенных вариантах осуществления CD8+-клетки дополнительно обогащают или обедняют наивными клетками, центральными клетками памяти, эффекторными клетками памяти и/или центральными стволовыми клетками памяти, например, посредством положительного или отрицательного отбора на основе поверхностных антигенов, ассоциированных с соответствующими популяциями. В определенных вариантах осуществления обогащение центральными T-клетками памяти (TCM) проводят для увеличения эффективности, такой как улучшение долговременного выживания, рост и/или приживление после введения, которые в определенных аспектах особенно сильны в таких субпопуляциях. См. Terakuraet al. (2012) Blood. 1:72-82; Wang et al. (2012) J. Immunother. 35(9):689-701. В определенных вариантах осуществления комбинирование обогащенных CD8+-T-клеток TCM и CD4+-T-клеток дополнительно увеличивает эффективность.
[0106] В вариантах осуществления T-клетки памяти присутствуют в обеих субпопуляциях, CD62L+- и CD62L-, CD8+-лимфоцитов периферической крови. PBMC можно обогащать или обеднять фракциями CD62L-CD8+-клеток и/или CD62L+CD8+-клеток, например, с использованием антител к CD8 и антител к CD62L.
[0107] В определенных вариантах осуществления обогащение центральными T-клетками памяти (TCM) проводят на основе положительной или высокой поверхностной экспрессии CD45RO, CD62L, CCR7, CD28, CD3, CD27 и/или CD127; в определенных аспектах его проводят на основе отрицательного отбора клеток, экспрессирующих или высокоэкспрессирующих CD45RA и/или гранзим B-клеток.
[0108] В определенных вариантах осуществления предоставляемые способы включают выделение, отбор и/или обогащение CD8+-клеток из образца, например, посредством положительного отбора на основе поверхностной экспрессии CD8. В определенных вариантах осуществления способы могут дополнительно включать обогащение центральными T-клетками памяти (TCM). В одном из аспектов обогащенные CD8+-клетки можно дополнительно обогащать центральными T-клетками памяти (TCM) посредством отбора по одному или нескольким маркерам, экспрессируемым на центральных T-клетках памяти (TCM), таких как один или несколько из CD45RO, CD62L, CCR7, CD28, CD3, CD27 и/или CD 127. Отбор можно проводить до или после выделения, отбора и/или обогащения CD4+-клеток. Такие отборы в определенных аспектах проводят одновременно, а в других аспектах проводят последовательно в любом порядке.
[0109] В определенных аспектах способы включают первый положительный отбор CD4+-клеток, в котором невыбранные клетки (CD4--клетки) после первого отбора используют в качестве источника клеток для второго отбора с обогащением CD8+-клеток, а обогащенные или выбранные CD8+-клетки используют в третьем отборе для дополнительного обогащения клеток, экспрессирующих один или несколько маркеров, экспрессируемых на центральных T-клетках памяти (TCM), например, посредством третьего отбора с обогащением CD45RO+-, CD62L+-, CCR7+-, CD28+-, CD3+-, CD27+- и/или CD127+-клеток. В определенных аспектах способы включают первый положительный отбор CD8+-клеток, в котором невыбранные клетки (CD8--клетки) после первого отбора используют в качестве источника клеток для второго отбора с обогащением CD4+-клеток, а обогащенные или выбранные CD8+-клетки после первого отбора также используют в третьем отборе для дополнительного обогащения клеток, экспрессирующих один или несколько маркеров, экспрессируемых на центральных T-клетках памяти (TCM), например, посредством третьего отбора с обогащением CD45RO+-, CD62L+-, CCR7+-, CD28+-, CD3+-, CD27+- и/или CD127+-клеток.
[0110] В определенных аспектах выделение популяции CD8+-клеток, обогащенной клетками TCM, проводят посредством обеднения клетками, экспрессирующими CD4, CD14, CD45RA, и положительного отбора или обогащения клетками, экспрессирующими CD62L. В одном из аспектов обогащение центральными T-клетками памяти (TCM) проводят, начиная с отрицательной фракции клеток, выбранных на основе экспрессии CD4, которую подвергают отрицательному отбору на основе экспрессии CD14 и CD45RA, и положительному отбору на основе CD62L. Такие отборы в определенных аспектах проводят одновременно, а в других аспектах проводят последовательно в любом порядке. В определенных аспектах такой же основанный на экспрессии CD4 этап отбора, как использованный при получении популяции или субпопуляции CD8+-клеток, также используют для получения популяции или субпопуляция CD4+-клеток так, что положительную и отрицательную фракции после основанного на CD4 разделения сохраняют и используют в последующих этапах способов, необязательно после одного или нескольких дополнительных этапов положительного или отрицательного отбора.
[0111] В конкретном примере образец PBMC или другой образец лейкоцитов подвергают отбору CD4+-клеток, где сохраняют отрицательную и положительную фракции. Затем отрицательную фракцию подвергают отрицательному отбору на основе экспрессии CD14 и CD45RA или CD19 и положительному отбору на основе маркерных характеристик центральных T-клеток памяти, таких как CD62L или CCR7, где положительный и отрицательный отборы проводят в любом порядке.
[0112] В определенных вариантах осуществления способы выделения, отбора и/или обогащение клеток, например, посредством положительного или отрицательного отбора на основе экспрессии поверхностного клеточного маркера или маркеров, например, любым из способов, описанных выше, могут включать основанные на иммуноаффинности отборы. В определенных вариантах осуществления основанные на иммуноаффинности отборы включают приведение образца, содержащего клетки, такие как первичные T-клетки человека, содержащие CD4+- и CD8+-клетки, в контакт с антителом или партнером по связыванию, которые специфически связываются с поверхностным клеточным маркером или маркерам. В определенных вариантах осуществления антитело или партнер по связыванию связаны с твердой подложкой или матриксом, такими как сфера или гранула, например, микрогранулы, наногранулы, включая агарозные, магнитные гранулы или парамагнитные гранулы, с обеспечением разделения клеток в течение положительного и/или отрицательного отбора. В определенных вариантах осуществления сферы или гранулы можно упаковывать в колонку для проведения иммуноаффинной хроматографии, при которой образец, содержащий клетки, такие как первичные T-клетки человека, содержащие CD4+- и CD8+-клетки, приводят в контакт с матриксом колонки, а затем элюируют или выделяют из нее.
a. Иммуноаффинные гранулы
[0113] Например, в определенных вариантах осуществления клетки и популяции клеток разделяют или выделяют с использованием способов иммуномагнитного (или аффинномагнитного) разделения (рассмотрено в Methods in Molecular Medicine, vol. 58: Metastasis Research Protocols, Vol. 2: Cell Behavior In Vitro and In Vivo, p 17-25 Edited by: S. A. Brooks and U. Schumacher © Humana Press Inc., Totowa, NJ).
[0114] В определенных аспектах образец или композицию клеток для разделения инкубируют с малым, намагничиваемым или магнитовосприимчивым материалом, таким как магнитовосприимчивые частицы или микрочастицы, такие как парамагнитные гранулы. Как правило, магнитовосприимчивый материал, например, частица непосредственно или опосредована связана с партнером по связыванию, например, антителом, которое специфически связывается с молекулой, например, поверхностным маркером, находящимся на клетке, клетках или в популяции клеток, которые необходимо выделять, например, т.е. необходимо подвергать отрицательному или положительному отбору. Такие гранулы известны и коммерчески доступны в ряде источников, включая в определенных аспектах Dynabeads® (Life Technologies, Carlsbad, CA), гранулы MACS® (Miltenyi Biotec, San Diego, CA) или реагенты с гранулами Streptamer® (IBA, Germany).
[0115] В определенных вариантах осуществления магнитная частица или гранула содержит магнитовосприимчивый материал, связанный со специфическим партнером по связывания, таким как антитело или другой партнер по связыванию. Существует множество хорошо известных магнитовосприимчивых материалов, используемых в способах магнитного разделения. Подходящие магнитные частицы включаю частицы, описанные в патенте США № 4452773, выданном Molday, и в описании патента Евросоюза EP 452342 B, которые, таким образом, включены в качестве ссылки. Другими примерами являются частицы с размером коллоидных частиц, такие как частицы, описанные в патенте патент США № 4795698, выданном Owen, и в патенте США № 5200084, выданном Liberti et al.
[0116] Как правило, инкубацию проводят в условиях, при которых антитела или партнеры по связыванию или молекулы, такие как вторичные антитела или другие реагенты, которые специфически связываются с такими антителами или партнерами по связыванию, которые связаны с магнитной частицей или гранулой, специфически связываются с молекулами клеточной поверхности, если они присутствуют на клетках образца.
[0117] В определенных аспектах образец помещают в магнитное поле и клетки со связанными с ними магнитовосприимчивыми или намагничиваемыми частицами притягиваются к магниту и отделяются от немеченых клеток. При положительном отборе сохраняют клетки, притянутые к магниту; при отрицательном отборе, сохраняют клетки, не притянутые к магниту (немеченые клетки). В определенных аспектах комбинацию положительного и отрицательного отбора проводят в течение одного и того же этапа отбора, когда положительные и отрицательные фракции сохраняют и дополнительно обрабатывают или подвергают дальнейшим этапам разделения.
[0118] В определенных вариантах осуществления магнитовосприимчивые частицы покрывают первичными антителами или другими партнерами по связыванию, вторичными антителами, лектинами, ферментами или стрептавидином. В определенных вариантах осуществления магнитные частицы связывают с клетками посредством покрытия первичными антителами, специфичными к одному или нескольким маркерам. В определенных вариантах осуществления первичным антителом или партнером по связыванию метят клетки, а не гранулы, а затем добавляют магнитные частицы, покрытые специфичными к типу клеток вторичными антителами или другими партнерами по связыванию (например, стрептавидином). В определенных вариантах осуществления используют покрытые стрептавидином магнитные частицы в сочетании с биотинилированными первичными или вторичными антителами.
[0119] В определенных вариантах осуществления магнитовосприимчивые частицы оставляют связанными с клетками, которые затем инкубируют, культивируют и/или подвергают инженерии; в определенных аспектах частицы оставляют связанными с клетками для введения пациенту. В определенных вариантах осуществления намагничиваемые или магнитовосприимчивые частицы из клеток удаляют. Способы удаления намагничиваемых частиц из клеток известны и включают, например, использование конкурирующих немеченых антител, намагничиваемых частиц или антител, конъюгированных с расщепляемыми линкерами и т.д. В определенных вариантах осуществления намагничиваем частицы являются биоразлагаемыми.
[0120] В определенных вариантах осуществления основанный на аффинности отбор проводят посредством активируемой магнитным полем сортировки клеток (MACS) (Miltenyi Biotech, Auburn, CA). Системы активируемой магнитным полем сортировки клеток (MACS) позволяют осуществлять отбор клеток со связанными с ними намагниченными частицами с высокой степенью очистки. В определенных вариантах осуществления MACS функционирует в режиме, где не являющиеся мишенями и являющиеся мишенями компоненты последовательно элюируют после приложения внешнего магнитного поля. Т.е., пока элюируют несвязанные компоненты клетки, связанные с намагниченными частицами, удерживаются на месте. Затем, после завершения первого этапа элюции, компоненты, которые удерживались в магнитном поле и у которых предотвращали элюцию, определенным образом высвобождаются так, что их можно элюировать восстанавливать. В определенных вариантах осуществления метят не являющиеся мишенями клетки и обедняют ими гетерогенную популяцию клеток.
[0121] В определенных вариантах осуществления в основанном на аффинности отборе используют Streptamer®, которые представляют собой магнитные гранулы, такие как наногранулы или микрогранулы, например, 1-2 мкМ, которые в определенных аспектах конъюгированы с иммуноаффинным реагентом партнера по связыванию, таким как антитело посредством мутантного стрептавидина, например, Strep-Tactin® или Strep-Tactin XT® (см. например, патент США № 6103493, публикации международных заявок PCT №№ WO 2013/011011, WO 2014/076277). В определенных вариантах осуществления мутантный стрептавидин функционализирован, нанесен и/или иммобилизован на гранулу.
[0122] В определенных вариантах осуществления мутантный стрептавидин проявляет более высокую аффинность связывания к пептидному лиганду, содержащему последовательность аминокислот, указанную в любой из SEQ ID NOS:1-6, например, такую как SEQ ID NO:5 и/или SEQ ID NO:6 (например, с меткой Strep-tag II®), чем немодифицированный стрептавидин или стрептавидин дикого типа, такой как немодифицированный стрептавидин или стрептавидин дикого типа, приведенный в SEQ ID NO: 11 или SEQ ID NO:14. В определенных вариантах осуществления мутантный стрептавидин проявляет аффинность связывания в виде константы аффинности для таких пептидов, которая больше чем аффинность связывания стрептавидина дикого типа к тому же пептиду более чем в 5 раз, в 10 раз, в 50 раз, в 100 раз, в 200 раз или более.
[0123] Мутеин стрептавидина по сравнению с немодифицированным стрептавидином, таким как стрептавидин дикого типа или его фрагмент, содержит одно или несколько отличий аминокислот. Термин "немодифицированный стрептавидин" относится к исходному полипептиду, в котором проводят одну или несколько модификаций. В определенных вариантах осуществления исходный или немодифицированный полипептид может представлять собой полипептид дикого типа, приведенный в SEQ ID NO:11. В определенных вариантах осуществления немодифицированный стрептавидин представляет собой фрагмент стрептавидина дикого типа, укороченный на N- и/или C-конце. Такие минимальные фрагмента стрептавидина включают любой фрагмент, который начинается на N-конце в области положений аминокислот 10-16 SEQ ID NO:11 и заканчивается на C-конце в области положений аминокислот 133-142 SEQ ID NO:11. В определенных вариантах осуществления немодифицированный стрептавидин содержит последовательность аминокислот, приведенную в SEQ ID NO:14. В определенных вариантах осуществления немодифицированный стрептавидин, такой как стрептавидин, приведенный в SEQ ID NO:14, дополнительно может содержать N-концевой метионин в положении, соответствующем Ala13 с нумерацией, как приведено в SEQ ID NO:11. Указания номеров остатков в стрептавидине, приводимые в настоящем документе, сделаны со ссылкой на нумерацию остатков в SEQ ID NO:11.
[0124] Термины "мутеин стрептавидина", "мутантный стрептавидин" или их вариации относятся к белку стрептавидину, который по сравнению с немодифицированным стрептавидином или стрептавидином дикого типа, таким как стрептавидин, приведенный в SEQ ID NO: 11 или SEQ ID NO:14, содержит одно или несколько отличий аминокислот. Одно или несколько отличий аминокислот могут представлять собой мутации аминокислот, такие как одна или несколько из замен, вставок или делеций аминокислот. В определенных вариантах осуществления мутеин стрептавидина по сравнению со стрептавидином дикого типа или немодифицированным стрептавидином может содержать по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 отличий аминокислот. В определенных вариантах осуществления замены аминокислот представляют собой консервативные или неконсервативные мутации. Мутеин стрептавидина, содержащий одно или несколько отличий аминокислот, проявляет аффинность связывания в виде константы аффинности, которая для пептидного лиганда (Trp Arg His Pro Gln Phe Gly Gly; также называемого меткой метка Strep-tag®, приведенного в SEQ ID NO:5) составляет более 2,7×104 M-1. В определенных вариантах осуществления мутантный стрептавидин проявляет аффинность связывания в виде константы аффинности, которая для пептидного лиганда (Trp Ser His Pro Gln Phe Glu Lys; также называемого меткой метка Strep-tag® II, приведенного в SEQ ID NO:6) составляет более 1,4×104 M-1. В определенных вариантах осуществления аффинность связывания можно определять известными в данной области способами, такими как любой из способов, описанных ниже.
[0125] В определенных вариантах осуществления мутеин стрептавидина содержит мутацию по одному или нескольким остаткам 44, 45, 46 и/или 47. В определенных вариантах осуществления мутантный стрептавидин содержит остатки Val44-Thr45-Ala46-Arg47, такие как приведены в иллюстративных мутеинах стрептавидина, приведенных в SEQ ID NO:12 или SEQ ID NO:15. В определенных вариантах осуществления мутеин стрептавидина содержит остатки Ile44-Gly45-Ala-46-Arg47, такие как приведены в иллюстративных мутеинах стрептавидина, приведенных в SEQ ID NO: 13 или 16. В определенных вариантах осуществления мутеин стрептавидина содержит последовательность аминокислот, приведенную в SEQ ID NO: 12, 13, 15 или 16 или последовательность аминокислот, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентична с последовательностью аминокислот, приведенной в SEQ ID NO:12, 13, 15 или 16, и демонстрирует аффинность связывания, которая составляет более 2,7×104 M-1 для пептидного лиганда (Trp Arg His Pro Gln Phe Gly Gly; также называемого меткой Strep-tag®, приведенного в SEQ ID NO:5) и/или более 1,4×104 M-1 для пептидного лиганда (Trp Ser His Pro Gln Phe Glu Lys; также называемого меткой Strep-tag® II, приведенного в SEQ ID NO:6).
[0126] В определенном варианте осуществления мутеин стрептавидина представляет собой мутант, как описано в публикациях международных заявок PCT №№ WO 2014/076277. В определенных вариантах осуществления мутеин стрептавидина содержит по меньшей мере два остатки цистеина в области положений аминокислот 44-53 относительно положений аминокислот, приведенных в SEQ ID NO:11. В определенных вариантах осуществления остатки цистеина находятся в положениях 45 и 52 с образованием дисульфидного мостика, соединяющего эти аминокислоты. В таком варианте осуществления аминокислота 44, как правило, представляет собой глицин или аланин, а аминокислота 46, как правило, представляет собой аланин или глицин, а аминокислота 47, как правило, представляет собой аргинин. В определенных вариантах осуществления мутеин стрептавидина содержит по меньшей мере одну мутацию или одно отличие аминокислоты в области остатков аминокислот 115-121 относительно положений аминокислот, приведенных в SEQ ID NO:11. В определенных вариантах осуществления мутеин стрептавидина содержит по меньшей мере одну мутацию в положении аминокислоты 117, 120 и 121 и/или делеции аминокислот 118 и 119 и замены по меньшей мере в положении аминокислоты 121.
[0127] В определенных вариантах осуществления мутеин стрептавидина может содержать любую из указанных выше мутаций в любой комбинация при условии, что полученный мутеин стрептавидина проявляет аффинность связывания, которая составляет более 2,7×104 M-1 для пептидного лиганда (Trp Arg His Pro Gln Phe Gly Gly; также называемого меткой Strep-tag®, приведенного в SEQ ID NO:5) и/или более чем 1,4×104 M-1 для пептидного лиганда (Trp Ser His Pro Gln Phe Glu Lys; также называемого меткой Strep-tag® II, приведенного в SEQ ID NO:6).
[0128] В определенных вариантах осуществления аффинность связывания мутантного стрептавидина к связывающему пептидный лиганд реагенту составляет более 5×104 M-1, 1×105 M-1, 5×105 M-1, 1×106 M-1, 5×106 M-1 или 1×107 M-1, но, как правило, составляет менее 1×1013 M-1, 1×1012 M-1 или 1×1011 M-1.
[0129] В определенных вариантах осуществления мутантный стрептавидин также демонстрирует связывание с другими лигандами стрептавидина, такими как, но не ограничиваясь ими, биотин, иминобиотин, липоевая кислота, детиобиотин, диаминобиотин, HABA (гидроксиазобензолбензойная кислота) или/и диметил-HABA. В определенных вариантах осуществления мутеины стрептавидина проявляет аффинность связывания к другому лиганду стрептавидина, такому как биотин или детиобиотин, которая больше чем аффинность связывания мутеина стрептавидина к пептидному лиганду (Trp Arg His Pro Gln Phe Gly Gly; также называемому меткой Strep-tag®, приведенному в SEQ ID NO:5) или пептидному лиганду (Trp Ser His Pro Gln Phe Glu Lys; также называемому меткой Strep-tag® II, приведенному в SEQ ID NO:6).
[0130] В определенных вариантах осуществления мутеин стрептавидина представляет собой мультимер. Мультимеры можно получать с использованием любых известных в данной области способов, таких как любой из способов, описанный в опубликованной патентной заявке США № US2004/0082012. В определенных вариантах осуществления олигомеры или полимеры мутеинов можно получать посредством введения карбоксильных остатков в полисахарид, например, декстран. В определенных аспектах затем, на втором этапе, мутеины стрептавидина посредством первичных аминогрупп внутренних остатков лизина и/или свободного N-конца связывают с карбоксильными группами в каркасе декстрана с использованием общепринятой карбодиимидной химии. В определенных вариантах осуществления реакцию связывания проводят в молярном отношении приблизительно 60 моль мутантного стрептавидин на моль декстрана. В определенных вариантах осуществления олигомеры или полимеры мутеинов также можно получать посредством сшивания посредством бифункциональных линкеров, таких как глутаровый альдегид, или другими известными в данной области способами.
[0131] В определенных аспектах иммуноаффинная гранула, такая как a Streptamer® или другая иммуноаффинная гранула, может содержать антитело, продуцируемое гибридомой или получаемое из гибридомы, как указано ниже: OKT3 (αCD3), 13B8.2 (αCD4), OKT8 (αCD8), FRT5 (αCD25), DREG56 (αCD62L), MEM56 (αCD45RA). В определенных вариантах осуществления любое из указанных выше антител может содержать одну или несколько мутаций в каркасе вариабельных областей тяжелых и легких цепей без затрагивания высоковариабельных областей CDR. В определенных аспектах примеры таких антител включают антитела к CD4, как описано в патенте США № 7482000 и Bes et al. (2003) J. Biol. Chem., 278:14265-14273. В определенных вариантах осуществления из таких антител известными в данной области способами, в определенных аспектах таких, как амплификация гипервариабельных последовательностей тяжелых и легких цепей и клонирование с получением комбинации с последовательностями, кодирующими соответствующий константный домен, можно получать антигенсвязывающий фрагмент, такой как фрагмент Fab. В определенных вариантах осуществления константный домен представляет собой подкласса IgG1/κ человека. Такие антитела на C-конце могут быть слитыми с пептидной связывающей стрептавидин молекулой такой, как приведена в SEQ ID NO:10. Примеры таких антител описаны в Stemberget et al. (2102) PLoS One, 7:35798 и в международной заявке PCT № WO2013/011011.
[0132] В определенных вариантах осуществления антитело, специфически связывающееся с поверхностным клеточным маркером, связанным с гранулой или другой поверхностью или нанесенным на них, представляет собой полноразмерное антитело или представляет собой его антигенсвязывающий фрагмент, включая фрагменты (Fab), фрагменты F(ab')2, фрагменты Fab', фрагменты Fv, области вариабельных областей тяжелых цепей (VH), способные к специфическому связыванию антигена, одноцепочечные фрагменты антител, включая одноцепочечные вариабельные фрагменты (scFv) и однодоменные фрагменты антител (например, sdAb, sdFv, нанотело). В определенных вариантах осуществления антитело представляет собой фрагмент Fab. В определенных вариантах осуществления антитело может быть одновалентным, двухвалентным или поливалентным. В определенных вариантах осуществления антитело, такое как Fab, представляет собой мультимер. В определенных вариантах осуществления антитело, такое как мультимер Fab, формирует с поверхностным клеточным маркером поливалентные комплекс.
[0133] В определенных вариантах осуществления антитело, такое Fab, ассоциированное со Streptamer, демонстрирует конкретную кинетическую меру аффинности связывания (например, константу диссоциации, KD, константу ассоциации KA, скорость обратной реакции или другой кинетический параметр аффинности связывания). Такие измерения можно проводить с использованием любого анализа связывания, известного специалисту в данной области. В конкретных примерах в качестве меры аффинности связывания используют технологию основанных на аффинности биосенсоров. Иллюстративные технологии биосенсоров включают, например, технологии Biacore, BioRad ProteOn, Reichert, GWC Technologies, IBIS SPIR Imaging, Nomadics SensiQ, Akubio RAPid, ForteBio Octet, IAsys, Nanofilm и другие (см. например, Rich et al. (2009) Analytical Biochemistry, 386:194-216). В определенных вариантах осуществления аффинность связывания определяют посредством титриметрического анализа флуоресценция или титриметрической калориметрии.
[0134] В определенных вариантах осуществления антитело, такое как Fab, демонстрирует скорость koff (также называемую константой скорости диссоциации) связывания с поверхностным клеточным маркером на клетке, которая составляет более чем приблизительно 0,5×10-4 сек-1, приблизительно 1×10-4 сек-1, приблизительно 2×10-4 сек-1, приблизительно 3×10-4 сек-1, приблизительно 4×10-4 сек-1, приблизительно 5×10-4 сек-1, приблизительно 1×10-3 сек-1, приблизительно 1,5×10-3 сек-1, приблизительно 2×10-3 сек-1, приблизительно 3×10-3 сек-1, приблизительно 4×10-3 сек-1, приблизительно 5×10-3 сек-1, приблизительно 1×10-2 сек-1, или приблизительно 5×10-1 сек-1 или более. Конкретная скорость koff может определять скорость, с которой реагент антитело может диссоциировать из его комплекса с клеткой, образованного посредством его связывания с поверхностным клеточным маркером (см. например, опубликованную международную заявку PCT № WO/2013011011). Например, в определенных аспектах диапазон koff можно выбирать в пределах диапазона, зависящего, например, от конкретного применения или использования выбранных или обогащенных клеток, включая такие факторы, как желание удалить связанное антитело с клеточной поверхности, длительность нахождения клеток в культуре или инкубации, чувствительность к клеточным и другим факторам. В одном из вариантов осуществления антитело обладает высокой скоростью koff, например, более 4,0×10-4 сек-1 так, что после разрушения поливалентных связанных комплексов большинство антитела можно удалить в пределах одного часа, поскольку, в определенных аспектах, учитывая время полужизни T1/2 комплекса, в пределах 56 минут концентрация комплексов снижается до 25% от исходной концентрация, полагая, что эффектами обратного связывания можно пренебречь ввиду достаточного разбавления). В другом варианте осуществления, антитела с меньшей скоростью koff, например, 1,0×10-4 сек-1, диссоциация с удалением 75% антитела с поверхности может проходить дольше, например, приблизительно 212 мин или приблизительно 3 с половиной часа.
[0135] В определенных вариантах осуществления антитело, такое как Fab, демонстрирует константу диссоциации (Ka) связывания с поверхностным клеточным маркером на клетка, которая может составлять диапазон приблизительно от 10-2 M до приблизительно 10-8 M, или приблизительно от 10-2 M до приблизительно 10-9 M, или приблизительно от 10-2 M до приблизительно 0,8×10-9M, или приблизительно от 10-2 M до приблизительно 0,6×10-9M, или приблизительно от 10-2 M до приблизительно 0,4×10-9 M, или приблизительно от 10-2 M до приблизительно 0,3×10-9 M, или приблизительно от 10-2 M до приблизительно 0,2×10-9, или приблизительно от 10-2 M до приблизительно 0,15×10-9M, или приблизительно от 10-2 до приблизительно 10-10. В определенных вариантах осуществления константа диссоциации (Ka) связывания с поверхностным клеточным маркером на клетке может находиться в диапазоне приблизительно от 10-7 M до приблизительно 10-10 M, или приблизительно от 10-7 M до приблизительно 0,8×10-9 M, или приблизительно от 10-7 M до приблизительно 0,6×10-9 M, приблизительно от 10-7 M до приблизительно 0,3×10-9 M, от 1,1×10-7 M до приблизительно 10-10 M, или приблизительно от 1,1×10-7 M до приблизительно 0,15×10-9M, или приблизительно от 1,1×10-7 M до приблизительно 0,3×10-9 M, или приблизительно от 1,1×10-7 M до приблизительно 0,6×10-9 M, или приблизительно от 1,1×10-7 M до приблизительно 0,8×10-9 M.
[0136] В определенных вариантах осуществления иммуноаффинный реагент, такой как антитело, например, Fab, прямо или опосредовано связан с пептидным лигандом, таким как пептидный лиганд, способный к связыванию с мутантным стрептавидином (см. например, патент США № 5506121). В определенных вариантах осуществления такой пептид содержит последовательность аминокислот, приведенную в любой из SEQ ID NOS:1-6. В определенных вариантах осуществления иммуноаффинный реагент, такой как антитело, например, Fab, прямо или опосредовано связан с пептидным лигандом, содержащим последовательность аминокислот, приведенную в SEQ ID NO:6.
[0137] В определенных вариантах осуществления иммуноаффинный реагент, такой как антитело, например, Fab, прямо или опосредовано слит с пептидной последовательностью, которая содержит в последовательном расположении по меньшей мере два связывающих стрептавидин модуля, где расстояние между двумя модулями составляет по меньшей мере 0 и не более 50 аминокислот, где один связывающий модуль содержит от 3 до 8 аминокислот и содержит по меньшей мере последовательность His-Pro-Xaa (SEQ ID NO:1), где Xaa представляет собой глутамин, аспарагин или метионин, и где другой связывающий модуль содержит последовательность того же или другого пептидного лиганда стрептавидина, такого как, приведен в SEQ ID NO:3 (см. например, опубликованная международная заявка PCT № WO02/077018; патент США № 7981632). В определенных вариантах осуществления пептидный лиганд, прямо или опосредовано слитый с иммуноаффинным реагентом, таким как антитело, например, Fab, содержит последовательность с формулой, приведенной в любой из SEQ ID NO:7 или 8. В определенных вариантах осуществления пептидный лиганд содержит последовательность аминокислот, приведенную в любой из SEQ ID NO:9, 10 или 17-19.
[0138] Альтернативно можно использовать другие связывающие стрептавидин пептиды, известные в данной области, например, как описано в Wilson et al. (Proc. Natl. Acad. Sci. USA 98 (2001), 3750-3755). В определенных вариантах осуществления пептид слит с N- и/или C-концом белка.
[0139] В определенных вариантах осуществления антитело, такое как Fab, слитое с пептидным лигандом, способное к связыванию с мутантным стрептавидином, приводят в контакт с содержащими мутантный стрептавидин гранулами с покрытием гранул антителом. В определенных вариантах осуществления покрытие гранулы можно использовать в способах обогащения и отбора, как описано в настоящем документе, посредством приведения таких гранул в контакт с образцом, содержащим клетки для обогащения или выбора.
[0140] В определенных вариантах осуществления связь между партнером по связыванию пептидным лигандом и связывающим реагентом мутеином стрептавидина является обратимой. В определенных вариантах осуществления связь между партнером по связыванию пептидным лигандом и связывающим реагентом мутеином стрептавидина является сильной так, как описано выше, но менее сильной, чем аффинность связывания связывающего реагента стрептавидина с биотином или аналогом биотина. Таким образом, в определенных вариантах осуществления для разрушения связывающих взаимодействий между связывающим реагентом мутеином стрептавидина на грануле и партнером по связыванию пептидным лигандом, ассоциированным с антителом, специфически связывающимся с клеточным маркером на поверхности клетки, можно добавлять биотин (витамин H) или аналог биотина для конкуренции за связывание. В определенных вариантах осуществления взаимодействием можно обращать в присутствии низких концентраций биотина или его аналога, например, в присутствии от 0,1 мМ до 10 мМ, от 0,5 мМ до 5 мМ или от 1 мМ до 3 мМ, например, как правило, по меньшей мере или по меньшей мере приблизительно 1 мМ или по меньшей мере 2 мМ, например, при или приблизительно при 2,5 мМ. В определенных вариантах осуществления при инкубации в присутствии конкурирующего средства, такого как биотин или аналог биотина, высвобождает гранула из комплекса с выбранной клеткой.
b. Иммуноаффинная хроматография
[0141] В определенных вариантах осуществления для основанного на аффинности отбора используют иммуноаффинную хроматографию. В определенных аспектах способы иммуноаффинной хроматографии включают один или несколько хроматографических матриксов, как описано в опубликованной патентной заявке США № US2015/0024411. В определенных вариантах осуществления хроматографический способ представляет собой хроматографию с подвижной фазой, как правило, жидкостную хроматографию. В определенных вариантах осуществления хроматографию можно проводить проточным способом, при котором жидкий образец, содержащий клетки для выделения вносят, например, самотеком или насосом в один конец колонки, содержащей хроматографический матрикс, и в котором жидкий образец выходит из колонки на другом конце колонки. Кроме того, в определенных аспектах хроматография можно проводить в режиме "вверх и вниз", при котором жидкий образец, содержащий клетки для выделения вносят, например, посредством пипетки в один конец колонки, содержащей хроматографический матрикс, упакованный в наконечнике пипетки, и при котором жидкий образец входит и покидает хроматографический матрикс/наконечник пипетки на другом конце колонки. В определенных вариантах осуществления хроматографию также можно проводить в периодическом режиме, в котором хроматографический материал (неподвижную фазу) инкубируют с образцом, содержащим клетки, например, при перемешивании, вращении или при повторном контакте и удалении жидкого образца, например, посредством пипетки.
[0142] В определенных вариантах осуществления хроматографический матрикс представляет собой неподвижную фазу. В определенных вариантах осуществления хроматография представляет собой колоночную хроматографию. В определенных вариантах осуществления можно использовать любой подходящий хроматографический материал. В определенных вариантах осуществления хроматографический матрикс имеет форму твердой или полутвердой фазы. В определенных вариантах осуществления хроматографический матрикс может содержать полимерную смолу, или оксид металла, или оксид полуметалла. В определенных вариантах осуществления хроматографический матрикс представляет собой немагнитный материал или ненамагничиваемый материал. В определенных вариантах осуществления хроматографический матрикс представляет собой дериватизированный диоксид кремния или поперечно сшитый гель, например, в форме природного полимера, например, полисахарида. В определенных вариантах осуществления хроматографический матрикс представляет собой агарозный гель. Агарозные гели для применения в хроматографическом матриксе известны в данной области и в определенных аспектах включают агарозу Superflow™ или материал Sepharose, например, Superflow™ Sepharose®, которые коммерчески доступны с различным размером гранул и пор. В определенных вариантах осуществления хроматографический матрикс представляет собой конкретный поперечно сшитый агарозный матрикс, с которым ковалентно связан декстран, например, любой известный в данной области, например, в определенных аспектах Sephadex®, Superdex® или Sephacryl®, которые доступны с различным размером гранул и пор.
[0143] В определенных вариантах осуществления хроматографический матрикс состоит из синтетического полимера, такого как полиакриламид, стиролдивинилбензольный гель, сополимер акрилата и диола или акриламида и диола, сополимер полисахарида и агарозы, например, состава из полиакриламида/агарозы, полисахарида и N, N'-метиленбисакриламида или дериватизированного диоксида кремния, связанного с синтетическим или природным полимером.
[0144] В определенных вариантах осуществления размер хроматографического матрикса, такого как гранулы агарозы или другого матрикса, составляет по меньшей мере или приблизительно по меньшей мере 50 мкм, 60 мкм, 70 мкм, 80 мкм, 90 мкм, 100 мкм, 120 мкм или 150 мкм или более. Эксклюзионный предел матрикса для эксклюзионной хроматографии выбран так, чтобы он составлял меньше максимальной ширины клетки-мишени в образце, например, T-клетки. В определенных вариантах осуществления объем матрикса составляет по меньшей мере 0,5 мл, 1 мл, 1,5 мл, 2 мл, 3 мл, 4 мл, 5 мл, 6 мл, 7 мл, 8 мл, 9 мл, 10 мл или более. В определенных вариантах осуществления хроматографический матрикс упакован в колонку.
[0145] В определенных вариантах осуществления хроматографический матрикс, который представляет собой матрикс для иммуноаффинной хроматографии, включает иммобилизованный на нем аффинный реагент, такой как антитело или его антигенсвязывающий фрагмент, такой как Fab. Антитела или их антигенсвязывающие фрагменты, такие как a Fab, могут быть любыми, как описано выше, в определенных аспектах включая известные в данной области антитела, антитела с конкретной скоростью koff и/или антитела с конкретной константой диссоциации (Ka).
[0146] В определенных вариантах осуществления аффинный реагент, такой как антитело или его антигенсвязывающий фрагмент, такой как Fab, является иммобилизованным. В определенных вариантах осуществления иммуноаффинный реагент, такой как антитело или его антигенсвязывающий фрагмент, такой как Fab, слит или связан с партнером по связыванию, который взаимодействует со связывающим реагентом, иммобилизованным на матриксе. В определенных вариантах осуществления связывающая способность хроматографического матрикса достаточна для адсорбции или способна к адсорбции по меньшей мере 1×107 клеток/мл, 5×107 клеток/мл, 1×108 клеток/мл, 5×108 клеток/мл, 1×109 клеток/мл или более, где указанные клетки представляют собой клетки, экспрессирующие поверхностный клеточный маркер, специфически распознаваемый аффинным реагентом, таким как антитело или его Fab.
[0147] В определенных вариантах осуществления взаимодействие между связывающим реагентом и партнером по связыванию формирует обратимую связь так, что связывание антитела с матриксом является обратимым. В определенных вариантах осуществления обратимое связывание может опосредовать партнер мутантного стрептавидина по связыванию и иммобилизованный на матриксе связывающий реагент, который представляет собой стрептавидин, аналог стрептавидина или его мутеин, авидин или аналог авидина или его мутеин.
[0148] В определенных вариантах осуществления обратимое связывание аффинного реагента, такого как антитело или его антигенсвязывающий фрагмент, такой как Fab, происходит посредством взаимодействия связывающего реагента пептидного лиганда и мутеина стрептавидина, как описано выше в отношении иммуноаффинных гранул. В определенных аспектах хроматографического матрикса матрикс, такой как агарозные гранулы или другой матрикс, фунционализирован или конъюгирован мутеином стрептавидина, таким как любой из описанных выше, например, любой, приведенный в SEQ ID NO: 12, 13, 15 или 16. В определенных вариантах осуществления антитело или его антигенсвязывающий фрагмент, такой как Fab, прямо или опосредовано слито или связано с пептидным лигандом, способным к связыванию с мутантным стрептавидином, таким как любой из описанных выше. В определенных вариантах осуществления пептидный лиганд представляет собой любой пептидный лиганд, как описано выше, такой как пептид, содержащий последовательность аминокислот, приведенную в любой из SEQ ID NO:1-10 или 17-19. В определенных вариантах осуществления колонку для хроматографического матрикса приводят в контакт с таким аффинным реагентом, например, антителом или его антигенсвязывающим фрагментом, таким как Fab, с иммобилизацией или обратимым связыванием аффинного реагента с колонкой.
[0149] В определенных вариантах осуществления иммуноаффинный хроматографический матрикс можно использовать в способах обогащения и отбора, как описано в настоящем документе, посредством приведения указанного матрикса в контакт с образцом, содержащим клетки, подлежащие обогащению или выбору. В определенных вариантах осуществления выбранные клетки элюируют или высвобождают из матрикса посредством разрушения взаимодействия партнера по связыванию/связывающего реагента. В определенных вариантах осуществления партнер по связыванию/связывающие реагенты опосредованы взаимодействием пептидного лиганда и мутантного стрептавидина, и высвобожденные или выбранные клетки можно получать вследствие наличия обратимой связи. Например, в определенных вариантах осуществления связь между партнером по связыванию пептидным лигандом и связывающим реагентом мутеином стрептавидина является сильной, такой, как описано выше, но менее сильной, чем аффинность связывания связывающего реагента стрептавидина к биотину или аналогу биотина. Таким образом, в определенных вариантах осуществления для разрушения связывающих взаимодействий между связывающим реагентом мутеином стрептавидина на матриксе и партнером по связыванию пептидным лигандом, ассоциированным с антителом, специфически связанным с клеточным маркером на поверхности клетки, можно добавлять биотин (витамин H) или аналог биотина для конкуренции за связывание. В определенных вариантах осуществления взаимодействие можно обращать в присутствии низких концентраций биотина или его аналога, например, в присутствии от 0,1 мМ до 10 мМ, от 0,5 мМ до 5 мМ или от 1 мМ до 3 мМ, например, как правило, по меньшей мере или приблизительно по меньшей мере 1 мМ или по меньшей мере 2 мМ, например, в количестве, которое составляет или приблизительно составляет 2,5 мМ. В определенных вариантах осуществления элюция в присутствии конкурирующего средства, такого как биотин или аналог биотина, высвобождает выбранные клетки из матрикса.
[0150] В определенных вариантах осуществления иммуноаффинную хроматография в предоставляемых способах проводят с использованием по меньшей мере двух колонок для хроматографического матрикса, которые являются функционально связанными, в соответствии с чем аффинное или связывающее средство для одного из CD4 или CD8, такое как антитело, например, Fab, связано с первым хроматографическим матриксом в первой селективной колонке, а аффинное или связывающее средство для другого из CD4 или CD8, такое как антитело, например, Fab, связано со вторым хроматографическим матриксе во второй селективной колонке. В определенных вариантах осуществления в замкнутых системе или устройстве, таких как замкнутые система или устройство, которые являются стерильными, находятся по меньшей мере две колонки для хроматографического матрикса.
[0151] Также в определенных вариантах осуществления в настоящем документе предоставлены замкнутые система или устройство, содержащее по меньшей мере две колонки для хроматографического матрикса, которые являются функционально связанными, в соответствии с чем аффинное или связывающее средство для одного из CD4 или CD8, такое как антитело, например, Fab, связано с первым хроматографическим матриксом в первой селективной колонке, а аффинной или связывающее средство для другого из CD4 или CD8, такое как антитело, например, Fab, связано со вторым хроматографическим матриксом во второй селективной колонке. Примеры таких системы и способов приведены на фигуре 1A, фигуре 1B и в примерах.
[0152] В определенных вариантах осуществления замкнутая система является автоматизированной. В определенных вариантах осуществления компоненты, ассоциированные с системой, могут включать интегрированный микрокомпьютер, перистальтический насос и различные клапаны, такие как запорные клапаны или запорные краны, для контроля потока жидкости между различными частями системы. В определенных аспектах интегрированный компьютер контролирует все компоненты устройства и управляет системой с проведением повторных процедур в стандартизированной последовательности. В определенных вариантах осуществления скорость потока на всем протяжении системы трубок контролирует перистальтический насос, и вместе с запорными клапанами он обеспечивает контролируемый поток буфера через систему.
[0153] Со ссылкой на фигуру 1A и фигуру 1B в определенных вариантах осуществления первый аффинный матрикс 3, содержащий первое аффинное или связывающее средство в первой селективной колонке 1 является i) функционально связанным со вторым аффинным матриксом 4, содержащим второе аффинное или связывающее средство во второй селективной колонке 2 посредством трубок и клапана 13 так, что клетки, прошедшие через первый аффинный хроматографический матрикс и не связавшиеся с первым аффинным или связывающим средством в ней, могут поступать во второй аффинный матрикс и ii) является функционально связанным с выходным контейнером, таким как емкость для культивирования 12, для сбора из первого аффинного матрикса выбранных клеток, которые связаны с первым аффинным или связывающим средством в нем, например, после элюции и высвобождения таких клеток из первого аффинного матрикса. В определенных вариантах осуществления второй аффинный матрикс 4, содержащий второе аффинное или связывающее средство во второй селективной колонке 2, также функционально связано с выходным контейнером, таким как емкость для культивирования 12, для сбора из второго аффинного матрикса выбранных клеток, которые связаны со вторым аффинным или связывающим средством в нем, например, после элюции и высвобождения таких клеток из второго аффинного матрикса. В определенных вариантах осуществления вторая селективная колонка 2 функционально связана с выходным контейнером, таким как емкость для культивирования 12, через камеру для удаления 9, которая содержит связывающий реагент, такой как мутантный стрептавидин, который с высокой аффинностью, такой как более 10-10 M-1, способен к связыванию с элюирующим реагентом, таким как биотин.
[0154] В определенных вариантах осуществления размер, например, длина и/или диаметр, первой селективной колонки 1 и второй селективной колонки 2 может быть одинаковым или различным. В определенных вариантах осуществления размер, например, длина и/или диаметр, одной из первых колонок 1 или второй колонки 2 больше, чем размер другой из колонок по меньшей мере в 1,2 раза, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или более.
[0155] В определенных вариантах осуществления первый аффинный матрикс 3, содержащий первое аффинное или связывающее средство в первой селективной колонке 1, также функционально связан с третьим аффинным матриксом 17, содержащим третье аффинное или связывающее средство в третьей селективной колонке 15 посредством трубок и клапана 13 так, что выбранные клетки из первого аффинного матрикса, которые связаны с первым аффинным или связывающим средством в нем, могут поступать в третий аффинный матрикс, например, после элюции и высвобождения таких клеток из первого аффинного матрикса. В определенных вариантах осуществления первая селективная колонка 1 функционально связана с третьей селективной колонкой 15 посредством камеры для удаления 9, которая содержит связывающий реагент, такой как мутантный стрептавидин, который с высокой аффинностью, такой как более 10-10 M-1, способен к связыванию с элюирующим реагентом, таким как биотин. В определенных вариантах осуществления третий аффинный матрикс 17, содержащий третье аффинное или связывающее средство в третьей селективной колонке 15, также функционально связан с выходным контейнером, таким как емкость для культивирования 12, для сбора выбранных клеток из третьего аффинного матрикса со связанным третьим аффинным или связывающим средством в нем (а ранее связанным с первым аффинным или связывающим средством), например, после элюции и высвобождения таких клеток из третьего аффинного матрикса (а ранее из первого аффинного матрикса). В определенных вариантах осуществления третья селективная колонка 15 функционально связана с выходным контейнером, таким как емкость для культивирования 12, посредством камеры для удаления 9, которая содержит связывающий реагент, такой как мутантный стрептавидин, который с высокой аффинностью, такой как более 10-10 M-1, способен к связыванию с элюирующим реагентом, таким как биотин.
[0156] В определенных вариантах осуществления размер, например, длина и/или диаметр, первой селективной колонки 1 и третьей селективной колонки 15 может быть одинаковым или различным. В определенных вариантах осуществления размер, например, длина и/или диаметр, одной из первых колонок 1 или третьей колонки 15 больше, чем размер другой из колонок по меньшей мере в 1,2 раза, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз или более.
[0157] В определенных вариантах осуществления первая селективная колонка 1 функционально связана, например, посредством трубок, клапанов и насоса 8, с резервуаром для хранения, содержащим образец клеток 5 для обеспечения поступления образца клеток в первую селективную колонку.
[0158] В определенных вариантах осуществления первая селективная колонка 1 также функционально связана с резервуаром для отмывочного буфера 6, содержащим отмывочный буфер и/или с резервуаром для элюирующего буфера 7, содержащим элюент, например, посредством трубок и клапанов, для обеспечения поступления отмывочного буфера или элюирующего буфера, соответственно, в первый хроматографический матрикс в первой селективной колонке. В определенных вариантах осуществления вследствие наличия функционального соединения между первой и второй селективными колонками, отмывочный буфер и/или элюирующий буфер могут эффективно поступать во вторую колонку. В определенных вариантах осуществления вследствие наличия функционального соединения между первой и третьей селективными колонками, отмывочными буфер и/или элюирующий буфер могут эффективно поступать в третью селективную колонку.
[0159] В определенных вариантах осуществления вторая селективная колонка 2 также функционально связана с резервуаром для отмывочного буфера 6, содержащим отмывочный буфер и/или резервуар для элюирующего буфера 7, содержащим элюент, например, посредством трубок и клапанов, для обеспечения поступления отмывочного буфера или элюирующего буфера, соответственно, в первый хроматографический матрикс в первой селективной колонке.
[0160] Отмывочный буфер может представлять собой любой физиологический буфер, который совместим с клетками, например, фосфатно-солевой буфер. В определенных вариантах осуществления отмывочный буфер, содержит бычий сывороточный альбумин, сывороточный альбумин человека или рекомбинантный сывороточный альбумин человека, например, в концентрации от 0,1% до 5% или от 0,2% до 1%, например, в концентрации равное или приблизительно равной 0,5%. В определенных вариантах осуществления элюент представляет собой биотин или аналог биотина, например, десбиотин, например, в количестве, которое составляет или приблизительно составляет по меньшей мере 0,5 мМ, 1 мМ, 1,5 мМ, 2 мМ, 2,5 мМ, 3 мМ, 4 мМ или 5 мМ.
[0161] В определенных вариантах осуществления первый аффинный матрикс 3 в первой селективной колонке 1 посредством трубок и клапанов функционально связан с резервуаром для первого аффинного реагента (например, резервуаром для Fab) 18, содержащим первое аффинное или связывающее средство, такое как антитело, например, Fab, например, для иммобилизации на первом аффинном матриксе. В определенных вариантах осуществления второй аффинный матрикс 4 во второй колонке 2 посредством трубок и клапанов функционально связан с резервуаром для второго аффинного или связывающего средства (например, резервуаром Fab) 19, содержащим второе аффинное или связывающее средство, такое как антитело, например, Fab, например, для иммобилизации на втором аффинном матриксе. В определенных вариантах осуществления третий аффинный матрикс 17 в третьей селективной колонке 15, посредством трубок и клапанов функционально связан с резервуаром для третьего аффинного или связывающего средства (например, резервуаром Fab) 20, содержащим третье аффинное или связывающее средство, такое как антитело, например, Fab, например для иммобилизации на втором аффинном матриксе.
[0162] В определенных вариантах осуществления первый и/или второй аффинный реагент специфически связывается с CD4 или CD8, где первый и второй аффинный реагенты не являются одинаковыми. В определенных вариантах осуществления третий аффинный реагент специфически связывается с маркером на наивных T-клетках, покоящихся T-клетках или центральных T-клетках памяти или специфически связывается с маркером который представляет собой CD45RO, CD62L, CCR7, CD28, CD3, CD27 и/или CD127.
5. Обогащение и соотношения получаемых композиций
[0163] В определенных вариантах осуществления проведение первого и второго отбора способами, как описано выше, приводит к обогащению из образца первой популяции клеток, экспрессирующей первый поверхностный клеточный маркер и второй популяции клеток, экспрессирующей второй поверхностный клеточный маркер, соответственно. В конкретных примерах, первая и/или вторая популяция обогащенных клеток может представлять собой популяцию клеток, обогащенных CD4+-клетками, а другая из популяций обогащенных клеток, т.е. другая из первой или второй популяции клеток, может представлять собой популяцию, обогащенную CD8+-клетками. Как описано выше, в определенном варианте осуществления можно проводить третий, четвертый или последующий отборы с обогащением дополнительных субпопуляций клеток из популяций клеток, ранее обогащенных в первом, втором или последующих обогащениях, таких как субпопуляция CD4+-клеток и/или субпопуляция CD8+-клеток.
[0164] В определенных вариантах осуществления способ позволяет получать композицию обогащенных клеток, содержащую первую и вторую популяцию обогащенных клеток, такую как популяция клеток, обогащенных CD4+-клетками и популяцию клеток, обогащенных CD8+-клетками. В определенных вариантах осуществления композиция обогащенных клеток обозначают как инициирующую культуру композицию и используют в последующих этапах обработки, таких как последующие этапы обработки, включающие инкубацию, стимуляцию, активацию, инженерию и/или формулирование обогащенных клеток. В определенных вариантах осуществления последующие после дополнительных этапов обработки, таких как этапы обработки, включающие инкубацию, стимуляцию, активацию, инженерию и/или формулирование, получают результирующую композицию, которая в определенных аспектах может содержать подвергнутые генетической инженерии клетки, содержащие CD4+-клетки и CD8+-клетки, экспрессирующие генетически сконструированный антигенный рецептор.
[0165] В определенных вариантах осуществления обогащенные композиции клеток представляют собой обогащенные из исходного образца клетки, как описано выше, в которых количество клеток в исходном образце является по меньшей мере большим, чем желаемое количество клеток в обогащенной композиции, такой как инициирующая культуру композиция. В определенных вариантах осуществления количество клеток в исходном образце больше чем желаемое количество клеток в обогащенной композиции по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 500%, 1000%, 5000% или более. В определенных примерах, желаемое количество клеток в обогащенной популяция, включая обогащенные CD4+-клетки, CD8+-клетки или их субпопуляции, составляет по меньшей мере 1×106 клеток, 2×106 клеток, 4×106 клеток, 6×106 клеток 8×106 клеток, 1×107 клеток, 2×107 клеток, 4×107 клеток, 6×107 клеток, 8×107 клетка, 1×108 клеток, 2×108 клеток, 4 ×108 клеток, 6×108 клеток, 8×108 клеток, 1×109 клеток или более. В определенных вариантах осуществления количество клеток в исходном образце составляет по меньшей мере 1×108 клеток, 5×108 клеток, 1×109 клеток, 2×109 клеток, 3×109 клеток, 4×109 клеток, 5×109 клеток, 6×109 клеток, 7×109 клеток, 8×109 клеток, 9×109 клеток, 1×1010 клеток или более.
[0166] В определенных вариантах осуществления выход первой и/или второй популяции или их субпопуляции в обогащенной композиции, т.е. количество обогащенных клеток в популяции или субпопуляции по сравнению с количеством той же популяции или субпопуляция клеток в исходном образце, составляет от 10% до 100%, например, от 20% до 80%, от 20% до 60%, от 20% до 40%, от 40% до 80%, от 40% до 60% или от 60% до 80%. В определенных вариантах осуществления выход первой и/или второй популяции клеток или их субпопуляции составляет менее 70%, менее 60%, менее 50%, менее 40%, менее 30% или менее 20%.
[0167] В определенных вариантах осуществления чистота первой и/или второй популяции клеток или их субпопуляции клеток в обогащенной композиции, т.е. процентное содержание клеток, положительных по выбранному поверхностному клеточному маркеру по сравнению со всеми клетками в популяции обогащенных клеток, составляет по меньшей мере 90%, 91%, 92%, 93%, 94%, а как правило составляет по меньшей мере 95%, 96%, 97%, 98%, 99% или более.
[0168] В определенных вариантах осуществления композиция обогащенных клеток, такая как инициирующая культуру композиция, содержит соотношение CD4+-клеток и CD8+-клеток в инициирующем культуру соотношении. Инициирующее культуру соотношение представляет собой соотношение или количество клеток с которым два типа клеток или две популяции выделенных клеток включают в инициирующую культуру композицию, предназначенную для получения желаемого результирующего соотношения или дозы, например, соотношения или дозы для введения пациенту, или в пределах их допустимой величины погрешности или различия, после завершении этапов инкубации и/или инженерии или других этапов обработки, и/или после оттаивания, и/или непосредственно перед введением индивидууму. В вариантах осуществления способов, предоставляемых в настоящем документе, первый и/или второй отборы или отборы их субпопуляций, можно проводить таким способом, чтобы получать выбранное инициирующее культуру соотношение. Примеры таких способов описаны ниже и в примерах.
a. Инициирующие культуру соотношения и количества
[0169] В определенных вариантах осуществления инициирующее культуру соотношение CD4+-клетки или их субпопуляций и CD8+-клеток или их субпопуляций составляет от или приблизительно от 10:1 до или приблизительно до 1:10, от или приблизительно от 5:1 до или приблизительно до 1:5, или от или приблизительно 2:1 до или приблизительно до 1:2. В определенных вариантах осуществления инициирующее культуру соотношение CD4+-клеток или их субпопуляций и CD8+-клеток или их субпопуляций составляет или приблизительно составляет 1:1.
[0170] В определенных вариантах осуществления инициирующее культуру соотношение CD4+- и CD8+-клеток или их субпопуляций, отличается от соотношения CD4+- и CD8+-клеток или их субпопуляций в образце, полученном у индивидуума. В определенных вариантах осуществления описано, что соотношение CD4+- и CD8+-T-клеток в образцах, полученных у индивидуумов, таких как образцы крови, составляет от 1:1 до 14:1 CD4+:CD8+-клеток, и, как правило, приблизительно составляет от 1,5:1 до приблизительно 2,5:1 CD4+:CD8+-клеток. В определенных вариантах осуществления соотношение CD4+- и CD8+-T-клеток в образце, таком как образец крови, приблизительно составляет 2:1 CD4+:CD8+-клеток. В определенных вариантах осуществления соотношение CD4+- и CD8+-T-клеток в образце, таком как образец крови, приблизительно составляет 1:1. (См. например, Amadori, A et al., Nature Med. 1: 1279-1283, 1995; Chakravarti, A., Nature Med. 1: 1240-1241, 1995; Clementi, M., et al., Hum. Genet. 105: 337-342, 1999.) В определенных вариантах осуществления указанное соотношение составляет менее 1:1 CD4+:CD8+-клеток. (См. например, Muhonen, T. J Immunother Emphasis Tumor Immunol. 1994 Jan;15(1):67-73.). В определенных вариантах осуществления инициирующее культуру соотношение CD4+- и CD8+-клеток по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 125%, по меньшей мере на 150, по меньшей мере на 200%, по меньшей мере на 300%, по меньшей мере на 400% или по меньшей мере на 500% больше или меньше, чем соотношение CD4+- и CD8+-клеток в образце, полученном у индивидуума.
[0171] В определенных вариантах осуществления перед проведением первого и/или второго отборов определяют соотношение CD4+- и CD8+-T-клеток в образце, полученном у индивидуума. На основе конкретного соотношения CD4+- и CD8+-T-клеток у индивидуума, которое может варьировать у индивидуумов, для каждого индивидуума можно индивидуализировать конкретный способ отбора, например, посредством установления размеров хроматографических колонок или выбора количества или концентрации иммуноаффинных реагентов, с достижением желаемого или выбранного инициирующего культуру соотношения. Относительный уровень или частоту различных популяции клеток у индивидуума можно определять на основе оценки экспрессии поверхностных маркеров или маркеров, присутствующих в таких популяциях или субпопуляциях. Для оценки уровня экспрессии поверхностных маркеров или белков можно использовать множество хорошо известных способов, таких как детекция посредством основанных на аффинности способов, например, основанных на иммуноаффинности способов, например, в случае поверхностных клеточных белков, например, посредством проточной цитометрии.
[0172] В определенных случаях подходящее инициирующее культуру соотношение конкретных типов клеток может варьировать в зависимости от случая, например, от конкретного заболевания, патологического состояния или перед лечением индивидуума, у которого получены клетки, и/или от конкретной антигенной специфичности клеток, относительной представленности различных субпопуляций в числе клеток конкретного типа (например, CD8+-T-клеток), например, эффекторов по сравнению с клетками памяти и по сравнению и наивными клетками, и/или от одного или нескольких условий, в которых клетки инкубируют, таких как среда, стимулирующие средства, время культивирования, буферы, содержание кислорода, содержание диоксида углерода, антигенов, цитокинов, антител и других компонентов. Таким образом, может происходить так, что определенный тип клеток, для которого известно, что он, как правило или в основном, пролиферирует или растет быстрее, чем другие, не всегда обладает таким свойством в каждом окружении. Таким образом, в определенных аспектах инициирующее культуру соотношение определяют на основе известных способностей типов клеток в нормальном или типичном окружении в сочетании с оценкой фенотипов или состояний клеток или индивидуума, у которого получают клетки, и/или эмпирических данных.
[0173] В определенных вариантах осуществления инициирующие культуру соотношения основаны на знании одного или нескольких из этих свойств конкретного типа клеток, известных или определенных, как существующие в определенной концентрации. В определенных вариантах осуществления соотношение CD4+- и CD8+-клеток в инициирующей культуру композиции более или менее чем 1,5 раза, 2, раза, 3 раза, 4 раза, 5 раза, 6 раза, 7 раза, 8 раза, 9 раза, 10 раза, 20 раза, 30 раза, 40 раза, 50 раза, 60 раза, 70 раза, 80 раза, 90 раза больше или меньше, соответственно, чем желаемое результирующее соотношение CD4+- и CD8+-клеток.
[0174] В определенных вариантах осуществления известно, что, например, CD4+-клетки в определенных случаях пролиферируют или растут в меньшей степени или менее быстро, чем CD8+-клетки, когда их инкубируют в определенных стимулирующих условиях. См., например, Foulds et al. (2002) J. Immunol. 168(4): 1528-1532; Caggiari et al. (2001) Cytometry. 46(4) 233-237; Hoffman, et al. (2002) Transplantation. 74(6): 836-845 и Rabenstein et al. (2014) J. Immunol. опубликовано онлайн перед печатью 17 марта 2014 года, doi: 10,4049/jimmunol.1302725. Таким образом, в определенных примерах, соотношение CD4+- и CD8+-клеток в инициирующей культуру композиции в 10 раз или в 100 раз больше желаемого результирующего соотношения. Например, если необходимо результирующее соотношение CD4-/CD8-клеток 1:1 (или 50%/50%), популяции CD4+- и CD8+-клеток, в одном из примеров, для учета различий скоростей роста в течение конкретного периода времени можно включать в инициирующую культуру композицию в соотношении, например, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 20:1, 30:1, 40:1, 50:1, 60:1, 70:1, 80:1, 90:1 или 100:1. В зависимости от отличий скоростей или роста или пролиферации одного из типов CD4+- или CD8+-клеток или их субпопуляций от другого специалист в данной области может эмпирически определять инициирующее культуру соотношение с достижением желаемого результирующего соотношения с использованием конкретных условий стимуляции или активации.
[0175] Инициирующее культуру соотношение не обязательно должно быть идентичным или даже приблизительно равным желаемому результирующему соотношению. Например, если необходимо вводить подвергнутые инженерии CD4+- и CD8+-T-клетки (например, экспрессирующие CAR) при 1:1 с определенной погрешностью или в пределах определенной погрешности, инициирующее культуру соотношение CD4+- и CD8+-клеток часто не является 1:1. В определенных вариантах осуществления инициирующее культуру соотношение, которое приводит к желаемому результирующему соотношению, варьирует, например, в зависимости от источника клеток, типов клеток, подлежащих культивированию, пациента, которому необходимо вводить клетки, индивидуума или индивидуумов, у которых выделены или получены клетки, например, какие заболевания или патологические состояния присутствуют у такого индивидуума, подлежащего лечению заболевания, условий культивирования и других параметров.
[0176] В определенных вариантах осуществления инициирующее культуру соотношение основано на составе каждой субпопуляции клеток. В определенных вариантах осуществления инициирующее культуру соотношение основано на продолжительности культивирования популяций клеток до их генетической инженерии. В определенных вариантах осуществления инициирующее культуру соотношение основано на скорости пролиферации каждой из популяций клеток.
[0177] В качестве другого аспекта в определенных вариантах осуществления способы дополнительно включают определение инициирующего культуру соотношения или количества. В определенных вариантах осуществления предоставляемые способы включают способы и этапы определения соответствующих соотношений, доз и количеств клеток, типов клеток и популяций клеток. Например, предоставлены способы определения соотношения CD4+/CD8+-клеток, -популяций и/или -субпопуляций и определения соответствующих доз таких клеток и их подтипов. В определенных вариантах осуществления предоставлены способы определения соответствующих соотношений или количеств типов клеток или популяций клеток для включения в композицию, такую как инициирующая культуру композиция, для достижения желаемого результата. В определенных аспектах такие соотношения или количества предназначены для применения на этапе инкубации или инженерии для достижения желаемого результирующего соотношения или дозы. В определенных вариантах осуществления предоставлены способы определения желаемого соотношения клеток, их типов или популяций и/или количеств этих клеток для введения индивидууму или пациенту.
[0178] В определенных вариантах осуществления выбранное инициирующее культуру соотношение основано на относительной способности различных типов клеток или популяций к выживанию и/или пролиферации или скорости роста каждых из популяций клеток или типов клетки (таких как CD4+-клетки по сравнению с CD8+-клетками) в культуре при инкубации в таких условиях. Таким образом, в определенных аспектах определяют или оценивают скорость пролиферации, выживание и/или результирующие соотношения после тестовых инкубаций, например, в конкретные момент или моменты времени после инкубации, и/или после этапа криоконсервация или замораживания, и/или после оттаивания после такой процедуры, например, непосредственно перед введением, например, у постели пациента, для определения оптимального соотношения для инициации культуры. Любое из множества хорошо известных способов определения in vitro или ex vivo скоростей пролиферации или выживаемости клеток включает способы проточной цитометрии, такие как мечение перед инкубацией сукцинимидиловым эфиром карбоксифлуоресцеиндиацетата (CFSE) или сходным флуоресцентным красителем с последующей оценкой интенсивности флуоресценции посредством проточной цитометрии и/или оценкой связывания клеток с аннексином V или другим соединением, распознающим маркеры на или в апоптических клетках; и/или захват интеркалирующих ДНК средств, таких как йодид пропидия или 7AAD, и оценка захвата и/или стадий клеточного цикла в качестве меры пролиферации или апоптоза посредством проточной цитометрии.
[0179] В определенных вариантах осуществления инициирующее культуру соотношение определяют посредством инкубации двух выделенных популяций, например, субпопуляций клеток в определенном диапазоне различных соотношений в тестовых композициях в определенных тестовых условиях, и оценивают один или несколько результатов, таких как результирующее соотношение, получаемое после определенного периода. В определенных аспектах условия являются стимулирующими условиями, такими как приблизительные условия, в которых инициирующие культуру композиции инкубируют на этапах культивирования и/или инженерии. Например, в определенных аспектах тестовые композиции вводят в присутствии одного или нескольких, например, каждого, из тех же стимулирующих средств, сред, буферов, газосодержания, и/или в том же типе контейнеров или емкостей, и/или в течение той же или приблизительно одной и той же продолжительности времени, что параметры, используемые на этапах инкубации и/или инженерия этапы, которые используют при получении или продукции конечных композиций, таких как подвергаемые инженерии композиции для введения.
[0180] Иллюстративные тестовые соотношения для тестовых инициирующих культуру композиций могут включать соотношения или приблизительные соотношения 90%/10%, 80%/20%, 70%/30%, 60/40%, 50/50%, 40/60%, 30/70%, 20%/80% и 10%/90% или 0,1:1, 0,5:1, 0,7:1, 0,8:1, 0,9:1, 1:1, 1:1,1, 1:1,2., 1:1,3, 1:1,4, 1:1,5, или более чем или приблизительно 1:1,5, или более чем или приблизительно 1:0,1, 1:0,4, 1:0,7, 1:0,8, 1:0,8, 1,1:1, 1,2:1, 1,3:1, 1,4:1 или 1,5;1, или более.
[0181] В определенных случаях подходящее инициирующее культуру соотношение CD4+- и CD8+-клеток для достижения желаемого соотношения CD4:CD8 в конце получения определяют на основе фракций субпопуляций CD4+- и/или CD8+-клеток в конкретном выделенном клеточном продукте, например, наличию и/или процентному содержанию компартментов наивных клеток, эффекторных клеток и различных клеток памяти, представленных в конкретной выделенной композиции. Такую оценку можно проводить посредством определения присутствия или уровня различных поверхностных маркеров на клетках, например, посредством проточной цитометрии.
[0182] В определенных вариантах осуществления инициирующее культуру соотношение основано на фенотипе каждой из популяций клеток. В определенных вариантах осуществления инициирующее культуру соотношение основано на условиях культивирования (например, таких как состав среды, присутствие и/или отсутствие факторов роста, стимуляторов и/или других средств, температура, условия аэрации и т.д.).
[0183] В определенных вариантах осуществления способов, описываемых в настоящем документе, инициирующее культуру соотношение обеспечивает результирующую композицию, которая содержит соотношение CD4+-:CD8+-клеток или ряд таких подтипов или общее количество клеток, которое находится в пределах приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30% приблизительно 35%, приблизительно 40%, приблизительно 45% или приблизительно 50% от желаемого соотношения или дозы, включая любой диапазон между этими значениями. В определенных вариантах осуществления способов, описываемых в настоящем документе, инициирующее культуру соотношение обеспечивает результирующую композицию с желаемым соотношением CD4+:CD8+-клеток или дозой таких клеток в течение по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или более 95% времени, включая любой диапазон между этими значениями. В определенных вариантах осуществления способов инициирующее культуру соотношение обеспечивает соотношение CD4+- и CD8+-клеток в результирующей композиции, которое находится в пределах 20% от желаемого результирующего соотношения по меньшей мере 80% времени. В определенных вариантах осуществления способов, описываемых в настоящем документе, результирующая композиция содержит соотношение CD4+- и CD8+-клеток, которое находится в пределах допустимого отличия от желаемого результирующего соотношения, где указанное допустимое отличие определено, как описано выше, например, посредством введения CD4+- и CD8+-клеток одному или нескольким индивидуумам во множестве соотношений.
b. Результирующие соотношения и дозы
[0184] В определенных вариантах осуществления способ позволяет получить результирующую композицию после одного или нескольких этапов обработки инициирующей культуру композиции, таких как инкубация, стимуляция, активация, инженерия и/или формулирование клеток. В определенных вариантах осуществления способ проводят с достижением или получением желаемого соотношения CD4+- и CD8+-клеток или их субпопуляций, которое составляет от или приблизительно от 2:1 до или приблизительно до 1:5, от или приблизительно от 2:1 до или приблизительно до 1:2, от или приблизительно от 1,5:1 до или приблизительно до 1:5, от или приблизительно от 1,5:1 до или приблизительно до 1:2 или от или приблизительно от 1:1 до или приблизительно до 1:2. В определенных вариантах осуществления желаемое результирующее соотношение CD4+- и CD8+-клеток в результирующей композиции составляет 1:1 или приблизительно составляет 1:1.
[0185] В определенных вариантах осуществления способ позволяет получать результирующую композицию, такую как композиция, содержащая подвергнутые генетической инженерии CD4+-T-клетки и CD8+-T-клетки или их субпопуляции, в которой результирующее соотношение CD4+- и CD8+-клеток или их субпопуляций в композиции, составляет от или приблизительно от 2:1 до или приблизительно до 1:5, от или приблизительно от 2:1 до или приблизительно до 1:2, от или приблизительно от 1,5:1 до или приблизительно до 1:5, от или приблизительно от 1,5:1 до или приблизительно до 1:2 или от или приблизительно от 1:1 до или приблизительно до 1:2. В определенных вариантах осуществления способ позволяет получать результирующую композицию, содержащую результирующее соотношение CD4+- и CD8+-клеток, которое составляет 1:1 или приблизительно составляет 1:1.
[0186] В определенных вариантах осуществления результирующее соотношение CD4+- и CD8+-T-клетки представляет собой соотношение, которое желательно в качестве части дозы T-клеток для иммунотерапии, например, в связи с способами адоптивной иммунотерапии.
[0187] В определенных вариантах осуществления определяют желаемые дозы, такие как желаемые количества клеток и/или желаемые результирующие соотношения типов клеток или популяций (например, соотношения, оптимальные для терапевтического введения пациенту). В определенных вариантах осуществления способы включают этапы определения допустимой погрешности или допустимого отличия от желаемого результата или вводимых соотношения или дозы, т.е., предел погрешности, на которую соотношение в данной композиции, например, подвергаемой инженерии композиции, может отклоняться от желаемого результирующего соотношения, и все еще обеспечивать желаемый результат, такой как приемлемый уровень безопасности для индивидуума или пациента или эффективность лечения конкретного заболевания или патологического состояния или другой терапевтический эффект.
[0188] В определенных вариантах осуществления желаем доза, соотношение и/или допустимая погрешность зависят от подлежащего лечению заболевания или патологического состояния, индивидуума, источника клеток, например, получены ли клетки у индивидуума с конкретным патологическим состоянием или заболеванием и предназначены ли клетки для аутологичного или аллогенного трансплантата, например, выделяют ли их у индивидуума, который уже получал клетки при адоптивной клеточной терапии, и/или получал или получает ли индивидуум другое лечение, и/или характеристик такого лечения. В определенных вариантах осуществления соотношение, количество и/или допустимое отличие или погрешность зависят от одного или нескольких других свойств клеток, таких как скорость пролиферации, способность к выживаемости, экспрессия конкретных маркеров или секреция факторов, таких как цитокины, или конкретных субпопуляций, выделяемых до этапов инкубации и инженерии. В определенных примерах желаемое соотношение и/или допустимая погрешность или отличие могут варьировать в зависимости от возраста, пола, состояния здоровья и/или массы индивидуума, от биомаркеров в качестве указания на характеристику заболевания, от лечебных средств совместно вводимых или ранее вводимых индивидууму.
[0189] В определенных вариантах осуществления желаемое соотношение, дозу и/или допустимую погрешность определяют посредством введения тестовому индивидууму различных тестовых композиций, где каждая содержит представляющие интерес типы или популяции клеток в различных соотношениях или в различных количествах, с последующей оценкой одного или нескольких исходов или параметров, таких как параметры, характеризующие безопасность, терапевтическую эффективность, концентрацию in vivo или локализацию клеток и/или другой желаемый исход.
[0190] В определенных вариантах осуществления тестовый индивидуум представляет собой не являющееся человеком животное, такое как нормальное животное или модель заболевания на животных, такого как заболевание или патологическое состояние подлежащее лечению посредством введения клеток. В определенных вариантах осуществления различные тестовые соотношения для введения тестовым индивидуумам составляют или приблизительно составляют, например, 90%/10%, 80%/20%, 70%/30%, 60/40%, 50/50%, 40/60%, 30/70%, 20%/80% и 10%/90%, выражаемые в виде процентного содержания одного типа или подтипа клеток (например, CD4+-T-клетки или их подтип) и другого типа клеток (например, CD8+-T-клетки или NK-клетки или их подтипы) и промежуточных значений. Соотношения можно выражать в виде относительных процентных содержаний или в любом другом формате, так как соотношения, составляющие или приблизительно составляющие 0,1:1, 0,5:1, 0,7:1, 0,8:1, 0,9:1, 1:1, 1:1,1, 1:1,2., 1:1,3, 1:1,4, 1:1,5 или более или приблизительно более 1:1,5, или составляющие или приблизительно составляющие 1:0,1, 1:0,4, 1:0,7, 1:0,8, 1:0,8, 1,1:1, 1,2:1, 1,3:1, 1,4:1 или 1,5;1 или более, включая любой диапазон между этими значениями. В определенных вариантах осуществления тестовый индивидуум представляет собой человека. В определенных вариантах осуществления желаемое соотношение представляет собой усредненное, среднее или медианное соотношение у тестовых индивидуумов с конкретным оптимальным действием. В определенных аспектах желаемое соотношение представляет собой соотношение, которое достигает определенного оптимального баланса между безопасностью и эффективностью. В определенных аспектах желаемые соотношение или доза представляют собой соотношение или дозу, которые достигают наибольшей эффективности из всех тестируемых соотношений или доз, при этом сохраняя пороговый уровень безопасности. В определенных аспектах желаемые соотношение или доза представляют собой соотношение или дозу, которые достигают наибольшего уровня безопасности, сохраняя пороговый уровень эффективности или находясь в пределах диапазона эффективности. В некоторых случаях оптимальные соотношение или доза выражают в виде диапазона, такого как от 1:1 до 1:2 одного типа клеток к другому или от 104 до 109 или от 105 до 106 клеток на кг массы тела.
[0191] В определенных вариантах осуществления допустимую погрешность определяют на основе отклонения от желаемого среднего тестовых индивидуумов, которых наблюдают для оценки терапевтической эффективности и/или безопасности каждой комбинации процентного содержания. В определенных вариантах осуществления допустимая погрешность находится в пределах приблизительно 1%, приблизительно 2%, приблизительно 3%, приблизительно 4% приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50% от желаемого соотношения, включая любое значение в пределах этих диапазонов.
6. Иллюстративные способы отбора или обогащения клеток
a. Один из технологических потоков и/или одновременный отбор с использованием иммуномагнитных гранул
[0192] В определенных вариантах осуществления разделение и/или его этапы проводят с использованием иммуномагнитных гранул. В определенных вариантах осуществления образец клеток, содержащий CD4+- и CD8+-клетки, такой как образец первичных T-клеток человека, приводят в контакт с магнитными гранулами, содержащими первый иммуноаффинный реагент, который связывается с CD4 или CD8, и магнитными гранулами, содержащими второй иммуноаффинный реагент, который связывается с другим из CD4 или CD8. Разделение и/или его этапы можно проводить одновременно и/или последовательно.
[0193] В определенных вариантах осуществления приведение клеток в контакт с магнитными гранулами проводят одновременно, в соответствии с чем обогащение клеток, содержащих поверхностные маркеры CD4 и CD8, также проводят одновременно. В определенных таких аспектах способ включает приведение в инкубируемой композиции клеток образца, содержащего первичные T-клетки человека, в контакт с первым иммуноаффинным реагентом, который специфически связывается с CD4, и вторым иммуноаффинным реагентом, который специфически связывается с CD8, в условиях, при которых иммуноаффинные реагенты специфически связываются с молекулами CD4 и CD8, соответственно, на поверхности клеток в образце, и выделение клеток, связанных с первым и/или вторым иммуноаффинными реагентами, получая, таким образом, обогащенную композицию, содержащую CD4+-клетки и CD8+-клетки в инициирующем культуру соотношении.
[0194] В определенных вариантах осуществления первый и/или второй иммуноаффинные реагенты присутствуют в инкубируемой композиции в обеспечивающих субоптимальный выход концентрациях, в результате чего обогащенная композиция содержит менее 70% от общего количества CD4+-клеток в инкубируемой композиции и/или менее 70% CD8+-клеток в инкубируемой композиции, таким образом, получая композицию, обогащенную CD4+- и CD8+-T-клетками.
[0195] В определенных вариантах осуществления обеспечивающие субоптимальный выход концентрация аффинного реагента представляют собой концентрации ниже концентрации, используемой или необходимой для достижения оптимального или максимального выхода связанных клеток после данного отбора или обогащения, включающих инкубацию клетки с реагентом и восстановление или выделение клеток со связанным реагентом (где "выход", например, представляет собой количество выделенных или выбранных таким образом клеток по сравнению с общим количеством клеток при инкубации, которые являются мишенью реагента или к которым реагент специфичен или которые несут маркер, к которому этот реагент специфичен и с которым может связываться). Как правило, обеспечивающая субоптимальный выход концентрация представляет собой концентрацию или количество реагента, которая в таком процессе или на соответствующем этапе после выделения клеток, связанных с реагентом, обеспечивает не более 70% выхода связанных клеток. В определенных вариантах осуществления при субоптимальной концентрации достигают не более или приблизительно 50%, 45%, 40%, 30% или 25% выхода. Концентрацию можно выражать в виде количества или массы частиц или поверхностей на клетку и/или величины массы или молекул средства (например, антитела, такого как фрагмент антитела) на клетку.
[0196] Например, в определенных вариантах осуществления обеспечивающий субоптимальный выход концентрация составляет менее чем или приблизительно 30 мкМ средства (например, антитела) на 1×109 клеток, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции. В определенных вариантах осуществления обеспечивающий субоптимальный выход концентрация составляет менее чем или приблизительно 30 мкМ средства (например, антитела) на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 20 мкМ средства (например, антитела) на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 10 мкМ средства (например, антитела) на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 15 мкМ средства (например, антитела) на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 10 мкМ средства (например, антитела) на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 5 мкМ средства (например, антитела) на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 1 мкМ средства (например, антитела) на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 0,5 мкМ средства (например, антитела) на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 0,2 мкМ средства (например, антитела) на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции.
[0197] В определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 15 мг гранул, частиц, поверхности или общего реагента на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 10 мг гранул, частиц, поверхности или общего реагента на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 5 мг гранул, частиц, поверхности или общего реагента на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 4 мг гранул, частиц, поверхности или общего реагента на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 3 мг гранул, частиц, поверхности или общего реагента на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 2 мг гранул, частиц, поверхности или общего реагента на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 1 мг гранул, частиц, поверхности или общего реагента на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции; в определенных вариантах осуществления обеспечивающая субоптимальный выход концентрация составляет менее чем или приблизительно 0,5 мг гранул, частиц, поверхности или общего реагента на 1×109, на 2×109 клеток, на 3×109 клеток, на 4×109 клеток, на 5×109 клеток, на 10×109 клеток, на 15×109 клеток или на 20×109 клеток в инкубируемой композиции.
[0198] В определенных вариантах осуществления, например, при использовании в обеспечивающей субоптимальный выход концентрации каждого или одного или нескольких из двух или более отборающих реагентов с аффинностью к двум или более маркерам или клеткам, один или несколько из таких реагентов используют в концентрации, которая выше, чем для одного или нескольких из других таких реагентов, для смещения отношения типа клеток, распознаваемого этим реагентом по сравнению с типом(ами) клеток, распознаваем другим(и). Например, реагент, специфически связывающийся с маркером, для которого желательно смешение отношения, можно инкубировать с концентрацией (например, средства или массой на клетки), которая по сравнению с другим(и) увеличена вполовину, 1-кратно, 2-кратно, 3-кратно, 4-кратно, 5-кратно, 10-кратно или более, в зависимости от того, насколько желательно увеличивать отношение.
[0199] В определенных вариантах осуществления применение обеспечивающей субоптимальный выход концентрация для смещения одной или обеих популяций клеток может обеспечивать желаемое или выбранное инициирующее культуру соотношение. В определенных вариантах осуществления отбор проводят из образца, который представляет собой образец, содержащий CD4+- и CD8+-клетки, содержащий высокие количества клеток, например, по меньшей мере 1×109 клеток, 2×109 клеток, 3×109 клеток, 4×109 клеток, 5×109 клеток, 6×109 клеток, 7×109 клеток, 8×109 клеток, 1×1010 клеток, 2×1010 клеток, 3×1010 клеток, 4×1010 клеток, 5×1010 клеток или более. В определенных вариантах осуществления высокого количества клеток достаточно, чтобы обеспечить насыщение иммуноаффинных реагентов в образце клетками, экспрессирующими маркер, такой как CD4 или CD8, с которым реагент специфически связывается.
[0200] В определенных вариантах осуществления при использовании в субоптимальном диапазоне и/или с достаточным количеством клеток для достижения насыщения реагентов, количество иммуноаффинного реагента пропорционально приблизительному выходу обогащенных клеток. В одном из вариантов осуществления для достижения инициирующего культуру соотношения CD4+-клеток и CD8+-клеток приблизительно 1:1 отбор CD4+-клеток и CD8+-клетки можно проводить с одинаковыми или одинаковыми обеспечивающими субоптимальный выход концентрациями иммуноаффинных реагентов к CD4 и CD8, соответственно. В другом иллюстративном варианте осуществления для достижения инициирующего культуру соотношения CD4+-клеток и CD8+-клетки приблизительно 2:1 отбор CD4+-клеток можно проводить с обеспечивающей субоптимальный выход концентрацией иммуноаффинного реагента к CD4, которая приблизительно в два раза больше, чем обеспечивающая субоптимальный выход концентрация иммуноаффинного реагента к CD8. Специалист в данной области может эмпирически выбрать или подобрать соответствующее количество или концентрацию иммуноаффинных реагентов в зависимости от желаемого или выбранного инициирующего культуру соотношения в получаемой композиции, содержащей обогащенные или выбранные клетки, принимая во внимание приведенные выше примеры.
[0201] В определенных вариантах осуществления разделение и/или его этапы проводят с использованием магнитных гранул, с которыми обратимо связаны иммуноаффинные реагенты, например, посредством взаимодействия пептидного лиганда с мутеином стрептавидина, как описано выше. Примерами таких магнитных гранул являются Streptamer®. В определенных вариантах осуществления разделение и/или его этапы проводят с использованием магнитных гранулы, таких как гранулы, коммерчески доступные в Miltenyi Biotec.
[0202] В определенных аспектах разделение и/или другие этапы проводят в течение автоматизированного разделение клеток на клиническом уровне в замкнутой и стерильной системе. Компоненты могут включать интегрированный микрокомпьютер, блок разделения в магнитном поле, перистальтический насос и различные запорные клапаны. В определенных аспектах интегрированный компьютер контролирует все компоненты устройства и управляет системой с проведением повторяемых процедур в стандартизированной последовательности. В определенных аспектах блок разделения в магнитном поле содержит подвижный постоянный магнит и держатель для селективной колонки. Перистальтический насос контролирует скорость потока на всем протяжении системы трубок и вместе с запорными клапанами обеспечивает контролируемый поток буфера через систему и непрерывную суспензию клеток. В определенных аспектах разделение и/или другие этапы проводят с использованием системы CliniMACS (Miltenyi Biotic).
[0203] В определенных вариантах осуществления автоматизированное разделение, например, с использованием системы CliniMACS, в определенных аспектах используют связанные с антителами намагничиваемые частицы, которые подают в стерильном апирогенном растворе. В определенных вариантах осуществления после мечения клеток магнитными частицами клетки отмывают для удаления избытка частиц. Затем пакет для получения клеток соединяют с системой трубок, которая в свою очередь соединена с пакетом, содержащим буфер и пакет для сбора клеток. Система трубок состоит из предварительно собранных стерильных трубок, включающих предколонку и делительную колонку и предназначенных только для одноразового использования. После начала программы разделения, система автоматически наносит образец клеток на делительную колонку. Меченые клетки сохраняются в колонке, тогда как немеченые клетки удаляют посредством ряда этапов отмывки. В определенных вариантах осуществления популяции клеток для применения в способах, описываемых в настоящем документе, являются немечеными и не удерживаются в колонке. В определенных вариантах осуществления популяции клеток для применения в способах, описываемых в настоящем документе, являются мечеными и сохраняются в колонке. В определенных вариантах осуществления популяции клеток для применения в способах, описываемых в настоящем документе, элюируют из колонки после отключения магнитного поля и собирают в пакет для сбора клеток.
[0204] В определенных вариантах осуществления разделение и/или другие этапы проводят с использованием системы, оборудованной блоком обработки клеток, который обеспечивает автоматизированную отмывку и фракционирование клеток посредством центрифугирования. В определенных аспектах разделение и/или другие этапы проводят с использованием системы CliniMACS Prodigy система (Miltenyi Biotec). Система с блоком обработки клеток также может содержать встроенную камеру и программное обеспечение для распознавания изображений, которое определяет оптимальную конечную точку фракционирования клеток посредством распознавания макроскопических слоев исходного клеточного продукта. Например, периферическая кровь автоматически разделяется на слои эритроцитов, лейкоцитов и плазмы. Система обработка клеток, такая как система CliniMACS Prodigy, также может включать интегрированную клеточную камеру для культивирования, в которой проводят протоколы культивирования клеток, например, такие как клеточные дифференцировка и рост, нагрузка антигеном и длительное культивирование клеток. Входные порты могут предусматривать удаление и пополнение сред в стерильных условиях, а клетки можно контролировать с использованием интегрированного микроскопа. См., например, Klebanoff et al.(2012) J. Immunother. 35(9): 651-660, Terakuraet al. (2012) Blood. 1:72-82 и Wang et al. (2012) J. Immunother. 35(9):689-701.
[0205] В определенных вариантах осуществления популяцию клеток, описанную в настоящем документе, собирают и обогащают (или обедняют) посредством проточной цитометрии, при которой в потоке жидкости находятся клетки с несколькими мечеными поверхностными клеточными маркерами. В определенных вариантах осуществления популяцию клеток, описанную в настоящем документе, собирают и обогащают (или обедняют) посредством сортировки FACS в препаративном масштабе. В определенных вариантах осуществления популяцию клеток, описанную в настоящем документе, собирают и обогащают (или обедняют) посредством использования чипов микроэлектромеханических систем (MEMS) в комбинации с основанной на FACS системой детекции (см., например, WO 2010/033140, Cho et al. (2010) Lab. Chip. 10, 1567-1573 и Godin et al. (2008) J. Biophoton. 1(5):355-376. В обоих случаях клетки можно метить несколькими маркерами, обеспечивая выделение хорошо определенных субпопуляций T-клеток с высокой чистотой.
[0206] В определенных вариантах осуществления для облегчения разделения при положительном и/или отрицательном отборе антитела или партнеры по связыванию мечены одним или несколькими детектируемыми маркерами. Например, разделение может быть основано на связывании флуоресцентно меченых антител. В определенных примерах разделение клеток на основе связывания антител или других партнеров по связыванию, специфичных к одному или нескольким поверхностным клеточным маркерам, проводят в потоке жидкости, например, посредством активируемой флуоресценцией сортировки клеток (FACS), включая препаративный масштаб (FACS) и/или чипы микроэлектромеханических систем (MEMS), например, в комбинации с проточно-цитометрической системой детекции. Такие способы обеспечивают положительный и отрицательный отбор на основе нескольких маркеров одновременно.
b. Один из технологических потоков и/или последовательные отборы с использованием иммуноаффинной хроматографии
[0207] В определенных вариантах осуществления первый отбор или обогащение популяции клеток и второй отбор и/или обогащение популяции клеток проводят с использованием основанных на иммуноаффинности реагентов, которые включают по меньшей мере первый и второй аффинные хроматографические матриксы, соответственно, с иммобилизованными на них антителами. В определенных вариантах осуществления в одном или обоих из первого и/или второго отборов можно использовать множество матриксов и/или антител для аффинной хроматографии, в соответствии с чем множество используемых матриксов и/или антител для одного и того же отбора, т.е. первого отбора или второго отбора, последовательно связаны. В определенных вариантах осуществления аффинные хроматографические матрикс или матриксы, используемые в первом и/или втором отборах адсорбируют или способны к отбору или обогащению по меньшей мере приблизительно 50×106 клеток/мл, 100×106 клеток/мл, 200×106 клеток/мл или 400×106 клеток/мл. В определенных вариантах осуществления адсорбционную способность можно модулировать на основе диаметра и/или длины колонки. В определенных вариантах осуществления инициирующее культуру соотношение выбранной или обогащенной композиции получают, выбирая достаточное количество матрикса и/или при достаточном относительном количестве для достижения инициирующего культуру соотношения, основываясь, например, на адсорбционной способности колонки или колонок для отбора клетки.
[0208] В одном иллюстративном варианте осуществления адсорбционная способность матрикса или матриксов в первом и втором отборах является одинаковой, например, составляет или приблизительно составляет 1×108 клеток/мл для обоих, в соответствии с чем обогащение или отбор клеток в первом отборе и втором отборе приводит к композиции, содержащей CD4+-клетки и CD8+-клетки в инициирующем культуру соотношении, составляющем или приблизительно составляющем 1:1. В другом иллюстративном варианте осуществления адсорбционная способность матрикса или матриксов, используемых в одном из первого отбора или второго отбора по меньшей мере в 1,5 раза, 2,0 раза, 3,0 раза, 4,0 раза, 5,0 раз, 6,0 раз, 7,0 раз, 8,0 раз, 9,0 раз, 10,0 раз или более выше, чем адсорбционная способность матрикса или матриксов используемых в другом из первого отбора или второго отбора, таким образом, приводя к инициирующему культуру соотношению, в котором клетки, выбранные с большей адсорбционной способностью, например, CD4+-клетки или CD8+-клетки, присутствуют в инициирующем культуру соотношении в количестве, которое по меньшей мере в 1,5 раза, 2,0 раза, 3,0 раза, 4,0 раза, 5,0 раз, 6,0 раз, 7,0 раз, 8,0 раз, 9,0 раз, 10,0 раз или более выше, чем в другой популяции клеток. Специалист в данной области в зависимости от желаемого или выбранного инициирующего культуру соотношения в получаемой композиции, содержащей обогащенные или выбранные клетки, может выбрать или подобрать для хроматографических колонок подходящий объем, диаметр или количество аффинного матрикса для первого и/или второго отбора.
[0209] Иллюстративные способы проведения отборов предоставляемыми способами приведены в примере 2. В определенных вариантах осуществления такие способы позволяют получать в обогащенной или получаемой композиции желаемое инициирующее культуру соотношение.
[0210] В определенных вариантах осуществления первый и/или второй отбор в предоставляемых способах включают первое обогащение одного типа CD4+- или CD8+-клеток, а затем обогащение субпопуляции этих клеток на основе, например, экспрессии поверхностных маркеров, экспрессируемых на покоящихся T-клетках, наивных T-клетках или центральных T-клетках памяти, например, маркера, который представляет собой CD28, CD62L, CCR7, CD127 или CD27. В определенных вариантах осуществления первый и/или второй отбор включает обогащение CD8+-клетки, где указанный отбор дополнительно включает обогащение центральных T-клеток памяти (TCM), тогда как другой из первого и/или второго отборов включает обогащение CD4+-клеток. В определенном варианте осуществления способы проводят с обогащением или отбором CD4+-клеток и с обогащением или отбором субпопуляции клеток, которые представляют собой CD8+/CD28+-, CD8+/CD62L+-, CD8+/CCR7+-, CD8+/CD127+- или CD8+/CD27+-клетки. В определенных вариантах осуществления первый отбор включает обогащение CD8+-Клеток, а второй отбор включает обогащение CD4+-клеток, где первый отбор, который приводит к получению клеток, обогащенных CD8+-клетками, дополнительно включает обогащение центральных T-клеток памяти (TCM) или обогащение клеток, экспрессирующих маркер, который представляет собой CD28, CD62L, CCR7, CD127 или CD27, получая, таким образом, композицию, такую как инициирующая культуру композиция, содержащую CD4+-клетки и CD8+-клетки, обогащенные центральными T-клетками памяти (TCM) или клетками, экспрессирующими маркер, который представляет собой CD28, CD62L, CCR7, CD127 или CD27. В определенных вариантах осуществления первый отбор включает обогащение CD4+-клеток, а второй отбор включает обогащение CD8+-клеток, где второй отбор, который позволяет получать клетки, обогащенные CD8+-клетками, дополнительно включает обогащение центральных T-клеток памяти (TCM) или обогащение клеток, экспрессирующих маркер, который представляет собой CD28, CD62L, CCR7, CD127 или CD27, получая, таким образом, композицию, такую как инициирующая культуру композиция, содержащую CD4+-клетки и CD8+-клетки, обогащенные центральными T-клетками памяти (TCM) или клетками, экспрессирующими маркер, который представляет собой CD28, CD62L, CCR7, CD127 или CD27.
[0211] В определенных таких вариантах осуществления, включающих дополнительное обогащение субпопуляции клеток с получением инициирующего культуру соотношение CD4+-клеток или их субпопуляции и CD8+-клеток или их субпопуляции, адсорбционную способность матрикса или матриксов колонок регулируют так, чтобы учитывать различия частоты субпопуляции, т.е. CD4+- или CD8+-клеток, обогащенных покоящимися клетками, наивными клетками, центральными клетками памяти или клетками, экспрессирующими маркер, который представляет собой CD28, CD62L, CCR7, CD127 или CD27, по сравнению с частотой клеток соответствующей исходной популяции CD4+-клеток или CD8+-клеток в исходном образце, получаемом у индивидуума. Относительный уровень или частоту различных популяций клеток у индивидуума можно определять на основе оценки экспрессии поверхностных маркеров или маркеров, присутствующих в таких популяциях или субпопуляциях. Для оценки уровня экспрессии поверхностных маркеров или белков можно использовать ряд хорошо известных способов, таких как детекция основанными на аффинности способами, например, основанными на иммуноаффинности способами, например, в случае клеточных поверхностных белков, такими как проточная цитометрия.
[0212] В иллюстративном варианте осуществления образец обогащен CD4+- и CD8+/CD62L+-клетками с получением соотношения CD4+- и CD8+-клеток 1:1. В этом иллюстративном варианте осуществления первый отбор может включать обогащение CD8+-клеток с использованием колонки с адсорбционной способностью, скорректированной на известные относительные частоты CD4+-клеток и CD8+/CD62L+-клеток, присутствующие в образце, или с использованием соотношений, для которых рассчитано их присутствие в таких образцах в общем случае. Например, субпопуляция CD62L+ CD8+-клеток, собираемых у человека, иногда может составлять приблизительно 25% от общего количества фракции CD8+-T-клеток. См. например, Maldonado, Arthritis Res. Ther. 2003; 5(2): R91-R96. В таком варианте осуществления для получения инициирующего культуру соотношения CD4+-клеток и субпопуляции CD8+- клеток, дополнительно содержащих CD62L+-клетки, в размере 1:1, колонки можно располагать так, чтобы собирать в 4 раза больше CD8+-клеток, чем CD4+-клеток. Таким образом, исходя из сходной адсорбционной способности и эффективности каждой селективной колонки, колонка для CD8+-клеток может быть приблизительно в 4 раза больше, чем селективная колонка для CD4 или селективная колонки для CD62L. Также размер колонок можно корректировать в зависимости от ожидаемого выхода. Например, если каждая колонка эффективна только на 80%, размер каждой колонки можно корректировать с учетом эффективности каждого последующего отбора.
[0213] Например, желаемая или выбранная инициирующая культуру композиция может представлять собой композицию, которая содержит 200×106 CD4+-клеток и 200×106 CD8+/CD62L+-клеток. В этом примере, с учетом предоставленных выше соотношений, образец, подлежащий обогащению, может содержать по меньшей мере или приблизительно 200×106 CD4+-клеток и по меньшей мере или приблизительно 800×106 CD8+-клеток, приблизительно 25% из которых (200×106) также могут представлять собой CD62L+-клетки. С учетом того, что каждые 2 мл отбирающего матрикса могут обеспечивать обогащение приблизительно 200×106 клетками, селективная для CD8 колонка с 8 мл отбирающего матрикса может связывать приблизительно 800×106 CD8+-клеток, тогда как фильтрат проходит в селективную для CD4 колонку. Селективная для CD4 колонка с 2 мл отбирающего матрикса может связывать приблизительно 200×106 CD4+-клеток. CD8+-клетки можно дополнительно обогащать CD62L+-клетками, элюируя CD8+-клетки в селективную для CD62L колонку. В этом иллюстративном варианте осуществления селективная для CD62L колонка может содержать 2 мл отбирающего матрикса, таким образом, обеспечивая обогащение приблизительно 200×106 CD8+/CD62L+-клетками. Колонки для CD4 и CD8/CD62L можно подвергать элюции в емкость для культивирования, получая инициирующую культуру композицию или композицию с инициирующим культуру соотношением 1:1.
[0214] В другом иллюстративном варианте осуществления, образец обогащен CD4+- и CD8+/CCR7+-клетками с получением соотношения CD4+- и CD8+-клеток 1:1. В этом иллюстративном варианте осуществления, первый отбор может включать обогащение CD8+-клеток с использованием колонка с адсорбционной способностью, скорректированной на известные относительные частоты CD4+-клеток и CD8+/CCR7+-клетки присутствующие в образце, или с использованием соотношений, для которых рассчитано их присутствие в таких образцах в общем случае. Например, субпопуляция CCR7+ CD8+-клеток, собираемых у человека, иногда может составлять приблизительно 60% от общего количества фракции CD8+-T-клеток. См. например, Chen, Blood. 2001 Jul 1;98(1):156-64. Для получения инициирующего культуру соотношения 1:1 колонки можно располагать так, чтобы собирать в 3⅓ больше CD8+-клеток, чем CD4+-клеток. Из сходя из сходных адсорбционной способности и эффективности каждой селективной колонки, колонка для CD8+-клеток может быть приблизительно в 3⅓ раза больше, чем селективная для CD4 колонка или селективная для CCR7 колонка. Также размер колонок можно корректировать в зависимости от ожидаемого выхода. Например, если каждая колонка эффективна только на 80%, размер каждой колонки можно корректировать с учетом эффективности каждого последующего отбора.
[0215] Например, желаемая инициирующая культура может содержать 200×106 CD4+-клеток и 200×106 CD8+/CCR7+-клеток. В этом примере, с учетом предоставленных выше соотношений, образец, подлежащий обогащению, может содержать по меньшей мере 200×106 CD4+-клеток и по меньшей мере или приблизительно 6,6×106 CD8+-клеток, приблизительно 60% из которых (200×106) также могут представлять собой CCR7+-клетки. С учетом того, что каждые 2 мл отбирающего матрикса могут обеспечивать обогащение 200×106 клетками, селективная для CD8 колонка с 3⅓ мл отбирающего матрикса может связывать приблизительно 6,6×106 CD8+-клеток, тогда как фильтрат проходит в селективную для CD4 колонку. Селективная для CD4 колонка с 2 мл отбирающего матрикса может связывать приблизительно 200×106 CD4+-клеток. CD8+-клетки можно дополнительно обогащать CCR7+-клетками, элюируя CD8+-клетки в селективную для CCR7 колонку. В этом иллюстративном варианте осуществления, селективная для CCR7 колонка может содержать 1 мл отбирающего матрикса, таким образом, обеспечивая обогащение приблизительно 200×106 CD8+/CCR7+-клетками. колонки для CD4 и CCCR7 можно подвергать элюции в емкость для культивирования, получая инициирующую культуру, содержащую приблизительно 200×106 CD4+-клеток и приблизительно 200×106 CD8+/CCR7+-клеток, или с инициирующим культуру соотношением 1:1.
[0216] Специалист в данной области может эмпирически выбирать или подбирать подходящие объем, диаметр или количество хроматографических колонок с аффинным матриксом для первого, и/или второго, и/или третьего отбора в зависимости от желаемого или выбранного инициирующего культуру соотношения в получаемой композиции, содержащей обогащенные или выбранные клетки, ожидаемой частоты каждой из субпопуляций, варьирующей эффективности каждой из селективных колонок и других факторов в пределах уровне компетенции специалиста в данной области и учитывая приведенные выше примеры.
B. Инкубация выделенных клеток
[0217] В определенных вариантах осуществления предоставляемые способы включают один или несколько из различных этапов инкубации выделенных клеток и популяций клеток, таких как популяции, выделенные способами по настоящему документу, таких как этапы инкубации популяции выделенных CD4+-T-клеток, например, нефракционированной популяции CD4+-T-клеток или ее субпопуляции(й), и популяции выделенных CD8+-T-клеток, например, популяции выделенных нефракционированных CD8+-T-клеток или ее субпопуляции(й). В определенных вариантах осуществления популяции клеток инкубируют в инициирующей культуру композиции.
[0218] Как правило, множество популяций выделенных клеток, например, популяций CD4+- и CD8+-клеток (например, нефракционированных клеток или их субпопуляций) инкубируют с популяциями клеток, комбинированными в инициирующей культуру композиции, в одной и той же емкости для культивирования, такой как одни и те же блок, камера, лунка, колонка, трубка, система трубок, клапан, флакон, культуральная чашка, пакет или другой контейнер для культур или культивирования клеток.
[0219] В определенных аспектах популяции клеток или типы клеток находятся в инициирующей культуру композиции в инициирующем культуру соотношении, например, соотношении CD4+- и CD8+-клеток, предназначенном для достижения после этапов инкубации и/или инженерии конкретного желаемого результирующего соотношения или соотношения, которое находится в пределах определенного диапазона допустимой погрешности такого желаемого результирующего соотношение, или предназначенного для осуществления этого в течение определенного процента времени. Например, результирующее соотношение может представлять собой соотношение, оптимальное для достижения после введения пациенту, например, посредством адоптивной клеточной терапии, одного или нескольких терапевтических эффектов. В определенных аспектах инициирующее культуру соотношение определяют эмпирически, например, способом определения, как описано в настоящем документе, например, с определением оптимального инициирующего культуру соотношения для достижения желаемого в конкретном случае результирующего соотношения.
[0220] Этапы инкубации могут включать культуру, культивирование, стимуляцию, активацию, размножения, включая инкубацию в стимулирующих условиях, например, условиях, предназначенных для индукции пролиферации, роста, активации и/или выживания клеток в популяции, с имитацией экспонирования антигена и/или с примированием клеток для генетической инженерии, например, для введения генетически сконструированного антигенного рецептора.
[0221] Условия могут включать одно или несколько из конкретных сред, температуры, содержания кислорода, содержания диоксида углерода, времени, средств, например, питательных веществ, аминокислот, антибиотиков, ионов и/или стимулирующих факторов, таких как цитокины, хемокины, антигены, партнеры по связыванию, слитые белки, рекомбинантные растворимые рецепторы и любые другие средства, предназначенные для активации клеток. В одном из примеров, стимулирующие условия включают одно или несколько средств, например, лигандов, которые запускают или инициируют каскад внутриклеточной сигнализации TCR/CD3 в T-клетке. Такие средства могут включать антитела, такие как антитела, специфичные для компонента TCR и/или костимулирующего рецептора, например, антитела к CD3, антитела к CD28, антитела к 4-1BB, например, связанные с твердой подложкой, такой как гранула, и/или один или несколько из цитокинов. Необязательно, способ выращивания может дополнительно включать этап добавления в среду для культивирования антител к CD3 и/или к CD28 (например, в концентрации по меньшей мере приблизительно 0,5 нг/мл). Необязательно, способ выращивания может дополнительно включать этап добавления в среду для культивирования IL-2, и/или IL-15, и/или IL-7, и/или IL-21 (например, где концентрация IL-2 составляет по меньшей мере приблизительно 10 единиц/мл).
[0222] В определенных аспектах инкубацию проводят такими способами, как способы, описанные в патенте США № 6040177, выданном Riddell et al., Klebanoff et al.(2012) J. Immunother. 35(9): 651-660, Terakuraet al. (2012) Blood. 1:72-82 и/или Wang et al. (2012) J. Immunother. 35(9):689-701.
[0223] В определенных вариантах осуществления популяции клеток, такие как популяции CD4+- и CD8+-клеток или их субпопуляции, выращивают, добавляя в инициирующую культуру композицию фидерных клеток, таких как неделящиеся мононуклеарные клетки периферической крови (PBMC), (например, так, что результирующая популяция клеток содержит по меньшей мере приблизительно 5, 10, 20 или 40 или более фидерных клеток PBMC на каждый T-лимфоцит в исходной популяции для выращивания); и инкубируя культуру (например, в течение периода времени, достаточного для роста определенного количества T-клеток). В определенных аспектах неделящиеся фидерные клетки могут содержать обученные гамма-излучением фидерные клетки PBMC. В определенных вариантах осуществления PBMC облучены гамма-лучами в диапазоне приблизительно от 3000 до 3600 рад для предотвращения деления клеток. В определенных аспектах фидерные клетки добавляют в среду для культивирования перед добавлением популяций T-клеток.
[0224] В определенных вариантах осуществления стимулирующие условия включают температуру, подходящую для роста T-лимфоцитов человека, например, по меньшей мере приблизительно 25°C, как правило, по меньшей мере приблизительно 30°C, и, как правило, при или приблизительно при 37°C. В определенных вариантах осуществления в течение культивирования осуществляют температурный сдвиг, например, с 37°C до 35°C. Необязательно, инкубация может дополнительно включать добавление в качестве фидерных клеток неделящихся трансформированных EBV лимфобластоидных клеток (LCL). LCL можно облучать гамма-лучами в диапазоне приблизительно от 6000 до 10,000 рад. Фидерные клетки LCL в определенных аспектах предоставлены в любом подходящем количестве, таком как соотношение фидерных клеток LCL и исходных T-лимфоциты по меньшей мере приблизительно 10:1.
[0225] В определенных вариантах осуществления можно получать популяции CD4+-клеток и CD8+-клеток, которые являются антигенспецифичными, посредством стимуляции наивных или антигенспецифичных T-лимфоцитов антигеном. Например, можно получать линии или клоны антигенспецифичных T-клеток к антигенам цитомегаловирусов посредством выделения T-клеток у инфицированных индивидуумов и стимуляции клеток in vitro теми же антигенами. Также можно использовать наивные T-клетки.
Промежуточная оценка и корректировка
[0226] В определенных вариантах осуществления способы включают оценку и/или корректировку клеток или композиции, содержащей клетки, в течение периода, следующего за инициацией инкубации или культуры, например, в течение инкубации. Оценка может включать одно или несколько измерений композиции или емкости, содержащей клетки, например, оценку скорости пролиферации клеток, степени жизнеспособности клеток, фенотипа клеток, например, экспрессии одного или нескольких поверхностных или внутриклеточных маркеров, таких как белки или полинуклеотиды, и/или оценку в композиции или емкости температуры, компонентов сред, содержания кислорода или диоксида углерода, и/или присутствия или отсутствия или количества или относительного количества одного или нескольких факторов, средств, компонентов и/или типов клеток, включая их подтипы. Оценка в определенных вариантах осуществления включает определение в инкубируемой композиции или емкости промежуточных соотношений множества, например, двух типов клеток, таких как CD4+- и CD8+-T-клетки. В определенных аспектах оценку проводят в автоматизированном режиме, например, с использованием устройства, как описано в настоящем документе, и/или ее устанавливают провести в определенных точках в течение инкубации. В определенных аспектах результат оценки, например, определенное промежуточное соотношение двух типов клеток, указывает на необходимость выполнения корректировки, такой как добавление или удаление одного или нескольких типов клеток.
[0227] Корректировка может включать корректировку любого фактора или параметра при культивировании клеток, такого как температура, длительность (время) в течение которой проводится инкубация или ее этап (длительность инкубации), пополнение, добавление и/или удаление в инкубируемой композиции одного или нескольких компонентов, например, среды или буфера или их компонентов, средств, например, питательных веществ, аминокислот, антибиотиков, ионов и/или стимулирующих факторов, таких как цитокины, хемокины, антигены, партнеры по связыванию, слитые белки, рекомбинантные растворимые рецепторы или клетки или типы клеток или популяции клеток. В определенных аспектах удаление или добавление различных компонентов или другую корректировку проводят в автоматизированном режиме, например, с использованием устройства или системы, как описано в настоящем документе. В определенных вариантах осуществления систему программируют так, чтобы корректировка происходила автоматически на основе определенных данных промежуточной оценки. Например, в некоторых случаях, в системе или устройстве программируют проведение одной или нескольких оценок в конкретный момент времени; в таких случаях систему или устройство можно дополнительно программировать так, чтобы конкретный результат такой оценки, такой как конкретное отношение одного типа клеток к другому, инициировал конкретную корректировку, например, добавление одного или нескольких типов клеток.
[0228] В определенных аспектах корректировку проводят посредством добавления или удаления способом, который не нарушает замкнутую среду, содержащую клетки и композиции, например, посредством впускных и/или выпускных клапанов, предназначенных для добавления или удаления компонентов при сохранении стерильности, например, в одном или нескольких устройствах или системах, как описано в настоящем документе.
[0229] В конкретном варианте осуществления в течение периода инкубации оценивают промежуточное соотношение CD4+- и CD8+-T-клеток. В определенных вариантах осуществления оценку проводят через 1, 2, 3, 4, 5, 6 или 7 суток, например, в пределах 3-5 суток, и/или в момент времени, когда все клетки находятся или предположительно находятся в клеточном цикле. В определенных аспектах определяемое таким образом промежуточное соотношение служит признаком того, что в емкости для культивирования или в инкубируемой композиции необходимо добавить или обогатить CD4+- или CD8+-T-клетки, такие как клетки популяции выделенных CD4+-T-клеток или популяции выделенных CD8+-T-клеток (например, субпопуляции, такой как центральные CD8+-T-клетки памяти). Таким образом, в определенных аспектах оценка влечет за собой такое добавление или удаление, как правило, добавление. В определенных аспектах в течение инкубации проводят несколько оценок и, возможно, корректировок, например, с определенными интервалами.
[0230] В определенных вариантах осуществления, в которых клетки подвергают инженерии, например, для введения генетически сконструированного антигенного рецептора, инкубацию в присутствии одного или нескольких стимулирующих средства в течение фазы инженерии продолжают.
[0231] В определенных вариантах осуществления клетки инкубируют в течение или приблизительно в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 суток, или вообще или до инженерии.
C. Инженерия, сконструированные антигенные рецепторы и подвергнутые инженерии клетки
[0232] В определенных вариантах осуществления способы включают генетическую инженерию выделенных и/или инкубируемых клеток, например, с введением в клетки рекомбинантных генов для экспрессии таких молекул, как рецепторы, например, антигенные рецепторы, пригодных в рамках адоптивной терапии.
[0233] В числе генов для внесения находятся гены, улучшающие эффективность терапии, например, способствуя жизнеспособности и/или подвергаемых переносу клеток; гены, предоставляющие генетический маркер для отбора и/или оценки клеток, например, для оценки выживания или локализации in vivo; гены для увеличения безопасности, например, делающие клетку чувствительной к отрицательному отбору in vivo, как описано в Lupton S. D. et al., Mol. and Cell Biol., 11:6 (1991); и Riddell et al., Human Gene Therapy 3:319-338 (1992); также см. публикации PCT/US91/08442 и PCT/US94/05601 Lupton et al., где описано применение бифункциональных селектируемых слитых генов, получаемых посредством слияния доминантного положительного селектируемого маркера с отрицательным селектируемым маркером. Это можно проводить известными способами (см., например, Riddell et al., патент США № 6040177, в разделах 14-17) или их вариантами, которые очевидны специалистам в данной области на основе настоящего описание.
[0234] Как правило, инженерия включает введение гена или генов для экспрессии генетически сконструированного антигенного рецептора. В ряду таких антигенных рецепторов находятся генетически сконструированные T-клеточные рецепторы (TCR) и их компоненты, и функциональные не являющие TCR антигенные рецепторы, такие как химерные антигенные рецепторы (CAR).
[0235] В определенных вариантах осуществления антигенные рецептор специфически связывается с лигандом на клетке или лигандом, обуславливающим подвергаемое лечению заболевание, такое как злокачественная опухоль или другое заболевание или патологическое состояние, включая заболевания, описываемые в настоящем документе, на которые направлены предоставляемые способы и композиции. Иллюстративные антигены представляют собой орфанную рецепторную тирозинкиназу ROR1, tEGFR, Her2, Ll-CAM, CD19, CD20, CD22, мезотелин, CEA и поверхностный антиген гепатита B, рецептор антифолатов, CD23, CD24, CD30, CD33, CD38, CD44, EGFR, EGP-2, EGP-4, 0EPHa2, ErbB2, 3 или 4, FBP, эмбриональный рецептор ацетилхолина e, GD2, GD3, HMW-MAA, IL-22R-альфа, IL-13R-альфа2, kdr, легкая цепь каппа, антиген Lewis Y, молекула клеточной адгезии L1, MAGE-A1, мезотелин, MUC1, MUC16, PSCA, лиганды NKG2D, NY-ESO-1, MART-1, gp100, онкофетальный антиген, ROR1, TAG72, VEGF-R2, раково-эмбриональный антиген (CEA), специфический антиген предстательной железы, PSMA, Her2/neu, рецептор эстрогенов, рецептор прогестерона, ephrinB2, CD123, CS-1, c-Met, GD-2, и MAGE A3 и/или биотинилированные молекулы, и/или молекулы, экспрессируемые ВИЧ, HCV, HBV или другими патогенами.
Антигенные рецепторы
[0236] В одном из вариантов осуществления сконструированные антигенные рецепторы представляют собой CAR. Как правило, CAR включают генетически сконструированные рецепторы, содержащие внеклеточный связывающий лиганд домен связанный с одним или несколькими компонентами внутриклеточной сигнализации. Как правило, такие молекулы имитируют или аппроксимируют сигнал через природный антигенный рецептор и/или сигнал через такой рецептор в комбинации с костимулирующим рецептором.
[0237] В определенных вариантах осуществления CAR конструируют со специфичностью к конкретному маркеру, такому как маркер, экспрессируемый в конкретном типе клеток, на которые направлена адоптивная терапия, например, маркер злокачественной опухоли. В определенных аспектах этого достигают посредством включения во внеклеточную часть CAR одной или нескольких антигенсвязывающих молекул, таких как один или несколько антигенсвязывающих фрагментов, доменом или частей, или один или несколько вариабельных доменов антитела, и/или молекулы антител. В определенных вариантах осуществления CAR содержит антигенсвязывающую часть или части молекулы антител, такие одноцепочечный фрагмент антитела (scFv), получаемый из вариабельных областей тяжелых (VH) и вариабельных областей легких (VL) цепей моноклонального антитела (mAb).
[0238] В определенных вариантах осуществления CAR содержит домен тяжелой цепи антитела, который специфически связывается с поверхностным клеточным антигеном клетки или заболевания, подвергаемого лечению, таких как опухолевая клетка или злокачественная клетка, например, любым из антигенов-мишеней, описываемых в настоящем документе или известных в данной области.
[0239] В определенных вариантах осуществления опухолевый антиген или молекула клеточной поверхности представляют собой полипептид. В определенных вариантах осуществления опухолевый антиген или молекула клеточной поверхности селективно экспрессированы или сверхэкспрессированы на опухолевых клетках по сравнению с неопухолевыми клетками той же ткани.
[0240] В определенных вариантах осуществления CAR связывается с патоген-специфическим антигеном. В определенных вариантах осуществления CAR специфичны к вирусным антигенами (таким как ВИЧ, HCV, HBV и т.д.), бактериальным антигенам и/или паразитарным антигенам.
[0241] В определенных аспектах компонент антиген-специфического связывания или распознавания связан с одним или несколькими трансмембранными доменами и доменами внутриклеточной сигнализации. В определенных вариантах осуществления CAR содержит трансмембранный домен, слитый с внеклеточным доменом CAR. В одном из вариантов осуществления используют трансмембранный домен, который в природе ассоциирован с одним из доменов CAR. В некоторых случаях, трансмембранный домен выбран или модифицирован посредством замены аминокислот во избежание связывания таких доменов с трансмембранными доменами того же или других поверхностных мембранных белков для минимизации взаимодействия с другими участниками рецепторного комплекса.
[0242] В определенных вариантах осуществления трансмембранный домен получают из природного или из синтетического источника. Когда источник является природным, домен в определенных аспектах получают из любого мембраносвязанного или трансмембранного белка. Трансмембранные области включают трансмембранные области, получаемые из (т.е. содержащие по меньшей мере трансмембранную область(и)) альфа-, бета- или зета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD 16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. Альтернативно, трансмембранный домен в определенных вариантах осуществления является синтетическим. В определенных аспектах синтетический трансмембранный домен преимущественно содержит гидрофобные остатки, такие как лейцин и валин. В определенных аспектах на каждом из концов синтетического трансмембранного домена находится триплет из фенилаланина, триптофана и валина.
[0243] В определенных вариантах осуществления присутствует короткий олиго- или полипептидный линкер, например, линкер длиной от 2 до 10 аминокислот, такой как линкер, содержащий остатки глицина и серина, например, дублет глицин-серин, и формирует связь между трансмембранным доменом и цитоплазматическим доменом передачи сигнала CAR.
[0244] Как правило, CAR включает компонент или компоненты внутриклеточной сигнализации. В определенных вариантах осуществления CAR содержит внутриклеточный компонент комплекса TCR, такой как CD3+-цепь TCR, которая опосредует активацию и цитотоксичность T-клеток, например, дзета-цепь CD3. Таким образом, в определенных аспектах антигенсвязывающая молекула связана с одним или несколькими модулями клеточной сигнализации. В определенных вариантах осуществления модули клеточной сигнализации включают трансмембранный домен CD3, домены внутриклеточной сигнализации CD3 и/или трансмембранные домены других CD. В определенных вариантах осуществления CAR дополнительно содержит часть одной или нескольких дополнительных молекул, таких как Fc-рецептор γ, CD8, CD4, CD25 или CD16. Например, в определенных аспектах CAR содержит химерную молекулу из CD3-дзета (CD3-ζ) или Fc-рецептора γ и CD8, CD4, CD25 или CD16.
[0245] В определенных вариантах осуществления после связывания CAR цитоплазматический домен или домен внутриклеточной сигнализации CAR активирует по меньшей мере одну из нормальных эффекторных функций клети иммунной системы, например, T-клетки подвергнутой инженерии с получением экспрессирующей клетки. Например, в некоторых случаях CAR индуцирует функцию T-клетки, такую как цитолитическая активность или T-хелперная активность, такую как секреция цитокинов или других факторов. Определенные варианты осуществления предполагают укороченную часть домена внутриклеточной сигнализации компонента антигенного рецептора или костимулирующей молекулы. Такую укороченную часть в определенных аспектах используют вместо интактной иммуностимулирующей цепи, например, если она передает сигнал эффекторной функции. В определенных вариантах осуществления домен или домены внутриклеточной сигнализации включают цитоплазматические последовательности T-клеточного рецептора (TCR), а в определенных аспектах также цитоплазматические последовательности корецепторов, которые в природном окружении действуют во взаимодействии с таким рецептором с инициацией передачи сигнала после связывания антигенного рецептора, и/или любое производное или вариант таких молекул, и/или любую синтетическую последовательность, которая обладает той же функциональностью.
[0246] В случае природного TCR полная активация, как правило, требует передачи не только сигнала через TCR, но также и костимулирующего сигнала. Таким образом, в определенных вариантах осуществления для обеспечения полной активации в CAR также включают компонент для генерации вторичного или костимулирующего сигнала. Активация T-клеток в определенных аспектах описана, как опосредуемая двумя классами цитоплазматических сигнальных последовательностей: последовательностями, которые инициируют антиген-зависимую первичную активацию через TCR (первичные цитоплазматические сигнальные последовательности), и последовательностями, которые действуют антиген-независимым образом с обеспечением вторичного или костимулирующего сигнала (вторичные цитоплазматические сигнальные последовательности). В определенных аспектах CAR содержит один или оба таких сигнальных компонента.
[0247] В определенных аспектах Первичная цитоплазматическая сигнальная последовательности может регулировать первичную активацию комплекса TCR стимулирующим образом или ингибирующим образом. Первичная цитоплазматическая сигнальная последовательности, которая действует стимулирующим образом, может содержать сигнальные мотивы, которые известны как иммунорецепторные тирозиновые активирующие мотивы или ITAM. Примеры ITAM, содержащие первичные цитоплазматические сигнальные последовательности, включают ITAM, получаемые из TCR дзета, FcR гамма, FcR бета, CD3 гамма, CD3 дельта, CD3 эпсилон, CDS, CD22, CD79a, CD79b и CD66d. В определенных вариантах осуществления цитоплазматическая сигнальная молекула(ы) в CAR, содержит цитоплазматический сигнальный домен, его часть или последовательность, получаемые из CD3 дзета.
[0248] В определенных вариантах осуществления CAR содержит сигнальный домен и/или трансмембранную часть костимулирующего рецептора, такого как CD28, 4-1BB, OX40, DAP10 и ICOS.
[0249] В определенных вариантах осуществления домен внутриклеточной сигнализации содержит трансмембранный и сигнальный домен CD28, связанный с внутриклеточным доменом CD3. В определенных вариантах осуществления домен внутриклеточной сигнализации содержит химерные костимулирующие домены CD28 и CD137, связанные с внутриклеточным доменом CD3. В определенных вариантах осуществления CAR также содержит маркер трансдукции (например, tEGFR). В определенных вариантах осуществления домен внутриклеточной сигнализации цитотоксических CD8+-T-клеток является таким же, как домен внутриклеточной сигнализации хелперных CD4+-T-клеток. В определенных вариантах осуществления домен внутриклеточной сигнализации цитотоксических CD8+-T-клеток отличается от домена внутриклеточной сигнализации хелперных CD4+-T-клеток.
[0250] В определенных вариантах осуществления CAR содержит два или более костимулирующих домена, комбинированные в цитоплазматической части с активирующим доменом, например, первичным активирующим доменом. Одним из примеров является рецептор, содержащий внутриклеточные компоненты CD3-дзета, CD28 и 4-1BB.
[0251] CAR и его получение и введение могут включать описанное, например, в описаниях опубликованных патентов WO200014257, US6451995, US2002131960, US7446190, US8252592, EP2537416, US2013287748 и WO2013126726, и/или описанное Sadelain et al., Cancer Discov. 2013 April; 3(4): 388-398; Davila et al. (2013) PLoS ONE 8(4): e61338; Turtle et al., Curr. Opin. Immunol., 2012 October; 24(5): 633-39; Wu et al., Cancer, 2012 March 18(2): 160-75.
[0252] В определенных вариантах осуществления T-клетки модифицируют рекомбинантным T-клеточным рецептором. В определенных вариантах осуществления рекомбинантный TCR специфичен к антигену, как правило, антигену, находящемуся на клетке-мишени, такому как опухолеспецифичный антиген, антиген, экспрессируемый на конкретном типе клеток, ассоциированных с аутоиммунным или воспалительным заболеванием, или антиген, происходящий из вирусного патогена или бактериального патогена.
[0253] В определенных вариантах осуществления T-клетки подвергают инженерии с экспрессией T-клеточных рецепторов (TCR), клонированных из природных T-клеток. В определенных вариантах осуществления высокоаффинный T-клеточный клон к антигену-мишени (например, антигену злокачественной опухоли) идентифицируют, выделяют у пациента и вводят в клетки. В определенных вариантах осуществления клон TCR к антигену-мишень получали у трансгенных мышей, подвергнутых инженерии с использованием генов иммунной системы человека (например, система лейкоцитарных антигенов человека или HLA). см., например, опухолевых антигенов (см., например, Parkhurst et al. (2009) Clin. Cancer. Res. 15:169-180 и Cohen et al. (2005) J. Immunol. 175:5799-5808. В определенных вариантах осуществления для выделения TCR к антигену-мишени используют фаговый дисплей (см., например, Varela-Rohena et al. (2008) Nat. Med. 14:1390-1395 и Li (2005) Nat. Biotechnol. 23:349-354.
[0254] В определенных вариантах осуществления после получения T-клеточного клона цепи TCR альфа и бета выделяют и клонируют в генный экспрессирующий вектор. В определенных вариантах осуществления гены TCR альфа и бета связаны посредством рибосомального вставочного пептида пикорнавируса 2A так, что обе цепи коэкспрессируются. В определенных вариантах осуществления генетический перенос TCR проводят посредством ретровирусных или лентивирусных векторов или посредством транспозонов (см., например, Baum et al. (2006) Molecular Therapy: The Journal of the American Society of Gene Therapy. 13:1050-1063; Frecha et al. (2010) Molecular Therapy: The Journal of the American Society of Gene Therapy. 18:1748-1757; an Hackett et al. (2010) Molecular Therapy: The Journal of the American Society of Gene Therapy. 18:674-683.
[0255] В определенных вариантах осуществления перенос генов проводят посредством первой стимуляции роста T-клеток, а затем активированные клетки подвергают трансдукции и растят в культуре до количеств, достаточных для клинического применения.
[0256] В некоторых случаях сверхэкспрессия стимулирующего фактора (например, лимфокина или цитокина) может быть токсична для индивидуума. Таким образом, в некоторых случаях, подвергнутые инженерии клетки содержат генные сегменты, которые обеспечивают чувствительность клеток к отрицательному отбору in vivo, например, после введения при адоптивной иммунотерапии. Например, в определенных аспектах клетки подвергают инженерии так, что они могут быть устранены в результате изменения состояния пациента, которому их вводят in vivo. Подверженный отрицательной селекции фенотип может быть результатом вставки гена, обуславливающего чувствительность к вводимому средству, например, соединению. Обеспечивающие отрицательную селекцию гены включают ген тимидинкиназы вируса простого герпеса типа I (HSV-I TK) (Wigler et al., Cell II:223, I977), который обуславливает чувствительность к ганцикловиру; ген клеточной гипоксантинфосфорибозилтрансферазы (HPRT), ген клеточной аденинфосфорибозилтрансферазы (APRT), ген бактериальной цитозиндезаминазы (Mullen et al., Proc. Natl. Acad. Sci. USA. 89:33 (1992)).
[0257] В определенных аспектах клетки дополнительно подвергают инженерии для обеспечения экспрессии цитокинов, таких как провоспалительные цитокины, например, IL-2, IL-12, IL-7, IL-15, IL-21.
Введение генетически сконструированных компонентов
[0258] Хорошо известны и можно использовать в предоставляемых способах и композициях различные способы введения генетически сконструированных компонентов, например, антигенных рецепторов, например, CAR. Иллюстративные способы включают способы переноса нуклеиновых кислот, кодирующих рецепторы, включая вирусы, например, ретровирусы или лентивирусы, трансдукцию, транспозоны и электропорацию.
[0259] В определенных вариантах осуществления рекомбинантные нуклеиновые кислоты переносят в клетки с использованием рекомбинантных инфекционных вирусных частиц, например, таких как векторы, получаемые из вируса обезьяны 40 (SV40), аденовирусов, аденоассоциированного вируса (AAV). В определенных вариантах осуществления рекомбинантные нуклеиновые кислоты переносят в T-клетки с использованием рекомбинантных лентивирусных векторов или ретровирусных векторов, таких как гамма-ретровирусные векторы (см., например, Koste et al. (2014) Gene Therapy 2014 Apr 3. doi: 10.1038/gt.2014.25; Carlens et al. (2000) Exp Hematol 28(10): 1137-46; Alonso-Camino et al. (2013) Mol Ther Nucl Acids 2, e93; Park et al., Trends Biotechnol. 2011 November; 29(11): 550-557.
[0260] В определенных вариантах осуществления ретровирусный вектор содержит последовательность длинных концевых повторов (LTR), например, ретровирусный вектор, получаемый из вируса лейкоза мышей Молони (MoMLV), миелопролиферативный вирус саркомы (MPSV), вирус эмбриональных стволовых клеток мыши (MESV), вирус стволовых клеток мыши (MSCV), вирус некроза селезенки (SFFV) или аденоассоциированный вирус (AAV). Большинство ретровирусных векторов получают из ретровирусов мышей. В определенных вариантах осуществления ретровирусы включают ретровирусы, получаемые из любого источника клеток птиц или млекопитающих. Как правило, ретровирусы являются амфотропными, что означает, что они способны к инфицированию клеток-хозяев нескольких видов, включая людей. В одном из вариантов осуществления ген, предназначенный для экспрессии, замещает последовательности ретровирусных gag, pol и/или env. Описан ряд иллюстративных ретровирусных систем (например, патенты США №№ 5219740; 6207453; 5219740; Miller and Rosman (1989) BioTechniques 7:980-990; Miller, A. D. (1990) Human Gene Therapy 1:5-14; Scarpa et al. (1991) Virology 180:849-852; Burns et al. (1993) Proc. Natl. Acad. Sci. USA 90:8033-8037 и Boris-Lawrie and Temin (1993) Cur. Opin. Genet. Develop. 3:102-109.
[0261] Способы лентивирусной трансдукции известны. Иллюстративные способы описаны, например, в Wang et al. (2012) J. Immunother. 35(9): 689-701; Cooper et al. (2003) Blood. 101:1637-1644; Verhoeyen et al. (2009) Methods Mol. Biol. 506: 97-114 и Cavalieri et al. (2003) Blood. 102(2): 497-505.
[0262] В определенных вариантах осуществления рекомбинантные нуклеинов кислоты переносят в T-клетки посредством электропорации (см., например, Chicaybam et al, (2013) PLoS One 8(3): e60298 и Van Tedeloo et al. (2000) Gene Therapy 7(16): 1431-1437). В определенных вариантах осуществления рекомбинантные нуклеиновые кислоты переносят в T-клетки посредством транспозиции (см., например, Manuri et al. (2010) Hum. Gene Ther. 21(4): 427-437; Sharma et al. (2013) Molec. Ther. Nucl. Acids. 2, e74; and Huang et al. (2009) Methods Mol. Biol. 506: 115-126). Другие способы внесения и экспрессии генетического материала в клетки иммунной системы включают трансфекцию с фосфатом кальция (например, как описано в Current Protocols in Molecular Biology, John Wiley & Sons, New York. N.Y.), слияние протопластов, катионную опосредованную липосомами трансфекцию; бомбардировка микрочастицами с вольфрамовыми частицами (Johnston, Nature, 346: 776-777 (1990)) и соосаждение ДНК с фосфатом стронция (Brash et al., Mol. Cell Biol., 7: 2031-2034 (1987)).
[0263] В определенных вариантах осуществления в каждый из CD4+- и CD8+-T-лимфоцитов вносят один и тот же CAR. В определенных вариантах осуществления в каждый из CD4+- и CD8+-T-лимфоцитов вносят различные CAR. В определенных вариантах осуществления CAR в каждой из этих популяций содержит антигенсвязывающую молекулу, которая специфически связывается с одним и тем же антигеном. В определенных вариантах осуществления CAR в каждой из этих популяций связывается с различными молекулами. В определенных вариантах осуществления CAR в каждой из этих популяций содержит модули клеточной сигнализации, которые различаются. В определенных вариантах осуществления каждый из CD4+- или CD8+-T-лимфоцитов до трансдукции отсортирован по наивным клеткам, центральным клеткам памяти или эффекторным клеткам.
[0264] В других вариантах осуществления клетки, например, T-клетки, не подвергают инженерии для экспрессии рекомбинантных рецепторов, но вместо этого они содержат природные антигенные рецепторы, специфичные к желаемым антигенам, такие как проникающие в опухоль лимфоциты и/или T-клетки, культивируемые in vitro или ex vivo, например, в течение этапа(ов) инкубации с обеспечением роста клеток с определенной антигенной специфичностью. Например, в определенных вариантах осуществления клетки получают для адоптивной клеточной терапии посредством выделения опухолеспецифичных T-клеток, например, аутологичных проникающих в опухоль лимфоцитов (TIL). Прямое воздействие на опухоли человека с использованием аутологичных проникающих в опухоль лимфоцитов в некоторых случаях может опосредовать регрессию опухоли (см. Rosenberg SA, et al.(1988) N. Engl. J. Med. 319:1676-1680). В определенных вариантах осуществления лимфоциты выделяют из удаленных опухолей. В определенных вариантах осуществления такие лимфоциты выращивают in vitro. В определенных вариантах осуществления такие лимфоциты культивируют с лимфокинами (например, IL-2). В определенных вариантах осуществления такие лимфоциты опосредуют специфический лизис аутологичных опухолевых клеток, но не аллогенных опухолей или аутологичных нормальных клеток.
[0265] В определенных аспектах этапы и/или способы инкубации и/или инженерии, как правило, приводят к желаемому результирующему соотношению (или соотношению, которая находится в пределах допустимых погрешности или отличия от такого соотношения), или обеспечивают его в пределах определенного процента времени проведения этих способов.
D. Криоконсервация
[0266] В определенных вариантах осуществления предоставляемые способы включают этапы замораживания, например, криоконсервации, клеток до или после выделения, инкубации и/или инженерии. В определенных вариантах осуществления этап замораживания и последующего оттаивания удаляет из популяции клеток гранулоциты и до некоторой степени моноциты. В определенных вариантах осуществления клетки суспендируют в растворе для замораживания, например, после этапа отмывки с удалением плазмы и тромбоцитов. В определенных аспектах можно использовать любые из множества известных растворов для замораживания и параметров. Один из примеров включает использование PBS, содержащего 20% DMSO и 8% сывороточный альбумин человека (HSA) или другие подходящие среды для замораживания клеток. Затем их разводят средой 1:1 так, что конечная концентрация DMSO и HSA составляет 10% и 4%, соответственно. Затем клетки замораживают до -80°C со скоростью 1° в минуту и хранят в газовой фазе хранилища с жидким азотом.
II. Наборы и системы
[0267] Также предоставлены системы, аппаратура и наборы, пригодные для проведения предоставляемых способов. В одном из примеров предоставлена единая система, в которой проводят одного или нескольких из этапов выделения, получения клеток, разделения клеток, например, разделение на основе плотности, аффинности, чувствительности к одному или нескольким компонентам или другого свойства, отмывки, обработки, инкубации, культивирования и/или формулирования этих способов. В определенных аспектах систему используют для проведения каждого из этих этапов в замкнутой или стерильной среде, например, для минимизации ошибок, манипуляций пользователя и/или загрязнения. В одном из примеров, система представляет собой систему, как описано в публикации международной патентной заявке № WO2009/072003 или US 20110003380 A1.
[0268] В определенных вариантах осуществления в системе или устройстве проводят один или несколько, например, все этапы выделения, обработки, инженерии и формулирования в интегрированной или замкнутой системе и/или в автоматизированном или программируемом режиме. В определенных аспектах система или устройство включает компьютер и/или компьютерную программу, соединенные с системой или устройством, которые позволяют пользователю программировать, контролировать оценивать результат и/или корректировать различные параметры этапов обработки, выделения, инженерии и формулирования.
[0269] Также предоставлены наборы для проведения предоставляемых способов. В определенных вариантах осуществления наборы содержат антитела или других партнеров по связыванию, как правило, связанные с твердой подложкой, для выделения, например, для основанных на иммуноаффинности этапов разделения этих способов.
[0270] В определенных вариантах осуществления набор содержит антитела для положительного и отрицательного отбора, связанные с магнитными гранулами. В одном из вариантов осуществления набор содержит инструкции для проведения отбор, начиная от образца, такого как образец PBMC, посредством отбора на основе экспрессии первого поверхностного маркера, распознаваемого одним или несколькими антителами, предоставляемыми с набором, сохраняя и положительную и отрицательную фракции. В определенных аспектах инструкции дополнительно включают инструкции для проведения одного или нескольких дополнительных этапов отбора, начиная с положительной и/или отрицательной фракции, полученных на его основе, например, сохраняя композиции в автономной среде и/или в одной и той же разделительной емкости.
[0271] В одном из вариантов осуществления набор содержит антитела к CD4, к CD14, к CD45RA, к CD14 и к CD62L, связанные с магнитными гранулами. В одном из вариантов осуществления набор содержит инструкции для проведения отбора, начиная от образца, такого как образец PBMC, посредством отбора на основе экспрессии CD4, сохранения положительной и отрицательной фракции, и для отрицательной фракции, дополнительного подвергания фракции, отрицательному отбору с использованием антител к CD14, к CD45RA и положительному отбору с использованием антител к CD62L в любом порядке. Альтернативно, компоненты и инструкции корректируют в соответствии с любыми вариантами осуществления разделения, описываемыми в настоящем документе.
[0272] В определенных вариантах осуществления набор дополнительно содержит инструкции по переносу популяций клеток, выделенных на этапах отбора, в емкость для культуры, культивирования или обработки, сохраняя клетки в замкнутой системе. В определенных вариантах осуществления набор содержит инструкции по переносу различных выделенных клеток при конкретном соотношении.
III. Клетки, композиции и способы введения
[0273] Также предоставлены клетки, популяции клеток и композиции (включая фармацевтические и терапевтические композиции), содержащие клетки и популяции, получаемые предоставляемыми способами. Также предоставлены способы, например, терапевтические способы введения клеток и композиций индивидуумам, например, пациентам.
[0274] Предоставлены способы введения клеток, популяций и композиций и применения таких клеток, популяций и композиций для лечения или профилактики заболеваний, патологических состояний и нарушений, включая злокачественные опухоли. В определенных вариантах осуществления клетки, популяции и композиции вводят индивидууму или пациенту с конкретным заболеванием или патологическим состоянием, подлежащим лечению, например, посредством адоптивной клеточной терапии, такой как адоптивная T-клеточная терапия. В определенных вариантах осуществления клетки и композиции, получаемые предоставляемыми способами, такие как подвергнутые инженерии композиции и конечные композиции после инкубации и/или других этапов обработки, вводят индивидууму, такому как индивидуум с заболеванием или патологическим состоянием или с их риском. Таким образом, в определенных аспектах этими способами проводят лечение, например, облегчают один или несколько симптомов заболевания или патологического состояния, например, посредством снижения опухолевой массы у злокачественной опухоли, экспрессирующей антиген, распознаваемый подвергнутыми инженерии T-клетками.
[0275] Способы введения клеток для адоптивной клеточной терапии известны, и их можно использовать по отношению к предоставляемым способам и композициям. Например, способы адоптивной T-клеточной терапии описаны, например, в публикации патентной заявки США № 2003/0170238 Gruenberg et al; патента США № 4690915 Rosenberg; Rosenberg (2011) Nat. Rev. Clin. Oncol. 8(10):577-85). См., например, Themeli et al. (2013) Nat. Biotechnol. 31(10): 928-933; Tsukahara et al. (2013) Biochem. Biophys. Res. Commun. 438(1): 84-9; Davila et al. (2013) PLoS One 8(4): e61338.
[0276] В определенных вариантах осуществления клеточную терапию, например, адоптивную T-клеточную терапию, проводят посредством аутологичного переноса, при котором клетки выделяют и/или иным образом получают у индивидуума, которому проводят клеточную терапию, или из образца, полученного у такого индивидуума. Таким образом, в определенных аспектах клетки получают у индивидуума, например, пациента, нуждающегося в лечении, и клетки после выделения и обработки вводят тому же индивидууму.
[0277] В определенных вариантах осуществления клеточную терапию, например, адоптивную T-клеточную терапию, проводят посредством аллогенного переноса, при котором клетки выделяют и/или иным образом получают у индивидуума, отличного от индивидуума, которому проводят или которому в конечном итоге проводят клеточную терапию, например, у первого индивидуума. В таких вариантах осуществления клетки затем вводят другому индивидууму, например, второму индивидууму того же вида. В определенных вариантах осуществления первый и второй индивидуумы генетически идентичны. В определенных вариантах осуществления первый и второй индивидуумы генетически сходны. В определенных вариантах осуществления второй индивидуум экспрессирует HLA того же класса или супертипа, что и первый индивидуум.
[0278] В определенных вариантах осуществления индивидуум, например, пациент, которому вводят клетки, популяции клеток или композиции, представляет собой млекопитающее, как правило, примата, такого как человек. В определенных вариантах осуществления примат представляет собой человекообразную обезьяну или другую обезьяну. Индивидуум может быть мужского рода или женского рода и может быть любого подходящего возраста, включая грудных детей, детей до пубертатного периода, индивидуумов юношеского периода, взрослых и индивидуумов старческого возраста. В определенных вариантах осуществления индивидуум представляет собой не являющееся приматом млекопитающее, такое как грызун.
[0279] Также предоставлены фармацевтические композиции для применения в таких способах.
[0280] В числе заболеваний, патологических состояний и нарушений для лечения предоставляемыми композициями, клетками, способами и применениями находятся опухоли, включая солидные опухоли, гематологические злокачественные новообразования и меланомы, и инфекционные заболевания, такие как инфекция вирусом или другим патогеном, например, ВИЧ, HCV, HBV, CMV, и паразитарные заболевание. В определенных вариантах осуществления заболевание или патологическое состояние представляет собой опухоль, злокачественную опухоль, злокачественное новообразование, неоплазия или другое пролиферативное заболевание. Такие заболевания в качестве неограничивающих примеров включают лейкоз, лимфому, например, хронический лимфоцитарный лейкоз (CLL), ALL, неходжкинскую лимфому, острый миелолейкоз, множественную миелому, не поддающуюся лечению фолликулярную лимфому, лимфому мантийных клеток, медленно развивающуюся B-клеточную лимфому, B-клеточные злокачественные новообразования, злокачественные опухоли толстой кишки, легких, печени, молочной железы, предстательной железы, яичника, кожи (включая меланому), костей и злокачественную опухоль головного мозга, рак яичника, эпителиальные злокачественные опухоли, почечноклеточную карциному, аденокарциному поджелудочной железы, ходжкинскую лимфому, карциному шейки матки, колоректальный рак, глиобластому, нейробластому, саркому Юинга, медуллобластому, остеосаркому, синовиальную саркому и/или мезотелиому.
[0281] В определенных вариантах осуществления заболевание или патологическое состояние представляют собой инфекционное заболевание или патологическое состояние, в качестве неограничивающих примеров, такое как вирусная, ретровирусная, бактериальная и протозойная инфекция, иммунодефицит, цитомегаловирус (CMV), вирус Эпштейна-Барр (EBV), аденовирус, полиомавирус BK. В определенных вариантах осуществления заболевание или патологическое состояние представляет собой аутоиммунное или воспалительное заболевание или патологическое состояние, такое как артрит, например, ревматоидный артрит (RA), диабет I типа, системная красная волчанка (SLE), воспалительное заболевание кишечника, псориаз, склеродермия, аутоиммунное заболевание щитовидной железы, болезнь Грейва, болезнь Крона рассеянный склероз, астма и/или заболевание или патологическое состояние, ассоциированное с трансплантатом.
[0282] В определенных вариантах осуществления антиген, ассоциированный с заболеванием или нарушением выбран из группы, состоящей из орфанной рецепторной тирозинкиназы RORl, tEGFR, Her2, Ll-CAM, CD19, CD20, CD22, мезотелина, CEA и поверхностного антигена гепатита B, рецептора антифолатов, CD23, CD24, CD30, CD33, CD38, CD44, EGFR, EGP-2, EGP-4, 0EPHa2, ErbB2, 3 или 4, FBP, эмбрионального рецептора ацетилхолина e, GD2, GD3, HMW-MAA, IL-22R-альфа, IL-13R-alpha2, kdr, легкой цепи каппа, антигена Lewis Y, молекулы клеточной адгезии L1, MAGE-A1, мезотелина, MUC1, MUC16, PSCA, лигандов NKG2D, NY-ESO-1, MART-1, gp100, онкофетального антигена, ROR1, TAG72, VEGF-R2, раково-эмбрионального антигена (CEA), специфического антигена предстательной железы, PSMA, Her2/neu, рецептора эстрогенов, рецептора прогестерона, ephrinB2, CD123, CS-1, c-Met, GD-2 и MAGE A3 и/или биотинилированных молекул, и/или молекул, экспрессируемых ВИЧ, HCV, HBV или другими патогенами.
[0283] В определенных вариантах осуществления клетки и композиции вводят индивидууму в форме фармацевтической композиции, такой как композиция, содержащая клетки или популяции клеток и фармацевтически приемлемый носитель или эксципиент. В определенных вариантах осуществления фармацевтические композиции дополнительно содержат другие фармацевтически активные средства или лекарственные средства, такие как химиотерапевтические средства, например, аспарагиназу, бусульфан, карбоплатин, цисплатин, даунорубицин, доксорубицин, фторурацил, гемцитабин, гидроксимочевину, метотрексат, паклитаксел, ритуксимаб, винбластин, винкристин и т.д. В определенных вариантах осуществления средства вводят в форме соли, например, фармацевтически приемлемой соли. Подходящие фармацевтически приемлемые соли присоединения кислот включают соли присоединения кислот, получаемые из неорганических кислот, таких как соляная, бромистоводородная, фосфорная, метафосфорная, азотная и серная кислоты, и органических кислот, таких как винная, уксусная, лимонная, яблочная, молочнаяая, фумаровая, бензойная, гликолевая, глюконовая, янтарная и арилсульфоновая кислоты, например, п-толуолсульфоновая кислота.
[0284] Выбор носителя в фармацевтической композиции частично определен конкретным сконструированным CAR или TCR, вектором или клетками, экспрессирующими CAR или TCR, а также конкретным способом, применяемым для введения вектора, или клетками-хозяевами, экспрессирующими CAR. Таким образом, существует множество подходящих составов. Например, фармацевтическая композиция может содержать консерванты. Подходящие консерванты могут включать, например, метилпарабен, пропилпарабен, бензоат натрия и хлорид бензалкония. В определенных аспектах используют смесь двух или более консервантов. Как правило, консервант или их смеси присутствует в количестве приблизительно от 0,0001% до приблизительно 2% по массе от общей композиции.
[0285] Кроме того, в определенных аспектах в композицию включены буферные средства. Подходящие буферные средства включают, например, лимонную кислоту, цитрат натрия, фосфорную кислоту, фосфат калия и другие различные кислоты и соли. В определенных аспектах используют смесь двух или более буферных средств. Буферное средство или их смеси, как правило, присутствуют в количестве приблизительно от 0,001% до приблизительно 4% по массе от общей композиции. Способы получения вводимых фармацевтических композиций известны. Иллюстративные способы более подробно описаны, например, в Remington: The Science and Practice of Pharmacy, Lippincott Williams & Wilkins; 21st ed. (1 мая 2005 года).
[0286] В определенных вариантах осуществления фармацевтическую композицию формулируют как комплекс включения, такой как циклодекстриновый комплекс включения, или виде липосом. Липосомы могут служить для направления клеток-хозяев (например, T-клеток или NK-клеток) в конкретную ткань. Для получения липосом доступно множество способов, таких как способы, описанные, например, в Szoka et al., Ann. Rev. Biophys. Bioeng., 9: 467 (1980) и в патентах США 4235871, 4501728, 4837028 и 5019369.
[0287] В определенных вариантах осуществления в фармацевтической композиции используют системы доставки с замедленным высвобождением, отсроченным высвобождением и/или длительным высвобождением так, что доставка композиции происходит до сенсибилизации обрабатываемого участка и в течение достаточного времени для ее вызова. Доступно и известно специалистам в данной области множество типов систем доставки с замедленным высвобождением. Такие системы в определенных аспектах могут обеспечить устранение необходимости в повторных введениях композиции, таким образом, увеличивая удобство индивидууму и врачу.
[0288] В определенных вариантах осуществления фармацевтическая композиция содержит клетки или популяции клеток в количестве, которое является эффективным для лечения или профилактики заболевания или патологического состояния, такое как терапевтически эффективное или профилактически эффективное количество. Таким образом, в определенных вариантах осуществления способы введения включают введение клеток и популяций в эффективных количествах. В определенных вариантах осуществления терапевтическую или профилактическую эффективность контролируют посредством периодических оценок подвергаемых лечению индивидуумов. При повторных введениях в течение нескольких суток или долее, в зависимости от патологического состояния, лечение повторяют до обеспечения желаемого подавления симптомов заболевания. Однако могут пригодными и можно определить другие режимы дозирования. Желаемую дозу можно доставлять посредством одного болюсного введения композиции, посредством нескольких болюсных введений композиции или посредством непрерывного вливания композиции.
[0289] В определенных вариантах осуществления клетки вводят в желаемой дозе, которая в определенных аспектах содержит желаемые дозу или количество клеток или тип(ы) клеток и/или желаемое соотношение типов клеток. Таким образом, в определенных вариантах осуществления доза клеток основана на общем количестве клеток (или количестве на кг массы тела) и желаемого соотношения отдельных популяций или подтипов, такого как соотношение CD4+- и CD8+-клеток. В определенных вариантах осуществления доза клеток основана на желаемом общем количестве (или количестве на кг массы тела) клеток в отдельных популяциях или отдельных типов клеток. В определенных вариантах осуществления доза основана на комбинации таких характеристик, например, желаемого количества всех клеток, желаемого соотношения и желаемого общего количества клеток в отдельных популяциях.
[0290] В определенных вариантах осуществления популяции или подтипы клеток, такие как CD8+- и CD4+-T-клетки, вводят с допустимым отличием или в пределах допустимого отличия от желаемой дозы всех клеток, такой как желаемая доза T-клеток. В определенных аспектах желаемая доза представляет собой желаемое количество клеток или желаемое количество клеток на единицу массы тела индивидуума, которому вводят клетки, например, клеток/кг. В определенных аспектах желаемая доза находится на уровне или выше минимального количества клеток или минимального количества клеток на единицу массы тела. В определенных аспектах в числе всех клеток, вводимых в желаемой дозе, индивидуальные популяции или подтипы присутствуют в или приблизительно в желаемом результирующем соотношении (таком как соотношение CD4+- и CD8+-клеток), например, в пределах определенных допустимых отличий или погрешности такого соотношения.
[0291] В определенных вариантах осуществления клетки вводят с допустимым отличием или в пределах допустимого отличия от желаемой дозы одной или нескольких отдельных популяций или подтипов клеток, такой как желаемая доза CD4+-клеток и/или желаемая доза CD8+-клеток. В определенных аспектах желаемая доза представляет собой желаем количество клеток определенных подтипа или популяции или желаемое количество таких клеток на единицу массы тела индивидуума, которому вводят клетки, например, клеток/кг. В определенных аспектах желаемая доза составляет или превышает минимальное количество клеток популяции или подтипа или минимальное количество клеток популяции или подтипа на единицу массы тела.
[0292] Таким образом, в определенных вариантах осуществления доза основана на желаемой фиксированной дозе всех клеток и желаемом соотношении и/или на основе желаемой фиксированной дозе одного или нескольких, например, каждого отдельных подтипов или субпопуляций. Таким образом, в определенных вариантах осуществления доза основана на желаемой фиксированной или минимальной дозе T-клеток и желаемом соотношении CD4+- и CD8+-клеток и/или основана на желаемой фиксированной или минимальной дозе CD4+- и/или CD8+-клеток.
[0293] В определенных вариантах осуществления клетки или отдельные популяции подтипов клеток, вводят индивидууму в диапазоне приблизительно от одного миллиона до приблизительно 100 миллиардов клеток, например, в таком как от 1 миллиона до приблизительно 50 миллиардов клеток (например, приблизительно 5 миллионов клеток, приблизительно 25 миллионов клеток, приблизительно 500 миллионов клеток, приблизительно 1 миллиард клеток, приблизительно 5 миллиардов клеток, приблизительно 20 миллиардов клеток, приблизительно 30 миллиардов клеток, приблизительно 40 миллиардов клеток или в диапазоне, определенном любыми двумя из указанных выше значений), в таком как приблизительно от 10 миллион до приблизительно 100 миллиардов клеток (например, приблизительно 20 миллионов клеток, приблизительно 30 миллионов клеток, приблизительно 40 миллионов клеток, приблизительно 60 миллионов клеток, приблизительно 70 миллионов клеток, приблизительно 80 миллионов клеток, приблизительно 90 миллионов клеток, приблизительно 10 миллиардов клеток, приблизительно 25 миллиардов клеток, приблизительно 50 миллиардов клеток, приблизительно 75 миллиардов клеток, приблизительно 90 миллиардов клеток или в диапазоне, определенном любыми двумя из указанных выше значений), а в некоторых случаях приблизительно от 100 миллионов клеток до приблизительно 50 миллиардов клеток (например, приблизительно 120 миллионов клеток, приблизительно 250 миллионов клеток, приблизительно 350 миллионов клеток, приблизительно 450 миллионов клеток, приблизительно 650 миллионов клеток, приблизительно 800 миллионов клеток, приблизительно 900 миллионов клеток, приблизительно 3 миллиардов клеток, приблизительно 30 миллиардов клеток, приблизительно 45 миллиардов клеток) или в любом значении между этими диапазонами.
[0294] В определенных вариантах осуществления доза всех клеток и/или доза отдельных субпопуляций клеток находится в диапазоне от или приблизительно от 104 до или приблизительно до 109 клеток/килограмм (кг) массы тела, например, от 105 до 106 клеток/кг массы тела, например, в количестве или приблизительно в количестве 1×105 клеток/кг, 1,5×105 клеток/кг, 2×105 клеток/кг или 1×106 клеток/кг массы тела. Например, в определенных вариантах осуществления клетки вводят в количестве, или в пределах определенного диапазона погрешности от или приблизительно от 104 до или приблизительно до 109 T-клеток/килограмм (кг) масса тела, например, от 105 до 106 T-клеток/кг массы тела, например, в количестве или приблизительно в количестве 1×105 T-клеток/кг, 1,5×105 T-клеток/кг, 2×105 T-клеток/кг или 1×106 T-клеток/кг массы тела.
[0295] В определенных вариантах осуществления клетки вводят в количестве или в пределах определенного диапазона погрешности от или приблизительно от 104 до или приблизительно до 109 CD4+- и/или CD8+-клеток/килограмм (кг) масса тела, например, от 105 до 106 CD4+- и/или CD8+клеток/кг массы тела, например, в количестве или приблизительно в количестве 1×105 CD4+- и/или CD8+-клеток/кг, 1,5×105 CD4+- и/или CD8+-клеток/кг, 2×105 CD4+- и/или CD8+-клеток/кг или 1×106 CD4+- и/или CD8+-клеток/кг массы тела.
[0296] В определенных вариантах осуществления клетки вводят в количестве, или в пределах определенного диапазона погрешности, более и/или по меньшей мере приблизительно 1×106, приблизительно 2,5×106, приблизительно 5×106, приблизительно 7,5×106 или приблизительно 9×106 CD4+-клеток, и/или по меньшей мере приблизительно 1×106, приблизительно 2,5×106, приблизительно 5×106, приблизительно 7,5×106 или приблизительно 9×106 CD8+-клеток, и/или по меньшей мере приблизительно 1×106, приблизительно 2,5×106, приблизительно 5×106, приблизительно 7,5×106 или приблизительно 9×106 T-клеток. В определенных вариантах осуществления клетки вводят в количестве, или в пределах определенного диапазона погрешности, приблизительно от 108 до 1012 или приблизительно от 1010 до 1011 T-клеток, приблизительно от 108 до 1012 или приблизительно от 1010 до 1011 CD4+-клеток, и/или приблизительно от 108 до 1012 или приблизительно от 1010 до 1011 CD8+-клеток.
[0297] В определенных вариантах осуществления клетки вводят в количестве или в пределах переносимого диапазона от желаемого результирующего соотношения нескольких популяций или подтипов клеток, таких как CD4+- и CD8+-клетки или их подтипы. В определенных аспектах желаемое соотношение может составлять конкретное соотношение или может находиться в диапазоне соотношений. Например, в определенных вариантах осуществления желаемое соотношение (например, соотношение CD4+- и CD8+-клеток) составляет от или приблизительно от 5:1 до или приблизительно до 5:1 (или более чем приблизительно 1:5 и менее чем приблизительно 5:1), или от или приблизительно от 1:3 до или приблизительно до 3:1 (или более чем приблизительно 1:3 и менее чем приблизительно 3:1), например, от или приблизительно от 2:1 до или приблизительно до 1:5 (или более чем приблизительно 1:5 и менее чем приблизительно 2:1, например, составляет или приблизительно составляет 5:1, 4,5:1, 4:1, 3,5:1, 3:1, 2,5:1, 2:1, 1,9:1, 1,8:1, 1,7:1, 1,6:1, 1,5:1, 1,4:1, 1,3:1, 1,2:1, 1,1:1, 1:1, 1:1,1, 1:1,2, 1:1,3, 1:1,4, 1:1,5, 1:1,6, 1:1,7, 1:1,8, 1:1,9: 1:2, 1:2,5, 1:3, 1:3,5, 1:4, 1:4,5 или 1:5. В определенных аспектах допустимое отличие находится в пределах приблизительно 1%, приблизительно 2%, приблизительно 3%, приблизительно 4% приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50% от желаемого соотношения, включая любое значение в пределах этих диапазонов.
[0298] В определенных вариантах осуществления популяции и композиции клеток вводят индивидууму стандартными способами введения, включая пероральное, внутривенное, интраперитонеальное, подкожное, ингаляционное, трансдермальное, внутримышечное, интраназальное, буккальное, сублингвальное введение или введение посредством суппозиториев. В определенных вариантах осуществления популяции клеток вводят парентерально. Как используют в настоящем документе, термин "парентеральное" включает внутривенное, внутримышечное, подкожное, ректальное, вагинальное и интраперитонеальное введение. В определенных вариантах осуществления популяции клеток вводят индивидууму с использованием периферической системной доставки посредством внутривенной, интраперитонеальной или подкожной инъекции.
[0299] В определенных вариантах осуществления популяции клеток, получаемые способами, описываемыми в настоящем документе, вводят совместно с одним или несколькими дополнительными терапевтическими средствами или в связи с другим терапевтическим вмешательством, одновременно или последовательно в любом порядке. В некоторых случаях клетки совместно вводят с другим лечебным средством достаточно близко по времени, чтобы популяции клеток усиливали действие одного или нескольких дополнительных терапевтических средств или наоборот. В определенных вариантах осуществления популяции клеток вводят перед одним или несколькими дополнительными терапевтическими средствами. В определенных вариантах осуществления популяции клеток вводят после одного или нескольких дополнительных терапевтических средств.
[0300] В определенных вариантах осуществления после введения клеток определяют биологическую активность подвергнутых инженерии популяций клеток, например, любым из ряда известных способов. Параметры для оценки включают специфическое связывание подвергнутых инженерии или природных T-клеток или других клеток иммунной системы с антигеном in vivo, например, посредством визуализации, или ex vivo, например, посредством ELISA или проточной цитометрии. В определенных вариантах осуществления можно определять способность подвергнутых инженерии клеток разрушать клетки-мишени любым подходящим известным в данной области способом, таким как анализы цитотоксичности, описанные, например, в Kochenderfer et al., J. Immunotherapy, 32(7): 689-702 (2009) и Herman et al. J. Immunological Methods, 285(1): 25-40 (2004). В определенных вариантах осуществления биологическую активность клеток определяют посредством анализа экспрессии и/или секреции одного или нескольких цитокинов, таких как CD107a, IFNγ, IL-2 и TNF. В определенных аспектах биологическую активность определяют посредством оценки клинического исхода, такого как снижение массы опухоли или опухолевой нагрузки.
[0301] В определенных вариантах осуществления подвергнутые инженерии клетки любым количеством способов дополнительно модифицируют так, чтобы возрастала их терапевтическая или профилактическая эффективность. Например, сконструированные CAR или TCR, экспрессируемые популяцией, можно прямо или опосредовано через линкер конъюгировать с поражающей молекулой. Практическое осуществление конъюгации соединений, например, CAR или TCR, с поражающими молекулами известно в данной области. См., например, Wadwa et al., J. Drug Targeting 3: 1 1 1 (1995) и патент США 5087616.
VI. Определения
[0302] Как используют в настоящем документе, если из контекста явно не следует иначе, формы единственного числа включают указание на множественное. Например, формы единственного числа означают "по меньшей мере один" или "один или несколько".
[0303] На всем протяжении настоящего описания различные аспекты заявляемого объекта изобретения представлены в формате диапазонов. Следует понимать, что описание в формате диапазонов предоставлено исключительно для удобства и краткости, и его не следует рассматривать как неизменное ограничение области заявляемого объекта изобретения. Таким образом, описание диапазона следует рассматривать как конкретное описание всех возможных поддиапазонов, а также отдельных числовых значений в диапазоне. Например, когда предоставлен диапазон значений, следует понимать, что каждое промежуточное значение между верхним и нижним пределами диапазона и любое другое указанное или промежуточное значение в указанном диапазоне включено в заявляемый объект изобретения. Верхний и нижний пределы этих более узких диапазонов могут быть независимо включены в более узкие диапазоны и также находятся в заявляемом объекте изобретения с условием любого конкретно исключенного предела указанного диапазона. Когда указанный диапазон включает один или оба предела, диапазоны, исключающие любой или оба из этих исключенных пределов, также включены в заявляемый объект изобретения. Это применимо вне зависимости от ширины диапазона.
[0304] Как используют в настоящем документе, термин "приблизительно" относится к обычному интервалу погрешностей для соответствующего значения хорошо известного специалисту в этой области техники. Указание "приблизительного" значения или параметра в настоящем документе включает (и описывает) варианты осуществления, которые относятся к самому этому значению или параметру.
[0305] Как используют в настоящем документе, если из контекста явно не следует иначе, формы единственного числа включают указание на множественное. Например, формы единственного числа означают "по меньшей мере один" или "один или несколько".
[0306] На всем протяжении настоящего описания различные аспекты заявляемого объекта изобретения представлены в формате диапазонов. Следует понимать, что описание в формате диапазонов предоставлено исключительно для удобства и краткости, и его не следует рассматривать как неизменное ограничение области заявляемого объекта изобретения. Таким образом, описание диапазона следует рассматривать как конкретное описание всех возможных поддиапазонов, а также отдельных числовых значений в диапазоне. Например, когда предоставлен диапазон значений, следует понимать, что каждое промежуточное значение между верхним и нижним пределами диапазона и любое другое указанное или промежуточное значение в указанном диапазоне включено в заявляемый объект изобретения. Верхний и нижний пределы этих более узких диапазонов могут быть независимо включены в более узкие диапазоны и также находятся в заявляемом объекте изобретения с условием любого конкретно исключенного предела указанного диапазона. Когда указанный диапазон включает один или оба предела, диапазоны, исключающие любой или оба из этих исключенных пределов, также включены в заявляемый объект изобретения. Это применимо вне зависимости от ширины диапазона.
[0307] Как используют в настоящем документе, "процент (%) идентичности аминокислотных последовательностей" и "процент идентичности", при их использовании в отношении аминокислотной последовательности (эталонной полипептидной последовательности) определен как процентное содержание аминокислотных остатков в последовательности-кандидате (например, мутеине стрептавидина), которые идентичны с аминокислотными остатками в эталонной полипептидной последовательности после выравнивания последовательностей и внесения, если необходимо, пропусков для достижения максимума процента идентичности последовательностей, и не рассматривая никакие консервативные замены как часть идентичности последовательностей. Выравнивание с целями определения процента идентичности аминокислотных последовательностей можно проводить различными способами, которые известны специалистам в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять подходящие для выравнивания последовательностей параметры, включая любые алгоритмы, необходимые для достижения максимального выравнивания сравниваемых полноразмерных последовательностей.
[0308] Замена аминокислот может включать замену одной кислоты в полипептиде другой аминокислотой. Как правило, аминокислоты можно группировать в соответствии с указанными ниже общими свойствами боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислые: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
[0309] Неконсервативные аминокислотные замены включают замену представителя одного из этих классов представителем другого класса.
[0310] Как используют в настоящем документе, индивидуум включает любой живой организм, такой как люди и другие млекопитающие. Млекопитающие в качестве неограничивающих примеров включают людей и не являющихся человеком животных, включая сельскохозяйственных животных, спортивных животных, грызунов и домашних животных.
[0311] Как используют в настоящем документе, композиция относится к любой смеси двух или более продуктов, веществ или соединений, включая клетки. Она может представлять собой раствор, суспензию, жидкость, порошок, пасту, водную композицию, неводную композицию или любое их сочетание.
[0312] Как используют в настоящем документе, "обеднение" при употреблении в отношении одного или нескольких конкретных типов клеток или популяций клеток, относится к уменьшению количества или процентного содержания этих типов клеток или популяций, например, по сравнению с общим количеством клеток в композиции или объеме композиции или относительно других типов клеток, например, посредством отрицательного отбора на основе маркеров, экспрессируемых популяцией или клеткой, или посредством положительного отбора на основе маркера, не присутствующего на популяции клеток или клетке, обеднение которых необходимо. Термин не требует полного устранения клеток, типа клеток или популяции из композиции.
[0313] Как используют в настоящем документе, "обогащение" при употреблении в отношении одного или нескольких конкретных типов клеток или популяций клеток, относится к увеличению количества или процентного содержания этих типов клеток или популяций, например, по сравнению с общим количеством клеток в композиции или объеме композиции или относительно других типов клеток, например, посредством положительного отбора на основе маркеров, экспрессируемых популяцией или клеткой, или посредством отрицательного отбора на основе маркера, не присутствующего в популяции клеток или в клетке, обеднение которых необходимо. Термин не требует полного устранения других клеток, типа клеток или популяций из композиции и не требует, чтобы таким образом обогащаемые клетки присутствовали в обогащенной композиции в доле или даже приблизительно в доле, составляющей 100%.
[0314] Как используют в настоящем документе, термины "лечение", "лечить" и "излечение" относятся к полному или частичному улучшению состояния или ослаблению заболевания или патологического состояния или нарушения, или симптома, побочного действия или исхода, или ассоциированного с ними фенотипа. В определенных вариантах осуществления действие является терапевтическим так, что оно частично или полностью излечивает заболевание или патологическое состояние или свойственный для него неблагоприятный симптом.
[0315] Как используют в настоящем документе, "терапевтически эффективное количество" соединения или композиции или комбинации относится к количеству, в дозах и в течение необходимых периодов времени эффективному для достижения желаемого терапевтического результата, такого как для лечения заболевания, патологического состояния или нарушения, и/или фармакокинетического или фармакодинамического эффекта лечения. Терапевтически эффективное количество может варьировать в зависимости от таких факторов, как состояние болезни, возраст, пол и масса индивидуума и популяции вводимых клеток.
[0316] Как используют в настоящем документе, указание, что клетка или популяция клеток являются "положительными" по конкретному маркеру относится к детектируемому присутствию конкретного маркера на клетке или в клетке, как правило, поверхностного маркера. При указании поверхностного маркера, термин относится к наличию поверхностной экспрессии, как детектируют посредством проточной цитометрии, например, посредством окрашивания антителом, которое специфически связывается с маркером, и детекции указанного антитела, где окрашивание детектируют проточной цитометрией на уровне, значительно большем, чем окрашивание, детектируемое при проведении того же способа с совпадающим по изотипу контролем или контролем пропускания при детекции флуоресценции минус один (FMO) с остальными идентичными условиями, и/или на уровне, по существу сходном с уровнем для клеток, для которых известно, что они положительны по этому маркеру, и/или на уровне, значительно большем, чем уровень для клеток, для которых известно, что они отрицательны по маркеру.
[0317] Как используют в настоящем документе, указание, что клетка или популяция клеток являются "отрицательными" по конкретному маркер относится к отсутствию значимого детектируемого присутствия конкретного маркера на клетке или в клетке, как правило, поверхностного маркера. При указании поверхностного маркера, термин относится к отсутствию поверхностной экспрессии, как детектируют посредством проточной цитометрии, например, посредством окрашивания антителом, которое специфически связывается с маркером, и детекции указанного антитела, где окрашивание не детектируют проточной цитометрией на уровне, значительно большем, чем окрашивание, детектируемое при проведении того же способа с совпадающим по изотипу контролем или контролем пропускания при детекции флуоресценции минус один (FMO) с остальными идентичными условиями, и/или на уровне значительно меньшем, чем уровень для клеток, для которых известно, что они положительны по этому маркеру, и/или на уровне по существу сходном по сравнению с уровнем для клеток, для которых известно, что они отрицательны по этому маркеру.
[0318] В определенных вариантах осуществления снижение экспрессии одного или нескольких маркеров относится к потере 1 log10 средней интенсивности флуоресценции и/или снижению процента клеток, которые несут маркер, по меньшей мере приблизительно до 20% клеток, 25% клеток, 30% клеток, 35% клеток, 40% клеток, 45% клеток, 50% клеток, 55% клеток, 60% клеток, 65% клеток, 70% клеток, 75% клеток, 80% клеток, 85% клеток, 90% клетки, 95% клеток и 100% клеток и любого % от 20 до 100% при сравнении с эталонной популяцией клеток. В определенных вариантах осуществления популяция клеток положительных по одному или нескольким маркерам относится к процентному содержанию клеток, которые несут маркер в количестве по меньшей мере приблизительно до 50% клеток, 55% клеток, 60% клеток, 65% клеток, 70% клеток, 75% клеток, 80% клеток, 85% клеток, 90% клетки, 95% клеток, и 100% клеток и любого % от 50 до 100% при сравнении с эталонной популяцией клеток.
V. Иллюстративные варианты осуществления
[0319] В числе вариантов осуществления, предоставляемых по настоящему документу находятся:
1. Способ обогащения CD4+- или CD8+-T-клеток, где способ включает:
(a) проведение в замкнутой системе первого отбора, где указанный первый отбор включает обогащение одного типа из (i) CD4+-клеток и (ii) CD8+-клеток из образца, содержащего первичные T-клетки человека, где обогащение, таким образом, позволяет получать первую популяцию отобранных клеток и популяцию неотобранных клеток; и
(b) проведение в замкнутой системе второго отбора, где указанный второй отбор включает обогащение другого типа из (i) CD4+-клеток и (ii) CD8+-клеток из популяции неотобранных клеток, где обогащение, таким образом, позволяет получать вторую популяцию отобранных клеток,
где способ позволяет получать обогащенную композицию, которая обогащена CD4+-клетками и CD8+-клетками и содержит клетки первой популяции отобранных клеток и клеток второй популяции отобранных клеток.
2. Способ по варианту осуществления 1, дополнительно включающий (c) комбинирование клеток первой популяции отобранных клеток и клеток второй популяции отобранных клеток, таким образом, получая обогащенную композицию, и/или где CD4+- и CD8+-клетки в обогащенной композиции находятся в инициирующем культуру соотношении CD4+-клеток и CD8+-клеток.
3. Способ по варианту осуществления 2, где указанное комбинирование проводят в замкнутой системе.
4. Способ получения генетически сконструированных T-клеток, где способ включает:
(a) проведение в замкнутой системе первого отбора, где указанный первый отбор включает обогащение одного типа из (i) CD4+-клеток и (ii) CD8+-клеток из образца, содержащего первичные T-клетки человека, где обогащение, таким образом, позволяет получать первую популяцию отобранных клеток и популяцию неотобранных клеток; и
(b) проведение в замкнутой системе второго отбора, где указанный второй отбор включает обогащение другого типа из (i) CD4+-клеток и (ii) CD8+-клеток из популяции неотобранных клеток, где обогащение, таким образом, позволяет получать вторую популяцию отобранных клеток;
(c) инкубацию инициирующей культуру композиции, которая содержит клетки первой популяции отобранных клеток и клеток второй популяции отобранных клеток, в емкости для культивирования в стимулирующих условиях, получая, таким образом, стимулированные клетки; и
(d) введение в стимулированные клетки, полученные в (c), генетически сконструированного антигенного рецептора,
где способ, таким образом, позволяет получать результирующую композицию, содержащую CD4+-T-клетки и CD8+-T-клетки, экспрессирующие генетически сконструированный антигенный рецептор.
5. Способ по варианту осуществления 4, дополнительно включающий перед этапом (c) комбинирование клеток первой и второй популяций выбранных клеток с получением инициирующей культуру композиции, и/или где CD4+- и CD8+-клетки в инициирующей культуру композиции присутствуют в инициирующем культуру соотношении CD4+-клеток и CD8+-клеток.
6. Способ по варианту осуществления 5, где указанное комбинирование проводят в замкнутой системе.
7. Способ по любому из вариантов осуществления 1-6, где один или несколько этапов проводят в автоматизированном режиме, и/или где замкнутая система является автоматизированной.
8. Способ по любому из вариантов осуществления 2-7, где инициирующее культуру соотношение CD4+- и CD8+-клеток составляет от или приблизительно от 10:1 до или приблизительно до 1:10, от или приблизительно от 5:1 до или приблизительно до 1:5 или от или приблизительно от 2:1 до или приблизительно до 1:2.
9. Способ по любому из вариантов осуществления 2-8, где инициирующее культуру соотношение CD4+- и CD8+-клеток составляет или приблизительно составляет 1:1.
10. Способ по любому из вариантов осуществления 2-6, где образец получают у человека и:
инициирующее культуру соотношение CD4+- и CD8+-клеток отличается от соотношения CD4+- и CD8+-клеток в образце, полученном у индивидуума; и/или
инициирующее культуру соотношение CD4+- и CD8+-клеток является по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, или по меньшей мере на 50% большим или меньшим, чем соотношение CD4+- и CD8+-клеток в образце, полученном у индивидуума.
11. Способ по любому из вариантов осуществления 1-10, где обогащение клеток в первом и/или втором отборах включает проведение положительного отбора или отрицательного отбора на основе экспрессии поверхностного клеточного маркера.
12. Способ по варианту осуществления 11, где обогащение клеток в первом и/или втором отборах включает отрицательный отбор, который включает обеднение клеток, экспрессирующих не принадлежащий T-клеткам поверхностный маркер.
13. Способ по варианту осуществления 12, где не принадлежащий T-клеткам маркер включает CD14.
14. Способ по любому из вариантов осуществления 1-13, где обогащение клеток в первом или втором отборах включает проведение ряда этапов положительного или отрицательного отбора на основе экспрессии поверхностного клеточного маркера или маркеров с обогащением CD4+- или CD8+-клеток.
15. Способ по любому из вариантов осуществления 1-14, где обогащение клеток в первом и/или втором отборах включает основанный на иммуноаффинности отбор.
16. Способ по варианту осуществления 15, где основанный на иммуноаффинности отбор проводят посредством контакта клеток с антителом, способным к специфическому связыванию с поверхностным клеточным маркером и выделения клеток, связанных с антителом, таким образом, проводя положительный отбор, или выделение клеток, не связанных с антителом, таким образом, проводя отрицательный отбор, где выделенные клетки обогащены CD4+-клетками или CD8+-клетками и антитело иммобилизовано на магнитной частице.
17. Способ по любому из вариантов осуществления 1-13, где первый отбор и второй отбор проводят в раздельных емкостях для разделения, которые функционально связаны.
18. Способ по варианту осуществления 17, где емкости для разделения функционально связаны посредством трубок.
19. Способ по любому из вариантов осуществления 15-18, где основанный на иммуноаффинности отбор проводят посредством контакта клеток с антителом, иммобилизованным на аффинном хроматографическом матриксе или связанным с ним, где указанное антитело способно к специфическому связыванию с поверхностным клеточным маркером, с проведением положительного или отрицательного отбора CD4+- или CD8+-клеток.
20. Способ по варианту осуществления 19, где:
антитело дополнительно содержит одного или нескольких партнеров по связыванию, способных к формированию обратимой связи со связывающим реагентом, иммобилизованном на матриксе, в соответствии с чем антитело в течение указанного контакта обратимо связывается с указанным матриксом; и
клетки, экспрессирующие поверхностный клеточный маркер, специфически связанные антителом на указанном матриксе, можно выделять из матрикса посредством разрушения обратимого связывания между связывающим реагентом и партнером по связыванию.
21. Способ по варианту осуществления 17, где:
партнер по связыванию выбран из числа биотина, аналога биотина и пептида, способного к связыванию со связывающим реагентом; и
связывающий реагент выбран из числа стрептавидина, аналога или мутеина стрептавидина, авидина и аналога или мутеина авидина.
22. Способ по варианту осуществления 21, где:
партнер по связыванию содержит последовательность аминокислот, приведенную в SEQ ID NO:6; и/или
связывающий реагент представляет собой мутеин стрептавидина содержащий последовательность аминокислот, приведенную в SEQ ID NO: 12, 13, 15 или 16.
23. Способ по любому из вариантов осуществления 19-21, дополнительно включающий после контакта клеток в образце с аффинным хроматографическим матриксом в первом отборе и/или втором отборе применение конкурирующего реагента для разрушения связи между партнером по связыванию и связывающим реагентом, таким образом, выделяя выбранные клетки из матрикса.
24. Способ по варианту осуществления 23, где конкурирующий реагент представляет собой биотин или аналог биотина.
25. Способ по любому из вариантов осуществления 20-24, где константа скорости диссоциации (koff) антитела или антител в первом и/или втором отборах для связывания антитела и поверхностного клеточного маркера составляет более или приблизительно более 3×10-5 сек-1.
26. Способ по любому из вариантов осуществления 20-25, где антитело или антитела в первом и/или втором отборах обладают аффинностью к поверхностному клеточному маркеру с константой диссоциации (Kd) в диапазоне приблизительно от 10-3 до 10-7 или в диапазоне приблизительно от 10-7 до приблизительно 10-10.
27. Способ по любому из вариантов осуществления 20-26, где хроматографический матрикс в первом и/или втором отборах упакован в емкости для разделения, которая представляет собой колонку.
28. Способ по варианту осуществления 19-27, где аффинный хроматографический матрикс адсорбирует и/или способен к отбору по меньшей мере или по меньшей мере приблизительно 50×106 клеток/мл, 100×106 клеток/мл, 200×106 клеток/мл или 400×106 клеток/мл.
29. Способ по любому из вариантов осуществления 19-28, где первый и второй этапы отбора включают применение аффинного хроматографического матрикса, и относительные количества матрикса, применяемого на первом и втором этапах отбора, достаточны для достижения инициирующего культуру соотношения.
30. Способ по любому из вариантов осуществления 1-29, где обогащение CD4+-клеток включает положительный отбор на основе поверхностной экспрессии CD4.
31. Способ по любому из вариантов осуществления 1-29, где обогащение CD8+-клеток включает положительный отбор на основе поверхностной экспрессии CD8.
32. Способ по любому из вариантов осуществления 1-29, где один из первого и второго отборов, который включает обогащение CD8+-клеток, дополнительно включает обогащение центральных T-клеток памяти (TCM); и/или
обогащение клеток, экспрессирующих маркер, выбранных из числа CD28, CD62L, CCR7, CD127 и CD27.
33. Способ по любому из вариантов осуществления 1-32, где:
первый отбор включает обогащение CD8+-клеток, а второй отбор включает обогащение CD4+-клеток; и
первый отбор дополнительно включает обогащение центральных T-клеток памяти (TCM) и/или обогащение клеток, экспрессирующих маркер, выбранный из числа CD28, CD62L, CCR7, CD127 и CD27.
34. Способ по варианту осуществления 32, или варианту осуществления 33, или варианту осуществления 35, где обогащение центральных T-клеток памяти (TCM) и/или обогащение клеток, экспрессирующих маркер, включает:
отбор из первой и/или второй популяции выбранных клеток, которая обогащена CD8+-клетками, клеток, экспрессирующих CD62L; и/или
отбор из первой и/или второй популяции выбранных клеток, которая обогащена CD8+-клетками, клеток, экспрессирующих CD27; и/или
отбор из первой и/или второй популяции выбранных клеток, которая обогащена CD8+-клетками, клеток, экспрессирующих CCR7; и/или
отбор из первой и/или второй популяции выбранных клеток, которая обогащена CD8+-клетками, клеток, экспрессирующих CD28; и/или
отбор из первой и/или второй популяции выбранных клеток, которая обогащена CD8+-клетками, клеток, экспрессирующих CD127.
35. Способ по любому из вариантов осуществления 1-32, где:
первый отбор включает обогащение CD4+-клеток, а второй отбор включает обогащение CD8+-клеток; и
второй отбор дополнительно включает обогащение центральных T-клеток памяти (TCM).
36. Способ по варианту осуществления 35, где:
(i) первый отбор включает обогащение CD4+-клеток посредством положительного отбора на основе поверхностной экспрессии CD4, получая, таким образом, первую отобранную популяцию, которая обогащена первичными CD4+-T-клеткАми человека, и образец с неотобранными клетками;
(ii) второй отбор включает обогащение CD8+-клеток и дополнительно включает обогащение второго выбранного образца центральными T-клетками памяти (TCM), где обогащение центральных T-клеток памяти (TCM) включает:
отрицательный отбор для обеднения клеток, экспрессирующих поверхностный маркер, присутствующий на наивных T-клетках, и положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти; или
положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти и не присутствующий на наивных T-клетках, и положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти;
получая, таким образом, первичные CD8+-T-клетки человека, обогащенные клетками TCM.
37. Способ по варианту осуществления 36, где:
маркер, присутствующий на наивных T-клетках, включает CD45RA; и
обогащение центральных T-клеток памяти (TCM) включает отрицательный отбор с обеднением клеток, экспрессирующих CD45RA, и положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти.
38. Способ по варианту осуществления 37, где:
поверхностный маркер, присутствующий на центральных T-клетках памяти и не присутствующий на наивных T-клетках, включает CD45RO;
обогащение центральных T-клеток памяти (TCM) включает положительный отбор клеток, экспрессирующих CD45RO и положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти.
39. Способ по любому из вариантов осуществления 36-38, где поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти, выбран из группы, состоящей из CD62L, CCR7, CD27, CD127 и CD44.
40. Способ по варианту осуществления 39, где поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти, представляет собой CD62L.
41. Способ по любому из вариантов осуществления 32-40, где популяция CD8+-клеток в обогащенной композиции или инициирующей культуру композиции содержит по меньшей мере 50% центральных T-клеток памяти (TCM) или содержит менее 20% наивных T-клеток (TN) или содержит по меньшей мере 80% CD62+-клеток.
42. Способ обогащения CD4+- и CD8+-T-клеток, где способ включает приведение клеток образца, содержащего первичные T-клетки человека, в контакт с первым иммуноаффинным реагентом, который специфически связывается с CD4, и вторым иммуноаффинным реагентом, который специфически связывается с CD8, в инкубируемой композиции, в условиях, при которых иммуноаффинные реагенты специфически связываются с молекулами CD4 и CD8, соответственно, на поверхности клеток в образце; и
выделение клеток, связанных с первым и/или вторым иммуноаффинными реагентами, получая, таким образом, обогащенную композицию, содержащую CD4+-клетки и CD8+-клетки в инициирующем культуру соотношении, где:
первый и/или второй иммуноаффинные реагенты присутствуют в инкубируемой композиции в обеспечивающих субоптимальный выход концентрациях, в соответствии с чем обогащенная композиция содержит менее 70% от общего количества CD4+-клеток в инкубируемой композиции и/или менее 70% CD8+-клеток в инкубируемой композиции, таким образом, получая композицию, обогащенную CD4+- и CD8+-T-клетками.
43. Способ получения генетически сконструированных T-клеток, где способ включает:
(a) обогащение первичных T-клеток человека из образца, содержащего первичные T-клетки человека, включающее:
приведение клеток указанного образца в контакт с первым иммуноаффинным реагентом, который специфически связывается с CD4, и вторым иммуноаффинным реагентом, который специфически связывается с CD8, в инкубируемой композиции, в условиях, при которых иммуноаффинные реагенты специфически связываются с молекулами CD4 и CD8, соответственно, на поверхности клеток в образце; и
выделение клеток, связанных с первым и/или вторым иммуноаффинными реагентами, получая, таким образом, обогащенную композицию, содержащую CD4+-клетки и CD8+-клетки в инициирующем культуру соотношении, где:
первый и/или второй иммуноаффинные реагенты присутствуют в инкубируемой композиции в обеспечивающих субоптимальный выход концентрациях, в соответствии с чем обогащенная композиция содержит менее 70% от общего количества CD4+-клеток в инкубируемой композиции и/или менее 70% CD8+-клеток в инкубируемой композиции; и
(b) инкубация клеток обогащенной композиции в инициирующей культуру композиции в емкости для культивирования в стимулирующих условиях, получая, таким образом, стимулированные клетки, где клетки находятся или по существу находятся в инициирующем культуру соотношении; и
(c) введение в стимулированные клетки после (b) генетически сконструированного антигенного рецептора, получая, таким образом, результирующую композицию, содержащую CD4+-T-клетки и CD8+-T-клетки, экспрессирующие генетически сконструированный антигенный рецептор.
44. Способ по варианту осуществления 42 или варианту осуществления 43, где обогащение первичных T-клеток человека проводят в замкнутой системе.
45. Способ по любому из вариантов осуществления 42-44, где первый и второй иммуноаффинные реагенты находятся в инкубируемой композиции в обеспечивающей субоптимальный выход концентрации, в соответствии с чем обогащенная композиция содержит менее 70% от общего количества CD4+-клеток в инкубируемой композиции и менее 70% от общего количества CD8+-клеток в инкубируемой композиции.
46. Способ по любому из вариантов осуществления 42-45, где:
первый иммуноаффинный реагент находится в инкубируемой композиции в обеспечивающей субоптимальный выход концентрации, в соответствии с чем обогащенная композиция содержит менее 60%, менее 50%, менее 40%, менее 30% или менее 20% от общего количества CD4+-клеток в инкубируемой композиции; и/или
второй иммуноаффинный реагент находится в инкубируемой композиции в обеспечивающей субоптимальный выход концентрации, в соответствии с чем обогащенная композиция содержит менее 60%, менее 50%, менее 40%, менее 30% или менее 20% от общего количества CD8+-клеток в инкубируемой композиции.
47. Способ по любому из вариантов осуществления 42-46, где образец содержит по меньшей мере 1×109 CD3+-T-клеток.
48. Способ по любому из вариантов осуществления 42-47, где концентрация одного из первого и второго иммуноаффинных реагентов в инкубируемой композиции является большей, чем другого, в соответствии с чем большая концентрация обуславливает более высокий выход в обогащенной композиции одного из типов CD4+-клеток или CD8+-клеток, соответственно, по сравнению с выходом другого типа CD4+- или CD8+-клеток, таким образом, обеспечивая в обогащенной композиции получение инициирующего культуру соотношения.
49. Способ по варианту осуществления 48, где:
концентрация одного из первого и второго иммуноаффинных реагентов является более высокой, по сравнению с концентрацией другого из первого и второго иммуноаффинных реагентов, по меньшей мере в 1,2 раза, 1,4 раза, 1,6 раза, 1,8 раза, 2,0 раза, 3,0 раза, 4,0 раза, 5,0 раз, 6,0 раз, 7,0 раз, 8,0 раз, 9,0 раз или 10 раз; и/или
более высокий выход в обогащенной концентрации является более высоким в 1,2 раза, 1,4 раза, 1,6 раза, 1,8 раза, 2,0 раза, 3,0 раза, 4,0 раза, 5,0 раз, 6,0 раз, 7,0 раз, 8,0 раз, 9,0 раз или 10 раз.
50. Способ по любому из вариантов осуществления 42-49, где инициирующее культуру соотношение CD4+- и CD8+-клеток составляет от или приблизительно от 10:1 до или приблизительно до 1:10, от или приблизительно от 5:1 до или приблизительно до 1:5 или составляет от или приблизительно от 2:1 до или приблизительно до 1:2.
51. Способ по любому из вариантов осуществления 42-50, где инициирующее культуру соотношение CD4+- и CD8+-клеток составляет или приблизительно составляет 1:1.
52. Способ по любому из вариантов осуществления 42-51, где:
инициирующее культуру соотношение CD4+- и CD8+-клеток отличается от соотношения CD4+- и CD8+-клеток в образце, полученном у индивидуума; и/или
инициирующее культуру соотношение CD4+- и CD8+-клеток по меньшей мере на 10%, по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, или по меньшей мере 50% больше или меньше, чем соотношение CD4+- и CD8+-клеток в образце, полученном у индивидуума.
53. Способ по любому из вариантов осуществления 42-52, где более 95% или более 98% клеток в инициирующей культуру композиции представляют собой CD4+-клетки и CD8+-клетки.
54. Способ по любому из вариантов осуществления 42-53, где каждый из иммуноаффинных реагентов содержит антитело.
55. Способ по варианту осуществления 54, где антитело иммобилизовано на внешней поверхности сферы.
56. Способ по варианту осуществления 55, где сфера представляет собой магнитную гранулу.
57. Способ по варианту осуществления 55 или варианту осуществления 56, где:
антитело содержит одного или нескольких партнеров по связыванию, способных к формированию обратимой связи со связывающим реагентом, иммобилизованным на сфере, в соответствии с чем антитело обратимо иммобилизовано на указанной сфере; и
способ после контакта клеток в образце с первым и вторым иммуноаффинными реагентами дополнительно включает применение конкурирующего реагента для разрушения связи между партнером по связыванию и связывающим реагентом, таким образом, обеспечивая отделение выбранных клеток от сферы.
58. Способ по варианту осуществления 57, где:
партнер по связыванию выбран из числа биотина, аналога биотина, или пептида, способного к связыванию со связывающим реагентом; и
связывающий реагент выбран из числа стрептавидина, аналога или мутеина стрептавидина, авидина, аналога или мутеина авидина.
59. Способ по варианту осуществления 58, где:
партнер по связыванию содержит пептид, содержащий последовательность аминокислот, приведенную в SEQ ID NO:6 и/или
связывающий реагент представляет собой мутеин стрептавидина, содержащий последовательность аминокислот, приведенную в SEQ ID NO: 12, 13, 15 или 16.
60. Способ по варианту осуществления 58 или варианту осуществления 59, где:
связывающий реагент представляет собой мультимер, содержащий один или несколько мономеров стрептавидина или мутеина стрептавидина; и
партнер по связыванию представляет собой пептид, содержащий в последовательном расположении по меньшей мере два модуля, где каждый способен к обратимому связыванию по меньшей мере с одним мономером связывающего реагента.
61. Способ по варианту осуществления 60, где партнер по связыванию содержит последовательность аминокислот, приведенную в любой из SEQ ID NO: 7-10.
62. Способ по любому из вариантов осуществления 57-61, где конкурирующий реагент представляет собой биотин или аналог биотина.
63. Способ по любому из вариантов осуществления 42-63, где константа скорости диссоциации (koff) антитела или антител в первом и/или втором отборах для связывания между антителом и поверхностным клеточным маркер составляет более или приблизительно более 3×10-5 сек-1.
64. Способ по любому из вариантов осуществления 42-63, где антитело или антитела в первом и/или втором отборах обладают аффинностью с константой диссоциации (Kd) в диапазоне приблизительно от 10-3 до 10-7 или с константой диссоциации в диапазоне приблизительно от 10-7 до приблизительно 10-10.
65. Способ по любому из вариантов осуществления 42-63, где один или несколько этапов проводят в автоматизированном режиме, и/или где замкнутая система является автоматизированной.
66. Способ по любому из вариантов осуществления 2, 3 и 5-41, включающий:
определение до проведения первого отбора и/или второго отбора соотношения CD4+- и CD8+-T-клеток в образце; и
корректировки на основе соотношение CD4+- и CD8+-T-клеток в образце первого и/или второго отборов с получением композиции, содержащей CD4+-клетки и CD8+-клетки в инициирующем культуру соотношении.
67. Способ по варианту осуществления 66, где:
первый и/или второй отборы включает основанный на иммуноаффинности отбор, включающий аффинный хроматографический матрикс; и
корректировка первого и/или второго отборов включает выбор количества аффинного хроматографического матрикса в первом и/или втором отборах, достаточного для получения инициирующего культуру соотношения.
68. Способ по любому из вариантов осуществления 42-65, включающий:
определение до приведения клеток образца в контакт с первым и вторым иммуноаффинным реагентом соотношения CD4+- и CD8+-T-клеток в образце; и
выбор на основе соотношения CD4+- и CD8+-T-клеток в образце концентрации первого и/или второго иммуноаффинных реагентов с получением обогащенной композиции, содержащей CD4+-клетки и CD8+-клетки в инициирующем культуру соотношении.
69. Способ по любому из вариантов осуществления 1-68, где способ приводит к результирующей композиции, содержащей соотношение CD4+- и CD8+-клеток, которое составляет от или приблизительно от 2:1 до или приблизительно до 1:5.
70. Способ по варианту осуществления 69, где соотношение CD4+- и CD8+-клеток в результирующей композиции составляет 1:1 или приблизительно составляет 1:1.
71. Способ по любому из вариантов осуществления 1-70, где образец получают у индивидуума.
72. Способ по варианту осуществления 71, где индивидуум представляет собой индивидуума, которому вводят указанные подвергнутые генетической инженерии T-клетки или клетки для адоптивной клеточной терапии.
73. Способ по варианту осуществления 72, где индивидуум представляет собой индивидуума, отличного от индивидуума, которому вводят указанные подвергнутые генетической инженерии T-клетки или клетки для адоптивной терапии.
74. Способ по любому из вариантов осуществления 1-73, где образец представляет собой кровь или получаемый из крови образец.
75. Способ по любому из вариантов осуществления 1-74, где образец представляет собой образец лейкоцитов.
76. Способ по любому из вариантов осуществления 1-75, где образец представляет собой образец после афереза, образец мононуклеарных клеток периферической крови (PBMC) или образец после лейкафереза.
77. Способ по любому из вариантов осуществления 4-41 или 43-76, где инкубацию композиция в емкости для культивирования в стимулирующих условиях проводят до, в течение и/или после введения генетически сконструированного антигенного рецептора.
78. Способ по любому из вариантов осуществления 4-41 или 43-76, где инкубацию композиция в емкости для культивирования в стимулирующих условиях проводят до, в течение и после введения генетически сконструированного антигенного рецептора.
79. Способ по любому из вариантов осуществления 4-41 или 43-78, где стимулирующие условия включают условия, в которых пролиферируют T-клетки композиции.
80. Способ по любому из вариантов осуществления 4-41 или 43-79, где стимулирующие условия включают средство, способное к активации одного или нескольких доменов внутриклеточной сигнализации одного или нескольких компонентов комплекса TCR.
81. Способ по варианту осуществления 80, где один или несколько компонентов комплекса TCR содержат дзета-цепь CD3.
82. Способ по любому из вариантов осуществления 4-41 или 43-81, где стимулирующие условия включают присутствие антитела к CD3 и антитела к CD28, антитела к 4-1BB и/или цитокина.
83. Способ по варианту осуществления 82, где антитело к CD3 и/или антитело к CD28 находятся на поверхности твердой подложки.
84. Способ по варианту осуществления 83, где цитокин включает IL-2, IL-15, IL-7 и/или IL-21.
85. Способ по любому из вариантов осуществления 4-41 или 43-84, где генетически сконструированный антигенный рецептор включает T-клеточный рецептор (TCR) или функциональный не являющийся TCR антигенный рецептор.
86. Способ по варианту осуществления 85, где рецептор специфически связывается с антигеном, экспрессируемым клетками подлежащего лечению заболевания или патологического состояния.
87. Способ по любому из вариантов осуществления 85 или 86, где антигенный рецептор представляет собой химерный антигенный рецептор (CAR).
88. Способ по варианту осуществления 87, где CAR содержит внеклеточный антигенраспознающий домен и домен внутриклеточной сигнализации, содержащий содержащую ITAM последовательность и домен внутриклеточной сигнализации T-клеточной костимулирующей молекулы.
89. Способ лечения, где указанный способ включает:
(a) получение результирующей композиции, содержащей CD4+-T-клетки и CD8+-T-клетки, полученных способом по любому из вариантов осуществления 1-88; и
(b) введение клеток результирующей композиции индивидууму.
90. Способ по варианту осуществления 89, где образец, из которого выделяют клетки, получают у индивидуума которому вводят клетки.
91. Композиция клеток, получаемых способом по любому из вариантов осуществления 1-88.
92. Композиция по варианту осуществления 91, содержащая фармацевтически приемлемый носитель.
93. Способ лечения, где указанный способ включает введение индивидууму композиции клеток по варианту осуществления 91 или 92.
94. Способ по варианту осуществления 93, где генетически сконструированный антигенный рецептор специфически связывается с антигеном, ассоциированным с заболеванием или патологическим состоянием.
95. Способ лечения по варианту осуществления 94, где заболевание или патологическое состояние представляет собой злокачественную опухоль.
96. Композиция по варианту осуществления 91 или варианту осуществления 92 для применения при лечении заболевания или патологического состояния у индивидуума.
97. Применение композиции по варианту осуществления 91 или варианту осуществления 92 для получения лекарственного средства для лечения заболевания или нарушения у индивидуума.
98. Композиция по варианту осуществления 96 или применение по варианту осуществления 97, где генетически сконструированный антигенный рецептор специфически связывается с антигеном, ассоциированным с заболеванием или патологическим состоянием.
99. Композиция или применение по любому из вариантов осуществления 96-98, где заболевание или патологическое состояние представляет собой злокачественную опухоль.
100. Замкнутая аппаратная система для очистки клеток-мишеней, содержащая:
a) первый аффинный хроматографический матрикс, содержащий иммобилизованное в нем первое связывающее средство, где это связывающее средство специфически связывается с первым поверхностным клеточным маркером, присутствующим на первой клетке, где первый аффинный хроматографический матрикс функционально связан с резервуаром для хранения, содержащим образец клеток, посредством первого функционального соединения, где указанное первое функциональное соединение может обеспечивать прохождение клеток из резервуара для хранения к первому аффинному хроматографическому матриксу, и где первый аффинный хроматографический матрикс функционально связан с выходной емкостью посредством второго функционального соединения; и
b) второй аффинный хроматографический матрикс, содержащий иммобилизованное в нем второе связывающее средство, где это второе связывающее средство специфически связывается со вторым поверхностным клеточным маркером, присутствующим на второй клетке, где первый аффинный хроматографический матрикс посредством третьего функционального соединения функционально связан со вторым аффинным хроматографическим матриксом, где указанное третье функциональное соединение может обеспечивать прохождение клеток, прошедших через первый аффинный хроматографический матрикс и не связавшихся с первым связывающим средством, со вторым аффинным хроматографическим матриксом, и где второй аффинный хроматографический матрикс посредством четвертого функционального соединения функционально связан с выходной емкостью, где четвертое функциональное соединение может обеспечивать прохождение клеток связавшихся и элюируемых из первого и/или второго аффинных хроматографических матриксов, и где второй аффинный хроматографический матрикс посредством пятого функционального соединения функционально связан с емкостью для отходов, где пятое функциональное соединение может обеспечивать прохождение клеток, прошедших через первый аффинный хроматографический матрикс и не связавшихся с первым связывающим средством и прошедших через второй аффинный хроматографический матрикс и не связавшихся со вторым связывающим средством;
c) выходную емкость; и
d) емкость для отходов,
где система сконфигурирована для осуществления в замкнутой системе сбора в выходной емкости, в одной композиции, (i) клеток, связавшихся и выделенных из первого аффинного хроматографического матрикса, и (ii) клеток, прошедших и не связавшихся с первым аффинным хроматографическим матриксом и связавшихся и выделенных из второго аффинного хроматографического матрикса.
101. Замкнутое устройство по варианту осуществления 100, где одно или несколько из указанных функциональных соединений включают трубки, соединяющие резервуар для хранения, первый аффинный хроматографический матрикс, второй аффинный хроматографический матрикс и/или емкость для культивирования.
102. Замкнутое устройство по варианту осуществления 101, где трубки соединены с задвижкой, клапаном или зажимом.
103. Замкнутая аппаратная система по любому из вариантов осуществления 100-102, где:
(a) первый аффинный хроматографический матрикс представляет собой один из аффинного к CD4+-клеткам хроматографического матрикса или аффинного к CD8+-клеткам хроматографического матрикса; и
(b) второй аффинный хроматографический матрикс представляет собой другой из аффинного к CD4+-клеткам хроматографического матрикса или аффинного к CD8+-клеткам хроматографического матрикса.
104. Замкнутая аппаратная система по любому из вариантов осуществления 100-103, дополнительно содержащая:
d) третий аффинный хроматографический матрикс, содержащий иммобилизованное в нем третье связывающее средство, где это связывающее средство специфически связывается с третьим поверхностным клеточным маркером, в соответствии с чем третье связывающее средство способно к связыванию клеток, экспрессирующих третий поверхностный клеточный маркер, где третье функциональное соединение дополнительно функционально связывает третий аффинный хроматографический матрикс с первым матриксом, а шестое функциональное соединение функционально связывает третий аффинный хроматографический матрикс с выходным контейнером так, что шестое функциональное соединение может обеспечивать прохождение клеток, связавшихся и выделенных из первого матрикса и связавшихся и выделенных из третьего матрикса, в выходной контейнер, и
пятое функциональное соединение дополнительно функционально связывает третий аффинный хроматографический матрикс с контейнером для отходов так, что пятое функциональное соединение может обеспечивать прохождение клеток, прошедших и не связавшихся с третьей колонкой, в контейнер для отходов.
105. Замкнутая аппаратная система по любому из вариантов осуществления 100-103, дополнительно содержащая:
d) третий аффинный хроматографический матрикс, содержащий иммобилизованное в нем третье связывающее средство, где это связывающее средство специфически связывается с третьим поверхностным клеточным маркером, вследствие чего третий аффинный хроматографический матрикс способен к связыванию клеток, экспрессирующих третий поверхностный клеточный маркер, где
второе функциональное соединение дополнительно функционально связывает третий аффинный хроматографический матрикс с первым матриксом и с выходным контейнером так, что второе функциональное соединение может обеспечивать прохождение клеток, связавшихся и выделенных из первого матрикса и связавшихся и выделенных из третьего матрикса, в выходной контейнер.
106. Замкнутая аппаратная система по варианту осуществления 104 или 105, где:
первый аффинный хроматографический матрикс содержит, связывающее средство, которое специфически связывается с CD8;
втор аффинный хроматографический матрикс содержит, связывающее средство, которое специфически связывается с CD4; и
третий аффинный хроматографический матрикс содержит связывающее средство, которое специфически связывается с маркером, экспрессированном на центральных T-клетках памяти (TCM).
107. Замкнутая аппаратная система по варианту осуществления 106, где связывающее средство третьего аффинного хроматографического матрикса селективно связывается с поверхностным клеточным маркером, выбранным из числа CD62L, CD45RA, CD45RO, CCR7, CD27, CD127 и CD44.
108. Замкнутая аппаратная система по любому из вариантов осуществления 100-107, где один или несколько или все аффинные хроматографические матриксы дополнительно функционально связаны с резервуаром для элюирующего буфера, содержащим один или несколько конкурирующих реагентов.
109. Замкнутая аппаратная система по любому из вариантов осуществления 100-107, где конкурирующий реагент представляет собой один или несколько из группы, состоящей из биотина, аналога биотина и пептида, способного к связыванию с хроматографическим матриксом.
110. Замкнутая аппаратная система по любому из вариантов осуществления 100-107, где один или несколько или все из третьего, четвертого или шестого функциональных соединений дополнительно содержат камеру для удаления конкурирующего средства.
111. Замкнутая аппаратная система по варианту осуществления 110, где камера для удаления конкурирующего средства дополнительно содержит связывающий реагент.
112. Замкнутая аппаратная система по варианту осуществления 111, где связывающий реагент включает один или несколько из группы, состоящей из стрептавидина, аналога или мутеина стрептавидина, авидина и аналог или мутеина авидина.
113. Замкнутая аппаратная система по любому из вариантов осуществления 100-112, где один или несколько или все связывающие средства представляют собой антитело.
114. Замкнутая аппаратная система по любому из вариантов осуществления 100-112, где один или несколько или все связывающие средства обратимо связываются с аффинным хроматографическим матриксом.
VI. ПРИМЕРЫ
[0320] Предоставленные ниже примеры приведены исключительно с иллюстративными целями и не предназначены для ограничения объема изобретения.
Пример 1: Получение композиции CD4+- и CD8+-T-клеток посредством иммуномагнитного разделения с использованием одного технологического потока для генетической инженерии и адоптивной клеточной терапии
[0321] В иллюстративном способе популяцию CD4+-T-клеток и популяцию CD8+-T-клеток, обогащенную центральными T-клетками памяти, выделяют из образца продукта афереза, а затем инкубируют и подвергают инженерии с последующим введением индивидууму. Процедуру выделения проводят с использованием одного технологического потока посредством иммуномагнитного разделения с использованием системы CliniMACS® Prodigy. Способ усовершенствован по сравнению с другими способами, в котором CD4+-клетки выделяют из первой фракции афереза, а CD8+-клетки выделяют и дополнительно обедняют/обогащают из второй фракции афереза с использованием устройства CliniMACS® Prodigy и трех отдельных систем трубок.
[0322] Усовершенствованный способ проводят с использованием одной системы трубок для выделения популяций CD4+- и CD8+-клеток, без переноса популяций клеток из одной емкости (например, системы трубок) в другую.
[0323] Популяцию CD4+-клеток выделяют посредством инкубации образца афереза с реагентом CD4 CliniMACS®. Затем клетки разделяют посредством устройства CliniMACS® Prodigy установленного на проведение программы обогащения, и обе фракции клеток (т.е., обогащенной иммуномагнитным способом фракции CD4+-клеток и фракции клеточного фильтрата) сохраняют. Обогащенная (положительная) фракция представляет собой популяцию выделенных CD4+-T-клеток. Популяцию CD8+-T-клеток выделяют посредством инкубации фракции фильтрата (отрицательной) с реагентом CD14 реагент и CliniMACS®ом CD45RA или реагентом CD19 CliniMACS®. Устройство CliniMACS® Prodigy устанавливают на проведения программы обеднения. Затем смесь клеток/реагентов разделяют посредством устройства CliniMACS® Prodigy с использованием той же системы трубок, которую использовали на первом этапе разделения. Фракцию фильтрата (отрицательную), в которой проводили обеднение CD14+/CD45RA+- или CD14+/CD19+-клеток, инкубируют с реагентом CD62L CliniMACS®. Смесь клеток/реагентов разделяют с использованием устройства CliniMACS® Prodigy, на котором выполняется программа обогащения с использованием той же системы трубок. Положительная фракция представляет собой популяцию выделенных CD8+-клеток, обогащенных центральными клетками памяти.
[0324] Популяции выделенных CD4+- и CD8+-клеток комбинируют в одной и той же емкости для культивирования в инициирующей культуру композиции при инициирующем культуру соотношении. Инициирующее культуру соотношение предназначено для достижения после этапов инкубации и/или инженерии конкретного желаемого результирующего соотношения или соотношения, которое находится в пределах определенного диапазона допустимой погрешности такого желаемого результирующего соотношения, или предназначено для осуществления этого в течение определенного процента времени. Клетки инкубируют в стимулирующих условиях, например, с использованием гранулы против CD3/против CD28 в присутствии IL-2 (100 IU/мл) в течение 72 часов при 37°C°C в системе Prodigy.
[0325] Композицию клеток в один или несколько моментов времени после начала инкубации или культивирования, например, один раз в течение инкубации, необязательно периодически оценивают и/или корректируют. Оценка включает определение скорости пролиферации, определение степени жизнеспособности, определение фенотипа, например, экспрессии одного или нескольких поверхностных или внутриклеточных маркеров, таких как белки или полинуклеотиды, и/или корректировку в композиции или емкости температуры, компонентов сред, содержания кислорода или диоксида углерода и/или наличия или отсутствия или количества или относительного количества одного или нескольких факторов, средств, компонентов и/или типов клеток, включая подтипы.
[0326] Затем, инкубируемые таким образом клетки подвергают генетической инженерии, посредством введение в клетки рекомбинантных генов для экспрессии рекомбинантных антигенных рецепторов, таких как химерные антигенные рецепторы (CAR) или рекомбинантные TCR. Введение проводят в автономной среде в устройстве CliniMACS® Prodigy, с CD4+- и CD8+-клетки, находящимися в одной и той же композиции и емкости. Способ приводит к результирующей композиции с подвергнутыми инженерии CD4+- и CD8+-T-клетками.
Пример 2: Получение композиции CD4+- и CD8+-T-клеток посредством последовательной очистки в замкнутой системе
[0327] Этот пример демонстрирует иллюстративный способ обогащения или отбора популяции CD4+-T-клеток и популяции CD8+-T-клеток из образца продукта афереза, получаемого у индивидуума. Способ проводят с использованием замкнутой системы с несколькими хроматографическими колонками с последовательным положительным отбором популяций CD4+- и CD8+-T-клеток из одного и того же исходного образца.
A. Обогащение популяции CD4+-T-клеток и популяции CD8+-T-клеток
[0328] В иллюстративном способе, изображенном на фигуре 1A, в замкнутом устройстве 14 расположен ряд колонок для иммунохроматографического отбора и колонок для удаления, функционально соединенных друг с другом и перистальтическим насосом 8 различными трубчатыми соединениями и клапанами 13 для контроля потока жидкой фазы.
[0329] Первая селективная колонка 1 содержит выбранный объем аффинного хроматографического матрикса 3, такого как агарозная смола, такого как смола, как описано в опубликованной патентной заявке США № US2015/0024411, для выделения T-клеток, такой как смола с эксклюзионным пределом, рассчитанным так, чтобы быть больше, чем размер T-клетки, такой как агароза, получаемая из Agarose Beads Technologies, Madrid, Spain, с уменьшенным эксклюзионным размером по сравнению с агарозой Superflow™, с эксклюзионным размером 6×106 Дальтон. Матрикс в первой колонке связан с мультимерами Strep-Tactin® (например, содержащими мутантный стрептавидин, приведенный в любой из SEQ ID NO:12, 13, 15 или 16, IBA GmbH, Germany, или как описано в публикации международных заявок PCT №№ WO 2014/076277). Вторая селективная колонка 2 содержит выбранный объем аффинного хроматографического матрикса 4, такого как агарозная смола, такая как смола как описано выше, которая также связана с мультимерами Strep-Tactin®.
[0330] Производят заполнение из резервуара 18, содержащего фрагмент Fab к CD8, с пропусканием через насос 8, трубки и клапаны 13 так, чтобы внести Fab к CD8 в первую селективную колонка 1, в результате чего Fab к CD8 иммобилизуется на Strep-Tactin® на аффинном матриксе 3 с меткой Twin Strep-tag® (например, приведенной в SEQ ID NO: 10; IBA GmbH) во фрагменте Fab, которая слита с C-конец его тяжелой цепи (см. например, опубликованная патентная заявка США № US 2015/0024411). В определенных вариантах осуществления из резервуара для отмывочного буфера 6 вносят отмывочный буфер, такой как фосфатно-солевой буфер (PBS), содержащий 0,5% бычий сывороточный альбумин, сывороточный альбумин человека или рекомбинантный сывороточный альбумин человека, с пропусканием через первую селективную колонку посредством функционально связанных трубок. Фильтрат направляют в контейнер для отходов 10 через клапаны 13, функционально связывающие первую селективную колонку и контейнер для отходов. В определенных вариантах осуществления этап отмывки повторяют несколько раз.
[0331] Производят заполнение из резервуара 19, содержащего фрагмент Fab к CD4, с пропусканием через насос 8, трубки и клапаны 13 так, чтобы внести Fab к CD4 во вторую селективную колонку 2, в результате чего Fab к CD8 иммобилизуется на Strep-Tactin® на аффинном матриксе 4 с меткой Twin Strep-tag®. В определенных вариантах осуществления из резервуара для отмывочного буфера 6 отмывочный буфер пропускают через вторую селективную колонку посредством функционально связанных трубок. Фильтрат направляют в контейнер для отходов 10 через клапаны 13, функционально связывающие вторую селективную колонку и контейнер для отходов. В определенных вариантах осуществления этап отмывки повторяют несколько раз.
[0332] Объемы реагента аффинного матрикса, содержащегося в первой селективной колонке и второй селективной колонке, могут быть одинаковыми или различными, и их можно выбирать на основе желаемого результата отбора и/или желаемого соотношения CD4+-клеток и CD8+-клеток после отбора. Выбираемый таким образом объем основан на предположении среднего выхода 1×108 клеток, которые можно отбирать на каждый 1 мл объема заполненной колонки. В одном из иллюстративных способов объемы колонок являются одинаковыми, например, с использованием объема 2 мл для колонки с фрагментом Fab к CD8 и 2 мл для колонки с фрагментом Fab к CD4. Длину колонки и/или диаметр колонки можно выбирать так, чтобы они соответствовали желаемому объему, например, для достижения желаемого инициирующего культуру соотношения CD4+-клеток и CD8+-клеток. В определенных вариантах осуществления для размещения объема аффинного матрикса можно прямо последовательно добавлять несколько колонок с иммобилизованным на них одинаковым реагентом Fab и функционально связывать их друг с другом посредством трубчатого соединения.
[0333] Для проведения отбора клеток образец афереза вносят в первую селективную колонку 1, в результате чего CD8+-T-клетки, если они присутствуют в образце, остаются связанными со смолой 3 первой колонки, тогда как неотобранные клетки (содержащие CD8--клетки) проходят через колонку. Количество клеток в исходном образце, используемое в определенных примерах, выбирают так, чтобы оно превосходило количество клеток, которое можно отобрать на основе комбинированного объема матриксов, например, количество, превышающее пропускную способность колонки для каждого из отборов (например, количество, составляющее более 200 миллионов CD8+-клеток и более 200 миллионов CD4+-клеток, например, больше, чем по меньшей мере приблизительно на 10% или на 20% или более). Затем фильтрат, содержащий неотобранные клетки (отрицательную фракцию), пропускают через первую колонку во вторую селективную колонку 2 через функционально связанные трубки. CD4+-T-клетки остаются связанными со смолой 4 во второй колонке. Фильтрат, содержащий жидкость и оставшиеся неотобранные клетки (отрицательные клетки), направляют в контейнер для отходов 10 через клапаны 13, функционально связывающие вторую селективную колонку и контейнер для отходов.
[0334] В определенных вариантах осуществления первая селективная колонка альтернативно может содержать хроматографический матрикс с аффинностью к CD4, а вторая селективная колонка может содержать хроматографический матрикс с аффинностью к CD8.
[0335] Из резервуара для отмывочного буфера 6 через первую колонку и вторую колонка через функционально связанные трубки пропускают отмывочный буфер. Фильтрат, содержащий любые клетки, которые отмывают из первой и второй колонок, направляют в контейнер для отходов 10 через клапаны 13, функционально связывающие вторую селективную колонку и контейнер для отходов. В определенных вариантах осуществления этап отмывки повторяют несколько раз.
[0336] Из резервуара для элюирующего буфера 7 вносят буфер, содержащий элюент, такой как буфер с низкими концентрациями биотина или его аналога, например, 2,5 мМ детиобиотина, с пропусканием через первую колонку и вторую колонку через функционально связанные трубки. В определенных вариантах осуществления элюент содержит среды для культивирования клеток. Фильтрат, содержащий обогащенные CD4+- и CD8+-клетки и остаточный биотин или его аналог, направляют в камеру для удаления 9 для удаления биотина или его аналога. Камера для удаления 9 представляет собой колонку Superflow™ с гранулами из сефарозы (Sepharose®) с иммобилизованными на них Strep-Tactin® с объемом, достаточным для удаления биотина или аналога биотина из образца, такую как колонка с объемом слоя 6 мл со связывающей способностью 300 наномоль биотина/мл. Фильтрат, содержащий обогащенные клетки, положительно выбранные по CD4+ и CD8+, направляют в емкость для культивирования 12, такую как пакет, через клапаны, функционально связывающие камеру для удаления 9 и емкость для культивирования. В определенных вариантах осуществления этап элюции повторяют.
[0337] В определенных вариантах осуществления после проведения этапа элюции отмывочный буфер заменяют активирующим буфером, содержащим активирующий T-клетки реагент (например, антитело к CD3, к CD28, IL-2, IL-15, IL-7 и/или IL-21), и направляют через камеру для удаления и фильтрат направляют в емкость для культивирования. Положительная фракция, собранная в емкости для культивирования, представляет собой выделенные и комбинированные популяции CD4+- и CD8+-клеток.
B. Обогащение популяции CD4+-T-клеток и популяции CD8+-T-клеток, обогащенных клетками, экспрессирующими маркер, присутствующий на центральных T-клетках памяти (TCM)
[0338] В иллюстративном способе, изображенном на фигуре 1B, в замкнутом устройстве 14 расположен ряд колонок для иммунохроматографического отбора и колонок для удаления, функционально связанных друг с другом и перистальтическим насосом 8 различными трубчатыми соединениями и клапанами 13 для контроля потока жидкой фазы.
[0339] Первая селективная колонка 1 и вторая селективная колонка 2 являются такими же, как описано выше в примере 2A. Кроме того, способ дополнительно включает третью селективную колонку 15, которая содержит выбранный объем аффинного матрикса 17, такого как агарозная смола, такая как смола, как описано в опубликованной патентной заявке США № US2015/0024411 для выделения T-клеток, такая как смола, как описано выше в примере 2A.
[0340] Fab к CD8 и Fab к CD4 вносят в первую колонку и вторую колонку, соответственно, как описано в пример 2A. Производят заполнение из резервуара, содержащего дополнительный фрагмент Fab к маркеру, экспрессируемому на центральных T-клетках памяти (TCM) 20, такому как один из CD28, CD62L, CCR7, CD27 или CD127, с пропусканием через насос 8, трубки и клапаны 13 так, чтобы внести дополнительный Fab в третью селективную колонку 15, в результате чего дополнительный Fab конъюгируется с Strep-Tactin® на аффинном матриксе 17 с меткой Twin Strep-tag® (SEQ ID NO: 10; IBA GmbH) во фрагменте Fab, которая слита с C-концом его тяжелой цепи, как описано в пример 2A. В определенных вариантах осуществления вносят отмывочный буфер, как описано в пример 2A, с пропусканием через третью селективную колонку через функционально связанные трубки. Фильтрат направляют в контейнер для отходов 10 через клапаны 13, функционально связывающие третью селективную колонку и контейнер для отходов. В определенных вариантах осуществления этап отмывки повторяют несколько раз.
[0341] Объемы реагента аффинного матрикса, содержащегося в первой селективной, второй и/или третьей селективных колонках, могут быть одинаковыми или различными, и их можно выбирать на основе желаемого результата отбора и/или желаемого соотношения CD4+-клеток и CD8+-клеток, обогащенных клетками, экспрессирующими маркер, экспрессируемый на центральных T-клетках памяти (TCM), после отбора. Выбираемый таким образом объем основан на предположении среднего выхода 1×108 клеток, которые можно отбирать на каждый 1 мл объема заполненной колонки. Также для конкретного выбранного инициирующего культуру соотношения, например, инициирующего культуру соотношения CD4+-клеток и популяции, содержащей CD8+-клетки, обогащенные по маркеру, экспрессируемому на центральных T-клетках памяти (TCM) (например, популяция CD8+-клеток, обогащенных на основе дополнительного отбора по одному из CD28, CD62L, CCR7, CD27 или CD127) 1:1, объем матрикса для отбора популяции, исходной для обогащенной популяции, например, CD8+-клеток, является большим, по сравнению с объемом матрикса, используемым для отбора другой из популяций CD4+ или CD8+-T-клеток, например, популяции CD4+-клеток. Количество или степень, в которой объем матрикса, используемого для отбора популяции, исходной для дополнительной обогащенной популяции, например, матрикса, содержащего фрагмент Fab к CD8, превышает объем другого матрикса или других матриксов, выбирают на основе фракции или процентного содержания дополнительной популяции обогащенных клеток в образце (например, CD8+/CD28+, CD8+/CD62L+, CD8+/CCR7+, CD8+/CD27+ или CD8+/CD127+) по сравнению с фракцией или процентным содержанием исходной популяции, например, CD8+-клеток, находящейся в образце. Это можно рассчитать до определения размера колонок для использования на основе средних у пациентов или здоровых доноров или можно измерять для конкретного пациента, у которого проводят отбор.
[0342] В одном из иллюстративных способов, объемы колонок, используемых в процессе, составляют, например, 2 мл у колонки с фрагментами Fab к CD4, 6 мл у колонки с фрагментами Fab к CD8 и 2 мл у колонки с фрагментами Fab к CD62L. Длину колонки и/или диаметр колонки можно выбирать так, чтобы они соответствовали желаемому объему, например, для достижения желаемого инициирующего культуру соотношения CD4+-клеток и CD8+-клеток, обогащенных клетками, экспрессирующими маркер, экспрессируемый на центральных T-клетках памяти (TCM), например, CD8+/CD2+-клетками, CD8+/CD62L+-клетками, CD8+/CCR7+-клетками, CD8+/CD27+-клетками или CD8+/CD127+-клетками. В определенных вариантах осуществления для размещения объема аффинного матрикса можно прямо последовательно добавлять несколько колонок с иммобилизованным на них одинаковым реагентом Fab и функционально связывать их друг с другом посредством трубчатого соединения.
[0343] Для проведения отбора клеток образец афереза вносят в первую селективную колонку 1, в результате чего CD8+-T-клетки, если они присутствуют в образце, остаются связанными со смолой первой колонки, тогда как неотобранные клетки (содержащие CD8--клетки) проходят через колонку. Количество клеток в исходном образце, используемое в определенных примерах, выбирают так, чтобы оно превосходило количество клеток, которое можно отобрать на основе комбинированного объема матриксов, например, количество, превышающее пропускную способность колонки для каждого из отборов (например, количество, составляющее более 200 миллионов CD8+/CD62L+-клеток и более 200 миллионов CD4+-клеток, например, больше, чем по меньшей мере приблизительно на 10% или на 20% или более). Фильтрат, содержащий неотобранные клетки (отрицательную фракцию), пропускают через вторую колонку 2 через клапан 13, функционально связывающий первую и вторую колонку. CD4+-T-клетки остаются связанными со смолой во второй колонке. Фильтрат, содержащий жидкость и оставшиеся неотобранные клетки (отрицательные клетки), направляют в первый контейнер для отходов 10 через клапаны 13, функционально связывающие вторую селективную колонку и контейнер для отрицательной фракции.
[0344] Из резервуара для отмывочного буфера 6 через первую колонку и вторую колонка через клапан и трубки, функционально связывающие колонки, пропускают отмывочный буфер, как описано в примере 2A. Фильтрат, содержащий любые клетки, которые отмывают из первой и второй колонок, направляют в контейнер для отходов 10 через клапаны 13, функционально связывающие вторую селективную колонку и контейнер для отходов. В определенных вариантах осуществления этап отмывки повторяют несколько раз.
[0345] Из резервуара для элюирующего буфера 7 вносят буфер, содержащий элюент, такой как биотин или его аналог, например, 2,5 мМ детиобиотин, с пропусканием через колонку 2 через клапаны 13 и трубки, функционально связывающие резервуар для элюирующего буфера и вторую колонку. В определенных вариантах осуществления элюирующий буфер, содержит среды для культивирования клеток. Фильтрат, содержащий обогащенные CD4+-клетки и остаточный биотин, для удаления биотина, как описано в пример 2A, направляют в камеру для удаления 9, которая функционально связана со второй колонкой через клапан 13 и трубки. Фильтрат, содержащий обогащенные клетки, положительно выбранные по CD4+, направляют в емкость для культивирования 12, такую как пакет, через клапаны 13, функционально связывающие камеру для удаления 9 и емкость для культивирования. В определенных вариантах осуществления этап элюции повторяют. В определенных вариантах осуществления после проведения этапа элюции отмывочный буфер заменяют активирующим буфером, содержащим активирующий T-клетки реагент (например, антитело к CD3, к CD28, IL-2, IL-15, IL-7 и/или IL-21) и через клапаны и трубки направляют из резервуара для отмывочного буфера в втор колонку, камеру для удаления и в емкость для культивирования. Положительная фракция, собранная в емкости для культивирования, представляет собой популяцию выделенных CD4+-клеток.
[0346] Из резервуара для элюирующего буфера 7, вносят буфер, содержащий элюент, такой как биотин, с пропусканием через первую колонку 1 через клапан 13 и трубки, функционально связывающие резервуар для элюирующего буфера и первую колонка. В определенных вариантах осуществления элюирующий буфер, содержит среды для культивирования клеток. Фильтрат, содержащий обогащенные CD8+-клетки и остаточный биотин или его аналог, для удаления биотина или аналога биотина, как описано в пример 2A, направляют в камеру для удаления 9, которая функционально связана с первой колонкой посредством клапана 13 и трубок. Фильтрат, содержащий обогащенные клетки, положительно выбранные по CD8+, направляют для прохождения в третью колонку 15 через клапан 13, функционально связывающий камеру для удаления 9 и третью колонку. Субпопуляция CD8+-клеток CD62L+ остается связанной со смолой в третьей колонке. Фильтрат, содержащий жидкость и оставшиеся невыбранные клетки (отрицательные клетки), направляют во второй контейнер для отходов 11 через клапаны 13, функционально связывающие третью селективную колонку и второй контейнер для отходов.
[0347] Из резервуара для отмывочного буфера 6, вносят отмывочный буфер, как описано в пример 2A, с пропусканием через третью колонку 15 через клапаны 13 и трубки, функционально связывающие резервуар для отмывочного буфера и третью колонку. Фильтрат, содержащий любые клетки, которые отмывают из третьей колонки, направляют во второй контейнер для отходов 11 через клапаны 13, функционально связывающие третью селективную колонку и второй контейнер для отходов. В определенных вариантах осуществления этап отмывки повторяют несколько раз.
[0348] Из резервуара для элюирующего буфера 7, вносят буфер, содержащий элюент, такой как биотин или его аналог, например, 2,5 мМ детиобиотин, с пропусканием через третью колонку 15 через клапан 13 и трубки, функционально связывающие резервуар для элюирующего буфера и третью колонку. В определенных вариантах осуществления элюирующий буфер содержит среды для культивирования клеток. Фильтрат, содержащий CD8+-клетки, обогащенные центральными T-клетками памяти (TCM), экспрессирующими один из CD28, CD62L, CCR7, CD27 или CD127, и остаточный биотин или его аналог, для удаления биотина или аналога биотина, как описано в пример 2A, направляют в камеру для удаления 9, которая функционально связана с третьей колонкой посредством клапана 13 и трубок. Фильтрат, содержащий обогащенные T-клетки памяти, положительно выбранные по CD8 и маркеру, экспрессируемому на центральных T-клетках памяти (TCM), такому как один из CD28, CD62L, CCR7, CD27 или CD127, направляют в емкость для культивирования 12, такую как пакет, через клапаны 13, функционально связывающие камеру для удаления 9 и емкость для культивирования. В определенных вариантах осуществления емкость для культивирования содержит активирующий T-клетки реагент, среды для культивирования клеток или и то, и другое. В определенных вариантах осуществления этап элюции повторяют. В определенных вариантах осуществления после проведения этапа элюции отмывочный буфер заменяют активирующим буфером, содержащим активирующий T-клетки реагент (например, антитело к CD3, к CD28, IL-2, IL-15, IL-7 и/или IL-21) и через клапаны и трубки направляют из резервуара для отмывочного буфера в первую и/или третью колонки, камеру для удаления и в емкость для культивирования. Положительную фракцию, содержащую CD8+-клетки и клетки, положительные по маркеру, экспрессируемому центральными T-клетками памяти (TCM), такому как один из CD28, CD62L, CCR7, CD27 или CD127, собирают в емкости для культивирования вместе с ранее собранной положительной по CD4+-клеткам фракцией. В определенных вариантах осуществления этапы способа можно проводить в другом порядке, например, посредством первого обогащения клеток, содержащих CD8+-клетки, и клеток, положительных по маркеру, экспрессируемому центральными T-клетками памяти (TCM), такому как один из CD28, CD62L, CCR7, CD27 или CD127 с последующим обогащением CD4+-клеток.
Пример 3: Получение композиции CD4+- и CD8+-T-клеток для применения в генетической инженерии и адоптивной клеточной терапии посредством последовательной очистки в замкнутой системе
[0349] Этот пример демонстрирует способ отбора и получения композиции клеток, содержащих CD4+- и CD8+-T-клетки, такие как CD4+- и CD8+-T-клетки, находящиеся в инициирующем культуру соотношении, для инкубации/активации и трансдукции в способах, связанных с генетической инженерией клеток для применения в связи с адоптивной клеточной терапией.
[0350] Композицию клеток, получаемых посредством отбора CD4+- и CD8+-клеток, проводимого как описано в примере 2A (CD4+ и CD8+) или примере 2B (CD4+-клетки и CD8+-клетки, обогащенные CD62+-клетками), инкубируют в стимулирующих условиях, например, с использованием антитела к CD3/антитела к CD28 в присутствии IL-2 (100 IU/мл), например, в течение 72 часов при 37°C. Затем стимулированные клетки подвергают генетической инженерии посредством введения в клетки рекомбинантных генов для экспрессии рекомбинантных антигенных рецепторов, таких как химерные антигенные рецепторы (CAR) или рекомбинантные TCR, например, посредством вирусной трансдукции. В определенных вариантах осуществления после введения клетки дополнительно инкубируют, как правило, при 37°C, например, для обеспечения клеточного роста.
[0351] Способ позволяет получать результирующую композицию с подвергнутыми инженерии CD4+- и CD8+-T-клетками. В определенных вариантах осуществления на основе выбранного объема селективных колонок соотношение CD4+- и CD8+-клеток в композиции, которую инкубируют в стимулирующих условиях до инженерии (инициирующее культуру соотношение), после этапов инкубации, стимуляции и/или инженерии приводит к конкретному желаемому результирующему соотношению CD4+- и CD8+-клеток или подвергнутых инженерии CD4+-клетки и подвергнутых инженерии CD8+-клеток или к такому соотношение, которое находится в определенном диапазоне допустимой погрешности такого желаемого результирующего соотношения. В определенных вариантах осуществления такого желаемого результирующего соотношения или соотношения в диапазоне допустимой погрешности достигают в течение определенного допустимого процента времени.
Пример 4: Отбор клеток с использованием обеспечивающих субоптимальный выход концентраций покрытых Fab поверхностей
[0352] Полученные посредством афереза образцы PBPC человека в диапазоне различных количеств клеток инкубировали в одной композиции с магнитными микрогранулами, конъюгированными с Fab к CD4, и магнитными микрогранулами, конъюгированными с Fab к CD8, с осторожным перемешиванием приблизительно в течение 30 минут. После этой инкубации проводили элюцию невыбранных клеток и проводят восстановление с использованием магнитного поля, как описано выше. Посредством инкубации с использованием от 0,05 до 1,5 мл каждого из реагента микрогранул на миллион клеток получали низкие выходы CD4+- или CD8+-клеток, соответственно (клетки восстановленные при соответствующем отборе по сравнению с положительными клетками при инкубации), которые в настоящем исследовании, как правило, находились в диапазоне 15-70%). В среднем, при использовании таких обеспечивающих субоптимальные выходы концентраций при более высоких концентрациях реагентов на клетку наблюдали большие выходы.
[0353] Таким образом, в одном из примеров проводят отбор, в котором PBMC инкубируют с субоптимальными концентрациями на клетку гранул, связанных со связывающим CD4 средством, и гранул связанных со связывающим CD8 средством, и клетки восстанавливают с использованием магнитного поля. На основе наблюдаемой зависимости между концентрацией реагента на клетку и выходом при использованных гранулах, один или другой из связывающего CD4 или связывающего CD8 реагентов добавляли в более высокой концентрации (например, большее количество связывающих CD4 или CD8 молекул на клетку), таким образом, получая после отбора результирующее соотношение CD8+-клеток:CD4+-клеток, которое составляет более или менее 1, такое как 1,5:1, или 2:1, или 3:1, или 1:1,5, 1:2 или 1:3. Результирующее соотношение можно выбирать на основе желаемого соотношения CD8- и CD4-клеток в композиции, содержащей подвергнутые инженерии клетки, получаемой после одного или нескольких дополнительных этапов, таких как активация, трансдукция и/или рост.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Juno Therapeutics, Inc.
RAMSBORG, Chris
BONYHADI, Mark
CHEN, Calvin
BEAUCHESNE, Pascal
<120> СПОСОБЫ ВЫДЕЛЕНИЯ, КУЛЬТИВИРОВАНИЯ И ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ ПОПУЛЯЦИЙ КЛЕТОК ИММУННОЙ СИСТЕМЫ ДЛЯ АДОПТИВНОЙ ТЕРАПИИ
<130> 735042000240
<140> Not Yet Assigned
<141> Concurrently Herewith
<150> US 61/983,415
<151> 2014-04-23
<160> 19
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Связывающий стрептавидин пептид
<220>
<221> Вариант
<222> 3
<223> Xaa выбрана из глутамина, аспарагина и метионина
<400> 1
His Pro Xaa
1
<210> 2
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Связывающий стрептавидин пептид
<400> 2
His Pro Gln Phe
1
<210> 3
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Связывающий стрептавидин пептид
<220>
<221> Вариант
<222> 1
<223> Xaa = Trp, Lys или Arg
<220>
<221> Вариант
<222> 2
<223> Xaa = любая аминокислота
<220>
<221> Вариант
<222> 7
<223> Xaa = Gly или Glu
<220>
<221> Вариант
<222> 8
<223> Xaa = Gly, Lys или Arg
<400> 3
Xaa Xaa His Pro Gln Phe Xaa Xaa
1 5
<210> 4
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Связывающий стрептавидин пептид
<220>
<221> Вариант
<222> 2
<223> Xaa = любая аминокислота
<220>
<221> Вариант
<222> 7
<223> Xaa = Gly или Glu
<220>
<221> Вариант
<222> 8
<223> Xaa = Gly, Lys или Arg
<400> 4
Trp Xaa His Pro Gln Phe Xaa Xaa
1 5
<210> 5
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Связывающий стрептавидин пептид
<400> 5
Trp Arg His Pro Gln Phe Gly Gly
1 5
<210> 6
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Strep-tag (зарегистрированная торговая марка) II
<400> 6
Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 7
<211> 28
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Последовательные модули связывающего стрептавидин пептида
<220>
<221> Вариант
<222> (9)...(20)
<223> Xaa в положениях 9-20 может представлять собой любую аминокислоту и 4 из них могут отсутствовать
<400> 7
Trp Ser His Pro Gln Phe Glu Lys Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Trp Ser His Pro Gln Phe Glu Lys
20 25
<210> 8
<211> 28
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Последовательные модули связывающего стрептавидин пептида
<220>
<221> Вариант
<222> (9)...(12)
<223> Эта аминокислота может отсутствовать
<400> 8
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Trp Ser His Pro Gln Phe Glu Lys
20 25
<210> 9
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Twin-Strep-Tag
<400> 9
Ser Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly
1 5 10 15
Gly Ser Gly Gly Gly Ser Trp Ser His Pro Gln Phe Glu Lys
20 25 30
<210> 10
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Twin-Strep-Tag
<400> 10
Ser Ala Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly
1 5 10 15
Gly Ser Gly Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys
20 25 30
<210> 11
<211> 159
<212> Белок
<213> Streptomyces Avidinii
<220>
<223> Стрептавидин
<400> 11
Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu Ala Gly
1 5 10 15
Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val Thr
20 25 30
Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Glu Ser Ala Val Gly
35 40 45
Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala Pro
50 55 60
Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp Lys
65 70 75 80
Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln Tyr
85 90 95
Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr Ser
100 105 110
Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His Asp
115 120 125
Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Ile Asp Ala Ala Lys
130 135 140
Lys Ala Gly Val Asn Asn Gly Asn Pro Leu Asp Ala Val Gln Gln
145 150 155
<210> 12
<211> 159
<212> Белок
<213> Streptomyces Avidinii
<220>
<223> Мутеин стрептавидина Val44-Thr45-Ala46-Arg47
<400> 12
Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu Ala Gly
1 5 10 15
Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val Thr
20 25 30
Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Val Thr Ala Arg Gly
35 40 45
Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala Pro
50 55 60
Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp Lys
65 70 75 80
Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln Tyr
85 90 95
Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr Ser
100 105 110
Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His Asp
115 120 125
Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Ile Asp Ala Ala Lys
130 135 140
Lys Ala Gly Val Asn Asn Gly Asn Pro Leu Asp Ala Val Gln Gln
145 150 155
<210> 13
<211> 159
<212> Белок
<213> Streptomyces Avidinii
<220>
<223> Мутеин стрептавидина Ile44-Gly45-Ala-46-Arg47
<400> 13
Asp Pro Ser Lys Asp Ser Lys Ala Gln Val Ser Ala Ala Glu Ala Gly
1 5 10 15
Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe Ile Val Thr
20 25 30
Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Ile Gly Ala Arg Gly
35 40 45
Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp Ser Ala Pro
50 55 60
Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val Ala Trp Lys
65 70 75 80
Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser Gly Gln Tyr
85 90 95
Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu Leu Thr Ser
100 105 110
Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val Gly His Asp
115 120 125
Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser Ile Asp Ala Ala Lys
130 135 140
Lys Ala Gly Val Asn Asn Gly Asn Pro Leu Asp Ala Val Gln Gln
145 150 155
<210> 14
<211> 126
<212> Белок
<213> Streptomyces Avidinii
<220>
<223> Минимальный стрептавидин
<400> 14
Glu Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
1 5 10 15
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Glu Ser
20 25 30
Ala Val Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp
35 40 45
Ser Ala Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val
50 55 60
Ala Trp Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser
65 70 75 80
Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu
85 90 95
Leu Thr Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val
100 105 110
Gly His Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
115 120 125
<210> 15
<211> 126
<212> Белок
<213> Streptomyces Avidinii
<220>
<223> Мутеин стрептавидина Val44-Thr45-Ala46-Arg47
<400> 15
Glu Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
1 5 10 15
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Val Thr
20 25 30
Ala Arg Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp
35 40 45
Ser Ala Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val
50 55 60
Ala Trp Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser
65 70 75 80
Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu
85 90 95
Leu Thr Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val
100 105 110
Gly His Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
115 120 125
<210> 16
<211> 126
<212> Белок
<213> Streptomyces Avidinii
<220>
<223> Мутеин стрептавидина Ile44-Gly45-Ala-46-Arg47
<400> 16
Glu Ala Gly Ile Thr Gly Thr Trp Tyr Asn Gln Leu Gly Ser Thr Phe
1 5 10 15
Ile Val Thr Ala Gly Ala Asp Gly Ala Leu Thr Gly Thr Tyr Ile Gly
20 25 30
Ala Arg Gly Asn Ala Glu Ser Arg Tyr Val Leu Thr Gly Arg Tyr Asp
35 40 45
Ser Ala Pro Ala Thr Asp Gly Ser Gly Thr Ala Leu Gly Trp Thr Val
50 55 60
Ala Trp Lys Asn Asn Tyr Arg Asn Ala His Ser Ala Thr Thr Trp Ser
65 70 75 80
Gly Gln Tyr Val Gly Gly Ala Glu Ala Arg Ile Asn Thr Gln Trp Leu
85 90 95
Leu Thr Ser Gly Thr Thr Glu Ala Asn Ala Trp Lys Ser Thr Leu Val
100 105 110
Gly His Asp Thr Phe Thr Lys Val Lys Pro Ser Ala Ala Ser
115 120 125
<210> 17
<211> 28
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Twin Strep-tag
<400> 17
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Trp Ser His Pro Gln Phe Glu Lys
20 25
<210> 18
<211> 24
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Twin Strep-tag
<400> 18
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Trp Ser His Pro Gln Phe Glu Lys
20
<210> 19
<211> 28
<212> Белок
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<223> Twin Strep-tag
<400> 19
Trp Ser His Pro Gln Phe Glu Lys Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Ser Ala Trp Ser His Pro Gln Phe Glu Lys
20 25
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК И НАБОРЫ И УСТРОЙСТВО ДЛЯ НИХ | 2016 |
|
RU2778411C2 |
| СПОСОБЫ, НАБОРЫ, СРЕДСТВА И УСТРОЙСТВА ДЛЯ ТРАНСДУКЦИИ | 2016 |
|
RU2761555C2 |
| СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК И НАБОРЫ И УСТРОЙСТВО ДЛЯ НИХ | 2016 |
|
RU2761557C2 |
| ОЛИГОМЕРНЫЕ РЕАГЕНТЫ В ВИДЕ ЧАСТИЦ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2777989C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ ГЕННО-ИНЖЕНЕРНЫХ КЛЕТОК И РОДСТВЕННЫХ КОМПОЗИЦИЙ | 2018 |
|
RU2790444C2 |
| ПРОДУЦИРОВАНИЕ СКОНСТРУИРОВАННЫХ КЛЕТОК ДЛЯ АДОПТИВНОЙ КЛЕТОЧНОЙ ТЕРАПИИ | 2017 |
|
RU2780156C2 |
| РЕАГЕНТЫ ДЛЯ РАЗМНОЖЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ РЕКОМБИНАНТНЫЕ РЕЦЕПТОРЫ | 2018 |
|
RU2783956C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ПОЛУЧЕНИЯ ГЕННО-ИНЖЕНЕРНЫХ КЛЕТОК | 2018 |
|
RU2795454C2 |
| КОМПОЗИЦИИ, ИЗДЕЛИЯ И СПОСОБЫ, СВЯЗАННЫЕ С ДОЗИРОВАНИЕМ В КЛЕТОЧНОЙ ТЕРАПИИ | 2018 |
|
RU2776823C2 |
| ТРАНСГЕННЫЕ ГЕНЕТИЧЕСКИЕ МЕТКИ И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2822461C1 |

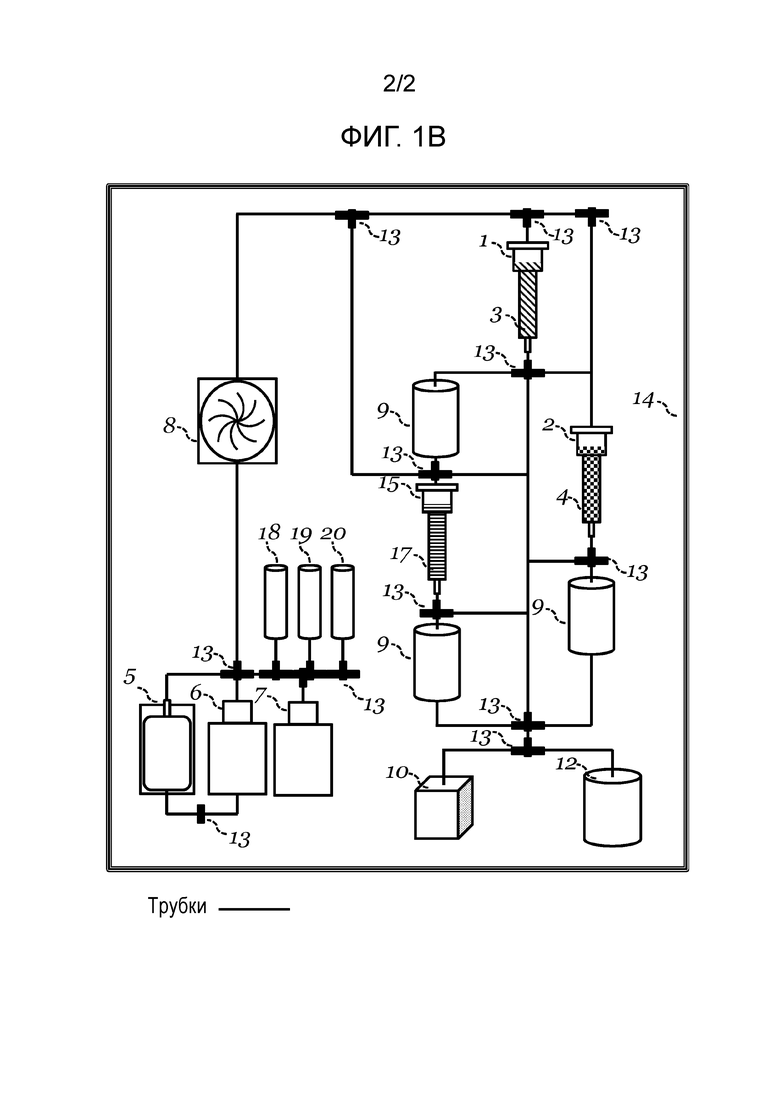
Настоящая группа изобретений относится к клеточной биологии. Предложен способ обогащения CD4+- и CD8+-T-клеток, который предусматривает проведение в замкнутой системе отбора CD4+-клеток и отбора CD8+-клеток из образца, содержащего первичные T-клетки человека, и комбинирование этих клеток в необходимом соотношении, составляющем приблизительно от 10:1 до 1:10. Также описан способ получения генетически сконструированных T-клеток, где Т-клетки получены указанным способом. Даная группа изобретений может найти применение в получении клеток для адоптивной терапии. 2 н. и 62 з.п. ф-лы, 2 ил., 4 пр.
1. Способ обогащения CD4+- и CD8+-T-клеток, где способ включает:
(a) проведение в замкнутой системе первого отбора, где указанный первый отбор включает обогащение одного типа из (i) CD4+-клеток и (ii) CD8+-клеток из образца, содержащего первичные T-клетки человека, где обогащение, таким образом, позволяет получать первую популяцию отобранных клеток и популяцию неотобранных клеток; и
(b) проведение в замкнутой системе второго отбора, где указанный второй отбор включает обогащение другого типа из (i) CD4+-клеток и (ii) CD8+-клеток из популяции неотобранных клеток, где обогащение, таким образом, позволяет получать вторую популяцию отобранных клеток; и
(c) комбинирование клеток первой популяции отобранных клеток и клеток второй популяции отобранных клеток в необходимом соотношении CD4+ клеток и CD8+ клеток, составляющем от или приблизительно от 10:1 до или приблизительно до 1:10,
где способ позволяет получать обогащенную композицию, содержащую CD4+-клетки и CD8+-клетки в необходимом соотношении, составляющем от или приблизительно от 10:1 до или приблизительно до 1:10.
2. Способ по п. 1, дополнительно включающий:
инкубацию клеток первой отобранной популяции при стимулирующих условиях и инкубацию клеток второй отобранной популяции при стимулирующих условиях; и/или
введение генетически сконструированного антигенного рецептора в клетки первой отобранной популяции и в клетки второй отобранной популяции.
3. Способ по п. 1 или 2, дополнительно включающий:
введение генетически сконструированного антигенного рецептора в клетки первой отобранной популяции и/или введение генетически сконструированного антигенного рецептора в клетки второй отобранной популяции; и
инкубацию клеток первой отобранной популяции при стимулирующих условиях и/или инкубацию клеток второй отобранной популяции при стимулирующих условиях,
где инкубацию клеток первой отобранной популяции и/или клеток второй отобранной популяции осуществляют до, в течение и/или после введения генетически сконструированного антигенного рецептора.
4. Способ получения генетически сконструированных T-клеток, где способ включает:
(a) проведение в замкнутой системе первого отбора, где первый отбор включает обогащение одного типа из (i) CD4+-клеток и (ii) CD8+-клеток из образца, содержащего первичные T-клетки человека, где обогащение, таким образом, позволяет получать первую популяцию отобранных клеток и популяцию неотобранных клеток; и
(b) проведение в замкнутой системе второго отбора, где второй отбор включает обогащение другого типа из (i) CD4+-клеток и (ii) CD8+-клеток из популяции неотобранных клеток, где обогащение, таким образом, позволяет получать вторую популяцию отобранных клеток;
(c) комбинирование клеток первой популяции отобранных клеток и клеток второй популяции отобранных клеток в необходимом соотношении CD4+-клеток и CD8+-клеток, составляющем от или приблизительно от 10:1 до или приблизительно до 1:10, для получения обогащенной композиции, содержащей CD4+-клетки и CD8+-клетки в необходимом соотношении, составляющем от или приблизительно от 10:1 до или приблизительно до 1:10;
(d) инкубацию обогащенной композиции в емкости для культивирования в стимулирующих условиях, получая, таким образом, стимулированные клетки; и
(e) введение в указанные стимулированные клетки генетически сконструированного антигенного рецептора,
где способ, таким образом, позволяет получать результирующую композицию, содержащую CD4+-T-клетки и CD8+-T-клетки, экспрессирующие генетически сконструированный антигенный рецептор.
5. Способ по любому из пп. 1-4, где указанное комбинирование проводят в замкнутой системе.
6. Способ по любому из пп. 1-5, где один или несколько этапов проводят в автоматизированном режиме и/или где замкнутая система является автоматизированной.
7. Способ по любому из пп. 1-6, где необходимое соотношение составляет от или приблизительно от 2:1 до или приблизительно до 1:5, от или приблизительно от 2:1 до или приблизительно до 1:2, от или приблизительно от 1.5:1 до или приблизительно до 1:5, от или приблизительно от 1.5:1 до или приблизительно до 1:2, или от или приблизительно от 1:1 до или приблизительно до 1:2, или 1.1 или приблизительно 1.1.
8. Способ по любому из пп. 1-6, где необходимое соотношение CD4+- и CD8+-клеток составляет от или приблизительно от 5:1 до или приблизительно до 1:5 или от или приблизительно от 2:1 до или приблизительно до 1:2.
9. Способ по любому из пп. 1-8, где необходимое соотношение CD4+- и CD8+-клеток составляет или приблизительно составляет 1:1.
10. Способ по любому из пп. 1-9, где образец получают у человека и
необходимое соотношение CD4+- и CD8+-клеток отличается от соотношения CD4+- и CD8+-клеток в образце, полученном у индивидуума, и/или
необходимое соотношение CD4+- и CD8+-клеток является по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50% большим или меньшим, чем соотношение CD4+- и CD8+-клеток в образце, полученном у индивидуума.
11. Способ по любому из пп. 1-10, где обогащение клеток в первом отборе и/или втором отборе включает проведение положительного отбора или отрицательного отбора на основе экспрессии поверхностного клеточного маркера.
12. Способ по п. 11, где обогащение клеток в первом отборе и/или втором отборе включает проведение отрицательного отбора, который включает обеднение клеток, экспрессирующих не принадлежащий T-клеткам поверхностный маркер.
13. Способ по п. 12, где не принадлежащий T-клеткам поверхностный маркер включает CD14.
14. Способ по любому из пп. 1-13, где обогащение клеток в первом отборе или втором отборе включает проведение ряда этапов положительного или отрицательного отбора на основе экспрессии поверхностного клеточного маркера или маркеров с обогащением CD4+- или CD8+-клеток.
15. Способ по п. 14, где обогащение клеток в первом отборе и/или втором отборе включает основанный на аффинности отбор.
16. Способ по п. 15, где основанный на аффинности отбор в первом отборе и/или втором отборе включает контакт клеток с антителом, способным к специфическому связыванию с поверхностным клеточным маркером, и выделение клеток, связанных с антителом, таким образом, проводя положительный отбор, или выделение клеток, не связанных с антителом, таким образом, проводя отрицательный отбор, где выделенные клетки обогащены CD4+-клетками или CD8+-клетками и антитело иммобилизовано на магнитной частице.
17. Способ по п. 15, где основанный на аффинности отбор при первом отборе и/или втором отборе включает контакт клеток с антителом, иммобилизованным на аффинном хроматографическом матриксе или связанным с ним, где указанное антитело способно к специфическому связыванию с поверхностным клеточным маркером, с проведением положительного или отрицательного отбора CD4+- или CD8+-клеток.
18. Способ по любому из пп. 1-17, где первый отбор и второй отбор проводят в раздельных емкостях для разделения, которые функционально связаны.
19. Способ по п. 18, где емкости для разделения функционально связаны посредством трубок.
20. Способ по любому из пп. 16-19, где антитело представляет собой Fab.
21. Способ по п. 17-20, где
антитело дополнительно содержит один или несколько партнеров по связыванию, способных к формированию обратимой связи со связывающим реагентом, иммобилизованном на аффинном хроматографическом матриксе, в соответствии с чем антитело в течение указанного контакта обратимо связывается с указанным аффинным хроматографическим матриксом, и
клетки, экспрессирующие поверхностный клеточный маркер, специфически связанный антителом на указанном аффинном хроматографическом матриксе, можно выделять из аффинного хроматографического матрикса посредством разрушения обратимого связывания между связывающим реагентом и партнером по связыванию.
22. Способ по п. 21, где
партнер по связыванию выбран из числа биотина, аналога биотина и пептида, способного к связыванию со связывающим реагентом, и
связывающий реагент выбран из числа стрептавидина, аналога стрептавидина или мутеина стрептавидина, авидина, аналога авидина или мутеина авидина.
23. Способ по п. 22, где
партнер по связыванию содержит последовательность аминокислот, приведенную в SEQ ID NO: 6, и/или
связывающий реагент представляет собой мутеин стрептавидина, содержащий последовательность аминокислот, приведенную в SEQ ID NO: 12, 13, 15 или 16.
24. Способ по любому из пп. 17-23, дополнительно включающий после контакта клеток в образце с антителом, иммобилизованном на аффинном хроматографическом матриксе или присоединенном к нему, в первом отборе и/или втором отборе применение конкурирующего реагента для разрушения связи между партнером по связыванию и связывающим реагентом, таким образом, выделяя выбранные клетки из матрикса.
25. Способ по п. 24, где конкурирующий реагент представляет собой биотин или аналог биотина.
26. Способ по любому из пп. 17-25, где константа скорости диссоциации (koff) антитела или антител в первом отборе и/или втором отборе для связывания антитела и поверхностного клеточного маркера составляет более или приблизительно более 3×10-5 сек-1.
27. Способ по любому из пп. 21-26, где антитело или антитела в первом отборе и/или втором отборе обладают аффинностью к поверхностному клеточному маркеру с константой диссоциации (Kd) в диапазоне приблизительно от 10-3 до 10-7 или в диапазоне приблизительно от 10-7 до приблизительно 10-10.
28. Способ по любому из пп. 17-27, где хроматографический матрикс первого отбора и/или второго отбора упакован в емкость для разделения, которая является колонкой.
29. Способ по любому из пп. 17-28, где аффинный хроматографический матрикс адсорбирует и/или способен к отбору по меньшей мере или по меньшей мере приблизительно 50×106 клеток/мл, 100×106 клеток/мл, 200×106 клеток/мл или 400×106 клеток/мл.
30. Способ по любому из пп. 17-29, где первый этап отбора и второй этап отбора включают применение аффинного хроматографического матрикса и относительные количества аффинного хроматографического матрикса, применяемого на первом и втором этапах отбора, достаточны для достижения необходимого соотношения.
31. Способ по любому из пп. 1-30, где обогащение CD4+-клеток включает положительный отбор на основе поверхностной экспрессии CD4.
32. Способ по любому из пп. 1-31, где обогащение CD8+-клеток включает положительный отбор на основе поверхностной экспрессии CD8.
33. Способ по любому из пп. 1-32, где один из первого и второго отборов, который включает обогащение CD8+-клеток, дополнительно включает обогащение центральных T-клеток памяти (TCM) и/или обогащение клеток, экспрессирующих маркер, выбранный из числа CD28, CD62L, CCR7, CD127 и CD27.
34. Способ по любому из пп. 1-33, где
первый отбор включает обогащение CD8+-клеток, а второй отбор включает обогащение CD4+-клеток и
первый отбор дополнительно включает обогащение центральных T-клеток памяти (TCM) и/или обогащение клеток, экспрессирующих маркер, выбранный из числа CD28, CD62L, CCR7, CD127 и CD27.
35. Способ по п. 33 или 34, где обогащение центральных T-клеток памяти (TCM) и/или обогащение клеток, экспрессирующих маркер, включает:
отбор из первой и/или второй популяции выбранных клеток, которая обогащена CD8+-клетками, клеток, экспрессирующих CD62L; и/или
отбор из первой и/или второй популяции выбранных клеток, которая обогащена CD8+-клетками, клеток, экспрессирующих CD27; и/или
отбор из первой и/или второй популяции выбранных клеток, которая обогащена CD8+-клетками, клеток, экспрессирующих CCR7; и/или
отбор из первой и/или второй популяции выбранных клеток, которая обогащена CD8+-клетками, клеток, экспрессирующих CD28; и/или
отбор из первой и/или второй популяции выбранных клеток, которая обогащена CD8+-клетками, клеток, экспрессирующих CD127.
36. Способ по любому из пп. 1-33, где
первый отбор включает обогащение CD4+-клеток, а второй отбор включает обогащение CD8+-клеток и
второй отбор дополнительно включает обогащение центральных T-клеток памяти (TCM).
37. Способ по п. 36, где:
(i) первый отбор включает обогащение CD4+-клеток посредством положительного отбора на основе поверхностной экспрессии CD4, получая, таким образом, первую отобранную популяцию, которая обогащена первичными CD4+-T-клетками человека, и образец с неотобранными клетками;
(ii) второй отбор включает обогащение CD8+-клеток и дополнительно включает обогащение второго выбранного образца центральными T-клетками памяти (TCM), где обогащение центральных T-клеток памяти (TCM) включает:
отрицательный отбор для обеднения клеток, экспрессирующих поверхностный маркер, присутствующий на наивных T-клетках, и положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти; или
положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти и не присутствующий на наивных T-клетках, и положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти;
получая, таким образом, первичные CD8+-T-клетки человека, обогащенные клетками TCM.
38 Способ по п. 37, где
маркер, присутствующий на наивных T-клетках, включает CD45RA и
обогащение центральных T-клеток памяти (TCM) включает отрицательный отбор с обеднением клеток, экспрессирующих CD45RA, и положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти.
39. Способ по п. 38, где
поверхностный маркер, присутствующий на центральных T-клетках памяти и не присутствующий на наивных T-клетках, включает CD45RO и
обогащение центральных T-клеток памяти (TCM) включает положительный отбор клеток, экспрессирующих CD45RO, и положительный отбор клеток, экспрессирующих поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти.
40. Способ по любому из пп. 37-39, где поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти, выбран из группы, состоящей из CD62L, CCR7, CD27, CD127 и CD44.
41. Способ по п. 40, где поверхностный маркер, присутствующий на центральных T-клетках памяти (TCM) и не присутствующий в другой субпопуляции T-клеток памяти, представляет собой CD62L.
42. Способ по любому из пп. 33-41, где популяция CD8+-клеток в обогащенной композиции содержит по меньшей мере 50% центральных T-клеток памяти (TCM) или содержит менее 20% наивных T-клеток (TN) или содержит по меньшей мере 80% CD62+-клеток.
43. Способ по любому из пп. 1-42, где способ приводит к результирующей композиции, содержащей соотношение CD4+- и CD8+-клеток, которое составляет от или приблизительно от 2:1 до или приблизительно до 1:5.
44. Способ по п. 43, где соотношение CD4+- и CD8+-клеток в результирующей композиции составляет 1:1 или приблизительно составляет 1:1.
45. Способ по любому из пп. 1-44, где образец получают у индивидуума.
46. Способ по п. 45, где индивидуум страдает раком.
47. Способ по п. 46, где рак представляет собой лейкоз или лимфому.
48. Способ по любому из пп. 45-47, где индивидуум представляет собой индивидуума, которому вводят подвергнутые генетической инженерии T-клетки или клетки для адоптивной клеточной терапии.
49. Способ по п. 45, где индивидууму не вводят подвергнутые генетической инженерии T-клетки или клетки для адоптивной терапии.
50. Способ по любому из пп. 1-49, где образец представляет собой кровь или получаемый из крови образец.
51. Способ по любому из пп. 1-50, где образец представляет собой образец лейкоцитов.
52. Способ по любому из пп. 1-51, где образец представляет собой образец после афереза, образец мононуклеарных клеток периферической крови (PBMC) или образец после лейкафереза.
53. Способ по любому из пп. 3-52, где инкубацию проводят до, в течение и/или после введения генетически сконструированного антигенного рецептора.
54. Способ по любому из пп. 3-53, где инкубацию проводят до, в течение и после введения генетически сконструированного антигенного рецептора.
55. Способ по любому из пп. 3-54, где стимулирующие условия включают условия, в которых пролиферируют T-клетки композиции.
56. Способ по любому из пп. 3-55, где стимулирующие условия включают средство, способное к активации одного или нескольких доменов внутриклеточной сигнализации одного или нескольких компонентов комплекса TCR.
57. Способ по п. 56, где один или несколько компонентов комплекса TCR содержат дзета-цепь CD3.
58. Способ по любому из пп. 3-57, где стимулирующие условия включают присутствие антитела к CD3, антитела к CD28, антитела к 4-1BB и/или цитокина.
59. Способ по п. 58, где антитело к CD3 и/или антитело к CD28 находятся на поверхности твердой подложки.
60. Способ по п. 58 или 59, где цитокин включает IL-2, IL-15, IL-7 и/или IL-21.
61. Способ по любому из пп. 3-60, где генетически сконструированный антигенный рецептор включает T-клеточный рецептор (TCR) или функциональный не являющийся TCR антигенный рецептор.
62. Способ по п. 61, где рецептор специфически связывается с антигеном, экспрессируемым клетками подлежащего лечению заболевания или состояния.
63. Способ по любому из пп. 61 или 62, где антигенный рецептор представляет собой химерный антигенный рецептор (CAR).
64. Способ по п. 63, где CAR содержит внеклеточный антигенраспознающий домен и домен внутриклеточной сигнализации, содержащий содержащую ITAM последовательность и домен внутриклеточной сигнализации T-клеточной костимулирующей молекулы.
| LI P | |||
| et al., "Multiparameter cell affinity chromatography: separation and analysis in a single microfluidic channel." Analytical chemistry, 2012, 84(19): 8140-8148 | |||
| STEMBERGER C | |||
| et al | |||
| "Novel serial positive enrichment technology enables clinical multiparameter cell sorting." PloS one, 2012, 7(4): e35798 | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| WO | |||
Авторы
Даты
2022-01-11—Публикация
2015-04-23—Подача