Изобретение относится к экспериментальной медицине, а именно к способам моделирования, и может быть использовано для моделирования иммунопатологической плацентарной недостаточности. Предназначено для акушеров-гинекологов, репродуктологов, иммунологов, гистологов с целью изучения особенностей морфогенеза плаценты и исхода беременности для плода в присутствии аутоантител, исследования механизмов, лежащих в основе повторных репродуктивных потерь у пациенток с аутоиммунными заболеваниями.
В настоящее время процент репродуктивных потерь, обусловленных нераспознанными факторами, не имеет тенденции к снижению и превышает 30%. По мнению большинства исследователей, в основе патогенеза этих репродуктивных потерь лежит повреждение плацентарной ткани, обусловленное иммунологическими нарушениями. Именно иммунологический конфликт рассматривается в качестве ключевого фактора повреждения плацентарной ткани, в том числе и у женщин с аутоиммунными заболеваниями. Таким образом, особый интерес представляет изучение особенности морфогенеза плаценты и исход беременности для плода в присутствии аутоантител.
Взаимосвязь аутоиммунных заболеваний (АИТ - аутоиммунный тиреоидит, СКВ - системная красная волчанка, АФС-антифосфолипидный синдром) с репродуктивными неудачами подтверждена многочисленными исследованиями, однако, вопрос о возможном прямом влиянии аутоантител продолжает оставаться предметом дискуссий. Сторонники сложившейся принципиальной позиции рассматривают аутоантитела в качестве маркеров и критериев иммунных нарушений на уровне органов и тканей, а репродуктивные потери расценивают как результат влияния системных нарушений в организме, ассоциированных с основным аутоиммунным заболеванием. Однако, в последнее время появляется все больше свидетельств в пользу возможного прямого влияния аутоантител на органы репродуктивной системы. Так, опубликованы метаанализы, показавшие, что наличие антител к тиреоидной пероксидазе (ТПО), даже при неизмененной функции щитовидной железы, является независимым фактором риска повышения процента невынашивания и преждевременных родов [Dhillon-Smith RK, Coomarasamy А. ТРО antibody positivity and adversepregnancy out comes. Best Pract Res ClinEndocrinolMetab. 2020 Jul; 34(4):101433. doi: 10.1016/j.beem.2020.101433. Epub 2020 Jun 18. PMID: 32883611.; Chen L, Hu R. Thyroid autoimmunity and miscarriage: a meta-analysis. ClinEndocrinol (Oxf). 2011 Apr; 74(4):513-9. doi: 10.1111/j.l365-2265.2010.03974.x. PMID: 21198746].
Для изучения профилактических и терапевтических мер разработано множество экспериментальных моделей на животных, что обусловлено невозможностью проведения таких исследований на человеке по этическим причинам. Одним из наиболее распространенных видов экспериментальных животных в данной области являются мыши. Это обусловлено сходством организации плацент мыши и человека, а также высокой плодовитостью и коротким сроком гестации мышей. Так, плацента человека относится к гемохориальным ворсинчатым, где увеличение площади контакта трофобласта с кровью матери достигается за счет многократного ветвления ворсин хориона, а плацента мыши - к гемохориальным лабиринтным, где увеличение контакта трофобласта с кровью матери достигается благодаря формированию сложного лабиринта каналов.
Существующие модели плацентарной недостаточности включают в себя широкий спектр различных повреждающих факторов: от перевязки маточных сосудов до использования векторных систем для доставки генов в трофоэктодерму.
Наиболее близкие к имеющимся в организме пациентки с аутоиммунным заболеванием условия создаются в моделях с использованием генетических или иммунологических повреждающих факторов.
Известен способ моделирования иммунопатологической плацентарной недостаточности (повреждения плаценты) с использованием линии мышей ВРН/5, которая является инбредной сублинией, полученной в результате многочисленных близкородственных скрещиваний известной линии мышей ВРН/2, отличающейся повышенным артериальным давлением (патент US 2004133929 A1). Данная линия экспериментальных животных демонстрирует умеренно повышенное артериальное давление до беременности и спонтанное развитие гестационной гипертензии, протеинурии, почечного гломерулосклероза и эндотелиальной дисфункции.
Очевидно, что любая инбредная линия имеет иммунологические нарушения, однако, наличие у данных животных генетически детерминированной предрасположенности к гипертензии затрудняет экстраполяцию данных на пациенток.
Известен способ моделирования иммунопатологической плацентарной недостаточности путем скрещивания самок линии CBA/J и самцов линии DBA/2 (патент CN 110100789 A). Данное сочетание линий мышей характеризуется высоким уровнем спонтанных абортов, обусловленных иммунологическими причинами.
Однако, принимая во внимание линейность экспериментальных животных, нужно помнить об ограничениях в экстраполяции данных на человеческую популяцию.
Известен способ моделирования иммунопатологической плацентарной недостаточности, заключающийся в удалении блестящей оболочки бластоцисты мыши и введении в трофоэктодерму sFLTl-кодирующей нуклеиновой кислоты (патент US 20130198874).
Однако такой способ моделирования является дорогостоящим и трудно воспроизводимым, в отличие от заявляемого. Кроме того, заявляемую модель выгодно отличает то, что используемая линия мышей гетерозиготна по неопределенному числу генов, что позволяет с большей достоверностью экстраполировать данные, полученные в эксперименте, на гетерогенную человеческую популяцию.
Известен способ моделирования иммунопатологической плацентарной недостаточности путем введения самкам линейных и нелинейных мышей гликозида мурамилдипептида - N-ацетил-β-1-О-гептилмурамил-L-аланил-D-изоглутамина (патент RU 2511107 C1). Введение молекулы, близкой по структуре к липополисахариду (ЛПС) бактериальной стенки, провоцирует гиперактивацию системного иммунного ответа, имеют место активация врожденного иммунитета и адъювантный эффект. В отличие от известного, заявляемый способ минимизирует системный иммунный ответ за счет пассивной иммунизации мышей благодаря отсутствию неспецифического адъювантного действия и активации факторов адаптивного иммунитета. Такой подход позволяет снизить вероятность негативного влияния иммунной системы матери на плацентарную ткань.
Известен способ моделирования иммунопатологической плацентарной недостаточности, основанный на введении галектина-9 беременным мышам внутрибрюшинно (патент CN 111514277 А).
Введение галектина-9 моделирует иммунопатологическую плацентарную недостаточность опосредованно, с последующим нарушением инвазии трофобласта и ремоделированием спиральных артерий, однако, происходит это в основном за счет активации CD14+ макрофагов, что более характерно для противоинфекционного иммунного ответа. В заявляемом же способе моделирования исключается активация этого звена иммунной системы, что приближает заявляемую модель к клинической картине аутоиммунного состояния.
Известен способ моделирования иммунопатологической плацентарной недостаточности, основанный на введении нефротоксических антител (патент SU 1267467 A1).
Недостатком способа является то, что при введении нефротоксических антител наблюдаются нарушения почечного кровотока, влекущие за собой вторичные изменения кровообращения в плаценте.
Техническим результатом изобретения является подтвержденное прямое повреждающее действие вводимых антител на морфогенез плаценты, отсутствие прямого повреждающего эффекта вводимых антител на орган мишень - щитовидную железу, минимизация системного иммунного ответа за счет пассивной иммунизации мышей, высокая достоверность экстраполяции на человеческую популяцию, доступность и воспроизводимость.
Указанный технический результат достигается в способе моделирования иммунопатологической плацентарной недостаточности, включающего введение антител беременным мышам, в котором аутбредным мышам ICR вводят антитела IgG, выделенные из анти-ТПО-положительных сывороток крови с титром более 1000 ед., полученных от пациенток с диагностированным аутоиммунным тиреоидитом, имеющих потерю плода и невынашивание беременности в анамнезе, введение IgG осуществляют внутривенно в хвостовую вену на 4-й день беременности в дозе 100 мкг/мышь, при этом адекватную модель иммунопатологической плацентарной недостаточности с морфологическими признаками повреждения плаценты, ассоциированного с антителами, получают на 16-й день беременности.
Преимущество введения антител IgG, выделенных из анти-ТПО-положительных сывороток крови с титром более 1000 ед., полученных от пациенток с диагностированным аутоиммунным тиреоидитом, имеющих потерю плода и невынашивание беременности в анамнезе заключается в отсутствии прямого повреждающего эффекта вводимых антител на орган мишень - щитовидную железу.
Наличие антител к тиреоглобулину и фосфолипидам у пациенток было исключено. В группе сравнения использовались Коммерческие IgG (Jackson, ImmunoResearchLaboratories) и PBS (Biologicallndustries, IsraelBeit-Haemek Ltd).
В эксперименте использовались самки мышей в возрасте 10-12 недель. Животных выращивали в стандартных условиях, при температуре 23°С (±1°С) в 12-часовых световых циклах (7:00 УТРА-7:00 вечера) с неограниченным доступом к пище и воде. Самок и самцов ссаживали в соотношении 3-4:1. После спаривания оценивалось наличие вагинальной пробки (день ее обнаружения считали 0-м днем беременности).
Антитела IgG вводили внутривенно в хвостовую вену на 4-й день беременности (начальный этап имплантации) по 100 мкг/мышь. Выбранный срок введения антител обусловлен стремлением моделировать состояние, близкое к клиническому относительно беременности, наступившей на фоне циркулирующих антител, имея в виду возможность оценить влияние вводимых антител на всех этапах плацентогенеза. В тоже время введение антител в сроки, соответствующие гестационному периоду, позволяет минимизировать системный иммунный ответ, обусловленный иммунизацией материнского организма, которая неизбежно развивается в течение 10-14 дней после индуцированной пассивной иммунизации.
В исследование были включены следующие группы мышей (n=15):
1) Мыши, получившие инъекцию IgG, выделенных из анти-ТПО-положительных сывороток, полученных от пациенток.
2) Мыши, получившие инъекцию коммерческой смеси IgG.
3) Мыши, получившие инъекцию PBS (Phosphate-bufferedsaline / Натрий-фосфатный буфер).
4) Интактный контроль.
Животные выводились из эксперимента на 16-й день беременности, соответствующий стадии максимального развития лабиринтной зоны плаценты у мышей, определяющей обмен между кровотоком матери и плода и, следовательно, ответственной за целевой эффект модели.
Рога матки с яичниками выделяли и оценивали процент жизнеспособных и резорбированных плодов по формуле:
Npeз./(Npeз.+Nжиз.) × 100%, где:
Npeз. - число резорбированных плодов;
Nжиз. - число жизнеспособных плодов.
Резорбция плода определялась как остановка роста или регрессия в некротическую массу. Затем жизнеспособные плоды и плаценты были взвешены. Для гистологической оценки были отобраны по 2 плаценты и 2 плода от каждой мыши из каждой группы, биоматериал немедленно фиксировали в 4% формальдегиде. После этого образцы подвергали дегидратации в 96% - ном этаноле с последующей обработкой ксилолом. Затем образцы погружали в парафин. Парафиновые блоки с образцами разрезали на слайды размером от 3 до 5 мкм и проводили окрашивание Н&Е.
Микропрепараты исследовали под микроскопом с настройкой освещения по Келлеру при увеличении 100×, 200× и 400× с целью получения общего представления о результатах гистологического исследования. Количественную оценку результатов проводили на микрофотографиях, полученных с помощью системы фиксации микроскопических изображений, состоящей из микроскопа Olympus ВХ46 и программного обеспечения «CellSens 47 Entry». Из фотосъемки исключались поля зрения, содержащие дефекты ткани, дефекты окрашивания и артефакты. Фотосъемку производили на увеличении 400× (окуляр 10×, объектив 40х), с полным открытием апертурной диафрагмы, в режиме Photo, время экспозиции 1/38 с, чувствительность камеры - максимальная, размер изображения 2080x×1544 пикселей, графический формат изображения JPEG (normal). Долю занимаемой площади клетками спонгиотрофобласта, клетками трофобласта лабиринтной части плаценты и гигантскими трофобластическими клетками рассчитывали с помощью программы ВидеоТест-Морфология 5.0 (Россия).
С каждой исследуемой области плаценты делали по 5 микроскопических изображений, оценивали: относительную площадь клеток (%), как отношение площади клеток к общей площади препарата по формуле:
Эотносительная = S клеток / S препарата × 100%.
Данные были оценены с помощью рангов, средних значений и стандартного отклонения. Значение р<0.05 было расценено как показатель достоверности разницы.
В ходе проведенного исследования были получены следующие результаты.
В группе мышей, получивших антитела от пациентов с АИТ, всего было получено 96 плодов, а в группе контроля - 201 плод (р<0,05). Среди всех плодов резорбции подверглось 27% (n=26) в исследуемой группе и только 3% (n=6) плодов в группе контроля (р<0,05). Таким образом, количество жизнеспособных плодов в группе сравнения (n=195) превысило количество жизнеспособных плодов в исследуемой группе (n=70) практически в 3 раза. Средний вес плодов и плацент в изучаемой группе составил 351 мг и 112 мг соответственно, в то время как в группе контроля 503 мг и 125 мг, соответственно (р<0,05). Гистологическая оценка плацент показала, что в отличие от группы сравнения, выявленные нарушения плацентогенеза в исследуемой группе затрагивали все плацентарные зоны. Данные изменения характеризовались неравномерной толщиной зон, нарушением соотношения плацентарных зон, а также неоднородным распределением клеток спонгиотрофобласта и гликогеновых клеток, свидетельствующим о нарушении процессов миграции клеток. Наиболее значимые нарушения были отмечены в лабиринтной зоне. Эти нарушения в основном были представлены неравномерной толщиной межсосудистых мембран и наравномерным кровенаполнением лакун. В остальных случаях была отмечена гиперваскуляризация разной степени выраженности.
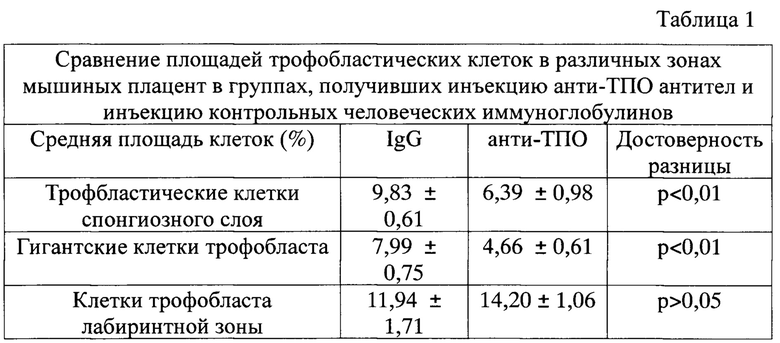
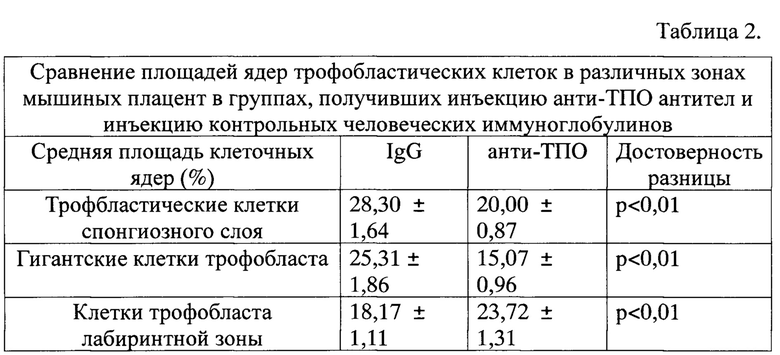
Способ иллюстрируется фиг. 1-10, где:
фиг.1 - скопление клеток спонгиотрофобласта в лабиринтной зоне плаценты, группа анти-ТПО. Н&Е, х200;
фиг. 2 - лабиринтная зона плаценты без скоплений трофобластических клеток, группа IgG, Н&Е, х400;
фиг. 3 - лакуны в лабиринтной зоне плаценты, стрелкой отмечено скопление гликогеновых клеток в лабиринтной зоне плаценты, группа анти-ТПО. Н&Е, х200;
фиг. 4 - равномерное кровенаполнение сосудистых лакун без признаков гиперваскуляризации и утолщения межсосудистых мембран в лабиринтной зоне плаценты, rpynnalgG. Н&Е, х400;
фиг. 5 - скопление гликогеновых клеток в лабиринтной зоне плаценты, группа анти-ТПО. Н&Е, х200;
фиг. 6 - незавершенная миграция клеток спонгиотрофобласта из лабиринтной зоны плаценты, группа анти-ТПО, Н&Е, х200;
фиг. 7 - нарушение соотношения плацентарных зон в плаценте, группа анти-ТПО. соотношение лабиринтная зона/ соединительная зона близко к 1,5:1. (норма-3:1), а-лабиринтная зона, b - соединительная зона/спонгиотрофобласт Н&Е, х40;
Фиг. 8 - экспрессия тиреопероксидазы клетками синцитиотрофобласта лабиринтной зоны мышиных плацент х400;
Фиг. 9 - экспрессия тиреопероксидазы клетками спонгиотрофобласта соединительной зоны мышиных плацент х400;
Фиг. 10 - экспрессия тиреопероксидазы гигантскими клетками трофобласта мышиных плацент хбОО.
В присутствии анти-ТПО антител площадь ядер гигантских клеток трофобласта и клеток спонгиотрофобласта, а также площадь самих клеток была достоверно ниже (р<0,01), чем во всех сравниваемых группах. При этом в лабиринтной части плаценты средняя площадь ядра оказалась достоверно выше (р<0,01), но площадь самой трофобластической клетки не имела достоверных отличий между группами, отмечалась только тенденция к увеличению в группе анти-ТПО. Полученные данные (табл. 1, 2) свидетельствуют о повреждении плацентарной ткани на клеточном уровне, что оказывает негативное влияние на состояние кровотока.
Впервые иммуногистохимическая оценка плацент мышей с использованием антител к мышиной тиреопероксидазе позволила выявить присутствие тиреопероксидазы в клетках синцитиотрофобласта, спонгиотрофобласта и гигантских клетках трофобласта. В таком случае эти данные позволяют подтвердить предположение о том, что все слои мышиных плацент содержат потенциальную мишень для прямого повреждающего действия антитиреоидных антител. Полученные результаты соотносятся с исследованием, показавшим, что в плаценте человека присутствует тиреопероксидаза [Rahnama R, Mahmoudi AR, Kazemnejad S, Salehi M, Ghahiri A, Soltanghoraee H, Vafaei S, Rezaei A, Zarnani AH. Thyroid peroxidase in human endometrium and placenta: a potential target for anti-TPO antibodies. ClinExp Med. 2021 Feb; 21(l):79-88. doi: 10.1007/sl0238-020-00663-y. Epub 2020 Sep 26. PMID: 32980989]. Авторы указанного исследования с помощью иммуногистохимического анализа плацент человека обнаружили тиреопероксидазу в клетках синцитиотрофобласта и на клеточной поверхности инвазивного трофобласта. В настоящем исследовании тиреопероксидаза была обнаружена в аналогичных структурах мышиных плацент.
Таким образом, результаты оценки состоятельности модели основаны на показателях репродуктивных потерь, сопряженных с детальной характеристикой целевого эффекта - морфологическими показателями повреждения плаценты, дополненными морфометрией и ИГХ исследованием. Ранее в известных моделях для изучения механизмов невынашивания беременности оценка влияния повреждающего фактора рассматривалась, как правило, только в сопоставлении с уровнем и характером плодовых потерь. Анализ состояния плацентарной ткани проводился, как правило, в единичных работах, фрагментарно, в описательном сопутствующем формате.
Повышенный процент резорбции плодов и отставание массо-ростовых показателей плодов являются традиционным признаком повреждения плаценты. Однако, выявленные в настоящей работе структурно-функциональные изменения плацентарной ткани служат объективным доказательством нарушения морфогенеза плаценты и позволяют определить патогенетические механизмы развития и возможного моделирования недостаточности маточно-плацентарной системы экспериментальных животных после введения IgG от пациенток с АИТ. Впервые выявленное наличие тиреопероксидазы в структурах плацентарной ткани, поврежденных у экспериментальных животных при иммунизации антителами к тиреопероксидазе может служить достаточным основанием для предположения о прямом повреждающем действии этих антител на морфогенез плаценты.
Полученные результаты позволяют сделать вывод о том, что заявленная модель является адекватной экспериментальной моделью, воспроизводящей антителозависимое повреждение плаценты. Формат модели технически может быть воспроизведен с другими антителами, полученными от пациенток, имеющих определенное аутоиммунное заболевание и невынашивание беременности в анамнезе. Этот способ может быть использован для оценки роли аутоантител в качестве фактора повреждения плаценты с последующей потерей плода при различных аутоиммунных заболеваниях и, в том числе, в клинических условиях для верификации идиопатических репродуктивных потерь.
Заявляемый способ имеет ряд достоинств:
- позволяет с большей достоверностью экстраполировать данные, полученные в эксперименте, на человеческую популяцию в отличие от экспериментов с линейными лабораторными животными в связи тем, что данные мыши гетерозиготны по неопределенному числу генов;
- позволяет определять антитела, как независимый иммунологический фактор повреждения плацентарной ткани;
- позволяет выявлять нарушения плацентогенеза, сопряженные с циркуляцией аутоантител;
- исключает влияние возможных повреждающих плацентарную ткань факторов (генетические, токсические, медикаментозные, химические, инфекционно-воспалительные, нарушающие кровообращение и др.);
- позволяет изучать независимые механизмы влияния репродуктивно значимых антител на плацентогенез;
- позволяет определить новые подходы к прогнозируемому риску осложненного течения беременности, родов, перинатального периода у женщин с аутоиммунными заболеваниями и обеспечить профилактику ранних повторных потерь беременности.
Заявляемый способ обеспечивает прямое повреждающее действие вводимых антител на морфогенез плаценты, отсутствие прямого повреждающего эффекта вводимых антител на орган мишень - щитовидную железу, минимизирует системный иммунный ответ, имеет высокую достоверность экстраполяции на человеческую популяцию, является доступным и воспроизводимым.



Изобретение относится к экспериментальной медицине в области акушерства-гинекологии, репродуктологии, иммунологии, гистологии. Способ моделирования иммунопатологической плацентарной недостаточности заключается в том, что аутбредным мышам ICR вводят антитела IgG, выделенные из анти-ТПО-положительных сывороток крови с титром более 1000 ед., полученных от пациенток с диагностированным аутоиммунным тиреоидитом, имеющих потерю плода и невынашивание беременности в анамнезе. Введение IgG осуществляют внутривенно в хвостовую вену на 4-й день беременности в дозе 100 мкг/мышь, при этом адекватную модель иммунопатологической плацентарной недостаточности с морфологическими признаками повреждения плаценты, ассоциированными с антителами, получают на 16-й день беременности. Изобретение обеспечивает прямое повреждающее действие вводимых антител на морфогенез плаценты, отсутствие прямого повреждающего эффекта вводимых антител на орган мишень - щитовидную железу, минимизирует системный иммунный ответ, имеет высокую достоверность экстраполяции на человеческую популяцию, является доступным и воспроизводимым. 10 ил., 2 табл.
Способ моделирования иммунопатологической плацентарной недостаточности, включающий введение антител беременным мышам, отличающийся тем, что аутбредным мышам ICR вводят антитела IgG, выделенные из анти-ТПО-положительных сывороток крови с титром более 1000 ед., полученных от пациенток с диагностированным аутоиммунным тиреоидитом, имеющих потерю плода и невынашивание беременности в анамнезе, введение IgG осуществляют внутривенно в хвостовую вену на 4-й день беременности в дозе 100 мкг/мышь, при этом адекватную модель иммунопатологической плацентарной недостаточности с морфологическими признаками повреждения плаценты, ассоциированного с антителами, получают на 16-й день беременности.
| СПОСОБ МОДЕЛИРОВАНИЯ ИММУНОЗАВИСИМОГО НЕВЫНАШИВАНИЯ АЛЛОГЕННОЙ БЕРЕМЕННОСТИ У ЛАБОРАТОРНЫХ МЫШЕЙ | 2012 |
|
RU2511107C1 |
| Способ моделирования недостаточности маточно-плацентарного кровообращения | 1984 |
|
SU1267467A1 |
| US 2013198874 A1, 01.08.2013 | |||
| МАГОМЕДОВА Ш.М | |||
| и др | |||
| Варианты экспериментального моделирования плацентарной недостаточности и преэклампсии / Известия Дагестанского государственного педагогического университета | |||
| Естественные и точные науки, 2012, 6 стр. | |||
| SEROR J | |||
| et al., Anti-TPO Antibodies | |||
Авторы
Даты
2022-01-11—Публикация
2021-07-08—Подача