ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к новому соединению бифенила, обладающему ингибирующим действием в отношении LSD1, или его соли; и фармацевтической композиции, содержащей соединение или его соль в качестве активного ингредиента.
УРОВЕНЬ ТЕХНИКИ
Модификация метилирования гистона является одним из эпигенетических механизмов, которые регулируют экспрессии генов. Модификация метилирования гистона регулирует различные процессы, включая поддерживание, рост и дифференциацию клеток.
LSD1 (KDM1A), один из ферментов, которые регулируют модификацию метилирования гистона, представляет собой ФАД (флавинадениндинуклеотид)–зависимую гистондеметилазу и в основном деметилирует лизиновый остаток в положении 4 (K4) и лизиновый остаток в положении 9 (K9) на гистоне H3 (непатентная литература (НПЛ) 1). Полагают, что имея такие функции, LSD1 положительно или отрицательно регулирует различные генные транскрипции и регулирует самообновление стволовых клеток и дифференциацию клеток в каждой нормальной ткани.
В общем, полагают, что аномалии в способности клеток к самообновлению или дифференциации приводят к канцеризации клеток. Таким образом, нарушенный контроль LSD1, который играет ключевую роль в этих процессах, возможно может вызывать канцеризацию клеток. Фактически, что касается различных солидных раков и раков крови, множество докладов было сделано относительно корреляции сверхэкспрессии LSD1 и их прогноза (НПЛ 2). Также в колониях клеток из карцином или в неклинических моделях было показано, что ингибирование LSD1 вызывало индукцию клеточной дифференциации, ингибирование роста и in vivo противоопухолевое действие (НПЛ 3 и НПЛ 4), что дает веские основания предполагать, что LSD1 является одной из важных целевых молекул в противораковой терапии. Эти карциномы, в которые вовлечен LSD1, такие как мелкоклеточный рак легких (МКРЛ) и острый миелоидный лейкоз (ОМЛ), имеют крайне короткое время жизни, и существующие терапевтические способы не могут дать удовлетворительного терапевтического эффекта.
Следовательно, ожидается, что лекарственные средства, ингибирующие LSD1, будут эффективными терапевтическими средствами, основанными на новых механизмах лечения не подающихся лечению раков, для которых в настоящее время не существует терапевтических способов.
Далее, согласно некоторым докладам, LSD1, который вовлечен в нейронные программы и функции, также может служить как цель при лечении заболеваний, отличных от рака, таких как болезнь Альцгеймера, болезнь Хантингтона, синдром Ретта и другие заболевания черепного нерва (НПЛ 2); инфекции вируса герпеса, в которых вовлечена функция LSD1 (НПЛ 5); и заболевания серповидных клеток (НПЛ 6).
Список цитат
Патентная литература
ПТЛ 1: WO 2015/089192
ПТЛ 2: WO 2015/168466
Непатентная литература
НПЛ 1: Biochim. Biophys. Acta, 1829 (10), pp. 981–986 (2013)
НПЛ 2: Epigenomics, 7 (4), pp. 609–626 (2015)
НПЛ 3: Cancer Cell, 21 (4), pp. 473–487 (2012)
НПЛ 4: Cancer Cell, 28 (1), pp. 57–69 (2015)
НПЛ 5: Sci. Transl. Med., 6 (265), 265ra169 (2014)
НПЛ 6: Nat. Med., 19 (3), pp. 291–294 (2013)
Сущность изобретения
Техническая проблема
Таким образом, объектом данного изобретения является получение нового соединения, которое обладает селективным и мощным ингибирующим действием в отношении LSD1, и которое полезно для лечения рака и других заболеваний, в которые вовлечен LSD1.
Соединение в соответствии с данным изобретением является новым соединением бифенила, имеющим превосходную ингибирующую активность в отношении LSD1. Более конкретно, как показано в формуле (I), соединение в соответствии с данным изобретением является новым соединением бифенила, содержащим
(i) бензольное кольцо, имеющее циклическую аминогруппу, связанную с ним через замещенный или незамещеный атом углерода,
(ii) бензольное кольцо, имеющее, в положении мета относительно атома углерода, бензольное кольцо, имеющее 4–нитро или 4–циано,
(iii) бензольное кольцо, дополнительно имеющее в положении пара относительно атома углерода, ненасыщенное углеводородное кольцо или ненасыщенное гетероциклическое кольцо.
В ПТЛ 1 и ПТЛ 2 описано замещенное гетероциклическое соединение как соединение, обладающее ингибирующей активностью в отношении LSD1. Более конкретно, в ПТЛ 1 и ПТЛ 2 описано, например, цианобензол–содержащее соединение пиримидина, цианобензол–содержащее соединение пиразола или соединение 6–оксо–1,6–дигидропиримидина, содержащее цианобензол и т.д.
Решение проблемы
Для решения указанных выше проблем авторы настоящего изобретения провели обширные исследования и обнаружили, что соединение бифенила в соответствии с данным изобретением обладает превосходной ингибирующей активностью в отношении LSD1 и ингибирующей активностью в отношении роста раковых клеток, и является пригодным в виде фармацевтического препарата для лечения раков. Таким образом, настоящее изобретение было осуществлено.
Более конкретно, в данном изобретении представлено следующее:
Пункт 1. Соединение, представленное формулой (I) или его соль:

где
кольцо A является моноциклической, мостиковой циклической или спироциклической азотсодержащей насыщенной гетероциклической группой,
кольцо B является моноциклическим или бициклическим ненасыщенным углеводородом или моноциклической или бициклической ненасыщенной гетероциклической группой, которая может быть замещена оксо,
R1 является нитро или циано,
R2 является галогеном,
R3 является замещенным или незамещенным амино, C1–C6 алкилом, галогеном, циано, оксо, гидрокси, карбамоилом, сульфо, C1–C6 алкокси или амино(C1–C6 алкилом),
R4 является галогеном, гидрокси, нитро, циано, амино, карбокси, (C2–C7 ацил)амино, (C2–C7 ацил)окси, замещенным или незамещенным C1–C8 алкилом, замещенным или незамещенным C2–C6 алкенилом, замещенным или незамещенным C1–C6 алкокси, замещенным или незамещенным C3–C7 циклоалкилом, моно– или ди(C1–C6 алкил)амино, замещенным или незамещенным карбамоилом, замещенным или незамещенным C2–C6 алкинилом, замещенным или незамещенным (C1–C6 алкил)карбонилом, замещенным или незамещенным 4–14–членной азотсодержащей насыщенной гетероциклической группой или замещенным или незамещенным C6–C14 ароматическим углеводородом,
R5 является водородом или C1–C6 алкилом, и R6 является водородом, или R5 и R6 вместе образуют оксо или тиоксо,
l является целым числом от 0 до 2,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 5,
где если l равно 2, два R2 могут быть одинаковыми или разными,
если m равно 2, два R3 могут быть одинаковыми или разными, и
если n равно от 2 до 5, от двух до пяти R4 могут быть одинаковыми или разными.
Пункт 2. Соединение или его соль по пункту 1, которое удовлетворяет следующим условиям в формуле (I):
кольцо A является моноциклической, мостиковой циклической или спироциклической 4–14–членной азотсодержащей насыщенной гетероциклической группой, имеющей от 1 до 3 атомов азота, от 0 до 1 атомов серы и от 0 до 2 атомов кислорода в качестве гетероатомов,
кольцо B является моноциклической или бициклической С5–С14 ненасыщенной углеводородной или моноциклической или бициклической 5–14–членной ненасыщенной гетероциклической группой, которая может быть замещена оксо, которая имеет от 0 до 4 атомов азота, от 0 до 2 атомов серы и от 0 до 3 атомов кислорода в качестве гетероатомов, и которая имеет, по меньшей мере, один из азота, серы или кислорода,
R1 является нитро или циано,
R2 является галогеном,
R3 является амино, моно– или ди(C1–C6 алкил)амино, (C3–C7 циклоалкил)амино или C1–C6 алкилом, и
R4 является галогеном, нитро, циано, карбокси, замещенным или незамещенным C1–C8 алкилом, замещенным или незамещенным C2–C6 алкенилом, замещенным или незамещенным C1–C6 алкокси, замещенным или незамещенным C3–C7 циклоалкилом, моно– или ди(C1–C6 алкил)амино или замещенным или незамещенным карбамоилом,
где если, по меньшей мере, один R4 является замещенным C1–C8 алкилом, замещенным C2–C6 алкенилом, замещенным C1–C6 алкокси, замещенным C3–C7 циклоалкилом или замещенным карбамоилом, заместителем является галоген, карбокси, C1–C6 алкокси, гидрокси, C1–C6 алкил, который может быть замещен гидрокси, моноциклический С5–С10 ненасыщенный углеводород, карбамоил, который может быть замещен C1–C6 алкилом или моноциклическим С5–С10 ненасыщенным углеводородом, (C2–C7 ацил)окси, амино, который может быть замещен C1–C6 алкилом или C2–C7 ацилом, C3–C7 циклоалкил, который может быть замещен гидрокси, или (C1–C6 алкокси)(C1–C6 алкил), и если присутствуют два или более заместителей, заместители могут быть одинаковыми или разными.
R5 является водородом или C1–C6 алкилом,
R6 является водородом,
l является целым числом от 0 до 2,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 5,
где если l равен 2, два R2 могут быть одинаковыми или разными, и если m равно 2, два R3 могут быть одинаковыми или разными, и если n равно 2–5, от двух до пяти R4 могут быть одинаковыми или разными.
Пункт 3. Соединение или его соль по пункту 1 или 2, которое удовлетворяет следующим условиям в формуле (I):
кольцо A является пирролидинилом, пиперидинилом, пиперазинилом, азепанилом, диазепанилом,

2,6–диазаспиро[3.4]октанилом, 2,7–диазаспиро[3.4]октанилом, 3,7–диазаспиро[3.4]октанилом, 2,6–диазаспиро[3.5]нонанилом, 2,7–диазаспиро[3.5]нонанилом, 2,8–диазаспиро[3.5]нонанилом, 3,7–диазаспиро[3.5]нонанилом, 3,8–диазаспиро[4.4]нонанилом, 3,8–диазаспиро[4.5]деканилом или 9–оксадиазаспиро[3.5]нонанилом,
кольцо B является моноциклическим или бициклическим C5–C14 ненасыщенным углеводородом или моноциклической или бициклической 5–14–членной ненасыщенной гетероциклической группой, которая может быть замещена оксо, которая имеет 0–4 атома азота, 0–2 атома серы и 0–3 атома кислорода в качестве гетероатомов, и которая имеет, по меньшей мере, один из азота, серы и кислорода,
R1 является нитро или циано,
R2 является галогеном,
R3 является амино, метиламино, этиламино, изопропиламино, диметиламино, циклобутиламино или метилом,
R4 является галогеном, нитро, циано, карбокси, замещенным или незамещенным C1–C8 алкилом, замещенным или незамещенным C2–C6 алкенилом, замещенным или незамещенным C1–C6 алкокси, замещенным или незамещенным C3–C7 циклоалкилом, моно– или ди(C1–C6 алкил)амино или замещенным или незамещенным карбамоилом,
где, по меньшей мере, один R4 является замещенным C1–C8 алкилом, замещенным C2–C6 алкенилом, замещенным C1–C6 алкокси, замещенным C3–C7 циклоалкилом или замещенным карбамоилом, заместителем является галоген, карбокси, C1–C6 алкокси, гидрокси, C1–C6 алкил, который может быть замещен гидрокси, моноциклический C5–C10 ненасыщенный углеводород, карбамоил, который может быть замещен C1–C6 алкилом или моноциклическим C5–C10 ненасыщенным углеводородом, C2–C7 ацил, амино, который может быть замещен C1–C6 алкилос или C2–C7 ацилом, C3–C7 циклоалкил, который может быть замещен гидрокси, или (C1–C6 алкокси)(C1–C6 алкил),
где если присутствуют два или более заместителей, заместители могут быть одинаковыми или разными,
R5 является водородом или C1–C6 алкилом,
R6 является водородом,
l является целым числом от 0 до 2,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 5,
где если l равен 2, два R2 могут быть одинаковыми или разными,
если m равен 2, два R3 могут быть одинаковыми или разными, и
если n равен 2–5, от двух до пяти R4 могут быть одинаковыми или разными.
Пункт 4. Соединение или его соль по любому из пунктов 1–3, которое удовлетворяет следующим условиям в формуле (I):
кольцо A является пирролидинилом,
 ,
,
2,6–диазаспиро[3.4]октанилом или 2,6–диазаспиро[3.5]нонанилом,
кольцо B является фенилом, индолилом, индазолилом или бензотриазолилом,
R1 является циано,
R2 является фтором и находится в орто положении относительно R1 в фениле,
R3 является амино (где если присутствуют два или более R3, R3 могут быть одинаковыми или разными),
R4 является фтором, хлором, бромом, метилом, гидроксиметилпропилом, гидроксиэтилбутилом или гидроксициклобутилметилом,
R5 является водородом или метилом,
R6 является водородом,
l является целым числом от 0 до 2,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 3,
где если m равно 2, два R3 могут быть одинаковыми или разными, и если n равно 2–3, от двух до трех R4 могут быть одинаковыми или разными.
Пункт 5. Соединения по любому из следующих (1)–(19) или соль соединений по любому из следующих (1)–(19);
(1) (S)–5′–((3–аминопирролидин–1–ил)метил)–4″–метил[1,1′:2′,1″–терфенил]–4–карбонитрил,
(2) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2″,3–дифтор–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил–изомер–X,
(3) (S)–5′–((3–амино–3–метилпирролидин–1–ил)метил)–2″,3–дифтор–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил,
(4) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(5) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–хлор–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(6) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(7) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–хлор–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(8) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(9) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2″,3–дифтор–4″–(2–гидрокси–2–метилпропил)–[1,1′:2′,1″–терфенил]–4–карбонитрил–изомер–X,
(10) (S)–5′–((3–аминопирролидин–1–ил)метил)–2″,3–дифтор–4″–(2–гидрокси–2–метилпропил)–[1,1′:2′,1″–терфенил]–4–карбонитрил,
(11) 5′–(1–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)этил)–2″,3–дифтор–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил–изомер–X,
(12) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(1–(2–этил–2–гидроксибутил)–6,7–дифтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(13) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(14) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–бром–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(15) (1R,2R,4S)–рел–7–((4–метил–4″–нитро–[1,1′:2′,1″–терфенил]–4′–ил)метил)–7–азабицикло[2.2.1]гептан–2–амин–изомер–X,
(16) 3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–5′–((гексагидропирроло[3,4–c]пиррол–2(1H)–ил)метил)–[1,1′–бифенил]–4–карбонитрил,
(17) 5′–((2,6–диазаспиро[3.5]нонан–2–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил,
(18) 5′–(((3–эндо)–амино–8–азабицикло[3.2.1]октан–8–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил и
(19) 5′–((2,6–диазаспиро[3.4]октан–6–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил.
Пункт 6. Ингибитор LSD1, содержащий соединение или его соль по любому из пунктов 1–5, в качестве активного ингредиента.
Пункт 7. Фармацевтическая композиция, содержащая соединение или его соль по любому из пунктов 1–5.
Пункт 8. Фармацевтическая композиция по пункту 7, которая является композицией для перорального введения.
Пункт 9. Противоопухолевый агент, содержащий соединение или его соль по любому из пунктов 1–5 в качестве активного ингредиента.
Пункт 10. Способ лечения пациента с раком, где способ включает введение эффективного количества соединения или его соли по любому из пунктов 1–5 пациенту.
Пункт 11. Соединение или его соль по любому из пунктов 1–5 для применения в лечении пациента с раком.
Пункт 12. Применение соединения или его соли по любому из пунктов 1–5 в производстве противоопухолевого агента.
Преимущественные эффекты изобретения
Настоящее изобретение предоставляет новое соединение, представленное формулой (I) выше, или его соль, оба из которых пригодны в качестве ингибитора LSD1.
Было обнаружено, что соединение в соответствии с данным изобретением или его соль обладает превосходной ингибирующей активностью в отношении LSD1 и ингибирующей активностью в отношении роста раковых клеток, имеет низкую токсичность и вводится перорально. Поэтому соединение в соответствии с данным изобретением или его соль пригодны в качестве агента для профилактики и/или лечения рака.
Описание вариантов
Соединение, представленное формулой (I) в соответствии с данным изобретением, является новым соединением бифенила, содержащим (i) бензольное кольцо, имеющее циклическую аминогруппу, связанную с ним через атом углерода, который может быть замещен заместителем, таким как C1–C6 алкил; (ii) бензольное кольцо, имеющее в положении мета относительно атома углерода, бензольное кольцо, имеющее 4–нитро или 4–циано, и (iii) бензольное кольцо, также имеющее ненасыщенное углеводородное кольцо или ненасыщенное гетероциклическое кольцо в положении пара относительно атома углерода.
В данном описании, если не указано иначе, примеры “заместителя” включают галоген, гидрокси, циано, нитро, алкил, гидроксиалкил, галогенoалкил, циклоалкил, гидроксициклоалкил, циклоалкилалкил, аралкил, алкенил, алкинил, алкокси, галогеноалкокси, циклоалкокси, циклоалкилалкокси, ненасыщенное углеводородное кольцо–алкокси, алкилтио, циклоалкилалкилтио, амино, моно– или диалкиламино, циклоалкиламино, циклоалкилалкиламино, ацил, ацилокси, оксо, карбокси, алкоксикарбонил, аралкилоксикарбонил, карбамоил, который может быть замещен ненасыщенным углеводородным кольцом, насыщенную или ненасыщенную гетероциклическую группу, ненасыщенное углеводородное кольцо (например, ароматический углеводород), насыщенный гетероциклический окси, и подобные. Количество заместителей, если присутствуют, обычно составляет один, два или три.
В данном описании, примеры “галогена” включают фтор, хлор, бром, йод, и подобные, где фтор, хлор, бром или йод предпочтительны, и фтор, хлор или бром более предпочтительны.
В данном описании, “алкил” может быть прямым или разветвленным. Примеры включают C1–C6 алкил, такой как метил, этил, н–пропил, изопропил, н–бутил, изобутил, втор–бутил, трет–бутил, н–пентил, изопентил, трет–пентил и н–гексил.
В данном описании, примеры “гидроксиалкила” включают перечисленные выше алкильные группы, имеющие, по меньшей мере, одну гидроксигруппу (например, одну или две гидроксигруппы). Конкретные примеры включают гидроксиметил, 2–гидроксиэтил, 1–гидроксиэтил, 3–гидроксипропил, 2–гидроксипропил, 1–метил–2–гидроксиэтил, 4–гидроксибутил, изобутил, 2,2–диметил–2–гидроксиэтил, 5–гидроксипентил, 3,3–диметил–3–гидроксипропил, 6–гидроксигексил, дигидроксиметил, 1,2–дигидроксиэтил, 2,3–дигидроксипропил, 3,4–дигидроксибутил, 4,5–дигидроксипентил, 5,6–дигидроксигексил, и подобные, где гидроксиалкил, имеющий одну гидроксигруппу, предпочтителен.
В данном описании, “галогеноалкил” является прямым или разветвленным C1–C6 алкилом, имеющим от 1 до 13 атомов галогена (галоген C1–C6 алкил). Примеры включают галоген C1–C6 алкил, такой как фторметил, дифторметил, трифторметил, трихлорметил, фторэтил, 1,1,1–трифторэтил, монофтор–н–пропил, перфтор–н–пропил и перфторизопропил, где галоген C1–C4 алкил предпочтителен, и галоген C1–C4 алкил, имеющий 1–7 атомов галогена, более предпочтителен.
В данном описании, конкретные примеры “циклоалкила” включают C3–C7 циклоалкил, такой как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
В данном описании, примеры “гидроксициклоалкила” включают перечисленные выше C3–C7 циклоалкильные группы, которые имеют, по меньшей мере, одну гидроксигруппу (например, одну или две гидроксигруппы). Конкретные примеры включают 1–гидроксициклопропил, 2–гидроксициклопропил, 1–гидроксициклобутил, 3–гидроксициклобутил, 1–гидроксициклопентил, 3,4–дигидроксициклопентил, 1–гидроксициклогексил, 4–гидроксициклогексил, 1–гидроксициклогептил, и подобные, где гидроксициклоалкил, имеющий одну гидроксигруппу, предпочтителен.
В данном описании, примеры “циклоалкилалкила” включают C3–C7 циклоалкил, замещенный C1–C4 алкилом, такой как циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил и циклогептилметил.
В данном описании, примеры “аралкил” включают C7–C13 аралкил, такой как бензил, фенетил, нафтилметил и флуоренилметил.
В данном описании, “алкенил” может быть прямым, разветвленным или циклическим и относится к ненасыщенному углеводороду, имеющему, по меньшей мере, одну двойную связь (например, одну или две двойные связи). Примеры включают C2–C6 алкенил, такой как винил, аллил, 1–пропенил, 2–метил–2–пропенил, изопропенил, 1–бутенил, 2–бутенил, 3–бутенил, изобутенил, 2–пенетнил, 3–пенетнил, 4–пенетнил, 2–метил–2–бутенил, 3–метил–2–бутенил, 5–гексенил, 1–циклопенетнил, 1–циклогексенил и 3–метил–3–бутенил.
В данном описании, “алкинил” может быть прямым, разветвленным или циклическим и относится к ненасыщенному углеводороду, имеющему, по меньшей мере, одну тройную связь (например, одну или две тройные связи). Примеры включают C2–C6 алкинил, такой как этинил, 1–пропинил, 2–пропинил, 1–бутинил, 2–бутинил, 3–бутинил и 1–метил–2–пропинил.
В данном описании, “алкокси” может быть прямым или разветвленным. Примеры включают C1–C6 алкокси, такой как метокси, этокси, н–пропокси, изопропокси, н–бутокси, изобутокси, втор–бутокси, трет–бутокси, пентилокси, изопентилокси и гексилокси.
В данном описании, “галогеноалкокси” относится к прямому или разветвленному C1–C6 алкокси, имеющему 1–13 атомов галогена (галоген C1–C6 алкокси). Примеры включают галоген C1–C6 алкокси, такой как фторметокси, дифторметокси, трифторметокси, трихлорметокси, фторэтокси, 1,1,1–трифторэтокси, монофтор–н–пропокси, перфтор–н–пропокси и перфторизопропокси, где галоген C1–C4 алкокси предпочтителен, и галоген C1–C4 алкокси, имеющий 1–7 атомов галогена, более предпочтителен.
В данном описании, примеры “циклоалкокси” включают C3–C7 циклоалкокси, такой как циклопропокси, циклобутокси, циклопентилокси, циклогексилокси и циклогептилокси.
В данном описании, примеры “циклоалкилалкокси” включают C3–C7 циклоалкил, замещенный C1–C4 алкокси, такой как циклопропилметокси, циклобутилметокси, циклопентилметокси, циклогексилметокси и циклогептилметокси.
В данном описании, “алкилтио” может быть прямым или разветвленным. Примеры включают C1–C6 алкилтио, такой как метилтио, этилтио, н–пропилтио, изопропилтио, н–бутилтио, изобутилтио, трет–бутилтио, н–пентилтио, изопентилтио и гексилтио.
В данном описании, примеры “циклоалкилалкилтио” включают C3–C7 циклоалкил–замещенный C1–C4 алкилтио, такой как циклопропилметилтио, циклобутилметилтио, циклопентилметилтио, циклогексилметилтио и циклогептилметилтио.
В данном описании, примеры “моноалкиламино” включают амино, монозамещенный прямым или разветвленным C1–6 алкилом, такой как метиламино, этиламино, н–пропиламино, изопропиламино, н–бутиламино, изобутиламино, трет–бутиламино, н–пентиламино, изопентиламино и гексиламино.
В данном описании, примеры “диалкиламино” включают амино, дизамещенный одинаковыми или разными прямыми или разветвленными C1–C6 алкильными группами, такой как диметиламино, диэтиламино, ди(н–пропил)амино, диизопропиламино, ди(н–бутил)амино, диизобутиламино, ди(трет–бутил)амино, ди(н–пентил)амино, диизопентиламино, дигексиламино, метилэтиламино и метилизопропиламино.
В данном описании, примеры “циклоалкиламино” включают амино, имеющий одну или две циклоалкильные группы, указанные выше. Конкретные примеры включают N–циклопропиламино, N, N–дициклопропиламино, N–циклобутиламино, N–циклопентиламино, N–циклогексиламино, N–циклогептиламино и подобные.
В данном описании, примеры “циклоалкилалкиламино” включают C3–C7 циклоалкилзамещенный C1–C4 алкиламино, такой как циклопропилметиламино, циклобутилметиламино, циклопентилметиламино, циклогексилметиламино и циклогептилметиламино.
В данном описании, “ацил” относится к алкилкарбонилу или арилкарбонил.
В данном описании, примеры “алкилкарбонила” включают прямой или разветвленный (C1–C6 алкил)карбонил, такой как метилкарбонил, этилкарбонил, н–пропилкарбонил, изопропилкарбонил, н–бутилкарбонил, изобутилкарбонил, трет–бутилкарбонил, н–пентилкарбонил, изопентилкарбонил и гексилкарбонил.
В данном описании, примеры “арилкарбонила” включают (C6–C13 арил)карбонил, такой как фенилкарбонил, нафтилкарбонил, флуоренилкарбонил, антрилкарбонил, бифенилилкарбонил, тетрагидронафтилкарбонил, хроманилкарбонил, 2,3–дигидро–1,4–диоксанафталенилкарбонил, инданилкарбонил и фенантрилкарбонил.
В данном описании, “ациламино” относится к алкилкарбониламино или арилкарбониламино.
В данном описании, примеры “алкилкарбониламино” включают прямой или разветвленный (C1–C6 алкил)карбониламино, такой как метилкарбониламино, этилкарбониламино, н–пропилкарбониламино, изопропилкарбониламино, н–бутилкарбониламино, изобутилкарбониламино, трет–бутилкарбониламино, н–пентилкарбониламино, изопентилкарбониламино и гексилкарбониламино.
В данном описании, примеры “арилкарбониламино” включают (C6–C13 арил)карбониламино, такой как фенилкарбониламино, нафтилкарбониламино, флуоренилкарбониламино, антрилкарбониламино, бифенилилкарбониламино, тетрагидронафтилкарбониламино, хроманилкарбониламино, 2,3–дигидро–1,4–диоксанафталенилкарбониламино, инданилкарбониламино и фенантрилкарбониламино.
В данном описании, “ацилокси” относится к алкилкарбонилокси или арилкарбонилокси.
В данном описании, примеры “алкилкарбонилокси” включают прямой или разветвленный (C1–C6 алкил)карбонилокси, такой как метилкарбонилокси, этилкарбонилокси, н–пропилкарбонилокси, изопропилкарбонилокси, н–бутилкарбонилокси, изобутилкарбонилокси, трет–бутилкарбонилокси, н–пентилкарбонилокси, изопентилкарбонилокси и гексилкарбонилокси.
В данном описании, примеры “арилкарбонилокси” включают (C6–C13 арил)карбонилокси, такой как фенилкарбонилокси, нафтилкарбонилокси, флуоренилкарбонилокси, антрилкарбонилокси, бифенилилкарбонилокси, тетрагидронафтилкарбонилокси, хроманилкарбонилокси, 2,3–дигидро–1,4–диоксанафталенилкарбонилокси, инданилкарбонилокси и фенантрилкарбонилокси.
В данном описании, “алкоксикарбонил” может быть прямым или разветвленным. Примеры включают (C1–C6 алкокси)карбонил, такой как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, трет–бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил и гексилоксикарбонил.
В данном описании, примеры “аралкилоксикарбонила” включают (C7–C13 аралкил)оксикарбонил, такой как бензилоксикарбонил, фенэтилоксикарбонил, нафтилметилоксикарбонил и флуоренилметилоксикарбонил.
В данном описании, “насыщенная гетероциклическая группа” относится к моноциклической или полициклической насыщенной гетероциклической группе, имеющей один или более (предпочтительно, 1–3) гетероатома, выбранных из азота, кислорода и серы. Конкретные примеры включают морфолинил, пирролидинил, пиперидинил, пиперазинил, азепанил, диазепанил, тетрагидрофуранил, тетрагидропиранил, тетрагидротиофенил, тиазолидинил, оксазолидинил и подобные.
В данном описании, “ненасыщенная гетероциклическая группа” относится к моноциклической или полициклической, полностью или частично ненасыщенной гетероциклической группе, содержащей один или более (предпочтительно, 1–3) гетероатома, выбранных из азота, кислорода и серы. Конкретные примеры включают имидазолил, тиенил, фурил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, тиадиазолил, пиразолил, триазолил, тетразолил, пиридил, пиразолил, пиримидинил, пиридазинил, пиразолопиридил, пиразолопиримидинил, индолил, изоиндолил, индазолил, триазолопиридил, бензоимидазолил, бензоксазолил, бензоизоксазолил, бензотиазолил, бензотиенил, бензофуранил, 1,3–дигидроизобензофуранил, пуринил, бензотриазолил, имидазопиридинил, хинолинил, изохинолинил, хиназолинил, хиноксалинил, фталазинил, метилендиоксифенил, этилендиоксифенил, дигидробензофуранил, и подобные.
В данном описании, примеры “ненасыщенного углеводорода” включают моноциклическое или полициклическое C5–С14 углеводородное кольцо, имеющее, по меньшей мере, одну ненасыщенную связь (например, 1–8 ненасыщенных связей), и подобные. “Ненасыщенным углеводородом” предпочтительно является ароматический углеводород или моноциклический или бициклический С5–С14 ненасыщенный углеводород.
В данном описании, примеры “ароматического углеводорода” включают C6–C14 ароматические углеводороды, такие как фенил, нафтил, антраценил, фенантрил, флуоренил и тетрагидронафтил.
В данном описании, примеры “моноциклического или бициклического С5–С14 ненасыщенного углеводорода” включают циклопентадиентил, фенил, нафтил, тетрагидронафтил, азуленил, гепталенил и подобные.
В данном описании, примеры “моноциклического С5–С10 ненасыщенного углеводорода” включают циклопентадиенил, фенил, циклооктатетраенил, и подобные.
В данном описании, “насыщенный гетероциклический окси” относится к насыщенному гетероциклическому окси, имеющему гетероатом, выбранный из азота, кислорода и серы. Конкретные примеры включают морфолинилокси, 1–пирролидинилокси, пиперидинилокси, пиперазинилокси, 4–метил–1–пиперазинилокси, тетрагидрофуранилокси, тетрагидропиранилокси, тетрагидротиофенилокси, тиазолидинилокси и оксазолидинилокси, где насыщенный гетероциклический окси, имеющий 1–3 гетероатома, выбранных из азота, кислорода и серы, предпочтителен.
В данном описании, термин “CA–CB”, применяемый при описании группы, означает, что группа имеет A–B количество атомов углерода. Например, “C1–C6 алкил” относится к алкилу, имеющему 1–6 атомов углерода, и “C6–C14 ароматический углеводород окси” относится к окси, к которому присоединен C6–C14 ароматический углеводород. Далее, термин “A–B–членный” означает, что количество атомов (количество членов кольца), которые составляют кольцо, равно A–B. Например, “4–10–членная азотсодержащая насыщенная гетероциклическая группа” относится к азотсодержащей насыщенной гетероциклической группе, содержащей 4–10 членов в кольце.
В соединении, представленном формулой (I) в соответствии с данным изобретением, кольцо A относится к азотсодержащей насыщенной гетероциклической группе, которая может быть поперечно сшитой или спироциклической. Как показано в формуле (1) выше, азот в кольце A связан с атомом углерода, который имеет водород или C1–C6 алкил в качестве заместителя, или который замещен оксо или тиоксо, образованным R5 и R6, взятыми вместе.
Примеры моноциклической азотсодержащей насыщенной гетероциклической группы в “моноциклической, мостиковой циклической, или спироциклической азотсодержащей насыщенной гетероциклической группе”, представленной кольцом A, включают моноциклические азотсодержащие насыщенные гетероциклические группы, такие как пирролидинил, пиперидинил, пиперазинил, азепанил, диазепанил, и подобные. Предпочтительно, моноциклической азотсодержащей насыщенной гетероциклической группой является моноциклическая азотсодержащая насыщенная гетероциклическая группа, имеющая от 1 до 3 атомов азота, от 0 до 1 атома серы и от 0 до 2 атомов кислорода в качестве гетероатомов. Более предпочтительно, моноциклической азотсодержащей насыщенной гетероциклической группой является моноциклическая азотсодержащая насыщенная гетероциклическая группа, имеющая от 1 до 2 атомов азота в качестве гетероатомов. Более предпочтительно, моноциклической азотсодержащей насыщенной гетероциклической группой является моноциклическая 4–10–членная азотсодержащая насыщенная гетероциклическая группа, имеющая от 1 до 2 атомов азота в качестве гетероатомов, более предпочтительно, моноциклическая 5–7–членная азотсодержащая насыщенная гетероциклическая группа, имеющая от 1 до 2 атомов азота в качестве гетероатомов, и более предпочтительно, пирролидинил, пиперидинил, пиперазинил, азепанил или диазепанил. Более предпочтительно, моноциклической азотсодержащей насыщенной гетероциклической группой является пирролидинил.
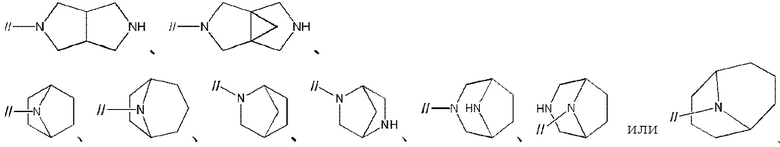
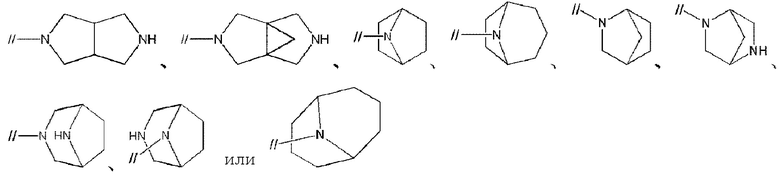
Примеры мостиковой циклической азотсодержащей насыщенной гетероциклической группы в “моноциклической, мостиковой циклической или спироциклической азотсодержащей насыщенной гетероциклической группы” представленной кольцом A, включают
 .
.
и подобные. Мостиковой циклической азотсодержащей насыщенной гетероциклической группой предпочтительно является
более предпочтительно,

более предпочтительно,

более предпочтительно,

более предпочтительно,
и более предпочтительно,
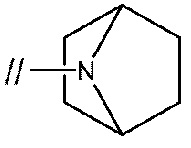 .
.
Примеры спироциклической азотсодержащей насыщенной гетероциклической группы в “моноциклической, мостиковой циклической или спироциклической азотсодержащей насыщенной гетероциклической группе”, представленной кольцом A, включают спироциклические группы, имеющие 0–2 атома кислорода, в которых любые две 4–7–членные азотсодержащие насыщенные гетероциклические группы связаны друг с другом. Спироциклической азотсодержащей насыщенной гетероциклической группой предпочтительно является 7–12–членная спироциклическая группа, имеющая 2 атома азота и 0–1 атом кислорода, в которой любые две 4–7–членные азотсодержащие насыщенные гетероциклические группы связаны друг с другом, более предпочтительно диазаспирогептанил, диазаспирооктанил, диазаспирононанил, диазаспиродеканил, диазаспироундеканил, оксадиазаспирогептанил, оксадиазаспирооктанил, оксадиазаспирононанил, оксадиазаспиродеканил или оксадиазаспироундеканил, более предпочтительно, диазаспирооктанил, диазаспирононанил, диазаспиродеканил или оксадиазаспирононанил, более предпочтительно, 2,6–диазаспиро[3.4]октанил, 2,7–диазаспиро[3.4]октанил, 3,7–диазаспиро[3.4]октанил, 2,6–диазаспиро[3.5]нонанил, 2,7–диазаспиро[3.5]нонанил, 2,8–диазаспиро[3.5]нонанил, 3,7–диазаспиро[3.5]октанил, 3,8–диазаспиро[4.4]нонанил, 3,8–диазаспиро[3.5]деканил или 9–окса–диазаспиро[3.5]нонанил, более предпочтительно 2,6–диазаспиро[3.4]октанил, 2,7–диазаспиро[3.4]октанил, 3,7–диазаспиро[3.4]октанил, 2,6–диазаспиро[3.5]нонанил, 2,7–диазаспиро[3.5]нонанил, 2,8–диазаспиро[3.5]нонанил или 9–окса–диазаспиро[3.5]нонанил, более предпочтительно 2,6–диазаспиро[3.4]октанил, 2,7–диазаспиро[3.4]октанил, 3,7–диазаспиро[3.4]октанил, 2,6–диазаспиро[3.5]нонанил или 2,8–диазаспиро[3.5]нонанил, и более предпочтительно 2,6–диазаспиро[3.4]октанил, 2,6–диазаспиро[3.5]нонанил или 2,8–диазаспиро[3.5]нонанил.
Кольцом A предпочтительно является моноциклическая, мостиковая циклическая или спироциклическая 4–14–членная азотсодержащая насыщенная гетероциклическая группа, содержащая 1–3 атома азота, 0–1 атом серы и 0–2 атома кислорода в качестве гетероатомов, более предпочтительно, моноциклическая 4–10–членная азотсодержащая насыщенная гетероциклическая группа, имеющая 1–2 атома азота в качестве гетероатомов, мостиковая циклическая азотсодержащая насыщенная гетероциклическая группа, такая как

или спироциклическая группа, имеющая 0–2 атома кислорода, в которой любые две 4–7–членные азотсодержащие насыщенные гетероциклические группы связаны друг с другом.
Кольцом А более предпочтительно является моноциклическая 4–10–членная азотсодержащая насыщенная гетероциклическая группа, содержащая 1–2 атома азота в качестве гетероатомов, мостиковая циклическая азотсодержащая насыщенная гетероциклическая группа, такая как

или 7–12–членная спироциклическая группа, имеющая 2 атома азота и 0–1 атом кислорода, в которой любые две 4–7–членные азотсодержащие насыщенные гетероциклические группы связаны друг с другом.
Кольцом А более предпочтительно является пирролидинил, пиперидинил, пиперазинил, азепанил, диазепанил,

2,6–диазаспиро[3.4]октанил, 2,7–диазаспиро[3.4]октанил, 3,7–диазаспиро[3.4]октанил, 2,6–диазаспиро[3.5]нонанил, 2,7–диазаспиро[3.5]нонанил, 2,8–диазаспиро[3.5]нонанил, 3,7–диазаспиро[3.5]нонанил, 3,8–диазаспиро[4.4]нонанил, 3,8–диазаспиро[4.5]деканил или 9–оксадиазаспиро[3.5]нонанил.
Кольцом A более предпочтительно является пирролидинил,

2,6–диазаспиро[3.4]октанил или 2,6–диазаспиро[3.5]нонанил.
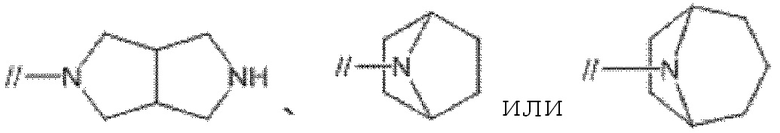
С другой стороны, кольцом А предпочтительно является моноциклическая 5–7–членная азотсодержащая насыщенная гетероциклическая группа, имеющая 1–2 атома углерода в качестве гетероатомов, или 5–9–членная мостиковая циклическая азотсодержащая насыщенная гетероциклическая группа, имеющая 1–2 атома азота в качестве гетероатомов.
Кольцом A более предпочтительно является пирролидинил или  .
.
В соединении, представленном формулой (I) в соответствии с данным изобретением кольцо B является моноциклическим или бициклическим ненасыщенным углеводородом или моноциклической или бициклической ненасыщенной гетероциклической группой, которая может быть замещена оксо.
“Моноциклическим или бициклическим ненасыщенным углеводородом”, представленным кольцом B, предпочтительно является моноциклический или бициклический 5–14–членный ненасыщенный углеводород, более предпочтительно, моноциклический или бициклический C5–C10 ненасыщенный углеводород, более предпочтительно, фенил или нафтил, и более предпочтительно, фенил.
“Моноциклическая или бициклическая ненасыщенная гетероциклическая группа”, представленная кольцом B, предпочтительно является моноциклической или бициклической, полностью или частично ненасыщенной гетероциклической группой, имеющей гетероатом, выбранный из азота, кислорода и серы.
“Моноциклическая или бициклическая ненасыщенная гетероциклическая группа”, представленная кольцом B, предпочтительно является 5–14–членной моноциклической или бициклической, полностью или частично ненасыщенной гетероциклической группой, имеющей 0–4 атома азота, 0–2 атома серы и 0–3 атома кислорода в качестве гетероатомов, и имеющая, по меньшей мере, один из азота, серы и кислорода.
“Моноциклической или бициклической ненасыщенной гетероциклической группой”, представленной кольцом B, предпочтительно является имидазолил, тиенил, фурил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, тиадиазолил, пиразолил, триазолил, тетразолил, пиридил, пиразил, пиримидинил, пиридазинил, пиразолопиридил, пиразолопиримидинил, индолил, изоиндолил, индолинил, индазолил, триазолопиридил, бензоимидазолил, бензоксазолил, бензоизоксазолил, бензотиазолил, бензотриазолил, бензотиенил, бензофуранил, пуринил, имидазопиридинил, хинолинил, изохинолинил, хиназолинил, хиноксалинил, фталазинил, метилендиоксифенил, этилендиоксифенил, дигидробензофуранил, 1,3–дигидроизобензофуранил, дигидробензоксазолил (например, 2,3–дигидробензо[d]оксазолил), дигидробензооксазинил (например, 3,4–дигидро–2H–бензо[b][1,4]оксазинил), бензодиоксолил (например, бензо[d][1,3]диоксолил), дигидробензодиоксинил (например, 2,3–дигидробензо[b][1,4]диоксинил) или дигидробензотиазолил (например, 2,3–дигидробензо[d]тиазолил).
С другой стороны, “моноциклической или бициклической ненасыщенной гетероциклической группой”, представленной кольцом B, предпочтительно является 5–14–членная моноциклическая или бициклическая полностью или частично ненасыщенная гетероциклическая группа, имеющая 1–4 атома азота, 0–2 атома серы и 0–3 атома кислорода в качестве гетероатомов, и имеющая, по меньшей мере, один атом азота. Более предпочтительно, “моноциклической или бициклической ненасыщенной гетероциклической группой”, представленной кольцом B, является 5–14–членная моноциклическая или бициклическая полностью или частично ненасыщенная гетероциклическая группа, имеющая только 1–4 атома азота в качестве гетероатомов.
“Моноциклической или бициклической ненасыщенной гетероциклической группой”, представленной кольцом B, более предпочтительно является индолил, индазолил или бензотриазолил. Моноциклическая или бициклическая ненасыщенная гетероциклическая группа, представленная кольцом B, может быть замещена огксо. Примеры моноциклической или бициклической ненасыщенной группы, которая замещена оксо, включают 2–оксо–индолинил,  , 2–оксо–2,3–дигидробензо[d]оксазолил,
, 2–оксо–2,3–дигидробензо[d]оксазолил,  , 2–оксо–2,3–дигидробензо[d]тиазолил,
, 2–оксо–2,3–дигидробензо[d]тиазолил,  и подобные.
и подобные.
Кольцом B предпочтительно является моноциклическая или бициклическая С5–С14 ненасыщенная углеводородная группа или моноциклическая или бициклическая 5–14–членная ненасыщенная гетероциклическая группа, которая может быть замещена оксо; которая имеет 0–4 атома азота, 0–2 атома серы и 0–3 атома кислорода в качестве гетероатомов; и которая имеет, по меньшей мере, один из азота, серы и кислорода.
Кольцом B более предпочтительно является фенил, нафтил, пиридил, пиразолопиридил, пиразолопиримидинил, индолил, индолинил, 2–оксоиндолинил, индазолил, бензоимидазолил, бензоизоксазолил, бензотиазолил, бензотриазолил, имидазопиридинил, хинолинил, изохинолинил, хиназолинил, хиноксалинил, фталазинил, 2–оксо–2,3–дигидробензо[d]оксазолил, 1,3–дигидроизобензофуранил, дигидробензооксазинил, бензодиоксолил, дигидробензодиоксинил или 2–оксо–2,3–дигидробензо[d]тиазолил, и более предпочтительно, фенил, нафтил, пиридил, пиразолопиридил, индолил, индолинил, индазолил, бензоимидазолил, бензоизоксазолил, бензотриазолил, хинолинил, 2–оксо–2,3–дигидробензо[d]оксазолил, 1,3–дигидроизобензофуранил, дигидробензооксазинил или 2–оксо–2,3–дигидробензо[d]тиазолил.
Кольцом В более предпочтительно является фенил, индолил, индазолил или бензотриазолил.
В соединении, представленном формулой (I) в соответствии с данным изобретением, R1 является нитро или циано, и, предпочтительно, циано.
В соединении, представленном формулой (I) в соответствии с данным изобретением, R2 является галогеном и, предпочтительно, фтором. Если присутствуют два или более R2, R2 могут быть одинаковыми или разными.
В соединении, представленном формулой (I) в соответствии с данным изобретением, l является целым числом от 0 до 2, и, предпочтительно, целым числом от 0 до 1.
В соединении, представленном формулой (I) в соответствии с данным изобретением, R3 является замещенным или незамещенным амино, C1–C6 алкилом, галогеном, циано, оксо, гидрокси, карбамоилом, сульфо, C1–C6 алкокси или амино(C1–C6 алкилом). Если присутствуют два или более R3, R3 могут быть одинаковыми или разными.
R3 предпочтительно является замещенным или незамещенным амино, C1–C6 алкилом, галогеном, циано, оксо, гидрокси, карбамоилом, сульфо, C1–C6 алкокси или амино(C1–C6 алкилом).
R3 более предпочтительно является амино, который может быть замещен от одной до двух C1–C6 алкильными или C3–C7 циклоалкильными группами, C1–C6 алкилом, галогеном, циано, оксо, гидрокси, карбамоилом, сульфо, C1–C6 алкокси или амино(C1–C6 алкилом).
R3 более предпочтительно является амино, моно– или ди(C1–C6 алкил)амино, (C3–C7 циклоалкил)амино или C1–C6 алкилом; более предпочтительно, амино, метиламино, этиламино, изопропиламино, диметиламино, циклобутиламино или метилом.
R3 более предпочтительно является амино, который может быть замещен от одной до двух C1–C6 алкильными или C3–C7 циклоалкильными группами.
R3 более предпочтительно является амино.
В соединении, представленном формулой (I) в соответствии с данным изобретением, m является целым числом от 0 до 2, и, предпочтительно, целым числом от 0 до 1.
В соединении, представленном формулой (I) в соответствии с данным изобретением, R4 является галогеном, гидрокси, нитро, циано, амино, карбокси, (C2–C7 ацил)амино, (C2–C7 ацил)окси, замещенным или незамещенным C1–C8 алкилом, замещенным или незамещенным C2–C6 алкенилом, замещенным или незамещенным C1–C6 алкокси, замещенным или незамещенным C3–C7 циклоалкилом, моно– или ди(C1–C6 алкил)амино, замещенным или незамещенным карбамоилом, замещенным или незамещенным C2–C6 алкинилом, замещенным или незамещенным (C1–C6 алкил)карбонилом, замещенной или незамещенной 4–14–членной азотсодержащей насыщенной гетероциклической группой, или замещенным или незамещенным C6–C14 ароматическим углеводородом. Если присутствуют два или более R4, R4 могут быть одинаковыми или разными.
В данном изобретении если, по меньшей мере, один R4 является замещенным C1–C8 алкилом, замещенным C2–C6 алкенилом, замещенным C1–C6 алкокси, замещенным C3–C7 циклоалкилом или замещенным карбамоилом, примеры заместителей включают галоген, карбокси, C1–C6 алкокси, гидрокси, C1–C6 алкил, который может быть замещен гидрокси, моноциклический С5–С10 ненасыщенный углеводород, карбамоил, который может быть замещен C1–C6 алкилом, или моноциклический С5–С10 ненасыщенный углеводород, (C2–C7 ацил)окси, амино, который может быть замещен C1–C6 алкилом или C2–C7 ацилом, C3–C7 циклоалкил, который может быть замещен гидрокси, (C1–C6 алкокси)(C1–C6 алкил), и подобные. Если присутствуют два или более заместителей, заместители могут быть одинаковыми или разными.
“C1–C8 алкил” в “замещенном или незамещенном C1–C8 алкиле”, представленном R4, предпочтительно является метилом, этилом, н–пропилом, изопропилом, н–бутилом, изобутилом, втор–бутилом, трет–бутилом, пентилом, гексилом, гептилом или октилом, более предпочтительно, C1–C6 алкилом, более предпочтительно, метилом, этилом, н–пропилом, изопропилом, н–бутилом, изобутилом, втор–бутилом, трет–бутилом, пентилом или гексилом, и более предпочтительно, метилом, этилом, н–пропилом, изопропилом, н–бутилом, изобутилом, втор–бутилом или трет–бутилом.
Заместителем в “замещенном или незамещенном C1–C8 алкиле”, представленном R4, может быть, например, заместитель из перечисленных выше, предпочтительно, галоген, амино, гидрокси, карбокси, карбамоил, алкилкарбамоил, ациламино, алкокси, гидроксициклоалкил или ацилокси, более предпочтительно, галоген, амино, гидрокси, карбокси, карбамоил, (C1–C6 алкил)карбамоил, (C2–C7 ацил)амино, C1–C6 алкокси, C3–C7 циклоалкил, гидрокси(C3–C7 циклоалкил) или (C2–C7 ацил)окси, более предпочтительно, галоген, амино, гидрокси, карбокси, карбамоил, (C1–C6 алкил)карбамоил, (C1–C6 алкил)карбониламино, C1–C6 алкокси, C3–C7 циклоалкил, гидрокси(C3–C7 циклоалкил) или (C1–C6 алкил)карбонилокси, и более предпочтительно, фтор, амино, гидрокси, карбокси, карбамоил, метилкарбамоил, диметилкарбамоил, ацетиламино, метокси, гидроксициклопропил или метилкарбонилокси.
“Замещенный или незамещенный C1–C8 алкил”, представленный R4, предпочтительно является незамещенным C1–C8 алкилом или C1–C8 алкилом, который может быть замещен галогеном, амино, гидрокси, карбокси, карбамоилом, (C1–C6 алкил)карбамоилом, (C1–C6 алкил)карбониламино, C1–C6 алкокси, C3–C7 циклоалкилом, гидрокси(C3–C7 циклоалкилом) или (C1–C6 алкил)карбонилокси.
“Замещенным или незамещенным C1–C8 алкилом”, представленным R4, более предпочтительно является метил, этил, н–пропил, изопропил, трет–бутил, дифторметил, трифторметил, фторэтил, аминоэтил, гидроксиметил, гидроксиэтил, гидроксипропил, гидроксидиметилэтил, гидроксиметилпропил, гидроксиметилбутил, гидроксиэтилбутил, карбоксиметил, карбамоилметил, метилкарбамоилметил, диметилкарбамоилметил, ацетиламиноэтил, метоксиэтил, гидроксициклопропилметил, гидроксициклопропилэтил, гидроксициклобутилметил или метилкарбонилоксиэтил. “Замещенным или незамещенным C1–C8 алкилом”, представленным R4, более предпочтительно является гидроксиметилпропил, гидроксиэтилбутил-или гидроксициклобутилметил.
“Замещенным или незамещенным C2–C6 алкенилом”, представленным R4, предпочтительно является незамещенный C2–C6 алкенил, более предпочтительно, винил, аллил, 1–пропенил, 2–метил–2–пропенил, изопропенил, 1–, 2– или 3–бутенил, изобутенил, 2–, 3– или 4–пенетнил, 2–метил–2–бутенил, 3–метил–2–бутенил, 5–гексенил, 1–циклопенетнил, 1–циклогексенил или 3–метил–3–бутенил, и более предпочтительно, изобутенил.
Примеры “C2–C6 алкинила” в “замещенном или незамещенном C2–C6 алкиниле”, представленном R4, включают этинил, 1– или 2–пропинил, 1–, 2– или 3–бутинил, 1–метил–2–пропинил, и подобные. “Замещенным или незамещенным C2–C6 алкинилом” предпочтительно является незамещенный C2–C6 алкинил.
“C1–C6 алкокси” в “замещенном или незамещенном C1–C6 алкокси”, представленном R4, предпочтительно является метокси, этокси, н–пропокси, изопропокси, н–бутокси, изобутокси, втор–бутокси, трет–бутокси, пентилокси или гексилокси, и более предпочтительно, метокси, этокси, н–пропокси, изопропокси, н–бутокси, изобутокси, втор–бутокси и трет–бутокси.
Заместителем в “замещенном или незамещенном C1–C6 алкокси”, представленном R4, может быть, например, заместитель из указанных выше и является, предпочтительно, гидрокси или С5–С14 ненасыщенный углеводород, более предпочтительно, гидрокси или моноциклический С5–С10 ненасыщенный углеводород, и более предпочтительно, гидрокси или фенил.
“Замещенным или незамещенным C1–C6 алкокси”, представленным R4, предпочтительно является C1–C6 алкокси, который может быть замещен гидрокси или С5–С14 ненасыщенным углеводородом, более предпочтительно, C1–C6 алкокси, который может быть замещен гидрокси или моноциклическим С5–С10 ненасыщенным углеводородом, более предпочтительно, C1–C6 алкокси, который может быть замещен гидрокси или фенилом, и более предпочтительно, метокси, гидроксипропокси или бензилокси.
“Замещенным или незамещенным C3–C7 циклоалкилом” представленным R4, предпочтительно является C3–C7 циклоалкил, который может быть замещен гидроксиалкилом, алкоксиалкилом, гидроксициклоалкилом или ненасыщенным углеводородом карбамоилом, более предпочтительно, C3–C7 циклоалкилом, который может быть замещен гидрокси(C1–C4 алкилом), (C1–C4 алкокси)(C1–C4 алкилом), гидрокси(C3–C7 циклоалкилом) или (C6–C14 ароматический углеводород)карбамоилом, более предпочтительно, C3–C7 циклоалкилом, который может быть замещен гидрокси(C1–C4 алкилом), (C1–C4 алкокси)(C1–C4 алкилом), гидрокси(C3–C7 циклоалкилом) или фенилкарбамоилом, более предпочтительно циклопропилом, гидроксиметилциклопропилом, метоксиметилциклопропилом, гидроксициклопропилциклопропилом или фенилкарбамоилциклопропилом, более предпочтительно, циклопропилом или гидроксиметилциклопропилом, и более предпочтительно, циклопропилом.
“Моно– или ди(C1–C6 алкил)амино”, представленным R4, является, предпочтительно, метиламино, этиламино, н–пропиламино, изопропиламино, н–бутиламино, изобутиламино, трет–бутиламино, н–пентиламино, изопентиламино, гексиламино, диметиламино, диэтиламино, ди(н–пропил)амино, диизопропиламино, ди(н–бутил)амино, диизобутиламино, ди(трет–бутил)амино, ди(н–пентил)амино, диизопентиламино, дигексиламино, метилэтиламино или метилизопропиламино, более предпочтительно, метиламино, этиламино, н–пропиламино, изопропиламино и н–бутиламино, изобутиламино, трет–бутиламино, диметиламино, диэтиламино, ди(н–пропил)амино, диизопропиламино, ди(н–бутил)амино, диизобутиламино, ди(трет–бутил)амино, метилэтиламино или метилизопропиламино, и более предпочтительно, диметиламино.
“Замещенным или незамещенным карбамоилом”, представленным R4, является, предпочтительно, карбамоил, который может быть замещен алкилом, более предпочтительно, карбамоил, который может быть замещен C1–C6 алкилом, и более предпочтительно, карбамоил, метилкарбамоил или диметилкарбамоил.
Примеры алкилкарбонила в “замещенном или незамещенном (C1–C6 алкил)карбониле”, представленном R4, включают прямой или разветвленный (C1–C6 алкил)карбонил, такой как метилкарбонил, этилкарбонил, н–пропилкарбонил, изопропилкарбонил, н–бутилкарбонил, изобутилкарбонил, трет–бутилкарбонил, н–пентилкарбонил, изопентилкарбонил и гексилкарбонил.
Примеры “азотсодержащей насыщенной гетероциклической группы” в “замещенной или незамещенной 4–14–членной азотсодержащей насыщенной гетероциклической группе”, представленной R4, включают морфолинил, азетидинил, пирролидинил, пиперидинил, пиперазинил и подобные.
Примеры “замещенного или незамещенного C6–C14 ароматического углеводорода”, представленного R4, включают C6–C14 ароматический углеводород, который может быть замещен метилом, таким как фенил, толуил, ксилил, нафтил, антраценил, фенантирл, флуоренил и тетрагидронафтил.
R4 предпочтительно является галогеном, гидрокси, нитро, циано, амино, карбокси, (C2–C7 ацил)амино, (C2–C7 ацил)окси, замещенным или незамещенным C1–C8 алкилом, замещенным или незамещенным C2–C6 алкенилом, замещенным или незамещенным C1–C6 алкокси, замещенным или незамещенным C3–C7 циклоалкилом, моно– или ди(C1–C6 алкил)амино, замещенным или незамещенным карбамоилом, замещенным или незамещенным C2–C6 алкинилом, замещенным или незамещенным (C1–C6 алкил)карбонилом, замещенной или незамещенной 4–14–членной азотсодержащей насыщенной гетероциклической группой или замещенным или незамещенным C6–C14 ароматическим углеводородом.
R4 более предпочтительно является галогеном, нитро, циано, карбокси, замещенным или незамещенным C1–C8 алкилом, замещенным или незамещенным C2–C6 алкенилом, замещенным или незамещенным C1–C6 алкокси, замещенным или незамещенным C3–C7 циклоалкилом, моно– или ди(C1–C6 алкил)амино или замещенным или незамещенным карбамоилом.
R4 более предпочтительно является галогеном, нитро, циано, карбокси,C1–C6 алкилом, который может быть замещен галогеном, амино, гидрокси, карбокси, карбамоилом, (C1–C6 алкил)карбамоилом, (C1–C6 алкил)карбониламино, C1–C6 алкокси, C3–C7 циклоалкилом, гидрокси(C3–C7 циклоалкилом) или (C1–C6 алкил)карбонилокси, C2–C6 алкенилом, C1–C6 алкокси, который может быть замещен гидрокси или моноциклическим C5–C10 ненасыщенным углеводородом, C3–C7 циклоалкилом, который может быть замещен гидрокси, гидрокси(C1–C4 алкилом), (C1–C4 алкокси)(C1–C4 алкилом), гидрокси(C3–C7 циклоалкилом) или (C6–C14 ароматический углеводород)–замещенным карбамоилом, моно– или ди(C1–C6 алкил)амино или карбамоилом, который может быть замещен C1–C6 алкилом.
R4 более предпочтительно является фтором, хлором, бромом, йодом, нитро, циано, карбокси, метилом, этилом, н–пропилом, изопропилом, трет–бутилом, дифторметилом, трифторметилом, фторэтилом, аминоэтилом, гидроксиметилом, гидроксиэтилом, гидроксипропилом, гидроксидиметилэтилом, гидроксиметилпропилом, гидроксиметилбутилом, гидроксиэтилбутилом, карбоксиметилом, карбамоилметилом, метилкарбамоилметилом, диметилкарбамоилметилом, ацетиламиноэтилом, метоксиэтилом, гидроксициклопропилметилом, гидроксициклопропилэтилом, гидроксициклобутилметилом, метилкарбонилоксиэтилом, изобутенилом, метокси, гидроксипропокси, циклопропилом, гидроксиметилциклопропилом, метоксиметилциклопропилом, гидроксициклопропилциклопропилом, фенилкарбамоилциклопропилом, бензилокси, диметиламино, карбамоилом, метилкарбамоилом или диметилкарбамоилом.
R4 более предпочтительно является фтором, хлором, бромом, метилом, гидроксиметилпропилом или гидроксиэтилбутилом.
В соединении, представленном формулой (I) в соответствии с данным изобретением, n является целым числом от 0 до 5 и предпочтительно, целым числом от 0 до 3.
В соединении, представленном формулой (I) в соответствии с данным изобретением, R5 является водородом или C1–C6 алкилом, и R6 является водородом, или R5 и R6 вместе образуют оксо или тиоксо.
“C1–C6 алкил”, представленный R5, предпочтительно является метилом, этилом, н–пропилом, изопропилом, н–бутилом, изобутилом, втор–бутилом, трет–бутилом, пентилом или гексилом; и более предпочтительно метилом.
В соединении, представленном формулой (I) в соответствии с данным изобретением, R6 является водородом.
Что касается R5 и R6 в соединении, представленном формулой (I) в соответствии с данным изобретением, “R5 является водородом или C1–C6 алкилом, и R6 является водородом, или R5 и R6 вместе образуют оксо или тиоксо”. Предпочтительно, R5 является водородом или C1–C6 алкилом, и R6 является водородом. Более предпочтительно, R5 является водородом или метилом, и R6 является водородом.
Соединением в соответствии с данным изобретением является соединение, представленное формулой (I), где
кольцом A является моноциклическая, мостиковая циклическая или спироциклическая азотсодержащая насыщенная гетероциклическая группа,
кольцом B является моноциклический или бициклический ненасыщенный углеводород, или моноциклическая или бициклическая ненасыщенная гетероциклическая группа, которая может быть замещена оксо,
R1 является нитро или циано,
R2 является галогеном,
R3 является замещенным или незамещенным амино, C1–C6 алкилом, галогеном, циано, оксо, гидрокси, карбамоилом, сульфо, C1–C6 алкокси или амино(C1–C6 алкилом),
R4 является галогеном, гидрокси, нитро, циано, амино, карбокси, (C2–C7 ацил)амино, (C2–C7 ацил)окси, замещенным или незамещенным C1–C8 алкилом, замещенным или незамещенным C2–C6 алкенилом, замещенным или незамещенным C1–C6 алкокси, замещенным или незамещенным C3–C7 циклоалкилом, моно– или ди(C1–C6 алкил)амино, замещенным или незамещенным карбамоилом, замещенным или незамещенным C2–C6 алкинилом, замещенным или незамещенным (C1–C6 алкил)карбонилом, замещенной или незамещенной 4–14–членной азотсодержащей насыщенной гетероциклической группой или замещенным или незамещенным C6–C14 ароматическим углеводородом,
l является целым числом от 0 до 2,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 5,
где если l равно 2, два R2 могут быть одинаковыми или разными,
если m равно 2, два R3 могут быть одинаковыми или разными, и
если n равно 2–5, от двух до пяти R4 могут быть одинаковыми или разными.
Более предпочтительным является соединение, представленное формулой (I), или его соль, где
кольцом A является моноциклическая, мостиковая циклическая или спироциклическая 4–14–членная азотсодержащая насыщенная гетероциклическая группа, имеющая 1–3 атома азота, 0–1 атом серы и 0–2 атома кислорода в качестве гетероатомов,
кольцом B является моноциклический или бициклический С5–С14 ненасыщенный углеводород или моноциклическая или бициклическая 5–14–членная ненасыщенная гетероциклическая группа, которая может быть замещена оксо, которая имеет 0–4 атома азота, 0–2 атома серы и 0–3 атома кислорода в качестве гетероатомов, и которая имеет, по меньшей мере, один из азота, серы и кислорода,
R1 является нитро или циано,
R2 является галогеном,
R3 является амино, моно– или ди(C1–C6 алкил)амино, (C3–C7 циклоалкил)амино или C1–C6 алкилом,
R4 является галогеном, нитро, циано, карбокси, замещенным или незамещенным C1–C8 алкилом, замещенным или незамещенным C2–C6 алкенилом, замещенным или незамещенным C1–C6 алкокси, замещенным или незамещенным C3–C7 циклоалкилом, моно– или ди(C1–C6 алкил)амино или замещенным или незамещенным карбамоилом,
где если, по меньшей мере, один R4 является замещенным C1–C8 алкилом, замещенным C2–C6 алкенилом, замещенным C1–C6 алкокси, замещенным C3–C7 циклоалкилом или замещенным карбамоилом, заместителем является галоген, карбокси, C1–C6 алкокси, гидрокси, C1–C6 алкил, который может быть замещен гидрокси, моноциклический С5–С10 ненасыщенный углеводород, карбамоил, который может быть замещен C1–C6 алкилом или моноциклическим, С5–С10 ненасыщенным углеводородом, (C2–C7 ацил)окси, амино, который может быть замещен C1–C6 алкилом или C2–C7 ацилом, C3–C7 циклоалкил, который может быть замещен гидрокси, или (C1–C6 алкокси)(C1–C6 алкил), где, если присутствуют два или более заместителя, заместители могут быть одинаковыми или разными,
R5 является водородом или C1–C6 алкилом,
R6 является водородом,
l является целым числом от 0 до 2,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 5,
где если l равно 2, два R2 могут быть одинаковыми или разными, если m равно 2, два R3 могут быть одинаковыми или разными, и
если n равно 2–5, от двух до пяти R4 могут быть одинаковыми или разными.
Более предпочтительным является соединение, представленное формулой (I), или его соль, где
кольцом A является пирролидинил, пиперидинил, пиперазинил, азепанил, диазепанил,

2,6–диазаспиро[3.4]октанил, 2,7–диазаспиро[3.4]октанил, 3,7–диазаспиро[3.4]октанил, 2,6–диазаспиро[3.5]нонанил, 2,7–диазаспиро[3.5]нонанил, 2,8–диазаспиро[3.5]нонанил, 3,7–диазаспиро[3.5]нонанил, 3,8–диазаспиро[4.4]нонанил, 3,8–диазаспиро[4.5]деканил или 9–оксадиазаспиро[3.5]нонанил,
кольцом B является моноциклический или бициклический С5–С14 ненасыщенный углеводород или моноциклическая или бициклическая 5–14–членная ненасыщенная гетероциклическая группа, которая может быть замещена оксо, которая имеет 0–4 атома азота, 0–2 атома серы и 0–3 атома кислорода в качестве гетероатомов, и которая имеет, по меньшей мере, один из азота, серы и кислорода,
R1 является нитро или циано,
R2 является галогеном,
R3 является амино, метиламино, этиламино, изопропиламино, диметиламино, циклобутиламино или метилом,
R4 представляет собой галоген, нитро, циано, карбокси, замещенный или незамещенный C1–C8 алкил, замещенный или незамещенный C2–C6 алкенил, замещенный или незамещенный C1–C6 алкокси, замещенный или незамещенный C3–C7 циклоалкил, моно– или ди(C1–C6 алкил)амино или замещенный или незамещенный карбамоил,
где если, по меньшей мере, один R4 является замещенным C1–C8 алкилом, замещенным C2–C6 алкенилом, замещенным C1–C6 алкокси, замещенным C3–C7 циклоалкилом или замещенным карбамоилом, заместителем является галоген, карбокси, C1–C6 алкокси, гидрокси, C1–C6 алкил, который может быть замещен гидрокси, моноциклический С5–С10 ненасыщенный углеводород, карбамоил, который может быть замещен C1–C6 алкилом или моноциклическим С5–С10 ненасыщенным углеводородом, C2–C7 ацил, амино, который может быть замещен C1–C6 алкилом или C2–C7 ацилом, C3–C7 циклоалкил, который может быть замещен гидрокси или (C1–C6 алкокси)(C1–C6 алкилом),
где, если присутствуют, два или более заместителя, заместители могут быть одинаковыми или разными,
R5 является водородом или C1–C6 алкилом,
R6 является водородом,
l является целым числом от 0 до 2,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 5,
где если l равно 2, два R2 могут быть одинаковыми или разными,
если m равно 2, два R3 могут быть одинаковыми или разными, и
если n равно 2–5, от двух до пяти R4 могут быть одинаковыми или разными.
Более предпочтительным является соединение, представленное формулой (I), или его соль, где
кольцом A является пирролидинил, пиперидинил, пиперазинил, азепанил, диазепанил,

2,6–диазаспиро[3.4]октанил, 2,7–диазаспиро[3.4]октанил, 3,7–диазаспиро[3.4]октанил, 2,6–диазаспиро[3.5]нонанил, 2,7–диазаспиро[3.5]нонанил, 2,8–диазаспиро[3.5]нонанил, 3,7–диазаспиро[3.5]нонанил, 3,8–диазаспиро[4.4]нонанил, 3,8–диазаспиро[4.5]деканил или 9–оксадиазаспиро[3.5]нонанил;
кольцом B является моноциклический или бициклический С5–С14 ненасыщенный углеводород или моноциклическая или бициклическая 5–14–членная ненасыщенная гетероциклическая группа, которая может быть замещена оксо, которая имеет 0–4 атома азота, 0–2 атома серы и 0–3 атома кислорода в качестве гетероатомов, и которая имеет, по меньшей мере, один из азота, серы и кислорода,
R1 является нитро или циано,
R2 является галогеном,
R3 является амино, метиламино, этиламино, изопропиламино, диметиламино, циклобутиламино или метилом,
R4 является галоген, нитро, циано, карбокси, C1–C8 алкил, который может быть замещен галогеном, амино, гидрокси, карбокси, карбамоил, (C1–C6 алкил)карбамоил, (C1–C6 алкил)карбониламино, C1–C6 алкокси, (C1–C6 алкил)карбонил, C3–C7 циклоалкил, гидрокси(C3–C7 циклоалкил) или (C1–C6 алкил)карбонилокси, C2–C6 алкенил, C1–C6 алкокси, который может быть замещен гидрокси или моноциклическим С5–С10 ненасыщенным углеводородом, C3–C7 циклоалкил, который может быть замещен гидрокси, гидрокси(C1–C4 алкил), (C1–C4 алкокси)(C1–C4 алкил), гидрокси(C3–C7 циклоалкил) или (C6–C14 ароматический углеводород)–замещенный карбамоил, моно– или ди(C1–C6 алкил)амино или карбамоил, который может быть замещен C1–C6 алкилом,
R5 является водородом или C1–C6 алкилом,
R6 является водородом,
l является целым числом от 0 до 2,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 5,
где если l равно 2, два R2 могут быть одинаковыми или разными,
если m равно 2, два R3 могут быть одинаковыми или разными, и
если n равно 2–5, от двух до пяти R4 могут быть одинаковыми или разными.
Более предпочтительно, в формуле (I)
кольцо A является пирролидинилом,  , 2,6–диазаспиро[3.4]октанилом или 2,6–диазаспиро[3.5]нонанилом,
, 2,6–диазаспиро[3.4]октанилом или 2,6–диазаспиро[3.5]нонанилом,
кольцо B является фенилом, индолилом, индазолилом или бензотриазолилом,
R1 является циано,
R2 является фтором и находится в положении орто относительно R1 в фениле,
R3 является амино (если присутствуют, два или более R3, R3 могут быть одинаковыми или разными),
R4 является фтором, хлором, бромом, метилом, гидроксиметилпропилом, гидроксиэтилбутилом или гидроксициклобутилметилом,
R5 является водородом или метилом,
R6 является водородом,
l является целым числом от 0 до 2,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 3,
где, если m равно 2, два R3 могут быть одинаковыми или разными, и если n равно 2–3, от двух до трех R4 могут быть одинаковыми или разными.
Конкретные примеры соединений в соответствии с данным изобретением включают, но не ограничены ими, соединения, полученные в примерах ниже.
Далее представлены примеры предпочтительных соединений в соответствии с данным изобретением:
(1) (S)–5′–((3–аминопирролидин–1–ил)метил)–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил,
(2) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2″,3–дифтор–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил–изомер–X,
(3) (S)–5′–((3–амино–3–метилпирролидин–1–ил)метил)–2″,3–дифтор–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил,
(4) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(5) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–хлор–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(6) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(7) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–хлор–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(8) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(9) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2″,3–дифтор–4″–(2–гидрокси–2–метилпропил)–[1,1′:2′,1″–терфенил]–4–карбонитрил–изомер–X,
(10) (S)–5′–((3–аминопирролидин–1–ил)метил)–2″,3–дифтор–4″–(2–гидрокси–2–метилпропил)–[1,1′:2′,1″–терфенил]–4–карбонитрил,
(11) 5′–(1–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)этил)–2″,3–дифтор–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил–изомер–X,
(12) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(1–(2–этил–2–гидроксибутил)–6,7–дифтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(13) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(14) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–бром–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(15) (1R,2R,4S)–рел–7–((4–метил–4″–нитро–[1,1′:2′,1″–терфенил]–4′–ил)метил)–7–азабицикло[2.2.1]гептан–2–амин–изомер–X,
(16) 3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–5′–((гексагидропирроло[3,4–c]пиррол–2(1H)–ил)метил)–[1,1′–бифенил]–4–карбонитрил,
(17) 5′–((2,6–диазаспиро[3.5]нонан–2–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил,
(18) 5′–(((3–эндо)–амино–8–азабицикло[3.2.1]октан–8–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил и
(19) 5′–((2,6–диазаспиро[3.4]октан–6–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил.
Далее описаны способы получения соединений в соответствии с данным изобретением.
Соединение (I) в соответствии с данным изобретением может быть получено, например, способами получения, представленными ниже, или способами, описанными в примерах. Однако способы получения соединения (I) в соответствии с данным изобретением не ограничены этими примерами реакций.
(На стадиях 1–5, кольцо A, кольцо B, R1, R2, R3, R4, R5, R6, l, m и n в формулах такие, как определены выше.)

Стадия 1: Восстановление до спирта
Эта стадия включает способ получения спиртового соединения (III) реакцией с применением соединения карбоновой кислоты, представленной формулой (II), и восстанавливающего агента. Примеры восстанавливающих агентов включают боран, алюмогидрид лития и подобные. Затем, боргидрид натрия, боргидрид лития или подобное может применяться в качестве восстанавливающего агента после образования активного сложного эфира из соединения карбоновой кислоты, представленного формулой (II) в системе. Примеры активных эстерифицирующих агентов включают WSCHCl, применяемый вместе с ГАТУ и ГОБт. Применяемое количество восстанавливающего агента составляет 1–10 моль, предпочтительно, 1–5 моль на моль соединения, представленного формулой (II). Количество применяемого активного эстерифицирующего агента составляет 1–10 моль, предпочтительно, 1–5 моль на моль соединения, представленного формулой (II). Растворитель не ограничен, пока он не оказывает негативного действия на реакцию. Примеры включают толуол, ацетонитрил, 1,2–диметоксиэтан, тетрагидрофуран, 1,4–диоксан, этанол, N, N–диметилформамид, воду, смешанные растворители, и подобные. Температура реакции обычно составляет от 0–200°C и, предпочтительно, от 0–100°C. Время реакции обычно составляет от 5 минут до 3 дней, предпочтительно, от 5 минут до 10 часов.
Полученное таким образом соединение, представленное формулой (III), может быть подвергнуто последующей стадии после или без выделения или очистки известными средствами выделения и очистки, такими как концентрация, вакуумная концентрация, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
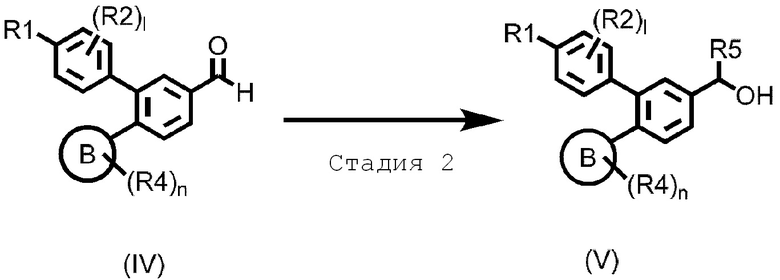
Стадия 2: Алкилирование
Эта стадия представляет способ получения спиртового соединения (V), где R5 является C1–C6 алкилом, реакцией с применением альдегидного соединения, представленного формулой (IV), и алкилметаллического реагента.
Примеры алкилметаллических реагентов включают литиевый, алкилмагниевый реагенты и подобные. Количество добавляемого алкилметаллического реагента составляет 1–10 моль, предпочтительно, 1–5 моль, на моль соединения, представленного формулой (IV). Растворитель применяют так же, как на стадии 1. Температура реакции обычно составляет –78–200°C, и предпочтительно, –78–0°C. Время реакции обычно составляет от 5 минут до 3 дней, и предпочтительно, от 5 минут до 10 часов.
Полученное таким образом соединение, представленное формулой (V), может быть подвергнуто последующей стадии после или без выделения или очистки известными средствами выделения и очистки, такими как концентрация, вакуумная концентрация, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.

Стадия 3: Окисление до альдегида или кетона
Эта стадия представляет способ получения соединения альдегида или кетона, представленного формулой (VI) с применением спиртового соединения, представленного формулой (V), и окисляющего агента.
Примеры окисляющего агента включают периодинан Десса–Мартина, диоксид марганца, перрутенат тетрапропиламмония, комплекс триоксида серы с пиридином, хлорхромат пиридиния и подобные. Количество добавляемого окисляющего агента составляет 1–10 моль, предпочтительно, 1–5 моль, на моль соединения, представленного формулой (V). Растворитель может быть таким же, как на стадии 1. Температура реакции обычно составляет –78–200°C, и предпочтительно, 0–100°C. Время реакции обычно составляет от 5 минут до 3 дней, и предпочтительно, от 5 минут до 10 часов.
Полученное таким образом соединение, представленное формулой (VI), может быть подвергнуто последующей стадии после или без выделения или очистки известными средствами выделения и очистки, такими как концентрация, вакуумная концентрация, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
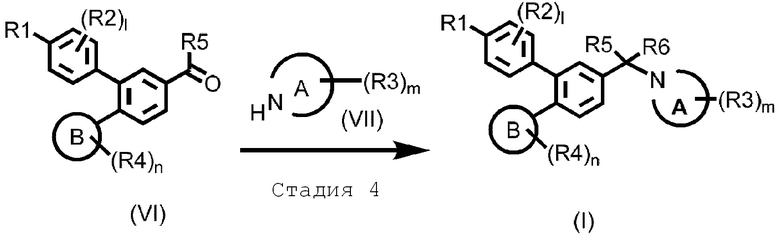
Стадия 4: Восстановительное аминирование
Эта стадия представляет способ получения соединения, представленного формулой (I), взаимодействием соединения альдегида или кетона, представленного формулой (VI), и аминового соединения, представленного формулой (VII) с применением восстанавливающего агента.
Примеры восстанавливающих агентов включают триацетоксиборгидрид натрия, цианоборгидрид натрия, боргидрид натрия и подобные. Количество добавляемого восстанавливающего агента составляет 1–10 моль, предпочтительно, 1–5 моль, на моль соединения, представленного формулой (VI).
Растворитель не ограничен, пока он не оказывает негативного действия на реакцию. Примеры включают толуол, хлороформ, тетрагидрофуран, дихлорметан, метанол, этанол и подобные; или их смешанные растворители.
Полученное таким образом соединение, представленное формулой (I), может быть подвергнуто последующей стадии после или без выделения или очистки известными средствами выделения и очистки, такими как концентрация, вакуумная концентрация, кристаллизация, экстракция растворителем, повторное осаждение и хроматография.
На любой из стадий 1–4, может подходящим образом проводиться защита заместителя и удаление или превращение защитной группы. Например, для функциональных групп, таких как амино, имино, гидрокси, карбокси, карбонильные и амидные группы, а также функциональных групп, имеющих активный протон, таких как индол, могут применяться защитные реагенты, или защитные группы могут быть введены в такие функциональные группы обычными способами; затем защитная группа может быть удалена на подходящей стадии в каждом способе получения.
Защитная группа аминогруппы или защитная группа иминогруппы особенно не ограничены, пока они обладают защитным действием. Примеры таких защитных групп включают аралкильные группы, такие как бензил, п–метоксибензил, 3,4–диметоксибензил, о–нитробензил, п–нитробензил, бензгидрид, тритил и кумил; низшие алканоильные группы, такие как формил, ацетил, пропионил, бутурил, пивалоил, трифторацетил и трихлорацетил; бензоил; арилалканоильные группы, такие как фенилацетил и феноксиацетил; низшие алкоксикарбонильные группы, такие как метоксикарбонил, этоксикарбонил, пропилоксикарбонил и трет–бутоксикарбонил; аралкилоксикарбонильные группы, такие как п–нитробензилоксикарбонил и фенэтилоксикарбонил; низшие алкилсилильные группы, такие как триметилсилил и трет–бутилдиметилсилил; тетрагидропиранил; триметилсилилэтоксиметил; низшие алкилсульфонильные группы, такие как метилсульфонил, этилсульфонил и трет–бутилсульфонил; низшие алкилсульфинильные группы, такие как трет–бутилсульфинил; арилсульфонильные группы, такие как бензолсульфонил и толуолсульфонил; и имидогруппы, такие как фталимидо. В частности, трифторацетил, ацетил, трет–бутоксикарбонил, бензилоксикарбонил, триметилсилилэтоксиметил, кумил и подобные предпочтительны.
Защитная группа гидроксигруппы особенно не ограничена, пока она обладает защитным действием. Примеры таких защитных групп включают низшие алкильные группы, такие как метил, этил, пропил, изопропил и трет–бутил; низшие алкилсилильные группы, такие как триметилсилил и трет–бутилдиметилсилил; низшие алкоксиметильные группы, такие как метоксиметил и 2–метоксиэтоксиметил; тетрагидропиранил; триметилсилилэтоксиметил; аралкильные группы, такие как бензил, п–метоксибензил, 2,3–диметоксибензил, о–нитробензил, п–нитробензил и тритил; и ацильные группы, такие как формил, ацетил и трифторацетил. В частности, метил, метоксиметил, тетрагидропиранил, триметилсилилэтоксиметил, трет–бутилдиметилсилил и ацетил предпочтительны.
Защитная группа карбоксигруппы особенно не ограничена, пока она обладает защитным действием. Примеры таких защитных групп включают низшие алкильные группы, такие как метил, этил, пропил, изопропил и трет–бутил; низшие галоалкильные группы, такие как 2,2,2–трихлорэтил; низшие алкенильные группы, такие как аллил; триметилсилилэтоксиметил; и аралкильные группы, такие как бензил, п–метоксибензил, п–нитробензил, бензгидрил и тритил. В частности, метил, этил, трет–бутил, аллил, бензил, п–метоксибензил, триметилсилилэтоксиметил, и подобные предпочтительны.
Защитная группа карбонильной группы особенно не ограничена, пока она обладает защитным действием. Примеры таких защитных групп включают этиленкеталь, триметиленкеталь, диметилкеталь, этиленацеталь, триметиленацеталь, диметилацеталь и подобные кетали и ацетали.
Защитная группа амидной группы или защитная группа функциональной группы, имеющей активный протон, такой как индол, особенно не ограничена, пока она обладает защитным действием. Примеры таких защитных групп включают низшие алкильные группы, такие как метил, этил, пропил, изопропил и трет–бутил; низшие алкилсилильные группы, такие как триметилсилил и трет–бутилдиметилсилил; низшие алкоксиметильные группы, такие как метоксиметил и 2–метоксиэтоксиметил; тетрагидропиранил; триметилсилилэтоксиметил; аралкильные группы, такие как бензил, п–метоксибензил, 2,3–диметоксибензил, о–нитробензил, п–нитробензил и тритил; и ацильные группы, такие как формил, ацетил и трифторацетил. В частности, метил, метоксиметил, тетрагидропиранил, триметилсилилэтоксиметил, трет–бутилдиметилсилил и ацетил предпочтительны.
Способ удаления таких защитных групп может варьироваться в зависимости от типа защитной группы, стабильности целевого соединения и т.д. Например, могут применяться следующие способы: сольволиз с применением кислоты или основания способом, описанным в публикации (Protective Groups in Organic Synthesis, third edition, T.W. Green, John Wiley & Sons (1999)) или подобным способом, например, способом, включающим взаимодействие с 0,01 моля или большим избытком кислоты, предпочтительно трифторуксусной кислоты, муравьиной кислоты или хлористоводородной кислоты, или от эквимолярного до большого избытка основания, предпочтительно, гидроксида калия или гидроксида кальция; химическое восстановление с применением металлгидридного комплекса и т.д.; или каталитическое восстановление с применением палладий–углеродного катализатора, катализатора на основе никеля Ренея и т.д.
Соединение в соответствии с данным изобретением может быть легко выделено и очищено обычными методами выделения и очистки. Примеры таких методов включают экстракцию растворителя, перекристаллизацию, препаративную высокоэффективную жидкостную хроматографию с обращенной фазой, хроматографию на колонке, препаративную тонкослойную хроматографию и подобные.
Если соединение в соответствии с данным изобретением имеет изомеры, такие как оптические изомеры, стереоизомеры, ротамеры и таутомеры, любые изомеры и их смеси включены в объем соединения в соответствии с данным изобретением, если не указано иначе. Например, если соединение в соответствии с данным изобретением имеет оптические изомеры, оптический изомер, выделенный из рацемической смеси, также включен в объем соединения в соответствии с данным изобретением, если не указано иначе. Каждый такой изомер может быть получен в виде отдельного соединения известными методами синтеза и разделения (например, концентрацией, экстрагированием растворителя и хроматографией на колонке, перекристаллизацей).
Как указано выше, если не указано иначе, соединение в соответствии с данным изобретением включает все энантиомеры и их смеси. Соединение в соответствии с данным изобретением может быть смесью R и S энантиомеров. Такой смесью может быть смесь, содержащая 90% или более, 95% или более или 99% или более R энантиомера; смесь, содержащая 90% или более, 95% или более или 99% или более S энантиомера; или подобная.
Способы хирального разделения включают, например: диастереомерный способ, заставляющий хиральный разделяющий агент действовать на соединение в соответствии с данным изобретением с получением соли и отделением одного из энантиомеров с помощью разницы в растворимости и т.д. полученной соли; способ избирательной кристаллизации путем добавления одного из энантиомеров в сверхнасыщенный раствор рацемата в качестве затравки для кристаллизации; и хроматографию на колонке, такую как ВЭЖХ с применением хиральной колонки. Хиральный разделяющий агент, который может применяться в диастереомерном способе, может быть подходящим образом выбран из, например, кислотных разделяющих агентов, таких как винная кислота, яблочная кислота, молочная кислота, миндальная кислота, 10–камфорсульфоновая кислота и их производные; и основных разделяющих агентов, таких как бруцин, стрихнин, хинин и подобные алкалоиды, производные аминокислоты, цинхонидин и α–метилбензиламин. Один из энантиомеров соединения в соответствии с данным изобретением отдельно может быть получен не только через получение соединения в соответствии с данным изобретением в виде смеси энантиомеров с последующим хиральным разделением, описанным выше, но также получением одного энантиомера соединения в соответствии с данным изобретением через хиральное разделение, описанное выше или другими способами с последующим применением его в качестве синтетического исходного сырья соединения в соответствии с данным изобретением. Кроме того, способы получения одного из энантиомеров соединения в соответствии с данным изобретением или его сырья включают способ селективного получения одного из энантиомеров корректировкой условий реакции для катализатора или подобных на стадии реакции создания асимметричного атома углерода.
Соединение в соответствии с данным изобретением или его соль могут быть в виде кристаллов. Отдельные кристаллы и полиморфные кристаллические смеси включены в объем соединения в соответствии с данным изобретением или его соли. Такие кристаллы могут быть получены кристаллизацией способом кристаллизации, известным per se в данной области техники. Соединение в соответствии с данным изобретением или его соль могут быть сольватом (например, гидратом) или не сольватом. Любые такие формы включены в объем соединения в соответствии с данным изобретением или его соли. Соединения, помеченные как изотоп (например, 3H, 14C, 35S и 125I), также включены в объем соединения в соответствии с данным изобретением или его соли.
Соли соединений в соответствии с данным изобретением или их промежуточные соединения являются обычными солями, применяемыми в области органической химии. Примеры таких солей включают основно–аддитивные соли карбоксигруппы, если соединение имеет карбоксигруппу, и кислотно–аддитивные соли амино или основной гетероциклической группы, если соединение имеет амино или основную гетероциклическую группу.
Благодаря превосходной ингибирующей активности в отношении LSD1 соединения в соответствии с данным изобретением или их соли пригодны в качестве фармацевтического препарата для профилактики и лечения LSD1–связанных заболеваний.
Примеры “LSD1–связанных заболеваний” включают заболевания, наступление которых может быть снижено, и симптомы которых могут быть ослаблены, облегчены и/или полностью вылечены исключением, подавлением и/или ингибированием функции LSD1. Примеры таких заболеваний включают, но не ограничены ими, злокачественные опухоли и т.д. Тип злокачественной опухоли, лечимой соединение или солью в соответствии с данным изобретением, особенно не ограничен. Примеры таких злокачественных опухолей включают раки головы и шеи, рак пищевода, рак желудка, рак толстой кишки, рак прямой кишки, рак печени, рак желчного пузыря, холангиосаркому, рак желчевыводящих путей, рак поджелудочной железы, рак легких, рак груди, рак яичников, рак шейки матки, рак эндометрия, рак почек, рак мочевого пузыря, рак простаты, рак яичек, остеосаркому, саркому мягких тканей, лейкоз, миелодиспластический синдром, хроническое миелопролиферативное заболевание, злокачественную лимфому, множественную миелому, рак кожи, рак мозга, мезотелиому и подобные. Предпочтительные примеры включают раки легких (например, немелкоклеточный рак легких и мелкоклеточный рак легких), лейкоз и миелодиспластические синдромы; и более предпочтительные примеры включают раки легких (например, не мелкоклеточный рак легких и мелкоклеточный рак легких) и лейкоз.
Если соединение в соответствии с данным изобретением или его соль применяют в виде фармацевтического препарата, может быть добавлен фармацевтический носитель, при необходимости, с получением подходящей лекарственной формы для целей профилактики и лечения. Примеры лекарственной формы включают пероральные препараты, инъекции, суппозитории, мази, пластыри и подобные. Из них предпочтительны пероральные препараты. Такие лекарственные формы могут быть получены способами, известными специалистам в данной области техники.
В качестве фармацевтического носителя могут применяться разные обычные органические или неорганические носители, применяемые в качестве материалов для препаратов. Например, такие материалы могут быть смешаны в виде эксципиента, связующего агента, разрыхлителя, смазывающего агента или покрытия в твердых препаратах; или в виде растворителя, солюбилизирующего агента, суспендирующего агента, изотонизирующего агента, рН корректора, буфера или смягчающего агента в жидких препаратах. Более того, также могут применяться добавки к фармацевтическим препаратам, такие как антисептики, антиоксиданты, красители, агенты, исправляющие вкус или вкусовые добавки и стабилизаторы, при необходимости.
Пероральные твердые препараты готовят следующим образом. После того, как эксципиент добавляют, необязательно со связующим агентом, разрыхлителем, смазывающим агентом, красителем, агентом, исправляющим вкус или вкусовой добавкой и т.д., к соединению в соответствии с данным изобретением, полученную смесь составляют в таблетки, таблетки в оболочке, гранулы, порошки, капсулы или подобные, обычными способами.
Примеры эксципиентов включают лактозу, сахарозу, D–маннит, глюкозу, крахмал, карбонат кальция, каолин, микрокристаллическую целлюлозу и ангидрид кремниевой кислоты. Примеры связующих агентов включают воду, этанол, 1–пропанол, 2–пропанол, простой сироп, жидкую глюкозу, жидкий α–крахмал, жидкий желатин, D–маннит, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропиловый крахмал, метилцеллюлозу, этилцеллюлозу, шеллак, фосфат кальция, поливинилпирролидон и подобные. Примеры разрыхляющих агентов включают сухой крахмал, альгинат натрия, порошковый агар, гидрокарбонат натрия, карбонат кальция, лаурилсульфат натрия, моноглицерид стеариновой кислоты, лактозу и подобные. Примеры смазывающих агентов включают очищенный тальк, стеарат натрия, стеарат магния, буру, полиэтиленгликоль и подобные. Примеры красителей включают оксид титана, оксид железа и подобные. Примеры исправляющих вкус или вкусовых добавок включают сахарозу, померанцевую корку, лимонную кислоту, винную кислоту и подобные.
Если получают жидкий препарат для перорального введения, исправляющий вкус агент, буфер, стабилизатор, вкусовой агент и подобные могут быть добавлены к соединению в соответствии с данным изобретением; и полученная смесь может быть составлена в пероральный жидкий препарат, сироп, эликсир и т.д. обычным способом.
Примеры исправляющих вкус или вкусовых добавок могут быть такими, которые указаны выше. Примеры буфера включают цитрат натрия и подобные. Примеры стабилизатора включают трагакант, аравийскую камедь, желатин и подобные. При необходимости эти препараты для перорального введения могут быть покрыты способами, известными в данной области техники, энтеросолюбильным покрытием или другим покрытием для целей, например, устойчивости эффектов. Примеры таких покрытий включают гидроксипропилметилцеллюлозу, этилцеллюлозу, гидроксиметилцеллюлозу, гидроксипропилцеллюлозу, полиоксиэтиленгликоль и Tween 80 (зарегистрированная торговая марка).
При приготовлении инъекции, pH корректор, буфер, стабилизатор, изотонирующий агент, местный анестетик и подобные могут быть добавлены к соединению в соответствии с данным изобретением; и полученная смесь может быть составлена в подкожные, внутримышечные и внутривенные инъекции обычным способом.
Примеры применяемых pH корректоров и буферов включают цитрат натрия, ацетат натрия, фосфат натрия и подобные. Примеры применяемых стабилизаторов включают пиросульфит натрия, ЭДТК, тиогликолевую кислоту и тиомолочную кислоту и подобные. Примеры применяемых местных анестетиков включают гидрохлорид прокаина гидрохлорид лидокаина и подобные. Примеры применяемых изотонизирующих агентов включают хлорид натрия, глюкозу, D–маннит, глицерин и подобные.
Количество соединения в соответствии с данным изобретением, добавляемое в каждую из таких дозированных единичных форм, зависит от состояния пациента, которому вводят соединение, дозированной формы и т.д. В общем, для перорального агента, инъекции и суппозитория, количество соединения в соответствии с данным изобретением предпочтительно составляет от 0,05 до 1000 мг, от 0,01 до 500 мг и от 1 до 1000 мг, соответственно, на дозированную единичную форму.
Суточная доза лекарства в такой лекарственной форме зависит от состояния, массы тела, возраста, пола и т.д. пациента и не может быть обобщена. Например, суточная доза соединения в соответствии с данным изобретением для взрослого человека (масса тела: 50 кг) может составлять обычно от 0,05 до 5000 мг и, предпочтительно, от 0,1 до 1000 мг; и, предпочтительно, вводится одной дозой или двумя или тремя разделенными дозами в сутки.
Примеры
Данное изобретение описано ниже более подробно со ссылкой на примеры. Однако объем данного изобретения не ограничен этими примерами. Данное изобретение полностью описано ниже в примерах; однако понятно, что возможны различные изменения и модификации специалистом в данной области техники. Поэтому такие изменения и модификации включены в объем данного изобретения в той степени, в которой они не выходят за рамки объема изобретения.
Различные реагенты, применяемые в примерах, получают от коммерческих поставщиков, если не указано иначе. Для хроматографии на колонке с силикагелем применяют колонку, наполненную двуокисью кремния, SNAP–Ultra (зарегистрированная торговая марка) производства Biotage. Для основной хроматографии на колонке с силикагелем применяют заполненную колонку KP–NH (зарегистрированная торговая марка) производства Biotage.
ЯМР спектр измеряют с применением AL400 (400 МГц; производства JEOL), Mercury 400 (400 МГц; производства Agilent Technologies, Inc.) или 500–MГц Bruker Avance III HD NMR Spectrometer (500 МГц; Bruker). Если дейтерированный растворитель содержит тетраметилсилан, тетраметилсилан применяют в качестве внутреннего стандарта. В других случаях, ЯМР растворитель применяют в качестве внутреннего стандарта. Все значения δ даны в ч./млн. Микроволновую реакцию проводят с применением Initiator производства Biotage.
ЖХМС спектр измеряют с применением Acquity SQD (квадрупольного) производства Waters Corporation в следующих условиях.
Колонка: Acquity UPLC (зарегистрированная торговая марка) BEH C18, 2,1×50 мм, 1,7 мкм (производства Waters Corporation)
МС определение: ИЭР положительная
УФ определение: 254 и 280 нм
Скорость потока колонки: 0,5 мл/мин
Подвижная фаза: вода/ацетонитрил (0,1% муравьиной кислоты)
Объем впрыска: 1 мкл
Градиент (таблица 1)
Очистку препаративной ВЭЖХ с обращенной фазой проводят в следующих условиях с применением препаративной системы разделения, доступной от Gilson, Inc.
Колонка: Xselect CSH Prep C18 5 мкм OBD (19×50 мм) + (19×100 мм), производства Waters Corporation
УФ определение: 254 нм
Скорость потока колонки: 18 мл/мин
Подвижная фаза: вода/ацетонитрил (0,1% муравьиной кислоты)
Объем впрыска: 0,1–0,5 мл
Символами обозначены следующие термины:
с: синглет
д: дублет
т: триплет
кв: квартет
дд: двойной дублет
дт: двойной триплет
тд: тройной дублет
тт: тройной триплет
ддд: двойной двойной дублет
ддт: двойной двойной триплет
дтд: двойной тройной дублет
тдд: тройной двойной дублет
м: мультиплет
уш: уширенный
ушс: уширенный синглет
ТГФ: тетрагидрофуран
ДМФ: N, N–диметилформамид
ДМЭ: 1,2–Диметоксиэтан
ДМСО: Диметилсульфоксид
ГАТУ: фторфосфат O–(7–азабензотриазол–1–ил)–N, N,N',N'–тетраметилгексаурония
ТЭА: Триэтиламин
WSC HCl: гидрохлорид 1–этил–3–(3–диметиламинопропил)карбодиимида
t–BuOH: третичный бутанол
ДМАП: N, N–диметиламинопиридин
Pd(PPh3)4: тетракис(трифенилфосфин)палладий(0)
Pd(dba)2: бис(дибензилиденацетон)палладий(0)
PCy3: трициклогексилфосфин
ТФК: Трифторуксусная кислота
Pd(OAc)2: ацетат палладия
KOAc: ацетат калия
PdCl2(dppf): дихлорид [1,1'–бис(дифенилфосфино)ферроцен]палладия(II)
PdCl2(dppf)CH2Cl2: комплекс дихлорметана с дихлоридом [1,1'–бис(дифенилфосфино)ферроцен]палладия(II)
ДМЭАД: ди–2–метоксиэтилазодикарбоксилат
PPh3: трифенилфосфин
ДМА: Диметилацетамид
MeMgBr: бромид метилмагния
EtMgBr: бромид этилмагния
МТБЭ: метил-трет-бутиловый эфир
ДХМ: дихлорметан
Boc2O: ди–трет–бутилдикарбонат
NBS: N–бромсукцинимид
X–phos: 2–дициклогексилфосфино–2',4',6'–триизопропилбифенил
MeOH: метанол
EtOH: этанол
ИПЭ: диизопропиловый эфир
ФТБА: фторид тетрабутиламмония
Pd2(dba)3: трис(дибензилиденацетон)дипалладий (0)
PdCl2(PPh3)2: хлорид бистрифенилфосфата палладия
S–Phos: 2–дициклогексилфосфино–2,6–диметоксибифенил
ГОБт: 1–Гидроксибензотриазол
Pd/C: палладий, нанесенный на активированный уголь
NMP: N–метил–2–пирролидинон
Silica–SMAP: иммобилизованный на кремнеземе каркасный триалкилфосфин
Пример 1: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(п–толил)фенил]бензонитрила
Стадия 1
3–Бром–4–хлорбензойную кислоту (19 г) растворяют в ДМФ (160 мл). При 25°C туда добавляют ДМАП (20 г) и WSC HCl (31 г), затем добавляют t–BuOH (38 мл). Полученную смесь перемешивают при комнатной температуре в течение ночи. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-3–бром–4–хлорбензоата.
Стадия 2
Трет–бутил-3–бром–4–хлорбензоат (1,3 г), полученный на стадии 1 выше, растворяют в 1,4–диоксане (8,7 мл). При комнатной температуре туда добавляют (4–цианофенил)бороновую кислоту (768 мг), Pd(PPh3)4 (151 мг) и 2M водный раствор карблоната натрия (5,4 мл), и реакционную смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Реакционную смесь затем концентрируют в вакууме, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-4–хлор–3–(4–цианофенил)бензоата.
Стадия 3
Трет–бутил-4–хлор–3–(4–цианофенил)бензоат (1,1 г), полученный на стадии 2 выше, растворяют в 1,4–диоксане (17 мл). При комнатной температуре туда добавляют п–толилбороновую кислоту (932 мг), Pd(dba)2 (157 мг), трикалийфосфат (1,5 г) и раствор 1 M PCy3 в ТГФ (0,57 мл), и реакционную смесь перемешивают в микроволновом реакторе при 160°C в течение 30 минут. После добавления хлороформа нерастворимое вещество отфильтровывают и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. Остаток растворяют в ТФК (2 мл). Растворитель отгоняют. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют с получением 3–(4–цианофенил)–4–(п–толил)бензойной кислоты.
Стадия 4
3–(4–Цианофенил)–4–(п–толил)бензойную кислоту (10 мг), полученную на стадии 3 выше, трет–бутил-N–[(3S)–пирролидин–3–ил]карбамат (6 мг) и ГАТУ (24 мг) растворяют в ТГФ (0,5 мл). При комнатной температуре туда добавляют ТЭА (0,013 мл), затем перемешивают при 50°C в течение ночи. Реакционную смесь концентрируют в вакууме, и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(п–толил)бензоил]пирролидин–3–ил]карбамата.
Стадия 5
Трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(п–толил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 4 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 2: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карботиоил]–2–(п–толил)фенил]бензонитрила
4–[5–[(3S)–3–Аминопирролидин–1–карбонил]–2–(п–толил)фенил]бензонитрил (6 мг), полученный на стадии 5 Примера 1, растворяют в ТГФ (0,8 мл). При комнатной температуре туда добавляют Реагент Лавессона (3,8 мг) с последующим перемешиванием при комнатной температуре в течение 30 минут. Туда добавляют хлороформ, и смесь разделяют бикарбонатом натрия и водой. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 3: Синтез 4–[5–(4–аминопиперидин–1–карбонил)–2–(п–толил)фенил]бензонитрила
3–(4–Цианофенил)–4–(п–толил)бензойную кислоту, (20 мг) полученную на стадии 3 примера 1, растворяют в ТГФ (1 мл). При комнатной температуре туда добавляют трет–бутил-N–(4–пиперидил)карбамат (13 мг), ГАТУ (49 мг) и ТЭА (0,027 мл), затем перемешивают при 50°C в течение ночи. Реакционную смесь концентрируют в вакууме и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[1–[3–(4–цианофенил)–4–(п–толил)бензоил]–4–пиперидил]карбамата.
Стадия 2
Трет–бутил-N–[1–[3–(4–цианофенил)–4–(п–толил)бензоил]–4–пиперидил]карбамат (30 мг), полученный на стадии 1 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС, с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 4: Синтез 4–[5–(2,8–диазаспиро[3.5]нонан–2–карбонил)–2–(п–толил)фенил]бензонитрила
Методику стадий 1–5 из Примера 1 проводят с применением гидрохлорида трет–бутил-2,8–диазаспиро[3.5]нонан–8–карбоксилата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 5: Синтез 4–[5–(2,7–диазаспиро[3.4]октан–7–карбонил)–2–(п–толил)фенил]бензонитрила
Методику стадий 1–5 из Примера 1 проводят с применением трет–бутил-2,7–диазаспиро[3.4]октан–2–карбоксилата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 6: Синтез 4–[5–(3,8–диазаспиро[4.4]нонан–8–карбонил)–2–(п–толил)фенил]бензонитрила
Методику стадий 1–5 из Примера 1 проводят с применением трет–бутил-3,8–диазаспиро[4.4]нонан–8–карбоксилата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 7: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(п–толил)фенил]бензонитрила
Стадия 1
3–Бром–4–хлор–бензойную кислоту (500 мг) растворяют в ДМА (5,3 мл). При комнатной температуре туда добавляют ГАТУ (1 г), ТЭА (0,59 мл) и трет–бутил-N–[(3–экзо)–8–азабицикло[3.2.1]октан–3–ил]карбамат (480 мг), с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–экзо)–8–(3–бром–4–хлор–бензоил)–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3–экзо)–8–(3–бром–4–хлорбензоил)–8–азабицикло[3.2.1]октан–3–ил]карбамата (200 мг), полученный на стадии 1 выше, растворяют в 1,4–диоксан (2,3 мл). При комнатной температуре туда добавляют (4–цианофенил)бороновую кислоту (60 мг), Pd(PPh3)4 (16 мг) и 2M Водный раствор карбоната натрия (1,1 мл), и реакционную смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–экзо)–8–[4–хлор–3–(4–цианофенил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3–экзо)–8–[4–хлор–3–(4–цианофенил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (15 мг), полученный на стадии 2 выше, растворяют в 1,4–диоксане (0,322 мл). При комнатной температуре туда добавляют п–толилбороновую кислоту (5,3 мг), Pd(dba)2 (0.93 мг), раствор 1 M PCy3 в ТГФ (0,003 мл) и трикалийфосфат (21 мг), и реакционную смесь перемешивают в микроволновом реакторе при 160°C в течение 30 минут. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–экзо)–8–[3–(4–цианофенил)–4–(п–толил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 4
Трет–бутил-N–[(3–экзо)–8–[3–(4–цианофенил)–4–(п–толил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (15 мг), полученный на стадии 3 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС, с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 8: Синтез 4–[5–[(3S)–3–амино–3–метилпирролидин–1–карбонил]–2–(п–толил)фенил]бензонитрила
Методику стадий 1–5 из Примера 1 проводят с применением трет–бутил-N–[(3S)–3–метилпирролидин–3–ил]карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 9: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(2–хлор–4–метилфенил)фенил]бензонитрила
Стадия 1
3–Бром–4–хлорбензойную кислоту (10 г) растворяют в ДМА (85 мл). При комнатной температуре туда добавляют ГАТУ (24 г), ТЭА (12 мл) и затем трет–бутил-N–[(3S)–пирролидин–3–ил]карбамат (8,7 г) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–(3–бром–4–хлорбензоил)пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–(3–бром–4–хлорбензоил)пирролидин–3–ил]карбамат (2,2 г) полученный на стадии 1 выше растворяют в 1,4–диоксане (13,6 мл). При комнатной температуре туда добавляют 4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензонитрил (1,5 г), Pd(PPh3)4 (189 мг) и 2M водный раствор карбоната натрия (6,8 мл), и реакционную смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[4–хлор–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3S)–1–[4–хлор–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамат (500 мг), полученный на стадии 2 выше, растворяют в 1,4–диоксане (9,8 мл). При комнатной температуре туда добавляют Pd(OAc)2 (26 мг), KOAc (346 мг), бис(пинаколато)диборон (596 мг) и Silica–SMAP (150 мг) (производства Wako Pure Chemical Corporation), затем перемешивают при 160°C в течение ночи. Смесь пропускают через Целит и фильтрат концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата.
Стадия 4
Трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 3 выше, 1–бром–2–хлор–4–метилбензол (12 мг) и Pd(PPh3)4 (1,7 мг) суспендируют в 1,4–диоксане (1,5 мл). При комнатной температуре туда добавляют 2 M водный раствор карбоната натрия (0,7 мл), затем перемешивают при 120°C в течение 30 минут. После фильтрации реакционной смеси, растворитель отгоняют с получением трет–бутил-N–[(3S)–1–[4–(2–хлор–4–метилфенил)–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамата.
Стадия 5
Трет–бутил-N–[(3S)–1–[4–(2–хлор–4–метилфенил)–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 4 выше, растворяют в ТФК (0,3 мл), и прогресс реакции подтверждают ЖХМС, с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 10: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(3–хлор–4–метилфенил)фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 4–бром–2–хлор–1–метилбензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 11: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[3–фтор–4–(трифторметил)фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 4–бром–2–фтор–1–(трифторметил)бензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 12: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(4–метил–2–нитрофенил)фенил]бензонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–[4–хлор–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 2 примера 9, пинаколовый эфир 4–метил–2–нитрофенилбороновой кислоты (18 мг), Pd(dba)2 (1,6 мг), раствор 1 M PCy3 в ТГФ (0,003 мл) и трикалийфосфат (15 мг) добавляют туда, и реакционную смесь перемешивают в микроволновом реакторе при 160°C в течение 30 минут. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(4–метил–2–нитрофенил)бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(4–метил–2–нитрофенил)бензоил]пирролидин–3–ил]карбамат (10 мг), полученный на стадии 1 выше, растворяют в ТФК (0,3 мл), и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 13: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(дифторметил)фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1–бром–4–(дифторметил)бензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 14: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(трифторметил)фенил]фенил]бензонитрила
Методику стадий 1–2 из Примера 12 проводят с применением [4–(трифторметил)фенил]бороновой кислоты вместо пинаколового эфира 4–метил–2–нитрофенилбороновой кислоты с получением указанного в заголовке соединения.
Пример 15: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(2–фтор–4–метилфенил)фенил]бензонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–[4–хлор–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамат (1,7 г), полученный на стадии 2 примера 9, растворяют в 1,4–диоксане (20 мл). При комнатной температуре туда добавляют (2–фтор–4–метил–фенил)бороновую кислоту (980 мг), Pd(dba)2 (110 мг), раствор 1 M PCy3 в ТГФ (0.4 мл) и трикалийфосфат (2,5 г), и реакционную смесь перемешивают в микроволновом реакторе при 160°C в течение 45 минут. Смесь очищают NH–силикагелем и промывают метанолом/этилацетатом, и растворитель отгоняют с получением трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(2–фтор–4–метилфенил)бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(2–фтор–4–метилфенил)бензоил]пирролидин–3–ил]карбамат (1,7 г), полученный на стадии 1 выше, растворяют в ТФК (44 мл) с последующим перемешиванием в течение 10 минут. Растворитель отгоняют, и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 16: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(п–толил)фенил]–2–фторбензонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–(3–бром–4–хлорбензоил)пирролидин–3–ил]карбамат (14 г), полученный на стадии 1 примера 9, растворяют в 1,4–диоксане (87 мл). При комнатной температуре туда добавляют (4–циано–3–фторфенил)бороновую кислоту (6,3 г), Pd(PPh3)4 (1,2 г) и 2 M водный раствор карбоната натрия (44 мл), затем перемешивают при 90°C в течение ночи. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[4–хлор–3–(4–циано–3–фторфенил)бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[4–хлор–3–(4–циано–3–фторфенил)бензоил]пирролидин–3–ил]карбамат (48 мг), полученный на стадии 1 выше, растворяют в 1,4–диоксане (0,5 мл). При комнатной температуре туда добавляют п–толилбороновую кислоту (29 мг), Pd(dba)2 (3,1 мг), раствор 1 M PCy3 в ТГФ (0,005 мл) и трикалийфосфат (68 мг), и реакционную смесь перемешивают в микроволновом реакторе при 160°C в течение 45 минут. Смесь очищают NH–силикагелем и промывают метанолом/этилацетатом, и растворитель отгоняют с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(п–толил)бензоил]пирролидин–3–ил]карбамата.
Стадия 3
ТФК (1,2 мл) добавляют к трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(п–толил)бензоил]пирролидин–3–ил]карбамату (48 мг), полученному на стадии 2 выше, с последующим перемешиванием в течение 10 минут. Растворитель отгоняют, и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 17: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(п–толил)фенил]–2–фторбензонитрила
Стадия 1
3–Бром–4–хлорбензойную кислоту (700 мг) растворяют в ТГФ (15 мл). При комнатной температуре туда добавляют ГАТУ (1,2 г), ТЭА (0,83 мл) и трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамат (700 мг), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–эндо)–8–(3–бром–4–хлорбензоил)–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3–эндо)–8–(3–бром–4–хлорбензоил)–8–азабицикло[3.2.1]октан–3–ил]карбамат (1,2 г), полученный на стадии 1 выше, растворяют в 1,4–диоксане (6,7 мл). При комнатной температуре туда добавляют (4–циано–3–фторфенил)бороновую кислоту (461 мг), PdCl2(dppf) (58 мг) и 2 M водный раствор карбоната натрия (3,3 мл), затем перемешивают при 95°C в течение ночи. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–эндо)–8–[4–хлор–3–(4–циано–3–фторфенил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3–эндо)–8–[4–хлор–3–(4–циано–3–фторфенил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (17 мг), полученный на стадии 2 выше, растворяют в 1,4–диоксане (0,5 мл). При комнатной температуре туда добавляют п–толилбороновую кислоту (9,6 мг), Pd(dba)2 (1,6 мг), трикалийфосфат (15 мг) и раствор 1 M PCy3 в ТГФ (0,004 мл), и смесь перемешивают в микроволновом реакторе при 160°C в течение 30 минут. Реакционную смесь фильтруют через NH–силикагель, и растворитель фильтрата отгоняют с получением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(п–толил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 4
Трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(п–толил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (15 мг), полученный на стадии 3 выше, растворяют в ТФК (0,3 мл), и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 18: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(1–метилиндол–5–ил)фенил]–2–фторбензонитрил
Стадия 1
Трет–бутил-N–[(3–экзо)–8–(3–бром–4–хлорбензоил)–8–азабицикло[3.2.1]октан–3–ил]карбамат (300 мг), полученный на стадии 1 примера 7, растворяют в 1,4–диоксане (1,7 мл). При комнатной температуре туда добавляют (4–циано–3–фторфенил)бороновую кислоту (123 мг), PdCl2(dppf) (17 мг) и 2 M водный раствор карбоната натрия (0,85 мл), и реакционную смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–экзо)–8–[4–хлор–3–(4–циано–3–фторфенил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3–экзо)–8–[4–хлор–3–(4–циано–3–фторфенил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (10 мг), полученный на стадии 1 выше, растворяют в 1,4–диоксане (0,5 мл). При комнатной температуре туда добавляют (1–метилиндол–5–ил)бороновую кислоту (7,2 мг), Pd(dba)2 (0,9 мг), трикалийфосфат (8,8 мг) и раствор 1 M PCy3 в ТГФ (0,002 мл), и реакционную смесь перемешивают в микроволновом реакторе при 160°C в течение 30 минут. Реакционную смесь фильтруют через NH–силикагель, и растворитель фильтрата отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–(1–метилиндол–5–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–(1–метилиндол–5–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (15 мг), полученный на стадии 2 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 19: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(п–толил)фенил]–2,6–дифторбензонитрила
Стадия 1
4–Бром–3–хлорбензойную кислоту (2 г) растворяют в ДМА (17 мл). При комнатной температуре туда добавляют ГАТУ (4,8 г), ТЭА (2.4 мл) и трет–бутил-N–[(3S)–пирролидин–3–ил]карбамат (1,7 г) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–(4–бром–3–хлорбензоил)пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–(4–бром–3–хлорбензоил)пирролидин–3–ил]карбамат, полученный на стадии 1 выше, растворяют в 1,4–диоксане (10,6 мл). При комнатной температуре туда добавляют Pd(PPh3)4 (147 мг), 2 M водный раствор карбоната натрия (5,3 мл) и п–толилбороновую кислоту (693 мг), и реакционную смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[3–хлор–4–(п–толил)бензоил]пирролидин–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3S)–1–[3–хлор–4–(п–толил)бензоил]пирролидин–3–ил]карбамат (666 мг), полученный на стадии 2 выше, растворяют в 1,4–диоксане (16 мл). При комнатной температуре туда добавляют Pd(OAc)2 (36 мг), KOAc (473 мг), бис(пинаколато)диборон (815 мг) и раствор 1 M PCy3 в ТГФ (0,24 мл). После дегазации и замещения азотом смесь перемешивают при 80°C в течение ночи. Реакционную смесь пропускают через Целит, и растворитель фильтрата отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[4–(п–толил)–3–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата.
Стадия 4
Трет–бутил-N–[(3S)–1–[4–(п–толил)–3–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 3 выше, 4–бром–2,6–дифторбензонитрил (12,9 мг) и Pd(PPh3)4 (1,7 мг) суспендируют в 1,4–диоксане (1,5 мл). При комнатной температуре туда добавляют 2 M водный раствор карбоната натрия (0,7 мл), и реакционную смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Реакционную смесь фильтруют, и растворитель отгоняют с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3,5–дифторфенил)–4–(п–толил)бензоил]пирролидин–3–ил]карбамата.
Стадия 5
Трет–бутил-N–[(3S)–1–[3–(4–циано–3,5–дифторфенил)–4–(п–толил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 4 выше, растворяют в ТФК (0,3 мл), и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 20: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Стадия 1
1–Бром–2–фтор–4–(2–метоксиэтил)бензол (4,5 г) суспендируют в 1,4–диоксане (48 мл) с последующим перемешиванием. Затем туда добавляют бис(пинаколато)диборон (7,4 г), KOAc (3,8 г) и PdCl2(dppf) (0,71 г), затем перемешивают при 90°C в течение ночи. Туда добавляют этилацетат, смесь пропускают через Целит и фильтрат промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 2–[2–фтор–4–(2–метоксиэтил)фенил]–4,4,5,5–тетраметил–1,3,2–диоксаборолана.
Стадия 2
Трет–бутил-N–[(3S)–1–[4–хлор–3–(4–циано–3–фторфенил)бензоил]пирролидин–3–ил]карбамат (150 мг), полученный на стадии 1 примера 16, 2–[2–фтор–4–(2–метоксиэтил)фенил]–4,4,5,5–тетраметил–1,3,2–диоксаборолан (189 мг), полученный на стадии 1 выше, Pd(dba)2 (15 мг), трикалийфосфат (144 мг) и раствор 1 M PCy3 в ТГФ (0,034 мл) растворяют в 1,4–диоксане (3,8 мл). Реакционную смесь перемешивают в микроволновом реакторе при 160°C в течение 45 минут. Реакционную смесь фильтруют через NH–силикагель, и растворитель фильтрата отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]пирролидин–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]пирролидин–3–ил]карбамат (150 мг), полученный на стадии 2 выше, растворяют в ТФК (10 мл), и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 21: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(2–фтор–4–метилфенил)фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 17 проводят с применением (2–фтор–4–метилфенил)бороновой кислоты вместо п–толилбороновой кислоты с получением указанного в заголовке соединения.
Пример 22: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Стадия 1
Трет–бутил-3–бром–4–хлорбензоат (1,00 г), полученный на стадии 1 примера 1, растворяют в 1,4–диоксане (8,6 мл). При комнатной температуре туда добавляют (4–циано–3–фторфенил)бороновую кислоту (509 мг), Pd(PPh3)4 (119 мг) и 2 M водный раствор карбоната натрия (4,3 мл), и реакционную смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-4–хлор–3–(4–циано–3–фторфенил)бензоата.
Стадия 2
Трет–бутил-4–хлор–3–(4–циано–3–фторфенил)бензоат (1,00 г), полученный на стадии 1 выше, растворяют в 1,4–диоксане (15 мл). При комнатной температуре туда добавляют 2–[2–фтор–4–(2–метоксиэтил)фенил]–4,4,5,5–тетраметил–1,3,2–диоксаборолан (1,69 г), полученный на стадии 1 примера 20, Pd(dba)2 (138 мг), трикалийфосфат (1,28 г) и раствор 1 M PCy3 в ТГФ (0,30 мл), и реакционную смесь перемешивают в микроволновом реакторе при 160°C в течение 30 минут. После добавления хлороформа нерастворимое вещество отфильтровывают и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. Остаток растворяют в ТФК (2 мл) и растворитель отгоняют. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензойной кислоты.
Стадия 3
3–(4–Циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензойную кислоту (10 мг), полученную на стадии 2 выше, трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамат (5,8 мг) и ГАТУ (19 мг) растворяют в ТГФ (0,5 мл). При комнатной температуре туда добавляют ТЭА (0,007 мл), затем перемешивают при 50°C в течение ночи. Реакционную смесь концентрируют в вакууме и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 4
Трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (10,9 мг), полученный на стадии 3 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 23: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(6–фтор–1–метилиндол–5–ил)фенил]–2–фторбензонитрила
Стадия 1
Трет–бутил-N–[(3–экзо)–8–[4–хлор–3–(4–циано–3–фторфенил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (270 мг), полученный на стадии 1 примера 18, растворяют в 1,4–диоксане (2,8 мл). При комнатной температуре туда добавляют Pd(OAc)2 (2,5 мг), KOAc (164 мг), бис(пинаколато)диборон (283 мг) и Silica–SMAP (4,6 мг), затем перемешивают при 150°C в течение ночи. Смесь пропускают через Целит, и фильтрат концентрируют в вакууме. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (10 мг), полученный на стадии 1 выше, 5–бром–6–фтор–1–метилиндол (4,8 мг) и PdCl2(dppf) (0,71 мг) суспендируют в 1,4–диоксане (0,5 мл). При комнатной температуре туда добавляют трикалийфосфат (11 мг), затем перемешивают при 125°C в течение 45 минут. После фильтрации реакционной смеси растворитель отгоняют с получением трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–(6–фтор–1–метилиндол–5–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–(6–фтор–1–метилиндол–5–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (8 мг), полученный на стадии 2 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 24: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(6–фтор–1–метилиндазол–5–ил)фенил]–2–фторбензонитрила
Стадия 1
Трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (10 мг), полученный на стадии 1 примера 23, растворяют в 1,4–диоксане (0,5 мл). При комнатной температуре туда добавляют 5–бром–6–фтор–1–метилиндазол (4,8 мг), PdCl2(dppf) (0,71 мг) и трикалийфосфат (11 мг), и смесь перемешивают в микроволновом реакторе при 125°C в течение 45 минут. Реакционную смесь фильтруют, и растворитель отгоняют с получением трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–(6–фтор–1–метилиндазол–5–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–(6–фтор–1–метилиндазол–5–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (15 мг), полученный на стадии 1 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 25: Синтез 4–[5–[(3S)–3–амино–3–метилпирролидин–1–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Стадия 1
3–(4–Циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензойную кислоту (10 мг), полученную на стадии 1 примера 22, и трет–бутил-N–[(3S)–3–метилпирролидин–3–ил]карбамат (5,1 мг) растворяют в ТГФ (0,5 мл). При комнатной температуре туда добавляют ТЭА (0,011 мл) и ГАТУ (19 мг), затем перемешивают при 50°C в течение ночи. Реакционную смесь концентрируют в вакууме, и растворитель отгоняют с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–3–метилпирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–3–метилпирролидин–3–ил]карбамат (15 мг), полученный на стадии 1 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 26: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Стадия 1
3–(4–Циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензойную кислоту (10 мг), полученную на стадии 2 примера 22, и трет–бутил-N–[(3–экзо)–8–азабицикло[3.2.1]октан–3–ил]карбамат (5,8 мг) растворяют в ТГФ (0,5 мл). При комнатной температуре туда добавляют ТЭА (0,011 мл) и ГАТУ (19 мг), затем перемешивают при 50°C в течение ночи. Реакционную смесь концентрируют в вакууме, и растворитель отгоняют с получением трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (15 мг), полученный на стадии 1 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 27: Синтез 4–[5–(3,8–диазабицикло[3.2.1]октан–8–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-3,8–диазабицикло[3.2.1]октан–3–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 28: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]фенил]–2–фторбензонитрила
Стадия 1
Метил-2–(4–бром–3–фторфенил)ацетат (500 мг) растворяют в ТГФ (2,2 мл). При –30°C туда по каплям добавляют раствор 3 M MeMgBr в диэтиловом эфире (5,40 мл) с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную смесь вводят в водный раствор хлорида аммония, туда добавляют этилацетат и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: этилацетат/гексан=10%→50%) с получением 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола.
Стадия 2
Трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (68 мг), полученный в примере 23 (стадия 1), 1–(4–бром–3–фторфенил)–2–метилпропан–2–ол (107 мг), полученный на стадии 1 выше, и Pd(PPh3)4 (6,42 мг) суспендируют в 1,4–диоксане (0,93 мл). При комнатной температуре туда добавляют 2 M водный раствор карбоната натрия (0,46 мл), затем перемешивают при 125°C в течение 45 минут. После фильтрации реакционной смеси, растворитель отгоняют с получением трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (90 мг), полученный на стадии 2 выше, растворяют в ТФК (0,3 мл), и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 29: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(гидроксиметил)фенил]фенил]бензонитрил
Стадия 1
[4–(4,4,5,5–Тетраметил–1,3,2–диоксаборолан–2–ил)фенил]метанол (500 мг) и ДМАП (26 мг) растворяют в ТГФ (7,1 мл), затем добавляют ТЭА (0,74 мл). При комнатной температуре туда добавляют ацетилхлорид (0,23 мл) с последующим перемешиванием в течение 1 часа. Туда добавляют этилацетат и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением [4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенил]метилацетата.
Стадия 2
Трет–бутил-N–[(3S)–1–[4–хлор–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамат (100 мг), полученный на стадии 2 примера 9, и [4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенил]метилацетат (130 мг), полученный на стадии 1 выше, растворяют в 1,4–диоксане (1,2 мл). При комнатной температуре туда добавляют Pd(dba)2 (6,8 мг), трикалийфосфат (100 мг) и раствор 1 M PCy3 в ТГФ (0,02 мл) и смесь перемешивают в микроволновом реакторе при 160°C в течение 1 часа. Реакционную смесь фильтруют через NH–силикагель и растворитель фильтрата отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: этилацетат/гексан=30%→100%) с получением [4–[4–[(3S)–3–(трет–бутоксикарбониламино)пирролидин–1–карбонил]–2–(4–цианофенил)фенил]фенил]метилацетата.
Стадия 3
[4–[4–[(3S)–3–(Трет–бутоксикарбониламино)пирролидин–1–карбонил]–2–(4–цианофенил)фенил]фенил]метилацетат (100 мг), полученный на стадии 2 выше, растворяют в MeOH (2 мл). При комнатной температуре туда добавляют карбонат калия (65 мг) с последующим перемешиванием при комнатной температуре в течение 30 минут. Туда добавляют хлороформ, смесь промывают последовательно насыщенным водным раствором хлорида аммония и насыщенным раствором соли и сушат над безводным сульфатом натрия, и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: этилацетат/гексан=40%→100%) с получением трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–[4–(гидроксиметил)фенил]бензоил]пирролидин–3–ил]карбамата.
Стадия 4
Трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–[4–(гидроксиметил)фенил]бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 3 выше, растворяют в ТФК (0,3 мл), и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 30: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(2–метоксиэтил)фенил]фенил]бензонитрила
Стадия 1
1–Бром–4–(2–метоксиэтил)бензол (450 мг) растворяют в 1,4–диоксане (5,2 мл). Затем туда добавляют бис(пинаколато)диборон (797 мг), KOAc (411 мг) и PdCl2(dppf) (77 мг), затем перемешивают при 90°C в течение ночи. Туда добавляют этилацетат, смесь пропускают через Целит и фильтрат промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: этилацетат/гексан=2%→20%) с получением 2–[4–(2–метоксиэтил)фенил]–4,4,5,5–тетраметил–1,3,2–диоксаборолана.
Стадия 2
Трет–бутил-N–[(3S)–1–[4–хлор–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамат (300 мг), полученный на стадии 2 примера 9, и 2–[4–(2–метоксиэтил)фенил]–4,4,5,5–тетраметил–1,3,2–диоксаборолан (369 мг), полученный на стадии 1 выше, растворяют в 1,4–диоксане (2 мл). При комнатной температуре туда добавляют Pd(dba)2 (32 мг), трикалийфосфат (300 мг) и раствор 1 M PCy3 в ТГФ (0,07 мл), и смесь перемешивают в микроволновом реакторе при 160°C в течение 45 минут. Реакционную смесь пропускают через Целит, и растворитель фильтрата отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–[4–(2–метоксиэтил)фенил]бензоил]пирролидин–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–[4–(2–метоксиэтил)фенил]бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 2 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 31: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(2–гидроксиэтил)фенил]фенил]бензонитрила
Методику стадий 1–4 из Примера 29 проводят с применением 2–[4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенил]этанола вместо [4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенил]метанола с получением указанного в заголовке соединения.
Пример 32: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(3–гидроксипропил)фенил]фенил]бензонитрил
Методику стадий 1–4 из Примера 29 проводят с применением 3–[4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенил]пропан–1–ола вместо [4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенил]метанола с получением указанного в заголовке соединения.
Пример 33: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–[1–(гидроксиметил)циклопропил]фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением (1–(4–бромфенил)циклопропил)метанола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 34: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(2–гидрокси–2–метилпропил)фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1–(4–бромфенил)–2–метилпропан–2–ола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 35: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(2–гидроксипропокси)фенил]фенил]бензонитрила
Стадия 1
Методику стадии 1 из Примера 12 проводят с применением (4–бензилоксифенил)бороновой кислоты вместо пинаколового эфира 4–метил–2–нитрофенилбороновой кислоты с получением трет–бутил-N–[(3S)–1–[4–(4–бензилоксифенил)–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[4–(4–бензилоксифенил)–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамат (800 мг), полученный на стадии 1 выше, и гидроксид палладия–углерод (160 мг) суспендируют в EtOH (20 мл) и проводят замещение водорода с последующим перемешиванием при комнатной температуре в течение 6 часов. Реакционную смесь пропускают через Целит, и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(4–гидроксифенил)бензоил]пирролидин–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(4–гидроксифенил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 2 выше, растворяют в ДМФ (0,5 мл). При комнатной температуре туда добавляют карбонат калия (6,4 мг) и 2–метилоксиран (5,4 мг), затем перемешивают при 120°C в течение 2 часов. Туда добавляют этилацетат, полученную смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–[4–(2–гидроксипропокси)фенил]бензоил]пирролидин–3–ил]карбамата.
Стадия 4
Трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–[4–(2–гидроксипропокси)фенил]бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 3 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 36: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(2–фтор–4–метилфенил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 16 проводят с применением (2–фтор–4–метилфенил)бороновой кислоты вместо п–толилбороновой кислоты с получением указанного в заголовке соединения.
Пример 37: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]фенил]–2–фторбензонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–[4–хлор–3–(4–циано–3–фторфенил)бензоил]пирролидин–3–ил]карбамат (4 г), полученный на стадии 1 примера 16, растворяют в 1,4–диоксане (45 мл). При комнатной температуре туда добавляют Pd(OAc)2 (0,40 г), KOAc (2,7 г), бис(пинаколато)диборон (4,6 г) и Silica–SMAP (0,72 г), затем перемешивают при 150°C в течение 18 часов. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамат (30 мг), полученный на стадии 1 выше, и 1–(4–бром–3–фторфенил)–2–метилпропан–2–ол (28 мг), полученный на стадии 1 примера 28, растворяют в 1,4–диоксане (0,8 мл). При комнатной температуре туда добавляют Pd(PPh3)4 (3,2 мг) и 2 M водный раствор карбоната натрия (0,4 мл), и смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Реакционную смесь фильтруют и растворитель отгоняют. Туда добавляют этилацетат, полученную смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]пирролидин–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]пирролидин–3–ил]карбамат (20 мг), полученный на стадии 2 выше, растворяют в метаноле (1 мл). При комнатной температуре туда добавляют 12 M HCl водный раствор (1 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь нейтрализуют добавлением воды (1 мл) и 2 M водного раствора гидроксида натрия (6 мл). Туда добавляют хлороформ, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют с получением указанного в заголовке соединения.
Пример 38: Синтез 2–фтор–4–[2–[2–фтор–4–(2–метоксиэтил)фенил]–5–(9–окса–2,6–диазаспиро[3.5]нонан–2–карбонил)фенил]бензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-9–окса–2,6–диазаспиро[3.5]нонан–6–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 39: Синтез 4–[5–(2,3,3a,4,6,6a–гексагидро–1H–пирроло[3,4–c]пиррол–5–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-2,3,3a,4,6,6a–гексагидро–1H–пирроло[3,4–c]пиррол–5–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 40: 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(2–гидрокси–2–метилпропил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 1–(4–бромфенил)–2–метилпропан–2–ола вместо 1–(4–бром–3–фторфенил)–2–метил–пропан–2–ола с получением указанного в заголовке соединения.
Пример 41: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]фенил]–2–фторбензонитрила
Стадия 1
Трет–бутил-4–хлор–3–(4–циано–3–фторфенил)бензоат (300 мг), полученный на стадии 1 примера 22, растворяют в 1,4–диоксане (5 мл). При комнатной температуре туда добавляют Pd(OAc)2 (40 мг), KOAc (300 мг), бис(пинаколато)диборон (500 мг) и Silica–SMAP (50 мг), затем перемешивают при 100°C в течение 26 часов. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоата.
Стадия 2
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (100 мг), полученный на стадии 1 выше, растворяют в ДХМ (1,2 мл). При комнатной температуре туда добавляют ТФК (1,00 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь концентрируют в вакууме и растворитель отгоняют. Туда добавляют хлороформ, смесь промывают водой и сушат над безводным сульфатом натрия, и растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензойной кислоты.
Стадия 3
3–(4–Циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензойную кислоту (500 мг), полученную на стадии 2 выше, и трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамат (308 мг) растворяют в ТГФ (4,5 мл). При комнатной температуре туда добавляют ТЭА (0,57 мл) и ГАТУ (1 г), затем перемешивают при 50°C в течение 1 часа. Реакционную смесь концентрируют в вакууме, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 4
Трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (30 мг), полученный на стадии 3 выше, и 1–(4–бром–3–фторфенил)–2–метил–пропан–2–ол (19 мг), полученный на стадии 1 примера 28, растворяют в 1,4–диоксане (0,5 мл). При комнатной температуре туда добавляют Pd(PPh3)4 (18 мг) и 2 M водный раствор карбоната натрия (0,3 мл), и смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Надосадочную жидкость реакционной смеси собирают и фильтруют через NH–силикагель, и растворитель отгоняют с получением трет–бутил–N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 5
Трет–бутил–N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (15 мг), полученный на стадии 4 выше, растворяют в MeOH (0,5 мл). При комнатной температуре туда добавляют 12 M HCl водный раствор (0,5 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. Затем туда добавляют воду и 2 M водный раствор гидроксида натрия (3 мл), и смесь разделяют и экстрагируют хлороформом. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 42: Синтез 4–[5–[(3S)–3–(метиламино)пирролидин–1–карбонил]–2–(п–толил)фенил]бензонитрила
Методику стадий 1–5 в Примере 1 проводят с применением (S)–трет–бутилметил(пирролидин–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 43: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(4–бензилоксифенил)фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1–(бензилокси)–4–бромбензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 44: Синтез 1–[4–[4–[(3S)–3–аминопирролидин–1–карбонил]–2–(4–цианофенил)фенил]фенил]–N–фенилциклопропанкарбоксамида
Методику стадий 1–5 из Примера 9 проводят с применением 1–(4–бромфенил)–N–фенилциклопропанкарбоксамида вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 45: Синтез 2–[4–[4–[(3S)–3–аминопирролидин–1–карбонил]–2–(4–цианофенил)фенил]фенил]этилацетата
Стадия 1
Методику стадии 1 из Примера 29 проводят с применением 2–(4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенил)этанола вместо [4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенил]метанола с получением 4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенэтилацетата.
Стадия 2
Методику стадий 1–2 из Примера 12 проводят с применением 4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенэтилацетата, полученного на стадии 1 выше, вместо пинаколового эфира 4–метил–2–нитрофенилбороновой кислоты с получением указанного в заголовке соединения.
Пример 46: Синтез 4–[2–[4–(2–гидроксиэтил)фенил]–5–[(3S)–3–(метиламино)пирролидин–1–карбонил]фенил]бензонитрила
Стадия 1
Методику стадий 1–5 из Примера 1 проводят с применением 4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенэтилацетата, полученного на стадии 1 примера 45, вместо п–толилбороновой кислоты и с применением (S)–трет–бутилметил(пирролидин–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением 2–[4–[2–(4–цианофенил)–4–[(3S)–3–(метиламино)пирролидин–1–карбонил]фенил]фенил]этилацетата.
Стадия 2
Методику стадии 3 из Примера 29 проводят с применением 2–[4–[2–(4–цианофенил)–4–[(3S)–3–(метиламино)пирролидин–1–карбонил]фенил]фенил]этилацетата, полученного на стадии 1 выше, вместо [4–[4–[(3S)–3–(трет–бутоксикарбониламино)пирролидин–1–карбонил]–2–(4–цианофенил)фенил]фенил]метилацетата с получением указанного в заголовке соединения.
Пример 47: Синтез 4–[2–[4–(2–метоксиэтил)фенил]–5–[(3S)–3–(метиламино)пирролидин–1–карбонил]фенил]бензонитрила
Стадия 1
Методику стадий 1–5 из Примера 1 проводят с применением (4–(2–метоксиэтил)фенил)бороновой кислоты вместо п–толилбороновой кислоты и с применением (S)–трет–бутилметил(пирролидин–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 48: Синтез 4–[5–[(3S)–3–(диметиламино)пирролидин–1–карбонил]–2–[4–[1–(гидроксиметил)циклопропил]фенил]фенил]бензонитрила
Методику стадий 1–4 из Примера 1 проводят с применением [4–[1–(гидроксиметил)циклопропил]фенил]бороновой кислоты вместо п–толилбороновой кислоты и с применением (S)–N, N–диметилпирролидин–3–амина вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 49: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(3–фтор–4–метилфенил)фенил]бензонитрил
Методику стадий 1–2 из Примера 12 проводят с применением (3–фтор–4–метилфенил)бороновой кислоты вместо пинаколового эфира 4–метил–2–нитрофенилбороновой кислоты с получением указанного в заголовке соединения.
Пример 50: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(4–хлорфенил)фенил]бензонитрил
Методику стадий 1–5 из Примера 9 проводят с применением 1–бром–4–хлорбензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 51: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(4–бромфенил)фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1,4–дибромбензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 52: Синтез 5'–[(1S,4S)–2,5–диазабицикло[2,2,1]гептан–2–карбонил]–4''–метил–[1,1':2',1''–терфенил]–4–карбонитрила
Методику стадий 1–5 из Примера 1 проводят с применением трет–бутил-(1S,4S)–2,5–диазабицикло[2.2,1]гептан–2–карбоксилата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 53: Синтез 4–[2–[4–(2–аминоэтил)фенил]–5–[(3S)–3–аминопирролидин–1–карбонил]фенил]бензонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–[3–(4–цианофенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамат (50 мг), полученный в примере 9 (стадия 3), растворяют в 1,4–диоксане (0,48 мл). При комнатной температуре туда добавляют 2–(4–бромфенил)этанамин (29 мг), Pd(PPh3)4 (3,4 мг) и 2 M водный раствор карбоната натрия (0,24 мл), и смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[4–[4–(2–аминоэтил)фенил]–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[4–[4–(2–аминоэтил)фенил]–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 1 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 54: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(4–йодфенил)фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1,4–дийодбензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 55: Синтез N–[2–[4–[4–[(3S)–3–аминопирролидин–1–карбонил]–2–(4–цианофенил)фенил]фенил]этил]ацетамида
Трет–бутил-N–[(3S)–1–[4–[4–(2–аминоэтил)фенил]–3–(4–цианофенил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 1 примера 53, растворяют в ТГФ. При комнатной температуре туда добавляют ТЭА (0,02 мл) и затем ацетилхлорид (4,6 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. ТФК добавляют к остатку, и прогресс реакции подтверждают ЖХМС с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 56: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(4–пропилфенил)фенил]бензонитрила
Методику стадий 1–2 из Примера 12 проводят с применением (4–пропилфенил)бороновой кислоты вместо пинаколового эфира 4–метил–2–нитрофенилбороновой кислоты с получением указанного в заголовке соединения.
Пример 57: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(2–нафтил)фенил]бензонитрила
Методику стадий 1–2 из Примера 12 проводят с применением 2–нафтилбороновой кислоты вместо пинаколового эфира 4–метил–2–нитрофенилбороновой кислоты с получением указанного в заголовке соединения.
Пример 58: Синтез 4–[2–[4–[1–(гидроксиметил)циклопропил]фенил]–5–[(3S)–3–(метиламино)пирролидин–1–карбонил]фенил]бензонитрила
Методику стадий 1–5 из Примера 1 проводят с применением [4–[1–(гидроксиметил)циклопропил]фенил]бороновой кислоты вместо п–толилбороновой кислоты и с применением (S)–трет–бутилметил(пирролидин–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 59: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–[(1–гидроксициклопропил)метил]фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1–[(4–бромфенил)метил]циклопропанола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 60: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(2–метилпроп–1–енил)фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1–бром–4–(2–метилпроп–1–енил)бензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 61: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(3–гидрокси–3–метилбутил)фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 4–(4–бромфенил)–2–метилбутан–2–ола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 62: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–[2–(1–гидроксициклопропил)этил]фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1–[2–(4–бромфенил)этил]циклопропанола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 63: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(2–гидроксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 2–(4–бромфенил)этанола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 64: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола, полученного в примере 28 (стадия 1), вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 65: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(3–гидрокси–3–метилбутил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 16 проводят с применением 2–метил–4–[4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)фенил]бутан–2–ола вместо п–толилбороновой кислоты с получением указанного в заголовке соединения.
Пример 66: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–[1–(метоксиметил)циклопропил]фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1–бром–4–[1–(метоксиметил)циклопропил]бензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 67: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[2–фтор–4–[(1–гидроксициклопропил)метил]фенил]бензонитрила
Стадия 1
Метил–2–(4–бром–3–фторфенил)ацетат (500 мг) и изопропоксид титана (0,84 мл) растворяют в ТГФ (5 мл). При 0°C туда по каплям добавляют раствор 3 M EtMgBr в диэтиловом эфире (1,9 мл) с последующим перемешиванием при комнатной температуре в течение ночи. Туда добавляют этилацетат, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–[(4–бром–3–фторфенил)метил]циклопропанола.
Стадия 2
Методику стадий 1–5 из Примера 9 проводят с применением 1–[(4–бром–3–фторфенил)метил]циклопропанола, полученного на стадии 1 выше, вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 68: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–[1–(1–гидроксициклопропил)циклопропил]фенил]фенил]бензонитрила
Стадия 1
Методику стадии 1 из Примера 67 проводят с применением метил-1–(4–бромфенил)циклопропанкарбоновой кислоты вместо метил–2–(4–бром–3–фторфенил)ацетата с получением 1–[1–(4–бромфенил)циклопропил]циклопропанола.
Стадия 2
Методику стадий 1–5 из Примера 9 проводят с применением 1–[1–(4–бромфенил)циклопропил]циклопропанола, полученного на стадии 1 выше, вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 69: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 16 проводят с применением 2–[4–(2–метоксиэтил)фенил]–4,4,5,5–тетраметил–1,3,2–диоксаборолана, полученного в примере 30 (стадия 1), вместо п–толилбороновой кислоты с получением указанного в заголовке соединения.
Пример 70: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[2–фтор–4–(2–гидроксиэтил)фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 2–(4–бром–3–фторфенил)этанола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 71: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1–бром–2–фтор–4–(2–метоксиэтил)бензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 72: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(2–гидрокси–1,1–диметилэтил)фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 2–(4–бромфенил)–2–метилпропан–1–ола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 73: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[4–(2–фторэтил)фенил]фенил]бензонитрила
Методику стадий 1–5 из Примера 9 проводят с применением 1–бром–4–(2–фторэтил)бензола вместо 1–бром–2–хлор–4–метилбензола с получением указанного в заголовке соединения.
Пример 74: Синтез 4–[5–(2,7–диазаспиро[3.4]октан–7–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-2,7–диазаспиро[3.4]октан–2–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 75: Синтез 4–[5–(2,8–диазаспиро[3.5]нонан–2–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-2,8–диазаспиро[3.5]нонан–8–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 76: Синтез 4–[5–(2,7–диазаспиро[3.4]октан–7–карбонил)–2–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением трет–бутил-2,7–диазаспиро[3.4]октан–2–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 77: Синтез 4–[5–(2,8–диазаспиро[3.5]нонан–2–карбонил)–2–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением трет–бутил-2,8–диазаспиро[3.5]нонан–8–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 78: Синтез гидрохлорида 4–[5–(3,8–диазаспиро[4.5]декан–8–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-3,8–диазаспиро[4.5]декан–3–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 79: Синтез 4–[5–(2,8–диазаспиро[3.5]нонан–8–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-2,8–диазаспиро[3.5]нонан–2–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 80: Синтез гидрохлорида 4–[5–(1,4–диазепан–1–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил–1,4–диазепан–1–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 81: Синтез 4–[5–(3,7–диазаспиро[3.4]октан–7–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил–3,7–диазаспиро[3.4]октан–3–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 82: Синтез 4–[5–[(1S,4S)–2,5–диазабицикло[2.2,1]гептан–2–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-(1S,4S)–2,5–диазабицикло[2.2,1]гептан–2–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 83: Синтез 4–[5–(3,7–диазаспиро[3.5]нонан–7–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-3,7–диазаспиро[3.5]нонан–3–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 84: Синтез 4–[5–(2,7–диазаспиро[3.5]нонан–2–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением гидрохлорида трет–бутил-2,7–диазаспиро[3.5]нонан–7–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 85: Синтез 4–[5–[(1R,4R)–2,5–диазабицикло[2.2,1] гептан–2–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-(1R,4R)–2,5–диазабицикло[2.2,1]гептан–2–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 86: Синтез 2–фтор–4–[2–[2–фтор–4–(2–метоксиэтил)фенил]–5–[(1S,4S)–5–метил–2,5–диазабицикло[2.2,1]гептан–2–карбонил]фенил]бензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением (1S,4S)–2–метил–2,5–диазабицикло[2.2,1]гептана вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 87: Синтез 2–фтор–4–[2–[2–фтор–4–(2–метоксиэтил)фенил]–5–[(1R,4R)–5–метил–2,5–диазабицикло[2.2,1]гептан–2–карбонил]фенил]бензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением (1R,4R)–2–метил–2,5–диазабицикло[2.2,1]гептана вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 88: Синтез 4–[5–(3,8–диазабицикло[3.2.1]октан–3–карбонил)–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-3,8–диазабицикло[3.2.1]октан–8–карбоновой кислоты вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 89: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(1,3–бензотиазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 16 проводят с применением 1,3–бензотиазол–5–илбороновой кислоты вместо п–толилбороновой кислоты с получением указанного в заголовке соединения.
Пример 90: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(1–метилпиразоло[3,4–b]пиридин–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 16 проводят с применением (1–метилпиразоло[3,4–b]пиридин–5–ил)бороновой кислоты вместо п–толилбороновой кислоты с получением указанного в заголовке соединения.
Пример 91: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(1–метилбензимидазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–1–метилбензимидазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 92: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(1–метилиндазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 16 проводят с применением (1–метилиндазол–5–ил)бороновой кислоты вместо п–толилбороновой кислоты с получением указанного в заголовке соединения.
Пример 93: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(2–метилиндазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 16 проводят с применением 2–метил–5–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)индазола вместо п–толилбороновой кислоты с получением указанного в заголовке соединения.
Пример 94: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карботиоил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику из Примера 2 проводят с применением 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила, полученного в примере 20 (стадия 3), вместо 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(п–толил)фенил]бензонитрила с получением указанного в заголовке соединения.
Пример 95: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(6–фтор–1–метилбензимидазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–6–фтор–1–метилбензимидазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 96: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(6–фтор–1–метилбензотриазол–5–ил)фенил]–2–фторбензонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный в примере 37 (стадия 1), растворяют в 1,4–диоксане (0,5 мл). При комнатной температуре туда добавляют 5–бром–6–фтор–1–метилбензотриазол (9,7 мг), PdCl2(dppf) (1,0 мг) и трикалийфосфат (18 мг), и смесь перемешивают в микроволновом реакторе при 125°C в течение 30 минут. Туда добавляют этилацетат и смесь помещают в NH–силикагель и промывают этилацетатом/метанолом. Растворитель отгоняют с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(6–фтор–1–метилбензотриазол–5–ил)бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(6–фтор–1–метилбензотриазол–5–ил)бензоил]пирролидин–3–ил]карбамат (15 мг), полученный на стадии 1 выше, растворяют в ТФК (0,3 мл) и прогресс реакции подтверждают ЖХМС, с последующей вакуумной концентрацией. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 97: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(4–фторфенил)фенил]бензонитрила
Методику стадий 1–3 из Примера 23 проводят с применением 1–бром–4–фторбензола вместо 5–бром–6–фтор–1–метилиндола с получением указанного в заголовке соединения.
Пример 98: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(4–хлорфенил)фенил]бензонитрила
Методику стадий 1–3 из Примера 23 проводят с применением 1–бром–4–хлорбензола вместо 5–бром–6–фтор–1–метилиндола с получением указанного в заголовке соединения.
Пример 99: Синтез [(3S)–3–аминопирролидин–1–ил]–[3–(4–нитрофенил)–4–(п–толил)фенил]метанона
Методику стадий 1–5 из Примера 19 проводят с применением 1–бром–4–нитробензола вместо 4–бром–2,6–дифторбензонитрила с получением указанного в заголовке соединения.
Пример 100: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–[6–(диметиламино)–3–пиридил]фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–N, N–диметилпиридин–2–амина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 101: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(1–метилбензотриазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–1–метилбензотриазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 102: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(6,7–дифтор–1–метилбензимидазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–6,7–дифтор–1–метилбензимидазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 103: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(1,2–диметилбензимидазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–1,2–диметилбензимидазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 104: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(2–нафтил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 23 проводят с применением 2–бромнафталина вместо 5–бром–6–фтор–1–метилиндола с получением указанного в заголовке соединения.
Пример 105: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(8–фтор–7–хинолил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 23 проводят с применением 7–бром–8–фторхинолина вместо 5–бром–6–фтор–1–метилиндола с получением указанного в заголовке соединения.
Пример 106: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(4–метил–2,3–дигидро–1,4–бензоксазин–7–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 23 проводят с применением 7–бром–4–метил–3,4–дигидро–2H–бензо[b][1,4]оксазина вместо 5–бром–6–фтор–1–метилиндола с получением указанного в заголовке соединения.
Пример 107: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(7–хинолин)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 23 проводят с применением 7–бромхинолина вместо 5–бром–6–фтор–1–метилиндола с получением указанного в заголовке соединения.
Пример 108: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(6–фтор–1–метилбензимидазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 23 проводят с применением 5–бром–6–фтор–1–метилбензимидазола вместо 5–бром–6–фтор–1–метилиндола с получением указанного в заголовке соединения.
Пример 109: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(6–фтор–1–метилбензотриазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 23 проводят с применением 5–бром–6–фтор–1–метилбензотриазола вместо 5–бром–6–фтор–1–метилиндола с получением указанного в заголовке соединения.
Пример 110: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(4–фтор–1–метилиндазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 23 проводят с применением 5–бром–4–фтор–1–метилиндазола вместо 5–бром–6–фтор–1–метилиндола с получением указанного в заголовке соединения.
Пример 111: Синтез 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(2–метилиндазол–5–ил)фенил]бензонитрила
Методику стадий 1–3 из Примера 23 проводят с применением 5–бром–2–метил–2H–индазола вместо 5–бром–6–фтор–1–метилиндола с получением указанного в заголовке соединения.
Пример 112: Синтез 2–фтор–4–[2–[2–фтор–4–(2–метоксиэтил)фенил]–5–[(3–экзо)–3–(изопропиламино)–8–азабицикло[3.2.1]октан–8–карбонил]фенил]бензонитрила
Ацетон (0,002 мл) добавляют при 25°C к раствору 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила, полученного в примере 26 (стадия 2), в дихлорметане (0,05 мл). Затем туда добавляют NaBH(OAc)3 (8,45 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют MeOH и растворитель отгоняют. Затем остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 113: Синтез 2–фтор–4–[2–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]–5–[(3–экзо)–3–(изопропиламино)–8–азабицикло[3.2.1]октан–8–карбонил]фенил]бензонитрила
Методику из Примера 112 проводят с применением 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]фенил]–2–фторбензонитрила, полученного в примере 28 (стадия 3), вместо 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила с получением указанного в заголовке соединения.
Пример 114: Синтез 4–[5–[(3S)–3–(этиламино)пирролидин–1–карбонил]–2–(6–фтор–1–метилбензотриазол–5–ил)фенил]–2–фторбензонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(6–фтор–1–метилбензотриазол–5–ил)бензоил]пирролидин–3–ил]карбамат (10 мг), полученный в примере 96 (стадия 1), растворяют в ТГФ (0,5 мл). При комнатной температуре туда добавляют гидрид натрия (0,85 мг) и затем йодэтан (5,58 мг), смесь перемешивают при 50°C в течение ночи и растворитель отгоняют с получением (S)–трет–бутил-(1–(4'–циано–3'–фтор–6–(6–фтор–1–метил–1H–бензо[d][1.2.3]триазол–5–ил)–[1,1'–бифенил]–3–карбонил)пирролидин–3–ил)(этил)карбамата. Полученный продукт применяют на следующей стадии без очистки.
Стадия 2
Методику стадии 2 из Примера 26 проводят с применением (S)–трет–бутил-(1–(4'–циано–3'–фтор–6–(6–фтор–1–метил–1H–бензо[d][1.2.3]триазол–5–ил)–[1,1'–бифенил]–3–карбонил)пирролидин–3–ил)(этил)карбамата, полученного на стадии 1 выше, вместо [(3–экзо)–8–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 115: Синтез 2–фтор–4–[2–(6–фтор–1–метилбензотриазол–5–ил)–5–[(3S)–3–(изопропиламино)пирролидин–1–карбонил]фенил]бензонитрила
Методику из Примера 112 проводят с применением 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(6–фтор–1–метилбензотриазол–5–ил)фенил]–2–фторбензонитрила, полученного в примере 96 (стадия 2), вместо 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила с получением указанного в заголовке соединения.
Пример 116: Синтез 4–[5–[(3S)–3–(циклобутиламино)пирролидин–1–карбонил]–2–(6–фтор–1–метилбензотриазол–5–ил)фенил]–2–фторбензонитрила
Методику из Примера 112 проводят с применением 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(6–фтор–1–метилбензотриазол–5–ил)фенил]–2–фторбензонитрила, полученного в примере 96 (стадия 2), вместо 4–[5–[(3–экзо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила и с применением циклобутанона вместо ацетона с получением указанного в заголовке соединения.
Пример 117: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(1–метилиндолин–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–1–метилиндоина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 118: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(4–метил–2,3–дигидро–1,4–бензоксазин–7–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 7–бром–4–метил–3,4–дигидро–2H–бензо[b][1,4]оксазина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 119: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(3–метил–2–оксо–1,3–бензооксазол–6–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 6–бром–3–метил–1,3–бензооксазол–2–она вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 120: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(3–метил–2–оксо–1,3–бензотиазол–6–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 6–бром–3–метил–1,3–бензотиазол–2–она вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 121: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(2,3–дигидро–1,4–бензодиоксин–6–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 16 проводят с применением 2,3–дигидро–1,4–бензодиоксан–6–илбороновой кислоты вместо п–толилбороновой кислоты с получением указанного в заголовке соединения.
Пример 122: Синтез 4–[5–[(3S)–3–аминопирролидин–1–карбонил]–2–(1,3–бензодиоксол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–3 из Примера 16 проводят с применением 1,3–бензодиоксол–5–илбороновой кислоты вместо п–толилбороновой кислоты с получением указанного в заголовке соединения.
Пример 123: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(6–фтор–1–метилиндол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–6–фтор–1–метилиндола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 124: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(6–фтор–1–метилиндазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–6–фтор–1–метилиндазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 125: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(6–фтор–1–метилбензотриазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–6–фтор–1–метилбензотриазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 126: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(6,7–дифтор–1–метилбензимидазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–6,7–дифтор–1–метилбензимидазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 127: Синтез 4–[5–[(3–экзо)–3–амино–9–азабицикло[3,3,1]нонан–9–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-N–[(3–экзо)–9–азабицикло[3,3,1]нонан–3–ил]карбамата вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 128: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(4–метил–2,3–дигидро–1,4–бензоксазин–7–ил)фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 7–бром–4–метил–3,4–дигидро–2H–бензо[b][1,4]оксазина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 129: Синтез 4–[5–[(3–эндо)–3–амино–9–азабицикло[3,3,1]нонан–9–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-N–[(3–эндо)–9–азабицикло[3,3,1]нонан–3–ил]карбамата вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 130: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(6–фтор–1–метилбензимидазол–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–6–фтор–1–метилбензимидазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 131: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–[6–(диметиламино)–3–пиридил]фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–N, N–диметилпиридин–2–амина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 132: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(1,3,3–триметил–2–оксоиндолин–5–ил)фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–1,3,3–триметилиндолин–2–она вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 133: Синтез 4–[5–[(3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил]–2–(3–метил–2–оксо–1,3–бензотиазол–6–ил)фенил]–2–фторбензонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 6–бром–3–метил–1,3–бензотиазол–2–она вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 134: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–3–фтор–2'–(6–фтор–1–метил–1H–индол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–6–фтор–1–метил–1H–индола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 135: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–3–фтор–2'–(6–фтор–1–метил–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–6–фтор–1–метил–1H–индазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 136: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
5–Бром–6–фтор–1H–индол (50 мг) растворяют в ДМФ (0,78 мл). При комнатной температуре туда добавляют карбонат цезия (151 мг) и 2,2–диметилоксиран (42 мкл), затем перемешивают при 90°C в течение 16 часов. Реакцию гасят насыщенным NH4Cl водным раствором, туда добавляют этилацетат и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(5–бром–6–фториндол–1–ил)–2–метилпропан–2–ола.
Стадия 2
Методику стадий 1–5 из Примера 41 проводят с применением 1–(5–бром–6–фториндол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 выше, вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 137: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(1,3–дигидроизобензофуран–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–1,3–дигидроизобензофурана вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 138: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(3–изопропил–2–оксо–2,3–дигидробензо[d]тиазол–6–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
6–Бром–3H–1,3–бензотиазол–2–он (100 мг) растворяют в ДМФ (0,87 мл). При комнатной температуре туда добавляют карбонат калия (90 мг), затем перемешивают при 0°C в течение 15 минут. При комнатной температуре туда добавляют 2–бромпропан (0,082 мл), затем перемешивают при 100°C в течение 3 часов. Реакцию гасят насыщенным NH4Cl водным раствором, туда добавляют этилацетат и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 6–бром–3–изопропил–1,3–бензотиазол–2–она.
Стадия 2
Методику стадий 1–5 из Примера 41 проводят с применением 6–бром–3–изопропил–1,3–бензотиазол–2–она, полученного на стадии 1 выше, вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 139: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(1–(трет–бутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–1–(трет–бутил)–6–фтор–1H–бензо[d][1.2.3]триазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 140: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(1,3–дигидроизобензофуран–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–1,3–дигидроизобензофурана вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 141: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–3–фтор–2'–(5–фтор–3–метил–2–оксо–2,3–дигидробензо[d]тиазол–6–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
5–Фтор–3H–1,3–бензотиазол–2–он (200 мг) суспендируют в MeCN (1 мл). При комнатной температуре туда добавляют NBS (231 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. Растворитель концентрируют в вакууме, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 6–бром–5–фтор–3H–1,3–бензотиазол–2–она.
Стадия 2
6–Бром–5–фтор–3H–1,3–бензотиазол–2–он (100 мг), полученный на стадии 1 выше, растворяют в ДМФ (1,3 мл). При комнатной температуре туда добавляют карбонат калия (84 мг), затем перемешивают при 0°C в течение 15 минут. При комнатной температуре туда добавляют йодметан (0,050 мл) с последующим перемешиванием при комнатной температуре в течение 0,5 часа. Реакцию гасят насыщенным NH4Cl водным раствором, туда добавляют этилацетат и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 6–бром–5–фтор–3–метил–1,3–бензотиазол–2–она.
Стадия 3
Методику стадий 1–3 из Примера 37 проводят с применением 6–бром–5–фтор–3–метил–1,3–бензотиазол–2–она, полученного на стадии 2 выше, вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 142: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
5–Бром–6–фтор–1H–индазол (94 мг) растворяют в ДМФ (1,5 мл). При комнатной температуре туда добавляют карбонат цезия (285 мг) и 2,2–диметилоксиран (0,078 мл), затем перемешивают при 90°C в течение 16 часов. Реакцию гасят насыщенным NH4Cl водным раствором, туда добавляют этилацетат и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола.
Стадия 2
Методику стадий 1–5 из Примера 41 проводят с применением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 выше, вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 143: Синтез 4–[5–[(1S,3R,4R)–рел–3–амино–7–азабицикло[2.2,1]гептан–7–карбонил]–2–[2–фтор–4–(2–метоксиэтил)фенил]фенил]–2–фторбензонитрила
Стадия 1
трет–Бутил-(1S,3R,4R)–рел–3–амино–7–азабицикло[2.2,1]гептан–7–карбоксилат (50 мг) растворяют в ТГФ (1,2 мл). При 0°C туда добавляют ТЭА (0,066 мл) и хлорид 2–нитробензолсульфонила (57 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. Остаток растворяют в 4 N растворе хлористоводородной кислоты–этилацетата (2 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционную смесь концентрируют в вакууме с получением гидрохлорида N–[(1S,3R,4R)–рел–7–азабицикло[2.2,1]гептан–3–ил]–2–нитробензолсульфонамида.
Стадия 2
Методику стадии 3 из Примера 22 проводят с применением гидрохлорида N–[(1S,3R,4R)–рел–7–азабицикло[2.2,1]гептан–3–ил]–2–нитробензолсульфонамида, полученного на стадии 1 выше, вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением N–[(1S,3R,4R)–рел–7–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2–нитробензолсульфонамида.
Стадия 3
N–[(1S,3R,4R)–Рел–7–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2–нитробензолсульфонамид (20 мг), полученный на стадии 2 выше, растворяют в ДМФ (0,5 мл). При комнатной температуре туда добавляют карбонат калия (21 мг) и 4–меркаптобензойную кислоту (12 мг), затем перемешивают при 40°C в течение 12 часов. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 144: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'',3,3''–трифтор–4''–метил–[1,1':2',1''–терфенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 1–бром–2,3–дифтор–4–метилбензола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 145: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(6,7–дифтор–1–метил–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
Трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (200 мг), полученный на стадии 3 из Примера 41, и 5–бром–6,7–дифтор–1–метилбензотриазол (129 мг) растворяют в 1,4–диоксане (1,74 мл). При комнатной температуре туда добавляют Pd(dba)2 (16,0 мг), X–phos (26,5 мг) и трикалийфосфат (221 мг) и смесь перемешивают в микроволновом реакторе при 125°C в течение 1 часа. Реакционную смесь фильтруют, и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: этилацетат/гексан) с получением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(6,7–дифтор–1–метилбензотриазол–5–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(6,7–дифтор–1–метилбензотриазол–5–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (210 мг), полученный на стадии 1 выше, растворяют в MeOH (1,60 мл). При комнатной температуре туда добавляют 4 N раствор хлористоводородной кислоты–этилацетата (2,40 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь концентрируют в вакууме и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 146: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамат (60 мг), полученный на стадии 1 из Примера 37, и 1–(5–бром–6–фториндол–1–ил)–2–метилпропан–2–ол (48,1 мг), полученный на стадии 1 из Примера 136, растворяют в 1,4–диоксане (0,50 мл). При комнатной температуре туда добавляют Pd(dba)2 (3,22 мг), X–phos (5,34 мг) и трикалийфосфат (71,4 мг) и смесь перемешивают в микроволновом реакторе при 125°C в течение 1 часа. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензоил]пирролидин–3–ил]карбамат (68,0 мг), полученный на стадии 1 выше, растворяют в MeOH (1,0 мл). При комнатной температуре туда добавляют 12 N хлористоводородную кислоту (1,0 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют 2 N водный раствор гидроксида натрия (6,00 мл) и хлороформ, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 147: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамат (70 мг), полученный на стадии 1 из Примера 37, и 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ол (56,3 мг), полученный на стадии 1 из Примера 142, растворяют в 1,4–диоксане (0,50 мл). При комнатной температуре туда добавляют Pd(dba)2 (3,76 мг), X–phos (6,23 мг) и трикалийфосфат (83,3 мг) и смесь перемешивают в микроволновом реакторе при 125°C в течение 1 часа. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индазол–5–ил]бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индазол–5–ил]бензоил]пирролидин–3–ил]карбамат (70,0 мг), полученный на стадии 1 выше, растворяют в MeOH (1,0 мл). При комнатной температуре туда добавляют 12 N хлористоводородную кислоту (1,0 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют 2 N водный раствор гидроксида натрия (6,00 мл) и хлороформ, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 148: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(хиноксалин–6–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 6–бромхиноксалина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 149: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(изохинолин–6–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 6–бромизохинолина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 150: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(изохинолин–7–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 7–бромизохинолина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 151: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(хинолин–6–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 6–бромхинолина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 152: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(хиназолин–7–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 7–бромхиназолина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 153: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(хиназолин–6–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 6–бромхиназолина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 154: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(фталазин–6–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 6–бромфталазина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 155: Синтез 5'–((1R,2R,4S)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'',3–дифтор–4''–(2–метоксиэтил)–[1,1':2',1''–терфенил]–4–карбонитрила–изомер–B
Стадия 1
трет–Бутил-(1S,3R,4R)–рел–3–амино–7–азабицикло[2.2,1]гептан–7–карбоксилат (550 мг) растворяют в ТГФ (13,0 мл). При 0°C туда добавляют ТЭА (0,720 мл) и хлорид 2,4–динитробензолсульфонила (829 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-(1S,3R,4R)–рел–3–[(2,4–динитрофенил)сульфониламино]–7–азабицикло[2.2,1]гептан–7–карбоксилата.
Стадия 2
Трет–бутил-(1S,3R,4R)–рел–3–[(2,4–динитрофенил)сульфониламино]–7–азабицикло[2.2,1]гептан–7–карбоксилат (440 мг), полученный на стадии 1 выше, подвергают хиральному разделению с применением SFC (устройство: Thar SFC prep 80 система, колонка: Chiralpak IE 20×250 мм, скорость потока: 50 г/мин, подвижная фаза: CO2/MeOH=90/10) с получением (1S,3R,4R)–рел–3–[(2,4–динитрофенил)сульфониламино]–7–азабицикло[2.2,1]гептан–7–карбоксилата–изомер–A (более быстрый изомер) и (1S,3R,4R)–рел–3–[(2,4–динитрофенил)сульфониламино]–7–азабицикло[2.2,1]гептан–7–карбоксилата–изомер–B (более медленный изомер).
Каждый изомер анализируют в следующих условиях ВЭЖХ.
Колонка: CHIRALPAK IE 4,6×150 мм
Подвижная фаза: гексан (0,1% триэтиламин)/этанол=85/15
Скорость потока: 1,0 мл/мин
Время удержания каждого изомера:
(1S,3R,4R)–рел–3–[(2,4–динитрофенил)сульфониламино]–7–азабицикло[2.2,1]гептан–7–карбоксилат–изомер–A: 10,903 мин (более быстрый изомер)
(1S,3R,4R)–рел–3–[(2,4–динитрофенил)сульфониламино]–7–азабицикло[2.2,1]гептан–7–карбоксилат–изомер–B: 14,028 мин (более медленный изомер)
Стадия 3
(1S,3R,4R)–Рел–3–[(2,4–динитрофенил)сульфониламино]–7–азабицикло[2.2,1]гептан–7–карбоксилат–изомер–B (200 мг), полученный на стадии 2 выше, растворяют в этилацетате (1,00 мл). При комнатной температуре туда добавляют 4 N раствор хлористоводородной кислоты–этилацетата (2,00 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют в вакууме с получением гидрохлорида N–((1R,2R,4S)–рел–7–азабицикло[2.2,1]гептан–2–ил)–2,4–динитробензолсульфонамида–изомер–B.
Стадия 4
3–(4–Циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензойную кислоту (8 мг), полученную на стадии 2 из Примера 22, и гидрохлорид N–((1R,2R,4S)–рел–7–азабицикло[2.2,1]гептан–2–ил)–2,4–динитробензолсульфонамида–изомер–B (8,47 мг), полученный на стадии 3 выше, растворяют в ТГФ (0,30 мл). При комнатной температуре туда добавляют ТЭА (8,49 мкл) и ГАТУ (15,5 мг), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением N–[(1S,3R,4R)–рел–7–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида–изомер–B.
Стадия 5
N–[(1S,3R,4R)–рел–7–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамид–изомер–B (14,5 мг), полученный на стадии 4 выше, растворяют в ДХМ (1 мл). При 0°C туда добавляют меркаптоуксусную кислоту (2,83 мкл) и ТЭА (7,49 мкл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют хлороформ, смесь промывают 4 N водным раствором гидроксида натрия и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 156: Синтез 5'–((1R,2R,4S)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'',3–дифтор–4''–(2–метоксиэтил)–[1,1':2',1''–терфенил]–4–карбонитрила–изомер–A
Стадия 1
(1S,3R,4R)–рел–3–[(2,4–динитрофенил)сульфониламино]–7–азабицикло[2.2,1]гептан–7–карбоксилат–изомер–A (200 мг), полученный на стадии 2 из Примера 155, растворяют в этилацетате (1,00 мл). При комнатной температуре туда добавляют 4 N раствор хлористоводородной кислоты–этилацетата (2,00 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Реакционную смесь концентрируют в вакууме с получением гидрохлорида N–((1R,2R,4S)–рел–7–азабицикло[2.2,1]гептан–2–ил)–2,4–динитробензолсульфонамида–изомер–A.
Стадия 2
3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензойную кислоту (8 мг), полученную на стадии 2 из Примера 22, и гидрохлорид N–((1r,2r,4s)–рел–7–азабицикло[2.2,1]гептан–2–ил)–2,4–динитробензолсульфонамида–изомер–A (8,47 мг), полученный на стадии 1 выше, растворяют в ТГФ (0,30 мл). При комнатной температуре туда добавляют ТЭА (8,49 мкл) и ГАТУ (15,5 мг), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением N–[(1S,3R,4R)–рел–7–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида–изомер–A.
Стадия 3
N–[(1S,3R,4R)–рел–7–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–метоксиэтил)фенил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамид–изомер–A (14,5 мг), полученный на стадии 2 выше, растворяют в ДХМ (1 мл). При 0°C туда добавляют меркаптоуксусную кислоту (2,83 мкл) и ТЭА (7,49 мкл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют хлороформ, смесь промывают 4 N водным раствором гидроксида натрия и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 157: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(3–метилимидазо[1,5–a]пиридин–7–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 7–бром–3–метилимидазо[1,5–a]пиридина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 158: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(3–метилпиразоло[1,5–a]пиримидин–6–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 6–бром–3–метилпиразоло[1,5–a]пиримидина вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 159: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(6–фтор–2–(2–гидрокси–2–метилпропил)–2H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
5–Бром–6–фтор–1H–индазол (94 мг) растворяют в ДМФ (1,5 мл). При комнатной температуре туда добавляют карбонат цезия (285 мг) и 2,2–диметилоксиран (0,078 мл), затем перемешивают при 90°C в течение 16 часов. Реакцию гасят насыщенным NH4Cl водным раствором, туда добавляют этилацетат и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(5–бром–6–фториндазол–2–ил)–2–метилпропан–2–ола.
Стадия 2
Методику стадий 1–5 из Примера 41 проводят с применением 1–(5–бром–6–фториндазол–2–ил)–2–метилпропан–2–ола, полученного на стадии 1 выше, вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 160: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(1–этил–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–1–этил–6–фторбензотриазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 161: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
1–(2,3–Дифтор–6–нитроанилино)–2–метилпропан–2–ол (6,20 г) растворяют в ДМФ (84,0 мл). При комнатной температуре туда добавляют NBS (5,80 г), затем перемешивают при 90°C в течение 1 часа. Туда добавляют этилацетат, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(4–бром–2,3–дифтор–6–нитроанилино)–2–метилпропан–2–ола.
Стадия 2
1–(4–Бром–2,3–дифтор–6–нитроанилино)–2–метилпропан–2–ол (5,67 г), полученный на стадии 1 выше, растворяют в этаноле (87,2 мл). При комнатной температуре туда добавляют хлорид аммония (5,67 г), железо (5,67 г) и воду (87,2 мл), затем перемешивают при 60°C в течение ночи. Реакционную смесь пропускают через Целит и промывают этилацетатом. Фильтрат концентрируют в вакууме, туда добавляют этилацетат, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(6–амино–4–бром–2,3–дифторанилино)–2–метилпропан–2–ола.
Стадия 3
1–(6–Амино–4–бром–2,3–дифторанилино)–2–метилпропан–2–ол (4,36 г), полученный на стадии 2 выше, растворяют в воде (28,4 мл) и ТГФ (28,4 мл). При 0°C туда добавляют 12 N хлористоводородную кислоту (28,4 мл) и нитрит натрия (1,80 г) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ола.
Стадия 4
Трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (50 мг), полученный на стадии 3 Примера 41, и 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ол (39,9 мг), полученный на стадии 3 выше, растворяют в 1,4–диоксане (0,50 мл). При комнатной температуре туда добавляют Pd(dba)2 (2,50 мг), X–phos (4,14 мг) и трикалийфосфат (55,3 мг) и смесь перемешивают в микроволновом реакторе при 125°C в течение 1 часа. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 5
Трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (55,0 мг), полученный на стадии 4 выше, растворяют в MeOH (1,0 мл). При комнатной температуре туда добавляют 12 N хлористоводородную кислоту (1,0 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют 2 N водный раствор гидроксида натрия (6,00 мл) и хлороформ, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 162: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамат (100 мг), полученный на стадии 1 из Примера 37, и 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ол (85,8 мг), полученный на стадии 3 из Примера 161, растворяют в 1,4–диоксане (0,934 мл). При комнатной температуре туда добавляют Pd(dba)2 (5,37 мг), X–phos (8,90 мг) и трикалийфосфат (119 мг) и смесь перемешивают в микроволновом реакторе при 125°C в течение 1 часа. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензоил]пирролидин–3–ил]карбамат (99,8 мг), полученный на стадии 1 выше, растворяют в MeOH (1,0 мл). При комнатной температуре туда добавляют 12 N хлористоводородную кислоту (1,0 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Затем туда добавляют 2 N водный раствор гидроксида натрия (6,00 мл) и хлороформ, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 163: Синтез 2'',3–дифтор–4''–(2–метоксиэтил)–5'–(пиперазин–1–карбонил)–[1,1':2',1''–терфенил]–4–карбонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутилпиперазин–1–карбоксилата вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 164: Синтез (R)–5'–(3–аминопиперидин–1–карбонил)–2'',3–дифтор–4''–(2–метоксиэтил)–[1,1':2',1''–терфенил]–4–карбонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-N–[(3R)–3–пиперидил]карбамата вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 165: Синтез 5'–(4–аминоазепан–1–карбонил)–2'',3–дифтор–4''–(2–метоксиэтил)–[1,1':2',1''–терфенил]–4–карбонитрила
Методику стадий 1–4 из Примера 22 проводят с применением трет–бутил-N–(азепан–4–ил)карбамата вместо трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 166: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'',3–дифтор–4''–(2–гидрокси–2–метилпропил)–[1,1':2',1''–терфенил]–4–карбонитрила–изомер–B
Стадия 1
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (500 мг), полученный на стадии 1 из Примера 41, и 1–(4–бром–3–фторфенил)–2–метилпропан–2–ол (379 мг), полученный на стадии 1 из Примера 28, растворяют в 1,4–диоксане (5,9 мл). При комнатной температуре туда добавляют Pd(dba)2 (68 мг), X–phos (113 мг) и трикалийфосфат (752 мг), затем перемешивают при 100°C в течение ночи. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоата.
Стадия 2
Трет–бутил-3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоат (300 мг), полученный на стадии 1 выше, растворяют в ТГФ (0,9 мл). При 0°C туда добавляют 12 N хлористоводородную кислоту (0,9 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Затем туда добавляют МТБЭ, смесь промывают водой и сушат над безводным сульфатом натрия и растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензойной кислоты.
Стадия 3
3–(4–Циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензойную кислоту (10 мг), полученную на стадии 2 выше, и гидрохлорид N–((1R,2R,4S)–рел–7–азабицикло[2.2,1]гептан–2–ил)–2,4–динитробензолсульфонамида–изомер–B (10,2 мг), полученный на стадии 3 из Примера 155, растворяют в ТГФ (0,12 мл). При комнатной температуре туда добавляют ТЭА (0,014 мл) и ГАТУ (18,7 мг), затем перемешивают при 50°C в течение 1 часа. Реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением N–[(1S,3R,4R)–рел–7–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида–изомер–B.
Стадия 4
N–[(1S,3R,4R)–Рел–7–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамид–изомер–B (15 мг), полученный на стадии 3 выше, растворяют в ДХМ (0,2 мл). При 0°C туда добавляют меркаптоуксусную кислоту (2 мкл) и ТЭА (8,6 мкл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 167: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(6,7–дифтор–1–метил–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамат (60 мг), полученный на стадии 1 из Примера 37, и 5–бром–6,7–дифтор–1–метилбензотриазол (41,7 мг) растворяют в 1,4–диоксане (0,56 мл). При комнатной температуре туда добавляют Pd(dba)2 (3,22 мг), X–phos (5,34 мг) и трикалийфосфат (71,4 мг) и смесь перемешивают в микроволновом реакторе при 125°C в течение 1 часа. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(6,7–дифтор–1–метилбензотриазол–5–ил)бензоил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(6,7–дифтор–1–метилбензотриазол–5–ил)бензоил]пирролидин–3–ил]карбамат (20 мг), полученный на стадии 1 выше, растворяют в ТФК (0,40 мл) с последующим перемешиванием при комнатной температуре в течение 5 минут. После подтверждения завершения реакции ЖХМС туда добавляют ДМСО (1,60 мл) и очистку проводят ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 168: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(6–фтор–1–пропил–1H–бензо[d][1.2.3]триазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 41 проводят с применением 5–бром–6–фтор–1–пропилбензотриазола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 169: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(6,7–дифтор–1–(2–метоксиэтил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
Методику стадий 1–3 из Примера 161 проводят с применением 2,3–дифтор–N–(2–метоксиэтил)–6–нитроанилина вместо 1–(2,3–дифтор–6–нитроанилино)–2–метилпропан–2–ола с получением 5–бром–6,7–дифтор–1–(2–метоксиэтил)бензотриазола.
Стадия 2
Методику стадий 1–3 из Примера 37 проводят с применением 5–бром–6,7–дифтор–1–(2–метоксиэтил)бензотриазола, полученного на стадии 1 выше, вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 170: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидроксиэтил)–1H–индол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 2–(5–бром–6–фтор–индол–1–ил)этанола вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 171: Синтез 5'–((1R,2R,4S)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1'–бифенил]–4–карбонитрила–изомер–B
Стадия 1
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (2,3 г), полученный на стадии 1 из Примера 41, и 1–(5–бром–6–фториндол–1–ил)–2–метилпропан–2–ол (2,02 г), полученный на стадии 1 из Примера 136, растворяют в 1,4–диоксане (18,1 мл). При комнатной температуре туда добавляют Pd(dba)2 (250 мг), X–phos (414 мг) и трикалийфосфат (3,46 г), затем перемешивают при 100°C в течение ночи. Растворитель отгоняют, остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. Остаток растворяют в ТГФ (40,0 мл). При 0°C туда добавляют 12 N хлористоводородную кислоту (30,0 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Затем туда добавляют МТБЭ, смесь промывают водой и сушат над безводным сульфатом натрия и растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойной кислоты.
Стадия 2
3–(4–Циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойную кислоту (8 мг), полученную на стадии 1 выше, и гидрохлорид N–((1R,2R,4S)–рел–7–азабицикло[2.2,1]гептан–2–ил)–2,4–динитробензолсульфонамида–изомер–B (7,47 мг), полученный на стадии 3 из Примера 155, растворяют в ТГФ (0,30 мл). При комнатной температуре туда добавляют ТЭА (0,00748 мл) и ГАТУ (13,6 мг), затем перемешивают при 50°C в течение 1 часа. Реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением N–[(1S,3R,4R)–рел–7–[3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида–изомер–B.
Стадия 3
N–[(1S,3R,4R)–Рел–7–[3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамид–изомер–B (13,8 мг), полученный на стадии 2 выше, растворяют в ДХМ (1,0 мл). При 0°C туда добавляют меркаптоуксусную кислоту (2,49 мкл) и ТЭА (7,48 мкл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют хлороформ и 4 N гидроксид натрия, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 172: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
5–Бром–6,7–дифтор–1H–индол (300 мг) растворяют в ДМФ (4,31 мл). При комнатной температуре туда добавляют карбонат цезия (843 мг) и 2,2–диметилоксиран (0,230 мл), затем перемешивают при 80°C в течение 3 часов. Реакционную смесь фильтруют, и растворитель отгоняют. Туда добавляют этилацетат, смесь промывают последовательно насыщенным водным раствором хлорида аммония, водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола.
Стадия 2
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (210 мг), полученный на стадии 1 из Примера 41, и 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ол (196 мг), полученный на стадии 1 выше, растворяют в 1,4–диоксане (1,65 мл). При комнатной температуре туда добавляют Pd(dba)2 (22,8 мг), X–phos (37,8 мг) и трикалийфосфат (316 мг), затем перемешивают при 100°C в течение ночи. Растворитель отгоняют, остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. Остаток растворяют в ТГФ (2,63 мл). При 0°C туда добавляют 12 N хлористоводородную кислоту (2,1 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют МТБЭ, смесь промывают водой и сушат над безводным сульфатом натрия и растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойной кислоты.
Стадия 3
3–(4–Циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойную кислоту (30 мг), полученную на стадии 2 выше, и трет–бутил-N–[(3S)–пирролидин–3–ил]карбамат (13,2 мг) растворяют в ТГФ (0,323 мл). При комнатной температуре туда добавляют ТЭА (0,027 мл) и ГАТУ (49,1 мг), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензоил]пирролидин–3–ил]карбамата.
Стадия 4
Трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензоил]пирролидин–3–ил]карбамат (40 мг), полученный на стадии 3 выше, растворяют в MeOH (0,80 мл). При комнатной температуре туда добавляют 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,80 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют хлороформ и 2 N водный раствор гидроксида натрия (1,6 мл), смесь промывают водой и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 173: Синтез 5'–(7–амино–2–азабицикло[2.2,1]гептан–2–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1'–бифенил]–4–карбонитрила
3–(4–Циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойную кислоту (8 мг), полученную на стадии 1 из Примера 171, растворяют в ТГФ (0,3 мл). При комнатной температуре туда добавляют трет–бутил-N–(3–азабицикло[2.2,1]гептан–7–ил)карбамат (3,80 мг), ТЭА (0,0075 мл) и ГАТУ (13,6 мг), затем перемешивают при 50°C в течение 3 часов. После подтверждения завершения реакции ЖХМС, реакционную смесь концентрируют. ТФК (0,20 мл) добавляют к остатку с последующим перемешиванием при комнатной температуре в течение 5 минут. После подтверждения завершения реакции ЖХМС, ДМСО (0,8 мл) добавляют в реакционную смесь и очистку проводят ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 174: Синтез 5'–(7–амино–2–азабицикло[2.2,1]гептан–2–карбонил)–2'',3–дифтор–4''–(2–гидрокси–2–метилпропил)–[1,1':2',1''–терфенил]–4–карбонитрила
Стадия 1
3–(4–Циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензойную кислоту (100 мг), полученную на стадии 2 из Примера 166, растворяют в ТГФ (0,982 мл). При комнатной температуре туда добавляют трет–бутил-N–(3–азабицикло[2.2,1]гептан–7–ил)карбамат (52,1 мг), ТЭА (0,103 мл) и ГАТУ (187 мг), затем перемешивают при 50°C в течение 3 часов. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[3–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]–3–азабицикло[2.2,1]гептан–7–ил]карбамата.
Стадия 2
Трет–бутил-N–[3–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]–3–азабицикло[2.2,1]гептан–7–ил]карбамат (30 мг), полученный на стадии 1 выше, растворяют в MeOH (0,5 мл). При комнатной температуре туда добавляют 12 N хлористоводородную кислоту (0,5 мл). Затем смесь перемешивают при комнатной температуре в течение 0,5 часа, туда добавляют воду и 2 N водный раствор гидроксида натрия (3,0 мл). Смесь экстрагируют хлороформом и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 175: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(6,7–дифтор–1–метил–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–B
Стадия 1
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (90 мг), полученный на стадии 1 из Примера 41, и 5–бром–6,7–дифтор–1–метилбензотриазол (68,6 мг) растворяют в 1,4–диоксане (0,71 мл). При комнатной температуре туда добавляют Pd(dba)2 (9,8 мг), X–phos (16 мг) и трикалийфосфат (135 мг), затем перемешивают при 100°C в течение ночи. Растворитель отгоняют, остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. Остаток растворяют в ТФК (1,0 мл), с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют МТБЭ, смесь промывают водой и сушат над безводным сульфатом натрия и растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–(6,7–дифтор–1–метил–бензотриазол–5–ил)бензойной кислоты.
Стадия 2
3–(4–Циано–3–фторфенил)–4–(6,7–дифтор–1–метилбензотриазол–5–ил)бензойную кислоту (30 мг), полученную на стадии 1 выше, и гидрохлорид N–((1R,2R,4S)–рел–7–азабицикло[2.2,1]гептан–2–ил)–2,4–динитробензолсульфонамида–изомер–B (30,6 мг), полученный на стадии 3 из Примера 155, растворяют в ТГФ (0,367 мл). При комнатной температуре туда добавляют ТЭА (0,042 мл) и ГАТУ (55,9 мг), затем перемешивают при 50°C в течение 1 часа. Реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением N–[(1R,3S,4S)–рел–7–[3–(4–циано–3–фторфенил)–4–(6,7–дифтор–1–метилбензотриазол–5–ил)бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида–изомер–B.
Стадия 3
N–[(1R,3S,4S)–рел–7–[3–(4–циано–3–фторфенил)–4–(6,7–дифтор–1–метилбензотриазол–5–ил)бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамид–изомер–B (51 мг), полученный на стадии 2 выше, растворяют в ДХМ (0,70 мл). При 0°C туда добавляют меркаптоуксусную кислоту (5,8 мкл) и ТЭА (29,1 мкл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 176: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила–изомер–B
Стадия 1
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (2,3 г), полученный на стадии 1 из Примера 41, и 1–(5–бром–6–фтор–1H–индазол–1–ил)–2–метилпропан–2–ол (2,03 г), полученный на стадии 1 из Примера 142, растворяют в 1,4–диоксане (18,7 мл). При комнатной температуре туда добавляют Pd(dba)2 (250 мг), X–phos (414 мг) и трикалийфосфат (3,46 г), затем перемешивают при 100°C в течение ночи. Растворитель отгоняют, остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. Остаток растворяют в ТГФ (10,0 мл). При 0°C туда добавляют 12 N хлористоводородную кислоту (10,0 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют МТБЭ, смесь промывают водой и сушат над безводным сульфатом натрия и растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индазол–5–ил]бензойной кислоты.
Стадия 2
3–(4–Циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индазол–5–ил]бензойную кислоту (30 мг), полученную на стадии 1 выше, и гидрохлорид N–((1R,2R,4S)–рел–7–азабицикло[2.2,1]гептан–2–ил)–2,4–динитробензолсульфонамида–изомер–B (27,9 мг), полученный на стадии 3 из Примера 155, растворяют в ТГФ (0,34 мл). При комнатной температуре туда добавляют ТЭА (0,038 мл) и ГАТУ (51,0 мг), затем перемешивают при 50°C в течение 1 часа. Реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением N–[(1S,3R,4R)–рел–7–[3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индазол–5–ил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида–изомер–B.
Стадия 3
N–[(1S,3R,4R)–Рел–7–[3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индазол–5–ил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамид–изомер–B (45 мг), полученный на стадии 2 выше, растворяют в ДХМ (0,58 мл). При 0°C туда добавляют меркаптоуксусную кислоту (4,9 мкл) и ТЭА (24 мкл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 177: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–B
Стадия 1
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (3,2 г), полученный на стадии 1 из Примера 41, и 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ол (3,01 г), полученный на стадии 3 из Примера 161, растворяют в 1,4–диоксане (25,2 мл). При комнатной температуре туда добавляют Pd(dba)2 (348 мг), X–phos (577 мг) и трикалийфосфат (4,81 г), затем перемешивают при 100°C в течение ночи. Растворитель отгоняют, остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. Остаток растворяют в ТГФ (15,0 мл). При 0°C туда добавляют 12 N хлористоводородную кислоту (15,0 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют МТБЭ, смесь промывают водой и сушат над безводным сульфатом натрия и растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензойной кислоты.
Стадия 2
3–(4–Циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензойную кислоту (30 мг), полученную на стадии 1 выше, и гидрохлорид N–((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)–2,4–динитробензолсульфонамида–изомер–B (26,8 мг) полученный на стадии 3 из Примера 155, растворяют в ТГФ (0,33 мл). При комнатной температуре туда добавляют ТЭА (0,037 мл) и ГАТУ (48,9 мг), затем перемешивают при 50°C в течение 1 часа. Реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением N–[(1S,2S,4R)–рел–7–[3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида–изомер–B.
Стадия 3
N–[(1S,2S,4R)–Рел–7–[3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамид–изомер–B (43 мг), полученный на стадии 2 выше, растворяют в ДХМ (0,54 мл). При 0°C туда добавляют меркаптоуксусную кислоту (4,5 мкл) и ТЭА (22,7 мкл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 178: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(3–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
Методику стадий 1–4 из Примера 41 проводят с применением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 из Примера 142, вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением трет–бутил-N–((3–эндо)–8–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил–[1,1'–бифенил]–3–карбонил)–8–азабицикло[3.2.1]октан–3–ил)карбамата.
Стадия 2
Трет–бутил-N–((3–эндо)–8–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил–[1,1'–бифенил]–3–карбонил)–8–азабицикло[3.2.1]октан–3–ил)карбамат (10 мг), полученный на стадии 1 выше, растворяют в ДМФ (0,076 мл). Туда добавляют NBS (3,5 мг), затем перемешивают при 80°C в течение ночи. Реакционную смесь разбавляют ДМСО до 1 мл и очистку проводят ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 179: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(5–фтор–3–метилбензо[d]изоксазол–6–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
3–Бром–4–фторфенол (5 г) растворяют в дихлорметане (114 мл). При 0°C туда добавляют ТЭА (5,5 мл) и ацетилхлорид (2,8 мл) по каплям. Реакционную смесь перемешивают при 20°C в течение 30 минут и разбавляют дихлорметаном (100 мл). Полученный продукт промывают 0,5 N хлористоводородной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, и растворитель отгоняют с получением 3–бром–4–фторфенилацетата.
Стадия 2
Комплекс трифторида бора–уксусной кислоты (53 мл) добавляют к 3–бром–4–фторфенилацетату (6,2 г), полученному на стадии 1 выше, затем перемешивают при 155°C в течение 14 часов. Реакционную смесь охлаждают до 0°C и туда добавляют лед. Осадок собирают фильтрацией, промывают водой при 0°C и сушат. Полученное твердое вещество очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(4–бром–5–фтор–2–гидроксифенил)этанона.
Стадия 3
MeOH (30 мл) добавляют к 1–(4–бром–5–фтор–2–гидроксифенил)этанону (2,16 г), полученному на стадии 2 выше, гидрохлориду гидроксиламина (1,29 г) и ацетату натрия (1,14 г), затем перемешивают при 60°C в течение 1 часа. Ледяную воду добавляют в реакционную смесь, и осадок собирают фильтрацией, промывают водой и сушат. Полученное твердое вещество растворяют в ТГФ (31 мл) и туда добавляют ТЭА (1,68 мл) и N, N'–карбонилдиимидазол (1,65 г), затем перемешивают при 70°C в течение 1 часа. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/этилацетат) с получением 6–бром–5–фтор–3–метилбензо[d]изоксазола.
Стадия 4
Методику стадий 1–5 из Примера 41 проводят с применением 6–бром–5–фтор–3–метилбензо[d]изоксазола, полученного на стадии 3 выше, вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 180: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–3–фтор–2'–(5–фтор–3–метилбензо[d]изоксазол–6–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–3 из Примера 37 проводят с применением 6–бром–5–фтор–3–метилбензо[d]изоксазола, полученного на стадии 3 из Примера 179, вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 181: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–3–метил–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрил
Стадия 1
Трет–бутил-N–((3–эндо)–8–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил–[1,1'–бифенил]–3–карбонил)–8–азабицикло[3.2.1]октан–3–ил)карбамат (69 мг), полученный на стадии 1 из Примера 178, растворяют в ДМФ (0,53 мл) и туда добавляют NBS (38 мг), затем перемешивают при 80°C в течение ночи. Смесь охлаждают до комнатной температуры и туда добавляют Boc2O (200 мг) и ДМАП (1 мг) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют этилацетат и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Растворитель отгоняют и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-((3–эндо)–8–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–3–карбонил)–8–азабицикло[3.2.1]октан–3–ил)карбамата.
Стадия 2
Трет–бутил-((3–эндо)–8–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–3–карбонил)–8–азабицикло[3.2.1]октан–3–ил)карбамат (15 мг), полученный на стадии 1 выше, триметилбороксин (7,7 мг), PdCl2(dppf)CH2Cl2 (1 мг) и карбонат цезия (20 мг) суспендируют в 1,4–диоксане, затем перемешивают при 125°C в течение 30 минут при микроволновом облучении. Растворитель отгоняют и к остатку добавляют трифторуксусную кислоту (0,2 мл) с последующим перемешиванием при комнатной температуре в течение 10 минут. Реакционную смесь разбавляют ДМСО до 1 мл и очистку проводят ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 182: Синтез 5'–((1R,2S,4S)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'',3–дифтор–4''–(2–гидрокси–2–метилпропил)–[1,1':2',1''–терфенил]–4–карбонитрила
Стадия 1
Трет–бутил-(1S,3S,4R)–рел–3–амино–7–азабицикло[2.2,1]гептан–7–карбоксилат (919 мг) растворяют в ТГФ (14,4 мл). При 0°C туда добавляют ТЭА (1,81 мл) и хлорид 2,4–динитробензолсульфонила (1,73 г) с последующим перемешиванием при комнатной температуре в течение ночи. Туда добавляют этилацетат, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-(1S,3S,4R)–рел–3–[(2,4–динитрофенил)сульфониламино]–7–азабицикло[2.2,1]гептан–7–карбоксилата.
Стадия 2
Трет–бутил-(1S,3S,4R)–рел–3–[(2,4–динитрофенил)сульфониламино]–7–азабицикло[2.2,1]гептан–7–карбоксилат (100 мг), полученный на стадии 1 выше, растворяют в этилацетате (1,00 мл). При комнатной температуре туда добавляют 4 N раствор хлористоводородной кислоты–этилацетата (2,00 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Реакционную смесь концентрируют в вакууме с получением гидрохлорида N–[(1S,3S,4R)–рел–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида.
Стадия 3
3–(4–Циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензойную кислоту (30 мг), полученную на стадии 2 из Примера 166, и гидрохлорид N–[(1S,3S,4R)–рел–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида (30,7 мг), полученный на стадии 2 выше, растворяют в ТГФ (0,40 мл). При комнатной температуре туда добавляют ТЭА (0,0420 мл) и ГАТУ (56,0 мг), затем перемешивают при 50°C в течение 1 часа. Реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением N–[(1S,3S,4R)–рел–7–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида.
Стадия 4
N–[(1S,3S,4R)–Рел–7–[3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензоил]–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамид (55 мг), полученный на стадии 3 выше, растворяют в ДХМ (0,752 мл). При 0°C туда добавляют меркаптоуксусную кислоту (6,27 мкл) и ТЭА (31,4 мкл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют хлороформ, смесь промывают 4 N водным раствором гидроксида натрия и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 183: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
3–(4–Циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойную кислоту (30 мг), полученную на стадии 2 из Примера 172, и трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамат (16,1 мг) растворяют в ТГФ (0,323 мл). При комнатной температуре туда добавляют ТЭА (0,027 мл) и ГАТУ (49,1 мг), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамат (42 мг), полученный на стадии 1 выше, растворяют в MeOH (0,84 мл). При комнатной температуре туда добавляют 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,84 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют хлороформ и 2 N водный раствор гидроксида натрия (1,68 мл), смесь промывают водой и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 184: Синтез 5'–((1R,2S,4S)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–3 из Примера 171 проводят с применением гидрохлорида N–[(1R,2S,4S)–рел–7–азабицикло[2.2,1]гептан–3–ил]–2,4–динитробензолсульфонамида, полученного на стадии 2 из Примера 182, вместо гидрохлорида N–((1R,2R,4S)–рел–7–азабицикло[2.2,1]гептан–2–ил)–2,4–динитробензолсульфонамида–изомер–B с получением указанного в заголовке соединения.
Пример 185: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(6,7–дифтор–1–метил–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 3–4 из Примера 172 проводят с применением 3–(4–циано–3–фторфенил)–4–(6,7–дифтор–1–метилбензотриазол–5–ил)бензойной кислоты, полученной на стадии 1 Примера 175, вместо 3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойной кислоты и с применением гидрохлорида трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 186: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–7–метокси–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
5–Бром–2,3,4–трифторбензальдегид (480 мг) растворяют в 1,2–диметоксиэтане (4,8 мл). При комнатной температуре туда добавляют моногидрат гидразина (7,68 мл), затем перемешивают при 80°C в течение 5 часов. Туда добавляют этилацетат, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 5–бром–6,7–дифтор–1H–индазола.
Стадия 2
5–Бром–6,7–дифтор–1H–индазол (97 мг), полученный на стадии 1 выше, растворяют в ДМФ (1,38 мл). При комнатной температуре туда добавляют метанол (0,1 мл), карбонат цезия (271 мг), 2,2–диметилоксиран (0,074 мл), затем перемешивают при 80°C в течение 1 часа. Туда добавляют этилацетат, смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(5–бром–6–фтор–7–метокси–индазол–1–ил)–2–метилпропан–2–ола.
Стадия 3
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (45,0 мг), полученный на стадии 1 из Примера 41, и 1–(5–бром–6–фтор–7–метоксииндазол–1–ил)–2–метилпропан–2–ол (43,8 мг), полученный на стадии 2 выше, растворяют в 1,4–диоксане (0,50 мл). При комнатной температуре туда добавляют Pd(dba)2 (4,89 мг), X–phos (8,11 мг) и трикалийфосфат (67,7 мг), затем перемешивают при 100°C в течение ночи. Растворитель отгоняют, остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. Остаток растворяют в ТГФ (0,45 мл). При 0°C туда добавляют 12 N хлористоводородную кислоту (0,56 мл) с последующим перемешиванием при комнатной температуре в течение 2 часов. Туда добавляют МТБЭ и смесь промывают водой и сушат над безводным сульфатом натрия. Затем растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)–7–метоксииндазол–5–ил]бензойной кислоты.
Стадия 4
Методику стадий 3–4 из Примера 172 проводят с применением 3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)–7–метоксииндазол–5–ил]бензойной кислоты, полученной на стадии 3 выше, вместо 3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойной кислоты и с применением трет–бутил-((3–эндо)–8–азабицикло[3.2.1]октан–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 187: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
5–Бром–6,7–дифтор–1H–индазол (101 мг), полученный на стадии 1 из Примера 186, растворяют в ДМФ (1,44 мл). При комнатной температуре туда добавляют карбонат цезия (283 мг) и 2,2–диметилоксиран (0,077 мл), затем перемешивают при 80°C в течение ночи. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(5–бром–6,7–дифториндазол–1–ил)–2–метилпропан–2–ола.
Стадия 2
Методику стадий 2–4 из Примера 172 проводят с применением 1–(5–бром–6,7–дифториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 выше, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 188: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 2–4 из Примера 172 проводят с применением 1–(5–бром–6,7–дифториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 из Примера 187, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола и с применением трет–бутил-((3–эндо)–8–азабицикло[3.2.1]октан–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 189: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 2–4 из Примера 172 проводят с применением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 из Примера 142, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола и с применением гидрохлорида трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 190: Синтез (S)–5'–(3–амино–3–метилпирролидин–1–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 2–4 из Примера 172 проводят с применением 1–(5–бром–6–фториндол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 из Примера 136, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола и с применением трет–бутил-(S)–(3–метилпирролидин–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 191: Синтез (S)–5'–(3–амино–3–метилпирролидин–1–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 3–4 из Примера 172 проводят с применением 3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензойной кислоты, полученной на стадии 1 из Примера 177, вместо 3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойной кислоты и с применением трет–бутил-(S)–(3–метилпирролидин–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 192: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 3–4 из Примера 172 проводят с применением 3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензойной кислоты, полученной на стадии 1 из Примера 177, вместо 3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойной кислоты и с применением гидрохлорида трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 193: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'',3–дифтор–4''–(2–гидрокси–2–метилпропил)–[1,1':2',1''–терфенил]–4–карбонитрила
Методику стадий 3–4 из Примера 172 проводят с применением 3–(4–циано–3–фторфенил)–4–[2–фтор–4–(2–гидрокси–2–метилпропил)фенил]бензойной кислоты, полученной на стадии 2 из Примера 166, вместо 3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойной кислоты и с применением гидрохлорида трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 194: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(6–фтор–1–(3–гидрокси–3–метилбутил)–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
5–Бром–6–фтор–1H–индазол (200 мг) растворяют в ДМФ (3,1 мл). При комнатной температуре туда добавляют карбонат цезия (606 мг) и 3–гидрокси–3–метилбутиловый эфир 4–метилбензолсульфоновой кислоты (481 мг), затем перемешивают при 90°C в течение 16 часов. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 4–(5–бром–6–фториндазол–1–ил)–2–метилбутан–2–ола.
Стадия 2
Методику стадий 2–4 из Примера 172 проводят с применением 4–(5–бром–6–фториндазол–1–ил)–2–метилбутан–2–ола, полученного на стадии 1 выше, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола и с применением трет–бутил-((3–эндо)–8–азабицикло[3.2.1]октан–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 195: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 2–4 из Примера 172 проводят с применением 1–(5–бром–6,7–дифториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 из Примера 187, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола и с применением гидрохлорида трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 196: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–4 из Примера 172 проводят с применением гидрохлорида трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 197: Синтез (S)–5'–(3–амино–3–метилпирролидин–1–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 2–4 из Примера 172 проводят с применением 1–(5–бром–6,7–дифториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 из Примера 187, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола и с применением трет–бутил-(S)–(3–метилпирролидин–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 198: Синтез (S)–5'–(3–амино–3–метилпирролидин–1–карбонил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–4 из Примера 172 проводят с применением трет–бутил-(S)–(3–метилпирролидин–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 199: Синтез 3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–5'–(2,7–диазаспиро[3.4]октан–6–карбонил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 2–4 из Примера 172 проводят с применением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 из Примера 142, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола и с применением трет–бутил-2,7–диазаспиро[3.4]октан–2–карбоксилата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 200: Синтез 2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–3–фтор–5'–(2,7–диазаспиро[3.4]октан–6–карбонил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–4 из Примера 172 проводят с применением трет–бутил-2,7–диазаспиро[3.4]октан–2–карбоксилата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 201: Синтез 2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–3–фтор–5'–(2,8–диазаспиро[3.5]нонан–2–карбонил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–4 из Примера 172 проводят с применением трет–бутил-2,8–диазаспиро[3.5]нонан–6–карбоксилата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 202: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–3–фтор–2'–(5–фтор–3–метилбензо[d]изоксазол–6–ил)–[1,1'–бифенил]–4–карбонитрила–изомер–X
Стадия 1
Гидрохлорид трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата (36 мг) растворяют в ДХМ (2,89 мл). При комнатной температуре туда добавляют ТЭА (40 мкл) и бензилхлорформиат (25 мкл), затем перемешивают при комнатной температуре в течение 1 часа. Растворитель отгоняют и туда добавляют хлороформ и воду. Смесь экстрагируют дважды хлороформом и промывают водой и насыщенным раствором соли. Растворитель отгоняют и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением бензил (1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбоксилата.
Бензил (1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбоксилат получают в виде 10 мг/мл раствора в этаноле, и разделение проводят в следующих условиях.
Изомер, имеющий более короткое время удержания, обозначают как “изомер–X”, и изомер, имеющий более длительное время удержания, обозначают как “изомер–Y”.
Колонка: Daicel CHIRALPAK IC 2,0×25 см
Подвижная фаза: гексан/2–пропанол=85/15
Скорость потока: 12,5 мл/мин
Время удержания каждого изомера:
бензил (1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбоксилат–изомер–X: 16,93 минут
бензил (1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбоксилат–изомер–Y: 23,82 минут.
Условия хирального анализа:
Колонка: CHIRALPAK IC 4,6×150 мм
Подвижная фаза: гексан/2–пропанол=85/15
Скорость потока: 1,0 мл/мин
Время удержания каждого изомера:
бензил (1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбоксилат–изомер–X: 6,972 минут
бензил (1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбоксилат–изомер–Y: 9,895 минут.
Стадия 2
Бензил (1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбоксилат–изомер–X (93 г), полученный на стадии 1 выше, и 10% Pd/C (10 г) суспендируют в метаноле (1,0 л). Смесь перемешивают при комнатной температуре в течение 5 часов в атмосфере водорода (50 ф/д2). Реакционную смесь фильтруют, и фильтрат концентрируют с получением трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X.
Методику стадий 2–4 из Примера 172 проводят с применением 6–бром–5–фтор–3–метилбензо[d]изоксазола, полученного на стадии 3 из Примера 179, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола и с применением трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X, полученного на стадии 2 выше, вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 203: Синтез 2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–3–фтор–5'–(октагидропирроло[3,4–c]пиррол–2–карбонил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–4 из Примера 172 проводят с применением трет–бутилгексагидропирроло[3,4–c]пиррол–2(1H)–карбоксилата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 204: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(1–(2–этил–2–гидроксибутил)–6–фтор–1H–индазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
5–Бром–6–фтор–1H–индазол (300 мг) растворяют в ДМФ (4,65 мл). При комнатной температуре туда добавляют карбонат цезия (90,9 мг) и 2,2–диэтилоксиран (0,20 мл), затем перемешивают при 90°C в течение 16 часов. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 3–[(5–бром–6–фториндазол–1–ил)метил]пентан–3–ола.
Стадия 2
Методику стадий 2–4 из Примера 172 проводят с применением 3–[(5–бром–6–фториндазол–1–ил)метил]пентан–3–ола, полученного на стадии 1 выше, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 205: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(1–(2–этил–2–гидроксибутил)–6–фтор–1H–индазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 2–4 из Примера 172 проводят с применением 3–[(5–бром–6–фториндазол–1–ил)метил]пентан–3–ола, полученного на стадии 1 из Примера 204, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола и с применением трет–бутил-((3–эндо)–8–азабицикло[3.2.1]октан–3–ил)карбамата вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 206: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(1–(2–этил–2–гидроксибутил)–6–фтор–1H–индазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику стадий 2–4 из Примера 172 проводят с применением 3–[(5–бром–6–фториндазол–1–ил)метил]пентан–3–ола, полученного на стадии 1 из Примера 204, вместо 1–(5–бром–6,7–дифториндол–1–ил)–2–метилпропан–2–ола и с применением трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X, полученного на стадии 2 из Примера 202, вместо трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 207: Синтез 2–(5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1H–индол–1–ил)уксусной кислоты–изомер–X
Стадия 1
5–Бром–6–фтор–1H–индол (500 мг) растворяют в ДМФ (7,79 мл). При комнатной температуре туда добавляют карбонат цезия (1,67 г) и этил-2–хлорацетат (573 мг), затем перемешивают при 90°C в течение 16 часов. Реакцию заканчивают насыщенным водным раствором хлорида аммония. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением этил-2–(5–бром–6–фториндол–1–ил)ацетата.
Стадия 2
3–(4–Циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензойную кислоту (2 г), полученную на стадии 2 из Примера 41, и трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (1,24 г), полученный на стадии 2 из Примера 202, растворяют в ТГФ (21,8 мл). При комнатной температуре туда добавляют ТЭА (1,52 мл) и ГАТУ (2,28 г), затем перемешивают при 50°C в течение 1 часа. Реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X.
Стадия 3
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (100 мг), полученный на стадии 2 выше, и этил-2–(5–бром–6–фториндол–1–ил)ацетат (69,5 мг), полученный на стадии 1 выше, суспендируют в 1,4–диоксане (0,59 мл). При комнатной температуре туда добавляют Pd(dba)2 (8,2 мг), X–phos (13,6 мг) и трикалийфосфат (113 мг), затем дегазируют и замещают азотом. В атмосфере азота перемешивают при внешней температуре 100°C в течение ночи. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол). Остаток растворяют в MeOH (1,0 мл) и туда добавляют 5 N водный раствор гидроксида натрия (1,0 мл) с последующим перемешиванием в течение 1 часа. Туда добавляют МТБЭ и водный слой экстрагируют. Водный слой подкисляют хлористоводородной кислотой, туда добавляют МТБЭ и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют с получением 2–(5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил–6–фтор–1H–индол–1–ил)уксусной кислоты–изомер–X.
Стадия 4
Ацетонитрил (1,0 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (1,0 мл) добавляют к 2–(5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил–6–фтор–1H–индол–1–ил)уксусной кислоте–изомер–X (10 мг), полученному на стадии 3 выше, с последующим перемешиванием в течение 30 минут. Растворитель отгоняют, и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 208: Синтез 2–(4'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–4''–циано–2,3''–дифтор–[1,1':2',1''–терфенил]–4–ил)уксусной кислоты–изомер–X
Методику стадий 3–4 из Примера 207 проводят с применением метил-2–(4–бром–3–фторфенил)ацетата вместо этил-2–(5–бром–6–фториндол–1–ил)ацетата с получением указанного в заголовке соединения.
Пример 209: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(7–хлор–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Стадия 1
2–Хлор–1,3–дифтор–4–нитробензол (1 г) растворяют в ТГФ (12,9 мл). Туда добавляют ТЭА (1,08 мл) и 1–амино–2–метилпропан–2–ол (0,59 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. Органический слой сушат над сульфатом натрия и растворитель отгоняют с получением 1–(2–хлор–3–фтор–6–нитроанилино)–2–метилпропан–2–ола.
Стадия 2
1–(2–Хлор–3–фтор–6–нитроанилино)–2–метилпропан–2–ол (1,3 г), полученный на стадии 1 выше, растворяют в ДМФ (9,9 мл). При комнатной температуре туда добавляют NBS (1,1 г), затем перемешивают при 90°C в течение 1 часа. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток кристаллизуют из ИПЭ:гексана=1:1 и промывают дважды гексаном с получением 1–(4–бром–2–хлор–3–фтор–6–нитроанилино)–2–метилпропан–2–ола.
Стадия 3
1–(4–Бром–2–хлор–3–фтор–6–нитроанилино)–2–метилпропан–2–ол (1,6 г), полученный на стадии 2 выше, NH4Cl (1,6 г) и железо (0,8 г) суспендируют в EtOH (7,81 мл) и воде (7,81 мл), затем перемешивают при 60°C в течение ночи. Туда добавляют МТБЭ и смесь пропускают через Целит. Туда добавляют МТБЭ и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель затем отгоняют с получением 1–(6–амино–4–бром–2–хлор–3–фторанилино)–2–метилпропан–2–ола.
Стадия 4
1–(6–Амино–4–бром–2–хлор–3–фторанилино)–2–метилпропан–2–ол (352 мг), полученный на стадии 3 выше, растворяют в воде (0,70 мл) и ТГФ (1,76 мл). При 0°C туда добавляют 12 N хлористоводородную кислоту (1,06 мл) и нитрит натрия (водный раствор (0,3 мл), в котором растворен 101 мг нитрита натрия) по каплям с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют МТБЭ и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель затем отгоняют. ИПЭ:гексан=1:1 (68 мл) добавляют к остатку, и целевое соединение собирают фильтрацией и промывают ИПЭ:гексаном=1:1 с получением 1–(5–бром–7–хлор–6–фторбензотриазол–1–ил)–2–метилпропан–2–ола.
Стадия 5
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (50 мг), полученный на стадии 2 из Примера 207, и 1–(5–бром–7–хлор–6–фторбензотриазол–1–ил)–2–метилпропан–2–ол (37,4 мг), полученный на стадии 4 выше, суспендируют в 1,4–диоксане (0,3 мл). При комнатной температуре туда добавляют Pd(dba)2 (4,1 мг), X–phos (6,8 мг) и трикалийфосфат (56,7 мг). После азотного замещения смесь перемешивают при 100°C в течение 2 часов. Туда добавляют этилацетат, и смесь помещают в NH–силикагель и промывают этилацетатом:метанолом=10:1. Растворитель отгоняют, и к остатку добавляют ацетонитрил (1,0 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (1,0 мл) с последующим перемешиванием в течение 10 минут. Растворитель отгоняют, остаток растворяют в ДМСО и очистку проводят ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 210: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(7–хлор–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 211: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(7–хлор–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 212: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–3–карбоновой кислоты–изомер–X
Стадия 1
3–(4–Циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индазол–5–ил]бензойную кислоту (250 мг), полученную на стадии 1 из Примера 176, растворяют в ТГФ (2,24 мл). При комнатной температуре туда добавляют ГАТУ (234 мг), трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (125 мг), полученный на стадии 2 из Примера 202, и ТЭА (0,156 мл), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X.
Стадия 2
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (289 мг), полученный на стадии 1 выше, растворяют в ДМФ (4,50 мл). При комнатной температуре туда добавляют NBS (120 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-((1S,2S,4R)–рел–7–(6–(3–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–4'–циано–3'–фтор–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X.
Стадия 3
Трет–бутил-((1S,2S,4R)–рел–7–(6–(3–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–4'–циано–3'–фтор–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (50 мг), полученный на стадии 2 выше, и PdCl2(PPh3)2 (2,4 мг) суспендируют в NMP (0,5 мл). При комнатной температуре туда добавляют N, N–диэтилэтаноламин (0,046 мл) и после замещения CO смесь перемешивают при 125°C в течение 1 часа. t–BuOH (0,5 мл) и 2 N водный раствор гидроксида натрия (0,25 мл) добавляют к реакционной смеси, затем перемешивают при комнатной температуре в течение 1 часа. Туда добавляют МТБЭ, и водный слой отделяют. Водный слой подкисляют хлористоводородной кислотой и экстрагируют МТБЭ. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Ацетонитрил (0,5 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,5 мл) добавляют к остатку с последующим перемешиванием в течение 10 минут. Реакционную смесь концентрируют, и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 213: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(7–хлор–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
3–(4–Циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензойную кислоту (500 мг), полученную на стадии 2 из Примера 41, и гидрохлорид трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамата (303,5 мг) растворяют в ТГФ (5.45 мл). При комнатной температуре туда добавляют ТЭА (0,379 мл) и ГАТУ (569,5 мг), затем перемешивают при 50°C в течение 1 часа. Реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата.
Стадия 2
Методику стадий 1–5 из Примера 209 проводят с применением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата, полученного на стадии 1 выше, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 214: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(1–(2–этил–2–гидроксибутил)–6,7–дифтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 161 проводят с применением 3–[(2,3–дифтор–6–нитроанилино)метил]пентан–3–ола вместо 1–(2,3–дифтор–6–нитроанилино)–2–метилпропан–2–ола и с применением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X, полученного на стадии 2 из Примера 207, вместо трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 215: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(1–(2–этил–2–гидроксибутил)–6,7–дифтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 161 проводят с применением 3–[(2,3–дифтор–6–нитроанилино)метил]пентан–3–ола вместо 1–(2,3–дифтор–6–нитроанилино)–2–метилпропан–2–ола и с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 216: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(1–(2–этил–2–гидроксибутил)–6,7–дифтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 161 проводят с применением 3–[(2,3–дифтор–6–нитроанилино)метил]пентан–3–ола вместо 1–(2,3–дифтор–6–нитроанилино)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 217: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(1–(2–этил–2–гидроксибутил)–6,7–дифтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 161 проводят с применением 3–[(2,3–дифтор–6–нитроанилино)метил]пентан–3–ола вместо 1–(2,3–дифтор–6–нитроанилино)–2–метилпропан–2–ола и с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата с получением указанного в заголовке соединения.
Пример 218: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(7–хлор–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 209 проводят с применением 3–(аминометил)пентан–3–ола вместо 1–амино–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 219: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(7–хлор–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 3–(аминометил)пентан–3–ола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 220: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(7–хлор–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 3–(аминометил)пентан–3–ола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 221: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(7–хлор–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 3–(аминометил)пентан–3–ола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 222: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–3–карбоновой кислоты–изомер–X
Стадия 1
3–(4–Циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)индол–5–ил]бензойную кислоту (250 мг), полученную на стадии 1 из Примера 171, растворяют в ТГФ (2,24 мл). При комнатной температуре туда добавляют ГАТУ (234 мг), трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (125 мг), полученный на стадии 2 из Примера 202, и ТЭА (0,156 мл), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X.
Стадия 2
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (289 мг), полученный на стадии 1 выше, растворяют в ДМФ (4,50 мл). При комнатной температуре туда добавляют N–йодсукцинимид (120 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–3–йод–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X.
Стадия 3
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–3–йод–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (20 мг), полученный на стадии 2 выше, и Pd(PPh3)4 (0,92 мг) суспендируют в NMP (0,2 мл). При комнатной температуре туда добавляют N, N–диэтилэтаноламин (0,0173 мл) и после замещения CO смесь перемешивают при 100°C в течение 1 часа. t–BuOH (0,2 мл) и 2 N водный раствор гидроксида натрия (0,2 мл) добавляют в реакционную смесь с последующим перемешиванием при комнатной температуре в течение ночи. Туда добавляют МТБЭ, и водный слой отделяют. Водный слой подкисляют хлористоводородной кислотой и экстрагируют МТБЭ. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Ацетонитрил (0,5 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,5 мл) добавляют к остатку с последующим перемешиванием в течение 10 минут. Реакционную смесь концентрируют, и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 223: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индазол–3–карбоновой кислоты–изомер–X
Стадия 1
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (350 мг), полученный на стадии 2 из Примера 207, и 5–бром–6–фтор–1–метилиндазол (186 мг) суспендируют в 1,4–диоксане (2,08 мл). При комнатной температуре туда добавляют Pd(dba)2 (28,7 мг), X–phos (47,6 мг) и трикалийфосфат (397 мг), затем дегазируют и замещают азотом. В атмосфере азота перемешивают при внешней температуре 100°C в течение ночи. Растворитель отгоняют и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–метил–1H–индазол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X.
Стадия 2
Методику стадий 2–3 из Примера 212 проводят с применением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–метил–1H–индазол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X, полученного на стадии 1 выше, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 224: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоты–изомер–X
Стадия 1
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (350 мг), полученный на стадии 2 из Примера 207, и 5–бром–6–фтор–1–метилиндол (185 мг) суспендируют в 1,4–диоксане (2,08 мл). При комнатной температуре туда добавляют Pd(dba)2 (28,7 мг), X–phos (47,6 мг) и трикалийфосфат (397 мг), затем дегазируют и замещают азотом. В атмосфере азота перемешивают при внешней температуре 100°C в течение ночи. Растворитель отгоняют и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–метил–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–илкарбамата–изомер–X.
Стадия 2
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–метил–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–илкарбамат–изомер–X (209 мг), полученный на стадии 1 выше, растворяют в ДМФ (3,6 мл). При комнатной температуре туда добавляют N–йодсукцинимид (121 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–3–йод–1–метил–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X.
Стадия 3
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–3–йод–1–метил–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (211 мг), полученный на стадии 2 выше, и PdCl2(PPh3)2 (10,5 мг) суспендируют в NMP (2,11 мл). При комнатной температуре туда добавляют N, N–диэтилэтаноламин (0,197 мл) и после замещения CO смесь перемешивают при 100°C в течение 1 часа. t–BuOH (0,2 мл) и 2 N водный раствор гидроксида натрия (0,2 мл) добавляют к реакционной смеси, и полученную смесь перемешивают при комнатной температуре в течение ночи. Туда добавляют МТБЭ и водный слой отделяют. Водный слой подкисляют хлористоводородной кислотой и экстрагируют МТБЭ. Органический слой сушат над сульфатом натрия, и растворитель отгоняют с получением 5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоты–изомер–X.
Стадия 4
Ацетонитрил (0,5 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,5 мл) добавляют к 5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоте–изомер–X (10 мг), полученной на стадии 3 выше, с последующим перемешиванием в течение 10 минут. Реакционную смесь концентрируют, и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 225: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(1–(2–этил–2–гидроксибутил)–6–фтор–1H–индазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат (40 мг), полученный на стадии 1 из Примера 213, и 3–[(5–бром–6–фториндазол–1–ил)метил]пентан–3–ол (29,2 мг), полученный на стадии 1 из Примера 204, суспендируют в 1,4–диоксане (0,5 мл). При комнатной температуре туда добавляют Pd(dba)2 (3,3 мг), X–phos (5,5 мг) и трикалийфосфат (45,4 мг), затем перемешивают при 100°C в течение 1 часа. Реакционную смесь фильтруют и растворитель отгоняют. Остаток растворяют в ацетонитриле (0,5 мл). При комнатной температуре туда добавляют 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,5 мл) с последующим перемешиванием при комнатной температуре в течение 5 минут. Реакционную смесь концентрируют и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 226: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1,3–дигидроизобензофуран–5–ил)–[1,1'–бифенил]–4–карбонитрила–изомер–X
Стадия 1
Метил-5–бром–4–фтор–2–йод–бензоат (2 г) растворяют в диэтиловом эфире (55,7 мл). При 0°C туда добавляют раствор 2,0 M LiBH4 в ТГФ (6,13 мл) и метанол (0,56 мл), затем перемешивают при 0°C в течение 1 часа. Туда добавляют МТБЭ и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением (5–бром–4–фтор–2–йод–фенил)метанола.
Стадия 2
(5–Бром–4–фтор–2–йодфенил)метанол (1,39 г), полученный на стадии 1 выше, и 3,4–дигидро–2H–пиран (0,419 мл) растворяют в ДХМ (8,4 мл). При комнатной температуре туда добавляют пиридиний п–толуолсульфоновую кислоту (106 мг) с последующим перемешиванием при комнатной температуре в течение ночи. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 2–[(5–бром–4–фтор–2–йодфенил)метокси]тетрагидропирана.
Стадия 3
2–[(5–Бром–4–фтор–2–йодфенил)метокси]тетрагидропиран (1,5 г), полученный на стадии 2 выше, PdCl2(PPh3)2 (130 мг) и CuI (34 мг) суспендируют в ТГФ (18 мл). При комнатной температуре туда добавляют ТЭА (18 мл) и 2–метил–3–бутин–2–ол (0,42 мл) с последующим перемешиванием при комнатной температуре в течение 4 часов. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 4–[4–бром–5–фтор–2–(тетрагидропиран–2–илоксиметил)фенил]–2–метил–3–бутин–2–ола.
Стадия 4
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (150 мг), полученный на стадии 2 из Примера 207, и 4–[4–бром–5–фтор–2–(тетрагидропиран–2–илоксиметил)фенил]–2–метил–3–бутин–2–ол (129 мг), полученный на стадии 3 выше, суспендируют в 1,4–диоксане (0,89 мл). При комнатной температуре туда добавляют Pd(dba)2 (12,3 мг), X–phos (20.4 мг), затем перемешивают при 100°C в течение 1 часа. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат). Остаток растворяют в ТГФ (0,92 мл) и воде (0,46 мл). При комнатной температуре туда добавляют моногидрат п–толуолсульфоновой кислоты (6,9 мг), затем перемешивают при 70°C в течение 1 часа. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-((1S,2S,4R)–рел–7–(4''–циано–2,3''–дифтор–4–(3–гидрокси–3–метил–1–бутин–1–ил)–5–(гидроксиметил)–[1,1':2',1''–терфенил]–4'–карбонил–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X.
Стадия 5
Трет–бутил-((1S,2S,4R)–рел–7–(4''–циано–2,3''–дифтор–4–(3–гидрокси–3–метил–1–бутин–1–ил)–5–(гидроксиметил)–[1,1':2',1''–терфенил]–4'–карбонил–7–азабицикло[2.2,1]гептан–2–ил)карбамат–изомер–X (30 мг), полученный на стадии 4 выше, растворяют в 1,4–диоксане (0,24 мл). При комнатной температуре туда добавляют раствор 1,0 M ФТБА в ТГФ (0,14 мл), затем перемешивают при 100°C в течение 1 часа. EtOH (0,12 мл) и 10% Pd/C (30 мг) добавляют к реакционной смеси и после замещения водородом смесь перемешивают при 70°C в течение 30 минут. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток растворяют в ТГФ. При комнатной температуре туда добавляют ТЭА (0,013 мл), ДМАП (1,1 мг) и Boc2O (20,4 мг), затем перемешивают при 70°C в течение 1 часа. Туда добавляют этилацетат, смесь промывают 5 раз фосфорной кислотой в концентрации около 0,5 моль/л, промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток растворяют в ацетонитриле (0,5 мл). При комнатной температуре туда добавляют 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,5 мл) с последующим перемешиванием при комнатной температуре в течение 5 минут. После подтверждения завершения реакции ЖХМС, растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 227: Синтез 5'–((S)–3–аминопирролидин–1–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1,3–дигидроизобензофуран–5–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (400 мг), полученный на стадии 1 из Примера 41, и 4–[4–бром–5–фтор–2–(тетрагидропиран–2–илоксиметил)фенил]–2–метил–3–бутин–2–ол (456 мг), полученный на стадии 3 из Примера 226, суспендируют в 1,4–диоксане (3,15 мл). При комнатной температуре туда добавляют Pd(dba)2 (43,5 мг), X–phos (144 мг) и трикалийфосфат (601 мг), затем перемешивают при 100°C в течение 1 часа. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол). Остаток растворяют в ТГФ (1,62 мл). При комнатной температуре туда добавляют воду (0,81 мл), моногидрат p–толуолсульфоновой кислоты (12,3 мг), затем перемешивают при 70°C в течение 1 часа. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-3–(4–циано–3–фторфенил)–4–[2–фтор–5–(гидроксиметил)–4–(3–гидрокси–3–метил–1–бутенил)фенил]бензоата.
Стадия 2
Трет–бутил-3–(4–циано–3–фторфенил)–4–[2–фтор–5–(гидроксиметил)–4–(3–гидрокси–3–метил–1–бутенил)фенил]бензоат (90 мг), полученный на стадии 1 выше, растворяют в 1,4–диоксане (0,9 мл). При комнатной температуре туда добавляют раствор 1,0 M ФТБА в ТГФ (0,54 мл), затем перемешивают при 100°C в течение 2 часов. EtOH (0,30 мл) и 10% Pd/C (90 мг) добавляют в реакционную смесь и после замещения водородом перемешивают при 70°C в течение ночи. Реакционную смесь фильтруют, и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат). Остаток растворяют в ТГФ (1,0 мл). При комнатной температуре туда добавляют 12 N хлористоводородную кислоту (0,5 мл) с последующим перемешиванием при комнатной температуре в течение 1,5 часов. Туда добавляют МТБЭ и экстрагируют дважды 2 N водным раствором гидроксида натрия. Водный слой подкисляют 2 N хлористоводородной кислотой и экстрагируют дважды МТБЭ. Органический слой последовательно промывают насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)–1,3–дигидроизобензофуран–5–ил]бензойной кислоты.
Стадия 3
3–(4–Циано–3–фторфенил)–4–[6–фтор–1–(2–гидрокси–2–метилпропил)–1,3–дигидроизобензофуран–5–ил]бензойную кислоту (10 мг), полученную на стадии 2 выше, растворяют в ТГФ (0,5 мл). При комнатной температуре туда добавляют ГАТУ (9,31 мг), трет–бутил-N–[(3S)–пирролидин–3–ил]карбамат (43,5 мг) и ТЭА (6,2 мкл), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют и туда добавляют MeOH (0,5 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,5 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. Растворитель отгоняют, и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 228: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–7–метил–1H–бензо[d][1.2.3]триазол–5–ил)–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 209 проводят с применением 1,3–дифтор–2–метил–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола с получением указанного в заголовке соединения.
Пример 229: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–3–фтор–2'–(5–фтор–3–(2–гидрокси–2–метилпропил)бензо[d]изоксазол–6–ил)–[1,1'–бифенил]–4–карбонитрила
Стадия 1
1–(4–Бром–5–фтор–2–гидроксифенил)этанон (150 мг), полученный на стадии 2 из Примера 179, растворяют в ТГФ (3,2 мл). При –25°C туда добавляют диизопропиламид лития (1,0 M, раствор в ТГФ) (3,2 мл), затем перемешивают при –25°C в течение 1 часа. Смесь охлаждают до –40°C и туда добавляют ацетон (0,118 мл), затем перемешивают при –40°C в течение 1 часа. Затем туда добавляют водный раствор фосфорной кислоты, туда добавляют этилацетат и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(4–бром–5–фтор–2–гидроксифенил)–3–гидрокси–3–метилбутан–1–она.
Стадия 2
1–(4–Бром–5–фтор–2–гидроксифенил)–3–гидрокси–3–метилбутан–1–он (60 мг), полученный на стадии 1 выше, гидрохлорид гидроксиламина (28,6 мг) и ацетат натрия (25,4 мг) растворяют в МеОН (0,69 мл), затем перемешивают при 60°C в течение ночи. Туда добавляют МТБЭ и смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток растворяют в ТГФ (0,69 мл) и туда добавляют N, N'–карбонилдиимидазол (36,8 мг), ТЭА (0,037 мл), затем перемешивают при 70°C в течение 1 часа. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(6–бром–5–фтор–1,2–бензооксазол–3–ил)–2–метилпропан–2–ола.
Стадия 3
Методику стадий 1–3 из Примера 37 проводят с применением 1–(6–бром–5–фтор–1,2–бензооксазол–3–ил)–2–метилпропан–2–ола, полученного на стадии 2 выше, вместо 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 230: Синтез 2–(5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1H–индол–1–ил)ацетамида
Стадия 1
Трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат (100 мг), полученный на стадии 1 из Примера 213, и этил-2–(5–бром–6–фториндол–1–ил)ацетат (69,5 мг), полученный на стадии 1 из Примера 207, суспендируют в 1,4–диоксане (0,59 мл). При комнатной температуре туда добавляют Pd(dba)2 (8,2 мг), X–phos (13,6 мг) и трикалийфосфат (113 мг), затем дегазируют и замещают азотом. В атмосфере азота перемешивают при внешней температуре 100°C в течение ночи. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол). Остаток растворяют в MeOH (1,0 мл) и туда добавляют 5 N водный раствор гидроксида натрия (1,0 мл) с последующим перемешиванием в течение 1 часа. Туда добавляют МТБЭ и водный слой экстрагируют. Водный слой подкисляют хлористоводородной кислотой, туда добавляют МТБЭ и смесь промывают последовательно водой и насыщенным раствором соли. Органический слой сушат над сульфатом натрия, и растворитель отгоняют с получением 2–(5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1H–индол–1–ил)уксусной кислоты.
Стадия 2
2–(5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1H–индол–1–ил)уксусную кислоту (10 мг), полученную на стадии 1 выше, растворяют в ТГФ (0,32 мл). Затем туда добавляют N, N'–карбонилдиимидазол (5,2 мг) и смесь перемешивают при комнатной температуре в течение 20 минут. Туда добавляют двадцати восьми процентный водный аммиак (0,06 мл) и смесь перемешивают при комнатной температуре в течение 20 минут. Растворитель отгоняют, и ацетонитрил (0,2 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,2 мл) добавляют к остатку с последующим перемешиванием в течение 30 минут. Растворитель отгоняют, и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 231: Синтез 2–(5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1H–индол–1–ил)–N–метилацетамида
2–(5–(5–((1S,2S,4R)–Рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1H–индол–1–ил)уксусную кислоту (10 мг), полученную на стадии 1 из Примера 230, растворяют в ТГФ (0,064 мл). При комнатной температуре туда добавляют ГАТУ (6,7 мг), гидрохлорид метиламина (2,2 мг) и ТЭА (6,7 мкл), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют, и ацетонитрил (1,0 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (1,0 мл) добавляют к остатку с последующим перемешиванием в течение 10 минут. Растворитель отгоняют, остаток растворяют в ДМСО и очистку проводят ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 232: Синтез 2–(5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1H–индол–1–ил)–N, N–диметилацетамида
Методику из Примера 231 проводят с применением гидрохлорида диметиламина вместо гидрохлорида метиламина с получением указанного в заголовке соединения.
Пример 233: Синтез 2–(4'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–4''–циано–2,3''–дифтор–[1,1':2',1''–терфенил]–4–ил)ацетамида
Стадия 1
2–(4–Бром–3–фторфенил)уксусную кислоту (600 мг) растворяют в ТГФ (10,3 мл). При комнатной температуре туда добавляют ГАТУ (1,08 г), NH4Cl (275,4 мг) и ТЭА (1,08 мл), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением 2–(4–бром–3–фторфенил)ацетамида.
Стадия 2
Методику из Примера 225 проводят с применением 2–(4–бром–3–фторфенил)ацетамида, полученного на стадии 1 выше, вместо 3–[(5–бром–6–фториндазол–1–ил)метил]пентан–3–ола с получением указанного в заголовке соединения.
Пример 234: Синтез 2–(4'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–4''–циано–2,3''–дифтор–[1,1':2',1''–терфенил]–4–ил)–N–метилацетамида
Стадия 1
2–(4–Бром–3–фторфенил)уксусную кислоту (600 мг) растворяют в ТГФ (10,3 мл). При комнатной температуре туда добавляют ГАТУ (1,08 г), метиламин (около 9,8 моль/л в MeOH) (0,525 мл) и ТЭА (1,08 мл), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением 2–(4–бром–3–фторфенил)–N–метилацетамида.
Стадия 2
Методику из Примера 225 проводят с применением 2–(4–бром–3–фторфенил)–N–метилацетамида, полученного на стадии 1 выше, вместо 3–[(5–бром–6–фториндазол–1–ил)метил]пентан–3–ола с получением указанного в заголовке соединения.
Пример 235: Синтез 2–(4'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4''–циано–2,3''–дифтор–[1,1':2',1''–терфенил]–4–ил)–N, N–диметилацетамида
Стадия 1
2–(4–Бром–3–фторфенил)уксусную кислоту (600 мг) растворяют в ТГФ (10,3 мл). При комнатной температуре туда добавляют ГАТУ (1,08 г), гидрохлорид диметиламина (419,9 мг) и ТЭА (1,08 мл), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением 2–(4–бром–3–фторфенил)–N, N–диметилацетамида.
Стадия 2
Методику из Примера 225 проводят с применением 2–(4–бром–3–фторфенил)–N, N–диметилацетамида, полученного на стадии 1 выше, вместо 3–[(5–бром–6–фториндазол–1–ил)метил]пентан–3–ола с получением указанного в заголовке соединения.
Пример 236: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоксамида–изомер–X
5–(5–((1S,2S,4R)–Рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновую кислоту–изомер–X (10 мг), полученную на стадии 3 из Примера 224, растворяют в ТГФ (0,32 мл). Затем туда добавляют N, N'–карбонилдиимидазол (5,2 мг) и смесь перемешивают при комнатной температуре в течение 20 минут. Туда добавляют двадцати восьми процентный водный аммиак (0,1 мл) и смесь перемешивают при комнатной температуре в течение 20 минут. Растворитель отгоняют, и ацетонитрил (0,2 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,2 мл) добавляют к остатку с последующим перемешиванием в течение 30 минут. Растворитель отгоняют, и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 237: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–N,1–диметил–1H–индол–3–карбоксамида–изомер–X
5–(5–((1S,2S,4R)–Рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновую кислоту–изомер–X (10 мг), полученную на стадии 3 из Примера 224, растворяют в ТГФ (0,064 мл). При комнатной температуре туда добавляют ГАТУ (6,7 мг), гидрохлорид метиламина (2,2 мг) и ТЭА (6,7 мкл), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют, и ацетонитрил (0,5 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,2 мл) добавляют к остатку с последующим перемешиванием в течение 10 минут. Растворитель отгоняют, остаток растворяют в ДМСО и очистку проводят ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 238: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–N, N,1–триметил–1H–индол–3–карбоксамида–изомер–X
Методику из Примера 237 проводят с применением гидрохлорида диметиламина вместо гидрохлорида метиламина с получением указанного в заголовке соединения.
Пример 239: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–7–метил–1H–бензо[d][1.2.3]триазол–5–ил–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1,3–дифтор–2–метил–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 240: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–7–метил–1H–бензо[d][1.2.3]триазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1,3–дифтор–2–метил–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 241: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–7–метил–1H–бензо[d][1.2.3]триазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1,3–дифтор–2–метил–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 242: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоты
Стадия 1
Трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат (200 мг), полученный на стадии 1 из Примера 213, и 5–бром–6–фтор–1–метилиндол (105,6 мг) суспендируют в 1,4–диоксане (1,19 мл). При комнатной температуре туда добавляют Pd(dba)2 (16,4 мг), X–phos (27,2 мг) и трикалийфосфат (226,9 мг), затем дегазируют и замещают азотом. В атмосфере азота перемешивают при внешней температуре 100°C в течение ночи. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–метил–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата.
Стадия 2
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–1–метил–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат (209 мг), полученный на стадии 1 выше, растворяют в ДМФ (3,6 мл). При комнатной температуре туда добавляют N–йодсукцинимид (121 мг) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–3–йод–1–метил–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата.
Стадия 3
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(6–фтор–3–йод–1–метил–1H–индол–5–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамат (211 мг), полученный на стадии 2 выше, и PdCl2(PPh3)2 (10.5 мг) суспендируют в NMP (2,11 мл). При комнатной температуре туда добавляют N, N–диэтилэтаноламин (0,197 мл) и после замещения СО, смесь перемешивают при 100°C в течение 1 часа. t–BuOH (0,2 мл) и 2 N водный раствор гидроксида натрия (0,2 мл) добавляют к реакционной смеси, и полученную смесь перемешивают при комнатной температуре в течение ночи. Туда добавляют МТБЭ и водный слой отделяют. Водный слой подкисляют хлористоводородной кислотой и экстрагируют МТБЭ. Органический слой сушат над сульфатом натрия и растворитель отгоняют с получением 5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоты.
Стадия 4
Ацетонитрил (0,5 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (0,5 мл) добавляют к 5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоте (10 мг), полученной на стадии 3 выше, с последующим перемешиванием в течение 10 минут. Реакционную смесь концентрируют, и остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 243: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–N,1–диметил–1H–индол–3–карбоксамида
Методику из Примера 237 проводят с применением 5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоты, полученной на стадии 3 из Примера 242, вместо 5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоты–изомер–X с получением указанного в заголовке соединения.
Пример 244: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–N, N,1–триметил–1H–индол–3–карбоксамида
Методику из Примера 237 проводят с применением 5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоты, полученной на стадии 3 из Примера 242, вместо 5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоты–изомер–X и с применением гидрохлорида диметиламина вместо гидрохлорида метиламина с получением указанного в заголовке соединения.
Пример 245: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоксамида
Методику из Примера 236 проводят с применением 5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоты, полученной на стадии 3 из Примера 242, вместо 5–(5–((1S,2S,4R)–рел–2–((трет–бутоксикарбонил)амино)–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–метил–1H–индол–3–карбоновой кислоты–изомер–X с получением указанного в заголовке соединения.
Пример 246: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(7–(дифторметил)–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 209 проводят с применением 2–(дифторметил)–1,3–дифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола с получением указанного в заголовке соединения.
Пример 247: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–7–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 209 проводят с применением 2,6–дифтор–3–нитробензонитрила вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением ТГФ вместо EtOH с получением указанного в заголовке соединения.
Пример 248: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(7–(дифторметил)–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2–(дифторметил)–1,3–дифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 249: Синтез (S)–5–(5–(3–аминопирролидин–1–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–7–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2,6–дифтор–3–нитробензонитрила вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением ТГФ вместо EtOH и с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 250: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(7–(дифторметил)–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2–(дифторметил)–1,3–дифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 251: Синтез 5–(5–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–7–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2,6–дифтор–3–нитробензонитрила вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением ТГФ вместо EtOH и с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 252: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(7–(дифторметил)–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2–(дифторметил)–1,3–дифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 253: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–7–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2,6–дифтор–3–нитробензонитрила вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением ТГФ вместо EtOH и с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 254: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(6,7–дифтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 209 проводят с применением 1,2,3–трифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 255: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(6,7–дифтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1,2,3–трифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 256: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(6,7–дифтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1,2,3–трифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 257: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2,1]гептан–7–карбонил)–2'–(7–хлор–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 209 проводят с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 258: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(7–хлор–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 259: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(7–хлор–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 260: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(7–(дифторметил)–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 209 проводят с применением 2–(дифторметил)–1,3–дифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 261: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(7–(дифторметил)–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2–(дифторметил)–1,3–дифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 262: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(7–(дифторметил)–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2–(дифторметил)–1,3–дифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 263: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(7–(дифторметил)–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2–(дифторметил)–1,3–дифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 264: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–7–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 209 проводят с применением 2,6–дифтор–3–нитробензонитрила вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 265: Синтез (S)–5–(5–(3–аминопирролидин–1–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–7–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2,6–дифтор–3–нитробензонитрила вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 266: Синтез 5–(5–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1,2,3]триазол–7–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2,6–дифтор–3–нитробензонитрила вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 267: Синтез 5–(5–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–4'–циано–3'–фтор–[1,1'–бифенил]–2–ил)–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–7–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 2,6–дифтор–3–нитробензонитрила вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 268: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(6,7–дифтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1,2,3–трифтор–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 269: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(7–хлор–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 270: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–3–фтор–2'–(6–фтор–1–((1–гидроксициклобутил)метил)–7–метил–1H–бензо[d][1.2.3]триазол–5–ил)–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 209 проводят с применением 1,3–дифтор–2–метил–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола и с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 271: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–3–фтор–2'–(6–фтор–1–((1–гидроксициклобутил)метил)–7–метил–1H–бензо[d][1.2.3]триазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1,3–дифтор–2–метил–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 272: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–3–фтор–2'–(6–фтор–1–((1–гидроксициклобутил)метил)–7–метил–1H–бензо[d][1.2.3]триазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1,3–дифтор–2–метил–4–нитробензола вместо 2–хлор–1,3–дифтор–4–нитробензола, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола и с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 273: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Стадия 1
2–Бром–1,3–дифтор–4–нитробензол (3 г) растворяют в ТГФ (31,5 мл). Туда добавляют ТЭА (2,6 мл) и 1–амино–2–метилпропан–2–ол (1,4 мл) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли. После того, как органический слой сушат над сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(2–бром–3–фтор–6–нитроанилино)–2–метилпропан–2–ола.
Стадия 2
1–(2–Бром–3–фтор–6–нитроанилино)–2–метилпропан–2–ол (1,03 г), полученный на стадии 1 выше, растворяют в уксусной кислоте (6,7 мл). При комнатной температуре туда добавляют N–йодсукцинимид (981 мг), затем перемешивают при 50°C в течение 3 часов. Туда добавляют МТБЭ и воду и дважды экстрагируют МТБЭ. Объединенные органические слои сушат над безводным сульфатом натрия и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(2–бром–3–фтор–4–йод–6–нитроанилино)–2–метилпропан–2–ола.
Стадия 3
1–(2–Бром–3–фтор–4–йод–6–нитроанилино)–2–метилпропан–2–ол (1,33 г), полученный на стадии 2 выше, и железо (1,33 г) растворяют в ТГФ (10,2 мл) и 2 N хлористоводородной кислоте (10,2 мл), затем перемешивают при 60°C в течение 1 часа. Туда добавляют МТБЭ, и смесь пропускают через Целит. Туда добавляют МТБЭ, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(6–амино–2–бром–3–фтор–4–йоданилино)–2–метилпропан–2–ола.
Стадия 4
1–(6–Амино–2–бром–3–фтор–4–йоданилино)–2–метилпропан–2–ол (940 мг), полученный на стадии 3 выше, растворяют в воде (1,88 мл) и ТГФ (4,7 мл). При 0°C туда добавляют 12 N хлористоводородную кислоту (2,82 мл) и водный раствор нитрита натрия (водный раствор, полученный растворением 209 мг нитрита натрия в 0,63 мл воды) по каплям с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют МТБЭ, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(7–бром–6–фтор–5–йодбензотриазол–1–ил)–2–метилпропан–2–ола.
Стадия 5
Трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамат–изомер–X (50 мг), полученный на стадии 2 из Примера 207, и 1–(7–бром–6–фтор–5–йодбензотриазол–1–ил)–2–метилпропан–2–ол (47,9 мг), полученный на стадии 4 выше, растворяют в 1,4–диоксане (0,3 мл). При комнатной температуре туда добавляют Pd(dba)2 (4,1 мг), X–phos (6,8 мг) и трикалийфосфат (56,7 мг). После замещения азотом смесь перемешивают при 90°C в течение ночи. Туда добавляют этилацетат, и смесь помещают в NH–силикагель и промывают этилацетатом:метанолом=10:1. Растворитель отгоняют и ацетонитрил (1,0 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (1,0 мл) добавляют к остатку с последующим перемешиванием в течение 10 минут. Растворитель отгоняют, остаток растворяют в ДМСО и очистку проводят ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 274: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 273 проводят с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 275: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 273 проводят с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 276: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–3–фтор–2'–(6–фтор–1–((1–гидроксициклобутил)метил)–7–метил–1H–бензо[d][1.2.3]триазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 209 проводят с применением 1,3–дифтор–2–метил–4–нитробензол вместо 2–хлор–1,3–дифтор–4–нитробензол, с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола, и с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 277: Синтез 5'–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 273 проводят с применением трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата, полученного на стадии 1 из Примера 213, вместо трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2,1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 278: Синтез 5'–((1R,2R,4S)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(7–циклопропил–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Стадия 1
1–(2–Бром–3–фтор–6–нитроанилино)–2–метилпропан–2–ол (975 мг), полученный на стадии 1 из Примера 273, растворяют в 1,4–диоксане (10,6 мл). При комнатной температуре туда добавляют дихлорбис(трициклогексилфосфин)палладий(II) (234 мг), циклопропилбороновую кислоту (464 мг) и трикалийфосфат (2,02 г), затем перемешивают при 10°C в течение ночи. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–((2–циклопропил–3–фтор–6–нитрофенил)амино)–2–метилпропан–2–ола.
Стадия 2
1–((2–Циклопропил–3–фтор–6–нитрофенил)амино)–2–метилпропан–2–ол (204 мг), полученный на стадии 1 выше, растворяют в ацетонитриле (1,5 мл). При комнатной температуре туда добавляют NBS (196 мг), затем перемешивают при 50°C в течение 1 часа. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–((4–бром–2–циклопропил–3–фтор–6–нитрофенил)амино)–2–метилпропан–2–ола.
Стадия 3
1–((4–Бром–2–циклопропил–3–фтор–6–нитрофенил)амино)–2–метилпропан–2–ол (250 мг), полученный на стадии 2 выше, и железо (250 мг) растворяют в ТГФ (2,4 мл) и 2 N хлористоводородной кислоте (2,4 мл), затем перемешивают при 60°C в течение 1 часа. Туда добавляют этилацетат, и смесь пропускают через Целит. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–((6–амино–4–бром–2–циклопропил–3–фторфенил)амино)–2–метилпропан–2–ола.
Стадия 4
1–((6–Амино–4–бром–2–циклопропил–3–фторфенил)амино)–2–метилпропан–2–ол (192 мг), полученный на стадии 3 выше, растворяют в ТГФ (2,0 мл) и 2 N хлористоводородной кислоте (2,0 мл). Туда по каплям добавляют водный раствор нитрита натрия (водный раствор, полученный растворением 54 мг нитрита натрия в 0,16 мл воды) с последующим перемешиванием при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(5–бром–7–циклопропил–6–фтор–1H–бензо[d][1.2.3]триазол–1–ил)–2–метилпропан–2–ола.
Стадия 5
Трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамат (15 мг), полученный на стадии 1 из Примера 213, и 1–(5–бром–7–циклопропил–6–фтор–1H–бензо[d][1.2.3]триазол–1–ил)–2–метилпропан–2–ол (10,5 мг), полученный на стадии 4 выше, растворяют в 1,4–диоксане (0,2 мл). Туда добавляют Pd(dba)2 (1,2 мг), X–phos (2,0 мг) и трикалийфосфат (17 мг). После азотного замещения смесь перемешивают при 100°C в течение ночи. Туда добавляют этилацетат, и смесь помещают в NH–силикагель и промывают этилацетатом:метанолом=10:1. Растворитель отгоняют, и ацетонитрил (1,0 мл) и 4 N раствор хлористоводородной кислоты–1,4–диоксана (1,0 мл) добавляют к остатку с последующим перемешиванием в течение 10 минут. Растворитель отгоняют, остаток растворяют в ДМСО и очистку проводят ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 279: Синтез 5'–((1R,2R,4S)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–карбонил)–2'–(7–циклопропил–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1,2,3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику стадий 1–5 из Примера 278 проводят с применением трет–бутил-((1S,2S,4R)–рел–7–(4'–циано–3'–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1'–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X, полученного на стадии 2 из Примера 207, вместо трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата.
Пример 280: Синтез (S)–5'–(3–аминопирролидин–1–карбонил)–2'–(7–циклопропил–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 278 проводят с применением трет–бутил-N–[(3S)–1–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]пирролидин–3–ил]карбамата, полученного на стадии 1 из Примера 37, вместо трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата с получением указанного в заголовке соединения.
Пример 281: Синтез 5'–((3–эндо)–3–амино–8–азабицикло[3.2.1]октан–8–карбонил)–2'–(7–циклопропил–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила
Методику стадий 1–5 из Примера 278 проводят с применением трет–бутил-N–[(3–эндо)–8–[3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоил]–8–азабицикло[3.2.1]октан–3–ил]карбамата, полученного на стадии 3 из Примера 41, вместо трет–бутил-((1S,2S,4R)–рел–7–(4’–циано–3’–фтор–6–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)–[1,1’–бифенил]–3–карбонил)–7–азабицикло[2.2.1]гептан–2–ил)карбамата с получением указанного в заголовке соединения.
Пример 282: Синтез (S)–5'–((3–аминопирролидин–1–ил)метил)–4''–метил–[1,1':2',1''–терфенил]–4–карбонитрила
Стадия 1
3–Бром–4–хлорбензальдегид (100 мг) и трет–бутил-N–[(3S)–пирролидин–3–ил]карбамат (93,4 мг) растворяют в MeOH (1,0 мл). При 0°C туда добавляют уксусную кислоту (0,1 мл) и комплекс боран–2–пиколин (146 мг), затем перемешивают при комнатной температуре в течение ночи. Туда добавляют этилацетат, и полученную смесь промывают последовательно водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[(3–бром–4–хлорфенил)метил]пирролидин–3–ил]карбамата.
Стадия 2
Трет–бутил-N–[(3S)–1–[(3–бром–4–хлорфенил)метил]пирролидин–3–ил]карбамат (60 мг), полученный на стадии 1 выше, и (4–цианофенил)бороновую кислоту (24,9 мг) растворяют в 1,4–диоксане (0,77 мл). При комнатной температуре туда добавляют PdCl2(dppf)CH2Cl2 (3,4 мг) и трикалийфосфат (97,9 мг), затем перемешивают при 125°C в течение 45 минут. Реакционную смесь фильтруют и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[[4–хлор–3–(4–цианофенил)фенил]метил]пирролидин–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(3S)–1–[[4–хлор–3–(4–цианофенил)фенил]метил]пирролидин–3–ил]карбамат (20 мг), полученный на стадии 2 выше, п–толилбороновую кислоту (13,2 мг), Pd2(dba)3 (2,23 мг), трикалийфосфат (20,6 мг) и раствор 1M PCy3 в ТГФ (0,1 мл) суспендируют в 1,4–диоксане (0,5 мл), затем перемешивают при 160°C в течение 45 минут. Реакционную смесь фильтруют через NH–силикагель, и растворитель из фильтрата отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(3S)–1–[[3–(4–цианофенил)–4–(п–толил)фенил]метил]пирролидин–3–ил]карбамата.
Стадия 4
Трет–бутил-N–[(3S)–1–[[3–(4–цианофенил)–4–(п–толил)фенил]метил]пирролидин–3–ил]карбамат (10 мг), полученный на стадии 3 выше, растворяют в ТФК (0,3 мл), и развитие реакции подтверждают ЖХМС, затем концентрируют в вакууме. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 283: Синтез 5'–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2'',3–дифтор–4''–метил–[1,1':2',1''–терфенил]–4–карбонитрила–изомер–X
Стадия 1
3–Бром–4–хлорбензальдегид (1,1 г) растворяют в 1,4–диоксане (13 мл). При комнатной температуре туда добавляют (4–циано–3–фторфенил)бороновую кислоту (870 мг), PdCl2(dppf)CH2Cl2 (110 мг), и 2M водный раствор карбоната натрия (6,3 мл), затем перемешивают при 90°C в течение 5 часов. Туда добавляют этилацетат, и полученную смесь последовательно промывают водой и насыщенным раствором соли. Затем органический слой сушат над безводным сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 4–(2–хлор–5–формилфенил)–2–фторбензонитрила.
Стадия 2
4–(2–хлор–5–формилфенил)–2–фторбензонитрил (505 мг), полученный на стадии 1 выше, растворяют в 1,4–диоксане (19,45 мл). При комнатной температуре туда добавляют (2–фтор–4–метилфенил)бороновую кислоту (599 мг), Pd2dba3 (89 мг), раствор 1M PCy3 в ТГФ (0,1 мл) и трикалийфосфат (1,24 г), и смесь перемешивают в микроволновом реакторе при 160°C в течение 1 часа. Растворитель отгоняют, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 2–фтор–4–[2–(2–фтор–4–метил–фенил)–5–формилфенил]бензонитрила.
Стадия 3
2–Фтор–4–[2–(2–фтор–4–метилфенил)–5–формилфенил]бензонитрил (10 мг), полученный на стадии 2 выше, растворяют в ДХМ (0,6 мл). При комнатной температуре туда добавляют трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2.1]гептан–2–ил)карбамат–изомер–X (9,55 мг), синтезированный на стадии 2 Примера 202, и триацетоксиборгидрид натрия (25,4 мг), затем перемешивают при комнатной температуре в течение 1 часа. Растворитель отгоняют, туда добавляют хлороформ, и нерастворимое вещество отфильтровывают. Растворитель отгоняют, и туда добавляют ацетонитрил (0,2 мл) и 4N раствор хлористоводородной кислоты в 1,4–диоксане (0,2 мл), затем перемешивают в течение 10 минут. Туда добавляют ДМСО (0,6 мл) и проводят очистку ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил) с получением указанного в заголовке соединения.
Пример 284: Синтез (S)–5'–((3–амино–3–метилпирролидин–1–ил)метил)–2'',3–дифтор–4''–метил–[1,1':2',1''–терфенил]–4–карбонитрила
Методику со стадии 3 из примера 283 проводят с применением трет–бутил-(S)–(3–метилпирролидин–3–ил)карбамата вместо трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 285: Синтез дигидрохлорида 5'–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2'–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор[1,1'–бифенил]–4–карбонитрила–изомер–X
Стадия 1
3–Бром–4–хлорбензойную кислоту (19 г) растворяют в ДМФ (160 мл). При 25°C туда добавляют ДМАП (20 г) и WSC HCl (31 г), затем добавляют t–BuOH (38 мл). Полученную смесь перемешивают при комнатной температуре в течение ночи. Туда добавляют этилацетат, и полученную смесь последовательно промывают водой и насыщенным раствором соли. Затем органический слой сушат над безводным сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-3–бром–4–хлорбензоата.
Стадия 2
Трет–бутил-3–бром–4–хлорбензоат (1,00 г), полученный на стадии 1 выше, растворяют в 1,4–диоксане (8,6 мл). При комнатной температуре туда добавляют (4–циано–3–фторфенил)бороновую кислоту (509 мг), Pd(PPh3)4 (119 мг) и 2M водный раствор карбоната натрия (4,3 мл), и реакционную смесь перемешивают в микроволновом реакторе при 120°C в течение 30 минут. Реакционную смесь фильтруют, и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-4–хлор–3–(4–циано–3–фторфенил)бензоата.
Стадия 3
Трет–бутил-4–хлор–3–(4–циано–3–фторфенил)бензоат (300 мг), полученный на стадии 2 выше, растворяют в 1,4–диоксане (5 мл). При комнатной температуре туда добавляют Pd(OAc)2 (40 мг), KOAc (300 мг), биспинаколатодиборон (500 мг) и Silica–SMAP (50 мг), затем перемешивают при 100°C в течение 26 часов. Реакционную смесь фильтруют, и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоата.
Стадия 4
1,2,3–Трифтор–4–нитробензол (500 мг), 1–амино–2–метилпропан–2–ол (302 мг) и триэтиламин (0,590 мл) растворяют в ТГФ (5,65 мл), затем перемешивают при 45°C в течение 5 часов. Туда добавляют этилацетат, и полученную смесь последовательно промывают водой и насыщенным раствором соли. Затем органический слой сушат над безводным сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(2,3–дифтор–6–нитроанилино)–2–метилпропан–2–ола.
Стадия 5
1–(2,3–Дифтор–6–нитроанилино)–2–метилпропан–2–ол (74,1 г), полученный на стадии 4 выше, растворяют в ДМФ (602 мл). При комнатной температуре туда добавляют NBS (64,3 г), затем перемешивают при 90°C в течение 1 часа. Туда добавляют этилацетат и смесь промывают 3 раза водой. Затем промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем растворитель отгоняют. Остаток кристаллизуют из ИПЭ:гексана=1:1, и кристаллы дважды промывают гексаном. Полученные кристаллы сушат с получением 1–(4–бром–2,3–дифтор–6–нитроанилино)–2–метилпропан–2–ола.
Стадия 6
1–(4–Бром–2,3–дифтор–6–нитроанилино)–2–метилпропан–2–ол (82,2 г), полученный на стадии 5 выше, хлорид аммония (82,2 г) и порошок железа (41,1 г) суспендируют в EtOH (421 мл) и воде (421 мл), затем перемешивают при 60°C в течение ночи. Туда добавляют МТБЭ, и смесь пропускают через Целит. Туда добавляют МТБЭХ, и смесь последовательно промывают водой и насыщенным раствором соли, и сушат над безводным сульфатом натрия. Затем растворитель отгоняют с получением 1–(6–амино–4–бром–2,3–дифторанилино)–2–метилпропан–2–ола.
Стадия 7
1–(6–Амино–4–бром–2,3–дифторанилино)–2–метилпропан–2–ол (68,1 г), полученный на стадии 6 выше, растворяют в воде (136 мл) и ТГФ (341 мл). При 0°C туда по каплям добавляют 12N хлористоводородную кислоту (204 мл) и нитрит натрия (водный раствор (60 мл), в котором растворены 20,7 г нитрита натрия) в течение более 3 минут, затем перемешивают при комнатной температуре в течение 1 часа. Туда добавляют МТБЭ, и смесь последовательно промывают водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. К остатку добавляют ИПЭ:гексан=1:1 (68 мл), и полученное твердое вещество собирают фильтрацией и промывают ИПЭ:гексаном=1:1. Полученное твердое вещество сушат с получением 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ола.
Стадия 8
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (3,2 г), полученный на стадии 3 выше, и 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ол (3,01 г), полученный на стадии 7 выше, растворяют в 1,4–диоксане (25,2 мл). При комнатной температуре туда добавляют Pd(dba)2 (348 мг), X–Phos (577 мг) и трикалийфосфат (4,81 г), затем перемешивают при 100°C в течение ночи. Растворитель отгоняют, остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. Остаток растворяют в ТГФ (15,0 мл). При 0°C туда добавляют 12N хлористоводородную кислоту (15,0 мл), затем перемешивают при комнатной температуре в течение 2 часов. Туда добавляют МТБЭ, смесь промывают водой и сушат над безводным сульфатом натрия, и растворитель отгоняют с получением 3–(4–циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензойной кислоты.
Стадия 9
3–(4–Циано–3–фторфенил)–4–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]бензойную кислоту (120 мг), полученную на стадии 8 выше, растворяют в ТГФ (1,29 мл). При комнатной температуре туда добавляют WSC HCl (98,6 мг) и ГОБт (78,8 мг), затем перемешивают при комнатной температуре в течение 20 минут. Туда добавляют боргидрид натрия (19,5 мг), затем перемешивают в течение 1 часа. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: хлороформ/метанол) с получением 4–[2–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]–5–(гидроксиметил)фенил]–2–фторбензонитрила.
Стадия 10
4–[2–[6,7–Дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]–5–(гидроксиметил)фенил]–2–фторбензонитрил (100 мг), полученный на стадии 9 выше, растворяют в ДХМ (2,21 мл). При комнатной температуре туда добавляют периодинан Десса–Мартина (103 мг), затем перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют в вакууме, и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 4–[2–[6,7–дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]–5–формилфенил]–2–фторбензонитрил.
Стадия 11
4–[2–[6,7–Дифтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]–5–формилфенил]–2–фторбензонитрил (50 мг), полученный на стадии 10 выше, растворяют в ДХМ (1,11 мл). При комнатной температуре туда добавляют трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2.1]гептан–2–ил)карбамат–изомер–X (47,1 мг), синтезированный на стадии 2 примера 202, затем перемешивают при комнатной температуре в течение 30 минут. При комнатной температуре туда добавляют триацетоксиборгидрид натрия (94,1 мг), затем перемешивают при комнатной температуре в течение ночи. После добавления хлороформа, нерастворимое вещество отфильтровывают и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (NH–силикагель, подвижная фаза: гексан/этилацетат), и растворитель отгоняют. Остаток растворяют в MeOH (1,0 мл) и туда добавляют 4N раствор хлористоводородной кислоты в 1,4–диоксане (1,0 мл), затем перемешивают в течение 30 минут. Растворитель удаляют из реакционной смеси с получением указанного в заголовке соединения.
Пример 286: Синтез дигидрохлорида 5'–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2'–(7–хлор–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику со стадий 4–11 из примера 285 проводят с применением 2–хлор–1,3–дифтор–4–нитробензола вместо 1,2,3–трифтор–4–нитробкнзола, и с применением 1–(аминометил)циклобутанола вместо 1–амино–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 287: Синтез дигидрохлорида 5'–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила–изомер–X
Стадия 1
5–Бром–6–фтор–1H–индазол (94 мг) растворяют в ДМФ (1,5 мл). При комнатной температуре туда добавляют карбонат цезия (285 мг) и 2,2–диметилоксиран (0,078 мл), затем перемешивают при 90°C в течение 16 часов. Реакцию гасят нсыщенным водным раствором хлорида аммония, туда добавляют этилацетат, и полученную смесь последовательно промывают водой и насыщенным раствором соли. Затем органический слой сушат над безводным сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола.
Стадия 2
Методику со стадий 8–11 из примера 285 проводят с применением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 выше, вместо 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 288: Синтез дигидрохлорида 5'–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2'–(7–хлор–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику со стадий 4–11 из примера 285 проводят с применением 2–хлор–1,3–дифтор–4–нитробензола вместо 1,2,3–трифтор–4–нитробензола, и с применением 3–(аминометил)пентан–3–ола вместо 1–амино–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 289: Синтез дигидрохлорида 5'–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1'–бифенил]–4–карбонитрила–изомер–X
Стадия 1
5–Бром–6–фтор–1H–индол (50 мг) растворяют в ДМФ (0,78 мл). При комнатной температуре туда добавляют карбонат цезия (151 мг) и 2,2–диметилоксиран (42 мкл), затем перемешивают при 90°C в течение 16 часов. Реакцию гасят насыщенным водным раствором хлорида аммония, туда добавляют этилацетат, и полученную смесь последовательно промывают водой и насыщенным раствором соли. Затем органический слой сушат над безводным сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(5–бром–6–фториндол–1–ил)–2–метилпропан–2–ола.
Стадия 2
Методику со стадий 8–11 из примера 285 проводят с применением 1–(5–бром–6–фториндол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 выше, вместо 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 290: Синтез дигидрохлорида 5'–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2'',3–дифтор–4''–(2–гидрокси–2–метилпропил)–[1,1':2',1''–терфенил]–4–карбонитрила–изомер–X
Стадия 1
Метил-2–(4–бром–3–фторфенил)ацетат (500 мг) растворяют в ТГФ (2,2 мл). При –30°C туда по каплям добавляют раствор 3M MeMgBr в диэтиловом эфире (5,40 мл), затем перемешивают при комнатной температуре в течение ночи. Реакционную смесь вводят в водным раствор хлорида аммония, туда добавляют этилацетат, и смесь последовательно промывают водой и насыщенным раствором соли. Зате органический слой сушат над безводным сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола.
Стадия 2
Методику со стадий 8–11 из примера 285 проводят с применением 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола, полученного на стадии 1 выше, вместо 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 291: Синтез дигидрохлорида (S)–5'–((3–аминопирролидин–1–ил)метил)–2'',3–дифтор–4''–(2–гидрокси–2–метилпропил)–[1,1':2',1''–терфенил]–4–карбонитрила
Методику со стадий 8–11 из примера 285 проводят с применением 1–(4–бром–3–фторфенил)–2–метилпропан–2–ола, полученного на стадии 1 из Примера 290 вместо 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ола, и с применением трет–бутил-N–[(3S)–пирролидин–3–ил]карбамата вместо трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 292: Синтез дигидрохлорида 5'–(1–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)этил)–2'',3–дифтор–4''–метил–[1,1':2',1''–терфенил]–4–карбонитрила–изомер–X
Стадия 1
1–(3–Бром–4–хлорфенил)этанон (2,00 г) растворяют в 1,4–диоксане (14,3 мл). При комнатной температуре туда добавляют (4–циано–3–фторфенил)бороновую кислоту (1,55 г), PdCl2(dppf)CH2Cl2 (188 мг) и 2M водный раствор карбоната натрия (10,7 мл), затем перемешивают при 90°C в течение ночи. Туда добавляют этилацетат, и полученную смесь последовательно промывают водой и насыщенным раствором соли. Затем органический слой сушат над безводным сульфатом натрия, растворитель отгоняют. Туда добавляют диэтиловый эфир, и осадок собирают фильтрацией с получением 4–(5–ацетил–2–хлорфенил)–2–фторбензонитрила.
Стадия 2
4–(5–Ацетил–2–хлорфенил)–2–фторбензонитрил (200 мг), полученный на стадии 1 выше, и трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2.1]гептан–2–ил)карбамат–изомер–X (160 мг), синтезированный на стадии 2 Примера 202, суспендируют в изопропоксиде титана (1,0 мл), затем перемешивают в течение 3 дней. Туда добавляют EtOH (5 мл) и боргидрид натрия (138 мг), затем перемешивают в течение 1 часа. Смесь разбавляют ТГФ, туда добавляют Целит, фльтруют через слой Целита и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (NH двуокись кремния, подвижная фаза: гексан/этилацетат) с получением трет–бутил-N–[(1S,3R,4R)–7–[1–[4–хлор–3–(4–циано–3–фторфенил)фенил]этил]–7–азабицикло[2.2.1]гептан–3–ил]карбамата.
Стадия 3
Трет–бутил-N–[(1S,3R,4R)–7–[1–[4–хлор–3–(4–циано–3–фторфенил)фенил]этил]–7–азабицикло[2.2.1]гептан–3–ил]карбамат (20 мг), полученный на стадии 2 выше, растворяют в ДМФ (0,50 мл). При комнатной температуре туда добавляют (2–фтор–4–метилфенил)бороновую кислоту (19,7 мг), S–Phos (1,75 мг), Pd(dba)2 (1,22 мг) и трикалийфосфат (27,1 мг), и смесь перемешивают в микроволновом реакторе при 160°C в течение 45 минут. Туда добавляют МТБЭ, и смесь промывают 3 раза водой. Затем промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем растворитель отгоняют. Остаток очищают ВЭЖХ с обращенной фазой (подвижная фаза: вода/ацетонитрил), и целевые фракции объединяют, нейтрализуют водным раствором гидрокарбоната натрия и экстрагируют дважды хлороформом. Растворитель отгоняют, остаток растворяют в MeOH (1,0 мл) и туда добавляют 4N раствор хлористоводородной кислоты в 1,4–диоксане (1,0 мл), затем перемешивают в течение 30 минут. Растворитель удаляют из реакционной смеси с получением указанного в заголовке соединения.
Пример 293: Синтез дигидрохлорида 5'–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2'–(1–(2–этил–2–гидроксибутил)–6,7–дифтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику со стадий 4–11 из примера 285 проводят с применением 3–(аминометил)пентан–3–ола вместо 1–амино–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 294: Синтез дигидрохлорида 5'–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2'–(7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор[1,1'–бифенил]–4–карбонитрила–изомер–X
Стадия 1
2–Бром–1,3–дифтор–4–нитробензол (3,00 г) растворяют в ТГФ (31,5 мл). Туда добавляют ТЭА (2,63 мл) и 1–амино–2–метилпропан–2–ол (1,40 мл), затем перемешивают при комнатной температуре в течение 1 часа. Туда добавляют этилацетат, и полученную смесь последовательно промывают водой и насыщенным раствором соли. Затем органический слой сушат над безводным сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(2–бром–3–фтор–6–нитроанилино)–2–метилпропан–2–ола.
Стадия 2
1–(2–Бром–3–фтор–6–нитроанилино)–2–метилпропан–2–ол (1,03 г), полученный на стадии 1 выше, растворяют в уксусной кислоте (6,7 мл). При комнатной температуре туда добавляют N–йодсукцинимид (981 мг), затем перемешивают при 50°C в течение 3 часов. Туда добавляют МТБЭ и воду, и смесь экстрагируют дважды МТБЭ. Затем объединенные органические слои сушат над безводным сульфатом натрия, растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(2–бром–3–фтор–4–йод–6–нитроанилино)–2–метилпропан–2–ола.
Стадия 3
1–(2–Бром–3–фтор–4–йод–6–нитроанилино)–2–метилпропан–2–ол (1,33 г), полученный на стадии 2 выше, и порошок железа (1,33 г) суспендируют в ТГФ (10,2 мл) и 2N хлористоводородную кислоту (10,2 мл), затем перемешивают при 60°C в течение 1 часа. Туда добавляют МТБЭ, и смесь пропускают через Целит. Туда добавляют МТБЭ и смесь последовательно промывают водой и насыщенным раствором соли, и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(6–амино–2–бром–3–фтор–4–йоданилино)–2–метилпропан–2–ола.
Стадия 4
1–(6–Амино–2–бром–3–фтор–4–йоданилино)–2–метилпропан–2–ол (940 мг), полученный на стадии 3 выше, растворяют в воде (1,88 мл) и ТГФ (4,7 мл). При 0°C туда добавляют 12N хлористоводородную кислоту (2,82 мл) и водный раствор нитрита натрия (водный раствор, полученный растворением 209 мг нитрита натрия в 0,63 мл воды), затем перемешивают при комнатной температуре в течение 1 часа. Туда добавляют МТБЭ, и смесь последовательно промывают водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Затем растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 1–(7–бром–6–фтор–5–йодбензотриазол–1–ил)–2–метилпропан–2–ола.
Стадия 5
Трет–бутил-3–(4–циано–3–фторфенил)–4–(4,4,5,5–тетраметил–1,3,2–диоксаборолан–2–ил)бензоат (3 г), полученный на стадии 3 Примера 285, и 1–(7–бром–6–фтор–5–йодбензотриазол–1–ил)–2–метилпропан–2–ол (3,228 г), полученный на стадии 5 выше, растворяют в 1,4–диоксане (23,6 мл). При комнатной температуре туда добавляют PdCl2(PPh3)2 (398 мг) и трикалийфосфат (4,513 г). После азотного замещения и дегазирования смесь перемешивают при 100°C в течение ночи. Реакционную смесь пропускают через Целит и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) и растворитель отгоняют. К остатку добавляют ТГФ (45,0 мл) и 12N хлористоводородную кислоту (45,0 мл), затем перемешивают при комнатной температуре в течение 2 часов. Туда добавляют МТБЭ и воду для разделения. Затем органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия, растворитель отгоняют. Остаток кристаллизуют из диэтилового эфира/гексана с получением 4–[7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]–3–(4–циано–3–фторфенил)бензойной кислоты.
Стадия 6
4–[7–Бром–6–фтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]–3–(4–циано–3–фторфенил)бензойную кислоту (88,0 мг), полученную на стадии 5 выше, растворяют в ТГФ (0,834 мл). При комнатной температуре туда добавляют WSC HCl (64,0 мг) и ГОБт (51,1 мг), затем перемешивают при комнатной температуре в течение 20 минут. Туда добавляют боргидрид натрия (18,9 мг), затем перемешивают в течение 1 часа. Растворитель отгоняют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 4–[2–[7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]–5–(гидроксиметил)фенил]–2–фторбензонитрила.
Стадия 7
4–[2–[7–Бром–6–фтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]–5–(гидроксиметил)фенил]–2–фторбензонитрил (43,5 мг), полученный на стадии 6 выше, растворяют в ДХМ (0,847 мл). При комнатной температуре туда добавляют периодинан Десса–Мартина (39,5 мг), затем перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют в вакууме и остаток очищают хроматографией на колонке с силикагелем (подвижная фаза: гексан/этилацетат) с получением 4–[2–[7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]–5–формилфенил]–2–фторбензонитрила.
Стадия 8
4–[2–[7–Бром–6–фтор–1–(2–гидрокси–2–метилпропил)бензотриазол–5–ил]–5–формилфенил]–2–фторбензонитрил (37,2 мг), полученный на стадии 7 выше, растворяют в ДХМ (1,00 мл). При комнатной температуре туда добавляют трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2.1]гептан–2–ил)карбамат–изомер–X (30,9 мг), синтезированный на стадии 2 Примера 202, затем перемешивают при комнатной температуре в течение 30 минут. При комнатной температуре туда добавляют триацетоксиборгидрид натрия (27,8 мг), затем перемешивают при комнатной температуре в течение ночи. Досле добавления хлороформа нерастворимое вещество отфильтровывают и растворитель отгоняют. Остаток очищают хроматографией на колонке с силикагелем (NH–силикагель, подвижная фаза: гексан/этилацетат), и растворитель отгоняют. Остаток растворяют в MeOH (1,0 мл) и туда добавляют 4N раствор хлористоводородной кислоты в 1,4–диоксане (1,0 мл), затем перемешивают в течение 30 минут. Растворитель удаляют из реакционной смеси с получением указанного в заголовке соединения.
Пример 295: Синтез дигидрохлорида 5'–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2'–(7–бром–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор[1,1'–бифенил]–4–карбонитрила–изомер–X
Методику со стадий 1–8 из примера 294 проводят с применением 3–(аминометил)пентан–3–ола вместо 1–амино–2–метилпропан–2–ола с получением указанного в заголовке соединения.
Пример 296: Синтез дигидрохлорида (1R,2R,4S)–рел–7–((4–метил–4''–нитро–[1,1':2',1''–терфенил]–4'–ил)метил)–7–азабицикло[2.2.1]гептан–2–амина–изомер–X
Методику со стадий 1–3 из примера 283 проводят с применением 4–нитрофенилбороновой кислоты вместо (4–циано–3–фторфенил)бороновой кислоты, и с применением 4–метилфенилбороновой кислоты вместо (2–фтор–4–метилфенил)бороновой кислоты с получением указанного в заголовке соединения.
Пример 297: Синтез дигидрохлорида 3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–5'–((гексагидропирроло[3,4–c]пиррол–2(1H)–ил)метил)–[1,1'–бифенил]–4–карбонитрила
Методику со стадий 8–11 из примера 285 проводят с применением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 Примера 287, вместо 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ола, и с применением трет–бутилгексагидропирроло[3,4–c]пиррол–2(1H)–карбоксилата вместо трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 298: Синтез дигидрохлорида 5'–((2,6–диазаспиро[3.5]нонан–2–ил)метил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику со стадий 8–11 из примера 285 проводят с применением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 Примера 287, вместо 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ола, и с применением трет–бутил-2,6–диазаспиро[3.5]нонан–2–карбоксилата вместо трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 299: Синтез дигидрохлорида 5'–((3–эндо)–амино–8–азабицикло[3.2.1]октан–8–ил)метил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику со стадий 8–11 из примера 285 проводят с применением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 Примера 287, вместо 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ола, и с применением трет–бутил-N–[(3–эндо)–8–азабицикло[3.2.1]октан–3–ил]карбамата вместо трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Пример 300: Синтез дигидрохлорида 5'–((2,6–диазаспиро[3.4]октан–6–ил)метил)–3–фтор–2'–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1'–бифенил]–4–карбонитрила
Методику со стадий 8–11 из примера 285 проводят с применением 1–(5–бром–6–фториндазол–1–ил)–2–метилпропан–2–ола, полученного на стадии 1 Примера 287, вместо 1–(5–бром–6,7–дифторбензотриазол–1–ил)–2–метилпропан–2–ола, и с применением трет–бутил-2,6–диазаспиро[3.4]октан–6–карбоксилата вместо трет–бутил-((1S,2S,4R)–рел–7–азабицикло[2.2.1]гептан–2–ил)карбамата–изомер–X с получением указанного в заголовке соединения.
Далее представлен список соединений из примеров 1–300.

В следующих таблицах, если структура
показана как:
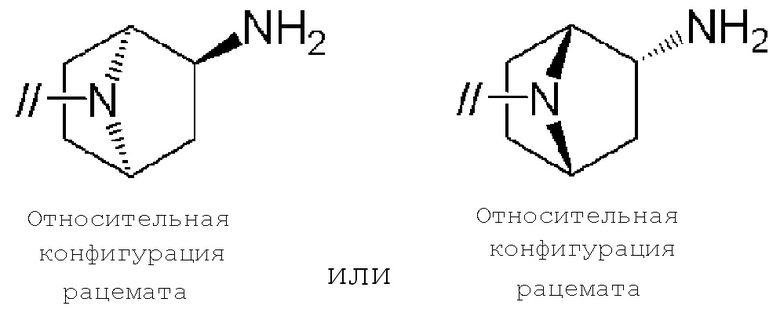
то соединение является смесью соединений, имеющих структуру:
 ,
,
если структура показана как:
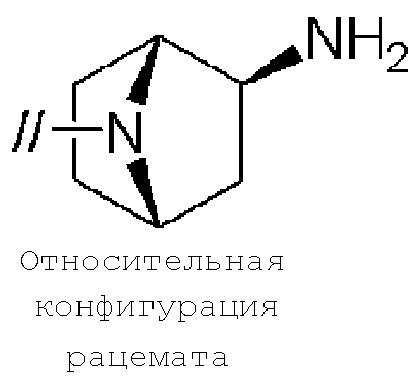 ,
,
то соединение является смесью соединений, имеющих структуру:
 ,
,
и если структура показана как:
 ,
,
то соединение имеет одну из следующих структур:
 .
.
Таблица 1



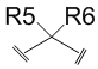

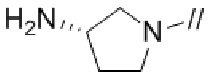







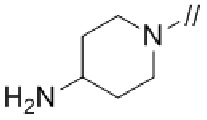



















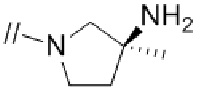





418,0



418,1
Таблица 2

























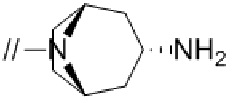



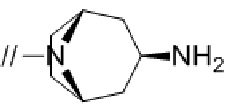









Таблица 3



































Таблица 4



































Таблица 5

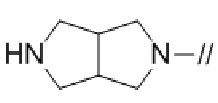

































Таблица 6

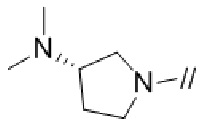


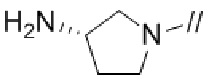




404,1



448,0




















Таблица 7
















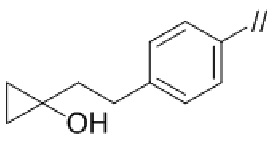

















Таблица 8


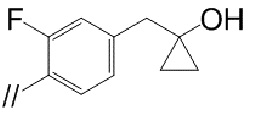





































Таблица 9





























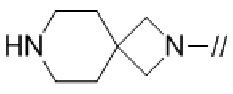



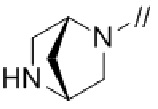


Таблица 10









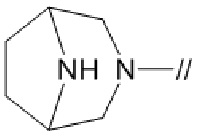























Таблица 11














444,2























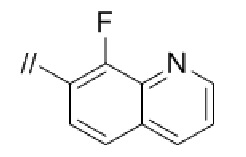

Таблица 12










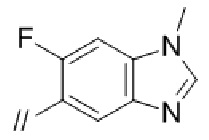














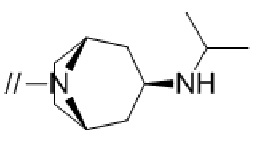
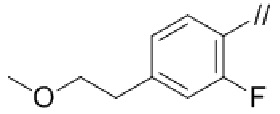









Таблица 13

































Таблица 14
















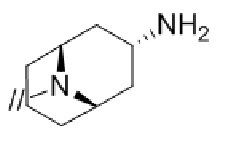



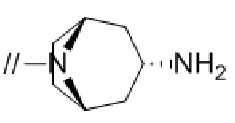



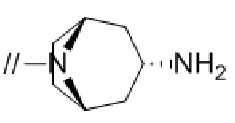






Таблица 15




























Таблица 16





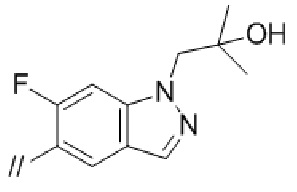

1,11 (6H, с).

рацемат
отн. конфиг.











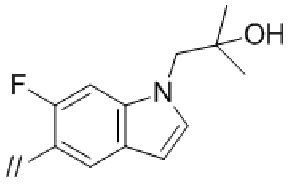












Таблица 17






















изомер–В
отн. конфиг.



изомер–А
отн. конфиг.








Таблица 18






























изомер–В
отн. конфиг.



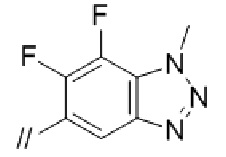

Таблица 19













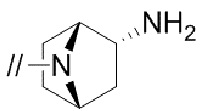
изомер–В
отн. конфиг.















изомер–В
отн. конфиг.



изомер–В
отн. конфиг.

Таблица 20


изомер–В
отн. конфиг.



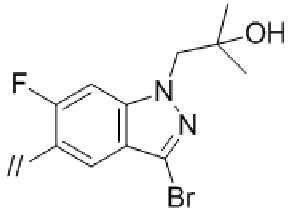



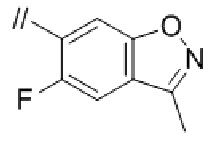










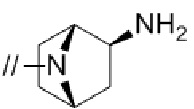
Рацемат
отн. конфиг.



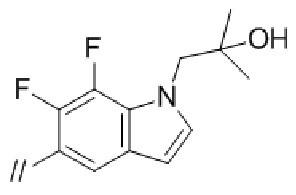



Рацемат
отн. конфиг.



Рацемат
отн. конфиг.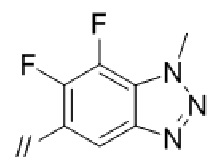

Таблица 21


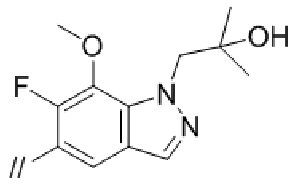











Рацемат
отн. конфиг.



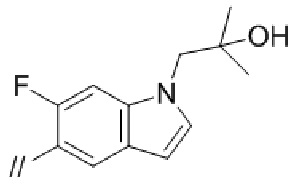







Рацемат
отн. конфиг.



Рацемат
отн. конфиг.





Таблица 22


Рацемат
отн. конфиг.



Рацемат
отн. конфиг.


















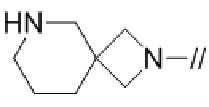




изомер–Х
отн. конфиг.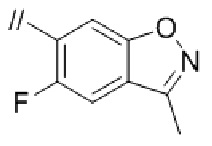


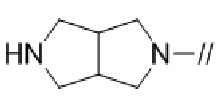


Таблица 23

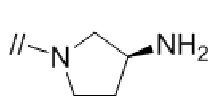
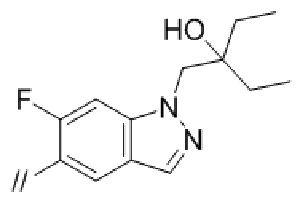







изомер–Х
отн. конфиг.



изомер–Х
отн. конфиг.



изомер–Х
отн. конфиг.



изомер–Х
отн. конфиг.

579,2



553,2
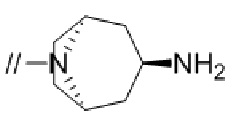


593,2
Таблица 24


изомер–Х
отн. конфиг.



рацемат
отн. конфиг.

579,2

изомер–Х
отн. конфиг.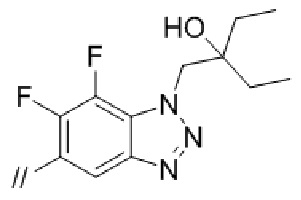











Рацемат
отн. конфиг.



изомер–Х
отн. конфиг.

607,2



581,3
Таблица 25




621,2

Рацемат
отн. конфиг.

607,2

изомер–Х
отн. конфиг.



изомер–Х
отн. конфиг.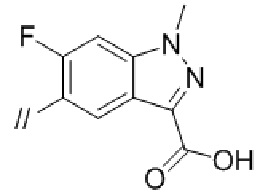



изомер–Х
отн. конфиг.



Рацемат
отн. конфиг.



изомер–Х
отн. конфиг.







изомер–Х
отн. конфиг.

Таблица 26






Рацемат
отн. конфиг.



Рацемат
отн. конфиг.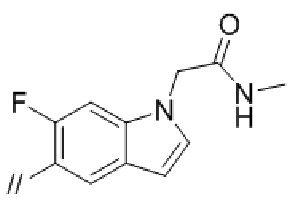



Рацемат
отн. конфиг.



Рацемат
отн. конфиг.



Рацемат
отн. конфиг.



Рацемат
отн. конфиг.



изомер–Х
отн. конфиг.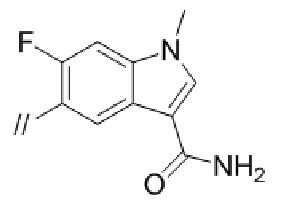

Таблица 27


изомер–Х
отн. конфиг.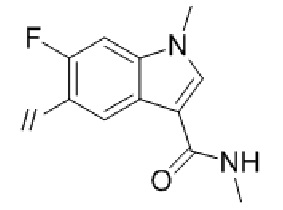



изомер–Х
отн. конфиг.



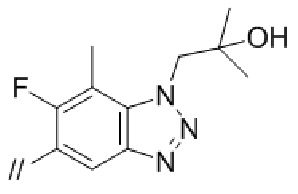







Рацемат
отн. конфиг.



Рацемат
отн. конфиг.



Рацемат
отн. конфиг.



Рацемат
отн. конфиг.



Рацемат
отн. конфиг.

Таблица 28


изомер–Х
отн. конфиг.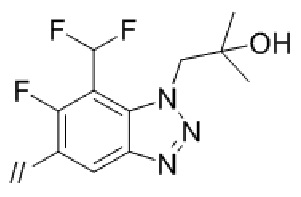



изомер–Х
отн. конфиг.



















Рацемат
отн. конфиг.



Рацемат
отн. конфиг.



изомер–Х
отн. конфиг.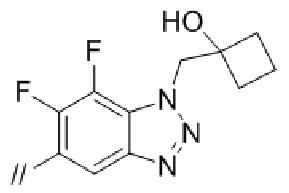





Таблица 29






изомер–Х
отн. конфиг.

591,2



565,2



605,2

изомер–Х
отн. конфиг.











Рацемат
отн. конфиг.



изомер–Х
отн. конфиг.

Таблица 30










Рацемат
отн. конфиг.



Рацемат
отн. конфиг.



Рацемат
отн. конфиг.

591,4

изомер–Х
отн. конфиг.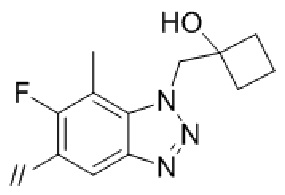











изомер–Х
отн. конфиг.

632,1
Таблица 31




597,1
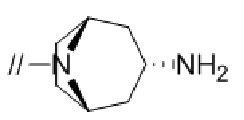


637,1

Рацемат
отн. конфиг.



Рацемат
отн. конфиг.

623,1

Рацемат
отн. конфиг.



изомер–Х
отн. конфиг.






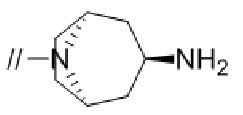


Таблица 32




изомер–Х
отн. конфиг.







изомер–Х
отн. конфиг.



изомер–Х
отн. конфиг.

576,1

изомер–Х
отн. конфиг.



изомер–Х
отн. конфиг.

592,0

изомер–Х
отн. конфиг.



изомер–Х
отн. конфиг.

Таблица 33





изомер–Х
отн. конфиг.



изомер–Х
отн. конфиг.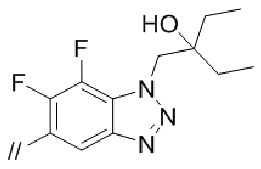



изомер–Х
отн. конфиг.

609,0

изомер–Х
отн. конфиг.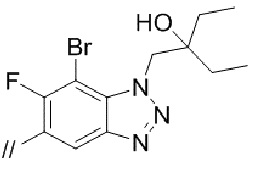

637,0

изомер–Х
отн. конфиг.

















Экспериментальный Пример 1: Измерение ингибирующей действия активности в отношении LSD1 (in vitro)
Условия для измерения ингибирующей активности соединений в отношении активности LSD1 определяют со ссылкой на документ, доступный на вебсайте PerkinElmer (U–TRF #38) и патент GlaxoSmithKline (WO2012135113).
Для измерения ингибирующей активности сначала соединение в соответствии с данным изобретением серийно разводят в диметилсульфоксиде (ДМСО). Затем раствор соединения в соответствии с данным изобретением в ДМСО (конечная концентрация ДМСО: 5%) и человеческого белка LSD1 (Abcam, ab80379) добавляют в реакционный буфер (25 мМ Tris–HCl (pH 7,5), 50 мМ KCl, 2 мМ CHAPS, 1 мМ ДТТ, 0,02% АБС). Смесь предварительно инкубируют при 25°C в течение 30 минут. Затем туда добавляют H3K4 (Me1)–биотин–меченный пептид (Anaspec #64355) (конечная концентрация: 200 нМ) и оставляют взаимодействовать в течение 60 минут. Затем туда добавляют транилципромин (конечная концентрация: 3 мМ) для остановки реакции. Затем туда добавляют раствор для обнаружения, содержащий Eu–меченное анти–H3K4 антитело (PerkinElmer, TRF0404) и Streptavidin Alexa Fluor 647 (Thermo Fisher Scientific, S21374), и смесь выдерживают при комнатной температуре в течение 1 часа. Наконец интенсивность флуоресценции при возбуждении светом с длиной волны 337 нм измеряют на PHERAstar FS (BMG Labtech) при двух длинах волны: 620 нм и 665 нм. Уровень деметилирования рассчитывают из отношения интенсивности флуоресценции при двух длинах волны, и концентрацию соединения, при которой деметилирование ингибируется на 50%, определяют как IC50 (нМ). В таблице ниже представлены результаты.
Таблица 34
Таблица 35
Результаты тестирования показывают, что соединения в соответствии с данным изобретением обладают ингибирующей активностью в отношении.
Экспериментальный Пример 2: тест на ингибирование роста клеток
В следующих условиях проводят тестирование ингибирования роста клеток in vitro в отношении клеток HEL (колония клеток острого миелоцитного лейкоза человека), клеток NCI–H1417 (колонии клеток мелкоклеточного рака легких человека) и клеток NCI–H146 (колонии клеток мелкоклеточного рака легких человека).
Клетки HEL (JCRB, Cat#: JCRB0062), клетки NCI–H1417 (ATCC, Cat#: CRL–5869) или клетки NCI–H146 (ATCC, Cat#: HTB–173), культивируемые в 10% ФБС–содержащей RPMI1640 среде (Thermo Fisher Scientific, Cat#: A10491–01) засевают в 96–луночный плоскодонный микропланшет (Thermo Fisher Scientific, Cat#: 165305) так, что каждая лунка содержит 1500 клеток HEL (100 мкл), 5000 клеток NCI–H1417 (100 мкл) или клеток 1200 NCI–H146 (100 мкл). Соединение в соответствии с данным изобретением серийно разводят в диметилсульфоксиде (ДМСО) до концентрации, которая в 500 раз выше конечной концентрации. Серийно разведенное соединение в соответствии с данным изобретением или чистый диметилсульфоксид добавляют в 10% ФБС–содержащую RPMI1640 среду до концентрации, которая в 2 раза выше конечной концентрации, и полученный продукт добавляют в количестве 100 мкл в каждую лунку культурального планшета, содержащего клетки HEL, клетки NCI–H1417 или клетки NCI–H146 так, что конечные концентрации соединения в соответствии с данным изобретением составляют 3000, 1000, 300, 100, 30, 10, 3, 1, 0,3, 0,1, 0,03 и 0,01 нМ. Конечную концентрацию диметилсульфоксида доводят до 0,2%. Клетки с соединением в соответствии с данным изобретением или с чистым диметилсульфоксидом культивируют при 37°C в инкубаторе с 5% двуокисью углерода в течение 5 дней (клетки HEL) или 10 дней (клетки NCI–H1417 и клетки NCI–H146). После культивирования планшет выдерживают при комнатной температуре в течение 30 минут и 100 мкл надосадочной жидкости берут из каждой лунки, оставляя 100 мкл раствора клеточной культуры. В каждую лунку, содержащую оставшиеся 100 мкл раствора клеточной культуры, добавляют такое же количество CellTiter–Glo 2,0 Assay (Promega, Cat#: G9242). Микропланшет встряхивают на планшетном миксере в течение 1 минуты и затем выдерживают в темном месте в течение 10 минут. Затем интенсивность люминесценции жизнеспособных клеток измеряют с применением микропланшетного ридера (PerkinElmer, EnSpire). Скорость роста клеток определяют согласно следующему уравнению, и определяют концентрацию, при которой скорость роста клеток составляет 50%, т.е. концентрацию каждого соединения в соответствии с данным изобретением, при которой рост клеток ингибируется на 50% (IC50 (нМ)).
Скорость роста клеток (%)=T/C×100
T: интенсивность люминесценции в лунке, в которую добавлено соединение в соответствии с данным изобретением (импульсы в секунду)
C: интенсивность люминесценции в лунке, в которую добавлен чистый диметилсульфоксид (импульсы в секунду)
В таблицах ниже показаны результаты.
Таблица 36
Тест ингибирования роста клеток: клетки HEL
Таблица 37
Тест ингибирования роста клеток: клетки HEL
Таблица 38
Тест ингибирования роста клеток: клетки NCI–H146
Таблица 39
Тест ингибирования роста клеток: клетки NCI–H1417
Таблица 40
Тест ингибирования роста клеток: клетки NCI–H1417
Результаты этого теста показывают, что соединение в соответствии с данным изобретением демонстрирует ингибирующие эффекты на рост клеток in vitro, и что соединение в соответствии с данным изобретением не только ингибирует активность рекомбинантного человеческого белка LSD1, но также ингибирует рост раковых клеток, что позволяет предположить, что соединение в соответствии с данным изобретением пригодно в качестве противоопухолевого агента.
Экспериментальный Пример 3: тестирование противоопухолевого эффекта с применением клеток NCI–H146 (колонии клеток мелкоклеточного рака легких человека)
Клетки NCI–H146, 3,5×106 клеток (100 мкл), подкожно имплантируют мышам BALB/cAJcl–nu/nu, и мышей с объемом опухоли в интервале от 100 до 300 мм3 делят на группы так, чтобы группы имели однородный средний объем опухоли. 5 мышам в каждой группе перорально вводят носитель (0,5% гидроксиметилпропилцеллюлозу, содержащую 0,1 N HCL) или каждое соединение из Примера. Введение проводят один раз в сутки в течение 21 дня подряд (соединение из Примера 41) или 28 дней подряд (соединения из Примеров 37, 161, 166, 175, 176 и 177). Длинные оси и короткие оси каждой опухоли измеряют два раза в неделю электрическим толщинометром для расчета объема опухоли (ОО). Согласно полученным объемам опухолей рассчитывают относительный объем опухоли (ООО) и относительное изменение объема опухоли (T/C (%)). ОО, ООО и T/C (%) рассчитывают с применением следующих уравнений.
Объем опухоли ОО (мм3)=(длинные оси, мм)×(короткие оси, мм)×(короткие оси, м)/2
Относительный объем опухоли ООО=ОО/(ОО на день деления на группы)
T/C (%)=(средний ООО в группе введения)/(средний ООО в группе введения носителя)×100.
В таблице ниже показаны результаты.
Таблица
Последним днем измерения является день, следующий за днем последнего введения. Соединение в соответствии с данным изобретением показывает противоопухолевое действе в представленной выше модели оценки эффективности, и процент снижения массы тела в последний день измерений составляет менее 20% массы тела до введения (день 0).
Результаты показывают, что соединение в соответствии с данным изобретением или его соль обладают превосходной ингибирующей активностью в отношении LSD1, демонстрируют ингибирующий эффект на рост раковых клеток, имеют низкую токсичность и вводятся перорально. Поэтому соединение в соответствии с данным изобретением или его соль пригодно в качестве агента для профилактики и/или лечения рака.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ СОЕДИНЕНИЕ БИФЕНИЛА ИЛИ ЕГО СОЛЬ | 2016 |
|
RU2726622C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА ИНГИБИТОРА LSD1 НА ОСНОВЕ ЭКСПРЕССИИ INSM1 | 2018 |
|
RU2789449C2 |
| УСИЛИТЕЛЬ ПРОТИВООПУХОЛЕВОГО ЭФФЕКТА С ПРИМЕНЕНИЕМ НОВОГО СОЕДИНЕНИЯ БИФЕНИЛА | 2018 |
|
RU2765153C2 |
| НОВОЕ ПРОИЗВОДНОЕ НИКОТИНАМИДА ИЛИ ЕГО СОЛЬ | 2011 |
|
RU2576623C2 |
| НИТРИЛСОДЕРЖАЩИЕ ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ | 2021 |
|
RU2820150C2 |
| ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV | 2010 |
|
RU2574410C2 |
| НИТРИЛСОДЕРЖАЩИЕ ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ | 2021 |
|
RU2786722C1 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
| МОДУЛЯТОРЫ ПРОТЕОЛИЗА И СООТВЕТСТВУЮЩИЕ СПОСОБЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2805511C2 |
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ 637: ПИРИДОПИРИМИДИНДИОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2008 |
|
RU2479584C2 |
Изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, обладающему ингибирующей активностью в отношении LSD1, ингибитору LSD1, фармацевтической композиции и противоопухолевому агенту на их основе, способу лечения пациента с острым миелоцитным лейкозом человека и мелкоклеточным раком легких, а также их применению в производстве такого противоопухолевого агента. Технический результат – обеспечение соединений формулы (I) или их фармацевтически приемлемых солей, обладающих ингибирующей активностью в отношении LSD1. В общей формуле (I) кольцо A является 5-9-членной моноциклической, мостиковой циклической или спироциклической азотсодержащей насыщенной гетероциклической группой, необязательно дополнительно содержащей 1 атом азота, кольцо B является фенилом или 9-членной бициклической ароматической гетероциклической группой с 1-3 атомами азота, R1 является нитро или циано, R2 является галогеном, R3 является незамещенным амино, моно– или ди(C1–C6 алкил)амино, (C3–C7 циклоалкил)амино или C1–C6 алкилом, R4 является галогеном, незамещенным C3–C7 циклоалкилом или C1–C8 алкилом, незамещенным или замещенным ОН или циклобутилом, R5 является водородом или C1–C6 алкилом, R6 является водородом, l является целым числом от 0 до 1, m является целым числом от 0 до 2, и n является целым числом от 0 до 3, где если m равно 2, два R3 могут быть одинаковыми или разными, и если n равно от 2 до 3, от двух до трех R4 могут быть одинаковыми или разными. 7 н. и 5 з.п. ф-лы, 42 табл., 300 пр.

1. Соединение, представленное формулой (I), или его фармацевтически приемлемая соль:
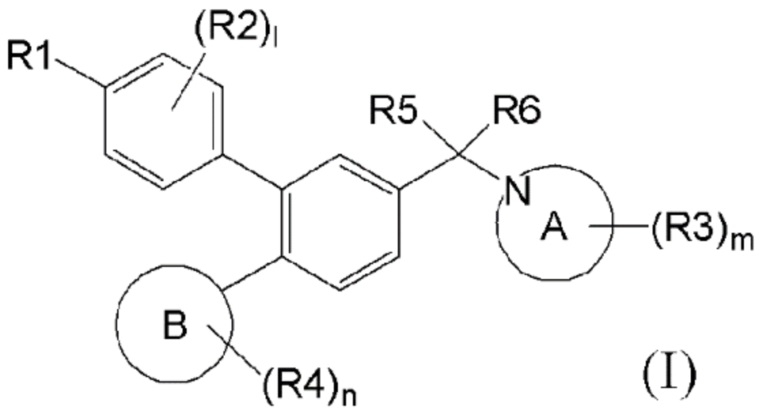
где
кольцо A является 5-9-членной моноциклической, мостиковой циклической или спироциклической азотсодержащей насыщенной гетероциклической группой, необязательно дополнительно содержащей 1 атом азота,
кольцо B является фенилом или 9-членной бициклической ароматической гетероциклической группой с 1-3 атомами азота,
R1 является нитро или циано,
R2 является галогеном,
R3 является незамещенным амино, моно– или ди(C1–C6 алкил)амино, (C3–C7 циклоалкил)амино или C1–C6 алкилом,
R4 является галогеном, незамещенным C3–C7 циклоалкилом или C1–C8 алкилом, незамещенным или замещенным ОН или циклобутилом,
R5 является водородом или C1–C6 алкилом,
R6 является водородом,
l является целым числом от 0 до 1,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 3,
где если m равно 2, два R3 могут быть одинаковыми или разными, и
если n равно от 2 до 3, от двух до трех R4 могут быть одинаковыми или разными.
2. Соединение или его фармацевтически приемлемая соль по п. 1, которое удовлетворяет следующим условиям в формуле (I):
кольцо A является 5-9-членной моноциклической, мостиковой циклической или спироциклической азотсодержащей насыщенной гетероциклической группой, имеющей от 1 до 3 атомов азота,
кольцо B является фенилом или 9-членной бициклической ароматической гетероциклической группой, которая имеет от 1 до 3 атомов азота,
R1 является нитро или циано,
R2 является галогеном,
R3 является незамещенным амино, моно– или ди(C1–C6 алкил)амино, циклобутиламино или C1–C6 алкилом, и
R4 является галогеном, незамещенным C3–C7 циклоалкилом или C1–C8 алкилом, незамещенным или замещенным ОН или циклобутилом,
где если, по меньшей мере, один R4 является C1–C8 алкилом, замещенным ОН или циклобутилом, и если присутствуют два или три заместителя, заместители могут быть одинаковыми или разными.
R5 является водородом или C1–C6 алкилом,
R6 является водородом,
l является целым числом от 0 до 1,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 3,
где если m равно 2, два R3 могут быть одинаковыми или разными, и если n равно 2–3, от двух до трех R4 могут быть одинаковыми или разными.
3. Соединение или его фармацевтически приемлемая соль по п. 1 или 2, которое удовлетворяет следующим условиям в формуле (I):
кольцо A является пирролидинилом, пиперидинилом, пиперазинилом, азепанилом, диазепанилом,

2,6–диазаспиро[3.4]октанилом, 2,7–диазаспиро[3.4]октанилом, 3,7–диазаспиро[3.4]октанилом, 2,6–диазаспиро[3.5]нонанилом, 2,7–диазаспиро[3.5]нонанилом, 2,8–диазаспиро[3.5]нонанилом, 3,7–диазаспиро[3.5]нонанилом, 3,8–диазаспиро[4.4]нонанилом, 3,8–диазаспиро[4.5]деканилом или 9–оксадиазаспиро[3.5]нонанилом,
кольцо B является фенилом или 9-членной бициклической ароматической гетероциклической группой, которая имеет 1-3 атома азота,
R1 является нитро или циано,
R2 является галогеном,
R3 является незамещенным амино, метиламино, этиламино, изопропиламино, диметиламино, циклобутиламино или метилом,
R4 является галогеном, незамещенным C3–C7 циклоалкилом или C1–C8 алкилом, незамещенным или замещенным ОН или циклобутилом,
где если присутствуют два или более заместителей, заместители могут быть одинаковыми или разными,
R5 является водородом или C1–C6 алкилом,
R6 является водородом,
l является целым числом от 0 до 1,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 3,
где если m равен 2, два R3 могут быть одинаковыми или разными, и
если n равен 2–3, от двух до трех R4 могут быть одинаковыми или разными.
4. Соединение или его фармацевтически приемлемая соль по любому из пп. 1–3, которое удовлетворяет следующим условиям в формуле (I):
кольцо A является пирролидинилом,
 ,
,
2,6–диазаспиро[3.4]октанилом или 2,6–диазаспиро[3.5]нонанилом,
кольцо B является фенилом, индолилом, индазолилом или бензотриазолилом,
R1 является циано,
R2 является фтором и находится в орто-положении относительно R1 в фениле,
R3 является незамещенным амино,
R4 является фтором, хлором, бромом, метилом, гидроксиметилпропилом, гидроксиэтилбутилом или гидроксициклобутилметилом,
R5 является водородом или метилом,
R6 является водородом,
l является целым числом от 0 до 1,
m является целым числом от 0 до 2, и
n является целым числом от 0 до 3,
где если m равно 2, два R3 могут быть одинаковыми или разными, и если n равно 2–3, от двух до трех R4 могут быть одинаковыми или разными.
5. Соединение, представляющее собой любое соединение из следующих (1)–(19), или его фармацевтически приемлемая соль;
(1) (S)–5′–((3–аминопирролидин–1–ил)метил)–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил,
(2) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2″,3–дифтор–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил–изомер–X,
(3) (S)–5′–((3–амино–3–метилпирролидин–1–ил)метил)–2″,3–дифтор–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил,
(4) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(6,7–дифтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(5) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–хлор–6–фтор–1–((1–гидроксициклобутил)метил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(6) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(7) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–хлор–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(8) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индол–5–ил)–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(9) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2″,3–дифтор–4″–(2–гидрокси–2–метилпропил)–[1,1′:2′,1″–терфенил]–4–карбонитрил–изомер–X,
(10) (S)–5′–((3–аминопирролидин–1–ил)метил)–2″,3–дифтор–4″–(2–гидрокси–2–метилпропил)–[1,1′:2′,1″–терфенил]–4–карбонитрил,
(11) 5′–(1–((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)этил)–2″,3–дифтор–4″–метил–[1,1′:2′,1″–терфенил]–4–карбонитрил–изомер–X,
(12) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(1–(2–этил–2–гидроксибутил)–6,7–дифтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(13) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–бром–6–фтор–1–(2–гидрокси–2–метилпропил)–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(14) 5′–(((1S,2S,4R)–рел–2–амино–7–азабицикло[2.2.1]гептан–7–ил)метил)–2′–(7–бром–1–(2–этил–2–гидроксибутил)–6–фтор–1H–бензо[d][1.2.3]триазол–5–ил)–3–фтор–[1,1′–бифенил]–4–карбонитрил–изомер–X,
(15) (1R,2R,4S)–рел–7–((4–метил–4″–нитро–[1,1′:2′,1″–терфенил]–4′–ил)метил)–7–азабицикло[2.2.1]гептан–2–амин–изомер–X,
(16) 3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–5′–((гексагидропирроло[3,4–c]пиррол–2(1H)–ил)метил)–[1,1′–бифенил]–4–карбонитрил,
(17) 5′–((2,6–диазаспиро[3.5]нонан–2–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил,
(18) 5′–(((3–эндо)–амино–8–азабицикло[3.2.1]октан–8–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил, и
(19) 5′–((2,6–диазаспиро[3.4]октан–6–ил)метил)–3–фтор–2′–(6–фтор–1–(2–гидрокси–2–метилпропил)–1H–индазол–5–ил)–[1,1′–бифенил]–4–карбонитрил.
6. Ингибитор LSD1, содержащий эффективное количество соединения или его фармацевтически приемлемой соли по любому из пп. 1–5, в качестве активного ингредиента.
7. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении LSD1, содержащая эффективное количество соединения или его фармацевтически приемлемой соли по любому из пп. 1–5 и фармацевтический носитель.
8. Фармацевтическая композиция по п. 7, которая является композицией для перорального введения.
9. Противоопухолевый агент, обладающий ингибирующей активностью в отношении LSD1, содержащий эффективное количество соединения или его фармацевтически приемлемой соли по любому из пп. 1–5 в качестве активного ингредиента, где опухоль выбрана из острого миелоцитного лейкоза человека и мелкоклеточного рака легких.
10. Способ лечения пациента с раком, где способ включает введение эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп. 1–5 пациенту, где рак выбран из острого миелоцитного лейкоза человека и мелкоклеточного рака легких.
11. Соединение или его фармацевтически приемлемая соль по любому из пп. 1–5 для применения в лечении пациента с раком, где рак выбран из острого миелоцитного лейкоза человека и мелкоклеточного рака легких.
12. Применение соединения или его фармацевтически приемлемой соли по любому из пп. 1–5 в производстве противоопухолевого агента, обладающего ингибирующей активностью в отношении LSD1, где опухоль выбрана из острого миелоцитного лейкоза человека и мелкоклеточного рака легких.
| WO 2016037005 A1, 10.03.2016 | |||
| WO 2016007727 A1, 14.01.2016 | |||
| ЛИЗИНСПЕЦИФИЧЕСКИЕ ИНГИБИТОРЫ ДЕМЕТИЛАЗЫ-1 И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2602814C2 |
Авторы
Даты
2022-01-26—Публикация
2018-05-25—Подача