Уровень техники
Изобретение относится к соединениям и способам ингибирования активности репликации вируса, включающим контакт 3C-подобной («3CL») протеиназы, родственной SARS-CoV-2, с терапевтически эффективным количеством ингибитора 3C-подобной протеазы, родственной SARS-CoV-2. Изобретение также относится к способам лечения коронавирусного заболевания 2019 («COVID-19») у пациента путем введения терапевтически эффективного количества ингибитора 3C-подобной протеазы, родственной SARS-CoV-2, пациенту, нуждающемуся в этом. Изобретение также относится к способам лечения COVID-19 у пациента, где способ включает введение пациенту, нуждающемуся в этом, фармацевтической композиции, содержащей терапевтически эффективное количество ингибитора 3C-подобной протеазы, родственной SARS-CoV-2.
Мировая вспышка коронавирусной болезни 2019 («COVID-19») была связана с заражениями, возникшими в конце 2019 г. в Ухане, провинция Хубэй, Китай. К середине 2020 года вспышка COVID-19 переросла в глобальную пандемию, когда было подтверждено, что миллионы людей инфицированы, что привело к сотням тысяч смертей. Возбудитель COVID-19 был идентифицирован как новый коронавирус, получивший название атипичная пневмония, вызванная коронавирусом 2 («SARS-CoV-2»). Последовательность генома SARS-CoV-2 была секвенирована из изолятов, полученных от девяти пациентов в Ухане, Китай, и было обнаружено, что она принадлежит к подроду Sarbecovirus рода Betacoronavirus. Lu, R. et al. The Lancet, 395, 10224, 565-574; online January 29, 2020. Было обнаружено, что последовательность SARS-CoV-2 имеет 88% гомологию с двумя коронавирусами типа SARS, полученными от летучих мышей, bat-SL-CoVZC45 и bat-SL-CoVZXC21, которые были собраны в 2018 году в Чжоушане, восточный Китай. Также было обнаружено, что SARS-CoV-2 имеет примерно 79% гомологии с вирусом короны атипичной пневмонии («SARS-CoV»), возбудителем вспышки SARS в 2002-2003 г, и примерно 50% гомологию с коронавирусом ближневосточного респираторного синдрома («MERS-CoV»), возбудителем вспышки респираторного вируса, возникшей на Ближнем Востоке в 2012 году. На основе недавнего анализа 103 секвенированных геномов SARS-CoV-2 было высказано предположение, что SARS-CoV- 2 можно разделить на два основных типа (L и S типы), при этом S тип является наследственным, и L тип произошел от S типа. Lu, J.; Cui, J. et al. On the origin and continuing evolution of SARS-CoV-2; National Science Review, 7(6), June 2020, 1012-1023, http://doi.org/10.1093/nsr/nwaa036. Типы S и L могут быть четко определены только двумя тесно связанными SNP в положениях 8782 (orf1ab:T8517C, синонимичные) и 28144 (ORF8: C251T, S84L). Из 103 проанализированных геномов примерно 70% принадлежали к L типу и примерно 30% к S типу. Неясно, произошла ли эволюция L типа от S типа у людей или через зоонозное промежуточное звено, но похоже, что L тип более агрессивен, чем S тип, и вмешательство человека в попытки сдержать вспышку возможно сдвинуло относительную численность типов L и S вскоре после начала вспышки SARS-CoV-2. Обнаружение предложенных S и L подтипов SARS-CoV-2 повышает вероятность того, что человек потенциально может инфицироваться последовательно отдельными подтипами или заразиться обоими подтипами одновременно. Ввиду этой растущей угрозы, в данной области техники существует острая потребность в эффективном лечении COVID-19 и в методах подавления репликации коронавируса SARS-CoV-2.
Недавние доказательства ясно показывают, что недавно возникший коронавирус SARS-CoV-2, возбудитель COVID-19 (Centers for Disease Control, CDC), приобрел способность передачи от человека к человеку, что приводит к распространению вируса среди населения. Последовательность рецептор-связывающего домена спайкового белка SARS-CoV-2 («RBD»), включая его рецептор-связывающий мотив (RBM), который непосредственно контактирует с рецептором ангиотензин-превращающего фермента 2, ACE2, аналогична RBD и RBM SARS-CoV, что убедительно свидетельствует о том, что SARS-CoV-2 использует ACE2 в качестве своего рецептора. Wan, Y.; Shang, J.; Graham, R.; Baric, R.S.; Li, F.; Receptor recognition by the novel coronavirus from Wuhan: An analysis based on decade-long structural studies of SARS coronavirus; J. Virol. 2020; doi:10.1128/JVI.00127-20. Несколько критических остатков в RBM SARS-CoV-2 (особенно Gln493) обеспечивают благоприятные взаимодействия с ACE2 человека, что согласуется со способностью SARS-CoV-2 инфицировать клетки человека. Несколько других критических остатков в RBM SARS-CoV-2 (в частности, Asn501) совместимы, но не идеальны для связывания человеческого ACE2, что позволяет предположить, что SARS-CoV-2 использует связывание ACE2 в некоторой степени для передачи от человека к человеку.
Функция репликации и транскрипции коронавируса кодируется так называемым геном «репликазы» (Ziebuhr, J., Snijder, E.J., and Gorbalenya, A.E.; Virus-encoded proteinases and proteolytic processing in the Nidovirales. J. Gen. Virol. 2000, 81, 853-879; и Fehr, A.R.; Perlman, S.; Coronaviruses: An Overview of Their Replication and Pathogenesis, Methods Mol. Biol. 2015; 1282: 1-23. doi:10.1007/978-1-4939-2438-7_1), который состоит из двух перекрывающихся полипротеинов, которые интенсивно процессируются вирусными протеазами. C-проксимальная область процессируется в одиннадцати консервативных междоменных участках соединений основной или «3C-подобной» протеазой коронавируса (Ziebuhr, Snijder, Gorbalenya, 2000 and Fehr, Perlman et al., 2015). Название «3C-подобная» протеаза происходит от определенного сходств между ферментом коронавируса и хорошо известными протеазами пикорнавируса 3C. К ним относятся предпочтения субстратов, использование цистеина в качестве нуклеофила в активном центре в катализе, и сходство их предполагаемых общих полипептидных складок. Было обнаружено, что последовательность протеазы 3CL SARS-CoV-2 (номер доступа YP_009725301.1) имеет 96,08% гомологии по сравнению с протеазой 3CL SARS-CoV (номер доступа YP_009725301.1) Xu, J.; Zhao, S.; Teng, T.; Abdalla, A.E.; Zhu, W.; Xie, L.; Wang, Y.; Guo, X.; Systematic Comparison of Two Animal-to-Human Transmitted Human Coronaviruses: SARS-CoV-2 and SARS-CoV; Viruses 2020, 12, 244; doi:10.3390/v12020244. Совсем недавно Hilgenfeld и коллеги опубликовали рентгеновскую структуру с высоким разрешением основной протеазы коронавируса SARS-CoV-2 (3CL) Zhang, L.; Lin, D.; Sun, X.; Rox, K.; Hilgenfeld, R.; X-ray Structure of Main Protease of the Novel Coronavirus SARS-CoV-2 Enables Design of α-Ketoamide Inhibitors; bioRxiv preprint doi: https://doi.org/10.1101/2020.02.17.952879. Структура указывает на различия при сравнении протеаз 3CL SARS-CoV-2 и SARS-CoV. В SARS-CoV, но не в димере протеазы SARS-CoV-2 3CL, существует полярное взаимодействие между двумя доменами III, включающее водородную связь 2,60-Å между гидроксильными группами боковой цепи остатка Thr285 каждого протомера, и поддерживается гидрофобным контактом между боковой цепью Ile286 и Thr285 Cγ2. В 3CL SARS-CoV-2 треонин заменен на аланин, а изолейцин на лейцин по сравнению с такими же остатками в 3CL SARS-CoV. Замена Thr285Ala, наблюдаемая в протеазе 3CL SARS-CoV-2, позволяет двум доменам III несколько сблизиться друг с другом (расстояние между атомами Cα остатков 285 в молекулах A и B составляет 6,77 Å в протеазе 3CL SARS-CoV и 5,21 Å в протеазе 3CL SARS-CoV-2, а расстояние между центрами масс двух доменов III сокращается с 33,4 Å до 32,1 Å). В активном сайте 3CL SARS-CoV-2, Cys145 и His 41 образуют каталитическую диаду, которая, будучи взятой вместе со скрытой молекулой воды, связанной водородной связью с His41, может считаться каталитической триадой протеазы 3CL SARS-CoV-2. Ввиду продолжающегося распространения SARS-CoV-2, вызвавшего текущую всемирную вспышку COVID-19, желательно иметь новые способы подавления репликации вируса SARS-CoV-2 и лечения COVID-19 у пациентов.
Сущность изобретения
В настоящем изобретении представлены новые соединения, которые действуют при ингибировании или профилактике репликации вируса SARS-CoV-2 и, таким образом, полезны для лечения COVID-19. Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединения, и способам лечения COVID-19 и ингибирования репликации вируса SARS-CoV-2 путем введения соединений по настоящему изобретению или фармацевтических композиций, содержащих соединения по настоящему изобретению. Следует понимать, что каждый из приведенных ниже вариантов осуществления способа лечения также может быть сформулирован как соответствующие варианты осуществления применения. Например, любое из соединений, или их фармацевтически приемлемых солей, или сольватов, или гидратов, или фармацевтически приемлемых солей соединений, сольватов или гидратов, как указано в любом из вариантов осуществления E1-E30, E45-E46, E50, E50a, E59-E68 и E80-E83 могут быть использованы для использования в качестве лекарственного средства или, альтернативно, для использования в способе лечения, как описано в любом из вариантов осуществления E36-E41, E47-E49, E52-E58a, E69-E74, E77-R79, E85-E93 и E95-E98.
E1 является соединением по E45 или E59, ниже, формулы I
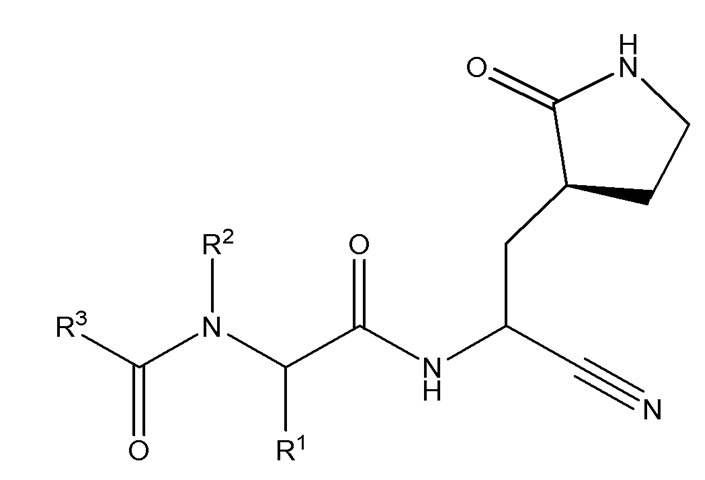 I;
I;
или его фармацевтически приемлемой солью; где R1 выбирают из группы, состоящей из C1-C6 алкила, который необязательно замещен циано или от одного до пяти атомами фтора; C2-C6 алкинила; и (C3-C6 циклоалкил)-C1-C3 алкила, который необязательно замещен от одного до двух заместителями, выбранными из трифторметила и C1-C3 алкила, или от одного до пяти атомами фтора; R2 является водородом, или R2 и R1, взятые вместе с атомами азота и углерода, к которым они присоединены, являются пирролидиновым или пиперидиновым кольцом, которое необязательно замещено от одного до четырех R2a; R2a в каждом случае независимо выбран из группы, состоящей из фтора, C1-C6 алкила, необязательно замещенного от одного до трех атомами фтора, и C1-C6 алкокси, необязательно замещенного от одного до трех атомами фтора; или две R2a группы, присоединенные к соседним атомам углерода и взятые вместе с атомами, к которым они присоединены, являются конденсированным C3-C6 циклоалкилом, который необязательно замещен от одного до четырех R2b; или две R2a группы, присоединенные к одному и тому же атому углерода и взятые вместе с атомами, к которым они присоединены, являются спиро C3-C6 циклоалкилом, который необязательно замещен от одного до четырех R2b; R2b в каждом случае независимо выбирают из фтора, C1-C3 алкила, необязательно замещенного от одного до трех атомами фтора, и C1-C3 алкокси, необязательно замещенного от одного до трех атомами фтора; R3 выбирают из группы, состоящей из C1-C8 алкила, C1-C8 алкокси, (C1-C6 алкокси)-C1-C6 алкила, C2-C6 алкинила, C2-C6 алкинилокси, C3-C12 циклоалкила, необязательно конденсированного с 5-6-членным гетероарилом или фенилом, (C3-C12 циклоалкил)-C1-C6 алкила, C3-C12 циклоалкокси, (C3-C12 циклоалкокси)-C1-C6 алкила, 4-12-членного гетероциклоалкила, который необязательно конденсирован с 5-6-членным гетероарилом или фенилом, и где указанный гетероциклоалкил содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S(O)n, (4-12-членный гетероциклоалкил)-C1-C6 алкила, где указанная гетероциклоалкильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S(O)n, C6-C10 арила, необязательно конденсированного с C4-C6 циклоалкилом или 4-7-членнным гетероциклоалкилом, (C6-C10 арил)-C1-C6 алкила, 5-10-членного гетероарила, содержащего от одного до пяти гетероатомов, независимо выбранных из N, O и S, который необязательно конденсирован с C5-C6 циклоалкилом; (5-10-членный гетероарил)-C1-C6 алкила, где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S; (C6-C10 арил)-(5-10-членного гетероарила)- где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S, (5-10-членный гетероарилокси)-C1-C6 алкила, где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S; (5-6-членный гетероарил)-(5-6-членный гетероарила)-, где каждая гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; (4-7-членнный гетероциклоалкил)-(5-6-членный гетероарила)-, где гетероциклоалкильная группа содержит от одного до трех гетероатомов, независимо выбранных из N, O и S(O)n и гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; (5-6-членный гетероарил)-(4-7-членнного гетероциклоалкила)-, где гетероциклоалкильная группа содержит от одного до трех гетероатомов, независимо выбранных из N, O и S(O)n и гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; где каждая R3 группа необязательно замещена от одного до пяти R4; R4 в каждом случае независимо выбран из группы, состоящей из оксо, галогена, гидрокси, циано, фенила, бензила, амино, (C1-C6 алкил)амино, необязательно замещенного от одного до пяти атомами фтора, ди(C1-C6 алкил)амино, необязательно замещенного от одного до десяти атомами фтора, C1-C6 алкила, необязательно замещенного от одного до пяти атомами фтора, C1-C6 алкокси, необязательно замещенного от одного до пяти атомами фтора, C1-C3 алкокси-C1-C3 алкила, необязательно замещенного от одного до пяти атомами фтора, C3-C6 циклоалкила, необязательно замещенного от одного до трех атомами фтора или C1-C3 алкила, C1-C6 алкил-C(O)NH-, необязательно замещенного от одного до пяти атомами фтора, C1-C6 алкил-S(O)2NH-, необязательно замещенного от одного до пяти атомами фтора, C1-C6 алкил-C(O)-, необязательно замещенного от одного до пяти атомами фтора, C1-C6 алкил-S(O)n-, необязательно замещенного от одного до пяти атомами фтора; и
n в каждом случае независимо выбирают из 0, 1 и 2.
E2 является соединением по любому из E1, E45 и E59, где R1 выбирают из группы, состоящей из (CH3)2CHCH2-, (CH3)3CCH2-, цианометила, 2-цианоэтила, 2,2-дифторэтила, 2,2,2-трифторэтила, 3,3-дифторпропила, 3,3,3-трифторпропила, 3,3,3-трифтор-2-метилпропила, циклопропилметила, (2,2-дифторциклопропил)метила, [1-(трифторметил)циклопропил]метила, (2-метилциклопропил)метила, (3,3-дифторциклобутил)метила, циклопентилметила и пропинила; и R2 является водородом; или его фармацевтически приемлемой солью.
E3 является соединением по любому из E1, E45 и E59, где R2 и R1, взятые вместе с атомами азота и углерода, к которым они присоединены, являются пирролидиновым или пиперидиновым кольцом который необязательно замещен от одного до четырех R2a; или его фармацевтически приемлемой солью.
E4 является соединением по любому из E1, E45, E59 и E3 где R2a в каждом случае независимо выбран из группы, состоящей из фтора, метила, изопропила, трифторметила и трет-бутокси; или две R2a группы, присоединенные к соседним атомам углерода и взятые вместе с атомами, к которым они присоединены, являются конденсированным циклопентаном или циклопропаном, который необязательно замещен от одного до четырех R2b; или две R2a группы, присоединенные к одному и тому же атому углерода и взятые вместе с атомами, к которым они присоединены, являются спироциклопропановым кольцом, которое необязательно замещено от одного до четырех R2b; или его фармацевтически приемлемой солью.
E5 является соединением по E1, E3, E4, E45 и E59, где R2b в каждом случае независимо выбран из группы, состоящей из фтора, метила и метокси; или его фармацевтически приемлемой солью.
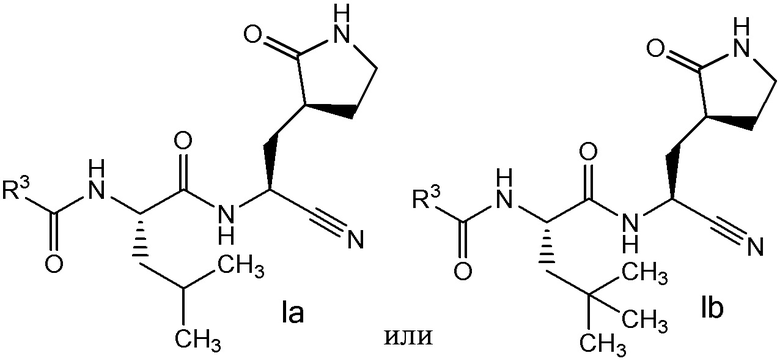
E6 является соединением по любому из E1, E2, E45 и E59, выбранным из группы, состоящей из формул Ia - Ig
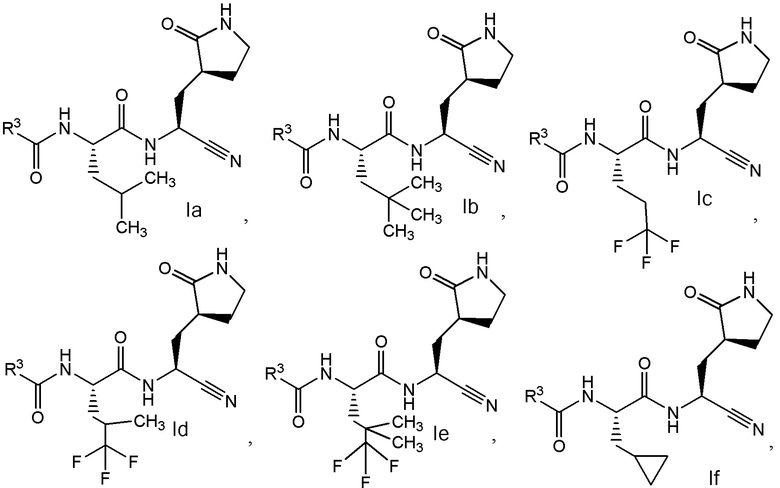
и 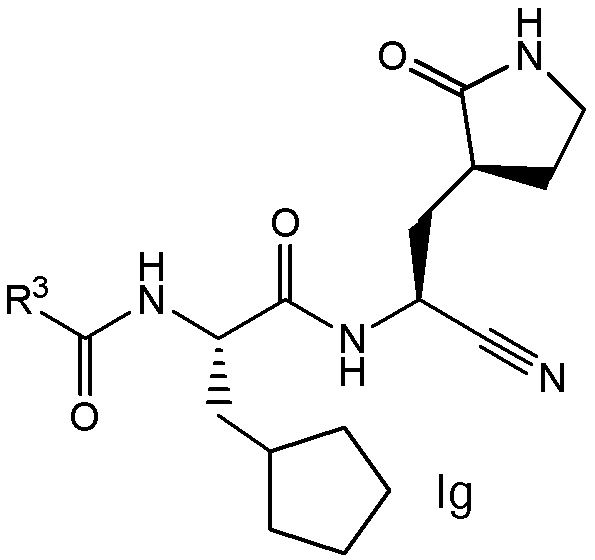 ;
;
или его фармацевтически приемлемой солью.
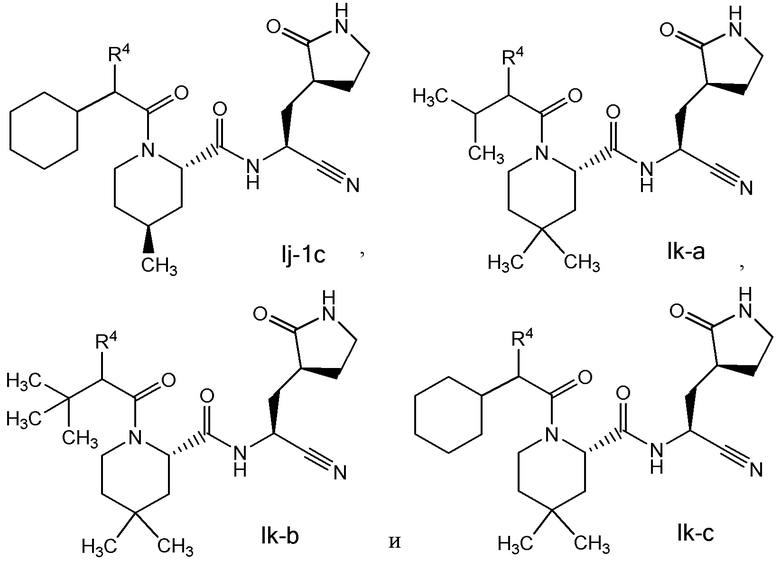
E7 является соединением по любому из E1, E3, E4, E45 и E59 выбранным из группы, состоящей из формул Ih - Ik
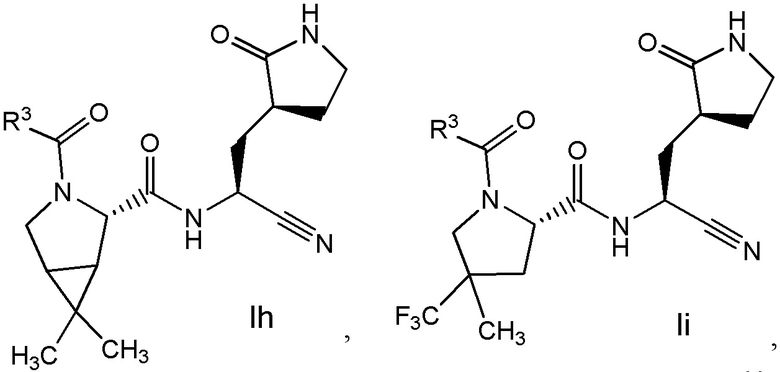
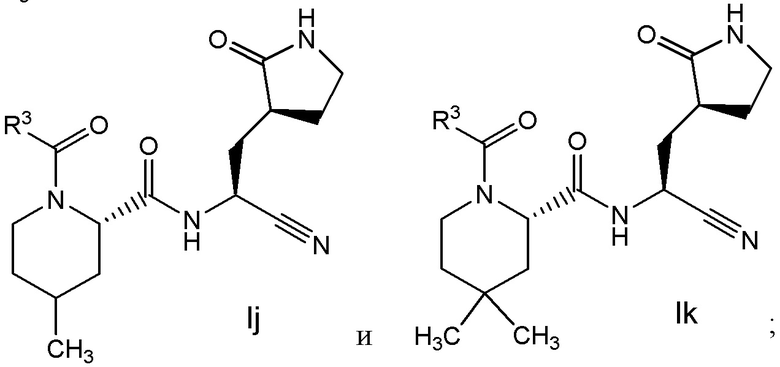
или его фармацевтически приемлемой солью.
E8 является соединением по любому из E1, E3, E4, E7, E45 и E59 выбранным из группы, состоящей из
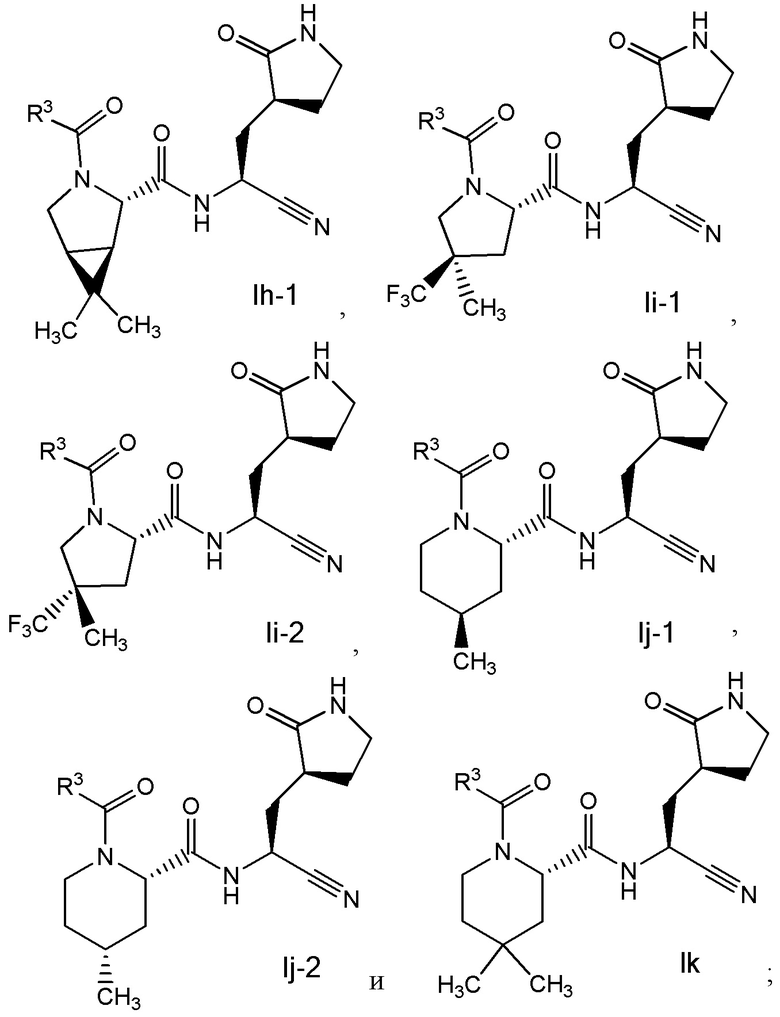
или его фармацевтически приемлемой солью.
E9 является соединением по любому из E1, E3, E4, E7, E8, E45 и E59 где R3 выбирают из группы, состоящей из C1-C6 алкила и (C3-C6 циклоалкил)-C1-C3 алкила; каждый из которых замещен от одного до четырех R4; или его фармацевтически приемлемой солью.
E10 является соединением по любому из E1, E3, E4, E7 to E9, E45 и E59 где R3 выбирают из группы, состоящей из (CH3)2CHCH(R4)-, (CH3)3CCH(R4)- и (циклогексил)CH(R4)-; или его фармацевтически приемлемой солью.
E11 является соединением по любому из E1, E3, E4, E7-E10, E45 и E59 выбранным из группы, состоящей из
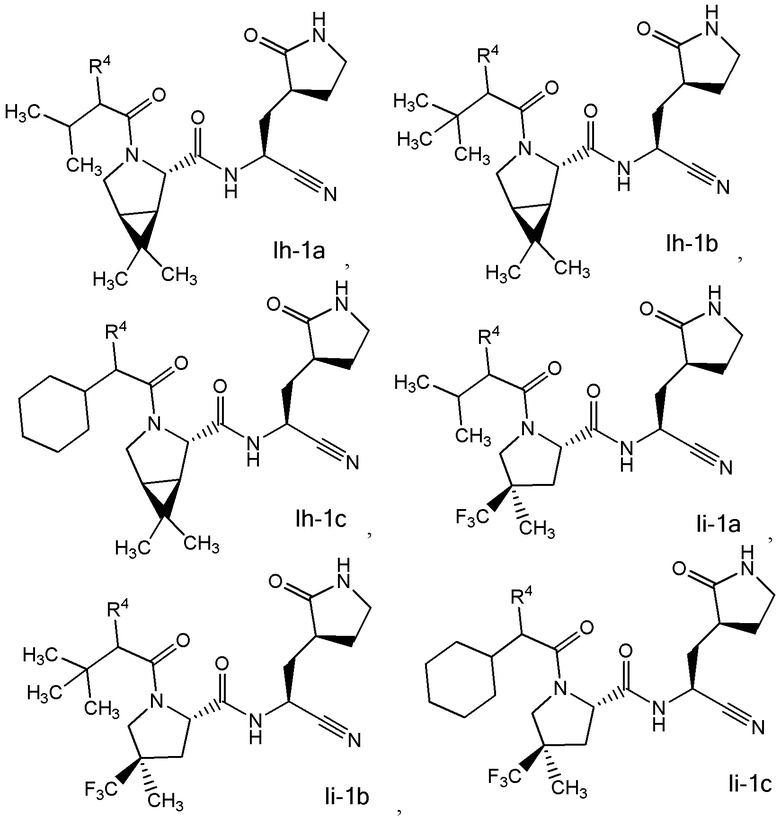 ,
,
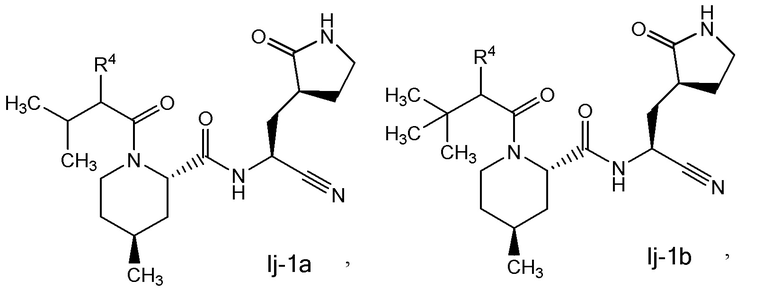
или его фармацевтически приемлемой солью.
E12 является соединением по любому из E1, E3, E4, E7-E11, E45 и E59, где R4 выбирают из группы, состоящей из (C1-C6 алкил)амино, необязательно замещенного от одного до пяти атомами фтора, C1-C6 алкил-C(O)NH-, необязательно замещенного от одного до пяти атомами фтора, и C1-C6 алкил-S(O)2NH-, необязательно замещенного от одного до пяти атомами фтора; или его фармацевтически приемлемой солью.
E13 является соединением по любому из E1, E3, E4, E7-E12, E45 и E59, где R4 выбирают из группы, состоящей из CF3C(O)NH-, CF3S(O)2NH-, CH3C(O)NH-, CH3CH2C(O)NH- и CF3CH2NH-; или его фармацевтически приемлемой солью.
E14 является соединением по любому из E1, E3, E4, E7-E13, E45 и E59, где R4 является CF3C(O)NH- или CF3S(O)2NH-; или его фармацевтически приемлемой солью.
E15 является соединением по любому из E1-E8, E45 и E59, где R3 является 4-12-членнымо гетероциклоалкилом, который необязательно конденсирован с 5-6-членным гетероарилом или фенилом, и где указанный гетероциклоалкил содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S(O)n, или является (4-12-членный гетероциклоалкил)-C1-C6 алкилом, где указанная гетероциклоалкильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S(O)n; eкаждый из которых необязательно замещен от одного до пяти R4; или его фармацевтически приемлемой солью.
E16 является соединением по любому из E1-E8, E15, E45 и E59, где 4-12-членную гетероциклоалкильную группу в R3 выбирают из группы, состоящей из ацетидинила, пирролидинила, пиперидинила, пиперазинила, морфолинила, оксетанила, тетрагидрофуранила, пиранила, 2-оксо-1,3-оксазолидинила, оксабицикло[2.2.1]гептила, 1-окса-8-азаспиро[4.5]децила, 1,1-диоксидо-1,2-тиазолидинила и 1,1-диоксидо-1,2-тиазинанила; каждый из который необязательно замещен от одного до трех R4; или его фармацевтически приемлемой солью.
E17 является соединением по любому из E1-E8, E45 и E59, где R3 выбирают из группы, состоящей из фенила, бензила, фенэтила, 5-10-членного гетероарила, содержащего от одного до пяти гетероатомов, независимо выбранных из N, O и S; (5-10-членного гетероарил)-C1-C6 алкила, где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S; и (5-10-членного гетероарилокси)-C1-C6 алкила, где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S; каждый из которых необязательно замещен от одного до пяти R4; или его фармацевтически приемлемой солью.
E18 является соединением по любому из E1-E8, E17, E45 и E59, где 5-10-членную гетероарильную группу в R3 выбирают из группы, состоящей из имидазолила, пиразолила, оксазолила, изоксазолила, тиазолила, изотиазолила, оксадиазолила, триазолила, пиридинила, пиримидинила, пиразинила, пиридазинила, индолила, бензимидазолила, пиридинопирролила, хинолинила, хиноксалинила, бензотриазолила, имидазо[1,2-a]пиридинила, имидазо[2,1-b][1,3]тиазолила, 4H-фуро[3,2-b]пирролила, 4H-тиено[3,2-b]пирролила, [1,2,4]триазоло[1,5-a]пиримидинила, [1,2,3]триазоло[1,5-a]пиридинила и нафтиридинила; каждый из которых необязательно замещен от одного до четырех R4; или его фармацевтически приемлемой солью.
E19 является соединением по любому из E1-E8, E17-E18, E45 и E59, где R3 является индолилом; который необязательно замещен от одного до четырех R4; или его фармацевтически приемлемой солью.
E20 является соединением по любому из E1-E8, E17-E19, E45 и E59, где R3 является индол-2-ил; который необязательно замещен от одного до четырех R4; и R4 в каждом случае независимо выбран из группы, состоящей из фтора, хлора, брома, гидрокси, метила, этила, пропила, изопропила, 1-метилпропила, бутила, трет-бутила, ацетила, метокси, этокси, пропокси, бутокси, трифторметила, трифторметокси, циклогексила и диэтиламино; или его фармацевтически приемлемой солью.
E21 является соединением по любому из E1, E2, E6, E9-E10, E12-E20, E45 и E59 формулы
 ;
;
или его фармацевтически приемлемой солью.
E22 является соединением по любому из E1, E2, E6, E9-E10, E12-E21, E45 и E59, где R3 выбирают из группы, состоящей из 1H-индол-2-ила, 7-фтор-4-метокси-1H-индол-2-ила, 4-метокси-7-(трифторметил)-1H-индол-2-ила, 4-метокси-1H-индол-2-ила, 4-(трифторметокси)-1H-индол-2-ила, 6-(трифторметил)-1H-индол-2-ила, 4-метокси-3,6,7-триc(трифторметил)-1H-индол-2-ила, 3-фтор-4-метокси-1H-индол-2-ила и 3,5-дифтор-4-метокси-1H-индол-2-ила; или его фармацевтически приемлемой солью.
E23 является соединением по любому из E1-E8, E21, E45 и E59, где R3 является C1-C6 алкокси; или его фармацевтически приемлемой солью.
E24 является соединением по любому из E1-E8, E21, E23, E45 и E59, где R3 выбирают из группы, состоящей из метокси, этокси и проп-2-окси; или его фармацевтически приемлемой солью.
E25 является соединением по любому из E1-E8, E21, E45 и E59, где R3 выбирают из группы, состоящей из C3-C12 циклоалкила, необязательно конденсированного с 5-6-членным гетероарилом или фенилом, (C3-C12 циклоалкил)-C1-C6 алкила, C3-C12 циклоалкокси и (C3-C12 циклоалкокси)-C1-C6 алкила; каждый из которых необязательно замещен от одного до трех R4; или его фармацевтически приемлемой солью.
E26 является соединением по любому из E1-E8, E21, E25, E45 и E59, где R3 выбирают из группы, состоящей из циклопропила, циклобутила, циклопентила, циклогексила, 1-(циклогексилокси)этила, циклогексоксиметила, циклопропилметила, циклопропилэтила, циклобутилметила, циклобутилэтила, циклопентилметила, циклопентилэтила, циклогексилметила и циклогексилэтила; каждый из которых необязательно замещен от одного до трех R4; или его фармацевтически приемлемой солью.
E27 является соединением по любому из E1-E8, E17, E45 и E59, где R3 выбирают из группы, состоящей из фенила, бензила и фенэтила, каждый из которых необязательно замещен от одного до трех R4; или его фармацевтически приемлемой солью.
E28 является соединением по любому из E1-E8, E17, E27, E45 и E59, где R4 выбирают из группы, состоящей из фтора, хлора, диметиламино, трифторметила, CF3C(O)NH- и CF3S(O)2NH-; или его фармацевтически приемлемой солью.
E29 является соединение по любому из E1, E45 и E59, выбранным из группы, состоящей из
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-{(2R)-2-(диметиламино)-2-[4-(трифторметил)фенил]ацетил}-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-{(2R)-2-(диметиламино)-2-[3-(трифторметил)фенил]ацетил}-4-метил-L-лейцинамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-6-(трифторметил)-1H-индолe-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-6-(трифторметил)-1H-индолe-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-3,6,7-трис(трифторметил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-(трифторметокси)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-(трифторметокси)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3-фтор-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3,5-дифтор-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5,7-дифтор-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-фтор-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-3,5,7-трис(трифторметил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-3,7-бис(трифторметил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-(трифторметил)-1H-индол-2-карбоксамида;
7-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-7-метил-1H-индол-2-карбоксамида;
6-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
4-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
5-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-7-(трифторметил)-1H-индол-2-карбоксамида;
4,6-дихлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-(трифторметил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-(трифторметил)-1H-индол-2-карбоксамида;
7-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-7-метил-1H-индол-2-карбоксамида;
6-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
4-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
5,7-дихлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
5-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-7-(трифторметил)-1H-индол-2-карбоксамида;
4,6-дихлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-(трифторметил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-метил-5-(трифторметил)имидазо[2,1-b][1,3]тиазол-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[4-метил-2-(трифторметил)-1,3-тиазол-5-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[5-метил-2-(трифторметил)-1,3-тиазол-4-ил]карбонил}-L-лейцинамида;
N2-[(4-бром-1-этил-3-метил-1H-пиразол-5-ил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-L-лейцинамида;
N2-[(4-хлор-1,3-диметил-1H-пиразол-5-ил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-L-лейцинамида;
3-ацетил-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3R)-2,5-диоксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-гидрокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-гидрокси-4-метокси-1H-индол-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(3,3-дифторциклобутил)ацетил]-4-метил-L-лейцинамида;
N2-[(транс-4-цианоциклогексил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида;
N2-[(транс-4-цианоциклогексил)карбонил]-N-{(1R)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[2-(циклогексилокси)пропаноил]-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[циклогексил(метокси)ацетил]-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[циклогексил(метокси)ацетил]-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(2S)-2-(диметиламино)-2-фенилацетил]-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-(пирролидин-1-илацетил)-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(2R)-2-(диметиламино)-2-фенилацетил]-4-метил-L-лейцинамида;
N2-[(4-хлор-1,3-диметил-1H-пиразол-5-ил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-3-(трифторметил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-7-(трифторметил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-3,7-бис(трифторметил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-3,5-бис(трифторметил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-3,6-бис(трифторметил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-3-(трифторметил)-1H-индол-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-(циклогексилкарбонил)-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-(циклогексилкарбонил)-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[2-(трифторметил)-1,3-тиазол-4-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-[(пропан-2-илокси)ацетил]-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(циклогексилокси)ацетил]-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-(4,4,4-трифтор-3-метилбутаноил)-L-лейцинамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-метилимидазо[2,1-b][1,3]тиазол-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-valyl]-3-азабицикло[3.1.0]hexane-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-5,5,5-трифтор-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-7-фтор-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]hexane-2-карбоксамида;
N2-[(4-бром-1-этил-3-метил-1H-пиразол-5-ил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-7-(трифторметил)-1H-индол-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-(2,6-дихлорбензоил)-4-метил-L-лейцинамида;
(2S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4,4-диметил-1-[3-метил-N-(трифторацетил)-L-валил]пиперидин-2-карбоксамида;
3-метил-N-(трифторацетил)-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-4-(трифторметил)-L-пролинамида;
(2S,4S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-{3-метил-N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-{[2-(трифторметил)-1,3-тиазол-5-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(2S)-2-(диметиламино)-2-фенилацетил]-4-метил-L-лейцинамида;
N2-[(транс-4-цианоциклогексил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида;
N2-[(транс-4-цианоциклогексил)карбонил]-N-{(1R)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида;
N-{(1R)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[2-(циклогексилокси)пропаноил]-4-метил-L-лейцинамида;
(2S,4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-[N-(трифторацетил)-L-валил]пиперидин-2-карбоксамида;
5-(бутан-2-ил)-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(4,5-дихлор-1H-имидазол-2-ил)карбонил]-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(4,5-дихлор-1H-пиразол-3-ил)карбонил]-4-метил-L-лейцинамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-2,3-диметил-4H-фуро[3,2-b]пиррол-5-карбоксамида;
5-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-пирроло[2,3-b]пиридин-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-(трифторметил)-1H-бензимидазол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-метокси-1H-пирроло[3,2-b]пиридин-2-карбоксамида;
5-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-пирроло[3,2-b]пиридин-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-фтор-1H-бензимидазол-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[3-(пропан-2-ил)-1H-пиразол-5-ил]карбонил}-L-лейцинамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-фтор-1H-бензимидазол-2-карбоксамида;
5-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-бензимидазол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5,6-дифтор-1H-бензимидазол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4H-тиено[3,2-b]пиррол-5-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[3-(2-метилпропил)-1H-пиразол-5-ил]карбонил}-L-лейцинамида;
N2-{[4-(3-хлорфенил)-1H-имидазол-2-ил]карбонил}-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида;
N2-[(3-трет-бутил-1H-пиразол-5-ил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида;
6-бром-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-бензимидазол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-метил-1H-бензимидазол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4,5,6,7-тетрагидро-1H-индазол-3-карбоксамида;
4,6-дихлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-бензимидазол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-6-(1-метилциклопропил)-4-(трифторметил)-1H-пирроло[2,3-b]пиридин-2-карбоксамида;
N2-{[5-(2-хлорфенил)-4-фтор-1H-пиразол-3-ил]карбонил}-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-2-метил-4H-тиено[3,2-b]пиррол-5-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-{[3-(4-метоксифенил)-1H-пиразол-5-ил]карбонил}-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-{[3-(2-метоксифенил)-1H-пиразол-5-ил]карбонил}-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-{[4-(4-метоксифенил)-1H-имидазол-2-ил]карбонил}-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[3-(4-метилфенил)-1H-пиразол-5-ил]карбонил}-L-лейцинамида;
7-бром-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-метил-1H-индол-2-карбоксамида;
7-бром-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
(2S,4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-[3-метил-N-(метилсульфонил)-L-валил]пиперидин-2-карбоксамида;
(2S,4S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-[N-(трифторацетил)-L-валил]пиперидин-2-карбоксамида;
(2S,4S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-[3-метил-N-(трифторацетил)-L-валил]пиперидин-2-карбоксамида;
(2S,4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-[3-метил-N-(трифторацетил)-L-валил]пиперидин-2-карбоксамида;
5-[(2S)-бутан-2-ил]-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3',3',3'-трифтор-N-(трифторацетил)-L-изолейцил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-{(2S)-2-циклогексил-2-[(трифторацетил)амино]ацетил}-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-{(2S)-2-циклопентил-2-[(трифторацетил)амино]ацетил}-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[4-метил-N-(трифторацетил)-L-лейцил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-{(2S)-2-(4,4-дифторциклогексил)-2-[(трифторацетил)амино]ацетил}-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-циклопентил-N-(трифторацетил)-L-alanyl]-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-циклогексил-N-(трифторацетил)-L-аланил]-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-L-лейцил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[6,6-дифтор-N-(трифторацетил)-L-норлейцил]-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-{(2S)-4,4,4-трифтор-2-[(трифторацетил)амино]бутаноил}-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-фтор-N-(трифторацетил)-L-валил]-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-{(2S)-2-циклопропил-2-[(трифторацетил)амино]ацетил}-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-(3,3-дифторциклобутил)-N-(трифторацетил)-L-аланил]-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-O-(трифторметил)-L-серил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-{(2S)-2-фенил-2-[(трифторацетил)амино]ацетил}-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-L-фенилаланил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3,5-дифтор-N-(трифторацетил)-L-фенилаланил]-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-3-(трифторметил)-L-фенилаланил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(2,2,2-трифторэтил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(2S,4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-{(2S)-3-метил-2-[(трифторацетил)амино]бутил}пиперидин-2-карбоксамида;
(2S,4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-{(2S)-3-метил-2-[(2,2,2-трифторэтил)амино]бутил}пиперидин-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(3,3,3-трифторпропаноил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-(N-пропаноил-L-валил)-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(2S,4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-[N-(2,2,2-трифторэтил)-L-валил]пиперидин-2-карбоксамида;
N2-[(4-хлор-1-этил-3-метил-1H-пиразол-5-ил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-L-лейцинамида;
5-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3-этил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-циклогексил-1H-индол-2-карбоксамида;
5-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3-метил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3,5-диметил-1H-индол-2-карбоксамида;
5-трет-бутил-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-(пропан-2-ил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3-этил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-6-этил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-этил-1H-индол-2-карбоксамида;
4-бутокси-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-(трифторметокси)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-6-(диэтиламино)-1H-индол-2-карбоксамида;
4-бром-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
5-бром-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
6-бром-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3-метил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-6-пропокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-7-фтор-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-7-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-6-фтор-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-фтор-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4,5-диметокси-1H-индол-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-[(4-метил-1,3-тиазол-5-ил)карбонил]-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-(этоксикарбонил)-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-(этоксикарбонил)-4-метил-L-лейцинамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-5,5,5-трифтор-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[2-(трифторметил)-1,3-оксазол-4-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[3-(трифторметил)-1,2-тиазол-4-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[3-(трифторметил)-1,2-оксазол-4-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-{[2-(трифторметил)-1,3-тиазол-4-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-5,5,5-трифтор-N2-{[2-(трифторметил)-1,3-тиазол-4-ил]карбонил}-L-норвалинамида;
(4S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-5,5,5-трифтор-N2-{[2-(трифторметил)-1,3-тиазол-4-ил]карбонил}-L-лейцинамида;
(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-5,5,5-трифтор-N2-{[2-(трифторметил)-1,3-тиазол-4-ил]карбонил}-L-лейцинамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-3-циклопентил-1-оксопропан-2-ил]-2-(трифторметил)-1,3-тиазол-4-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[5-(трифторметил)-1,2-тиазол-4-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[5-(трифторметил)-1,2-оксазол-4-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[2-(трифторметил)-1,3-оксазол-5-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[2-(трифторметил)-1,3-тиазол-5-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-5,5,5-трифтор-4-метил-N2-{[2-(трифторметил)-1,3-тиазол-4-ил]карбонил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-{[(2S)-2-метилтетрагидрофуран-2-ил]карбонил}-L-лейцинамида;
N-[(2S,4R)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-5,5,5-трифтор-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида;
N-[(2S,4S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-5,5,5-трифтор-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-5,5,5-трифтор-4,4-диметил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-3-циклопентил-1-оксопропан-2-ил]-4-метокси-1H-индол-2-карбоксамида;
5,7-дихлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
5-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-этил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-циклогексил-1H-индол-2-карбоксамида;
5-хлор-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-метил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3,5-диметил-1H-индол-2-карбоксамида;
5-трет-бутил-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-(пропан-2-ил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-7-(пропан-2-ил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-этил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-6-этил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-этил-1H-индол-2-карбоксамида;
4-бутокси-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-(трифторметокси)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-6-(диэтиламино)-1H-индол-2-карбоксамида;
4-бром-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
5-бром-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
6-бром-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-метил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-6-пропокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-метил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-6-метил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-7-фтор-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-7-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-6-фтор-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-фтор-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-6-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4,5-диметокси-1H-индол-2-карбоксамида;
5-(бутан-2-ил)-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-7-(пропан-2-ил)-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-метил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-6-метил-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-6-метокси-1H-индол-2-карбоксамида;
5-(бутан-2-ил)-N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-1H-индол-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(2R)-2-циклогексил-2-метоксиацетил]-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(2R)-2-(циклогексилокси)пропаноил]-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-(4,4,4-трифтор-3-метилбутаноил)-L-лейцинамида;
N2-[(транс-4-цианоциклогексил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(1-этил-4-метил-1H-пиразол-5-ил)карбонил]-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-(циклогексилкарбонил)-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(циклогексилокси)ацетил]-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(3,3-дифторциклобутил)ацетил]-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(пропан-2-илокси)ацетил]-L-лейцинамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3-метилимидазо[2,1-b][1,3]тиазол-2-карбоксамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(2R)-2-циклогексил-2-метоксиацетил]-4-метил-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(1-этил-4-метил-1H-пиразол-5-ил)карбонил]-4-метил-L-лейцинамида;
N2-[2-хлор-4-(метилсульфонил)бензоил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-L-лейцинамида;
N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-(2,6-дихлорбензоил)-L-лейцинамида;
(1R,2S,5S)-3-[N-(трет-бутилсульфонил)-3-метил-L-валил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-3-{[(3R)-1-бензил-5-оксопирролидин-3-ил]карбонил}-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-{[(3R)-5-оксо-1-фенилпирролидин-3-ил]карбонил}-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-3-{[(3R)-1-трет-бутил-5-оксопирролидин-3-ил]карбонил}-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[(3-метилимидазо[2,1-b][1,3]тиазол-2-ил)карбонил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-{[2-(трифторметил)-1,3-тиазол-4-ил]карбонил}-3-азабицикло[3.1.0]гексан-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-3-циклопропил-1-оксопропан-2-ил]-4-метокси-1H-индол-2-карбоксамида; и
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-3-циклопропил-1-оксопропан-2-ил]-1H-индол-2-карбоксамида;
или его фармацевтически приемлемой соли.
E30 является соединением по любому из E1, E45 и E59 выбранным из группы, состоящей из
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-7-фтор-4-метокси-1H-индол-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-7-(трифторметил)-1H-индол-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида;
N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-7-фтор-4-метокси-1H-индол-2-карбоксамида;
(2S,4S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-[N-(трифторацетил)-L-валил]пиперидин-2-карбоксамида;
(2S,4S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-[3-метил-N-(трифторацетил)-L-валил]пиперидин-2-карбоксамида;
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-{(2S)-2-циклогексил-2-[(трифторацетил)амино]ацетил}-6,6-диметил-3-азабицикло[3.1.0]гексан-2-карбоксамида;
(2S,4S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-1-{3-метил-N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамида;
3-метил-N-(трифторацетил)-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-4-(трифторметил)-L-пролинамида; и
(2S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4,4-диметил-1-[3-метил-N-(трифторацетил)-L-валил]пиперидин-2-карбоксамида;
или его фармацевтически приемлемой соли.
E31 является фармацевтической композицией, содержащей фармацевтически эффективное количество соединения по любому из E1-E30 или его фармацевтически приемлемой соль, вместе с фармацевтически приемлемым носителем.
E32 является фармацевтической композицией по E31, где композиция имеет внутривенную, подкожную, ингалируемую или пероральную дозированную формую
E33 является фармацевтической композицией по E31 или E32, где композиция имеет пероральную дозированную форму.
E34 является фармацевтической композицией по любому из E31-E33, дополнительно содержащей дополнительный терапевтический агент.
E35 является фармацевтической композицией по любому из E31-E34, где фармацевтическая композиция дополнительно содержит один или несколько из дексаметазона, азитромицина и ремдесивира.
E36 является способом лечения коронавирусной инфекции у пациента, где способ включает введение терапевтически эффективного количества соединения по любому из E1-E30 или его фармацевтически приемлемой соли, пациенту, нуждающемуся в этом.
E37 является способом по E36, где коронавирусной инфекцией является COVID-19.
E38 является способом лечения коронавирусной инфекцией у пациента, где способ включает введение фармацевтической композиции по любому из E31-E35 пациенту, нуждающемуся в этом.
E39 является способом по E38, где коронавирусной инфекцией является COVID-19.
E40 является способом ингибирования или профилактики репликации вируса SARS-CoV-2, включающим контакт протеазы 3CL коронавируса SARS-CoV-2 с терапевтически эффективным количеством соединения или его фармацевтически приемлемой соли по любому из E1-E30.
E41 является способом ингибирования или профилактики репликации вируса SARS-CoV-2 у пациента, включающим введение пациенту, нуждающемуся в ингибировании или профилактике репликации вируса SARS-CoV-2, терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по любому из E1-E30.
E42 является применением соединения или его фармацевтически приемлемой соли по любому из E1-E30 для лечения коронавирусной инфекции.
E43 является применением E42, где коронавирусной инфекцией является COVID-19.
E44 является применением соединения или его фармацевтически приемлемой соли по любому из E1-E30 для получения лекарственного средства, которое применяют для лечения коронавирусной инфекции.
E44a является применением по E44, где коронавирусной инфекцией является COVID-19.
E45 является соединением формулы I’
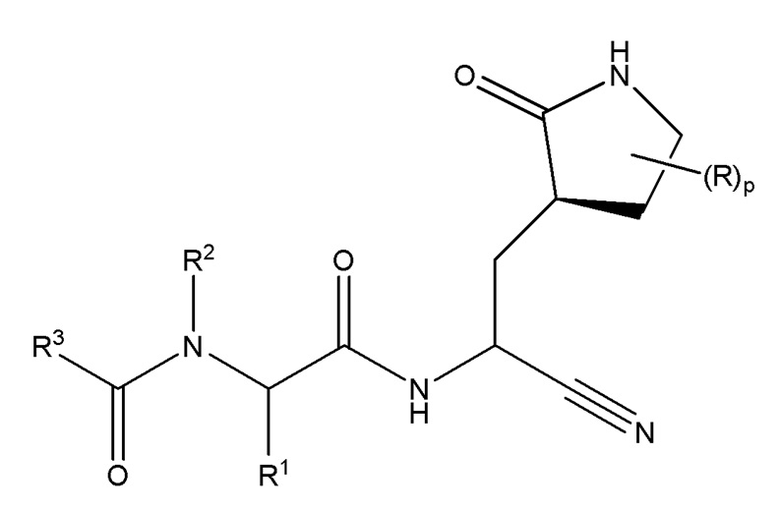 I’;
I’;
или его фармацевтически приемлемой солью; где R в каждом случае независимо является гидрокси или оксо; p равен 0, 1 или 2; R1 выбирают из группы, состоящей из C1-C6 алкила, который необязательно замещен циано или от одного до пяти атомами фтора; C2-C6 алкинила; и (C3-C6 циклоалкил)-C1-C3 алкила, который необязательно замещен от одного до двух заместителями, выбранными из трифторметила и C1-C3 алкила или от одного до пяти атомами фтора; R2 является водородом или R2 и R1 взятые вместе с атомами азота и углерода, к которым они присоединены, являются пирролидиновым или пиперидиновым кольцом, которое необязательно замещен от одного до четырех R2a; R2a в каждом случае независимо выбран из группы, состоящей из фтора, гидрокси, C1-C6 алкила, необязательно замещенного от одного до трех атомами фтора, и C1-C6 алкокси, необязательно замещенного от одного до трех атомами фтора; или две R2a группы, присоединенные к соседним атомам углерода и взятые вместе с атомами, к которым они присоединены, являются конденсированным C3-C6 циклоалкилом, который необязательно замещен от одного до четырех R2b; или две R2a группы, присоединенные к одному и тому же атому углерода и взятые вместе с атомами, к которым они присоединены, являются спиро C3-C6 циклоалкилом, который необязательно замещен от одного до четырех R2b; R2b в каждом случае независимо выбирают из фтора, гидрокси, C1-C3 алкила, необязательно независимо замещенного от одного до трех фтор или гидрокси, и C1-C3 алкокси, необязательно независимо замещенного от одного до трех фтор или гидрокси; R3 выбирают из группы, состоящей из C1-C8 алкила, C1-C8 алкокси, (C1-C6 алкокси)-C1-C6 алкила, C2-C6 алкинила, C2-C6 алкинилокси, C3-C12 циклоалкила, необязательно конденсированного с 5-6-членным гетероарилом или фенилом, (C3-C12 циклоалкил)-C1-C6 алкила, C3-C12 циклоалкокси, (C3-C12 циклоалкокси)-C1-C6 алкила, 4-12-членного гетероциклоалкила, который необязательно конденсирован с 5-6-членным гетероарилом или фенилом и где указанный гетероциклоалкил содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S(O)n, (4-12-членного гетероциклоалкил)-C1-C6 алкила, где указанная гетероциклоалкильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S(O)n, C6-C10 арила, необязательно конденсированного с C4-C6 циклоалкилом или 4-7-членнным гетероциклоалкилом, (C6-C10 арил)-C1-C6 алкила, 5-10-членного гетероарила, содержащего от одного до пяти гетероатомов, независимо выбранных из N, O и S, который необязательно конденсирован с C5-C6 циклоалкилом; (5-10-членного гетероарил)-C1-C6 алкила, где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S; (C6-C10 арил)-(5-10-членного гетероарила)-, где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S, (5-10-членного гетероарилокси)-C1-C6 алкила, где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S; (5-6-членный гетероарил)-(5-6-членный гетероарил)-, где каждая гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; (4-7-членнный гетероциклоалкил)-(5-6-членный гетероарил)-, где гетероциклоалкильная группа содержит от одного до трех гетероатомов, независимо выбранных из N, O и S(O)n и гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; (5-6-членный гетероарил)-(4-7-членнным гетероциклоалкил)-, где гетероциклоалкильная группа содержит от одного до трех гетероатомов, независимо выбранных из N, O и S(O)n и гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; где каждая R3 группа необязательно замещена от одного до пяти R4; R4 в каждом случае независимо выбран из группы, состоящей из оксо, гало, гидрокси, циано, фенила, бензила, амино, (C1-C6 алкил)амино, необязательно замещенного от одного до пяти атомами фтора, ди(C1-C6 алкил)амино, необязательно замещенного от одного до десяти атомами фтора, C1-C6 алкила, необязательно замещенного от одного до пяти атомами фтора, C1-C6 алкокси, необязательно замещенного от одного до пяти атомами фтора, C1-C3 алкокси-C1-C3 алкила, необязательно замещенного от одного до пяти атомами фтора, C3-C6 циклоалкила, необязательно замещенного от одного до трех атомами фтора или C1-C3 алкила, C1-C6 алкил-C(O)NH-, необязательно замещенного от одного до пяти атомами фтора, C1-C6 алкил-OC(O)NH-, необязательно замещенного от одного до пяти атомами фтора или одним R5, C1-C6 алкил-NHC(O)NH-, необязательно замещенного от одного до пяти атомами фтора или одним R5, C1-C6 алкил-S(O)2NH-, необязательно замещенного от одного до пяти атомами фтора или одним R5, C1-C6 алкил-C(O)-, необязательно замещенного от одного до пяти атомами фтора или одним R5, C1-C6 алкил-S(O)n-, необязательно замещенного от одного до пяти атомами фтора или одним R5; R5 выбирают из фенил, фенокси, C3-C6 циклоалкила, C3-C6 циклоалкокси, 4-7-членнного гетероциклоалкила-, где гетероциклоалкильная группа содержит от одного до трех гетероатомов, независимо выбранных из N, O и S(O)n, и 5-6-членный гетероарил-, где гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; где каждый R5 необязательно независимо замещен от одного до трех гало, C1-C3 алкилом и C1-C3 алкокси; и n в каждом случае независимо выбирают из 0, 1 и 2.
E46 является соединением, выбранным из группы, состоящей из (2S,4R)-4-трет-бутил-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамида; (2R,4S)-4-трет-бутил-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамида; 3-метил-N-(трифторацетил)-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамида; (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(метилкарбамоил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида; метил {(2S)-1-[(1R,2S,5S)-2-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}карбамоил)-6,6-диметил-3-азабицикло[3.1.0]гексан-3-ил]-3,3-диметил-1-оксобутан-2-ил}карбамата; и N-(трифторацетил)-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамида; или его фармацевтически приемлемой солью.
E47 является способом лечения коронавирусной инфекции у пациента, где способ включает введение терапевтически эффективного количества соединения по любому из E45 и E46 или его фармацевтически приемлемой соли пациенту, нуждающемуся в этом.
E48 является способом по E47, где коронавирусной инфекцией является COVID-19.
E49 является способом лечения коронавирусной инфекции у пациента, где способ включает введение терапевтически эффективного количества соединения по любому из E1-E30 и E45-E46 или его фармацевтически приемлемой соли, где вводят дополнительный терапевтический агент, и дополнительный терапевтический агент выбирают из группы, состоящей из ремдесивира, галидесивир, фавилавира/авифавира, молнупиравира, AT-527, AT-301, BLD-2660, фавипиравира, камостата, SLV213, эмтриктабина/тенофивира, клевудина, дальцетрапиба, боцепревира, ABX464, дексаметазона, гидрокортизона, конвалесцентной плазмы, гелсолина (Rhu-p65N), регданвимаба (Regkirova), равулизумаба (Ultomiris), VIR-7831/VIR-7832, BRII-196/BRII-198, COVI-AMG/COVI DROPS (STI-2020), бамланивимаба (LY-CoV555), маврилимаба, леронлимаба (PRO140), AZD7442, лензилумаба, инфликсимаба, адалимумаба, JS 016, STI-1499 (COVIGUARD), ланаделумаба (Takhzyro), канакинумаба (Ilaris), гимсилумаба, отилимаба, касиривимаба/имдевимаба (REGN-Cov2), MK-7110 (CD24Fc/SACCOVID), гепарина, апиксабана, тоцилизумаба (Actemra), сарилумаба (Kevzara), димезилата апилимода, DNL758, DC402234, PB1046, дапаглифозина, абивертиниба, ATR-002, бемцентиниба, акалабрутиниба, барицитиниба, тофацитиниба, лосмапимода, фамотидина, ритонавира, никлозамида и диминазена.
E50 является соединением (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид; или его фармацевтически приемлемой солью.
E50a является соединением (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид.
E51 является фармацевтической композицией, содержащей терапевтически эффективное количество (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида; или его фармацевтически приемлемой соли вместе с фармацевтически приемлемым носителем.
E51a является фармацевтической композицией, содержащей терапевтически эффективное количество (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида вместе с фармацевтически приемлемым носителем.
E52 является способом лечения коронавирусной инфекции у пациента, где способ включает введение терапевтически эффективного количества (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида; или его фармацевтически приемлемой соли пациенту, нуждающемуся в ее лечении.
E52a является способом лечения коронавирусной инфекции у пациента, где способ включает введение терапевтически эффективного количества (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида пациенту, нуждающемуся в ее лечении.
E53 является способом по E52, где коронавирусной инфекцией является COVID-19.
E53a является способом по E52a, где коронавирусной инфекцией является COVID-19.
E54 является способом по E52 или E53, где (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид; или его фармацевтически приемлемую соль вводят перорально.
E54a является способом по E52a или E53a, где (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид вводят перорально.
E55 является способом по E54, где от 50 мг до 1500 мг (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида; или его фармацевтически приемлемой соли вводят каждый день.
E55a является способом по E54a, где от 50 мг до 1500 мг (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида вводят каждый день.
E56 является способом по E55, где 380 мг (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида; или его фармацевтически приемлемую соль вводят три раза в день.
E56a является способом по E55a, где 380 мг (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид; или его фармацевтически приемлемую соль вводят три раза в день.
E57 является способом по E55, где от 50 мг до 1500 мг (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида; или его фармацевтически приемлемой соли вводят каждый день в виде пероральной суспензии, капсулы или таблетки.
E57a является способом по E55a, где от 50 до 1500 мг (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида; или его фармацевтически приемлемой соли вводят каждый день в виде пероральной суспензии, капсулы или таблетки.
E58 является способом по E57, где вводят таблетку.
E58a является способом по E57a, где вводят таблетку.
E59 является соединением формулы I”
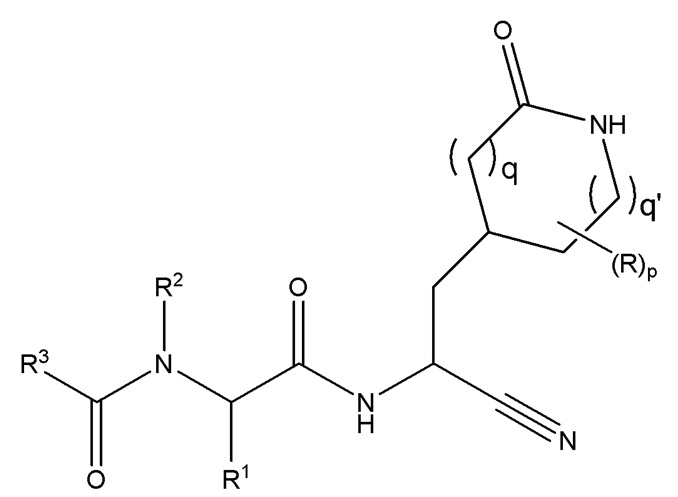 I”;
I”;
или его сольватом или гидратом, или фармацевтически приемлемой солью указанного соединения, его сольвата или гидрата;
где
R в каждом случае независимо является гидрокси или оксо;
q и q’ каждый независимо выбирают из 0, 1 и 2;
p равен 0, 1 или 2;
R1 выбирают из группы, состоящей из C1-C6 алкила, который необязательно замещен циано или от одного до пяти атомами фтора; C2-C6 алкинила; и (C3-C6 циклоалкил)-C1-C3 алкила, который необязательно замещен от одного до двух заместителями, выбранными из трифторметила и C1-C3 алкила, или от одного до пяти атомами фтора;
R2 является водородом или R2 и R1 взятые вместе с атомами азота и углерода, к которым они присоединены, являются пирролидиновым или пиперидиновым кольцом которое необязательно замещено от одного до четырех R2a;
R2a в каждом случае независимо выбран из группы, состоящей из фтора, гидрокси, C1-C6 алкила, необязательно замещенного от одного до трех атомами фтора, и C1-C6 алкокси, необязательно замещенного от одного до трех атомами фтора; или две R2a группы, присоединенные к соседним атомам углерода и взятые вместе с атомами, к которым они присоединены, являются конденсированным C3-C6 циклоалкилом, который необязательно замещен от одного до четырех R2b; или две R2a группы, присоединенные к одному и тому же атому углерода и взятые вместе с атомами, к которым они присоединены, являются спиро C3-C6 циклоалкилом, который необязательно замещен от одного до четырех R2b;
R2b в каждом случае независимо выбирают из фтора, гидрокси, C1-C3 алкила, необязательно независимо замещенного от одного до трех атомами фтора или гидрокси, и C1-C3 алкокси необязательно независимо замещенного от одного до трех атомами фтора или гидрокси;
R3 выбирают из группы, состоящей из C1-C8 алкила, C1-C8 алкокси, (C1-C6 алкокси)-C1-C6 алкила, C2-C6 алкинила, C2-C6 алкинилокси, C3-C12 циклоалкила, необязательно конденсированного с 5-6-членным гетероарилом или фенилом, (C3-C12 циклоалкил)-C1-C6 алкила, C3-C12 циклоалкокси, (C3-C12 циклоалкокси)-C1-C6 алкила, 4-12-членного гетероциклоалкила, который необязательно конденсирован с 5-6-членным гетероарилом или фенилом, и где указанный гетероциклоалкил содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S(O)n, (4-12-членного гетероциклоалкил)-C1-C6 алкила, где указанная гетероциклоалкильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S(O)n, C6-C10 арила, необязательно конденсированного с C4-C6 циклоалкилом или 4-7-членнным гетероциклоалкилом, (C6-C10 арил)-C1-C6 алкила, 5-10-членного гетероарила, содержащего от одного до пяти гетероатомов, независимо выбранных из N, O и S, который необязательно конденсирован с C5-C6 циклоалкилом; (5-10-членного гетероарил)-C1-C6 алкила, где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S; (C6-C10 арил)-(5-10-членного гетероарил)-, где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S, (5-10-членного гетероарилокси)-C1-C6 алкила, где гетероарильная группа содержит от одного до пяти гетероатомов, независимо выбранных из N, O и S; (5-6-членный гетероарил)-(5-6-членный гетероарил)-, где каждая гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; (4-7-членнным гетероциклоалкил)-(5-6-членный гетероарил)-, где гетероциклоалкильная группа содержит от одного до трех гетероатомов, независимо выбранных из N, O и S(O)n и гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; (5-6-членный гетероарил)-(4-7-членнным гетероциклоалкил)-, где гетероциклоалкильная группа содержит от одного до трех гетероатомов, независимо выбранных из N, O и S(O)n и гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; где каждая R3 группа необязательно замещена от одного до пяти R4;
R4 в каждом случае независимо выбран из группы, состоящей из оксо, гало, гидрокси, циано, фенила, бензила, амино, (C1-C6 алкил)амино, необязательно замещенного от одного до пяти атомами фтора, ди(C1-C6 алкил)амино, необязательно замещенного от одного до десяти атомами фтора, C1-C6 алкила, необязательно замещенного от одного до пяти атомами фтора, (5-6-членный гетероарил)амино-, где гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; (4-7-членнный гетероциклоалкил)амино-, где гетероциклоалкильная группа содержит от одного до трех гетероатомов, независимо выбранных из N, O и S(O)n, C1-C6 алкокси, необязательно замещенного от одного до пяти атомами фтора, C1-C3 алкокси-C1-C3 алкила, необязательно замещенного от одного до пяти атомами фтора, C3-C6 циклоалкила, необязательно замещенного от одного до трех атомами фтора или C1-C3 алкилом, C1-C6 алкил-C(O)NH-, необязательно замещенного от одного до пяти атомами фтора, C1-C6 алкил-OC(O)NH-, необязательно замещенного от одного до пяти атомами фтора или одним R5, C1-C6 алкил-NHC(O)NH-, необязательно замещенного от одного до пяти атомами фтора или одним R5, C1-C6 алкил-S(O)2NH-, необязательно замещенного от одного до пяти атомами фтора или одним R5, C1-C6 алкил-C(O)-, необязательно замещенного от одного до пяти атомами фтора или одним R5, C1-C6 алкил-S(O)n-, необязательно замещенного от одного до пяти атомами фтора или одним R5;
R5 выбирают из фенила, фенокси, C3-C6 циклоалкила, C3-C6 циклоалкокси, 4-7-членнного гетероциклоалкила, где гетероциклоалкильная группа содержит от одного до трех гетероатомов, независимо выбранных из N, O и S(O)n, и 5-6-членного гетероарила, где гетероарильная группа содержит от одного до четырех гетероатомов, независимо выбранных из N, O и S; где каждый R5 is необязательно независимо замещен от одного до трех галогеном, C1-C3 алкилом и C1-C3 алкокси; и
n в каждом случае независимо выбирают из 0, 1 и 2.
E60 является соединением по E59, которым является (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид; или его сольват или гидрат, или фармацевтически приемлемая соль указанного соединения, сольвата или гидрата.
E61 является соединением (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид, имеющий структуру
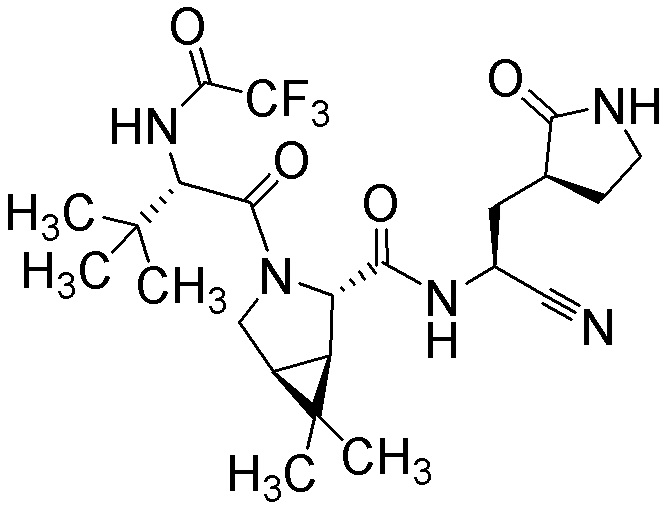 ;
;
или его сольват или гидрат.
E62 является соединением по E61, которое является кристаллическим (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамидом.
E63 является соединением по E62, которое является кристаллическим (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамидом, твердая форма 1.
E64 является соединением по E62, которое является кристаллическим (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамидом, твердая форма 4.
E65 является соединением по E61, которое является аморфным (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамидом.
E66 является соединением по E61, которое является (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамидом, метил трет-бутиловым сольватом.
E67 является соединением по E66, которое является кристаллическим (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамидом, метил трет-бутиловым сольватом.
E68 является соединением по E67, которое является кристаллическим (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид, метил трет-бутиловым сольватом, твердая форма 2.
E69 является способом лечения коронавирусной инфекции у пациента, где способ включает введение терапевтически эффективного количества соединения по любому E61-E68 пациенту, нуждающемуся в ее лечении.
E70 является способом по E69, где коронавирусной инфекцией является COVID-19.
E71 является способом по E70, где пациенту также вводят ритонавир.
E72 является способом по E71, где соединение по любому из E61-E68 и ритонавир вводят пациенту перорально.
E73 является способом по E72, где вводят от примерно 10 мг до примерно 1500 мг в сутки соединения по любому из E61-E68 и примерно 10 мг до примерно 1000 мг в сутки ритонавира.
E74 является способом по E73, где примерно 50 мг соединения по любому из E61-E68 и примерно 100 мг ритонавира каждый вводят пациенту дважды в сутки.
E75 является фармацевтической композицией, содержащей терапевтически эффективное количество (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида; или его сольвата или гидрата, или фармацевтически приемлемой соли указанного соединения, сольвата или гидрата вместе с фармацевтически приемлемым носителем.
E75a является фармацевтической композицией, содержащей терапевтически эффективное количество (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид; или его сольват или гидрат вместе с фармацевтически приемлемым носителем.
E76 является фармацевтической композицией по E75a, содержащей соединение по любому из E62-E68.
E77 является способом по E69 или E70, где примерно 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг или 750 мг соединения по любому из E61-E68 вводят пациенту перорально дважды в сутки.
E78 является способом по E77, где ритонавир вводят совместно перорально пациенту два раза в сутки.
E79 является способом по E78, где примерно 300 мг соединения по любому из E61-E68 и примерно 100 мг ритонавира совместно вводят пациенту два раза в сутки.
E80 является соединением по E63, которое характеризуется 19F пиком с химическим сдвигом -73,3±0,1 ч./млн. и 13C пики с химическими сдвигами 31,0±0,1 ч./млн., 27,9±0,1 ч./млн. и 178,9±0,2 ч./млн.
E81 является соединением по E64, которое характеризуется одним или несколькими пиками, выбранным из группы, состоящей из 19F пика с химическим сдвигом -73,6±0,1 ч./млн. и 13C пиками при 26,9±0,1 ч./млн., 21,6±0,1 ч./млн. и 41,5±0,1 ч./млн.
E82 является соединением N-(Метоксикарбонил)-3-метил-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамидом, имеющим структуру
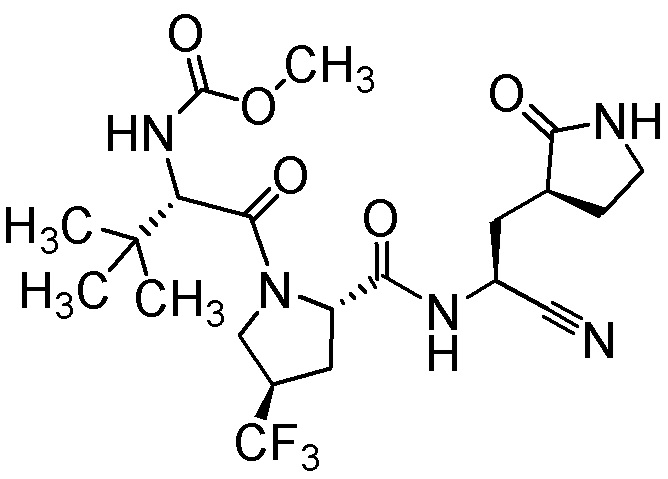 ;
;
или его сольватом или гидратом.
E83 является соединением по E82, которым является N-(Метоксикарбонил)-3-метил-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамид.
E84 является фармацевтической композицией, содержащей терапевтически эффективное количество N-(Метоксикарбонил)-3-метил-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамид; или его сольват или гидрат, вместе с фармацевтически приемлемым носителем.
E85 является способом лечения коронавирусной инфекции у пациента, где способ включает введение терапевтически эффективного количества соединения E82 или E83 пациенту, нуждающемся в ее лечении.
E86 является способом по E85, где коронавирусной инфекцией является COVID-19.
E87 является способом по E85 или E86, где вводят от 10 мг до 1500 мг в сутки соединения E82 или E83.
E88 является способом по любому из E85-E87 где соединение вводят перорально.
E89 является способом по E88, где 200 мг соединения вводят дважды в сутки.
E90 является способом таргетирования ингибирования SARS-CoV-2 соединением по любому из E1-E30, E45-E46, E50, E50a, E59-E68 и E80-E83 в качестве средства лечения показаний, вызванных вирусными инфекциями, родственными SARS-CoV-2.
E91 является способом идентификации клеточных или вирусных путей, вмешивающихся в функционирование членов, которые могут применяться для лечения показаний, вызванных инфекциями SARS-CoV-2 через введение соединения ингибитора протеазы SARS-CoV-2 по любому из E1-E30, E45-E46, E50, E50a, E59-E68 и E80-E83.
E92 является способом применения соединения ингибитора протеазы SARS-CoV-2 по любому из E1-E30, E45-E46, E50, E50a, E59-E68 и E80-E83 в качестве инструмента для понимания механизма действия других ингибиторов SARS-CoV-2.
E93 является способом применения соединения ингибитора 3C-подобной протеазы SARS-CoV-2 по любому из E1-E30, E45-E46, E50, E50a, E59-E68 и E80-E83 для проведения экспериментов по определению профиля генов для отслеживания активации или подавления генов для целей идентификации ингибиторов для лечения показаний, вызванных инфекциями SARS-CoV-2, такими как COVID-19.
E94 является фармацевтической композицией для лечения COVID-19 у млекопитающих, содержащей количество соединения ингибитора 3C-подобной протеазы SARS-CoV-2 по любому из E1-E30, E45-E46, E50, E50a, E59-E68 и E80-E83, которое эффективно для лечения COVID-19, вместе с фармацевтически приемлемым носителем.
E95 является способом лечения MERS у пациента, где способ включает введение терапевтически эффективного количества соединения по любому из E1-E30, E45-E46, E50, E50a, E59-E68 и E80-E83 пациенту, нуждающемуся в этом.
E96 является способом лечения MERS у пациента, где способ включает введение фармацевтической композиции по любому из E31-E35, E51, E51a, E75, E75a, E84 и E94 пациенту, нуждающемуся в этом.
E97 является способом ингибирования или профилактики вирусной репликации MERS, включающим контакт 3CL протеазы SARS-CoV-2 коронавируса с терапевтически эффективным количеством соединения по любому из E1-E30, 45-46, 50, 50a, 59-68 и 80-83.
E98 является способом ингибирования или профилактики вирусной репликации MERS у пациента, включающим введение пациенту, нуждающемуся в ингибировании или профилактике вирусной репликации MERS, терапевтически эффективного количества соединения по любому из E1-E30, 45-46, 50, 50a, 59-68 и 80-83.
E99 применение соединения по любому из E1-E30, 45-46, 50, 50a, 59-68 и 80-83 для лечения коронавирусной инфекции.
E100 применение по E99, где коронавирусной инфекцией является COVID-19.
E101 применение соединения по любому из E1-E30, 45-46, 50, 50a, 59-68 и 80-83 при получении лекарственного средства.
E102 является соединением по любому из вариантов осуществления E1-E30, или его фармацевтически приемлемой солью, для применения в качестве лекарственного средства.
E103 является соединением по любому из вариантов осуществления по E1-E30, или его фармацевтически приемлемой солью, для применения в способе лечения, где способ такой, как описан в любом из вариантов осуществления E36-E41.
Краткое описание чертежей
Фигура 1: Порошковая рентгеновская дифрактограмма 13, сольвата метил трет-бутилового эфира, Твердая форма 2, из альтернативного синтеза из примера 13, сольват метил трет-бутилового эфира; получение твердой формы 2.
Фигура 2: Порошковая рентгеновская дифрактограмма 13, сольвата метил трет-бутилового эфира, Твердая форма 2, из второго альтернативного синтеза из примера 13, сольват метил трет-бутилового эфира; получение твердой формы 2
Фигура 3: Порошковая рентгеновская дифрактограмма примера 13, Твердая форма 1, из перекристаллизации из примера 13; получение твердой формы 1
Фигура 4: Монокристальное рентгеновское определение структуры примера 13, Твердая форма 1. ORTEP диаграмма изображена с параметрами замещения при 50% вероятности.
Фигура 5: Наложение порошковой рентгенограммы, полученной для примера 13, Твердая форма 1, из перекристаллизации из примера 13; получение твердой формы 1 (Фигура 3) и расчетная порошковая рентгенограмма, полученная с применением программы Mercury, из данных разрешающей однокристальной рентгенограммы формы 1 (см. Монокристальное рентгеновское определение структуры примера 13, Твердая форма 1).
Фигура 6: Порошковая рентгеновская дифрактограмма примера 13, Твердая форма 4, из альтернативной перекристаллизации примера 13; получение твердой формы 4.
Фигура 7: Монокристальное рентгеновское определение структуры примера 13, Твердая форма 4. ORTEP диаграмма, изображенная с параметрами замещения при 50% вероятности.
Фигура 8: Наложение порошковой рентгенограммы, полученной для примера 13, Твердая форма 4, из альтернативной перекристаллизации примера 13; получение твердой формы 4 (Фигура 6) и расчетная порошковая рентгенограмма, полученная с применением программы Mercury, из данных разрешающей однокристальной рентгенограммы формы 4 (см. Монокристальное рентгеновское определение структуры примера 13, Твердая форма 4).
Фигура 9: Порошковая рентгеновская дифрактограмма примера 13, Твердая форма 5, из примера 96.
Фигура 10: Порошковая рентгеновская дифрактограмма промежуточного соединения C16, соль HCl.
Фигура 11: Порошковая рентгеновская дифрактограмма промежуточного соединения C91.
Фигура 12: Монокристальное рентгеновское определение структуры промежуточного соединения C91. ORTEP диаграмма, изображенная с параметрами замещения при 50% вероятности.
Фигура 13: Порошковая рентгеновская дифрактограмма промежуточного соединения C92.
Фигура 14: Порошковая рентгеновская дифрактограмма промежуточного соединения C42.
Фигура 15: Монокристальное рентгеновское определение структуры промежуточного соединения C42. ORTEP диаграмма, изображенная с параметрами замещения при 50% вероятности.
Подробное описание изобретения
Для целей настоящего изобретения, как описано и заявлено в настоящем документе, следующие термины определены следующим образом:
Используемые в настоящем документе термины «содержащий» и «включающий» используют в их открытом, неограничивающем смысле. Используемый в настоящем документе термин «лечение», если не указано иное, означает обращение, облегчение, ингибирование прогрессирования или профилактику нарушения или состояния, к которому применяется такой термин, или одного или нескольких симптомов такого нарушения или состояния. В способах лечения COVID-19 следует понимать, что COVID-19 является заболеванием, вызываемым у пациентов инфицированием вирусом SARS-CoV-2. Под вирусом SARS-CoV-2 следует понимать первоначально обнаруженный штамм вируса, а также возникающие мутантные штаммы, такие как, но не ограниченные ими, штаммы, такие как B.1.1.7 (вариант из Великобритании), B.1.351 (вариант из Южной Африки), P.1 (вариант из Бразилии) и B.1.427/B.1.429 (варианты из Калифорнии). Используемый в настоящем документе термин «лечение», если не указано иное, относится к акту лечения, в том смысле, как «лечение» определено непосредственно выше.
Термин «пациент» относится к теплокровным животным, таким как, например, морские свинки, мыши, крысы, песчанки, кошки, кролики, собаки, крупный рогатый скот, козы, овцы, лошади, обезьяны, шимпанзе и люди. Что касается лечения COVID-19, способы по изобретению особенно полезны для лечения человека.
Термин «фармацевтически приемлемое» означает, что вещество или композиция должны быть совместимы, химически и/или токсикологически, с другими ингредиентами, входящими в состав, и/или с млекопитающим, которое лечат ими.
Термин «терапевтически эффективное количество» означает количество соединения по настоящему изобретению, которое (i) лечит или предотвращает конкретное заболевание, состояние или нарушение, (ii) ослабляет, облегчает или устраняет один или несколько симптомов конкретного заболевания, состояния или нарушения, или (iii) предотвращает или задерживает начало одного или нескольких симптомов конкретного заболевания, состояния или нарушения, описанных в настоящем документе.
Используемый в настоящем документе термин «алкил» относится к насыщенному углеводородному заместителю с линейной или разветвленной цепью (т.е. заместителю, полученному из углеводорода путем удаления водорода); в одном варианте осуществления, содержащем от одного до восьми атомов углерода, в другом, до шести атомов углерода, и еще в одном, до трех атомов углерода. Неограничивающие примеры таких заместителей включают метил, этил, пропил (включая н-пропил и изопропил), бутил (включая н-бутил, изобутил, втор-бутил и трет-бутил), пентил, изоамил, гексил, гептил, октил и подобные. В другом варианте осуществления, содержащий от одного до трех атомов углерода и состоящий из метила, этила, н-пропила и изопропила.
Используемый в настоящем документе термин «алкинил» относится к насыщенному углеводородному заместителю с линейной или разветвленной цепью, который содержит тройную связь углерод-углерод (т.е. заместителю, полученному из углеводорода, содержащего тройную связь, путем удаления водорода); в одном варианте осуществления, содержащему от двух до шести атомов углерода. Неограничивающие примеры таких заместителей включают проп-2-ин-1-ил, бут-3-ин-1-ил, пент-4-ин-1-ил и гекс-5- ин-1-ил.
Термин «алкокси» относится к линейному или разветвленному насыщенному гидрокарбильному заместителю, присоединенному к кислородному радикалу (т.е. заместителю, полученному из углеводородного спирта путем удаления водорода из ОН); в одном варианте осуществления, содержащему от одного до шести атомов углерода. Не ограничивающие примеры таких заместителей включают метокси, этокси, пропокси (в том числе н-пропокси и изопропокси), бутокси (в том числе н-бутокси, изобутокси, втор-бутокси и трет-бутокси), пентокси, гексокси и подобные. В другом варианте осуществления, содержащему от одного до трех атомов углерода и состоящему из метокси, этокси, н-пропокси и изопропокси. Алкоксигруппа, которая присоединена к алкильной группе, называется алкоксиалкил. Примером алкоксиалкильной группы является метоксиметил.
Термин «алкинилокси» относится к линейному или разветвленному насыщенному гидрокарбильному заместителю, содержащему тройную связь углерод-углерод, присоединенную к кислородному радикалу (то есть заместителю, полученному из углеводородного спирта, содержащего тройную связь, путем удаления водорода из группы ОН); в одном варианте осуществления, содержащему от трех до шести атомов углерода. Неограничивающие примеры таких заместителей включают пропинилокси, бутинилокси и пентинилокси и подобные.
В некоторых случаях, количество атомов углерода в гидрокарбильном заместителе (например, алкиле, циклоалкиле и т. д.) обозначается префиксом «Cx-Cy- » или «Cx-y», где x является минимальным и y является максимальным количеством атомов углерода в заместителе. Так, например, «C1-C8алкил» или «C1-8алкил» относится к алкильному заместителю, содержащему от 1 до 8 атомов углерода, «C1-C6алкил» или «C1-6алкил» относится к алкильному заместителю, содержащему от 1 до 6 атомов углерода, «C1-C3алкил» или «C1-3алкил» относится к алкильному заместителю, содержащему от 1 до 3 атомов углерода. Иллюстрируя далее, C3-C6циклоалкил или C3-6-циклоалкил относится к насыщенной циклоалкильной группе, содержащей от 3 до 6 атомов углерода в кольце.
Термин «циклоалкил» относится к карбоциклическому заместителю, полученному удалением водорода из насыщенной карбоциклической молекулы, например, имеющей от трех до семи атомов углерода. Термин «циклоалкил» включает моноциклические насыщенные карбоциклы. Термин «C3-C7циклоалкил» означает радикал трех-семичленной кольцевой системы, которая включает группы циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Термин «C3-C6циклоалкил» означает радикал трех-шестичленной кольцевой системы, которая включает группы циклопропил, циклобутил, циклопентил и циклоалкил. Циклоалкильные группы также могут быть бициклическими или спироциклическими карбоциклами. Например, термин «C3-C12циклоалкил» включает моноциклические карбоциклы и бициклические и спироциклические группы, такие как бициклопентил, бициклогексил, бициклогептил, бициклооктил, бициклононил, спиропентил, спирогексил, спирогептил, спирооктил и спирононил.
Термин «C3-C6циклоалкокси» относится к трех-шестичленной циклоалкильной группе, присоединенной к кислородному радикалу. Примеры включают циклопропокси, циклобутокси, циклопентокси и циклогексокси.
Термин «арил» относится к карбоциклической ароматической системе. Термин «C6-C10арил» относится к карбоциклическим ароматическим системам с 3-10 атомами и включает фенил и нафтил.
В некоторых случаях количество атомов в циклическом заместителе, содержащем один или несколько гетероатомов (например, гетероариле или гетероциклоалкиле), обозначается префиксом «x-y-членный», где x является минимальным, и y является максимальным количеством атомов, образующих циклическую группу заместителя. Так, например, «4-6-членный гетероциклоалкил» относится к гетероциклоалкилу, содержащему от 4 до 6 атомов, включая от одного до трех гетероатомов, в циклической части гетероциклоалкила. Аналогичным образом фраза «5-6-членный гетероарил» относится к гетероарилу, содержащему от 5 до 6 атомов, а «5-10-членный гетероарил» относится к гетероарилу, содержащему от 5 до 10 атомов, каждый из которых включает один или несколько гетероатомов, в циклической группе гетероарила. Кроме того, фразы «5-членный гетероарил» и «6-членный гетероарил» относятся к пятичленной гетероароматической кольцевой системе и шестичленной гетероароматической кольцевой системе соответственно. Гетероатомы, присутствующие в этих кольцевых системах, выбраны из N, O и S.
Термин «гидрокси» или «гидроксил» относится к -ОН. При использовании в сочетании с другим термином, префикс «гидрокси» указывает, что заместитель, к которому присоединен префикс, замещен одним или несколькими гидрокси заместителями. Соединения, несущие углерод, у которого один или несколько гидрокси заместителей, включают, например, спирты, енолы и фенол. Термины циано и нитрил относятся к группе -CN. Термин «оксо» означает кислород, который присоединен к атому углерода двойной связью (то есть, когда R4 является оксо, тогда R4 вместе с углеродом, к которому он присоединен, являются группой C=O).
Термин «гало» или «галоген» относится к фтору (который может быть изображен как -F), хлору (который может быть изображен как -Cl), брому (который может быть изображен как -Br), или йоду (который может быть изображен как -I).
Термин «гетероциклоалкил» относится к заместителю, полученному удалением водорода из насыщенной или частично насыщенной кольцевой структуры, содержащей в общей сложности указанное число атомов, например от 4 до 6 атомов в кольце или от 4 до 12 атомов, где, по меньшей мере, один из атомов кольца является гетероатомом (т.е. кислородом, азотом или серей), при этом остальные атомы кольца выбирают независимо друг от друга, из группы, состоящей из углерода, кислорода, азота и серы. Сера может быть окисленной [т.е. S(O) или S(O)2] или нет. В группе, которая имеет гетероциклоалкильный заместитель, кольцевой атом гетероциклоалкильного заместителя, который связан с группой, может быть гетероатомом азота или может быть атомом углерода кольца. Аналогично, если гетероциклоалкильный заместитель, в свою очередь, замещен группой или заместителем, группа или заместитель могут быть связаны с гетероатомом азота или могут быть связаны с атомом углерода кольца. Следует понимать, что гетероциклическая группа может быть моноциклической, бициклической, полициклической или спироциклической.
Термин «гетероарил» относится к ароматической кольцевой структуре, содержащей указанное количество кольцевых атомов, в которой, по меньшей мере, один из кольцевых атомов является гетероатомом (т.е. кислородом, азотом или серой), а остальные кольцевые атомы независимо выбраны из группы, состоящей из углерода, кислорода, азота и серы. Примеры гетероарильных заместителей включают 6-членные гетероарильные заместители, такие как пиридил, пиразил, пиримидинил и пиридазинил; и 5-членные гетероарильные заместители, такие как триазолил, имидазолил, фуранил, тиофенил, пиразолил, пирролил, оксазолил, изоксазолил, тиазолил, 1,2,3-, 1,2,4-, 1,2,5-, или 1,3,4-оксадиазолил и изотиазолил. Гетероарильная группа также может быть бициклической гетероароматической группой, такой как индолил, бензофуранил, бензотиенил, бензимидазолил, бензотиазолил, бензоксазолил, бензоизоксазолил, оксазолопиридинил, имидазопиридинил, имидазопиримидинил и подобными. В группе, которая имеет гетероарильный заместитель, кольцевой атом гетероарильного заместителя, который связан с группой, может быть одним из гетероатомов или может быть атомом углерода кольца. Точно так же, если гетероарильный заместитель, в свою очередь, замещен группой или заместителем, группа или заместитель могут быть связаны с одним из гетероатомов, или они могут быть связаны с атомом углерода кольца. Термин «гетероарил» также включает N-оксиды пиридила и группы, содержащие N-оксидное кольцо пиридина. Кроме того, гетероарильная группа может содержать оксогруппу, такую как группа, присутствующая в пиридоновой группе. Дополнительные примеры включают фурил, тиенил, оксазолил, тиазолил, имидазолил, пиразолил, триазолил, тетразолил, изоксазолил, изотиазолил, оксадиазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиридин-2(1H)-онтл, пиридазин-2(1H)-онил, пиримидин-2(1H)-онил, пиразин-2(1H)-онил, имидазо[1,2-a]пиридинил и пиразоло[1,5-a]пиридинил. Гетероарил может быть дополнительно замещен, как определено в настоящем описании.
Примеры гетероарилов с одним кольцом и гетероциклоалкилов включают фуранил, дигидрофуранил, тетрагидрофуранил, тиофенил, дигидротиофенил, тетрагидротиофенил, пирролил, изопирролил, пирролинил, пирролидинил, имидазолил, изоимидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, триазолил, тетразолил, дитиолил, оксатиолил, оксазолил, изоксазолил, тиазолил, изотиазолил, тиазолинил, изотиазолинил, тиазолидинил, изотиазолидинил, тиаоксадиазолил, оксатиазолил, оксадиазолил (включая оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил), пиранил (включая 1,2-пиранил или 1,4-пиранил), дигидропиранил, пиридинил, пиперидинил, диазинил (включая пиридазинил, пиримидинил, пиперазинил, триазинил (включая втор-триазинил, as-триазинил и v-триазинил), оксазинил (в том числе 2H-1,2-оксазинил, 6H-1,3-оксазинил или 2H-1,4-оксазинил), изоксазинил (в том числе о-изоксазинил или п-изоксазинил), оксазолидинил, изоксазолидинил, оксатиазинил (в том числе 1,2,5-оксатиазинил или 1,2,6-оксатиазинил), оксадиазинил (в том числе, 2H-1,2,4-оксадиазинил или 2H-1,2,5-оксадиазинил), и морфолинил.
Термин «гетероарил» может также включать, если он определен как таковой, кольцевые системы, имеющие два кольца, где такие кольца могут быть конденсированы, и где одно кольцо является ароматическим, а другое кольцо не полностью является частью конъюгированной ароматической системы (т. е. гетероароматическое кольцо может быть конденсировано с циклоалкильным или гетероциклоалкильным кольцом). Не ограничивающие примеры таких кольцевых систем включают 5,6,7,8-тетрагидроизохинолинил, 5,6,7,8-тетрагидрохинолинил, 6,7-дигидро-5Н-циклопента[b]пиридинил, 6,7-дигидро-5H-циклопента[c]пиридинил, 1,4,5,6-тетрагидроциклопента[c]пиразолил, 2,4,5,6-тетрагидроциклопента[c]пиразолил, 5,6-дигидро-4H-пирроло[1,2-b]пиразолил, 6,7-дигидро-5H-пирроло[1,2-b][1,2,4]триазолил, 5,6,7,8-тетрагидро-[1,2,4]триазоло[1,5-a]пиридинил, 4,5,6,7-тетрагидропиразоло[1,5-a]пиридинил, 4,5,6,7-тетрагидро-1H-индазолил и 4,5,6,7-тетрагидро-2H-индазолил. Следует понимать, что если карбоциклическая или гетероциклическая группа может быть связана или иным образом присоединена к обозначенному субстрату через различные кольцевые атомы без указания конкретной точки присоединения, тогда подразумеваются все возможные точки, будь то через атом углерода или, например, трехвалентный атом азота. Например, термин «пиридил» означает 2-, 3- или 4-пиридил, термин «тиенил» означает 2- или 3-тиенил и так далее.
Если заместители описаны как «независимые», имеющие более одной переменной, каждый заместитель выбирают независимо от других из списка доступных переменных. Следовательно, каждый заместитель может быть идентичным или отличаться от другого заместителя.
Если заместители описаны как «независимо выбранные» из группы, каждый заместитель выбирают независимо от других. Следовательно, каждый заместитель может быть идентичным или отличаться от другого заместителя.
Используемые в настоящем документе термины «Формула I», «Формула I’» или «Формула I”» могут в дальнейшем обозначаться как «соединение по изобретению», «настоящее изобретение» и «соединение формулы I, I' или I”». Такие термины также определены как включающие все формы формулы I, I' и I”, включая их гидраты, сольваты, изомеры, кристаллические и не кристаллические формы, изоморфы, полиморфы и их метаболиты. Например, соединения по изобретению или их фармацевтически приемлемые соли могут существовать в не сольватированных и сольватированных формах. Когда растворитель или вода плотно связаны, комплекс будет иметь четко определенную стехиометрию, не зависящую от влажности. Однако, когда растворитель или вода связаны слабо, как в канальных сольватах и гигроскопичных соединениях, содержание воды/растворителя будет зависеть от влажности и условий сушки. В таких случаях, не стехиометрия будет нормой.
Соединения по изобретению могут существовать в виде клатратов или других комплексов. В объем изобретения входят комплексы, такие как клатраты, комплексы включения лекарственное средство-хозяин, где лекарственное средство и хозяин присутствуют в стехиометрических или нестехиометрических количествах. Также включены комплексы по изобретению, содержащие два или несколько органических и/или неорганических компонента, которые могут быть в стехиометрических или не стехиометрических количествах. Полученные комплексы могут быть ионизированными, частично ионизированными или не ионизированными. Обзор таких комплексов представлен в J. Pharm. Sci., 64 (8), 1269-1288 by Haleblian (August 1975).
Соединения по изобретению имеют асимметричные атомы углерода. Соединения углерод-углерод по изобретению могут быть изображены в настоящем документе с использованием сплошной линии (  ), сплошного клина (
), сплошного клина (  ) или пунктирного клина (
) или пунктирного клина (  ). Использование сплошной линии для изображения связей с асимметричными атомами углерода предназначено для обозначения того, что включены все возможные стереоизомеры (например, определенные энантиомеры, рацемические смеси и т.д.) на этом атоме углерода. Использование сплошного или пунктирного клина для изображения связей с асимметричными атомами углерода означает, что предполагается включение только показанного стереоизомера. Возможно, что соединения формулы I, I' и I” могут содержать более одного асимметричного атома углерода. В этих соединениях, использование сплошной линии для изображения связей с асимметричными атомами углерода предназначено для обозначения того, что все возможные стереоизомеры должны быть включены. Например, если не указано иное, предполагается, что соединения формулы I, I' и I” могут существовать в виде энантиомеров и диастереомеров или в виде рацематов и их смесей. Использование сплошной линии для изображения связей с одним или несколькими асимметричными атомами углерода в соединении формулы I, I' и I” и использование сплошного или пунктирного клина для изображения связей с другими асимметричными атомами углерода в том же соединении означает, что присутствует смесь диастереомеров.
). Использование сплошной линии для изображения связей с асимметричными атомами углерода предназначено для обозначения того, что включены все возможные стереоизомеры (например, определенные энантиомеры, рацемические смеси и т.д.) на этом атоме углерода. Использование сплошного или пунктирного клина для изображения связей с асимметричными атомами углерода означает, что предполагается включение только показанного стереоизомера. Возможно, что соединения формулы I, I' и I” могут содержать более одного асимметричного атома углерода. В этих соединениях, использование сплошной линии для изображения связей с асимметричными атомами углерода предназначено для обозначения того, что все возможные стереоизомеры должны быть включены. Например, если не указано иное, предполагается, что соединения формулы I, I' и I” могут существовать в виде энантиомеров и диастереомеров или в виде рацематов и их смесей. Использование сплошной линии для изображения связей с одним или несколькими асимметричными атомами углерода в соединении формулы I, I' и I” и использование сплошного или пунктирного клина для изображения связей с другими асимметричными атомами углерода в том же соединении означает, что присутствует смесь диастереомеров.
Стереоизомеры формулы I, I' и I” включают цис- и транс-изомеры, оптические изомеры, такие как энантиомеры R и S, диастереомеры, геометрические изомеры, вращательные изомеры, конформационные изомеры и таутомеры соединений по настоящему изобретению, включая соединения, проявляющие более одного типа изомерии; и их смеси (такие как рацематы и диастереомерные пары). Также включены кислотно-аддитивные или основно-аддитивные соли, где противоион является оптически активным, например, D-лактат или L-лизин, или рацемическим, например, DL-тартрат или DL-аргинин.
При кристаллизации любого рацемата возможны кристаллы двух разных типов. Первым типом является рацемическое соединение (истинный рацемат), упомянутое выше, где образуется одна гомогенная форма кристалла, содержащая оба энантиомера в эквимолярных количествах. Вторым типом является рацемическая смесь или конгломерат, где две формы кристаллов образуются в эквимолярных количествах, каждая из которых содержит единственный энантиомер.
Соединения по настоящему изобретению, такие как соединения формулы I, I' и I”, могут проявлять явление таутомерии; такие таутомеры также рассматриваются как соединения по изобретению. Все такие таутомерные формы и их смеси включены в объем соединений формулы I, I' и I”. Таутомеры существуют в виде смесей таутомеров в растворе. В твердой форме, обычно преобладает один таутомер. Даже несмотря на то, что может быть описан один таутомер, настоящее изобретение включает все таутомеры соединений формулы I, I' и I” и их соли.
Используемая в настоящем документе фраза «фармацевтически приемлемые соли», если не указано иное, включает соли кислотных или основных групп, которые могут присутствовать в соединениях, описанных в настоящем документе. Соединения, используемые в способах по настоящему изобретению, которые являются основными по природе, способны образовывать широкий спектр солей с различными неорганическими и органическими кислотами. Кислотами, которые можно использовать для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений, являются те, которые образуют нетоксичные кислотно-аддитивные соли, то есть соли, содержащие фармакологически приемлемые анионы, такие как ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, эдетат кальция, камзилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдетат, эдислат, эстолат, эзилат, этилсукцинат, фумарат, глюцепат, глюконат, глутамат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, йодид, изетионат, лактат, лактобионат, лаурат, малат, малеат, миндалят, мезилат, метилсульфат, мукат, напсилат, нитрат, олеат, оксалат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодод и валерат.
Что касается соединений изобретения, используемых в способах изобретения, если соединения также существуют в таутомерных формах, то настоящее изобретение относится к этим таутомерам и применению всех таких таутомеров и их смесей.
Настоящее изобретение также включает соединения и способы лечения коронавирусных инфекций, таких как COVID-19, и способы ингибирования SARS-CoV-2 с помощью изотопно меченых соединений, которые идентичны перечисленным в настоящем документе, но где один или несколько атомов являются заменены атомами, имеющими атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат указанные выше изотопы и/или изотопы других атомов, входят в объем настоящего изобретения. Некоторые меченые изотопами соединения по настоящему изобретению, например те, в которые включены радиоактивные изотопы, такие как 3H и 14C, могут быть использованы в анализах распределения лекарственного средства и/или субстрата в тканях. Изотопы тритий, т.е. 3H, и углерод-14, т.е. 14C, особенно предпочтительны из-за простоты их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может дать определенные терапевтические преимущества, обусловленные большей метаболической стабильностью, например, увеличенный период полувыведения in vivo или уменьшенные требования к дозировке, и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Меченые изотопами соединения, используемые в способах по настоящему изобретению, и их пролекарства, как правило, могут быть получены путем проведения процедур получения соединений, описанных в данной области техники, путем замены легко доступным изотопно-меченным реагентом не изотопно-меченного реагента.
Это изобретение также включает способы с использованием фармацевтических композиций и способы лечения коронавирусных инфекций, таких как инфекции COVID-19, путем введения пролекарств соединений по изобретению. Соединения, содержащие свободные амино, амидо или гидроксигруппы, могут быть превращены в пролекарства. Пролекарства включают соединения, в которых аминокислотный остаток или полипептидная цепь из двух или нескольких (например, двух, трех или четырех) аминокислотных остатков ковалентно связана через сложноэфирную связь с гидрокси соединений, используемых в способах по настоящему изобретению. Аминокислотные остатки включают, но не ограничиваются ими, 20 встречающихся в природе аминокислот, обычно обозначаемых трехбуквенными символами, и также включают 4-гидроксипролин, гидроксилизин, десмозин, изодесмозин, 3-метилгистидин, норвалин, бета-аланин, гамма-аминомасляную кислоту, цитруллин, гомоцистеин, гомосерин, орнитин и метионинсульфон. Также включены дополнительные типы пролекарств. Например, свободные гидроксигруппы могут быть дериватизированы с использованием групп, включающих, но не ограниченных ими, гемисукцинаты, сложные фосфатные эфиры, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, как указано в Advanced Drug Delivery Reviews, 1996, 19, 115. Карбаматные пролекарства гидрокси и аминогрупп также включены, также как и карбонатные пролекарства, сульфонатные эфиры и сульфатные эфиры гидроксигрупп. Дериватизация гидроксигрупп в виде (ацилокси)метиловых и (ацилокси)этиловых эфиров, где ацильная группа может быть алкиловым эфиром, необязательно замещенным группами, включая, но не ограничиваясь ими, функциональные группы простого эфира, амина и карбоновой кислоты, или где ацильной группой является сложный эфир аминокислоты, как описано выше, также охватывается. Пролекарства этого типа описаны в J. Med. Chem., 1996, 29, 10. Свободные амины также могут быть образованы в виде амидов, сульфонамидов или фосфонамидов. Все эти пролекарства могут включать группы, включая, но не ограничиваясь ими, функциональные группы простого эфира, амина и карбоновой кислоты.
Соединения по настоящему изобретению можно использовать в способах по настоящему изобретению в сочетании с другими лекарственными средствами. Например, введение пациенту, инфицированному коронавирусом SARS-CoV-2 (т.е. пациенту с COVID-19), ингибитора протеазы 3CL коронавируса SARS-CoV-2 по изобретению и интерферона, такого как интерферон альфа или пегилированного интерферона, такого как PEG-Intron или Pegasus, может обеспечить большую клиническую пользу, чем дозирование либо только интерферона, либо пегилированного интерферона, либо только ингибитора коронавируса SARS-CoV-2. Другие дополнительные агенты, которые можно использовать в способах по настоящему изобретению, включают дексаметазон, азитромицин и ремдесивир. Примеры более значительных клинических преимуществ могут включать большее уменьшение симптомов COVID-19, более быстрое время для облегчения симптомов, уменьшение патологии легких, большее снижение количества коронавируса SARS-CoV-2 у пациента (вирусной нагрузки) и снижение смертности.
Коронавирус SARS-CoV-2 инфицирует клетки, экспрессирующие Р-гликопротеин. Некоторые из ингибиторов протеазы 3CL коронавируса SARS-CoV-2 по изобретению являются субстратами P-гликопротеина. Соединения, которые ингибируют коронавирус SARS-CoV-2, которые также являются субстратами P-гликопротеина, могут быть дозированы с ингибитором P-гликопротеина. Примерами ингибиторов Р-гликопротеина являются верапамил, винбластин, кетоконазол, нелфинавир, ритонавир или циклоспорин. Ингибиторы Р-гликопротеина действуют путем ингибирования истечения ингибиторов коронавируса SARS-CoV-2 по изобретению из клетки. Ингибирование истечения на основе P-гликопротеина предотвратит снижение внутриклеточных концентраций ингибитора коронавируса SARS-CoV-2 из-за оттока P-гликопротеина. Ингибирование оттока Р-гликопротеина приведет к более высоким внутриклеточным концентрациям ингибиторов коронавируса SARS-CoV-2. Дозирование пациента, инфицированного коронавирусом SARS-CoV-2, ингибиторов протеазы 3CL коронавируса SARS-CoV-2 по изобретению и ингибитора P-гликопротеина может снизить количество ингибитора протеазы коронавируса 3CL SARS-CoV-2, необходимое для достижения эффективной дозы за счет увеличения внутриклеточной концентрации ингибитора протеазы 3CL коронавируса SARS-CoV-2.
Среди агентов, которые могут быть использованы для увеличения воздействия соединения по настоящему изобретению на млекопитающее, есть те, которые могут действовать как ингибиторы по меньшей мере одной изоформы ферментов цитохрома P450 (CYP450). Изоформы CYP450, которые можно эффективно ингибировать, включают, но не ограничиваются ими, CYP1A2, CYP2D6, CYP2C9, CYP2C19 и CYP3A4. Соединения, используемые в способах по настоящему изобретению, включают соединения, которые могут быть субстратами CYP3A4 и метаболизируются CYP3A4. Дозирование пациенту, инфицированному коронавирусом SARS-CoV-2, ингибитора коронавируса SARS-CoV-2, который является субстратом CYP3A4, такого как ингибитор протеазы 3CL коронавируса SARS-CoV-2, и ингибитора CYP3A4, такого как ритонавир, нелфинавир или делавирдин, снизит метаболизм ингибитора коронавируса SARS-CoV-2 с помощью CYP3A4. Это приведет к снижению клиренса ингибитора коронавируса SARS-CoV-2 и увеличению концентрации ингибитора коронавируса SARS-CoV-2 в плазме крови. Сниженный клиренс и более высокие концентрации в плазме могут привести к более низкой эффективной дозе ингибитора коронавируса SARS-CoV-2.
Дополнительные терапевтические агенты, которые можно использовать в сочетании с ингибиторами SARS-CoV-2 в способах по настоящему изобретению, включают следующие:
Ингибиторы PLpro, апиломод, EIDD-2801, рибавирин, валганцикловир, β-тимидин, аспартам, окспренолол, доксициклин, ацетофеназин, иопромид, рибофлавин, репротерол, 2,2′-циклоцитидин, хлорамфеникол, хлорфенезин карбамат, леводропропизин, цефамандол, флоксуридин, тигециклин, пеметрексед, L(+)-аскорбиновую кислоту, глутатион, гесперетин, адеметионин, мазопрокол, изотретиноин, дантролен, сульфасалазин антибактериальный, силибин, никардипин, силденафил, платикодин, хризин, неогесперидин, баикалин, 9 сугетриол-3,9-диацетат, (-)-эпигаллокатехин галлат, файтантрин D, 2-(3,4-дигидроксифенил)-2-[[2-(3,4-дигидроксифенил)-3,4-дигидро-5,7-дигидрокси-2H-1-бензопиран-3-ил]окси]-3,4-дигидро-2H-1-бензопиран-3,4,5,7-тетрол, 2,2-ди(3-индолил)-3-индолон, (S)-(1S,2R,4aS,5R,8aS)-1-формамидо-1,4a-диметил-6-метилен-5-((E)-2-(2-оксо-2,5-дигидрофуран-3-ил)этенил)декагидронафталин-2-ил-2-амино-3-фенилпропаноат, пицеатаннол, розмариновую кислоту и магнолол.
Ингибиторы 3CLpro, лаймециклин, хлоргексидин, альфузозин, циластатин, фамотидин, альмитрин, прогабид, непафенак, карведилол, ампренавир, тигециклин, монтелукаст, карминовую кислоту, мимозин, флавин, лютеин, цефпирамид, фенетициллин, кандоксатрил, никардипин, эстрадиол, валерат, пиоглитазон, кониваптан, телмисартан, доксициклин, окситетрациклин, (1S,2R,4aS,5R,8aS)-1-формамидо-1,4a-диметил-6-метилен-5-((E)-2-(2-оксо-2,5-дигидрофуран-3-ил)этенил)декагидронафталин-2-ил 5-((R)-1,2-дитиолан-3-ил)пентаноат, бетулонал, хризин-7-О-β-глюкуронид, андрографизид, (1S,2R,4aS,5R,8aS)-1-формамидо-1,4a-диметил-6-метилен-5-((E)-2-(2-оксо-2,5-дигидрофуран-3-ил)этенил)декагидронафталин-2-ил2-нитробензоат, 2β-гидрокси-3,4-секофриделолактон-27-ую кислоту (S)-(1S,2R,4aS,5R,8aS)-1-формамидо-1,4a-диметил-6-метилен-5-((E)-2-(2-оксо-2,5-дигидрофуран-3-ил)этенил)декагидронафталин-2-ил-2-амино-3-фенилпропаноат, изодекортинол, церевистерол, гесперидин, неогесперидин, андрограпанин, 2-((1R,5R,6R,8aS)-6-гидрокси-5-(гидроксиметил)-5,8a-диметил-2-метилендекагидронафталин-1-ил)этилбензоат, космосиин, клейстокальтон А, 2,2-ди(3-индолил)-3-индолон, биоробин, гнидицин, филлаэмблинол, теафлавин 3,3'-ди-O-галлат, розмариновую кислоту, куиченсид I, олеаноловую кислоту, стигмаст-5-ен-3-ол, деацетилцентапикрин и берхемол.
Ингибиторы RdRp, валганцикловир, хлоргексидин, цефтибутен, фенотерол, флударабин, итраконазол, цефуроксим, атоваквон, хенодезексихолевую кислоту, кромолин, панкурония бромид, кортизон, тиболон, новобиоцин, силубин, идарубицин бромокриптин, дифеноксилат, бензилпеннициорил G, габигартан этексилат, гнидицин, 2β,30β-дигидрокси-3,4-секофриделолактон-27-лактон, 14-деокси-11,12-дидегидроандрографолид, гнидитрин, теафлавин 3,3'-ди-O-галлат, (R)-((1R,5aS,6R,9aS)-1,5a-диметил-7-метилен-3-оксо-6-((E)-2-(2-оксо-2,5-дигидрофуран-3-ил)этенил)декагидро-1H-бензо[c]азепин-1-ил)метил2-амино-3-фенилпропаноат, 2β-Гидрокси-3,4-секофриделолактон-27-овую кислоту, 2-(3,4-дигидроксифенил)-2-[[2-(3,4-дигидроксифенил)-3,4-дигидро-5,7-дигидрокси-2H-1-бензопиран-3-ил]окси]-3,4-дигидро-2H-1-бензопиран-3,4,5,7-тетрол, филлаэмблицин B, 14-гидроксициперотундон, андрографизид, 2-((1R,5R,6R,8aS)-6-гидрокси-5-(гидроксиметил)-5,8a-диметил-2-метилендекагидронафталин-1-ил)этилбензоат, андрографолид, сугетриол-3,9-диацетат, Байкалин, (1S,2R,4aS,5R,8aS)-1-формамидо-1,4a-диметил-6-метилен-5-((E)-2-(2-оксо-2,5-дигидрофуран-3-ил)этенил)декагидронафталин-2-ил 5-((R)-1,2-дитиолан-3-ил)пентаноат, 1,7-дигидрокси-3-метоксексантон, 1,2,6-триметокси-8-[(6-O-β-D-ксилопиранозил-β-D-глюкопиранозил)окси]-9H-ксантен-9-он и 1,8-дигидрокси-6-метокси-2-[(6-O-β-D-ксилопиранозил-β-D-глюкопиранозил)окси]-9H-ксантен-9-он, 8-(β-D-глюкопиранозилокси)-1,3,5-тригидрокси-9H-ксантен-9-он.
Дополнительные терапевтические агенты, которые можно использовать в способах по настоящему изобретению, включают диосмин, гесперидин, MK-3207, венетоклакс, дигидроэргокристин, болазин, R428, дитеркалиний, этопозид, тенипозид, UK-432097, иринотекан, люмакафтор, велпатасвир, элуксадолин, ледипасвир, лопинавир/ритонавир+рибавирин, альферон и преднизон. Другие дополнительные агенты, используемые в способах по настоящему изобретению, включают дексаметазон, азитромицин и ремдесивир, а также боцепревир, умифеновир и фавипиравир.
Другие дополнительные агенты, которые можно использовать в способах по настоящему изобретению, включают соединения α-кетоамидов, обозначенные как 11r, 13a и 13b, показанные ниже, как описано у Zhang, L.; Lin, D.; Sun, X.; Rox, K.; Hilgenfeld, R.; X-ray Structure of Main Protease of the Novel Coronavirus SARS-CoV-2 Enables Design of α-Ketoamide Inhibitors; bioRxiv preprint doi: https://doi.org/10.1101/2020.02.17.952879
Дополнительные агенты, которые могут применяться в способах по настоящему изобретению, включают активаторы пути RIG 1, такие, как описаны в патенте США № 9,884,876.
Другие дополнительные терапевтические агенты включают ингибиторы протеазы, такие, как описаны в Dai W, Zhang B, Jiang X-M, et al. Structure-based design of antiviral drug candidates targeting the SARS-CoV-2 main protease. Science. 2020;368(6497):1331-1335, включая соединения, такие как показаны ниже, и соединения, обозначенные как DC402234.
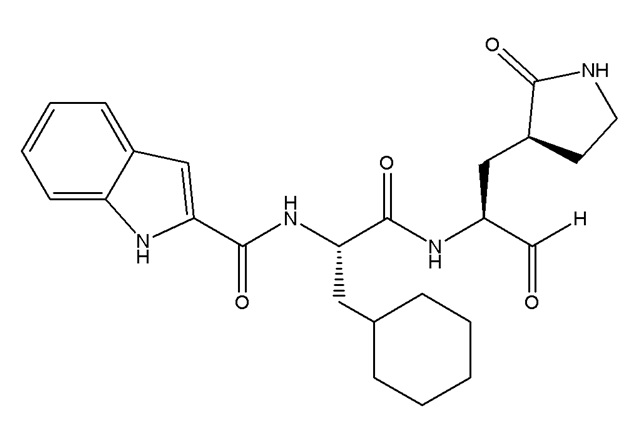
Другим вариантом осуществления настоящего изобретения является способ лечения COVID-19 у пациента, где в дополнение к введению соединения по настоящему изобретению (т.е. соединения формулы I, I' или I” или его сольвата или гидрата или его фармацевтически приемлемой соли соединения или сольвата или гидрата) вводят дополнительный агент, и этот дополнительный агент выбирают из противовирусных средств, таких как ремдесивир, галидесивир, фавилавир/авифавир, молнупиравир (MK-4482/EIDD 2801), AT-527, AT-301, BLD-2660, фавипиравир, камостат, SLV213 эмтриктабин/тенофивир, клевудин, дальцетрапиб, боцепревир и ABX464, глюкокортикоиды, такие как дексаметазон и гидрокортизон, реконвалесцентной плазмы, рекомбинантной плазмы человека, такой как гелсолин (Rhu-p65N), моноклональные антитела, такие как регданвимаб (Regkirova), равулизумаб (Ultomiris), VIR-7831/VIR-7832, BRII-196/BRII-198, COVI-AMG/COVI DROPS (STI-2020), бамланивимаб (LY-CoV555), маврилимаб, леронлимаб (PRO140), AZD7442, лензилумаб, инфликсимаб, адалимумаб, JS 016, STI-1499 (COVIGUARD), ланаделумаб (Takhzyro), канакинумаб (Ilaris), гимсилумаб и отилимаб, коктейли антител, такие как касиривимаб/имдевимаб (REGN-Cov2), рекомбинантный слитый белок, такой как MK-7110 (CD24Fc/SACCOVID), антикоагулянты, такие как гепарин и апиксабан, агонисты рецептора IL-6, такие как тоцилизумаб (Actemra) и сарилумаб (Kevzara), ингибиторы PIKfyve, такие как апилимод димезилат, ингибиторы RIPK1, такие как DNL758, DC10462234, агонисты рецептора VIP, такие как РВ1046, ингибиторы SGLT2, такие как дапаглифозин, ингибиторы TYK, такие как абивертиниб, ингибиторы киназы, такие как ATR-002, бемцентиниб, акалабрутиниб, лосмапимод, барицитиниб и тофацитиниб, блокаторы H2, такие как фамотидин, антигельминтные средства, такие как никлозамид, ингибиторы фурина, такие как диминащен.
Термин «агент, ингибирующий SARS-CoV-2» означает любое соединение ингибитор 3C-подобной протеазы родственной коронавирусу SARS-CoV-2, описанное в настоящем документе, или его фармацевтически приемлемую соль, гидрат, пролекарство, активный метаболит или сольват или соединение, которое ингибирует репликацию SARS-CoV-2 любым способом.
Термин «вмешательство или профилактика» вирусной репликации коронавируса, родственного SARS-CoV-2 («SARS-CoV-2») в клетке означает снижение репликации SARS-CoV-2 или продуцирования компонентов SARS-CoV-2, необходимых для потомства вируса в клетке, обработанной соединением по настоящему изобретению, по сравнению с клеткой, не обработанной соединением по настоящему изобретению. Простые и удобные анализы для определения снижения репликации вируса SARS-CoV-2 включают анализ ELISA на наличие, отсутствие или пониженное присутствие анти-SARS-CoV-2 антител в крови субъекта (Nasoff, et al., PNAS 88:5462-5466, 1991), RT-PCR (Yu, et al., in Viral Hepatitis and Liver Disease 574-577, Nishioka, Suzuki and Mishiro (Eds.); Springer-Verlag, Tokyo, 1994). Такие способы хорошо известны специалистам в данной области техники. Альтернативно, общая РНК из трансдуцированных и инфицированных «контрольных» клеток может быть выделена и подвергнута анализу с помощью дот-блоттинга или нозерн-блоттинга и зондирована ДНК, специфичной для SARS-CoV-2, чтобы определить, снижается ли репликация SARS-CoV-2. Альтернативно, снижение экспрессии белка SARS-CoV-2 также можно использовать в качестве индикатора ингибирования репликации SARS-CoV-2. Снижение репликации SARS-CoV-2 более чем на пятьдесят процентов по сравнению с контрольными клетками обычно количественно определяет профилактику репликации SARS-CoV-2.
Если соединение-ингибитор SARS-CoV-2, используемое в способе изобретения, является основанием, желаемая соль может быть получена любым подходящим способом, известным в данной области, включая обработку свободного основания неорганической кислотой (такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные) или с органической кислотой (такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидиловая кислота (такая как глюкуроновая кислота или галактуроновая кислота), альфа-гидроксикислота (такая как лимонная кислота или винная кислота), аминокислота (такая как аспарагиновая кислота или глутаминовая кислота), ароматическая кислота (такая как бензойная кислота или коричная кислота), сульфоновая кислота (такая как п-толуолсульфоновая кислота или этансульфоновая кислота) и подобные.
Если соединение ингибитор SARS-CoV-2, используемое в способе изобретения, представляет собой кислоту, желаемая соль может быть получена любым подходящим способом, известным в данной области, включая обработку свободной кислоты неорганическим или органическим основанием [таким как амин (первичный, вторичный или третичный)], гидроксид щелочного металла или гидроксид щелочноземельного металла. Иллюстративные примеры подходящих солей включают органические соли, полученные из аминокислот (таких как глицин и аргинин), аммиак, первичные амины, вторичные амины, третичные амины и циклические амины (такие как пиперидин, морфолин и пиперазин), а также неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития.
В случае соединений ингибиторов SARS-CoV-2, пролекарств, солей или сольватов, которые являются твердыми веществами, специалистам в данной области техники понятно, что соединение, пролекарства, соли и сольваты, используемые в способе по настоящему изобретению, могут существовать в различных полиморфных или кристаллических формах, все из которых входят в объем настоящего изобретения и указанные формулы. Кроме того, соединение, соли, пролекарства и сольваты, используемые в способе по настоящему изобретению, могут существовать в виде таутомеров, все которые предназначены для включения в широкий объем настоящего изобретения.
Солюбилизирующие агенты также могут использоваться с соединениями по изобретению для увеличения растворимости соединений в воде физиологически приемлемых растворов. Эти солюбилизирующие агенты включают циклодекстрины, пропиленгликоль, диэтилацетамид, полиэтиленгликоль, Tween, этанол и мицеллообразующие агенты. Предлагаемыми солюбилизирующими агентами являются циклодекстрины, особенно бета-циклодекстрины и, в частности, гидроксипропил бета-циклодекстрин и сульфобутиловый эфир бета-циклодекстрин.
В некоторых случаях, соединения ингибиторов SARS-CoV-2, соли, пролекарства и сольватов, используемые в способе по настоящему изобретению, могут иметь хиральные центры. Когда присутствуют хиральные центры, соединение, соли, пролекарства и сольваты могут существовать в виде отдельных стереоизомеров, рацематов и/или смесей энантиомеров и/или диастереомеров. Все такие отдельные стереоизомеры, рацематы, и их смеси предназначены для включения в широкий объем настоящего изобретения.
Как обычно понимают специалисты в данной области техники, оптически чистым соединением является соединение, которое является энантиомерно чистым. Используемый в настоящем документе термин «оптически чистый» предназначен для обозначения соединения, обладающего, по меньшей мере, достаточной активностью. Предпочтительно, оптически чистое количество одного энантиомера для получения соединения, имеющего желаемое фармакологически чистое соединение по настоящему изобретению, включает, по меньшей мере, 90% одного изомера (80% энантиомерный избыток), более предпочтительно, по меньшей мере 95% (90% эи), даже более предпочтительно, по меньшей мере, 97,5% (95% эи), и наиболее предпочтительно, по меньшей мере, 99% (98% эи).
Термин «лечение», используемый в настоящем документе, если не указано иное, означает обращение, облегчение, ингибирование развития, или профилактику нарушения или состояния, к которому этот термин применяется, или одного или нескольких симптомов такого состояния или нарушения. Термин «лечение», как он использован в настоящем документе, если не указано иное, относится к акту лечения, в том смысле в котором «лечение» определено непосредственно выше. В предпочтительном варианте осуществления настоящего изобретения, «лечить» или «лечение» означает, по меньшей мере, смягчение болезненного состояния у человека, которое облегчается путем ингибирования активности 3C-подобной протеазы SARS-COV-2, которая является основной протеазой SARS-COV-2, возбудителя COVID-19. Для пациентов, страдающих от COVID-19, лихорадка, усталость, и сухой кашель являются основными проявлениями болезни, в то время как заложенность носа, насморк, и другие симптомы верхних дыхательных путей встречаются редко. Beijing Centers for Diseases Control and Prevention указывает, что типовой случай COVID-19 вызывает прогрессирующее обострение. COVID-19 может быть классифицирован на легкие, нормальные, тяжелые, и критические типы на основе тяжести заболевания. National Health Commission of the People’s Republic of China. Diagnosis and Treatment of Pneumonia Caused by 2019-nCoV (Trial Version 4). Доступно онлайн: http://www.nhc.gov.cn/jkj/s3577/202002/573340613ab243b3a7f61df260551dd4/files/c791e5a7ea5149f680fdcb34dac0f54e.pdf: (1) Легкие случаи - клинические симптомы были легкими, и воспаление легких не было обнаружено при компьютерной томографии (КТ) грудной клетки; (2) нормальные случаи - лихорадка, респираторные симптомы, и установлено что пациенты имели визуализирующиеся проявления пневмонии; (3) тяжелые случаи - одно из следующих трех условий: респираторный дистресс, частота дыхания ≥30 раз/мин (в состоянии покоя, относятся к насыщению кислородом ≤93%), частичное артериальное давление кислорода (РаО2)/концентрации абсорбции кислорода (FiO2 ) ≤300 мм рт.ст. (1 мм рт.ст.=0133 кПа); (4) критические случаи - одно из следующих трех условий: дыхательная недостаточность и необходимость искусственной вентиляции легких, шок, или ассоциированная недостаточность других органов, требующая интенсивной терапии. Текущие клинические данные показывают, что большинство случаев смерти произошло среди пациентов пожилого возраста. Тем не менее, тяжелые случаи были зарегистрированы у молодых людей, которые имеют уникальные факторы, в частности, хронические заболевания, такие как диабет или гепатит B. Те, которые длительное время принимали гормоны или иммунодепрессанты, и имеют пониженные функции иммунитета, вероятно будут сильно инфицированы.
Способы лечения для смягчения болезненного состояния, связанного с коронавирусом, такого как COVID-19, включают использование одного или нескольких соединений по изобретению любым общепринятым способом. Согласно некоторым предпочтительным вариантам осуществления изобретения, соединение или соединения, используемые в способах по настоящему изобретению, вводят млекопитающему, такому как человек, при необходимости. Предпочтительно, чтобы млекопитающее, нуждающееся в этом, было инфицировано коронавирусом, таким как возбудитель COVID-19, а именно SARS-CoV-2.
Настоящее изобретение также включает профилактические способы, включающие введение эффективного количества ингибитора SARS-CoV-2 по изобретению или его фармацевтически приемлемой соли, пролекарства, фармацевтически активного метаболита или сольвата млекопитающему, например человеку, подверженному риску заражения SARS-CoV-2. Согласно некоторым предпочтительным вариантам осуществления, эффективное количество одного или нескольких соединений по настоящему изобретению или их фармацевтически приемлемой соли, пролекарства, фармацевтически активного метаболита или сольвата вводят человеку, подверженному риску заражения SARS-CoV-2, возбудителя COVID-19. Профилактические способы по изобретению включают использование одного или нескольких соединений по изобретению любым общепринятым способом.
Определенные соединения, используемые в способах по изобретению, например дексаметазон, азитромицин и ремдесивир, известны и могут быть получены способами, известными в данной области техники.
Последние данные указывают на то, что новый коронавирус SARS-CoV-2 является возбудителем COVID-19. Нуклеотидная последовательность коронавируса SARS-CoV-2, а также недавно определенные подтипы L и S, были недавно определены и стали общедоступными.
Активность соединений ингибиторов в качестве ингибиторов вирусной активности SARS-CoV-2 может быть измерена любым из подходящих способов, доступных в данной области техники, включая анализы in vivo и in vitro. Активность соединений по настоящему изобретению в качестве ингибиторов активности коронавируса 3C-подобной протеазы (такой как 3C-подобная протеаза коронавируса SARS-CoV-2) может быть измерена любым из подходящих способов, известных специалистам в данной области техники, в том числе анализы in vivo и in vitro. Примеры подходящих анализов для измерения активности включают анализы противовирусных клеточных культур, описанные в настоящем документе, а также анализы антипротеаз, описанные в настоящем документе, такие как анализы, описанные в экспериментальном разделе.
Введение соединений-ингибиторов SARS-CoV-2 и их фармацевтически приемлемых пролекарств, солей, активных метаболитов и сольватов может осуществляться любым из общепринятых способов введения, доступных специалистам в данной области техники. Иллюстративные примеры подходящих способов введения включают пероральный, назальный, легочный, парентеральный, местный, внутривенный, инъекционный, трансдермальный и ректальный. Предпочтительны пероральные, внутривенные, подкожные и назальные доставки.
Агент, ингибирующий SARS-CoV-2, можно вводить в виде фармацевтической композиции в любой подходящей фармацевтической форме. Подходящие фармацевтические формы включают твердые, полужидкие, жидкие или лиофилизированные составы, такие как таблетки, порошки, капсулы, суппозитории, суспензии, липосомы и аэрозоли. Агент, ингибирующий SARS-CoV-2, может быть приготовлен в виде раствора с использованием любой из множества методик. Например, агент, ингибирующий SARS-CoV-2, можно растворить в кислоте (например, 1 M HCl) и разбавить достаточным объемом раствора 5% декстрозы в воде (D5W), чтобы получить желаемую конечную концентрацию агента, ингибирующего SARS-CoV-2 (например, примерно 15 мМ). Альтернативно, можно использовать раствор D5W, содержащий примерно 15 мМ HCl, чтобы получить раствор агента, ингибирующего SARS-CoV-2, в соответствующей концентрации. Кроме того, агент, ингибирующий SARS-CoV-2, может быть приготовлен в виде суспензии с использованием, например, 1% раствора карбоксиметилцеллюлозы (CMC).
Приемлемые способы приготовления подходящих фармацевтических форм фармацевтических композиций известны или могут быть определены обычным образом специалистами в данной области техники. Например, фармацевтические препараты могут быть приготовлены в соответствии с общепринятыми методами фармацевтической химии, включающими такие стадии, как смешивание, гранулирование и прессование, когда необходимо, для таблетированных форм, или смешивание, наполнение и растворение ингредиентов, если необходимо, с получением желаемых продуктов для внутривенного, перорального, парентерального, местного, интравагинального, интраназального, внутрибронхиального, внутриглазного, интрааурального и/или ректального введения.
Обычно соединение по настоящему изобретению вводят в количестве, эффективном для лечения состояния, описанного в настоящем документе. Соединения по изобретению вводят любым подходящим путем в форме фармацевтической композиции, адаптированной к такому пути, и в дозе, эффективной для предполагаемого лечения. Терапевтически эффективные дозы соединений, необходимые для лечения прогрессирования медицинского состояния, легко определяются обычным специалистом в данной области техники с использованием доклинических и клинических подходов, знакомых специалистам в области медицины.
Соединения по изобретению можно вводить перорально. Пероральное введение может включать глотание, так что соединение попадает в желудочно-кишечный тракт, или может применяться буккальное или сублингвальное введение, при котором соединение попадает в кровоток непосредственно изо рта.
В другом варианте осуществления, соединения по изобретению также можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, внутрижелудочковое, внутриуретральное, внутригрудинное, внутричерепное, внутримышечное и подкожное. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) инъекторы, безыгольные инъекторы и методы инфузии.
В другом варианте осуществления, соединения по изобретению также можно вводить местно на кожу или слизистую оболочку, то есть дермально или трансдермально. В другом варианте осуществления, соединения по изобретению также можно вводить интраназально или путем ингаляции. В другом варианте осуществления, соединения по изобретению можно вводить ректально или вагинально. В другом варианте осуществления, соединения по изобретению также можно вводить непосредственно в глаз или ухо.
Схема дозирования соединений и/или композиций, содержащих соединения, основан на множестве факторов, включая тип, возраст, вес, пол и медицинское состояние пациента; тяжесть состояния; способ введения; и активность конкретного используемого соединения. Таким образом, схема дозирования может широко варьироваться. Уровни дозировки от примерно 0,01 мг до примерно 100 мг на килограмм массы тела в сутки полезны при лечении вышеуказанных состояний. В одном варианте осуществления, общая суточная доза соединения по настоящему изобретению (вводимая в виде однократной или разделенной дозы) обычно составляет от примерно 0,01 до примерно 100 мг/кг. В другом варианте осуществления, общая суточная доза соединения по настоящему изобретению составляет от примерно 0,1 до примерно 50 мг/кг, а в другом варианте от примерно 0,5 до примерно 30 мг/кг (т.е. мг соединения по настоящему изобретению на кг массы тела). В одном варианте осуществления, дозировка составляет от 0,01 до 10 мг/кг/сутки. В другом варианте осуществления, дозировка составляет от 0,1 до 1,0 мг/кг/сутки. Стандартные дозированные композиции могут содержать такие количества или их кратные количества, чтобы составить суточную дозу. Во многих случаях, введение соединений будет повторяться множество раз в сутки (обычно не более 4 раз). При желании можно использовать многократные дозы в сутки для увеличения общей суточной дозы.
Для перорального введения, композиции могут быть представлены в форме таблеток, содержащих от примерно 0,01 мг до примерно 500 мг активного ингредиента, или, в другом варианте осуществления, от примерно 1 мг до примерно 100 мг активного ингредиента. При внутривенном введении дозы могут варьироваться от примерно 0,1 до примерно 10 мг/кг/мин при постоянной скорости инфузии.
Подходящие пациенты согласно настоящему изобретению включают млекопитающих пациентов. Млекопитающие по настоящему изобретению включают, но не ограничиваются ими, собак, кошек, крупный рогатый скот, коз, лошадей, овец, свиней, грызунов, зайцеобразных, приматов и подобных, и включают млекопитающих в утробе матери. В одном варианте осуществления, подходящими пациентами являются люди. Пациенты-люди могут быть любого пола и на любой стадии развития.
В другом варианте осуществления, изобретение включает использование одного или нескольких соединений по изобретению для приготовления лекарственного средства для лечения состояний, перечисленных в настоящем документе.
Для лечения состояний, указанных выше, соединение по настоящему изобретению можно вводить как соединение само по себе. Альтернативно, фармацевтически приемлемые соли подходят для медицинского применения из-за их большей растворимости в воде по сравнению с исходным соединением.
В другом варианте осуществления, настоящее изобретение включает фармацевтические композиции. Такие фармацевтические композиции содержат соединение по изобретению, представленное с фармацевтически приемлемым носителем. Фармацевтически приемлемый носитель включает любую подходящую дозированную форму, приемлемую для введения пациенту. Носитель может быть твердым, жидким или и тем, и другим, и может быть составлен с соединением в виде композиции разовой дозы, например, таблетки, которая может содержать от 0,05% до 95% массовых активных соединений. Соединение по настоящему изобретению может быть связано с подходящими полимерами в качестве таргетных носителей лекарственного средства. Также могут присутствовать другие фармакологически активные вещества.
Соединения по настоящему изобретению могут быть введены любым подходящим путем, предпочтительно в форме фармацевтической композиции, адаптированной к такому пути, и в дозе, эффективной для предполагаемого лечения. Активные соединения и композиции, например, можно вводить перорально, ректально, парентерально или местно.
Пероральное введение твердой дозированной формы может быть, например, представлено в дискретных единицах, таких как твердые или мягкие капсулы, пилюли, крахмальные облатки, пастилки или таблетки, каждая из которых содержит заранее определенное количество, по меньшей мере, одного соединения по настоящему изобретению. В другом варианте осуществления, пероральное введение может быть в форме порошка или гранул. В другом варианте осуществления, пероральная лекарственная форма является сублингвальной, такой как, например, пастилка. В такой твердой дозированной форме соединения по настоящему изобретению обычно объединяют с одним или несколькими адъювантами. Такие капсулы или таблетки могут содержать состав с контролируемым высвобождением. В случае капсул, таблеток и пилюль, дозированная форма также может содержать буферные агенты или может быть приготовлена с энтеросолюбильными покрытиями.
В другом варианте осуществления, пероральное введение может осуществляться в жидкой дозированной форме. Жидкие дозированные формы для перорального введения включают, например, фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители, обычно используемые в данной области техники (например, воду). Такие композиции также могут содержать адъюванты, такие как смачивающие, эмульгирующие, суспендирующие, ароматизирующие (например, подслащивающие) и/или отдушки.
В другом варианте осуществления, настоящее изобретение включает парентеральную дозированную форму. «Парентеральное введение» включает, например, подкожные инъекции, внутривенные инъекции, внутрибрюшинные инъекции, внутримышечные инъекции, внутригрудинные инъекции и инфузии. Препараты для инъекций (например, стерильные водные или масляные суспензии для инъекций) могут быть составлены в соответствии с известным уровнем техники с использованием подходящих диспергирующих, смачивающих агентов и/или суспендирующих агентов.
В другом варианте осуществления, настоящее изобретение включает дозированную форму для местного применения. «Местное введение» включает, например, чрескожное введение, такое как чрескожные пластыри или устройства для ионтофореза, внутриглазное введение или интраназальное или ингаляционное введение. Композиции для местного применения также включают, например, гели для местного применения, спреи, мази и кремы. Состав для местного применения может включать соединение, которое усиливает абсорбцию или проникновение активного ингредиента через кожу или другие пораженные участки. Когда соединения по настоящему изобретению вводят с помощью чрескожного устройства, введение будет осуществляться с использованием пластыря либо резервуарного типа, либо пористой мембраны, либо твердой матрицы. Типовые составы для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, вафли, имплантаты, губки, волокна, повязки и микроэмульсии. Также можно использовать липосомы. Типовые носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены усилители проникновения; см., например, J. Pharm. Sci., 88 (10), 955-958, by Finnin and Morgan (October 1999).
Композиции, пригодные для местного введения в глаз, включают, например, глазные капли, где соединение по настоящему изобретению растворяют или суспендируют в подходящем носителе. Типовые составы, подходящие для глазного или ушного введения, могут быть в форме капель микронизированной суспензии или раствора в изотоническом рН-доведенном стерильном солевом растворе. Другие препараты, подходящие для глазного и ушного введения, включают мази, биоразлагаемые (например, рассасывающиеся гелевые губки, коллаген) и не биоразлагаемые (например, силиконовые) имплантаты, облатки, линзы и системы на основе частиц или пузырьков, такие как ниосомы или липосомы. Полимер, такой как поперечно сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например, гелановая камедь, могут быть включены вместе с консервантом, таки как хлорид бензалкония. Такие препараты также могут быть доставлены с помощью ионтофореза.
Для интраназального введения или введения путем ингаляции активные соединения по настоящему изобретению удобно доставлять в форме раствора или суспензии из помпового распылителя, который сжимается или накачивается пациентом, или в виде аэрозольного спрея из находящегося под давлением контейнера или небулайзера, с использованием подходящего пропеллента. Составы, пригодные для интраназального введения, обычно вводят в форме сухого порошка (либо отдельно, в виде смеси, например, в сухой смеси с лактозой, либо в виде смешанной сложной частицы, например, смешанной с фосфолипидами, такими как фосфатидилхолин) из ингалятора сухого порошка или в виде аэрозольного спрея из контейнера под давлением, насоса, спрея, распылителя (предпочтительно, распылителя с использованием электрогидродинамики для получения мелкодисперсного тумана), или небулайзера, с или без использования подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для интраназального применения порошок может содержать биоадгезивный агент, например хитозан или циклодекстрин.
В другом варианте осуществления, настоящее изобретение включает ректальную дозированную форму. Такая ректальная дозированная форма может быть в форме, например, суппозитория. Какао-масло является традиционной основой для суппозиториев, но при необходимости могут использоваться различные альтернативы.
Также можно использовать другие материалы-носители и способы введения, известные в фармацевтике. Фармацевтические композиции по настоящему изобретению можно приготовить с помощью любых хорошо известных фармацевтических методик, таких как эффективные методики составления и процедуры введения. Вышеупомянутые соображения в отношении эффективных методик составления и введения хорошо известны в данной области техники и описаны в стандартных учебниках. Составление лекарственных средств обсуждается, например, в Hoover, John E., Remington’s Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania, 1975; Liberman et al., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; and Kibbe et al., Eds., Handbook of Pharmaceutical Excipients (3rd Ed.), American Pharmaceutical Association, Washington, 1999.
Соединения по настоящему изобретению можно использовать отдельно или в комбинации с другими терапевтическими агентами при лечении различных состояний или болезненных состояний. Соединение по настоящему изобретению и другое терапевтическое средство можно вводить одновременно (либо в одной и той же дозированной форме, либо в отдельных дозированных формах) или последовательно. Два или несколько соединений можно вводить одновременно, параллельно или последовательно. Кроме того, одновременное введение может осуществляться путем смешивания соединений перед введением или путем введения соединений в один и тот же момент времени, но в разные анатомические участки, или с использованием разных путей введения. Фразы «параллельное введение», «совместное введение», «одновременное введение» и «вводить одновременно» означают, что соединения вводят в комбинации.
Настоящее изобретение включает использование комбинации соединения по изобретению и одного или нескольких дополнительных терапевтических агентов. Если вводится комбинация активных агентов, то их можно вводить последовательно или одновременно, в отдельной дозированной форме или в сочетании в одной дозированной форме. Соответственно, настоящее изобретение также включает фармацевтические композиции, содержащие некоторое количество: (а) первого агента, содержащего соединение по изобретению или фармацевтически приемлемую соль соединения; (b) второй терапевтический агент; и (c) фармацевтически приемлемый носитель. Фармацевтические композиции по изобретению могут также включать подходящие эксципиенты, разбавители, носители и носители, а также другие фармацевтически активные агенты, в зависимости от предполагаемого использования. В фармацевтических композициях могут применяться твердые или жидкие фармацевтически приемлемые носители, разбавители, носители или эксципиенты. Иллюстративные твердые носители включают крахмал, лактозу, дигидрат сульфата кальция, сульфат кальция, сахарозу, тальк, желатин, пектин, аравийскую камедь, стеарат магния и стеариновую кислоту. Иллюстративные жидкие носители включают сироп, арахисовое масло, оливковое масло, солевой раствор и воду. Носитель или разбавитель может включать подходящий материал с пролонгированным высвобождением, такой как глицерилмоностеарат или глицерилдистеарат, отдельно или с воском. Когда используется жидкий носитель, препарат может быть в форме сиропа, эликсира, эмульсии, мягкой желатиновой капсулы, стерильной жидкости для инъекций (например, раствора) или не водной или водной жидкой суспензии.
Доза фармацевтической композиции может содержать, по меньшей мере, терапевтически эффективное количество агента, ингибирующего SARS-CoV-2, и предпочтительно состоит из одной или нескольких фармацевтических дозированных единиц. Выбранная доза может быть введена млекопитающему, например пациенту-человеку, нуждающемуся в лечении, опосредованном ингибированием активности коронавируса, родственного SARS-CoV-2, любым известным или подходящим способом введения дозы, включая местное, например, в виде мази или крема; пероральное, ректальное, например, в виде суппозитория; парентеральное, путем инъекции; внутривенное; или непрерывное путем интравагинальной, интраназальной, внутрибронхиальной, интраауральной или внутриглазной инфузии.
Фразы «терапевтически эффективное количество» и «эффективное количество» предназначены для обозначения количества агента по изобретению, которое при введении млекопитающему, нуждающемуся в лечении, является достаточным для лечения повреждений или болезненных состояний, облегченных ингибированием репликации вируса SARS-CoV-2. Количество данного агента, ингибирующего SARS-CoV-2, используемого в способе по настоящему изобретению, которое будет терапевтически эффективным, будет варьироваться в зависимости от таких факторов, как конкретный агент, ингибирующий SARS-CoV-2, болезненное состояние и его тяжесть, личность и характеристики нуждающегося в этом млекопитающего, количество которых может быть определено обычным образом специалистами в данной области техники.
Следует понимать, что фактические дозировки агентов, ингибирующих SARS-CoV-2, используемых в фармацевтических композициях по настоящему изобретению, будут выбираться в соответствии со свойствами конкретного применяемого агента, конкретной составленной композиции, способом и конкретным сайтом введения, и лечимым хозяином и состоянием. Оптимальные дозировки для данного набора условий могут быть установлены специалистами в данной области техники с использованием обычных тестов для определения дозировки. Для перорального введения, например, доза, которую можно использовать, составляет от примерно 0,01 до примерно 1000 мг/кг массы тела, предпочтительно, от примерно 0,1 до примерно 500 мг/кг массы тела, и даже более предпочтительно, от примерно 1 до примерно 500 мг/кг массы тела при повторении курсов лечения через соответствующие промежутки времени. Для внутривенного введения можно использовать дозу до 5 граммов в сутки. Внутривенное введение может происходить с перерывами в течение дня или непрерывно в течение 24-часового периода.
Термины «количество, ингибирующее цитохром P450» и «количество, ингибирующее активность фермента цитохрома P450», используемые в настоящем документе, относятся к количеству соединения, необходимому для снижения активности ферментов цитохрома P450 или определенных изоформ фермента цитохрома P450 в присутствии такого соединения. Снижает ли конкретное соединение активность фермента цитохрома P450 и количество такого соединения, необходимое для этого, можно определить способами, известными специалистам в данной области техники, и способами, описанными в данном документе.
Функции белков, необходимые для репликации и транскрипции коронавируса, кодируются так называемым геном «репликазы». Два перекрывающихся полипротеина транслируются из этого гена и интенсивно процессируются вирусными протеазами. C-проксимальная область процессируется в одиннадцати консервативных междоменных соединениях основной или «3C-подобной» протеазой коронавируса. Название «3C-подобная» протеаза происходит от определенного сходства между ферментом коронавируса и хорошо известными 3C протеазами пикорнавируса. К нему относятся предпочтения субстратов, использование цистеина в качестве нуклеофила в активном сайте в катализе, и сходство в их предполагаемых общих полипептидных складках. Сравнение аминокислотной последовательности 3C-подобной протеазы коронавируса, ассоциированной с SARS-CoV-2, с аминокислотной последовательностью других известных коронавирусов, таких как SARS-CoV, показывает, что аминокислотные последовательности имеют примерно 96% общей гомологии.
Аминокислоты субстрата в сайте расщепления протеазой пронумерованы от N до C-конца следующим образом: -P3-P2-P1-P1’-P2’-P3’, причем расщепление происходит между остатками P1 и P1' (Schechter & Berger, 1967). Специфичность субстрата во многом определяется положениями P2, P1 и P1'. Специфичность сайта расщепления основной протеазой коронавируса является высококонсервативной с потребностью в глутамине на P1 и малой аминокислоте на P1' [Journal of General Virology, 83, pp. 595-599 (2002)].
Соединения по настоящему изобретению могут быть получены в соответствии со способами, изложенными на схемах реакций 1-3 ниже.
Приведенные ниже схемы дополнительно иллюстрируют и являются примерами соединения по настоящему изобретению и способов получения таких соединений. Следует понимать, что объем настоящего изобретения никоим образом не ограничивается объемом следующих примеров и приготовлений. В следующих примерах, молекулы с одним хиральным центром могут существовать в виде одного энантиомера или рацемической смеси. Эти молекулы с двумя или несколькими хиральными центрами могут существовать в виде одного энантиомера, рацемической или иной смеси двух энантиомеров или в виде различных смесей диастереомеров. Такие энантиомеры, рацематы и диастереомеры могут быть получены и/или разделены способами, известными специалистам в данной области техники. Специалисту в данной области техники будет понятно, что определенные синтетические манипуляции могут эпимеризовать или рацемизировать стереоцентр, и условия синтеза могут быть выбраны так, чтобы стимулировать или препятствовать такой эпимеризации или рацемизации.
Схема 1 иллюстрирует последовательность синтеза для получения соединений формулы I как показано, где N-BOC метиловый эфир формулы 1 (WO 2005/113580) превращают в первичный амид формулы 3 (N-BOC является N-трет-бутоксикарбонил). Это может осуществляться непосредственно, например, обработкой аммиаком (NH3) в герметично закрытом сосуде, в растворителе, таком как метанол или этанол, например, необязательно в присутствии добавок, таких как хлорид кальция (CaCl2) или диметоксид магния, Mg(OMe)2.
Схема 1
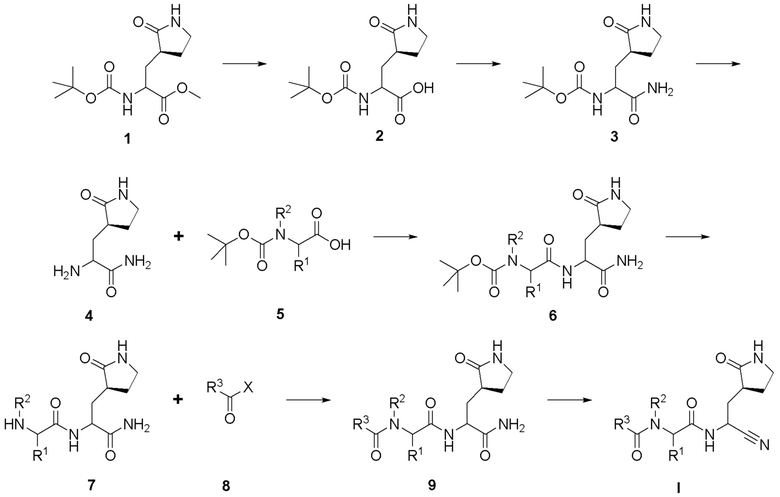
Превращение соединения формулы 1 в соединение формулы 3 также можно проводить предварительным превращением в карбоновую кислоту формулы 2 (WO 2005/113580). В этом случае, compound формулы 2 может быть превращено в соединение формулы 3 с применением способов, хорошо известных специалистам в данной области техники. Например, соединение формулы 2 может быть обработано реагентом, таким как гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ), изобутилхлорформиат, гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (EDCI) и гидроксибензотриазол (HOBt) или 1,1’-карбонилдиимидазол (КДИ), необязательно в присутствии основания, такого как N, N-диизопропилэтиламин (ДИЭА), 4-метилморфолин (NMM) или триэтиламин (ТЭА), с последующей обработкой NH3, вводимым в виде газа или раствора в совместимом с реакцией растворителе, или солью NH3, такой как ацетат аммония или хлорид аммония в присутствии основания, такого как N, N-диизопропилэтиламин, 4-метилморфолин или триэтиламин. подходящие растворители включают, но не ограничиваются ими, дихлорметан (CH2Cl2), N, N-диметилформамид (ДМФ), тетрагидрофуран (ТГФ) или ацетонитрил (CH3CN).
Соединение формулы 3 может быть лишено N-защиты с получением амина формулы 4 с применением способов, хорошо известных специалисту в данной области техники для проведения таких снятий защиты. Часто используют кислые реагенты, такие как гидрохлорид, метансульфоновая кислота или трифторуксусная кислота, обычно в совместимом с реакцией растворителе, таком как CH2Cl2, 1,4-диоксан, 1,2-дихлорэтан или CH3CN. Специалист в данной области техники поймет, что соединение формулы 4 часто получают в виде кислотно-аддитивной соли. Соединение формулы 4 затем может быть превращено в соединение формулы 6 обработкой соединения N-защищенной аминокислоты формулы 5 в подходящих условиях. такие способы хорошо известны специалисту в данной области техники, и в общем могут быть выбраны стандартные условия пептидного сочетания.
Соединение формулы 6 может быть лишено N-защиты с получением амина формулы 7 с применением способов, хорошо известных специалисту в данной области техники для проведения таких снятий защиты. Часто используют кислые реагенты, такие как гидрохлорид, метансульфоновая кислота или трифторуксусная кислота, обычно в совместимом с реакцией растворителе, таком как CH2Cl2, 1,4-диоксан, 1,2-дихлорэтан или CH3CN. Специалист в данной области техники поймет, что соединение формулы 7 часто получают в виде кислотно-аддитивной соли. Соединение формулы 7 затем могут быть превращены в соединение формулы 9 обработкой карбоновой кислотой формулы 8 в подходящих условиях. Такие способы хорошо известны специалисту в данной области техники. Например, если X=атом хлора, карбоновая кислота известна как хлорангидрид, и реакцию проводят в присутствии основания для потребления гидрогалогенида HX, полученного в качестве побочного продукта реакции. Примеры подходящих оснований включает, но не ограничиваются ими, третичные амины, такие как 4-метилморфолин, 2,6-диметилпиридин или N, N-диизопропилэтиламин, или неорганические основания, такие как оксид магния (MgO), карбонат натрия (Na2CO3) или бикарбонат калия (KHCO3). подходящие растворители включают, но не ограничиваются ими, CH2Cl2, ДМФ, ТГФ или CH3CN. Если X=OH, обычно применяют реагент или комбинации реагентов для того, чтобы способствовать реакции карбоновой кислоты 8. Специалист в данной области техники может выбрать для применения, например, карбодиимидного реагента, такого как гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (EDCI) или N, N’-дициклогексилкарбодиимид (ДЦК), необязательно в присутствии вспомогательного нуклеофила, такого как гидроксибензотриазол (HOBt) или 2-гидроксипиридин-N-оксид (HOPO). Затем, если X=OH, специалист в данной области техники может выбрать для применения реагенты, которые подходят для образования смешанных карбоксильных/карбоновых ангидридов, таких как КДИ, изобутил или этил хлорформиат, часто в присутствии основания, такого как описано выше. Подходящие растворители включают, но не ограничиваются ими, CH2Cl2, ТГФ, или CH3CN. Другим подходом, обычно применяемым специалистом в данной области техники, когда X=OH, является обработка карбоновой кислоты формулы 8 хлоридом карбоновой кислоты, например, таким как Me3CCOCl, в присутствии основания, такого как описано выше, с получением смешанного карбонового ангидрида формулы R3C(O)O(O)CCMe3. Подходящие растворители включают, но не ограничиваются ими, CH2Cl2, ТГФ, или CH3CN. Во многих случаях, возможно применять симметрический ангидрид желаемой карбоновой кислоты формулы 8 для проведения реакции, необязательно в присутствии основания, такого как описано выше, в этом случае X=O(O)CR3 и поэтому карбоновой кислотой формулы 8 является R3C(O)O(O)CR3. Подходящие растворители включают, но не ограничиваются ими, CH2Cl2, ТГФ, или CH3CN.
Соединение формулы 9 может быть превращено в соединение формулы I обработкой в условиях дегидратации, хорошо известных специалистам в данной области техники. Часто эту стадию дегидратации можно выполнять с использованием избытка трифторуксусного ангидрида или оксихлорида фосфора, обычно в присутствии основания, такого как пиридин, N, N-диизопропилэтиламин, 4-метилморфолин или триэтиламин.
Специалист в данной области техники будет знать, что N-BOC-защищенные аминокислоты формулы 5 известны в химической литературе, коммерчески доступны и могут быть получены из соответствующих известных и коммерчески доступных аминокислот специалистом в данной области техники с использованием хорошо известных процедур синтеза N-защищенных аминокислот. Точно так же, специалист в данной области техники поймет, что соединения карбоновой кислоты формулы 8 могут быть известны в химической литературе, и/или коммерчески доступны, и/или могут быть получены опубликованными способами или по аналогии с опубликованными способами.
Специалист в данной области техники поймет, что стадии формирования связи в схеме 1 могут проводиться в другом порядке с соответствующими соображениями, например, как показано на схеме 2.
Схема 2
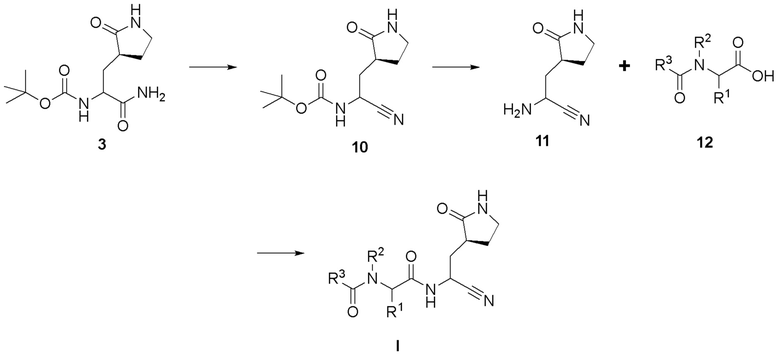
На схеме 2, соединение формулы 3 превращают в соединение формулы 10 обработкой в условиях дегидратации, хорошо известных специалисту в данной области техники. Часто эту стадию дегидратации проводят с применением избытка трифторуксусного ангидрида или оксихлорида фосфора, обычно в присутствии основания, такого как пиридин, N, N-диизопропилэтиламин, 4-метилморфолин или триэтиламин. Соединение формулы 10 лишают N-защиты с получением амина формулы 11 с применением способов, хорошо известных специалисту в данной области техники, для проведения таких снятий защиты. Часто используют кислые реагенты, такие как гидрохлорид, метансульфоновая кислота, или трифторуксусная кислота, обычно в совместимом с реакцией растворителе, таком как CH2Cl2, 1,4-диоксан, 1,2-дихлорэтан или CH3CN. Специалист в данной области техники поймет, что соединение формулы 11 часто получают в виде кислотно-аддитивной соли. Соединение формулы 11 затем может быть превращено в соединение формулы I обработкой соединением формулы 12 в подходящих условиях. Такие способы хорошо известны специалисту в данной области техники, и в общем могут быть выбраны стандартные условия пептидного сочетания. Соединения формулы 12 исключительно хорошо известны в химической литературе, и специалист в данной области техники может выбрать получение любого данного соединения формулы 12 с применением способов, аналогичных тем, которые описаны в химической литературе.
Специалист в данной области техники поймет, что стадии образования связей на схемах 1 и 2 могут проводиться в другом, отличном, порядке с учетом соответствующих факторов, например, как показано на Схеме 3.
Схема 3
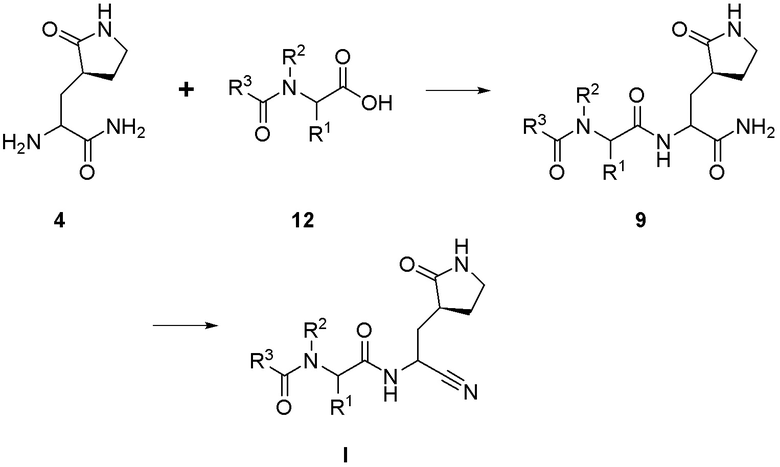
На схеме 3 соединение формулы 4 затем может быть превращено в соединение формулы 9 обработкой соединением формулы 12 в подходящих условиях. Такие способы хорошо известны специалистам в данной области техники, и, как правило, можно выбрать стандартные условия связывания пептидов. Соединения формулы 12 исключительно хорошо известны в химической литературе, и специалист в данной области техники может выбрать получение любого данного соединения формулы 12 с использованием способов, аналогичных описанным в химической литературе. Соединение формулы 9 затем превращают в соединение формулы I обработкой в условиях дегидратации, хорошо известных специалистам данной области техники. Часто эту стадию дегидратации можно выполнять с использованием избытка трифторуксусного ангидрида или оксихлорида фосфора, обычно в присутствии основания, такого как пиридин, N, N-диизопропилэтиламин, 4-метилморфолин или триэтиламин.
Специалист в данной области техники поймет, что дальнейшие перестановки стадий образования связи и манипуляции с функциональными группами на схемах 1, 2 и 3 могут быть применены с учетом соответствующих факторов. Такие перестановки в выборе порядка стадий хорошо известны в химической литературе, и при желании специалист в данной области техники может обратиться к химической литературе для получения дополнительных указаний. Специалист в данной области техники поймет, что можно сделать другой выбор защитных групп и реагентов для осуществления различных превращений.
ПРИМЕРЫ
Методики эксперимента
Следующее иллюстрирует синтез различных соединений по настоящему изобретению. Дополнительные соединения в объеме данного изобретения могут быть получены с использованием способов, проиллюстрированных в этих примерах, либо по отдельности, либо в сочетании со способами, обычно известными в данной области техники. Все исходные материалы в этих примерах получения и примерах либо коммерчески доступны, либо могут быть получены способами, известными в данной области техники, или описанными в настоящем документе.
Все реакции проводят при непрерывном перемешивании в атмосфере азота или аргона, если не указано иное. При необходимости, реакционные устройства сушат в динамическом вакууме с использованием тепловой пушки и безводных растворителей (продукты Sure-Seal™ от Aldrich Chemical Company, Milwaukee, Wisconsin или продукты DriSolv™ от EMD Chemicals, Gibbstown, NJ). В некоторых случаях коммерческие растворители пропускают через колонки, заполненные молекулярными ситами 4Å, пока не будут достигнуты следующие стандарты контроля качества для воды: а) <100 ч/млн. для дихлорметана, толуола, N, N-диметилформамида и тетрагидрофурана; b) <180 ч./млн. для метанола, этанола, 1,4-диоксана и диизопропиламина. Для очень чувствительных реакций растворители дополнительно обрабатывают металлическим натрием, гидридом кальция или молекулярными ситами и дистиллируют непосредственно перед использованием. Другие коммерческие растворители и реагенты используют без дополнительной очистки. Для эталонных методик синтеза в других примерах или способах, условия реакции (время реакции и температура) могут варьироваться. Как правило, продукты сушат в вакууме перед тем, как использовать их в дальнейших реакциях или отправить на биологические испытания.
Если указано, реакции нагревают микроволновым излучением с использованием микроволн Biotage Initiator или Personal Chemistry Emrys Optimizer. За ходом реакции следят с помощью тонкослойной хроматографии (ТСХ), жидкостной хроматографии-масс-спектрометрии (ЖХМС), высокоэффективной жидкостной хроматографии (ВЭЖХ) и/или газовой хроматографии-масс-спектрометрии (ГХМС). ТСХ выполняют на предварительно покрытых пластинах силикагеля с индикатором флуоресценции (длина волны возбуждения 254 нм) и визуализируют в УФ-свете и/или с I2, KMnO4, CoCl2, фосфоромолибденовой кислотой и/или пятнами молибдата церия и аммония. Данные ЖХМС получают на приборе Agilent 1100 Series с автопробоотборником Leap Technologies, колонками Gemini C18, градиентами ацетонитрил/вода и модификаторами трифторуксусная кислота, муравьиная кислота или гидроксид аммония. Элюат колонки анализируют с использованием масс-спектрометра Waters ZQ, сканирующего в режимах как положительных, так и отрицательных ионов, от 100 до 1200 Да. Используют и другие подобные инструменты. Данные ВЭЖХ обычно получают на приборе Agilent 1100 Series с использованием указанных колонок, градиентов ацетонитрил/вода и модификаторов трифторуксусная кислота или гидроксид аммония. Данные ГХМС получают с использованием печи Hewlett Packard 6890 с инжектором HP 6890, колонкой HP-1 (12 м x 0,2 мм x 0,33 мкм) и газом-носителем гелием. Образец анализируют на масс-селективном детекторе HP 5973 со сканированием от 50 до 550 Да с использованием электронной ионизации. Очистку проводят способом средне эффективной жидкостной хроматографии (СЭЖХ) с использованием инструментов Isco CombiFlash Companion, AnaLogix IntelliFlash 280, Biotage SP1 или Biotage Isolera One и предварительно упакованных картриджей с диоксидом кремния Isco RediSep или Biotage Snap. Хиральную очистку выполняют с помощью хиральной сверхкритической жидкостной хроматографии (СЖХ), обычно с использованием инструментов Berger или Thar; колонок, таких как колонки ChiralPAK-AD, -AS, -IC, Chiralcel-OD, или -OJ; и смеси CO 2 с метанолом, этанолом, 2-пропанолом или ацетонитрилом, отдельно или модифицированные с использованием трифторуксусной кислоты или пропан-2-амина. УФ определение используют для запуска сбора фракций. Для эталонных процедур синтеза в других примерах или методах, очистки могут варьироваться: в общем, растворители и соотношения растворителей, используемые для элюентов/градиентов, выбирают так, чтобы обеспечить подходящие Rf или время удержания.
Данные масс-спектрометрии получают из анализа ЖХМС. Масс-спектрометрию (МС) проводят с использованием источников химической ионизации при атмосферном давлении (ХИАД), ионизации электрораспылением (ИЭР), ионизации электронным ударом (ЭУ) или ионизации электронным рассеянием (ЭР). Химические сдвиги протонной ядерной магнитной спектроскопии (1H ЯМР) даны в частях на миллион в слабом поле от тетраметилсилана и зарегистрированы на 300, 400, 500 или 600 МГц спектрометрах Varian, Bruker или Jeol. Химические сдвиги выражают в частях на миллион (ч./млн., δ) со ссылкой на остаточные пики дейтерированного растворителя (хлороформ, 7,26 ч./млн.; CD2HOD, 3,31 ч./млн.; ацетонитрил-d2, 1,94 ч./млн.; диметилсульфоксид-d5, 2,50 ч./млн.; DHO, 4,79 ч./млн.). Формы пиков описаны следующим образом: с, синглет; д, дублет; т, триплет; кв, квартет; квинт, квинтет; м, мультиплет; шс, широкий синглет; вид., видимый. Аналитические данные СЖХ обычно получают на аналитическом приборе Berger, как описано выше. Данные по оптическому вращению получают на поляриметре PerkinElmer модель 343 с использованием ячейки 1 дм. Микроанализы выполняют Quantitative Technologies Inc. и полученные данные составляют в пределах 0,4% от расчетных значений.
Если не указано иное, химические реакции проводят при комнатной температуре (примерно 23 градуса Цельсия).
Если не указано иное, все реагенты получают коммерчески и использовались без дополнительной очистки, или получают способами, известными в литературе.
Термины «концентрированный», «выпаренный» и «концентрированный в вакууме» относятся к удалению растворителя при пониженном давлении на роторном испарителе с температурой бани менее 60°C. Аббревиатуры «мин» и «ч» обозначают «минуты» и «часы» соответственно. Термин «ТСХ» относится к тонкослойной хроматографии, «комнатная температура или температура окружающей среды» означает температуру от 18 до 25°C, «ГХМС» относится к газовой хроматографии-масс-спектрометрии, «ЖХМС» относится к жидкостной хроматографии-масс-спектрометрии, «УЭЖХ» относится к ультраэффективной жидкостной хроматографии, «ВЭЖХ» относится к высокоэффективной жидкостной хроматографии, и «СЖХ» относится к сверхкритической жидкостной хроматографии.
Гидрогенизация может выполняться в шейкере Парра под давлением газообразного водорода или в проточном аппарате для гидрогенизации Thales-nano H-Cube при полном водороде и скорости потока 1-2 мл/мин при заданной температуре.
Время удержания ВЭЖХ, УЭЖХ, ЖХМС, ГХМС и СЖХ измеряют с использованием способов, указанных в процедурах.
В некоторых примерах было выполнено хиральное разделение для разделения энантиомеров или диастереомеров определенных соединений по изобретению (в некоторых примерах разделенные энантиомеры обозначены как ENT-1 и ENT-2 в соответствии с их порядком элюирования; аналогично, разделенные диастереомеры обозначены как DIAST-1 и DIAST-2, в соответствии с порядком их элюирования). В некоторых примерах, оптическое вращение энантиомера измеряют с помощью поляриметра. Согласно наблюдаемым данным о вращении (или данным удельного вращения) энантиомер с вращением по часовой стрелке обозначен как (+)-энантиомер, и энантиомер с вращением против часовой стрелки обозначен как (-)-энантиомер. На рацемические соединения указывает либо отсутствие нарисованной или описанной стереохимии, либо присутствие (+/-) соседней к структуре; в этом последнем случае указанная стереохимия представляет собой только один из двух энантиомеров, которые составляют рацемическую смесь.
Соединения и промежуточные соединения, описанные ниже, были названы с использованием соглашения о наименованиях, предоставленного ACD/ChemSketch 2019.1.1, File Version C05H41, Build 110712 (Advanced Chemistry Development, Inc., Toronto, Ontario, Canada). Соглашение о наименованиях, предоставляемое ACD/ChemSketch 2019.1.1, хорошо известно специалистам в данной области техники, и считается, что соглашение об именах, предоставляемое ACD/ChemSketch 2019.1.1 в целом согласуется с IUPAC (International Union for Pure and Applied Chemistry) рекомендациями в правилах Nomenclature of Organic Chemistry and the CAS Index.
Пример 1
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (1)
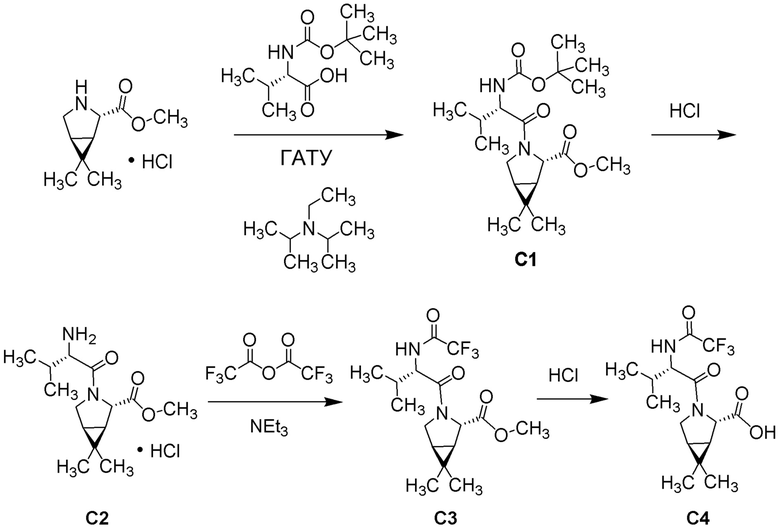
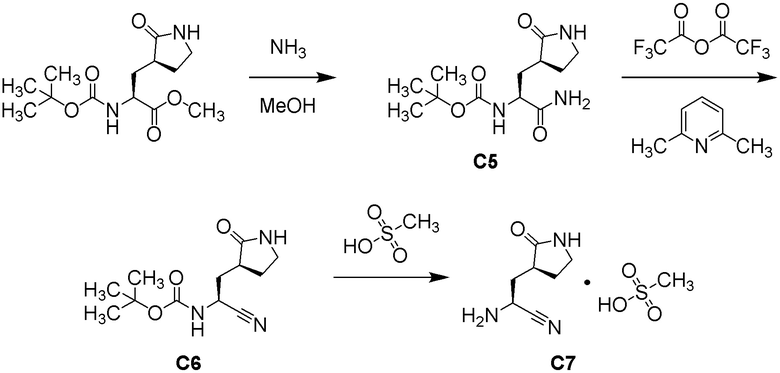
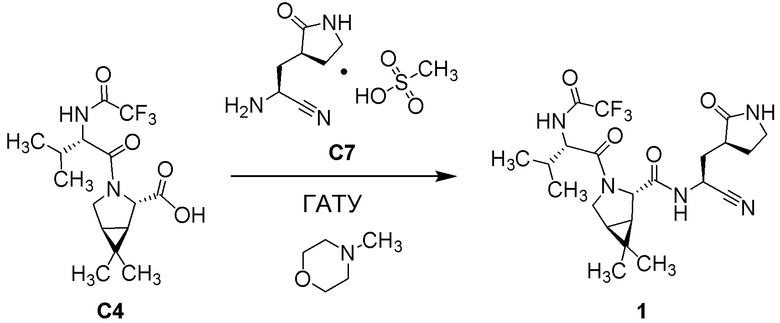
Стадия 1. Синтез метил (1R,2S,5S)-3-[N-(трет-бутоксикарбонил)-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата (C1).
0°C раствор N-(трет-бутоксикарбонил)-L-валина (69,7 г, 321 ммоль) в смеси ацетонитрила и N, N-диметилформамида (10:1, 1,10 л) обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 122 г, 321 ммоль), затем N, N-диизопропилэтиламином (127 мл, 729 ммоль). затем реакционную смесь перемешивают в течение 5 минут, добавляют метил (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилат, гидрохлорид (60,0 г, 292 ммоль), и перемешивание продолжают при 0°C в течение 1 часа. Реакционную смесь затем разбавляют водным раствором лимонной кислоты (1 N; 50 мл) и водой (100 мл), перемешивают в течение 2 минут, и концентрируют в вакууме до приблизительно половины исходного объема. Полученную смесь разделяют между этилацетатом и водой, и водный слой экстрагируют три раза этилацетатом. Объединенные органические слои затем промывают три раза водой и один раз насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Остаток перемешивают в минимальном количестве этилацетата, и затем фильтруют; нерастворимый продукт промывают этилацетатом, пока он не станет белым. Объединенные фильтраты концентрируют при пониженном давлении и затем подвергают хроматографии на силикагеле (Элюент: 1:1 этилацетат/гептан), с получением C1 в виде желтого масла. Выход: 109 г, количественный. ЖХМС m/z 369,3 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 5,08 (д, J=9,6 Гц, 1H), 4,45 (с, 1H), 4,11 (дд, J=9,7, 7,8 Гц, 1H), 3,95 (д, половина АВ квартета, J=10,1 Гц, 1H), 3,86 (дд, компонент системы АВХ, J=10,2, 4,8 Гц, 1H), 3,74 (с, 3H), 2,04-1,93 (м, 1H), 1,50-1,41 (м, 2H), 1,40 (с, 9H), 1,04 (с, 3H), 1,00 (д, J=6,8 Гц, 3H), 0,95 (д, J=6,8 Гц, 3H), 0,93 (с, 3H).
Стадия 2. Синтез метил (1R,2S,5S)-6,6-диметил-3-L-валил-3-азабицикло[3,1,0]гексан-2-карлоксилата, гидрохлорида (C2).
Раствор гидрохлорида в 1,4-диоксане (4 M; 15 мл, 60 ммоль) добавляют к 0°C раствору C1 (1,00 г, 2,71 ммоль) в этилацетате (50 мл). Реакционную смесь перемешивают при 0°C в течение 2 часов, затем добавляют дополнительный гидрохлорид в растворе 1,4-диоксана (4 M; 10 мл, 40 ммоль), и перемешивание продолжают при 0°C в течение 3 часов, затем при комнатной температуре в течение 1 часа. Реакционную смесь затем обрабатывают раствором гидрохлорида в 1,4-диоксане (4 M; 10 мл, 40 ммоль) и метаноле (15 мл) и перемешивают в течение ночи при комнатной температуре. Концентрация в вакууме дает C2 в виде камеди; этот продукт применяют для следующей химической обработки без дальнейшей очистки, и реакцию оценивают как количественную. ЖХМС m/z 269,3 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,24 (шс, 3H), 4,27 (с, 1H), 3,81-3,61 (м, 3H), 3,67 (с, 3H), 2,21-2,06 (м, 1H), 1,63-1,55 (м, 1H), 1,49 (д, компонент АВ квартета, J=7,6 Гц, 1H), 1,09-0,88 (м, 12H).
Стадия 3. Синтез метил (1R,2S,5S)-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карлоксилата (C3).
Триэтиламин (1,55 мл, 11,1 ммоль) добавляют к 0°C раствору C2 (1,0 г, 3,3 ммоль) в дихлорметане (37 мл), затем по каплям добавляют трифторуксусный ангидрид (0,57 мл, 4,0 ммоль) в течение 30 минут. Реакционную смесь перемешивают при 0°C в течение 30 минут, затем ее разбавляют дихлорметаном (100 мл), промывают последовательно 10% водным раствором бисульфата калия (50 мл) и насыщенным водным раствором хлорида натрия (30 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме с получением C3 в виде светло-желтого масла. Выход: 1,2 г, 3,3 ммоль, количественный. ЖХМС m/z 365,2 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 7,04 (шд, J=8,8 Гц, 1H), 4,54 (дд, J=8,9, 6,3 Гц, 1H), 4,46 (с, 1H), 3,91 (дд, J=10,1, 5,0 Гц, 1H), 3,80-3,73 (м, 1H), 3,76 (с, 3H), 2,25-2,13 (м, 1H), 1,55-1,47 (м, 2H), 1,09-1,03 (м, 6H), 0,94 (д, J=6,8 Гц, 3H), 0,92 (с, 3H).
Стадия 4. Синтез (1R,2S,5S)-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C4).
Концентрированную хлористоводородную кислоту (0,57 мл, 6,6 ммоль) добавляют в раствор C3 (1,25 г, 3,43 ммоль) в смеси уксусной кислоты (40,8 мл) и воды (8,2 мл). Реакционную смесь нагревают при 55°C в течение 3 дней, затем ее разделяют между водой (50 мл) и этилацетатом (100 мл). Водный слой экстрагируют этилацетатом (2×50 мл), и объединенные органические слои промывают насыщенным водным раствором хлорида натрия (50 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме с получением C4 в виде белой пены. Выход: 1,00 г, 2,85 ммоль, 83%. ЖХМС m/z 351,2 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d), характеристические пики: δ 4,56-4,44 (м, 2H), 2,24-2,12 (м, 1H), [1,66 (д, компонент АВ квартета, J=7,5 Гц) и 1,59-1,47 (м), всего 2H], 1,10-1,01 (м, 6H), 0,96-0,91 (м, 6H).
Стадия 5. Синтез трет-бутил {(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамата (C5).
Раствор аммиака в метаноле (7,0 M; 150 мл, 1,0 моль) добавляют к 0°C раствору метил N-(трет-бутоксикарбонил)-3-[(3S)-2-оксопирролидин-3-ил]-L-аланината (5,00 г, 17,5 ммоль) в метаноле (25 мл). Затем реакционную смесь перемешивают при комнатной температуре в течение 3 дней, ее концентрируют в вакууме; остаток разбавляют и повторно концентрируют последовательно смесь этилацетата и гептана (1:1, 4×50 мл) затем гептана (50 мл) с получением C5 в виде твердого вещества (5,27 г, количественная оценка) которое содержит остаточный растворитель. Часть этого продукта применяют на следующей стадии. ЖХМС m/z 216,2 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 4,16-3,96 (м, 1H), 3,40-3,27 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,55-2,42 (м, 1H), 2,35 (дддд, J=12,2, 8,6, 6,8, 3,3 Гц, 1H), 2,03 (ддд, J=14,0, 11,0, 4,4 Гц, 1H), 1,93-1,81 (м, 1H), 1,74 (ддд, J=14,2, 10,1, 4,3 Гц, 1H), 1,45 (с, 9H).
Стадия 6. Синтез трет-бутил {(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}карбамата (C6).
2,6-диметилпиридин (2 мл, 17 ммоль) и трифторуксусный ангидрид (0,94 мл, 6,6 ммоль) добавляют к 0°C раствору C5 (с предыдущей стадии; 1,0 г, ≤3,3 ммоль) в дихлорметане (12 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 часов, где ее обрабатывают хлористоводородной кислотой (1 M; 30 мл) и дихлорметаном (60 мл). Органический слой промывают последовательно насыщенным водным раствором хлорида натрия (30 мл) и насыщенным водным раствором бикарбоната натрия (30 мл), сушат над сульфатом натрия, и концентрируют в вакууме; хроматография на силикагеле (Градиент: 40%-100% этилацетат в гептане) дает C6 в виде твердого вещества. Выход: 737 мг, 2,91 ммоль, 88% за 2 стадии. ЖХМС m/z 254,3 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 4,72 (дд, J=9,3, 6,8 Гц, 1H), 3,39-3,27 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,57-2,46 (м, 1H), 2,36 (дддд, J=12,2, 8,6, 6,3, 3,4 Гц, 1H), 2,21 (ддд, J=13,8, 9,3, 5,6 Гц, 1H), 1,92-1,79 (м, 2H), 1,47 (с, 9H).
Стадия 7. Синтез (2S)-2-амино-3-[(3S)-2-оксопирролидин-3-ил]пропаннитрил, метансульфонат (C7).
В раствор C6 (317 мг, 1,25 ммоль) в 1,1,1,3,3,3-гексафторпропан-2-оле (3 мл) добавляют метансульфоновую кислоту (81,2 мкл, 1,25 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в течение 45 минут, концентрируют в вакууме, затем несколько раз помещают в смесь растворителей и повторно концентрируют: ацетонитрил и этилацетат (1:1, 2×10 мл) затем этилацетат и гептан (1:1, 2×10 мл). Полученный C7 получают в виде стекла (423 мг), который не содержит нитриловый эпимер через 1H и 13C ЯМР анализ. Часть этого продукта используют в следующих реакциях без дополнительной очистки. ЖХМС m/z 154,2 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 4,78 (t, J=7,3 Гц, 1H), 3,42-3,36 (м, 2H), 2,82-2,68 (м, 1H), 2,70 (с, 3H), 2,50-2,39 (м, 1H), 2,20 (t, J=7,3 Гц, 1H), 2,07-1,80 (м, 2H).
Стадия 8. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (1).
Смесь C7 (с предыдущей стадии; 98,8 мг, ≤0,292 ммоль) и C4 (100 мг, 0,285 ммоль) в ацетонитриле (1,5 мл) охлаждают до 0°C. Добавляют O-(7-Азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония гексафторфосфат (ГАТУ, 97%; 112 мг, 0,286 ммоль), затем раствор 4-метилморфолин (94,0 мкл, 0,855 ммоль) в ацетонитриле (0,5 мл), и реакционную смесь перемешивают при 0°C в течение приблизительно 2 часов. Затем добавляют насыщенный водный раствор бикарбоната натрия (30 мл) к 0°C реакционной смеси, затем дихлорметан (50 мл), и органический слой промывают хлористоводородной кислотой (1 M; 30 мл). Объединенные водные слои экстрагируют дихлорметаном (60 мл), затем объединенные органические слои сушат над сульфатом натрия, концентрируют в вакууме, и подвергают хроматографии на силикагеле (Градиент: 0% - 20% метанол в этилацетате). Полученный продукт оценивают ЯМР и ЖХМС как загрязненный эпимером продукта, его затем очищают ВЭЖХ с обращенной фазой (Колонка: Waters Sunfire C18, 19×100 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусную кислоту (об./об.); Подвижная фаза B: ацетонитрил, содержащий 0,05% трифторуксусную кислоту (об./об.); Градиент: 5% - 95% B за 8,54 минут, затем 95% B в течение 1,46 минут; Скорость потока: 25 мл/минуту) с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (1). Выход: 14,6 мг, 30,1 мкмоль, 11%. ЖХМС m/z 486,5 [M+H]+. Время удержания: 2,33 минут (Аналитические условия. Колонка: Waters Atlantis C18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусную кислоту (об./об.); Подвижная фаза B: ацетонитрил, содержащий 0,05% трифторуксусную кислоту (об./об.). Градиент: 5% - 95% B за 4,0 минут, затем 95% B в течение 1,0 минуты. Скорость потока: 2 мл/минуту).
Альтернативный синтез C4
(1R,2S,5S)-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C4)
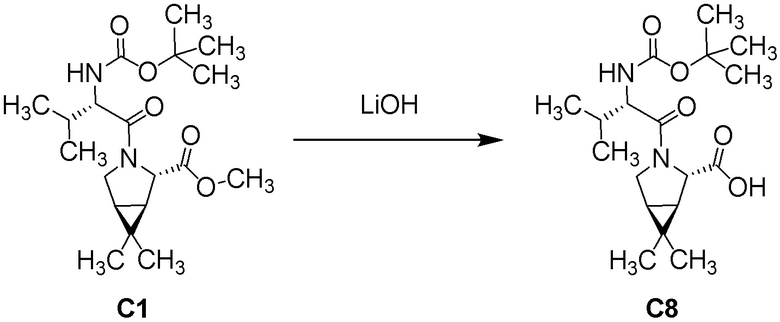
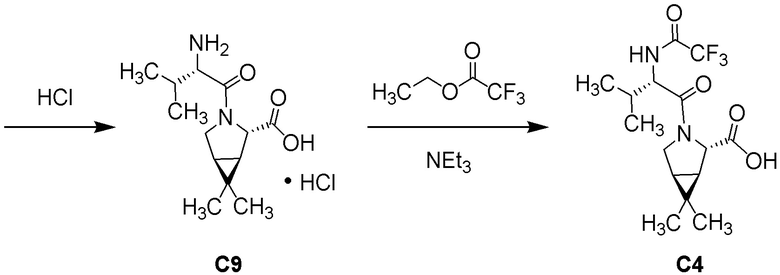
Стадия 1. Синтез (1R,2S,5S)-3-[N-(трет-бутоксикарбонил)-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C8).
Водный раствор гидроксида лития (2,0 M; 436 мл, 872 ммоль) добавляют в раствор C1 (107 г, 290 ммоль) в тетрагидрофуране (730 мл). Затем полученную смесь перемешивают при комнатной температуре в течение приблизительно 2 часов, ее разбавляют водой и этилацетатом, затем обрабатывают 1 M водным раствором гидроксида натрия. Водный слой промывают этилацетатом, и объединенные органические слои экстрагируют три раза 1 M водным раствором гидроксида натрия, до тех пор, пока ЖХМС анализ не показал, что C8 был полностью удален из органического слоя. Подкисление объединенных водных слоев до pH 2 проводят добавлением концентрированной хлористоводородной кислоты, затем смесь экстрагируют три раза этилацетатом. Объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют; растирание остатка с гептаном дает C8 в виде белого твердого вещества. Выход: 92,8 г, 262 ммоль, 90%. ЖХМС m/z 355,3 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 4,32 (с, 1H), 4,05 (д, половина АВ квартета, J=10,5 Гц, 1H), 4,01 (д, J=9,0 Гц, 1H), 3,88 (дд, компонент системы АВХ, J=10,4, 5,3 Гц, 1H), 2,03-1,91 (м, 1H), 1,57 (дд, компонент системы АВХ, J=7,5, 5,2 Гц, 1H), 1,50 (д, половина АВ квартета, J=7,5 Гц, 1H), 1,41 (с, 9H), 1,08 (с, 3H), 0,99 (д, J=6,8 Гц, 3H), 0,97-0,94 (м, 6H).
Стадия 2. Синтез (1R,2S,5S)-6,6-диметил-3-L-валил-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты, гидрохлорид (C9).
В раствор C8 (82,8 г, 234 ммоль) в дихлорметане (230 мл) добавляют раствор гидрохлорида в 1,4-диоксане (4,0 M; 409 мл, 1,64 моль). Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем ее концентрируют в вакууме, с получением C9 в виде белой пены. Этот продукт применяют непосредственно на следующей стадии. ЖХМС m/z 255,3 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 4,42 (с, 1H), 4,05 (д, J=4,8 Гц, 1H), 3,89 (дд, компонент системы АВХ, J=10,5, 5,2 Гц, 1H), 3,74 (д, половина АВ квартета, J=10,5 Гц, 1H), 2,36-2,25 (м, 1H), 1,62 (дд, компонент системы АВХ, J=7,5, 5,1 Гц, 1H), 1,57 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,16 (д, J=7,0 Гц, 3H), 1,10 (с, 3H), 1,04 (д, J=6,9 Гц, 3H), 1,01 (с, 3H).
Стадия 3. Синтез (1R,2S,5S)-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C4).
Раствор C9 (с предыдущей стадии; ≤234 ммоль) в метаноле (230 мл) охлаждают до 0°C, обрабатывают триэтиламином (66,7 мл, 479 ммоль), и перемешивают в течение 5 минут, затем медленно добавляют этилтрифторацетат (36,1 мл, 303 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в течение 90 минут, ее концентрируют в вакууме. Остаток разбавляют водой, 1 M водным раствором гидроксида натрия и этилацетатом, и полученный органический слой экстрагируют дважды 1 M водным раствором гидроксида натрия. Объединенные водные слои подкисляют до pH 2 добавлением 1 M хлористоводородной кислоты, затем экстрагируют три раза этилацетатом. Объединенные органические слои промывают водой и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме, с получением C4 в виде белой пены. Выход: 73,4 г, 210 ммоль, 90% за 2 стадии. ЖХМС m/z 351,3 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 12,65 (v шс, 1H), 9,82 (д, J=7,7 Гц, 1H), 4,16 (дд, J=9,9, 7,9 Гц, 1H), 4,12 (с, 1H), 3,86 (д, половина АВ квартета, J=10,4 Гц, 1H), 3,81 (дд, компонент системы АВХ, J=10,5, 5,0 Гц, 1H), 2,18-2,05 (м, 1H), 1,54 (дд, компонент системы АВХ, J=7,7, 4,6 Гц, 1H), 1,42 (д, половина АВ квартета, J=7,5 Гц, 1H), 1,02 (с, 3H), 0,95 (д, J=6,7 Гц, 3H), 0,89 (д, J=6,6 Гц, 3H), 0,84 (с, 3H).
Альтернативный синтез примера 1
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (1)
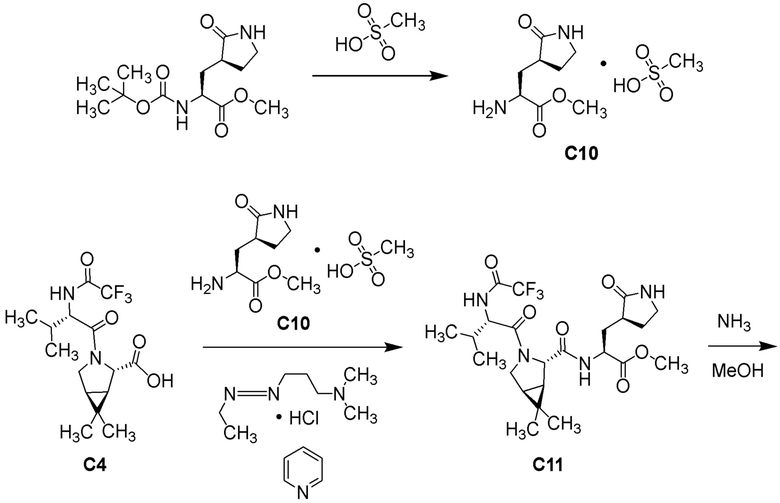
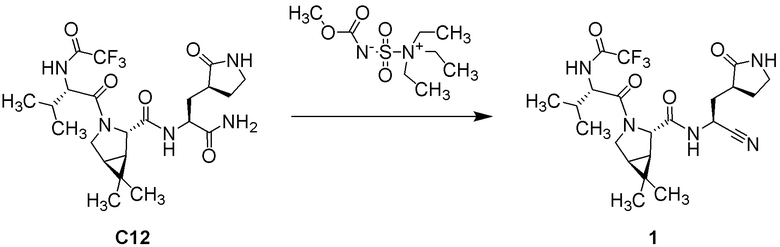
Стадия 1. Синтез метил 3-[(3S)-2-оксопирролидин-3-ил]-L-аланинат, метансульфоната (C10).
В раствор метил N-(трет-бутоксикарбонил)-3-[(3S)-2-оксопирролидин-3-ил]-L-аланината (10,1 г, 35,3 ммоль) в 1,1,1,3,3,3-гексафторпропан-2-оле (70 мл) добавляют метансульфоновую кислоту (2,30 мл, 35,4 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в течение 70 минут, ЖХМС анализ показывает, что исходный материал был превращен в C10: ЖХМС m/z 187,2 [M+H]+. Реакционную смесь концентрируют в вакууме, и остаток дважды перерастворяют, затем концентрируют при пониженном давлении в смеси ацетонитрила и этилацетата (1:1, 2×20 мл). Полученный продукт помещают в смесь ацетонитрила и этилацетата (1:1, 30 мл), концентрируют, затем дважды перерастворяют в этилацетате (2×40 мл) и концентрируют. Остаток растирают этилацетатом (60 мл) с получением C10. Выход: 9,87 г, 35,0 ммоль, 99%. 1H ЯМР (400 MГц, метанол-d4) δ 4,22 (дд, J=9,7, 3,6 Гц, 1H), 3,86 (с, 3H), 3,41-3,36 (м, 2H), 2,84-2,74 (м, 1H), 2,70 (с, 3H), 2,41 (дддд, J=12,3, 8,6, 5,1, 3,6 Гц, 1H), 2,25 (ддд, J=15,1, 4,5, 3,6 Гц, 1H), 1,98 (ддд, J=15,1, 9,6, 9,6 Гц, 1H), 1,87 (дддд, J=12,6, 10,9, 9,2, 9,2 Гц, 1H).
Стадия 2. Синтез метил N-({(1R,2S,5S)-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-ил}карбонил)-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинат (C11).
К 0°C раствору C10 (2,76 г, 9,78 ммоль) и C4 (3,43 г, 9,79 ммоль) в ацетонитриле (40 мл) добавляют гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (1,88 г, 9,81 ммоль), затем по каплям добавляют пиридин (2,37 мл, 29,3 ммоль). Реакционную смесь перемешивают при 0°C в течение 2,25 часов, затем обрабатывают хлористоводородной кислотой (1 M; 50 мл) и экстрагируют этилацетатом (150 мл). Органический слой промывают последовательно насыщенным водным раствором хлорида натрия (50 мл), насыщенным водным раствором бикарбоната натрия (50 мл) и насыщенным водным раствором хлорида натрия (50 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Остаток помещают в метил трет-бутиловый эфир (30 мл) и концентрируют при пониженном давлении, и полученное стекло перемешивают с метил трет-бутиловым эфиром (50 мл) при комнатной температуре в течение ночи. После фильтрации, фильтровальную лепешку промывают с метил трет-бутиловым эфиром (3×6 мл) с получением C11 в виде твердого вещества, которое согласно 1H ЯМР анализу содержит значительный остаточный метил трет-бутиловый эфир. Часть этого продукта применяют на следующей стадии. Выход: 3,74 г; скорректирован на остаточный метил трет-бутиловый эфир: 2,94 г, 5,67 ммоль, 58%. ЖХМС m/z 519,5 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 4,55 (дд, J=12,0, 3,8 Гц, 1H), 4,34 (с, 1H), 4,29 (д, J=9,6 Гц, 1H), 3,97 (д, J=3,1 Гц, 2H), 3,74 (с, 3H), 3,37-3,23 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,73-2,62 (м, 1H), 2,32 (дддд, J=12,4, 8,8, 6,7, 2,4 Гц, 1H), 2,21-2,10 (м, 2H), 1,86-1,74 (м, 2H), 1,60 (дт, компонент ABX2 системы, J=7,7, 3,1 Гц, 1H), 1,49 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,09 (с, 3H), 1,02 (д, J=6,9 Гц, 3H), 0,99-0,95 (м, 6H).
Стадия 3. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (C12).
Раствор аммиака в метаноле (7,0 M; 5 мл, 40 ммоль) добавляют в раствор C11 (с предыдущей стадии: 205 мг, 0,311 ммоль) в метаноле (1 мл). Полученный раствор перемешивают при комнатной температуре в течение 1,5 часов, затем снова добавляют раствор аммиака в метаноле (7,0 M; 5 мл, 40 ммоль), и перемешивание продолжают в течение ночи. Реакционную смесь затем обрабатывают третий раз тем же количеством аммиака в метаноле; через еще 8 часов реакции, ее концентрируют в вакууме. Остаток разбавляют и повторно концентрируют последовательно этилацетатом (2×20 мл) и смесью этилацетата и гептана (1:1, 2×20 мл). Полученный продукт растворяют в дихлорметане (50 мл), промывают хлористоводородной кислотой (1 M; 30 мл) и насыщенным водным раствором хлорида натрия (30 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме с получением C12 в виде твердого вещества. Выход: 87 мг, 0,17 ммоль, 55%. ЖХМС m/z 504,5 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 8,68 (д, J=7,9 Гц, <1H, неполностью заменен растворителем), 4,44 (ддд, J=11,9, 7,9, 4,0 Гц, 1H), 4,37-4,26 (м, 2H), 4,01 (дд, компонент системы АВХ, J=10,3, 5,1 Гц, 1H), 3,94 (д, половина АВ квартета, J=10,2 Гц, 1H), 3,39-3,24 (м, 2H, предполагаемый; в большей части закрыт пиком растворителя), 2,72-2,62 (м, 1H), 2,38-2,28 (м, 1H), 2,21-2,08 (м, 2H), 1,90-1,72 (м, 2H), 1,58 (дд, компонент системы АВХ, J=7,5, 5 Гц, 1H), 1,54 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,08 (с, 3H), 1,02 (д, J=6,7 Гц, 3H), 0,97 (д, J=6,7 Гц, 3H), 0,96 (с, 3H).
Стадия 4. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (1).
Метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 88,4 мг, 0,371 ммоль) добавляют в раствор C12 (85,0 мг, 0,17 ммоль) в дихлорметане (4,0 мл), и реакционную смесь перемешивают при комнатной температуре. Через 3 часа, метил снова добавляют N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 20 мг, 84 мкмоль); через 30 минут реакционную смесь разбавляют этилацетатом (60 мл), промывают последовательно хлористоводородной кислотой (1 M; 30 мл), насыщенным водным раствором бикарбоната натрия (30 мл), и насыщенным водным раствором хлорида натрия (30 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Остаток берут в гептане и повторно концентрируют с последующей очисткой хроматографией на силикагеле (Градиент: 0% - 5% метанол в этилацетате). (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (1) выделяют в виде твердого вещества. Выход: 35 мг, 72 мкмоль, 42%. ЖХМС m/z 486,5 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 5,04 (дд, J=10,7, 5,4 Гц, 1H), 4,28 (д, J=9,6 Гц, 1H), 4,25 (с, 1H), 4,03-3,94 (м, 2H), 3,35-3,23 (м, 2H, предполагаемый; в большей части закрыт пиком растворителя), 2,72-2,62 (м, 1H), 2,37-2,26 (м, 2H), 2,19-2,08 (м, 1H), 1,93-1,75 (м, 2H), 1,64 (ддд, J=7,6, 4,2, 2,1 Гц, 1H), 1,41 (д, J=7,6 Гц, 1H), 1,09 (с, 3H), 1,02 (д, J=6,8 Гц, 3H), 1,00-0,95 (м, 6H).
Пример 2
N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-(пирролидин-1-илацетил)-L-лейцинамид, трифторацетат (2)
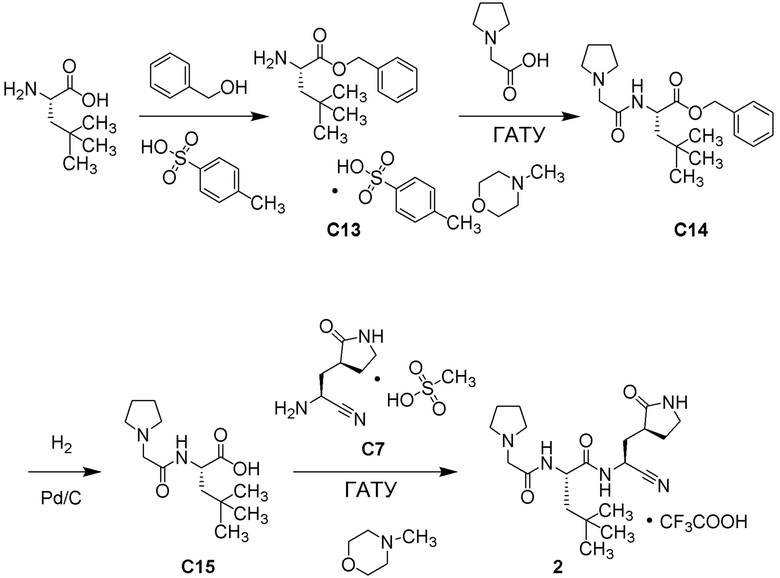
Стадия 1. Синтез бензил 4-метил-L-лейцината, соли п-толуолсульфоновой кислоты (C13).
Суспензию 4-метил-L-лейцина (9,5 г, 65 ммоль), бензилового спирта (28,3 г, 262 ммоль), и моногидрата п-толуолсульфоновой кислоты (14,9 г, 78,3 ммоль) в толуоле (200 мл) нагревают при кипении с обратным холодильником в течение ночи; ловушку Дина-Старка применяют для азеотропного удаления полученной воды. Реакционную смесь затем концентрируют в вакууме, затем остаток разбавляют диэтиловым эфиром (200 мл) и этилацетатом (100 мл). Полученную суспензию перемешивают в течение 1,5 часов и фильтруют; фильтровальную лепешку промывают диэтиловым эфиром с получением C13 в виде белого твердого вещества. Выход: 24,9 г, 61,1 ммоль, 94%. ЖХМС m/z 236,3 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,30 (шс, 3H), 7,47 (д, J=8,1 Гц, 2H), 7,44-7,36 (м, 5H), 7,11 (д, J=7,8 Гц, 2H), 5,23 (AB квартет, JAB=12,3 Гц, δνAB=13,7 Гц, 2H), 4,02 (дд, J=7,3, 4,5 Гц, 1H), 2,29 (с, 3H), 1,81 (дд, J=14,5, 7,3 Гц, 1H), 1,57 (дд, J=14,5, 4,6 Гц, 1H), 0,90 (с, 9H).
Стадия 2. Синтез бензил 4-метил-N-(пирролидин-1-илацетил)-L-лейцината (C14).
0°C смесь C13 (800 мг, 1,96 ммоль) и пирролидин-1-илуксусной кислоты (254 мг, 1,97 ммоль) в N, N-диметилформамиде (4 мл) обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 746 мг, 1,96 ммоль), затем раствором 4-метилморфолина (0,496 мл, 4,51 ммоль) в дихлорметане (1 мл). Затем реакционную смесь перемешивают при 0°C в течение 2 часов, добавляют насыщенный водный раствор бикарбоната натрия (30 мл) при 0°C; полученную смесь экстрагируют этилацетатом (2×60 мл), и объединенные органические слои сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Очистку хроматографией на силикагеле проводят дважды (Градиент: 0% - 20% этилацетат в гептане, затем вторая хроматографическая очистка с применением 0% - 10% этилацетат в гептане), с получением C14 в виде камеди (761 мг). Этот продукт применяют непосредственно на следующей стадии. ЖХМС m/z 347,4 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 7,40-7,29 (м, 5H), 5,16 (AB квартет, JAB=12,2 Гц, δνAB=11,1 Гц, 2H), 4,56 (дд, J=9,0, 3,1 Гц, 1H), 3,76 (AB квартет, JAB=15,6 Гц, δνAB=13,6 Гц, 2H), 3,17-3,06 (м, 4H), 2,03-1,93 (м, 4H), 1,81 (дд, J=14,5, 3,1 Гц, 1H), 1,60 (дд, J=14,5, 9,0 Гц, 1H), 0,95 (с, 9H).
Стадия 3. Синтез 4-метил-N-(пирролидин-1-илацетил)-L-лейцина (C15).
В раствор C14 (с предыдущей стадии; 760 мг, ≤1,96 ммоль) в метаноле (5 мл) добавляют палладий на угле (76,0 мг). Реакционную смесь перемешивают при комнатной температуре под водородом (50 ф./кв.д.) в течение ночи, затем ЖХМС анализ показывает превращение в C15: ЖХМС m/z 257,4 [M+H]+. Реакционную смесь фильтруют дважды через 0,15 мкм фильтр, и фильтрат концентрируют в вакууме. Остаток дважды растворяют в смеси этилацетата и гептана (1:1, 2×20 мл), затем концентрируют при пониженном давлении; это дает C15 в виде твердого вещества (646 мг). Порции этого материала применяют в последующих химических реакциях без дальнейшей очистки. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,46 (д, J=8,3 Гц, 1H), 4,31 (ддд, J=8,9, 8,6, 3,0 Гц, 1H), 3,74-3,60 (м, 2H), 3,00 ш (с, 4H), 1,90-1,79 (м, 4H), 1,70 (дд, компонент системы АВХ, J=14,3, 3,0 Гц, 1H), 1,56 (дд, компонент системы АВХ, J=14,3, 9,2 Гц, 1H), 0,90 (с, 9H).
Стадия 4. Синтез N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-(пирролидин-1-илацетил)-L-лейцинамид, трифторацетата (2).
Смесь C15 (с предыдущей стадии; 30 мг, ≤91 мкмоль) и C7 (со стадии 7 примера 1; 35,3 мг, ≤0,104 ммоль) в N, N-диметилформамиде (1 мл) охлаждают до 0°C и обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ, 97%; 39,9 мг, 0,102 ммоль), затем раствором 4-метилморфолина (28,0 мкл, 0,255 ммоль) в дихлорметане (0,25 мл). Затем реакционную смесь перемешивают при 0°C в течение примерно 1,5 часов, ее разбавляют насыщенным водным раствором бикарбоната натрия (3 мл) при 0°C и экстрагируют дихлорметаном (4×4 мл). Объединенные органические слои концентрируют в вакууме и очищают ВЭЖХ с обращенной фазой (Колонка: Waters Sunfire C18, 19×100 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил, содержащий 0,05% трифторуксусной кислоты (об./об.); Градиент: 5% - 25% B в течение 8,5 минут, затем 25% - 95% ацетонитрил в течение 0,5 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 25 мл/минуту) с получением N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-N2-(пирролидин-1-илацетил)-L-лейцинамида, трифторацетата (2) в виде камеди. Выход: 8,1 мг, 16 мкмоль, 18% за 3 стадии. ЖХМС m/z 392,6 [M+H]+. Время удержания: 1,47 минут (Аналитические условия. Колонка: Waters Atlantis C18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.). Градиент: 5% - 95% B over 4,0 минут, затем 95% B в течение 1,0 минуты. Скорость потока: 2 мл/минуту).
Пример 3
N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-(2,6-дихлорбензоил)-4-метил-L-лейцинамид (3)
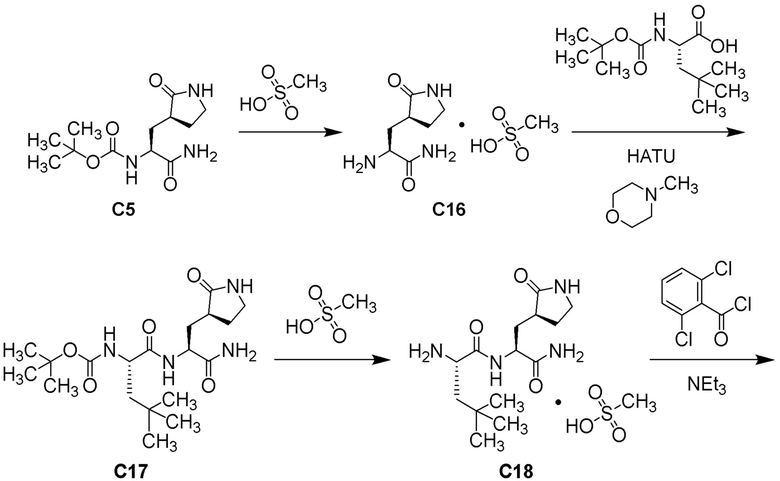
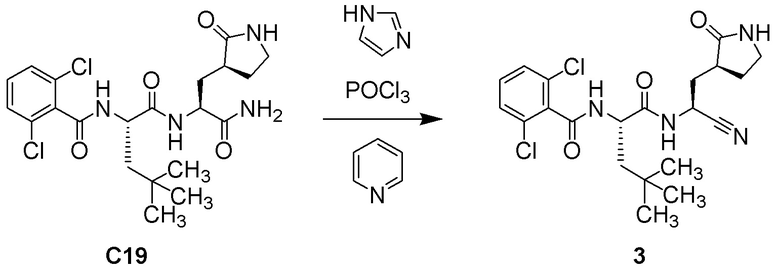
Стадия 1. Синтез 3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида, метансульфоната (C16).
В раствор C5 (6,13 г, ≤19 ммоль) в 1,1,1,3,3,3-гексафторпропан-2-оле (40 мл) добавляют метансульфоновую кислоту (1,83 г, 19 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, затем ее концентрируют в вакууме, ресуспендируют в смеси толуола и гептана, и концентрируют еще один раз с получением гигроскопичного стекла (7,47 г). Часть этого продукта (6,47 г) разбавляют и повторно концентрируют последовательно со следующим: смесь дихлорметана и этанола (2:3, 2×50 мл); этилацетата и этанола (2:3, 50 мл); этилацетата, гептана и дихлорметана (4:4:1, 2×50 мл). Полученный продукт растворяют в смеси ацетонитрила и воды (1:1, 22 мл) и лиофилизируют в течение 2 дней с получением C16 в виде стекла. Выход: 3,23 г, 12,1 ммоль, 73% за 2 стадии. ЖХМС m/z 172,2 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 4,03 (дд, J=9,1, 4,6 Гц, 1H), 3,43-3,35 (м, 2H), 2,82-2,72 (м, 1H), 2,71 (с, 3H), 2,49-2,38 (м, 1H), 2,12-1,96 (м, 2H), 1,94-1,81 (м, 1H).
Стадия 2. Синтез N-(трет-бутоксикарбонил)-4-метил-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C17).
0°C раствор C16 (1,34 г, 5,02 ммоль) и N-(трет-бутоксикарбонил)-4-метил-L-лейцина (1,28 г, 5,22 ммоль) в N, N-диметилформамиде (7,0 мл) обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ, 97%; 2,04 г, 5,20 ммоль), затем раствором 4-метилморфолина (1,43 мл, 13,0 ммоль) в дихлорметане (3 мл). Затем реакционную смесь перемешивают при 0°C в течение 2,25 часов, ее гасят при 0°C добавлением хлористоводородной кислоты (1 M; 30 мл) и затем разбавляют дихлорметаном (50 мл). Органический слой промывают насыщенным водным раствором бикарбоната натрия (30 мл), и объединенные водные слои экстрагируют дихлорметаном (60 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и суспендируют/концентрируют с гептаном (3×10 мл). Очистка остатка хроматографией на силикагеле (Градиент: 0% - 20% метанол в этилацетате) дает C17 в виде твердого вещества. Выход: 1,42 г, 3,56 ммоль, 71%. ЖХМС m/z 399,4 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 6,83 (д, J=7,4 Гц, <1H, неполностью заменен растворителем), 4,43 (дд, J=11,2, 4,2 Гц, 1H), 4,11-4,05 (м, 1H), 3,38-3,24 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,52-2,41 (м, 1H), 2,40-2,30 (м, 1H), 2,13 (ддд, J=14,0, 11,2, 4,5 Гц, 1H), 1,91-1,75 (м, 2H), 1,71 (дд, компонент системы АВХ, J=14,4, 3,2 Гц, 1H), 1,51 (дд, компонент системы АВХ, J=14,4, 9,3 Гц, 1H), 1,45 (с, 9H), 0,97 (с, 9H).
Стадия 3. Синтез 4-метил-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида, метансульфоната (C18).
Метансульфоновую кислоту (32,6 мкл, 0,502 ммоль) добавляют в раствор C17 (200 мг, 0,502 ммоль) в 1,1,1,3,3,3-гексафторпропан-2-оле (1,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 40 минут, затем ее концентрируют в вакууме, растворяют в этилацетате и концентрируют еще один раз с получением C18 в виде твердого вещества (238 мг). Большую часть этого продукта применяют на следующей стадии. ЖХМС m/z 299,4 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 4,53 (дд, J=10,3, 5,0 Гц, 1H), 3,91 (дд, J=7,6, 5,5 Гц, 1H), 3,41-3,27 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,70 (с, 3H), 2,57-2,47 (м, 1H), 2,41 (дддд, J=12,0, 8,6, 7,0, 3,2 Гц, 1H), 2,15 (ддд, J=14,0, 10,3, 5,0 Гц, 1H), 2,01 (дд, J=14,4, 7,5 Гц, 1H), 1,96-1,85 (м, 1H), 1,78 (ддд, J=14,1, 9,1, 5,0 Гц, 1H), 1,59 (дд, J=14,3, 5,5 Гц, 1H), 1,01 (с, 9H).
Стадия 4. Синтез N-(2,6-дихлорбензоил)-4-метил-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C19).
0°C суспензию C18 (с предыдущей стадии: 234 мг, ≤0,49 ммоль) в дихлорметане (2 мл) обрабатывают триэтиламином (170 мкл, 1,2 ммоль), затем по каплям добавляют раствор 2,6-дихлорбензоилхлорида (130 мг, 0,621 ммоль) в дихлорметане (0,2 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, затем ее разбавляют дихлорметаном (60 мл), затем промывают хлористоводородной кислотой (1 M; 30 мл), затем насыщенным водным раствором бикарбоната натрия (30 мл). Органический слой сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и подвергают хроматографией на силикагеле (Градиент: 0% - 30% метанол в этилацетате) с получением C19. Выход: 120 мг, 0,255 ммоль, 52% за 2 стадии. ЖХМС m/z 471,4 (наблюдается паттерн дихлорного изотопа) [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 8,45 (д, J=7,9 Гц, <1H, неполностью заменен растворителем), 7,45-7,35 (м, 3H), 4,59 (дд, J=7,8, 4,5 Гц, 1H), 4,52-4,44 (м, 1H), 3,37-3,24 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,65-2,55 (м, 1H), 2,37 (дддд, J=12,5, 8,8, 6,6, 2,8 Гц, 1H), 2,19 (ддд, J=13,9, 11,3, 4,5 Гц, 1H), 1,91-1,72 (м, 3H), 1,66 (дд, компонент системы АВХ, J=14,4, 7,8 Гц, 1H), 1,03 (с, 9H).
Стадия 5. Синтез N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-(2,6-дихлорбензоил)-4-метил-L-лейцинамида (3).
Раствор C19 (90 мг, 0,19 ммоль) и 1H-имидазола (33,8 мг, 0,496 ммоль) в пиридине (1 мл) охлаждают на бане ацетонитрил/сухой лед (-35°C). Туда добавляют оксихлорид фосфора (0,100 мл, 1,07 ммоль), и реакционную смесь перемешивают at -30°C - -20°C. Через 30 минут, добавляют пиридин (2 мл) для облегчения перемешивания; через 1 час, дихлорметан (2 мл) добавляют по той же причине. После 2 часов реакции, снова добавляют оксихлорид фосфора (0,100 мл, 1,07 ммоль), и перемешивание продолжают в течение 30 минут при -30°C, затем реакционную смесь нагревают до 0°C и перемешивают в течение еще 40 минут. Ее затем обрабатывают хлористоводородной кислотой (1 M; 30 мл) и экстрагируют дихлорметаном (2×60 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и подвергают хроматографии на силикагеле (Градиент: 0% - 15% метанол в этилацетате) с получением твердого вещества (67 мг). Этот продукт объединяют с продуктом (12 мг) из аналогичной реакции, проводимой с применением C19 (30 мг, 64 мкмоль) и дважды берут в этилацетате (2×3 мл), затем концентрируют при пониженном давлении. Остаток перемешивают со смесью этилацетата и гептана (1:3, 4 мл) при комнатной температуре в течение 40 минут и фильтруют; фильтровальную лепешку промывают смесью этилацетата и гептана (1:3, 5×2 мл) с получением N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-(2,6-дихлорбензоил)-4-метил-L-лейцинамида (3) в виде твердого вещества. Объединенный выход: 70 мг, 0,15 ммоль, 59%. ЖХМС m/z 453,3 (наблюдается паттерн дихлорного изотопа) [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 7,45-7,34 (м, 3H), 5,05 (дд, J=10,7, 5,4 Гц, 1H), 4,56 (дд, J=7,0, 5,7 Гц, 1H), 3,37-3,23 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,70-2,59 (м, 1H), 2,42-2,29 (м, 2H), 1,95-1,77 (м, 3H), 1,67 (дд, компонент системы АВХ, J=14,4, 7,0 Гц, 1H), 1,04 (с, 9H).
Пример 4
N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамид (4)
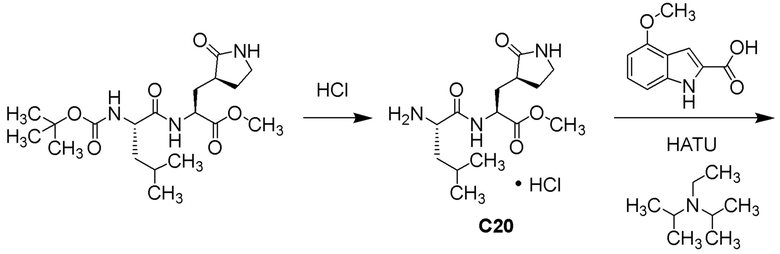
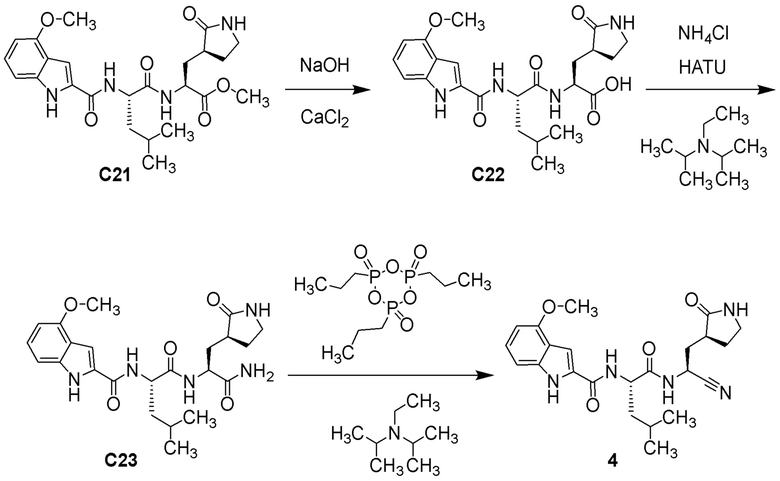
Стадия 1. Синтез метил L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланината, гидрохлорида (C20).
Раствор метил N-(трет-бутоксикарбонил)-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланината (см. Prior, A.M., et al., Bioorg. Med. Chem. Lett. 2013, 23, 6317-6320; 2,0 г, 5,0 ммоль) в смеси метанола (2 мл) и раствора гидрохлорида в этилацетате (4 M; 20 мл) перемешивают при 25°C в течение 1 часа. Концентрация в вакууме дает C20 в виде белого твердого вещества (1,92 г, количественная оценка). 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ 9,09-8,98 (м, 1H), 8,39 (шс, 3H), 7,69 (с, 1H), 4,44-4,31 (м, 1H), 3,22-3,07 (м, 2H), 2,5-2,38 (м, 1H, предполагаемый; частично закрыт пиком растворителя), 2,24-2,11 (м, 1H), 2,11-1,99 (м, 1H), 1,78-1,48 (м, 5H), 0,92 (д, J=6,5 Гц, 3H), 0,89 (д, J=6,5 Гц, 3H).
Стадия 2. Синтез метил N-(4-метокси-1H-индол-2-карбонил)-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланината (C21).
Гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 494 мг, 1,30 ммоль) и N, N-диизопропилэтиламина (388 мг, 3,00 ммоль) добавляют к 0°C раствору C20 (из эксперимента меньшего масштаба аналогичного стадии 1; 336 мг, ≤0,840 ммоль) и 4-метокси-1H-индол-2-карбоновой кислоты (159 мг, 0,832 ммоль) в N, N-диметилформамид (6 мл). Раствор перемешивают при 0°C в течение 1,5 часов, затем выливают в воду/лед (10 мл) и экстрагируют этилацетатом (3×10 мл). Объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (элюент: 10:1 дихлорметан/метанол) дает C21 в виде желтого масла. Выход: 380 мг, 0,804 ммоль, 97%. ЖХМС m/z 473,2 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 11,59-11,53 (м, 1H), 8,53 (д, J=8,0 Гц, 1H), 8,37 (д, J=8,0 Гц, 1H), 7,65 (с, 1H), 7,37-7,33 (м, 1H), 7,09 (дд, J=8, 8 Гц, 1H), 7,00 (д, компонент АВ квартета, J=8,2 Гц, 1H), 6,50 (д, J=7,6 Гц, 1H), 4,56-4,47 (м, 1H), 4,40-4,31 (м, 1H), 3,88 (с, 3H), 3,62 (с, 3H), 3,18-3,05 (м, 2H), 2,41-2,29 (м, 1H), 2,15-2,03 (м, 2H), 1,78-1,49 (м, 5H), 0,93 (д, J=6,3 Гц, 3H), 0,89 (д, J=6,4 Гц, 3H).
Стадия 3. Синтез N-(4-метокси-1H-индол-2-карбонил)-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланин (C22).
К перемешиваемой смеси хлорида кальция (0,887 г, 7,99 ммоль) и гидроксида натрия (0,168 г, 4,20 ммоль) в 2-пропаноле (7 мл) и воде (3 мл) добавляют C21 (1,8 г, 3,8 ммоль). Реакционную смесь перемешивают при 20°C в течение 6 часов, затем ее концентрируют в вакууме, разбавляют водой (4 мл), доводят до pH 4 добавлением 1 M хлористоводородной кислоты и экстрагируют этилацетатом (3×10 мл). Объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Хроматография на силикагеле (элюент: 10:1:0,1 дихлорметан/метанол/уксусной кислоты) дает C22 в виде желтого твердого вещества. Выход: 1,76 г, 3,84 ммоль, 100%. ЖХМС m/z 459,2 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d), характеристические пики: δ 6,51-6,43 (м, 1H), 4,80-4,66 (м, 1H), 4,60-4,45 (м, 1H), 3,92 (с, 3H), 3,36-3,18 (м, 2H), 2,59-2,44 (м, 1H).
Альтернативная стадия 3. Синтез N-(4-метокси-1H-индол-2-карбонил)-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланина (C22).
Раствор C21 (20 мг, 42 мкмоль) в тетрагидрофуране (0,4 мл) обрабатывают водным раствором, содержащим гидроксид лития (14,2 мг, 0,593 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в течение 2,5 часов, ее разбавляют этилацетатом и промывают 10% водным раствором бисульфата калия. Органический слой затем сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме с получением C22 в виде белого твердого вещества. Выход: 20 мг, количественный. ЖХМС m/z 459,2 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 7,27 (с, 1H), 7,14 (дд, компонент системы АВХ, J=8, 8 Гц, 1H), 7,02 (д, компонент АВ квартета, J=8,3 Гц, 1H), 6,50 (д, J=7,7 Гц, 1H), 4,66 (дд, J=9,0, 5,9 Гц, 1H), 4,52 (дд, J=11,7, 3,9 Гц, 1H), 3,92 (с, 3H), 3,30-3,18 (м, 2H), 2,65-2,52 (м, 1H), 2,38-2,26 (м, 1H), 2,21 (ддд, J=14,0, 11,7, 4,1 Гц, 1H), 1,90-1,70 (м, 5H), 1,02 (д, J=6,3 Гц, 3H), 0,99 (д, J=6,3 Гц, 3H).
Стадия 4. Синтез N-(4-метокси-1H-индол-2-карбонил)-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C23).
К 0°C раствору C22 (1,76 г, 3,84 ммоль) и хлорида аммония (0,246 г, 4,60 ммоль) в N, N-диметилформамиде (15 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 1,90 г, 5,00 ммоль) и N, N-диизопропилэтиламин (1,49 г, 11,5 ммоль). Затем реакционную смесь перемешивают при 0°C в течение 1,5 часов, N, N-диизопропилэтиламин (2,3 г, 18 ммоль) используют для доведения pH до 8. Реакционную смесь перемешивают в течение еще 30 минут, затем ее выливают в смесь хлористоводородной кислоты (1 M; 20 мл, 20 ммоль) и льда. Полученную смесь экстрагируют этилацетатом (3×10 мл); объединенные органические слои промывают последовательно хлористоводородной кислотой (1 M; 10 мл) и насыщенным водным раствором хлорида натрия (10 мл), сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и очищают хроматографией на силикагеле (Элюент: 10:1 дихлорметан/метанол), с получением C23 в виде желтого твердого вещества. Выход: 1,09 г, 2,38 ммоль, 62%. ЖХМС m/z 458,0 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 11,62-11,55 (м, 1H), 8,42 (д, J=7,9 Гц, 1H), 8,04 (д, J=8,4 Гц, 1H), 7,60 (шс, 1H), 7,38-7,26 (м, 2H), 7,10 (дд, компонент системы АВХ, J=8, 8 Гц, 1H), 7,06 (шс, 1H), 7,00 (д, компонент АВ квартета, J=8,2 Гц, 1H), 6,51 (д, J=7,7 Гц, 1H), 4,54-4,41 (м, 1H), 4,34-4,22 (м, 1H), 3,88 (с, 3H), 3,17-3,01 (м, 2H), 2,31-1,95 (м, 3H), 1,76-1,45 (м, 5H), 0,92 (д, J=6,1 Гц, 3H), 0,88 (д, J=6,3 Гц, 3H).
Стадия 5. Синтез N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида (4).
К 0°C смеси C23 (500 мг, 1,09 ммоль) и N, N-диизопропилэтиламина (565 мг, 4,37 ммоль) в тетрагидрофуране (8 мл) добавляют 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан 2,4,6-триоксид (50% раствор по массе в этилацетате; 2,78 г, 4,37 ммоль). Затем реакционную смесь перемешивают при 50°C в течение 3 часов, ее концентрируют в вакууме, разбавляют водой (5 мл) и экстрагируют этилацетатом (3×5 мл). Объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме; очистка хроматографией на силикагеле (элюент: 10:1 дихлорметан/метанол) затем ВЭЖХ с обращенной фазой (Колонка: YMC-Actus Triart C18, 50×250 мм, 7 мкм; Подвижная фаза A: вода, содержащая 0,225% муравьиной кислоты; Подвижная фаза B: ацетонитрил; Градиент: 18% - 58% B; Скорость потока: 25 мл/минуту) дает N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамид (4) в виде желтого твердого вещества. Выход: 130 мг, 0,296 ммоль, 27%. ЖХМС m/z 440,2 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 11,58 (шс, 1H), 8,90 (д, J=8,0 Гц, 1H), 8,47 (д, J=7,7 Гц, 1H), 7,71 (шс, 1H), 7,38-7,35 (м, 1H), 7,09 (дд, компонент системы АВХ, J=8, 8 Гц, 1H), 7,00 (д, компонент АВ квартета, J=8,2 Гц, 1H), 6,51 (д, J=7,7 Гц, 1H), 5,02-4,93 (м, 1H), 4,49-4,40 (м, 1H), 3,88 (с, 3H), 3,19-3,05 (м, 2H), 2,41-2,29 (м, 1H), 2,20-2,06 (м, 2H), 1,85-1,62 (м, 4H), 1,58-1,47 (м, 1H), 0,94 (д, J=6,3 Гц, 3H), 0,89 (д, J=6,3 Гц, 3H).
Альтернативный синтез примера 4
N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамид (4)
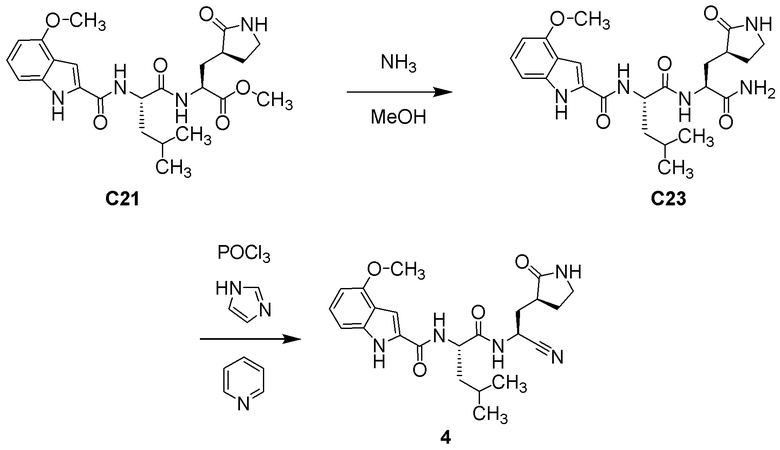
Стадия 1. Синтез N-[(4-метокси-1H-индол-2-ил)карбонил]-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C23).
Раствор аммиака в метаноле (7,0 M; 21 мл, 150 ммоль) добавляют в раствор C21 (500 мг, 1,06 ммоль) в метаноле (2,0 мл). Затем реакционную смесь перемешивают при комнатной температуре в течение 6 часов, и снова добавляют раствор аммиака в метаноле (7,0 M; 7,0 мл, 49 ммоль) и перемешивание продолжают в течение ночи. Раствор аммиака в метаноле (7,0 M; 7,0 мл, 49 ммоль) снова добавляют, и перемешивание продолжают в течение 24 часов, затем проводят конечную обработку раствором аммиака в метаноле (7,0 M; 7,0 мл, 49 ммоль). Реакционную смесь перемешивают в течение еще одного дня, затем ее концентрируют в вакууме. Остаток объединяют с продуктом аналогичной реакции (350 мг из выделенных 512 мг) с применением C21 (500 мг, 1,06 ммоль), и смесь повторно растворяют в этилацетате (5×10 мл) и концентрируют при пониженном давлении с получением C23 (835 мг). Этот продукт применяют непосредственно на следующей стадии. ЖХМС m/z 458,4 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 7,29 (д, J=0,9 Гц, 1H), 7,15 (дд, компонент системы АВХ, J=8, 8 Гц, 1H), 7,03 (шд, компонент АВ квартета, J=8,3 Гц, 1H), 6,51 (д, J=7,7 Гц, 1H), 4,59 (дд, J=9,7, 5,0 Гц, 1H), 4,45 (дд, J=11,3, 4,2 Гц, 1H), 3,93 (с, 3H), 3,34-3,19 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,57-2,47 (м, 1H), 2,31 (дддд, J=12,6, 8,5, 6,8, 2,8 Гц, 1H), 2,15 (ддд, J=14,0, 11,4, 4,6 Гц, 1H), 1,88-1,67 (м, 5H), 1,02 (д, J=6,1 Гц, 3H), 0,98 (д, J=6,1 Гц, 3H).
Стадия 2. Синтез N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида (4).
Раствор C23 (с предыдущей стадии; 835 мг, ≤1,78 ммоль) и 1H-имидазола (323 мг, 4,74 ммоль) в смеси пиридина (4 мл) и дихлорметана (4 мл) охлаждают до -35°C с применением бани ацетонитрил/сухой лед, затем оксихлорид фосфора (0,956 мл, 10,2 ммоль) добавляют по каплям в течение 5 минут. Реакционную смесь перемешивают при температуре от -30°C до -20°C в течение примерно 1,5 часов, затем обрабатывают хлористоводородной кислотой (1 M; 50 мл) и перемешивают в течение 1 часа. После экстрагирования дихлорметаном (3×60 мл), полученные органические слои объединяют, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Остаток объединяют с очищенным 4 из другой партии (75 мг, 0,17 ммоль) и подвергают хроматографии на силикагеле (Градиент: 0% - 5% метанол в этилацетате) с получением 4 в виде твердого вещества (800 мг). Этот продукт объединяют с продуктом (80 мг) из аналогичной реакции, проводимой с применением C23 (161 мг, 0,352 ммоль); полученный продукт перемешивают в диэтиловом эфире (25 мл) в течение 3 дней, затем его фильтруют. Фильтровальную лепешку промывают со смесью диэтилового эфира и гептана (1:1, 4×2 мл) с получением N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида (4) в виде твердого вещества. Объединенный выход: 519 мг, 1,18 ммоль, приблизительно 50% за 2 стадии. ЖХМС m/z 440,5 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 11,57 (д, J=2,3 Гц, 1H), 8,90 (д, J=8,1 Гц, 1H), 8,46 (д, J=7,7 Гц, 1H), 7,70 (с, 1H), 7,37 (д, J=2,3 Гц, 1H), 7,10 (дд, компонент системы АВХ, J=8, 8 Гц, 1H), 7,00 (д, компонент АВ квартета, J=8,2 Гц, 1H), 6,51 (д, J=7,7 Гц, 1H), 5,03-4,92 (м, 1H), 4,51-4,39 (м, 1H), 3,88 (с, 3H), 3,19-3,05 (м, 2H), 2,42-2,30 (м, 1H), 2,20-2,06 (м, 2H), 1,80 (ддд, J=13,2, 9,3, 6,7 Гц, 1H), 1,75-1,63 (м, 3H), 1,58-1,47 (м, 1H), 0,94 (д, J=6,2 Гц, 3H), 0,89 (д, J=6,2 Гц, 3H).
Примеры 5 и 6
N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-3-(трифторметил)-1H-индол-2-карбоксамид (5) и N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-7-(трифторметил)-1H-индол-2-карбоксамид (6)
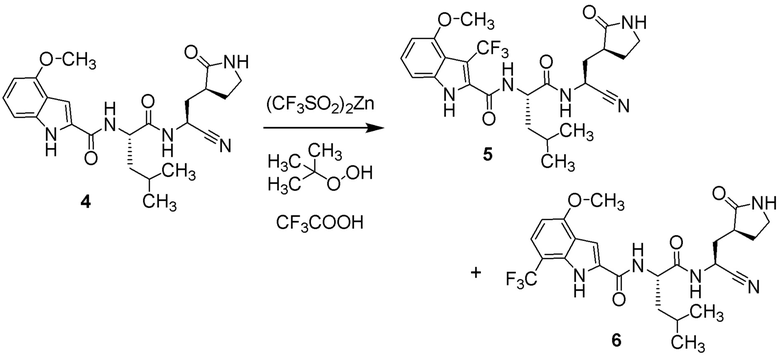
В пробирку со сбросом давления, содержащую трифторметансульфонат цинка(II) (98%, 2,44 мг, 7,21 мкмоль) последовательно добавляют раствор 4 (0,79 мг, 1,8 мкмоль) в диметилсульфоксиде (60 мкл), трифторуксусной кислоте (0,56 мкл, 7,3 мкмоль) и трет-бутилгилропероксиде (70% в воде; 1,25 мкл, 9,03 мкмоль). Пробирку закрывают крышкой и нагревают до 50°C в течение ночи, затем реакционную смесь охлаждают и разбавляют ацетонитрилом и 1% раствором муравьиной кислоты в воде до объема приблизительно 2-3 мл. Конечная смесь композиции растворителя такова, чтобы полученная смесь была прозрачной, обычно примерно 20% - 30% ацетонитрил. Всю смесь подвергают ВЭЖХ с обращенной фазой (Колонка: Phenomenex Luna C18,10×250 мм, 10 мкм; Подвижная фаза A: 0,5% уксусной кислоты в воде; Подвижная фаза B: 9:1 ацетонитрил/метанол; Градиент: 15% B в течение 5 минут, затем 15% - 70% B линейный градиент в течение 84 минут, затем 70% - 95% B в течение 1 минуты, затем 95% B в течение 9 минут; Скорость потока: 2 мл/мин). Элюат пропускают через УФ/ВИД датчик и затем разделяют при приблизительно 15:1 между сборщиком фракций и масс спектрометром с ионной ловушкой. Фракции собирают каждые 20 секунд и те, которые потенциально содержат представляющие интерес продукты оценивают СВЭЖХ-УФ-МСВР перед объединением. Два продукта элюируют при приблизительно 71 и 75 минут. Продуктом, элюированным первым, является 5 {N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-3-(трифторметил)-1H-индол-2-карбоксамид}, и продуктом, элюированным вторым, является 6 {N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-7-(трифторметил)-1H-индол-2-карбоксамид}.
5 - Выход: 0,101 мг, 0,199 мкмоль, 11%. МС с высоким разрешением m/z 508,2171 [M+H]+; рассчитано для C24H29F3N5O4, 508,2172. 1H ЯМР (600 MГц, ДМСО-d6) δ 12,22 (шс, 1H), 9,01 (д, J=7,6 Гц, 1H), 8,96 (д, J=7,9 Гц, 1H), 7,73 (с, 1H), 7,21 (дд, J=8, 8 Гц, 1H), 7,08 (д, J=8,2 Гц, 1H), 6,69 (д, J=7,8 Гц, 1H), 5,03-4,95 (м, 1H), 4,49-4,40 (м, 1H), 3,87 (с, 3H), 3,22-3,08 (м, 2H), 2,43-2,34 (м, 1H), 2,23-2,10 (м, 2H), 1,82 (ддд, J=13,7, 9,3, 6,8 Гц, 1H), 1,78-1,66 (м, 2H), 1,62 (ддд, J=14,6, 9,7, 5,2 Гц, 1H), 1,49 (ддд, J=13,8, 8,8, 5,5 Гц, 1H), 0,97-0,88 (м, 6H). Время удержания: 8,43 минут (Аналитические условия. Колонка: Phenomenex Kinetex XB-C18, 2,1×100 мм, 2,6 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: ацетонитрил; Градиент: 5% B в течение 0,5 минут, затем 5% - 70% B в течение 10,5 минут, затем 70% - 95% B в течение 2 минут; Скорость потока: 0,4 мл/мин).
6 - Выход: 14,7 мкг, 0,029 мкмоль, 1,6%. МС с высоким разрешением m/z 508,2178 [M+H]+; рассчитано для C24H29F3N5O4, 508,2172. 1H ЯМР (600 MГц, ДМСО-d6) δ 11,47 (шс, 1H), 9,00 (д, J=7,9 Гц, 1H), 8,79 (д, J=7,8 Гц, 1H), 7,70 (с, 1H), 7,55 (д, J=8,2 Гц, 1H), 7,35 (с, 1H), 6,72 (д, J=8,3 Гц, 1H), 5,02-4,94 (м, 1H), 4,56-4,48 (м, 1H), 3,97 (с, 3H), 3,18-3,05 (м, 2H), 2,39-2,30 (м, 1H), 2,18-2,08 (м, 2H), 1,86-1,77 (м, 1H), 1,75-1,64 (м, 3H), 1,61-1,52 (м, 1H), 0,95 (д, J=6,1 Гц, 3H), 0,90 (д, J=6,1 Гц, 3H). Время удержания: 8,92 минут (Аналитические условия идентичны тем, которые используют для 5).
Альтернативный синтез примера 6
N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-7-(трифторметил)-1H-индол-2-карбоксамид (6)
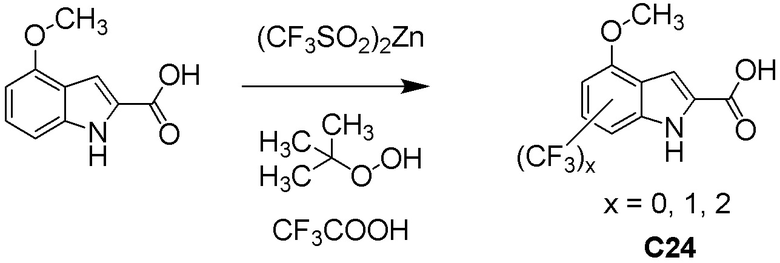
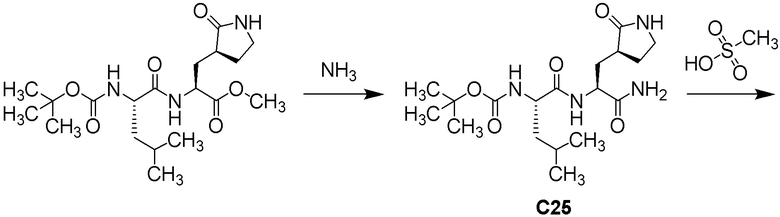
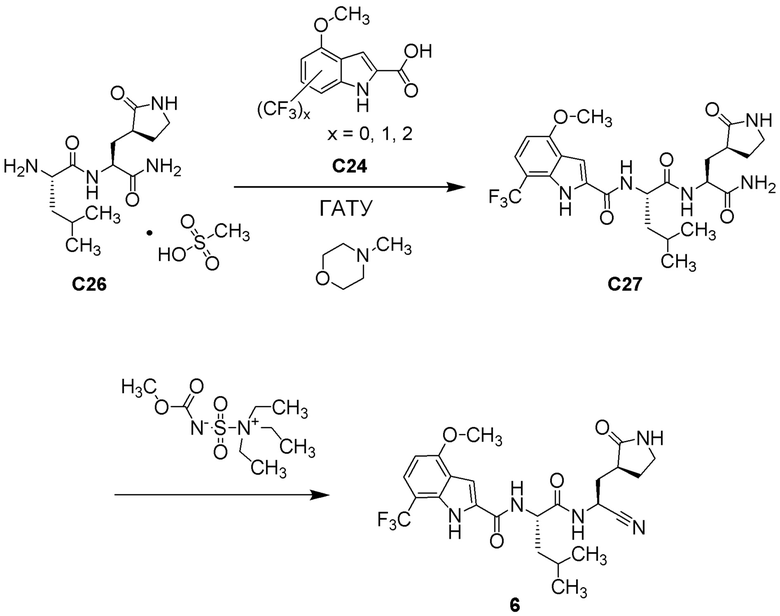
Стадия 1. Синтез трифторметилированной 4-метокси-1H-индол-2-карбоновой кислоты (C24).
Смесь 4-метокси-1H-индол-2-карбоновой кислоты (100 мг, 0,523 ммоль) и трифторметансульфината цинка(II) (120 мг, 0,362 ммоль) обрабатывают диметилсульфоксидом (1,5 мл), затем трифторуксусной кислотой (56 мкл, 0,727 ммоль). После охлаждения реакционной смеси до 0°C, добавляют трет-бутилгилропероксид (70% в воде; 143 мкл, 1,03 ммоль) и перемешивание продолжают при 0°C в течение 20 минут, затем при комнатной температуре в течение 25 минут. Реакционную смесь затем нагревают при 52°C в течение 2 часов, затем ее охлаждают до комнатной температуры и обрабатывают по каплям водным раствором бикарбоната натрия до прекращения барботирования. Затем полученную смесь разделяют между водным раствором бикарбоната натрия и этилацетатом, водный слой экстрагируют один раз этилацетатом и органические слои отбрасывают. Водный слой затем подкисляют до pH 7 с 1 M хлористоводородной кислотой; добавляют этилацетат, и смесь перемешивают до доведения pH до 1 добавлением 1 M хлористоводородной кислоты. После перемешивания двухфазной смеси в течение 10 минут, органический слой промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют, и концентрируют в вакууме. По ЖХМС анализу, остаток (115 мг) содержит смесь исходного продукта и моно-трифторметилированные продукты, а также небольшое количество ди-трифторметилированного продукта. Объем этой смеси применяют на стадии 4. Выход: 115 мг, <0,4 ммоль. ЖХМС m/z 189,8, 257,8, 325,8 (незначительный) [M-H]-. 1H ЯМР (400 MГц, метанол-d4), характеристические пики их трех основных компонентов: δ 7,07 (шд, J=8,4 Гц), 7,02 (шд, J=8,4 Гц), 6,81 (д, J=7,8 Гц), 6,66 (д, J=7,8 Гц), 6,51 (д, J=7,7 Гц), 4,06 (с, -OMe), 3,93 (с, -OMe), 3,92 (с, -OMe).
Стадия 2. Синтез N-(трет-бутоксикарбонил)-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C25).
К 0°C раствору метил N-(трет-бутоксикарбонил)-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланината (см. Prior, A.M., et al., Bioorg. Med. Chem. Lett. 2013, 23, 6317-6320; 1,5 г, 3,8 ммоль) в метаноле (5 мл) добавляют раствор аммиака в метаноле (7 M; 43 мл, 300 ммоль). После того, как реакционный сосуд будет закрыт крышкой, реакционную смесь перемешивают в течение ночи при комнатной температуре. Раствор аммиака в метаноле (7 M; 10,7 мл, 74,9 ммоль) снова добавляют, и реакцию продолжают при комнатной температуре в течение 3 дней, затем ее концентрируют в вакууме. Остаток берут дважды в диэтиловом эфире (40 мл) и концентрируют при пониженном давлении с получением C25 в виде белого твердого вещества. Выход: 1,46 г, 3,80 ммоль, количественный. ЖХМС m/z 385,4 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 8,29-8,17 (м, 1H), 7,23 (шс, 1H), 5,64 (шс, 1H), 5,32 (шс, 1H), 5,02 (д, J=6,1 Гц, 1H), 4,50-4,38 (м, 1H), 4,05 (ддд, J=10,3, 6,3, 4,5 Гц, 1H), 3,44-3,32 (м, 2H), 2,51-2,35 (м, 2H), 2,16-1,98 (м, 2H), 1,97-1,83 (м, 1H), 1,76-1,6 (м, 2H, предполагаемый; частично закрыт пиком воды), 1,49-1,39 (м, 1H), 1,45 (с, 9H), 0,94 (д, J=6,4 Гц, 3H), 0,94 (д, J=6,3 Гц, 3H).
Стадия 3. Синтез L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамид, метансульфоната (C26).
Раствор метансульфоновой кислоты (0,861 мл, 13,3 ммоль) в 1,1,1,3,3,3-гексафторпропан-2-оле (5 мл) медленно добавляют в раствор C25 (5,1 г, 13 ммоль) в 1,1,1,3,3,3-гексафторпропан-2-оле (43 мл). Через 30 минут, ЖХМС анализ показывает превращение в C26: ЖХМС m/z 285,3 [M+H]+. Реакционную смесь концентрируют в вакууме, затем берут в следующей смеси растворителей и повторно концентрируют: смесь ацетонитрила и этилацетата (1:1, 2×20 мл), затем смесь этилацетата и гептана (1:1, 2×20 мл). Полученное твердое вещество подвергают азеотропной перегонке дважды со смесью ацетонитрила и этилацетата, затем дважды со смесью этилацетата и гептана, с получением C26 в виде белого твердого вещества (6,05 г) которое удерживает растворители по 1H ЯМР анализу. Выход: количественная оценка. 1H ЯМР (600 MГц, метанол-d4) δ 4,50 (дд, J=10,7, 4,9 Гц, 1H), 3,91 (дд, J=8,6, 5,5 Гц, 1H), 3,39-3,28 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,70 (с, 3H), 2,53-2,46 (м, 1H), 2,43-2,36 (м, 1H), 2,14 (ддд, J=14,0, 10,7, 5,0 Гц, 1H), 1,95-1,86 (м, 1H), 1,82-1,71 (м, 3H), 1,70-1,64 (м, 1H), 1,02 (д, J=6,3 Гц, 3H), 1,01 (д, J=6,1 Гц, 3H).
Стадия 4. Синтез N-{[4-метокси-7-(трифторметил)-1H-индол-2-ил]карбонил}-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C27).
Раствор C24 (со стадии 1; 101 мг, <0,35 ммоль) и C26 (с предыдущей стадии; 204 мг, ≤0,438 ммоль) в ацетонитриле (1,7 мл) и N, N-диметилформамиде (1 мл) охлаждают до 0°C и обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 163 мг, 0,429 ммоль) затем 4-метилморфолином (0,129 мл, 1,17 ммоль). Реакционную смесь перемешивают при 0°C в течение 40 минут, затем 1:1 смесь водного раствора бикарбоната натрия и льда медленно добавляют до образования мутного осадка. Этилацетат затем добавляют, и двухфазную смесь перемешивают в течение 5 минут. Водный слой экстрагируют один раз этилацетатом, и объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют, и концентрируют в вакууме. Очистку хроматографией на силикагеле проводят дважды (Градиент #1: 0% - 10% метанол в дихлорметане; Градиент #2: 5% - 10% метанол в дихлорметане) с получением C27. Региохимию этого продукта подтверждают 2D ЯМР экспериментами. Выход: 19 мг, 36 мкмоль, приблизительно 10%. ЖХМС m/z 526,5 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 7,53 (шд, J=8,2 Гц, 1H), 7,41 (с, 1H), 6,68 (д, J=8,3 Гц, 1H), 4,60 (дд, J=9,5, 5,1 Гц, 1H), 4,45 (дд, J=11,4, 4,2 Гц, 1H), 4,01 (с, 3H), 3,3-3,21 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,60-2,49 (м, 1H), 2,36-2,26 (м, 1H), 2,15 (ддд, J=14,1, 11,5, 4,6 Гц, 1H), 1,89-1,68 (м, 5H), 1,03 (д, J=6,1 Гц, 3H), 0,99 (д, J=6,2 Гц, 3H).
Стадия 5. Синтез N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-7-(трифторметил)-1H-индол-2-карбоксамида (6).
Метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 17,2 мг, 72,2 мкмоль) добавляют в раствор C27 (19 мг, 36 мкмоль) в смеси дихлорметана (0,5 мл) и ацетонитрила (0,2 мл). Затем реакционную смесь перемешивают при комнатной температуре в течение 1 часа, ее разбавляют этилацетатом и промывают 1:1 смесью водного раствора бикарбоната натрия и льда. Водный слой экстрагируют этилацетатом, и объединенные органические слои промывают насыщенным водным раствором хлорида натрия, и пропускают через картридж для твердофазной экстракции, заполненный сульфатом магния. Концентрация фильтрата в вакууме дает остаток, который очищают ВЭЖХ с обращенной фазой (Колонка: Waters Sunfire C18, 19×100 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.); Градиент: 25% - 65% B за 8,5 минут, затем 65% - 95% B за 0,5 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 25 мл/минуту) с получением N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-4-метокси-7-(трифторметил)-1H-индол-2-карбоксамида (6). Выход: 4,3 мг, 8,5 мкмоль, 24%. ЖХМС m/z 508,6 [M+H]+. Время удержания: 2,83 минут (Колонка: Waters Atlantis C18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащая 0,05% трифторуксусной кислоты (об./об.); Градиент: 5% - 95% B за 4,0 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 2 мл/минуту).
Пример 7
N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-метилимидазо[2,1-b][1,3]тиазол-2-карбоксамид (7)
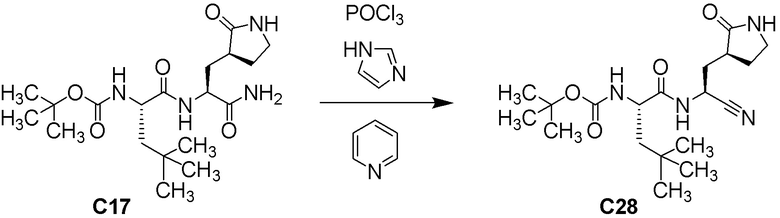
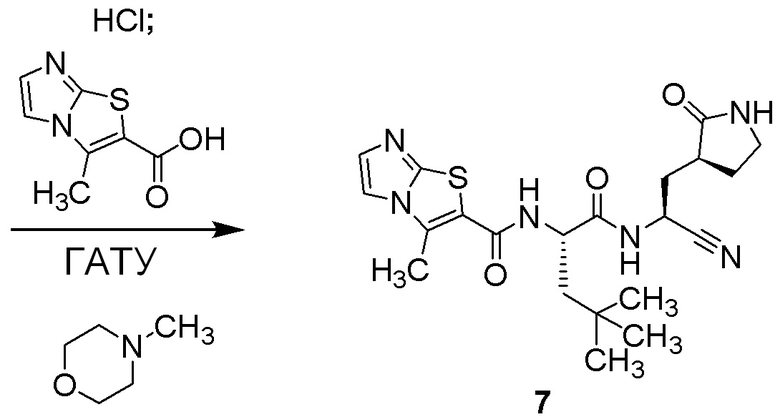
Стадия 1. Синтез N2-(трет-бутоксикарбонил)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида (C28).
Раствор C17 (560 мг, 1,41 ммоль) и 1H-имидазола (249 мг, 3,65 ммоль) в смеси пиридина (3 мл) и дихлорметана (3 мл) охлаждают до -35°C с применением бани ацетонитрил/сухой лед. Оксихлорид фосфора (0,74 мл, 7,94 ммоль) добавляют по каплям, в течение 4 минут, затем дополнительный дихлорметан (2 мл), и перемешивание продолжают при от -30°C до -20°C. Через 1 час, реакционную смесь разбавляют дихлорметаном (2 мл). После приблизительно 1,5 часов добавляют хлористоводородную кислоту (1 M; 30 мл); полученную смесь перемешивают в течение 30 минут, и затем экстрагируют дихлорметаном (2×60 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме, с получением C28 в виде твердого вещества. Выход: 492 мг, 1,29 ммоль, 91%. ЖХМС m/z 381,4 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 5,03 (дд, J=10,4, 5,7 Гц, 1H), 4,09 (дд, J=8,7, 4,2 Гц, 1H), 3,39-3,25 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,64-2,52 (м, 1H), 2,40-2,27 (м, 2H), 1,97-1,78 (м, 2H), 1,70 (дд, компонент системы АВХ, J=14,3, 4,1 Гц, 1H), 1,54 (дд, компонент системы АВХ, J=14,3, 8,7 Гц, 1H), 1,45 (с, 9H), 1,00 (с, 9H).
Стадия 2. Синтез N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-метилимидазо[2,1-b][1,3]тиазол-2-карбоксамида (7).
Раствор гидрохлорида в 1,4-диоксане (4,0 M; 0,3 мл, 1,2 ммоль) добавляют в раствор C28 (100 мг, 0,263 ммоль) в смеси ацетонитрила (1,5 мл) и метанола (1,0 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут, затем ее обрабатывают 4-метилморфолином (0,144 мл, 1,31 ммоль). После удаления растворителей в вакууме, остаток дважды ресуспендируют в смеси дихлорметана и гептана (1:1, 2×10 мл) и концентрируют при пониженном давлении. Остаток объединяют с 3-метилимидазо[2,1-b][1,3]тиазол-2-карбоновой кислотой (47,9 мг, 0,263 ммоль) в N, N-диметилформамиде (3,3 мл), охлаждают до 0°C, и обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 99,9 мг, 0,263 ммоль) затем раствором 4-метилморфолина (72 мкл, 0,655 ммоль) в дихлорметане (0,2 мл). Затем реакционную смесь перемешивают при 0°C в течение приблизительно 2 часов, ее обрабатывают при 0°C хлористоводородной кислотой (1 M; 30 мл), и полученную смесь экстрагируют дихлорметаном (2×60 мл). Водный слой затем подщелачивают до pH 9 добавлением насыщенным водным раствором бикарбоната натрия, затем его экстрагируют дихлорметаном (3×60 мл). Объединенные органические слои промывают насыщенным водным раствором хлорида аммония (50 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. 1H ЯМР анализ этого продукта указывает на присутствие незначительного эпимера, предположительно возникающего при частичной рацемизации на центре, несущем нитрил. Основной продукт выделяют с применением хроматографии на силикагеле (Градиент: 0% - 20% метанол в этилацетате), с получением N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-метилимидазо[2,1-b][1,3]тиазол-2-карбоксамида (7) в виде твердого вещества. Выход: 56 мг, 0,13 ммоль, 49%. ЖХМС m/z 445,4 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 7,73 (д, J=1,6 Гц, 1H), 7,37 (д, J=1,6 Гц, 1H), 5,04 (дд, J=10,3, 5,9 Гц, 1H), 4,53 (дд, J=7,8, 5,0 Гц, 1H), 3,36-3,24 (м, 2H; предполагаемый; частично закрыт пиком растворителя), 2,70 (с, 3H), 2,67-2,57 (м, 1H), 2,38-2,27 (м, 2H), 1,93 (ддд, J=14,0, 9,4, 6,0 Гц, 1H), 1,88-1,78 (м, 3H), 1,03 (с, 9H).
Примеры 8 и 9
N-{1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[циклогексил(метокси)ацетил]-4-метил-L-лейцинамид, DIAST-1 (8) и N-{1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[циклогексил(метокси)ацетил]-4-метил-L-лейцинамид, DIAST-2 (9)
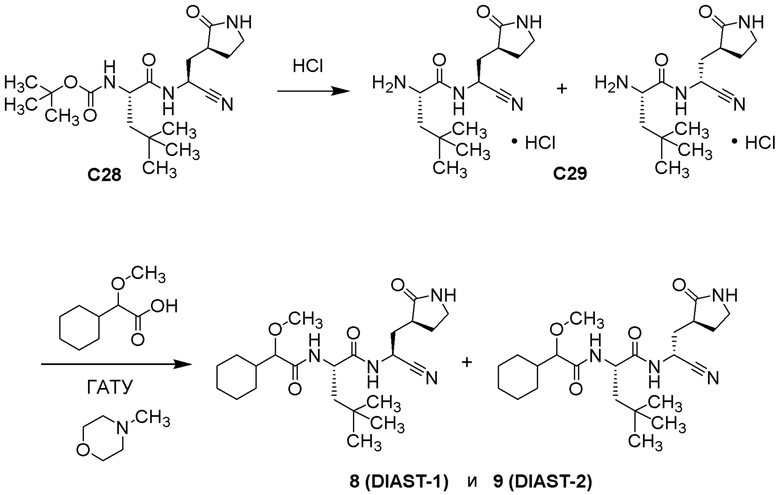
Стадия 1. Синтез N-{1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида (C29).
В раствор C28 (114 мг, 0,300 ммоль) в смеси ацетонитрила (1 мл) и метанола (1 мл) добавляют раствор гидрохлорида в 1,4-диоксане (4 M; 0,4 мл, 1,6 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут, затем добавляют 4-метилморфолин (0,165 мл, 1,50 ммоль), доводя pH до 7-8. Затем растворители удаляют в вакууме, остаток дважды берут в смеси этилацетата и гептана (1:1, 2×10 мл) и концентрируют при пониженном давлении с получением C29 в виде твердого вещества (269 мг); по 1H ЯМР анализу, он состоит из смеси эпимеров, предположительно находящихся на центре, несущем нитрил, в соотношении 2-3 к 1. Часть этого продукта применяют на следующей стадии. ЖХМС m/z 281,3 [M+H]+. 1H ЯМР (400 MГц, метанол-d4), характеристические пики: δ [5,11 (дд, J=8,8, 7,3 Гц, основной) и 5,01 (дд, J=6,5, 6,5 Гц, незначительный), всего 1H], [2,75-2,65 (м, незначительный) и 2,64-2,54 (м, основной), всего 1H], 2,48-2,38 (м, 1H), 2,30-2,20 (м, 1H), 2,06-1,83 (м, 3H), 1,64 (дд, J=14,1, 4,8 Гц, 1H), [1,04 (с, основной), 1,01 (с, незначительный), всего 9H].
Стадия 2. Синтез N-{1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[циклогексил(метокси)ацетил]-4-метил-L-лейцинамид, DIAST-1 (8) и N-{1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[циклогексил(метокси)ацетил]-4-метил-L-лейцинамида, DIAST-2 (9).
К 0°C раствору C29 (с предыдущей стадии; 83,4 мг, ≤93 мкмоль) и циклогексил(метокси)уксусной кислоты (17,2 мг, 99,9 мкмоль) в N, N-диметилформамиде (1 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 38,0 мг, 0,100 ммоль), затем раствор 4-метилморфолина (30,8 мкл, 0,280 ммоль) в дихлорметане (0,2 мл). Затем реакционную смесь перемешивают при 0°C в течение примерно 2 часов, ее разбавляют насыщенным водным раствором бикарбоната натрия (3 мл) при 0°C, и экстрагируют дихлорметаном (4×4 мл). Объединенные органические слои концентрируют в вакууме; по ЖХМС анализу, остаток состоит из двух компонентов, предположительно соответствующих двум эпимерам на центре, несущем нитрил. Эти диастереомеры разделяют ВЭЖХ с обращенной фазой (Колонка: Waters XBridge C18, 19×100 мм, 5 мкм; Подвижная фаза A: water; Подвижная фаза B: ацетонитрил; Градиент: 5% - 95% B over 8,54 минут, затем 95% B в течение 1,46 минут; Скорость потока: 25 мл/минуту). Первый элюированный диастереомер обозначают как 8 (N-{1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[циклогексил(метокси)ацетил]-4-метил-L-лейцинамид, DIAST-1), и второй элюированный диастереомер как 9 (N-{1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[циклогексил(метокси)ацетил]-4-метил-L-лейцинамид, DIAST-2).
8 - Выход: 12,8 мг, 29,4 мкмоль, 32% за 2 стадии. ЖХМС m/z 435,6 [M+H]+. Время удержания: 2,63 минут (Аналитические условия. Колонка: Waters Atlantis C18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.). Градиент: 5% to 95% B в течение 4,0 минут, затем 95% B в течение 1,0 минуты. Скорость потока: 2 мл/минуту).
9 - Выход: 10 мг, 23,0 мкмоль, 25% за 2 стадии. ЖХМС m/z 435,6 [M+H]+. Время удержания: 2,72 минут (Аналитические условия идентичным тем, которые применяют для 8).
Пример 10
N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамид (10)
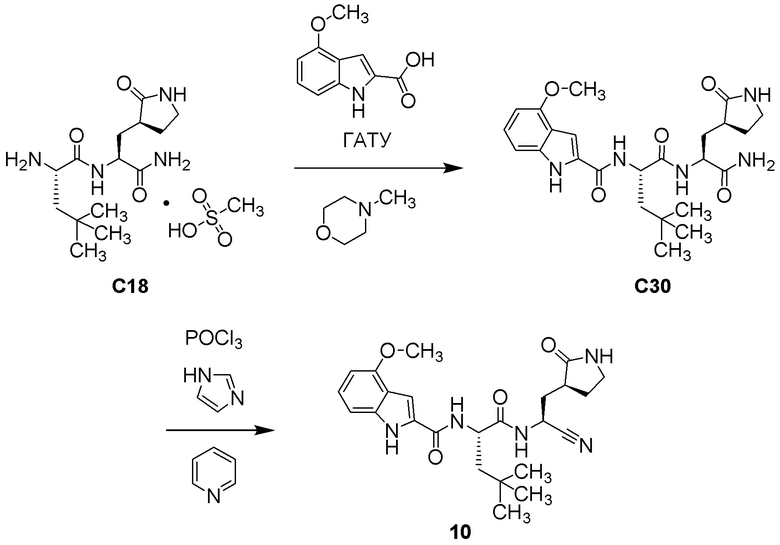
Стадия 1. Синтез N-[(4-метокси-1H-индол-2-ил)карбонил]-4-метил-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C30).
К 0°C раствору C18 (200 мг, ≤0,46 ммоль) и 4-метокси-1H-индол-2-карбоновой кислоты (88,2 мг, 0,460 ммоль) в ацетонитриле (2 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 175 мг, 0,460 ммоль), затем раствор 4-метилморфолина (0,127 мл, 1,16 ммоль) в ацетонитриле (0,2 мл). Реакционную смесь перемешивают при 0°C в течение 2,5 часов, затем ее разбавляют насыщенным водным раствором бикарбоната натрия (30 мл) при 0°C, затем экстрагируют дихлорметаном (50 мл). Органический слой промывают хлористоводородной кислотой (1 M; 30 мл), и водные слои экстрагируют дихлорметаном (60 мл). Затем объединенные органические слои сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме, остаток очищают хроматографией на силикагеле (Градиент: 0% - 30% метанол в этилацетате) с получением C30 в виде твердого вещества. Выход: 148 мг, 0,314 ммоль, 68% за 2 стадии. ЖХМС m/z 472,4 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 7,25 (д, J=0,9 Гц, 1H), 7,15 (дд, J=8, 8 Гц, 1H), 7,03 (шд, компонент АВ квартета, J=8,3 Гц, 1H), 6,51 (д, J=7,7 Гц, 1H), 4,65 (дд, J=9,2, 3,4 Гц, 1H), 4,44 (дд, J=11,2, 4,2 Гц, 1H), 3,93 (с, 3H), 3,29-3,15 (м, 2H), 2,54-2,44 (м, 1H), 2,29 (дддд, J=12,6, 8,6, 7,0, 2,7 Гц, 1H), 2,14 (ддд, J=14,0, 11,2, 4,6 Гц, 1H), 1,89 (дд, компонент системы АВХ, J=14,5, 3,4 Гц, 1H), 1,85-1,74 (м, 3H), 1,02 (с, 9H).
Стадия 2. Синтез N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида (10).
Раствор C30 (143 мг, 0,303 ммоль) и 1H-имидазолe (53,7 мг, 0,789 ммоль) в смеси пиридина (1 мл) и дихлорметана (1 мл) охлаждают на бане ацетонитрил/сухой лед (-35°C). Оксихлорид фосфора (0,159 мл, 1,71 ммоль) добавляют по каплям в течение 5 минут, и реакционную смесь перемешивают при от -30°C до -20°C в течение 2 часов, затем ее обрабатывают хлористоводородную кислоту (1 M; 30 мл), перемешивают в течение 20 минут и экстрагируют дихлорметаном (2×60 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Хроматография на силикагеле (Градиент: 0% - 10% метанол в этилацетате) дает N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамид (10) в виде твердого вещества. Выход: 68 мг, 0,15 ммоль, 50%. ЖХМС m/z 454,5 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 7,24 (д, J=0,9 Гц, 1H), 7,14 (дд, J=8, 8 Гц, 1H), 7,02 (шд, компонент АВ квартета, J=8,3 Гц, 1H), 6,51 (д, J=7,7 Гц, 1H), 5,03 (дд, J=10,1, 6,0 Гц, 1H), 4,64 (дд, J=8,6, 4,3 Гц, 1H), 3,93 (с, 3H), 3,30-3,17 (м, 2H), 2,63-2,52 (м, 1H), 2,37-2,21 (м, 2H), 1,95-1,74 (м, 4H), 1,03 (с, 9H).
Пример 11
N 2-[(4-Бром-1-этил-3-метил-1H-пиразол-5-ил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамид (11)
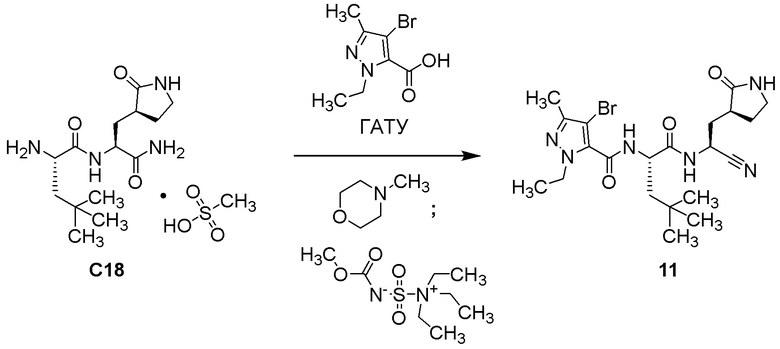
К 0°C суспензии C18 (43,4 мг, ≤0,10 ммоль) и 4-бром-1-этил-3-метил-1H-пиразол-5-карбоновой кислоты (23,3 мг, 0,100 ммоль) в ацетонитриле (1,0 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 38,0 мг, 0,100 ммоль), затем раствор 4-метилморфолина (30 мкл, 0,27 ммоль) в ацетонитриле (0,2 мл). Затем реакционную смесь перемешивают при 0°C в течение приблизительно 80 минут, добавляют метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 71,5 мг, 0,300 ммоль) и перемешивание продолжают. Через приблизительно 2,75 часов, снова добавляют метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 71,5 мг, 0,300 ммоль), и реакцию проводят в течение 1,5 часов, затем ее обрабатывают насыщенным водным раствором бикарбоната натрия (3 мл) при 0°C и экстрагируют дихлорметаном (2×8 мл). Объединенные органические слои концентрируют в вакууме, затем растворяют в ацетонитриле (4 мл) и снова концентрируют с применением испарителя Genevac с получением неочищенного продукта (138 мг). Часть этого продукта (80 мг) очищают ВЭЖХ с обращенной фазой (Колонка: Waters Sunfire C18, 19×100 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.); Градиент: 5% - 95% B в течение 8,54 минут, затем 95% B в течение 1,46 минут; Скорость потока: 25 мл/минуту) с получением N2-[(4-бром-1-этил-3-метил-1H-пиразол-5-ил)карбонил]-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамида (11). Выход: 24,7 мг, 49,8 мкмоль, 86% за 2 стадии. ЖХМС m/z 495,5 (наблюдается паттерн изотопа брома) [M+H]+. Время удержания: 2,48 минут (Аналитические условия. Колонка: Waters Atlantis C18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.). Градиент: 5% - 95% B в течение 4,0 минут, затем 95% B в течение 1,0 минуты. Скорость потока: 2 мл/минуту).
Пример 12
N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(3,3-дифторциклобутил)ацетил]-4-метил-L-лейцинамид (12)
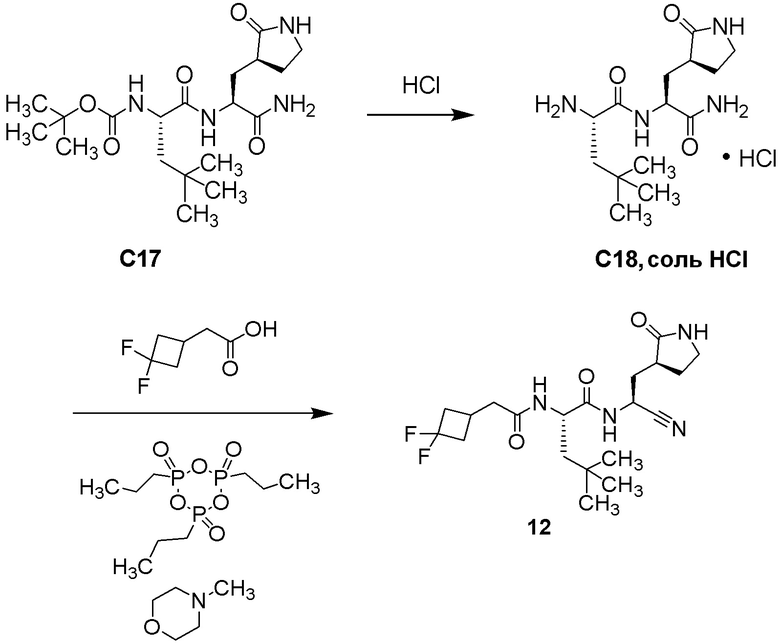
Стадия 1. Синтез 4-метил-L-лейцил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамид, гидрохлорид (C18, соль HCl).
Раствор гидрохлорида в 1,4-диоксане (4 M; 1,7 мл, 6,8 ммоль) добавляют в раствор C17 (260 мг, 0,652 ммоль) в ацетонитриле (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 часов, затем ее концентрируют в вакууме, затем повторно растворяют в смеси дихлорметана и гептана (1:1, 3×10 мл) и повторно концентрируют, с получением C18, соли HCl (242 мг) в виде стекла. Часть этого продукта применяют на следующей стадии. ЖХМС m/z 299,3 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 4,53 (дд, J=10,3, 5,0 Гц, 1H), 3,91 (дд, J=7,5, 5,4 Гц, 1H), 3,41-3,26 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,57-2,47 (м, 1H), 2,41 (дддд, J=12,0, 8,7, 7,0, 3,1 Гц, 1H), 2,15 (ддд, J=13,9, 10,3, 4,9 Гц, 1H), 2,05-1,97 (м, 1H), 1,97-1,85 (м, 1H), 1,78 (ддд, J=14,1, 9,1, 5,0 Гц, 1H), 1,60 (дд, J=14,3, 5,4 Гц, 1H), 1,01 (с, 9H).
Стадия 2. Синтез N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(3,3-дифторциклобутил)ацетил]-4-метил-L-лейцинамида (12).
Суспензию C18, соли HCl (с предыдущей стадии; 37,2 мг, ≤0,100 ммоль) и (3,3-дифторциклобутил)уксусной кислоты (15,8 мг, 0,105 ммоль) в тетрагидрофуране (1,0 мл) обрабатывают триоксидом 2,4,6-триоксида 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана (50% раствор по массе в этилацетате; 65,5 мкл, 0,110 ммоль) и 4-метилморфолином (27,5 мкл, 0,250 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в течение ночи, ее нагревают при 50°C в течение 4,5 часов, затем снова добавляют триоксид 2,4,6-триоксида 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана (50% раствор по массе в этилацетате; 2,2 эквивалента) и 4-метилморфолина (5 эквивалентов). Затем реакционную смесь перемешивают при 50°C в течение 3 дополнительный дней, ее обрабатывают насыщенным водным раствором бикарбоната натрия (3 мл) и экстрагируют дихлорметаном (4×4 мл). Объединенные органические слои концентрируют в вакууме и очищают ВЭЖХ с обращенной фазой (Колонка: Waters XBridge C18, 19×100 мм, 5 мкм; Подвижная фаза A: water; Подвижная фаза B: ацетонитрил; Градиент: 20% - 40% B в течение 8,5 минут, затем 40% - 95% B в течение 0,5 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 25 мл/минуту) с получением N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[(3,3-дифторциклобутил)ацетил]-4-метил-L-лейцинамида (12). Выход: 10,1 мг, 24,5 мкмоль, 24% за 2 стадии. ЖХМС m/z 413,5 [M+H]+. Время удержания: 1,96 минут (Аналитические условия. Колонка: Waters Atlantis C18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.). Градиент: 5% - 95% B в течение 4,0 минут, затем 95% B в течение 1,0 минуты. Скорость потока: 2 мл/минуту).
Пример 13
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (13)
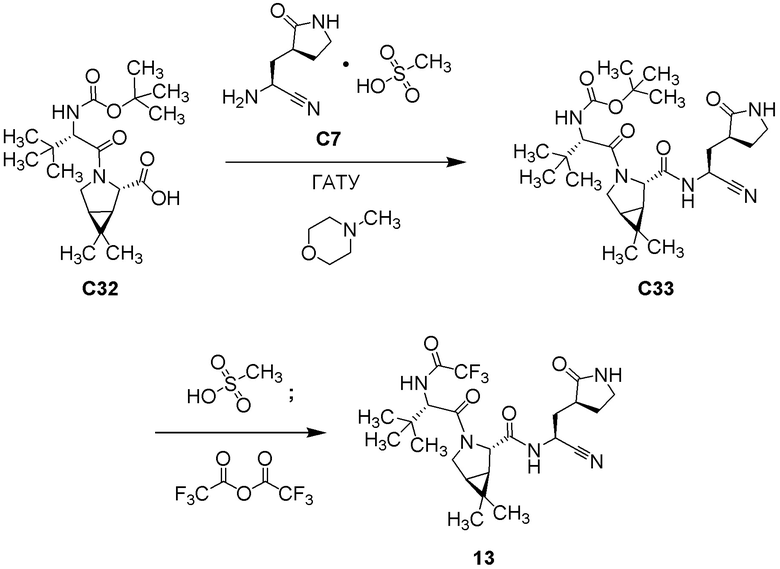
Стадия 1. Синтез метил (1R,2S,5S)-3-[N-(трет-бутоксикарбонил)-3-метил-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата (C31).
Гексафторфосфат O-(7-Азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 7,92 г, 20,8 ммоль) добавляют к 0°C смеси N-(трет-бутоксикарбонил)-3-метил-L-валина (4,38 г, 18,9 ммоль) и метил (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата, гидрохлорида (3,9 г, 19 ммоль) в N, N-диметилформамиде (95 мл). Затем реакционную смесь перемешивают в течение 5 минут, добавляют N, N-диизопропилэтиламин (8,25 мл, 47,4 ммоль); перемешивание продолжают при 0°C в течение 2 часов, затем добавляют водный раствор лимонной кислоты (1 N, 20 мл) и воды (40 мл). Полученную смесь перемешивают в течение 2 минут, и затем разбавляют этилацетатом (250 мл). Органический слой промывают водой (3×150 мл) и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Очистка хроматографией на силикагеле (Градиент: 0% - 100% этилацетат в гептане) дает C31 в виде масла. Выход: 3,60 г, 9,41 ммоль, 50%. 1H ЯМР (400 MГц, метанол-d4) δ 6,42 (д, J=9,7 Гц, <1H; неполностью заменен растворителем), 4,35 (с, 1H), 4,21 (д, J=9,7 Гц, 1H), 4,02 (д, половина АВ квартета, J=10,4 Гц, 1H), 3,91 (дд, компонент системы АВХ, J=10,3, 5,3 Гц, 1H), 3,73 (с, 3H), 1,57 (дд, компонент системы АВХ, J=7,5, 5,1 Гц, 1H), 1,47 (д, половина АВ квартета, J=7,5 Гц, 1H), 1,41 (с, 9H), 1,07 (с, 3H), 1,02 (с, 9H), 0,93 (с, 3H).
Стадия 2. Синтез (1R,2S,5S)-3-[N-(трет-бутоксикарбонил)-3-метил-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C32).
Водный раствор гидроксида лития (1,0 M; 14,7 ммоль, 14,7 мл) добавляют по каплям к 0°C раствору C31 (3,60 г, 9,41 ммоль) в смеси тетрагидрофурана и метанола (1:1, 30 мл). Затем реакционную смесь перемешивают при 0°C в течение 1 часа, ее нагревают до комнатной температуры и перемешивают в течение 1 часа, затем ЖХМС анализ показывает превращение в C32: ЖХМС m/z 367,3 [M-H]-. Корректировку до pH 3 проводят добавлением 1 M хлористоводородной кислоты, после чего смесь разбавляют водой (30 мл). Водный слой экстрагируют этилацетатом (2×75 мл), и объединенные органические слои сушат над сульфатом натрия, фильтруют, и концентрируют при пониженном давлении с получением C32 в виде беловатого твердого вещества. Выход: 3,10 г, 8,41 ммоль, 89%. 1H ЯМР (400 MГц, метанол-d4) δ 6,39 (д, J=9,7 Гц, приблизительно 0,5H; неполностью заменен растворителем), 4,33 (с, 1H), [4,21 (д, J=9,6 Гц) и 4,21 (с), всего 1H], 4,01 (д, половина АВ квартета, J=10,5 Гц, 1H), 3,91 (дд, компонент системы АВХ, J=10,4, 5,2 Гц, 1H), 1,56 (дд, компонент системы АВХ, J=7,5, 5,0 Гц, 1H), 1,50 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,42 (с, 9H), 1,07 (с, 3H), 1,02 (с, 9H), 0,93 (с, 3H).
Стадия 3. Синтез трет-бутил {(2S)-1-[(1R,2S,5S)-2-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-3,3-диметил-1-оксобутан-2-ил}карбамата (C33).
0°C смесь C7 (31,9 мг, ≤94 мкмоль) и C32 (34 мг, 92 мкмоль) в ацетонитриле (1 мл) обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ, 97%; 36,2 мг, 92,3 мкмоль) затем раствором 4-метилморфолина (25 мкл, 0,23 ммоль) в ацетонитриле (0,25 мл). Затем реакционную смесь перемешивают при 0°C в течение приблизительно 1 часа, ее разбавляют насыщенным водным раствором бикарбоната натрия (3 мл) при 0°C и экстрагируют дихлорметаном (4×4 мл). Объединенные органические слои концентрируют в вакууме с получением C33 в виде камеди (48 мг). Большую часть этого продукта применяют на следующей стадии. ЖХМС m/z 504,6 [M+H]+.
Стадия 4. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (13).
Получают исходный раствор метансульфоновой кислоты (60 мкл) в 1,1,1,3,3,3-гексафторпропан-2-оле (940 мкл). В раствор C33 (с предыдущей стадии; 47 мг, ≤90 мкмоль) в 1,1,1,3,3,3-гексафторпропан-2-оле (1 мл) добавляют часть исходного раствора метансульфоновой кислоты (0,1 мл; 100 мкмоль). Затем реакционную смесь перемешивают при комнатной температуре в течение 1 часа, ее концентрируют в вакууме, затем берут в следующей смеси растворителей и повторно концентрируют: смесь ацетонитрила и этилацетата (1:1, 2×10 мл), и затем смесь этилацетата и гептана (1:1, 2×10 мл). Остаток растворяют в дихлорметане (1 мл) и обрабатывают 4-метилморфолином (30,8 мкл, 0,280 ммоль), затем трифторуксусным ангидридом (0,143 мл, 1,01 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 40 минут, затем ее обрабатывают 4-метилморфолином (30,8 мкл, 0,280 ммоль), затем трифторуксусным ангидридом (0,143 мл, 1,01 ммоль); через 30 минут снова добавляют 4-метилморфолин (30,8 мкл, 0,280 ммоль), затем трифторуксусный ангидрид (0,143 мл, 1,01 ммоль). Через еще 15 минут перемешивания, реакционную смесь обрабатывают хлористоводородной кислотой (1 M; 3 мл), и полученную смесь экстрагируют дихлорметаном (3×4 мл); объединенные органические слои концентрируют в вакууме и очищают с применением ВЭЖХ с обращенной фазой (Waters Sunfire C18, 19×100 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.). Градиент: 20% - 60% B в течение 8,5 минут, затем 60% - 95% B в течение 0,5 минут, затем 95% B в течение 1 минуты; Скорость потока: 25 мл/минуту) с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (13). Выход: 7,5 мг, 15 мкмоль, 17% за 2 стадии. ЖХМС m/z 500,5 [M+H]+. Время удержания: 2,66 минут (Аналитические условия. Колонка: Waters Atlantis dC18, 4,6×50 мм, 5 мкм; Подвижная фаза A: 0,05% трифторуксусной кислоты в воде (об./об.); Подвижная фаза B: 0,05% трифторуксусной кислоты в ацетонитриле (об./об.); Градиент: 5,0% - 95% B в течение 4,0 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 2 мл/минуту).
Альтернативный синтез примера 13, сольват метил трет-бутилового эфира; создание 13, сольвата метил трет-бутилового эфира, Твердая форма 2
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид, сольват метил трет-бутилового эфира (13, сольват метил трет-бутилового эфира), Твердая форма 2
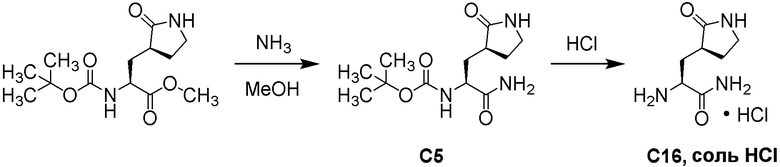
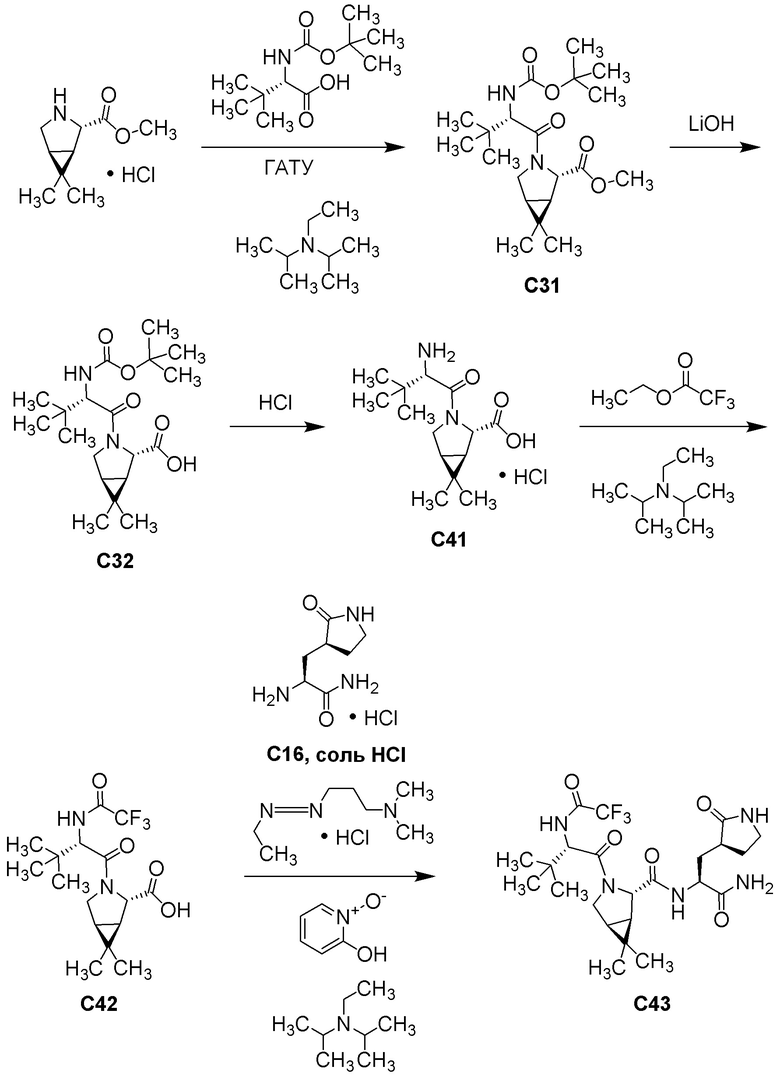
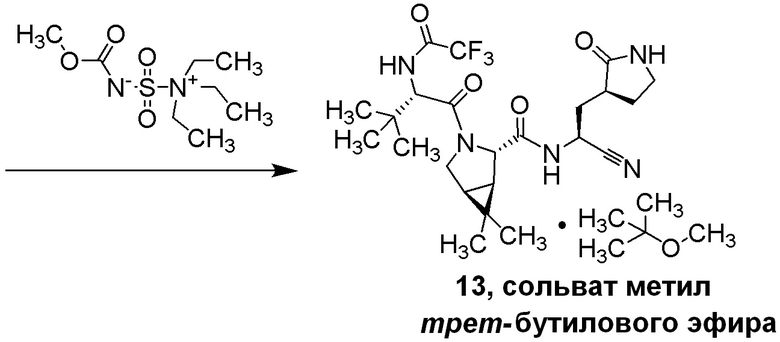
Стадия 1. Синтез трет-бутил {(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамата (C5).
Этот эксперимент проводят в 2 параллельных партиях. Раствор аммиака в метаноле (7 M; 2,4 л, 17 моль) добавляют к метил N-(трет-бутоксикарбонил)-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинату (600 г, 2,10 моль) и реакционную смесь перемешивают при 25°C в течение 40 часов. Концентрация в вакууме и объединение 2 партий дает C5 в виде желтого твердого вещества. Объединенный выход: 1,10 кг, 4,05 моль, 96%. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,63 (шс, 1H), 7,29 (шс, 1H), 7,01 (шс, 1H), 6,89 (д, J=8,5 Гц, 1H), 3,96-3,85 (м, 1H), 3,22-3,06 (м, 2H, предполагаемый; частично закрыт пиком воды), 2,28-2,08 (м, 2H), 1,89 (ддд, J=14,6, 10,8, 4,0 Гц, 1H), 1,74-1,60 (м, 1H), 1,56-1,43 (м, 1H), 1,36 (с, 9H).
Стадия 2. Синтез 3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида, гидрохлорида (C16, соль HCl).
Этот эксперимент проводят в 3 параллельные партии. К 0°C раствору C5 (840 г, 3,10 моль) в дихлорметане (2,0 L) добавляют раствор гидрохлорид в 1,4-диоксане (4 M; 2 л, 8 моль). Реакционную смесь перемешивают при 25°C в течение 2 часов, затем ее концентрируют в вакууме; объединение 3 партий дает C16, соль HCl в виде белого твердого вещества. Объединенный выход: 1,20 кг, 5,78 моль, 62%. МС m/z 172,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,52-8,35 (шс, 3H), 8,12 (с, 1H), 7,95 (с, 1H), 7,57 (с, 1H), 3,88-3,76 (м, 1H), 3,24-3,10 (м, 2H), 2,59-2,5 (м, 1H, предполагаемый; частично закрыт пиком растворителя), 2,35-2,24 (м, 1H), 2,01 (ддд, J=14,9, 9,2, 6,1 Гц, 1H), 1,80-1,68 (м, 2H).
Образец C16, соли HCl растирают в 2-пропанoле в течение 1,5 часов, затем его собирают фильтрацией и промывают 2-пропанолом. Объединенное твердое вещество сушат в течение ночи в высоком вакууме с получением образца для исследования порошковой рентгеновской дифракцией. Порошковая рентгеновская дифрактограмма для этого продукта дана на фигуре 10; характеристические пики перечислены в таблице Q.
Сбор данных порошковой рентгеновской дифракции
Анализ порошковой рентгеновской дифракцией проводят с использованием дифрактометра Bruker AXS D4 Endeavour, оборудованного источником излучения Cu. Щель расходимости установлена на 0,6 мм, в то время как вторичная оптика использует вариабельные щели. Дифрагированное излучение регистрируют датчиком PSD-Lynx Eye. Напряжение и сила тока рентгеновской трубки установлены на 40 кВ и 40 мА, соответственно. Данные собирают в гониометре Тэта-2Тэта при длине волны Cu от 3,0 до 40,0 градусов 2-Тэта с использованием размера шага 0,020 градусов и времени шага 0,3 секунды. Образцы готовят, помещая их в кремниевый низкофоновый держатель образцов и вращая во время сбора.
Анализ порошковой рентгеновской дифракцией проводят с использованием дифрактометра Bruker AXS D8 Advance, оборудованного источником излучения Cu. Дифрагированное излучение регистрируют датчиком LYNXEYE_EX с моторизованными щелями. И первичная, и вторичная оборудованы 2,5-дюймовыми щелями. Напряжение и сила тока рентгеновской трубки установлены на 40 кВ и 40 мА, соответственно. Данные собирают в гониометре Тэта-Тэта при сканировании с замкнутой парой при длине волны Cu K-альфа (средняя) от 3,0 до 40,0 градусов 2-Тэта с шагом 0,02 градуса, с использованием скорости сканирования 0,5 секунд на шаг. Образцы получают путем помещения в кремниевый низкофоновый держатель для образцов.
Данные собирают обоими приборами с использованием программного обеспечения Bruker DIFFRAC Plus, и анализ выполняют с помощью программного обеспечения EVA DIFFRAC plus. Файл данных PXRD не обрабатывают до поиска пика. Используя алгоритм поиска пиков в программном обеспечении EVA, пики, выбранные с пороговым значением 1, используют для предварительного назначения пиков. Для обеспечения достоверности корректировки вносят вручную; вывод автоматических назначений проверяют визуально, и положения пиков доводят до максимума пика. Обычно выбирают пики с относительной интенсивностью ≥3%. Обычно пики, которые не разрешены или соответствуют шуму, не выбирают. Типовая ошибка, связанная с положением пика PXRD, указана в USP до +/- 0,2° 2-Тэта (USP-941).
Альтернативный синтез 3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида, гидрохлорида, C16 соль HCl
Альтернативное получение соединения C16, соли HCl изображено на схеме реакции ниже.
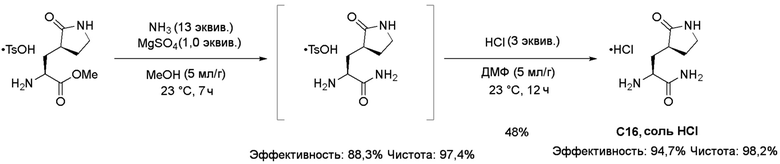
В раствор аммиака в метаноле (7,0 M; 100 мл, 725,4 ммоль) добавляют 4-метилбензолсульфонат метил (S)-2-амино-3-((S)-2-оксопирролидин-3-ил)пропаноата (20 г, 55,8 ммоль) и сульфат магния (6,7 г, 55,8 ммоль) при комнатной температуре. После перемешивания реакционной смеси в течение 7 часов при комнатной температуре, азот барботируют в реакционную смесь в течение 1 часа для продувания избытка аммиака. Затем реакционную смесь фильтруют через слой Celite® и затем концентрируют в вакууме, и полученный 4-метилбензолсульфонат (S)-2-амино-3-((S)-2-оксопирролидин-3-ил)пропанамид применяют непосредственно на следующей стадии без дальнейшей очистки. В раствор диметилформамида (50 мл, 647 ммоль) добавляют часть 4-метилбензолсульфоната (S)-2-амино-3-((S)-2-оксопирролидин-3-ил)пропанамида (10 г, 25,9 ммоль) и раствор гидрохлорида в 1,4-диоксане (4,0 M; 19,4 мл, 77,7 ммоль). После перемешивания в течение 12 часов при комнатной температуре суспензию фильтруют и промывают диметилформамидом (15 мл, 190 ммоль). Полученное твердое вещество сушат в вакуумной печи при 40°C в течение 12 часов с получением 3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида, гидрохлорида, C16 соли HCl (2,7 г, 12,4 ммоль) в виде рыжевато-коричневого твердого вещества (общий выход 48%).
Стадия 3. Синтез метил (1R,2S,5S)-3-[N-(трет-бутоксикарбонил)-3-метил-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата (C31).
Этот эксперимент проводят в 3 параллельных партиях. К 0°C раствору метил (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата, гидрохлорида (237 г, 1,15 моль) и N-(трет-бутоксикарбонил)-3-метил-L-валина (293 г, 1,27 моль) в смеси N, N-диметилформамида (400 мл) и ацетонитрила (3,6 L) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония (ГАТУ; 481 г, 1,26 моль), затем по каплям добавляют N, N-диизопропилэтиламин (601 мл, 3,45 моль). Реакционную смесь затем нагревают до 25°C и перемешивают в течение 16 часов, затем ее выливают в смесь ледяной воды (1 л) и хлористоводородной кислоты (0,5 M; 1 л), с pH приблизительно 5, и перемешивают в течение 6 минут. Полученную смесь экстрагируют этилацетатом (2 л), и органический слой промывают водой (2 л), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Остаток очищают с применением хроматографии на силикагеле (Градиент: 0% - 50% этилацетат в петролейном эфире), с получением, после объединения 3 партий, C31 в виде бесцветного масла. Объединенный выход: 1,17 кг, 3,06 моль, 89%. ЖХМС m/z 383,3 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 5,10 (д, J=10,2 Гц, 1H), 4,46 (с, 1H), 4,20 (д, J=10,3 Гц, 1H), 3,98 (д, половина АВ квартета, J=10,2 Гц, 1H), 3,89-3,82 (м, 1H), 3,74 (с, 3H), 1,48-1,41 (м, 2H), 1,38 (с, 9H), 1,03 (с, 3H), 1,01 (с, 9H), 0,89 (с, 3H).
Стадия 4. Синтез (1R,2S,5S)-3-[N-(трет-бутоксикарбонил)-3-метил-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C32).
Этот эксперимент проводят в 3 параллельных партиях. В раствор C31 (668 г, 1,75 моль) в тетрагидрофуране (2,5 л) добавляют моногидрат гидроксида лития (220 г, 5,24 моль) и воду (500 мл). Затем реакционную смесь перемешивают при 25°C в течение 2 часов, ее концентрируют в вакууме для удаления большей части тетрагидрофурана; остаток затем доводят до pH 2 добавлением 1 M хлористоводородной кислоты. Полученную смесь экстрагируют этилацетатом (2×500 мл), и объединенные органические слои промывают насыщенным водным раствором хлорида натрия (500 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме с получением C32 в виде белого твердого вещества (2,0 кг) после объединения 3 партий. Этот продукт применяют непосредственно на следующей стадии. ЖХМС m/z 313,2 [(M - 2-метилпроп-1-ен)+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 5,14 (д, J=10,2 Гц, 1H), 4,46 (с, 1H), 4,24 (д, J=10,2 Гц, 1H), 4,06 (д, половина АВ квартета, J=10,5 Гц, 1H), 3,82 (дд, компонент системы АВХ, J=10,5, 5,5 Гц, 1H), 1,75 (д, J=7,7 Гц, 1H), 1,49 (дд, J=7,7, 5,4 Гц, 1H), 1,40 (с, 9H), 1,06 (с, 3H), 1,00 (с, 9H), 0,89 (с, 3H).
Стадия 5. Синтез (1R,2S,5S)-6,6-диметил-3-(3-метил-L-валил)-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты, гидрохлорида (C41).
Этот эксперимент проводят в 2 параллельных партиях. Раствор гидрохлорида в 1,4-диоксане (4 M; 4,0 L, 16 моль) добавляют в раствор C32 (с предыдущей стадии; 1,00 кг, ≤2,62 моль) в дихлорметане (1,0 л), и реакционную смесь перемешивают при 25°C в течение 16 часов. Удаление растворителей в вакууме при 50°C дает C41 в виде белого твердого вещества (1,8 кг) после объединения 2 партий. Этот продукт применяют непосредственно на следующей стадии. 1H ЯМР (400 MГц, метанол-d4) δ 4,42 (с, 1H), 4,00 (с, 1H), 3,94 (дд, компонент системы АВХ, J=10,7, 5,4 Гц, 1H), 3,80 (д, половина АВ квартета, J=10,7 Гц, 1H), 1,62 (дд, компонент системы АВХ, J=7,7, 5,2 Гц, 1H), 1,56 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,15 (с, 9H), 1,09 (с, 3H), 1,03 (с, 3H).
Стадия 6. Синтез (1R,2S,5S)-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C42).
Этот эксперимент проводят в 3 параллельных партиях. К 0°C раствору C41 (с предыдущей стадии; 600 г, ≤1,75 моль) в метаноле (2 л) добавляют триэтиламин (1,64 л, 11,8 моль), затем этилтрифторацетат (699 г, 4,92 моль), затем реакционную смесь нагревают до 25°C, и перемешивают в течение 16 часов. Ее затем концентрируют в вакууме при 50°C, и остаток разбавляют этилацетатом (3 л) и доводят до pH 3-4 добавлением 2 M хлористоводородной кислоты. После экстрагирования водного слоя этилацетатом (1 л), объединенные органические слои промывают насыщенным водным раствором хлорида натрия (3 л), сушат над сульфатом натрия, фильтруют, и концентрируют при пониженном давлении. В этот момент 3 партии объединяют, обрабатывают смесь петролейным эфиром и этилацетатом (5:1, 3 л), и перемешивают при 25°C в течение 2 часов. Фильтрация дает C42 в виде белого твердого вещества. Объединенный выход: 1,90 кг, 5,21 моль, 99% за 3 стадии. ЖХМС m/z 365,1 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 8,88 (д, J=8,8 Гц, <1H; не полностью заменен), [4,60 (д, J=8,9 Гц) и 4,59 (с), всего 1H], 4,35 (с, 1H), 3,96 (дд, компонент системы АВХ, J=10,5, 5,1 Гц, 1H), 3,90 (д, половина АВ квартета, J=10,4 Гц, 1H), 1,58 (дд, компонент системы АВХ, J=7,6, 4,9 Гц, 1H), 1,52 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,08 (с, 12H), 0,92 (с, 3H).
Стадия 7. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (C43).
Этот эксперимент проводят в 4 параллельные партии. 2-Гидроксипиридин 1-оксид (33,9 г, 305 ммоль) добавляют в раствор C42 (445 г, 1,22 моль) и C16, соли HCl (256 г, 1,23 моль) в бутан-2-оне (2,5 л), и смесь охлаждают до 0°C. N, N-диизопропилэтиламин (638 мл, 3,66 моль) затем добавляют, затем по каплям добавляют 1-[3-(диметиламино)пропил]-3-этилкарбодиимида гидрохлорид (351 г, 1,83 моль). Реакционную смесь перемешивают при 25°C в течение 16 часов, затем ее разбавляют этилацетатом (1 л) и обрабатывают смесью хлористоводородной кислоты (1 M; 1,5 л, 1,5 моль) и насыщенного водного раствора хлорида натрия (1 л). Органический слой промывают смесью водного раствора гидроксида натрия (1 M; 1,5 л, 1,5 моль) и насыщенного водного раствора хлорида натрия (1 л), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Комбинация 4 партий дает C43 в виде белого твердого вещества (2,3 кг). Объединенный выход: 2,1 кг (скорректирован на остаточный этилацетат), 4,1 моль, 84%. ЖХМС m/z 518,3 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,41 (шд, J=7,7 Гц, 1H), 8,30 (д, J=8,8 Гц, 1H), 7,56 (с, 1H), 7,32 (шс, 1H), 7,04 (шс, 1H), 4,43 (шд, J=7,3 Гц, 1H), 4,35-4,25 (м, 1H), 4,28 (с, 1H), 3,89 (дд, J=10,3, 5,5 Гц, 1H), 3,67 (д, J=10,4 Гц, 1H), 3,17-3,09 (м, 1H), 3,07-2,98 (м, 1H), 2,46-2,35 (м, 1H), 2,19-2,10 (м, 1H), 1,99-1,89 (м, 1H), 1,70-1,58 (м, 1H), 1,55-1,44 (м, 2H), 1,38 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,01 (с, 3H), 0,98 (с, 9H), 0,84 (с, 3H).
Стадия 8. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, сольвата метил трет-бутилового эфира (13, сольват метил трет-бутилового эфира), Твердая форма 2.
Этот эксперимент проводят в 3 параллельных партиях. Метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 552 г, 2,32 моль) добавляют в раствор C43 (600 г, 1,16 моль) в этилацетате (3 л). Затем реакционную смесь перемешивают при 25°C в течение 3 часов, ее обрабатывают дополнительным метил N-(триэтиламмониосульфонил)карбаматом, внутренней солью (реагент Бурджеса; 27,6 г, 116 ммоль) и реакционную смесь перемешивают в течение 1 часа. Ее затем фильтруют; фильтровальную лепешку промывают этилацетатом (2×500 мл) и объединенные фильтраты промывают последовательно водным раствором бикарбоната натрия (1 M; 2 л), насыщенным водным раствором хлорида натрия (2 л), хлористоводородную кислоту (1 M; 2 л), и насыщенным водным раствором хлорида натрия (2 л). Органический слой затем сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Остаток обрабатывают смесь этилацетатом и метил трет-бутиловым эфиром (1:10, 2,5 л) и нагревают до 50°C; после перемешивания в течение 1 часа при 50°C ее охлаждают до 25°C и перемешивают в течение 2 часов. Твердое вещество собирают фильтрацией, и 3 партии объединяют в этилацетате (8 л) и фильтруют через силикагель (3,0 кг); силикагель затем промывают этилацетатом (2×2 л). Затем объединенные элюаты концентрируют в вакууме, остаток берут в этилацетате (900 мл) и метил трет-бутиловом эфире (9 л). Эту смесь нагревают до 50°C в течение 1 часа, охлаждают до 25°C и перемешивают в течение 2 часов. Фильтрация дает (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид, сольват метил трет-бутилового эфира (13, сольват метил трет-бутилового эфира) в виде белого твердого вещества. Порошковая рентгеновская дифрактограмма для этого продукта, обозначенного как Твердая форма 2, дана на Фигуре 1; характеристические пики перечислены в таблице A. Объединенный выход: 1,41 кг, 2,82 моль, 81%. ЖХМС m/z 500,3 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,42 (д, J=8,4 Гц, 1H), 9,03 (д, J=8,6 Гц, 1H), 7,68 (с, 1H), 4,97 (ддд, J=10,9, 8,5, 5,1 Гц, 1H), 4,41 (д, J=8,5 Гц, 1H), 4,16 (с, 1H), 3,91 (дд, J=10,4, 5,5 Гц, 1H), 3,69 (д, J=10,4 Гц, 1H), 3,18-3,10 (м, 1H), 3,08-2,99 (м, 1H), 2,46-2,34 (м, 1H), 2,20-2,03 (м, 2H), 1,78-1,65 (м, 2H), 1,57 (дд, J=7,6, 5,4 Гц, 1H), 1,32 (д, J=7,6 Гц, 1H), 1,03 (с, 3H), 0,98 (с, 9H), 0,85 (с, 3H).
Сбор данных порошковой рентгеновской дифракции
Анализ порошковой рентгеновской дифракцией проводят с использованием дифрактометра Bruker AXS D8 Endeavour, оборудованного источником излучения Cu (среднее K-α). Щель расхождения устанавливают на постоянное освещение 15 мм. Дифрагированное излучение регистрируют датчиком PSD-Lynx Eye с раскрытием PSD датчика на 2,99 градуса. Напряжение и сила тока рентгеновской трубки установлены на 40 кВ и 40 мА, соответственно. Данные собирают в гониометре Тэта-Тэта при длине волны Cu от 3,0 до 40,0 градусов 2-Тэта с использованием размера шага 0,00998 градуса и времени шага 1,0 секунды. Экран антирассеивания устанавливают на фиксированное расстояние 1,5 мм. Во время сбора образцы вращают со скоростью 15/мин. Образцы получают, помещая их в кремниевый низкофоновый держатель образцов и вращая во время сбора. Данные собирают с помощью программного обеспечения Bruker DIFFRAC Plus, и анализ выполняют с помощью программного обеспечения EVA DIFFRAC Plus. Используя алгоритм поиска пиков в программном обеспечении EVA, пики, выбранные с пороговым значением 1, используют для предварительного присвоения пиков. Для обеспечения достоверности корректировки вносят вручную; вывод автоматических отчислений проверяют визуально и положения пиков доводят до максимума пика. Обычно выбирают пики с относительной интенсивностью ≥3%. Пики, которые не разрешены или соответствуют шуму, не выбирают. Типовая ошибка, связанная с положением пика PXRD, указанным в USP, составляет до +/- 0,2° 2-Тэта (USP-941).
+/- 0,2° 2-Тэта
+/- 0,2° 2-Тэта
Альтернативный синтез (1R,2S,5S)-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C42).
Второй альтернативный синтез примера 13, сольват метил трет-бутилового эфира; создание 13, сольват метил трет-бутилового эфира, Твердая форма 2
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид, сольват метил трет-бутилового эфира (13, сольват метил трет-бутилового эфира), Твердая форма 2
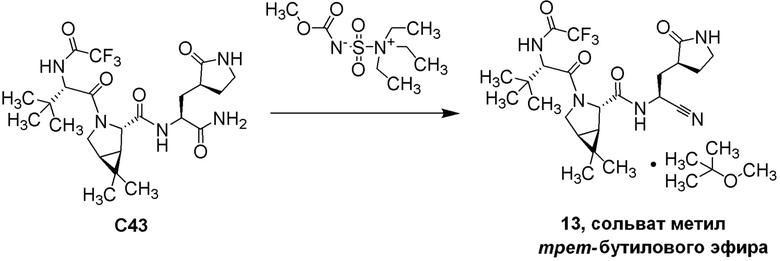
Метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 392 г, 1,64 моль) добавляют в раствор C43 (415 г, 802 ммоль) в этилацетате (2,0 л). Реакционную смесь перемешивают при 25°C в течение 3 часов, затем снова добавляют метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 86,0 г, 361 ммоль). Затем реакционную смесь перемешивают в течение 1 часа, ее фильтруют, и фильтрат промывают последовательно водным раствором бикарбоната натрия (1 M; 1,5 л), насыщенным водным раствором хлорида натрия (1,5 л), хлористоводородной кислотой (1 M; 1,5 л) и насыщенным водным раствором хлорида натрия (1,5 л), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Остаток обрабатывают смесью этилацетата и метил трет-бутилового эфира (1:10, 2,5 л) и нагревают до 50°C; после перемешивания в течение 1 часа при 50°C, ее охлаждают до 25°C и перемешивают в течение 2 часов. Сбор твердого вещества фильтрацией дает (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид, сольват метил трет-бутилового эфира (13, сольват метил трет-бутилового эфира) в виде кристаллического белого твердого вещества. Порошковая рентгеновская дифрактограмма для этого продукта, обозначенного как Твердая форма 2, дана на Фигуре 2; характеристические пики перечислены в таблице B. Выход: 338 г, 575 ммоль, 72%. ЖХМС m/z 500,3 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,43 (д, J=8,4 Гц, 1H), 9,04 (д, J=8,6 Гц, 1H), 7,68 (с, 1H), 4,97 (ддд, J=10,9, 8,5, 5,0 Гц, 1H), 4,41 (д, J=8,5 Гц, 1H), 4,15 (с, 1H), 3,91 (дд, компонент системы АВХ, J=10,4, 5,5 Гц, 1H), 3,69 (д, половина АВ квартета, J=10,4 Гц, 1H), 3,18-3,10 (м, 1H), 3,08-2,98 (м, 1H), 2,46-2,34 (м, 1H), 2,20-2,02 (м, 2H), 1,77-1,65 (м, 2H), 1,57 (дд, J=7,6, 5,4 Гц, 1H), 1,32 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,02 (с, 3H), 0,98 (с, 9H), 0,85 (с, 3H); пики метил трет-бутилового эфира: 3,07 (с, 3H), 1,10 (с, 9H).
Способ сбора данных порошковой рентгеновской дифракции описан в Альтернативном синтезе примера 13, сольвата метил трет-бутилового эфира, Стадия 8.
+/-0,2° 2-Тэта
+/-0,2° 2-Тэта
+/-0,2° 2-Тэта
Третий альтернативный синтез примера 13
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (13)
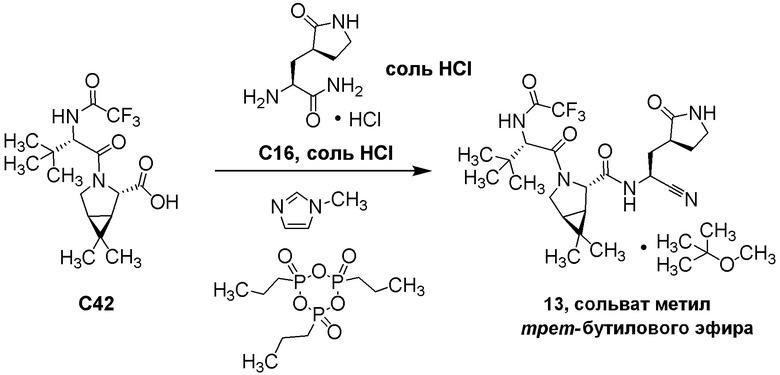
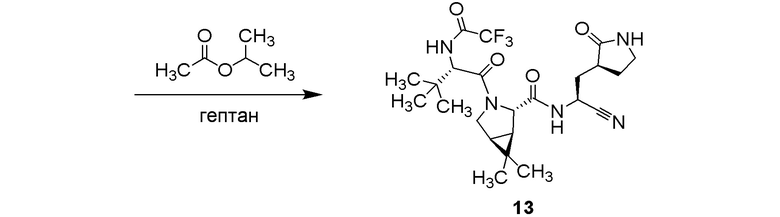
Стадия 1. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид, сольват метил трет-бутилового эфира (13, сольват метил трет-бутилового эфира)
0°C смесь C42 (90,5% масс., 5,05 г, 12,5 ммоль) и C16, соль HCl (98,9% масс., 3,12 г, 14,9 ммоль) в ацетонитриле (50 мл) обрабатывают 2,4,6-триоксидом 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана (50% раствор по массе в ацетонитриле; 17 мл, 24,3 ммоль) в течение приблизительно 10 минут. Затем медленно добавляют 1-метил-1H-имидазол (4,0 мл, 50,2 ммоль) в течение приблизительно 15 минут, и реакционную смесь перемешивают при 0°C в течение 3,5 часов, затем ее нагревают до 25°C. 2,4,6-триоксид 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана (50% раствор по массе в ацетонитриле; 17 мл, 24,3 ммоль) добавляют одной порцией, и реакционную смесь перемешивают при 45°C в течение 16 часов. Ее охлаждают до 25°C в этот момент, и затем обрабатывают 10 минут водным раствором бикарбоната натрия (1,14 M; 35 мл, 40 ммоль). После добавления этилацетата (25 мл) и достаточного количества воды для растворения полученных твердых веществ, органический слой промывают дважды водным раствором бикарбоната натрия (1,14 M; 25 мл, 28 ммоль). Затем органический слой промывают водным раствором хлорида натрия (14%, 2×20 мл), его сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Остаток смешивают с этилацетатом (2,1 мл) и обрабатывают метил трет-бутиловым эфиром (19 мл); полученную суспензию нагревают при перемешивании при 50°C в течение 1 часа, охлаждают до 25°C в течение 1 часа, и выдерживают при 25°C в течение 1,5 часов. Твердые вещества выделяют фильтрацией, промывают метил трет-бутиловым эфиром (2 мл/г) и сушат в вакуумной печи в течение ночи при 50°C с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, сольвата метил трет-бутилового эфира (13, сольвата метил трет-бутилового эфира) в виде кристаллического белого твердого вещества. Объем этого продукта прогрессирует на следующей стадии. Выход: 3,71 г, 6,31 ммоль, 50%. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,40 (д, J=8,4 Гц, 1H), 9,02 (д, J=8,6 Гц, 1H), 7,66 (с, 1H), 4,97 (ддд, J=10,7, 8,6, 5,1 Гц, 1H), 4,41 (д, J=8,4 Гц, 1H), 4,16 (с, 1H), 3,91 (дд, компонент системы АВХ, J=10,3, 5,5 Гц, 1H), 3,69 (д, половина АВ квартета, J=10,4 Гц, 1H), 3,18-3,10 (м, 1H), 3,09-2,99 (м, 1H), 2,46-2,35 (м, 1H), 2,20-2,04 (м, 2H), 1,78-1,64 (м, 2H), 1,56 (дд, J=7,4, 5,6 Гц, 1H), 1,32 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,03 (с, 3H), 0,98 (с, 9H), 0,85 (с, 3H); пики метил трет-бутилового эфира: 3,07 (с, 3H), 1,10 (с, 9H).
Стадия 2. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (13).
Смесь пропан-2-илацетата (17 мл) и гептана (17 мл) добавляют к 13, сольвату метил трет-бутилового эфира (с предыдущей стадии; 3,41 г, 5,80 ммоль), и перемешивание проводят в течение ночи при 20°C. Гептан (17 мл) затем добавляют в течение 2 часов, и смесь перемешивают в течение ночи при комнатной температуре. Полученную суспензию фильтруют, и собранные твердые вещества промывают смесью пропан-2-илацетата (1,36 мл) и гептана (3,73 мл) и сушат при 50°C под вакуумом, с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (13) в виде кристаллического твердого вещества. Часть этой партии применяют как затравочный материал для перекристаллизации примера 13; получение твердой формы 1 ниже. Выход: 2,73 г, 5,46 ммоль, 94%.
Перекристаллизация примера 13; получение твердой формы 1
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (13), Твердая форма 1
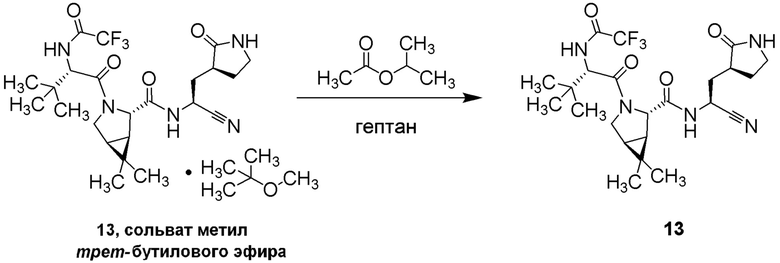
Смесь 13, сольвата метил трет-бутилового эфира (из альтернативного синтеза из примера 13, сольват метил трет-бутилового эфира; получение 13, сольват метил трет-бутилового эфира, Твердая форма 2; 60,1 г, 102 ммоль) и пропан-2-илацетата (480 мл) нагревают до 60°C. Образец 13 (затравочный продукт из третьего альтернативного синтеза примера 13, Стадия 2; 1,2 г, 2,4 ммоль) добавляют; через 10 минут затравочный продукт все еще присутствует в твердой форме. Гептан (360 мл) медленно добавляют к перемешиваемой смеси в течение 12 часов. Дополнительный гептан (360 мл) вводят в течение 4 часов, и полученную смесь перемешивают в течение 30 минут. Ее затем охлаждают до 20°C со скоростью 0,1 градусов/минуту, затем ее перемешивают в течение ночи. Твердое вещество собирают фильтрацией, и промывают смесью пропан-2-илацетата (72 мл) и гептана (168 мл). Затем ее затем сушат под вакуумом при 50°C с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (13) в виде белого кристаллического твердого вещества. Порошковая рентгеновская дифрактограмма этого продукта, обозначенного как Твердая форма 1, дана на Фигуре 3; характеристические пики перечислены в таблице C. Выход: 47,8 г, 95,7 ммоль, 94%.
Способ сбора данных порошковой рентгеновской дифракции описан в Альтернативном синтезе примера 13, сольвата метил трет-бутилового эфира, Стадия 8.
+/-0,2° 2-Тэта
+/-0,2° 2-Тэта
+/-0,2° 2-Тэта
Монокристальное рентгеновское определение структуры примера 13, Твердая форма 1
Образец примера 13 подвергают кристаллизации путем диффузии с использованием этилацетата и гексана. Сосуд для кристаллизации выстаивают при комнатной температуре, пока растворитель испаряется; через 2,5 месяца появились кристаллы рентгеновского качества. Один из них используют для определения структуры. Диаграмма ORTEP для данных монокристалла показана на фигуре 4. Программное обеспечение Mercury используют для расчета структуры порошка на основе разрешенной кристаллической структуры; сравнение с дифрактограммой из примера Перекристаллизации 13; получение твердой формы 1, идентифицирует данный продукт как Твердую форму 1 (см. Фигуру 5). Характеристики пики для этих расчетных данных представлены в таблице D.
+/-0,2° 2-Тэта
+/-0,2° 2-Тэта
+/-0,2° 2-Тэта
Рентгеновский анализ монокристаллов
Сбор данных проводят на дифрактометре Bruker D8 Quest при комнатной температуре. Сбор данных состоит из сканирования омега и фи.
Структура была разрешена путем внутреннего фазирования с использованием программного пакета SHELX в пространственной группе орторомбического класса P212121. В дальнейшем структуру уточняют полноматричным методом наименьших квадратов. Все атомы, отличные от водорода, найдены и уточнены с использованием параметров анизотропного смещения.
Атомы водорода, расположенные на азоте, найдены из разностной карты Фурье и уточнены с ограничением расстояний. Остальные атомы водорода размещены в расчетных положениях и им позволили перемещаться на своих атомах-носителях. Окончательное уточнение включает параметры изотропного смещения для всех атомов водорода.
Анализ абсолютной структуры с использованием способов вероятности (Hooft, 2008) проводят с использованием PLATON (Spek). Результаты показывают, что абсолютная структура назначена правильно. Способ рассчитывает, что вероятность того, что структура назначена правильно, составляет 100%. Параметр Хофта представлен как -0,01 с осо (оценочное стандартное отклонение) (3), и параметр Парсона представлен как -0,01 с осо (2).
Итоговый R-индекс составляет 3,3%. Конечная разностная карта Фурье не обнаружила отсутствующей или смещенной электронной плотности.
Соответствующий кристалл, сбор данных и уточняющая информация сведены в таблицу E. Координаты атомов, длины связей, углы связей и параметры смещения перечислены в таблицах F-H.
Программное обеспечение и ссылки
SHELXTL, Version 5,1, Bruker AXS, 1997.
PLATON, A. L. Spek, J. Appl. Cryst. 2003, 36, 7-13.
MERCURY, C. F. Macrae, P. R. Edington, P. McCabe, E. Pidcock, G. P. Shields, R. Taylor, M. Towler, и J. van de Streek, J. Appl. Cryst. 2006, 39, 453-457.
OLEX2, O. V. Dolomanov, L. J. Bourhis, R. J. Gildea, J. A. K. Howard, и H. Puschmann, J. Appl. Cryst. 2009, 42, 339-341.
R. W. W. Hooft, L. H. Straver, и A. L. Spek, J. Appl. Cryst. 2008, 41, 96-103.
H. D. Flack, Acta Cryst. 1983, A39, 867-881.
Масса формулы
Температура
Длина волны
Кристаллическая система
Пространственная группа
Постоянная решетки
Объем
Z
Плотность (расчетная)
Коэффициент абсорбции
F(000)
Размер кристалла
Интервал тэта для сбора данных
Диапазоны индексов
Собранные отражения
Независимые отражения
Полнота до тэта=67,679°
Коррекция абсорбции
Способ уточнения
Данные/ограничения/параметры
Соответствие по F2
Конечные индексы R [I>2σ(I)]
Индексы R (все данные)
Параметр абсолютной структуры
Коэффициент возбуждения
Наибольшие дифф. пики и впадины
499,53
296(2) K
1,54178 Å
Ортотромбическая
P212121
a=9,6836(2) Å
b=15,0522(4) Å
c=18,0272(5) Å
2627,64(11) Å3
4
1,263 Мг/м3
0,862 мм-1
1056
0,300×0,280×0,260 мм3
3,826 до 80,042°
-12<=h<=12, -18<=k<=19, -22<=l<=23
79731
5628 [Rint=0,0294]
99,3%
Эмпирическая
Наименьшие квадраты в полноматричном приближении по F2
5628/9/358
1,040
R1=0,0326, wR2=0,0906
R1=0,0346, wR2=0,0928
-0,01(3)
н/д
0,112 и -0,121 e.Å-3
β=90°
γ=90°
Таблица F. Атомные координаты (x 104) и параметры эквивалентного изотропного замещения (Å2×103) для примера 13, Твердая форма 1. U(экв) определен как одна третья от следа ортогонализированного тензора Uij.
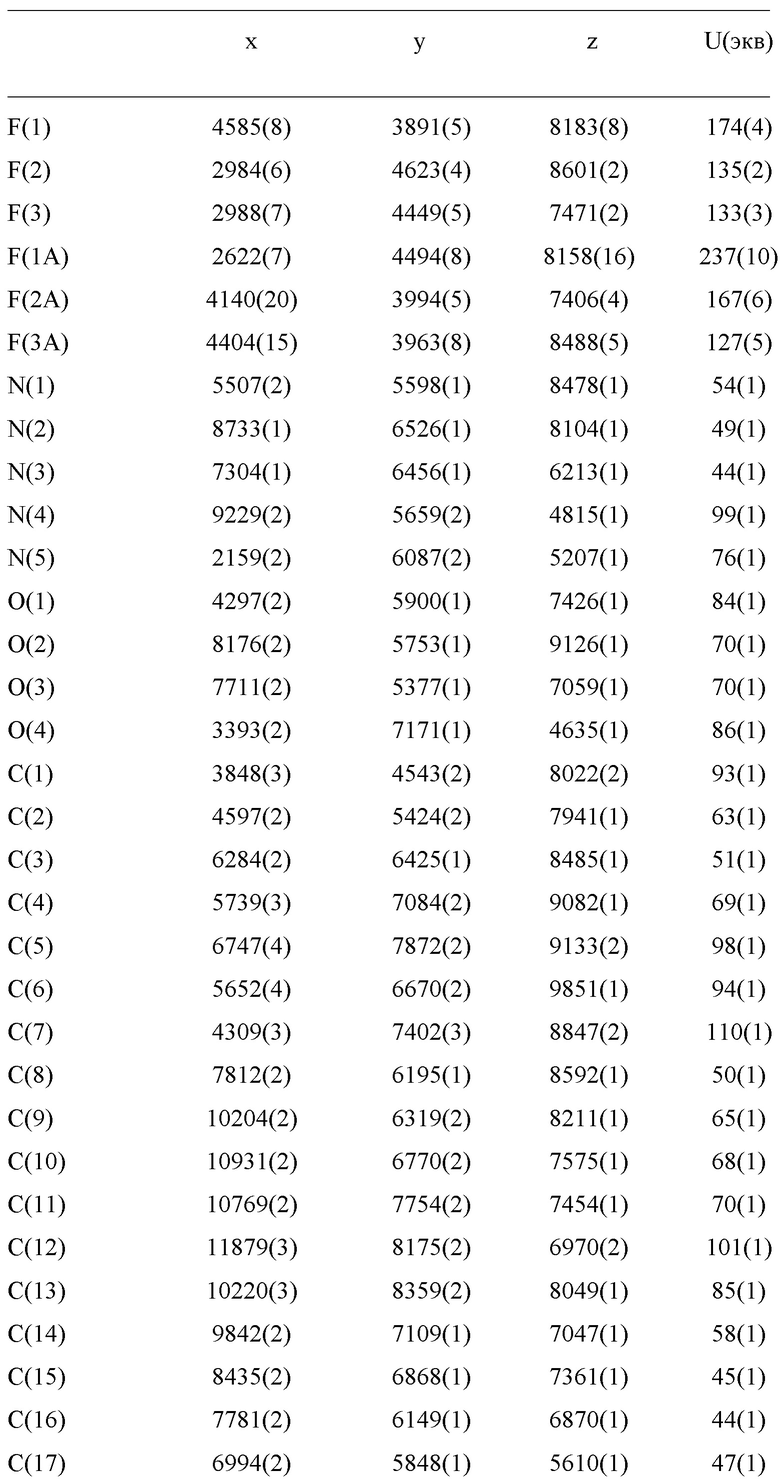

Таблица G. Длины связей [Å] и углы [°] для примера 13, Твердой формы 1.







Симметричные превращения используют для создания эквивалентных атомов.
Таблица H. Параметры анизотропного замещения (Å2×103) для примера 13, Твердая форма 1. Экспонента коэффициента анизотропного замещения принимает форму: -2π2[h2 a*2U11 + ... + 2 h k a* b* U12].
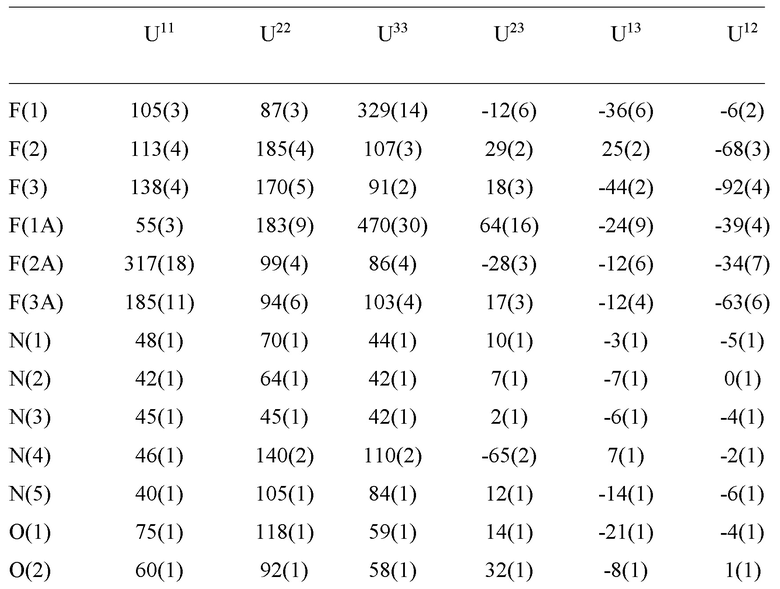
ЯМР анализ твердого тела соединения из Примера 13, Форм 1 и 4, проводят на зонде CPMAS, установленном в ЯМР спектрометр Bruker-BioSpin Avance III 500 МГц (частота 1H). Используют скорость вращения под магическим углом 15,0 кГц. Спектры формы 1 собирают при температуре окружающей среды (не контролируемая температура) и спектры формы 4 собирают при 15°C.
Спектры 13C ssЯМР получают с применением эксперимента с кросс-поляризацией и вращением под магическим углом (CPMAS) с развязанным протоном. Во время сбора спектров применяют фазомодулированное поле развязки протонов 80-100 кГц. Время кросс-поляризационного контакта установлено равным 2 мс, и задержку рециркуляции на 3,5 секунды для Формы 1 и Формы 4. Количество сканирований доводят до получения адекватного отношения сигнала к шуму. Шкала химического сдвига 13C была сопоставлена с использованием эксперимента 13C CPMAS на внешнем стандарте кристаллического адамантана, установив его резонанс в верхнем поле на 29,5 ч/млн.
Спектры 19F ssЯМР получают с помощью эксперимента с вращением под магическим углом (MAS) с развязкой протонов. Во время сбора спектров применяют фазомодулированное поле развязки протонов 80-100 кГц. Спектры собирают с задержкой рециркуляции до 6 секунд для Формы 1 и 5,25 секунд для Формы 4. Количество сканирований доводят до получения адекватного отношения сигнала к шуму. Для шкалы химического сдвига 19F используют эксперимент 19F MAS с внешним стандартом трифторуксусной кислоты (50%/50% об./об. в H2O), установив его резонанс на -76,54 ч./млн.
Автоматический сбор пиков выполняют с использованием программного обеспечения Bruker-BioSpin TopSpin версии 3,6. Как правило, для предварительного выбора пика используют пороговое значение 4% относительной интенсивности. Выходные данные автоматического сбора пиков визуально проверяют, чтобы убедиться в их достоверности, и при необходимости вносят корректировки вручную. Несмотря на то, что здесь приведены конкретные значения пиков ЯМР твердого тела, существует диапазон для этих значений пиков из-за различий в инструментах, образцах и подготовке образцов. Это обычная практика в области ЯМР твердого тела из-за различий в положениях пиков. Типовая вариабельность значения химического сдвига 13C по оси абсцисс составляет порядка плюс-минус 0,2 ч/млн, если не указано иное, для кристаллического твердого вещества. Вариабельность значения химического сдвига по оси абсцисс 19F составляет порядка плюс-минус 0,1 ч/млн. Приведенные здесь высоты пиков ЯМР твердого тела являются относительными интенсивностями. Интенсивность ЯМР твердого тела может варьироваться в зависимости от реальной настройки экспериментальных параметров и термической истории образца.
13C ЯМР твердого тела Примера 13, Формы 1 получают, как описано выше, и определяют следующий список пиков Примера 13, Формы 1. Вариабельность для значений 13C химического сдвига составляет ±0,2 ч./млн., если не указано иное.
19F ЯМР твердого тела соединения примера 13, формы 1 получают, и определяют пик 19F ЯМР твердого тела при химическом сдвиге -73,3±0,1 ч./млн.
Характеристическими пиками для соединения примера 13, формы 1 являются 19F пик с химическим сдвигом -73,3±0,1 ч./млн. в комбинации с 13C пиками с химическими сдвигами 31,0±0,1 ч./млн., 27,9±0,1 ч./млн. и 178,9±0,2 ч./млн.
Альтернативная перекристаллизация примера 13; получение твердой формы 4
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (13), Твердая форма 4
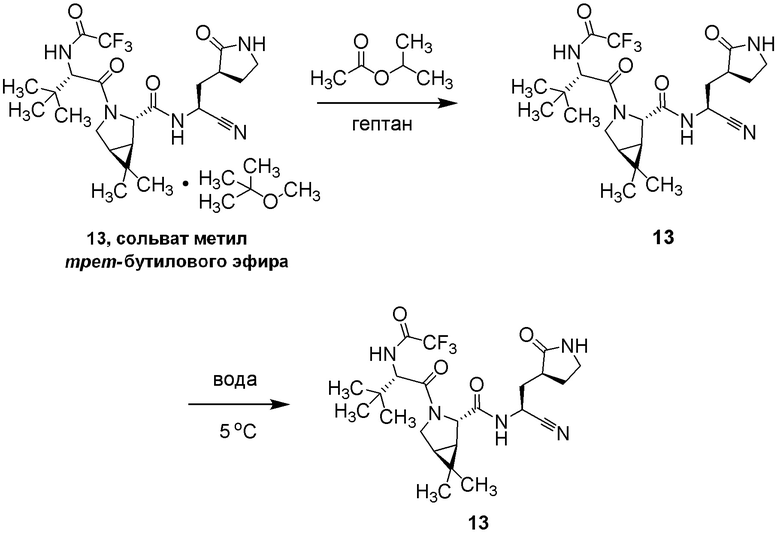
Стадия 1. Перекристаллизация (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (13) из пропан-2-ил ацетата и гептана.
Смесь пропан-2-илацетата (50 мл) и гептана (50 мл) добавляют к 13, сольвату метил трет-бутилового эфира, Твердая форма 2 (из второго альтернативного синтеза из примера 13, сольват метил трет-бутилового эфира; 10,02 г, 17,0 ммоль) и смесь перемешивают при 20°C и 3500 об./мин. в течение ночи. Гептан (50 мл) затем медленно добавляют, и перемешивание продолжают в течение 30 минут, затем смесь охлаждают до 10°C в течение 30 минут. После перемешивания в течение еще 2 часов, суспензию фильтруют; фильтровальную лепешку промывают смесью пропан-2-илацетата (4 мл) и гептана (16 мл) и затем сушат при 55°C под вакуумом с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (13) в виде кристаллического твердого вещества. Часть этого продукта применяют в следующей перекристаллизации. Выход: 7,74 г, 15,5 ммоль, 91%.
Стадия 2. Перекристаллизация (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (13) из воды.
Суспензию 13 (с предыдущей стадии; 1,0 г, 2,0 ммоль) в воде (12 мл) перемешивают при 5°C в течение 21 дней, затем твердое вещество собирают фильтрацией. Ее затем сушат под вакуумом в течение 10 минут и сушат на воздухе в тонком слое на бумаге в течение 20 минут с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (13) в виде белого кристаллического твердого вещества. Порошковая рентгеновская дифрактограмма этого продукта, обозначенного как Твердая форма 4, дана на фигуре 6; характеристические пики перечислены в таблице J. Выход: 755 мг, 1,51 ммоль, 76%. Способ сбора данных порошковой рентгеновской дифракции описаны в Альтернативном синтезе примера 13, сольвата метил трет-бутилового эфира, Стадия 8.
+/-0,2° 2-Тэта
+/-0,2° 2-Тэта
+/-0,2° 2-Тэта
Монокристальный рентгеновский структурный анализ примера 13, твердая форма 4
Образец образца 13 подвергают кристаллизации путем диффузии при комнатной температуре, используя этилацетат и пентан; один из полученных кристаллов используют для монокристального рентгеновского структурного анализа. Диаграмма ORTEP для данных монокристалла показана на фигуре 7. Программное обеспечение Mercury используют для расчета порошковой дифрактограммы на основе разрешенной кристаллической структуры; сравнение с дифракционной картиной из альтернативной перекристаллизации примера 13; получение твердой формы 4 идентифицирует этот продукт как твердую форму 4 (см. фигуру 8). Характеристические пики для этих расчетных данных приведены в таблице К.
+/-0,2° 2-Тэта
+/-0,2° 2-Тэта
+/-0,2° 2-Тэта
Рентгеновский анализ монокристаллов
Сбор данных проводят на дифрактометре Bruker D8 Venture при -100°C. Сбор данных состоит из сканирования омега и фи.
Структура была разрешена путем внутреннего фазирования с использованием программного пакета SHELX в пространственной группе орторомбического класса P212121. В дальнейшем структуру уточняют полноматричным методом наименьших квадратов. Все атомы, отличные от водорода, найдены и уточнены с использованием параметров анизотропного смещения.
Атомы водорода, расположенные на азоте, найдены из разностной карты Фурье и уточнены с ограничением расстояний. Остальные атомы водорода размещены в расчетных положениях и им позволили перемещаться на своих атомах-носителях. Окончательное уточнение включает параметры изотропного смещения для всех атомов водорода.
Анализ абсолютной структуры с использованием способов вероятности (Hooft, 2008) проводят с использованием PLATON (Spek). Абсолютная стереохимия не определена из-за значений параметров Хофта/Парсонса/Флака за пределами спецификации и стандартных отклонений.
Итоговый R-индекс составляет 6,3%. Конечная разностная карта Фурье не обнаружила отсутствующей или смещенной электронной плотности.
Соответствующий кристалл, сбор данных и уточняющая информация сведены в таблицу L. Координаты атомов, длины связей, углы связей и параметры смещения перечислены в таблицах M-P.
Программное обеспечение и ссылки
SHELXTL, Version 5,1, Bruker AXS, 1997.
PLATON, A. L. Spek, J. Appl. Cryst. 2003, 36, 7-13.
MERCURY, C. F. Macrae, P. R. Edington, P. McCabe, E. Pidcock, G. P. Shields, R. Taylor, M. Towler, и J. van de Streek, J. Appl. Cryst. 2006, 39, 453-457.
OLEX2, O. V. Dolomanov, L. J. Bourhis, R. J. Gildea, J. A. K. Howard, и H. Puschmann, J. Appl. Cryst. 2009, 42, 339-341.
R. W. W. Hooft, L. H. Straver, и A. L. Spek, J. Appl. Cryst. 2008, 41, 96-103.
H. D. Flack, Acta Cryst. 1983, A39, 867-881.
Масса формулы
Температура
Длина волны
Кристаллическая система
Пространственная группа
Постоянная решетки
Объем
Z
Плотность (расчетная)
Коэффициент абсорбции
F(000)
Размер кристалла
Интервал тэта для сбора данных
Диапазоны индексов
Собранные отражения
Независимые отражения
Полнота до тэта=54,284°
Коррекция абсорбции
Способ уточнения
Данные/ограничения/параметры
Соответствие по F2
Конечные индексы R [I>2σ(I)]
R индексы (все данные)
Параметр абсолютной структуры
Коэффициент возбуждения
Наибольшие дифф. пики и впадины
499,53
173(2) K
1,54178 Å
Ортотромбическая
P212121
a=9,2114(9) Å
b=15,1607(16) Å
c=18,191(2) Å
2540,5(5) Å3
4
1,306 Мг/м3
0,892 мм-1
1056
0,100×0,060×0,040 мм3
3,795-54,284°
-9<=h<=9, -15<=k<=15, -18<=l<=18
15896
3070 [Rint=0,1260]
99,1%
Эмпирическая
Наименьшие квадраты в полноматричном приближении по F2
3070/9/349
1,067
R1=0,0625, wR2=0,1515
R1=0,0696, wR2=0,1578
0,14(14)
н/д
0,280 и -0,220 e.Å-3
β=90°
γ=90°
Таблица M. Атомные координаты (x 104) и параметры эквивалентного изотропного замещения (Å2×103) для примера 13, Твердая форма 4. U(экв) определен как одна треть от следа ортогонализированного тензора Uij.
Таблица N. Длины связи [Å] и углы [°] для примера 13, твердая форма 4.








Симметричные превращения используют для создания эквивалентных атомов.
Таблица P. Параметры анизотропного замещения (Å2×103) для примера 13, твердая форма 4. Экспонента фактора анизотропного замещения принимает форму: -2π2[h2 a*2U11 + ... + 2 h k a* b* U12].
Список пиков 13C ЯМР твердого тела PF-07321332-00 формы4. Вариабельность для 13C значений химического сдвига составляет ±0,2 ч./млн., если не указано иное.
19F ЯМР твердого тела соединения примера 13, формы 4 получают и пик при -73,6±0,1 с относительной интенсивностью 100% определяют.
Для соединения примера 13, формы 4, идентифицированы шесть характеристических пиков: 19F химический сдвиг при -73,6±0,1 ч./млн. и 13C химические сдвиги при 26,9±0,1 ч./млн., 21,6±0,1 ч./млн., 41,5±0,2 ч./млн., 27,9±0,1 ч./млн., и 12,9±0,1. 19F пик с химическим сдвигом -73,6±0,1 ч./млн. является характеристическим для соединения примера 13, формы4. 13C пики при 26,9±0,1 ч./млн., 21,6±0,1 ч./млн. и 41,5±0,1 ч./млн. каждый является характеристическим пиком соединения примера 13, формы 4. 13C пики при 27,9 ч./млн. и 12,9 ч./млн. каждый является характеристическим для соединения примера 13, формы 4, когда взяты в комбинации с одним или несколькими из пиков, выбранных из 13C пиков при 21,6 ч./млн., 26,9 ч./млн. и 41,5 ч./млн. и 19F пика при -73,6 ч./млн.
Четвертый альтернативный синтез примера 13, сольвата метил трет-бутилового эфира
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид, сольват метил трет-бутилового эфира (13, сольват метил трет-бутилового эфира)
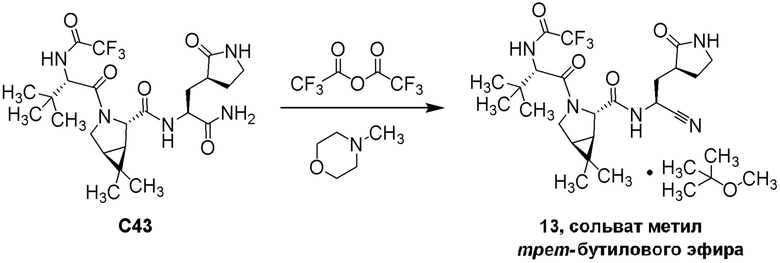
К 0°C суспензии C43 (5,0 г, 9,7 ммоль) в пропан-2-илацетате (7,6 мл/г, 38 мл) загружают 4-метилморфолин (4,5 эквивалента; 4,8 мл, 44 ммоль). В полученную суспензию загружают трифторуксусный ангидрид (2,25 эквивалента; 3,1 мл, 22 ммоль) в течение 1 часа через дозирующий насос. После перемешивания при 0°C в течение, по меньшей мере, 1 часа, реакционную смесь нагревают до примерно 20°C, гасят водой (8 мл/г, 40 мл) и перемешивают в течение, по меньшей мере, 10 минут. После декантирования, нижний (водный) слой отбрасывают и воду (8 мл/г, 40 мл) добавляют в органический слой. После перемешивания в течение, по меньшей мере, 10 минут, слои разделяют, и нижний (водный) слой отбрасывают. Органический слой концентрируют при пониженном давлении до приблизительно 4 мл/г (около 20 мл), затем вакуум разрушают с применением азота и раствор нагревают до приблизительно 50°C. Метил трет-бутиловый эфир (12 мл/г, 60 мл) медленно добавляют в течение, по меньшей мере, 4 часов через капельную воронку, и реакционную смесь выдерживают при 50°C в течение, по меньшей мере, 1 часа, затем охлаждают до 25°C в течение 1 часа. Полученную суспензию выдерживают при 25°C в течение ночи, затем фильтруют, промывают последовательно смесью пропан-2-илацетата и метил трет-бутилового эфира [1:3 (об./об.); 2 мл/г] и метил трет-бутиловым эфиром (2 мл/г, 10 мл), и сушат на фильтре в течение, по меньшей мере, 30 минут. Твердые вещества затем переносят в вакуумную печь при 50°C и сушат в течение, по меньшей мере, 8 часов, с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, сольвата метил трет-бутилового эфира (13, сольват метил трет-бутилового эфира) в виде беловатого твердого вещества. Выход: 3,4 г, 5,8 ммоль, 60%.
Пятый альтернативный синтез примера 13, сольват метил трет-бутилового эфира
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид, сольват метил трет-бутилового эфира (13, сольват метил трет-бутилового эфира)
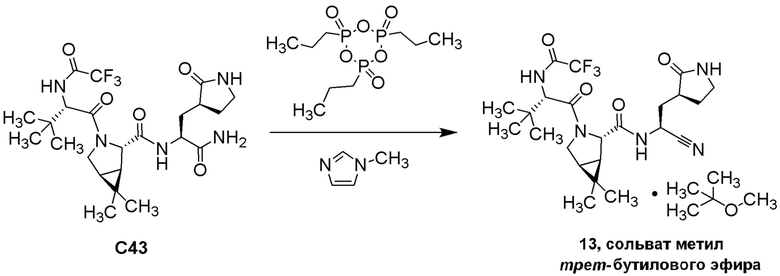
К суспензии C43 (4,0 г, 7,7 ммоль) в ацетонитриле (10 мл/г, 40 мл) при комнатной температуре загружают 1-метил-1H-имидазол (4,6 эквивалента; 2,84 мл, 35,6 ммоль) и полученную смесь нагревают до приблизительно 30°C. Раствор 2,4,6-триоксида 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана (50% раствор по массе в ацетонитриле; 2 эквивалента; 10,8 мл) добавляют в течение, по меньшей мере, 6 часов с применением насоса. Затем реакционную смесь перемешивают в течение, по меньшей мере, 10 часов, ее охлаждают до 25°C и осторожно гасят добавлением насыщенным водным раствором бикарбоната натрия (7 мл/г, 28 мл) (экзотермическая и без газа). Ацетонитрил затем отгоняют при пониженном давлении; к полученной смеси добавляют этилацетат (10 мл/г, 40 мл) и дополнительный насыщенный водный раствор бикарбоната натрия (5 мл/г, 20 мл). После разделения фаз, нижний (водный) слой отбрасывают и органический слой промывают насыщенным водным раствором бикарбоната натрия (3,5 мл/г; 14 мл). Водный слой снова отбрасывают, и органический слой концентрируют при пониженном давлении до приблизительно 1 мл/г (4 мл). Метил трет-бутиловый эфир (9 мл/г; 36 мл) загружают, и полученный раствор нагревают до 50°C, быстро получая суспензию. Эту суспензию хранят при 50°C в течение, по меньшей мере, 30 минут, затем ее охлаждают до 25°C в течение 1 часа и хранят при 25°C в течение, по меньшей мере, 8 часов. Суспензию затем фильтруют, промывают смесью этилацетата и метил трет-бутилового эфира [1:3 (об./об.); 2 мл/г], и затем промывают метил трет-бутиловым эфиром (2 мл/г; 8 мл). Объединенное твердое вещество сушат на фильтре в течение, по меньшей мере, 30 минут, переносят в вакуумную печь при примерно 50°C, и сушат в течение, по меньшей мере, 8 часов, с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, сольвата метил трет-бутилового эфира (13, сольват метил трет-бутилового эфира) в виде беловатого твердого вещества. Выход: 2,9 г, 4,9 ммоль, 64%.
Примеры составов для соединения примера 13
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид или его гидрат или сольват или фармацевтически приемлемую соль соединения, гидрата или сольвата составляют с получением обычной таблетки и немедленным выделением с пленочным покрытием для перорального введения, где дозы варьируются от 100 до 250 мг. В качестве примера, состав для немедленного выделения описан в таблице составов и содержит обычные неактивные эксципиенты микрокристаллическую целлюлозу и моногидрат лактозы (разбавители), кросповидон (разрыхлитель), коллоидный диоксид кремния (глидант) и стеарилфумарат натрия (смазывающий агент). Таблетки с немедленным выделение покрывают пленочным покрытием с применением коммерчески доступных составов для пленочного покрытия, включая Opadry white и Opadry pink. Все эксципиенты в таблетке с пленочным покрытием являются широко применяемыми и присутствуют на известных уровнях. Представленный состав является примером таблетированного состава с немедленным выделением и, как таковой, специалист в данной области техники сможет использовать легко доступные обычные методики с применением альтернативных эксципиентов для составов с получением подходящих таблеток и достижения желаемых характеристик качества таблетки.
Примеры составов: типовые таблетированные составы с покрытием для (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида.
Таблетки с немедленным выделением (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (называемого ниже API) производят с применением обычных, стандартных периодических процессов для твердых пероральных таблеток с немедленным выделением. Примеры стандартных периодических процессов, которые можно применяться для производства таблеток (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида с немедленным выделением включают прямое прессование, сухую грануляцию и влажную грануляцию. Альтернативно, может применяться непрерывный процесс производства. После прессования таблеток, сердцевины таблеток покрывают пленкой. Покрытие таблеток пленкой может проводиться с применением непрерывного нанесения покрытия или с применением обычного периодического процесса нанесения пленочного покрытия.
Состав таблетки: составы таблеток 100 мг, 150 мг и 250 мг (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида
(YS-1-7027-SP)
(058140011)
Пример 14
N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-5,5,5-трифтор-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамид (14)
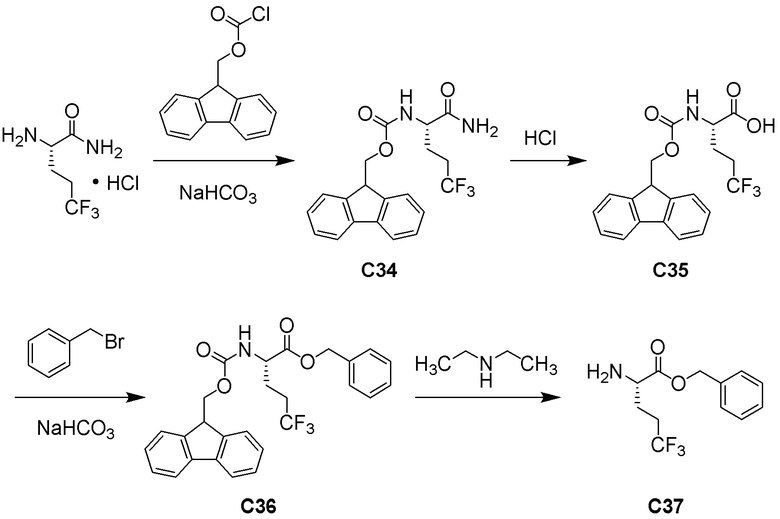
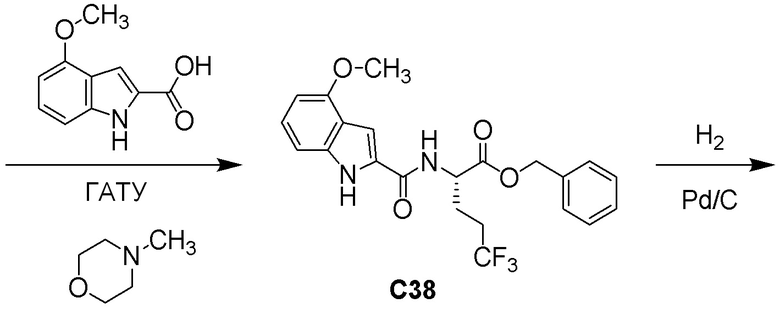
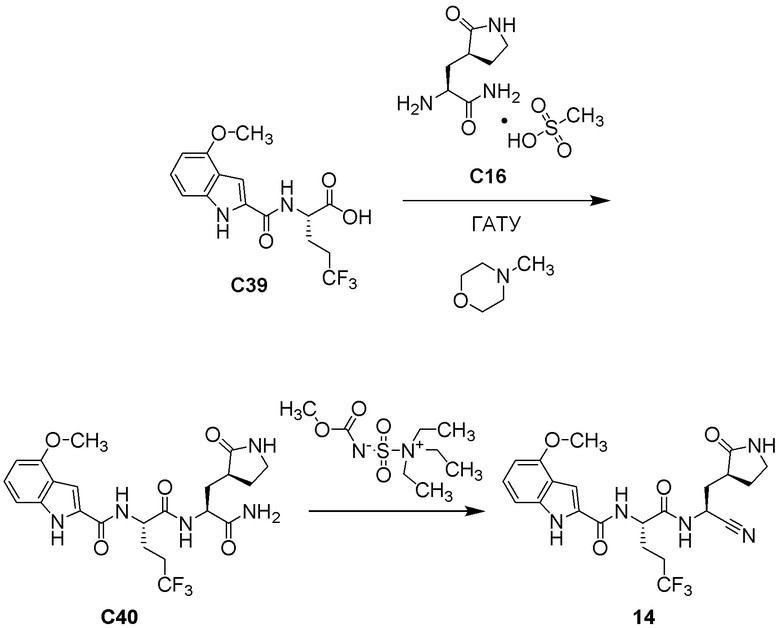
Стадия 1. Синтез 9H-флуорен-9-илметил [(2S)-1-амино-5,5,5-трифтор-1-оксопентан-2-ил]карбамат (C34).
Бикарбонат натрия (4,8 г, 57 ммоль) добавляют в раствор 5,5,5-трифтор-L-норвалинамида, гидрохлорида (его синтезируют с применением способа, описанного для его энантиомера, в J. E. Starrett, PCT Int. Appl., 2010107997, September 23, 2010; 4,0 г, 19 ммоль) и 9H-флуорен-9-илметила карбонохлоридата (хлорид Fmoc; 10,2 г, 39,4 ммоль) в воде (80 мл). Полученную суспензию перемешивают при 15°C - 25°C в течение 24 часов, затем ее разделяют между водой и дихлорметаном. Органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме, с получением C34 в виде твердого вещества. Выход: 6,2 г, 16 ммоль, 83%. ЖХМС m/z 393,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,9 (д, 2H), 7,7 (м, 2H), 7,5 (д, 1H), 7,4 (м, 5H), 7,1 (шс, 1H), 4,3 (м, 3H), 4,0 (м, 1H), 2,2 (м, 2H), 1,9 (м, 1H), 1,7 (м, 1H).
Стадия 2. Синтез N-[(9H-флуорен-9-илметокси)карбонил]-5,5,5-трифтор-L-норвалина (C35).
В раствор C34 (6,2 г, 16 ммоль) в 1,4-диоксане (60 мл) добавляют хлористоводородную кислоту (3 M; 10 мл, 30 ммоль), и реакционную смесь перемешивают при 80°C в течение 16 часов. Ее затем разделяют между водой и дихлорметаном, и органический слой промывают водой и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Остаток растирают с петролейным эфиром с получением C35 в виде твердого вещества. Выход: 5,5 г, 14 ммоль, 88%. ЖХМС m/z 392,1 [M-H]-. 1H ЯМР (400 MГц, ДМСО-d6) δ 12,83 (шс, 1H), 7,89 (д, J=7,4 Гц, 2H), 7,77-7,67 (м, 3H), 7,46-7,38 (м, 2H), 7,36-7,28 (м, 2H), 4,38-4,28 (м, 2H), 4,26-4,19 (м, 1H), 4,06 (ддд, J=9, 9, 4,9 Гц, 1H), 2,43-2,15 (м, 2H), 2,01-1,89 (м, 1H), 1,89-1,75 (м, 1H).
Стадия 3. Синтез бензил N-[(9H-флуорен-9-илметокси)карбонил]-5,5,5-трифтор-L-норвалината (C36).
Смесь C35 (435 мг, 1,11 ммоль), бензилбромида (0,263 мл, 2,21 ммоль) и бикарбоната натрия (464 мг, 5,52 ммоль) в N, N-диметилформамиде (20 мл) перемешивают в течение 15 часов при 25°C. Затем реакционную смесь разбавляют водой (30 мл) и экстрагируют этилацетатом (3×30 мл), объединенные органические слои промывают последовательно насыщенным водным раствором хлорида натрия и 5% водным раствором хлорида лития, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (градиент: 0% - 100% этилацетат в петролейном эфире) дает C36 в виде белого твердого вещества. Выход: 510 мг, 1,05 ммоль, 95%. ЖХМС m/z 506,1 [M+Na+].
Стадия 4. Синтез бензил 5,5,5-трифтор-L-норвалината (C37).
Диэтиламин (10 мл) добавляют к 0°C смеси C36 (510 мг, 1,05 ммоль) в ацетонитриле (25 мл). Затем реакционную смесь перемешивают при 20°C в течение 2 часов, ее концентрируют при пониженном давлении; затем хроматография на силикагеле (градиент: 0% - 10% метанол в дихлорметане) дает C37 в виде бесцветного масла. Выход: 250 мг, 0,957 ммоль, 91%. ЖХМС m/z 302,9 [M+CH3CN+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 7,42-7,32 (м, 5H), 5,17 (с, 2H), 3,50 (дд, J=8,4, 5,0 Гц, 1H), 2,32-2,13 (м, 2H), 2,01 (дддд, J=13,7, 10,8, 5,2, 5,2 Гц, 1H), 1,76 (дддд, J=13,6, 10,8, 8,4, 5,3 Гц, 1H).
Стадия 5. Синтез бензил 5,5,5-трифтор-N-[(4-метокси-1H-индол-2-ил)карбонил]-L-норвалината (C38).
К 0°C раствору C37 (250 мг, 0,957 ммоль) и 4-метокси-1H-индол-2-карбоновой кислоты (220 мг, 1,15 ммоль) в N, N-диметилформамиде (10 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 437 мг, 1,15 ммоль), затем по каплям добавляют 4-метилморфолин (194 мг, 1,92 ммоль). Перемешивание продолжают при 0°C - 10°C в течение 1 часа, затем реакционную смесь разбавляют водой (20 мл) и водным раствором лимонной кислоты (20 мл) и экстрагируют этилацетатом (3×20 мл). Объединенные органические слои промывают последовательно насыщенным водным раствором бикарбоната натрия (30 мл), насыщенным водным раствором хлорида натрия, и водным раствором хлорида лития (5%, 20 мл), затем сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Остаток очищают с применением хроматографии на силикагеле (градиент: 0% - 100% этилацетат в петролейном эфире) с получением C38 в виде белого твердого вещества. Выход: 350 мг, 0,806 ммоль, 84%. ЖХМС m/z 435,1 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 9,09 (шс, 1H), 7,42-7,33 (м, 5H), 7,23 (дд, J=8, 8 Гц, 1H), 7,09 (д, J=2,3 Гц, 1H), 7,03 (д, J=8,3 Гц, 1H), 6,76 (шд, J=7,6 Гц, 1H), 6,53 (д, J=7,8 Гц, 1H), 5,25 (AB квартет, JAB=12,1 Гц, δνAB=11,4 Гц, 2H), 4,94-4,87 (м, 1H), 3,96 (с, 3H), 2,35-2,14 (м, 2H), 2,14-1,96 (м, 2H).
Стадия 6. Синтез 5,5,5-трифтор-N-[(4-метокси-1H-индол-2-ил)карбонил]-L-норвалина (C39).
Смесь C38 (350 мг, 0,806 ммоль) и палладия на угле (10%, 85,7 мг, 80,5 мкмоль) в метаноле (10 мл) гидрируют в течение 16 часов при 20°C и 15 ф./кв.д. Реакционную смесь затем фильтруют, и фильтровальную лепешку промывают с метанолом (10 мл); объединенные фильтраты концентрируют в вакууме и подвергают хроматографии на силикагеле (элюент: этилацетат) с получением C39 в виде белого твердого вещества. Выход: 270 мг, 0,784 ммоль, 97%. ЖХМС m/z 345,0 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 11,62 (шс, 1H), 8,61 (д, J=7,9 Гц, 1H), 7,32 (д, J=2,2 Гц, 1H), 7,11 (дд, J=8, 8 Гц, 1H), 7,01 (д, половина АВ квартета, J=8,2 Гц, 1H), 6,51 (д, J=7,6 Гц, 1H), 4,47 (ддд, J=8,5, 8,5, 4,8 Гц, 1H), 3,89 (с, 3H), 2,5-2,27 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 2,12-1,92 (м, 2H).
Стадия 7. Синтез 5,5,5-трифтор-N-[(4-метокси-1H-индол-2-ил)карбонил]-L-норвалил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C40).
0°C смесь C16 (58,2 мг, 0,218 ммоль) и C39 (75,0 мг, 0,218 ммоль) в N, N-диметилформамиде (4 мл) обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 99,4 мг, 0,261 ммоль) и 4-метилморфолином (44,1 мг, 0,436 ммоль). Затем реакционную смесь перемешивают при 0°C в течение 1 часа, ее разбавляют водой (20 мл) и водным раствором лимонной кислоты (1 M; 20 мл), и экстрагируют этилацетатом (3×30 мл). Объединенные органические слои промывают насыщенным водным раствором бикарбоната натрия (20 мл) и насыщенным водным раствором хлорида натрия (3×20 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (элюент: 10:1 этилацетат/метанол) дает C40 в виде белого твердого вещества. Выход: 72 мг, 0,145 ммоль, 66%. ЖХМС m/z 498,2 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 11,60 (шс, 1H), 8,52 (д, J=7,7 Гц, 1H), 8,20 (д, J=8,3 Гц, 1H), 7,61 (с, 1H), 7,42-7,33 (м, 2H), 7,14-7,05 (м, 2H), 7,00 (д, половина АВ квартета, J=8,2 Гц, 1H), 6,51 (д, J=7,7 Гц, 1H), 4,58-4,46 (м, 1H), 4,32-4,22 (м, 1H), 3,89 (с, 3H), 3,18-3,02 (м, 2H), 2,45-2,21 (м, 3H), 2,18-2,07 (м, 1H), 2,06-1,88 (м, 3H), 1,73-1,59 (м, 1H), 1,59-1,48 (м, 1H).
Стадия 8. Синтез N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-5,5,5-трифтор-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида (14).
К смеси C40 (52 мг, 0,10 ммоль) в дихлорметане (13 мл) добавляют метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 37 мг, 0,16 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1,5 часов, затем снова добавляют метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 37 мг, 0,16 ммоль), и перемешивание продолжают в течение 16 часов. Конечное добавление метил N-(триэтиламмониосульфонил)карбамата, внутренней соли (реагент Бурджеса; 24,9 мг, 0,105 ммоль) затем перемешивают в течение 2 часов, затем реакционную смесь разбавляют водой (20 мл) и экстрагируют дихлорметаном (3×10 мл). Объединенные органические слои промывают насыщенным водным раствором хлорида натрия (2×20 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме; препаративная тонкослойная хроматография (элюент: 20:1 этилацетат/метанол) дает N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-5,5,5-трифтор-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамид (14) в виде белого твердого вещества. Выход: 17,4 мг, 36,3 мкмоль, 36%. Этот продукт объединяют с очищенными продуктами двух других синтезов 14 (3 мг и 4 мг) и подвергают сверхкритической жидкостной хроматографии [Колонка: Chiral Technologies ChiralCel OD-H, 30×250 мм, 5 мкм; Подвижная фаза: 7:3 диоксид углерода/(этанол содержащий 0,1% гидроксид аммония); Скорость потока: 60 мл/минуту] с получением N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-5,5,5-трифтор-1-оксопентан-2-ил]-4-метокси-1H-индол-2-карбоксамида (14) в виде твердого вещества. Выход: 11,3 мг, 23,6 мкмоль, 46% для сверхкритической жидкостной хроматографии. ЖХМС m/z 480,2 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 11,61 (шс, 1H), 8,96 (д, J=8,0 Гц, 1H), 8,61 (д, J=7,7 Гц, 1H), 7,71 (с, 1H), 7,37 (д, J=2,2 Гц, 1H), 7,11 (дд, J=8, 8 Гц, 1H), 7,01 (д, половина АВ квартета, J=8,2 Гц, 1H), 6,51 (д, J=7,7 Гц, 1H), 5,03-4,94 (м, 1H), 4,51-4,43 (м, 1H), 3,89 (с, 3H), 3,19-3,07 (м, 2H), 2,43-2,28 (м, 3H), 2,20-2,08 (м, 2H), 2,06-1,92 (м, 2H), 1,86-1,76 (м, 1H), 1,76-1,64 (м, 1H).
Примеры 15, 16, 17, 18, и 19
N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-7-фтор-4-метокси-1H-индол-2-карбоксамид (15), N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-фтор-4-метокси-1H-индол-2-карбоксамид (16), N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3-фтор-4-метокси-1H-индол-2-карбоксамид (17), N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5,7-дифтор-4-метокси-1H-индол-2-карбоксамид (18) и N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3,5-дифтор-4-метокси-1H-индол-2-карбоксамид (19)
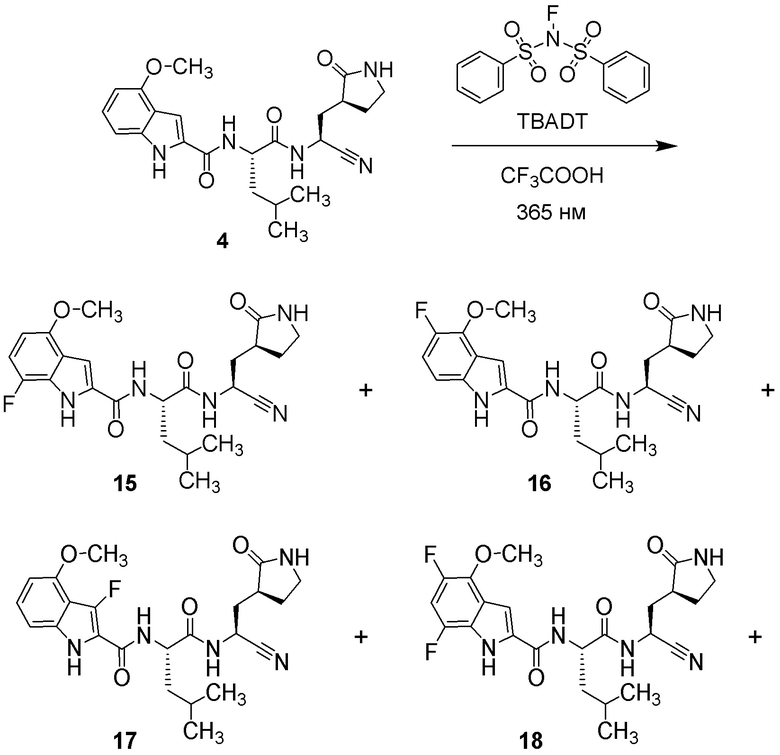
Смесь 4 (10,0 мг, 22,8 мкмоль), декавольфрамата тетра-н-бутиламмония (TBADT; 3,78 мг, 1,14 мкмоль) и N-фтор-N-(фенилсульфонил)бензолсульфонамида (8,61 мг, 27,3 мкмоль) обрабатывают ацетонитрилом (0,75 мл), водой (0,5 мл) и трифторуксусной кислотой (1,74 мкл, 22,6 мкмоль) под аргоном. Реакционную пробирку затем герметично закрывают, помещают в EvoluChem™ PhotoRedOx Box, оборудованный вентилятором и облучают черным светом (PAR20-18W LG 365 нм, 100-240 VAC) при 25°C в течение 16 часов. В реакционную смесь добавляют водный раствор фосфата калия (1 M, pH 7,45; 1 мл), затем попеременно аликвоты воды и ацетонитрила для поддержания очищенного раствора в конечном объеме 18 мл. Аликвоты (3 мл) этой смеси наносят на Biotage Isolute C18 твердофазные картриджи для экстрагирования, которые заранее обрабатывают метанолом (3 мл), затем водой (3 мл). Картриджи промывают водой (3 мл) и 20% ацетонитрилом в 20 мМ водным раствором ацетата аммония (3 мл), затем элюируют ацетонитрилом (3 мл). После выпаривания элюатов в вакуумной центрифуге, остатки восстанавливают в смеси 1% водной муравьиной кислоты и ацетонитрила, и объединяют до всего 6 мл. Этот раствор делят наполовину, и каждую половину подвергают ВЭЖХ с обращенной фазой (Колонка: Phenomenex Luna C18,10×250 мм, 10 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: ацетонитрил; градиент: 15% B в течение 5 минут, затем 15% - 70% B в течение 70 минут, затем 70% - 95% B в течение 15 минут; скорость потока: 2 мл/мин). Фракции собирают каждые 20 секунд, и подобные представляющие интерес фракции из двух разделений объединяют и концентрируют. Эти фракции затем очищают ВЭЖХ с обращенной фазой (Колонка: Agilent Polaris C18, 4,6×250 мм, 5 мкм; Подвижная фаза A: вода, содержащая 10 мМ ацетат аммония; Подвижная фаза B: ацетонитрил; Градиент: 10% B в течение 5 минут, затем 10% - 35% B в течение 35 минут, затем 35% - 60% B в течение 15 минут, затем 60% - 95% B в течение 9 минут; Скорость потока: 0,8 мл/мин). Фракции собирают каждые 20 секунд с получением N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-7-фтор-4-метокси-1H-индол-2-карбоксамида (15), N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5-фтор-4-метокси-1H-индол-2-карбоксамида (16), N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3-фтор-4-метокси-1H-индол-2-карбоксамида (17), N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-5,7-дифтор-4-метокси-1H-индол-2-карбоксамида (18), и N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4-метил-1-оксопентан-2-ил]-3,5-дифтор-4-метокси-1H-индол-2-карбоксамида (19).
15 - Первое разделение, номера фракций 172-174; Второе разделение, номера фракций 136-137. Выход: 58 мкг, 0,13 мкмоль, 0,6%. МС с высоким разрешением m/z 458,2201 [M+H]+; рассчитано для C23H29FN5O4, 458,2204. 1H ЯМР (600 MГц, ДМСО-d6) δ 12,05 (шс, 1H), 8,93 (д, J=7,9 Гц, 1H), 8,51 (д, J=7,6 Гц, 1H), 7,70 (с, 1H), 7,37 (д, J=2,3 Гц, 1H), 6,92 (дд, J=10,8, 8,6 Гц, 1H), 6,42 (дд, J=8,4, 2,5 Гц, 1H), 5,01-4,94 (м, 1H), 4,50-4,43 (м, 1H), 3,87 (с, 3H), 3,18-3,07 (м, 2H), 2,40-2,31 (м, 1H), 2,19-2,08 (м, 2H), 1,85-1,76 (м, 1H), 1,76-1,64 (м, 3H), 1,58-1,49 (м, 1H), 0,94 (д, J=6,3 Гц, 3H), 0,89 (д, J=6,3 Гц, 3H). Время удержания: 7,90 минут (Аналитические условия. Колонка: Phenomenex Kinetex XB-C18, 2,1×100 мм, 2,6 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: ацетонитрил; Градиент: 5% B в течение 0,5 минут, затем 5% - 70% B в течение 10,5 минут, затем 70% - 95% B в течение 2 минут; Скорость потока: 0,4 мл/мин).
16 - Первое разделение, номера фракций 172-174; Второе разделение, номера фракций 138-139. Выход: 153 мкг, 0,33 мкмоль, 1,4%. МС с высоким разрешением m/z 458,2201 [M+H]+; рассчитано для C23H29FN5O4, 458,2204. 1H ЯМР (600 MГц, ДМСО-d6) δ 11,73 (шс, 1H), 8,95 (д, J=8,0 Гц, 1H), 8,61 (д, J=7,7 Гц, 1H), 7,70 (с, 1H), 7,49 (с, 1H), 7,09-7,03 (м, 2H), 5,01-4,94 (м, 1H), 4,51-4,43 (м, 1H), 4,06 (с, 3H), 3,18-3,07 (м, 2H), 2,40-2,31 (м, 1H), 2,19-2,08 (м, 2H), 1,80 (ддд, J=13,6, 9,2, 7,2 Гц, 1H), 1,76-1,65 (м, 3H), 1,58-1,50 (м, 1H), 0,94 (д, J=6,3 Гц, 3H), 0,89 (д, J=6,3 Гц, 3H). Время удержания: 7,94 минут (Аналитические условия идентичны тем, которые используют для 15).
17 - Первое разделение, номера фракций 176-177; Второе разделение, номера фракций 141-142. Выход: 22 мкг, 0,048 мкмоль, 0,21%. МС с высоким разрешением m/z 458,2199 [M+H]+; рассчитано для C23H29FN5O4, 458,2204. 1H ЯМР (600 MГц, ДМСО-d6) δ 11,45 (с, 1H), 8,94 (д, J=7,8 Гц, 1H), 7,71 (с, 1H), 7,62 (шд, J=7,5 Гц, 1H), 7,16 (дд, J=8, 8 Гц, 1H), 6,95 (шд, J=8,3 Гц, 1H), 6,54 (д, J=7,8 Гц, 1H), 5,02-4,94 (м, 1H), 4,54-4,46 (м, 1H), 3,88 (с, 3H), 3,19-3,07 (м, 2H), 2,41-2,31 (м, 1H), 2,20-2,08 (м, 2H), 1,85-1,77 (м, 1H), 1,76-1,63 (м, 3H), 1,61-1,53 (м, 1H), 0,94 (д, J=6,3 Гц, 3H), 0,91 (д, J=6,3 Гц, 3H). Время удержания: 8,06 минут (Аналитические условия идентичны тем, которые используют для 15).
18 - Первое разделение, номера фракций 180-181; Второе разделение, номер фракции 145. Выход: 17 мкг, 0,036 мкмоль, 0,16%. МС с высоким разрешением m/z 476,2100 [M+H]+; рассчитано для C23H28F2N5O4, 476,2109. 1H ЯМР (600 MГц, ДМСО-d6) δ 12,23 (с, 1H), 8,96 (д, J=8,0 Гц, 1H), 8,62 (д, J=7,6 Гц, 1H), 7,70 (с, 1H), 7,52-7,48 (м, 1H), 7,13 (дд, J=11, 11 Гц, 1H), 5,02-4,94 (м, 1H), 4,53-4,44 (м, 1H), 4,01 (с, 3H), 3,18-3,07 (м, 2H), 2,38-2,30 (м, 1H), 2,19-2,08 (м, 2H), 1,81 (ддд, J=13,6, 9,1, 7,0 Гц, 1H), 1,76-1,65 (м, 3H), 1,59-1,51 (м, 1H), 0,95 (д, J=6,2 Гц, 3H), 0,90 (д, J=6,3 Гц, 3H). Время удержания: 8,20 минут (Аналитические условия идентичны тем, которые используют для 15).
19 - Первое разделение, номера фракций 185-187; Второе разделение, номера фракций 150-151. Выход: 35 мкг, 0,074 мкмоль, 0,32%. МС с высоким разрешением m/z 476,2107 [M+H]+; рассчитано для C23H28F2N5O4, 476,2109. 1H ЯМР (600 MГц, ДМСО-d6) δ 11,64 (с, 1H), 8,94 (д, J=7,9 Гц, 1H), 7,80 (шд, J=7 Гц, 1H), 7,71 (с, 1H), 7,16 (дд, компонент системы АВХ, J=11,9, 9,1 Гц, 1H), 7,08 (шд, половина АВ квартета, J=8,5 Гц, 1H), 5,02-4,94 (м, 1H), 4,55-4,47 (м, 1H), 3,99 (с, 3H), 3,19-3,08 (м, 2H), 2,41-2,32 (м, 1H), 2,19-2,10 (м, 2H), 1,81 (ддд, J=13,7, 9,0, 7,2 Гц, 1H), 1,77-1,63 (м, 3H), 1,57 (ддд, J=12,9, 8,4, 4,8 Гц, 1H), 0,94 (д, J=6,4 Гц, 3H), 0,91 (д, J=6,4 Гц, 3H). Время удержания: 8,44 минут (Аналитические условия идентичны тем, которые используют для 15).
Примеры 20, 21, 22, и 23
N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-7-фтор-4-метокси-1H-индол-2-карбоксамид (20), N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-фтор-4-метокси-1H-индол-2-карбоксамид (21), N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-фтор-4-метокси-1H-индол-2-карбоксамид (22) и N-[(2S)-1-({(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5,7-дифтор-4-метокси-1H-индол-2-карбоксамид (23)
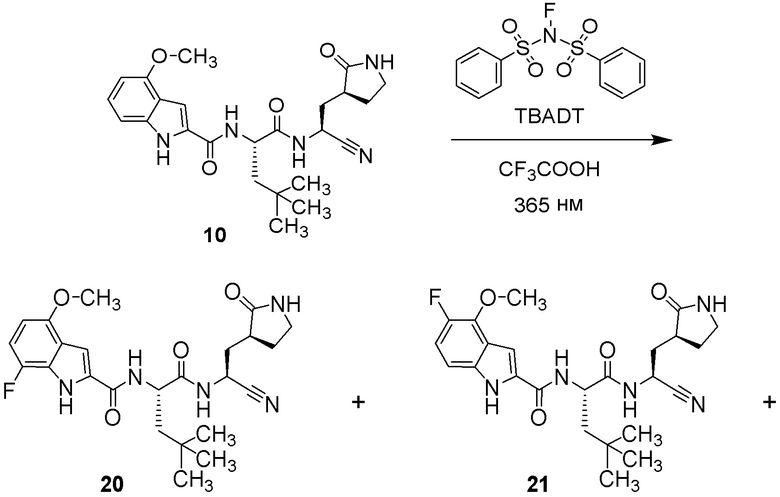
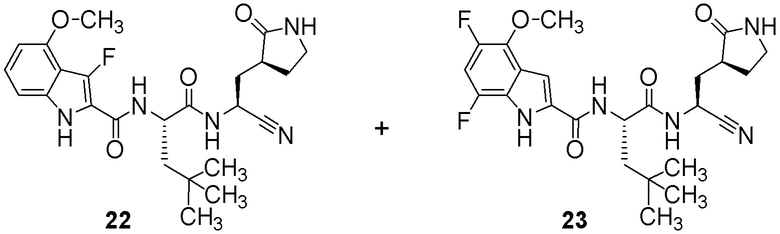
Смесь 10 (10,0 мг, 22,0 мкмоль), декавольфрамата тетра-н-бутиламмония (TBADT; 3,66 мг, 1,10 мкмоль) и N-фтор-N-(фенилсульфонил)бензолсульфонамида (8,34 мг, 26,4 мкмоль) обрабатывают ацетонитрилом (0,75 мл), водой (0,5 мл) и трифторуксусной кислотой (1,69 мкл, 21,9 мкмоль) под аргоном. Реакционную пробирку затем герметично закрывают, помещают в EvoluChem™ PhotoRedOx Box, оборудованную вентилятором, и облучают черным светом (PAR20-18W LG 365 нм, 100-240 VAC) при 25°C в течение 16 часов. В реакционную смесь добавляют водный раствор фосфата калия (1 M, pH 7,45; 1 мл), затем попеременно аликвоты воды и ацетонитрила для сохранения очищенного раствора в конечном объеме 18 мл. Аликвоты (3 мл) этой смеси наносят на Biotage Isolute C18 картриджи для твердофазной экстракции, которые предварительно обрабатывают метанолом (3 мл), затем водным раствором ацетата аммония (10 мМ; 3 мл). Картриджи промывают водным раствором ацетата аммония (10 мМ; 3 мл) и 20% ацетонитрилом в 20 мМ ацетата аммония (3 мл), затем элюируют ацетонитрилом (3 мл). После выпаривания элюатов в вакуумной центрифуге, остатки восстанавливают в смеси 1% водной муравьиной кислоты и ацетонитрила, и объединяют до всего 6 мл. Этот раствор делят наполовину, и каждую половину подвергают ВЭЖХ с обращенной фазой (Колонка: Phenomenex Luna C18,10×250 мм, 10 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: ацетонитрил; Градиент: 15% B в течение 5 минут, затем 15% - 70% B в течение 70 минут, затем 70% - 95% B в течение 15 минут; Скорость потока: 2 мл/мин). Фракции собирают каждые 20 секунд, и похожие фракции, представляющие интерес, из двух разделений объединяют и концентрируют. Эти фракции затем очищают ВЭЖХ с обращенной фазой (Колонка: Agilent Polaris C18, 4,6×250 мм, 5 мкм; Подвижная фаза A: вода, содержащая 10 мМ ацетат аммония; Подвижная фаза B: ацетонитрил; Градиент: 10% B в течение 5 минут, затем немедленное повышение до 20% B, затем 20% - 40% B в течение 35 минут, затем 40% - 60% B в течение 15 минут, затем 60% - 95% B в течение 9 минут; Скорость потока: 0,8 мл/мин). Фракции собирают каждые 20 секунд, с получением N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-7-фтор-4-метокси-1H-индол-2-карбоксамида (20), N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5-фтор-4-метокси-1H-индол-2-карбоксамида (21), N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-3-фтор-4-метокси-1H-индол-2-карбоксамида (22) и N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-5,7-дифтор-4-метокси-1H-индол-2-карбоксамида (23).
20 - Первое разделение, номера фракций 183-185; Второе разделение, номера фракций 150-151. Выход: 24 мкг, 0,051 мкмоль, 0,23%. МС с высоким разрешением m/z 472,2342 [M+H]+; рассчитано для C24H31FN5O4, 472,2360. 1H ЯМР (600 MГц, ДМСО-d6) δ 12,05 (шс, 1H), 8,91 (д, J=8,0 Гц, 1H), 8,52 (д, J=8,0 Гц, 1H), 7,69 (с, 1H), 7,37-7,32 (м, 1H), 6,92 (дд, J=10,9, 8,4 Гц, 1H), 6,41 (дд, J=8,5, 2,7 Гц, 1H), 5,00-4,93 (м, 1H), 4,52 (ддд, J=8,5, 8,2, 3,7 Гц, 1H), 3,87 (с, 3H), 3,17-3,05 (м, 2H), 2,38-2,30 (м, 1H), 2,18-2,06 (м, 2H), 1,85-1,64 (м, 4H), 0,94 (с, 9H). Время удержания: 8,32 минут (Аналитические условия. Колонка: Phenomenex Kinetex XB-C18, 2,1×100 мм, 2,6 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: ацетонитрил; Градиент: 5% B в течение 0,5 минут, затем 5% - 70% B в течение 10,5 минут, затем 70% - 95% B в течение 2 минут; Скорость потока: 0,4 мл/минуту).
21 - Первое разделение, номера фракций 183-185; Второе разделение, номера фракций 152-153. Выход: 68 мкг, 0,14 мкмоль, 0,64%. МС с высоким разрешением m/z 472,2344 [M+H]+; рассчитано для C24H31FN5O4, 472,2360. 1H ЯМР (600 MГц, ДМСО-d6) δ 11,72 (шс, 1H), 8,91 (д, J=8,1 Гц, 1H), 8,59 (д, J=8,0 Гц, 1H), 7,69 (с, 1H), 7,47 (д, J=2,2 Гц, 1H), 7,09-7,04 (м, 2H), 5,00-4,93 (м, 1H), 4,52 (ддд, J=8,5, 8,5, 3,8 Гц, 1H), 4,06 (шс, 3H), 3,17-3,05 (м, 2H), 2,39-2,31 (м, 1H), 2,18-2,06 (м, 2H), 1,84-1,77 (м, 1H), 1,78 (дд, J=13,9, 9,0 Гц, 1H), 1,74-1,64 (м, 2H), 0,94 (с, 9H). Время удержания: 8,34 минут (Аналитические условия идентичны тем, которые используют для 20).
22 - Первое разделение, номера фракций 187-188; Второе разделение, номер фракции 154. Выход: 5 мкг, 0,011 мкмоль, 0,05%. МС с высоким разрешением m/z 472,2354 [M+H]+; рассчитано для C24H31FN5O4, 472,2360. 1H ЯМР (600 MГц, ДМСО-d6) δ 11,45 (с, 1H), 8,91 (д, J=7,9 Гц, 1H), 7,70 (с, 1H), 7,57 (дд, J=8,2, 3,6 Гц, 1H), 7,15 (дд, J=8, 8 Гц, 1H), 6,95 (шд, J=8,3 Гц, 1H), 6,54 (д, J=7,8 Гц, 1H), 5,00-4,94 (м, 1H), 4,56-4,49 (м, 1H), 3,88 (с, 3H), 3,18-3,07 (м, 2H), 2,40-2,32 (м, 1H), 2,17-2,09 (м, 2H), 1,84-1,77 (м, 1H), 1,76-1,65 (м, 3H), 0,95 (с, 9H). Время удержания: 8,51 минут (Аналитические условия идентичны тем, которые используют для 20).
23 - Первое разделение, номера фракций 190-192; Второе разделение, номера фракций 156-157. Выход: 21 мкг, 0,043 мкмоль, 0,19%. МС с высоким разрешением m/z 490,2258 [M+H]+; рассчитано для C24H30F2N5O4, 490,2266. 1H ЯМР (600 MГц, ДМСО-d6) δ 12,24 (с, 1H), 8,95 (д, J=8,0 Гц, 1H), 8,64 (д, J=8,0 Гц, 1H), 7,69 (с, 1H), 7,49-7,47 (м, 1H), 7,13 (дд, J=11,1, 11,1 Гц, 1H), 5,00-4,93 (м, 1H), 4,54 (ддд, J=8, 8, 4,1 Гц, 1H), 4,00 (с, 3H), 3,17-3,06 (м, 2H), 2,38-2,30 (м, 1H), 2,18-2,07 (м, 2H), 1,85-1,65 (м, 4H), 0,95 (с, 9H). Время удержания: 8,65 минут (Аналитические условия идентичны тем, которые используют для 20).
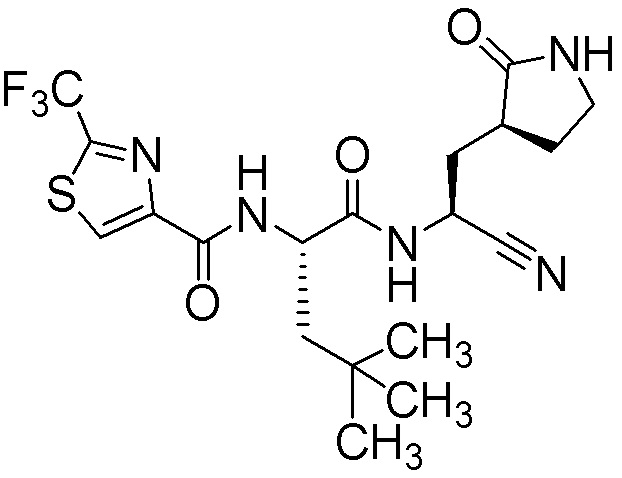
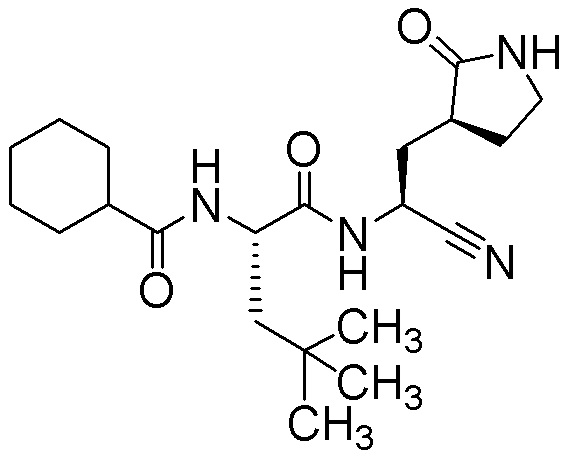
или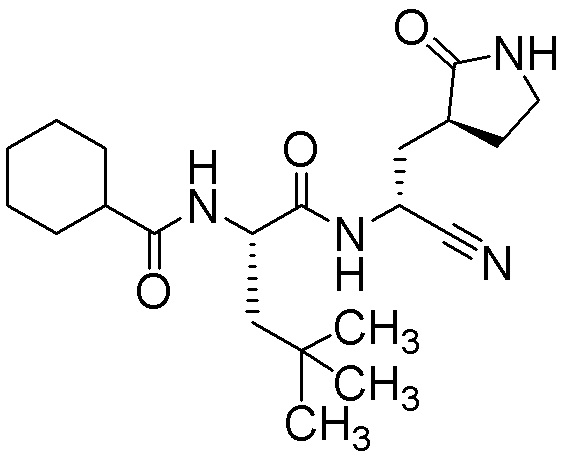
DIAST-1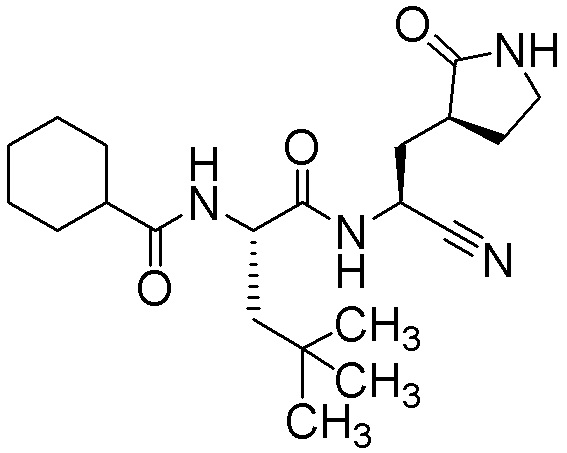
или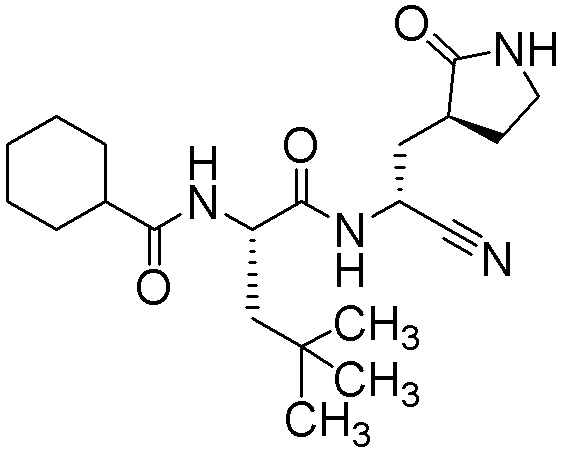
DIAST-2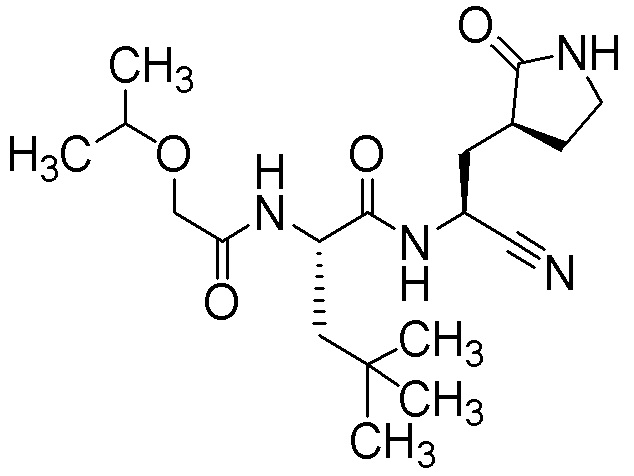
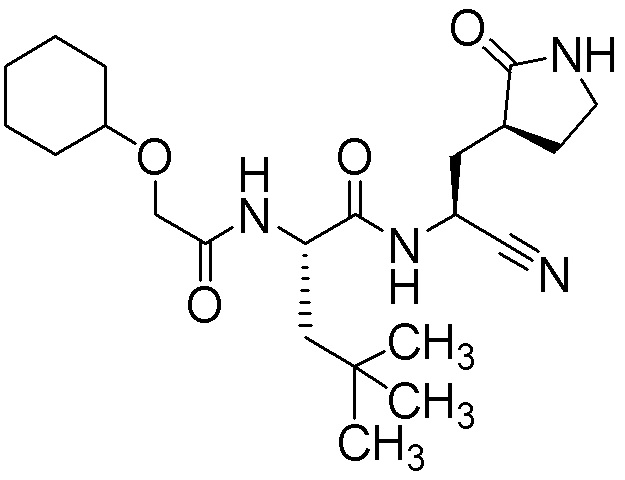
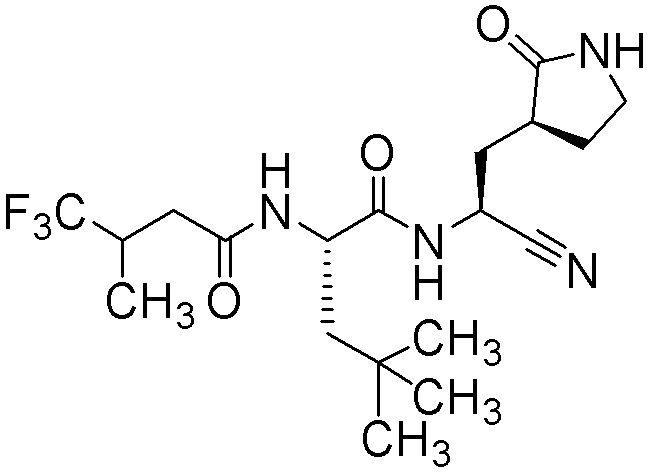
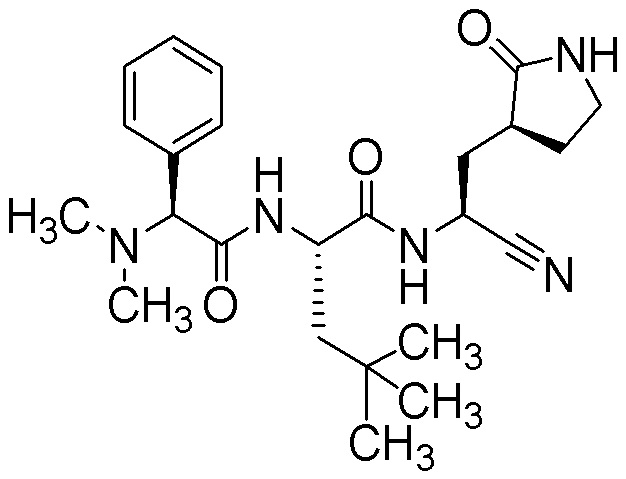
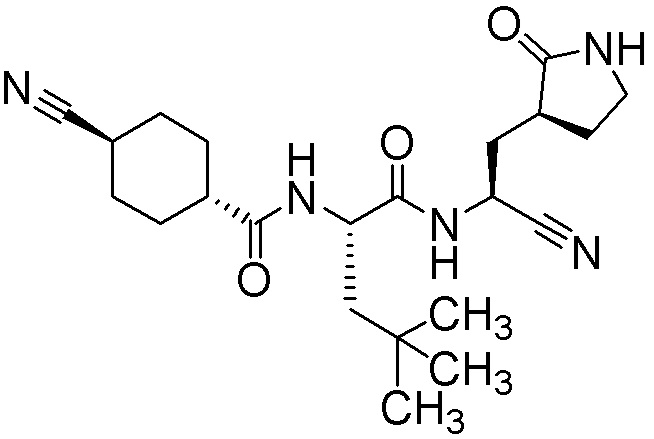
или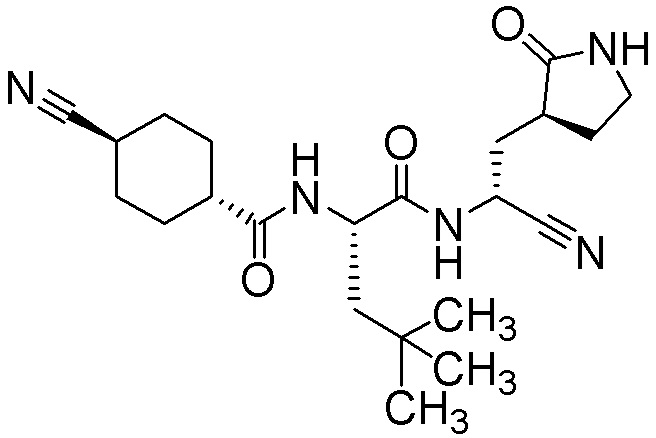
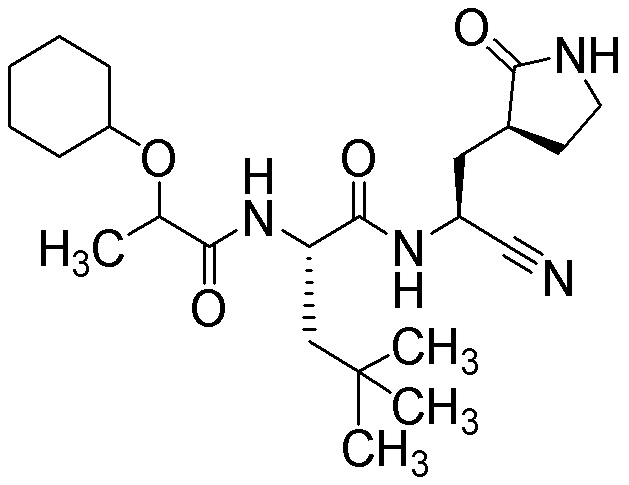
или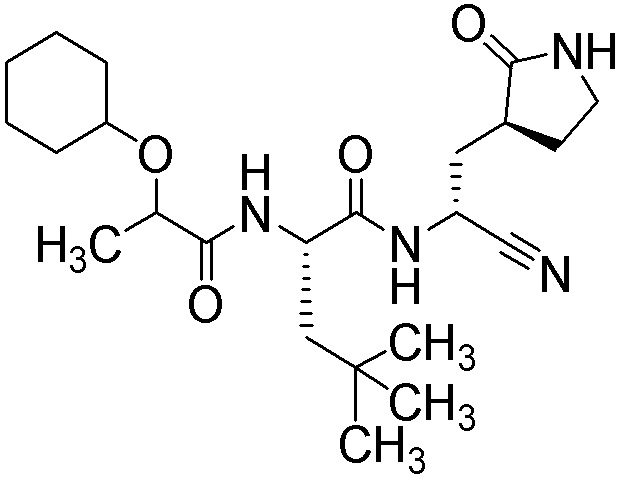
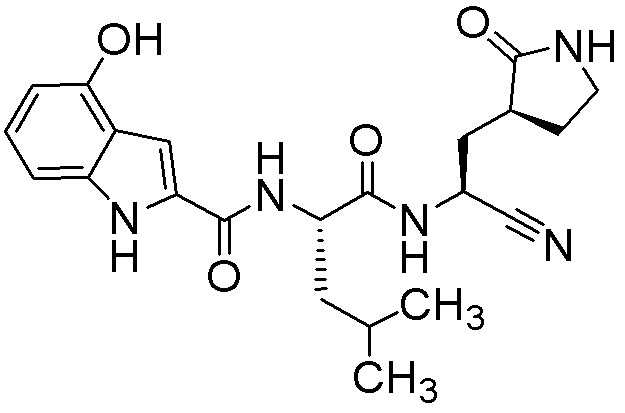
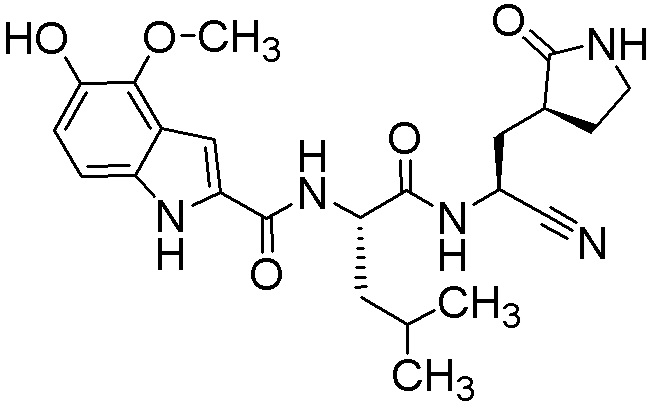
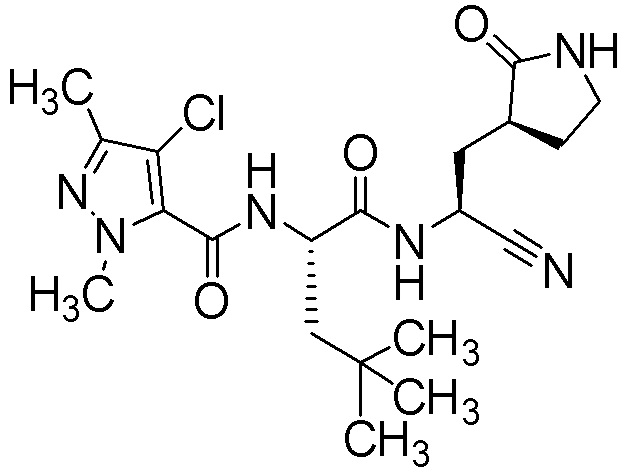
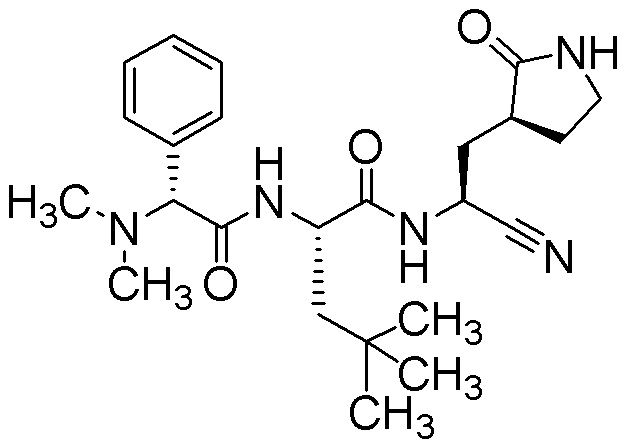
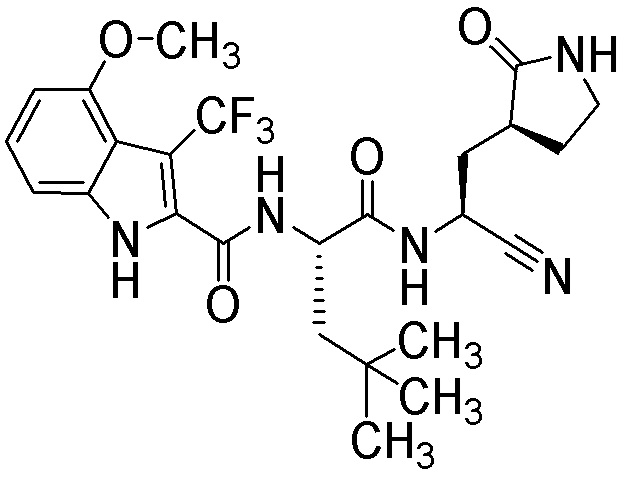
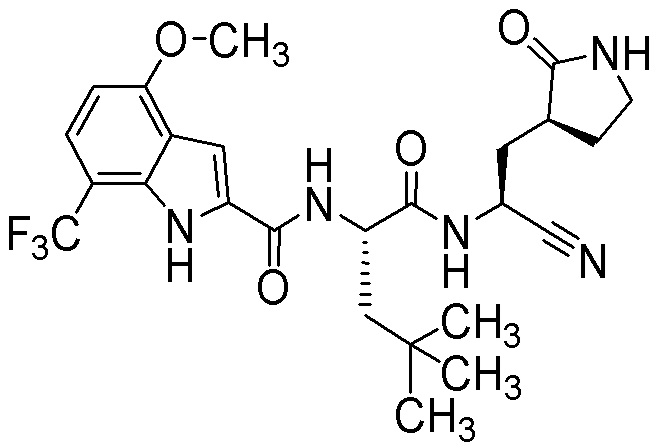
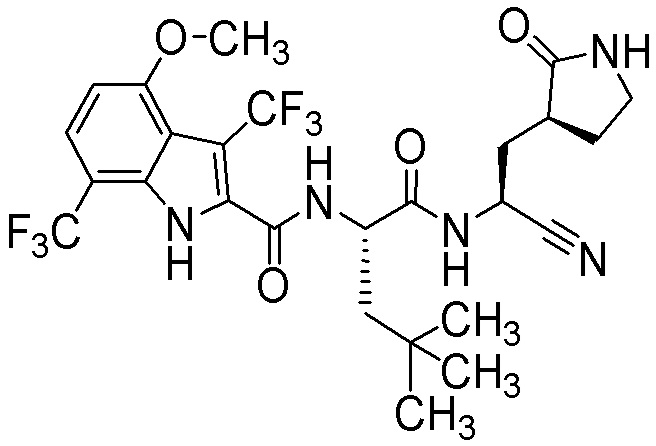
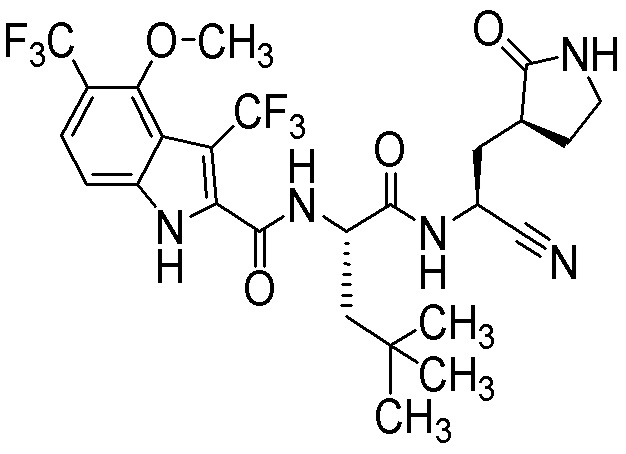
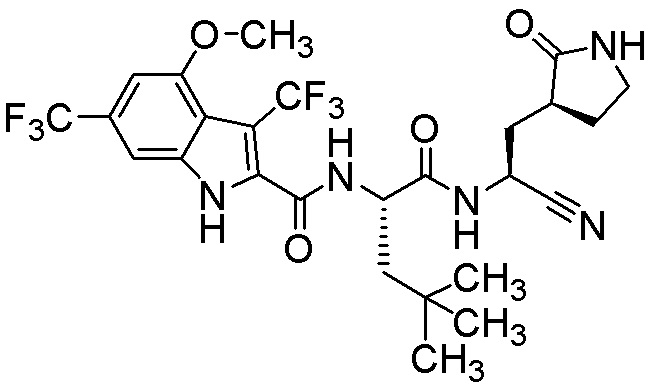
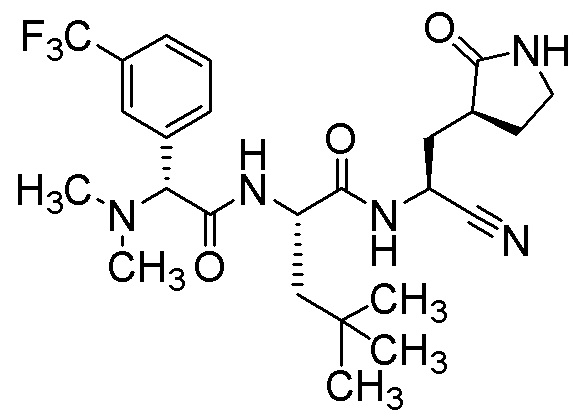
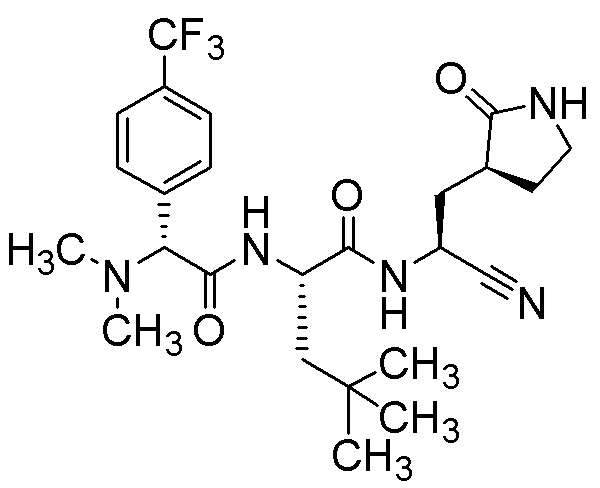
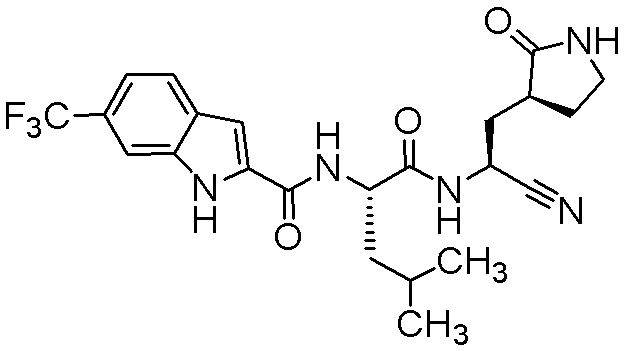
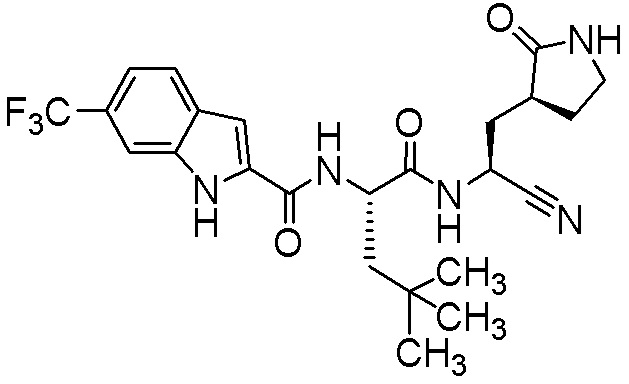
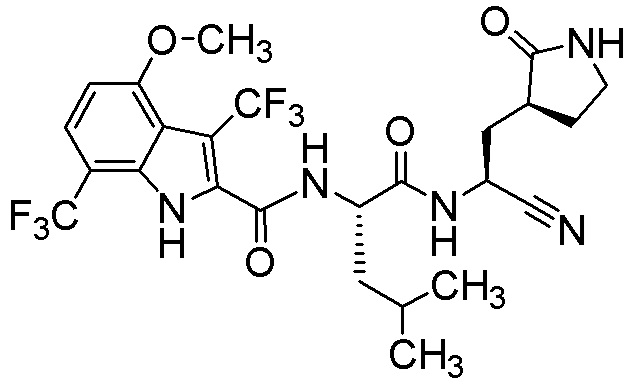
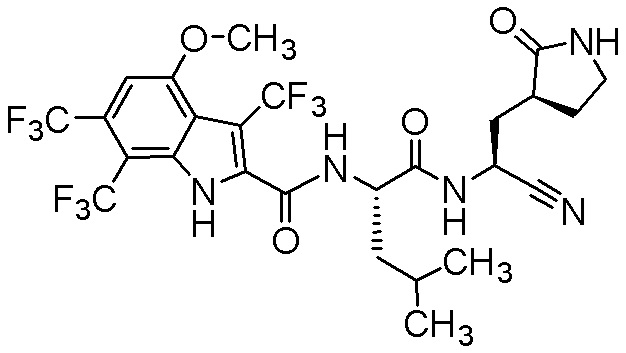
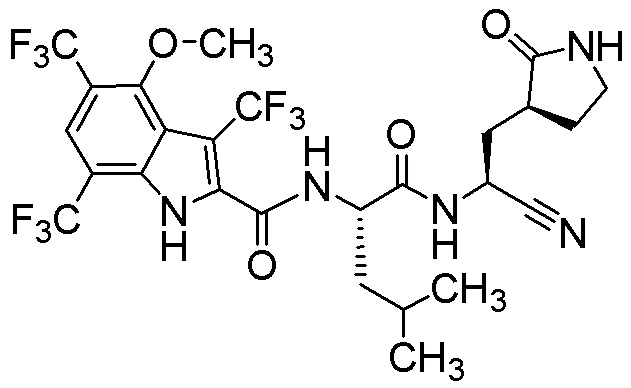
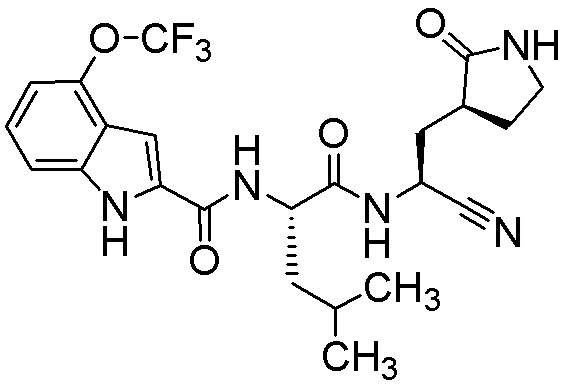
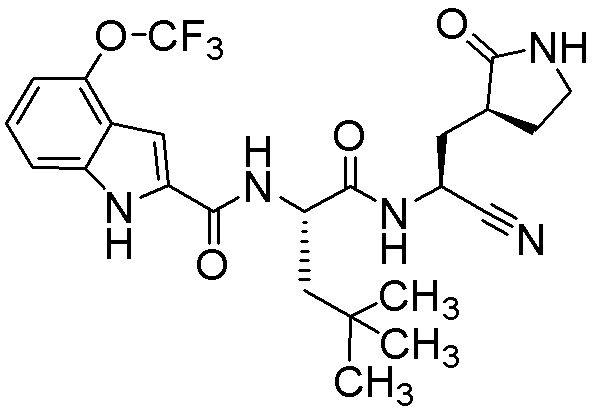
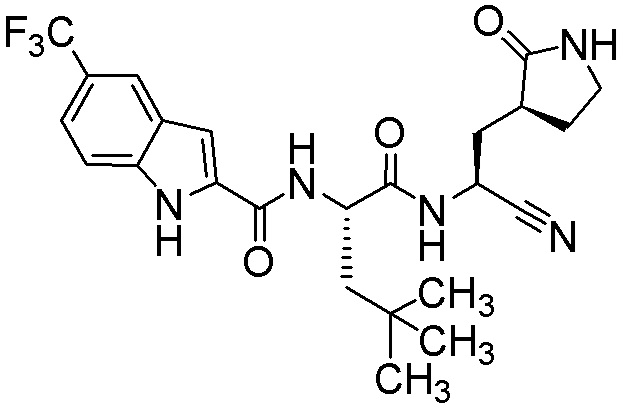
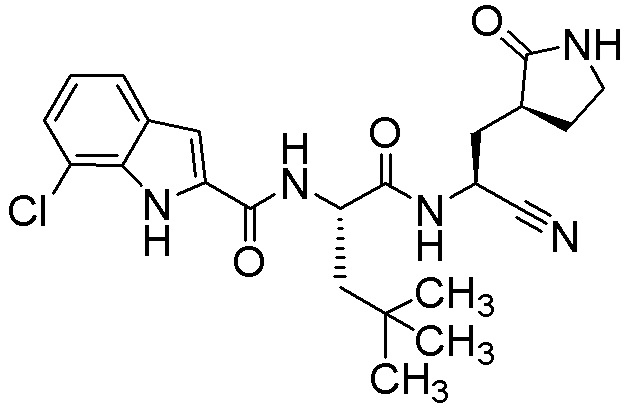
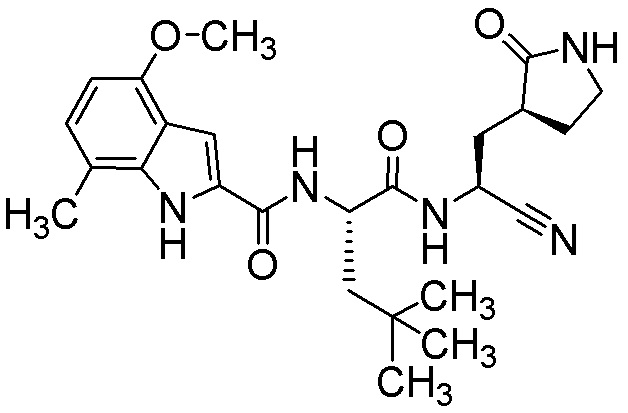
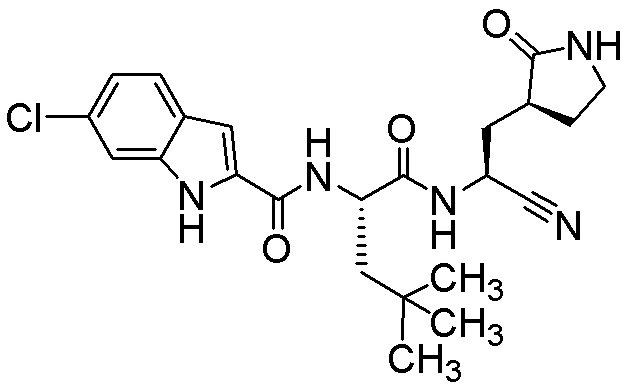
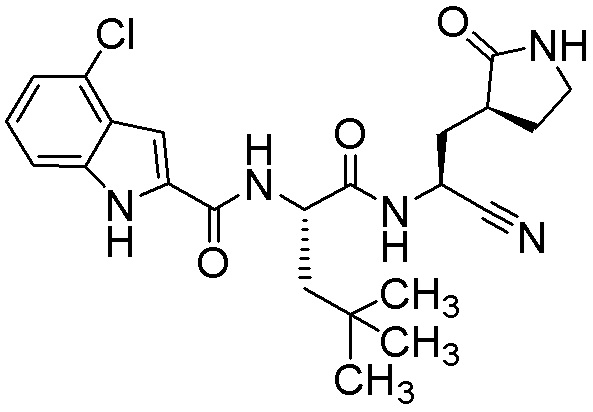
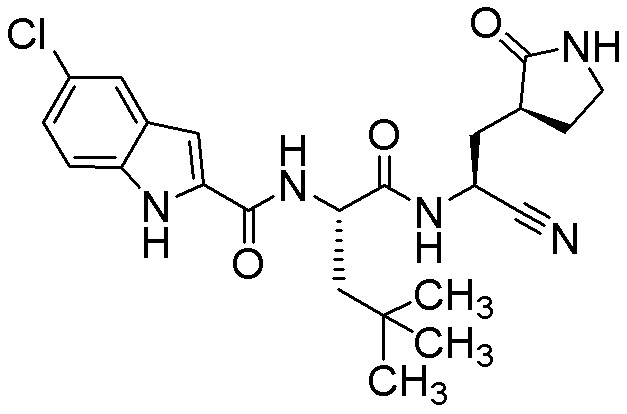
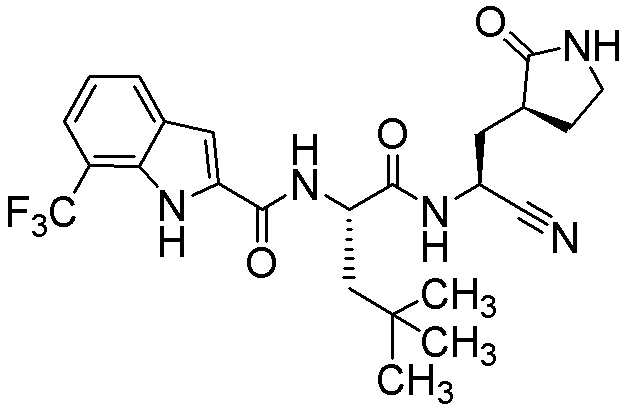
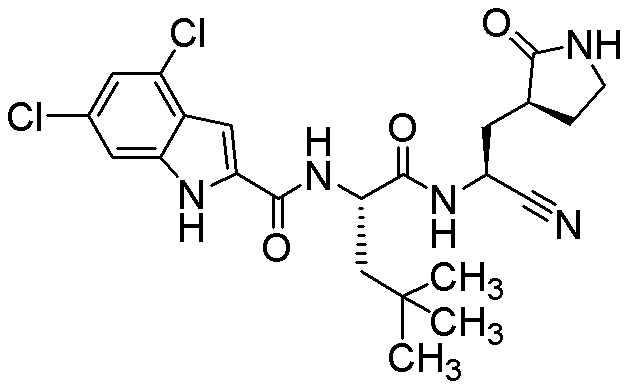
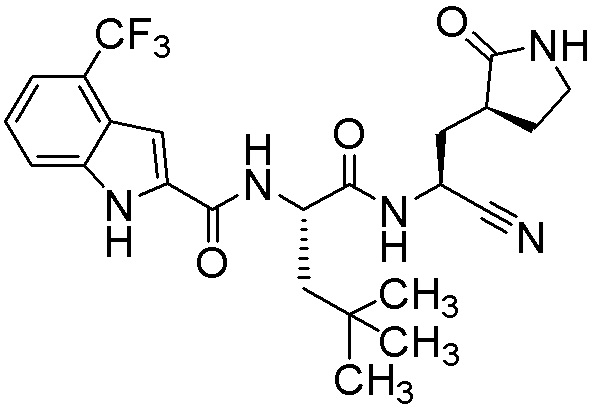
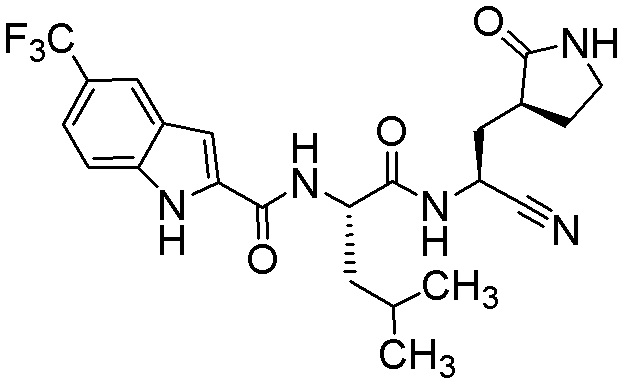
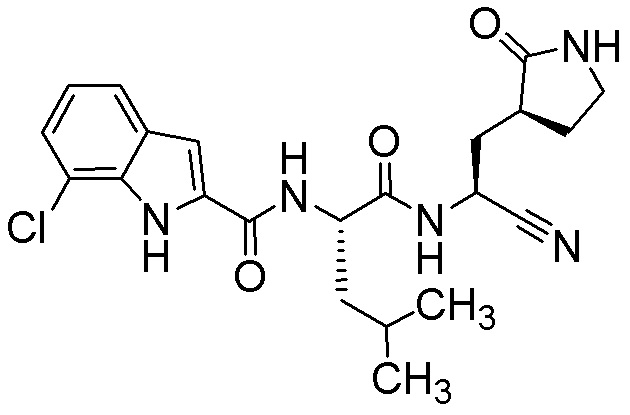
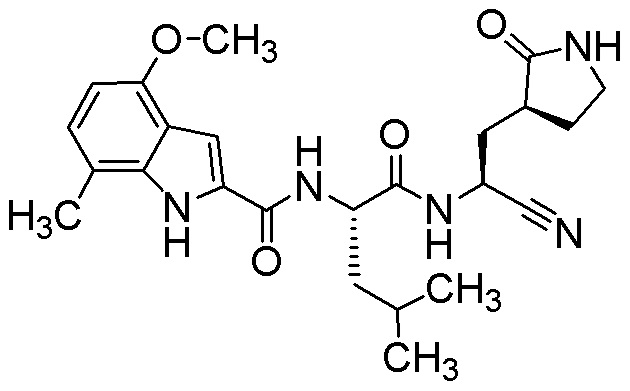
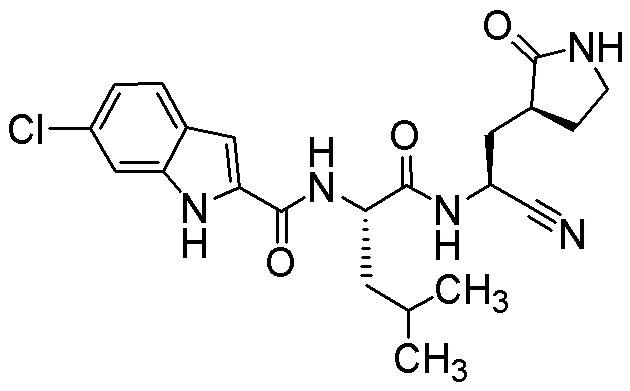
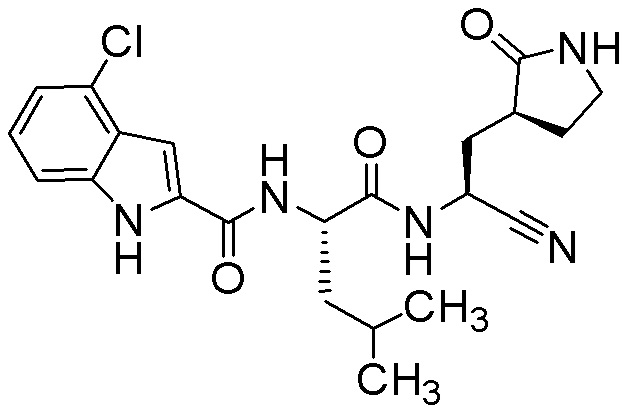
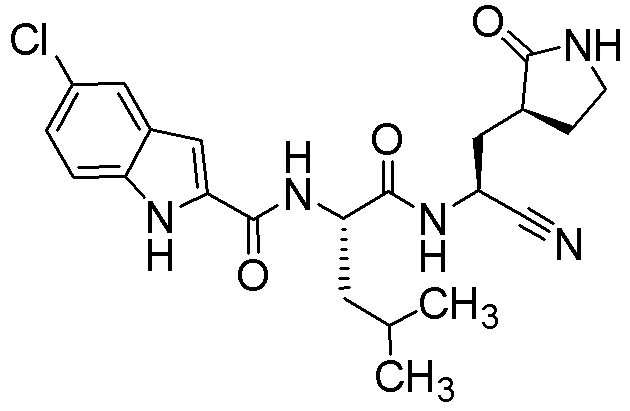
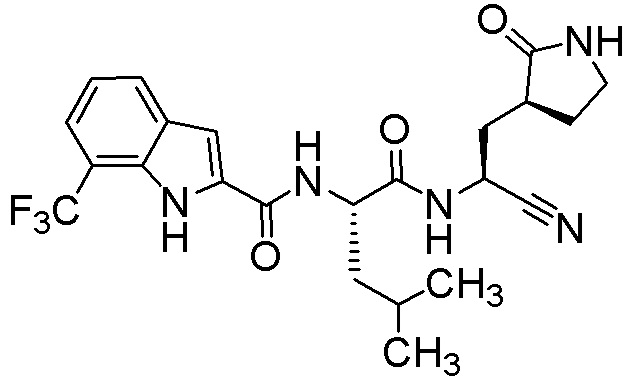
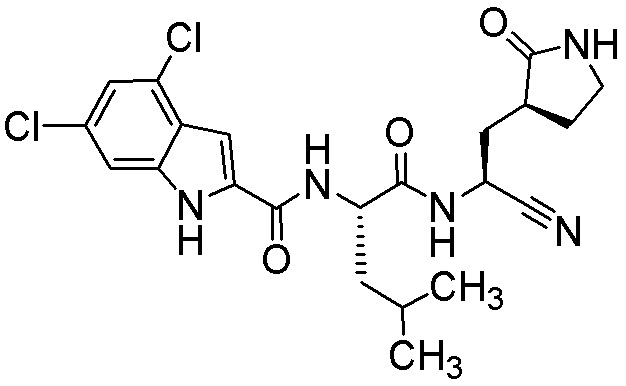
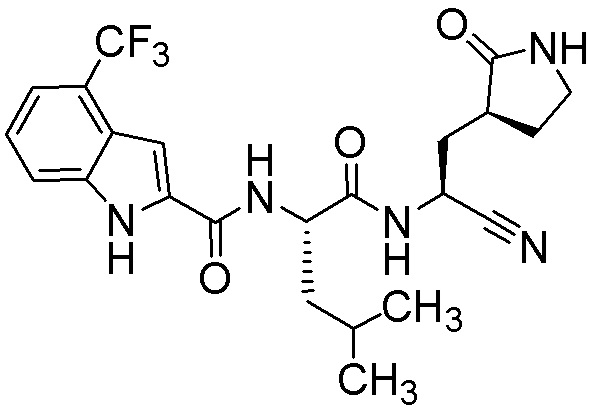
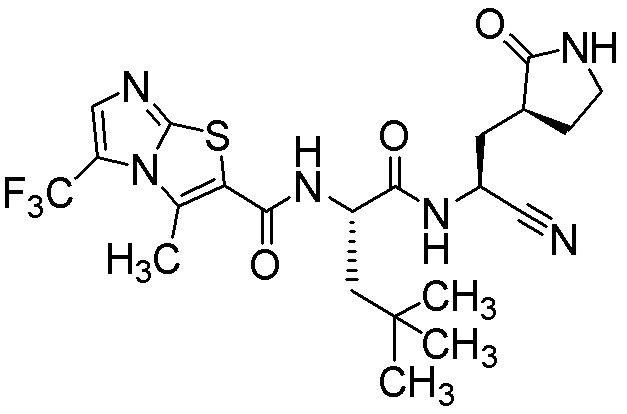
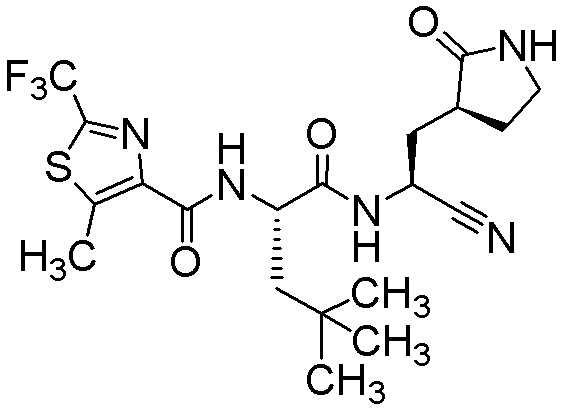
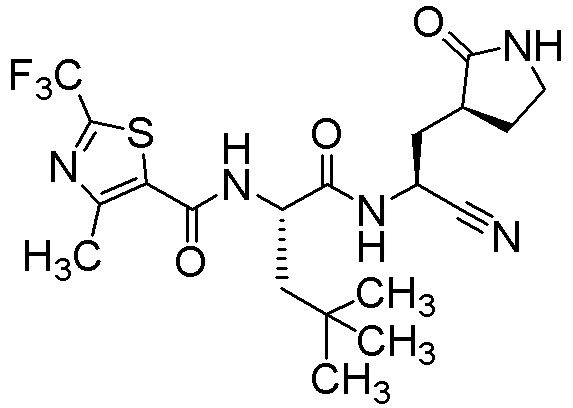
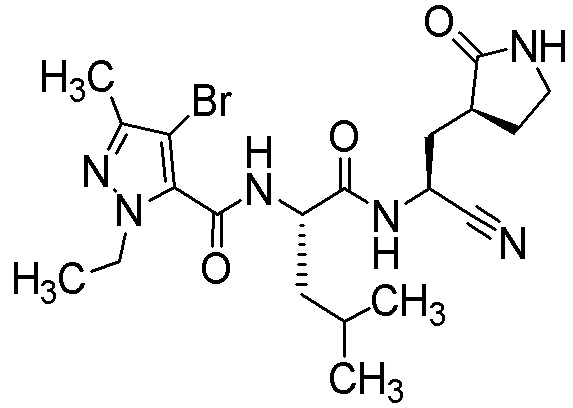
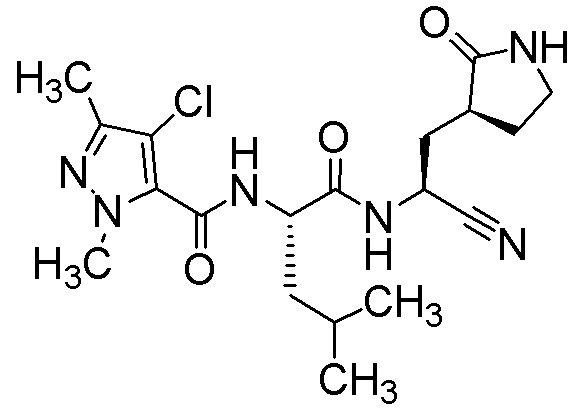
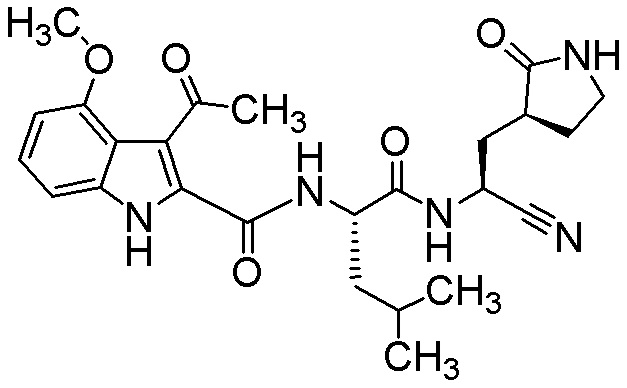
1. В этом случае, C28 лишают защиты с применением метансульфоновой кислоты, а не гидрохлорида.
2. Эпимеры примера 25 и примера 26 разделяют сверхкритической жидкостной хроматографией (Колонка: Chiral Technologies Chiralpak IB, 21×250 мм, 5 мкм; Подвижная фаза: 9:1 диоксид углерода/метанол; Обратное давление: 120 бар, Скорость потока: 75 мл/минуту). Первый элюированный диастереомер обозначают пример 25, и второй элюированный диастереомер обозначают пример 26.
3. Условия для аналитической ВЭЖХ. Колонка: Chiral Technologies Chiralpak IB, 4,6×100 мм, 5 мкм; Подвижная фаза: 85:15 диоксид углерода/метанол; Обратное давление: 120 бар; Скорость потока: 1,5 мл/минуту.
4. Условия для аналитической ВЭЖХ. Колонка: Waters Atlantis dC18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.); Градиент: 5,0% - 95% B, линейный, в течение 4,0 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 2 мл/минуту.
5. 1H ЯМР примера 30 до конечной очистки: 1H ЯМР (400 MГц, метанол-d4) δ 7,48-7,42 (м, 2H), 7,36-7,26 (м, 3H), 4,90 (дд, J=10,5, 5,7 Гц, 1H), 4,37 (дд, J=7,7, 4,9 Гц, 1H), 3,69 (с, 1H), 3,25 (ддд, J=9,9, 8,9, 2,5 Гц, 1H), 3,18 (ддд, J=9,6, 9,0, 7,1 Гц, 1H), 2,40-2,29 (м, 1H), 2,20 (с, 6H), 2,2-2,10 (м, 1H), 2,09-1,99 (м, 1H), 1,80-1,61 (м, 2H), 1,73 (дд, J=14,5, 5,0 Гц, 1H), 1,61 (дд, J=14,4, 7,8 Гц, 1H), 0,95 (с, 9H).
6. Амидное сочетание с подходящей карбоновой кислотой проводят с применением триоксида 2,4,6-триоксида 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана.
7. Пример 4 (25 мкм) инкубируют с цитохромом человека P450 3A5 (4 нмоль) в буфере на основе фосфата калия (100 мМ, pH 7,4; 40 мл), содержащем хлорид магния (3,3 мМ) и NADPH (1,3 мМ). Инкубацию проводят в течение 0,75 часов во встряхиваемой водяной бане, выдерживаемой при 37°C. Инкубацию заканчивают добавлением равного объема ацетонитрила, затем смесь вращают в центрифуге при 1700 x g в течение 5 минут, и супернатант подвергают вакуумному центрифугированию в течение приблизительно 1,5 часов. К этой смеси добавляют муравьиную кислоту (0,5 мл), ацетонитрил (0,5 мл) и воду до конечного объема 50 мл, и полученную смесь вращают в центрифуге при 40000 x g в течение 30 минут. Супернатант подвергают ВЭЖХ с обращенной фазой (Колонка: Polaris C18, 4,6×250 мм; 5 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: метанол; Градиент: 15% B в течение 5 минут, затем 15% - 35% B в течение 75 минут, затем 35% - 95% B в течение 10 минут; Скорость потока: 0,8 мл/минуту). Фракции собирают каждые 20 секунд. первый элюированный продукт, не чистый пример 33, элюируют при 54,7 минут, и пример 34 элюируют при 55,3 минут. Не чистый пример 33 повторно очищают с применением ВЭЖХ с обращенной фазой (Колонка: Phenomenex Kinetex XB-C18, 2,1×100 мм, 2,6 мкм; Подвижная фаза A: вода, содержащая 0,5% уксусной кислоты; Подвижная фаза B: 9:1 ацетонитрил/метанол; Градиент: 10% B в течение 0,5 минут, затем 10% - 35% в течение 26,5 минут, затем 35% - 60% B в течение 3 минут; Скорость потока 0,5 мл/минуту); фракции собирают каждые 15 секунд. В этой системе, пример 33 имеет время удержания 12,7 минут; дополнительный пример 34 элюируют при 13,5 минут.
8. Необходимую 4-хлор-1,3-диметил-1H-пиразол-5-карбоновая кислота может быть получена гидролизом коммерчески доступного этилового эфира.
9. Реакционную смесь разбавляют ацетонитрилом и 1% водной муравьиной кислотой до объема приблизительно 2 мл; композиция конечного растворителя такова, что смесь является прозрачной, с содержанием ацетонитрила приблизительно 20% - 30%. Компоненты этой смеси разделяют ВЭЖХ с обращенной фазой (Колонка: Phenomenex Luna C18, 10×250 мм, 10 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: ацетонитрил; Градиент: 15% B в течение 5 минут, затем 15% - 70% B в течение 70 минут, затем 70% - 95% B в течение 15 минут; Скорость потока: 2 мл/минуту); фракции собирают каждые 20 секунд. Примеры 37, 38, 39, 40, и 41 элюируют с временем удержания, данным ниже.
10. Условия для аналитической ВЭЖХ. Колонка: Phenomenex Kinetex XB-C18, 2,1×100 мм, 2,6 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: ацетонитрил; Градиент: 5% B в течение 0,5 минут, затем 5% - 70% B в течение 10,5 минут, затем 70% - 95% B в течение 2 минут; Скорость потока: 0,4 мл/мин.
11. Региохимия примера 41 не была строго определена; другими возможными структурами для этого примера являются N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-5,6-бис(трифторметил)-1H-индол-2-карбоксамид и N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-6,7-бис(трифторметил)-1H-индол-2-карбоксамид.
12. Реакционную смесь очищают с применением условий, описанных в примечании 9. Пример 42 элюируют при 58,1 минут и пример 43 элюируют при 59,2 минут.
13. Реакционную смесь разбавляют смесью ацетонитрила (0,3 мл) и 1% водной муравьиной кислоты (0,7 мл). Полученную смесь центрифугируют, и супернатант подвергают ВЭЖХ с обращенной фазой (Колонка: Phenomenex Luna C18, 10×250 мм, 10 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: ацетонитрил; Градиент: 2% - 10% B в течение 5,0 минут, затем 10% - 95% B в течение 95 минут; Скорость потока: 2 мл/минуту); фракции собирают каждые 20 секунд. Примеры 46, 47, и 48 элюируют с временем удержания, данным ниже. Пример 5 также выделяют из этой реакции, во фракциях 189-190.
14. Условия для аналитической ВЭЖХ. Колонка: Phenomenex Kinetex C18, 2,1×50 мм, 1,7 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: ацетонитрил содержащий 0,1% муравьиной кислоты; Градиент: 5% B в течение 0,5 минут, затем 5% - 50% B в течение 6,0 минут, затем 50% - 80% B в течение 1,5 минут, затем 80% - 95% B в течение 1,0 минуты; Скорость потока: 0,4 мл/мин.
15. Только указанный продукт наблюдают в этой реакции.
16. Получают исходный раствор примера 4 (5,56 мг, 12,7 мкмоль) и трифторуксусной кислоты (4 мкл, 50 мкл) в диметилсульфоксиде (420 мкл). Одну шестую этого раствора обрабатывают 1,1-дифторэтансульфинатом натрия 1,3 мг, 8,5 мкмоль), затем трет-бутилгилропероксидом (70% в воде; 1,4 мкл, 10 мкмоль) и нагревают при 50°C в течение ночи. Реакционную смесь разбавляют ацетонитрилом и 1% водной муравьиной кислотой до объема приблизительно 2-3 мл; композиция конечного растворителя такова, что смесь является прозрачной, с содержанием ацетонитрила приблизительно 20% - 30%. Компоненты этой смеси разделяют ВЭЖХ с обращенной фазой (Колонка: Phenomenex Luna C18, 10×250 мм, 10 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты; Подвижная фаза B: ацетонитрил; Градиент: 15% B в течение 5 минут, затем 15% - 40% B в течение 70 минут, затем 40% - 95% B в течение 15 минут; Скорость потока: 2 мл/минуту); фракции собирают каждые 20 секунд. Пример 74 элюируют при 68,6 минут.
Примеры 75 и 76
(2S,4R)-4-трет-Бутил-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамид и (2R,4S)-4-трет-Бутил-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамид [75 (DIAST-1) и 76 (DIAST-2)
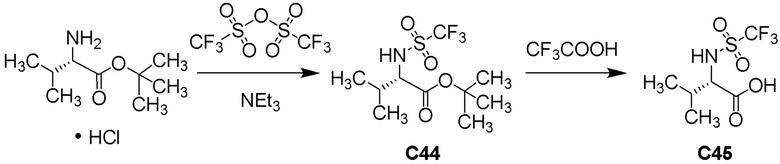
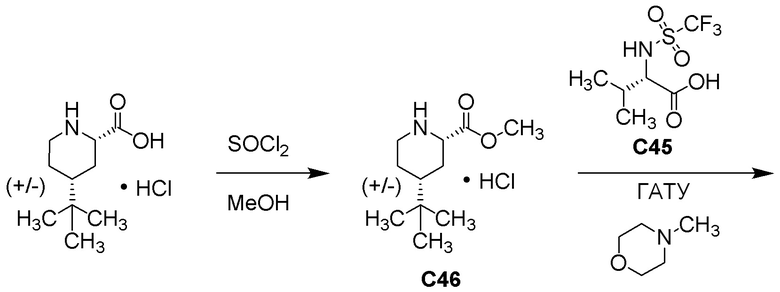
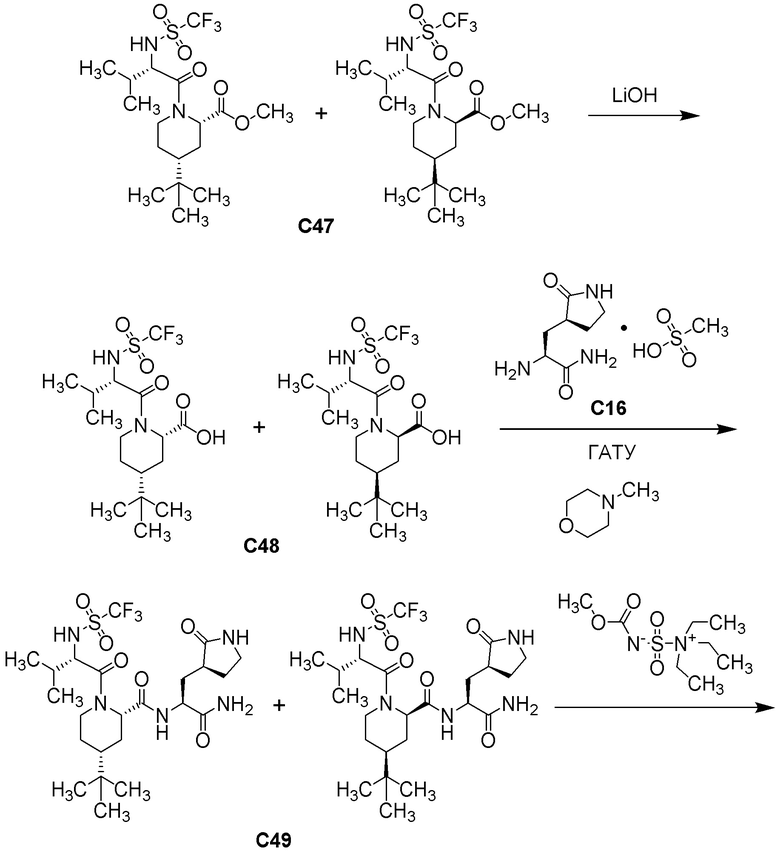
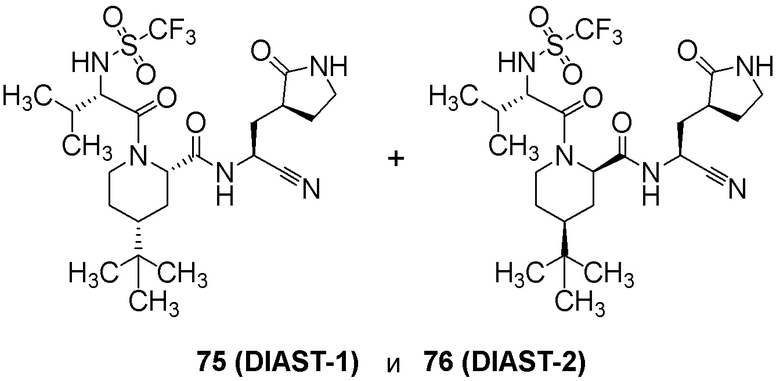
Стадия 1. Синтез трет-бутил N-[(трифторметил)сульфонил]-L-валината (C44).
Раствор трифторметансульфонового ангидрида (8,88 мл, 52,8 ммоль) в дихлорметане (10 мл) добавляют к -78°C раствору трет-бутил L-валината, гидрохлорида (10,0 г, 47,7 ммоль) и триэтиламина (18,7 мл, 134 ммоль) в дихлорметане (90 мл). Реакционную смесь перемешивают при -78°C в течение 2 часов, затем ее выливают в воду и подкисляют до pH приблизительно 4 добавлением 1 M хлористоводородной кислотой. Полученную смесь экстрагируют дихлорметаном, и органический слой промывают водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Остаток объединяют с продуктами двух аналогичных реакций, проводимых с применением трет-бутил L-валината, гидрохлорида (1,00 г, 4,77 ммоль; 1,00 г, 4,77 ммоль) и очищают хроматографией на силикагеле (градиент: 0% - 20% этилацетат в петролейном эфире) с получением C44 в виде белого твердого вещества. Объединенный выход: 14,0 г, 45,9 ммоль, 80%. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,92 (д, J=8,8 Гц, 1H), 3,68 (дд, J=8,8, 6,2 Гц, 1H), 2,16-2,02 (м, 1H), 1,43 (с, 9H), 0,92 (д, J=6,9 Гц, 3H), 0,90 (д, J=6,9 Гц, 3H).
Стадия 2. Синтез N-[(трифторметил)сульфонил]-L-валина (C45).
В раствор C44 (14,0 г, 45,9 ммоль) в дихлорметане (85 мл) добавляют трифторуксусную кислоту (85 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, затем ее концентрируют в вакууме; остаток промывают петролейным эфиром с получением C45 в виде белого твердого вещества. Выход: 10,9 г, 43,7 ммоль, 95%. МС m/z 248,0 [M-H]-. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,86 (шд, J=8,3 Гц, 1H), 3,79-3,71 (м, 1H), 2,19-2,05 (м, 1H), 0,93 (д, J=6,8 Гц, 3H), 0,90 (д, J=6,8 Гц, 3H).
Стадия 3. Синтез метил цис-4-трет-бутилпиперидин-2-карлоксилата, гидрохлорида (C46).
К 0°C раствору цис-4-трет-бутилпиперидин-2-карбоновой кислоты, гидрохлорида (см. R. T. Shuman et al., J. Org. Chem. 1990, 55, 738-741; 4,00 г, 18,0 ммоль) в метаноле (40 мл) добавляют тионилхлорид (6,44 г, 54,1 ммоль). Затем реакционную смесь перемешивают при 25°C в течение 16 часов, ее концентрируют в вакууме с получением C46 в виде беловатого твердого вещества (4,50 г). Часть этого продукта применяют на следующей стадии. ЖХМС m/z 200,0 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,46 (шс, 1H), 9,09 (шс, 1H), 4,11-3,96 (м, 1H), 3,76 (с, 3H), 3,4-3,21 (м, 1H, предполагаемый; значительно закрыт пиком воды), 2,93-2,77 (м, 1H), 2,07 (шд, J=10,8 Гц, 1H), 1,75 (шд, J=10,6 Гц, 1H), 1,51-1,32 (м, 3H), 0,84 (с, 9H).
Стадия 4. Синтез метил (2S,4R)-4-трет-бутил-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карлоксилата и метил (2R,4S)-4-трет-бутил-1-{N-[(трифторметил) сульфонил]-L-валил}пиперидин-2-карлоксилата (C47).
К 25°C смеси C45 (300 мг, 1,20 ммоль) и C46 (с предыдущей стадии; 341 мг, ≤1,36 ммоль) в N, N-диметилформамиде (3 мл) добавляют 4-метилморфолин (365 мг, 3,61 ммоль). Полученную смесь охлаждают до 0°C и обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 549 мг, 1,44 ммоль). Затем реакционную смесь продувают азотом в течение 1 минуты, ее перемешивают при 25°C в течение 12 часов. ЖХМС анализ в этой точке показывает присутствие C47: ЖХМС m/z 431,1 [M+H]+. Реакционную смесь разделяют между этилацетатом (20 мл) и водой (20 мл), и водный слой экстрагируют этилацетатом (20 мл). Объединенные органические слои промывают насыщенным водным раствором хлорида натрия (4×20 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (градиент: 0% - 20% этилацетат в петролейном эфире) с получением C47 в виде желтой камеди. 1H ЯМР анализ подтвердил, что продукт содержит смесь диастереомеров. Выход: 320 мг, 0,743 ммоль, 62%. 1H ЯМР (400 MГц, хлороформ-d) δ 6,12-5,94 (м, 1H), [4,51 (дд, J=11,7, 6,3 Гц) и 4,32-4,18 (м), всего 2H], [3,73 (с) и 3,71 (с), всего 3H], [3,63-3,49 (м) и 3,48-3,39 (м), всего 2H], 2,18-1,93 (м, 2H), 1,91-1,77 (м, 1H), 1,63-1,37 (м, 2H), 1,37-1,22 (м, 1H), 1,13-1,04 (м, 3H), [0,94 (д, J=6,8 Гц) и 0,91 (д, J=6,8 Гц), всего 3H], 0,87 (с, 9H).
Стадия 5. Синтез (2S,4R)-4-трет-бутил-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоновой кислоты и (2R,4S)-4-трет-бутил-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоновой кислоты (C48).
Раствор C47 (314 мг, 0,729 ммоль) в смеси метанола (2 мл) и тетрагидрофурана (2 мл) обрабатывают раствором моногидрата гидроксида лития (91,8 мг, 2,19 ммоль) в воде (1,4 мл) и реакционную смесь перемешивают при 25°C в течение 3 часов. После удаления растворителя в вакууме остаток разбавляют водой (10 мл) и подкисляют до pH приблизительно 1 добавлением 1 M хлористоводородной кислоты. Полученную смесь экстрагируют этилацетатом (2×20 мл), и объединенные органические слои промывают насыщенным водным раствором хлорида натрия (15 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме, с получением C48 в виде желтого стекла. 1H ЯМР анализ подтвердил, что продукт содержит смесь диастереомеров. Выход: 304 мг, количественный. 1H ЯМР (400 MГц, ДМСО-d6) δ [9,82 (д, J=8,7 Гц) и 9,69 (шд, J=8,8 Гц), всего 1H], [4,28 (дд, J=11,5, 6,4 Гц), 4,24-4,14 (м), и 4,05-3,96 (м), всего 2H], [3,80-3,69 (м) и 3,6-3,2 (м, предполагаемый; по существу закрыт пиком воды), всего 2H], 2,06-1,90 (м, 2H), 1,80-1,65 (м, 1H), 1,41-1,17 (м, 3H), [0,96 (д, J=6,8 Гц) и 0,93 (д, J=6,5 Гц), всего 3H], [0,89 (д, J=6,9 Гц) и 0,86-0,80 (м), всего 12H].
Стадия 6. Синтез (2S,4R)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-4-трет-бутил-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамида и (2R,4S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-4-трет-бутил-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамида (C49).
К 25°C смеси C16 (120 мг, 0,449 ммоль) и C48 (144 мг, 0,346 ммоль) в N, N-диметилформамиде (3 мл) добавляют 4-метилморфолин (100 мг, 0,989 ммоль), затем смесь охлаждают до 0°C и обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 151 мг, 0,397 ммоль). Реакционную смесь продувают азотом в течение 1 минуты и затем перемешивают при 25°C в течение 12 часов. ЖХМС анализ показывает присутствие C49: ЖХМС m/z 570,3 [M+H]+. Реакционную смесь затем разделяют между этилацетатом (20 мл) и водой (20 мл), и водный слой насыщают твердым хлоридом натрия и экстрагируют этилацетатом (5×20 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и подвергают хроматографии на силикагеле (градиент: 0% - 15% метанол в дихлорметане), с получением C49 в виде белого твердого вещества. Этот продукт содержит смесь диастереомеров, по анализу 1H ЯМР. Выход: 190 мг, 0,334 ммоль, 96%. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики, интеграции являются приблизительными: δ [9,88 (д, J=8,6 Гц) и 9,82-9,68 (м), всего 1H], [8,12 (д, J=8,8 Гц) и 8,09-7,98 (м), всего 1H], [7,63 (с) и 7,57 (с), всего 1H], [7,30 (шс) и 7,18 (шс), всего 1H], [7,06 (шс) и 7,03 (шс), всего 1H], [4,36 (дд, J=12,0, 6,1 Гц) и 4,32-4,08 (м), всего 2H], 2,26-2,05 (м, 2H), 1,81-1,54 (м, 2H), 1,53-1,30 (м, 2H), 0,98-0,87 (м, 6H), 0,86-0,76 (м, 9H).
Стадия 7. Синтез (2S,4R)-4-трет-бутил-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамида и (2R,4S)-4-трет-бутил-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамида [75 (DIAST-1) и 76 (DIAST-2)].
Смесь C49 (190,0 мг, 0,334 ммоль) и метил N-(триэтиламмониосульфонил)карбамата, внутреннюю соль (реагент Бурджеса; 238 мг, 1,00 ммоль) в дихлорметане (10 мл) перемешивают при 25°C в течение 2 дней, затем реакционную смесь разбавляют водой (20 мл) и экстрагируют дихлорметаном (2×20 мл). Объединенные органические слои промывают насыщенным водным раствором хлорида натрия (10 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (градиент: 0% - 8% метанол в дихлорметане) дает белое твердое вещество, которое согласно ЖХМС анализу содержит приблизительно 3:1 смесь продуктов: ЖХМС m/z 552,2 [M+H]+ и ЖХМС m/z 552,2 [M+H]+. Эти диастереомеры разделяют сверхкритической жидкостной хроматографией [Колонка: Chiral Technologies Chiralpak IG, 30×250 мм, 10 мкм; Подвижная фаза: 3:1 диоксид углерода/(этанол, содержащий 0,1% гидроксид аммония); скорость потока: 70 мл/минуту]. Первый элюированный диастереомер, выделенный в виде белого твердого вещества, обозначают как 75, и второй элюированный диастереомер, также белое твердое вещество, обозначают как 76 [(2S,4R)-4-трет-бутил-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамид и (2R,4S)-4-трет-бутил-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамид].
75 - Выход: 26,2 мг, 47,5 мкмоль, 14%. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,87 (д, J=8,8 Гц, 1H), 8,87 (д, J=8,4 Гц, 1H), 7,70 (с, 1H), 4,99-4,91 (м, 1H), 4,24 (дд, J=12,3, 6,0 Гц, 1H), 4,18 (дд, J=8,3, 8,3 Гц, 1H), 3,88-3,78 (м, 1H), 3,19-3,00 (м, 2H), 2,46-2,35 (м, 1H), 2,17-2,02 (м, 2H), 1,99-1,85 (м, 2H), 1,79-1,62 (м, 3H), 1,50-1,36 (м, 2H), 1,26-1,12 (м, 2H), 0,97-0,87 (м, 6H), 0,84 (с, 9H). Время удержания: 1,30 минут (Аналитические условия. Колонка: Chiral Technologies Chiralpak IG-3, 4,6×50 мм, 3 мкм; Подвижная фаза A: диоксид углерода; Подвижная фаза B: этанол содержащий 0,05% диэтиламин; градиент: 5% - 40% B в течение 2 минут, затем 40% B в течение 1,2 минут; Скорость потока: 4 мл/минуту; Обратное давление: 1500 ф./кв.д.).
76 - Выход: 8,8 мг, 16 мкмоль, 5%. ЖХМС m/z 552,3 [M+H]+. By 1H ЯМР анализ, этот образец 76 содержит примеси. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики, интеграции являются приблизительными: δ 9,76 (д, J=8,8 Гц, 1H), 8,59 (д, J=8,1 Гц, 1H), 7,72 (с, 1H), 5,02-4,90 (м, 1H), 0,94-0,86 (м, 6H), 0,82 (с, 9H). Время удержания: 1,61 минут (Аналитические условия идентичны тем, которые используют для 75).
Пример 77
3-Метил-N-(трифторацетил)-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил] этил}-4-(трифторметил)-L-пролинамид (77)
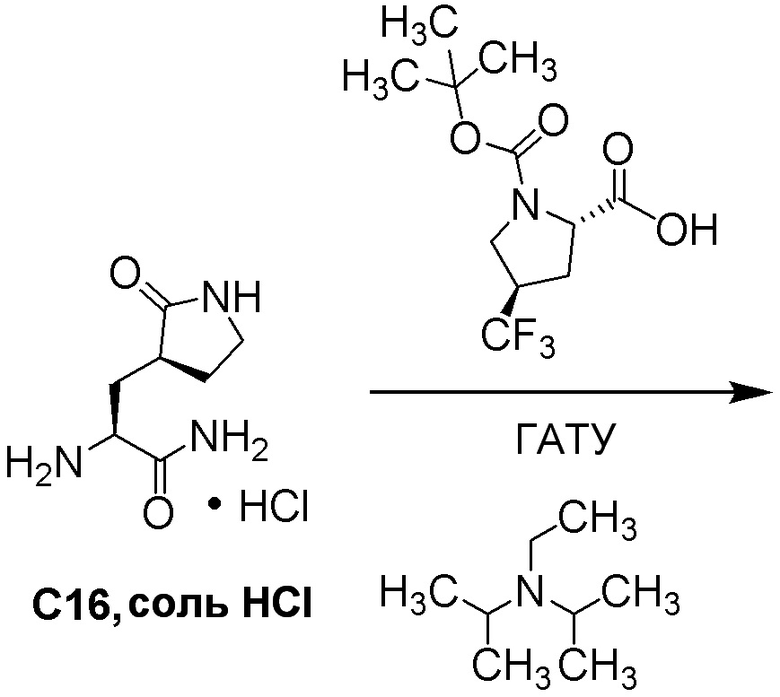
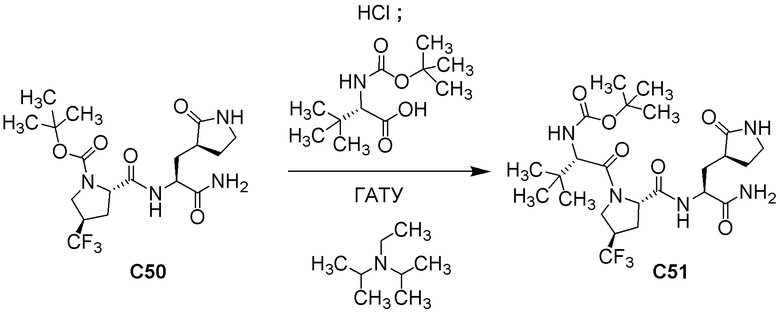
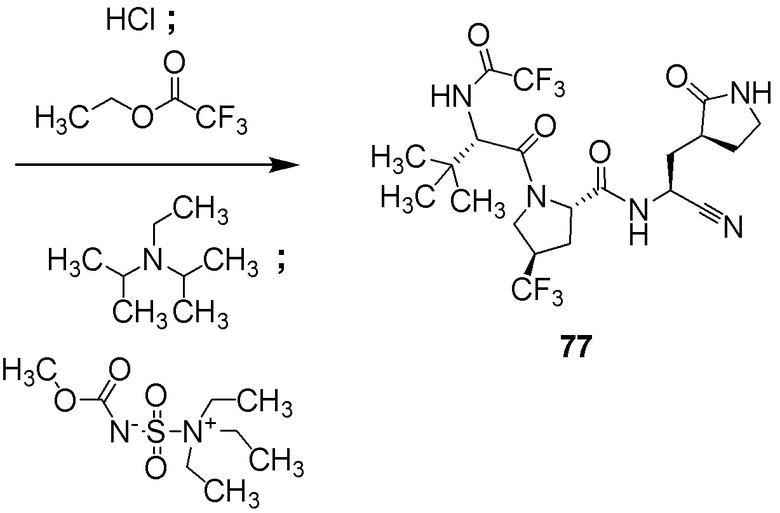
Стадия 1. Синтез (4R)-1-(трет-бутоксикарбонил)-4-(трифторметил)-L-пролил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C50).
К -30°C смеси (4R)-1-(трет-бутоксикарбонил)-4-(трифторметил)-L-пролина (429 мг, 1,51 ммоль) и C16, соли HCl (346 мг, 1,67 ммоль) в N, N-диметилформамиде (7,8 мл) добавляют N, N-диизопропилэтиламин (0,791 мл, 4,54 ммоль), затем гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 633 мг, 1,66 ммоль). Реакционную смесь нагревают до 0°C в течение 1 часа, затем ее разбавляют водным раствором бикарбоната натрия (30 мл) и экстрагируют смесью 2-бутанола и дихлорметана (9:1, 3×7 мл). Объединенные органические слои концентрируют в вакууме и очищают хроматографией на силикагеле (Градиент: 0% - 100% метанол в дихлорметане), с получением C50 в виде беловатой пены. Согласно 1H ЯМР анализу, этот продукт существует в виде спеси ротамеров, и содержит примеси, полученные из применяемых реагентов; часть этого образца переносят на следующую стадию. Выход: 613 мг, 1,40 ммоль, 93%. ЖХМС m/z 459,3 [M+Na+]. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики продукта только: δ 8,33-8,18 (м, 1H), [7,65 (шс) и 7,59 (шс), всего 1H], [7,39 (шс) и 7,27 ш (с), всего 1H], 7,05 (шс, 1H), 4,38-4,28 (м, 1H), 4,28-4,17 (м, 1H), 3,46-3,36 (м, 1H), 2,02-1,89 (м, 1H), 1,80-1,45 (м, 2H), [1,39 (с) и 1,32 (с), всего 9H].
Стадия 2. Синтез N-(трет-бутоксикарбонил)-3-метил-L-валил-(4R)-4-(трифторметил)-L-пролил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C51).
Смесь C50 (242 мг, 0,554 ммоль) и раствор гидрохлорида в 1,4-диоксане (4 M; 2 мл, 8 ммоль) перемешивают при комнатной температуре в течение 5 минут, затем реакционную смесь концентрируют в вакууме для удаления растворителя и остаточного гидрохлорида. Полученный продукт со снятой защитой объединяют с N-(трет-бутоксикарбонил)-3-метил-L-валином (128 мг, 0,553 ммоль) и гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ: 232 мг, 0,610 ммоль) в N, N-диметилформамиде (2 мл), и затем охлаждают до -30°C. N, N-диизопропилэтиламин (0,290 мл, 1,66 ммоль) добавляют, и реакционную смесь нагревают до 0°C в течение 1 часа. После добавления водного раствора бикарбоната натрия, полученную смесь экстрагируют три раза этилацетатом; объединенные органические слои концентрируют в вакууме и очищают хроматографией на силикагеле (градиент: 0% - 30% метанол в дихлорметане), с получением C51 в виде твердого вещества. Выход: 230 мг, 0,418 ммоль, 75%. ЖХМС m/z 550,3 [M+H]+.
Стадия 3. Синтез 3-метил-N-(трифторацетил)-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамида (77).
Смесь C51 (230 мг, 0,418 ммоль) и раствор гидрохлорида в 1,4-диоксане (4 M; 2 мл, 8 ммоль) перемешивают при комнатной температуре в течение 5 минут, затем реакционную смесь концентрируют в вакууме для удаления растворителя и остаточного гидрохлорида. Полученный продукт со снятой защитой объединяют с этилтрифторацетатом (595 мг, 4,19 ммоль) и N, N-диизопропилэтиламином (0,219 мл, 1,26 ммоль) в метаноле (1,0 мл). Затем реакционную смесь перемешивают при комнатной температуре в течение 30 минут, снова добавляют этилтрифторацетат (60 мг, 0,422 ммоль) и перемешивание продолжают в течение 30 минут. Водный раствор бикарбоната натрия затем добавляют, и полученную смесь экстрагируют три раза этилацетатом. Объединенные органические слои сушат над сульфатом магния, фильтруют, концентрируют в вакууме и растворяют в дихлорметане (3 мл). Туда добавляют этил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 299 мг, 1,25 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 2 часов, затем ее обрабатывают дополнительным метил N-(триэтиламмониосульфонил)карбаматом, внутренней солью (реагентом Бурджеса; 100 мг, 0,420 ммоль) и перемешивают в течение еще 30 минут. Хатем добавляют разбавленный водный раствор карбоната натрия, и смесь экстрагируют дважды этилацетатом; объединенные органические слои сушат над сульфатом магния, фильтруют, и концентрируют в вакууме. Очистка сверхкритической жидкостной хроматографией (Колонка: Princeton Dinitrophenyl, 10×250 мм, 5 мкм; Подвижная фаза: 9:1 диоксид углерода/метанол; Обратное давление: 120 бар; Скорость потока: 80 мл/минуту) дает продукт, который затем суспендируют в гептане (2,0 мл) при 50°C в течение 2 часов, охлаждают до комнатной температуры и собирают фильтрацией, с получением 3-метил-N-(трифторацетил)-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамида (77) в виде твердого вещества. Выход: 64 мг, 0,121 ммоль, 29%. ЖХМС m/z 528,2 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,46 (д, J=8,4 Гц, 1H), 9,05 (д, J=8,6 Гц, 1H), 7,67 (с, 1H), 4,96 (ддд, J=11,0, 8,5, 5,0 Гц, 1H), 4,56 (д, J=8,5 Гц, 1H), 4,37 (дд, J=7,5, 7,5 Гц, 1H), 3,98 (дд, компонент системы АВХ, J=11,2, 7,5 Гц, 1H), 3,92 (дд, компонент системы АВХ, J=11,3, 4,8 Гц, 1H), 3,46-3,35 (м, 1H), 3,19-3,10 (м, 1H), 3,09-3,00 (м, 1H), 2,5-2,38 (м, 1H, предполагаемый; частично закрыт пиком растворителя), 2,38-2,28 (м, 1H), 2,21-2,04 (м, 3H), 1,78-1,65 (м, 2H), 0,99 (с, 9H).
Пример 78
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(метилкарбамоил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (78)
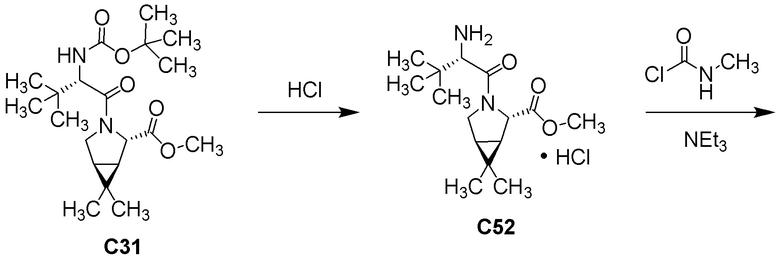
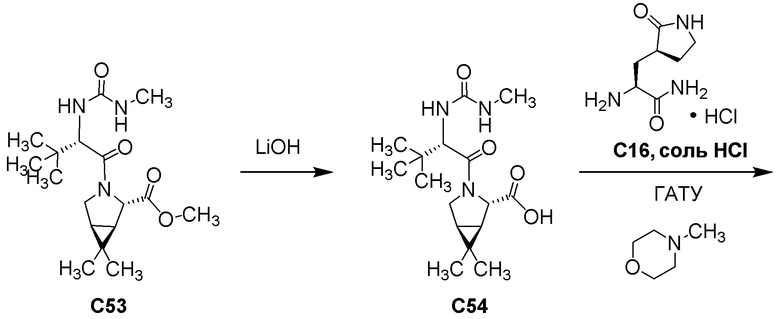
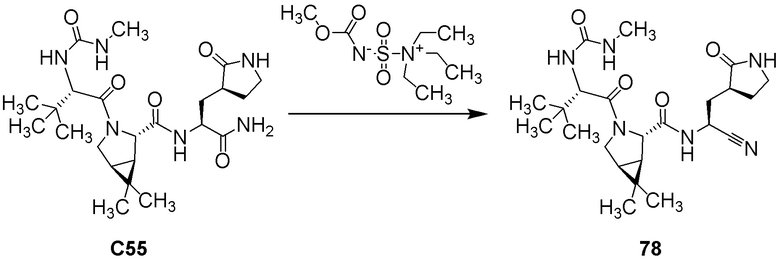
Стадия 1. Синтез метил (1R,2S,5S)-6,6-диметил-3-(3-метил-L-валил)-3-азабицикло[3,1,0]гексан-2-карлоксилата, гидрохлорида (C52).
К 0°C раствору C31 (1,00 г, 2,61 ммоль) в дихлорметане (20 мл) добавляют, по каплям, раствор гидрохлорида в этилацетате (4 M; 20 мл, 80 ммоль). Затем реакционную смесь перемешивают при 25°C в течение ночи, ее концентрируют в вакууме с получением C52 в виде белой камеди. Выход: 700 мг, 2,20 ммоль, 84%. ЖХМС m/z 283,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,22 (шс, 3H), 4,25 (с, 1H), 3,87-3,77 (м, 2H), 3,72 (д, половина АВ квартета, J=10,8 Гц, 1H), 3,67 (с, 3H), 1,59 (дд, компонент системы АВХ, J=7,7, 5,3 Гц, 1H), 1,49 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,03 (с, 9H), 1,02 (с, 3H), 0,96 (с, 3H).
Стадия 2. Синтез метил (1R,2S,5S)-6,6-диметил-3-[3-метил-N-(метилкарбамоил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карлоксилата (C53).
К 0°C раствору C52 (320 мг, 1,00 ммоль) в дихлорметане (6 мл) медленно добавляют триэтиламин (0,769 мл, 5,52 ммоль) и метилкарбамилхлорид (188 мг, 2,01 ммоль). Реакционную смесь нагревают до 20°C и перемешивают в течение 18 часов, затем ее обрабатывают по каплям насыщенным водным раствором карбоната натрия (5 мл) и экстрагируют дихлорметаном (2×5 мл). Объединенные органические слои промывают насыщенным водным раствором хлорида натрия (2×20 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (Градиент: 0% - 10% метанол в дихлорметане) с получением C53 в виде светло-желтой камеди. Выход: 190 мг, 0,560 ммоль, 56%. ЖХМС m/z 339,9 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 6,03 (д, J=9,4 Гц, 1H), 5,89 (шкв, J=5 Гц, 1H), 4,20-4,14 (м, 2H), 3,91 (д, половина АВ квартета, J=10,3 Гц, 1H), 3,79 (дд, компонент системы АВХ, J=10,3, 5,3 Гц, 1H), 3,65 (с, 3H), 3,17 (д, J=5,3 Гц, 3H), 1,55-1,49 (м, 1H), 1,40 (д, половина АВ квартета, J=7,4 Гц, 1H), 1,00 (с, 3H), 0,92 (с, 9H), 0,83 (с, 3H).
Стадия 3. Синтез (1R,2S,5S)-6,6-диметил-3-[3-метил-N-(метилкарбамоил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C54).
К 0°C раствору C53 (190 мг, 0,560 ммоль) в смеси тетрагидрофурана (2 мл), воды (4 мл) и метанола (1 мл) добавляют моногидрат гидроксида лития (82,0 мг, 1,95 ммоль). Затем реакционную смесь перемешивают при 20°C в течение 2 часов, ее разбавляют этилацетатом (10 мл); водный слой затем охлаждают до 0°C - 5°C и подкисляют до pH 2-3 добавлением 1 M хлористоводородной кислоты. Водную смесь экстрагируют этилацетатом (3×15 мл), и эти объединенные слои этилацетата сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме с получением C54 в виде белого твердого вещества. Выход: 120 мг, 0,369 ммоль, 66%. ЖХМС m/z 348,3 [M+Na+]. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ 6,04 (д, J=9,6 Гц, 1H), 5,89 (д, J=4,7 Гц, 1H), 4,17 (д, J=9,6 Гц, 1H), 4,09 (с, 1H), 3,87 (д, половина АВ квартета, J=10,4 Гц, 1H), 3,77 (дд, компонент системы АВХ, J=10,3, 5,4 Гц, 1H), 1,49 (дд, компонент системы АВХ, J=7,6, 5,1 Гц, 1H), 1,38 (д, половина АВ квартета, J=7,5 Гц, 1H), 1,00 (с, 3H), 0,92 (с, 9H), 0,82 (с, 3H).
Стадия 4. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-[3-метил-N-(метилкарбамоил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (C55).
К 0°C - 5°C раствору C54 (120 мг, 0,369 ммоль) и C16, соли HCl (75%, 107 мг, 0,387 ммоль) в N, N-диметилформамиде (3,0 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 154 мг, 0,405 ммоль) и 4-метилморфолин (0,144 мл, 1,31 ммоль). Затем реакционную смесь нагревают от 0°C до 20°C в течение 1,5 часов, ее перемешивают при 20°C в течение 18 часов, затем ее разбавляют водой и обрабатывают твердым сульфатом натрия до насыщения. Полученную смесь экстрагируют смесью 2-пропанола и хлороформа (1:4, 3×20 мл), и объединенные органические слои сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Хроматография на силикагеле (градиент: 0% - 20% метанол в дихлорметане) дает C55 (240 мг) в виде бесцветного стекла. Часть этого продукта применяют на следующей стадии. ЖХМС m/z 479,2 [M+H]+. Согласно 1H ЯМР анализу, этот продукт загрязнен побочным продуктом, полученным из реагента ГАТУ. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики продукта только: δ 8,21 (д, J=8,7 Гц, 1H), 7,53 (шс, 1H), 7,29 (шс, 1H), 7,03 (шс, 1H), 6,02 (д, J=9,6 Гц, 1H), 5,86 (кв, J=4,6 Гц, 1H), 4,31-4,23 (м, 1H), 4,21 (с, 1H), 4,15 (д, J=9,6 Гц, 1H), 2,18-2,08 (м, 1H), 1,98-1,88 (м, 1H), 1,68-1,55 (м, 1H), 1,54-1,42 (м, 2H), 1,34 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,01 (с, 3H), 0,90 (с, 9H), 0,84 (с, 3H).
Стадия 5. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(метилкарбамоил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (78).
В раствор C55 (с предыдущей стадии; 190 мг, ≤0,292 ммоль) в ацетонитриле (12 мл) добавляют метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 303 мг, 1,26 ммоль). Реакционную смесь перемешивают при 20°C в течение 22 часов, затем ее объединяют с аналогичной реакцией, проводимой с применением C55 (с предыдущей стадии; 50 мг, ≤77 мкмоль). Полученный раствор концентрируют в вакууме, разбавляют водой (10 мл) и экстрагируют этилацетатом (3×10 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме; очистка ВЭЖХ с обращенной фазой (Колонка: Boston Prime C18, 30×150 мм, 5 мкм; Подвижная фаза A: 0,225% муравьиной кислоты в воде; Подвижная фаза B: ацетонитрил; Градиент: 23% - 46% B; Скорость потока: 25 мл/минуту) дает (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(метилкарбамоил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (78) в виде белого твердого вещества. Объединенный выход: 25 мг, 54 мкмоль, 15% за 2 стадии. ЖХМС m/z 461,2 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ 8,96 (д, J=8,6 Гц, 1H), 7,65 (с, 1H), 6,02 (д, J=9,5 Гц, 1H), 5,85 (кв, J=4,5 Гц, 1H), 4,95 (ддд, J=10,8, 8,4, 5,1 Гц, 1H), 4,13 (д, J=9,6 Гц, 1H), 4,11 (с, 1H), 3,88-3,79 (м, 2H), 3,18-3,09 (м, 1H), 3,07-2,98 (м, 1H), 2,48-2,37 (м, 1H), 2,20-2,02 (м, 2H), 1,77-1,62 (м, 2H), 1,56-1,50 (м, 1H), 1,27 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,02 (с, 3H), 0,89 (с, 9H), 0,85 (с, 3H). 1H ЯМР (400 MГц, хлороформ-d), характеристические пики: δ 8,12 (д, J=7,6 Гц, 1H), 5,78 (шс, 1H), 5,04 (шд, J=9,4 Гц, 1H), 4,99-4,90 (м, 1H), 4,57-4,49 (м, 1H), 4,39 (д, J=9,7 Гц, 1H), 4,25 (с, 1H), 4,01 (д, половина АВ квартета, J=10,2 Гц, 1H), 3,93 (шдд, компонент системы АВХ, J=10,6, 4,9 Гц, 1H), 3,43-3,25 (м, 2H), 2,71 (д, J=4,8 Гц, 3H), 2,61-2,50 (м, 1H), 2,45-2,30 (м, 2H), 2,03-1,93 (м, 1H), 1,91-1,78 (м, 1H), 1,05 (с, 3H), 0,98 (с, 9H), 0,91 (с, 3H).
Пример 79
Метил {(2S)-1-[(1R,2S,5S)-2-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-3,3-диметил-1-оксобутан-2-ил}карбамат (79)
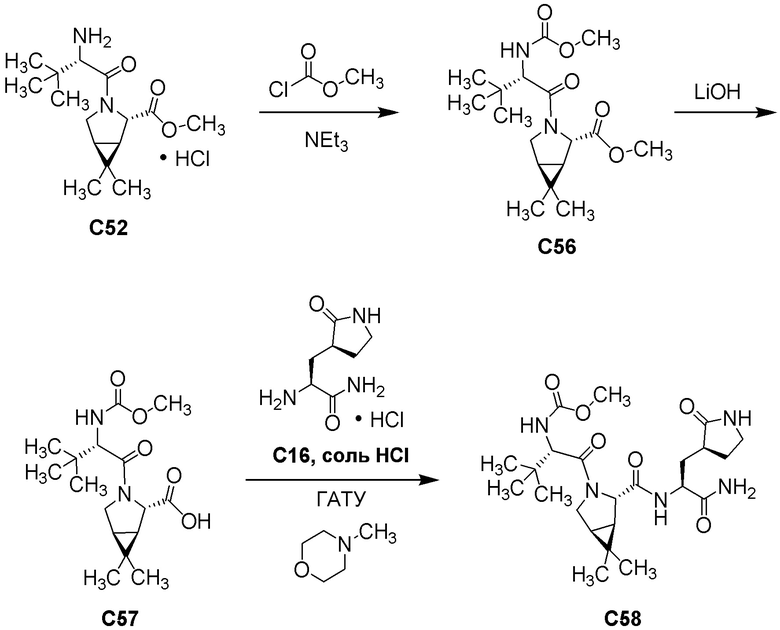
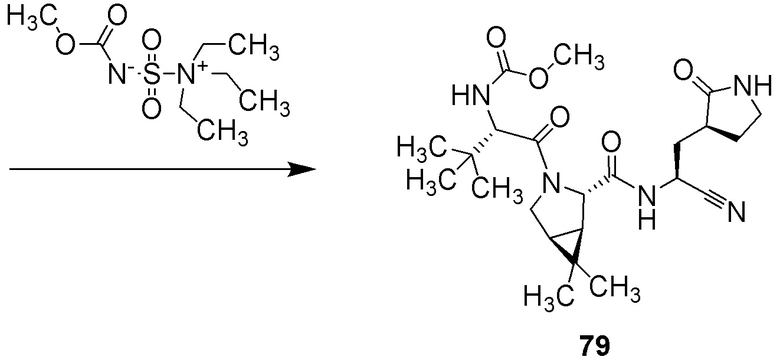
Стадия 1. Синтез метил (1R,2S,5S)-3-[N-(метоксикарбонил)-3-метил-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата (C56).
К 0°C раствору C52 (370 мг, 1,16 ммоль) в дихлорметане (6 мл) медленно добавляют триэтиламин (0,647 мл, 4,64 ммоль) и метил хлорформиат (335 мг, 3,55 ммоль). затем реакционную смесь перемешивают при 20°C в течение 16 часов, ее разбавляют по каплям насыщенным водным раствором карбоната натрия (5 мл) и экстрагируют дихлорметаном (2×20 мл). Объединенные органические слои промывают насыщенным водным раствором хлорида натрия (2×20 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме; хроматография на силикагеле (градиент: 0% - 100% этилацетат в петролейном эфире) дает C56 в виде белой камеди. Выход: 115 мг, 0,338 ммоль, 29%. ЖХМС m/z 341,1 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 5,29 (шд, J=9,6 Гц, 1H), 4,46 (с, 1H), 4,23 (д, J=9,9 Гц, 1H), 3,94-3,86 (м, 2H), 3,74 (с, 3H), 3,63 (шс, 3H), 1,49-1,41 (м, 2H), 1,04 (с, 3H), 1,03 (с, 9H), 0,91 (с, 3H).
Стадия 2. Синтез (1R,2S,5S)-3-[N-(метоксикарбонил)-3-метил-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C57).
В раствор C56 (115 мг, 0,338 ммоль) в смеси метанола (2,0 мл), тетрагидрофурана (2,0 мл), и воды (2 мл) добавляют моногидрат гидроксида лития (28,4 мг, 0,677 ммоль). Реакционную смесь перемешивают при комнатной температуре (22°C - 25°C) в течение 16 часов, затем концентрируют в вакууме. Водный остаток разделяют между водой (5 мл) и этилацетатом (20 мл), затем органический слой отбрасывают, и водный слой доводят до pH 1-2 добавлением концентрированной хлористоводородной кислоты. Полученную смесь экстрагируют три раза этилацетатом; объединенные органические слои сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме с получением C57 в виде бесцветной камеди. Выход: 100 мг, 0,306 ммоль, 91%. ЖХМС m/z 327,2 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 5,42 (д, J=9,9 Гц, 1H), 4,46 (с, 1H), 4,26 (д, J=10,0 Гц, 1H), 3,96 (д, половина АВ квартета, J=10,5 Гц, 1H), 3,87 (дд, компонент системы АВХ, J=10,3, 5,4 Гц, 1H), 3,64 (с, 3H), 1,68 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,50 (дд, компонент системы АВХ, J=7,6, 5,3 Гц, 1H), 1,06 (с, 3H), 1,01 (с, 9H), 0,91 (с, 3H).
Стадия 3. Синтез метил {(2S)-1-[(1R,2S,5S)-2-({(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-3,3-диметил-1-оксобутан-2-ил}карбамата (C58).
К 0°C раствору C57 (100 мг, 0,306 ммоль) и C16, соли HCl (75%, 84,8 мг, 0,306 ммоль) в N, N-диметилформамиде (3 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 140 мг, 0,368 ммоль), затем по каплям добавляют раствор 4-метилморфолина (93 мг, 0,919 ммоль) в N, N-диметилформамиде (1 мл). Реакционную смесь затем нагревают до комнатной температуры (25°C) и перемешивают в течение 16 часов, затем добавляют воду (10 мл). После добавления сульфата натрия до насыщения, полученную смесь экстрагируют смесью хлороформа и 2-пропанола (4:1, 3×10 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и очищают с применением хроматографии на силикагеле (Градиент: 0% - 30% метанол в дихлорметане), с получением C58 в виде белого твердого вещества. Выход: 93 мг, 0,19 ммоль, 62%. ЖХМС m/z 480,0 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 8,30 (шс, 1H), 7,18 (шс, 1H), 5,98 (шс, 1H), 5,64 (шс, 1H), 5,58-5,42 (м, 1H), 4,49-4,37 (м, 1H), 4,29 (д, J=10,0 Гц, 1H), 4,23 (с, 1H), 4,11 (дд, компонент системы АВХ, J=10,3, 5,5 Гц, 1H), 3,93 (д, половина АВ квартета, J=10,3 Гц, 1H), 3,64 (с, 3H), 3,43-3,29 (м, 2H), 2,55-2,33 (м, 2H), 2,15-1,81 (м, 3H), 1,54-1,47 (м, 1H), 1,45 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,03 (с, 3H), 1,01 (с, 9H), 0,88 (с, 3H).
Стадия 4. Синтез метил {(2S)-1-[(1R,2S,5S)-2-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-3,3-диметил-1-оксобутан-2-ил}карбамата (79).
К суспензии C58 (93 мг, 0,19 ммоль) в дихлорметане (5 мл) добавляют метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 139 мг, 0,583 ммоль), и реакционную смесь перемешивают при 25°C в течение 2 часов. Ее затем разбавляют водой (10 мл) и экстрагируют дихлорметаном (3×10 мл); объединенные органические слои промывают насыщенным водным раствором хлорида натрия (2×10 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (градиент: 0% - 100% этилацетат в петролейном эфире, затем градиент 0% - 20% метанол в дихлорметане) дает метил {(2S)-1-[(1R,2S,5S)-2-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-3,3-диметил-1-оксобутан-2-ил}карбамат (79) в виде белого твердого вещества. Выход: 7,0 мг, 15 мкмоль, 8%. ЖХМС m/z 462,2 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 8,13 (шд, J=7,0 Гц, 1H), 5,68 (шс, 1H), 5,34 (шд, J=9,9 Гц, 1H), 4,95-4,85 (м, 1H), 4,26 (с, 1H), 4,23 (д, J=10,0 Гц, 1H), 3,94 (дд, компонент системы АВХ, J=10,1, 4,5 Гц, 1H), 3,88 (д, половина АВ квартета, J=10,3 Гц, 1H), 3,63 (с, 3H), 3,45-3,29 (м, 2H), 2,62-2,50 (м, 1H), 2,46-2,28 (м, 2H), 2,02-1,93 (м, 1H), 1,92-1,79 (м, 1H), 1,6-1,49 (м, 2H, предполагаемый; частично закрыт пиком воды), 1,06 (с, 3H), 0,98 (с, 9H), 0,90 (с, 3H).
Пример 80
N-(Трифторацетил)-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамид (80)
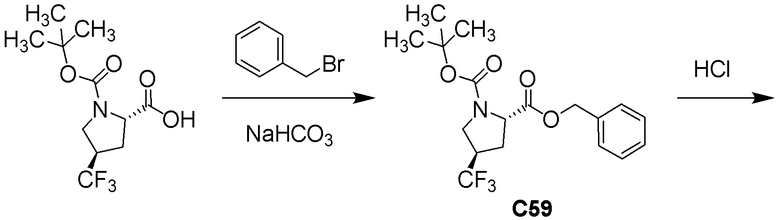
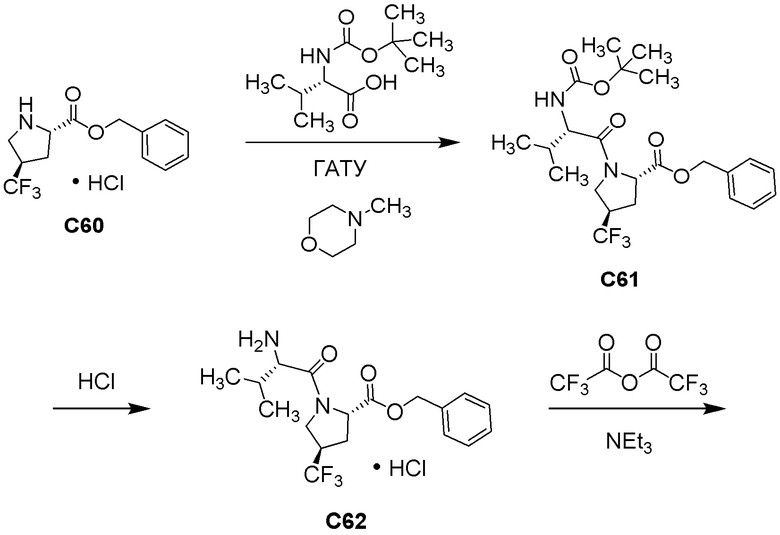
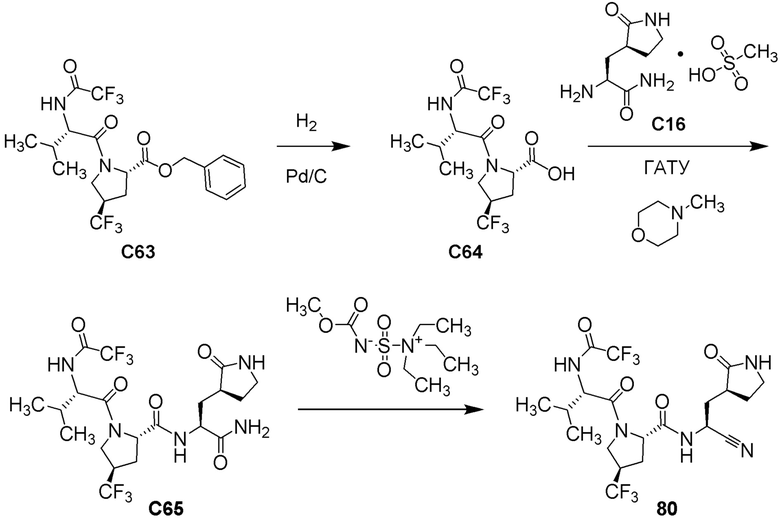
Стадия 1. Синтез 2-бензил 1-трет-бутил (2S,4R)-4-(трифторметил)пирролидин-1,2-дикарлоксилат (C59).
Смесь (4R)-1-(трет-бутоксикарбонил)-4-(трифторметил)-L-пролина (400 мг, 1,41 ммоль), бензилбромида (0,335 мл, 2,82 ммоль) и бикарбоната натрия (593 мг, 7,06 ммоль) в N, N-диметилформамиде (8 мл) перемешивают в течение 15 часов при 25°C. Затем реакционную смесь разбавляют водой (30 мл) и экстрагируют этилацетатом (3×30 мл), объединенные органические слои промывают насыщенным водным раствором хлорида натрия и 5% водным раствором хлорида лития, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (Градиент: 0% - 30% этилацетат в петролейном эфире) дает C59 в виде бесцветного масла. Согласно 1H ЯМР анализу, этот продукт существует в виде смеси ротамеров. Выход: 355 мг, 0,951 ммоль, 67%. 1H ЯМР (400 MГц, хлороформ-d) δ 7,44-7,28 (м, 5H), 5,29-5,07 (м, 2H), [4,54 (шд, J=8,6 Гц) и 4,40 (шдд, J=8,5, 2 Гц), всего 1H], 3,87-3,70 (м, 1H), [3,58 (дд, J=11,2, 7,4 Гц) и 3,49 (дд, J=11,0, 7,9 Гц), всего 1H], 3,13-2,95 (м, 1H), 2,47-2,27 (м, 1H), 2,25-2,11 (м, 1H), [1,46 (с) и 1,33 (с), всего 9H].
Стадия 2. Синтез бензил (4R)-4-(трифторметил)-L-пролината, гидрохлорида (C60).
К 0°C раствору C59 (200 мг, 0,536 ммоль) в этилацетате (3 мл) добавляют раствор гидрохлорида в этилацетате (4 M; 6 мл, 24 ммоль). Затем реакционную смесь перемешивают при комнатной температуре (28°C) в течение 3 часов, ее концентрируют в вакууме с получением C60 в виде белого твердого вещества; этот продукт берут непосредственно на следующую стадию. ЖХМС m/z 274,0 [M+H]+.
Стадия 3. Синтез бензил N-(трет-бутоксикарбонил)-L-валил-(4R)-4-(трифторметил)-L-пролината (C61).
Гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 277 мг, 0,728 ммоль) и 4-метилморфолин (184 мг, 1,82 ммоль) добавляют к 0°C смеси C60 (с предыдущей стадии; ≤0,536 ммоль) и N-(трет-бутоксикарбонил)-L-валина (158 мг, 0,727 ммоль) в N, N-диметилформамиде (3 мл). Реакционную смесь перемешивают при 0°C в течение 1 часа, затем ее выливают в ледяную воду (15 мл) и экстрагируют этилацетатом (2×15 мл). Объединенные органические слои промывают последовательно 1 M хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Очистка хроматографией на силикагеле (Градиент: 0% - 40% этилацетат в петролейном эфире) дает C61 в виде бесцветной камеди. Выход: 230 мг, 0,487 ммоль, 91% за 2 стадии. ЖХМС m/z 495,0 [M+Na+]. 1H ЯМР (400 MГц, хлороформ-d), характеристические пики: δ 7,40-7,30 (м, 5H), 5,17 (AB квартет, JAB=12,3 Гц, δνAB=12,6 Гц, 2H), 4,21 (дд, J=9,3, 6,8 Гц, 1H), 4,00-3,86 (м, 2H), 3,18-3,04 (м, 1H), 2,36 (ддд, компонент ABXY системы, J=13,5, 9, 9 Гц, 1H), 2,20 (ддд, компонент ABXY системы, J=13,4, 7,4, 3,5 Гц, 1H), 2,05-1,94 (м, 1H), 1,42 (с, 9H), 0,98 (д, J=6,7 Гц, 3H), 0,91 (д, J=6,8 Гц, 3H).
Стадия 4. Синтез бензил L-валил-(4R)-4-(трифторметил)-L-пролината, гидрохлорида (C62).
К 0°C раствору C61 (230 мг, 0,487 ммоль) в этилацетате (2 мл) добавляют раствор гидрохлорида в этилацетате (4 M; 4 мл, 16 ммоль). Реакционную смесь перемешивают при комнатной температуре (28°C) в течение 1 часа, затем ЖХМС анализ показывает превращение в C62: ЖХМС m/z 373,1 [M+H]+. Концентрация реакционной смеси в вакууме дает C62 в виде белого твердого вещества, которое берут непосредственно на следующую стадию.
Стадия 5. Синтез бензил N-(трифторацетил)-L-валил-(4R)-4-(трифторметил)-L-пролината (C63).
Раствор трифторуксусного ангидрида (154 мг, 0,733 ммоль) в дихлорметане (0,5 мл) добавляют к 0°C суспензии C62 (с предыдущей стадии; ≤0,487 ммоль) в дихлорметане (3 мл). Через 3 минуты, раствор триэтиламина (148 мг, 1,46 ммоль) в дихлорметане (0,5 мл) добавляют по каплям, и перемешивание продолжают при 25°C в течение 3 часов. После разбавления дихлорметаном (5 мл), реакционную смесь промывают насыщенным водным раствором карбоната натрия (10 мл) и насыщенным водным раствором хлорида натрия (15 мл), сушат, фильтруют, и концентрируют в вакууме; хроматография на силикагеле (Градиент: 0% - 30% этилацетат в петролейном эфире) дает C63 в виде бесцветного масла. Выход: 129 мг, 0,275 ммоль, 56% за 2 стадии. ЖХМС m/z 491,2 [M+Na+].
Стадия 6. Синтез N-(трифторацетил)-L-валил-(4R)-4-(трифторметил)-L-пролина (C64).
К 28°C раствору C63 (129 мг, 0,275 ммоль) в метаноле (3 мл) добавляют палладий на угле (10%, 29,3 мг, 27,5 мкмоль), затем смесь гидрогенируют при 15 ф./кв.д. в течение 16 часов. Фильтрация дает фильтровальную лепешку, которую промывают метанолом (10 мл); объединенные фильтраты концентрируют в вакууме с получением C64 в виде светло-желтого твердого вещества. Выход: 80 мг, 0,21 ммоль, 76%. ЖХМС m/z 401,0 [M+Na+].
Стадия 7. Синтез N-(трифторацетил)-L-валил-(4R)-4-(трифторметил)-L-пролил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C65).
Гексафторфосфат O-(7-Азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 88,5 мг, 0,233 ммоль) и 4-метилморфолин (64,2 мг, 0,635 ммоль) добавляют к 0°C раствору C64 (80 мг, 0,21 ммоль) и C16 (76,8 мг, 0,287 ммоль) в N, N-диметилформамиде (3 мл). затем реакционную смесь перемешивают при 0°C в течение 2 часов, ее обрабатывают водой (10 мл) и водным раствором лимонной кислоты (1 M; 10 мл, 10 ммоль), затем экстрагируют этилацетатом (3×10 мл). Объединенные органические слои промывают последовательно насыщенным водным раствором бикарбоната натрия (15 мл) и насыщенным водным раствором хлорида натрия (15 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Очистка хроматографией на силикагеле (Градиент: 0% - 10% метанол в дихлорметане) дает C65 в виде белого твердого вещества. Выход: 72 мг, 0,14 ммоль, 67%. ЖХМС m/z 532,2 [M+H]+.
Стадия 8. Синтез N-(трифторацетил)-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамида (80).
Метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 96,9 мг, 0,407 ммоль) добавляют к смеси C65 (72 мг, 0,14 ммоль) в дихлорметане (5 мл), и реакционную смесь перемешивают при комнатной температуре в течение ночи. После разбавления водой (15 мл), смесь экстрагируют дихлорметаном (3×15 мл), и объединенные органические слои промывают насыщенным водным раствором хлорида натрия (2×20 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (Градиент: 0% - 10% метанол в дихлорметане) дает N-(трифторацетил)-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамид (80) в виде белого твердого вещества. Выход: 30,9 мг, 60,2 мкмоль, 43%. ЖХМС m/z 536,1 [M+Na+]. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ 9,89 (д, J=7,8 Гц, 1H), 9,06 (д, J=8,4 Гц, 1H), 7,69 (с, 1H), 4,96 (ддд, J=10,6, 8,4, 5,5 Гц, 1H), 4,38 (дд, J=7,9, 6,3 Гц, 1H), 4,28 (дд, J=9,8, 7,8 Гц, 1H), 4,07-3,94 (м, 2H), 3,20-3,00 (м, 2H), 2,5-2,41 (м, 1H, предполагаемый; частично закрыт пиком растворителя), 2,38-2,28 (м, 1H), 2,19-2,02 (м, 4H), 1,78-1,61 (м, 2H), 0,92 (д, J=7 Гц, 3H), 0,90 (д, J=6,8 Гц, 3H).
Примеры 81-84
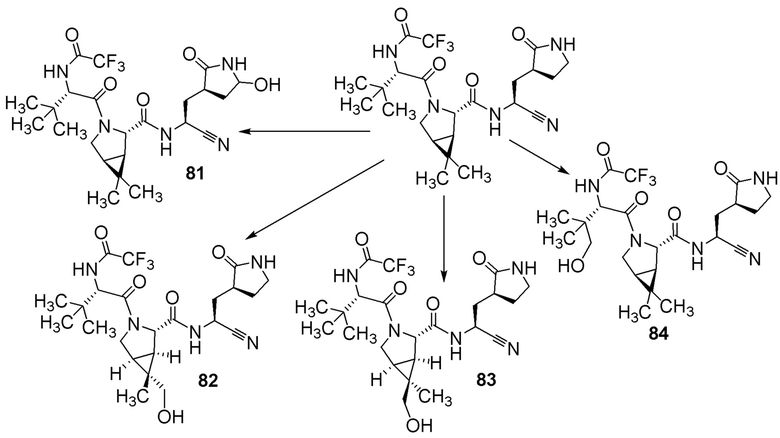
Пример 81: (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3R)-5-гидрокси-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид
Пример 82: (1R,2S,5S,6R)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6-(гидроксиметил)-6-метил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид
Пример 83: (1R,2S,5S,6S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6-(гидроксиметил)-6-метил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид
Пример 84: (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-(гидроксиметил)-N-(трифторацетил)-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид
Соединения примеров 81-84 получают путями биотрансформации, и in vitro и in vivo, из (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (соединение примера 13) следующим образом. В исследованиях in vitro, (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид инкубируют с микросомами печени мыши, крысы, хомяка, кролика, обезьяны или человека (см. таблицу M1 ниже) или гепатоцитами крысы, обезьяны или человека (см. таблицу M2 ниже). Альтернативно, в исследованиях in vivo (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид вводят крысам и обезьянам. Получают образцы плазмы, мочи и желчи крысы и плазмы обезьяны. Полученные метаболиты затем анализируют с применением ВЭЖХ/МС и полученные окислительные метаболиты соединений примеров 81-84 определяют и получают. Кроме соединений примеров 81-84, дополнительный метаболит, (1R,2S,5S)-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновую кислоту, получаемую при гидролитическом расщеплении, наблюдают в исследованиях in vivo.
В таблицах M1, M2 и M3 применяют следующие обозначения: -=не определено; +=определено масс спектрометрией и незначительный УФ пик; ++=определено масс спектрометрией и средний УФ пик; +++=определено масс спектрометрией и основной УФ пик; t=след, определенный только масс спектрометрией
Примеры 82, 83, 84, и 81
(1R,2S,5S,6R)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6-(гидроксиметил)-6-метил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (82), (1R,2S,5S,6S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6-(гидроксиметил)-6-метил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (83), (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-(гидроксиметил)-N-(трифторацетил)-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид (84) и (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3R)-5-гидрокси-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (81)
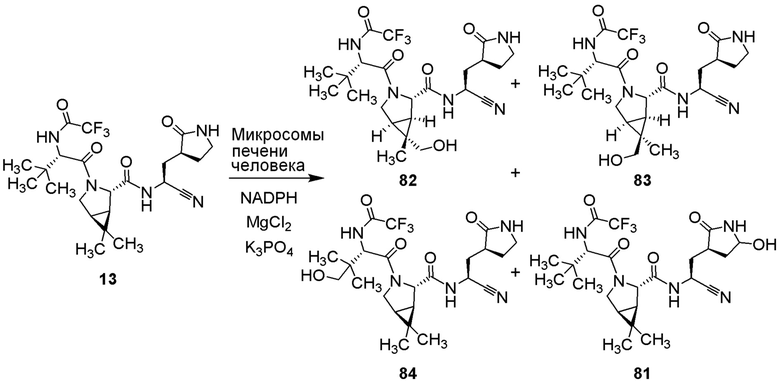
Пример 13 (25 мкм) объединяют с микросомами печени человека (2 мг/мл) в буфере на основе фосфата калия (100 мМ, pH 7,4; 40 мл), содержащем хлорид магния (3,3 мМ) и NADPH (1,3 мМ). Инкубацию проводят в течение 55 минут во встряхиваемой водяной бане, выдерживаемой при 37°C. Реакцию заканчивают добавлением равного объема ацетонитрила, затем смесь вращают в центрифуге при 1800 x g в течение 5 минут, и супернатант подвергают вакуумному центрифугированию в течение приблизительно 1,5 часов. К остатку добавляют муравьиную кислоту (0,5 мл), ацетонитрил (0,5 мл) и воду до конечного объема 50 мл, и полученную смесь вращают в центрифуге при 40000 x g в течение 30 минут. Супернатант наносят на ВЭЖХ колонку (Polaris C18, 4,6×250 мм; 5 мкм) при 1 мл/мин с применением Jasco ВЭЖХ насоса. После нанесения, колонку перемещают в ВЭЖХ-УФ систему Waters Acquity, соединенную с Thermo LTQ масс-спектрометром и сборщиком фракций CTC Analytics и подвергают разделению ВЭЖХ с обращенной фазой (Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты (об./об.); Подвижная фаза B: ацетонитрил; Градиент: 2% в течение 5 минут, затем повышают до 15% B, затем 15% - 60% B в течение 80 минут, затем 60% - 95% B в течение 5 минут; Скорость потока: 0,8 мл/мин). Фракции собирают каждые 20 секунд с получением (1R,2S,5S,6R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6-(гидроксиметил)-6-метил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (82), (1R,2S,5S,6S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6-(гидроксиметил)-6-метил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (83), (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-(гидроксиметил)-N-(трифторацетил)-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида (84) и (1R,2S,5S)-N-{(1S)-1-циано-2-[(3R)-5-гидрокси-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (81).
82 - Выход: 60 мкг, 0,12 мкмоль, 12%. МС с высоким разрешением m/z 516,2424 [M+H]+; рассчитано для C23H33F3N5O5, 516,2434. 1H ЯМР (600 MГц, ДМСО-d6), характеристические пики: δ 9,42 (шд, J=7,9 Гц, 1H), 9,03 (д, J=8,5 Гц, 1H), 7,66 (с, 1H), 5,01-4,93 (м, 1H), 4,69-4,63 (м, 1H), 4,43 (д, J=8,3 Гц, 1H), 4,15 (с, 1H), 3,94 (дд, компонент системы АВХ, J=10,2, 5,4 Гц, 1H), 3,68 (д, половина АВ квартета, J=10,4 Гц, 1H), 3,21-3,17 (м, 2H), 3,17-3,11 (м, 1H), 3,07-3,00 (м, 1H), 1,69-1,65 (м, 1H), 1,44 (д, J=7,8 Гц, 1H), 0,98 (с, 9H), 0,84 (с, 3H).
83 - Выход: 30 мкг, 0,058 мкмоль, 6%. МС с высоким разрешением m/z 516,2425 [M+H]+; рассчитано для C23H33F3N5O5, 516,2434. 1H ЯМР (600 MГц, ДМСО-d6), характеристические пики: δ 9,37 (д, J=7,0 Гц, 1H), 9,04 (д, J=8,5 Гц, 1H), 7,65 (с, 1H), 5,00-4,94 (м, 1H), 4,54-4,49 (м, 1H), 4,40 (д, J=8,1 Гц, 1H), 4,28 (с, 1H), 3,93 (дд, компонент системы АВХ, J=10,2, 5,8 Гц, 1H), 3,74 (д, половина АВ квартета, J=10,6 Гц, 1H), 3,3-3,20 (м, 1H, предполагаемый; частично закрыт пиком воды), 3,17-3,11 (м, 1H), 3,07-3,00 (м, 1H), 1,75-1,63 (м, 2H), 1,38 (д, половина АВ квартета, J=7,3 Гц, 1H), 1,06 (с, 3H), 0,98 (с, 9H).
84 - Выход: 40 мкг, 0,078 мкмоль, 8%. МС с высоким разрешением m/z 516,2423 [M+H]+; рассчитано для C23H33F3N5O5, 516,2434. 1H ЯМР (600 MГц, ДМСО-d6), характеристические пики: δ 9,61-9,51 (м, 1H), 9,00 (д, J=8,3 Гц, 1H), 7,68 (с, 1H), 5,02-4,92 (м, 1H), 4,51-4,43 (м, 1H), 4,16 (с, 1H), 3,92 (шдд, J=10,0, 5,6 Гц, 1H), 3,78 (д, J=10,6 Гц, 1H), 3,51 (д, J=10,1 Гц, 1H), 3,18-3,10 (м, 1H), 3,10-3,03 (м, 1H), 1,73-1,67 (м, 2H), 1,60-1,54 (м, 1H), 1,31 (д, J=7,6 Гц, 1H), 1,03 (с, 3H), 1,01 (с, 3H), 0,88 (шс, 6H).
81 - Выход: 130 мкг, 0,252 мкмоль, 25%. Определено, что этот продукт существует в виде взаимопревращающейся смеси стереоизомеров вокруг карбинолаиновой группы пирролидона (см. примеры 81 и 82). МС с высоким разрешением m/z 516,2428 [M+H]+; рассчитано для C23H33F3N5O5, 516,2434. 1H ЯМР (600 MГц, ДМСО-d6) δ [9,40 (д, J=8,4 Гц) и 9,38 (д, J=8,2 Гц), всего 1H], [8,99 (д, J=8,5 Гц) и 8,92 (д, J=7,6 Гц), всего 1H], [8,37 (с) и 8,25 (с), всего 1H], [5,83 (шс) и 5,70 (шс), всего 1H], 5,04-4,92 (м, 2H), 4,44-4,38 (м, 1H), [4,19 (с) и 4,15 (с), всего 1H], 3,91 (дд, J=10,2, 5,5 Гц, 1H), [3,69 (д, J=10 Гц) и 3,68 (д, J=10,2 Гц), всего 1H], [2,65-2,57 (м), 2,43-2,30 (м), и 2,21-2,13 (м), всего 2H], [2,08 (ддд, J=13,7, 8,4, 6,2 Гц), 2,00-1,90 (м), и 1,87-1,79 (м), всего 2H], [1,78-1,70 (м) и 1,51-1,44 (м), всего 1H], 1,60-1,53 (м, 1H), [1,32 (д, J=7,6 Гц) и 1,29 (д, J=7,6 Гц), всего 1H], 1,03 (с, 3H), [0,99 (с) и 0,98 (с), всего 9H], [0,85 (с) и 0,84 (с), всего 3H].
Примеры 81 и 85
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3R)-5-гидрокси-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (81) и (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3R)-2,5-диоксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (85)
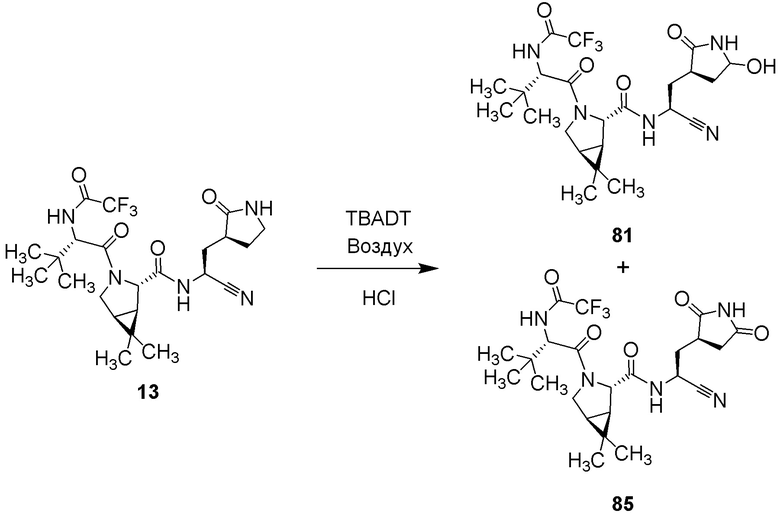
Смесь примера 13 (1,0 мг, 2,0 мкмоль) и декавольфрамата тетра-н-бутиламмония (TBADT; 0,33 мг, 0,10 мкмоль) обрабатывают ацетонитрилом (0,15 мл) и хлористоводородной кислотой (1,0 M; 0,05 мл, 50 мкмоль). Иглу шприца (калибр 18) вставляют через тефлоновую крышку пробирки и доступную для воздуха смесь помещают в EvoluChem™ PhotoRedOx Box, оборудованную вентилятором и облучают черным светом (PAR20-18W LG 365 нм, 100-240 VAC) при 25°C в течение 16 часов. В реакционную смесь добавляют водный раствор фосфата калия (1 M, pH 7,5; 0,5 мл), затем воду (до объема приблизительно 6 мл), затем добавляют водную муравьиную кислоту (1%, 2 мл) и ацетонитрил, достаточный для сохранения раствора. Полученный раствор делят наполовину и наносят на два 5 г Biotage Isolute C18 картриджи для твердофазной экстракции. Картриджи промывают водным раствором ацетата аммония (10 мМ; 3 мл) и 20% ацетонитрилом в 10 мМ водном растворе ацетата аммония (3 мл), затем элюируют ацетонитрилом (3 мл). Растворители удаляют с применением испарителя Genevac, и два остатка восстанавливают в смеси ацетонитрила и 1% водной муравьиной кислоты и объединяют до всего 2 мл раствора. Этот продукт подвергают ВЭЖХ с обращенной фазой (Колонка: Phenomenex Luna C18,10×250 мм, 10 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты (об./об.); Подвижная фаза B: ацетонитрил; Градиент: 2% - 15% B в течение 5 минут, затем 15% - 60% B в течение 80 минут, затем 60% - 95% B в течение 5 минут; Скорость потока: 2 мл/мин). Фракции собирают каждые 20 секунд; элюированным первым соединением является (1R,2S,5S)-N-{(1S)-1-циано-2-[(3R)-5-гидрокси-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (81), и элюированным вторым соединением является (1R,2S,5S)-N-{(1S)-1-циано-2-[(3R)-2,5-диоксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (85).
Выход 81: 0,122 мг, 0,237 мкмоль, 12%. Определяют, что этот продукт существует в виде взаимопревращающейся смеси стереоизомеров вокруг карбиноламиновой группы пирролидона, и элюируется в виде двойного пика на ВЭЖХ. МС с высоким разрешением m/z 516,2413 [M+H]+; рассчитано для C23H33F3N5O5, 516,2434. 1H ЯМР (600 MГц, ДМСО-d6) δ 9,44-9,34 (м, 1H), [8,99 (д, J=8,5 Гц) и 8,92 (д, J=7,6 Гц), всего 1H], [8,37 (с) и 8,25 (с), всего 1H], [5,83 (шс) и 5,70 (шс), всего 1H], 5,05-4,91 (м, 2H), 4,44-4,37 (м, 1H), [4,19 (с) и 4,15 (с), всего 1H], 3,91 (дд, J=10,3, 5,5 Гц, 1H), [3,69 (д, J=10,1 Гц) и 3,68 (д, J=10,3 Гц), всего 1H], [2,65-2,57 (м), 2,43-2,30 (м), и 2,17 (ддд, J=14,9, 10,7, 4,7 Гц), всего 2H], [2,08 (ддд, J=14,1, 8,5, 6,2 Гц), 2,01-1,90 (м), и 1,83 (ддд, J=13,7, 10,1, 5,7 Гц), всего 2H], [1,78-1,70 (м) и 1,51-1,44 (м), всего 1H], 1,60-1,53 (м, 1H), [1,32 (д, J=7,6 Гц) и 1,29 (д, J=7,6 Гц), всего 1H], 1,03 (с, 3H), [0,99 (с) и 0,98 (с), всего 9H], [0,85 (с) и 0,84 (с), всего 3H]. Время удержания: 7,7 минут (Аналитические условия. Колонка: Phenomenex Kinetex XB-C18, 2,1×100 мм, 2,6 мкм; Подвижная фаза A: вода, содержащая 0,1% муравьиной кислоты (об./об.); Подвижная фаза B: ацетонитрил; Градиент: 5% B в течение 0,5 минут, затем 5% - 70% B в течение 10,5 минут, затем 70% - 95% B в течение 2 минут; Скорость потока: 0,4 мл/минуту).
Выход 85: 0,104 мг, 0,203 мкмоль, 10%. МС с высоким разрешением m/z 514,2259 [M+H]+; рассчитано для C23H31F3N5O5, 514,2277. 1H ЯМР (600 MГц, ДМСО-d6) δ 11,17 (шс, 1H), 9,40 (шс, 1H), 9,08 (д, J=8,9 Гц, 1H), 5,06-4,98 (м, 1H), 4,42-4,36 (м, 1H), 4,13 (с, 1H), 3,91 (дд, J=10,3, 5,6 Гц, 1H), 3,70 (д, половина АВ квартета, J=10,4 Гц, 1H), 3,00-2,93 (м, 1H), 2,60 (дд, компонент системы АВХ, J=18,0, 5,9 Гц, 1H), 2,46 (дд, компонент системы АВХ, J=18,1, 9,1 Гц, 1H), 2,25-2,18 (м, 1H), 2,04-1,97 (м, 1H), 1,60-1,55 (м, 1H), 1,35 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,03 (с, 3H), 0,95 (с, 9H), 0,86 (с, 3H). Время удержания: 8,3 минут (Аналитические условия идентичны тем, которые применяют для 81).
Пример 86
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[5,5,5-трифтор-2-(2,2,2-трифторацетамидо)пентаноил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (86)
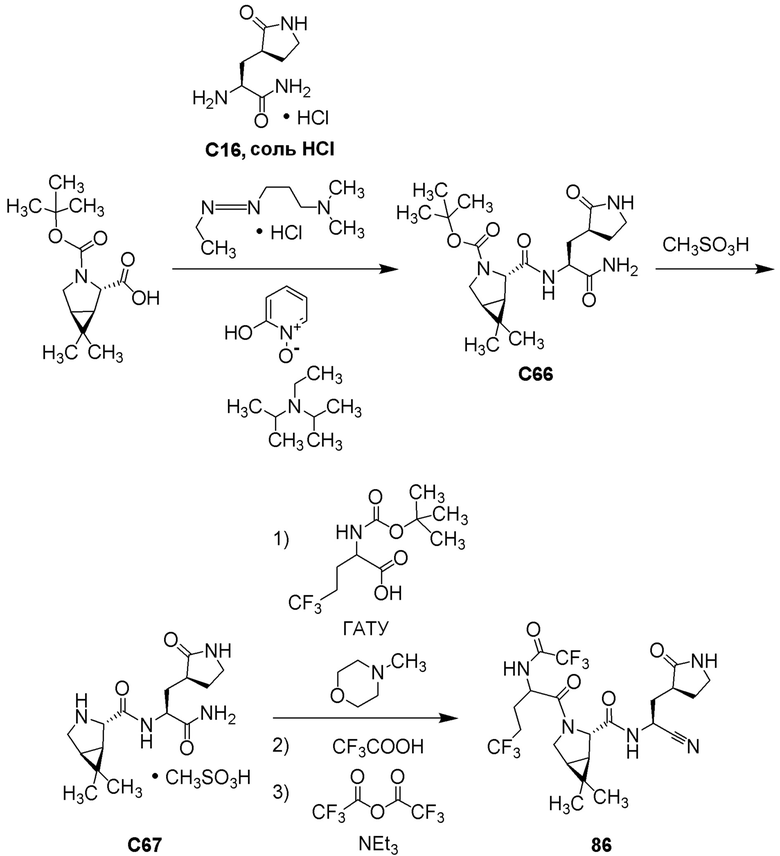
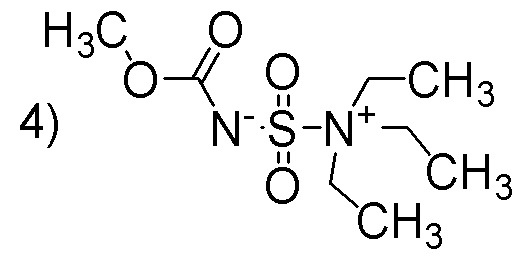
Стадия 1. Синтез трет-бутил (1R,2S,5S)-2-({(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-карлоксилата (C66).
К 0°C суспензии (1R,2S,5S)-3-(трет-бутоксикарбонил)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (5,25 г, 20,6 ммоль), C16, соли HCl (4,70 г, 22,6 ммоль) и 2-гидроксипиридин 1-оксида (571 мг, 5,14 ммоль) в бутан-2-оне (108 мл) добавляют N, N-диизопропилэтиламин (7,97 г, 61,7 ммоль), затем гидрохлорид 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (4,73 г, 24,7 ммоль). Затем реакционную смесь перемешивают при 0°C в течение 20 минут, ее постепенно нагревают до комнатной температуры, и затем перемешивают при комнатной температуре в течение ночи, затем ЖХМС анализ показывает присутствие C66: ЖХМС m/z 407,1 [M-H]-. Реакционную смесь разбавляют этилацетатом (100 мл), и промывают последовательно следующим: смесью воды (50 мл) и насыщенного водного раствора хлорида натрия (20 мл), насыщенным водным раствором хлорида натрия (70 мл), дважды смесью хлористоводородной кислоты (1 M; 50 мл) и насыщенного водного раствора хлорида натрия (20 мл), и наконец, насыщенным водным раствором хлорида натрия (70 мл). Каждый водный слой экстрагируют этилацетатом (100 мл), и объединенные органические слои сушат над сульфатом натрия и фильтруют. Собранный сульфат натрия промывают этилацетатом (2×50 мл), и объединенные фильтраты концентрируют в вакууме, разбавляют гептаном (50 мл) и концентрируют при пониженном давлении с получением C66 в виде бесцветного стекла (6,69 г). Согласно 1H ЯМР анализу, присутствует некоторое количество растворителя; чистоту оценивают как приблизительно 85% массовых. 1H ЯМР анализ также показал, что этот продукт существует в виде смеси ротамеров. Выход, скорректированный на присутствие растворителей: 5,7 г, 14 ммоль, 68%. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ 8,23-8,13 (м, 1H), [7,63 (шс) и 7,59 (шс), всего 1H], [7,36 (шс) и 7,23 (шс), всего 1H], 7,08-7,00 (м, 1H), 4,31-4,19 (м, 1H), [4,03 (с) и 3,99 (с), всего 1H], [3,58 (дд, J=10,8, 4,6 Гц) и 3,49 (дд, J=10,8, 3,9 Гц), всего 1H], [3,27 (д, J=10,9 Гц) и 3,26 (д, J=10,7 Гц), всего 1H], 3,22-3,00 (м, 2H), 2,38-2,09 (м, 2H), 1,79-1,43 (м, 2H), [1,36 (с) и 1,29 (с), всего 9H], 1,00 (с, 3H), 0,89 (с, 3H).
Стадия 2. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида, метансульфоната (C67).
Метансульфоновую кислоту (0,920 мл, 14,2 ммоль) добавляют в раствор C66 (приблизительно 85% массовых, с предыдущей стадии; 6,68 г, 14 ммоль) в 1,1,1,3,3,3-гексафторпропан-2-оле (30 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов, затем ее концентрируют в вакууме. Остаток последовательно берут в следующих системах растворителей, затем повторно концентрируют: ацетонитрил/этилацетат (1:1, 2×10 мл) и этилацетат/гептан (1:1, 2×10 мл), с получением C67 в виде стекла (7,18 г). Часть этого продукта берут на следующую стадию. ЖХМС m/z 309,3 [M+H]+. 1H ЯМР (400 MГц, метанол-d4) δ 4,51 (дд, J=10,8, 4,7 Гц, 1H), 4,21 (шс, 1H), 3,73 (дд, J=12,4, 6,3 Гц, 1H), 3,41-3,22 (м, 3H), 2,70 (с, 3H), 2,58-2,47 (м, 1H), 2,42-2,32 (м, 1H), 2,16 (ддд, J=14,0, 10,8, 4,8 Гц, 1H), 1,97 (шд, J=7,9 Гц, 1H), 1,95-1,84 (м, 1H), 1,84-1,75 (м, 2H), 1,15 (с, 6H).
Стадия 3. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[5,5,5-трифтор-2-(2,2,2-трифторацетамидо)пентаноил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (86).
В раствор 2-[(трет-бутоксикарбонил)амино]-5,5,5-трифторпентановой кислоты (59,0 мг, 0,218 ммоль) в смеси ацетонитрила (0,60 мл) и N, N-диметилформамида (0,40 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 82,7 мг, 0,218 ммоль), затем 4-метилморфолин (54,4 мкл, 0,495 ммоль). Затем реакционную смесь перемешивают в течение 20 минут, C67 (с предыдущей стадии; 100 мг, ≤0,19 ммоль) добавляют в виде твердого вещества. Реакционную смесь перемешивают в течение 1,5 часов, затем ее разделяют между этилацетатом и насыщенным водным раствором бикарбоната натрия. Водный слой экстрагируют этилацетатом, и объединенные органические слои сушат над сульфатом магния, фильтруют, и концентрируют с применением потока азота. Остаток растворяют в дихлорметане (0,70 мл), обрабатывают трифторуксусной кислоты (0,175 мл) и перемешивают при комнатной температуре. Через 2 часа, снова добавляют трифторуксусную кислоту (0,10 мл); перемешивание продолжают в течение еще 3 часов, затем реакционную смесь концентрируют под потоком азота, и затем в вакууме. Этот продукт растворяют в дихлорметане (0,75 мл), охлаждают на ледяной бане и обрабатывают триэтиламином (54,8 мкл, 0,393 ммоль); трифторуксусный ангидрид (41,2 мкл, 0,292 ммоль) добавляют по каплям, и реакционную смесь перемешивают при 0°C в течение 3 часов. Летучие вещества удаляют с применением испарителя Genevac evaporator, и остаток растворяют в дихлорметане (0,90 мл), обрабатывают метил N-(триэтиламмониосульфонил)карбаматом, внутреннюю соль (реагент Бурджеса; 132 мг, 0,554 ммоль), и перемешивают при комнатной температуре в течение 2,5 часов. Реакционную смесь затем концентрируют под потоком азота, разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия. Водный слой экстрагируют этилацетатом, и объединенные органические слои сушат над сульфатом магния, фильтруют, и концентрируют под потоком азота. Очистка ВЭЖХ с обращенной фазой (Колонка: Waters Sunfire C18, 19×100 мм, 5 мкм; Подвижная фаза A: 0,05% трифторуксусной кислоты в воде; Подвижная фаза B: 0,05% трифторуксусной кислоты в ацетонитриле; Градиент: 5% - 95% B в течение 8,54 минут, затем 95% B в течение 1,46 минут; Скорость потока: 25 мл/минуту) дает (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[5,5,5-трифтор-2-(2,2,2-трифторацетамидо)пентаноил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (86). Выход: 14 мг, 26 мкмоль, 14% за 2 стадии. ЖХМС m/z 540,6 [M+H]+. Время удержания: 2,60 минут (Аналитические условия. Колонка: Waters Atlantis dC18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.); Градиент: 5,0% - 95% B, линейный, в течение 4,0 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 2 мл/минуту).
Пример 87
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[(2S)-2-циклогексил-2-{[(трифторметил)сульфонил]амино}ацетил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид (87)
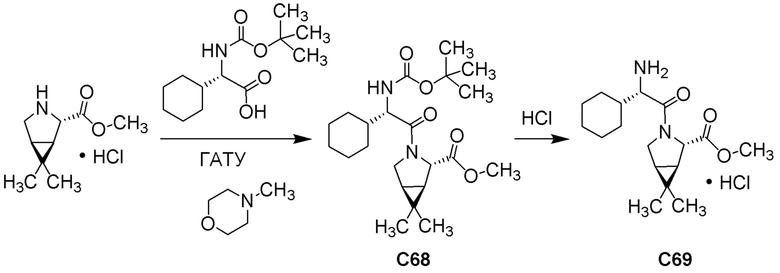
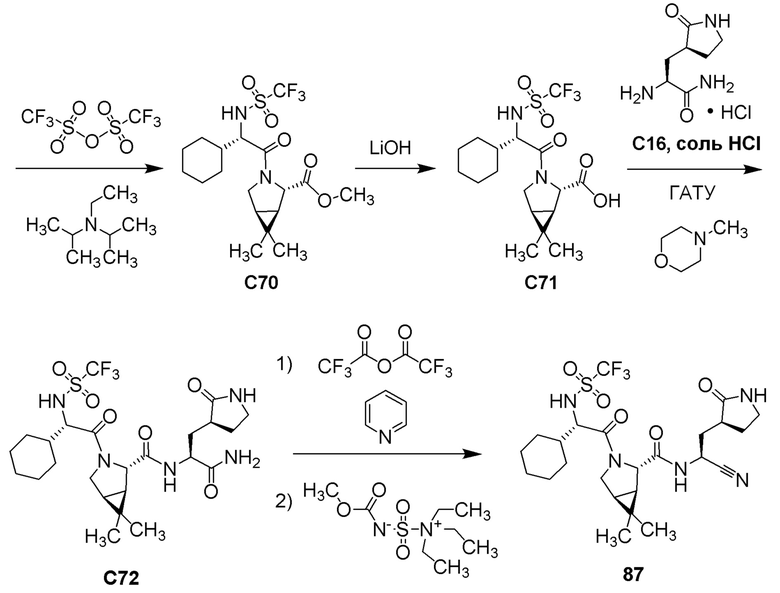
Стадия 1. Синтез метил (1R,2S,5S)-3-{(2S)-2-[(трет-бутоксикарбонил)амино]-2-циклогексилацетил}-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата (C68).
К 0°C раствору метил (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата, гидрохлорида (300 мг, 1,46 ммоль) и (2S)-[(трет-бутоксикарбонил)амино](циклогексил)уксусной кислоты (394 мг, 1,53 ммоль) в N, N-диметилформамиде (5 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 610 мг, 1,60 ммоль), затем по каплям добавляют 4-метилморфолин (443 мг, 4,38 ммоль). Реакционную смесь перемешивают при 0°C в течение 10 минут, затем при комнатной температуре (20°C) в течение 2 часов, затем ее выливают в ледяную воду (30 мл) и экстрагируют этилацетатом (3×40 мл). Объединенные органические слои промывают последовательно водой (40 мл), хлористоводородной кислотой (1 M; 40 мл), насыщенным водным раствором бикарбоната натрия (40 мл), и насыщенным водным раствором хлорида натрия, затем сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме с получением C68 в виде белой пены. Выход: 580 мг, 1,42 ммоль, 97%. ЖХМС m/z 409,3 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 7,03 (д, J=8,5 Гц, 1H), 4,17 (с, 1H), 4,00 (д, J=10,4 Гц, 1H), 3,88 (дд, J=9, 9 Гц, 1H), 3,75 (дд, J=10,3, 5,3 Гц, 1H), 3,64 (с, 3H), 1,83-1,47 (м, 8H), 1,46-1,28 (м, 2H), 1,33 (с, 9H), 1,18-1,06 (м, 3H), 1,00 (с, 3H), 0,86 (с, 3H).
Стадия 2. Синтез метил (1R,2S,5S)-3-[(2S)-2-амино-2-циклогексилацетил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата, гидрохлорида (C69).
Раствор гидрохлорида в 1,4-диоксане (4 M; 15 мл) добавляют по каплям к 5°C раствору C68 (580 мг, 1,42 ммоль) в 1,4-диоксане (3 мл). Затем реакционную смесь перемешивают при комнатной температуре (20°C) в течение 1,5 часов, ее концентрируют в вакууме. Остаток совместно выпаривают с дихлорметаном с получением C69 в виде светло-желтой пены (490 мг), всю которую используют в следующем эксперименте. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,22 (шс, 3H), 4,26 (с, 1H), 3,99-3,90 (м, 1H), 3,76 (дд, компонент системы АВХ, J=10,7, 5,1 Гц, 1H), 3,71 (д, половина АВ квартета, J=10,6 Гц, 1H), 3,66 (с, 3H), 1,83-1,60 (м, 6H), 1,59 (дд, J=7,6, 5,1 Гц, 1H), 1,49 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,27-1,02 (м, 5H), 1,03 (с, 3H), 0,94 (с, 3H).
Стадия 3. Синтез метил (1R,2S,5S)-3-[(2S)-2-циклогексил-2-{[(трифторметил)сульфонил]амино}ацетил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата (C70).
К -10°C раствору C69 (с предыдущей стадии; 480 мг, ≤1,39 ммоль) в дихлорметане (10 мл) добавляют N, N-диизопропилэтиламин (630 мг, 4,87 ммоль), затем по каплям добавляют трифторметансульфоновый ангидрид (0,328 мл, 1,95 ммоль). Реакционную смесь перемешивают при -10°C в течение 1 часа, затем при комнатной температуре (20°C) в течение 1 часа, затем ее разбавляют насыщенным водным раствором хлорида натрия (50 мл) и экстрагируют дихлорметаном (3×30 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и очищают хроматографией на силикагеле (Элюент: 1:4 этилацетат/петролейным эфиром), с получением C70 в виде светло-желтого масла. Выход: 124 мг, 0,282 ммоль, 20% за 2 стадии. ЖХМС m/z 441,1 [M+H]+.
Стадия 4. Синтез (1R,2S,5S)-3-[(2S)-2-циклогексил-2-{[(трифторметил)сульфонил]амино}ацетил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C71).
В раствор C70 (120 мг, 0,272 ммоль) в смеси воды (2 мл), метанола (2 мл) и тетрагидрофурана (2 мл) добавляют моногидрат гидроксида лития (28,6 мг, 0,682 ммоль). Затем реакционную смесь перемешивают при комнатной температуре (20°C) в течение 18 часов при комнатной температуре, ЖХМС показывает, что реакция завершена: ЖХМС m/z 427,2 [M+H]+. Реакционную смесь концентрируют в вакууме для удаления органических растворителей. Остаток разбавляют водой (5 мл) и затем подкисляют до pH 2-3 добавлением 1 M хлористоводородной кислоты; полученную смесь экстрагируют этилацетатом (2×30 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме, с получением C71 в виде светло-желтого твердого вещества. Выход: 92,0 мг, 0,216 ммоль, 79%.
Стадия 5. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-3-[(2S)-2-циклогексил-2-{[(трифторметил)сульфонил]амино}ацетил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида (C72).
К 0°C раствору C71 (92,0 мг, 0,216 ммоль) и C16, соли HCl (72%, 68,8 мг, 0,238 ммоль) в N, N-диметилформамиде (3 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 98,4 мг, 0,259 ммоль), затем 4-метилморфолин (76,4 мг, 0,755 ммоль). Реакционную смесь затем перемешивают при 20°C в течение 2 часов, затем ее выливают в ледяную воду (10 мл) и экстрагируют смесью хлороформа и 2-пропанола (4:1, 4×20 мл). Объединенные органические слои сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и очищают хроматографией на силикагеле (Градиент: 0% - 10% метанол в дихлорметане), с получением C72 в виде бесцветного стекла. Выход: 100 мг, 0,173 ммоль, 80%. ЖХМС m/z 580,2 [M+H]+.
Стадия 6. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[(2S)-2-циклогексил-2-{[(трифторметил)сульфонил]амино}ацетил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида (87).
Раствор трифторуксусного ангидрида (47,1 мг, 0,224 ммоль) в дихлорметане (1 мл) добавляют по каплям к 0°C раствору C72 (100 мг, 0,173 ммоль) и пиридина (41,7 мкл, 0,516 ммоль) в дихлорметане (3 мл). Затем смесь перемешивают в течение 20 часов при комнатной температуре (10°C - 20°C), ее концентрируют в вакууме и повторно растворяют в дихлорметане (3 мл). Метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 103 мг, 0,432 ммоль) добавляют, и реакционную смесь перемешивают при комнатной температуре (20°C) в течение 20 часов. Ее затем разбавляют насыщенным водным раствором хлорида натрия (10 мл) и экстрагируют дихлорметаном (3×20 мл); объединенные органические слои сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и подвергают сверхкритической жидкостной хроматографии [Колонка: Chiral Technologies Chiralcel OD, 30×250 мм, 10 мкм; Подвижная фаза: 4:1 диоксид углерода/(этанол содержащий 0,1% гидроксид аммония); Скорость потока: 60 мл/минуту]. Фракции, содержащие 87, концентрируют в вакууме ниже 40°C для удаления спиртового сорастворителя. Остаток разбавляют этилацетатом (50 мл) и дихлорметаном (5 мл) и промывают последовательно хлористоводородной кислотой (1 M; 20 мл), насыщенным водным раствором бикарбоната натрия (20 мл), и насыщенным водным раствором хлорида натрия. Полученный органический слой сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме, затем смешивают с водой (20 мл) и ацетонитрилом (5 мл); эту смесь лиофилизируют с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[(2S)-2-циклогексил-2-{[(трифторметил)сульфонил]амино}ацетил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида (87) в виде белого твердого вещества. Выход: 27,6 мг, 49,1 мкмоль, 28%. ЖХМС m/z 562,2 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ 9,93 (д, J=8,3 Гц, 1H), 9,10 (д, J=8,7 Гц, 1H), 7,70 (с, 1H), 5,03-4,94 (м, 1H), 4,15 (с, 1H), 3,88-3,78 (м, 2H), 3,55 (д, J=10,2 Гц, 1H), 3,20-3,11 (м, 1H), 3,10-3,00 (м, 1H), 2,19-2,08 (м, 1H), 2,06-1,95 (м, 1H), 1,85-1,53 (м, 9H), 1,33 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,03 (с, 3H), 0,89 (с, 3H).
Примеры 88 и 89
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-циклобутил-N-(трифторацетил)-L-аланил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид и (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-циклобутил-N-(трифторацетил)-D-аланил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид (88 и 89)
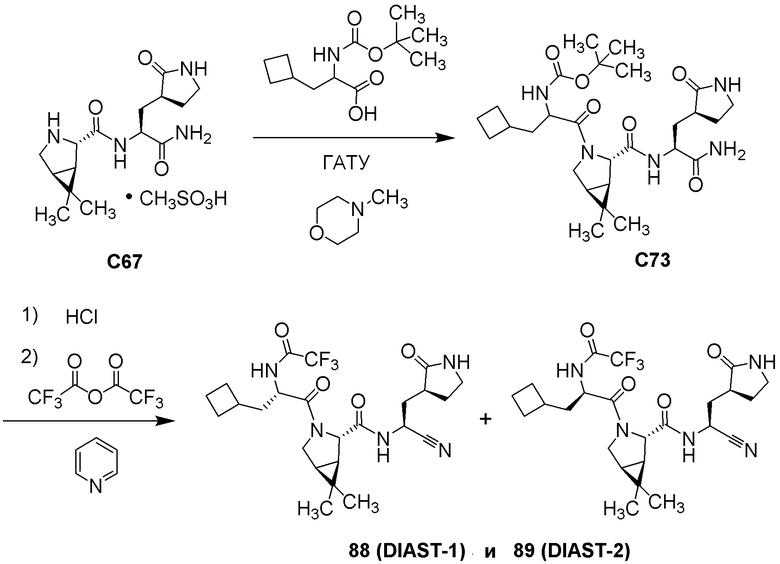
Стадия 1. Синтез трет-бутил {1-[(1R,2S,5S)-2-({(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-3-циклобутил-1-оксопропан-2-ил}карбамата (C73).
0°C раствор C67 (150 мг, 0,371 ммоль) и N-(трет-бутоксикарбонил)-3-циклобутилаланина (99,2 мг, 0,408 ммоль) в N, N-диметилформамиде (3 мл) обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 169 мг, 0,444 ммоль). Затем добавляют по каплям 4-метилморфолин (131 мг, 1,30 ммоль), затем реакционную смесь нагревают до 25°C и перемешивают в течение ночи. Добавляют ледяную воду (10 мл), и полученную смесь экстрагируют смесью хлороформа и 2-пропанола (4:1, 4×20 мл); объединенные органические слои сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматографию на силикагеле (Градиент: 0% - 10% метанол в дихлорметане) проводят дважды с получением C73 в виде белого твердого вещества, которое содержит смесь двух диастереомеров. Выход: 106 мг, 0,199 ммоль, 54%. ЖХМС m/z 534,2 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ [8,59 (д, J=5,5 Гц) и 7,85 (д, J=7,7 Гц), всего 1H], 7,20-7,06 (м, 1H), [5,78 (шс) и 5,67 (шс), всего 1H], [5,51 (шс) и 5,40 ш (с), всего 1H], 5,22-5,12 (м, 1H), [4,49-4,39 (м) и 4,38-4,23 (м), всего 3H], 4,17-4,06 (м, 1H), [3,83 (д, J=10,4 Гц) и 3,50 (д, J=10,5 Гц), всего 1H], 3,42-3,28 (м, 2H), 2,50-2,30 (м, 3H), 2,23-2,00 (м, 4H), 2,00-1,77 (м, 4H), 1,73-1,44 (м, 5H), [1,40 (с) и 1,39 (с), всего 9H], [1,07 (с) и 1,03 (с), всего 3H], [0,98 (с) и 0,92 (с), всего 3H].
Стадия 2. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-циклобутил-N-(трифторацетил)-L-аланил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида и (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-циклобутил-N-(трифторацетил)-D-аланил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида [88 (DIAST-1) и 89 (DIAST-2)].
Раствор гидрохлорида в 1,4-диоксане (4 M; 5 мл, 20 ммоль) добавляют по каплям к 0°C раствору C73 (106 мг, 0,199 ммоль) в дихлорметане (5 мл). Реакционную смесь перемешивают при 0°C в течение 15 минут и затем при 25°C в течение 2 часов, затем ее концентрируют в вакууме с получением продукта со снятой защитой в виде белого твердого вещества: ЖХМС m/z 434,2 [M+H]+. Его растворяют в дихлорметане (3 мл), охлаждают на ледяной бане, и обрабатывают пиридином (79,9 мг, 1,01 ммоль) и раствором трифторуксусного ангидрида (170 мг, 0,809 ммоль) в дихлорметане (1,5 мл). Реакционную смесь перемешивают при 20°C в течение 20 часов; затем добавляют пиридин (40,0 мг, 0,506 ммоль), и перемешивание продолжают в течение еще 12 часов при 25°C. После разбавления дихлорметаном (15 мл), реакционную смесь промывают последовательно хлористоводородной кислотой (1 M; 10 мл), насыщенным водным раствором бикарбоната натрия (3×10 мл), и насыщенным водным раствором хлорида натрия (10 мл), сушат, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (Градиент: 0% - 20% метанол в дихлорметане) затем сверхкритическая жидкостная хроматография [Колонка: Chiral Technologies Chiralpak IC, 30×250 мм, 10 мкм; Подвижная фаза: 3:1 диоксид углерода/(метанол содержащий 0,1% гидроксида аммония); Скорость потока: 70 мл/минуту], с получением разделенных диастереомеров (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-циклобутил-N-(трифторацетил)-L-аланил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида и (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-циклобутил-N-(трифторацетил)-D-аланил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида. Какой из продуктов содержит D-аланил конфигурацию, а какой содержит L-аланил конфигурацию определено не было; первый элюированный диастереомер обозначают 88, и второй элюированный диастереомер обозначают как 89. Оба получают в виде белого твердого вещества.
88 - Выход: 9,3 мг, 18,2 мкмоль, 9% за 2 стадии. ЖХМС m/z 512,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,75 (шд, J=7,0 Гц, 1H), 8,96 (д, J=8,1 Гц, 1H), 7,71 (с, 1H), 5,00-4,90 (м, 1H), 4,32-4,23 (м, 1H), 4,13 (с, 1H), 3,82 (дд, компонент системы АВХ, J=10,2, 5,4 Гц, 1H), 3,69 (д, половина АВ квартета, J=10,2 Гц, 1H), 3,20-3,02 (м, 2H), 2,44-2,28 (м, 2H), 2,16-2,04 (м, 2H), 2,04-1,91 (м, 2H), 1,87-1,54 (м, 9H), 1,32 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,03 (с, 3H), 0,88 (с, 3H). Время удержания: 2,78 минут (Аналитические условия. Колонка: Chiral Technologies Chiralpak IC-3, 4,6×150 мм, 3 мкм; Подвижная фаза A: диоксид углерода; Подвижная фаза B: метанол содержащий 0,05% диэтиламин (об./об.); Градиент: 5% - 40% B в течение 5 минут, затем 40% B в течение 2,5 минут; Обратное давление: 1500 ф./кв.д.; Скорость потока: 2,5 мл/минуту).
89 - Выход: 23 мг, 45,0 ммоль, 23% за 2 стадии. 1H ЯМР анализ показывает, что этот продукт существует в виде смеси ротамеров. ЖХМС m/z 512,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ [9,92 ш (с) и 9,65 (шс), всего 1H], [9,22 (д, J=7,7 Гц) и 8,85 (д, J=8,4 Гц), всего 1H], [7,76 (с) и 7,67 (с), всего 1H], [5,11-5,00 (м) и 4,98-4,87 (м), всего 1H], [4,51 (с) и 4,07 (с), всего 1H], [4,47-4,36 (м) и 4,09-4,00 (м), всего 1H], [3,90 (дд, J=10,2, 5,3 Гц) и 3,60-3,45 (м), всего 2H], 3,21-3,00 (м, 2H), 2,44-2,33 (м, 1H), 2,28-1,98 (м, 3H), 1,98-1,52 (м, 10H), [1,49-1,38 (м) и 1,32 (д, половина АВ квартета, J=7,6 Гц), всего 2H], [1,04 (с) и 1,02 (с), всего 3H], [0,93 (с) и 0,82 (с), всего 3H]. Время удержания: 4,14 минут (Аналитические условия идентичны тем, которые применяют для 88).
Пример 90
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-(пиридин-2-ил)-N-(трифторацетил)-L-аланил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (90)
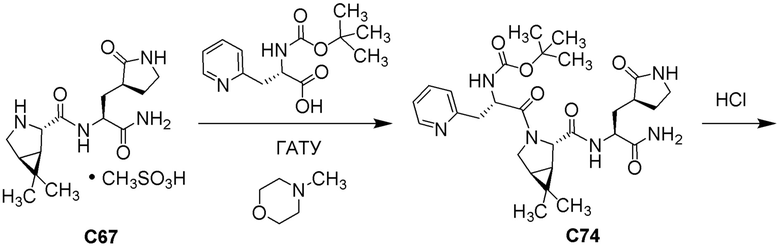
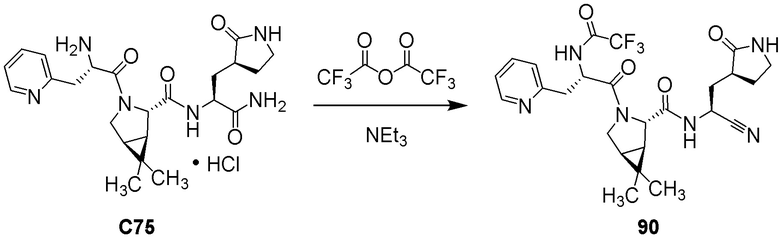
Стадия 1. Синтез трет-бутил [(2S)-1-[(1R,2S,5S)-2-({(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-1-оксо-3-(пиридин-2-ил)пропан-2-ил]карбамата (C74).
К 0°C раствору C67 (250 мг, 0,618 ммоль) и N-(трет-бутоксикарбонил)-3-пиридин-2-ил-L-аланина (198 мг, 0,744 ммоль) в N, N-диметилформамиде (2 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 282 мг, 0,742 ммоль), затем по каплям добавляют раствор 4-метилморфолин (188 мг, 1,86 ммоль) в N, N-диметилформамиде (1 мл). Реакционную смесь затем нагревают до 20°C и перемешивают в течение 2 часов, затем ее разбавляют водой (10 мл) и экстрагируют этилацетатом (10 мл). Твердый сульфат натрия добавляют к водному слою до достижения насыщения, затем водный слой экстрагируют смесью дихлорметана и метанола (10:1, 3×20 мл). Объединенные органические слои концентрируют в вакууме и очищают хроматографией на силикагеле (Градиент: 0% - 10% метанол в дихлорметане), с получением C74 в виде желтой камеди. Выход: 250 мг, 0,449 ммоль, 73%. ЖХМС m/z 557,0 [M+H]+. 1H ЯМР (400 MГц, метанол-d4), характеристические пики: δ 8,49 (д, J=5,2 Гц, 1H), 7,78-7,71 (м, 1H), 7,35 (д, J=7,8 Гц, 1H), 7,30-7,25 (м, 1H), 4,73 (дд, J=8,5, 5,2 Гц, 1H), 4,40 (дд, J=11,8, 4,2 Гц, 1H), 4,30 (с, 1H), 4,01-3,90 (м, 1H), 3,26 (дд, J=14,2, 5,6 Гц, 1H), 2,94 (дд, J=14,1, 8,9 Гц, 1H), 2,65-2,53 (м, 1H), 2,37-2,25 (м, 1H), 2,14-2,04 (м, 1H), 1,91-1,78 (м, 2H), 1,61-1,55 (м, 1H), 1,53 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,34 (с, 9H), 1,08 (с, 3H), 1,00 (с, 3H).
Стадия 2. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-[3-(пиридин-2-ил)-L-аланил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, гидрохлорида (C75).
Раствор гидрохлорида в 1,4-диоксане (4 M; 6 мл) добавляют к 0°C раствору C74 (250 мг, 0,449 ммоль) в дихлорметане (2 мл), и реакционную смесь перемешивают в течение 5 часов при 20°C. ЖХМС анализ показывает превращение в C75: ЖХМС m/z 457,1 [M+H]+. Удаление растворителей в вакууме дает C75 в виде желтого твердого вещества (250 мг); часть этого продукта применяют непосредственно на следующей стадии. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ 8,81 (шд, J=5,4 Гц, 1H), 8,43 (д, J=8,3 Гц, 1H), 8,39-8,31 (м, 1H), 7,90 (д, J=8,0 Гц, 1H), 7,87-7,81 (м, 1H), 7,65 (с, 1H), 7,43 (шс, 1H), 7,06 (шс, 1H), 4,77-4,67 (м, 1H), 4,35 (с, 1H), 4,32-4,23 (м, 1H), 3,94-3,86 (м, 1H), 3,80 (д, половина АВ квартета, J=10,6 Гц, 1H), 3,36-3,25 (м, 1H), 3,20-3,08 (м, 2H), 2,35-2,23 (м, 1H), 2,17-2,06 (м, 1H), 2,01-1,90 (м, 1H), 1,55-1,48 (м, 1H), 1,43 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,04 (с, 3H), 0,96 (с, 3H).
Стадия 3. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-(пиридин-2-ил)-N-(трифторацетил)-L-аланил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (90).
К 0°C раствору C75 (с предыдущей стадии; 175 мг, ≤0,314 ммоль) в дихлорметане (6 мл) добавляют пиридин (197 мг, 2,49 ммоль), затем раствор трифторуксусного ангидрида (186 мг, 0,886 ммоль) в дихлорметане (2 мл). Затем реакционную смесь перемешивают при 20°C в течение 2 часов, ее разбавляют водой и экстрагируют смесью дихлорметана и метанола (10:1, 3×15 мл). Объединенные органические слои концентрируют в вакууме и подвергают хроматографии на силикагеле (Градиент: 0% - 10% метанол в дихлорметане), затем сверхкритической жидкостной хроматографии [Колонка: Chiral Technologies Chiralpak AS, 30×250 мм, 10 мкм; Подвижная фаза: 3:1 диоксид углерода/(этанол содержащий 0,1% гидроксид аммония); Скорость потока: 70 мл/минуту], с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-(пиридин-2-ил)-N-(трифторацетил)-L-аланил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (90) в виде белого твердого вещества. Выход: 25 мг, 46,8 мкмоль, 15% за 2 стадии. ЖХМС m/z 535,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,92 (д, J=7,5 Гц, 1H), 8,91 (д, J=8,0 Гц, 1H), 8,51 (шд, J=5 Гц, 1H), 7,75-7,68 (м, 2H), 7,28 (д, J=7,8 Гц, 1H), 7,25 (дд, J=7,3, 5,1 Гц, 1H), 5,00-4,88 (м, 2H), 4,15 (с, 1H), 3,86 (дд, компонент системы АВХ, J=10,3, 5,4 Гц, 1H), 3,70 (д, половина АВ квартета, J=10,3 Гц, 1H), 3,21-3,04 (м, 4H), 2,42-2,31 (м, 1H), 2,18-2,04 (м, 2H), 1,76 (ддд, J=13,5, 9,6, 6,6 Гц, 1H), 1,74-1,62 (м, 1H), 1,62-1,53 (м, 1H), 1,33 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,03 (с, 3H), 0,89 (с, 3H).
Пример 91
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-{N-[(4-фторфенокси)ацетил]-3-метил-L-валил}-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид (91)
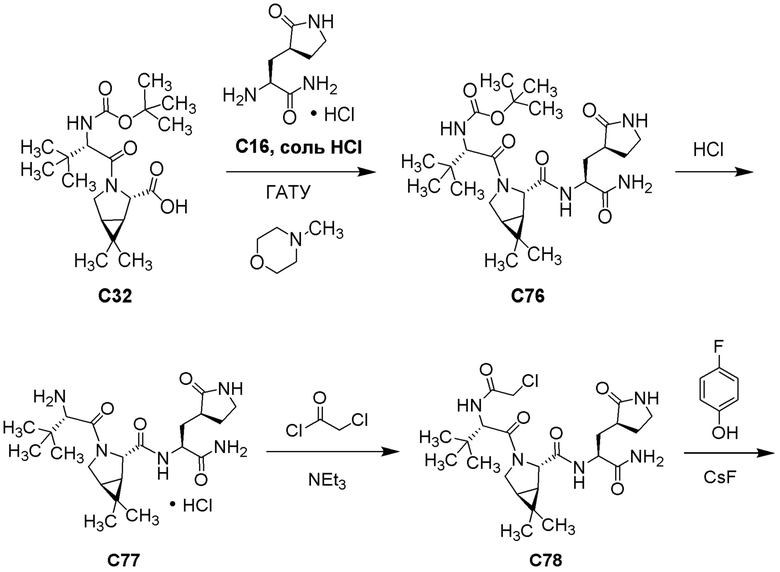
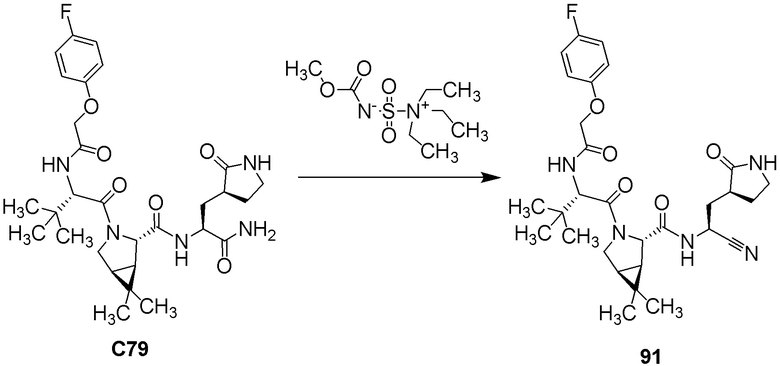
Стадия 1. Синтез трет-бутил {(2S)-1-[(1R,2S,5S)-2-({(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-3,3-диметил-1-оксобутан-2-ил}карбамата (C76).
Раствор C32 (15,4 г, 41,8 ммоль) и C16, соли HCl (75%, 11,6 г, 41,9 ммоль) в N, N-диметилформамиде (380 мл) охлаждают до -5°C - 0°C. Туда добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 18,3 г, 48,1 ммоль) и 4-метилморфолин (12,7 г, 126 ммоль) при -5°C - 0°C. Затем реакционную смесь перемешивают при 0°C в течение 1,5 часов, ее выливают в ледяную воду (400 мл) и полученную смесь экстрагируют этилацетатом (3×200 мл). Объединенные органические слои последовательно промывают водным раствором лимонной кислоты (1 M; 120 мл), насыщенным водным раствором бикарбоната натрия (120 мл) и насыщенным водным раствором хлорида натрия (3×60 мл), сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и объединяют с неочищенным продуктом из аналогичной реакции, проводимой с применением C32 (1,08 г, 2,93 ммоль). Хроматография на силикагеле (Градиент: 0% - 10% метанол в дихлорметане) дает C76 в виде белого твердого вещества (9,80 г). Объединенные водные слои экстрагируют смесью хлороформа и 2-пропанола (4:1, 3×100 мл); концентрация этих объединенных экстрактов с последующей хроматографией на силикагеле (Градиент: 0% - 10% метанол в дихлорметане) дает дополнительный C76 в виде белого твердого вещества (2,3 г). Объединенный выход: 12,1 гм, 23,2 ммоль, 52%. ЖХМС m/z 522,5 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 8,28 (шд, J=5,9 Гц, 1H), 7,20 (шс, 1H), 5,71 (шс, 1H), 5,38 (шс, 1H), 5,10 (шд, J=10,3 Гц, 1H), 4,47-4,38 (м, 1H), 4,28-4,20 (м, 2H), 4,12 (дд, компонент системы АВХ, J=10,2, 4,0 Гц, 1H), 3,99 (д, половина АВ квартета, J=10,2 Гц, 1H), 3,40-3,33 (м, 2H), 2,53-2,35 (м, 2H), 2,17-2,07 (м, 1H), 2,00-1,81 (м, 2H), 1,52-1,4 (м, 2H, предполагаемый; значительно закрыт сигналом пика воды и трет-бутила), 1,39 (с, 9H), 1,02 (с, 3H), 1,01 (с, 9H), 0,88 (с, 3H).
Стадия 2. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-(3-метил-L-валил)-3-азабицикло[3,1,0]гексан-2-карбоксамида, гидрохлорида (C77).
К 0°C раствору C76 (12,1 г, 23,2 ммоль) в дихлорметане (50 мл) добавляют раствор гидрохлорида в 1,4-диоксане (4 M; 250 мл). Затем реакционную смесь перемешивают при 20°C в течение 2 часов, ее фильтруют. Фильтровальную лепешку перемешивают метил трет-бутиловым эфиром (250 мл) в течение 18 часов; фильтрация дает C77 в виде светло-желтого/белого твердого вещества (10,89 г). ЖХМС m/z 422,2 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,38 (д, J=9,0 Гц, 1H), 8,19 (шс, 3H), 7,57 (шс, 1H), 7,41 (шс, 1H), 7,04 (шс, 1H), 4,35-4,27 (м, 1H), 4,34 (с, 1H), 3,85-3,72 (м, 2H), 3,65 (д, половина АВ квартета, J=10,8 Гц, 1H), 3,16-3,09 (м, 1H), 3,05-2,95 (м, 1H), 2,43-2,31 (м, 1H), 2,17-2,04 (м, 1H), 2,00-1,89 (м, 1H), 1,71-1,42 (м, 3H), 1,38 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,02 (с, 3H), 1,02 (с, 9H), 0,97 (с, 3H).
Стадия 3. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-3-[N-(хлорацетил)-3-метил-L-валил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида (C78).
Триэтиламин (2,21 г, 21,8 ммоль) добавляют к 0°C раствору C77 (с предыдущей стадии; 2,50 г, ≤5,33 ммоль) в дихлорметане (100 мл). Раствор хлорацетилхлорида (1,23 г, 10,9 ммоль) в дихлорметане (9 мл) добавляют в реакционную смесь по каплям, и перемешивание продолжают при 0°C в течение 1 часа. Затем добавляют воду (50 мл), и полученную смесь экстрагируют смесь. хлороформа и 2-пропанола (4:1, 3×50 мл); объединенные органические слои промывают насыщенным водным раствором хлорида натрия (50 мл), сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Очистка хроматографией на силикагеле (Градиент: 0% - 10% метанол в дихлорметане) дает C78 в виде белого твердого вещества. Выход: 1,21 г, 2,43 ммоль, 46% за 2 стадии. ЖХМС m/z 498,1 (наблюдается паттерн изотопа хлора) [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,30-8,22 (м, 2H), 7,54 (шс, 1H), 7,30 (шс, 1H), 7,03 (шс, 1H), 4,35 (д, J=8,9 Гц, 1H), 4,29 (ддд, J=12,1, 8,7, 3,4 Гц, 1H), 4,24 (с, 1H), 4,11 (AB квартет, JAB=12,4 Гц, δνAB=14,3 Гц, 2H), 3,86 (дд, компонент системы АВХ, J=10,2, 5,4 Гц, 1H), 3,72 (д, половина АВ квартета, J=10,3 Гц, 1H), 3,18-3,08 (м, 1H), 3,07-2,97 (м, 1H), 2,48-2,36 (м, 1H), 2,19-2,08 (м, 1H), 1,99-1,88 (м, 1H), 1,69-1,43 (м, 3H), 1,37 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,01 (с, 3H), 0,94 (с, 9H), 0,84 (с, 3H).
Стадия 4. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-3-{N-[(4-фторфенокси)ацетил]-3-метил-L-валил}-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида (C79).
4-Фторфенол (49,5 мг, 0,442 ммоль) добавляют к смеси фторида цезия (67,1 мг, 0,442 ммоль) в N, N-диметилформамиде (3 мл) и смесь перемешивают при 65°C в течение 1 часа, затем добавляют C78 (110,0 мг, 0,221 ммоль) и реакционную смесь перемешивают при 65°C в течение 8 часов. Ее затем объединяют с аналогичной реакцией, проводимой с применением C78 (30 мг, 60 мкмоль), выливают в воду (10 мл) и экстрагируют этилацетатом (3×10 мл). Объединенные органические слои промывают последовательно водой (20 мл), хлористоводородной кислотой (1 M; 10 мл), насыщенным водным раствором карбоната натрия (10 мл) и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (Градиент: 0% - 10% метанол в дихлорметане) дает C79 в виде белого стекла. Объединенный выход: 100 мг, 0,174 ммоль, 62%. ЖХМС m/z 574,2 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 8,23 (шд, J=6 Гц, 1H), 7,19 (шс, 1H), 7,04 (шд, J=10,2 Гц, 1H), 6,99 (дд, J=9,2, 8,0 Гц, 2H), 6,85 (дд, компонент системы АВХ, J=9,1, 4,2 Гц, 2H), 5,78 (шс, 1H), 5,46 (шс, 1H), 4,65 (д, J=9,8 Гц, 1H), 4,52-4,38 (м, 3H), 4,22 (с, 1H), 4,14 (дд, компонент системы АВХ, J=10,3, 5,3 Гц, 1H), 3,93 (д, половина АВ квартета, J=10,3 Гц, 1H), 3,41-3,32 (м, 2H), 2,55-2,34 (м, 2H), 2,14-2,05 (м, 1H), 2,03-1,80 (м, 3H), 1,03 (с, 3H), 1,00 (с, 9H), 0,86 (с, 3H).
Стадия 5. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-{N-[(4-фторфенокси)ацетил]-3-метил-L-валил}-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида (91).
Раствор метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 125 мг, 0,524 ммоль) в дихлорметане (2 мл) добавляют по каплям к 10°C (комнатная температуре) раствору C79 (100 мг, 0,174 ммоль) в дихлорметане (4 мл). Затем реакционную смесь перемешивают при 10°C в течение 16 часов, ее разбавляют водой (10 мл) и экстрагируют дихлорметаном (3×10 мл). Объединенные органические слои промывают насыщенным водным раствором хлорида натрия (2×10 мл) и концентрируют в вакууме; хроматография на силикагеле (Градиент: 0% - 10% метанол в дихлорметане), затем сверхкритическая жидкостная хроматография [Колонка: Chiral Technologies Chiralcel OD, 30×250 мм, 10 мкм; Подвижная фаза: 4:1 диоксид углерода/(этанол содержащий 0,1% гидроксид аммония); Скорость потока: 60 мл/минуту], дает (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-{N-[(4-фторфенокси)ацетил]-3-метил-L-валил}-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид (91) в виде белого твердого вещества. Выход: 55 мг, 99,0 мкмоль, 57%. ЖХМС m/z 556,3 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,01 (д, J=8,5 Гц, 1H), 7,96 (д, J=9,1 Гц, 1H), 7,68 (с, 1H), 7,13-7,04 (м, 2H), 6,90-6,84 (м, 2H), 4,97 (ддд, J=10,9, 8,5, 5,1 Гц, 1H), 4,61-4,50 (м, 2H), 4,39 (д, J=8,9 Гц, 1H), 4,12 (с, 1H), 3,87 (дд, компонент системы АВХ, J=10,4, 5,5 Гц, 1H), 3,73 (д, половина АВ квартета, J=10,4 Гц, 1H), 3,19-3,09 (м, 1H), 3,09-2,99 (м, 1H), 2,47-2,36 (м, 1H, предполагаемый; частично закрыт пиком растворителя), 2,21-2,02 (м, 2H), 1,79-1,65 (м, 2H), 1,53 (дд, J=7,6, 5,4 Гц, 1H), 1,29 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,00 (с, 3H), 0,93 (с, 9H), 0,75 (с, 3H).
Пример 92
3-Метил-N-[(4-метилфенил)ацетил]-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамид (92)
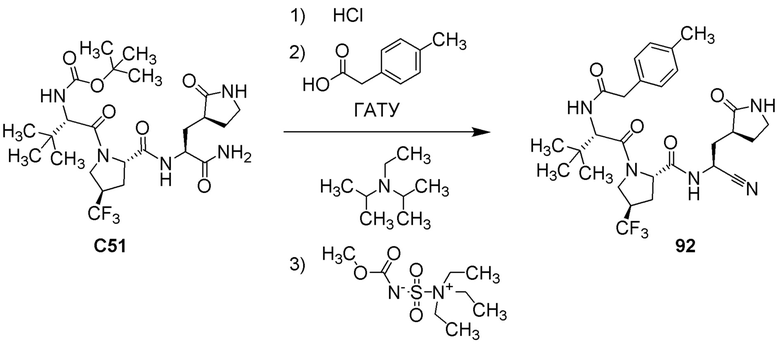
Смесь C51 (68,0 мг, 0,12 ммоль) и раствор гидрохлорида в 1,4-диоксане (4 M; 1 мл, 4 ммоль) перемешивают при комнатной температуре в течение 5 минут, затем реакционную смесь концентрируют в вакууме для удаления растворителя, затем далее отсасывают с применением высокого вакуума для удаления остаточного гидрохлорида. (4-Метилфенил)уксусную кислоту (18,6 мг, 0,124 ммоль) добавляют к остатку; полученную смесь растворяют в N, N-диметилформамиде (1,0 мл) и охлаждают до -30°C. После добавления N, N-диизопропилэтиламина (64,7 мкл, 0,371 ммоль), затем гексафторфосфата O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 61,2 мг, 0,161 ммоль), реакционную смесь нагревают до комнатной температуры в течение 1 часа и затем обрабатывают водным раствором бикарбоната натрия. Смесь экстрагируют 5 раз этилацетатом, и объединенные органические слои концентрируют при пониженном давлении. Остаток затем растворяют в дихлорметане (1 мл), обрабатывают метил N-(триэтиламмониосульфонил)карбаматом, внутренней солью (реагентом Бурджеса; 88,5 мг, 0,371 ммоль), и перемешивают при комнатной температуре в течение 1 часа, затем реакционную смесь обрабатывают разбавленным водным раствором карбоната натрия и экстрагируют дважды этилацетатом. Объединенные органические слои сушат над сульфатом магния, фильтруют, концентрируют в вакууме, и очищают ВЭЖХ с обращенной фазой (Колонка: Waters XBridge C18, 19×100 мм, 5 мкм; Подвижная фаза A: water; Подвижная фаза B: ацетонитрил; Градиент: 20% - 60% B в течение 8,5 минут, затем 60% - 95% B в течение 0,5 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 25 мл/минуту) с получением 3-метил-N-[(4-метилфенил)ацетил]-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамида (92). Выход: 20,7 мг, 36,7 мкмоль, 31%. ЖХМС m/z 564,8 [M+H]+. Время удержания: 2,71 минут (Аналитические условия. Колонка: Waters Atlantis dC18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.); Градиент: 5,0% - 95% B, линейный, в течение 4,0 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 2 мл/минуту).
Пример 93
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-(1H-пиразол-1-ил)-N-(трифторацетил)-L-аланил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (93)
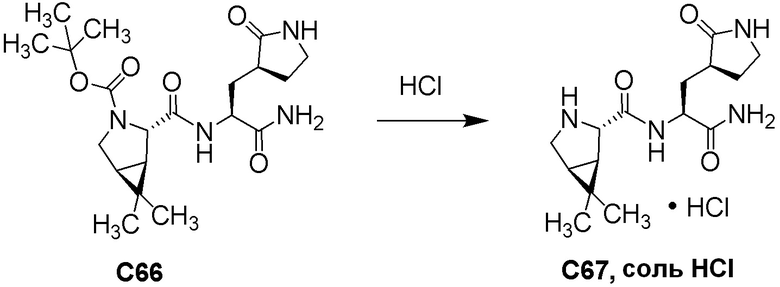
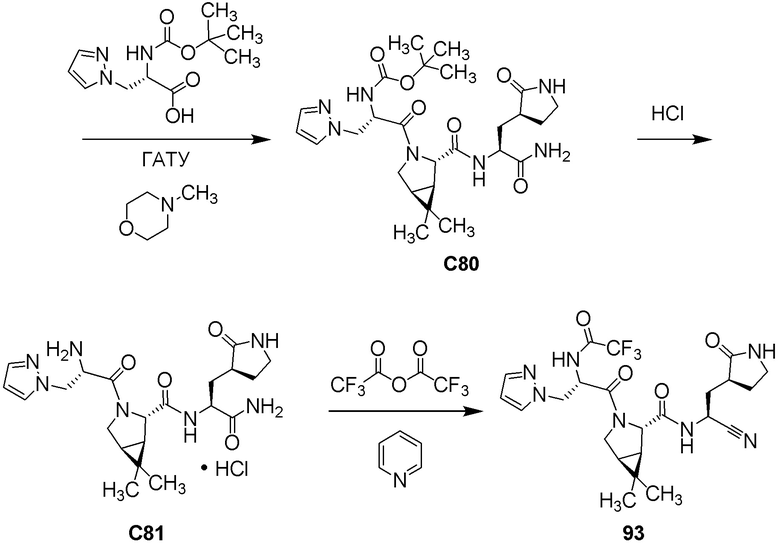
Стадия 1. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида, гидрохлорида (C67, соль HCl).
В раствор C66 (9,97 г, 24,4 ммоль) в дихлорметане (50 мл) добавляют раствор гидрохлорида в 1,4-диоксане (4 M; 90 мл). Реакционную смесь перемешивают при комнатной температуре (25°C) в течение 2 часов, затем ЖХМС анализ показывает превращение в C67: ЖХМС m/z 309,0 [M+H]+. Концентрация в вакууме дает C67, соль HCl в виде белого твердого вещества. Выход: 8,10 г, 23,5 ммоль, 96%. 1H ЯМР (400 MГц, ДМСО-d6) δ 10,20-10,08 (м, 1H), 8,93 (д, J=8,0 Гц, 1H), 8,86-8,71 (м, 1H), 7,68 (шс, 1H), 7,63 (шс, 1H), 7,12 (шс, 1H), 4,30 (ддд, J=10,9, 8,1, 4,1 Гц, 1H), 4,09-4,02 (м, 1H), 3,63-3,53 (м, 1H, предполагаемый; частично закрыт пиком воды), 3,22-2,99 (м, 3H), 2,34-2,22 (м, 1H), 2,21-2,11 (м, 1H), 2,01 (ддд, J=13,6, 11,1, 3,6 Гц, 1H), 1,80-1,66 (м, 3H), 1,55 (ддд, J=13,6, 11,4, 4,1 Гц, 1H), 1,08 (с, 3H), 1,05 (с, 3H).
Стадия 2. Синтез трет-бутил [(2S)-1-[(1R,2S,5S)-2-({(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-1-оксо-3-(1H-пиразол-1-ил)пропан-2-ил]карбамата (C80).
0°C раствор C67, соли HCl (300 мг, 0,870 ммоль) и N-(трет-бутоксикарбонил)-3-(1H-пиразол-1-ил)-L-аланина (222 мг, 0,870 ммоль) в N, N-диметилформамиде (10 мл) обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 430 мг, 1,13 ммоль) и 4-метилморфолином (264 мг, 2,61 ммоль). Затем реакционную смесь перемешивают при 0°C в течение 2 часов, ее разбавляют водой (50 мл) и экстрагируют этилацетатом (20 мл). Водный слой затем насыщают добавлением твердого сульфата натрия и экстрагируют смесью дихлорметана и метанола (10:1, 4×30 мл). Объединенные органические слои концентрируют в вакууме и подвергают хроматографии на силикагеле дважды (Градиент #1: 0% - 10% метанол в дихлорметане; Градиент #2: 0% - 25% метанол в дихлорметане), с получением C80 в виде ярко-желтого твердого вещества. Выход: 340 мг, 0,623 ммоль, 72%. ЖХМС m/z 546,1 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 8,29 (шд, J=8,6 Гц, 1H), 7,70-7,66 (м, 1H), 7,64 (с, 1H), 7,51 (шс, 1H), 7,38 (шд, J=8,2 Гц, 1H), 7,15-7,06 (м, 2H), 6,23-6,19 (м, 1H), 4,53-4,43 (м, 1H), 4,34-4,18 (м, 3H), 4,17 (с, 1H), 3,76 (д, половина АВ квартета, J=10,5 Гц, 1H), 3,65 (дд, компонент системы АВХ, J=10,4, 5,4 Гц, 1H), 3,20-3,06 (м, 2H), 2,36-2,24 (м, 1H), 2,19-2,08 (м, 1H), 2,02-1,90 (м, 1H), 1,71-1,55 (м, 2H), 1,53-1,46 (м, 1H), 1,39 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,30 (с, 9H), 1,01 (с, 3H), 0,89 (с, 3H).
Стадия 3. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-[3-(1H-пиразол-1-ил)-L-аланил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, гидрохлорида (C81).
Раствор гидрохлорида в 1,4-диоксане (4 M; 15 мл) добавляют к 0°C раствору C80 (340 мг, 0,623 ммоль) в дихлорметане (4 мл). Затем реакционную смесь перемешивают при 20°C в течение 1 часа, ее фильтруют, и фильтровальную лепешку промывают дихлорметаном (3×10 мл). Объединенные фильтраты концентрируют в вакууме с получением C81 в виде белого твердого вещества. Выход: 244 мг, 0,506 ммоль, 81%. ЖХМС m/z 446,0 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ 8,57-8,48 (м, 3H), 8,42 (шд, J=8,6 Гц, 1H), 7,81 (д, J=2,3 Гц, 1H), 7,65 (шс, 1H), 7,58 (д, J=1,9 Гц, 1H), 7,35 (шс, 1H), 7,09 (шс, 1H), 6,27 (дд, J=2, 2 Гц, 1H), 4,59 (дд, компонент системы АВХ, J=14,4, 4,7 Гц, 1H), 4,54-4,41 (м, 2H), 4,36-4,25 (м, 1H), 4,30 (с, 1H), 3,66-3,60 (м, 1H), 3,42-3,33 (м, 1H), 3,21-3,03 (м, 2H), 2,31-2,20 (м, 1H), 2,18-2,06 (м, 1H), 1,97 (ддд, J=13,5, 11,5, 3,7 Гц, 1H), 1,46 (дд, компонент системы АВХ, J=7,7, 5,3 Гц, 1H), 1,41 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,01 (с, 3H), 0,92 (с, 3H).
Стадия 4. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-(1H-пиразол-1-ил)-N-(трифторацетил)-L-аланил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (93).
0°C раствор C81 (120 мг, 0,249 ммоль) в дихлорметане (6,0 мл) обрабатывают пиридином (170 мг, 2,15 ммоль), затем aдобавляют раствор трифторуксусного ангидрида (158 мг, 0,752 ммоль) в дихлорметане (2,0 мл). Реакционную смесь затем нагревают до 20°C и перемешивают в течение 3 часов, затем ее разбавляют водой (20 мл) и экстрагируют дихлорметаном (3×20 мл). Объединенные органические слои промывают хлористоводородной кислотой (1 M; 20 мл) и насыщенным водным раствором хлорида натрия (2×20 мл), сушат, фильтруют, и концентрируют в вакууме. Хроматография на силикагеле (Градиент: 0% - 10% метанол в дихлорметане), затем сверхкритическая жидкостная хроматография [Колонка: Chiral Technologies Chiralpak AD, 30×250 мм, 10 мкм; Подвижная фаза: 4:1 диоксид углерода/(этанол содержащий 0,1% гидроксид аммония); Скорость потока: 60 мл/минуту], дает (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-(1H-пиразол-1-ил)-N-(трифторацетил)-L-аланил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (93) в виде белого твердого вещества. Выход: 15,0 мг, 28,6 мкмоль, 11%. ЖХМС m/z 524,0 [M+H]+. 1H ЯМР (500 MГц, ДМСО-d6) δ 10,03 (шс, 1H), 8,92 (д, J=8,0 Гц, 1H), 7,74 (шс, 1H), 7,69 (д, J=2,3 Гц, 1H), 7,51 (д, J=1,9 Гц, 1H), 6,23 (дд, J=2, 2 Гц, 1H), 5,01-4,93 (м, 1H), 4,91-4,83 (м, 1H), 4,49-4,39 (м, 2H), 4,13 (с, 1H), 3,73 (дд, компонент системы АВХ, J=10,4, 5,4 Гц, 1H), 3,60 (д, половина АВ квартета, J=10,4 Гц, 1H), 3,21-3,09 (м, 2H), 2,40-2,31 (м, 1H), 2,20-2,10 (м, 2H), 1,79 (ддд, J=13,7, 9,5, 6,8 Гц, 1H), 1,76-1,66 (м, 1H), 1,56 (дд, J=7,5, 5,4 Гц, 1H), 1,36 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,02 (с, 3H), 0,85 (с, 3H).
Пример 94
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[(2S)-4,4-дифтор-2-(2,2,2-трифторацетамидо)бутаноил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид (94)
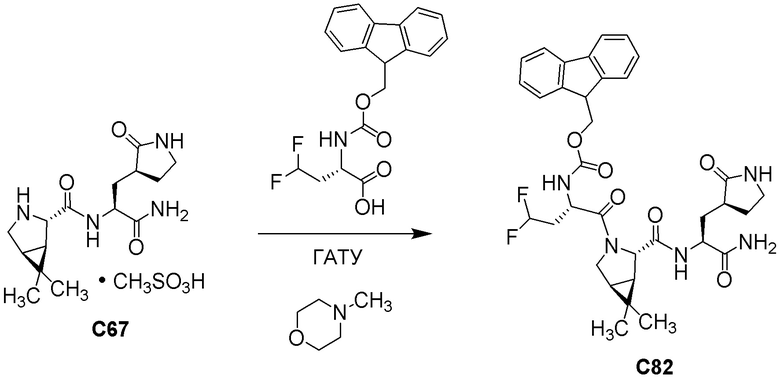
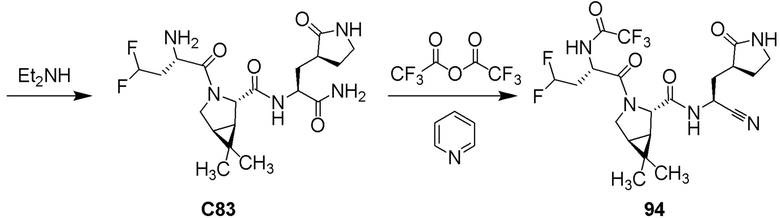
Стадия 1. Синтез 9H-флуорен-9-илметил {(2S)-1-[(1R,2S,5S)-2-({(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-4,4-дифтор-1-оксобутан-2-ил}карбамата (C82).
К 0°C раствору C67 (230 мг, 0,569 ммоль) и (2S)-2-{[(9H-флуорен-9-илметокси)карбонил]амино}-4,4-дифторбутановой кислоты (247 мг, 0,684 ммоль) в N, N-диметилформамиде (5 мл) добавляют гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 281 мг, 0,739 ммоль) одной порцией; затем по каплям добавляют 4-метилморфолин (173 мг, 1,71 ммоль). Затем реакционную смесь перемешивают при 0°C в течение 10 минут, ее нагревают до комнатной температуры (20°C) и перемешивание продолжают в течение 2 часов, затем реакционную смесь выливают в ледяную воду (15 мл) и экстрагируют этилацетатом (2×15 мл). Объединенные органические слои последовательно промывают 1 M хлористоводородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют, концентрируют в вакууме, и очищают хроматографией на силикагеле (Градиент: 0% - 10% метанол в дихлорметане) с получением C82 в виде белого твердого вещества. Выход: 245 мг, 0,376 ммоль, 66%. ЖХМС m/z 652,5 [M+H]+. 1H ЯМР (400 MГц, хлороформ-d) δ 8,86 (шс, 1H), 7,74 (д, J=7,6 Гц, 2H), 7,58-7,51 (м, 2H), 7,38 (дд, J=7,4, 7,4 Гц, 2H), 7,33-7,25 (м, 2H, предполагаемый; частично закрыт пиком растворителя), 7,08 (шс, 1H), 6,49-6,32 (м, 1H), 6,17-5,79 (м, 3H), 4,78-4,67 (м, 1H), 4,41-4,24 (м, 4H), 4,22-4,07 (м, 2H), 3,83 (д, J=10,5 Гц, 1H), 3,45-3,32 (м, 2H), 2,62-2,36 (м, 3H), 2,26-2,10 (м, 2H), 1,99-1,83 (м, 2H), 1,53 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,51-1,44 (м, 1H), 1,03 (с, 3H), 0,89 (с, 3H).
Стадия 2. Синтез (1R,2S,5S)-3-[(2S)-2-амино-4,4-дифторбутаноил]-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида (C83).
К 0°C суспензии C82 (195 мг, 0,299 ммоль) в дихлорметане (3 мл) добавляют раствор диэтиламина (32,8 мг, 0,448 ммоль) в дихлорметане (0,5 мл). Реакционную смесь перемешивают при 30°C в течение 16 часов, затем ее объединяют с аналогичной реакцией, проводимой с применением C82 (50 мг, 77 мкмоль) и концентрируют в вакууме. Очистка хроматографией на силикагеле [Градиент: 0% - 10% (10:1 смесь метанола и гидроксида аммония) в дихлорметане] дает C83 в виде бесцветной камеди. Объединенный выход: 149 мг, 0,347 ммоль, 92%. ЖХМС m/z 452,3 [M+Na+]. 1H ЯМР (400 MГц, хлороформ-d) δ 8,73 (шд, J=5,3 Гц, 1H), 7,11 (шс, 1H), 6,03 (тдд, J=56,8, 6,2, 3,0 Гц, 1H), 5,64 (шс, 1H), 5,28 (шс, 1H), 4,35-4,27 (м, 1H), 4,27 (с, 1H), 4,11 (дд, J=10,3, 5,5 Гц, 1H), 3,72 (дд, J=9,3, 4,1 Гц, 1H), 3,61 (д, J=10,3 Гц, 1H), 3,41-3,35 (м, 2H), 2,53-2,36 (м, 3H), 2,20-2,11 (м, 1H), 2,00-1,84 (м, 3H), 1,6-1,45 (м, 2H, предполагаемый; частично закрыт пиком воды), 1,06 (с, 3H), 0,94 (с, 3H).
Стадия 3. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[(2S)-4,4-дифтор-2-(2,2,2-трифторацетамидо)бутаноил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида (94).
К 0°C раствору C83 (99 мг, 0,23 ммоль) в дихлорметане (4 мл) добавляют пиридин (146 мг, 1,85 ммоль) и раствор трифторуксусного ангидрида (194 мг, 0,924 ммоль) в дихлорметане (2 мл). Реакционную смесь перемешивают при комнатной температуре (15°C) в течение 20 часов, обрабатывают дополнительным пиридином (30 мг, 0,38 ммоль) и перемешивают при комнатной температуре (15°C) в течение еще 16 часов. Ее затем разделяют между дихлорметаном (15 мл) и хлористоводородной кислотой (1 M; 15 мл), и органический слой промывают насыщенным водным раствором бикарбоната натрия (15 мл) и насыщенным водным раствором хлорида натрия (10 мл), сушат, фильтруют, и концентрируют в вакууме. Остаток объединяют с продуктом из аналогичной реакции, проводимой с применением C83 (50 мг, 0,12 ммоль) и очищают с применением ВЭЖХ с обращенной фазой (Колонка: Waters XBridge BEH C18, 25×150 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% гидроксид аммония (об./об.); Подвижная фаза B: ацетонитрил; Градиент: 23% - 63% B). (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[(2S)-4,4-дифтор-2-(2,2,2-трифторацетамидо)бутаноил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид (94) выделяют в виде белого твердого вещества. Объединенный выход: 28,8 мг, 56,8 мкмоль, 16%. ЖХМС m/z 508,0 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 10,01 (шс, 1H), 8,96 (д, J=8,0 Гц, 1H), 7,72 (с, 1H), 6,16 (тт, J=55,9, 4,6 Гц, 1H), 4,99-4,90 (м, 1H), 4,65-4,57 (м, 1H), 4,14 (с, 1H), 3,85 (дд, компонент системы АВХ, J=10,2, 5,4 Гц, 1H), 3,67 (д, половина АВ квартета, J=10,3 Гц, 1H), 3,21-3,04 (м, 2H), 2,42-2,19 (м, 3H), 2,17-2,04 (м, 2H), 1,83-1,64 (м, 2H), 1,60 (дд, J=7,6, 5,3 Гц, 1H), 1,35 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,03 (с, 3H), 0,89 (с, 3H).
Пример 95
N-(Метоксикарбонил)-3-метил-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамид (95)
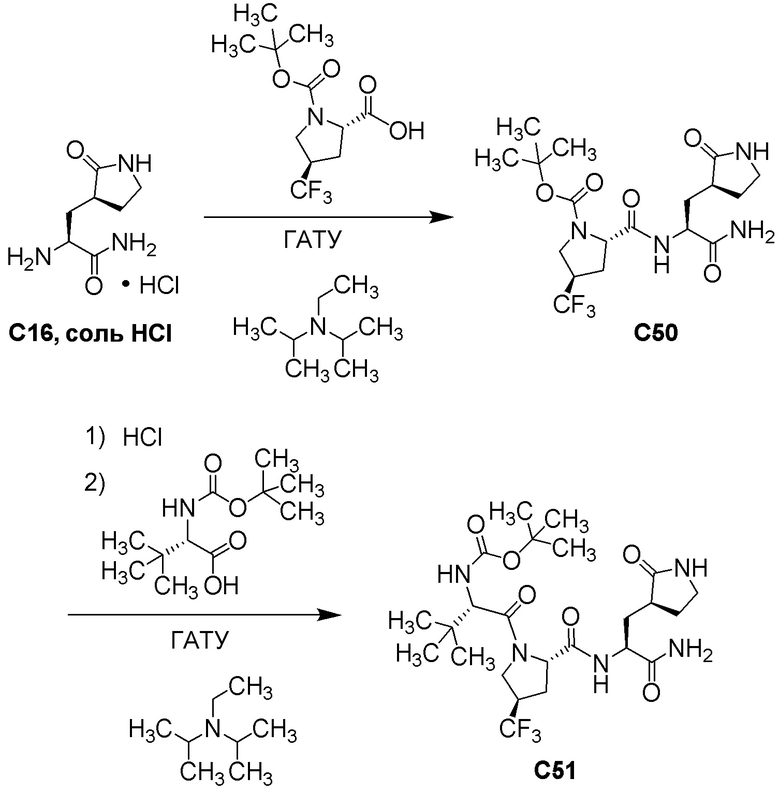
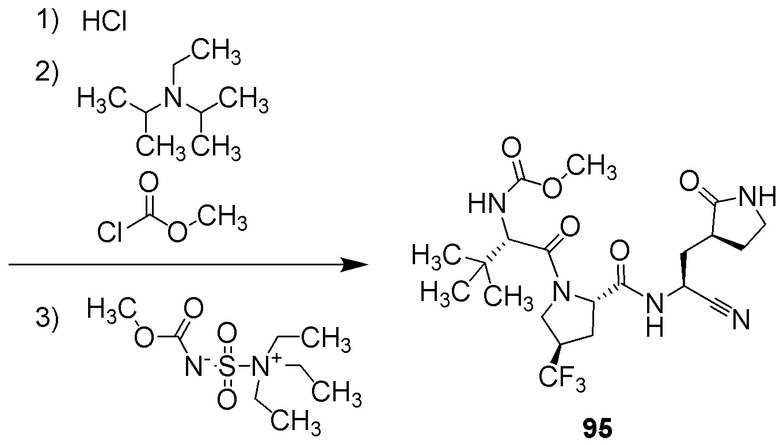
Стадия 1. Синтез (4R)-1-(трет-бутоксикарбонил)-4-(трифторметил)-L-пролил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C50).
N, N-диизопропилэтиламин (14,8 мл, 85,0 ммоль) добавляют к -30°C смеси (4R)-1-(трет-бутоксикарбонил)-4-(трифторметил)-L-пролина (8,00 г, 28,2 ммоль), C16, соли HCl (6,45 г, 31,1 ммоль) и гексафторфосфата O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 11,8 г, 31,0 ммоль) в N, N-диметилформамиде (100 мл). Реакционную смесь нагревают до 0°C в течение 1 часа, затем ЖХМС анализ показывает присутствие C50: ЖХМС m/z 437,3 [M+H]+. Водным раствором бикарбоната натрия (300 мл) добавляют, и полученную смесь экстрагируют со смесью 2-пропанола и дихлорметана (1:4, 5×100 мл); объединенные органические слои концентрируют в вакууме и очищают хроматографией на силикагеле (Градиент: 0% - 100% метанол в дихлорметане), с получением C50 в виде масла. 1H ЯМР анализ показывает, что этот продукт существует в виде смеси ротамеров. Выход: 10,9 г, 25,0 ммоль, 89%. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ [8,28 (д, J=8,5 Гц) и 8,22 (д, J=8,2 Гц), всего 1H], [7,64 (с) и 7,59 (с), всего 1H], [7,38 (шс) и 7,27 (шс), всего 1H], 7,05 (шс, 1H), 4,38-4,28 (м, 1H), 4,28-4,17 (м, 1H), 3,45-3,36 (м, 1H), 3,12-3,00 (м, 1H), 2,42-2,03 (м, 4H), 2,02-1,89 (м, 1H), 1,80-1,45 (м, 2H), [1,39 (с) и 1,32 (с), всего 9H].
Стадия 2. Синтез N-(трет-бутоксикарбонил)-3-метил-L-валил-(4R)-4-(трифторметил)-L-пролил-3-[(3S)-2-оксопирролидин-3-ил]-L-аланинамида (C51).
Раствор гидрохлорида в 1,4-диоксане (4 M; 80 мл) добавляют в раствор C50 (7,00 г, 16,0 ммоль) в дихлорметане (15 мл). Затем реакционную смесь перемешивают при комнатной температуре в течение 5 минут, ее концентрируют в вакууме для удаления растворителя, и затем отсасывают через высокий вакуум для удаления остаточного гидрохлорида. Остаток смешивают с N-(трет-бутоксикарбонил)-3-метил-L-валином (4,08 г, 17,6 ммоль) и гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 6,71 г, 17,6 ммоль) в N, N-диметилформамиде (25 мл), охлаждают до -30°C и обрабатывают N, N-диизопропилэтиламином (8,38 мл, 48,1 ммоль). Реакционную смесь нагревают до 0°C в течение 1 часа, затем ЖХМС анализ показывает присутствие C51: ЖХМС m/z 550,4 [M+H]+. Реакционную смесь затем разбавляют водным раствором бикарбоната натрия и экстрагируют три раза 4:1 смесью дихлорметана и 2-пропанола. Затем объединенные органические слои концентрируют в вакууме, остаток очищают хроматографией на силикагеле (Градиент: 0% - 30% метанол в дихлорметане), с получением C51 в виде твердого вещества. Выход: 3,95 г, 7,19 ммоль, 45%, 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ 8,28 (д, J=8,8 Гц, 1H), 7,55 (с, 1H), 7,29 (шс, 1H), 7,03 (шс, 1H), 6,77 (шд, J=9,1 Гц, 1H), 4,52-4,43 (м, 1H), 4,24 (ддд, J=12,2, 8,7, 3,5 Гц, 1H), 4,12 (д, J=9,2 Гц, 1H), 4,02-3,84 (м, 2H), 3,16-3,08 (м, 1H), 3,08-2,98 (м, 1H), 2,50-2,37 (м, 1H), 2,31-2,20 (м, 1H), 2,19-2,05 (м, 2H), 2,00-1,87 (м, 1H), 1,69-1,55 (м, 1H), 1,55-1,44 (м, 1H), 1,36 (с, 9H), 0,93 (с, 9H).
Стадия 3. Синтез N-(метоксикарбонил)-3-метил-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамида (95).
Смесь C51 (230 мг, 0,418 ммоль) и раствор гидрохлорида в 1,4-диоксане (4 M; 2 мл, 8 ммоль) перемешивают при комнатной температуре в течение 5 минут, затем реакционную смесь концентрируют в вакууме для удаления растворителя, затем отсасывают через высокий вакуум для удаления остаточного гидрохлорида. Остаток растворяют в дихлорметане (2 мл), охлаждают до 0°C и обрабатывают N, N-диизопропилэтиламином (0,219 мл, 1,26 ммоль) затем метилхлорформиатом (59,3 мг, 0,628 ммоль). Затем реакционную смесь перемешивают при 0°C в течение 10 минут, ее разбавляют водным раствором бикарбоната натрия и экстрагируют три раза 4:1 смесью дихлорметана и 2-пропанола; объединенные органические слои сушат над сульфатом магния, фильтруют, и концентрируют в вакууме. Остаток растворяют в дихлорметане (3 мл); после добавления метил N-(триэтиламмониосульфонил)карбамата, внутренней соли (реагент Бурджеса; 299 мг, 1,25 ммоль), реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Ее затем обрабатывают разбавленным водным раствором карбоната натрия и экстрагируют 3 раза этилацетатом. Объединенные органические слои сушат над сульфатом магния, фильтруют, и очищают хроматографией на силикагеле (Градиент: 50% - 100% этилацетат в гептане). Полученный продукт суспендируют в гептане (4 мл) при 50°C в течение 2 часов, охлаждают до комнатной температуры и перемешивают при комнатной температуре в течение ночи; сбор твердого вещества дает N-(метоксикарбонил)-3-метил-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамид (95) в виде твердого вещества. Выход: 123 мг, 0,251 ммоль, 60%. ЖХМС m/z 490,4 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,02 (д, J=8,6 Гц, 1H), 7,65 (с, 1H), 7,27 (шд, J=8,7 Гц, 1H), 4,94 (ддд, J=11,1, 8,5, 5,0 Гц, 1H), 4,36 (дд, J=7,3, 7,2 Гц, 1H), 4,14 (д, J=8,7 Гц, 1H), 4,00-3,91 (м, 2H), 3,52 (с, 3H), 3,46-3,34 (м, 1H, предполагаемый; частично закрыт пиком воды), 3,18-2,98 (м, 2H), 2,5-2,39 (м, 1H, предполагаемый; частично закрыт пиком растворителя), 2,35-2,23 (м, 1H), 2,22-2,01 (м, 3H), 1,77-1,63 (м, 2H), 0,94 (с, 9H).
Пример 96
(1R,2S,5S)-N-{(1R)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (96) и (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (13), Твердая форма 5
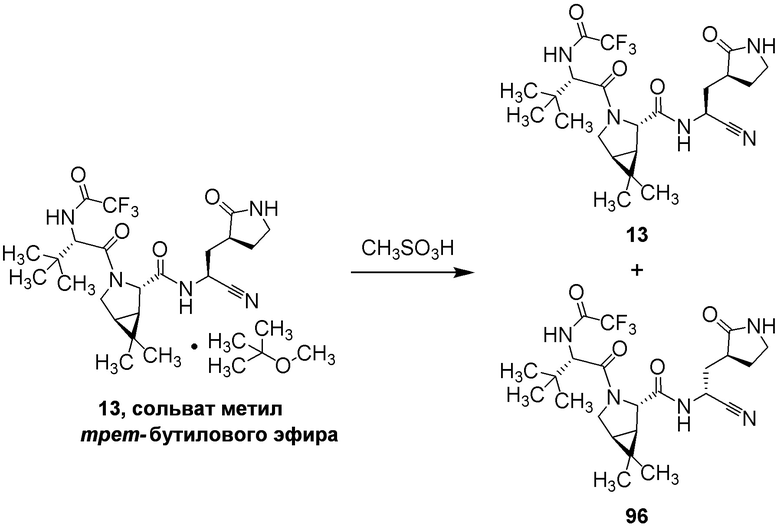
В раствор 13, сольвата метил трет-бутилового эфира (из альтернативного синтеза из примера 13, сольват метил трет-бутилового эфира; 15,0 г, 25,5 ммоль) в ацетонитриле (80 мл) добавляют метансульфоновую кислоту (6,4 мл, 99 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 4 часов, затем ее подщелачивают добавлением смеси насыщенного водного раствора бикарбоната натрия (80 мл) и насыщенного водного раствора хлорида натрия (10 мл). Полученную смесь экстрагируют дихлорметаном (2×100 мл), и объединенные органические слои сушат над сульфатом натрия, фильтруют, и концентрируют в вакууме. Разделение двух эпимеров проводят сверхкритической жидкостной хроматографией (Колонка: Chiral Technologies Chiralcel OX-H, 30×250 мм, 5 мкм; Подвижная фаза: 9:1 диоксид углерода/2-пропанол; Обратное давление: 100 бар; Скорость потока: 80 мл/минуту). Первым элюированным продуктом является восстановленный (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамид (13). Согласно порошковой рентгеновской дифракции, этот продукт является аморфным; его обозначают как Твердую форму 5. Второй элюированный продукт получают в виде стекла, которое растворяют в дихлорметане, обрабатывают гептаном и концентрируют в вакууме с получением (1R,2S,5S)-N-{(1R)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (96) в виде твердого вещества.
Восстановленное 13 - Выход: 6,00 г, 12,0 ммоль, 47%. ЖХМС m/z 500,3 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,46-9,33 (м, 1H), 9,01 (д, J=8,5 Гц, 1H), 7,66 (с, 1H), 5,03-4,91 (м, 1H), 4,46-4,37 (м, 1H), 4,16 (с, 1H), 3,97- 3,86 (м, 1H), 3,69 (д, половина АВ квартета, J=10,4 Гц, 1H), 3,19-3,09 (м, 1H), 3,09-2,98 (м, 1H), 2,46-2,33 (м, 1H), 2,21-2,03 (м, 2H), 1,79-1,65 (м, 2H), 1,61-1,53 (м, 1H), 1,32 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,03 (с, 3H), 0,98 (с, 9H), 0,85 (с, 3H). Время удержания: 3,93 минут (Аналитические условия. Колонка: Chiral Technologies Chiralcel OX-H, 4,6×250 мм, 5 мкм; Подвижная фаза A: диоксид углерода; Подвижная фаза B: 2-пропанол; Градиент: 5% B в течение 1,00 минуты, затем 5% - 60% B в течение 8,00 минут; Обратное давление: 120 бар; Скорость потока: 3,0 мл/минуту). Порошковая рентгеновская дифрактограмма для этого аморфоного продукта дана на Фигуре 9. Способ сбора данных порошковой рентгеновской дифракции описан в Альтернативном синтезе примера 13, сольвата метил трет-бутилового эфира, Стадия 8.
96 - Выход: 2,58 г, 5,16 ммоль, 20%. ЖХМС m/z 500,3 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6) δ 9,42 (д, J=8,4 Гц, 1H), 9,06 (д, J=7,6 Гц, 1H), 7,79 (с, 1H), 4,96-4,86 (м, 1H), 4,41 (д, J=8,7 Гц, 1H), 4,20 (с, 1H), 3,92 (шдд, J=10,7, 5,4 Гц, 1H), 3,66 (д, половина АВ квартета, J=10,5 Гц, 1H), 3,22-3,12 (м, 2H), 2,43-2,31 (м, 1H), 2,31-2,20 (м, 1H), 2,16-2,04 (м, 1H), 1,84-1,63 (м, 2H), 1,57-1,49 (м, 1H), 1,32 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,00 (шс, 12H), 0,84 (с, 3H). Время удержания: 4,20 минут (Аналитические условия идентичны тем, которые применяют для восстановленного 13 выше).
Пример 97
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[2-(2,2,2-трифторацетамидо)-3-(трифторметил)пентаноил]-3-азабицикло[3,1,0]гексан-2-карбоксамид, из C86 (DIAST-2) (97)
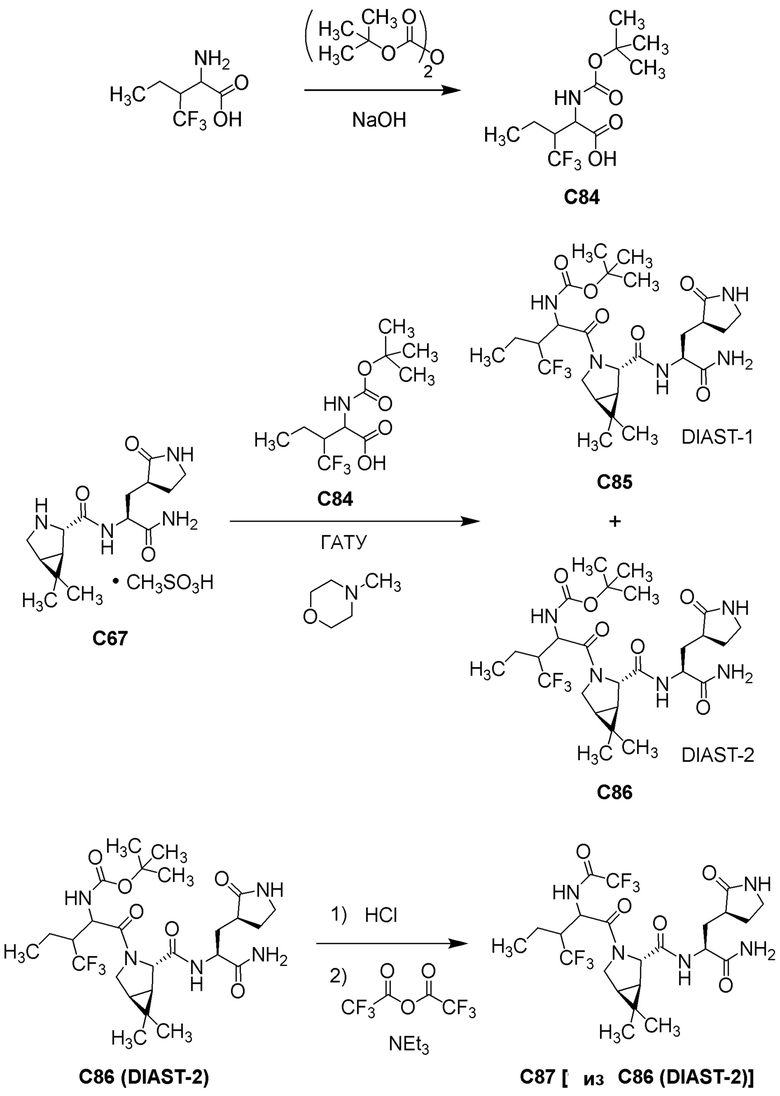
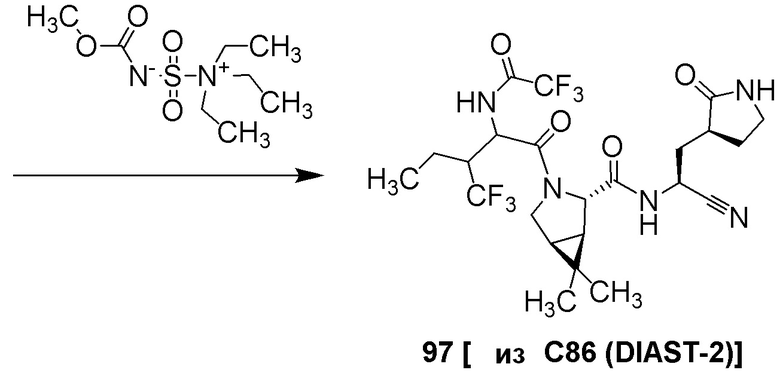
Стадия 1. Синтез 2-[(трет-бутоксикарбонил)амино]-3-(трифторметил)пентанoвой кислоты (C84).
Водный раствор гидроксида натрия (1 M; 1,48 мл, 1,48 ммоль) добавляют в суспензию 2-амино-3-(трифторметил)пентановой кислоты (Wang et al., J. Amer. Chem. Soc. 2003, 125, 6900-6906; 137 мг, 0,740 ммоль) в 1,4-диоксане (3 мл) и полученную смесь охлаждают до 0°C. Медленно добавляют ди-трет-бутилдикарбонат (0,204 мл, 0,888 ммоль), затем реакционную смесь перемешивают при комнатной температуре в течение ночи. После разбавления этилацетатом, реакционную смесь охлаждают на ледяной бане и затем подкисляют до pH 2 добавлением 1 M водного раствора гидросульфата калия. Водный слой экстрагируют дважды этилацетатом, и объединенные органические слои сушат над сульфатом магния, фильтруют, и концентрируют в вакууме, с получением C84 в виде твердого вещества. Этот продукт предположительно состоит из смеси 4 диастереомеров, потенциально демонстрирующих также ротамеры. Выход: 197 мг, 0,690 ммоль, 93%. ЖХМС m/z 284,3 [M-H]-. 1H ЯМР (400 MГц, ДМСО-d6) δ 13,16 (шс, 1H), [7,29 (д, основной, J=9,8 Гц) и 6,95-6,85 (м, незначительный), всего 1H], [4,55 (дд, основной, J=9,8, 3,3 Гц), 4,46 (шд, незначительный, J=9,1 Гц), и 4,40 (дд, незначительный, J=9,4, 4,5 Гц), всего 1H], 2,86-2,67 (м, 1H), 1,71-1,47 (м, 2H), 1,39 (шс, 9H), [0,98 (т, незначительный, J=7,4 Гц) и 0,91 (т, основной, J=7,5 Гц), всего 3H].
Стадия 2. Синтез трет-бутил {1-[(1R,2S,5S)-2-({(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-1-оксо-3-(трифторметил)пентан-2-ил}карбамата, DIAST-1 (C85) и трет-бутил {1-[(1R,2S,5S)-2-({(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}карбамоил)-6,6-диметил-3-азабицикло[3,1,0]гексан-3-ил]-1-оксо-3-(трифторметил)пентан-2-ил}карбамата, DIAST-2 (C86).
0°C раствор C84 (128 мг, 0,449 ммоль) в смеси ацетонитрила (2,7 мл) и N, N-диметилформамида (1,5 мл) обрабатывают гексафторфосфатом O-(7-азабензотриазол-1-ил)-N, N,N’,N’-тетраметилурония (ГАТУ; 176 мг, 0,463 ммоль) и 4-метилморфолином (0,116 мл, 1,06 ммоль). Затем реакционную смесь перемешивают при 0°C в течение 30 минут, C67 (170 мг, 0,420 ммоль) добавляют в виде твердого вещества, и перемешивание продолжают в течение 2 часов. Реакционную смесь затем разбавляют этилацетатом и водой, и промывают насыщенным водным раствором бикарбоната натрия. Водный слой экстрагируют дважды этилацетатом, и объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют, и концентрируют в вакууме. Полученное масло подвергают азеотропной перегонке дважды гептаном и дважды метил трет-бутиловым эфиром, затем подвергают хроматографии на силикагеле (Градиент: 0% - 20% метанол в дихлорметане). Первый элюированный диастереомер обозначают C85, и второй элюированный диастереомер обозначают как C86.
C85 (DIAST-1) - Выход: 77,3 мг, 0,134 ммоль, 32%. Этот продукт содержит смесь изомеров или ротамеров по 1H ЯМР анализу. ЖХМС m/z 576,2 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики, интеграции являются приблизительными: δ [8,35 (д, J=7,9 Гц) и 8,16 (д, J=8,5 Гц), всего 1H], 7,62-7,54 (м, 1H), 7,41-7,18 (м, 2H), [7,02 (шс) и 6,98 (шс), всего 1H], 4,59-4,50 (м, 1H), 4,29-4,13 (м, 2H), 3,89 (дд, J=10,4, 5,4 Гц, 1H), 3,44 (д, J=10,4 Гц, 1H), 3,20-3,04 (м, 2H), 2,70-2,59 (м, 1H), 2,43-2,31 (м, 1H), 2,21-2,08 (м, 1H), 1,99-1,88 (м, 1H), [1,38 (с) и 1,36 (с), всего 9H], 1,01 (шс, 3H), 0,94-0,82 (м, 6H).
C86 (DIAST-2) - Выход: 87,8 мг, 0,153 ммоль, 36%. Этот продукт в большей части является единственным изомером по 1H ЯМР анализу. ЖХМС m/z 576,2 [M+H]+. 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики: δ 8,27 (д, J=8,6 Гц, 1H), 7,59 (с, 1H), 7,31 (д, J=9,5 Гц, 1H), 7,22 (шс, 1H), 7,04 (шс, 1H), 4,55 (дд, J=9,5, 5,9 Гц, 1H), 4,30-4,17 (м, 1H), 4,23 (с, 1H), 3,79 (дд, компонент системы АВХ, J=10,1, 5,2 Гц, 1H), 3,71 (д, половина АВ квартета, J=10,1 Гц, 1H), 3,09-2,99 (м, 1H), 2,68-2,55 (м, 1H), 2,42-2,30 (м, 1H), 2,17-2,04 (м, 1H), 1,97-1,86 (м, 1H), 1,36 (с, 9H), 1,02 (с, 3H), 0,94-0,83 (м, 6H).
Стадия 3. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-[2-(2,2,2-трифторацетамидо)-3-(трифторметил)пентанoил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, из C86 (DIAST-2) (C87).
Раствор C86 (DIAST-2) (87,8 мг, 0,153 ммоль) в дихлорметане (1 мл) обрабатывают раствор гидрохлорида в 1,4-диоксане (4 M; 0,381 мл, 1,52 ммоль). Затем реакционную смесь перемешивают при комнатной температуре в течение 40 минут, добавляют метанол (0,5 мл) для улучшения растворимости. После еще 40 минут, добавляют раствор гидрохлорида в 1,4-диоксане (4 M; 0,10 мл, 0,4 ммоль); через 30 минут, ЖХМС анализ показывает полное удаление защитной группы: ЖХМС m/z 476,2 [M+H]+. Реакционную смесь концентрируют в вакууме и подвергают азеотропной перегонке дважды гептаном; остаток растирают дважды диэтиловым эфиром, суспендируют в дихлорметане (1,2 мл) и охлаждают до 0°C. После добавления триэтиламина (42,4 мкл, 0,304 ммоль), затем трифторуксусного ангидрида (47,9 мкл, 0,339 ммоль), реакционную смесь перемешивают при 0°C в течение 30 минут, затем ее удаляют из ледяной бани и разделяют между водой и этилацетатом. Водный слой экстрагируют этилацетатом, и объединенные органические слои промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют, концентрируют в вакууме, и подвергают азеотропной перегонке дважды с метил трет-бутиловым эфиром. По 1H ЯМР и ЖХМС анализу, этот продукт содержит смесь C87 и соответствующий метиловый эфир (ЖХМС m/z 587,4 [M+H]+). 1H ЯМР (400 MГц, ДМСО-d6), характеристические пики для C87: δ 8,31 (д, J=8,7 Гц, 1H), 7,59 (с, 1H), 7,26 (с, 1H), 7,05 (с, 1H), 3,59 (д, половина АВ квартета, J=10,0 Гц, 1H), 1,97-1,87 (м, 1H), 1,40 (д, половина АВ квартета, J=7,6 Гц, 1H), 1,03 (с, 3H), 0,84 (с, 3H). Очистка хроматографией на силикагеле (Градиент: 0% - 20% метанол в дихлорметане), затем азеотропная перегонка полученного масла с гептаном, затем азеотропная перегонка со смесью диэтилового эфира и гептана, дает C87 в виде белого твердого вещества. Выход: 17,9 мг, 31,3 мкмоль, 20%. ЖХМС m/z 572,0 [M+H]+.
Стадия 4. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[2-(2,2,2-трифторацетамидо)-3-(трифторметил)пентаноил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, из C86 (DIAST-2) (97).
Метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 18,8 мг, 78,9 мкмоль) добавляют в раствор C87 (18 мг, 31 мкмоль) в этилацетате (0,8 мл). Затем реакционную смесь перемешивают при комнатной температуре в течение 1 часа, снова добавляют метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса) на конце шпателя. Перемешивание продолжают в течение 2 часов, затем реакционную смесь фильтруют, и фильтровальную лепешку промывают этилацетатом. Объединенные фильтраты промывают насыщенным водным раствором бикарбоната натрия, и водный слой экстрагируют один раз этилацетатом; объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют, и концентрируют в вакууме с получением неочищенного продукта. 1H ЯМР (600 MГц, ДМСО-d6), основной компонент: δ 9,90 (д, J=8,8 Гц, 1H), 8,85 (д, J=8,1 Гц, 1H), 7,56 (шс, 1H), 4,97-4,89 (м, 2H), 4,17 (с, 1H), 3,89 (дд, J=10,1, 5,4 Гц, 1H), 3,62 (д, J=10,1 Гц, 1H), 3,21-3,14 (м, 1H), 3,12-3,06 (м, 1H), 2,92-2,82 (м, 1H), 2,43-2,35 (м, 1H), 2,18-2,10 (м, 2H), 1,78 (ддд, J=13,6, 9,6, 6,0 Гц, 1H), 1,75-1,66 (м, 2H), 1,62-1,55 (м, 2H), 1,35 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,04 (с, 3H), 0,97-0,92 (t, J=7,6 Гц, 3H), 0,85 (с, 3H). Этот продукт очищают ВЭЖХ с обращенной фазой (Колонка: Waters Sunfire C18, 19×100 мм, 5 мкм; Подвижная фаза A: 0,05% трифторуксусной кислоты в воде (об./об.); Подвижная фаза B: 0,05% трифторуксусной кислоты в ацетонитриле (об./об.); Градиент: 5% - 95% B в течение 8,54 минут, затем 95% B в течение 1,46 минут; Скорость потока: 25 мл/минуту) с получением (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[2-(2,2,2-трифторацетамидо)-3-(трифторметил)пентаноил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, из C86 (DIAST-2) (97). Выход: 8,3 мг, 15 мкмоль, 48%. ЖХМС m/z 554,6 [M+H]+. Время удержания: 2,72 минут (Аналитические условия. Колонка: Waters Atlantis dC18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.); Градиент: 5,0% - 95% B, линейный в течение 4,0 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 2 мл/минуту).
Пример 98
(1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[2-(2,2,2-трифторацетамидо)-3-(трифторметил)пентаноил]-3-азабицикло[3,1,0]гексан-2-карбоксамид, из C85 (DIAST-1) (98)
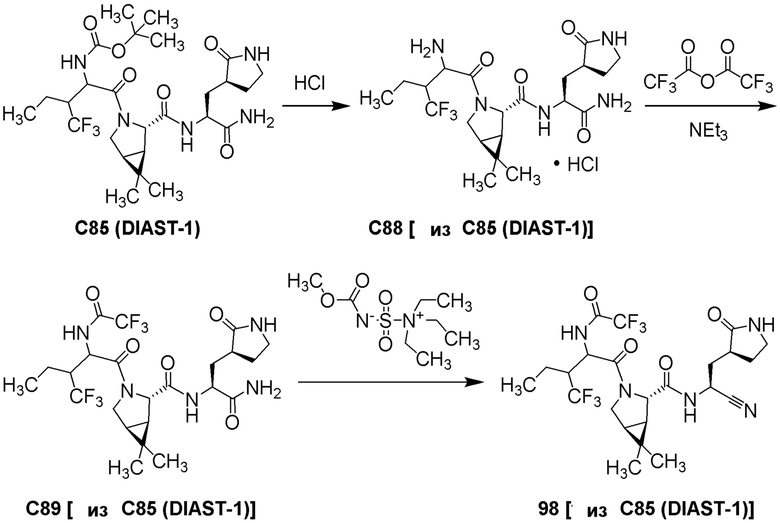
Стадия 1. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-3-[2-амино-3-(трифторметил)пентаноил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамида, гидрохлорида, из C85 (DIAST-1) (C88).
Раствор гидрохлорида в 1,4-диоксане (4 M; 0,336 мл, 1,34 ммоль) добавляют в раствор C85 (DIAST-1) (77,3 мг, 0,134 ммоль) в дихлорметане (1 мл). Затем реакционную смесь перемешивают при комнатной температуре в течение 40 минут, метанол (0,5 мл) добавляют для улучшения растворимости. Перемешивание продолжают в течение 2 часов, затем ЖХМС анализ показывает завершение снятия защиты: ЖХМС m/z 476,2 [M+H]+. Реакционную смесь концентрируют в вакууме; остаток подвергают азеотропной перегонке дважды гептаном, затем растирают дважды диэтиловым эфиром с получением C88 в виде белого твердого вещества. Выход: 54,5 мг, 0,106 ммоль, 79%. 1H ЯМР (400 MГц, ДМСО-d6), основных характеристические пики: δ 8,53 (шс, 3H), 8,36 (д, J=8,5 Гц, 1H), 7,61 (с, 1H), 7,28 (шс, 1H), 7,06 (шс, 1H), 4,25 (ддд, J=10,9, 8,4, 4,5 Гц, 1H), 4,17 (с, 1H), 4,08 (дд, J=10,5, 5,6 Гц, 1H), 2,80-2,68 (м, 1H), 2,37-2,26 (м, 1H), 2,23-2,13 (м, 1H), 2,05-1,96 (м, 1H), 1,73-1,51 (м, 5H), 1,44 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,04 (с, 3H), 0,90 (с, 3H).
Стадия 2. Синтез (1R,2S,5S)-N-{(2S)-1-амино-1-оксо-3-[(3S)-2-оксопирролидин-3-ил]пропан-2-ил}-6,6-диметил-3-[2-(2,2,2-трифторацетамидо)-3-(трифторметил)пентаноил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, из C85 (DIAST-1) (C89).
0°C суспензию C88 (54,5 мг, 0,106 ммоль) в дихлорметане (1 мл) обрабатывают триэтиламином (26 мкл, 0,19 ммоль), затем трифторуксусным ангидридом (19,5 мкл, 29,1 мг, 0,138 ммоль). Затем реакционную смесь перемешивают при 0°C в течение 1 часа и 10 минут, добавляют трифторуксусный ангидрид (1 эквивалент); через 30 минут снова добавляют трифторуксусный ангидрид (9,4 мкл, 67 мкмоль). Перемешивание продолжают в течение 45 минут, затем ЖХМС анализ показывает полное превращение в C89: ЖХМС m/z 572,4 [M+H]+. Реакционную смесь разделяют между водой и этилацетатом, и водный слой экстрагируют этилацетатом. Объединенные органические слои промывают последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют в вакууме с получением C89. Выход: 41,2 мг, 72,1 мкмоль, 68%. 1H ЯМР (400 MГц, ДМСО-d6), основной компонент, характеристические пики: δ 10,04 (д, J=9,3 Гц, 1H), 8,23 (д, J=8,5 Гц, 1H), 7,58 (с, 1H), 7,31 (шс, 1H), 7,01 (шс, 1H), 4,92-4,83 (м, 1H), 4,23 (с, 1H), 3,95 (дд, J=10,2, 5,5 Гц, 1H), 2,98-2,86 (м, 1H), 2,38-2,27 (м, 1H), 1,90 (ддд, J=13,5, 11,2, 4,0 Гц, 1H), 1,39 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,02 (с, 3H), 0,90 (с, 3H).
Стадия 3. Синтез (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[2-(2,2,2-трифторацетамидо)-3-(трифторметил)пентаноил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, из C85 (DIAST-1) (98).
Метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса; 42,7 мг, 0,179 ммоль) добавляют в раствор C89 (41,0 мг, 71,7 мкмоль) в этилацетате (0,8 мл). Затем реакционную смесь перемешивают при комнатной температуре в течение 1 часа, добавляют метил N-(триэтиламмониосульфонил)карбамат, внутреннюю соль (реагент Бурджеса) на кончике шпателя. Перемешивание продолжают в течение 2 часов, затем реакционную смесь фильтруют, и фильтровальную лепешку промывают этилацетатом. Объединенные фильтраты промывают насыщенным водным раствором бикарбоната натрия, и водный слой экстрагируют этилацетатом; объединенные органические слои промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют, и концентрируют в вакууме с получением неочищенного продукта. 1H ЯМР (600 MГц, ДМСО-d6), основной компонент, характеристические пики: δ 10,12 (д, J=9,1 Гц, 1H), 8,99 (д, J=8,1 Гц, 1H), 7,70 (с, 1H), 4,94 (ддд, J=9,4, 8,1, 6,5 Гц, 1H), 4,87 (дд, J=9,0, 9,0 Гц, 1H), 4,11 (с, 1H), 3,96 (дд, J=10,2, 5,6 Гц, 1H), 3,52 (д, J=10,0 Гц, 1H), 3,18-3,07 (м, 2H), 2,98-2,88 (м, 1H), 2,40-2,33 (м, 1H), 1,79-1,52 (м, 4H), 1,61 (дд, J=7,6, 5,5 Гц, 1H), 1,33 (д, половина АВ квартета, J=7,7 Гц, 1H), 1,04 (с, 3H), 0,91-0,86 (м, 6H).
Очистка этого продукта ВЭЖХ с обращенной фазой (Колонка: Waters Sunfire C18, 19×100 мм, 5 мкм; Подвижная фаза A: 0,05% трифторуксусной кислоты в воде; Подвижная фаза B: 0,05% трифторуксусной кислоты в ацетонитриле; Градиент: 5% - 95% B в течение 8,54 минут, затем 95% B в течение 1,46 минут; Скорость потока: 25 мл/минуту) дает (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[2-(2,2,2-трифторацетамидо)-3-(трифторметил)пентаноил]-3-азабицикло[3,1,0]гексан-2-карбоксамид, из C85 (DIAST-1) (98). Выход: 4,3 мг, 7,8 мкмоль, 11%. ЖХМС m/z 554,6 [M+H]+. Время удержания: 2,80 минут (Аналитические условия. Колонка: Waters Atlantis dC18, 4,6×50 мм, 5 мкм; Подвижная фаза A: вода, содержащая 0,05% трифторуксусной кислоты (об./об.); Подвижная фаза B: ацетонитрил содержащий 0,05% трифторуксусной кислоты (об./об.); Градиент: 5,0% - 95% B, линейный в течение 4,0 минут, затем 95% B в течение 1,0 минуты; Скорость потока: 2 мл/минуту).
Получение 3-трет-бутил 2-метил (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2,3-дикарлоксилата (C90)
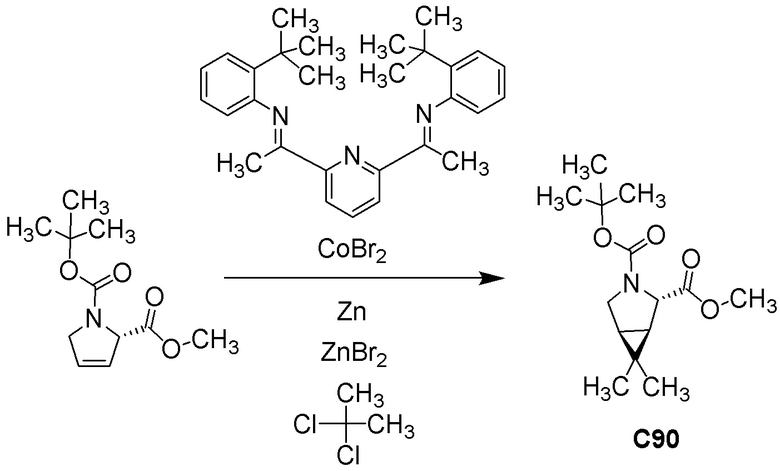
Это получение проводят с применением общей методики, описанной у C. Uyeda and J. Werth, Angew. Chem. Int. Ed. 2018, 57, 13902-13906. В 3-горлую колбу, оборудованную магнитной мешалкой, обратным холодильником, термометром и входом для азота загружают бромид кобальта(II) (0,15 эквивалента; 0,146 г, 0,667 ммоль), (1E,1'E)-1,1'-пиридин-2,6-диилбис[N-(2-трет-бутилфенил)этанимин] (2-t-BuPDI; 0,15 эквивалента; 0,284 г, 0,667 ммоль) и тетрагидрофуран (11 мл). Густую зеленую суспензию перемешивают в течение ночи при комнатной температуре, и добавляют цинк (2,4 эквивалента; 0,70 г, 11 ммоль) и бромид цинка (1,1 эквивалента; 1,1 г, 4,9 ммоль). После перемешивания в течение 15 минут, реакционная смесь становится фиолетовой, и добавляют раствор 1-трет-бутил 2-метил (2S)-2,5-дигидро-1H-пиррол-1,2-дикарлоксилата (1,0 эквивалент; 1,0 г, 4,4 ммоль) в тетрагидрофуране (7,5 мл) и 2,2-дихлорпропане (2,0 эквивалента; 1,0 г, 8,8 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 дней, затем ее фильтруют через слой диатомовой земли и промывают тетрагидрофураном (10,8 мл). Фильтрат объединяют насыщенным водным раствором хлорида аммония (3,5 мл) и этилацетатом (9,5 мл); затем слои разделяют, и водную фазу экстрагируют этилацетатом (8,4 мл). Объединенные органические экстракты промывают насыщенным водным раствором бикарбоната натрия (10,5 мл), сушат над сульфатом магния, фильтруют, и концентрируют досуха с получением 3-трет-бутил 2-метил (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2,3-дикарлоксилата (C90) в виде желтого масла. Выход: 0,90 г, 3,3 ммоль, 75%. По 1H ЯМР анализу, этот продукт существует в виде двух карбаматных ротамеров (соотношение ~3:2). 1H ЯМР (400 MГц, хлороформ-d) δ 4,20 & 4,09 (2 с, 1H), 3,74 & 3,75 (2 с, 3H), 3,68-3,60 (м, 1H), 3,44 & 3,38 (2 д, J=10,9 Гц, 1H), 1,43 & 1,38 (2 с, 9H), 1,38-1,34 (м, 2H), 1,03 & 0,98 & 0,96 (3 с, 6H). ИЭР-МС (пол.) m/z (%)=255,1 (12,5) [M - Me+H]+, 214,1 (100) [M - t-Bu+H]+, 170,2 (50) [M - Boc+H]+.
Альтернативное получение C42
(1R,2S,5S)-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C42)
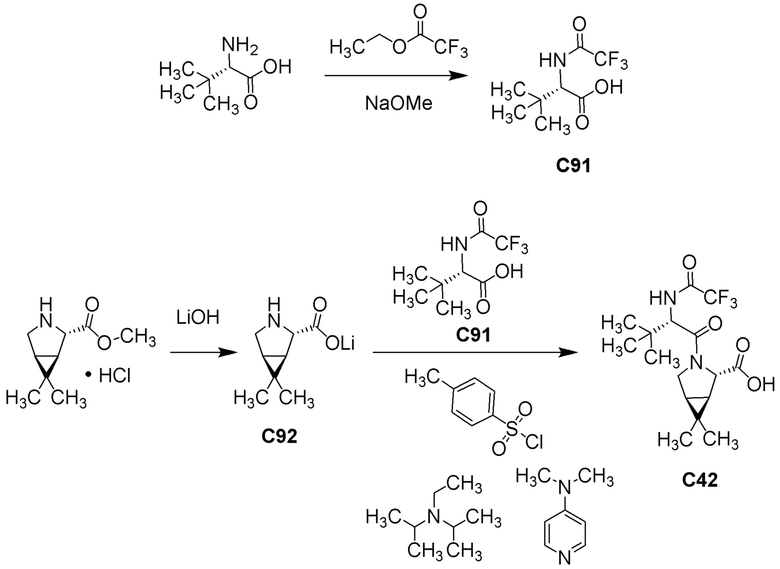
Стадия 1. Синтез 3-метил-N-(трифторацетил)-L-валина (C91).
Раствор метоксида натрия в метаноле (25% массовых; 28,5 мл, 124 ммоль) добавляют в раствор 3-метил-L-валин (99%, 15 г, 113 ммоль) в метаноле (30 мл). Затем добавляют этилтрифторацетат (130 ммоль) и реакционную смесь перемешивают при 40°C до завершения реакции (приблизительно 2,5 часа), затем ее охлаждают до 20°C. После добавления хлористоводородной кислоты (1 M; 136 мл, 136 ммоль), смесь разбавляют этилацетатом (150 мл) и слои разделяют. Органический слой промывают дважды насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, и фильтруют. Гептан добавляют к фильтрату, затем раствор концентрируют при 50°C до объема 5 мл/г. Эту методику повторяют дважды; после второй дистилляции добавляют затравочные кристаллы C91 (50 мг; см. ниже). Полученное твердое вещество собирают фильтрацией, промывают гептаном и сушат при 40°C с получением C91 в виде беловатого твердого вещества. Выход: 22,2 г, 97,7 ммоль, 86%.
Затравочные кристаллы, применяемые выше, получают из аналогичной реакции, проводимой с применением 3-метил-L-валина; затем органический слой, содержащий C91, сушат над сульфатом магния и фильтруют, концентрация в вакууме дает твердое вещество. Часть этого твердого вещества применяют в качестве затравочного продукта.
Физико-химические данные получают на образцах C91, полученных из реакций, проводимых по той же методике. МСВР-ИЭР+ (m/z): [M+H]+ Рассчитано для C8H13F3NO3, 228,0842; найдено, 228,0842. Первичный ион наблюдают как C8H11F3NNa2O3 [M+Na+]: Рассчитано, 272,0481; Найдено, 272,0482. 1H ЯМР (600 MГц, ДМСО-d6) δ 13,05 (с, 1H), 9,48 (д, J=8,9 Гц, 1H), 4,21 (д, J=8,9 Гц, 1H), 1,00 (с, 9H). 13C ЯМР (150,8 MГц, ДМСО-d6) δ 170,9, 156,6 (кв, 2JCF=36,9 Гц), 115,8 (кв, 1JCF=287,7 Гц), 61,0, 33,6, 26,5. Порошковая рентгеновская дифрактограмма для C91 дана на Фигуре 11; характеристические пики перечислены в таблице R.
(°2-тэта)
(°2-тэта)
(°2-тэта)
Кристалл для рентгеновской кристаллографии получают перекристаллизацией из этилацетата и гексана с использованием затравочных кристаллов из той же партии, что и выше. Диаграмма ORTEP для данных монокристалла C91 показана на фигуре 12.
Однокристальный рентгеновский структурный анализ C91
Однокристальный рентгеновский анализ
Сбор данных проводят на дифрактометре Bruker D8 Quest при -100°C. Сбор данных состоит из сканирования омега и фи.
Структура была разрешена путем внутреннего фазирования с использованием программного пакета SHELX в пространственной группе орторомбического класса P212121. В дальнейшем структуру уточняют полноматричным методом наименьших квадратов. Все атомы, отличные от водорода, найдены и уточнены с использованием параметров анизотропного смещения.
Атомы водорода, расположенные на азоте, найдены из разностной карты Фурье и уточнены с ограничением расстояний. Водород на O2 (H2Z) и O3 (H3Z) разделен как заряд и уточнен как занятость по 10,5 каждый. Остальные атомы водорода размещены в расчетных положениях и им позволили перемещаться на своих атомах-носителях. Окончательное уточнение включает параметры изотропного смещения для всех атомов водорода.
Определяют и моделируют нарушение занятости популяции как отношение ~ 67/33 в сегменте -CF3.
Анализ абсолютной структуры с использованием способов вероятности (Hooft, 2008) проводят с использованием PLATON (Spek). Результаты показывают, что абсолютная структура назначена правильно. Способ рассчитывает, что вероятность того, что структура назначена правильно, составляет 100%. Параметр Хофта представлен как -0,02 с осо (оценочное стандартное отклонение) (4), и параметр Парсона представлен как -0,02 с осо (4).
Итоговый R-индекс составляет 4,1%. Конечная разностная карта Фурье не обнаружила отсутствующей или смещенной электронной плотности.
Соответствующий кристалл, сбор данных и уточняющая информация сведены в таблицу S. Координаты атомов, длины связей, углы связей и параметры смещения перечислены в таблицах T-V.
Список используемого программного обеспечения и ссылок можно найти в Монокристальном рентгеновском определении структуры примера 13, Твердая форма 1.
Масса формулы
Температура
Длина волны
Кристаллическая система
Пространственная группа
Постоянная решетки
Объем
Z
Плотность (расчетная)
Коэффициент абсорбции
F(000)
Размер кристалла
Интервал тэта для сбора данных
Диапазоны индексов
Собранные отражения
Независимые отражения
Полнота до тэта=67,679°
Коррекция абсорбции
Способ уточнения
Данные/ограничения/параметры
Соответствие по F2
Конечные R индексы [I>2σ(I)]
R индексы (все данные)
Параметр абсолютной структуры
Коэффициент возбуждения
Наибольшие дифф. пики и впадины
227,19
173(2) K
1,54178 Å
Тетрагональная
P41212
a=9,9168(6) Å
b=9,9168(6) Å
c=22,721(2) Å
2234,5(4) Å3
8
1,351 Мг/м3
1,184 мм-1
944
0,200×0,170×0,080 мм3
4,866-70,114°
-11<=h<=10, -12<=k<=12, -27<=l<=27
48160
2122 [Rint=0,0392]
99,8%
Эмпирическая
Наименьшие квадраты в полноматричном приближении по F2
2122/9/158
1,010
R1=0,0408, wR2=0,1012
R1=0,0429, wR2=0,1039
0,03(4)
н/д
0,280 и -0,215 e.Å-3
β=90°
γ=90°
Таблица T. Атомные координаты (x 104) и параметры эквивалентного изотропного замещения (Å2×103) для C91. U(экв) определены как одна треть от следа ортогонализированного тензора Uij.
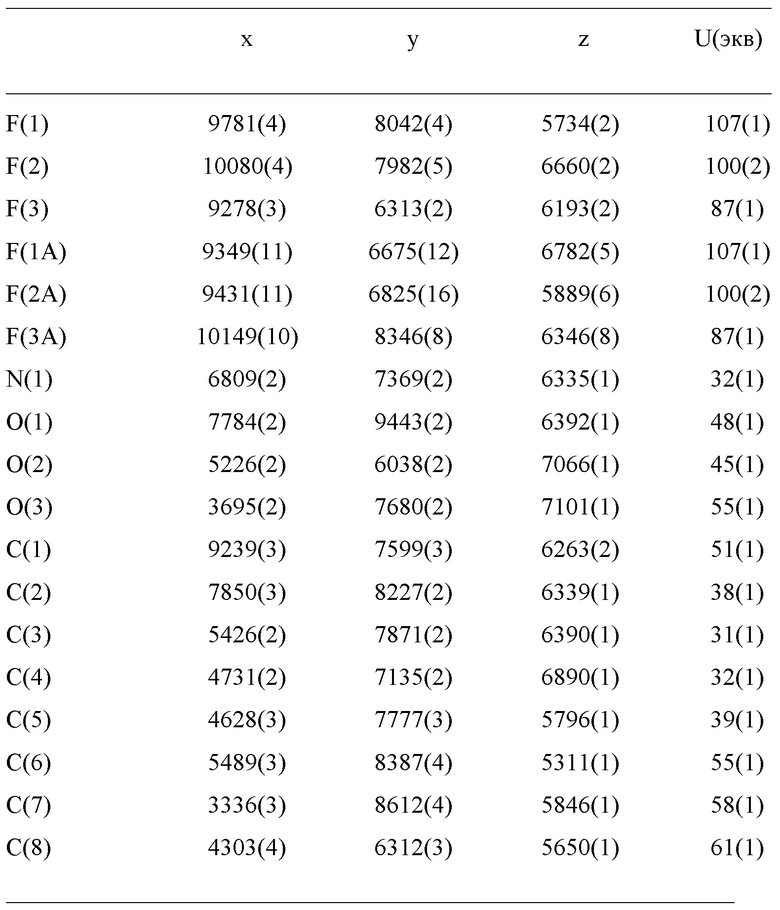
Таблица U. Длины связей [Å] и углы [°] для C91.

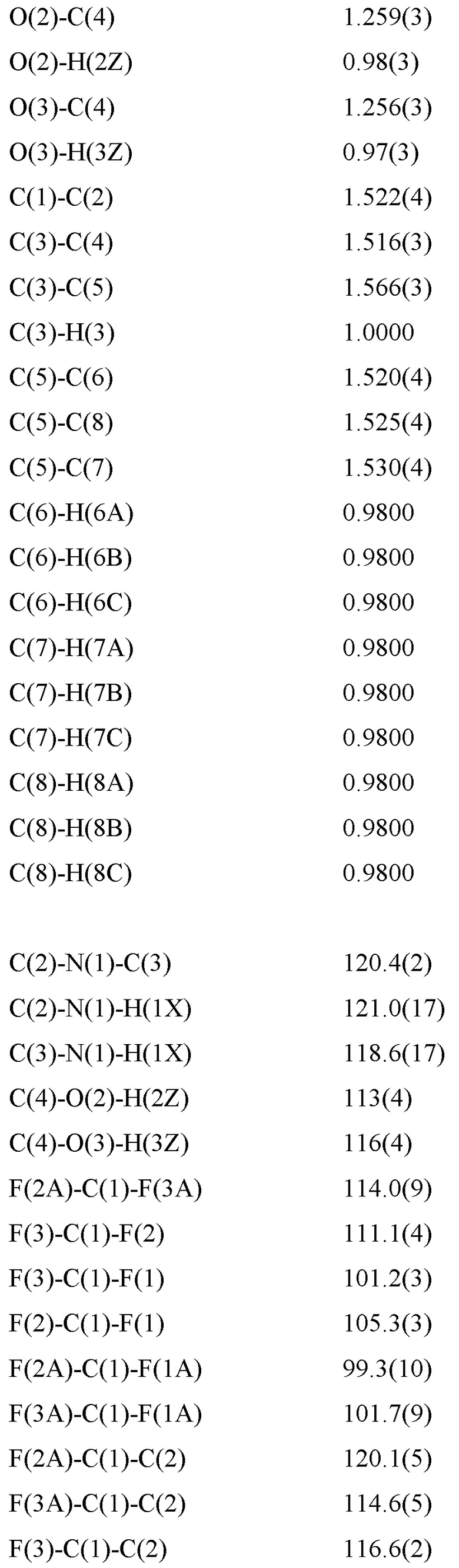


Симметричные превращения используют для создания эквивалентных атомов.
Таблица V. Параметры анизотропного замещения (Å2×103) для C91. Экспонента фактора анизотропного замещения принимает форму: -2π2[h2 a*2U11 + ... + 2 h k a* b* U12].
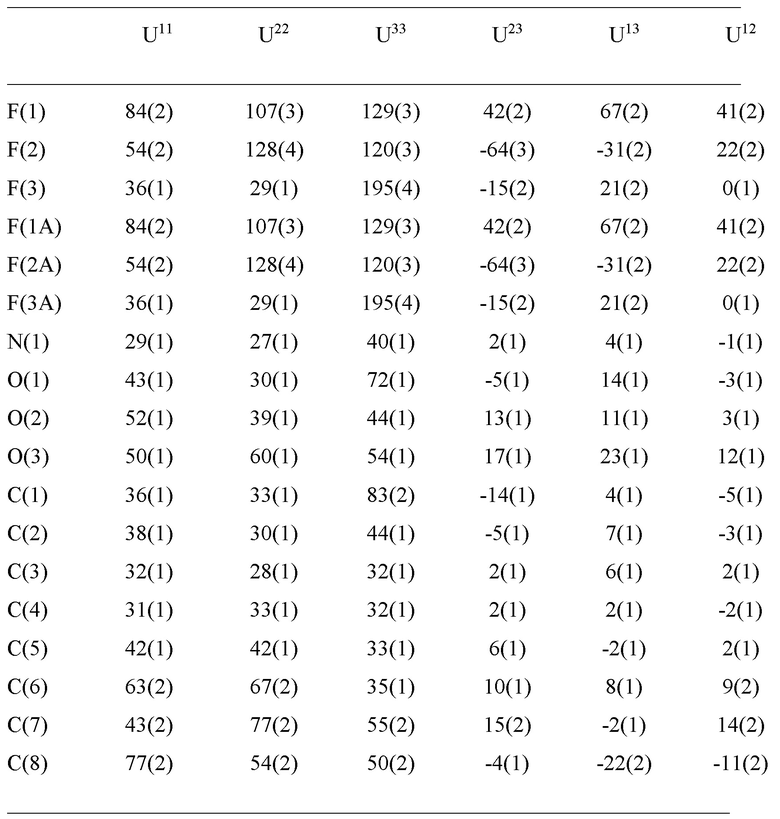
Стадия 2. Синтез (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата лития (C92).
Моногидрат гидроксида лития (29,0 г, 678 ммоль) добавляют к смеси метил (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата, гидрохлорида (68,5 г, 333 ммоль) в тетрагидрофуране (950 мл) и воде (48 мл). Реакционную смесь перемешивают при 25°C до завершения гидролиза, затем твердое вещество собирают фильтрацией, промывают 5% раствором воды тетрагидрофуране (400 мл) и сушат под вакуумом при 70°C с получением C92 в виде белого/беловатого твердого вещества. Выход: 47,6 г, 295 ммоль, 89%. Физико-химические данные, полученные для образцов C92, получают в реакциях, проводимых по той же методике.
МСВР-ИЭР+ (m/z): [M+H]+ Рассчитано для C8H14NO2, 156,1019; Найдено, 156,1019. 1H ЯМР (600 MГц, D2O) δ 3,23 (д, J=1,1 Гц, 1H), 3,09 (дд, J=11,1, 5,2 Гц, 1H), 2,63 (д, J=11,1 Гц, 1H), 1,33-1,24 (м, 2H), 0,86 (с, 2H), 0,83 (с, 3H). 13C ЯМР (150,8 MГц, D2O) δ 182,7, 62,3, 45,6, 35,5, 30,0, 25,8, 19,3, 12,7. Порошковая рентгеновская дифрактограмма для C92 дана на Фигуре 13; характеристические пики перечислены в таблице W.
(°2-тэта)
(°2-тэта)
Стадия 3. Синтез (1R,2S,5S)-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C42).
Смесь C91 (1,29 г, 5,68 ммоль), 4-(диметиламино)пиридина (0,60 г, 4,8 ммоль) и N, N-диизопропилэтиламина (1,70 мл, 9,75 ммоль) в тетрагидрофуране (10 мл), обрабатывают п-толуолсульфонилхлоридом (0,99 г, 5,2 ммоль). Затем реакционную смесь перемешивают в течение 2 часов при 20°C, загружают C92 (75,7% масс., 1,00 г, 4,70 ммоль) и перемешивание продолжают в течение ночи при 20°C. Полученную суспензию смешивают с пропан-2-илацетатом (10 мл) и промывают последовательно водным раствором лимонной кислоты (10%, 10 мл) и водой (10 мл). Органический слой затем концентрируют, затем добавляют пропан-2-илацетат (5 мл), затем по каплям добавляют гептан (15 мл) из капельной воронки. Твердые вещества выделяют фильтрацией и сушат под вакуумом с получением (1R,2S,5S)-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C42) в виде белого твердого вещества. Выход: 1,2 г. Это соединение демонстрирует два набора ЯМР сигналов. Основной и незначительный наборы соответствуют Z и E изомерам третичного амида, соответственно, в молярном отношении 20:1. Образец также содержит изопропилацетат в 37% молярном отношении относительно C42, показывая 1H резонансы при 4,86, 1,96, и 1,17 ч./млн., и 13C резонансы при 169,7, 66,9, 21,5, и 21,0 ч./млн. 1H и 13C сигналы обозначают с применением TMS сигнала, установленного на 0 ч./млн. в обоих.
МСВР-ИЭР+ (m/z): [M+H]+ Рассчитано для C16H24F3N2O4, 365,1683; Найдено: 365,1684. 1H ЯМР (600 MГц, ДМСО-d6) δ основной: 9,44 (д, J=8,5 Гц, 1H), 4,44 (д, J=8,5 Гц, 1H), 4,15 (с, 1H), 3,85 (дд, J=10,5, 5,4 Гц, 1H), 3,73 (д, J=10,5 Гц, 1H), 1,53 (дд, J=7,6, 5,3 Гц, 1H), 1,43 (д, J=7,6 Гц, 1H), 1,01 (с, 3H), 1,01 (с, 9H), 0,83 (с, 3H); незначительный: 9,11 (д, J=9,4 Гц, 1H), 4,53 (с, 1H), 4,33 (д, J=9,4 Гц, 1H), 3,53 (дд, J=12,5, 5,3 Гц, 1H), 3,41 (д, J=12,5 Гц, 1H), 1,55 (д, J=7,5 Гц, 1H), 1,41 (дд, J=7,5, 5,3 Гц, 1H), 1,02 (с, 3H), 0,97 (с, 3H), 0,91 (с, 9H). 13C ЯМР (150,8 MГц, ДМСО-d6) δ основной: 172,3, 167,5, 156,8 (2JCF=37,0 Гц), 115,7 (1JCF=287,7 Гц), 59,1, 58,0, 47,1, 34,6, 29,6, 26,7, 26,1, 25,6, 18,7, 12,0; незначительный: 172,3, 168,1, 155,9 (2JCF=36,8 Гц), 115,8 (1JCF=288,1 Гц), 59,9, 57,3, 46,4, 36,2, 32,1, 26,2, 26,0, 24,4, 19,0, 12,7. Порошковая рентгеновская дифрактограмма для C42 дана на фигуре 14; характеристические пики перечислены в таблице X.
Кристаллизация для порошковой рентгеновской дифракции и однокристального рентгеновского структурного анализа проводят следующим образом. Раствор C42 (2,96 г) в этаноле (9 мл) нагревают до 40°C при перемешивании (3500 об./мин.), затем добавляют воду (10,5 мл) в течение 10 минут. Затем добавляют дополнительную воду (16,5 мл) в течение 4 часов, и смесь охлаждают до 10°C и перемешивают в течение ночи. После фильтрации, фильтровальную лепешку промывают водой (6 мл) и сушат при 50°C с получением кристаллического C42 (2,6 г).
(°2-тэта)
(°2-тэта)
(°2-тэта)
Диаграмма ORTEP для данных монокристалла C42 показана на фигуре 15.
Однокристальный рентгеновский структурный анализ C42
Однокристальный рентгеновский анализ
Сбор данных проводят на дифрактометре Bruker D8 Venture при комнатной температуре. Специальную стратегию данных 0,3 градуса ширины на рамки применяют для разделения доменов, тем самым исключая любые вопросы TWIN и псевдосимметрии.
Структуру разрешают путем внутреннего фазирования с использованием программного пакета SHELX в группе ромбоэдрического класса R3. В дальнейшем структуру уточняют полноматричным методом наименьших квадратов. Все атомы, отличные от водорода, найдены и уточнены с использованием параметров анизотропного смещения.
Атомы водорода, расположенные на азоте и кислороде, найдены из разностной карты Фурье и уточнены с ограничением расстояний. Остальные атомы водорода размещены в расчетных положениях и им позволили перемещаться на своих атомах-носителях. Окончательное уточнение включает параметры изотропного смещения для всех атомов водорода.
Анализ абсолютной структуры с использованием способов вероятности (Hooft, 2008) проводят с использованием PLATON (Spek). Результаты показывают, что абсолютная структура назначена правильно. Способ рассчитывает, что вероятность того, что структура назначена правильно, составляет 100%. Параметр Хофта представлен как -0,08 с осо (оценочное стандартное отклонение) (7), и параметр Парсона представлен как -0,09 с осо (6).
Определяют и моделируют нарушение занятости популяции как отношение 78:22 в сегменте C1_F1_F2.
Итоговый R-индекс составляет 5,8%. Конечная разностная карта Фурье не обнаружила отсутствующей или смещенной электронной плотности.
Соответствующий кристалл, сбор данных и уточняющая информация сведены в таблицу Y. Координаты атомов, длины связей, углы связей и параметры смещения перечислены в таблицах Z-BB.
Список используемого программного обеспечения и ссылок можно найти в Монокристальном рентгеновском определении структуры примера 13, Твердая форма 1.
Масса формулы
Температура
Длина волны
Кристаллическая система
Пространственная группа
Постоянная решетки
Объем
Z
Плотность (расчетная)
Коэффициент абсорбции
F(000)
Размер кристалла
Интервал тэта для сбора данных
Диапазоны индексов
Собранные отражения
Независимые отражения
Полнота до тэта=67,679°
Коррекция абсорбции
Способ уточнения
Данные/ограничения/параметры
Соответствие по F2
Конечные R индексы [I>2σ(I)]
R индексы (все данные)
Параметр абсолютной структуры
Коэффициент возбуждения
Наибольшие дифф. пики и впадины
364,36
296(2) K
1,54178 Å
Тригональная
R3
a=14,1740(6) Å
b=14,1740(6) Å
c=14,1740(2) Å
1715,9(4) Å3
3
1,058 Мг/м3
0,788 мм-1
576
0,200×0,100×0,100 мм3
6,445-80,034°
-17<=h<=16, -14<=k<=16,
-14<=l<=17
13310
4011 [Rint=0,0369]
98,9%
Эмпирическая
Наименьшие квадраты в полноматричном приближении по F2
4011/6/244
1,056
R1=0,0582, wR2=0,1675
R1=0,0611, wR2=0. 0,1710
-0,09(6)
н/д
0,292 и -0,174 e.Å-3
β=114,11°
γ=114,11°
Таблица Z. Атомные координаты (x 104) и параметры эквивалентного изотропного замещения (Å2×103) для C42. U(экв) определены как одна треть от следа ортогонализированного тензора Uij.
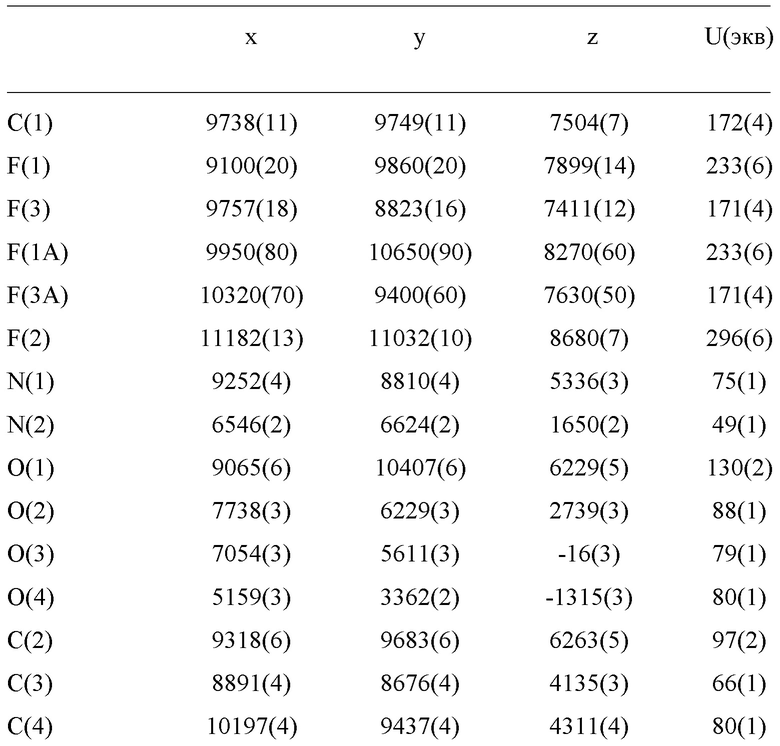
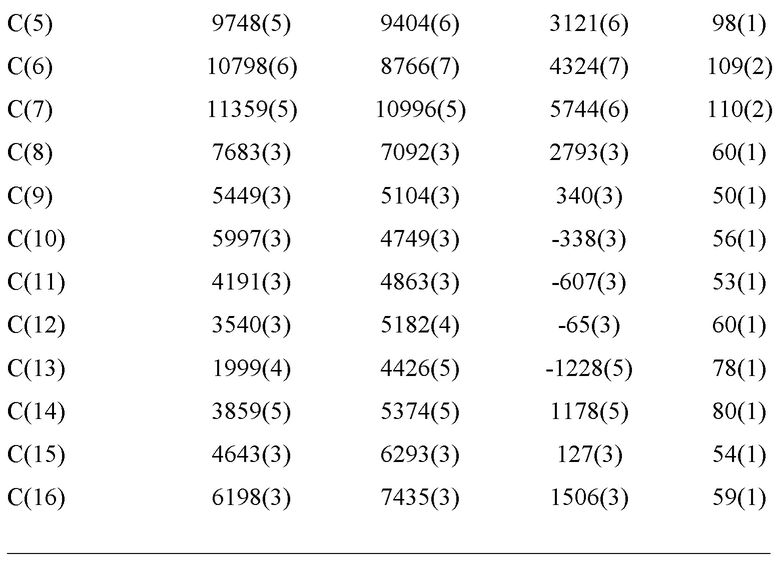
Таблица AA. Длины связей [Å] и углы [°] для C42.










Симметричные превращения используют для создания эквивалентных атомов.
Таблица BB. Параметры анизотропного замещения (Å2×103) для C42. Экспонента фактора анизотропного замещения принимает форму: -2π2[h2 a*2U11 + ... + 2 h k a* b* U12].
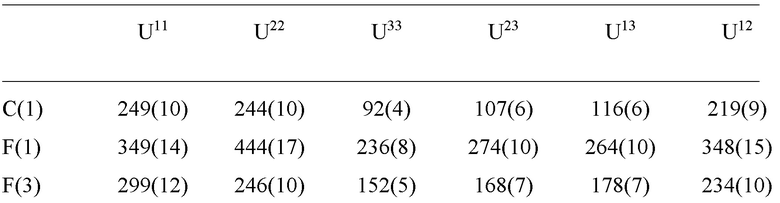
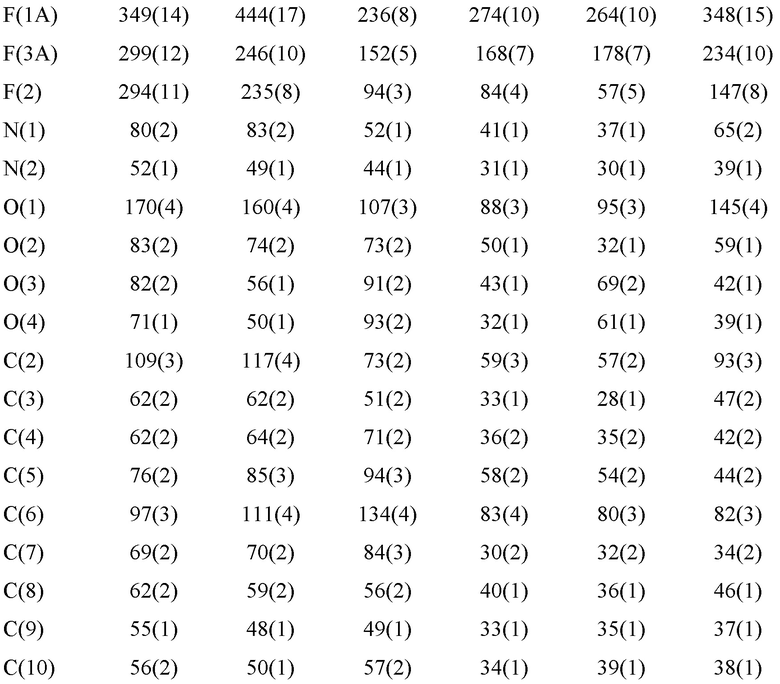

В дополнение к получению (1R,2S,5S)-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоновой кислоты (C42) согласно способам, описанным выше, соединение также может быть получено как изображено на схемах реакции, показанных непосредственно ниже. На стадии 1, метил (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилат гидрохлорид сначала обрабатывают триэтиламином в смеси тетрагидрофурана и воды для нейтрализации гидрохлорида, затем гидролизуют метиловый эфир с применением гидроксида натрия в смеси тетрагидрофурана и воды с получением (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата натрия.
Получение (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилат натрия
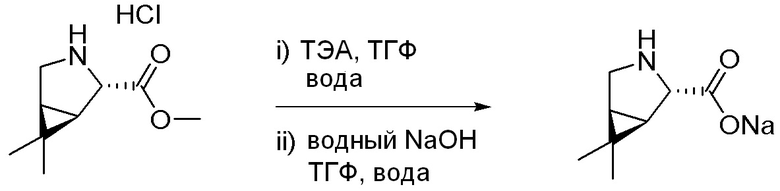
В подходящий сосуд добавляют тетрагидрофуран (30 мл), воду (7,5 мл), триэтиламин (7,62 мл, 54,7 ммоль) и гидрохлорид метил (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0] гексан-2-карлоксилата (7,59 г, 36,9 ммоль). Смесь перемешивают при 25°C в течение, по меньшей мере, 30 минут. Перемешивание останавливают и слои разделяют. В отдельном сосуде 28% масс./масс. водного гидроксида натрия (4,19 мл, 38,3 ммоль) и тетрагидрофуран (71 мл) добавляют при перемешивании при 40°C. 25% органического слоя, содержащего раствор метил (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0] гексан-2-карлоксилата в тетрагидрофуране, после разделения добавляют, и раствор засевают (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилатом натрия (0,1182 г, 0,7336 ммоль - ранее полученным по аналогичной методике). Смесь выдерживают при 40°C в течение, по меньшей мере, 15 минут и медленно добавляют оставшиеся 75% органического слоя. Смесь выдерживают при перемешивании при 40°C в течение 16 часов, затем медленно охлаждают до 20°C и выдерживают в течение, по меньшей мере, 4 ч. Полученный твердый (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилат натрия выделяют фильтрацией, промывают раствором, состоящим из тетрагидрофурана (43 мл) и воды (2,25 мл). Твердый продукт сушат при 70°C под вакуумом с получением 6,13 г (93,8%) (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата натрия в виде кристаллического твердого вещества. ПРД определяют способами, описанными выше.
Выбранные ПРД пики кристаллического (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилата натрия.
градусы
2-θ
± 0,2 °2-θ
градусы
2-θ
± 0,2 °2-θ
градусы
2-θ
± 0,2 °2-θ
Выбранные ПРД пики (S)-3,3-диметил-2-(2,2,2-трифторацетамидо)бутановой кислоты (C91)
2-θ ±0,2 °2-θ
2-θ
±0,2 °2-θ
2-θ
±0,2 °2-θ
Уточнение кристаллических данных и уточнение структуры для (S)-3,3-диметил-2-(2,2,2-трифторацетамидо)бутановой кислоты (C91).
Масса формулы
Температура
Длина волны
Кристаллическая система
Пространственная группа
Постоянная решетки
Объем
Z
Плотность (расчетная)
Коэффициент абсорбции
F(000)
Размер кристалла
Интервал тэта для сбора данных
Диапазоны индексов
Собранные отражения
Независимые отражения
Полнота до тэта=67,679°
Коррекция абсорбции
Способ уточнения
Данные/ограничения/параметры
Соответствие по F2
Конечные R индексы [I>2σ(I)]
R индексы (все данные)
Параметр абсолютной структуры
Коэффициент возбуждения
Наибольшие дифф. пики и впадины
227,19
173(2) K
1,54178 Å
Тетрагональная
P41212
a=9,9168(6) Å
b=9,9168(6) Å
c=22,721(2) Å
2234,5(4) Å3
8
1,351 Мг/м3
1,184 мм-1
944
0,200×0,170×0,080 мм3
4,866-70,114°
-11<=h<=10, -12<=k<=12, -27<=l<=27
48160
2122 [Rint=0,0392]
99,8%
Эмпирическая
Наименьшие квадраты в полноматричном приближении по F2
2122/9/158
1,010
R1=0,0408, wR2=0,1012
R1=0,0429, wR2=0,1039
0,03(4)
н/д
0,280 и -0,215 e.Å-3
β=90°
γ=90°
На стадии 2, полученный (1R,2S,5S)-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карлоксилат натрия затем сочетают с (S)-3,3-диметил-2-(2,2,2-трифторацетамидо)бутановой кислоты с присутствии тозилхлорида и диметиламинопиридина в тетрагидрофуране. Тетрагидрофуран удаляют и заменяют изопропилацетатом, затем обрабатывают HCl в насыщенном растворе соли, затем обрабатывают водой и гептаном с получением C42.
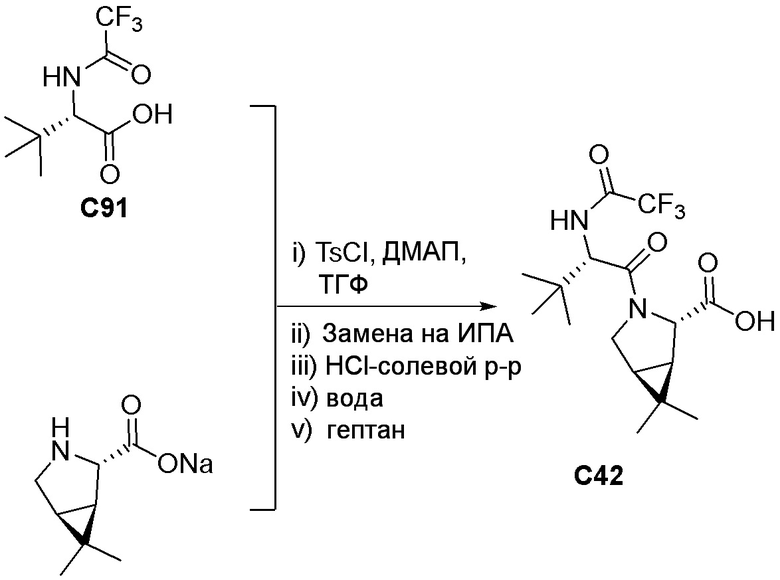
Кристаллический C42 характеризуют ПРД и идентифицируют дополнительную форму, полученную после продолжительной сушки или более высокой температуры.
Выбранные ПРД пики для C42 - кристаллическая форма, полученная после продолжительной сушки или более высокой температуры
градусы
2-θ
± 0,2 °2-θ
градусы
2-θ
± 0,2 °2-θ
градусы
2-θ
± 0,2 °2-θ
Противовирусная активность от инфекции SARS-CoV-2
Способность соединений предотвращать гибель клеток, вызванную коронавирусом SARS-CoV-2, или цитопатический эффект можно оценить по жизнеспособности клеток с использованием формата анализа, в котором люцифераза используется для измерения внутриклеточного АТФ в качестве конечной точки. Коротко, клетки VeroE6, которые обогащены экспрессией hACE2, инокулируют SARS-CoV-2 (USA_WA1/2020) при множественности заражения 0,002 в BSL-3 lab. Клетки, инокулированные вирусом, затем добавляют в планшеты с готовым к анализу соединением при плотности 4000 клеток/лунку. После 3-дневной инкубации, когда вирус-индуцированный цитопатический эффект составляет 95% в необработанных инфицированных контрольных условиях, жизнеспособность клеток оценивают с помощью Cell Titer-Glo (Promega) в соответствии с протоколом производителя, который количественно определяет уровни АТФ. Цитотоксичность соединения оценивают параллельно не инфицированным клеткам. Тестируемые соединения испытывают либо по отдельности, либо в присутствии ингибитора P-гликопротеина (P-gp) CP-100356 в концентрации 2 мкм. Включение CP 100356 предназначено для оценки того, выводятся ли тестируемые соединения из клеток VeroE6, которые имеют высокие уровни экспрессии P-гликопротеина. Долю эффекта для каждого тестируемого соединения рассчитывают на основании значений для лунок без вируса и контрольных лунок, содержащих вирус на каждом планшете для анализа. Значение концентрации, необходимой для 50% ответа (EC50), определяют на основе этих данных с использованием 4-параметрической логистической модели. Кривые EC50 соответствуют наклону 3 по Хиллу при >3 и максимальной дозе, дающей ≥50% эффект. Если цитотоксичность обнаруживают при эффекте более 30%, соответствующие данные исключают из определения ЕС50.
Для планшетов с цитотоксичностью рассчитывают долю эффекта для каждого вида тестируемого соединения на основе значений для контрольных лунок, содержащих только клетки, и контрольных лунок, содержащих гиамин, на каждом аналитическом планшете. Значение CC50 рассчитывают с использованием 4-параметрической логистической модели. Затем рассчитывают TI путем деления значения CC50 на значение EC50.
FRET исследование и анализ 3C протеазы SARS-CoV-2 коронавируса
Протеолитическую активность основной протеазы, 3CLpro, SARS-CoV-2 контролируют с помощью анализа непрерывного резонансного переноса энергии флуоресценции (FRET). Анализ SARS-CoV-2 3CLpro измеряет активность полноразмерной 3CL протеазы SARS-CoV-2 по расщеплению синтетического флуоргенного субстратного пептида со следующей последовательностью: Dabcyl-KTSAVLQ-SGFRKME-Edans, смоделированной на основе консенсусного пептида (V. Grum-Tokars et al. Evaluating the 3C-like protease activity of SARS-coronavirus: recommendations for standardized assays for drug discovery. Virus Research 133 (2008) 63-73). Флуоресценцию расщепленного пептида Edans (возбуждение 340 нм/испускание 490 нм) измеряют с использованием протокола интенсивности флуоресценции на ридере Flexstation (Molecular Devices). Флуоресцентный сигнал снижается в присутствии PF-835231, мощного ингибитора SARS-CoV-2 3CLpro. Буфер для реакции анализа содержит 20 мМ Трис-HCl (pH 7,3), 100 нМ NaCl, 1 мМ ЭДТК и 25 мкм пептидного субстрата. Ферментные реакции инициируют добавлением 15 нМ 3CL протеазы SARS-CoV-2 и проводят в течение 60 минут при 23°C. Долю ингибирования или активности рассчитывают на основе контрольных лунок без соединения (0% ингибирования/100% активности) и контрольного соединения (100% ингибирования/0% активности). Значения IC50 получают с использованием четырехпараметрической модели подгонки с использованием программного обеспечения ABASE (IDBS). Значения Ki соответствуют уравнению Моррисона с параметром концентрации фермента, установленным на уровне 15 нМ, параметром Km, установленным на уровне 14 мкм, и параметром концентрации субстрата, установленным на уровне 25 мкм, с использованием программного обеспечения ABASE (IDBS).
Протеолитическую активность 3CL протеазы SARS-CoV-2 коронавируса измеряют с помощью анализа непрерывного резонансного переноса энергии флуоресценции. FRET анализ SARS-CoV-2 3CLpro измеряет катализируемое протеазой расщепление TAMRA-SITSAVLQSGFRKMK-(DABCYL)-OH до TAMRA-SITSAVLQ и SGFRKMK(DABCYL)-OH. Флуоресценцию расщепленного пептида TAMRA (возб. 558 нм/исп. 581 нм) измеряют с использованием планшетного ридера для флуоресценции TECAN SAFIRE в течение 10 мин. Типовые реакционные растворы содержат 20 мМ HEPES (pH 7,0), 1 мМ EDTК, 4,0 мкм субстрата FRET, 4% ДМСО и 0,005% Tween-20. Анализы инициируют добавлением 25 нМ SARS 3CLpro (нуклеотидная последовательность 9985-10902 полной последовательности генома штамма Urbani коронавируса SARS (номер доступа NCBI AY278741)). Долю ингибирования определяют дважды при уровне ингибитора 0,001 мМ. Данные анализируют с помощью программы анализа нелинейной регрессии Kalidagraph с использованием уравнения:
FU=расхождение + (предел) (1- e-(kobs)t)
где расхождение равно сигналу флуоресценции нерасщепленного пептидного субстрата, и предел равен флуоресценции полностью расщепленного пептидного субстрата. Kobs представляет собой константу скорости первого порядка для этой реакции, и в отсутствие какого-либо ингибитора представляет использование субстрата. В ферменте запускается реакция, которая содержит необратимый ингибитор, и если рассчитанный предел составляет менее 20% от теоретического максимального предела, вычисленный kobs является скоростью инактивации 3C протеазы коронавируса. Наклон (kobs/I) графика kobs vs. [I] является мерой авидности ингибитора для фермента. Для очень быстрых необратимых ингибиторов kobs/I рассчитывают из наблюдений только для одного или двух [I], а не как наклон.
или
N2-[(транс-4-цианоциклогексил)карбонил]-N-{(1R)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-метил-L-лейцинамид
или
N-{(1R)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-N2-[2-(циклогексилокси)пропаноил]-4-метил-L-лейцинамид
или
(2R,4S)-4-трет-бутил-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамид
или
(2R,4S)-4-трет-бутил-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-1-{N-[(трифторметил)сульфонил]-L-валил}пиперидин-2-карбоксамид
или
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-циклобутил-N-(трифторацетил)-D-аланил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид
или
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-3-[3-циклобутил-N-(трифторацетил)-D-аланил]-6,6-диметил-3-азабицикло[3,1,0]гексан-2-карбоксамид
1. Не определено.
2. Региохимия примера 41 определена не точно; другими возможными структурами для этого примера являются N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-5,6-бис(трифторметил)-1H-индол-2-карбоксамид и N-[(2S)-1-({(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}амино)-4,4-диметил-1-оксопентан-2-ил]-4-метокси-6,7-бис(трифторметил)-1H-индол-2-карбоксамид.
Спрогнозированные фармакокинетические параметры (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида (соединение примера 13) у человека
Основываясь на моделировании физиологически основанной фармакокинетики (PBPK) in-vitro данных, включая CLint из микросом печени человека и CLbile из гепатоцитов человека в сандвич-культивированных условиях, спрогнозированные CL и Vss в плазме человека для (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида составляют 5,9 мл/мин/кг и 0,97 л/кг, соответственно, и дают эффективный период полужизни, t1/2, 1,9 часа. Целевой Ceff 0,16 мМ (несвязанная плазменная концентрация) определяют на основе данных антивирусного ингибирования, полученных из in vitro исследований (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида с либо VeroE6 клетками в присутствии ингибитора P-gp (значение EC90 0,156 мМ), либо в анализе дифференцированных нормальных клеток бронхиального эпителия человека (dNHBE) (значение EC90 0,149 мМ). Доза 380 мг (1R,2S,5S)-N-{(1S)-1-Циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3,1,0]гексан-2-карбоксамида, вводимая перорально три раза в сутки (TID),предположительно покрывает эффективную несвязанную концентрацию 0,16 мМ при Cmin.
Все патенты и публикации, описанные выше, полностью включены в настоящий документ посредством ссылки. Хотя изобретение было описано в терминах различных предпочтительных вариантов осуществления и конкретных примеров, изобретение следует понимать как не ограниченное вышеприведенным подробным описанием, а как определенное прилагаемой формулой изобретения и ее эквивалентами.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Pfizer Inc.
Owen, Dafydd
Pettersson, Martin
Reese, Matthew
Sammons, Matthew
Tuttle, Jamison
Yang, Qingyi
Yang, Xiaojing
Verhoest, Patrick
<120> НИТРИЛСОДЕРЖАЩИЕ ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ
<130> PC072660A
<150> US 63/073,982
<151> 2020-09-03
<150> US 63/143,435
<151> 2021-01-29
<150> US 63/170,158
<151> 2021-04-02
<150> US 63/194,241
<151> 2021-05-28
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 306
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Ser Gly Phe Arg Lys Met Ala Phe Pro Ser Gly Lys Val Glu Gly Cys
1 5 10 15
Met Val Gln Val Thr Cys Gly Thr Thr Thr Leu Asn Gly Leu Trp Leu
20 25 30
Asp Asp Val Val Tyr Cys Pro Arg His Val Ile Cys Thr Ser Glu Asp
35 40 45
Met Leu Asn Pro Asn Tyr Glu Asp Leu Leu Ile Arg Lys Ser Asn His
50 55 60
Asn Phe Leu Val Gln Ala Gly Asn Val Gln Leu Arg Val Ile Gly His
65 70 75 80
Ser Met Gln Asn Cys Val Leu Lys Leu Lys Val Asp Thr Ala Asn Pro
85 90 95
Lys Thr Pro Lys Tyr Lys Phe Val Arg Ile Gln Pro Gly Gln Thr Phe
100 105 110
Ser Val Leu Ala Cys Tyr Asn Gly Ser Pro Ser Gly Val Tyr Gln Cys
115 120 125
Ala Met Arg Pro Asn Phe Thr Ile Lys Gly Ser Phe Leu Asn Gly Ser
130 135 140
Cys Gly Ser Val Gly Phe Asn Ile Asp Tyr Asp Cys Val Ser Phe Cys
145 150 155 160
Tyr Met His His Met Glu Leu Pro Thr Gly Val His Ala Gly Thr Asp
165 170 175
Leu Glu Gly Asn Phe Tyr Gly Pro Phe Val Asp Arg Gln Thr Ala Gln
180 185 190
Ala Ala Gly Thr Asp Thr Thr Ile Thr Val Asn Val Leu Ala Trp Leu
195 200 205
Tyr Ala Ala Val Ile Asn Gly Asp Arg Trp Phe Leu Asn Arg Phe Thr
210 215 220
Thr Thr Leu Asn Asp Phe Asn Leu Val Ala Met Lys Tyr Asn Tyr Glu
225 230 235 240
Pro Leu Thr Gln Asp His Val Asp Ile Leu Gly Pro Leu Ser Ala Gln
245 250 255
Thr Gly Ile Ala Val Leu Asp Met Cys Ala Ser Leu Lys Glu Leu Leu
260 265 270
Gln Asn Gly Met Asn Gly Arg Thr Ile Leu Gly Ser Ala Leu Leu Glu
275 280 285
Asp Glu Phe Thr Pro Phe Asp Val Val Arg Gln Cys Ser Gly Val Thr
290 295 300
Phe Gln
305
<210> 2
<211> 306
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Ser Gly Phe Arg Lys Met Ala Phe Pro Ser Gly Lys Val Glu Gly Cys
1 5 10 15
Met Val Gln Val Thr Cys Gly Thr Thr Thr Leu Asn Gly Leu Trp Leu
20 25 30
Asp Asp Val Val Tyr Cys Pro Arg His Val Ile Cys Thr Ser Glu Asp
35 40 45
Met Leu Asn Pro Asn Tyr Glu Asp Leu Leu Ile Arg Lys Ser Asn His
50 55 60
Asn Phe Leu Val Gln Ala Gly Asn Val Gln Leu Arg Val Ile Gly His
65 70 75 80
Ser Met Gln Asn Cys Val Leu Lys Leu Lys Val Asp Thr Ala Asn Pro
85 90 95
Lys Thr Pro Lys Tyr Lys Phe Val Arg Ile Gln Pro Gly Gln Thr Phe
100 105 110
Ser Val Leu Ala Cys Tyr Asn Gly Ser Pro Ser Gly Val Tyr Gln Cys
115 120 125
Ala Met Arg Pro Asn Phe Thr Ile Lys Gly Ser Phe Leu Asn Gly Ser
130 135 140
Cys Gly Ser Val Gly Phe Asn Ile Asp Tyr Asp Cys Val Ser Phe Cys
145 150 155 160
Tyr Met His His Met Glu Leu Pro Thr Gly Val His Ala Gly Thr Asp
165 170 175
Leu Glu Gly Asn Phe Tyr Gly Pro Phe Val Asp Arg Gln Thr Ala Gln
180 185 190
Ala Ala Gly Thr Asp Thr Thr Ile Thr Val Asn Val Leu Ala Trp Leu
195 200 205
Tyr Ala Ala Val Ile Asn Gly Asp Arg Trp Phe Leu Asn Arg Phe Thr
210 215 220
Thr Thr Leu Asn Asp Phe Asn Leu Val Ala Met Lys Tyr Asn Tyr Glu
225 230 235 240
Pro Leu Thr Gln Asp His Val Asp Ile Leu Gly Pro Leu Ser Ala Gln
245 250 255
Thr Gly Ile Ala Val Leu Asp Met Cys Ala Ser Leu Lys Glu Leu Leu
260 265 270
Gln Asn Gly Met Asn Gly Arg Thr Ile Leu Gly Ser Ala Leu Leu Glu
275 280 285
Asp Glu Phe Thr Pro Phe Asp Val Val Arg Gln Cys Ser Gly Val Thr
290 295 300
Phe Gln
305
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НИТРИЛСОДЕРЖАЩИЕ ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ | 2021 |
|
RU2786722C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ АЗАБИЦИКЛОГЕКСАНА | 2023 |
|
RU2811800C1 |
| НОВЫЕ ФОРМЫ (1R,2S,5S)-N-[(1S)-1-ЦИАНО-2-[(3S)-2-ОКСОПИРРОЛИДИН-3-ИЛ]ЭТИЛ]-3-[(2S)-3,3-ДИМЕТИЛ-2-[(2,2,2-ТРИФТОРАЦЕТИЛ)АМИНО]БУТАНОИЛ]-6,6-ДИМЕТИЛ-3-АЗАБИЦИКЛО[3.1.0]ГЕКСАН-2-КАРБОКСАМИДА | 2023 |
|
RU2827357C1 |
| НОВЫЕ ФОРМЫ (1R,2S,5S)-N-[(1S)-1-ЦИАНО-2-[(3S)-2-ОКСОПИРРОЛИДИН-3-ИЛ]ЭТИЛ]-3-[(2S)-3,3-ДИМЕТИЛ-2-[(2,2,2-ТРИФТОРАЦЕТИЛ)АМИНО]БУТАНОИЛ]-6,6-ДИМЕТИЛ-3-АЗАБИЦИКЛО[3.1.0]ГЕКСАН-2-КАРБОКСАМИДА | 2023 |
|
RU2827358C1 |
| НОВЫЕ ФОРМЫ (1R,2S,5S)-N-[(1S)-1-ЦИАНО-2-[(3S)-2-ОКСОПИРРОЛИДИН-3-ИЛ]ЭТИЛ]-3-[(2S)-3,3-ДИМЕТИЛ-2-[(2,2,2-ТРИФТОРАЦЕТИЛ)АМИНО]БУТАНОИЛ]-6,6-ДИМЕТИЛ-3-АЗАБИЦИКЛО[3.1.0]ГЕКСАН-2-КАРБОКСАМИДА | 2023 |
|
RU2827154C1 |
| НОВЫЕ ФОРМЫ (1R,2S,5S)-N-[(1S)-1-ЦИАНО-2-[(3S)-2-ОКСОПИРРОЛИДИН-3-ИЛ]ЭТИЛ]-3-[(2S)-3,3-ДИМЕТИЛ-2-[(2,2,2-ТРИФТОРАЦЕТИЛ)АМИНО]БУТАНОИЛ]-6,6-ДИМЕТИЛ-3-АЗАБИЦИКЛО[3.1.0]ГЕКСАН-2-КАРБОКСАМИДА | 2023 |
|
RU2827158C1 |
| НОВЫЕ ФОРМЫ (1R,2S,5S)-N-[(1S)-1-ЦИАНО-2-[(3S)-2-ОКСОПИРРОЛИДИН-3-ИЛ]ЭТИЛ]-3-[(2S)-3,3-ДИМЕТИЛ-2-[(2,2,2-ТРИФТОРАЦЕТИЛ)АМИНО]БУТАНОИЛ]-6,6-ДИМЕТИЛ-3-АЗАБИЦИКЛО[3.1.0]ГЕКСАН-2-КАРБОКСАМИДА | 2023 |
|
RU2827157C1 |
| СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ KDM5, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2840256C1 |
| ЗАМЕЩЕННЫЕ 3-АЗАБИЦИКЛО[3.1.0]ГЕКСАНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КЕТОГЕКСОКИНАЗЫ | 2016 |
|
RU2696269C1 |
| СИНТЕЗ (1R,2S,5S)-N-[(1S)-1-ЦИАНО-2-[(3S)-2-ОКСОПИРРОЛИДИН-3-ИЛ]ЭТИЛ]-3-[(2S)-3,3-ДИМЕТИЛ-2-[(2,2,2-ТРИФТОРАЦЕТИЛ)АМИНО]БУТАНОИЛ]-6,6-ДИМЕТИЛ-3-АЗАБИЦИКЛО[3.1.0]ГЕКСАН-2-КАРБОКСАМИДА | 2022 |
|
RU2794748C1 |
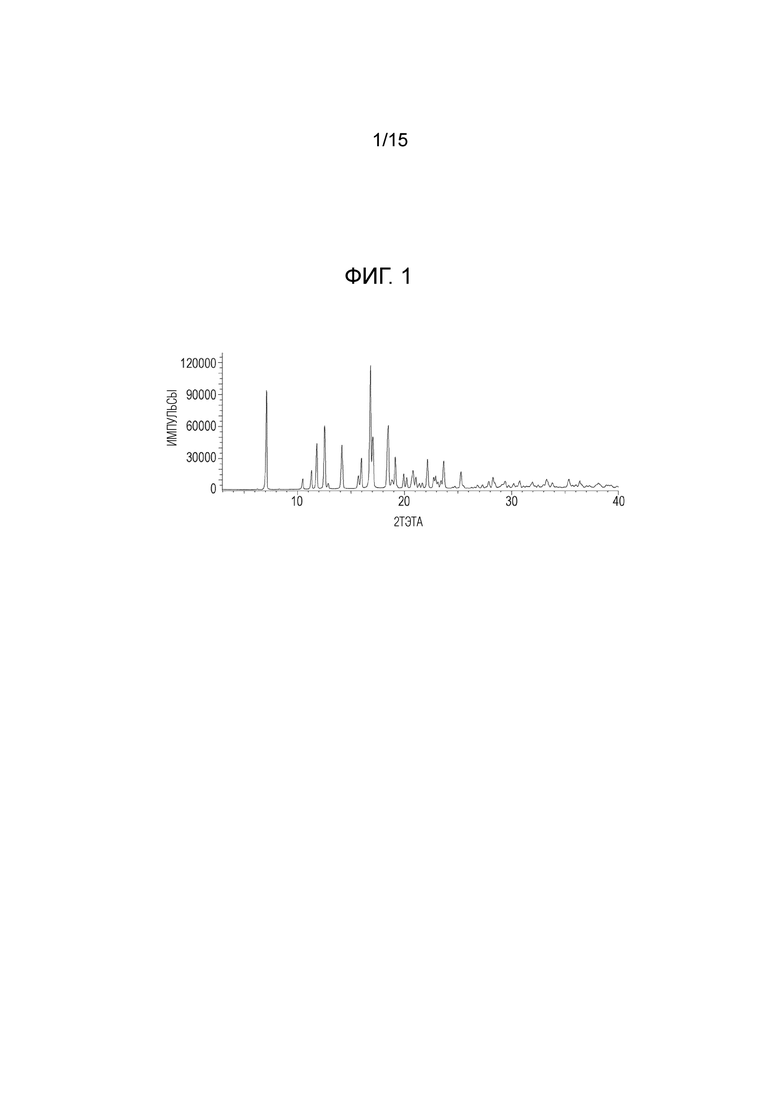
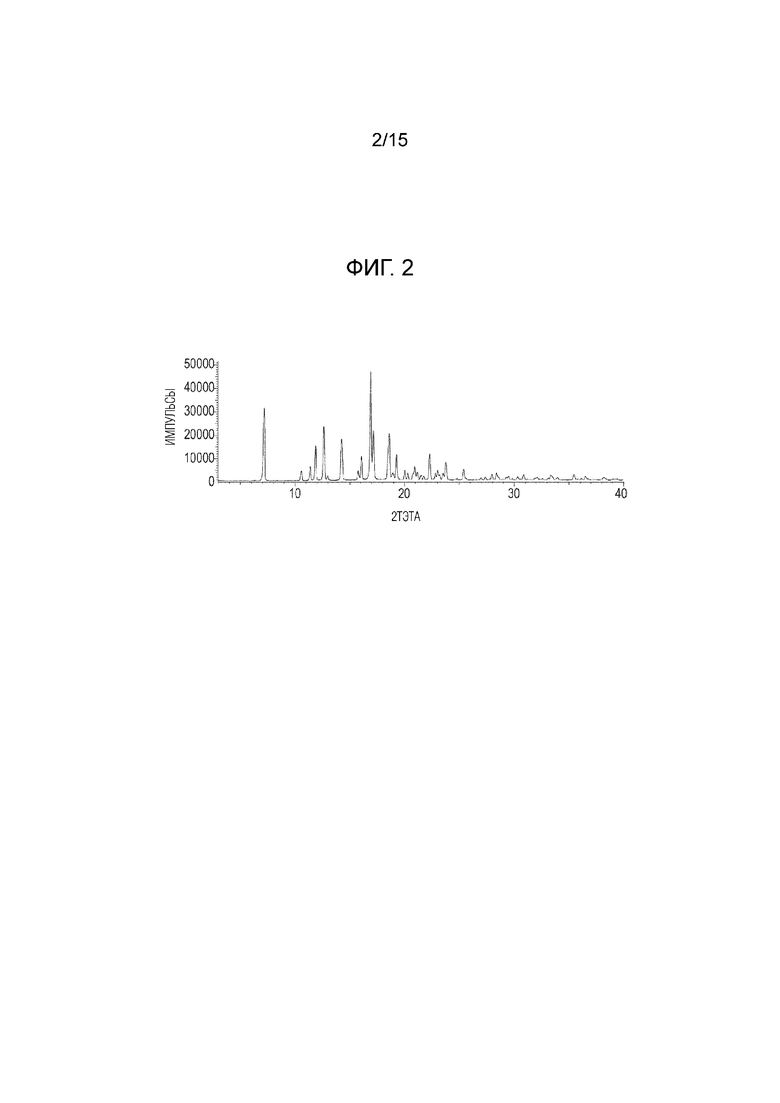
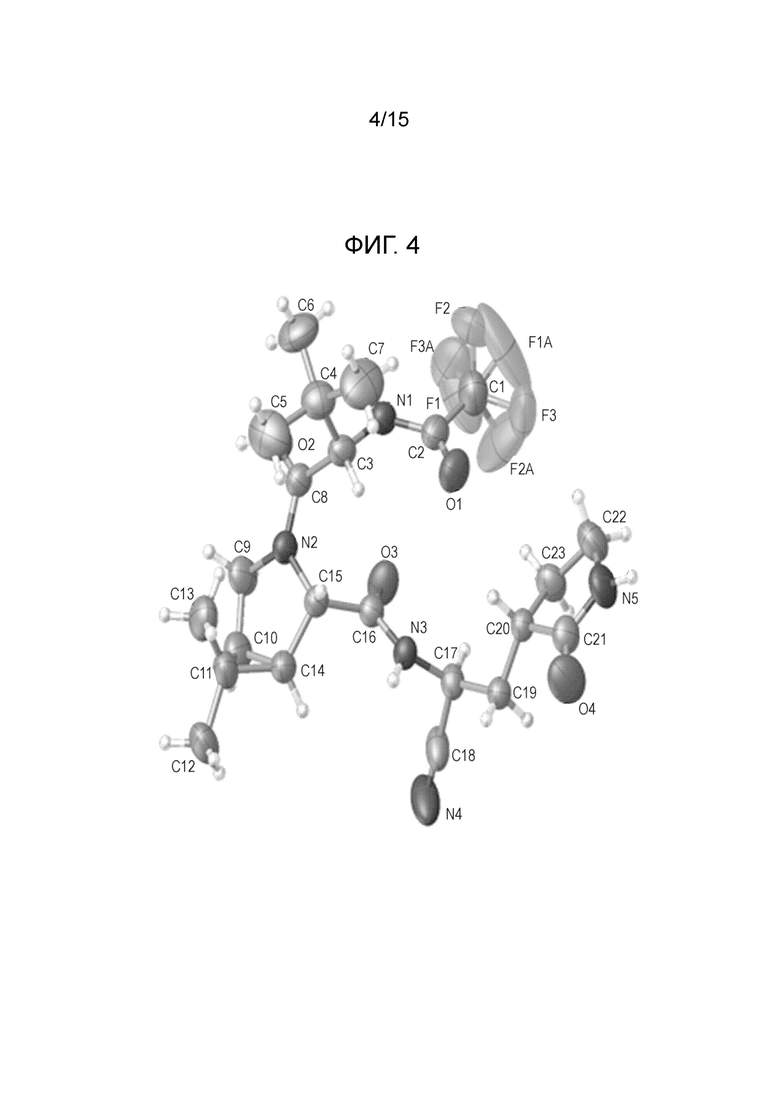
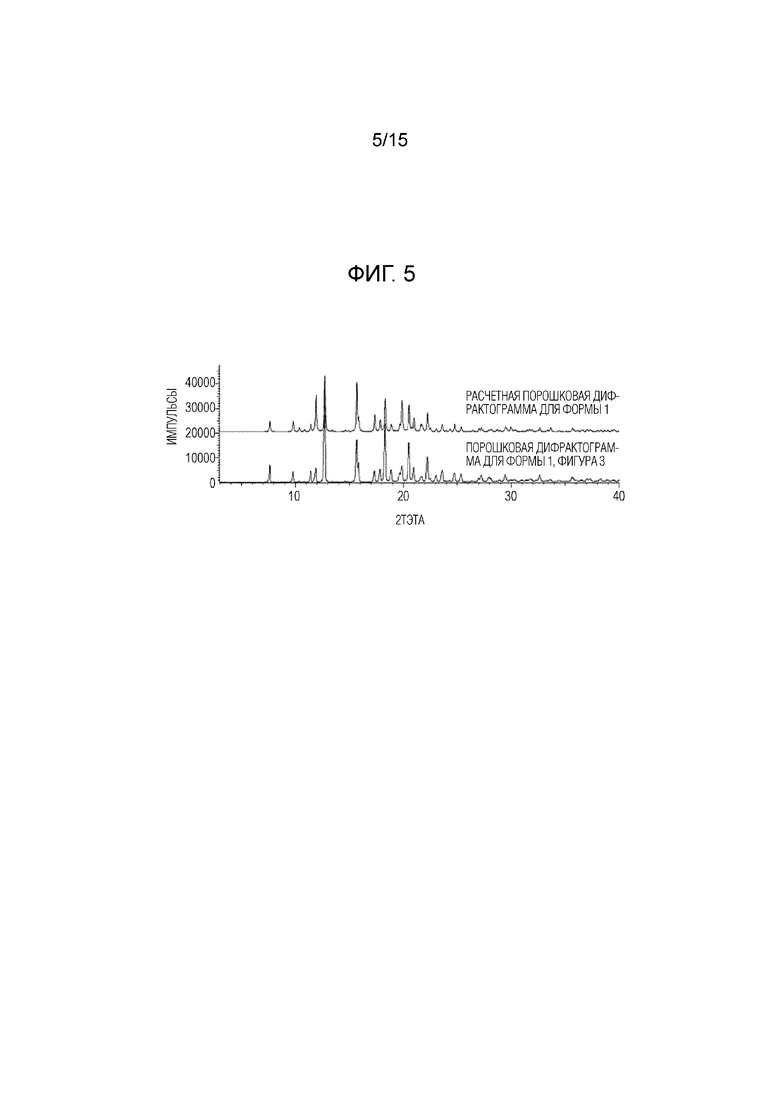
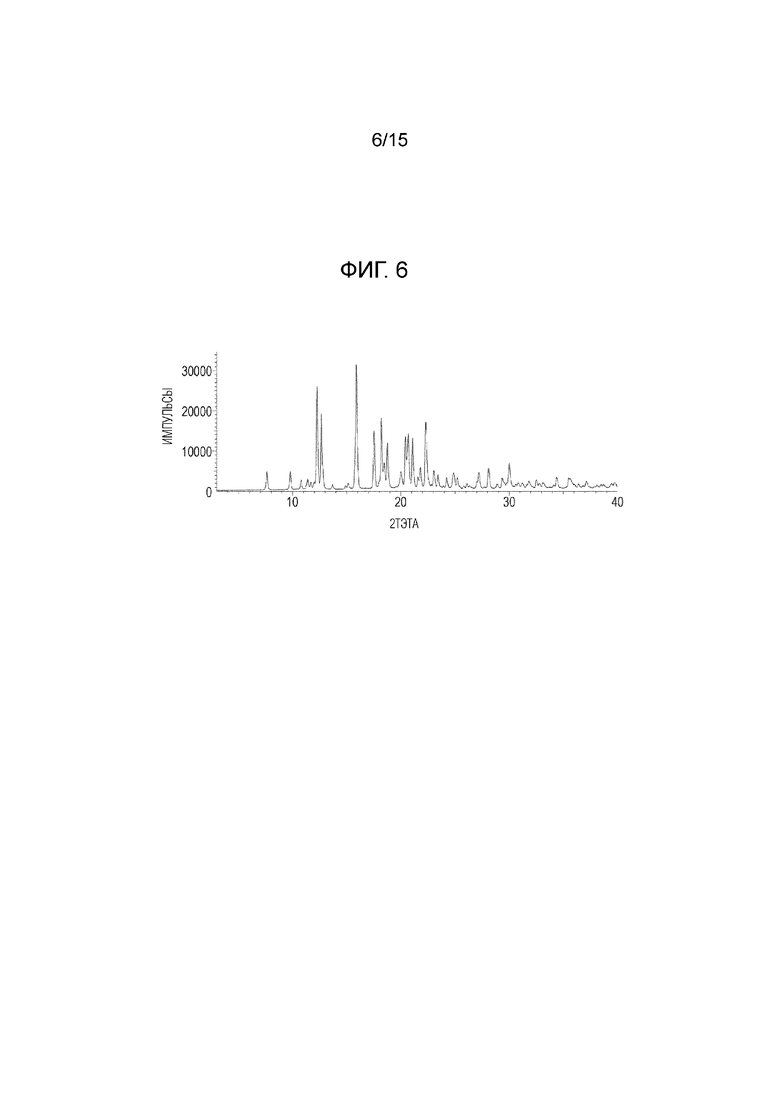
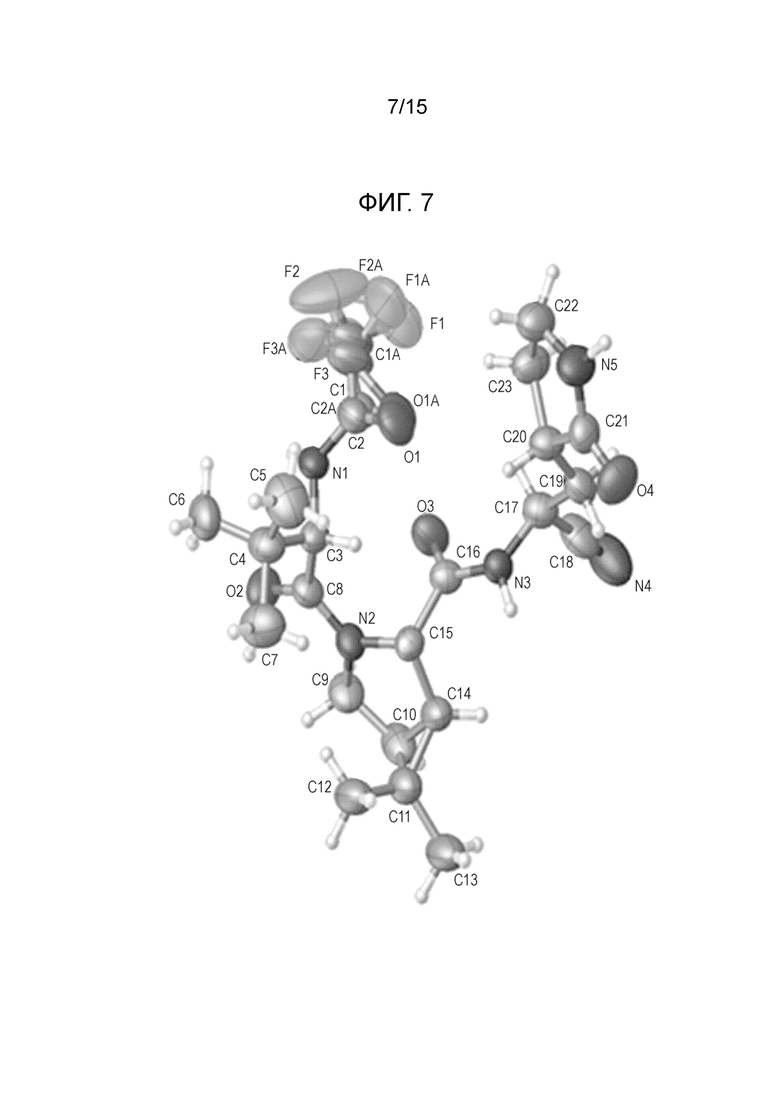
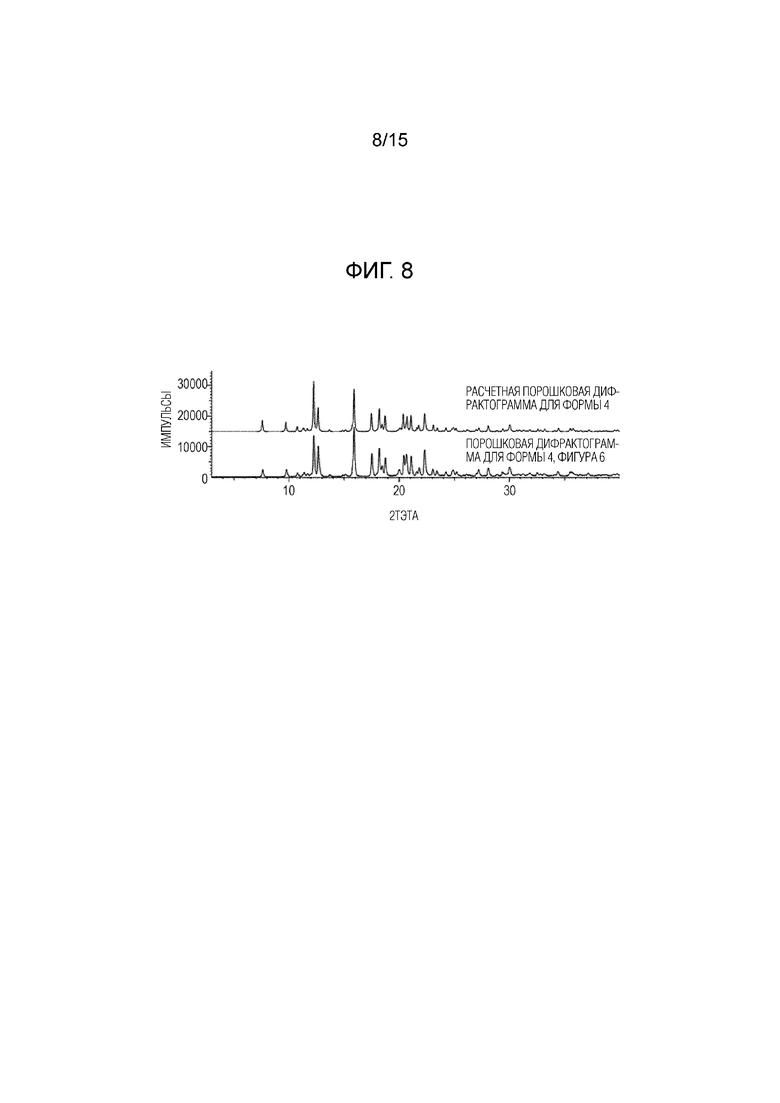
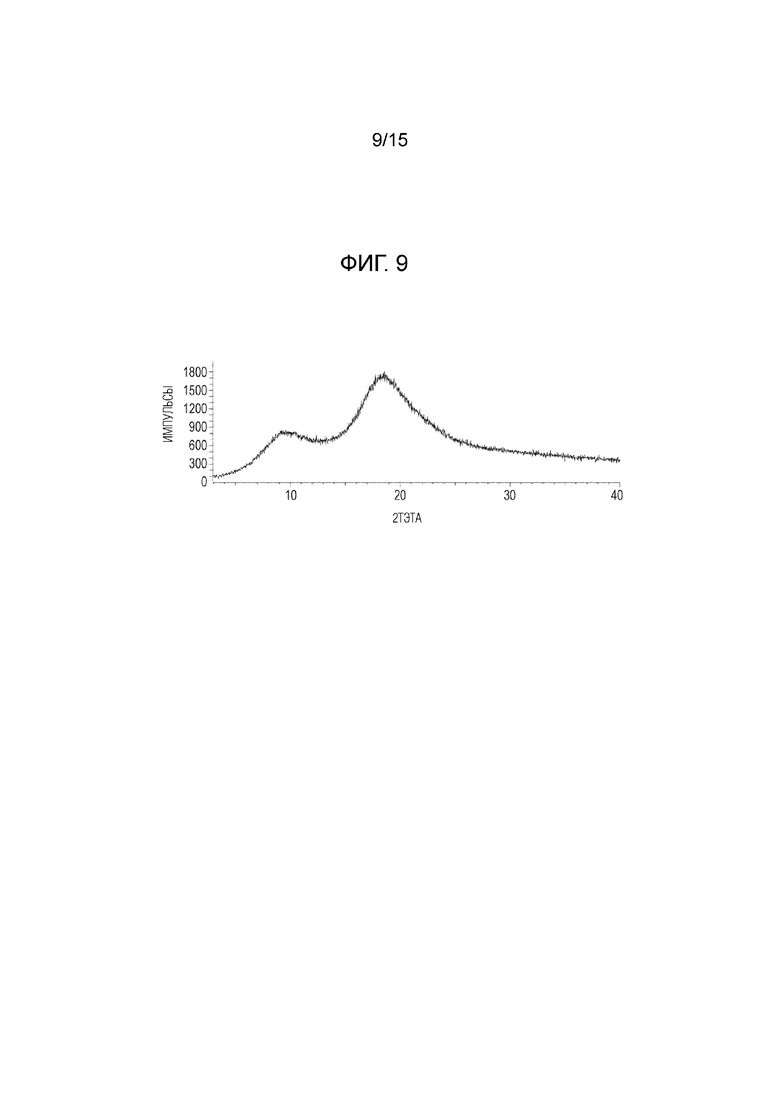
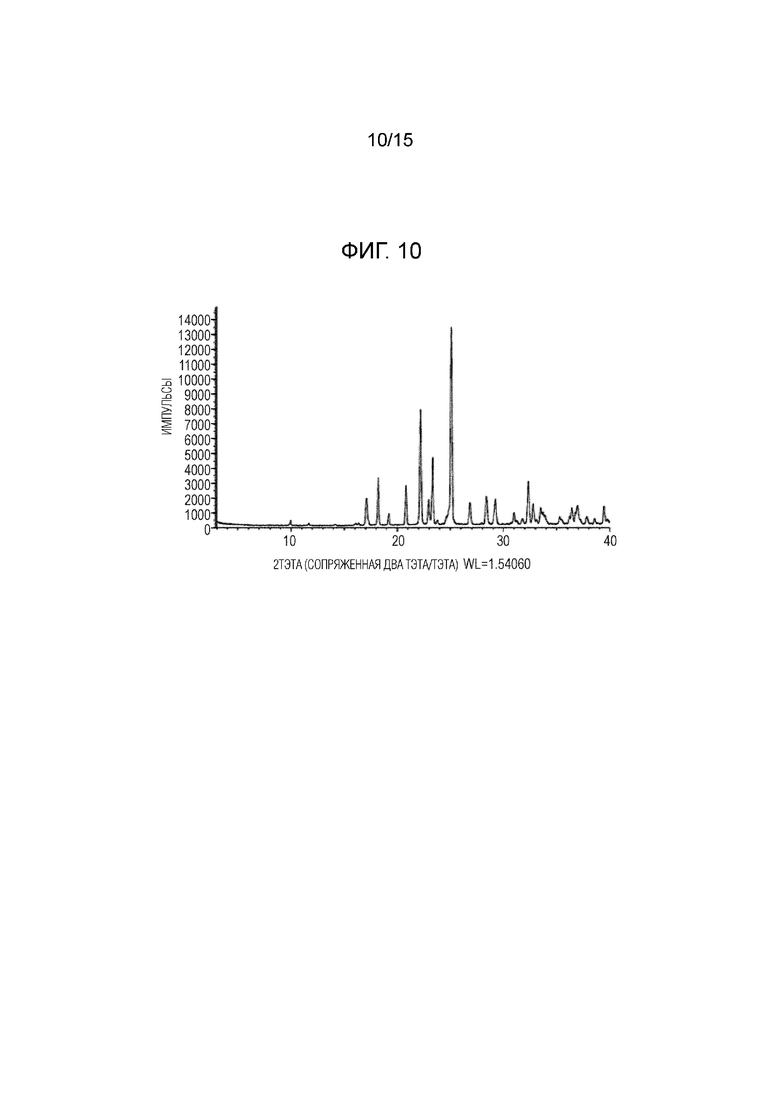
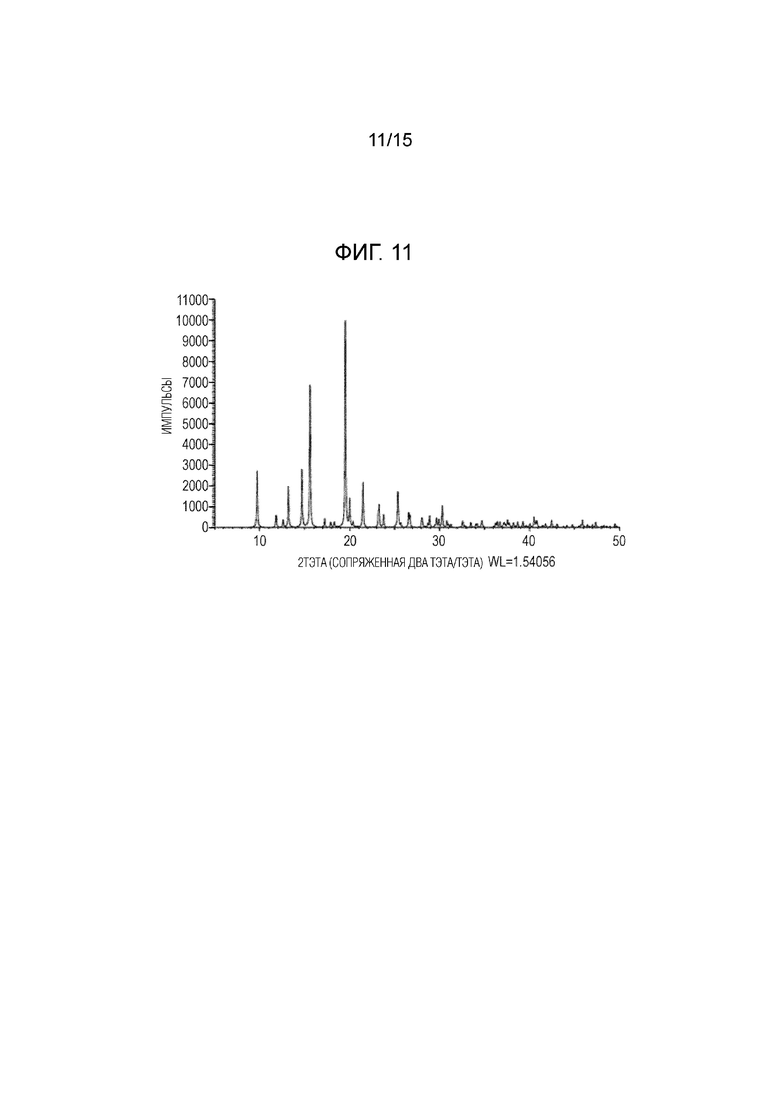
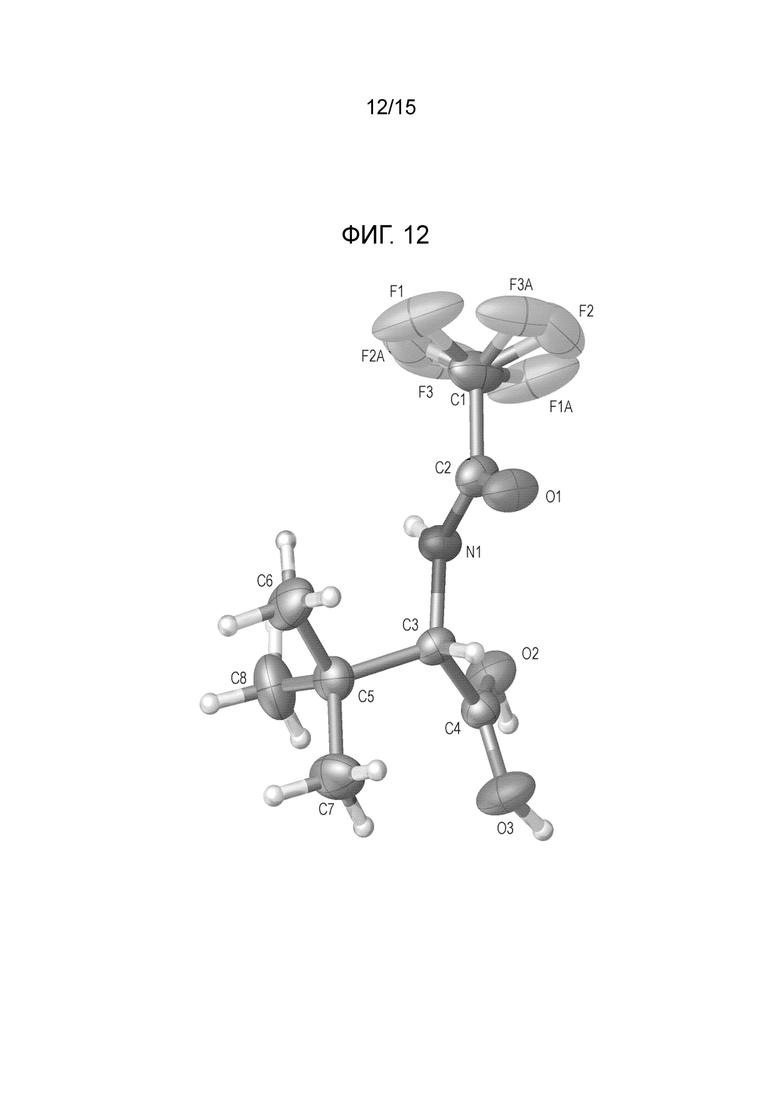
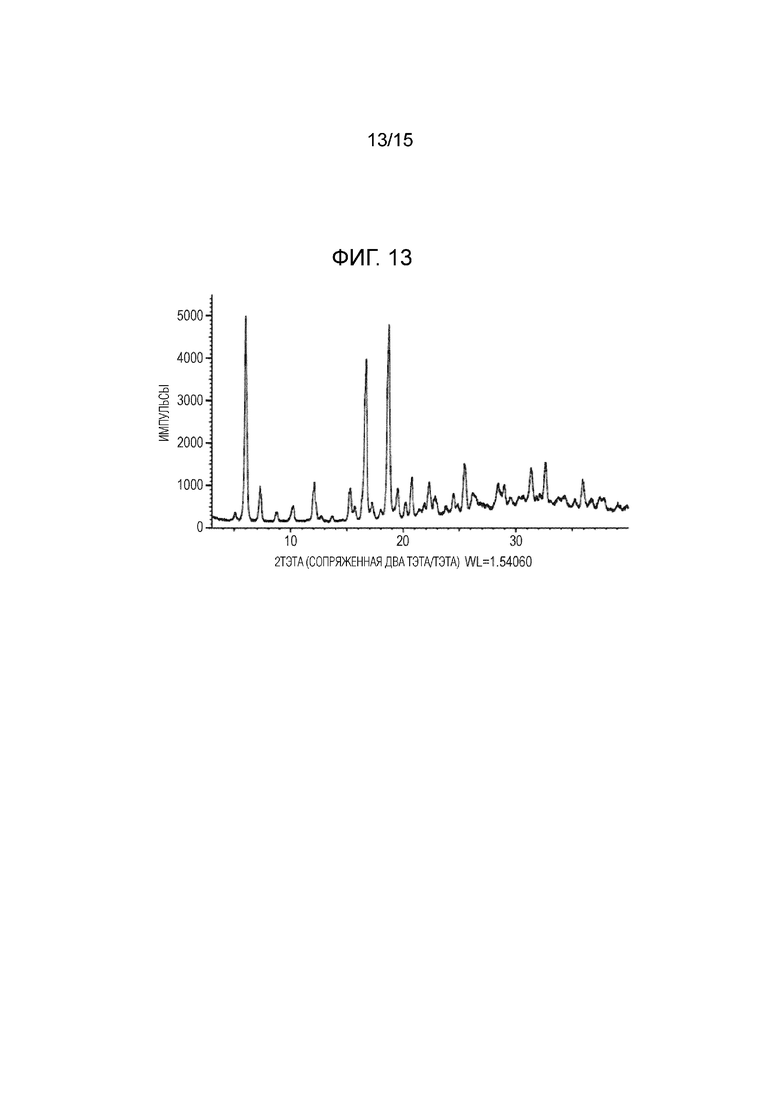
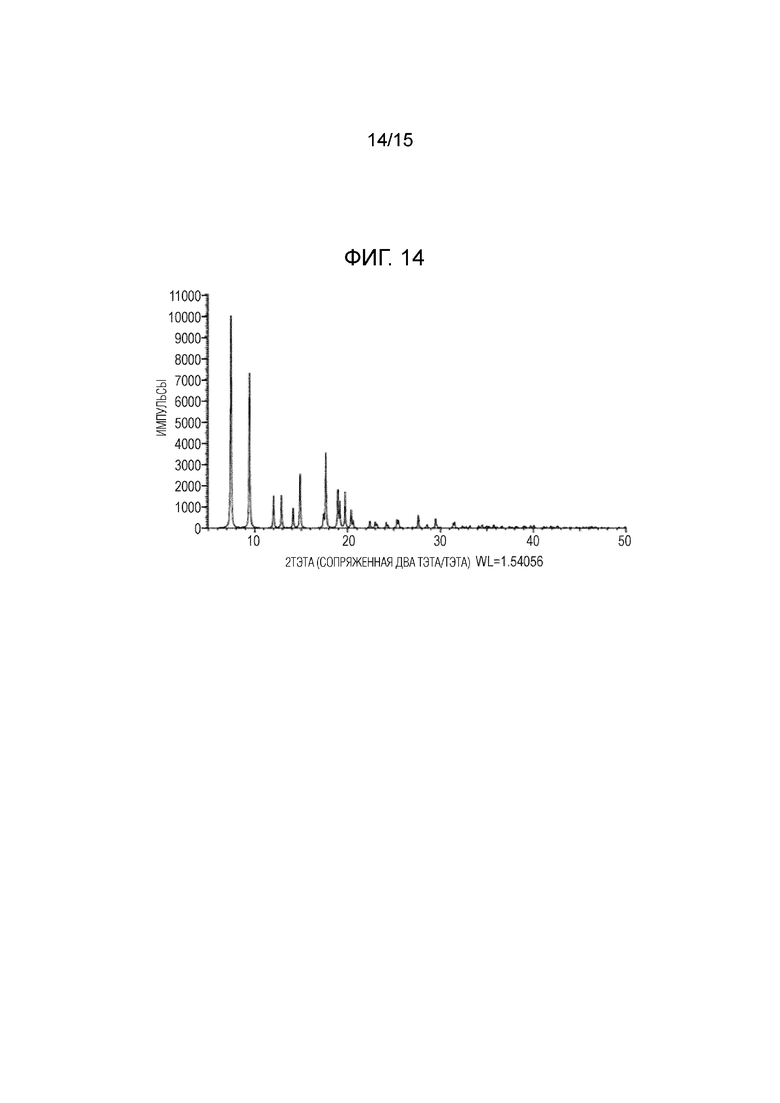
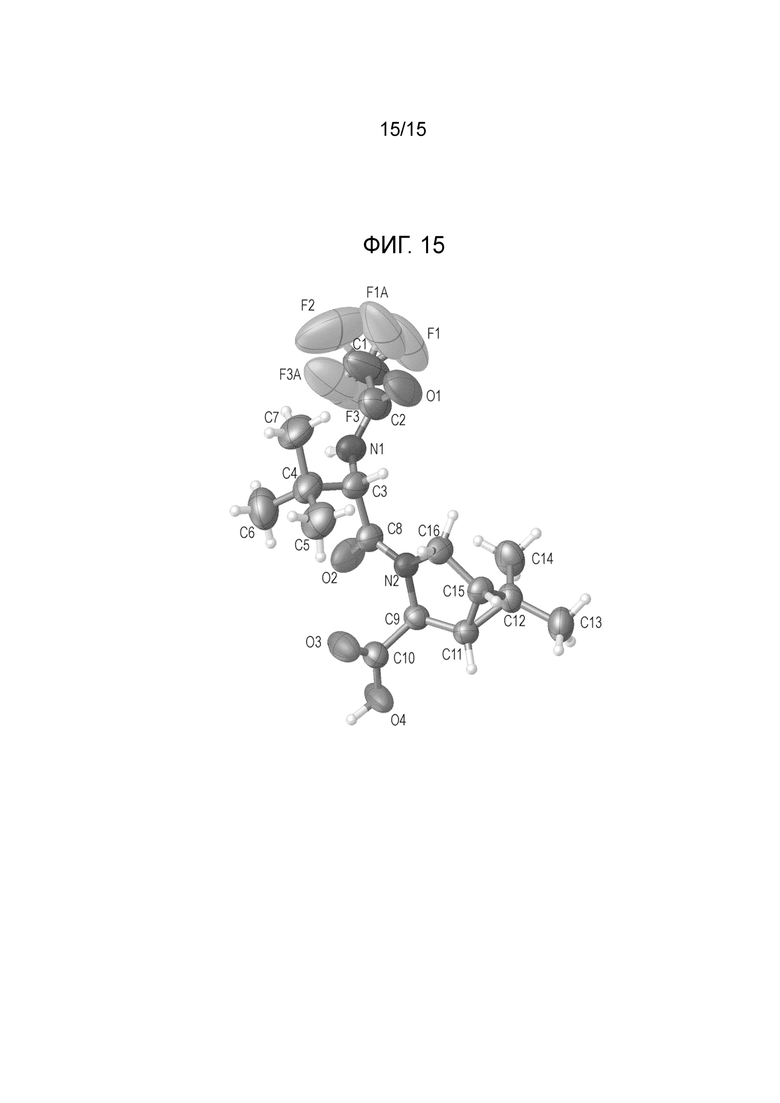
Изобретение относится к соединению формулы I'', где R, R1, R2, R3, p, q и q' такие, как определены в формуле изобретения, фармацевтическим композициям, содержащим соединения, и применению соединений для лечения коронавирусной инфекции, такой как COVID-19. 7 н. и 29 з.п. ф-лы, 15 ил., 2 табл., 98 пр.
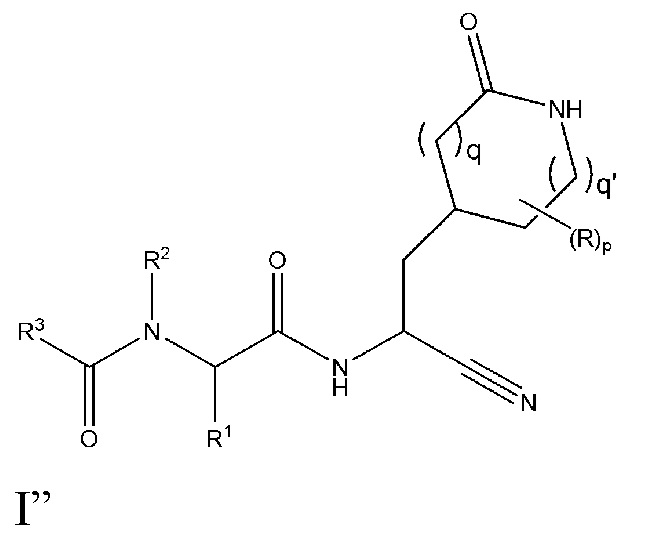
1. Соединение, выбранное из группы, состоящей из
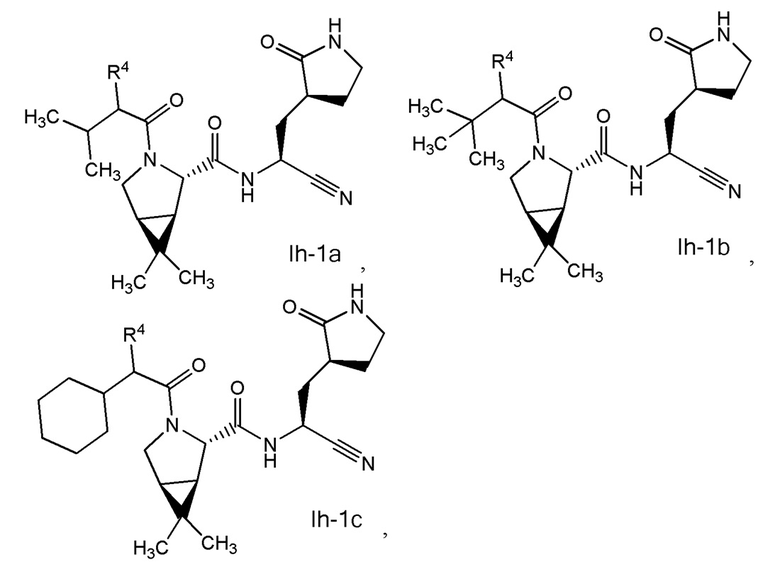
где R4 выбирают из группы, состоящей из C1-C6 алкил-C(O)NH-, необязательно замещенного от одного до пяти атомами фтора, и C1-C6 алкил-S(O)2NH-, необязательно замещенного от одного до пяти атомами фтора;
или его сольват.
2. Соединение по п.1, отличающееся тем, что R4 выбирают из группы, состоящей из CF3C(O)NH-, CF3S(O)2NH-, CH3C(O)NH- и CH3CH2C(O)NH-; или его сольват.
3. Соединение по п.2, отличающееся тем, что R4 является CF3C(O)NH- или CF3S(O)2NH-; или его сольват.
4. Соединение N-(Метоксикарбонил)-3-метил-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамид, имеющее структуру
или его сольват.
5. Соединение по п.4, которым является N-(Метоксикарбонил)-3-метил-L-валил-(4R)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-4-(трифторметил)-L-пролинамид.
6. Фармацевтическая композиция для лечения коронавирусной инфекции, содержащая эффективное количество соединения по любому из пп.1-5 или его сольват вместе с фармацевтически приемлемым носителем.
7. Применение соединения по любому из пп.1-5, или его сольвата, или фармацевтической композиции по п.6 для лечения коронавирусной инфекции у пациента, нуждающегося в этом.
8. Применение по п.7, отличающееся тем, что коронавирусной инфекцией является COVID-19.
9. Применение по п.8, отличающееся тем, что пациенту совместно вводят ритонавир.
10. Применение по п.9, отличающееся тем, что соединение по любому из пп.1-5 и ритонавир вводят пациенту перорально.
11. Применение по п.10, отличающееся тем, что вводят от примерно 10 мг до примерно 1500 мг в сутки соединения по любому из пп.1-5 и от примерно 10 мг до примерно 1000 мг в сутки ритонавира.
12. Применение по п.11, отличающееся тем, что примерно 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг или 750 мг соединения по любому из пп.1-5 вводят перорально пациенту дважды в сутки.
13. Применение по п.12, отличающееся тем, что ритонавир совместно вводят перорально пациенту дважды в сутки.
14. Применение по п.13, отличающееся тем, что примерно 300 мг соединения по любому из пп.1-5 и примерно 100 мг ритонавира вводят совместно пациенту дважды в сутки.
15. Применение соединения по любому из пп.1-5 или его сольвата для получения лекарственного средства для лечения коронавирусной инфекции у пациента.
16. Фармацевтическая композиция для лечения коронавирусной инфекции, содержащая эффективное количество соединения (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид, имеющее структуру
 ;
;
или его сольват и фармацевтическую приемлемый носитель; где фармацевтическая композиция представляет собой пероральную лекарственную форму.
17. Фармацевтическая композиция по п.16, где пероральная лекарственная форма представляет собой таблетку, капсулу, пастилку, эмульсию, суспензию, сироп или раствор.
18. Фармацевтическая композиция по п.17, которая содержит от 10 до 1500 мг (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида.
19. Фармацевтическая композиция по п.18, которая содержит 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг или 750 мг (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида.
20. Фармацевтическая композиция по п.19, где фармацевтическая композиция представляет собой таблетку.
21. Фармацевтическая композиция по п.20, в которой таблетка содержит один или более компонентов, выбранных из группы, состоящей из разбавителя, разрыхлителя, глиданта и смазывающего агента.
22. Фармацевтическая композиция по п.21, в которой таблетка содержит один или более компонентов, выбранных из группы, состоящей из микрокристаллической целлюлозы, моногидрата лактозы, кросповидона, коллоидного диоксида кремния, интрагранулированного стеарилфумарата натрия и экстрагранулированного стеарилфумарата натрия.
23. Фармацевтическая композиция по п.22, в которой таблетка содержит 100 мг, 150 мг или 250 мг (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида.
24. Фармацевтическая композиция по п.23, в которой таблетка содержит 100 мг (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида, 246,67 мг микрокристаллической целлюлозы, 123,33 мг моногидрата лактозы, 15,00 мг кросповидона, 5,00 мг коллоидного диоксида кремния, 5,00 мг интрагранулированного стеарилфумарата натрия и 5,00 мг экстрагранулированного стеарилфумарата натрия.
25. Фармацевтическая композиция по п.24, в которой таблетка содержит покрытие.
26. Фармацевтическая композиция по п.23, в которой таблетка содержит 150 мг (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида, 370,00 мг микрокристаллической целлюлозы, 185,00 мг моногидрата лактозы, 22,50 мг кросповидона, 7,50 мг коллоидного диоксида кремния, 7,50 мг интрагранулированного стеарилфумарата натрия и 7,50 мг экстрагранулированного стеарилфумарата натрия.
27. Фармацевтическая композиция по п.26, в которой таблетка содержит покрытие.
28. Фармацевтическая композиция по п.23, в которой таблетка содержит 250 мг (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида, 460,00 мг микрокристаллической целлюлозы, 230,00 мг моногидрата лактозы, 30,00 мг кросповидона, 10,00 мг коллоидного диоксида кремния, 10,00 мг интрагранулированного стеарилфумарата натрия и 10,00 мг экстрагранулированного стеарилфумарата натрия.
29. Фармацевтическая композиция по п.28, в которой таблетка содержит покрытие.
30. Фармацевтическая композиция по п.20, в которой таблетка содержит кристаллический (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид, который характеризуется пиком в твердотельном 19F ЯМР с химическим сдвигом при -73,3 ± 0,1 ч./млн и пиками в твердотельном 13C ЯМР с химическими сдвигами при 31,0 ± 0,1 ч./млн, 27,9 ± 0,1 ч./млн и 178,9 ± 0,2 ч./млн.
31. Фармацевтическая композиция по п.20, в которой таблетка содержит кристаллический (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид, который характеризуется одним или несколькими пиками, выбранным из группы, состоящей из пика в твердотельном 19F ЯМР с химическим сдвигом при -73,6 ± 0,1 ч./млн и пиков в твердотельном 13C ЯМР с химическими сдвигами при 26,9 ± 0,1 ч./млн, 21,6 ± 0,1 ч./млн и 41,5 ± 0,1 ч./млн.
32. Фармацевтическая композиция по п.20, в которой таблетка содержит кристаллический сольват (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамида с метил трет-бутиловым эфиром.
33. Комбинация для лечения коронавирусной инфекции, содержащая:
(1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид, имеющее структуру
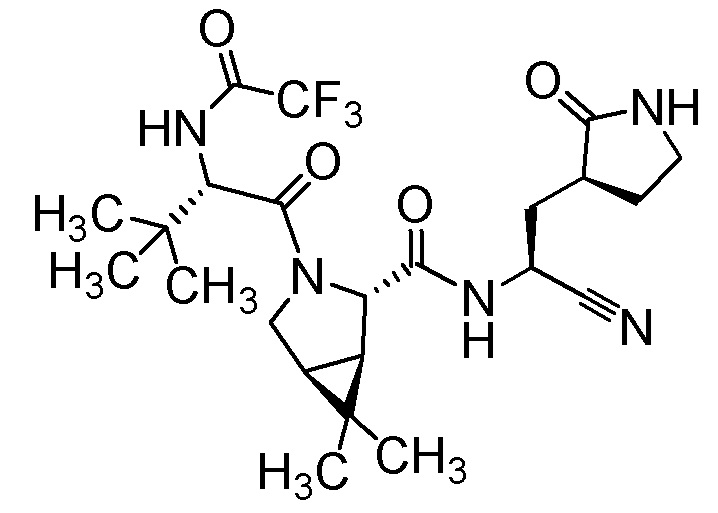 ; и
; и
ритонавир.
34. Комбинация по п.33, в которой (1R,2S,5S)-N-{(1S)-1-циано-2-[(3S)-2-оксопирролидин-3-ил]этил}-6,6-диметил-3-[3-метил-N-(трифторацетил)-L-валил]-3-азабицикло[3.1.0]гексан-2-карбоксамид и ритонавир находятся в отдельных дозированных формах.
35. Комбинация по п.33 для применения в производстве лекарственного средства для лечения коронавирусной инфекции.
36. Комбинация по п.35, отличающаяся тем, что коронавирусной инфекцией является COVID-19.
| WO 2005113580 A1, 01.12.2005 | |||
| HAI YANGYANG et al | |||
| Контрольный стрелочный замок | 1920 |
|
SU71A1 |
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| WANG YAXIN et al | |||
| Контрольный стрелочный замок | 1920 |
|
SU71A1 |
Авторы
Даты
2024-05-30—Публикация
2021-08-06—Подача