Изобретение относится к синтезу хиральных цис-миртанилсульфонамидов, потенциальных биологически активных соединений.
Природные терпены обладают бактерицидным, противогрибковым, противовирусным, обезболивающим и муколитическим действиями; оказывают химиопрофилактическое действие при раке, антигипергликемическое, противовоспалительное и противопаразитарное действие [R. Paduch, M. Kandefer-Szerszen, M. Trytek and J. Fiedurek, Arch. Immun. Ther. Exp., 2007, 55, 315].
Введение серы различной степени окисления в молекулу терпена повышает противогрибковую, противовоспалительную, антихеликобактерную, противоопухолевую и другие активности [L. E. Nikitina, N. P. Artemova, V. A. Startseva, I. V. Fedyunina and V. V. Klochkov, Chem. Nat. Comp., 2017, 53, 811].
Монотерпеновые сульфонамиды на основе камфоры обладают ингибирующей активностью в отношении вирусов Эбола и Марбург [А.С. Соколова, Д.В. Баранова, О.И. Яровая, Д.С. Баев, О.А. Полежаева и др. Изв. АН, Сер. Хим., 2019, 5, 1041]. Энантиомеры транс-миртанилсульфонамида, содержащие группы NH2, пиперазиновый и хлорфенильный фрагменты, являются антагонистами белок-белкового взаимодействия Bcl-2 [N. Yusuff, M. Dore, C. Joud, M. Visser, C. Springer, X. Xie, K. Herlihy, D. Porter, B. B. Toure. ACS Med. Chem. Lett., 2012, 3(7), 579. doi: 10.1021/ml300095a].
В патентах [Е.С. Изместьев, С.В. Пестова, О.М. Лезина, С.А. Рубцова, А.В. Кучин. Патент № 2726793. 2020. Бюл. № 20] и [О.М. Лезина, О.Н. Гребенкина, Е.С. Изместьев, С.Н. Субботина, С.А. Рубцова, А.В. Кучин. Патент № 2725878. 2020. Бюл. № 19] (наиболее близкий аналог) получена серия хиральных сульфонамидов на основе дегидроабиетана и (-)-β-пинена соответственно, однако заявленных в настоящей работе соединений выявлено не было.
Задачей настоящего изобретения является синтез хиральных цис- миртанилсульфонамидов, потенциальных биологически активных веществ.
Технический результат заключается в расширении арсенала монотерпеновых сульфопроизводных заданной структуры, потенциальных биологически активных соединений.
Технический результат достигается получением хиральных цис-миртанилсульфонамидов (RSO2R1) структурной формулы (I):
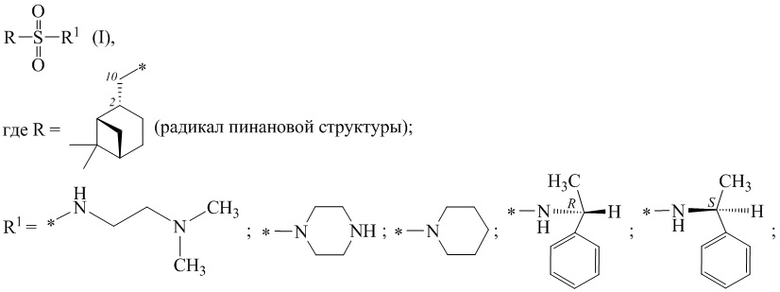
где звездочкой обозначена связь, к которой присоединяется сульфогруппа (-SO2-).
Для получения миртанилсульфонамидов из (-)-β-пинена (схема 1) использовали метод, включающий синтез оптически чистого миртантиола с последующим окислительным хлорированием диоксидом хлора и добавлении алифатического, ароматического или гетероциклического амина. Способ позволяет получить целевые продукты с сохранением структуры терпенового фрагмента с хорошим выходом.
В качестве исходного субстрата использовали (-)-β-пинен 1, из которого реакцией гидроборирования-окисления был получен цис-миртанол 2 [Кучин А.В, Фролова Л.Л. Изв. АН. Сер хим. 2000, 9, 1658], далее - йодид 3 [Garegg P.J., Samuelsson B. J. Chem. Soc., Perkin Trans. 1. 1980, 2866], а затем - взаимодействием с AcSK - тиоацетат 4 [T.-C. Zheng, M. Burkart, D. E. Richardson, Tetrahedron Lett. 1999, 40, 603]. Последний деацилировали по методике [Banach A.,  Ja., Ozimek P. Phosphorus, Sulfur, and Silicon and the Related Elements. 2014, 189, 274] до тиола 5 (схема).
Ja., Ozimek P. Phosphorus, Sulfur, and Silicon and the Related Elements. 2014, 189, 274] до тиола 5 (схема).
Из тиола 5 окислительным хлорированием диоксидом хлора (ClO2) в присутствии катализатора ацетилацетоната ванадила (VO(acac)2) с количественным выходом получен цис-миртанилсульфохлорид 6 (схема) [O. N. Grebyonkina, O. M. Lezina, E. S. Izmest'ev, S. A. Rubtsova and A. V. Kutchin, Russ. J. Org. Chem., 2019, 55(10), 1510)].
На основе сульфохлорида 6 реакцией с аминами синтезированы сульфонамиды 7-11. Реакцию проводили в хлороформе в соотношении сульфохлорид-амин, равном 1:2, по модифицированной методике [Губен-Вейль. Методы органической химии. М.: Химия, 1967, 2, 612] (схема). Выходы сульфонамидов составляют 39-65%. Выход целевого продукта снижается за счет образования соответствующей сульфоновой кислоты или ее соли. Сульфонамид 7 выделен в виде аммониевой соли, где противоионом является цис-миртанильный сульфонат-анион.
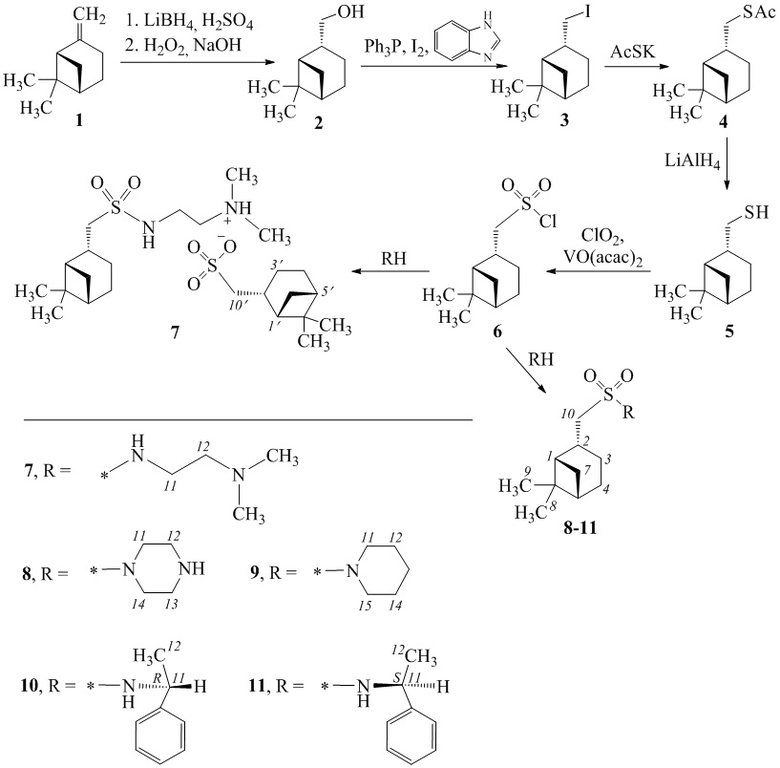
Схема 1. Синтез миртанилсульфонамидов.
Водный раствор диоксида хлора (ClO2) - промышленный продукт, концентрацию которого определяли титрованием по методике [Петренко Н.Ф., Мокиенко А.В. Диоксид хлора: применение в технологиях водоподготовки. Одесса: Оптимум, 2005, 371].
Амины - коммерческие препараты производства Sigma Aldrich и Alfa Aesar, чистота 99% (ее 99%).
ИК спектры регистрировали на ИК-Фурье-спектрометре Shimadzu IR Prestige 21 в тонком слое. Спектры ЯМР 1H и 13C регистрировали на спектрометре Bruker Avance-300 (300.17 МГц для 1Н и 75.48 МГц для 13С) в растворах CDCl3 (внутренний стандарт - сигнал хлороформа) и ДМСО-d6. Полное отнесение сигналов 1Н и 13С выполняли с помощью двумерных гомо- (1H-1H COSY, 1H-1H NOESY) и гетероядерных экспериментов (1H-13C HSQC). Колоночную хроматографию выполняли на силикагеле Alfa Aesar (0.06-0.2 мм).
Ниже представлены физико-химические характеристики полученных соединений 7-11.
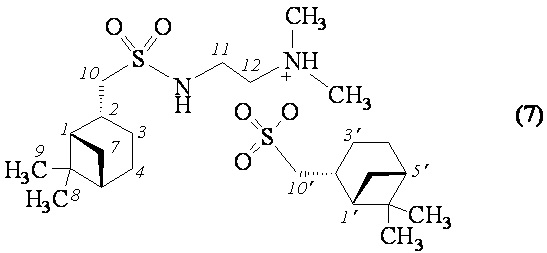
((1S,2R,5S)-6,6-Диметилбицикло [3.1.1]гептан-2-ил)метансульфонат 2- (((1S,2R,5S)-6,6-диметилбицикло [3.1.1]гептан)-2-ил)метил)сульфонамидо)-N, N-диметилэтан-1-аммония (7). Выход 45%. Вязкая масса бежевого цвета. 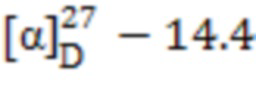 (с 0.22, CH3ОН). Спектр ЯМР 1Н (MeOD–d4, δ, м.д., J/Hz): 0.94-1.02 (с, 8 H, H(7α), H(7'α), H(8)Ме, H(8')Ме); 1.17, 1.18 (оба c, по 3 H, H(9)Ме, H(9')Ме); 1.68 (д.д.д, 2 H, H(3α), H(3'α), J1 = 15.2, J2 = 10.2, J3 = 4.9), 1.81-1.98 (м, 4 Н, H(4), H(4'), Н(5), Н(5')), 2.00-2.08 (м, 2 H, H(1), H(1')), 2.09-2.21 (м, 2 Н, H(3β), H(3'β)), 2.28-2.36 (м, 2 Н, H(7β), H(7'β)), 2.36 (с, 6Н, N(CH3)2), 2.57-2.66 (м, 4 Н, Н(2), Н(2'), Н(11)), 2.85-2.93 (м, 2 H, Н(10')), 3.12-3.23 (м, 4 Н, Н(10), Н(12)), 4.80 (уш.с, 2 Н, NH-SO2, NН(CH3)2). Спектр ЯМР 13С (MeOD-d4, δ, м.д.): 23.0, 23.3 C(3), C(3'), 23.7 C(8), C(8'), 27.1, 27.3 C(4), C(4'), 28.3, 28.5 C(9), C(9'), 33.5, 33.8 C(7), C(7'), 37.4 C(2), 38.5 C(2'), 39.6 C(6), C(6'), 41.1 C(12), 42.3, 42.4 C(5), C(5'), 45.3 (N(CH3)2), 47.8, 48.1 C(1), C(1'), 60.0 C(11), 60.4, 60.5 C(10), C(10'). ИК спектр (KBr), ν/см-1: 3431 (N-H), 1319 (SO2), 1186 (SO2-О), 1147 (SO2), 1039 (SO2-О). Найдено (%): C, 57.05; H, 9.18; N, 5.62; S, 12.43. C14H28N2O2S·C10H18O3S. Вычислено (%): C, 56.88; H, 9.15; N, 5.53; S, 12.65.
(с 0.22, CH3ОН). Спектр ЯМР 1Н (MeOD–d4, δ, м.д., J/Hz): 0.94-1.02 (с, 8 H, H(7α), H(7'α), H(8)Ме, H(8')Ме); 1.17, 1.18 (оба c, по 3 H, H(9)Ме, H(9')Ме); 1.68 (д.д.д, 2 H, H(3α), H(3'α), J1 = 15.2, J2 = 10.2, J3 = 4.9), 1.81-1.98 (м, 4 Н, H(4), H(4'), Н(5), Н(5')), 2.00-2.08 (м, 2 H, H(1), H(1')), 2.09-2.21 (м, 2 Н, H(3β), H(3'β)), 2.28-2.36 (м, 2 Н, H(7β), H(7'β)), 2.36 (с, 6Н, N(CH3)2), 2.57-2.66 (м, 4 Н, Н(2), Н(2'), Н(11)), 2.85-2.93 (м, 2 H, Н(10')), 3.12-3.23 (м, 4 Н, Н(10), Н(12)), 4.80 (уш.с, 2 Н, NH-SO2, NН(CH3)2). Спектр ЯМР 13С (MeOD-d4, δ, м.д.): 23.0, 23.3 C(3), C(3'), 23.7 C(8), C(8'), 27.1, 27.3 C(4), C(4'), 28.3, 28.5 C(9), C(9'), 33.5, 33.8 C(7), C(7'), 37.4 C(2), 38.5 C(2'), 39.6 C(6), C(6'), 41.1 C(12), 42.3, 42.4 C(5), C(5'), 45.3 (N(CH3)2), 47.8, 48.1 C(1), C(1'), 60.0 C(11), 60.4, 60.5 C(10), C(10'). ИК спектр (KBr), ν/см-1: 3431 (N-H), 1319 (SO2), 1186 (SO2-О), 1147 (SO2), 1039 (SO2-О). Найдено (%): C, 57.05; H, 9.18; N, 5.62; S, 12.43. C14H28N2O2S·C10H18O3S. Вычислено (%): C, 56.88; H, 9.15; N, 5.53; S, 12.65.
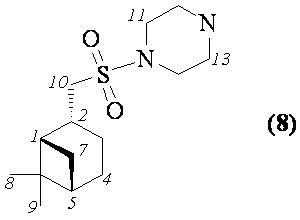
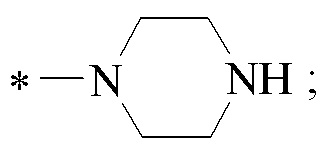
1-((((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метил)сульфонил) пиперазин (8). Выход 65%. Вязкая, густая масса бежевого цвета. 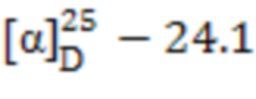 (с 0.39, CHCl3). Спектр ЯМР 1Н (Ру-d5, δ, м.д., J/Hz): 0.89 (д, 1 H, H(7α), J = 9.9); 0.93, 1.12 (оба c, по 3 H, H(8)Ме, H(9)Ме); 1.67 -1.88 (м, 4 H, H(3α), H(4), Н(5)), 2.07-2.30 (м, 3 H, H(1), H(3β), H(7β)), 2.84-2.89 (м, 5 H, Н(2), Н(12), Н(13)), 3.17 (д, 2 Н, Н(10), J = 6.6), 3.28-3.35 (м, 4 Н, Н(11), Н(14)), 5.32 (уш.с, 1 Н, NH). Спектр ЯМР 13С (Ру-d5, δ, м.д.): 22.5 C(3), 23.3 C(8), 26.5 C(4), 28.1 C(9), 33.1 C(7), 36.2 C(2), 38.8 C(6), 41.4 C(5), 46.4 C(12), С(13), 46.9 C(1), 47.2 C(11), С(14), 55.7 C(10). ИК спектр (KBr), ν/см-1: 3346 (N-H), 1317 (SO2), 1153 (SO2), 950 (S-N). Найдено (%): C, 59.05; H, 9.68; N, 9.82; S, 11.23. C14H26N2O2S. Вычислено (%): C, 58.71; H, 9.15; N, 9.78; S, 11.19.
(с 0.39, CHCl3). Спектр ЯМР 1Н (Ру-d5, δ, м.д., J/Hz): 0.89 (д, 1 H, H(7α), J = 9.9); 0.93, 1.12 (оба c, по 3 H, H(8)Ме, H(9)Ме); 1.67 -1.88 (м, 4 H, H(3α), H(4), Н(5)), 2.07-2.30 (м, 3 H, H(1), H(3β), H(7β)), 2.84-2.89 (м, 5 H, Н(2), Н(12), Н(13)), 3.17 (д, 2 Н, Н(10), J = 6.6), 3.28-3.35 (м, 4 Н, Н(11), Н(14)), 5.32 (уш.с, 1 Н, NH). Спектр ЯМР 13С (Ру-d5, δ, м.д.): 22.5 C(3), 23.3 C(8), 26.5 C(4), 28.1 C(9), 33.1 C(7), 36.2 C(2), 38.8 C(6), 41.4 C(5), 46.4 C(12), С(13), 46.9 C(1), 47.2 C(11), С(14), 55.7 C(10). ИК спектр (KBr), ν/см-1: 3346 (N-H), 1317 (SO2), 1153 (SO2), 950 (S-N). Найдено (%): C, 59.05; H, 9.68; N, 9.82; S, 11.23. C14H26N2O2S. Вычислено (%): C, 58.71; H, 9.15; N, 9.78; S, 11.19.
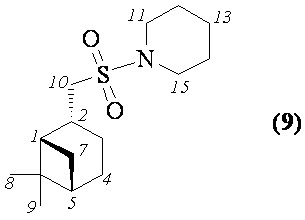
1-((((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метил)сульфонил) пиперидин (9). Выход 65%. Порошок кремового цвета. Т. пл. 64°С. 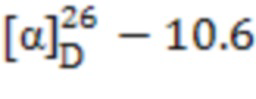 (с 0.25, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.96–1.04 (м, 4 H, H(7α), H(8)Ме), 1.19 c (3 H, H(9)Ме), 1.50-1.72 (м, 7 H, H(3α), H(13), Н(12), Н(14)), 1.84-1.97 (м, 3 H, H(5), Н(4)), 1.97-2.05 (м, 1 H, H(1)), 2.08-2.25 (м, 1 H, H(3β)), 2.28-2.43 (м, 1 H, H(7β)), 2.63-2.77 (м, 1 H, H(2)), 2.86-3.03 (м, 2 Н, Н(10)), 3.13-3.28 (м, 4 Н, Н(11), Н(15)). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.9 C(3), 23.1 C(8), 23.8 C(13), 25.6 C(12), С(14), 25.9 C(4), 27.6 C(9), 32.6 C(7), 35.5 C(2), 38.4 C(6), 40.7 C(5), 46.5 C(11), С(15), 46.6 C(1), 56.0 C(10). ИК спектр (KBr), ν/см-1: 1321 (SO2), 1149 (SO2), 931 (S-N). Найдено (%): C, 63.52; H, 9.48; N, 4.82; S, 11.33. C15H27NO2S. Вычислено (%): C, 63.12; H, 9.53; N, 4.91; S, 11.23.
(с 0.25, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.96–1.04 (м, 4 H, H(7α), H(8)Ме), 1.19 c (3 H, H(9)Ме), 1.50-1.72 (м, 7 H, H(3α), H(13), Н(12), Н(14)), 1.84-1.97 (м, 3 H, H(5), Н(4)), 1.97-2.05 (м, 1 H, H(1)), 2.08-2.25 (м, 1 H, H(3β)), 2.28-2.43 (м, 1 H, H(7β)), 2.63-2.77 (м, 1 H, H(2)), 2.86-3.03 (м, 2 Н, Н(10)), 3.13-3.28 (м, 4 Н, Н(11), Н(15)). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.9 C(3), 23.1 C(8), 23.8 C(13), 25.6 C(12), С(14), 25.9 C(4), 27.6 C(9), 32.6 C(7), 35.5 C(2), 38.4 C(6), 40.7 C(5), 46.5 C(11), С(15), 46.6 C(1), 56.0 C(10). ИК спектр (KBr), ν/см-1: 1321 (SO2), 1149 (SO2), 931 (S-N). Найдено (%): C, 63.52; H, 9.48; N, 4.82; S, 11.33. C15H27NO2S. Вычислено (%): C, 63.12; H, 9.53; N, 4.91; S, 11.23.
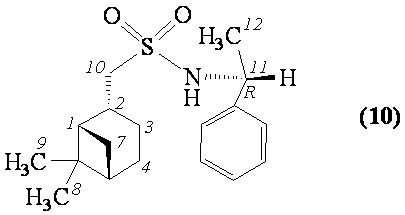
1-((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-N-((R)-1-фенилэтил)метансульфонамид (10). Выход 39%. Вязкая, густая прозрачная масса. 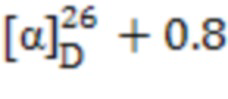 (с 0.26, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Hz): 0.80 (c, 3 H, H(8)Ме), 0.93 (д.д, 1 H, H(7α), J = 9.9), 1.12 (c, 3 H, H(9)Ме), 1.53-1.66 (м, 5 H, H(1), H(3α), H(12)), 1.811.94 (м, 3 H, H(4), H(5)), 2.02-2.17 (м, 1 H, H(3β)), 2.23-2.35 (м, 1 H, H(7β)), 2.46-2.60 (м, 1 H, H(2)), 2.64-2.74 (м, 1 Н, Н(10а)), 2.80-2.91 (м, 1 Н, Н(10β)), 4.64 (т, 1 Н, Н(11), J = 6.9), 4.96 (д, 1 Н, N-H, J = 6.6), 7.31-7.43 (м, 5 H, Н(Ar)). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.7 C(3), 22.9 C(8), 24.0 C(12), 25.8 C(4), 27.5 C(9), 32.4 C(7), 35.7 C(2), 38.4 C(6), 40.7 C(5), 46.7 C(1), 53.6 C(11), 61.6 C(10), 126.3, 127.8, 128.8 С(Ar), 142.8 С(Ar). ИК спектр (KBr), ν/см-1: 3275 (N-H), 1315 (SO2), 1149 (SO2), 962 (S-N). Найдено (%): C, 67.51; H, 8.57; N, 4.57; S, 10.15. C18H27NO2S. Вычислено (%): C, 67.25; H, 8.47; N, 4.36; S, 9.97.
(с 0.26, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Hz): 0.80 (c, 3 H, H(8)Ме), 0.93 (д.д, 1 H, H(7α), J = 9.9), 1.12 (c, 3 H, H(9)Ме), 1.53-1.66 (м, 5 H, H(1), H(3α), H(12)), 1.811.94 (м, 3 H, H(4), H(5)), 2.02-2.17 (м, 1 H, H(3β)), 2.23-2.35 (м, 1 H, H(7β)), 2.46-2.60 (м, 1 H, H(2)), 2.64-2.74 (м, 1 Н, Н(10а)), 2.80-2.91 (м, 1 Н, Н(10β)), 4.64 (т, 1 Н, Н(11), J = 6.9), 4.96 (д, 1 Н, N-H, J = 6.6), 7.31-7.43 (м, 5 H, Н(Ar)). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.7 C(3), 22.9 C(8), 24.0 C(12), 25.8 C(4), 27.5 C(9), 32.4 C(7), 35.7 C(2), 38.4 C(6), 40.7 C(5), 46.7 C(1), 53.6 C(11), 61.6 C(10), 126.3, 127.8, 128.8 С(Ar), 142.8 С(Ar). ИК спектр (KBr), ν/см-1: 3275 (N-H), 1315 (SO2), 1149 (SO2), 962 (S-N). Найдено (%): C, 67.51; H, 8.57; N, 4.57; S, 10.15. C18H27NO2S. Вычислено (%): C, 67.25; H, 8.47; N, 4.36; S, 9.97.
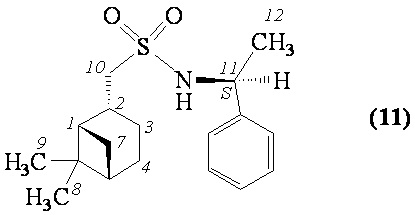
1-((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-N-((S)-1-фенилэтил)метансульфонамид (11). Выход 40%. Вязкая, густая прозрачная масса. 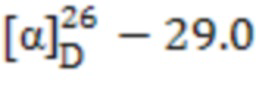 (с 0.36, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Hz): 0.82 (c, 3 H, H(8)Ме), 0.92 (д, 1 H, H(7α), J = 9.9), 1.16 (c, 3 H, H(9)Ме), 1.32-1.46 (м, 1 H, H(3α)), 1.57 (д, 3 H, H(12), J = 7.3), 1.74-2.06 (м, 5 H, H(1), H(3β), H(4), H(5)), 2.26-2.37 (м, 1 H, H(7β)), 2.50-2.62 (м, 1 H, H(2)), 2.80 (д, 2 Н, Н(10), J = 6.6), 4.60-4.71 (м, 1 Н, Н(11)), 5.11 (д, 1 Н, N-H, J = 6.6), 7.33-7.46 (м, 5 H, Н(Ar)). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.7 C(3), 22.9 C(8), 24.0 C(12), 25.8 C(4), 27.6 C(9), 32.4 C(7), 35.7 C(2), 38.2 C(6), 40.6 C(5), 46.1 C(1), 53.6 C(11), 61.3 C(10), 126.3, 127.8, 128.8 С(Ar), 142.8 С(Ar). ИК спектр (KBr), ν/см-1: 3277 (N-H), 1317 (SO2), 1149 (SO2), 962 (S-N). Найдено (%): C, 67.51; H, 8.57; N, 4.47; S, 10.15. C18H27NO2S. Вычислено (%): C, 67.25; H, 8.47; N, 4.36; S, 9.97.
(с 0.36, CHCl3). Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Hz): 0.82 (c, 3 H, H(8)Ме), 0.92 (д, 1 H, H(7α), J = 9.9), 1.16 (c, 3 H, H(9)Ме), 1.32-1.46 (м, 1 H, H(3α)), 1.57 (д, 3 H, H(12), J = 7.3), 1.74-2.06 (м, 5 H, H(1), H(3β), H(4), H(5)), 2.26-2.37 (м, 1 H, H(7β)), 2.50-2.62 (м, 1 H, H(2)), 2.80 (д, 2 Н, Н(10), J = 6.6), 4.60-4.71 (м, 1 Н, Н(11)), 5.11 (д, 1 Н, N-H, J = 6.6), 7.33-7.46 (м, 5 H, Н(Ar)). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.7 C(3), 22.9 C(8), 24.0 C(12), 25.8 C(4), 27.6 C(9), 32.4 C(7), 35.7 C(2), 38.2 C(6), 40.6 C(5), 46.1 C(1), 53.6 C(11), 61.3 C(10), 126.3, 127.8, 128.8 С(Ar), 142.8 С(Ar). ИК спектр (KBr), ν/см-1: 3277 (N-H), 1317 (SO2), 1149 (SO2), 962 (S-N). Найдено (%): C, 67.51; H, 8.57; N, 4.47; S, 10.15. C18H27NO2S. Вычислено (%): C, 67.25; H, 8.47; N, 4.36; S, 9.97.
Обоснование применения.
Полученные соединения - потенциальные биологически активные вещества, что обусловлено терпеновым фрагментом, модифицированным сульфонамидной группой. Нами проанализирована зависимость «структура - биологическая активность» с помощью компьютерного моделирования спектров биологической активности полученных соединений программой PASS (http://pharmaexpert.ru/passonline/). Результаты показали высокую степень проявления ими свойств антагонистов простагландина Е1 (81-83%), антагонистов вазопрессина (71-76%), сердечно-сосудистых аналептиков (60-89%), антагонистов антидиуретического гормона (64-77%), антиневротического действия (74%) и других.
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИРАЛЬНЫЕ МИРТАНИЛСУЛЬФОНАМИДЫ | 2019 |
|
RU2725878C1 |
| Хиральные трифторметилированные монотерпеновые тиоацетаты и тиолы пинанового ряда | 2020 |
|
RU2733369C1 |
| Сульфопроизводные на основе бета-пинена и способ их получения | 2019 |
|
RU2708617C1 |
| Хиральные трифторметилированные монотерпеновые тиоацетаты и тиолы на основе миртеналя | 2020 |
|
RU2743302C1 |
| Хиральные γ-кетосульфонильные производные пинановой структуры и способ их получения | 2021 |
|
RU2780452C1 |
| Способ получения антиагрегационного и антиоксидантного средства | 2023 |
|
RU2819387C1 |
| Антиагрегационное и антиоксидантное средство | 2023 |
|
RU2808474C1 |
| Хиральные γ-кетосульфанильные производные пинановой структуры и способ их получения | 2021 |
|
RU2783164C1 |
| Способ получения монотерпеновых сульфокислот | 2016 |
|
RU2651791C2 |
| Хиральные монотерпеновые сульфинамиды | 2017 |
|
RU2646959C1 |
Изобретение относится к новым хиральным цис-миртанилсульфонамидам структурной формулы (I)

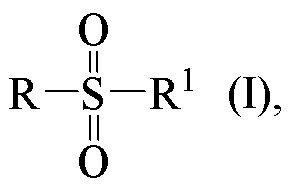

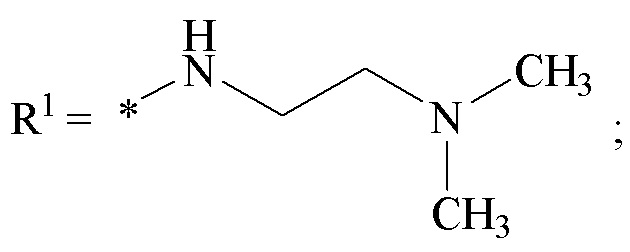
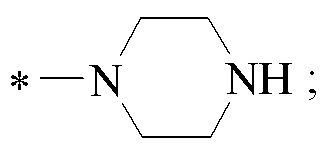
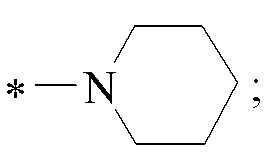
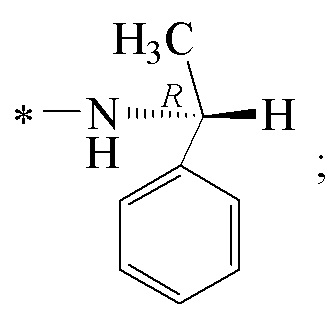
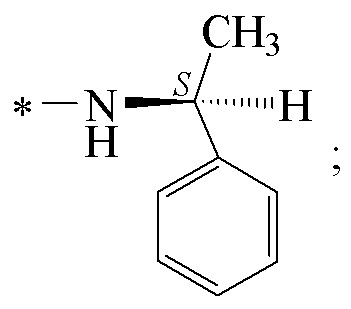
где звездочкой обозначена связь, к которой присоединяется сульфогруппа (-SO2-). Технический результат: получены новые монотерпеновые сульфопроизводные, которые могут быть использованы в качестве потенциальных биологически активных соединений.
Хиральные цис-миртанилсульфонамиды (RSO2R1) на основе (-)-β-пинена структурной формулы (I)

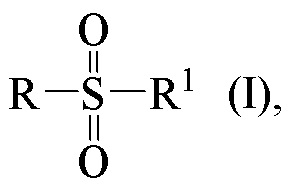


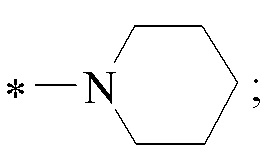
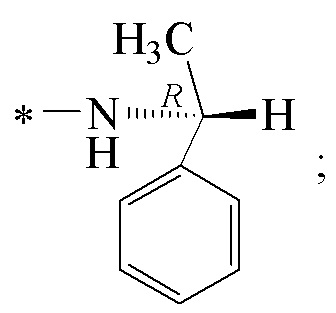
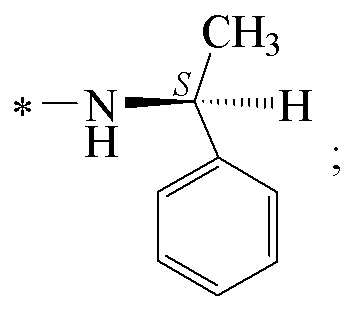
где звездочкой обозначена связь, к которой присоединяется сульфогруппа (-SO2-).
| Grebyonkina, O | |||
| N.; Lezina, O | |||
| M.; Izmest'ev, E | |||
| S.; Rubtsova, S | |||
| A.; Kutchin, A | |||
| V | |||
| Synthesis of New Sulfonamides Based on β-Pinene | |||
| Russian Journal of Organic Chemistry, 56(3), 405-411, 2020 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Yusuff, Naeem; Dore, Michael; Joud, | |||
Авторы
Даты
2022-02-02—Публикация
2021-06-18—Подача