Изобретение относится к синтезу хиральных цис- и транс-миртанилсульфонамидов, потенциальных биологически активных соединений.
Синтез новых биологически активных веществ и создание на их основе лекарственных средств является одной из важнейших задач современной органической и медицинской химии. Перспективным подходом в получении является использование доступных растительных субстратов в качестве исходных соединений, в первую очередь, терпенов. Известно, что они обладают противогрибковым, бактерицидным, противовирусным, обезболивающим и муколитическим действиями; оказывают химиопрофилактическое действие при раке, антигипергликемическое, противовоспалительное и противопаразитарное действие [R. Paduch, M. Kandefer-Szerszen, M. Trytek and J. Fiedurek, Arch. Immun. Ther. Exp., 2007, 55, 315].
Химическая модификация терпенов позволяет получать продукты, в которых биологическая активность, обусловленная терпеновым фрагментом, сочетается со свойствами введенных фармакоформных групп. В работе [L. E. Nikitina, N. P. Artemova, V. A. Startseva, I. V. Fedyunina and V. V. Klochkov, Chem. Nat. Comp., 2017, 53, 811] показано, что введение серы различной степени окисления в молекулу терпена повышает противогрибковую, противовоспалительную, антихеликобактерную, противоопухолевую и другие активности.
Монотерпеновые сульфонамиды на основе камфоры обладают ингибирующей активностью в отношении вирусов Эбола и Марбург [А.С.Соколова, Д.В.Баранова, О.И.Яровая, Д.С.Баев, О.А.Полежаева и др. Изв. АН, Сер. Хим., 2019, 5, 1041]. Энантиомеры транс-миртанилсульфонамида (наиболее близкий аналог), содержащие группы NH2, пиперазиновый и хлорфенильный фрагменты, являются антагонистами белок-белкового взаимодействия Bcl-2 [N. Yusuff, M. Dore, C. Joud, M. Visser, C. Springer, X. Xie, K. Herlihy, D. Porter, B. B. Toure. ACS Med. Chem. Lett., 2012, 3(7), 579. doi: 10.1021/ml300095a].
Иных аналогов получения заявленных миртанилсульфонамидов выявлено не было.
Задачей настоящего изобретения является синтез хиральных цис- и транс- миртанилсульфонамидов, потенциальных биологически активных веществ, полученных эффективным способом.
Технический результат заключается в расширении арсенала монотерпеновых сульфопроизводных заданной структуры, востребованных в органическом синтезе биологически активных соединений.
Технический результат достигается получением хиральных цис- и транс-миртанилсульфонамидов (RSO2R1) структурной формулы (I):
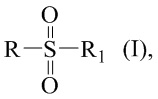
где R – радикал пинановой структуры
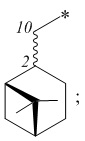
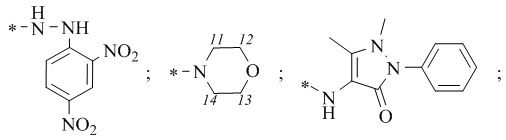
R1 = -NH2; -N(Me)2; -NHEt; -NHEtOH; -N(Et)2; -N(Et)2NH2; -NHBn;
-NHPh; -NHPhCH3;
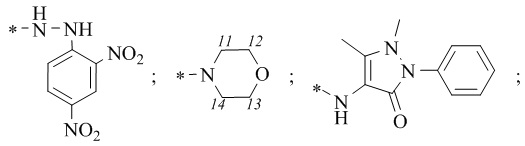
где звездочкой обозначена связь, к которой присоединяется сульфогруппа (-SO2-).
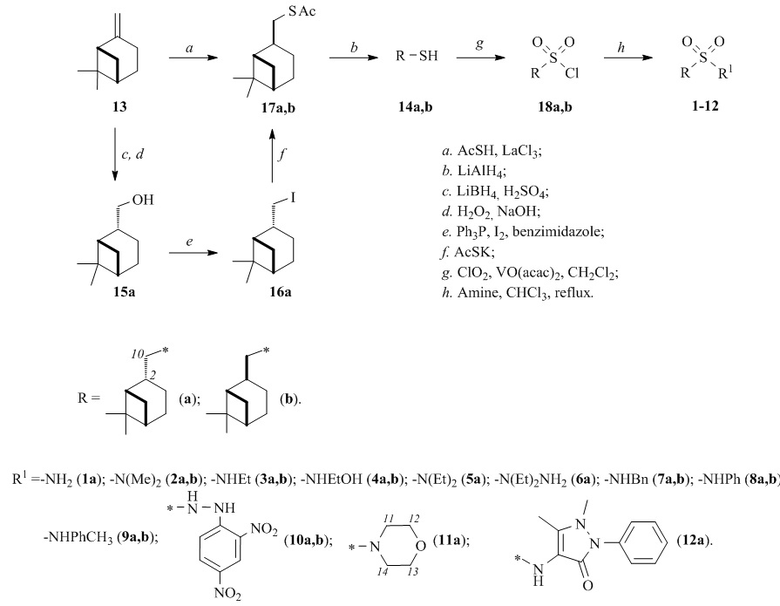
Для получения миртанилсульфонамидов 1-12 из (-)-β-пинена 13 (схема 1) использовали метод, включающий синтез оптически чистого миртантиола 14а,б с последующим окислительным хлорированием диоксидом хлора и добавлении алифатического, ароматического или гетероциклического амина. Способ позволяет получить целевые продукты с сохранением структуры терпенового фрагмента с высоким выходом.
Для получения диастереомерно чистого тиола 14а из (-)-β-пинена реакцией гидроборирования-окисления был получен цис-миртанол 15а [Кучин А.В, Фролова Л.Л. Изв. АН. Сер хим. 2000, 9, 1658], далее по модифицированной методике - йодид 16а [Garegg P.J., Samuelsson B. J. Chem. Soc., Perkin Trans. 1. 1980, 2866], а затем взаимодействием с AcSK - тиоацетат 17а [T.-C. Zheng, M. Burkart, D. E. Richardson, Tetrahedron Lett. 1999, 40, 603], из которого по методике [Banach A., Ścianowski Ja., Ozimek P. Phosphorus, Sulfur, and Silicon and the Related Elements. 2014, 189, 274] - тиол 14а. Смесь диастереомерных тиолов 14а,б (dе 75%) получена присоединением тиоуксусной кислоты по двойной связи (-)-β-пинена в присутствии LaCl3 и последующем восстановлении полученных диастереомерных тиоацетатов 17а,б LiAlH4 до тиолов 14а,б [Banach A., Ścianowski Ja., Ozimek P. Phosphorus, Sulfur, and Silicon and the Related Elements. 2014, 189, 274].
Полученные тиол 14а или смесь 14а,б окисляли диоксидом хлора (ClO2) в дихлорметане в присутствии катализатора VO(acac)2 [O. N. Grebyonkina, O. M. Lezina, E. S. Izmest’ev, S. A. Rubtsova and A. V. Kutchin, Russ. J. Org. Chem., 2019, 55(10), 1510)], в результате чего количественно образуются соответствующие сульфохлориды 18а,б.
В раствор миртанилсульфохлоридов 18а,б без дополнительной очистки и выделения добавляли амин [Губен-Вейль. Методы органической химии. М.: Химия, 1967, 2, 612], смесь нагревали до 40-60°C в течение 0.5-1 ч. Выходы миртанилсульфонамидов 1-12а,б составляют 38-92%.
Схема 1. Синтез миртанилсульфонамидов.
Водный раствор диоксида хлора (ClO2) – промышленный продукт, концентрацию которого определяли титрованием по методике [Петренко Н.Ф., Мокиенко А.В. Диоксид хлора: применение в технологиях водоподготовки. Одесса: Оптимум, 2005, 371].
Амины - коммерческие препараты производства Sigma Aldrich и Alfa Aesar, чистота 99%.
ИК спектры регистрировали на ИК-Фурье-спектрометре Shimadzu IR Prestige 21 в тонком слое. Спектры ЯМР 1H и 13C регистрировали на спектрометре Bruker Avance-300 (300.17 МГц для 1Н и 75.48 МГц для 13С) в растворах CDCl3 (внутренний стандарт – сигнал хлороформа) и ДМСО-d6. Полное отнесение сигналов 1Н и 13С выполняли с помощью двумерных гомо- (1H–1H COSY, 1H–1H NOESY) и гетероядерных экспериментов (1H–13C HSQC, HMBC). Колоночную хроматографию выполняли на силикагеле Alfa Aesar (0.06–0.2 мм).
Ниже представлены характеристики полученных соединений (спектры транс-сульфонамидов (b) ((S)-конфигурации по атому C2) получены вычитанием сигналов из спектров смеси с соединениями 1а-12а с использованием двумерных спектров 1H–13C HSQC).
((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метансульфонамид 7а.
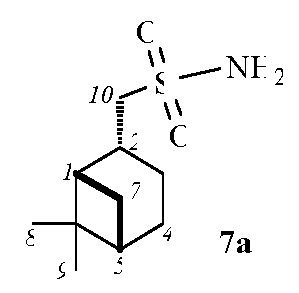
Выход 92%.  (с 0.2, CHCl3). ИК спектр (KBr, ν, см–1): 3250, 3339 (NH2), 1321 (SO2), 1153 (SO2), 916 (S-N). Спектр ЯМР 1Н (СDCl3, δ, м.д.): 1.02 c (3H, H8), 0.95–1.08 м (1H, H7α), 1.22 c (3H, H9), 1.61–1.80 м (1H, H3α), 1.83–2.03 м (3H, H4, H5), 1.98–2.09 м (1H, H1), 2.06–2.30 м (1H, H3β), 2.30–2.45 м (1H, H7β), 2.64–2.80 м (1H, H2), 3.21–3.36 м (2Н, Н10), 5.06 уш. с (2H, NH2). Спектр ЯМР 13С (CDСl3, δ, м.д.): 21.7 (C3), 23.0 (C8), 25.8 (C4), 27.5 (C9), 32.4 (C7), 36.1 (C2), 38.3 (C6), 40.6 (C5), 46.5 (C1), 62.8 (C10). Найдено, %: С 55.49; Н 8.89; N 6.43; S 15.01. C10H19NO2S. Вычислено, %: C 55.27; H 8.81; N 6.45; S 14.75.
(с 0.2, CHCl3). ИК спектр (KBr, ν, см–1): 3250, 3339 (NH2), 1321 (SO2), 1153 (SO2), 916 (S-N). Спектр ЯМР 1Н (СDCl3, δ, м.д.): 1.02 c (3H, H8), 0.95–1.08 м (1H, H7α), 1.22 c (3H, H9), 1.61–1.80 м (1H, H3α), 1.83–2.03 м (3H, H4, H5), 1.98–2.09 м (1H, H1), 2.06–2.30 м (1H, H3β), 2.30–2.45 м (1H, H7β), 2.64–2.80 м (1H, H2), 3.21–3.36 м (2Н, Н10), 5.06 уш. с (2H, NH2). Спектр ЯМР 13С (CDСl3, δ, м.д.): 21.7 (C3), 23.0 (C8), 25.8 (C4), 27.5 (C9), 32.4 (C7), 36.1 (C2), 38.3 (C6), 40.6 (C5), 46.5 (C1), 62.8 (C10). Найдено, %: С 55.49; Н 8.89; N 6.43; S 15.01. C10H19NO2S. Вычислено, %: C 55.27; H 8.81; N 6.45; S 14.75.
1-((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-N,N-диметилметансульфонамид 8а.
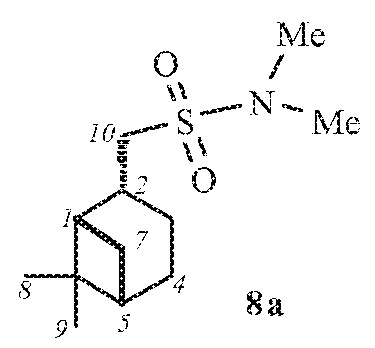
Выход 64%. ИК спектр (KBr, ν, см–1): 1322, 1147 (SO2), 958 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.92–1.03 м (1H, H7α), 0.99 c (3H, H8), 1.19 c (3H, H9), 1.59–1.72 м (1H, H3α), 1.86–2.01 м (3H, H4, H5), 1.96–2.07 м (1H, H1), 2.07–2.20 м (1H, H3β), 2.30–2.41 м (1H, H7β), 2.63–2.75 м (1H, H2), 2.84 с (6Н, N(CН3)2), 2.92–3.00 м (2Н, Н10). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.73 (C3), 23.02 (C8), 25.80 (C4), 27.56 (C9), 32.49 (C7), 35.35 (C2), 37.29 (N(CН3)2), 38.28 (C6), 40.61 (C5), 46.40 (C1), 54.79 (C10). Найдено, %: C 58.98; H 9.41; N 5.65; S 13.67. C12H23NO2S. Вычислено, %: C 58.74; H 9.45; N 5.71; S 13.07.
1-((1S,2S,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-N,N-диметилметансульфонамид 8b.
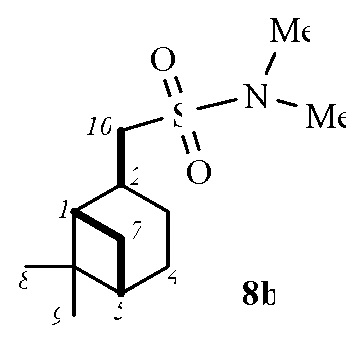
Выход смеси диастереомеров 8а,b (7:1) 60%. ИК спектр (KBr, ν, см–1): 1322, 1147 (SO2), 958 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.86 c (3H, H8), 0.89–0.92 м (1H, H7α), 1.19 c (3H, H9), 1.28–1.33м (1H, H3α), 1.41–1.52 м (2H, H4), 1.72-1.90 м (2Н, H5, H1), 2.05–2.15 м (1H, H3β), 2.30–2.41 м (1H, H7β), 2.56–2.65 м (1H, H2), 2.69 с (6Н, N(CН3)2), 2.75–2.80 м (2Н, Н10). Спектр ЯМР 13С (CDCl3, δ, м.д.): 19.94 (C8), 23.10 (C3), 24.07 (C4), 26.49 (C9), 30.71 (C2), 32.49 (C7), 37.29 (N(CН3)2), 38.28 (C6), 40.24 (C5), 45.39 (C1), 53.15 (C10). Найдено, %: C 58.66; H 9.49; N 5.59; S 13.13. C12H23NO2S. Вычислено, %: C 58.74; H 9.45; N 5.71; S 13.07.
1-(((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-метил)-N-этилметансульфонамид 9а.
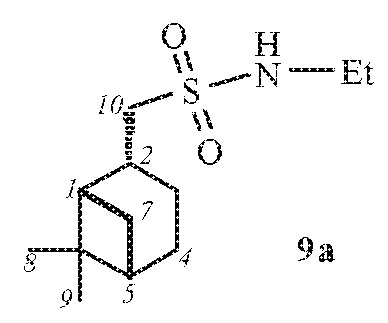
Выход 80%. 
 (с 0.18, CHCl3). ИК спектр (KBr, ν, см–1): 3275 (NH), 1315, 1149 (SO2), 948 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.99-1.05 м (4H, H8, Н7α), 1.18-1.29 м (6H, H9, NСН2CН3), 1.68 ддд (1H, H3α, J 15.5, 10.6, 5.0 Гц), 1.87-2.00 м (3Н, H4, H5), 2.00-2.06 м (1H, H1), 2.13-2.24 м (1H, H3β), 2.22–2.42 м (1H, H7β), 2.64-2.75 м (1H, H2), 3.09-3.22 м (4Н, Н10, NСН2CН3), 4.26-4.40 м (1Н, NН). Спектр ЯМР 13С (CDCl3, δ, м.д.): 15.85 (NСН2CН3), 21.90 (C3), 23.13 (C8), 25.92 (C4), 27.66 (C9), 32.55 (C7), 36.07 (C2), 38.19 (NСН2CН3), 38.41 (C6), 40.77 (C5), 46.62 (C1), 60.20 (C10). Найдено, %: C 59.14; H 9.23; N 5.66; S 12.89. C12H23NO2S Вычислено, %: C 58.74; H 9.45; N 5.71; S 13.07.
(с 0.18, CHCl3). ИК спектр (KBr, ν, см–1): 3275 (NH), 1315, 1149 (SO2), 948 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.99-1.05 м (4H, H8, Н7α), 1.18-1.29 м (6H, H9, NСН2CН3), 1.68 ддд (1H, H3α, J 15.5, 10.6, 5.0 Гц), 1.87-2.00 м (3Н, H4, H5), 2.00-2.06 м (1H, H1), 2.13-2.24 м (1H, H3β), 2.22–2.42 м (1H, H7β), 2.64-2.75 м (1H, H2), 3.09-3.22 м (4Н, Н10, NСН2CН3), 4.26-4.40 м (1Н, NН). Спектр ЯМР 13С (CDCl3, δ, м.д.): 15.85 (NСН2CН3), 21.90 (C3), 23.13 (C8), 25.92 (C4), 27.66 (C9), 32.55 (C7), 36.07 (C2), 38.19 (NСН2CН3), 38.41 (C6), 40.77 (C5), 46.62 (C1), 60.20 (C10). Найдено, %: C 59.14; H 9.23; N 5.66; S 12.89. C12H23NO2S Вычислено, %: C 58.74; H 9.45; N 5.71; S 13.07.
1-(((1S,2S,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метил)-N-этилметансульфонамид 9b.
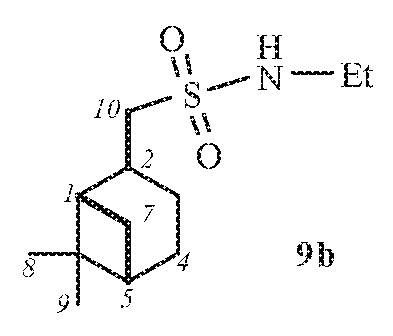
Выход смеси диастереомеров 9а,b (7:1) 80%. ИК спектр (KBr, ν, см–1): 3275 (NH), 1315, 1124 (SO2), 916 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.88 с (3H, H8), 0.99-1.05 м (1Н, Н7α), 1.10-1.18 м (3Н, NСН2CН3), 1.25 с (3Н, H9), 1.30-1.36 м (1Н, H3α), 1.75-1.86 (2Н, H4), 1.86-2.00 м (2Н, H1, H5), 2.10-2.17 м (1H, H3β), 2.22–2.42 м (1H, H7β), 2.56-2.64 м (1H, H2), 2.95 д (2Н, Н10, J 6.61), 3.03-3.09 м (2Н, NСН2CН3), 4.3 уш. с (1Н, NН). Спектр ЯМР 13С (CDCl3, δ, м.д.): 15.78 (NСН2CН3), 20.01 (C8), 23.24 (C3), 24.16 (C4), 26.56 (C9), 31.37 (C2), 32.49 (C7), 38.12 (NСН2CН3), 38.35 (C6), 40.32 (C5), 45.50 (C1), 58.95 (C10). Найдено, %: C 59.10; H 9.53; N 5.69; S 12.92. C12H23NO2S. Вычислено, %: C 58.74; H 9.45; N 5.71; S 13.07.
1-((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-N-(2-гидроксиэтил)метансульфонамид 10а.
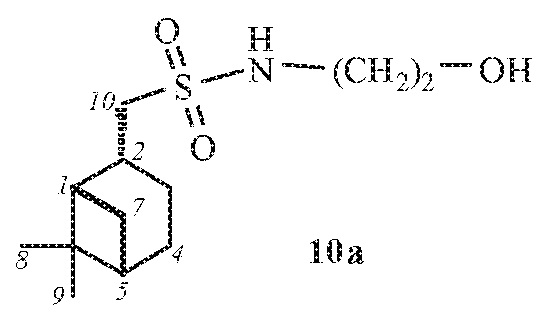
Выход 82%. 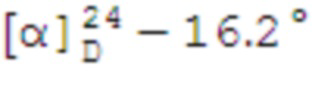
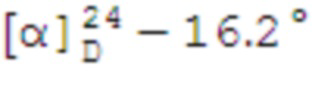 (с 0.2, CHCl3). ИК спектр (KBr, ν, см–1): 3287 (NH, ОН), 1315 (SO2), 1148 (SO2), 1065 (С-О), 950 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.95-1.06 с (4H, Н7α, H8), 1.23 с (3Н, H9), 1.61-1.76 м (1Н, H3α), 1.85-2.00 м (3Н, H4, H5), 2.01-2.08 м (1Н, H1), 2.11–2.28 м (1H, H3β), 2.33-2.45 м (1H, H7β), 2.65-2.82 м (1H, H2), 3.10-3.22 м (2Н, Н10), 3.22-3.33 м (2Н, NСН2), 3.78 т (2Н, СН2ОН, J 4.62 Гц), 5.07-5.21 м (1Н, NН). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.83 (C3), 23.12 (C8), 25.90 (C4), 27.65 (C9), 32.54 (C7), 35.98 (C2), 38.40 (C6), 40.74 (C5), 45.30 (NСН2), 46.59 (C1), 60.09 (C10), 61.78 (СН2ОН). Найдено, %: C 55. 48; H 8.69; N 5.46; S 12.68. C12H23NO3S. Вычислено, %: C 55.14; H 8.87; N 5.36; S 12.27.
(с 0.2, CHCl3). ИК спектр (KBr, ν, см–1): 3287 (NH, ОН), 1315 (SO2), 1148 (SO2), 1065 (С-О), 950 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.95-1.06 с (4H, Н7α, H8), 1.23 с (3Н, H9), 1.61-1.76 м (1Н, H3α), 1.85-2.00 м (3Н, H4, H5), 2.01-2.08 м (1Н, H1), 2.11–2.28 м (1H, H3β), 2.33-2.45 м (1H, H7β), 2.65-2.82 м (1H, H2), 3.10-3.22 м (2Н, Н10), 3.22-3.33 м (2Н, NСН2), 3.78 т (2Н, СН2ОН, J 4.62 Гц), 5.07-5.21 м (1Н, NН). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.83 (C3), 23.12 (C8), 25.90 (C4), 27.65 (C9), 32.54 (C7), 35.98 (C2), 38.40 (C6), 40.74 (C5), 45.30 (NСН2), 46.59 (C1), 60.09 (C10), 61.78 (СН2ОН). Найдено, %: C 55. 48; H 8.69; N 5.46; S 12.68. C12H23NO3S. Вычислено, %: C 55.14; H 8.87; N 5.36; S 12.27.
1-((1S,2S,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-N-(2-гидроксиэтил)метансульфонамид 10b.
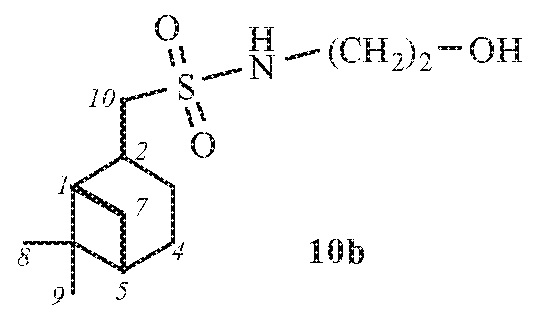
Выход смеси диастереомеров 10а,b (7:1) 76%. ИК спектр (KBr, ν, см–1): 3287 (NH, ОН), 1315 (SO2), 1145 (SO2), 1041 (С-О), 918 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.89 с (3H, H8), 0.95-1.01 м (1H, Н7α), 1.28 с (3Н, H9), 1.29-1.53 м (1Н, H3α), 1.79-1.88 м (2H, H4), 1.88-2.01 м (1Н, H1), 2.01-2.10 м (1Н, H5), 2.10-2.16 м (1H, H3β), 2.28–2.42 м (1H, H7β), 2.60-2.78 м (1H, H2), 3.00 д (2Н, Н10, J 6.61), 3.42-3.50 м (2Н, NСН2), 3.67-3.77 (2Н, СН2ОН). Спектр ЯМР 13С (CDCl3, δ, м.д.): 20.07 (C8), 23.28 (C3), 24.19 (C4), 26.61 (C9), 31.41 (C2), 32.54 (C7), 38.40 (C6), 40.36 (C5), 42.52 (NСН2), 45.53 (C1), 58.98 (C10), 60.84 (СН2ОН). Найдено, %: C 55.60; H 8.81; N 5.51; S 12.38. C12H23NO3S. Вычислено, %: C 55.14; H 8.87; N 5.36; S 12.27.
1-((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-N,N-диэтилметансульфонамид 11а.
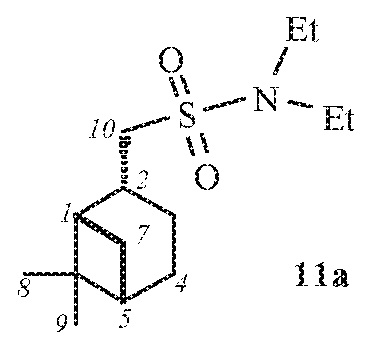
Выход 79%. 
 (с 0.17, CHCl3). ИК спектр (KBr, ν, см–1): 1325, 1144 (SO2), 934 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.95-1.11 м (4H, Н7α, H8), 1.14-1.27 м (9H, N(СН2CН3)2, H9), 1.63-1.75 м (1H, H3α), 1.79–1.96 м (3H, H4, H5), 1.96-2.12 м (1Н, H1), 2.08–2.25 м (1H, H3β), 2.30–2.41 м (1H, H7β), 2.59–2.76 м (1H, H2), 2.97–3.09 м (2Н, Н10), 3. 30 к (4Н, N(СН2CН3)2, J 6.8). Спектр ЯМР 13С (CDCl3, δ, м.д.): 14.48 (N(СН2CН3)2), 21.92 (C3), 23.12 (C8), 25.92 (C4), 27.66 (C9), 32.58 (C7), 35.85 (C2), 38.38 (C6), 40.74 (C5), 41.46 (N(СН2CН3)2), 46.56 (C1), 59.44 (C10). Найдено, %: C 61.90; H 9.85; N 5.31; S 12.32. C14H27NO2S. Вычислено, %: C 61.50; H 9.95; N 5.12; S 11.72.
(с 0.17, CHCl3). ИК спектр (KBr, ν, см–1): 1325, 1144 (SO2), 934 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.95-1.11 м (4H, Н7α, H8), 1.14-1.27 м (9H, N(СН2CН3)2, H9), 1.63-1.75 м (1H, H3α), 1.79–1.96 м (3H, H4, H5), 1.96-2.12 м (1Н, H1), 2.08–2.25 м (1H, H3β), 2.30–2.41 м (1H, H7β), 2.59–2.76 м (1H, H2), 2.97–3.09 м (2Н, Н10), 3. 30 к (4Н, N(СН2CН3)2, J 6.8). Спектр ЯМР 13С (CDCl3, δ, м.д.): 14.48 (N(СН2CН3)2), 21.92 (C3), 23.12 (C8), 25.92 (C4), 27.66 (C9), 32.58 (C7), 35.85 (C2), 38.38 (C6), 40.74 (C5), 41.46 (N(СН2CН3)2), 46.56 (C1), 59.44 (C10). Найдено, %: C 61.90; H 9.85; N 5.31; S 12.32. C14H27NO2S. Вычислено, %: C 61.50; H 9.95; N 5.12; S 11.72.
N-(2-Аминоэтил)-1-((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфонамид 12а.
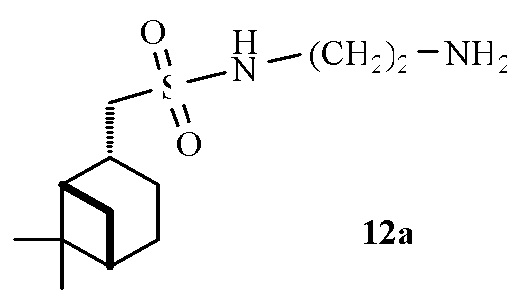
Выход 38%. 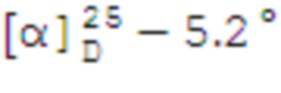
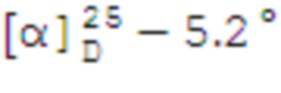 (с 0.1, CHCl3). ИК спектр (KBr, ν, см–1): 3288 (NH), 1317, 1148 (SO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.03 с (3H, H8), 1.03-1.07 м (1Н, Н7α), 1.23 с (3H, H9), 1.27-1.35 м (2Н, NН2СН2), 1.51-1.75 м (1H, H3α), 1.79–2.10 м (6H, H1, H4, H5, NН2), 2.26-2.30 м (1H, H3β), 2.40-2.49 м (1Н, H7β), 2.51–2.75 м (1H, H2), 3.09-3.25 м (2Н, Н10), 3.25-3.40 м (2Н, SO2NHСН2), 5.15-5.25 м (1Н, NНSO2). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.8 (C3), 23.1 (C8), 25.9 (C4), 27.6 (C9), 29.7 (NН2CН2), 32.5 (C7), 35.9 (C2), 38.4 (C6), 40.7 (C5), 43.7 (SO2NHСН2), 46.6 (C1), 60.3 (C10). Найдено, %: C 55.60; H 9.25; N 10.31; S 12.32. C12H24N2O2S. Вычислено, %: C 55.35, H 9.29, N 10.76, S 12.31.
(с 0.1, CHCl3). ИК спектр (KBr, ν, см–1): 3288 (NH), 1317, 1148 (SO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.03 с (3H, H8), 1.03-1.07 м (1Н, Н7α), 1.23 с (3H, H9), 1.27-1.35 м (2Н, NН2СН2), 1.51-1.75 м (1H, H3α), 1.79–2.10 м (6H, H1, H4, H5, NН2), 2.26-2.30 м (1H, H3β), 2.40-2.49 м (1Н, H7β), 2.51–2.75 м (1H, H2), 3.09-3.25 м (2Н, Н10), 3.25-3.40 м (2Н, SO2NHСН2), 5.15-5.25 м (1Н, NНSO2). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.8 (C3), 23.1 (C8), 25.9 (C4), 27.6 (C9), 29.7 (NН2CН2), 32.5 (C7), 35.9 (C2), 38.4 (C6), 40.7 (C5), 43.7 (SO2NHСН2), 46.6 (C1), 60.3 (C10). Найдено, %: C 55.60; H 9.25; N 10.31; S 12.32. C12H24N2O2S. Вычислено, %: C 55.35, H 9.29, N 10.76, S 12.31.
Смесь диастереомеров N-Бензил-1-((1S,2(R,S),5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфонамид 13а:13b (7:1).
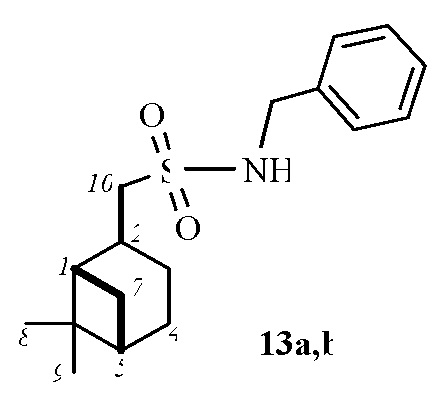
Выход смеси 89%. ИК спектр (KBr, ν, см–1): 3302 (NH), 1317, 1145 (SO2). Найдено, %: C 66.49; H 8.32; N 4.55; S 10.64. C17H25NO2S. Вычислено, %: C 66.41; H 8.20; N 4.56; S 10.43.
13а: Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.94 c (3H, H8), 0.99 д (1H, H7α, J 9.9 Гц), 1.20 c (3H, H9), 1.62 ддд (1H, H3α, J 15.2, 10.6, 4.6 Гц), 1.87–1.99 м (4H, H4, H5, H1), 2.06-2.20 м (1H, H3β), 2.31-2.40 м (1H, H7β), 2.60–2.73 м (1H, H2), 3.00-3.10 м (2Н, Н10), 4.30 д (2Н, NCH2), 4.86-4.99 м (1Н, NH), 7.30-7.50 м (5Н, НAr). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.76 (C3), 22.99 (C8), 25.83 (C4), 27.57 (C9), 32.44 (C7), 35.86 (C2), 38.27 (C6), 40.67 (C5), 46.47 (C1), 47.09 (NCH2), 60.86 (C10), 127.91, 127.97, 128.74 (CAr), 137.03 (NCH2CAr).
13b: ИК спектр (KBr, ν, см–1): 3302 (NH), 1317, 1145 (SO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.87 c (3H, H8), 0.92 д (1H, H7α, J 9.9 Гц), 1.16-1.27 м (4H, H9, H3α), 1.74–1.89 м (3H, H4, H1), 2.06-2.20 м (1H, H3β), 2.31-2.40 м (1H, H7β), 2.50–2.60 м (1H, H2), 2.87 д (2Н, Н10, J 9.9 Гц), 4.30 д (2Н, NCH2), 4.86-4.99 м (1Н, NH), 7.55-7.70 м (5Н, НAr). Спектр ЯМР 13С (CDCl3, δ, м.д.): 20.00 (C8), 23.19 (C3), 24.12 (C4), 26.52 (C9), 31.35 (C2), 32.44 (C7), 38.28 (C6), 40.27 (C5), 45.40 (C1), 59.57 (C10), 128.20, 128.92, 129.66 (CAr), 137.03 (NCH2CAr).
1-((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-N-фенилметансульфонамид 14а.
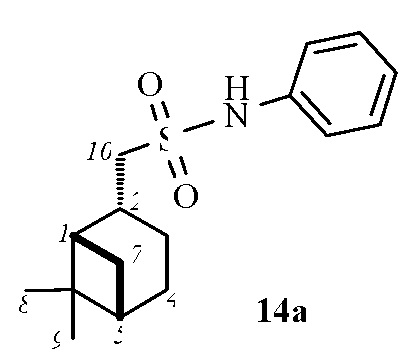
Выход 85%. 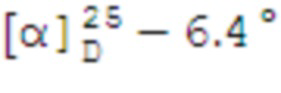
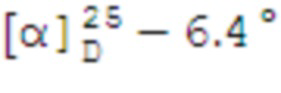 (с 0.17, CHCl3). ИК спектр (KBr, ν, см–1): 3259 (NH), 1321, 1151 (SO2), 924 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.91 c (3H, H8), 0.99 д (1H, H7α, J 9.9 Гц), 1.15 c (3H, H9), 1.62 дт (1H, H3α, J 10.6, 5.3 Гц), 1.83–1.95 м (3H, H4, H5), 1.96–2.03 м (1H, H1), 2.08–2.25 м (1H, H3β), 2.34 д (1H, H7β, J 6.6 Гц), 2.20–2.85 м (1H, H2), 3.20-3.28 м (2Н, Н10), 7.10-7.31 м (3Н, НAr), 7.32-7.41 м (2Н, НAr). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.67 (C3), 22.93 (C8), 25.79 (C4), 27.47 (C9), 32.45 (C7), 35.85 (C2), 38.27 (C6), 40.61 (C5), 46.15 (C1), 58.73 (C10), 119.95, 124.74, 129.56 (CAr), 136.99 (NCAr). Найдено, %: C 65.78; H 7.99; N 4.88; S 11.33. C16H23NO2S. Вычислено, %: C 65.49; H 7.90; N 4.77; S 10.93.
(с 0.17, CHCl3). ИК спектр (KBr, ν, см–1): 3259 (NH), 1321, 1151 (SO2), 924 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.91 c (3H, H8), 0.99 д (1H, H7α, J 9.9 Гц), 1.15 c (3H, H9), 1.62 дт (1H, H3α, J 10.6, 5.3 Гц), 1.83–1.95 м (3H, H4, H5), 1.96–2.03 м (1H, H1), 2.08–2.25 м (1H, H3β), 2.34 д (1H, H7β, J 6.6 Гц), 2.20–2.85 м (1H, H2), 3.20-3.28 м (2Н, Н10), 7.10-7.31 м (3Н, НAr), 7.32-7.41 м (2Н, НAr). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.67 (C3), 22.93 (C8), 25.79 (C4), 27.47 (C9), 32.45 (C7), 35.85 (C2), 38.27 (C6), 40.61 (C5), 46.15 (C1), 58.73 (C10), 119.95, 124.74, 129.56 (CAr), 136.99 (NCAr). Найдено, %: C 65.78; H 7.99; N 4.88; S 11.33. C16H23NO2S. Вычислено, %: C 65.49; H 7.90; N 4.77; S 10.93.
1-((1S,2S,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-N-фенилметансульфонамид 14b.
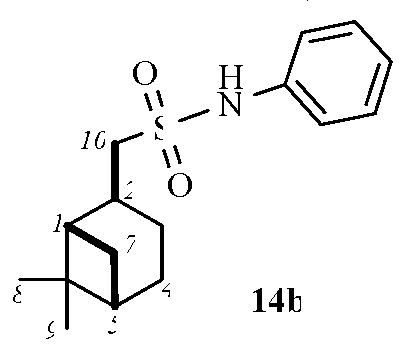
Выход 85%. ИК спектр (KBr, ν, см–1): 3259 (NH), 1321, 1151 (SO2), 924 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.85 c (3H, H8), 0.89–0.92 м (1H, H7α), 1.18 c (3H, H9), 1.21–1.33м (1H, H3α), 1.72–1.83 м (2H, H4), 1.83–1.93 м (1Н, H1), 1.96–2.03 м (1H, H5), 2.02–2.10 м (1H, H3β), 2.27-2.39 м (1H, H7β), 2.60–2.70 м (1H, H2), 3.05 д (2Н, Н10 J 6.6 Гц), 7.10-7.31 м (2Н, НAr), 7.32-7.41 м (3Н, НAr). Спектр ЯМР 13С (CDCl3, δ, м.д.): 19.94 (C8), 23.13 (C3), 24.07 (C4), 26.44 (C9), 31.28 (C2), 32.45 (C7), 38.27 (C6), 40.20 (C5), 45.28 (C1), 57.96 (C10), 120.77, 124.89, 129.56 (CAr), 136.99 (NCAr). Найдено, %: C 65.38; H 7.79; N 4.78; S 11.22. C16H23NO2S. Вычислено, %: C 65.49; H 7.90; N 4.77; S 10.93.
1-(((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метил)-N-(п-толил)метансульфонамид 15а.
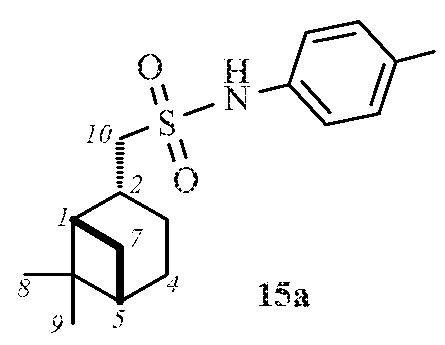
Выход 87%. 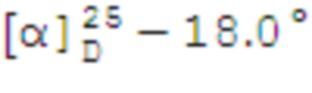
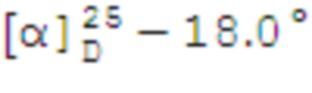 (с 0.2, CHCl3). ИК спектр (KBr, ν, см–1): 3259 (NH), 1327, 1149 (SO2), 918 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.93 c (3H, H8), 1.00 д (1H, H7α, J 9.9 Гц), 1.17 c (3H, H9), 1.56-1.71 м (1H, H3α), 1.83–1.96 м (3H, H4, H5), 1.96-2.03 м (1Н, H1), 2.11-2.22 м (1H, H3β), 2.28-2.42 м (1H, H7β), 2.36 с (3Н, СН3CAr), 2.69–2.82 м (1H, H2), 3.18-3.23 м (2Н, Н10), 6.83 с (1Н, NH), 7.12-7.20 м (4Н, НAr). Спектр ЯМР 13С (CDCl3, δ, м.д.): 20.76 (СН3CAr), 21.73 (C3), 22.97 (C8), 25.83 (C4), 27.53 (C9), 32.51 (C7), 35.92 (C2), 38.31 (C6), 40.68 (C5), 46.24 (C1), 58.63 (C10), 120.83, 130.10 (CAr), 134.22, 134.87 (NCAr, СН3CAr). Найдено, %: C 66.41; H 8.38; N 4.34; S 10.27. C17H26NO2S. Вычислено, %: C 66.20; H 8.50; N 4.54; S 10.39.
(с 0.2, CHCl3). ИК спектр (KBr, ν, см–1): 3259 (NH), 1327, 1149 (SO2), 918 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.93 c (3H, H8), 1.00 д (1H, H7α, J 9.9 Гц), 1.17 c (3H, H9), 1.56-1.71 м (1H, H3α), 1.83–1.96 м (3H, H4, H5), 1.96-2.03 м (1Н, H1), 2.11-2.22 м (1H, H3β), 2.28-2.42 м (1H, H7β), 2.36 с (3Н, СН3CAr), 2.69–2.82 м (1H, H2), 3.18-3.23 м (2Н, Н10), 6.83 с (1Н, NH), 7.12-7.20 м (4Н, НAr). Спектр ЯМР 13С (CDCl3, δ, м.д.): 20.76 (СН3CAr), 21.73 (C3), 22.97 (C8), 25.83 (C4), 27.53 (C9), 32.51 (C7), 35.92 (C2), 38.31 (C6), 40.68 (C5), 46.24 (C1), 58.63 (C10), 120.83, 130.10 (CAr), 134.22, 134.87 (NCAr, СН3CAr). Найдено, %: C 66.41; H 8.38; N 4.34; S 10.27. C17H26NO2S. Вычислено, %: C 66.20; H 8.50; N 4.54; S 10.39.
1-(((1S,2S,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метил)-N-(п-толил)метансульфонамид 15b.
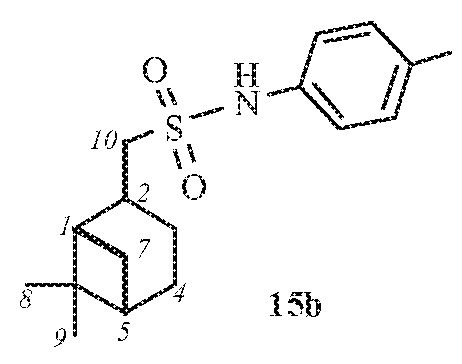
Выход смеси диастереомеров 15a:15b (7:1) 83%. ИК спектр (KBr, ν, см–1): 3260 (NH), 1330, 1150 (SO2), 916 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.84 c (3H, H8), 1.00-1.09 м (1H, H7α), 1.17 с (3H, H9), 1.56-1.66 м (1H, H3α), 1.60-1.77 м (2H, H4), 1.83–1.94 м (3H, H1), 1.94-2.00 м (1Н, H5), 2.07 с (3Н, СН3CAr), 2.10-2.20 м (1H, H3β), 2.37-2.46 м (1H, H7β), 2.58–2.68 м (1H, H2), 2.99-3.03 м (2Н, Н10), 6.9-7.02 м (2Н, НAr), 7.14-7.22 м (2Н, НAr), 7.38 уш. с (1Н, NH). Спектр ЯМР 13С (CDCl3, δ, м.д.): 19.85, 20.92 (СН3CAr, C8), 23.06 (C3), 24.01 (C4), 26.39 (C9), 31.15 (C2), 32.44 (C7), 38.28 (C6), 40.13 (C5), 45.21 (C1), 57.47 (C10), 120.96, 129.64 (CAr), 134.48, 134.65 (NCAr, СН3CAr). Найдено, %: C 66.50; H 8.32; N 4.62; S 10.31. C17H26NO2S. Вычислено, %: C 66.20; H 8.50; N 4.54; S 10.39.
1-(((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)-N-(2,4-динитрофенил)метансульфонгидразид 16а.
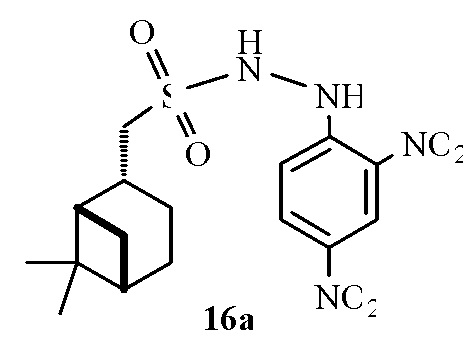
Выход 60%. Красный порошок. ИК спектр (KBr, ν, см–1): 3327 (NH), 1516 (NO2), 1337 (NO2, SO2), 1136 (SO2). Спектр ЯМР 1Н (ДМСО-d6, δ, м.д.): 0.77-1.01 м (4H, H7α, H8), 1.14 с (3H, H9), 1.40-1.66 м (1H, H3α), 1.69-1.87 м (3H, H4, H5), 1.89–2.01 м (2H, H1, H3β), 2.16-2.25 м (1H, H7β), 2.38-2.51 (1Н, H2), 2.53-2.67 м (2Н, Н10), 6.02, 10.11 уш. с (2Н, NH), 7.51, 8.42 д (2Н, HAr, J 7.93 Гц), 8.85 с (1Н, НAr). Спектр ЯМР 13С (ДМСО-d6, δ, м.д.): 21.89 (C3), 22.91 (C8), 25.86 (C4), 27.73 (C9), 32.30 (C7), 36.64 (C2), 38.03 (C6), 40.41 (C5), 46.01 (C1), 59.26 (C10), 115.51, 122.98, 129.84 (CAr), 129.96 (NCAr), 136.72, 146.47 (NO2CAr). Найдено, %: C 48.53; H 5.67; N 14.36; S 8.41. C16H22N4O6S. Вычислено, %: C 48.23; H 5.57; N 14.06; S 8.05.
4-((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метил)сульфонил)морфолин 17а.
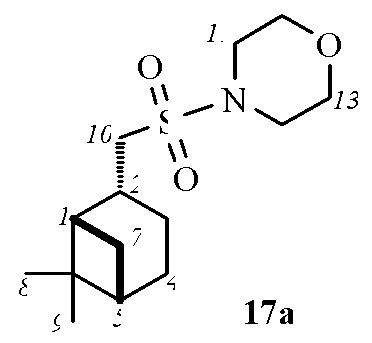
Выход 78%. 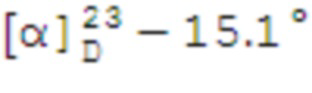
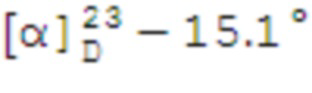 (с 0.4, CHCl3). ИК спектр (KBr, ν, см–1): 1336, 1151 (SO2), 1114 (С-О), 945 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.01 c (3H, H8), 0.98–1.05 м (1H, H7α), 1.22 c (3H, H9), 1.69 дд (1H, H3α, J 10.2, 5.6 Hz), 1.86–1.96 м (3H, H4, H5), 1.98–2.08 м (1H, H1), 2.15–2.27 м (1H, H3β), 2.32–2.42 м (1H, H7β), 2.67–2.80 м (1H, H2), 2.92–3.02 м (2Н, Н10), 3.21–3.28 м (4Н, Н11,14), 3.77-3.80 м (4H, Н12,13). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.80 (C3), 23.03 (C8), 25.77 (C4), 27.53 (C9), 32.38 (C7), 35.28 (C2), 38.28 (C6), 40.59 (C5), 45.62 (C11,14), 46.38 (C1), 55.49 (C10), 66.44 (C12,13). Найдено, %: C 58.64; H 8.79; N 4.77; S 11.65. C14H25NO3S. Вычислено, %: C 58.51; H 8.77; N 4.87; S 11.15.
(с 0.4, CHCl3). ИК спектр (KBr, ν, см–1): 1336, 1151 (SO2), 1114 (С-О), 945 (S-N). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.01 c (3H, H8), 0.98–1.05 м (1H, H7α), 1.22 c (3H, H9), 1.69 дд (1H, H3α, J 10.2, 5.6 Hz), 1.86–1.96 м (3H, H4, H5), 1.98–2.08 м (1H, H1), 2.15–2.27 м (1H, H3β), 2.32–2.42 м (1H, H7β), 2.67–2.80 м (1H, H2), 2.92–3.02 м (2Н, Н10), 3.21–3.28 м (4Н, Н11,14), 3.77-3.80 м (4H, Н12,13). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.80 (C3), 23.03 (C8), 25.77 (C4), 27.53 (C9), 32.38 (C7), 35.28 (C2), 38.28 (C6), 40.59 (C5), 45.62 (C11,14), 46.38 (C1), 55.49 (C10), 66.44 (C12,13). Найдено, %: C 58.64; H 8.79; N 4.77; S 11.65. C14H25NO3S. Вычислено, %: C 58.51; H 8.77; N 4.87; S 11.15.
N-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1H-пиразол-4-ил)-1-((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метилсульфонамид 18а.
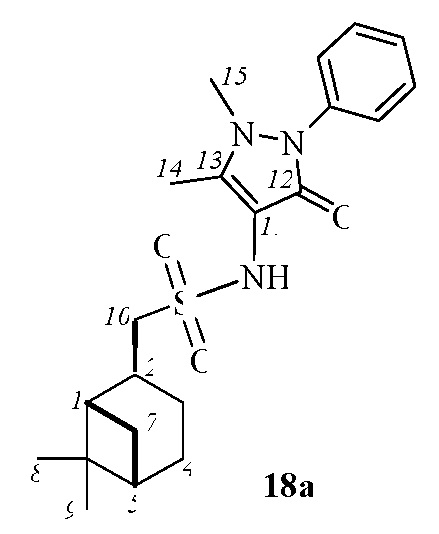
Выход 39%. 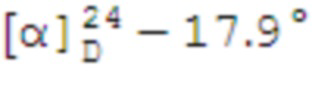
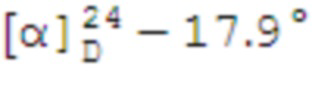 (с 0.2, CHCl3). Желтый порошок. Т. плав. 140°С с разл. ИК спектр (KBr, ν, см–1): 1649, 1591 (С=N), 1302 (SO2), 1151 (SO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.86-0.92 (1H, H7α), 0.93 c (3H, H8), 1.15 c (3H, H9), 1.59–1.77 м (1H, H3α), 1.77-1.93 м (3Н, H4, H5), 2.01-2.16 м (2Н, H1, H3β), 2.25-2.35 м (1Н, H7β), 2.38 с (3Н, СН3Ht), 2.68–2.80 м (1Н, H2), 3.18 с (3H, NCH3), 3.25 д (2H, H10, J 6.6 Гц), 7.24 с (1Н, NH), 7.35-7.44 м (3Н, НAr), 7.51 т (2Н, НAr). Спектр ЯМР 13С (CDCl3, δ, м.д.): 10.9 (СН3Ht), 21.5 (C3), 22.9 (C8), 25.9 (C4), 27.6 (C9), 32.7 (C7), 35.2 (NСН3Ht), 36.0 (C2), 38.3 (C6), 40.8 (C5), 46.1 (C1), 60.2 (C10), 105.9 (C13), 124.9 (CAr), 127.5 (CAr), 129.4 (CAr), 134.0 (C11), 154.2 (CAr), 162.2 (C=O). Найдено, %: C 62.36; H 7.30; N 10.24; S 7.80. C21H29N3O3S. Вычислено, %: C 62.50, H 7.24, N 10.41, S 7.94.
(с 0.2, CHCl3). Желтый порошок. Т. плав. 140°С с разл. ИК спектр (KBr, ν, см–1): 1649, 1591 (С=N), 1302 (SO2), 1151 (SO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.86-0.92 (1H, H7α), 0.93 c (3H, H8), 1.15 c (3H, H9), 1.59–1.77 м (1H, H3α), 1.77-1.93 м (3Н, H4, H5), 2.01-2.16 м (2Н, H1, H3β), 2.25-2.35 м (1Н, H7β), 2.38 с (3Н, СН3Ht), 2.68–2.80 м (1Н, H2), 3.18 с (3H, NCH3), 3.25 д (2H, H10, J 6.6 Гц), 7.24 с (1Н, NH), 7.35-7.44 м (3Н, НAr), 7.51 т (2Н, НAr). Спектр ЯМР 13С (CDCl3, δ, м.д.): 10.9 (СН3Ht), 21.5 (C3), 22.9 (C8), 25.9 (C4), 27.6 (C9), 32.7 (C7), 35.2 (NСН3Ht), 36.0 (C2), 38.3 (C6), 40.8 (C5), 46.1 (C1), 60.2 (C10), 105.9 (C13), 124.9 (CAr), 127.5 (CAr), 129.4 (CAr), 134.0 (C11), 154.2 (CAr), 162.2 (C=O). Найдено, %: C 62.36; H 7.30; N 10.24; S 7.80. C21H29N3O3S. Вычислено, %: C 62.50, H 7.24, N 10.41, S 7.94.
Полученные соединения - потенциальные биологически активные вещества, что обусловлено терпеновым фрагментом, модифицированным сульфонамидной группой. Синтез библиотек монотерпеновых сульфонамидов позволит в дальнейшем проанализировать зависимость «структура - биологическая активность».
Компьютерное прогнозирование спектров биологической активности полученных соединений программой PASS (http://pharmaexpert.ru/passonline/) показало высокую вероятность проявления ими свойств антагонистов простагландина Е1 (83-88%), сердечно-сосудистых аналептиков (83-87%), ноотропов (60-75%), антиневротического действия (61-65%) и многих других.
Сульфонамиды являются промежуточными продуктами в производстве лекарств, дезинфицирующих средств, дегазирующих веществ, красителей, оптических отбеливателей, пластификаторов. Используются для синтеза других реакционноспособных соединений: сульфониминов, хлораминов и др., которые широко применяют в промышленности, медицине [Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 528-535].
| название | год | авторы | номер документа |
|---|---|---|---|
| Сульфопроизводные на основе бета-пинена и способ их получения | 2019 |
|
RU2708617C1 |
| Хиральные γ-кетосульфонильные производные пинановой структуры и способ их получения | 2021 |
|
RU2780452C1 |
| Способ получения монотерпеновых сульфокислот | 2016 |
|
RU2651791C2 |
| Хиральные γ-кетосульфанильные производные пинановой структуры и способ их получения | 2021 |
|
RU2783164C1 |
| Трифторметилированные монотерпеновые аминоспирты на основе нопинона, камфорохинона или вербанона | 2022 |
|
RU2802954C1 |
| Хиральные цис-миртанилсульфонамиды на основе (-)-β-пинена | 2021 |
|
RU2765749C1 |
| Сульфопроизводные α-пинена | 2017 |
|
RU2657730C1 |
| Хиральные 18-сульфопроизводные дегидроабиетана и способ их получения | 2020 |
|
RU2726793C1 |
| Фосфониевые соли на основе алантолактона, обладающие противоопухолевой активностью, и способ их получения | 2023 |
|
RU2818095C1 |
| Хиральные трифторметилированные монотерпеновые тиоацетаты и тиолы на основе миртеналя | 2020 |
|
RU2743302C1 |
Изобретение относится к соединениям хиральных цис- и транс-миртанилсульфонамидов общей формулы I, потенциальных биологически активных соединений. В общей формуле (I) R – радикал пинановой структуры 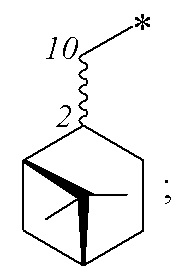 R1 = -NH2; -N(Me)2; -NHEt; -NHEtOH; -N(Et)2; -N(Et)2NH2; -NHBn; -NHPh; -NHPhCH3;
R1 = -NH2; -N(Me)2; -NHEt; -NHEtOH; -N(Et)2; -N(Et)2NH2; -NHBn; -NHPh; -NHPhCH3; 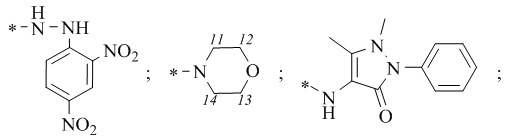 где звездочкой обозначена связь, к которой присоединяется сульфогруппа (-SO2-).
где звездочкой обозначена связь, к которой присоединяется сульфогруппа (-SO2-).
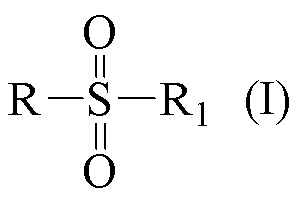
Хиральные цис- и транс-миртанилсульфонамиды (RSO2R1) структурной формулы (I)
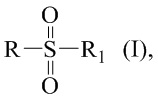
где R – радикал пинановой структуры
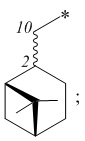
R1 = -NH2 (цис-форма); -N(Me)2; -NHEt; -NHС2Н4OH; -N(Et)2; -NHС2Н4NH2; -NHBn; -NHPh; -NHPhCH3;
где звездочкой обозначена связь, к которой присоединяется сульфогруппа (-SO2-).
| Yusuff, Naeem; Dore, Michael et al "Lipophilic Isosteres of a π-π Stacking Interaction: New Inhibitors of the Bcl-2-Bak Protein-Protein Interaction", ACS Medicinal Chemistry Letters, vol | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Предохранительный прибор от вылета челнока на ткацких станках | 1924 |
|
SU579A1 |
| ПРОИЗВОДНЫЕ 1Н-ИМИДАЗОЛА КАК МОДУЛЯТОРЫ РЕЦЕПТОРА КАННАБИНОИДОВ СВ2 | 2006 |
|
RU2410377C2 |
| Способ получения производных пинана в виде оптически активных изомеров | 1975 |
|
SU604479A3 |
Авторы
Даты
2020-07-07—Публикация
2019-12-30—Подача