ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к биспецифическим антиген связывающим молекулам, которые связывают муцин 16 (MUC16) и CD3, в комбинации с костимуляцией 4-1ВВ, а также к способам их применения.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Официальная копия перечня последовательностей подается одновременно с описанием в электронном виде через EFS-Web в виде перечня последовательностей в формате ASCII с именем файла 10604WO01_SEQ_LIST_ST25, дата создания 19 июня 2020 г., и размером приблизительно 16 384 байт. Перечень последовательностей, содержащийся в этом документе формата ASCII, является частью описания и включен в данный документ посредством ссылки во всей своей полноте.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0003] Муцин 16 (MUC16), также известный как раковый антиген 125, антиген карциномы 125, углеводный антиген 125 или СА-125, представляет собой интегральный мембранный гликопротеин с высокой степенью гликозилирования с одним трансмембранным доменом, который экспрессируется на высоком уровне при раке яичника. MUC16 состоит из трех основных доменов: внеклеточного N-концевого домена, крупного домена с тандемными повторами, перемежающимися с повторами белка спермы морского ежа, энтерокиназного домена и доменов агрина (SEA), и карбоксиконцевого домена, который содержит сегмент из трансмембранной области и короткого цитоплазматического хвоста. Протеолитическое расщепление приводит к отщеплению большей части внеклеточной части MUC16 в кровоток. MUC16 сверхэкспрессируется при видах рака, включая рак яичника, рак молочной железы, рак поджелудочной железы, немелкоклеточный рак легкого, внутрипеченочную холангиокарциному мае сообразующего типа, аденокарциному шейки матки и аденокарциному желудочного тракта, и при заболеваниях и состояниях, включая воспалительное заболевание кишечника, цирроз печени, сердечную недостаточность, перитонеальную инфекцию и абдоминальную хирургию. (Haridas, D. et al., 2014, FASEB J., 28:4183-4199). Показано, что экспрессия на раковых клетках защищает опухолевые клетки от иммунной системы. (Felder, М. et al., 2014, Molecular Cancer, 13:129). Были разработаны способы лечения рака яичника с применением антител к MUC16. Ореговомаб и абговомаб представляют собой антитела к MUC16, которые используются с ограниченным успехом. (Felder, выше, Das, S. and Batra, S.K. 2015, Cancer Res. 75:4660-4674.)
[0004] CD3 представляет собой гомодимерный или гетеродимерный антиген, экспрессируемый на Т-клетках в ассоциации с Т-клеточным рецепторным комплексом (TCR), и он необходим для активации Т-клеток. Функциональный CD3 образуется за счет димерной ассоциации двух из четырех различных цепей: эпсилон, дзета, дельта и гамма. Димерные структуры CD3 включают гамма/эпсилон, дельта/эпсилон и дзета/дзета. Было показано, что антитела к CD3 содействуют образованию кластеров CD3 на Т-клетках, тем самым вызывая активацию Т-клеток аналогично вовлечению TCR за счет нагруженных пептидом молекул МНС. Таким образом, антитела к CD3 были предложены для терапевтических целей с вовлечением активации Т-клеток. Кроме того, биспецифические антитела, способные связывать CD3 и целевой антиген, были предложены для терапевтических путей применения, включая нацеливание иммунных ответов с участием Т-клеток на ткани и клетки, экспрессирующие целевой антиген.
[0005] При активации Т-клеток костимуляция через суперсемейство рецепторов TNF является ключевым фактором выживания, приобретения эффекторных функций и дифференцировки клеток памяти. 4-1ВВ (TnfrsfP), также известный как CD137, является представителем суперсемейства рецепторов TNF. Экспрессия рецептора индуцируется при активации лимфоцитов после TCR-опосредованного примирования, но ее уровни могут быть повышены за счет костимуляции CD28. Воздействие лигандов или агонистических моноклональных антител (mAb) на CD8+ Т-клетки костимулирует 4-1ВВ, способствуя клональной экспансии, выживанию и развитию Т-клеток, индуцированной пролиферации периферических моноцитов, активации NF-каппа В, усилению апоптоза Т-клеток, индуцированному запущенной с помощью TCR/CD3 активацией, и образованию клеток памяти.
КРАТКОЕ ОПИСАНИЕ
[0006] В данном документе предусмотрены способы лечения рака у субъекта. В некоторых аспектах способы включают введение субъекту фармацевтической композиции, содержащей антитело к MUC16 или биспецифическую антиген связывающую молекулу к MUC16/CD3 и фармацевтически приемлемый носитель или разбавитель, и дополнительно введение субъекту агониста 4-1ВВ. В некоторых аспектах способы включают введение субъекту фармацевтической композиции, содержащей антитело к MUC16 или биспецифическую антиген связывающую молекулу к MUC16/CD3, агонист4-1ВВ и фармацевтически приемлемый носитель или разбавитель. В некоторых вариантах осуществления рак выбран из группы, состоящей из рака яичника, рака молочной железы, рака поджелудочной железы, рака эндометрия, рак фаллопиевой трубы, мезотелиомы, немелкоклеточного рака легкого, внутрипеченочной холангиокарциномы массообразующего типа, аденокарциномы шейки матки и аденокарциномы желудочного тракта. В некоторых случаях рак представляет собой рак яичника. В некоторых случаях рак представляет собой рак молочной железы.
[0007] Кроме того, в данном документе предусмотрены способы лечения рака или подавления роста опухоли. В некоторых аспектах способы включают введение субъекту, нуждающемуся в этом, терапевтически эффективного количества каждого из: (а) антитела к MUC16 или его антигенсвязывающего фрагмента или биспецифической антигенсвязывающей молекулы к CD3/MUC16 и (b) агониста 4-1ВВ.
[0008] В данном документе также предусмотрены терапевтические способы нацеливания/уничтожения опухолевых клеток, экспрессирующих MUC16. В некоторых аспектах терапевтические способы включают введение терапевтически эффективного количества антитела к MUC16 или биспецифической антигенсвязывающей молекулы к CD3/MUC16 и терапевтически эффективного количества агониста 4-1ВВ субъекту, нуждающемуся в этом. В некоторых аспектах антитело к MUC16 или биспецифическая антигенсвязывающая молекула к CD3/MUC16 и агонист 4-1ВВ составлены по отдельности. В некоторых аспектах антитело к MUC16 или биспецифическая антигенсвязывающая молекула к CD3/MUC16 и агонист 4-1ВВ составлены в одной фармацевтической композиции.
[0009] Также в данном документе предусмотрено применение антитела к MUC16 или биспецифической антигенсвязывающей молекулы к CD3/MUC16 с агонистом 4-1ВВ в изготовлении лекарственного препарата для лечения заболевания или нарушения, связанных с MUC16-экспрессирующими клетками или вызванных ими.
[0010] Введение антитела к MUC16 или его антиген связывающего фрагмента или биспецифической антигенсвязывающей молекулы к MUC16/CD3 в присутствии агониста 4-1ВВ может уменьшить объем опухоли по сравнению с объемом опухоли у субъекта, которому вводили антитело к MUC16 или биспецифическую антиген связывающую молекулу к CD3/MUC16 в отсутствие агониста 4-1ВВ.
[0011] Введение антитела к MUC16 или его антиген связывающего фрагмента или биспецифической антигенсвязывающей молекулы к MUC16/CD3 в присутствии агониста 4-1ВВ может повысить безопухолевую выживаемость у субъекта по сравнению с безопухолевой выживаемостью у субъекта, которому вводили антитело к MUC16 или биспецифическую антиген связывающую молекулу к CD3/MUC16 в отсутствие агониста 4-1ВВ. В некоторых аспектах повышение безопухолевой выживаемости происходит без потери веса у субъекта.
[0012] Введение антитела к MUC16 или его антиген связывающего фрагмента или биспецифической антигенсвязывающей молекулы к MUC16/CD3 в присутствии агониста 4-1ВВ может инициировать ответ с участием клеток памяти у субъекта, подвергавшегося лечению с помощью антитела к MUC16 или биспецифической антигенсвязывающей молекулы к CD3/MUC16 в присутствии агониста 4-1ВВ, при последующем воздействии на опухолевые клетки.
[0013] Агонист 4-1ВВ может представлять собой низкомолекулярный или биологический агонист 4-1ВВ, и в некоторых аспектах представляет собой антитело. Иллюстративные агонисты 4-1ВВ включают коммерчески доступные антитела, например агонисты 4-1ВВ мыши, и терапевтические антитела, такие как урелумаб и утомилумаб.
[0014] В соответствии со способами, предусмотренными в данном документе, применимыми являются антитела к MUC16 или их антигенсвязывающие фрагменты, а также биспецифические антитела и их антигенсвязывающие фрагменты, которые связывают MUC16 человека и CD3 человека. Биспецифические антитела применимы, среди прочего, для нацеливания на Т-клетки, экспрессирующие CD3, и для стимуляции активации Т-клеток, например в условиях, когда полезным или необходимым является опосредованное Т-клетками уничтожение клеток, экспрессирующих MUC16. Например, биспецифические антитела способны направлять СВ3-опосредованную активацию Т-клеток на специфические MUC16-экспрессирующие клетки, такие как опухолевые клетки яичника.
[0015] Антитела к MUC16 или их антигенсвязывающие фрагменты, которые связывают MUC16, применимы в комбинации с агонистом 4-1ВВ для лечения заболеваний и нарушений, связанных с MUC16-экспрессирующими опухолями или вызванных ими, и, в частности, опухолями, которые являются очень крупными и/или сложнее поддаются лечению. Иллюстративные антитела к MUC16 и их антигенсвязывающие фрагменты подробно описаны в U.S. 2018/0112001. В некоторых аспектах антитело к MUC16 содержит HCVR под SEQ ID NO: 18 и LCVR под SEQ ID NO: 26, упоминаемые в U.S. 2018/0112001. В некоторых аспектах антитело kMUC16 представляет собой антитело Н1Н8767Р, упоминаемое в U.S. 2018/0112001.
[0016] Кроме того, иллюстративные биспецифические антигенсвязывающие молекулы, которые связывают как MUC16, так и CD3, описаны в публикации США No. 2018/0112001, включенной в данный документ посредством ссылки.
[0017] Биспецифические антигенсвязывающие молекулы (например антитела), которые связывают MUC16 и CD3, также упоминаются в данном документе как «биспецифические молекулы к MUC16/CD3», «биспецифические молекулы к CD3/MUC16», «bsAb к MUC16xCD3» или просто «MUC16xCD3». Связывающая MUC16 часть биспецифической молекулы к MUC16/CD3 применима для нацеливания на клетки (например опухолевые клетки), которые экспрессируют MUC16 (например опухоли яичника), а связывающая CD3 часть биспецифической молекулы применима для активации Т-клеток. Одновременное связывание MUC16 на опухолевой клетке и CD3 на Т-клетке облегчает направленное уничтожение (клеточный лизис) подвергаемой нацеливанию опухолевой клетки под действием активированной Т-клетки. Следовательно, биспецифические молекулы к MUC16/CD3 применимы, среди прочего, для лечения заболеваний и нарушений, связанных с MUC16-экспрессирующими опухолями или вызванных ими (например опухолями яичника). Биспецифические молекулы к MUC16/CD3 также применимы в комбинации с агонистом 4-1ВВ для лечения заболеваний и нарушений, связанных с MUC16-экспрессирующими опухолями или вызванных ими, и для инициации ответа с участием клеток памяти и/или распространением эпитопа. В некоторых аспектах биспецифические антигенсвязывающие молекулы к MUC16/CD3 в комбинации с агонистом 4-1ВВ применимы для стимуляции противоопухолевого ответа независимо от присутствия антигена MUC16 или ответа на него, в частности для супрессии образования вторичной опухоли.
[0018] Биспецифические антигенсвязывающие молекулы содержат первый антиген связывающий домен, который специфически связывает CD3 человека, и второй антигенсвязывающий домен, который специфически связывает MUC16.
[0019] Иллюстративные биспецифические антитела, применимые в соответствии со способами, предусмотренными в данном документе, представляют собой биспецифические молекулы к CD3/MUC16, где первый антигенсвязывающий домен, который специфически связывает CD3, содержит любую из аминокислотных последовательностей вариабельной области тяжелой цепи (HCVR), любую из аминокислотных последовательностей вариабельной области легкой цепи (LCVR), любую из пар аминокислотных последовательностей HCVR/LCVR, любую из аминокислотных последовательностей CDR1-CDR2-CDR3 тяжелой цепи или любую из аминокислотных последовательностей CDR1-CDR2-CDR3 легкой цепи, изложенных в публикации США №2018/0112001.
[0020] В соответствии со способами, предусмотренными в данном документе, применимыми являются биспецифические антигенсвязывающие молекулы к CD3/MUC16, где первый антигенсвязывающий домен, который специфически связывает CD3, содержит любую из аминокислотных последовательностей HCVR и/или любую из аминокислотных последовательностей LCVR или в значительной степени сходную с ними последовательность, характеризующуюся по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности, как изложено в таблицах 16, 18, 19, 22 и 24 публикации США №2018/0112001. В некоторых аспектах первый антигенсвязывающий домен, который специфически связывает CD3, содержит аминокислотную последовательность HCVR-1 под SEQ ID NO: 2. В некоторых аспектах первый антигенсвязывающий домен, который специфически связывает CD3, содержит полноразмерную аминокислотную последовательность тяжелой цепи под SEQ ID NO: 5.
[0021] В соответствии со способами, предусмотренными в данном документе, применимыми являются биспецифические молекулы к MUC16/MUC16, где второй антигенсвязывающий домен, который специфически связывает CD3, содержит любую из аминокислотных последовательностей HCVR и/или любую из аминокислотных последовательностей LCVR или в значительной степени сходную с ними последовательность, характеризующуюся по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%) или по меньшей мере 99% идентичностью последовательности, как изложено в таблице 1 публикации США №2018/0112001. В некоторых аспектах второй антигенсвязывающий домен, который специфически связывает MUC16, содержит аминокислотную последовательность HCVR-2 под SEQ ID NO: 1. В некоторых аспектах второй антигенсвязывающий домен, который специфически связывает MUC16, содержит полноразмерную аминокислотную последовательность тяжелой цепи под SEQ ID NO: 4.
[0022] В соответствии со способами, предусмотренными в данном документе, применимыми являются биспецифические молекулы к CD3/MUC16, содержащие любую из последовательностей, или в значительной степени сходную с ней последовательность, характеризующуюся по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98%, или по меньшей мере 99% идентичностью последовательности, как изложено в таблице 4 публикации США №2018/0112001.
[0023] В соответствии со способами, предусмотренными в данном документе, применимыми являются биспецифические молекулы к CD3/MUC16, где первый антигенсвязывающий домен, который специфически связывает CD3, содержит аминокислотную последовательность HCVR-1 под SEQ ID NO: 2, и где второй антигенсвязывающий домен, который специфически связывает MUC16, содержит аминокислотную последовательность HCVR-2 под SEQ ID NO: 1. В некоторых аспектах биспецифическая молекула к CD3/MUC16 содержит аминокислотную последовательность общей LCVR под SEQ ID NO: 3.
[0024] В соответствии со способами, предусмотренными в данном документе, применимыми являются биспецифические антигенсвязывающие молекулы к CD3/MUC16, где первый антигенсвязывающий домен, который специфически связывает CD3, содержит полноразмерную аминокислотную последовательность тяжелой цепи под SEQ ID NO: 5, и где второй антигенсвязывающий домен, который специфически связывает MUC16, содержит полноразмерную аминокислотную последовательность тяжелой цепи под SEQ ID NO: 4. В некоторых аспектах биспецифическая молекула к CD3/MUC16 содержит полноразмерную аминокислотную последовательность легкой цепи под SEQ ID NO: 6.
[0025] В одном аспекте в данном документе предусмотрена фармацевтическая композиция, содержащая антигенсвязывающую молекулу к MUC16 или биспецифическую антигенсвязывающую молекулу к MUC16/CD3 и фармацевтически приемлемый носитель или разбавитель. В некоторых аспектах фармацевтическая композиция дополнительно содержит агонист 4-1ВВ.
[0026] В соответствии со способами по настоящему изобретению применимыми являются антитела к MUC16 и их антигенсвязывающие фрагменты, а также биспецифические антигенсвязывающие молекулы к CD3/MUC16, характеризующиеся модифицированным профилем гликозилирования. В некоторых вариантах применения может быть применима модификация с удалением нежелательных сайтов гликозилирования или антитело без фукозного фрагмента, присутствующего в олигосахаридной цепи, например, для увеличения функционального свойства антителозависимой клеточной цитотоксичности (ADCC) (см. Shield et al. (2002) JBC 277:26733). В других вариантах применения модификацию, представляющую собой галактозилирование, можно осуществлять для модифицирования комплементзависимой цитотоксичности (CDC).
[0027] В одном аспекте настоящего изобретения предусмотрена фармацевтическая композиция, содержащая антитело к MUC16 или его антиген связывающий фрагмент или биспецифическую антигенсвязывающую молекулу к CD3/MUC16, раскрытую в данном документе, агонист 4-1ВВ и фармацевтически приемлемый носитель. В связанном аспекте настоящего изобретения описана композиция, которая представляет собой комбинацию антитела к MUC16 или его антиген связывающего фрагмента или биспецифической антигенсвязывающей молекулы к CD3/MUC16, агониста 4-1ВВ и третьего терапевтического средства. В одном варианте осуществления третье терапевтическое средство представляет собой любое средство, при объединении которого с антителом к MUC16 или его антиген связывающим фрагментом или биспецифической антигенсвязывающей молекулой к CD3/MUC16 обеспечивается преимущество. Иллюстративные средства, которые можно комбинировать с биспецифической антигенсвязывающей молекулой к CD3/MUC16 с обеспечением преимущества, подробно обсуждаются в другом разделе данного документа.
[0028] В другом аспекте в данном документе предусмотрены меченные радиоактивной меткой конъюгаты на основе антитела к MUC16 или конъюгаты на основе биспецифической антигенсвязывающей молекулы к CD3/MUC16 для применения в иммунной РЕТ-визуализации. Конъюгат содержит антитело к MUC16 или биспецифическую антигенсвязывающую молекулу к CD3/MUC16, хелатообразующий фрагмент и позитронный излучатель.
[0029] В данном документе представлены способы синтеза указанных конъюгатов и синтетических промежуточных соединений, применимых для этого.
[0030] В данном документе предусмотрены способы визуализации ткани, которая экспрессирует MUC16, при этом способы включают введение в ткань меченного радиоактивной меткой конъюгата на основе антитела к MUC16 или конъюгата на основе биспецифической антигенсвязывающей молекулы к CD3/MUC16, описанной в данном документе, и визуальное наблюдение экспрессии MUC16 посредством визуализации с помощью позитронно-эмиссионной томографии (PET).
[0031] В данном документе предусмотрены способы визуализации ткани, содержащей MUC16-экспрессирующие клетки, при этом способы включают введение в ткань меченного радиоактивной меткой конъюгата на основе антитела к MUC16 или конъюгата на основе биспецифической антигенсвязывающей молекулы к CD3/MUC16, описанной в данном документе, и визуальное наблюдение экспрессии MUC16 посредством РЕТ-визуализации.
[0032] В данном документе предусмотрены способы выявления MUC16 в ткани, при этом способы включают введение в ткань меченного радиоактивной меткой конъюгата на основе антитела к MUC16 или конъюгата на основе биспецифической антигенсвязывающей молекулы к CD3/MUC16, описанной в данном документе, и визуальное наблюдение экспрессии MUC16 посредством РЕТ-визуализации. В одном варианте осуществления ткань присутствует в организме субъекта-человека. В определенных вариантах осуществления субъект представляет собой отличное от человека млекопитающее. В определенных вариантах осуществления у субъекта имеется заболевание или нарушение, такое как рак, воспалительное заболевание или инфекция.
[0033] В данном документе предусмотрены способы выявления MUC16 в ткани, при этом способы включают приведение ткани в контакт с конъюгатом на основе антитела к MUC16 или биспецифической антигенсвязывающей молекулой к CD3/MUC16, конъюгированной с флуоресцентной молекулой, описанной в данном документе, и визуальное наблюдение экспрессии MUC16 посредством флуоресцентной визуализации.
[0034] В данном документе предусмотрены способы идентификации субъекта, подходящего для противоопухолевой терапии, при этом способы включают отбор субъекта с солидной опухолью, введение меченного радиоактивной меткой конъюгата на основе антитела к MUC16 или конъюгата на основе биспецифической антигенсвязывающей молекулы к CD3/MUC16, описанного в данном документе, и визуальное наблюдение введенного меченного радиоактивной меткой конъюгата на основе антитела в опухоли посредством РЕТ-визуализации, при этом присутствие меченного радиоактивной меткой конъюгата на основе антитела в опухоли позволяет идентифицировать субъекта как подходящего для противоопухолевой терапии.
[0035] В данном документе предусмотрены способы лечения опухоли, при этом способы включают отбор субъекта с опухолью, определение того, является ли опухоль MUC16-положительной, и введение средства противоопухолевой терапии субъекту, нуждающемуся в этом. В определенных вариантах осуществления средство противоопухолевой терапии предусматривает ингибитор сигнальной оси PD-1/PD-L1 (например, антитело к PD-1 или антитело к PD-L1), пример средства терапии на основе ингибитора контрольных точек иммунного ответа. В определенных вариантах осуществления субъекту вводится меченный радиоактивной меткой конъюгат на основе антитела к MUC16 или конъюгат на основе биспецифической антиген связывающей молекулы к CD3/MUC16, описанной в данном документе, и локализация меченного радиоактивной меткой конъюгата на основе антитела визуализируется посредством визуализации с помощью позитронно-эмиссионной томографии (PET) для определения того, является ли опухоль MUC16-положительной. В определенных вариантах осуществления субъекту дополнительно вводят меченный радиоактивной меткой конъюгат на основе антитела к PD-1 и локализации меченного радиоактивной меткой конъюгата на основе антитела визуализируют за счет визуализации с помощью позитронно-эмиссионной томографии (PET) для определения того, является ли опухоль PD-1-положительной.
[0036] В данном документе предусмотрены способы мониторинга эффективности средства противоопухолевой терапии у субъекта, при этом способы включают отбор субъекта с солидной опухолью, где субъект подвергается лечению с помощью средства противоопухолевой терапии, введение субъекту меченного радиоактивной меткой конъюгата на основе антитела к MUC16 или конъюгата на основе биспецифической антигенсвязывающей молекулы к CD3/MUC16, описанной в данном документе, визуализацию локализации введенного меченного радиоактивной меткой конъюгата в опухоли посредством РЕТ-визуализации и определение опухолевого роста, где снижение поглощения конъюгата или сигнала радиоактивной метки относительно исходного уровня указывает на эффективность средства противоопухолевой терапии.
[0037] В определенных вариантах осуществления средство противоопухолевой терапии включает ингибитор PD-1 (например, REGN2810, BGB-А317, ниволумаб, пидилизумаб и пембролизумаб), ингибитор PD-L1 (например, атезолизумаб, авелумаб, дурвалумаб, MDX-1105 и REGN3504, а также те, которые раскрыты в публикации патента США №2015-0203580), ингибитор CTLA-4 {например ипилимумаб), ингибитор TIM3, ингибитор BTLA, ингибитор TIGIT, ингибитор CD47, ингибитор GITR, антагонист другого Т-клеточного коингибитора или лиганда (например антитело к LAG3, CD-28, 2В4, LY108, LAIR1, ICOS, CD160 или VISTA), ингибитор индоламин-2,3-диоксигеназы (IDO), антагонист фактора роста эндотелия сосудов (VEGF) [например «VEGF-Trap», такой как афлиберцепт или другой VEGF-ингибирующий слитый белок, как изложено в US 7087411, или антитело к VEGF или его антигенсвязывающий фрагмент {например бевацизумаб или ранибизумаб), или низкомолекулярный ингибитор киназы рецептора VEGF (например, сунитиниб, сорафениб или пазопаниб)], ингибитор Ang2 (например несвакумаб), ингибитор трансформирующего фактора роста бета (TGFβ), ингибитор рецептора эпидермального фактора роста (EGFR) (например, эрлотиниб, цетуксимаб), ингибитор CD20 (например антитело к CD20, такое как ритуксимаб), антитело к опухоль-специфическому антигену (например, СА9, СА125, ассоциированному с меланомой антигену 3 (MAGE3), карциноэмбриональному антигену (СЕА), виментину, опухолевому белку М2-PK, специфическому антигену предстательной железы (PSA), специфическому мембранному антигену предстательной железы (PSMA), также известному как фолатгидролаза 1 (FOLH1), муцину-1, MART-1 и СА19-9], вакцину (например, бациллу Кальметта-Герена, противораковую вакцину), адъювант для повышения представления антигена (например гранулоцитарно-макрофагальный колониестимулирующий фактор), биспецифическое антитело (например биспецифическое антитело к CD3xCD20 или биспецифическое антитело к PSMAxCD3), цитотоксин, полимеразу поли-АДФ-рибозы (PARP), химиотерапевтическое средство (например, дакарбазин, темозоломид, циклофосфамид, доцетаксел, доксорубицин, даунорубицин, цисплатин, карбоплатин, гемцитабин, метотрексат, митоксантрон, оксалиплатин, паклитаксел и винкристин), циклофосфамид, средство лучевой терапии, ингибитор IL-6R (например сарилумаб), ингибитор IL-4R {например дупилумаб), ингибитор IL-10, цитокин, такой как IL-2, IL-7, IL-21 и IL-15, конъюгат антитела и лекарственного средства (ADC) (например ADC на основе антитела к CD19-DM4 и ADC на основе антитела к DS6-DM4).
[0038] Другие варианты осуществления будут очевидны из обзора следующего подробного описания.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0039] На фигуре 1 показаны результаты модели исследования OVCAR-3 1 (средн. интенсивность излучения [ф/с/см2/ср] в день 4). Все группы характеризовались сходной опухолевой нагрузкой, оцененной посредством BLI перед началом введения доз. Показанные данные представляют собой опухолевую нагрузку, оцененную посредством BLI в день 4 после имплантации опухоли. Статистическую значимость определяли с применением непарных непараметрических t-критериев Манна-Уитни. Не было значимой разницы в опухолевой нагрузке между группами после начала введения доз.
[0040] На фигуре 2 показаны результаты модели исследования OVCAR-3 1 (средн. интенсивность излучения [ф/с/см22/ср] в день 25). BSMUC16/CD3-001 в значительной степени снижает опухолевую нагрузку при 12,5 мкг, и добавление антитела к 4-1ВВ усиливает противоопухолевую эффективность по сравнению с BSMUC16/CD3-001 отдельно. Мышам NSG с привитыми Т-клетками человека имплантировали клетки OVCAR-3/Luc человека. Мышей обрабатывали в дни 5 и 8 после имплантации опухоли с помощью BSMUC16/CD3-001 (12,5 мкг IV) или контрольного CD3-связывающего антитела (12,5 мкг IV) отдельно или в комбинации с агонистом 4-1ВВ (100 мкг IV). Показанные данные представляют собой опухолевую нагрузку, оцененную посредством BLI в день 25 после имплантации опухоли. Статистическую значимость определяли с применением непарных непараметрических t-критериев Манна-Уитни. Группы сравнивали с контрольным CD3-связывающим антителом (*р=0,0159 для BSMUC16/CD3-001, **р<0,0079 для BSMUC16/CD3-001 и комбинации с антителом к 4-1ВВ). Комбинацию BSMUC16/CD3-001 и антитела к 4-1ВВ также сравнивали с BSMUC16/CD3-001 отдельно (# р=0,0159).
[0041] На фигуре 3 показаны результаты на мышиной модели ID8-VEGF/hu MUC16 после лечения с помощью BSMUC16/CD3-001 + комбинация с антителом к 4-1ВВ. Лечение с помощью BSMUC16/CD3-001 в значительной степени повышает медианную выживаемость на модели асцита ID8-VEGF/huMUC16, и добавление костимуляции 4-1ВВ обеспечивает выживание нескольких мышей. Мышам, экспрессирующим CD3 человека вместо CD3 мыши и химерную молекулу MUC16, имплантировали линию клеток опухоли яичника мыши, экспрессирующих часть MUC16 человека. Мышам вводили либо BSMUC16/CD3-001 (1 мг/кг IV), либо контрольное CD3-связывающее антитело (1 мг/кг IV) с изотипическим контролем в дни 3, 6 и 10 после имплантации или с антителом к 4-1ВВ (клон LOB12.3, 2,5 мг/кг IV) в день 3 после имплантации с последующим введением двух дополнительных доз BSMUC16/CD3-001 (1 мг/кг IV) в дни 6 и 10. Мышей умерщвляли, если они характеризовались набором веса, составляющим более чем 30%, вследствие асцитиндуцированного вздутия брюшной полости. Статистическую значимость определяли с применением метода Гехана-Бреслоу-Уилкоксона. Для статистического анализа группы сравнивали с контрольным CD3-связывающим антителом (**р=0,0026 для BSMUC16/CD3-001, ****р<0,0001 для BSMUC16/CD3-001 с антителом к 4-1ВВ). Кроме того, для определения того, приводит ли добавление антитела к -4-1ВВ к любому полезному результату по сравнению с BSMUC16/CD3-001 отдельно, антитело к 4-1ВВ сравнивали с BSMUC16/CD3-001 отдельно (#р=0,0168). BSMUC16/CD3-001 повысило медианную выживаемость по сравнению с группой, обработанной контрольным CD3-связывающим антителом, а также % выживших мышей (с 0 до 27%). Медианную выживаемость для группы с комбинацией BSMUC16/CD3-001 + антитело к -4-1ВВ не удалось определить, поскольку выжило более 50% мышей. Общая выживаемость в группе, обработанной комбинацией, составляла 55%.
[0042] На фигуре 4 изображено изменение веса с течением времени. Обработка с помощью комбинации BSMUC16/CD3-001 + антитело к 4-1ВВ, как показано на фигуре 3, не инициировала какую-либо значительную потерю веса в ходе периода введения, которую использовали в качестве показателя токсичности.
[0043] На фигуре 5 представлены данные из второго исследования на мышиной модели ID8-VEGF/huMUC16, обработанной при 3 разных схемах введения доз комбинацией BSMUC16/CD3-001 + антитело к 4-1ВВ: А) комбинация либо BSMUC16/CD3-001 (1 мг/кг внутривенно), либо контрольного CD3-связывающего антитела (1 мг/кг внутривенно) с либо изотопическим контролем (2,5 мг/кг IV), либо антителом к 4-1ВВ (2,5 мг/кг внутривенно) в дни 3, 7 и 10 после имплантации; В) одна доза комбинации BSMUC16/CD3-001 (1 мг/кг внутривенно) плюс антитело к 4-1ВВ (2,5 мг/кг внутривенно) в день 3 после имплантации с последующим введением доз BSMUC16/CD3-001 (1 мг/кг внутривенно) в дни 7 и 10 после имплантации; С) одна доза комбинации BSMUC16/CD3-001 (1 мг/кг внутривенно) или контрольного CD3-связывающего антитела (1 мг/кг внутривенно) плюс антитело к 4-1ВВ (2,5 мг/кг внутривенно) в день 3 после имплантации без дополнительных обработок. Показанные данные представляют собой медианную выживаемость. Мышей умерщвляли, если они характеризовались набором веса, составляющим более чем 30%, вследствие асцит-индуцированного вздутия брюшной полости. Статистическую значимость определяли с применением метода Гехана-Бреслоу-Уилкоксона. Для статистического анализа группы сравнивали с контрольным CD3-связывающим антителом (**р=0,002 для BSMUC16/CD3-001, ****р<0,0001 для всех трех групп, состоящих из BSMUC16/CD3-001 и комбинации с антителом к 4-1ВВ). Кроме того, для определения того, приводит ли применение комбинации с антителом к 4-1ВВ к какому-либо полезному результату по сравнению с BSMUC16/CD3-001 отдельно, все группы сравнивали с данной группой (#р=0,011 для Gp4 (3 дозы биспецифического антитела к CD3 + 3 дозы антитела к 4-1ВВ), #р=0,027 для Gp5 (3 дозы биспецифического антитела к CD3 + только 1 доза антитела к 4-1ВВ), #р=0,011 для Gp7 (одна доза биспецифического антитела к CD3 + антитело к 4-1ВВ)).
[0044] На фигуре 6 изображено изменение веса с течением времени. Обработка с помощью комбинации BSMUC16/CD3-001 + антитело к 4-1ВВ при трех различных схемах введения доз, как показано на фигуре 5, не инициировала какую-либо значительную потерю веса в ходе периода введения, которую использовали в качестве показателя токсичности.
[0045] Перед приведением описания настоящего изобретения следует понимать, что настоящее изобретение не ограничивается конкретными описанными способами и условиями экспериментов, поскольку такие способы и условия могут варьировать. Также следует понимать, что терминология, используемая в данном документе, предназначена только для целей описания конкретных вариантов осуществления и не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничиваться только прилагаемой формулой изобретения.
[0046] Если не определено иное, то все технические и научные термины, используемые в данном документе, имеют такое же значение, как это обычно понимает специалист средней квалификации в области техники, к которой принадлежит настоящее изобретение. Используемый в данном документе термин «приблизительно» при использовании в отношении конкретного упомянутого числового значения означает, что значение может отличаться от упомянутого значения на не более чем 1%. Например, используемое в данном документе выражение «приблизительно 100» включает 99 и 101 и все значения между ними (например, 99,1, 99,2, 99,3, 99,4 и т.д.).
[0047] Хотя при практическом осуществлении или тестировании настоящего изобретения можно применять любые способы и материалы, сходные с описанными в данном документе или эквивалентные им, в данном документе описаны только предпочтительные способы и материалы. Все патенты, заявки на патент и непатентные публикации, упомянутые в данном описании, включены в данный документ посредством ссылки во всей своей полноте.
[0048] Как показано в разделе Примеры, биспецифические антитела к MUC16xCD3 были эффективны в лечении опухолей яичника на нескольких мышиных моделях. Однако авторы настоящего изобретения стремились усилить и продлить индуцированную MUC16xCD3 активность Т-клеток посредством обеспечения костимулирующего сигнала с применением агониста 4-1ВВ. Сигнальный путь 4-1ВВ может повышать интенсивность и продолжительность Т-клеточных ответов, содействуя выживанию Т-клеток, устраняя анергию Т-клеток и впоследствии приводя к образованию Т-клеток памяти для содействия эффективной противоопухолевой активности и распространению эпитопа.
[0049] Как показано в данном документе, объединение биспецифического антитела к MUC16xCD3 с костимуляцией 4-1ВВ привело к значительной противоопухолевой эффективности при опухолях яичника. Противоопухолевые эффекты наблюдались в отсутствие потери веса. Также показано, что данная комбинация индуцирует образование опухоль-специфических Т-клеток памяти и инициирует распространение эпитопа. Также показано, что данная комбинация стимулирует противоопухолевый ответ независимо от присутствия антигена MUC16 или ответа на него, в частности для супрессии образования вторичной опухоли.
[0050] Способность антител к MUC16 и биспецифических антител к MUC16xCD3 в комбинации с костимуляцией 4-1ВВ повышает интенсивность и продолжительность Т-клеточного ответа, что приводит к значительной противоопухолевой эффективности, как продемонстрировано в данном документе. Объединение антител к MUC16 или биспецифических антител к MUC16xCD3 с костимуляцией 4-1ВВ применимо в способах лечения опухолей для достижения лучшей общей выживаемости.
Пути терапевтического применения антигенсвязывающих молекул
[0051] Настоящее изобретение предусматривает способы, включающие введение субъекту, нуждающемуся в этом, антитела к MUC16 или его антиген связывающего фрагмента или биспецифической антигенсвязывающей молекулы, которая специфически связывает CD3 и MUC16, с агонистом 4-1ВВ. Терапевтическая композиция, применимая согласно способам, описанным в данном документе, может содержать антитело kMUC16 или биспецифическую антигенсвязывающую молекулу к MUC16xCD3 и фармацевтически приемлемый носитель или разбавитель. Используемое в данном документе выражение «субъект, нуждающийся в этом» означает человека или отличное от человека животное, которые демонстрируют один или более симптомов или признаков рака (например субъекта, у которого имеется опухоль или который страдает от любого из типов рака, упомянутых в данном документе ниже) или которые иным образом получат пользу от подавления или снижения активности MUC16 или истощения MUC16 + клеток (например клеток рака яичника).
[0052] Антитела и биспецифические антигенсвязывающие молекулы, раскрытые в данном документе (и терапевтические композиции, содержащие их), применимы, среди прочего, в комбинации с агонистом 4-1ВВ для лечения любого заболевания или нарушения, при которых были бы полезны стимуляция, активация и/или нацеливание иммунного ответа. В частности, антитела к MUC16 и биспецифические антигенсвязывающие молекулы к CD3/MUC16 в комбинации с агонистом 4-1ВВ можно использовать для лечения, предупреждения и/или облегчения любого заболевания или нарушения, ассоциированного с экспрессией MUC16 или активностью или пролиферацией MUC16+клеток или опосредованного ими. Механизм действия, посредством которого достигаются терапевтические способы, раскрытые в данном документе, включает уничтожение клеток, экспрессирующих MUC16, в присутствии эффекторных клеток, например, посредством CDC, апоптоза, ADCC, фагоцитоза или посредством комбинации двух или более из этих механизмов. Клетки, экспрессирующие MUC16, которые можно подавлять или уничтожать с применением антител или биспецифических антиген связывающих молекул, включают, например, опухолевые клетки яичника. Дополнительный терапевтический эффект достигается за счет костимуляции 4-1ВВ, в том числе вклад в клональную экспансию, выживание и развитие Т-клеток, индуцированную пролиферацию периферических моноцитов, активацию NF-каппа В, усиление апоптоза Т-клеток, индуцированного запущенной TCR/CD3 активацией, образование клеток памяти.
[0053] Антигенсвязывающие молекулы, включая антитела к MUC16 и биспецифические антитела к MUC16/CD3 в комбинации с агонистом 4-1ВВ, можно использовать для лечения, например, первичных и/или метастатических опухолей, таких как рак яичника, рак молочной железы, рак поджелудочной железы, рак эндометрия, рак фаллопиевой трубы, мезотелиома, немелкоклеточный рак легкого, внутрипеченочная холангиокарцинома массообразующего типа, аденокарцинома шейки матки и аденокарцинома желудочного тракта, а также заболеваний и состояний, включая воспалительное заболевание кишечника, цирроз печени, сердечную недостаточность, перитонеальную инфекцию и абдоминальную хирургию. В определенных вариантах осуществления антитела или биспецифические антигенсвязывающие молекулы используются для лечения одного или более из следующих типов рака: рак яичника, рак молочной железы, рак поджелудочной железы, рак эндометрия, рак фаллопиевой трубы, мезотелиома, немелкоклеточный рак легкого, внутрипеченочная холангиокарцинома массообразующего типа, аденокарцинома шейки матки и аденокарцинома желудочного тракта. Согласно определенным вариантам осуществления настоящего изобретения антитела к MUC16 или биспецифические антитела к MUC16/CD3 в комбинации с агонистом 4-1ВВ применимы для лечения пациента, пораженного раком яичника или раком молочной железы. Согласно другим связанным вариантам осуществления, раскрытым в данном документе, предусмотрены способы, включающие введение биспецифической антигенсвязывающей молекулы к CD3/MUC16 в комбинации с агонистом 4-1ВВ пациенту, пораженному раком яичника или раком молочной железы.
[0054] Настоящее изобретение также включает способы инициации ответа с образованием клеток памяти и/или распространением эпитопа. Настоящее изобретение также включает способы стимуляции противоопухолевого ответа независимо от присутствия антигена MUC16 или ответа на него, например для супрессии образования вторичной опухоли.
[0055] В настоящее изобретение также включены способы лечения остаточного рака у субъекта. Используемый в данном документе термин «остаточный рак» означает наличие или сохранение одной или более раковых клеток у субъекта после лечения с помощью противораковой терапии.
[0056] Согласно определенным аспектам настоящее изобретение предусматривает способы лечения заболевания или нарушения, ассоциированных с экспрессией MUC16 (например рака яичника), включающие введение одной или более биспецифических антигенсвязывающих молекул, описанных в другом разделе, в комбинации с агонистом 4-1ВВ субъекту после того, как было установлено, что у субъекта имеется рак яичника. Например, настоящее изобретение предусматривает способы лечения рака яичника, включающие введение биспецифической антигенсвязывающей молекулы к CD3/MUC16 пациенту через 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 1 неделю, 2 недели, 3 недели или 4 недели, 2 месяца, 4 месяца, 6 месяцев, 8 месяцев, 1 год или более после того, как субъект прошел гормональную терапию (например антиандрогенную терапию).
Определения
[0057] Используемое в данном документе выражение «CD3» относится к антигену, который экспрессируется на Т-клетках как часть мультимолекулярного Т-клеточного рецептора (TCR) и который состоит из гомодимера или гетеродимера, образованного при ассоциации двух из четырех рецепторных цепей: CD3-эпсилон, CD3-дельта, CD3-дзета и CD3-гамма. Все ссылки на белки, полипептиды и фрагменты белка в данном документе относятся к человеческой версии соответствующего белка, полипептида или фрагмента белка, если явно не указано, что они получены от отличных от человека видов. Таким образом, выражение «CD3» означает CD3 человека, если не указано, что он происходит из отличных от человека видов, например, «CD3 мыши», «CD3 обезьяны» и т.д.
[0058] Используемое в данном документе «антитело, которое связывает CD3» или «антитело к CD3» включает антитела и их антигенсвязывающие фрагменты, которые специфически распознают отдельную субъединицу CD3 (например, эпсилон, дельта, гамма или дзета), а также антитела и их антигенсвязывающие фрагменты, которые специфически распознают димерный комплекс из двух субъединиц CD3 (например, димеры CD3 гамма/эпсилон, дельта/эпсилон и дзета/дзета). Применимые в данном документе антитела и антигенсвязывающие фрагменты могут связывать растворимый CD3 и/или CD3, экспрессируемый на поверхности клетки. Растворимый CD3 включает природные белки CD3, а также рекомбинантные варианты белков CD3, такие как, например, мономерные и димерные конструкции CD3, в которых отсутствует трансмембранный домен или которые иным образом не ассоциированы с клеточной мембраной.
[0059] Используемое в данном документе выражение «CD3, экспрессируемый на клеточной поверхности», означает один или более белков CD3, которые экспрессируются на поверхности клетки in vitro или in vivo, вследствие чего по меньшей мере часть белка CD3 располагается на внеклеточной стороне клеточной мембраны и доступна для антигенсвязывающей части антитела. «CD3, экспрессируемый на клеточной поверхности» включает белки CD3, содержащиеся в рамках функционального Т-клеточного рецептора в мембране клетки. Выражение «CD3, экспрессируемый на клеточной поверхности» включает белок CD3, экспрессируемый как часть гомодимера или гетеродимера на поверхности клетки (например, димеры CD3 гамма/эпсилон, дельта/эпсилон и дзета/дзета). Выражение «CD3, экспрессируемый на клеточной поверхности» также включает цепь CD3 (например, CD3-эпсилон, CD3-дельта или CD3-гамма), которая экспрессируется сама по себе, без других типов цепей CD3, на поверхности клетки. «CD3, экспрессируемый на клеточной поверхности» может содержать белок CD3, экспрессируемый на поверхности клетки, которая в норме экспрессирует белок CD3, или состоять из него. В качестве альтернативы «CD3, экспрессируемый на клеточной поверхности» может содержать белок CD3, экспрессируемый на поверхности клетки, которая в норме не экспрессирует CD3 человека на своей поверхности, но была искусственно сконструирована для экспрессии CD3 на своей поверхности, или состоять из него.
[0060] Используемое в данном документе выражение «MUC16» относится к муцину 16, также известному как раковый антиген 125 (СА125). MUC16 представляет собой крупный ассоциированный с мембраной муцин, содержащий один трансмембранный домен. Данный гликопротеин клеточной поверхности характеризуется высоким уровнем экспрессии при раке яичника и играет роль в стимуляции роста раковых клеток. Используемые в данном документе выражения «антитело, которое связывает MUC16» или «антитело к MUC16» включают антитела и их антигенсвязывающие фрагменты, которые специфически распознают MUC16.
[0061] Используемое в данном документе выражение «4-1ВВ», также известное как CD137, относится к индуцированной активацией костимулирующей молекуле. 4-1ВВ представляет собой важный регулятор иммунных ответов и является представителем суперсемейства рецепторов TNF. Выражение «агонист 4-1ВВ» означает любой лиганд, который связывает 4-1ВВ и активирует рецептор. Иллюстративные агонисты 4-1ВВ включают урелумаб (BMS-663513) и утомилумаб (PF-05082566), а также коммерчески доступные антитела к 4-1ВВ мыши. Кроме того, термин «агонист 4-1ВВ» относится к любой молекуле, которая частично или полностью стимулирует, индуцирует, повышает и/или активирует биологическую активность 4-1ВВ. Подходящие агонистические молекулы, в частности, включают агонистические антитела или фрагменты антител, в том числе биспецифические антитела, например, биспецифическое антитело, содержащее одно плечо, которое связывает 4-1ВВ на иммунной клетке, и другое плечо, которое связывается, например, с антигеном на опухолевой мишени. Термин также включает фрагменты или варианты аминокислотной последовательности нативных полипептидов, пептидов, антисмысловых олигонуклеотидов, малых органических молекул и т.д. В некоторых вариантах осуществления активация в присутствии агониста происходит дозозависимым образом. В некоторых вариантах осуществления измеренный сигнал (например, биологическая активность) на по меньшей мере приблизительно 5%, по меньшей мере приблизительно 10%, по меньшей мере приблизительно 15%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 100% превышает сигнал, измеренный при использовании отрицательного контроля в сопоставимых условиях. Эффективность агониста также можно определить с применением функциональных анализов, таких как способность агониста активировать или стимулировать функцию полипептида. Например, функциональный анализ может предусматривать приведение полипептида в контакт с агонистической молекулой-кандидатом и измерение обнаруживаемого изменения одной или более биологических активностей, в норме ассоциированных с полипептидом. Эффективность агониста обычно определяется его значением ЕС50 (концентрация, требуемая для активации 50%) ответа с участием агониста). Чем ниже значение ЕС50, тем выше эффективность агониста и тем ниже концентрация, которая требуется для активации максимального биологического ответа. Агонист 4-1ВВ может также включать молекулу, содержащую лиганд 4-1ВВ или фрагмент лиганда 4-1ВВ, например биспецифическую молекулу, содержащую одно плечо, которое содержит 4-1BBL или его фрагмент, и другое плечо, которое связывается, например, с антигеном на опухоли. Эти фрагменты могут включать Fc-область.
[0062] Термин «антигенсвязывающая молекула» включает антитела и антигенсвязывающие фрагменты антител, в том числе, например, биспецифические антитела.
[0063] Используемый в данном документе термин «антитело» означает любую антигенсвязывающую молекулу или молекулярный комплекс, содержащий по меньшей мере одну определяющую комплементарность область (CDR), которая специфически связывается или взаимодействует с конкретным антигеном (например MUC16 или CD3). Термин «антитело» включает молекулы иммуноглобулинов, содержащие четыре полипептидные цепи, две тяжелые (Н) цепи и две легкие (L) цепи, соединенные между собой дисульфидными связями, а также их мультимеры (например, IgM). Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно обозначаемую в данном документе как HCVR или VH) и константную область тяжелой цепи. Константный участок тяжелой цепи содержит три домена CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно обозначаемую в данном документе как LCVR или VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен (CL1). Области VH и VL могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность областями (CDR), чередующиеся с более консервативными областями, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В различных вариантах осуществления, раскрытых в данном документе, FR антитела к MUC16 или антитела к CD3 (или их антиген связывающей части) могут быть идентичны последовательностям зародышевого типа человека или могут быть модифицированы естественным или искусственным путем. Консенсусную аминокислотную последовательность можно определить на основании анализа на основе параллельного сравнения двух или более CDR.
[0064] Используемый в данном документе термин «антитело» также включает антигенсвязывающие фрагменты молекул полного антитела. Используемые в данном документе термины «антигенсвязывающая часть» антитела, «антигенсвязывающий фрагмент» антитела и т.п. включают любой встречающийся в природе, полученный ферментативным путем, синтетический или сконструированный с помощью методов генной инженерии полипептид или гликопротеин, которые специфически связывают антиген с образованием комплекса. Антиген связывающие фрагменты антитела могут быть получены, например, из молекул полного антитела с помощью любых подходящих стандартных методик, таких как протеолитическое расщепление или рекомбинантные технологии генной инженерии, включающие манипуляцию с ДНК, кодирующей вариабельные и необязательно константные домены антител, и ее экспрессию. Такая ДНК известна и/или легкодоступна, например, из коммерческих источников, библиотек ДНК (включая, например, фаговые библиотеки антител) или может быть синтезирована. ДНК можно секвенировать и с ней можно проводить химические манипуляции или манипуляции с применением методик молекулярной биологии, например, для расположения одного или более вариабельных и/или константных доменов в подходящей конфигурации или для введения кодонов, включения остатков цистеина, модификации, добавления или удаления аминокислот и т.д.
[0065] Неограничивающие примеры антигенсвязывающих фрагментов включают: (i) Fab-фрагменты; (ii) F(ab')2-фрагменты; (iii) Fd-фрагменты; (iv) Fv-фрагменты; (v) одноцепочечные молекулы Fv (scFv); (vi) dAb-фрагменты и (vii) минимальные распознающие единицы, состоящие из аминокислотных остатков, которые имитируют гипервариабельную область антитела (например, выделенная определяющая комплементарность область (CDR), такая как пептид CDR3), или пептид FR3-CDR3-FR4 с ограниченной конформационной свободой. Другие сконструированные молекулы, такие как домен-специфические антитела, однодоменные антитела, антитела с удаленным доменом, химерные антитела, антитела с привитой CDR, диатела, триатела, тетратела, минитела, нанотела (например, моновалентные нанотела, бивалентные нанотела и т.д.), иммунофармацевтические препараты на основе модульного белка небольшого размера (SMIP) и вариабельные домены IgNAR акулы, также охватываются выражением «антигенсвязывающий фрагмент», используемым в данном документе.
[0066] Антигенсвязывающий фрагмент антитела, как правило, будет содержать по меньшей мере один вариабельный домен. Вариабельный домен может быть любого размера или аминокислотного состава и обычно будет содержать по меньшей мере одну CDR, которая находится в смежном положении или в одной рамке считывания с одной или более каркасными последовательностями. В антиген связывающих фрагментах, содержащих домен VH, ассоциированный с доменом VL, домены VH и VL могут располагаться в любом подходящем порядке друг относительно друга. Например, вариабельная область может быть димерной и содержать димеры VH-VH, VH-VL или VL-VL. В качестве альтернативы антигенсвязывающий фрагмент антитела может содержать мономерный домен VH или VL.
[0067] В определенных вариантах осуществления антигенсвязывающий фрагмент антитела может содержать по меньшей мере один вариабельный домен, ковалентно связанный с по меньшей мере одним константным доменом. Неограничивающие иллюстративные конфигурации вариабельных и константных доменов, которые могут находиться в пределах антигенсвязывающего фрагмента антитела, применимого в данном документе, включают (i) VH-CH1; (ii) VH-CH2; (iii) VH-CH3; (iv) VH-CH1-CH2; (v) VH-CH1-CH2-CH3; (vi) VH-CH2-CH3; (vii) VH-CL; (viii) VL-CH1; (ix) VL-CH2; (x) VL-CH3; (xi) VL-CH1-CH2; (xii) VL-CH1-CH2-CH3; (xiii) VL-CH2-CH3 и (xiv) VL-CL. В любой конфигурации вариабельных и константных доменов, в том числе любой из иллюстративных конфигураций, перечисленных выше, вариабельные и константные домены могут быть либо непосредственно соединены друг с другом, либо могут быть соединены посредством целой шарнирной или линкерной области или ее части. Шарнирная область может состоять из по меньшей мере 2 (например, 5, 10, 15, 20, 40, 60 или больше) аминокислот, которые обеспечивают образование гибкой или полугибкой связи между смежными вариабельным и/или константным доменами в одной полипептидной молекуле. Более того, антигенсвязывающий фрагмент антитела, применимого в данном документе, может содержать гомодимер или гетеродимер (или другой мультимер) в любой из конфигураций вариабельного и константного доменов, изложенных выше, находящихся в нековалентной ассоциации друг с другом и/или с одним или более мономерными доменом VH или VL (например, с помощью дисульфидной связи(-ей)).
[0068] Как и в случае с молекулами полного антитела антигенсвязывающие фрагменты могут быть моноспецифическими или полиспецифическими (например, биспецифическими). Полиспецифический антигенсвязывающий фрагмент антитела, как правило, будет содержать по меньшей мере два различных вариабельных домена, где каждый вариабельный домен способен специфически связываться с отдельным антигеном или с другим эпитопом того же антигена. Любой формат полиспецифических антител, в том числе иллюстративные форматы биспецифических антител, раскрытые в данном документе, могут быть адаптированы для применения в рамках антигенсвязывающего фрагмента антитела, применимого в данном документе, с помощью традиционных методик, доступных в данной области техники.
[0069] Антитела, применимые в данном документе, могут функционировать посредством комплементзависимой цитотоксичности (CDC) или зависимой от антителозависимой опосредованной клетками цитотоксичности (ADCC). «Комплементзависимая цитотоксичность» (CDC) относится к лизису экспрессирующих антиген клеток с участием антитела, раскрытого в данном документе, в присутствии комплемента. «Антителозависимая опосредованная клетками цитотоксичность» (ADCC) относится к опосредованной клетками реакции, при которой неспецифические цитотоксические клетки, которые экспрессируют Fc-рецепторы (FcR) (например, натуральные клетки-киллеры (NK), нейтрофилы и макрофаги), распознают связанное антитело на клетке-мишени и за счет этого осуществляют лизис клетки-мишени. CDC и ADCC могут быть измерены с использованием анализов, которые хорошо известны и доступны в данной области техники (см., например, патенты США №№5500362 и 5821337, а также Clynes et al. (1998) Proc. Natl. Acad. Sci. (USA) 9.5:652 656). Константная область антитела важна для способности антитела фиксировать комплемент и опосредовать клеточно-зависимую цитотоксичность. Таким образом, изотип антитела может быть выбран на основании того, необходимо ли, чтобы антитело опосредовало цитотоксичность.
[0070] В определенных вариантах осуществления антитела к MUC16 или биспецифические антитела к MUC16/CD3, применимые в данном документе, представляют собой человеческие антитела. Предусматривается, что используемый в данном документе термин «человеческое антитело» включает антитела, содержащие вариабельные и константные области, полученные из последовательностей иммуноглобулина зародышевой линии человека. Антитела человека могут содержать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина зародышевой линии человека (например, мутации, введенные посредством случайного или сайт-специфического мутагенеза in vitro или посредством соматической мутации in vivo), например, в CDR и, в частности, CDR3. Однако подразумевается, что используемый в данном документе термин «человеческое антитело» не включает антитела, в которых последовательности CDR, полученные из зародышевой линии другого вида млекопитающих, например мыши, были привиты на человеческие каркасные последовательности.
[0071] В некоторых вариантах осуществления антитела, применимые в соответствии со способами, раскрытыми в данном документе, могут быть рекомбинантными человеческими антителами. Подразумевается, что используемый в данном документе термин «рекомбинантное человеческое антитело» включает все антитела человека, которые получают, экспрессируют, создают или выделяют посредством рекомбинантных способов, такие как антитела, экспрессируемые с применением рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина (дополнительно описанные ниже), антитела, выделяемые из рекомбинантной комбинаторной библиотеки человеческих антител (дополнительно описанные ниже), антитела, выделяемые из животного (например, мыши), которое является трансгенным по генам иммуноглобулинов человека (см., например, Taylor et al. (1992) Nucl. Acids Res. 20:6287-6295), или антитела, получаемые, экспрессируемые, создаваемые или выделяемые посредством любых других способов, которые включают сплайсинг последовательностей генов иммуноглобулинов человека с другими последовательностями ДНК. Такие рекомбинантные человеческие антитела содержат вариабельные и константные области, полученные из последовательностей иммуноглобулина зародышевой линии человека. Однако в определенных вариантах осуществления такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или, если используют животное, трансгенное по последовательностям Ig человека, соматическому мутагенезу in vivo) и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител представляют собой последовательности, которые, хотя и получены из последовательностей VH и VL зародышевой линии человека и родственны им, могут не существовать в природе в репертуаре антител зародышевой линии человека in vivo.
[0072] Человеческие антитела могут существовать в двух формах, которые ассоциированы с гетерогенностью шарнира. В одной форме молекула иммуноглобулина содержит стабильную конструкцию из четырех цепей размером приблизительно 150-160 кДа, в которой димеры удерживаются вместе межцепочечной дисульфидной связью при тяжелых цепях. Во второй форме димеры не связаны межцепочечными дисульфидными связями, и образуется молекула размером приблизительно 75-80 кДа, состоящая из соединенных ковалентной связью легкой и тяжелой цепей (полуантитело). Эти формы было чрезвычайно трудно разделить даже после аффинной очистки.
[0073] Частота появления второй формы в различных изотипах интактного IgG обусловлена без ограничения структурными различиями, ассоциированными с изотипом шарнирного участка антитела. Одна аминокислотная замена в шарнирном участке шарнира IgG4 человека может значительно снизить частоту появления второй формы (Angal et al. (1993) Molecular Immunology 30:105) до уровней, как правило, наблюдаемых при использовании шарнира IgG1 человека. Настоящее изобретение охватывает антитела, содержащие одну или более мутаций в шарнире, области CH2 или CH3, которые могут быть необходимы, например, при получении, для обеспечения улучшения выхода необходимой формы антитела.
[0074] Антитела, применимые в данном документе, могут представлять собой выделенные антитела. Используемый в данном документе термин «выделенное антитело» означает антитело, которое было идентифицировано и отделено от по меньшей мере одного компонента его природного окружения и/или извлечено из такового. Например, антитело, которое было отделено или удалено от по меньшей мере одного компонента из организма, или из ткани или клетки, в которых антитело существует или продуцируется естественным путем, является «выделенным антителом» для целей настоящего изобретения. Выделенное антитело также включает антитело in situ в пределах рекомбинантной клетки. Выделенные антитела представляют собой антитела, которые были подвергнуты по меньшей мере одной стадии очистки или выделения. В соответствии с определенными вариантами осуществления выделенное антитело может по сути не содержать другой клеточный материал и/или химические вещества.
[0075] Антитела к MUC16 и антитела к MUC 16/CD3, применимые согласно способам, раскрытым в данном документе, могут содержать одну или более аминокислотных замен, вставок и/или делеций в каркасной области и/или областях CDR вариабельных доменов тяжелой и легкой цепей по сравнению с соответствующими последовательностями зародышевого типа, из которых были получены антитела. Такие мутации можно легко определить путем сравнения аминокислотных последовательностей, раскрытых в данном документе, с последовательностями зародышевой линии, доступными, например, из общедоступных баз данных последовательностей антител. Настоящее изобретение включает антитела и их антигенсвязывающие фрагменты, которые получены из любых аминокислотных последовательностей, раскрытых в данном документе, где одна или более аминокислот в пределах одной или более каркасных областей и/или областей CDR мутированы с получением соответствующего(-их) остатка(-ов) из последовательности зародышевой линии, из которой получено антитело, или с получением соответствующего(-их) остатка(-ов) из другой последовательности зародышевой линии человека, или с получением консервативной аминокислотной замены из соответствующего(-их) остатка(-ов) зародышевой линии (такие изменения последовательности в данном документе в совокупности обозначаются как «мутации зародышевой линии»). Специалист средней квалификации в данной области техники, беря за основу раскрытые в данном документе последовательности вариабельных областей тяжелой и легкой цепей, легко может получить многочисленные антитела и антигенсвязывающие фрагменты, которые содержат одну или более отдельных мутаций зародышевой линии или их комбинации. В определенных вариантах осуществления все остатки из каркасного области и/или CDR в доменах VH и/или VL подвергнуты обратной мутации с получением остатков, встречающихся в исходной последовательности зародышевой линии, из которой было получено антитело. В других вариантах осуществления только определенные остатки подвергнуты обратной мутации с получением исходной последовательности зародышевой линии, например, мутации подвергнуты только остатки, находящиеся в пределах первых 8 аминокислот FR1 или в пределах последних 8 аминокислот FR4, или мутации подвергнуты только остатки, находящиеся в пределах CDR1, CDR2 или CDR3. В других вариантах осуществления один или более остатков из каркасной области и/или CDR подвергнуты мутации с получением соответствующего(-их) остатка(-ов) из другой последовательности зародышевой линии (т.е. последовательности зародышевой линии, которая отличается от последовательности зародышевой линии, из которой исходно было получено антитело). Кроме того, антитела, применимые в данном документе, могут содержать любую комбинацию из двух или более мутаций зародышевой линии в пределах каркасных областей и/или областей CDR, например, где определенные отдельные остатки подвергнуты мутации с получением соответствующего остатка из конкретной последовательности зародышевой линии, при этом определенные другие остатки, которые отличаются от исходной последовательности зародышевой линии, сохраняют или подвергают мутации с получением соответствующего остатка из другой последовательности зародышевой линии. После получения антитела и антигенсвязывающие фрагменты, которые содержат одну или более мутаций зародышевой линии, можно легко протестировать в отношении одного или более необходимых свойств, таких как улучшенная специфичность связывания, повышенная аффинность связывания, улучшенные или усиленные антагонистические или агонистические биологические свойства (в случае необходимости), сниженная иммуногенность и т.п. Настоящее изобретение охватывает антитела и антигенсвязывающие фрагменты, полученные с помощью этого общего способа.
[0076] Согласно способам, предусмотренным в данном документе, применимы антитела к MUC16 и антитела к MUC16/CD3, содержащие варианты любой из раскрытых в данном документе аминокислотных последовательностей HCVR, LCVR и/или CDR, содержащие одну или более консервативных замен. Например, настоящее изобретение включает антитела к MUC16 и антитела к MUC16/CD3, содержащие аминокислотные последовательности HCVR, LCVR и/или CDR, например, с 10 или меньше, 8 или меньше, 6 или меньше, 4 или меньше и т.д. консервативными аминокислотными заменами по сравнению с любой из аминокислотных последовательностей тяжелой цепи или легкой цепи, изложенных в таблице 1 в данном документе.
[0077] Термин «эпитоп» относится к антигенной детерминанте, которая взаимодействует со специфическим антигенсвязывающим сайтом в вариабельной области молекулы антитела, известным как паратоп. Один антиген может содержать более чем один эпитоп. Таким образом, различные антитела могут связываться с различными зонами на антигене и могут оказывать различные биологические эффекты. Эпитопы могут быть конформационными или линейными. Конформационный эпитоп образуют аминокислоты из разных сегментов линейной полипептидной цепи, располагающиеся рядом в пространстве. Линейный эпитоп представляет собой эпитоп, образуемый смежными аминокислотными остатками в полипептидной цепи. В определенных обстоятельствах эпитоп может содержать фрагменты сахаридов, фосфорильные группы или сульфонильные группы на антигене.
[0078] Термин «идентичность по сути» или «по сути идентичный» по отношению к нуклеиновой кислоте или ее фрагменту указывает на то, что при оптимальном выравнивании с учетом соответствующих нуклеотидных вставок или делеций с другой последовательностью нуклеиновой кислоты (или ее комплементарной нитью) идентичность нуклеотидной последовательности составляет по меньшей мере приблизительно 95% и более предпочтительно по меньшей мере приблизительно 96%, 97%, 98% или 99% нуклеотидных оснований, как измерено с помощью хорошо известного алгоритма определения идентичности последовательностей, такого как FASTA, BLAST или Gap, как обсуждается ниже. Молекула нуклеиновой кислоты, которая по сути идентична молекуле эталонной нуклеиновой кислоты, в определенных случаях может кодировать полипептид, имеющий такую же или по сути сходную аминокислотную последовательность, что и полипептид, кодируемый молекулой эталонной нуклеиновой кислоты.
[0079] Применительно к полипептидам термин «сходство по сути» или «по сути сходный» означает, что две пептидные последовательности при оптимальном выравнивании, как, например, с помощью программ GAP или BESTFIT, с применением значений штрафа за открытие гэпа по умолчанию, характеризуются по меньшей мере 95% идентичностью последовательности, еще более предпочтительно по меньшей мере 98% или 99% идентичностью последовательности. Предпочтительно, положения остатков, не являющихся идентичными, отличаются консервативными аминокислотными заменами. «Консервативная аминокислотная замена» представляет собой замену, при которой аминокислотный остаток заменен другим аминокислотным остатком, содержащим боковую цепь (R-группу) со сходными химическими свойствами (например, зарядом или гидрофобностью). В целом, консервативная аминокислотная замена по сути не будет изменять функциональные свойства белка. В случаях, если две или более аминокислотные последовательности отличаются друг от друга консервативными заменами, процентную идентичность последовательности или степень сходства можно регулировать в сторону повышения для коррекции консервативного характера замены. Средства для осуществления такой коррекции хорошо известны специалистам в данной области техники. См., например, Pearson (1994) Methods Mol. Biol. 24: 307-331, которая включена в данный документ посредством ссылки. Примеры групп аминокислот, которые содержат боковые цепи со сходными химическими свойствами, включают: (1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; (2) алифатические боковые цепи с гидроксильными группами: серии и треонин; (3) амид-содержащие боковые цепи: аспарагин и глутамин; (4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; (5) основные боковые цепи: лизин, аргинин и гистидин; (6) кислые боковые цепи: аспартат и глутамат и (7) серосодержащие боковые цепи: цистеин и метионин. Предпочтительными группами консервативных аминокислотных замен являются валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин. В качестве альтернативы консервативным замещением является любое изменение, имеющее положительное значение в матрице логарифмической функции правдоподобия РАМ250, раскрытой в Gonnet et al. (1992) Science 256: 1443-1445, которая включена в данный документ посредством ссылки. «Умеренно консервативным» замещением является любое изменение, имеющее неотрицательное значение в матрице логарифмической функции правдоподобия РАМ250.
[0080] Для полипептидов сходство последовательностей, которое также называют идентичностью последовательностей, как правило, измеряют с помощью программного обеспечения для анализа последовательностей. Программное обеспечение для анализа белков сопоставляет сходные последовательности с применением показателей сходства, присваиваемых различным заменам, делециям и другим модификациям, в том числе консервативным аминокислотным заменам. Например, программный пакет GCG включает программы, такие как Gap и Bestfit, которые можно применять с параметрами по умолчанию для определения степени гомологии последовательностей или идентичности последовательностей между близкородственными полипептидами, такими как гомологичные полипептиды от различных видов организмов, или между белком дикого типа и его мутеином. См., например, GCG версии 6.1. Полипептидные последовательности также можно сравнивать с помощью FASTA с применением параметров по умолчанию или рекомендованных параметров; программа в GCG версии 6.1. FASTA (например, FASTA2 и FASTA3) обеспечивает выравнивания и расчет процента идентичности последовательности в областях наибольшего перекрывания между последовательностями запроса и поиска (Pearson (2000), выше). Другим предпочтительным алгоритмом при сравнении последовательности, раскрытой в данном документе, с базой данных, содержащей большое количество последовательностей от разных организмов, является компьютерная программа BLAST, в частности BLASTP или TBLASTN, с использованием параметров по умолчанию. См., например, Altschul et al. (1990) J. Mol. Biol. 215:403-110 и Altschul et al. (1997) Nucleic Acids Res. 25:3389-402, каждая из которых включена в данный документ посредством ссылки.
Варианты последовательности
[0081] Антитела и биспецифические антитела, применимые в данном документе, содержат одну или более аминокислотных замен, вставок и/или делеций в каркасной области и/или областях CDR вариабельных доменов тяжелой цепи по сравнению с соответствующими последовательностями зародышевого типа, из которых были получены антитела.
[0082] Также в данном документе применимы антитела и их антигенсвязывающие фрагменты, которые получены из любых аминокислотных последовательностей, раскрытых в данном документе, где одна или более аминокислот в пределах одной или более каркасных областей и/или областей CDR подвергнуты мутации с получением соответствующего(-их) остатка(-ов) из последовательности зародышевой линии, из которой получено антитело, или с получением соответствующего(-их) остатка(-ов) из другой последовательности зародышевой линии человека, или с получением консервативной аминокислотной замены из соответствующего(-их) остатка(-ов) зародышевой линии (такие изменения последовательностей обозначаются в данном документе в совокупности как «мутации зародышевой линии»).
[0083] Кроме того, антитела, применимые в данном документе, могут содержать любую комбинацию из двух или более мутаций зародышевой линии в пределах каркасных областей и/или областей CDR, например, где определенные отдельные остатки подвергнуты мутации с получением соответствующего остатка из конкретной последовательности зародышевой линии, при этом определенные другие остатки, которые отличаются от исходной последовательности зародышевой линии, сохраняют или подвергают мутации с получением соответствующего остатка из другой последовательности зародышевой линии. После получения антитела и антигенсвязывающие фрагменты, которые содержат одну или более мутаций зародышевой линии, можно протестировать в отношении одного или более необходимых свойств, таких как улучшенная специфичность связывания, слабая или сниженная аффинность связывания, улучшенные или усиленные фармакокинетические свойства, сниженная иммуногенность и т.д. Антитела и антигенсвязывающие фрагменты, полученные с помощью этого общего способа с учетом инструкций из настоящего изобретения, охватываются настоящим изобретением.
[0084] Согласно настоящему изобретению применимы антитела и биспецифические антитела, содержащие варианты любой из предусмотренных в данном документе аминокислотных последовательностей тяжелой цепи или легкой цепи, содержащие одну или более консервативных замен. Антитела и биспецифические антигенсвязывающие молекулы, применимые в данном документе, содержат одну или более аминокислотных замен, вставок и/или делеций в каркасной области и/или областях CDR вариабельных доменов тяжелой и легкой цепей по сравнению с соответствующими последовательностями зародышевого типа, из которых были получены отдельные антигенсвязывающие домены, при сохранении или улучшении необходимых характеристик связывания антигена. «Консервативная аминокислотная замена» представляет собой замену, при которой аминокислотный остаток заменен другим аминокислотным остатком, содержащим боковую цепь (R-группу) со сходными химическими свойствами (например, зарядом или гидрофобностью). В целом, консервативная аминокислотная замена по сути не будет изменять функциональные свойства белка. Примеры групп аминокислот, которые содержат боковые цепи со сходными химическими свойствами, включают: (1) алифатические боковые цепи: глицин, аланин, валин, лейцин и изолейцин; (2) алифатические боковые цепи с гидроксильными группами: серии и треонин; (3) амид-содержащие боковые цепи: аспарагин и глутамин; (4) ароматические боковые цепи: фенилаланин, тирозин и триптофан; (5) основные боковые цепи: лизин, аргинин и гистидин; (6) кислые боковые цепи: аспартат и глутамат и (7) серосодержащие боковые цепи: цистеин и метионин. Предпочтительными группами консервативных аминокислотных замен являются валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, глутамат-аспартат и аспарагин-глутамин. В качестве альтернативы консервативным замещением является любое изменение, имеющее положительное значение в матрице логарифмической функции правдоподобия РАМ250, раскрытой в Gonnet et al. (1992) Science 256: 1443-1445. «Умеренно консервативным» замещением является любое изменение, имеющее неотрицательное значение в матрице логарифмической функции правдоподобия РАМ250.
[0085] Настоящее изобретение также включает антигенсвязывающие молекулы, содержащие антигенсвязывающий домен с аминокислотной последовательностью HCVR, LCVR и/или CDR, которая практически идентична любой из аминокислотных последовательностей HCVR, LCVR и/или CDR, раскрытых в данном документе, при сохранении или улучшении необходимой аффинности к антигену. Термин «идентичность по сути» или «по сути идентичный» по отношению к аминокислотной последовательности означает, что две аминокислотные последовательности при оптимальном выравнивании, как, например, с помощью программ GAP или BESTFIT с применением значений штрафа за открытие гэпа по умолчанию, характеризуются по меньшей мере 95% идентичностью последовательности, еще более предпочтительно по меньшей мере 98% или 99% идентичностью последовательности. Предпочтительно, положения остатков, не являющихся идентичными, отличаются консервативными аминокислотными заменами. В случаях, если две или более аминокислотные последовательности отличаются друг от друга консервативными заменами, процентную идентичность последовательности или степень сходства можно регулировать в сторону повышения для коррекции консервативного характера замены. Средства для осуществления такой коррекции хорошо известны специалистам в данной области техники. См., например, Pearson (1994) Methods Mol. Biol. 24: 307-331, включенную в данный документ посредством ссылки.
[0086] Для полипептидов сходство последовательностей, которое также называют идентичностью последовательностей, как правило, измеряют с помощью программного обеспечения для анализа последовательностей. Программное обеспечение для анализа белков сопоставляет сходные последовательности с применением показателей сходства, присваиваемых различным заменам, делециям и другим модификациям, в том числе консервативным аминокислотным заменам. Например, программный пакет GCG включает программы, такие как Gap и Bestfit, которые можно применять с параметрами по умолчанию для определения степени гомологии последовательностей или идентичности последовательностей между близкородственными полипептидами, такими как гомологичные полипептиды от различных видов организмов, или между белком дикого типа и его мутеином. См., например, GCG версии 6.1. Полипептидные последовательности также можно сравнивать с помощью FASTA с применением параметров по умолчанию или рекомендованных параметров; программа в GCG версии 6.1. FASTA (например, FASTA2 и FASTA3) обеспечивает выравнивания и расчет процента идентичности последовательности в областях наибольшего перекрывания между последовательностями запроса и поиска (Pearson (2000), выше). Другим предпочтительным алгоритмом при сравнении последовательности, раскрытой в данном документе, с базой данных, содержащей большое количество последовательностей от разных организмов, является компьютерная программа BLAST, в частности BLASTP или TBLASTN, с использованием параметров по умолчанию. См., например, Altschul et al. (1990) J. Mol. Biol. 215:403-110 и Altschul et al. (1997) Nucleic Acids Res. 25:3389-102.
[0087] После получения антигенсвязывающие домены, которые содержат одну или более мутаций зародышевой линии, тестировали в отношении уменьшенной аффинности связывания с использованием одного или более анализов in vitro. Хотя антитела, которые распознают конкретный антиген, как правило, проходят скрининг с точки зрения тестирования в отношении высокой (т.е. сильной) аффинности связывания с антигеном, антитела, применимые в данном документе, демонстрируют слабое связывание или отсутствие обнаруживаемого связывания. Биспецифические антигенсвязывающие молекулы, содержащие один или несколько антиген связывающих доменов, полученных таким общим способом, также охватываются настоящим изобретением и, как было обнаружено, приносят пользу в качестве средств терапии опухолей на основе авидности.
[0088] С помощью описанных в данном документе способов могут быть реализованы неожиданные преимущества, например улучшенные фармакокинетические свойства и низкая токсичность для пациента.
Связывающие свойства антител
[0089] Используемый в данном документе термин «связывание» в контексте связывания антитела, иммуноглобулина, связывающего фрагмента антитела или Fc-содержащего белка с любым, например, заранее определенным антигеном, таким как белок клеточной поверхности или его фрагмент, как правило, относится к взаимодействию или ассоциации между минимум двумя объектами или молекулярными структурами, таким как взаимодействие антитело-антиген.
[0090] Например, аффинность связывания, как правило, соответствует значению KD, составляющему приблизительно 10-7 М или меньше, как, например, приблизительно 10-8 М или меньше, как, например, приблизительно 10-9 М или меньше, при определении, например, с помощью технологии поверхностного плазмонного резонанса (SPR) в приборе BIAcore 3000 с использованием антигена в качестве лиганда и антитела, Ig, связывающего фрагмента антитела или Fc-содержащего белка в качестве аналита (или антилиганда). Традиционно также используются стратегии связывания на основе клеток, такие как анализы связывания с сортировкой флуоресцентно-активируемых клеток (FACS), и данные, полученные в FACS, хорошо коррелируют с другими методами, такими как конкурентное связывание лигандов с радиоактивной меткой и SPR (Benedict, СА, J Immunol Methods. 1997, 201(2): 223-31; Geuijen, СА, et al. J Immunol Methods. 2005, 302(1-2):68-77).
[0091] Соответственно, антитело или антигенсвязывающий белок, раскрытые в данном документе, связываются с заранее определенным антигеном или молекулой (рецептором) клеточной поверхности, с аффинностью, соответствующей значению KD, которое в по меньшей мере десять раз ниже, чем его аффинность связывания с неспецифическим антигеном (например, BSA, казеином). В соответствии с настоящим изобретением аффинность антитела, соответствующая значению KD, которое равно или в менее чем десять раз ниже, чем значение для неспецифического антигена, может считаться необнаруживаемым связыванием, однако такое антитело можно спаривать со вторым антигенсвязывающим плечом для получения биспецифического антитела, раскрытого в данном документе.
[0092] Термин «KD» (М) относится к равновесной константе диссоциации конкретного взаимодействия антитело-антиген или равновесной константе диссоциации связывания антитела или связывающего фрагмента антитела с антигеном. Между KD и аффинностью связывания существует обратная зависимость, следовательно, чем меньше значение KD, тем выше, т.е. сильнее, аффинность. Таким образом, термины «более высокая аффинность» или «более сильная аффинность» относятся к более высокой способности вступать во взаимодействие и, следовательно, к меньшему значению KD, и, наоборот, термины «более низкая аффинность» или «более слабая аффинность» относятся к более низкой способности вступать во взаимодействие и, следовательно, большему значении KD. В некоторых случаях более высокая аффинность связывания (или KD) конкретной молекулы (например, антитела) с ее молекулой-партнером по взаимодействию (например, антигеном X) по сравнению с аффинностью связывания молекулы (например, антитела) с другой молекулой-партнером по взаимодействию (например, антигеном Y) может быть выражена как отношение связывания, определяемое путем деления большего значения KD (более низкая или более слабая аффинность) на меньшее KD (более высокая или более сильная аффинность), например, выраженное как аффинность связывания в 5 раз или 10 раз больше, в зависимости от обстоятельств.
[0093] Термин «kd» (сек -1 или 1/с) относится к константе скорости диссоциации конкретного взаимодействия антитело-антиген или константе скорости диссоциации связывания антитела или связывающего фрагмента антитела. Указанное значение также обозначается как значение koff.
[0094] Термин «ka» (М-1 х сек-1 или 1/М) относится к константе скорости ассоциации конкретного взаимодействия антитело-антиген или константе скорости ассоциации связывания антитела или связывающего фрагмента антитела.
[0095] Термин «KA» (М-1 или 1/М) относится к равновесной константе ассоциации конкретного взаимодействия антитело-антиген или равновесной константе скорости ассоциации связывания антитела или связывающего фрагмента антитела. Равновесную константу ассоциации получают путем деления ka на kd.
[0096] Термин «ЕС50» или «ЕС50» относится к полумаксимальной эффективной концентрации, которая включает концентрацию антитела, которая вызывает половинный ответ между исходным уровнем и максимумом после указанного времени воздействия. ЕС50 фактически представляет концентрацию антитела, при которой наблюдается 50% от его максимального эффекта. В некоторых вариантах осуществления значение ЕС50 равно концентрации антитела, раскрытого в данном документе, которая дает полумаксимальное связывание с клетками, экспрессирующими CD3 или опухолеассоциированный антиген, как определено, например, с помощью анализа связывания FACS. Таким образом, сниженное или более слабое связывание наблюдается при повышенном значении ЕС50 или полумаксимальной эффективной концентрации.
[0097] В одном варианте осуществления уменьшенное связывание можно определить как повышение концентрации антитела ЕС50, которая обеспечивает связывание с полумаксимальным количеством целевых клеток.
[0098] В другом варианте осуществления значение ЕС50 представляет концентрацию антитела, которая вызывает полумаксимальное истощение целевых клеток за счет цитотоксической активности Т-клеток. Таким образом, повышенная цитотоксическая активность (например, опосредованное Т-клетками уничтожение опухолевых клеток) наблюдается при уменьшенном значении ЕС50 или полумаксимальной эффективной концентрации.
Биспецифические антигенсвязывающие молекулы
[0099] Используемые в данном документе антитела могут быть моноспецифическими, биспецифическими или полиспецифическими. Полиспецифические антитела могут быть специфичными к разным эпитопам одного целевого полипептида или могут содержать антигенсвязывающие домены, специфические в отношении более чем одного целевого полипептида. См., например, Tutt et al., 1991, J. Immunol. 147:60 69; Kufer et al., 2004, Trends Biotechnol. 22:238-244. Биспецифические антитела к MUC16/CD3, применимые в данном документе, могут быть связаны или экспрессированы совместно с другой функциональной молекулой, например с другим пептидом или белком. Например, антитело или его фрагмент могут быть функционально соединены (например, посредством образования химической связи, генетического слияния, нековалентной ассоциации или иным образом) с одним или более другими молекулярными объектами, такими как другое антитело или фрагмент антитела, с получением биспецифического или полиспецифического антитела со второй или дополнительной специфичностью связывания.
[00100] Подразумевается, что использование в данном документе выражения «антитело к CD3» или «антитело к MUC16» включает как моноспецифические антитела к CD3 или антитела к MUC16, так и биспецифические антитела, содержащие CD3-связывающее плечо и MUC16-связывающее плечо. Таким образом, настоящее изобретение включает моноспецифические антитела, который связывают MUC16, например антитела к MUC16, описанные в U.S. 2018/0112001. Иллюстративные антитела к MUC16 включают антитело Н1Н8767Р и антитела, содержащие CDR в пределах антитела Н1Н8767Р, раскрытого в U.S. 2018/0112001. Кроме того, настоящее изобретение включает биспецифические антитела, в которых одно плечо иммуноглобулина связывает CD3 человека, а другое плечо иммуноглобулина является специфическим в отношении MUC16 человека. Иллюстративные последовательности биспецифического антитела, применимого в соответствии со способами, представленными в данном документе, показаны в таблице 1.
[00101] В определенных вариантах осуществления CD3-связывающее плечо связывается с CD3 человека и индуцирует активацию человеческих Т-клеток. В определенных вариантах осуществления CD3-связывающее плечо слабо связывается с CD3 человека и индуцирует активацию человеческих Т-клеток. В других вариантах осуществления CD3-связывающее плечо слабо связывается с CD3 человека и индуцирует уничтожение клеток, экспрессирующих опухолеассоциированных антиген, в рамках биспецифического или полиспецифического антитела. В других вариантах осуществления CD3-связывающее плечо связывается или слабо ассоциирует с CD3 человека и яванского макака (обезьяны), при этом связывающее взаимодействие не обнаруживается с помощью анализов in vitro, известных в данной области техники.
[00102] Согласно определенным иллюстративным вариантам осуществления настоящее изобретение включает биспецифические антигенсвязывающие молекулы, которые специфически связывают CD3 и MUC16. Такие молекулы могут обозначаться в данном документе, например, как «биспецифические молекулы к CD3/MUC16» или «биспецифические молекулы к CD3xMUC16» или «CD3xMUC16» или с помощью других аналогичных терминов (например антитело к MUC16/антитело к CD3).
[00103] Используемый в данном документе термин «MUC16» относится к белку MUC16 человека, если не указано, что он происходит из вида, отличного от человека (например, «MUC16 мыши», «MUC16 обезьяны» и т.д.).
[00104] Вышеупомянутые биспецифические антигенсвязывающие молекулы, которые специфически связывают CD3 и MUC16, могут содержать антиген связывающую молекулу к CD3, которая связывается с CD3 со слабой аффинностью связывания, например характеризуется KD, составляющей более чем приблизительно 40 нМ, как измерено посредством анализа аффинности связывания in vitro.
[00105] Используемое в данном документе выражение «антигенсвязывающая молекула» означает белок, полипептид или молекулярный комплекс, содержащий или состоящий из по меньшей мере одной определяющей комплементарность области (CDR), которая отдельно или в комбинации с одной или более дополнительными CDR и/или каркасными областями (FR), специфически связывается с конкретным антигеном. В определенных вариантах осуществления антигенсвязывающая молекула представляет собой антитело или фрагмент антитела в том качестве, как эти термины определены в другом разделе в данном документе.
[00106] Используемое в данном документе выражение «биспецифическая антиген связывающая молекула» означает белок, полипептид или молекулярный комплекс, содержащий по меньшей мере первый антигенсвязывающий домен и второй антигенсвязывающий домен. Каждый антигенсвязывающий домен в пределах биспецифической антигенсвязывающей молекулы содержит по меньшей мере одну CDR, которая отдельно или в комбинации с одной или более дополнительными CDR и/или FR специфически связывается с конкретным антигеном. В контексте настоящего изобретения первый антигенсвязывающий домен специфически связывает первый антиген (например CD3), а второй антигенсвязывающий домен специфически связывает второй, другой антиген (например MUC16).
[00107] В определенных иллюстративных вариантах осуществления биспецифическая антигенсвязывающая молекула представляет собой биспецифическое антитело. Каждый антигенсвязывающий домен биспецифического антитела содержит вариабельный домен тяжелой цепи (HCVR) и вариабельный домен легкой цепи (LCVR). В рамках биспецифической антигенсвязывающей молекулы, содержащей первый и второй антигенсвязывающий домен (например, биспецифического антитела), CDR первого антигенсвязывающего домена могут обозначаться с помощью префикса «А1», а CDR второго антигенсвязывающего домена могут обозначаться с помощью префикса «А2». Таким образом, CDR первого антигенсвязывающего домена могут обозначаться в данном документе как А1-HCDR1, A1-HCDR2 и A1-HCDR3; a CDR второго антигенсвязывающего домена могут обозначаться в данном документе как A2-HCDR1, A2-HCDR2 и A2-HCDR3.
[00108] Первый антигенсвязывающий домен и второй антигенсвязывающий домен могут быть прямо или опосредованно соединены друг с другом с образованием биспецифической антигенсвязывающей молекулы, применимой в данном документе. В качестве альтернативы каждый из первого антигенсвязывающего домена и второго антигенсвязывающего домена могут быть соединены с отдельным доменом мультимеризации. Ассоциация одного домена мультимеризации с другим доменом мультимеризации облегчает ассоциацию между двумя антигенсвязывающими доменами, за счет чего образуется биспецифическая антигенсвязывающая молекула. Используемый в данном документе «домен мультимеризации» подразумевает любую макромолекулу, белок, полипептид, пептид или аминокислоту, которые характеризуются способностью ассоциировать с вторым доменом мультимеризации с такой же или подобной структурой или составом. Например, домен мультимеризации может представлять собой полипептид, содержащий домен CH3 иммуноглобулина. Неограничивающим примером компонента мультимеризации является Fc-часть иммуноглобулина (содержащая домен CH2-CH3), например, Fc-домен IgG, выбранного из изотипов IgG1, IgG2, IgG3 и IgG4, а также любого аллотипа в пределах каждой изотипической группы.
[00109] Биспецифические антигенсвязывающие молекулы, применимые в данном документе, как правило, содержат два домена мультимеризации, например, два Fc-домена, каждый из которых по отдельности является частью отдельной тяжелой цепи антитела. Первый и второй домены мультимеризации могут относиться к одному и тому же изотипу IgG, такому как, например, IgG1/IgG1, IgG2/IgG2, IgG4/IgG4. В качестве альтернативы первый и второй домены мультимеризации могут относиться к разным изотипам IgG, таким как, например, IgG1/IgG2, IgG1/IgG4, IgG2/IgG4 и т.д.
[00110] В определенных вариантах осуществления домен мультимеризации представляет собой Fc-фрагмент или аминокислотную последовательность длиной от 1 до приблизительно 200 аминокислот, содержащую по меньшей мере один остаток цистеина. В других вариантах осуществления домен мультимеризации представляет собой остаток цистеина или короткий цистеинсодержащий пептид. Другие домены мультимеризации включают пептиды или полипептиды, содержащие лейциновую застежку, мотив спираль-петля или мотив суперспираль, или состоящие из них.
[00111] Любой формат биспецифического антитела или технологию можно использовать для получения биспецифических антиген связывающих молекул, применимых в данном документе. Например, антитело или его фрагмент, характеризующиеся первой антигенсвязывающей специфичностью, можно функционально связать (например, путем образования химического связи, генетического слияния, нековалентной ассоциации или иным образом) с одним или более другими молекулярными объектами, такими как другое антитело или фрагмент антитела, характеризующиеся второй антигенсвязывающей специфичностью, с получением биспецифической антигенсвязывающей молекулы. Конкретные иллюстративные биспецифические форматы, которые можно использовать в контексте настоящего изобретения, включают без ограничения, например, биспецифические форматы на основе scFv или диател, слияния IgG-scFv, двойной вариабельный домен (DVD)-Ig, квадрому, «выступы-в углубления», общую легкую цепь (например, общую легкую цепь со структурой «выступы-в-углубления» и т.п.), CrossMab, CrossFab, (SEED)-антитело, «лейциновую застежку», дуотело, IgG1/IgG2, Fab(DAF)-IgG двойного действия и биспецифические форматы Mab2 (обзор вышеизложенных форматов см., например, в Klein et al. 2012, mAbs 4:6, 1-11, и цитируемых в нем ссылках).
[00112] В контексте биспецифических антигенсвязывающих молекул, применимых в данном документе, домены мультимеризации, например, Fc-домены, могут содержать одно или более аминокислотных изменений (например, вставки, делеции или замены) по сравнению со встречающейся в природе версией Fc-домена дикого типа. Например, настоящее изобретение включает биспецифические антигенсвязывающие молекулы, содержащие одну или более модификаций в Fc-домене, которые приводят к получению модифицированного Fc-домена, характеризующегося модифицированным взаимодействием связывания (например, усиленным или ослабленным) между Fc и FcRn. В одном варианте осуществления биспецифическая антигенсвязывающая молекула содержит модификацию в области CH2 или CH3, где модификация увеличивает аффинность Fc-домена в отношении FcRn в кислой среде (например, в эндосоме, где рН находится в диапазоне от приблизительно 5,5 до приблизительно 6.0). Неограничивающие примеры таких модификаций Fc включают, например, модификацию в положении 250 (например, Е или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т), или модификацию в положении 428 и/или 433 (например, L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428, или модификацию в положении 307 или 308 (например, 308F, V308F) и 434. В одном варианте осуществления модификация включает модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 2591 (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L (например, T250Q и M428L) и модификацию 307 и/или 308 (например, 308F или 308Р).
[00113] В настоящее изобретение также включены биспецифические антигенсвязывающие молекулы, содержащие домен CH3 первого Ig и домен CH3 второго Ig, где домены CH3 первого и второй Ig отличаются друг от друга по меньшей мере одной аминокислотой, и где отличие в по меньшей мере одной аминокислоте снижает связывание биспецифического антитела с белком А по сравнению с биспецифическим антителом, в котором отсутствует аминокислотное отличие. В одном варианте осуществления домен CH3 первого Ig связывает белок А, а домен CH3 второго Ig содержит мутацию, которая ослабляет или устраняет связывание белка А, такую как модификация H95R (согласно нумерации экзонов IMGT; H435R согласно нумерации EU). Второй CH3 может дополнительно содержать модификацию Y96F (согласно IMGT; Y436F согласно EU). См., например, патент США №8586713. Дополнительные модификации, которые могут встречаться в пределах второго CH3, включают: D16E, L18M, N44S, K52N, V57M и V82I (согласно IMGT; D356E, L358M, N384S, K392N, V397M и V422I согласно EU) в случае антител IgG1; N44S, K52N и V82I (IMGT; N384S, K392N и V422I согласно EU) в случае антител IgG2, а также Q15R, N44S, K52N, V57M, R69K, E79Q и V82I (согласно IMGT; Q355R, N384S, K392N, V397M, R409K, E419Q и V422I согласно EU) в случае антител IgG4.
[00114] В определенных вариантах осуществления Fc-домен может быть химерным, объединяющим последовательности Fc, полученные из более чем одного изотипа иммуноглобулина. Например, химерный Fc-домен может содержать часть или всю последовательность CH2, полученную из области CH2 IgG1 человека, IgG2 человека или IgG4 человека, и часть или всю последовательность CH3, полученную из IgG1 человека, IgG2 человека или IgG4 человека. Химерный Fc-домен также может содержать химерную шарнирную область. Например, химерный шарнир может содержать «верхнюю шарнирную» последовательность, полученную из шарнирной области IgG1 человека, IgG2 человека или IgG4 человека, в комбинации с «нижней шарнирной» последовательностью, полученной из шарнирной области IgG1 человека, IgG2 человека или IgG4 человека. Конкретный пример химерного Fc-домена, который может быть включен в любую из антигенсвязывающих молекул, изложенных в данном документе, содержит от N- к С-концу: [CH1 IgG4] - [верхний шарнир IgG4] -[нижний шарнир IgG2] - [СН2 IgG4] - [СН3 IgG4]. Другой пример химерного Fc-домена, который может быть включен в любую из антигенсвязывающих молекул, изложенных в данном документе, содержит от N- к С-концу: [CH1 IgG1] - [верхний шарнир IgG1] - [нижний шарнир IgG2] - [СН2 IgG4] - [СН3 IgG1]. Эти и другие примеры химерных Fc-доменов, которые могут быть включены в любую из антигенсвязывающих молекул, применимых в данном документе, описаны в публикации заявки на патент США 2014/0243504, опубликованной 28 августа 2014 г., которая включена в данный документ во всей своей полноте. Химерные Fc-домены, содержащие эти общие структурные схемы и их варианты, могут характеризоваться измененным связыванием с Fc-рецептором, что, в свою очередь, влияет на эффекторную функцию Fc.
рН-зависимое связывание
[00115] Настоящее изобретение включает антитела к MUC16 и биспецифические антигенсвязывающие молекулы к CD3/MUC16 с рН-зависимыми характеристиками связывания. Например, плечо к MUC16 биспецифической антигенсвязывающей молекулы, применимой в данном документе, может проявлять сниженное связывание с MUC16 при кислом рН по сравнению со связыванием при нейтральном рН. В качестве альтернативы, биспецифические антигенсвязывающие молекулы к CD3/MUC16, применимые в данном документе, могут проявлять усиленное связывание с MUC16 при кислом рН по сравнению со связыванием при нейтральном рН. Выражение «кислый рН» включает значения рН, составляющие менее приблизительно 6,2, например, приблизительно 6,0, 5,95, 5,9, 5,85, 5,8, 5,75, 5,7, 5,65, 5,6, 5,55, 5,5, 5,45, 5,4, 5,35, 5,3, 5,25, 5,2, 5,15, 5,1, 5,05, 5,0 или меньше. Используемое в данном документе выражение «нейтральный рН» означает рН, составляющий от приблизительно 7,0 до приблизительно 7,4. Выражение «нейтральный рН» включает значения рН, составляющие приблизительно 7,0, 7,05, 7,1, 7,15, 7,2, 7,25, 7,3, 7,35 и 7,4.
[00116] В некоторых случаях «сниженное связывание … при кислом рН по сравнению со связыванием при нейтральном рН» выражают в виде отношения значения KD связывания антитела с его антигеном при кислом рН к значению KD связывания антитела с его антигеном при нейтральном рН (или наоборот). Например, антитело или его антигенсвязывающий фрагмент можно рассматривать как характеризующиеся «пониженным связыванием с MUC16 при кислом рН по сравнению с нейтральным рН» для целей настоящего изобретения, если антитело или его антигенсвязывающий фрагмент характеризуются соотношением KD при кислом/нейтральном рН, составляющим приблизительно 3,0 или больше. В определенных иллюстративных вариантах осуществления отношение KD при кислых/нейтральных условиях для антитела или антигенсвязывающего фрагмента может составлять приблизительно 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5, 10,0, 10,5, 11,0, 11,5, 12,0, 12,5, 13,0, 13,5, 14,0, 14,5, 15,0, 20,0, 25,0, 30,0, 40,0, 50,0, 60,0, 70,0, 100,0 или больше.
[00117] Антитела с рН-зависимыми характеристиками связывания можно получить, например, путем скрининга группы антител в отношении сниженного (или усиленного) связывания с конкретным антигеном при кислом рН по сравнению с нейтральным рН. Кроме того, модификации антигенсвязывающего домена на уровне аминокислот могут давать антитела с рН-зависимыми характеристиками. Например, путем замены одной или более аминокислот антигенсвязывающего домена (например, в пределах CDR) на остаток гистидина можно получить антитело со сниженной антигенсвязывающей способностью при кислом рН по сравнению с нейтральным рН.
Антитела, содержащие варианты Fc
[00118] Согласно определенным вариантам осуществления, применимым в данном документе, предусмотрены антитела к MUC16 и биспецифические антигенсвязывающие молекулы к CD3/MUC16, содержащие Fc-домен, содержащий одну или более мутаций, которые усиливают или ослабляют связывание антитела с FcRn-рецептором, например при кислом рН по сравнению с нейтральным рН. Например, в настоящее изобретение включены антитела, содержащие мутацию в области CH2- или CH3 Fc-домена, где мутация(-и) обеспечивает(-ют) повышение аффинности Fc-домена в отношении FcRn в кислой среде (например, в эндосоме, где значение рН находится в диапазоне от приблизительно 5,5 до приблизительно 6,0). Результатом таких мутаций может быть увеличение периода полужизни антитела в сыворотке крови при введении животному. Неограничивающие примеры таких модификаций Fc включают, например, модификацию в положении 250 (например, Е или Q); 250 и 428 (например, L или F); 252 (например, L/Y/F/W или Т), 254 (например, S или Т) и 256 (например, S/R/Q/E/D или Т), или модификацию в положении 428 и/или 433 (например, H/L/R/S/P/Q или K) и/или 434 (например, H/F или Y); или модификацию в положении 250 и/или 428, или модификацию в положении 307 или 308 (например, 308F, V308F) и 434. В одном варианте осуществления модификация включает модификацию 428L (например, M428L) и 434S (например, N434S); модификацию 428L, 2591 (например, V259I) и 308F (например, V308F); модификацию 433K (например, H433K) и 434 (например, 434Y); модификацию 252, 254 и 256 (например, 252Y, 254Т и 256Е); модификацию 250Q и 428L (например, T250Q и M428L) и модификацию 307 и/или 308 (например, 308F или 308Р).
[00119] Например, настоящее изобретение включает антитела к MUC16 и биспецифические антигенсвязывающие молекулы к CD3/MUC16, содержащие Fc-домен, содержащий одну или более пар или групп мутаций, выбранных из группы, состоящей из: 250Q и 248L (например, T250Q и M248L); 252Y, 254Т и 256Е (например, M252Y, S254T и Т256Е); 428L и 434S (например, M428L и N434S); а также 433K и 434F (например, H433K и N434F). Объемом настоящего изобретения предусмотрены все возможные комбинации вышеупомянутых мутаций в Fc-домене и другие мутации в пределах вариабельных доменов антитела, раскрытых в данном документе.
Биологические характеристики биспецифических антигенсвязывающих молекул
[00120] Согласно настоящему изобретению применимы моноспецифические и биспецифические антитела и их антигенсвязывающие фрагменты, которые связывают CD3-экспрессирующие Т-клетки человека и/или MUC16-экспрессирующие Т-клетки человека с высокой аффинностью (например при значениях KD на субнаномолярном уровне). Такие антитела и их свойства раскрыты в публикации США №2018/0112001, включенной в данный документ посредством ссылки. Такие биспецифические антитела особенно применимы в комбинации с агонистом 4-1ВВ при лечении опухолей.
[00121] В данном документе применимы антитела к MUC16 и биспецифические антигенсвязывающие молекулы к CD3/MUC16, которые проявляют одну или более характеристик, выбранных из группы, состоящей из: (а) подавления опухолевого роста у мышей с ослабленным иммунитетом, несущих ксенотрансплантаты рака яичника человека; и (b); супрессии опухолевого роста сформировавшихся опухолей у мышей с ослабленным иммунитетом, несущих ксенотрансплантаты рака яичника человека (см., например, публикацию США №2018/0112001, пример 8).
[00122] В данном документе применимы антитела и их антигенсвязывающие фрагменты, которые связывают CD3 человека со средней или низкой аффинностью, в зависимости от терапевтического контекста и конкретных свойств нацеливания, которые необходимы. Например, в контексте биспецифической антигенсвязывающей молекулы, где одно плечо связывает CD3, а другое плечо связывает целевой антиген (например MUC16), может быть необходимо, чтобы плечо, связывающее целевой антиген, связывало целевой антиген с высокой аффинностью, в то время как плечо к CD3 связывало CD3 с умеренной или низкой аффинностью. Таким образом, может достигаться предпочтительное нацеливание антигенсвязывающей молекулы на клетки, экспрессирующие целевой антиген, при одновременном предотвращении общего/нецелевого связывания CD3 и последующих нежелательных побочных эффектов, ассоциированных с этим.
[00123] Биспецифические антигенсвязывающие молекулы (например биспецифические антитела), применимые в данном документе, способны одновременно связываться с CD3 человека и MUC16 человека. Связывающее плечо, которое взаимодействует с клетками, экспрессирующими CD3, может характеризоваться слабым или не обнаруживаемым связыванием, как измерено в подходящем анализе связывания in vitro. Степень, с которой биспецифическая антиген связывающая молекула связывает клетки, которые экспрессируют CD3 и/или MUC 16, можно оценить посредством сортировки флуоресцентно-активированных клеток (FACS), как проиллюстрировано в U.S. 2018/0112001, пример 5.
[00124] Например, в данном документе применимы биспецифические антитела, которые специфически связывают линии Т-клеток человека, которые экспрессируют CD3, но не экспрессируют MUC16, например Jurkat и/или Т-клетки приматов (например мононуклеарные клетки периферической крови яванского макака [РВМС]). Также в данном документе применимы биспецифические антитела, которые связываются с MUC16-экспрессирующими клетками и линиями клеток со значением ЕС50, составляющим 7 нМ (7×10-9) или меньше, как определено с применением анализа связывания FACS, изложенного в публикации США №2018/0112001, пример 5, или по сути аналогичного анализа.
[00125] В некоторых аспектах биспецифические антитела связывают CD3 человека со слабой (т.е. низкой) аффинностью или даже без обнаруживаемой аффинности. В соответствии с определенными вариантами осуществления в настоящее изобретение включены антитела и антигенсвязывающие фрагменты антител, которые связывают CD3 человека (например, при 37°С) с KD, составляющей более чем приблизительно 11 нМ, как измерено с помощью поверхностного плазмонного резонанса.
[00126] В некоторых аспектах биспецифические антитела связывают CD3 обезьяны (например, яванского макака) со слабой (т.е. низкой) аффинностью или даже без обнаруживаемой аффинности.
[00127] В некоторых аспектах биспецифические антитела связывают CD3 человека и индуцируют активацию Т-клеток. Например, определенные антитела к CD3 индуцируют активацию человеческих Т-клеток при значении ЕС50, составляющем менее приблизительно 113 пМ, как измерено с помощью анализа активации Т-клеток in vitro.
[00128] Биспецифические антитела, применимые в данном документе, могут связывать CD3 человека и индуцировать опосредованное Т-клетками уничтожение опухолевых клеток, экспрессирующих антиген. Например, в настоящее изобретение включены биспецифические антитела, которые индуцируют опосредованное Т-клетками уничтожение опухолевых клеток при ЕС50, составляющей менее приблизительно 1,3 нМ, как измерено в анализе опосредованного Т-клетками уничтожения опухолевых клеток in vitro.
[00129] Биспецифические антитела, применимые в данном документе, могут связывать CD3 с диссоциативным периодом полужизни (t½), составляющим менее приблизительно 10 минут, как измерено с помощью поверхностного плазмонного резонанса при 25°С или 37°С.
[00130] Биспецифические антигенсвязывающие молекулы к CD3/MUC16, применимые в данном документе, могут дополнительно проявлять одну или более характеристик, выбранных из группы, состоящей из: (а) индукции пролиферации РВМС in vitro; (b) активации Т-клеток посредством индукции высвобождения IFN-гамма и положительной регуляции CD25 в цельной крови человека, и (с) индукции опосредованной Т-клетками цитотоксичности в отношении опухолевых клеток, экспрессирующих MUC16.
[00131] Настоящее изобретение включает биспецифические антигенсвязывающие молекулы к CD3/MUC16, которые способны истощать клетки, экспрессирующие опухолевый антиген, у субъекта (см., например, публикацию США №2018/0112001, пример 8). Например, согласно определенным вариантам осуществления предусмотрены биспецифические антигенсвязывающие молекулы к CD3/MUC16, где однократное введение биспецифической антигенсвязывающей молекулы субъекту (например в дозе, составляющей приблизительно 5,0 мг/кг, приблизительно 0,1 мг/кг, приблизительно 0,08 мг/кг, приблизительно 0,06 мг/кг, приблизительно 0,04 мг/кг, приблизительно 0,02 мг/кг, приблизительно 0,01 мг/кг или меньше) вызывает снижение количества MUC16-экспрессирующих клеток у субъекта (например опухолевый рост у субъекта супрессируется или подавляется) ниже выявляемых уровней. Если не указано иное, интенсивность биолюминесцентного излучения относится к [ф/с/см22/ср].
[00132] В определенных вариантах осуществления однократное введение биспецифической антигенсвязывающей молекулы к CD3/MUC16 в дозе, составляющей приблизительно 0,4 мг/кг, вызывает снижение опухолевого роста у субъекта ниже выявляемых уровней в приблизительно день 7, приблизительно день 6, приблизительно день 5, приблизительно день 4, приблизительно день 3, приблизительно день 2 или приблизительно день 1 после введения субъекту биспецифической антигенсвязывающей молекулы. Согласно определенным вариантам осуществления однократное введение биспецифической антигенсвязывающей молекулы к CD3/MUC16, раскрытой в данном документе, в дозе, составляющей по меньшей мере приблизительно 0,01 мг/кг, например по меньшей мере приблизительно 85 мкг/кг или по меньшей мере приблизительно 100 мкг/кг, приводит к тому, что количество MUC16-экспрессирующих опухолевых клеток остается ниже выявляемых уровней до по меньшей мере приблизительно 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней, 15 дней, 16 дней, 17 дней после введения или больше. Используемое в данном документе выражение «ниже выявляемых уровней» означает, что опухолевые клетки не могут быть непосредственно или опосредованно выявлены как растущие подкожно у субъекта с применением стандартных методов измерения штангенциркулем, например, как изложено в публикации США №2018/0112001, пример 8.
[00133] Также согласно способам, предусмотренным в данном документе, применимы биспецифические антигенсвязывающие молекулы к CD3/MUC16, которые проявляют одну или более характеристик, выбранных из группы, состоящей из: (а) подавления опухолевого роста у мышей с ослабленным иммунитетом, несущих ксенотрансплантаты рака яичника человека; (b) подавления опухолевого роста у иммунокомпетентных мышей, несущих ксенотрансплантаты рака яичника человека; (c) супрессии опухолевого роста сформировавшихся опухолей у мышей с ослабленным иммунитетом, несущих ксенотрансплантаты рака яичника человека; и (d) снижения опухолевого роста сформировавшихся опухолей у иммунокомпетентных мышей, несущих ксенотрансплантаты рака яичника человека (см., например, публикацию США №2018/0112001, пример 8). Иллюстративный биспецифические антигенсвязывающие молекулы к CD3/MUC16 могут дополнительно проявлять одну или более характеристик, выбранных из группы, состоящей из: (а) индукции временного дозозависимого повышения уровней циркулирующих цитокинов, (b) индукции временного повышения уровней циркулирующих Т-клеток и (с) отсутствия истощения эффекторных Т клеток (например, CD4+ Т-клеток, CD8+ Т-клеток и регуляторных Т-клеток, т.е. Treg).
[00134] Также согласно способам, предусмотренным в данном документе, применимы конъюгаты антитела к MUC16 и лекарственного средства, включая конъюгаты биспецифической антигенсвязывающей молекулы kMUC16xCD3 и лекарственного средства, которые подавляют опухолевый рост в MUC16-положительных моделях ксенотрансплантата рака яичника in vivo (см., например, U.S. 2018/0112001, пример 10, в анализе с биолюминесцентной визуализацией или в по сути подобном анализе).
Эпитопное картирование и родственные технологии
[00135] Эпитоп на CD3 и/или MUC16, с которым связываются антигенсвязывающие молекулы, применимые в данном документе, может состоять из одной непрерывной последовательности из 3 или более (например, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более) аминокислот белка CD3 или MUC16. В качестве альтернативы, эпитоп может состоять из множества несмежных аминокислот (или аминокислотных последовательностей) CD3 или MUC16. Антитела, применимые в соответствии со способами, раскрытыми в данном документе, могут взаимодействовать с аминокислотами, содержащимися в пределах одной цепи CD3 (например, CD3-эпсилон, CD3-дельта или CD3-гамма), или могут взаимодействовать с аминокислотами в двух или более различных цепях CD3. Используемый в данном документе термин «эпитоп» относится к антигенной детерминанте, которая взаимодействует со специфическим антигенсвязывающим сайтом в вариабельной области молекулы антитела, известным как паратоп. Один антиген может содержать более чем один эпитоп. Таким образом, различные антитела могут связываться с различными зонами на антигене и могут оказывать различные биологические эффекты. Эпитопы могут быть конформационными или линейными. Конформационный эпитоп образуют аминокислоты из разных сегментов линейной полипептидной цепи, располагающиеся рядом в пространстве. Линейный эпитоп представляет собой эпитоп, образуемый смежными аминокислотными остатками в полипептидной цепи. В определенных обстоятельствах эпитоп может содержать фрагменты сахаридов, фосфорильные группы или сульфонильные группы в антигене.
[00136] Разные методики, известные специалистам средней квалификации в данной области техники, можно использовать для определения «взаимодействует ли антиген связывающий домен антитела с одной или более аминокислотами» в пределах полипептида или белка. Иллюстративные методики включают, например, традиционный анализ перекрестного блокирования, такой как описано в Antibodies, Harlow and Lane (Cold Spring Harbor Press, Cold Spring Harb., NY), аланин-сканирующий мутационный анализ, анализ на основе пептидного блоттинга (Reineke, 2004, Methods Mol Biol 248: 443-463) и анализ пептидного расщепления. Кроме того, можно использовать такие способы, как вырезание эпитопа, выделение эпитопа и химическая модификация антигенов (Tomer, 2000, Protein Science 9:487-496). Другим способом, который можно использовать для идентификации в пределах полипептида аминокислот, с которыми взаимодействует антигенсвязывающий домен антитела, является водородно-дейтериевый обмен, обнаруживаемый посредством масс-спектрометрии. В общих чертах метод водородно-дейтериевого обмена включает мечение дейтерием белка, представляющего интерес, с последующим связыванием антитела с меченным дейтерием белком. Затем комплекс белок/антитело переносят в воду, чтобы обеспечить осуществление водородно-дейтериевого обмена по всем остаткам, за исключением защищенных антителом остатков (которые остаются меченными дейтерием). После диссоциации антитела целевой белок подвергают расщеплению протеазами и анализу посредством масс-спектрометрии, за счет чего выявляют меченные дейтерием остатки, которые соответствуют специфическим аминокислотам, с которыми взаимодействует антитело. См., например, Ehring (1999) Analytical Biochemistry 267(2):252-259; Engen and Smith (2001) Anal. Chem. 75:256A-265A. Для картирования эпитопа также можно использовать рентгеновскую кристаллографию комплекса антиген/антитело.
[00137] Иллюстративные биспецифические антигенсвязывающие молекулы, применимые в данном документе, могут содержать первый антигенсвязывающий домен, который специфически связывает CD3 человека и/или CD3 яванского макака с низкой или выявляемой аффинностью связывания, и второй антигенсвязывающий домен, который специфически связывает MUC16 человека, где первый антигенсвязывающий домен связывается с тем же эпитопом на CD3, что и любой из конкретных иллюстративных CD3-специфических антигенсвязывающих доменов, описанных в данном документе, и/или где второй антигенсвязывающий домен связывается с тем же эпитопом на MUC16, что и любой из конкретных иллюстративных MUC16-специфических антигенсвязывающих доменов, описанных в данном документе.
[00138] Аналогичным образом, биспецифические антигенсвязывающие молекулы, применимые в данном документе, могут содержать первый антигенсвязывающий домен, который специфически связывает CD3 человека, и второй антигенсвязывающий домен, который специфически связывает MUC16 человека, где первый антигенсвязывающий домен конкурирует за связывание с CD3 с любым из конкретных иллюстративных СО3-специфических антигенсвязывающих доменов, описанных в данном документе в таблице 1, и/или где второй антигенсвязывающий домен конкурирует за связывание с MUC16 с любым из конкретных иллюстративных MUC16-специфических антигенсвязывающих доменов, описанных в данном документе в таблице 1.
[00139] С использованием традиционных способов, известных в данной области техники, можно легко определить, связывается ли конкретная антигенсвязывающая молекула (например, антитело) или ее антигенсвязывающий домен с тем же эпитопом, что и эталонная антигенсвязывающая молекула по настоящему изобретению, или конкурирует с ней. Например, чтобы определить, связывается ли тестируемое антитело с тем же эпитопом на MUC16 (или CD3), что и эталонная биспецифическая антигенсвязывающая молекула по настоящему изобретению, сначала обеспечивается возможность связывания эталонной биспецифической молекулы с белком MUC16 (или белком CD3). Затем оценивается способность тестируемого антитела связываться с молекулой MUC16 (или CD3). Если тестируемое антитело способно связываться с MUC16 (или CD3) после насыщающего связывания с эталонной биспецифической антигенсвязывающей молекулой, можно сделать вывод, что исследуемое антитело связывается с эпитопом MUC16 (или CD3), отличным от эпитопа, с которым связывается эталонная биспецифическая антигенсвязывающая молекула. С другой стороны, если тестируемое антитело не способно связываться с молекулой MUC16 (или CD3) после насыщающего связывания с эталонной биспецифической антигенсвязывающей молекулой, то тестируемое антитело может связываться с тем же эпитопом MUC16 (или CD3), что и эпитоп, связанный эталонной биспецифической антигенсвязывающей молекулой. Затем можно провести дополнительные традиционные эксперименты (например, анализы с мутацией пептидов и анализы связывания) для того, чтобы подтвердить, действительно ли наблюдаемое отсутствие связывания тестируемого антитела обусловлено связыванием с тем же эпитопом, с которым связывается эталонная биспецифическая антигенсвязывающая молекула, или что причиной отсутствия наблюдаемого связывания является стерическое блокирование (или другое явление). Эксперименты такого типа можно проводить с применением ELISA, PJA, Biacore, проточной цитометрии или любого другого количественного или качественного анализа связывания антитела, доступного в данной области техники. В соответствии с определенными вариантами осуществления настоящего изобретения два антиген связывающих белка связываются с одним и тем же (или перекрывающимся) эпитопом, если, например, 1-, 5-, 10-, 20- или 100-кратный избыток одного антигенсвязывающего белка подавляет связывание другого на по меньшей мере 50%, но предпочтительно 75%, 90% или даже 99%, как измерено в анализе конкурентного связывания (см., например, Junghans et al., Cancer Res. 1990:50:1495-1502). В качестве альтернативы, считается, что два антигенсвязывающих белка связываются с одним и тем же эпитопом, если практически все аминокислотные мутации в антигене, которые ослабляют или устраняют связывание одного антигенсвязывающего белка, ослабляют или устраняют связывание другого. Считается, что два антигенсвязывающих белка имеют «перекрывающиеся эпитопы», если только часть аминокислотных мутаций, которые ослабляют или устраняют связывание одного антигенсвязывающего белка, ослабляют или устраняют связывание другого.
[00140] Для определения того, конкурирует ли антитело или антигенсвязывающий домен за связывание с эталонной антигенсвязывающей молекулой, описанную выше методику связывания выполняют в двух направлениях. В первом направлении обеспечивается возможность связывания эталонной антигенсвязывающей молекулы с белком MUC16 (или белком CD3) в условиях насыщения с последующей оценкой связывания тестируемого антитела с молекулой MUC16 (или CD3). Во втором направлении обеспечивается возможность связывания тестируемого антитела с молекулой MUC16 (или CD3) в условиях насыщения с последующей оценкой связывания эталонной антигенсвязывающей молекулы с молекулой MUC16 (или CD3). Если в обоих направлениях только первая (насыщающая) антигенсвязывающая молекула способна к связыванию с молекулой MUC16 (или CD3), то делается заключение, что тестируемое антитело и эталонная антигенсвязывающая молекула конкурируют за связывание с MUC16 (или CD3). Специалисту средней квалификации в данной области техники будет понятно, что антитело, которое конкурирует за связывание с эталонной антигенсвязывающей молекулой, необязательно должно связываться с тем же эпитопом, что и эталонное антитело, но может стерически блокировать связывание эталонного антитела за счет связывания перекрывающегося или смежного эпитопа.
Получение антигенсвязывающих доменов и конструирование биспецифических молекул
[00141] Антигенсвязывающие домены, специфические в отношении конкретных антигенов, можно получать с помощью любой технологии получения антител, известной в данной области техники. После получения два разных антигенсвязывающих домена, специфических в отношении двух разных антигенов (например CD3 и MUC16), можно соответствующим образом расположить относительно друг друга с получением биспецифической антигенсвязывающей молекулы с применением традиционных способов. (Обсуждение иллюстративных форматов биспецифических антител, которые можно использовать для конструирования биспецифических антигенсвязывающих молекул по настоящему изобретению, приведено в другом разделе в данном документе). В определенных вариантах осуществления один или более отдельных компонентов (например, тяжелая и легкая цепи) полиспецифических антигенсвязывающих молекул получены из химерных, гуманизированных или полностью человеческих антител. Способы получения таких антител хорошо известны в данной области техники. Например, одну или более тяжелых и/или легких цепей биспецифических антигенсвязывающих молекул, применимых в данном документе, можно получить с использованием технологии VELOCIMMUNE™. С применением технологии VELOCIMMUNE™ (см., например, US 6596541, Regeneron Pharmaceuticals, VELOCIMMUNE® или любую другую технологию получения человеческих антител) первоначально выделяются химерные высокоаффинные антитела к конкретному антигену (например CD3 или MUC16), содержащие человеческую вариабельную область и мышиную константную область. Антитела подвергают анализу и отбирают по необходимым характеристикам, в том числе аффинности, селективности, эпитопу и т.д. Мышиные константные области заменяют необходимой человеческой константной областью для получения полностью человеческих тяжелых и/или легких цепей, которые могут быть включены в биспецифические антигенсвязывающие молекулы, применимые в данном документе.
[00142] Сконструированных с помощью генной инженерии животных можно использовать для получения человеческих биспецифических антигенсвязывающих молекул. Например, можно использовать генетически модифицированную мышь, у которой отсутствует способность осуществлять реаранжировку и экспрессию эндогенной последовательности вариабельной области легкой цепи иммуноглобулина мыши, при этом мышь экспрессирует только один или два вариабельных домена человеческой легкой цепи, кодируемые последовательностями иммуноглобулина человека, функционально связанные с геном мышиной константной области каппа-цепи в эндогенном локусе мышиной каппа-цепи. Таких генетически модифицированных мышей можно использовать для получения полностью человеческих биспецифических антигенсвязывающих молекул, содержащих две разные тяжелые цепи, которые ассоциируют с идентичной легкой цепью, которая содержит вариабельный домен, полученный из одного из двух различных генных сегментов вариабельной области человеческой легкой цепи. (Подробное обсуждение таких полученным методами генной инженерии мышей и их применение для получения биспецифических антигенсвязывающих молекул см., например, в патенте США №10143186).
Биоэквиваленты
[00143] Раскрытые в настоящем описании способы предполагают применение антигенсвязывающих молекул, содержащих аминокислотные последовательности, которые отличаются от последовательностей иллюстративных молекул, раскрытых в данном документе, но которые сохраняют способность связывать CD3 и/или MUC16. Такие молекулы-варианты могут содержать одно или более добавлений, делеций или замен аминокислот при сравнении с исходной последовательностью, однако проявляют биологическую активность, которая практически эквивалентна активности описанных биспецифических антигенсвязывающих молекул.
[00144] В данном документе применимы антигенсвязывающие молекулы, которые являются биоэквивалентами любой из иллюстративных антигенсвязывающих молекул, изложенных в таблице 1. Два антигенсвязывающих белка или антитела считаются биоэквивалентами, если, например, они являются фармацевтическими эквивалентами или фармацевтическими альтернативами, у которых скорость и/или степень поглощения не демонстрирует значительного отличия при введении с одинаковой молярной дозой в сходных экспериментальных условиях, как в случае однократной дозы, так и в случае нескольких доз. Некоторые антигенсвязывающие белки будут считаться эквивалентами или фармацевтическими альтернативами, если они являются эквивалентными по степени их поглощения, но не по скорости их поглощения, и все же могут считаться биоэквивалентами, поскольку такие отличия в скорости поглощения являются предусмотренными и отражены в листке-вкладыше, не являются необходимыми для достижения эффективных концентраций лекарственного средства в организме, например, при длительном применении, и считаются незначимыми с медицинской точки зрения в случае конкретного исследуемого лекарственного продукта.
[00145] В одном варианте осуществления два антигенсвязывающих белка являются биоэквивалентами, если отсутствуют клинически значимые отличия с точки зрения их безопасности, чистоты и эффективности.
[00146] В одном варианте осуществления два антигенсвязывающих белка являются биоэквивалентами, если пациента можно перевести один или более раз с эталонного продукта на биологический продукт без ожидаемого увеличения риска возникновения нежелательных эффектов, в том числе значимого с клинической точки зрения изменения иммуногенности, или уменьшения эффективности по сравнению с таковой при продолжении терапии без такого перевода.
[00147] В одном варианте осуществления два антигенсвязывающих белка являются биоэквивалентами, если они оба действуют согласно общему механизму или механизмам действия при условии или условиях применения, в том объеме, в котором такие механизмы известны.
[00148] Биоэквивалентность можно продемонстрировать с помощью способов in vivo и in vitro. Измерения степени биоэквивалентности включают, например, (а) тест на человеке или других млекопитающих in vivo, в котором концентрацию антитела или его метаболитов измеряют в крови, плазме крови, сыворотке крови или других биологических жидкостях в зависимости от времени; (b) тест in vitro, который коррелировал с данными биодоступности у человека in vivo и с достаточной точностью предсказывал их; (с) тест на человеке и других млекопитающих in vivo, в котором соответствующий ранний фармакологический эффект антитела (или его мишени) измеряют в зависимости от времени; и (d) строго контролируемое клиническое испытание, в котором устанавливают безопасность, эффективность или биодоступность или биоэквивалентность антигенсвязывающего белка.
[00149] Варианты-биоэквиваленты иллюстративных биспецифических антигенсвязывающих молекул, изложенных в данном документе, можно сконструировать с помощью, например, осуществления различных замен остатков или последовательностей, или делеции концевых или внутренних остатков или последовательностей, которые не являются необходимыми для биологической активности. Например, остатки цистеина, не являющиеся необходимыми для биологической активности, можно подвергнуть делеции или заменить другими аминокислотами для предупреждения образования при ренатурации внутримолекулярных дисульфидных мостиков, которые не являются необходимыми или являются неправильными. В других ситуациях антигенсвязывающие белки-биоэквиваленты могут включать варианты иллюстративных биспецифических антигенсвязывающих молекул, изложенных в данном документе, которые содержат аминокислотные изменения, которые модифицируют характеристики гликозилирования молекул, например мутации, которые устраняют или удаляют гликозилирование.
Видовая селективность и межвидовая перекрестная реактивность
[00150] В соответствии с определенными вариантами осуществления биспецифические антигенсвязывающие молекулы, применимые в данном документе, связываются с CD3 человека, но не с CD3 других видов. В данном документе также применимы антигенсвязывающие молекулы, которые связываются с MUC16 человека, но не с MUC16 других видов. Раскрытые в настоящем описании способы также предполагают применение биспецифических антигенсвязывающих молекул, которые связываются с CD3 человека и с CD3 одного или более видов, отличных от человека, и/или биспецифических антигенсвязывающих молекул, которые связываются с MUC16 человека и с MUC16 одного или более видов, отличных от человека.
[00151] Согласно определенным иллюстративным вариантам осуществления антигенсвязывающие молекулы, применимые в данном документе, связываются с CD3 человека и/или MUC16 человека и могут связываться или не связываться, в зависимости от конкретного случая, с одним или более из CD3 и/или MUC16 мыши, крысы, морской свинки, хомяка, песчанки, свиньи, кошки, собаки, кролика, козы, овцы, коровы, лошади, верблюда, яванского макака, мартышки, макака-резуса или шимпанзе. Например, в конкретном иллюстративном варианте осуществления настоящего изобретения предусмотрены биспецифические антигенсвязывающие молекулы, содержащие первый антигенсвязывающий домен, который связывает CD3 человека и CD3 яванского макака, и второй антигенсвязывающий домен, который специфически связывает MUC16 человека.
Меченные радиоактивной меткой иммуноконъюгаты на основе антигенсвязывающей молекулы к MUC16/CD3 для иммунной РЕТ-визуализации
[00152] В данном документе предусмотрены меченные радиоактивной меткой антигенсвязывающие белки, которые связывают MUC16 и/или CD3. В некоторых вариантах осуществления меченные радиоактивной меткой антигенсвязывающие белки предусматривают антигенсвязывающий белок, ковалентно связанный с позитронным излучателем. В некоторых вариантах осуществления меченные радиоактивной меткой антигенсвязывающие белки предусматривают антигенсвязывающий белок, ковалентно связанный с одним или более хелатообразующими фрагментами, которые представляют собой химические фрагменты, способные образовывать хелатный комплекс с позитронным излучателем.
[00153] Подходящие меченные радиоактивной меткой антигенсвязывающие белки, например меченные радиоактивной меткой антитела, включают те, которые не нарушают или по сути не нарушают функцию Т-клеток при воздействии меченного радиоактивной меткой антигенсвязывающего белка. В некоторых вариантах осуществления меченный радиоактивной меткой антигенсвязывающий белок, который связывает антигенсвязывающую молекулу к MUC16/CD3, является слабым блокатором функции CD3 Т-клеток, т.е. функция Т-клеток не нарушается или практически не нарушается при воздействии меченного радиоактивной меткой антитела. Применение меченного радиоактивной меткой CD3-связывающего белка, оказывающего минимальное влияние на опосредованную CD3 функцию Т-клеток в соответствии со способами, представленными в данном документе, гарантирует то, что субъект, подвергнутый лечению с помощью такой молекулы, не будет получать негативных эффектов вследствие неспособности его Т-клеток устранять инфекцию.
[00154] В некоторых вариантах осуществления предусмотрены антитела к MUC16 или антигенсвязывающие молекулы KMUC16/CD3, например биспецифические антитела, где указанные антигенсвязывающие белки ковалентно связаны с одним или более фрагментами, характеризующимися следующей структурой:
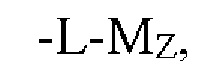
где L представляет собой хелатообразующий фрагмент, М представляет собой позитронный излучатель, и z независимо в каждом случае составляет 0 или 1, и где по меньшей мере один из z составляет 1.
[00155] В некоторых вариантах осуществления меченный радиоактивной меткой антигенсвязывающий белок представляет собой соединение формулы (I):
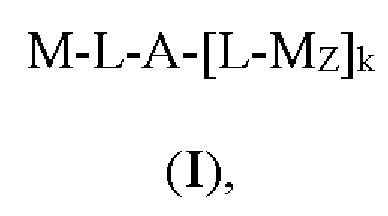
А представляет собой антитело к MUC16 или антигенсвязывающую молекулу к MUC16/CD3, L представляет собой хелатообразующий фрагмент, М представляет собой позитронный излучатель, z равняется 0 или 1, и к представляет собой целое число от 0 до 30. В некоторых вариантах осуществления к составляет 1. В некоторых вариантах осуществления к составляет 2.
[00156] В определенных вариантах осуществления меченный радиоактивной меткой антигенсвязывающий белок представляет собой соединение формулы (II):
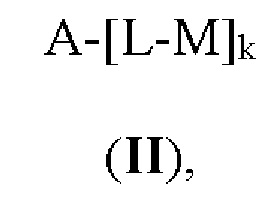
где А представляет собой антитело к MUC16 или антигенсвязывающую молекулу к MUC16/CD3, L представляет собой хелатообразующий фрагмент, М представляет собой позитронный излучатель, и к представляет собой целое число от 1 до 30.
[00157] В некоторых вариантах осуществления в данном документе представлены композиции, содержащие конъюгат, имеющий следующую структуру:
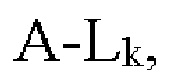
где А представляет собой антитело к MUC16 или антигенсвязывающую молекулу к MUC16/CD3, L представляет собой хелатообразующий фрагмент, и к представляет собой целое число от 1 до 30, где конъюгат образует хелатное соединение с позитронным излучателем в количестве, достаточном для обеспечения удельной активности, подходящей для клинической PET-визуализации.
[00158] Ниже представлены хелатообразующие фрагменты и позитронные излучатели.
Позитронные излучатели и хелатообразующие фрагменты
[00159] Подходящие позитронные излучатели включают без ограничения те, которые образуют стабильные комплексы с хелатообразующим фрагментом и характеризуются периодами физической полужизни, подходящими для целей иммунной РЕТ-визуализации. Иллюстративные позитронные излучатели включают без ограничения 89Zr, 68Ga, 64Cu, 44Sc и 86Y. Подходящие позитронные излучатели также включают те, которые непосредственно связываются с антителом к MUC16 или биспецифической антигенсвязывающей молекулой к MUC16/CD3, в том числе без ограничения 76Вг и 124I, и те, которые введены посредством простетической группы, например 18F.
[00160] Описанные в данном документе хелатообразующие фрагменты представляют собой химические фрагменты, которые ковалентно связаны с антителом к MUC16 или антигенсвязывающей молекулой KMUC16/CD3 и содержат часть, способную образовывать хелатное соединение с позитронным излучателем, т.е. способную реагировать с позитронным излучателем с образованием координированного хелатного комплекса. Подходящие фрагменты включают те, которые обеспечивают эффективную загрузку конкретного металла и образуют комплексы металл-хелатор, которые являются в достаточной степени стабильными in vivo для диагностических путей применения, например, для иммунной РЕТ-визуализации. Иллюстративные хелатообразующие фрагменты включают те, которые обеспечивают сведение к минимуму диссоциации позитронного излучателя и его накопление в минеральном костном веществе, белках плазмы крови и/или его отложение в костном мозге до степени, подходящей для диагностических путей применения.
[00161] Примеры хелатообразующих фрагментов включают без ограничения те, которые образуют стабильные комплексы с позитронными излучателями 89Zr, 68Ga, 64Cu, 44Sc и/или 86Y. Иллюстративные хелатообразующие фрагменты включают без ограничения фрагменты, описанные в Nature Protocols, 5(4): 739, 2010; Bioconjugate Chem., 26(12): 2579 (2015); Chem Commun (Camb), 51(12): 2301 (2015); Mol. Pharmaceutics, 12: 2142 (2015); Mol. Imaging Biol., 18: 344 (2015); Eur. J. Nucl. Med. Mol. Imaging, 37:250 (2010); Eur. J. Nucl. Med. Mol. Imaging (2016). doi:10.1007/s00259-016-3499-x; Bioconjugate Chem., 26(12): 2579 (2015); WO 2015/140212 A1 и US 5639879, которые включены посредством ссылки во всей своей полноте.
[00162] Иллюстративные хелатообразующие фрагменты также включают без ограничения те, которые содержат десферроксамин (DFO), 1,4,7,10-тетрауксусную кислоту (DOTA), диэтилентриаминпентауксусную кислоту (DTPA), этилендиаминтетрауксусную кислоту (EDTA), 1,4,7,10-тетраазациклододекан-1,4,7,10-тетра(метиленфосфоновую) кислоту (DOTP), (1R,4R,7R,10R)-α'α''α'''-тетраметил-1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTMA), 1,4,8,11-тетраазациклотетрадекан-1,4,8,11-тетрауксусную кислоту (ТЕТА), H4октапа, Н6фоспа, H2дедпа, H5декапа, H2азапа, НОРО, DO2A, 1,4,7,10-тетракис(карбамоилметил)-1,4,7,10-тетраазациклододекан (DOTAM), 1,4,7-триазациклононан-N,N,N''-триуксусную кислоту (NOTA), 1,4,7,10-тетракис(карбамоилметил)-1,4,7,10-тетраазациклододекан (DOTAM), 1,4,8,11-тетраазабицикло[6.6.2]гексадекан-4,11-дикетиновую кислоту (СВ-ТЕ2А), 1,4,7,10-тетраазациклододекан (циклен), 1,4,8,11-тетраазациклотетрадекан (циклам), октадентатные хелаторы, октадентатные бифункциональные хелатирующие средства, например, DFO*, гексадентатные хелаторы, фосфонатные хелаторы, макроциклические хелаторы, хелаторы, содержащие макроциклические терефталамидные лиганды, бифункциональные хелаторы, фузаринин С и хелаторы, которые представляют собой производные фузаринина С, триацетилфузарин С (TAFC), ферроксамин Е (FOXE), ферроксамин В (FOXB), феррихром A (FCHA) и т.п.
[00163] В некоторых вариантах осуществления хелатообразующие фрагменты ковалентно связаны с антителом к MUC16 или биспецифической антигенсвязывающей молекулой к MUC16/CD3 за счет линкерного фрагмента, который ковалентно присоединяет хелатообразующую часть хелатообразующего фрагмента к связывающему белку. В некоторых вариантах осуществления эти линкерные фрагменты образованы в результате реакции между реакционноспособным фрагментом биспецифической антигенсвязывающей молекулы, например, цистеином или лизином антитела, и реакционноспособным фрагментом, который присоединен к хелатору, в том числе, например, п-изотиоцианатобенильной группой и реакционноспособными фрагментами, представленными в способах конъюгации ниже. Кроме того, такие линкерные фрагменты необязательно содержат химические группы, используемые в целях регулировки полярности, растворимости, стерических взаимодействий, жесткости и/или длины между хелатообразующей частью и антителом к MUC16 или биспецифической антигенсвязывающей молекулой к MUC16/CD3.
Получение меченных радиоактивной меткой конъюгатов на основе биспецифической антигенсвязывающей молекулы к MUC16/CD3
[00164] Меченные радиоактивной меткой конъюгаты на основе антитела к MUC16 и конъюгаты на основе биспецифической антигенсвязывающей молекулы к MUC16/CD3 можно получить посредством: (1) осуществления реакции антигенсвязывающей молекулы с молекулой, содержащей хелатор для позитронного излучателя и фрагмент, вступающий в реакцию с необходимым сайтом конъюгации биспецифического связывающего белка, и (2) загрузки требуемого позитронного излучателя.
[00165] Подходящие сайты конъюгации включают без ограничения лизин и цистеин, оба из которых, например, могут быть нативными или сконструированными, и могут, например, присутствовать в тяжелой или легкой цепи антитела. Цистеиновые сайты конъюгации включают без ограничения полученные путем мутации, вставки или восстановления дисульфидных связей антитела. Способы получения антител со сконструированным остатком цистеина включают без ограничения способы, раскрытые в WO 2011/056983. Сайтспецифические способы конъюгации также можно применять для направления реакции конъюгации в специфические сайты антитела, достижения требуемой стехиометрии и/или достижения требуемого соотношения хелатора и антитела. Такие способы конъюгации известны специалистам средней квалификации в данной области техники и включают без ограничения конструирование остатка цистеина и ферментативные и химико-ферментативные способы, в том числе без ограничения конъюгацию по остатку глутамина, конъюгацию по Q295 и конъюгацию, опосредованную трансглутаминазой, а также способы, которые описаны в J.Clin.Immunol., 36: 100 (2016), включенном в данный документ посредством ссылки во всей своей полноте. Подходящие фрагменты, вступающие в реакцию с необходимым сайтом конъюгации, обычно обеспечивают эффективное и легкое связывание биспецифической антигенсвязывающей молекулы к MUC16/CD3, например биспецифического антитела, и хелатора для позитронного излучателя. Фрагменты, вступающие в реакцию с лизиновыми и цистеиновыми сайтами, включают электрофильные группы, которые известны специалистам средней квалификации в данной области техники. В определенных аспектах, если необходимым сайтом конъюгации является остаток лизина, реакционноспособный фрагмент представляет собой изотиоцианат, например, п-изотиоцианатобенильную группу или реакционноспособный сложный эфир. В определенных аспектах, если необходимым сайтом конъюгации является остаток цистеина, реакционноспособный фрагмент представляет собой малеимид.
[00166] Если хелатор представляет собой десферроксамин (DFO), подходящие реакционноспособные фрагменты включают без ограничения изотиоциантатобензильную группу, сложный н-гидроксисукцинимидный эфир, сложный 2,3,5,6-тетрафторфенольный эфир, н-сукцинимидил-S-ацетилтиоацетат и фргаменты, описанные в BioMed Research International, Vol 2014, ID статьи 203601, включенной в данный документ посредством ссылки во всей своей полноте. В определенных вариантах осуществления молекула, содержащая хелатор для позитронного излучателя и фрагмент, вступающий в реакцию с сайтом конъюгации, представляет собой п-изотиоциантатобензилдесферроксамин (p-SCN-Bn-DFO):
[00167] Загрузка позитронного излучателя осуществляется посредством инкубации антитела к MUC16 или конъюгата хелатора и биспецифической антигенсвязывающей молекулы к MUC16/CD3 с позитронным излучателем в течение времени, достаточного для обеспечения образования координационной связи указанного позитронного излучателя с хелатором, например посредством осуществления способов, описанных в примерах, предусмотренных в данном документе, или по сути аналогичного способа.
Иллюстративные варианты осуществления конъюгатов
[00168] В настоящее изобретение включены меченные радиоактивной меткой конъюгаты на основе антитела, содержащие антитело к MUC16 или биспецифическую антигенсвязывающую молекулу к MUC16/CD3 и позитронный излучатель. В настоящее изобретение также включены меченные радиоактивной меткой конъюгаты на основе антитела, содержащие антитело к MUC16 или биспецифическую антигенсвязывающую молекулу к MUC16/CD3, хелатообразующий фрагмент и позитронный излучатель. (Tavare et al. Cancer Res. 2016, 76(1): 73-82, и Azad et al. Oncotarget. 2016, 7(11): 12344-58.)
[00169] В некоторых вариантах осуществления хелатообразующий фрагмент предусматривает хелатор, способный образовывать комплекс с 89Zr. В определенных вариантах осуществления хелатообразующий фрагмент предусматривает десферроксамин. В определенных вариантах осуществления хелатообразующий фрагмент представляет собой п-изотиоцианатобензилдесферроксамин.
[00170] В некоторых вариантах осуществления позитронный излучатель представляет собой 89Zr. В некоторых вариантах осуществления менее 1,0% антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 конъюгировано с позитронным излучателем, менее 0,9% антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 конъюгировано с позитронным излучателем, менее 0,8% антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 конъюгировано с позитронным излучателем, менее 0,7%о антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 конъюгировано с позитронным излучателем, менее 0,6% антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 конъюгировано с позитронным излучателем, менее 0,5% антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 конъюгировано с позитронным излучателем, менее 0,4% антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 конъюгировано с позитронным излучателем, менее 0,3% антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 конъюгировано с позитронным излучателем, менее 0,2% антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 конъюгировано с позитронным излучателем или менее 0,1% антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 конъюгировано с позитронным излучателем.
[00171] В некоторых вариантах осуществления отношение хелатообразующего фрагмента к антителу в конъюгате составляет от 1,0 до 2,0. Используемый в данном документе термин «отношение хелатообразующего фрагмента к антителу» представляет собой среднее отношение хелатообразующего фрагмента к антителу и является показателем загрузки хелатора на антитело. Данное соотношение аналогично «DAR», т.е. отношению лекарственного средства к антителу, которое применяют специалисты в данной области для измерения загрузки лекарственного средства на антитело в случае конъюгатов антитела и лекарственного средства (ADC); при этом в контексте конъюгатов для iPET-визуализации, описанных в данном документе, отношение хелатообразующего фрагмента к антителу можно установить с помощью способов, описанных в данном документе, и других способов определения DAR, известных в данной области техники, например, описанных в Wang et al., Antibody-Drug Conjugates, The 21st Century Magic Bullets for Cancer (2015). В некоторых вариантах осуществления отношение хелатообразующего фрагмента к антителу составляет приблизительно 1,7. В некоторых вариантах осуществления отношение хелатообразующего фрагмента к антителу составляет от 1,0 до 2,0. В некоторых вариантах осуществления отношение хелатообразующего фрагмента к антителу составляет приблизительно 1,7.
[00172] В конкретном варианте осуществления хелатообразующий фрагмент представляет собой п-изотиоцианатобензилдесферроксамин, и позитронный излучатель представляет собой 89Zr. В другом конкретном варианте осуществления хелатообразующий фрагмент представляет собой п-изотиоцианатобензилдесферроксамин, и позитронный излучатель представляет собой 89Zr, и отношение хелатообразующего фрагмента к антителу в конъюгате составляет от 1 до 2.
[00173] В некоторых вариантах осуществления в данном документе предусмотрены антитела к MUC16 или биспецифические антигенсвязывающие молекулы к MUC16/CD3, где указанные антигенсвязывающие молекулы ковалентно связаны с одним или более фрагментами, характеризующимися следующей структурой:
где L представляет собой хелатообразующий фрагмент, М представляет собой позитронный излучатель, и z независимо в каждом случае составляет 0 или 1, и где по меньшей мере один из z составляет 1. В определенных вариантах осуществления меченный радиоактивной меткой антигенсвязывающий белок представляет собой соединение формулы (I):
А представляет собой антитело к MUC16 или биспецифическую антигенсвязывающую молекулу к MUC16/CD3, L представляет собой хелатообразующий фрагмент, М представляет собой позитронный излучатель, z равняется 0 или 1, и к представляет собой целое число от 0 до 30. В некоторых вариантах осуществления к составляет 1. В некоторых вариантах осуществления к составляет 2.
[00174] В некоторых вариантах осуществления L представляет собой:
[00175] В некоторых вариантах осуществления М представляет собой 89Zr.
[00176] В некоторых вариантах осуществления k составляет целое число от 1 до 2. В некоторых вариантах осуществления к составляет 1. В некоторых вариантах осуществления к составляет 2.
[00177] В некоторых вариантах осуществления -L-M представляет собой:
 где Zr представляет собой позитронный излучатель 89Zr.
где Zr представляет собой позитронный излучатель 89Zr.
[00178] В настоящее изобретение также включены способы синтеза меченного радиоактивной меткой конъюгата на основе антитела, предусматривающие приведение в контакт соединения формулы (III):
с 89Zr, где А представляет собой антитело к MUC16 или биспецифическую антигенсвязывающую молекулу к MUC16/CD3. В определенных вариантах осуществления соединение формулы (III) синтезируется посредством приведения антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3 в контакт с p-SCN-Bn-DFO.
[00179] В данном документе также представлен продукт реакции соединения формулы (III) с 89Zr.
[00180] В данном документе представлены соединения формулы (III):
где А представляет собой антитело к MUC16 или биспецифическую антигенсвязывающую молекулу к MUC16/CD3, и к представляет собой целое число от 1 до 30. В некоторых вариантах осуществления к составляет 1 или 2.
[00181] В дани ом д окумент е пр еду смотр ен ы конъю гаты н а оси ов е антит ел а, содержащие: (i) антитело к MUC16 или биспецифическую антигенсвязывающую молекулу к MUC16/CD3 и (ii) один или более хе лат о образующих фрагментов.
[00182] В некоторых вариантах осуществления хелатообразующий фрагмент преду сматрив ает:
 представляет собой ковалентную связь с антителом или его антиген связывающим фрагментом
представляет собой ковалентную связь с антителом или его антиген связывающим фрагментом
[00183] В некоторых аспектах конъюгат на основе антитела характеризуется отношением хелатообразующего фрагмента к антителу, составляющим от приблизительно 1,0 до приблизительно 2,0. В некоторых аспектах конъюгат на основе антитела характеризуется отношением хелатообразующего фрагмента к антителу, составляющим приблизительно 1,7.
[00184] В некоторых вариантах осуществления в данном документе представлены композиции, содержащие конъюгат, имеющий следующую структуру:
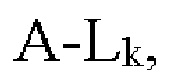
где А представляет собой антитело к MUC16 или биспецифическую антигенсвязывающую молекулу к MUC16/CD3, L представляет собой хелатообразующий фрагмент, и к представляет собой целое число от 1 до 30, при этом конъюгат образует хелатное соединение с позитронным излучателем в количестве, достаточном для обеспечения удельной активности, подходящей для клинической РЕТ-визуализации. В некоторых вариантах осуществления количество хелатированного позитронного излучателя представляет собой количество, достаточное для обеспечения удельной активности, составляющей от приблизительно 1 до приблизительно 50 мКи на 1-50 мг антитела к MUC16 или биспецифической антигенсвязывающей молекулы к MUC16/CD3.
[00185] В некоторых вариантах осуществления количество хелатированного позитронного излучателя представляет собой количество, достаточное для обеспечения удельной активности до 50 мКи, до 45 мКи, до 40 мКи, до 35 мКи, до 30 мКи, до 25 мКи или до 10 мКи на 1-50 мг биспецифической антигенсвязывающей молекулы к MUC16/CD3, например, в диапазоне от приблизительно 5 до приблизительно 50 мКи, от приблизительно 10 до приблизительно 40 мКи, от приблизительно 15 до приблизительно 30 мКи, от приблизительно 7 до приблизительно 25 мКи, от приблизительно 20 до приблизительно 50 мКи или от приблизительно 5 до приблизительно 10 мКи.
Способы применения меченных радиоактивной меткой имму ноконъюг атов
[00186] В определенных аспектах настоящего изобретения представлены диагностические и терапевтические способы применения меченных радиоактивной меткой конъюгатов на основе антител по настоящему изобретению.
[00187] Согласно одному аспекту настоящего изобретения предусмотрены способы выявления MUC16 в ткани, при этом способы включают введение в ткань меченного радиоактивной меткой конъюгата на основе антитела к MUC16 или конъюгата на основе биспецифической антигенсвязывающей молекулы к MUC16/CD3, предусмотренных в данном документе, и визуальное наблюдение экспрессии MUC16 посредством визуализации с помощью позитронно-эмиссионной томографии (PET). В определенных вариантах осуществления ткань содержит клетки или линии клеток. В определенных вариантах осуществления ткань присутствует в субъекте, где субъект представляет собой млекопитающее. В определенных вариантах осуществления субъект представляет собой субъекта-человека. В определенных вариантах осуществления у субъекта имеется заболевание или нарушение, выбранное из группы, состоящей из рака, при котором экспрессируется антиген MUC16, такого как рак яичника, рак молочной железы, рак поджелудочной железы, рак эндометрия, рак фаллопиевой трубы, мезотелиома, немелкоклеточный рак легкого, внутрипеченочная холангиокарцинома массообразующего типа, аденокарцинома шейки матки и аденокарцинома желудочного тракта. В одном варианте осуществления у субъекта имеется рак яичника.
[00188] Согласно одному аспекту настоящее изобретение предусматривает способы визуализации ткани, которая экспрессирует MUC16, включающие введение в ткань меченного радиоактивной меткой конъюгата на основе антитела к MUC16 или конъюгата на основе биспецифической антигенсвязывающей молекулы к MUC16/CD3 по настоящему изобретению, и визуальное наблюдение экспрессии MUC16 посредством визуализации с помощью позитронно-эмиссионной томографии (PET). В одном варианте осуществления ткань содержится в опухоли. В одном варианте осуществления ткань содержится в культуре опухолевых клеток или линии опухолевых клеток. В одном варианте осуществления ткань содержится в очаге опухоли у субъекта. В одном варианте осуществления ткань представляет собой внутриопухолевые лимфоциты в ткани. В одном варианте осуществления ткань содержит MUC16-экспрессирующие клетки.
[00189] В соответствии с одним аспектом настоящего изобретения представлены способы определения, подходит ли субъект, у которого имеется опухоль, для противоопухолевой терапии, при этом способы предусматривают введение меченного радиоактивной меткой конъюгата на основе антитела по настоящему изобретению и локализацию введенного меченного радиоактивной меткой конъюгата на основе антитела в опухоли посредством РЕТ-визуализации, при этом присутствие меченного радиоактивной меткой конъюгата на основе антитела в опухоли позволяет идентифицировать субъекта как подходящего для противоопухолевой терапии.
[00190] Согласно одному аспекту настоящего изобретения предусмотрены способы прогнозирования ответа субъекта, у которого имеется солидная опухоль, на противоопухолевую терапию, при этом способы включают определение того, является ли опухоль MUC16-положительной, где положительный ответ субъекта прогнозируется в том случае, если опухоль является MUC16-положительной. В определенных вариантах осуществления опухоль определяется как положительная посредством введения меченного радиоактивной меткой конъюгата на основе антитела по настоящему изобретению и локализации меченного радиоактивной меткой конъюгата на основе антитела в опухоли посредством РЕТ-визуализации, где присутствие меченного радиоактивной меткой конъюгата на основе антитела в опухоли указывает на то, что опухоль является MUC16-положительной.
[00191] Согласно одному аспекту настоящего изобретения предусмотрены способы выявления MUC16-положительной опухоли у субъекта. Способы, согласно данному аспекту, включают введение субъекту меченного радиоактивной меткой конъюгата на основе антитела по настоящему изобретению и определение локализации меченного радиоактивной меткой конъюгата на основе антитела посредством РЕТ-визуализации, где присутствие меченного радиоактивной меткой конъюгата на основе антитела в опухоли указывает на то, что опухоль является MUC16-положительной.
[00192] В данном документе предусмотрены способы прогнозирования положительного ответа на противоопухолевую терапию, включающие введение субъекту меченного радиоактивной меткой конъюгата на основе антитела к MUC16 или конъюгата на основе биспецифической антигенсвязывающей молекулы к MUC16/CD3 для определения присутствия MUC16-положительных клеток в солидной опухоли. Присутствие MUC16-положительных клеток позволяет прогнозировать положительный ответ на противоопухолевую терапию.
[00193] Используемое в данном документе выражение «субъект, нуждающийся в этом» означает человека или отличное от человека млекопитающее, у которого проявляется один или более симптомов или признаков рака, и/или у которого был диагностирован рак, в том числе солидная опухоль, и который нуждается в его лечении. Во многих вариантах осуществления термин «субъект» может использоваться взаимозаменяемо с термином «пациент». Например, у субъекта-человека может быть диагностирована первичная или метастатическая опухоль и/или один или более симптомов или признаков, в том числе без ограничения необъяснимая потеря веса, общая слабость, постоянная усталость, потеря аппетита, лихорадка, ночная потливость, боль в костях, одышка, вздутие живота, боль/давление в груди, увеличение селезенки и повышение уровня связанного с раком биомаркера (например, СА125). Данное выражение включает субъектов с первичными или сформировавшимися опухолями. В конкретных вариантах осуществления выражение включает субъектов-людей, у которых имеется солидная опухоль или которые нуждаются в ее лечении, например, рак яичника, рак молочной железы, рак поджелудочной железы, рак эндометрия, рак фаллопиевой трубы, мезотелиома, немелкоклеточный рак легкого, внутрипеченочная холангиокарцинома массообразующего типа, аденокарцинома шейки матки и аденокарцинома желудочного тракта. Термин включает субъектов с первичными или метастатическими опухолями (злокачественными новообразованиями на поздней стадии). В определенных вариантах осуществления выражение «субъект, нуждающийся в этом» включает субъектов с солидной опухолью, которая является устойчивой или рефрактерной к предшествующей терапии (например, лечению с помощью противоракового средства) или недостаточно контролируется ею. Например, выражение включает субъектов, которых подвергали лечению с помощью одной или более линий предшествующей терапии, таких как химиотерапия (например, карбоплатин или доцетаксел). В определенных вариантах осуществления выражение «субъект, нуждающийся в этом» включает субъектов с солидной опухолью, которые подвергали лечению с помощью одной или более линий предшествующей терапии, но у которые впоследствии произошел рецидив или м етастазирован ие.
[00194] В определенных вариантах осуществления способы по настоящему изобретению используются у субъекта с солидной опухолью. Термины «опухоль», «рак» и «злокачественное новообразование» используются в данном документе взаимозаменяемо. Используемый в данном документе термин «солидная опухоль» относится к аномальной массе ткани, которая обычно не содержит кист или областей с жидкостью. Солидные опухоли могут быть доброкачественными (не являются раковыми) или злокачественными (раковыми). Для целей настоящего изобретения термин «солидная опухоль» означает злокачественные солидные опухоли. Термин включает различные типы солидных опухолей, названные по типам клеток, которые их образуют, а именно саркомы, карциномы и лимфомы.
[00195] В определенных вариантах осуществления рак или опухоль выбраны из группы, состоящей из астроцитомы, рака анального канала, рака мочевого пузыря, рака крови, рака крови, рака кости, рака головного мозга, рака молочной железы, рака шейки матки, светлоклеточной почечноклеточной карциномы, колоректального рака, колоректального рака с умеренным уровнем микросателлитной нестабильности, плоскоклеточной карциномы кожи, диффузной В-крупноклеточной лимфомы, рака эндометрия, рака пищевода, рака фаллопиевой трубы, мезотелиомы, фибросаркомы, рака желудка, глиобластомы, мультиформной глиобластомы, плоскоклеточной карциномы головы и шеи, печеночноклеточной карциномы, внутрипеченочной холангиокарциномы массообразующего типа, лейкоза, рака печени, лейомиосаркомы, рака легкого, лимфомы, меланомы, мезотелиомы, миеломы, рака носоглотки, немелкоклеточного рака легкого, остеосаркомы, рака яичника, рака поджелудочной железы, аденокарциномы протоков поджелудочной железы, первичного и/или рецидивирующего рака, рака предстательной железы, почечноклеточной карциномы, рабдомиосаркомы, рака слюнной железы, рака кожи, мелкоклеточного рака легкого, плоскоклеточного рака, рака желудка, синовиальной саркомы, рака яичка, рака щитовидной железы, трижды отрицательного рака молочной железы, рака матки, включая аденокарциному шейки матки, и опухоли Вильмса. В некоторых аспектах рак представляет собой первичный рак. В некоторых аспектах рак представляет собой метастатический и/или рецидивирующий рак.
[00196] В определенных вариантах осуществления рак или опухоль выбраны из MUC16-положительной опухоли, такой как опухоль, происходящая из яичника, молочной железы, бронхов, эндометрия, роговицы, эпителия желудка, поджелудочной железы или ободочной и прямой кишки. В некоторых аспектах рак представляет собой рак молочной железы, рак яичника, рак роговицы, рак поджелудочной железы, рак эндометрия, рак фаллопиевой трубы, мезотелиому, немелкоклеточный рак легкого, внутрипеченочную холангиокарциному массообразующего типа, рак матки, рак шейки матки, рак желудка или колоректальную карциному. В некоторых аспектах рак представляет собой рак яичника. В некоторых аспектах рак представляет собой метастатический рак, происходящий из первичной опухоли яичника.
[00197] Используемые в данном документе термины «лечить», «осуществлять лечение» или т.п. означают облегчение симптомов, устранение причин симптомов либо на временной, либо на постоянной основе, задержку или подавление опухолевого роста, уменьшение нагрузки опухолевых клеток или опухолевой массы, содействие регрессу опухоли, обеспечение уменьшения, некроза и/или исчезновения опухоли, предупреждение рецидива опухоли, предупреждение или подавление метастазирования, ингибирование метастатического опухолевого роста и/или увеличение продолжительность выживания субъекта.
[00198] В определенных вариантах осуществления меченный радиоактивной меткой конъюгат на основе антитела к MUC16 или конъюгат на основе биспецифической антигенсвязывающей молекулы к MUC16/CD3 вводится субъекту внутривенно, интраперитонеально или подкожно. В определенных вариантах осуществления меченный радиоактивной меткой конъюгат на основе антитела вводят внутрь опухоли. После введения меченный радиоактивной меткой конъюгат на основе антитела локализуют в опухоли. Локализованный меченный радиоактивной меткой конъюгат на основе антитела визуализируют посредством РЕТ-визуализации, а поглощение опухолью меченного радиоактивной меткой конъюгата на основе антитела измеряют посредством способов, известных в данной области техники. В определенных вариантах осуществления визуализацию проводят через 1, 2, 3, 4, 5, 6 или 7 дней после введения меченного радиоактивной меткой конъюгата. В определенных вариантах осуществления визуализацию проводят в тот же день после введения меченного радиоактивной меткой конъюгата на основе антитела.
[00199] В определенных вариантах осуществления меченный радиоактивной меткой конъюгат на основе антитела к MUC16 или конъюгат на основе биспецифической антигенсвязывающей молекулы к MUC16/CD3 можно вводить в дозе, составляющей от приблизительно 0,1 мг/кг веса тела до приблизительно 100 мг/кг веса тела субъекта, например, от приблизительно 0,1 мг/кг до приблизительно 50 мг/кг, или от приблизительно 0,5 мг/кг до приблизительно 25 мг/кг, или от приблизительно 0,1 мг/кг до приблизительно 1,0 мг/кг веса тела.
Составление и введение терапевтического препарата
[00200] В соответствии с настоящим изобретением применимы фармацевтические композиции, содержащие антигенсвязывающие молекулы, применимые в данном документе. В некоторых аспектах фармацевтическая композиция дополнительно содержит агонист 4-1ВВ. Фармацевтические композиции составляют с подходящими носителями, вспомогательными веществами и другими средствами, которые обеспечивают улучшение переноса, доставки, переносимости и т.п. Множество подходящих составов можно найти в справочнике, хорошо известном всем химикам-фармацевтам: Remington's Pharmaceutical Sciences, Mack Publishing Company, Истон, Пенсильвания, США. Эти составы включают, например, порошки, пасты, мази, желе, воска, масла, липиды, везикулы, содержащие липиды (катионные или анионные) (такие как LIPOFECTIN™, Life Technologies, Карлсбад, Калифорния, США), конъюгаты на основе ДНК, безводные абсорбционные пасты, эмульсии типа «масло воде» и «вода в масле», эмульсии на основе карбовакса (полиэтиленгликоли с различной молекулярной массой), полужидкие гели и полужидкие смеси, содержащие карбовакс. См. также Powell et al. «Compendium of excipients for parenteral formulations)) PDA (1998) J Pharm Sci Technol 52:238-311.
[00201] Доза антигенсвязывающей молекулы, вводимой пациенту, может варьироваться в зависимости от возраста и размера тела пациента, целевого заболевания, состояний, пути введения и т.п. Предпочтительную дозу, как правило, рассчитывают в соответствии с массой тела или площадью поверхности тела. Если биспецифическая антигенсвязывающая молекула применяется для терапевтических целей у взрослого пациента, преимущественным является внутривенное введение биспецифической антигенсвязывающей молекулы в норме в однократной дозе, составляющей от приблизительно 0,01 до приблизительно 20 мг/кг массы тела, более предпочтительно от приблизительно 0,02 до приблизительно 7, от приблизительно 0,03 до приблизительно 5 или от приблизительно 0,05 до приблизительно 3 мг/кг массы тела. В зависимости от тяжести состояния можно корректировать частоту введения и длительность лечения. Эффективные дозировки и схемы введения биспецифической антигенсвязывающей молекулы могут быть определены эмпирически; например, путем периодического оценивания можно контролировать прогресс пациента, и соответствующим образом корректировать дозу. Более того, можно выполнять межвидовое масштабирование дозировок с применением способов, хорошо известных в данной области техники (например, Mordenti et al., 1991, Pharmaceut. Res. 8:1351).
[00202] Доза агониста 4-1BB, вводимого пациенту, может варьироваться в зависимости от возраста и размера тела пациента, целевого заболевания, состояний, пути введения и т.п. Предпочтительную дозу, как правило, рассчитывают в соответствии с массой тела или площадью поверхности тела. Если агонист 4-1ВВ применяется для терапевтических целей у взрослого пациента, преимущественным является внутривенное введение агониста в норме в однократной дозе, составляющей от приблизительно 0,01 до приблизительно 20 мг/кг массы тела, более предпочтительно от приблизительно 0,02 до приблизительно 7, от приблизительно 0,03 до приблизительно 5 или от приблизительно 0,05 до приблизительно 3 или приблизительно 2,5 мг/кг массы тела.
[00203] Известны различные системы доставки, и их можно применять для введения фармацевтических композиций, применимый в данном документе, например, инкапсулирование в липосомы, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать мутантные вирусы, опосредованный рецепторами эндоцитоз (см., например, Wu et al., 1987, J. Biol. Chem. 262:4429-4432). Способы введения включают без ограничения внутрикожный, внутримышечный, внутрибрюшинный, внутривенный, подкожный, интраназальный, эпидуральный и пероральный пути. Композицию можно вводить любым удобным путем, например посредством инфузии или болюсной инъекции, посредством абсорбции через эпителиальные или кожно-слизистые покровы (например, слизистую оболочку ротовой полости, слизистую оболочку прямой кишки и кишечника и т.д.), и ее можно вводить вместе с другими биологически активными средствами. Введение может быть системным или местным.
[00204] Фармацевтическую композицию, применимую в данном документе, можно доставлять подкожно или внутривенно с помощью стандартной иглы и шприца. Кроме того, что касается подкожной доставки, то при доставке фармацевтической композиции, применимой в данном документе, свободно можно применять устройство для доставки по типу шприца-ручки. Такое устройство для доставки по типу шприца-ручки может быть многоразовым или одноразовым. В многоразовом устройстве для доставки по типу шприца-ручки обычно используется сменный картридж, который содержит фармацевтическую композицию. После того, как вся фармацевтическая композиция из картриджа была введена, и картридж опустошился, пустой картридж можно сразу удалить в отходы и заменить новым картриджем, который содержит фармацевтическую композицию. Устройство для доставки по типу шприца-ручки затем можно применять повторно. В случае одноразового устройства для доставки по типу шприца-ручки сменный картридж отсутствует. Вместо этого одноразовое устройство для доставки по типу шприца-ручки предоставляется предварительно заполненным фармацевтической композицией, содержащейся в резервуаре внутри устройства. После опустошения резервуара от фармацевтической композиции устройство помещается в отходы целиком.
[00205] При подкожной доставке фармацевтической композиции, применимой в данном документе, применяют разнообразные многоразовые устройства для доставки по типу шприца-ручки и автоинъектора. Примеры включают без ограничения AUTOPEN™ (Owen Mumford, Inc., Вудсток, Великобритания), шприц-ручку DISETRONIC™ (Disetronic Medical Systems, Бургдорф, Швейцария), шприц-ручку HUMALOG MIX 75/25™, шприц-ручку HUMALOG™, шприц-ручку HUMALIN 70/30™ (Eli Lilly and Co., Индианаполис, Индиана, США), NOVOPEN™ I, II и III (Novo Nordisk, Копенгаген, Дания), NOVOPEN JUNIOR™ (Novo Nordisk, Копенгаген, Дания), шприц-ручку BD™ (Becton Dickinson, Франклин-Лэйкс, Нью-Джерси, США), OPTIPEN™, OPTIPEN PRO™, OPTIPEN STARLET™ и OPTICLIK™ (Sanofi-Aventis, Франкфурт, Германия), при этом упомянуты лишь некоторые из них. Примеры одноразовых устройств для доставки в виде шприца-ручки, применяемых для подкожного введения фармацевтической композиции, применимой в данном документе, включают без ограничения шприц-ручку SOLOSTAR™ (sanofi-aventis), FLEXPEN™ (Novo Nordisk) и KWIKPEN™ (Eli Lilly), автоинъектор SURECLICK™ (Amgen, Таузанд-Окс, Калифорния, США), PENLET™ (Haselmeier, Штутгарт, Германия), EPIPEN (Dey, L.P.) и шприц-ручку HUMIRA™ (Abbott Labs, Эббот-Парк, Иллинойс, США), при этом упомянуты лишь несколько из них.
[00206] В определенных ситуациях фармацевтическую композицию можно доставлять в виде системы с контролируемым высвобождением. В одном варианте осуществления можно применять помпу (см. Langer, выше; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:201). В другом варианте осуществления можно применять полимерные материалы; см. Medical Applications of Controlled Release, Langer and Wise (eds.), 1974, CRC Pres., Бока-Ратон, Флорида, CILLA. В еще одном варианте осуществления систему с контролируемым высвобождением можно поместить вблизи мишени композиции, при этом требуется лишь часть системной дозы (см., например, Goodson, 1984, в Medical Applications of Controlled Release, выше, т. 2, стр. 115-138). Другие системы с контролируемым высвобождением обсуждаются в обзоре Langer, 1990, Science 249:1527-1533.
[00207] Инъекционные препараты могут включать лекарственные формы для внутривенных, подкожных, внутрикожных и внутримышечных инъекций, для капельных инфузий и т.п. Эти инъекционные препараты можно получить с помощью общеизвестных способов. Например, инъекционные препараты можно получить, например, путем растворения, суспендирования или эмульгирования антитела или его соли, описанных выше, в стерильной водной среде или масляной среде, традиционно применяемых для инъекций. В качестве водной среды для инъекций применяют, например, физиологический солевой раствор, изотонический раствор, содержащий глюкозу и другие вспомогательные средства и т.п., которые можно применять в комбинации с подходящим солюбилизирующим средством, таким как спирт (например, этанол), многоатомный спирт (например, пропиленгликоль, полиэтиленгликоль), неионогенное поверхностно-активное вещество [например, полисорбат 80, НСО-50 (полиоксиэтиленовый (50 моль) аддукт гидрогенизированного касторового масла)] и т.п. В качестве масляной среды используют, например, кунжутное масло, соевое масло и т.п., которые можно применять в комбинации с солюбилизирующим средством, таким как бензилбензоат, бензиловый спирт и т.п. Полученным таким способом инъекционным составом предпочтительно наполняют подходящую ампулу.
[00208] Преимущественно описанные выше фармацевтические композиции для перорального или парентерального применения получают в виде лекарственных форм со стандартной дозой, подобранной таким образом, чтобы она соответствовала дозе активных ингредиентов. Такие лекарственные формы со стандартной дозой включают, например, таблетки, пилюли, капсулы, инъекционные составы (ампулы), суппозитории и т.д. Количество содержащегося вышеупомянутого антитела обычно составляет от приблизительно 1 до приблизительно 500 мг на лекарственную форму со стандартной дозой; в частности в форме инъекционного состава; в случае других лекарственных форм предпочтительно, чтобы содержание вышеупомянутого антитела составляло от приблизительно 1 до приблизительно 300 мг и от приблизительно 10 до приблизительно 500 мг.
Средства и составы для комбинированной терапии
[00209] В настоящем изобретении представлены способы, которые предусматривают введение фармацевтической композиции, содержащей любые из иллюстративных моноспецифических или биспецифических антигенсвязывающих молекул, описанных в данном документе, в комбинации с агонистом 4-1ВВ и одним или несколькими дополнительными терапевтическими средствами. Иллюстративные дополнительные терапевтические средства, которые можно комбинировать или вводить в комбинации с агонистом 4-1ВВ и биспецифической антигенсвязывающей молекулой, применимыми в данном документе, включают, например, антагонист EGFR (например, антитело к EGFR [например, цетуксимаб или панитумумаб] или низкомолекулярный ингибитор EGFR [например, гефитиниб или эрлотиниб]), антагонист другого представителя семейства EGFR, такого как Her2/ErbB2, ErbB3 или ErbB4 (например, антитело к ErbB2, антитело к ErbB3 или антитело к ErbB4 или низкомолекулярный ингибитор активности ErbB2, ErbB3 или ErbB4), антагонист EGFRvIII (например, антитело, которое специфически связывает EGFRvIII), антагонист сМЕТ (например, антитело к сМЕТ), антагонист IGF1R (например, антитело к IGFIR), ингибитор B-raf (например, вемурафениб, сорафениб, GDC-0879, PLX-4720), ингибитор PDGFR-α (например, антитело к PDGFR-α), ингибитор PDGFR-β (например, антитело к PDGFR-β), антагонист VEGF (например, VEGF-»ловушка», см., например, патент США №7087411 (также называемый в данном документе «слитый белок, ингибирующий VEGF»), антитело к VEGF (например, бевацизумаб), низкомолекулярный ингибитор киназы рецептора VEGF (например, сунитиниб, сорафениб или пазопаниб)), антагонист DLL4 (например, антитело к DLL4, раскрытое в заявке на патенте США №2009/0142354, такое как REGN421), антагонист Ang2 (например, антитело к Ang2, раскрытое в заявке на патент США №2011/0027286, такое как Н1Н685Р), антагонист FOLH1 (PSMA), антагонист PRLR (например, антитело к PRLR), антагонист STEAP1 или STEAP2 (например, антитело к STEAP1 или антитело к STEAP2), антагонист TMPRSS2 (например, антитело к TMPRSS2), антагонист MSLN (например, антитело к MSLN), антагонист СА9 (например, антитело к СА9), антагонист уроплакина (например, антитело к уроплакину) и т.д. Другие средства, которые предпочтительно можно вводить в комбинации с композициями, представленными в данном документе, включают ингибиторы цитокинов, в том числе низкомолекулярные ингибиторы цитокинов и антитела, которые связываются с цитокинами, такими как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-8, IL-9, IL-11, IL-12, IL-13, IL-17, IL-18, или с их соответствующими рецепторами. Фармацевтические композиции, используемые в данном документе (например фармацевтические композиции, содержащие биспецифическую антигенсвязывающую молекулу к CD3/MUC16, раскрытую в данном документе), также можно вводить как часть терапевтической схемы, предусматривающей агонист 4-1ВВ и одну или более терапевтических комбинаций, выбранных из «ICE»: ифосфамид (например Ifex®), карбоплатин (например Paraplatin®), этопозид (например Etopophos®, Toposar®, VePesid®, VP-16); «DFLAP»: дексаметазон (например Decadron®), цитарабин (например Cytosar-U®, арабинозид цитозина, ага-С), цисплатин (например Platinol®-AQ), и «ESHAP»: этопозид (например Etopophos®, Toposar®, VePesid®, VP-16), метилпреднизолон (например Medrol®), цитарабин в высоких дозах, цисплатин (например Platinol®-AQ).
[00210] В настоящее изобретение также включены комбинации терапевтических препаратов, содержащие любую из антигенсвязывающих молекул, упомянутых в данном документе, и ингибитор одного или более из VEGF, Ang2, DLL4, EGFR, ErbB2, ErbB3, ErbB4, EGFRvIII, cMet, IGF1R, B-raf, PDGFR-α, PDGFR-β, PRLR, STEAP1, STEAP2, TMPRSS2, MSLN, CA9, уроплакина или любого из вышеупомянутых цитокинов, где ингибитор представляет собой аптамер, антисмысловую молекулу, рибозим, siRNA, пептитело, нанотело или фрагмент антитела (например, Fab-фрагмент; F(ab’)2-фрагмент; Fd-фрагмент; Fv-фрагмент; scFv; dAb-фрагмент; или другие сконструированные молекулы, такие как диатела, триатела, тетратела, мини-тела и минимальные распознающие единицы). Антигенсвязывающие молекулы, раскрытые в данном документе, также можно вводить и/или совместно составлять в комбинации с противовирусными препаратами, антибиотиками, анальгетиками, кортикостероидами и/или NSAID. Антигенсвязывающие молекулы, раскрытые в данном документе, также можно вводить как часть схемы лечения, которая также включает лучевую терапию и/или стандартную химиотерапию.
[00211] Дополнительный терапевтически активный(-ые) компонент(-ы) можно вводить непосредственно перед введением антигенсвязывающей молекулы, применимой в данном документе, одновременно с ней или вскоре после ее введения (для целей настоящего изобретения такие схемы введения рассматриваются как введение антигенсвязывающей молекулы «в комбинации с» дополнительным терапевтически активным компонентом).
[00212] В настоящее изобретение включены фармацевтические композиции, в которых антигенсвязывающая молекула, применимая в данном документе, составлена совместно с одним или более из дополнительных терапевтически активных компонентов, описанных в другом разделе в данном документе.
Схемы введения
[00213] Согласно определенным вариантам осуществления настоящего изобретения субъекту можно вводить несколько доз антигенсвязывающей молекулы (например антитела к MUC16 или биспецифической антигенсвязывающей молекулы к CD3/MUC16) в течение определенного периода времени. Кроме того, субъекту можно вводить несколько доз агониста 4-1ВВ в течение определенного периода времени. Способы согласно этому аспекту включают последовательное введение субъекту одной или более доз каждого терапевтического препарата, т.е. одной или более доз антигенсвязывающей молекулы и одной или более доз агониста 4-1ВВ. Используемое в данном документе «последовательное введение» означает, что каждую дозу терапевтического препарата, например, антигенсвязывающей молекулы, вводят субъекту в отдельный момент времени, например, в разные дни, разделенные заранее определенным интервалом (например, часами, днями, неделями или месяцами). В настоящее изобретение включены способы, которые предусматривают последовательное введение пациенту однократной начальной дозы антигенсвязывающей молекулы, называемой нагрузочной дозой, а затем одной или более вторичных доз антигенсвязывающей молекулы, и необязательно затем одной или более третичных доз антигенсвязывающей молекулы. В настоящее изобретение включены способы, которые предусматривают последовательное введение пациенту однократной начальной дозы агониста 4-1ВВ, называемой нагрузочной дозой, а затем одной или более вторичных доз агониста 4-1ВВ, и необязательно затем одной или более третичных доз агониста 4-1ВВ.
[00214] Термины «начальная доза», «вторичные дозы» и «третичные дозы» относятся к временной последовательности введения антигенсвязывающей молекулы и/или агониста 4-1ВВ, применимых в данном документе. Таким образом, «начальная доза» представляет собой дозу, которую вводят в начале схемы лечения (также называется «исходной дозой»); «вторичные дозы» представляют собой дозы, которые вводят после начальной дозы; и «третичные дозы» представляют собой дозы, которые вводят после вторичных доз. Все из начальной, вторичной и третичной доз могут содержать одинаковое количество антигенсвязывающей молекулы (или агониста 4-1ВВ), но обычно могут отличаться друг от друга по частоте введения. Однако в определенных вариантах осуществления количество антигенсвязывающей молекулы (или агониста 4-1ВВ), содержащегося в начальной, вторичной и/или третичной дозах, отличается друг от друга (например, при необходимости корректируется в сторону повышения или понижения) на протяжении курса лечения. В определенных вариантах осуществления две или более (например, 2, 3, 4 или 5) доз вводятся в начале режима лечения как «нагрузочные дозы», а затем последующие дозы вводятся с меньшей частотой (например, «поддерживающие дозы»).
[00215] В одном иллюстративном варианте осуществления настоящего изобретения каждую вторичную и/или третичную дозу вводят через 1-26 (например, 1, 1½ 2, 2½, 3, 3½, 4, 4½, 5, 5½, 6, 6½, 7, 7½, 8, 8½, 9, 9½, 10, 10½, 11, 11½, 12, 12½, 13, 13½, 14, 14½, 15, 15½, 16, 16½, 17, 17½, 18, 18½, 19, 19½, 20, 20½, 21, 21½, 22, 22½, 23, 23½, 24, 24½, 25, 25½, 26, 26½ или более) недель после непосредственно предшествующей дозы. Используемая в данном документе фраза «непосредственно предшествующая доза» означает дозу антигенсвязывающей молекулы (или агониста 4-1ВВ) в последовательности из нескольких введений, которую вводят пациенту перед введением ближайшей следующей дозы в последовательности без введения промежуточных доз.
[00216] Способы согласно данному аспекту настоящего изобретения могут включать введение пациенту любого количества вторичных и/или третичных доз агониста 4-1ВВ, антитела к MUC16 или биспецифической антигенсвязывающей молекулы, которая специфически связывает MUC16 и CD3. Например, в определенных вариантах осуществления пациенту вводят только одну вторичную дозу. В других вариантах осуществления пациенту вводят две или более (например, 2, 3, 4, 5, 6, 7, 8 или более) вторичных доз. Аналогичным образом в определенных вариантах осуществления пациенту вводят только одну третичную дозу. В других вариантах осуществления пациенту вводят две или более (например, 2, 3, 4, 5, 6, 7, 8 или более) третичных доз.
[00217] В вариантах осуществления, включающих несколько вторичных доз, каждую вторичную дозу можно вводить с той же частотой, что и другие вторичные дозы. Например, каждую вторичную дозу можно вводить пациенту через 12 недели после введения непосредственно предшествующей дозы. Аналогичным образом в вариантах осуществления, включающих несколько третичных доз, каждую третичную дозу можно вводить с той же частотой, что и другие третичные дозы. Например, каждую третичную дозу можно вводить пациенту через 2-4 недели после введения непосредственно предшествующей дозы. В качестве альтернативы частота, с которой пациенту вводят вторичные и/или третичные дозы, может варьироваться на протяжении схемы лечения. Врач может корректировать частоту введения в ходе курса лечения в зависимости от потребностей отдельного пациента после клинического обследования.
Пути применения антител в диагностике
[00218] Биспецифические антитела по настоящему изобретению также можно использовать для выявления и/или измерения содержания MUC16 или MUC16-экспрессирующих клеток в образце, например для диагностических целей. Например, антитело к MUC16 или его фрагмент можно использовать для диагностики состояния или заболевания, характеризующихся аберрантной экспрессией (например, сверхэкспрессией, недостаточной экспрессией, отсутствием экспрессии и т.д.) MUC16. Иллюстративные диагностические анализы в отношении MUC16 могут предусматривать, например, приведение образца, полученного от субъекта, в контакт с антителом kMUC16 или биспецифическим антителом к MUC16xCD3, где антитело помечено выявляемой меткой или репортерной молекулой. В качестве альтернативы, в диагностических вариантах применения можно использовать немеченое антитело к MUC16 или биспецифическое антитело к MUC16xCD3 в комбинации с вторичным антителом, которое как таковое помечено для обеспечения выявления. Обнаруживаемая метка или репортерная молекула могут представлять собой радиоактивный изотоп, такой как 3Н, 14С, 32Р, 35S или 125I; флуоресцентный или хемилюминесцентный фрагмент, такой как флуоресцеинизотиоцианат или родамин; или фермент, такой как щелочная фосфатаза, бета-галактозидаза, пероксидаза хрена или люцифераза. Другое иллюстративное диагностическое применение биспецифических антител к MUC16xCD3, применимых в данном документе, включает антитела, меченные 89Zr, например меченные 89Zr-десфероксамином, для целей неинвазивной идентификации и отслеживания опухолевых клеток в организме субъекта (например посредством визуализации с помощью позитронно-эмиссионной томографии (PET)). (См., например, Tavare, R. et al. Cancer Res. 2016 Jan 1;76(1):73-82; and Azad, BB. et al. Oncotarget. 2016 Mar 15; 7(11): 12344-58.) Конкретные иллюстративные анализы, которые можно использовать для выявления или измерения содержания MUC16 в образце, включают твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA) и сортировку флуоресцентно-активированных клеток (FACS).
[00219] Образцы, которые можно использовать в диагностических анализах в отношении MUC16 согласно настоящему изобретению, включают образец любой ткани или жидкости, который можно получить от пациента и который содержит выявляемые количества белка MUC16 или его фрагментов в нормальном или патологическом состояниях. Обычно для первоначального определения исходного или стандартного уровня MUC16 будут измеряться уровни MUC16 в конкретном образце, полученном от здорового пациента (например пациента, не пораженного заболеванием или состоянием, ассоциированными с аномальными уровнями или активностью MUC16). Данный исходный уровень MUC16 затем можно сравнивать с уровнями MUC16, измеренными в образцах, полученных от индивидуумов с подозрением на наличие заболевания или состояния, связанных с MUC16 (например опухоли, содержащей MUC16-экспрессирующие клетки).
ПРИМЕРЫ
[00220] Следующие примеры представлены с тем, чтобы обеспечить специалистов средней квалификации в данной области техники полным раскрытием и описанием того, как осуществлять и применять способы и композиции, применимые в данном документе, и они не предполагают ограничение объема того, что авторы настоящего изобретения рассматривают в качестве своего изобретения. Были приложены усилия для обеспечения точности в используемых числах (например, количествах, температуре и т.п.), однако необходимо учитывать некоторые экспериментальные погрешности и отклонения. Если не указано иное, то части являются частями по весу, молекулярная масса представляет собой среднюю молекулярную массу, температура представлена в градусах Цельсия, а давление является атмосферным или близким к атмосферному.
Пример 1. Получение биспецифических антител, которые связывают MUC16 и CD3
[00221] Настоящее изобретение предусматривает антитела к MUC16, применимые согласно способам, раскрытым в данном документе. Антитела получали согласно раскрытию, представленному в U.S. 2018/0112001. Иллюстративные антитела, применимые в данном документе, включают антитело Н1Н8767Р, а также последовательности CDR, HCVR и LCVR, охватываемые этим антителом. Таким образом, иллюстративное антитело к MUC16 или его антигенсвязывающий фрагмент содержат HCVR под SEQ ID NO: 18 (SEQ ID NO: 1, в данном документе) и LCVR под SEQ ID NO: 26 (SEQ ID NO: 3, в данном документе), раскрытые в U.S. 2018/0112001.
[00222] Настоящее изобретение также предусматривает биспецифические антигенсвязывающие молекулы, которые связывают CD3 и муцин 16 (MUC16); такие биспецифические антигенсвязывающие молекулы также обозначаются в данном документе как «биспецифические молекулы к MUC16/CD3». Связывающая MUC16 часть биспецифической молекулы к MUC16/CD3 применима для нацеливания на опухолевые клетки, которые экспрессируют MUC16, а связывающая CD3 часть биспецифической молекулы применима для активации Т-клеток. Одновременное связывание MUC16 на опухолевой клетке и CD3 на Т-клетке облегчает направленное уничтожение (клеточный лизис) подвергаемой нацеливанию опухолевой клетки под действием активированной Т-клетки.
[00223] Биспецифические антитела, содержащие MUC16-специфический связывающий домен и CD3-специфический связывающий домен, конструировали с применением стандартных методик, где каждый из антигенсвязывающего домена к MUC16 и антигенсвязывающего домена к CD3 содержат разные, отличающиеся HCVR, спаренные с общей LCVR. В случае биспецифических антител молекулы конструировали с использованием тяжелой цепи из антитела к CD3, тяжелой цепи из антитела к MUC16 и общей легкой цепи из антитела к MUC16. В других случаях биспецифические антитела можно конструировать с использованием тяжелой цепи из антитела к CD3, тяжелой цепи из антитела к MUC16 и легкой цепи из антитела к CD3 или легкой цепи антитела, которая, как известно, является «промискуитетной» или эффективно образует пару с множеством плеч тяжелых цепей.
[00224] Краткое описание составных частей иллюстративной конструкции биспецифического антитела к MUC16xCD3 изложено в таблице 1.

Пример 2. Модель ксеногенного асцита с клетками OVCAR-3, экспрессирующими люциферазу
[00225] Эффективность in vivo биспецифического антитела к MUC16/CD3 в комбинации с костимуляцией 4-1ВВ первоначально оценивали на ксеногенной модели опухоли. В случае ксеногенной модели асцита клетки из линии клеток OVCAR-3/Luc, ранее пассированные in vivo (день 0), интраперитонеально вводили мышам NSG (Nod scid гамма) через тринадцать дней после прививания с помощью РВМС человека. Пять мышей в каждой группе интраперитонеально обрабатывали с помощью MUC16XCD3 в дозе 12,5 мкг/мышь или СО3-связывающим контрольным антителом отдельно или в комбинации с антителом к 4-1ВВ человека в дозе 100 мкг/мышь (клон LOB12.3 из BioXcell, Лебанон, Нью-Гэмпшир) в дни 5 и 8. Опухолевую нагрузку оценивали посредством визуализации биолюминесценции (BLI; измерение люминесценции) в дни 4, 8, 12, 15, 20 и 25 после имплантаций опухоли.
[00226] Расчет опухолевого роста ксенотрансплантата и подавление: BLI использовали для измерения опухолевой нагрузки. Мышам IP вводили 150 мг/кг (как определено по значениям веса тела в начале эксперимента) субстрата люциферазы D-люциферина, суспендированного в PBS. Через десять минут после введения дозы проводили ВЫ-визуализацию мышей под анестезией с помощью изофлурана с применением системы Xenogen IVIS. Получение изображения проводили с полем обзора D, высотой объекта 1,5 см и средним уровнем биннинга в течение времени экспозиции 0,5 мин. BLI-сигналы получали с применением программного обеспечения Living Image. Представляющие интерес области очерчивали вокруг каждой опухолевой массы и значения интенсивности испускания фотонов регистрировали в виде ф/с/см2/ср. Статистический анализ проводили с применением программного обеспечения GraphPad Prism (версия 6). Статистическую значимость результатов BLI определяли с применением непарного непараметрического т-критерия Манна-Уитни.
[00227] Показанные данные представляют собой опухолевую нагрузку, оцененную посредством BLI в день 4 после имплантации опухоли (таблица 2 и фигура 1). Статистическую значимость определяли с применением непарных непараметрических t-критериев Манна-Уитни. Имело место незначительное различие в опухолевой нагрузке между группами в день 4 (демонстрируя, что все группы характеризовались сходной опухолевой нагрузкой в начале исследования).

[00228] В таблице 3 показана опухолевая нагрузка, оцененная посредством BLI в день 25 после имплантации опухоли (см. также фигуру 2). Статистическую значимость определяли с применением непарных непараметрических t-критериев Манна-Уитни. Группы сравнивали с контрольным CD3-связывающим антителом (*р=0,0159 для MUC16XCD3, **р<0,0079 для MUC16XCD3 и комбинации с антителом к 4-1ВВ). Комбинацию MUC16XCD3 и антитела к 4-1ВВ также сравнивали с MUC16XCD3 отдельно (#р=0,0159). MUC16XCD3 в значительной степени снижало опухолевую нагрузку при 12,5 мкг по сравнению с опухолевой нагрузкой после обработки CD3-связывающим контрольным антителом, и добавление антитела к 4-1ВВ повышало противоопухолевую эффективность по сравнению с MUC16XCD3 отдельно.
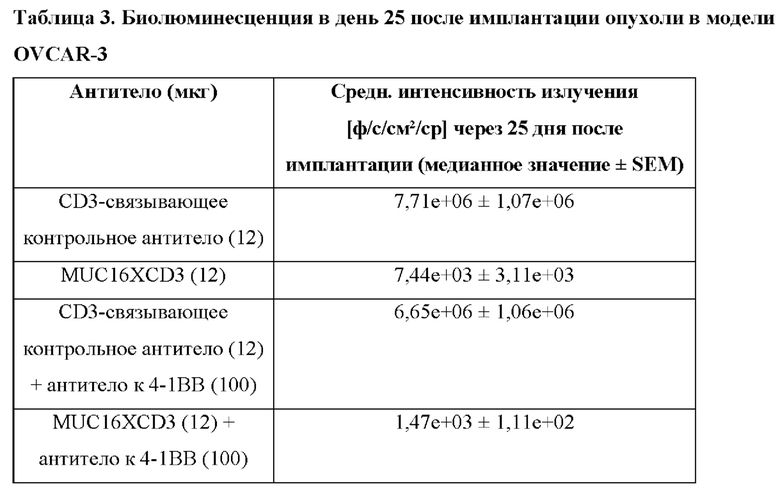
Пример 3. Обработка с помощью MUC16xCD3+4-1ВВ на модели сингенного асцита
[00229] Для оценки эффективности в иммунокомпетентной модели ген CD3 мыши заменяли на CD3 человека и часть гена MUC16 мыши заменяли на последовательность человека. В результате мыши имеют Т-клетки, которые экспрессируют CD3 человека и у мышей экспрессируется химерная молекула MUC16, содержащая часть MUC16 человека, при этом биспецифические антитела связываются с MUC16xCD3. Мышам имплантировали клетки ID8-VEGF/huMUC16 (линия клеток опухоли яичника мыши, сконструированная для экспрессии части MUC16 человека) внутрибрюшинно и обработку антителами проводили внутривенно, и начинали в день 3 после имплантации опухоли. Мышам вводили либо MUC16XCD3 (1 мг/кг IV) либо контрольное CD3-связывающее антитело (1 мг/кг IV) с изотипическим контролем в дни 3, 6 и 10 после имплантации или с антителом к 4-1ВВ мыши (2,5 мг/кг IV) в день 3 после имплантации с последующим введением двух дополнительных доз MUC16XCD3 (1 мг/кг IV) в дни 6 и 10. В каждой группе было 8-12 мышей. Мышей умерщвляли, если они характеризовались набором веса, составляющим более чем 30%, вследствие асцит-индуцированного вздутия брюшной полости. Статистическую значимость определяли с применением метода Гехана-Бреслоу-Уилкоксона.
[00230] Обработка с помощью MUC16XCD3 в значительной степени повышало медианную выживаемость на модели асцита ID8-VEGF/huMUC16, и добавление костимуляции 4-1ВВ обеспечивало выживание нескольких мышей. Для статистического анализа группы сравнивали с контрольным CD3-связывающим антителом (**р=0,0026 для MUC16XCD3, ****р<0,0001 для MUC16XCD3 с антителом к 4-1ВВ). Кроме того, для определения того, приводит ли добавление антитела к 4-1ВВ к любому полезному результату по сравнению с MUC16XCD3 отдельно, антитело к 4-1ВВ сравнивали с MUC16XCD3 отдельно (#р=0,0168). MUC16XCD3 повысило медианную выживаемость с группой, обработанной контрольным CD3-связывающим антителом, а также % выживших мышей (с 0 до 27%). Медианную выживаемость для группы с комбинацией MUC16XCD3 + антитело к 4-1ВВ не удалось определить, поскольку выжило более 50% мышей. Общая выживаемость в группе, обработанной комбинацией, составляла 55%) (таблица 4 и фигура 3). Такие эффекты наблюдали без какой-либо значительный потери веса в ходе периода введения, которую использовали в качестве показателя токсичности (таблица 5 и фигура 4).
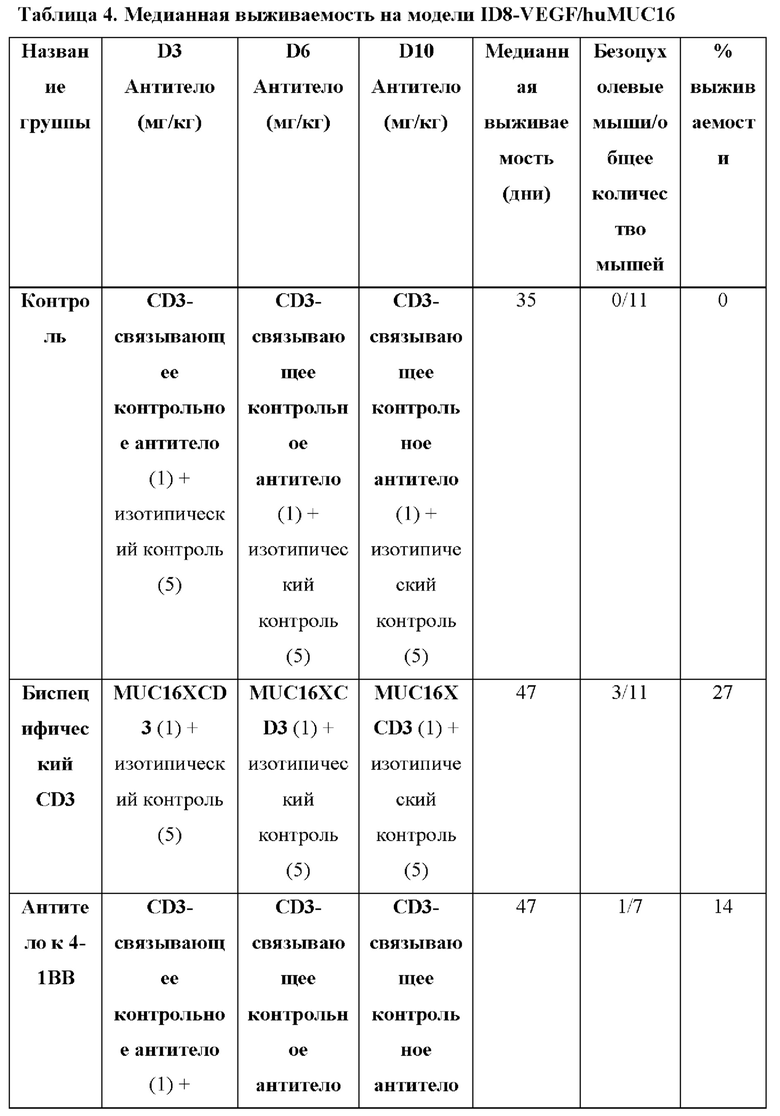
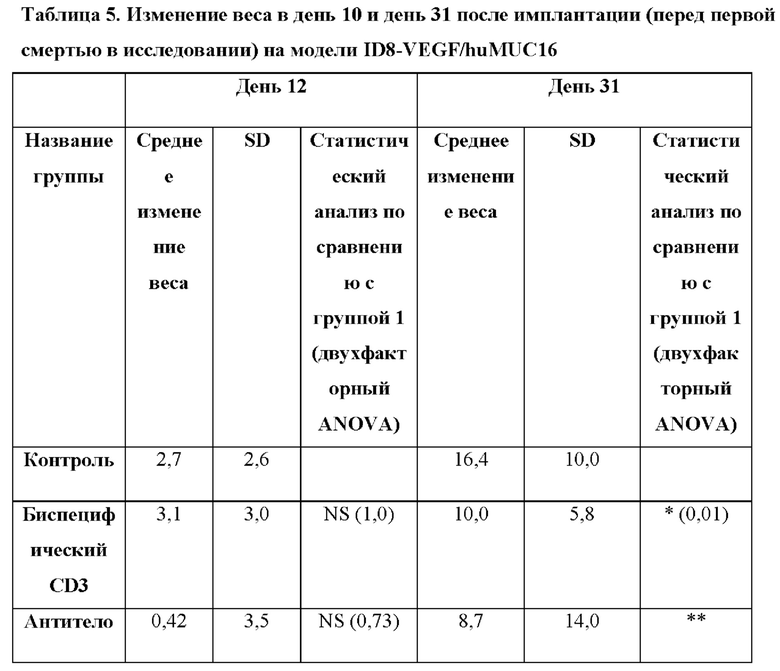
[00231] В дополнение к исходной противоопухолевой эффективности мышей также оценивали в отношении любого ответа с образованием клеток памяти и распространением эпитопа. На день 116 после имплантации безопухолевым мышам повторно вводили исходную ID8-VEGF посредством подкожной имплантации. Девять необработанных мышей также включали в качестве контроля в отношении опухолевого роста. Показанные данные представляют собой число безопухолевых мышей после повторного введения (таблица 6). У двух из трех мышей, обработанных с помощью MUC16XCD3, опухоль исчезала после вторичного введения исходной линии опухолевых клеток, не экспрессирующих MUC16. Кроме того, у всех из 5 мышей, обработанных комбинацией MUC16XCD3 + антитело к 4-1ВВ опухоли исчезали. Это показывает, что было возможно формирование ответа с образованием клеток памяти с использованием таких двух режимов обработки.
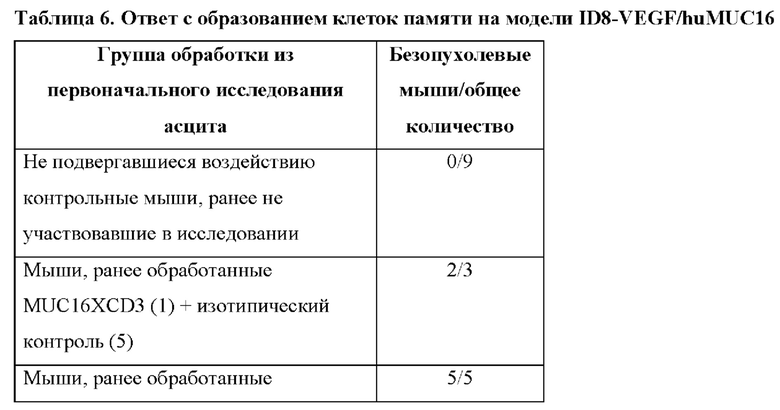

Пример 4. Обработка с помощью MUC16XCD3 + 4-1ВВ на модели ID8-VEGF/huMUC16
[00232] Как и в примере 3, мышам, экспрессирующим CD3 человека вместо CD3 мыши и химерную молекулу MUC16, имплантировали линию клеток опухоли яичника мыши, экспрессирующих часть MUC16 человека. Три режима введения доз тестировали с 9-10 мышами на обработку в каждом режиме введения.
A) Комбинация либо MUC16XCD3 (1 мг/кг внутривенно), либо CD3-связывающего контрольного антитела (1 мг/кг внутривенно) либо с изотопическим контролем (2,5 мг/кг IV), либо с антителом к 4-1ВВ мыши (2,5 мг/кг внутривенно) в дни 3, 7 и 10 после имплантации.
B) Одна доза комбинации MUC16XCD3 (1 мг/кг внутривенно) плюс антитело к 4-1ВВ мыши (2,5 мг/кг внутривенно) в день 3 после имплантации с последующими дозами MUC16XCD3(1 мг/кг внутривенно) в дни 7 и 10 после имплантации.
C) Одна доза комбинации MUC16XCD3 (1 мг/кг внутривенно) или CD3-связывающего контрольного антитела (1 мг/кг внутривенно) плюс антитело к 4-1ВВ мыши (2,5 мг/кг внутривенно) в день 3 после имплантации без дополнительных обработок.
[00233] Показанные данные представляют собой медианную выживаемость в день 67 после имплантации опухоли. См. таблицу 7 и фигуру 5. Мышей умерщвляли перед днем 67 если они характеризовались набором веса, составляющим более чем 30%, вследствие асцит-индуцированного вздутия брюшной полости. Статистическую значимость определяли с применением метода Гехана-Бреслоу-Уилкоксона. Для статистического анализа группы сравнивали с контрольным CD3-связывающим антителом (**р=0,002 для MUC16XCD3, ****р<0,0001 для всех трех групп, состоящих из MUC16XCD3 и комбинации с антителом к 4-1ВВ). Кроме того, для определения того, приводит ли применение комбинации с антителом к 4-1ВВ к какому-либо полезному результату по сравнению с MUC16XCD3 отдельно, все группы сравнивали с данной группой (#р=0,011 для Gp4 (3 дозы биспецифического антитела к CD3 + 3 дозы антитела к 4-1ВВ), #р=0,027 для Gp5 (3 дозы биспецифического антитела к CD3 + только 1 доза антитела к 4-1ВВ), #р=0,011 для Gp7 (одна доза биспецифического антитела к CD3 + антитело к 4-1ВВ)). Мыши, обработанные MUC16xCD3+антитело к 4-1ВВ, демонстрировали эффективность и долгосрочную выживаемость. Такие эффекты наблюдали без какой-либо значительный потери веса в ходе периода введения, которую использовали в качестве показателя токсичности (таблица 8 и фигура 6).
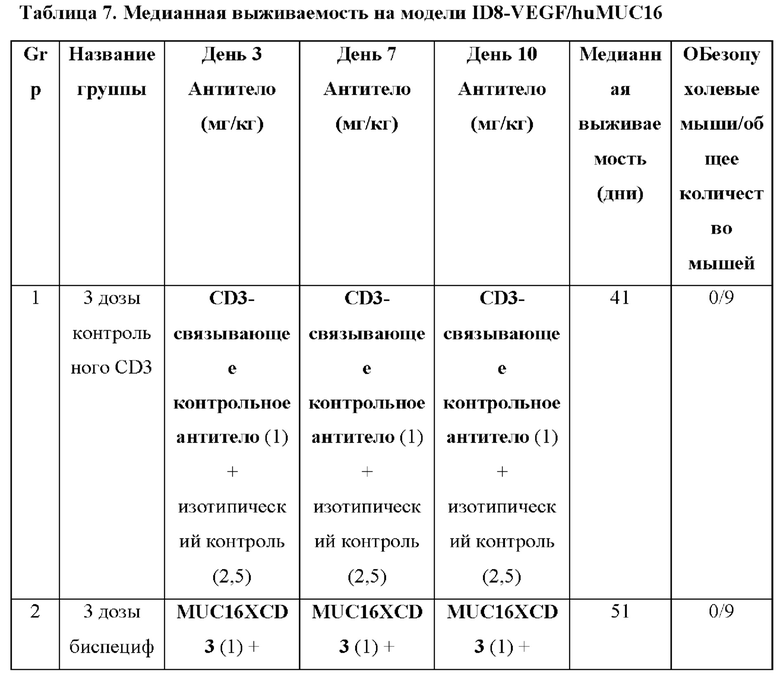
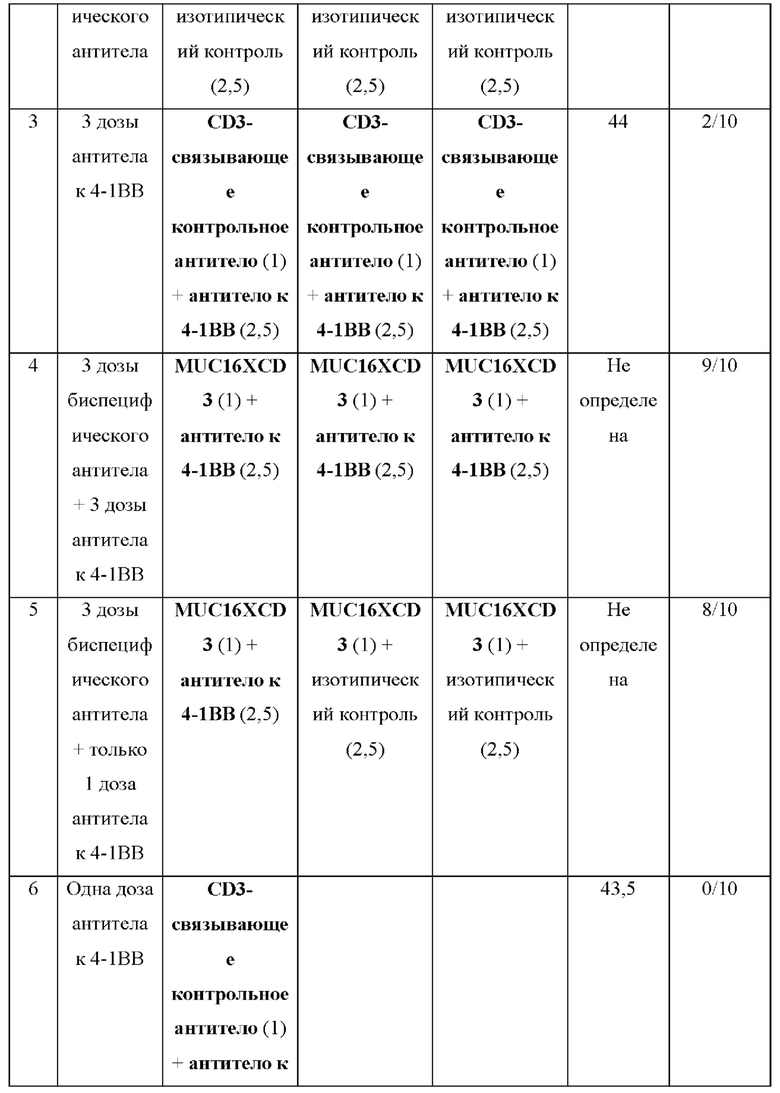

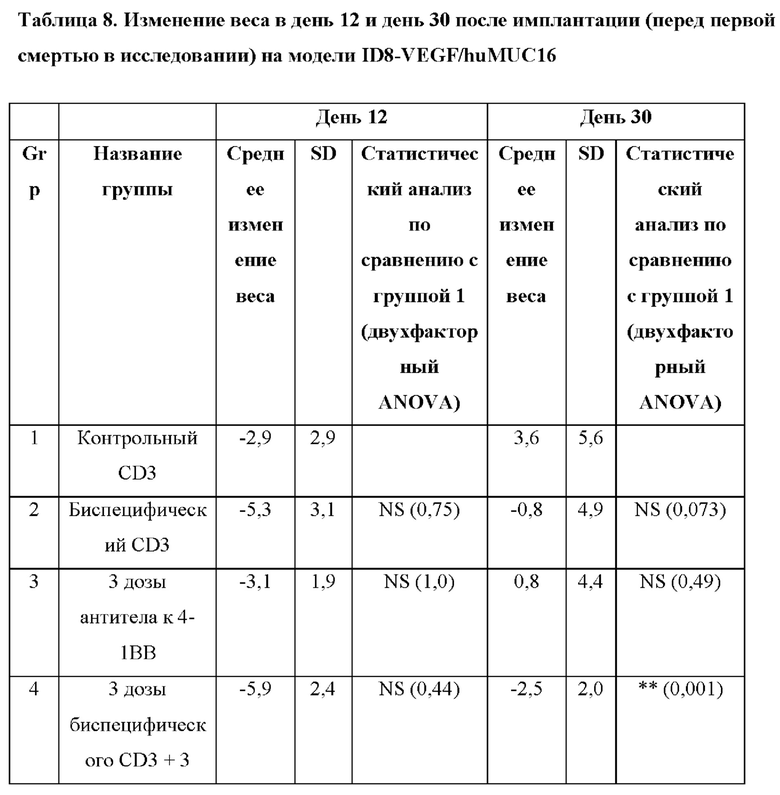
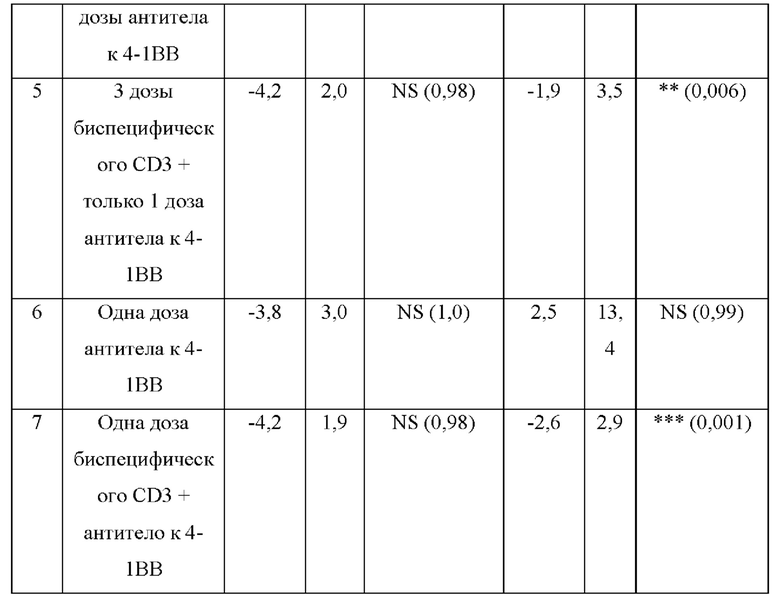
Выводы
[00234] Биспецифическое антитело к CD3, нацеливающееся на опухолевый антиген MUC16 (MUC16), демонстрирует доклиническую эффективность на нескольких мышиных моделях. MUC16xCD3 в комбинации с антителом к 4-1ВВ обеспечивал устойчивую противоопухолевую активность, что приводит к долгосрочному выживанию мышей, демонстрируя, что костимуляция может повысить эффективность биспецифических антител к MUC16xCD3 в отношении солидных опухолей на поздних стадиях. Такие эффекты наблюдали в отсутствие потери веса у мышей; потерю веса использовали в качестве показателя токсичности. Кроме того, ответ с образованием клеток памяти возникал при повторной инъекции опухолевых клеток, в которых отсутствует антиген MUC16, что демонстрирует устойчивый противоопухолевый ответ, который не зависел от ответов на антиген MUC16.
[00235] Объем настоящего изобретения не ограничен конкретными вариантами осуществления, описанными в данном документе. В действительности различные модификации настоящего изобретения в дополнение к описанным в данном документе будут очевидны специалистам в данной области техники на основании вышеизложенного описания. Предполагается, что такие модификации входят в объем прилагаемой формулы изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Regeneron Pharmaceuticals, Inc.
Kirshner, Jessica R.
Crawford, Alison
Chiu, Danica
<120> ПРИМЕНЕНИЕ БИСПЕЦИФИЧЕСКИХ АНТИГЕНСВЯЗЫВАЮЩИХ МОЛЕКУЛ, КОТОРЫЕ
СВЯЗЫВАЮТ MUC16 И CD3, В КОМБИНАЦИИ С КОСТИМУЛЯЦИЕЙ 4-1BB
<130> 10604WO01
<140> TBA
<141> 2020-06-19
<150> 62/864,960
<151> 2019-06-21
<160> 6
<170> Версия PatentIn 3.5
<210> 1
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 1
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Tyr Ile Ser Gly Arg Gly Ser Thr Ile Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Ile Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Val Lys Asp Arg Gly Gly Tyr Ser Pro Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 2
<211> 124
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ser Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Lys Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Tyr Gly Ser Gly Tyr Gly Lys Phe Tyr His Tyr Gly Leu Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 3
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 3
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Thr Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Thr Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Pro
85 90 95
Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 4
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 4
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Tyr Ile Ser Gly Arg Gly Ser Thr Ile Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Ile Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Val Lys Asp Arg Gly Gly Tyr Ser Pro Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
225 230 235 240
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
245 250 255
Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn
260 265 270
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
275 280 285
Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
290 295 300
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
305 310 315 320
Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys
325 330 335
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu
340 345 350
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
355 360 365
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
370 375 380
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
385 390 395 400
Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly
405 410 415
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
420 425 430
Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 5
<211> 450
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ser Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Lys Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Tyr Gly Ser Gly Tyr Gly Lys Phe Tyr His Tyr Gly Leu Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu
130 135 140
Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn
195 200 205
Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser
210 215 220
Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu
260 265 270
Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 6
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Thr Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Thr Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Pro
85 90 95
Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| HER-2-НАПРАВЛЕННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СОДЕРЖАЩИЕ 4-1BBL | 2019 |
|
RU2815451C2 |
| ПРИМЕНЕНИЕ БИСПЕЦИФИЧЕСКИХ АНТИГЕНСВЯЗЫВАЮЩИХ МОЛЕКУЛ, КОТОРЫЕ СВЯЗЫВАЮТ PSMA И CD3, В КОМБИНАЦИИ С КОСТИМУЛЯЦИЕЙ 4-1BB | 2020 |
|
RU2822092C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CD3 | 2017 |
|
RU2790288C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CD3 | 2017 |
|
RU2807216C2 |
| НОВОЕ PSMA-СВЯЗЫВАЮЩЕЕ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЯ | 2017 |
|
RU2762704C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2020 |
|
RU2841523C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С HLA-A2/WT1 | 2018 |
|
RU2815176C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CD3 | 2017 |
|
RU2779489C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2810924C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕСЯ С 4-1ВВ | 2011 |
|
RU2551963C2 |
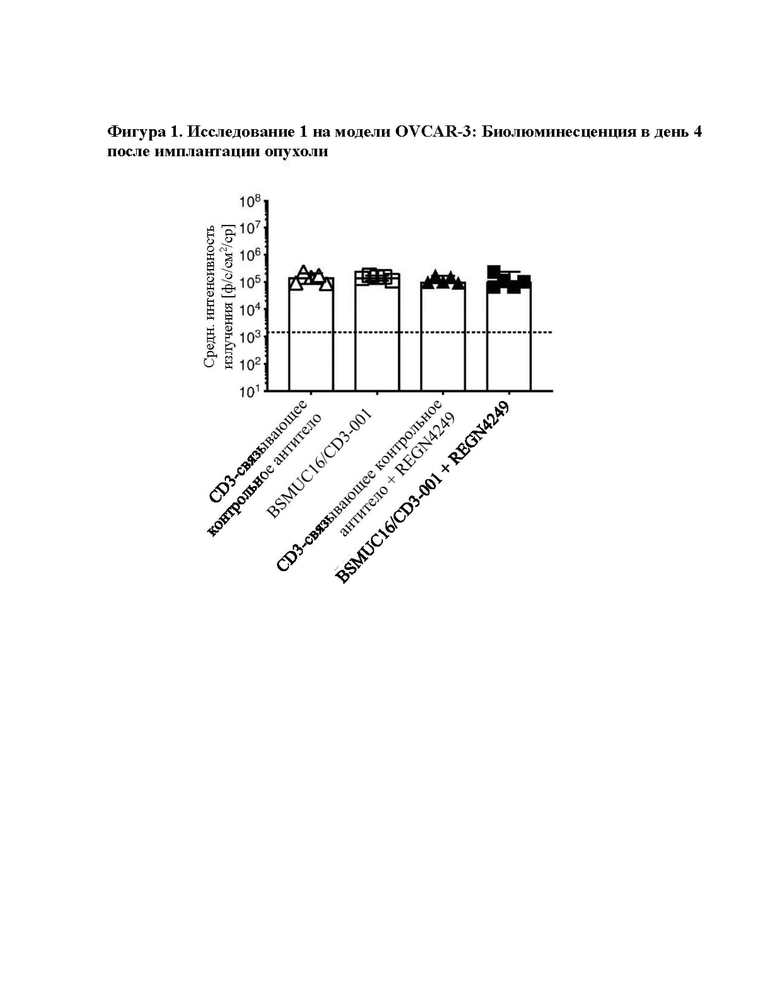
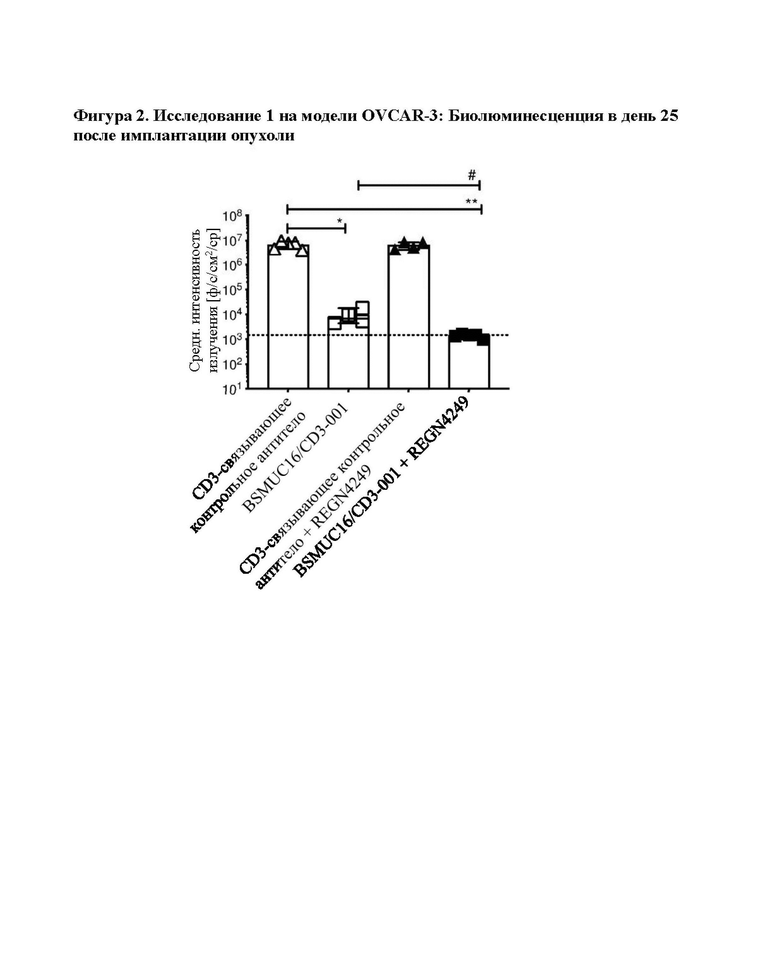
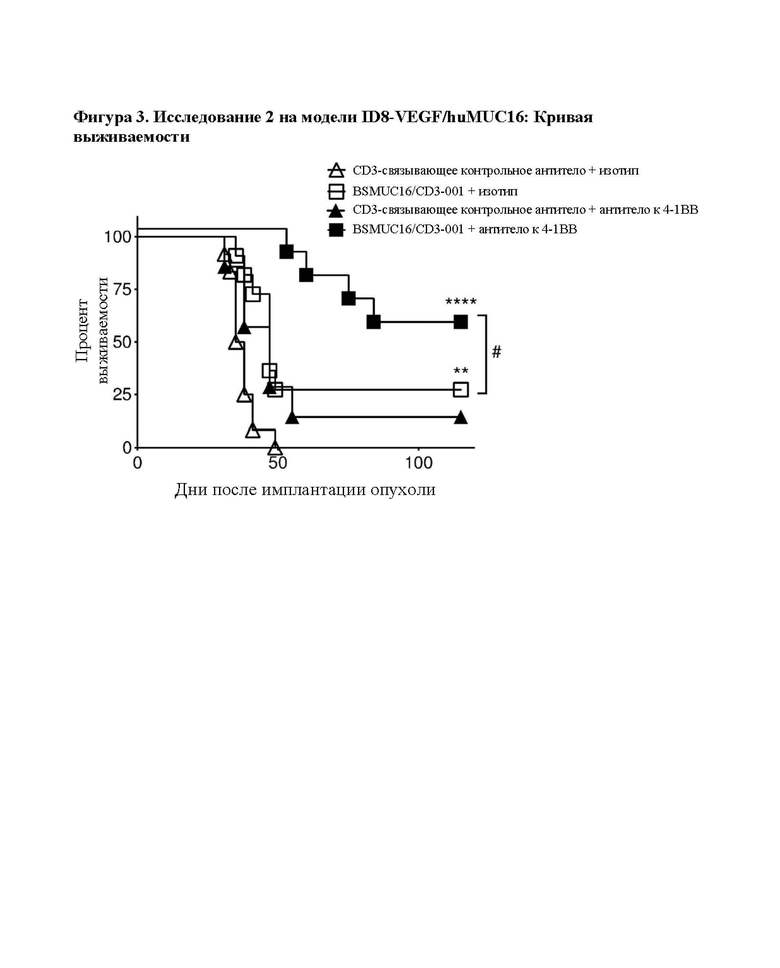
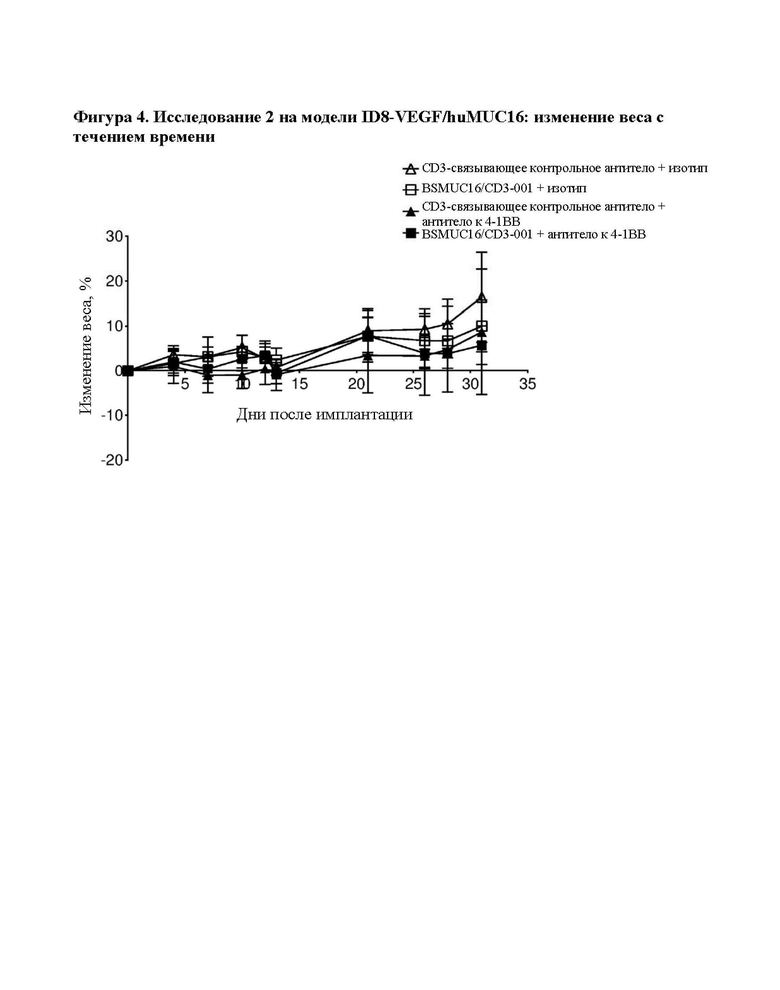
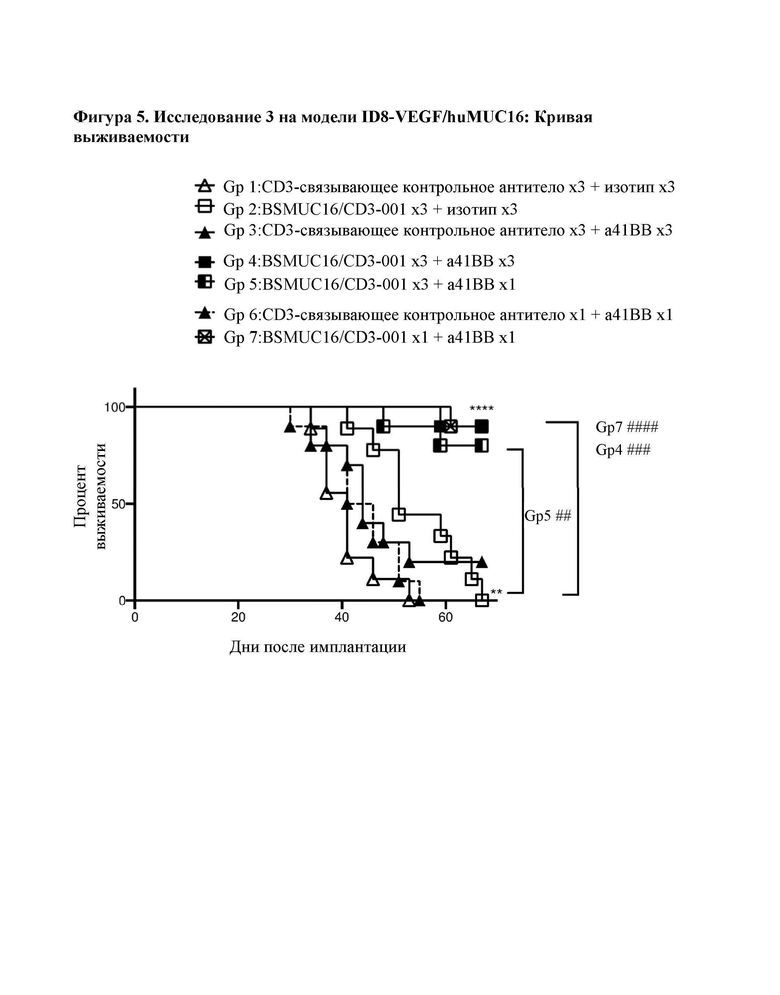
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая применение биспецифической антигенсвязывающей молекулы к CD3/MUC16 и агониста 4-1BB для лечения MUC16-положительного рака или подавления роста MUC16-положительной опухоли и фармацевтическую комбинацию для лечения MUC16 положительного рака или подавления роста MUC16-положительной опухоли. В одном варианте реализации биспецифическая антигенсвязывающая молекула к CD3/MUC16 содержит аминокислотную последовательность вариабельной области тяжелой цепи SEQ ID NO: 1 и вариабельную область легкой цепи SEQ ID NO: 3. Изобретение расширяет арсенал средств для лечения MUC16-положительного рака. 2 н. и 22 з.п. ф-лы, 6 ил., 8 табл., 4 пр.
1. Применение биспецифической антигенсвязывающей молекулы к CD3/MUC16 и агониста 4-1ВВ для лечения МUС16-положительного рака или подавления роста МUС16-положительной опухоли, где биспецифическая антигенсвязывающая молекула к CD3/MUC16 содержит:
первый антигенсвязывающий домен, который специфически связывает CD3 человека; и
второй антигенсвязывающий домен, который специфически связывает MUC16 человека и содержит три аминокислотные последовательности определяющей комплементарность области тяжелой цепи (HCDR1-2, HCDR2-2 и HCDR3-2) в пределах аминокислотной последовательности вариабельной области тяжелой цепи (HCVR-2) под SEQ ID NO: 1 и три аминокислотные последовательности определяющей комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3) в пределах аминокислотной последовательности вариабельной области легкой цепи (LCVR), содержащей SEQ ID NO: 3; и
где агонист 4-1ВВ представляет собой антитело к 4-1ВВ.
2. Применение по п. 1, где рак выбран из группы, состоящей из рака молочной железы, рака яичника, рака роговицы, рака поджелудочной железы, рака эндометрия, рака фаллопиевой трубы, мезотелиомы, немелкоклеточного рака легкого, внутрипеченочной холангиокарциномы массообразующего типа, рака матки, рака шейки матки, рака желудка или колоректальной карциномы.
3. Применение по п. 2, где рак представляет собой рак яичника.
4. Применение по п. 2, где рак представляет собой рак молочной железы.
5. Применение по п. 1, где биспецифическое антитело к CD3/MUC16 и агонист 4-1ВВ вводят по отдельности.
6. Применение по п. 1, где биспецифическое антитело к CD3/MUC16 и агонист 4-1ВВ вводят совместно.
7. Применение по п. 1, где биспецифическое антитело к CD3/MUC16 вводят до, одновременно или после введения агониста 4-1ВВ.
8. Применение по п. 7, где биспецифическое антитело к CD3/MUC16 вводят до введения агониста 4-1ВВ.
9. Применение по п. 7, где биспецифическое антитело к CD3/MUC16 вводят в тот же день, что и агонист 4-1ВВ.
10. Применение по любому из пп. 1-9, где биспецифическое антитело к CD3/MUC16 вводят в комбинации с агонистом 4-1ВВ.
11. Применение по п. 1, где антитело к 4-1ВВ представляет собой антитело, выбранное из группы, состоящей из урелумаба и утомилумаба.
12. Применение по любому из пп. 1-11, где первый антигенсвязывающий домен, который специфически связывает CD3 человека, содержит аминокислотную последовательность вариабельной области тяжелой цепи (HCVR-1) под SEQ ID NO: 2.
13. Применение по любому из пп. 1-12, где второй антигенсвязывающий домен, который специфически связывает MUC16 человека, содержит аминокислотную последовательность HCVR-2 под SEQ ID NO: 1.
14. Применение по любому из пп. 1-13, где первый антигенсвязывающий домен, который специфически связывает CD3, содержит аминокислотную последовательность HCVR-1 под SEQ ID NO: 2 и второй антигенсвязывающий домен, который специфически связывает MUC16, содержит аминокислотную последовательность HCVR-2 под SEQ ID NO: 1.
15. Применение по любому из пп. 1-14, где биспецифическая антигенсвязывающая молекула содержит аминокислотную последовательность общей вариабельной области легкой цепи (LCVR) под SEQ ID NO: 3.
16. Применение по п. 1, где объем опухоли уменьшается по сравнению с объемом опухоли у субъекта, которому вводили биспецифическую антигенсвязывающую молекулу к CD3/MUC16 в отсутствие агониста 4-1ВВ.
17. Применение по п. 1, где безопухолевая выживаемость у субъекта повышается по сравнению с безопухолевой выживаемостью у субъекта, которому вводили биспецифическую антигенсвязывающую молекулу к CD3/MUC16 в отсутствие агониста 4-1ВВ.
18. Применение по п. 17, где повышение безопухолевой выживаемости происходит без потери веса у субъекта.
19. Применение по п. 1, где последующее воздействие опухолевых клеток инициирует ответ с участием клеток памяти у субъекта, подвергавшегося лечению биспецифической антигенсвязывающей молекулой к CD3/MUC16 в присутствии агониста 4-1ВВ.
20. Фармацевтическая комбинация для лечения MUC16 положительного рака или подавления роста МиС16-положительной опухоли, содержащая:
(a) биспецифическую антигенсвязывающую молекулу к CD3/MUC16, содержащую: (i) первый антигенсвязывающий домен, который специфически связывает CD3 человека, и (ii) второй антигенсвязывающий домен, который специфически связывает MUC16 человека и содержит три аминокислотные последовательности определяющей комплементарность области тяжелой цепи (HCDR1-2, HCDR2-2 и HCDR3-2) в пределах аминокислотной последовательности вариабельной области тяжелой цепи (HCVR-2) под SEQ ID NO: 1 и три аминокислотные последовательности определяющей комплементарность области легкой цепи (LCDR1, LCDR2 и LCDR3) в пределах аминокислотной последовательности вариабельной области легкой цепи (LCVR), содержащей SEQ ID NO: 3;
(b) агонист 4-1ВВ, где агонист 4-1ВВ представляет собой антитело к 4-1ВВ, и
(c) фармацевтически приемлемый носитель или разбавитель.
21. Фармацевтическая комбинация по п. 20, где биспецифическая антигенсвязывающая молекула из части (а) содержит аминокислотную последовательность общей LCVR под SEQ ID NO: 3.
22. Фармацевтическая комбинация по п. 20, где первый антигенсвязывающий домен, который специфически связывает CD3 человека, содержит аминокислотную последовательность вариабельной области тяжелой цепи (HCVR-1) под SEQ ID NO: 2.
23. Фармацевтическая комбинация по п. 20, где второй антигенсвязывающий домен, который специфически связывает MUC16 человека, содержит аминокислотную последовательность HCVR-2 под SEQ ID NO: 1.
24. Фармацевтическая комбинация по п. 22 или 23, где первый антигенсвязывающий домен, который специфически связывает CD3, содержит аминокислотную последовательность HCVR-1 под SEQ ID NO: 2 и второй антигенсвязывающий домен, который специфически связывает MUC16, содержит аминокислотную последовательность HCVR-2 под SEQ ID NO: 1.
| WO 2018114754 A1, 28.06.2018 | |||
| WO 2018067331 A1, 12.04.2018 | |||
| CD3-ЭПСИЛОН-СВЯЗЫВАЮЩИЙ ДОМЕН С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2008 |
|
RU2561457C2 |
| US 10179819 B2, 15.01.2019. | |||
Авторы
Даты
2024-07-01—Публикация
2020-06-19—Подача