Перекрестная ссылка
Согласно настоящей заявке испрашивается приоритет в соответствии с международной заявкой PCT/CN2016/105042, поданной 8 ноября 2016 г., и в соответствии с международной заявкой PCT/CN2015/095166, поданной 20 ноября 2015 г., обе из которых включены посредством ссылки во всей своей полноте.
Предпосылки создания изобретения
Устойчивость к антибиотикам является серьезным и прогрессирующим явлением в современной медицине, и оказалась основной проблемой здравоохранения 21-го века. Таким образом, новые классы антибиотиков широкого спектра действия, особенно таковых, которые воздействуют на новые механизмы действия, необходимы для борьбы с патогенами с множественной лекарственной устойчивостью.
Сущность изобретения
В настоящем документе описаны новые макроциклические соединения для лечения инфекций, вызываемых микроорганизмами, например, для лечения бактериальных инфекций. В соответствии с различными вариантами осуществления настоящее раскрытие предусматривает липопептидные макроциклические соединения для лечения бактериальных инфекций. В соответствии с различными вариантами осуществления настоящее раскрытие предусматривает классы и подклассы химических соединений, структурно связанных с ариломицином, для лечения бактериальных инфекций. В соответствии с различными вариантами осуществления макроциклические соединения действуют посредством ингибирования бактериальной сигнальной пептидазы 1 типа (SpsB), основного белка у бактерий.
Согласно одному аспекту в настоящем изобретении описано соединение формулы (I):

где:
R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -CH2CH(гетероциклоалкил)CH2NH2, -CH2C(О)NH2, -CH2C(О)N(H)CH2CN, -С1-С6)алкил-С(О)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-C(О)NR25R26, -(C1-C6)алкил-N(R23)C(О)(С1-C6)алкилR21R22 или -(С1-С6)алкил-C(О)N(R23)(С1-C6)алкил или необязательно замещенный гетероциклоалкил;
R3 представляет собой Н или -(С1-С6)алкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(О)NH2; или R3 и R4 объединены с образованием гетероциклоалкильного кольца;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R6, R7 и R8 каждый независимо представляет собой Н или -(Сл-С6)алкил;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R10 представляет собой Н или -(С1-С6)алкил;
R11 и R12 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-C6)алкил-OR23, -(C1-C6)алкил-SR23, -(С1-С6)алкил-С(О)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-CN, -(C1-C6)алкил-C(О)NR25R26, -(С1-С6)гетероалкил-CO2H, -(С1-С6)алкил-S(О)-(С1-С6)алкил, -(С1-С6)алкил-N(Н)СН=NH, -(С1-С6)алкил-N(Н)С(NH)NH2, -(С1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(С1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н;
R15, R16, R17 и R18 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(C1-C6)алкил-OR23, -(C1-C6)алкил-C(О)OR23 или -(С1-С6)алкил-NR21R22;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(С1-С6)алкил-, -N(R24)(С1-С6)алкил-, -N(R24)(С6-С10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(C1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С1-С6)алкил-N(R24)(С1-С6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(С1-С6)алкил-, -N(R24)SO2(С1-C6)алкил, -N(R24)C(О)(С1-C6)алкил-, -С(О)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(О)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(О)N(R24)арил-, необязательно замещенный -N(R24)C(О)арил-, необязательно замещенный -N(R24)SO2арил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -СО2Н, -(С1-С12)алкил,-(Сг-С12)алкенил, -(С2-С12)алкинил, -C(О)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)С(О)(С1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(С1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(О)(С1-С6)алкил, -C(О)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетеро никлоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил;
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R27 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
каждый R28 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
р равно 0, 1 или 2; и
q равно 0, 1 или 2;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно другому аспекту в настоящем изобретении описано соединение формулы (I'):

где:
R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил; -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -CH2CH(гетероциклоалкил)CH2NH2, -CH2C(О)NH2, -CH2C(О)N(H)CH2CN, -(С1-С6)алкил-C(О)OR23, -(С1-C6)алкил-NR21R22, -(С1-C6)алкил-C(О)NR25R26, -(C1-C6)алкил-N(R23)C(О)(C1-C6)aлкилNR21R22, -(С1-C6)алкил-C(О)N(R23)(С1-С6)алкил, -(С1-С1)алкил-C(О)N(R23)(С1-С6)алкилгетероциклоалкил, (С1-C6)гетероалкил или необязательно замещенный гетероциклоалкил;
R3 представляет собой Н или -(С1-С6)алкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(О)NH2; или R3 и R4 объединены с образованием гетероциклоалкильного кольца;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R6, R7 и R8 каждый независимо представляет собой Н, фтор, гидроксил, амино необязательно замещенный ал кил или гетероалкил или - (С1-С6)алкил;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R10 представляет собой Н, -(С1-С6)алкнл, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
или R9 и R10 объединены с образованием гетероциклоалкильного или циклоалкильного кольца;
R11 и R12 каждый независимо представляет собой Н, -NH2, -(C1-С6)алкил, -(C1-С6)алкил-OR23, -(С1-C6)алкил-SR23, -(С1-C6)алкил-C(О)OR23, -(С1-С6)алкил-NR21R22, -(С1-С6)алкил-CN; -(С1-C6)алкил-C(О)NR25R26, -(С1--С6)гетероалкил-CO2H, -(С1-C6)алкил-S(O)-(С1-С6)алкилб -(С1-C6)алкил-N(H)CH=NH, -(С1-С6)алкил-С(NH2)=NH; -(С1-С6)алкил-N(H)C(NH)NH2, -(С1-C6)алкил-N(H)SO2NR25R16, -(С1-C6)акил-N(H)-C(О)NR25R26, -(С1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(С1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н;
R15, R16, R17 и R18 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(C1-C6)алкил-OR23, -(C1-C6)алкил-C(О)OR23 или -(C1-C6)алкил-NR21R22;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(С1-С6)алкил-, -N(R24)(С1-С6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(C1-C6)алкил-N(R24)(C1-C6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(C1-C6)алкил-, -N(R24)SO2(С1-C6)алкил-, -N(R24)C(О)(С1-C6)алкил-, -С(О)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(О)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(О)N(R24)арил-, необязательно замещенный -N(R24)C(О)алкил-, необязательно замещенный -N(R24)SO2apил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -СО2Н, -(С1-С12)алкил,-(С2-С12)алкенил, -(С2-С12)алкинил, -C(О)NR25R26, -O-(С1-С12)алкил, -N(R24)(С1-C12)алкил, -N(R24)C(О)(С1-C12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(С1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(О)(С1-С6)алкил, -С(О)O(С1-С6)алкил, -C(О)O(С1-С6)галогеналкил, -С(=NH)(С1-С6)алкил, -C(=NH)N(R31)2, -C(О)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(Сл-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил;
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R27 независимо представляет собой галоген, -NR23R24, -NC(О)R23, -NC(О)NR23R24), нитро, гадроксил, необязательно замещенный -(С1-С6)алкил, необязательно замещенный -(С1-С6)гетероалкил, -(С1-С6)алкокси, -С(О)(С1-С6)алкил или -S(О)2(С1-С6)алкил;
каждый R28 независимо представляет собой галоген, -NR23R24, -NC(О)R23, -NC(О)NR23R24), нитро, гадроксил, необязательно замещенный -(С1-С6)алкил, необязательно замещенный -(С1-С6)гетероалкил, -(С1-С6)алкокси, -С(О)(С1-С6)алкил или -S(О)2(С1-С6)алкил;
р равно 0, 1 или 2; и
q равно 0, 1 или 2;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (I) или (I'), характеризующееся структурой формулы (Ia):
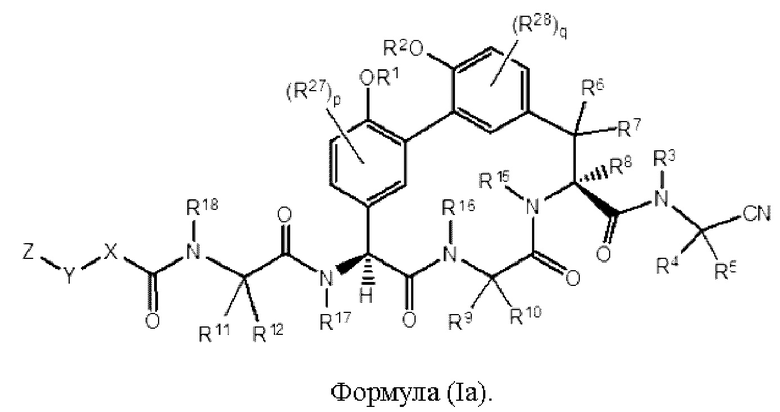
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (I), (I') или (Ia), где R6, R7 и R8 представляют собой Н. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (I), (I') или (Ia), где R15 и R16 представляют собой Н.
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (I) или (I'), характеризующееся структурой формулы (Ib):
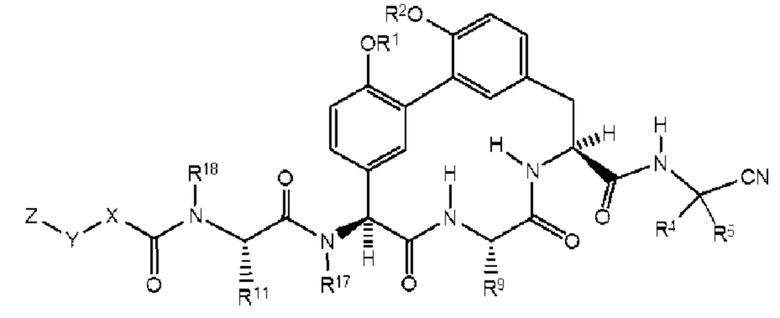

Согласно одному варианту осуществления представлено соединение формулы (I), (I'), (Ia) или (Ib), где R17 представляет собой -СН3. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia) или (Ib), где R1S представляет собой Н. Согласно дополнительным вариантам осуществления представлено соединение формулы (I), (I'), (Ia) или (Ib), где R5 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia) или (Ib), где R4 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia) или (Ib), где R4 представляет собой -(С1-С6)алкил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia) или (Ib), где R4 представляет собой -(С3-С6)циклоалкил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia) или (Ib), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia) или (Ib), где R9 представляет собой -(С1-С6)алкил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia) или (Ib), где R9 представляет собой -СН3.
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (I) или (I'), характеризующееся структурой формулы (Ic):

Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R11 представляет собой -(С1-С6)алкил-OR23. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R11 представляет собой -CH2CH2OH. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R11 представляет собой -(С1-С6)алкил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R11 представляет собой -(С1-С6)алкил-NR21R22. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R11 представляет собой -(C1-С2)алкил-NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R11 представляет собой -CH2NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R11 представляет собой -CH2CH2CH2NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R11 представляет собой -CH2CH2CH2CH2NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R11 представляет собой -CH2CH2NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R1 и R2 каждый независимо представляет собой Н или -(С1-С6)алкил-NR21R22. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R1 и R2 каждый независимо представляет собой -(С1-С6)алкил-NR21R22. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R1 и R2 каждый представляет собой -CH2CH2NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R1 представляет собой -(С1-С6)алкил-NR21R22 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R1 представляет собой Н и R2 представляет собой -(С1-С6)алкил-NR21R22. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib) или (Ic), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (I) или (I'), характеризующееся структурой формулы (Id):


где R11 представляет собой -CH2NH2, -CH2CH2NH2 или -CH2CH2CH2NH2.
Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой необязательно замещенный арил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой гетероарил, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой гетероарил, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой пиридин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой пиридин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой пиримидин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой пиримидин, который замещен дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Y представляет собой необязательно замещенный арил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Y представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Y представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Y представляет собой -O-(С1-С6)алкил-. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Y представляет собой -N(Н)-(С1-С6)алкил-. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Y представляет собой связь. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой -(С1-С6)алкил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой необязательно замещенный арил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой фенил, замещенный один раз или дважды -(С1-С8)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой фенил, замещенный один раз н-бутилом, изобутилом или трет-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой фенил, замещенный один раз н-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой фенил, замещенный один раз изобутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой фенил, замещенный один раз трет-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), (I'), (Ia), (Ib), (Ic) или (Id), где Z представляет собой галоген.
Согласно дополнительному варианту осуществления представлено соединение формулы (I), (Ia), (Ib), (Ic) или (Id), где -X-Y-Z представляет собой

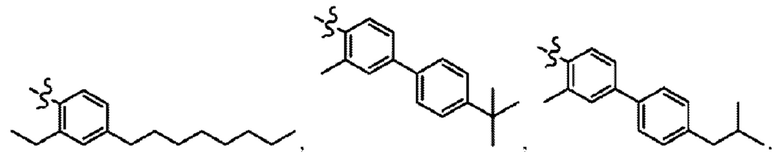

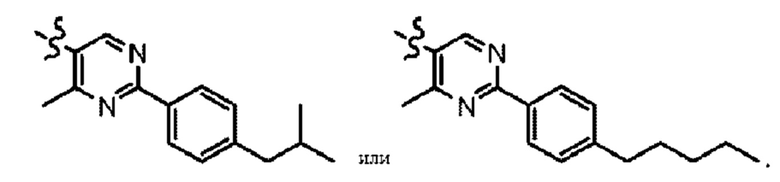
Согласно другому аспекту в настоящем изобретении описано соединение формулы (II):
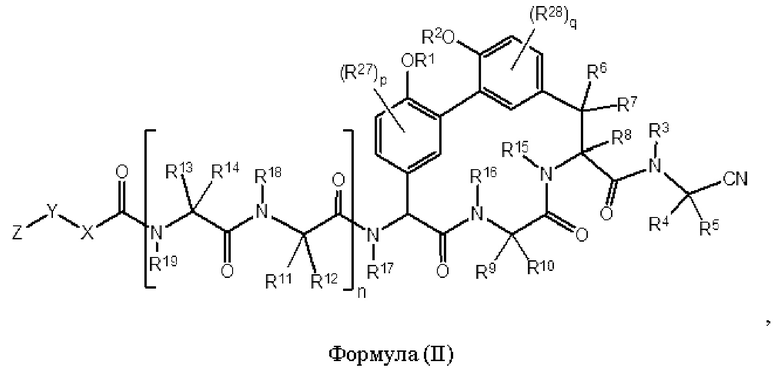
где:
R1 и R2 каждый независимо представляет собой Н, -(С1 -С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -CH2CH(гетероциклоалкил)CH2NH2, -CH2C(О)NH2, -CH2C(О)N(H)CH2CN; -(С1-С6)алкил-С(О)OR23, -(С1-C6)алкил-NR21R22, -(С1-С6)алкил-C(О)NR25NR26, -(С1-С6)алкил-N(R23)С(О)(С1-С6)алкилNR21R22 или -(C1-С6)алкил-C(О)N(R23)(С1-C6)алкил или необязательно замещенный гетероциклоалкил;
R3 представляет собой Н или -(С1-С6)алкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(О)NH2; или R3 и R4 объединены с образованием гетероциклоалкильного кольца;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R6, R7 и R8 каждый независимо представляет собой Н или -(С1-С6)алкил;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R10 представляет собой Н или -(С1-С6)алкил;
R11 и R12 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-С6)алкил-SR23, -(С1-С6)алкил-SR23; -(С1-С6)алкил-С(О)OR23, -(С1-C6)алкил-NR21R22, -(С1-С6)алкил-СН -(С1-C6)алкил-C(О)NR25R26, -(С1-С6)гетероалкил-СО2Н, -(С1-С6)алкил-S(О)-(С1-С6)алкил, -(С1-С6)алкил-N(Н)СН=NH, -(С1-С6)алкил-N(Н)С(NH)NH2; -(С1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(С1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н;
R13 и R14 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -(С1-C6)алкил-SR23, -(С1-C6)алкил-C(О)OR23, -(С1-С6)алкил-NR21R22; -(С1-С6)алкил-CN, -(С1-C6)алкил-C(О)NR25R26, -(С1-C6)алкил-N(H)C(NH)NH2, -(С1-С6)алкилгетероциклоалкил или -(С1-С6)алкилгетероарил; или R13 и R19 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R14 представляет собой Н;
R15, R16, R17, R18 и R19 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(С1-С6)алкил-OR23, -(С1-С6)алкил-С(О)OR23 или -(С1-С6)алкил-NR21R22;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(С1-С6)алкил-, -N(R24)(С1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С1-C6)алкил-N(R24)(С1-C6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(С1-C6)алкил-, -N(R24)SO2(С1-C6)алкил-, -N(R24)C(О)(С1-C6)алкил-, -С(О)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-C6)алкил-, -С(О)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(О)N(R24)арил-, необязательно замещенный -N(R24)C(О)арил-, необязательно замещенный -N(R24)SO2apил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -(С1-С12)алкил,-(С2-С12)алкенил, -(С2-С12)алкинил, -C(О)NR25R26, -O-(С1-С12)алкил, -N(R24)(С1-С12)алкил, -N(R24)C(О)(С1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(С1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(О)(С1-С6)алкил, -C(О)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил;
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R27 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
каждый R28 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
n равно 0 или 1;
р равно 0, 1 или 2; и
q равно 0, 1 или 2;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно другому аспекту в настоящем изобретении описано соединение формулы (II'):

где:
R1 и R2 каждый независимо представляет собой Н, -(C1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -CH2CH(гетероциклоалкил)CH2NH2, -CH2C(О)NH2, -CH2C(О)N(H)CH2CN, -(С1-C6)алкил-C(О)OR23, -(С1-C6)алкил-NR21R22, -(С1-С6)алкил-C(О)NR25R26, -(С1-С6)алкил-N(R23)С(О)(С1-С6)алкилR21R22, -(С1-C6)алкил-C(О)N(R23)(С1-С6)алкил, -(С1-C6)алкил-C(О)N(R23)(С1-C6)алкилгетероциклоалкил, необязательно замещенный (С1-С6)гетероалкил или необязательно замещенный гетероциклоалкил;
R3 представляет собой Н или -(С1-С6)алкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(О)NH2; или R3 и R4 объединены с образованием гетероциклоалкильного кольца;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R6, R7 и R8 каждый независимо представляет собой Н или -(С1-С6)алкил;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R10 представляет собой Н или -(С1-С6)алкил;
R11 и R12 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -(С1-C6)алкил-SR23; (С1-С6)алкил-С(О)OR23, -(С1-C6)алкил-NR21R22, -(С1-С6)алкил-CN, -(С1-C6)алкил-C(О)NR25R26, -(С1-С6)гетероалкил-CO2H, -(С1-C6)алкил-S(О)-(С1-С6)алкил, -(С1-C6)алкил-N(H)CH=NH, -(С1-С6)алкил-С(NH2)=NН, -(С1-С6)алкил-N(H)C(NH)NH2, -(С1-C6)алкил-N(H)SO2NR25R26, -(С1-C6)алкил-N(H)-C(О)NR25R26, -(С1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(С1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н;
R13 и R14 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -(С1-C6)алкил-SR23, -(С1-С6)алкил-С(О)OR23, -(С1-C6)алкил-NR21R22, -(С1-С6)алкил-CN, -(С1-C6)алкил-C(О)NR25R26, -(С1-C6)алкил-N(H)C(NH)NH2, -(С1-С6)алкилгетероциклоалкил или -(С1-С6)алкилгетероарил; или R13 и R19 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R14 представляет собой Н;
R15, R16, R17, R18 и R19 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(С1-С6)алкил-OR23, -(С1-С6)алкил-С(О)OR23 или -(С1 -С6)алкил-NR21R22.
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(С1-С6)алкил-, -N(R24)(С1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С1-C6)алкил-N(R24)(С1-C6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(С1-C6)алкил-, -N(R24)SO2(С1-C6)алкил-, -N(R24)C(О)(С1-C6)алкил-, -С(О)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(О)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(О)N(R24)арил-, необязательно замещенный -N(R24)C(О)алкил-, необязательно замещенный -N(R24)SO2apил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -(С1-С12)алкил,-(С2-С12)алкенил, -(С2-С12)алкинил, -C(О)NR25R26, -O-(С1-С12)алкил, -N(R24)(С1-С12)алкил, -N(R24)C(О)(С1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(С1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(О)(С1-С6)алкил, -C(О)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил;
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R27 независимо представляет собой галоген, -NR23R24, -NC(О)R23, -NC(О)NR23R24), нитро, гадроксил, необязательно замещенный -(С1-С6)алкил, необязательно замещенный -(С1-С6)гетероалкил, -(С1-С6)алкокси, -С(О)(С1-С6)алкил или -S(О)2(С1-С6)алкил;
каждый R28 независимо представляет собой галоген, -NR23R24, -NC(О)R23, -NC(О)NR23R24), нитро, гадроксил, необязательно замещенный -(С1-С6)алкил, необязательно замещенный -(С1-С6)гетероалкил, -(С1-С6)алкокси, -С(О)(С1-С6)алкил или -S(О)2(С1-С6)алкил;
n равно 0 или 1;
р равно 0, 1 или 2; и
q равно 0, 1 или 2;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II) или (II'), характеризующееся структурой формулы (IIa):

Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II') или (IIa), где R6, R7 и R8 представляют собой Н. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II') или (IIa), где R15 и R16 представляют собой Н.
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II) или (II'), характеризующееся структурой формулы (IIb):
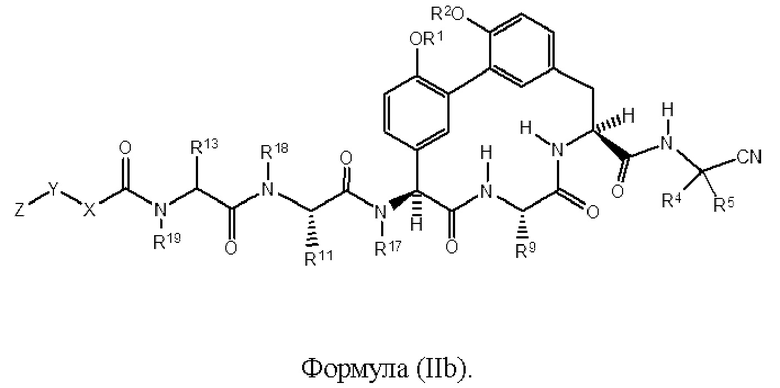
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa) или (IIb), где R18 представляет собой Н. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa) или (IIb), где R19 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IIb), где R17 представляет собой -CH3. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IIb), где R5 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IIb), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IIb), где R4 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение (II), (II'), (IIa) или (IIb), где R4 представляет собой -(С3-С6)пиклоалкил. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IIb), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IIb), где R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IIb), где R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IIb), где R1 и R2 каждый независимо представляет собой Н или -(С1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IIb), где R1 и R2 каждый независимо представляет собой -(С1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IIb), где R1 и R2 каждый представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II) или (II'), характеризующееся структурой формулы (IIc):

где R1 и R2 каждый независимо представляет собой Н или -CH2CH2NH2.
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R11 представляет собой -CH2CH2OH. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R11 представляет собой -(С1-C6)алкил-NR21R22. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R11 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R11 представляет собой -CH2NH2. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R11 представляет собоп -CH2CH2NH2. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R13 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (IV), (IIa), (IIb) или (IIc), где R13 представляет собой -CH2OH. Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), (II'), (IIa), (IIb) или (IIc), где R13 представляет собой -CH2CH2OH.
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II) или (II'), характеризующееся структурой формулы (IId):

Согласно одному варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R17 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R5 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R4 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R4 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R1 и R2 каждый независимо представляет собой Н или -(С1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R1 и R2 каждый независимо представляет собой -(С1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II), (II'), (IIa) или (IId), где R1 и R2 каждый представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II) или (II'), характеризующееся структурой формулы (IIe):
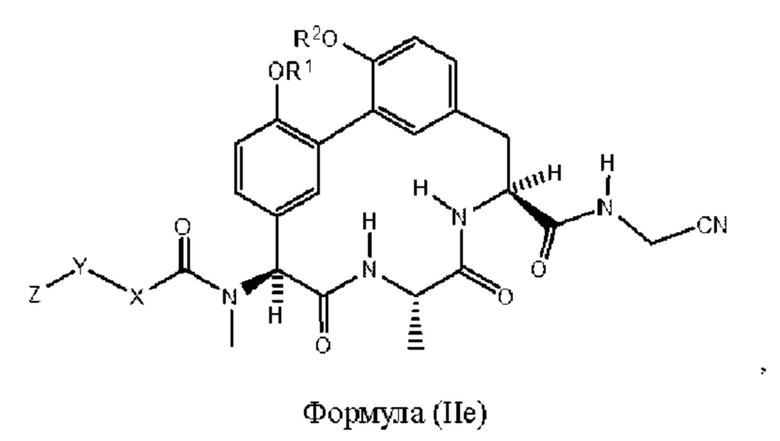
где R1 и R2 каждый независимо представляет собой Н или -CH2CH2NH2.
Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где X представляет собой необязательно замещенный арил. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где X представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где X представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где Y представляет собой необязательно замещенный арил. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где Y представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где Y представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где Y представляет собой -O-(С1-С6)алкил-. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где Y представляет собой -N(Н)-(С1-С6)алкил-. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где Y представляет собой связь. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (IIa), (IIb), (IIc), (IId) или (IIe), где Z представляет собой -(С1-С6)алкил. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (IIa), (IIb), (IIc), (IId) или (IIe), где Z представляет собой необязательно замещенный арил. Согласно дополнительному варианту осуществления представлено соединение формулы (П), (IIa), (IIb), (IIc), (IId) или (IIe), где Z представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где Z представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где Z представляет собой галоген.
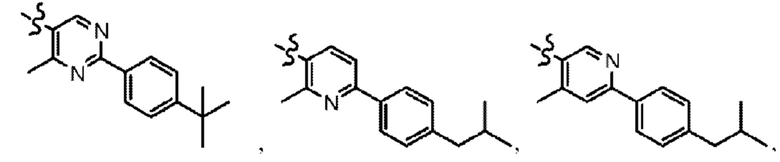
Согласно дополнительному варианту осуществления представлено соединение формулы (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), где -X-Y-Z представляет собой


Согласно другому аспекту представлена фармацевтическая композиция, содержащая соединение формулы (I), (I’), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемую соль, фармацевтически приемлемый сольват или фармацевтически приемлемое пролекарство и его фармацевтически приемлемое вспомогательное вещество.
Согласно другому аспекту представлено применение соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (I'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или фармацевтически приемлемого пролекарства для получения лекарственного средства для лечения бактериальной инфекции у пациента.
Согласно другому варианту осуществления предусмотрен способ лечения бактериальной инфекции у млекопитающего, предусматривающий введение млекопитающему соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), или фармацевтически приемлемой соли, фармацевтически приемлемого сольвата или их фармацевтически приемлемого пролекарственного средства, с частотой и в течение времени, достаточными для обеспечения благоприятного эффекта млекопитающему. В соответствии с другим вариантом осуществления бактериальная инфекция представляет собой инфекцию, вызываемую Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas acidovorans, Pseudomonas alcaligenes, Pseudomonas putida, Stenotrophomonas maltophilia, Burkholderia cepacia, Aeromonas hydrophilia, Escherichia coli, Citrobacter freundii, Salmonella typhimurium, Salmonella typhi, Salmonella paratyphi, Salmonella enteritidis, Shigella dysenteriae, Shigella flexneri, Shigella sonnei, Enterobacter cloacae, Enterobacter aerogenes, Klebsiella pneumoniae, Klebsiella oxytoca, Serratia marcescens, Francisella tularensis, Morganella morganii, Proteus mirabilis, Proteus vulgaris, Providencia alcalifaciens, Providencia rettgeri, Providencia stuartii, Acinetobacter baumannii, Acinetobacter calcoaceticus, Acinetobacter haemolyticus, Yersinia enterocolitica, Yersinia pestis, Yersinia pseudotuberculosis, Yersinia intermedia, Bordetella pertussis, Bordetella parapertussis, Bordetella bronchiseptica, Haemophilus influenzae, Haemophilus parainfluenzae, Haemophilus haemolyticus, Haemophilus parahaemolyticus, Haemophilus ducreyi, Pasteurella multocida, Pasteurella haemolytica, Branhamella catarrhalis, Helicobacter pylori, Campylobacter fetus, Campylobacter jejuni, Campylobacter coli, Borrelia burgdorferi, Vibrio cholerae, Vibrio parahaemolyticus, Legionella pneumophila, Listeria monocytogenes, Neisseria gonorrhoeae, Neisseria meningitidis, Kingella, Moraxella, Gardnerella vaginalis, Bacteroides fragilis, Bacteroides distasonis, Bacteroides гомологичной группы 3452A, Bacteroides vulgatus, Bacteroides ovalus, Bacteroides thetaiotaomicron, Bacteroides uniformis, Bacteroides eggerthii, Bacteroides splanchnicus, Clostridium difficile, Mycobacterium tuberculosis, Mycobacterium avium, Mycobacterium intracellulare, Mycobacterium leprae, Corynebacterium diphtheriae, Corynebacterium ulcerans, Streptococcus pneumoniae, Streptococcus agalactiae, Streptococcus pyogenes, Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Staphylococcus intermedius, Staphylococcus hyicus subsp.hyicus, Staphylococcus haemolyticus, Staphylococcus hominis или Staphylococcus saccharolyticus.
Согласно другому варианту осуществления бактериальной инфекций является инфекция, которая включает в себя грамотрицательные бактерии. Согласно другому варианту осуществления введение включает в себя местное применение.
В дополнительном варианте осуществления представлены способы лечения млекопитающего при необходимости такого лечения, причем способ включает в себя введение млекопитающему второго терапевтического средства. Согласно другому варианту осуществления вторым терапевтическим средством не является ингибитор SpsB. Согласно другому варианту осуществления вторым терапевтическим средством является аминогликозидный антибиотик, фторхинолоновый антибиотик, β-лактамный антибиотик, макролидный антибиотик, гликопептидный антибиотик, рифампицин, хлорамфеникол, фторамфеникол, колистин, мупироцин, бацитрацин, даптомицин или линезолид. Согласно другому варианту осуществления вторым терапевтическим средством является β-лактамный антибиотик. Согласно другому варианту осуществления β-лактамный антибиотик выбран из пенициллинов, монобактамов, цефалоспоринов, цефамицинов и карбапенемов. Согласно другому варианту осуществления β-лактамный антибиотик выбран из азлоциллина, амоксициллина, ампициллина, дорипенема, меропенема, биапенема, цефамандола, имипенема, мезлоциллина, цефметазола, цефпрозила, пиперациллина/тазобактама, карбенициллина, цефаклора, цефалотина, эртапенема, цефазолина, цефепима, цефоницида, цефокситина, цефтазидима, оксациллина, цефдинира, цефиксима, цефотаксима, цефотетана, цефподоксима, цефтизоксима, цефтриаксона, фаропенема, мециллинама, метициллина, моксалактама, тикарциллина, томопенема, цефтобипрола, цефтаролина, фломоксефа, цефпирома и цефозопрана. Дополнительный вариант осуществления включает в себя введение β-лактамазного ингибитора.
Включение признаков путем ссылки
Все публикации, патенты и патентные заявки, упомянутые в настоящем описании, включены в настоящее изобретение путем ссылки в такой же степени, как если бы каждая отдельная публикация, патент или патентная заявка были конкретно и отдельно обозначены, как включенные путем ссылки.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКОГО МАТЕРИАЛА
На фигуре 1 изображена активность соединения 135 в модели инфекции бедра при нейтропении.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Определения
Используемые в описании и приложенной формуле изобретения формы единственного числа включают в себя ссылку на множественное число, если в контексте четко не указано иное.
Используемый в настоящем описании термин «приблизительно» по отношению к числовому значению или диапазону предусматривает степень варьирования в значении или диапазоне, например, в пределах 10% или в пределах 5% установленного значения установленного предела диапазона.
Все процентные содержания представлены в массовых процентах, если не отмечено иное.
Все средние молекулярные массы полимеров представляют собой среднемассовые молекулярные массы, если не отмечено иное.
Используемый в настоящем описании «субъект» (как в субъекте лечения) означает как млекопитающих, так и не млекопитающих. Млекопитающие включают в себя, например, людей; приматов, кроме человека, например, высшие и низшие обезьяны; и не приматов, например, собаки, кошки, крупный рогатый скот, лошади, овцы и козы. Не млекопитающие включают в себя, например, рыб и птиц.
Термины «заболевание» или «нарушение» или «патологическое состояние» использовали взаимозаменяемо и использовали по отношению к заболеваниям или состояниям, причем бактериальная SPase играет роль в биохимических механизмах, связанных с заболеванием или патологическим состоянием, в результате чего терапевтически благоприятный эффект может быть достигнут воздействием на фермент. «Воздействие» SPase может включать в себя связывание с SPase и/или ингибирование биологической активности SPase.
Выражение «эффективное количество» при использовании для описания терапии по отношению к субъекту, страдающему от нарушения, относится к количеству описанного в настоящем изобретении соединения, которое эффективно для ингибирования или иного воздействия на SPase в тканях субъекта, где SPase, связанная с нарушением, является активной, причем такое ингибирование или другое действие встречается в такой степени, которой достаточно для образования благоприятного терапевтического эффекта.
Используемый в настоящем изобретении термин «в основном» означает полностью или почти полностью; например, композиция, которая «в основном не содержит» компонент, или вообще не содержит компонент или содержит такое следовое количество, при котором любое соответствующее функциональное свойство композиции не затронуто присутствием следового количества, или соединение, которое является «в основном чистым», содержит только малые следы примесей.
«Лечение» или «терапия» в пределах значений настоящего изобретения относятся к облегчению симптомов, связанных с нарушением или заболеванием, или ингибированию дальнейшего развития или ухудшения таких симптомов, или предупреждению или профилактике заболевания или нарушения, или лечению заболевания или нарушения. Подобным образом, используемое в настоящем описании «эффективное количество» или «терапевтически эффективное количество» соединения относится к количеству соединения, которое облегчает, полностью или частично, симптомы, связанные с нарушением или состоянием, или останавливает или замедляет дальнейшее развитие или ухудшение таких симптомов, или предупреждает или обеспечивает профилактику нарушения или состояния. В частности, «терапевтически эффективное количество» относится к количеству, эффективному, в дозировках и для периодов необходимого времени, для достижения требуемого терапевтического результата. Терапевтически эффективное количество также является таким, при котором любые токсичные или неблагоприятные эффекты описанных в настоящем изобретении соединений сводятся к нулю под воздействием терапевтически благоприятных эффектов.
Под «химически осуществимым» подразумевается связывающее расположение или соединение, где обычно понимаемые правила органической структуры не нарушены; например, структура в рамках определения формулы изобретения, которая будет содержать в определенных ситуациях пятивалентный атом углерода, который не будет существовать в природе, будет пониматься как не включенная в формулу изобретения. Подразумевается, что раскрытые в настоящем изобретении структуры во всех своих вариантах осуществления включают в себя только «химически осуществимые» структуры и любые перечисленные структуры, которые не являются химически осуществимыми, например, структуры, показанные с различными атомами или группами, не предусмотрены для раскрытия или включения в формулу изобретения.
Если заместитель определен как атом или атомы с установленным названием «или связь», конфигурация указана, если заместитель является «связью», при помощи которой группы, которые прямо связаны с указанным заместителем, непосредственно соединены друг с другом в химически осуществимой связывающей конфигурации.
Предусмотрены все хиральные, диастереомерные, рацемические формы структуры, если конкретно не указана особая стереохимия или изомерная форма. Описанные в настоящем изобретении соединения могут включать в себя обогащенные или расщепленные оптические изомеры при любом или всех асимметрических атомах, как это видно из описания, при любой степени обогащения. Обе рацемические и диастереомерные смеси, а также отдельные оптические изомеры могут быть выделены или синтезированы, так чтобы в основном не содержать своих энантиомерных и диастереомерных участников, и они находятся в пределах объема настоящего изобретения.
Включение изотопной формы одного или нескольких атомов в молекулу, что отличается от встречающегося в природе изотопного распределения атома в природе, указано как «изотопно меченная форма» молекулы. Все изотопные формы атомов включены как варианты в композицию любой молекулы, если не указана конкретная изотопная форма атома. Например, любой атом водорода или набор атомов в молекуле может быть любой из изотопных форм водорода, например, протаем (1Н), дейтерием (2Н) или тритием (3Н) в любой комбинации. Подобным образом, любой атом углерода или набор атомов в молекуле может быть любой из изотопных форм углерода, например, 11С, 12С, 13С или 14С, или любой атом азота или набор атомов в молекуле может быть любой из изотопных форм азота, например, 13N, 14N или 15N. Молекула может включать в себя любую комбинацию изотопных форм в составляющих атомах, формирующих молекулу, изотопная форма каждого атома, формирующего молекулу, была независимо выбрана. В многомолекулярном образце соединения не у каждой отдельной молекулы обязательно одинаковая изотопная композиция. Например, образец соединения может включать в себя молекулы, содержащие многие различные изотопные композиции, такие как в образце трития или 14С с радиометкой, где только некоторые фракции набора молекул, формирующих макроскопический образец, содержат радиоактивный атом. Также является понятным, что многие элементы, которые сами по себе не являются искусственно изотопно обогащенными, являются смесями изотопных форм природного происхождения, таких как 14N и 15N, 32S и 34S, и т.п. Описанная в настоящем документе молекула определена как включающая в себя изотопные формы всех своих составляющих элементов в каждом положении молекулы. Как хорошо известно из области техники, изотопно меченные соединения могут быть получены традиционными способами химического синтеза, за исключением замещения изотопно меченной молекулы прекурсора. Изотопы, с радиоактивной меткой или стабильные, могут быть получены любым способом, известным из области техники, таким как образование путем поглощения нейтронов прекурсора нуклида в ядерном реакторе, циклотронными реакциями или изотопным разделением, например, при помощи масс-спектрометрии. Изотопные формы включены в прекурсоры, как требуется, для применения в любом конкретном пути синтезирования. Например, 14С и 3Н могут быть получены с применением нейтронов, образованных в ядерном реакторе. Следующие ядерные превращения 14С и 3Н включены в молекулы прекурсора с последующим дополнительным исследованием при необходимости.
Используемый в настоящем описании термин «защитная группа для аминогруппы» или «N-защищенная» относится к таким группам, которые предусмотрены для защиты аминогруппы от нежелательных реакций в течение процессов синтеза и которые позже могут быть удалены с высвобождением амина. Традиционно используемые защитные группы для аминогруппы раскрыты в Protective Groups in Organic Synthesis, Greene, T.W.; Wuts, P. G. M., John Wiley & Sons, New York, NY, (3rd Edition, 1999). Защитные группы для аминогруппы включают в себя ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутил ацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, орто-нитрофеноксиацетил, α-хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и т.п.; сульфонильные группы, такие как бензолсульфонил, пара-толуолсульфонил и т.п.; алкокси- или арилоксикарбонильные группы (которые образуют уретаны с защищенным амином), такие как бензилоксикарбонил (Cbz), пара-хлорбензилоксикарбонил, пара-метоксибензилоксикарбонил, пара-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, пара-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(пара-бифенилил)-1-метилэтоксикарбонил, α,α-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутилоксикарбонил (Boc), диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил (Alloc), 2,2,2-трихлорэтоксикарбонил, 2-триметилсилилэтилоксикарбонил (Теос), феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил (Fmoc), циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и т.п.; аралкильные группы, такие как бензил, трифенилметил, бензилоксиметил и т.п.; и силильные группы, такие как триметилсилил и т.п. Защитные группы для аминогруппы также включают в себя циклические защитные группы для аминогруппы, такие как фталоил и дитиосукцинимидил, которые включают аминный азот в гетероцикл. Как правило, защитные группы для аминогруппы включают в себя формил, ацетил, бензоил, пивалоил, трет-бутилацетил, фенилсульфонил, Alloc, Теос, бензил, Fmoc, Вое и Cbz. Для рядового специалиста является полезным навык выбирать и использовать подходящую защитную группу для аминогруппы для предстоящей задачи синтеза.
Используемый в настоящем описании термин «защитная группа для гидроксила» или «О-защищенная» относится к таким группам, которые предусмотрены для защиты ОН группы от нежелательных реакций в течение процессов синтеза и которые позже могут быть удалены с высвобождением амина. Традиционно используемые защитные группы для гидроксила раскрыты в Protective Groups in Organic Synthesis, Greene, T.W.; Wuts, P. G. M., John Wiley & Sons, New York, NY, (3rd Edition, 1999). Защитные группы для гидроксила включают в себя ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, орто-нитрофеноксиацетил, α-хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и т.п.; сульфонильные группы, такие как бензолсульфонил, пара-толуол сульфонил и т.п.; ацилоксигруппы (которые образуют уретаны с защищенным амином), такие как бензилоксикарбонил (Cbz), пара-хлорбензилоксикарбонил, пара-метоксибензилоксикарбонил, пара-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, пара-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(пара-бифенилил)-1-метилэтоксикарбонил, α,α-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутилоксикарбонил (Boc), диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил (Alloc), 2,2,2-трихлорэтоксикарбонил, 2-триметилсилилэтилоксикарбонил (Теос), феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил (Fmoc), циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и т.п.; аралкильные группы, такие как бензил, трифенилметил, бензилоксиметил и т.п.; и силильные группы, такие как триметилсилил и т.п. Для рядового специалиста является полезным навык выбирать и использовать подходящую защитную группу для гидроксила для предстоящей задачи синтеза.
В целом, «замещенный» относится к органической группе, как определено в настоящем описании, в которой одна или несколько связей с атомом водорода, содержащимся в ней, заменены одной или несколькими связями с неводородным атомом, таким как галоген (т.е., F, Cl, Br и I); атом кислорода в группах, таких как гидроксильные группы, алкоксигруппы, арилоксигруппы, аралкилоксигруппы, оксо(карбонил) группы, карбоксильные группы, включая карбоновые кислоты, карбоксилаты и сложные эфиры карбоновых кислот; атом серы в группах, таких как тиольные группы, алкильные и арильные сульфидные группы, сульфоксидные группы, сульфоновые группы, сульфонильные группы и сульфонамидные группы; атом азота в группах, таких как амины, гидроксиламины, нитрилы, нитрогруппы, N-оксиды, гидразиды, азиды и енамины; и другими гетероатомами в различных других группах. Неограничивающие примеры заместителей, которые могут быть связаны с замещенным атомом углерода (или другим) включают в себя F, Cl, Br, I, OR', OC(О)N(R')2, CN, NO, NO2, ONO2, азидо, CF3, OCF3, R', О (оксо), S (тионо), C(O), S(O), метилендиокси, этилендиокси, N(R')2, SR', SOR', SO2R', SO2N(R')2, SO3R', C(О)R', C(О)C(О)R', C(О)CH2C(О)R', C(S)R', C(О)OR', OC(О)R', C(О)N(R')2, OC(О)N(R')2, C(S)N(R')2, (CH2)o-2N(R')C(О)R', (CH2)o-2N(R')N(R')2, N(R')N(R')C(О)R', N(R')N(R')C(О)OR', N(R')N(R')CON(R')2, N(R')SO2R', N(R')SO2N(R')2, N(R')C(О)OR', N(R')C(О)R', N(R')C(S)R', N(R')C(О)N(R')2, N(R')C(S)N(R')2, N(COR')COR', N(OR')R', C(=NH)N(R')2, C(О)N(OR')R' или C(=NOR')R', где R' может быть водородом или фрагментом на основе углерода, и где фрагмент на основе углерода может сам быть дополнительно замещенным.
Если заместитель одновалентный, такой как, например, F или Cl, он связан с другим атомом одной связью. Если заместитель более чем одновалентный, такой как О, который является двухвалентным, он может быть связан с другими атомами более чем одной связью, т.е., двухвалентный заместитель связан двойной связью; например, С, замещенный О, образует карбонильную группу, С=O, которая также может быть записана как «СО», «С(О)» или «C(=O)», где С и О связаны двойной связью. Если атом углерода замещен кислородной группой с двойной связью (=O), кислородный заместитель назван «оксо» группа. Если двухвалентный заместитель, такой как NR, связан с атомом углерода двойной связью, полученная группа C(=NR) названа «имино» группа. Если двухвалентный заместитель, такой как S, связан с атомом углерода двойной связью, полученная группа C(=S) названа «тиокарбонильная» группа.
Альтернативно, двухвалентный заместитель, такой как О, S, С(О), S(O) или S(О)2, может быть связан двумя простыми связями с двумя разными атомами углерода. Например, О, двухвалентный заместитель, может быть связан с каждым из двух смежных атомов углерода с обеспечением эпоксидной группы, или О может образовывать эфирную группу с мостиковыми связями, называемую «окси» группа, между смежными или не смежными атомами углерода, например, образование мостиковых связей 1,4-атомов углерода циклогексильной группы с образованием [2.2.1]-оксабициклической системы. Кроме того, любой заместитель может быть связан с атомом углерода или другим атомом при помощи линкера, такого как (CH2)n или (CR'2)n, где n равно 1, 2, 3 или более и каждый R' выбран независимо.
С(О) и S(О)2 группы могут быть связаны с одним или двумя гетероатомами, такими как азот, а не с атомом углерода. Например, если группа С(О) связана с одним атомом углерода и одним атомом азота, полученная группа называется «амид» или «карбоксамид». Если группа С(О) связана с двумя атомами азота, функциональная группа называется мочевина. Если группа S(О)2 связана с одним атомом углерода и одним атомом азота, полученная группа называется «сульфонамид». Если группа S(О)2 связана с двумя атомами азота, полученная группа называется «сульфамат».
Замещенные алкильные, алкенильные, алкинильные, циклоалкильные и циклоалкенильные группы, а также другие замещенные группы также включают в себя группы, в которых одна или несколько связей с атомом водорода заменены одной или несколькими связями, включая двойные или тройные связи, с атомом углерода или с гетероатомом, таким как без ограничения кислород в карбонильных (оксо), карбоксильных, сложноэфирных, амидных, имидных, уретановых и мочевинных группах; и азот в иминах, гидроксииминах, оксимах, гидразонах, амидинах, гуанидинах и нитрилах.
Замещенные кольцевые группы, такие как замещенные циклоалкильные, арильные, гетероциклильные и гетероарильные группы, также включают в себя кольца и конденсированные кольцевые системы, в которых связь с атомом водорода заменена связью с атомом углерода. Таким образом, замещенные циклоалкильные, арильные, гетероциклильные и гетероарильные группы также могут быть замещены алкильными, алкенильными и алкинильными группами, как определено в настоящем описании.
Под «кольцевой системой» как используемого в настоящем описании термина подразумевается фрагмент, содержащий одно, два, три или более колец, которые могут быть замещены не кольцевыми группами или другими кольцевыми системами, или тем и другим, которые могут быть полностью насыщенными, частично ненасыщенными, полностью ненасыщенными или ароматическими, и если кольцевая система включает в себя более одного кольца, кольца могут быть конденсированными, с мостиковыми связями или спироциклическими. Под «спироциклическим» подразумевается класс структур, где два кольца конденсированы при одном тетраэдрическом атоме углерода, как хорошо известно из области техники.
Что касается любой из описанных в настоящем изобретении групп, которые содержат один или несколько заместителей, безусловно, является понятным, что такие группы не содержат никакого замещения или моделей замещения, которые являются стерически невозможными и/или синтетически не осуществимыми. Кроме того, соединения такого раскрытого объекта изобретения включают в себя все стереохимические изомеры, возникающие в результате замещения таких соединений.
Выбранные заместители в описанных в настоящем изобретении соединениях присутствуют в рекурсивной степени. В этом контексте «рекурсивный заместитель» означает, что заместитель может описывать другой вариант себя или другого заместителя, который сам описывает первый заместитель. Из-за рекурсивной природы таких заместителей теоретически большое число может присутствовать в любом представленном пункте формулы изобретения. Специалисту в области медицинской химии и органической химии будет понятно, что общее число таких заместителей в разумных пределах ограничено требуемыми свойствами заданного соединения. Такие свойства включают в себя в качестве примера и без ограничений физические свойства, такие как молекулярная масса, растворимость или log Р, способность к нанесению, такая как действие в отношении предусмотренной цели, и практические свойства, такие как легкость синтеза.
Рекурсивные заместители находятся в предполагаемом аспекте раскрытого объекта изобретения. Специалисту в области медицинской и органической химии будет понятна разносторонность таких заместителей. До степени, в которой рекурсивные заместители находятся в пункте формулы раскрытого объекта изобретения, общее число должно быть определено, как изложено выше.
Алкильные группы включают в себя алкильные группы и циклоалкильные группы с неразветвленной или разветвленной цепью, содержащие от 1 до приблизительно 20 атомов углерода и типично от 1 до 12 атомов углерода или согласно некоторым вариантам осуществления от 1 до 8 атомов углерода. Примеры алкильных групп с неразветвленной цепью включают в себя группы с от 1 до 8 атомов углерода, такие как метальные, этильные, н-пропильные, н-бутильные, н-пентильные, н-гексильные, н-гептильные и н-октильные группы. Примеры алкильных групп с разветвленной цепью включают в себя без ограничения изопропильные, изо-бутильные, втор-бутильные, трет-бутильные, неопентильные, изопентильные и 2,2-диметилпропильные группы. Используемый в настоящем описании термин «алкил» охватывает н-алкильные, изоалкильные и антеизоалкильные группы, а также другие формы алкила с разветвленной цепью. Типичные замещенные алкильные группы могут быть замещены один или несколько раз любой из групп, изложенный выше, например, амино, гидрокси, циано, карбокси, нитро, тио, алкокси и галогеновыми группами.
Термин «алкилен» означает неразветвленный насыщенный двухвалентный углеводородный радикал с атомами углерода в количестве от одного до шести или разветвленный насыщенный двухвалентный углеводородный радикал с атомами углерода в количестве от одного до шести, если не отмечено иное, такой как метилен, этилен, пропилен, 1-метил про пилен, 2-метилпропилен, бутилен, пентилен и т.п.
Термин «карбонил» означает С=O.
Термины «карбокси» и «гидроксикарбонил» означают СООН.
Циклоалкильными группами являются циклические алкильные группы, такие как без ограничения циклопропильные, циклобутильные, циклопентильные, циклогексильные, циклогептильные и циклооктильные группы. Согласно некоторым вариантам осуществления циклоалкильная группа может содержать от 3 до приблизительно 8-12 кольцевых членов, причем согласно другим вариантам осуществления число кольцевых атомов углерода находится в диапазоне от 3 до 4, 5, 6 или 7. Циклоалкильные группы дополнительно включают в себя полициклические циклоалкильные группы, такие как без ограничения норборнильные, адамантильные, борнильные, камфенильные, изокамфенильные и каренильные группы, и конденсированные кольца, такие как без ограничения декалинил и т.п. Циклоалкильные группы также включают в себя кольца, которые замещены алкильными группами с неразветвленной или разветвленной цепью, как определено выше. Типичные замещенные циклоалкильные группы могут быть монозамещенными или замещенными более одного раза, такие как без ограничения 2,2-, 2,3-, 2,4- 2,5- или 2,6-дизамещенные циклогексильные группы или моно-, ди- или тризамещенные норборнильные или циклогептильные группы, которые могут быть замещены, например, амино, гидрокси, циано, карбокси, нитро, тио, алкокси и галогеновыми группами. Термин «циклоалкенил» отдельно или в комбинации означает циклическую алкенильную группу.
Термины «карбоциклический», «карбоциклильный» и «карбоцикл» означает кольцевую структуру, где атомами кольца являются атомы углерода, например, циклоалкильная группа или арильная группа. Согласно некоторым вариантам осуществления карбоцикл содержит от 3 до 8 кольцевых членов, причем согласно другим вариантам осуществления число кольцевых атомов углерода равно 4, 5, 6 или 7. Если конкретно не указано, карбоциклическое кольцо может быть замещено не менее N-1 заместителями, где N представляет собой размер карбоциклического кольца, например, алкильными, алкенильными, алкинильными, амино, арильными, гидрокси, циано, карбокси, гетероарильными, гетероциклильными, нитро, тио, алкокси и галогеновыми группами, или другими группами, как изложено выше. Карбоциклильным кольцом может быть циклоалкильное кольцо, циклоалкенильное кольцо или арильное кольцо. Карбоциклил может быть моноциклическим или полициклическим, и если он полициклический, каждое кольцо независимо может быть циклоалкильным кольцом, циклоалкенильным кольцом или арильным кольцом.
(Циклоалкил)алкильные группы, также называемые как циклоалкилалкил, представляют собой алкильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы заменена связью с циклоалкильной группой, как определено выше.
Алкенильные группы включают в себя алкильные группы с неразветвленной и разветвленной цепью и циклические алкильные группы, как определено выше, за исключением того, что существует по меньшей мере одна двойная связь между двумя атомами углерода. Таким образом, алкенильные группы содержат от 2 до приблизительно 20 атомов углерода и типично от 2 до 12 атомов углерода или согласно некоторым вариантам осуществления от 2 до 8 атомов углерода. Примеры включают в себя без ограничения винил, -СН=СН(СН3), -СН=С(СН3)2, -С(СН3)=CH2, -С(СН3)=СН(СН3), -С(CH2CH3)=СН2, циклогексенил, циклопентенил, циклогексадиенил, бутадиенил, пентадиенил и гексадиенил, среди прочего.
Циклоалкенильные группы включают в себя циклоалкильные группы, содержащие по меньшей мере одну двойную связь между 2 атомами углерода. Таким образом, например, циклоалкенильные группы включают в себя без ограничения циклогексенильные, циклопентенильные и циклогексадиенильные группы. Циклоалкенильные группы могут содержать от 3 до приблизительно 8-12 кольцевых членов, причем согласно другим вариантам осуществления число кольцевых атомов углерода находится в диапазоне от 3 до 5, 6 или 7. Циклоалкильные группы дополнительно включают в себя полициклические циклоалкильные группы, такие как без ограничения норборнильные, адамантильные, борнильные, камфенильные, изокамфенильные и каренильные группы, и конденсированные кольца, такие как без ограничения декалинил и т.п., при условии, что они включают в себя по меньшей мере одну двойную связь в пределах кольца. Циклоалкенильные группы также включают в себя кольца, которые замещены алкильными группами с неразветвленной или разветвленной цепью, как определено выше.
(Циклоалкенил)алкильными группами являются алкильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы заменена связью с циклоалкенильной группой, как определено выше.
Алкинильные группы включают в себя алкильные группы с неразветвленной и разветвленной цепью, за исключением того, что существует по меньшей мере одна тройная связь между двумя атомами углерода. Таким образом, алкинильные группы содержат от 2 до приблизительно 20 атомов углерода и типично от 2 до 12 атомов углерода или согласно некоторым вариантам осуществления от 2 до 8 атомов углерода. Примеры включают в себя без ограничения С≡СН, -С≡С(CH3), С≡С(CH2CH3), -CH2C≡СН, -CH2C≡С(СН3) и -CH2C≡С(CH2CH3), среди прочего.
Термин «гетероалкил» сам по себе или в комбинации с другим термином означает, если не отмечено иное, устойчивую алкильную группу с неразветвленной или разветвленной цепью, состоящую из установленного числа атомов углерода и одного или двух гетероатомов, выбранных из группы, состоящей из О, N и S, и где атомы азота и серы могут быть необязательно окислены, а азотный гетероатом может быть необязательно кватернизован. Гетероатом(ы) может(гут) быть размещен(ы) в любом положении гетероалкильной группы, включая положение между остатком гетероалкильной группы и фрагментом, к которому он присоединен, а также присоединен к самому конечному атому углерода в гетероалкильной группе. Примеры включают в себя: -О-CH2-CH2-СН3, -CH2-CH2CH2-ОН, -CH2-CH2-NH-CH3, -CH2-S-CH2-CH3, -CH2CH2-S (=O)-СН3 и -CH2CH2-O-CH2CH2-O-СН3. До двух гетероатомов могут быть последовательно расположенными, как, например, -CH2-NH-OCH_3 или -CH2-CH2-S-S-CH3.
«Гетероциклоалкильное» кольцо представляет собой циклоалкильное кольцо, содержащее меньшей мере один гетероатом. Гетероциклоалкильное кольцо также может быть названо «гетероциклил», как описано ниже.
Термин «гетероалкенил» сам по себе или в комбинации с другим термином означает, если не отмечено иное, стабильную мононенасыщенную или диненасыщенную углеводородную группу с неразветвленной или разветвленной цепью, состоящую из установленного числа атомов углерода и одного или двую гетероатомов, выбранных из группы, состоящей из О, N и S, и где атомы азота и серы необязательно могут быть окислены, а азотный гетероатом необязательно может быть кватернизован. До двух гетероатомов может быть размещено последовательно. Примеры включают в себя -СН=СН-O-СН3, -СН=СН-CH2-ОН, -CH2-CH=N-OCH3, -CH=CH-N(CH3)-CH3, -CH2-С H=CH-CH2-SH и -СН=СН-O-CH2CH2-O-СН3.
Арильные группы представляют собой циклические ароматические углеводороды, которые не содержат гетероатомов в кольце. Таким образом, арильные группы включают в себя без ограничения фенильные, азуленильные, гепталенильные, бифенильные, индаценильные, флуоренильные, фенантренильные, трифениленильные, пиренильные, нафтаценильные, хризенильные, бифениленильные, антраценильные и нафтильные группы. Согласно некоторым вариантам осуществления арильные группы содержат от приблизительно 6 до приблизительно 14 атомов углерода в кольцевых фрагментах групп. Арильные группы могут быть незамещенными или замещенными, как определено выше. Типичные замещенные арильные группы могут быть монозамещенными или замещенными более одного раза, например, без ограничения 2-, 3-, 4-, 5- или 6-заещенными фенильными или 2-8-замещенными нафтильными группами, которые могут быть замещены углеродными или не углеродными группами, которые перечислены выше.
Аралкильные группы представляют собой алкильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы заменена связью с арильной группой, как определено выше. Типичные аралкильные группы включают в себя бензильные и фенилэтильные группы и конденсированные (циклоалкиларил)алкильные группы, такие как 4-этилинданил. Аралкенильная группа представляет собой алкенильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы заменена связью с арильной группой, как определено выше.
Гетероциклильные группы или термин «гетероциклил» включает в себя ароматические и не ароматические циклические соединения, содержащие 3 или более кольцевых членов, из которых один или несколько являлись гетероатомом, таким как без ограничения N, О и S. Таким образом, гетероциклил может быть гетероциклоалкилом или гетероарилом, или если он полициклический, то любой их комбинацией. Согласно некоторым вариантам осуществления гетероциклильные группы включают в себя от 3 до приблизительно 20 кольцевых членов, при этом другие такие группы содержат от 3 до приблизительно 15 кольцевых членов. Гетероциклильная группа, обозначенная как С2-гетероциклил, может быть 5-кольцом с двумя атомами углерода и тремя гетероатомами, 6-кольцом с двумя атомами углерода и четырьмя гетероатомами и т.п. Аналогичным образом, С4-гетероциклил может быть 5-кольцом с одним гетероатомом, 6-кольцом с двумя гетероатомами и т.п. Число атомов углерода плюс число гетероатомов дает в сумме общее число кольцевых атомов. Гетероциклильное кольцо также может включать в себя одну или несколько двойных связей. Гетероарильное кольцо представляет собой вариант осуществления гетеро цикл ильной группы. Выражение «гетероциклильная группа» включает в себя конденсированные типы колец, включая такие, которые содержат конденсированные ароматические и не ароматические группы. Например, диоксоланильное кольцо и бенздиоксоланильная кольцевая система (метилендиоксифенильная кольцевая система) оба представляют собой гетероциклильные группы в пределах значения настоящего изобретения. Выражение также включает в себя полициклические кольцевые системы, содержащие гетероатом, такие как без ограничения хинуклидинил. Гетероциклильные группы могут быть незамещенными или могут быть замещенными, как обсуждалось выше. Гетероциклильные группы включают в себя без ограничения пирролидинильные, пиперидинильные, пиперазинильные, морфолинильные, пирролильные, пиразолильные, триазолильные, тетразолильные, оксазолильные, изоксазолильные, тиазолильные, пиридинильные, тиофенильные, бензотиофенильные, бензофуранильные, дигидробензофуранильные, индолильные, дигидроиндолильные, азаиндолильные, индазолильные, бензимидазолильные, азабензимидазолильные, бензоксазолильные, бензотиазолильные, бензотиадиазолильные, имидазопиридинильные, изоксазолопиридинильные, тианафталенильные, пуринильные, ксантинильные, аденинильные, гуанинильные, хинолинильные, изохинолинильные, тетрагидрохинолинильные, хиноксалинильные и хиназолинильные группы. Типичные замещенные гетероциклильные группы могут быть монозамещенными или замещенными более одного раза, такими как без ограничения пиперидинильные или хинолинильные группы, которые являются 2-, 3-, 4-, 5- или 6-замещенными или дизамещенными группами, которые изложены выше.
Гетероарильные группы представляют собой ароматические циклические соединения, содержащие 5 или более кольцевых членов, из которых один или несколько членов представляют собой гетероатом, такой как без ограничения N, О и S; например, гетероарильные кольца могут содержать от 5 до приблизительно 8-12 кольцевых членов. Гетероарильная группа представляет собой разные гетероциклильные группы, которые обладают ароматической электронной структурой. Гетероарильная группа, обозначенная как С2-гетероарил, может быть 5-кольцом с двумя атомами углерода и тремя гетероатомами, 6-кольцом с двумя атомами углерода и четырьмя гетероатомами и т.п. Аналогичным образом, С4-гетероарил может быть 5-кольцом с одним гетероатомом, 6-кольцом с двумя гетероатомами и т.п. Число атомов углерода плюс число гетероатомов дает в сумме общее число кольцевых атомов. Гетероарильные группы включают в себя без ограничения такие группы, как пирролильные, пиразолильные, триазолильные, тетразолильные, оксазолильные, изоксазолильные, тиазолильные, пиридинильные, тиофенильные, бензотиофенильные, бензофуранильные, индолильные, азаиндолильные, индазолильные, бензимидазолильные, азабензимидазолильные, бензоксазолильные, бензотиазолильные, бензотиадиазолильные, имидазопиридинильные, изоксазолопиридинильные, тианафталенильные, пуринильные, ксантинильные, аденинильные, гуанинильные, хинолинильные, изохинолинильные, тетрагидрохинолинильные, хиноксалинильные и хиназолинильные группы. Гетероарильные группы могут быть незамещенными или могут быть замещены группами, как обсуждалось выше. Типичные замещенные гетероарильные группы могут быть замещены один или несколько раз группами, которые изложены выше.
Дополнительные примеры арильных и гетероарильных групп включают в себя без ограничения фенил, бифенил, инденил, нафтил (1-нафтил, 2-нафтил), N-гидрокситетразолил, N-гидрокситриазолил, N-гидроксиимидазолил, антраценил (1-антраценил, 2-антраценил, 3-антраценил), тиофенил (2-тиенил, 3-тиенил), фурил (2-фурил, 3-фурил), индолил, оксадиазолил, изоксазолил, хиназолинил, флуоренил, ксантенил, изоинданил, бензгидрил, акридинил, тиазолил, пирролил (2-пирролил), пиразолил (3-пиразолил), имидазолил (1-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил), триазолил (1,2,3-триазол-1-ил, 1,2,3-триазол-2-ил 1,2,3-триазол-4-ил, 1,2,4-триазол-3-ил), оксазолил (2-оксазолил, 4-оксазолил, 5-оксазолил), тиазолил (2-тиазолил, 4-тиазолил, 5-тиазолил), пиридил (2-пиридил, 3-пиридил, 4-пиридил), пиримидинил (2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил), пиразинил, пиридазинил (3-пиридазинил, 4-пиридазинил, 5-пиридазинил), хинолил (2-хинолил, 3-хинолил, 4-хинолил, 5-хинолил, 6-хинолил, 7-хинолил, 8-хинолил), изохинолил (1-изохинолил, 3-изохинолил, 4-изохинолил, 5-изохинолил, 6-изохинолил, 7-изохинолил, 8-изохинолил), бензо[b]фуранил (2-бензо[b]фуранил, 3-бензо[b]фуранил, 4-бензо[b]фуранил, 5-бензо[b]фуранил, 6-бензо[b]фуранил, 7-бензо[b]фуранил), 2,3-дигидробензо[b]фуранил (2-(2,3-дигидробензо[b]фуранил), 3-(2,3-дигидробензо[b]фуранил), 4-(2,3-дигидробензо[b]фуранил), 5-(2,3-дигидробензо[b]фуранил), 6-(2,3-дигидробензо[b]фуранил), 7-(2,3-дигидробензо[b]фуранил), бензо[b]тиофенил (2-бензо[b] тиофенил, 3-бензо[b]тиофенил, 4-бензо[b]тиофенил, 5-бензо[b]тиофенил, 6-бензо[b] тиофенил, 7-бензо[b]тиофенил), 2,3-дигидробензо[b]тиофенил, (2-(2,3-дигидробензо[b]тиофенил), 3-(2,3-дигидробензо[b]тиофенил), 4-(2,3-дигидробензо[b]тиофенил), 5-(2,3-дигидробензо[b]тиофенил), 6-(2,3-дигидробензо[b]тиофенил), 7-(2,3-дигидробензо[b]тиофенил), индолил (1-индолил, 2-индолил, 3-индолил, 4-индолил, 5-индолил, 6-индолил, 7-индолил), индазол (1-индазолил, 3-индазолил, 4-индазолил, 5-индазолил, 6-индазолил, 7-индазолил), бензимидазолил (1-бензимидазолил, 2-бензимидазолил, 4-бензимидазолил, 5-бензимидазолил, 6-бензимидазолил, 7-бензимидазолил, 8-бензимидазолил), бензоксазолил (1-бензоксазолил, 2-бензоксазолил), бензотиазолил (1-бензотиазолил, 2-бензотиазолил, 4-бензотиазолил, 5-бензотиазолил, 6-бензотиазолил, 7-бензотиазолил), карбазолил (1-карбазолил, 2-карбазолил, 3-карбазолил, 4-карбазолил), 5Н-дибенз[b,f]азепин (5Н-дибенз[b,f]азепин-1-ил, 5Н-дибенз[b,f]азепин-2-ил, 5Н-дибенз[b,f]азепин-3-ил, 5Н-дибенз[b,f]азепин-4-ил, 5Н-дибенз[b,f]азепин-5-ил), 10,11-дигидро-5Н-дибенз[b,f]азепин (10,11-дигидро-5Н-дибенз[b,f]азепин-1-ил, 10,11-дигидро-5Н-дибенз[b,f]азепин-2-ил, 10,11-дигидро-5Н-дибенз[b,f]азепин-3-ил, 10,11-дигидро-5Н-дибенз[b,f]азепин-4-ил, 10,11-дигидро-5Н-дибенз[b,f]азепин-5-ил) и т.п.
Гетероциклилалкильные группы представляют собой алкильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы, как определено выше, заменена связью с гетероциклильной группой, как определено выше. Типичные гетероциклильные алкильные группы включают в себя без ограничения фуран-2-илметил, фуран-3-илметил, пиридин-3-илметил, тетрагидрофуран-2-илэтил и индол-2-илпропил.
Гетероарилалкильные группы представляют собой алкильные группы, как определено выше, в которых водородная или углеродная связь алкильной группы заменена связью с гетероарильной группой, как определено выше.
Термин «алкокси» относится к атому кислорода, соединенному с алкильной группой, включая циклоалкильную группу, как определено выше. Примеры неразветвленных алкоксигрупп включают в себя без ограничения метокси, этокси, пропокси, бутокси, пентилокси, гексилокси и т.п. Примеры разветвленного алкокси включают в себя без ограничения изопропокси, втор-бутокси, трет-бутокси, изопентилокси, изогексилокси и т.п. Примеры циклического алкокси включают в себя без ограничения циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и т.п. Алкоксигруппа может включать в себя от одного до приблизительно 12-20 атомов углерода, связанных с атомом кислорода, и дополнительно может включать в себя двойные или тройные связи, а также может включать в себя гетероатомы. Например, аллилоксигруппа представляет собой алкоксигруппу в пределах значения настоящего изобретения. Метоксиэтоксигруппа также представляет собой алкоксигруппу в пределах значения настоящего изобретения, что и метилендиоксигруппа, в контексте, где два смежных атома структур при этом замещены.
Термин «тиоалкокси» относится к определенной ранее алкильной группе, присоединенной к исходному молекулярному фрагменту через атом серы.
Термин «гликозилоксиокси» относится к гликозиду, присоединенному к исходному молекулярному фрагменту через атом кислорода.
Термин «алкоксикарбонил» представляет собой сложноэфирную группу; т.е. алкоксигруппу, присоединенную к исходному молекулярному фрагменту через карбонильную группу, такую как метоксикарбонил, этоксикарбонил и т.п.
Термины «гало» или «галоген» или «галогенид» сами по себе или как часть другого заместителя означают, если не отмечено иное, атом фтора, хлора, брома или йода, предпочтительно, фтора, хлора или брома.
«Галогеналкильная» группа включает в себя моногалогеналкильные группы, полигалогеналкильные группы, где все атомы галогена могут быть одинаковыми или разными, и пергалогеналкильные группы, где все атомы водорода заменены атомами галогена, такими как фтор. Примеры галогеналкила включают в себя трифторметил, 1,1-дихлоэтил, 1,2-дихлоэтил, 1,3-дибром-3,3-дифторпропил, перфторбутил и т.п.
«Галогеналкокси» группа включает моногалогеналкоксигруппы, полигалогеналкоксигруппы, где все атомы галогена могут быть одинаковыми или разными, и пер гало геналкоксигруппы, где все атомы водорода заменены атомами галогена, такими как фтор. Примеры галогеналкокси включают в себя трифторметокси, 1,1-дихлорэтокси, 1,2-дихлорэтокси, 1,3-дибром-3,3-дифторргороху, перфторбутокси и т.п.
Термин «(Сх-Су)перфторалкил», где х<у, означает алкильную группу с минимумом х атомов углерода и максимумом у атомов углерода, где все атомы водорода заменены атомами фтора. Предпочтительным является -(С1-С6)перфторалкил, более предпочтительным является -(С1-С3)перфторалкил, наиболее предпочтительным является CF3.
Термин «(Сх-Су)перфторалкилен, где х<у, означает алкиленовую группу с минимумом х атомов углерода и максимумом у атомов углерода, где все атомы водорода заменены атомами фтора. Предпочтительным является -(С1-С6)перфторалкилен, более предпочтительным является -(С1-С3)перфторалкилен, наиболее предпочтительным является -CF2-.
Термины «арилокси» и «арилалкокси» относятся к, соответственно, арильной группе, связанной с атомом кислорода, и аралкильной группе, связанной с атомом кислорода при алкильном фрагменте. Примеры включают в себя без ограничения фенокси, нафтилокси и бензилокси.
«Ацильная» группа как используемый в настоящем описании термин относится к группе, содержащей карбонильный фрагмент, где группа связана через карбонильный углеродный атом. Карбонильный углеродный атом также связан с другим атомом углерода, который может быть частью алкильной, арильной, аралкильной, циклоалкильной, циклоалкилал киль ной, гетероциклильной, гетероциклилалкильной, гетеро арильной, гетероарилалкильной группы или т.п. В особом случае, где карбонильный углеродный атом связан с атомом водорода, группа является «формильной» группой, ацильной группой как используемый в настоящем описании термин. Ацильная группа может включать в себя от 0 до приблизительно 12-20 дополнительных атомов углерода, связанных с карбонильной группой. Ацильная группа может включать в себя двойные или тройные связи в пределах значения настоящего изобретения. Акрилоильная группа является примером ацильной группы. Ацильная группа также может включать в себя гетероатомы в пределах значения настоящего изобретения. Никотиноильная группа (пиридил-3-карбонил) является примером ацильной группы в пределах значения настоящего изобретения. Другие примеры включают в себя ацетильные, бензоильные, фенилацетильные, пиридилацетильные, циннамоильные и акрилоильные группы и т.п. Если группа, содержащая атом углерода, который связан с атомом углерода карбонила, содержит атом галогена, группа называется «галогенацильная» группа. Примером является трифторацетильная группа.
Термин «амин» включает в себя первичные, вторичные и третичные амины, содержащие, например, формулу N(группа)3 где каждая группа независимо может быть Н или не-Н, такая как алкил, арил и т.п.. Амины включают в себя без ограничения R-NH2, например, алкиламины, ариламины, алкил арил амины; R2NH, где каждый R независимо выбран, такой как диалкиламины, диариламины, аралкиламины, гетероциклиламины и т.п.; и R3N, где каждый R независимо представляет выбран, такой как триалкиламины, диалкилариламины, алкилдиариламины, триариламины и т.п. Термин «амин» также включает в себя аммонийные ионы, как используется в настоящем описании.
«Амино» группа является заместителем формы -NH2, -NHR, -NR2, -NR3+, где каждый R независимо выбран, и протонированными формами каждого, за исключением -NR3+, который не может быть протонирован. Соответствующим образом, любое соединение, замещенное аминогруппой, может рассматриваться как амин. «Аминогруппа» в пределах значения настоящего изобретения может быть первичной, вторичной, третичной или четвертичной аминогруппой. «Алкиламино» группа включает в себя моноалкиламино, диалкиламино и триалкиламиногруппу.
«Аммонийный» ион включает в себя незамещенный аммонийный ион NH4+, но если не отмечено иное, он также включает в себя любые протонированные или кватернизованные формы аминов. Таким образом, триметиламония гидрохлорид и тетраметиламмония хлорид оба являются аммонийными ионами и аминами в пределах значения настоящего изобретения.
Термин «амид» (или «амидо») включает в себя С- и N-амидные группы, например, -C(О)NR2 и -NRC(О)R группы, соответственно. Таким образом, амидные группы включат в себя без ограничения первичные карбоксамидные группы (-C(О)NH2) и формамидые группы(-NHC(О)H). «Карбоксамидо» или «аминокарбонильная» группа является группой формулы C(О)NR2, где R может быть Н, алкилом, арилом и т.п.
Термин «азидо» относится к N3 группе. «Азид» может быть органическим азидом или может быть солью азидного (N3-) аниона. Термин «нитро» относится к NO2 группе, связанной с органическим фрагментом. Термин «нитрозо» относится к NO группе, связанной с органическим фрагментом. Термин нитрат относится к ONO2 группе, связанной с органическим фрагментом, или к соли нитратного (NO3-) аниона.
Термин «уретан» («карбамоил» или «карбамил») включает в себя N- и О-уретановые группы, т.е., -NRC(О)OR и OC(О)NR2 группы, соответственно.
Термин «сульфонамид» (или «сульфонамидо») включает в себя S- и N-сульфонамидные группы, т.е., -SO2NR2 и -NRSO2R группы, соответственно. Таким образом, сульфонамидные группы включают в себя без ограничения сульфамоильные группы (-SO2NH2). Является понятным, что сероорганическая структура, представленная формулой -S(О)(NR)-, относится к сульфоксимину, где оба атома кислорода и азота связаны с атомом серы, который также связан с двумя атомами углерода.
Термин «амидин» или «амидино» включает в себя группы формулы -C(NR)NR2. Как правило, амидиногруппа представляет собой -C(NH)NH2.
Термин «гуанидин» или «гуанидино» включает в себя группы формулы -NRC(NR)NR2. Как правило, гуанидино группа представляет собой NHC(NH)NH2.
Термин «кольцо, полученное из сахара» относится к соединению, которое образует кольцо путем удаления атомов водорода из двух гидроксильных групп любого сахара.
«Соль», как хорошо известно из области техники, включает в себя органическое соединение, такое как карбоновая кислота, сульфоновая кислота или амин, в ионной форме в комбинации с противоионом. Например, кислоты в своей анионной форме могут образовывать соли с катионами, такими как катионы металлов, например, натрия, калия и т.п.; с аммонийными солями, такими как NH4+, или катионами различных аминов, включая тетраалкиламмонийные соли, такие как тетраметиламмоний, или другими катионами, такими как триметилсульфоний и т.п. «Фармацевтически приемлемая» или «фармакологически приемлемая» соль представляет собой соль, образованную из иона, который был одобрен для потребления человеком и обычно является не токсичным, такую как хлоридная соль или натриевая соль. «Цвиттерион» представляет собой внутреннюю соль, которая может быть образована в молекуле, которая содержит по меньшей мере две ионогенные группы, одна образует анион, а вторая катион, которые служат для баланса друг друга. Например, аминокислоты, такие как глицин, могут существовать в цвиттерионной форме. ««Цвиттерион» представляет собой соль в пределах значения настоящего изобретения. Описанные в настоящем изобретении соединения могут принимать форму солей. Термин «соли» охватывает аддитивные соли свободных кислот или свободных оснований, которые являются описанными в настоящем изобретении соединениями. Соли могут быть «фармацевтически приемлемыми солями». Термин «фармацевтически приемлемая соль» относится к солям, которые обладают профилями токсичности в пределах диапазона, который позволяет использование в фармацевтических применениях. Фармацевтически неприемлемые соли могут при этом обладать такими свойствами, как высокая степень кристалличности, что применимо на практике настоящего изобретения, так, например, применение при способе синтеза, очистки или составлении соединение по настоящему изобретению.
Подходящие фармацевтически приемлемые кислотно-аддитивные соли могут быть получены из неорганической кислоты или из органической кислоты. Примеры неорганических кислот включают в себя хлористоводородные, бромистоводородные, йодистоводородные, азотные, угольные, серные и фосфорные кислоты. Соответствующие органические кислоты могут быть выбраны из алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновых и сульфоновых классов органических кислот, примеры которых включают в себя муравьиную, уксусную, пропионовую, янтарную, гликолевую, глюконовую, молочную, яблочную, виннокаменную, лимонную, аскорбиновую, глюкуроновую, малеиновую, фумаровую, пировиноградную, аспарагиновую, глутаминовую, бензойную, аминобензойную, 4-гидроксибензойную, фенилуксусную, миндальную, эмбоновую (памовую), метансульфоновую, этансульфоновую, бензолсульфоновую, пантотеновую, трифторметансульфоновую, 2-гидроксиэтансульфоновую, пара-толуолсульфоновую, сульфаниловую, циклогексиламиносульфоновую, стеариновую, альгиновую, β-гидроксимасляную, салициловую, галактаровую и галактуроновую кислоту. Примеры фармацевтически неприемлемых кислотно-аддитивных солей включают в себя, например, перхлораты и тетрафторбораты.
Подходящие фармацевтически приемлемые основно-аддитивные соли соединений по настоящему раскрытию включают в себя, например, соли металлов, включая соли щелочного металла, щелочноземельного металла и соли переходных металлов такие как, например, соли кальция, магния, калия, натрия и цинка. Фармацевтически приемлемые основно-аддитивные соли также включают в себя органические соли, полученные из основных аминов, таких как, например, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглюмин (N-метилглюкамин) и прокаин. Примеры фармацевтически неприемлемых основно-аддитивных солей включают в себя соли лития и цианатные соли. Хотя фармацевтически неприемлемые соли обычно не применимы в качестве лекарственных средств, такие соли могут быть применимы, например, в качестве промежуточных соединений в синтезе соединений формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), например, при их очистке перекристаллизацией. Все эти соли могут быть получены традиционными способами из соответствующего соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) путем осуществления взаимодействия, например, соответствующей кислоты или основания с соединением формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (Пе). Термин «фармацевтически приемлемые соли» относится к нетоксичным неорганическим или органическим кислотно- и/или основно-аддитивным солям, см., например, Lit et al., Salt Selection for Basic Drugs (1986), Int J. Pharm., 33, 201-217, что включено в настоящее описание путем ссылки.
«Гидрат» представляет собой соединение, которое существует в композиции с молекулами воды. Композиция может включать в себя воду в стехиометрических количествах, например, моногидрат или дигидрат, или может включать в себя воду в случайном количестве. В качестве используемого в настоящем описании термина «гидрат» относится к твердой форме, т.е., соединение в водном растворе, при этом оно может быть гидратировано, не является гидратом в качестве используемого в настоящем описании термина.
«Сольват» представляет собой подобную композицию, за исключением того, что растворитель, отличный от воды, заменяет воду. Например, метанол или этанол могут образовывать «алкоголят», который может в свою очередь быть стехиометрическим или не стехиометрическим. В качестве используемого в настоящем описании термина «сольват» относится к твердой форме, т.е., соединение в растворе растворителя, при этом оно может быть сольватировано, не является сольватом в качестве используемого в настоящем описании термина.
«Пролекарство», как хорошо известно из области техники, является веществом, которое может быть введено пациенту, где вещество превращено in vivo под воздействием биохимических веществ внутри организма пациента, таких как ферменты, в активный фармацевтический ингредиент. Примеры пролекарств включают в себя сложные эфиры карбоновокислотных групп, которые могут быть гидролизованы эндогенными эстеразами, которые входят в кровоток людей и других млекопитающих. Дополнительные примеры пролекарств включают в себя боронатные сложные эфиры, которые могут быть гидролизованы при физиологических условиях с получением соответствующей бороновой кислоты. Общепринятые способы выбора и получения подходящих производных пролекарств описаны, например, в «Design of Prodrugs», ed. H. Bundgaard, Elsevier, 1985.
Кроме того, если признаки или аспекты настоящего раскрытия описаны в отношении групп Маркуша, специалисты настоящей области техники придут к выводу, что описанные в настоящем изобретении соединения также тем самым описаны в отношении любого отдельного члена или подгруппы членов группы Маркуша. Например, если X описан как выбранный из группы, состоящей из брома, хлора и йода, утверждения, что X представляет собой бром и утверждения, что X представляет собой бром и хлор, описаны полностью. Более того, если признаки или аспекты настоящего раскрытия описаны в отношении групп Маркуша, специалисты настоящей области техники придут к выводу, что настоящее раскрытие также тем самым описано в отношении любой комбинации отдельных членов или подгрупп членов групп Маркуша. Таким образом, например, если X описан как выбранный из группы, состоящей из брома, хлора и йода, и Y описан как выбранный из группы, состоящей из метила, этила и пропила, утверждения, что X представляет собой бром и Y представляет собой метил, описаны полностью.
Если значение переменной, которая обязательно является целым числом, например, число атомов углерода в алкильной группе или число заместителей в кольце, описано в виде диапазона, например, 0-4, это означает, что значение может быть любым целым числом от 0 до 4 включительно, т.е., 0, 1, 2, 3 или 4.
Согласно различным вариантам осуществления соединение или группа соединений, которые используются в способах по настоящему изобретению, могут быть любой из любых комбинаций и/или подкомбинаций вышеуказанных вариантов осуществления.
Согласно различным вариантам осуществления представлено соединение, как показано в любом из примеров или среди приводимых в качестве примера соединений. Условия могут относиться к любой из раскрытых категорий и вариантов осуществления, где любой один или несколько других раскрытых выше вариантов осуществления или видовых признаков могут быть исключены из таких категорий или вариантов осуществления.
Настоящее раскрытие дополнительно охватывает выделенные соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe). Выражение «выделенное соединение» относится к получению соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или смеси соединений формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIe), (IId) или (IIe), где выделенное соединение было отделено от используемых реагентов и/или от образованных побочных продуктов при синтезе соединения или соединений. «Выделенное» не означает, что получение является технически чистым (гомогенным), но оно является достаточно чистым для соединения в форме, в которой оно может быть использовано в терапевтических целях. Предпочтительно «выделенное соединение» относится к препарату соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или смеси соединений формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), что содержит указанное соединение или смесь соединений формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) в количестве по меньшей мере 10 процентов по массе от общей массы. Предпочтительно препарат содержит указанное соединение или смесь соединений в количестве по меньшей мере 50 процентов по массе от общей массы; более предпочтительно по меньшей мере 80 процентов по массе от общей массы; и наиболее предпочтительно по меньшей мере 90 процентов, по меньшей мере 95 процентов или по меньшей мере 98 процентов по массе от общей массы препарата.
Описанные в настоящем изобретении соединения и промежуточные соединения могут быть выделены из их реакционных смесей и очищены стандартными методиками, такими как фильтрация, жидкость-жидкостная экстракция, твердофазная экстракция, дистилляция, перекристаллизация или хроматография, включая колоночную флеш-хроматографию или HPLC.
Изомерия и таутомерия в описанных в настоящем изобретении соединениях
Таутомерия
В пределах раскрытия настоящего изобретения является понятным, что соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его соль может проявлять феномен таутомерии, в соответствии с чем два химических соединения способны к легкому взаимопревращению путем обмена атома водорода между двумя атомами, с любым из которых образуется ковалентная связь. Поскольку таутомерные соединения существуют в подвижном равновесии друг с другом, они могут рассматриваться как разные изомерные формы того же соединения. Является понятным, что изображения формул в пределах настоящего описания могут представлять только одну из возможных таутомерных форм. Тем не менее, также является понятным, что настоящее раскрытие охватывает любую таутомерную форму и не будет ограничено только любой одной таутомерной формой, используемой в изображениях формул. Изображения формул в пределах настоящего описания могут представлять только одну из возможных таутомерных формул, и является понятным, что описание охватывает все возможные таутомерные формы изображенных соединений, не только те формы, которые было удобно графически изобразить в настоящем изобретении. Например, таутомерия может проявляться при помощи пиразолильной группы, связанной, как отмечено, волнистой линией. Поскольку оба заместителя будут называться 4-пиразолильная группа, является очевидным, что разный атом азота несет атом водорода в каждой структуре.

Такая таутомерия также может возникать с замещенными пиразолами, такими как 3-метил-, 5-метил- или 3,5-диметилпиразолы и т.п. Другим примером таутомерии является амидо-имидо (лактам-лактимная, если циклическое) таутомерия, например, которую видно в гетероциклических соединениях, несущих кольцевой атом кислорода, смежный с кольцевым атомом азота. Например, равновесие:
 является примером таутомерии. Соответствующим образом, предусмотрено, что изображенная в настоящем описании структура в виде одного таутомера также включает в себя другой таутомер.
является примером таутомерии. Соответствующим образом, предусмотрено, что изображенная в настоящем описании структура в виде одного таутомера также включает в себя другой таутомер.
Оптическая изомерия
Будет понятно, что если соединения по настоящему раскрытию содержат один или несколько хиральных центров, соединения могут существовать в виде и могут быть выделены как чистые энантиомерные или диастереомерные формы или как рацемические смеси. Таким образом, настоящее раскрытие включает в себя любые возможные энантиомеры, диастереомеры, рацематы или их смеси описанных в настоящем изобретении соединений.
Изомеры, полученные в результате присутствия хирального центра, включают в себя пару не совпадающих при наложении изомеров, которые называются «энантиомеры». Простые энантиомеры чистого соединения являются оптически активными, т.е., они способны вращать плоскость плоскополяризованного света. Простые энантиомеры обозначены согласно системе Кана-Ингольда-Прелога. Приоритет заместителей оценивали на основе атомной массы, более высокая атомная масса, как определено систематической процедурой, содержит более высокую приоритетность. Как только определили приоритетность четырех групп, молекула была ориентирована таким образом, что группа низшего приоритета обращена от наблюдающего. Затем, если снижение порядка по рангу других групп проходит по часовой стрелке, молекула обозначена (R), а если снижающийся порядок других групп проходит против часовой стрелки, молекула обозначена (S). В примере ниже упорядоченность по системе Кана-Ингольда-Прелога представляет собой А>В>С>D. Самый низкий в ранге атом D обращен от наблюдающего.
Подразумевается, что настоящее раскрытие охватывает диастереомеры, а также их рацемические и расщепленные, диастереомерно и энантиомерно чистые формы и их соли. Диастереомерные пары могут быть расщеплены известными способами разделения, включая хроматографию с нормальной и обращенной фазой и кристаллизацию.
«Выделенный оптический изомер» означает соединение, которое было значительно очищено от соответствующего(их) оптического(их) изомера(ов) той же формулы. Предпочтительно, выделенный изомер составляет по меньшей мере приблизительно 80%, более предпочтительно по меньшей мере 90% чистоты, даже более предпочтительно по меньшей мере 98% чистоты, наиболее предпочтительно по меньшей мере приблизительно 99% чистоты по массе.
Выделенные оптические изомеры могут быть очищены от рацемических смесей хорошо известными методиками хирального разделения. Согласно одному такому методу рацемическая смесь описанного в настоящем изобретении соединения или его хиральное промежуточное соединение разделяли на 99% масс. % чистые оптические изомеры методом HPLC с применением подходящей хиральной колонки, такой как член серий DAICEL® CHIRALPAK® группы колонок (Daicel Chemical Industries, Ltd., Tokyo, Japan). Колонка работает согласно инструкций изготовителя.
Вращательная изомерия
Является понятным, что вследствие химических свойств (т.е., резонанс, придающий некоторый характер двойной связи к связи C-N) ограниченного вращения вокруг сцепления амидной связи (как показано ниже) является возможным наблюдать отдельные ротамерные продукты и даже при определенных обстоятельствах выделять такие продукты (см. ниже). Кроме того, является понятным, что определенные структурные элементы, включая стерический блок или заместители при амидном азоте, могут усиливать устойчивость ротамера до степени, в которой соединение может быть выделено в виде, и существовать неограниченно, простого устойчивого ротамера. Таким образом, настоящее раскрытие включает в себя любые возможные устойчивые ротамеры формулы (I), которые являются биологически активными при лечении злокачественной опухоли или других стадий пролиферативного заболевания.

Региоизомерия
Согласно некоторым вариантам осуществления описанные в настоящем изобретении соединения обладают конкретным пространственным расположением заместителей на ароматических кольцах, что связано с зависимостью активности от структуры, представленной классом соединения. Часто такое расположение заместителей обозначено при помощи системы нумерации; тем не менее, системы нумерации часто не согласуются между различными кольцевыми системами. В шестичленных ароматических системах пространственные расположения характеризуются при помощи общепринятой номенклатуры «пара» для 1,4-замещения, «мета» для 1,3-замещения и «орто» для 1,2-замещения, как показано ниже.


Согласно различным вариантам осуществления соединение или группа соединений, которые находятся среди соединений по настоящему изобретению или используются в способах по настоящему изобретению, могут быть любой из любых комбинаций и/или подкомбинаций вышеуказанных вариантов осуществления.
Соединения
Согласно одному аспекту в настоящем изобретении описаны соединения формулы (I):

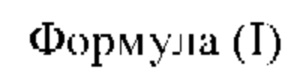
где:
R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -CH2CH(гетероциклоалкил)CH2NH2, -CH2C(О)NH2, -CH2C(О)N(H)CH2CN, -(С1-С6)алкил-С(О)OR23, -(О-С6)алкил-NR21R22, -(С1-С6)алкил-C(О)NR25R26, -(С1-C6)алкил-N(R23)C(О)(С1-C6)алкилNR21R22 или -(С1-С6)алкил-С(О)N(R23)(С1-С6)алкил или необязательно замещенный гетероциклоалкил;
R3 представляет собой Н или -(С1-С6)алкил;
R4 представляет собой Н, -(С1-С6)алкил, -(C1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(О)NH2; или R3 и R4 объединены с образованием гетероциклоалкильного кольца;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R6, R7 и R8 каждый независимо представляет собой Н или -(С1-С6)алкил;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R10 представляет собой Н или -(С1-С6)алкил;
R11 и R12 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -(С1-C6)алкил-SR23, -(С1-С6)алкил-С(О)OR23, -(С1-C6)алкил-NR21R22, -(С1-С6)алкил-CN, -(С1-C6)алкил-C(О)NR25R26, -(С1-С6)гетероалкил-CO2H, -(С1-С6)алкил-S(О)-(С1-С6)алкил, -(С1-C6)алкил-N(H)CH=NH, -(С1-C6)алкил-N(H)C(NH)NH2, -(С1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(С1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н;
R15, R16, R17 и R18 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(С1-C6)алкил-OR23, -(С1-C6)алкил-C(О)OR23 или -(С1-С6)алкил-NR21R22;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(С1-С6)алкил-, -N(R24)(С1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С1-С6)алкил-N(R24)(С1-С6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(С1-C6)алкил-, -N(R24)SO2(С1-С6)алкил-, -N(R24)C(О)(С1-C6)алкил-, -С(О)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(О)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(О)N(R24)арил, необязательно замещенный -N(R24)С(О)арил-, необязательно замещенный -N(R24)SO2арил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -СО2Н, -(С1-С12)алкил,-(С2-С12)алкенил, -(С2-С12)алкинил, -C(О)NR25R26, -O-(С1-С12)алкил, -N(R24)(С1-С12)алкил, -N(R24)С(О)(С1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(С1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(О)(С1-С6)алкил, -C(О)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил;
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R27 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
каждый R28 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
р равно 0, 1 или 2; и
q равно 0, 1 или 2;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (I), где R6, R7 и R8 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где R15 и R16 представляют собой Н.
Согласно одному варианту осуществления представлено соединение формулы (I), где R17 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I), где R17 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (I), где R17 представляет собой -CH2CH3. Согласно другому варианту осуществления представлено соединение формулы (I), где R17 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (I), где R17 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (I), где R17 представляет собой -(С1-С6)алкил-C(О)OR23. Согласно другому варианту осуществления представлено соединение формулы (I), где R17 представляет собой -CH2CH2OH. Согласно другому варианту осуществления представлено соединение формулы (I), где R17 представляет собой -(С1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (I), где R17 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I), где R17 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где R18 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где R3 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где R5 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (I), где R4 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I), где R4 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (I), где R4 представляет собой -CH2CH3. Согласно другому варианту осуществления представлено соединение формулы (I), где R4 представляет собой -(С1-С6)алкил-ОН. Согласно другому варианту осуществления представлено соединение формулы (I), где R4 представляет собой -CH2OH. Согласно другому варианту осуществления представлено соединение формулы (I), где R4 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (I), где R4 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (I), где R4 представляет собой -C(О)NH2.
Согласно другому варианту осуществления представлено соединение формулы (I), где R3, R4 и R5 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо.
Согласно другому варианту осуществления представлено соединение формулы (I), где R10 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где R10 представляет собой Н и R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I), где R10 представляет собой Н и R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (I), где R10 представляет собой Н и R9 представляет собой -CH2CH3. Согласно другому варианту осуществления представлено соединение формулы (I), где R10 представляет собой Н и R9 представляет собой -(С1-С6)галогеналкил. Согласно другому варианту осуществления представлено соединение формулы (I), где R10 представляет собой Н и R9 представляет собой -CH2F. Согласно другому варианту осуществления представлено соединение формулы (I), где R10 представляет собой Н и R9 представляет собой -CHF2. Согласно другому варианту осуществления представлено соединение формулы (I), где R10 представляет собой Н и R9 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (I), где R10 представляет собой Н и R9 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (I), где R10 представляет собой Н и R9 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -CH2CH2OH. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -(С1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -(С1-C6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -CH2C(О)NH2. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -CH2CH2C(О)NH2. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (I), где R12 представляет собой Н и R11 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I), где р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (I), где р равно 1 и R27 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I), где q равно 0, р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (I), где q равно 0, р равно 1 и R27 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I), где q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (I), где q равно 1 и R28 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I), где р равно 0, q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (I), где р равно 0, q равно 1 и R28 представляет собой необязательно замещенный -(С1-С6)алкил.
Согласно другому варианту осуществления представлено соединение формулы (I), где р равно 0 и q равно 0.
Согласно другому варианту осуществления представлено соединение формулы (I), где R1 и R2 каждый независимо представляет собой Н или -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (I), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (I), где R1 и R2 каждый независимо представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (I), где R1 представляет собой Н и R2 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (I), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (I), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (I), где R1 и R2 каждый представляет собой -CH2CH2NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где R1 представляет собой Н и R2 представляет собой -(C1-C6)алкил-NR21R22. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (I), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (I), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (I), где X представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой гетероарил, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой гетероарил, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно другому варианту осуществления представлено соединение формулы (I), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой пиридин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой пиримидин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой пиридин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой пиримидин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где X представляет собой пиримидин, который замещен дважды метилом. Согласно другому варианту осуществления представлено соединение формулы (I), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (I), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (I), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (I), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (I), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (I), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (I), где Y представляет собой -N(Н)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (I), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (I), где Z представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (I), где Z представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где Z представляет собой фенил, замещенный один раз или дважды -(С1-С8)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где Z представляет собой фенил, замещенный один раз н-бутилом, изобутилом или трет-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где Z представляет собой фенил, замещенный один раз н-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где Z представляет собой фенил, замещенный один раз изобутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I), где Z представляет собой фенил, замещенный один раз трет-бутилом. Согласно другому варианту осуществления представлено соединение формулы (I), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (I), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (I), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (I), где -X-Y-Z представляет собой

Согласно одному аспекту в настоящем изобретении описаны соединения формулы (I'):
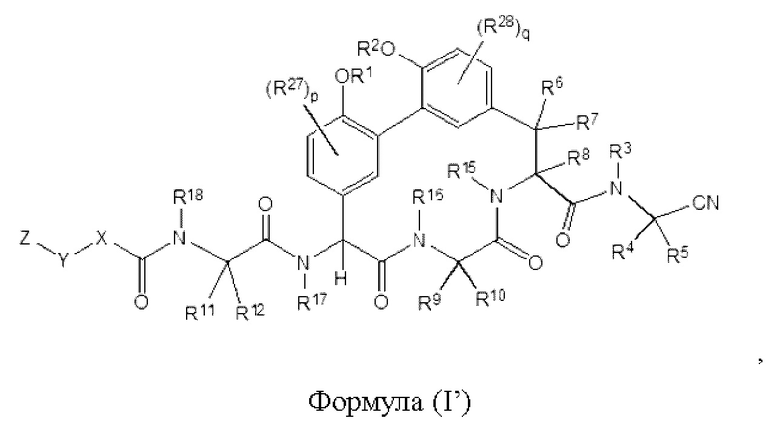
где:
R1 и R2 каждый независимо представляет собой Н, -(C1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -СН2СН(гетероциклоалкил)CH2NH2, -CH2C(O)NH2, -CH2C(O)N(H)CH2CN, -(С1-С6)алкил-С(O)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-C(O)NR25R26, -(С1-С6)алкил-N(R23)С(O)(С1-С6)алкилNR21R22, -(C1-C6)алкил-C(O)N(R23)(C1-С6)алкил, -(С1-С6)алкил-С(O)R(R23)(С1-С6)алкилгетероциклоалкил, (С1-С6)гетероалкил или необязательно замещенный гетероциклоалкил;
R3 представляет собой Н или -(С1-С6)алкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)ажил-ОН, -(С3-С6)циклоалкил или -C(O)NH2; или R3 и R4 объединены с образованием гетероциклоалкильного кольца;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R6, R7 и R8 каждый независимо представляет собой Н, фтор, гидроксил, амино необязательно замещенный алкил или гетероалкил или -(С1-С6)алкил;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R10 представляет собой Н, -(С1-С6)алкил, -(C1-С6)галогеналкил или -(С3-С6)циклоалкил;
или R9 и R10 объединены с образованием гетероциклоалкильного или циклоалкильного кольца
R11 и R12 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(C1-C6)алкил-OR23, -(С1-С6)алкил-SR23, -(С1-С6)алкил-С(O)OR23, -(С1-С6)алкил-NR21R22, -(C1-С6)алкил-CN, -(С1-С6)алкил-С(O)NR25R26, -(С1-С6)гетероалкил-CO2H, -(C1-C6)алкил-S(O)-(С1-С6)алкил, -(С1-С6)алкил-N(Н)СН=NH, -(C1-C6)алкил-C(NH2)=NH, -(С1-С6)алкил-N(H)C(NH)NH2, -(C1-C6)алкил-N(H)SO2NR25R26, -(C1-C6)алкил-N(H)-C(O)NR25R26, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероцикло алкил или -(С1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н;
R15, R16, R17 и R18 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(C1-C6)алкил-OR23, -(C1-C6)алкил-C(O)OR23 или -(C1-C6)алкил-NR21R22;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(C1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С1-С6)алкил-N(R24)(С1-С6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(C1-C6)алкил-, -N(R24)SO2(С1-С6)алкил-, -N(R24)C(O)(C1-C6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(O)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил-, необязательно замещенный -N(R24)SO2арил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -CO2H, -(С1-С12)алкил, -(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)С(O)(С1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(C1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(O)(C1-С6)алкил, -С(O)O(С1-С6)алкил, -C(O)O(C1-С6)галогеналкил, -С(=NH)(С1-С6)алкил, -C(=NH)N(R31)2, -C(O)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетерониклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил;
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R27 независимо представляет собой галоген, -NR23R24, -NC(O)R23, -NC(O)NR23R24), нитро, гидроксил, необязательно замещенный -(С1-С6)алкил, необязательно замещенный -(С1-С6)гетероалкил, -(С1-С6)алкокси, -С(O)(С1-С6)алкил или -S(O)2(С1-С6)алкил;
каждый R28 независимо представляет собой галоген, -NR23R24, -NC(O)R23, -NC(O)NR23R24), нитро, гидроксил, необязательно замещенный -(С1-С6)алкил, необязательно замещенный -(С1-С6)гетероалкил, -(С1-С6)алкокси, -С(O)(С1-С6)алкил или -S(O)2(С1-С6)алкил;
р равно 0, 1 или 2; и
q равно 0, 1 или 2;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (I'), где R6, R7 и R8 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R15 и R16 представляют собой Н.
Согласно одному варианту осуществления представлено соединение формулы (I'), где R17 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R17 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (I'), где R17 представляет собой -CH2CH3. Согласно другому варианту осуществления представлено соединение формулы (I'), где R17 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R17 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R17 представляет собой -(C1-С6)алкил-C(O)OR23. Согласно другому варианту осуществления представлено соединение формулы (I'), где R17 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (I'), где R17 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (I'), где R17 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I'), где R17 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R18 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R3 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R5 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (I'), где R4 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R4 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (I'), где R4 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (I'), где R4 представляет собой -(C1-С6)алкил-ОН. Согласно другому варианту осуществления представлено соединение формулы (I'), где R4 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (I'), где R4 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R4 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R4 представляет собой -C(O)NH2.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R3, R4 и R5 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R10 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R10 представляет собой Н и R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R10 представляет собой Н и R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (I'), где R10 представляет собой Н и R9 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (I'), где R10 представляет собой Н и R9 представляет собой -(С1-С6)галогеналкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R10 представляет собой Н и R9 представляет собой -CH2F. Согласно другому варианту осуществления представлено соединение формулы (I'), где R10 представляет собой Н и R9 представляет собой -CHF2. Согласно другому варианту осуществления представлено соединение формулы (I'), где R10 представляет собой Н и R9 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R10 представляет собой Н и R9 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R10 представляет собой Н и R9 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (I'), где R12 представляет собой Н и R11 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (I'), где р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (I'), где р равно 1 и R27 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где q равно 0, р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (I'), где q равно 0, р равно 1 и R27 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (I'), где q равно 1 и R28 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где р равно 0, q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (I'), где р равно 0, q равно 1 и R28 представляет собой необязательно замещенный -(С1-С6)алкил.
Согласно другому варианту осуществления представлено соединение формулы (I'), где р равно 0 и q равно 0.
Согласно другому варианту осуществления представлено соединение формулы (I'), где R1 и R2 каждый независимо представляет собой Н или -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (I'), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (I'), где R1 и R2 каждый независимо представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (I'), где R1 представляет собой Н и R2 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (I'), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (I'), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (I'), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (I'), где R1 и R2 каждый представляет собой -CH2CH2NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где R1 представляет собой Н и R2 представляет собой -(C1-C6)алкил-NR21R22. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (I'), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (I'), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (I'), где X представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где X представляет собой гетероарил, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где X представляет собой гетероарил, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно другому варианту осуществления представлено соединение формулы (I'), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где X представляет собой пиридин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где X представляет собой пиримидин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где X представляет собой пиридин, который замещен один раз метилом. Согласно другому варианту осуществления представлено соединение формулы (I'), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (I'), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (I'), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (I'), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (I'), где Y представляет собой необязательно замещенный -(C1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (I'), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (I'), где Y представляет собой -N(H)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (I'), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (I'), где Z представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (I'), где Z представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где Z представляет собой фенил, замещенный один раз или дважды -(С1-С8)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где Z представляет собой фенил, замещенный один раз н-бутилом, изобутилом или трет-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где Z представляет собой фенил, замещенный один раз н-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где Z представляет собой фенил, замещенный один раз изобутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (I'), где Z представляет собой фенил, замещенный один раз трет-бутилом. Согласно другому варианту осуществления представлено соединение формулы (I'), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (I'), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (I'), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (I'), где -X-Y-Z представляет собой

Согласно другому варианту осуществления представлено соединение формулы (I), характеризующееся структурой формулы (Ia):

где:
R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -СН2СН(гетероциклоалкил)CH2NH2, -CH2C(O)NH2, -CH2C(O)N(H)CH2CN, -(С1-С6)алкил-С(O)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-C(O)NR25R26, -(С1-С6)алкил-N(R23)С(O)(С1-С6)алкилNR21R22 или -(С1-С6)алкил-C(O)N(R23)(C1-C6)алкил или необязательно замещенный гетероциклоалкил;
R3 представляет собой Н или -(С1-С6)алкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(O)NH2; или R3 и R4 объединены с образованием гетероциклоалкильного кольца;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R6, R7 и R8 каждый независимо представляет собой Н или -(С1-С6)алкил;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R10 представляет собой Н или -(С1-С6)алкил;
R11 и R12 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(C1-С6)алкил-OR23, -(C1-C6)алкил-SR23, -(С1-С6)алкил-С(O)OR23, -(С1-С6)алкил-NR21R22, -(C1-С6)алкил-CN, -(C1-C6)алкил-C(O)NR25R26, -(С1-С6)гетероалкил-CO2H, -(C1-C6)алкил-S(O)-(С1-С6)алкил, -(C1-C6)алкил-N(H)CH=NH, -(C1-C6)алкил-N(H)C(NH)NH2, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(С1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н;
R15, R16, R17 и R18 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(С1-С6)алкил-OR23, -(С1-С6)алкил-С(O)OR23 или -(C1-C6)алкил-NR21R22;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(C1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(C1-C6)алкил-N(R24)(C1-C6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(C1-C6)алкил-, -N(R24)SO2(C1-C6)алкил-, -N(R24)C(O)(C1-C6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(O)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил, необязательно замещенный -N(R24)SO2apил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -CO2H, -(С1-С12)алкил,-(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)C(O)(C1-C12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(C1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(O)(С1-С6)алкил, -C(O)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил;
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R27 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
каждый R28 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
р равно 0, 1 или 2; и
q равно 0, 1 или 2;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (Ia), где R6, R7 и R8 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R15 и R16 представляют собой Н.
Согласно одному варианту осуществления представлено соединение формулы (Ia), где R17 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R17 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R17 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R17 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R17 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R17 представляет собой -(С1-С6)алкил-C(O)OR23. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R17 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R17 представляет собой -(C1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R17 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R17 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R18 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R3 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R5 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R4 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R4 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R4 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R4 представляет собой -(C1-С6)алкил-ОН. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R4 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R4 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R4 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R4 представляет собой -C(O)NH2.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R3, R4 и R5 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R10 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R10 представляет собой Н и R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R10 представляет собой Н и R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R10 представляет собой Н и R9 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R10 представляет собой Н и R9 представляет собой -(С1-С6)галогеналкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R10 представляет собой Н и R9 представляет собой -CH2F. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R10 представляет собой Н и R9 представляет собой -CHF2. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R10 представляет собой Н и R9 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R10 представляет собой Н и R9 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R10 представляет собой Н и R9 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R12 представляет собой Н и R11 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (Ia), где р равно 1 и R27 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (I), где q равно 0, р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (I), где q равно 0, р равно 1 и R27 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (Ia), где q равно 1 и R28 представляет собой необязательно замещенный -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где р равно 0, q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (Ia), где р равно 0, q равно 1 и R28 представляет собой необязательно замещенный -(С1-С6)алкил.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где р равно 0 и q равно 0.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где R1 и R2 каждый независимо представляет собой Н или -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R1 и R2 каждый независимо представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R1 представляет собой Н и R2 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R1 представляет собой -(С1-С6)алкил-NR21R22 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ia), где R1 и R2 каждый представляет собой -CH2CH2NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где R1 представляет собой Н и R2 представляет собой -(С1-С6)алкил-NR21R22. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где X представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой гетероарил, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой гетероарил, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно другому варианту осуществления представлено соединение формулы (Ia), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой пиридин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой пиримидин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой пиридин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой пиримидин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где X представляет собой пиримидин, который замещен дважды метилом. Согласно другому варианту осуществления представлено соединение формулы (Ia), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Y представляет собой -N(Н)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Z представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Z представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где Z представляет собой фенил, замещенный один раз или дважды -(С1-С8)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где Z представляет собой фенил, замещенный один раз н-бутилом, изобутилом или трет-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где Z представляет собой фенил, замещенный один раз н-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где Z представляет собой фенил, замещенный один раз изобутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ia), где Z представляет собой фенил, замещенный один раз трет-бутилом. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (Ia), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (Ia), где -X-Y-Z представляет собой

Согласно другому варианту осуществления представлено соединение формулы (I), характеризующееся структурой формулы (Ib):

где:
R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -СН2СН(гетероциклоалкил)CH2NH2, -CH2C(O)NH2, -CH2C(O)N(H)CH2CN, -(С1-С6)алкил-С(O)CR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-C(O)NR25R26, -(С1-С6)алкил-N(R23)С(O)(С1-С6)алкилNR21R22 или -(C1-С6)алкил-C(O)N(R23)(C1-C6)алкил или необязательно замещенный гетероциклоалкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(O)NH2;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R11 представляет собой Н, -NH2, -(С1-С6)алкил, -(C1-C6)алкил-OR23, -(С1-С6)алкил-SR23, -(С1-С6)алкил-CO)OR23, -(С1-С6)алкил-NR21R22, -(С1-С6)алкил-CN, -(С1-С6)алкил-C(O)NR25R26, -(С1-С6)гетероалкил-CO2H, -(С1-С6)алкил-S(O)-(С1-С6)алкил, -(С1-С6)алкил-N(H)CH=NH, -(C1-C6)алкил-N(H)C(NH)NH2, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(C1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца;
R17 и R18 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(С1-С6)алкил-OR23, -(C1-C6)алкил-C(O)OR23 или -(C1-C6)алкил-NR21R22;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(C1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(C1-C6)алкил-N(R24)(C1-C6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(C1-C6)алкил-, -N(R24)SO2(C1-C6)алкил-, -N(R24)C(O)(C1-C6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(O)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил-, необязательно замещенный -N(R24)SO2арил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -CO2H, -(С1-С12)алкил, -(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)C(O)(C1-C12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(C1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(O)(С1-С6)алкил, -C(O)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил; и
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (Ib), где R17 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R17 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R17 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R17 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R17 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R17 представляет собой -(C1-С6)алкил-C(O)OR23. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R17 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R17 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R17 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R17 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ib), где R18 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ib), где R5 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ib), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R4 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R4 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R4 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R4 представляет собой -(С1-С6)алкил-ОН. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R4 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R4 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R4 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R4 представляет собой -C(O)NH2.
Согласно другому варианту осуществления представлено соединение формулы (Ib), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо.
Согласно другому варианту осуществления представлено соединение формулы (Ib), где R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R9 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R9 представляет собой -(С1-С6)галогеналкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R9 представляет собой -CH2F. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R9 представляет собой -CHF2. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R9 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R9 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R9 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -(C1-C6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой -(C1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ib), где R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца.
Согласно другому варианту осуществления представлено соединение формулы (Ib), где R1 и R2 каждый независимо представляет собой Н или -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R1 и R2 каждый независимо представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R1 представляет собой Н и R2 представляет собой -(C1-C6)алкил- NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ib), где R1 и R2 каждый представляет собой -CH2CH2NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где R1 представляет собой Н и R2 представляет собой -(С1-С6)алкил-NR21R22. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (Ib), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где X представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой гетероарил, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой гетероарил, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно другому варианту осуществления представлено соединение формулы (Ib), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды -(C1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой пиридин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой пиримидин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой пиридин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой пиримидин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где X представляет собой пиримидин, который замещен дважды метилом. Согласно другому варианту осуществления представлено соединение формулы (Ib), где X представляет собой необязательно замещенный -(C1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Y представляет собой необязательно замещенный -(C1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Y представляет собой -N(H)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Z представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Z представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где Z представляет собой фенил, замещенный один раз или дважды -(С1-С8)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где Z представляет собой фенил, замещенный один раз н-бутилом, изобутилом или трет-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где Z представляет собой фенил, замещенный один раз н-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где Z представляет собой фенил, замещенный один раз изобутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ib), где Z представляет собой фенил, замещенный один раз трет-бутилом. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (Ib), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (Ib), где -X-Y-Z представляет собой

Согласно другому варианту осуществления представлено соединение формулы (I), характеризующееся структурой формулы (Ic):
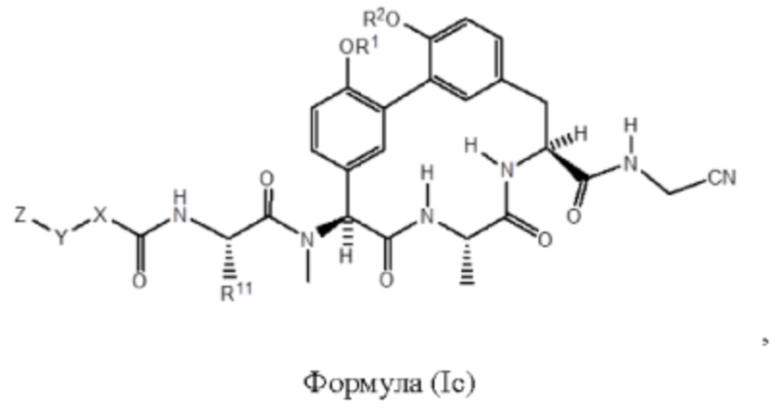
где:
R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -СН2СН(гетероциклоалкил)CH2NH2, -CH2C(O)NH2, -CH2C(O)N(H)CH2CN, -(С1-С6)алкил-С(O)OR23, -(С1-С6)алкил-NR21R22, -(С1-С6)алкил-C(O)NR25R26, -(C1-C6)алкил-N(R23)C(O)(C1-C6)алкилNR21R22 или -(С1-С6)алкил-C(O)N(R23)(C1-C6)алкил или необязательно замещенный гетероциклоалкил;
R11 представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -(С1-С6)алкил-SR23, -(С1-С6)алкил-С(O)OR23, -(С1-С6)алкил-NR21R22, -(С1-С6)алкил-CN, -(С1-С6)алкил-C(O)NR25R26, -(С1-С6)гетероалкил-CO2H, -(С1-С6)алкил-S(O)-(С1-С6)алкил, -(C1-С6)алкил-N(H)CH=NH, -(C1-C6)алкил-N(H)C(NH)NH2, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(C1-С6)алкилгетероарил;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил. необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(C1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(C1-C6)алкил-N(R24)(C1-C6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(C1-C6)алкил-, -N(R24)SO2(C1-C6)алкил-, -N(R24)C(O)(C1-C6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(O)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил-, необязательно замещенный -N(R24)SO2apил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -СО2Н, -(С1-С12)алкил, -(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)C(O)(C1-C12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(C1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(O)(С1-С6)алкил, -C(O)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил; и
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -(C1-C6)алкил[-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -(С1-С6)алкил-СМ. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -(C1-C6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой -(C1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R11 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (Ic), где R1 и R2 каждый независимо представляет собой Н или -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R1 и R2 каждый независимо представляет собой -(С1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R1 представляет собой Н и R2 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (Ic), где R1 и R2 каждый представляет собой -CH2CH2NH2. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где R1 представляет собой Н и R2 представляет собой -(С1-С6)алкил-NR21R22. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (Ic), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где X представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой гетероарил, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой гетероарил, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно другому варианту осуществления представлено соединение формулы (Ic), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой пиридин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой пиримидин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой пиридин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой пиримидин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где X представляет собой пиримидин, который замещен дважды метилом. Согласно другому варианту осуществления представлено соединение формулы (Ic), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Y представляет собой -N(Н)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Z представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Z представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где Z представляет собой фенил, замещенный один раз или дважды -(С1-С8)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где Z представляет собой фенил, замещенный один раз н-бутилом, изобутилом или трет-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где Z представляет собой фенил, замещенный один раз н-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где Z представляет собой фенил, замещенный один раз изобутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Ic), где Z представляет собой фенил, замещенный один раз трет-бутилом. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (Ic), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (Ic), где -X-Y-Z представляет собой

Согласно другому варианту осуществления представлено соединение формулы (I), характеризующееся структурой формулы (Id):

где:
R11 представляет собой -CH2NH2, -CH2CH2NH2 или -CH2CH2CH2NH2;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетерогдтклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(C1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С1-С6)алкил-N(R24)(С1-С6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(C1-C6)алкил-, -N(R24)SO2(C1-С6)алкил-, -N(R24)C(O)(C1-C6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(O)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил-, необязательно замещенный -N(R24)SO2арил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -CO2H, -(С1-С12)алкил, -(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)C(O)(C1-C12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил; и
R25 и R26 независимо представляет собой Н или необязательно замещенный -(C1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (Id), где R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (Id), где R11 представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (Id), где R11 представляет собой -CH2CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (Id), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Id), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (Id), где X представляет собой необязательно замещенный гетероарил. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой гетероарил, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой гетероарил, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно другому варианту осуществления представлено соединение формулы (Id), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды -(C1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой пиридин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой пиридин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой пиримидин, который является незамещенным или замещен один раз -(С1-С6)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой пиримидин, который является незамещенным или замещен один раз или дважды метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой пиридин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой пиримидин, который замещен один раз метилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где X представляет собой пиримидин, который замещен дважды метилом. Согласно другому варианту осуществления представлено соединение формулы (Id), где X представляет собой необязательно замещенный -(C1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Id), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Id), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (Id), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (Id), где Y представляет собой необязательно замещенный -(C1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Id), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Id), где Y представляет собой -N(H)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (Id), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (Id), где Z представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (Id), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (Id), где Z представляет собой необязательно замещенный фенил. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где Z представляет собой фенил, замещенный один раз или дважды -(С1-С8)алкилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где Z представляет собой фенил, замещенный один раз н-бутилом, изобутилом или трет-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где Z представляет собой фенил, замещенный один раз н-бутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где Z представляет собой фенил, замещенный один раз изобутилом. Согласно дополнительному варианту осуществления представлено соединение формулы (Id), где Z представляет собой фенил, замещенный один раз трет-бутилом. Согласно другому варианту осуществления представлено соединение формулы (Id), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (Id), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (Id), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (Id), где -X-Y-Z представляет собой

Согласно другому аспекту в настоящем изобретении описано соединение формулы (II):
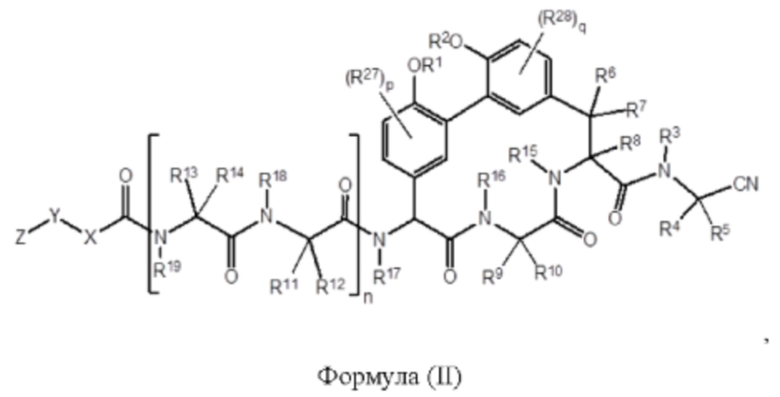
где:
R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -СН2СН(гетероциклоалкил)CH2NH2, -CH2C(O)NH2, -CH2C(O)N(H)CH2CN, -(С1-С6)алкил-С(O)OR23, -(С1-С6)алкил-NR21R22, -(С1-С6)алкил-C(O)NR25R26, -(C1-С6)алкил-N(R23)С(О)(С1-С6)алкилNR21R22 или (С1-С6)алкил-C(O)N(R23)(C1-C6)алкил или необязательно замещенный гетероциклоалкил;
R3 представляет собой Н или -(С1-С6)алкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(O)NH2; или R3 и R4 объединены с образованием гетероциклоалкильного кольца;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R6, R7 и R8 каждый независимо представляет собой Н или -(С1-С6)алкил;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R10 представляет собой Н или -(С1-С6)алкил;
R11 и R12 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(C1-С6)алкил-OR23, -(C1-C6)алкил-SR23, -(С1-С6)алкил-С(O)OR23, -(C1-C6)алкил-NR21R22, -(C1-С6)алкил-CN, -(C1-C6)алкил-C(O)NR25R26, -(С1-С6)гетероалкил-CO2H, -(С1-С6)алкил-S(O)-(С1-С6)алкил, -(С1-С6)алкил-N(Н)СН=NH, -(C1-C6)алкил-N(H)C(NH)NH2, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(С1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н;
R13 и R14 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(C1-С6)алкил-OR23, -(C1-C6)алкил-SR23, -(С1-С6)алкил-С(O)OR23, -(C1-C6)алкил-NR21R22, -(C1-С6)алкил-CN, -(C1-C6)алкил-C(O)NR25R26, -(C1-C6)алкил-N(H)C(NH)NH2, -(C1-С6)алкилгетероциклоалкил или -(С1-С6)алкилгетероарил; или R13 и R19 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R14 представляет собой Н;
R15, R16, R17, R18 и R19 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(С1-С6)алкил-OR23, -(C1-C6)алкил-C(O)OR23 или -(C1-С6)алкил-NR21R22.
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(C1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(C1-C6)алкил-;
Y представляет собой связь, необязательно замещенный -(C1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(C1-C6)алкил-N(R24)(C1-C6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(C1-C6)алкил-, -N(R24)SO2(C1-C6)алкил-, -N(R24)C(O)(C1-C6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(C1-C6)алкил-, -С(O)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил-, необязательно замещенный -N(R24)SO2арил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -(С1-С12)алкил, -(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)C(O)(C1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(C1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(O)(С1-С6)алкил, -C(O)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил;
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(C1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R27 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
каждый R28 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
n равно 0 или 1;
р равно 0, 1 или 2; и
q равно 0, 1 или 2;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (II), где n равно 0. Согласно другому варианту осуществления представлено соединение формулы (II), где n равно 1.
Согласно другому варианту осуществления представлено соединение формулы (II), где R6, R7 и R8 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R15 и R16 представляют собой Н.
Согласно одному варианту осуществления представлено соединение формулы (II), где R17 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R17 представляет собой -CH3. Согласно другому варианту осуществления представлено соединение формулы (II), где R17 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (II), где R17 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R17 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (II), где R17 представляет собой -(C1-С6)алкил-C(O)OR23. Согласно другому варианту осуществления представлено соединение формулы (II), где R17 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II), где R17 представляет собой -(C1-C6)арил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II), где R17 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R17 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R18 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R19 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R3 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R5 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II), где R4 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R4 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II), где R4 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (II), где R4 представляет собой -(C1-С6)алкил-ОН. Согласно другому варианту осуществления представлено соединение формулы (II), где R4 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II), где R4 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R4 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (II), где R4 представляет собой -C(O)NH2.
Согласно другому варианту осуществления представлено соединение формулы (II), где R3, R4 и R5 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо.
Согласно другому варианту осуществления представлено соединение формулы (II), где R10 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R10 представляет собой Н и R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R10 представляет собой Н и R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II), где R10 представляет собой Н и R9 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (II), где R10 представляет собой Н и R9 представляет собой -(С1-С6)галогеналкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R10 представляет собой Н и R9 представляет собой -CH2F. Согласно другому варианту осуществления представлено соединение формулы (II), где R10 представляет собой Н и R9 представляет собой -CHF2. Согласно другому варианту осуществления представлено соединение формулы (II), где R10 представляет собой Н и R9 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R10 представляет собой Н и R9 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (II), где R10 представляет собой Н и R9 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (II), где R11 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -(C1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -(C1-C6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (II), где R12 представляет собой Н и R11 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (II), где R14 представляет собой Н и R13 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где R13 и R19 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R14 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II), где р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (II), где р равно 1 и R27 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где q равно 0, р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (II), где q равно 0, р равно 1 и R27 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (II), где q равно 1 и R28 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где р равно 0, q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (II), где р равно 0, q равно 1 и R28 представляет собой необязательно замещенный -(С1-С6)алкил.
Согласно другому варианту осуществления представлено соединение формулы (II), где р равно 0 и q равно 0.
Согласно другому варианту осуществления представлено соединение формулы (II), где R1 и R2 каждый независимо представляет собой Н или -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II), где R1 и R2 каждый независимо представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II), где R1 представляет собой Н и R2 представляет собой -(C1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II), где R1 и R2 каждый представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (II). где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (II), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (II), где X представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (II), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно другому варианту осуществления представлено соединение формулы (II), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (II), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (II), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (II), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (II), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (II), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (II), где Y представляет собой -N(Н)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (II), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (II), где Z представляет собой -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (II), где Z представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (II), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (II), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (II), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (II), где -X-Y-Z представляет собой
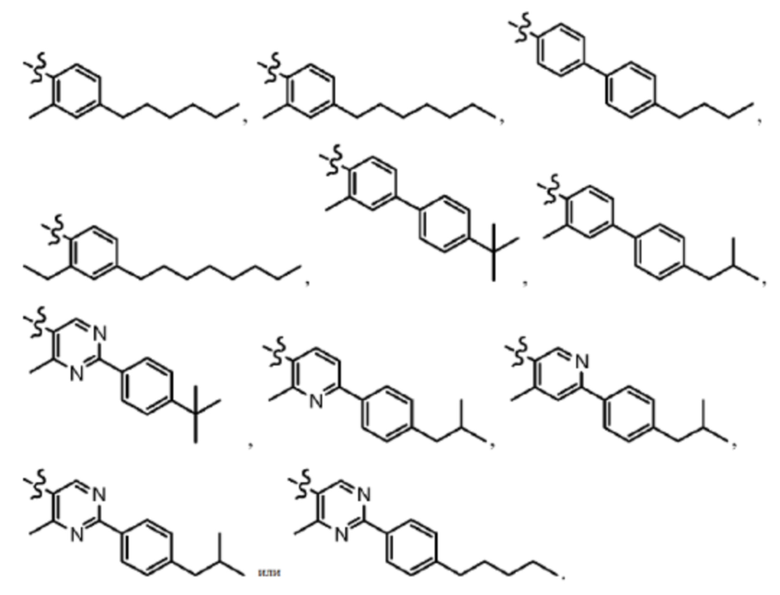
Согласно другому аспекту в настоящем изобретении описано соединение формулы (II'):

R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -СН2СН(гетероциклоалкил)CH2NH2, -CH2C(O)NH2, -CH2C(O)N(H)CH2CN, -(С1-С6)алкил-С(O)O23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-C(O)NR25R26, -(C1-C6)алкил-N(R23)C(O)(C1-C6)aлкилNR21R22, -(C1-C6)алкил-C(O)N(R23)(C1-С6)алкил, -(С1-С6)алкил-С(O)N(R23)(С1-С6)алкилгетероциклоалкил, необязательно замещенный (С1-С6)гетероалкил или необязательно замещенный гетероциклоалкил;
R3 представляет собой Н или -(С1-С6)алкил;
R4 представляет собой Н, -(С1-С6)алкил, -(C1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(O)NH2; или R3 и R4 объединены с образованием гетероциклоалкильного кольца;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R6, R7 и R8 каждый независимо представляет собой Н или -(С1-С6)алкил;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R10 представляет собой Н или -(С1-С6)алкил;
R11 и R12 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(C1-C6)алкил-OR23, -(С1-С6)алкил-SR23, -(C1-C6)алкил-C(O)OR23, -(C1-C6)алкил-NR21R22, -(C1-С6)алкил-CN, -(C1-C6)алкил-C(O)NR25R26, -(С1-С6)гетероалкил-CO2H, -(С1-С6)алкил-S(O)-(С1-С6)алкил, -(C1-C6)алкил-N(H)CH=NH, -(С1-С6)алкил-С(NH2)=NH, -(С1-С6)алкил-N(H)C(NH)NH2, -(C1-C6)алкил-N(H)SO2NR25R26, -(C1-C6)алкил-N(H)-C(O)NR25R26, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероцикло алкил или -(С1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н;
R13 и R14 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(C1-С6)алкил-OR23, -(C1-C6)алкил-SR23, -(C1-C6)алкил-C(O)OR23, -(C1-C6)алкил-NR21R22, -(C1-С6)алкил-CN, -(C1-C6)алкил-C(O)NR25R26, -(C1-C6)алкил-N(H)C(NH)NH2, -(C1-С6)алкилгетероциклоалкил или -(С1-С6)алкилгетероарил; или R13 и R19 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R14 представляет собой Н;
R15, R16, R17, R18 и R19 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(C1-C6)алкил-OR23, -(C1-C6)алкил-C(O)OR23 или -(С1-С6)алкил-NR21R22;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(C1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(C1-C6)алкил-N(R24)(C1-C6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(С1-С6)алкил-, -N(R24)SO2(C1-C6)алкил-, -N(R24)C(O)(C1-C6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(O)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил-, необязательно замещенный -N(R24)SO2apил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -(С1-С12)алкил, -(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)C(O)(C1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(C1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(O)(С1-С6)алкил, -C(O)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил;
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R27 независимо представляет собой галоген, -NR23R24, -NC(O)R23, -NC(O)NR23R24), нитро, гидроксил, необязательно замещенный -(C1-С6)алкил, необязательно замещенный -(С1-С6)гетероалкил, -(С1-С6)алкокси, -С(O)(С1-С6)алкил или -S(O)2(С1-С6)алкил;
каждый R28 независимо представляет собой галоген, -NR23R24, -NC(O)R23, -NC(O)NR23R24), нитро, гидроксил, необязательно замещенный -(C1-С6)алкил, необязательно замещенный -(С1-С6)гетероалкил, -(С1-С6)алкокси, -С(O)(С1-С6)алкил или -S(O)2(С1-С6)алкил;
n равно 0 или 1;
р равно 0, 1 или 2; и
q равно 0, 1 или 2;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (II'), где n равно 0. Согласно другому варианту осуществления представлено соединение формулы (II'), где n равно 1.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R6, R7 и R8 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R15 и R16 представляют собой Н.
Согласно одному варианту осуществления представлено соединение формулы (II'), где R17 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R17 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II'), где R17 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (II'), где R17 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R17 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R17 представляет собой -(С1-С6)алкил-C(O)OR23. Согласно другому варианту осуществления представлено соединение формулы (II'), где R17 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II'), где R17 представляет собой -(С1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II'), где R17 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R17 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R18 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R19 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R3 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R5 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II'), где R4 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R4 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II'), где R4 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (II'), где R4 представляет собой -(С1-С6)алкил-ОН. Согласно другому варианту осуществления представлено соединение формулы (II'), где R4 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II'), где R4 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R4 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R4 представляет собой -C(O)NH2.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R3, R4 и R5 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R10 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R10 представляет собой Н и R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R10 представляет собой Н и R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II'), где R10 представляет собой Н и R9 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (II'), где R10 представляет собой Н и R9 представляет собой -(C1-С6)галогеналкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R10 представляет собой Н и R9 представляет собой -CH2F. Согласно другому варианту осуществления представлено соединение формулы (II'), где R10 представляет собой Н и R9 представляет собой -CHF2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R10 представляет собой Н и R9 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R10 представляет собой Н и R9 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R10 представляет собой Н и R9 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (II'), где R11 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -(C1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -(C1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -(C1-C6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R12 представляет собой Н и R11 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (II'), где R14 представляет собой Н и R13 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R13 и R19 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R14 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (II'), где р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (II'), где р равно 1 и R27 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где q равно 0, р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (II'), где q равно 0, р равно 1 и R27 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (II'), где q равно 1 и R28 представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где р равно 0, q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (II'), где р равно 0, q равно 1 и R28 представляет собой необязательно замещенный -(С1-С6)алкил.
Согласно другому варианту осуществления представлено соединение формулы (II'), где р равно 0 и q равно 0.
Согласно другому варианту осуществления представлено соединение формулы (II'), где R1 и R2 каждый независимо представляет собой Н или -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II'), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II'), где R1 и R2 каждый независимо представляет собой -(C1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II'), где R1 представляет собой Н и R2 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (II'), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II'), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (II'), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (II'), где R1 представляет собой R2 каждый представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (II'), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (II'), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (II'), где X представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (II'), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно другому варианту осуществления представлено соединение формулы (II'), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (II'), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (II'), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (II'), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (II'), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (II'), где Y представляет собой -O-(О-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (II'), где Y представляет собой -Х(Н)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (II'), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (II'), где Z представляет собой -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (II'), где Z представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (II'), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (II'), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (II'), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (II'), где -X-Y-Z представляет собой

Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), характеризующееся структурой формулы (IIa):

где:
R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -СН2СН(гетероциклоалкил)CH2NH2, -CH2C(O)NH2, -CH2C(O)N(H)CH2CN, -(C1-C6)алкил-C(O)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-C(O)NR25R26, -(C1-C6)алкил-N(R23)C(O)(C1-С6)алкил-NR21R22 или -(С1-С6)алкил-C(O)N(R23)(C1-C6)алкил или необязательно замещенный гетероциклоалкил;
R3 представляет собой Н или -(С1-С6)алкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(O)NH2; или R3 и R4 объединены с образованием гетероциклоалкильного кольца;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R6, R7 и R8 каждый независимо представляет собой Н или -(С1-С6)алкил;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R10 представляет собой Н или -(С1-С6)алкил;
R11 и R12 каждый независимо представляет собой Н, -NH2, -(С1-С6)алкил, -(C1-С6)алкил-OR23, -(C1-C6)алкил-SR23, -(С1-С6)алкил-С(O)OR23, -(C1-C6)алкил-NR21R22, -(C1-С6)алкил-CN, -(C1-C6)алкил-C(O)NR25R26, -(С1-С6)гетероалкил-СО2Н, -(C1-C6)алкил-S(O)-(С1-С6)алкил, -(C1-C6)алкил-N(H)CH=NH, -(C1-C6)алкил-N(H)C(NH)NH2, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(С1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н;
R13 и R14 каждый независимо представляет собой Н, -NH2, -(О-С6)алкил, -(C1-С6)алкил-OR23, -(С1-С6)алкил-SR23, -(С1-С6)алкил-С(O)OR23, -(C1-C6)алкил-NR21R22, -(C1-С6)алкил-CN, -(C1-C6)алкил-C(O)NR25R26, -(C1-C6)алкил-N(H)C(NH)NH2, -(C1-С6)алкилгетероциклоалкил или -(С1-С6)алкилгетероарил; или R13 и R19 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R14 представляет собой Н;
R15, R16, R17, R18 и R19 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(С1-С6)алкил-OR23, -(C1-C6)алкил-C(O)OR23 или -(C1-С6)алкил-NR21R22.
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-. -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(C1-C6)алкил-, -N(R24)(C6-C10)арил- или -SO2(C1-C6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(C1-C6)алкил-N(R24)(C1-C6)алкил-, -O-(С1-С6)алкил-, -О(С6-С10)арил-, -N(R24)(C1-C6)алкил-, -N(R24)SO2(C1-C6)алкил-, -N(R24)C(O)(C1-C6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(O)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил-, необязательно замещенный -N(R24)SО2apил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -(С1-С12)алкил,-(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-С12)алкил, -N(R24)C(O)(C1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(C1-С6)гетероалкил, -(С1-С6)алкил-СО2Н, -С(O)(С1-С6)алкил, -C(O)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил;
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R27 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
каждый R28 независимо представляет собой галоген, необязательно замещенный -(С1-С6)алкил или необязательно замещенный -(С1-С6)гетероалкил;
n равно 0 или 1;
р равно 0, 1 или 2; и
q равно 0, 1 или 2;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (IIa), где n равно 0. Согласно другому варианту осуществления представлено соединение формулы (IIa), где n равно 1.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R6, R7 и R8 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R15 и R16 представляют собой Н.
Согласно одному варианту осуществления представлено соединение формулы (IIa), где R17 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R17 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R17 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R17 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R17 представляет собой -(С1-С6)алкил-C(O)OR23. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R17 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R17 представляет собой -(С1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R17 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R17 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R18 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R19 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R3 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R5 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R4 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R4 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R4 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R4 представляет собой -(С1-С6)алкил-ОН. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R4 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R4 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R4 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R4 представляет собой -C(O)NH2.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R3, R4 и R5 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R10 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R10 представляет собой Н и R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R10 представляет собой Н и R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R10 представляет собой Н и R9 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R10 представляет собой Н и R9 представляет собой -(C1-С6)галогеналкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R10 представляет собой Н и R9 представляет собой -CH2F. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R10 представляет собой Н и R9 представляет собой -CHF2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R10 представляет собой Н и R9 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R10 представляет собой Н и R9 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R10 представляет собой Н и R9 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R11 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -(C1-С6)алкил-НН2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -(C1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -(C1-C6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой -(С1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R12 представляет собой Н и R11 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-НН2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой -(С1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R14 представляет собой Н и R13 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R13 и R19 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R14 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (IIa), где р равно 1 и R27 представляет собой необязательно замещенный -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где q равно 0, р равно 1 и R27 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (IIa), где q равно 0, р равно 1 и R представляет собой необязательно замещенный -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (IIa), где q равно 1 и R28 представляет собой необязательно замещенный -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где р равно 0, q равно 1 и R28 представляет собой галоген. Согласно другому варианту осуществления представлено соединение формулы (IIa), где р равно 0, q равно 1 и R28 представляет собой необязательно замещенный -(С1-С6)алкил.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где р равно 0 и q равно 0.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где R1 и R2 каждый независимо представляет собой Н или -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R1 и R2 каждый независимо представляет собой -(С1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R1 представляет собой Н и R2 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIa), где R1 и R2 каждый представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где X представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно другому варианту осуществления представлено соединение формулы (IIa), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Y представляет собой -N(Н)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Z представляет собой -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Z представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IIa), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (IIa), где -X-Y-Z представляет собой

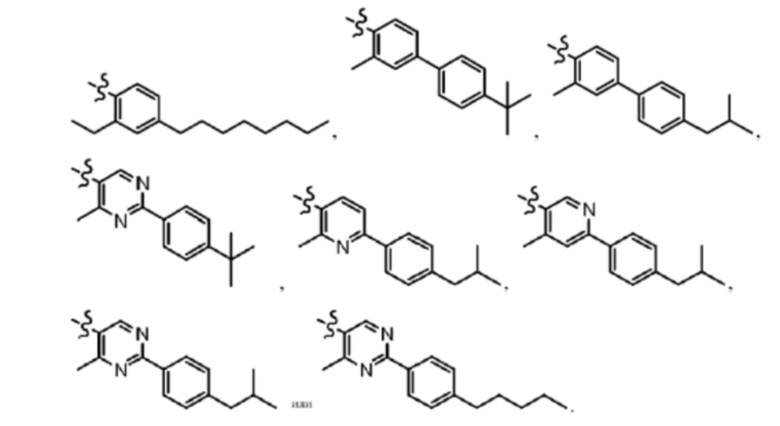
Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), характеризующееся структурой формулы (IIb):

где:
R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -СН2СН(гетероциклоалкил)CH2NH2, -CH2C(O)NH2, -CH2C(O)N(H)CH2CN, -(С1-C6)алкил-С(O)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-C(O)NR25R26, -(С1-С6)алкил-N(R23)С(O)(С1-С6)алкилNR21R22 или -(С1-С6)алкил-C(O)N(R23)(C1-C6)алкил или необязательно замещенный гетероциклоалкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(O)NH2;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R11 представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -(С1-С6)алкил-SR23, -(С1-С6)алкил-С(O)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-CN, -(С1-С6)алкил-C(O)NR25R26, -(С1-С6)гетероалкил-CO2H, -(С1-С6)алкил-S(O)-(С1-С6)алкил, -(C1-С6)алкил-N(H)CH=NH, -(C1-C6)алкил-N(H)C(NH)NH2, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-N(Н)гетероциклоалкил или -(C1-С6)алкилгетероарил; или R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца;
R13 представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -(С1-С6)алкил-SR23, -(С1-С6)алкил-С(O)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-CN, -(С1-С6)алкил-C(O)NR25R26, -(C1-C6)алкил-N(H)C(NH)NH2, -(С1-С6)алкилгетероциклоалкил или -(C1-С6)алкилгетероарил; или R13 и R19 объединены с образованием необязательно замещенного гетероциклоалкильного кольца;
R17, R18 и R19 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(C1-C6)алкил-OR23, -(C1-C6)алкил-C(O)OR23 или -(C1-C6)алкил-NR21R22;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(С1-С6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(C1-C6)алкил-N(R24)(C1-C6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(C1-C6)алкил-, -N(R24)SO2(C1-C6)алкил-, -N(R24)C(O)(C1-C6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(O)NH(С1-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил-, необязательно замещенный -N(R24)SО2apил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -(С1-С12)алкил,-(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)C(O)(C1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(C1-С6)гетероалкил, -(С1-С6)алкил-СО2Н, -С(O)(С1-С6)алкил, -C(O)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил; и
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (IIb), где R17 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R17 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R17 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R17 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R17 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R17 представляет собой -(С1-С6)алкил-C(O)OR23. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R17 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R17 представляет собой -(С1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R17 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R17 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R18 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R19 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R5 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 представляет собой -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 представляет собой -(С1-С6)алкил-ОН. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 представляет собой -C(O)NH2.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 и R5 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R9 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R9 представляет собой -(С1-С6)галогеналкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R9 представляет собой -CH2F. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R9 представляет собой -CHF2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R9 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R9 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R9 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -(С1-С6)алкил-НН2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -(C1-C6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой -(C1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R11 и R18 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R12 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -(C1-C6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой -(C1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R13 и R19 объединены с образованием необязательно замещенного гетероциклоалкильного кольца и R14 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где R1 и R2 каждый независимо представляет собой Н или -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R1 и R2 каждый независимо представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R1 представляет собой Н и R2 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIb), где R1 и R2 каждый представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где X представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно другому варианту осуществления представлено соединение формулы (IIb), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Y представляет собой -O-(О-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Y представляет собой -Х(Н)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Z представляет собой -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Z представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IIb), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (IIb), где -X-Y-Z представляет собой

Согласно другому варианту осуществления в настоящем изобретении описано соединение формулы (II), характеризующееся структурой формулы (IIc):

где:
R1 и R2 каждый независимо представляет собой Н или -CH2CH2NH2;
R11 представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -(С1-С6)алкил-SR23, -(C1-C6)алкил-C(O)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-CN, -(C1-С6)алкил-C(O)NR25R26, -(С1-С6)гетероалкил-CO2H, -(С1-С6)алкил-S(O)-(С1-С6)алкил, -(C1-С6)алкил-N(H)CH=NH, -(C1-C6)алкил-N(H)C(NH)NH2, -(С1-С6)алкилгетероциклоалкил, необязательно замещенный -(С1-С6)алкил-Н(Н)гетероциклоапкил или -(C1-С6)алкилгетероарил;
R13 представляет собой Н, -NH2, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -(С1-С6)алкил-SR23, -(С1-С6)алкил-С(O)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-CN, -(а-С6)алкил-C(O)NR25R26, -(C1-C6)алкил-N(H)C(NH)NH2, -(С1-С6)алкилгетероциклоалкил или -(C1-С6)алкилгетероарил;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(С1-С6)алкил-, -N(R24)(С6-С10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С1-С6)алкил-N(R24)(С1-С6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(С1-С6)алкил-, -N(R24)SO2(C1-C6)алкил-, -N(R24)С(O)(С1-С6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(O)МН(О-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил-, необязательно замещенный -N(R24)SО2apил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -(С1-С12)алкил,-(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)C(O)(C1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(C1-С6)гетероалкил, -(С1-С6)алкил-СО2Н, -С(O)(С1-С6)алкил, -C(O)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил; и
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -(О-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -(С1-С6)алкил-NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -(C1-C6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой -(C1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R11 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -(С1-С6)алкил-OR23. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -(С1-С6)алкил-NH2.
Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -CH2CH2CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -(С1-С6)алкил-CN. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -CH2CN. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -(C1-C6)алкил-C(O)NR25R26. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -CH2CH2C(O)NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой -(C1-С6)алкилгетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R13 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IIc), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIc), где R1 и R2 каждый представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (IIc), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где X представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно другому варианту осуществления представлено соединение формулы (IIc), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Y представляет собой необязательно замещенный арил.
Согласно другому варианту осуществления представлено соединение формулы (IIc), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Y представляет собой -N(Н)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Z представляет собой -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Z представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IIc), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (IIc), где -X-Y-Z представляет собой
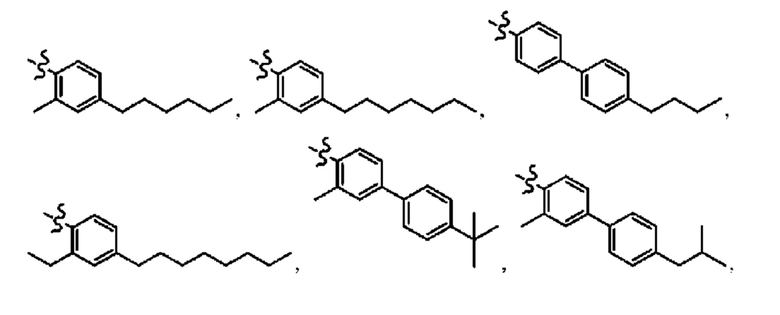
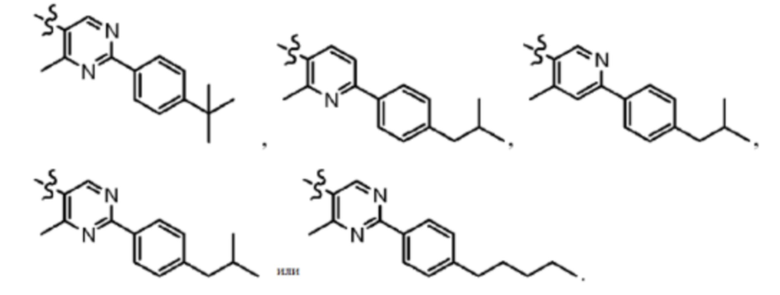
Согласно другому варианту осуществления в настоящем изобретении описаны соединения формулы (II), характеризующиеся структурой формулы (IId):

где:
R1 и R2 каждый независимо представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-OR23, -CH2CH(OH)CH2NH2, -СН2СН(гетероциклоалкил)CH2NH2, -CH2C(O)NH2, -CH2C(O)N(H)CH2CN, -(C1-C6)алкил-C(O)OR23, -(C1-C6)алкил-NR21R22, -(С1-С6)алкил-C(O)NR25R26, -(С1-С6)алкил-N(R23)С(О)(С1-С6)алкилNR21R22 или -(С1-С6)алкил-C(O)N(R23)(C1-C6)алкил или необязательно замещенный гетероциклоалкил;
R4 представляет собой Н, -(С1-С6)алкил, -(С1-С6)алкил-ОН, -(С3-С6)циклоалкил или -C(O)NH2;
R5 представляет собой Н или -(С1-С6)алкил; или R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо;
R9 представляет собой Н, -(С1-С6)алкил, -(С1-С6)галогеналкил или -(С3-С6)циклоалкил;
R17 представляет собой Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(С1-С6)алкил-OR23, -(C1-C6)алкил-C(O)OR23 или -(C1-C6)алкил-NR21R22;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(C1-С6)алкил-, -N(R24)(С6-С10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С1-С6)алкил-N(R24)(С1-С6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(С1-С6)алкил-, -N(R24)SO2(C1-C6)алкил-, -N(R24)С(O)(С1-С6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(С1-С6)алкил-, -С(O)NH(О-С6)алкил-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)C(O)арил-, необязательно замещенный -N(R24)SО2apил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -(С1-С12)алкил,-(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(С1-С12)алкил, -N(R24)(C1-C12)алкил, -N(R24)C(O)(C1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R21 и R22 независимо представляет собой Н, -(С1-С6)алкил, -(C1-С6)гетероалкил, -(С1-С6)алкил-CO2H, -С(O)(С1-С6)алкил, -C(O)N(R31)2 или -SO2N(R31)2; или R21 и R22 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R31 независимо представляет собой Н или -(С1-С6)алкил; или два R31 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
каждый R23 независимо представляет собой Н или -(С1-С6)алкил;
каждый R24 независимо представляет собой Н или -(С1-С6)алкил; и
каждый R25 и R26 независимо представляет собой Н или необязательно замещенный -(С1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (IId), где R17 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IId), где R17 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IId), где R17 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (IId), где R17 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IId), где R17 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (IId), где R17 представляет собой -(С1-С6)алкил-C(O)OR23. Согласно другому варианту осуществления представлено соединение формулы (IId), где R представляет собой -СН2СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IId), где R17 представляет собой -(С1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IId), где R17 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IId), где R17 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IId), где R5 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 представляет собой -(С1-С6)алкил-ОН. Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 представляет собой -СН2ОН. Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 представляет собой -C(O)NH2.
Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 и R5 представляют собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IId), где R4 и R5 и атом углерода, к которому они присоединены, образуют циклопропильное кольцо.
Согласно другому варианту осуществления представлено соединение формулы (IId), где R9 представляет собой -(С1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IId), где R9 представляет собой -СН3. Согласно другому варианту осуществления представлено соединение формулы (IId), где R9 представляет собой -СН2СН3. Согласно другому варианту осуществления представлено соединение формулы (IId), где R9 представляет собой -(С1-С6)галогеналкил. Согласно другому варианту осуществления представлено соединение формулы (IId), где R9 представляет собой -CH2F. Согласно другому варианту осуществления представлено соединение формулы (IId), где R9 представляет собой -CHF2. Согласно другому варианту осуществления представлено соединение формулы (IId), где R9 представляет собой -(С3-С6)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IId), где R9 представляет собой циклопропил. Согласно другому варианту осуществления представлено соединение формулы (IId), где R9 представляет собой Н.
Согласно другому варианту осуществления представлено соединение формулы (IId), где R1 и R2 каждый независимо представляет собой Н или -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IId), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IId), где R1 и R2 каждый независимо представляет собой -(C1-C6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IId), где R1 представляет собой Н и R2 представляет собой -(C1-С6)алкил-NR21R22. Согласно другому варианту осуществления представлено соединение формулы (IId), где R1 представляет собой -(C1-C6)алкил-NR21R22 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IId), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IId), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IId), где R1 и R2 каждый представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (IId), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IId), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IId), где X представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IId), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно другому варианту осуществления представлено соединение формулы (IId), где X представляет собой необязательно замещенный -(C1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IId), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IId), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IId), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IId), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IId), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IId), где Y представляет собой -N(Н)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IId), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (IId), где Z представляет собой -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IId), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IId), где Z представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IId), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IId), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IId), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (IId), где -X-Y-Z представляет собой
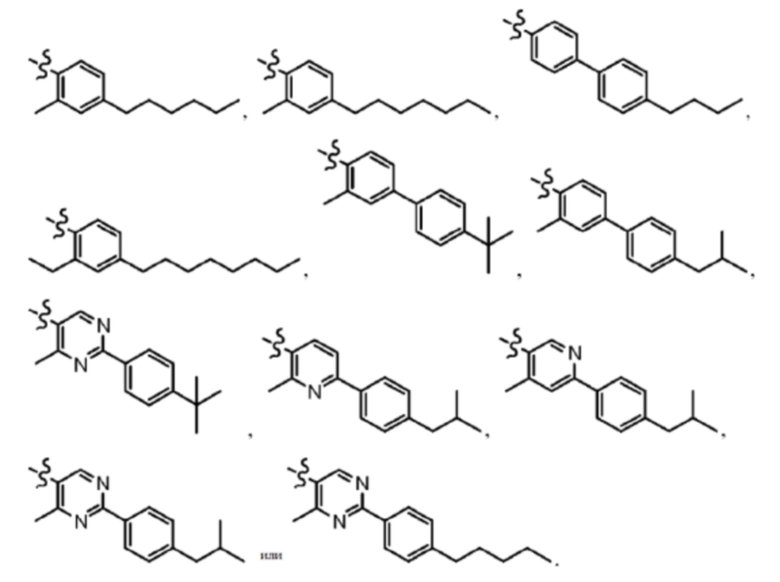
Согласно другому варианту осуществления в настоящем изобретении описаны соединения формулы (II), характеризующиеся структурой формулы (IIe):
где:
R1 и R2 каждый независимо представляет собой Н или -CH2CH2NH2;
X представляет собой необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С3-С7)циклоалкил-, необязательно замещенный гетероциклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, -O-(C1-С6)алкил-, -N(R24)(C1-С6)алкил-, -N(R24)(C6-C10)арил- или -SO2(С1-С6)алкил-;
Y представляет собой связь, необязательно замещенный -(С1-С6)алкил-, -(С2-С6)алкенил-, -(С2-С6)алкинил, -(С1-С6)алкил-N(R24)(С1-С6)алкил-, -O-(С1-С6)алкил-, -O(С6-С10)арил-, -N(R24)(C1-C6)алкил, -N(R24)SO2(C1-C6)алкил-, -N(R24)C(O)(C1-C6)алкил-, -С(O)(С1-С6)алкил-, -S(С1-С6)алкил-, -SO2(C1-C6)алкил-, -С(O)NH(C1-С6)алкпл-, -(С3-С7)циклоалкил-, необязательно замещенный -C(O)N(R24)арил-, необязательно замещенный -N(R24)С(O)арил-, необязательно замещенный -N(R24)SO2арил-, необязательно замещенный арил или необязательно замещенный гетероарил;
Z представляет собой Н, галоген, -NH2, -CN, -CF3, -(С1-С12)алкил,-(С2-С12)алкенил, -(С2-С12)алкинил, -C(O)NR25R26, -O-(C1-С6)алкил, -N(R24)(C1-С6)алкил, -N(R24)C(O)(C1-С12)алкил, необязательно замещенный -(С3-С7)циклоалкил, -(C1-С6)алкилгетероциклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R24 независимо представляет собой Н или -(C1-С6)алкил; и
R25 и R26 независимо представляет собой Н или необязательно замещенный -(C1-С6)алкил; или R25 и R26 и атом азота, к которому они присоединены, образуют гетероциклоалкильное кольцо;
или его фармацевтически приемлемая соль, сольват или пролекарство.
Согласно одному варианту осуществления представлено соединение формулы (IIe), где R1 и R2 каждый представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIe), где R1 представляет собой Н и R2 представляет собой -CH2CH2NH2. Согласно другому варианту осуществления представлено соединение формулы (IIe), где R1 представляет собой -CH2CH2NH2 и R2 представляет собой Н. Согласно другому варианту осуществления представлено соединение формулы (IIe), где R1 и R2 каждый представляет собой -CH2CH2NH2.
Согласно другому варианту осуществления представлено соединение формулы (IIe), где X представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где X представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где X представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где X представляет собой необязательно замещенный пиридин или необязательно замещенный пиримидин. Согласно другому варианту осуществления представлено соединение формулы (IIe), где X представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Y представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Y представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Y представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Y представляет собой необязательно замещенный -(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Y представляет собой -O-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Y представляет собой -N(Н)-(С1-С6)алкил-. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Y представляет собой связь. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Z представляет собой -(C1-С6)алкил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Z представляет собой необязательно замещенный арил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Z представляет собой необязательно замещенный фенил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Z представляет собой необязательно замещенный гетероарил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Z представляет собой необязательно замещенный -(С3-С7)циклоалкил. Согласно другому варианту осуществления представлено соединение формулы (IIe), где Z представляет собой галоген.
Согласно другому варианту осуществления представлено соединение формулы (IIe), где -X-Y-Z представляет собой

Согласно другому аспекту представлены гидраты или метаболиты, содержащие любое из вышеупомянутых соединений.
Согласно другому аспекту представлены фармацевтические композиции, содержащие любое из вышеупомянутых соединений вместе с фармацевтически приемлемым вспомогательным веществом.
Согласно другому аспекту в настоящем изобретении описано применение соединения, представленного в настоящем документе, при изготовлении лекарственного средства для лечения бактериальной инфекции у пациента.
В соответствии с другим аспектом предусмотрены способы лечения млекопитающего, нуждающегося в таком лечении, предусматривающие введение эффективного в антибактериальном отношении количества любого из вышеуказанных соединений для оказания благоприятного эффекта млекопитающему. В соответствии с одним вариантом осуществления млекопитающее имеет бактериальную инфекцию, которая является устойчивой к лечению ариломицином А2. В соответствии с дополнительным вариантом осуществления возбудителем бактериальной инфекции является вид бактерий, включающий Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas acidovorans, Pseudomonas alcaligenes, Pseudomonas putida, Stenotrophomonas maltophilia, Burkholderia cepacia, Aeromonas hydrophilia, Escherichia coli, Citrobacter freundii, Salmonella typhimurium, Salmonella typhi, Salmonella paratyphi, Salmonella enteritidis, Shigella dysenteriae, Shigella flexneri, Shigella sonnei, Enterobacter cloacae, Enterobacter aerogenes, Klebsiella pneumoniae, Klebsiella oxytoca, Serratia marcescens, Francisella tularensis, Morganella morganii, Proteus mirabilis, Proteus vulgaris, Providencia alcaIIfaciens, Providencia rettgeri, Providencia stuartii, Acinetobacter baumannii, Acinetobacter calcoaceticus, Acinetobacter haemolyticus, Yersinia enterocolitica, Yersinia pestis, Yersinia pseudotuberculosis, Yersinia intermedia, Bordetella pertussis, Bordetella parapertussis, Bordetella bronchiseptica, Haemophilus influenzae, Haemophilus parainfluenzae, Haemophilus haemolyticus, Haemophilus parahaemolyticus, Haemophilus ducreyi, Pasteurella multocida, Pasteurella haemolytica, Branhamella catarrhalis, Helicobacter pylori, Campylobacter fetus, Campylobacter jejuni, Campylobacter coli, Borrelia burgdorferi, Vibrio cholerae, Vibrio parahaemolyticus, Legionella pneumophila, Listeria monocytogenes, Neisseria gonorrhoeae, Neisseria meningitidis, Kingella, Moraxella, Gardnerella vaginaIIs, Bacteroides fragilis, Bacteroides distasonis, Bacteroides гомологичной группы 3452A, Bacteroides vulgatus, Bacteroides ovalus, Bacteroides thetaiotaomicron, Bacteroides uniformis, Bacteroides eggerthii, Bacteroides splanchnicus, Clostridium difficile, Mycobacterium tuberculosis, Mycobacterium avium, Mycobacterium intracellulare, Mycobacterium leprae, Corynebacterium diphtheriae, Corynebacterium ulcerans, Streptococcus pneumoniae, Streptococcus agalactiae, Streptococcus pyogenes, Enterococcus faecaIIs, Enterococcus faecium, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophytics, Staphylococcus intermedius, Staphylococcus hyicus subsp.hyicus, Staphylococcus haemolyticus, Staphylococcus hominis или Staphylococcus saccharolyticus. В соответствии с другим вариантом осуществления бактериальная инфекция представляет собой инфекцию при участии грамотрицательных бактерий. В соответствии с дополнительным вариантом осуществления бактериальная инфекция представляет собой инфекцию при участии грамположительных бактерий.
В соответствии с дополнительным вариантом осуществления предусмотрены способы лечения млекопитающего, нуждающегося в таком лечении, предусматривающие введение млекопитающему второго терапевтического средства в соответствии с любым из вышеуказанных способов лечения. В соответствии с другим вариантом осуществления второе терапевтическое средство не представляет собой ингибитор SpsB. В соответствии с другим вариантом осуществления второе терапевтическое средство представляет собой аминогликозидный антибиотик, фторхинолоновый антибиотик, β-лактамный антибиотик, макролидный антибиотик, гликопептидный антибиотик, рифампицин, хлорамфеникол, фторамфеникол, колистин, мупироцин, бацитрацин, даптомицин или линезолид.
В соответствии с некоторыми вариантами осуществления предусмотрен способ лечения бактериальной инфекции у пациента, предпочтительно человека, где лечение предусматривает введение терапевтически или фармакологически эффективного количества комбинации 1) β-лактамного антибиотика; и 2) соединения формулы (I), (I'). (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), или его фармацевтически приемлемой соли; и 3) фармацевтически приемлемого носителя. В соответствии с вариантами осуществления, где β-лактамный антибиотик применяется в комбинации с соединением формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), β-лактамный антибиотик может представлять собой карбапенем, цефалоспорин. цефамицин, монобактам или пенициллин. Иллюстративные карбапенемовые антибиотики, пригодные в способах по настоящему изобретению, включают эртапенем, имипенем, биапенем и меропенем. Иллюстративные цефалоспориновые антибиотики, пригодные в способах по настоящему изобретению, включают цефтобипрол, цефтаролин, цефпиром, цефозопран, цефепим, цефотаксим и цефтриазон. Иллюстративные пенициллиновые антибиотики, пригодные в способах по настоящему изобретению, включают ампициллин, амоксициллин, пиперациллин, оксациллин, клоксациллин, метициллин и нафциллин. В соответствии с некоторыми вариантами осуществления β-лактам можно вводить с ингибитором β-лактамаз. В соответствии с некоторыми вариантами осуществления настоящего изобретения карбапенем можно вводить с ингибитором DHP, например, циластатином.
В соответствии с различными вариантами осуществления настоящего изобретения, где соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) и β-лактамный антибиотик применяются в комбинации, β-лактамный антибиотик и соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) можно вводить последовательно или одновременно. Предпочтительно β-лактамный антибиотик и соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) вводят совместно. При одновременном введении β-лактамный антибиотик и соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) можно вводить в одном и том же составе или в отдельных составах. При последовательном введении либо β-лактамный антибиотик либо соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) можно вводить первым. После введения первого соединения другое соединение вводят, например, в пределах от 1 до 60 минут, например, в пределах 1, 2, 3, 4, 5, 10, 15, 30 или 60 минут. В соответствии с одним аспектом настоящего изобретения при применении ингибитора β-лактамаз его можно вводить отдельно или в составе с соединением формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) и/или β-лактамным антибиотиком. В соответствии с одним аспектом настоящего изобретения при применении ингибитора DHP в целях повышения стабильности карбапенема его можно вводить отдельно или в составе с соединением формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) и/или карбапенемом.
В настоящем документе дополнительно описаны фармацевтические композиции, содержащие соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe), фармацевтически приемлемый носитель и необязательно β-лактамный антибиотик. В соответствии с вариантами осуществления, где применяется комбинация, β-лактамный антибиотик и соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) присутствуют в таких количествах, что их комбинация составляет терапевтически эффективное количество. В результате усиливающих эффектов соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) количество β-лактамного антибиотика, присутствующего в комбинации, может быть меньшим, чем таковое β-лактамного антибиотика, применяемого в отдельности. В соответствии с определенными вариантами осуществления композиция дополнительно содержит ингибитор β-лактамаз.
В соответствии с дополнительными вариантами осуществления, где β-лактамный антибиотик представляет собой карбапенем, предусмотрена фармацевтическая композиция, содержащая карбапенемовый антибиотик, ингибитор DHP, соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) и фармацевтически приемлемый носитель. В соответствии с некоторыми вариантами осуществления, где β-лактамный антибиотик представляет собой карбапенем, карбапенемовый антибиотик предпочтительно выбирают из группы, состоящей из эртапенема, имипенема и меропенема.
В соответствии с некоторыми вариантами осуществления предусмотрено соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) для применения при лечении бактериальной инфекции. В соответствии с некоторыми вариантами осуществления предусмотрено соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) в комбинации с одним или несколькими дополнительными терапевтическими средствами, в том числе β-лактамным антибиотиком, для применения при лечении бактериальной инфекции. В соответствии с некоторыми вариантами осуществления предусмотрено соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) для применения в качестве лекарственного средства для лечения бактериальной инфекции. В соответствии с некоторыми вариантами осуществления предусмотрено соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (Не) в комбинации с одним или несколькими дополнительными терапевтическими средствами, в том числе (3-лактамным антибиотиком, для применения в качестве лекарственного средства для лечения бактериальной инфекции. В соответствии с некоторыми вариантами осуществления предусмотрено соединение формулы (I), (I'), (1а), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (Не) для применения при получении лекарственного средства для лечения бактериальной инфекции. В соответствии с некоторыми вариантами осуществления предусмотрено соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (Не) в комбинации с одним или несколькими дополнительными терапевтическими средствами, в том числе β-лактамным антибиотиком, для применения в получении лекарственного средства для лечения бактериальной инфекции.
В соответствии с некоторыми вариантами осуществления, описанными в настоящем документе, соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (Не) может усиливать активность β-лактамного антибактериального средства в результате индукции восприимчивости к антибактериальному средству у устойчивого к лекарственному средству штамма, такого как MRSA. В соответствии с некоторыми вариантами осуществления соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (Не) может усиливать активность β-лактамного антибактериального средства в результате снижения дозы антибактериального средства, необходимой для терапевтического эффекта, у устойчивого к лекарственному средству штамма. Например, если соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) снижает минимальную ингибирующую концентрацию (MIC) антибактериального средства (где MIC представляет собой минимальную концентрацию антибактериального средства, которое будет полностью ингибировать рост) у восприимчивого штамма, то такое лечение может быть предпочтительным в целях обеспечения снижения количества вводимого антибактериального средства (может снижать побочные эффекты антибиотика) или снижения частоты введения. В соответствии с некоторыми вариантами осуществления соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (Не) могут усиливать активность антибактериального средства, такого как карбапенем в целях предупреждения появления устойчивой субпопуляциии в гетерогенной популяции бактерий с устойчивой субпопуляцией.
Потенцирующие средства можно применять в целях усиления активности антибактериальных средств, клиническая активность которых была ограничена в результате возрастающей распространенности устойчивых штаммов. В соответствии с некоторыми вариантами, описанным в настоящем документе, соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) применяется в качестве потенцирующего средства, где соединение формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) можно вводить совместно с β-лактамным антибиотиком (либо одновременно либо последовательно) в целях обеспечения эффективного лечения инфекции при участии устойчивой бактерии или в целях снижения количества антибактериального средства, необходимого для лечения инфекции.
В соответствии с одним вариантом осуществления предусмотрено соединение, описанное в настоящем документе, которое проявляет антибиотическую активность, пригодное для лечения бактериальных инфекций, таких как, исключительно для примера, вызываемых различными штаммами S. aureus, S. pneumoniae, Е. faecaIIs, Е. faecium, В. subtiIIs и Е. coII, в том числе видами, которые являются устойчивыми ко многим антибиотикам, такими как устойчивый к метициллину S. aureus (MR.SA), устойчивый к ванкомицину Enterococcus sp. (VRE), Е. faecium со множественной лекарственной устойчивостью, устойчивые к макролидам S. aureus и S. epidermidis и устойчивые к линезолиду S. aureus и Е. faecium.
Устойчивый к метициллину Staphylococcus aureus
Staphylococcus aureus (S. aureus), бактерия сферической формы, является наиболее распространенной причиной стафилококковых инфекций. Известно, что S. aureus вызывает ряд заболеваний, от незначительных кожных инфекций, таких как прыщи, импетиго, нарывы, флегмона, фолликулит, фурункулы, карбункулы, синдром ошпаренной кожи, абсцессы, до опасных для жизни заболеваний, таких как пневмония, менингит, остеомиелит, эндокардит, инфекционно-токсический шок и септицемия. Также S. aureus является одной из наиболее распространенных причин нозокомиальных инфекций, часто вызывающих послеоперационные раневые инфекции.
Метициллин был введен в конце 1950-х гг.для лечения инфекций, вызываемых устойчивым к пенициллину S. aureus. Ранее отмечалось, что изоляты S. aureus приобрели устойчивость к метициллину (устойчивый к метициллину S. aureus, MRSA). Ген устойчивости к метициллину (mecA) кодирует устойчивый к метициллину пенициллинсвязывающий белок, который не присутствует у восприимчивых штаммов. mecA переносится на мобильном генетическом элементе, стафилококковой хромосомной кассете mec (SCCmec), у которой были описаны четыре формы, которые различаются по размеру и набору генов. Устойчивый к метициллину пенициллинсвязывающий белок обеспечивает устойчивость к β-лактамным антибиотикам и исключает их клинический эффект во время инфекций, вызываемых MRSA.
В соответствии с одним аспектом предусмотрен способ лечения субъекта, имеющего устойчивую бактерию, предусматривающий введение субъекту соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства. В соответствии с одним вариантом осуществления бактерия представляет собой грамположительную бактерию. В соответствии с другим вариантом осуществления грамположительная бактерия представляет собой S. aureus. В соответствии с дополнительным вариантом осуществления S. aureus является устойчивым или невосприимчивым к бета-лактамному антибиотику. В соответствии с еще одним дополнительным вариантом осуществления бета-лактамный антибиотик принадлежит к классу пенициллинов. В соответствии с дополнительным вариантом осуществления бета-лактамный антибиотик представляет собой метициллин. В соответствии с еще одним вариантом осуществления субъект имеет устойчивую к метициллину бактерию S. aureus. В соответствии с одним вариантом осуществления бета-лактамным антибиотиком является флуклоксациллин. В соответствии с другим вариантом осуществления предусмотрен способ лечения субъекта, имеющего устойчивую к диклоксациллину бактерию, предусматривающий введение субъекту соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где субъект является невосприимчивым к диклоксациллину. В настоящем документе также раскрыт способ лечения субъекта, имеющего устойчивую к метициллину бактерию, предусматривающий введение соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где было определено, что субъект имеет невосприимчивую к метициллину бактерию. В соответствии с одним вариантом осуществления субъекта обследуют на наличие устойчивых к метициллину бактерий. В соответствии с другим вариантом осуществления обследование субъекта выполняется при помощи посева из носа. В соответствии с дополнительным вариантом осуществления устойчивые к метициллину бактерии выявляют при помощи взятия мазка из ноздри(ноздрей) субъекта и выделения бактерий. В соответствии с другим вариантом осуществления ПЦР в реальном времени и/или количественная ПЦР используется для определения того, имеет ли субъект устойчивую к метициллину бактерию.
В соответствии с одним вариантом осуществления раскрыт способ лечения субъекта, имеющего устойчивую к цефалоспорину первого поколения бактерию, предусматривающий введение соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где субъект является невосприимчивым к цефалоспорину первого поколения. В соответствии с одним вариантом осуществления бактерия является устойчивой к цефалоспорину первого поколения. В соответствии с дополнительным вариантом осуществления бактерия является устойчивой к цефацетрилу. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефадроксилу. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к цефалексину. В соответствии с одним вариантом осуществления бактерия является устойчивой к цефалоглицину. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефалонию. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефалоридину. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к цефалотину. В соответствии с дополнительным вариантом осуществления бактерия является устойчивой к цефапирину. В соответствии с еще одним дополнительным вариантом осуществления бактерия является устойчивой к цефатризину. В соответствии с одним вариантом осуществления бактерия является устойчивой к цефазафлуру. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефазедону. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к цефазолину. В соответствии с дополнительным вариантом осуществления бактерия является устойчивой к цефрадину. В соответствии с еще одним дополнительным вариантом осуществления бактерия является устойчивой к цефроксадину. В соответствии с одним вариантом осуществления бактерия является устойчивой к цефтезолу.
В соответствии с одним вариантом осуществления раскрыт способ лечения субъекта, имеющего устойчивую к цефалоспорину второго поколения бактерию, предусматривающий введение соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где субъект является невосприимчивым к цефалоспорину второго поколения. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефалоспорину второго поколения. В соответствии с дополнительным вариантом осуществления бактерия является устойчивой к цефаклору. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефонициду. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к цефпрозилу. В соответствии с одним вариантом осуществления бактерия является устойчивой к цефуроксиму. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефузонаму. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефметазолу. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к цефотетану. В соответствии с дополнительным вариантом осуществления бактерия является устойчивой к цефокситину.
В соответствии с одним вариантом осуществления раскрыт способ лечения субъекта, имеющего устойчивую к цефалоспорину третьего поколения бактерию, предусматривающий введение соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где субъект является невосприимчивым к цефалоспорину третьего поколения. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефалоспорину третьего поколения. В соответствии с дополнительным вариантом осуществления бактерия является устойчивой к цефкапену. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефдалоксиму. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к цефдиниру. В соответствии с одним вариантом осуществления бактерия является устойчивой к цефдиторену. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефиксиму. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефменоксиму. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к цефодизиму. В соответствии с дополнительным вариантом осуществления бактерия является устойчивой к цефотаксиму. В соответствии с еще одним дополнительным вариантом осуществления бактерия является устойчивой к цефпимизолу. В соответствии с одним вариантом осуществления бактерия является устойчивой к цефподоксиму. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефтераму. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к цефтибутену. В соответствии с дополнительным вариантом осуществления бактерия является устойчивой к цефтиофуру. В соответствии с еще одним дополнительным вариантом осуществления бактерия является устойчивой к цефтиолену. В соответствии с одним вариантом осуществления бактерия является устойчивой к цефтизоксиму. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефтриаксону. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к цефоперазону. В соответствии с еще одним дополнительным вариантом осуществления бактерия является устойчивой к цефтазидиму.
В соответствии с одним вариантом осуществления раскрыт способ лечения субъекта, имеющего устойчивую к цефалоспорину четвертого поколения бактерию, предусматривающий введение соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где субъект является невосприимчивым к цефалоспорину четвертого поколения. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефалоспорину четвертого поколения. В соответствии с дополнительным вариантом осуществления бактерия является устойчивой к цефклидину. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефепиму. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к цефлупренаму. В соответствии с одним вариантом осуществления бактерия является устойчивой к цефозелису. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефозопрану. В соответствии с другим вариантом осуществления бактерия является устойчивой к цефпирому. В соответствии с еще одним вариантом осуществления бактерия является невосприимчивой к цефхиному.
В соответствии с одним вариантом осуществления раскрыт способ лечения субъекта, имеющего устойчивую к карбапенему бактерию, предусматривающий введение соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где субъект является невосприимчивым к карбапенему. В соответствии с другим вариантом осуществления бактерия является устойчивой к карбапенему. В соответствии с дополнительным вариантом осуществления бактерия является устойчивой к имипенему. В соответствии с другим вариантом осуществления бактерия является устойчивой к меропенему. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к эртапенему. В соответствии с одним вариантом осуществления бактерия является устойчивой к фаропенему. В соответствии с другим вариантом осуществления бактерия является устойчивой к дорипенему. В соответствии с другим вариантом осуществления бактерия является устойчивой к панипенему. В соответствии с еще одним вариантом осуществления бактерия является устойчивой к биапенему.
Staphylococcus aureus с умеренной устойчивостью к ванкомицину и устойчивый к ванкомицину Staphylococcus aureus
Staphylococcus aureus с умеренной устойчивостью к ванкомицину и устойчивый к ванкомицину Staphylococcus aureus представляют собой определенные типы устойчивых к антимикробным препаратам стафилококковых бактерий, которые являются невосприимчивыми к лечению ванкомицином. Изоляты S. aureus, для которых MIC ванкомицина составляют 4-8 мкг/мл классифицируют как имеющие умеренную устойчивость к ванкомицину, а изоляты, для которых MIC ванкомицина составляют ≥16 мкг/мл классифицируют как устойчивые к ванкомицину (Clinical and Laboratory Standards Institute/NCCLS. Performance Standards for Antimicrobial Susceptibility Testing. Sixteenth informational supplement. M100-S16. Wayne, PA: CLSI, 2006).
Используемый в настоящем документе термин «минимальная ингибирующая концентрация» (MIC) относится к наименьшей концентрации антибиотика, необходимой для ингибирования роста бактериального изолята in vitro. Распространенным способом определения MIC антибиотика является приготовление нескольких пробирок, содержащих серийные разведения антибиотика, в которые затем вносят представляющий интерес бактериальный изолят.MIC антибиотика определяется на основе пробирки с наименьшей концентрацией, которая не характеризуется мутностью (отсутствует рост).
В соответствии с одним аспектом предусмотрен способ лечения субъекта, имеющего бактериальную инфекцию, предусматривающий введение субъекту соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где бактериальная инфекция предусматривает бактерию Staphylococcus aureus с умеренной устойчивостью к ванкомицину. В соответствии с одним вариантом осуществления бактерия Staphylococcus aureus с умеренной устойчивостью к ванкомицину характеризуется MIC, составляющей от приблизительно 4 до приблизительно 8 мкг/мл. В соответствии с другим вариантом осуществления бактерия Staphylococcus aureus с умеренной устойчивостью к ванкомицину характеризуется MIC, составляющей приблизительно 4 мкг/мл. В соответствии с еще одним вариантом осуществления бактерия Staphylococcus aureus с умеренной устойчивостью к ванкомицину характеризуется MIC, составляющей приблизительно 5 мкг/мл. В соответствии с дополнительным вариантом осуществления бактерия Staphylococcus aureus с умеренной устойчивостью к ванкомицину характеризуется MIC, составляющей приблизительно 6 мкг/мл. В соответствии с еще одним дополнительным вариантом осуществления бактерия Staphylococcus aureus с умеренной устойчивостью к ванкомицину характеризуется MIC, составляющей приблизительно 7 мкг/мл. В соответствии с одним вариантом осуществления бактерия Staphylococcus aureus с умеренной устойчивостью к ванкомицину характеризуется MIC, составляющей приблизительно 8 мкг/мл.
В соответствии с другим аспектом предусмотрен способ лечения субъекта, имеющего бактериальную инфекцию, предусматривающий введение субъекту соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где бактериальная инфекция предусматривает устойчивую к ванкомицину бактерию Staphylococcus aureus. В соответствии с одним вариантом осуществления устойчивая к ванкомицину бактерия Staphylococcus aureus характеризуется MIC, составляющей приблизительно 16 мкг/мл. В соответствии с другим вариантом осуществления устойчивая к ванкомицину бактерия Staphylococcus aureus характеризуется MIC, составляющей приблизительно ≥ 16 мкг/мл. В соответствии с еще одним вариантом осуществления устойчивая к ванкомицину бактерия Staphylococcus aureus характеризуется MIC, составляющей приблизительно 20 мкг/мл. В соответствии с дополнительным вариантом осуществления устойчивая к ванкомицину бактерия Staphylococcus aureus характеризуется MIC, составляющей приблизительно 25 мкг/мл.
В соответствии с одним вариантом осуществления состояния, которые лечат при помощи соединений, описываемых в настоящем документе, включают без ограничения эндокардит, остеомиелит, менингит, инфекции кожи и кожных структур, инфекции мочеполовой системы, абсцессы и некротизирующие инфекции. В соответствии с другим вариантом осуществления соединения, описываемые в настоящем документе, применяют для лечения состояний, таких как без ограничения инфекции на фоне диабетической стопы, пролежни, ожоговые инфекции, инфекции на фоне укушенных ран животных и человека, синергетическая некротизирующая гангрена, некротизирующий фасцилит, внутрибрюшинная инфекция, ассоциированная с нарушением целостности кишечного барьера, тазовая инфекция, ассоциированная с нарушением целостности кишечного барьера, аспирационная пневмония и послеоперационные раневые инфекции. В соответствии с другим вариантом осуществления состояния, приведенные в настоящем документе, вызваны, содержат или возникают в результате присутствия VISA и/или VRSA.
Устойчивые к ванкомицину энтерококки
Энтерококки представляют собой бактерии, которые обычно присутствуют в кишечнике человека и в женской половой системе и часто встречаются в окружающей среде. Эти бактерии иногда вызывают инфекции. В некоторых случаях энтерококки становятся устойчивыми к ванкомицину (также известные как устойчивые к ванкомицину энтерококки или VRE.) Распространенные формы устойчивости к ванкомицину возникают у энтерококковых штаммов, которые включают приобретение совокупности генов, кодирующих белки, которые контролируют включение предшественниками пептид о гликанов D-Ala-D-Lac вместо D-Ala-D-Ala. Шесть различных типов устойчивости к ванкомицину, проявляемых энтерококками, представляют собой Van-A, Van-B, Van-C, Van-D, Van-E и Van-F. В некоторых случаях VRE Van-A является устойчивым как к ванкомицину, так и к тейкопланину, в то время как в других случаях VRE Van-B является устойчивым к ванкомицину, но восприимчивым к тейкопланину; в дополнительных случаях Van-C является частично устойчивым к ванкомицину и восприимчивым к тейкопланину.
В соответствии с одним аспектом предусмотрен способ лечения субъекта, имеющего устойчивого к ванкомицину энтерококка, предусматривающий введение субъекту соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где энтерококк приобрел устойчивость к ванкомицину. В соответствии с одним вариантом осуществления субъекта ранее лечили ванкомицином в течение длительного периода времени. В соответствии с другим вариантом осуществления субъекта госпитализировали. В соответствии с еще одним вариантом осуществления субъект имеет ослабленную иммунную систему, например, пациенты в отделениях интенсивной терапии или в онкологических отделениях или отделениях трансплантации. В соответствии с дополнительным вариантом осуществления субъект перенес хирургические процедуры, такие как, например, хирургическое вмешательство на брюшной полости или грудной клетке. В соответствии с еще одним дополнительным вариантом осуществления субъект колонизирован VRE. В соответствии с одним вариантом осуществления субъект имеет медицинское изделие, такое, при котором возникла инфекция. В соответствии с другим вариантом осуществления медицинское изделие представляет собой урологический катетер или центральный внутривенный (IV) катетер.
В соответствии с другим вариантом осуществления предусмотрен способ лечения субъекта, имеющего устойчивого к ванкомицину энтерококка, предусматривающий введение субъекту соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где энтерококк имеет устойчивость Van-А.
В соответствии с другим вариантом осуществления предусмотрен способ лечения субъекта, имеющего устойчивого к ванкомицину энтерококка, предусматривающий введение субъекту соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb). (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где энтерококк имеет устойчивость Van-B.
В соответствии с другим вариантом осуществления предусмотрен способ лечения субъекта, имеющего устойчивого к ванкомицину энтерококка, предусматривающий введение субъекту соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или его фармацевтически приемлемой соли, сложного эфира, сольвата, алкилированной соли четвертичного аммония, стереоизомера, таутомера или пролекарственного средства, где энтерококк имеет устойчивость Van-C.
Введение и фармацевтическая композиция
Фармацевтические композиции, описываемые в настоящем документе, содержат терапевтически эффективное количество соединения, описываемого в настоящем документе (т.е., соединения из любой формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe)), составленного совместно с одним или несколькими фармацевтически приемлемыми носителями. Используемый в настоящем документе термин «фармацевтически приемлемый носитель» означает нетоксичный инертный твердый, мягкий или жидкий наполнитель, разбавитель, инкапсулирующий материал или вспомогательное средство любого типа. Некоторыми примерами материалов, которые могут выступать в роли фармацевтически приемлемых носителей, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетатцеллюлоза; порошковый трагакант; солод; желатин; тальк; вспомогательные вещества, такие как масло какао и суппозиторные воска; масла, такие как арахисовое масло, хлопковое масло; сафлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные средства, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический раствор; раствор Рингера; этиловый спирт и фосфатные буферные растворы, а также другие нетоксичные сопоставимые скользящие средства, такие как лаурилсульфат натрия и стеарат магния, а также красители, разделительные средства, покрывающие средства, подсластители, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в композиции по усмотрению разработчика состава. Фармацевтические композиции, описываемые в настоящем документе, можно вводить людям или другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, наружно (в виде порошков, мазей или капель), буккально или в виде спрея для полости рта или назального спрея, или жидкой аэрозоли или сухого порошкового состава для ингаляции.
Жидкие лекарственные формы для перорального применения включают в себя фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений, жидкие лекарственные формы необязательно содержат инертные разбавители, обычно используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие средства и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное масла, масло зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот сорбитана и их смеси. Помимо инертных разбавителей, композиции для перорального применения могут также включать вспомогательные средства, такие как смачивающие средства, эмульгирующие средства и суспендирующие средства, подсластители, вкусовые добавки и ароматизаторы.
Инъекционные препараты, например, стерильные инъекционные водные или маслянистые суспензии необязательно составляют в соответствии с известным уровнем техники при помощи подходящих диспергирующих или смачивающих средств и суспендирующих средств. Стерильный инъекционный препарат необязательно представляет собой стерильный инъекционный раствор, суспензию или эмульсию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых основ и растворителей, которые необязательно используются, находятся вода, раствор Рингера, изотонический раствор хлорида натрия со степенью чистоты U.S.Р. Кроме того, стерильные нелетучие масла традиционно используются в качестве растворителя или суспендирующей среды. С этой целью можно использовать любое мягкое нелетучее масло, в том числе синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, используются при получении инъекционных препаратов.
Инъекционные препараты можно стерилизовать, например, при помощи фильтрации через удерживающий бактерии фильтр, или при помощи включения стерилизующих средств в форме стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой инъекционной среде перед применением.
В целях продления эффекта лекарственного средства часто желательно замедлить всасывание лекарственного средства после выполнения подкожной или внутримышечной инъекции. Это необязательно сопровождается применением жидкой суспензии кристаллического или аморфного материала со слабой растворимостью в воде. Затем скорость всасывания лекарственного средства зависит от его скорости растворения, которая, в свою очередь, может зависеть от размера кристаллов и формы кристаллов. Альтернативно замедленное всасывание парентерально вводимой лекарственной формы необязательно сопровождается растворением или суспендированием лекарственного средства в масляной основе. Инъекционные депо-формы изготавливают в результате образования микроинкапсулированных матриксов лекарственного средства в биоразрушаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения лекарственного средства к полимеру и природы конкретного применяемого полимера, скорость высвобождения лекарственного средства можно контролировать. Примеры других биоразрушаемых полимеров включают сложные поли(орто)эфиры и поли(ангидриды). Депо-инъекционные составы необязательно получают в результате захвата лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма.
Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые можно получать в результате смешивания соединения, описываемого в настоящем документе (т.е., соединения из любой формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe)) с подходящими не вызывающими раздражения вспомогательными веществами или носителями, такими как масло какао, полиэтиленгликоль или суппозиторный воск, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела, и, таким образом, плавятся в прямой кишке или полости влагалища и высвобождают активное соединение.
Твердые лекарственные формы для перорального применения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивается по меньшей мере с одним инертным фармацевтически приемлемым вспомогательным веществом или носителем, таким как цитрат натрия или дикальция фосфат и/или а) наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связывающими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, с) увлажняющими средствами, такими как глицерин, d) средствами для улучшения распадаемости таблеток, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия, е) замедлители растворения, такие как парафин, f) ускорители всасывания, такие как соединения четвертичного аммония, g) смачивающие средства, такие как, например, ацетиловый спирт и глицеринмоностеарат, h) абсорбенты, такие как каолин и бентонитовая глина, и i) смазывающие средства, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль лекарственные формы необязательно содержат буферные средства.
Твердые композиции аналогичного типа необязательно применяются в качестве наполнителей в мягких и твердых желатиновых капсулах при помощи таких вспомогательных веществ, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно получить с покрытиями и оболочками, такими как кишечнорастворимые покрытия и другие покрытия, известные в области составления фармацевтических средств. Они необязательно содержат замутняющие средства и также могут являться частью композиции, в которой они лишь высвобождают активный компонент(активные компоненты), или предпочтительно в определенной части кишечного тракта, необязательно, замедленным образом. Примеры вспомогательных веществ, которые можно применять, включают полимерные вещества и воска.
Твердые композиции аналогичного типа необязательно применяются в качестве наполнителей в мягких и твердых желатиновых капсулах при помощи таких вспомогательных средств, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
Активные соединения также могут находиться в инкапсулированной форме с одним или несколькими вспомогательными веществами, как упомянуто выше. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно получить с покрытиями и оболочками, такими как кишечнорастворимые покрытия, покрытия с контролируемым высвобождением и другие покрытия, известные в области составления фармацевтических средств. В таких твердых лекарственных формах активное соединение необязательно примешивают по меньшей мере к одному инертному разбавителю, такому как сахароза, лактоза или крахмал. Такие лекарственные формы необязательно содержат, что является обычной практикой, дополнительные вещества, отличные от инертных разбавителей, например, смазывающие вещества для производства таблеток и другие вспомогательные вещества для производства таблеток, например, стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль лекарственные формы необязательно содержат буферные средства. Они необязательно содержат замутняющие средства и также могут являться частью композиции, в которой они лишь высвобождают активный компонент(активные компоненты), или предпочтительно в определенной части кишечного тракта, необязательно, замедленным образом. Примеры вспомогательных веществ, которые можно применять, включают полимерные вещества и воска.
Лекарственные формы для наружного или трансдермального введения соединения, описанного в настоящем документе, включают мази, пасты, кремы, лосьоны, гели, порошки, спреи, летучие вещества или пластыри. Активный компонент примешивают в стерильных условиях с фармацевтически допустимым носителем и любыми необходимыми консервантами или буферами в качестве необязательно требующихся. Также предусмотрены офтальмологические составы, глазные капли и т.п.
Мази, пасты, кремы и гели могут содержать, помимо активного соединения, описанного в настоящем документе, вспомогательные вещества, такие как растительные и животные жиры, масла, воска, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и оксид цинка или их смеси.
Композиции, описываемые в настоящем документе, необязательно составляют для доставки в виде жидкого аэрозоля или сухого порошка для ингаляции. Жидкие аэрозольные составы необязательно распыляют преимущественно до размеров частиц, которые могут быть доставлены к терминальным и респираторным бронхиолам, где находятся бактерии у пациентов с хроническими инфекциями, такими как хронический бронхит и пневмония. Патогенные бактерии обычно присутствуют на всем протяжении дыхательных путей до бронхов, бронхиол и легочной паренхимы, в частности, в терминальных и респираторных бронхиолах. Во время обострения инфекции бактерии могут присутствовать в альвеолах. Жидкие аэрозольные составы и составы на основе сухого порошка для ингаляций предпочтительно доставляют через эндобронхиальное дерево до терминальных бронхиол и в конечном итоге паренхиматозной ткани.
Аэрозольные составы, описываемые в настоящем документе, необязательно доставляют при помощи аэрозолеобразующего устройства, такого как струйный, вибрационный ячеисто-пластинчатый или ультразвуковой небулайзер, предпочтительно выбранного в целях обеспечения образования аэрозольных частиц, имеющих массовый медианный средний диаметр преимущественно от 1 до 5 мкм. Также состав предпочтительно имеет осмолярно уравновешенную ионную силу и концентрацию хлоридов, а также минимальный объем для аэрозолизирования, способный доставлять эффективную дозу соединений, описываемых в настоящем документе (т.е., соединения из любой формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe)) к очагу инфекции. Кроме того, аэрозольный состав предпочтительно не влияет отрицательно на функциональность дыхательных путей и не вызывает нежелательных побочных эффектов.
Устройства для аэрозолирования, пригодные для введения аэрозольных составов, описываемых в настоящем документе, включают, например, струйные, вибрационные ячеисто-пластинчатые, ультразвуковые небулайзеры и снабжаемые энергией порошковые ингаляторы, которые способны распылять состав до размера частиц аэрозоля, преимущественно в размерном диапазоне от 1-5 мкм. Преимущественно в настоящей заявке означает, что по меньшей мере 70%, но предпочтительно более 90% всех образованных аэрозольных частиц находятся в диапазоне 1-5 мкм. Струйный небулайзер работает при помощи давления воздуха с разделением жидкого раствора на аэрозольные капли. Вибрационные ячеисто-пластинчатые небулайзеры работают с применением ультразвукового вакуума, образующегося в результате быстро вибрирующей ячеистой пластины, с экструзией капли растворителя через ячеистую пластину. Ультразвуковой небулайзер работает при помощи пьезоэлектрического кристалла, который рассекает жидкость на мелкие аэрозольные капли. Доступен ряд подходящих устройств, в том числе, например, вибрационные пористо-пластинчатые небулайзеры AeroNebTM и AeroDoseTM (AeroGen, Inc., Саннивейл, Калифорния), небулайзеры Sidestream® (Medic-Aid Ltd., Западный Суссекс, Англия), струйные небулайзеры Pari LC® и Pari LC Star® (Pari Respiratory Equipment, Inc., Ричмонд, Виргиния) и ультразвуковые небулайзеры AerosonicTM (DeVilbiss Medizinische Produkte (Deutschland) GmbH, Хайден, Германия) и UltraAire® (Omron Healthcare, Inc., Вернон-Хиллс, Иллинойс).
В соответствии с некоторыми вариантами осуществления соединения, описываемые в настоящем документе (т.е., соединение из любой формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe)), составляют для применения в качестве порошков для наружного применения и спреев, которые содержат, помимо соединений, описываемых в настоящем документе, вспомогательные вещества, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси этих веществ. Спреи необязательно содержат общепринятые пропелленты, такие как хлорфторуглеводороды.
Трансдермальные пластыри обладают дополнительным преимуществом обеспечения контролируемой доставки соединения в организм. Такие лекарственные формы могут быть изготовлены в результате растворения или диспергирования соединения в соответствующей среде. Усилители всасывания также можно применять в целях повышения поступления соединения через кожу. Скорость можно контролировать либо в результате предусмотрения мембраны, контролирующей скорость высвобождения, либо в результате диспергирования соединения в полимерном матриксе или геле.
В соответствии со способами лечения, описываемыми в настоящем документе, бактериальные инфекции лечат или предупреждают у пациента, такого как человек или низшее млекопитающее, при помощи введения пациенту терапевтически эффективного количества соединения, описываемого в настоящем документе, в таких количествах и в течение такого времени, которое необходимо для достижения желаемого результата. Под «терапевтически эффективным количеством» соединения, описываемого в настоящем документе, подразумевается достаточное количество соединения для лечения бактериальных инфекций, при целесообразном соотношении польза/риск, применимом к любому терапевтическому лечению. Однако будет понятно, что общая суточная доза соединений и композиций в настоящем документе будет выбрана при посещении врача в рамках тщательной медицинской оценки. Конкретный уровень терапевтически эффективной дозы для какого-либо определенного субъекта будет зависеть от нескольких факторов, в том числе: нарушения, подлежащего лечению, и тяжести нарушения; активности конкретного применяемого соединения; конкретной применяемой композиции, возраста, веса тела, общего состояния здоровья, пола и питания пациента; времени введения, способа введения и скорости экскреции конкретного применяемого соединения; длительности лечения; лекарственных средств, применяемых в комбинации или совместно с конкретным применяемым соединением, и подобных факторов, известных в медицине.
Общая суточная доза соединений, описываемых в настоящем документе (т.е., соединения из любой формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe)), вводимых человеку или другому млекопитающему в однократной или в разделенных дозах, может находиться в количествах, например, от 0,01 до 50 мг/кг массы тела или более, обычно от 0,1 до 25 мг/кг массы тела. Композиции с однократными дозами могут содержать такие количества или их дольные единицы для получения суточной дозы. Как правило, режимы лечения, описываемые в настоящем документе, предусматривают введение пациенту, нуждающемуся в таком лечении, от приблизительно 10 мг до приблизительно 2000 мг соединения(соединений), описываемого(описываемых) в настоящем документе, в день в однократной или многократных дозах.
Примеры
Раскрытые в настоящем изобретении соединения получали способами, описанными в реакционных схемах, показанных ниже. В настоящем изобретении представлены способы, которые в комбинации со знаниями химика-органика относительно синтеза в настоящей области техники находятся в некоторых вариантах осуществления, которые использовали для получения полного диапазона соединений, как раскрыто и заявлено в настоящем изобретении.
Исходные вещества и реагенты, используемые при получении таких соединений, или доступны от коммерческих поставщиков, таких как Aldrich Chemical Co., (Milwaukee, Wis.), Bachem (Torrance, Calif.) или Sigma (St. Louis, Mo.), или их получали способами, известными специалистам настоящей области техники на основе процедур, изложенных в ссылочных материалах, таких как Fieser and Fieser's Reagents for Organic Synthesis, Volumes 1-17 (John Wiley and Sons, 1991); Rodd's Chemistry of Carbon Compounds, Volumes 1-5 and Supplemental (Elsevier Science Publishers, 1989); Organic Reactions, Volumes 1-40 (John Wiley and Sons, 1991), March's Advanced Organic Chemistry, (John Wiley and Sons, 4th Edition) и Larock's Comprehensive Organic Transformations (VCH Publishers Inc., 1989). Такие схемы только иллюстрируют некоторые способы, при помощи которых раскрытые в настоящем изобретении соединения синтезировали в некоторых вариантах осуществления, и различные модификации таких схем могут быть сделаны и будут рассмотрены специалистом настоящей области техники с упоминанием настоящего раскрытия. Исходные вещества и промежуточные соединения, а также конечные продукты реакции могут быть выделены и очищены при необходимости с применением традиционных технологий, включая без ограничения фильтрацию, дистилляцию, кристаллизацию, хроматографию и т.п.Такие вещества могут быть характеризованы с применением традиционных способов, включая физические константы и спектральные данные. Соединения типично выделяли в виде солей муравьиной кислоты методом HPLC с обращенной фазой с применением AcCN/H2O с муравьиной кислотой в качестве вспомогательного вещества. В некоторых случаях способы очистки проводили без муравьиной кислоты и соединения выделяли в виде свободного основания.
Способы анализа LCMS являются следующими:
LCMS (способ 5-95 АВ, ESI): ESI, 5% AcCN/H2O, 0,7 мин; до 95% AcCN/H2O, 0,4 мин; 1,5 мл/мин, Merck RP-18e, 2 × 25 мм.
LCMS (способ 10-80АВ, 2 мин, ESI): ESI, 10% AcCN/H2O (0,04% TFA), 0,9 мин до 80% AcCN/H2O (0,04% TFA), затем выдерживание в течение 0,6 мин; 1,2 мл/мин, Xtimate С18, 3 мкм, 2,1 × 30 мм).
LCMS (способ 10-80АВ, 7 мин, ESI): ESI, 10% AcCN/H2O (0,04% TFA), 6 мин до 80% AcCN/H2O (0,04% TFA), затем выдерживание в течение 0,9 мин; 0,8 мл/мин, Xtimate С18, 3 мкм, 2,1 × 30 мм).
Некоторые используемые в настоящем изобретении аббревиатуры являются следующими:
DIPEA: диизопропилэтиламин
DMAP: 4-диметиламинопиридин
DMF: диметилформамид
DCM: дихлорметан
TFA: трифторуксусная кислота
EDC: 1-этил-3-(3-диметиламинопропил)карбодиимид
HATU: O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат
HCTU: O-(6-хлорбензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат
HOBt: гидроксибензотриазол
руВОР: (бензотриазол-1-илокси)трипирролидинофосфоний гексафторфосфат
DMDO: 3,3-диметилдиоксиран
DMP: перйодат Десса-Мартина
THF: тетрагидрофуран
МеОН: метанол
EtOAc: этил ацетат
смола Trt: 2-хлортритилхлоридная смола
амидная смола Rink: амид(аминометил)полистирол Rink
Boc: t-бутоксикарбонил
CBz: бензилоксикарбонил
Fmoc: [(9H-флюорен-9-ил)метокси]карбонил
Теос: триметилсилилэтоксикарбонил
CDI: 1,1'-карбонилдиимидазол
HFIP: 1,1,1,3,3,3-гексафторпропан-2-ол
TLC: тонкослойная хроматография
Пример 1: Синтез (S)-метил-2-амино-3-(4-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноата
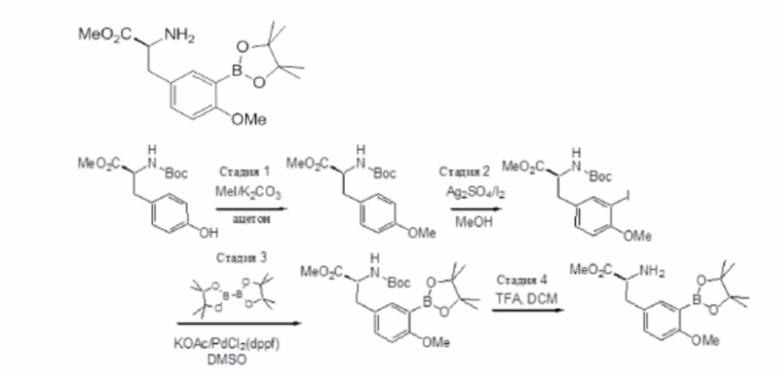
Стадия 1: К раствору (S)-метил-2-((трет-бутоксикарбонил)амино)-3-(4-гидроксифенил)пропаноата (100 г, 0,323 моль) в ацетоне (2,0 л) добавляли K2CO3 (37 г, 0,34 моль). После добавления по каплям добавляли MeI (32 мл, 0,97 моль) и реакционную смесь перемешивали при комнатной температуре в течение 72 ч и наблюдали при помощи метода TLC. Реакция еще не завершилась, поэтому к реакционной смеси добавляли NaOH (0,1 экв.). И через 2 ч реакция была завершена. Твердое вещество фильтровали и растворитель удаляли. Остаток переносили в этил ацетат и промывали Н2О, экстрагировали этилацетатом (300 мл × 3). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и концентрировали с получением (S)-метил-2-((трет-бутоксикарбонил)амино)-3-(4-метоксифенил)пропаноата (100 г, 95,4%).
Стадия 2: К раствору (S)-метил-2-((трет-бутоксикарбонил)амино)-3-(4-метоксифенил)пропаноата (80 г, 40 г каждый × 2, вводили двумя отдельными партиями, 259 ммоль всего) в метаноле (1,5 л в каждой из двух колб) добавляли последовательно Ag2SO4 (85 г, 272 ммоль, ½-добавляли в каждую колбу) и I2 (72 г, 283 ммоль, ½-добавляли в каждую колбу). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. За реакцией наблюдали при помощи метода LCMS. Когда весь (S)-метил-2-((трет-бутоксикарбонил)амино)-3-(4-метоксифенил)пропаноат был израсходован, затем добавляли раствор тиосульфата натрия 10% (масса/масса), пока реакционная смесь не стала бледно-желтой. Твердое вещество фильтровали и большую часть метанола выпаривали вращательным испарением. Воду и этилацетат добавляли к каждой партии. Водный слой экстрагировали этилацетатом (3 × 200 мл). Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и концентрировали. Неочищенное вещество объединяли в две партии и их вместе очищали методом колоночной флеш-хроматографии на силикагеле (25%, затем 35%, затем 40% этилацетата в гексане) с получением (S)-метил-2-((трет-бутоксикарбонил)амино)-3-(3-йод-4-метоксифенил)пропаноата (97 г, 89%).
Стадия 3: (S)-Метил-2-((трет-бутоксикарбонил)амино)-3-(3-йод-4-метоксифенил)пропаноат (92 г, 46 г каждого вводили двумя отдельными партиями, 211 ммоль) растворяли в безводном DMSO (1,5 л, ½-добавляли для каждой партии) в аргоне и к раствору добавляли бис(пинаколято)диборон (80,5 г, 317 ммоль, ½-добавляли для каждой партии) и KOAc (103 г, 1,05 моль, ½-добавляли для каждой партии). Эту смесь дегазировали аргоном в течение двадцати минут, затем добавляли Pd(dppf)Cl2 (4,6 г, 6 ммоль, ½-добавляли для каждой партии). Смесь дегазировали аргоном пять раз, затем удерживали в аргоне и нагревали до 80°С в течение 3 ч. При помощи метода TLC наблюдали завершение реакции и реакционную смесь охлаждали до комнатной температуры и фильтровали. Реакционную смесь растворяли в ЕА и промывали H2O. Водный слой экстрагировали этилацетатом (3×200 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали с получением неочищенного продукта. Партии затем объединяли и очищали вместе методом колоночной флеш-хроматографии на силикагеле (3% этилацетата в гексане, затем 20%-25% этилацетата в гексане с получением (S)-метил-2-((трет-бутоксикарбонил)амино)-3-(4-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноата (70 г, 76%).
Стадия 4: (S)-Метил-2-((трет-бутоксикарбонил)амино)-3-(4-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат (22 г, 50,6 ммоль) растворяли в дихлорметане (150 мл) и обрабатывали трифторуксусной кислотой (50 мл). Реакционную смесь перемешивали при комнатной температуре и за реакцией наблюдали при помощи метода HPLC. При израсходовании всего исходного вещества растворители выпаривали, добавляли DCM и добавляли Na2CO3 для нейтрализации TFA. Смесь фильтровали и раствор концентрировали. DCM добавляли к концентрированному маслу и смесь охлаждали при 0°С в течение 1 ч, после чего образованные твердые осадки фильтровали. Фильтрат концентрировали с получением (S)-метил-2-амино-3-(4-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноата. Вещество использовали без дополнительной очистки.
Пример 2: Синтез (S)-2-((трет-бутоксикарбонил)амино)-2-(4-гидроксифенил)уксусной кислоты

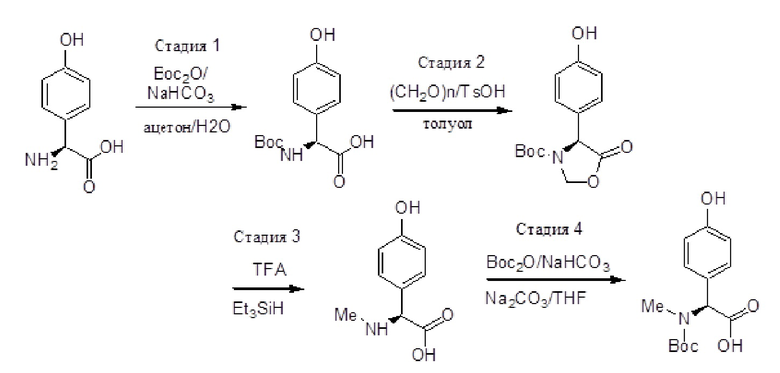
Стадия 1: К перемешиваемой смеси (S)-2-амино-2-(4-гидроксифенил)уксусной кислоты (100 г, 0,6 моль, 1 экв.) в смеси ацетона (400 мл) и воды (400 мл) добавляли ди-трет-бутилдикарбонат (130,5 г, 0,6 моль, 1 экв.) и NaHCO3 (75,4 г, 0,9 моль, 1,5 экв.). Смесь оставляли перемешиваться при 25°С всю ночь. После того, как при помощи метода HPLC наблюдали завершение реакции, смесь подкисляли 5% лимонной кислотой (рН ~ 3). Смесь фильтровали и фильтрационный кек промывали водой, затем сушили с получением (S)-2-((трет-бутоксикарбонил)амино)-2-(4-гидроксифенил)уксусной кислоты (140 г, 87,5%). Неочищенный продукт использовали сразу без дополнительной очистки.
Стадия 2: К раствору (S)-2-((трет-бутоксикарбонил)амино)-2-(4-гидроксифенил)уксусной кислоты (45 г, 0,17 моль) в сухом бензоле (500 мл) добавляли параформальдегид (75,6 г, 0,84 моль, 5 экв.) и пара-толуолсульфоновую кислоту (1,6 г, 8,5 ммоль, 0,05 экв.). Прибор Дина-Старка с присоединенным конденсатором затем прикрепляли к верхней части колбы и смесь нагревали при приблизительно 120°С, пока при помощи метода LC-MS не наблюдали завершение реакции. Реакционную смесь затем охлаждали и бензол выпаривали. Остаток переносили в этил ацетат, промывали насыщенным NaHCO3 (2 × 150 мл), затем сушили над сульфатом натрия и фильтровали. Растворитель удаляли с получением (S)-трет-бутил-4-(4-гадроксифенил)-5-оксооксазолидин-3-карбоксилата (36 г, 76,5%).
Стадия 3: (S)-трет-бутил-4-(4-гидроксифенил)-5-оксооксазолидин-3-карбоксилат (36 г, 0,13 моль, 1 экв.) растворяли в трифторуксусной кислоте (75 мл) при 0°С, затем обрабатывали триэтилсиланом (80 мл, 4 экв.). Смесь перемешивали при комнатной температуре всю ночь. После того, как при помощи метода LC-MS наблюдали завершение реакции, TFA затем выпаривали с получением (S)-2-(4-гидроксифенил)-2-(метиламино)уксусной кислоты, которую использовали без дополнительной очистки.
Стадия 4: Полученную (S)-2-(4-гидроксифенил)-2-(метиламино)уксусную кислоту растворяли в воде (85 мл) и к этому раствору добавляли твердый NaHCO3 до достижения значения рН 7. Раствор охлаждали до 0°С, затем добавляли Na2CO3 до достижения значения рН 9. Раствор ди-трет-бутилдикарбоната (28,3 г, 1,0 экв.) в THF (75 мл) добавляли к смеси. Смесь оставляли нагреваться до комнатной температуры, затем перемешивали всю ночь. После того, как при помощи метода HPLC наблюдали завершение реакции, THF затем выпаривали. Водный раствор экстрагировали 2х гексаном, а затем подкисляли лимонной кислотой до значения рН ~3-4. Подкисленный раствор затем экстрагировали этилацетатом (200 мл × 3). Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали с получением (S)-2-((трет-бутоксикарбонил)(метил)амино)-2-(4-гидроксифенил)уксусной кислоты (35 г, 97% за 2 стадии).
Пример 3: Синтез соединения 101-В

Стадия 1: К раствору (S)-2-((трет-бугоксикарбонил)(метил)амино)-2-(4-гидроксифенил)уксусной кислоты (35 г, 0,12 моль) в DMF (300 мл) добавляли триэтиламин (18,4 мл, 0,14 моль, 1,1 экв.), HOBt (16,2 г, 0,12 моль, 1 экв.), Ala-OMe HCl (19,5 г, 0,14 моль, 1,1 экв.) и EDC (26,7 г, 0,14 моль, 1,1 экв.) и реакционную смесь перемешивали всю ночь. После того, как при помощи метода LC-MS наблюдали завершение реакции, добавляли воду и EtOAc. Водный слой экстрагировали EtOAc (3 × 150 мл) и объединенные органические слои промывали 5% лимонной кислотой (рН-3), насыщенным NaHCO3 (водн.), водой и солевым раствором. Объединенные органические слои затем сушили над сульфатом натрия, фильтровали и концентрировали с получением (S)-метил-2-((S)-2-((трет-бутоксикарбонил)(метил)амино)-2-(4-гидроксифенил)ацетамидо)пропаноата (30 г, 65,8%) в виде белой пены. Неочищенный продукт переносили на следующую стадию сразу без дополнительной очистки.
Стадия 2: К раствору (S)-метил-2-((S)-2-((трет-бутоксикарбонил)(метил)амино)-2-(4-гидроксифенил)ацетамидо)пропаноата (30 г, 82 ммоль) в ацетоне (400 мл) добавляли K2CO3 (56,6 г, 0,41 моль, 5 экв.) и йодметан (20,8 мл, 0,41 моль, 5 экв.) и реакционную смесь перемешивали при температуре образования флегмы всю ночь. После того, как при помощи метода LC-MS наблюдали завершение реакции, реакционную смесь затем охлаждали до комнатной температуры и смесь фильтровали. Фильтрат концентрировали и остаток переносили в воду и этилацетат. Водную фазу экстрагировали EtOAc (3 × 150 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали с получением (S)-метил-2-((S)-2-((трет-бутоксикарбонил)(метил)амино)-2-(4-метоксифенил)ацетамидо)пропаноата (28 г, 90%) в виде белой пены.
Стадия 3: К раствору (S)-метил-2-((S)-2-((трет-бутоксикарбонил)(метил)амино)-2-(4-метоксифенил)ацетамидо)пропаноата (85 г, 0,22 моль, 1 экв.) в метаноле (1000 мл) добавляли последовательно Ag2SO4 (72,6 г, 0,23 моль, 1,05 экв.) и I2 (59,6 г, 1,05 экв.). После того, как при помощи метода LC-MS наблюдали завершение реакции, добавляли раствор 10% (масса/масса) тиосульфат натрия, пока реакционная смесь не стала бледно-желтой. Большую часть метанола выпаривали вращательным испарением, а затем добавляли воду и этилацетат. Водный слой экстрагировали этилацетатом (3 × 300 мл). Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия и концентрировали с получением (S)-метил-2-((S)-2-((трет-бутоксикарбонил)(метил)амино)-2-(3-йод-4-етоксифенил)ацетамидо)пропаноата (100 г. 88,5%).
Стадия 4: К (S)-метил-2-((S)-2-((трет-бутоксикарбонил)(метил)амино)-2-(3-йод-4-метоксифенил)ацетамидо)пропаноату (25 г, 49,4 ммоль, 1 экв.) в THF (300 мл) добавляли 0,2 М LiOH (500 мл, 98,8 ммоль, 2 экв.). Раствор перемешивали, пока при помощи метода TLC не наблюдали израсходование всего исходного вещества. 5% лимонной кислоты (рН 3) добавляли до значения рН 3, а затем THF выпаривали вращательным испарением.
Водный слой экстрагировали EtOAc (3 × 100 мл). Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали с получением (S)-2-((S)-2-((трет-бутоксикарбонил)(метил)амино)-2-(3-йод-4-метоксифенил)ацетамидо)пропановой кислоты (23 г, 94,6%), которую использовали сразу без дополнительной очистки.
Стадия 5: К раствору (S)-метил-2-амино-3-(4-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноата (6,5 г, 19,4 ммоль, 1 экв.) и (S)-2-((S)-2-((трет-бутоксикарбонил)(метил)амино)-2-(3-йод-4-метоксифенил)ацетамидо)пропановой кислоты (10 г, 20,3 ммоль, 1,05 экв.) в ацетонитриле:DMF (2,2:1, 168 мл) добавляли HOBt (6,5 г, 48,5 ммоль, 2,5 экв.) и EDC (8,1 г, 42,7 ммоль, 2,2 экв.). Реакционную смесь перемешивали при комнатной температуре всю ночь. После того, как при помощи метода LC-MS наблюдали завершение реакции, добавляли разбавленную лимонную кислоту (рН-3) и водный слой экстрагировали EtOAc (3 × 150 мл). Объединенные органические слои затем промывали насыщенным раствором NaHCO3, солевым раствором и сушили над сульфатом натрия. Смесь фильтровали и фильтрат концентрировали с получением неочищенного продукта (68,98,128)-метил-6-(3-йод-4-метоксифенил)-12-(4-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензил)-2,2,5,9-тетраметил-4,7,10-триоксо-3-окса-5,8,11-триазатридекан-13-оата, который использовали сразу без дополнительной очистки.
Стадия 6: (68,98,128)-Метил-6-(3-йод-4-метоксифенил)-12-(4-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензил)-2,2,5,9-тетраметил-4,7,10-триоксо-3-окса-5,8,11-триазатридекан-13-оат (16 г, 19,4 ммоль, 1 экв.) и NaHCO3 (16,3 г, 0,19 моль) закупоривали в колбе с конденсатором и помещали в атмосферу аргона. DMF (600 мл) в круглодонной колбе продували несколько раз при помощи цикла вакуума и Ar. PdCl2(dppf) (3,3 г, 4,5 ммоль) затем добавляли к DMF. Раствор DMF затем дегазировали при помощи Ar в течение 15 минут. Раствор PdCl2(dppf), растворенный в DMF, затем переносили при помощи шприца в колбу, содержащую субстрат и NaHCO3. Полученную смесь подвергали еще нескольким циклам вакуума и Ar, затем нагревали до 120°С всю ночь. После того, как при помощи метода LCMS наблюдали завершение реакции, DMF выпаривали в вакууме. Неочищенное вещество подвергали сокращенному методу колоночной хроматографии (40% ЕА в РЕ) с удалением большинства частиц Pd, а затем очищали методом преп-HPLC с получением соединения 101-А (2,1 г, 19,5% за две стадии).
Стадия 7: К перемешиваемому раствору соединения 101-А (2,1 г, 3,78 ммоль) в DCM (25 мл) добавляли TFA (2 мл). За реакцией наблюдали при помощи метода TLC и при израсходовании исходного вещества растворитель выпаривали в вакууме. Остаток затем растворяли в EtOAc и органический слой промывали насыщенным NaHCO3 (10 мл), сушили над сульфатом натрия и концентрировали с получением соединения 101-В (1,7 г, 98,8%). MS (ESI) m/z 456,2 (М+Н)+.
Пример 4: Синтез соединения 101-G

Стадия 1: Удаление защитных групп для метила было описано и названо как общий способ 1. К раствору соединения 101-В (5,0 г, 11,0 ммоль) в EtSH (116 мл, 1,61 моль) медленно добавляли AlBr3 (165 мл, 165 ммоль) при 0°С в атмосфере N2. Смесь перемешивали в течение 18 ч. Летучие вещества удаляли при пониженном давлении и остаток гасили водой (50 мл), затем дополнительно промывали DCM (20 мл × 3). Водный слой очищали методом преп-HPLC (ацетонитрил 1-20%/0Д% TFA в воде) с получением соединения 101-С (4,5 г, 99,2% выход) в виде белого твердого вещества.
Стадия 2: К раствору соединения 101-С (4,7 г, 8,9 ммоль) в 1,4-диоксане/Н20 (9:1, 165 мл) по каплям добавляли 1 н NaOH до значения рН ~11. Затем добавляли раствор Cbz-OSu (6,66 г, 26,7 ммоль), растворенный в 1,4-диоксане (50 мл). После перемешивания в течение 1 ч к реакционной смеси затем добавляли NaOH (1,07 г, 26,7 ммоль), а затем МеОН (60 мл). Эту полученную смесь оставляли перемешиваться в течение 20 мин. К реакционной смеси затем добавляли разбавленную лимонную кислоту (10% объем/объем, 50 мл), водный слой экстрагировали EtOAc (3 × 150 мл) и объединенные органические слои промывали солевым раствором (3 × 100 мл), сушили над Na2SO4 и концентрировали с получением неочищенного продукта. Остаток разбавляли DCM (50 мл) и суспензию фильтровали с получением требуемого соединения (3,2 г). Фазу DCM концентрировали и остаток очищали на колонке с силикагелем (с элюированием 10-20% метанола в EtOAc) с получением требуемого соединения (1,0 г). Объединенные партии давали соединение 101-D (4,2 г, 86,1% выход) в виде белого твердого вещества.
Стадия 3: К соединению 101-D (4,3 г, 7,85 ммоль) добавляли раствор 1,25 М HCl в МеОН (128 мл) и реакционную смесь перемешивали при 0°С. Летучие вещества удаляли с получением соединения 101Е (4Д5 г, 94,1% выход) в виде белого твердого вещества, которое использовали сразу на следующей стадии.
Стадия 4: Бис-алкилирование фенольных групп было описано и названо как общий способ 2. К раствору соединения 101-Е (3,9 г, 6,94 ммоль) и K2CO3 (14,4 г, 104 ммоль) в DMF (50 мл) добавляли трет-бутил-2-бромэтилкарбамат (15,6 г, 69,5 ммоль) при 0°С. Смесь перемешивали при комнатной температуре в течение 48 ч. Смесь фильтровали и фильтрат разбавляли EtOAc (500 мл). Слой EtOAc промывали солевым раствором (2 × 400 мл), сушили над Na2SO4, концентрировали и очищали методом хроматографии на силикагеле (градиент растворителя: 0-60% EtOAc в петролейном эфире) с получением соединения 101-F (4,8 г, 81,5% выход) в виде белого твердого вещества.
Стадия 5: Гидрирование Cbz защитных групп было описано и названо как общий способ 3. К раствору соединения 101-F (4,8 г, 5,7 ммоль) в МеОН (100 мл) при комнатной температуре добавляли 10% Pd/C (1,26 г, 1,18 ммоль) на углеродной подложке. Реакционную смесь перемешивали в течение 1 ч при той же температуре в атмосфере водорода (15 фунт/кв. дюйм). Фильтрат затем концентрировали с получением соединения 101-G (4,0 г, 99% выход) в виде белого твердого вещества.
Пример 5: Синтез соединений 101-I,101-J, 101-K и 101-L

Стадия 1: Реакция соединений Cbz-защищенной аминокислоты с амином была описана и названа как общий способ 4. К раствору соединения 101-G (3,5 г, 4,9 ммоль) и (S)-2-(((бензил окси)карбонил)амино)-6-((трет-бутоксикарбонил)амино)гексановой кислоты (2,4 г, 6,4 ммоль) в DCM (30 мл) при 0°С добавляли HATU (3,7 г, 9,8 ммоль) и DIPEA (1,9 г, 14,7 ммоль). Полученную смесь оставляли постепенно нагреваться до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь разбавляли DCM (100 мл), затем промывали солевым раствором (100 мл × 3). Органический слой сушили над Na2SO4, концентрировали и остаток очищали методом колоночной хроматографии на силикагеле с получением соединения 101-Н (5,3 г, 99% выход) в виде белого твердого вещества
Стадия 2: Стадию гидрирования проводили с применением общего способа 3 (пример 4) с применением соединения 101-Н (1,5 г, 1,4 ммоль) с получением соединения 101-1 (1,2 г, 93% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=0,711, [М+Н]+=942,6.
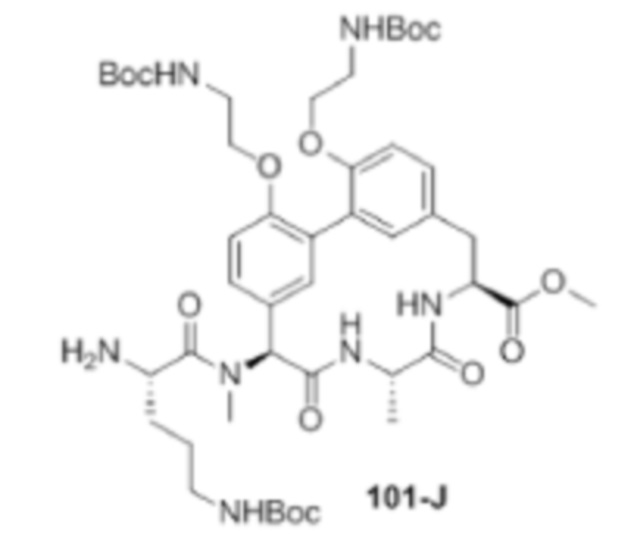
Соединение 101-J получали из соединения 101-G и (S)-2-(((бензилокси)карбонил)амино)-5-((трет-бутоксикарбонил)амино)пентановой кислоты с применением условий примера 5. LCMS (способ 5-95 АВ, ESI): tR=0,841, [М+Н]+=928,4.

Соединение 101-К получали из соединения 101G и (S)-2-(((бензилокси)карбонил)амино)-4-((трет-бутоксикарбонил)амино)буталовой кислоты с применением условий примера 5. LCMS (способ 5-95 АВ, ESI): tR-0,838, [М+Н]+=914,5.
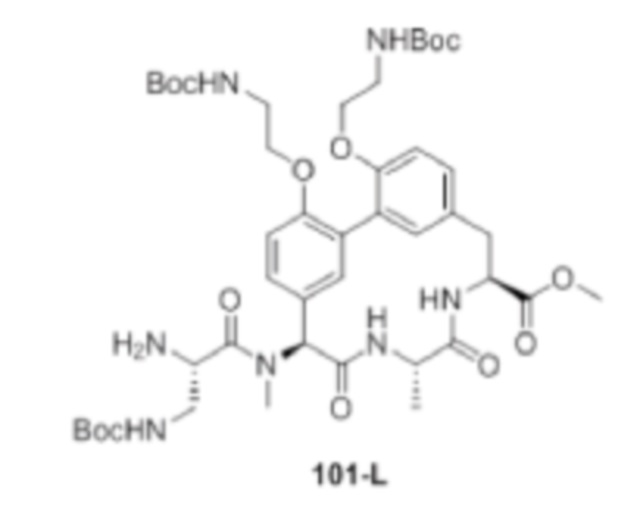
Соединение 101-L получали из соединения 101G и (S)-2-(((бензилокси)карбонил)амино)-3-((трет-бутоксикарбонил)амино)пропановой кислоты с применением условий примера 5. LCMS (способ 5-95 АВ, ESI): tR=0,833, [М+Н]+=900,5.
Пример 6: Синтез 3-((трет-бутоксикарбонил)(децил)амино)пропановой кислоты

К раствору метилакрилата (2,2 г, 26 ммоль) в THF (20 мл) добавляли раствор декан-1-амина (6 г, 38 ммоль) в THF (20 мл) при 0°С. Реакционную смесь перемешивали при 30°С в течение 48 ч. Полученный раствор концентрировали с получением метил-3-(дециламино)пропаноата (6,4 г).
Стадия 2: К раствору неочищенного метил-3-(дециламино)пропаноата (6,4 г, 15 ммоль) и Et3N (4 г, 40 ммоль) в DCM (30 мл) по каплям добавляли раствор Вос2О (5,7 г, 26 ммоль) в DCM (20 мл) при 0°С. Реакционную смесь затем постепенно оставляли нагреваться до 30°С и перемешивали в течение 18 ч. После завершения реакции добавляли Н2О (50 мл) и полученный водный слой дополнительно экстрагировали DCM (50 мл × 2). Объединенные органические слои концентрировали и остаток очищали на колонке с силикагелем (РЕ/EtOAc=50/1~20/1) с получением метил-3-((трет-бутоксикарбонил)(децил)амино)пропаноата (6,5 г, 73%) в виде бесцветного масла.
Стадия 3: К раствору метил-3-((трет-бутоксикарбонил)(децил)амино)пропаноата (8,2 г, 23,9 ммоль, неочшценный) в EtOH (40 мл) добавляли раствор LiOH (1,15 г, 48 ммоль) в Н2О (20 мл) при 0°С. Реакционную смесь затем постепенно оставляли нагреваться до 30°С и перемешивали в течение 18 ч. После завершения реакции EtOH удаляли при пониженном давлении. Оставшийся водный раствор затем доводили до значения рН=2~3 при помощи 6 н HCl, а затем экстрагировали EtOAc (50 мл × 3). Объединенные слои EtOAc сушили над Na2SO4 и концентрировали с получением 3-((трет-бутоксикарбонил)(децил)амино)пропановой кислоты (7 г, 88,6%) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDCl3) δ 3.47-3.43 (t, J=6.8 Гц, 2Н), 3.19-3.15 (t, J=7.2 Гц, 2Н), 2.61 (brs, 2Н), 1.51-1.39 (m, 11Н), 1.24-1.22 (m, 14Н), 0.88-0.84 (t, J=6.8Гц, 3Н).
Пример 7: Синтез соединения 101

Стадия 1: Общий способ 4 (пример 5) использовали по отношению к соединению 101-1 (1,0 г, 1,27 ммоль) и 3-((трет-бутоксикарбонил)(децил)амино)пропановой кислоты (504 мг, 1,53 ммоль) с получением соединения 101-М (1,3 г, 82% выход) в виде белого твердого вещества.
Стадия 2: Гидролиз при помощи гидроксида лития сложного эфира в кислоту был описан и назван как общий способ 5. К раствору соединения 101-М (1,3 г, 1,04 ммоль) в THF/H2O (40 мл, 1:1) добавляли LiOH моногидрат (87 мг, 2,07 ммоль) при 0°С. Смесь оставляли постепенно нагреваться до комнатной температуры и перемешивали в течение 1 ч. Большую часть THF удаляли при пониженном давлении и значение рН полученной смеси доводили до 5 насыщенной лимонной кислотой, затем дополнительно экстрагировали EtOAc (30 мл × 3). Объединенные органические слои промывали солевым раствором (100 мл), сушили над Na2SO4 и концентрировали с получением соединения 101-N (1,1 г, 86% выход) в виде белого твердого вещества.
Стадии 3 и 4: Реакцию соединения аминонитрила с карбоновой кислотой и последующее снятие защитных групп Вое было описано и названо как общий способ 6. К раствору соединения 101-N (180 мг, 0,15 ммоль), аминоацетонитрила гидрохлорида (31 мг, 0,33 ммоль) и DIPEA (38 мг, 0,29 ммоль) в DCM/DMF (3 мл, 2:1) при 0°С при перемешивании добавляли HATU (56 мг, 0,15 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Большую часть DCM удаляли при пониженном давлении и остаток выливали в воду (10 мл), которую экстрагировали EtOAc (20 мл × 3). Объединенные органические слои промывали солевым раствором (50 мл), сушили над Na2SO4, концентрировали до остатка, который очищали методом колоночной флеш-хроматографии с получением соединения 101-О (140 мг, 76%) в виде белого твердого вещества.
Соединение 101-О (130 мг, 0,10 ммоль) добавляли к 5% TFA в HFTP (6,5 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Летучие вещества удаляли при пониженном давлении и полученное неочищенное вещество повторно растворяли в DMF (5 мл), а затем нейтрализовали твердым NaHCO3. Фильтрат затем очищали методом HPLC с получением соединения 101 (54 мг, 60% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=0,710, М+Н+=877,6; 1НЯМР (400 МГц, МеОН-d4) δ 8.51 (brs, 2Н, НСООН), 7.28-7.25 (m, 2Н), 7.20 (d, J=8 Гц, 1H), 7.18 (d, J=8 Гц, 1Н), 6.90 (brs, 1Н), 6.84 (brs, 1Н), 6.37 (s, 1H), 4.82-4.79 (m, 3Н), 4.28-4.20 (m, 4Н), 4.21 (s, 2Н), 3.33-3.26 (m, 2Н), 3.26-3.16 (m, 5Н), 3.16-3.12 (m, 1Н), 3.11-2.95 (m, 2Н), 2.95-2.91 (m, 2Н), 2.90 (s, 3Н), 2.73-2.66 (m, 2Н), 1.75-1.65 (m, 6Н), 1.64-1.51 (m, 1Н), 1.50-1.16 (m, 18Н), 0.92 (t, J=6.8 Гц, 3Н).
Пример 8: Синтез соединения 102
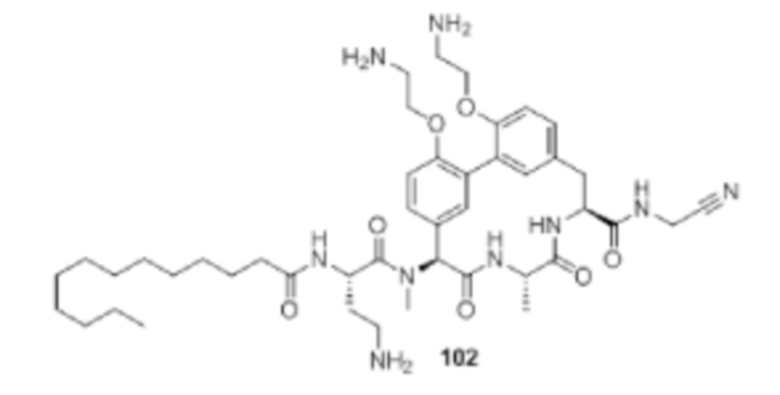
Соединение 102 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,766 мин, [М+Н]+=834,4.
Пример 9: Синтез соединения 103
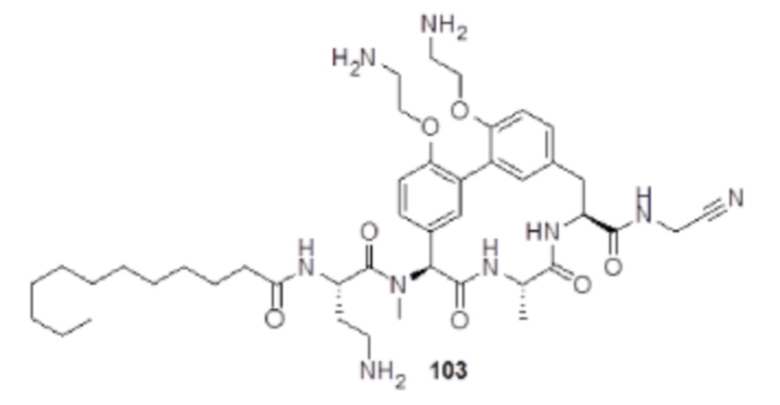
Соединение 103 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,747 мин, [М+Н]+=820,4.
Пример 10: Синтез соединения 104
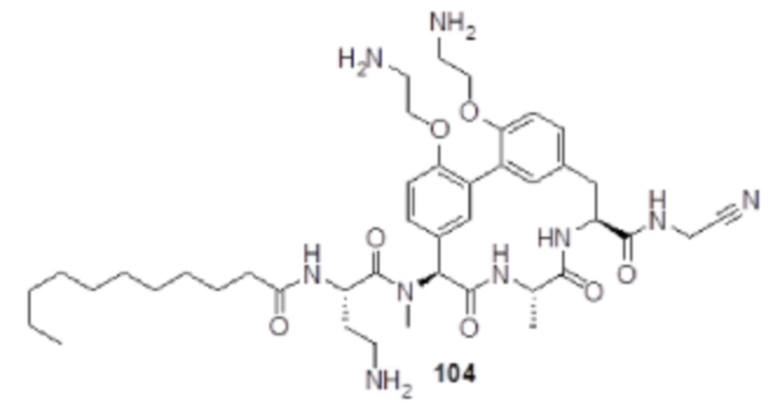
Соединение 104 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR = 0,725 мин, [М+Н]+- 806,5.
Пример 11: Синтез соединения 105

Соединение 105 (соль муравьиной кислоты) получали с 50% выходом в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,709 мин, [М+Н]+=792,3.
Пример 12: Синтез соединения 106

Соединение 106 (соль муравьиной кислоты) получали с 43% выходом в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,681 мин, [М+Н]+=778,3.
Пример 13: Синтез соединения 107
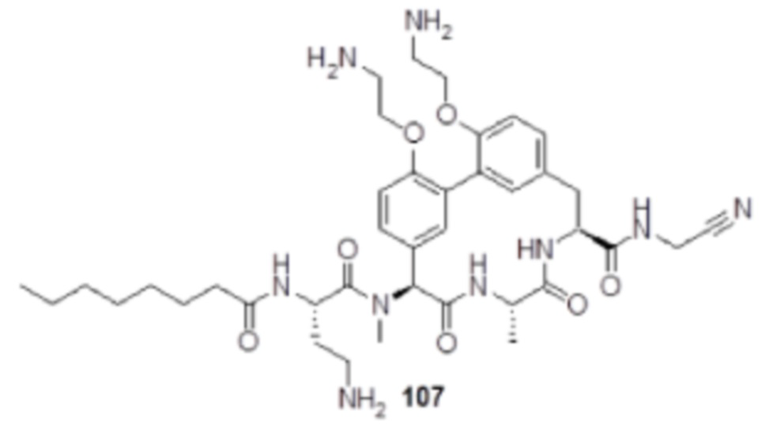
Соединение 107 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,652 мин, [М+Н]+=764,4.
Пример 14: Синтез соединения 108

Соединение 108 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=902 [М+Н]+; 1Н ЯМР (500 МГц, DMSO-d6) δ 9.21 (d, J=7.7 Гц, 1H), 9.00 (d, J=5.1 Гц, 1H), 8.80 (dd, J=23.6, 7.8 Гц, 1H), 8.39 (d,J=7.9 Гц, 1H), 8.01 (dd, J=15.0, 8.4 Гц, 2Н), 7.78 (d, J=8.4 Гц, 2Н), 7.68 (d, J=8.3 Гц, 2Н), 7.52 (d, J=8.4 Гц, 2Н), 7.21 (d, J=8.4 Гц, 1H), 7.15 (s, 2Н), 7.04 (dd, J=21.3, 7.0 Гц, 1Н), 6.72 (s, 2Н), 6.35 (s, 1Н), 4.84 (dd,J=13.5, 7.8 Гц, 1H), 4.79-4.74 (m, 1Н), 4.69 (dd,J=15.3, 8.2 Гц, 1H), 4.48 (d,J=6.8 Гц, 1H), 4.17 (d,J=5.6 Гц, 2Н), 4.11-4.02 (m, 4Н), 3.19 (d,J=16.0 Гц, 1H), 3.01 (d, J=17.3 Гц, 1Н), 2.98-2.87 (m, 5H), 2.80 (s, 3Н), 2.74 (dd, J=18.2, 7.5 Гц, 2H), 1.94-1.72 (m, 2H), 1.68-1.55 (m, 2H), 1.53-1.37 (m, 2H), 1.33 (d, J=3.7 Гц, 9H), 1.20 (d,J=6.6 Гц, 3Н).
Пример 15: Синтез соединения 109

Соединение 109 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=906 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.97 (d, J=8.0 Гц, 1H), 8.76-8.68 (m, 2Н), 8.37 (d, J=9.0 Гц, 1H), 8.16 (s, 1H), 8.03-7.97 (m, 2Н), 7.82-7.76 (m, 2Н), 7.33-7.27 (m, 2Н), 7.25-7.19 (m, 1Н), 7.16 (s, 1H), 7.07 (d, J=8.7 Гц, 2Н), 6.73 (d, J=2.1 Гц, 2Н), 6.37 (s, 1H), 4.86 (q, J=7.3 Гц, 1H), 4.80 -4.67 (m, 2Н), 4.18 (d, J=5.9 Гц, 2Н), 4.10 (dq, J=12.3, 5.9, 5.1 Гц, 4Н), 3.84 (d, J=23.8 Гц, 6Н), 3.17 (s, 1H), 3.01 (dt, J=10.6, 5.6 Гц, 4Н), 2.80 (s, 3Н), 2.77 (d, J=1.4 Гц, 2Н), 1.78 (d,J=7.8 Гц 2Н), 1.65-1.53 (m, 2Н), 1.51-1.38 (m, 2Н), 1.21 (d, J=6.7 Гц, 3Н).
Пример 16: Синтез соединения 110
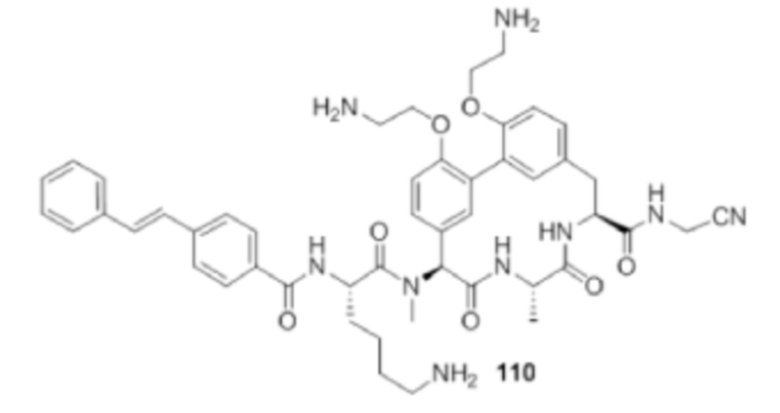
Соединение 110 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=872 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.95 (d, J=8.0 Гц, 1H), 8.70 (t, J=6.5 Гц, 2Н), 8.35 (d, J=9.0 Гц, 1Н), 7.95 (d, J=8.2 Гц, 2Н), 7.75-7.70 (m, 2Н), 7.68-7.62 (m, 2Н), 7.45-7.38 (m, 3Н), 7.36-7.30 (m, 2Н), 7.25-7.21 (m, 1Н), 7.16 (d, J=1.3 Гц, 2Н), 7.08 (d, J=8.5 Гц, 1H), 6.72 (s, 2Н), 6.37 (s, 1H), 4.84 (d, J=7.2 Гц, 1Н),4.72 (dd, J=17.1, 9.2 Гц, 2Н),4.19 (d,J=5.9 Гц, 2Н), 4.17-4.06 (m, 4Н), 3.18 (s, 1Н), 3.05 (dt, J=10.9, 5.9 Гц, 5Н), 2.80 (s, 3Н), 2.77 (s, 2Н), 1.77 (d, J=7.7 Гц, 2Н), 1.59 (d,J=7.3 Гц, 2Н), 1.48 (s, 2Н), 1.21 (^J=6.7 Гц, 3Н).
Пример 17: Синтез соединения 111

Соединение 111 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=914 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.96 (d, J=8.0 Гц, 1H), 8.83 (d, J=7.8 Гц, 1Н), 8.70 (t, J=5.6 Гц, 1Н), 8.37 (d, J=9.0 Гц, 1Н), 8.07-8.01 (m, 2Н), 7.94-7.88 (m, 2Н), 7.83 (dd, J=5.6, 1.9 Гц, 2Н), 7.68 (t, J=1.8 Гц, 1Н), 7.22 (d, J=8.8 Гц, 1H), 7.15 (d, J=1.3 Гц, 2Н), 7.07 (d, J=8.5 Гц, 1Н), 6.73 (d,J=1.9 Гц, 2Н), 6.37 (s, 1H), 4.86 (d,.7=7.3 Гц, 1Н), 4.72 (dd, J=16.4, 9.0 Гц, 2Н), 4.18 (d, J=5.9 Гц, 2Н), 4.15-4.06 (m, 4Н), 3.17 (s, 1H), 3.01 (q, J=5.3 Гц, 5Н), 2.80 (s, 3Н), 2.79 (A, J=2.2 Гц, 2Н), 1.83- 1.74 (m, 2Н), 1.64-1.55 (m, 2Н), 1.46 (s, 2Н), 1.20 (d, J=6.7 Гц, 3Н).
Пример 18: Синтез соединения 112
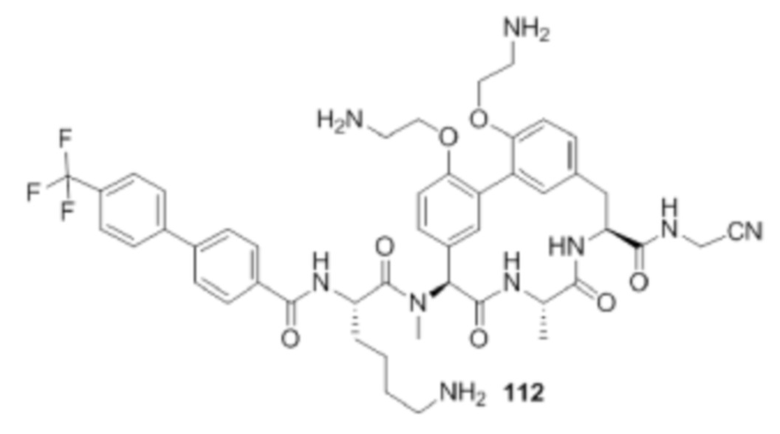
Соединение 112 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=914 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.97 (d, J=8.0 Гц, 1H), 8.82 (d, J=7.8 Гц, 1Н), 8.70 (t,.7=5.5 Гц, 1H), 8.38 (d, J=9.0 Гц, 1H), 8.10-8.05 (m, 2H), 7.98 (d,J=8.2 Гц, 2H), 7.88 (dd, J=8.4, 5.5 Гц, 4H), 7.22 (dd, J=8.5, 2.3 Гц, 1H), 7.15 (d, J=1.4 Гц, 2H), 7.07 (d, J=8.5 Гц, 1H), 6.73 (s, 2H), 6.37 (s, 1H), 4.90-4.82 (m, 1H), 4.80-4.66 (m, 2H), 4.18 (d, J=5.8 Гц, 2H), 4.12-4.05 (m, 4H), 3.17 (s, 1H), 2.99 (dt, J=9.7, 5.3 Гц, 5H), 2.81 (s, 3H), 2.81-2.77 (m, 2H), 1.79 (q, J=7.5 Гц, 2H), 1.65-1.54 (m, 2H), 1.51-1.38 (m, 2H), 1.20 (d, J=6.7 Гц, 3Н).
Пример 19: Синтез соединения 113
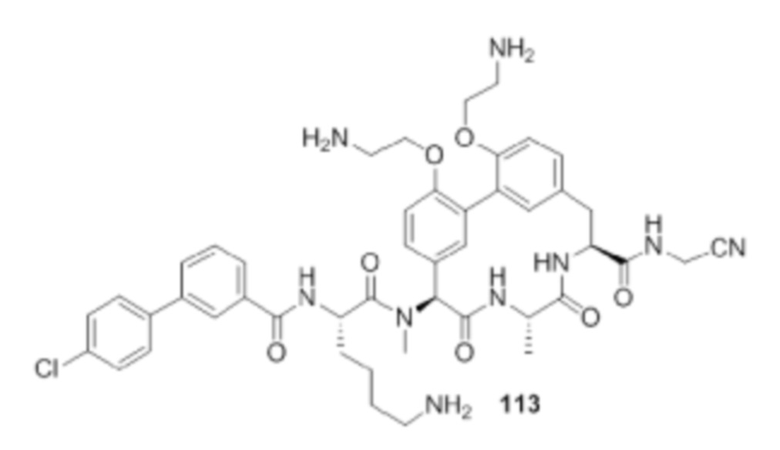
Соединение 113 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=880 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.98 (A, J=1.1 Гц, 1H), 8.92 (d, J=1.9 Гц, 1H), 8.73 (t, J=5.8 Гц, 1H), 8.39 (d, J=9.0 Гц, 1Н), 8.21 (t, J=1.9 Гц, 1H), 7.93-7.80 (m, 4Н), 7.64-7.57 (m, 3Н), 7.19 (ddd, J=15.7, 8.7, 2.5 Гц, 2Н), 7.04 (dd, J=12.0, 8.5 Гц, 2Н), 6.72 (t, J=2.3 Гц, 2Н), 6.36 (s, 1H), 4.93-4.85 (m, 1Н), 4.79-4.68 (m, 2Н), 4.18 (d, J=5.1 Гц, 2Н), 4.02 (dd, J=11.1, 5.5 Гц, 4Н), 3.19 (d, J=18.3 Гц, 1H), 3.01-2.88 (m, 5Н), 2.78 (s, 5Н), 1.77 (d, J=16.9 Гц, 2Н), 1.59 (q, J=7.4 Гц, 2Н), 1.46 (s, 2Н), 1.20 (d, J=6.8 Гц, 3Н).
Пример 20: Синтез соединения 114
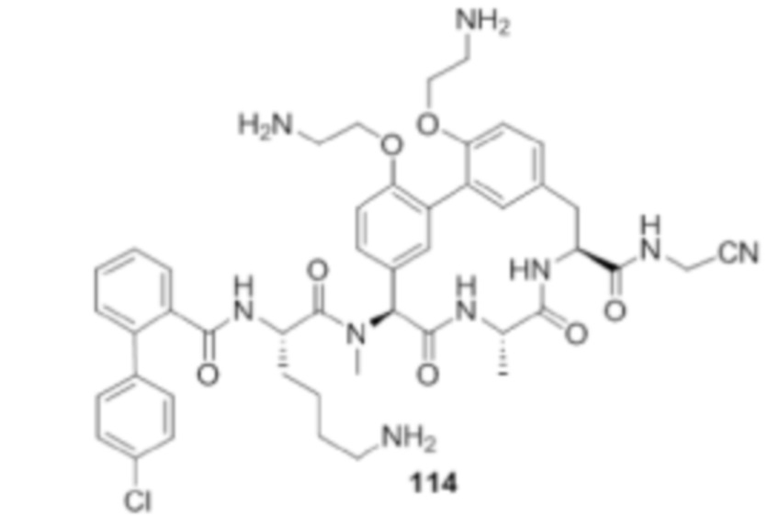
Соединение 114 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=880 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.97 (d, J=8.0 Гц, 1H), 8.79 (d, J=7.5 Гц, 1H), 8.71 (t, J=5.1 Гц, 1H), 8.36 (d, J=9.0 Гц, 1H), 7.56 (ddd, J=7.6, 6.2, 2.7 Гц, 1H), 7.50-7.42 (m, 7Н), 7.23 (dd, J=8.6, 2.3 Гц, 1H), 7.10-7.02 (m, 2Н), 6.99 (dd, J=8.7, 2.4 Гц, 1H), 6.76-6.69 (m, 2Н), 6.47 (s, 1H), 4.81-4.68 (m, 2Н), 4.61-4.54 (m, 1Н), 4.19 (d, J=5.9 Гц, 2Н), 4.17-4.08 (m, 4Н), 3.19 (s, 1H), 3.12-3.00 (m, 5Н), 2.78 (d, J=8.5 Гц, 2Н), 2.74 (s, 3Н), 1.67- 1.49 (m, 4Н), 1.38-1.28 (m, 2Н), 1.21 (d,J=6.7 Гц, 3Н).
Пример 174: Синтез соединения 115
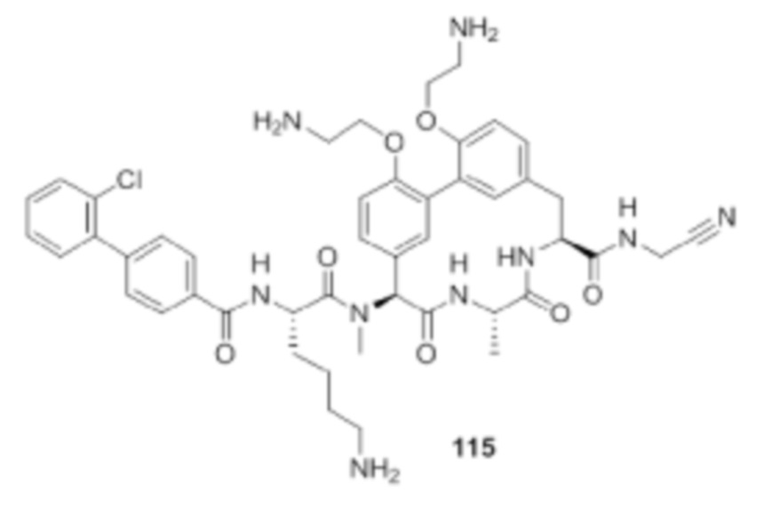
Соединение 115 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=880 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.96 (d, J=8.0 Гц, 1H), 8.81 (d, J=7.9 Гц, 1H), 8.70 (t, J=5.6 Гц, 1H), 8.35 (d, J=8.9 Гц, 1H), 8.04-7.98 (m, 2H), 7.64-7.59 (m, 1H), 7.59-7.54 (m, 2H), 7.49-7.42 (m, 3H), 7.26-7.20 (m, 1H), 7.16 (d, J=1.3 Гц, 2H), 7.08 (d,J=8.6 Гц, 1H), 6.73 (d,.7=3.3 Гц, 2H), 6.39 (s, 1H), 4.90-4.83 (m, 1H), 4.80-4.67 (m, 2H), 4.19 (d, J=6.0 Гц, 2H), 4.13 (dd, J=10.5, 5.2 Гц, 4H), 3.18 (s, 1H), 3.06 (dq, J=9.7, 5.4 Гц, 5H), 2.82 (s, 3H), 2.80 (s, 2H), 1.78 (d, J=7.6 Гц, 2H), 1.59 (d,.7=7.1 Гц, 2H), 1.50 (s, 2H), 1.21 (d, J=6.8 Гц, 3Н).
Пример 22: Синтез соединения 116

Соединение 116 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=896 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.99 (d, J=7.9 Гц, 1H), 8.74 (t, J=5.6 Гц, 1H), 8.66 (d, J=1.1 Гц, 1H), 8.36 (d, J=8.9 Гц, 1H), 8.01-7.95 (m, 2H), 7.53-7.46 (m, 2H), 7.25-7.19 (m, 1H), 7.16-7.04 (m, 7H), 6.76-6.69 (m, 2H), 6.35 (s, 1H), 4.83 (t, J=1.2 Гц, 1H), 4.79-4.67 (m, 2H), 4.18 (d, J=5.9 Гц, 2H), 4.09 (dd,J=10.9,5.6 Гц, 4H), 3.19 (d, J=16.6 Гц, 1H), 2.98 (dt, J=11.0,5.4 Гц, 5H), 2.79 (s, 3H), 2.78 (s, 2H), 1.75 (q,.7=7.6 Гц, 2H), 1.58 (dq, J=15.2, 7.4 Гц, 2H), 1.44 (dq, J=15.0, 7.3 Гц, 2H), 1.20 (d, J=6.1 Гц, 3Н).
Пример 23: Синтез соединения 175
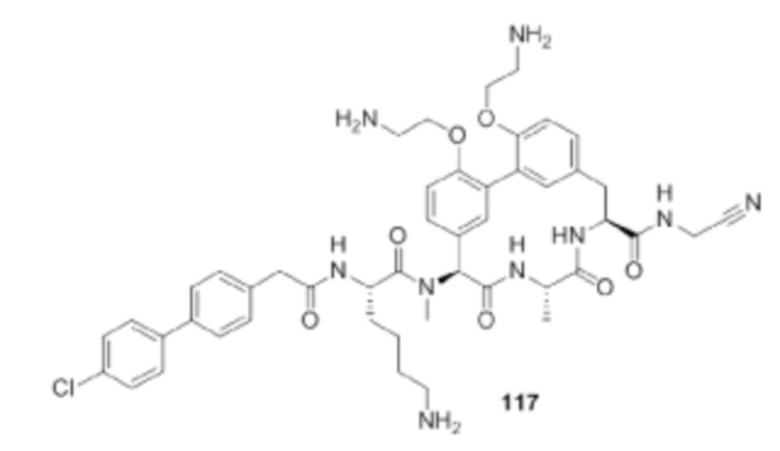
Соединение 117 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=894 [М+Н]+.
Пример 24: Синтез соединения 118
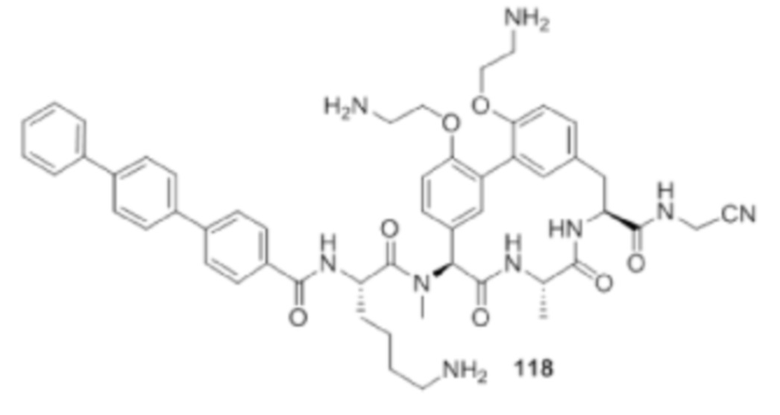
Соединение 118 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=922 [М+Н]+.
Пример 25: Синтез соединения 119
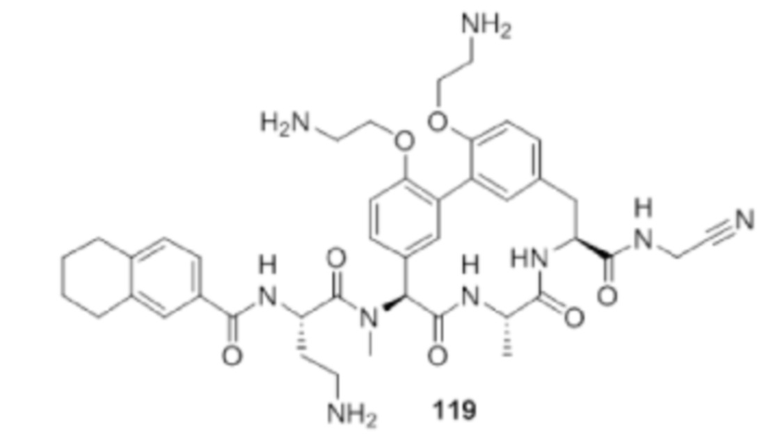
Соединение 119 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=796 [М+Н]+.
Пример 26: Синтез соединения 120

Соединение 120 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=842 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 9.07 (d, J=7.8 Гц, 1Н), 9.01 (d, J=7.3 Гц, 1H), 8.82 (t J=5.6 Гц, 1H), 8.38 (d, J=8.9 Гц, 1H), 7.99 (d,J=8.5 Гц, 2Н), 7.69 (d,.7=8.4 Гц, 2Н), 7.63-7.57 (m, 2Н), 7.49-7.44 (m, 3Н), 7.22-7.08 (m, 3Н), 7.04 (d, J=8.5 Гц, 1H), 6.72 (d, J=2.5 Гц, 2Н), 6.30 (s, 1H), 4.96 (s, 1H 4.74 (dt, J=15.5, 8.9 Гц, 2Н), 4.17 (d, J=5.8 Гц, 2Н), 4.00 (dd, J=11.9, 6.4 Гц, 4Н), 3.18 (d J=16.0 Гц, 1H), 3.05-2.96 (m, 1Н), 2.88 (d,J=8.9 Гц, 6Н), 2.77 (s, 3Н), 2.01 (s, 2Н), 1.19 (d, J=6.7 Гц, 3Н).
Пример 27: Синтез соединения 121

Соединение 121 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=846 [М+Н]+.
Пример 28: Синтез соединения 122
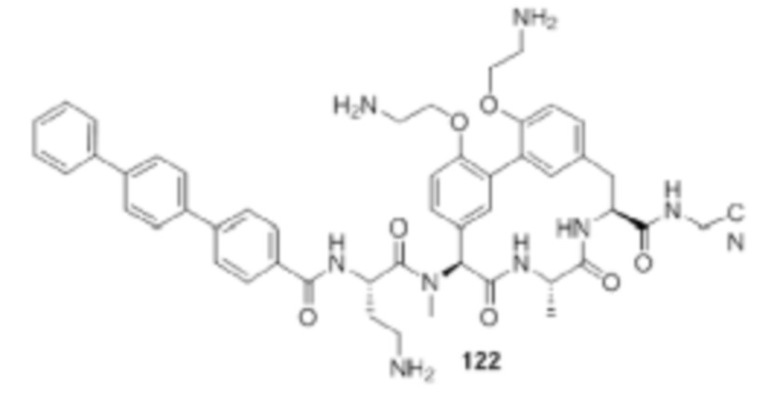
Соединение 122 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=894 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.98 (dd, J=7.6, 4.4 Гц, 2Н), 8.70 (t, J=5.6 Гц, 1H), 8.42 (d,J=8.8 Гц, 1Н), 8.05 (d,J=8.5 Гц, 2Н), 7.91-7.79 (m, 5Н), 7.77-7.73 (m, 2Н), 7.54-7.49 (m, 2Н), 7.44-7.38 (m, 2H 7.22 (dt,J=8.6, 2.4 Гц, 1H), 7.16 (d, J=8.6 Гц, 2Н), 7.07 (d,J=8.5 Гц, 1H), 6.73 (t, J=2.3 Гц, 2Н), 6.33 (s, 1H), 5.02 (q, J=7.3 Гц, 1H), 4.79-4.70 (m, 2Н), 4.18 (d, J=5.9 Гц, 2Н), 4.13-4.05 (m, 4Н), 3.20 (d, J=18.2 Гц, 1H), 3.06-2.92 (m, 9Н), 2.77 (s, 3Н), 2.07 (dd, J=20.0, 12.5 Гц, 2Н), 1.21 (d, J=6.7 Гц, 3Н).
Пример 29: Синтез соединения 123

Соединение 123 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=804 [М+Н]+.
Пример 30: Синтез соединения 124
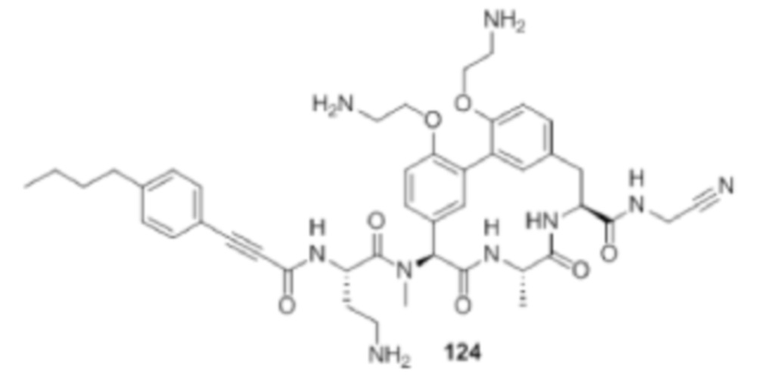
Соединение 124 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=822 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 9.28 (d, J=7.5 Гц, 1H), 8.96 (d, J=7.9 Гц, 1H), 8.70 (t, J=5.7 Гц, 1H), 8.39 (d, J=9.0 Гц, 1Н), 7.51 ((1,J=8.2 Гц, 2Н), 7.34 -7.29 (m, 2Н), 7.22 (dd,J=8.7, 2.3 Гц, 1H), 7.18-7.12 (m, 2Н), 7.08 (d, J=8.5 Гц, 1H), 6.72 (d, J=2.4 Гц, 2Н), 6.34 (s, 1H), 4.83 (s, 1Н), 4.73 (td, J=15.9, 14.1, 9.1 Гц, 2Н), 4.18 (d, J=5.8 Гц, 2Н), 4.16-4.06 (m, 4Н), 3.19 (d, J=16.2 Гц, 1H), 3.01 (dt,J=10.3, 5.4 Гц, 5Н), 2.88 (dd,J=10.0, 6.0 Гц, 2Н), 2.77 (s, 3Н), 2.67-2.59 (m, 2Н), 2.05-1.88 (m, 2Н), 1.61-1.53 (m, 2Н), 1.35-1.26 (m, 2Н), 1.20 (d, J=6.7 Гц, 3Н), 0.90 (t, J=7.3 Гц, 3Н).
Пример 31: Синтез соединения 125

Соединение 125 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=792 [М+Н]+;1Н ЯМР (400 МГц, DMSO-d6) δ 9.08 (d,J=7.8 Гц, 1Н), 8.98 (d,J=7.8 Гц, 1H), 8.71 (г,J=5.6 Гц, 1Н), 8.42 (d,J=9.0 Гц, 1Н), 8.08-7.95 (m, 4Н), 7.64 (ddt, J=10.3, 5.2, 3.7 Гц, 3Н), 7.23 (t, J=9.0 Гц, 1Н), 7.15 (s, 2Н), 7.06 (d,J=8.8 Гц, 1H), 6.73 (d,J=4.0 Гц, 2Н), 6.33 (d,J=0.9 Гц, 1Н), 5.04 (1,-7=7.1 Гц, 1Н), 4.80-4.70 (m, 2Н), 4.18 (d, J=5.9 Гц, 2Н), 4.08 (s, 4Н), 3.19 (d,J=16.4 Гц, 1Н), 2.98 (d, J=16.3 Гц, 5Н), 2.78 (s, 3Н), 2.68-2.64 (m, 2Н), 2.17-2.01 (m, 2Н), 1.21 (d, J=6.7 Гц, 3Н).
Пример 32: Синтез соединения 126

Соединение 126 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=790 [М+Н]+.
Пример 33: Синтез соединения 127
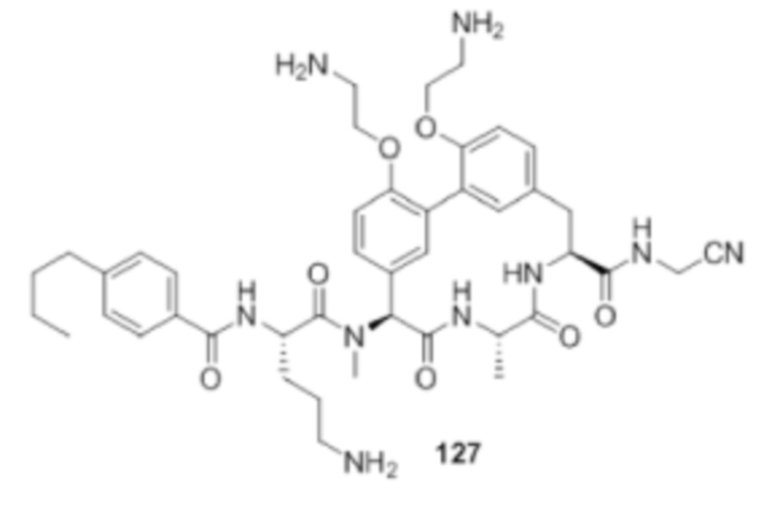
Соединение 127 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 101-J и 4-бутилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,545, [М+Н]+=812,2.
Пример 34: Синтез соединения 128
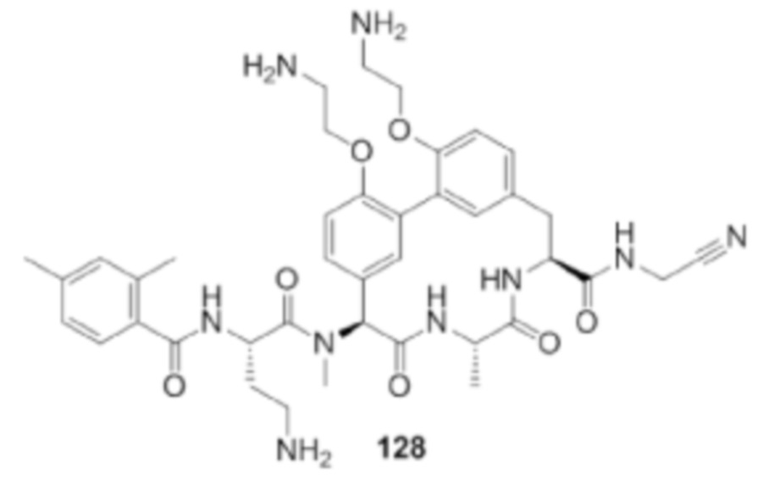
Соединение 128 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 0-60АВ): tR=0,850 мин/ 2 мин, [М+Н]+=770,5.
Пример 35: Синтез соединения 129
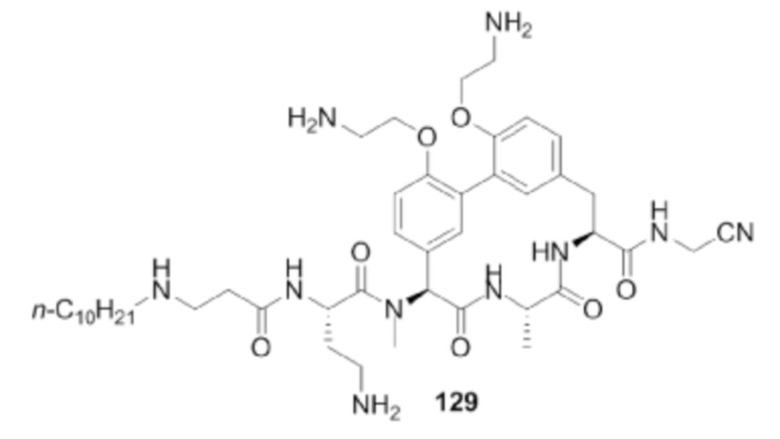
Соединение 129 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из 3-((трет-бутоксикарбонил)(децил)амино)пропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,557, [М+Н]+=849,5; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.49 (brs, 2FL НСООН), 7.29-7.24 (m, 2Н), 7.17 (d, 7=8 Гц, 1H), 7.10 (d, 7=8 Гц, 1H), 6.88 (brs, 1Н), 6.81 (brs, 1H), 6.29 (s, 1Н)=4.91-4.76 (m, 3Н), 4.27-4.15 (m, 4Н), 4.19 (s, 2Н), 3.36-3.23 (m, 6Н), 3.17-3.01 (m, 6Н), 2.86 (s, 3Н), 2.76-2.71 (m, 2Н), 2.20-2.10 (m, 1Н), 2.05-1.95 (m, 1Н), 1.71 (brs, 2Н), 1.38-1.31 (m, 17Н), 0.90 (1,7=6.4 Гц, 3Н).
Пример 36: Синтез соединения 130

Соединение 130 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,699, [М+Н]+=835,6; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.45 (brs, 1H), 7.34-7.20 (m, 2Н), 7.16 (d, J=8.5 Гц, 1H), 7.10 (d, J=8.5 Гц, 1H), 6.88 (brs, 1H), 6.80 (brs, 1H), 6.22 (s, 1Н), 5.21-5.13 (m, 1Н), 4.86^.79 (m, 2Н), 4.30-4.17 (m, 4Н), 4.19 (s, 2Н), 3.41-3.32 (m, 3Н), 3.29-3.22 (m, 5Н), 3.22-3.09 (m, 2Н), 3.06-2.99 (m, 2Н), 2.80 (в, 3Н), 1.77-1.65 (m, 2Н), 1.46 -1.23 (m, 19Н), 0.90 (t, J=6.8 Гц, 3Н).
Пример 37: Синтез соединения 131
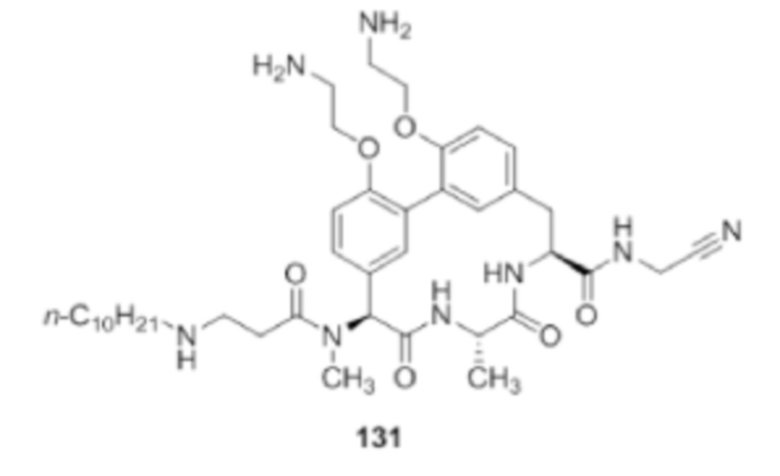
Соединение 131 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из 3-((трет-бутоксикарбошш)(децил)амино)пропановой кислоты и соединения 101-G. LCMS (способ 5-95 АВ, ESI): tR=0,585, [М+Н]+=749,3; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.47 (brs, 2Н, HCOOH),7.29-7.23(m, 2Н), 7.17 (d, J=8.0 Гц, 1H), 7.09 (d, J=8.0 Гц, 1H), 6.87 (brs, 1H), 6.80 (brs, 1Н), 6.31 (s, 1H), 4.81^1.76 (m, 2Н), 4.26-4.18 (m, 4Н), 4.21 (s, 2Н), 3.34-3.28 (m, 2Н), 3.25-3.15 (m, 4Н), 3.15-3.10 (m, 2Н), 3.07-3.03 (m, 2Н), 2.94-2.90 (m, 2Н), 2.78 (s, 3Н), 1.74-1.70 (m, 2Н), 1.39-1.32 (m, 17Н), 0.90 (t, J=6.4 Гц, 3Н).
Пример 38: Синтез соединения 181

К раствору декан-1-амина (10,5 г, 66,8 ммоль) в безводном дихлорметане (250 мл) добавляли триэтиламин (13,5 г, 133,5 ммоль) при 0°С и реакционную смесь перемешивали при 0°С в течение 30 мин. Затем по каплям добавляли метилбромацетат (10,2 г, 66,8 ммоль) при 0°С и реакционную смесь перемешивали при комнатной температуре в течение 14 ч. Раствор, содержащий метил-2-(дециламино)ацетат, использовали сразу на следующей стадии.
Образование N-Boc и LiOH сложноэфирный гидролиз проводили способом, подобным описанному в примере 6, с получением 1,1 г 2-((трет-бутоксикарбонил)(децил)амино)уксусной кислоты. 1Н ЯМР (400 МГц, CDCl3) δ 3.96 (s, 1Н), 3.89 (s, 1H), 3.25-3.23 (m, 2H), 1.50-1.41 (m, ПН), 1.25 (m, 14H), 0.88-0.85 (t, m=6.8 Гц, 3Н).
Соединение 132 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 37 (соединение 131) из 2-((трет-бутоксикарбонил)(децил)амино)уксусной кислоты и соединения 101-G. LCMS (способ 5-95 АВ, ESI): tR=0,627, [М+Н]+=735,2.
Пример 39: Синтез соединения 133
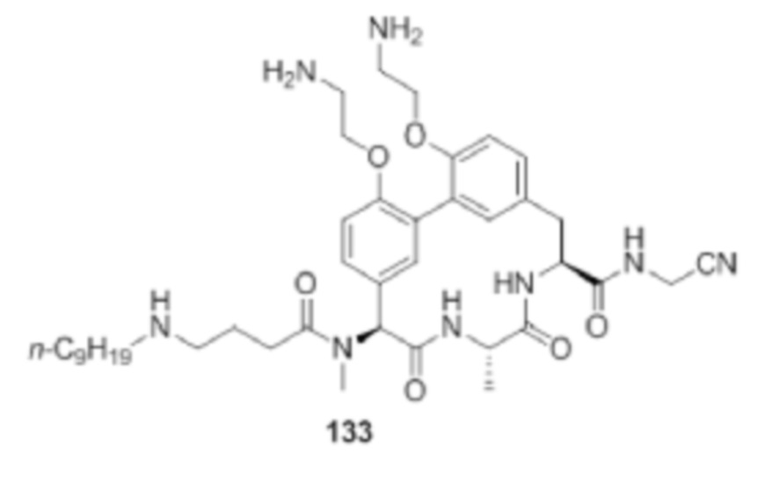
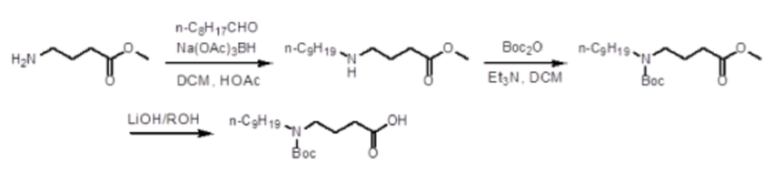
К раствору нонаналя (600 мг, 4,22 ммоль) в DCM (25 мл) при 0°С добавляли метил-4-аминобутаноат (988 мг, 8,44 ммоль) и НОАс (1 мл), а затем добавляли NaBH3CN (398 мг, 2 ммоль). Смесь перемешивали при 15°С в течение 12 ч. После завершения реакции добавляли Н2О (20 мл) и водный слой экстрагировали DCM (30 мл × 2). Объединенные органические слои концентрировали с получением метил-4-(нониламино)бутаноата. LCMS (способ 5-95 АВ, ESI): tR=0,770, [М+Н]+=244,0
Образование N-Boc и LiOH сложноэфирный гидролиз проводили способом, подобным описанному в примере 6, с получением 0,46 г 4-((трет-бутоксикарбонил)(нонил)амино)бутановой кислоты. ELSD-LC/MS 352,3 [M+Na+].
Соединение 133 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 37 (соединение 131). LCMS (способ 5-95 АВ, ESI): tR=0.717, [М+Н]+=749.5; 1Н ЯМР (400 МГц, MeOH-d4) 5 8.48 (brs, 3Н, НСООН), 7.29-7.20 (m, 2Н), 7.16 (d, J=8.4 Гц, 1H), 7.09 (d, J=8.4 Гц, 1H), 6.91(brs, 1H), 6.77 (brs, 1Н), 6.30 (s, 1Н), 4.82-4.74 (m, 2Н), 4.29-4.12 (m, 4Н), 4.19 (s, 2Н), 3.38-3.33 (m, 1Н), 3.24-3.05 (m, 7Н), 3.04-2.95 (m, 3Н), 2.78 (s, 3Н), 2.73-2.57 (m, 3Н), 2.07-1.94 (m, 2Н), 1.74-1.63 (m, 2Н), 1.50-1.23 (m, 15Н), 0.90 (t, J=6.6 Гц, 3Н).
Пример 40: Синтез соединения 134
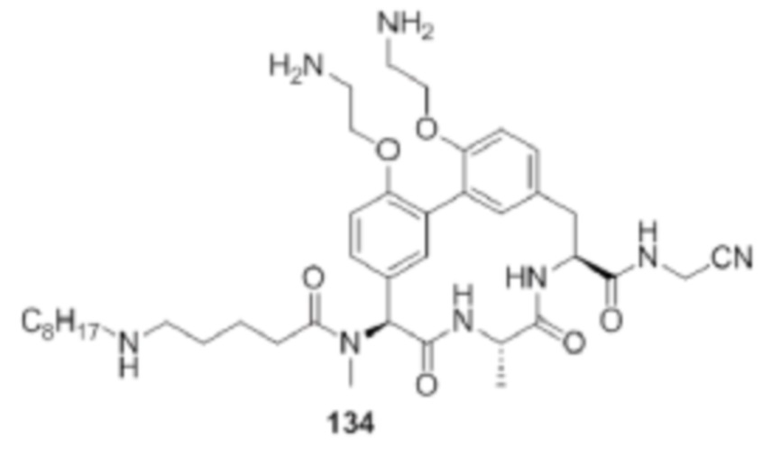
Соединение 134 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 39 (соединение 133). LCMS (способ 5-95 АВ, ESI): tR=0,562, М+Н+=749,3.
Пример 41: Синтез соединения 135

Стадия 1: Раствор 1-бром-4-н-бутилбензола (100 г, 0,472 моль), 4-(метоксикарбонил)бензолбороновой кислоты (82,0 г, 0,456 моль), 2 М Na2CO3 (150 г, 1,42 моль) в толуоле/EtOH (900 мп/300 мл) дегазировали трижды N2, затем добавляли Pd(PPh3)4 (27,2 г, 23,6 ммоль). Полученную смесь дегазировали N2 трижды, а затем нагревали до температуры образования флегмы в течение 5 ч. После того, как при помощи TLC наблюдали завершение реакции, толуол и EtOH удаляли в вакууме. Остаток экстрагировали ЕА (3×). Объединенные органические слои промывали солевым раствором и сушили Na2SO4. Растворитель удаляли с получением неочищенного продукта. Неочищенный продукт очищали методом колоночной хроматографии на силикагеле, элюировали РЕ: ЕА (150:1). Растворитель удаляли с получением метил-4'-бутил-[1,1'-бифенил]-4-карбоксилата(105 г, 86,0%) в виде белого твердого вещества.
Стадия 2: Смесь метил-4'-бутил-[1,1'-бифенил]4-карбоксилата (89,0 г, 0,332 моль), NaOH (26,6 г, 0,664 моль) в THF/H2O (500 мл/100 мл) нагревали до температуры образования флегмы всю ночь. После того, как при помощи TLC наблюдали завершение реакции, THF удаляли. Значение рН остатка доводили до 3-4 2 н раствором HCl. Полученную смесь фильтровали и фильтрационный осадок промывали водой и сушили с получением 4'-бутил-[1,1'-бифенил]-4-карбоновой кислоты (60,0 г, 71,1%) в виде белого твердого вещества.
Соединение 135 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 101-J и 4'-бутил-[1,1'-бифенил]-4-карбоновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,757, [М+Н]+=888,4; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.47 (brs, 1H, НСООН), 7.91 (d, J=8 Гц, 2Н), 7.71 (d, J=8.0 Гц, 2Н), 7.53 (d, J=8 Гц, 2Н), 7.36-7.20 (m, 4Н), 7.25-7.18 (m, 2Н), 6.90 (brs, 1Н), 6.81 (brs, 1H), 6.50 (s, 1H), 5.10-5.05 (m, 1Н), 4.854.72 (m, 2Н), 4.324.20 (m, 4Н), 4.21 (s, 2Н), 3.35-3.10 (m, 6Н), 3.08-2.95 (m, 2Н), 2.92 (s, 3Н), 2.70-2.60 (m, 2Н), 2.05-1.75 (m, 4H), 1.70-1.55 (m, 2H), 1.45-1.30 (m, 2H), 1.37 (d, m=7.2 Гц, 3Н), 0.95 (t, J=6.8 Гц, 3Н).
Пример 42: Синтез соединения 136
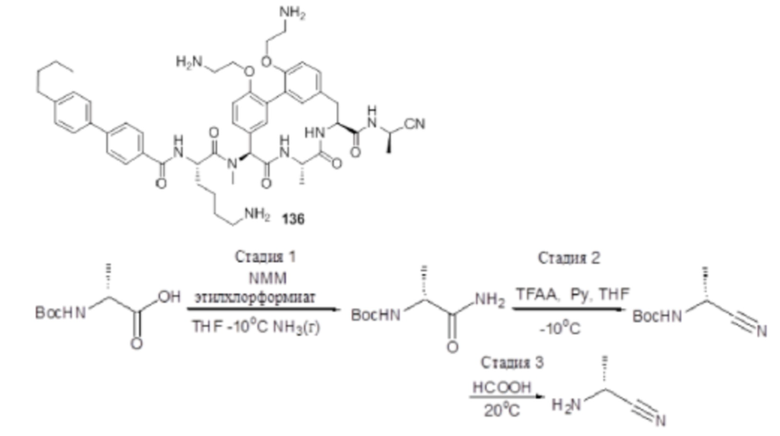
Стадия 1: К перемешиваемому раствору (R)-2-((трет-бутоксикарбонил)амино)пропановой кислоты (10,0 г, 52,8 ммоль), NMM (5,88 г, 58,1 ммоль) в THF (50 мл) по каплям добавляли этилхлорформиат (8,86 г, 81,6 ммоль) при -10°С и смесь перемешивали при той же температуре в течение 20 мин, а затем медленно добавляли 10 н аммиак в THF (50 мл, 500 ммоль). Полученную смесь перемешивали при -10°С еще 2 ч. Летучие вещества удаляли и остаток переносили в EtOAc (100 мл), затем промывали 1 н раствором KHSO4 и солевым раствором (50 мл каждого). Органический слой сушили над Na2SO4 и концентрировали с получением (R)-трет-бутил(1-амино-1-оксопропан-2-ил)карбамата (6,5 г, 65,3% выход) в виде белого твердого вещества.
Стадия 2: К раствору (R)-трет-бутил(1-амино-1-оксопропан-2-ил)карбамата (3,5 г, 18,6 ммоль) и пиридина (4,4 г, 55,8 ммоль) в безводном THF (50 мл) по каплям добавляли TFAA (5,9 г, 27,9 ммоль) при -10°С и смесь перемешивали при той же температуре в течение 2 ч. Летучие вещества удаляли и остаток переносили в EtOAc (100 мл), затем промывали 1 и раствором KHSO4 и солевым раствором (50 мл каждого). Органический слой сушили над Na2SO4 и концентрировали до неочищенного продукта, который дополнительно перекристаллизовали с применением 100 мл (20% EtOAc в петролейном эфире) с получением (R)-трет-бутил(1-цианоэтил)карбамата (1,5 г, 47,4% выход) в виде белого твердого вещества.1Н ЯМР (400 МГц, CDCl3) δ 4.82 (hrs, 1H), 4.61 (brs, 1H), 1.53 (d, J=7.6 Гц, 3Н), 1.45 (s, 9Н).
Стадия 3: (R)-Трет-бутил(1-цианоэтил)карбамат (100 мг, 0,59 ммоль) добавляли частями в НСООН (1,0 мл) при 0°С и смесь оставляли нагреваться до 20°С при перемешивании и перемешивали при той же температуре в течение 3 ч. Летучие вещества удаляли с получением (R)-2-аминопропаннитрила (65 мг, 95,3% выход) в виде белого твердого вещества, которое использовали сразу на следующей стадии.
Соединение 136 (соль муравьиной кислоты) получали с применением способов примера 41 (соединение 135), за исключением того, что (R)-2-аминопропаннитрила гидрохлорид использовали на стадии сочетания. LC-MS: m/z=880 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.91 (d, J=7.9 Гц, 1H), 8.82 (d, J=7.5 Гц, 1H), 8.74 (d, J=7.9 Гц, 1H), 8.37 (d, J=8.9 Гц, 1H), 8.01 (d, J=8.4 Гц, 2H), 7.80-7.75 (m, 2H), 7.69-7.63 (m, 2H), 7.33 (d, J=8.1 Гц, 2H), 7.19 (d, J=8.6 Гц, 1H), 7.15 (s, 2H), 7.09-7.02 (m, 1H), 6.74 (s, 2H), 6.37 (s, 1H), 4.84 (dd, J=16.0, 7.4 Гц, 2H), 4.72 (d, J=12.6 Гц, 2H), 4.05 (s, 4H), 2.94 (s, 5H), 2.80 (s, 3H), 2.78 (d, J=7.9 Гц, 2H), 2.65-2.62 (m, 2H), 1.78 (s, 2H), 1.60 (t, J=7.6 Гц, 4H), 1.44 (d, J=7.2 Гц, 5H), 1.38-1.31 (m, 2H), 1.20 (d, J=6.7 Гц 3Н), 0.96-0.88 (m, 3Н).
Пример 43: Синтез соединения 137

Соединение 137 (соль муравьиной кислоты) получали с применением способов примера 41 (соединение 135). LC-MS: m/z=903 [М+Н]+; 1H ЯМР (400 МГц DMSO-d6) δ 9.00 (d, J=7.8 Гц, 1H), 8.89 (d, J=8.0 Гц, 1H), 8.74 (t, J=5.7 Гц, 1H), 8.39 (d, J=9.0 Гц, 1H), 8.20 (t, J=1.8 Гц, 1H), 7.90-7.81 (m, 2H), 7.72-7.66 (m, 2H), 7.57 (t, J=7.8 Гц, 1H), 7.35 (d,J=8.2 Гц, 2H), 7.18 (ddd, J=16.6, 8.6, 2.5 Гц, 2H), 7.03 (t,J=8.7 Гц, 2H), 6.72 (d, J=2.6 Гц, 2H), 6.35 (s, 1H), 4.88 (q, J=7.5, 7.0 Гц, 1H), 4.79 -4.68 (m, 2H), 4.18 (d, J=5.8 Гц 2H), 3.99 (dt, J=10.6, 5.5 Гц, 4H), 3.18 (d, J=17.8 Гц, 1H),3.02 (d, J=12.1 Гц, 1H), 2.89 (q, J=5.6, 4.3 Гц, 4H), 2.78 (s, 3H), 2.76 (s, 2H), 2.68-2.62 (m, 2H), 1.77 (d, J=13.1 Гц, 2H), 1.65-1.55 (m, 4H), 1.45 (s, 4H), 1.40-1.29 (m, 2H), 1.20 (d, J=6.7 Гц, 3Н), 0.92 (t, J=7.3 Гц, 3Н).
Пример 44: Синтез соединения 138

Соединение 138 (соль муравьиной кислоты) получали с применением способов примера 41 (соединение 135). LC-MS: m/z=872 [М+Н]+; 1Н ЯМР (500 МГц, DMSO-d6) δ 9.09 (t, J=1.1 Гц, 1H), 8.98 (d, J=7.6 Гц 1Н), 8.89-8.79 (m, 1H), 8.44 (d, J=9.0 Гц, 1H), 8.01 (d, J=8.4 Гц, 2H), 7.77 (d, J=8.4 Гц 2H), 7.47-7.42 (m, 2H), 7.24-7.12 (m, 5H), 7.07 (d, J=8.6 Гц, 1H), 6.75-6.71 (m, 2H), 6.31 (s, 1H), 5.02-4.94 (m, 1H), 4.79-4.68 (m, 2H), 4.18 (d, J=6.5 Гц, 2Щ4.08 (dq, J=26.1, 10.5, 7.8 Гц, 4H), 3.19 (d,J=15.8 Гц, 1H), 3.08-2.88 (m, 7H), 2.83-2.79 (m, 2H), 2.76 (s, 5H), 2.14-1.98 (m, 2H), 1.79-1.70 (m, 4H), 1.21 (d, J=6.7 Гц 3Н).
Пример 45: Синтез соединения 139
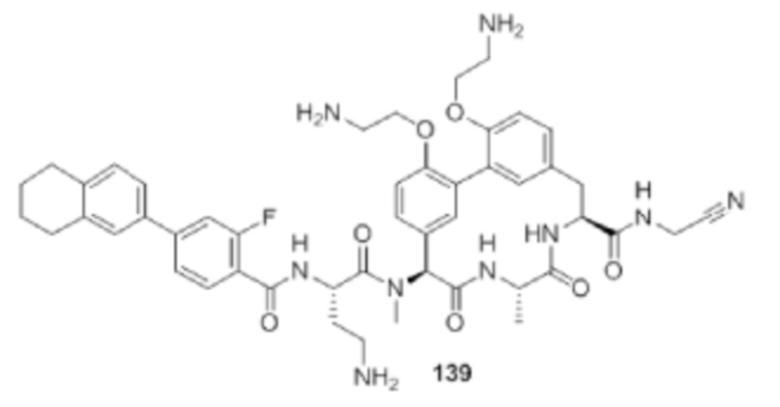
Соединение 139 (соль муравьиной кислоты) получали с применением способов примера 41 (соединение 135). LC-MS: m/z=890 [М+Н]+.
Пример 46: Синтез соединения 140

Соединение 140 (соль муравьиной кислоты) получали с применением способов примера 41 (соединение 135). LC-MS: m/z=906 [М+Н]+; 1Н ЯМР (400 МГц, DMSO-d6) δ 9.00 (t, J=8.7 Гц, 1Н), 8.74 (t, J=5.6 Гц 1H), 8.39 (d, J=9.0 Гц, 1H), 7.77 (d, J=1.7 Гц, 1H), 7.70 (dd, J=8.0, 1.8 Гц 2H), 7.50 (d, J=8.0 Гц 2H), 7.44 (d, J=6.6 Гц, 2H), 7.24-7.11 (m, 2H), 7.06 (d, J=8.6 Гц, 2H), 6.77-6.71 (m, 2H), 6.32 (s, 1H), 4.99 (d, J=1.5 Гц, 1H), 4.80-4.68 (m, 2H), 4.18 (d, J=5.8 Гц 2H), 4.05 (dt, J=11.2, 5.5 Гц, 4H), 3.19 (d, J=15.8 Гц 1H), 3.05-3.00 (m, 1H), 2.92 (t, J=7.7 Гц, 4H), 2.83 (s, 3H), 2.81 (s, 2H), 2.76 (s, 4H), 2.09-1.93 (m, 2H), 1.77 (p, J=3.4 Гц, 4H), 1.20 (d, J=6.8 Гц, 3Н).
Пример 47: Синтез соединения 141

Синтез биарильного хвоста путем катализируемой Pd реакции сочетания Сузуки арилбороновой кислоты и арилгалогенида с последующим основным гидролизом сложного эфира был описано и назван как общий способ 7.
Стадия 1: К раствору 4-трет-бутилбензолбороновой кислоты (151,6 мг, 0,85 ммоль) в 1,4-диоксане (5 мл) и воде (1 мл) добавляли карбонат калия (181,0 мг, 1,31 ммоль), 1,1'-бис(дифенилфосфино)ферроцен палладия дихлорид (47,9 мг, 0,07 ммоль) и метил-4-бром-2-метилбензоат (150,0 мг, 0,65 ммоль). Реакционную смесь перемешивали при 100°С в течение 2 ч в атмосфере N2 и концентрировали. Остаток переносили в EtOAc (20 мл) и промывали водой (20 мл × 2) и солевым раствором (20 мл). Органический слой сушили над MgSO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (5% EtOAc в петролейном эфире, Rf=0,7) с получением метил-4-(4-трет-бутилфенил)-2-метилбензоата (120 мг, 64,9% выход) в виде бесцветного масла. LCMS (5-95АВ_1,5 мин): tR=0,972 мин, [М+Н]+=281,9.
Стадия 2: Метил-4-(4-трет-бутилфенил)-2-метилбензоат (120,0 мг, 0,430 ммоль) гидролизировали с применением общего способа NaOH с получением 4-(4-трет-бутилфенил)-2-метилбензойной кислоты (100 мг, 0,3726 ммоль, 87,7% выход) в виде белого твердого вещества.
Соединение 141 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,633 мин, [М+Н]+=902,4.
Пример 48: Синтез соединения 142
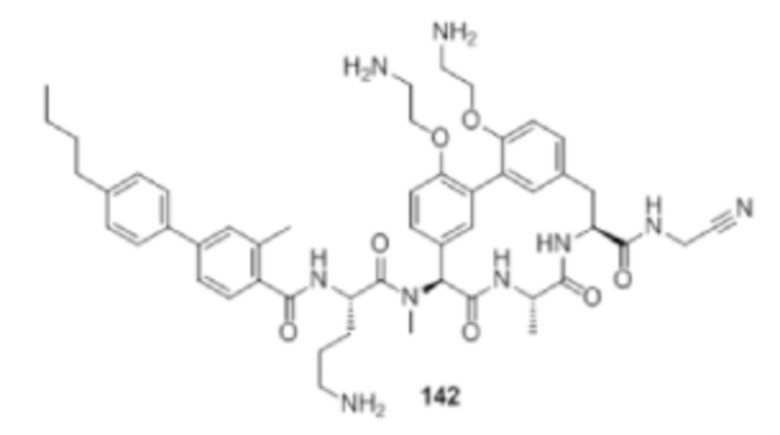
Соединение 142 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141) из 4-(4-бутилфенил)-2-метилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,643 мин, [М+Н]+=902,4.
Пример 49: Синтез соединения 143
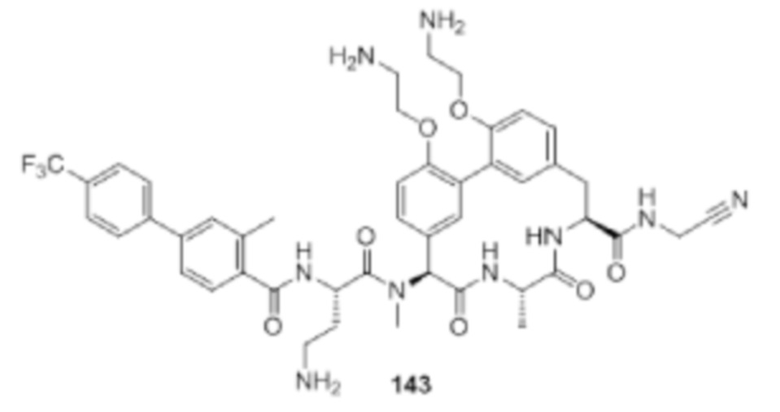
Соединение 143 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141) из 4-(4-трифторметилфенил)-2-метилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,588 мин, [М+Н]+=900,3.
Пример 50: Синтез соединения 144

Соединение 144 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141) из 3-метил-[1,1':4',1''-терфенил]-4-карбоновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,615 мин, [М+Н]+=908,4.
Пример 189: Синтез соединения 145
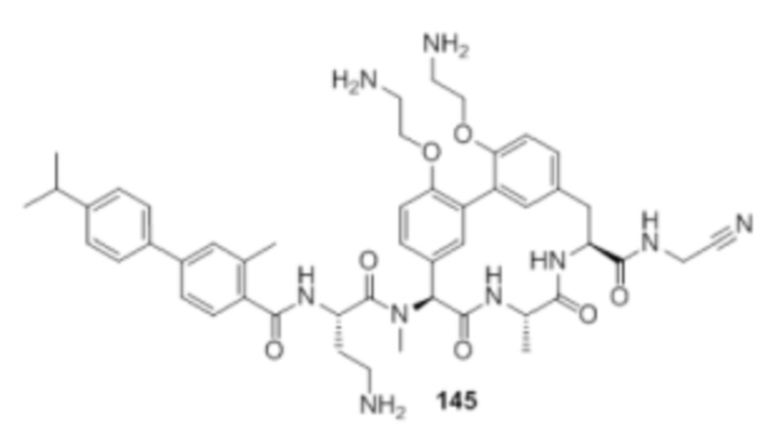
Соединение 145 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,632 мин, [М+Н]+=874,6.
Пример 52: Синтез соединения 146

Соединение 146 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141) из 4-(4-изобутилфенил)-2-метилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,653 мин, [М+Н]+=888,5. 1Н ЯМР (400 МГц, CD3OD): δ 7.56-7.50 (m, 4Н), 7.48-7.44 (m, 1Н), 7.35-7.31 (m, 1H), 7.26-7.17 (m, 4H), 7.10-7.08 (m, 1H), 6.92-6.90 (m, 1H), 6.79 (br s, 1H), 6.39 (s, 1H), 5.19-5.15 (m, 1H), 4.81-4.79 (m, 3H), 4.30-4.15 (m, 5H), 3.36-3.33 (m, 1H), 3.25-3.05 (m, 7H), 2.95 (s, 3H), 2.53 (d, J=7.6 Гц, 2H), 2.49 (s, 3H), 2.35-2.20 (m, 1H), 2.20-2.05 (m, 1H), 1.95-1.80 (m, 1H), 1.36 (d, J=7.2 Гц, 3Н), 0.94 (d, J=6.4 Гц, 6H).
Пример 53: Синтез соединения 147

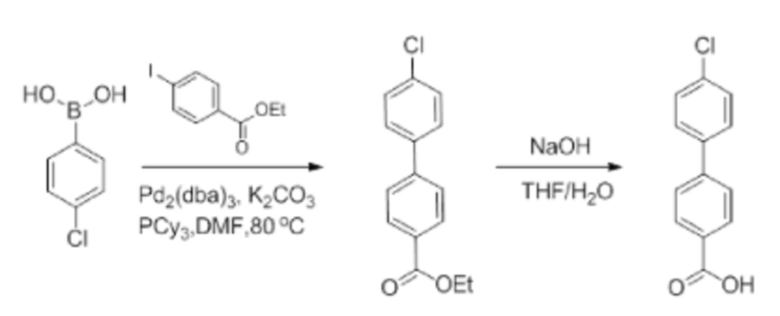
Высушенную в сушильном шкафу трехгорлую колбу (500 мл) заполняли (4-хлорфенил)бороновой кислотой (12 г, 74,7 ммоль), этил-4-йодбензоатом (14,1 г, 51,2 ммоль), Pd2(dba)3 (4,68 г, 5,12 ммоль), РСу3 (1,43 г, 5,12 ммоль) и K2CO3 (21,21 г, 153,5 ммоль). Добавляли DMF (100 мл) и реакционную смесь продували N2. Смесь перемешивали при 80°С в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры и фильтровали с удалением K2CO3 Растворитель удаляли и коричневый остаток очищали на колонке (1%-5% EtOAc в петролейном эфире) с получением этил-4'-хлор-[1,1'-бифенил]-4-карбоксилата (9,5 2 г, 71,4%).
К раствору этил-4'-хлор-[1,1'-бифенил]-4-карбоксилата (9,52 г, 36,6 ммоль) в смеси THF (150 мл) и H2O (20 мл) добавляли NaOH (4 н, 5,86 г, 146 ммоль). Затем смесь перемешивали при 70°С в течение 10 ч, органический растворитель удаляли при пониженном давлении и значение рН доводили до 3 при помощи 4 М HCl. Продукт собирали фильтрацией, промывали водой и сушили с получением 4'-хлор-[1,1'-бифенил]-4-карбоновой кислоты (8.5 г, 100%). 1Н ЯМР (400 МГц, CDCl3) δ 8.10 (d, J=8.4 Гц, 2 Н), 7.70(d,J=8 Гц, 2Н), 7.65 (d, J=8.8 Гц, 2 Н), 7.47 (d, J=8.8 Гц, 2 Н).
Соединение 147 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141) из 4'-хлор-[1,1'-бифенил]-4-карбоновой кислоты. LCMS (способ 5-95 АВ, ESI): te=0,710, [М+Н]+=852,4; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.48 (bre, 2Н, НСООН), 7.97 (d, J=8.4 Гц, 2Н), 7.77 (d, J=8.4 Гц, 2Н), 7.68 (d, ^8.4 Гц, 2Н), 7.50 (d, J 8.4 Гц, 2Н), 7.32 (d, J=8.0 Гц, 1H), 7.24 (d, J=8.0 Гц, 1Н), 7.16 (d,J=8.0 Гц, 1H), 7.09 (d,J=8.0 Гц, 1H), 6.89 (Гц, 1H), 6.82 (brs, 1H), 6.34 (s, 1H), 5.22-5.14 (m, 1Н), 4.834.79 (m, 2Н), 4.324.14 (m, 4Н), 4.20 (s, 2Н), 3.37-3.33 (m, 2Н), 3.27-2.95 (m, 7Н), 2.89 (s, 3Н), 2.37-2.30 (m, 1Н), 2.22-2.14 (m, 1Н), 1.36 (d, J=6.4 Гц, 3Н).
Пример 54: Синтез соединения 148

Соединение 148 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141) из 4'-хлор-3-метил-[1,1'-бифенил]-4-карбоновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,560, [М+Н]+=866,2.
Пример 55: Синтез соединения 149

Соединение 149 (свободное основание) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,661, [М+Н]+=832,5.
Пример 56: Синтез соединения 150

Соединение 150 (свободное основание) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141) из 3-метил-[1,1'-бифенил]-4-карбоновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,649, [М+Н]+=846,4.
Пример 57: Синтез соединения 151

Соединение 151 (свободное основание) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,735, [М+Н]+=860,5; 1Н ЯМР (400 МГц, MeOH-d4) δ 7.45-7.38 (m, 2Н), 7.36-7.16 (m, 7Н), 7.06-6.98 (m, 2Н), 6.84 (brs, 1H), 6.71 (brs, 1H), 6.50 (s, 1H), 5.20-5.13 (m, 1H), 4.78-4.71 (m, 1H), 4.544.46 (m, 1H), 4.23-3.97 (m, 4H), 4.21 (s, 2H), 3.10-2.80 (m, 5H), 3.00 (s, 3H), 2.67 (q, J=6.8 Гц, 2H), 2.33 (s, 3H), 2.16-2.06 (m, 1H), 2.06-1.96 (m, 1H), 1.36 (d, J=6.8 Гц, 3Н), 1.26 (t, J=6.8 Гц, 3Н).
Пример 58: Синтез соединения 152

Соединение 152 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141) из 4'-этил-3-метил-[1,1'-бифенил]-4-карбоновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,698, [М+Н]+=874,2; 1H ЯМР (400 МГц, MeOH-d4) 5 8.50 (brs, 1Н, НСООН), 7.50-7.44 (m, 5Н), 7.35-7.33 (m, 1Н), 7.29 (d, J=8 Гц, 2H), 7.22 (d, J=8 Гц, 2Н), 7.12 (d, J=8 Гц, 1H), 6.92 (brs, 1H), 6.74-6.58 (m, 2Н), 5.11-5.08 (m, 1Н), 4.85-4.81 (m, 2Н), 4.314.21 (m, 6Н), 3.28-3.24 (m, 5Н), 3.15-3.01 (m, 3Н), 3.04 (s, 3Н), 2.71 (q, J=7.2 Гц, 2Н), 2.46 (s, 3Н), 2.08-1.70 (m, 4Н), 1.39 (d, J=7.2 Гц, 3Н), 1.29 (t,J=7.2 Гц, 3Н).
Пример 59: Синтез соединения 193
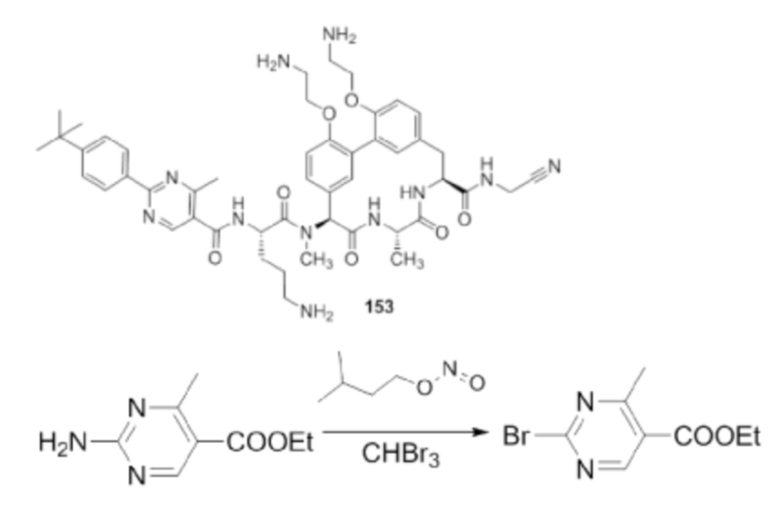
К раствору этал-2-амино-4-метилпиримидин-5-карбоксилата (4,0 г, 22 ммоль) в CHBr3 (66 мл) добавляли изопентилнитрит (44 мл) и смесь перемешивали при 85°С в течение 4 ч. Летучие вещества удаляли и остаток переносили в EtOAc (100 мл), затем промывали солевым раствором (100 мл × 2). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением этил-2-бром-4-метилпиримидин-5-карбоксилата (3,0 г, 55,5% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCb): 5 8.93 (s, 1H), 4.41 (q, J=7.2 Гц, 2Н), 2.82 (s, 3Н), 1.41 (t, J=7.0 Гц, 3Н).
Соединение 153 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141) из этил-2-бром-4-метилпиримидин-5-карбоксилата. LCMS (способ 5-95 АВ, ESI): tR=0,736 мин, [М+Н]+=904,7.
Пример 60: Синтез соединения 154
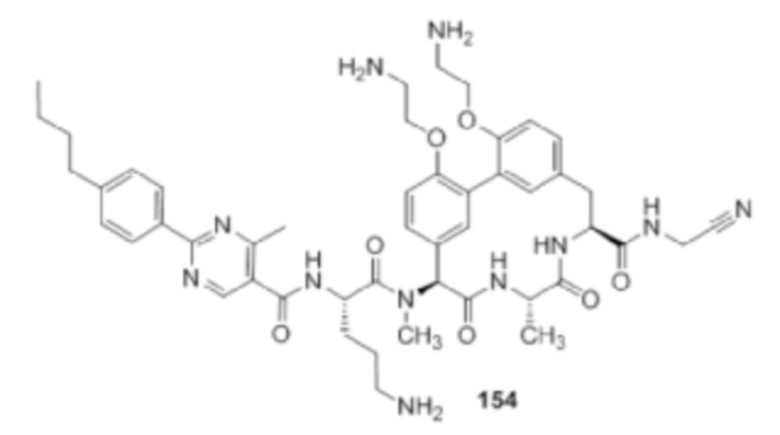
Соединение 154 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,661 мин, [М+Н]+=905,6.
Пример 61: Синтез соединения 155

Соединение 155 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,681 мин, [М+Н]+=862,4.
Пример 62: Синтез соединения 156
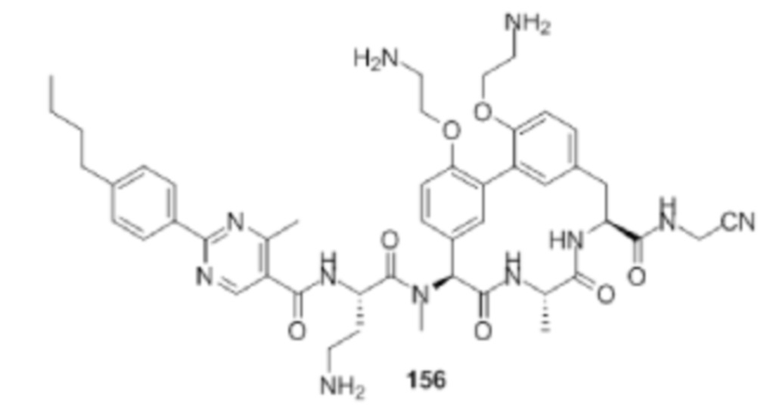
Соединение 156 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,617 мин, [М+Н]+=890,4. 1Н ЯМР (400 МГц, CD3OD): δ 8.77 (s, 1Н), 8.53 (s, 1H), 8.32 (d, J=8.4 Гц, 2H), 7.32 (d, J=8.0 Гц, 2H), 7.19 (d, J=8.4 Гц, 2H), 7.07 (d, J=8.4 Гц, 1H), 6.89 (s, 1H), 6.74 (s, 1H), 6.45 (s, 1H), 5.25-5.15 (m, 1H), 4.85-4.75 (m, 2H), 4.30-4.10 (m, 6H), 3.35 (s, 2H), 3.30-3.20 (m, 1H), 3.20-3.05 (m, 5H), 2.96 (s, 3H), 2.80-2.60 (m, 5H), 2.35-2.20 (m, 1H), 2.20-2.0 (m, 1H), 1.75-1.60 (m, 2H), 1.50-1.25 (m, 5H), 0.98 (t, J=7.2 Гц, 3Н).
Пример 63: Синтез соединения 157

Соединение 157 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,607 мин, [M+H]+=890,5. 1H ЯМР (400 МГц, CD3OD): δ 8.70 (s, 1H), 8.10 (d, J=7.6 Гц, 2Н), 7.30-7.05 (m, 4Н), 7.00-6.80 (m, 3Н), 6.74 (s, 1Н), 6.28 (s, 1H), 5.25-5.10 (m, 1Н), 4.80-4.65 (m, 2H), 4.50-4.35 (m, 1Н), 4.30-4.05 (m, 4H), 4.05-3.90 (m, 1Н), 3.10-2.75 (m, 11Н), 2.60-2.40 (m, 5H), 2.15-2.05 (m, 1H), 2.05-1.85 (m, 2H), 1.34 (d, J=6.8 Гц, 3Н), 0.97 (d, J=6.0 Гц, 6H).
Пример 64: Синтез соединения 158

Соединение 158 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,722 мин, [М+Н]+=910,4.
Пример 65: Синтез соединения 159
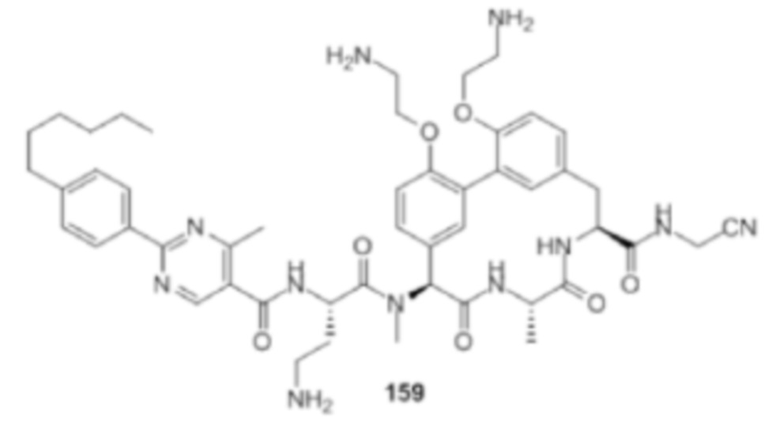
Соединение 159 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,770 мин, [M+Na]+=940,0.
Пример 66: Синтез соединения 160

Соединение 160 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,710 мин, [M+H]+=876,8.
Пример 67: Синтез соединения 161

Соединение 161 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,587 мин, [М+Н]+=876,6.
Пример 68: Синтез соединения 162

Соединение 162 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,757 мин, [М+H]+=904,6. 1Н ЯМР (400 МГц, CD3OD): δ 8.78 (s, 1H), 8.50 (br s, 2Н), 8.35 (d, J=8.4 Гц, 2Н), 7.35-7.25 (m, 3Н), 7.23-7.18 (m, 2Н), 7.08 (d, J=8.4 Гц, 1Н), 6.90 (s, 1H), 6.79 (s, 1H), 6.40 (s, 1H), 5.19-5.16 (m, 1H), 4.804.70 (m, 2H), 4.21 -4.18 (m, 6H), 3.15-3.13 (m, 7H), 2.95 (s, 3H), 2.72-2.68 (m, 6H), 2.32-2.14 (m, 2H), 1.70-1.66 (m, 2H), 1.38-1.35 (m, 7H), 0.92 (t,J=6.8 Гц, 3Н).
Пример 69: Синтез соединения 163
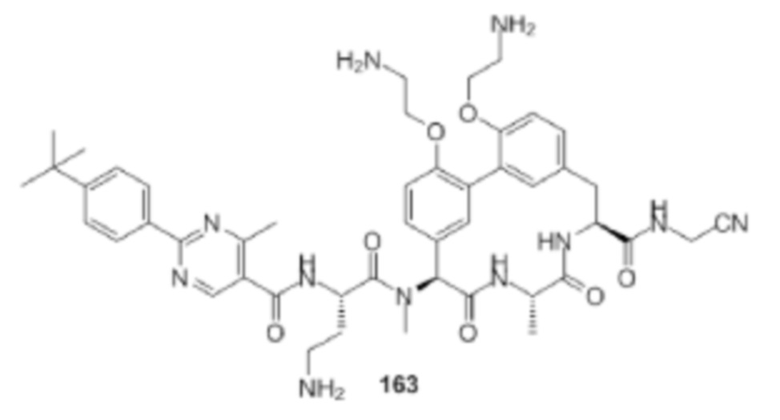
Соединение 163 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,711 мин, [M+H]+=890,5. 1H ЯМР (400 МГц, CD3OD): δ 8.78 (s, 1H), 8.48 (br s, 2Н), 8.36 (d, J=8.4 Гц, 2Н), 7.55 (d, J=8.4 Гц, 2Н), 7.32 (d, J=8.8 Гц, 1H), 7.25-7.15 (m, 2Н), 7.08 (d,.7=8.8 Гц, 1H), 6.90 (s, 1H), 6.79 (s, 1Н), 6.39 (s, 1H), 5.19-5.16 (m, 1Н), 4.80-4.70 (m, 2Н), 4.25-4.10 (m, 6Н), 3.20-3.10 (m, 8Н), 2.95 (s, 3Н), 2.75-2.65 (m, 4Н), 2.32 -2.14 (m, 1Н), 1.40-1.30 (m, 12Н).
Пример 70: Синтез соединения 164

Соединение 164 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,727 мин, [М+Н]+=906,5. 1Н ЯМР (400 МГц, CD3OD): δ.74 (s, 1H), 8.50 (br s, 2Н), 8.36 (d, J=8.8 Гц, 2Н), 7.32 (d, J=8.4 Гц, 1H), 7.20 (d, J=8.4 Гц, 2Н), 7.09 (d, J=8.4 Гц, 1Н), 7.02 (d,J=8.8 Гц, 2Н), 6.89 (s, 1Н), 6.75 (s, 1H), 6.44 (s, 1H), 5.25-5.15 (m, 1Н), 4.85-4.75 (m, 2Н), 4.30-4.15 (m, 6Н), 4.08 (d, J=6.4 Гц, 2Н), 3.25-3.10 (m, 8Н), 2.96 (s, 3Н), 2.67 (s, 3Н), 2.35-2.25 (m, 1Н), 2.25-2.10 (m, 1Н), 1.85-1.75 (m, 2Н), 1.60-1.50 (m, 2Н), 1.36 (d, J=6.8 Гц, 3Н), 1.02 (t, J=7.4 Гц, 3Н).
Пример 71: Синтез соединения 165

Смесь этилдиацетоацетата (4,0 г, 23,23 ммоль) и CS2CO3 (15,2 г, 46,46 ммоль) в ацетонитриле (50 мл) перемешивали при 25°С в течение 30 мин и охлаждали до 0°С. По каплям добавляли MeOTf (3,81 г, 23,23 ммоль) и смесь перемешивали при 25°С в течение 1,5 ч. Смесь разбавляли этиловым эфиром и фильтровали, а фильтрат концентрировали.
Остаток переносили в этиловый эфир (100 мл), промывали 2 н NaOH (10 мл × 2), сушили над Na2SO4 и концентрировали с получением неочищенного этил(Е)-2-ацетил-3-метокси-бут-2-еноата (2,7 г, 62,4% выход) в виде желтого масла, которое использовали сразу на следующей стадии.
Смесь этил(Е)-2-ацетил-3-метокси-бут-2-еноата (2,7 г, 14,5 ммоль), гуанидина гидрохлорида (3463,0 мг, 36,25 ммоль) и NaOMe (1566,6 мг, 29 ммоль) в этаноле (20 мл) перемешивали при 80°С в течение 12 ч и охлаждали до 0°С и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток переносили в EtOAc (100 мл), промывали солевым раствором (50 мл × 3); сушили над Na2SO4 и концентрировали. Остаток очищали на колонке с силикагелем (10% EtOAc в петролейном эфире, Rf=0,45) с получением этил-2-амино-4,б-диметилпиримидин-5-карбоксилата (820 мг, 29% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц DMSO-d6): δ 6.96 (s, 2Н), 4.26 (q, J=7.2 Гц, 2Н), 2.30 (s, 6Н), 1.29(1, J=7.4 Гц, 3Н).
Соединение 165 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 59 (соединение 153). LCMS (способ 5-95 АВ, ESI): tR=0,707 мин, [М+Н]+=890,4. 1Н ЯМР (400 МГц, CD3OD): 8.50 (br s, 2Н), 8.30-8.20 (m, 2Н), 7.30-7.28 (m, 3Н), 7.19 (d, J=8.4 Гц, 2H), 7.08 (d, J=8.4 Гц, 1H), 6.89 (s, 1H), 6.74 (s, 1H), 6.46 (s, 1H), 5.25-5.20 (m, 1H), 4.80-4.70 (m, 2H), 4.30-4.10 (m, 6H), 3.25 -3.10 (m, 8H), 3.00 (s, 3H), 2.67 (t, J=7.4 Гц, 2H), 2.53 (s, 6H), 2.35-2.20 (m, 1H), 2.20-2.05 (m, 1H), 1.73-1.67 (m, 2H), 1.35 (d, J=6.8 Гц, 3Н), 0.98 (t, 7=7.2 Гц, 3Н).
Пример 72: Синтез соединения 166

Соединение 166 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,613 мин, [М+Н]+=895,5.
Пример 73: Синтез соединения 167
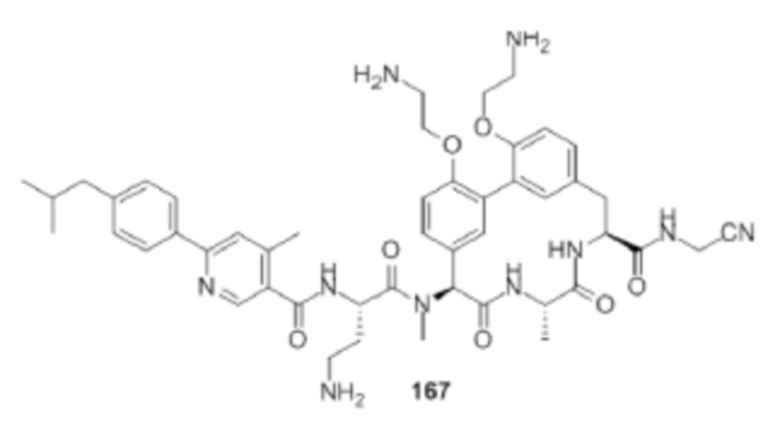
Соединение 167 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,604 мин, [М+Н]+=889,9.
Пример 74: Синтез соединения 168
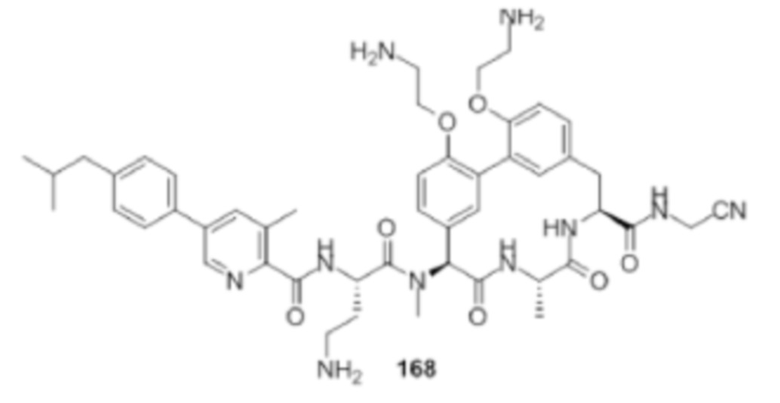
Соединение 168 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,745 мин, [М+Н]+=889,4.
Пример 75: Синтез соединения 169

Соединение 169 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,644 мин, [М+Н]+=889,5.1Н ЯМР (400 МГц, CD3OD): δ 7.88 (d, J=7.6 Гц, 2Н), 7.83 (d, J=8.0 Гц, 1Н), 7.72 (d, J=8.0 Гц, 1H), 7.35-7.25 (m, 3Н), 7.25-7.15 (m, 2Н), 7.10 (d, J=8.4 Гц, 1H), 6.90 (s, 1Н), 6.76 (s, 1H), 6.44 (s, 1Н), 5.20-5.10 (m, 1Н), 4.85-4.75 (m, 2Н), 4.30-4.15 (m, 6Н), 3.25-3.05 (m, 8Н), 2.96 (s, 3Н), 2.67 (s, 3Н), 2.56 (d, J=7.2 Гц, 2Н), 2.35-2.20 (m, 1Н), 2.20-2.10 (m, 1Н), 2.00-1.85 (m, 1Н), 1.36 (d, J=6.4 Гц, 3Н), 0.95 (d, J=6.4 Гц, 6Н).
Пример 76: Синтез соединения 170

Соединение 170 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,737 мин, [М+Н]+=906,5. 1Н ЯМР (400 МГц, CD3OD): δ 8.82 (s, 1Н), 8.50 (br s, 2H, FA), 8.43 (d, J=8.0 Гц, 2H), 7.69 (d, J=8.0 Гц, 2H), 7.34-7.32 (m, 1H), 7.24 (d, J=8.4 Гц, 1H), 7.19 (d, J=8.8 Гц, 1H), 7.09 (d, J=8.4 Гц, 1H), 6.92 (br s, 1H), 6.82 (br s, 1H), 6.39 (s, 1H), 5.18-5.17 (m, 1H), 4.82-4.79 (m, 2H), 4.25-4.15 (m, 6H), 3.50-3.30 (m, 3H), 3.15 -3.12 (m, 5H), 2.96 (s, 3H), 2.72 (s, 3H), 2.40-2.10 (m, 2H), 1.36 (d, J=6.8 Гц, 3Н), 0.32 (s, 9H).
Пример 77: Синтез соединения 171

Соединение 171 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,697 мин, [М+Н]+=902,7.
Пример 78: Синтез соединения 172

Соединение 172 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,769 мин, [М+Н]+=924,5.
Пример 79: Синтез соединения 173

Стадия 1: Смесь ацетата калия (649,2 мг, 6,55 ммоль), 1,1'-бис(дифенилфосфино)ферроцен палладия дихлорида (159,7 мг, 0,22 ммоль), бис(пинаколято)диборона (1108,5 мг, 4,37 ммоль) и метил-4-бром-2-метилбензоата (500,0 мг, 2,18 ммоль) в 1,4-диоксане (20 мл) перемешивали при 110°С в течение 4 ч в атмосфере защиты N2 и выпаривали досуха. Остаток переносили в EtOAc (30 мл), промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (10% этилацетата в петролейном эфире, Rf=0,6) с получением метил-2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (400 мг, 66,4% выход) в виде желтого масла.
Стадия 2: К раствору 5-бром-2-хлорпиридина (200,0 мг, 1,04 ммоль) в толуоле (10 мл) и воде (2 мл) добавляли карбонат цезия (1693,1 мг, 5,2 ммоль), изобутилбороновую кислоту (158,9 мг, 1,56 ммоль) и тетракис(трифенилфосфин)палладий(0) (120,1 мг, 0,10 ммоль). Реакционную смесь перемешивали при 110°С в течение 16 ч и фильтровали. Фильтрат разбавляли Н2О (20 мл) и экстрагировали EtOAc (40 мл × 2). Объединенные органические слои промывали водой (80 мл × 3) и солевым раствором (80 мл), сушили над Na2SO4 и концентрировали. Остаток очищали методом преп-ТЪС (7,5% EtOAc в петролейном эфире) с получением 2-хлор-5-изобутилпиридина (110 мг, 62,4% выход) в виде желтого масла. LCMS (способ 5-95 АВ, ESI): tR=0,872 мин, [М+Н]+=169,8.
Стадия 3: Смесь 2-хлор-5-изобутилпиридина (50,0 мг, 0,29 ммоль), 1,1'-бис(дифенилфосфино)ферроцен палладия дихлорида (21,6 мг, 0,03 ммоль), метил-2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (122,1 мг, 0,44 ммоль) и карбоната цезия (288,1 мг, 0,88 ммоль) в толуоле (5 мл) и воде (1 мл) перемешивали при 110°С в течение 16 ч в атмосфере азота. Смесь разбавляли H2O (10 мл) и экстрагировали EtOAc (10 мл × 2). Объединенные органические слои промывали водой (20 мл × 4) и солевым раствором (20 мл), сушили над Na2SO4 и концентрировали. Остаток очищали методом преп-TLC (7,5% EtOAc в петролейном эфире) с получением метил-4-(5-изобугилпиридин-2-ил)-2-метилбензоата (74 мг, 88,6% выход) в виде желтого масла. LCMS (способ 5-95 АВ, EST): tR=0,816 мин, [М+Н]+=283,9.
Соединение 173 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,639 мин, [М+Н]+=889,5.
Пример 80: Синтез соединения 174

Соединение 174 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 79 (соединение 173) из 5-бром-2-хлорпиримидина. LCMS (способ 5-95 АВ, ESI): tR=0,553 мин, [М+Н]+=890,9.
Пример 81: Синтез соединения 175
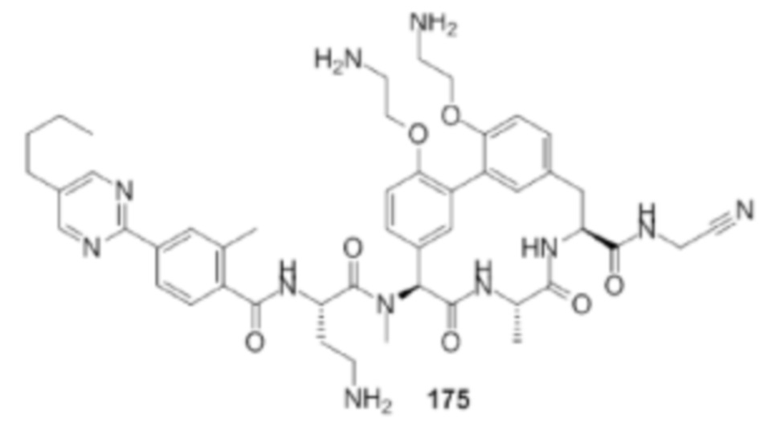
Соединение 175 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 79 (соединение 173) из 5-бром-2-хлорпиримидина. LCMS (способ 5-95 АВ, ESI): tR=0,699 мин, [М+Н]+=890,5.
Пример 82: Синтез соединения 176
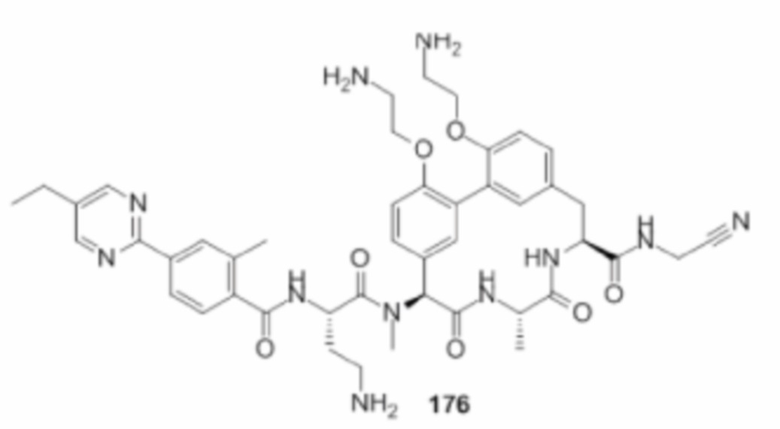
Соединение 176 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 79 (соединение 173). LCMS (способ 5-95 АВ, ESI): tR=0,626 мин, [М+Н]+=862,5.
Пример 83: Синтез соединения 177

Соединение 177 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 79 (соединение 173) из (4-(метоксикарбонил)фенил)бороновой кислоты, 1-бром-4-йодбензола и изопентилбороновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,782 мин, [М+Н]+=888,5.
Пример 84: Синтез соединения 178

К раствору 2,5-дибромпиразина (200,0 мг, 0,84 ммоль) в толуоле (5 мл) и воде (1 мл) добавляли карбонат калия (348,6 мг, 2,52 ммоль), метил-2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоат (232,2 мг, 0,84 ммоль) и тетракис(трифенилфосфин)палладий(0) (97,2 мг, 0,08 ммоль). Реакционную смесь перемешивали при 80°С в течение 16 ч и фильтровали. Фильтрат разбавляли H2O (20 мл) и экстрагировали EtOAc (40 мл × 2). Объединенные органические слои промывали водой (80 мл × 3) и солевым раствором (80 мл), сушили над Na2SO4 и концентрировали. Остаток очищали методом преп-TLC (7,5% EtOAc в петролейном эфире) с получением метил-4-(5-бромпиразин-2-ил)-2-метилбензоата (150 мг, 58,1% выход) в виде белого твердого вещества.1Н ЯМР (400 МГц, CDCl3): δ 8.81 (s, 1Н), 8.75 (d, J=1.2 Гц, 1H), 8.04 (d, J=8.4 Гц, 1H), 7.88 (s, 1H), 7.85 (d, J=8.4 Гц, 1H), 3.93 (s, 3H), 2.70 (s, 3H).
К раствору изобутилбороновой кислоты (99,6 мг, 0,98 ммоль) в толуоле (3 мл) и воде (0,3 мл) добавляли тетракис(трифенилфосфин)палладий(0) (56,4 мг, 0,05 ммоль), карбонат калия (202,5 мг, 1,47 ммоль) и метил-4-(5-бромпиразин-2-ил)-2-метилбензоат (150,0 мг, 0,49 ммоль). Реакционную смесь перемешивали при 100°С в течение 16 ч и фильтровали. Фильтрат разбавляли H2O (20 мл) и экстрагировали EtOAc (40 мл × 2). Объединенные органические слои промывали водой (80 мл × 3) и солевым раствором (80 мл), сушили над Na2SO4 и концентрировали. Остаток очищали методом преп -TLC (9,5% EtOAc в петролейном эфире, Rf=0,4) с получением метил-4-(5-изобутилпиразин-2-ил)-2-метилбензоата (52 мг, 37,4% выход) в виде желтого масла. LCMS (способ 5-95 АВ, EST): tR=0,956 мин, [М+Н]+=284,9.
Соединение 178 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141). LCMS (способ 5-95 АВ, ESI): tR=0,679 мин, [М+Н]+=890,5.
Пример 85: Синтез соединения 179
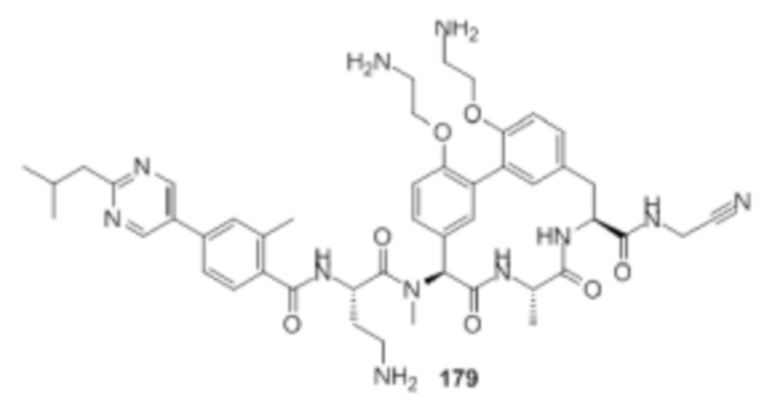
Соединение 179 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 84 (соединение 178) из 5-бром-2-хлорпиримидина. LCMS (способ 5-95 АВ, ESI): tR=0,657 мин, [М+Н]+=890,2.
Пример 86: Синтез соединения 180

Соединение 180 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 84 (соединение 178) из 3,6-дибромпиридазина. LCMS (способ 5-95 АВ, ESI): tR=0,633 мин, [М+Н]+=890,4.
Пример 87: Синтез соединения 181

Соединение 181 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 84 (соединение 178). LCMS (способ 5-95 АВ, ESI): tR=0,503 мин, [М+Н]+=889,4.
Пример 88: Синтез соединения 182
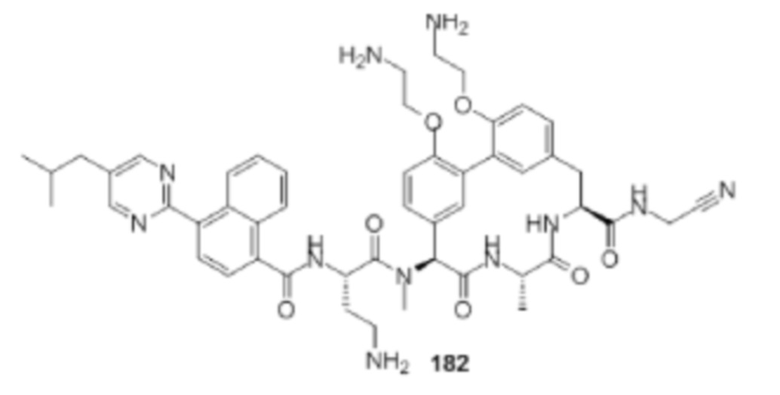
Соединение 182 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 79 (соединение 173) из 2-хлор-5-изобутилпиримидина и метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1-нафтоата. LCMS (способ 5-95 АВ, ESI): tR=0,596 мин, [М+Н]+=926,3.
Пример 89: Синтез соединения 183

Соединение 183 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 47 (соединение 141) из 4,4,5,5-тетраметил-2-(4-(трет-пентил)фенил)-1,3,2-диоксаборолана. LCMS (способ 5-95 АВ, ESI): tR=0,743 мин, [М+Н]+=905,2. 1Н ЯМР (400 МГц, CD3OD): δ 8.79 (s, 1Н), 8.52 (br s, 3Н), 8.38 (d, J=8.4 Гц, 2H), 7.50 (d, J=8.8 Гц, 2H), 7.33-7.30 (m, 1H), 7.22 (d, J=8.8 Гц, 1H), 7.18 (d, J=8.8 Гц, 1H), 7.08 (d, J=8.4 Гц, 1H), 6.90 (br s, 1H), 6.80 (br s, 1H), 6.39 (s, 1H), 5.19-5.17 (m, 1H), 4.82-4.75 (m, 1H), 4.204.13 (m, 7H), 3.15-3.05 (m, 8H), 2.95 (s, 3H), 2.70 (s, 3H), 2.30-2.10 (m, 2H), 1.74 (q, J=7.3 Гц, 2H), 1.36 (s, 6H), 1.30-1.20 (m, 3H), 0.71 (t, J=7.6 Гц, 3Н).
Пример 90: Синтез соединения 184
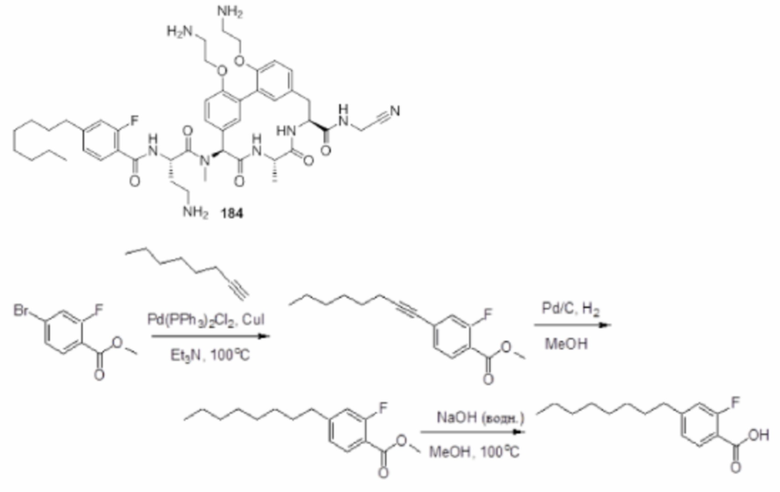
Сочетание Соногаширы ацетилена с ароматическим галогенидом с последующим восстановлением алкина и гидролизом сложного эфира было описано и названо как общий способ 8. Смесь метил4-бром-2-фторбензоата (500,0 мг, 2,15 ммоль), окт-1-ина (702,9 мг, 6,44 ммоль), бис(трифенилфосфин)палладдй(II) дихлорида (75,3 мг, 0,11 ммоль) и йодида меди (I) (20,4 мг, 0,11 ммоль) в триэтиламине (9,83 мл, 70,9 ммоль) перемешивали при 100°С в течение 2 ч в атмосфере азота. LCMS (5-95АВ/1,5 мин): tR=1,006 мин, [М+Н]+ 262,9, что показывало 60% DP. Реакцию гасили водой (15 мл) и экстрагировали дихлорметаном (3 × 25 мл). Объединенные органические экстракты промывали солевым раствором (2 × 25 мл), сушили над безводным Na2SO4 и фильтровали. Фильтрат концентрировали и остаток очищали методом колоночной хроматографии на силикагеле (элюировали 5% этилацетатом в петролейном эфире, Rf=0,5) с получением метил-2-фтор-4-(окт-1-ин-1-ил)бензоата (550 мг, 97,7% выход) в виде коричневого твердого вещества. LCMS (5-95АВ_1,5 мин): tR=1,006 мин, [М+Н]+ 262,9.
К раствору метил-2-фтор-4-(окт-1-ин-1-ил)бензоата (550,0 мг, 2,1 ммоль) в метаноле (25 мл) добавляли 10% палладий на угле (111,56 мг, 0,10 ммоль). Смесь перемешивали при 30°С в атмосфере водорода (40 фунт/кв. дюйм) в течение 16 ч. Реакционную смесь фильтровали через слой целита и концентрировали. Остаток очищали методом колоночной хроматографии на силикагеле (элюировали петролейньгм эфиром/этилацетатом от 100:1 до 10:1) с получением метил-2-фтор-4-октилбензоата (500 мг, 89,5% выход) в виде желтого твердого вещества. LCMS (5-95АВ_1,5 мин): tR=1,033 мин, [М+Н]+ 266.
К раствору метил-2-фтор-4-октилбензоата (500,0 мг, 1,88 ммоль) в метаноле (5 мл) добавляли NaOH (1000,0 мг, 25 ммоль) в воде (5 мл). Смесь перемешивали при 100°С в течение 2 ч, охлаждали до к. т.и добавляли хлористоводородную кислоту (1,0 М) до значения рН 3-4. Смесь экстрагировали этилацетатом (3 × 30 мл). Объединенные органические экстракты промывали солевым раствором (2 × 30 мл), сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали с получением 2-фгор-4-октилбензойной кислоты (450 мг, 95% выход) в виде желтого твердого вещества.1Н ЯМР (400 МГц, CDCl3): δ 7.94 (t, J=8.0 Гц, 1Н), 7.06 (d, J=8.4 Гц, 1H), 6.99 (d, J=12.0 Гц, 1H), 2.66 (t, J=7.4 Гц, 2H), 1.65-1.62 (m,2H), 1.31-1.28 (m, 10H), 0.89 (t, J=6.8 Гц, 3Н).
Соединение 184 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из 2-фтор-4-октилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,775 мин, [М+Н]+ =872,4.
Пример 91: Синтез соединения 185

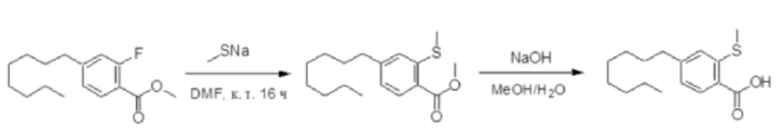
К раствору тиометилата натрия (45,3 мг, 0,65 ммоль) в N,N-дтгметилформамиде (3 мл) добавляли метил-2-фтор-4-октилбензоат (86,0 мг, 0,32 ммоль) и смесь перемешивали при 20°С в течение 16 ч. Смесь разбавляли водой (5 мл) и экстрагировали EtOAc (10 мл × 3). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали методом преп-TLC (10% EtOAc в петролейном эфире, Rf=0,7) с получением метил-2-(метилтио)-4-октилбензоата (30 мг, 31,6% выход) в виде желтого масла. 1Н ЯМР (400 МГц, CDCl3): δ 7.90 (d, J=8.0 Гц, 1Н), 7.03 (s, 1H), 6.95 (d, J=8.0 Гц, 1H), 3.88 (s, 3H), 2.62 (t, J=7.6 Гц, 2H), 2.45 (s, 3H), 1.69-1.56 (m, 2H), 1.27 (m, 10H), 0.86 (t, J=6.6 Гц, 3Н).
Метил-2-(метилтио)-4-октилбензоат (30,0 мг, 0,10 ммоль) гидролизировали LiOH согласно общему способу 5 (пример 5) с получением неочищенной 2-(метилтио)-4-октилбензойной кислоты (22 мг, 77% выход) в виде желтого твердого вещества.
Соединение 185 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из 2-(метилтио)-4-октилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,676 мин, [М+Н]+ =900,4.
Пример 92: Синтез соединения 186

К раствору 2-фтор-4-октилбензойной кислоты (120,0 мг, 0,48 ммоль) в тетрагидрофуране (3 мл) по каплям добавляли этилмагния бромид (0,55 мл, 1,66 ммоль) в Et2O (3 М) при 0°С. Смесь перемешивали при 15°С в течение 16 ч. Реакцию гасили водой (2 мл) и экстрагировали EtOAc (20 мл × 3). Объединенные органические слои промывали насыщенным солевым раствором (15 мл × 3), сушили над Na2SO4 и концентрировали. Остаток очищали методом преп-TLC (20% этилацетат в петролейном эфире, Rf=0,5) с получением 2-этил-4-октилбензойной кислоты (70 мг, 56,1% выход) в виде белого твердого вещества.
Соединение 186 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из 2-этил-4-октилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,787 мин, [М+Н]+=882,5.
Пример 93: Синтез соединения 187

3-Метил-5-октилпиколиновую кислоту получали с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,730 мин, [М+Н]+ =250,0.
Соединение 187 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184) из 3-метил-5-октилпиколиновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,658 мин, [М+Н]+ =869,6.
Пример 94: Синтез соединения 188

Соединение 188 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,614 мин, [М+Н]+=872,7.
Пример 95: Синтез соединения 189
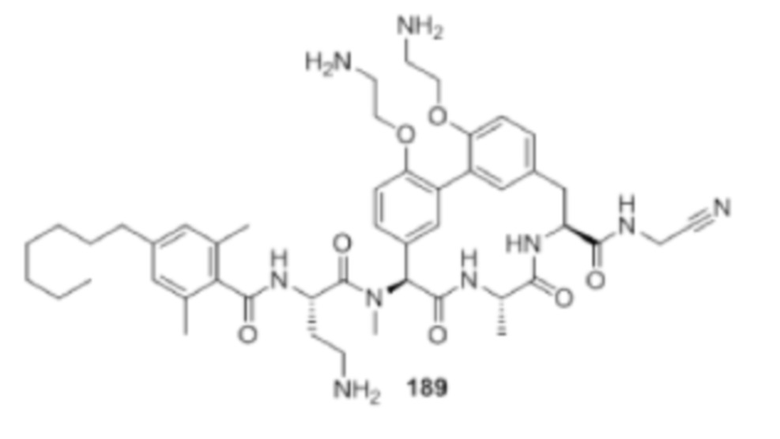
4-Гептил-2,6-диметилбензойную кислоту, бесцветное масло, получали с применением способов примера 90 (соединение 184).1Н ЯМР (400 МГц, CDCl3) δ 6.76 (s, 2Н), 2.44 (t, J=7.6 Гц, 2Н), 2.27 (s, 6Н), 1.55-1.45 (m, 2Н), 1.30-1.15 (m, 8Н), 0.816 (t, J=5.8 Гц, 3Н).
Соединение 189 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184) из 4-гегггил-2,6-диметилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,776 мин, [М+Н]+ =869,4.
Пример 96: Синтез соединения 190
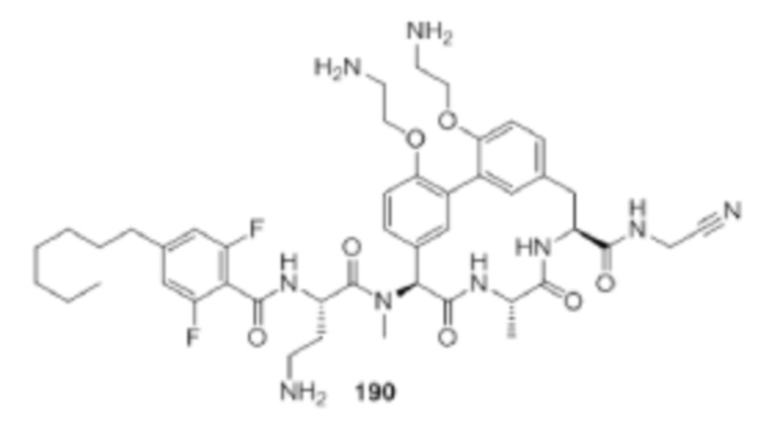
2,6-Дифтор-4-гептилбензойную кислоту, желтое твердое вещество, получали с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,873 мин, [М+Н]+ =257,9.
Соединение 190 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184) из 2,6-дифтор-4-гептилбензойной кислоты. LCMS (способ 5-95 АВ, EST): tR=0,636 мин, [М+Н]+ =876,4.
Пример 97: Синтез соединения 191
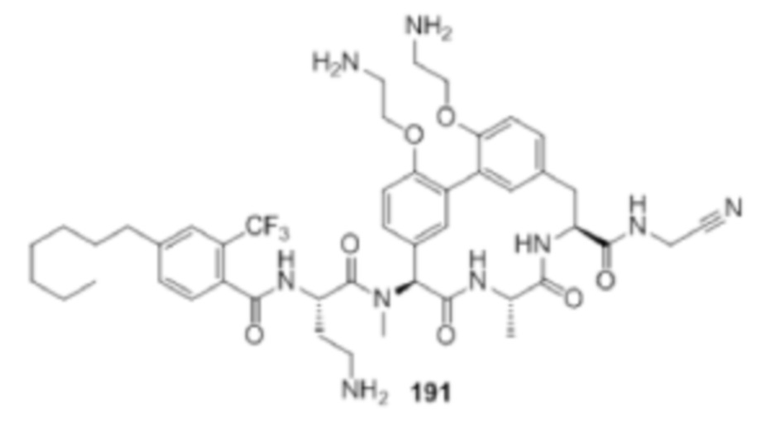
4-Гептил-2-(трифторметил)бензойную кислоту, коричневое твердое вещество, получали с применением способов примера 90 (соединение 184).1Н ЯМР (400 МГц, CD3OD): δ 7.73 (d, J=8.0 Гц, 1H), 7.61 (s, 1H), 7.53 (d, J=8.0 Гц, 1H), 3.89 (s, 3Н), 2.74 (t, J=7.8 Гц 2Н), 1.70-1.60 (m, 2Н), 1.40-1.20 (m, 8Н), 0.90 (t, J=6.8 Гц 3Н).
Соединение 191 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184) из 4-гептил-2-(трифторметил)бензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,640 мин, [М+Н]+ =908,7.
Пример 98: Синтез соединения 192

4-Октил-2-(трифторметил)бензойную кислоту, желтое твердое вещество, получали с применением способов примера 90 (соединение 184). 1Н ЯМР (400 МГц, CD3OD): δ 7.76 (d, J=8.0 Гц, 1Н),7.59 (s, 1H), 7.51 (d, J=7.2 Гц, 1H), 2.74 (t, J=7.6 Гц, 2Н), 1.70-1.60 (m, 2Н), 1.40-1.20 (m, 10Н), 0.90 (t, J=7.0 Гц, 3Н).
Соединение 192 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,664 мин, [М+Н]+=922,4.
Пример 99: Синтез соединения 193

Соединение 193 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,637 мин, [М+Н]+ =871,3.
Пример 100: Синтез соединения 194

Соединение 194 (соль муравьиной кислоты) получали в виде белого твердого вещества (42,7 мг) с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,633, [М+Н]+=868,5; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.51 (brs, 2Н, НСООН), 7.36-7.27 (m, 2Н), 7.4 (d, J=8.0 Гц, 1Н), 7.17 (d, J=8.0 Гц, 1H), 7.13-7.06 (m, 3Н), 6.90 (brs, 1H), 6.83 (brs, 1H), 6.42 (s, 1H), 5.04-5.00 (m, 1H), 4.81-4.77 (m, 2H), 4.274.15 (m, 4H), 4.20 (s, 2H), 3.36-3.30 (m, 1H), 3.22-3.10 (m, 5H), 3.05-2.93 (m, 2H), 2.99 (s, 3H), 2.61 (t, /=7.6 Гц, 2H), 2.45 (s, 3H), 2.03-1.95 (m, 2H), 1.90-1.80 (m, 3H), 1.65-1.58 (m, 2H), 1.40-1.25 (m, 10H), 0.90 (t, J=6.4 Гц, 3H).
Пример 101: Синтез соединения 195

Соединение 195 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,590, [М+Н]+=826,4.
Пример 102: Синтез соединения 196

Соединение 196 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,704, [М+Н]+=826,5.
Пример 103: Синтез соединения 197

Соединение 197 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,584, [М+Н]+=840,5.
Пример 104: Синтез соединения 198
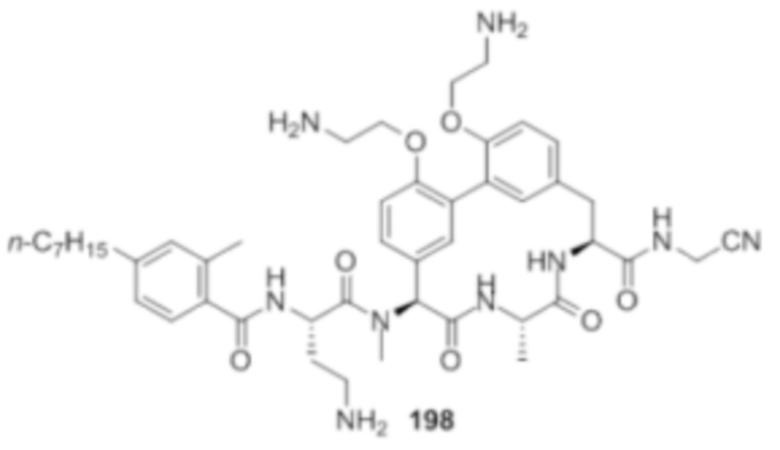
Соединение 198 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,753, [М+Н]+=854,4; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.49 (brs, 1Н), 7.34 (d, J=8.0 Гц, 2H), 7.26 (d, J=8.0 Гц, 1H), 7.13 (brs, 1H), 7.11 (d, J=8.0 Гц, 2H), 6.92 (brs, 1H), 6.83 (brs, 1H), 6.35 (s, 1H), 5.17-5.14 (m, 2H), 4.83-4.81 (m, 1H), 4.30-4.20 (m, 4H), 4.22 (s, 2H), 3.32-3.13 (m, 8H), 2.95 (s, 3H), 2.64 (t, J=7.2 Гц, 2H), 2.43 (s, 3H), 2.40-2.25 (m, 1H), 2.15-2.02 (m, 1H), 1.64 (brs, 2H), 1.40-1.20 (m, 11H), 0.92 (t, J=6.8 Гц, 3H).
Пример 105: Синтез соединения 199

Соединение 199 получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,596, М+Н+=868,4.
Пример 106: Синтез соединения 200

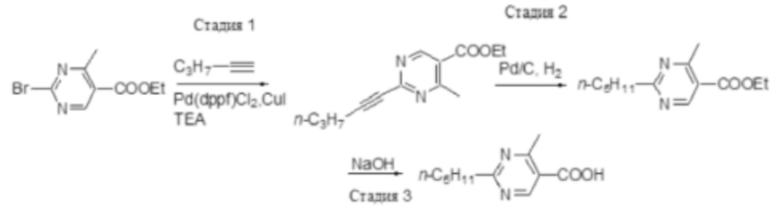
Стадии 1-3: Начиная с этил-2-бром-4-метилпиримидин-5-карбоксилата стандартной процедурой сочетания по Соногашире, гидрированием и сложноэфирным гидролизом (общий способ по Соногашире) получали 4-метил-2-пентилпиримидин-5-карбоновую кислоту (105 мг) в виде желтого твердого вещества. 1Н ЯМР (400 МГц, DMSO-D6) δ 8.97 (s, 1 Н), 2.85 (d, J=7.6 Гц, 2Н), 2.69 (s, 3Н), 1.79-1.72 (m, 2Н), 1.32-1.28 (m, 4Н), 0.89-0.83 (t, J=6.8 Гц, 3Н).
Соединение 200 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,492, [М+Н]+=828,1; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.70 (s, 1H), 8.50 (brs, 2H, HCOOH), 7.33 (d, J=8.0, 1H), 7.26 (d, J=8.0, 1H), 7.20 (d, J=8.4, 1H), 7.11 (d, J=8.4, 1H), 6.92 (brs, 1H), 6.84 (brs, 1H), 6.39 (s, 1H), 5.19-5.15 (m, 1H), 4.80-4.70 (m, 2H),4.27-4.18 (m, 4H), 4.22 (s, 2H), 3.33-3.12 (m, 9H), 2.96 (s, 3H), 2.95 (t, J=8.0 Гц, 2H), 2.65 (s, 3H), 2.29-2.19 (m, 1H), 2.17-2.05 (m, 1H), 1.86-1.78 (m, 2H), 1.40-1.25 (m, 7H), 0.94 (t, J=6.4 Гц, 3Н).
Пример 107: Синтез соединения 201
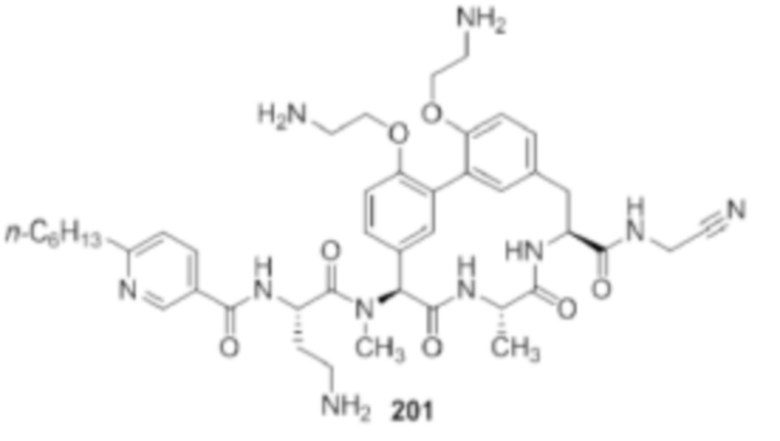
Соединение 201 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184) из 6-гексилникотиновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,537, [М+Н]+=827,3; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.92 (d, J=2 Гц, 1Н), 8.48 (brs, 2Н, НСООН), 8.21 (d, J=S.O Гц, 1Н), 7.46 (d, J=8.0 Гц, 1H), 7.32 (d, J=8.0 Гц, 1Н), 7.25 (d, J=8.0 Гц, 1H), 7.17 (d, J=8.0 Гц, 1Н), 7.09 (d, J=8.0 Гц, 1Н), 6.88 (brs, 1Н), 6.81 (brs, 1Н), 6.34 (s, 1Н), 5.18-5.14 (m, 2Н), 4.8-4.77 (m, 1Н), 4.26-4.10 (m, 4Н), 4.20 (s, 2Н), 3.37-3.33 (m, 1H), 3.22-3.17 (m, 5Н), 3.14-3.10 (m, 3Н), 2.89-2.85 (m, 4Н), 2.33-2.20 (m, 1Н), 2.20-2.05 (m, 1Н), 1.76-1.60 (m, 3Н), 1.40-1.20 (m, 8Н), 0.91 (t, J=6.6 Гц, 3Н).
Пример 108: Синтез соединения 202
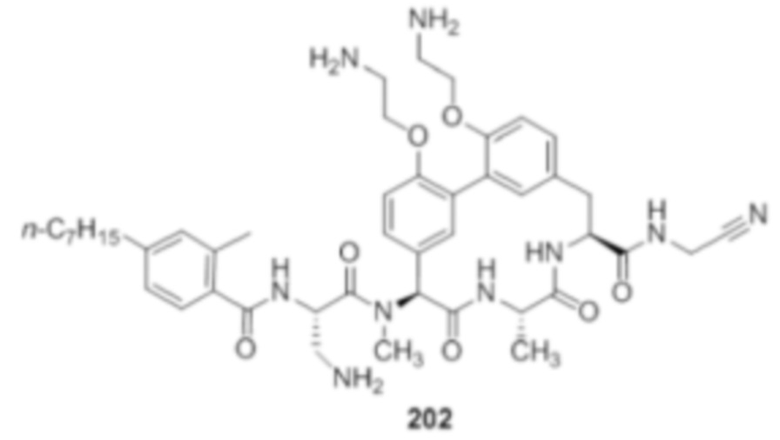
Соединение 202 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,749 мин, [М+Н]+=840,5.
Пример 109: Синтез соединения 203

Соединение 203 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,641 мин, [М+Н]+=872,4.
Пример 110: Синтез соединения 204
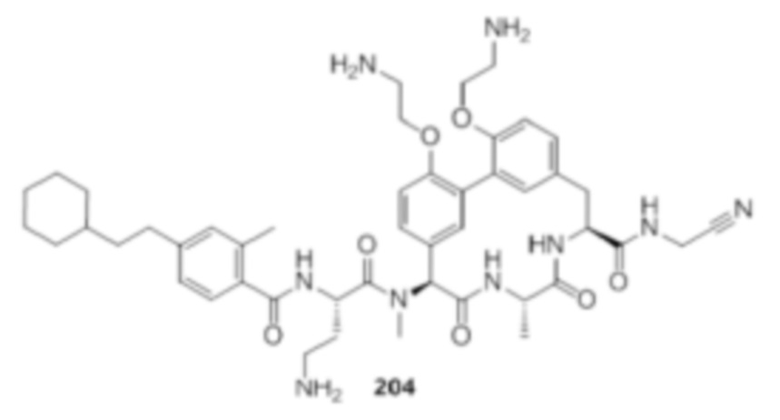
Соединение 204 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 90 (соединение 184). LCMS (способ 5-95 АВ, ESI): tR=0,636 мин, [М+Н]+=866,6.
Пример 111: Синтез соединения 205

Соединение 205 (соль муравьиной кислоты) получали с применением способов примера 90 (соединение 184), за исключением того, что восстановление алкина проводили следующим образом. К раствору метил-2-хлор-4-(гепт-1-ин-1-ил)-6-метилбензоата (250,0 мг, 0,90 ммоль) в толуоле (10 мл) добавляли хлортрис(трифенилфосфин)родий(1) (124,5 мг, 0,13 ммоль). Смесь перемешивали в атмосферном давлении 15 фунт/кв. дюйм при 60°С в течение 16 ч, фильтровали и выпаривали. Остаток очищали методом хроматографии на силикагеле (0-5% EtOAc в петролейном эфире) с получением метил-2-хлор-4-гептил-6-метилбензоата (200 мг, 78,9% выход) в виде желтого твердого вещества. 1Н ЯМР (400 МГц, CD3OD): δ 7.10 (s, 1Н), 7.03 (s, 1Н), 3.90 (s, 3Н), 2.58 (t, J=7.8 Гц, 2Н), 2.27 (s, 3Н), 1.65-1.55 (m, 2Н), 1.35-1.25 (m, 8Н), 0.90 (t, J=7.0 Гц, 3Н).
Данные соединения 205: LCMS (способ 5-95 АВ, ESI): tR=0,640 мин, [М+Н]+=888,5.
Пример 112: Синтез соединения 206
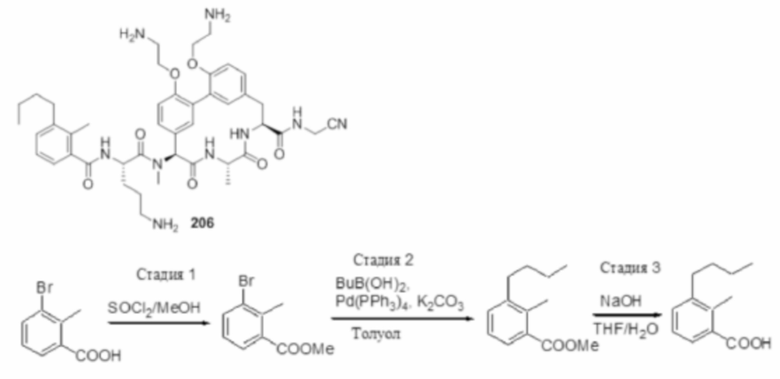
Стадия 1: К смеси 3-бром-2-метилбензойной кислоты (5,0 г, 23 ммоль) в МеОН (80 мл) добавляли SOCl2 (11,0 г, 93 ммоль) при 20°С. Смесь перемешивали в течение 1,5 ч при 70°С. Летучие вещества удаляли и остаток переносили в EtOAc (100 мл), затем последовательно промывали насыщенным NaHCO3 и солевым раствором (каждого 100 мл). Слой EtOAc сушили над Na2SO4, концентрировали и остаток очищали методом колоночной флеш-хроматографии с получением метил 3-бром-2-метилбензоата (5,3 г, 99% выход) в виде красного твердого вещества.
Стадия 2: Раствор метил-3-бром-2-метилбензоата (500 мг, 2,2 ммоль), н-бутилбороновой кислоты (890 мг, 8,7 ммоль), Pd(PPh3)4 (252 мг, 0,22 ммоль) и K2CO3 (905 мг, 6,6 ммоль) в толуоле (20 мл) перемешивали при 100°С в течение 4 ч. После фильтрации фильтрат промывали солевым раствором (20 мл × 3), сушили над Na2SO4 и концентрировали. Остаток очищали методом HPLC с получением метил-3-бутил-2-метилбензоата (120 мг, 27% выход) в виде бесцветного масла. LCMS (способ 5-95 АВ, ESI): tR=0,871, [М+Н]+=206,9.
Стадия 3: Описанные ранее способ сложноэфирного гидролиза с NaOH (общий способ NaOH) (пример 47) использовали по отношению к метил-3-бутил-2-метилбензоату (120 мг, 0,58 ммоль) с получением 3-бутил-2-метилбензойной кислоты (110 мг, 98% выход) в виде белого твердого вещества.
Соединение 206 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из 3-бутил-2-метилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,541, [М+Н]+=826,3.
Пример 113: Синтез соединения 207

Соединение 207 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206) из 5-бутил-2-метилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,554, [М+Н]+=826,2.
Пример 114: Синтез соединения 208

Соединение 208 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206). LCMS (способ 5-95 АВ, ESI): tR=0,546, [М+Н]+=812,3.
Пример 115: Синтез соединения 209
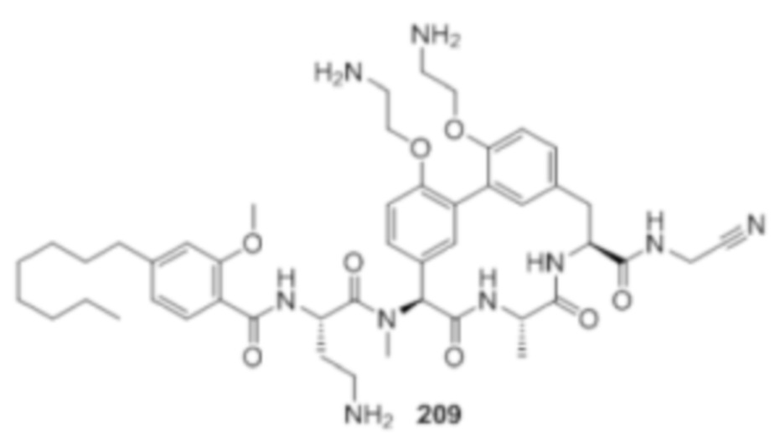
Соединение 209 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206) из 2-метокси-4-октилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,782 мин, [М/2+Н]+=442,9.
Пример 116: Синтез соединения 210

Соединение 210 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206). LCMS (способ 5-95 АВ, ESI): tR=0,772 мин, [М/2+Н]+=444,8.
Пример 117: Синтез соединения 211

На основе подобных процедур, как описано для соединения 206 (пример 112), 2-бром-4-октилбензойную кислоту (180 мг, 0,5747 ммоль, 94% выход) получали в виде белого твердого вещества из 2-бром-4-йодбензойной кислоты. 1Н ЯМР (400 МГц, CD3OD): δ 7.74 (d, J=8.0 Гц, 1Н), 7.52 (s, 1H), 7.30-7.20 (m, 1H), 2.64 (t, J=7.8 Гц, 2H), 1.65-1.55 (m, 2H), 1.35-1.20 (m, 10H), 0.90 (t, J=6.8 Гц, 3H).
Соединение 211 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206) из 2-бром-4-октилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,626 мин, [М+Н]+=932,3.
Пример 118: Синтез соединения 212
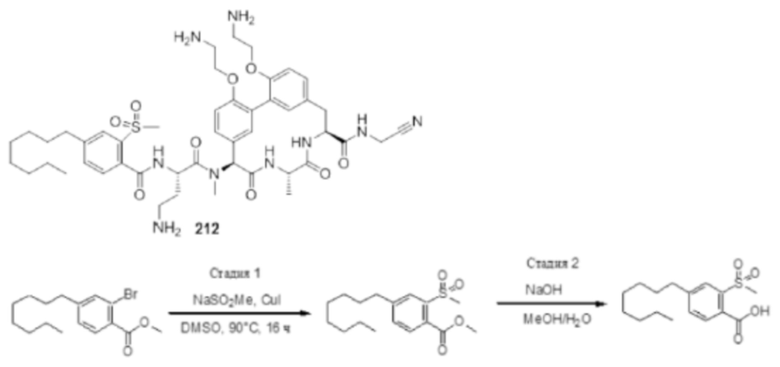
Стадия 1: К раствору метил-2-бром-4-октилбензоата (100,0 мг, 0,31 ммоль) в диметилсульфоксиде (2 мл) добавляли йодид меди (I) (174,6 мг, 0,92 ммоль) и метансульфинат натрия (93,6 мг, 0,92 ммоль). Смесь перемешивали при 100°С в течение 16 ч в атмосфере N2, разбавляли водой (10 мл) и экстрагировали ЕЮ Ас (10 мл × 3). Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали методом преп-TLC (20% EtOAc в петролейном эфире, Rf=0,3) с получением метил-2-метилсульфонил-4-октилбензоата (80 мг, 80,2% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц CDCl3): δ 7.95 (s, 1H), 7.65 (d, J=7.6 Гц, 1Н), 7.48 (d, J=7.2 Гц 1H), 3.97 (s, 3H), 3.37 (s, 3H), 2.72 (t, J=7.8 Гц, 2H), 1.70-1.60 (m, 2H), 1.40-1.20 (m, 10H), 0.89 (t, J=6.4 Гц, 3H).
Стадия 2: 2-(Метилсульфонил)-4-октилбензойную кислоту получали из метил-2-(метилсульфонил)-4-октилбензоата с применением общего способа NaOH.
Соединение 212 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206) из 2-(метилсульфонил)-4-октилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,759 мин, [М+Н]+=932,5.
Пример 119: Синтез соединения 213

4-Метил-2-октилтиазол-5-карбоновук) кислоту, белое твердое вещество, получали с применением способов примера 112 (соединение 206) из этил-2-бром-4-метилтиазол-5-карбоксилата. 1Н ЯМР (400 МГц, CDCl3): δ 3.10-2.90 (m, 2Н), 2.74 (s, 3Н), 1.90-1.70 (m, 2Н), 1.46-1.24 (m, 10Н), 0.89 (t, 6.6 Гц, 3Н).
Соединение 213 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206). LCMS (способ 5-95 АВ, ESI): tR=0,775 мин, [М+Н]+=875,6.
Пример 120: Синтез соединения 214
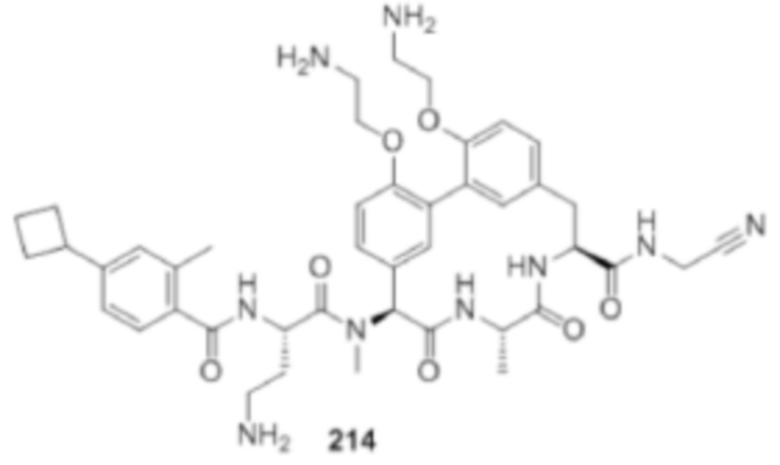
4-Циклобутил-2-метилбеюойную кислоту, белое твердое вещество, получали с применением способов примера 112 (соединение 206). 1Н ЯМР (400 МГц, CDCl3): δ 8.01 (d, J=8.0 Гц, 1H), 7.14-7.11 (m, 2Н), 3.57 (р, J=8.8 Гц, 1Н), 2.65 (s, 3Н), 2.41-2.37 (m, 2Н), 2.20-2.17 (m, 2Н), 2.16-2.07 (m, 1H), 1.95-1.84 (m, 1H).
Соединение 214 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206) из 4-циклобутил-2-метилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,682 мин, [М+Н]+=810,7.
Пример 121: Синтез соединения 215

Соединение 215 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206) из 4-циклопентил-2-метилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,550 мин, [М+Н]+=824,3.
Пример 122: Синтез соединения 216
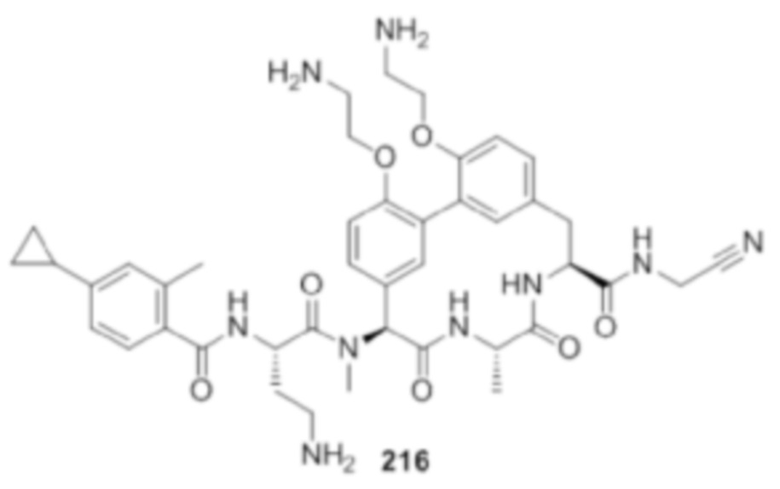
Соединение 216 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206) из 4-циклопропил-2-метилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,479 мин, [М+Н]+=797,2.
Пример 123: Синтез соединения 217

Стадия 1: К раствору тетракис(трифенилфосфин)палладия (0) (151,3 мг, 0,130 ммоль) в толуоле (10 мл) и воде (2 мл) добавляли 3-метил-1-бутилбороновую кислоту (759,4 мг, 6,55 ммоль), метил-4-бром-2-метилбензоат (300 мг, 1,31 ммоль) и карбонат натрия (694 мг, 6,55 ммоль). Реакционную смесь перемешивали при 110°С в течение 16 ч. Смесь фильтровали и фильтрат разбавляли H2O (30 мл) и экстрагировали EtOAc (30 мл × 2). Органические слои объединяли и промывали водой (60 мл × 2) и солевым раствором (30 мл). Органические слои разделяли, сушили над Na2SO4 и концентрировали. Остаток очищали методом препаративной TLC (5% EtOAc в петролейном эфире) с получением метил-4-изопентил-2-метилбензоата (250 мг, 1,1348 ммоль, 86,6% выход) в виде бесцветного масла.
Стадия 2: Метил 4-изопентил-2-метилбензоат (250 мг, 1,13 ммоль) гидролизировали, как описано ранее (общий способ NaOH), с получением неочищенной 4-изопентил-2-метилбензойной кислоты (200 мг, 0,970 ммоль, 85,4% выход) в виде желтого твердого вещества.
Соединение 217 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,732 мин, [М+Н]+=826,5.
Пример 124: Синтез соединения 218

4-Изобутил-2-метилбензойную кислоту, белое твердое вещество, получали с применением способов примера 112 (соединение 206). 1Н ЯМР (400 МГц, CDCl3): δ 8.00 (d, J=8.0 Гц, 1Н), 7.14-6.94 (m, 2H), 2.65 (s, 3Н), 2.50 (d, J=6.8 Гц, 2H), 1.95-1.80 (m, 1H),0.92 (d, J=6.5 Гц, 6H).
Соединение 218 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206). LCMS (способ 5-95 АВ, ESI): tR=0,701 мин, [М+Н]+=812,4.
Пример 125: Синтез соединения 219

2-Метил-4-неопентилбензойную кислоту, белое твердое вещество, получали с применением способов примера 112 (соединение 206). LCMS (способ 5-95 АВ, EST): tR=0,807 мин, [М+Н]+=206,8.
Соединение 219 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206) из 2-метил-4-неопентилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,573 мин, [М+Н]+=826,3.
Пример 126: Синтез соединения 220
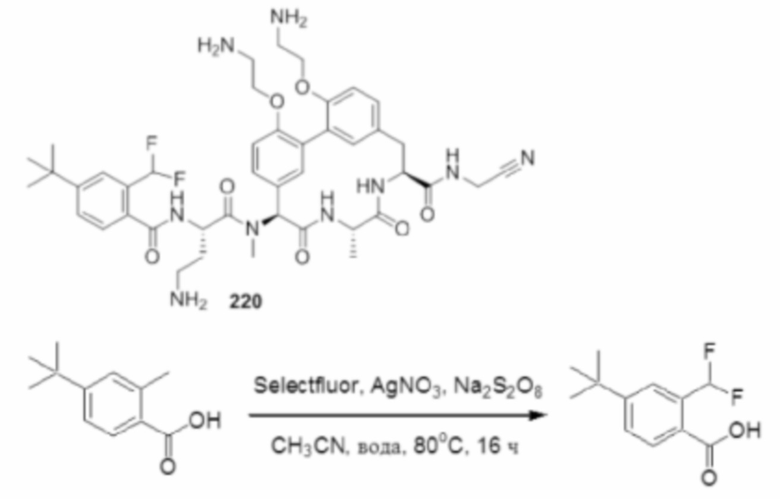
К дегазированной смеси 4-трет-бутил-2-метилбензойной кислоты (192,0 мг, 1 ммоль), персульфата натрия (1,19 г, 4,99 ммоль) и Selectfluor (1,77 г, 4,99 ммоль) в ацетонитриле (4 мл) и воде (4 мл) в бане с сухим людом и ацетоном добавляли нитрат серебра (17,0 мг, 0,10 ммоль). Смесь дегазировали тремя циклами замораживания-прокачивания-размораживания и нагревали при 80°С в течение 16 ч. Добавляли воду (10 мл) и смесь экстрагировали EtOAc (15 мл × 2). Объединенные органические слои концентрировали и остаток очищали методом преп-TLC (петролейный эфир/EtOAc/НОАс 2/1/0.01, Rf=0,3) с получением 4-(трет-бутил)-2-(дифторметил)бензойной кислоты (75 мг, 32,9% выход) в виде белого твердого вещества.
Соединение 220 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,593 мин, [М+Н]+=848,3.
Пример 127: Синтез соединения 221
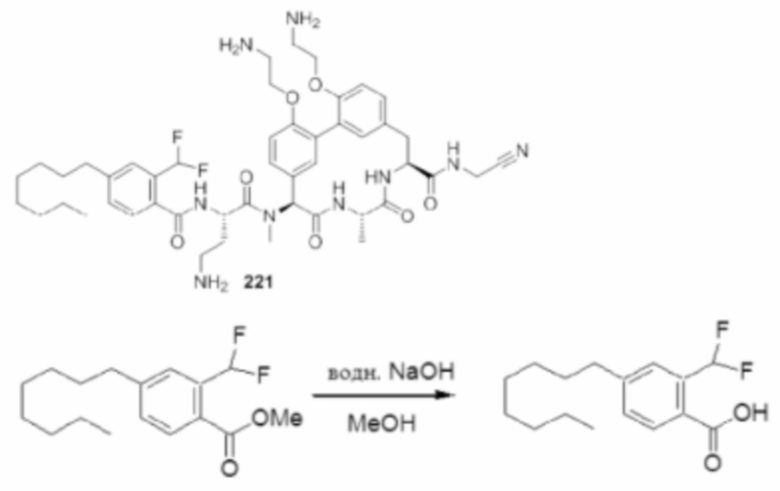
Метил-2-(дифторметил)-4-октилбензоат, бесцветное масло, получали на основе подобных процедур, описанных в примере 126 (соединение 220) и примере 112 (соединение 206). 1Н ЯМР (400 МГц, CDCl3) δ 7.94 (d, J=7.6 Гц, 1H), 7.61 (s, 1H), 7.52 (t, J=55.8 Гц, 1H), 7.32 (d, J=8.0 Гц, 1H), 3.90 (s, 3Н), 2.68 (t, J=7.8 Гц, 2Н), 1.64-1.58 (m, 2Н), 1.40-1.10 (m, 10Н), 0.86 (t, J=6.6 Гц, 3Н). Метил-2-(дифторметил)-4-октилбензоат гидролизировали, как описано ранее (общий способ NaOH), с получением 2-(дифторметил)-4-октилбензойной кислоты.
Соединение 221 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 126 (соединение 220) и примера 112 (соединение 206). LCMS (способ 5-95 АВ, ESI): tR=0,780 мин, [М+Н]+=904,8.
Пример 128 Синтез соединения 222
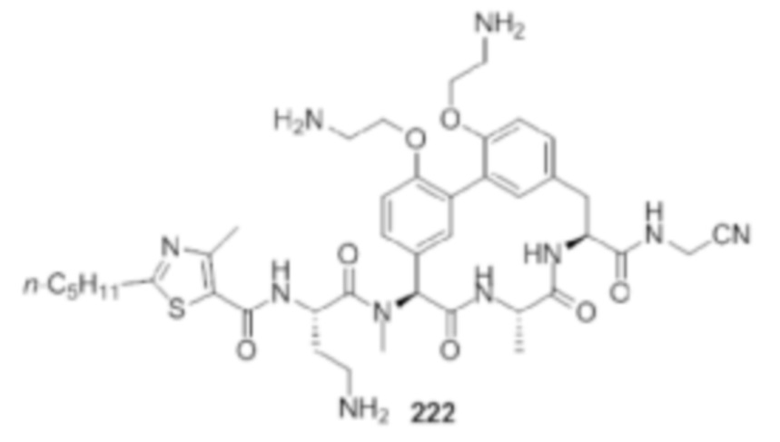
Соединение 222 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206) из 4-метил-2-пентилтиазол-5-карбоновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,643, [М+Н]+=833,5; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.49 (brs, 2Н, НСООН), 7.33 (d, J=8.0 Гц, 1H), 7.27 (d, J=8.0 Гц, 1H), 7.19 (d, J=8.0 Гц, 1H), 7.11 (d, J=8.0 Гц, 1H), 6.91 (brs, 1H), 6.84 (brs, 1H), 6.34 (s, 1H), 5.12-5.09 (m, 1H), 4.82-4.81 (m, 2Н), 4.28-4.20 (m, 4Н), 4.21 (s, 2Н), 3.35-3.25 (m, 1H), 3.22-3.09 (m, 7Н), 3.03 (t, J=l.2 Гц, 2Н), 2.90 (s, 3Н), 2.64 (s, 3Н), 2.31-2.25 (m, 1H), 2.15-2.11 (m, 1H), 1.84-1.80 (m, 2Н), 1.42-1.37 (m, 7Н), 0.98 (t, J=6.8 Гц, 3Н).
Пример 129: Синтез соединения 223

Соединение 223 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206). LCMS (способ 5-95 АВ, ESI): tR=0,760 мин, [М+Н]+=869,6.
Пример 130: Синтез соединения 224

Соединение 224 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206). LCMS (способ 5-95 АВ, ESI): tR=0,758 мин, [М+Н]+=868,4.
Пример 131: Синтез соединения 225
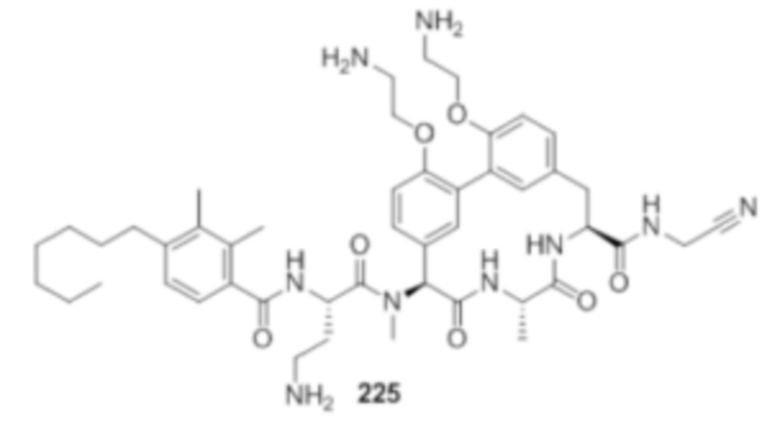
Соединение 225 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206). LCMS (способ 5-95 АВ, ESI): tR=0,753 мин, [М+Н]+=869,5.
Пример 132: Синтез соединения 226

Соединение 226 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206). LCMS (способ 5-95 АВ, ESI): tR=0,753 мин, [М+Н]+=908,4.
Пример 133: Синтез соединения 227

Раствор метил-6-бромникотината (500 мг, 2,3 ммоль), н-бутилбороновой кислоты (708 мг, 6,9 ммоль), Pd2(dba)3 (212 мг, 0,23 ммоль), RuPhos (108 мг, 0,23 ммоль) и K3PO4 (1,47 г, 6,9 ммоль) перемешивали в атмосфере N2 при 100°С всю ночь. Летучие вещества удаляли и полученный остаток очищали на испарительной колонке с силикагелем с получением метил-6-бутилникотината (330 мг, 73,8% выход) в виде бесцветного масла. LCMS (способ 5-95 АВ, ESI): tR=0,733, [М+Н]+=194,0.
Соединение 227 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 112 (соединение 206) из метил-6-бутилникотината. LCMS (0-60 АВ, 2 мин, ESI): tR=0,828, [М+Н]+=799,5.
Пример 134: Синтез соединения 228

Соединение 228 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 133 (соединение 227). LCMS (способ 5-95 АВ, ESI): tR=0,566 мин, [М+Н]+=856,6.
Пример 135: Синтез соединения 229


Метил-2-амино-4-пентилбензоат, желтое масло, получали с применением способов примера 90 (соединение 184) из 2-амино-4-бромбензойной кислоты. 1Н ЯМР (400 МГц, CDCl3) δ 7.76 (d, J=8.8 Гц, 1H), 6.56-6.43 (m, 2H), 5.66 (brs, 2H), 3.86 (s, 3H), 2.51 (t, J=7.8 Гц, 2H), 1.62-1.57 (m, 2H), 1.33-1.30 (m, 4H), 0.89 (t, J=6.6 Гц, 3Н).
Стадия 1: К раствору бромистоводородной кислоты (1,08 мл, 37,08 ммоль) в воде (4 мл) добавляли метил-2-амино-4-пентилбензоат (400,0 мг, 1,8075 ммоль). Раствор охлаждали до 0°С и по каплям добавляли нитрит натрия (249,4 мг, 3,62 ммоль) в воде (0,1 мл). Смесь перемешивали при 0°С, пока не прекратилось выделение газа, затем нагревали при 80°С в течение 16 ч и экстрагировали дихлорметаном (40 мл × 2). Объединенные органические слои промывали насыщенным NaHCO3 (40 мл) и солевым раствором (40 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали методом преп-TLC (10% EtOAc в петролейном эфире, Rf=0,6) с получением метил-2-бром-4-пентилбензоата (90 мг, 17,5% выход) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDCl3) δ 7.74 (d, J=8.0 Гц, 1H), 7.49 (s, 1H), 7.16 (d, J=8.0 Гц, 1H), 3.92 (s, 3Н), 2.61 (t, J=7.8 Гц, 2H), 1.67-1.59 (m, 2H), 1.36-1.27 (m, 4H), 0.90 (t, J=7.0 Гц, 3Н).
Стадии 2 и 3: На основе подобных процедур, описанных в примере 120 (соединение 214), 2-циклопропил-4-пентилбензойную кислоту (40 мг, 94% выход) получали в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3) δ 7.90 (d, J=8.0 Гц, 1H), 7.05 (d, J=8.0 Гц, 1H), 6.83 (s, 1Н), 2.60 (t, J=7.6 Гц, 2H), 1.63-1.57 (m, 3Н), 1.35-1.29 (m, 4H), 1.06-1.00 (m, 2H), 0.90 (t, J=6.6 Гц, 3Н), 0.75-0.69 (m, 2H).
Соединение 229 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,733 мин, [М+Н]+=852,5.
Пример 136: Синтез соединения 230

Стадия 1: Общий способ 4 (пример 5) использовали по отношению к соединению 101-J (200 мг, 0,22 ммоль) и 4-бром-2,6-диметилбензойной кислоты (99 мг, 0,44 ммоль) с получением соединения 230-А (186 мг, 76% выход) в виде белого твердого вещества.
Стадия 2: Общий способ алкилбороновой кислоты использовали по отношению к соединению 230-А (186 мг, 0,16 ммоль) и н-бутилбороновой кислоты (67 мг, 0.65 ммоль) с получением соединения 230-В (160 мг, 88% выход) в виде бледно-желтого твердого вещества.
Соединение 230 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 230-В. LCMS (способ 5-95 АВ, EST): tR=0,556, [М+Н]+=840,4. 1Н ЯМР (400 МГц, МеОН-d4) δ 8.48 (brs, 2Н, НСООН), 7.28-7.22 (m, 2Н), 7.19 (d, J=8.0 Гц, 1Н), 7.11 (d, J=8.0 Гц, 1H), 6.89 (brs, 2Н), 6.86 (brs, 1Н), 6.73 (brs, 1H), 6.53 (s, 1Н), 5.10-5.08 (m, 1Н), 4.89-4.78 (m, 2Н), 4.29-4.23 (m, 4Н), 4.22-4.20 (m, 2Н), 3.35-3.33 (m, 1H), 3.28-3.20 (m, 4Н), 3.15-3.08 (m, 2Н), 3.02 (s, 3Н), 2.98 (t, J=7.2 Гц, 2Н), 2.53-2.46 (m, 2Н), 2.26 (s, 6Н), 1.99-1.94 (m, 1H), 1.90-1.78 (m, 3Н), 1.57-1.49 (m, 2Н), 1.37-1.27 (m, 2Н), 1.36 (d, J=7.2 Гц, 3Н), 0.92 (t, J=6.8 Гц, 3Н).
Пример 137: Синтез соединения 231

Соединение 231 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из (S)-2-(((бензилокси)карбонил)амино)-3-(трет-бутокси)пропановой кислоты и додекановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,653, [М+Н]+=807,3. LCMS (способ 5-95 АВ, ESI): tR=0.653, [М+Н]+=807.3; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.48 (brs, 2Н, НСООН), 7.28-7.23 (m, 2Н), 7.15 (d, J=8.0 Гц, 1Н), 7.09 (d, J=8.0 Гц, 1H), 6.87 (brs, 1H), 6.81 (brs, 1H), 6.35 (s, 1H), 5.00-4.75 (m, 3Н), 4.25-4.15 (m, 4Н), 4.19 (s, 2Н), 3.89-3.84 (m, 1H), 3.72-3.67 (m, 1H), 3.40-3.25 (m, 1H), 3.18-3.09 (m, 5Н), 2.92 (s, 3Н), 2.30-2.26 (m, 2Н), 1.65-1.52 (m, 2Н), 1.40-1.30 (m, 19Н), 0.90 (t, J=6.4 Гц, 3Н).
Пример 138: Синтез соединения 232
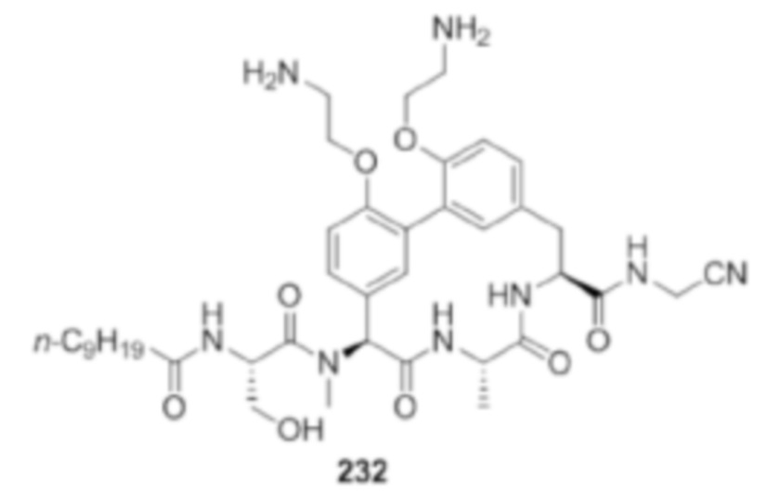
Соединение 232 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 137 (соединение 231) из декановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,747, [М+Н]+=779,4.
Пример 139: Синтез соединения 233

Соединение 233 (соль муравьиной кислоты) получали в виде белого твердого вещества (17,3 мг) с применением способов примера 137 (соединение 231) из 4'-хлор-[1,1'-бифенил]-4-карбоновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0.616, [М+Н]+=839.2. 1Н ЯМР (400 МГц, МеОН-d4) δ 8.49 (brs, 2Н, НСООН), 7.96 (d, J=8.4 Гц, 2Н), 7.72 (d, J=8.4 Гц, 4Н), 7.47 (d, J=8.4 Гц, 2Н), 7.35-7.20 (m, 2Н), 7.17-7.06 (m, 2Н), 6.89 (s, 1Н), 6.79 (s, 1Н), 6.48 (s, 1Н), 5.20-5.10 (m, 1H), 4.80-4.76 (m, 2Н), 4.32-4.13 (m, 4Н), 4.17 (s, 2Н), 4.06-3.98 (m, 1Н), 3.94-3.86 (m, 1Н), 3.37-3.33 (m, 1H), 3.26-3.08 (m, 5Н), 3.00 (s, 3Н), 1.36 (d, J=4.8 Гц, 3Н).
Пример 140: Синтез соединения 234

Стадия 1: Смесь метил-2-хлорпиримидин-5-карбоксилата (2,0 г, 12,9 ммоль) и (4-хлорфенил)бороновой кислоты (2,0 г, 12,9 ммоль), Pd(PPh3)2Cl2 (752 мг, 1,07 ммоль) и Na2CO3 (1,1 г, 10,7 ммоль) в DME (50 мл) перемешивали при 80°С в течение 24 ч. К реакционной смеси добавляли воду (250 мл), которую экстрагировали EtOAc (100 мл × 3). Объединенные органические слои объединяли, концентрировали и остаток очищали методом хроматографии на силикагеле с получением метил-2-(4-хлорфенил)пиримидин-5-карбоксилата (250 мг, 8,9% выход) в виде белого твердого вещества. (Типичные условия реакции Сузуки)
Стадия 2: К раствору THF (15 мл) и H2O (4 мл) добавляли метил-2-(4-хлорфенил)пиримидин-5-карбоксилат (250 мг, 1,0 ммоль) и NaOH (103 мг, 2,6 ммоль). Смесь перемешивали при 80°С всю ночь. Смесь концентрировали и остаток доводили до значения рН~5 при помощи 2 и раствора HCl. Полученный осадок собирали, затем промывали водой (20 мл) с получением 2-(4-хлорфенил)пиримидин-5-карбоновой кислоты (200 мг, 85% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=0,839, [М+Н]+=234,7 (Типичная процедура сложноэфирного гидролиза, NaOH/THF/H2O)
Соединение 234 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 137 (соединение 231) из 2-(4-хлорфенил)пиримидин-5-карбоновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,698, [М+Н]+=841,5.
Пример 141: Синтез соединения 235

Соединение 235 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 137 (соединение 231), за исключением того, что (3)-2-(((бензилокси)карбонил)амино)-3-(трет-бутокси)пропановую кислоту использовали на стадии сочетания аминокислоты. LCMS (способ 5-95 АВ, ESI): tR=0,805 мин, [М+Н]+=856,5.
Пример 142: Синтез соединения 236
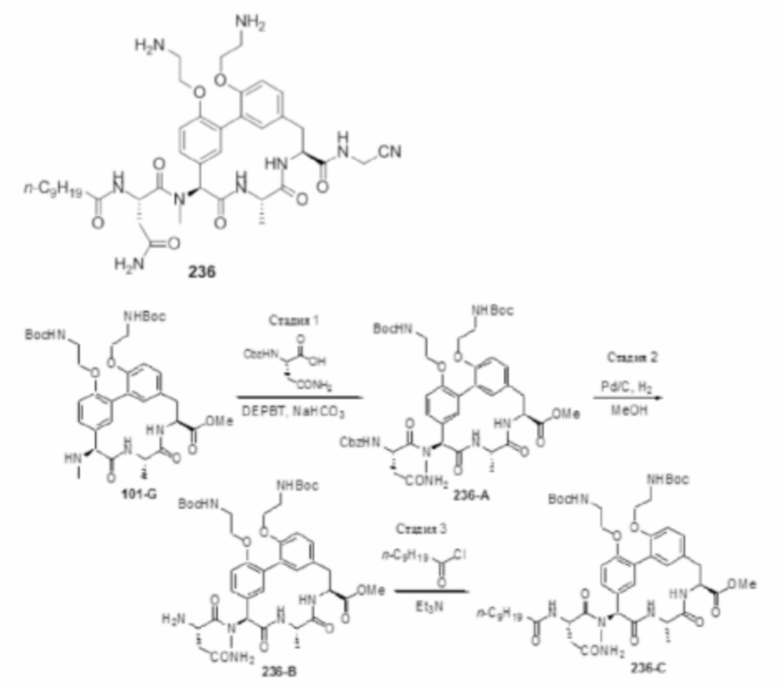
Стадия 1: К раствору (3)-4-амино-2-(((бензилокси)карбонил)амино)-4-оксобутановой кислоты (75 мг, 0.28 ммоль) в THF (15 мл) при 0°С добавляли DEPBT (252 мг, 0,84 ммоль) и NaHCO3 (71 мг, 0,84 ммоль). Смесь перемешивали при той же температуре в течение 10 мин, а затем добавляли соединение 101-G (100 мг, 0,14 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4 суток. Летучие вещества удаляли и полученный остаток переносили в EtOAc (50 мл), затем промывали солевым раствором (50 мл × 2). Слой EtOAc сушили над Na2SO4, концентрировали и остаток очищали методом колоночной флеш-хроматографии с получением соединения 236-А (95 мг, 71% выход) в виде белого твердого вещества.
Стадия 2: Общий способ гидрирования (Pd/C, H2) использовали по отношению к соединению 236-А (95 мг, 0.10 ммоль) с получением соединения 236-В (84 мг, 99% выход) в виде белого твердого вещества.
Стадия 3: Реакция сочетания амина с хлорангидридом была описана и названа как общий способ хлорангидрида. К раствору соединения 236-В (84 мг, 0,10 ммоль) в DCM (5 мл) добавляли деканоилхлорид (23 мг, 0,12 ммоль) и Et3N (20 мг, 0,20 ммоль) при 0°С. Смесь перемешивали при комнатной температуре в течение 1 ч. Значение рН реакционной смеси доводили до 5 насыщенным раствором лимонной кислоты, затем экстрагировали DCM (10 мл × 3). Объединенные органические слои промывали солевым раствором (20 мл). Слой DCM сушили над Na2SO4, концентрировали и остаток очищали методом преп-TLC с получением соединения 236-С (87 мг, 90% выход) в виде белого твердого вещества.
Соединение 236 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 236-С. LCMS (способ 5-95 АВ, EST): tR=0,896, [М+Н]+=806,8. 1Н ЯМР (400 МГц, МеОН-d4) δ 7.28-7.22 (m, 2Н), 7.14-7.06 (m, 2Н), 6.87 (brs, 1Н), 6.81 (brs, 1Н), 6.33 (s, 1H), 5.22-5.18 (m, 1Н), 4.80-4.70 (m, 2Н), 4.21 (brs, 2Н), 4.12-4.09 (m, 4Н), 3.19-3.05 (m, 2Н), 3.00 (brs, 4Н), 2.92 (s, 3Н), 2.76-2.65 (m, 1Н), 2.61-2.50 (m, 1Н), 2.26-2.15 (m, 2Н), 1.64 (brs, 2Н), 1.36-1.33 (m, 15Н), 0.92 (t, J=7.2 Гц, 3Н).
Пример 143: Синтез соединения 237
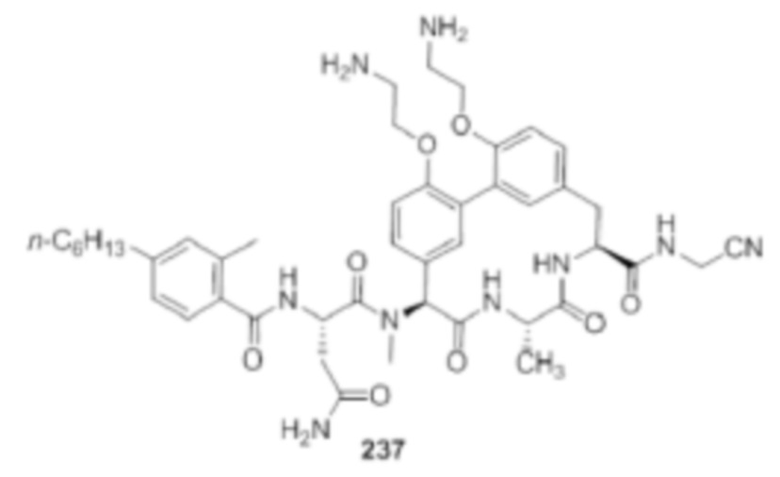
Соединение 237 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 142 (соединение 236) из соединения 236-В. LCMS (способ 5-95 АВ, EST): tR=0,631, [М+Н]+=854,3. 1Н ЯМР (400 МГц, МеОН-d4) δ 8.51 (brs, 2Н, НСООН), 7.35-7.28 (m, 2Н), 7.25 (d, J=8.0 Гц, 1H), 7.16 (d, J=8.0 Гц, 1Н), 7.12-7.03 (m, 3Н), 6.90 (brs, 1H), 6.80 (brs, 1Н), 6.38 (s, 1Н), 5.38-5.33 (m, 1H), 4.81-4.74 (m, 2Н), 4.25-4.12 (m, 4Н), 4.19 (s, 2Н), 3.20-3.06 (m, 4Н), 2.99 (s, 3Н), 2.83-2.76 (m, 2Н), 2.73-2.64 (m, 2H), 2.63-2.57 (m, 2H), 2.39 (s, 3Н), 1.66-1.54 (m, 2H), 1.40-1.24 (m, 9H), 0.90 (t, J=5.2 Гц, 3Н).
Пример 144: Синтез соединения 238

Соединение 238 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 142 (соединение 236) из соединения 236-В. LCMS (способ 5-95 АВ, ESI): tR=0,587, [М+Н]+=826,4.
Пример 145: Синтез соединения 239
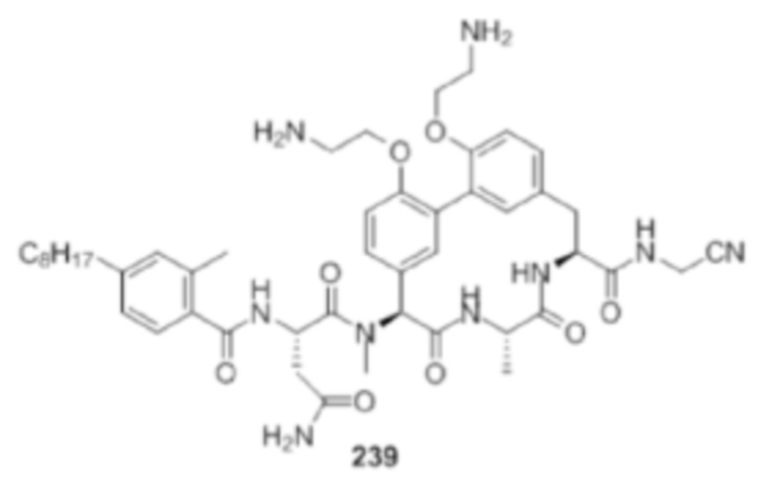
Соединение 239 (свободное основание) получали в виде белого твердого вещества с применением способов примера 142 (соединение 236). LCMS (способ 5-95 АВ, ESI): tR=0,813, [М+Н]+=882,7.
Пример 146: Синтез соединения 240

Соединение 240 (свободное основание) получали в виде белого твердого вещества с применением способов примера 142 (соединение 236). LCMS (способ 5-95 АВ, ESI): tR=0,782, [М+Н]+=902,5.
Пример 147: Соединение 241

Соединение 241 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 101-G и (3)-2-(((бензилокси)карбонил)амино)пропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,679, [М+Н]+=791,3. 1Н ЯМР (400 МГц, MeOH-d4) δ 8.47 (brs, 2Н, НСООН), 7.30 (d, J=8.0 Гц, 1H), 7.24 (d, J=8.0 Гц, 1H), 7.16 (d, J=8.4 Гц, 1H), 7.09 (d, J=8.4 Гц, 1Н), 6.89 (brs, 1Н), 6.80 (brs, 1Н), 6.35 (s, 1Н), 4.79-4.72 (m, 3Н), 4.30-4.15 (m, 4Н), 4.19 (s, 2Н), 3.40-3.34 (m, 1H), 3.24-3.09 (m, 5Н), 2.88 (s, 3Н), 2.25 (t, J=7.6 Гц, 2Н), 1.69-1.53 (m, 3Н), 1.50-1.22 (m, 21Н), 0.90 (t, J=6.6 Гц, 3Н).
Пример 148: Синтез соединения 242

Соединение 242 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 147 (соединение 241). LCMS (способ 5-95 АВ, ESI): tR=0,616, [М+Н]+=783,3.
Пример 149: Синтез соединения 243

Соединение 243 (соль муравьиной кислоты) получали с 29% выходом в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из (S)-2-(((бензилокси)карбонил)амино)пропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,707 мин, [М+Н]+=839,3.
Пример 150: Синтез соединения 244

Соединение 244 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов, используемый в примере 7 (соединение 101) из соединения 101-G и (S)-5-амино-2-(((бензилокси)карбонил)амино)-5-оксопентановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,782, [М+Н]+=848,6. 1Н ЯМР (400 МГц, MeOH-d4) δ 8.53 (brs, 2Н, НСООН), 7.31-7.26 (m, 2Н), 7.18 (d, J=8.0 Гц, 1Н), 7.12 (d, J=8.0 Гц, 1Н), 6.90 (brs, 1Н), 6.84 (brs, 1H), 6.36 (s, 1Н), 5.00-4.76 (m, 3Н), 4.30-4.20 (m, 4Н), 4.21 (s, 2Н), 3.40-3.22 (m, 5Н), 3.20-3.10 (m, 1Н), 2.94 (s, 3Н), 2.39-2.36 (m, 2Н), 2.29-2.27 (m, 2Н), 2.20-2.05 (m, 1Н), 1.93-1.82 (m, 1H), 1.70-1.54 (m, 2Н), 1.38-1.33 (m, 19Н), 0.92 (t, J=7.2 Гц, 3Н).
Пример 151: Синтез соединения 245
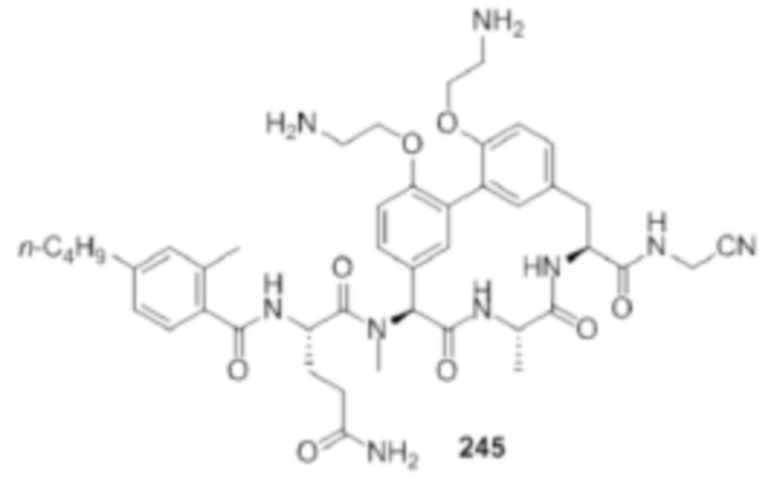
Соединение 245 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением тех же способов, используемых в примере 150 (соединение 244). LCMS (способ 5-95 АВ, ESI): tR=0,732, [М+Н]+=840,5.
Пример 152: Синтез соединения 246

Соединение 246 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 150 (соединение 244). LCMS (способ 5-95 АВ, ESI): tR=0,637, [М+Н]+=868,9.
Пример 153: Синтез соединения 247

Соединение 247 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 150 (соединение 244). LCMS (способ 5-95 АВ, ESI): tR=0,835, [М+Н]+=896,6.
Пример 154: Синтез соединения 248

Соединение 248 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 150 (соединение 244). LCMS (способ 5-95 АВ, ESI): tR=0,786, [М+Н]+=916,5.
Пример 155: Синтез соединения 249

Соединение 249 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) за исключением того, что (3)-2-(((бензилокси)карбонил)амино)-3-гидроксипропановую кислоту использовали на стадии сочетания аминокислоты. LCMS (способ 5-95 АВ, ESI): tR=0,659 мин, [М+Н]+=861,8.
Пример 156: Синтез соединения 250

Стадия 1: Раствор метил-6-хлорникотината (4,0 г, 23,3 ммоль), Pd(PPh3)4 (32,7 г, 46,6 ммоль), Na2CO3 (7,4 г, 69,9 ммоль), (4-хлорфенил)бороновой кислоты (7,3 г, 46,6 ммоль) в ACN/H2O (70 мл, объем/объем = 5:2) перемешивали при 90°С в течение 16 ч в атмосфере N2. После фильтрации летучие вещества удаляли и остаток переносили в EtOAc (90 мл), затем промывали солевым раствором (90 мл × 2). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением продукта метил-6-(4-хлорфенил)никотината (2,7 г, 46,8% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3) δ 9.25 (d, J=2.0 Гц, 1H), 8.35 (dd, J=8.4, 2.0 Гц, 1Н), 8.00 (d, J=8.4 Гц, 2Н), 7.78 (d, J=8.4 Гц, 1H), 7.46 (d, J=8.4 Гц, 2Н),3.96 (s, 3H).
Стадия 2: Типичную процедуру сложноэфирного гидролиза (NaOH/THF) использовали по отношению к метил-6-(4-хлорфенил)никотинату (700 мг, 2,83 ммоль) с получением 6-(4-хлорфенил)никотиновой кислоты (470 мг, 72% выход) в виде белого твердого вещества.
Соединение 250 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением тех же способов, используемых при получении соединения 231 (пример 137), за исключением того, что 6-(4-хлорфенил)никотиновую кислоту использовали на стадии сочетания. LCMS (способ 5-95 АВ, ESI): tR=0,640, [М+Н]+=840,0.
Пример 157 Синтез соединения 251

Соединение 251 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из (R)-2-(((бензилокси)карбонил)амино)пропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,851 мин, [М+Н]+=839,5.
Пример 158: Синтез соединения 252

Соединение 252 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из 2-(((бензилокеи)карбонил)амино)уксусной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,723 мин, [М+Н]+=825,2.
Пример 159: Синтез соединения 253

Соединение 253 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из (S)-2-(((бензилокси)карбонил)амино)-5-(трет-бутокси)-5-оксопентановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,799, [М+Н]+=849,4
Пример 160: Синтез соединения 254 и соединения 255

Стадия 1: Соединение 254-А получали согласно общему способу 4 (пример 5) из соединения 101-G (104 мг, 0,28 ммоль) и Fmoc-L-метионина с получением соединения 254-А (100 мг, 66,9%) в виде светло-желтого твердого вещества после колоночной хроматографии на силикагеле.
Стадия 2: Соединение 254-А подвергали стандартным условиям Fmoc-снятия защитных групп. К раствору соединения 254-А (100 мг, 0,18 ммоль) в DCM (4 мл) добавляли пиперидин (1,0 мл) при 0°С и смесь перемешивали при комнатной температуре в атмосфере N2 в течение 2 ч. Летучие вещества концентрировали и остаток повторно растворяли в EtOAc (30 мл), затем промывали солевым раствором (2 × 30 мл). Органический слой сушили над MgSO4, концентрировали и очищали методом преп-TLC (элюирование 3% МеОН в DCM) с получением соединения 254-В (50 мг, 63,1% выход) в виде желтого твердого вещества.
Стадии 3 и 4: Соединение 254-С получали, как было ранее описано, из деканоилхлорида с применением триэтиламина в качестве основания в DCM с последующим LiOH сложноэфирным гидролизом.
Соединение 254 (соль муравьиной кислоты) получали в виде белого твердого вещества (16 мг) с применением способов примера 137 (соединение 231). Данные соединения 254: LCMS (способ 5-95 АВ, EST): tR=0.663, [М+Н]+=823,2.
Соединение 255 (2 мг, белое твердое вещество) выделяли в виде побочного продукта, который возникает вследствие окисления сульфида в течение получения соединения 254. Данные соединения 255: LCMS (способ 5-95 АВ, ESI): tR=0,653, [М+Н]+=839,2.
Пример 161: Синтез соединения 256

Соединение 256 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 160 (соединение 254) из (2S,3R)-2-((((9H-флуорен-9-ил)метокси)карбонил)амино)-3-(трет-бутокси)бутановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,659, [М+Н]+=821,3.
Пример 162: Синтез соединения 257

К смеси бензилхлорформиата (930,84 мг, 5,46 ммоль) и бикарбоната натрия (705,25 мг, 8,39 ммоль) в воде (10 мл) добавляли (23)-2-амино-4-гадроксибутановую кислоту (500,0 мг, 4,2 ммоль) и перемешивали при 15°С в течение 3 часов в атмосфере азота. Реакционную смесь промывали этилацетатом (20 мл × 3), подкисляли до значения рН 4 с применением 2 н HCl (приблизительно 20 мл) при 0°С и экстрагировали этилацетатом (30 мл × 3). Объединенные органические слои сушили над сульфатом натрия и концентрировали с получением (2S)-2-(бензилоксикарбониламино)-4-гидроксибутановой кислоты (450 мг, 1,7769 ммоль, 42,3% выход) в виде бесцветного масла. Его использовали на следующей стадии без дополнительной очистки.
К смеси (2S)-2-(бензилоксикарбониламино)-4-гидроксибутановой кислоты (450,0 мг, 1,78 ммоль) и триэтиламина (395,57 мг, 3,91 ммоль) в N,N-диметилформамиде (8 мл) добавляли трет-бутилдиметилхлорсилан (401,72 мг, 2,67 ммоль) при 0°С и перемешивали при 15°С в течение 1 часа. Реакционную смесь разбавляли водой (30 мл) и добавляли карбонат натрия (5 г). Полученную смесь промывали этилацетатом (15 мл × 3). Водную фазу подкисляли до значения рН 4 с применением 2 н HCl (приблизительно 20 мл) при 0°С и экстрагировали этилацетатом (30 мл × 3). Объединенные органические слои сушили над сульфатом натрия и концентрировали с получением (S)-2-(((бензилокси)карбонил)амино)-4-((трет-бутилдиметилсилил)окси)бутановой кислоты (450 мг, 1,2245 ммоль, 68,9% выход) в виде бесцветного масла. Его использовали на следующей стадии без дополнительной очистки. LCMS (способ 5-95 АВ, EST): tR=0,833 мин, [M+Na]+=389,9.
Соединение 257 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 101-G и (3)-2-(((бензилокси)карбонил)амино)-4-гидроксибутановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,657, [М+Н]+=821,3.
Пример 163: Синтез соединения 258
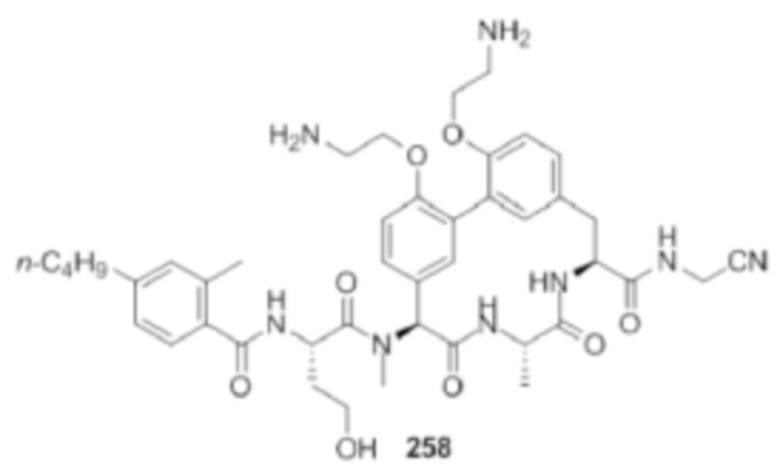
Соединение 258 (соль муравьиной кислоты) получали в виде белого твердого вещества (10 мг) с применением способов примера 162 (соединение 257). LCMS (способ 5-95 АВ, EST): tR=0,585, [М+Н]+=813,3. 1Н ЯМР (400 МГц, МеОН-d4) δ 8.48 (brs, 2Н, НСООН), 7.37-7.35 (m, 2Н), 7.27 (d, J=8.0 Гц, 1H), 7.19 (d, J=8.0 Гц, 1H), 7.15-7.05 (m, 3H), 6.92 (brs, 1H), 6.85 (brs, 1H), 6.46 (s, 1H), 5.17-5.14 (m, 1H), 4.80-4.70 (m, 2H), 4.27-4.20 (m, 4H), 4.21 (s, 2H), 3.78-3.70 (m, 2H), 3.25-3.23 (m, 4H), 3.16-3.12 (m, 1H), 3.02 (s, 3H), 2.66-2.62 (m, 3H), 2.45 (s, 3H), 2.15-2.00 (m, 1H), 2.00-1.90 (m, 1H), 1.64-1.50 (m, 2H), 1.42-1.30 (m, 5H), 0.96 (t, J=7.2 Гц, 3Н).
Пример 164: Синтез соединения 259

Соединение 259 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 162 (соединение 257). LCMS (способ 5-95 АВ, ESI): tR=0,598, [М+Н]+=853,5.
Пример 165: Синтез соединения 260
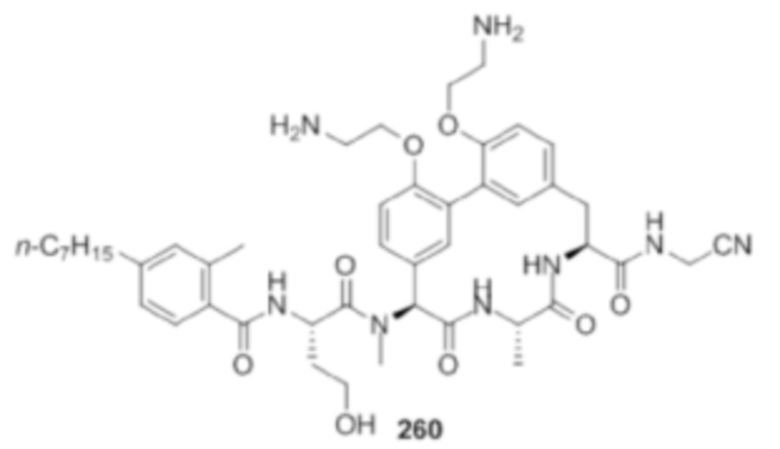
Соединение 260 (свободное основание) получали в виде белого твердого вещества с применением способов примера 162 (соединение 257). LCMS (способ 5-95 АВ, ESI): tR=0,810, [М+Н]+=855,5; 1Н ЯМР (400 МГц, МеОН-d4) δ 7.31-7.22 (m, 2Н), 7.22 (d, J=7.5 Гц, 1H), 7.14 (d, J=7.5 Гц, 1H), 7.07-7.04 (m, 3Н), 6.84 (brs, 1H), 6.65-6.58 (m, 2Н), 5.20-5.18 (m, 1H), 4.80-4.70 (m, 2Н), 4.21 (s, 2Н), 4.16-4.01(m, 4Н), 3.74 (t, J=5.6 Гц, 2Н), 3.32-3.28 (m, 1H), 3.15-2.91 (m, 5Н), 3.02 (s, 3Н), 2.61-2.52 (m, 2Н), 2.36 (s, 3Н), 2.16-2.05 (m, 1H), 2.00-1.90 (m, 1H), 1.57 (brs, 2Н), 1.40-1.20 (m, 11Н), 0.92 (t, J=6.4 Гц, 3Н).
Пример 166: Синтез соединения 261

Соединение 261 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 162 (соединение 257). LCMS (способ 5-95 АВ, ESI): tR=0,794, [М+Н]+=889,6.
Пример 167: Синтез соединения 262

Соединение 262 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,684 мин, [М+Н]+=869,4.
Пример 168: Синтез соединения 263

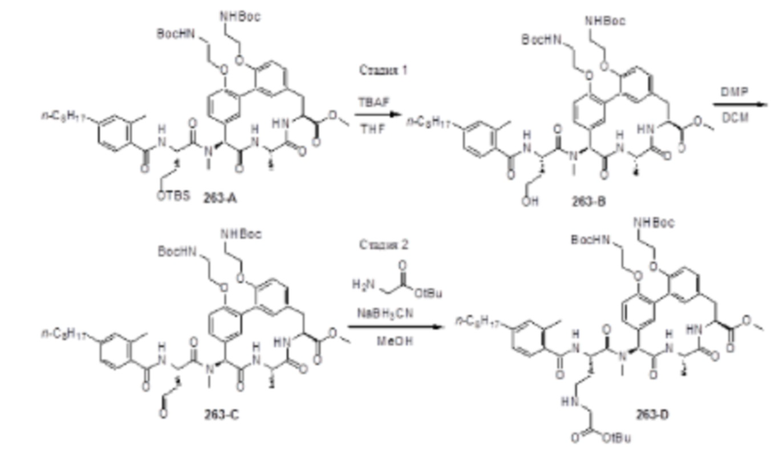
Соединение 263-А является промежуточным соединением при получении соединения 262 (пример 167). К раствору соединения 263-А (360,0 мг, 0,31 ммоль) в тетрагидрофуране (8 мл) добавляли тетрабутиламмония фторид (2М; 2,0 мл, 4 ммоль) в тетрагидрофуране. Раствор перемешивали при 20°С в течение 2 ч и выпаривали досуха. Остаток переносили в EtOAc (20 мл), промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографин (5% метанола в DCM, Rf=0,5) с получением соединения 263-В (320 мг, 98,6% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=1,122 мин, [М+Н]+=1045,4.
К раствору соединения 263-В (170,0 мг, 0,16 ммоль) в дихлорметане (10 мл) добавляли перйодат Десса-Мартина (138,0 мг, 0,33 ммоль). Смесь перемешивали при 20°С в течение 2 ч, гасили насыщенным раствором NaHCO3 и экстрагировали EtOAc (20 мл). Органический слой промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали с получением неочищенного соединения 263-С (160 мг, 94,3% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=0,974 мин, [М+Н]+=1043,5.
К раствору соединения 263-С (400,0 мг, 0,38 ммоль) и трет-бутил-2-аминоацетата гидрохлорида (128,5 мг, 0,77 ммоль) в метаноле (20 мл) добавляли цианоборгидрид натрия (48,2 мг, 0,77 ммоль). Реакционную смесь перемешивали при 20°С в течение 2 ч и выпаривали досуха. Остаток переносили в EtOAc (10 мл), промывали водой (10 мл × 2) и солевым раствором (10 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (5% метанола в DCM, Rf=0,5) с получением соединения 263-D (300 мг, 67,5% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=1,043 мин, [М+Н]+=1159,3.
Соединение 263 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 263-D. LCMS (способ 5-95 АВ, ESI): tR=0,642 мин, [М+Н]+=927,4.
Пример 169: Синтез соединения 264

Стадия 1: К раствору (S)-4-(((бензилокси)карбонил)амино)-5-метокси-5-оксопентановой кислоты (1,0 г, 3,4 ммоль) в THF (3,5 мл) при 0°С добавляли 1 М ВН3/THF (6,7 мл, 6,7 ммоль) и смесь перемешивали при той же температуре в течение 1 ч. Реакцию гасили добавлением 1 М NaHSO4 (10 мл), а затем удаляли большую часть THF при пониженном давлении. Полученную смесь разбавляли водой (20 мл), которую экстрагировали EtOAc (30 мл × 3). Объединенные органические слои промывали солевым раствором (90 мл), сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением (S)-метил-2-(((бензилокси)карбонил)амино)-5-гидроксипентаноата (550 мг, 60% выход) в виде бесцветного масла. LCMS (способ 5-95 АВ, ESI): tR=0,729, M+Na+=303,9
Стадии 2 и 3: Типичную защиту TBS и процедуру сложноэфирного гидролиза (LiOH) проводили с получением (S)-2-(((бензилокси)карбонил)амино)-5-((трет-бутилдиметилсилил)окси)пентановой кислоты (640 мг) в виде бесцветного масла.
Соединение 264 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 162 (соединение 257). LCMS (способ 5-95 АВ, ESI): tR=0.658, [М+Н]+=835.6; 1Н ЯМР (400 МГц, МеОН-d4) S 8.49 (brs, 2Н, НСООН), 7.35-7.25 (m, 2Н), 7.17 (d, J=8.0 Гц, 1H), 7.12 (d, J=8.0 Гц, 1Н), 6.92 (brs, 1H), 6.80 (brs, 1Н), 6.41 (s, 1Н), 4.95-4.88 (m, 1H), 4.82-4.70 (m, 2Н), 4.40-4.22 (m, 4Н), 4.20 (s, 2Н), 3.65-3.58 (m, 2Н), 3.48-3.35 (m, 1H), 3.31-3.22 (m, 4Н), 3.20-3.10 (m, 1Н), 2.93 (s, 3Н), 2.32-2.20 (m, 2Н), 2.00-1.90 (m, 1Н), 1.80-1.60 (m, 5Н), 1.50-1.20 (m, 20Н), 0.92 (t, J=6.8 Гц, 3Н).
Пример 170: Синтез соединения 265
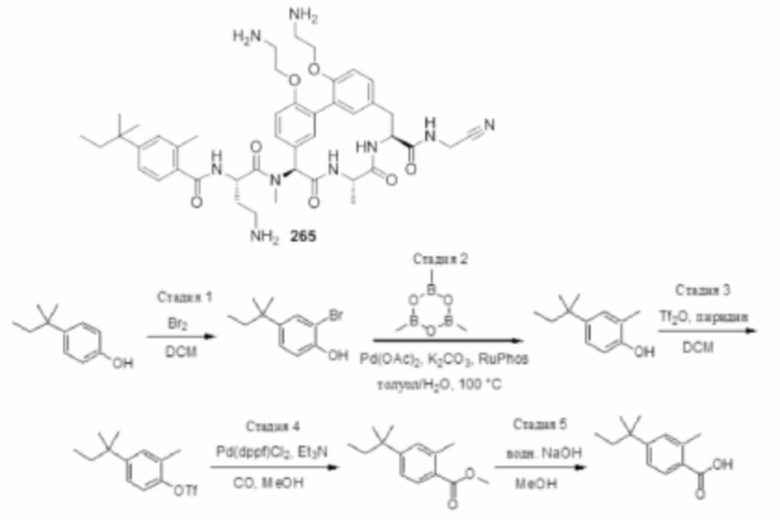
Стадия 1: К раствору 4-третамилфенола (3,0 г, 18,27 ммоль) в дихлорметане (20 мл) по каплям добавляли бром (0,94 мл, 18,27 ммоль) при 0°С и перемешивали в течение 30 мин. Затем смесь оставляли нагреваться до 20°С и перемешивали в течение 16 ч. Реакционную смесь разбавляли DCM (20 мл), промывали водой (50 мл × 3), сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали на колонке с силикагелем с этилацетатом/петролейным эфиром (1:10) с получением 2-бром-4-(1,1-диметилпропил)фенола (2.6 г, 58,5% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3): δ 7.37 (d, J=2.0 Гц, 1Н), 7.16 (dd, J=8.4, 2.4 Гц, 1H), 6.94 (d, J=8.4 Гц, 1H), 5.35 (s, 1H), 1.58 (q, J=7.5 Гц, 2H), 1.23 (s, 6H), 0.66 (t, J=7.4 Гц, 3Н).
Стадия 2: Смесь 2-бром-4-(1,1-диметилпропил)фенола (500 мг, 2,06 ммоль), ацетата палладия (II) (46,2 мг, 0,21 ммоль), RuPhos (192,0 мг, 0,41 ммоль) и карбоната калия (710,6 мг, 5,14 ммоль) в толуоле (10 мл) и воде (1 мл) обрабатывали триметилбороксином (516,3 мг, 4,11 ммоль) и нагревали при 80°С в течение 16 часов в атмосфере азота. Реакционную смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои сушили над сульфатом натрия и концентрировали. Остаток очищали методом преп-TLC (10% этилацетата в петролейном эфире) с получением 4-(1,1-диметилпропил)-2-метилфенола (220 мг, 60% выход) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDCl3): δ 7.05-6.95 (m, 2Н), 6.69 (d, J=8.4 Гц, 1H), 4.51 (s, 1H), 2.24 (s, 3Н), 1.61-1.56 (m, 2H), 1.23 (s, 7H), 0.66 (t, J=7.4 Гц, 3Н).
Стадия 3: Раствор 4-(1,1-диметилпропил)-2-метилфенола (220,0 мг, 1,23 ммоль) и пиридина (292,9 мг, 3,7 ммоль) в дихлорметане (5 мл) обрабатывали трифторметансульфоновым ангидридом (417,8 мг, 1,48 ммоль) при 0°С. Полученную смесь перемешивали при 15°С в течение 1 часа в атмосфере азота. Реакционную смесь доводили до значения рН 5 с применением 2 н HCl и экстрагировали дихлорметаном (20 мл × 3). Объединенные органические слои сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали с получением [4-(1,1-диметилпропил)-2-метилфенил]трифторметансульфоната (360 мг, 94% выход) в виде коричневого масла, которое использовали на следующей стадии без очистки.
Стадия 4: Карбонилирование арилтрифлата было описано и названо как общий способ карбонилирования. Этот способ также может быть использован с арилбромидами и йодидами.
Раствор [4-(1,1-диметилпропил)-2-метилфенил]трифторметансульфоната (240 мг, 0,770 ммоль) и триэтиламина (234,8 мг, 2,32 ммоль) в метаноле (10 мл) обрабатывали 1,1'-бис(дифенилфосфино)ферроцена палладия дихлоридом (56,6 мг, 0,08 ммоль). Полученную смесь перемешивали при 60°С в течение 16 часов в атмосфере СО (35 фунт/кв. дюйм). Реакционную смесь концентрировали и остаток очищали на колонке с силикагелем (3% этилацетата в петролейном эфире) с получением метил-4-(1,1-диметилпропил)-2-метилбензоата (40 мг, 23,5% выход) в виде бесцветного масла.
Стадия 5: 4-(1,1-Диметилпропил)-2-метилбензоат (40,0 мг, 0,18 ммоль) гидролизировали, как описано ранее (общий способ NaOH), с получением неочищенной 4-(1,1-диметилпропил)-2-метилбензойной кислоты (30 мг, 80,1% выход) в виде белого твердого вещества.
Соединение 265 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,602 мин, [М+Н]+=826,2.
Пример 171: Синтез соединения 266

Соединение 266 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 170 (соединение 265) начиная с 4-(трет-бутил)-2-метилфенола. LCMS (способ 5-95 АВ, ESI): tR=0,562 мин, [М+Н]+=812,5.
Пример 172: Синтез соединения 267

Стадия 1: К раствору 2-хлор-4-гидроксибензойной кислоты (200,0 мг, 1,16 ммоль) в метаноле (5 мл) по каплям добавляли тионилхлорид (413,6 мг, 3,48 ммоль) при 0°С. Реакционную смесь перемешивали при 70°С в течение 2 ч и концентрировали. Остаток разбавляли водой (15 мл) и экстрагировали EtOAc (15 мл × 2). Органические слои объединяли и промывали водой (30 мл × 2) и солевым раствором (20 мл). Органические слои разделяли, сушили над Na2SO4 и концентрировали с получением метил-2-хлор-4-гидроксибензоата (200 мг, 92,5% выход) в виде желтого твердого вещества, которое использовали сразу без дополнительной очистки.
Стадия 2: К раствору метил-2-хлор-4-гидроксибензоата (100,0 мг, 0,54 ммоль) в N,N-диметилформамиде (3 мл) добавляли 1-бромгептан (2879,6 мг, 16,08 ммоль) и карбонат калия (2222,1 мг, 16,08 ммоль). Смесь перемешивали при 20°С в течение 4 ч, разбавляли водой (20 мл) и экстрагировали EtOAc (20 мл × 2). Органические слои объединяли и промывали водой (40 мл × 4)и солевым раствором (20 мл). Органические слои разделяли, сушили над Na2SO4 и концентрировали. Остаток очищали методом препаративной TLC (5% EtOAc в петролейном эфире) с получением метил-2-хлор-4-гептоксибензоата (152 мг, 99,6% выход) в виде желтого масла. Для более стерически затрудненных алкилгалогенидов использовали повышенные температуры.
Стадия 3: Метил-2-хлор-4-гептоксибензоат (152,0 мг, 0,53 ммоль) гидролизировали, как описано ранее (общий способ NaOH), с получением неочищенной 2-хлор-4-гептоксибензойной кислоты (110 мг, 76,1% выход) в виде желтого твердого вещества.
Соединение 267 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,647 мин, [М+Н]+=890,4.
Пример 173: Синтез соединения 268
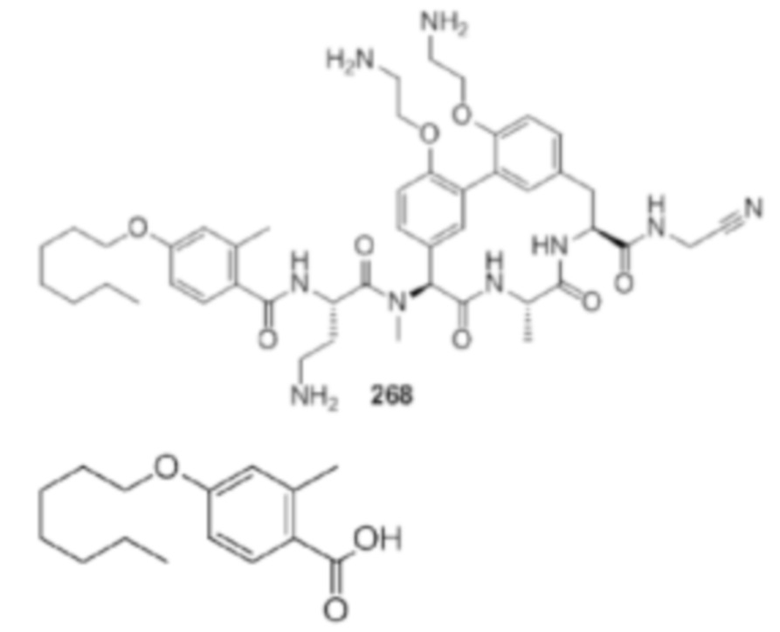
На основе подобных процедур, описанных в примере 172 (соединение 267), 4-(гептилокси)-2-метилбензойную кислоту (605 мг, 96,1% выход) получали в виде желтого твердого вещества из 4-гидрокси-2-метилбензойной кислоты. 1Н ЯМР (400 МГц, CDCl3) δ 8.09-8.04 (m, 1H), 6.79-6.73 (m, 2Н), 4.01 (t, J=6.4 Гц, 2Н), 2.64 (s, 3Н), 1.84-1.73 (m=2Н), 1.49-1.27 (m, 8Н), 0.90 (t, J=7.0 Гц, 3Н).
Соединение 268 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, ESI): tR=0,608 мин, [М+Н]+=870,4. 1Н ЯМР (400 МГц, МеОН-d4) δ 8.46 (brs, 2Н), 7.38 (d, J=8.0 Гц, 1Н), 7.32 (dd, J=8.4, 1.8 Гц, 1H), 7.25 (d, J=8.0 Гц, 1H), 7.18 (d, J=8.0 Гц, 1Н), 7.10 (d, J=8.0 Гц, 1H), 6.90 (d, J=1.8 Гц, 1H), 6.85-6.77 (m, 3Н), 6.35 (s, 1Н), 5.14-5.10 (m, 1H), 4.82-4.76 (m, 2Н), 4.36-4.18 (m, 4Н), 4.20 (s, 2Н), 3.99 (t, J=6.4 Гц, 2H), 3.35-3.20 (m, 5Н), 3.17-3.08 (m, 3Н), 2.91 (s, 3Н), 2.40 (s, 3Н), 2.30-2.24 (m, 1H), 2.20-2.05 (m, 1H), 1.81-1.74 (m, 2Н), 1.53-1.31 (m, 11Н), 0.92 (t, J=6.6 Гц, 3Н).
Пример 174: Синтез соединения 269

На основе подобных процедур, описанных в примере 172, 4-бутокси-2-хлорбензойную кислоту (160 мг, 0,70 ммоль) получали в виде белого твердого вещества из 2-хлор-4-гидроксибензойной кислоты. 1Н ЯМР (400 МГц, CD3OD): δ 7.90 (d, J=9.2 Гц, 1Н), 7.02 (d, J=2.0 Гц, 1Н), 6.91 (dd, J=9.0, 2.6 Гц, 1H), 4.04 (t, J=6.4 Гц, 2Н), 1.80-1.70 (m, 2Н), 1.55-1.45 (m, 2Н), 0.99 (t, J=7.6 Гц, 3Н).
Соединение 269 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, EST): tR=0,574 мин, [М+Н]+=848,5.
Пример 175: Синтез соединения 270
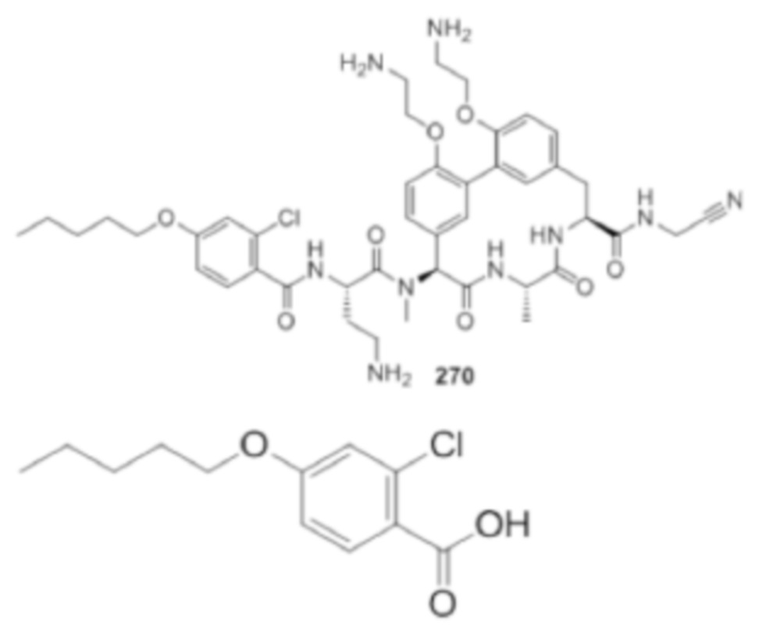
На основе подобных процедур, описанных в примере 172, 2-хлор-4-(пентилокси)бензойную кислоту (160 мг, 0,6593 ммоль, 94% выход) получали в виде желтого твердого вещества. 1Н ЯМР (400 МГц, CD3OD): δ 7.90 (d, J=8.8 Гц, 1Н), 7.02 (d, J=2.8 Гц, 1Н), 6.92 (dd, J=8.8, 2.4 Гц, 1Н), 4.04 (t, J=6.4 Гц, 2Н), 1.85-1.75 (m, 2Н), 1.50-1.35 (m, 4Н), 0.96 (t, J=7.2 Гц, 3Н).
Соединение 270 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, EST): tR=0,591 мин, [М+Н]+=862,6.
Пример 176: Синтез соединения 271


На основе подобных процедур, описанных в примере 172, 2-хлор-4-(гексилокси)бензойную кислоту (670 мг, 2,61 ммоль, 88,3% выход) получали в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=0,926 мин, [М+Н]+=256,9.
Соединение 271 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, ESI): tR=0,735 мин, [М+Н]+=876,6.
Пример 177: Синтез соединения 272

Соединение 272 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 172 (соединение 267) из 2-хлор-4-(октилокси)бензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,649 мин, [М+Н]+=904,6.
Пример 178: Синтез соединения 273

Соединение 273 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 172 (соединение 267) из 4-(гептилокси)-2-(трифторметил)бензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,634 мин, [М+Н]+=924,4.
Пример 179: Синтез соединения 274
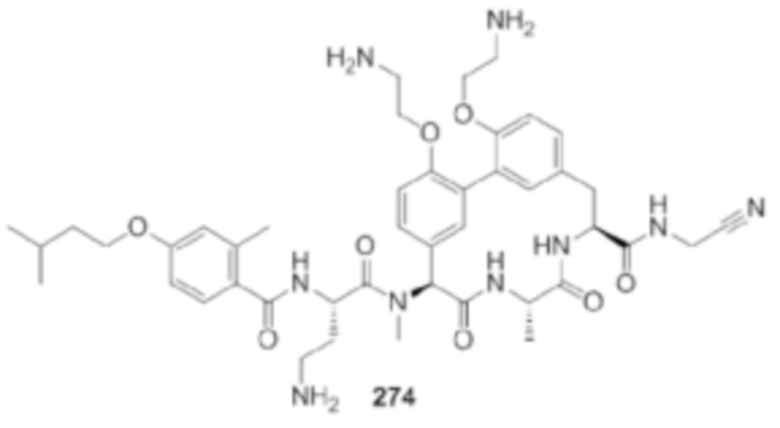
Соединение 274 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, ESI): tR=0,582 мин, [М+Н]+=842,3.
Пример 180: Синтез соединения 275
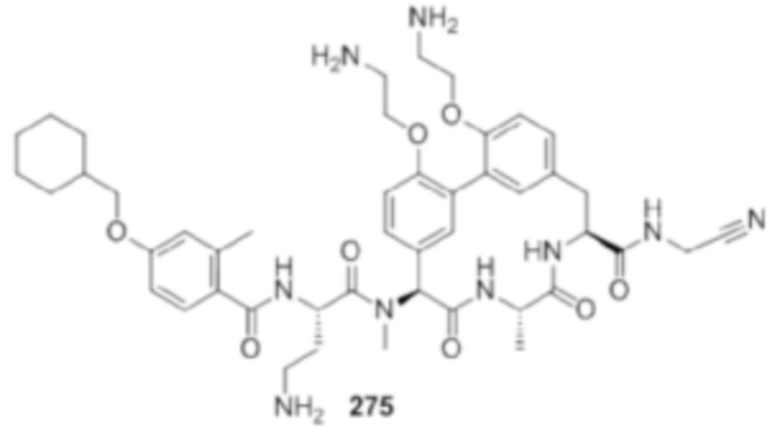
Соединение 275 (соль муравьиной кислоты) получали с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, ESI): tR=0,601 мин, [М+Н]+=868,5.
Пример 181: Синтез соединения 276

Соединение 276 (соль муравьиной кислоты) получали с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, ESI): tR=0,679 мин, [М+Н]+=828,5.
Пример 182: Синтез соединения 277
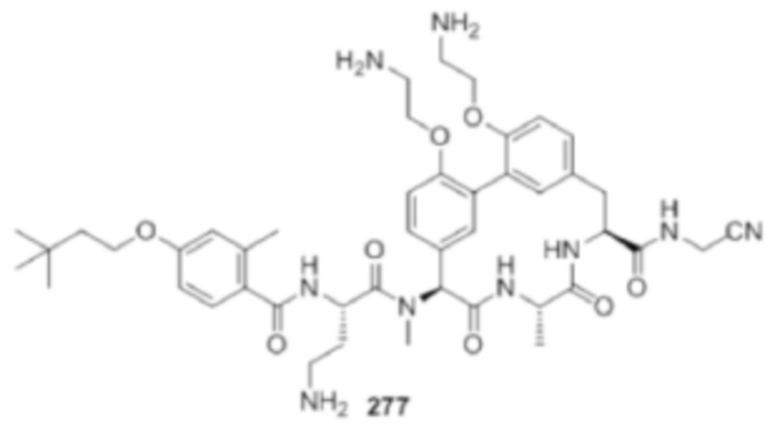
Соединение 277 (соль муравьиной кислоты) получали с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, ESI): tR=0,613 мин, [M+Na]+=878,4.
Пример 183: Синтез соединения 278

Соединение 278 (соль муравьиной кислоты) получали с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, ESI): tR=0,706 мин, [М+Н]+=904,5.
Пример 184: Синтез соединения 279

Соединение 279 (соль муравьиной кислоты) получали с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, ESI): tR=0,713 мин, [М+Н]+=862,4.
Пример 185: Синтез соединения 280

Соединение 280 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 172 (соединение 267) из 2-метил-4-(неопентилокси)бензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,575 мин, [М/2+Н]+=421,9.
Пример 186: Синтез соединения 281

Соединение 281 (соль муравьиной кислоты) получали в виде белого твердого вещества (38 мг) с применением способов примера 172 (соединение 267) из 4-(гептилокси)-2-метилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,755, [М+Н]+=884,5.
Пример 187: Синтез соединения 282
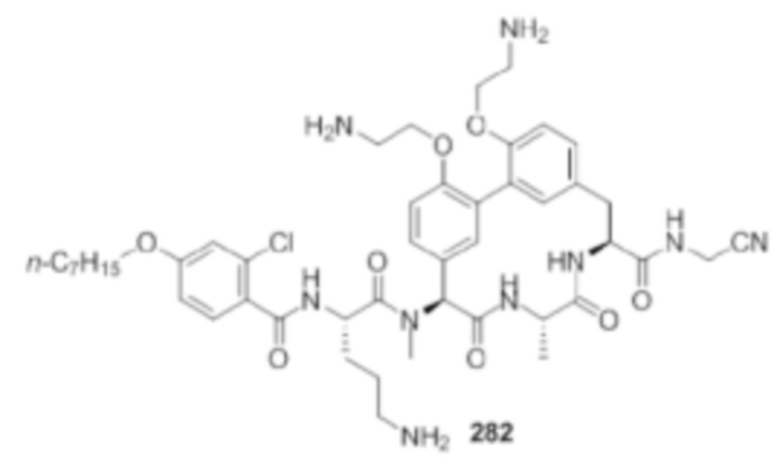
Соединение 282 (соль муравьиной кислоты) получали в виде белого твердого вещества (87 мг) с применением способов примера 172 (соединение 267) из 2-хлор-4-(гептилокси)бензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,760, [М+Н]+=904,9; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.45 (brs, 1H, НСООН), 7.46 (d, J=8.0 Гц, 1Н), 7.32-7.24 (m, 2Н), 7.18 (d, J=8 Гц, 1H), 7.11 (d, J=8 Гц, 1H), 7.02 (brs, 1H), 6.94 (d, J=8.0 Гц, 1H), 6.89 (bis, 1H), 6.81 (brs, 1H), 6.41 (s, 1H), 5.07-5.03 (m, 1H), 4.81-4.75 (m, 2Н), 4.29-4.17 (m, 4Н), 4.20 (s, 2H), 4.01 (t, J=4.8 Гц, 2H), 3.38-3.34 (m, 1H), 3.28-3.24 (m, 4H), 3.15-3.05 (m, 1H), 3.01-2.94 (m, 1H), 2.96 (s, 3H), 2.02-1.97 (m, 1H), 1.90-1.75 (m, 5H), 1.52-1.30 (m, 11H), 0.92 (t, J=6.8 Гц, 3Н).
Пример 188: Синтез соединения 283

К перемешиваемому раствору метил-2-хлор-4-гидроксибензоата (200,0 мг, 1,07 ммоль), гепт-2-ин-1-ола (120,23 мг, 1,07 ммоль) и дифенил-2-пиридилфосфина (338,63 мг, 1,29 ммоль) в сухом тетрагидрофуране (10 мл) при 0°С в атмосфере азота по каплям добавляли раствор ди-трет-бутилазодикарбоксилата (296,17 мг, 1,29 ммоль) в THF (2 мл) в течение 5 мин. Реакционную смесь перемешивали в течение 1 ч и растворитель выпаривали при пониженном давлении. Полученное масло разбавляли водой (30 мл) и экстрагировали EtOAc (25 мл × 3). Объединенные органические слои промывали 1 н HCl (10 мл × 3) и солевым раствором (20 мл × 3), сушили над Na2SO4 и концентрировали. Остаток очищали методом преп-TLC (10% EtOAc в петролейном эфире, Rf=0,1) с получением метил 2-хлор-4-гепт-2-иноксибензоата (220 мг, 0,7836 ммоль, 73,1% выход) в виде бесцветного масла. НЯМР (400 МГЦ, CDCl3): 7.86 (d, J=8.8 Гц, 1Н), 7.04 (d, J=2.8 Гц, 1H), 6.89-6.87 (m, 1H), 4.69 (s, 2H), 3.88 (s, 3H), 2.20 (t, J=6.8 Гц, 2H), 1.49-1.43 (m, 2H), 1.39-1.35 (m, 2H), 0.87 (t, J=7.2 Гц, 3Н).
Соединение 283 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,712 мин, [М+Н]+=886,4.
Пример 189: Синтез соединения 284


К раствору метилизобутирата (2000,0 мг, 19,58 ммоль) в тетрагидрофуране (50 мл), охлажденному при -78°С под защитой N2 добавляли диизопропиламид лития (11,75 мл, 23,5 ммоль) и перемешивали при 0°С в течение 3 ч. Добавляли пропаргилбромид (2562,5 мг, 21,54 ммоль). После перемешивания при 20°С в течение 2 ч реакцию гасили насыщенным раствором NH4Cl (10 мл) и экстрагировали EtOAc (20 мл). Органический слой промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (10% EtOAc в петролейном эфире) с получением метил-2,2-диметилпент-4-иноата (500 мг, 3,5668 ммоль, 18,2% выход) в виде желтого масла.
К раствору метил-2,2-диметилпент-4-иноата (4000,0 мг, 28,54 ммоль) в тетрагидрофуране (5 мл), охлажденному до 0°С, частями добавляли алюмогидрид лития (1600,0 мг, 42,8 ммоль) и перемешивали при 0°С в течение 3 ч. Реакцию гасили последовательно водой (1 мл), 10% раствором NaOH (1 мл) и водой (1 мл). Смесь фильтровали и концентрировали с получением 2,2-диметилпент-4-ин-1-ола (3000 мг, 26,745 ммоль, 93,7% выход) в виде желтого масла. 1Н ЯМР (400 МГц, CDCl3) δ 3.44 (s, 2Н), 2.18 (d, J=2.4 Гц, 2Н), 2.01 (t, J=2.6 Гц, 1Н), 0.99 (s, 6Н).
Смесь 2,2-диметилпент-4-ин-1-ола (500,0 мг, 4,46 ммоль), 4-диметиламинопиридина (54,5 мг, 0,45 ммоль), триэтиламина (2255,3 мг, 22,29 ммоль) и пара-толуолсульфонилхлорид а (1699,7 мг, 8,92 ммоль) в дихлорметане (20 мл) перемешивали при 35°С в течение 16 ч и концентрировали досуха. Остаток переносили 6 EtOAc (20 мл), промывали водой (20 мл × 2) и солевым раствором (10 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (10% EtOAc в петролейном эфире) с получением 2,2-диметилпент-4-инил-4-метилбензолсульфоната (900 мг, 3,38 ммоль, 75,8% выход) в виде желтого масла.
Смесь метил-4-гидрокси-2-метилбензоата (100,0 мг, 0,60 ммоль), карбоната цезия (588,23 мг, 1,81 ммоль) и 2,2-диметилпент-4-инил-4-метилбензолсульфоната (320,6 мг, 1,2 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 120°С в течение 16 ч. Реакцию гасили водой (20 мл) и экстрагировали EtOAc (20 мл). Органический слой промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (10% EtOAc в петролейном эфире) с получением метил-4-(2,2-диметилпент-4-инокси)-2-метилбензоата (150 мг, 95,7% выход) в виде желтого масла. Сложноэфирным гидролизом с NaOH (общий способ NaOH) получали 4-((2,2-диметилпент-4-ин-1-ил)окси)-2-метилбензойную кислоту.
Соединение 284 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,600 мин, [М+Н]+=867,5.
Пример 190: Синтез соединения 285

Соединение 285 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 189 (соединение 284), за исключением того, что аллилбромид использовали в начальной стадии алкилирования с метилизобутиратом. LCMS (способ 5-95 АВ, ESI): tR=0,599 мин, [М+Н]+=868,5.
Пример 192: Синтез соединения 287
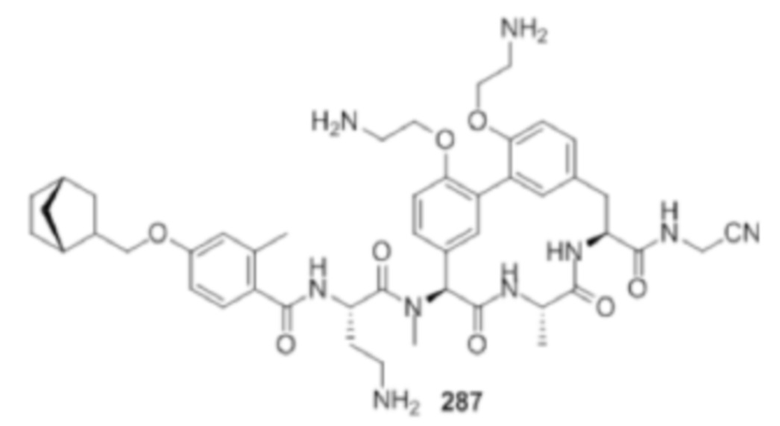
Соединение 287 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 189 (соединение 284) начиная с (1R,4S)-бицикло[2.2.1]гептан-2-илметанола.
LCMS (способ 5-95 АВ, ESI): RT=0,723, [М+Н]+=880,5.
Пример 193: Синтез соединения 288

К 2,2-диметилпентановой кислоте (500 мг, 3,84 ммоль) добавляли 1 М боран (19,2 мл, 19,2 ммоль) в тетрагидрофуране при 0°С и перемешивали в течение 16 ч в атмосфере азота. Реакцию гасили МеОН при 0°С и концентрировали с получением неочищенного 2,2-диметилпентан-1-ола (540 мг, 4,6472 ммоль) в виде желтого масла. 1Н ЯМР (400 МГц, CDCl3): δ 3.31 (s, 2Н), 1.35-1.15 (m, 4Н), 0.90 (t, J=6.8 Гц, 3Н), 0.86 (s, 6Н).
Соединение 288 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 189 (соединение 284). LCMS (способ 5-95 АВ, ESI): tR=0,749 мин, [M+Na]+=892,8.
Пример 194: Синтез соединения 289
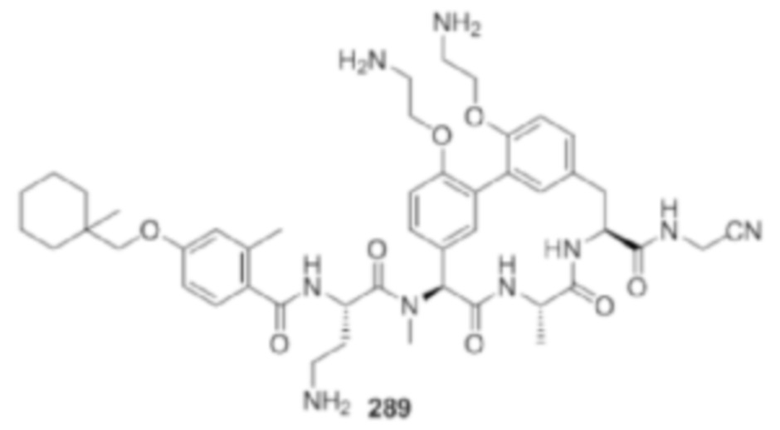
Соединение 289 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 193 (соединение 288) начиная с 1-метилциклогексанкарбоновой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,636 мин, [M+Na]+=904,5.
Пример 195: Синтез соединения 290

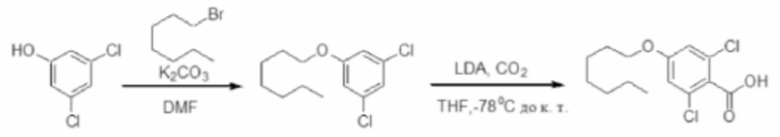
Стадия 1: 1,3-Дихлор-5-гептоксибензол получали с применением способов примера 172 (соединение 267).
Стадия 2: К раствору 1,3-дихлор-5-гептоксибензола (200,0 мг, 0,77 ммоль) в тетрагидрофуране (10 мл) добавляли диизопропиламид лития (0,37 мл, 0,92 ммоль) и перемешивали при -78°С в течение 1 ч. СО2 барботировали и перемешивали при -78°С в течение 2 ч. Реакцию гасили водой (40 мл) и экстрагировали EtOAc (30 мл × 3). Органические слои промывали водой (50 мл × 2) и солевым раствором (50 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом преп-TLC (20% EtOAc в петролейном эфире, Rf=0,5) с получением 2,6-дихлор4-гептоксибензойной кислоты (150 мг, 64,2% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3): δ 6.72 (s, 2Н), 3.83 (t, J=6.4 Гц, 2Н), 1.69-1.64 (m, 2Н), 1.35-1.19 (m, 8Н), 0.82 (t, J=6.4 Гц, 3Н).
Соединение 290 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,754 мин, [М+Н]+=924,5.
Пример 196: Синтез соединения 291
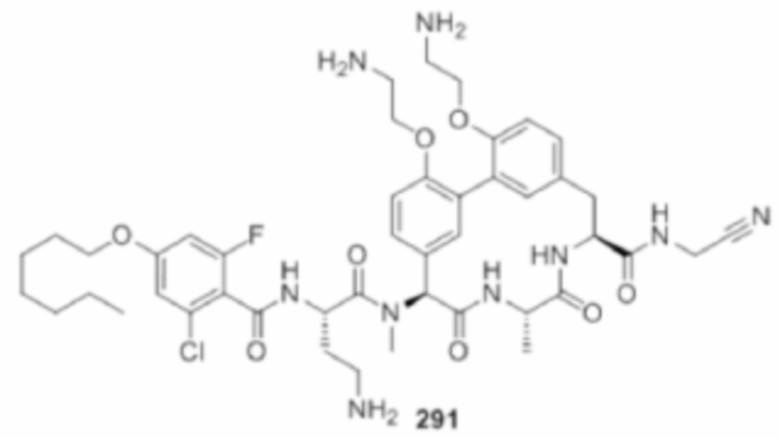
Соединение 291 (соль муравьиной кислоты) получали с применением способов примера 195 (соединение 290). LCMS (способ 5-95 АВ, ESI): RE=0,756 мин, [М+Н]+=909,6.
Пример 197: Синтез соединения 292
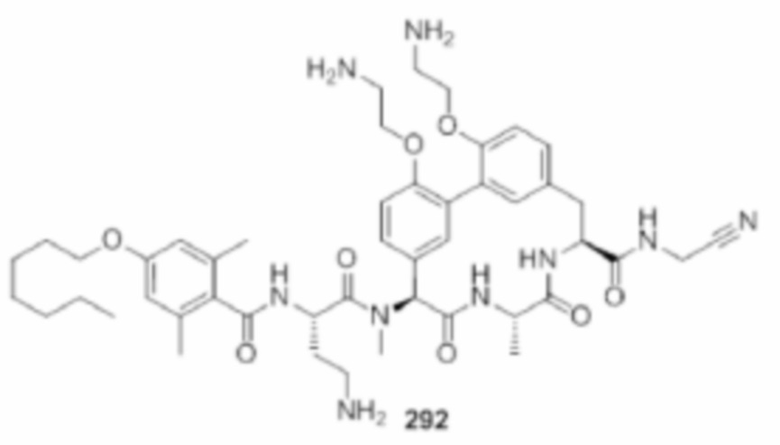

Метил-4-(гетилокси)-2,6-диметилбензоат получали при условиях карбонилирования примера 170 (соединение 265) из 2-бром-5-(гептилокси)-1,3-диметил бензола.
Соединение 292 (соль муравьиной кислоты) получали с применением способов примера 170 (соединение 265). LCMS (способ 5-95 АВ, ESI): tR=0,752 мин, [М+Н]+=884,5.
Пример 198: Синтез соединения 293

Соединение 293 (соль муравьиной кислоты) получали с применением способов примера 197 (соединение 292). LCMS (способ 5-95 АВ, ESI): tR=0,631 мин, [М+Н]+=908,5.
Пример 199: Синтез соединения 294

Соединение 294 (соль муравьиной кислоты) получали с применением способов примера 197 (соединение 292). LCMS (способ 5-95 АВ, ESI): tR=0,761 мин, [М+Н]+=884,4.
Пример 200: Синтез соединения 295

Соединение 295 (соль муравьиной кислоты) получали с применением способов примера 197 (соединение 292). LCMS (способ 5-95 АВ, ESI): tR=0,635 мин, [М+Н]+=906,4.
Пример 201: Синтез соединения 296

Соединение 296 (соль муравьиной кислоты) получали с применением способов примера 197 (соединение 292). LCMS (способ 5-95 АВ, ESI): tR=0,738 мин, [М+Н]+=878,4.
Пример 202: Синтез соединения 297
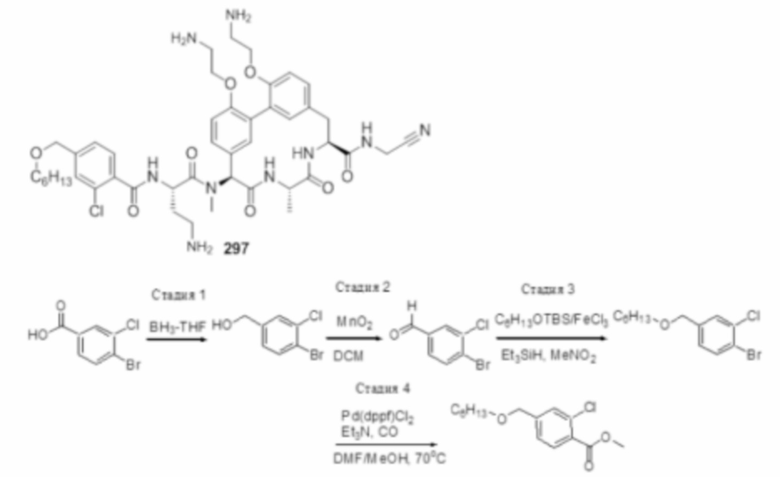
Стадия 1: Комплекс боран-THF (31,85 мл, 31,85 ммоль) добавляли к 4-бром-3-хлорбензойной кислоте (1,5 г, 6,37 ммоль) при 0°С и перемешивали при 0°С в течение 10 ч. Реакцию гасили метанолом (50 мл) и концентрировали при пониженном давлении с получением (4-бром-3-хлорфенил) метанол а (1,3 г, 5,8696 ммоль, 92,1% выход) в виде светло-желтого масла.
Стадия 2: К раствору (4-бром-3-хлорфенил)метанола (1,3 г, 5,87 ммоль) в 1,2-дихлорэтане (20 мл) при 25°С добавляли диоксид марганца (5,1 г, 58,7 ммоль) и перемешивали при 25°С в течение 18 ч. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали на колонке с силикагелем (5-10% EtOAc в петролейном эфире) с получением 4-бром-3-хлорбензальдегида (600 мг, 46,6% выход) в виде светло-желтого масла.
Стадия 3: К суспензии безводного хлорида трехвалентного железа (14,2 мг, 0,09 ммоль) и 4-бром-3-хлорбензальдегида (462,4 мг, 2,11 ммоль) в нитрометане (10 мл) постепенно добавляли трет-бутил(гексилокси)диметилсилан (380,0 мг, 1,76 ммоль) и триэтилсилан (449,1 мг, 3,86 ммоль) при 0°С в атмосфере азота. После перемешивания при комнатной температуре в течение 30 мин реакцию гасили фосфатным буфером до значения рН=7 и экстрагировали DCM (45 мл × 3). Объединенные органические слои промывали солевым раствором (15 мл × 3), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом преп-TLC (5% EtOAc в петролейном эфире) с получением 1-бром-2-хлор-4-((гексилокси)метил)бензола (450 мг, 83,9% выход) в виде бесцветного масла.
Стадия 4: На основе процедуры метоксикарбонилирования (общий способ карбонилирования) 1-бром-2-хлор-4-((гексилокси)метил)бензол (200,0 мг, 0,65 ммоль) превращали в метил-2-хлор-4-((гексилокси)метил)бензоат (125 мг, 67,1% выход) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDCl3): δ 7.80 (d, J=8.0 Гц, 1Н), 7.42 (s, 1H), 7.25 (d, J=8.0 Гц, 1H), 4.49 (s, 2H), 3.91 (s, 3H), 3.46 (t, J=6.6 Гц, 2H), 1.64-1.61 (m, 2H), 1.37-1.29 (m, 6H), 0.88 (t, J=6.6 Гц, 3Н).
Соединение 297 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,719 мин, [М+Н]+=890,9.
Пример 203: Синтез соединения 298

К раствору 4-бром-2-метилбензойной кислоты (3,0 г, 13,95 ммоль) в тетрагидрофуране (30 мл) при -78°С добавляли 2 М nBuLi (13,95 мл, 27,9 ммоль) в гексане и перемешивали при -78°С в течение 3 ч. Добавляли DMF (2,0 г, 27,9 ммоль) и смесь перемешивали при -78°С в течение 1,5 ч. Реакцию гасили 1 н HCl (20 мл) и экстрагировали EtOAc (200 мл × 4). Объединенные органические слои сушили над Na2SO4 и концентрировали. Полученное желтое твердое вещество промывали петролейным эфиром с получением неочищенной 4-формил-2-метилбензойной кислоты (900 мг, 5,4825 ммоль, 39,3% выход), которую использовали сразу на следующей стадии.
К раствору 4-формил-2-метилбензойной кислоты (0,9 г, 5,48 ммоль) в N,N-диметилформамиде (5 мл) при 20°С добавляли K2CO3 (2269,8 мг, 16,45 ммоль) и йодметан (2,84 г, 20,01 ммоль) и перемешивали в течение 10 ч. Смесь разбавляли 1 н HCl (15 мл) и экстрагировали EtOAc (30 мл × 3). Объединенные органические слои промывали солевым раствором (30 мл × 3), сушили над Na2SO4 и концентрировали. Остаток очищали на колонке с силикагелем (5% EtOAc в петролейном эфире) с получением метил-4-формил-2-метилбензоата (900 мг, 5,0511 ммоль, 92,1% выход) в виде желтого масла. 1Н ЯМР (400 МГц, CDCl3): δ 10.03 (s, 1Н), 8.01 (d, J=8.4 Гц, 1Н), 7.74-7.72 (m, 2Н), 3.92 (s, 3Н), 2.65 (s, 3Н).
Соединение 298 (соль муравьиной кислоты) получали с применением способов примера 202 (соединение 297). LCMS (способ 5-95 АВ, ESI): tR=0,726 мин, [М+Н]+=870,5.
Пример 204: Синтез соединения 299
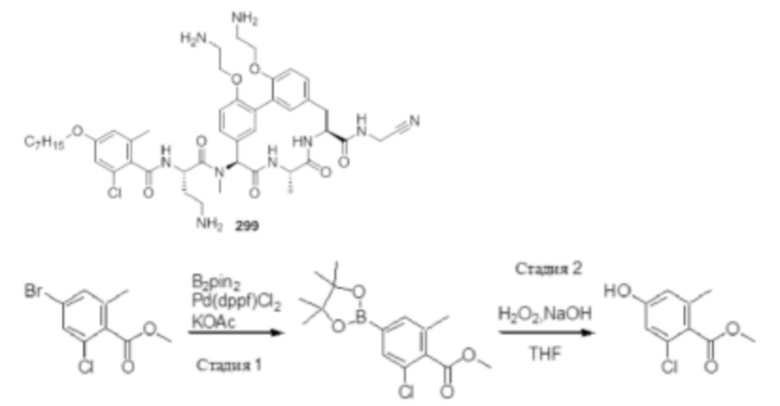
Стадия 1: К раствору метил-4-бром-2-хлор-6-метилбензоата (300 мг, 1,14 ммоль) и бис(пинаколято)диборона (361,4 мг, 1,42 ммоль) в диметилсульфоксиде (5 мл) добавляли 1,1'-бис(дифенилфосфино)ферроцена палладия дихлорид (83,3 мг, 0,11 ммоль) и ацетат калия (290,5 мг, 2,96 ммоль) и перемешивали при 100°С в течение 16 ч в атмосфере N2. Реакционную смесь разбавляли водой (5 мл) и экстрагировали EtOAc (10 мл × 3). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом преп-TLC (9% EtOAc в петролейном эфире, Rf=0,5) с получением метил 2-хлор-6-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (260 мг, 73,5% выход). 1Н ЯМР (400 МГц, CDCl3): δ 7.63 (s, 1Н), 7.51 (s, 1H), 3.92 (s, 3H), 2.30 (s, 3H), 1.32 (s, 12H).
Стадия 2: К раствору метил-2-хлор-6-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (260,0 мг, 0,84 ммоль) в тетрагидрофуране (3 мл) добавляли пероксид водорода (187,1 мг, 1,93 ммоль) и 1 М водн. гидроксид натрия (0,84 мл, 0,84 ммоль) и перемешивали при 28°С в течение 16 ч. Смесь разбавляли водой (5 мл) и экстрагировали EtOAc (10 мл × 3). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного метил-2-хлор-4-гидрокси-6-метилбензоата (150 мг, 89,3% выход) в виде желтого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=0,654 мин, [М+Н]+=200,9.
Соединение 299 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 172 (соединение 267). LCMS (способ 5-95 АВ, ESI): tR=0,756 мин, [М+Н]+=904,5.
Пример 205: Синтез соединения 300 и 301
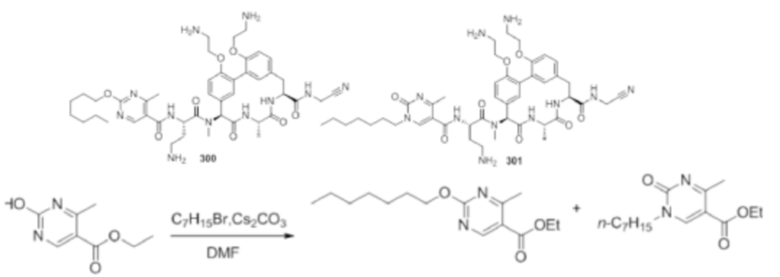
К раствору этил-2-гидрокси-4-метиштиримидин-5-карбоксилата (200,0 мг, 1,1 ммоль) в N,N-диметилформамиде (5 мл) добавляли карбонат цезия (1073,1 мг, 3,29 ммоль) и 1-бромгептан (636,03 мг, 3,29 ммоль). Смесь перемешивали при 20°С в течение 16 ч и концентрировали досуха. Остаток переносили в EtOAc (50 мл), промывали водой (50 мл × 2) и солевым раствором (50 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом преп-TLC с получением этил-2-(гептилокси)-4-метилпиримидин-5-карбоксилата (55 мг, 0,1962 ммоль, 17,9% выход; 5% EtOAc в петролейном эфире, Rf=0,3) и этил-1-гептил-4-метил-2-оксо-1,2-дигидропиримидин-5-карбоксилата (130 мг, 0,4637 ммоль, 42,2% выход; 50% EtOAc в петролейном эфире, Rf=0,3), оба в виде белого твердого вещества.
Соединение 299 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из этил-2-(гептилокси)-4-метилпиримидин-5-карбоксилата. LCMS (способ 5-95 АВ, ESI): tR=0,722 мин, [М+Н]+=872,4.
Соединение 300 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из этил-1-гептил-4-метил-2-оксо-1,2-дигидропиримидин-5-карбоксилата. LCMS (способ 5-95 АВ, ESI): tR=0,646 мин, [М+Н]+=872,6.
Пример 206: Синтез соединения 302

Стадия 1: Дегазированную смесь 4-трет-бутил фенола (275,4 мг, 1,83 ммоль), метил-4-бром-2-метилбензоата (350,0 мг, 1,53 ммоль), (диметиламино)уксусной кислоты (86,7 мг, 0,84 ммоль), хлорида меди (75,6 мг, 0,76 ммоль) и карбоната цезия (995,7 мг, 3,06 ммоль) в 1,4-диоксане (10 мл) нагревали при 105°С в течение 16 ч в атмосфере азота. После охлаждения реакционную смесь разбавляли EtOAc (15 мл) и фильтровали. Фильтрат концентрировали и остаток очищали методом преп-TLC (2% EtOAc в петролейном эфире, Rf=0,5) с получением метил-4-(4-(трет-бутил)фенокси)-2-метилбензоата (240 мг, 52,6% выход) в виде бесцветного масла.
Стадия 2: Метил-4-(4-(трет-бутил)фенокси)-2-метилбензоат (240,0 мг, 0,80 ммоль) гидролизировали, как описано ранее (общий способ NaOH), с получением 4-(4-(трет-бутил)фенокси)-2-метилбензойной кислоты (210 мг, 91,8% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц CDCl3): δ 8.06 (d, J=8.4 Гц, 1Н), 7.41 (d, J=8.8 Гц, 2H), 7.01 (d, J=8.4 Гц, 2H), 6.89-6.78 (m, 2H), 2.64 (s, 3H), 1.36 (s, 9H).
Соединение 302 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,777 мин, [М+Н]+=904,6.
Пример 207: Синтез соединения 303

На основе подобных процедур, описанных в примере 206, 4-(4-бутилфенокси)-2-метилбензойную кислоту (180 мг, 94,4% выход) получали в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3): δ 8.06 (d, J=8.8 Гц, 1Н), 7.20 (d, J=8.4 Гц, 2H), 6.99 (d, J=8.4 Гц, 2H), 6.86-6.77 (m, 2H), 2.67-2.58 (m, 5H), 1.67-1.59 (m, 2H), 1.42-1.36 (m, 2H), 0.96 (t, J=7.2 Гц, 3H).
Соединение 303 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,756 мин, [М+Н]+=904,4.
Пример 208: Синтез соединения 304
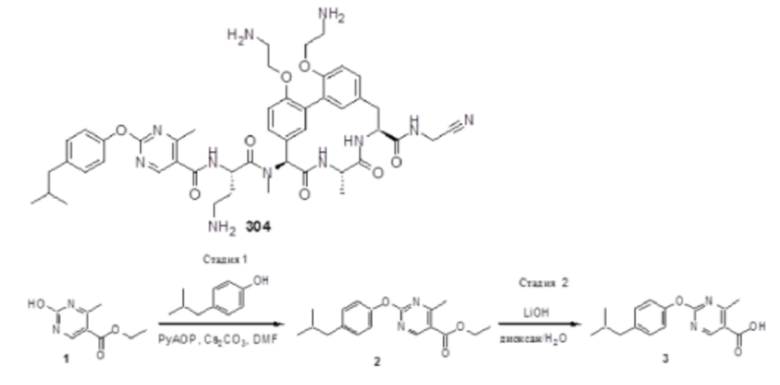
Смесь этил-2-гидрокси-4-метилпиримидин-5-карбоксилата (50,0 мг, 0,27 ммоль), РуАОР (485,5 мг, 1,1 ммоль) и Cs2CO3 (179 мг, 0,55 ммоль) в N,N-диметилформамиде (5 мл) перемешивали при 25°С в течение 1 ч, затем добавляли 4-изобутилфенол (164,9 мг, 1,1 ммоль) и Cs2CO3 (179 мг, 0,55 ммоль). Реакционную смесь перемешивали в микроволновом облучении при 75°С в течение 1 ч, разбавляли водой (20 мл) и экстрагировали EtOAc (25 мл ×3). Объединенные органические слои промывали солевым раствором (25 мл ×3), сушили над Na2SO4 и концентрировали. Остаток очищали методом преп-TLC (10% EtOAc в петролейном эфире) с получением этил-2-(4-изобутилфенокси)-4-метилпиримидин-5-карбоксилата (110 мг, 63,7% выход).
Стадия 2: Этил-2-(4-изобутилфенокси)-4-метилпиримидин-5-карбоксилат (110,0 мг, 0,35 ммоль) гидролизировали LiOH (общий способ LiOH) с получением 2-(4-изобутилфенокси)-4-метилпиримидин-5-карбоновой кислоты (60 мг, 59,9% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3): δ 9.07 (s, 1H), 7.20 (d, J=8.8 Гц, 2H), 7.11 (d,J=8.4 Гц, 2H), 2.82 (s, 3H), 2.50 (d, J=7.2 Гц, 2H), 1.95-1.80 (m, 1H), 0.94 (d, J=6.4 Гц, 6H).
Соединение 304 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,722 мин, [М+Н]+=906,4.
Пример 209: Синтез соединения 305
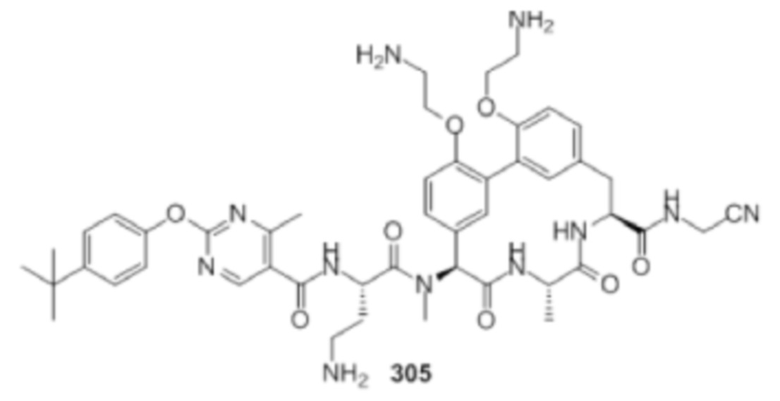
Соединение 305 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 208 (соединение 304). LCMS (способ 5-95 АВ, ESI): tR=0,706 мин, [М+Н]+=906,5.
Пример 210: Синтез соединения 306
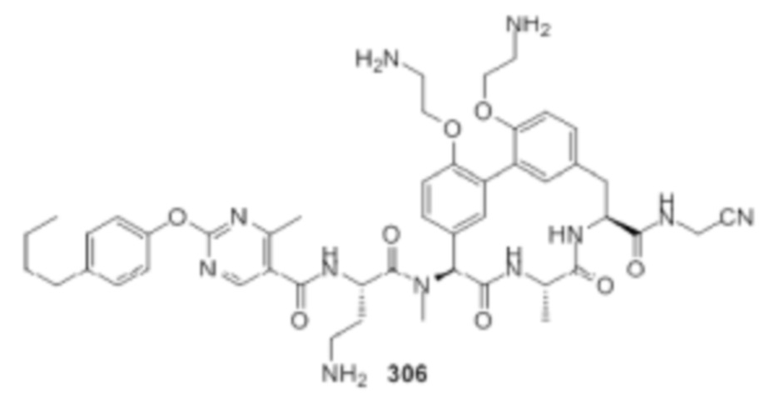
Соединение 306 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 208 (соединение 304). LCMS (способ 5-95 АВ, EST): tR=0,718 мин, [М+Н]+=906,7.
Пример 211: Синтез соединения 307

Получение алкинильных ароматических соединений проводили реакцией сочетания по Соногашире и основным гидролизом. Метил-2-метил-4-(пент-1-ин-1-ил)бензоат является промежуточным соединением при получении соединения 197 (пример 103).
Сложиоэфирным гидролизом с NaOH согласно примеру 47 получали 2-метил-4-(пент-1-ин-1-ил)бензойную кислоту.
Соединение 307 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95 АВ, ESI): tR=0,686, [М+Н]+=822,4.
Пример 212: Синтез соединения 308
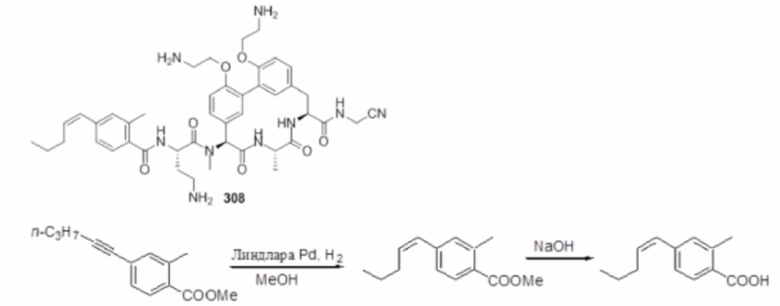
Стадия 1: К раствору метил-2-метил-4-(пент-1-ин-1-ил)бензоата (пример 103) (300 мг, 1,4 ммоль) в МеОН (50 мл) добавляли Pd катализатор Линдлара (30 мг, 0,46 ммоль) и смесь перемешивали при комнатной температуре в атмосфере Н2 (15 фунт/кв. дюйм) в течение 1 ч. Фильтрат концентрировали с получением (Z)-метил-2-метил-4-(пент-1-ен-1-ил)бензоата (200 мг, 65% выход) в виде бесцветного масла. LCMS (5-95 АВ, 2 мин, ESI): tR=1,464, [М+Н]+=219,2.
Стадия 2: Процедуру сложноэфирного гидролиза с NaOH (пример 47) использовали по отношению к (Z)-метил-2-метил-4-(пент-1-ен-1-ил)бензоату (100 мг, 0,45 ммоль) с получением (Z)-2-метил-4-(пент-1-ен-1-ил)бензойной кислоты (80 мг, 85,4% выход) в виде белого твердого вещества.
Соединение 308 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95 АВ, ESI): tR=0,573, [М+Н]+=824,4; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.49 (brs, 2Н, НСООН), 7.39 (d, J=8.0 Гц, 1Н), 7.32 (d, J=8.0 Гц, 1Н), 7.24 (d, J=8.0 Гц, 1Н), 7.18 (brs, 1Н), 7.16 (d, J=8.0 Гц, 2Н), 7.09 (d, J=8.0 Гц, 1Н), 6.90 (brs, 1Н), 6.82 (brs, 1Н), 6.43 (d, J=12.0 Гц, 1Н), 6.33 (s, 1Н), 5.80-5.70 (m, 1Н), 5.12-5.16 (m, 1Н), 4.82-4.78 (m, 2Н), 4.36-4.16 (m, 4Н), 4.19 (s, 2Н), 3.37-3.10 (m, 8Н), 2.93 (s, 3Н), 2.43 (s, 3Н), 2.33-2.15 (m, 3Н), 2.12-2.00 (m, 1Н), 1.52-1.46 (m, 2Н), 1.36 (d, J=6.8 Гц, 3Н), 0.94 (t, J=7.2 Гц, 3Н).
Пример 213: Синтез соединения 309

Соединение 309 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 211 (соединение 307). LCMS (способ 5-95 АВ, ESI): tR=0,567 мин, [М+Н]+=822,7.
Пример 214: Синтез соединения 310

Соединение 310 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 211 (соединение 307). LCMS (способ 5-95 АВ, ESI): tR=0,743 мин, [М+Н]+=862,5.
Пример 215: Синтез соединения 311
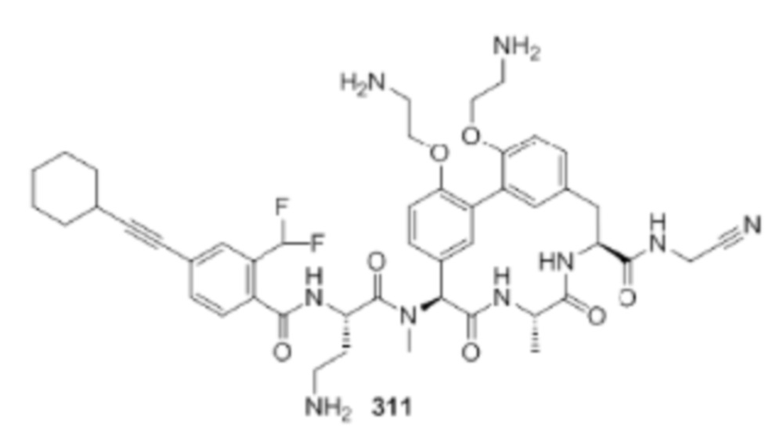
Соединение 311 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 211 (соединение 307). LCMS (способ 5-95 АВ, ESI): tR=0,743 мин, [М+Н]+=898,7.
Пример 216: Синтез соединения 312

Соединение 312 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 211 (соединение 307). LCMS (способ 5-95 АВ, ESI): RT=0,662 мин, [M+Na]+=887,7.
Пример 217: Синтез соединения 313

Соединение 313 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 133 (соединение 227). LCMS (способ 5-95 АВ, ESI): RT=0,611 мин, [M+Na]+=878,4.
Пример 218: Синтез соединения 314
Стадия 1: Соединение 101-D (2,0 г, 3,65 ммоль) добавляли к раствору 1,25 н HCl/МеОН (150 мл) и смесь перемешивали при 0°С в течение 4 ч. Летучие вещества удаляли с получением неочищенного соединения в виде белого твердого вещества.
Стадия 2: Вышеуказанное неочищенное соединение растворяли в DCM (5 мл) и в смесь добавляли Вос2О (0,93 г, 4,27 ммоль) и TEA (1,08 г, 10,7 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Летучие вещества удаляли и остаток очищали на испарительной колонке с силикагелем с получением соединения 314-А1 и соединения 314-А2 в виде смеси региоизомеров (1,8 г, 76,4% выход) в виде белого твердого вещества. LCMS (5-95 АВ, ESI): tR=0,880, [М+Н]+=684,6.
К смеси соединения 314-А1 и соединения 314-А2 (1,8 г, 2,72 ммоль) и трет-бутил(2-бромэтил)карбамата (3,0 г, 13,6 ммоль) в DMF (5 мл) добавляли K2CO3 (3,8 г, 27,2 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. В реакционную смесь добавляли DCM (50 мл), затем промывали 2 н HCl, насыщенным NaHCO3 и солевым раствором (20 мл каждого). Органический слой затем сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением смеси региоизомеров, которую дополнительно очищали методом SFC (OD, 250 мм ×30 мм, 5 мкм) с получением соединения 314-В1 (80 мг, 3,6% выход) и соединения 314-В2 (1,6 г, 73,2% выход) в виде белого твердого вещества.
Соединение 314 (свободное основание) получали с использованием способов, подобных описанным в примере 5 и примере 7 из соединения 314-В2. LCMS (5-95 АВ, ESI): tR=0,782, [M+H]+=811,5; 1Н ЯМР (400 МГц, МеОН-d4) δ 7.28-7.15 (m, 2H), 7.10 (d, J=8.0 Гц, 1H), 7.09-7.01 (m, 3H), 6.92 (brs, 1H), 6.83 (d, J=8.0 Гц 1H), 6.61 (brs, 1H), 6.55 (s, 1H), 5.12-5.09 (m, 1H), 4.81-4.78 (m, 1H), 4.68-4.66 (m, 1H), 4.19 (s, 2H), 4.18-4.10 (m, 2H), 3.24-3.20 (m, 1H), 3.14-3.06 (m, 1H), 3.02-2.96 (m, 2H), 2.98 (s, 3H), 2.87-2.80 (m, 2H), 2.53-2.48 (m, 1H), 2.33 (s, 3H), 2.10-1.90 (m, 1H), 1.57-1.54 (m, 2H), 1.36-1.29 (m, 12H), 0.91 (t, J=7.2 Гц, 3H).
Пример 219: Синтез соединения 315
Соединение 315 (свободное основание) получали с использованием способов, подобных описанным в примере 5 и примере 7 из соединения 314-В1. LCMS (5-95 АВ, ESI):tR=0,788, [М+Н]+=811,4.
Пример 220: Синтез соединения 316

Соединение 316 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 37 (соединение 131) из соединения 314-В2. LCMS (5-95 АВ, ESI): tR=0,794, [М+Н]+=706,3; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.53 (brs, 1Н), 7.28 (d, J=8.0 Гц, 1H), 7.15-7.11 (m, 2H), 6.94 (brs, 1Н), 6.90 (d, J=8.0 Гц 1H), 6.78 (brs, 1H), 6.36 (s, 1H), 4.83-4.87 (m, 3H), 4.32-4.36 (m, 2H), 4.31 (s, 2H), 3.33-3.26 (m, 2H), 3.16-3.05 (m, 4H), 2.93 (brs, 2H), 2.76 (s, 3H), 1.66-1.80 (m, 2H), 1.35-1.42 (m, 19H), 0.92 (t, J=6.4 Гц, 3H).
Пример 221: Синтез соединения 317

Соединение 317 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 37 (соединение 131) из соединения 314-В1. LCMS (5-95 АВ, ESI): tR=0,640, [М+Н]+=706,3
Пример 222: Синтез соединения 318

Стадия 1: К перемешиваемому раствору соединения 318-А (211 мг, 0,2 ммоль) в сухом МеОН (5 мл) при 0°С медленно по каплям добавляли SOCl2 (0,2 мл). Реакционную смесь перемешивали при к.т. всю ночь. Растворитель удаляли при пониженном давлении, а остаток сушили под высоким вакуумом и использовали сразу в следующей реакции с получением соединения 318-В. LCMS: MS (ESI) для C41H44ClN5O8: m/z 770,1 (М+Н)+.
Стадия 2: Соединение 318-В (0,3 ммоль) растворяли в CH2Cl2 (8 мл) и Et3N (140 мкл, 1,0 ммоль, 5 экв.), к этому перемешиваемому раствору добавляли (Вос)2О (106 мкл, 0,46 ммоль, 2,3 экв.). Реакционную смесь перемешивали при к.т. всю ночь. После завершения реакции добавляли солевой раствор и смесь экстрагировали этилацетатом. Объединенные органические слои промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали методом флеш-хроматографии (DCM - 5% DCM-MeOH) с получением 152 мг (78%, за 2 стадии) соединения 318-С в виде белого твердого вещества. MS (ESI) для (C51H60ClN5O12): m/z 970,2 (М+Н)+.
Стадия 3: К перемешиваемому раствору соединения 318-С (145 мг, 0,15 ммоль) в сухом DMF (5 мл) добавляли K2CO3 (42 мг, 0,3 ммоль, 2 экв.), а затем трет-бутил(2-бромэтил)карбамат (100 мг, 0,45 ммоль). Реакционную смесь перемешивали при к.т. всю ночь. После завершения реакции добавляли дробленый лед и полученную белую мутную смесь экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором и сушили над безводный Na2SO4, фильтровали и растворитель удаляли в вакууме. Остаток очищали методом флеш-хроматографии (DCM - 5% DCM-MeOH) с получением 118 мг (71%) соединения 318-D в виде белого твердого вещества. MS (ESI) для (C58H73ClN6O14): m/z 1113,4 (М+Н)+.
Соединение 318 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331) из соединения 318-D. LCMS (ESI): [М+Н]+=837,4.
Пример 223: Синтез соединения 319
(S)-2-Аминопропаннитрил получали способом, подобным (R)-2-аминопропаннитрилу (пример 42, за исключением того, что (S)-2-((трет-бутоксикарбонил)амино)пропановую кислоту использовали в качестве исходного вещества.
Соединение 319 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331) из (S)-2-аминопропаннитрила. LCMS (ESI): [М+Н]+=851,4.
Пример 224: Синтез соединения 320
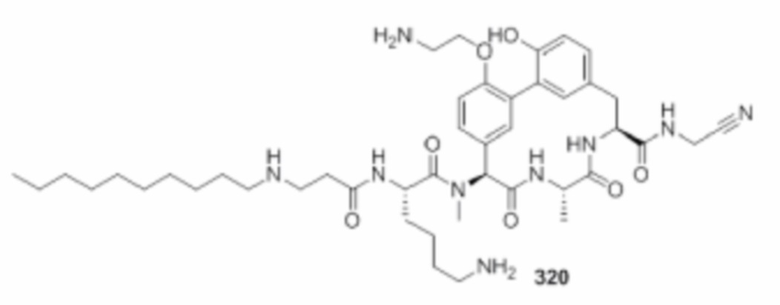
Соединение 320 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 222. LCMS (ESI): [М+Н]+=834,6.
Пример 225: Синтез соединения 321

Соединение 321-А получали с применением способов примера 218.
Раствор соединения 321-А (410,0 мг, 0,38 ммоль) и пиперидина (1 мл, 11,74 ммоль) в дихлорметане (4 мл) перемешивали при 25°С в течение 18 ч. Реакционную смесь разбавляли DCM (50 мл) и подкисляли 10% водн. лимонной кислотой. Органический слой промывали водой (20 мл ×2) и солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали в вакууме с получением соединения 321-В (300 мг, 0,3021 ммоль, 80,5% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=1,062 мин, [М+Н]+=993,6.
Смесь соединения 321-В (50,0 мг, 0,05 ммоль), 2-бромэтанола (188,7 мг, 1,51 ммоль) и карбоната калия (208,7 мг, 1,51 ммоль) в N,N-диметилформамиде (1,5 мл) перемешивали при 25°С в течение 48 ч. Смесь выливали в ледяную воду (10 мл) и экстрагировали EtOAc (20 мл ×2). Объединенные органические слои промывали водой (15 мл ×2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом преп-TLC (10% метанола в DCM, Rf=0,3) с получением 321-С (30 мг, 57,5% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=1,055 мин, [М+Н]+=1038,2.
Соединение 321 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов, подобных описанным в примере 7 с применением соединения 321-С. LCMS (способ 5-95 АВ, ESI): tR=0,787 мин, [М+Н]+=861,7.
Пример 226: Синтез соединения 322
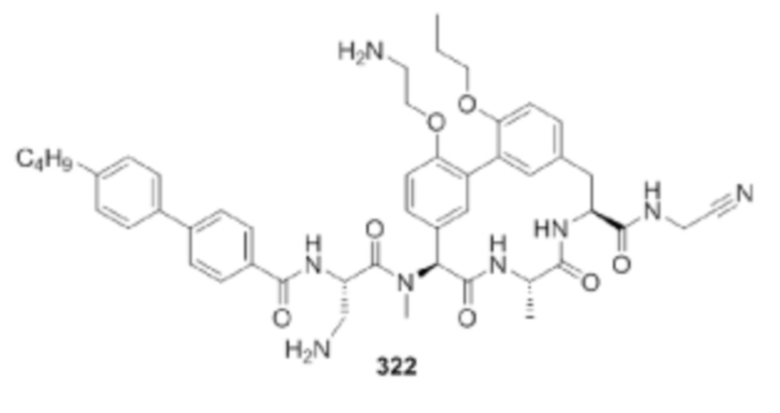
Соединение 322 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 225 (соединение 321). LCMS (способ 5-95 АВ, ESI): tR=0,804 мин, [М+Н]+=859,8.
Пример 227: Синтез соединения 323

Соединение 323 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 225 (соединение 321). LCMS (способ 5-95 АВ, ESI): tR=0,823 мин, [М+Н]+=847,5.
Пример 228: Синтез соединения 324
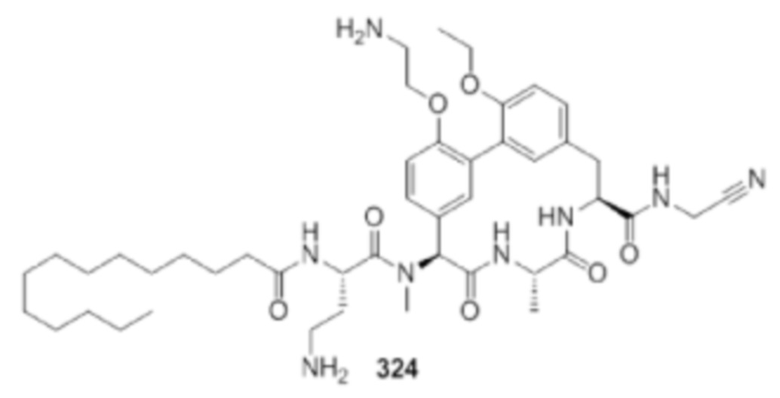
Соединение 324 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 225 (соединение 321). LCMS (способ 5-95 АВ, ESI): tR=0,823 мин, [М+Н]+=834,7.
Пример 229: Синтез соединения 325
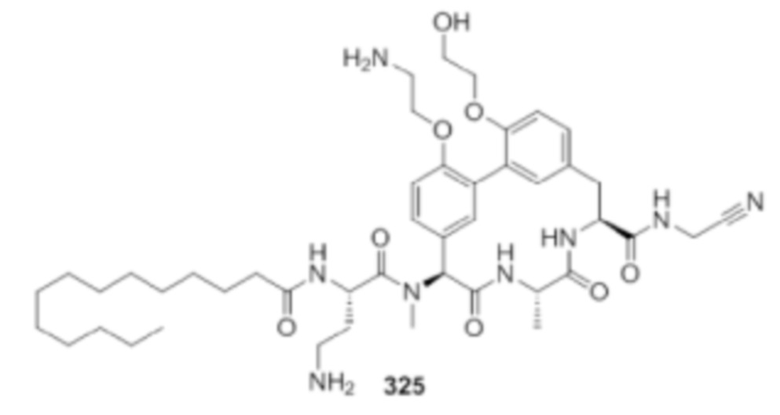
Соединение 325 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 225 (соединение 321). LCMS (способ 5-95 АВ, ESI): tR=0,816 мин, [М+Н]+=849,4.
Пример 230: Синтез соединения 326

Соединение 326 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 225 (соединение 321). LCMS (способ 5-95 АВ, ESI): tR=0,692 мин, [М+Н]+=819,5.
Пример 231: Синтез соединения 327 и соединения 328

Соединение 327 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 225 (соединение 321). LCMS (способ 5-95 АВ, ESI): tR=0,822 мин, [М+Н]+=863,4.
Соединение 328 (соль муравьиной кислоты) выделяли в виде белого твердого вещества в результате неполного снятия защитных групп с промежуточных соединений Boc в течение получения соединения 327. LCMS (способ 5-95 АВ, ESI): tR=0,717 мин, [М+Н]+=919,4.
Пример 232: Синтез соединения 329

Соединение 329 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 225 (соединение 321), за исключением того, что первое алкилирование фенола проводили с (2-бромэтокси)(трет-бутил)диметилсиланом, а второе алкилирование проводили с трет-бутил(2-бромэтил)карбаматом. LCMS (способ 5-95 АВ, EST): tR=0,825 мин, [М+Н]+=849,9.
Пример 233: Синтез соединения 330
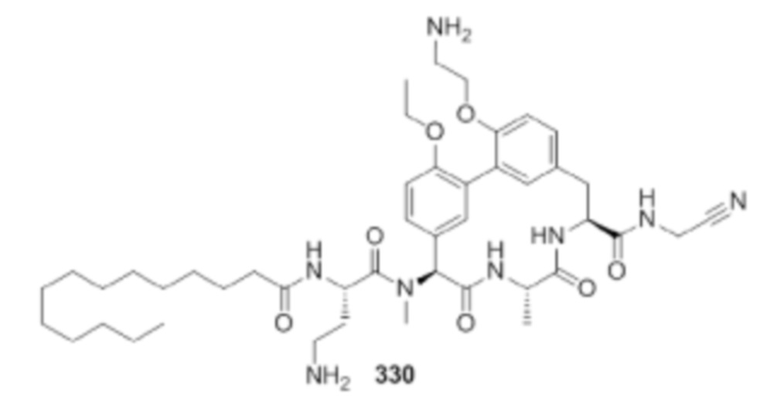
Соединение 330 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 225 (соединение 321), за исключением того, что первое алкилирование фенола проводили с бромэтаном, а второе алкилирование проводили с трет-бутил(2-бромэтил)карбаматом. LCMS (способ 5-95 АВ, ESI): tR=0,839 мин/1,5 мин, [М+Н]+=833,6.
Пример 234: Синтез соединения 331-G
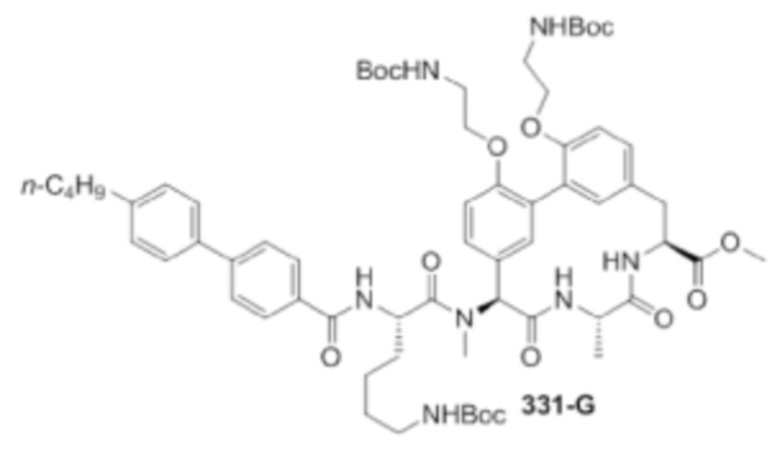
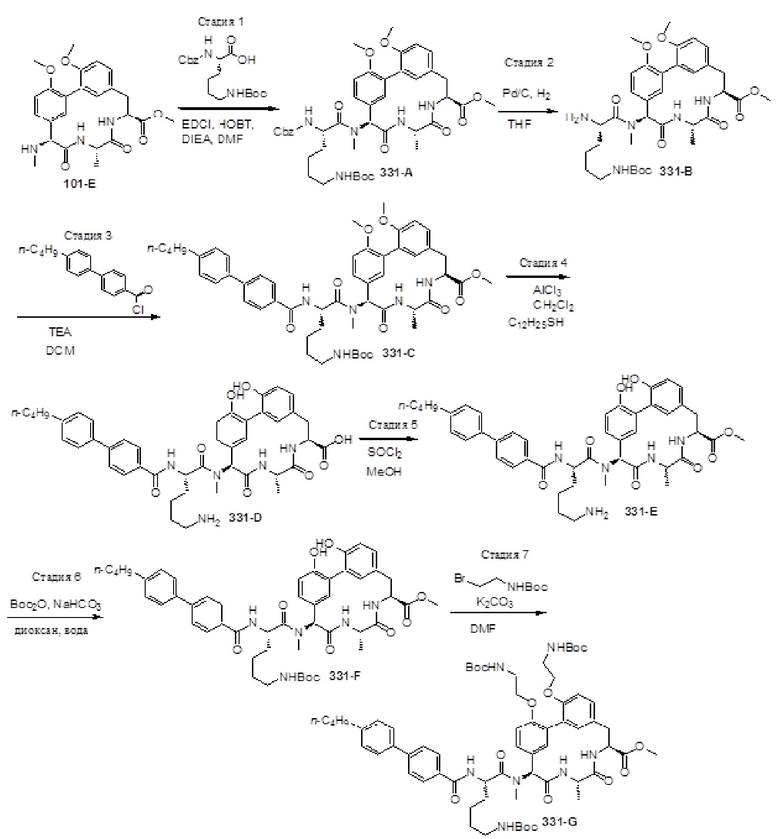
Стадия 1: К раствору соединения 101-Е (800 мг, 1,76 ммоль) в DMF (15 мл) добавляли (S)-2-(((бензилокси)карбонил)амино)-6-((трет-бутоксикарбонил)амино)гексановую кислоту (735 мг, 1,93 ммоль), 3-[(E)-этилазо]-N,N-диметилпропан-1-амина гидрохлорид (946,77 мг, 5,27 ммоль), 1-гидроксибензотриазол (711,94 мг, 5,27 ммоль) и N,N-диизопропилэтиламин (681 мг, 5,27 ммоль). Смесь перемешивали при 30°С в течение 16 ч. При помощи TLC наблюдали израсходование исходного вещества (50% этилацетата в петролейном эфире, Rf=0,5). Смесь выливали в воду (30 мл). Осадок фильтровали, промывали водой, повторно растворяли в метаноле и концентрировали с получением соединения 331-А (1200 мг, 1,45 ммоль, 83,5% выход) в виде желтого твердого вещества.
Стадия 2: К раствору соединения 331-А (1200 мг, 1,47 ммоль) в метаноле (15 мл) добавляли Pd/C (200,0 мг, 1,47 ммоль) и смесь перемешивали при 30°С в атмосфере водорода (50 фунт/кв. дюйм) в течение 16 ч. Катализатор отфильтровывали и фильтрат концентрировали с получением соединения 331-В (900 мг, 1,12 ммоль, 81,6% выход) в виде белого твердого вещества. LCMS (5-95АВ_1,5 мин_1500): tR=0,782 мин, [М+Н]+ 684,4.
Стадия 3: Реакция сочетания хлорангидрида с амином являлась общим способом хлорангидрида и она описана для этого примера. Смесь 4-(4-бутилфенил)бензойной кислоты (200 мг, 0,79 ммоль) в тионилхлориде (5,0 мл) перемешивали при 60°С в течение 16 ч. Раствор концентрировали и растворяли в дихлорметане (2 мл). К раствору соединения 331-В (500 мг, 0,73 ммоль) и триэтиламина (74 мг, 0,73 ммоль) в дихлорметане (15 мл) добавляли вышеуказанный раствор 4-(4-бутилфенил)бензоилхлорида в дихлорметане. Реакционную смесь перемешивали при 25°С в течение 3 ч. При помощи LCMS наблюдали, что все исходное вещество было полностью израсходовано. TLC (10% дихлорметан в метаноле, Rf=0,4). Реакционную смесь концентрировали досуха и остаток очищали методом колоночной флеш-хроматографии (элюировали 5% дихлорметаном в метаноле). Требуемые фракции концентрировали с получением соединения 331-С (650 мг, 0,71 ммоль, 96,6% выход) в виде белого твердого вещества. LCMS (5-95 АВ/1,5 мин): tR=0,951 мин, [М+Н]+ 921,4. Альтернативно, такая реакция сочетания может быть проведена с применением 4'-бутил-[1,1'-бифенил]-4-карбоновой кислоты с применением условий общего способа HATU примера 4.
Стадия 4: Смесь хлорида алюминия (2,8 г, 21,19 ммоль) и 1-додекантиола (4,3 г, 21,19 ммоль) в дихлорметане (12 мл) перемешивали при 26°С в течение 5 мин, а затем охлаждали до 0°С. Затем медленно добавляли соединение 331-С (650 мг, 0,71 ммоль). Раствор перемешивали при 26°С в течение 2 ч. При помощи LCMS наблюдали полное израсходование всего исходного вещества. Раствор гасили 1 н хлористоводородной кислотой и фильтровали. Фильтрационный кек сушили с получением неочищенного соединения 331-D в виде белого твердого вещества. LCMS (5-95 АВ/1,5 мин): tR=0,828 мин, [М+Н]+=778,4.
Стадия 5: Раствор соединения 331-D (500 мг, 0,64 ммоль) и тионилхлорида (229 мг, 1,93 ммоль) в метаноле (10 мл) перемешивали при 60°С в течение 1 ч. При помощи LCMS наблюдали полное израсходование всего исходного вещества. Раствор концентрировали с получением соединения 331-Е (500 мг, 0,63 ммоль, 98,2% выход) в виде желтого твердого вещества. LCMS (5-95 АВ/1,5 мин): tR=0,856 мин, [М+Н]+=792,8.
Стадия 6: К раствору соединения 331-Е (500 мг, 0,63 ммоль) и бикарбоната натрия (10,6 мг, 0,13 ммоль) в 1,4-диоксане (6 мл) и воде (2 мл) добавляли ди-трет-бутилдикарбонат (138 мг, 0,63 ммоль). При помощи LCMS наблюдали полное израсходование всего исходного вещества. TLC (5% дихлорметан в метаноле, Rf=0,2). Реакционную смесь концентрировали досуха и остаток переносили в этилацетат (50 мл). Ее промывали водой (20 мл ×2) и солевым раствором (10 мл), сушили (сульфат натрия) и концентрировали. Неочищенное вещество очищали методом колоночной флеш-хроматографии (элюировали 5% дихлорметаном в метаноле). Требуемые фракции концентрировали в вакууме с получением соединения 331-F (500 мг, 0,56 ммоль, 88,8% выход) в виде белого твердого вещества. LCMS (5-95 АВ/1,5 мин): tR=1,048 мин, [М+Н]+=892,4.
Стадия 7: Смесь соединения 331-F (500 мг, 0,56 ммоль), трет-бутил-2-бромэтилкарбамата (1,25 г, 5,61 ммоль) и карбоната калия (2,32 г, 16,82 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при 26°С в течение 96 ч. При помощи LCMS наблюдали полное израсходование всего исходного вещества. Реакцию гасили ледяной водой (5 мл) и смесь переносили в этилацетат (20 мл). Органический слой промывали водой (20 мл ×2) и солевым раствором (10 мл), сушили (сульфат натрия) и концентрировали. Неочищенное вещество очищали методом колоночной флеш-хроматографии (элюировали этилацетатом). Требуемые фракции концентрировали с получением соединения 331-G (450 мг, 0,38 ммоль, 68,1% выход) в виде бесцветного масла. LCMS (5-95 АВ/1,5 мин): tR=0,995 мин, [М+Н]+ 1179,0.
Пример 235: Синтез соединения 331
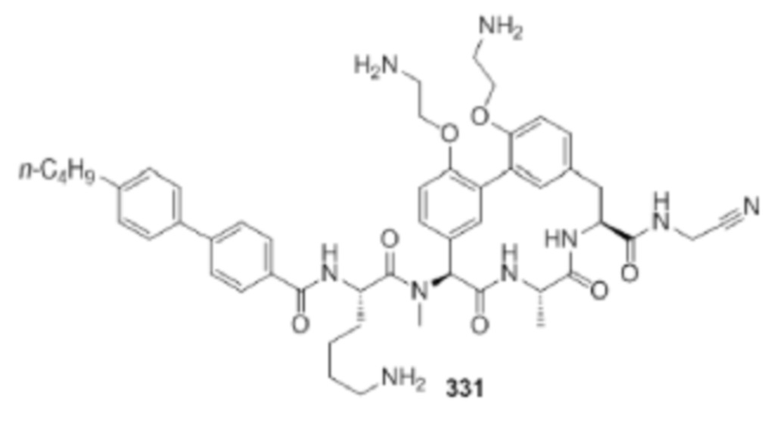

Стадия 1: Смесь соединения 331-G (80 мг, 0,07 ммоль) и водного гидроксида лития гидрата (0,41 мл, 0,2 ммоль, 0,5 М) в 1,4-диоксане (2 мл) и воде (1 мл) перемешивали при 26°С в течение 2 ч. Раствор гасили 5% водным раствором бисульфата калия до значения рН=6 и смесь переносили в этилацетат (20 мл). Органические вещества промывали водой (20 мл ×2) и солевым раствором (10 мл), сушили (сульфат натрия) и концентрировали с получением соединения 331-Н (50 мг, 0,043 ммоль, 63,2% выход) в виде белого твердого вещества. LCMS (5-95 АВ/1,5 мин): tR=1,103 мин, [М+Н]+ 1164,9.
Стадия 2: Начиная с соединения 331-Н (50,0 мг, 0,04 ммоль) и 2-аминоацетонитрила гидрохлорида (39,7 мг, 0,43 ммоль) использовали общий способ HATU (пример 5) для получения соединения 331-1 (30 мг, 58.2% выход) в виде белого твердого вещества. LCMS (5-95АВ_1,5 мин): tR=1,103 мин, [М+Н]+ 1204,1.
Стадия 3: Снятие защитных групп с группы N-Boc с применением чистой муравьиной кислоты было описано и названо как общий способ FA. Смесь соединения 331-1 (30,0 мг, 0,025 ммоль) в муравьиной кислоте перемешивали при 15°С в течение 1 часа, затем смесь лиофилизировали до твердого вещества. Методом препаративной HPLC (ацетонитрил/вода с 0,22% муравьиной кислоты) получали соединение 331 (3,7 мг, 16%) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CD3OD): δ 8.49 (s, 3Н), 7.94 (d, J=8.4 Гц, 2Н), 7.74 (d, J=8.0 Гц, 2Н), 7.57 (d, J=7.6 Гц, 2Н), 7.32-7.11 (m, 5Н), 6.90-6.82 (m, 2Н), 6.45 (s, 1Н), 5.06-4.95 (m, 1Н), 4.80-4.79 (m, 2Н), 4.29-4.15 (m, 5Н), 3.18-3.10 (m, 5Н), 2.99-2.85 (m, 5Н), 2.71-2.64 (m, 3Н), 2.01-1.92 (m, 2Н), 1.82-1.45 (m, 6Н), 1.43-1.38 (m, 6Н), 0.97 (t, J=7.2 Гц, 3Н). LCMS (способ 5-95 АВ, ESI): tR=0.753 мин, [М+Н]+=903.1.
Пример 236: Синтез соединения 332
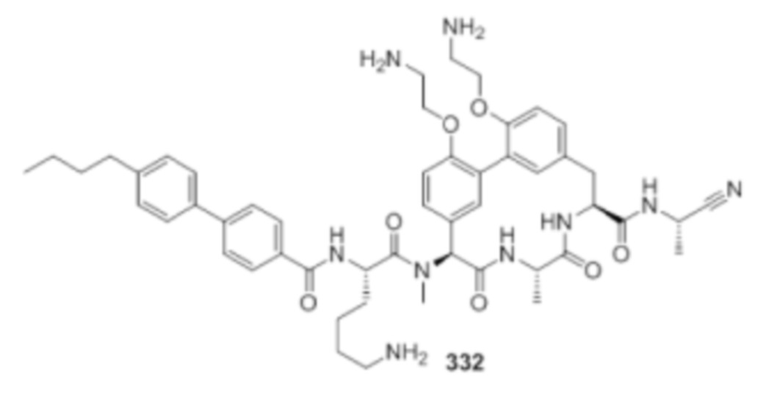
Соединение 332 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331) из соединения 331-Н и (S)-2-аминопропаннитрильной соли муравьиной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,770 мин, [М+Н]+=916,7.
Пример 237: Синтез соединения 333
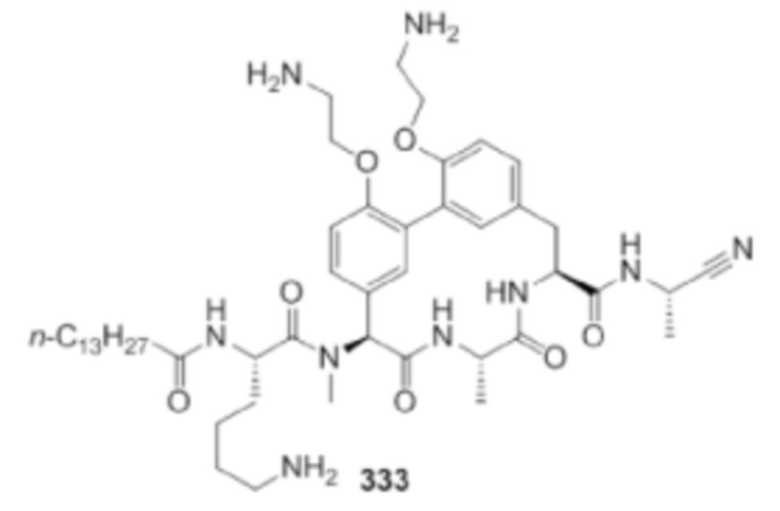
Соединение 333 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 236 (соединение 332) с применением тетрадекановой кислоты. LCMS (способ 10-80 АВ): tR=2,785 мин/ 7 мин, [М+Н]+=891,8.
Пример 238: Синтез соединения 334

Соединение 334 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов получения соединения 331 (пример 235). LCMS (способ 5-95 АВ, ESI): tR=0,769 мин, [М+Н]+=876,5.
Пример 239: Синтез соединения 335

Соединение 335 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331). LCMS (способ 5-95 АВ, ESI): tR=0,753 мин, [М+Н]+=868,6.
Пример 240: Синтез соединения 336

Соединение 336 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331). LCMS (способ 5-95 АВ, ESI): tR=0,783 мин, [М+Н]+=862,9.
Пример 241: Синтез соединения 337
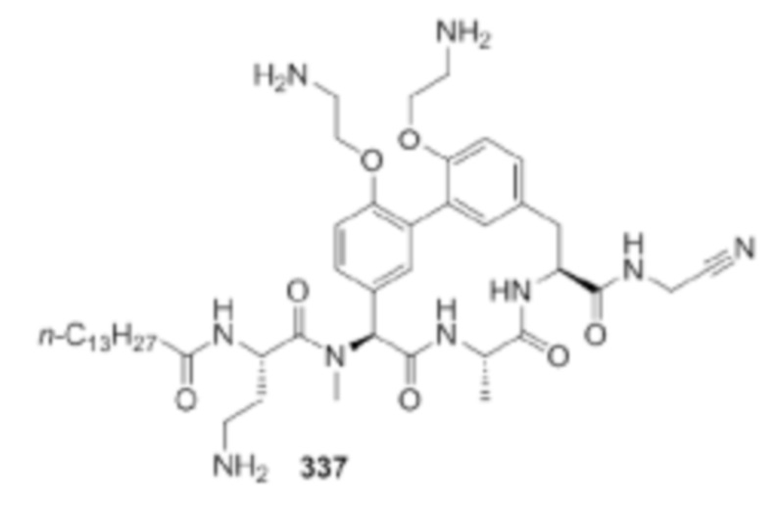
Соединение 337 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331). LCMS (способ 5-95 АВ, ESI): tR=0,771 мин, [М+Н]+=848,7.
Пример 242: Синтез соединения 338

Соединение 338 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331). LCMS (способ 5-95 АВ, ESI): tR=0,746 мин, [М+Н]+=874,7.
Пример 243: Синтез соединения 339
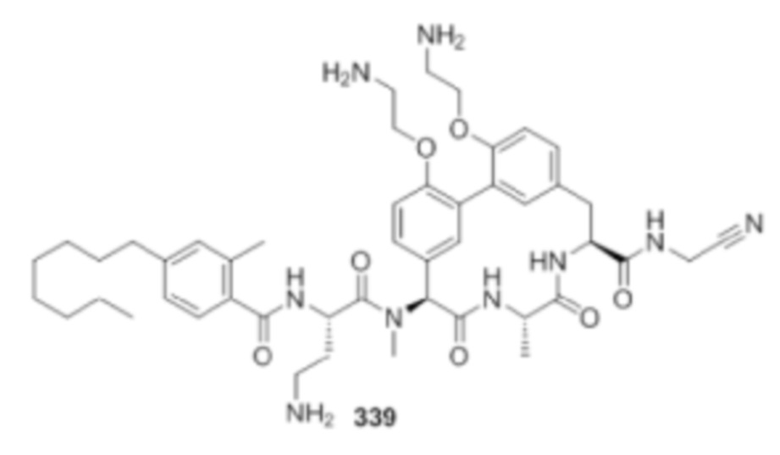
Соединение 339 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331) из 2-метил-4-октилбензойной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,778 мин, [M+Na]+=890,5.
Пример 244: Синтез соединения 340
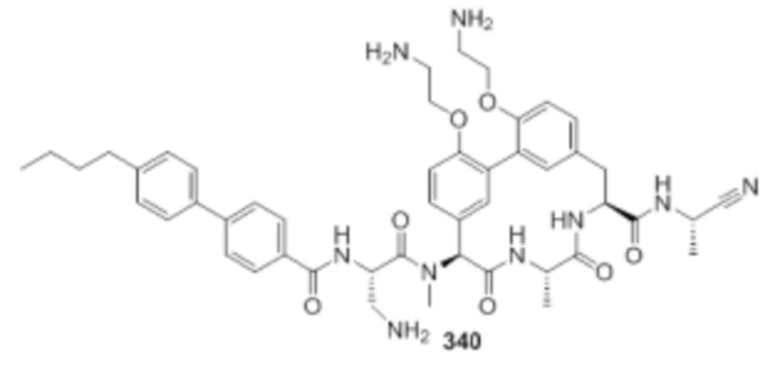
Соединение 340 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов получения соединения примера 236 (соединение 332) LCMS (способ 10-80 АВ): tR=0,885 мин/ 2 мин, [М+Na]+=896,3.
Пример 245: Синтез соединения 341

Соединение 341 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331). LCMS (способ 5-95 АВ, ESI): tR=0,733 мин, [М+Н]+=860,8.
Пример 246: Синтез соединения 342

Соединение 342 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 236 (соединение 332). LCMS (способ 5-95 АВ, ESI): tR=0,813 мин, [М+Н]+=848,4.
Пример 247: Синтез соединения 343

Соединение 343 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331). LCMS (способ 5-95 АВ, ESI): tR=0,802 мин, [М+Н]+=834,5.
Пример 248: Синтез соединения 344
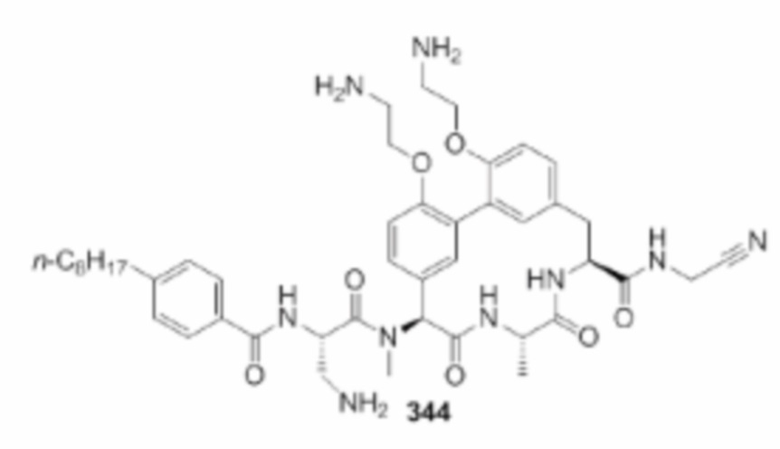
Соединение 344 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 235 (соединение 331). LCMS (способ 5-95 АВ, ESI): tR=0,754 мин, [М+Н]+=840,8.
Пример 249: Синтез соединения 345

Стадия 1: К смеси (S)-2-(((бензилокси)карбонил)амино)-3-гидроксипропановой кислоты (10,0 г, 42 ммоль) и имидазола (5,7 г, 84 ммоль) в DMF (500 мл) добавляли TBSCl (6,3 г, 42 ммоль) при 0°С. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали еще 16 ч. Летучие вещества удаляли и остаток переносили в EtOAc (1000 мл) и слой EtOAc промывали последовательно 1 н HCl, насыщенным NaHCO3 и солевым раствором (500 мл каждого). Слой EtOAc сушили над Na2SO4, концентрировали и полученный остаток очищали методом колоночной флеш-хроматографии с получением (S)-2-(((бензилокси)карбонил)амино)-3-((трет-бутилдиметилсилил)окси)пропановой кислоты (7,0 г, 48% выход) в виде бесцветного масла.
Стадия 2: Типичные условия сочетания HATU использовали по отношению к соединению 101-G (пример 4) (100 мг, 0.14 ммоль) и (S)-2-(((бензилокси)карбонил)амино)-3-((трет-бутилдиметилсилил)окси)пропановой кислоте (99 мг, 0,28 ммоль) с получением грязно-белого твердого вещества (120 мг, 82% выход).
Стадия 3: Типичное условие гидрирования (Pd/C, Н2) использовали по отношению к (120 мг, 0.11 ммоль) с получением соединения 345-А (100 мг, 96% выход) в виде белого твердого вещества.
Стадия 4: К раствору соединения 345-А (100 мг, 0,11 ммоль) и октан-1-сульфонилхлоридного соединения (93 мг, 0,44 ммоль) в DCM (5 мл) добавляли DIPEA (71 мг, 0,55 ммоль) при 0°С. Полученную смесь перемешивали при 0°С в течение 1 ч. Летучие вещества удаляли и полученный остаток переносили в EtOAc (50 мл), затем промывали солевым раствором (50 мл ×2). Слой EtOAc сушили над MgSO4, концентрировали и остаток очищали методом колоночной флеш-хроматографии с получением соединения 345-В (98 мг, 83% выход) в виде белого твердого вещества.
Стадия 5: К раствору соединения 345-В (98 мг, 0,09 ммоль) в DCM (5 мл) добавляли TBAF гидрат (47 мг, 0,18 ммоль). Полученную смесь перемешивали в течение 1 ч. Летучие вещества удаляли и остаток очищали методом колоночной флеш-хроматографии с получением соединения 345-С (80 мг, 92% выход) в виде белого твердого вещества. LCMS (5-95 АВ, ESI): tR=0,857, [М+Н]+=1000,3.
Соединение 345 получали в виде белого твердого вещества с применением способов для соединения 101 (пример 7) из соединения 345-С. LCMS (5-95 АВ_30 мин, ESI): tR=14,41, [М+Н]+=801,3. 1Н ЯМР (400 МГц, MeOH-d4) δ 8.51 (brs, 2Н, HCOOH), 7.31-7.26 (m, 2Н), 7.19 (d, J=8.0 Гц, 1Н), 7.12 (d, J=8.0 Гц, 1Н), 6.91 (d, J=8.0 Гц, 1Н), 6.83 (d, J=8.0 Гц, 1Н), 6.45 (s, 0.6Н), 6.23 (s, 0.4Н), 4.80-4.33 (m, 2Н), 4.28-4.20 (m, 4Н), 4.21 (s, 2Н), 3.86-3.80 (m, 1Н), 3.78-3.70 (m, 1Н), 3.30-3.00 (m, 6Н), 2.94 (s, 3Н), 2.75 (brs, 2Н), 1.86-1.70 (m, 2Н), 1.50-1.25 (m, 13Н), 0.91 (t, J=6.8 Гц, 3Н).
Пример 250: Синтез соединения 346

Соединение 346 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 249 (соединение 345) из соединения 101-K (пример 5). LCMS (5-95 АВ, ESI): tR=0,765, [М+Н]+=842,6; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.49 (bra, 2Н, НСООН), 1.21-1.23 (m, 2Н), 7.17 (d, J=8.0 Гц, 1Н), 7.09 (d, J=8.0 Гц, 1H), 6.89 (brs, 1Н), 6.82 (bra, 1Н), 6.34 (s, 1Н), 4.80-4.75 (m, 2Н), 4.60-4.56 (m, 1Н), 4.39-4.13 (m, 4Н), 4.19 (s, 2Н), 3.23-3.03 (m, 8Н), 2.87 (s, 3Н), 2.80-2.70 (m, 1Н), 2.67-2.65 (m, 1Н), 2.13-1.90 (m, 2Н), 1.85-1.77 (m, 2Н), 1.54-1.23 (m, 17Н), 0.90 (t, J=6.0 Гц, 3Н).
Пример 251: Синтез соединения 347

Стадия 1: К раствору 1-бром-3-метилбензола (500 мг, 2,9 ммоль) в CHCl3 (10 мл) медленно добавляли хлорсульфоновую кислоту (1,2 мл) при 0°С и реакционную смесь перемешивали при той же температуре в течение 4 ч. Смесь выпивали на дробленый лед (50 мл), затем экстрагировали CHCl3 (30 мл ×3). Объединенные органические слои промывали солевым раствором (60 мл ×2), сушили над Na2SO4 и концентрировали с получением 4-бром-2-метилбензол-1-сульфонилхлорида (600 мг, 76% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3) δ 7.91 (d, J=8.4 Гц, 1Н), 7.58 (d, J=4.6 Гц, 1H), 7.55 (dd, J=8.4, 1.6 Гц, 1H), 2.75 (s, 3H).
Стадия 2: Процедуру сульфонамидного образования примера 249 (соединение 345) использовали по отношению к соединению 101-K (200 мг, 0,22 ммоль) с получением соединения 347-А (160 мг, 63,7% выход) в виде белого твердого вещества.
Стадии 3 и 4: Реакцией сочетания по Соногашире и восстановлением соединения 347-А (общий способ по Соногашире) получали соединение 347-В.
Соединение 347 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов для соединения 101 (пример 7). LCMS (5-95 АВ, ESI): tR=0,731, [М+Н]+=876,6; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.47 (brs, 2Н, НСООН), 7.85 (d, J=8.0 Гц, 1Н), 7.29 (brs, 1Н), 7.25-7.16 (m, 2Н), 7.14-7.04 (m, 2Н), 6.83-6.74 (m, 3Н), 6.00 (s, 1Н), 4.76-4.66 (m, 2Н), 4.36-4.30 (m, 1Н), 4.29-4.15 (m, 4Н), 4.18 (s, 2Н), 3.27-2.96 (m, 8Н), 2.76-2.72 (m, 2Н), 2.67 (s, 3Н), 2.61 (s, 3Н), 2.13-1.85 (m, 2Н), 1.75-1.62 (m, 2Н), 1.46-1.24 (m, 9Н), 0.90 (t, J=6.8 Гц, 3Н).
Пример 252: Синтез соединения 348

Стадия 1: К раствору 2-хлорэтансульфонилхлорида (0,64 мл, 6,1 ммоль) в DCM (10 мл) добавляли пиридин (0,97 г, 12,2 ммоль) при -78°С и полученную смесь перемешивали при той же температуре в течение 20 мин. Реакционную смесь нагревали до комнатной температуры при перемешивании и перемешивали еще 20 мин при той же температуре.
Стадия 2: К раствору соединения 348-А (290 мг, 0,31 ммоль) и Et3N (474 мг, 4,7 ммоль) в DCM (20 мл) добавляли вышеуказанный раствор при 0°С. Полученную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч при той же температуре. Затем добавляли DCM (50 мл) и смесь промывали насыщенной лимонной кислотой, насыщенным NaHCO3 и солевым раствором (50 мл каждого). Органический слой сушили над безводным Na2SO4, концентрировали и остаток очищали методом преп-TLC с получением соединения 348-В (210 мг, 66% выход) в виде желтого твердого вещества. LCMS (5-95 АВ, ESI): RT=1,056, M+Na+=1041,5.
Стадия 3: К раствору соединения 348-В (0,21 г, 0,206 ммоль) в МеОН (2 мл) добавляли 1-аминодекан (0,31 г, 2 ммоль) при 0°С и смесь нагревали и перемешивали при комнатной температуре в течение 16 ч. Летучие вещества удаляли и остаток очищали методом колоночной флеш-хроматографии с получением соединения 348-С (180 мг, zz% выход). LCMS (5-95 АВ, ESI): tR=1,051, [М+Н]+=1176,6.
Стадия 4: Типичное условие введения защитных групп Boc (Вос2О, 1,5 экв., Et3N) использовали по отношению к соединению 348-С (180 мг, 0,15 ммоль) с получением соединения 348-D (170 мг, 87% выход) в виде белого твердого вещества.
Соединение 348 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95 АВ, ESI): tR=0.748, [М+Н]+=887.0. 1Н ЯМР (400 МГц, МеОН-d4) δ 8.50 (brs, 2Н, НСООН), 7.33-7.11 (m, 3Н), 7.12 (d, J=8.5 Гц, 1Н), 6.92 (d, J=8.5 Гц, 1Н), 6.84 (d, J=8.5 Гц, 1Н), 6.40 (s, 0.7Н), 5.98 (s, 0.3Н), 4.80-4.54 (m, 3Н), 4.29-4.20 (m, 4Н), 4.21 (s, 2Н), 3.75-3.65 (m, 2Н), 3.54-3.42 (m, 4Н), 3.26-3.03 (m, 7Н), 2.90 (s, 3Н), 2.73(brs, 1Н), 2.08-1.94 (m, 2Н), 1.80-1.71 (m, 3Н), 1.42-1.32 (m, 18Н), 0.91 (t, J=4.0 Гц, 3Н).
Пример 253: Синтез соединения 349

Соединение 349 (свободное основание) получали в виде белого твердого вещества с применением способов примера 348. LCMS (5-95 АВ, ESI): tR=0,583, [М+Н]+=899,5; 1Н ЯМР (400 МГц, MeOH-d4) δ 7.27-7.17 (m, 2Н), 7.10 (d, J=8.4 Гц, 1Н), 7.02 (d, J=8.4 Гц, 1Н), 6.85-6.75 (m, 2Н), 6.38 (s, 1Н), 4.78-4.73 (m, 2Н), 4.42 (brs, 1Н), 4.20 (s, 2Н), 4.12-3.95 (m, 4Н), 3.26-3.20 (m, 2Н), 3.16-3.09 (m, 2Н), 3.09-2.96 (m, 3Н), 2.94-2.84 (m, 2Н), 2.89 (s, 3Н), 2.84-2.67 (m, 3Н), 2.65-2.56 (m, 2Н), 1.94-1.63 (m, 6Н), 1.58-1.45 (m, 3Н), 1.43-1.23 (m, 14Н), 0.90 (t, J=6.4 Гц, 3Н).
Пример 254: Синтез соединения 350

Соединение 350 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 252 (соединение 348). LCMS (5-95 АВ, ESI): tR=0,572, [М+Н]+=885,7.
Пример 255: Синтез соединения 351

Соединение 351 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 252 (соединение 348) из соединения 101-G. LCMS (5-95 АВ, ESI): tR=0,747, [М+Н]+=785,3.
Пример 256: Синтез соединения 352
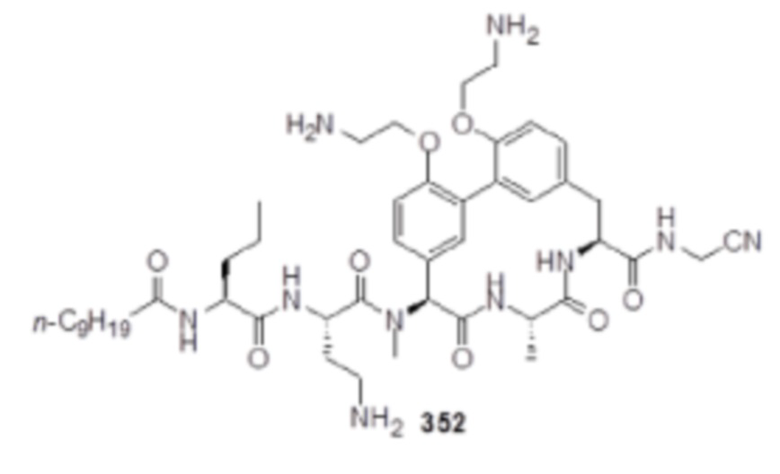
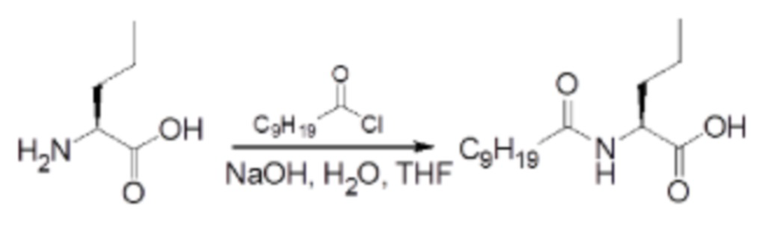
К перемешиваемому раствору деканоилхлорида (500 мг, 2,6 ммоль) в THF (5 мл) добавляли (S)-2-аминопентановую кислоту (461 мг, 3,9 ммоль) и 2 и NaOH (5,0 мл) при 0°С и полученную смесь перемешивали при 0°С в течение 1 ч. Значение рН смеси доводили до 2 с применением 1 н HCl, затем экстрагировали EtOAc (20 мл ×3). Объединенные органические слои промывали солевым раствором (50 мл ×2), сушили над Na2SO4 и концентрировали с получением (S)-2-деканамидопентановой кислоты (630 мг, 88,5% выход) в виде белого твердого вещества, которое использовали сразу на следующей стадии. LCMS (5-95 АВ, ESI): tR=0,904, [М+Н]+=272,0.
Соединение 352 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95 АВ, ESI): tR=0,620, [М+Н]+=891,4; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.50 (brs, 3Н, НСООН), 7.24-7.16 (m, 2Н), 7.14 (d, J=8.0 Гц, 1Н), 7.08 (d, J=8.0 Гц, 1Н), 6.87 (brs, 1Н), 6.81 (brs, 1Н), 6.26 (s, 1Н), 5.00-4.97 (m, 1Н), 4.85-4.77 (m, 3Н), 4.23-4.15 (m, 4Н), 4.19 (s, 2Н), 3.34-3.33 (m, 1Н), 3.17-3.03 (m, 7Н), 2.82 (s, 3Н), 2.28-2.19 (m, 5Н), 2.05-1.90 (m, 2Н), 1.67-1.62 (m, 5Н), 1.35-1.30 (m, 14Н), 0.98 (t, J=7.6 Гц, 3Н), 0.91 (t, J=7.6 Гц, 3Н).
Пример 257: Синтез соединения 353

Соединение 353 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 256 (соединение 352). LCMS (5-95 АВ, ESI): tR=0,733, [М+Н]+=891,6.
Пример 258: Синтез соединения 354

Соединение 354 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 256 (соединение 352). LCMS (5-95 АВ, ESI): tR=0,730, [М+Н]+=911,4.
Пример 259: Синтез соединения 355
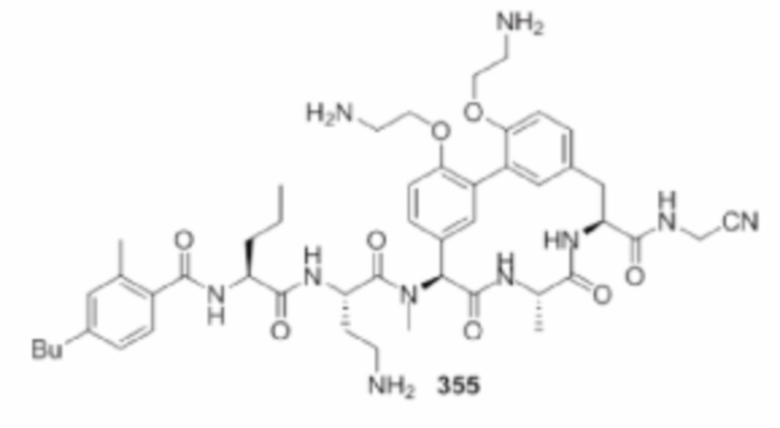
Соединение 355 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 256 (соединение 352). LCMS (5-95 АВ, ESI): tR=0,732, [М+Н]+=911,5.
Пример 260: Синтез соединения 356

Соединение 356 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 256 (соединение 352) из (2S,3R)-3-(трет-бутокси)-2-деканамидобутановой кислоты. LCMS (5-95 АВ, ESI): tR=0,720, [М+Н]+=893,5.
Пример 261: Синтез соединения 357-Р1 и соединения 357-Р2
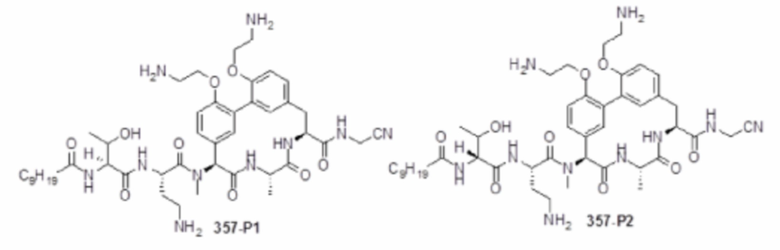
Соединение 357-Р1 и соединение 357-Р2 (соли муравьиной кислоты) получали в виде белых твердых веществ с применением способов примера 256 (соединение 352) из (D,L)-(эритро)-2-деканамидо-3-гидроксибутановой кислоты. Соединения получали из рацемического алло-треонина и стереохимическое отнесение при этих положениях является произвольным. Они отличаются элюированием из HPLC с обращенной фазой как соединение 357-Р1 в виде пика 1 и соединение 357-Р2 в виде пика 2.
Данные соединения 357-Р1: LCMS (5-95 АВ, ESI): tR=0,574, [М+Н]+=893,5.
Данные соединения 357-Р2: LCMS (5-95 АВ, ESI): tR=0,709, [М+Н]+=893,7; 1Н ЯМР (400 МГц, MeOH-d4) δ 7.21-7.18 (m, 2Н), 7.08 (d, J=8.0 Гц, 1Н), 7.01 (d, J=8.0 Гц, 1Н), 6.82 (brs, 1Н), 6.77 (brs, 1Н), 6.31 (s, 1Н), 4.83-4.75 (m, 2Н), 4.37-4.35 (m, 1Н), 4.32-4.28 (m, 1Н), 4.19 (s, 2Н), 4.10-3.95 (m, 5Н), 3.35-3.15 (m, 1Н), 3.16-3.13 (m, 2Н), 2.90-2.75 (m, 7Н), 2.34-2.32 (m, 3Н), 2.13-2.08 (m, 2Н), 1.92-1.88 (m, 2Н), 1.65-1.62 (m, 3Н), 1.33-1.19 (m, 16 Н), 0.91 (t, J=6.6 Гц, 3Н).
Пример 263: Синтез соединения 359

Стадия 1: Декановую кислоту и (R)-метил-2-амино-3-гидроксипропаноата гидрохлорид подвергали общему способу HATU с получением (R)-метил-2-деканамидо-3-гидроксипропаноата.
Стадия 2: (R)-Метил-2-деканамидо-3-гидроксипропаноат подвергали общему способу LiOH с получением (R)-2-деканамидо-3-гидроксипропановой кислоты.
Соединение 359 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из (R)-2-деканамидо-3-гидроксипропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,576 мин, [М/2+Н]+=440,3.
Пример 264: Синтез соединения 360
297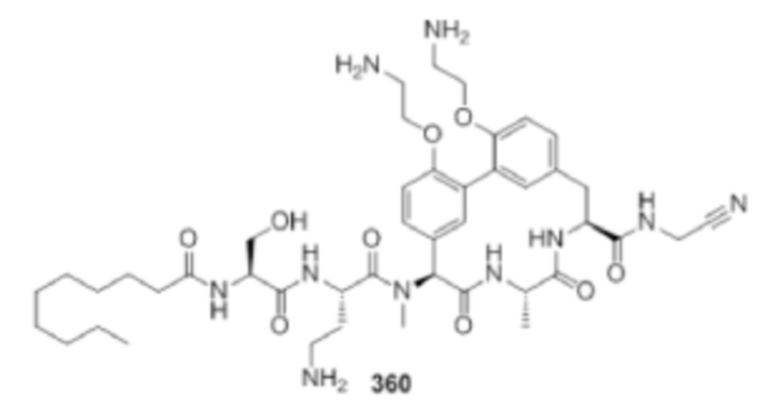
Соединение 360 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из (S)-2-деканамидо-3-гидроксипропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,709 мин, [М+Н]+=879,7.
Пример 265: Синтез соединения 361
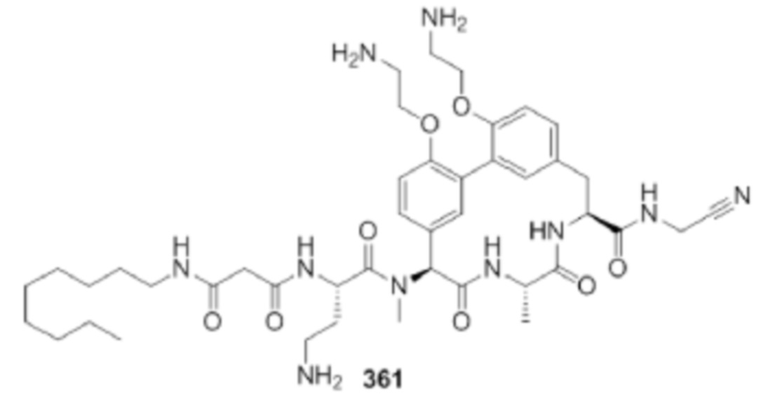
Соединение 361 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из 3-(нониламино)-3-оксопропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,718 мин, [М+Н]+=850,6.
Пример 266: Синтез соединения 362

Соединение 362 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из 2-(2-деканамидоацетамидо)уксусной кислоты. LCMS (способ 5-95 АВ, EST): tR=0,719 мин, [М+Н]+=906,5.
Пример 267: Синтез соединения 363
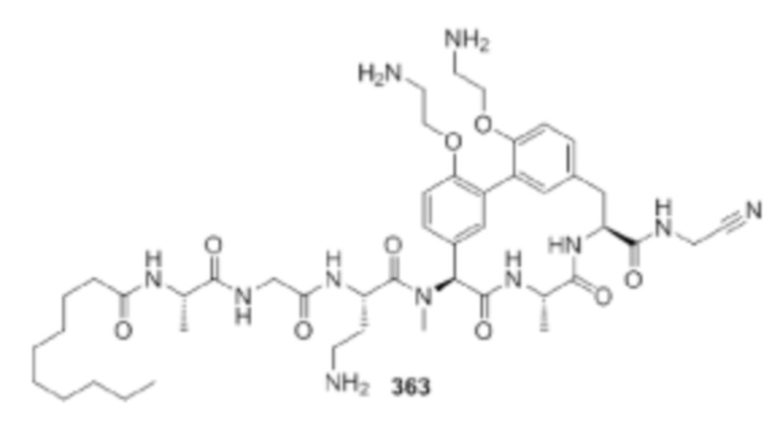
Соединение 363 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из (S)-2-(2-деканамидопропанамидо)уксусной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,718 мин, [М+Н]+=920,6.
Пример 268: Синтез соединения 364
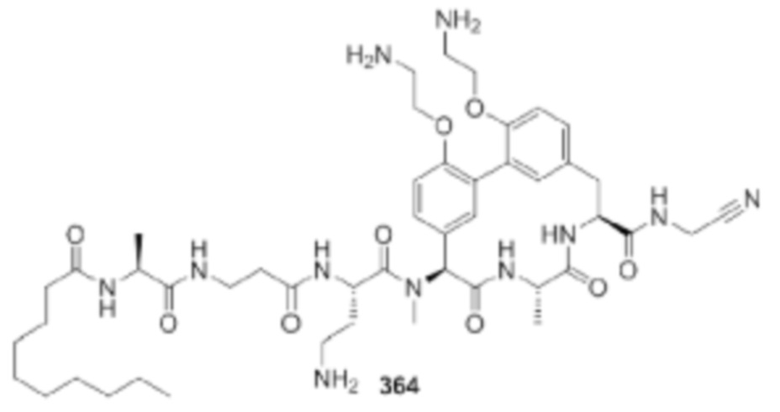
Соединение 364 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из (S)-3-(2-деканамидопропанамидо)пропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,726 мин, [М+Н]+=934,7.
Пример 269: Синтез соединения 365

Соединение 365 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из (R)-3-(2-деканамидопропанамидо)пропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,729 мин, [М+Н]+=934,5.
Пример 270: Синтез соединения 366

Соединение 366 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из (R)-2-(2-деканамидопропанамидо)уксусной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,609 мин, [М+Н]+=920,5.
Пример 271: Синтез соединения 367

Соединение 367 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из 3-деканамидопропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,578 мин, [М+Н]+=863,3.
Пример 272: Синтез соединения 368

Соединение 368 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов, описанных ранее, из 2-(3-деканамидопропанамидо)уксусной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,573 мин, [М+Н]+=920,4.
Пример 273: Синтез соединения 369

Соединение 369 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из 4-(нониламино)-4-оксобутановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,713 мин, [М+Н]+=863,5.
Пример 274: Синтез соединения 370

2-(4-Бутил-2-метилбензамидо)уксусную кислоту, белое твердое вещество, получали ранее описанными способами. 1Н ЯМР (400 МГц, CD3OD): δ 7.35 (d, J=7.6 Гц, 1Н), 7.10-7.00 (m, 2Н), 4.05 (s, 2Н), 2.60 (t, J=7.8 Гц, 2Н), 2.41 (s, 3Н), 1.65-1.55 (m, 2Н), 1.40-1.30 (m, 2Н), 0.93 (t, J=7.2 Гц, 3Н).
Соединение 370 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,593 мин, [М+Н]+=870,3.
Пример 275: Синтез соединения 371

Соединение 371 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением ранее описанных способов из 2-(2-(4-бутил-2-метилбензамидо)ацетамидо)уксусной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,599 мин, [М+Н]+=926,3.
Пример 276: Синтез соединения 372

Соединение 372 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из 2-деканамидоуксусной кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,717 мин, [М+Н]+=849,5.
Пример 277: Синтез соединения 373

Соединение 373 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из (S)-2-деканамидопропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,722 мин, [М+Н]+=863,6.
Пример 278: Синтез соединения 374

Соединение 374 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из (R)-2-деканамидопропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,718 мин, [М+Н]+=863,6.
Пример 279: Синтез соединения 375
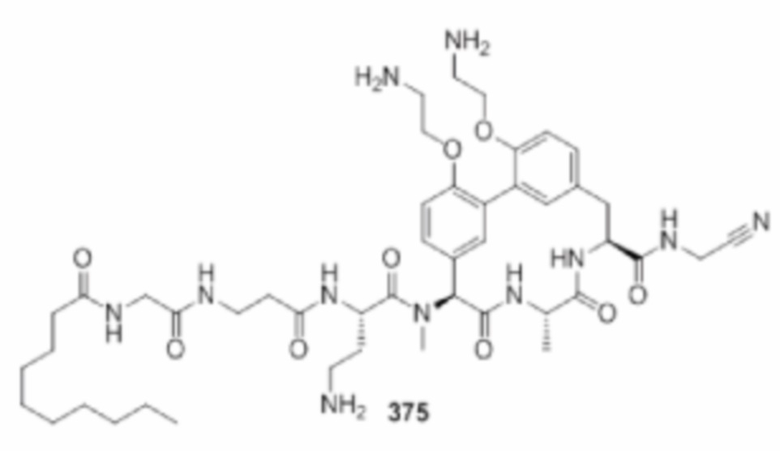
Соединение 375 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением ранее описанных способов из 3-(2-деканамидоацетамидо)пропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,588 мин, [M+Na]+=943,1.
Пример 280: Синтез соединения 376

Соединение 376 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением ранее описанных способов из 3-(3-деканамидопропанамидо)пропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0,584 мин, [M+Na]+=956,6.
Пример 281: Синтез соединения 377

Стадия 1: Смесь 4-бутил-2-метилбензойной кислоты (150,0 мг, 0,78 ммоль), дифенилфосфорилазида (300 мг, 1,09 ммоль), бензилового спирта (252 мг, 2,34 ммоль) и триэтиламина (220 мг, 2,19 ммоль) в толуоле (10 мл) перемешивали при 100°С в течение 12 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали EtOAc (30 мл ×3). Объединенные органические слои промывали водой (20 мл ×2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом хроматографии на силикагеле (10% EtOAc в петролейном эфире, Rf=0,5) с получением бензил-N-(4-бутил-2-метилфенил)карбамата (100 мг, 0,34 ммоль, 64,6% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) δ 8.87 (s, 1Н), 7.40-7.35 (m, 5H), 7.21 (d, J=8.0 Гц, 1H), 6.99-6.95 (m, 2H), 5.12 (s, 2H), 2.50 (t, J=7.6 Гц, 1H), 2.16 (s, 3H), 1.55-1.48 (m, 2H), 1.31-1.26 (m, 2H), 0.89 (t J=7.6 Гц, 1H).
Стадия 2: К раствору бензил-N-(4-бутил-2-метилфенил)карбамата (150 мг, 0,50 ммоль) в метаноле (10 мл) добавляли 10% палладий (53,68 мг, 0,05 ммоль) на углеродной подложке. Реакционную смесь перемешивали при 15°С в течение 2 ч в атмосфере 1Н при 15 фунт/кв. дюйм. Смесь фильтровали и концентрировали с получением 4-бутил-2-метил-анилина (80 мг, 0,49 ммоль, 97,1% выход) в виде белого твердого вещества.
Стадия 3: К смеси 4-бутил-2-метиланилина (70 мг, 0,43 ммоль) и триэтиламина (0,18 мл, 1,29 ммоль) в дихлорметане (10 мл) добавляли метил-4-хлор-4-оксобутират (64,56 мг, 0,43 ммоль). Реакционную смесь перемешивали при 20°С в течение 12 ч. Смесь концентрировали с получением метил-4-(4-бутил-2-метиланилино)-4-оксобутаноата (100 мг, 0,36 ммоль, 84,1% выход) в виде белого твердого вещества. LCMS (5-95АВ_1,5 мин): tR=0,919 мин, [М+Н]+ 278,0.
Стадия 4: Метил-4-(4-бутил-2-метиланилино)-4-оксобутаноат (90 мг, 0,32 ммоль) гидролизировали обычным способом с получением 4-(4-бутил-2-метиланилино)-4-оксобутановой кислоты (80 мг, 0,30 ммоль, 93,6% выход) в виде белого твердого вещества.
Соединение 377 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, EST): tR=0,707 мин, [М+Н]+=883,7.
Пример 282: Синтез соединения 378

Соединение 378 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением тех же способов, используемых при получении соединения 101 (пример 7), за исключением того, что к последовательности добавляли дополнительные стадии пептидного сочетания и снятия защитных групп, начиная с (S)-2-(((бензилокси)карбонил)амино)-4-((трет-бутилдиметилсилил)окси)бутановой кислоты. LCMS (5-95 АВ, ESI): tR=0,715, [М+Н]+=893,7; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.50 (brs, 2Н, НСООН), 7.33-7.24 (m, 2Н), 7.19 (d, J=8.4 Гц, 1Н), 7.11 (d, J=8.4 Гц, 1Н), 6.90 (brs, 1Н), 6.83 (brs, 1Н), 6.29 (s, 1Н), 5.03-4.76 (m, 3Н), 4.40-4.38 (m, 1Н), 4.32-4.18 (m, 4Н), 4.21 (s, 2Н), 3.74-3.62 (m, 2Н), 3.32-2.95 (m, 7Н), 2.84 (s, 3Н), 2.34-2.14 (m, 3Н), 2.13-1.82 (m, 3Н), 1.66-1.63 (m, 2Н), 1.39-1.27 (m, 16Н), 0.92 (t, J=6.4, 3Н).
Пример 283: Синтез соединения 379

Соединение 379 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 282 (соединение 378) из (R)-2-(((бензилокси)карбонил)амино)-4-((трет-бутилдиметилсилил)окси)бутановой кислоты. LCMS (5-95 АВ, ESI): tR=0,712, [М+Н]+=893,6.
Пример 284: Синтез соединения 380

Соединение 380 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением тех же способов, используемых при получении соединения 378 (пример 282). LCMS (5-95 АВ, ESI): tR=0,713, [М+Н]+=883,5.
Пример 285: Синтез соединения 381

Соединение 381 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 282 (соединение 378) из (R)-2-(((бензилокси)карбонил)амино)-4-((трет-буталдиметалсилил)окси)бутановой кислоты. LCMS (5-95 АВ, ESI): tR=0,694, [М+Н]+=913,7.
Пример 286: Синтез соединения 382
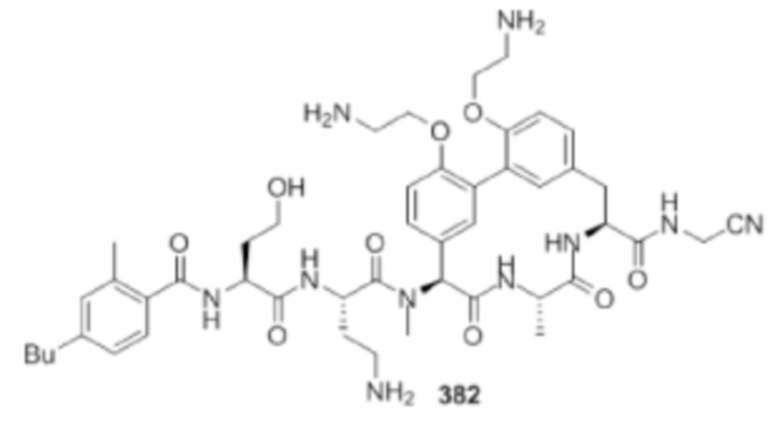
Соединение 382 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 282 (соединение 378) из (S)-2-(((бензилокси)карбонил)амино)-4-((трет-бутилдиметилсилил)окси)бутановой кислоты. LCMS (5-95 АВ, ESI): tR=0,689, [М+Н]+=913,9.
Пример 287: Синтез соединения 383
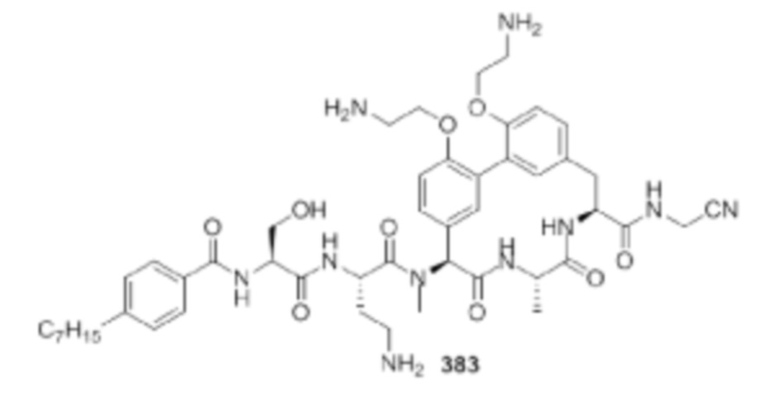
Соединение 383 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 282 (соединение 378) из Cbz-Ser(O-t-Bu)-OH. LCMS (5-95 АВ, ESI): tR=0,741, [М+Н]+=927,8
Пример 288: Синтез соединения 384
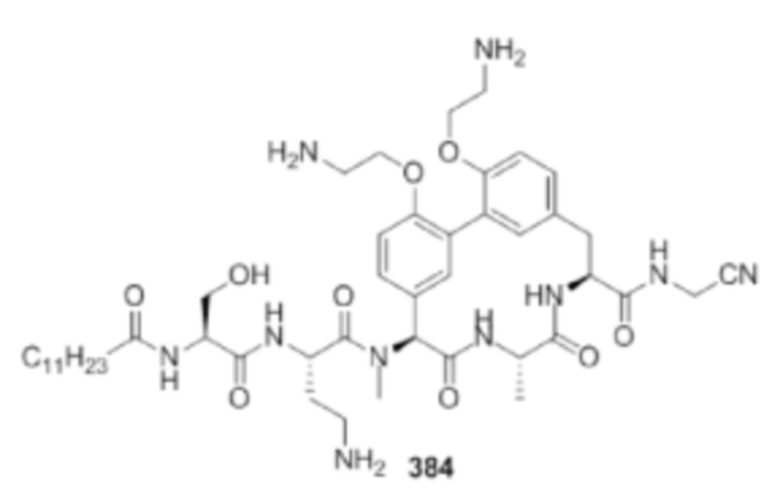
Соединение 384 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 282 (соединение 378). LCMS (5-95 АВ, ESI): tR=0,751, [М+Н]+=907,6.
Пример 289: Синтез соединения 385

Соединение 385 (свободное основание) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из (S)-5-амино-2-(((бензилокси)карбонил)амино)-5-оксопентановой кислоты. LCMS (5-95 АВ, ESI): tR=0,573, [М+Н]+=921,0.
Пример 290: Синтез соединения 386

Соединение 386 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 263 (соединение 359) из (S)-4-ацетамидо-2-(((бензилокси)карбонил)амино)бутановой кислоты. LCMS (5-95 АВ, ESI): tR=0,716, [М+Н]+=934,7.
Пример 291: Синтез соединения 387

Соединение 387 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 282 (соединение 378). LCMS (способ 5-95 АВ, ESI): tR=0,757 мин, [М+Н]+=921,6.
Пример 292: Синтез соединения 388
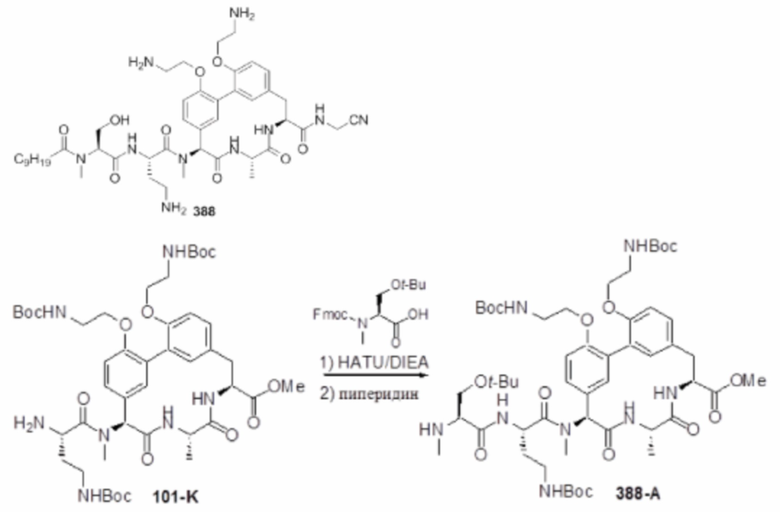
Начиная с соединения 101-K проводили типичную реакцию амидного сочетания (HATU) с (S)-2-((((9Н-флуорен-9-ил)метокси)карбонил)(метил)амино)-3-(трет-бутокси)пропановой кислотой и процедуру удаления Fmoc (пиперидин) с получением соединения 388-А (110 мг) в виде белого твердого вещества.
Соединение 388 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 388-А. LCMS (5-95 АВ, ESI): tR=0,708, [М+Н]+=893,5.
Пример 293: Синтез соединения 389

К раствору метил-4-фтор-2-метилбензоата (200,0 мг, 1,19 ммоль) в N,N-диметилформамиде (10 мл) добавляли 1-гептантиол (0,91 мл, 5,95 ммоль) и карбонат цезия (1937,6 мг, 5,95 ммоль) и перемешивали при 60°С в течение 16 ч. Реакцию гасили 5% водн. KHSO4 до значения рН=6, разбавляли Н2О (20 мл) и экстрагировали EtOAc (20 мл ×2). Объединенные органические слои промывали водой (40 мл ×2) и солевым раствором (20 мл), сушили над Na2SO4 и концентрировали. Остаток перетирали в порошок с петролейным эфиром. Полученное белое твердое вещество фильтровали, промывали петролейным эфиром и сушили с получением 4-(гептилтио)-2-метилбензойной кислоты (198 мг, 62,5% выход). 1Н ЯМР (400 МГц, CD3OD): δ 7.84 (d, J=8.8 Гц, 1Н), 7.15-7.05 (m, 2Н), 3.00 (t, J=7.2 Гц, 2Н), 2.55 (s, 3Н), 1.75-1.60 (m, 2Н), 1.50-1.35 (m, 2Н), 1.35-1.20 (m, 6Н), 0.90 (t, J=7.0 Гц, 3Н).
Соединение 389 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): RT=0,649 мин, [M+Na]+=908,5.
Пример 294: Синтез соединения 390
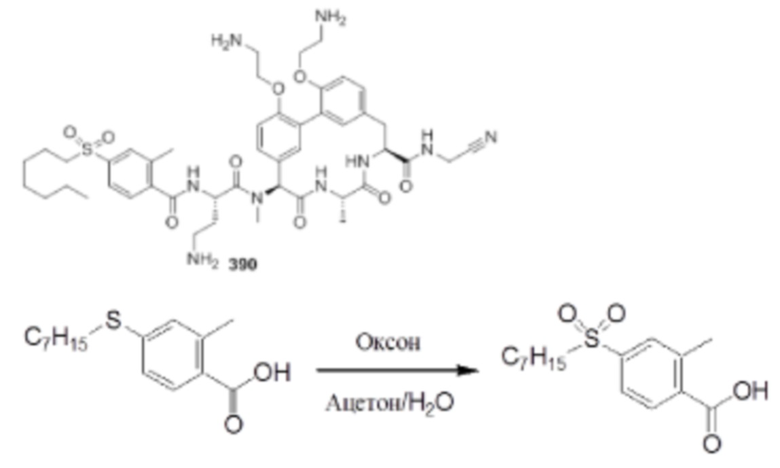
К раствору 4-гептилсульфанил-2-метилбензойной кислоты (50,0 мг, 0,19 ммоль) в ацетоне (3 мл) добавляли пероксимоносульфат калия (230,8 мг, 0,38 ммоль) в воде (1 мл). Смесь перемешивали при 0°С в течение 2 ч, гасили насыщенным водным раствором Na2SO3 и экстрагировали EtOAc (20 мл ×2). Объединенные органические слои промывали водой (40 мл ×2) и солевым раствором (20 мл), сушили над Na2SO4 и концентрировали с получением 4-гептилсульфонил-2-метилбензойной кислоты (50 мг, 89,3% выход) в виде белого твердого вещества, которое сразу использовали.
Соединение 390 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95 АВ, ESI): tR=0,590 мин, [М+Н]+=918,4.
Пример 295: Синтез соединения 391
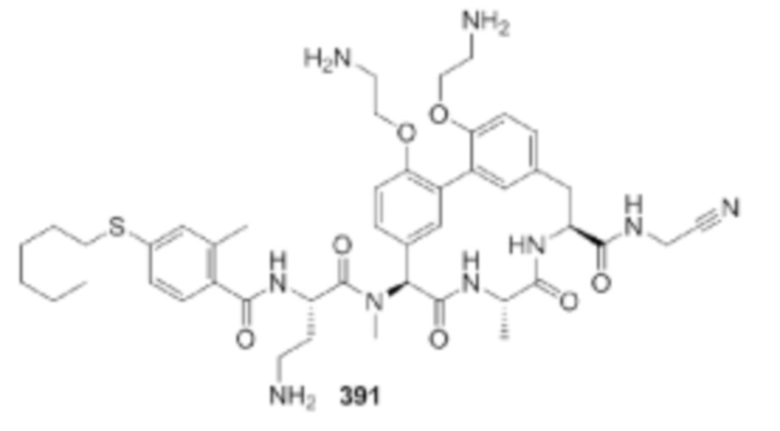
Соединение 391 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 293 (соединение 389). LCMS (способ 5-95 АВ, ESI): tR=0,637 мин, [M+Na]+=894,4.
Пример 296: Синтез соединения 392

Стадия 1: К раствору октановой кислоты (5,0 г, 34,7 ммоль) в THF (100 мл) добавляли 3-метокси-3-оксопропаноат калия (6,2 г, 38,1 ммоль) и смесь перемешивали при комнатной температуре в течение 2 ч, а затем добавляли MgCl2 (3,3 г, 34,7 ммоль) и CDI (5,7 г, 36,4 ммоль). Полученную смесь нагревали до 60°С в течение 3 ч. После охлаждения до комнатной температуры фильтрат концентрировали и остаток переносили в EtOAc (150 мл), затем промывали солевым раствором (150 мл ×2). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением метил-3-оксодеканоата (4,4 г, 63,4% выход) в виде желтого масла.
Стадия 2: Процедуру общего способа NaOH (NaOH сложноэфирный гидролиз) использовали по отношению к метил-3-оксодеканоату (200 мг, 1,0 ммоль) с получением 3-оксодекановой кислоты (150 мг, 81% выход) в виде белого твердого вещества.
Соединение 392 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением тех же способов, используемых при получении соединения 231 (пример 137), за исключением того, что 3-оксодекановую кислоту использовали на стадии сочетания. LCMS (5-95 АВ, ESI): tR=0,574, [М+Н]+=793,2.
Пример 297: Синтез соединения 393-Р1 и соединения 393-Р2
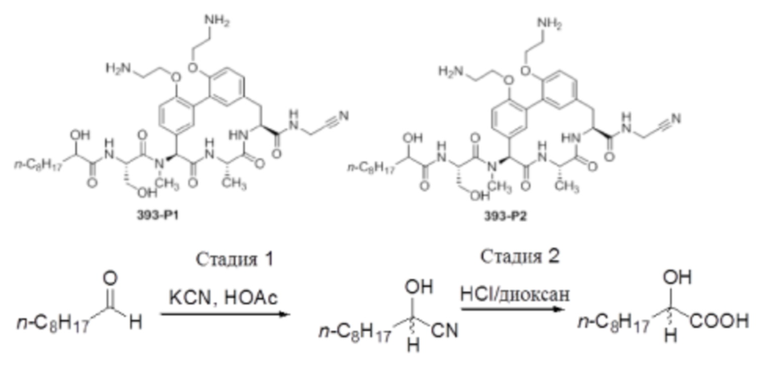
Стадия 1: К смеси KCN (2,59 г, 39,7 ммоль) в EtOAc/МеОН (80 мл, объем/объем = 1:1) добавляли последовательно НОАс (2,39 г, 39,7 ммоль) и нонаналь (5,0 г, 35,2 ммоль) при 0°С и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Летучие вещества удаляли и остаток выливали в Н2О (50 мл), затем экстрагировали EtOAc (40 мл ×3). Объединенные органические слои сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением (±)-2-гидроксидеканнитрила (5,8 г, 97,5% выход) в виде бесцветного масла.
Стадия 2: Кислотный гидролиз нитрила до кислоты было описан и назван как общий способ нитрильного гидролиза. К раствору (±)-2-гидроксидеканнитрила (2,0 г, 11,8 ммоль) в 1,4-диокеане (10 мл) добавляли 36% раствор HCl (10 мл) и смесь нагревали до 100°С при перемешивании и перемешивали при той же температуре в течение 12 ч. Летучие вещества удаляли с получением (±)-2-гидроксидекановой кислоты (1,6 г, 60,3% выход) в виде белого твердого вещества, которое использовали сразу на следующей стадии.
Соединение 393-Р1 (соль муравьиной кислоты) и соединение 393-Р2 получали в виде белых твердых веществ с применением тех же способов, используемых при получении соединения 231 (пример 137), за исключением того, что (±)-2-гидроксидекановую кислоту использовали на стадии сочетания. Диастереомеры разделяли методом преп-HPLC. Данные соединения 393-Р1: LCMS (5-95 АВ, ESI): tR=0,727, [М+Н]+=795,4. Данные соединения 393-Р2: LCMS (5-95 АВ, ESI): tR=0,730, [М+Н]+=795,4.
Пример 298: Синтез соединения 394
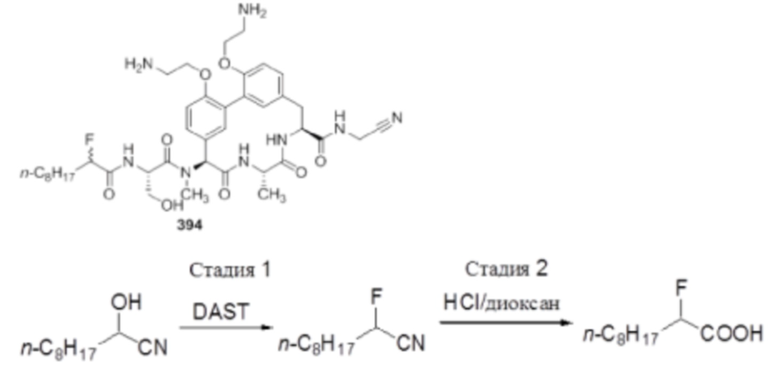
Стадия 1: К раствору (±)-2-гидроксидеканнитрила (3,0 г, 17,7 ммоль) в DCM (20 мл) по каплям добавляли DAST (6,4 г, 39,9 ммоль) при -78°С в течение 0,5 ч. Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали при той же температуре в течение 36 ч. Летучие вещества удаляли и остаток переносили в EtOAc (100 мл), затем промывали солевым раствором (100 мл ×2). Органический слой сушили Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением (±)-2-фтордеканнитрила (1,5 г, 49,4% выход) в виде бесцветного масла.
Стадия 2: (±)-2-Фтордеканнитрил (490 мг, 2,9 ммоль) подвергали общему способу нитрильного гидролиза с получением (±)-2-фтордекановой кислоты (450 мг, 83% выход) в виде светло-желтого твердого вещества.
Соединение 394-Р1 (соль муравьиной кислоты) и соединение 394-Р2 получали в виде белых твердых веществ с применением тех же способов, используемых при получении соединения 231 (пример 137), за исключением того, что (±)-2-фтордекановую кислоту использовали на стадии сочетания. Диастереомеры разделяли методом преп-HPLC. Данные соединения 394-Р1: LCMS (5-95 АВ, ESI): tR=0,760, [М+Н]+=797,6. Данные соединения 394-Р2: LCMS (5-95 АВ, ESI): tR=0,773, [М+Н]+=797,4.
Пример 299: Синтез соединения 395
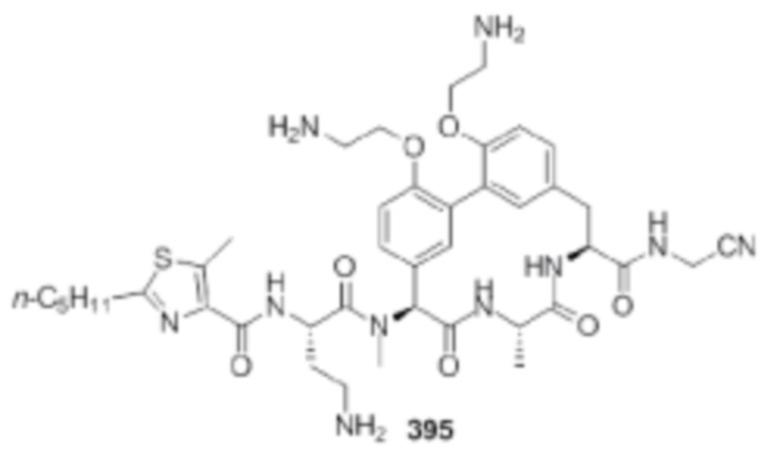

Стадия 1: К раствору гексанамида (500 мг, 4,4 ммоль) в ТВМЕ (40 мл) добавляли пентасульфид фосфора (241 мг, 1,1 ммоль) при комнатной температуре и смесь перемешивали при той же температуре в течение 18 ч. Летучие вещества удаляли и остаток очищали на испарительной колонке с силикагелем с получением гексантиоамида (420 мг, 73,7% выход) в виде бледно-желтого твердого вещества.
Стадия 2: К раствору гексантиоамида (420 мг, 3,2 ммоль) в EtOH (6 мл) по каплям добавляли этил-3-бром-2-оксобутаноат (669 мг, 3,2 ммоль) в атмосфере N2 при 0°С и смесь постепенно нагревали и перемешивали при комнатной температуре в течение 18 ч. Летучие вещества удаляли и остаток переносили в EtOAc (50 мл), затем промывали солевым раствором (50 мл). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением этил-5-метил-2-пентилтиазол-4-карбоксилата (390 мг, 50,5% выход) в виде бледно-зеленого масла.
Стадия 3: Процедуру NaOH сложиоэфирного гидролиза (общий способ NaOH) использовали по отношению к этил-5-метил-2-пентилтиазол-4-карбоксилату (390 мг, 1,62 ммоль) с получением 5-метил-2-пентилтиазол-4-карбоновой кислоты (250 мг, 72,5% выход) в виде бледно-желтого твердого вещества.
Соединение 395 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95 АВ, ESI): tR=0,568, [М+Н]+=833,3.
Пример 300: Синтез соединения 396


Стадия 1: К раствору (3)-метил-2-амино-4-((трет-бутоксикарбонил)амино)бутаноата (2,8 г, 12,0 ммоль), 2-нитробензолсульфонилхпорида (4,0 г, 18,0 ммоль) в DCM (40 мл) добавляли Et3N (3,7 г, 36,0 ммоль) при 0°С и смесь перемешивали при той же температуре в течение 2 ч. Реакционную смесь затем промывали 1 н HCl (40 мл), насыщенным раствором NaHCO3 (40 мл) и солевым раствором (40 мл). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением (S)-метил-4-((трет-бутоксикарбонил)амино)-2-(2-нитрофенилсульфонамидо)бутаноата (4,5 г, 89,4% выход) в виде бледно-зеленого масла.
Стадия 2: К раствору (S)-метил-4-((трет-бутоксикарбонил)амино)-2-(2-нитрофенилсульфонамидо)бутаноата (2,3 г, 5,5 ммоль), K2CO3 (3,8 г, 27,5 ммоль) в DMF (10 мл) добавляли метилйодид (3,9 г, 27,5 ммоль) и смесь перемешивали при комнатной температуре в течение 1,5 ч. В реакционную смесь добавляли EtOAc (100 мл) и путем фильтрации промывали солевым раствором (100 мл ×3). Органический слой сушили над Na2SO4, концентрировали с получением (S)-метил-4-((трет-бутоксикарбонил)амино)-2-(N-метил-2-нитрофенилсульфонамидо)бутаноата (2,3 г, 96,7% выход) в виде бледно-желтого масла.
Стадия 3: К раствору (S)-метил-4-((трет-бутоксикарбонил)амино)-2-(N-метил-2-нитрофенилсульфонамидо)бутаноата (2,2 г, 5,1 ммоль), K2CO3 (4,2 г, 30,6 ммоль) в DMF (15 мл) добавляли тиофенол (6,3 г, 57,1 ммоль) и смесь перемешивали при комнатной температуре в течение 3 ч. При помощи TLC (50% этилацетат в петролейном эфире, Rf=0,1) наблюдали израсходование исходного вещества. В реакционную смесь добавляли EtOAc (100 мл) и путем фильтрации промывали солевым раствором (100 мл ×3). Органический слой сушили над Na2SO4, концентрировали с получением (S)-метил-4-((трет-бутоксикарбонил)амино)-2-(метиламино)бутаноата (830 мг, 66,1% выход) в виде желтого масла. 1H ЯМР (400 МГц, CDCl3) δ 5.15-5.21 (m, 1Н), 3.73 (s, 3Н), 3.17-3.32 (m, 3Н), 2.35 (s, 3Н), 1.84-1.89 (m, 1Н), 1.66-1.73 (m, 1Н), 1.43 (s, 9Н)
Стадия 4: К раствору (S)-метил4-((трет-бутоксикарбонил)амино)-2-(метиламино)бутаноата (730 мг, 2,96 ммоль) и Et3N (750 мг, 7,41 ммоль) в DCM (50 мл) по каплям добавляли бензилхлорформиат (758 мг, 4,45 ммоль) при 0°С и смесь нагревали до температуры при перемешивании и перемешивали при той же температуре в течение 2 ч. Смесь промывали последовательно 1 н HCl (30 мл) и солевым раствором (30 мл ×2). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением (S)-метил-2-(((бензилокси)карбонил)(метал)амино)-4-((трет-бутоксикарбонил)амино)бутаноата (1,0 г, 88,7% выход) в виде бледно-желтого масла.
Стадия 5: Типичный сложноэфирный гидролиз (NaOH/MeOH/H2O) использовали по отношению к (S)-метил-2-(((бензилокси)карбонил)(метал)амино)-4-((трет-бутоксикарбонил)амино)бутаноату (1,0 г, 2,63 ммоль) с получением (S)-2-(((бензилокси)карбонил)(метил)амино)4-((трет-бутоксикарбонил)амино)бутановой кислоты (800 мг, 83% выход) в виде бледно-желтого масла.
Соединение 396 (6,0 мг) в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95 АВ, ESI): tR=0,739, [М+Н]+=854,6; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.49 (brs, 2Н), 7.35-7.22 (m, 6Н), 7.19 (d, J=8.4 Гц, 1Н), 7.09 (d, J=8.4 Гц, 1Н), 6.90 (brs, 1Н), 6.81 (brs, 1Н), 6.24 (s, 1Н), 5.57 (s, 2Н), 4.77-4.75 (m, 1Н), 4.26-4.17 (m, 4Н), 4.20 (s, 2Н), 3.30-3.20 (m, 1Н), 3.18-3.14 (m, 4Н), 3.08-3.03 (m, 2Н), 3.00 (s, 3Н), 2.82 (s, 3Н), 2.72-2.64 (m, 3Н), 2.40-2.25 (m, 1Н), 2.20-2.16 (m, 1Н), 1.64 (s, 3Н), 1.39-1.25 (m, 10Н), 0.90 (t, J=6.6 Гц, 3Н).
Пример 301: Синтез соединения 397
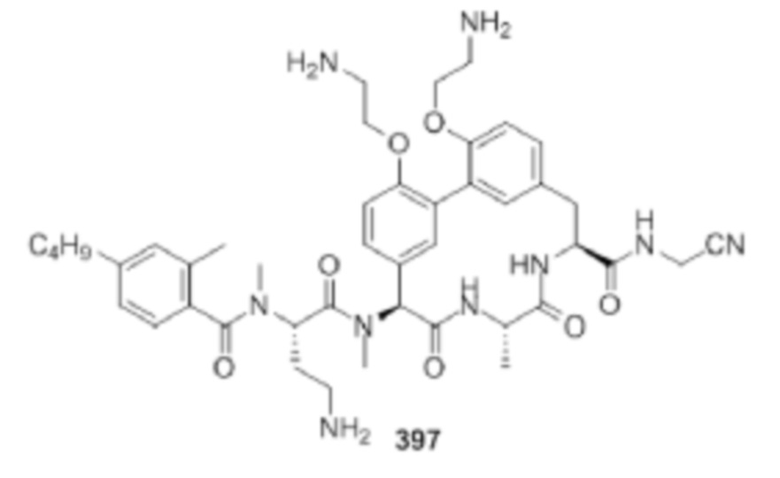
Соединение 397 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 300. LCMS (5-95 АВ, ESI): tR=0,688, [М+Н]+=826,5.
Пример 302: Синтез соединения 398

Соединение 398 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 300. LCMS (5-95 АВ, ESI): tR=0,753, [М+Н]+=834,6.
Пример 303: Синтез соединения 399
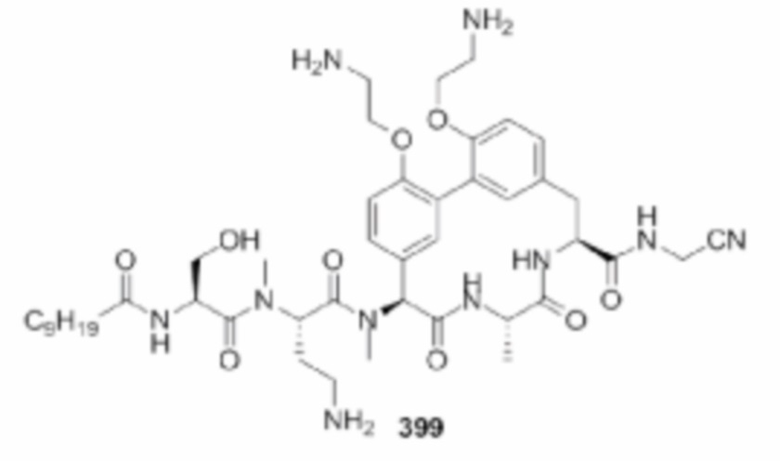
Соединение 399 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 300. LCMS (5-95 АВ, ESI): tR=0,585, [М+Н]+=893,6.
Пример 304: Синтез соединения 400
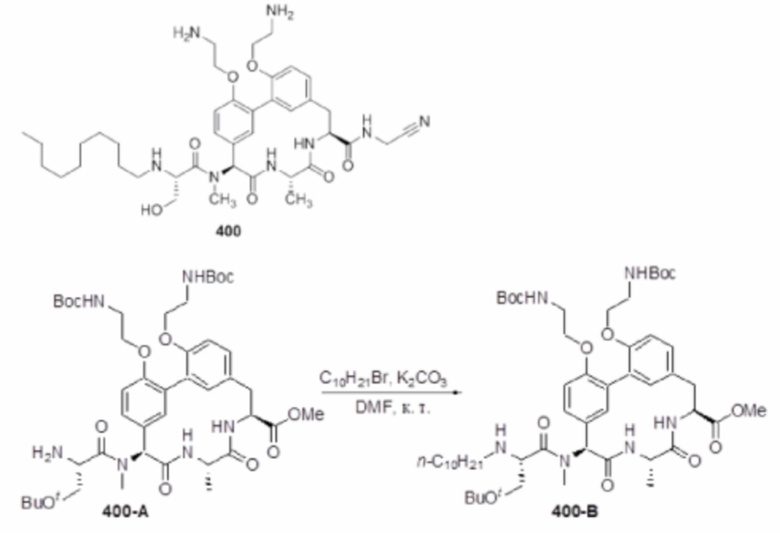
Соединение 400-А представляет собой промежуточное соединение при получении соединения 231 (пример 137).
К перемешиваемому раствору соединения 400-А (150 мг, 0,16 ммоль) в DMF (5 мл) добавляли 1-бромдекан (697 мг, 3,15 ммоль) и K2CO3 (435 мг, 3,15 ммоль) и смесь перемешивали при комнатной температуре в течение 2 суток. В реакционную смесь затем добавляли EtOAc (50 мл), затем промывали солевым раствором (50 мл ×2). Органический слой сушили над Na2SO4, концентрировали и остаток очищали методом преп-TLC с получением соединения 400-В (70 мг, 44,6% выход) в виде белого твердого вещества. LCMS (5-95 АВ, ESI): tR=0,851, [М+Н]+=997,5
Соединение 400 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением тех же способов, используемых при получении соединения 101 (пример 7), начиная с соединения 400-В. LCMS (5-95 АВ, ESI): tR=0,597, [М+Н]+=765,3; 1Н ЯМР (400 МГц, MeOH-d4) δ 7.31-7.28 (m, 2Н), 7.20 (d, J=8.0 Гц, 1Н), 7.12 (d, J=8.0 Гц, 1H), 6.91 (brs, 1H), 6.82 (brs, 1H), 6.39 (s, 1H), 4.80-4.75 (m, 1H), 4.27-4.15 (m, 6H), 4.21 (s, 2H), 4.05-3.95 (m, 1H), 3.85-3.77 (m, 1H), 3.25-3.16 (m, 7H), 2.93-2.80 (m, 1H), 2.89 (s, 3H), 1.73 (brs, 2H), 1.41-1.20 (m, 17H), 0.93 (t, J=6.0 Гц, 3Н). LCMS (5-95 АВ, ESI): tR=0.597, [M+H]+=765.3; 1H ЯМР (400 МГц, MeOH-d4) δ 7.31-7.28 (m, 2H), 7.20 (d, J=8.0 Гц, 1H), 7.12 (d, J=8.0 Гц, 1H), 6.91 (brs, 1H), 6.82 (brs, 1H), 6.39 (s, 1H), 4.80-4.75 (m, 1H), 4.27-4.15 (m, 6H), 4.21 (s, 2H), 4.05-3.95 (m, 1H), 3.85-3.77 (m, 1H), 3.25-3.16 (m, 7H), 2.93-2.80 (m, 1H), 2.89 (s, 3H), 1.73 (brs, 2H), 1.41-1.20 (m, 17H), 0.93 (t, J=6.0 Гц, 3Н).
Пример 305: Синтез соединения 401

Соединение 401-А представляет собой промежуточное соединение при синтезе соединения 401 с применением ранее описанных способов.
К перемешиваемому раствору соединения 401-А (100 мг, 0,11 ммоль) в DMF (3 мл) добавляли трет-бутил(3-бромпропил)карбамат (34 мг, 0,16 ммоль), K2CO3 (37 мг, 0,27 ммоль). Смесь затем перемешивали при комнатной температуре в течение 72 ч. В реакционную смесь добавляли EtOAc (30 мл), затем промывали солевым раствором (30 мл ×2). Органический слой сушили над MgSO4, концентрировали и остаток очищали методом преп-TLC с получением соединения 401-В (30 мг, 25,7% выход) в виде белого твердого вещества. LCMS (5-95 AB.ESI): tR=0,833, [М+Н]+=1087,7
Соединение 401 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением тех же способов, используемых при получении соединения 257 (пример 162). LCMS (5-95 АВ, ESI): tR=0,737, [М+Н]+=927,1.
Пример 306: Синтез соединения 402
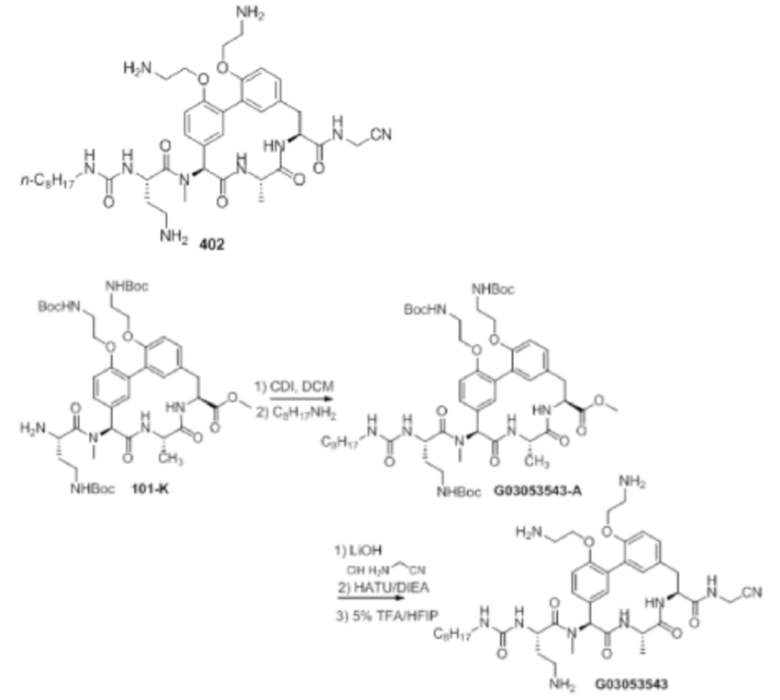
К раствору соединения 101-K (100 мг, 0,20 ммоль) в DCM (2 мл) добавляли CDI (20 мг, 0,20 ммоль) при комнатной температуре и смесь перемешивали всю ночь. К смеси затем добавляли n-C8H17NH2 (42 мг, 0.33 ммоль) при той же температуре и полученную смесь перемешивали еще 20 ч при комнатной температуре. Реакционную смесь разбавляли DCM (50 мл), а затем последовательно промывали насыщенной лимонной кислотой, насыщенным NaHCO3 и солевым раствором (30 мл каждого). Органический слой сушили над Na2SO4, концентрировали и остаток очищали методом преп-TLC с получением соединения 402-А (85 мг, 72,9% выход) в виде белого твердого вещества. LCMS (5-95 АВ, ESI): tR=1,072, [М+Н]+=1070,0.
Начиная с соединения 402-А соединение 402 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95 АВ, ESI): tR=0,751, [M+H]+=793,9; 1H ЯМР (400 МГц, MeOH-d4) δ 8.50 (brs, 2H, HCOOH), 7.38-7.25 (m, 2H), 7.20-7.11 (m, 2H), 6.90 (brs, 1H), 6.83 (brs, 1H), 6.31 (s, 1H), 5.00-4.79 (m, 3H), 4.30-4.20 (m, 4H), 4.21 (s, 2H), 3.30-2.88 (m, 10H), 2.87 (s, 3H), 2.20-2.10 (m, 1H), 2.00-1.85 (m, 1H), 1.55-1.45 (m, 2H), 1.40-1.30 (m, 13H), 0.93 (t, J=6.8 Гц, 3Н).
Пример 307: Синтез соединения 403

Соединение 403 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 306 (соединение 402). LCMS (5-95 АВ, ESI): tR=0,763, [М+Н]+=835,5.
Пример 308: Синтез соединения 404

Стадия 1: Раствор 4-гексил-2-метилбензойной кислоты (300 мг, 1,4 ммоль), дифенилфосфорилазида (450 мг, 1,6 ммоль), бензилового спирта (442 мг, 4,1 ммоль) и Et3N (386 мг, 3,8 ммоль) в толуоле (10 мл) перемешивали при 100°С в течение 16 ч. Реакционную смесь разбавляли водой (30 мл), затем экстрагировали EtOAc (30 мл × 2). Объединенные органические слои промывали солевым раствором (50 мл × 2), сушили над MgSO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением бензил(4-гексил-2-метилфенил)карбамата (270 мг, 60,9% выход) в виде белого твердого вещества. LCMS (5-95АВ, ESI): tR=1,099, [М+Н]+=326,0.
Стадия 2: Стандартную процедуру гидрирования (Pd/C) (общий способ гидрирования) использовали по отношению к бензил(4-гексил-2-метилфенил)карбамату (270 мг, 0,83 ммоль) с получением 4-гексил-2-метиланилина (125 мг, 79% выход) в виде белого твердого вещества.
Стадия 3: К раствору 4-гексил-2-метиланилина (30 мг, 0,16 ммоль) в THF (1 мл) частями добавляли фенилхлорформиат (27 мг, 0,17 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию гасили водой (5 мл), смесь экстрагировали EtOAc (5 мл × 3). Объединенные органические слои сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением фенил(4-гексил-2-метилфенил)карбамата (40 мг, 81,9% выход) в виде бесцветного масла. LCMS (5-95АВ, ESI): tR=0,960, [М+Н]+=311,9
Стадия 4: К раствору соединения 101-K (80 мг, 0,09 ммоль) в CHCl3 (3 мл) добавляли Et3N (27 мг, 0,26 ммоль) и фенил(4-гексил-2-метилфенил)карбамат (35 мг, 0,11 ммоль) и смесь нагревали до 80°С при перемешивании и перемешивали при той же температуре в течение 3 ч. Летучие вещества удаляли и остаток очищали методом преп-TLC с получением соединения 404А-А (90 мг, 90,9% выход) в виде грязно-белого твердого вещества. LCMS (5-95АВ, ESI): tR=0,983, [М+Н]+=1132,5.
Начиная с соединения 404А-А соединение 404 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95АВ, ESI): tR=0,627, [М+Н]+=855,5; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.46 (brs, 2Н, НСООН), 7.35-7.27 (m, 2Н), 7.24 (d, J=8.0 Гц, 1H), 7.15 (d, J=8.0 Гц, 1H), 7.09 (d, J=8.0 Гц, 1H), 7.03 (brs, 1H), 6.98 (d, J=8.0 Гц, 1H), 6.90 (brs, 1H), 6.81 (brs, 1Н), 6.31 (s, 1H), 4.80-4.76 (m, 3Н), 4.28-4.17 (m, 4Н), 4.19 (s, 2Н), 3.27-3.20 (m, 4Н), 3.18-3.04 (m, 4Н), 2.88 (s, 3Н), 2.55 (t, J=7.2 Гц, 2Н), 2.26-2.15 (m, 1H), 2.24 (s, 3Н), 2.03-1.95 (m, 1Н), 1.63-1.55 (m, 2Н), 1.37-1.26 (m, 9Н), 0.89 (t, J=6.4 Гц, 3Н).
Пример 309: Синтез соединения 405

Стадия 1: К раствору 4-бром-2-метилбензойной кислоты (10,7 г, 50 ммоль) в THF (250 мл) при -78°С по каплям добавляли 2 М н-BuLi в гексане (6,0 мл) и смесь перемешивали при той же температуре в течение 3 ч. DMF (3,85 мл, 50 ммоль) затем добавляли к смеси при -78°С и полученную смесь медленно нагревали до комнатной температуры при перемешивании и перемешивали при той же температуре в течение 1,5 ч. Реакцию гасили 1 н HCl (200 мл), затем экстрагировали EtOAc (200 мл × 3). Объединенные органические слои сушили над Na2SO4 и концентрировали с получением неочищенного вещества, которое перетирали в порошок с петролейным эфиром с получением 4-формил-2-метилбензойной кислоты (3,0 г, 36,7% выход) в виде грязно-белого твердого вещества.
Стадия 2: К раствору 4-формил-2-метилбензойной кислоты (762 мг, 4,6 ммоль), нонан-5-она (600 мг, 4,2 ммоль) в DCM (10 мл) добавляли диэтиловый эфират трифторида бора (1,07 мл, 8,44 ммоль) и смесь перемешивали при 45°С в течение 16 ч. DCM (30 мл) добавляли к реакционной смеси, которую затем промывали солевым раствором (50 мл × 2). Органический слой сушили над Na2SO4, концентрировали и остаток очищали методом HPLC с получением (Е)-2-метил-4-(пент-1-ен-1-ил)бензойной кислоты (400 мг, 46,4% выход) в виде грязно-белого твердого вещества. LCMS (10-80 АВ 2 мин, ESI): tR=1,221, [М+Н]+=205,2.
Соединение 405 (свободное основание) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95АВ, ESI): tR=0,700, [М+Н]+=824,5.
Пример 310: Синтез соединения 406

К раствору метилизобутирата (1,0 г, 9,8 ммоль) в THF (15 мл) по каплям добавляли 2 М LDA в THF (5,9 мл, 11,8 ммоль) при -78°С и смесь перемешивали при той же температуре в течение 0,5 ч. Затем добавляли 1-бромдекан (2,6 г, 11,8 ммоль) и НМРА (2,1 г, 11,8 ммоль) при -78°С и полученную смесь медленно нагревали до комнатной температуры при перемешивании и перемешивали еще 3 ч при комнатной температуре. Реакцию гасили насыщенным раствором NH4Cl (30 мл), затем экстрагировали EtOAc (30 мл × 3). Объединенные органические слои сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением метил-2,2-диметилдодеканоата (1,7 мг, 71,6% выход) в виде бесцветного масла. 1Н ЯМР (400 МГц. CDCl3) δ 3.64 (s, 3Н), 1.50-1.46 (m, 2Н), 1.30-1.23 (m, 16Н), 1.14 (s, 6Н), 0.86 (t, J=6.4 Гц, 3Н).
Стадия 2: Процедуру сложноэфирного гидролиза с NaOH (общий способ NaOH) использовали по отношению к метил-2,2-диметилдодеканоату (500 мг, 0,45 ммоль) с получением 2,2-диметилдодекановой кислоты (330 мг, 70,1% выход) в виде светло-желтого твердого вещества.
Соединение 406 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95АВ, ESI): tR=0,609, [М+Н]+=848,5
Пример 311: Синтез соединения 407
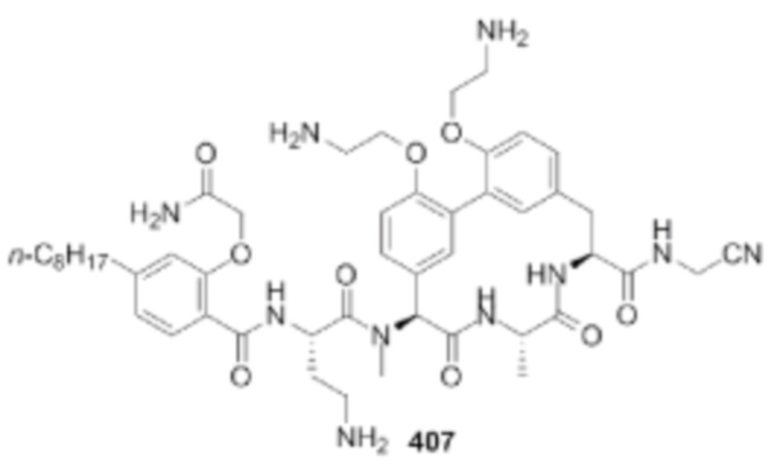

Стадия 1: Раствор метил-4-бром-2-гидроксибензоата (600 мг, 2,8 ммоль) и октилбороновой кислоты (874 мг, 5,6 ммоль), Pd(PPh3)4 (320 мг, 0,28 ммоль) и K2CO3 (1,15 г, 8,3 ммоль) в толуоле (16 мл) перемешивали при 100°С в атмосфере N2 в течение 16 ч. Летучие вещества удаляли и остаток очищали на испарительной колонке с силикагелем с получением метил-2-гидрокси-4-октилбензоата (706 мг, 96,6% выход) в виде бесцветного масла.
Стадия 2: К раствору метил-2-гидрокси-4-октилбензоата (300 мг, 1,13 ммоль) в DMF (8 мл) добавляли 2-бромацетамид (188 мг, 1.36 ммоль) и Cs2CO3 (740 мг, 2,27 ммоль) и смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли EtOAc (50 мл), затем промывали солевым раствором (50 мл × 2). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением метил-2-(2-амино-2-оксоэтокси)-4-октилбензоата (172 мг, 47,2% выход) в виде белого твердого вещества. LCMS (5-95АВ, ESI): tR=1,025, [М+Н]+=322,0
Стадия 3: Типичный сложноэфирный гидролиз (NaOH/THF) использовали по отношению к метил-2-(2-амино-2-оксоэтокси)-4-октилбензоату (70 мг, 0,22 ммоль) с получением 2-(2-амино-2-оксоэтокси)-4-октилбензойной кислоты (68 мг, 99% выход) в виде белого твердого вещества.
Проводили способы примера 7 (соединение 101) с получением соединения 407 (21,4 мг) в виде белого твердого вещества. LCMS (5-95АВ, ESI): tR=0,756, [М+Н]+=927,5; 1Н ЯМР (400 МГц, МеОН-d4) δ 7.81 (d, J=8.0 Гц 1Н), 7.32 (d, J=8.0 Гц, 1Н), 7.23 (d, J=8.0 Гц, 1H), 7.15 (d, J=8.0 Гц, 1H), 7.09 (d, J=8.0 Гц 1H), 6.97 (d, J=8.0 Гц, 1H), 6.93 (brs, 1H), 6.88 (brs, 1H), 6.81 (brs, 1H), 6.34 (s, 1H), 4.90-4.75 (m, 5H), 4.23-4.18 (m, 4H), 4.19 (s, 2H), 3.35-3.30 (m, 4H), 3.20-3.13 (m, 4H), 2.90 (s, 3H), 2.71-2.65 (m, 2H), 2.28-2.15 (m, 2H), 1.70-1.55 (m, 2H), 1.40-1.20 (m, 13H), 0.89 (t, J=6.0 Гц, 3H).
Пример 312: Синтез соединения 408
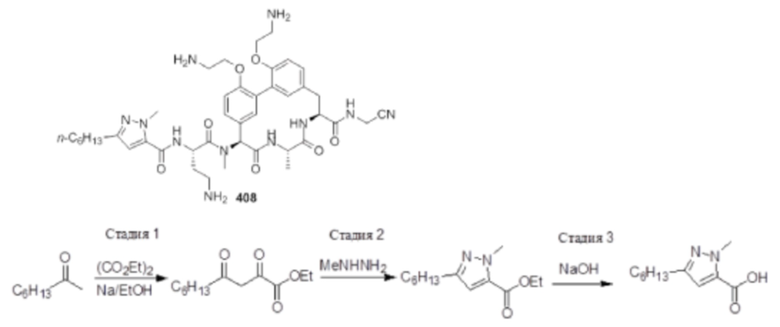
Стадия 1: Na (179 мг, 7,8 ммоль) частями добавляли к EtOH (10 мл) при перемешивании и смесь перемешивали при комнатной температуре в течение 2 ч, а затем последовательно добавляли диэтилоксалат (1,14 г, 7,8 ммоль) и окстан-2-он (1,0 г, 7,8 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч. В реакционную смесь добавляли EtOAc (50 мл), затем промывали солевым раствором (50 мл × 2). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением этил 2,4-диоксодеканоата в виде светло-желтого масла (900 мг).
Стадия 2: Раствор этил-2,4-диоксодеканоата (700 мг, 3,1 ммоль) и метилгидразина (155 мг, 3,4 ммоль) в EtOH (10 мл) перемешивали при 80°С в течение 3 ч. Летучие вещества удаляли и остаток переносили в EtOAc (50 мл), затем промывали солевым раствором (30 мл × 2). Органический слой сушили над MgSO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением этил-3-гексил-1-метил-1Н-пиразол-5-карбоксилата (280 мг, 38,3% выход) в виде желтого масла. 1Н ЯМР (400 МГц, CDCl3) δ 6.61 (s, 1H), 4.31 (q, J=7.2 Гц, 2Н), 4.12 (s, 3Н), 2.61-2.54 (m, 2Н), 1.66-1.56 (m, 2Н), 1.34 (t, J=7.2 Гц, 3Н), 1.33-1.25 (m, 6Н), 0.89 (t, J=6.8 Гц, 3Н).
Стадия 3: Типичную процедуру сложи оэфирного гидролиза (NaOH/THF) использовали по отношению к этил-3-гексил-1-метил-1Н-пиразол-5-карбоксилату (260, 1,1 ммоль) с получением 3-гексил-1-метил-1H-пиразол-5-карбоновой кислоты (220 мг, 96% выход) в виде белого твердого вещества.
Проводили способы примера 7 (соединение 101) с получением соединения 408 (9,0 мг) в виде белого твердого вещества. LCMS (5-95АВ, ESI): tR=0,686, [М+Н]+=830,5.
Пример 313: Синтез соединения 409

Соединение 409-А получали в течение синтеза соединения 193 (пример 99) с применением способов примера 112 (соединение 206). LCMS (способ 5-95АВ): tR=1,017 мин, [М+Н]+=1171,0.
Смесь соединения 409-А (30,0 мг, 0,03 ммоль), карбоната калия (10,6 мг, 0,08 ммоль) и трет-бутилбромацетата (15.0 мг, 0,08 ммоль) в N,N-диметилформамиде (3 мл) перемешивали при 15°С в течение 2 ч. Реакционную смесь выливали в воду (3 мл) и экстрагировали EtOAc (10 мл). Органический экстракт промывали водой (10 мл × 2) и солевым раствором (10 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом преп-TLC (5% метанола в DCM, Rf=0,4) с получением соединения 409-В (20 мг, 60,7% выход) в виде белого твердого вещества. LCMS (способ 5-95АВ): tR=1,035 мин, [М+Н]+=1285,2.
Соединение 409 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95АВ): tR=0,627 мин, [М+Н]+=929,0.
Пример 314: Синтез соединения 410
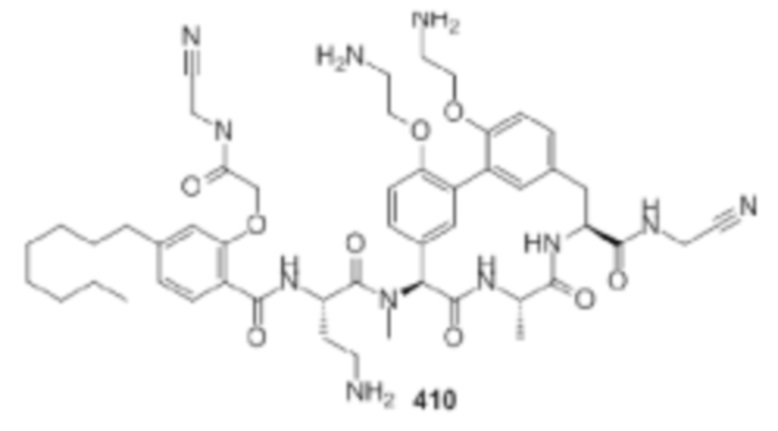

Соединение 410-А получали с использованием описанных ранее способов из 2-(2-(трет-бутокси)-2-оксоэтокси)-4-октилбензойной кислоты. В течение реакции сочетания с карбоновой кислотой с применением общего способа 4 (пример 5) проходило бис-добавление нитрила с образованием соединения 410-В.
Соединение 410 (соль муравьиной кислоты) получали в виде белого твердого вещества из соединения 410-В с применением условий гидролиза TFA примера 7. LCMS (способ 5-95АВ): tR=0,617 мин, [М+Н]+=966,3.
Пример 315: Синтез соединения 411
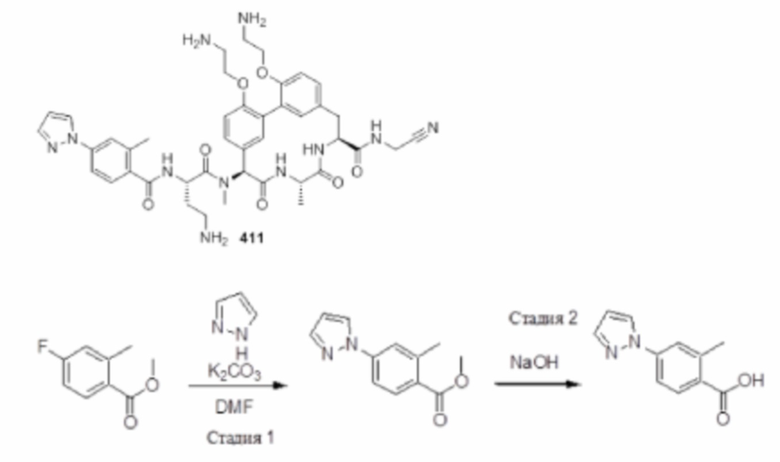
Стадия 1: Смесь пиразола (100 мг, 1,47 ммоль), метил-4-фтор-2-метилбензоата (123,51 мг, 0,73 ммоль) и карбонат калия (609,0 мг, 4,41 ммоль) в N,N-диметилформамиде (5 мл) перемешивали при 60°С в течение 16 ч. Реакционную смесь выливали в воду (5 мл) и экстрагировали EtOAc (20 мл). Органический экстракт промывали водой (20 мл × 2) и солевым раствором (10 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом преп-TLC (33% этилацетата в петролейном эфире, Rf=0,3) с получением метил-2-метил-4-(1Н-пиразол-1-ил)бензоата (50 мг, 15,7% выход) в виде белого твердого вещества. LCMS (способ 5-95АВ): tR=0,732 мин, [М+Н]+=216,9.
Стадия 2: Метил-2-метил-4-(1Н-пиразол-1-ил)бензоат гидролизировапи, как описано ранее (общий способ NaOH), с получением 2-метил-4-(1Н-пиразол-1-ил)бензойной кислоты.
Соединение 315 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 0-60АВ): tR=0,830 мин/2 мин, [М+Н]+=822,3.
Пример 316: Синтез соединения 412

Стадия 1: Смесь 1-(3-диметиламиногфоггил)-3-этилкарбодиимида гидрохлорида (1,15 г, 6,01 ммоль), N,N-диизопропилэтиламина (2,48 мл, 15,03 ммоль), 1-гидроксибензотриазола (0,81 г, 6,01 ммоль), 4-бром-3-хлорбензойной кислоты (1,18 г, 5,01 ммоль) и N,O-диметилгидроксиламина гидрохлорида (0,98 г, 10,02 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 20°С в течение 16 ч. Реакцию гасили водой (20 мл) и экстрагировали EtOAc (25 мл × 2). Объединенные органические слои концентрировали и очищали на колонке (30% EtOAc в петролейном эфире, Rf=0,3) с получением 4-бром-3-хлор-N-метокси-N-метилбензамида (1,38 г, 98,9% выход) в виде желтого масла.
Стадия 2: К раствору гептилмагния бромида (2,37 мл, 2,37 ммоль) в тетрагидрофуране (3 мл) добавляли 4-бром-3-хлор-N-метокси-N-метилбензамид (300,0 мг, 1,08 ммоль) в атмосфере N2 при 0°С и перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили водн. NH4Cl (1 мл) и экстрагировали EtOAc (10 мл × 3). Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток очищали на колонке с силикагелем, элюировали этилацетатом/петролейным эфиром (1:10) с получением 1-(4-бром-3-хлор-фенил)октан-1-она (310 мг, 90,6% выход) в виде бесцветного масла. 1H ЯМР (400 МГц, CDCl3): δ 8.00 (d, J=1.6 Гц, 1H), 7.75-7.60 (m, 2H), 2.90 (t, J=7.6 Гц, 2H), 1.70 (квинт., J=7.3 Гц, 2Н), 1.45-1.20 (m, 8Н), 0.87 (t, J=7.0 Гц, 3Н).
Стадия 3: Смесь 1-(4-бром-3-хлор-фенил)октан-1-она (150,0 мг, 0,47 ммоль) в деоксофторе (R) (2,14 мл, 11,81 ммоль) перемешивали при 80°С в течение 16 ч. Смесь гасили води. Na2S2O3 (3 мл) и водн. NaHCO3 (3 мл) при 0°С и экстрагировали петролейным эфиром (10 мл × 3). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом преп-TLC (5% EtOAc в петролейном эфире, Rf=0,5) с получением 1-бром-2-хлор-4-(1,1-дифтороктил)бензола (54 мг, 33,7% выход) в виде бесцветного масла.
Стадия 4: Раствор 1-бром-2-хлор-4-(1,1-дифтороктил)бензола (50,0 мг, 0,15 ммоль) и триэтиламина (44,7 мг, 0,44 ммоль) в метаноле (10 мл) обрабатывали 1,1'-бис(дифенилфосфино)ферроцена палладия дихлоридом (10,8 мг, 0,01 ммоль). Полученную смесь перемешивали при 80°С в течение 16 часов в атмосфере СО (45 фунт/кв. дюйм). Реакционную смесь концентрировали и остаток очищали на колонке с силикагелем (10% этилацетата в петролейном эфире) с получением метил-2-хлор-4-(1,1-дифтороктил)бензоата (30 мг, 63,9% выход) в виде бесцветного масла.
Стадия 5: Метил-2-хлор-4-(1,1-дифтороктил)бензоат (30,0 мг, 0,09 ммоль) гидролизировали, как описано ранее (общий способ NaOH), с получением неочищенной 2-хлор-4-(1,1-дифтороктил)бензойной кислоты (25 мг, 87,2% выход) в виде белого твердого вещества.
Соединение 412 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95АВ): tR=0,664 мин, [M+Na]+=946,4.
Пример 317: Синтез соединения 413


1-(4-бром-3-хлор-фенил)октан-1-он был описан в примере 316. С применением способов примера 316 (карбонилирование, а затем сложноэфирный гидролиз NaOH с общим способом NaOH) синтезировали 2-хлор-4-октаноилбензойную кислоту.
Соединение 413 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95АВ): tR=0,745 мин, [М+Н]+=902,7.
Пример 318: Синтез соединения 414

Стадия 1: К раствору метил-2-хлор-4-октилбензоату (350,0 мг, 1,24 ммоль) в 1,4-диоксане (2 мл) добавляли трет-бутилакрилат (174,5 мг, 1,36 ммоль), бис(три-трет-бутилфосфин)палладий(0) (9,5 мг, 0,02 ммоль), трис(дибензилиденацетон)дипалладий(0) (34,0 мг, 0,04 ммоль) и N,N-дициклогексилметиламин (265,9 мг, 1,36 ммоль). Смесь перемешивали при 25°С в течение 16 ч в атмосфере N2 и фильтровали. Фильтрат разбавляли водой (10 мл) и экстрагировали EtOAc (10 мл × 3). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом преп-TLC (10% EtOAc в петролейном эфире, Rf=0,7) с получением метил-2-[(Е)-3-трет-бутокси-3-оксопроп-1-енил]-4-октилбензоата (290 мг, 62,6% выход) в виде желтого масла. 1H ЯМР (400 МГц, CDCl3): δ 8.35 (d, J=16.0 Гц, 1H), 7.86 (d, J=8.0 Гц, 1H), 7.39 (s, 1H), 7.22 (d, J=8.0 Гц, 1H), 6.23 (d, J=15.9 Гц, 1H), 3.91 (s, 3Н), 2.64 (t, J=7.8 Гц, 2Н), 1.65-1.55 (m, 2Н), 1.54 (s, 9Н), 1.33-1.22 (m, 10Н), 0.88 (t, J=6.6 Гц, 3Н).
Стадия 2: К раствору метил-2-[(Е)-3-трет-бутокси-3-оксопроп-1-енил]-4-октил-бензоата (290,0 мг, 0,77 ммоль) в 1,2-дихлорэтане (2 мл) добавляли триметилолова гидроксид (1400,2 мг, 7,74 ммоль) и смесь перемешивали при 80°С в течение 16 ч. При помощи LCMS (5-95АВ/1,5 мин): tR=1,158 мин, [M+Na]+383,1 наблюдали 36% DP и 51% SM. Смесь разбавляли 0,1 н KHSO4 (5 мл) и экстрагировали EtOAc (10 мл × 3). Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали методом преп-TLC (50% EtOAc в петролейном эфире, Rf=0,2) с получением 2-[(Е)-3-трет-бутокси-3-оксопроп-1-енил]-4-октилбензойной кислоты (80 мг, 28,7% выход) в виде желтого твердого вещества.
Соединение 414 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,760 мин, [М+Н]+=924,5.
Пример 319: Синтез соединения 415

Соединение 415-А получали с применением ранее описанных способов.
Соединение 415-А (57,6 мг, 0,05 ммоль) растворяли в безводном THF (2 мл) и охлаждали реакционную смесь до 0°С в ледяной бане. Добавляли изобутилхлорформиат (10 мкл, 0,075 ммоль), а затем N-метилморфолин (16 мкл, 0,15 ммоль) в атмосфере N2. Реакционную смесь перемешивали в течение 30 мин. После полного израсходования исходного вещества (наблюдали при помощи TLC) добавляли (R)-2-аминопропаннитрил (7 мг, 0,1 ммоль) в THF (1,0 мл) и реакционную смесь перемешивали в течение 4 ч. После завершения реакции (наблюдали при помощи LCMS) реакционную смесь гасили насыщенным раствором NH4Cl (1,0 мл). Реакционную смесь разбавляли солевым раствором (2 мл) и экстрагировали EtOAc и объединенные органические слои промывали солевым раствором. Органический слой сушили над безводным Na2SO4, фильтровали и растворитель удаляли в вакууме.
Остаток подвергали процедуре глобального снятия защитных групп Boc (TFA/HFIP) (пример 7) с получением указанного соединения (5,0 мг) в виде белого твердого вещества. LCMS (способ 5-95АВ, ESI): tR=0.718, [М+Н]+=891.6; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.52 (brs, 4Н), 7.27-7.22 (m, 2Н), 7.17 (d, J=8.0 Гц, 1Н), 7.09 (d, J=8.0 Гц, 1Н), 6.87 (brs, 1Н), 6.83 (brs, 1Н), 6.34 (s, 1Н), 4.80-4.76 (m, 3Н), 4.27-4.22 (m, 5Н), 3.27-3.23 (m, 6H), 3.16-3.12 (m, 2Н), 3.02 (t, J=7.6 Гц, 2Н), 2.94 (t, J=7.6 Гц, 2Н), 2.88 (s, 2Н), 2.74 (brs, 2Н), 1.87 (brs, 2Н) 1.71 (m, 6Н), 1.54 (d, J=8.0 Гц, 3Н), 1.38-1.31 (m, 18Н), 0.91-0.88 (m, 3Н).
Пример 320: Синтез соединения 416

Стадия 1: К раствору соединения 416-А (500 мг, 0,5 ммоль) в диоксане (20 мл) добавляли 1 М NaOH (10 мл, 10 ммоль) и (Вос)2О (1,2 мл, 5 ммоль). Реакционную смесь перемешивали при комнатной температуре всю ночь. Диоксан удаляли при пониженном давлении и смесь подкисляли 1 М HCl. Полученное белое пастообразное вещество сушили с получением соединения 416-В (507 мг, 96%). MS (ESI) для (C55H66ClN5O14): m/z 1056 (М+Н)+.
Стадии 2 и 3: Соединение 416 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (5-95АВ, ESI): tR=0,658, [М+Н]+=794,0; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.50 (brs, 1H), 7.75 (d, J=8.0 Гц, 2Н), 7.60 (d, J=8.0 Гц, 2Н), 7.47 (d, J=8.0 Гц, 2Н), 7.39 (d, J=8.4 Гц, 2Н), 7.19 (d, J=8.0 Гц, 1 Н), 6.94 (d, J=8.0 Гц, 1 Н), 6.91 (brs, 1Н), 6.90 (brs, 1Н), 6.82 (d, J=8.0 Гц, 1Н), 6.72 (brs, 2Н), 4.95-4.91 (m, 1Н), 4.79-4.72 (m, 1Н), 4.58-4.50 (m, 1Н), 4.18 (s, 2Н), 3.10-2.80 (m, 4Н), 2.94 (s, 3 Н), 2.00-1.90 (m, 2Н), 1.65-1.45 (m, 4Н), 1.37 (d, J=6.8 Гц, 3 Н).
Пример 321: Синтез соединения 417

Соединение 417 (соль муравьиной кислоты) получали с применением ранее описанных способов из (S)-2-аминопропаннитрила. LCMS (5-95АВ, EST): tR=0,790, [М+Н]+=808,7.
Пример 322: Синтез соединения 418

Стадия 1: (S)-метил-2-((трет-бутоксикарбонил)амино)-3-((трет-бутилдиметилсилил)окси)пропаноат (1,0 г, 3 ммоль) добавляли к раствору насыщенного NH3 в МеОН (50 мл) и смесь перемешивали в закупоренной колбе в течение 18 ч. Летучие вещества удаляли с получением (S)-трет-бутил(1-амино-3-((трет-бутилдиметилсилил)окси)-1-оксопропан-2-ил)карбамата (950 мг, 99,5% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6) δ 7.35 (brs, 1H), 7.16 (brs, 1H), 6.46 (d, J=8.4 Гц, 1H), 4.02-4.06 (m, 1H), 3.76-3.63 (m, 2Н), 1.42(s, 9Н), 0.88 (s, 9Н), 0.06 (s, 6Н).
Стадии 2 и 3: (S)-трет-бутил(1-амино-3-((трет-бутилдиметилсилил)окси)-1-оксопропан-2-ил)карбамат подвергали тем же условиям дегидратации и гидролиза, что и в примере 42 (соединение 136).
Соединение 418 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (5-95АВ, ESI): tR=0,793, [М+Н]+=824,5; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.51 (brs, 1H), 7.87 (d, J=8.0 Гц, 2Н), 7.69 (d, J=8.0 Гц, 2Н), 7.59 (d, J=8.0 Гц, 2Н), 7.45 (d, J=8.0 Гц, 2Н), 7.12 (d, J=8.0 Гц, 1H), 7.05 (d, J=8.0 Гц, 1H), 6.99-6.94 (m, 2Н), 6.90-6.80 (m, 2Н), 6.57 (s, 1H), 5.05-5.01 (m, 1Н), 4.85-4.79 (m, 2Н), 4.70-4.55 (m, 1H), 3.80-3.70 (m, 2Н), 3.09-2.90 (m, 2Н), 2.95 (m, 3Н), 2.00-1.93 (m, 3Н), 1.75-1.58 (m, 5Н), 1.36 (d, J=6.8 Гц, 3Н).
Пример 323: Синтез соединения 419

Стадия 1: Смесь соединения 419-А (2,6 г, 8,0 ммоль) и 1-(бромметил)-2-(трифторметил)бензола (2,5 г, 10,4 ммоль) в толуоле (24 мл) перемешивали при 100°С в течение 14 ч. После охлаждения до комнатной температуры осажденное твердое вещество собирали, промывали пентаном, затем дополнительно очищали методом HPLC с получением соединения 41943 (1,2 г, 27% выход) в виде желтого твердого вещества.
К раствору mpem-бутилкарбамата (4,0 г, 34 ммоль) в THF (14 мл) последовательно добавляли бензолсульфинат натрия (5,6 г, 34 ммоль), пропиональдегид (2,18 г, 37,6 ммоль) и муравьиную кислоту (9,5 г, 205 ммоль) и смесь перемешивали при комнатной температуре в течение 18 ч. Полученный осадок фильтровали, который кристаллизовали в Нех/EtOAc=4:1 с получением трет-бутил(1-(фенилсульфонил)пропил)карбамата (5,0 г, 48,9% выход) в виде белого твердого вещества. LCMS (5-95АВ, ESI): RT=0,816, M+Na+=321,9
К раствору трет-бутил(1-(фенилсульфонил)пропил)карбамата (3,0 г, 10,0 ммоль) в толуоле (100 мл) добавляли соединение 419-В (565 мг, 1,0 ммоль) и циангидрин ацетона (1,7 г, 20,0 ммоль). После охлаждения вышеуказанного раствора до -20°С добавляли одну часть K2CO3 (6,9 г, 50,0 ммоль) в H2O (7,0 мл) и затем полученную смесь энергично перемешивали при той же температуре в течение 20 мин, а затем постепенно нагревали до комнатной температуры при перемешивании и дополнительно перемешивали в течение 48 ч. Смесь гасили 5% раствором NaHCO3 (60 мл), затем экстрагировали EtOAc (100 мл × 2). Объединенные органические слои промывали солевым раствором (100 мл × 3), сушили над Na2SO4, концентрировали и остаток очищали на колонке с силикагелем с получением (S)-трет-бутил(1-цианопропил)карбамат (1.4 г, 76% выход) в виде светло-желтого твердого вещества. 1Н ЯМР (CDCl3, 400 МГц) δ 4.87 (brs, 1H), 4.50 (brs, 1Н), 1.86-1.74 (m, 2Н), 1.44 (s, 9Н), 1.08 (t, J=7.6 Гц, 3Н).
Начиная с (S)-трет-бутил(1-цианопропил)карбамата проводили процедуру удаления Boc (FA) с применением ранее описанных способов с получением (S)-2-аминобутаннитрила (70 мг, 67% выход) в виде желтого масла.
Соединение 419 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (5-95АВ, ESI): RT=0,802, М+Н+=835,5.
Пример 324: Синтез соединения 420

Соединение 420 (соль муравьиной кислоты) получали с применением способов примера 323 (соединение 419). LCMS (5-95АВ, ESI): RT=0,799, М+Н+=847,5.
Пример 325: Синтез соединения 421
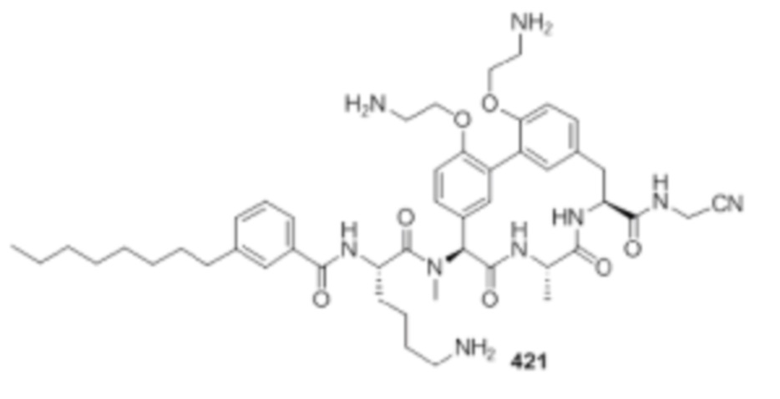
Соединение 421 (соль муравьиной кислоты) получали с применением способов примера 90 (соединение 184). LC-MS: m/z=882 [М+Н]+.
Пример 326: Синтез соединения 422

Соединение 422 (соль муравьиной кислоты) получали с применением способов примера 90 (соединение 184). LC-MS: m/z=896 [М+Н]+.
Пример 327: Синтез соединения 423

Смесь 4-бром-2-фторбензойной кислоты (250 мг, 1,14 ммоль), бис(трифенилфосфин)палладий(II) дихлорида (120,18 мг, 0,17 ммоль) и йодида меди (32,61 мг, 0,17 ммоль) в TEA (8 мл) дегазировали N2. Добавляли этинилбензол (349,74 мг, 3,42 ммоль), закупоривали в стеклянной пробирке, нагревали на масляной бане при 60°С всю ночь. Ее разбавляли нас. NH4Cl, промывали iPrOAc (2×). Водный слой подкисляли 1 н HCl, экстрагировали iPrOAc (2×30 мл), сушили над MgSO4, фильтровали, концентрировали в вакууме, сушили под высоким вакуумом с получением 271 мг (99%) 2-фтор-4-(2-фенилэтинил) бензойной кислоты в виде коричневого твердого вещества. LCMS: m/z=241 [М+Н]+.
Соединение 423 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=860 [М+Н]+. 1Н ЯМР (400 МГц, DMSO-d6) δ 8.97 (d, J=7.8 Гц, 1H), 8.89 (d, J=7.4 Гц, 1H), 8.71 (t, J=5.6 Гц, 1H), 8.40 (d, J=9.0 Гц, 1H), 7.68 (t, J=7.8 Гц, 1H), 7.62-7.57 (m, 2H), 7.53-7.45 (m, 5H), 7.23 (dd, J=8.6, 2.2 Гц, 1H), 7.19-7.15 (m, 2H), 7.08 (d, J=8.5 Гц, 1H), 6.73 (t, J=2.9 Гц, 2H), 6.32 (s, 1H), 5.03-4.96 (m, 1H), 4.79-4.69 (m, 2H), 4.19 (d, J=5.8 Гц, 2H), 4.15-4.06 (m, 4H), 3.20 (d, J=15.8 Гц, 1H), 3.03 (dd, J=9.6, 4.8 Гц, 5H), 2.93 (t, J=8.0 Гц, 2H), 2.80 (s, 3H), 2.08 (d, J=5.7 Гц, 1H), 2.02-1.94 (m, 1H), 1.21 (d, J=6.7 Гц, 3H).
Пример 328: Синтез соединения 424

Соединение 424 (соль муравьиной кислоты) получали с применением способов примера 327 (соединение 423). 1H ЯМР (400 МГц, DMSO-d6) δ 9.10 (d, J=7.9 Гц, 1H), 8.97 (d, J=7.8 Гц, 1H), 8.70 (t, J=5.6 Гц, 1H), 8.39 (d, J=9.0 Гц, 1H), 7.75 (d, J=1.5 Гц, 1H), 7.64-7.58 (m, 3H), 7.51-7.46 (m, 4H), 7.23 (dd, J=8.8, 2.3 Гц, 1H), 7.16 (d, J=1.7 Гц, 2H), 7.08 (d, J=8.5 Гц, 1H), 6.76-6.72 (m, 2H), 6.33 (s, 1H), 4.99 (q, J=7.4 Гц, 1H), 4.79-4.68 (m, 2H), 4.18 (d, J=5.9 Гц, 2H), 4.15-4.06 (m, 4H), 3.20 (d, J=16.8 Гц, 1H), 3.00 (h, J=11.8, 9.8 Гц, 9H), 2.83 (s, 3H), 2.12-1.94 (m, 2H), 1.20 (d, J=6.7 Гц, 3H).
Пример 329: Синтез соединения 425

Соединение 425 (соль муравьиной кислоты) получали с применением способов примера 327 (соединение 423). 1H ЯМР (400 МГц, DMSO-d6) δ 8.98 (d, J=7.8 Гц, 1H), 8.85 (d, J=7.6 Гц, 1H), 8.71 (t, J=5.6 Гц, 1H), 8.39 (d, J=9.2 Гц, 1H), 7.60-7.55 (m, 2Н), 7.51-7.38 (m, 6Н), 7.22 (dd, J=8.6, 2.3 Гц, 1H), 7.17 (d, J=2.0 Гц, 2Н), 7.08 (d, J=8.5 Гц, 1H), 6.74 (dd, J=7.0, 2.1 Гц, 2Н), 635 (s, 1H), 4.95 (q, J=7.7 Гц, 1H), 4.79-4.68 (m, 2Н), 4.18 (d, J=5.1 Гц, 2Н), 4.09 (dd, J=11.4, 5.7 Гц, 4Н), 3.19 (d, J=16.7 Гц, 1H), 3.05-2.88 (m, 9Н), 2.83 (s, 3Н), 2.38 (s, 3Н), 2.10-1.93 (m, 2Н), 1.20 (d, J=6.1 Гц, 3Н).
Пример 330: Синтез соединения 426
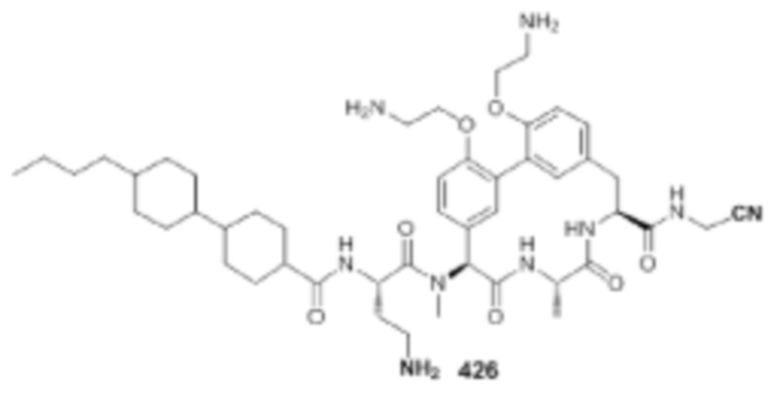
Соединение 426 (соль муравьиной кислоты) получали с применением ранее описанных способов. LC-MS: m/z=886 [М+Н]+.
Пример 331: Синтез соединения 427


Стадия 1: Смесь 4-(4-хлорфенил)бензальдегида (1,0 г, 4,6 ммоль) и метил-2-(трифенил-λ5-фосфанилиден)ацетата (2,0 г, 6,0 ммоль) в ацетонитриле (12 мл) перемешивали при комнатной температуре всю ночь. Ее очищали при помощи ISCO, колонка 24 г, элюировали 0-30% iPrOAc/гептаном с получением 1,18 г (94%) метил(Е)-3-(4'-хлор-[1,1'-бифенил]-4-ил)акрилата в виде белого твердого вещества. LC-MS: m/z=273 [М+Н]+.
Стадия 2: Смесь метил(Е)-3-[4-(4-хлорфенил)фенил]проп-2-еноата (1,18 г, 4,33 ммоль) и LiOH (327 мг, 13,0 ммоль) в 1,4-диоксане (16 мл) и воде (4 мл) перемешивали при комнатной температуре всю ночь. Ее концентрировали в вакууме, суспендировали в воде, подкисляли 1 и HCl до значения рН~5. Белый осадок собирали фильтрацией, промывали водой, сушили с получением 1,11 г (99%) (Е)-3-(4'-хлор-[1,1'-бифенил]-4-ил)акриловой кислоты в виде грязно-белого твердого вещества. LC-MS: m/z=259 [М+Н]+.
Соединение 427 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LC-MS: m/z=878 [М+Н]+.
Пример 332: Синтез соединения 428

Соединение 428 (соль муравьиной кислоты) получали с применением способов примера 331 (соединение 427). LC-MS: m/z=824 [М+Н]+.
Пример 333 Синтез соединения 429
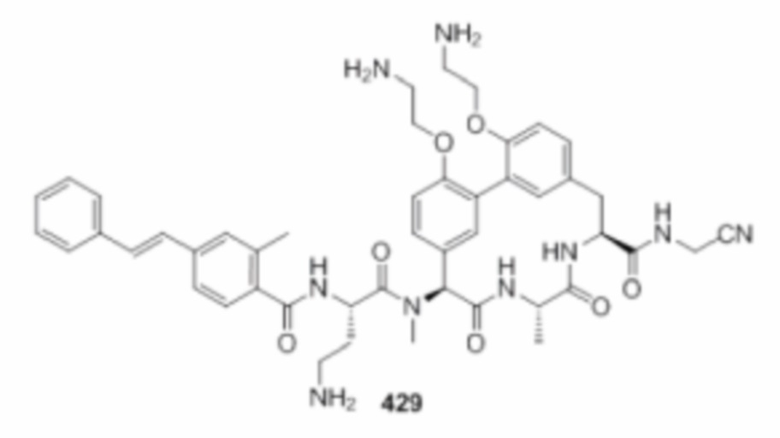
Соединение 429 (соль муравьиной кислоты) получали с применением способов примера 47 (соединение 141), за исключением того, что (Е)-стирилбороновую кислоту использовали при реакции сочетания Сузуки. LCMS (способ 5-95АВ, ESI): tR=0,705 мин, [М+Н]+=858,9.
Пример 334: Синтез соединения 430
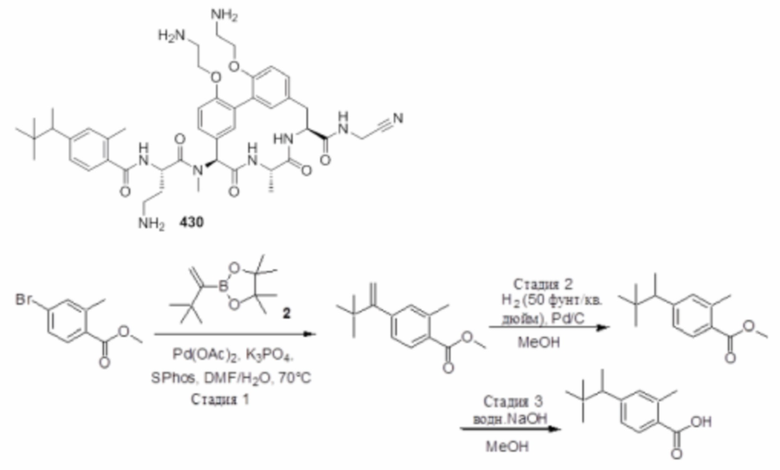
Стадия 1: К смеси ацетата палладия(II) (29,4 мг, 0,13 ммоль), 2-(3,3-диметилбут-1-ен-2-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (328,6 мг, 1,57 ммоль), фосфата калия, трехосновного (695,0 мг, 3,27 ммоль) и SPhos (107,5 мг, 0,26 ммоль) в DMF (3 мл) и воде (0,3 мл) добавляли метил-4-бром-2-метилбензоат (300 мг, 1,31 ммоль). Полученную смесь нагревали при 70°С в течение 16 часов в атмосфере азота. Реакционную смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали. Остаток очищали методом rrpen-TLC (10% этилацетат в петролейном эфире) с получением метил-4-(3,3-диметилбут-1-ен-2-ил)-2-метилбензоата (246 мг, 80,9% выход) в виде бесцветного масла.
Стадия 2: Смесь метил-4-(3,3-диметилбут-1-ен-2-ил)-2-метилбензоата (246 мг, 1,06 ммоль) и 10% палладия (56,3 мг, 0,05 ммоль) на углеродной подложке в метаноле (15 мл) перемешивали при 15°С в атмосфере H2 (50 фунт/кв. дюйм) в течение 16 ч. Катализатор отфильтровывали и растворитель выпаривали с получением метил-4-(3,3-диметилбутан-2-ил)-2-метилбензоата (220 мг, 88,7% выход) в виде белого твердого вещества.
Стадия 3: Метил-4-(3,3-диметилбутан-2-ил)-2-метилбензоат (220,0 мг, 0,94 ммоль) гидролизировали согласно общему способу NaOH с получением 4-(3,3-диметилбутан-2-ил)-2-метилбензойной кислоты (190 мг, 91,9% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CD3OD): δ 7.90 (d, J=8.0 Гц, 1Н), 7.06-6.93 (m, 2H), 2.57 (s, 3Н), 2.51 (q, J=7.6 Гц, 1H), 1.19 (d, J=7.2 Гц, 3H),0.81 (s, 9H).
Соединение 430 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95АВ): tR=0,721 мин, [М+Н]+=840,5.
Пример 335: Синтез соединения 431
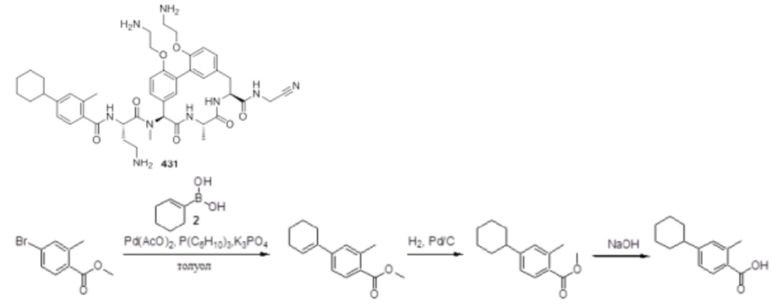
Смесь метил-4-бром-2-метилбензоата (50,0 мг, 0,22 ммоль), 1,1'-бис(дифенилфосфино)ферроцена палладия дихлорида (16,0 мг, 0,02 ммоль), карбоната калия (60,3 мг, 0,44 ммоль) и 1-циклогексен-1-ил бороновой кислоты (41,2 мг, 0,33 ммоль) в толуоле (5 мл) перемешивали при 120°С в течение 2 ч в атмосфере N2 и выпаривали досуха. Остаток переносили в EtOAc (20 мл), промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (5% EtOAc в петролейном эфире, Rf=0,7) с получением метил-4-(циклогексен-1-ил)-2-метилбензоата (40 мг, 79,6% выход) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDCl3) δ 7.88 (d, J=8.8 Гц, 1Н), 7.28-7.23 (m, 2H), 6.23-6.21 (m, 1H), 3.88 (s, 3H), 2.61 (s, 3H), 2.41-2.39 (m, 2H), 2.23-2.21 (m, 2H), 1.80-1.77 (m,2H), 1.68-1.65 (m,2H).
4-Циклогексил-2-метил бензойную кислоту получали с применением общих способов гидрирования и NaOH из метил-4-(циклогексен-1-ил)-2-метилбензоата.
Соединение 431 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из 4-циклогексил-2-метилбензойной кислоты. LCMS (способ 5-95АВ): tR=0,565 мин, [М+Н]+=838,3.
Пример 336: Синтез соединения 432

Соединение 432 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов, подобных примеру 47 (соединение 141), из метил-4'-бром-[1,1'-бифенил]-4-карбоксилата и циклогекс-1-ен-1-илбороновой кислоты. LCMS (способ 5-95АВ): tR=0,783 мин, [М+Н]+=900,5.
Пример 337: Синтез соединения 433

Стадия 1: Смесь метил-4-бром-2-метилбензоата (2,29 г, 10,0 ммоль), карбоната цезия (6,51 г, 20,0 ммоль), изопропенилтрифторбората калия (2,96 г, 20,0 ммоль) и 1,1'-бис(дифенилфосфино)ферроцена палладия дихлорида (0,73 г, 1 ммоль) в тетрагидрофуране (100 мл) и воде (5 мл) перемешивали при 80°С в течение 2 ч. После охлаждения реакционную смесь выпаривали досуха. Остаток переносили в EtOAc (30 мл), промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над Na2SO4 и концентрировали. Неочищенное вещество очищали методом колоночной флеш-хроматографии (1% EtOAc в петролейном эфире) с получением метил-2-метил-4-(проп-1-ен-2-ил)бензоата (1,8 г, 94,6% выход).
Стадии 2 и 3: Метил-2-метил-4-(проп-1-ен-2-ил)бензоат гидрировали и гидролизировали, как было описано ранее, с получением 4-изопропил-2-метилбензойной кислоты (340 мг, 96,5% выход) в виде желтого твердого вещества. 1Н ЯМР (400 МГц, CDCl3): δ 8.02 (d, J=8.0 Гц, 1H), 7.20-7.10 (m, 2H), 3.00-2.85 (m, 1H), 2.66 (s, 3H), 1.28 (d, J=7.2 Гц, 6H).
Соединение 433 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95АВ): tR=0,657 мин, [М+Н]+=798,5.
Пример 338: Синтез соединения 434

Соединение 434 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением тех же способов, что и в примере 433. LCMS (способ 5-95АВ): tR=0,694 мин, [М+Н]+=812,5.
Пример 339: Синтез соединения 435

К раствору метил-2-метил-4-(проп-1-ен-2-ил)бензоата (1,0 г, 5,26 ммоль) в дихлорметане (50 мл) добавляли диэтилцинк (1M в толуоле; 157,7 мл, 157,7 ммоль) при 0°С, а затем раствор дийодметана (6,35 мл, 78,85 ммоль) в дихлорметане (10 мл). Реакционную смесь оставляли нагреваться до 20°С и перемешивали в течение 16 ч, гасили водн. NH4Cl и экстрагировали EtOAc (50 мл × 3). Объединенные органические слои промывали солевым раствором (50 мл) и сушили над Na2SO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (1% EtOAc в петролейном эфире, Rf=0,7) в виде смеси DP и STM, которую разделяли методом преп-HPLC (ацетонитрил 67-77%/0,1% TFA в воде) с получением метил-2-метил-4-(1-метилциклопропил)бензоата (80 мг, 7,5% выход) в виде бесцветного масла.
Метил-2-метил-4-(1-метилциклопропил)бензоат (80,0 мг, 0,39 ммоль) гидролизировали обычным способом (общий способ NaOH) с получением 2-метил-4-(1-метилциклопропил)бензойной кислоты (70 мг, 93,9% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CD3OD): δ 7.83 (d, J=8.0 Гц, 1H), 7.15-7.10 (m, 2Н), 2.56 (s, 3Н), 1.42 (s, 3Н), 0.95-0.85 (m, 2Н), 0.85-0.75 (m, 2Н).
Соединение 435 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95АВ): tR=0,557 мин, [М+Н]+=810,3.
Пример 340: Синтез соединения 436

Стадия 1: Смесь метил-2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (400,0 мг, 1,45 ммоль), перйодата натрия (309,8 мг, 1,45 ммоль) и ацетата аммония (800,0 мг, 10,38 ммоль) в ацетоне (8 мл) и воде (4 мл) перемешивали при 20°С в течение 16 ч и выпаривали досуха. Остаток переносили в EtOAc (20 мл), промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (33% этилацетата в петролейном эфире) с получением (4-метоксикарбонил-3-метилфенил)бороновой кислоты (200 мг, 71,2% выход) в виде белого твердого вещества.
Стадия 2: Раствор циклогептанона (2000,0 мг, 17,83 ммоль) и 4-метилбензолсульфоногидразида (3320 мг, 17,83 ммоль) в этаноле (10 мл) перемешивали при 60°С в течение 16 ч. Реакционную смесь разбавляли дополнительным количеством этанола (10 мл) и фильтровали. Фильтрат концентрировали с получением N-(циклогепталиденамино)-4-метилбензолсульфонамида (4000 мг, 80% выход) в виде белого твердого вещества.
Стадия 3: Смесь карбонат цезия (313,8 мг, 0,96 ммоль), (4-метоксикарбонил-3-метилфенил)бороновой кислоты (186,8 мг, 0,96 ммоль) и N-(циклогептилиденамино)-4-метилбензолсульфонамида (180,0 мг, 0,64 ммоль) в 1,4-диоксане (5 мл) перемешивали при 110°С в течение 16 ч под защитой N2 и выпаривали досуха. Остаток переносили в EtOAc (30 мл), промывали водой (30 мл × 2) и солевым раствором (30 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом преп-TLC (10% EtOAc в петролейном эфире, Rf=0,6) с получением метил-4-циклогептил-2-метилбензоата (80 мг, 50,6% выход) в виде бесцветного масла. LCMS (способ 5-95АВ, ESI): tR=0,976 мин, [М+Н]+=246,9.
Стадия 4: Метил-4-циклогептил-2-метилбензоат гидролизировали, как описано ранее (общий способ NaOH), с получением 4-циклогептил-2-метилбензойной кислоты.
Соединение 436 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95АВ, ESI): tR=0,654 мин, [М+Н]+=852,4.
Пример 341: Синтез соединения 437
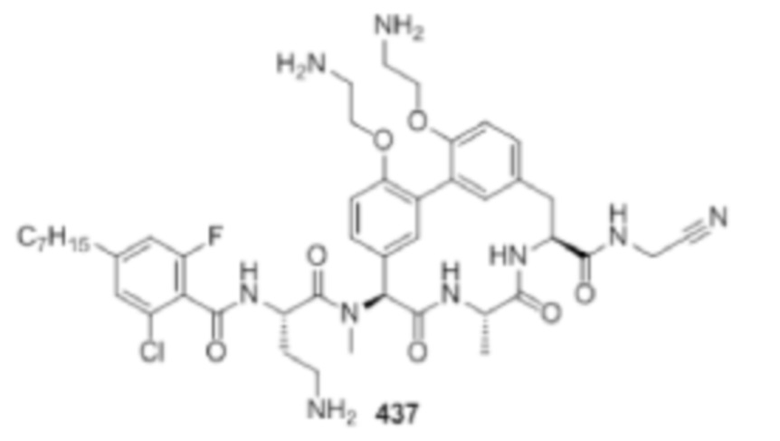
Соединение 437 (соль муравьиной кислоты) получали с применением способов примера 340 (соединение 436) и примера 195 (соединение 290). LCMS (способ 5-95АВ, ESI): tR=0,625 мин, [М+Н]+=892,4.
Пример 342А: Синтез соединения 438
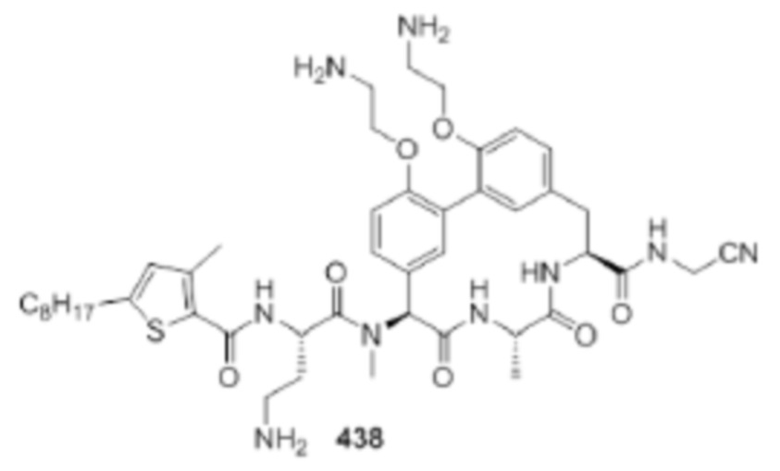

Стадия 1: К смеси 2-бром-3-метилтиофена (226,7 мг, 1,28 ммоль) и хлорида алюминия (375,6 мг, 2,82 ммоль) в 1,2-дихлорэтане (3 мл) добавляли октаноил хлорид (229,1 мг, 1,41 ммоль) и перемешивали при 20°С в течение 12 ч. При помощи LCMS (5-95АВ/1,5 мин): RT=0,991 мин, [М+Н]+ 302,9 наблюдали 45% DP. Смесь выливали на лед и экстрагировали EtOAc (30 мл). Органический слой промывали солевым раствором, сушили над Na2SO4 и концентрировали. Остаток очищали методом преп-TLC (5% EtOAc в петролеином эфире, Rf=0,5) с получением 1-(5-бром-4-метил-2-тиенил)октан-1-она (160 мг, 41,2% выход) в виде желтого масла. 1Н ЯМР (400 МГц, CDCl3): δ 7.60 (s, 1Н), 2.86 (t, J=7.4 Гц, 2H), 2.22 (s, 3Н), 1.67 (квинт., J=7.3 Гц, 2Н), 1.43-1.22 (m, 8Н), 0.90 (t, J=7.0 Гц, 3Н).
Стадия 2: Раствор 1-(5-бром-4-метил-2-тиенил)октан-1-она (160,0 мг, 0,53 ммоль) и триэтиламина (0,22 мл, 1,58 ммоль) в метаноле (10 мл) обрабатывали 1,1'-бис(дифенилфо с фино)ферроцена палладия дихлоридом (38,6 мг, 0,05 ммоль). Полученную смесь перемешивали при 80°С в течение 10 ч в атмосфере СО (45 фунт/кв. дюйм) и концентрировали. Остаток очищали методом преп-TLC (7% этил ацетат в петр олеином эфире) с получением метил-3-метил-5-октаноилтиофен-2-карбоксилата (120 мг, 80,5% выход) в виде бесцветного масла.
Стадия 3: К раствору метип-3-метил-5-октаноилтиофен-2-карбоксилата (50,0 мг, 0,18 ммоль) в 2,2,2-трифторуксусной кислоте (1 мл) по каплям добавляли триэтилсилан (82,4 мг, 0,71 ммоль). Смесь перемешивали при 20°С в течение 16 ч и концентрировали. Остаток очищали методом преп-TLC (5% EtOAc в петр олеином эфире, Rf=0,6) с получением метил-3-метил-5-октилтиофен-2-карбоксилата (38 мг, 80% выход) в виде желтого масла. LCMS (способ 5-95 AB, ESI): RT=1,180 мин, [М+Н]+=269,1.
Соединение 438 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101). LCMS (способ 5-95АВ, ESI): tR=0,785 мин, [М+Н]+=874,4.
Пример 342В: Синтез соединения 439 и соединения 440

Стадия 1: К раствору 4-формил-2-метилбензойной кислоты (450,0 мг, 2,74 ммоль) в N,N-диметилформамиде (5 мл) при 30°С добавляли K2CO3 (1,13 г, 8,22 ммоль) и йодметан (1,3 мл, 20,85 ммоль) и перемешивали в течение 10 ч. Реакционную смесь разбавляли 1 н HCl (15 мл) и экстрагировали EtOAc (50 мл × 3). Объединенные органические слои промывали солевым раствором (30 мл × 3), сушили над Na2SO4 и концентрировали. Остаток очищали на колонке с силикагелем (5% EtOAc в петролейном эфире) с получением метил-4-формил-2-метилбензоата (400 мг, 81,9% выход) в виде желтого масла.
Стадия 2: К раствору тозилгидразида (418,1 мг, 2,24 ммоль) в метаноле (2 мл) по каплям добавляли метил-4-формил-2-метилбензоат (400,0 мг, 2,24 ммоль) при 60°С и перемешивали при 60°С в течение 2 ч. Раствор концентрировали с получением неочищенного метил-2-метил-4-((2-тозилгидразоно)метил)бензоата (580,0 мг) в виде белого твердого вещества, которое использовали сразу на следующей стадии.
Стадия 3: К раствору метил-2-метил-4-((2-тозилгидразоно)метил)бензоата (580,0 мг, 1,67 ммоль) в диоксане (4 мл) добавляли стирол (348,8 мг, 3,35 ммоль) и карбонат калия (347,1 мг, 2,51 ммоль). Реакцию гасили водой (10 мл) и экстрагировали EtOAc (20 мл × 3). Объединенные органические слои промывали водой (20 мл) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Остаток сначала очищали методом преп-TLC (8% этилацетат в петролейном эфире), а затем методом хроматографии с обращенной фазой (ацетонитрил 70-100/0,225% муравьиной кислоты в воде) с получением (±)-анти-метил-2-метил-4-(2-фенилциклопропил)бензоата (91 мг, 20,4% выход) и (±)-син-метил-2-метил-4-(2-фенилциклопропил)бензоата (40 мг, 9% выход), оба в виде бесцветного масла.
Соединение 439 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,715 мин, [М+Н]+=872,9.
Соединение 440 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,708 мин, [М+Н]+=872,6.
Пример 343А: Синтез соединения 441

Стадия 1: Раствор трихлорацетилхлорида (9091,5 мг, 50 ммоль) и оксихлорида фосфора (5,47 г, 35,67 ммоль) в эфире (25 мл) по каплям добавляли к раствору стирола (2603,8 мг, 25 ммоль) и пары цинка-меди (4,9 г, 75 ммоль) в эфире (50 мл). Полученный раствор перемешивали при 50°С в течение 2 ч, затем при комнатной температуре всю ночь. Полученную смесь фильтровали через целит и промывали эфиром (60 мл). К фильтрату добавляли гексан (200 мл) и осторожно перемешивали при комнатной температуре в течение 1 ч. Суспензию фильтровали и фильтрат концентрировали при пониженном давлении с получением неочищенного 2,2-дихлор-3-фенилциклобутанона (4,2 г, 78,1% выход) в виде желтого масла. 1H ЯМР (400 МГц, CDCl3): δ 7.46-7.39 (m, 3Н), 7.38-7.30 (m, 2Н), 4.25 (t, J=10.2 Гц, 1H), 3.73 (dd, J=17.6, 10.4 Гц, 1H), 3.55 (dd, J=17.6, 10.0 Гц, 1H).
Стадия 2: К раствору 2,2-дихлор-3-фенилциклобутанона (4,2 г, 19,53 ммоль) в АсОН (50 мл, 19,53 ммоль) добавляли цинковую пыль (5,11 г, 78,11 ммоль) и перемешивали при 100°С в течение 12 ч. Смесь разбавляли водой (100 мл) и экстрагировали петролейный эфир (50 мл × 4). Объединенные органические слои промывали нас. NaHCO3 (30 мл × 4) и солевым раствором (30 мл × 3), сушили над Na2SO4 и концентрировали. Остаток очищали на колонке с силикагелем (5% EtOAc в петролейном эфире) с получением 3-фенилциклобутанона (1,1 г, 38,5% выход) в виде желтого масла. 1Н ЯМР (400 МГц, CDCl3): δ 7.38-7.25 (m, 5Н), 3.70-3.68 (m, 1H), 3.53-3.46 (m, 2H), 3.28-3.22 (m, 2H).
Соединение 441 (соль муравьиной кислоты) получали с применением способов примера 340 (соединение 436). LCMS (способ 5-95АВ, ESI): tR=0,719 мин, [М+Н]+=886,5.
Пример 343В: Синтез соединения 442
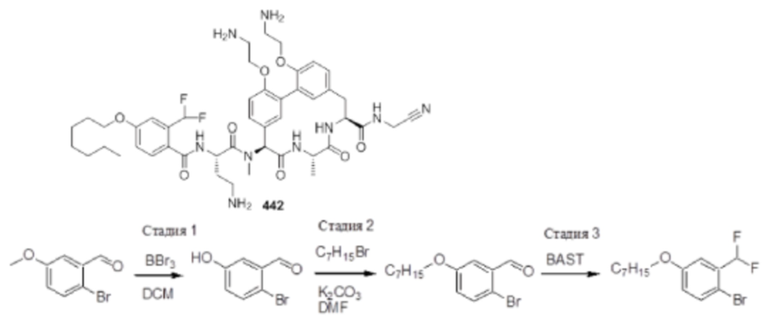
Стадия 1: К смеси 2-бром-5-метоксибензальдегида (2000,0 мг, 9,3 ммоль) в дихлорметане (10 мл) медленно добавляли трибромид бора (2M в DCM; 4,65 мл, 9,3 ммоль) при 0°С. Реакционную смесь нагревали до 25°С и перемешивали в течение 3 ч. Реакцию гасили водой (10 мл) при 0°С и экстрагировали EtOAc (50 мл). Органический слой промывали водой (50 мл × 2) и солевым раствором (50 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (петролейный эфир) с получением 2-бром-5-гидроксибензальдегида (1,7 г, 90,9% выход) в виде бесцветного масла.
Стадия 2: К раствору 2-бром-5-гидроксибензальдегида (100,0 мг, 0,50 ммоль) в N,N-диметилформамиде (3 мл) добавляли 1-бромгептан (267,3 мг, 1,49 ммоль) и карбонат калия (206,3 мг, 1,49 ммоль). Смесь перемешивали при 20°С в течение 16 ч и концентрировали досуха. Остаток переносили в EtOAc (50 мл), промывали водой (50 мл × 2) и солевым раствором (50 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом преп-TLC (10% EtOAc в петролейном эфире, Rf=0,3) с получением 2-бром-5-(гептилокси)бензальдегида (100 мг, 67,2% выход) в виде желтого масла. 1H ЯМР (400 МГц, CDCl3): δ 10.32 (s, 1H), 7.52 (d, J=9.2 Гц, 1H), 7.41 (d, J=2.8 Гц, 1H), 7.03 (dd, J=8.8, 3.2 Гц, 1H), 3.99 (t, J=6.6 Гц, 2Н), 1.85-1.75 (m, 2Н), 1.50-1.20 (m, 8Н), 0.90 (t, J=6.8 Гц, 3Н).
Стадия 3: Смесь 2-бром-5-(гептилокси)бензальдегида (100,0 мг, 0,33 ммоль) в деоксофторе (2,0 мл, 1 ммоль) перемешивали при 80°С в течение 16 ч и концентрировали досуха. Остаток переносили в EtOAc (50 мл), промывали водой (50 мл × 2) и солевым раствором (50 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом преп-TLC (5% EtOAc в петролейном эфире, Rf=0,3) с получением 1-бром-2-(дифторметил)-4-(гептилокси)бензола (80 мг, 74,5% выход) в виде желтого масла. 1Н ЯМР (400 МГц, CDCl3): δ 7.44 (d, J=8.8 Гц, 1Н), 7.15 (d, J=3.2 Гц, 1Н), 7.00-6.70 (m, 2Н), 3.94 (t, J=6.6 Гц, 2Н), 1.80-1.70 (m, 2Н), 1.50-1.20 (m, 8Н), 0.88 (t, J=6.6 Гц, 3Н).
Соединение 442 (соль муравьиной кислоты) получали с применением способов примера 170 (соединение 265). LCMS (способ 5-95АВ, ESI): tR=0,781 мин, [М+Н]+=906,4.
Пример 344: Синтез соединения 443 и соединения 444

Смесь метил-3-метил-1Н-пиразол-4-карбоксилата (250,0 мг, 1,78 ммоль), 4-изобутилфенилбороновой кислоты (412,9 мг, 2,32 ммоль), пиридина (282,2 мг, 3,57 ммоль) и ацетата меди(II) (486,0 мг, 2,68 ммоль) в N,N-диметилформамиде (6 мл) перемешивали при 25°С в течение 14 ч. Реакционную смесь разбавляли EtOAc (120 мл), промывали солевым раствором (50 мл × 3), сушили над Na2SO4 и концентрировали. Остаток очищали методом преп-TLC (20% EtOAc в петролейном эфире, Rf=0,45) с получением метил-1-(4-изобутилфенил)-3-метил-1Н-пиразол-4-карбоксилата (350 мг, 72% выход) в виде белого твердого вещества. LCMS (способ 5-95АВ, ESI): tR=0,996 мин, [М+Н]+=272,9.
Соединение 443 и соединение 444 (соль муравьиной кислоты) получали с использованием способов примера 5 и примера 7. Перед снятием загцитных групп с TFA изомеры разделяли методом препаративной TLC. Данные соединения 443: LCMS (способ 5-95АВ, ESI): tR=0,726 мин, [М+Н]+=878,5. Данные соединения 444: LCMS (способ 5-95АВ, ESI): tR=0,720 мин, [М+Н]+=878,5.
Пример 345: Синтез соединения 445

Стадия 1: Смесь метил-4-фтор-2-метилбензоата (300,0 мг, 1,78 ммоль), 4-бром-1Н-пиразола (393,3 мг, 2,68 ммоль) и карбоната калия (739,7 мг, 535 ммоль) в N,N-диметилформамиде (20 мл) перемешивали при 70°С в течение 12 ч. Реакционную смесь разбавляли водой (100 мл) и экстрагировали EtOAc (100 мл × 3). Объединенные органические слои промывали водой (50 мл × 2) и солевым раствором (50 мл), сушили над MgSO4 и концентрировали. Остаток очищали методом преп-TLC (20% EtOAc в петролейном эфире, Rf=0,5) с получением метил-4-(4-бромпиразол-1-ил)-2-метилбензоата (200 мг, 38% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, DMSO-d6): δ 8.87 (s, 1Н), 7.94-7.91 (m, 2H), 7.81 (s, 1H), 7.76-7.74 (m, 1H), 3.80 (s, 3H), 2.56 (s,3H).
Стадия 2: Смесь метил-4-(4-бромпиразол-1-ил)-2-метилбензоата (200,0 мг, 0,68 ммоль), изобутилбороновой кислоты (345,41 мг, 3,39 ммоль), карбоната натрия (359,1 мг, 3,39 ммоль) и тетракис(трифенилфосфин)палладия(0) (783,1 мг, 0,68 ммоль) в толуоле (5 мл) и воде (1 мл) перемешивали при 110°С в течение 12 ч и фильтровали. Фильтрат концентрировали и очищали методом преп-TLC (30% EtOAc в петролейном эфире, Rf=0,7) с получением метил-4-(4-шобутилпиразол-1-ил)-2-метилбензоата (40 мг, 21,7% выход) в виде белого твердого вещества. LCMS (способ 5-95АВ, ESI): tR=1,010 мин, [М+Н]+=272,9.
Соединение 445 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,585 мин, [М+Н]+=878,5.
Пример 346: Синтез соединения 446
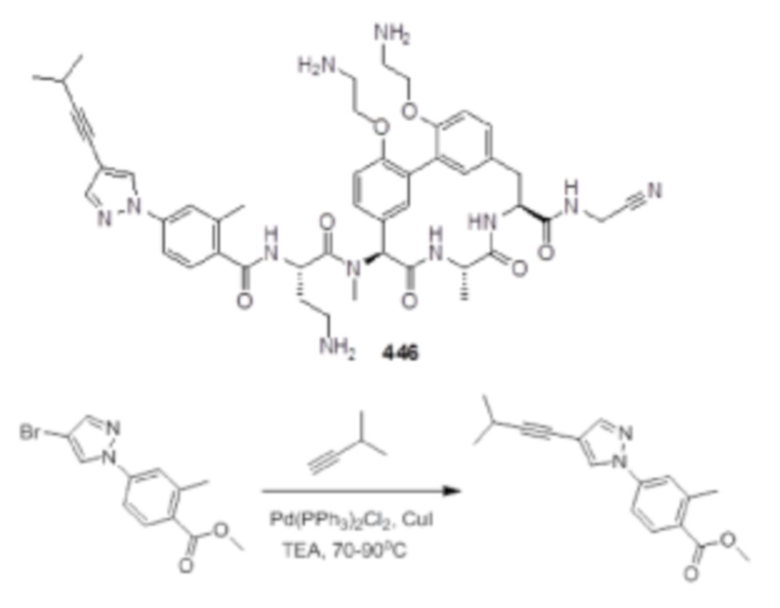
Смесь метил-4-(4-бромпиразол-1-ил)-2-метилбензоата (150,0 мг, 0,51 ммоль). бис(трифенилфосфин)палладия(II) дихлорида (17,9 мг, 0,03 ммоль), 3-метил-1-бутина (103,9 мг, 1,52 ммоль) и йодида меди(I) (4,9 мг, 0,03 ммоль) в триэтиламине (4,19 мл. 30,03 ммоль) перемешивали при 100°С в течение 18 ч в атмосфере азота. Реакцию гасили водой (10 мл) и экстрагировали дихлорметаном (10 мл × 3). Объединенные органические экстракты промывали солевым раствором (10 мл × 2), сушили над безводным Na2SO4 и концентрировали. Остаток очищали методом преп-HPLC с получением метил-2-метил-4-[4-(3-метилбут-1-инил)пиразол-1-ил]бензоата (35 мг, 24,4% выход) в виде белого твердого вещества. LCMS (способ 5-95АВ, ESI): tR=1.014 мин, [М+Н]+=283,2.
Соединение 446 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,709 мин, [М+Н]+=888,6.
Пример 347: Синтез соединения 447

Соединение 447 (соль муравьиной кислоты) получали с применением способов примера 318 (соединение 414), за исключением того, что метил-2-[(Е)-3-трет-бутокси-3-оксопроп-1-енил]-4-октилбензоат подвергали стандартным условиям условия (пример 4) с получением метил-2-(3-(трет-бутокси)-3-оксопроггил)-4-октилбензоата. LCMS (способ 5-95АВ, ESI): RT=0,768 мин, [М+Н]+=926,6.
Пример 348: Синтез соединения 448

Стадия 1: Раствор 5-бром-2,3-дигидро-1Н-инден-1-она (1,0 г, 4,7 ммоль), Pd(PPh3)4 (274 мг, 0,24 ммоль), K2CO3 (1,3 г, 9,5 ммоль) и октилбороновой кислоты (1,1 г, 7,1 ммоль) в толуоле (15 мл) и H2O (1 мл) перемешивали в атмосфере N2 при 100°С в течение 16 ч. В реакционную смесь добавляли EtOAc (100 мл), затем промывали солевым раствором (100 мл). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением 5-октил-2,3-дигидро-1Н-инден-1-она (1,1 г, 95% выход) в виде желтого масла.
Стадия 2: К раствору 5-октил-2,3-дигидро-1Н-инден-1-она (1,1 г, 4,5 ммоль) в Et2O (15 мл) добавляли 4 М HCl/МеОН (5 мл), а затем добавляли раствор 1-нитробутана (511 мг, 5,0 ммоль) в Et2O (15 мл), и смесь перемешивали при комнатной температуре в течение 2 ч. Полученный осадок затем собирали, промывали Et2O и сушили с получением 2-(гидроксиимино)-5-октил-2,3-дигидро-1Н-инден-1-она (800 мг, 65% выход) в виде желтого твердого вещества. LCMS (способ 5-95АВ, ESI): tR=0,920, [М+Н]+=274,0
Стадия 3: Раствор 2-(гидроксиимино)-5-октил-2,3-дигидро-1H-инден-1-она (800 мг.2,9 ммоль) и TsOH (725 мг, 3.,8 ммоль) в Н2О (10 мл) нагревали до 50°С, а затем добавляли NaOH (468 мг, 11,7 ммоль). Полученную смесь дополнительно нагревали до 80°С еще 15 мин. После охлаждения до комнатной температуры осадок удаляли из смеси и фильтрат подкисляли концентрированной HCl. Полученный осадок собирали и очищали на испарительной колонке с силикагелем с получением 2-(цианометил)-4-октилбензойной кислоты (700 мг, 87,5% выход) в виде желтого твердого вещества.
Стадия 4: Типичную процедуру амидного сочетания (HATU/DIEA) использовали по отношению к соединению 101-K (100 мг, 0,11 ммоль) и 2-(цианометил)-4-октилбензойной кислоты (39 мг, 0,14 ммоль) с применением ранее описанных способов с получением соединения 449-А (120 мг, 94% выход) в виде белого твердого вещества.
Стадия 5: К раствору соединения 449-А (120 мг, 0,10 ммоль) в EtOH/Н2О (3,0 мл, объем/объем=4/1) добавляли ацетальдоксим (24 мг, 0,41 ммоль), каталитическое количество Ph3P (5,4 мг) и Pd(OAc)2 (0,5 мг) и смесь перемешивали в атмосфере N2 при 80°С в течение 3 ч. К реакционной смеси добавляли H2O (15 мл) и смесь экстрагировали EtOAc (15 мл × 3). Объединенные органические слои сушили Na2SO4 и концентрировали с получением соединения 449-В (110 мг, 90,3% выход) в виде желтого твердого вещества, которое использовали сразу на следующей стадии. LCMS (способ 5-95АВ, ESI): tR=0,964, [М+Н]+=1187,6.
Соединение 448 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,630, [М+Н]+=911,6; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.47 (brs, 2Н, НСООН), 7.50 (d, J=8.0 Гц, 1H), 7.35 (d, J=8.0 Гц, 1H), 7.28-7.18 (m, 4Н), 7.11 (d, J=8.0 Гц, 1H), 6.91 (brs, 1H), 6.83 (brs, 1H), 6.37 (s, 1H), 5.11-5.08 (m, 1H), 4.81-4.75 (m, 2Н), 4.28-4.19 (m, 4Н), 4.22 (s, 2Н), 3.87-3.77 (m, 2Н), 3.37-3.35 (m, 1H), 3.27-3.10 (m, 7Н), 2.94 (s, 3Н), 2.69-2.65 (m, 2Н), 2.29-2.24 (m, 1H), 2.18-2.12 (m, 1H), 1.67-1.63 (m, 2Н), 1.43-1.23 (m, 13Н), 0.89 (t, J=6.8 Гц, 3Н).
Пример 349: Синтез соединения 449

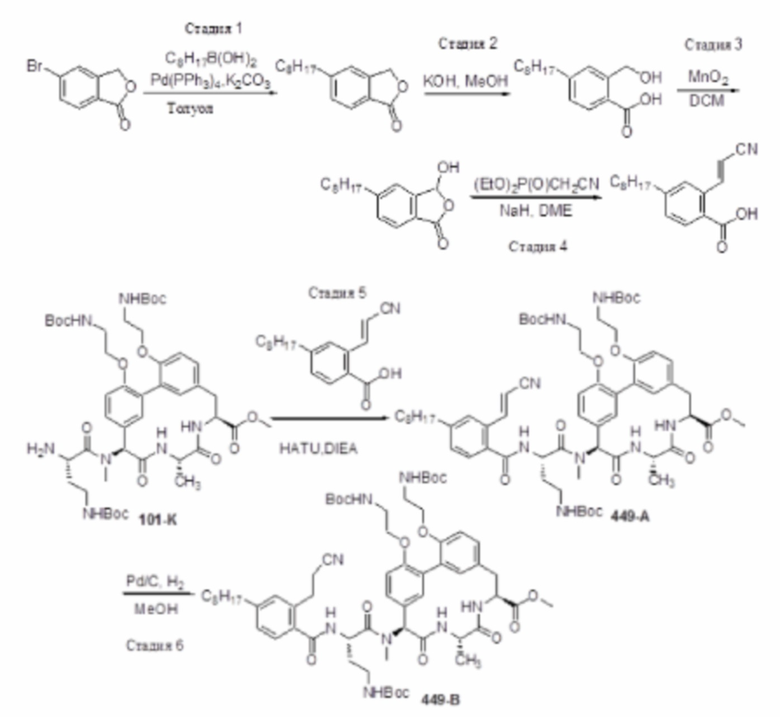
Стадия 1: Раствор 5-бромизобензофуран-1(3Н)-она (2,0 г, 9,4 ммоль), K2CO3 (3,9 г, 28,2 ммоль), Pd(PPh3)4 (1,1 г, 0,94 ммоль) и октилбороновой кислоты (3,0 г, 18,8 ммоль) в толуоле (40 мл) перемешивали в атмосфере N2 при 100°С в течение 24 ч. В реакционную смесь добавляли EtOAc (100 мл), затем промывали солевым раствором (100 мл). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением 5-октилизобензофуран-1(3Н)-она (1,26 г, 54% выход) в виде бесцветного масла.
Стадия 2: К раствору 5-октилизобензофуран-1(3Н)-она (1,26 г, 5,1 ммоль) в MeOH (22 мл) добавляли KOH (430 мг, 7,7 ммоль) при комнатной температуре и реакционную смесь нагревали до 70°С при перемешивании и перемешивали при той же температуре в течение 6 ч. Летучие вещества удаляли, а остаток повторно растворяли в воде (20 мл), а затем подкисляли до значения рН 4 раствором 1 М KHSO4. Полученный осадок собирали, промывали водой и сушили в вакууме с получением 2-(гадроксиметил)-4-октилбензойной кислоты (852 мг, 63,1% выход) в виде белого твердого вещества. LCMS (способ 5-95АВ, ESI): fR=0,977, M+Na+=287,9
Стадия 3: К раствору 2-(гадроксиметил)-4-октилбензойной кислоты (752 мг, 3,0 ммоль) в DCM (18 мл) добавляли MnO2 (2,6 г, 30 ммоль) и смесь перемешивали при комнатной температуре в течение 5 ч. Фильтрат затем концентрировали с получением 3-гидрокси-5-октилизобензофуран-1(3Н)-она (565 мг, 71,7% выход) в виде желтого масла, которое использовали сразу на следующей стадии. LCMS (способ 5-95АВ, ESI): tR=0,982, [М+Н]+=262,9
Стадия 4: К раствору 3-гадрокси-5-октилизобензофуран-1(3Н)-она (565 мг, 2,15 ммоль) и диэтилцианометила фосфоната (382 мг, 2,15 ммоль) в DME (11 мл) добавляли 60% NaH в масле (172 мг, 4,30 ммоль) при 0°С и смесь перемешивали при той же температуре в течение 1 ч. Реакционную смесь гасили H2O (30 мл), затем экстрагировали EtOAc (30 мл × 2). Объединенные органические слои сушили над Na2SO4, концентрировали и остаток очищали методом HPLC с получением (Е)-2-(2-циановинил)-4-октилбензойной кислоты (60 мг, 9,8% выход) в виде белого твердого вещества. 1Н ЯМР (400 МГц, CDCl3) δ 8.38 (d, J=16 Гц, 1Н), 8.05 (d, J=8 Гц, 1H), 7.34-7.31 (m, 2Н), 5.77 (d, J=16 Гц, 1H), 2.67 (t, J=8.0 Гц, 2H), 1.69-1.66 (m, 2H), 1.30-1.26 (m, 10H), 0.87 (t, J=6.8 Гц, 3Н).
Типичную процедуру амидного сочетания (HATU) использовали по отношению к соединению 101-K (150 мг, 0,16 ммоль) и (Е)-2-(2-циановинил)-4-октилбензойной кислоте (56 мг, 0,20 ммоль) с получением соединения 449-А (152 мг, 78% выход) в виде белого твердого вещества.
Раствор соединения 449-А (122 мг, 0,10 ммоль), 10% Pd/C (22 мг, 0,02 ммоль) в МеОН (12 мл) перемешивали в атмосфере H2 при комнатной температуре. При помощи LCMS наблюдали за реакцией, чтобы не допустить чрезмерного восстановления нитрила. После того, как при помощи LCMS наблюдали завершение реакции, фильтрат концентрировали с получением соединения 449-В (116 мг, 94,9% выход) в виде белого твердого вещества. LCMS (способ 5-95АВ, ESI): tR=1,139, [М+Н]+=1183,8.
Соединение 449 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,769, [М+Н]+=907,5
Пример 350: Синтез соединения 450

Соединение 450 (свободное основание) получали с применением способов, подобных способам примера 348 (соединение 448). LCMS (способ 5-95АВ, ESI): tR=0,764, [М+Н]+=923,5.
Пример 351: Синтез соединения 451

Соединение 451 (свободное основание) получали с применением способов, подобных способам примера 348 (соединение 448). LCMS (способ 5-95АВ, ESI): tR=0,776, [М+Н]+=925,8.
Пример 352: Синтез соединения 452
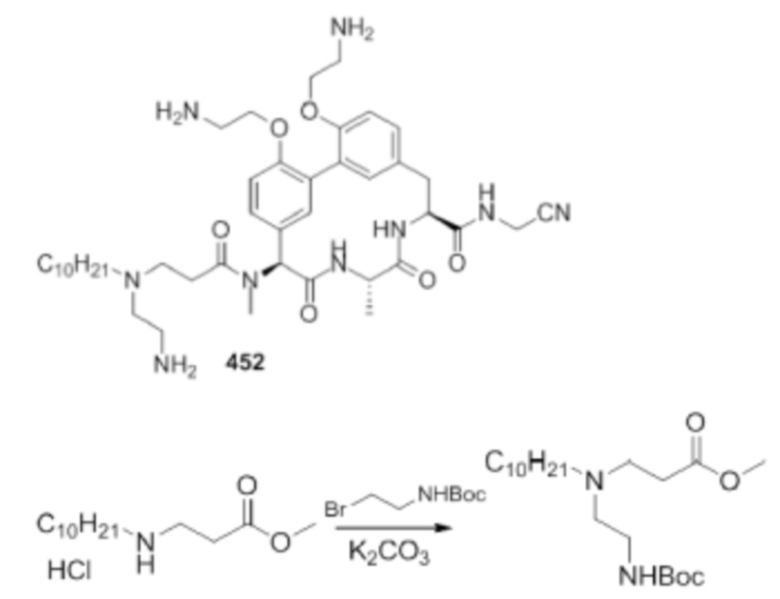
К раствору метил-3-(дециламино)пропаноата (380 мг, 1,36 ммоль) в DMF (3 мл) добавляли K2CO3 (560 мг, 4,07 ммоль) и трет-бутил-2-бромэтилкарбамат (300 мг, 1,36 ммоль) при 0°С и смесь перемешивали при комнатной температуре в течение 48 ч. В реакционную смесь добавляли Н2О (30 мл), затем экстрагировали EtOAc (30 мл × 2). Объединенные органические слои сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением метил-3-((2-((трет-бутоксикарбонил)амино)этил)(децил)амино)пропаноата (166 мг, 31,6% выход) в виде бесцветного масла. LCMS (способ 5-95АВ, ESI): tR=0,874, [М+Н]+=387,3.
Соединение 452 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,700, [М+Н]+=792,5.
Пример 353: Синтез соединения 453

К смеси соединения 101-G (300 мг, 0,42 ммоль), Cbz-Asn-OH (224 мг, 0,84 ммоль), HATU (319 мг, 0,84 ммоль), MgSO4 (252 мг, 2,1 ммоль) в DMF/DCM (20 мл, объем/объем=1:3) добавляли DIEA (217 мг, 1,68 ммоль) при 0°С и смесь нагревали до комнатной температуры при перемешивании и перемешивали в течение 2 ч. Летучие вещества удаляли и остаток переносили в EtOAc (100 мл), затем промывали солевым раствором (50 мл × 2). Органический слой сушили над Na2SO4, концентрировали и остаток очищали методом преп-TLC с получением соединения 453-А (100 мг, 25,2% выход) в виде белого твердого вещества. В течение сочетания происходила дегидратация амида.
Соединение 453 (свободное основание) получали с применением ранее описанных способов из соединения 453-А. LCMS (способ 5-95АВ, ESI): tR=0,686, [М+Н]+=816,2; 1H ЯМР (400 МГц, MeOH-d4) δ 7.27-7.24 (m, 2Н), 7.14 (d, J=8.0 Гц, 1Н), 7.09 (d, J=8.0 Гц, 1H), 6.87 (brs, 1H), 6.79 (brs, 1H), 6.21 (s, 1H), 5.18-5.15 (m, 1H), 4.83-4.77 (m, 2Н), 4.21-4.17 (m, 4Н), 4.19 (s, 2Н), 3.16-3.13 (m, 5Н), 2.93-2.90 (m, 2Н), 2.81 (s, 3Н), 2.28-2.25 (m, 3Н), 1.65-1.61 (m, 3Н), 1.33-1.29 (m, 18Н), 0.90 (t, J=6.4 Гц, 3Н).
Пример 354: Синтез соединения 454


К раствору (S)-метил-2-(((бензилокси)карбонил)амино)-4-гидроксибутаноата (900 мг, 3,4 ммоль) и Et3N (0,94 мл, 6,8 ммоль) в DCM (10 мл) добавляли MsCl (0,39 мл, 5,1 ммоль) при 0°С и реакционную смесь нагревали до комнатной температуры при перемешивании и перемешивали при той же температуре в течение 3 ч. Значение рН реакционной смеси доводили до 5 насыщенным раствором лимонной кислоты, затем экстрагировали DCM (30 мл × 2). Объединенные органические слои сушили над Na2SO4, концентрировали и остаток очищали методом HPLC с получением (S)-метил-2-(((бензилокси)карбонил)амино)-4-((метилсульфонил)окси)бутаноата (500 мг, 43% выход) в виде белого твердого вещества LCMS (способ 5-95АВ, ESI): tR=0,780, [М+Н]+=345,9.
Раствор (S)-метил-2-(((бензилокси)карбонил)амино)-4-((метилсульфонил)окси)бутаноата (200 мг, 0,58 ммоль), K2CO3 (160 мг, 1,16 ммоль), 1,2,4-триазола (80,0 мг, 1,16 ммоль) в DMF (2 мл) перемешивали при 60°С в течение 16 ч. К реакционной смеси добавляли воду (10 мл), затем экстрагировали EtOAc (20 мл × 3). Объединенные органические слои промывали солевым раствором (50 мл), сушили над MgSO4, концентрировали и остаток очищали методом преп-TLC с получением (S)-метил-2-(((бензилокси)карбонил)амино)-4-(1H-1,2,4-триазол-1-ил)бутаноата (100 мг, 54,2% выход). LCMS (способ 5-95АВ, ESI): tR=0,728, [М+Н]+=318,9.
Соединение 454 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,672, [М+Н]+=872,4; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.51 (s, 1H), 8.49 (brs, 2Н, НСООН), 7.97 (s, 1Н), 7.25-7.22 (m, 2Н), 7.17 (d, J=8.0 Гц, 1H), 7.07 (d, J=8.0 Гц, 1H), 6.86 (brs, 1H), 6.78 (brs, 1H), 6.29 (s, 1H), 4.80-4.74 (m, 3Н), 4.35 (t, J=6.4 Гц, 2Н), 4.18 (brs, 6Н), 3.16-3.13 (m, 5Н), 2.71 (s, 3Н), 2.40-2.30 (m, 2Н), 2.26 (t, J=6.0 Гц, 2Н), 2.25-2.15 (m, 2Н), 1.68-1.64 (m, 3Н), 1.34-1.28 (m, 17Н), 0.89 (t, J=6.8 Гц, 3Н).
Пример 355: Синтез соединения 455

К раствору (S)-метил-2-(((бензилокси)карбонил)амино)-4-гидроксибутаноата (400 мг, 1,16 ммоль) в DMF (5 мл) добавляли NaCN (62 мг, 1,27 ммоль) при комнатной температуре и реакционную смесь нагревали до 75°С при переменгивании и перемешивали при той же температуре в течение 2 ч. Летучие вещества удаляли и остаток переносили в EtOAc (40 мл), затем промывали солевым раствором (40 мл). Органический слой сушили над Na2SO4, концентрировали и остаток очищали методом преп-TLC с получением (S)-метил-2-(((бензилокси)карбонил)амино)-4-цианобутаноата (210 мг, 65,6% выход) в виде бесцветного масла. LCMS (способ 5-95АВ, ESI): tR=0,779, M+Na+=298,9.
Соединение 455 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,814, [М+Н]+=830,4.
Пример 356: Синтез соединения 456

Стадия 1: К смеси Bn2NH (1,0 г, 5,1 ммоль) и этил-4-бромбутаноата (1,0 г, 5,1 ммоль) в DMF (5 мл) добавляли K2CO3 (3,5 г, 25,6 ммоль) при комнатной температуре и смесь перемешивали при 100°С в течение 16 ч. В реакционную смесь добавляли EtOAc (50 мл), затем промывали солевым раствором (50 мл х 3). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением этил-4-(дибензиламино)бутаноата (520 мг, 32,6% выход) в виде бледно-желтого масла.
Стадия 2: К раствору этил-4-(дибензиламино)бутаноата (4,0 г, 12,8 ммоль) в THF (40 мл) по каплям добавляли 2 н LDA в THF (6,4 мл, 12,8 ммоль) при -78°С и реакционную смесь перемешивали при той же температуре в течение 0,5 ч, а затем добавляли раствор трет-бутил-2-бромацетата (3,0 г, 15,4 ммоль) и НМРА (2,3 г, 12,8 ммоль) в THF (40 мл). Полученную смесь перемешивали в течение 3 ч при -78°С и реакционную смесь нагревали до комнатной температуры при перемешивании и перемешивали еще 3 ч. В реакционную смесь добавляли EtOAc (200 мл), затем промывали насыщенным NH4Cl и солевым раствором (каждого 200 мл). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением 4-трет-бутил-1-этил-2-(2-(дибензиламино)этил)сукцината (800 мг, 14,6% выход) в виде бледного масла. 1H ЯМР (400 МГц, CDCl3) δ 7.36-7.21 (m, 10Н), 4.05 (q, J=7.0 Гц, 2Н), 3.61 (d, J=16 Гц, 2Н), 3.47 (d, J=16 Гц, 2Н), 2.92-2.86 (m, 1H), 2.46-2.39 (m, 3Н), 2.17-2.11 (m, 1Н), 1.98-1.90 (m, 2Н). 1.42 (s, 9Н), 1.17 (t, J=7.2 Гц, 3Н).
Стадия 3: Стандартным кислотным гидролизом трет-бутилового сложного эфира с TFAb DCM получали 5-(дибензиламино)-3-(этоксикарбонил)пентановую кислоту.
Соединение 456 (соль муравьиной кислоты) получали с применением ранее описанных способов в виде смеси диастереомеров. LCMS (способ 5-95АВ, ESI): tR=0,719, [М+Н]+=826,5; 1Н ЯМР (400 МГц, MeOH-d4) δ 7.39-7.21 (m, 3Н), 7.14-7.03 (m, 4Н), 6.89 (brs, 1Н), 6.83 (brs, 1H), 6.34 (s, 1H), 4.25-4.19 (m, 4H), 4.21 (s, 2H), 3.21-2.97 (m, 9H), 2.84 (s, 3Н), 2.74-2.70 (m, 1H), 2.63-2.59 (m, 2H), 2.23 (s, 3H), 2.10-1.98 (m, 2H), 1.65-1.57 (m, 2H), 1.63-1.35 (m, 6H), 1.22-1.17 (m, 1H), 0.96 (t, J=6.8 Гц, 3Н).
Пример 357: Синтез соединения 457

Соединение 457 (соль муравьиной кислоты) получали с применением ранее описанных способов с применением трет-бутил(3-бромпропил)карбамата на стадии фенольного алкилирования. LCMS (способ 5-95АВ): tR=0,772 мин/1,5 мин, [М+Н]+=896,6.
Пример 358: Синтез соединения 458
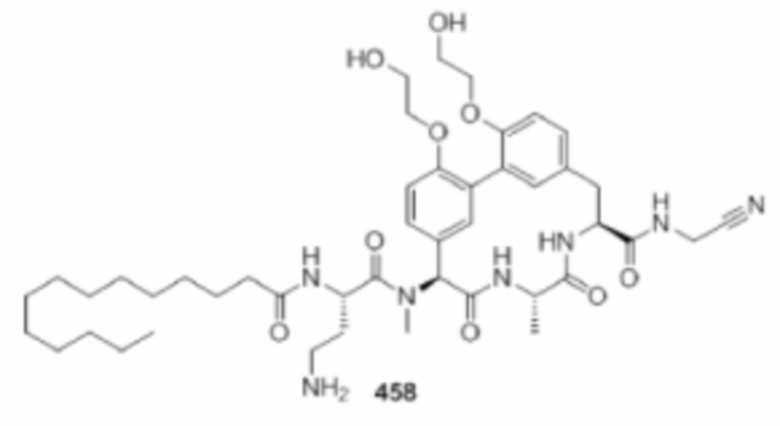
Соединение 458 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101) с применением (2-бромэтокси)(трет-бутил)диметилсилана на стадии фенольного алкилирования. LCMS (способ 5-95АВ): tR=0,723 мин/1,5 мин, [М+Н]+=850,8.
Пример 359: Синтез соединения 459
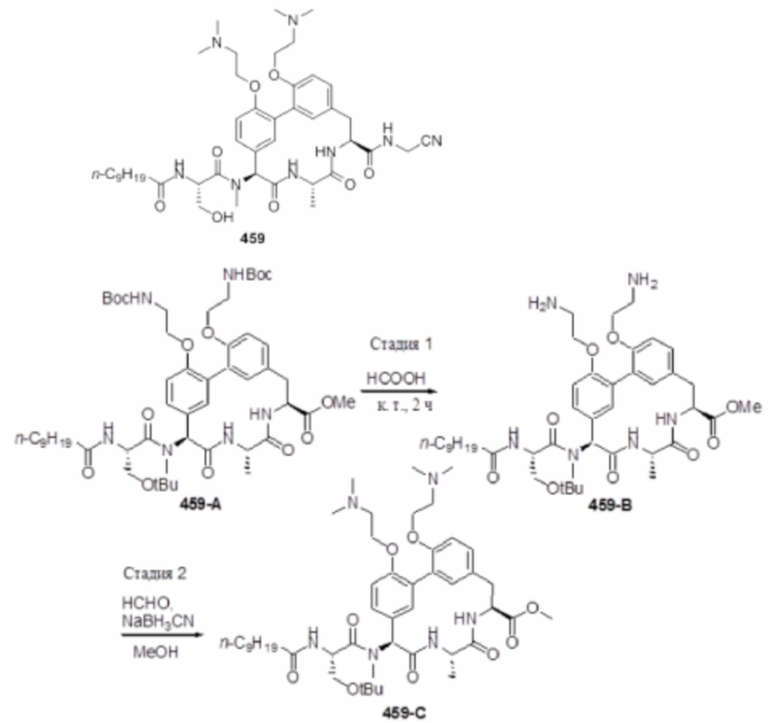
Соединение 459-А получали с использованием способов примера 7.
Стадия 1: Соединение 459-А (70 мг, 0,07 ммоль) обрабатывали согласно общему способу муравьиной кислоты с получением соединения 459-В (40 мг, 67,4% выход) в виде белого твердого вещества. LCMS (5-95АВ, ESI): tR=0,678, [М+Н]+=811,2.
Стадия 2: К перемешиваемому раствору соединения 459-В (40 мг, 0,05 ммоль) и НСНО (28 мг, 0,93 ммоль) в МеОН (1 мл) добавляли Et3N (14 мг, 0,14 ммоль) и NaBH3CN (59 мг, 0,93 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч. Летучие вещества удаляли и остаток очищали методом преп-TLC с получением соединения 459-С (20 мг, 49,4% выход) в виде светло-желтого твердого вещества. LCMS (5-95АВ, ESI): tR=0,806, [М+Н]+=867,9.
Начиная с соединения 459-С соединение 459 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (5-95АВ, ESI): tR=0,639, [М+Н]+=835,3.
Пример 360: Синтез соединения 460

Соединение 460 (соль муравьиной кислоты) получали с применением способов примера 359 (соединение 459). LCMS (5-95АВ, ESI): tR=0,728, [М+Н]+=804,4.
Пример 361: Синтез соединения 461

3-((Трет-бутоксикарбонил)((4'-хлор-[1,1'-бифенил]-4-ил)метил)амино)пропановую кислоту получали способом, подобным для 3-((трет-бутоксикарбонил)(децил)амино)пропановой кислоты (пример 6). LCMS (5-95АВ, ESI): tR=1,015, [M+Na]+=412,1.
Соединение 461 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (5-95АВ, ESI): tR=0,586, [М+Н]+=809,3.
Пример 362: Синтез соединения 462

Соединение 462 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (5-95AB, ESI): tR=0,747, [М+Н]+=783,8.
Пример 363: Синтез соединения 463

Соединение 463 (соль муравьиной кислоты) получали с применением ранее описанных способов из 2-деканамидоуксусной кислоты. LCMS (5-95АВ, ESI): tR=0,601, [М+Н]+=749,5.
Пример 364: Синтез соединения 464

Соединение 464 (соль муравьиной кислоты) получали с применением ранее описанных способов из 3-деканамидопропановая кислота. LCMS (5-95АВ, ESI): tR=0,619, [М+Н]+=763,3.
Пример 365: Синтез соединения 465

Соединение 465 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением ранее описанных способов из (S)-2-(((бензилокси)карбонил)амино)бутановой кислоты. LCMS (способ 5-95АВ): tR=0,864 мин/1,5 мин, [М+Н]+=833,4.
Пример 366: Синтез соединения 466

Соединение 466 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (5-95АВ, ESI): tR=0,835, [М+Н]+=754,5
Пример 367: Синтез соединения 467
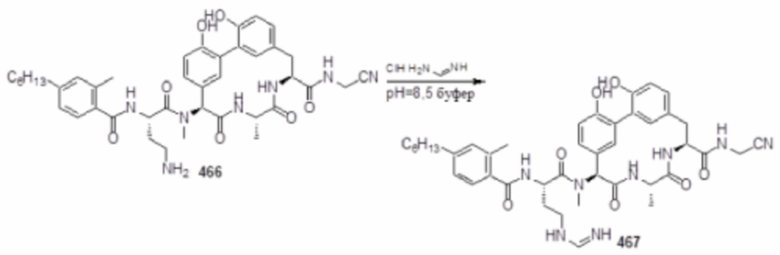
К перемешиваемому раствору соединения 466 (20 мг, 0,03 ммоль) в буфере со значением рН 7, содержащем 1 н NaH2PO3 и 1 н Na2HPO3, по каплям добавляли 1 н раствор NaOH до значения рН 8,5, а затем добавляли имидоформамида гидрохлорид (43 мг, 0,53 ммоль). Полученную смесь перемешивали при 0°С в течение 2 ч. МеОН (2 мл) добавляли к реакционной смеси. После фильтрации фильтрат концентрировали и остаток очищали методом HPLC с получением соединения 467 (1,6 мг, 7,7% выход) в виде белого твердого вещества. LCMS (5-95АВ, ESI): tR=0,838, [М+Н]+=781,4; 1Н ЯМР (400 МГц, MeOH-d4) δ 8.55 (brs, 1H), 7.86 (s, 1Н), 7.36-7.29 (m, 1H), 7.13-6.93 (m, 6H), 6.92-6.86 (m, 1H), 6.85-6.79 (m, 1H), 6.40 (s, 1H), 5.16-5.08 (m, 1H), 4.79-4.74 (m, 2H), 4.19 (s, 2H), 3.52-3.41 (m, 2H), 3.18-3.00 (m, 2H), 2.92 (s, 3H), 2.62-2.50 (m, 2H), 2.38 (s, 3H), 2.29-2.07 (m, 2H), 1.65-1.50 (m, 2H), 1.40-1.21 (m, 9H), 0.90 (t, J=6.8 Гц, 3Н).
Пример 368: Синтез соединения 468

Соединение 468 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (5-95АВ, ESI): tR=0,842, [М+Н]+=762,4.
Пример 369: Синтез соединения 469
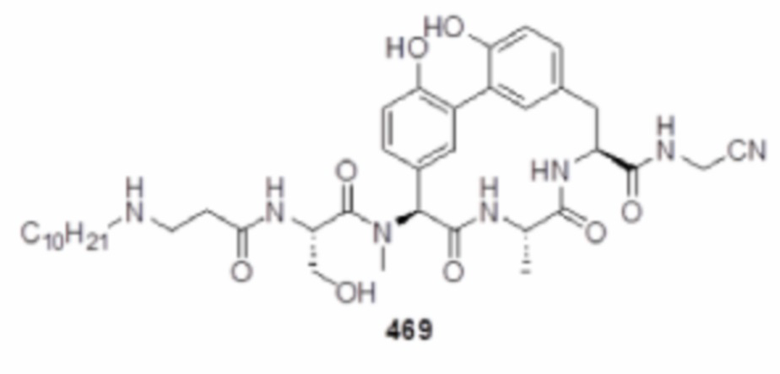
Соединение 469 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (5-95AB, ESI): tR=0,671, [М+Н]+=750,2.
Пример 370: Синтез соединения 470

Соединение 470 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,905 мин/1,5 мин, [М+Н]+=825,0.
Пример 371: Синтез соединения 471

Соединение 471 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,905 мин/1,5 мин, [М+Н]+=810,5.
Пример 372: Синтез соединения 472
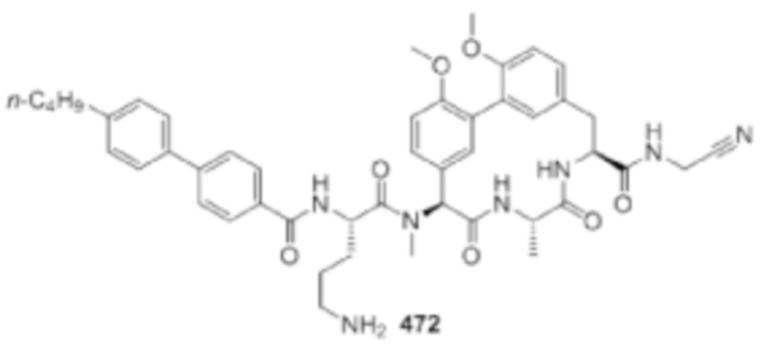
Соединение 472 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,876 мин/1,5 мин, [М+Н]+=831,6.
Пример 373: Синтез соединения 473

Соединение 473 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,895 мин/1,5 мин, [М+Н]+=840,6.
Пример 374: Синтез соединения 474
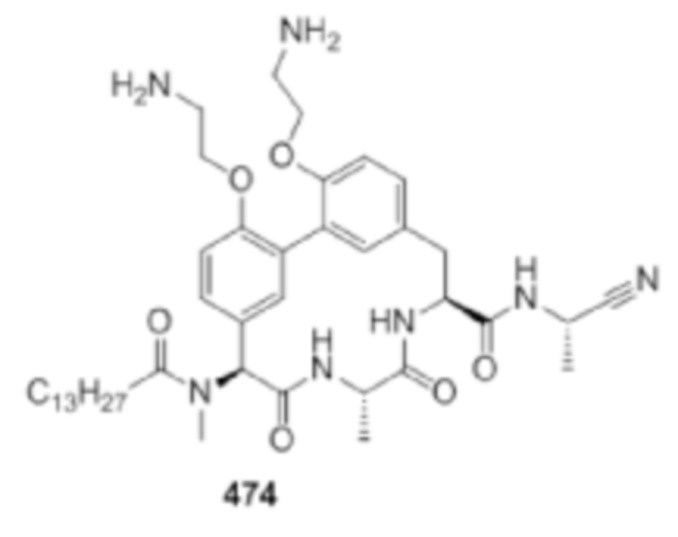
Соединение 474 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,838 мин/1,5 мин, [М+Н]+=762,5.
Пример 375: Синтез соединения 475
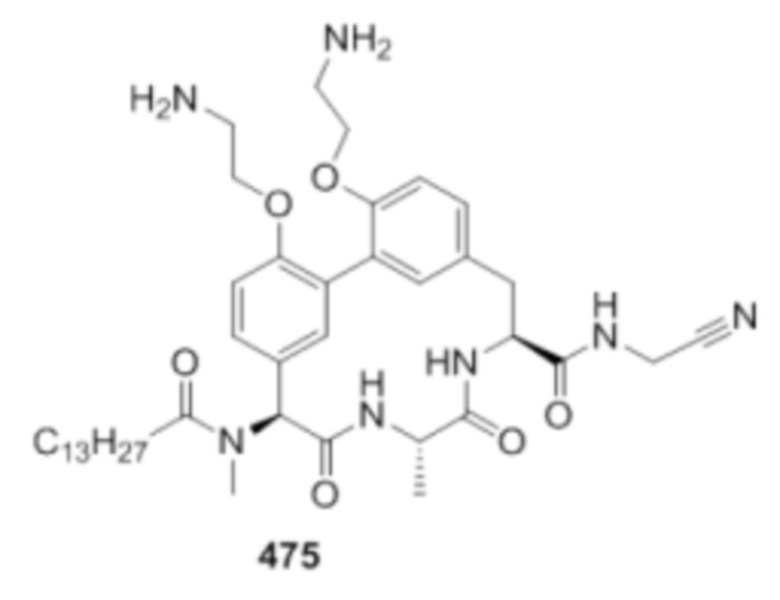
Соединение 475 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,848 мин/1,5 мин, [М+Н]+=748,5.
Пример 376: Синтез соединения 476

Соединение 476 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,821 мин/1,5 мин, [М+Н]+=754,5.
Пример 377: Синтез соединения 477
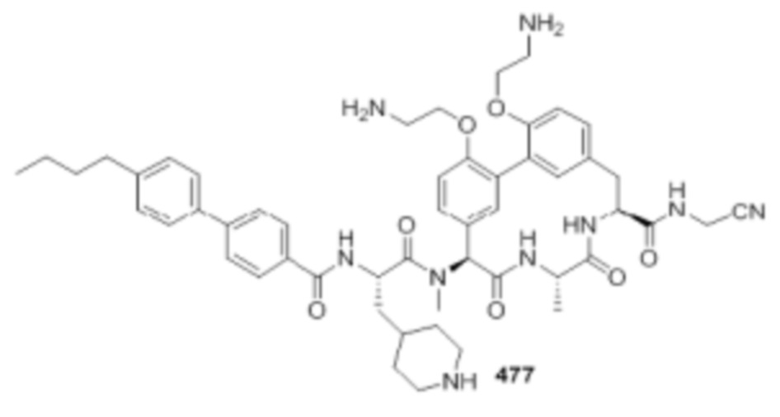
Соединение 477 (соль муравьиной кислоты) получали с применением ранее описанных способов из (S)-2-(((бензил окси)карбонил)амино)-3-(1-(трет-бутоксикарбонил)пиперидин-4-ил)пропановой кислоты. LC-MS: m/z=928 [М+Н]+.
Пример 378: Синтез соединения
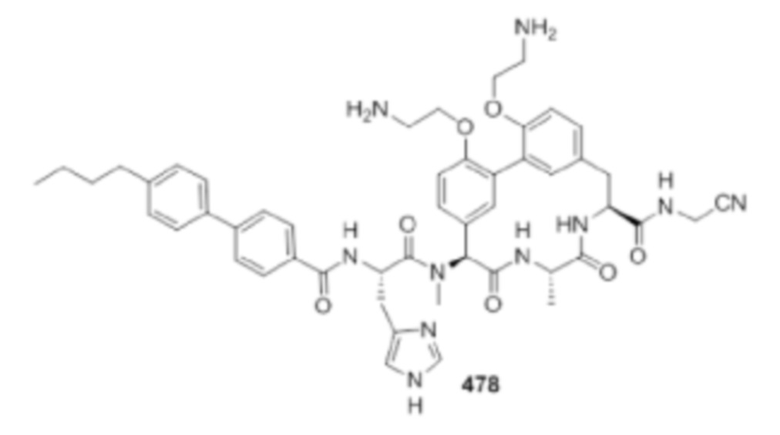
Соединение 478 (соль муравьиной кислоты) получали с применением ранее описанных способов из (S)-2-((((9Н-флуорен-9-ил)метокси)карбонил)амино)-3-(1-тритил-1Н-имидазол-4-ил)пропановой кислоты. LC-MS: m/z=911 [М+Н]+.
Пример 379: Синтез соединения 479
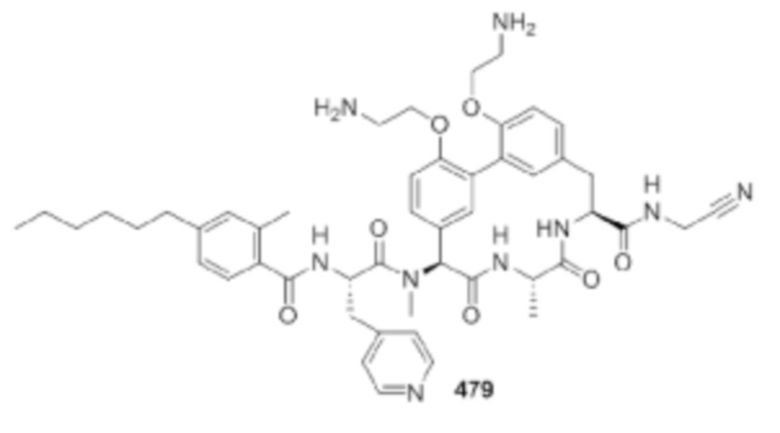
Соединение 479 (соль муравьиной кислоты) получали с применением ранее описанных способов из (S)-2-((((9Н-флуорен-9-ил)метокси)карбонил)амино)-3-(пиридин-4-ил)пропановой кислоты. LC-MS: m/z=888 [М+Н]+.
Пример 380: Синтез соединения 480
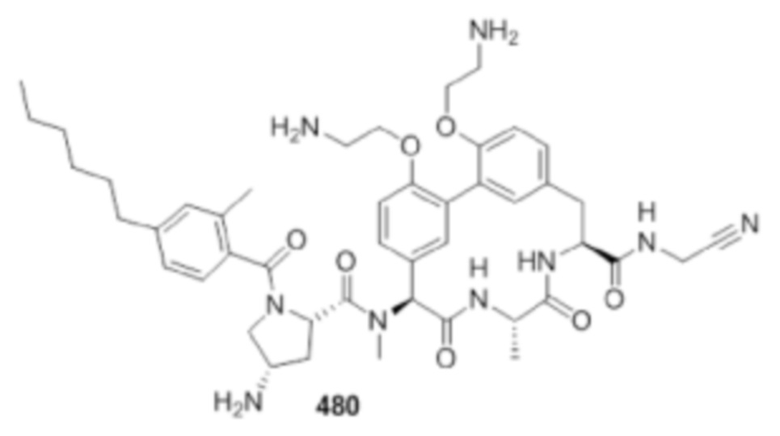
Соединение 480 (соль муравьиной кислоты) получали с применением ранее описанных способов из (2S,4S)-1-((бензилокси)карбонил)-4-((трет-бутоксикарбонил)амино)пирролидин-2-карбоновой кислоты. LC-MS: m/z=852 [М+Н]+.
Пример 381: Синтез соединения

Соединение 481 (соль муравьиной кислоты) получали с применением ранее описанных способов из (2S,4S)-1-((бензилокси)карбонил)-4-((трет-бутоксикарбонил)амино)пирролидин-2-карбоновой кислоты. LC-MS: m/z=860 [М+Н]+.
Пример 382: Синтез соединения 482

Соединение 482 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (ESI): [М+Н]+=880,4.
Пример 383: Синтез соединения 483

Соединение 483 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (ESI): [М+Н]+=894,4.
Пример 384: Синтез соединения 484


Раствор метил-2-(((бензилокси)карбонил)амино)-2-(диметоксифосфорил)ацетата (1,0 г, 3,0 ммоль) и DBU (0,35 мл) в DCM (5 мл) перемешивали при 0°С в течение 20 мин, а затем добавляли раствор (S)-трет-бутил-2-формилпирролидин-1-карбоксилата (500 мг, 2,5 ммоль) в DCM (5 мл). Полученную смесь затем нагревали до комнатной температуры при перемешивании и перемешивали в течение 20 ч при той же температуре. Летучие вещества удаляли и остаток очищали на испарительной колонке с силикагелем с получением (S,Е)-трет-бутил-2-(2-(((бензилокси)карбонил)амино)-3-метокси-3-оксопроп-1-ен-1-ил)пирролидин-1-карбоксилата (700 мг, 69% выход) в виде бесцветного масла. LCMS (способ 5-95АВ, ESI): tR=0,801, M+Na+=427,0
Раствор (S,Е)-трет-бутил-2-(2-(((бензилокси)карбонил)амино)-3-метокси-3-оксопроп-1-ен-1-ил)пирролидин-1-карбоксилата (500 мг, 1,24 ммоль) и 10%Pd/C (132 мг, 0,12 ммоль) в МеОН (10 мл) перемешивали при комнатной температуре в течение 2 ч в атмосфере Нэ (15 фунт/кв. дюйм). Фильтрат концентрировали и остаток очищали методом HPLC (10 мМ NH4HCO3-ACN, 30%-50%) с получением (S)-трет-бутил-2-((S)-2-(((бензилокси)карбонил)амино)-3-метокси-3-океопропил)пирролидин-1-карбоксилата (200 мг, 60% выход) в виде белого твердого вещества. Оптическую чистоту подтверждали методом SFC. LCMS (способ 5-95АВ, EST): tR=0,639, [М+Н]+=272,9
К раствору (S)-трет-бутил-2-((S)-2-(((бензилокси)карбонил)амино)-3-метокси-3-оксопропил)пирролидин-1-карбоксилата (900 мг, 3,3 ммоль) в DCM (10 мл) добавляли Et3N (501 мг, 5,0 ммоль), а затем добавляли раствор Cbz-OSu (820 мг, 3,3 ммоль) в DCM (25 мл). Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Летучие вещества удаляли и остаток очищали на испарительной колонке с силикагелем с получением (S)-трет-бутил-2-((S)-2-(((бензилокси)карбонил)амино)-3-метокси-3-оксопропил)пирролидин-1-карбоксилата (900 мг, 67% выход) в виде бесцветного масла.
Соединение 484 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,780, [М+Н]+=860,4; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.50 (brs, 3Н, НСООН), 7.33-7.23 (m, 2Н), 7.18 (d, J=8.4 Гц, 1Н), 7.11 (d, J=8.4 Гц, 1Н), 6.93 (brs, 1Н), 6.79 (brs, 1Н), 6.28 (s, 1Н), 4.35-4.14 (m, 4Н), 4.21 (s, 2Н), 3.63-3.48 (m, 1H), 3.26-3.04 (m, 5Н), 2.85 (s, 3Н), 2.40-1.94 (m, 8Н), 1.86-1.56 (m, 4Н), 1.47-1.19 (m, 20Н), 0.92 (t, J=6.4 Гц, 3Н).
Пример 385: Синтез соединения 485

К перемешиваемому раствору (S)-4-амино-2-(((бензилокси)карбонил)амино)бутановой кислоты (200 мг, 0,8 ммоль) в DMF (5 мл) добавляли трет-бутал(((трет-бутоксикарбонил)амино)(1Н-пиразол-1-ил)метилен)карбамат (492 мг, 1,6 ммоль) и DIEA (205 мг, 1,6 ммоль) и смесь перемешивали при комнатной температуре в течение 3 ч. Летучие вещества удаляли и остаток очищали на испарительной колонке с силикагелем с получением (S)-2-(((бензилокси)карбошгл)амино)-4-(2,3-бис(трет-бутоксикарбонил)гуанидино)бутановой кислоты (220 мг, 56,1% выход) в виде белого твердого вещества. LCMS (способ 5-95АВ, ESI): tR=0,894, [М+Н]+=495,1
Соединение 485 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ, ESI): tR=0,757, [М+Н]+=882,4.
Пример 386: Синтез соединения 486


Соединение 486-А представляет собой промежуточное соединение при получении соединения 223 (пример 129).
Смесь соединения 486-А (100,0 мг, 0,09 ммоль), триэтилортоформиата (14,2 мг, 0,10 ммоль) и пара-толуолсульфоновой кислоты (1,5 мг, 0,01 ммоль) в этилацетате (5 мл) перемешивали при 50°С в течение 2 ч. Смесь концентрировали и очищали методом преп-TLC (7% метанола в дихлорметане, Rf=0,5) с получением соединения 486-А (70 мг. 69,4% выход) в виде белого твердого вещества. LCMS (способ 5-95АВ, ESI): tR=1,139 мин, [М+Н]+=1156,0.
Соединение 486 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101). LCMS (способ 5-95АВ, ESI): tR=0,759 мин, [М+Н]+=879,9.
Пример 387: Синтез соединения 487
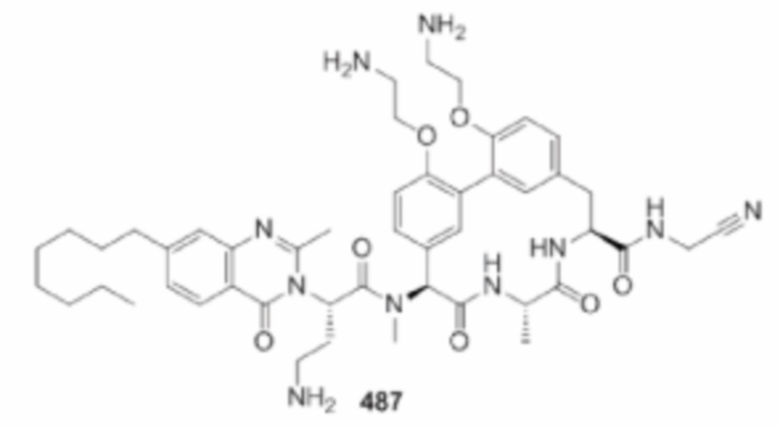
Соединение 487 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением способов примера 386 (соединение 486), за исключением того, что триэтилортоацетат использовали на стадии циклизации. LCMS (способ 5-95АВ, ESI): tR=0,760 мин, [М+Н]+=893,5.
Пример 388: Синтез соединения 488


К раствору 5-октил-3H-изобензофуран-1-она (200,0 мг, 0,81 ммоль) в метаноле (8,5 мл) и воде (1,5 мл) добавляли гидроксид калия (68,33 мг, 1,22 ммоль). Смесь перемешивали при 80°С в течение 3 ч и концентрировали. Остаток переносили в ЕЮ Ас (20 мл), промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали с получением неочищенной 2-(гидроксиметил)-4-октилбензойной кислоты (200 мг, 93,2% выход) в виде белого твердого вещества
Смесь 2-(гидроксиметил)-4-октилбензойной кислоты (189,9 мг, 0,72 ммоль), диоксида марганца (187,4 мг, 2,16 ммоль) в дихлорметане (5 мл) перемешивали при 20°С в течение 16 ч и фильтровали. Фильтрат концентрировали и очищали методом колоночной флеш-хроматографии (5% метанола в DCM, Rf=0,4) с получением 2-формил-4-октилбензойной кислоты (150 мг, 79,6% выход) в виде белого твердого вещества
Смесь 2-формил-4-октилбензойной кислоты (100,0 мг, 0,38 ммоль), йодметана (108,2 мг, 0,76 ммоль) и карбоната калия (158,1 мг, 1,14 ммоль) в N,N-диметилформамиде (3 мл) перемешивали при 20°С в течение 16 ч. Реакционную смесь разбавляли EtOAc (20 мл), промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Неочищенное вещество очищали методом колоночной флеш-хроматографии (10% этилацетатав петролейном эфире, Rf=0,5) с получением метил-2-формил-4-октилбензоата (100 мг, 94,9% выход) в виде бесцветного масла. 1Н ЯМР (400 МГц, CDCl3): δ 10.65 (s, 1H), 7.91 (d, J=8.0 Гц, 1H), 7.75 (s, 1H), 7.46-7.43 (m, 1H), 3.97 (s, 3H), 2.70 (t, J=7.6 Гц, 2H), 1.66-1.60 (m, 2Н), 1.30-1.24 (m, 10Н), 0.88 (t, J=6.8 Гц, 3H).
К раствору соединения 101-K (100,0 мг, 0,11 ммоль), метил-2-формил-4-октилбензоата (60,47 мг, 0,22 ммоль) и уксусной кислоты (0,30 мл) в метаноле (10 мл) добавляли цианоборгидрид натрия (8,3 мг, 0,13 ммоль). Раствор перемешивали при 20°С в течение 6 ч и концентрировали. Остаток переносили в EtOAc (20 мл), промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Неочищенное вещество очищали методом преп-TLC (66% EtOAc в петролейном эфире, Rf=0,4) с получением соединения 488-А (100 мг, 77,8% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=0,888 мин, [М+Н]+=1174,6.
Раствор соединения 488-А (100,0 мг, 0,09 ммоль) в 1,2-дихлорэтане (5 мл) перемешивали при 60°С в течение 16 ч и концентрировали с получением неочищенного соединения 488-В (99 мг) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=1,015 мин, [М+Н]+=1164,9.
Соединение 488 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95 АВ, ESI): tR=0,633 мин, [М+Н]+=866,5.
Пример 389: Синтез соединения 489

Стадия 1: Смесь метил-2-хлор-4-октилбензоата (160,0 мг, 0,57 ммоль), трициклогексилфосфина (47,6 мг, 0,17 ммоль), трис(дибензилиденацетон)дипалладия (0) (51,8 мг, 0,06 ммоль), сложного пинаколового эфира (Е)-1-этоксиэтен-2-бороновой кислоты (123,3 мг, 0,62 ммоль) и трехосновного фосфата калия (240,2 мг, 1,13 ммоль) в 1,4-диоксане (4 мл) перемешивали при 100°С в течение 16 ч и концентрировали. Остаток переносили в EtOAc (20 мл), промывали водой (20 мл × 2) и солевым раствором (20 мл), сушили над MgSO4 и концентрировали. Неочищенное вещество очищали методом колоночной флеш-хроматографии (20% этил ацетата в петролейном эфире, Rf=0,7) с вероятным получением метил-2-(1-этоксивинил)-4-октилбензоата (150 мг, 83,3% выход) в виде желтого масла вместо ожидаемого региоизомера.
Стадия 2: К раствору метал-2-(1-этоксивинил)-4-октилбензоата (150,0 мг, 0,47 ммоль) в дихлорметане (5 мл) добавляли трифторуксусную кислоту (0,21 мл, 2,83 ммоль), перемешивали при 20°С в течение 2 ч и концентрировали. Остаток переносили в EtOAc (20 мл), промывали водой (10 мл × 2) и солевым раствором (10 мл), сушили над MgSO4 и концентрировали с получением неочищенного метил-2-ацетил-4-октилбензоата (130 мг, 95% выход) в виде желтого масла.
Соединение 489 (соль муравьиной кислоты) получали с применением способов примера 388 (соединение 488). LCMS (способ 5-95 АВ, ESI): tR=0.676 мин, [M+Na]+=902.5.
Пример 390: Синтез соединения 490-Р1 и соединения 490-Р2

Стадия 1: К раствору (S)-4-амино-2-(((бензилокси)карбонил)амино)бутановой кислоты (2000,0 мг, 7,93 ммоль) в N,N-диметилформамиде (50 мл) по каплям добавляли 2-нитробензолсульфонилхлорид (0,46 мл, 23,78 ммоль) и триэтиламин (4,42 мл, 31,71 ммоль). Реакционную смесь перемешивали при 25°С в течение 12 ч и фильтровали. К фильтрату добавляли воду (50 мл) и полученный осадок собирали с получением (S)-2-(((бензилокси)карбонил)амино)-4-(2-нитрофенилсульфонамидо)бутановой кислоты (2000 мг, 4,5723 ммоль, 57,7% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): RT=0,790 мин, [М+Н]+=437,0.
Стадия 2: К раствору (S)-2-(((бензилокси)карбонил)амино)-4-(2-нитрофенилсульфонамидо)бутановой кислоты (800,0 мг, 1,83 ммоль) в N,N-диметилформамиде (5 мл) добавляли йодметан (4,59 мл, 73,43 ммоль) и карбонат калия (758,3 мг, 5,49 ммоль). Смесь перемешивали при 25°С в течение 14 ч, разбавляли Н2О (20 мл) и экстрагировали EtOAc (35 мл × 3). Объединенные органические слои промывали водой (30 мл × 4) н солевым раствором (40 мл), сушили над Na2SO4 и концентрировали. Остаток очищали методом колоночной флеш-хроматографии (30% EtOAc в петролейном эфире, Rf=0,3) с получением (S)-метил-2-(((бензилокси)карбонил)амнно)-4-(N-метил-2-нитрофенилсульфонамидо)бутаноата (610 мг, 71,7% выход) в виде желтого масла. LCMS (способ 5-95 АВ, ESI): RT=0,813 мин, [М+Н]+=466,1.
Стадии 3 и 4: Стандартный гидролиз NaOH сложного эфира с получением (S)-2-(((бензилокси)карбонил)амино)-4-(N-метил-2-нитрофенилсульфонамидо)бутановой кислоты проводили после стандартного сочетания HATU (пример 5) с получением соединения 390-А.

Стадия 5: К раствору соединения 490-А (220,0 мг, 0,19 ммоль) в ацетонитриле (3 мл) добавляли тиогликолевую кислоту (0,09 мл, 1,27 ммоль) и DBU (0,29 мл, 1,94 ммоль). Реакционную смесь перемешивали при 25°С в течение 4 ч, разбавляли H2O (20 мл) и экстрагировали EtOAc (20 мл × 2). Объединенные органические слои промывали насыщенным водн. NaHCO3 (40 мл × 2), водой (40 мл × 2) и солевым раствором (40 мл), сушили над Na2SO4 и концентрировали. Остаток очищали методом препаративной TLC (10% метанола в дихлорметане, Rf=0,4) с получением соединения 490-В (170 мг, 92,1% выход) в виде желтого твердого вещества. LCMS (способ 5-95 АВ, ESI): RT=0,720 мин, [М+Н]+=962,5.
Стадия б: При стандартных условиях Boc получали соединение 490-С.
Соединение 490-Р1 и соединение 490-Р2 (соль муравьиной кислоты) получали с применением ранее описанных способов и выделяли в виде чистых диастереомеров методом HPLC с обращенной фазой. Данные соединения 490-PI: LCMS (способ 5-95 АВ, ESI): RT=0,642 мин, [М+Н]+=868,6. Данные соединения 490-Р2: LCMS (способ 5-95 АВ, ESI): RT=0,658 мин, [M+Н]+=868,6.
Пример 391: Синтез соединения 491
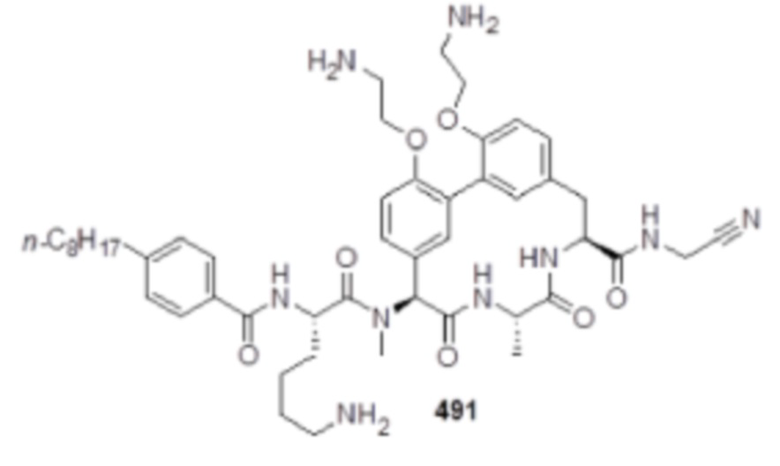
Соединение 491 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением ранее описанных способов с применением октилбензойной кислоты. LCMS (способ 5-95АВ): tR=0,756 мин/1,5 мин, [М+Н]+=882,5.
Пример 392: Синтез соединения 492
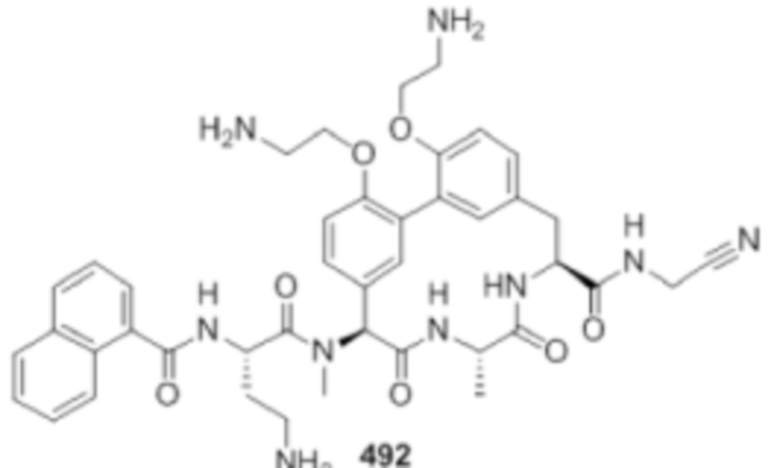
Соединение 492 (соль муравьиной кислоты) получали с применением ранее описанных способов. LC-MS: m/z=792 (М+Н).
Пример 393: Синтез соединения 493

Соединение 493 (соль муравьиной кислоты) получали с применением ранее описанных способов. LC-MS: m/z=802 (М+Н).
Пример 394: Синтез соединения 494

Соединение 494 (соль муравьиной кислоты) получали с применением ранее описанных способов из 1-аминоциклопропанкарбонитрила гидрохлорида. LC-MS: m/z=928 (М+Н).
Пример 395: Синтез соединения 495

Соединение 495 (соль муравьиной кислоты) получали с применением ранее описанных способов из 1-аминоциклопропанкарбонитрила гидрохлорида. LC-MS: m/z=885 (М+Н).
Пример 396: Синтез соединения 496

Соединение 496 (соль муравьиной кислоты) получали с применением ранее описанных способов из 2-амино-2-метилпропаннитрила. LC-MS: m/z=930 (М+Н).
Пример 397: Синтез соединения 497-Р1 и соединения 497-Р2
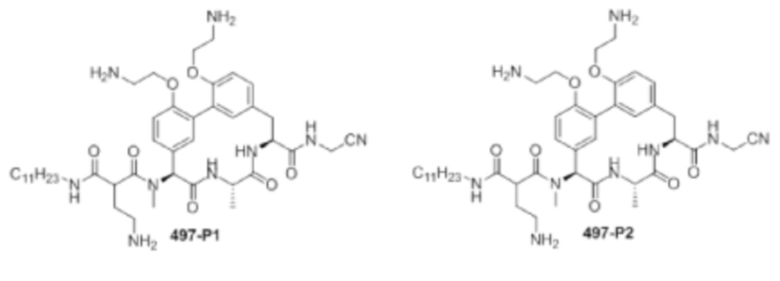
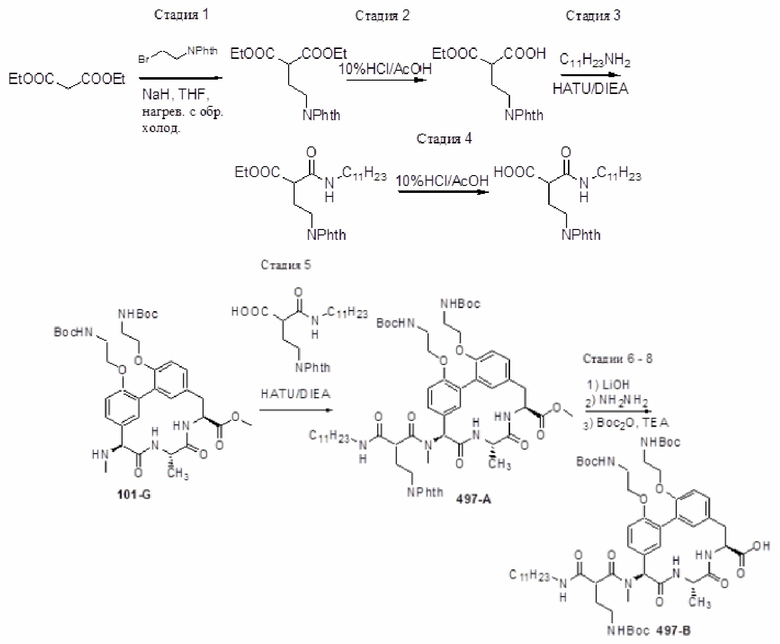
К перемешиваемому раствору 60% NaH (1,0 г, 25 ммоль) в THF (30 мл) добавляли 2-(2-бромэтил)изоиндолин-1,3-дион (5,6 г, 25 ммоль) и смесь перемешивали при 0°С в течение 0,5 ч, а затем добавляли диэтилмалонат (4,0 г, 25 ммоль). Полученную смесь затем перемешивали при комнатной температуре еще 16 ч. Реакционную смесь разбавляли EtOAc (100 мл), затем промывали солевым раствором (100 мл × 3). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на испарительной колонке с силикагелем с получением соединения диэтил-2-(2-(1,3-диоксоизоиндолин-2-ил)этил)малоната (1,2 г, 15,8% выход) в виде светло-желтого масла.
К перемешиваемому раствору диэтил-2-(2-(1,3-диоксоизоиндолин-2-ил)этил)малоната (1,0 г, 3,0 ммоль) в НОАс (9,0 мл) добавляли 10% раствор HCl (3,0 мл) и смесь нагревали до 90°С при перемешивании и перемешивали в течение 2 ч. Летучие вещества удаляли и остаток переносили в EtOAc (50 мл), затем промывали солевым раствором (30 мл × 2). Органический слой сушили над MgSO4, концентрировали и остаток очищали методом HPLC с получением 4-(1,3-диоксоизоиндолин-2-ил)-2-(этоксикарбонил)бутановой кислоты (250 мг, 27,3% выход) в виде желтого масла. LCMS (способ 5-95 АВ, ESI): tR=0,941, [М+Н]+=306,1.
Типичное амидное сочетание (HATU, пример 5)) и сложноэфирный гидролиз с процедурой НОАс/HCl использовали с получением 4-(1,3-диоксоизоиндолин-2-ил)-2-(ундецилкарбамоил)бутановой кислоты (150 мг) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=1,327, [М+Н]+=431,3
Процедуру типичного амидного сочетания (HATU, пример 5)) использовали по отношению к соединению 101-G (150 мг, 0.21 ммоль) и 4-(1,3-диоксоизоиндолин-2-ил)-2-(ундецилкарбамоил)бутановой кислоты (90 мг, 0,21 ммоль) с получением соединения 497-А (220 мг, 93% выход) в виде белого твердого вещества.
Процедуру типичного сложноэфирного гидролиза (LiOH/THF) использовали по отношению к соединению 497-А (150 мг, 0,13 ммоль) с получением неочищенного продукта. Раствор продукта, гидразина моногидрат (27 мг, 0,53 ммоль) в МеОН (2 мл), перемешивали при 80°С в течение 16 ч. Реакционную смесь разбавляли DCM (30 мл), затем промывали солевым раствором (30 мл × 2). Органический слой сушили над Na2SO4, концентрировали с получением остатка. Процедуру типичного добавления Boc использовали по отношению к остатку с получением соединения 497-В (60 мг) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=1,104, [М+Н]+=1082,7.
Соединение 497-Р1 (4,4 мг) и соединение 497-Р2 (1,9 мг) (соль муравьиной кислоты) получали с применением ранее описанных способов и выделяли в виде отдельных диастереомеров. Данные соединения 497-Р1 и соединения 497-Р2: LCMS (способ 5-95 АВ, ESI): tR=0,766, [М+Н]+=821,0 (они идентичны при этих условиях HPLC).
Пример 398: Синтез соединения 498

Соединение 498 (свободное основание) получали с применением ранее описанных способов. LCMS (способ 5-95 АВ, ESI): RT=0,759, [М+Н]+=852,5.
Пример 399: Синтез соединения 499

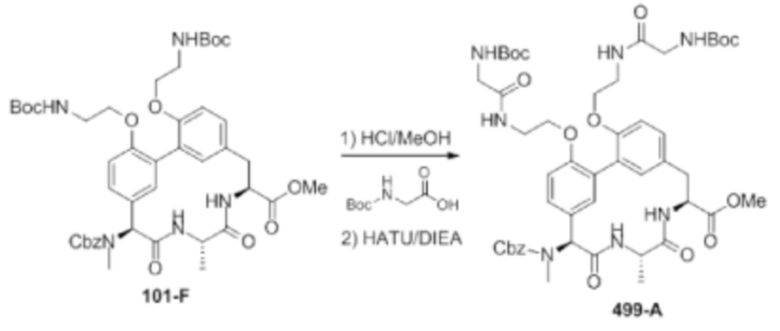
Начиная с соединения 101-F (пример 4) типичной процедурой, включая удаление Boc (HCl/MeOH), амидное сочетание с 2-((трет-бутоксикарбонил)амино)уксусной кислотой (HATU/DIEA), получали соединение 499-А.
Соединение 499 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95 АВ, ESI): RT=0,751, [М+Н]+=969,7; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.52 (brs, 3H), 7.34 (d, J=8.0 Гц, 2Н), 7.28 (d, J=8.0 Гц, 1Н), 7.21 (d, J=8.0 Гц, 1H), 7.12-7.04 (m, 4Н), 6.85 (brs, 1H), 6.73 (brs, 1H), 6.39 (s, 1H), 5.17-5.13 (m, 1Н), 4.84-4.79 (m, 2Н), 4.22 (s, 2Н), 4.20-4.05 (m, 6Н), 3.58-3.43(m, 8Н), 3.17-3.10 (m, 3H), 2.97 (s, 3H), 2.62 (t, J=6.8 Гц, 2Н), 2.41 (s, 3H), 2.33-2.24 (m, 1H), 2.19-2.10 (m, 1H), 1.68-1.51(m, 2Н), 1.40-1.25 (m, 11H), 0.92 (t, J=6.8 Гц, 3H).
Пример 400: Синтез соединения 500
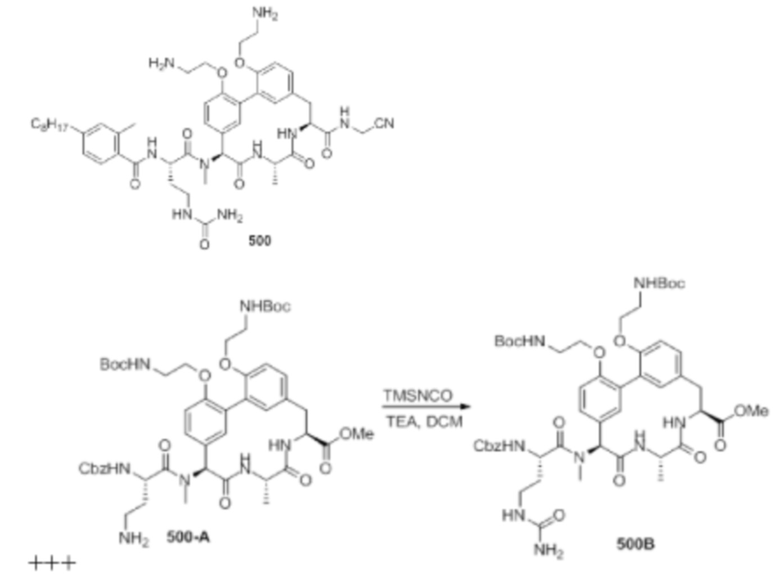
Соединение 500-А получали с использованием способов примера 5, за исключением того, что (S)-4-((((9Н-флуорен-9-ил)метокси)карбонил)амино)-2-(((бензилокси)карбонил)амино)бутановую кислоту использовали в реакции сочетания с последующим снятием защитных групп Fmoc при помощи пиперидина.
К раствору соединения 500-А (120 мг, 0,13 ммоль) и Et3N (53 мкл, 0,38 ммоль) в DCM (5 мл) добавляли триметилсилилизоцианат (44 мг, 0,38 ммоль) при 0°С. Полученную смесь нагревали до комнатной температуры при перемешивании и перемешивали при той же температуре в течение 2 ч. Летучие вещества удаляли и остаток очищали методом преп-TLC с получением соединения 500-В (90 мг, 72% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): RT=0,759, [М+Н]+=991,7.
Начиная с соединения 500-В проводили типичное гидрирование, реакцию амидного сочетания (HATU/DIEA) и процедуру глобального удаления Вое (TFA/HFIP) (примеры 5 и 7) с получением соединения 500 в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): RT=0,803, [М+Н]+=911,6; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.51 (brs, 2Н), 7.42-7.31 (m, 2Н), 7.26 (d, J=8.4 Гц, 1Н), 7.19 (d, J=8.4 Гц, 1Н), 7.14-7.03 (m, 3H), 6.90 (brs, 1H), 6.81 (brs, 1H), 6.46 (s, 1H), 5.02-4.98 (m, 1H), 4.81-4.76 (m, 2Н), 4.33-4.22 (m, 4Н), 4.21 (s, 2Н), 3.43-3.35 (m, 2Н), 3.28-3.14 (m, 6Н), 2.98 (s, 3H), 2.61 (t, J=7.6 Гц, 2Н), 2.43 (s, 3H), 2.17-2.03 (m, 1Н), 1.97-1.84 (m, 1Н), 1.62 (brs, 2Н), 1.39-1.26 (m, 13Н), 0.92 (t, J=6.8 Гц, 3H).
Пример 401: Синтез соединения 501

Соединение 501 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95 АВ, ESI): RT=0,805, [М+Н]+=910,5
Пример 402: Синтез соединения 502
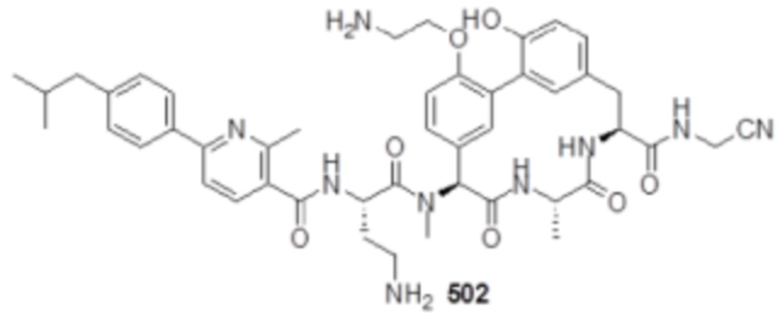
Соединение 502 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,729, [М+Н]+=846,5.
Пример 403: Синтез соединения 503

Соединение 503 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,756, [М+Н]+=847,6
Пример 404: Синтез соединения 504

Соединение 504 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,793, [М+Н]+=875,6.
Пример 405: Синтез соединения 505

Соединение 505 (свободное основание) получали с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,719, [М+Н]+=819,4.
Пример 406: Синтез соединения 506

Соединение 506 (свободное основание) получали с применением ранее описанных способов. MS (ESI) для (C53H75N11O9): m/z 1010,7 [М+Н]+. HPLC tR 2,73 мин (10% AcCN/H2O - 90% AcCN/H2O, 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм).
Пример 407: Синтез соединения 507
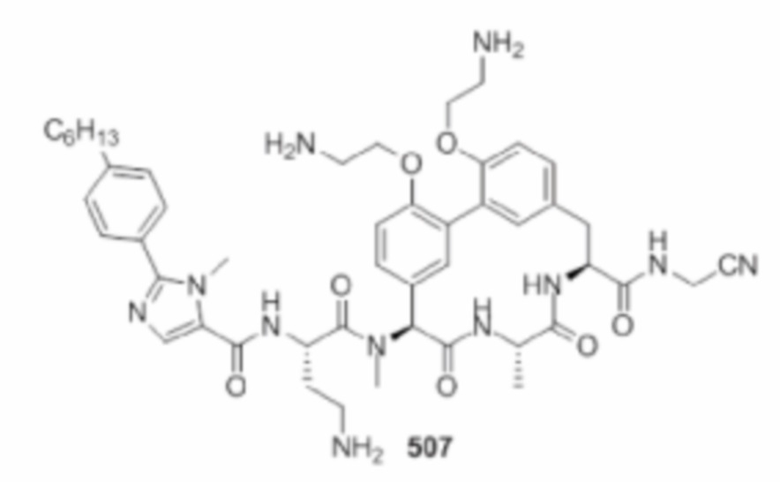
Соединение 507 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,722, [М+Н]+=906,7.
Пример 408: Синтез соединения 508

Стадия 1: Синтез (S)-3-(((бензилокси)карбонил)амино)-7-((трет-бутоксикарбонил)амино)гептановой кислоты. Изобутилхлорформиат (0,81 мл, 6,2 ммоль) в безводном THF (5 мл) добавляли к раствору (2S)-2-(бензилоксикарбониламино)-6-(трет-бутоксикарбониламино)гексановой кислоты (2282 мг, 6,0 ммоль) и DIEA (0,68 мл, 6,2 ммоль) в THF (30 мл) при -15°С и смесь перемешивали в течение 30 минут при -5°С. К реакционной смеси добавляли ацетонитрил (20 мл) и (триметилсилил)диазометан (2,0 моль/л) в гексане (6,0 мл) и смесь перемешивали при комнатной температуре всю ночь (18 часов).
Стадия 2: Добавляли диэтиловый эфир (80 мл) и смесь экстрагировали 10% води, лимонной кислотой, нас. водн. NaHCO3 и нас. водн. NaCl (60 мл каждого). Органический слой сушили над MgSO4 и растворители выпаривали с получением неочищенного трет-бутил-N-[(5S)-5-(бензилоксикарбониламино)-7-диазо-6-оксо-гептил]карбамата (2427 мг, 100,0%).
Трет-бутил-N-[(5S)-5-(бензилоксикарбониламино)-7-диазо-6-оксо-гептил]кабамат (2427 мг, 6.0 ммоль) суспендировали в THF (30 мл) и метаноле (30 мл) и постепенно добавляли раствор бензоата серебра (274,8 мг, 1,2 ммоль) в триэтиламине (8,36 мл, 60,0 ммоль), при этом смесь обрабатывали ультразвуком в ультразвуковой ванне. Реакция была завершена за 30 минут при комнатной температуре. Метанол и THF выпаривали и остаток растворяли в iPrOAc (60 мл), экстрагировали нас. водн. NaHCO3, 10% водн. лимонной кислотой и нас. водн. NaCl (40 мл каждого) и сушили над MgSO4. Выпаривание растворителя проводили методом колоночной хроматографии на силикагеле (0-100% EtOAc в гептане) с получением метил(3S)-3-(бензилоксикарбониламино)-7-(трет-бутоксикарбониламино)гептаноата (1434,2 мг, 58,5%).
Метил-(3S)-3-(бензилоксикарбониламино)-7-(трет-бутоксикарбониламино)гептаноат (1,4341 г, 3,511 ммоль) растворяли в 1,4-диоксане (20 мл) и добавляли гидроксид лития (10 ммоль) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь охлаждали до 0°С и подкисляли 1,0 М HCl. Полученный белый осадок экстрагировали iPrOAc, сушили MgSO4, фильтровали и концентрировали с получением (3S)-3-(бензилоксикарбониламино)-7-(трет-бутоксикарбониламино)гептановой кислоты (1,405 г, 100%), которую использовали без дополнительной очистки.
Соединение 508 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101) с применением (S)-3-(((бензилокси)карбонил)амино)-7-((трет-бутоксикарбонил)амино)гептановой кислоты. MS+ 892.6. 1Н ЯМР (400 МГц, Methanol-d4) δ 7.42-7.21 (m, 3H), 7.21-7.02 (m, 4Н), 6.92-6.78 (m, 2Н), 4.57 (d, J=7.4 Гц, 1H), 4.32 -4.17 (m, 6Н), 3.31-3.19 (m, 27Н), 3.19-3.01 (m, 3H), 2.98-2.86 (m, 1Н), 2.85 (s, 2Н), 2.79 (dd, J=16.1, 5.8 Гц, 1Н), 2.61 (t, J=7.6 Гц, 2Н), 2.40 (s, 3H), 2.08 (dtd, J=16.5, 8.2, 3.9 Гц, 1Н), 1.93 (dtd, J=13.7, 9.1, 8.3, 3.7 Гц, 1Н), 1.65-1.52 (m, 2Н), 1.35 (р, J=7.5 Гц, 5Н), 0.93 (td, J=7.3, 2.9 Гц, 3H).
Пример 409: Синтез соединения 509

Соединение 509 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101) с применением (S)-3-(((бензилокси)карбонил)амино)-7-((трет-бутоксикарбонил)амино)гептановой кислоты. MS+ 855.5 1H ЯМР (400 МГц, Methanol-d4) δ 7.36-7.24 (m, 3H), 7.24-7.10 (m, 3H), 7.10-7.04 (m, 2Н), 6.95-6.80 (m, 2Н), 4.81 (q, J=6.8 Гц,4Н), 4.54 (h, J=5.8, 5.1 Гц, 1H), 4.37-4.19 (m, 6Н), 3.41-3.22 (m, 9H), 3.15 (dd, J=17.3, 11.2 Гц, 1H), 3.07-2.92 (m, 3H), 2.90 (s, 2H), 2.79 (dd, J=6.8, 3.3 Гц, 2H), 2.63 (t, J=7.6 Гц, 2H), 2.42 (s, 3H), 1.88-1.71 (m, 3H), 1.71-1.51 (m, 5H), 1.44-1.29 (m, 5H), 0.95 (t, J=7.4 Гц, 3H).
Пример 410: Синтез соединения 510
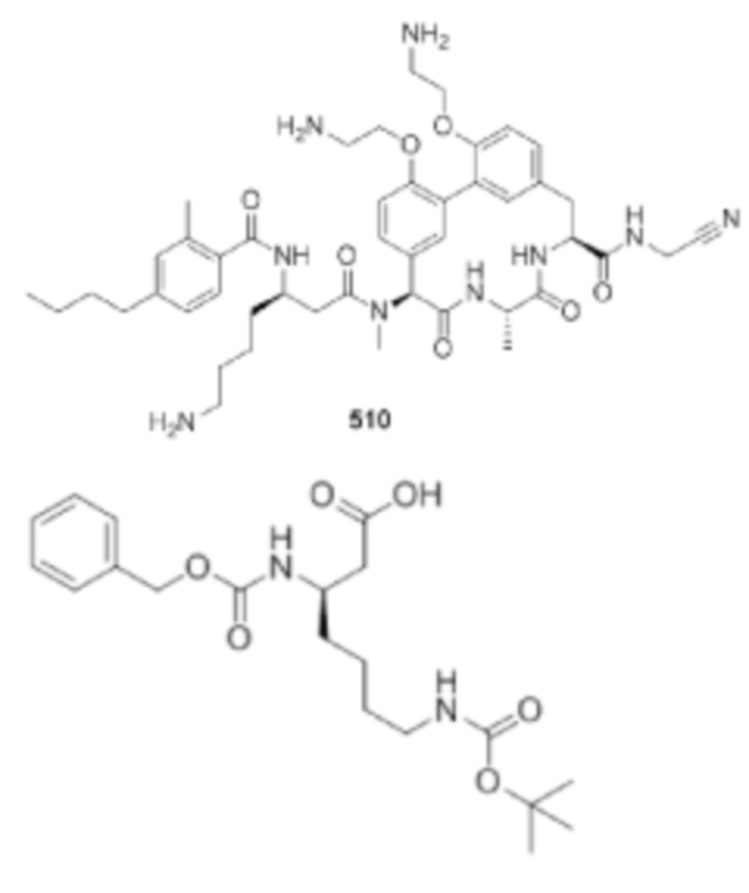
Синтез (R)-3-(((бензилокси)карбонил)амино)-7-((трет-бутоксикарбонил)амино)гептановой кислоты: Начиная с N2-((бензилокси)карбонил)-N6-(трет-бутоксикарбонил)-D-лизина (R)-3-(((бензилокси)карбонил)амино)-7-((трет-бутоксикарбонил)амино)гептановую кислоту получали процедурами примера 408 (63% весь выход за три стадии).
Соединение 510 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101) с применением (R)-3-(((бензилокси)карбонил)амино)-7-((трет-бутоксикарбонил)амино)гептановой кислоты. MS+ 855,5 1Н ЯМР (500 МГц, Methanol-d4) δ 7.30 (d, J=7.7 Гц, 1H), 7.28-7.24 (m, 2Н), 7.16 (d, J=8.6 Гц, 1H), 7.15-7.10 (m, 2Н), 7.08 (d, J=8.0 Гц, 1H), 6.91 (d, J=2.4 Гц, 1H), 6.84 (d, J=2.2 Гц, 1H), 6.35 (s, 1H), 4.88 (dd, J=11.3, 3.0 Гц, 1H), 4.80 (q, J=7.0 Гц, 1H), 4.52 (dq, J=10.5, 6.4 Гц, 1H), 4.28 (dtd, J=19.7, 11.0, 5.2 Гц, 4H), 4.22 (d,J=2.3 Гц, 2H), 3.37 (d, J=2.8 Гц, 1H), 3.29 (ddd, J=11.0, 7.3, 4.9 Гц,4Н), 3.15 (dd, J=17.3, 11.3 Гц, 1H), 3.04-2.93 (m, 2H), 2.90-2.85 (m, 1H), 2.85 (s, 3H), 2.76-2.69 (m, 1H), 2.62 (t, J=7.6 Гц, 2H), 2.42 (s, 3H), 1.88-1.65 (m, 4H), 1.65-1.51 (m, 4H), 1.42-1.29 (m, 5H), 0.96 (t, J=7.4 Гц, 3H).
Пример 411: Синтез соединения 511

Синтез (S)-3-(((бензилокси)карбонил)амино)-5-((трет-бутоксикарбонил)амино)пентановой кислоты: Начиная с (S)-2-(((бензилокси)карбонил)амино)-4-((трет-бутоксикарбонил)амино)бутановой кислоты (S)-3-(((бензилокси)карбонил)амино)-5-((трет-бутоксикарбонил)амино)пентановую кислоту получали процедурами примера 408 (58% весь выход за три стадии).
Соединение 511 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101) с применением (S)-3-(((бензилокси)карбонил)амино)-5-((трет-бутоксикарбонил)амино)пентановой кислоты. MS+ 827,5
Пример 412: Синтез соединения 512
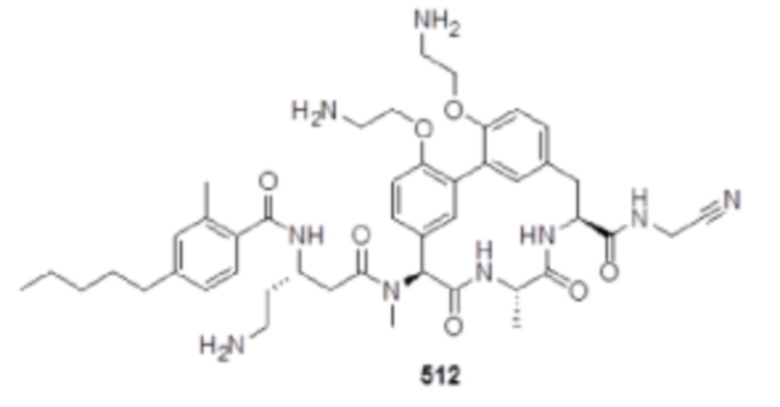
Соединение 512 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101) с применением (S)-3-(((бензилокси)карбонил)амино)-5-((трет-бутоксикарбонил)амино)пентановой кислоты. MS+ 840,5.
Пример 413: Синтез соединения 513

Соединение 513 (соль муравьиной кислоты) получали с использованием способов примера 7 (соединение 101) с применением (S)-3-(((бензилокси)карбонил)амино)-5-((трет-бутоксикарбонил)амино)пентановой кислоты. MS+ 854,5.
Пример 414: Синтез соединения 514
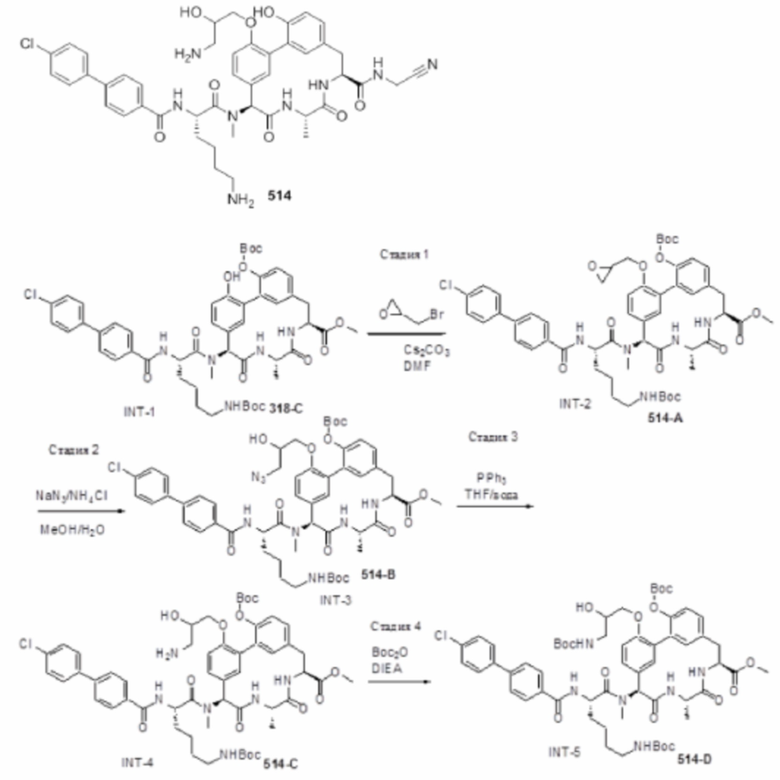
Стадия 1: К смеси соединения 318-С (пример 222) (485,2 мг, 0,50 ммоль) и карбоната цезия (325,8 мг, 1,0 ммоль) в N,N-диметилформамиде (10 мл) добавляли эпибромгидрин (0,05 мл, 0,60 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение выходных. Реакционную смесь выливали в ледяную воду и экстрагировали 3 раза iPrOAc. Органические слои промывали солевым раствором, сушили (MgSO4) и концентрировали и остаток очищали на силикагеле с элюированием 0-3,5% МеОН в DCM с получением соединения 514-А (513,3 мг, 83%).
Стадия 2: К смеси соединения 514-А (319 мг, 0,31073 ммоль) в метаноле (10 мл) и воде (1 мл) добавляли хлорид аммония (41,6 мг, 0,77684 ммоль), а затем добавляли азид натрия (102,0 мг, 1,5537 ммоль). Реакционную смесь нагревали при 65°С в течение 6 часов. Реакционную смесь концентрировали и остаток разделяли между iPrOAc и водой. Органический слой сушили и концентрировали с получением неочищенного соединения 514-В (321 мг, 96,582%), которое использовали без дополнительной очистки.
Стадия 3: Смесь соединения 514-В (428,5 мг, 0,40 ммоль) и трифенилфосфина (111,4 мг, 0,42 ммоль) в THF (10 мл) и воде (2 мл) перемешивали при комнатной температуре в течение выходных. Реакционную смесь концентрировали и остаток разделяли между iPrOAc и солевым раствором. Органический слой сушили (MgSO4) и растворитель удаляли при пониженном давлении с получением неочищенного соединения 514-С (418,1 мг, 100,0%).
Стадия 4: Соединение 514-С (418,1 мг, 0,40 ммоль) растворяли в дихлорметане (12 мл) и добавляли N,N-диизопропилэтиламин (0,14 мл, 0,80 ммоль), а затем добавляли ди-трет-бутилдикарбонат (180,3 мг, 0,80 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали и остаток очищали на силикагеле, элюировали 0-5% МеОН в DCM с получением соединения 514-D (188 мг, 41,03% за 2 стадии).
Соединение 514 (смесь диастереомеров) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 514-D. MS+ 867,4 1Н ЯМР (400 МГц, Methanol-d4) δ 8.02-7.89 (m, 2Н), 7.80-7.70 (m, 2Н), 7.70-7.59 (m, 2Н), 7.51-7.43 (m, 2Н), 7.34-7.25 (m, 1Н), 7.18-7.01 (m, 2Н), 6.88-6.78 (m, 1Н), 6.76-6.63 (m, 1Н), 6.54-6.46 (m, 1Н), 5.04 (dd, J=8.7, 5.4 Гц, 1H), 4.19 (d, J=1.0 Гц, 2Н), 4.18-4.05 (m, 3H), 3.28-3.12 (m, 3H), 3.12-2.90 (m, 7Н), 2.08-1.88 (m, 2Н), 1.74 (q, J=6.9, 6.0 Гц, 2Н), 1.61 (dd, J=13.1, 6.4 Гц, 2Н), 1.37 (d, J=6.8 Гц, 3H).
Пример 415: Синтез соединения 515
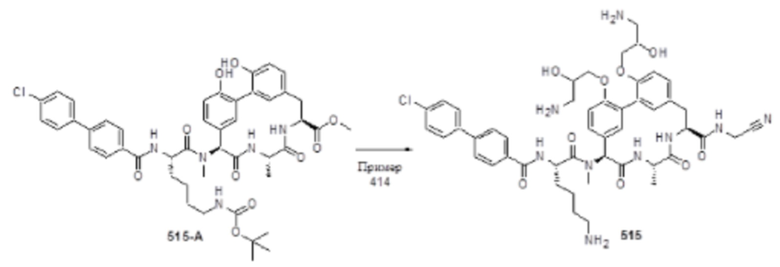
Соединение 515 (смесь диастереомеров) получали в виде белого твердого вещества с применением способов примера 414 из соединения 515-А. MS+ 942.5 1Н ЯМР (400 МГц, Methanol-d4) δ 8.02-7.93 (m, 2Н), 7.76 (dd, J=8.7, 2.8 Гц, 2Н), 7.72-7.64 (m, 2Н), 7.53-7.45 (m, 2Н), 7.34-7.26 (m, 1Н), 7.21 (d, J=8.5 Гц, 1H), 7.07 (ddd, J=33.2, 8.4, 3.6 Гц, 2H), 6.85 (q, J=3.5, 3.0 Гц, 1H), 6.77 (s, 1H), 6.42 (d, J=3.8 Гц, 1H), 5.06 (dd, J=8.5, 5.4 Гц, 1H), 4.77 (q, J=6.4 Гц, 2H), 4.23-4.08 (m, 5H), 4.08-3.96 (m, 3H), 3.31 (dp, J=3.3, 1.4 Гц, 25H), 3.18-3.00 (m, 4H), 3.00-2.84 (m, 7H), 2.09-1.84 (m, 2H), 1.74 (d, J=7.4 Гц, 2H), 1.36 (d, J=6.8 Гц, 3H).
Пример 416: Синтез соединения 516

Соединение 516-А представляет собой промежуточное соединение при получении соединения 320 и его получали согласно способам примера 222.
Соединение 516-В синтезировали из β-D-глюкозамина с применением процедур, описанных в литературе. (WO 2012/135049 and Organic Letters, 16(14), 3772-3775; 2014): MS (ESI) для (C15H20Cl3NO10): m/z 344,3 (M-277). HPLC: (два пика с той же массой; tR 3,21 мин (30%) и 3,54 мин (70%) (10% AcCN/H2O - 90% AcCN/H2O (с 0,05% TFA), 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм). 1Н ЯМР (400 МГц, CDCl3) δ 8.80 (s, 1H), 6.42 (d, J=3.0 Гц, 1Н), 5.35 (t, J=8.0 Гц, 1Н), 5.25 (t, J=8.0 Гц, 1H), 5.18 (d, J=8.0 Гц, 1Н), 4.71 (ABq, J=10.0, 3.0 Гц, 1Н), 4.29-4.26 (га, 2Н), 2.08 (s, 3H), 2.05 (s, 3H), 2.03 (s, 3H).
Стадия 1: К смеси соединения 516-А (106 мг, 0,1 ммоль), соединения 516-В (311 мг, 0,5 ммоль) и 4  MS (высушивали на пламени горелки) в сухом DCM (5,0 мл) по каплям добавляли BF3-Et2O (125 мкл, 0,3 ммоль) при 0°С. Перемешивание продолжали дополнительно 6 ч при той же температуре, а затем реакционную смесь сохраняли в холодильнике всю ночь. Реакционную смесь разбавляли DCM и фильтровали через целит и фильтрат концентрировали при пониженном давлении с получением региоизомерной смеси соединения 516-С. MS (ESI): (C56H81Cl3N7O17), m/z 1228,9 [M+H]+; HPLC: tR 3,31 мин, (10% AcCN/H2O - 90% AcCN/H2O (с 0,05%TFA), 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм).
MS (высушивали на пламени горелки) в сухом DCM (5,0 мл) по каплям добавляли BF3-Et2O (125 мкл, 0,3 ммоль) при 0°С. Перемешивание продолжали дополнительно 6 ч при той же температуре, а затем реакционную смесь сохраняли в холодильнике всю ночь. Реакционную смесь разбавляли DCM и фильтровали через целит и фильтрат концентрировали при пониженном давлении с получением региоизомерной смеси соединения 516-С. MS (ESI): (C56H81Cl3N7O17), m/z 1228,9 [M+H]+; HPLC: tR 3,31 мин, (10% AcCN/H2O - 90% AcCN/H2O (с 0,05%TFA), 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм).
Стадия 2: Полученную смесь соединения 516-С растворяли в 1:1 МеОН-АсОН (5,0 мл) и охлаждали до 0°С, затем добавляли Zn пыль (130 мг, 20 экв.) и реакционную смесь перемешивали при к т. в течение 3 ч. Смесь фильтровали через целитный слой и целитный слой тщательно промывали МеОН. Фильтрат концентрировали при пониженном давлении. Остаток очищали методом препаративной HPLC (10% AcCN/H2O - 60% AcCN/H2O (с 0,05% НСО2Н) с получением соединения 516-D в виде смеси региоизомеров. LCMS (ESI): (C53H80N7O15): m/z 1055,3 (М+2Н); HPLC: tR 2,99 мин (10% AcCN/Н2О - 90% AcCN/H2O (с 0,05%TFA), 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм).
Стадия 3: Соединение 516-D (22 мг, 0,2 ммоль) подвергали введению защитных групп Вое с применением условий примера 218 (соединение 314), затем полученный остаток растворяли в МеОН. Смесь охлаждали до 0°С и добавляли раствор NaOMe (20 экв., 25 масс. % в МеОН). Реакционную смесь перемешивали при к.т. всю ночь, гасили льдом и продолжали перемешивание еще 1 ч. Метанол удаляли, охлаждали смесь в ледяной бане и подкисляли 1 М HCl. Липкое вещество собирали и сушили под высоким вакуумом с получением соединения 516-Е.
Соединение 516 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 516-Е. MS (ESI): (C48H73N9O11): m/z 952,6 [М+Н]+; HPLC: tR 2,70 мин (10% AcCN/H2O - 90% AcCN/Н2О (с 0,05%TFA), 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм).
Пример 417: Синтез соединения 517
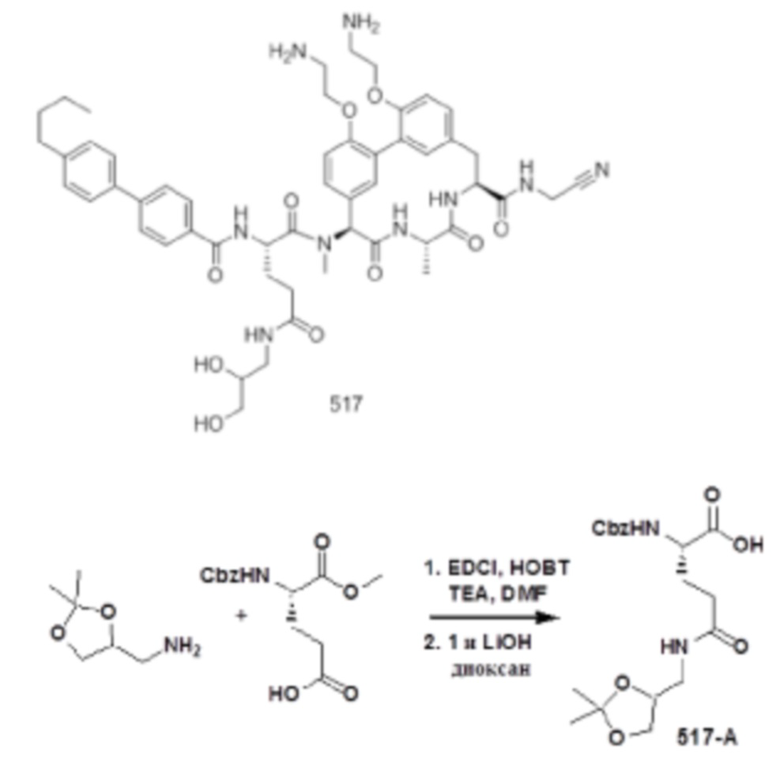
Соединение 517-А получали с применением (2,2-диметил-1,3-диоксолан-4-ил)метанамина и (S)-4-(((бензилокси)карбонил)амино)-5-метокси-5-оксопентановой кислоты с последующими общими процедурами сочетания EDCI-HOBT (пример 234) и гидролизом LiOH (пример 7). MS (ESI): (C19H27N2O7), m/z 395,3 [M+H]+; HPLC: tR 2,88 мин, (10% AcCN/H2O - 90% AcCN/H2O (с 0,05%TFA), 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм).
Соединение 517 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением соединения 101-G и соединения 517-А с использованием способов примера 5 и 7 (соединение 101-I и соединение 101). MS (ESI): (C52H66N9O10): m/z 976,4 [М+Н]+; HPLC: tR 2,68 мин (10% AcCN/H2O - 90% AcCN/H2O (с 0,05% TFA), 3,0 мин, 1,0 мл/мин Kinetix C18, 4,8×50 мм).
Пример 418: Синтез соединения 518
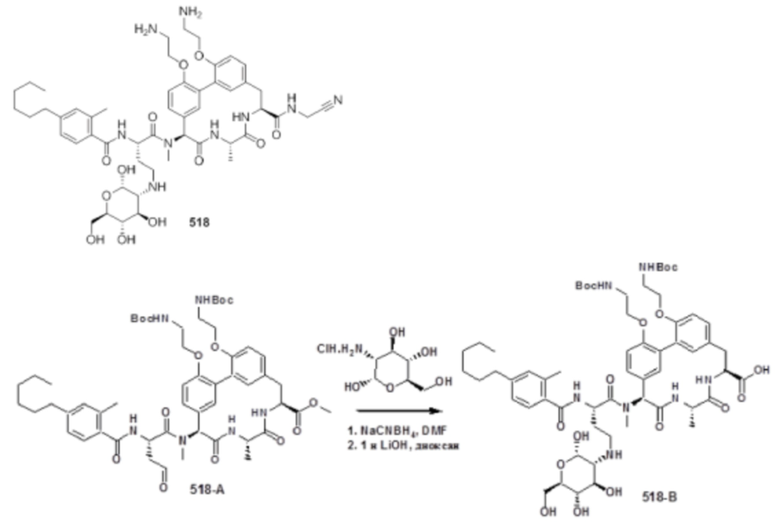
Соединение 518-А получали согласно способам примера 168.
Соединение 518-В получали с применением процедуры, как описано в примере 168 (соединение 263). MS (ESI): (C59H86N7O17), m/z 1164,3 [М+Н]+; HPLC: tR 3,23 мин, (50% AcCN/H2O - 90% AcCN/H2O (с 0,05%TFA), 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм).
Соединение 518 (соль муравьиной кислоты) получали в виде белого твердого вещества с использованием способов примера 7 (соединение 101) из соединения 518-В. MS (ESI): (C51H72N9O12: m/z 1002.6 [M+H]+; HPLC: tR 2,68 мин (10% AcCN/H2O - 90% AcCN/H2O (с 0,05% TFA), 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм).
Пример 419: Синтез соединения 519

Соединение 519-А получали с применением процедуры алкилирования, описанной в примере 311 (соединение 407). MS (ESI): (C22H37NO5Si), m/z 432,3 [M+Na]+; HPLC: tR 2,27 мин, (75% AcCN/Н2О - 90% AcCN/H2O (c 0,05% TFA), 3,0 мин, 1,0 мл/мин Kinetix C18, 4,8×50 мм).
Способы примера 7 (соединение 101) проводили с получением соединения 519 (21,4 мг) в виде белого твердого вещества. MS (ESI): (C61H88N10O14), m/z 1185,9 [M+H]+; HPLC: tR 2,87 мин, (50% AcCN/H2O - 90% AcCN/H2O (с 0,05% TFA), 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм). Остаток подвергали глобальному снятию защитных групп общим способом (снятие защитных групп Вос). MS (ESI): (C46H64N10O8), m/z 885,6 [M+H]+; HPLC: tR 2,54 мин, (10% AcCN/H2O - 90% AcCN/Н2О (с 0,05% TFA), 3,0 мин, 1,0 мл/мин Kinetix С18, 4,8×50 мм). 1H ЯМР (400 МГц, CD3OD) δ 7.87-7.86 (d, J=6.4 Гц, 1H), 7.32-7.30 (d, J=8 Гц, 1H), 7.26-7.24 (d, J=8 Гц, 1H), 7.18-7.16 (d, J=8 Гц, 1H), 7.11-7.09 (d, J=8 Гц, 1H), 7.04 (s, 1Н), 7.01-6.99 (d, J=8 Гц, 2Н), 6.89 (s, 1Н), 6.82 (s, 1Н), 6.41 (s, 1H), 5.27-5.24 (dd, J=3.2, 7.6 Гц, 1H), 4.90-4.88 (dd, J=2, 7.6 Гц, 1H), 4.85-4.78 (dd, J=4, 7.6 Гц, 1H), 4.23-4.18 (m, 6Н), 4.20 (s, 2Н), 3.60-3.58 (m, 1H), 3.52-3.50 (m, 1H), 3.18-3.15 (m, 6Н), 3.08-3.07 (m, 2Н), 2.94 (s, 8Н), 0.92-0.89 (t, J=112 Гц, 3H).
Пример 420: Синтез соединения 520


NH3 (газ) барботировали в метанол (20 мл) при -30°С в течение 20 минут. К раствору медленно добавляли 2,3-дибромпропионитрил (5,3 г, 24,9 ммоль) при 5°С. Через 20 минут медленно добавляли триэтиноламин (7429,0 мг, 49,8 ммоль) при 10°С и перемешивали при 14°С в течение 40 минут. Реакционную смесь нагревали с обратным холодильником в течение 4 ч, охлаждали до 5°С и поддерживали при 5°С еще 16 ч. Смесь фильтровали и промывали метанолом (2,5 мл). Фильтрат сушили в вакууме. К остатку добавляли 2 М H2SO4 (1,25 мл) при 0°С, а затем водн. сульфит натрия (5,5 г в 100 мл воды) до значения рН 6 и экстрагировали EtOAc (10 мл × 5). Объединенные органические слои концентрировали и очищали методом TLC (25% EtOAc в петролейном эфире, Rf=0,2) с получением азиридин-2-карбонитрила (800 мг, 23,6% выход) в виде бесцветного масла (примесь определяли НЯМР).
Соединение 520 получали с использованием способов примера 7 (соединение 101) из азиридин-2-карбонитрила. LCMS (способ 5-95АВ): tR=0,761 мин/1,5 мин, [М+Н]+=901,5.
Пример 421: Синтез соединения 521, соединения 522 и соединения 523


Стадии 1 и 2: Соединение 521-А получали с применением ранее описанных способов. Фенольным алкилированием с 2-бромацетамидом согласно общему способу 2 (пример 4) и LiOH гидролизом (пример 7) получали соединение 521-С.
Стадия 3: Реакцией сочетания соединения 521-С (150,0 мг, 0,16 ммоль) с 2-аминоацетонитрилом (общий способ 6 (пример 7)) (74,0 мг, 0,80 ммоль) получали требуемое соединение 521-D (30 мг) вместе с двумя побочными продуктами, соединением 522-А (60 мг) и соединением 523-А (30 мг).
Соединение 521 получали с применением ранее описанных способов гидролиза (пример 7). LCMS (способ 5-95 АВ, ESI): tR=0,844 мин, [М+Н]+=877,6.
Соединение 522 получали с применением ранее описанных способов гидролиза (пример 7). LCMS (способ 5-95 АВ, ESI): tR=0,861 мин, [М+Н]+=916,7.
Соединение 523 получали с применением ранее описанных способов гидролиза (пример 7). LCMS (способ 5-95 АВ, ESI): tR=0,874 мин, [М+Н]+=956,6.
Пример 422: Синтез соединения 524 1 и соединения 524-2
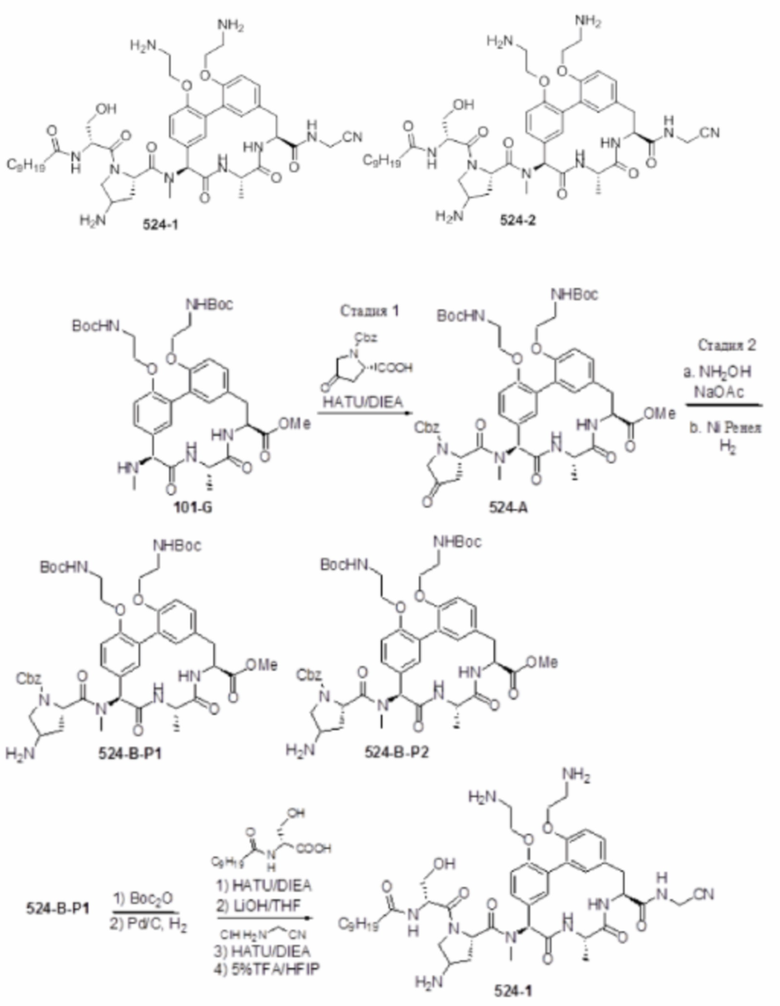
Стадия 1: Начиная с соединения 101-G (1 г, 1,40 ммоль) проводили процедуру типичного амидного сочетания (HATU) с получением соединения 524-А (1,25 г, 93% выход) в виде белого твердого вещества.
Стадия 2: К раствору соединения 524-А (1,25 г, 1,3 ммоль) в EtOH (26 мл) добавляли HONH2⋅HCl (725 мг, 10,4 ммоль) и Et3N (1,06 г, 10,4 ммоль) и смесь перемешивали при комнатной температуре в течение 2 ч. Летучие вещества удаляли и к остатку добавляли H2O (50 мл), затем экстрагировали DCM (60 мл). Органический слой сушили над Na2SO4, концентрировали с получением неочищенного соединения 524-В, которое использовали сразу на следующей стадии. Вышеуказанный остаток затем растворяли в МеОН (26 мл), затем добавляли Ni Ренея (15 мг, 0,26 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере H2 (15 фунт/кв. дюйм). Фильтрат концентрировали и остаток очищали на колонке с силикагелем элюировали (1% метилового спирта в дихлорметане) с получением смеси диастереомеров, которую дополнительно очищали методом преп-HPLC с получением соединения 524-В-Р1 (200 мг, 16% выход) в виде белого твердого вещества и соединения 524-В-Р2 (180 мг, 14% выход) в виде белого твердого вещества.
Стадия 3: Начиная с соединения 524-В-Р1 с применением ранее описанных способов соединение 524-1 (11,0 мг) получали в виде белого твердого вещества из (R)-2-деканамидо-3-гидроксипропановой кислоты. LCMS (способ 5-95 АВ, ESI): tR=0.713, [М+Н]+=891.8; 1Н ЯМР (400 МГц, МеОН-d4) δ 8.50 (brs, 2Н), 7.43 (brs, 1H), 7.36 (d, J=8.4 Гц, 1Н), 7.24 (d, J=8.4 Гц, 1H), 7.17 (d, J=8.0 Гц, 1H), 7.09 (d, J=8.0 Гц, 1H), 6.87 (brs, 1Н), 6.81 (brs, 1H), 6.27 (s, 1H), 5.05-5.00 (m, 1Н), 4.85-4.75 (m, 3H), 4.264.20 (m, 4Н), 4.18 (s, 2Н), 4.06-3.76 (m, 2Н), 3.76-3.72 (m, 2Н), 3.38-3.13 (m, 5Н), 3.35 (s, 3H), 2.91-2.85 (m, 2Н), 2.30-2.25 (m, 2Н), 1.65-1.48 (m, 2Н), 1.35-1.20 (m, 17Н), 0.89 (t, J=7.2 Гц, 3H).
Начиная с соединения 524-В-Р2 получали соединение 524-2 с применением ранее описанных способов из (R)-2-деканамидо-3-гидроксипропановой кислоты. Данные соединения 524-2: LCMS (способ 5-95 АВ, ESI): tR=0,711, [М+Н]+=891,5.
Пример 423: Синтез соединения 525

Стадия 1: К раствору бензил(3-гидроксипропил)карбамата (1,0 г, 4,8 ммоль) в DMSO (5 мл) добавляли Et3N (2,4 г, 24,0 ммоль) и комплекс триоксида серы-пиридина (2,3 г, 14,4 ммоль) при 0°С и смесь перемешивали при той же температуре в течение 1 ч. Смесь затем разбавляли DCM (20 мл), затем промывали 10% раствором CuSO4, насыщенным раствором лимонной кислоты и солевым раствором (30 мл каждого). Органический слой сушили над Na2SO4, концентрировали и остаток очищали на колонке с силикагелем с получением бензил(3-оксопропил)карбамата (200 мг, 20,2% выход) в виде белого твердого вещества.
Стадия 2: К энергично перемешиваемому раствору формальдегида (235 мг, 2,9 ммоль) в толуоле (2,0 мл) последовательно добавляли 0,2 М фосфатный буфер (pH=7, 2,0 мл), (R)-2-(дифенил((триметилсилил)окси)метил)пирролидин (94 мг, 0,29 ммоль) и бензил(3-оксопропил)карбамат (200 мг, 0,97 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 12 ч. Слой толуола отделяли и концентрировали в вакууме (предупреждение: при выпаривании поддерживать температуру водяной бани <40°С). Остатки затем растворяли с t-BuOH (5,0 мл), куда добавляли 2-метил-2-бутен (677 мг, 9,6 ммоль) и раствор NaClO2 (349 мг, 3,9 ммоль) и NaH2PO4 (463 мг, 3,9 ммоль) в Н2О (2 мл). Смесь перемешивали при комнатной температуре в течение 5 ч. Летучие вещества удаляли и остаток растворяли в EtOAc (20 мл), затем промывали 1% HCl и солевым раствором (20 мл каждого). Органический слой сушили над Na2SO4, концентрировали и остаток очищали методом преп-TLC с получением 3-(((бензилокси)карбонил)амино)-2-(гидроксиметил)пропановой кислоты (53 мг, 21,7% выход) в виде светло-желтого масла.
Стадии 3 и 4: Начиная с 3-(((бензилокси)карбонил)амино)-2-(гидроксиметил)пропановой кислоты (153 мг) проводили стандартное введение защитных групп TBS и процедуру сложноэфирного гидролиза (LiOH, THF/H2O) с получением 3-(((бензилокси)карбонил)амино)-2-(((трет-буталдиметилсилил)окси)метил)пропановой кислоты (155 мг) в виде бесцветного масла.
Соединение 525 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (5-95 АВ, ESI): tR=0,755, [М+Н]+=779,5.
Пример 424: Синтез соединения 526-1, соединения 526-2, соединения 526-3

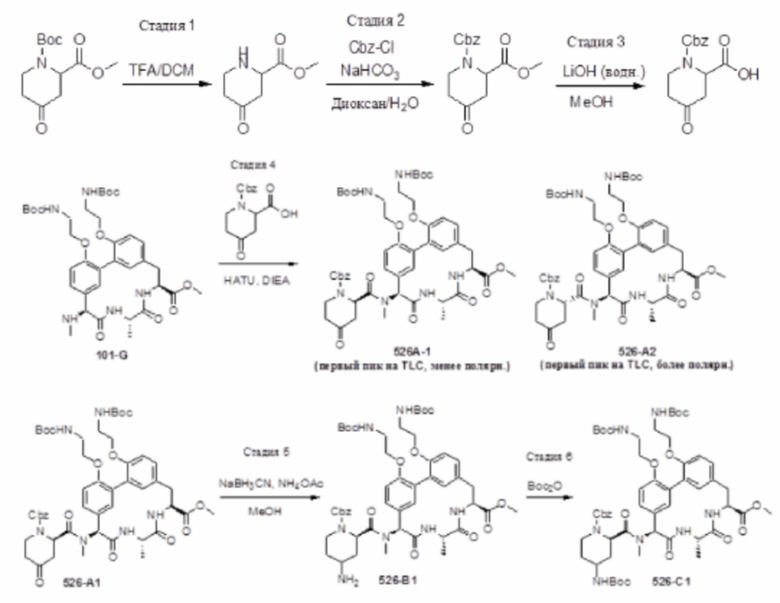
Стадии 1-3: 1-((Бензилокси)карбонил)-4-оксопиперидин-2-карбоновую кислоту получали с применением ранее описанных способов (снятие защитных групп Вос, снятие защитных групп Cbz и сложноэфирный гидролиз) из 1-трет-бутил-2-метил4-оксопиперидин-1,2-дикарбоксилата.
Стадия 4: Обработкой соединения 101-G 1-((бензилокси)карбонил)-4-оксопиперидин-2-карбоновой кислотой при стандартных условиям HATU (пример 5) получали соединение 526-А1 (пик 1) и соединение 526-А2 (пик 2) после хроматографии на силикагеле.
Стадия 5: К раствору соединения 526-А1 (225,0 мг, 0,23 ммоль) и соединения 4А MS (200,0 мг, 0,23 ммоль) в метаноле (4 мл) добавляли ацетат аммония (196,1 мг, 2,54 ммоль) и цианоборгидрид натрия (14,5 мг, 0,23 ммоль) и перемешивали при 25°С в течение 48 ч. Реакционную смесь выпаривали и очищали методом преп-TLC (10% МеОН в DCM, Rf=0,3) с получением соединения 526-В1 (80 мг, 35,5% выход) в виде белого твердого вещества. LCMS (способ 5-95 АВ, ESI): tR=0,850 мин, [М+Na]+=997,0.
Стадия 6: Стандартная защита Boc соединения 526-В1 с получением соединения 527-С1.
Соединение 526-1 (соль муравьиной кислоты) получали с применением ранее описанных способов из соединения 526-С1. LCMS (способ 5-95 АВ, ESI): tR=0,606 мин, [М/2+Н]+=433,7.
Соединение 526-2 (соль муравьиной кислоты) получали с применением ранее описанных способов из соединения 526-С1 и выделяли как второй пик. LCMS (способ 5-95 АВ, ESI): tR=0,622 мин, [М+Н]+=866,6.
Начиная с соединения 526-А2 более полярное промежуточное соединение, соединение 526-3, получали с применением ранее описанных способов. LCMS (способ 5-95 АВ, ESI): tR=0,616 мин, [М+Na]+=889,0.
Пример 425: Синтез соединения 527

Соединение 528 (соль муравьиной кислоты) получали с применением ранее описанных способов. LCMS (способ 5-95АВ): tR=0,754, [М+Н]+=1002,2.
Пример 426: Синтез соединения 528
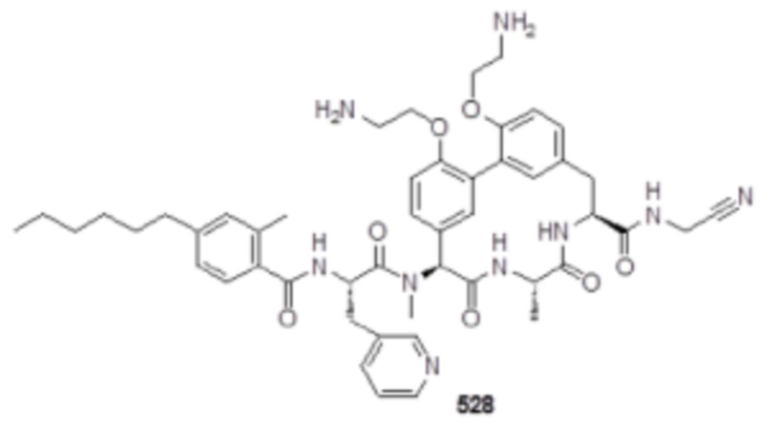
Соединение 529 (соль муравьиной кислоты) получали в виде белого твердого вещества с применением ранее описанных способов. LC-MS: m/z=888 [М+Н]+.
Биологические анализы
Пример 427
Определение минимальной ингибирующей концентрации
Антимикробную активность in vitro каждого соединения определяли при помощи измерения минимальных ингибирующих концентраций (MIC) с применением методики микроразведения в бульоне, одобренной Институтом клинических и лабораторных стандартов (CLSI) (Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically; Approved Standard - Eighth Edition. CLSI document M07-A8. Wayne, PA: Clinical and Laborahoy Standards; 2009). Антимикробную активность измеряли в отношении трех штаммов бактерий: устойчивого к метициллину штамма Staphylococcus aureus USA 300, NRS384 (S. aureus); штамма Escherichia coli MC4100, несущего IMP4213 (E.coli IMP), который приводит к повышенной проницаемости наружной мембраны (В Martin and Silhavy Т. Imp/OstA is required for cell envelope biogenesis in Escherichia coli. (2002) Molecular Microbiology, 45(5), 1289-1302), к Escherichia coli ATCC 25922 (E. coli), клинически значимого грамотрицательного штамма. Клетки вносили на планшеты с триптиказо-соевым агаром или агаром Луриа соответственно и выращивали при 35°С в течение 20 часов. Посевные суспензии получали в результате соскоба клеток в 1 мл исследуемых сред (бульон Мюллера-Хинтона со стандартизированным содержанием катионов с добавлением 0,002% об./об. Твин-80) и разведения до конечного значения OD600nm, составляющего 0,01.
Исследуемые соединения готовили в DMSO при концентрации 10 мг/мл. Соединения исследовали при нескольких различных форматах разведения и данные представляли в таблице 1. В протоколе 1 исходные растворы соединений разводили в исследуемых средах при концентрации 64 мкг/мл и выполняли серийные 2-кратные разведения в тех же самых средах в 96-луночных микротитрационных планшетах с U-образным дном, в общей сложности для 10 концентраций соединений. В протоколе 2 исходные растворы соединений разводили в исследуемых средах при концентрации 4 мкг/мл и выполняли серийные 2-кратные разведения в тех же самых средах в 96-луночных микротитрационных планшетах с U-образным дном, в общей сложности для 10 концентраций соединений. В протоколе 3 исходные растворы соединений разводили в исследуемых средах при концентрации 0,5 мкг/мл, при этом серийные 2-кратные разведения проводили, как описано выше. В протоколе 4 исходные растворы соединений разводили в исследуемых средах при концентрации 0,13 мкг/мл, при этом серийные 2-кратные разведения проводили, как описано выше. Посевные суспензии добавляли к 2-кратным серийным разведениям исследуемых соединений до конечной плотности значения OD OD600nm, составляющего 0,0005 и инкубировали при 35°С в течение 22 часов. После инкубирования планшеты исследовали визуально и минимальную концентрацию исследуемого соединения, которая полностью предупреждала бактериальный рост, отмечали в виде MIC. Результаты представлены в таблице 1.

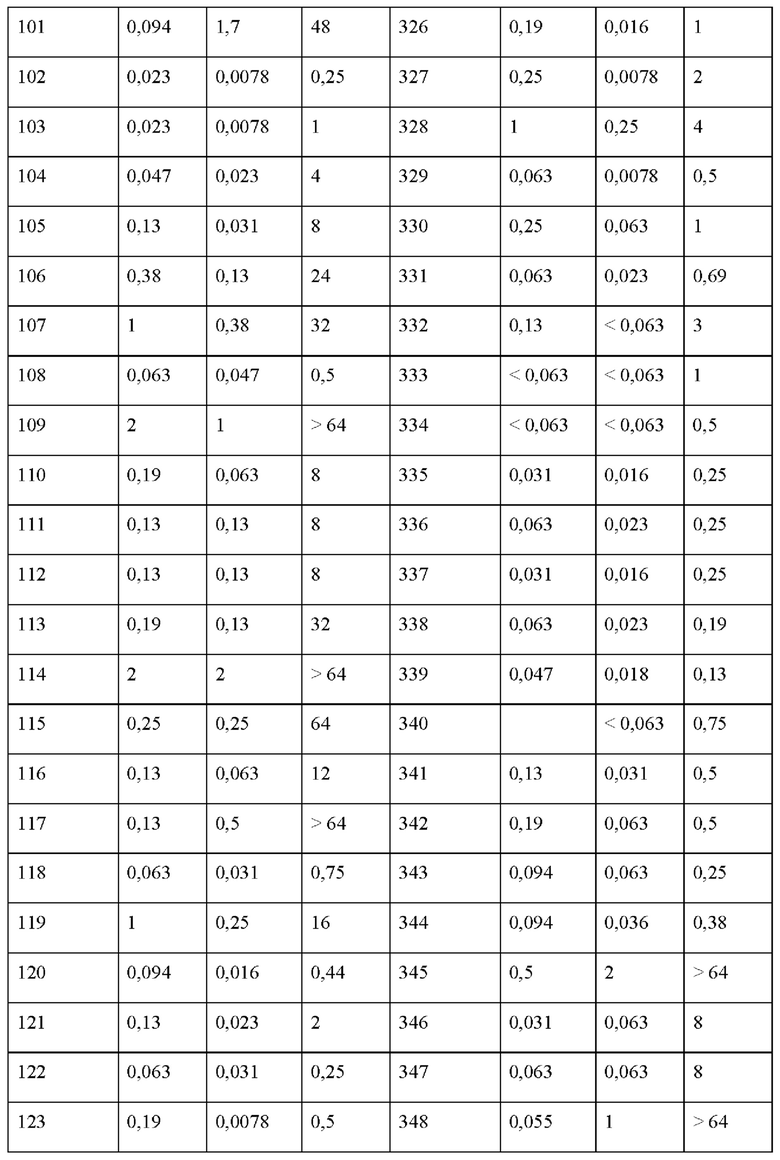
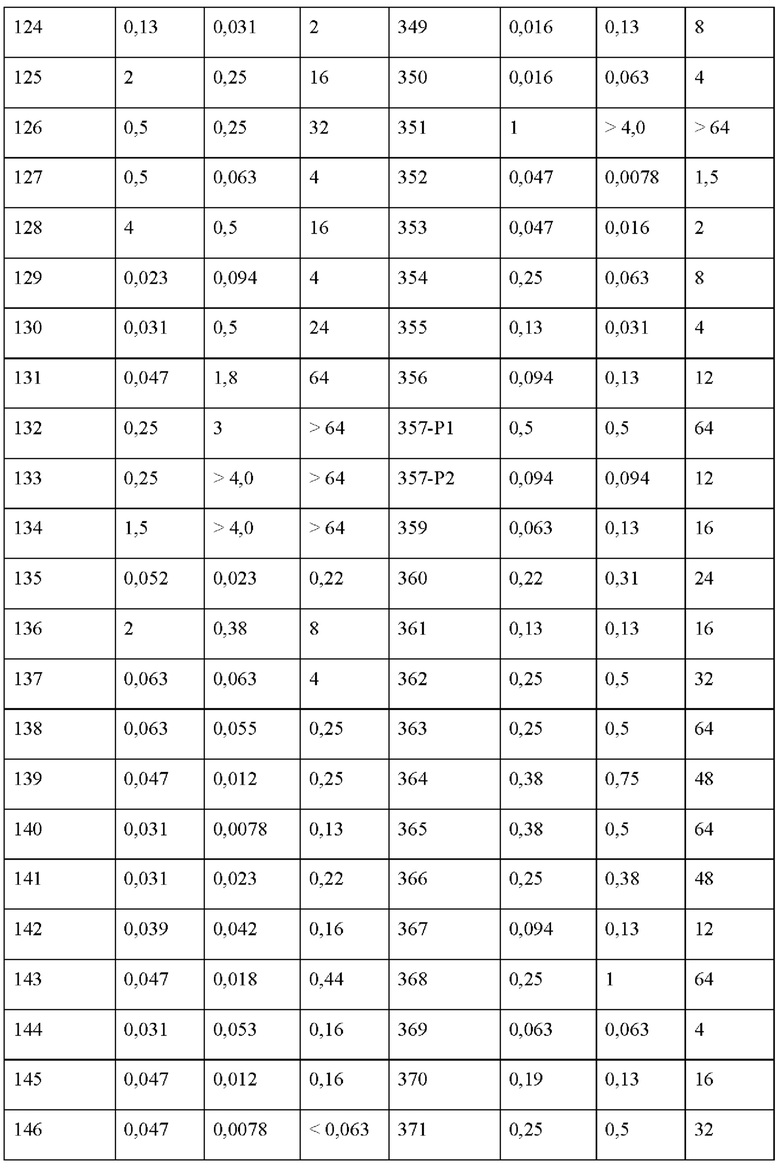


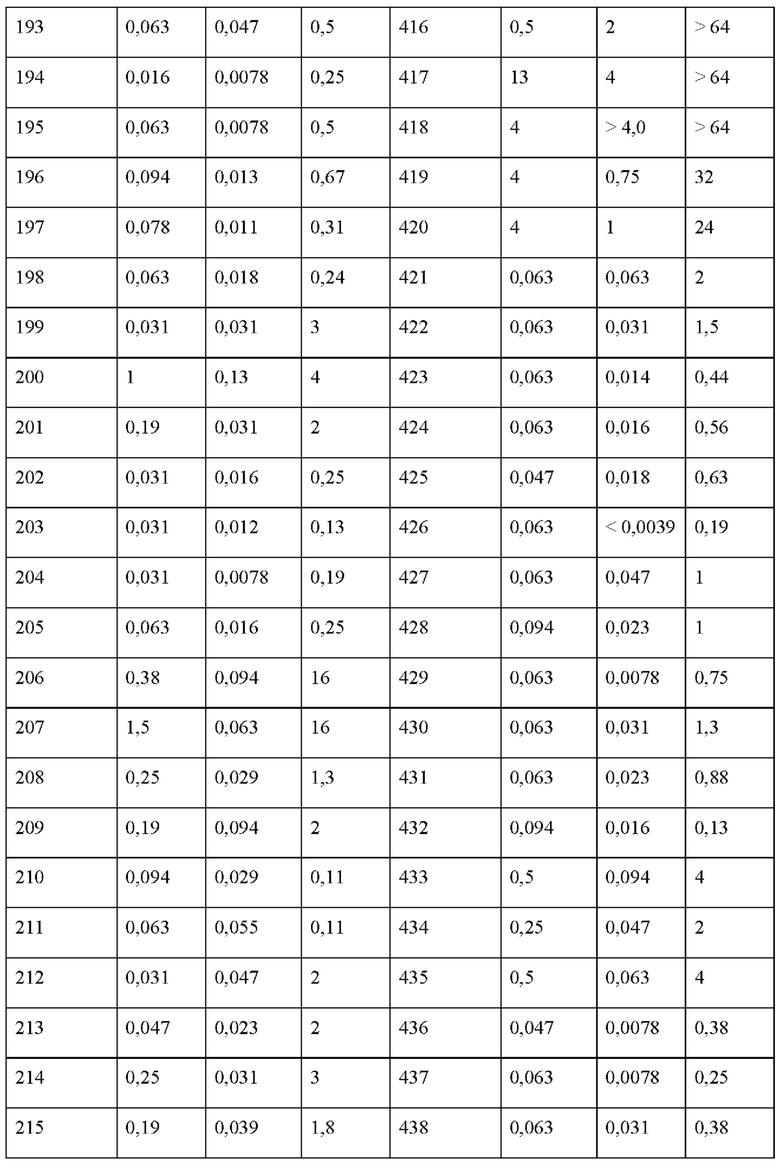




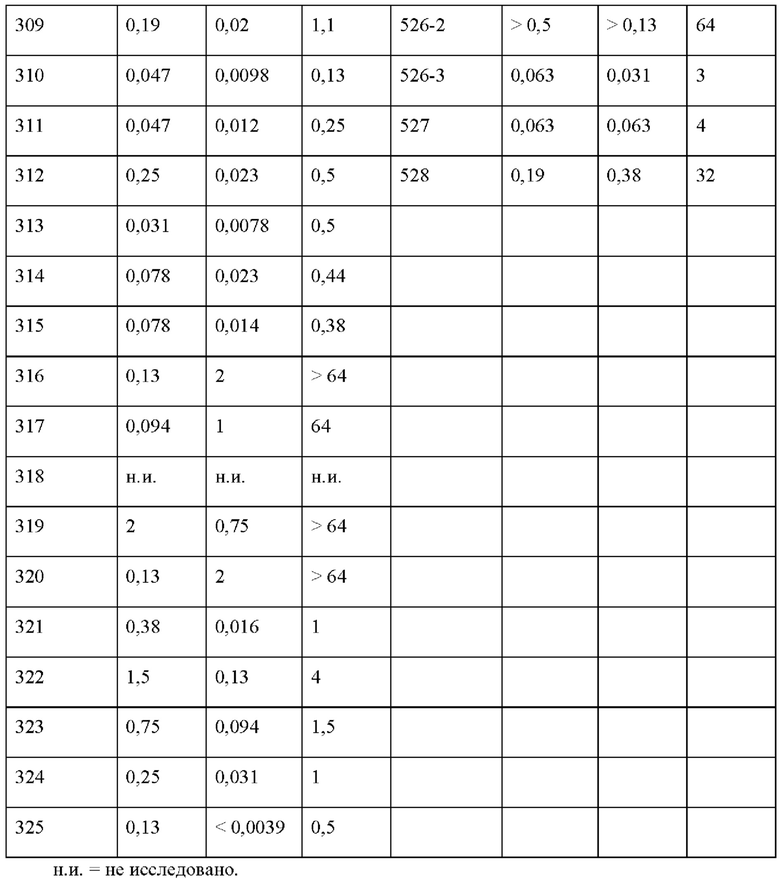
Пример 428
Биохимический скрининговый анализ SpsB в клетке
Кинетический флуорогенный анализ ферментативной активности применяли для определения ингибирования активности SpsB (сигнальной пептидазы Staphylococcus aureus) и определяли IC50. В данном анализе применяли суспензию клеток Staphylococcus aureus в качестве источника SpsB вместо рекомбинантного белка SpsB.
Приготовление клеток
В бульон Луриа (LB) вводили S. aureus (фон USA300, сверхэкспрессирующий SpsB) и встряхивали при 37°С до достижения значения OD600nm, составляющего 1,5-2,0 (~4 часа). Затем культуру разводили до значения OD600nm, составляющего 1,0, при помощи LB, разделяли на аликвоты и центрифугировали при 10000× g в течение 2 минут. Супернатант удаляли и осадок ресуспендировали в фосфатном буфере (1× PBS, 12,5 мг/л MgCl2, 25 мг/л CaCl2, 0,1% Твин-80) до значения OD600nm, составляющего 0,5, затем снова центрифугировали при 10000× g в течение 2 минут. Супернатант удаляли и осадки замораживали при -20°С.
Исследуемые соединения готовили в DMSO при концентрации 10 мг/мл. Эти исходные растворы соединений разводили в DMSO до концентрации 25 мкг/мл и выполняли серийные 3-кратные разведения в DMSO, в общей сложности для 11 концентраций соединений. 20 нл раствора каждого соединения предварительно помещали в 384-луночном планшете белого цвета (50 мкл/планшет полипропилена, Nunc) при помощи акустического перетекания жидкостей (Echo).
Замороженные осадки S. aureus ресуспендировали в аналитическом буфере (1× PBS, 12,5 мг/л MgCl2, 25 мг/л CaCl2, 0,1% Твин-80) до значения OD600nm, составляющего 0,05, затем смешивали 1:1 (об./об.) с 20 мкМ субстрата ((Dabcyl)βAla-KPAKAAE(Edans)) в аналитическом буфере и этот раствор добавляли (20 мкл/лунку) к 384-луночному планшету, в который предварительно помещали соединение. После этого незамедлительно кинетически считывали значение интенсивности флуоресценции в течение 30 минут с интервалами считывания, равными 2 минуты, для контроля расщепления пептидного субстрата с внутренним тушением флуоресценции (длина волны возбуждения = 340 нм, длина волны испускания = 490 нм, Molecular Devices Spectramax М5). Время реакции (угол наклона) откладывали на графике в зависимости от концентрации ингибиторов с получением IC50. Результаты представлены в таблице 2.
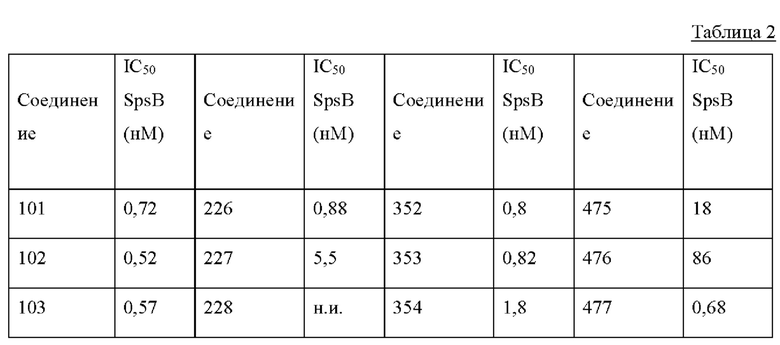



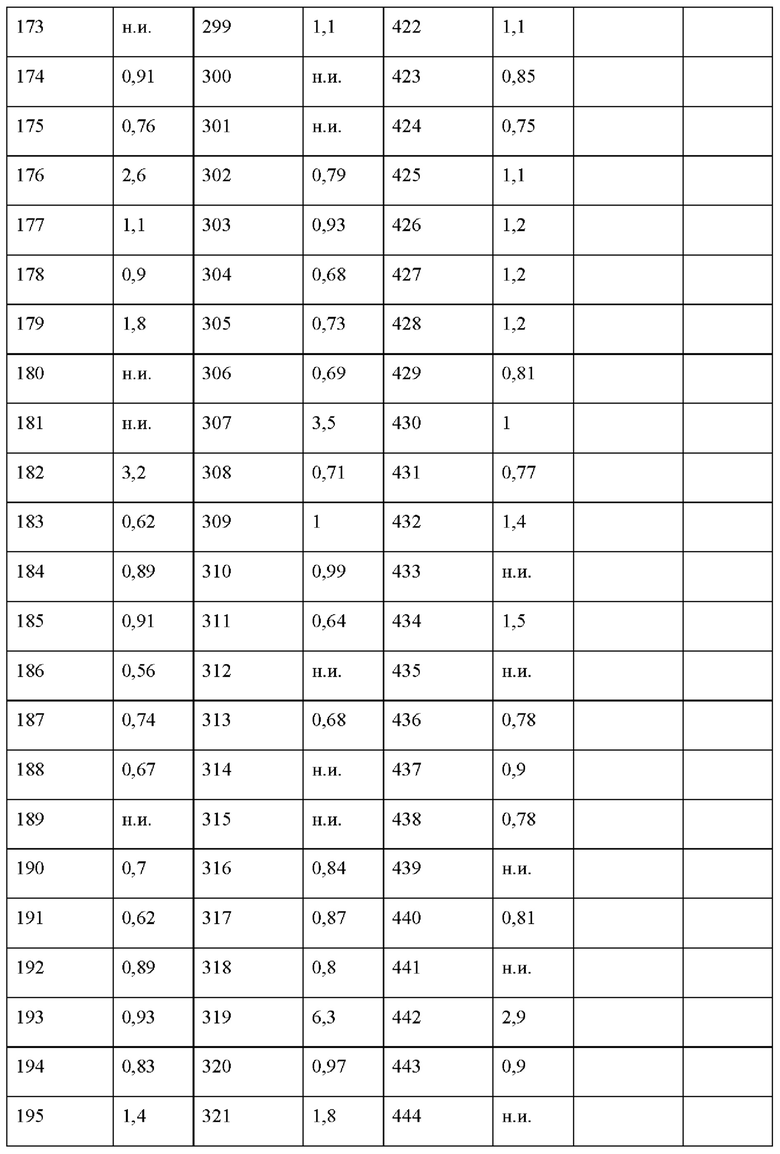
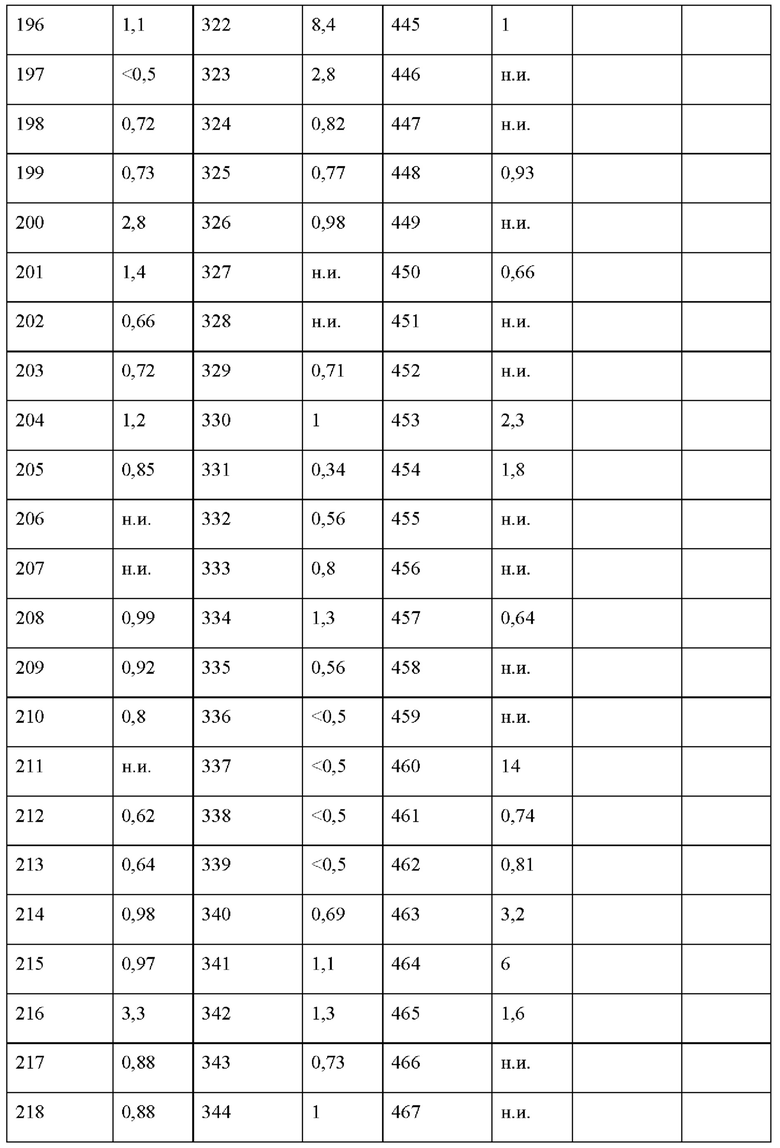

Пример 429
Активность в модели инфекции бедра с нейтропенией
Способность соединения ингибировать инфекцию бактериального патогена можно было измерить с применением модели инфекции бедра у мышей с нейтропенией. Снижение бактериальной нагрузки представляло собой показатель антибактериальной активности in vivo.
Мышей CD-1 с канюлированной яремной веной подвергали индуцированной нейтропении (<100 клеток/мм3) в результате инъецирования 150 мг/кг и 100 мг/кг циклофосфамида на -5-й день и -2-й день соответственно. На -1-й день солевой раствор инфузировали при 20 мкл/ч в течение 12 часов при помощи инфузионных насосов Harvard Apparatus PHD 2000. На 0-й день мышей инфицировали в мышцу бедра 1×105 CFU/50 мкл штамма Escherichia coli АТСС 25922. Присутствовали четыре исследуемые группы и одна группа носителя, в которых введение начали через 1 час после инфицирования:
группа 1 - контроль с носителем (3% НР-бета-циклодекстрин в PBS);
группа 2 соединение группы 135, вводимое при концентрации раствора 0,62 мг/мл, инфузированного при 80 мкл/ч в течение 23 часов, при этом целевая концентрация в устойчивом состоянии (Css) составляла 13 мкг/мл;
группа 3 - соединение группы 135, вводимое при концентрации раствора 0,21 мг/мл, инфузированного при 80 мкл/ч в течение 23 часов, с достижением концентрации в устойчивом состоянии (Css) 3,4 мкг/мл;
группа 4 - соединение группы 135, вводимое при концентрации раствора 0,07 мг/мл (Css, 1,2 мкг/мл), инфузированного при 80 мкл/ч в течение 23 часов;
группа 5 соединение группы 135, вводимое при концентрации раствора 0,02 мг/мл (Css, 0,31 мкг/мл), инфузированного при 80 мкл/ч в течение 23 часов.
Через 24 часа после инфицирования бактериальную нагрузку в мышце бедра определяли при помощи помещения гомогената ткани в серийных разведениях на планшеты с кровяным агаром. Как обозначено на фигуре 1, соединение 135 характеризовалось дозозависимым снижением бактериальной нагрузки, указывая на его активность in vivo.
Пример 430
Клиническое испытание безопасности и эффективности соединений формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) у пациентов с С. Difficile-ассоциированной диареей
Цель: Целью данного исследования было определение безопасности и эффективности соединений, представляемых в настоящем документе, для лечения симптомов С. difficile-ассоциированной диареи и снижения риска повторных эпизодов диареи. Соединения оценивали в сравнении с текущей стандартной антибиотикотерапией. в связи с этим все пациенты получали активный лекарственный препарат. Было предусмотрено все связанное с исследованием лечение, в том числе визиты врача, физические осмотры, лабораторные исследования и применение исследуемого препарата. Общая продолжительность участия составляла примерно 10 недель.
Пациенты
Подходящие для участия в исследовании субъекты представляли собой мужчин и женщин в возрасте 18 лет и старше.
Критерии
Критерии включения:
возраст составлял по меньшей мере 18 лет;
наличие активной слабой или умеренной С. difficile-ассоциированной диареи (CDAD);
способность переносить препарат для перорального введения;
отсутствие беременности или грудного вскармливания; и
подписание и датирование формы информированного согласия.
План исследования
Рандомизированное двойное слепое соединение с применением активного контроля по оценке эффективности, безопасности и переносимости соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) у пациентов с С. difficile-ассоциированной диареей.
Пример 431
Клиническое испытание по сравнению соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) с ванкомпцином для лечения MRSA остеомиелита
Цель
Данное исследование было направлено на определение эффективности соединений, представляемых в настоящем документе, по сравнению с ванкомицином, для лечения остеомиелита, вызываемого устойчивым к метициллину Staphylococcus aureus (MRSA).
Пациенты
Подходящие для участия в исследовании субъекты представляли собой мужчин и женщин в возрасте 18 лет и старше.
Критерии
Критерии включения:
подтвержденный культивированием MRSA, полученный в операционной, или процедура биопсии в стерильных условиях из области кости; область инфицирования и взятие образца находились либо в кости, либо в области глубоких мягких тканей, которая расположена рядом с костью; ИЛИ рентгенографическое нарушение, соответствующее остеомиелиту, в сочетании с положительным результатом посева крови на MRSA;
хирургическая обработка очага инфекции, при необходимости;
способность субъекта предоставить письменное информированное согласие; и
способность субъекта получать парентеральную терапию в амбулаторных условиях в течение 12 недель.
Критерии исключения:
повышенная чувствительность к соединению формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или ванкомицину;
наличие S. aureus, устойчивого к соединению формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) или ванкомицину;
остеомиелит, который развивается непосредственно на фоне хронической открытой раны;
полимикробный результат культивирования (единственное исключение присутствие в культуре коагулазонегативного стафилококка, который согласно клинической оценке являлся контаминантом);
наличие у субъекта положительного теста на беременность во время включения в исследование;
исходная почечная или печеночная недостаточность, которая исключила бы введение исследуемых лекарственных средств;
активное применение инъекционных лекарственных средств без соблюдения условий безопасности с введением внутривенных антибиотиков в течение 3 месяцев; и
предполагаемое применение антибиотиков в течение более 14 дней по поводу инфекции помимо остеомиелита.
План исследования
Рандомизированное открытое испытание с активным контролем по оценке эффективности по сравнению ванкомицина с соединением формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) для лечения MRSA остеомиелита.
Пример 432
Клиническое испытание по оценке соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) при некоторых серьезных инфекциях, вызываемых устойчивым к ванкомицину стрептококком (VRE)
Цель
Данное клиническое исследование было направлено на оценку безопасности и эффективности соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) при лечении некоторых серьезных инфекций, вызываемых VRE.
Пациенты
Подходящие для участия в исследовании субъекты представляли собой мужчин и женщин в возрасте 18 лет и старше.
Критерии
Критерии включения:
выделение одной из следующих бактерий с множественной устойчивостью к антибиотикам: устойчивого к ванкомицину Enterococcus faecium, устойчивого к ванкомицину Enterococcus faecalis в отдельности или в виде части полимикробной инфекции; и
наличие подтвержденного диагноза серьезной инфекции (например, бактеремии [за исключением исключенной инфекции], осложненной внутрибрюшинной инфекции, осложненной инфекции кожи и кожных структур, или пневмонии), требующей назначения внутривенной (IV) антибиотикотерапии.
Критерии исключения:
субъекты с любым сопутствующим состоянием или принимающие любой сопутствующий лекарственный препарат, который, по мнению исследователя, мог бы исключить оценку ответа или сделать маловероятным то, что предусмотренный курс терапии или последующей оценки был бы завершен, или значительно повысить риск, ассоциированный с участием субъекта в данном исследовании;
предполагаемая продолжительность антибиотикотерапии составляла менее 7 дней.
План исследования
Рандомизированное двойное слепое исследование по оценке безопасности и эффективности соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) при лечении некоторых серьезных инфекций, вызываемых VRE.
Фармацевтические композиции
Парентеральная композиция
Для получения парентеральной фармацевтической композиции, подходящей для введения инъекционным путем, 100 мг соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) растворяли в DMSO, а затем смешивали с 10 мл 0,9% стерильного солевого раствора. Смесь включали в единичную лекарственную форму, подходящую для введения инъекционным путем.
Согласно другому варианту осуществления следующие ингредиенты смешивали с образованием инъекционного состава:

Все вышеуказанные ингредиенты, за исключением воды, объединяли и перемешивали и при необходимости, при легком нагревании. Затем добавляли достаточное количество воды.
Пероральная композиция
Для получения фармацевтической композиции для пероральной доставки 100 мг соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) смешивали с 750 мг крахмала. Смесь включали в пероральную лекарственную форму, такую как твердая желатиновая капсула, которая подходит для перорального введения.
Согласно другому варианту осуществления следующие ингредиенты тщательно смешивали и сжимали в отдельные таблетки с насечками.

Согласно еще одному варианту осуществления следующие ингредиенты тщательно смешивали и заполняли в желатиновую капсулу с твердой оболочкой.

Согласно еще одному варианту осуществления следующие ингредиенты смешивали с образованием раствора/суспензии для перорального введения:

Гелевая композиция для местного нанесения
Для получения фармацевтической гелевой композиции для местного нанесения 100 мг соединения формулы (I), (I'), (Ia), (Ib), (Ic), (Id), (II), (II'), (IIa), (IIb), (IIc), (IId) или (IIe) смешивали с 1,75 г гидроксипропилцеллюлозы, 10 мл пропиленгликоля, 10 мл изопропилмиристата и 100 мл очищенного спирта USP. Полученную гелевую смесь затем наполняли в контейнеры, таки как тюбики, которые подходят для местного нанесения.
Несмотря на то, что предпочтительные варианты осуществления настоящего раскрытия были показаны и описаны в настоящей заявке, для специалистов настоящей области техники было очевидно, что такие варианты осуществления представлены только в качестве примера. Специалистам настоящей области техники будут встречаться многие варианты, изменения и замещения без отклонения от настоящего изобретения. Следует понимать, что различные альтернативы описанных вариантов осуществления могут быть использованы в практическом осуществлении настоящего изобретения. Предусмотрено, что следующая формула изобретения определяет объем настоящего изобретения и что способы и структуры в пределах объема настоящей формулы изобретения и их эквиваленты также в ней охвачены.
| название | год | авторы | номер документа |
|---|---|---|---|
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА | 2018 |
|
RU2779477C2 |
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ | 2016 |
|
RU2761476C2 |
| БИЦИКЛИЧЕСКИЕ АГОНИСТЫ СТИМУЛЯТОРА ГЕНОВ ИНТЕРФЕРОНА STING | 2020 |
|
RU2800072C1 |
| НОВЫЕ АКТИВАТОРЫ РАСТВОРИМОЙ ГУАНИЛАТЦИКЛАЗЫ И ИНГИБИТОРЫ ФОСФОДИЭСТЕРАЗЫ С ДВОЙНЫМ МЕХАНИЗМОМ ДЕЙСТВИЯ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2758373C2 |
| ЛИГАНДЫ ЦЕРЕБЛОНА И БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ | 2018 |
|
RU2795146C2 |
| ИНГИБИТОРЫ CDK | 2011 |
|
RU2621674C2 |
| ИНГИБИТОРЫ MAGL НА ОСНОВЕ ПИРАЗОЛА | 2018 |
|
RU2789157C2 |
| АНАЛОГИ СОЕДИНЕНИЙ 4Н-ПИРАЗОЛО[1,5-А]БЕНЗИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ PARP | 2015 |
|
RU2672722C2 |
| ИНГИБИТОРЫ MEK И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2812929C1 |
| СОЕДИНЕНИЯ, МОДУЛИРУЮЩИЕ ЭСТРОГЕНОВЫЕ РЕЦЕПТОРЫ | 2019 |
|
RU2826635C2 |

Изобретение относится к соединениям, выбранным из группы, состоящей из соединений 101, 102, 103, 104 и т.д., которые относятся к макроциклическим антибиотикам широкого спектра действия и могут найти применение для лечения различных бактериальных инфекций. Изобретение относится также к фармацевтической композиции и способу лечения бактериальной инфекции с использованием указанных соединений. 3 н. и 1 з.п. ф-лы, 1 ил., 2 табл., 432 пр.



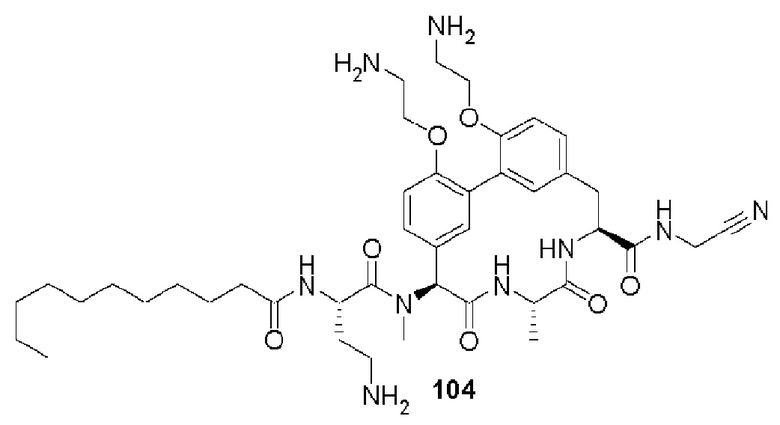
1. Соединение, выбранное из группы, состоящей из
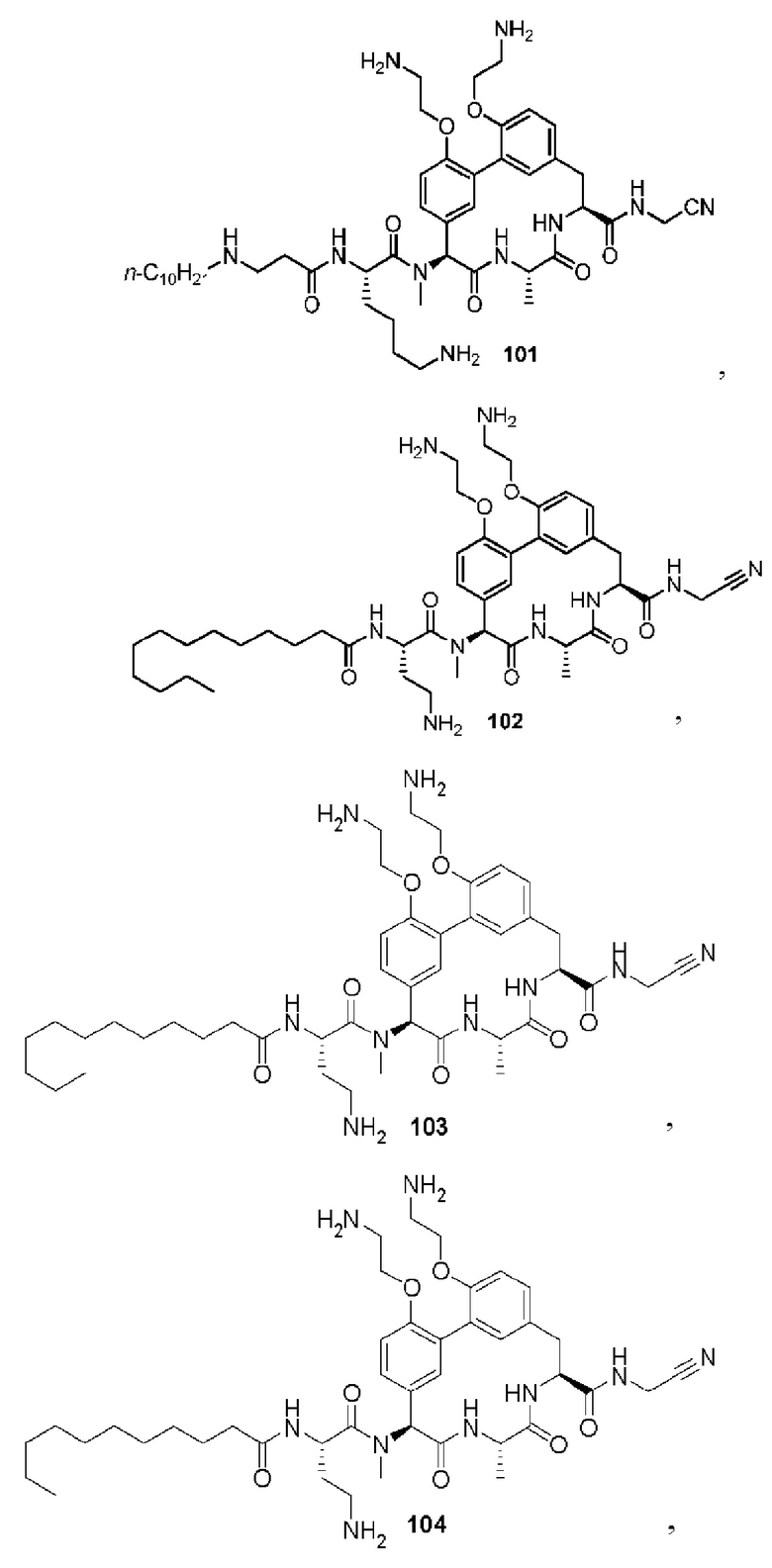
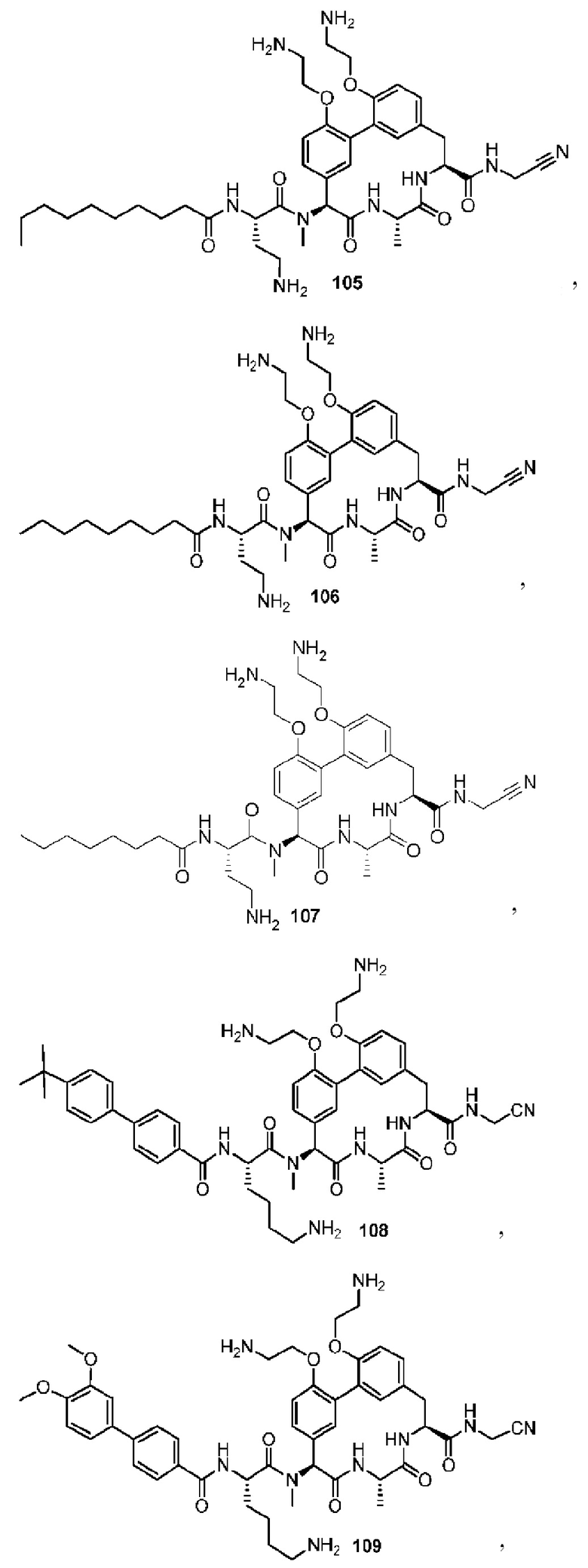

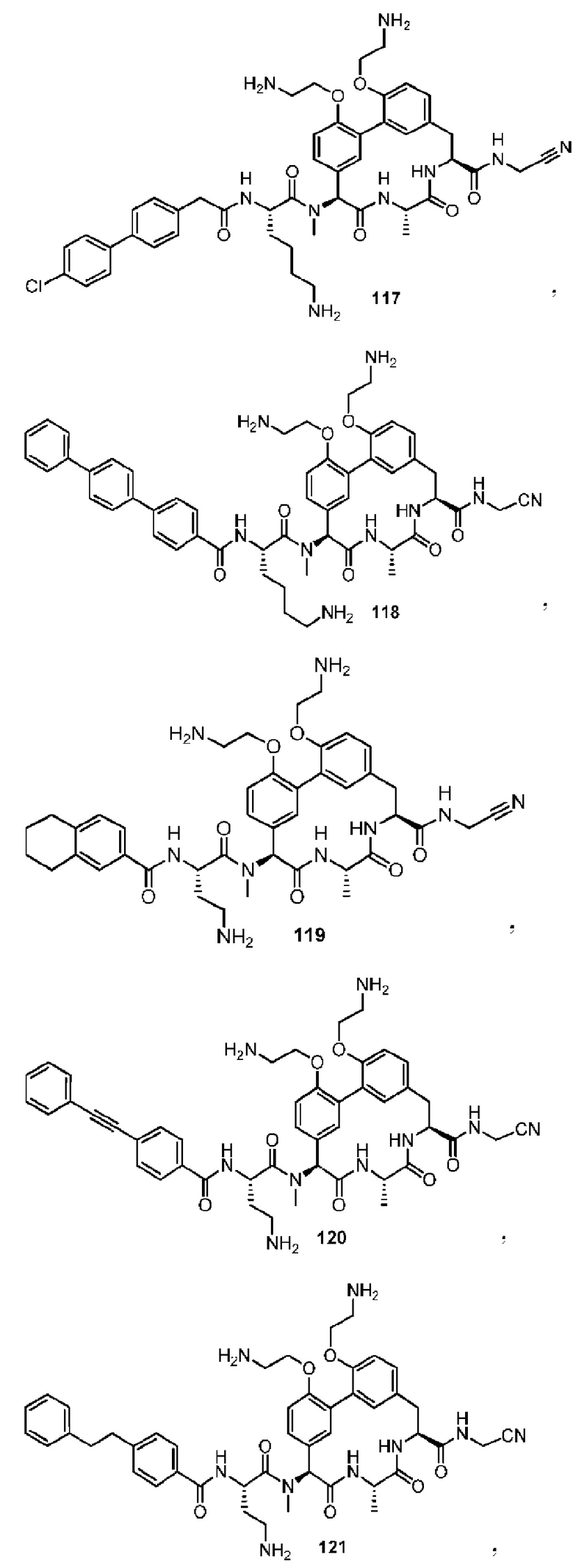
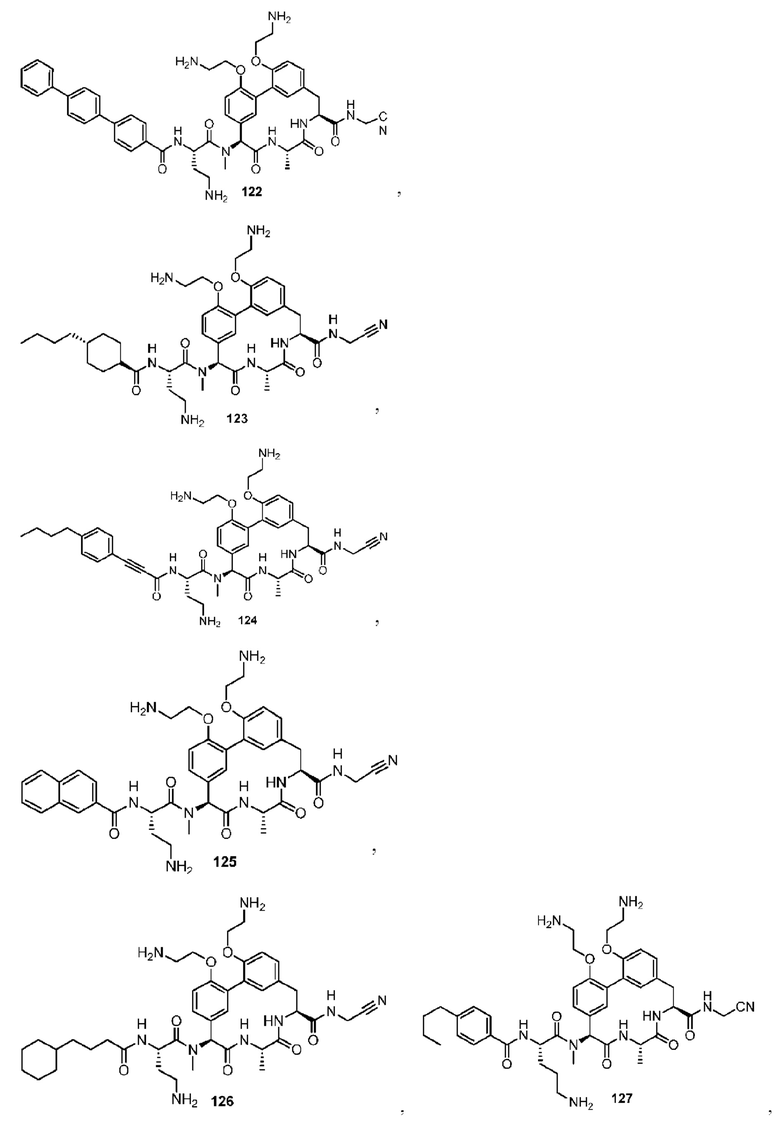

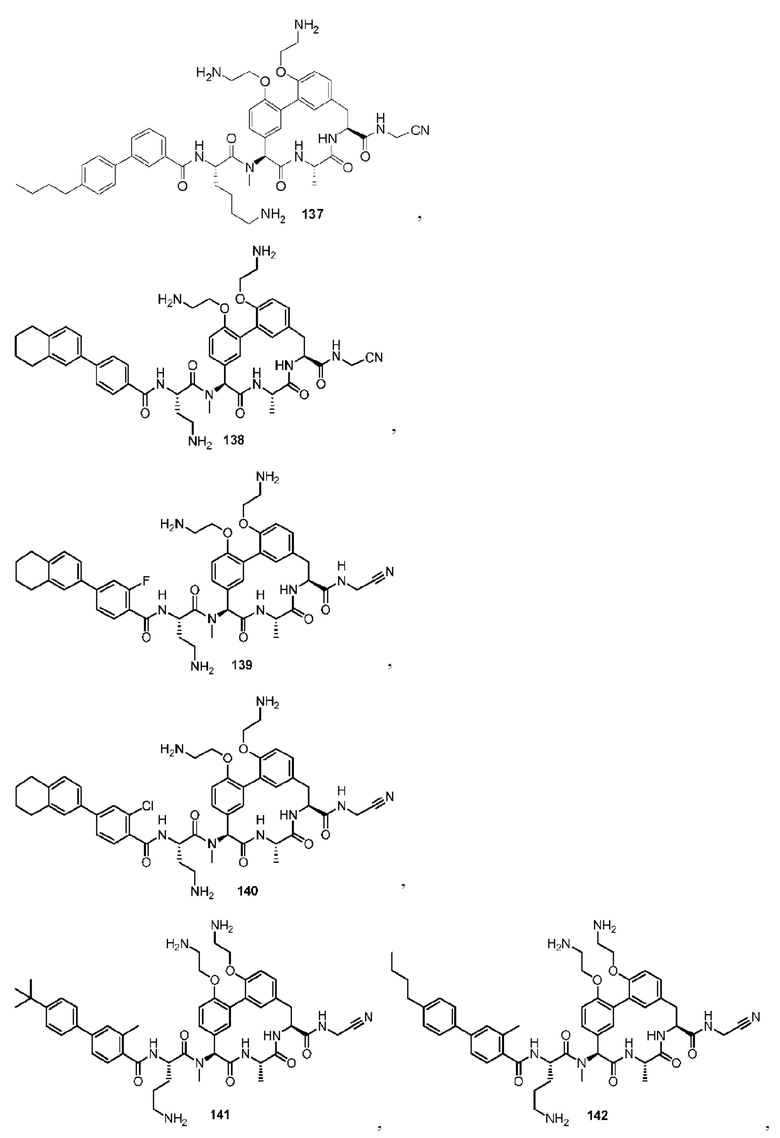
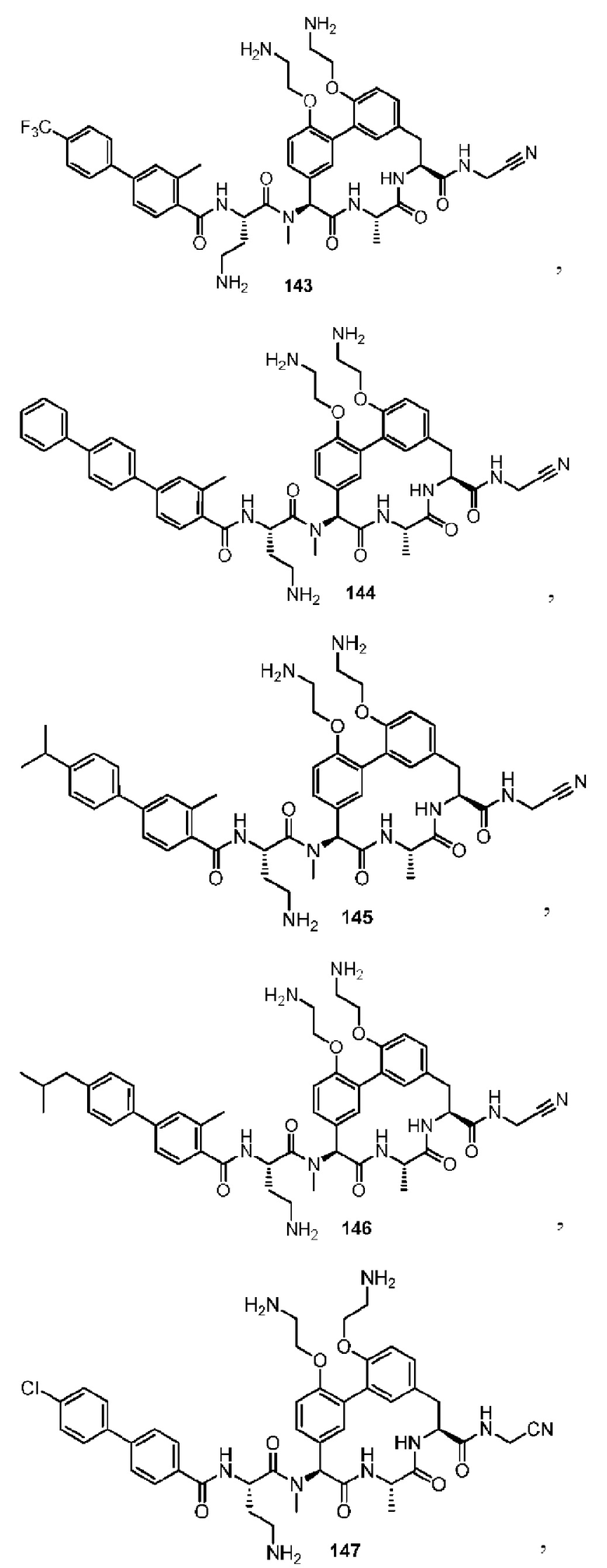
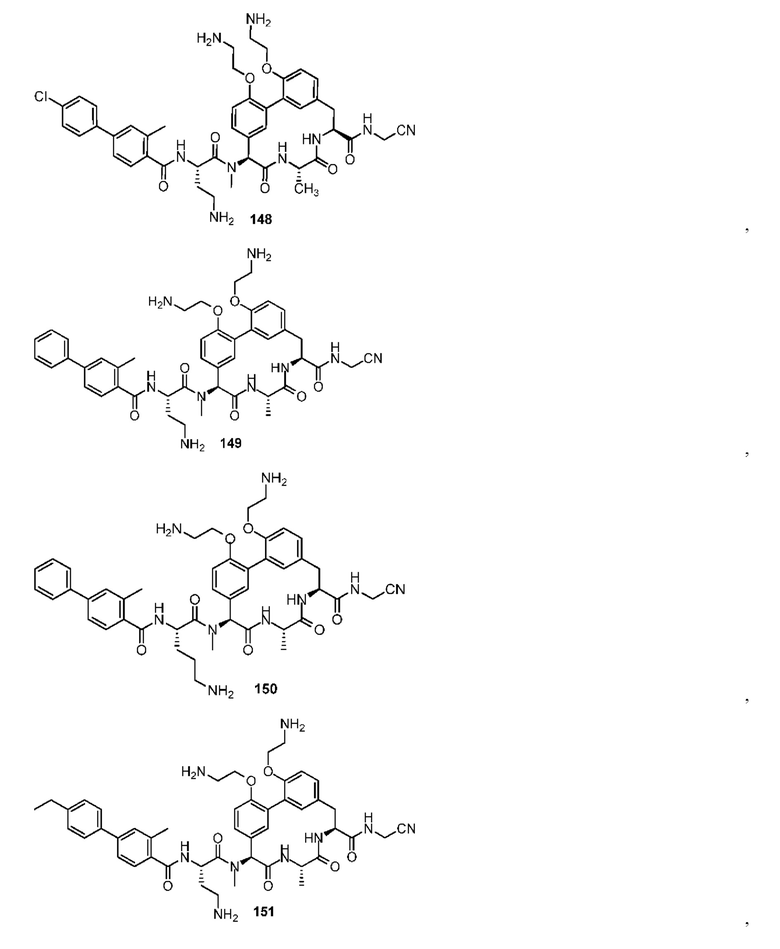

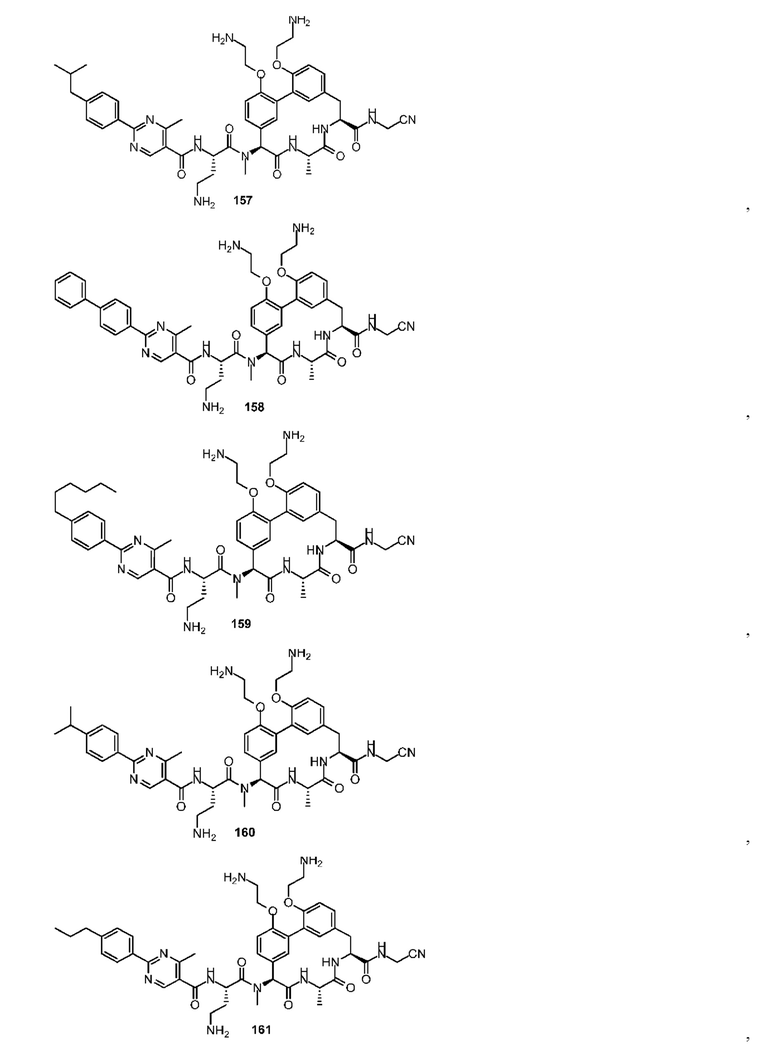

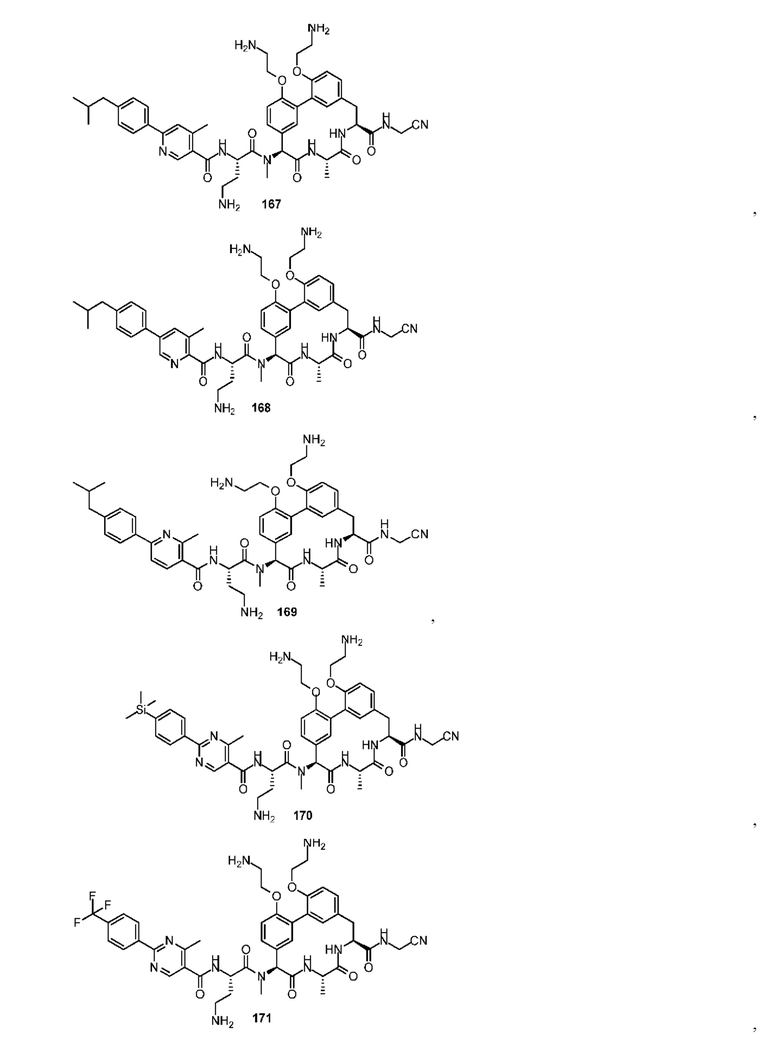


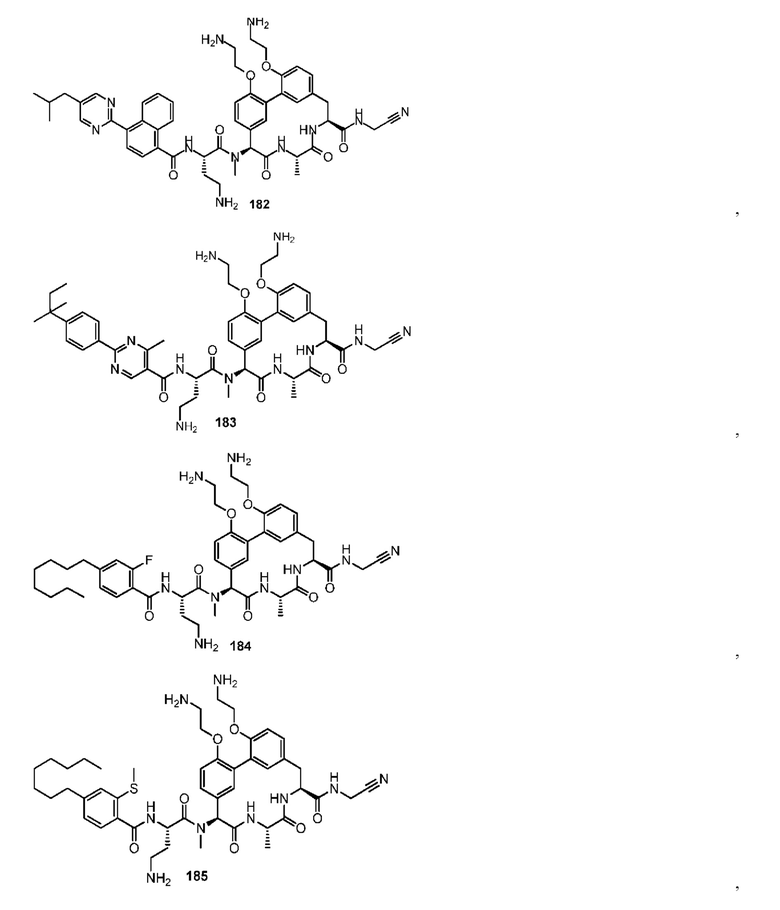




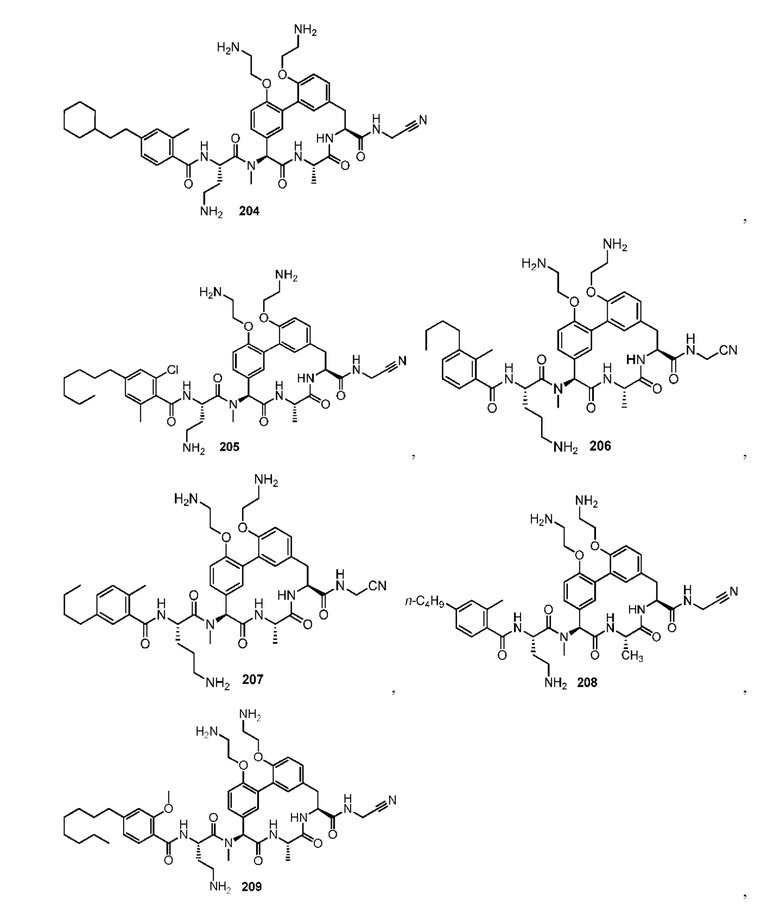



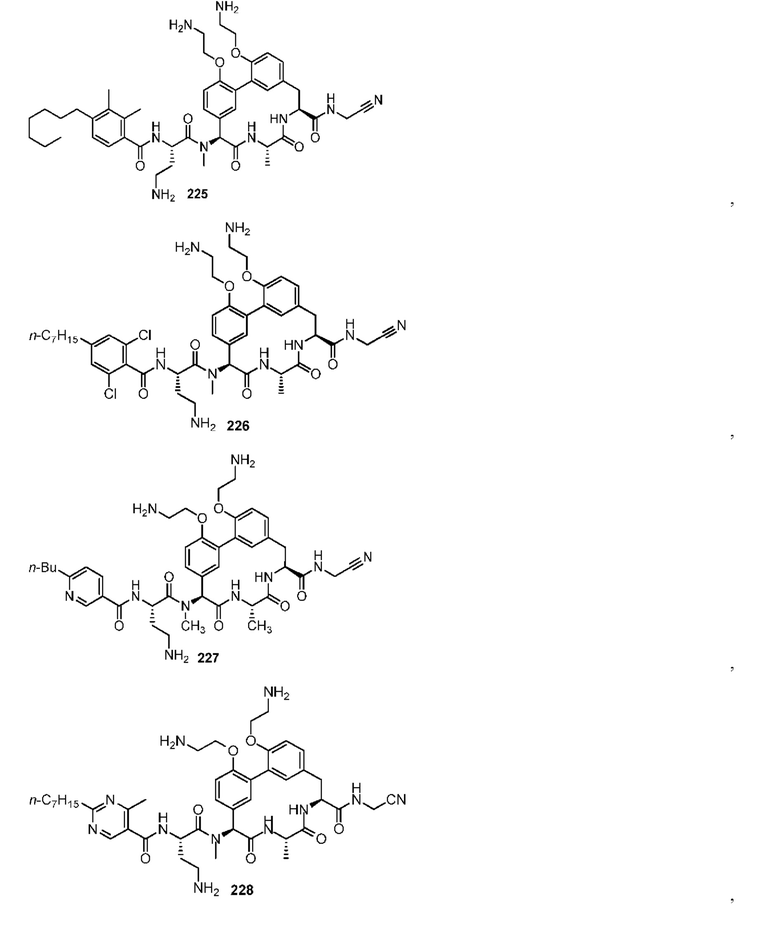





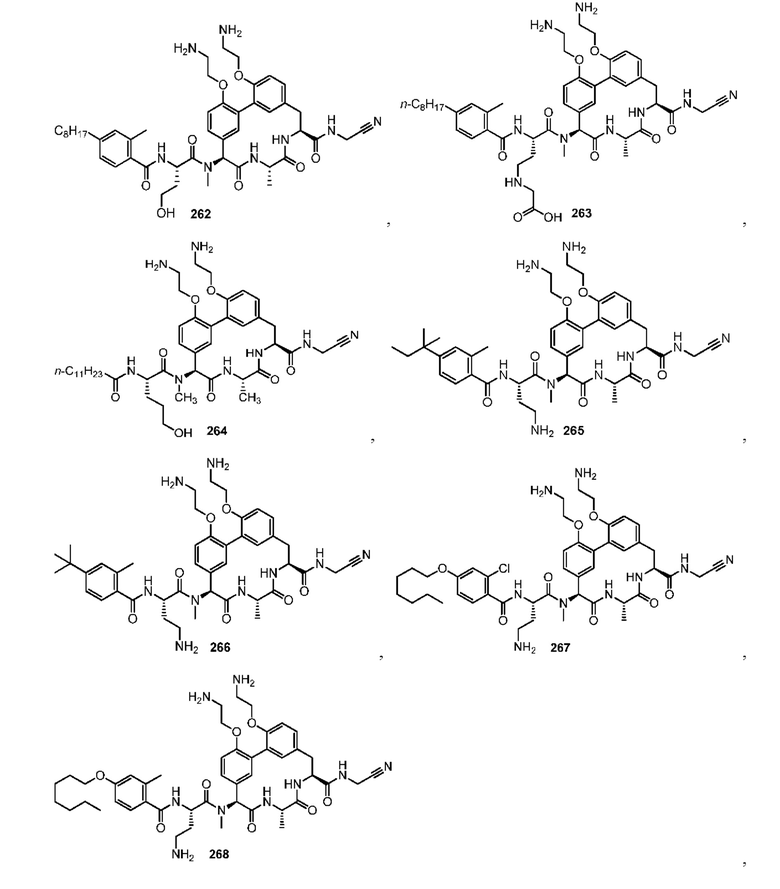



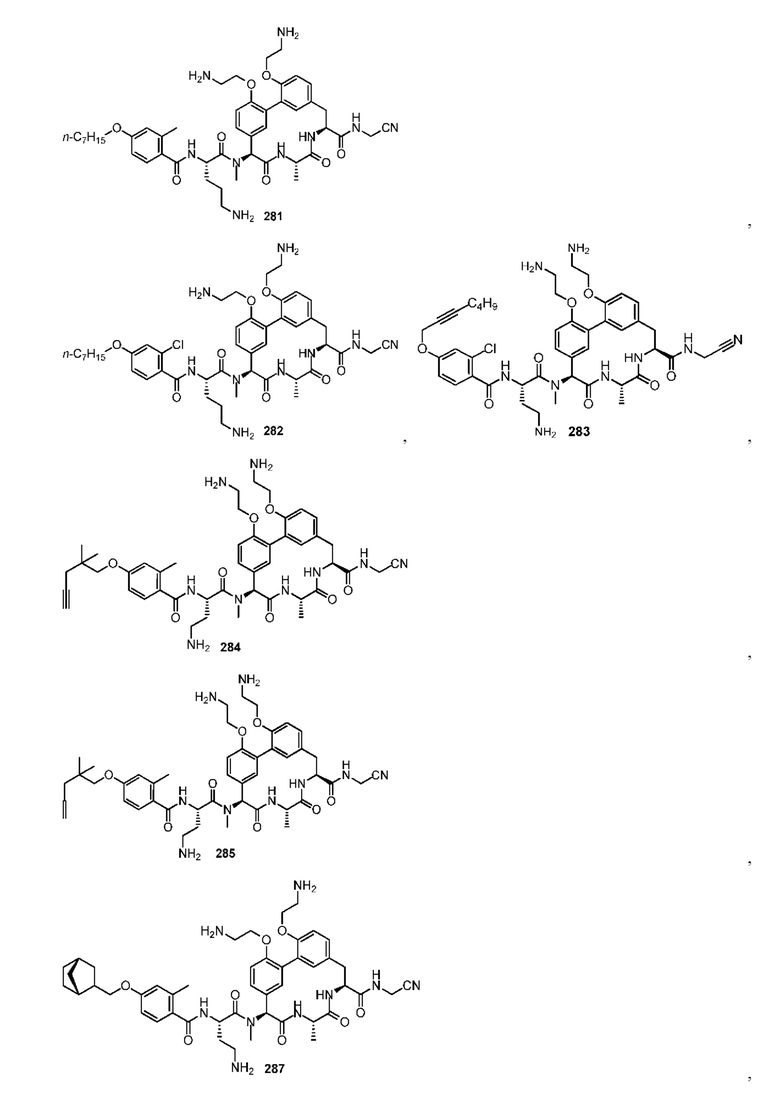

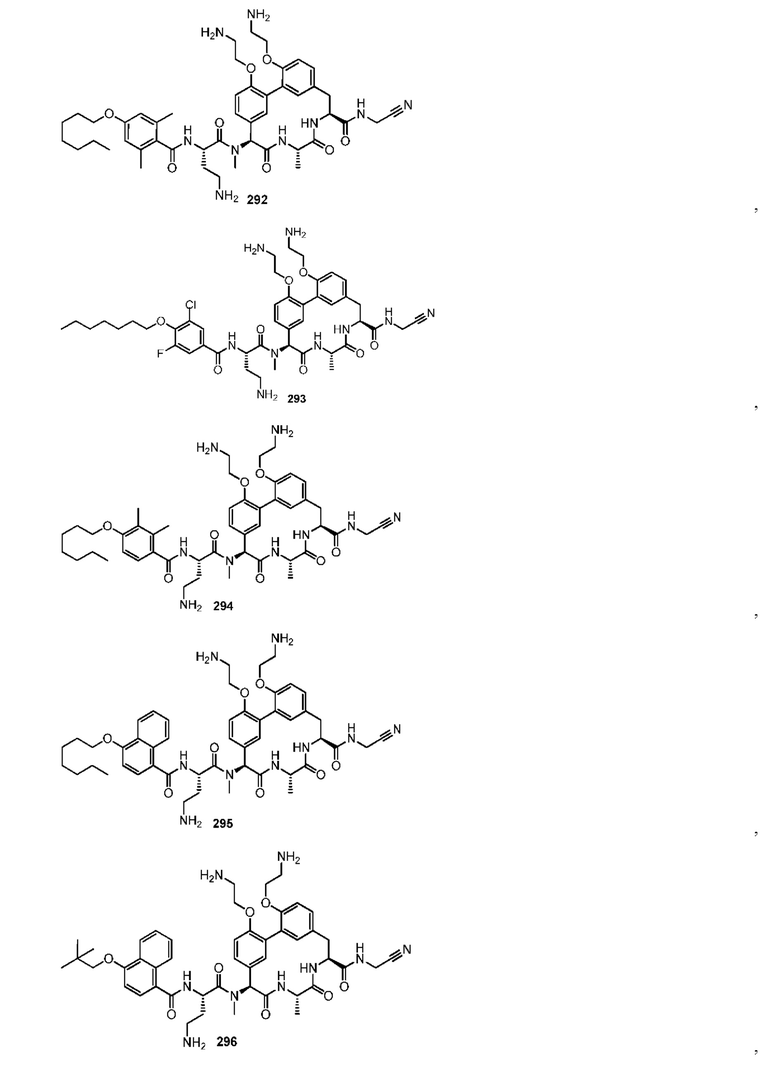
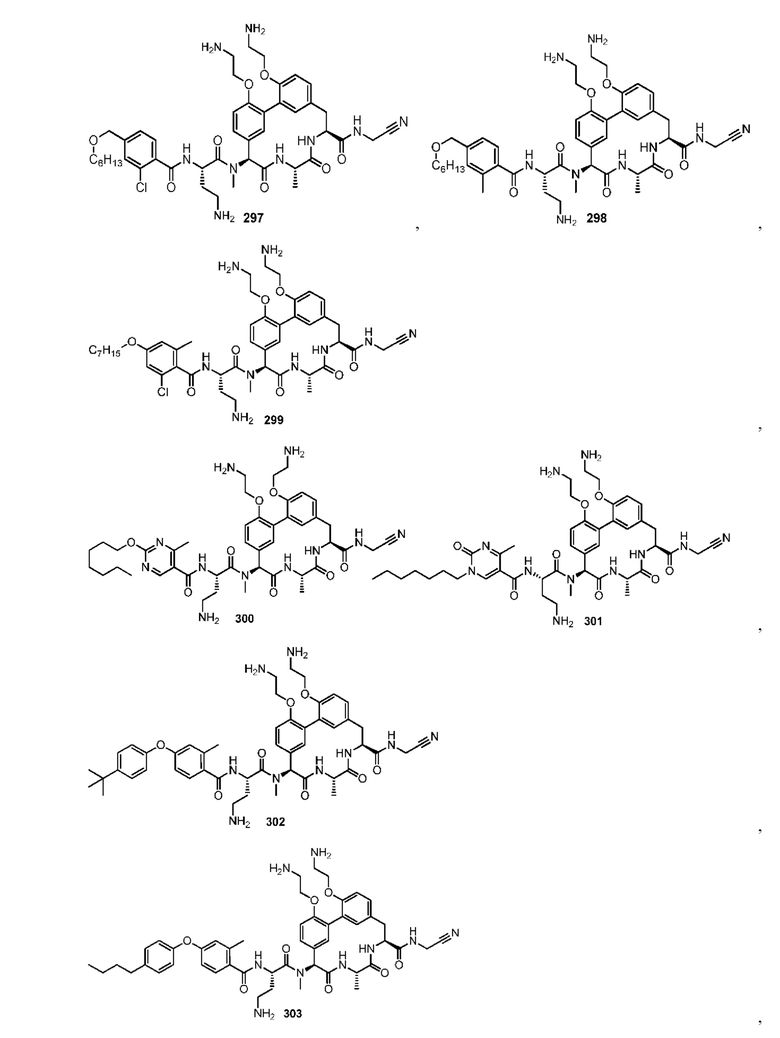
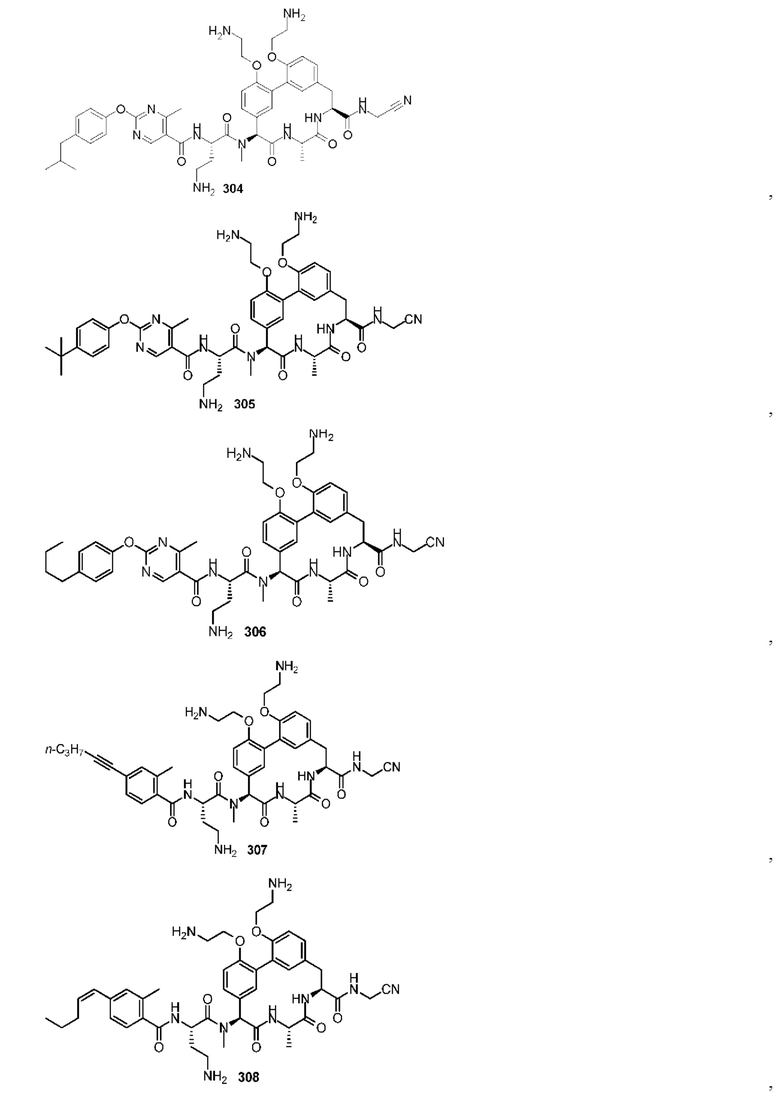




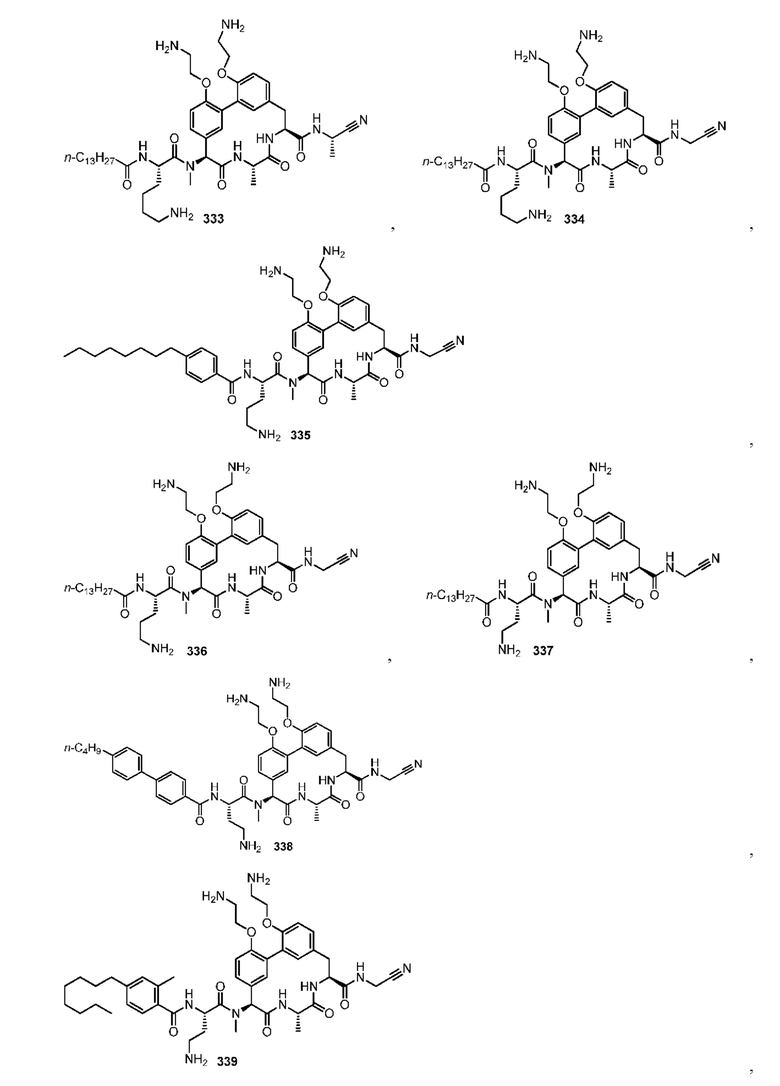
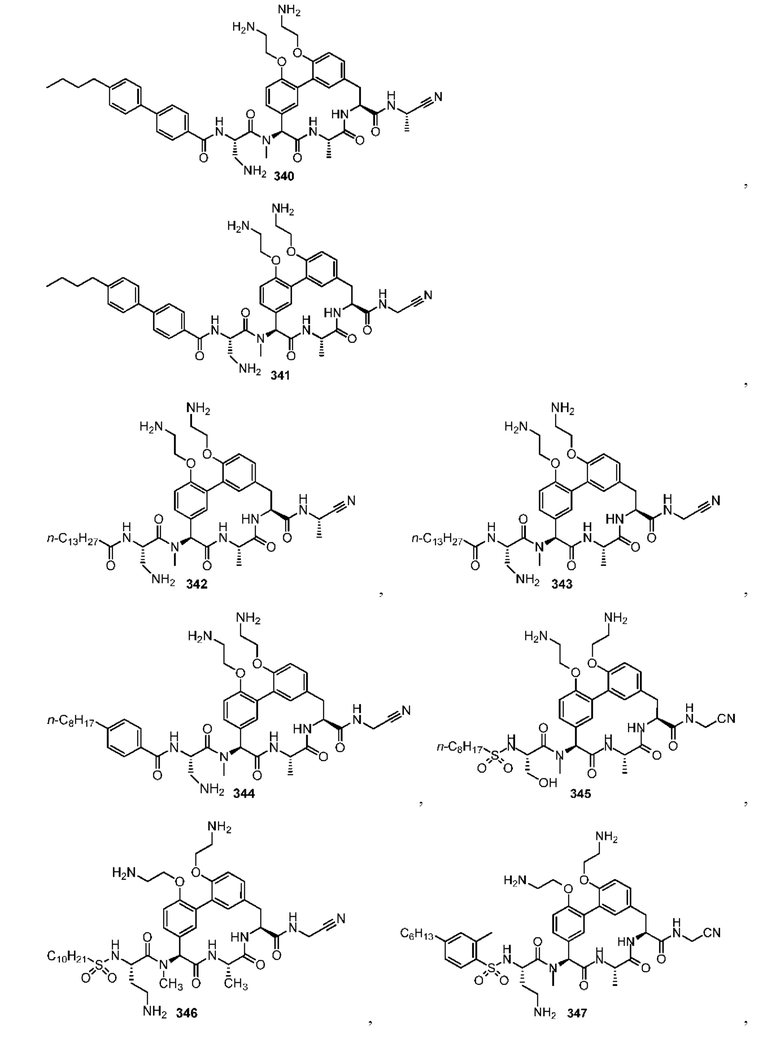
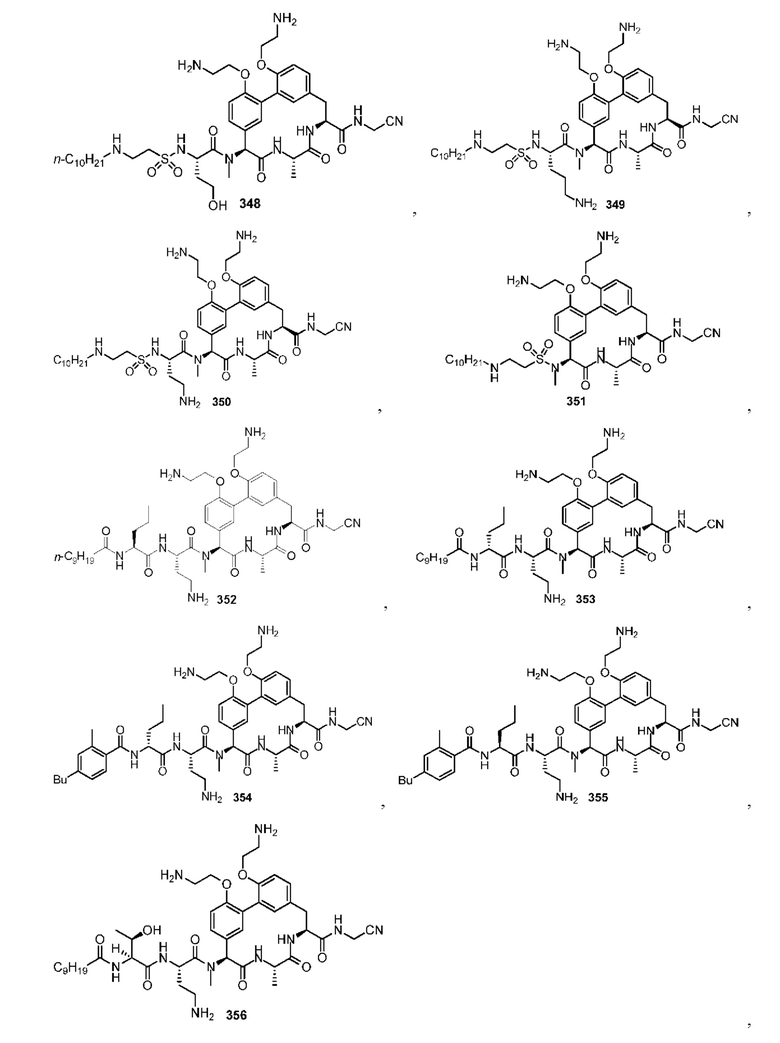
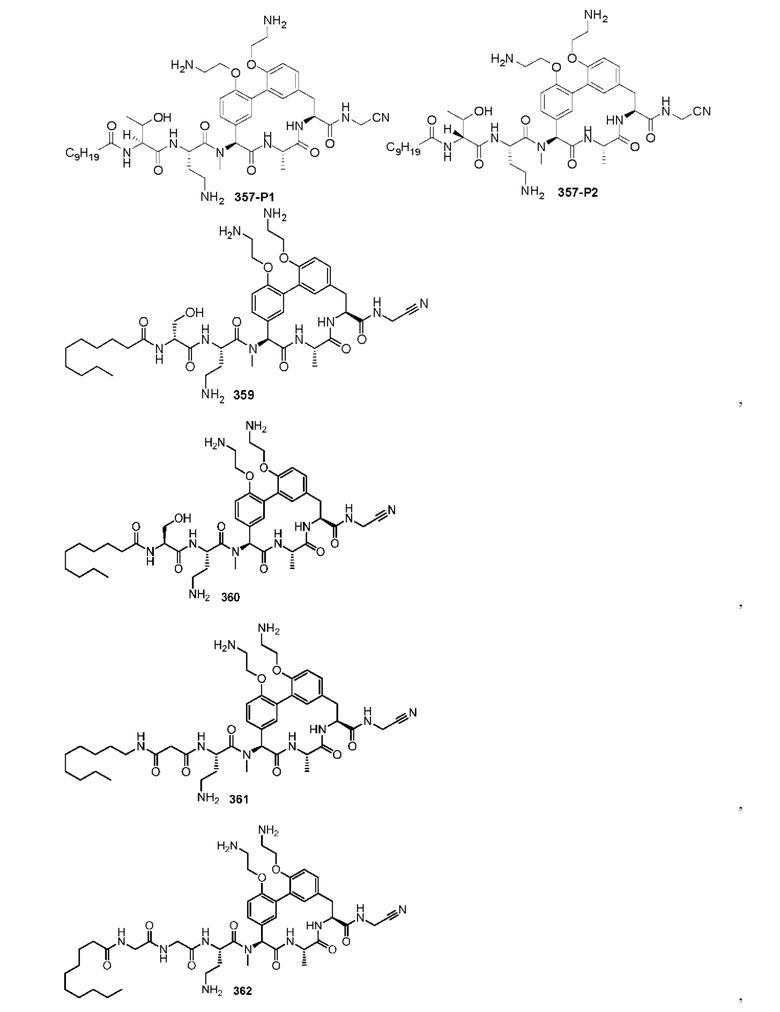
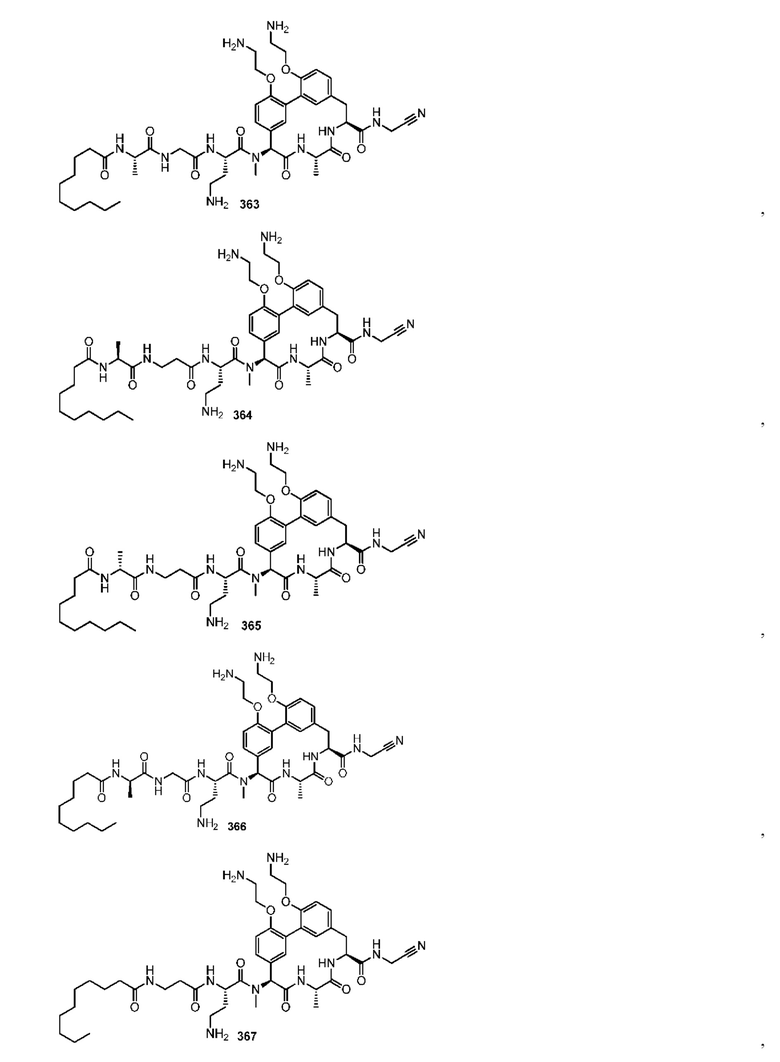
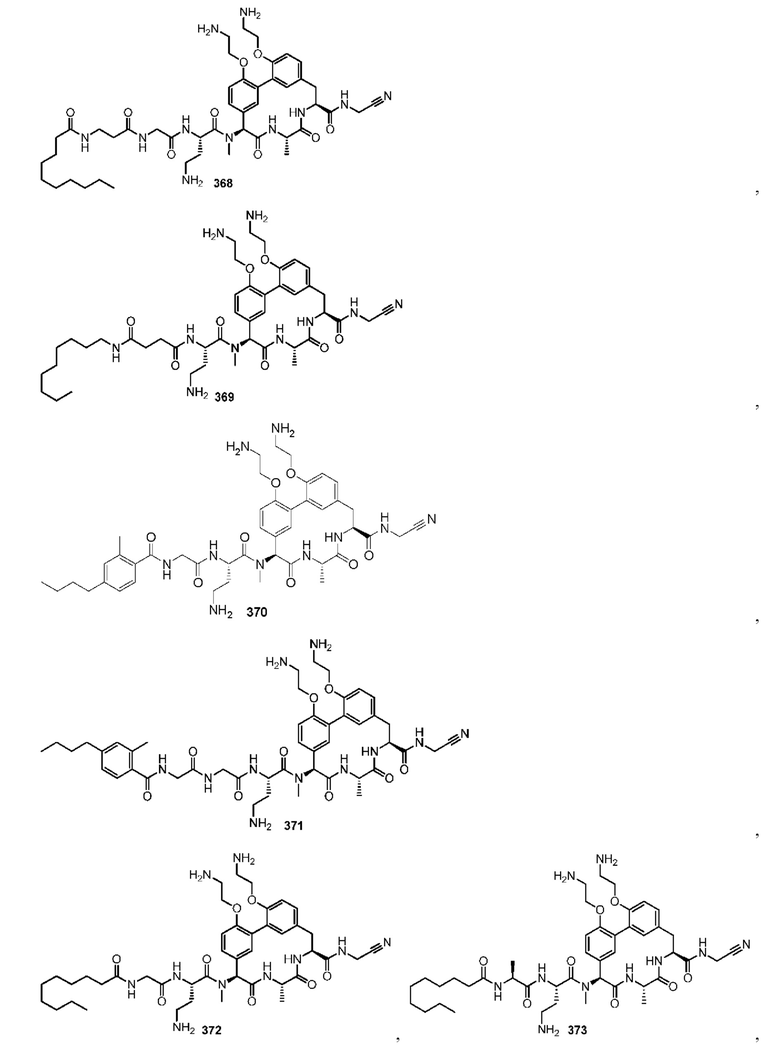

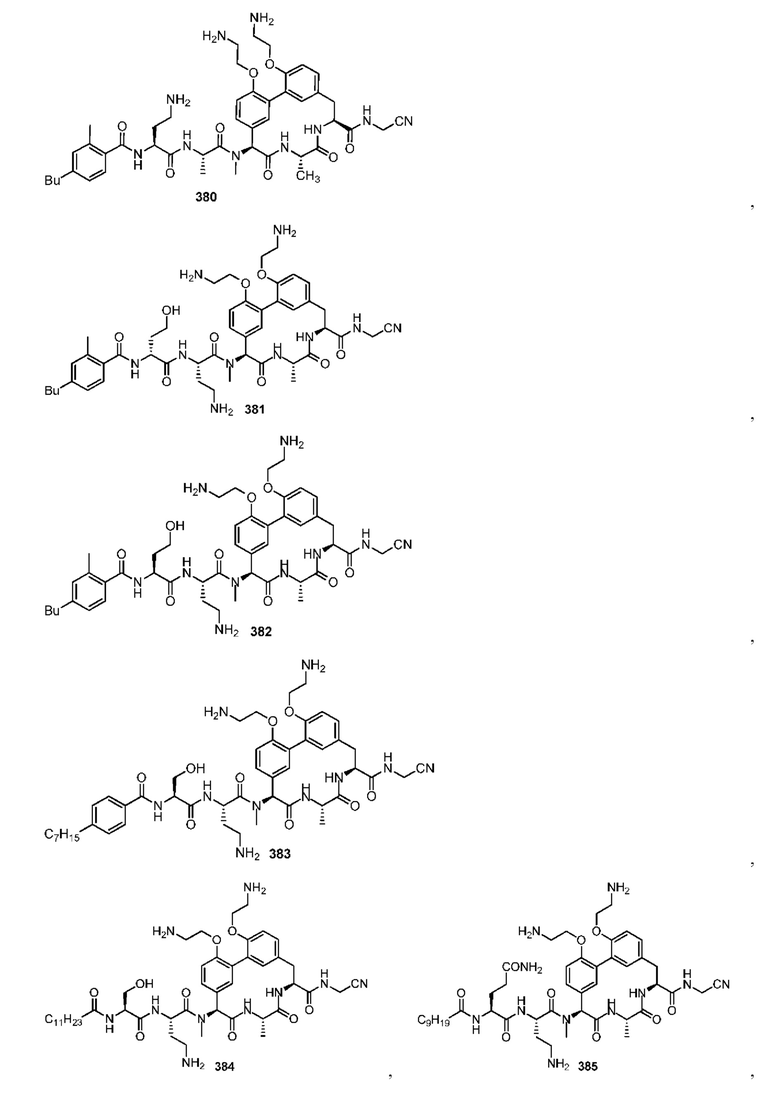









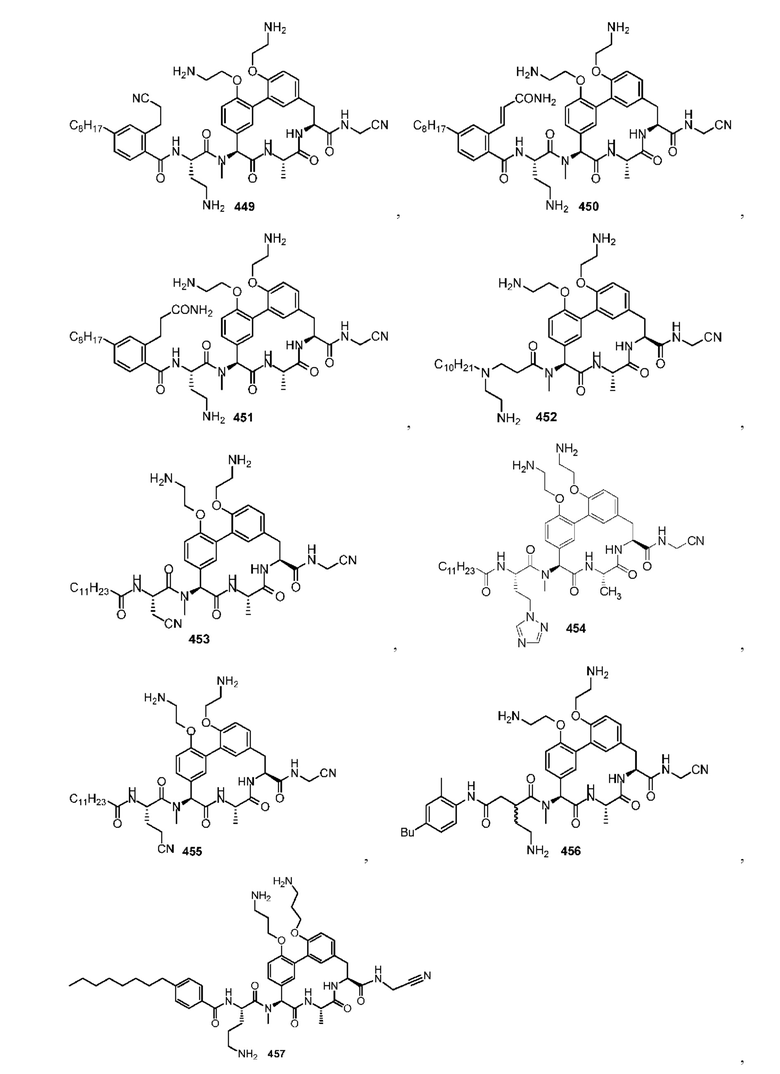

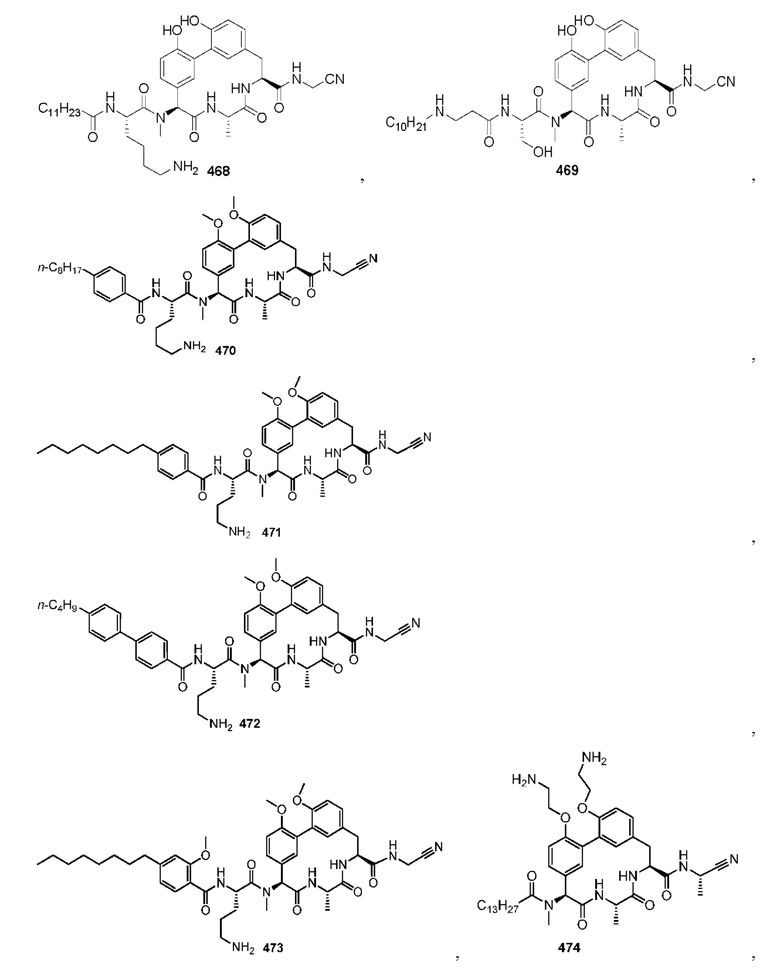


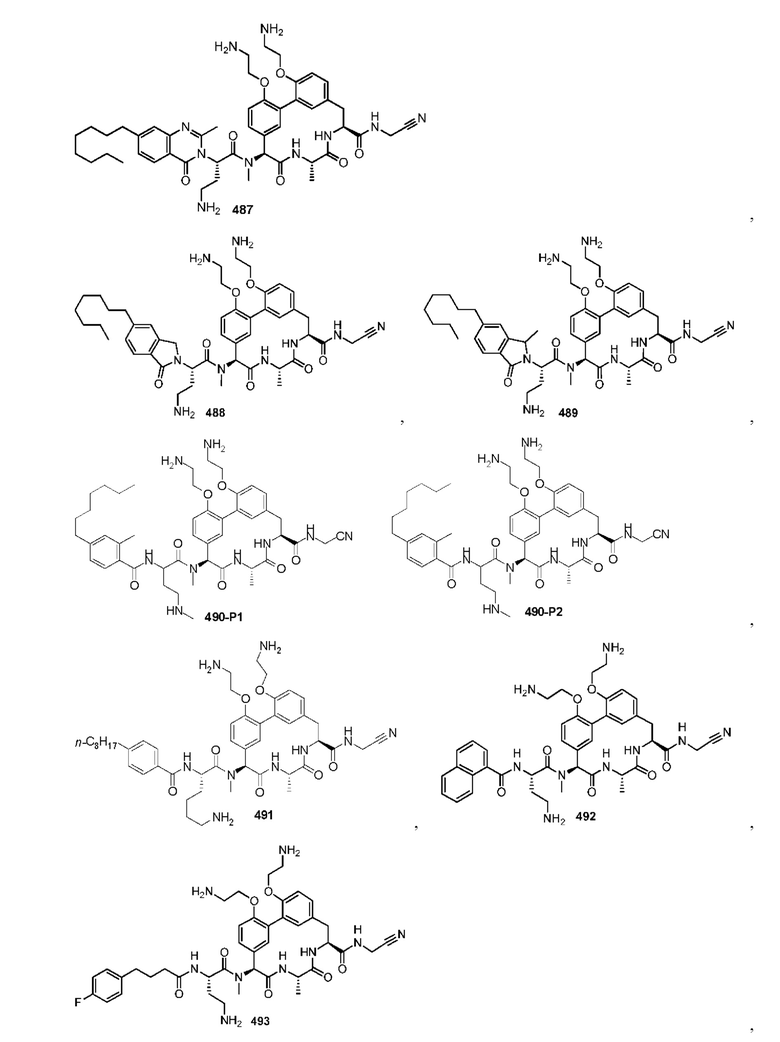
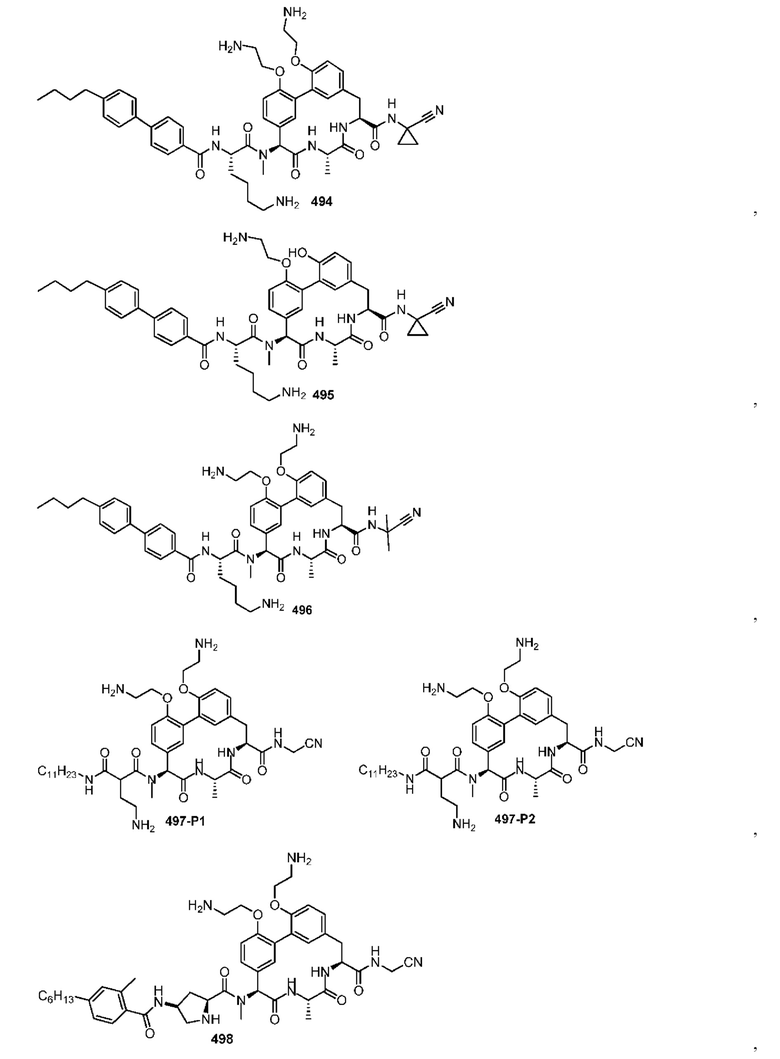
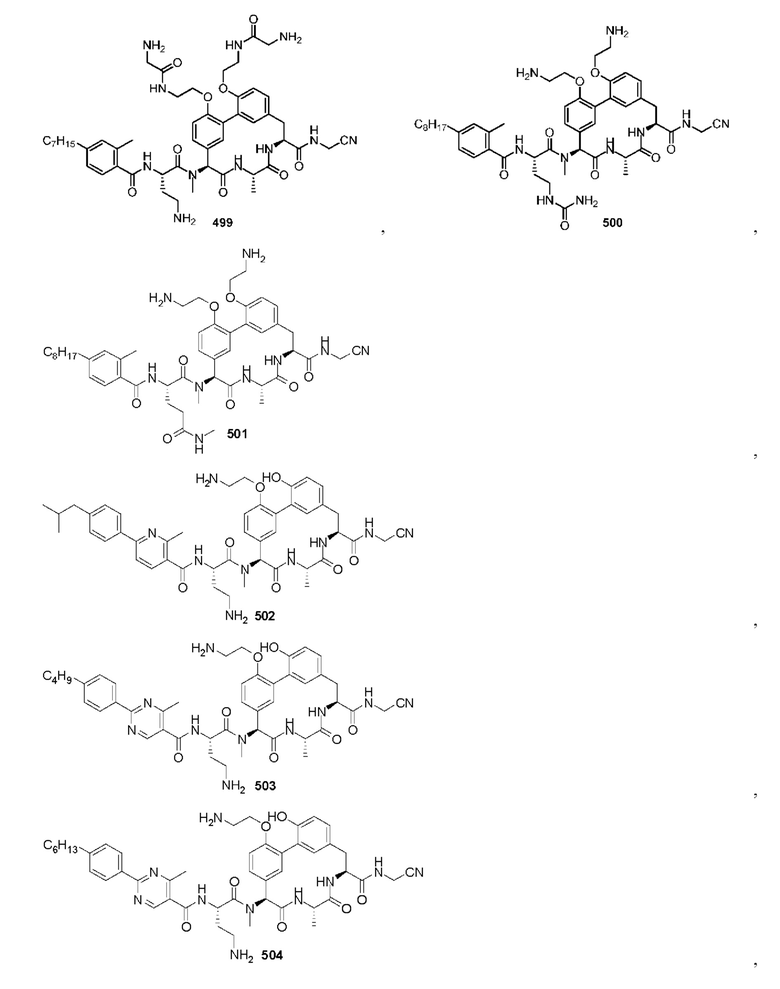
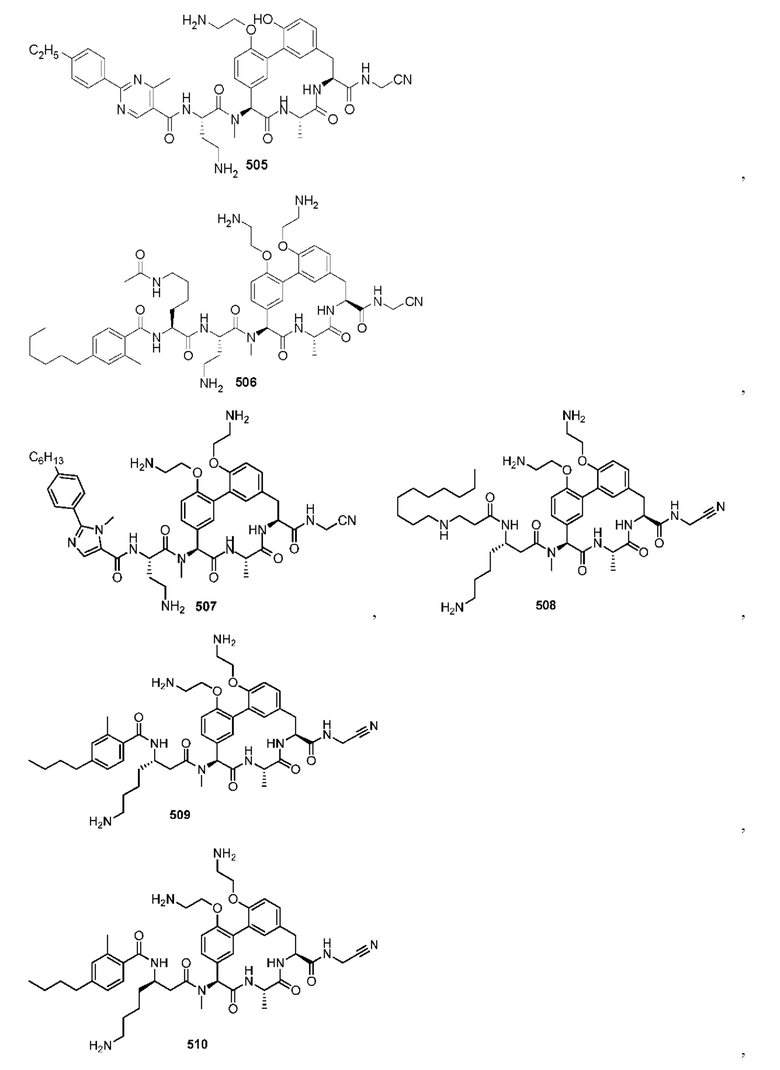


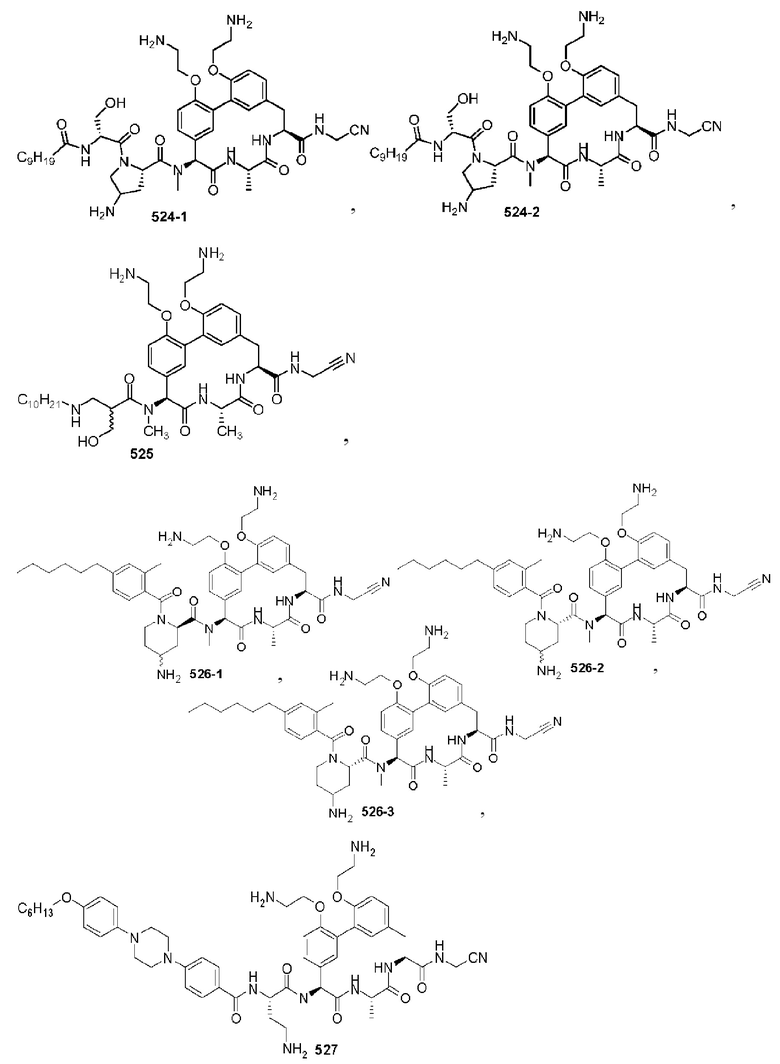
и

или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция для лечения бактериальной инфекции, содержащая эффективное количество соединения по п. 1 или его фармацевтически приемлемой соли и фармацевтически приемлемое вспомогательное вещество.
3. Способ лечения бактериальной инфекции у млекопитающего, включающий введение млекопитающему эффективного количества соединения по п. 1 или его фармацевтически приемлемой соли с частотой и длительностью, достаточными для обеспечения благоприятного эффекта по отношению к млекопитающему.
4. Способ по п. 3, при котором бактериальной инфекцией является инфекция, которая включает в себя Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas acidovorans, Pseudomonas alcaligenes, Pseudomonas putida, Stenotrophomonas maltophilia, Burkholderia cepacia, Aeromonas hydrophilia, Escherichia coli, Citrobacter freundii, Salmonella typhimurium, Salmonella typhi, Salmonella paratyphi, Salmonella enteritidis, Shigella dysenteriae, Shigella flexneri, Shigella sonnei, Enterobacter cloacae, Enterobacter aerogenes, Klebsiella pneumoniae, Klebsiella oxytoca, Serratia marcescens, Francisella tularensis, Morganella morganii, Proteus mirabilis, Proteus vulgaris, Providencia alcalifaciens, Providencia rettgeri, Providencia stuartii, Acinetobacter baumannii, Acinetobacter calcoaceticus, Acinetobacter haemolyticus, Yersinia enterocolitica, Yersinia pestis, Yersinia pseudotuberculosis, Yersinia intermedia, Bordetella pertussis, Bordetella parapertussis, Bordetella bronchiseptica, Haemophilus influenzae, Haemophilus parainfluenzae, Haemophilus haemolyticus, Haemophilus parahaemolyticus, Haemophilus ducreyi, Pasteurella multocida, Pasteurella haemolytica, Branhamella catarrhalis, Helicobacter pylori, Campylobacter fetus, Campylobacter jejuni, Campylobacter coli, Borrelia burgdorferi, Vibrio cholerae, Vibrio parahaemolyticus, Legionella pneumophila, Listeria monocytogenes, Neisseria gonorrhoeae, Neisseria meningitidis, Kingella, Moraxella, Gardnerella vaginalis, Bacteroides fragilis, Bacteroides distasonis, гомологичную группу Bacteroides 3452A, Bacteroides vulgatus, Bacteroides ovalus, Bacteroides thetaiotaomicron, Bacteroides uniformis, Bacteroides eggerthii, Bacteroides splanchnicus, Clostridium difficile, Mycobacterium tuberculosis, Mycobacterium avium, Mycobacterium intracellulare, Mycobacterium leprae, Corynebacterium diphtheria, Corynebacterium ulcerans, Streptococcus pneumoniae, Streptococcus agalactiae, Streptococcus pyogenes, Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Staphylococcus intermedius, подвид hyicus Staphylococcus hyicus, Staphylococcus haemolyticus, Staphylococcus hominis или Staphylococcus saccharolyticus.
| RU 2012142832 A, 20.04.2014 | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| J | |||
| LIU ET AL., Efforts toward broadening the spectrum of arylomycin antibiotic activity, BIOORG | |||
| MED | |||
| CHEM | |||
| LETT., 2013, 23, pp | |||
| МЕХАНИЧЕСКАЯ ФОРСУНКА | 1926 |
|
SU5654A1 |
Авторы
Даты
2022-03-15—Публикация
2016-11-21—Подача