УРОВЕНЬ ТЕХНИКИ
Область техники
[0001] Настоящее изобретение относится к областям химии и медицины. Более конкретно, настоящее изобретение относится к ингибиторам MEK, способам разработки и синтеза таких ингибиторов MEK, композициям, содержащим ингибиторы MEK, и способам лечения заболевания, включающим введение ингибиторов MEK.
Описание родственной технологии
[0002] Рак является одной из самых распространенных причин смерти в Соединенных Штатах. В Соединенных Штатах рак является причиной примерно одной из каждых четырех смертей. Пятилетняя относительная выживаемость пациентов с раком, диагностированным в 1996-2003 гг., составляет приблизительно две трети по сравнению с примерно половиной в 1975-1977 гг. (Cancer Facts & Figures, American Cancer Society: Atlanta, Ga. (2008)). Частота новых случаев рака снижалась в среднем на 0,6% в год среди мужчин в период с 2000 по 2009 год, но оставалась неизменной среди женщин. С 2000 по 2009 год смертность от всех видов рака вместе взятых снижалась в среднем на 1,8% в год среди мужчин и на 1,4% в год среди женщин. Это улучшение выживаемости отражает прогресс в диагностике на более ранней стадии, а также улучшения в оптимизацию лечения, в которой сохраняется потребность. Открытие высокоэффективных противоопухолевых агентов с низкой токсичностью является основной целью исследований рака.
[0003] Кроме того, связанная с раком кахексия представляет собой изнурительное состояние, ассоциированное с потерей мышечной массы, утомляемостью, слабостью и потерей аппетита у онкологических пациентов. Кахексия также ассоциируется с тяжелыми клиническими последствиями, включая мышечную слабость, которая может привести к трудностям при передвижении и легочным осложнениям. Кахексия является важным фактором, способствующим смерти пациентов с раком.
[0004] Кахексия частично характеризуется истощением массы скелетных мышц, которое не устраняется традиционной нутритивной поддержкой, что приводит к выраженной потере веса и серьезно влияет на заболеваемость и смертность пациентов. Кахексия выявлена более чем у 80% пациентов с раком желудка, поджелудочной железы и пищевода; примерно 70% пациентов с раком головы и шеи; и примерно 60% пациентов с раком легкого, колоректальным раком и раком предстательной железы. См., Muscle (2012) 3, 245-51. Несмотря на влияние кахексии на смертность среди пациентов с раком, эффективных методов лечения, предотвращающих или препятствующих прогрессированию кахексии, не разработано. Например, по оценкам, более 85% пациентов с раком поджелудочной железы, включая пациентов на ранней стадии, теряют в среднем 14% своего веса, имеющегося до болезни. См., ВМС Cancer, 2010 Jul. 8; 10:363. Кахектические пациенты с раком поджелудочной железы часто слабы и утомлены, характеризуются более низкой переносимостью терапии и имеют более неблагоприятные исходы хирургического вмешательства. Следовательно, кахексия является основным фактором смертности при раке поджелудочной железы. К сожалению, 5-летняя выживаемость при раке поджелудочной железы за последние четыре десятилетия не превышает 6%, что является самой низкой выживаемостью среди всех злокачественных новообразований.
[0005] Для разработки лечения синдрома кахексии были приложены существенные усилия, но, к сожалению, не существует единственного, полностью удовлетворительного лечения для обращения вспять потери веса, ассоциированной с раковой кахексией. Разработка различных терапевтических стратегий сосредоточена на двух целях: противодействии анорексии и нейтрализации метаболических нарушений. Однако обеспечение полных потребностей в питательных веществах путем общего парентерального питания не отменяет потери веса. Вместо этого, было предложено много лекарственных средств, которые применялись в клинических исследованиях, в то время как другие все еще исследуются на экспериментальных животных с целью обращения вспять метаболических изменений. См., Toledo, et al. 2014 PloS One. В одном исследовании было обнаружено, что селуметиниб, ингибитор MEK, способствует увеличению мышечной массы у пациентов с холангиокарциномой. См. British Journal of Cancer, (2012), 106, 1583-1586. В другом исследовании было обнаружено, что биметиниб, ингибитор MEK, способствует увеличению мышечной массы у пациентов с ВТС. См., Inv New Drugs (2018) 36, 1037-1043.
[0006] В дополнение к своей потенциальной роли в кахексии, MEK является критически важным сигнальным промежуточным звеном в пути MAPK/ERK, который неадекватно активируется в широком спектре опухолей человека, включая опухоли, происходящие из легких, поджелудочной железы, яичников, кожи и толстой кишки. Хотя на сегодняшний день несколько ингибиторов MEK получили одобрение регулирующих органов, эти ингибиторы MEK еще не оправдали ожиданий относительно своей клинической эффективности. Идентификация нового класса ингибиторов MEK, которые максимизируют реверсирование патологического пути MAPK/ERK, в то же время ограничивая токсичность, связанную с лекарственными препаратами, окажет значительное влияние на заболеваемость и смертность пациентов с раком.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Было обнаружено, что соединения, описанные в настоящей заявке, проявляют неожиданные и удивительные биологические эффекты. Эти соединения являются ингибиторами MEK, которые максимизируют реверсирование патологического пути MAPK/ERK, являются эффективными агентами против рака и раковой кахексии и пригодными для применения в фармацевтических составах против рака и раковой кахексии.
[0008] В некоторых вариантах осуществления предлагается соединение, имеющее структуру Формулы (I):

включая его фармацевтически приемлемые соли, где:
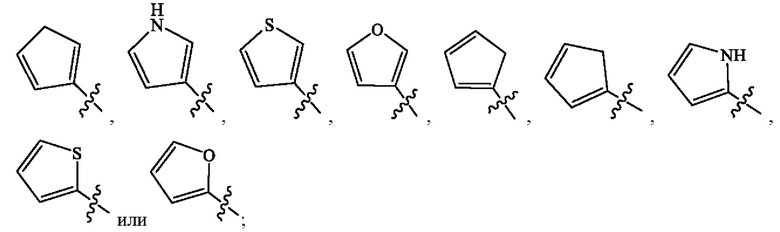
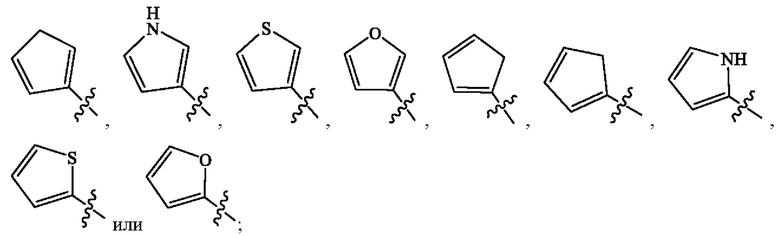
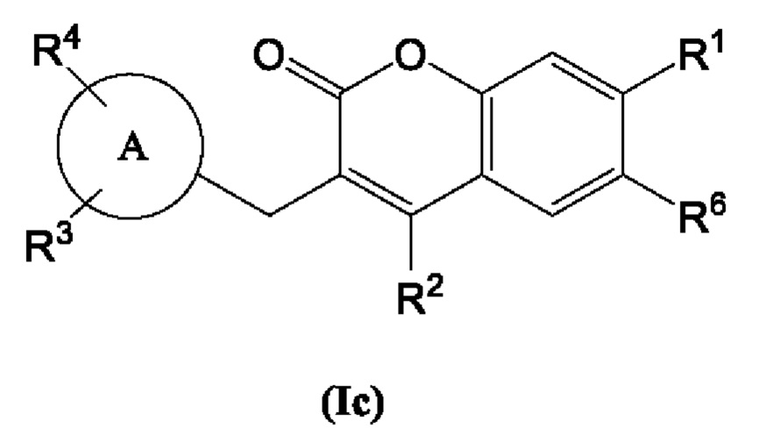
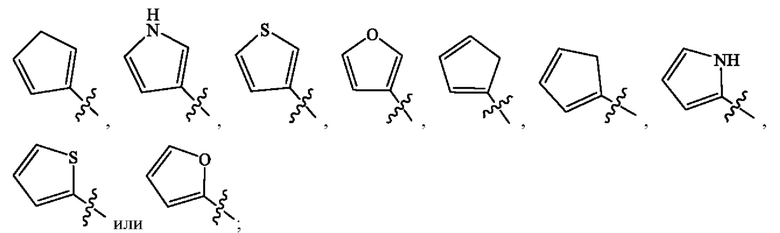
Кольцо А представляет собой 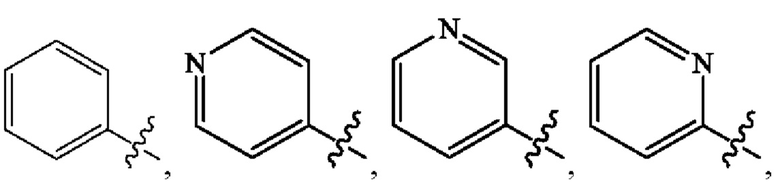
R1, R2, R3, R4 и R6 каждый независимо выбан из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, или L;
Х представляет собой C(R5)2, CH(R5), CH2, -O-, 
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2, и Z3 независимо представляют собой -CH2-, -O-, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C-O, -R5CO2-, -R5NH-, -R5NH(СО)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C1-C6 алкил, необязательно замещенный C3-C8 циклоалкил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил, необязательно замещенный C3-C10 гетероарил, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
каждый R5 независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный C2-C6 алкенил, необязательно замещенный C2-C6 алкинил, необязательно замещенный C3-C8 карбоциклил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил или необязательно замещенный C3-C10 гетероарил; и
Y представляет собой CH2, NH или О,
при условии, что R1 не является пиримидилом.
[0009] В некоторых вариантах осуществления Формулы (I) Кольцо А представляет собой  В некоторых вариантах осуществления R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой -Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2 и Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил). В некоторых вариантах осуществления Z1 представляет собой -CH2- и Z2 представляет собой необязательно замещенный
В некоторых вариантах осуществления R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой -Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2 и Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил). В некоторых вариантах осуществления Z1 представляет собой -CH2- и Z2 представляет собой необязательно замещенный 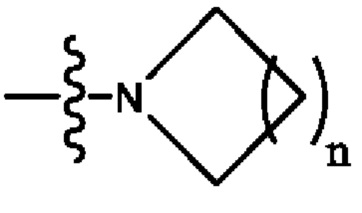 , где n представляет собой 1, 2, 3 или 4. В некоторых вариантах осуществления Z1 представляет собой -CH2- и Z2 представляет собой необязательно замещенный
, где n представляет собой 1, 2, 3 или 4. В некоторых вариантах осуществления Z1 представляет собой -CH2- и Z2 представляет собой необязательно замещенный 
[0010] В некоторых вариантах осуществления предлагается соединение Формулы (Ia):
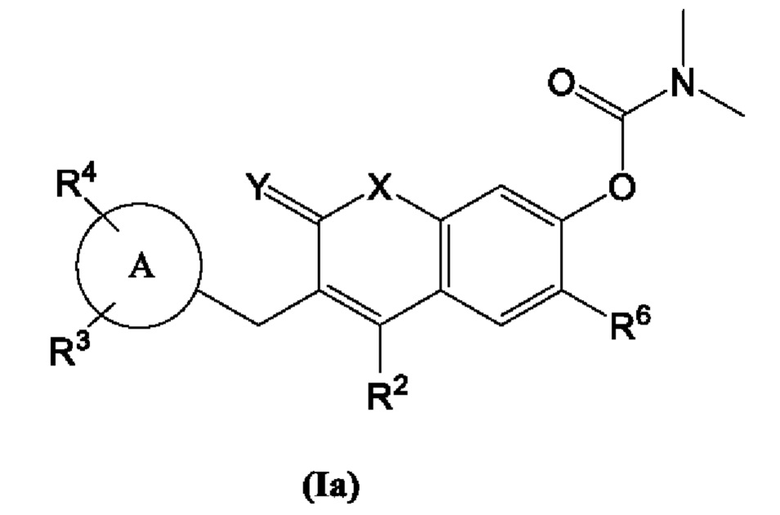
включая его фармацевтически приемлемые соли, где:
Кольцо А представляет собой 
R2, R3, R4 и R6 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, или L;
Х представляет собой C(R5)2, CH(R5), CH2, -O-, 
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2, и Z3 независимо представляют собой -CH2-, -O-,- S-, -S=O-, -SO2-, -С=O-, -CO2-, -NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(СО)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C3-C8 циклоалкил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил, необязательно замещенный C3-C10 гетероарил, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
каждый R5 независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный C2-C6 алкенил, необязательно замещенный C2-C6 алкинил, необязательно замещенный C3-C8 карбоциклил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил или необязательно замещенный C3-C10 гетероарил; и
Y представляет собой CH2, NH или О,
при условии, что R1 не является пиримидилом.
[0011] В некоторых вариантах осуществления Формулы (Ia) Кольцо А представляет собой 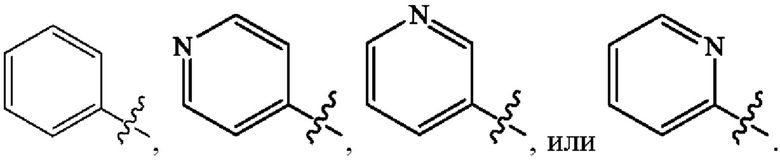 В некоторых вариантах осуществления R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой -Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2-, Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил). В некоторых вариантах осуществления Z1 представляет собой CH2 и Z2 представляет собой необязательно замещенный
В некоторых вариантах осуществления R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой -Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2-, Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил). В некоторых вариантах осуществления Z1 представляет собой CH2 и Z2 представляет собой необязательно замещенный  , где n представляет собой 1, 2, 3 или 4. В некоторых вариантах осуществления Z1 представляет собой CH2 и Z2 представляет собой необязательно замещенный
, где n представляет собой 1, 2, 3 или 4. В некоторых вариантах осуществления Z1 представляет собой CH2 и Z2 представляет собой необязательно замещенный 
[0012] В некоторых вариантах осуществления предлагается соединение Формулы (Ib):

включая его фармацевтически приемлемые соли, где:
Кольцо А представляет собой 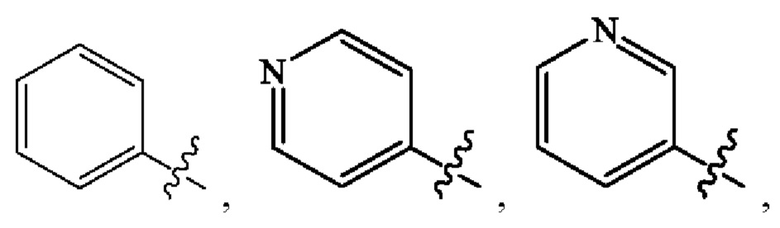
R2, R3, R4 и R6 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, или L;
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -CH2-, -О-, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, SO2-NH, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(СО)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C3-C8 циклоалкил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил, необязательно замещенный C3-C10 гетероарил, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
каждый R5 независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный C2-C6 алкенил, необязательно замещенный C2-C6 алкинил, необязательно замещенный C3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный C3-C8 гетероциклил или необязательно замещенный C3-C10 гетероарил; и
при условии, что R1 не является пиримидилом.
[0013] В некоторых вариантах осуществления Формулы (Ib) Кольцо А представляет собой  В некоторых вариантах осуществления R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой -Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2-, Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил).
В некоторых вариантах осуществления R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой -Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2-, Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил).
[0014] В некоторых вариантах осуществления предлагается соединение Формулы (Ic):
включая его фармацевтически приемлемые соли, где:
Кольцо А представляет собой 
R1, R2, R3, R4 и R6 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, или L;
Х представляет собой C(R5)2, CH(R5), CH2, -O-, 
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -CH2-, -O-, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(СО)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C3-C8 циклоалкил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил, необязательно замещенный C3-C10 гетероарил, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
каждый R5 независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный C2-C6 алкенил, необязательно замещенный C2-C6 алкинил, необязательно замещенный C3-C8 карбоциклил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил или необязательно замещенный C3-C10 гетероарил; и
Y представляет собой CH2, NH или О,
при условии, что R1 не является пиримидилом.
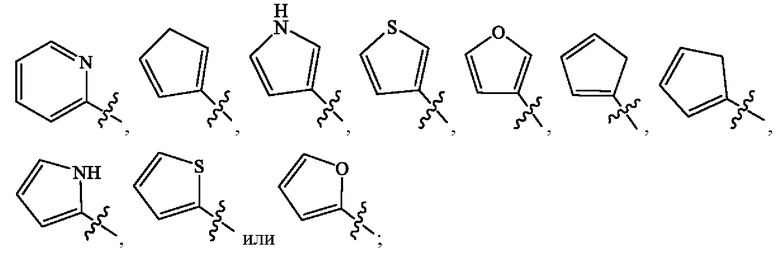
[0015] В некоторых вариантах осуществления Формулы (Ic) Кольцо А
представляет собой  В некоторых вариантах осуществления R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2-, Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил). В некоторых вариантах осуществления Z1 представляет собой -CH2-, а Z2 представляет собой необязательно замещенный
В некоторых вариантах осуществления R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2-, Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил). В некоторых вариантах осуществления Z1 представляет собой -CH2-, а Z2 представляет собой необязательно замещенный  , где n представляет собой целое число, выбранное из 1, 2, 3 и 4. В некоторых вариантах осуществления Z1 представляет собой -CH2-, а Z2 представляет собой необязательно замещенный
, где n представляет собой целое число, выбранное из 1, 2, 3 и 4. В некоторых вариантах осуществления Z1 представляет собой -CH2-, а Z2 представляет собой необязательно замещенный 
[0016] Соединение Формулы (I), имеющее структуру, изображенную в Формуле (Id):

включая его фармацевтически приемлемые соли, где:
Кольцо А представляет собой 
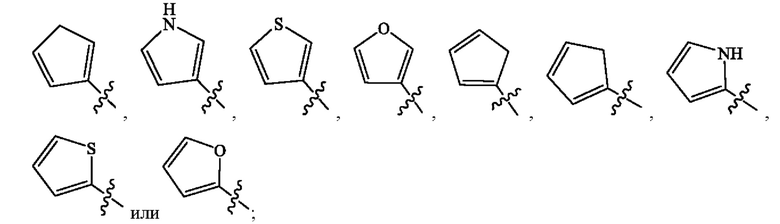
R3 и R4 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, и L;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила и необязательно замещенного C2-C6 алкинила;
каждый R9 и R10 независимо выбран из водорода, дейтерия, необязательно замещенного C1-C6 алкила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
X1 выбран из группы, состоящей из СН, В, N или PO4;
n выбран из 1, 2, 3 или 4;
каждый R5 и R5 независимо выбран из Н, дейтерия, необязательно замещенного C1-C6 алкил, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинил, необязательно замещенный C3-C8 карбоциклила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила и необязательно замещенного C3-C10 гетероарила; и Y представляет собой CH2, NH или О,
при условии, что R1 не является пиримидилом.
[0017] В некоторых вариантах осуществления n равно 1 или 2. В некоторых вариантах осуществления X1 представляет собой СН или N. В некоторых вариантах осуществления R9 выбран из необязательно замещенного C1-C6 алкила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила. В некоторых вариантах осуществления R10 выбран из необязательно замещенного C1-C6 алкила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила.
[0018] В некоторых вариантах осуществления предлагается соединение формулы (II):
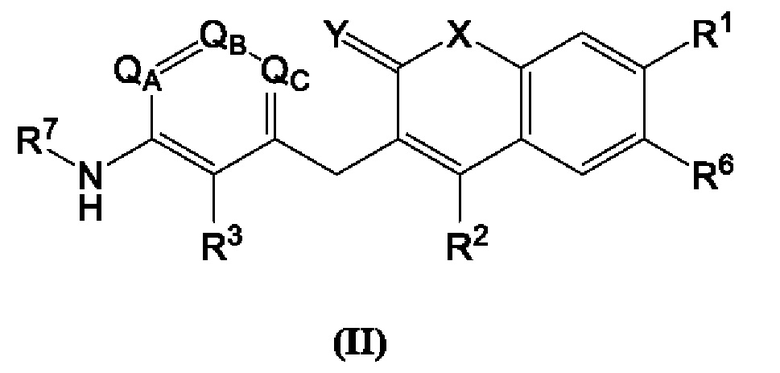
включая его фармацевтически приемлемые соли, где:
qa, qb, Qc независимо представляют собой С или N;
R1, R2, R3, R6 и R7 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, или L;
Х представляет собой C(R5)2, CH(R5), CH2, -O-, 
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -CH2-, -О-, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(СО)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5, необязательно замещенный C3-C8 циклоалкил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил, необязательно замещенный C3-C10 гетероарил, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
каждый R5 независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный C2-C6 алкенил, необязательно замещенный C2-C6 алкинил, необязательно замещенный C3-C8 карбоциклил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил или необязательно замещенный C3-C10 гетероарил;
Y представляет собой CH2, NH или О, и
Z представляет собой С или N;
при условии, что R1 не является пиримидилом.
[0019] В некоторых вариантах осуществления Формулы (II), R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой -Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2-, Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил). В некоторых вариантах осуществления Z1 представляет собой -CH2-, а Z2 представляет собой необязательно замещенный  , где n представляет собой целое число, выбранное из 1, 2, 3 и 4. В некоторых вариантах осуществления Z1 представляет собой -CH2-, а Z2 представляет собой необязательно замещенный
, где n представляет собой целое число, выбранное из 1, 2, 3 и 4. В некоторых вариантах осуществления Z1 представляет собой -CH2-, а Z2 представляет собой необязательно замещенный 
[0020] В некоторых вариантах осуществления предлагается соединение Формулы (IIa):
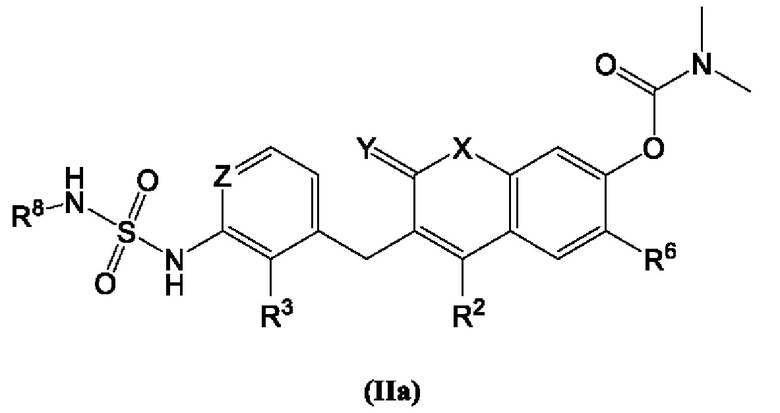
включая его фармацевтически приемлемые соли, где:
R2, R3, R6 и R8 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, или L;
Х представляет собой С(R5)2, CH(R5), CH2, -O-, 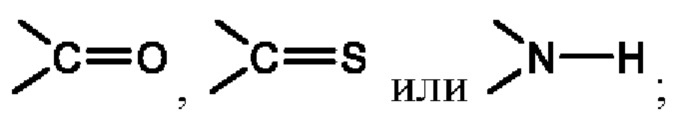
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2, и Z3 независимо выбран из гало, -CH2-, О, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
каждый из R5 и R5 независимо выбран из Н, дейтерия, необязательно замещенного C1-C6 алкил, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинил, необязательно замещенный C3-C8 карбоциклила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила или необязательно замещенного C3-C10 гетероарила;
Y представляет собой CH2, NH или О, и
Z представляет собой С или N.
[0021] В некоторых вариантах осуществления Формулы (IIa), R2 представляет собой -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного С3-С8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CCH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2-, Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил). В некоторых вариантах осуществления Z1 представляет собой -CH2-, а Z2 является необязательно замещенным  , где n выбран из 1, 2, 3 и 4. В некоторых вариантах осуществления Z1 представляет собой -CH2-, а Z2 представляет собой необязательно замещенный
, где n выбран из 1, 2, 3 и 4. В некоторых вариантах осуществления Z1 представляет собой -CH2-, а Z2 представляет собой необязательно замещенный 
[0022] В некоторых вариантах осуществления предлагается соединение, изображенное Формулой (IIb):

включая его фармацевтически приемлемые соли, где:
R2 представляет собой L;
R6 представляет собой Н, дейтерий, галоген или необязательно замещенный C1-C6 алкил;
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -CH2-, -O-, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O, -R5S, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(СО)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C3-C8 циклоалкил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил, необязательно замещенный C3-C10 гетероарил, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
каждый R5 независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный C2-C6 алкенил, необязательно замещенный C2-C6 алкинил, необязательно замещенный C3-C8 карбоциклил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил или необязательно замещенный C3-C10 гетероарил;
Z представляет собой С или N.
[0023] В некоторых вариантах осуществления Формулы (IIb), L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероарила, -NR5R5, -CH2CCH или -CH2CN. В некоторых вариантах осуществления R5 выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой -Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2-, Z2 представляет собой необязательно замещенный C3-C8 гетероциклил и Z3 представляет собой -CH2-(необязательно замещенный арил). В некоторых вариантах осуществления Z1 представляет собой CH2 и Z2 представляет собой необязательно замещенный  , где n представляет собой 1, 2, 3 или 4. В некоторых вариантах осуществления Z1 представляет собой -CH2- и Z2 представляет собой необязательно замещенный
, где n представляет собой 1, 2, 3 или 4. В некоторых вариантах осуществления Z1 представляет собой -CH2- и Z2 представляет собой необязательно замещенный 
[0024] В некоторых вариантах осуществления соединение Формулы (II) представлено структурой Формулы (IIc):
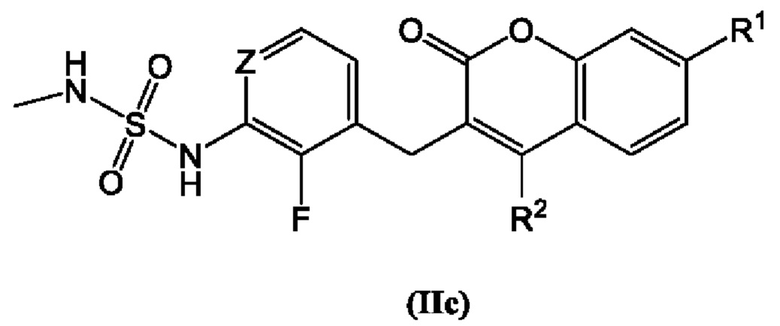
включая его фармацевтически приемлемые соли, где:
R1 и R2 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, или L;
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2, и Z3 независимо представляют собой -CH2-, -O-, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5', -NH(CO)-, -(CO)NH-, -(CO)NR5R5'-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -R5(CO)NH-, -NHCH2CO-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C3-C8 циклоалкил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил, необязательно замещенный C3-C10 гетероарил, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
каждый R5 и R5 независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный C2-C6 алкенил, необязательно замещенный C2-C6 алкинил, необязательно замещенный C3-C8 карбоциклил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил или необязательно замещенный C3-C10 гетероарил; и
Z представляет собой С или N;
при условии, что R1 не является пиримидилом.
[0025] В некоторых вариантах осуществления R2 не является -СН3. В некоторых вариантах осуществления R2 представляет собой L. В некоторых вариантах осуществления L представляет собой -Z1-Z2. В некоторых вариантах осуществления Z1 представляет собой -CH2-. В некоторых вариантах осуществления Z2 выбран из необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C8 гетероаила, -NR5R5', -CH2CCH или -CH2CN. В некоторых вариантах осуществления R5 и R5' выбран из Н или СН3. В некоторых вариантах осуществления L представляет собой Z1-Z2-Z3. В некоторых вариантах осуществления Z1 представляет собой -CH2-, Z2 выбран из N или необязательно замещенного С3-C8 гетероциклила, и Z3 выбран из необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила или необязательно замещенного C3-C10 гетероарила; и
[0026] В некоторых вариантах осуществления соединение Формулы (II) представлено структурой Формулы (IId):

включая его фармацевтически приемлемые соли, где:
R3 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила и необязательно замещенного C2-C6 алкинила;
R8 выбран из Н, дейтерия, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 карбоциклила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила;
каждый R9 и R10 независимо выбран из водорода, дейтерия, необязательно замещенного C1-C6 алкила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил); и
X1 выбран из группы, состоящей из СН, В, N.
[0027] В некоторых вариантах осуществления R3 выбран из Н, дейтерия, C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила.
[0028] В некоторых вариантах осуществления R6 выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила.
[0029] В некоторых вариантах осуществления R8 выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила.
[0030] В некоторых вариантах осуществления R9 выбран из Н, дейтерия, C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила.
[0031] В некоторых вариантах осуществления R10 выбран из Н, дейтерия, C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила.
[0032] В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc) или (IId) выбран из соединения из Таблицы А. В некоторых вариантах осуществления соединение Формулы (I) или Формулы (II) выбран из группы, состоящей из:
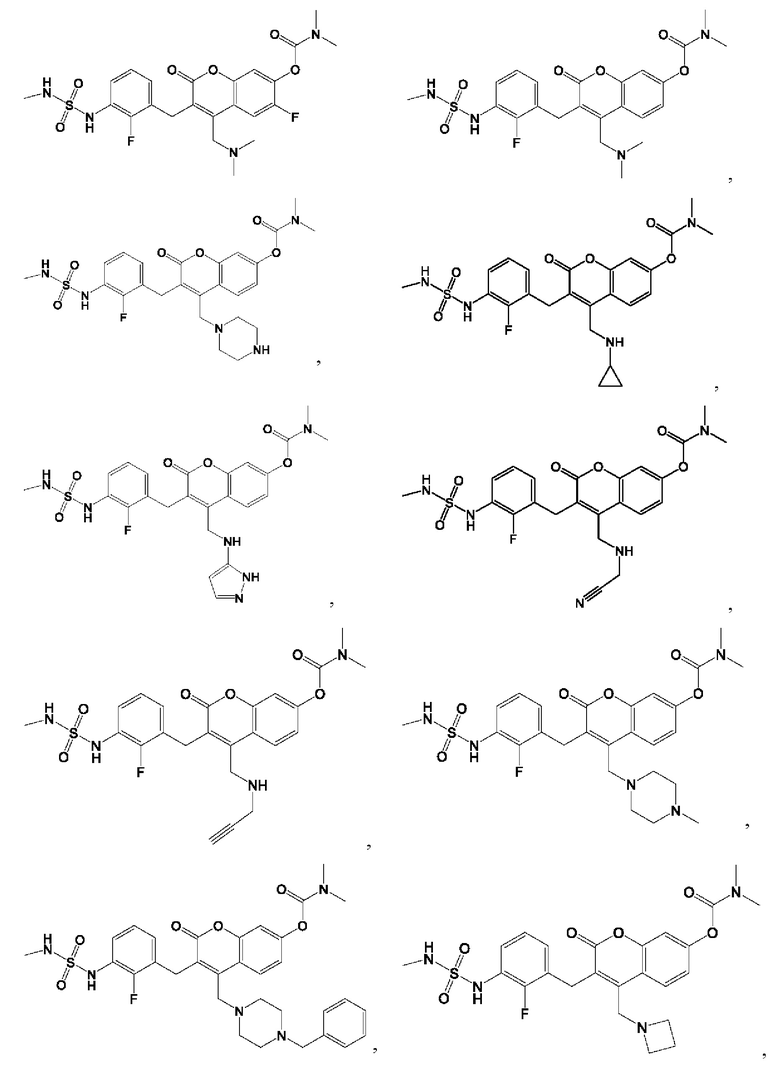
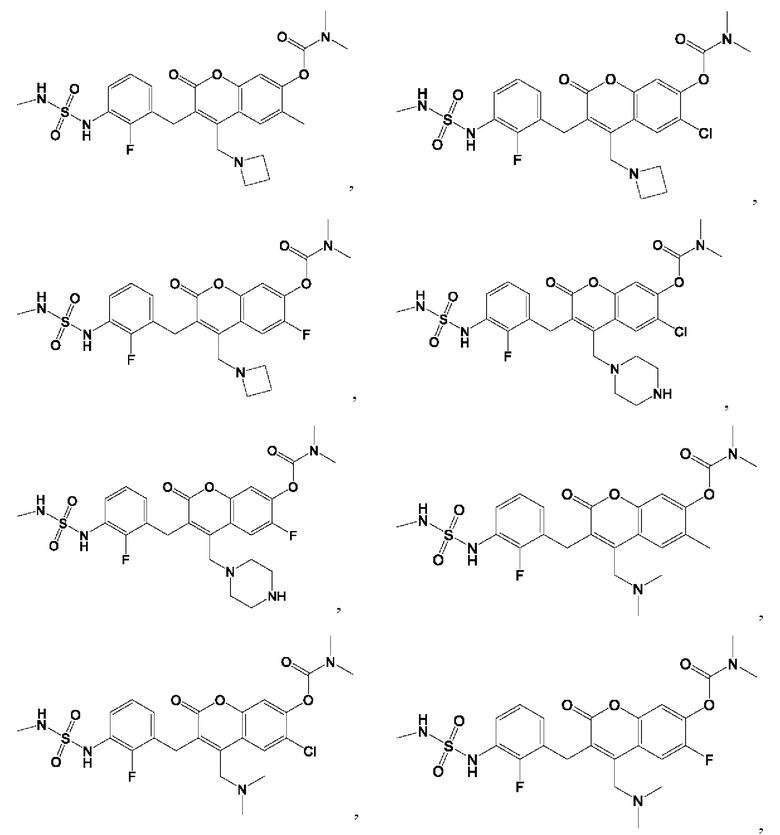
и их фармацевтически приемлемых солей.
[0033] В некоторых вариантах осуществления фармацевтически приемлемая соль представляет собой соль щелочного металла или соль аммония.
[0034] В некоторых вариантах осуществления предлагается фармацевтическая композиция, содержащая терапевтически эффективное количество по меньшей мере одного соединения, имеющего структуру Формулы (I):
1. 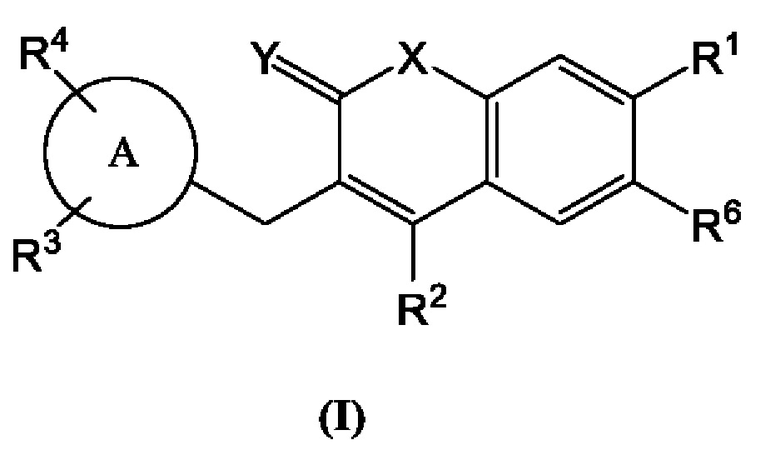
включая его фармацевтически приемлемые соли, где:
Кольцо А представляет собой 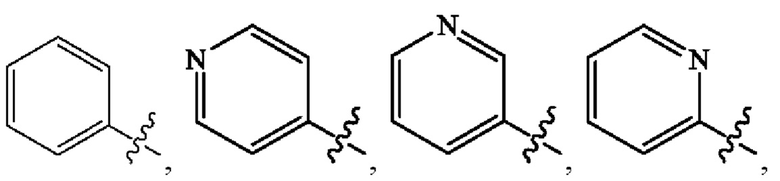
R1, R2, R3, R4 и R6 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, или L;
Х представляет собой C(R5)2, CH(R5), CH2, -O-, 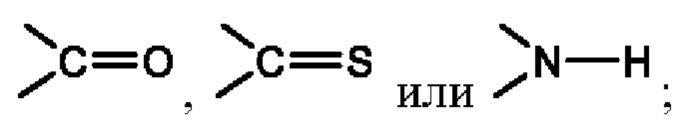
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -CH2-, -O-, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(СО)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, SO2-NHR5-, необязательно замещенный C3-C8 циклоалкил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил, необязательно замещенный C3-C10 гетероарил, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
каждый R5 независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный C2-C6 алкенил, необязательно замещенный C2-C6 алкинил, необязательно замещенный C3-C8 карбоциклил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил или необязательно замещенный C3-C10 гетероарил; и
Y представляет собой CH2, NH или О,
при условии, что R1 не является пиримидилом.
[0035] В некоторых вариантах осуществления предлагается фармацевтическая композиция, содержащая терапевтически эффективное количество по меньшей мере одного соединения, имеющего структуру Формулы (II):
2. 
включая его фармацевтически приемлемые соли, где:
qa, QB, QC независимо представляют собой С или N;
R1, R2, R3, R6 и R7 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного O-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного O-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного C3-C8 циклоалкила, необязательно замещенного C6-C10 арила, необязательно замещенного C3-C8 гетероциклила, необязательно замещенного C3-C10 гетероарила, или L;
Х представляет собой C(R5)2, CH(R5), CH2, -О-, 
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -CH2-, -О-, -S-, S=O, -SO2-, С=O, -CO2-, NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, SO2-NHR5, необязательно замещенный C3-C8 циклоалкил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил, необязательно замещенный C3-C10 гетероарил, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный C3-C8 циклоалкил) или -CH2-(необязательно замещенный C3-C10 гетероарил);
каждый R5 независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный C2-C6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный C3-C8 карбоциклил, необязательно замещенный C6-C10 арил, необязательно замещенный C3-C8 гетероциклил или необязательно замещенный C3-C10 гетероарил;
Y представляет собой CH2, NH или О, и
Z представляет собой С или N;
при условии, что R1 не является пиримидилом.
[0036] Некоторые варианты осуществления относятся к способу лечения млекопитающего, имеющего заболевание или нарушение. В некоторых вариантах осуществления указанный способ включает введение млекопитающему терапевтически эффективного количества соединения, как описано в данном документе. Некоторые варианты осуществления относятся к способу лечения млекопитающего, имеющего заболевание или нарушение. В некоторых вариантах осуществления указанный способ включает введение млекопитающему терапевтически эффективного количества фармацевтической композиции, как описано в данном документе. В некоторых вариантах осуществления млекопитающее представляет собой человека. В некоторых вариантах осуществления указанный способ дополнительно включает введение млекопитающему дополнительного лекарственного средства. В некоторых вариантах осуществления указанный способ включает введение субъекту, страдающему указанным заболеванием или нарушением, эффективного количества соединения любого из соединений, описанных в данном документе, или его фармацевтически приемлемой соли.
[0037] Некоторые варианты осуществления относятся к способу лечения заболевания. В некоторых вариантах осуществления указанный способ включает введение субъекту, страдающему указанным заболеванием, эффективного количества фармацевтической композиции, как описано в данном документе. В некоторых вариантах осуществления заболевание представляет собой рак. В некоторых вариантах осуществления рак выбран из группы, состоящей из рака головного мозга, рака молочной железы, рака легких, немелкоклеточного рака легкого, рака яичников, рака поджелудочной железы, рака желудка, рака предстательной железы, рака почки, колоректального рака или лейкоза. В других или дополнительных вариантах осуществления фиброгенетическое нарушение представляет собой склеродермию, полимиозит, системную волчанку, ревматоидный артрит, цирроз печени, образование келоидов, интерстициальный нефрит или легочный фиброз. В некоторых вариантах осуществления рак ассоциируется с мутацией Ras. В некоторых вариантах осуществления мутация RAS представляет собой мутацию KRAS, выбранную из группы, состоящей из G12C, G12S, G12R, G12F, G12L, G12N, G12A, G12D, G12V, G13C, G13S, G13D, G13V, G13P, S17G, P34S, А59Е., A59G, А59Т, Q61K, Q61L, Q61R и Q61H. В некоторых вариантах осуществления заболевание представляет собой раковую кахексию.
[0038] Некоторые варианты осуществления относятся к способу ингибирования пролиферации клетки. В некоторых вариантах осуществления указанный способ включает приведение клетки в контакт с эффективным количеством соединения, описанного в данном документе, или фармацевтической композиции, описанной в данном документе. В некоторых вариантах осуществления клетка имеет мутацию RAS.
[0039] Некоторые варианты осуществления относятся к способу индукции апоптоза в клетке. В некоторых вариантах осуществления указанный способ включает приведение клетки в контакт с эффективным количеством соединения, описанного в данном документе, или фармацевтической композиции, описанной в данном документе.
[0040] Некоторые варианты осуществления относятся к способу лечения субъекта с раком, устойчивым к лечению ингибитором протеинкиназы MEK. В некоторых вариантах осуществления указанный способ включает приведение клетки в контакт с эффективным количеством соединения, описанного в данном документе, или фармацевтической композиции, описанной в данном документе.
[0041] Некоторые варианты осуществления относятся к способу лечения субъекта с раком, устойчивым к лечению ингибитором протеинкиназы RAF. В некоторых вариантах осуществления указанный способ включает приведение клетки в контакт с эффективным количеством соединения, описанного в данном документе, или фармацевтической композиции, описанной в данном документе.
[0042] Некоторые варианты осуществления относятся к способу лечения раковой кахексии у млекопитающего, больного раком. В некоторых вариантах осуществления указанный способ включает введение эффективного количества соединения, описанного в данном документе, или фармацевтической композиции, описанной в данном документе.
[0043] В некоторых вариантах осуществления соединение, описанное в данном документе, или фармацевтическая композиция, описанная в данном документе, можно вводить в виде разовой дозы. В некоторых вариантах осуществления соединение, описанное в данном документе, или фармацевтическую композицию, описанную в данном документе, можно вводить в виде разовой дозы один раз в день.
[0044] В некоторых вариантах осуществления соединение, описанное в данном документе, или фармацевтическую композицию, описанную в данном документе, можно вводить в нескольких дозах, более одного раза в день. В некоторых вариантах осуществления соединение, описанное в данном документе, или фармацевтическую композицию, описанную в данном документе, можно вводить два раза в день. В некоторых вариантах осуществления соединение, описанное в данном документе, или фармацевтическую композицию, описанную в данном документе, можно вводить три раза в день. В некоторых вариантах осуществления соединение, описанное в данном документе, или фармацевтическую композицию, описанную в данном документе, можно вводить в дозе от 0,1 мг до 2000 мг. В некоторых вариантах осуществления соединение, описанное в данном документе, или фармацевтическую композицию, описанную в данном документе, можно вводить в дозе от около 0,001 до около 1000 мг/кг массы тела/день.
[0045] В некоторых вариантах осуществления соединение, как описано в данном документе, характеризуется лекарственным профилем устойчивости к RAF, введением дозы два раза в день, сбалансированным метаболизмом и активностью в течение от около 3 до около 6 часов.
[0046] В некоторых вариантах осуществления соединение, как описано в данном документе, взаимодействует с первой областью, содержащей L115, L118, V127 и М143 киназы MEK.
[0047] В некоторых вариантах осуществления соединение взаимодействует со второй областью, содержащей K97 киназы MEK.
[0048] В некоторых вариантах осуществления соединение, как описано в данном документе, взаимодействует с третьей областью, содержащей S212, I215 и М219 киназы MEK.
[0049] В некоторых вариантах осуществления в данном документе описан способ разработки молекул, основанный на оценке и балансе двух нижерасположенных молекулярных мишеней.
[0050] В некоторых вариантах осуществления указанный способ может включать введение соединения, нацеленного на pERK (T202/Y204) и pSTAT3(S727).
[0051] В некоторых вариантах осуществления в данном документе описан способ предотвращения повторной активации MEK посредством обхода CRAF.
[0052] В некоторых вариантах осуществления указанный способ может включать введение эффективного количества любого из соединений или фармацевтической композиции, как описано в данном документе.
[0053] В некоторых вариантах осуществления в данном документе описан способ разработки лекарственного терапевтического окна для двойных ингибиторов RAF/MEK.
[0054] В некоторых вариантах осуществления указанный способ может включать введение терапевтического агента с периодом полувыведения из плазмы менее 12 часов, введение дозы 1 р/д или 2 р/д, устойчивость к реактивации MEK путем обхода CRAF и оптимальный метаболический баланс между ингибированием pERK и pSTAT3(S727).
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0055] Фиг. 1 демонстрирует соотношение «pERK(Т202/Y204):общий-ERK» и «pSTAT3(S727):общий-STAT3» при раке легкого с мутацией А549 KRAS для Эталона-1, Эталона-2, Соединения (Соед)-7, Соединения-10, Соединения-9, Соединения-11, Соединения-12, Соединения-13, Соединения-14, Соединения-15 и Соединения-16.
[0056] Фиг. 2 демонстрирует обход CRAF посредством повышенных соотношений «pMEK:общий-MEK» при раке легкого с мутацией А549 KRAS после лечения выбранными эталонными ингибиторами MEK.
[0057] Фиг. 3 демонстрирует результаты фармакокинетики икроножной мышцы (PK) для одного момента времени 2 часа в модели опухоли С26 для Эталона-1, Эталона-2, Соединения-7, Соединения-10, Соединения-9, Соединения-11, Соединения-12, Соединения-13, Соединения-14, Соединения-15 и Соединения-16.
[0058] Фиг. 4 демонстрирует результаты опухолевой фармакокинетики (PK) для одного момента времени 2 часа в модели опухоли С26 для Эталона-1, Эталона-2, Соединения-7, Соединения-10, Соединения-9, Соединения-11, Соединения-12, Соединения-13, Соединения-14, Соединения-15 и Соединения-16.
[0059] Фиг. 5 демонстрирует результаты фармакокинетики (PK) плазмы для одного момента времени 2 часа в модели опухоли С26 для Эталона-1, Эталона-2, Соединения-7, Соединения-10, Соединения-9, Соединения-11, Соединения-12, Соединения-13, Соединения-14, Соединения-15 и Соединения-16.
[0060] Фиг. 6 демонстрирует результаты печеночной фармакокинетики (PK) для одного момента времени 2 часа в модели опухоли С26 для Эталона-1, Эталона-2, Соединения-7, Соединения-10, Соединения-9, Соединения-11, Соединения-12, Соединения-13, Соединения-14, Соединения-15 и Соединения-16.
[0061] Фиг. 7А демонстрирует сравнительное исследование MTD, несущего опухоль С26, между Эталоном-1 и Соединением-9 в дозе 100 мг/кг 1 р/д.
[0062] Фиг. 7В демонстрирует сравнительное исследование MTD, несущего опухоль С26, между Соединением 13 и Соединением 14 в дозе 100 мг/кг 1 р/д.
[0063] Фиг. 8А демонстрирует сравнительное исследование MTD, несущего опухоль С26, между Эталоном-1 и Соединением-9 в дозе 100 мг/кг 2 р/д.
[0064] Фиг. 8В демонстрирует сравнительное исследование MTD, несущего опухоль С26, между Соединением-13 и Соединением-14 в дозе 100 мг/кг 2 р/д.
[0065] Фиг. 9 демонстрирует ответ на дозу А549 (KRAS-G12S) pERK.
[0066] Фиг. 10 демонстрирует график модели опухоли-26 толстой кишки относительно эффективности и безопасности KRAS G12D CRC..
[0067] Фиг. 11А демонстрирует график роста опухоли в С-26 фармакологическом исследовании KRAS G12D CRC; Фиг. 11В иллюстрирует график потери веса в С-26 фармакологическом исследовании KRAS G12D CRC.
[0068] Фиг. 12 демонстрирует график активности в CRC модели мутантной опухоли толстой кишки-26 KRAS.
[0069] Фиг. 13 демонстрирует график устойчивости двойного RAF/MEK обходу CRAF.
[0070] Фиг. 14А демонстрирует график временной зависимости «двойной RAF/MEK: обход CRAF» для «А459 KRAS pERK:общий ERK»; Фиг. 14В демонстрирует соотношение «pMEK:общий MEK» в NSCLC-модели А549 KRAS(G12S).
[0071] Фиг. 15А демонстрирует график «pERK:общий ERK (активация)» в модели меланомы А375 с мутацией BRAF V600E; Фиг. 15В демонстрирует соотношение «pERK:общий ERK» в KRAS G12S мутантной А549-модели и парадоксальную активацию ингибитором RAF.
[0072] Фиг. 16 демонстрирует график фармакокинетического профиля разовой дозы в плазме.
[0073] Фиг. 17 демонстрирует график фармакокинетического профиля разовой дозы в CRC-модели опухоли толстой кишки-26.
[0074] Фиг. 18 демонстрирует график относительной массы тела с поправкой на объем опухоли в NSCLC-модели А549.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0075] В некоторых вариантах осуществления предлагаются ингибиторы MEK. Различные варианты осуществления этих соединений включают соединения, имеющие структуру Формулы I, как описано в данном документе, или их фармацевтически приемлемые соли. В некоторых вариантах осуществления предлагаются пролекарства, метаболиты, стереоизомеры, гидраты, сольваты, полиморфы и фармацевтически приемлемые соли соединений, описанных в данным документе.
[0076] В определенных аспектах данного изобретения предлагаются терапевтические способы или применения для лечения, предотвращения или облегчения заболевания или патологического состояния у субъекта, при этом эти способы включают введение субъекту по меньшей мере одного соединения, описанного в данном документе. В некоторых вариантах осуществления предлагаются терапевтические способы или применения для лечения, профилактики или облегчения течения рака, включающие введение соединения, имеющего структуры Формул (I), (Ia), (Ib), (Ic), (Id) (II), (IIa), (IIb), (IIc) или (IId), как описано в данном документе. В некоторых вариантах осуществления предлагаются терапевтические способы или применения для лечения для лечения раковой кахексии, включающие введение соединения, имеющего структуры Формул (I), (Ia), (Ib), (Ic), (Id) (II), (IIa), (IIb), (IIc) или (IId), как описано в данном документе.
Определения
[0077] Если явно не указано иное, используемые в данном документе технические и/или научные термины имеют то же значение, которое обычно понимается специалистом в данной области техники. В случае наличия множества определений термина в данном документе преимущественную силу имеют те из них, которые даны в этом разделе, если не указано иное. Использование в данном описании и в прилагаемой формуле изобретения форм единственного числа включает ссылку на множественное число, если в контексте явно не указано иное. Если не указано иное, используются традиционные методы масс-спектроскопии, ЯМР, HPLC, химии белков, биохимии и фармакологии. Использование союза «или» или «и» означает «и/или», если не указано иное. Кроме того, использование термина «включая», а также других форм, таких как «включать», «включает» и «включено», не является ограничивающим. В контексте данного документа, будь то в переходной фразе или в основной части формулы изобретения, термины «содержит» и «содержащий» следует интерпретировать как имеющие неограниченные значения. То есть термины должны толковаться как синонимы фраз «имеющий по меньшей мере» или «включающий по меньшей мере». При использовании в контексте процесса, термин «содержащий» означает, что процесс включает по меньшей мере перечисленные этапы, но может включать и дополнительные этапы. При использовании в контексте соединения, композиции или устройства, термин «содержащий» означает, что соединение, композиция или устройство включает по меньшей мере перечисленные признаки или компоненты, но может также включать дополнительные признаки или компоненты.
[0078] Хотя изобретение было проиллюстрировано и подробно описано в предшествующем описании, такое описание следует рассматривать как иллюстративное или типовое, а не ограничительное. Данное изобретение не ограничивается описанными вариантами осуществления. Другие варианты описанных вариантов осуществления могут быть поняты и осуществлены специалистами в данной области техники при практическом применении заявленного изобретения на основе изучения описания и прилагаемой формулы изобретения.
[0079] Что касается использования в данном документе по существу любых терминов во множественном и/или единственном числе, специалисты в данной области техники могут перевести множественное число в единственное число и/или единственное число во множественное число в зависимости от контекста и/или применения. Различные перестановки в единственном/множественном числе могут быть явно изложены в данном документе для ясности. В некоторых случаях единственное число не исключает множественного числа. Тот факт, что определенные варианты изложены во взаимно различных зависимых пунктах формулы изобретения, не означает, что комбинация этих вариантов не может использоваться с преимуществом.
[0080] Все ссылки, цитируемые в данном документе, включены в данный документ посредством ссылки в полном объеме. В тех случаях, когда публикации и патенты или заявки на патенты, включенные посредством ссылки, противоречат описанию, содержащемуся в спецификации, указанная спецификация предназначена для замены и/или приоритета над любым таким противоречащим материалом.
[0081] Если не указано иное, всем терминам (включая технические и научные термины) следует придавать их обычное и общепринятое значение специалисту в данной области техники, и они не должны ограничиваться специальным или индивидуальным значением, если это прямо не определено в данном документе. Следует отметить, что использование конкретной терминологии при описании определенных признаков или аспектов данного изобретения не должно означать, что терминология переопределяется в данном документе, чтобы ограничить ее включением любых конкретных характеристик признаков или аспектов данного изобретения, с которым связана эта терминология.
[0082] Когда указан диапазон значений, подразумевается, что верхний и нижний пределы и каждое промежуточное значение между верхним и нижним пределами диапазона охватываются вариантами осуществления.
[0083] В контексте данного документа термин «пролекарство» относится к агенту, который превращается в исходное лекарственное средство in vivo. Пролекарства часто являются полезными, потому что в некоторых ситуациях их легче вводить, чем исходное лекарственное средство. Пролекарства могут, например, быть биодоступными при пероральном введении, в отличие от исходного лекарственного средства. Пролекарство также может иметь улучшенную растворимость в фармацевтических композициях по сравнению с исходным лекарственным средством. Примером, без ограничения, Пролекарства может быть соединение, которое вводят в виде сложного эфира («пролекарство») для облегчения переноса через клеточную мембрану, кода растворимость в воде препятствует подвижности, который затем метаболически гидролизуется до карбоновой кислоты, активного объекта, внутри клетки, где растворимость в воде является полезной. Еще одним примером Пролекарства может быть короткий пептид (полиаминокислота), связанный с кислотной группой, при этом указанный пептид метаболизируется, чтобы выявить активный фрагмент. Обычные процедуры выбора и получения пригодных производных пролекарств описаны, например, в публикации Design of Prodrugs, (ed. H. Bundgaard, Elsevier, 1985), которая полностью включена в данный документ посредством ссылки.
[0084] Метаболиты соединений, описанных в данном документе, включают активные соединения, которые образуются при введении соединений в биологическую среду.
[0085] Описанные в данном документе соединения, имеющие по меньшей мере один хиральный центр, могут существовать в виде рацемата или в виде каждого энантиомера, а могут существовать в виде энантиомерически обогащенных смесей энантиомеров. Следует отметить, что все такие изомеры и их смеси входят в объем данного изобретения. Кроме того, кристаллические формы соединений, описанных в данном документе, могут существовать в виде альтернативных полиморфов. Такие полиморфы включены в один из вариантов осуществления данного изобретения. Кроме того, некоторые из соединений по данному изобретению могут образовывать сольваты с водой (т.е. гидраты) или с обычными органическими растворителями. Такие сольваты включены в один из вариантов осуществления данного изобретения.
[0086] В контексте данного документа термин «фармацевтически приемлемая соль» относится к соли соединения, которая не вызывает значительного раздражения организма, в который ее вводят, и не отменяет биологическую активность и свойства соединения. В некоторых вариантах осуществления указанная соль представляет собой кислотно-аддитивную соль соединения. Фармацевтические соли могут быть получены в результате реакции соединения с неорганическими кислотами, такими как галогенводородная кислота (например, соляная кислота или бромистоводородная кислота), серная кислота, азотная кислота, фосфорная кислота и т.п. Фармацевтические соли также могут быть получены в результате реакции соединения с органической кислотой, такой как алифатическая или ароматическая карбоновая или сульфоновая кислота, например, уксусная, янтарная, молочная, яблочная, винная, лимонная, аскорбиновая, никотиновая, метансульфокислота, этансульфокислота, р-толуолсульфокислота, салициловая или нафталинсульфокислота. Фармацевтические соли также могут быть получены путем взаимодействия соединения с основанием с образованием соли, такой как соль аммония, соль щелочного металла, такого как соль натрия или калия, соль щелочноземельного металла, такая как кальциевая или магниевая соль, соль органических оснований, таких как дициклогексиламин, N-метил-D-глюкамин, трис(гидроксиметил)метиламин, C1-C7 алкиламин, циклогексиламин, триэтаноламин, этилендиамин, и соли с аминокислотами, такими как аргинин, лизин и т.п.
[0087] Если изготовление фармацевтических составов включает тщательное смешивание фармацевтических эксципиентов и активного ингредиента в форме его соли, то может быть желательным применять фармацевтические эксципиенты, которые не являются основными, то есть являются либо кислотными или нейтральными эксципиентами.
[0088] В различных вариантах осуществления соединения, описанные в данном документе, можно применять отдельно, в комбинации с другими соединениями, описанными в данном документе, или в комбинации с одним или большим количеством других агентов, действующими в терапевтических областях, описанных в данном документе.
[0089] В контексте данного документа термин «атом галогена» означает любой из радиостабильных атомов столбца 7 Периодической таблицы элементов, например, фтор, хлор, бром или йод, при этом фтор и хлор являются предпочтительными.
[0090] В контексте данного документа термин «сложный эфир» относится к химическому фрагменту с формулой -(R)n-COOR', где R и R' независимо выбраны из группы, состоящей из алкила, циклоалкила, арила, гетероарила (связанного через кольцевой углерод) и гетероалициклической группы (связанной через кольцевой углерод), и где n равно 0 или 1.
[0091] В контексте данного документа термин «амид» относится к химическому фрагменту с формулой -(R)n-C(O)NHR' или -(R)n-NHC(O)R', где R и R' независимо выбраны из группы, состоящей из алкила, циклоалкила, арила, гетероарила (связанного через кольцевой углерод) и гетероалициклической группы (связанной через кольцевой углерод), и где n равно 0 или 1. Амид может представлять собой молекулу аминокислоты или пептида, присоединенную к молекуле по данному изобретению, таким образом образуя пролекарство.
[0092] Любая аминовая, гидроксильная или карбоксильная боковая цепь соединений, описанных в данном документе, может быть этерифицирована или амидирована. Процедуры и конкретные группы, применяемые для достижения этой цели, известны специалистам в данной области техники и могут быть легко найдены в справочных источниках, таких как Greene and Wilts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley & Sons, New York, NY, 1999, которые включены в данный документ в полном объеме посредством ссылки.
[0093] В контексте данного документа термин «ароматический» относится к ароматической группе, которая имеет по меньшей мере одно кольцо, имеющее сопряженную пи-электронную систему, и включает как карбоциклические арильные (например, фенильные), так и гетероциклические арильные группы (например, пиридин). Этот термин включает моно циклические или содержащие конденсированные кольца полициклические (т.е. кольца с общими соседними парами атомов углерода) группы. Термин «карбоциклический» относится к соединению, которое содержит одну или большее количество ковалентно замкнутых кольцевых структур, и все атомы, образующие основу кольца, представляют собой атомы углерода. Таким образом, этот термин отличает карбоциклические кольца от гетероциклических, в которых основная цепь кольца содержит по меньшей мере один атом, отличный от углерода. Термин «гетероароматический» относится к ароматической группе, которая содержит по меньшей мере одно гетероциклическое кольцо.
[0094] В контексте данного документа «от Са до Cb» где «а» и «b» представляют собой целые числа, относятся к числу атомов углерода в алкильной, алкенильной или алкинильной группе или к числу атомов углерода в кольце циклоалкильной, арильной, гетероарильной или гетероциклильной группы. То есть алкил, алкенил, алкинил, кольцо циклоалкила, кольцо арила, кольцо гетероарила или кольцо гетероциклила могут содержать от «а» до «b» включительно атомов углерода. Так, например, группа «от C1 до С4алкил» или «С1-С4алкил» относится ко всем алкильным группам, имеющим от 1 до 4 атомов углерода, то есть, СН3-, CH3CH2-, CH3CH2CH2-, (СН3)2СН-, CH3CH2CH2CH2-, CH3CH2CH(СН3)- и (СН3)3С-. Подобным образом, например, циклоалкильная группа может содержать от «а» до «b» включительно, общее число атомов, например, С3-C8 циклоалкильная группа, от 3 до 8 атомов углерода в кольце(кольцах). Если в отношении алкила, циклоалкила или циклоалкенила не заданы «а» и «b», следует исходить из самого широкого диапазона, описанного в этих определениях. Аналогично, «4-7-членный гетероциклил» относится ко всем гетероциклильным группам с общим числом атомов в кольце от 4 до 7, например, азетидин, оксетан, оксазолин, пирролидин, пиперидин, пиперазин, морфолин и т.п. В контексте данного документа термин «C1-C6» включает C1, C2, С3, С4, С5 и С6, а также диапазон, определяемый любым из двух предыдущих чисел. Например, C1-C6 алкил включает C1, C2, С3, C4, C5 и С6 алкил, C2-C6 алкил, C1-С3 алкил и т.п. Аналогично, C3-C8 карбоциклил или циклоалкил, каждый из которых включает углеводородное кольцо, содержащее 3, 4, 5, 6, 7 и 8 атомов углерода, или диапазон, определяемый любым из двух чисел, например, С3-С7 циклоалкил или С5-С6 циклоалкил. В качестве другого примера, 3-10-членный гетероциклил включает 3, 4, 5, 6, 7, 8, 9 или 10 атомов в кольце или диапазон, определяемый любым из двух предшествующих чисел, например, 4-6-членный или 5-7-членный гетероциклил.
[0095] В контексте данного документа термин «алкил» относится к полностью насыщенной (без двойных или тройных связей) углеводородной группе с прямой или разветвленной углеводородной цепью. Алкильная группа может иметь от 1 до 20 атомов углерода (всякий раз, когда она появляется в данном документе, числовой диапазон, такой как «1-20», относится к каждому целому числу в данном диапазоне, например, «от 1 до 20 атомов углерода» означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода и т.д., вплоть до 20 атомов углерода, хотя настоящее определение также охватывает появление термина «алкил» в случае, если не обозначен числовой диапазон). Алкильная группа также может представлять собой алкил среднего размера, имеющий от 1 до 10 атомов углерода. Алкильная группа также может представлять собой низший алкил, имеющий от 1 до 5 атомов углерода. Алкильная группа соединений может быть обозначена как «C1-C4 алкил» или с помощью аналогичных обозначений. Исключительно в качестве примера термин «C1-C4 алкил» указывает на то, что в алкильной цепи присутствует от одного до четырех атомов углерода, т.е. алкильная цепь выбрана из группы, состоящей из метила, этила, пропила, изопропила, n-бутила, изобутила, втор-бутила и трет-бутила. Типичные алкильные группы включают без ограничения метил, этил, пропил, изопропил, бутил, изобутил, третичный бутил, пентил, гексил, этенил, пропенил, бутенил и т.п.
[0096] Алкильная группа может быть замещенной или незамещенной. При замещении, заместительная группа (группы) представляет(-ют) собой одну или большее количество групп, индивидуально и независимо выбранных из алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкинила, арила, гетероарила, гетероалициклила, аралкила, гетероаралкила, (гетероалициклил)алкила, гидрокси, защищенного гидроксила, алкокси, арилокси, ацила, сложного эфира, меркапто, алкилтио, арилтио, циано, галогена, карбонила, тиокарбонила, O-карбамила, N-карбамила, O-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, S-сульфонамидо, N-сульфонамидо, С-карбокси, защищенного С-карбокси, O-карбокси, изоцианато, тиоцианато, изотиоцианато, нитро, силила, сульфенила, сульфинила, сульфонила, галоалкила, галоалкокси, тригалометансульфонила, тригалометансульфонамидо и амино, включая моно- и дизамещенные аминогруппы и их защищенные производные. Когда заместитель описан как «необязательно замещенный», этот заместитель может быть замещен одним из вышеуказанных заместителей.
[0097] В контексте данного документа термин «алкенил» относится к алкильной группе, которая в прямой или разветвленной углеводородной цепи содержит одну или большее количество двойных связей. Алкенильная группа может быть незамещенной или замещенной. При замещении заместители могут быть выбраны из групп, описанных выше, по отношению к замещению алкильной группы. Алкенильная группа может иметь от 2 до 20 атомов углерода, хотя настоящее определение также охватывает использование термина «алкенил», когда не указан числовой диапазон. Алкенильная группа также может представлять собой алкенил среднего размера, имеющий от 2 до 9 атомов углерода. Алкенильная группа также может представлять собой низший алкенил, имеющий от 2 до 4 атомов углерода. Алкенильная группа соединений может быть обозначена как «С2-4 алкенил» или с помощью аналогичных обозначений. Только в качестве примера, «С2-4 алкенил» означает, что в алкенильной цепи имеется от двух до четырех атомов углерода, т.е. алкенильная цепь выбрана из группы, состоящей из этенила, пропен-1-ила, пропен-2-ила, пропен-3-ила, бутен-1-ила, бутен-2-ила, бутен-3-ила, бутен-4-ила, 1-метилпропен-1-ила, 2-метилпропен-1-ила, 1-этилэтен-1-ила, 2-метилпропен-3-ила, бута-1,3-диенила, бута-1,2-диенила и бута-1,2-диен-4-ила. Типовые алкенильные группы включают, помимо прочего, этенил, пропенил, бутенил, пентенил и гексенил и т.п.
[0098] В контексте данного документа термин «алкинил» относится к алкильной группе, которая в прямой или разветвленной углеводородной цепи содержит одну или большее количество тройных связей. Алкинильная группа может быть незамещенной или замещенной. При замещении заместители могут быть выбраны из групп, описанных выше, по отношению к замещению алкильной группы. Алкинильная группа может иметь от 2 до 20 атомов углерода, хотя настоящее определение также охватывает использование термина «алкинил», когда не указан числовой диапазон. Алкинильная группа также может представлять собой алкинил среднего размера, имеющий от 2 до 9 атомов углерода. Алкинильная группа также может представлять собой низший алкинил, имеющий от 2 до 4 атомов углерода. Алкинильная группа соединений может быть обозначена как «C2-4 алкинил» или с помощью аналогичных обозначений. Только в качестве примера, «C2-4 алкинил» означает, что в алкинильной цепи имеется от двух до четырех атомов углерода, т.е. алкинильная цепь выбрана из группы, состоящей из этинила, пропин-1-ила, пропин-2-ила, бутин-1-ил, бутин-3-ила, бутин-4-ила и 2-бутинила. Типовые алкинильные группы включают, помимо прочего, этинил, пропинил, бутинил, пентинил и гексинил и т.п.
[0099] В контексте данного документа термин «гетероалкил» относится к прямой или разветвленной углеводородной цепи, содержащей один или большее количество гетероатомов, то есть элемент, отличный от углерода, включая, помимо прочего, азот, кислород и серу в основной цепи. Гетероалкильная группа может иметь от 1 до 20 атомов углерода, хотя настоящее определение также охватывает использование термина «гетероалкил», когда не указан числовой диапазон. Гетероалкильная группа также может представлять собой гетероалкил среднего размера, имеющий от 1 до 9 атомов углерода. Гетероалкильная группа также может представлять собой низший гетероалкил, имеющий от 1 до 4 атомов углерода. Гетероалкильная группа соединений может быть обозначена как «C1-4 гетероалкил» или с помощью аналогичных обозначений. Гетероалкильная группа может содержать один или большее количество гетероатомов. Только в качестве примера, «C1-4 гетероалкил» указывает, что в гетероалкильной цепи имеется от одного до четырех атомов углерода и дополнительно один или большее количество гетероатомов в основной цепи.
[0100] В контексте данного документа термин «арил» относится к карбоциклическому (цельноуглеродному) кольцу или к двум или большему количеству сочлененных колец (кольца, которые имеют два смежных атома углерода), которые имеют полностью делокализованную систему пи-электронов. Примеры арильных групп включают, помимо прочего, бензол, нафталин и азулен. Арильная группа может быть замещенной или незамещенной. При замещении, атомы водорода заменены заместительной(ыми) группой(ами), которая(ые) представляет(ют) собой одну или большее количество групп, независимо выбранных из алкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкинила, арила, гетероарила, гетероалициклила, аралкила, гетероаралкила, (гетероалициклил)алкила, гидрокси, защищенного гидроксила, алкокси, арилокси, ацила, сложного эфира, меркапто, алкилтио, арилтио, циано, галогена, карбонила, тиокарбонила, O-карбамила, N-карбамила, O-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, S-сульфонамидо, N-сульфонамидо, С-карбокси, защищенного С-карбокси, O-карбокси, изоцианато, тиоцианато, изотиоцианато, нитро, силила, сульфенила, сульфинила, сульфонила, галоалкила, галоалкокси, тригалометансульфонила, тригалометансульфонамидо и амино, включая моно- и дизамещенные аминогруппы и их защищенные производные. При замещении, заместители на арильной группе могут образовывать неароматическое кольцо, конденсированное с арильной группой, включая циклоалкил, циклоалкенил, циклоалкинил и гетероциклил.
[0101] В контексте настоящего документа термин «гетероарил» относится к моноциклической или полициклической ароматической кольцевой системе (кольцевой системе с полностью делокализованной системой пи-электронов), одному или двум или большему количеству конденсированных колец, которые содержат один или большее количество гетероатомов, то есть элемент, отличный от углерода, включая, помимо прочего, азот, кислород и серу. Примеры гетероарильных колец включают, помимо прочего, фуран, тиофен, фталазин, пиррол, оксазол, тиазол, имидазол, пиразол, изоксазол, изотиазол, триазол, тиадиазол, пиридин, пиридазин, пиримидин, пиразин и триазин. Гетероарильная группа может быть замещенной или незамещенной. При замещении, атомы водорода заменены заместительной(ыми) группой(ами), которая(ые) представляет(ют) собой одну или большее количество групп, независимо выбранных из алкила, алкенила, алкинила, циклоалкила, цикло алкенила, циклоалкинила, арила, гетероарила, гетероалициклила, аралкила, гетероаралкила, (гетероалициклил)алкила, гидрокси, защищенного гидроксила, алкокси, арилокси, ацила, сложного эфира, меркапто, алкилтио, арилтио, циано, галогена, карбонила, тиокарбонила, O-карбамила, N-карбамила, O-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, S-сульфонамидо, N-сульфонамидо, С-карбокси, защищенного С-карбокси, O-карбокси, изоцианато, тиоцианато, изотиоцианато, нитро, силила, сульфенила, сульфинила, сульфонила, галоалкила, галоалкокси, тригалометансульфонила, тригалометансульфонамидо и амино, включая моно- и дизамещенные аминогруппы и их защищенные производные. При замещении, заместители на гетероарильной группе могут образовывать неароматическое кольцо, конденсированное с арильной группой, включая циклоалкил, циклоалкенил, циклоалкинил и гетероциклил.
[0102] В контексте данного документа термин «аралкил» или «арилалкил» относится к арильной группе, присоединенной в качестве заместителя через алкиленовую группу. Алкиленовая и арильная группа аралкила может быть замещенной или незамещенной. Примеры включают, помимо прочего, бензил, замещенный бензил, 2-фенилэтил, 3-фенилпропил и нафтилалкил. В некоторых случаях алкиленовая группа представляет собой низшую алкиленовую группу.
[0103] В контексте данного документа термин «гетероаралкил» или «гетероарилалкил» представляет собой гетероарильную группу, присоединенную в качестве заместителя через алкиленовую группу. Алкиленовая и гетероарильная группа гетероаралкила может быть замещенной или незамещенной. Примеры включают, помимо прочего, 2-тиенилметил, 3-тиенилметил, фурилметил, тиенилэтил, пирролилалкил, пиридилалкил, изоксазолилалкил и имидазолилалкил, а также их замещенные и бензо-конденсированные аналоги. В некоторых случаях алкиленовая группа представляет собой низшую алкиленовую группу.
[0104] В контексте данного документа термин «алкилен» относится к разветвленной или прямой цепи полностью насыщенного дирадикала, содержащего только углерод и водород, который присоединен к остальной части молекулы через две точки присоединения (т.е. алкандиил). Алкиленовая группа может иметь от 1 до 20 атомов углерода, хотя настоящее определение также охватывает использование термина «алкилен», когда не указан числовой диапазон. Алкиленовая группа также может представлять собой алкилен среднего размера, имеющий от 1 до 9 атомов углерода. Алкиленовая группа также может представлять собой низший алкилен, имеющий от 1 до 4 атомов углерода. Алкиленовая группа может быть обозначена как «C1-4 алкилен» или с помощью аналогичных обозначений. Только в качестве примера, «C1-4 алкилен» означает, что в алкиленовой цепи имеется от одного до четырех атомов углерода, т.е. алкиленовая цепь выбрана из группы, состоящей из метилена, этилена, этан-1,1-диила, пропилена, пропан-1,1-диила, пропан-2,2-диила, 1-метилэтилена, бутилена, бутан-1,1-диила, бутан-2,2-диила, 2-метил-пропан-1,1-диила, 1-метилпр опилена, 2-метилпропилена, 1,1-диметилэтилена, 1,2-диметилэтиленаи 1-этилэтилена.
[0105] В контексте данного документа термин «алкенилен» относится к дирадикальной химической группе с прямой или разветвленной цепью, содержащей только углерод и водород, а также содержащей по меньшей мере одну углерод-углеродную двойную связь, которая присоединена к остальной части молекулы через две точки присоединения. Алкениленовая группа может иметь от 2 до 20 атомов углерода, хотя настоящее определение также охватывает использование термина «алкенилен», когда не указан числовой диапазон. Алкениленовая группа также может представлять собой алкенилен среднего размера, имеющий от 2 до 9 атомов углерода. Алкениленовая группа также может представлять собой низший алкенилен, имеющий от 2 до 4 атомов углерода. Алкениленовая группа может быть обозначена как «С2-4 алкенилен» или с помощью аналогичных обозначений. Только в качестве примера, «С2-4 алкенилен» означает, что в алкениленовой цепи имеется от двух до четырех атомов углерода, т.е. алкениленовая цепь выбрана из группы, состоящей из этенилена, этен-1,1-диила, пропенилена, пропен-1,1-диила, проп-2-ен-1,1-диила, 1-метилэтенилена, бут-1-енилена, бут-2-енилена, бут-1,3-диенилена, бутен-1,1-диила, бут-1,3-диен-1,1-диила, бут-2-ен-1,1-диила, бут-3-ен-1,1-диила, 1-метил-проп-2-ен-1,1-диила, 2-метил-проп-2-ен-1,1-диила, 1-этилэтенилена, 1,2-диметилэтенилена, 1-метилпропенилена, 2-метилпропенилена, 3-метилпропенилена, 2-метилпропен-1,1-диила и 2,2-диметилэтен-1,1-диила.
[0106] В контексте данного документа термин «алкилиден» относится к двухвалентной группе, такой как =CR'R'', которая присоединена к одному углероду другой группы, образуя двойную связь, алкилиденовые группы включают, помимо прочего, метилиден (=CH2) и этилиден (=СНСН3). В контексте данного документа термин «арилалкилиден» относится к алкилиденовой группе, в которой R' и R'' представляет собой арильную группу. Алкилиденовая группа может быть замещенной или незамещенной.
[0107] В контексте данного документа термин «алкокси» относится к формуле -OR, где R представляет собой алкил, определенный выше, например метокси, этокси, n-пропокси, 1-метилэтокси (изопропокси), n-бутокси, изобутокси, втор-бутокси, трет-бутокси, амокси, трет-амокси и т.п. Алкокси-группа может быть замещенной или незамещенной.
[0108] В контексте данного документа термин «алкилтио» относится к формуле -SR, где R представляет собой алкил, как определено выше, например, метилмеркапто, этилмеркапто, n-пропилмеркапто, 1-метилэтилмеркапто (изопропилмеркапто), n-бутилмеркапто, изобутилмеркапто, втор-бутилмеркапто, трет-бутилмеркапто и т.п. Алкилтио-группа может быть замещенной или незамещенной.
[0109] В контексте данного документа термины «арилокси» и «арилтио» относятся к RO- и RS-, соответственно, где R представляет собой арил, такой как, помимо прочего, фенил. Как арилоксил, так и арилтио могут быть замещенными или незамещенными.
[0110] В контексте данного документа термин «ацил» относится к -C(=O)R, где R представляет собой водород, C1-6 алкил, C1-6 алкенил, C2-6 алкинил, С3-7 карбоциклил, арил, 5-10-членный гетероарил и 5-10-членный гетероциклил, как определено в данном документе. Неограничивающие примеры включают формил, ацетил, пропаноил, бензоил и акрил.
[0111] В контексте данного документа термин «циклоалкил» относится к полностью насыщенной (отсутствуют двойные связи) моно- или полициклической углеводородной кольцевой системе. При наличии двух или большего количества колец, эти кольца могут быть соединены вместе в конденсированную, соединенную мостиковой связью или спирокольцевую систему. Циклоалкильные группы могут варьироваться от С3 до С10, в других вариантах осуществления они варьироваться от С3 до С6. Циклоалкильная группа может быть незамещенной или замещенной. Типовые циклоалкильные группы включают, помимо прочего, циклопропил, циклобутил, циклопентил, циклогексил и т.п. В случае замещения, заместитель(-и) может(-гут) представлять собой алкил или выбранный из вышеуказанных по отношению к замещению алкильной группы, если не указано иное. При замещении заместители на циклоалкильной группе могут образовывать ароматическое кольцо, конденсированное с циклоалкильной группой, включая арил и гетероарил.
[0112] В контексте данного документа термин «циклоалкенил» относится к циклоалкильной группе, которая содержит одну или большее количество двойных связей в кольце, однако если таких связей присутствует больше одной, они не могут образовать полностью делокализованную систему пи-электронов в кольце (в противном случае группа будет «арильной», как определено в данном документе). При наличии двух или большего количества колец, эти кольца могут быть связаны вместе в конденсированную, соединенную мостиковой связью или спирокольцевую систему. Циклоалкенильная группа может быть незамещенной или замещенной. При замещении, заместитель(-и) может(-гут) представлять собой арил или быть выбран(-ы) из групп, описанных выше, по отношению к замещению алкильной группы, если не указано иное. При замещении заместители на цикло алкенильной группе могут образовывать ароматическое кольцо, конденсированное с цикло алкенильной группой, включая арил и гетероарил.
[0113] В контексте данного документа термин «циклоалкинил» относится к циклоалкильной группе, которая содержит одну или большее количество тройных связей в кольце. При наличии двух или большего количества колец, эти кольца могут быть соединены вместе в конденсированную, соединенную мостиковой связью или спирокольцевую систему. Циклоалкинильная группа может быть незамещенной или замещенной. При замещении, заместитель(-и) может(-гут) представлять собой арил или быть выбран(-ы) из групп, описанных выше, по отношению к замещению алкильной группы, если не указано иное. При замещении, заместители на циклоалкильной группе могут образовывать ароматическое кольцо, конденсированное с циклоалкинильной группой, включая арил и гетероарил.
[0114] В контексте данного документа «гетероалициклический» или «гетероалициклил» относится к стабильному 3-18-членному кольцу, которое состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы. «Гетероалициклический» или «гетероалициклильный» может представлять собой моноциклическую, бициклическую, трициклическую или тетрациклическую систему колец, которые могут быть соединены в конденсированную, соединенную мостиковой связью или спирокольцевую систему; атомы азота, углерода и серы в «гетероалициклиле» или «гетероалициклиле» могут быть необязательно окислены; азот может быть необязательно кватернизован; и кольца могут также содержать одну или большее количество двойных связей при условии, что они не образуют полностью делокализованную пи-электронную систему во всех кольцах. Гетероалициклильные группы могут быть незамещенными или замещенными. При замещении, заместитель(и) может представлять собой одну или большее количество групп, независимо выбранных из группы, состоящей из алкила, алкенила, алкинила, циклоалкила, циклоалкенила, циклоалкинила, арила, гетероарила, гетероалициклила, аралкила, гетероаралкила, (гетероалициклил)алкила, гидрокси, защищенного гидроксила, алкокси, арилокси, ацила, сложного эфира, меркапто, алкилтио, арилтио, циано, галогена, карбонила, тиокарбонила, O-карбамила, N-карбамила, O-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, S-сульфонамидо, N-сульфонамидо, С-карбокси, защищенного С-карбокси, O-карбокси, изоцианато, тиоцианато, изотиоцианато, нитро, силила, галоалкила, галоалкокси, тригалометансульфонила, тригалометансульфонамидо и амино, включая моно- и дизамещенные аминогруппы и их защищенные производные. Примеры таких «гетероалициклических» или «гетероалициклильных» групп включают, помимо прочего, азепинил, акридинил, карбазолил, циннолинил, диоксоланил, имидазолинил, морфолинил, оксиранил, N-оксид пиперидинила, пиперидинил, пиперазинил, пирролидинил, 4-пиперидонил, пиразолидинил, 2-оксопирролидинил, тиаморфолинил, тиаморфолинилсульфоксид и тиаморфолинилсульфоксид. При замещении, заместители на гетероалициклильной группе могут образовывать ароматическое кольцо, конденсированное с гетероалициклильной группой, включая арил и гетероарил.
[0115] В контексте данного документа термин «(циклоалкенил)алкил» относится к циклоалкенильной группе, присоединенной в качестве заместителя через алкиленовую группу. Алкилен и циклоалкенил в (циклоалкенил)алкиле могут быть замещенными или незамещенными. В некоторых случаях алкиленовая группа представляет собой низшую алкиленовую группу.
[0116] В контексте данного документа термин «(циклоалкинил)алкил» относится к циклоалкинильной группе, присоединенной в качестве заместителя через алкиленовую группу. Алкилен и циклоалкинил в (циклоалкинил)алкиле могут быть замещенными или незамещенными. В некоторых случаях алкиленовая группа представляет собой низшую алкиленовую группу.
[0117] В контексте данного документа термин «O-карбокси-группа» относится к «RC(=O)O-» группе, где R может представлять собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероарил, гетероалициклил, аралкил или (гетероалициклил)алкил, как определено в настоящем документе. O-карбокси-группа может быть замещенной или незамещенной.
[0118] В контексте данного документа термин «С-карбокси-группа» относится к группе «-C(=O)R», где R соответствует определению по отношению к O-карбокси. С-карбокси-группа может быть замещенной или незамещенной.
[0119] В контексте данного документа термин «тригалометансульфонил» относится к группе «X3CSO2-», где Х представляет собой галоген.
[0120] В контексте данного документа термин «циано» относится к группе «-CN».
[0121] В контексте данного документа термин «цианато» относится к группе «-OCN».
[0122] В контексте данного документа термин «изоцианато» относится к группе «-NCO».
[0123] В контексте данного документа термин «тиоцианато» относится к группе «-SCN».
[0124] В контексте данного документа термин «изотиоцианато» относится к группе «-NCS».
[0125] В контексте данного документа термин «сульфинил» относится к группе «-S(=O)-R», где R соответствует определению по отношению к O-карбокси. Сульфинил-группа может быть замещенной или незамещенной.
[0126] В контексте данного документа термин «сульфонил» относится к группе «-SO2R», где R соответствует определению по отношению к O-карбокси. Сульфонил-группа может быть замещенной или незамещенной.
[0127] В контексте данного документа термин «S-сульфонамидо» относится к группе «-SO2NRARB», где ra и rb могут быть такими же, как определено в отношении O-карбокси. S-сульфонамидо-группа может быть замещенной или незамещенной.
[0128] В контексте данного документа термин «N-сульфонамидо» относится к группе «-SO2N(RA)(RB)», где R, ra и rb могут быть такими же, как определено в отношении O-карбокси. Сульфонил-группа может быть замещенной или незамещенной.
[0129] В контексте данного документа термин «тригалогенметансульфонамидо-группа» относится к группе «X3CSO2N(R)-», где Х представляет собой галоген, а R соответствует определению по отношению к O-карбокси. Тригалогенметансульфонамидо-группа может быть замещенной или незамещенной.
[0130] В контексте данного документа термин «O-карбамил» относится к группе «-oc(=o)nrarb», где ra и rb могут быть такими же, как определено в отношении O-карбокси. O-карбамил-группа может быть замещенной или незамещенной.
[0131] В контексте данного документа термин «N-карбамил» относится к группе «roc(=o)nra-», где R и ra могут быть такими же, как определено в отношении O-карбокси. N-карбамил-группа может быть замещенной или незамещенной.
[0132] В контексте данного документа термин «O-тиокарбамил» относится к группе «-ОС(=S)-NRARB», где ra и rb могут быть такими же, как определено в отношении O-карбокси. O-тиокарбамил-группа может быть замещенной или незамещенной.
[0133] В контексте данного документа термин «N-карбамил» относится к группе «roc(=s)nra-», где R и ra могут быть такими же, как определено в отношении O-карбокси. N-тиокарбамил-группа может быть замещенной или незамещенной.
[0134] В контексте данного документа термин «С-амидо» относится к группе «-c(=o)nrarb», где ra и rb могут быть такими же, как определено в отношении O-карбокси. С-амидо-группа может быть замещенной или незамещенной.
[0135] В контексте данного документа термин «N-амидо» относится к группе «rc(=o)nra-», где R и ra могут быть такими же, как определено в отношении O-карбокси. N-амидо-группа может быть замещенной или незамещенной.
[0136] В контексте данного документа термин «амино» относится к группе «-NRARB», где RA и RB каждый независимо выбран из водорода, С1-6 алкила, С2-6алкенила, С2-6алкинила, С3-7 карбоциклила, С6-10 арила, 5-10-членного гетероарила и 5-10-членного гетероциклила, как определено в данном документе.
[0137] В контексте данного документа термин «аминоалкил» относится к аминогруппе, соединенной через алкиленовую группу.
[0138] В контексте данного документа термин «сложный эфир» относится к группе «-C(=О)OR», где R соответствует определению по отношению к О-карбокси. Сложный эфир может быть замещенным или незамещенным.
[0139] В контексте данного документа термин «низший аминоалкил» относится к аминогруппе, соединенной через низшую алкиленовую группу. Низший аминоалкил может быть замещенным или незамещенным.
[0140] В контексте данного документа термин «низший алкоксиалкил» относится к алкоксигруппе, соединенной через низшую алкиленовую группу. Низший алкоксиалкил может быть замещенным или незамещенным.
[0141] В контексте данного документа термин «ацетил» относится к группе «-С(=О)СН3».
[0142] В контексте данного документа термин «тригалометансульфонил» относится к группе X3CS(=О)2-, где X представляет собой галоген.
[0143] В контексте данного документа термин «О-карбамил» относится к группе -OC(=О)-NR, где R может представлять собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероарил, гетероалициклил, аралкил или (гетероалициклил)алкил, как определено в данном документе. О-карбамил-группа может быть замещенной или незамещенной.
[0144] В контексте данного документа термин «N-карбамил» относится к группе ROC(=О)NH-, где R может представлять собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероарил, гетероалициклил, аралкил или (гетероалициклил)алкил, как определено в данном документе. N-карбамил-группа может быть замещенной или незамещенной.
[0145] В контексте данного документа термин «О-тиокарбамил» относится к группе -OC(=S)-NR, где R может представлять собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероарил, гетероалициклил, аралкил или (гетероалициклил)алкил, как определено в данном документе. О-тиокарбамил-группа может быть замещенной или незамещенной.
[0146] В контексте данного документа термин «N-тиокарбамил» относится к группе ROC(=S)NH-, где R может представлять собой водород, алкил, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил, арил, гетероарил, гетероалициклил, аралкил или (гетероалициклил)алкил, как определено в данном документе. N-тиокарбамил-группа может быть замещенной или незамещенной.
[0147] В контексте данного документа термин «пергалогеналкил» относится к алкильной группе, в которой все атомы водорода заменены атомами галогена.
[0148] В контексте данного документа термин «галоген» или «гало» относится к любому из радиостабильных атомов столбца 7 Периодической таблицы элементов, например, фтор, хлор, бром или йод, при этом фтор и хлор являются предпочтительными.
[0149] В контексте данного документа термин «карбоциклил» относится к неароматическому циклическому кольцу или кольцевой системе, содержащей только атомы углерода в основной цепи кольцевой системы. Когда карбоциклил представляет собой кольцевую систему, два или большее количество колец могут быть соединены в конденсированную, соединенную мостиковой связью или спирокольцевую систему. Карбоциклилы могут иметь любую степень насыщения при условии, что хотя бы одно кольцо в кольцевой системе не является ароматическим. Таким образом, карбоциклилы включают циклоалкилы, циклоалкенилы и циклоалкинилы. Карбоциклильная группа может иметь от 3 до 20 атомов углерода, хотя настоящее определение также охватывает использование термина «карбоциклил», когда не указан числовой диапазон. Карбоциклильная группа также может представлять собой карбоциклил среднего размера, имеющий от 3 до 10 атомов углерода. Карбоциклильная группа также может представлять собой карбоциклил, имеющий от 3 до 6 атомов углерода. Карбоциклильная группа может быть обозначена как «С3-6 карбоциклил» или с помощью аналогичных обозначений. Примеры карбоциклильных колец включают, помимо прочего, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, 2,3-дигидроинден, бицикл[2.2.2]октанил, адамантил и спиро[4.4]нонанил.
[0150] В контексте данного документа термин «(циклоалкил)алкил» относится к циклоалкильной группе, присоединенной в качестве заместителя через алкиленовую группу. Алкилен и циклоалкил в (циклоалкил)алкиле могут быть замещенными или незамещенными. Примеры включают, помимо прочего, циклопропилметил, циклобутилметил, циклопропилэтил, циклопропилбутил, циклобутилэтил, циклопропилизопропил, циклопентил метил, циклопентилэтил, циклогексилметил, циклогексилэтил, циклогептилметил и т.п. В некоторых случаях алкиленовая группа представляет собой низшую алкиленовую группу.
[0151] В контексте данного документа термин «циклоалкил» относится к полностью насыщенному карбоциклильному кольцу или кольцевой системе. Примеры включают циклопропил, циклобутил, циклопентил и циклогексил.
[0152] В контексте данного документа термин «циклоалкенил» означает карбоциклильное кольцо или кольцевую систему, имеющую по меньшей мере одну двойную связь, при этом ни одно кольцо в кольцевой системе не является ароматическим. Примером является циклогексенил.
[0153] В контексте данного документа термин «гетероциклил» относится к трех-, четырех-, пяти-, шести-, семи-, восьми- или более -членным кольцам, в которых атомы углерода вместе с 1-3 гетероатомами составляют указанное кольцо. Однако гетероциклил может необязательно содержать одну или большее количество ненасыщенных связей, расположенных таким образом, что ароматическая пи-электронная система не возникает. Гетероатомы независимо выбран из кислорода, серы и азота.
[0154] Гетероциклил может дополнительно содержать одну или большее количество карбонильных или тиокарбонильных функциональных групп, чтобы определение включало оксосистемы и тиосистемы, такие как лактамы, лактоны, циклические имиды, циклические тиоимиды, циклические карбаматы и т.п.
[0155] В контексте данного документа термин «гетероциклил» относится к неароматическому циклическому кольцу или кольцевой системе, содержащей по меньшей мере один гетероатом в основной цепи кольца. Гетероциклилы могут быть соединены в конденсированную, соединенную мостиковой связью или спирокольцевую систему. Гетероциклилы могут иметь любую степень насыщения при условии, что хотя бы одно кольцо в кольцевой системе не является ароматическим. Гетероатом(ы) может присутствовать либо в неароматическом, либо в ароматическом кольце в кольцевой системе. Гетероциклильная группа может иметь от 3 до 20 членов в кольце (т.е. количество атомов, составляющих основную цепь кольца, включая атомы углерода и гетероатомы), хотя настоящее определение также охватывает использование термина «гетероциклил», когда не указан числовой диапазон. Гетероциклильная группа может также представлять собой гетероциклил среднего размера, содержащий от 3 до 10 членов в кольце. Гетероциклильная группа также может быть гетероциклилом, имеющим от 3 до 6 членов в кольце. Гетероциклильная группа может быть обозначена как «3-6-членный гетероциклил» или подобными обозначениями. В предпочтительных шестичленных моноциклических гетероциклилах гетероатом(ы) выбран из одного-трех атомов О, N или S, а в предпочтительных пятичленных моноциклических гетероциклилах гетероатом(ы) выбран из одного или двух гетероатомов, выбранных из О, N или S. Примеры гетероциклильных колец включают, помимо прочего, азепинил, акридинил, карбазолил, циннолинил, диоксоланил, имидазолинил, имидазолидинил, морфолинил, оксиранил, оксепанил, тиепанил, пиперидинил, пиперазинил, диоксопиперазинил, пирролидинил, пирролидонил, пирролидионил, 4-пиперидонил, пиразолинил, пиразолидинил, 1,3-диоксинил, 1,3-диоксанил, 1,4-диоксинил, 1,4-диоксанил, 1,3-оксатианил, 1,4-оксатиинил, 1,4-оксатианил, 2H-1,2-оксазинил, триоксанил, гексагидро-1,3,5-триазинил, 1,3-диоксолил, 1,3-диоксоланил, 1,3-дитиолил, 1,3-дитиоланил, изоксазолинил, изоксазолидинил, оксазолинил, оксазолидинил, оксазолидинонил, тиазолинил, тиазолидинил, 1,3-оксатиоланил, индолинил, изоиндолинил, тетрагидрофуранил, тетрагидропиранил, тетрагидротиофенил, тетрагидротиопиранил, тетрагидро-1,4-тиазинил, тиаморфолинил, дигидробензофуранил, бензимидазолидинил и тетрагидрохинолин.
[0156] В контексте данного документа термин «(гетероциклил)алкил» относится к гетероциклильной группе, присоединенной в качестве заместителя через алкиленовую группу. Примеры включают, помимо прочего, имидазолинилметил и индолинилэтил.
[0157] В контексте данного документа термины «очищенный», «по существу очищенный» и «выделенный» относятся к описанным в данном документе соединениям, не содержащим других, отличающихся соединений, с которыми соединения по данному изобретению обычно связаны в их естественном состоянии, так что соединения по данному изобретению составляют по меньшей мере 0,5%, 1%, 5%, 10% или 20% и наиболее предпочтительно по меньшей мере 50% или 75% по массе данного образца.
[0158] Замещенные группы основаны или получены из незамещенной исходной группы, в которой произошел обмен одного или большего количества атомов водорода на другой атом или группу. Если не указано иное, когда группа считается «замещенной», группа замещена одним или большим количеством заместителей, езависимо выбранных из C1-С6 алкила, C1-C6 алкенила, C1-С6 алкинила, C1-С6 гетероалкила, С3-С7 карбоциклила (необязательно замещенного галогеном, C1-С6 алкилом, C1-С6 алкокси, C1-С6 галоалкилом и C1-C6 галоалкокси), С3-С7-карбоциклил-С1-С6-алкила (необязательно замещенного галогеном, C1-С6 алкилом, C1-С6 алкокси, C1-С6 галоалкилом и C1-C6 галоалкокси), 5-10-членного гетероциклила (необязательно замещенного галогеном, C1-С6 алкилом, C1-C6 алкокси, C1-С6 галоалкилом и C1-С6 галоалкокси), 5-10-членного гетероциклил-С1-С6-алкила (необязательно замещенного галогеном, C1-С6 алкилом, C1-С6 алкокси, C1-C6 галоалкилом и C1-С6 галоалкокси), арила (необязательно замещенного галогеном, C1-C6 алкилом, C1-С6 алкокси, C1-С6 галоалкилом и C1-С6 галоалкокси), арил(С1-С6)алкила (необязательно замещенного галогеном, C1-С6 алкилом, C1-C6 алкокси, C1-С6 галоалкилом и C1-С6 галоалкокси), 5-10-членного гетероарила (необязательно замещенного галогеном, C1-С6 алкилом, C1-C6 алкокси, C1-С6 галоалкилом и C1-С6 галоалкокси), 5-10-членного гетероарил(С1-С6)алкила (необязательно замещенного галогеном, C1-C6 алкилом, C1-C6 алкокси, C1-С6 галоалкилом и C1-С6 галоалкокси), галогена, циано, гидрокси, C1-С6 алкокси, C1-С6 алкокси, (С1-С6)алкила (т.е. эфира), арилокси, сульфгидрил (меркапто), гало(С1-С6)алкила (например, -CF3), гало(С1-С6)алкокси (например,-OCF3), C1-C6 алкилтио, арилтио, амино, амино(С1-С6)алкила, нитро, О-карбамила, N-карбамила, О-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, S-сульфонамидо, N-сульфонамидо, С-карбокси, О-карбокси, ацила, цианато, изоцианато, тиоцианато, изотиоцианато, сульфинила, сульфонила и оксо (=О). Во всех случаях, когда группа описана как «необязательно замещенная», эта группа может быть замещена указанными выше заместителями.
[0159] В некоторых вариантах осуществления замещенная группа замещена одним или большим количеством заместителей, индивидуально и независимо выбранных из С1-С4 алкила, амино, гидрокси и галогена.
[0160] Следует понимать, что некоторые соглашения о названиях радикалов могут включать либо монорадикал, либо дирадикал, в зависимости от контекста. Например, когда заместитель требует двух точек присоединения к остальной части молекулы, подразумевается, что заместитель представляет собой бирадикал. Например, заместитель, идентифицированный как алкил, который требует двух точек присоединения, включает бирадикалы, такие как -СН2-, -СН2СН2-, -СН2СН(СН3)СН2-, и тому подобное. Другие соглашения о названиях радикалов ясно указывают на то, что радикал представляет собой бирадикал, такой как «алкилен» или «алкенилен».
[0161] Если не указано иное, когда заместитель считается «необязательно замещенным», это означает, что заместитель представляет собой группу, которая может быть замещена одной или большим количеством групп, индивидуально и независимо выбранными из алкила, алкенила, алкинила, циклоалкила, арила, гетероарила, гетероалицикла, гидроксила, алкокси, арилокси, меркапто, алкилтио, арилтио, циано, галогена, карбонила, тиокарбонила, О-карбамила, N-карбамила, О-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, S-сульфонамидо, N-сульфонамидо, С-карбокси, О-карбокси, изоцианато, тиоцианато, изотиоцианато, нитро, силила, тригалометансульфонила и амино, включая моно- и дизамещенные аминогруппы, и их защищенные производные. Защитные группы, которые могут образовывать защитные производные указанных выше заместителей, известны специалистам в данной области техники и могут быть найдены в источниках, таких как Greene and Wilts, выше.
[0162] В контексте данного документа термин «агент» или «тест-агент» включает любое вещество, молекулу, элемент, соединение, объект или их комбинацию. Он включает, помимо прочего, например, белок, полипептид, пептид или миметик, малую органическую молекулу, полисахарид, полинуклеотид и т.п. Это может быть натуральный продукт, синтетическое соединение, химическое соединение или комбинация двух или большего количества веществ. Если не указано иное, термины «агент», «вещество» и «соединение» используются в данном документе взаимозаменяемо.
[0163] В контексте данного документа термин «аналог» относится к молекуле, которая по структуре напоминает эталонную молекулу, но которая была модифицирована целенаправленным и контролируемым образом путем замены определенного заместителя эталонной молекулы альтернативным заместителем. Специалист в данной области техники может ожидать, что по сравнению с эталонной молекулой аналог проявит такую же, подобную или улучшенную полезность. Синтез и скрининг аналогов для выявления вариантов известных соединений, обладающих улучшенными характеристиками (такими как более высокая аффинность связывания с молекулой-мишенью), представляет собой подход, хорошо известный в фармацевтической химии.
[0164] В контексте данного документа термин «млекопитающее» используется в его обычном биологическом смысле. Таким образом, этот термин конкретно включает, помимо прочего, приматов, в том числе обезьян (шимпанзе, человекообразных обезьян, обезьян) и людей, крупного рогатого скота, лошадей, овец, коз, свиней, кроликов, собак, кошек, крыс и мышей, но также включает многие другие виды.
[0165] В контексте данного документа термин «микробная инфекция» относится к инвазии организма-хозяина патогенными микробами, независимо от того, является ли организм позвоночным, беспозвоночным, рыбой, растением, птицей или млекопитающим. Этот термин включает чрезмерный рост микробов, которые обычно присутствуют в организме или на теле млекопитающего или другого организма. В более общем смысле микробная инфекция может представлять собой любую ситуацию, в которой присутствие микробной популяции (популяций) наносит ущерб млекопитающему-хозяину. Таким образом, млекопитающее «страдает» от микробной инфекции, когда в организме или на теле млекопитающего присутствует избыточное количество микробной популяции, или когда воздействие присутствия микробной популяции (популяций) повреждает клетки или другие ткани организма млекопитающего. В частности, это описание относится к бактериальной инфекции. Следует отметить, что соединения по предпочтительным вариантам осуществления также являются полезными при лечении микробного роста или контаминации клеточных культур или других сред, неодушевленных поверхностей или объектов, и ничто в данном документе не должно ограничивать предпочтительные варианты осуществления только лечением высших организмов, за исключением случаев, когда это прямо указано в формуле изобретения.
[0166] В контексте данного документа термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемый эксципиент» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, замедляющие абсорбцию, и т.п. Применение таких сред и агентов для фармацевтических активных веществ хорошо известно в данной области техники. За исключением случаев, когда любая обычная среда или агент несовместимы с активным ингредиентом, предполагается их применение в терапевтических композициях. Кроме того, могут быть включены различные адъюванты, такие как обычно применяемые в данной области техники. Соображения по включению различных компонентов в фармацевтические композиции описаны, например, в публикации Oilman et al. (ред.) (1990); Goodman and Oilman's: The Pharmacological Basis of Therapeutics, 8th Ed., Pergamon Press, которая полностью включена в данный документ посредством ссылки.
[0167] В контексте данного документа термин «субъект» относится к человеку или млекопитающему, отличному от человека, например, к собаке, кошке, мыши, крысе, корове, овце, свинье, козе, примату, отличному от человека, или птице, например, курице, а также к любому другому позвоночному или беспозвоночному организму.
[0168] В контексте данного документа термин «эффективное количество» или «терапевтически эффективное количество» относится к количеству терапевтического средства, которое в некоторой степени эффективно облегчает или снижает вероятность возникновения одного или большего количества симптомов заболевания или патологического состояния, и включает лечение указанного заболевания или патологического состояния. «Излечение» означает устранение симптомов заболевания или патологического состояния; однако некоторые долгосрочные или постоянные эффекты могут существовать даже после излечения (например, обширное повреждение тканей).
[0169] В контексте данного документа термин «лечить», «лечение» или «воздействие» относится к введению фармацевтической композиции в профилактических и/или терапевтических целях. Термин «профилактическое лечение» относится к лечению субъекта, у которого еще не проявляются симптомы заболевания или патологического состояния, но который подвержен или иным образом подвергается риску конкретного заболевания или патологического состояния, при этом указанное лечение снижает вероятность того, что у пациента будет развиваться заболевание или патологическое состояние. Термин «терапевтическое лечение» относится к назначению лечения субъекту.
[0170] Следует понимать, что если соединения, описанные в данном описании, имеют незаполненные валентности, то валентности должны быть заполнены водородом и/или дейтерием.
[0171] Следует понимать, что соединения, описанные в данном документе, могут быть помечены изотопами или другими способами, включая, помимо прочего, применение хромофоров или флуоресцентных фрагментов, биолюминесцентных меток или хемилюминесцентных меток. Замещение изотопами, такими как дейтерий, может дать некоторые терапевтические преимущества вследствие большей метаболической стабильности соединений, например, большего периода полувыведения in vivo или снижения необходимой дозы. Любой химический элемент, представленный в структуре соединения, может содержать любой изотоп указанного элемента. Например, в структуре соединения атом водорода может быть явно указан или подразумеваться как присутствующий в соединении. В любом положении соединения, в котором может присутствовать атом водорода, атом водорода может быть любым изотопом водорода, включая, помимо прочего, водород-1 (протий), водород-2 (дейтерий) и водород-3 (тритий). Таким образом, ссылка в данном документе на соединение охватывает все потенциальные изотопные формы, если из контекста явно не следует иное.
[0172] В контексте данного документа термин «около» относится к количеству, уровню, значению, числу, частоте, проценту, величине, размеру, объему, массе или длине, которые варьируют вплоть до 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1% относительно эталонного количества, уровня, значения, числа, частоты, процента, величины, размера, объема, массы или длины. Когда значению предшествует термин «около», компонент не предназначен для строгого ограничения этим значением, но предназначен для включения количеств, которые отличаются от указанного значения.
Соединения
[0173] В некоторых вариантах осуществления предлагается соединение Формулы (I):
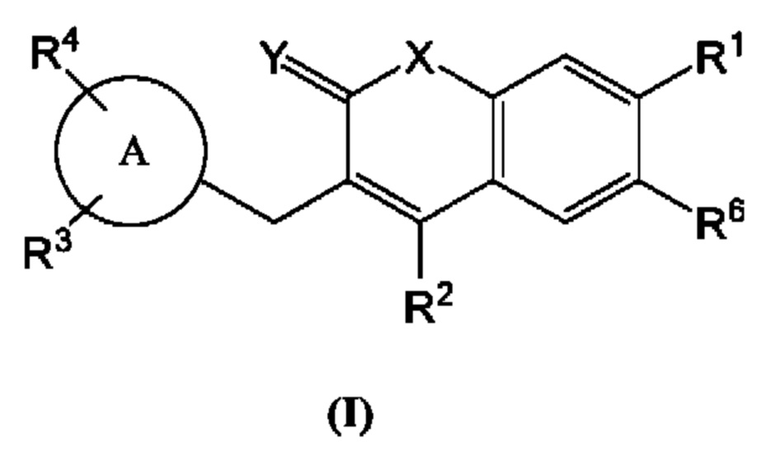
[0174] В некоторых вариантах осуществления Формула (I) представляет собой фармацевтически приемлемую соль, как описано в данном документе.
[0175] В некоторых вариантах осуществления Формула (I) представлена Формулой (Ia), Формулой (Ib), Формулой (Ic) или Формулой (Id):
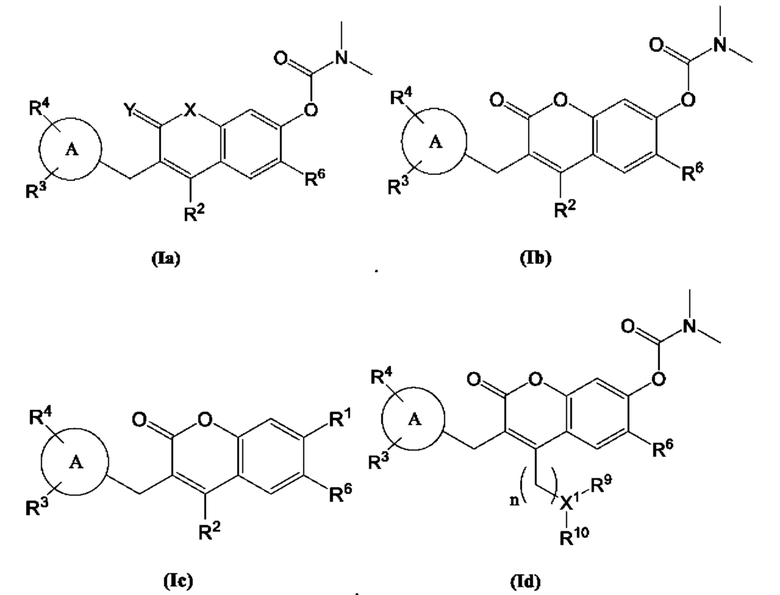
[0176] В некоторых вариантах осуществления Формула (Ia), Формула (Ib), Формула (Ic) или Формула (Id) представляют собой фармацевтически приемлемую соль, как описано в данном документе.
[0177] В некоторых вариантах осуществления Кольцо А представляет собой

[0178] В некоторых вариантах осуществления соединений Формулы (I) или (Ic), R1 может быть выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, О-арила, О-гетероарила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-С6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L.
[0179] В некоторых вариантах осуществления R1 не является О-пиримидинилом. В некоторых вариантах осуществления R1 не является пиримидилом с простой эфирной связью.
[0180] В некоторых вариантах осуществления соединений Формулы (I), (Ia) или (Ib), R2 может быть выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-С6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L. В некоторых дополнительных вариантах осуществления R2 представляет собой L. В некоторых дополнительных вариантах осуществления R2 представляет собой -CH3.
[0181] В некоторых вариантах осуществления соединений Формулы(I), (I, (Ib), (Ic) или (Id), R3 может быть выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-С6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L.
[0182] В некоторых вариантах осуществления соединений Формулы(I), (Ia), (Ib), (Ic) или (Id), R4 может быть выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-С6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L.
[0183] В некоторых вариантах осуществления соединений Формулы (I), (Ia), (Ib) или (Ic), R5 может быть выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного C1-С6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила и необязательно замещенного С2-С6 алкинила. В некоторых вариантах осуществления R5 представляет собой Н, дейтерий, галоген или необязательно замещенный C1-C6 алкил.
[0184] В некоторых вариантах осуществления соединений Формулы (I), (Ia), (Ib) или (Ic), R5 может быть выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-С6 алкила, необязательно замещенного С2-С6 алкенила и необязательно замещенного С2-С6 алкинила. В некоторых вариантах осуществления R5' представляет собой Н, дейтерий, галоген или необязательно замещенный C1-С6 алкил.
[0185] В некоторых вариантах осуществления соединений Формулы (I), (Ia), (Ib) или (Ic), R6 может быть выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-С6 алкила, необязательно замещенного С2-С6 алкенила и необязательно замещенного С2-С6 алкинила. В некоторых вариантах осуществления R6 представляет собой Н, дейтерий, галоген или необязательно замещенный C1-С6 алкил.
[0186] В некоторых вариантах осуществления соединений Формулы (I) или (Ia), X может быть выбран из C(R5)2, CH(R5), СН2, -Ο-,  В некоторых дополнительных вариантах осуществления X представляет собой СН2 или -О-. В некоторых дополнительных вариантах осуществления X представляет собой –О-.
В некоторых дополнительных вариантах осуществления X представляет собой СН2 или -О-. В некоторых дополнительных вариантах осуществления X представляет собой –О-.
[0187] В некоторых вариантах осуществления соединений Формулы (I), (Ia), (Ib) или (Ic) L может быть выбран из -Z1-Z2. В некоторых вариантах осуществления соединений Формулы (I), (Ia), (Ib) или (Ic) L может быть выбран из -Z1-Z2-Z3.
[0188] В некоторых вариантах осуществления соединений Формулы (I), (Ia), (Ib) или (Ic) Ζ1 может быть выбран из -СН2-, -О-, -S-, S=O, -SO2-, С=O, -СО2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5 R5', -NH(CO)-, -(CO)NH-, -(CO)NR5 R5'-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, R5NH(CO)-, -NHCH2CO-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенного C1-С6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил). В некоторых дополнительных вариантах осуществления Ζ1 представляет собой -CH2-.
[0189] В некоторых вариантах осуществления соединений Формулы (I), (Ia), (Ib) или (Ic) Z2 может быть выбран из водорода, дейтерия, галогена, -СН2-, -О-, -S-, S=O, -SO2-, С=O, -СО2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5', -NH(CO), -(CO)NH-, (CO)NR5R5-, -NHCH2CO-, -NH-SO2-, -SO2-NH-, -R5CH2-, R5O-, R5S-, R5-S=O, R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенного C1-С6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил). В некоторых дополнительных вариантах осуществления Z2 представляет собой необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-C8 гетероарил, -NR5R5, -СН2СН или -CH2CN. В некоторых дополнительных вариантах осуществления Z2 представляет собой необязательно замещенный С3-C8 гетероциклил. В некоторых вариантах осуществления Z2 представляет собой -СН2-, а Z2 представляет собой -NR5R5'. В некоторых вариантах осуществления Z2 представляет собой необязательно замещенный С3-C8 гетероциклил.
[0190] В некоторых вариантах осуществления соединений Формулы (I), (Ia), (Ib) или (Ic) Z3 может быть выбран из водорода, дейтерия, галогена, -СОН, -CO2H, -ΝΟ2, -СН2ССН, -CH2CN, -NR5R5', -(CO)NH2, -(CO)NR5R5', -SO2-NH2, -R5CH3, -R5-COH, -R5CO2H, -R5NH2, -R5NH(COH), -R5(CO)NH2, -R5NH-SO2H, -R5SO2-NH2, -CH2R5, -OR5, -SO2R5-, -CO2R5-, -NHR5, -NH(CO)R5, -(CO)NHR5, -NH-SO2R5, -SO2-NHR5, необязательно замещенного амино, необязательно замещенного С1-С4 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-С8 гетероциклила, необязательно замещенного С3-С10 гетероарила, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил).
[0191] В некоторых вариантах осуществления соединений Формулы (Id) n равно 1, 2, 3 или 4. В некоторых вариантах осуществления n равно 1, 2 или 3. В некоторых вариантах осуществления n равно 1 или 2. В некоторых вариантах осуществления n равно 2 или 3. В некоторых вариантах осуществления n равно 1. В некоторых вариантах осуществления n равно 2. В некоторых вариантах осуществления n равно 3. В некоторых вариантах осуществления n равно 4.
[0192] В некоторых вариантах осуществления соединений Формулы (Id) X1 может быть выбран из -СН, В, N или РО4. В некоторых вариантах осуществления X1 представляет собой -СО2-, N или -SO2-. В некоторых вариантах осуществления X1 представляет собой N.
[0193] В некоторых вариантах осуществления соединений Формулы (Id), R9 может быть выбран из водорода, дейтерия, необязательно замещенного C1-C6 алкила, необязательно замещенного С3-С8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил); В некоторых дополнительных вариантах осуществления Z2 представляет собой необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-C8 гетероарил, -NR5R5', -СН2СН или -CH2CN.
[0194] В некоторых вариантах осуществления соединений Формулы (Id), R10 может быть выбран из водорода, дейтерия, необязательно замещенного C1-C6 алкила, необязательно замещенного С3-С8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-С8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил); В некоторых дополнительных вариантах осуществления Z2 представляет собой необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-C8 гетероарил, -NR5R5', -СН2СН или -CH2CN.
[0195] В некоторых вариантах осуществления необязательно замещенный гетероциклил С3-C8 гетероциклил представляет собой  В некоторых вариантах осуществления n равно 1, 2, 3 или 4. В некоторых вариантах осуществления n равно 1, 2 или 3. В некоторых вариантах осуществления n равно 1 или 2. В некоторых вариантах осуществления n равно 1. В некоторых вариантах осуществления n равно 2. В некоторых вариантах осуществления n равно 3. В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой
В некоторых вариантах осуществления n равно 1, 2, 3 или 4. В некоторых вариантах осуществления n равно 1, 2 или 3. В некоторых вариантах осуществления n равно 1 или 2. В некоторых вариантах осуществления n равно 1. В некоторых вариантах осуществления n равно 2. В некоторых вариантах осуществления n равно 3. В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой  В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой
В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой  В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой
В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой  В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой
В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой  В некоторых вариантах осуществления Z2 представляет собой
В некоторых вариантах осуществления Z2 представляет собой 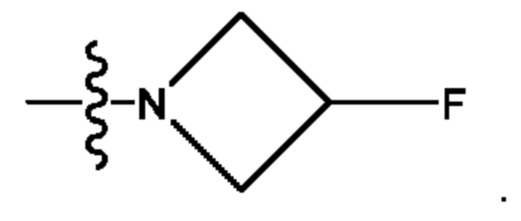 В некоторых вариантах осуществления необязательно замещенный С3-С8 гетероциклил представляет собой
В некоторых вариантах осуществления необязательно замещенный С3-С8 гетероциклил представляет собой 
[0196] В некоторых вариантах осуществления Ζ1 представляет собой -СН2-, Z2 представляет собой необязательно замещенный С3-С8 гетероциклил, a Z3 представляет собой необязательно замещенный арил. В некоторых вариантах осуществления Ζ1 представляет собой -СН2-, Z2 представляет собой необязательно замещенный С3-C8 гетероциклил, a Z3 представляет собой водород. В некоторых вариантах осуществления Ζ1 представляет собой -СН2-, Z2 представляет собой необязательно замещенный С3-C8 гетероциклил, a Z3 представляет собой необязательно замещенный алкил. В некоторых вариантах осуществления Ζ1 представляет собой -СН2-, Z2 представляет собой необязательно замещенный С3-C8 гетероциклил, a Z3 представляет собой –СН2- (не обязательно замещенный арил). В некоторых вариантах осуществления Ζ1 представляет собой -СН2-, a Z2 представляет собой 
[0197] В некоторых вариантах осуществления соединений Формулы (I) или (Ia), Υ представляет собой СН2, ΝΗ или О.
[0198] В некоторых вариантах осуществления Формула (I) представляет собой соединение описанной формулы, например, Формулы (I), Формулы (Ia), Формулы (Ib), Формулы (Ic), Формулы (Id), Формулы (II), Формулы (IIa), Формулы (IIb), Формулы (IIc) или Формулы (IId), но исключая соединения: 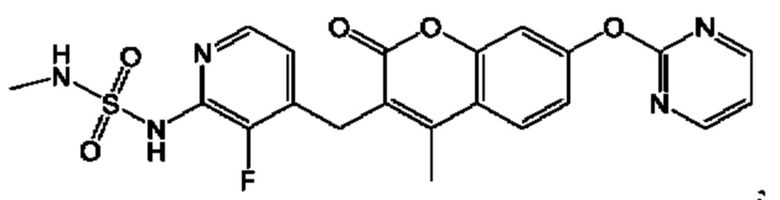
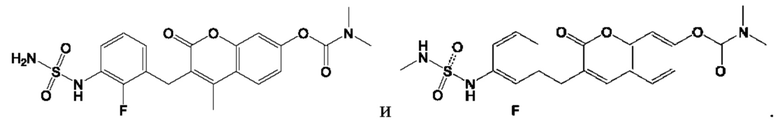 В некоторых вариантах осуществления Формула (I) представляет собой соединение описанной формулы, например, Формулы (I), Формулы (Ia), Формулы (Ib), Формулы (Ic), Формулы (Id), Формулы (II), Формулы(IIa), Формулы (IIb), Формулы (IIc) или Формулы (IId), но исключая R2 в виде C1-C6 алкила. В некоторых вариантах осуществления Формула (I) представляет собой соединение описанной формулы, например, Формулы (I), Формулы (Ia), Формулы (Ib), Формулы (Ic), Формулы (Id), Формулы (II), Формулы(IIa), Формулы (IIb), Формулы (IIc) или Формулы (IId), но исключая R2 в виде метила. В некоторых вариантах осуществления Формула (I) представляет собой соединение описанной формулы, например, Формулы (I), Формулы (Ia), Формулы (Ib), Формулы (Ic), Формулы (Id), Формулы (II), Формулы(IIa), Формулы (IIb), Формулы (IIc) или Формулы (IId), но исключая R2 в виде этила.
В некоторых вариантах осуществления Формула (I) представляет собой соединение описанной формулы, например, Формулы (I), Формулы (Ia), Формулы (Ib), Формулы (Ic), Формулы (Id), Формулы (II), Формулы(IIa), Формулы (IIb), Формулы (IIc) или Формулы (IId), но исключая R2 в виде C1-C6 алкила. В некоторых вариантах осуществления Формула (I) представляет собой соединение описанной формулы, например, Формулы (I), Формулы (Ia), Формулы (Ib), Формулы (Ic), Формулы (Id), Формулы (II), Формулы(IIa), Формулы (IIb), Формулы (IIc) или Формулы (IId), но исключая R2 в виде метила. В некоторых вариантах осуществления Формула (I) представляет собой соединение описанной формулы, например, Формулы (I), Формулы (Ia), Формулы (Ib), Формулы (Ic), Формулы (Id), Формулы (II), Формулы(IIa), Формулы (IIb), Формулы (IIc) или Формулы (IId), но исключая R2 в виде этила.
[0199] В некоторых вариантах осуществления предлагается соединение формулы (II):
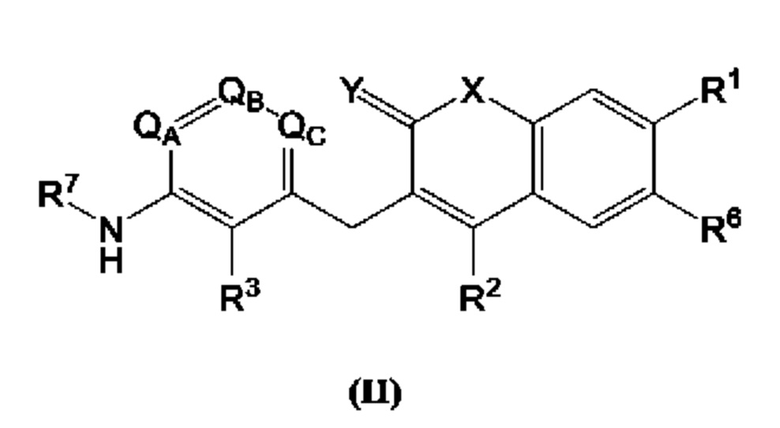
[0200] В некоторых вариантах осуществления Формула (II) представляет собой фармацевтически приемлемую соль, как описано в данном документе.
[0201] В некоторых вариантах осуществления Формула (II) представлена Формулой (IIa), Формулой (IIb), Формулой (IIc):


[0202] В некоторых вариантах осуществления Формула (IIa), Формула (IIb), Формула (IIc) или Формула (IId) могут представлять собой фармацевтически приемлемую соль, как описано в данном документе.
[0203] В некоторых вариантах осуществления Формулы (II), QA, QB, QC независимо представляют собой С или N.
[0204] В некоторых вариантах осуществления соединений Формулы (II) или (IIc), R1 может быть выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, О-арила, О-гетероарила, необязательно замещенной мочевины, необязательно замещенного C1-С6 алкокси, необязательно замещенного C1-С6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L.
[0205] В некоторых вариантах осуществления R1 не является О-пиримидинилом. В некоторых вариантах осуществления R1 не является пиримидилом с простой эфирной связью.
[0206] В некоторых вариантах осуществления соединений Формулы (II), (IIa) или (IIb), R2 может быть выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-С6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L. В некоторых дополнительных вариантах осуществления R2 представляет собой L. В некоторых дополнительных вариантах осуществления R2 представляет собой -СН3.
[0207] В некоторых вариантах осуществления соединений Формулы (II), (IIa) или (IId), R3 представляет собой Н, дейтерий, гидроксил, галоген, циано, нитро, необязательно замещенный амино, необязательно замещенный С-амидо, необязательно замещенный N-амидо, необязательно замещенный сложный эфир, необязательно замещенный сульфонил, необязательно замещенный S-сульфонамидо, необязательно замещенный N-сульфонамидо, необязательно замещенный сульфонат, необязательно замещенный О-тиокарбамил, необязательно замещенный N-тиокарбамил, необязательно замещенный N-карбамил, необязательно замещенный О-карбамил, необязательно замещенную мочевину, необязательно замещенный C1-С6 алкокси, необязательно замещенный C1-С6 алкил, необязательно замещенный С2-С6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил или L.
[0208] В некоторых вариантах осуществления соединений Формулы (II) или (IIa), R4 может быть выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-С6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L.
[0209] В некоторых вариантах осуществления соединений Формулы (II), (IIa), (IIb) или (IIc), R5 представляет собой Н, дейтерий, гидроксил, галоген, циано, нитро, необязательно замещенный амино, необязательно замещенный C1-C6 алкокси, необязательно замещенный C1-C6 алкил, необязательно замещенный С2-С6 алкенил и необязательно замещенный С2-С6 алкинил. В некоторых вариантах осуществления R5 представляет собой Н, дейтерий, галоген или необязательно замещенный C1-С6 алкил.
[0210] В некоторых вариантах осуществления соединений Формулы (II), (IIa), (IIb) или (IIc), R5 представляет собой Н, дейтерий, гидроксил, галоген, циано, нитро, необязательно замещенный амино, необязательно замещенный C1-С6 алкокси, необязательно замещенный C1-С6 алкил, необязательно замещенный С2-С6 алкенил и необязательно замещенный С2-С6 алкинил. В некоторых вариантах осуществления R5 представляет собой Н, дейтерий, галоген или необязательно замещенный C1-С6 алкил.
[0211] В некоторых вариантах осуществления соединений Формулы (II), (IIa), (IIb), (IIc) или (IId), R6 представляет собой Н, дейтерий, гидроксил, галоген, циано, нитро, необязательно замещенный амино, необязательно замещенный C1-С6 алкокси, необязательно замещенный C1-С6 алкил, необязательно замещенный С2-С6 алкенил и необязательно замещенный С2-С6 алкинил. В некоторых вариантах осуществления R6 представляет собой Н, дейтерий, галоген или необязательно замещенный C1-С6 алкил.
[0212] В некоторых вариантах осуществления соединений Формулы (II) или (IIa), X представляет собой C(R5)2, CH(R5), СН2, -Ο-, 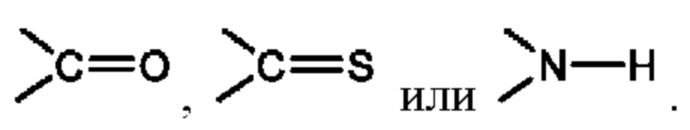 В некоторых дополнительных вариантах осуществления X представляет собой СН2 или -О-. В некоторых дополнительных вариантах осуществления X представляет собой -О-.
В некоторых дополнительных вариантах осуществления X представляет собой СН2 или -О-. В некоторых дополнительных вариантах осуществления X представляет собой -О-.
[0213] В некоторых вариантах осуществления соединений Формулы (II), (IIa), (IIb) или (IIc), L представляет собой -Ζ1-Ζ2. В некоторых вариантах осуществления соединений Формулы (II), (IIa) или (IIb) -Ζ1-Ζ2-Ζ3.
[0214] В некоторых вариантах осуществления соединений Формулы (II), (IIa), (IIb) или (IIc), Ζ1 представляет собой -СН2-, -О-, -S-, S=O, -SO2-, С=O, -СО2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5, -NH(CO)-, (CO)NH-, -(CO)NR5R5-, -ΝΗ-SO2, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, -R5-S=O, -R5SO2-, R5-C=O, - R5CO2-, -R5NH-, -R5NH(CO)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5, необязательно замещенный C3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил); В некоторых дополнительных вариантах осуществления Ζ1 представляет собой -СН2-.
[0215] В некоторых вариантах осуществления соединений Формулы (II), (IIa), (IIb) или (IIc), Z2 представляет собой гало, -СН2-, -О-, -S-, S=O, -SO2-, С=O, -СО2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил); В некоторых дополнительных вариантах осуществления Z2 представляет собой необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-C8 гетероарил, -NR5R5, -СН2СН или -CH2CN. В некоторых дополнительных вариантах осуществления Z2 представляет собой необязательно замещенный С3-C8 гетероциклил. В некоторых вариантах осуществления Ζ1 представляет собой -СН2-, a Z2 представляет собой -NR5R5. В некоторых вариантах осуществления Z2 представляет собой необязательно замещенный С3-С7 гетероциклил.
[0216] В некоторых вариантах осуществления соединений Формулы (II), (IIa), (IIb) или (IIc), Z3 представляет собой водород, гало, -СОН, -CO2H, -NO2, -СН2ССН, -CH2CN, -NR5R5, -(CO)NH2, -(CO)NR5R5, -SO2-NH2, -R5CH3, -R5-COH, -R5CO2H, -R5NH2, -R5NH(COH), -R5(CO)NH2, -R5NH-SO2H, -R5SO2-NH2, -CH2R5, -OR5, -SO2R5-, -CO2R5, -NHR5, -NH(CO)R5, -(CO)NHR5, -NH-SO2R5, -SO2-NHR5, необязательно замещенный амино, необязательно замещенный С1-С4 алкил, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2-(необязательно замещенный арил), -СН2- (необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил).
[0217] В некоторых вариантах осуществления Z1 представляет собой -СН2-, Z2 представляет собой необязательно замещенный С3-С8 гетероциклил, а Z3 представляет собой необязательно замещенный арил. В некоторых вариантах осуществления Z1 представляет собой -СН2-, Z2 представляет собой необязательно замещенный С3-C8 гетероциклил, а Z3 представляет собой водород. В некоторых вариантах осуществления Z1 представляет собой -СН2-, Z2 представляет собой необязательно замещенный С3-C8 гетероциклил, а Z3 представляет собой необязательно замещенный алкил. В некоторых вариантах осуществления Z1 представляет собой -СН2-, Z2 представляет собой необязательно замещенный С3-C8 гетероциклил, а Z3 представляет собой -СН2-(необязательно замещенный арил). В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой 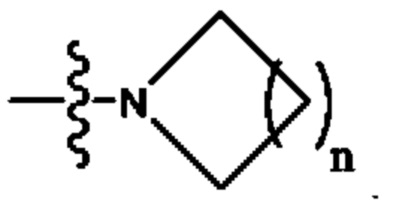 В некоторых вариантах осуществления n равно 1, 2, 3 или 4. В некоторых вариантах осуществления n равно 1, 2 или 3. В некоторых вариантах осуществления n равно 1 или 2. В некоторых вариантах осуществления n равно 1. В некоторых вариантах осуществления n равно 2. В некоторых вариантах осуществления n равно 3. В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой
В некоторых вариантах осуществления n равно 1, 2, 3 или 4. В некоторых вариантах осуществления n равно 1, 2 или 3. В некоторых вариантах осуществления n равно 1 или 2. В некоторых вариантах осуществления n равно 1. В некоторых вариантах осуществления n равно 2. В некоторых вариантах осуществления n равно 3. В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой  В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой необязательно замещенный
В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой необязательно замещенный 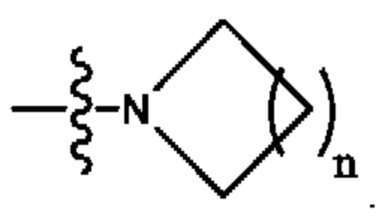 В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой необязательно замещенный
В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой необязательно замещенный 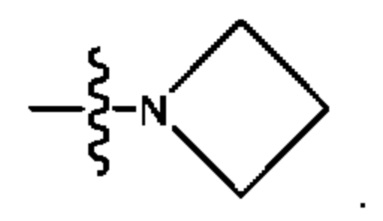 В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой
В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой 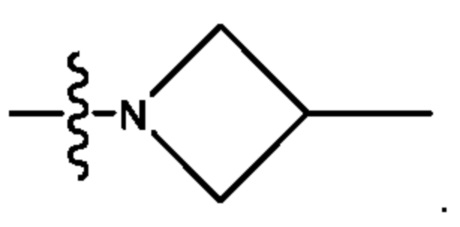 В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой
В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой  В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой
В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой 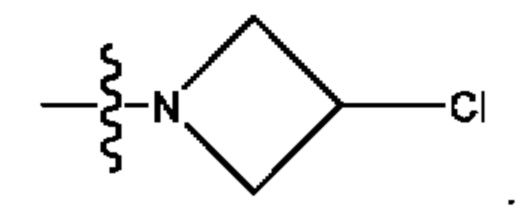 В некоторых вариантах осуществления Z2 представляет собой
В некоторых вариантах осуществления Z2 представляет собой  В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой
В некоторых вариантах осуществления необязательно замещенный С3-C8 гетероциклил представляет собой 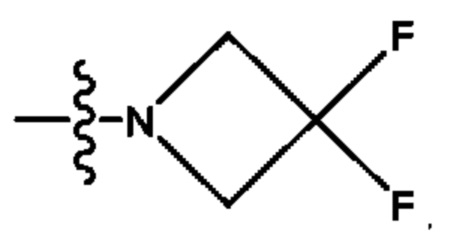
[0218] В некоторых вариантах осуществления соединений формулы (II) R7 независимо представляет собой Н, дейтерий, необязательно замещенный C1-С6 алкил, необязательно замещенный С2-С6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил или L. В еще некоторых вариантах осуществления R7 выбран из галогена, Η или СН3.
[0219] В некоторых вариантах осуществления соединений Формулы (IIa), R8 независимо представляет собой Н, дейтерий, необязательно замещенный C1-С6 алкил, необязательно замещенный С2-С6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил. В некоторых дополнительных вариантах осуществления R8 выбран из гало, Η или СН3.
[0220] В некоторых вариантах осуществления соединений Формулы (Id) X1 может быть выбран из -СН, -СО2-, N или -SO2-. В некоторых вариантах осуществления X1 представляет собой -СО2-, N или -SO2-. В некоторых вариантах осуществления X1 представляет собой N.
[0221] В некоторых вариантах осуществления соединений Формулы (Id), R9 может быть выбран из водорода, дейтерия, необязательно замещенного C1-С6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, -СН2- (необязательно замещенный арил), -СН2- (необязательно замещенный С3-C8 циклоалкил) или –CH2- (необязательно замещенный С3-С10 гетероарил); В некоторых дополнительных вариантах осуществления Z2 представляет собой необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-C8 гетероарил, -NR5R5', -СН2СН или -CH2CN.
[0222] В некоторых вариантах осуществления соединений Формулы (Id), R10 может быть выбран из водорода, дейтерия, необязательно замещенного C1-С6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил); В некоторых дополнительных вариантах осуществления Z2 представляет собой необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-C8 гетероарил, -NR5R5, -CH2CH или CH2CN.
[0223] В некоторых вариантах осуществления соединений Формулы (II) или (IIa), Υ представляет собой СН2, ΝΗ или О.
[0224] В некоторых вариантах осуществления соединений Формулы (II) или (IIa), X представляет собой СН2 или О.
[0225] В некоторых вариантах осуществления соединений Формулы (II), (IIa), или (IId), Ζ представляет собой С или N.
[0226] В некоторых вариантах осуществления Формула (II) исключает 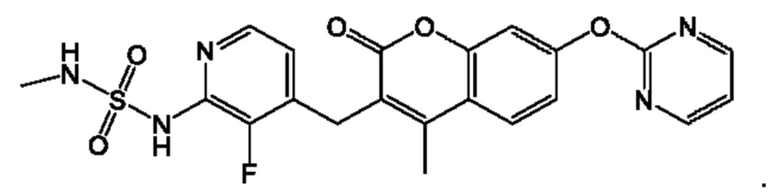 В некоторых вариантах осуществления Формула (II), (IIa), (IIb) или (IIc) исключает R2 в качестве СН3.
В некоторых вариантах осуществления Формула (II), (IIa), (IIb) или (IIc) исключает R2 в качестве СН3.
[0227] В некоторых вариантах осуществления соединения Формулы (I), (Ia), (Ib), (Ic), (II), (IIa), (IIb) или (IIc) выбраны из соединений из Таблицы А, и их фармацевтически приемлемых солей.
[0228] Таблица А. Типовые соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc) или (IId):
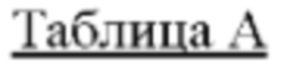

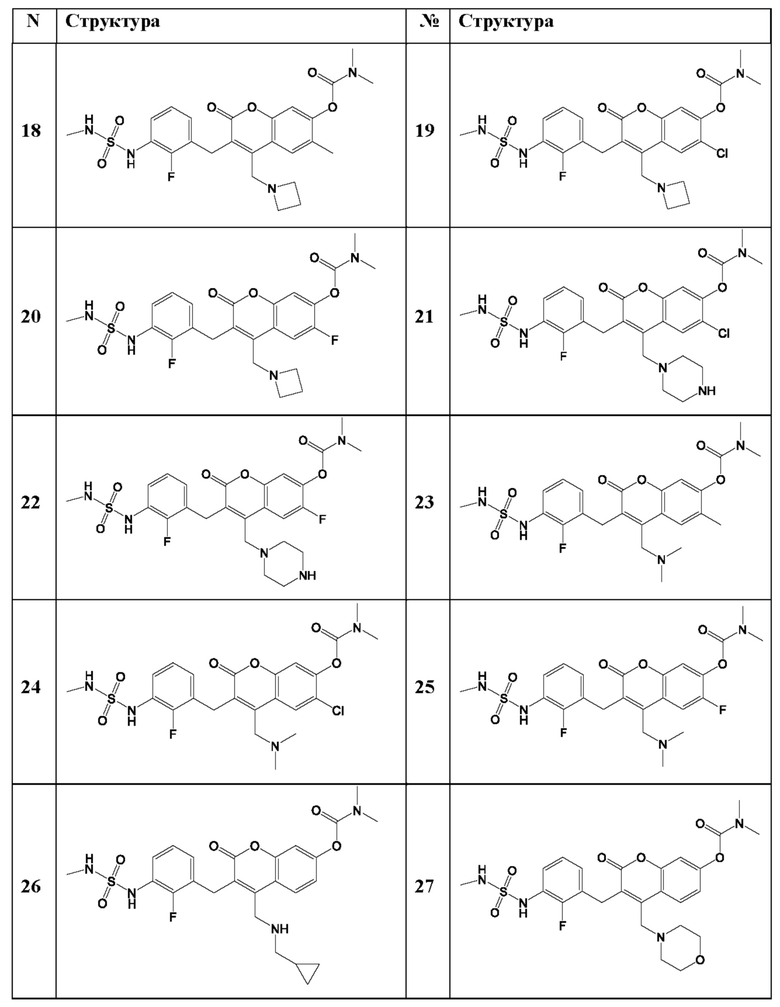
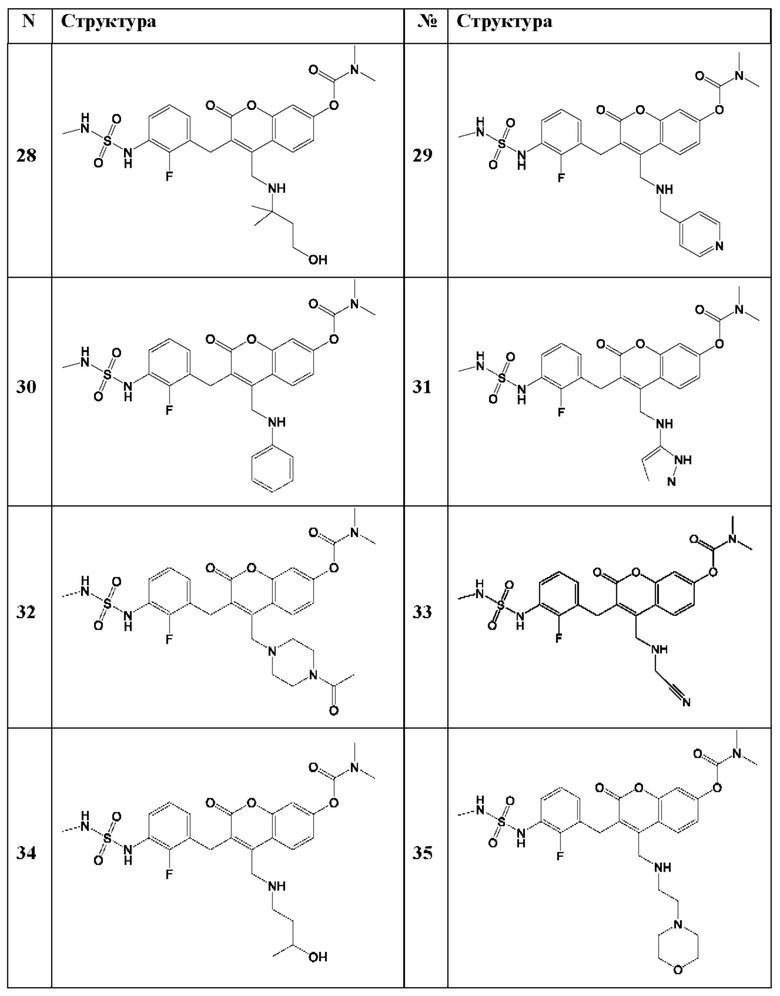
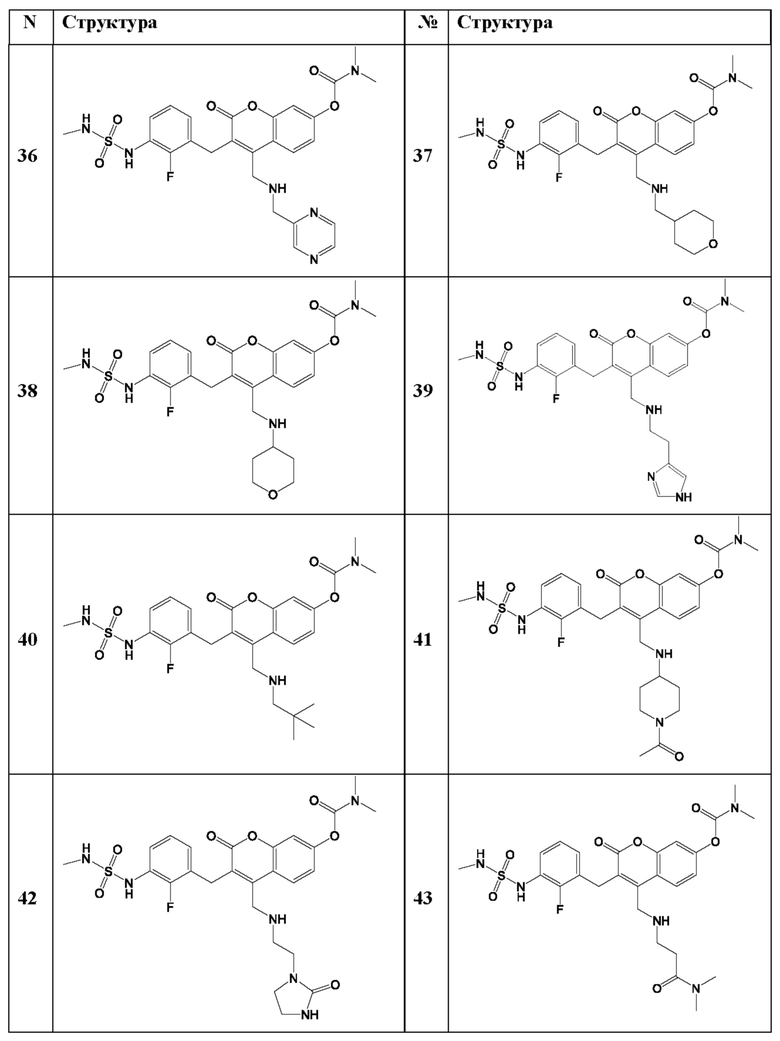






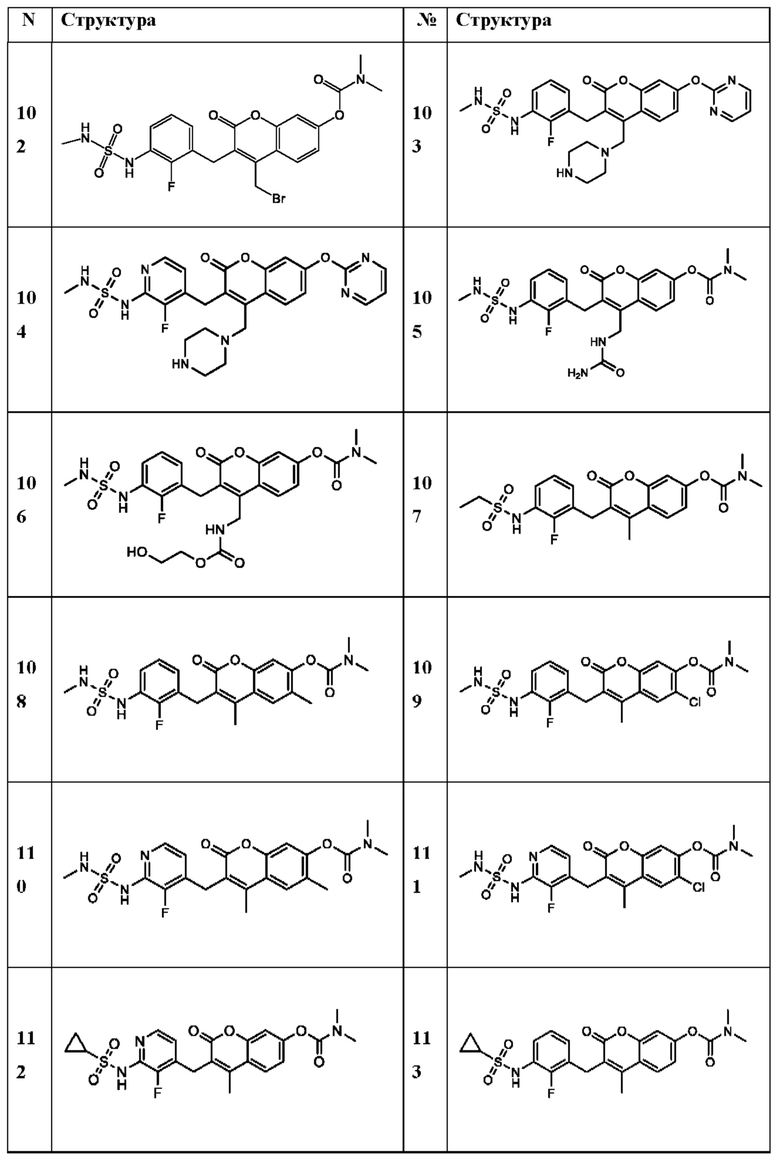
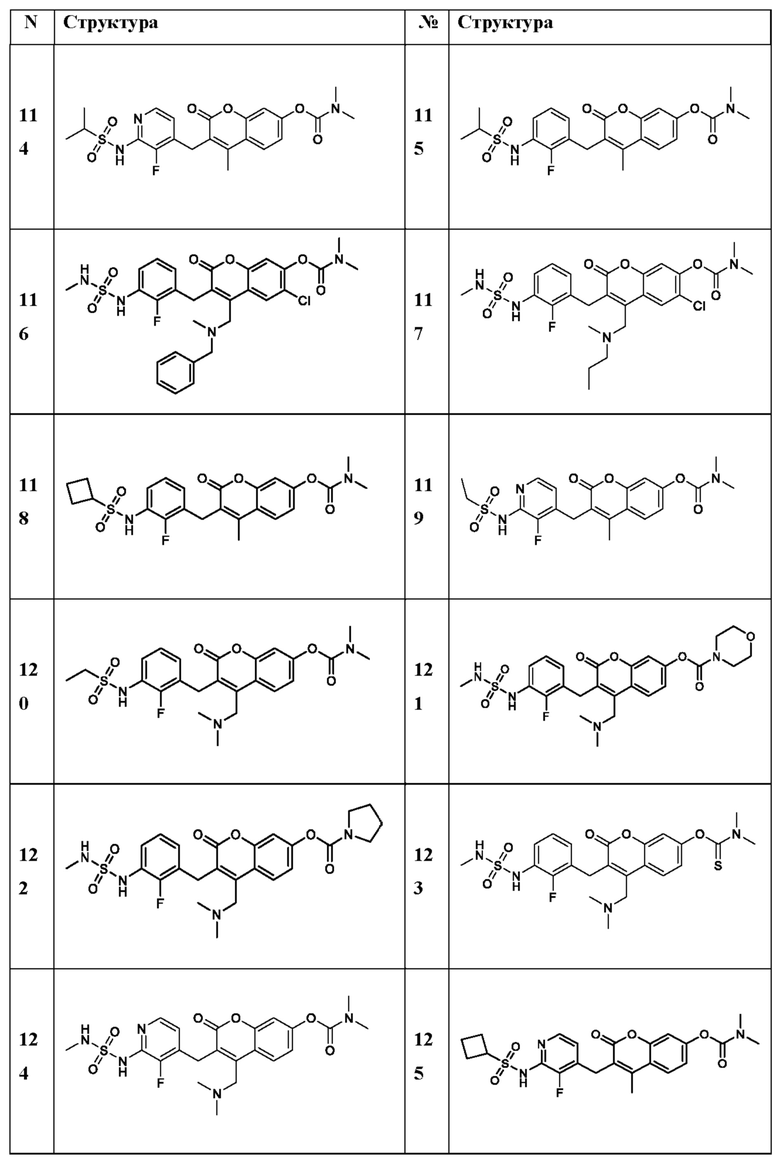

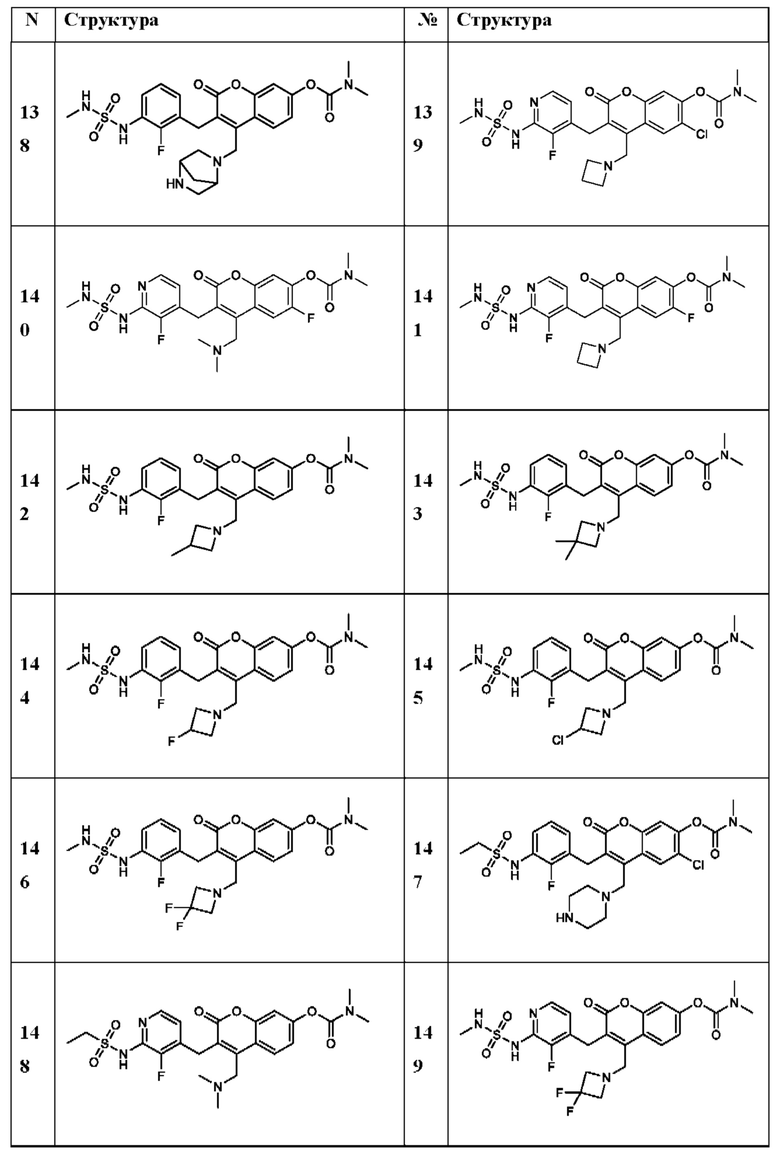

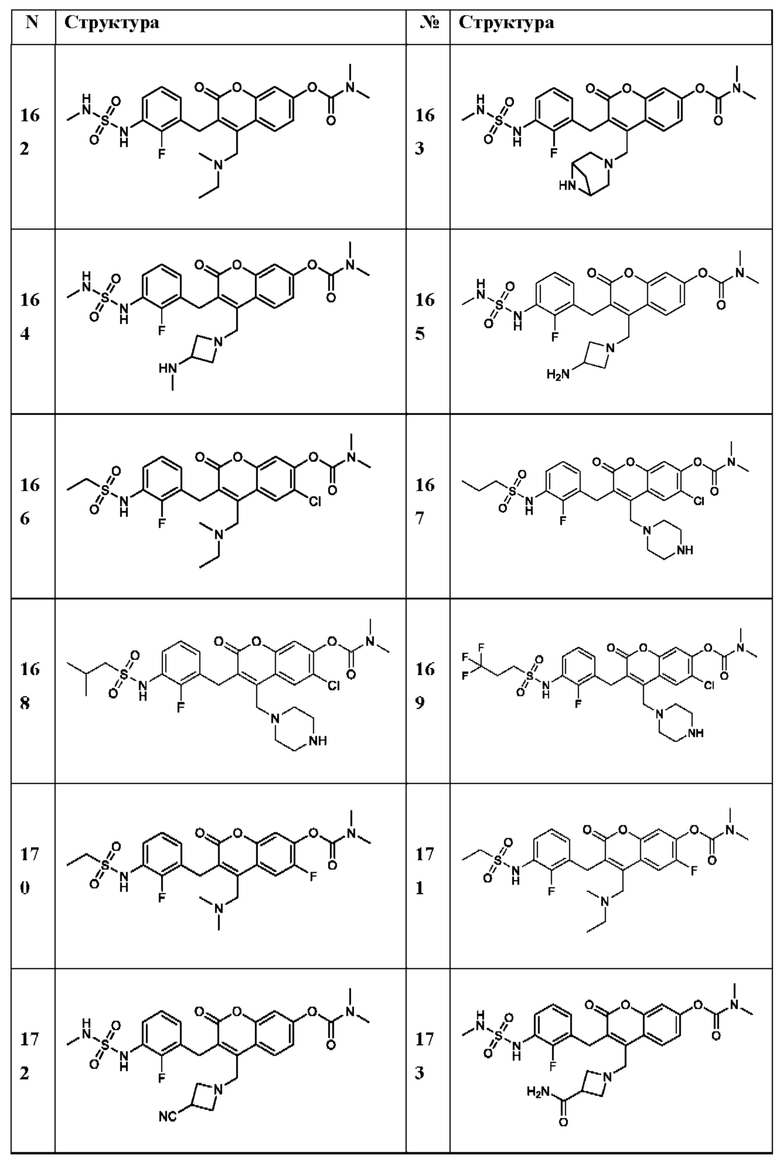

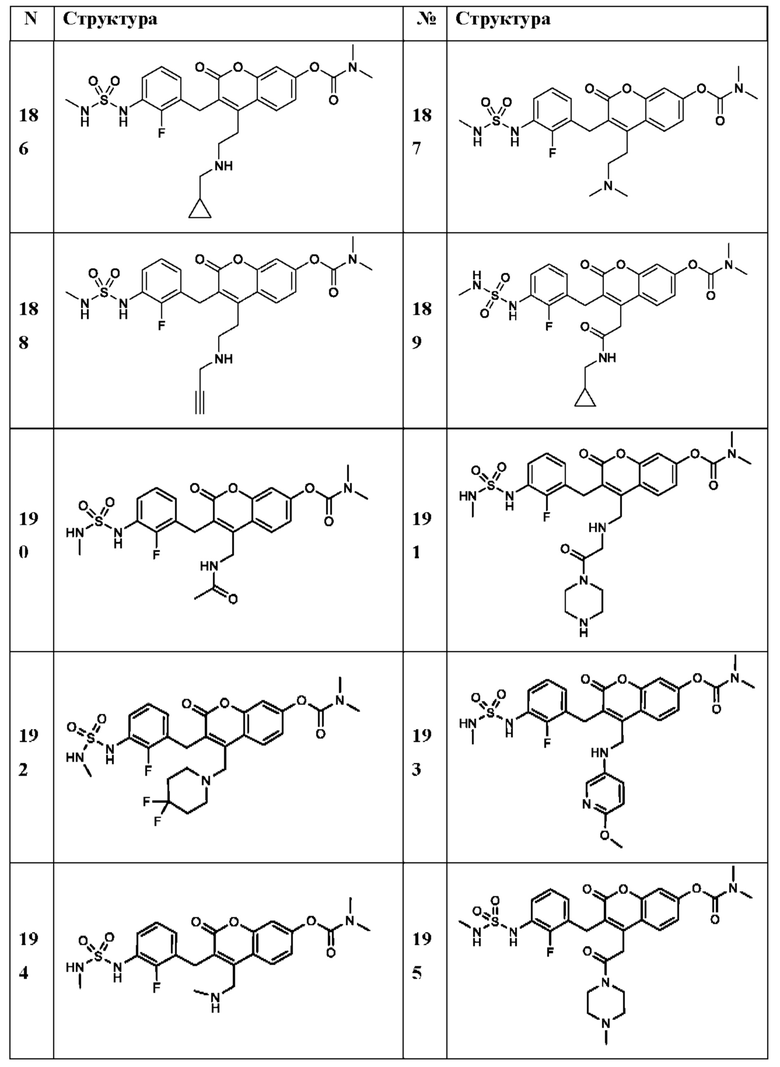
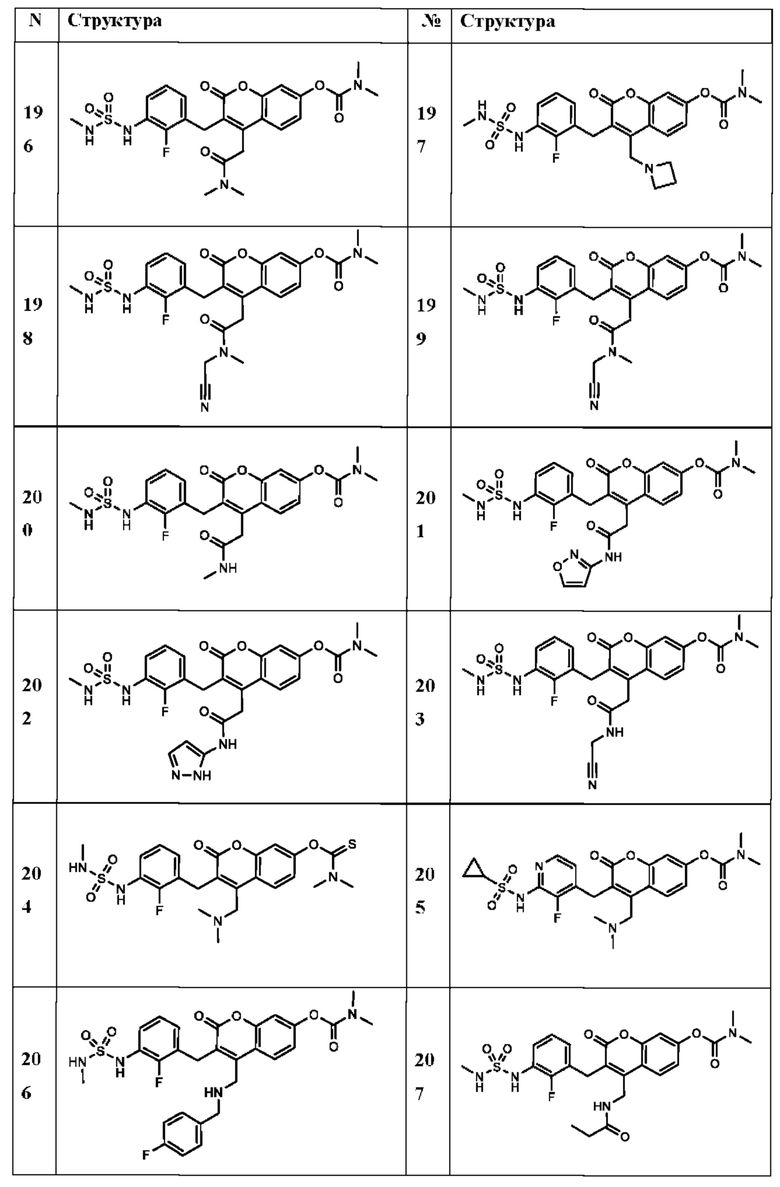

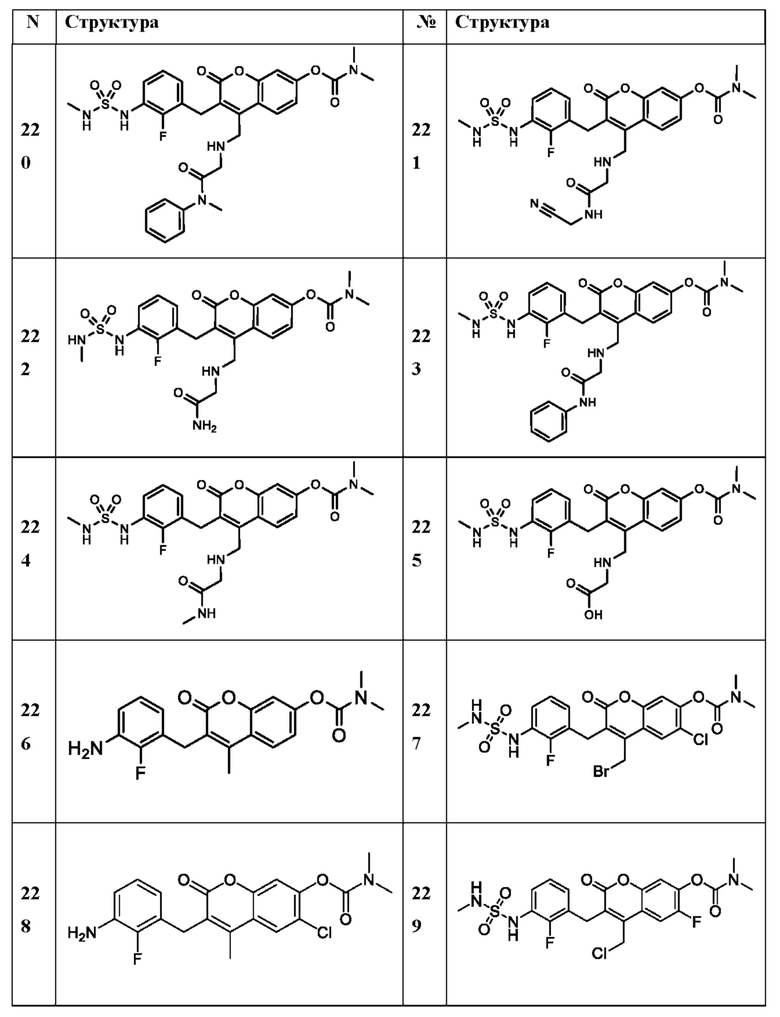
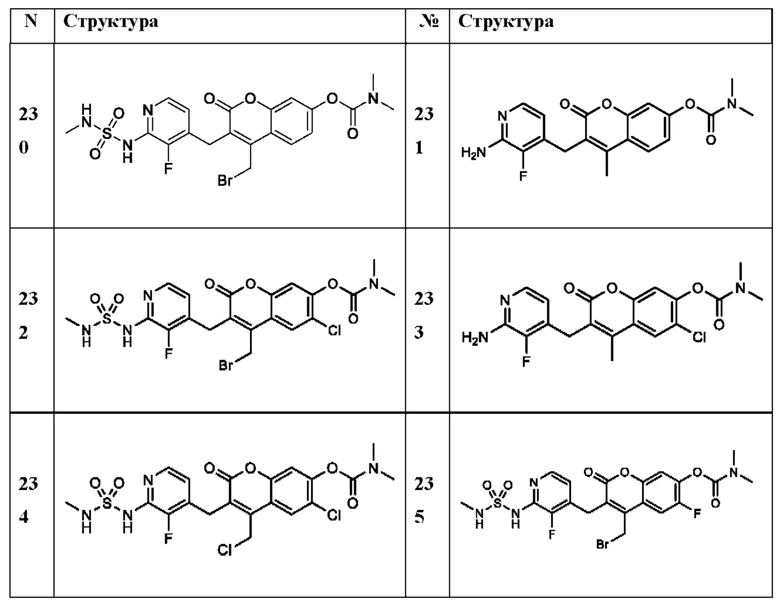
[0229] В некоторых вариантах осуществления фармацевтически приемлемая соль может представлять собой соль щелочного металла. В некоторых вариантах осуществления фармацевтически приемлемая соль может представлять собой соль щелочного металла. В некоторых вариантах осуществления фармацевтически приемлемая соль может представлять собой соль щелочноземельного металла. В некоторых вариантах осуществления фармацевтически приемлемая соль может представлять собой соль аммония. Синтез
[0230] Соединения Формулы (I), Ila), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или их фармацевтически приемлемые соли, описанные в данном документе, могут быть получены различными способами, включая способы, известные специалистам в данной области техники. Способы, приведенные и описанные в данном документе, являются только иллюстративным, не предназначены и не должны толковаться как ограничивающие объем формулы изобретения каким-либо образом. Специалисты в данной области техники смогут распознать модификации описанных синтезов и разработать альтернативные пути на основе представленных в данном документе описаний; все такие модификации и альтернативные пути входят в объем формулы изобретения. Примеры способов описаны в Примерах ниже.
Способы получения
[0231] Соединения, описанные в данном документе, могут быть синтезированы с помощью способов, описанных ниже, или модификаций этих способов. Варианты модификации методологии включают, помимо прочего, температуру, растворитель, реагенты и т.д., и они будут очевидны для специалистов в данной области техники. В общем, во время любого из описанных в данном документе способов получения соединений может оказаться необходимым и/или желательным защитить чувствительные или реакционные группы на любой из описанных молекул. Этого можно достичь с помощью обычных защитных групп, таких как группы, описанные в публикациях Protective Groups in Organic Chemistry (ed. J.F.W. McOmie, Plenum Press, 1973); и Greene & Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991, которые полностью включены в данный документ посредством ссылки. Защитные группы могут быть удалены на удобной последующей стадии с помощью способов, известных из уровня техники. Преобразования в синтетической химии, применяемые при синтезе применимых соединений, известны в данной области техники и включают, например, описанные в публикациях R. Larock, Comprehensive Organic Transformations, VCH Publishers, 1989, или L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons, 1995, которые полностью включены в данный документ посредством ссылки.
[0232] Если в результате описанных в данном документе способов получения соединений получают смеси стереоизомеров, такие изомеры могут быть разделены обычными методами, такими как препаративная хиральная хроматография. Соединения могут быть получены в рацемической форме, или отдельные энантиомеры могут быть получены стереоселективным синтезом или разделением. Соединения могут быть разделены на составляющие их энантиомеры стандартными методами, такими как образование диастереомерных пар путем образования соли с оптически активной кислотой, такой как (-)-ди-р-толуоил-d-винная кислота и/или (+)-ди-р-толуоил-1-винная кислота с последующей фракционной кристаллизацией и регенерацией свободного основания. Соединения также могут быть разделены с применением хирального вспомогательного вещества путем образования диастереомерных производных, таких как сложные эфиры, амиды или кетали, с последующим хроматографическим разделением и удалением указанного хирального вспомогательного вещества.
Фармацевтические композиции
[0233] В другом аспекте описаны фармацевтические композиции, которые содержат физиологически приемлемые поверхностно-активные вещества, носители, разбавители, эксципиенты, гомогенизирующие агенты, суспендирующие агенты, пленкообразующие вещества и вспомогательные вещества для покрытия или их комбинация; а также в данном документе описано соединение. Приемлемые носители или разбавители для терапевтического применения хорошо известны в области фармацевтики и описаны, например, в публикации Remington's Pharmaceutical Sciences, 18th Ed., Mack Publishing Co., Easton, PA (1990), которая включена в данный документ посредством ссылки в полном объеме. В фармацевтическую композицию могут быть включены консерванты, стабилизаторы, красители, подсластители, отдушки, ароматизаторы и т.п. Например, в качестве консервантов могут быть добавлены бензоат натрия, аскорбиновая кислота и сложные эфиры р-гидроксибензойной кислоты. Также можно применять антиоксиданты и суспендирующие агенты. В различных вариантах осуществления в качестве поверхностно-активных агентов могут применяться спирты, сложные эфиры, сульфатированные алифатические спирты и т.п.; в качестве эксципиентов могут применяться сахароза, глюкоза, лактоза, крахмал, кристаллизованная целлюлоза, маннит, легкий безводный силикат, алюминат магния, метасиликат алюминат магния, синтетический силикат алюминия, карбонат кальция, кислый карбонат натрия, гидрофосфат кальция, карбоксиметилцеллюлоза кальция и т.п.; в качестве гомогенизирующих агентов могут применяться стеарат магния, тальк, отвержденное масло и т.п.; в качестве суспендирующих или смазывающих агентов могут применяться кокосовое масло, оливковое масло, кунжутное масло, арахисовое масло, соевое масло; в качестве суспендирующих агентов могут применяться фталат ацетата целлюлозы как производной углевода, такого как целлюлоза или сахар, или сополимер метилацетата и метакрилата как производный поливинила; и в качестве суспендирующих агентов могут применяться пластификаторы, такие как сложные эфиры фталатов и т.п.
[0234] В контексте данного документа термин «фармацевтическая композиция» относится к смеси описанного в данном документе соединения с другими химическими компонентами, такими как разбавители или носители. Фармацевтическая композиция облегчает введение соединения в организм. В данной области техники существует множество способов введения соединения, включая, помимо прочего, пероральное, инъекционное, аэрозольное, парентеральное и местное введение. Фармацевтические композиции также могут быть получены в результате реакции соединений с неорганическими или органическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, метансульфокислота, этансульфокислота, р-толуолсульфокислота, салициловая кислота и т.п.
[0235] В контексте данного документа термин «носитель» относится к химическому соединению, которое способствует включению соединения в клетки или ткани. Например, диметилсульфоксид (DMSO) является широко применяемым носителем, который облегчает проникновение многих органических соединений в клетки или ткани организма.
[0236] В контексте данного документа термин «разбавитель» относится к химическим соединениям, разведенным в воде, которые будут растворять представляющее интерес соединение, а также стабилизировать биологически активную форму соединения. Соли, растворенные в буферных растворах, применяются в качестве разбавителей в данной области техники. Одним из часто применяемых буферных растворов является фосфатно-солевой буфер, поскольку он имитирует солевые условия крови человека. Поскольку буферные соли могут контролировать рН раствора при низких концентрациях, буферный разбавитель редко изменяет биологическую активность соединения.
[0237] В контексте данного документа термин «физиологически приемлемый» относится к носителю или разбавителю, который не отменяет биологическую активность и свойства соединения.
[0238] В контексте данного документа термин «эксципиент» относится к инертному веществу, которое добавляется в фармацевтическую композицию для придания композиции, помимо прочего, массы, однородности, стабильности, связывающей способности, смазывающей способности, способности распадаться и т.д. «Разбавитель» является разновидностью эксципиента.
[0239] Для каждого из соединений, описанных в данном документе, и для каждого рода или подрода соединений, описанных в данном документе, также описаны фармацевтические композиции, содержащие это соединение отдельно или в смеси с другими соединениями этого рода или подрода или с альтернативными соединениями, описанными в данном документе, или с одним или большим количеством альтернативных фармацевтически активных соединений и одним или большим количеством фармацевтически приемлемых носителей, разбавителей, эксципиентов или их комбинацией. Описанные в данном документе фармацевтические композиции можно вводить пациенту-человеку как есть или в составе фармацевтических композиций, где они смешаны с другими активными ингредиентами, как при комбинированной терапии, или с носителями, разбавителями, эксципиентами или их комбинациями. Подходящая лекарственная форма зависит от выбранного пути введения. Способы приготовления и введения описанных в данном документе соединений известны специалистам в данной области техники.
[0240] Фармацевтические композиции, описанные в данном документе, могут быть получены любым способом, который сам по себе известен, например, посредством обычных способов смешивания, растворения, гранулирования, приготовления драже, растирания, эмульгирования, инкапсулирования, захвата или таблетирования. Кроме того, активные ингредиенты содержатся в количестве, эффективном для достижения намеченной цели. Многие из соединений, применяемых в описанных в данном документе фармацевтических комбинациях, могут быть представлены в виде солей с фармацевтически совместимыми противоионами.
[0241] Описанные в данном документе фармацевтические композиции можно вводить пациенту-человеку как есть или в составе фармацевтических композиций, где они смешаны с другими активными ингредиентами, как при комбинированной терапии, или с подходящими носителями или эксципиентами. Методики приготовления и введения соединений по настоящей заявке можно найти в публикации «Remington's Pharmaceutical Sciences», Mack Publishing Co., Easton, PA, 18-е издание, 1990.
[0242] Подходящие пути введения могут, например, включать в себя пероральное, ректальное, трансмукозальное, местное или кишечное введение; парентеральную доставку, включая внутримышечные, подкожные, внутривенные, интрамедуллярные инъекции, а также интратекальные, прямые внутрижелудочковые, внутрибрюшинные, интраназальные или внутриглазные инъекции. Соединения также можно вводить в лекарственных формах с замедленным или контролируемым высвобождением, включая инъекции депо, осмотические насосы, пилюли, трансдермальные (включая электроперенос) пластыри и т.п., для пролонгированного и/или регулируемого по времени, импульсного введения с заданной скоростью.
[0243] Фармацевтические композиции по данному изобретению могут быть получены способом, который сам по себе известен, например, посредством обычных способов смешивания, растворения, гранулирования, приготовления драже, растирания, эмульгирования, инкапсулирования, захвата или таблетирования.
[0244] Фармацевтические композиции для применения в соответствии с данным изобретением могут, таким образом, быть приготовлены посредством обычных способов с применением одного или большего количества физиологически приемлемых носителей, включающих эксципиенты и вспомогательные вещества, которые облегчают процессинг активных соединений в препаратах, которые можно применять в фармацевтике. Подходящая лекарственная форма зависит от выбранного пути введения. Любые из хорошо известных способов, носителей и эксципиентов могут применяться как подходящие и как это понимается в данной области техники, например, см. публикацию Remington's Pharmaceutical Sciences выше.
[0245] Инъекционные препараты могут быть приготовлены как обычные лекарственные формы, либо в виде жидких растворов, либо в виде суспензий, в виде твердых форм, пригодных для растворения или суспендирования в жидкости перед инъекцией, либо в виде эмульсий. Подходящими эксципиентами являются, например, вода, физиологический солевой раствор, декстроза, маннит, лактоза, лецитин, альбумин, глутамат натрия, гидрохлорид цистеина и т.п. Кроме того, при желании фармацевтические композиции для инъекций могут содержать незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие агенты, рН-буферные агенты и т.п. Физиологически совместимые буферы включают, помимо прочего, раствор Хэнкса, раствор Рингера или физиологический солевой буфер. При желании можно применять препараты, усиливающие абсорбцию (например, липосомы).
[0246] Для трансмукозального введения в составе могут применяться пенетранты, соответствующие барьеру для проникновения.
[0247] Фармацевтические составы для парентерального введения, например, путем болюсной инъекции или непрерывной инфузии, включают водные растворы активных соединений в водорастворимой форме. Кроме того, суспензии активных соединений могут быть приготовлены в виде подходящих масляных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или другие органические масла, такие как соевое, грейпфрутовое или миндальное масла, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, которые увеличивают вязкость суспензии, такие как натрий-карбоксиметилцеллюлоза, сорбит или декстран. Необязательно, суспензия может также содержать подходящие стабилизаторы или вещества, которые повышают растворимость соединений, для обеспечения получения высококонцентрированных растворов. Составы для инъекции могут быть представлены в стандартной лекарственной форме, например, в ампулах или многодозовых контейнерах с добавлением консерванта. Композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать формулирующие агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. В альтернативном варианте активный ингредиент может быть представлен в виде порошка для смешивания с подходящим носителем, например, стерильной апирогенной водой, перед применением.
[0248] Для перорального введения, соединения могут быть легко приготовлены путем объединения активных соединений с фармацевтически приемлемыми носителями, хорошо известными в данной области техники. Такие носители позволяют изготавливать соединения по данному изобретению в форме таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и т.п. для перорального приема пациентом, подлежащим лечению. Фармацевтические препараты для перорального применения могут быть получены путем объединения активных соединений с твердым эксципиентом, необязательного измельчения полученной смеси и обработки смеси гранул после добавления, если желательно, подходящих вспомогательных веществ с получением ядер таблеток или драже. Подходящими вспомогательными веществами являются, в частности, наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон (PVP). Если желательно, могут быть добавлены дезинтегрирующие агенты, такие как сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия. Ядра драже снабжены подходящими покрытиями. Для этой цели можно применять концентрированные растворы сахаров, которые могут необязательно содержать гуммиарабик, тальк, поливинилпирролидон, карбопол-гель, полиэтиленгликоль и/или диоксид титана, растворы лаков и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены к покрытиям таблеток или драже для идентификации или для характеризации различных комбинаций доз активного соединения. Для этой цели можно применять концентрированные растворы сахаров, которые могут необязательно содержать гуммиарабик, тальк, поливинилпирролидон, карбопол-гель, полиэтиленгликоль и/или диоксид титана, растворы лаков и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены к покрытиям таблеток или драже для идентификации или для характеризации различных комбинаций доз активного соединения.
[0249] Фармацевтические препараты, которые можно применять перорально, включают твердые капсулы, изготовленные из желатина, а также мягкие герметичные капсулы из желатина и пластификатора, такого как глицерин или сорбит. Твердые капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующими веществами, такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Все составы для перорального введения должны находиться в лекаарственных формах, подходящих для такого введения.
[0250] Для трансбуккального введения композиции могут иметь форму таблеток или пастилок, приготовленных обычным способом.
[0251] Для введения путем ингаляции соединения по данному изобретению удобно доставлять в форме аэрозольного спрея из упаковок под давлением или распылителя с применением подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением, единица дозы может быть определена путем обеспечения клапана для доставки отмеренного количества. Капсулы и картриджи из, например, желатина для применения в ингаляторе или инсуффляторе, могут содержать порошкообразную смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал.
[0252] Кроме того, в данном документе описаны различные фармацевтические композиции, хорошо известные в области фармацевтики для применения, которое включает внутриглазную, интраназальную и внутриушную доставку. Подходящие пенетранты для этих целей хорошо известны в данной области техники. Фармацевтические композиции для внутриглазной доставки включают водные офтальмологические растворы активных соединений в водорастворимой форме, такой как глазные капли, или в геллановой камеди (Shedden et al., Clin. Ther., 23(3):440-50 (2001)) или в гидрогелях (Mayer et al., Ophthalmologica, 210(2): 101-3 (1996)); глазные мази; офтальмологические суспензии, такие как микрочастицы, низкомолекулярные полимерные частицы, содержащие лекарственное средство, которые суспендированы в жидкой среде-носителе (Joshi, A., J. Ocul. Pharmacol, 10(1):29-45 (1994)), жирорастворимые составы (Aim et al., Prog. Clin. Biol. Res., 312:447-58 (1989)), микросферы (Mordenti, Toxicol. Sci., 52(1): 101-6 (1999)); а также глазные вставки. Все литературные источники, упомянутые выше, полностью включены в данное описание посредством ссылки. Такие подходящие фармацевтические составы чаще всего и предпочтительно изготавливают стерильными, изотоническими и забуференными для стабильности и комфорта. Фармацевтические композиции для интраназальной доставки могут также включать капли и спреи, часто приготовленные для имитации во многих отношениях назальных выделений для обеспечения поддержания нормального функционирования ресничек. Как описано в публикации Remington's Pharmaceutical Sciences, 18th Ed., Mack Publishing Co., Easton, PA (1990), которая полностью включена в данный документ посредством ссылки и хорошо известна специалистам в данной области техники, подходящие составы чаще всего и предпочтительно являются изотоническими, слегка забуференными для поддержания рН от 5,5 до 6,5 и наиболее часто и предпочтительно включают противомикробные консерванты и соответствующие стабилизаторы лекарственных средств. Фармацевтические составы для внутриушной доставки включают суспензии и мази для местного применения в ухе. Широко применяемые растворители для таких ушных составов включают глицерин и воду.
[0253] Указанные соединения также могут быть приготовлены в виде ректальных композиций, таких как суппозитории или ретенционные клизмы, например, содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды.
[0254] В дополнение к составам, описанным ранее, указанные соединения также могут быть составлены в виде депо-препарата. Такие составы пролонгированного действия вводят путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Таким образом, например, указанные соединения могут быть составлены с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами или в виде труднорастворимых производных, например, в виде труднорастворимой соли.
[0255] Для гидрофобных соединений подходящим фармацевтическим носителем может быть система сорастворителей, включающая бензиловый спирт, неполярное поверхностно-активное вещество, смешивающийся с водой органический полимер и водную фазу. Широко применяемой системой сорастворителей является система сорастворителей VPD, которая представляет собой раствор бензилового спирта с концентрацией 3% масс/об., 8% масс./об. неполярного поверхностно-активного вещества Polysorbate 80™ и 65% масс/об. полиэтиленгликоля 300, доведенных до объема в абсолютном этаноле. Естественно, пропорции системы сорастворителей могут значительно варьироваться без нарушения ее характеристик растворимости и токсичности. Кроме того, идентичность компонентов сорастворителей может варьироваться: например, вместо POLYSORBATE 80™ можно применять другие малотоксичные неполярные поверхностно-активные вещества; фракционный размер полиэтиленгликоля может варьироваться; другие биосовместимые полимеры могут заменять полиэтиленгликоль, например, поливинилпирролидон; и другие сахара или полисахариды могут заменять декстрозу.
[0256] В альтернативном варианте могут применяться другие системы доставки гидрофобных фармацевтических соединений. Липосомы и эмульсии являются хорошо известными примерами средств доставки или носителей для гидрофобных лекарственных средств. Также могут применяться и некоторые органические растворители, такие как диметилсульфоксид, хотя обычно за счет большей токсичности. Кроме того, указанные соединения могут быть доставлены с помощью системы замедленного высвобождения, такой как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие терапевтический агент. Различные материалы с замедленным высвобождением широко применяются и хорошо известны специалистам в данной области техники. Капсулы с замедленным высвобождением могут, в зависимости от их химической природы, высвобождать соединения в течение от нескольких недель до более чем 100 дней. В зависимости от химической природы и биологической стабильности терапевтического реагента могут применяться дополнительные стратегии стабилизации белка.
[0257] Агенты, предназначенные для внутриклеточного введения, можно вводить с помощью способов, хорошо известных специалистам в данной области техники. Например, такие агенты могут быть инкапсулированы в липосомы. Все молекулы, присутствующие в водном растворе во время образования липосомы, включаются в водную среду. Содержимое липосом защищено от внешней микросреды и, поскольку липосомы сливаются с клеточными мембранами, эффективно доставляется в цитоплазму клетки. Липосома может быть покрыта тканеспецифическим антителом. Липосомы будут нацелены на нужный орган и избирательно поглощаются им. В альтернативном варианте небольшие гидрофобные органические молекулы можно вводить непосредственно внутриклеточно.
[0258] В фармацевтические композиции могут быть включены дополнительные терапевтические или диагностические агенты. В альтернативном или дополнительном варианте фармацевтические композиции можно комбинировать с другими композициями, содержащими другие терапевтические или диагностические агенты. Парентеральная фармацевтическая композиция
[0259] Для приготовления парентеральной фармацевтической композиции, подходящей для введения путем инъекции (подкожной, внутривенной или т.п.), от 0,1 мг до 120 мг водорастворимой соли/саморастворимого материала/солюбилизированного комплекса соединения согласно предпочтительному варианту осуществления растворяют в стерильной воде и затем смешивают с 10 мкл 0,9% стерильного физиологического раствора. Смесь включена в разовую лекарственную форму, пригодную для введения путем инъекции.
Инъекционная фармацевтическая композиция
[0260] Для приготовления препарата для инъекций смешивают от 0,1 до 100 мг соединения Формулы (I), (Ia), (Ib), (Ic), (II), (IIa), (IIb) или (IIc), 2,0 мл буферного раствора ацетата натрия (0,4 М), HCl (1 н.) или NaOH (1 М) (q.s. до подходящего рН), воду (дистиллированную, стерильную) (q.s. до 20 мл). Все вышеперечисленные ингредиенты, кроме воды, соединяют и перемешивают, а при необходимости и при небольшом подогреве. Затем добавляют достаточное количество воды. Пероральная фармацевтическая композиция
[0261] Чтобы приготовить фармацевтическую композицию для пероральной доставки, от 0,1 мг до 120 мг соединения согласно варианту осуществления смешивают с 750 мг крахмала. Смесь включают в пероральную лекарственную форму, такую как твердая желатиновая капсула, или от 0,1 до 120 мг соединения гранулируют со связующим раствором, таким как раствор крахмала, вместе с подходящими разбавителями, такими как микрокристаллическая целлюлоза или тому подобное, разрыхлителями, такими как кроскарамеллоза натрия, полученную смесь сушат, добавляют смазывающее вещество и прессуют в таблетку, пригодную для перорального применения.
Сублингвальная (твердая пастилка) фармацевтическая композиция
[0262] Для приготовления фармацевтической композиции для трансбуккальной доставки, такой как твердая пастилка, от 0,1 мг до 120 мг соединения согласно предпочтительному варианту осуществления смешивают с 420 мг сахарной пудры/маннита/ксилита или таких сахаров, которые обеспечивают отрицательную теплоту раствора в системе, 1,6 мл светлого кукурузного сиропа, 2,4 мл дистиллированной воды и 0,42 мл экстракта мяты или других ароматизаторов. Смесь смешивают и выливают в форму для получения пастилки, подходящей для трансбуккального введения. Быстрораспадающаяся сублингвальная таблетка
[0263] Быстрораспадающуюся сублингвальную таблетку готовят путем смешивания 48,5% по массе соединения по предпочтительному варианту осуществления, 20% по массе микрокристаллической целлюлозы (KG-802), 24,5% по массе либо маннита, либо модифицированной декстрозы, либо их комбинации, которые способствуют более быстрому растворению прессованной таблетки во рту, 5% по массе низкозамещенной гидроксипропилцеллюлозы (50 мкм) и 2% по массе стеарата магния. Таблетки готовят прямым прессованием (AAPS PharmSciTech. 2006; 7(2):Е41). Общий вес прессованных таблеток составляет 150 мг. Состав готовят путем смешивания количества соединения согласно предпочтительному варианту осуществления с общим количеством микрокристаллической целлюлозы (МСС) и маннита/модифицированной декстрозы или их комбинации и двух третей количества низкозамещенной гидроксипропилцеллюлозы (L-HPC) с помощью трехмерного ручного миксера (Inversina, Bioengineering AG, Швейцария) в течение 4,5 минут. Весь стеарат магния (MS) и оставшуюся треть количества L-HPC добавляют за 30 секунд до окончания перемешивания.
Ингаляционная фармацевтическая композиция
[0264] Для приготовления фармацевтической композиции для ингаляционной доставки от 0,1 до 100 мг соединения по предпочтительному варианту осуществления смешивают с 50 мг безводной лимонной кислоты и 100 мл 0,9% раствора хлорида натрия. Смесь вводят в устройство для ингаляционной доставки, такое как небулайзер, который подходит для ингаляционного введения.
Фармацевтическая композиция суспензии для небулайзера
[0265] В другом варианте осуществления соединение по предпочтительному варианту осуществления (от 0,1 мг до 100 мг) суспендируют в стерильной воде (100 мл); добавляют Span 85 (1 г) с последующим добавлением декстрозы (5,5 г) и аскорбиновой кислоты (10 мг). Добавляют хлорид бензалкония (3 мл водного раствора 1:750) и рН доводят до 7 с помощью фосфатного буфера. Суспензию расфасовывают в стерильные небулайзеры.
Фармацевтическая композиция трансдермального пластыря
[0266] Чтобы приготовить фармацевтическую композицию для чрескожной доставки, от 0,1 мг до 100 мг соединения по предпочтительному варианту осуществления заливают или наносят на пластырь с одной липкой поверхностью. Полученный пластырь затем прикрепляют к коже через клейкую поверхность для чрескожного введения.
Гелевая фармацевтическая композиция для местного применения
[0267] Для приготовления фармацевтической гелевой композиции для местного применения от 0,1 до 100 мг соединения по предпочтительному варианту осуществления смешивают с 1,75 г гидроксипропилцеллюлозы, 10 мл пропиленгликоля, 10 мл изопропилмиристата и 100 мл очищенного спирта USP. Полученную гелевую смесь затем помещают в контейнеры, такие как тубы, которые подходят для местного применения.
Офтальмологический раствор
[0268] Для приготовления фармацевтической композиции офтальмологического раствора от 0,1 мг до 100 мг соединения по предпочтительному варианту осуществления смешивают с 0,9 г NaCl в 100 мл очищенной воды и фильтруют с применением 0,2-микронного фильтра. Полученный изотонический раствор затем вводят в офтальмологические средства доставки, такие как контейнеры для глазных капель, которые подходят для офтальмологического введения.
Раствор назального спрея
[0269] Для приготовления фармацевтического раствора назального спрея от 0,1 мг до 100 мг соединения по предпочтительному варианту осуществления смешивают с 30 мл 0,05 М фосфатного буферного раствора (рН 4,4). Раствор помещают в назальный дозатор, рассчитанный на подачу 100 мкл спрея на каждое применение.
Способы лечения/применения
[0270] Аспекты, описанные в данном документе, относятся к введению нуждающемуся в этом субъекту эффективного количества соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или их фармацевтически приемлемой соли), или фармацевтической композиции, которая включает одно или большее количество соединений, описанных в данном документе (например, одно или большее количество соединений Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или их фармацевтически приемлемая соль).
[0271] Как описано в другом месте данного документа, некоторые варианты осуществления относятся к лечению заболевания или патологического состояния, такого как рак, путем введения соединения или композиции, как описано в данном документе. Субъекта, нуждающегося в получении соединения или композиции, как описано в данном документе, для улучшения здоровья указанного субъекта, не всегда нужно идентифицировать до получения первого лечения соединением или композицией. Например, для субъекта может быть заранее определено, что у него разовьется заболевание или патологическое состояние, такое как рак, до проявления каких-либо признаков заболевания или патологического состояния. В альтернативном варианте, субъект может получать профилактическое лечение, если он/она находится в группе риска или у него/нее не развивается заболевание или патологическое состояние, такое как рак (например, когда у пациента проявляются симптомы другого заболевания или патологического состояния, ассоциированного с раком). Соответственно, в некоторых вариантах осуществления соединение или композицию можно вводить субъекту после того, как субъекту поставлен диагноз на ранней стадии. В некоторых вариантах осуществления не каждый субъект является кандидатом на такое введение, и может быть желательной идентификация субъектов лечения. Следует понимать, что выбор пациента зависит от ряда факторов, входящих в компетенцию врача обычной квалификации. Таким образом, некоторые варианты осуществления, описанные в данном документе, дополнительно включают идентификацию субъекта как субъекта, которому будет полезно введение эффективного количества по меньшей мере одного соединения или композиции для увеличения продолжительности жизни, увеличения времени выживания или повышения повседневной активности.
[0272] В других аспектах данное изобретение относится к способу лечения, предупреждения или профилактики рака, который может включать введение субъекту, нуждающемуся в этом, эффективного количества одного или большего количества соединений, описанных в данном документе (например, соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или их фармацевтически приемлемая соль), или фармацевтической композиции, которая включает соединение, описанное в данном документе (такое как соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль). В определенных вариантах осуществления рак может быть выбран из рака головного мозга, рака молочной железы, рака легких, рака яичника, рака поджелудочной железы, рака желудка, рака предстательной железы, рака почки, колоректального рака или лейкоза. В других или дополнительных вариантах осуществления рак представляет собой рак головного мозга или ахенокортикальную карциному. В других или дополнительных вариантах осуществления рак представляет собой рак молочной железы. В других или дополнительных вариантах осуществления рак представляет собой рак яичника. В других или дополнительных вариантах осуществления рак представляет собой рак поджелудочной железы. В других или дополнительных вариантах осуществления рак представляет собой рак желудка. В других или дополнительных вариантах осуществления рак представляет собой рак предстательной железы. В других или дополнительных вариантах осуществления рак представляет собой рак почки. В других или дополнительных вариантах осуществления рак представляет собой колоректальный рак. В других или дополнительных вариантах осуществления рак представляет собой миелоидный лейкоз. В других или дополнительных вариантах осуществления рак представляет собой глиобластому. В других или дополнительных вариантах осуществления рак представляет собой фолликулярную лимфому. В других или дополнительных вариантах осуществления рак представляет собой представляет собой пре-В острый лейкоз. В других или дополнительных вариантах осуществления рак представляет собой хронический лимфоцитарный В-лейкоз. В других или дополнительных вариантах осуществления рак представляет собой мезотелиому. В других или дополнительных вариантах осуществления рак представляет собой мелкоклеточный рак.
[0273] Некоторые варианты осуществления относятся к способу ингибирования пролиферации клеток с мутацией RAS, включающему введение соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли). В некоторых вариантах осуществления рак ассоциируется с мутацией RAS. Некоторые варианты осуществления относятся к способу индукции апоптоза в клетке, имеющей мутацию RAS, включающему введение соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли). Некоторые варианты осуществления относятся к способу ингибирования пролиферации клеток с мутацией KRAS, включающему введение соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли). В некоторых вариантах осуществления рак ассоциируется с мутацией KRAS. Некоторые варианты осуществления относятся к способу индукции апоптоза в клетке, имеющей мутацию KRAS, включающему введение соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли). Некоторые варианты осуществления относятся к способу ингибирования пролиферации клеток с мутацией NRAS, включающему введение соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли). В некоторых вариантах осуществления рак ассоциируется с мутацией NRAS. Некоторые варианты осуществления относятся к способу индукции апоптоза в клетке, имеющей мутацию RAS, включающему введение соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли). В некоторых вариантах осуществления мутация KRAS находится в кодонах 12, 13, 59, 61 и/или 146. В некоторых вариантах осуществления мутантная форма белка KRAS имеет одну или большее количество аминокислотных замен, выбранных из группы, состоящей из G12C, G12S, G12R, G12F, G12L, G12N, G12A, G12D, G12V, G13C, G13S, G13D, G13V, G13P, S17G, P34S, А59Е, A59G, А59Т, Q61K, Q61L, Q61R и Q61H. В некоторых вариантах осуществления мутантная форма белка KRAS имеет одну или большее количество аминокислотных замен, выбранных из группы, состоящей из G12C, G12R, G12S, G12A, G12D, G12V, G13C, G13R, G13S, G13A, G13D, G13V, А59Е, A59G, А59Т, Q61K, Q61L, Q61R, Q61H, K117N, K117R, K117E, А146Р, А146Т и A146V.
[0274] В определенных вариантах осуществления рак устойчив к лечению ингибитором протеинкиназы МЕК. В других вариантах осуществления рак устойчив к лечению ингибитором протеинкиназы RAF. В других вариантах осуществления устойчивость представляет собой приобретенную устойчивость. В других вариантах осуществления устойчивость представляет собой устойчивость de novo. В других или дополнительных вариантах осуществления рак устойчив к противораковому агенту.
[0275] В некоторых аспектах в данном документе предлагаются соединения или фармацевтические композиции и способы лечения рака, включающие терапевтически эффективное количество ингибитора протеинкиназы двойного RAF7MEK. В некоторых вариантах осуществления введение ингибитора протеинкиназы двойного RAF/MEK обеспечивает увеличение площади под кривой зависимости концентрации в сыворотке от времени (AUC) ингибитора протеинкиназы двойного RAF/MEK. В некоторых вариантах осуществления рак устойчив к лечению ингибитором протеинкиназы RAF. В дополнительных вариантах осуществления рак устойчив к ингибитору протеинкиназы RAF, и ингибитор протеинкиназы RAF включает ингибитор A-RAF, ингибитор B-RAF или ингибитор C-RAF. В дополнительных вариантах осуществления рак устойчив к ингибитору протеинкиназы RAF, и ингибитор протеинкиназы RAF включает ингибитор B-RAF.
[0276] В некоторых вариантах осуществления устойчивый рак представляет собой рак поджелудочной железы, меланому, рак толстой кишки, легких или желудка. В дополнительных вариантах осуществления данного изобретения устойчивый рак представляет собой рак поджелудочной железы. В дополнительных вариантах осуществления данного изобретения устойчивый рак представляет собой рак желудка. В альтернативных вариантах осуществления предлагаются фармацевтические комбинации и способы для ресенсибилизации раковых клеток к лечению у пациента с раком, устойчивым к противораковому агенту, или с подозрением на него, включающие этап введения пациенту терапевтически эффективного количества ингибитора двойного MEK/RAF, как описано в данном документе.
[0277] Некоторые варианты осуществления, описанные в данном документе, относятся к способу лечения млекопитающего, имеющего заболевание, который может включать введение субъекту, нуждающемуся в этом, эффективного количества одного или большего количества соединений, описанных в данном документе (например, соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или их фармацевтически приемлемая соль), или фармацевтической композиции, которая включает соединение, описанное в данном документе (такое как соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль). Другие варианты осуществления, описанные в данном документе, относятся к способу лечения субъекта с раковой кахексией, который может включать введение субъекту эффективного количества одного или большего количества соединений, описанных в данном документе (например, соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или их фармацевтически приемлемая соль), или фармацевтически приемлемой соли любого из вышеперечисленных соединений), или фармацевтической композиции, которая включает соединение, описанное в данном документе, такое как соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль).
[0278] Некоторые варианты осуществления, описанные в данном документе, относятся к применению одного или большего количества соединений, описанных в настоящем документе (таких как соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль), при изготовлении лекарственного средства для облегчения и/или лечения рака или раковых состояний, таких как раковая кахексия, при этом указанное применение может включать введение субъекту эффективного количество одного или большего количества соединений, описанных в данном документе (таких как соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль). Дополнительные другие варианты осуществления, описанные в данном документе, относятся к применению одного или большего количества соединений, описанных в настоящем документе (таких как соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль), которые можно применять для облегчения и/или лечения рака или раковых состояний, таких как раковая кахексия, при этом указанное применение может включать введение субъекту эффективного количество одного или большего количества соединений, описанных в данном документе или их фармацевтически приемлемых солей.
[0279] Некоторые варианты осуществления, описанные в данном документе, относятся к способам облегчения и/или лечения рака, которые могут включать приведение в контакт с раковой клеткой эффективного количества одного или большего количество соединений, описанных в данном документе (таких как соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль), или фармацевтической композиции, которая включает одно или большее количество соединений, описанных в данном документе (таких как соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль). В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль может действовать как ингибитор MEK. В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль может действовать как ингибитор ERK. В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль может действовать как ингибитор митоСТАТ3. В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль может уменьшать воспалительную кахексию и атрофию мышц.
[0280] В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемую соль можно вводить в разовой дозе один раз в день. В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемую соль можно вводить во множестве доз, более одного раза в день. В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемую соль можно вводить один раз в день. В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемую соль можно вводить два раза в день. В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемую соль можно вводить три раза в день. В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемую соль можно вводить четыре раза в день.
[0281] В некоторых аспектах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемая соль может ингибировать аномальный рост клеток. В некоторых вариантах осуществления аномальный рост клеток происходит у млекопитающего.
Способы ингибирования аномального роста клеток могут включать введение эффективного количества соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли, при этом ингибируется аномальный рост клеток. Способы ингибирования аномального роста клеток у млекопитающего могут включать введение млекопитающему соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли, при этом количества соединения являются эффективными для ингибирования аномального роста клеток у млекопитающего.
[0282] В других аспектах данное изобретение направлено на способ расщепления, ингибирования роста или уничтожения раковой клетки, включающий приведение указанной клетки в контакт с соединением Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой солью, эффективные для расщепления, ингибирования роста или уничтожения указанной клетки. В некоторых вариантах осуществления раковые клетки включают клетки рака головного мозга, молочной железы, легких, яичников, поджелудочной железы, желудка, предстательной железы, почек или толстой кишки.
[0283] В некоторых вариантах осуществления раковые клетки расщепляются. В некоторых вариантах осуществления расщепляются 1% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 2% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 3% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 4% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 5% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 10% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 20% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 25% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 30% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 40% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 50% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 60% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 70% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 75% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 80% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 90% раковых клеток. В других или дополнительных вариантах осуществления расщепляются 100% раковых клеток. В других или дополнительных вариантах осуществления по существу все раковые клетки расщепляются.
[0284] В некоторых вариантах осуществления раковые клетки уничтожаются. В других или дополнительных вариантах осуществления уничтожаются 1% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 2% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 3% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 4% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 5% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 1,0% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 20% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 25% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 30% раковых клеток. В дополнительных или добавочных вариантах осуществления уничтожаются 40% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 50% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 60% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 70% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 75% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 80% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 90% раковых клеток. В других или дополнительных вариантах осуществления уничтожаются 100% раковых клеток. В дополнительных или добавочных вариантах осуществления по существу все раковые клетки уничтожаются.
[0285] В других или дополнительных вариантах осуществления ингибируется рост раковых клеток. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 1%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 2%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 3%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 4%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 5%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 10%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 20%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 25%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 30%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 40%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 50%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 60%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 70%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 75%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 80%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 90%. В других или дополнительных вариантах осуществления рост раковых клеток ингибируется на около 100%.
[0286] В некоторых вариантах осуществления размер опухоли уменьшается путем введения терапевтически эффективного количества соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 1%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 2%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 3%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 4%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 5%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 10%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 20%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 25%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 30%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 40%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 50%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 60%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 70%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 75%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 80%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 85%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 90%. В других или дополнительных вариантах осуществления размер опухоли уменьшается по меньшей мере на 95%. В других или дополнительных вариантах осуществления опухоль эрадицируется. В некоторых вариантах осуществления размер опухоли не увеличивается.
[0287] В некоторых вариантах осуществления пролиферация опухоли уменьшается в результате введения соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 1%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 2%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 3%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 4%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 5%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 10%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 20%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 25%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 30%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 40%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 50%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 60%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 70%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 75%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 75%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 80%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 90%. В некоторых вариантах осуществления пролиферация опухоли уменьшается по меньшей мере на 95%. В некоторых вариантах осуществления пролиферация опухоли предотвращается.
Способы введения
[0288] Соединения или фармацевтические композиции можно вводить пациенту любым подходящим способом. Неограничивающие примеры способов введения включают, помимо прочего, (а) введение пероральным путем, при этом указанное введение включает введение в виде капсул, таблеток, гранул, спрея, сиропа или других подобных форм; (b) введение неоральными путями, такими как ректальное, вагинальное, внутриуретральное, внутриглазное, интраназальное или внутриушное, при этом указанное введение включает введение в виде водной суспензии, масляного препарата и т.п. или в виде капельницы, спрея, суппозитория, мази, линимента или тому подобное; (с) введение посредством инъекции, подкожной, внутрибрюшинной, внутривенной, внутримышечной, внутрикожной, интраорбитальной, интракапсулярной, интраспинальной, интрастернальной и т.п., включая доставку инфузионным насосом; (d) местное введение, такое как инъекция непосредственно в область почек или сердца, например, путем имплантации депо; а также (е) местное введение; как сочтут целесообразным специалисты в данной области техники для приведения соединения по данному изобретению в контакт с живой тканью.
[0289] Фармацевтические композиции, подходящие для введения, включают композиции, в которых активные ингредиенты содержатся в количестве, эффективном для достижения намеченной цели. Терапевтически эффективное количество описанных в данном документе соединений, требуемое в виде дозы, будет зависеть от пути введения, типа животного, включая человека, который подлежит лечению, и физических характеристик конкретного рассматриваемого животного. Доза может быть адаптирована для достижения желаемого эффекта, но она будет зависеть от таких факторов, как вес, питание, сопутствующее лечение и других факторов, которые известны специалистам в области медицины. Более конкретно, терапевтически эффективное количество означает количество соединения, эффективное для предотвращения, облегчения или ослабления симптомов заболевания или продления жизни субъекта, подлежащего лечению. Определение терапевтически эффективного количества находится в компетенции специалистов в данной области техники, особенно в свете подробного описания данного изобретения.
[0290] Как будет очевидно специалисту в данной области техники, полезная доза для введения in vivo и конкретный способ введения будут варьироваться в зависимости от возраста, массы тела и вида млекопитающих, подлежащих лечению, конкретных применяемых соединений и конкретного применения, для которого эти соединения используются. Определение эффективных уровней дозы, то есть уровней дозы, необходимых для достижения желаемого результата, может быть осуществлено специалистом в данной области техники с помощью обычных фармакологических способов. Как правило, клиническое применение продуктов у человека начинают с более низких уровней дозы, при этом уровень дозы увеличивают до тех пор, пока не будет достигнут желаемый эффект. В альтернативном варианте, данные соответствующих исследований in vitro могут быть использованы для установления пригодных доз и способов введения композиций, идентифицированных посредством данных способов, с применением широко известных фармакологических способов.
[0291] В исследованиях на животных, кроме человека, применение потенциальных продуктов начинают с более высоких уровней дозы, при этом дозу снижают до тех пор, пока не перестанет достигаться желаемый эффект или не исчезнут неблагоприятные побочные эффекты. Доза может широко варьироваться в зависимости от желаемых эффектов и терапевтических показаний. Как правило, дозы могут составлять от около 10 мкг/кг до 100 мг/кг массы тела, предпочтительно от около 100 мкг/кг до 10 мг/кг массы тела. В альтернативном варианте дозы могут быть основаны и рассчитаны на площади поверхности пациента, как будет понятно специалистам в данной области техники.
[0292] Точный состав, способ введения и доза фармацевтических композиций по данному изобретению могут быть выбраны врачом в зависимости от состояния пациента. (См., например, публикацию, Fingl et at. 1975, в "The Pharmacological Basis of Therapeutics", которая полностью включена в данный документ посредством ссылки, с конкретной ссылкой в гл. 1, с. 1). Как правило, диапазон доз композиции, вводимой пациенту, может составлять от около 0,5 до 1000 мг/кг массы тела пациента. Введение может быть разовым или серией из двух или большего количества доз в течение одного или большего количества дней, в зависимости от потребности пациента. В тех случаях, когда дозы соединений для человека были установлены по меньшей мере для некоторых патологических состояний, в данном изобретении будут применяться те же самые дозы или дозы, которые составляют от около 0,1% до 500%, более предпочтительно от около 25% до 250% от установленной дозы для человека. Если доза для человека не установлена, как это будет в случае с недавно открытыми фармацевтическими соединениями, подходящая доза для человека может быть выведена из значений ED-50 или ID-50 или других соответствующих значений, полученных в исследованиях in vitro или in vivo, подтвержденных исследованиями токсичности и исследованиями эффективности на животных.
[0293] Следует отметить, что лечащий врач должен знать, как и когда прекратить, прервать или скорректировать введение из-за токсичности или органной дисфункции. И наоборот, лечащий врач также будет знать, что следует скорректировать дозу до более высоких уровней, если клинический ответ не будет адекватным (исключая токсичность). Величина вводимой дозы при лечении представляющего интерес нарушения будет варьироваться в зависимости от тяжести состояния, подлежащего лечению, и пути введения. Тяжесть состояния можно, например, частично оценить с помощью стандартных методов прогностической оценки. Кроме того, доза и, возможно, частота приема также будут варьироваться в зависимости от возраста, массы тела и ответа отдельного пациента. Программа, сравнимая с рассмотренной выше, может применяться в ветеринарии.
[0294] Хотя точная доза будет определяться в зависимости от препарата, в большинстве случаев можно сделать некоторые обобщения относительно дозы. Суточная доза для взрослого пациента-человека может представлять собой, например, пероральную дозу от ОД до 2000 мг каждого активного ингредиента, предпочтительно от 1 до 500 мг, например, от 5 до 200 мг. В других вариантах осуществления внутривенная, подкожная или внутримышечная доза каждого активного ингредиента составляет от 0,01 до 100 мг, предпочтительно от 0,1 до 60 мг, например, от 1 до 40 мг. В случаях введения фармацевтически приемлемой соли дозы могут быть рассчитаны как свободное основание. В некоторых вариантах осуществления композицию вводят от 1 до 4 раз в день. В альтернативном варианте композиции по изобретению можно вводить посредством непрерывной внутривенной инфузии, предпочтительно в дозе каждого активного ингредиента до 1000 мг в день. Как будет понятно специалистам в данной области техники, в определенных ситуациях может быть необходимо вводить описанные в данном документе соединения в количествах, которые превышают или даже значительно превышают указанный выше предпочтительный диапазон доз для эффективного и агрессивного лечения особенно агрессивных заболеваний или инфекций. В некоторых вариантах осуществления соединения будут вводиться в течение периода непрерывной терапии, например, в течение недели или более, или в течение месяцев или лет.
[0295] В других или дополнительных вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемую соль можно вводить в диапазоне от около 0,001 до около 1000 мг/кг веса тела/день. В других или дополнительных вариантах осуществления количество соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли можно вводить в диапазоне от около 0,5 до около 50 мг/кг/день. В других или дополнительных вариантах осуществления количество соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли можно вводить в диапазоне от около 0,001 до около 7 г/день. В других или дополнительных вариантах осуществления количество соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли можно вводить в диапазоне от около 0,002 до около 6 г/день. В других или дополнительных вариантах осуществления количество соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли можно вводить в диапазоне от около 0,005 до около 5 г/день. В других или дополнительных вариантах осуществления количество соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли можно вводить в диапазоне от около 0,01 до около 5 г/день. В других или дополнительных вариантах осуществления количество соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли можно вводить в диапазоне от около 0,02 до около 5 г/день. В других или дополнительных вариантах осуществления количество соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли можно вводить в диапазоне от около 0,05 до около 2,5 г/день. В других или дополнительных вариантах осуществления количество соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли можно вводить в диапазоне от около 0,1 до около 1 г/день. В других или дополнительных вариантах осуществления уровни доз ниже нижнего предела вышеуказанного диапазона могут быть более чем достаточными.
[0296] Величина дозы и интервал могут быть скорректированы индивидуально для обеспечения уровней активного компонента в плазме, достаточных для поддержания модулирующих эффектов или минимальной эффективной концентрации (МЕС). МЕС будет варьироваться для каждого соединения, но ее можно оценить по данным in vitro. Дозы, необходимые для достижения МЕС, будут зависеть от индивидуальных особенностей и пути введения. Однако для определения концентрации в плазме можно использовать анализы HPLC или биоанализы.
[0297] Интервалы между дозами также можно определить с учетом значения МЕС. Композиции следует вводить по схеме, которая поддерживает уровни в плазме выше МЕС в течение 10-90% времени, предпочтительно в пределах 30-90% и наиболее предпочтительно в пределах 50-90%.
[0298] В случаях местного введения или селективного поглощения эффективная локальная концентрация препарата может быть не связана с концентрацией в плазме.
[0299] Количество вводимой композиции может зависеть от субъекта, который подлежит лечению, от веса субъекта, тяжести заболевания, способа введения и решения лечащего врача.
[0300] Соединения, описанные в данном документе, могут быть оценены на эффективность и токсичность с помощью известных способов. Например, токсикология конкретного соединения или группы соединений, имеющих общие химические фрагменты, может быть установлена путем определения токсичности in vitro по отношению к клеточной линии, такой как клеточная линия млекопитающего и предпочтительно человека. Результаты таких исследований часто прогнозируют токсичность у животных, таких как млекопитающие, или, точнее, у людей. В альтернативном варианте токсичность конкретных соединений на животных моделях, таких как мыши, крысы, кролики или обезьяны, может быть определена с помощью известных способов. Эффективность конкретного соединения может быть установлена с помощью нескольких общепризнанных способов, таких как способов in vitro, модели на животных или клинические исследования на людях. Признанные модели in vitro существуют почти для каждого класса патологических состояний, включая, помимо прочего, рак, сердечно-сосудистые заболевания и различные нарушения иммунной системы. Точно так же приемлемые модели на животных можно применять для установления эффективности химических веществ для лечения таких патологических состояний. При выборе модели для определения эффективности специалист в данной области техники может руководствоваться уровнем техники для выбора подходящей модели, дозы, пути и схемы введения. Разумеется, результаты клинических исследований на людях также можно применять для определения эффективности соединения у людей.
[0301] Композиции могут, при желании, быть представлены в упаковке или дозаторе, который может содержать одну или большее количество стандартных лекарственных форм, содержащих активный ингредиент. Упаковка может, например, содержать металлическую или пластиковую фольгу, такую как блистерная упаковка. Упаковка или дозатор могут сопровождаться инструкциями по применению. Упаковка или дозатор также могут сопровождаться уведомлением, ассоциированным с контейнером, по форме, предписанной государственным органом, регулирующим производство, применение или продажу фармацевтических препаратов, которое отражает одобрение агентством формы лекарственного средства для введения человеку или животному. Таким уведомлением, например, может быть маркировка, одобренная Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для отпускаемых по рецепту лекарственных средств, или одобренный листок-вкладыш. Композиции, содержащие соединение по данному изобретению в совместимом фармацевтическом носителе, также могут быть приготовлены, помещены в соответствующий контейнер и маркированы для лечения указанного состояния.
Введение и фармацевтические композиции
[0302] Соединения вводят в терапевтически эффективной дозе. Хотя уровни доз для человека еще предстоит конкретно определить для соединений, описанных в данном документе, обычно суточная доза может составлять от около 0,25 мг/кг до около 120 мг/кг или более массы тела, от около 0,5 мг/кг или менее до около 70 мг/кг, от около 1,0 мг/кг до около 50 мг/кг массы тела или от около 1,5 мг/кг до около 10 мг/кг массы тела. Таким образом, для введения человеку с массой тела 70 кг диапазон доз будет составлять от около 17 мг в день до около 8000 мг в день, от около 35 мг в день или менее до около 7000 мг в день или более, от около 70 мг в день до около 6000 мг в день, от около 100 мг в день до около 5000 мг в день или от около 200 мг до около 3000 мг в день. Разумеется, количество вводимого активного соединения будет зависеть от субъекта и патологического состояния, подлежащего лечению, тяжести заболевания, способа и схемы введения и решения лечащего врача.
[0303] Введение соединений, описанных в данном документе, или их фармацевтически приемлемых солей может осуществляться любым из принятых способов введения для агентов, которые выполняют аналогичные функции, включая, помимо прочего, перорально, подкожно, внутривенно, интраназально, местно, чрескожно, внутрибрюшинно, внутримышечно, внутрипульмонарно, вагинально, ректально или интраокулярно. Пероральное и парентеральное введение являются типовыми при лечении патологических состояний, которые являются предметом предпочтительных вариантов осуществления.
[0304] Соединения, применяемые, как описано выше, могут быть включены в состав фармацевтических композиций для применения при лечении этих патологических состояний. Применяются стандартные методики составления фармацевтических препаратов, такие как описанные в публикации Remington's The Science and Practice of Pharmacy, 21st Ed., Lippincott Williams & Wilkins (2005), полностью включенной в данный документ посредством ссылки. Соответственно, некоторые варианты осуществления включают фармацевтические композиции, содержащие: (а) безопасное и терапевтически эффективное количество соединения, описанного в данном документе (включая его энантиомеры, диастереоизомеры, таутомеры, полиморфы и сольваты), или его фармацевтически приемлемых солей; и (b) фармацевтически приемлемый носитель, разбавитель, эксципиент или их комбинацию
[0305] В дополнение к выбранному соединению, пригодному для применения, как описано выше, следующие варианты осуществления включают композиции, содержащие фармацевтически приемлемый носитель. Термин «фармацевтически приемлемый носитель» или «фармацевтически приемлемый эксципиент» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, замедляющие абсорбцию, и т.п. Применение таких сред и агентов для фармацевтических активных веществ хорошо известно в данной области техники. За исключением случаев, когда любая обычная среда или агент несовместимы с активным ингредиентом, предполагается их применение в терапевтических композициях. Кроме того, могут быть включены различные адъюванты, такие как обычно применяемые в данной области техники. Соображения по включению различных компонентов в фармацевтические композиции описаны, например, в публикации Gilman et al. (ред.) (1990); Goodman and Gilman's: The Pharmacological Basis of Therapeutics, 8th Ed., Pergamon Press, которая полностью включена в данный документ посредством ссылки.
[0306] Некоторыми примерами веществ, которые могут служить фармацевтически приемлемыми носителями или их компонентами, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и метилцеллюлоза; порошкообразный трагакант; солод; желатин; тальк; твердые смазывающие вещества, такие как стеариновая кислота и стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло теоброма; полиолы, такие как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновая кислота; эмульгаторы, такие как TWEENS; смачивающие агенты, такие как лаурилсульфат натрия; красящие вещества; ароматизаторы; таблетирующие агенты, стабилизаторы; антиоксиданты; консерванты; апирогенная вода; изотонический раствор; и фосфатно-буферные растворы.
[0307] Выбор фармацевтически приемлемого носителя для применения в сочетании с рассматриваемым соединением в основном определяется способом введения соединения.
[0308] Композиции, описанные в данном документе, предпочтительно предоставляются в виде стандартной лекарственной формы. В контексте данного документа термин «стандартная лекарственная форма» представляет собой композицию, содержащую количество соединения, подходящее для введения животному, предпочтительно млекопитающему, в виде разовой дозы в соответствии с надлежащей медицинской практикой. Однако приготовление разовой или стандартной лекарственной формы не означает, что лекарственную форму вводят один раз в день или один раз за курс лечения. Предполагается, что такие лекарственные формы вводят один, два, три или большее количество раз в день, и их можно вводить в виде инфузии в течение определенного периода времени (например, от около 30 минут до около 2-6 часов) или вводить в виде непрерывной инфузии и можно вводить более одного раза в течение курса лечения, хотя отдельно не исключается однократное введение. Квалифицированному специалисту будет понятно, что состав не предусматривает конкретно весь курс лечения, и такие решения оставлены на усмотрение специалистов в области лечения, а не приготовления состава.
[0309] Композиции, применимые, как описано выше, могут быть в любой из множества подходящих форм для различных способов введения, например, для перорального, назального, ректального, местного (включая чрескожное), глазного, внутримозгового, внутричерепного, интратекального, интраартериального, внутривенного, внутримышечного или других парентеральных путей введения. Специалисту в данной области техники будет понятно, что пероральные и назальные композиции включают композиции, которые вводятся путем ингаляции и изготавливаются с помощью доступных методик. В зависимости от желаемого конкретного пути введения можно применять различные фармацевтически приемлемые носители, хорошо известные в данной области техники. Фармацевтически приемлемые носители включают, например, твердые или жидкие наполнители, разбавители, гидротропы, поверхностно-активные агенты и инкапсулирующие вещества. Могут быть включены необязательные фармацевтически активные вещества, которые существенно не влияют на ингибирующую активность соединения. Количество носителя, применяемого вместе с соединением, достаточно для обеспечения практического количества материала для введения на стандартную дозу соединения. Методики и композиции для изготовления лекарственных форм, применимых в способах, описанных в данном документе, описаны в следующих источниках, все из которых включены в данное описание посредством ссылки: Modern Pharmaceutics, 4th Ed., Chapters 9 and 10 (Banker & Rhodes, editors, 2002); Lieberman et al., Pharmaceutical Dosage Forms: Tablets (1989); and Ansel, Introduction to Pharmaceutical Dosage Forms 8th Edition (2004).
[0310] Можно применять различные пероральные лекарственные формы, включая такие твердые формы, как таблетки, капсулы, гранулы и нерасфасованные порошки. Таблетки могут быть спрессованы, растерты, покрыты энтеросолюбильным покрытием, сахарным покрытием, пленочным покрытием или подвергаться многократному прессованию, содержать подходящие связующие вещества, смазывающие вещества, разбавители, разрыхлители, красители, ароматизаторы, агенты, вызывающие текучесть, и плавящие агенты. Жидкие пероральные лекарственные формы включают водные растворы, эмульсии, суспензии, растворы и/или суспензии, восстановленные из нешипучих гранул, и шипучие препараты, восстановленные из шипучих гранул, содержащие подходящие растворители, консерванты, эмульгаторы, суспендирующие агенты, разбавители, подсластители, плавящие агенты, красители и ароматизаторы.
[0311] Фармацевтически приемлемый носитель, пригодный для приготовления стандартных лекарственных форм для перорального введения, хорошо известен в данной области техники. Таблетки обычно содержат типовые фармацевтически совместимые адъюванты в качестве инертных разбавителей, такие как карбонат кальция, карбонат натрия, маннит, лактоза и целлюлоза; связующие вещества, такие как крахмал, желатин и сахароза; разрыхлители, такие как крахмал, альгиновая кислота и кроскармелоза; смазывающие вещества, такие как стеарат магния, стеариновая кислота и тальк. Глиданты, такие как диоксид кремния, можно применять для улучшения характеристик текучести порошковой смеси. Красящие агенты, такие как красители FD&C, могут быть добавлены для придания внешнего вида. Подсластители и ароматизаторы, такие как аспартам, сахарин, ментол, мята перечная и фруктовые ароматизаторы, являются полезными адъювантами для жевательных таблеток. Капсулы обычно содержат один или большее количество твердых разбавителей, описанных выше. Выбор компонентов носителя зависит от второстепенных факторов, таких как вкус, стоимость и стабильность при хранении, которые не являются критически важными и могут быть легко выполнены специалистом в данной области техники.
[0312] Пероральные композиции также включают жидкие растворы, эмульсии, суспензии и т.п. Фармацевтически приемлемые носители, пригодные для приготовления таких композиций, хорошо известны в данной области техники. Типовые компоненты носителей для сиропов, эликсиров, эмульсий и суспензий включают этанол, глицерин, пропиленгликоль, полиэтиленгликоль, жидкую сахарозу, сорбит и воду. Типовые суспендирующие агенты для суспензии включают метилцеллюлозу, карбоксиметилцеллюлозу натрия, AVICEL RC-591, трагакант и альгинат натрия; типовые смачивающие агенты включают лецитин и полисорбат 80; и типовые консерванты включают метилпарабен и бензоат натрия. Пероральные жидкие композиции могут также содержать один или большее количество компонентов, таких как подсластители, ароматизаторы и красители, описанные выше.
[0313] Такие композиции также могут быть покрыты с помощью обычных способов, как правило, покрытиями, зависящими от рН или времени, так что рассматриваемое соединение высвобождается в желудочно-кишечном тракте вблизи желаемого местного применения или в разное время для продления желаемого действия. Такие лекарственные формы обычно включают, помимо прочего, один или большее количество из следующих агентов: фталат ацетат целлюлозы, фталат поливинилацетат, фталат гидроксипропилметилцеллюлозы, этилцеллюлоза, покрытия Eudragit, воск и шеллак.
[0314] Композиции, описанные в данном документе, могут необязательно включать другие активные лекарственные вещества.
[0315] Другие композиции, пригодные для системной доставки описанных соединений, включают сублингвальные, трансбуккальные и назальные лекарственные формы. Такие композиции обычно содержат одно или большее количество растворимых веществ-наполнителей, таких как сахароза, сорбит и маннит; и связующих агентов, таких как аравийская камедь, микрокристаллическая целлюлоза, карбоксиметилцеллюлоза и гидроксипропилметилцеллюлоза. Также могут быть включены глиданты, смазывающие вещества, подсластители, красители, антиоксиданты и вкусовые вещества, описанные выше.
[0316] Жидкая композиция, приготовленная для местного офтальмологического применения, составлена таким образом, что ее можно вводить местно в глаза. Комфорт должен быть максимальным, насколько это возможно, хотя иногда характеристики состава (например, стабильность лекарственного средства) могут потребовать меньшего комфорта, чем оптимальный. В случае, когда комфорт не может быть максимальным, жидкость должна быть составлена таким образом, чтобы жидкость была переносима пациентом при местном офтальмологическом применении. Кроме того, офтальмологически приемлемая жидкость должна быть либо упакована для одноразового применения, либо содержать консервант для предотвращения загрязнения при многократном применении.
[0317] Для офтальмологического применения растворы или лекарственные средства часто готовят с использованием физиологического солевого раствора в качестве основного носителя. Офтальмологические растворы предпочтительно должны поддерживаться при комфортном рН с помощью соответствующей буферной системы. Составы могут также содержать обычные, фармацевтически приемлемые консерванты, стабилизаторы и поверхностно-активные вещества.
[0318] Консерванты, которые можно применять в описанных в данном документе фармацевтических композициях, включают, помимо прочего, хлорид бензалкония, РНМВ, хлорбутанол, тимеросал, фенилртуть, ацетат и нитрат фенилртути. Пригодным поверхностно-активным веществом является, например, Tween 80. Подобным образом, в описанных в данном документе офтальмологических препаратах можно применять различные пригодные носители. Эти носители включают, помимо прочего, поливиниловый спирт, повидон, гидроксипропилметилцеллюлозу, полоксамеры, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу и очищенную воду.
[0319] По мере необходимости или для удобства могут быть добавлены регуляторы тоничности. Они включают, помимо прочего, соли, в частности хлорид натрия, хлорид калия, маннит и глицерин, или любой другой пригодный офтальмологически приемлемый регулятор тоничности.
[0320] Можно применять различные буферы и средства для регулирования рН, если полученный препарат является офтальмологически приемлемым. Для многих композиций рН будет находиться между 4 и 9. Соответственно, буферы включают ацетатные буферы, цитратные буферы, фосфатные буферы и боратные буферы. Кислоты или основания можно применять для корректировки рН этих составов по мере необходимости.
[0321] Аналогичным образом, офтальмологически приемлемый антиоксидант включает, помимо прочего, метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол.
[0322] Другими вспомогательными компонентами, которые могут быть включены в офтальмологические препараты, являются хелатирующие агенты. Пригодным хелатирующим агентом является эдетат динатрия, хотя вместо него или в сочетании с ним также можно применять другие хелатирующие агенты.
[0323] Для местного применения используют кремы, мази, гели, растворы или суспензии и т.д., содержащие описанное в данном документе соединение. Препараты для местного применения обычно могут состоять из фармацевтического носителя, сорастворителя, эмульгатора, усилителя проникновения, системы консервантов и смягчающего вещества.
[0324] Для внутривенного введения описанные в данном документе соединения и композиции могут быть растворены или диспергированы в фармацевтически приемлемом разбавителе, таком как солевой раствор или раствор декстрозы. Для достижения желаемого рН могут быть включены подходящие эксципиенты, включая, помимо прочего, NaOH, карбонат натрия, ацетат натрия, HCl и лимонную кислоту. В различных вариантах осуществления рН конечной композиции находится в диапазоне от 2 до 8 или предпочтительно от 4 до 7. Эксципиенты-антиоксидантные могут включать бисульфит натрия, ацетон бисульфит натрия, формальдегид натрия, сульфоксилат, тиомочевину и EDTA. Другие неограничивающие примеры пригодных эксципиентов, содержащихся в конечной композиции для внутривенного введения, могут включать фосфаты натрия или калия, лимонную кислоту, винную кислоту, желатин и углеводы, такие как декстроза, маннит и декстран. Дополнительные приемлемые эксципиенты описаны в публикациях Powell, et al., Compendium of Excipients for Parenteral Formulations, PDA J Pharm Sci and Tech 1998, 52 238-311 и Nema et al., Excipients and Their Role in Approved Injectable Products: Current Usage and Future Directions, PDA J Pharm Sci and Tech 2011, 65 287-332, обе из которых полностью включены в данный документ посредством ссылки. Антимикробные агенты также могут быть включены для получения бактериостатического или фунгистатического раствора, включая, помимо прочего, нитрат фенилртути, тимеросал, хлорид бензетония, хлорид бензалкония, фенол, крезол и хлорбутанол.
[0325] Композиции для внутривенного введения могут быть предоставлены лицам, осуществляющим уход, в форме одного или большего количества твердых веществ, которые восстанавливают пригодным разбавителем, таким как стерильная вода, физиологический солевой раствор или декстроза в воде, незадолго до введения. В других вариантах осуществления композиции представлены в виде растворов, готовых к парентеральному введению. В других вариантах осуществления композиции представлены в виде раствора, который дополнительно разбавляют перед введением. В вариантах осуществления, которые включают введение комбинации соединения, описанного в данном документе, и другого агента, комбинация может быть предоставлена лицам, осуществляющим уход, в виде смеси, или лица, осуществляющие уход, могут смешивать два агента перед введением, или два агента могут вводиться отдельно.
[0326] Фактическая доза активных соединений, описанных в данном документе, зависит от конкретного соединения и патологического состояния, подлежащего лечению; при этом выбор подходящей дозы хорошо известен специалисту в данной области техники.
Вторые (или другие дополнительные) агенты
[0327] В некоторых вариантах осуществления второй терапевтический агент представляет собой противовоспалительный агент. В некоторых вариантах осуществления второй терапевтический агент представляет собой нестероидный противовоспалительный агент. В некоторых вариантах осуществления второй терапевтический агент представляет собой противораковый агент.
[0328] В некоторых вариантах осуществления указанные способы включают введение эффективного количества соединения Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемой соли в комбинации с некоторым количеством химиотерапевтического средства, при этом количества комбинации и химиотерапевтического средства вместе эффективны в ингибировании аномального роста клеток. Многие химиотерапевтические средства в настоящее время известны в данной области техники и могут применяться в комбинации. В некоторых вариантах осуществления химиотерапевтическое средство выбран из группы, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов фактора роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормонов, ингибиторов ангиогенеза, и антиандрогенов. Также описаны способы ингибирования аномального роста клеток у млекопитающего, включающие введение млекопитающему некоторого количества ингибитора протеинкиназы MEK и/или ингибитора протеинкиназы Raf в комбинации с лучевой терапией, при этом количества ингибитора протеинкиназы MEK и/или ингибитора протеинкиназы Raf в комбинации с лучевой терапией эффективны для ингибирования аномального роста клеток или лечения гиперпролиферативного нарушения у млекопитающего. Методы проведения лучевой терапии известны в данной области техники, и эти методы можно применять в описанной в данном документе комбинированной терапии.
[0329] В некоторых вариантах осуществления данное изобретение также относится к способу ингибирования аномального роста клеток у млекопитающего, который может включать соединение Формул (I), (Ia), (Ib), (Ic), (II), (IIa), (IIb), (IIc) или их фармацевтически приемлемую соль, а также количество одного или большее количество веществ, выбранных из антиангиогенных агентов, ингибиторов сигнальной трансдукции и антипролиферативных агентов. Антиангио генные агенты, такие как ингибиторы ММР-2 (матриксной металлопротеиназы 2), ингибиторы ММР-9 (матриксной металлопротеиназы 9) и ингибиторы СОХ-II (циклооксигеназы II), можно применять в сочетании с соединением по настоящему изобретению и фармацевтическими композициями, описанными в данном документе. Примеры пригодных ингибиторов СОХ-II включают CELEBREX™ (алекоксиб), вальдекоксиб и рофекоксиб. Примеры пригодных ингибиторов матриксных металлопротеиназ описаны в WO 96/33172 (опубликовано 24 октября 1996 г.), WO 96/27583 (опубликовано 7 марта 1996 г.), заявке на европейский патент №97304971.1 (подано 8 июля 1997 г.), заявке на европейский патент №99308617.2 (подано 29 октября 1999 г.), WO 98/07697 (опубликовано 26 февраля 1998 г.), WO 98/03516 (опубликовано 29 января 1998 г.), WO 98/34918 (опубликовано 13 августа 1998 г. ), WO 98/ 34915 (опубликовано 13 августа 1998 г.), WO 98/33768 (опубликовано 6 августа 1998 г.), WO 98/30566 (опубликовано 16 июля 1998 г.), публикации Европейского патента 606046 (опубликовано 13 июля 1994 г.), публикации Европейского патента 931788 (опубликовано 28 июля 1999 г.), WO 90/05719 (опубликовано 31 мая 1990 г.), WO 99/52910 (опубликовано 21 октября 1999 г.), WO 99/52889 (опубликовано 21 октября 1999 г.), WO 99/29667 (опубликовано 17 июня 1999 г.), международной заявке РСТ №PCT/IB98/01113 (подано 21 июля 1991 г.), заявке на Европейский патент №99302232.1 (подано 25 марта 1999 г.), заявке на патент Великобритании №9912961.1 (подано 3 июня 1999 г.), предварительной заявке США №60/148 464 (подано 12 августа 1999 г.), патенте США 5 863 949 (выдано 26 января 1999 г.), патенте США 5 861 510 (выдано 19 января 1999 г.) и публикации Европейского патента 780386 (опубликовано 25 июня 1997 г.). Некоторые ингибиторы ММР-2 и ММР-9 незначительно или совсем не ингибируют ММР-1, в то время как некоторые селективно ингибируют ММР-2 и/или АМР-9 по сравнению с другими матриксными моталлопротеиназами (например, МАР-1, NEMP-3, ММР-4, M7v1P-5, ММР-6, ММР-7, ММР-8, ММР-10, ММР-11 и ММР-13). Некоторыми конкретными примерами ингибиторов M1v1P, применимых в настоящем изобретении, являются AG-3340, RU 32-3555 и RS 13-0830.
[0330] В некоторых вариантах осуществления соединение Формулы (I), (Ia), (Ib), (Ic), (Id), (II), (IIa), (IIb), (IIc), (IId) или его фармацевтически приемлемую соль вводят по меньшей мере с одним дополнительным терапевтическим агентом. В некоторых вариантах осуществления терапевтический агент представляет собой таксол, бортезорниб или оба препарата. В других или дополнительных вариантах осуществления терапевтический агент выбран из группы, состоящей из цитотоксических агентов, антиангиогенных агентов и антинеопластических агентов. В других или дополнительных вариантах осуществления антинеопластические агенты выбран из группы, состоящей из алкилирующих агентов, антиметаболитов, эпиклофиллотоксимов, антинеопластических ферментов, ингибиторов топоизомеразы, прокарбазина, митоксантрона, координационных комплексов платины, модификаторов биологического ответа и ингибиторов роста, гормональных/ антигормональных терапевтических агентов и гемопоэтических факторов роста.
[0331] В настоящее время в данной области техники известны многие химиотерапевтические агенты, и их можно применять в комбинации с соединениями и композициями по данному изобретению. В некоторых вариантах осуществления химиотерапевтическое средство выбран из группы, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов фактора роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антигормонов, ингибиторов ангиогенеза, и антиандрогенов.
[0332] В некоторых вариантах осуществления указанную комбинацию вводят в сочетании с дополнительной терапией. В других или дополнительных вариантах осуществления дополнительная терапия представляет собой лучевую терапию, химиотерапию, хирургическое вмешательство или любую их комбинацию. В других или дополнительных вариантах осуществления указанную комбинацию вводят в сочетании по меньшей мере с одним дополнительным терапевтическим агентом. В других или дополнительных вариантах осуществления терапевтический агент выбран из группы, состоящей из цитотоксических агентов, антиангиогенных агентов и антинеопластических агентов. В других или дополнительных вариантах осуществления антинеопластический агент выбран из группы, состоящей из алкилирующих агентов, антиметаболитов, эпиклофиллотоксимов, противоопухолевых ферментов, ингибиторов топоизомеразы, прокарбазина, митоксантрона, координационных комплексов платины, модификаторов биологического ответа и ингибиторов роста, гормональных/ антигормональных терапевтических агентов и гемопоэтических факторов роста.
[0333] В некоторых вариантах осуществления второй терапевтический агент представляет собой агент для совместной регуляции путей MEK или RAF. В некоторых вариантах осуществления второй терапевтический агент представляет собой ингибитор MEK или RAF. В некоторых вариантах осуществления ингибитор RAF представляет собой вемурафениб, дабрафениб, XL-281, LGX-818, СЕР-32496, ARQ-736, MEK-162, селуметиниб, рефаметиниб, Е-6201, пимасертиб, WX-554 и GDC-0973.
[0334] В некоторых вариантах осуществления второй терапевтический агент выбран из следующих агентов: аспирин; дифлюнизал; сальсалат; ацетаминофен; ибупрофен; дексибупрофен; напроксен; фенопрофен; кетопрофен; декскетопрофен; флурбипрофен; оксапрозин; локсопрофен; индометацин; толметин; сулиндак; этодолак; кеторолак; диклофенак; ацеклофенак; набуметон; эноловая кислота; пироксикам; мелоксикам; теноксикам; дроксикам; лорноксикам; изоксикам; мефенамовая кислота; меклофенамовая кислота; флуфенамовая кислота; толфенамовая кислота; сульфанилиды; клониксин; ликофелон; дексаметазон; а также преднизолон.
[0335] В некоторых вариантах осуществления второй терапевтический агент выбран из следующих агентов: мехлорэтамин; циклофосфамид; мелфалан; хлорамбуцил; ифосфамид; бусульфан; N-нитрозо-N-метилмочевина (MNU); кармустин (BCNU); ломустин (CCNU); семустин (MeCCNU); фотемустин; стрептозотоцин; дакарбазин; митозоломид; темозоломид; тиотепа; митомицин; диазиквон (AZQ); цисплатин; карбоплатин; а также оксалиплатин.
[0336] В некоторых вариантах осуществления второй терапевтический агент выбран из следующих агентов: винкристин; винбластин; винорелбин; виндезин; винфлунин; паклитаксел; доцетаксел; этопозид; тенипозид; тофацитиниб; иксабепилон; иринотекан; топотекан; камптотецин; доксорубицин; митоксантрон; а также тенипозид.
[0337] В некоторых вариантах осуществления второй терапевтический агент выбран из следующих агентов: актиномицин; блеомицин; пликамицин; митомицин; даунорубицин; эпирубицин; идарубицин; пирарубицин; акларубицин; митоксантрон; циклофосфамид; метотрексат; 5-фторурацил; преднизолон; фолиновая кислота; метотрексат; мелфалан; капецитабин; мехлорэтамин; урамустин; мелфалан; хлорамбуцил; ифосфамид; бендамустин; 6-меркаптопурин; а также прокарбазин.
[0338] В некоторых вариантах осуществления второй терапевтический агент выбран из следующих агентов: кладрибин; пеметрексед; флударабин; гемцитабин; гидроксимочевина; неларабин; кладрибин; клофарабин; итарабин; децитабин; цитарабин; цитарабин липосомальный; пралатрексат; флоксуридин; флударабин; колхицин; тиогуанин; кабазитаксел; ларотаксел; ортатаксел; тезетаксел; аминоптерин; пеметрексед; пралатрексат; ралтитрексед; пеметрексед; кармофур; а также флоксуридин.
[0339] В некоторых вариантах осуществления второй терапевтический агент выбран из следующих агентов: азацитидин; децитабин; гидроксикарбамид; топотекан; иринотекан; белотекан; тенипозид; акларубицин; эпирубицин; идарубицин; амрубицин; пирарубицин; валрубицин; зорубицин; митоксантрон; пиксантрон; мехлорэтамин; хлорамбуцил; преднимустин; урамустин; эстрамустин; кармустин; ломустин; фотемустин; нимустин; ранимустин; карбокон; тиоТЕПА; триазиквон; а также триэтиленмеламин.
[0340] В некоторых вариантах осуществления второй терапевтический агент выбран из следующих агентов: недаплатин; сатраплатин; прокарбазин; дакарбазин; темозоломид; альтретамин; митобронитол; пипоброман; актиномицин; блеомицин; пликамицин; аминолевулиновая кислота; метиламинолевулинат; эфапроксирал; талапорфин; темопорфин; вертепорфин; альвоцидиб; селициклиб; палбоциклиб; бортезомиб; карфилзомиб; анагрелид; масопрокол; олапариб; белиностат; панобиностат; ромидепсин; вориноста; иделалисиб; атрасентан; бексаротен; тестолактон; амсакрин; трабектин; алитретиноин; третиноин; демеколцин; эльсамитруцин; этоглюцид; лонидамин; лукантон; митогуазон; митотан; облимерсен; омацетаксин мепесукцинат; а также эрибулин.
[0341] В некоторых вариантах осуществления второй терапевтический агент выбран из следующих агентов: азатиоприн; микофеноловая кислота; лефлуномид; терифлуномид; такролимус; циклоспорин; пимекролимус; абетимус; гусперимус; леналидомид; помалидомид; талидомид; анакинра; сиролимус; эверолимус; ридафоролимус; темсиролимус; умиролимус; зотаролимус; экулизумаб; адалимумаб; афелимомаб; цертолизумаб пегол; голимумаб; инфликсимаб; нерелимомаб; меполизумаб; омализумаб; фаралимомаб; элсилимомаб; лебрикизумаб; устекинумаб; этанерцепт; отеликсизумаб; теплизумаб; визилизумаб; кленоликсимаб; келиксимаб; занолимумаб; эфализумаб; эрлизумаб; обинутузумаб; ритуксимаб; а также окрелизумаб.
[0342] В некоторых вариантах осуществления второй терапевтический агент выбран из следующих агентов: пасколизумаб; гомиликсимаб; люмиликсимаб; тенеликсимаб; торализумаб; азелизумаб; галиксимаб; гавилимомаб; руплизумаб; белимумаб; блисибимод; ипилимумаб; тремелимумаб; бертилимумаб; лерделимумаб; метелимумаб; натализумаб; тоцилизумаб; одулимомаб; базиликсимаб; даклизумаб; инолимомаб; золимома; аторолимумаб; седелизумаб; фонтолизумаб; маслимомаб; моролимумаб; пекселизумаб; реслизумаб; ровелизумаб; сиплизумаб; тализумаб; телимомаб; вапаликсимаб; вепалимомаб; абатацепт; белатацепт; пегсунерцепт; афлиберцепт; алефацепт; и рилонацепт.
ПРИМЕРЫ
Общие процедуры
[0343] Дополнительные варианты осуществления более подробно описаны в следующих примерах, которые никоим образом не предназначены для ограничения объема формулы изобретения.
[0344] Материалы, применяемые при приготовлении соединений Формулы (I), (Ia), (Ib) или (Ic), описанных в данном документе, могут быть получены известными способами или коммерчески доступны. В этих реакциях также можно применять варианты, которые сами по себе известны специалистам в данной области техники, но не упоминаются в более подробном описании. Квалифицированный специалист, ознакомившись с литературой и данным описанием, может приготовить любое из этих соединений.
[0345] Признано, что квалифицированный специалист в области органической химии может легко проводить манипуляции без дополнительных указаний, то есть выполнение этих манипуляций вполне входит в объем навыков и практики квалифицированного специалиста. Они включают восстановление карбонильных соединений до соответствующих им спиртов, окисление, ацилирование, ароматические замещения, как электрофильные, так и нуклеофильные, этерификацию, эстерификацию, омыление и тому подобное. Эти манипуляции обсуждаются в стандартных текстах, таких как March's Advanced Organic Chemistry (Wiley), Carey and Sundberg, Advanced Organic Chemistry (полностью включенных в данный документ посредством ссылки) и т.п..
[0346] Для квалифицированного специалиста будет понятно, что некоторые реакции лучше всего проводить, когда другая функциональность замаскирована или защищена в молекуле, что позволяет избежать любых нежелательных побочных реакций и/или увеличить выход реакции. Часто специалист в данной области техники применяет защитные группы для достижения таких повышенных выходов или для предотвращения нежелательных реакций. Эти реакции описаны в литературе и также находятся в пределах компетенции специалиста в данной области техники. Примеры многих из этих манипуляций можно найти, например, в публикации Т. Greene и P. Wuts Protecting Groups in Organic Synthesis, 4-е изд., John Wiley & Sons (2007), полностью включенной в данный документ посредством ссылки.
[0347] Следующие примеры схем представлены для руководства читателю и представляют собой предпочтительные способы получения соединений, приведенных в данном документе в качестве примеров. Эти способы не являются ограничивающими, и будет очевидно, что для получения этих соединений могут применяться и другие способы. Такие способы конкретно включают химию на основе твердой фазы, включая комбинаторную химию. Квалифицированный специалист в данной области техники имеет все необходимое для получения этих соединений с помощью способов, описанных в литературе и в данном изобретении. Нумерации соединений, применяемые в схемах синтеза, изображенных ниже, предназначены только для этих конкретных схем, и их не следует толковать или путать с такими же нумерациями в других разделах заявки.
[0348] Торговые марки, используемые в данном изобретении, являются только примерами и отражают иллюстративные материалы, применявшиеся в изобретении. Квалифицированному специалисту будет понятно, что возможны изменения в партии, производственных процессах и т.п. Следовательно, примеры и товарные знаки, используемые в них, не являются ограничивающими и не предназначены для ограничения, а являются просто иллюстрацией того, как специалист в данной области техники может решить реализовать один или большее количество вариантов осуществления изобретения.
[0349] Следующие примеры схем представлены для руководства читателю и в совокупности представляют типовый способ получения соединений, представленных в данном документе. Кроме того, другие способы получения соединений, описанные в данном документе, будут очевидны специалисту в данной области техники в свете последующих схем реакций и примеров. Если не указано иное, все переменные определены выше.
ПРИМЕР 1. Общий синтез А
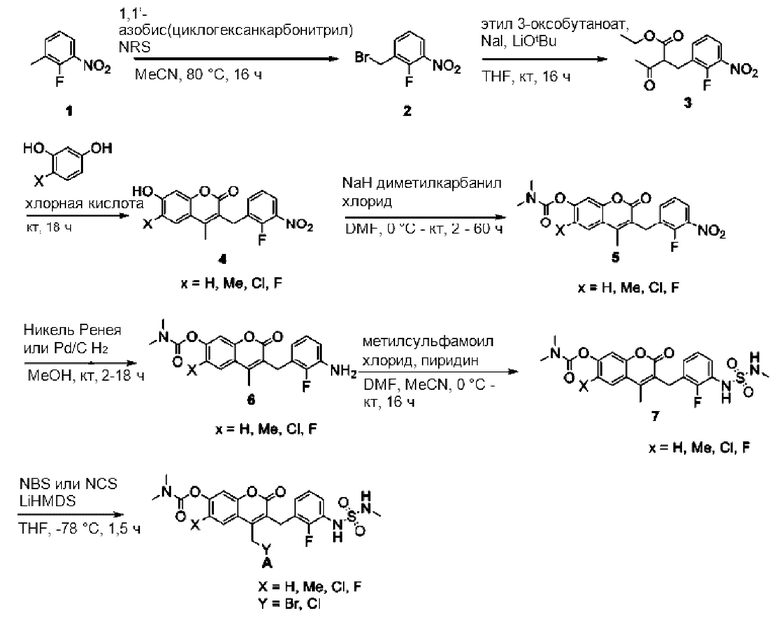
[0350] Соединение 2: К раствору 2-фтор-3-нитротолуола 1 (153,9 г, 268 ммоль, 1,0 экв.) и NBS (57,8 г, 321 ммоль, 1,20 экв.) в MeCN (1340 мл) в атмосфере азота добавляли 1,1-азобис(циклогексанкарбонитрил) (8,0 г, 32,1 ммоль, 0,12 экв.). Образовавшуюся реакционную смесь перемешивали при 80°С в течение 16 часов. Реакционной смеси давали остыть до комнатной температуры и концентрировали при пониженном давлении с получением оранжевой суспензии. Добавляли Et2O и образовавшуюся суспензию перемешивали в течение 18 часов при комнатной температуре. Суспензию фильтровали и остаток промывали дополнительным количеством Et2O. Объединенные органические слои промывали насыщенным водным раствором NaHCO3 и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением темно-красного масла, которое кристаллизовалось при отстаивании. Продукт перекристаллизовывали, используя гептан, с получением 1-(бромметил)-2-фтор-3-нитробензола 2 (43,8 г, 186,7 ммоль, выход: 70%, чистота: 99%) в виде белого твердого вещества.
[0332] LCMS (Способ К): tR=1,95 мин; m/z рассч. Для [М+Н]+=234,0, обнаруж. = нет массы; 1Н ЯМР (400 МГц, DMSO) δ 8,14 (td, J=7,8, 7,3, 1,7 Гц, 1H), 8,01 - 7,93 (m, 1H), 7,50 - 7,40 (m, 1H), 4,81 (d, J=1,4 Гц, 2Н).
[0351] Соединение 3: К раствору этил 2-(2-фтор-3-нитробензил)-3-оксобутаноата 3 (1,0 экв.) в хлорной кислоте (10-20 экв.) добавляли диол (1,20 экв.). Образовавшуюся реакционную смесь перемешивали в течение 1-18 ч при комнатной температуре. К реакционной смеси добавляли воду и продукт фильтровали, промывали водой и Et2O. Остаток сушили, получая кумарин в виде твердого вещества.
[0352] Соединение 4: К раствору кумарина (1,0 экв.) в N,N-диметилформамиде (сухом) (0,13-0,2 М) при 0°С в атмосфере N2 добавляли 60%-ную дисперсию гидрида натрия в минеральном масле (1,60 экв.). Образовавшуюся реакционную смесь оставляли для перемешивания на 10 мин, после чего добавляли диметилкарбамоилхлорид (1,50-1,60 экв.). Образовавшейся реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 2-60 часов. Добавляли воду, чтобы погасить реакционную смесь. Образовавшуюся суспензию фильтровали, промывали водой и Et2O. Остаток сушили, получая диметилкарбамат в виде твердого вещества.
[0353] Соединение 5: Диметилкарбамат (1,0 экв.) суспендировали в метаноле (0,2 М), в некоторых случаях добавляли некоторое количество CH2Cl2 для получения раствора. Через раствор барботировали аргон в течение 10 мин. Затем добавляли 50% суспензию Raney®-Nickel в воде (1,0 экв.) или 10% палладия на активированном угле (0,05 экв.). Образовавшуюся реакционную смесь продували водородом и перемешивали в течение 2-18 ч при комнатной температуре. Реакционную смесь фильтровали через кизельгур и промывали MeCN, CH2Cl2 и МеОН. Фильтрат концентрировали при пониженном давлении с получением первичного амина в виде твердого вещества.
[0354] Соединение 6: В охлажденную на бане со льдом (0°С) суспензию первичного амина (1,0 экв.) и пиридина (3,00 экв.) в N,N-диметилформамиде (0,2 М) по каплям добавляли прозрачный раствор метилсульфамоилхлорида (2,50 экв.) в ацетонитриле (безводном) (0,2 М). После завершения добавления образовавшейся реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1-16 часов. К реакционной смеси добавляли воду и образовавшуюся суспензию перемешивали в течение 1 часа. Суспензию фильтровали, промывали водой и Et2O. Остаток сушили, получая сульфамоил в виде твердого вещества.
[0355] Соединение 7: Раствор сульфамоила (1,0 экв.) в тетрагидрофуране (сухой) (0,06-0,10 М) в атмосфере азота охлаждали до -78°С и медленно добавляли LiHMDS 1M в THF (3,00 экв.). После полного добавления образовавшуюся реакционную смесь в некоторых случаях разбавляли дополнительным количеством тетрагидрофурана (сухого) и перемешивали в течение 30 мин, давали нагреться до 0°С. Его добавляли по каплям через канюлю в течение 15 минут к охлажденному (-78°С) раствору NCS или NBS (1,20 экв.) в тетрагидрофуране (сухой) (0,04 М). Образовавшуюся реакционную смесь перемешивали в течение 1 часа при -78°С. При -78°С реакционную смесь гасили 1М HCl и давали нагреться до комнатной температуры. Добавляли дополнительное количество воды и продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 0:1) с получением брома или хлора в виде твердого вещества.
ПРИМЕР 2
Общий синтез В

[0356] Соединение В.1: К раствору этилового эфира 2-(2-фтор-3-нитробензил)-3-оксобутаноата 3 (6,54 г, 23,09 ммоль, 1,0 экв.) в хлорной кислоте (29,8 мл, 346 ммоль, 15,0 экв.) добавляли резорцин (3,05 г, 27,7 ммоль, 1,20 экв.). Образовавшуюся реакционную смесь перемешивали в течение 1 ч при комнатной температуре. К реакционной смеси добавляли воду и продукт фильтровали, промывали водой и Et2O. Остаток сушили в течение ночи при 40°С при пониженном давлении с получением 3-(2-фтор-3-нитробензил)-7-гидрокси-4-метил-2Н-хромен-2-она (15,224 г, 45,8 ммоль, выход: 112%) в виде не совсем белого твердого вещества.
[0357] LCMS (Способ I): tR=1,92 мин; m/z рассч. для [М+Н]+=330,1, обнаруж.=330,0; 1Н ЯМР (400 МГц, DMSO) δ 10,51 (s, 1H), 8,03 - 7,92 (m, 1H), 7,69 (d, J=8,8 Гц, 1H), 7,60 - 7,51 (m, 1H), 7,32 (t, J=8,0 Гц, 1H), 6,83 (dd, J=8,8, 2,4 Гц, 1H), 6,72 (d, J=2,4 Гц, 1H), 4,02 (s, 2Н), 2,43 (s, 3Н).
[0358] Соединение В.2: К суспензии 3-(2-фтор-3-нитробензил)-7-гидрокси-4-метил-2Н-хромен-2-она (3 г, 7,74 ммоль, 1,0 экв.) в CH2Cl2 (0,6 М) добавляли DIPEA (5 мл, 28,6 ммоль, 3,70 экв.). Добавляли МЕМ-Cl (1,8 мл, 15,90 ммоль, 2,05 экв.) и образовавшуюся реакционную смесь перемешивали в течение 18 часов при комнатной температуре. Реакционную смесь очищали колоночной хроматографией методом «флэш» (гептан/EtOAc 3:1 → 1:3) с получением 3-(2-фтор-3-нитробензил)-7-((2-метоксиэтокси)метокси)-4-метил-2Н-хромен-2-она (2,71 г, 6,49 ммоль, выход: 84%) в виде бесцветного масла.
[0359] LCMS (Способ I): tR=2,08 мин; m/z рассч. для [М+Н]+=418,0, обнаруж. = 418,0
[0360] Соединение В.3: Раствор 3-(2-фтор-3-нитробензил)-7-((2-метоксиэтокси)метокси)-4-метил-2Н-хромен-2-она (2,71 г, 6,49 ммоль, 1,0 экв.) в тетрагидрофуране (сухой) (0,04 М) охлаждали до -78°С и медленно добавляли LiHMDS (1 М в THF, 7,79 мл, 7,79 ммоль, 1,20 экв.). Образовавшуюся реакционную смесь перемешивали в течение 30 мин при -78°С, после чего медленно добавляли NBS (1,156 г, 6,49 ммоль, 1,0 экв.), растворенный в тетрагидрофуране (сухой) (75 мл). Образовавшийся желтый раствор перемешивали в течение 30 минут при -78°С. Реакционную смесь гасили насыщ. водн. NH4Cl при -78°С и нагревали до комнатной температуры. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением желтого масла. Неочищенный продукт очищали колоночной хроматографией методом «флэш» (гептан/EtOAc 1:0 → 1:3) с получением 4-(бромметил)-3-(2-фтор-3-нитробензил)-7-((2-метоксиэтокси)метокси)-2Н-хромен-2-она (2,1 г, 4,23 ммоль, выход: 65%) в виде не совсем белого пористого твердого вещества.
[0361] LCMS (Способ K): tR=1,94 мин; m/z рассч. для [М+Н]+=496,0/498,0, обнаруж.=496,0/498,0
[0362] Соединение В.4: 4-(бромметил)-3-(2-фтор-3-нитробензил)-7-((2-метоксиэтокси)метокси)-2Н-хромен-2-он (1,5 г, 3,02 ммоль, 1,0 экв.) суспендировали в диметиламин (2,0 М в МеОН, 15 мл, 30,0 ммоль, 10,0 экв.) при комнатной температуре.
Образовавшуюся реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении. Неочищенный продукт суспендировали в Et2O. Твердое вещество отфильтровывали, а остаток промывали Et2O и сушили с получением 4-((диметиламино)метил)-3-(2-фтор-3-нитробензил)-7-((2-метоксиэтокси)метокси)-2Н-хромен-2-она (1,27 г, 2,59 ммоль, выход: 86%) в виде не совсем белого твердого вещества.
[0363] LCMS (Способ I): tR=2,11 мин; m/z рассч. для [М+Н]+=461,1, обнаруж. = 461,1
[0364] Соединение В.5: К смеси 4-((диметиламино)метил)-3-(2-фтор-3-нитробензил)-7-((2-метоксиэтокси)метокси)-2Н-хромен-2-она (1,27 г, 2,59 ммоль, 1,0 экв.) в метаноле (0,26 М) добавляли Raney®-Nickel (50% суспензия в воде, 0,5 мл, 2,59 ммоль, 1,0 экв.) и полученную реакционную смесь помещали в атмосферу водорода на 4 часа. Реакционную смесь разбавляли МеОН и образовавшийся раствор фильтровали. Фильтрат концентрировали при пониженном давлении и дважды упаривали толуолом с получением 3-(3-амино-2-фторбензил)-4-((диметиламино)метил)-7-((2-метоксиэтокси)метокси)-2Н-хромен-2-она (1,116 г, 2,59 ммоль, выход: 100%) в виде липкого твердого вещества.
[0365] LCMS (Способ U): tR=2,02 мин; m/z рассч. для [М+Н]+=430,8, обнаруж. = 430,8
[0366] Соединение В.6: К раствору 3-(3-амино-2-фторбензил)-4-((диметиламино)метил)-7-((2-метоксиэтокси)метокси)-2Н-хромен-2-она (1,1 г, 2,56 ммоль, 1,0 экв.) в N,N-диметилформамиде (сухой) (1,2 М), добавляли пиридин (0,413 мл, 5,11 ммоль, 2,0 экв.) и раствор метилсульфамоилхлорида (0,268 мл, 3,07 ммоль, 1,2 экв.) в ацетонитриле (безводный) (1,2 М). Образовавшуюся реакционную смесь перемешивали при комнатной температуре в течение 1 часа. 50% водн. NaHCO3 добавляли к реакционной смеси и продукт экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=3:2 → 1:9) с получением сульфамида (1,35 г, 2,58 ммоль, выход: 101%) в виде желтого масла.
[0367] LCMS (Способ U): tR=1,94 мин; m/z рассч. для [М+Н]+=524,2, обнаруж. = 524,1
[0368] Соединение В.7: К раствору сульфамида (910 мг, 1,738 ммоль, 1,0 экв.) в смеси метанол/THF (1:1) (0,17 мл) добавляли серную кислоту (1,5 мл, 28,1 ммоль, 16 экв.). Образовавшуюся реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь гасили в насыщ. водн. NaHCO3 и экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2 /МеОН 1:0 → 95:5). Желаемые фракции объединяли и концентрировали при пониженном давлении. Остаток растворяли в смеси MeCN/вода и лиофилизировали с получением фенола (510 мг, 1,171 ммоль, выход: 67%) в виде твердого вещества желтого цвета.
[0369] LCMS (Способ J): tR=2,68 мин; m/z рассч. для [М+Н]+=436,1, обнаруж. = 436,0
ПРИМЕР 3
Общий синтез С
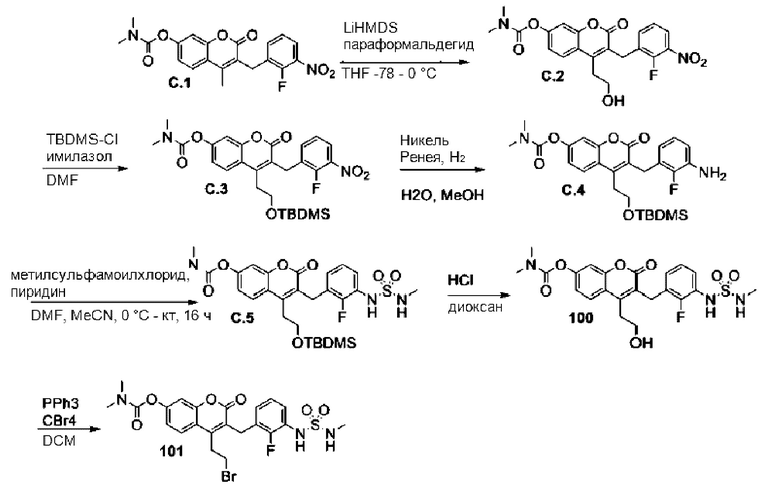
[0370] Соединение С.2: Раствор С1 (3,0 г, 7,49 ммоль) в тетрагидрофуране (сухой) (100 мл) в атмосфере азота охлаждали до -78°С и медленно добавляли LiHMDS 1М в THF (9,7 мл, 9,7 ммоль, 1,3 экв.). После полного добавления образовавшуюся реакционную смесь перемешивали 30 мин при -78°С, а затем 30 мин при 0°С. Затем параформальдегид (3,4 г, 112 ммоль, 15 экв.). Реакционную смесь перемешивали в течение 1 часа при 0°С. Затем реакционную смесь гасили 1М HCl, нагревали до комнатной температуры и продукт экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0→3:7) с получением С.2 (1,67 г, 3,41 ммоль, чистота: 88%, выход: 46%) в виде не совсем белого твердого вещества.
[0371] Соединение С.3: Трет-бутилдиметилсилилхлорид (338 мг, 2,24 ммоль) и имидазол (162 мг, 2,37 ммоль) растворяли в N,N-диметилформамиде (20 мл), добавляли 3-(2-фтор-3-нитробензил)-4-(2-гидроксиэтил)-2-оксо-2Н-хромен-7-илдиметилкарбамат (645 мг, 1,32 ммоль) и смесь перемешивали в течение ночи. Затем реакционную смесь гасили водой и продукт экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0→1:1) с получением С.3 (502 мг, 0,92 ммоль, выход: 70%) в виде бесцветного масла.
[0372] Соединение С.4: С.3 (2,3 г, 4,22 ммоль) растворяли в 150 мл МеОН и через раствор барботировали аргон в течение 10 мин. Затем добавляли 50% суспензию Raney-Ni в воде (2 мл, 8,44 ммоль). Смесь продували водородом и перемешивали в течение 1,5 ч при комнатной температуре. Затем реакцию гасили продувкой аргоном, смесь фильтровали через целит, концентрировали и упаривали EtOAc и DCM с получением С.4 (2,41 г, 4,21 ммоль, чистота: 90%, выход: 100%) в виде коричневого масла.
[0373] Соединение С.5: В охлажденную на бане со льдом (0°С) суспензию первичного амина (1,0 экв.) и пиридина (3,00 экв.) в N,N-диметилформамиде (0,2 М) по каплям добавляли прозрачный раствор метилсульфамоилхлорида (2,50 экв.) в ацетонитриле (безводном) (0,2 М). После завершения добавления образовавшейся реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1-16 часов. К реакционной смеси добавляли воду и образовавшуюся суспензию перемешивали в течение 1 часа. Суспензию фильтровали, промывали водой и Et2O. Остаток сушили, получая сульфамоил в виде твердого вещества. 727 мг, 5,61 ммоль С.4 давали С.5 (1,97 г, 3,24 ммоль, чистота: 95%, выход: 87%) в виде оранжевой пены.
[0374] Соединение 100: К перемешиваемому раствору С,5 (1,97 г, 2,92 ммоль) в 5 мл 1,4-диоксана добавляли 2 мл 4N HCl в 1,4-диоксане. Через 30 мин растворители выпаривали, упаривали с применением DCM и очищали колоночной флэш-хроматографией (гептан/EtOAc=1:0→0:1) с получением 100 (1,45 г, 2,79 ммоль, выход: 96%) в виде не совсем белой пены.
[0375] Анализ: LCMS (Способ Р): tR=1,19 мин; m/z рассч. для [М+Н]+=494,1, обнаруж.=494,1; 1H ЯМР (400 МГц, CDCl3) δ 7,65 (d, J=8,7 Гц, 1Н), 7,34 (dt, 1H), 7,14-7,07 (m, 2Н), 7,02-6,90 (m, 2Н), 6,81-6,73 (m, 1H), 4,79 (q, J=5,3 Гц, 1H), 4,09 (s, 2H), 3,67 (t, J=7,3 Гц, 2H), 3,17-3,08 (m, 5H), 3,03 (s, 3Н), 2,75 (d, J=5,3 Гц, 3Н), 2,27 (s, 1H).
[0376] Соединение 101: К охлажденному льдом перемешиваемому раствору 100 (100 мг, 203 ммоль) и четырехбромистого углерода (161 мг, 0,487 ммоль, 2,4 экв.) в 4 мл DCM добавляли трифенилфосфин (117 мг, 0,446 ммоль, 2,2 экв.), и реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 5 часов. Растворитель выпаривали, а остаток повторно растворяли в 1 мл DCM и очищали методом колоночной флэш-хроматографии (гептан/EtOAc=1:0→2:8) с получением 101 (146 мг, 0,186 ммоль, чистота: 71%, выход: 92%) в виде белой пены.
ПРИМЕР 4
Общий синтез D
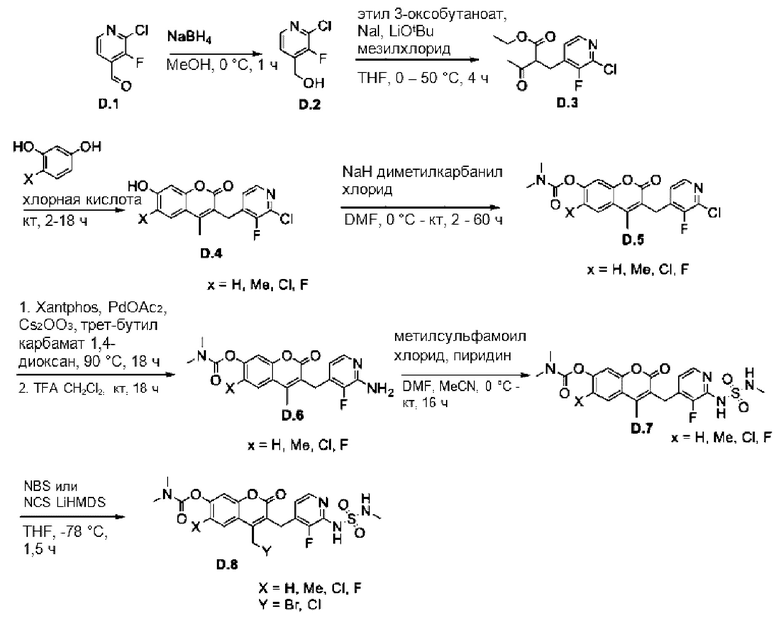
[0377] Соединение D.2: Гидрат 2-хлор-3-фторизоникотинового альдегида (56,13 г, 316 ммоль, 1,0 экв.) растворяли в метаноле (630 мл), после чего раствор охлаждали до 0°С. Порциями добавляли боргидрид натрия (11,96 г, 316 ммоль, 1,0 экв.), образовавшуюся реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь гасили 1000 мл суспензии ледяной воды и медленно подкисляли. Реакционную смесь экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4 и концентрировали при пониженном давлении с получением (2-хлор-3-фторпиридин-4-ил)метанола (66,25 г, 410 ммоль, выход 98%) в виде не совсем белого твердого вещества.
[0378] LCMS (Способ K): tR=1,20 мин; m/z рассч. для [М+Н]+=162,0, обнаруж.=162,0
[0379] Соединение D.3: (2-хлор-3-фторпиридин-4-ил)метанол (30 г, 186 ммоль, 1,0 экв.) растворяли в безводном тетрагидрофуране (460 мл), помещали в атмосферу азота и охлаждали до 0°С. По каплям добавляли трет-бутоксид лития (2,2 М, 89 мл, 195 ммоль, 1,05 экв.) в THF, после чего по каплям добавляли мезилхлорид (17,25 мл, 223 ммоль, 1,20 экв.). Образовавшуюся реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь добавляли к охлажденному (0°С) раствору йодида натрия (27,8 г, 186 ммоль, 1,0 экв.), трет-бутоксида лития (93 мл, 204 ммоль, 1,10 экв.) и этилацетата (47,2 мл, 371 ммоль, 2,00 экв.) в 300 мл безводного THF. Образовавшуюся реакционную смесь перемешивали в течение 30 минут при 0°С, а затем в течение 3 часов при 50°С. После охлаждения до комнатной температуры реакционную смесь разбавляли EtOAc и промывали 0,2 М раствором LiCl и один раз солевым раствором. Органическую фазу сушили над Na2SO4 и концентрировали при пониженном давлении с получением этил 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутаноата (54,5 г, 199 ммоль, выход 107%) в виде желтого масла.
[0380] LCMS (Способ K): tR=1,91 и 2,12 мин; m/z рассч. для [М+Н]+=274,1, обнаруж.=274,0.
[0381] Соединение D.4: К раствору этилового эфира 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутаноата (51,2 г, 187 ммоль 1, 1,0 экв.) в серной кислоте (3-20 экв.) добавляли диол 4 (2,00 экв.). Образовавшуюся реакционную смесь перемешивали в течение 2-18 ч при комнатной температуре. К реакционной смеси добавляли воду и продукт фильтровали, промывали водой и Et2O. Остаток перекристаллизовывали из EtOH:H2O 8:2 с получением кумарина в виде твердого вещества.
[0382] Соединение D.5: К раствору кумарина (1,0 экв.) в N,N-диметилформамиде (сухом) (0,15-0,4 М) при 0°С в атмосфере N2 добавляли 60%-ную дисперсию гидрида натрия в минеральном масле (1,40 1,60 экв.). Образовавшуюся реакционную смесь оставляли для перемешивания на 10-20 мин, после чего добавляли диметилкарбамоилхлорид (1,25-1,60 экв.). Образовавшейся реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1-24 часов. Добавляли воду, чтобы погасить реакционную смесь. Образовавшуюся суспензию перемешивали 1 час, фильтровали, промывали водой и гептаном. Остаток сушили, получая диметилкарбамат в виде твердого вещества.
[0383] Соединение D.6: К раствору диметилкарбамата (1,0 экв.) и трет-бутилкарбамата (1,40-10,0 экв.) в 1,4-диоксане (0,1-0,2 М) в атмосфере азота добавляли ксанфос (0,10-0,20 экв.), цезий карбонат (1,20-1,50 экв.) и PdOAc2 (0,10 экв.). После 5 дополнительных минут продувки азотом образовавшуюся реакционную смесь перемешивали в течение 18 часов при 90°С. Реакционную смесь фильтровали через целит и промывали CH2Cl2. Фильтрат концентрировали при пониженном давлении, после чего остаток растворяли в CH2Cl2 (0,3-0,5 М). Добавляли TFA (0,30-10,00 экв.) и образовавшуюся реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и дважды совместно выпаривали с CH2Cl2 с получением масла. Масло очищали методом обращенно-фазовой хроматографии «флэш-кислота» с получением аминопиридина в виде твердого вещества.
[0384] Соединение D.7: В охлажденную на бане со льдом (0°С) суспензию аминопиридина (1,0 экв.) и пиридина (3,00 экв.) в N,N-диметилформамиде (0,2 0,30 М) по каплям добавляли прозрачный раствор метил сульфамоил хлорид а (2,50 экв.) в ацетонитриле (безводном) (0,2 М). После завершения добавления образовавшейся реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 16 часов. К реакционной смеси добавляли воду и образовавшуюся суспензию перемешивали в течение 1 часа. Суспензию фильтровали, промывали водой и Et2O. Остаток сушили, получая сульфамоил в виде твердого вещества.
[0385] Соединение D.8: Раствор сульфамоила (1,0 экв.) в тетрагидрофуране (сухой) (0,06 М) в атмосфере азота охлаждали до -78°С и медленно добавляли LiHMDS 1М в THF (3,00 экв.). После полного добавления образовавшуюся реакционную смесь в некоторых случаях разбавляли дополнительным количеством тетрагидрофурана (сухого) и перемешивали в течение 30 мин, давали нагреться до 0°С. Его добавляли по каплям через канюлю в течение 15 минут к охлажденному (-78°С) раствору NCS или NBS (1,20 экв.) в тетрагидрофуране (сухой) (0,04 М). Образовавшуюся реакционную смесь перемешивали в течение 1 часа при -78°С. При -78°С реакционную смесь гасили 1М HCl и давали нагреться до комнатной температуры. Добавляли дополнительное количество воды и продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением брома или хлора в виде твердого вещества.
ПРИМЕР 5
Общий синтез Е
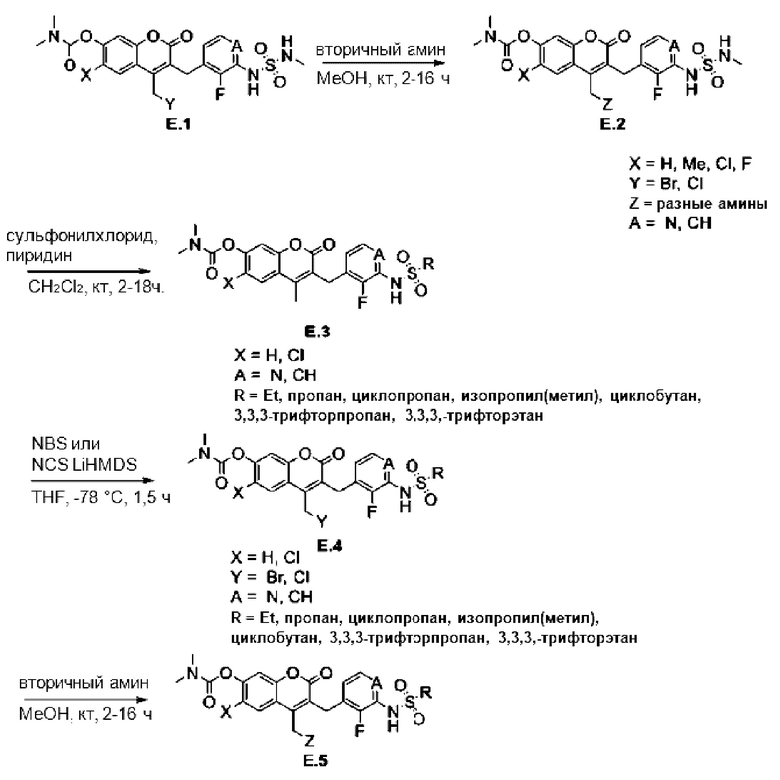
[0386] Соединение Е.2: Бром или хлор (1,0 экв.) суспендировали в метаноле (0,10-0,20 М). Добавляли амин (1-10 экв.) и образовавшуюся реакционную смесь перемешивали в течение 2-16 ч при комнатной температуре. Реакционную смесь фильтровали и очищали препаративной HPLC (метод: препаративная кислота или препаративное основание) с получением желаемого амина после сушки вымораживанием или Genevac™ в виде твердого вещества.
[0387] Соединение Е.3: Диметиламин Е.2 (1,0 экв.) и пиридин (1,1-1,5 экв.) растворяли в CH2Cl2 (0,2-0,8 М). Добавляли сульфонилхлорид (1,2-1,7 экв.) и образовавшуюся реакционную смесь перемешивали при комнатной температуре в течение 2-18 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали колоночной «флэт» - хроматографией (CH2Cl2/EtOAc=1:0→6:4) с получением сульфамоила Е. 3 в виде твердого вещества.
[0388] Соединение Е.4: Раствор сульфамоила Е.3 (1,0 экв.) в тетрагидрофуране (сухой) (0,06 М) в атмосфере азота охлаждали до -78°С и медленно добавляли LiHMDS 1М в THF (1-3 экв.). После полного добавления образовавшуюся реакционную смесь в некоторых случаях разбавляли дополнительным количеством тетрагидрофурана (сухого) и перемешивали в течение 30 мин, давали нагреться до 0°С. Его добавляли по каплям через канюлю в течение 15 минут к охлажденному (-78°С) раствору NCS или NBS (1,2 экв.) в тетрагидрофуране (сухой) (0,04 М). Образовавшуюся реакционную смесь перемешивали в течение 1 часа при -78°С. При -78°С реакционную смесь гасили 1М H2SO4 и давали нагреться до комнатной температуры. Добавляли дополнительное количество воды и продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением брома или хлора Е.4 в виде твердого вещества.
[0389] Соединение Е.3: Бром или хлор Е.4 (1,0 экв.) суспендировали в метаноле (0,10-0,20 М). Добавляли амин (1-10 экв.) и образовавшуюся реакционную смесь перемешивали в течение 2-16 ч при комнатной температуре. Реакционную смесь фильтровали и очищали препаративной HPLC (метод: препаративная кислота или препаративное основание) с получением желаемого амина Е.5 после сушки вымораживанием или Genevac™ в виде твердого вещества.
ПРИМЕР 6
Общий синтез F

[0390] Фенол F.1 (1,0 экв.) и карбонат калия (2,0 экв.) растворяли в DMF (0,03-0,2 М). Добавляли хлорангидрид (1,0 экв.) и перемешивали в течение 1-18 часов при комнатной температуре. Реакционные смеси очищали препаративной HPLC (метод: «препаратитая кислота» или «препаратиеное основание») с получением желаемого F.2 после сушки вымораживанием или Genevac™ в виде твердого вещества.
ПРИМЕР 7
Общий синтез G
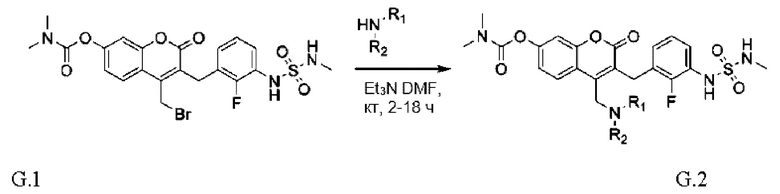
[0391] Соединение G.2. К растворам G.1 (1,0 экв.) в DMF (0,1-0,2 М) добавляли соответствующие амины (1,5 экв.) и Et3N (2-5 экв.); каждый в одном отдельном флаконе. Реакционные смеси перемешивали в течение 2-18 ч при комнатной температуре. Реакционные смеси затем фильтровали и очищали с помощью препаративной HPLC (метод: препаративная кислота или препаративное основание) с получением желаемых продуктов G.2 в виде твердых веществ после выпаривания в вакууме при 40°С в Genevac™.
ПРИМЕР 8
Синтез соединения 102
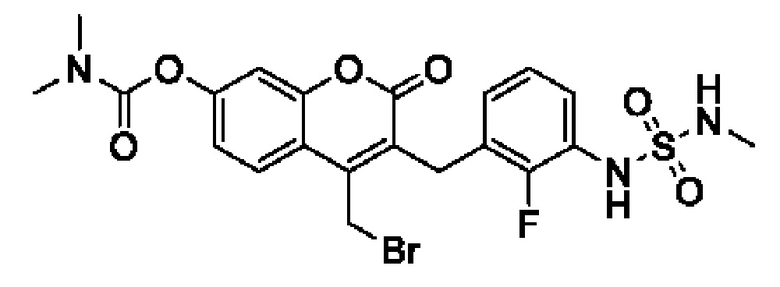
[0392] Соединение 102 получали в 5 стадий:
[0393] Стадия 1: Начиная с этилового эфира 2-(2-фтор-3-нитробензил)-3-оксобутаноата 3 (48,9 г, 173 ммоль) и резорцина (1,04 экв.) в соответствии с процедурой общего синтеза А. После фильтрации остаток перемешивали в вод. насыщ. NaHCO3 до тех пор, пока прекращалось выделение газа. Суспензию снова фильтровали, промывали водой, Et2O и сушили с получением соответствующего кумарина 5 (50,3 г, 153 ммоль, выход: 98%) в виде твердого вещества желтого цвета.
[0394] Стадия 2: Следуя процедуре синтеза Соединения 4 получали соответствующий диметилкарбамат 6 (70,7 г, 166 ммоль, выход: 109%) в виде твердого вещества желтого цвета.
[0395] Стадия 3: Следуя процедуре синтеза Соединения 5, с Pd/C и EtOH/THF 1:2 (0,05 М) в качестве растворителей, получали соответствующий первичный амин 7 (50,83 г, 130 ммоль, выход: 77%) в виде светло-розового твердого вещества.
[0396] Стадия 4: Следуя процедуре синтеза Соединения 6, начинали с 35 г, 90 ммоль Соединения 7. Добавляли метилсульфамоилхлорид в 2,5 экв. с получением соответствующего сульфамоила 8 (37,8 г, 76 ммоль, выход: 84%) в виде твердого вещества бежевого цвета.
[0397] Стадия 5. Следуя общей процедуре Е, используя NBS и за исключением того, что вместо 1N H2SO4 применяли 1N HCl, получали указанное в заголовке соединение (23,9 г, 40,5 ммоль, выход: 56%) в виде белого твердого вещества.
[0398] Выход: указанное в заголовке соединение выделяли в виде белого твердого вещества (40% за 5 стадий).
[0399] Анализ: LCMS (Способ U): tR=1,97 мин; m/z рассч. для [М+H2O]+=559,0/561,0, обнаруж.=559,0/561,0
ПРИМЕР 9
Синтез Соединения 7
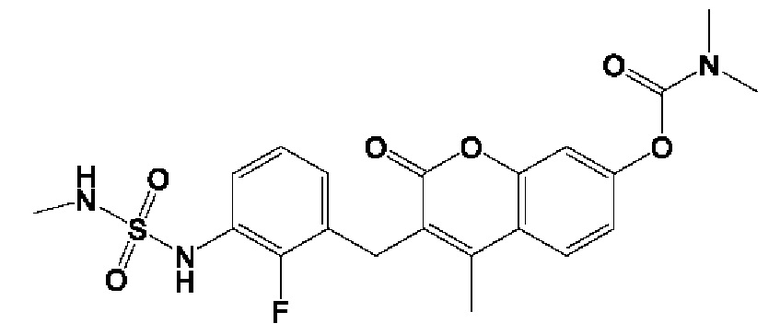
[0400] Соединение 7 получали в 4 стадии:
[0401] Стадия 1: Начинали с этил 2-(2-фтор-3-нитробензил)-3-оксобутаноата (48,9 г, 173 ммоль) и резорцина (1,04 экв.) следуя процедуре общего синтеза Соединения 4. После фильтрации остаток перемешивали в водн. насыщ. NaHCO3 до тех пор, пока прекращалось выделение газа. Суспензию снова фильтровали, промывали водой, Et2O и сушили с получением соответствующего кумарина 5 (50,3 г, 153 ммоль, выход: 98%) в виде твердого вещества желтого цвета.
[0402] Стадия 2: Следуя процедуре общего синтеза Соединения 5 получали соответствующий диметилкарбамат (70,7 г, 166 ммоль, выход: 109%) в виде твердого вещества желтого цвета.
[0403] Стадия 3: Следуя процедуре общего синтеза Соединения 6 с Pd/C и EtOH/THF 1:2 (0,05 М) в качестве растворителей, получали соответствующий первичный амин (50,83 г, 130 ммоль, выход: 77%) в виде светло-розового твердого вещества.
[0404] Стадия 4: Следуя процедуре общего синтеза Соединения 7, начинали с 35 г, 90 ммоль 7. Добавляли метилсульфамоилхлорид в 2,5 экв. с получением указанного в заголовке соединения (37,8 г, 76 ммоль, выход: 84%) в виде твердого вещества бежевого цвета.
[0405] Выход: указанное в заголовке соединение выделяли в виде твердого вещества бежевого цвета (69% за 4 стадии).
[0406] Анализ: LCMS (Способ I): tR=1,98 мин; m/z рассч. для [М+Н]+=464,1, обнаруж.=464,1; 1H ЯМР (400 МГц, CDCl3) δ 7,65-7,59 (m, 1Н), 7,39 (td, J=7,8, 1,7 Гц, 1H), 7,15-7,08 (m, 2Н), 7,01 (t, J=7,8 Гц, 1H), 6,95 (td, J=7,9, 7,4, 1,8 Гц, 1H), 6,60 (d, J=3,0 Гц, 1H), 4,44 (q, J=5,4 Гц, 1H), 4,06 (s, 2Н), 3,13 (s, 3Н), 3,03 (s, 3Н), 2,75 (d, J=5,3 Гц, 3Н), 2,44 (s, 3Н).
ПРИМЕР 10
Синтез Соединения 9
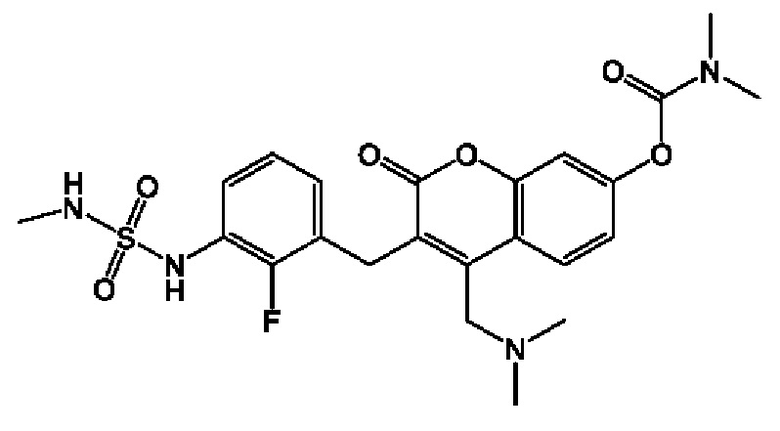
[0407] Соединение 9 получали в 1 стадию:
[0408] Стадия 1: Начинали с 4-(бромметил)-3-(2-фтор-3-((N-метилсулъфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (22,22 г, 34,79 ммоль) и диметиламина 2М в МеОН, следуя процедуре общего синтеза Соединения Е.2. После полного превращения реакционную смесь концентрировали при пониженном давлении. К остатку добавляли 1М HCl и водный слой экстрагировали CH2Cl2. Водный слой подщелачивали твердым Na2CO3. Основной водный слой экстрагировали CH2Cl2. Органический слой из основной экстракции промывали соляным раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (13,23 г, 25,7 ммоль, выход: 74%) в виде светло-желтого твердого вещества.
[0409] Выход: Соединение 9 выделяют в виде твердого вещества светло-желтого цвета (74% за 1 стадию).
[0410] Анализ: LCMS (Способ Т): tR=1,53 мин; m/z рассч. для [М-Н]+=507,2, обнаруж.=507,2; 1Н ЯМР (400 МГц, DMSO) δ 9,38 (s, 1H), 8,08 (d, J=8,8 Гц, 1H), 7,28 (td, J=8,0, 1,6 Гц, 1H), 7,25 7,18 (m, 2Н), 7,15 (dd, J=8,8, 2,4 Гц, 1H), 7,00 (t, J=7,9 Гц, 1H), 6,90-6,77 (m, 1Н), 4,04 (s, 2Н), 3,64 (s, 2Н), 3,06 (s, 3Н), 2,93 (s, 3Н), 2,52 (d, J=4,9 Гц, 3Н), 2,19 (s, 6Н).
ПРИМЕР 11
Синтез Соединения 10
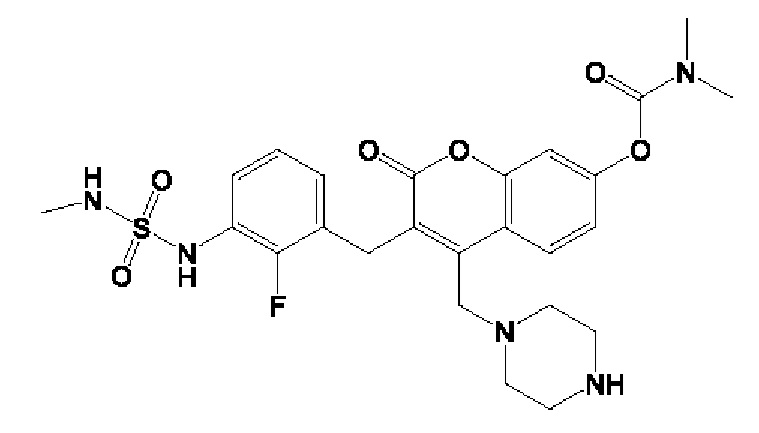
[0411] Соединение 10 получали в 2 стадии:
[0412] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,35 г, 0,59 ммоль) и N-Boc пиперазина, следуя процедуре общего синтеза соединения Е.2, с добавлением NEt3 (1,0 экв.). Продукт очищали методом препаративного основания. Желаемые фракции объединяли и концентрировали при пониженном давлении с получением амина (0,414 г, 0,486 ммоль, выход: 82%, чистота: 76%) в виде бесцветного масла.
[0413] Стадия 2: Амин растворяли в 1,4-диоксане (3 мл), добавляли HCl в диоксане (4М, 16,7 экв., 2,0 мл, 8,00 ммоль) и перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении и дважды совместно выпаривали с CH2Cl2. Остаток растворяли в смеси MeCN/вода и лиофилизировали с получением указанного в заголовке соединения (304 мг, 0,49 ммоль, выход: 102%) в виде белого твердого вещества.
[0414] Выход: Соединение 10 выделяют в виде белого твердого вещества (84% за 2 стадии).
[0415] Анализ: LCMS (Способ S): tR=1,00 мин; m/z рассч. для [М-Н]+=548,2, обнаруж.=548,2; 1Н ЯМР (400 МГц, DMSO) δ 9,37 (s, 1Н), 8,88 (s, 2Н), 8,09 (d, J=8,8 Гц, 1H), 7,32-7,19 (m, 3Н), 7,17 (dd, J=8,9, 2,4 Гц, 1Н), 7,00 (t, J=7,8 Гц, 1H), 6,86-6,78 (m, 1H), 4,04 (s, 2Н), 3,86 (s, 2Н), 3,07 (s, 3Н), 2,95 (d, J=14,4 Гц, 7Н), 2,73 (s, 4Н), 2,54 (d, J=2,8 Гц, 3Н).
ПРИМЕР 12
Синтез Соединения 103
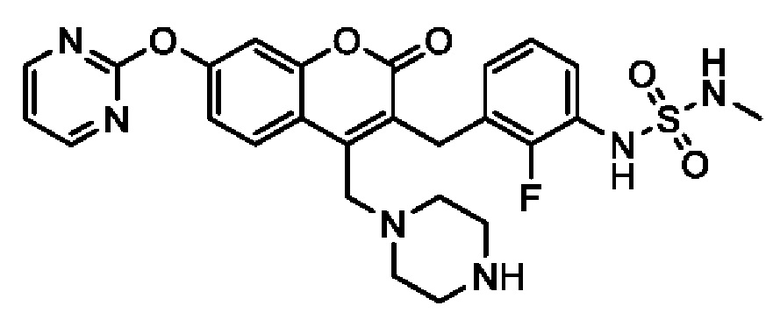
[0416] Соединение 103 получали в 5 стадий:
[0417] Стадия 1: К раствору 3-(2-фтор-3-нитробензил)-7-гидрокси-4-метил-2Н-хромен-2-она (700 мг, 2,126 ммоль, 1,0 экв.) и 2-бромпиримидина (2467 мг, 15,52 ммоль, 7,3 экв.) в N,N-диметилформамиде (0,1 М) при комнатной температуре добавляли карбонат калия (588 мг, 4,25 ммоль, 2,00 экв.) и образовавшуюся реакционную смесь перемешивали при 80°С в течение 1 часа. Растворитель выпаривали при пониженном давлении. Добавляли воду и экстрагировали продукт с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали колоночной хроматографией методом «флэш» (гептан/EtOAc 4:1→1:4) с получением 3-(2-фтор-3-нитробензил)-4-метил-7-(пиримидин-2-илокси)-2Н-хромен-2-она (470 мг, 1,154 ммоль, выход: 51%) в виде светло-желтого твердого вещества.
[0418] Стадия 2: К суспензии 3-(2-фтор-3-нитробензил)-4-метил-7-(пиримидин-2-илокси)-2Н-хромен-2-она (470 мг, 1,154 ммоль, 1,0 экв.) в N,N-диметилформамиде (сухом) (0,11 М) добавляли дигидрат хлорида олова (II) (1302 мг, 5,77 ммоль, 5,00 экв.). Образовавшуюся реакционную смесь перемешивали при 70°С в течение 1,5 ч. Реакционную смесь концентрировали при пониженном давлении и к остатку добавляли воду. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением 3-(3-амино-2-фторбензил)-4-метил-7-(пиримидин-2-илокси)-2Н-хромен-2-он (430 мг, 1,026 ммоль, выход: 84%) в виде оранжевого масла.
[0419] Стадия 3: К раствору 3-(3-амино-2-фторбензил)-4-метил-7-(пиримидин-2-илокси)-2Н-хромен-2-она (430 мг, 1,026 ммоль, 1,0 экв.) и пиридина (0,373 мл, 4,61 ммоль, 4,50 экв.) в N,N-диметилформамиде (сухом) (0,1 М) при 0°С добавляли раствор метилсульфамоилхлорида (0,203 мл, 2,359 ммоль, 2,30 экв.) в ацетонитриле (3 мл) и образовавшуюся реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли воду и экстрагировали продукт с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением сульфамоила (493 мг, 0,912 ммоль, выход: 89%) в виде оранжевого твердого вещества.
[0420] Стадия 4: Сульфамоил (30 мг, 0,064 ммоль, 1,0 экв.) растворяли в тетрагидрофуране (сухом) (0,04 М), продували аргоном и охлаждали до -78°С. 3атем добавляли LiHMDS (1 M в THF, 0,191 мл, 0,191 ммоль, 3,00 экв.) и смесь перемешивали в течение 30 мин. По каплям добавляли раствор N-бромсукцинимида (13,62 мг, 0,077 ммоль, 1,20 экв.) в тетрагидрофуране (сухой) (0,5 мл). Смесь оставляли для перемешивания на 30 мин при -78°С. К реакционной смеси добавляли воду. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением бромида (30 мг, 0,034 ммоль, выход: 53%) в виде оранжевого твердого вещества.
[0421] Стадия 5: Начиная с брома (0,02 г, 0,037 ммоль) и пиперазина, следуя общей процедуре Р, с очисткой препаративным основанием с получением указанного в заголовке соединения (11,1 мг, 0,02 ммоль, выход: 54%) в виде белого твердого вещества.
[0422] Выход: Указанное в заголовке соединение выделяли в виде белого твердого вещества (11% за 5 стадий).
[0423] Анализ: LCMS (Способ Р): tR=1,12 мин; m/z рассч. для [М-Н]+=555,2, обнаруж.=555,2
ПРИМЕР 13
Синтез Соединения 104

[0424] Соединение 104 получали в 2 стадии:
[0425] Стадия 1: Сульфамид, N-[3-фтор-4-[[4-метил-2-оксо-7-(2-пиримидинилокси)-2Н-1-бензопиран-3-ил]метил]-2-пиридинил]-N'-метил- (20 мг, 0,042 ммоль, 1,0 экв.) растворяли в тетрагидрофуране (сухом) (0,02 М) продували аргоном и охлаждали до -78°С. 3атем добавляли LiHMDS (1 М в THF, 0,169 мл, 0,169 ммоль, 4,00 экв.) и смесь перемешивали в течение 30 мин. По каплям добавляли раствор N-бромсукцинимида (9 мг, 0,051 ммоль, 1,20 экв.) в тетрагидрофуране (сухой) (0,5 мл). Смесь оставляли для перемешивания на 30 мин при -78°С. К реакционной смеси добавляли 1М HCl. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением бромида (27 мг, 0,028 ммоль, выход: 66%) в виде оранжевого масла.
[0426] Стадия 2: Начиная с брома (0,02 г, 0,037 ммоль) и пиперазина, следуя процедуре общего синтеза соединения G.2 с применением препаративного основания с получением указанного в заголовке соединения (7,8 мг, 0,0140 ммоль, выход: 38%) в виде белого твердого вещества.
[0427] Выход: Указанное в заголовке соединение выделяли в виде белого твердого вещества (25% за 2 стадии).
[0428] Анализ: LCMS (Способ Р): tR=0,83 мин; m/z рассч. для [М-Н]+=556,2, обнаруж.=556,2
ПРИМЕР 14
Синтез Соединения 105

[0429] Соединение 105 получали в 2 стадии:
[0430] Стадия 1: 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамат (0,3 г, 0,553 ммоль, 1,0 экв.) растворяли в аммиаке (0,5 М в THF, 20 мл, 10,0 ммоль, 18 экв.) и перемешивали в течение 18 часов при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении с получением гидробромида 4-(аминометил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (331 мг, 0,592 ммоль, выход: 107%) в виде не совсем белого твердого вещества.
[0431] Стадия 2: гидробромид 4-(аминометил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (40 мг, 0,072 ммоль, 1,0 экв.) растворяли в CH2Cl2 (0,04 М). Добавляли Et3N (0,08 мл, 0,572 ммоль, 8,0 экв.) и триметилсилилизоцианат (0,077 мл, 0,572 ммоль, 8,0 экв.) и образовавшуюся реакционную смесь перемешивали в течение 18 часов при комнатной температуре. Продукт очищали препаративной кислотой с получением указанного в заголовке соединения (6,5 мг, 0,012 ммоль, выход: 17%) в виде белого твердого вещества после лиофилизации.
[0432] Выход: Соединение 105 выделяли в виде белого твердого вещества (18% за 2 стадии).
[0433] Анализ: LCMS (Способ Т): tR=1,20 мин; m/z рассч. для [М+Н]+=522,2, обнаруж.=522,4.
ПРИМЕР 15
Синтез Соединения 106
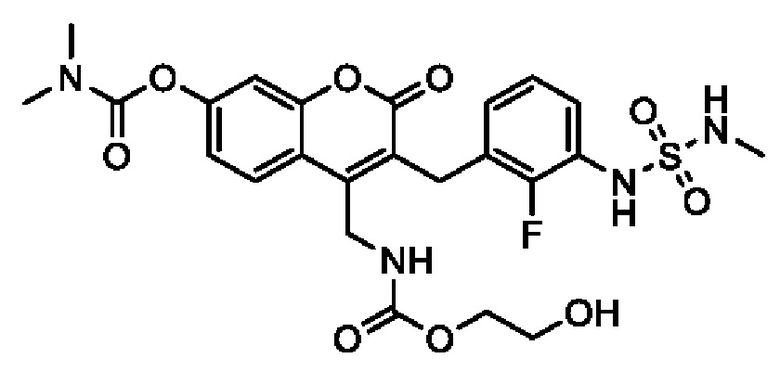
[0434] Соединение 106 получали в 3 стадии:
[0435] Стадия 1: 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамат (0,3 г, 0,553 ммоль, 1,0 экв.) растворяли в аммиаке (0,5 М в THF, 20 мл, 10,0 ммоль, 18 экв.) и перемешивали в течение 18 часов при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении с получением гидробромида 4-(аминометил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (331 мг, 0,592 ммоль, выход: 107%) в виде не совсем белого твердого вещества.
[0436] Стадия 2: К раствору гидробромида 4-(аминометил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (40 мг, 0,072 ммоль, 1,0 экв.) и 2-((трет-бутилдиметилсилил)окси)этил(4-нитрофенил)карбоната (31,7 мг, 0,093 ммоль, 1,3 экв.) в N,N-диметилформамиде (сухой) (2 мл) добавляли триэтиламин (0,030 мл, 0,215 ммоль, 3,0 экв.) и полученную реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Смесь разбавляли EtOAc и водой, слои разделяли и водный слой экстрагировали EtOAc один раз. Объединенный органический слой дважды промывали водой и солевым раствором, сушили над Na2SO4 и концентрировали. К реакционной смеси добавляли воду. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали колоночной хроматографией методом «флэш» (гептан/EtOAc 4:1→1:4) с получением 3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-4-(8,8,9,9-тетраметил-3-оксо-4,7-диокса-2-аза-8-силадецил)-2Н-хромен-7-илдиметилкарбамат (25 мг, 0,033 ммоль, выход: 46%) в виде белого твердого вещества.
[0437] Стадия 3: К раствору 3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-4-(8,8,9,9-тетраметил-3-оксо-4,7-диокса-2-аза-8-силадецил)-2Н-хромен-7-илдиметилкарбамата (25 мг, 0,037 ммоль, 1,0 экв.) в тетрагидрофуране (0,5 мл) добавляли соляную кислоту (4N в диоксане, 0,092 мл, 0,367 ммоль, 10 экв.) и образовавшуюся реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Продукт очищали препаративным основанием с получением указанного в заголовке соединения (9,6 мг, 0,017 ммоль, выход: 46%) в виде белого твердого вещества после лиофилизации.
[0438] Выход: указанное в заголовке соединение выделяли в виде белого твердого вещества (23% за 3 стадии).
[0439] Анализ: LCMS (Способ Т): tR=1,25 мин; m/z рассч. для [М+Н]+=567,2, обнаруж.=567,4; 1H ЯМР (400 МГц, DMSO) δ 9.38 (s, 1H), 7,94 (d, J=8,9 Гц, 1Н), 7,85 (t, J=5,7 Гц, 1H), 7,32-7,22 (m, 2Н), 7,19 (dd, J=8,8, 2,4 Гц, 1H), 6,97 (t, J=8,0 Гц, 1H), 6,81 (s, 1H), 4,71 (t, J=5,3 Гц, 1H), 4,41 (d, J=5,6 Гц, 2Н), 4,12 (s, 2Н), 3,96 (t, J=5,1 Гц, 2Н), 3,50 (q, J=5,2 Гц, 2Н), 3,07 (s, 3Н), 2,93 (s, 3Н).
ПРИМЕР 16
Синтез Соединения 107

[0440] Соединение 107 получали в 1 стадию:
[0441] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,1 г, 0,27 ммоль) и этансульфонилхлорида, следуя процедуре общего синтеза Е.3, получали указанное в заголовке соединение (46,8 мг, 0,10 ммоль, выход: 37%) в виде белого твердого вещества.
[0442] Выход: Соединение 107 выделяли в виде белого твердого вещества (37% за 1 стадии).
[0443] Анализ: LCMS (Способ R): tR=1,57 мин; m/z рассч. для [М+H2O]+=480,2, обнаруж.=480,1; 1Н ЯМР (400 МГц, DMSO) δ 9,60 (s, 1H), 7,86 (d, J=8,7 Гц, 1H), 7,29-7,22 (m, 2Н), 7,19 (dd, J=8,8, 2,3 Гц, 1H), 7,03 (t, J=7,9 Гц, 1H), 6,95 (td, J=7,9, 7,5, 1,7 Гц, 1H), 3,99 (s, 2Н), 3,15-3,02 (m, 5Н), 2,93 (s, 3Н), 2,45 (s, 3Н), 1,26 (t, J=7,4 Гц, 3Н).
ПРИМЕР 17
Синтез Соединения 108
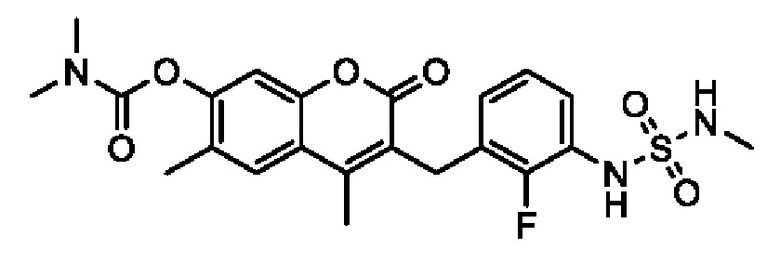
[0444] Соединение 108 получали в 4 стадии:
[0445] Стадия 1: Начиная с этил 2-(2-фтор-3-нитробензил)-3-оксобутаноата (1,0 г, 3,53 ммоль) и 4-метилбензол-1,3-диола (1,20 экв.), следуя процедуре общего синтеза Соединения 4 с получением соответствующего кумарина в виде не совсем белого твердого вещества (1,32 г, 3,68 ммоль, выход: 104%).
[0446] Стадия 2: Следуя процедуре общего синтеза Соединения 5 с получением соответствующего диметилкарбамата (0,91 г, 2,06 ммоль, выход: 54%) в виде твердого вещества светло-желтого цвета.
[0447] Стадия 3: Следуя процедуре общего синтеза Соединения 6, после фильтрации продукт очищали колоночной хроматографией методом «флэш» (CH2Cl2/МеОН=1:0→95:5) с получением соответствующего первичного амина (0,54 г, 0,79 ммоль, чистота: 56%, выход: 35%) в виде светло-желтого твердого вещества.
[0448] Стадия 4: Следуя процедуре общего синтеза Соединения 7, после фильтрации получали 576 мг неочищенного соединения. 50 мг дополнительно очищали препаративной LC (основание) с получением указанного в заголовке соединения (13,2 мг, 0,027 ммоль, выход: 66%) после сушки вымораживанием в виде белого твердого вещества.
[0449] Выход: Соединение 108 выделяли в виде белого твердого вещества (13% за 4 стадии).
[0450] Анализ: LCMS (Способ Т): tR=1,58 мин; m/z рассч. для [М-Н]+=476,1, обнаруж.=476,2; 1H ЯМР (400 МГц, DMSO) δ 9,38 (s, 1H), 7,76 (s, 1H), 7,30-7,24 (m, 1H), 7,22 (s, 1H), 7,13 (s, 1H), 6,99 (t, J=7,9 Гц, 1H), 6,82 (t, J=7,2 Гц, 1H), 3,96 (s, 2Н), 3,09 (s, 3Н), 2,94 (s, 3Н), 2,44 (s, 3Н), 2,23 (s, 3Н).
ПРИМЕР 18
Синтез Соединения 109
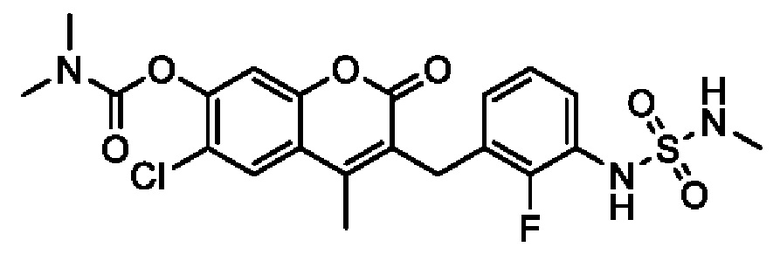
[0451] Соединение 109 получали в 4 стадии:
[0452] Стадия 1: Начиная с этил-2-(2-фтор-3-нитробензил)-3-оксобутаноата 3 (1,0 г, 3,53 ммоль) и 4-хлорбензен-1,3-диола (1,20 экв.), следуя процедуре общего синтеза Соединения 4, получали соответствующий кумарин 5 (0,95 г, 2,57 ммоль, выход: 73%) в виде не совсем белого твердого вещества.
[0453] Стадия 2: Следуя процедуре общего синтеза Соединения 5 получали соответствующий диметилкарбамат (0,88 г, 1,95 ммоль, выход: 75%) в виде светло-желтого твердого вещества.
[0454] Стадия 3: Следуя процедуре общего синтеза Соединения 6, получали соответствующий диметилкарбамат (0,51 г, 1,22 ммоль, выход: 60%) в виде светло-желтого твердого вещества.
[0455] Стадия 4: Следуя процедуре общего синтеза Соединения 7, после фильтрации получали 588 мг неочищенного соединения. 50 мг дополнительно очищали препаративной LC (основание) с получением указанного в заголовке соединения (28,9 мг, 0,027 ммоль, выход: 44%) после сушки вымораживанием в виде белого твердого вещества.
[0456] Выход: Соединение 109 выделяли в виде белого твердого вещества (14% за 4 стадии).
[0457] Анализ: LCMS (Способ Т): tR=1,63 мин; m/z рассч. для [М-Н]+=496,1, обнаруж.=496,2; 1Н ЯМР (400 МГц, DMSO) δ 9,40 (s, 1H), 8,03 (s, 1H), 7,50 (s, 1H), 7,28 (td, J=7,9, 1,8 Гц, 1H), 7,10 (s, 1H), 6,98 (t, J=7,9 Гц, 1H), 6,84 (t, J=7,0 Гц, 1H), 3,97 (s, 2H), 3,10 (s, 3H), 2,95 (s, 3H), 2,45 (s, 3H).
ПРИМЕР 19
Синтез Соединения 19

[0458] Соединение 19 получали в 1 стадию:
[0459] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (23,9 г, 44,1 ммоль) и азетидина, следуя процедуре общего синтеза соединения Е.2, с добавлением DIPEA (2,0 экв.) во время реакции. После полного превращения реакционную смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0→0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением указанного в заголовке соединения (11,8 г, 22,17 ммоль, выход: 50%) в виде не совсем белого твердого вещества.
[0460] Выход: Соединение 19 выделяли в виде не совсем белого твердого вещества (50% за 1 стадию).
[0461] Анализ: LCMS (Способ Т): tR=1,53 мин; m/z рассч. для [М-Н]+=519,2, обнаруж.=519,2; 1H ЯМР (400 МГц, CDCl3) δ 8,01 (d, J=8,8 Гц, 1Н), 7,38 (td, J=7,8, 1,6 Гц, 1H), 7,15-7,03 (m, 2Н), 6,99 (t, J=8,1 Гц, 1Н), 6,86 (t, J=7,7 Гц, 1H), 6,68 (s, 1H), 4,58 (q, J=5,3 Гц, 1H), 4,15 (s, 2Н), 3,60 (s, 2Н), 3,12 (s, 3Н), 3,03 (s, 3Н), 2,73 (d, J=5,3 Гц, 3Н), 2,26 (s, 6Н).
ПРИМЕР 20
Синтез Соединения 21
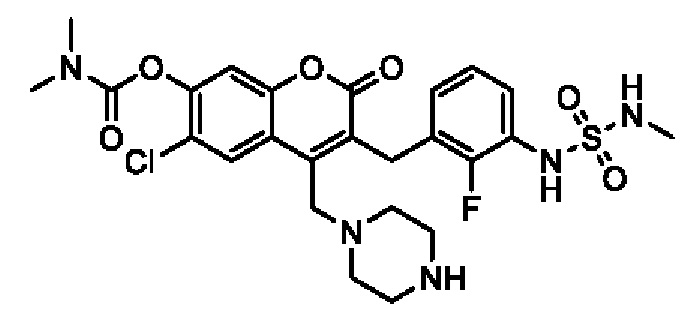
[0462] Соединение 21 получали в 1 стадию:
[0463] Стадия 1: начиная с 6-хлор-4-(хлорметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (50 мг, 0,094 ммоль) и пиперазина, следуя процедуре общего синтеза соединения Е.2. Неочищенный продукт объединяли с другими партиями и очищали с препаративным основанием с получением указанного в заголовке соединения (22 мг, 0,037 ммоль, выход: 39%) после сушки вымораживанием в виде белого твердого вещества.
[0464] Выход: Соединение 21 выделяли в виде белого твердого вещества (65% за 1 стадию).
[0465] Анализ: LCMS (Способ R): tR=1,43 мин; m/z рассч. для [М+Н]+=582,2, обнаруж.=582,2; 1Н ЯМР (400 МГц, DMSO) δ 8,30 (s, 1H), 8,27 (s, 1H), 7,48 (s, 1H), 7,31-7,19 (m. 2Н), 6,99 (t, J=7,9 Гц, 1H), 6,83 (t, J=7,2 Гц, 1Н), 4,03 (s, 2Н), 3,70 (s, 2Н), 3,10 (s, 3Н), 2,95 (s, 3Н), 2,64 (t, J=4,6 Гц, 4Н), 2,53 (d, J=2,9 Гц, 3Н), 2,40 (s, 4Н).
ПРИМЕР 21
Синтез Соединения 110
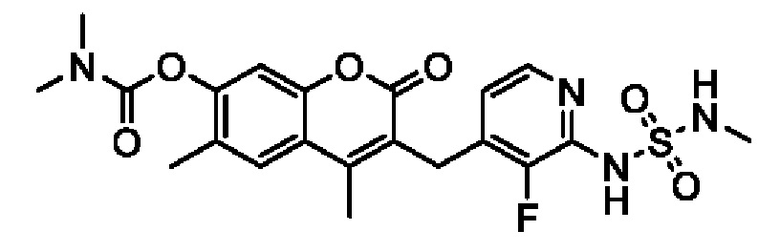
[0466] Соединение 110 получали в 4 стадии:
[0467] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутаноата (1,18 г, 4,31 ммоль) и 4-метилбензол-1,3-диола (1,20 экв.), следуя процедуре общего синтеза соединения D.4. После завершения реакции добавляли воду и образовавшуюся суспензию фильтровали. Остаток упаривали совместно с Et2O. Остаток сушили в течение ночи при 40°С при пониженном давлении с получением соответствующего кумарина (1,7 г, 4,53 ммоль, выход: 105%, чистота: 89%) в виде твердого вещества бежевого цвета.
[0468] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, получали соответствующий диметилкарбамат (1,94 г, 4,32 ммоль, выход: 95%, чистота: 90%) в виде твердого вещества бежевого цвета.
[0469] Стадия 3: Следуя процедуре общего синтеза Соединения D.6, начиная с 0,9 г, 2,22 ммоль Соединения D.5. Снятие защиты с помощью TFA не проводили. Реакционную смесь фильтровали и концентрировали при пониженном давлении. Неочищенный продукт объединяли с другой партией и очищали колоночной хроматографией методом «флэш» (CH2Cl2/МеОН 1:0→94:6) с получением соответствующего первичного амина D.6 (0,22 г, 0,303 ммоль, выход: 14%, чистота: 53%) в виде коричневого твердого вещества.
[0470] Стадия 4: Следуя процедуре общего синтеза Соединения D.7, После полного превращения реакционную смесь гасили водой и продукт экстрагировали EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт разбавляли CH2Cl2 и очищали колоночной хроматографией по методу «флэш» (CH2Cl2/МеОН 1:0→96:4) с получением 141 мг желтого масла. 25 мг неочищенного продукта очищали препаративным основанием с получением указанного в заголовке соединения (13,7 мг, 0,029 ммоль, выход: 59%) после лиофилизации в виде белого твердого вещества.
[0471] Выход: Соединение 110 выделяли в виде белого твердого вещества (8% за 4 стадии).
[0472] Анализ: LCMS (Способ Т): tR=1,58 мин; m/z рассч. для [М-Н]+=479,1, обнаруж.=479,2; 1H ЯМР (400 МГц, DMSO) δ 10,34 (s, 1Н), 7,89 (s, 1H), 7,78 (s, 1H), 7,23 (s, 1H), 6,94 (s, 1H), 6,77 (s, 1H), 4,00 (s, 2Н), 3,10 (s, 3Н), 2,94 (s, 3Н), 2,46 (s, 3Н), 2,23 (s, 3Н).
ПРИМЕР 22
Синтез Соединения 111

[0473] Соединение 111 получали в 4 стадии:
[0474] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутаноата (15,0 г, 46,0 ммоль) и 4-хлорбензол-1,3-диола (1,20 экв.), следуя процедуре общего синтеза соединения D.4. После завершения реакции добавляли воду и образовавшуюся суспензию фильтровали. Остаток выпаривали совместно с EtOH и растирали в смеси EtOH/Et2O. Твердые вещества отфильтровывали, получая соответствующий кумарин (4,8 г, 13,55 ммоль, выход: 29%) в виде белого твердого вещества.
[0475] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, получали соответствующий диметилкарбамат (5,48 г, 11,86 ммоль, выход: 87%, чистота: 92%) в виде светло-желтого твердого вещества.
[0476] Стадия 3: Следуя процедуре общего синтеза Соединения D.6, начиная с 1,0 г, 2,35 ммоль Соединения D.5. Снятие защиты с помощью TFA не проводили. Реакционную смесь фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=9:1→1:4) с получением соответствующего первичного амина (0,12 г, 0,281 ммоль, выход: 12%) в виде твердого вещества бежевого цвета.
[0477] Стадия 4: Следуя процедуре общего синтеза Соединения D.7, начиная с 400 мг, 0,789 ммоль первичного амина. После полного превращения реакционную смесь гасили водой. Продукт экстрагировали с применением EtOAc, объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2/МеОН=1:0→96:4). Неочищенный продукт очищали препаративным основанием с получением указанного в заголовке соединения (27,5 мг, 0,054 ммоль, выход: 7%) после лиофилизации в виде белого твердого вещества.
[0478] Выход: Соединение 111 выделяли в виде белого твердого вещества (0,2% за 4 стадии).
[0479] Анализ: LCMS (Способ Т): tR=1,20 мин; m/z рассч. для [М+Н]+=499,1, обнаруж.=499,2; 1Н ЯМР (400 МГц, DMSO) δ 10,34 (s, 1H), 8,04 (s, 1H), 7,95-7,86 (m, 1H), 7,51 (s, 1H), 6,95 (s, 1H), 6,81 (s, 1H), 4,01 (s, 2H), 3,11 (s, 3Н), 2,95 (s, 3Н), 2,47 (s, 3Н).
ПРИМЕР 23
Синтез Соединения 112

[0480] Соединение 112 получали в 3 стадию:
[0481] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутаноата (10,0 г, 24,12 ммоль) и резорцин (2,00 экв.), следуя процедуре общего синтеза соединения D.4. Вместо хлорной кислоты использовали серную кислоту. После полного превращения реакционную смесь охлаждали (0°С) и гасили насыщ. водн. NaHCO3 до щелочного рН. Образовавшуюся белую суспензию промывали водой, Et2O и сушили с получением соответствующего кумарина (8,61 г, 23,4 ммоль, выход: 97%, чистота: 87%) в виде не совсем белого твердого вещества.
[0482] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, получали соответствующий диметилкарбамат (9,33 г, 23,16 ммоль, выход: 99%) в виде твердого вещества бежевого цвета.
[0483] Стадия 3: К раствору диметилкарбамата (200 мг, 0,512 ммоль, 1,0 экв.) и циклопропансульфонамида (93 мг, 0,768 ммоль, 1,5 экв.) в 1,4-диоксане (экстрасухой) (0,1 М) в атмосфере N2 добавляли Xantphos (59,2 мг, 0,102 ммоль, 0,2 экв.), карбонат цезия (250 мг, 0,768 ммоль, 1,5 экв.) и PdOAc2 (11,49 мг, 0,051 ммоль, 0,1 экв.). Образовавшуюся реакционную смесь перемешивали при 100°С в течение 16 часов. Реакционную смесь фильтровали через слой целита, элюируя CH2Cl2. Фильтрат концентрировали и очищали колоночной хроматографией по методу «флэш» (CH2Cl2/EtOAc=1:0→6:4). Неочищенный продукт далее очищали препаративным основанием с получением указанного в заголовке соединения (89 мг, 0,208 ммоль, выход: 41%) после лиофилизации в виде белого твердого вещества.
[0484] Выход: Соединение 112 выделяли в виде белого твердого вещества (39% за 3 стадии).
[0485] Анализ: LCMS (Способ R): tR=1,43 мин; m/z рассч. для [М+Н]+=476,1, обнаруж.=476,2; 1Н ЯМР (400 МГц, DMSO) δ 10,62 (s, 1H), 7,94 (d, J=5,1 Гц, 1H), 7,88 (d, J=8,8 Гц, 1H), 7,27 (d, J=2,3 Гц, 1H), 7,20 (dd, J=8,8, 2,4 Гц, 1H), 6,88 (d, J=6,0 Гц, 1H), 4,02 (s, 2H), 3,17 (s, 1H), 3,07 (s, 3Н), 2,93 (s, 3Н), 2,48 (s, 3Н), 1,16-0,93 (m, 4H).
ПРИМЕР 24
Синтез Соединения 113

[0486] Соединение 113 получали в 1 стадию:
[0487] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,1 г, 0,27 ммоль) и циклопропансульфонилхлорида, следуя процедуре общего синтеза Соединения Е.3., получали указанное в заголовке соединение (71,4 мг, 0,15 ммоль, выход: 56%) в виде белого твердого вещества.
[0488] Выход: Соединение 113 выделяли в виде белого твердого вещества (56% за 1 стадию).
[0489] Анализ: LCMS (Способ R): tR=1,58 мин; m/z рассч. для [М+H2O]+=492,4, обнаруж.=492,1; 1Н ЯМР (400 МГц, DMSO) δ 9,58 (s, 1H), 7,86 (d, J=8,8 Гц, 1H), 7,31-7,22 (m, 2Н), 7,19 (dd, J=8,7, 2,3 Гц, 1H), 7,09-6,94 (m, 2H), 3,99 (s, 2H), 3,07 (s, 3H), 2,93 (s, 3H), 2,64 (tt, J=7,9, 4,8 Гц, 1H), 2,45 (s, 3H), 1,00-0,80 (m, 4H).
ПРИМЕР 25
Синтез Соединения 114
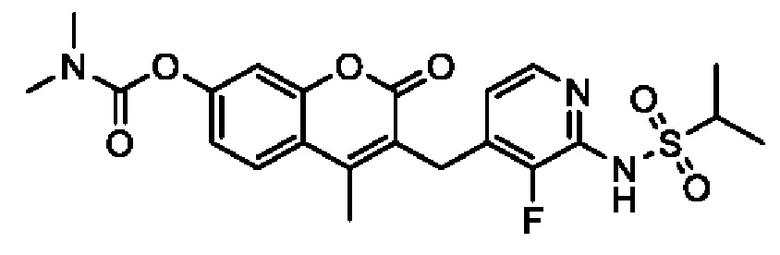
[0490] Соединение 114 получали в 3 стадии:
[0491] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутаноата (10,0 г, 24,12 ммоль) и резорцина (2,00 экв.), следуя процедуре общего синтеза Соединения D.4. Вместо хлорной кислоты использовали серную кислоту. После полного превращения реакционную смесь охлаждали (0°С) и гасили насыщ. водн. NaHCO3 до щелочного рН. Образовавшуюся суспензию белого цвета промывали водой, Et2O и сушили, получая соответствующий кумарин (8,61 г, 23,4 ммоль, выход: 97%, чистота: 87%) в виде не совсем белого твердого вещества.
[0492] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, получали соответствующий диметилкарбамат (9,33 г, 23,16 ммоль, выход: 99%) в виде бежевого твердого вещества.
[0493] Стадия 3: К раствору диметилкарбамата (100 мг, 0,256 ммоль, 1,0 экв.) и изопропилсульфонамида (47 мг, 0,384 ммоль, 1,5 экв.) в 1,4-диоксане (экстрасухой) (0,1 М) в атмосфере N2 добавляли Xantphos (29,6 мг, 0,051 ммоль, 0,2 экв.), карбонат цезия (125 мг, 0,384 ммоль, 1,5 экв.) и PdOAc2 (5,7 мг, 0,026 ммоль, 0,1 экв.). Образовавшуюся реакционную смесь перемешивали при 100°С в течение 16 часов. Реакционную смесь фильтровали через слой целита, элюируя CH2Cl2. Фильтрат концентрировали и очищали колоночной хроматографией по методу «флэш» (CH2Cl2/EtOAc=1:0→6:4). Неочищенный продукт далее очищали препаративным основанием с получением указанного в заголовке соединения (37 мг, 0,077 ммоль, выход: 30%) после лиофилизации в виде белого твердого вещества.
[0494] Выход: Соединение 114 выделяли в виде белого твердого вещества (29% за 3 стадии).
[0495] Анализ: LCMS (Способ R): tR=1,47 мин; m/z рассч. для [М+Н]+=478,1, обнаруж.=478,2; 1Н ЯМР (400 МГц, DMSO) δ 10,49 (s, 1H), 8,05-7,82 (m, 2Н), 7,27 (d, J=2,3 Гц, 1Н), 7,20 (dd, J=8,8, 2,3 Гц, 1Н), 6,88 (s, 1H), 4,08-3,86 (m, 3Н), 3,07 (s, 3Н), 2,93 (s, 3Н), 2,47 (s, 3Н), 1,31 (d, J=6,8 Гц, 6Н).
ПРИМЕР 26
Синтез Соединения 115

[0496] Соединение 115 получали в 1 стадии:
[0497] Стадия 1: начиная с 3-(3-амино-2-фторбензил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,1 г, 0,27 ммоль) и 2-пропансульфонилхлорида, следуя процедуре общего синтеза соединения Е.3. Время реакции составляло 3 дня, продукт очищали колоночной хроматографией по методу «флэш'» (CH2Cl2/EtOAc=1:0→6:4) с получением указанного в заголовке соединения (35,8 мг, 0,074 ммоль, выход: 27%) в виде белого твердого вещества.
[0498] Выход: Соединение 115 выделяли в виде белого твердого вещества (27% за 1 стадию).
[0499] Анализ: LCMS (Способ R): tR=1,62 мин; m/z рассч. для [М+Н]+=477,1, обнаруж.=477,2; 1Н ЯМР (400 МГц, DMSO) δ 9,58 (s, 1H), 7,86 (d, J=8,8 Гц, 1H), 7,31-7,22 (m, 2H), 7,19 (dd, J=8,8, 2,3 Гц, 1H), 7,02 (t, J=7,9 Гц, 1H), 6,97-6,88 (m, 1H), 3,98 (s, 2H), 3,22 (p, J=6,8 Гц, 1H), 3,07 (s, 3H), 2,93 (s, 3H), 2,45 (s, 3H), 1,27 (d, J=6,8 Гц, 6H)
ПРИМЕР 27
Синтез Соединения 116

[0500] Соединение 116 получали в 1 стадию:
[0501] Стадия 1: Начиная с 4-(бромметил)-6-хлор-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (45 мг, 0,075 ммоль, выход: 40%) и N-метилбензиламина, следуя процедуре общего синтеза Соединения Е.2, с добавлением Net3 3,0 экв. Продукт очищали препаративным основанием с получением указанного в заголовке соединения (12,8 мг, 0,021 ммоль, выход: 66%) после сушки вымораживанием в виде белого твердого вещества.
[0502] Выход: Соединение 116 выделяли в виде белого твердого вещества (66% за 1 стадию).
[0503] Анализ: LCMS (Способ Т): tR=1,98 мин; m/z рассч. для [М+Н]+=617,2/619,2, обнаруж.=617,4/619,4; 1H ЯМР (400 МГц, DMSO) δ 9,41 (s, 1H), 8,25 (s, 1H), 7,47 (s, 1H), 7,37-7,21 (m, 6H), 7,15 (s, 1H), 6,97 (t, J=7,9 Гц, 1H), 6,80 (t, J=7,2 Гц, 1H), 4,05 (s, 2H), 3,76 (s, 2H), 3,56 (s, 2H), 3,11 (s, 3H), 2,95 (s, 3H), 2,52 (d, J=4,0 Гц, 3Н), 2,06 (s, 3Н).
ПРИМЕР 28
Синтез Соединения 117

[0504] Соединение 117 получали в 1 стадию:
[0505] Стадия 1: Начиная с 4-(бромметил)-6-хлор-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (45 мг, 0,075 ммоль, выход: 40%) и N-Метилпропиламина, следуя процедуре общего синтеза Соединения Е.2, с добавлением Net3 3,0 экв. Продукт очищали препаративным основанием, а затем препаративной кислотой с получением указанного в заголовке соединения (3,8 мг, 0,007 ммоль, выход: 21%) после сушки вымораживанием в виде белого твердого вещества.
[0506] Выход: Соединение 117 выделяли в виде белого твердого вещества (21% за 1 стадию).
[0507] Анализ: LCMS (Способ Т): tR=1,94 мин; m/z рассч. для [М+Н]+=569,2/571,2, обнаруж.=569,4/571,4; 1Н ЯМР (400 МГц, DMSO) δ 9,41 (s, 1H), 8,29 (s, 1H), 7,48 (s, 1H), 7,28 (t, J=7,7 Гц, 1H), 7,15 (s, 1H), 6,98 (t, J=7,9 Гц, 1H), 6,81 (t, J=7,2 Гц, 1H), 4,04 (s, 2Н), 3,71 (s, 2Н), 3,10 (s, 3Н), 2,95 (s, 3Н), 2,52 (s, 3Н), 2,35 (t, J=7,0 Гц, 2Н), 2,06 (s, 3Н), 1,44 (h, J=7,3 Гц, 2Н), 0,82 (t, J=7,3 Гц, 3Н),
ПРИМЕР 29
Синтез Соединения 118
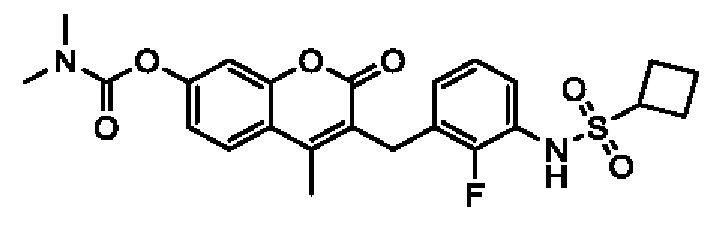
[0508] Соединение 117 получали в 1 стадию:
[0509] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,1 г, 0,27 ммоль) и циклобутансульфонилхлорида. следуя процедуре общего синтеза Соединения Е.3. Реакционную смесь очищали методом «препаратного основания» с получением указанного в заголовке соединения (8,0 мг, 0,016 ммоль, выход: 6%) после лиофилизации в виде белого твердого вещества.
[0510] Выход: Соединение 117 выделяли в виде белого твердого вещества (6% за 1 стадию).
[0511] Анализ: LCMS (Способ R): tR=1,65 мин; m/z рассч. для [М+Н]+=489,1, обнаруж.=489,4; 1Н ЯМР (400 МГц, DMSO) δ 9,51 (s, 1H), 7,86 (d, J=8,8 Гц, 1H), 7,28-7,15 (m, 3Н), 7,06-6,88 (m, 2Н), 3,98 (s, 2Н), 3,90 (р, J=8,2 Гц, 1H), 3,07 (s, 3Н), 2,93 (s, 3Н), 2,45 (s, 3Н), 2,36-2,13 (m, 4Н), 1,97-1,80 (m, 2Н).
ПРИМЕР 30
Синтез Соединения 119

[0512] Соединение 119 получали в 1 стадию:
[0513] Стадия 1: Начиная с 3-((2-амино-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,05 г, 0,135 ммоль) и этансульфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. Реакционную смесь очищали методом «препаративного основания» с получением указанного в заголовке соединения (3,6 мг, 0,007 ммоль, выход: 6%) после лиофилизации в виде белого твердого вещества.
[0514] Выход: Соединение 119 выделяли в виде белого твердого вещества (6% за 1 стадию).
[0515] Анализ: LCMS (Способ R): tR=1,42 мин; m/z рассч. для [М+Н]+=464,1, обнаруж.=464,2; 1Н ЯМР (400 МГц, DMSO) δ 10,54 (s, 1H), 8,01-7,80 (m, 2Н), 7,27 (d, J=2,3 Гц, 1H), 7,20 (dd, J=8,8, 2,4 Гц, 1H), 6,88 (s, 1H), 4,02 (s, 2H), 3,63-3,42 (m, 2H), 3,07 (s, 3H), 2,93 (s, 3H), 2,47 (s, 3H), 1,26 (t, J=7,4 Гц, 3Н).
ПРИМЕР 31
Синтез Соединения 120
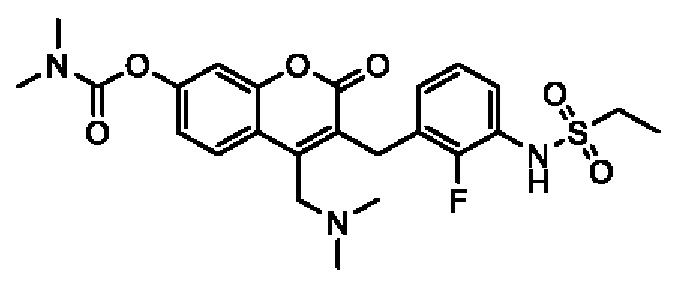
[0516] Соединение 120 получали в 3 стадии:
[0517] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,516 г, 1,115 ммоль) и этансульфонилхлорида, следуя процедуре общего синтеза Соединения Е.3, получали сульфамоил (320 мг, 0,678 ммоль, выход: 61%) в виде белого твердого вещества.
[0518] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали колоночной хроматографией методом «флэш» (гептан/EtOAc=1:0→0:1) с получением соответствующего соединения брома (324 мг, 0,53 ммоль, выход: 79%, чистота: 89%) в виде белого твердого вещества.
[0519] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 10 мг, 0,016 ммоль соединения брома и 2М диметиламина в МеОН. Неочищенный продукт очищали препаративным основанием с последующим градиентом SFC CEL-2 с получением указанного в заголовке соединения (2,8 мг, 0,005 ммоль, выход: 33%) в виде белого твердого вещества.
[0520] Выход: Соединение 120 выделяли в виде белого твердого вещества (16% за 3 стадии).
[0521] Анализ: LCMS (Способ Т): tR=1,61 мин; m/z рассч. для [М+Н]+=506,2, обнаруж.=506,4; 1H ЯМР (400 МГц, CDCl3) δ 8,01 (d, J=8,8 Гц, 1H), 7,44 (td, J=7,7, 1,2 Гц, 1H), 7,14-7,05 (m, 2Н), 7,01 (t, J=7,9 Гц, 1H), 6,90 (t, J=7,2 Гц, 1H), 6,49-6,43 (m, 1H), 4,16 (s, 2H), 3,60 (s, 2H), 3,16 (q, J=7,4 Гц, 3Н), 3,13 (s, 2H), 3,04 (s, 3H), 2,27 (s, 6H), 1,40 (t, J=7,4 Гц, 3Н).
ПРИМЕР 32
Синтез Соединения 121
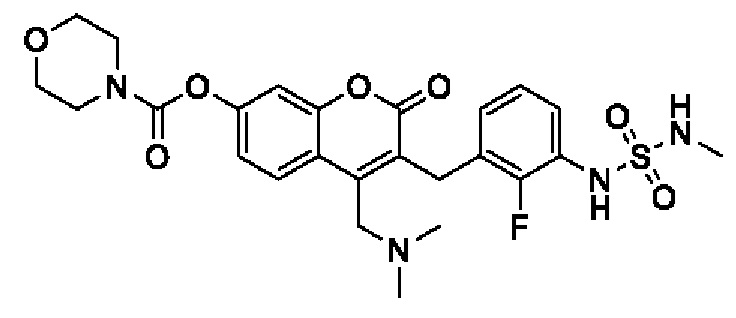
[0522] Соединение 121 получали в 1 стадию:
[0523] Стадия 1: Начиная с фенола (20 мг, 0,046 ммоль) и 4-морфолинкарбонилхлорида, следуя процедуре общего синтеза Соединения F.2 с очисткой методом «препаративного основания» с получением указанного в заголовке соединения (16 мг, 0,029 ммоль, выход: 64%) в виде белого твердого вещества после лиофилизации.
[0524] Выход: Соединение 121 выделяли в виде белого твердого вещества (64% за 1 стадию).
[0525] Анализ: LCMS (Способ Р): tR=1,39 мин; m/z рассч. для [М+Н]+=549,2, обнаруж.=549,1; 1H ЯМР (400 МГц, CDCl3) δ 8,03 (d, J=8,8 Гц, 1Н), 7,39 (td, J=7,9, 1,6 Гц, 1H), 7,14-7,05 (m, 2Н), 7,00 (td, J=8,0, 1,2 Гц, 1H), 6,92-6,84 (m, 1H), 6,61 (d, J=3,2 Гц, 1H), 4,43 (t, J=5,3 Гц, 1H), 4,15 (s, 2Н), 3,77 (dd, J=5,5, 4,0 Гц, 4Н), 3,70 (d, J=7,4 Гц, 2Н), 3,60 (d, J=12,2 Гц, 4Н), 2,76 (d, J=5,3 Гц, 3Н), 2,28 (s, 6Н).
ПРИМЕР 33
Синтез Соединения 122

[0526] Соединение 122 получали в 1 стадию:
[0527] Стадия 1: Начиная с фенола (20 мг, 0,046 ммоль) и 4-морфолинкарбонилхлорида, следуя процедуре общего синтеза Соединения F.2. Выполняли очистку методом «препаративного основания» с получением указанного в заголовке соединения (16 мг, 0,029 ммоль, выход: 64%) в виде белого твердого вещества после лиофилизации.
[0528] Выход: Соединение 122 выделяли в виде белого твердого вещества (64% за 1 стадию).
[0529] Анализ: LCMS (Способ Р): tR=1,39 мин; m/z рассч. для [М+Н]+=549,2, обнаруж.=549,1; 1H ЯМР (400 МГц, CDCl3) δ 8,03 (d, J=8,8 Гц, 1H), 7,39 (td, J=7,9, 1,6 Гц, 1H), 7,14-7,05 (m, 2Н), 7,00 (td, J=8,0, 1,2 Гц, 1H), 6,92-6,84 (m, 1H), 6,61 (d, J=3,2 Гц, 1H), 4,43 (t, J=5,3 Гц, 1H), 4,15 (s, 2Н), 3,77 (dd, J=5,5, 4,0 Гц, 4Н), 3,70 (d, J=7,4 Гц, 2Н), 3,60 (d, J=12,2 Гц, 4Н), 2,76 (d, J=5,3 Гц, 3Н), 2,28 (s, 6Н).
ПРИМЕР 34
Синтез Соединения 123
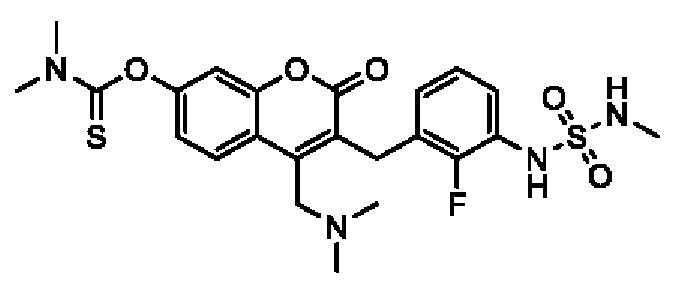
[0530] Соединение 123 получали в 1 стадию.
[0531] Стадия 1: Начиная со стадии общего синтеза, D.4 (155 мг, 0,356 ммоль) растворяли в MeCN (1,8 мл) и добавляли DMAP (130 мг, 1,07 ммоль, 3 экв.) и диметилтиокарбамоилхлорид (66 мг, 0,53 ммоль, 1,5 экв.). Эту смесь перемешивали в течение ночи при комнатной температуре и в течение 4 часов при 40°С. Реакцию как таковую очищали методом «препаративной кислоты» с получением указанного в заголовке соединения (163 мг, 0,31 ммоль, выход: 86%) в виде белого твердого вещества после лиофилизации.
[0532] Анализ: LCMS (Способ R): tR=0,951 мин; m/z рассч. для [М-Н]+=523,2, обнаруж.=523,4; 1Н ЯМР (400 МГц, DMSO) δ 9,38 (s, 1H), 8,08 (d, J=8,9 Гц, 1H), 7,33-7,16 (m, 3Н), 7,11 (dd, J=8,8, 2,4 Гц, 1H), 7,00 (t, J=7,9 Гц, 1H), 6,84 (t, J=7,1 Гц, 1H), 4,05 (s, 2H), 3,65 (s, 2H), 3,41-3,30 (m, 6H), 2,55-2,52 (m, 3Н), 2,20 (s, 6H).
ПРИМЕР 35
Синтез Соединения 124
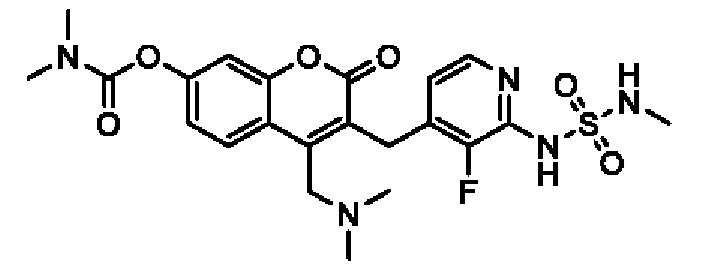
[0533] Соединение 124 получали в 1 стадию:
[0534] Стадия 1: начиная с 4-(хлорметил)-3-((3-фтор-2-((N-метилсульфамоил)амино)пиридин-4-ил)метил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (390 мг г, 0,391 ммоль, чистота: 50%) и 2М диметиламипа в МеОН, следуя процедуре общего синтеза Соединения Е.2. Продукт очищали по методу «препаративной кислоты» с получением указанного в заголовке соединения (80 г, 0,155 ммоль, выход: 40%) в виде не совсем белого твердого вещества после лиофилизации.
[0535] Выход: Соединение 124 выделяли в виде не совсем белого твердого вещества (40% за 1 стадию).
[0536] Анализ: LCMS (Способ R): tR=0,80 мин; m/z рассч. для [М-Н]+=508,2, обнаруж.=508,4; 1Н ЯМР (400 МГц, DMSO) δ 10,34 (s, 1H), 8,09 (d, J=8,9 Гц, 1H), 7,90 (d, J=5,1 Гц, 1Н), 7,24 (d, J=2,3 Гц, 1H), 7,16 (dd, J=8,8, 2,4 Гц, 1H), 6,96 (s, 1H), 6,79 (t, J=5,1 Гц, 1H), 4,07 (s, 2H), 3,66 (s, 2H), 3,07 (s, 3H), 2,93 (s, 3H), 2,20 (s, 6H).
ПРИМЕР 36
Синтез Соединения 125
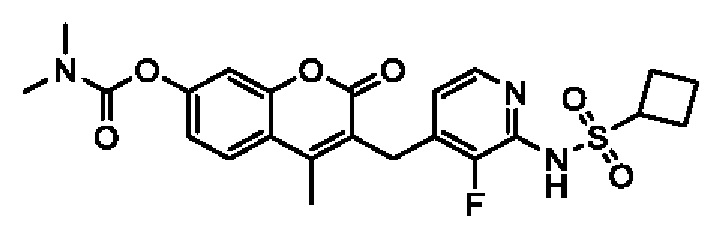
[0537] Соединение 125 получали в 3 стадию:
[0538] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутаноата (10,0 г, 24,12 ммоль) и резорцина (2,00 экв.), следуя процедуре общего синтеза Соединения D.4. Вместо хлорной кислоты использовали серную кислоту. После полного превращения реакционную смесь охлаждали (0°С) и гасили насыщ. водн. NaHCO3 до щелочного рН. Образовавшуюся суспензию белого цвета промывали водой, Et2O и сушили, получая соответствующий кумарин (8,61 г, 23,4 ммоль, выход: 97%, чистота: 87%) в виде не совсем белого твердого вещества.
[0539] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, получали соответствующий диметилкарбамат (9,33 г, 23,16 ммоль, выход: 99%) в виде бежевого твердого вещества.
[0540] Стадия 3: К раствору диметилкарбамата (200 мг, 0,512 ммоль, 1,0 экв.) и циклобутансульфонамида (104 мг, 0,768 ммоль, 1,5 экв.) в 1,4-диоксане (экстрасухой) (0,1 М) в атмосфере N2 добавляли Xantphos (59,2 мг, 0,102 ммоль, 0,2 экв.), карбонат цезия (250 мг, 0,768 ммоль, 1,5 экв.) и PdOAc2 (11,5 мг, 0,051 ммоль, 0,1 экв.). Образовавшуюся реакционную смесь перемешивали при 100°С в течение 16 часов. Реакционную смесь фильтровали через слой целита, элюируя CH2Cl2. Фильтрат концентрировали и очищали препаративным основанием с получением указанного в заголовке соединения (53 мг, 0,107 ммоль, выход: 21%) после лиофилизации в виде белого твердого вещества.
[0541] Выход: Соединение 125 выделяли в виде белого твердого вещества (20% за 3 стадии).
[0542] Анализ: LCMS (Способ L): tR=3,71 мин; m/z рассч. для [М+Н]+=490,2, обнаруж.=490,1; 1H ЯМР (400 МГц, DMSO) δ 10,53 (bs, 1Н), 8,00-7,79 (m, 2H), 7,26 (d, J=2,3 Гц, 1H), 7,20 (dd, J=8,7, 2,3 Гц, 1H), 6,84 (s, 1H), 4,50 (bs, 1H), 4,00 (s, 2H), 3,07 (s, 3H), 2,93 (s, 3H), 2,48-2,34 (m, 5H), 2,29-2,17 (m, 2H), 2,01-1,83 (m, 2H).
ПРИМЕР 37
Синтез Соединения 126
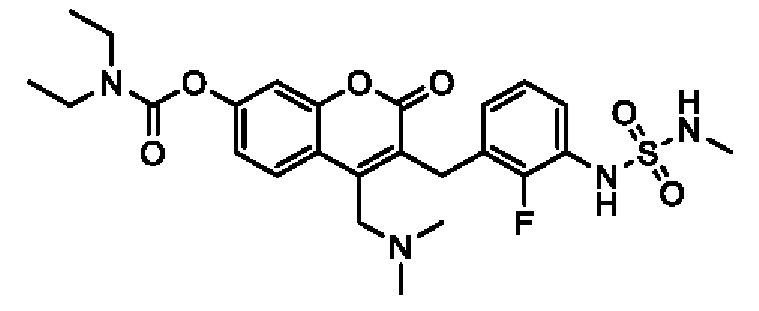
[0543] Соединение 125 получали в 1 стадию:
[0544] Стадия 1: Начиная с фенола (20 мг, 0,046 ммоль) и диэтилкарбамилхлорида, следуя процедуре общего синтеза Соединения F.2. Выполняли очистку методом «препаративного основания» с получением указанного в заголовке соединения (9,7 мг, 0,018 ммоль, выход: 39%) в виде белого твердого вещества после лиофилизации.
[0545] Выход: Соединение 125 выделяли в виде белого твердого вещества (39% за 1 стадии).
[0546] Анализ: LCMS (Способ Р): tR=1,65 мин; m/z рассч. для [М+Н]+=535,2, обнаруж.=535,1; без Н ЯМР, соединение было приготовлено в библиотеке.
ПРИМЕР 38
Синтез Соединения 127
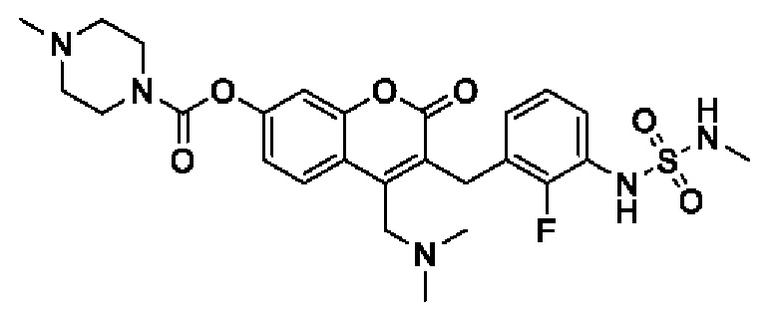
[0547] Соединение 126 получали в 1 стадию:
[0548] Стадия 1: Начиная с фенола (20 мг, 0,046 ммоль) и 4-метил-1-пиперазинкарбонилхлорида, следуя процедуре общего синтеза Соединения F.2. Выполняли очистку методом «препаративного основания» с получением указанного в заголовке соединения (17,8 мг, 0,032 ммоль, выход: 70%) в виде белого твердого вещества после лиофилизации.
[0549] Выход: Соединение 126 выделяли в виде белого твердого вещества (70% за 1 стадию).
[0550] Анализ: LCMS (Способ Р): tR=1,33 мин; m/z рассч. для [М+Н]+=562,2, обнаруж.=562,1; без Н ЯМР, соединение было приготовлено в библиотеке.
ПРИМЕР 39
Синтез Соединения 128

[0551] Соединение 128 получали в 1 стадию:
[0552] Стадия 1: Начиная с фенола (50 мг, 0,115 ммоль) и азетидин-1-карбонилхлорида, следуя процедуре общего синтеза Соединения F.2 добавляли DMAP (0,6 экв.) и Et3N (1,1 экв.) и реакцию проводили в CH2Cl2 (0,11 М). После полного превращения реакционную смесь концентрировали и к остатку добавляли воду. Продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали методом «препаративного основания» с получением указанного в заголовке соединения (6 мг, 0,012 ммоль, выход: 10%) в виде белого твердого вещества после лиофилизации.
[0553] Выход: Соединение 128 выделяли в виде белого твердого вещества (10% за 1 стадию).
[0554] Анализ: LCMS (Способ Т): tR=1,44 мин; m/z рассч. для [М+Н]+=519,2, обнаруж.=519,1; 1H ЯМР (400 МГц, CDCl3) δ 8,00 (d, J=8,8 Гц, 1Н), 7,39 (td, J=7,9, 1,6 Гц, 1H), 7,15-7,05 (m, 2Н), 7,03-6,96 (m, 1H), 6,90-6,83 (m, 1H), 6,61 (s, 1H), 4,44 (q, J=5,4 Гц, 1H), 4,25 (s, 2Н), 4,15 (s, 4Н), 3,59 (s, 2Н), 2,75 (d, J=5,3 Гц, 3Н), 2,36 (р, J=7,7 Гц, 2Н), 2,27 (s, 6Н).
ПРИМЕР 40
Синтез Соединения 129

[0555] Соединение 129 получали в 1 стадию:
[0556] Стадия 1: К раствору производного фенола (50 мг, 0,115 ммоль, 1,0 экв.) и 2-бромпиримидина (30 мг, 0,19 ммоль, 1,6 экв.) в N,N-диметилформамиде (сухой) (2 мл) добавляли карбонат калия (26 мг, 0,19 ммоль, 1,6 экв.). Образовавшуюся реакционную смесь перемешивали в течение 5 часов при 80°С. Добавляли воду и экстрагировали продукт с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали методом «препаративного основания» с получением указанного в заголовке соединения (8,0 мг, 0,016 ммоль, выход: 14%) в виде белого твердого вещества после лиофилизации.
[0557] Выход: Указанное в заголовке соединение выделяли в виде белого твердого вещества (14% за 1 стадию).
[0558] Анализ: LCMS (Способ Т): tR=1,34 мин; m/z рассч. для [М+Н]+=514,2, обнаруж.=514,1; 1H ЯМР (400 МГц, CDCl3) δ 8,60 (d, J=4,7 Гц, 2Н), 8,11 (d, J=8,8 Гц, 1H), 7,40 (td, J=7,8, 1,6 Гц, 1H), 7,22 (d, J=2,4 Гц, 1Н), 7,17 (dd, J=8,8, 2,4 Гц, 1H), 7,12 (t, J=4,8 Гц, 1H), 7,01 (t, J=8,0 Гц, 1H), 6,91-6,81 (m, 1H), 6,61 (s, 1H), 4,43 (q, J=5,4 Гц, 1H), 4,17 (s, 2Н), 3,62 (s, 2Н), 2,77 (d, J=5,2 Гц, 3Н), 2,29 (s, 6Н).
ПРИМЕР 41
Синтез Соединения 130
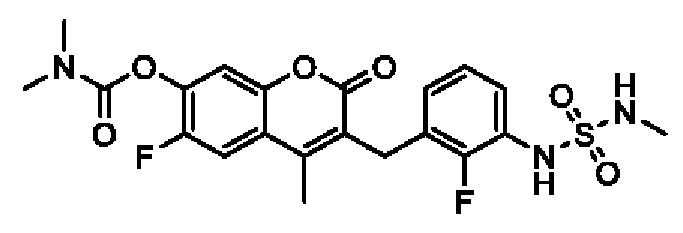
[0559] Соединение 130 получали в 4 стадии:
[0560] Стадия 1: Начиная с этил 2-(2-фтор-3-нитробензил)-3-оксобутаноата (2,0 г, 7,06 ммоль) и 4-фтор6ензол-1,3-диола (1,20 экв.), следуя процедуре общего синтеза Соединения 4 с получением соответствующего соединения кумарина (2,85 г, 8,13 ммоль, выход: 115%) в виде не совсем белого твердого вещества.
[0561] Стадия 2: Следуя процедуре общего синтеза Соединения 5, при времени реакции 2,5 дня, получали соответствующий диметилкарбамат (2,28 г, 5,01 ммоль, чистота: 92%, выход: 61%) в виде твердого вещества бежевого цвета.
[0562] Стадия 3: Следуя процедуре общего синтеза Соединения 6, получали соответствующий первичный амин (1,28 г, 3,11 ммоль, выход: 57%) в виде светло-желтого твердого вещества.
[0563] Стадия 4: Следуя процедуре общего синтеза Соединения 7, после фильтрации неочищенный продукт очищали колоночной флэш-хроматографией (CH2Cl2/МеОН=1:0→97:3) с получением указанного в заголовке соединения (1,043 г, 2,15 ммоль, выход: 65%) в виде не совсем белого твердого вещества.
[0564] Выход: Соединение 130 выделяли в виде не совсем белого твердого вещества (26% за 4 стадии).
[0565] Анализ: LCMS (Способ R): tR=1,55 мин; m/z рассч. для [М-Н]+=480,1, обнаруж.=480,2; 1Н ЯМР (400 МГц, DMSO) δ 9,37 (s, 1H), 7,86 (d, J=11,2 Гц, 1H), 7,49 (d, J=6,8 Гц, 1H), 7,28 (td, J=7,8, 1,6 Гц, 1H), 7,21 (q, J=5,1 Гц, 1H), 7,01 (t, J=7,9 Гц, 1H), 6,91-6,83 (m, 1H), 3,98 (s, 2H), 3,08 (s, 3Н), 2,94 (s, 3Н), 2,53 (s, 3Н), 2,43 (s, 3Н).
ПРИМЕР 42
Синтез Соединения 131
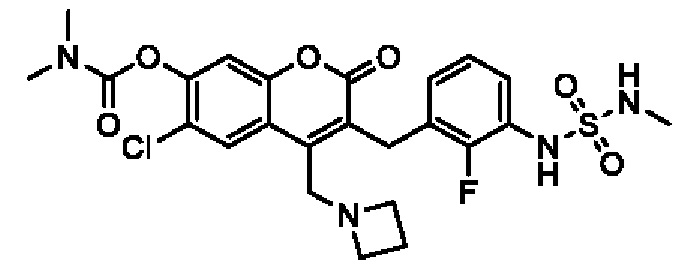
[0566] Соединение 131 получали в 1 стадию:
[0567] Стадия 1: Начиная с 6-хлор-4-(хлорметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (20 мг, 0,038 ммоль) и азетидииа, следуя процедуре общего синтеза Соединения Е.2, с добавлением карбоната калия 3,0 экв. Неочищенный продукт объединяли с другими партиями и очищали препаративным основанием с получением указанного в заголовке соединения (44 мг, 0,076 ммоль, выход: 65%) после сушки вымораживанием в виде белого твердого вещества.
[0568] Выход: Указанное в заголовке соединение выделяли в виде белого твердого вещества (65% за 1 стадию).
[0569] Анализ: LCMS (Способ R): tR=0,95 мин; m/z рассч. для [М+Н]+=553,1, обнаруж.=553,2; 1Н ЯМР (400 МГц, DMSO) 5 9,39 (s, 1Н), 8,20 (s, 1H), 7,48 (s, 1H), 7,33-7,19 (m, 2H), 7,00 (t, J=8,0 Гц, 1H), 6,81 (t, J=7,1 Гц, 1H), 4,09 (s, 2H), 3,82 (s, 2H), 3,16 (t, J=6,9 Гц, 4H), 3,10 (s, 3Н), 2,95 (s, 3Н), 2,53 (d, J=4,8 Гц, 3Н), 1,91 (p, J=7,0 Гц, 2H).
ПРИМЕР 43
Синтез Соединения 132
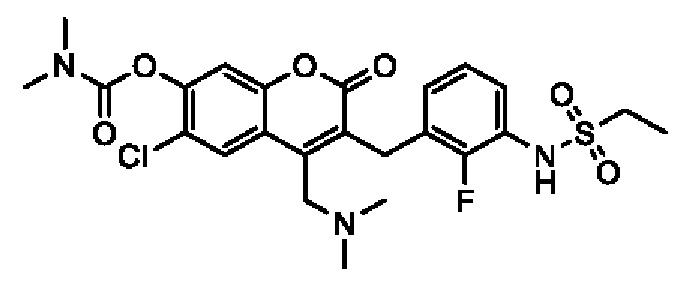
[0570] Соединение 132 получали в 3 стадии:
[0571] Стадия 1: Начиная с 3-(3-амино-2-фторбепзил)-6-хлор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,320 г, 0,585 ммоль) и этаисульфоиилхлорида, следуя процедуре общего синтеза Соединения Е.3, во время обработки реакционную смесь объединяли с другой партией с получением сульфамоила (350 мг, 0,704 ммоль, выход: 92%) в виде белого твердого вещества.
[0572] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали колоночной хроматографией методом «флэш» (гептан/EtOAc=1:0→0:1) с последующим очищением препаративной кислотой с получением соответствующего брома (65 мг, 0,113 ммоль, выход: 19%) в виде твердого вещества бежевого цвета.
[0573] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5 с применением диметиламина 2М в МеОН. Реакционную смесь гасили водой и продукт экстрагировали CH2Cl2. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали препаративной кислотой с получением указанного в заголовке соединения (39 мг, 0,073 ммоль, выход: 65%) в виде белого твердого вещества после лиофилизации.
[0574] Выход: Соединение 132 выделяли в виде белого твердого вещества (11% за 3 стадии).
[0575] Анализ: LCMS (Способ V): tR=3,92 мин; m/z рассч. для [М+Н]+=540,1/542,1, обнаруж.=540,1/542,1; 1Н ЯМР (400 МГц, DMSO) δ 9,67 (s, 1H), 8,21 (s, 1H), 7,48 (s, 1H), 7,25 (td, J=7,8, 1,7 Гц, 1H), 7,03 (t, J=7,8 Гц, 1H), 6,98-6,88 (m, 1H), 4,05 (s, 2H), 3,66 (s, 2H), 3,14-3,07 (m, 5H), 2,95 (s, 3H), 2,18 (s, 6H), 1,26 (t, J=7,3 Гц, 3Н).
ПРИМЕР 44
Синтез Соединения 133

[0576] Соединение 133 готовили аналогично соединению 225 с хлоридом вместо бромида.
[0577] Стадия-1: 6-хлор-4-(хлорметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамат (300 мг, 0,564 ммоль) и триэтиламин (236 мкл, 1,69 ммоль, 3 экв.) перемешивали при 40°С в DCM (7 мл) и добавляли трет-бутилглицинат (308 мкл, 2,25 ммоль, 4 экв.). На следующий день добавляли воду и продукт экстрагировали DCM (2х). Объединенный экстракт сушили над соляным раствором и сульфатом натрия и упаривали. Остаток повторно растворяли в 1 мл DCM и очищали колоночной хроматографией по методу «препаративное основание» с получением промежуточного трет-бутилового эфира (126 мг, 0,20 ммоль, выход: 35%).
[0578] Стадия-2: Промежуточное соединение с предыдущей стадии (126 мг, 0,20 ммоль) перемешивали в 2 мл DCM и 2 мл 4 N HCl в диоксане (58 ммоль, 287 экв.). На следующий день летучие вещества выпаривали, остаток упаривали с применением DCM, а неочищенный продукт повторно растворяли в MeCN и очищали по методу «препаративного основания», получая указанное в заголовке соединение (94 мг, 0,16 ммоль, выход: 81%) в виде не совсем белого твердого вещества.
ПРИМЕР 45
Синтез Соединения 134

[0579] Соединение 134 получали в 1 стадию:
[0580] Стадия 1: Начиная с 4-(хлорметил)-6-фтор-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (30 мг, 0,058 ммоль) и пиперезина, следуя процедуре общего синтеза Соединения Е.2, с добавлением Et3N 3,0 экв. Неочищенный продукт очищали препаративным основанием с получением указанного в заголовке соединения (17,3 мг, 0,029 ммоль, выход: 51%) после сушки вымораживанием в виде белого твердого вещества.
[0581] Выход: Соединение 134 выделяли в виде белого твердого вещества (51% за 1 стадии).
[0582] Анализ: LCMS (Способ Т): tR=1,39 мин; m/z рассч. для [М+Н]+=566,2, обнаруж.=566,4; 1Н ЯМР (400 МГц, DMSO) δ 8,04 (d, J=11,8 Гц, 1H), 7,47 (d, J=6,9 Гц, 1H), 7,28 (td, J=7,9, 1,7 Гц, 1H), 7,24-7,12 (m, 1H), 6,99 (t, J=7,9 Гц, 1H), 6,82 (t, J=7,1 Гц, 1H), 4,03 (s, 2Н), 3,66 (s, 2Н), 3,08 (s, 3Н), 2,94 (s, 3Н), 2,63-2,55 (m, 4Н), 2,55-2,52 (m, 3Н), 2,41-2,28 (m, 4Н).
ПРИМЕР 46
Синтез Соединения 135

[0583] Соединение 135 получали в 1 стадию:
[0584] Стадия 1: Начиная с 4-(хлорметил)-6-фтор-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (50 мг, 0,097 ммоль) и диметиламина 2М в МеОН, следуя процедуре общего синтеза Соединения Е.2. Продукт объединяли с другой партией и очищали препаративным основанием с получением указанного в заголовке соединения (9,1 мг, 0,017 ммоль, выход: 18%) после сушки вымораживанием в виде белого твердого вещества.
[0585] Выход: Указанное в заголовке соединение выделяли в виде белого твердого вещества (18% за 1 стадию).
[0586] Анализ: LCMS (Способ Т): tR=1,63 мин; m/z рассч. для [М+Н]+=525,2, обнаруж.=525,2; 1Н ЯМР (400 МГц, DMSO) δ 9,38 (s, 1Н), 8,00 (d, J=11,7 Гц, 1H), 7,46 (d, J=6,9 Гц, 1H), 7,32-7,25 (m, 1H), 7,18 (s, 1H), 6,99 (t, J=7,9 Гц, 1H), 6,82 (t, J=7,2 Гц, 1H), 4,04 (s, 2Н), 3,63 (s, 2Н), 3,08 (s, 3Н), 2,94 (s, 3Н), 2,54-2,51 (m, 3Н), 2,18 (s, 6Н).
ПРИМЕР 47
Синтез Соединения 136
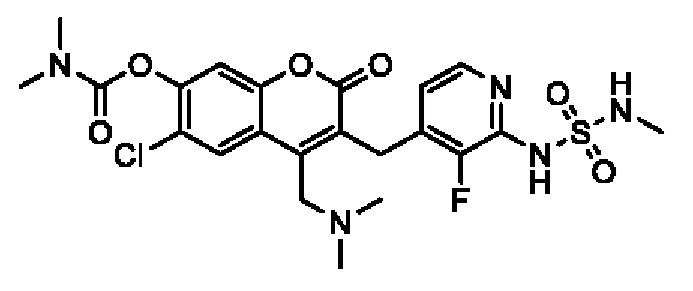
[0587] Соединение 136 получали в 1 стадию:
[0588] Стадия 1: Начиная с 4-(бромметил)-6-хлор-3-((3-фтор-2-((Х-метилсульфамоил)амино)пиридин-4-ил)метил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (151 мг, 0,055 ммоль, чистота: 21%) и диметиламина 2М в МеОН (109 экв.), следуя процедуре общего синтеза Соединения Е.2, реакцию проводили в чистом виде. Продукт очищали препаративной кислотой с получением указанного в заголовке соединения (12 мг, 0,022 ммоль, выход: 40%) после лиофилизации в виде светло-желтого твердого вещества.
[0589] Выход: Соединение 136 выделяли в виде светло-желтого твердого вещества (40% за 1 стадию).
[0590] Анализ: LCMS (Способ V): tR=2,96 мин; m/z рассч. для [М+Н]+=542,1, обнаруж.=542,1; 1Н ЯМР (400 МГц, DMSO) 5 8,22 (s, 1Н), 7,89 (d, J=5,2 Гц, 1H), 7,50 (s, 1H), 6,78 (t, J=5,1 Гц, 1H), 4,07 (s, 2H), 3,67 (s, 2H), 3,10 (s, 3Н), 2,95 (s, 3Н), 2,51 (s, 3Н), 2,20 (s, 6H).
ПРИМЕР 48
Синтез Соединения 205
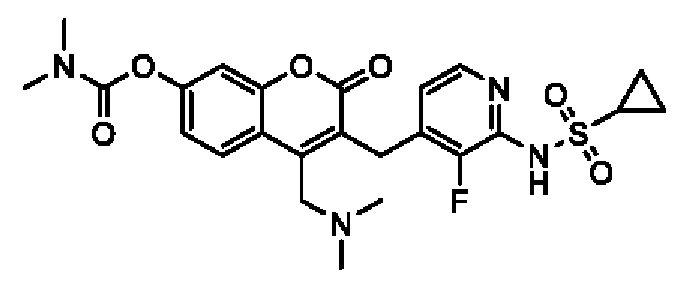
[0591] Соединение 205 получали в 3 стадии:
[0592] Стадия 1: К раствору 3-((2-хлор-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,5 г, 1,279 ммоль, 1,0 экв.) и этансульфонамида (1,41 г, 12,92 ммоль, 10,1 экв.) в 1,4-диоксане (0,1 М) в инертной атмосфере добавляли Xantphos (0,148 г, 0,256 ммоль, 0,2 экв.), карбонат цезия (0,625 г, 1,919 ммоль, 1,5 экв.) и PdOAc2 (0,049 г, 0,218 ммоль, 0,17 экв.). Образовавшуюся реакционную смесь перемешивали в течение 24 часа при 100°С. Реакционную смесь фильтровали через целит и промывали ШО и CH2Cl2. Слои фильтрата разделяли и органический слой промывали солевым раствором. Сушили над Na2SO4, фильтровали, и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2/МеОН=1:0→9:1). Все еще неочищенный продукт очищали препаративным основанием с получением 3-((2-(этилсульфонамидо)-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (32 мг, 0,068 ммоль, выход: 5,3%) в виде не совсем белого твердого вещества.
[0593] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. Реакцию гасили водой с IN H2SO4, и большую часть THF удаляли при пониженном давлении. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением соответствующего брома (42 мг, 0,046 ммоль, выход: 64%, чистота: 59%) в виде липкого желтого твердого вещества.
[0594] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 33 мг, 0,040 ммоль брома и 2М диметиламипа в МеОН. Неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (8,4 мг, 0,016 ммоль, выход: 40%) в виде белого твердого вещества.
[0595] Выход: Соединение 205 выделяли в виде белого твердого вещества (1% за 3 стадии).
[0596] Анализ: LCMS (Способ L): tR=2,32 мин; m/z рассч. для [М+Н]+=519,2, обнаруж.=519,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,25 (s, 1H), 8,08 (d, J=8,9 Гц, 1H), 7,78 (s, 1H), 7,24 (d, J=2,3 Гц, 1Н), 7,15 (dd, J=8,8, 2,4 Гц, 1H), 6,57 (s, 1H), 4,03 (s, 2H), 3,65 (s, 2H), 3,07 (s, 3H), 2,93 (s, 3H), 2,21 (s, 7H), 0,92 (d, J=41,0 Гц, 4H).
ПРИМЕР 49
Синтез Соединения 137
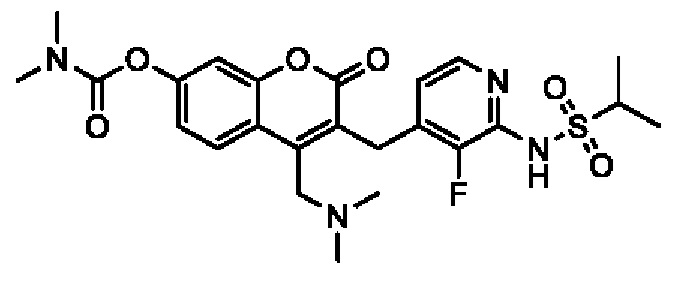
[0597] Соединение 137 получали в 3 стадии:
[0598] Стадия 1: К раствору 3-((2-хлор-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,5 г, 1,279 ммоль, 1,0 экв.) и этансульфонамида (1,41 г, 12,92 ммоль, 10,1 экв.) в 1,4-диоксане (0,1 М) в инертной атмосфере добавляли Xantphos (0,148 г, 0,256 ммоль, 0,2 экв.), карбонат цезия (0,625 г, 1,919 ммоль, 1,5 экв.) и PdOAc2 (0,049 г, 0,218 ммоль, 0,17 экв.). Образовавшуюся реакционную смесь перемешивали в течение 24 часа при 100°С. Реакционную смесь фильтровали через целит и промывали Н2О и CH2Cl2. Слои фильтрата разделяли и органический слой промывали солевым раствором. Сушили над Na2SO4, фильтровали, и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2/МеОН=1:0→9:1). Все еще неочищенный продукт очищали препаративным основанием с получением 3-((2-(этилсульфонамидо)-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (32 мг, 0,068 ммоль, выход: 5,3%) в виде не совсем белого твердого вещества.
[0599] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. Реакцию гасили водой с IN H2SO4, и большую часть THF удаляли при пониженном давлении. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением соответствующего брома (42 мг, 0,046 ммоль, выход: 64%, чистота: 59%) в виде липкого желтого твердого вещества.
[0600] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 106 мг, 0,078 ммоль брома и 2М диметиламина в МеОН. Неочищенный продукт дважды очищали препаративной кислотой с получением указанного в заголовке соединения (23 мг, 0,044 ммоль, выход: 57%) в виде белого твердого вещества.
[0601] Выход: Соединение 137 выделяли в виде белого твердого вещества (1% за 3 стадии).
[0602] Анализ: LCMS (Способ L): tR=2,38 мин; m/z рассч. для [М+Н]+=521,2, обнаруж.=521,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,09 (d, J=8,8 Гц, 1H), 7,87 (d, J=5,0 Гц, 1H), 7,24 (d, J=2,3 Гц, 1H), 7,16 (dd, J=8,7, 2,4 Гц, 1H), 6,76 (s, 1H), 4,06 (s, 2H), 3,91 (s, 1H), 3,66 (s, 2H), 3,07 (s, 3H), 2,93 (s, 3H), 2,54 (s, 1H), 2,20 (s, 6H), 1,29 (d, J=6,8 Гц, 6H).
ПРИМЕР 50
Синтез Соединения 138
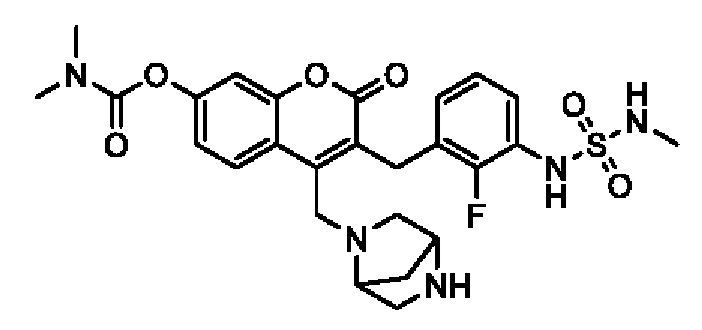
[0603] Соединение 138 получали в 2 стадии:
[0604] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (100 мг, 0,184 ммоль) и трет-бутил 2,5-диазабицикло[2.2.1]гептан-2-карбоксилата, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в CH2Cl2 и добавляли Et3N (1,8 экв.). После полного превращения добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0→1:9). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением Вос-амина (73 мг, 0,111 ммоль, 120%) в виде бесцветного масла.
[0605] Стадия 2: Вос-амин растворяли в CH2Cl2 (0,05 М) и добавляли TFA (341 мкл, 4,43 ммоль, 40 экв.). Образовавшуюся реакционную смесь перемешивали в течение 18 часов при комнатной температуре. К реакционной смеси добавляли воду с последующим добавлением некоторого количества насыщ. водн. Na2CO3. Продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (25,4 мг, 0,045 ммоль, выход: 40%) после лиофилизации в виде белого твердого вещества.
[0606] Выход: Соединение 138 выделяли в виде белого твердого вещества (83% за 2 стадии).
[0607] Анализ: LCMS (Способ Т): tR=1,28 мин; m/z рассч. для [М+Н]+=560,2, обнаруж.=560,2; 1H ЯМР (400 МГц, CDCl3) δ 8,49 (s, 1H), 7,94 (d, J=8,8 Гц, 1Н), 7,33 (dd, J=8,3, 6,5 Гц, 1H), 7,14 (d, J=2,3 Гц, 1H), 7,08 (dd, J=8,9, 2,4 Гц, 1H), 6,99 (t, J=7,9 Гц, 1H), 6,92 (t, J=6,9 Гц, 1H), 4,22-4,08 (m, 2Н), 4,06-3,94 (m, 2Н), 3,85 (d, J=13,6 Гц, 1H), 3,26 (s, 1Н), 3,13 (s, 3Н), 3,03 (s, 3Н), 2,93 (t, J=11,5 Гц, 2Н), 2,87-2,79 (m, 2Н), 2,77 (s, 3Н), 1,88-1,73 (m, 2Н).
ПРИМЕР 51
Синтез Соединения 139
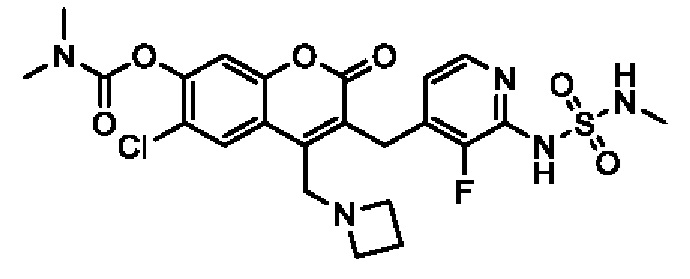
[0608] Соединение 139 получали в 1 стадию:
[0609] Стадия 1: Начиная с 6-хлор-4-(хлорметил)-3-((3-фтор-2-((N-метилсульфамоил)амино)пиридин-4-ил)метил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (100 мг, 0,12 ммоль, чистота: 64%) и азетидииа, следуя процедуре общего синтеза Соединения Е.2, реакцию проводили в THF 0,12 М и с добавлением NaI 2,0 экв. Продукт очищали препаративной кислотой, а затем препаративным основанием с получением указанного в заголовке соединения (6,5 мг, 0,011 ммоль, выход: 9%) после лиофилизации в виде белого твердого вещества.
[0610] Выход: Соединение 139 выделяли в виде белого твердого вещества (9% за 1 стадию).
[0611] Анализ: LCMS (Способ Т): tR=1,25 мин; m/z рассч. для [М+Н]+=554,1, обнаруж.=554,2; 1Н ЯМР (400 МГц, DMSO) 5 8,21 (s, 1H), 7,83 (s, 1H), 7,49 (s, 1H), 7,09-6,43 (m, 2Н), 4,09 (s, 2Н), 3,84 (s, 2Н), 3,18 (t, J=6,9 Гц, 4Н), 3,11 (s, 3Н), 2,95 (s, 3Н), 2,47 (s, 3Н), 1,91 (р, J=6,8 Гц, 2Н).
ПРИМЕР 52
Синтез Соединения 140
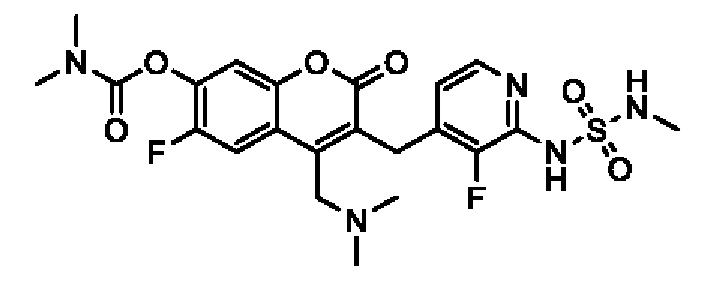
[0612] Соединение 140 получали в 1 стадию:
[0613] Стадия 1: начиная с 4-(бромметил)-6-фтор-3-((3-фтор-2-((N-метилсульфамоил)амино)пиридии-4-ил)метил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (50 мг, 0,050 ммоль, чистота: 56%) и 2М диметиламина в МеОН, следуя процедуре общего синтеза Соединения Е.2, реакцию проводили в THF вместо МеОН. Продукт очищали препаративной кислотой с последующей очисткой препаративным основанием с получением указанного в заголовке соединения (5,8 мг, 0,011 ммоль, выход: 22%) после лиофилизации в виде белого твердого вещества.
[0614] Выход: Соединение 140 выделяли в виде белого твердого вещества (22% за 1 стадию).
[0615] Анализ: LCMS (Способ Т): tR=1.17 мин; m/z рассч. для [М+Н]+=526,2, обнаруж.=526,2; 1H ЯМР (400 МГц, DMSO) δ 10,35 (s, 1H), 8,02 (d, J=11,7 Гц, 1H), 7,91 (d, J=5,1 Гц, 1Н), 7,48 (d, J=6,8 Гц, 1H), 6,98 (d, J=5,4 Гц, 1H), 6,81 (t, J=5,1 Гц, 1H), 4,07 (s, 2H), 3,65 (s, 2H), 3,08 (s, 3H), 2,94 (s, 3H), 2,20 (s, 6H).
ПРИМЕР 53
Синтез Соединения 141
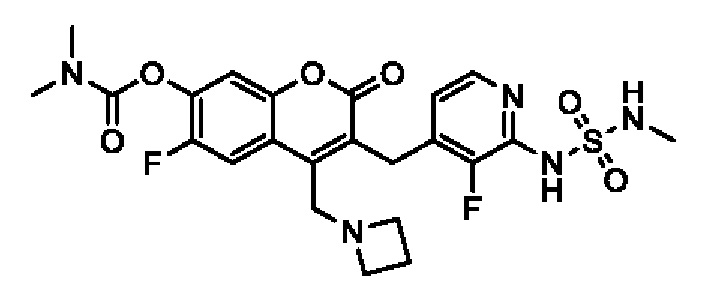
[0616] Соединение 141 получали в 1 стадию:
[0617] Стадия 1: Начиная с 4-(бромметил)-6-фтор-3-((3-фтор-2-((N-метилсульфамоил)амино)пиридин-4-ил)метил)-2-оксо-2Н-хромен-7-ил диметилкарбамата (50 мг, 0,05 ммоль, чистота: 56%) и азетидина, следуя процедуре общего синтеза Соединения Е.2, реакцию проводили в 0,05 М THF. Продукт очищали препаративной кислотой с последующей очисткой препаративным основанием с получением указанного в заголовке соединения (4,6 мг, 0,008 ммоль, выход: 16%) после лиофилизации в виде белого твердого вещества.
[0618] Выход: Соединение 141 выделяли в виде белого твердого вещества (16% за 1 стадию).
[0619] Анализ: LCMS (Способ Т): tR=1,16 мин; m/z рассч. для [М+Н]+=538,2, обнаруж.=538,2; 1H ЯМР (400 МГц, DMSO) δ 10,36 (s, 1H), 8,03 (d, J=11,6 Гц, 1H), 7,89 (s, 1Н), 7,47 (d, J=6,8 Гц, 1H), 6,95 (s, 1H), 6,75 (s, 1H), 4,11 (s, 2H), 3,82 (s, 2H), 3,18 (t, J=6,9 Гц, 4H), 3,09 (s, 3H), 2,95 (s, 3H), 1,90 (dd, J=7,9, 6,0 Гц, 2H).
ПРИМЕР 54
Синтез Соединения 142

[0620] Соединение 142 получали в 1 стадию:
[0621] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (33 мг, 0,061 ммоль) и 3-метил азетидина гидрохлорида, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли карбонат калия (1,3 экв.). Продукт очищали препаративной кислотой с получением указанного в заголовке соединения (24 мг, 0,045 ммоль, выход: 74%) после лиофилизации в виде белого твердого вещества.
[0622] Выход: Соединение 142 выделяли в виде белого твердого вещества (74% за 1 стадию).
[0623] Анализ: LCMS (Способ L): tR=2,44 мин; m/z рассч. для [М+Н]+=533,2, обнаруж.=533,2; 1Н ЯМР (400 МГц, DMSO-d6) 5 9,39 (s, 1H), 8,06 (d, J=8,9 Гц, 1H), 7,32-7,25 (m, 1H), 7,25-7,19 (m, 2Н), 7,00 (t, J=7,9 Гц, 1H), 6,81 (t, J=7,2 Гц, 1H), 4,07 (s, 2Н), 3,80 (s, 2Н), 3,06 (s, 3Н), 2,93 (s, 3Н), 2,74 (t, J=6,8 Гц, 2Н), 2,53 (d, J=5,0 Гц, 3Н), 2,42-2,34 (m, 1H), 1,04 (d, J=6,7 Гц, 3Н).
ПРИМЕР 55
Синтез Соединения 143
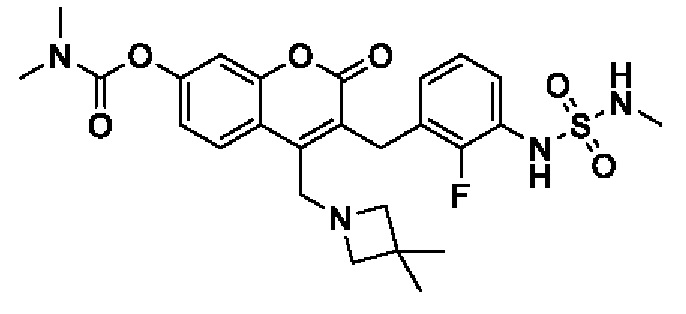
[0624] Соединение 143 получали в 1 стадию:
[0625] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (33 мг, 0,061 ммоль) и 3,3-диметилазетидина гидрохлорида, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли карбонат калия (1,3 экв.). Продукт очищали препаративной кислотой с получением указанного в заголовке соединения (26,2 мг, 0,048 ммоль, выход: 78%) после лиофилизации в виде белого твердого вещества.
[0626] Выход: Соединение 143 выделяли в виде белого твердого вещества (78% за 1 стадию).
[0627] Анализ: LCMS (Способ L): tR=2,52 мин; m/z рассч. для [М+Н]+=547,2, обнаруж.=547,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,10 (d, J=8,8 Гц, 1H), 7,31-7,25 (m, 1H), 7,22 (t, J=2,9 Гц, 2Н), 7,17 (dd, J=8,8, 2,4 Гц, 1H), 6,99 (t, J=7,9 Гц, 1Н), 6,81 (t, J=7,1 Гц, 1H), 4,06 (s, 2H), 3,83 (s, 2H), 3,06 (s, 3H), 2,92 (d, J=9,8 Гц, 7H), 2,53 (s, 3H), 1,09 (s, 6H).
ПРИМЕР 56
Синтез Соединения 144
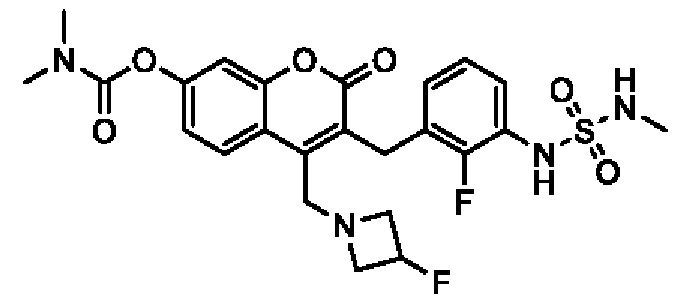
[0628] Соединение 144 получали в 1 стадию:
[0629] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (33 мг, 0,061 ммоль) и 3-фторазетидина гидрохлорида, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли карбонат калия (1,3 экв.). Продукт очищали препаративной кислотой с получением указанного в заголовке соединения (23,8 мг, 0,044 ммоль, выход: 72%) после лиофилизации в виде белого твердого вещества.
[0630] Выход: Соединение 144 выделяли в виде белого твердого вещества (72% за 1 стадию).
[0631] Анализ: LCMS (Способ L): tR=2,69 мин; m/z рассч. для [М+Н]+=537,2, обнаруж.=537,1; 1Н ЯМР (400 МГц, DMSO-d6) 5 9,39 (s, 1H), 8,06 (d, J=8,8 Гц, 1H), 7,31-7,25 (m, 1Н), 7,23 (d, J=2,4 Гц, 1H), 7,16 (dd, J=8,8, 2,4 Гц, 1H), 6,99 (t, J=7,9 Гц, 1H), 6,80 (s, 1H), 5,08 (dt, J=57,6, 5,1 Гц, 1H), 4,08 (s, 2H), 3,94 (s, 2H), 3,61-3,51 (m, 2H), 3,25 (dd, J=9,1, 4,5 Гц, 3Н), 3,22-3,14 (m, 2H), 3,06 (s, 3H), 2,93 (s, 3H), 2,53 (s, 1H).
ПРИМЕР 57
Синтез Соединения 145
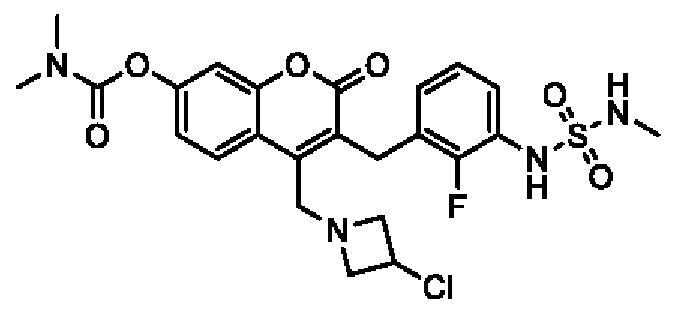
[0632] Соединение 145 получали в 1 стадию:
[0633] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (33 мг, 0,061 ммоль) и 3-хлоразетидина гидрохлорида, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли карбонат калия (1,3 экв.). Продукт очищали препаративной кислотой с получением указанного в заголовке соединения (10,9 мг, 0,019 ммоль, выход: 32%) после лиофилизации в виде белого твердого вещества.
[0634] Выход: Соединение 145 выделяли в виде белого твердого вещества (32% за 1 стадию).
[0635] Анализ: LCMS (Способ L): tR=3,08 мин; m/z рассч. для [М+Н]+=553,2/555,2, обнаруж.=553,1/555,1; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,04 (d, J=8,8 Гц, 1H), 7,27 (t, J=7,9 Гц, 1H), 7,23 (d, J=2,3 Гц, 1H), 7,17 (dd, J=8,7, 2,4 Гц, 1H), 6,96 (s, 1H), 6,75 (s, 1H), 4,51 (t, J=5,9 Гц, 1H), 4,07 (s, 2H), 3,94 (s, 2H), 3,72 (dd, J=8,3, 6,3 Гц, 2H), 3,29-3,23 (m, 7H), 3,06 (s, 3Н), 2,93 (s, 3Н).
ПРИМЕР 58
Синтез Соединения 146
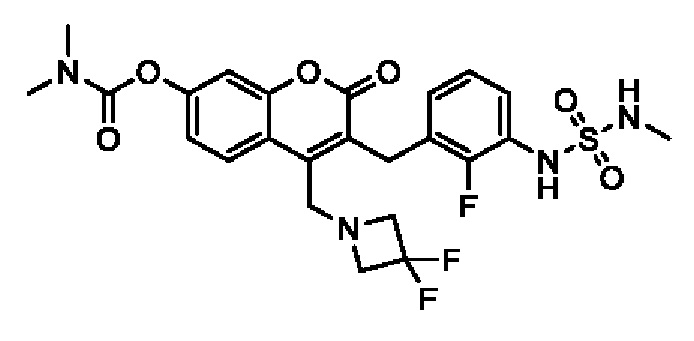
[0636] Соединение 146 получали в 1 стадию:
[0637] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (26 мг, 0,048 ммоль) и 3,3-дифторазетидина гидрохлорида, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли карбонат калия (1,4 экв.). Продукт очищали градиентом SFC 2-PIC с получением указанного в заголовке соединения (7 мг, 0,013 ммоль, выход: 26%) после лиофилизации в виде белого твердого вещества.
[0638] Выход: Соединение 146 выделяли в виде белого твердого вещества (26% за 1 стадию).
[0639] Анализ: LCMS (Способ L): tR=3,67 мин; m/z рассч. для [М+Н]+=555,2, обнаруж.=555,1; 1Н ЯМР (400 МГц, DMSO-d6) δ 9,30 (s, 1H), 8,10 (d, J=8,9 Гц, 1H), 7,28 (t, J=7,8 Гц, 1H), 7,23 (d, J=2,4 Гц, 1H), 7,18 (dd, J=8,8, 2,4 Гц, 1H), 6,97 (t, J=8,0 Гц, 1H), 6,76 (s, 1H), 4,08 (d, J=12,0 Гц, 4H), 3,65 (t, J=12,1 Гц, 4H), 3,07 (s, 3H), 2,93 (s, 3H), 2,54 (s, 3H), 1,25 (d, J=8,9 Гц, 1H).
ПРИМЕР 59
Синтез Соединения 147
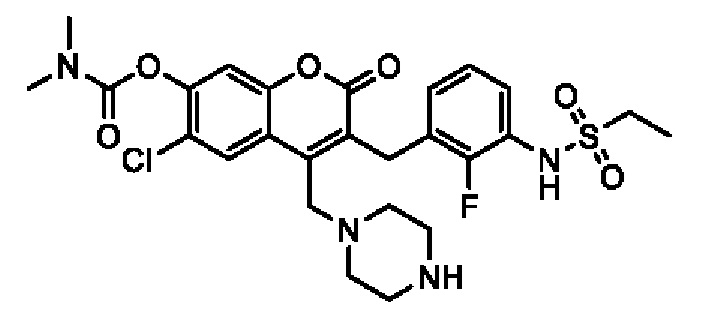
[0640] Соединение 147 получали в 3 стадии:
[0641] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-хлор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,320 г, 0,585 ммоль) и этансульфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. Во время обработки реакционную смесь объединяли с другой партией с получением сульфамоила (350 мг, 0,704 ммоль, выход: 92%) в виде белого твердого вещества.
[0642] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали колоночной хроматографией методом «флэш» (гептан/EtOAc=1:0→0:1) с последующим очищением препаративной кислотой с получением соответствующего брома (65 мг, 0,113 ммоль, выход: 19%) в виде твердого вещества бежевого цвета.
[0643] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 0,2 мг, 0,16 ммоль соединения брома с применением пиперазина и Et3N (2,0 экв.). Неочищенный продукт очищали препаративным основанием, а затем препаративной кислотой с получением указанного в заголовке соединения (21 мг, 0,036 ммоль, выход: 22%) в виде белого твердого вещества после лиофилизации.
[0644] Выход: Соединение 147 выделяли в виде белого твердого вещества (4% за 3 стадии).
[0645] Анализ: LCMS (Способ Т): tR=1,47 мин; m/z рассч. для [М+Н]+=581,2/583,2, обнаруж.=581,2/583,2; 1H ЯМР (400 МГц, DMSO) δ 8,25 (d, J=3,1 Гц, 2Н), 7,49 (s, 1Н), 7,25 (td, J=7,8, 1,7 Гц, 1Н), 7,02 (t, J=7,9 Гц, 1H), 6,95 - 6,88 (m, 1H), 4,04 (s, 2Н), 3,74 (s, 2Н), 3,13 - 3,07 (m, 6Н), 2,95 (s, 3H), 2,71 (t, J=4,9 Гц, 4Н), 2,46 (s, 4Н), 1,26 (t, J=7,3 Гц, 3H).
ПРИМЕР 60
Синтез Соединения 148

[0646] Соединение 148 получали в 3 стадии:
[0647] Стадия 1: К раствору 3-((2-хлор-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,5 г, 1,279 ммоль, 1,0 экв.) и этансульфонамида (1,41 г, 12,92 ммоль, 10,1 экв.) в 1,4-диоксане (0,1 М) в инертной атмосфере добавляли Xantphos (0,148 г, 0,256 ммоль, 0,2 экв.), карбонат цезия (0,625 г, 1,919 ммоль, 1,5 экв.) и PdOAc2 (0,049 г, 0,218 ммоль, 0,17 экв.). Образовавшуюся реакционную смесь перемешивали в течение 24 часа при 100°С. Реакционную смесь фильтровали через целит и промывали ШО и СНгСЬ. Слои фильтрата разделяли и органический слой промывали солевым раствором. Сушили над Na2SO4, фильтровали, и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2 /МеОН=1:0 → 9:1). Все еще неочищенный продукт очищали препаративным основанием с получением 3-((2-(этилсульфонамидо)-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (32 мг, 0,068 ммоль, выход: 5,3%) в виде не совсем белого твердого вещества.
[0648] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. Реакцию гасили водой с 1N H2SO4, и большую часть THF удаляли при пониженном давлении. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением соответствующего брома (42 мг, 0,046 ммоль, выход: 64%, чистота: 59%) в виде липкого желтого твердого вещества.
[0649] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 27 мг, 0,029 ммоль брома и 2М диметиламина в МеОН. Неочищенный продукт очищали с помощью градиента SFC 2-PIC с последующим очищением препаративным основанием с получением указанного в заголовке соединения (3,5 мг, 0,007 ммоль, выход: 24%) в виде белого твердого вещества.
[0650] Выход: Соединение 148 выделяли в виде белого твердого вещества (1% за 3 стадии).
[0651] Анализ: LCMS (Способ R): tR=0,83 мин; m/z рассч. для [М+Н]+=507,2, обнаруж.=507,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,37 (s, 2Н), 8,06 (d, J=8,9 Гц, 1H), 7,59 (s, 1H), 7,22 (d, J=2,4 Гц, 1H), 7,14 (dd, J=8,8, 2,4 Гц, 1H), 6,23 (s, 1H), 3,96 (s, 2H), 3,63 (s, 2H), 3,07 (s, 4H), 2,93 (s, 3H), 2,20 (s, 6H), 1,10 (t, J=7,4 Гц, 3H).
ПРИМЕР 61
Синтез Соединения 149
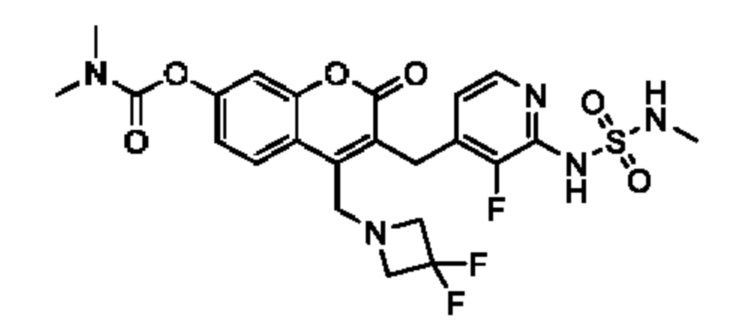
[0652] Соединение 149 получали в 1 стадию:
[0653] Стадия 1: Начиная с 4-(бромметыл)-3-((3-фтор-2-((N-метилсульфамоил)амино)пиридии-4-ил)метил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (30 мг, 0,055 ммоль) и 3,3-дифторазетидина гидрохлорида, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в CH2Cl2 и добавляли Et3N. После перемешивания в течение 24 часов добавляли NaI (2,00 экв.), гидрохлорид 3,3-дифторазетидина (1,00 экв.) и Et3N (1,00 экв.) и перемешивали в течение 1 часа при комнатной температуре. Добавляли К2СО3 (1,00 экв.) и гидрохлорид 3,3-дифторазетидина (1,00 экв.) и перемешивали в течение 24 часов при комнатной температуре. Продукт очищали градиентом SFC 2-PIC с получением указанного в заголовке соединения (3,4 мг, 0,006 ммоль, выход: 11%) после сушки вымораживанием в виде белого твердого вещества.
[0654] Выход: Соединение 149 выделяли в виде белого твердого вещества (11% за 1 стадию).
[0655] Анализ: LCMS (Способ R): tR=1,52 мин; m/z рассч. для [М+Н]+=556,2, обнаруж.=556,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,45 (s, 2Н), 8,08 (d, J=8,8 Гц, 1H), 7,56 (d, J=5,3 Гц, 1H), 7,23 (d, J=2,4 Гц, 1H), 7,17 (dd, J=8,8, 2,4 Гц, 1H), 6,14 (s, 1H), 4,03 (d, J=16,4 Гц, 4H), 3,66 (t, J=12,1 Гц, 4H), 3,07 (s, 3H), 2,93 (s, 3H), 2,31 (s, 3H), 1,24 (s, 1H).
ПРИМЕР 62
Синтез Соединения 150

[0656] Соединение 150 получали в 3 стадии:
[0657] Стадия 1: К раствору 3-((2-хлор-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,5 г, 1,279 ммоль, 1,0 экв.) и этансульфонамида (1,41 г, 12,92 ммоль, 10,1 экв.) в 1,4-диоксане (0,1 М) в инертной атмосфере добавляли Xantphos (0,148 г, 0,256 ммоль, 0,2 экв.), карбонат цезия (0,625 г, 1,919 ммоль, 1,5 экв.) и PdOAc2 (0,049 г, 0,218 ммоль, 0,17 экв.). Образовавшуюся реакционную смесь перемешивали в течение 24 часа при 100°С. Реакционную смесь фильтровали через целит и промывали H2O и CH2Cl2. Слои фильтрата разделяли и органический слой промывали солевым раствором. Сушили над Na2SO4, фильтровали, и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2 /МеОН=1:0 → 9:1). Все еще неочищенный продукт очищали препаративным основанием с получением 3-((2-(этилсульфонамидо)-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (32 мг, 0,068 ммоль, выход: 5,3%) в виде не совсем белого твердого вещества.
[0658] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. Реакцию гасили водой с 1N H2SO4, и большую часть THF удаляли при пониженном давлении. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением соответствующего брома (42 мг, 0,046 ммоль, выход: 64%, чистота: 59%) в виде липкого желтого твердого вещества.
[0659] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 33 мг, 0,040 ммоль брома и пиперазина в THF. Неочищенный продукт очищали градиентом SFC ВЕН, а затем препаративной кислотой с получением указанного в заголовке соединения (5,75 мг, 0,010 ммоль, выход: 25%) в виде белого твердого вещества.
[0660] Выход: Соединение 150 выделяли в виде белого твердого вещества (1% за 3 стадии).
[0661] Анализ: LCMS (Способ R): tR=0,91 мин; m/z рассч. для [М+Н]+=560,2, обнаруж.=560,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,33 (s, 2Н), 8,08 (d, J=8,9 Гц, 1H), 7,66 (d, J=5,3 Гц, 1H), 7,24 (d, J=2,3 Гц, 1H), 7,16 (dd, J=8,8, 2,4 Гц, 1H), 6,33 (s, 1H), 3,97 (s, 2H), 3,71 (s, 2H), 3,07 (s, 3H), 2,93 (s, 3H), 2,73 - 2,63 (m, 4H), 0,88 (s, 2H), 0,75 (d, J=8,4 Гц, 2H).
ПРИМЕР 63
Синтез Соединения 151

[0662] Соединение 151 получали в 1 стадию:
[0663] Стадия 1: Начиная с 4-(хлорметил)-3-((3-фтор-2-((N-метилсульфамоил)амино)пиридин-4-ил)метил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (50 мг, 0,064 ммоль, чистота: 70%) и пиперазина, следуя процедуре общего синтеза Соединения Е.2, за исключением того, что применяли THF. Продукт очищали градиентом SFC ВЕН, а затем препаративной кислотой с получением указанного в заголовке соединения (4 мг, 0,007 ммоль, выход: 10%) в виде не совсем белого твердого вещества после лиофилизации.
[0664] Выход: Соединение 151 выделяли в виде не совсем белого твердого вещества (10% за 1 стадию).
[0665] Анализ: LCMS (Способ R): tR=1,01 мин; m/z рассч. для [М+Н]+=549,2, обнаруж.=549,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,38 (s, 2Н), 8,08 (d, J=8,9 Гц, 1H), 7,66 (d, J=5,2 Гц, 1H), 7,24 (d, J=2,3 Гц, 1H), 7,16 (dd, J=8,9, 2,3 Гц, 1H), 6,34 (s, 1H), 3,98 (s, 2H), 3,69 (s, 2H), 3,07 (s, 3H), 2,93 (s, 3H), 2,37 (s, 3H).
ПРИМЕР 64
Синтез Соединения 152
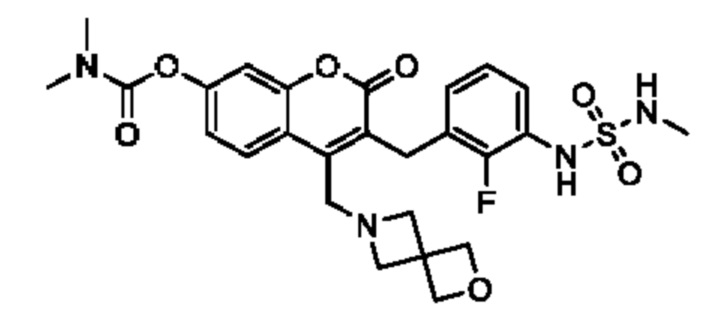
[0666] Соединение 152 получали в 1 стадию:
[0667] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (18 мг, 0,033 ммоль) и 2-окса-6-азаспиро[3.3]гептана, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в CH2Cl2 и добавляли Et3N (1,8 экв.). Продукт очищали препаративной кислотой с получением указанного в заголовке соединения (13,2 мг, 0,023 ммоль, выход: 68%) после лиофилизации в виде белого твердого вещества.
[0668] Выход: Соединение 162 выделяли в виде белого твердого вещества (68% за 1 стадию).
[0669] Анализ: LCMS (Способ Т): tR=1,37 мин; m/z рассч. для [М+Н]+=561,2, обнаруж.=561,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,02 (d, J=8,8 Гц, 1H), 7,36 - 7,24 (m, 1H), 7,24 - 7,12 (m, 3H), 6,99 (t, J=7,9 Гц, 1Н), 6,79 (t, J=7,1 Гц, 1H), 4,52 (s, 4H), 4,06 (s, 2H), 3,80 (s, 2H), 3,06 (s, 3H), 2,93 (s, 3H), 2,54 (s, 2H), 2,53 (s, 2H).
ПРИМЕР 65
Синтез Соединения 153
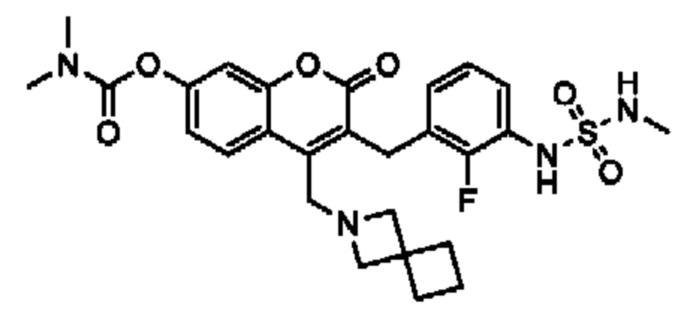
[0670] Соединение 153 получали в 1 стадию:
[0671] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (40 мг, 0,074 ммоль) и 2-азаспиро[3.3]гептана гидрохлорида, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли карбонат калия (1,3 экв.). Продукт очищали препаративным основанием, а затем препаративной кислотой с получением указанного в заголовке соединения (15,8 мг, 0,028 ммоль, выход: 38%) после лиофилизации в виде белого твердого вещества.
[0672] Выход: Соединение 153 выделяли в виде белого твердого вещества (38% за 1 стадию).
[0673] Анализ: LCMS (Способ R): tR=0,96 мин; m/z рассч. для [М+Н]+=559,2, обнаруж.=559,2; 1Н ЯМР (400 МГц, DMSO) δ 9,38 (s, 1H), 8,04 (d, J=8,9 Гц, 1H), 7,31 - 7,20 (m, 3H), 7,16 (dd, J=8,8, 2,4 Гц, 1Н), 6,99 (t, J=7,8 Гц, 1Н), 6,84 - 6,76 (m, 1H), 4,05 (s, 2Н), 3,78 (s, 2Н), 3,14 (s, 4Н), 3,06 (s, 3H), 2,93 (s, 3H), 2,53 (d, J=4,8 Гц, 3H), 1,96 (t, J=7,6 Гц, 4Н), 1,74 - 1,63 (m, 2Н).
ПРИМЕР 66
Синтез Соединения 154
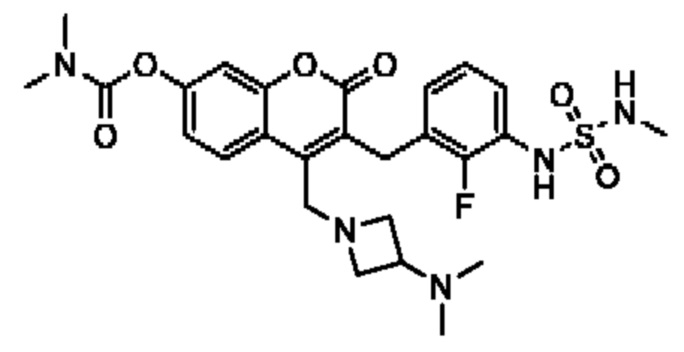
[0674] Соединение 154 получали в 1 стадию:
[0675] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (40 мг, 0,074 ммоль) и N,N-диметилазетидин-3-амина дигидрохлорида, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли карбонат калия (1,3 экв.). Продукт очищали препаративным основанием, а затем препаративной кислотой с получением указанного в заголовке соединения (19,5 мг, 0,035 ммоль, выход: 47%) после лиофилизации в виде белого твердого вещества.
[0676] Выход: Соединение 154 выделяли в виде белого твердого вещества (47% за 1 стадию).
[0677] Анализ: LCMS (Способ R): tR=0,92 мин; m/z рассч. для [М+Н]+=562,2, обнаруж.=562,2; 1Н ЯМР (400 МГц, DMSO) δ 9,38 (s, 1Н), 8,30 (s, 1H), 8,05 (d, J=8,9 Гц, 1H), 7,35 - 7,25 (m, 2H), 7,23 (d, J=2,3 Гц, 1H), 7,16 (dd, J=8,8, 2,4 Гц, 1H), 7,00 (t, J=7,9 Гц, 1H), 6,86 - 6,77 (m, 1H), 4,06 (s, 2H), 3,81 (s, 2H), 3,31 (d, J=6,4 Гц, 2H), 3,07 (s, 3H), 2,93 (s, 3H), 2,75 (d, J=6,6 Гц, 2H), 2,66 (p, J=6,3 Гц, 1H), 2,55 (d, J=4,7 Гц, 3H), 1,92 (s, 6H).
ПРИМЕР 67
Синтез Соединения 155

[0678] Соединение 155 получали в 3 стадии:
[0679] Стадия 1: К раствору 3-((2-хлор-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,5 г, 1,279 ммоль, 1,0 экв.) и этансульфонамида (1,41 г, 12,92 ммоль, 10,1 экв.) в 1,4-диоксане (0,1 М) в инертной атмосфере добавляли Xantphos (0,148 г, 0,256 ммоль, 0,2 экв.), карбонат цезия (0,625 г, 1,919 ммоль, 1,5 экв.) и PdOAc2 (0,049 г, 0,218 ммоль, 0,17 экв.). Образовавшуюся реакционную смесь перемешивали в течение 24 часа при 100°С. Реакционную смесь фильтровали через целит и промывали H2O и CH2Cl2. Слои фильтрата разделяли и органический слой промывали солевым раствором. Сушили над Na2SO4, фильтровали, и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2/МеОН=1:0 → 9:1). Все еще неочищенный продукт очищали препаративным основанием с получением 3-((2-(этилсульфонамидо)-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (32 мг, 0,068 ммоль, выход: 5,3%) в виде не совсем белого твердого вещества.
[0680] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. Реакцию гасили водой с 1N H2SO4, и большую часть THF удаляли при пониженном давлении. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением соответствующего брома (42 мг, 0,046 ммоль, выход: 64%, чистота: 59%) в виде липкого желтого твердого вещества.
[0681] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 33 мг, 0,040 ммоль брома и азетидина. Неочищенный продукт очищали препаративной кислотой, а затем обрабатывали градиентом SFC ВЕН с получением указанного в заголовке соединения (17,4 мг, 0,030 ммоль, выход: 73%, чистота: 90%) в виде белого твердого вещества.
[0682] Выход: Соединение 155 выделяли в виде белого твердого вещества (2,5% за 3 стадии).
[0683] Анализ: LCMS (Способ Т): tR=1,09 мин; m/z рассч. для [М+Н]+=531,2, обнаруж.=531,2; 1H ЯМР (400 МГц, Хлороформ-d) δ 8,03 - 7,95 (m, 1H), 7,90 (s, 1H), 7,14 - 7,09 (m, 2Н), 6,76 (t, J=5,3 Гц, 1H), 4,18 (s, 2Н), 3,73 (s, 2Н), 3,25 (t, J=6,9 Гц, 4Н), 3,19 (d, J=7,1 Гц, 1H), 3,13 (d, J=2,2 Гц, 3H), 3,03 (d, J=2,4 Гц, 3H), 2,04 (р, J=6,9 Гц, 2Н), 1,40 (dt, J=7,0, 3,4 Гц, 2Н), 1,12 - 1,05 (m, 2Н), 0,86 (d, J=18,2 Гц, 1Н).
ПРИМЕР 68
Синтез Соединения 156

[0684] Соединение 156 получали в 1 стадию:
[0685] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (50 мг, 0,092 ммоль) и 1,4-диазепан-2-она, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли Et3N (1,8 экв.). Продукт очищали препаративной кислотой с получением указанного в заголовке соединения (29,3 мг, 0,051 ммоль, выход: 55%) после лиофилизации в виде белого твердого вещества.
[0686] Выход: Соединение 156 выделяли в виде белого твердого вещества (55% за 1 стадии).
[0687] Анализ: LCMS (Способ R): tR=1,33 мин; m/z рассч. для [М-Н]+=574,2, обнаруж.=574,2; 1H ЯМР (400 МГц, Хлороформ-d) δ 7,92 (d, J=8,9 Гц, 1H), 7,33 (td, J=7,9, 1,7 Гц, 1H), 7,14 (d, J=2,3 Гц, 1H), 7,09 (dd, J=8,9, 2,4 Гц, 1H), 7,05 - 6,95 (m. 1H), 6,84 (t, J=7,3 Гц, 1H), 6,59 (s, 1H), 6,14 (s, 1H), 5,38 (q, J=5,2 Гц, 1Н), 4,14 (s, 2Н), 3,91 (s, 2Н), 3,47 (s, 2Н), 3,20 (q, J=5,2 Гц, 2Н), 3,13 (s, 3H), 3,04 (s, 3H), 2,78 (dd, J=15,3, 5,5 Гц, 5Н), 0,83 (s, 1H).
ПРИМЕР 69
Синтез Соединения 157
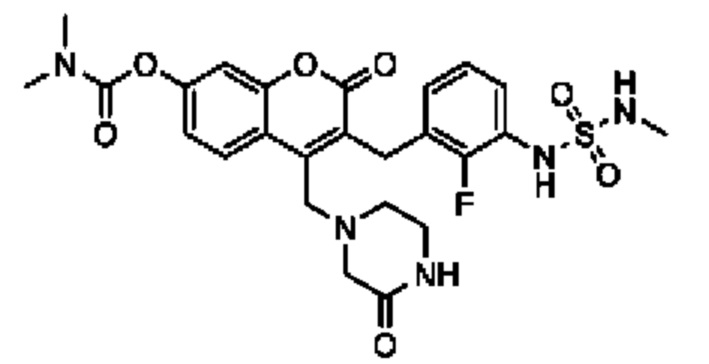
[0688] Соединение 157 получали в 1 стадию:
[0689] Стадия 1: Начиная с 4-(6ромметш)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромеи-7-илдиметилкарбамата (50 мг, 0,092 ммоль) и пиперазин-2-она, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли Et3N (1,8 экв.). Продукт очищали препаративной кислотой с получением указанного в заголовке соединения (27,3 мг, 0,049 ммоль, выход: 53%) после лиофилизации в виде белого твердого вещества.
[0690] Выход: Соединение 157 выделяли в виде белого твердого вещества (53% за 1 стадию).
[0691] Анализ: LCMS (Способ R): tR=1,27 мин; m/z рассч. для [М+Н]+=562,2, обнаруж.=562,2; 1H ЯМР (400 МГц, Хлороформ-d) δ 7,93 (d, J=8,9 Гц, 1H), 7,40 (td, J=7,9, 1,7 Гц, 1H), 7,14 (d, J=2,3 Гц, 1Н), 7,09 (dd, J=8,9, 2,4 Гц, 1Н), 7,05 - 6,98 (m, 1Н), 6,97 - 6,90 (m, 1H), 5,92 (s, 1H), 4,92 (d, J=5,3 Гц, 1H), 4,14 (s, 2Н), 3,78 (s, 2Н), 3,21 - 3,14 (m, 2Н), 3,13 (s, 3H), 3,09 (s, 2Н), 3,04 (s, 3H), 2,75 (d, J=5,2 Гц, 3H), 2,60 (t, J=5,4 Гц, 2Н).
ПРИМЕР 70
Синтез Соединения 158

[0692] Соединение 158 получали в 1 стадию:
[0693] Стадия 1: Начиная с 4-(6ромметил)-3-(2-фтор-3-((N-метилсульфамоил)амиио)6ензил)-2-оксо-2Н-хромеи-7-илдиметилкарбамата (19 мг, 0,035 ммоль) и 1,4-диазепан-5-она, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли K2СО3 (1,8 экв.). Продукт очищали препаративной кислотой, а затем второй препаративной кислотой с получением указанного в заголовке соединения (5,1 мг, 0,009 ммоль, выход: 25%) после лиофилизации в виде белого твердого вещества.
[0694] Выход: Соединение 158 выделяли в виде белого твердого вещества (25% за 1 стадию).
[0695] Анализ: LCMS (Способ Т): tR=1.30 мин; m/z рассч. для [М+Н]+=576,2, обнаруж.=576,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 9,36 (s, 1H), 8,50 (s, 1Н), 8,11 (d, J=8,9 Гц, 1H), 7,53 (t, J=5,6 Гц, 1H), 7,29 - 7,21 (m, 2H), 7,15 (dd, J=8,8, 2,4 Гц, 1H), 6,95 (s, 1H), 6,74 (s, 1H), 4,02 (s, 2H), 3,81 (s, 2H), 3,06 (s, 3H), 2,99 (s, 2H), 2,93 (s, 3H), 2,63 - 2,51 (m, 7H), 2,29 (d, J=7,5 Гц, 2H).
ПРИМЕР 71
Синтез Соединения 159
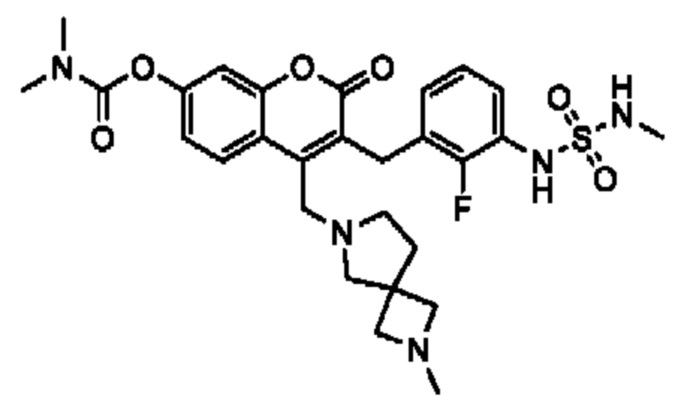
[0696] Соединение 159 получали в 1 стадию:
[0697] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (50 мг, 0,092 ммоль) и 2-метил-2,6-диазаспиро[3.4]октан дигидрохлорида, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли K2СО3 (1,8 экв.). После полного превращения реакционную смесь разбавляли МеОН и CH2Cl2. Твердые вещества отфильтровывали и фильтрат концентрировали при пониженном давлении. Добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2sO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали методом «препаративного основания» с получением указанного в заголовке соединения (4,7 мг, 0,008 ммоль, выход: 8%) после лиофилизации в виде белого твердого вещества.
[0698] Выход: Соединение 159 выделяли в виде белого твердого вещества (8% за 1 стадию).
[0699] Анализ: LCMS (Способ R): tR=0,84 мин; m/z рассч. для [М+Н]+=588,2, обнаруж.=588,4; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,09 (d, J=8,9 Гц, 1H), 7,31 - 7,19 (m, 2Н), 7,14 (dd, J=8,8, 2,4 Гц, 1H), 6,97 (t, J=8,0 Гц, 1H), 6,79 (s, 1H), 4,04 (s, 2Н), 3,80 (s, 2Н), 3,06 (s, 3H), 2,99 (d, J=6,8 Гц, 2Н), 2,93 (s, 3H), 2,88 (d, J=6,8 Гц, 2Н), 2,61 (s, 2Н), 2,47 (d, J=7,1 Гц, 4Н), 2,11 (s, 3H), 1,79 (t, J=6,9 Гц, 2Н).
ПРИМЕР 72
Синтез Соединения 160
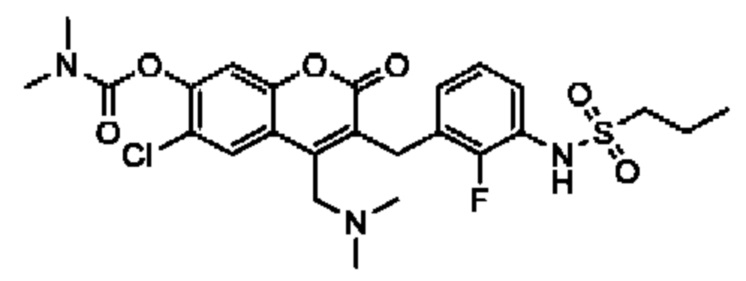
[0700] Соединение 160 получали в 3 стадии:
[0701] Стадия 1: Суспензию 3-(3-амино-2-фторбензил)-6-хлор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,500 г, 0,914 ммоль, 1,0 экв.) и пропана-1-сульфонилхлорид (257 мкл, 2,285 ммоль, 2,50 экв.) в пиридине (2,8 мл, 34,7 ммоль, 38 экв.) перемешивали в течение 18 часов при комнатной температуре. Добавляли 1М HCl и продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением 6-хлор-3-(2-фтор-3-(пропилсульфонамидо)бензил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (476 мг, 0,932 ммоль, выход: 102%) в виде светло-желтой пены.
[0702] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. Реакционную смесь гасили 1М HCl. После экстракции неочищенный продукт очищали колоночной хроматографией методом «флэш» (гептан/EtOAc=1:0 → 1:1) с получением смеси хлорида и брома (110 мг, 0,186 ммоль, выход: 20%) в виде светло-желтого твердого вещества.
[0703] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 50 мг, 0,092 ммоль соединения Е.4 и применяя диметиламип 2М в МеОН. Реакционную смесь перемешивали в течение 2 дней. Неочищенный продукт очищали методом «препаративной кислоты» с получением указанного в заголовке соединения (12 мг, 0,022 ммоль, выход: 23%) в виде белого твердого вещества после лиофилизации.
[0704] Выход: Соединение 160 выделяли в виде белого твердого вещества (5% за 3 стадии).
[0705] Анализ: LCMS (Способ R): tR=1,09 мин; m/z рассч. для [М+Н]+=554,1/556,1, обнаруж.=554,2/556,2; 1Н ЯМР (400 МГц, DMSO) δ 9,67 (s, 1H), 8,21 (s, 1H), 7,48 (s, 1Н), 7,29 - 7,20 (m, 1H), 7,01 (t, J=7,8 Гц, 1Н), 6,91 (t, J=6,8 Гц, 1H), 4,05 (s, 2Н), 3,65 (s, 2Н), 3,10 (s, 3H), 3,08 - 3,01 (m, 2Н), 2,95 (s, 3H), 2,18 (s, 6Н), 1,81 - 1,67 (m, 2Н), 0,96 (t, J=7,4 Гц, 3H).
ПРИМЕР 73
Синтез Соединения 161
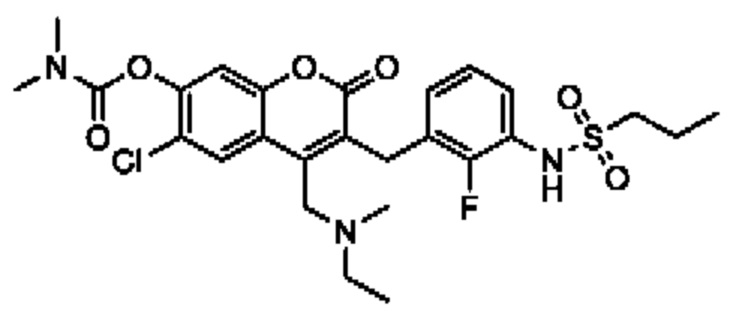
[0706] Соединение 161 получали в 3 стадии:
[0707] Стадия 1: Суспензию 3-(3-амино-2-фторбепзил)-6-хлор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,500 г, 0,914 ммоль, 1,0 экв.) и пропана-1 -сульфонилхлорид (257 мкл, 2,285 ммоль, 2,50 экв.) в пиридине (2,8 мл, 34,7 ммоль, 38 экв.) перемешивали в течение 18 часов при комнатной температуре. Добавляли 1М HCl и экстрагировали продукт с применением EtOAc.Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением 6-хлор-3-(2-фтор-3-(пропилсульфонамидо)бензил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (476 мг, 0,932 ммоль, выход: 102%) в виде светло-желтой пены.
[0708] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. Реакционную смесь гасили 1М HCl. После экстракции неочищенный продукт очищали колоночной хроматографией методом «флэш» (гептан/EtOAc=1:0 → 1:1) с получением смеси хлорида и брома (110 мг, 0,186 ммоль, выход: 20%) в виде светло-желтого твердого вещества.
[0709] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 50 мг, 0,092 ммоль соединения Е.4 и применяя п-этиламин.. Реакционную смесь перемешивали в течение 2 дней. Неочищенный продукт очищали методом «препаративной кислоты» с получением указанного в заголовке соединения (2 мг, 0,003 ммоль, выход: 4%) в виде белого твердого вещества после лиофилизации.
[0710] Выход: Соединение 161 выделяли в виде белого твердого вещества (1% за 3 стадии).
[0711] Анализ: LCMS (Способ R): tR=1,13 мин; m/z рассч. для [М+Н]+=568,1/570,1, обнаруж.=568,2/570,2; 1H ЯМР (400 МГц, DMSO) δ 9,66 (s, 1Н), 8,26 (s, 1H), 7,48 (s, 1H), 7,23 (t, J=7,7 Гц, 1H), 6,99 (t, J=7,8 Гц, 1H), 6,86 (s, 1H), 4,04 (s, 2Н), 3,71 (s, 2Н), 3,10 (s, 3H), 3,02 (t, J=7,6 Гц, 2Н), 2,95 (s, 3H), 2,44 (t, J=7,1 Гц, 2Н), 2,09 (s, 3H), 1,72 (h, J=7,5 Гц, 2Н), 1,01 (t, J=7,1 Гц, 3H), 0,95 (t, J=7,5 Гц, 3H).
ПРИМЕР 74
Синтез Соединения 162

[0712] Соединение 162 получали в 1 стадию:
[0713] Стадия 1: начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (50 мг, 0,092 ммоль) и N-этилметиламина в CH2Cl2 и с DIPEA (1,0 экв.), следуя процедуре общего синтеза соединения Е.2. После полного превращения реакционную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=4:1 → 3:7) с получением указанного в заголовке соединения (30 мг, 0,058 ммоль, выход: 62%) в виде белого твердого вещества.
[0714] Выход: Соединение 162 выделяли в виде белого твердого вещества (62% за 1 стадию).
[0715] Анализ: LCMS (Способ Н): tR=2,34 мин; m/z рассч. для [N-Н]+=521,4, обнаруж.=521,4; 1Н ЯМР (400 МГц, DMSO) δ 9,38 (s, 1H), 8,11 (d, J=8,9 Гц, 1H), 7,28 (td, J=7,8, 1,6 Гц, 1H), 7,24 7,18 (m, 2Н), 7,15 (dd, J=8,8, 2,4 Гц, 1H), 6,99 (t, J=7,9 Гц, 1H), 6,85 - 6,79 (m, 1H), 4,04 (s, 2H), 3,69 (s, 2H), 3,06 (s, 3H), 2,93 (s, 3H), 2,52 (d, J=4,8 Гц, 3H), 2,45 (q, J=7,1 Гц, 2H), 2,10 (s, 3H), 1,00 (t, J=7,1 Гц, 3H).
ПРИМЕР 75
Синтез Соединения 163
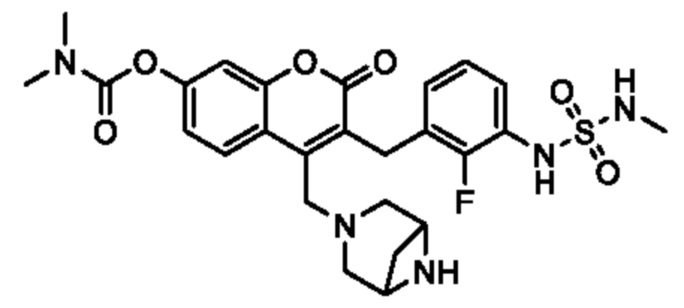
[0716] Соединение 163 получали в 2 стадии:
[0717] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амиио)6ензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (100 мг, 0,184 ммоль) и трет-бутил 3,6-диазабицикло[3.1.1]гептан-6-карбоксилата, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в CH2Cl2 и добавляли Et3N (1,8 экв.). После полного превращения добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением Вос-амина (100,8 мг, 0,153 ммоль, 83%) в виде не совсем белого твердого вещества.
[0718] Стадия 2: Вос-амин растворяли в CH2Cl2 (0,05 М) и добавляли TFA (374 мкл, 4,85 ммоль, 40 экв.). Образовавшуюся реакционную смесь перемешивали в течение 2 часов при комнатной температуре. К реакционной смеси добавляли воду и продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали методом «препаративной кислоты» с получением указанного в заголовке соединения (56 мг, 0,100 ммоль, выход: 83%) после лиофилизации в виде белого твердого вещества.
[0719] Выход: Соединение 163 выделяли в виде белого твердого вещества (69% за 2 стадии).
[0720] Анализ: LCMS (Способ R): tR=0,95 мин; m/z рассч. для [М+Н]+=560,2, обнаруж.=560,2; 1H ЯМР (400 МГц, DMSO) δ 8,35 (d, J=1,6 Гц, 1H), 8,08 (d, J=8,9 Гц, 1H), 7,33 - 7,18 (m, 3H), 7,18 - 7,12 (m, 1H), 7,00 (t, J=7,9 Гц, 1H), 6,82 (t, J=7,2 Гц, 1H), 4,09 (s, 2Н), 3,99 (s, 2Н), 3,79 (d, J=5,7 Гц, 2Н), 3,10 (d, J=10,8 Гц, 2Н), 3,06 (s, 3H), 2,93 (s, 3H), 2,90 (d, J=11,2 Гц, 2Н), 2,53 (s, 3H).
ПРИМЕР 76
Синтез Соединения 164

[0721] Соединение 164 получали в 2 стадии:
[0722] Стадия 1: Начиная с 4-(6ромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (50 мг, 0,092 ммоль) и трет-бутилазетидин-3-ил(метил)карбамата, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в CH2Cl2 и добавляли Et3N (1,8 экв.). После полного превращения добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 1:9) с получением Вос-защищенного амина 10 (44 мг, 0,068 ммоль, выход: 74%) в виде бесцветного масла.
[0723] Стадия 2: Вос-защищенный амин 10 растворяли в CH2Cl2 (0,05 М) и добавляли TFA (40 экв.). Образовавшуюся реакционную смесь перемешивали в течение 18 часов при комнатной температуре. К реакционной смеси добавляли воду и подщелачивали твердым Na2CO3. Продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали методом «препаративной кислоты» с получением указанного в заголовке соединения (16 мг, 0,029 ммоль, выход: 43%) после лиофилизации в виде белого твердого вещества.
[0724] Выход: Соединение 164 выделяли в виде белого твердого вещества (35% за 1 стадию).
[0725] Анализ: LCMS (Способ R): tR=1,98 мин; m/z рассч. для [М+Н]+=592,2, обнаруж.=592,2; 1H ЯМР (400 МГц, CDCl3) δ 8,35 (s, 1H), 7,99 (d, J=8,8 Гц, 1H), 7,35 -7,29 (m, 1H), 7,12 (d, J=2,3 Гц, 1H), 7,09 - 7,01 (m, 3H), 4,13 (s, 2Н), 3,79 (s, 2Н), 3,44 -3,31 (m, 3H), 3,13 (s, 3H), 3,03 (s, 3H), 2,86 (s, 3H), 2,60 (t, J=6,7 Гц, 2Н).
ПРИМЕР 77
Синтез Соединения 165

[0726] Соединение 165 получали в 2 стадии:
[0727] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (50 мг, 0,069 ммоль, выход: 75%) и трет-бутилазетидип-3-илкарбамата гидрохлорида, следуя процедуре общего синтеза Соединения Е.2, с добавлением К2СО3 (1,80 экв.). Образовавшуюся реакционную смесь перемешивали в течение 3 дней при комнатной температуре. Реакционную смесь фильтровали и концентрировали при пониженном давлении с получением Вос-защищенного амина в виде желтого масла. Последний применялся как таковой в последующей реакции.
[0728] Стадия 2: Желтое масло со стадии 1 (неизвестная чистота и масса) растворяли в CH2Cl2 и добавляли TFA (0,209 мл, 2,71 ммоль) и перемешивали в течение 18 часов при комнатной температуре. Реакционную смесь очищали препаративным основанием с получением указанного в заголовке соединения (13,7 мг, 0,025 ммоль, выход: 37%) после сушки вымораживанием в виде белого твердого вещества.
[0729] Выход: Соединение 165 выделяли в виде белого твердого вещества (37% за 2 стадии).
[0730] Анализ: LCMS (Способ R): tR=0.87 мин; m/z рассч. для [М+Н]+=534,2, обнаруж.=534,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,04 (d, J=8,8 Гц, 1H), 7,26 (t, J=7,8 Гц, 1H), 7,21 (d, J=2,4 Гц, 1H), 7,16 (dd, J=8,8, 2,4 Гц, 1H), 6,92 (t, J=7,9 Гц, 1H), 6,66 (s, 1H), 4,06 (s, 2Н), 3,80 (s, 2Н), 3,46 (t, J=6,6 Гц, 3H), 3,29 - 3,25 (m, 4Н), 3,06 (s, 3H), 2,93 (s, 3H), 2,72 (t, J=6,9 Гц, 2Н), 2,51 (s, 3H).
ПРИМЕР 78
Синтез Соединения 166

[0731] Соединение 166 получали в 3 стадии:
[0732] Стадия 1: Суспензию 3-(3-амино-2-фторбензил)-6-хлор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,250 г, 0,457 ммоль, 1,0 экв.) и этансульфонилхлорида (59,9 мг, 0,548 ммоль, 1,20 экв.) в пиридине (1,4 мл, 17,37 ммоль, 38 экв.) перемешивали в течение 18 часов при комнатной температуре. Добавляли 1М HCl и экстрагировали продукт с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением 6-хлор-3-(3-(этилсульфонамидо)-2-фторбензил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (183 мг, 0,368 ммоль, выход: 81%) в виде светло-желтой пены.
[0733] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали колоночной хроматографией методом «флэш» (гептан/EtOAc=1:0 → 1:1) с получением соответствующего брома (213 мг, 0,370 ммоль, выход: 100%) в виде светло-желтого твердого вещества.
[0734] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5 с применением N-этилметиламина. Неочищенный продукт очищали методом «препаративной кислоты» с получением указанного в заголовке соединения (25 мг, 0,045 ммоль, выход: 12%) в виде белого твердого вещества после лиофилизации.
[0735] Выход: Соединение 166 выделяли в виде белого твердого вещества (10% за 3 стадии).
[0736] Анализ: LCMS (Способ R): tR=1,06 мин; m/z рассч. для [М+Н]+=554,1/556,1, обнаруж.=554,2/556,2; 1Н ЯМР (400 МГц, DMSO) δ 9,68 (s, 1H), 8,27 (s, 1H), 7,48 (s, 1Н), 7,25 (td, J=7,8, 1,8 Гц, 1H), 7,01 (t, J=7,9 Гц, 1Н), 6,96 - 6,85 (m, 1H), 4,05 (s, 2Н), 3,71 (s, 2Н), 3,09 (d, J=8,6 Гц, 5Н), 2,95 (s, 3H), 2,45 (q, J=7,0 Гц, 2Н), 2,09 (s, 3H), 1,26 (t, J=7,3 Гц, 3H), 1,01 (t, J=7,0 Гц, 3H).
ПРИМЕР 79
Синтез Соединения 167

[0737] Соединение 167 получали в 3 стадии:
[0738] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-хлор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,300 г, 0,548 ммоль, выход 74%) и пропан-1-сулъфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. Пиридин применяли в качестве растворителя в 38 экв. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Слои разделяли с помощью фазового сепаратора. Органический слой концентрировали при пониженном давлении и остаток очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (273 мг, 0,534 ммоль, выход: 97%) в виде белого твердого вещества.
[0739] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстрагирования неочищенный продукт очищали методом «препаративной кислоты» с получением соответствующего брома (115 мг, 0,195 ммоль, выход: 36%) в виде белого твердого вещества.
[0740] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 41 мг, 0,070 ммоль брома и трет-бутилпиперазин-1 -карбоксилата. Реакцию проводили в THF. После полного превращения добавляли HCl (4М в диоксане, 8,00 экв.) и образовавшуюся реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (34 мг, 0,057 ммоль, выход: 82%) в виде белого твердого вещества.
[0741] Выход: Соединение 167 выделяли в виде белого твердого вещества (29% за 3 стадии).
[0742] Анализ: LCMS (Способ Т): tR=1,57 мин; m/z рассч. для [М+Н]+=595,2/597,2, обнаруж.=595,2/597,2; 1H ЯМР (400 МГц, DMSO) δ 8,23 (d, J=5,2 Гц, 1H), 7,50 (s, 1H), 7,25 (td, J=7,8, 1,7 Гц, 1H), 7,02 (t, J=7,9 Гц, 1H), 6,93 (t, J=6,8 Гц, 1H), 4,04 (s, 2H), 3,78 (s, 2H), 3,10 (s, 3H), 3,10 - 3,04 (m, 3H), 2,95 (s, 3H), 2,80 (d, J=5,1 Гц, 4H), 2,58 - 2,53 (m, 4H), 1,80 - 1,68 (m, 2H), 0,97 (t, J=7,4 Гц, 3H).
ПРИМЕР 80
Синтез Соединения 168

[0743] Соединение 168 получали в 3 стадии:
[0744] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-хлор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,300 г, 0,548 ммоль, выход: 74%) и 2-метилпропан-1-сулъфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. Пиридин применяли в качестве растворителя в 38 экв. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Слои разделяли с помощью фазового сепаратора. Органический слой концентрировали при пониженном давлении и остаток очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 1:9). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (253 мг, 0,482 ммоль, выход: 88%) в виде твердого вещества желтого цвета.
[0745] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали препаративной кислотой с получением соответствующего брома (104 мг, 0,172 ммоль, выход: 36%) в виде белого твердого вещества.
[0746] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 50 мг, 0,083 ммоль брома и трет-бутилпиперазип-1-карбоксилата. Реакцию проводили в THF. После полного превращения добавляли HCl (4М в диоксане, 8,00 экв.) и образовавшуюся реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Неочищенный продукт очищали препаративным основанием с получением указанного в заголовке соединения (33 мг, 0,054 ммоль, выход: 65%) в виде белого твердого вещества.
[0747] Выход: Соединение 168 выделяли в виде белого твердого вещества (17% за 3 стадии).
[0748] Анализ: LCMS (Способ Т): tR=1,68 мин; m/z рассч. для [М+Н]+=609,2/611,2, обнаруж.=609,4/611,4; 1H ЯМР (400 МГц, DMSO) δ 8,24 (d, J=5,0 Гц, 2Н), 7,49 (s, 1H), 7,25 (td, J=7,9, 1,7 Гц, 1H), 7,02 (t, J=7,8 Гц, 1H), 6,93 (t, J=7,1 Гц, 1H), 4,04 (s, 2H), 3,75 (s, 2H), 3,10 (s, 4H), 2,98 (d, J=6,4 Гц, 2H), 2,95 (s, 3H), 2,77 - 2,66 (m, 4H), 2,54 (s, 1H), 2,48 - 2,44 (m, 3H), 2,17 (гепт, J=6,5 Гц, 1H), 1,01 (d, J=6,7 Гц, 6H).
ПРИМЕР 81
Синтез Соединения 169

[0749] Соединение 169 получали в 3 стадии:
[0750] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-хлор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,300 г, 0,741 ммоль) и 3,3,3-трифторпропан-1-сульфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. Пиридин применяли в качестве растворителя в 38 экв. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Слои разделяли с помощью фазового сепаратора. Органический слой концентрировали при пониженном давлении и остаток очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 1:9). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (315 мг, 0,558 ммоль, выход: 75%) в виде твердого вещества желтого цвета.
[0751] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 1:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением соответствующего брома (230 мг, 0,322 ммоль, выход: 58%, чистота: 90%) в виде белого твердого вещества.
[0752] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 50 мг, 0,078 ммоль брома и пиперазина. К реакционной смеси добавляли 3,00 экв. NEt3. После полного превращения неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (28 мг, 0,043 ммоль, выход: 55%) в виде белого твердого вещества.
[0753] Выход: Соединение 169 выделяли в виде белого твердого вещества (24% за 3 стадии).
[0754] Анализ: LCMS (Способ Т): tR=1,44 мин; m/z рассч. для [М+Н]+=649,2/651,2, обнаруж.=649,2/651,2; 1H ЯМР (400 МГц, DMSO) δ 8,23 (s, 1H), 7,48 (s, 1H), 7,23 - 7,14 (m, 1H), 6,89 (t, J=7,8 Гц, 1H), 6,66 (t, J=7,1 Гц, 1H), 4,00 (s, 2Н), 3,73 (s, 2Н), 3,16 - 3,08 (m, 5Н), 2,95 (s, 3H), 2,79 - 2,60 (m, 6Н), 2,50 - 2,45 (m, 4Н).
ПРИМЕР 82
Синтез Соединения 170
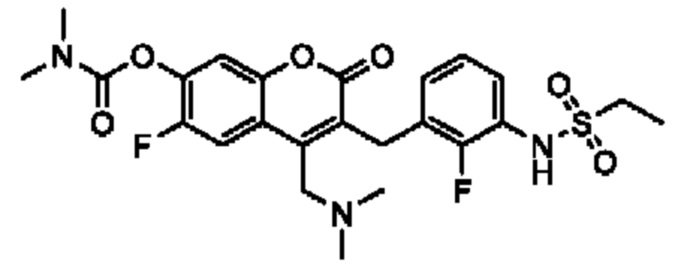
[0755] Соединение 170 получали в 3 стадии:
[0756] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-фтор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (1,00 г, 2,57 ммоль) и этансульфонилхлорида, следуя процедуре общего синтеза соединения Е.3. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (997 мг, 2,013 ммоль, выход: 78%) в виде белого твердого вещества.
[0757] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением соответствующего брома (237 мг, 0,339 ммоль, выход: 54%, чистота: 80%) в виде коричневого твердого вещества.
[0758] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 50 мг, 0,072 ммоль (чистота: 80%) и диметиламин 2М в МеОН. К реакционной смеси добавляли 3,00 экв. NEt3. После полного превращения неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (22 мг, 0,041 ммоль, выход: 58%) в виде не совсем белого твердого вещества.
[0759] Выход: Соединение 170 выделяли в виде белого твердого вещества (24% за 3 стадии).
[0760] Анализ: LCMS (Способ Т): tR=1.66 мин; m/z рассч. для [М+Н]+=524,2, обнаруж.=524,2; 1Н ЯМР (400 МГц, DMSO) δ 9,62 (s, 1Н), 8,00 (d, J=11,7 Гц, 1H), 7,46 (d, J=6,9 Гц, 1H), 7,23 (t, J=7,8 Гц, 1H), 7,03 - 6,91 (m, 1H), 6,88 - 6,72 (m, 1H), 4,04 (s, 2H), 3,63 (s, 2H), 3,08 (s, 3H), 3,06 - 2,99 (m, 2H), 2,94 (s, 3H), 2,18 (s, 6H), 1,24 (t, J=7,3 Гц, 3H).
ПРИМЕР 83
Синтез Соединения 171
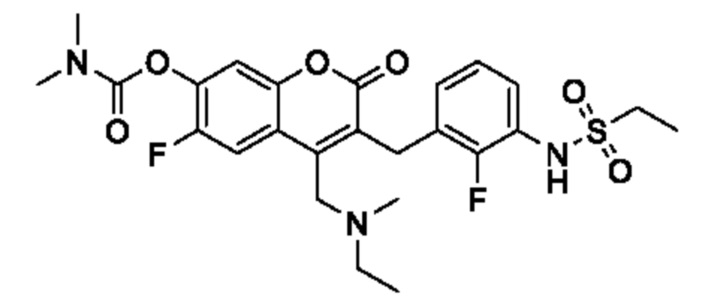
[0761] Соединение 170 получали в 3 стадии:
[0762] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-фтор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (1,00 г, 2,57 ммоль) и этансульфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (997 мг, 2,013 ммоль, выход: 78%) в виде белого твердого вещества.
[0763] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением соответствующего брома (237 мг, 0,339 ммоль, выход: 54%, чистота: 80%) в виде коричневого твердого вещества.
[0764] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 50 мг, 0,072 ммоль (чистота: 80%) брома и N-метилэтанамина. К реакционной смеси добавляли 3,00 экв. NEt3 После полного превращения неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (26 мг, 0,048 ммоль, выход: 67%) в виде не совсем белого твердого вещества.
[0765] Выход: Соединение 171 выделяли в виде белого твердого вещества (28% за 3 стадии).
[0766] Анализ: LCMS (Способ Т): tR=1,79 мин; m/z рассч. для [М+Н]+=538,2, обнаруж.=538,2; 1Н ЯМР (400 МГц, DMSO) δ 9,60 (s, 1Н), 8,04 (d, J=11,8 Гц, 1H), 7,47 (d, J=6,9 Гц, 1H), 7,24 (td, J=7,9, 1,7 Гц, 1H), 7,01 (t, J=7,9 Гц, 1H), 6,93 - 6,85 (m, 1H), 4,05 (s, 2Н), 3,69 (s, 2Н), 3,13 - 3,03 (m, 5Н), 2,94 (s, 3H), 2,46 - 2,39 (m, 2Н), 2,09 (s, 3H), 1,25 (t, J=7,3 Гц, 3H), 0,99 (t, J=7,1 Гц, 3H).
ПРИМЕР 84
Синтез Соединения 172
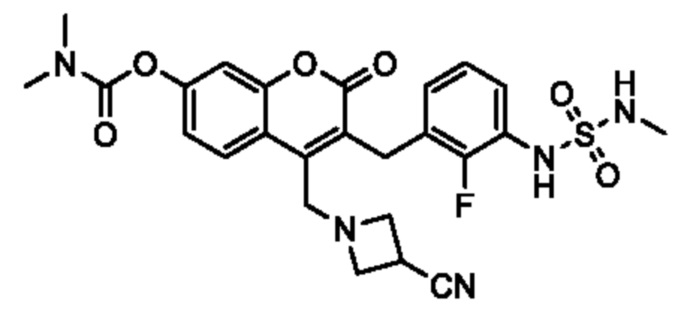
[0767] Соединение 172 получали в 1 стадию:
[0768] Стадия 1: Начиная с 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (50 мг, 0,069 ммоль, чистота: 75%) и гидрохлорида 3-азетидина карбонитрила, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в MeCN и добавляли карбонат калия (1,3 экв.). Продукт очищали способом препаративным основанием, а затем способом «препаративная кислота» с получением указанного в заголовке соединения (6,2 мг, 0,011 ммоль, выход: 16%) после лиофилизации в виде белого твердого вещества.
[0769] Выход: Соединение 172 выделяли в виде белого твердого вещества (16% за 1 стадию).
[0770] Анализ: LCMS (Способ Т): tR=1,48 мин; m/z рассч. для [М+Н]+=544,2, обнаруж.=544,2; 1H ЯМР (400 МГц, Хлороформ-d) δ 7,92 (d, J=8,7 Гц, 1H), 7,45 - 7,34 (m, 1H), 7,16 - 7,08 (m, 2Н), 7,03 (dd, J=15,8, 7,8 Гц, 1H), 6,91 (t, J=7,3 Гц, 1H), 6,58 (s, 1H), 4,52 (d, J=5,3 Гц, 1H), 4,15 (s, 2Н), 3,83 (s, 2Н), 3,53 (t, J=7,2 Гц, 2Н), 3,28 (t, J=7,0 Гц, 2Н), 3,19 (d, J=7,3 Гц, 1H), 3,13 (s, 3H), 3,04 (s, 3H), 2,79 (d, J=5,3 Гц, 3H).
ПРИМЕР 85
Синтез Соединения 173

[0771] Соединение 173 получали в 1 стадию:
[0772] Стадия 1: Начиная с 4-(6ромметш)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамата (70 мг, 0,129 ммоль) иазетидин-3-карбоксамида, следуя процедуре общего синтеза соединения Е.2, за исключением того, что реакцию проводили в CH2Cl2 и добавляли Et3N (1,8 экв.). После полного превращения добавляли насыщ. водн. NaHCO3 и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Неочищенный продукт очищали препаративным основанием с получением указанного в заголовке соединения (29,5 мг, 0,052 ммоль, выход: 41%) после лиофилизации в виде белого твердого вещества.
[0773] Выход: Соединение 173 выделяли в виде белого твердого вещества (41% за 1 стадию).
[0774] Анализ: LCMS (Способ Т): tR=1,22 мин; m/z рассч. для [М+Н]+=562,2, обнаруж.=562,2; 1H ЯМР (400 МГц, Хлороформ-d) δ 7,99 (d, J=8,8 Гц, 1H), 7,41 (td, J=7,9, 1,8 Гц, 1Н), 7,16 - 7,05 (m, 2Н), 7,04 - 6,98 (m, 1Н), 6,95 (d, J=7,2 Гц, 1H), 6,72 (s, 1Н), 5,62 (s, 1H), 5,29 (s, 1H), 4,97 (d, J=5,4 Гц, 1H), 4,15 (s, 2Н), 3,84 (s, 2Н), 3,40 (t, J=7,4 Гц, 2Н), 3,19 (t, J=6,7 Гц, 2Н), 3,13 (s, 3H), 3,04 (s, 4Н), 2,81 (d, J=5,3 Гц, 3H).
ПРИМЕР 86
Синтез Соединения 174
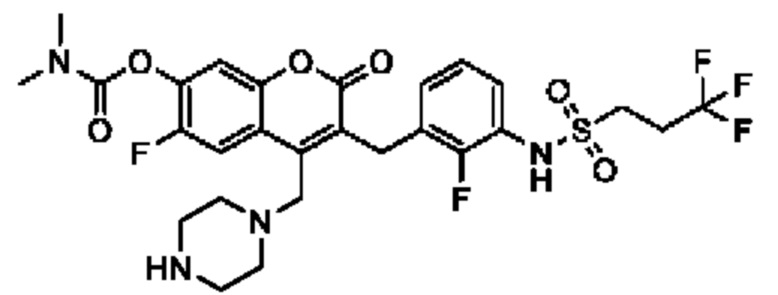
[0775] Соединение 173 получали в 3 стадии:
[0776] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-фтор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,700 г, 1,802 ммоль) и 3,3,3-трифторпропап-1-сульфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Остаток очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (526 мг, 0,959 ммоль, выход: 53%) в виде белого твердого вещества.
[0777] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением соответствующего брома (675 мг, 0,570 ммоль, выход: 66%, чистота: 53%) в виде коричневого твердого вещества.
[0778] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная со 100 мг, 0,084 ммоль брома и пиперазина. К реакционной смеси добавляли 3,00 экв. NEt3 После полного превращения неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (36 мг, 0,056 ммоль, выход: 67%) в виде не совсем белого твердого вещества.
[0779] Выход: Соединение 174 выделяли в виде не совсем белого твердого вещества (23% за 3 стадии).
[0780] Анализ: LCMS (Способ Т): tR=1,34 мин; m/z рассч. для [М+Н]+=633,2, обнаруж.=633,4; 1Н ЯМР (400 МГц, DMSO) δ 8,01 (d, J=11,7 Гц, 1H), 7,47 (d, J=6,9 Гц, 1H), 7,22 - 7,13 (m, 1H), 6,89 (t, J=7,8 Гц, 1Н), 6,65 (t, J=7,1 Гц, 1H), 4,00 (s, 2Н), 3,70 (s, 2Н), 3,15 - 3,10 (m, 2Н), 3,08 (s, 3H), 2,94 (s, 3H), 2,78 - 2,71 (m, 4Н), 2,71 - 2,61 (m, 2Н), 2,48 - 2,44 (m, 4Н).
ПРИМЕР 87
Синтез Соединения 175
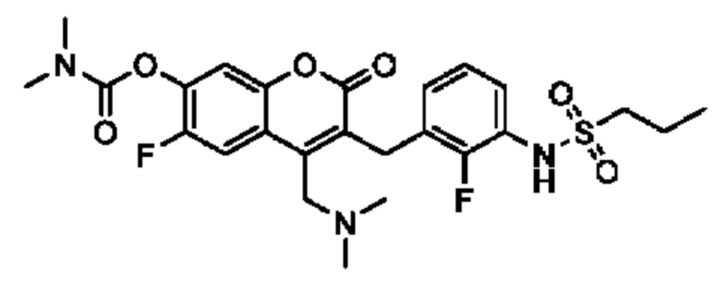
[0781] Соединение 175 получали в 3 стадии:
[0782] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-фтор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (1,00 г, 2,57 ммоль) и пропан-1-сулъфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Остаток очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (973 мг, 1,948 ммоль, выход: 76%) в виде белого твердого вещества.
[0783] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением соответствующего брома (661 мг, 0,980 ммоль, выход: 50%, чистота: 85%) в виде белого твердого вещества.
[0784] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 220 мг, 0,384 ммоль брома и 2М диметиламина в МеОН. После полного превращения неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (92,5 мг, 0,172 ммоль, выход: 45%) в виде не совсем белого твердого вещества.
[0785] Выход: Соединение 175 выделяли в виде не совсем белого твердого вещества (17% за 3 стадии).
[0786] Анализ: LCMS (Способ Т): tR=1,75 мин; m/z рассч. для [М+Н]+=538,2, обнаруж.=538,2; 1H ЯМР (400 МГц, CDCl3) δ 7,89 (d, J=11,3 Гц, 1H), 7,45 (td, J=7,8, 1,6 Гц, 1H), 7,19 (d, J=6,6 Гц, 1Н), 7,06 - 6,98 (m, 1Н), 6,91 - 6,85 (m, 1Н), 6,47 (s, 1H), 4,15 (s, 2Н), 3,56 (s, 2Н), 3,15 (s, 3H), 3,13 - 3,06 (m, 2Н), 3,04 (s, 3H), 2,25 (s, 6Н), 1,92 - 1,82 (m, 2Н), 1,05 (t, J=7,4 Гц, 3H).
ПРИМЕР 88
Синтез Соединения 176
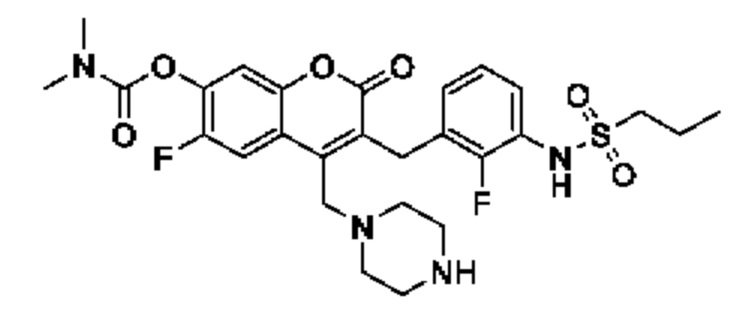
[0787] Соединение 176 получали в 3 стадии:
[0788] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-фтор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (1,00 г, 2,57 ммоль) и пропан-1-сулъфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Остаток очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (973 мг, 1,948 ммоль, выход: 76%) в виде белого твердого вещества.
[0789] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением соответствующего брома (661 мг, 0,980 ммоль, выход: 50%, чистота: 85%) в виде белого твердого вещества.
[0790] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 220 мг, 0,384 ммоль брома и пиперазина. После полного превращения неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (147,2 мг, 0,247 ммоль, выход: 64%) в виде не совсем белого твердого вещества.
[0791] Выход: Соединение 176 выделяли в виде не совсем белого твердого вещества (24% за 3 стадии).
[0792] Анализ: LCMS (Способ Т): tR=1,45 мин; m/z рассч. для [М+Н]+=579,2, обнаруж.=579,4; 1H ЯМР (400 МГц, CDCl3) δ 7,90 (d, J=11,3 Гц, 1H), 7,44 (td, J=7,9, 1,6 Гц, 1H), 7,19 (d, J=6,6 Гц, 1H), 7,02 (td, J=8,0, 1,2 Гц, 1H), 6,92 6,85 (m, 1H), 4,14 (s, 2Н), 3,62 (s, 2Н), 3,15 (s, 3H), 3,13 - 3,07 (m, 2Н), 3,05 (s, 3H), 2,82 (t, J=4,8 Гц, 4Н), 2,44 (s, 5Н), 1,94 - 1,82 (m, 3H), 1,05 (t, J=7,4 Гц, 3H).
ПРИМЕР 89
Синтез Соединения 177

[0793] Соединение 177 получали в 3 стадии:
[0794] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-фтор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (1,00 г, 2,57 ммоль) и пропан-1-сулъфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Остаток очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (973 мг, 1,948 ммоль, выход: 76%) в виде белого твердого вещества.
[0795] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением соответствующего брома (661 мг, 0,980 ммоль, выход: 50%, чистота: 85%) в виде белого твердого вещества.
[0796] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 220 мг, 0,384 ммоль брома и N-метилэтанамипа. После полного превращения неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (146,5 мг, 0,266 ммоль, выход: 69%) в виде не совсем белого твердого вещества.
[0797] Выход: Соединение 177 выделяли в виде не совсем белого твердого вещества (26% за 3 стадию).
[0798] Анализ: LCMS (Способ Т): tR=1,87 мин; m/z рассч. для [М+Н]+=552,2, обнаруж.=552,4; 1H ЯМР (400 МГц, CDCl3) δ 7,97 (d, J=11,3 Гц, 1H), 7,44 (td, J=7,9, 1,6 Гц, 1H), 7,19 (d, J=6,7 Гц, 1Н), 7,05 - 6,98 (m, 1Н), 6,91 - 6,84 (m, 1Н), 6,47 (s, 1H), 4,15 (s, 2Н), 3,61 (s, 2Н), 3,15 (s, 3H), 3,12 - 3,06 (m, 2Н), 3,05 (s, 3H), 2,47 (q, J=7,1 Гц, 2Н), 2,16 (s, 3H), 1,94 - 1,82 (m, 2Н), 1,09 (t, J=7,1 Гц, 3H), 1,05 (t, J=7,4 Гц, 3H).
ПРИМЕР 90
Синтез Соединения 178
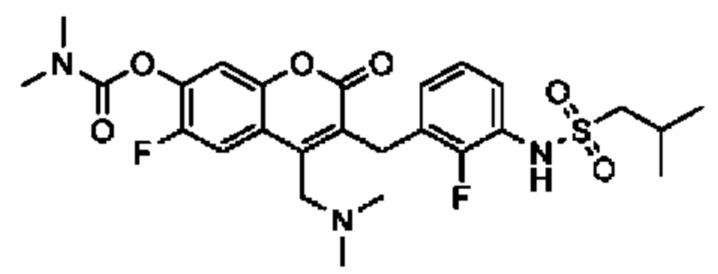
[0799] Соединение 178 получали в 3 стадии:
[0800] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-фтор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,70 г, 1,802 ммоль) и 2-метилпропап-1-сулъфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Остаток очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (648 мг, 1,274 ммоль, выход: 71%) в виде бежевого твердого вещества.
[0801] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением соответствующего брома (162 мг, 0,207 ммоль, выход: 18%, чистота: 75%) в виде белого твердого вещества.
[0802] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 220 мг, 0,375 ммоль брома и 2М диметиламина в МеОН. После полного превращения неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (43 мг, 0,078 ммоль, выход: 21%) в виде не совсем белого твердого вещества.
[0803] Выход: Соединение 178 выделяли в виде не совсем белого твердого вещества (3% за 3 стадию).
[0804] Анализ: LCMS (Способ Т): tR=1,84 мин; m/z рассч. для [М+Н]+=552,2, обнаруж.=552,4; 1H ЯМР (400 МГц, CDCl3) δ 7,89 (d, J=11,3 Гц, 1H), 7,44 (td, J=7,9, 1,6 Гц, 1Н), 7,19 (d, J=6,6 Гц, 1Н), 7,02 (td, J=8,0, 1,2 Гц, 1Н), 6,92 - 6,85 (m, 1H), 6,48 (s, 1H), 4,15 (s, 2Н), 3,56 (s, 2Н), 3,15 (s, 3H), 3,04 (s, 3H), 3,01 (d, J=6,6 Гц, 2Н), 2,32 (dt, J=13,3, 6,7 Гц, 1Н), 2,25 (s, 6Н), 1,10 (d, J=6,7 Гц, 6Н).
ПРИМЕР 91
Синтез Соединения 179
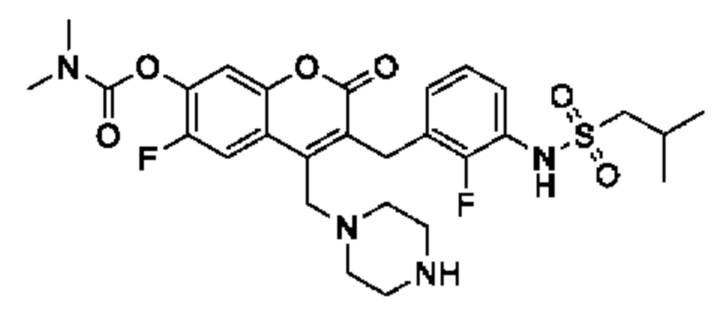
[0805] Соединение 179 получали в 3 стадии:
[0806] Стадия 1: Начиная с 3-(3-амино-2-фторбензил)-6-фтор-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,70 г, 1,802 ммоль) и 2-метилпропан-1-сульфонилхлорида, следуя процедуре общего синтеза Соединения Е.3. После полного превращения к реакционной смеси добавляли воду и продукт экстрагировали с применением CH2Cl2. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под пониженным давлением. Остаток очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением сульфамоила (648 мг, 1,274 ммоль, выход: 71%) в виде бежевого твердого вещества.
[0807] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. После экстракции неочищенный продукт очищали флэш-колоночной хроматографией (гептан/EtOAc=1:0 → 0:1). Желаемые фракции объединяли и концентрировали при пониженном давлении с получением соответствующего брома (162 мг, 0,207 ммоль, выход: 18%, чистота: 75%) в виде белого твердого вещества.
[0808] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 220 мг, 0,375 ммоль брома и пиперазина. После полного превращения неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (51 мг, 0,084 ммоль, выход: 22%) в виде не совсем белого твердого вещества.
[0809] Выход: Соединение 179 выделяли в виде не совсем белого твердого вещества (3% за 3 стадию).
[0810] Анализ: LCMS (Способ Т): tR=1,56 мин; m/z рассч. для [М+Н]+=593,2, обнаруж.=593,4; 1Н ЯМР (400 МГц, CDCl3) δ 7,90 (d, J=11,2 Гц, 1H), 7,43 (t, J=7,5 Гц, 1H), 7,19 (d, J=6,7 Гц, 1H), 7,03 (t, J=7,9 Гц, 1H), 6,88 (t, J=7,4 Гц, 1Н), 4,14 (s, 2Н), 3,62 (s, 2Н), 3,15 (s, 3H), 3,05 (s, 3H), 3,01 (d, J=6,5 Гц, 2Н), 2,82 (t, J=4,8 Гц, 4Н), 2,44 (s, 4Н), 2,32 (dt, J=13,3, 6,6 Гц, 1H), 1,10 (d, J=6,7 Гц, 6Н).
ПРИМЕР 92
Синтез Соединения 180

[0811] Соединение 180 получали в 2 стадии:
[0812] Стадия-1: 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамат (2,715 г, 3,30 ммоль) суспендировали в MeCN (60 мл) и добавляли ацетат серебра (1 г, 5,99 ммоль, 1,8 экв.). На следующий день добавляли воду и продукт экстрагировали DCM (2х). Объединенный экстракт сушили над соляным раствором и сульфатом натрия и упаривали. Сырой продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=9:1 → 5:5) с получением промежуточного ацетата (1,40 г, 2,68 ммоль, выход: 81%) в виде не совсем белого твердого вещества.
[0813] Стадия 2: К раствору вышеуказанного ацетата (1,21 г, 2,52 ммоль) в МеОН (27 мл) добавляли карбонат калия (0,445 г, 3,22 ммоль, 1,2 экв.). Через 2 ч добавляли HCl (1 н. в воде) до тех пор, пока смесь не становилась слегка кислой. Затем добавляли воду и DCM. Водный слой экстрагировали с применением DCM (2х), объединенный экстракт сушили над солевым раствором и сульфатом натрия и выпаривали с получением указанного в заголовке соединения (1,21 г, 2,52 ммоль, выход: 94%) в виде не совсем белого твердого вещества.
ПРИМЕР 93
Синтез Соединения 181

[0814] Соединение 181 получали в одну стадию.
[0815] Стадия 1: Гидрид натрия (60% масс/масс./в минеральном масле, 8 мг, 0,20 ммоль, 2,1 экв.) суспендировали в сухом DMF (1 мл) и добавляли морфолин-3-он (20 мг, 0,198 ммоль, 2,1 экв.). Через 30 минут этот раствор медленно добавляли к 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамату (50 мг, 0,092 ммоль) в сухом DMF (1 мл). Через 30 мин реакцию гасили 1 N HCl и продукт экстрагировали с применением EtOAc (2х). Объединенный экстракт сушили над солевым раствором, выпаривали сульфат натрия и очищали методом колоночной «флэш»-хроматографии (гептан/EtOAc=9:1 → 0:1). Фракции продукта собирали, выпаривали и упаривали с помощью Et2O, получая указанное в заголовке соединение (33 мг, 0,059 ммоль, выход: 64%) в виде белого твердого вещества.
[0816] Анализ: LCMS (Способ R): tR=1,31 мин; m/z рассч. для [М+Н]+=563,1, обнаруж.=563,4; 1H ЯМР (400 МГц, DMSO) δ 9,37 (s, 1H), 7,91 (d, J=8,9 Гц, 1H), 7,33 -7,25 (m, 2Н), 7,24 - 7,15 (m, 2Н), 7,00 (t, J=7,9 Гц, 1H), 6,86 (t, J=6,4 Гц, 1H), 4,95 (s, 2Н), 4,06 (s, 2Н), 3,96 (s, 2Н), 3,66 - 3,57 (m, 2Н), 3,17 (t, J=5,2 Гц, 2Н), 3,06 (s, 3H), 2,93 (s, 3H), 2,52 (d, J=4,9 Гц, 3H).
ПРИМЕР 94
Синтез Соединения 182

[0817] Соединение 182 получали в две стадии.
[0818] Стадия 1: Первую стадию выполняли аналогично получению соединения 180, применяя трет-бутил 3-оксопиперазин-1-карбоксилат (40 мг, 0,20 ммоль, 2,2 экв.) вместо морфолин-3-она, в результате чего получали Вос-защищенный промежуточный продукт (35 мг, 0,048 ммоль, чистота: 90%, выход: 52%) в виде белого твердого вещества.
[0819] Стадия 2: Вос-защищенное промежуточное соединение (32 мг, 0,048 ммоль) растворяли в сухом диоксане (2 мл) и добавляли 4 N HCl в диоксане (0,48 мл, 1,90 ммоль, 40 экв.). Через 1 ч летучие вещества выпаривали, а остаток повторно растворяли в смеси вода/MeCN и лиофилизировали с получением указанного в заголовке соединения (20 мг, 0,033 ммоль, чистота: 94%, выход: 70%) в виде не совсем белого твердого вещества.
[0820] Анализ: LCMS (Способ Т): tR=1,17 мин; m/z рассч. для [М+Н]+=562,1, обнаруж.=562,4 (свободное основание); 1H ЯМР (400 МГц, DMSO) δ 9,38 (s, 1Н), 9,33 (s, 2H), 7,86 (d, J=8,9 Гц, 1H), 7,33 - 7,26 (m, 2H), 7,23 (q, J=5,0 Гц, 1H), 7,17 (dd, J=8,8, 2,4 Гц, 1H), 7,01 (t, J=7,9 Гц, 1H), 6,89 (t, J=6,9 Гц, 1H), 4,94 (s, 2H), 4,07 (s, 2H), 3,72 (s, 2H), 3,18 (t, J=5,6 Гц, 2H), 3,06 (s, 3H), 2,93 (s, 3H), 2,52 (d, J=4,9 Гц, 3H).
ПРИМЕР 95
Синтез Соединения 183
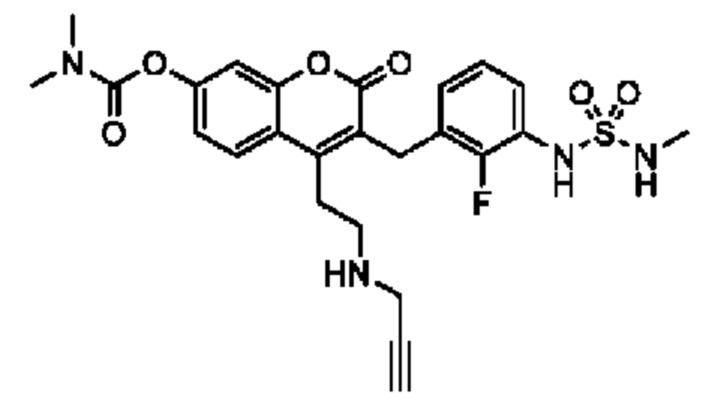
[0821] Соединение 183 получали в одну стадию:
[0822] Стадия 1: К перемешиваемому раствору соединения 17 (30 мг, 0,038 ммоль) в N,N-диметилформамиде (1,0 мл), добавляли пропаргиламон (3,1 мкл, 0,049 ммоль, 1,3 экв.) и триэтиламин (16 мкл, 0,113 ммоль, 3 экв.). На следующий день смесь очищали методом «препаративного основания». Фракции продукта лиофилизировали с получением указанного в заголовке соединения (3,5 мг, 6,60 мкмоль, выход: 17%).
[0823] Анализ: LCMS (Способ Р): tR=1,30 мин; m/z рассч. для [М+Н]+=531,2, обнаруж.=531,1; 1H ЯМР (400 МГц, CDCl3) δ 7,67 (d, J=8,6 Гц, 1Н), 7,39 (td, J=7,7, 1,8 Гц, 1H), 7,16 - 7,09 (m, 2Н), 7,08 - 6,90 (m, 2Н), 5,05 - 4,82 (m, 1H), 4,11 (s, 2Н), 3,41 (d, J=2,5 Гц, 2Н), 3,13 (s, 3H), 3,06 - 2,97 (m, 5Н), 2,81 - 2,71 (m, 5Н), 2,21 (t, J=2,4 Гц, 1Н).
ПРИМЕР 96
Синтез Соединения 184

[0824] Соединение 184 получали в одну стадию.
[0825] Стадия 1: К раствору соединения 182 (40 мг, 0,072 ммоль) в DCM (2 мл) и триэтиламине (80 мкл, 0,57 ммоль, 8 экв.) добавляли триметилсилилизоцианат (77 мкл, 0,57 ммоль, 8 экв.). На следующий день растворители выпаривали, а остаток повторно растворяли в DMSO и очищали методом «препаративной кислоты». Фракции продукта лиофилизировали с получением указанного в заголовке соединения (6,5 мг, 0,012 ммоль, выход: 17%).
ПРИМЕР 97
Синтез Соединения 185

[0826] Соединение 185 получали в три стадии.
[0827] Стадия 1: К раствору бис(4-нитрофенил)карбоната (500 мг, 1,64 ммоль) и триэтиламина (344 мкл, 2,47 ммоль, 1,5 экв.) в DCM (10 мл) медленно добавляли 2-(t-бутилдиметилсилокси)этанол. На следующий день добавляли воду и продукт экстрагировали с применением DCM. Экстракт сушили над соляным раствором и сульфатом натрия и упаривали. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=98:2 -» 6:4) с получением 2-((трет-бутилдиметилсилил)окси)этил(4-нитрофенил)карбоната (360 мг, 1,05 ммоль, выход: 64%).
[0828] Стадия 2: К раствору соединения 181 (40 мг, 0,072 ммоль) и триэтиламина (30 мкл, 0,22 ммоль, 3 экв.) в сухом DMF (2 мл) добавляли 2-((трет-бутилдиметилсилил)окси)этил(4-нитрофенил)карбонат (39 мг, 0,11 ммоль, 1,5 экв.). На следующий день реакционную смесь разбавляли водой и экстрагировали с применением EtOAc. Экстракт промывали водой (2 раза), сушили над солевым раствором и сульфатом натрия и упаривали. Неочищенный продукт очищали колоночной хроматографией методом «флэш» (гептан/EtOAc=8:2 → 2:8) с получением защищенного продукта 3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-4-(8,8,9,9-тетраметил-3-оксо-4,7-диокса-2-аза-8-силадецил)-2Н-хромен-7-илдиметилкарбамат (25 мг, 0,033 ммоль, чистота: 89%, выход: 46%).
[0829] Стадия-3: к раствору защищенного продукта (25 мг, 0,033 ммоль) добавляли 4N HCl в диоксане (92 мкл, 0,37 ммоль, 10 экв.). Через 1 ч растворитель выпаривали и сырой продукт очищали методом «препаративного основания» с получением указанного в заголовке соединения (9,6 мг, 0,017 ммоль, выход: 46%) в виде белого твердого вещества после лиофилизации.
[0830] Анализ: LCMS (Способ Т): tR=1,25 мин; m/z рассч. для [М+Н]+=567,1, обнаруж.=567,4; 1H ЯМР (400 МГц, DMSO): δ 9,38 (s, 1H), 7,94 (d, J=8,9 Гц, 1H), 7,85 (t, J=5,7 Гц, 1H), 7,31 - 7,23 (m, 2Н), 7,19 (dd, J=8,8, 2,4 Гц, 1H), 6,97 (t, J=8,0 Гц, 1H), 6,81 (s, 1H), 4,71 (t, J=5,3 Гц, 1H), 4,41 (d, J=5,6 Гц, 2Н), 4,12 (s, 2Н), 3,96 (t, J=5,1 Гц, 2Н), 3,50 (q, J=5,2 Гц, 2Н), 3,07 (s, 3H), 2,93 (s, 3H), 2,52 (s, 3H).
ПРИМЕР 98
Синтез Соединения 186
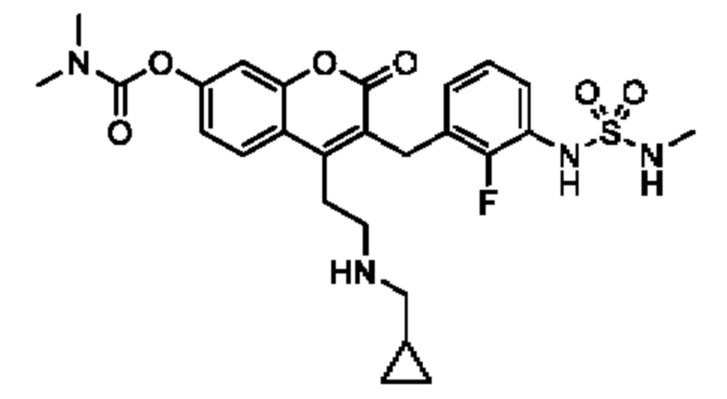
[0831] К перемешиваемому раствору соединения 100 (30 мг, 0,055 ммоль) в дихлорметане (1,0 мл) добавляли периодан Десс-Мартина (35 мг, 0,082 ммоль, 1,5 экв.) при комнатной температуре. Через 1 час реакцию гасили МеОН (1 мл). Через 30 минут добавляли аминометилциклопропан (7,8 мг, 0,11 ммоль, 2 экв.). Через 20 минут добавляли триацетоксиборгидрид натрия (46 мг, 0,22 ммоль). На следующий день добавляли боргидрид натрия (1,0 мг, 0,27 ммоль). Через 30 мин растворитель выпаривали, а остаток повторно растворяли в DMSO и очищали методом «препаративного основания». Фракции продукта лиофилизировали с получением указанного в заголовке соединения (2,7 мг, 4,94 мкмоль, выход: 9%).
[0832] Анализ: LCMS (Способ Р): tR=1,38 мин; m/z рассч. для [М+Н]+=547,2, обнаруж.=547,2; 1H ЯМР (400 МГц, CDCl3) δ 7,63 (d, J=8,7 Гц, 1H), 7,42 - 7,35 (m, 1H), 7,16 - 7,09 (m, 2Н), 7,02 (t, J=7,9 Гц, 1H), 6,94 (t, J=7,0 Гц, 1H), 5,22 (s, 1H), 4,11 (s, 2Н), 3,13 (s, 3H), 3,06 - 2,96 (m, 5Н), 2,78 (s, 3H), 2,65 - 2,58 (m, 2Н), 2,43 (d, J=6,9 Гц, 2Н), 0,91 - 0,86 (m, 1H), 0,52 - 0,44 (m, 2Н), 0,13 - 0,06 (m, 2Н).
ПРИМЕР 99
Синтез Соединения 187

[0833] Соединение 187 получали в одну стадию.
[0834] Стадия 1: К перемешиваемому раствору соединения 100 (30 мг, 0,055 ммоль) в дихлорметане (1,0 мл) добавляли периодан Десс-Мартина (46 мг, 0,109 ммоль, 2,0 экв.) при комнатной температуре. Через 1 час реакцию гасили МеОН (1 мл). Через 30 минут добавляли 2М диметиламин в THF (219 мкл, 0,22 ммоль, 4 экв.). Через 20 мин добавляли боргидрид натрия (27 мг, 0,711 ммоль, 13 экв.). На следующий день растворитель выпаривали, а остаток снова растворяли в DMSO и очищали методом «препаративного основания». Фракции продукта лиофилизировали с получением указанного в заголовке соединения (2,1 мг, 3,74 мкмоль, чистота: 92,6%, выход: 6,8%).
[0835] Анализ: LCMS (Способ Р): tR=1,30 мин; m/z рассч. для [М+Н]+=521,2, обнаруж.=521,2; 1H ЯМР (400 МГц, CDCl3) δ 7,59 (d, J=8,7 Гц, 1H), 7,41 (td, J=7,8, 1,7 Гц, 1H), 7,17 - 7,09 (m, 2Н), 7,07 - 7,00 (m, 1H), 6,99 - 6,92 (m, 1H), 5,40 - 5,25 (m, 1H), 4,10 (s, 2Н), 3,13 (s, 3H), 3,04 (s, 3H), 2,99 - 2,90 (m, 2Н), 2,78 (d, J=4,5 Гц, 3H), 2,24 - 2,16 (m, 8Н).
ПРИМЕР 100
Синтез Соединения 188

[0836] Соединение 188 получали в одну стадию.
[0837] Стадия 1: К перемешиваемому раствору соединения 17 (30 мг, 0,038 ммоль) в N,N-диметилформамиде (1,0 мл), добавляли пропаргиламон (3,1 мкл, 0,049 ммоль, 1,3 экв.) и триэтиламин (16 мкл, 0,113 ммоль, 3 экв.). На следующий день смесь очищали методом «препаративного основания». Фракции продукта лиофилизировали с получением указанного в заголовке соединения (3,5 мг, 6,60 мкмоль, выход: 17%).
[0838] Анализ: LCMS (Способ Р): tR=1,30 мин; m/z рассч. для [М+Н]+=531,2, обнаруж.=531,1; 1H ЯМР (400 МГц, CDCl3) δ 7,67 (d, J=8,6 Гц, 1Н), 7,39 (td, J=7,7, 1,8 Гц, 1H), 7,16 - 7,09 (m, 2Н), 7,08 - 6,90 (m, 2Н), 5,05 - 4,82 (m, 1H), 4,11 (s, 2Н), 3,41 (d, J=2,5 Гц, 2Н), 3,13 (s, 3H), 3,06 - 2,97 (m, 5Н), 2,81 - 2,71 (m, 5Н), 2,21 (t, J=2,4 Гц, 1Н).
ПРИМЕР 101
Синтез Соединения 189

[0839] Соединение 189 получали в одну стадию.
[0840] Стадия 1: Амидный продукт получали путем амидного сочетания Соединения С.6 (20 мг, 0,039 ммоль) с соответствующими аминами (1,2 экв.) с применением EDC-HCl (1,1 экв.) и HOAt (0,2 экв.) в DCM. После реакции DCM выпаривали, а остаток повторно растворяли в DMSO и очищали методом «препаративного основания». Продукты получали в виде твердых веществ после выпаривания в вакууме при 40°С в приборе Genevac™.
ПРИМЕР 102
Синтез Соединения 190

[0841] Соединение 190 получали в одну стадию.
[0842] Стадия 1: Амидные продукты получали амидным сочетанием соли Соединения 182-HBr (34 мг, 0,047 ммоль) с соответствующими кислотами (1,4 экв.) с применением EDC-HC1 (1,1 экв.) и этилциано(гидроксиимино)ацетата (0,2 экв.) и 3 экв. триэтиламина) в DCM. После реакции DCM выпаривали, а остаток повторно растворяли в DMSO и очищали методом «препаративного основания». Продукты получали в виде твердых веществ после выпаривания в вакууме при 40°С в приборе Genevac™.
[0843] Анализ: LCMS (Способ Т): tR=1,27 мин; m/z рассч. для [М+Н]+=521,1, обнаруж.=521,2; 1H ЯМР (400 МГц, CDCl3) δ 7,68 (d, J=8,7 Гц, 1H), 7,38 (td, J=7,8, 1,7 Гц, 1H), 7,14 (d, J=2,3 Гц, 1H), 7,10 (dd, J=8,7, 2,4 Гц, 1H), 7,02 (t, J=6,5 Гц, 1H), 6,94 (t, J=6,5 Гц, 1H), 6,64 (s, 1H), 5,53 (t, J=5,2 Гц, 1H), 4,90 (q, J=5,3 Гц, 1H), 4,62 (d, J=5,4 Гц, 2H), 4,14 (s, 2H), 3,13 (s, 3H), 3,03 (s, 3H), 2,78 (d, J=5,2 Гц, 3H), 1,83 (s, 3H).
ПРИМЕР 103
Синтез Соединения 191
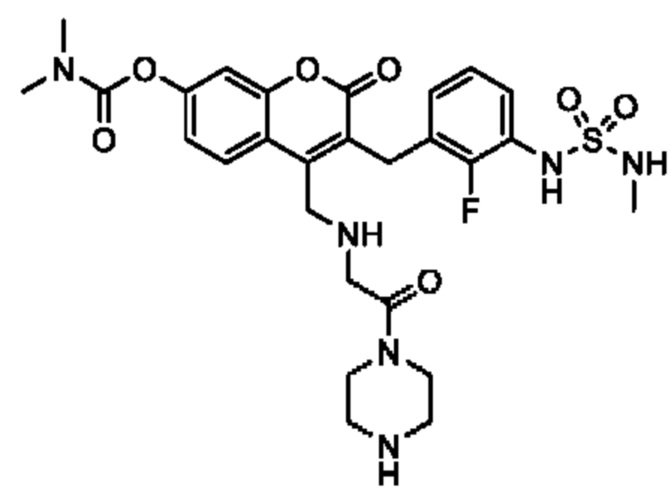
[0844] Соединение 191 получали в три стадии.
[0845] Стадия 1: 4-(бромметил)-3-(2-фтор-3-((N-метилсульфамоил)амино)бензил)-2-оксо-2Н-хромен-7-илдиметилкарбамат (900 мг, 1,00 ммоль) и триэтиламин (416 мкл, 3,00 ммоль, 3 экв.) перемешивали в DCM (5 мл) и добавляли трет-бутилглицинат (680 мкл, 5,00 ммоль, 5 экв.). На следующий день добавляли воду и продукт экстрагировали DCM (2х). Объединенный экстракт сушили над соляным раствором и сульфатом натрия и упаривали. Остаток повторно растворяли в 1 мл DCM и очищали колоночной хроматографией по методу «флэш» (гептан/EtOAc=0:0 → 3:7) с получением промежуточного трет-бутилового эфира (480 мг, 0,61 ммоль, чистота: 75%, выход: 61%).
[0846] Стадия 2: Промежуточное соединение с предыдущей стадии (480 мг, 0,61 ммоль) перемешивали в 4 N HCl в диоксане (7,6 мл, 30,4 ммоль, 50 экв.). На следующий день летучие вещества выпаривали и остаток упаривали с применением DCM, получая глицерил-HCl-соль (540 мг, 0,57 ммоль, чистота: 60%, выход: 93%) в виде не совсем белого твердого вещества. Это вещество применяли как таковое.
[0847] Стадия 3: Амидный продукт получали из глицерил-HCL-соли стадии 2 (20 мг, 0,041 ммоль) с соответствующими аминами (1,2 экв.) с применением HATU (1,2 экв.) и DIPEA (4 экв.) в DMF. После реакции реакционные растворы очищали методом «препаративного основания». Продукты получали в виде твердых веществ после выпаривания в вакууме при 40°С в приборе Genevac™.
[0848] Анализ: LCMS (Способ Р): tR=1,06 мин; m/z рассч. для [М+Н]+=605,2, обнаруж.=605,1; 1H ЯМР (400 МГц, CDCl3) δ 7,99 (d, J=8,6 Гц, 1H), 7,43 - 7,36 (m, 1H), 7,15 - 7,08 (m, 2Н), 7,05 -6,96 (m, 2Н), 5,02 (s, 1H), 4,15 (s, 2Н), 3,96 (s, 2Н), 3,58 (t, J=5,2 Гц, 2Н), 3,37 (s, 2Н), 3,31 - 3,23 (m, 2Н), 3,13 (s, 3H), 3,03 (s, 3H), 2,89 - 2,79 (m, 4Н), 2,74 (s, 3H).
ПРИМЕР 104
Синтез Соединения 205
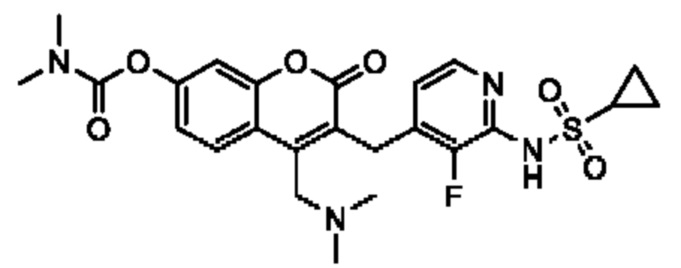
[0849] Соединение 205 получали в 3 стадии:
[0850] Стадия 1: К раствору 3-((2-хлор-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (0,5 г, 1,279 ммоль, 1,0 экв.) и этансульфонамида (1,41 г, 12,92 ммоль, 10,1 экв.) в 1,4-диоксане (0,1 М) в инертной атмосфере добавляли Xantphos (0,148 г, 0,256 ммоль, 0,2 экв.), карбонат цезия (0,625 г, 1,919 ммоль, 1,5 экв.) и PdOAc2 (0,049 г, 0,218 ммоль, 0,17 экв.). Образовавшуюся реакционную смесь перемешивали в течение 24 часа при 100°С. Реакционную смесь фильтровали через целит и промывали H2O и CH2Cl2. Слои фильтрата разделяли и органический слой промывали солевым раствором. Сушили над Na2SO4, фильтровали, и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2 /МеОН=1:0 → 9:1). Все еще неочищенный продукт очищали препаративным основанием с получением 3-((2-(этилсульфонамидо)-3-фторпиридин-4-ил)метил)-4-метил-2-оксо-2Н-хромен-7-илдиметилкарбамата (32 мг, 0,068 ммоль, выход: 5,3%) в виде не совсем белого твердого вещества.
[0851] Стадия 2: Следуя процедуре общего синтеза Соединения Е.4 с применением NBS. Реакцию гасили водой с 1N H2SO4, и большую часть THF удаляли при пониженном давлении. Продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением соответствующего брома (42 мг, 0,046 ммоль, выход: 64%, чистота: 59%) в виде липкого желтого твердого вещества.
[0852] Стадия 3: Следуя процедуре общего синтеза Соединения Е.5, начиная с 33 мг, 0,040 ммоль брома и 2М диметиламина в МеОН. Неочищенный продукт очищали препаративной кислотой с получением указанного в заголовке соединения (8,4 мг, 0,016 ммоль, выход: 40%) в виде белого твердого вещества.
[0853] Выход: Соединение 205 выделяли в виде белого твердого вещества (1% за 3 стадии).
[0854] Анализ: LCMS (Способ L): tR=2,32 мин; m/z рассч. для [М+Н]+=519,2, обнаруж.=519,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 8,25 (s, 1H), 8,08 (d, J=8,9 Гц, 1H), 7,78 (s, 1H), 7,24 (d, J=2,3 Гц, 1H), 7,15 (dd, J=8,8, 2,4 Гц, 1H), 6,57 (s, 1H), 4,03 (s, 2H), 3,65 (s, 2H), 3,07 (s, 3H), 2,93 (s, 3H), 2,21 (s, 7H), 0,92 (d, J=41,0 Гц, 4H).
ПРИМЕР 105
Синтез Соединения 228

[0855] Соединение 228 получали в 3 стадии:
[0856] Стадия 1: Начиная с этил 2-(2-фтор-3-нитробензил)-3-оксобутаноата 3 (48,9 г, 173 ммоль) и резорцина (1,04 экв.) после общего синтеза Соединения 4. После фильтрации остаток перемешивали в водн. насыщ. NaHCO3 до тех пор, пока прекращалось выделение газа. Суспензию снова фильтровали, промывали водой, Et2O и сушили с получением соответствующего кумарина 5 (50,3 г, 153 ммоль, выход: 98%) в виде твердого вещества желтого цвета.
[0857] Стадия 2: После общего синтеза Соединения 5 получают соответствующий диметилкарбамат 6 (70,7 г, 166 ммоль, выход: 109%) в виде твердого вещества желтого цвета.
[0858] Стадия 3: Следуя процедуре общего синтеза Соединения С, с Pd/C и EtOH/THF 1:2 (0,05 М) в качестве растворителей, получали указанное в заголовке соединения (50,83 г, 130 ммоль, выход: 77%) в виде твердого вещества светло-розового цвета.
[0859] Выход: Соединение 228 выделяли в виде белого твердого вещества (43% за 3 стадии).
[0860] Анализ: LCMS (Способ U): tR=1,95 мин; m/z рассч. для [М+Н]+=371,1, обнаруж.=371,2.
ПРИМЕР 106
Синтез Соединения 227
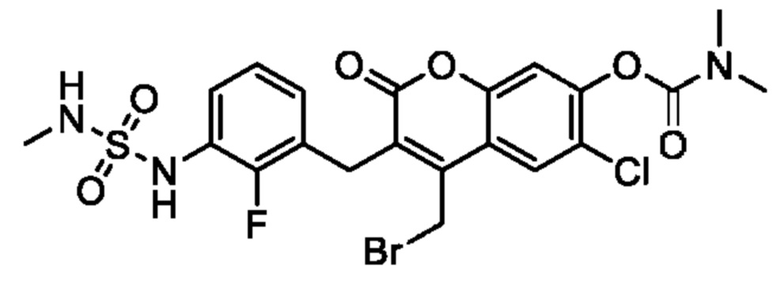
[0861] Соединение 229 получали в 5 стадии:
[0862] Стадия 1: Начиная с этил 2-(2-фтор-3-нитробензил)-3-оксобутаноата 3 (1,0 г, 3,53 ммоль) и 4-хлорбепзен-1,3-диола (1,20 экв.), следуя процедуре общего синтеза Соединения 4, получали соответствующий кумарин 5 (0,95 г, 2,57 ммоль, выход: 73%) в виде не совсем белого твердого вещества.
[0863] Стадия 2: Следуя процедуре общего синтеза Соединения 5, получали соответствующий диметилкарбамат 6 (0,88 г, 1,95 ммоль, выход: 75%) в виде светло-желтого твердого вещества.
[0864] Стадия 3: Следуя процедуре общего синтеза Соединения 6, получали соответствующий первичный амин 7 (0,51 г, 1,22 ммоль, выход: 60%) в виде светло-желтого твердого вещества.
[0865] Стадия 4: Следуя процедуре общего синтеза Соединения 7, получали соответствующий сульфамоил 8 (0,54 г, 1,03 ммоль, выход: 81%) в виде твердого вещества бежевого цвета.
[0866] Стадия 5: Следуя процедуре общего синтеза Соединения 8, начиная с 280 мг, 0,56 ммоль 8 и применяя NBS, получали указанное в заголовке соединение (0,17 г, 0,12 ммоль, чистота: 40%, выход: 20%) в виде не совсем белого твердого вещества.
[0867] Выход: Соединение 229 выделяли в виде не совсем белого твердого вещества (5% за 5 стадий).
[0868] Анализ: LCMS (Способ I): tR=2,06 мин; m/z рассч. для [М+H2O]+=574,0/576,0, обнаруж.=573,9/575,9.
ПРИМЕР 107
Синтез Соединения 228

[0869] Соединение 230 получали в 3 стадии:
[0870] Стадия 1: Начиная с этил 2-(2-фтор-3-питробензил)-3-оксобутапоата 3 (1,0 г, 3,53 ммоль) и 4-хлорбепзен-1,3-диола (1,20 экв.), следуя процедуре общего синтеза Соединения 4, получали соответствующий кумарин 5 (0,95 г, 2,57 ммоль, выход: 73%) в виде не совсем белого твердого вещества.
[0871] Стадия 2: Следуя процедуре общего синтеза Соединения 5, получали соответствующий диметилкарбамат 6 (0,88 г, 1,95 ммоль, выход: 75%) в виде светло-желтого твердого вещества.
[0872] Стадия 3: Следуя процедуре общего синтеза Соединения 6, получали указанное в заголовке соединение (0,51 г, 1,22 ммоль, выход: 60%) в виде твердого вещества светло-желтого цвета.
[0873] Выход: Указанное в заголовке соединение выделяли в виде белого твердого вещества (33% за 3 стадии).
[0874] Анализ: LCMS (Способ U): tR=2,08 мин; m/z рассч. для [М+Н]+=405,1/407,1, обнаруж.=405,1/407,1.
ПРИМЕР 108
Синтез Соединения 229
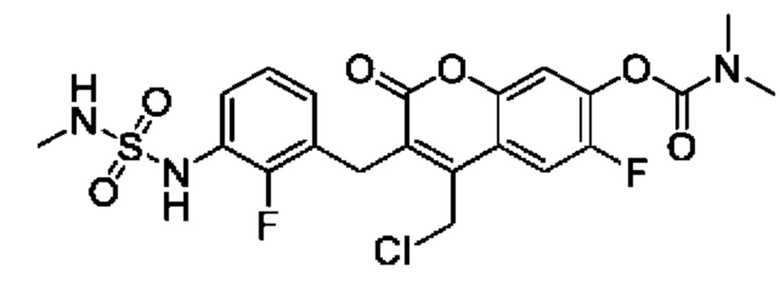
[0875] Соединение 231 получали в 5 стадии:
[0876] Стадия 1: Начиная с этил 2-(2-фтор-3-нитробензил)-3-оксобутаноата 3 (2,0 г, 7,06 ммоль) и 4-фторбензол-1,3-диола (1,20 экв.), следуя процедуре общего синтеза Соединения 4, получали соответствующий кумарин 5 (2,85 г, 8,13 ммоль, выход: 115%) в виде не совсем белого твердого вещества.
[0877] Стадия 2: Следуя процедуре общего синтеза Соединения 5. При времени реакции 2,5 дня получали соответствующий диметилкарбамат 6 (2,28 г, 5,01 ммоль, чистота: 92%, выход: 61%) в виде бежевого твердого вещества.
[0878] Стадия 3: Следуя процедуре общего синтеза Соединения 6, получали соответствующий первичный амин 7 (1,28 г, 3,11 ммоль, выход: 57%) в виде светло-желтого твердого вещества.
[0879] Стадия 4: Следуя процедуре общего синтеза Соединения 7. После фильтрации неочищенный продукт очищали колоночной хроматографией методом «флэш» (CH2Cl2/МеОН=1:0 → 97:3) с получением соответствующего сульфамоила 8 (1,04 г, 2,15 ммоль, выход: 65%) в виде твердого вещества бежевого цвета.
[0880] Стадия 5: Следуя процедуре общего синтеза Соединения 8, применяя NCS, и без колоночной флэш-хроматографии, получали указанное в заголовке соединение (1,22 г, 2,13 ммоль, чистота: 90%, выход: 98%) в виде не совсем белого твердого вещества.
[0881] Выход: указанное в заголовке соединение выделяли в виде не совсем белого твердого вещества (25% за 5 стадий).
[0882] Анализ: LCMS (Способ I): tR=2,06 мин; m/z рассч. для [М+H2O]+=533,1/535,1, обнаруж.=533,1/535,0.
ПРИМЕР 109
Синтез Соединения 230

[0883] Соединение 232 получали в 5 стадии:
[0884] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридип-4-ил)метил)-3-оксобутаноата (10,0 г, 24,12 ммоль) и резорцина (2,00 экв.), следуя процедуре общего синтеза Соединения D.4. Вместо хлорной кислоты использовали серную кислоту. После полного превращения реакционную смесь охлаждали (0°С) и гасили насыщ. водн. NaHCO3 до щелочного рН. Образовавшуюся суспензию белого цвета промывали водой, Et2O и сушили, получая соответствующий кумарин (8,61 г, 23,4 ммоль, выход: 97%, чистота: 87%) в виде не совсем белого твердого вещества.
[0885] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, получали соответствующий диметилкарбамат (9,33 г, 23,16 ммоль, выход 99%) в виде бежевого твердого вещества.
[0886] Стадия 3: Следуя процедуре общего синтеза Соединения D.6, начиная с 0,7 г, 1,79 ммоль соединения D.5. На втором стадии сначала применяли 4N HCl в 1,4-диоксане, а затем добавляли TFA для достижения полного превращения. После концентрирования реакционной смеси остаток наносили на гидроматрицу и очищали колоночной хроматографией по методу «флэш»(CHCl2/МеОН+1.5% (об./об.) Et3N=1:0 → 9:1) с получением соответствующего первичного амина (0,37 г/г, 0,986 ммоль, выход: 55%) в виде твердого вещества бежевого цвета.
[0887] Стадия 4: Следуя процедуре общего синтеза Соединения D.7, После полного превращения реакционную смесь гасили водой. Продукт экстрагировали с применением EtOAc, объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2/МеОН=1:0 → 9:1) с получением соответствующего сульфамоила 0,236 г, 0,462 ммоль, выход: 49%) в виде зелено-белого твердого вещества.
[0888] Стадия 5. Следуя процедуре общего синтеза Соединения D.8, с применением NBS и за исключением того, что вместо 1N H2SO4 применяли 1N HCl для гашения реакции, получали указанное в заголовке соединения (0,265 г, 0,341 ммоль, выход: 67%, чистота: 70%) в виде желтого липкого твердого вещества.
[0889] Выход: Указанное в заголовке соединение выделяли в виде липкого желтого твердого вещества (17% за 5 стадий).
[0890] Анализ: LCMS (Способ K): tR=1,91 мин; m/z рассч. для [М+Н]+=543,0/545,0, обнаруж.=543,0/545,0.
ПРИМЕР 110
Синтез Соединения 231
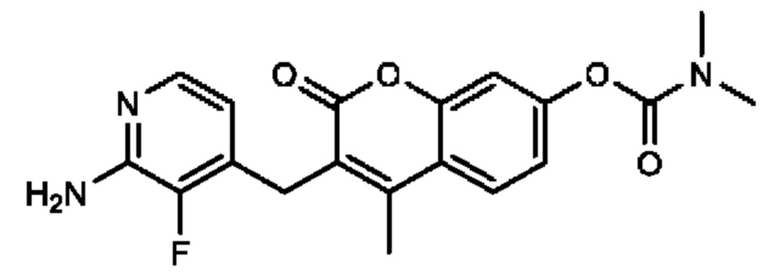
[0891] Соединение 233 получали в 3 стадии:
[0892] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутапоата (10,0 г, 24,12 ммоль) и резорцина (2,00 экв.), следуя процедуре общего синтеза Соединения D.4. Вместо хлорной кислоты использовали серную кислоту. После полного превращения реакционную смесь охлаждали (0°С) и гасили насыщ. водн. NaHCO3 до щелочного рН. Образовавшуюся суспензию белого цвета промывали водой, Et2O и сушили, получая соответствующий кумарин (8,61 г, 23,4 ммоль, выход: 97%, чистота: 87%) в виде не совсем белого твердого вещества.
[0893] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, получали соответствующий диметилкарбамат (9,33 г, 23,16 ммоль, выход 99%) в виде бежевого твердого вещества.
[0894] Стадия 3: Следуя процедуре общего синтеза Соединения D.6, начиная с 0,7 г, 1,79 ммоль Соединения D.5. На второй стадии сначала применяли 4N HCl в 1,4-диоксане, а затем добавляли TFA для достижения полного превращения. После концентрирования реакционной смеси остаток наносили на гидроматрицу и очищали колоночной хроматографией по методу «флэш»(CH2Cl2/МеОН+1.5% (об./об.) Et3N=1:0 → 9:1) с получением соединения 108 (0,37 г, 0,986 ммоль, выход: 55%) в виде бежевого твердого вещества.
[0895] Выход: указанное в заголовке соединение выделяли в виде твердого вещества бежевого цвета (53% за 3 стадии).
[0896] Анализ: LCMS (Способ I): tR=1,85 мин; m/z рассч. для [М+Н]+=372,1, обнаруж.=372,1.
ПРИМЕР 111
Синтез Соединения 22
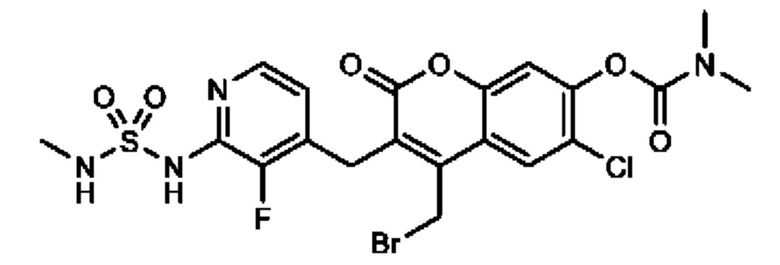
[0897] Соединение 234 получали в 5 стадии:
[0898] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутаноата (15,0 г, 46,0 ммоль) и 4-хлорбензол-1,3-диола (1,20 экв.), следуя процедуре общего синтеза соединения D.4. После завершения реакции добавляли воду и образовавшуюся суспензию фильтровали. Остаток выпаривали совместно с EtOH и растирали в смеси EtOH/Et2O. Твердые вещества отфильтровывали, получая соответствующий кумарин (4,8 г, 13,55 ммоль, выход: 29%) в виде белого твердого вещества.
[0899] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, получали соответствующий диметилкарбамат (5,48 г, 11,86 ммоль, выход: 87%, чистота: 92%) в виде светло-желтого твердого вещества.
[0900] Стадия 3: Следуя процедуре общего синтеза Соединения D.6, начиная с 1,0 г, 2,35 ммоль соединения. Снятие защиты с помощью TFA не проводили. Реакционную смесь фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=9:1 → 1:4) с получением соответствующего первичного амина (0,12 г, 0,281 ммоль, выход: 12%) в виде твердого вещества бежевого цвета.
[0901] Стадия 4: Следуя процедуре общего синтеза Соединения D.7. После полного превращения реакционную смесь гасили водой. Продукт экстрагировали с применением EtOAc, объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2/МеОН=1:0 → 96:4) с получением соответствующего сульфамоила (0,100 г, 0,198 ммоль, выход: 67%) в виде прозрачного масла.
[0902] Стадия 5: Следуя процедуре общего синтеза Соединения D.8, начиная с 200 мг, 0,401 ммоль D.7 и применяя NBS. Для обработки реакционную смесь гасили гидросульфатом калия (0,5 М) при -78°С. Добавляли дополнительное количество воды и продукт экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением Соединения 109 (0,151 г, 0,055 ммоль, выход: 14%, чистота: 21%) в виде желтого масла.
[0903] Выход: Указанное в заголовке соединение выделяли в виде бежевого твердого вещества (0,3% за 5 стадий).
[0904] Анализ: LCMS (Способ I): tR=1,77 мин; m/z рассч. для [М+Н]+=577,0/579,0, обнаруж.=576,9/578,9.
ПРИМЕР 112
Синтез Соединения 233

[0905] Соединение 235 получали в 3 стадии:
[0906] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридип-4-ил)метил)-3-оксобутаноата (15,0 г, 46,0 ммоль) и 4-хлорбензол-1,3-диола (1,20 экв.), следуя процедуре общего синтеза соединения D.4. После завершения реакции добавляли воду и образовавшуюся суспензию фильтровали. Остаток выпаривали совместно с EtOH и растирали в смеси EtOH/Et2O. Твердые вещества отфильтровывали, получая соответствующий кумарин (4,8 г, 13,55 ммоль, выход: 29%) в виде белого твердого вещества.
[0907] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, получали соответствующий диметилкарбамат (5,48 г, 11,86 ммоль, выход: 87%, чистота: 92%) в виде светло-желтого твердого вещества.
[0908] Стадия 3: Следуя процедуре общего синтеза Соединения D.6, начиная с 1,0 г, 2,35 ммоль соединения D.5. Снятие защиты с помощью TFA не проводили. Реакционную смесь фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=9:1 → 1:4) с получением указанного в заголовке соединения (0,12 г, 0,281 ммоль, выход: 12%) в виде бежевого твердого вещества.
[0909] Выход: Указанное в заголовке соединение выделяли в виде бежевого твердого вещества (3% за 3 стадии).
[0910] Анализ: LCMS (Способ I): tR=1,92 мин; m/z рассч. для [М+Н]+=406,1/408,1, обнаруж.=406,0/408,0.
ПРИМЕР 113
Синтез Соединения 234
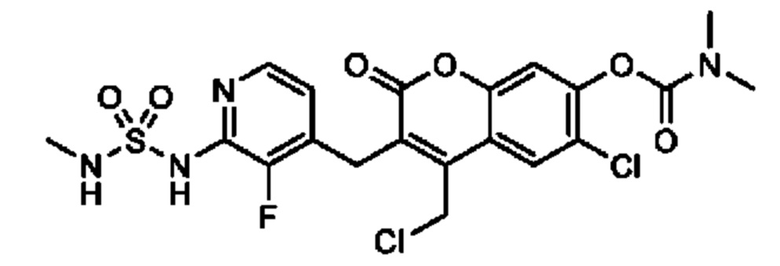
[0911] Соединение 236 получали в 5 стадии:
[0912] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутапоата (15,0 г, 46,0 ммоль) и 4-хлорбензол-1,3-диола (1,20 экв.), следуя процедуре общего синтеза соединения D.4. После завершения реакции добавляли воду и образовавшуюся суспензию фильтровали. Остаток выпаривали совместно с EtOH и растирали в смеси EtOH/Et2O. Твердые вещества отфильтровывали, получая соответствующий кумарин (4,8 г, 13,55 ммоль, выход: 29%) в виде белого твердого вещества.
[0913] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, получали соответствующий диметилкарбамат (5,48 г, 11,86 ммоль, выход: 87%, чистота: 92%) в виде светло-желтого твердого вещества.
[0914] Стадия 3: Следуя процедуре общего синтеза Соединения D.6, начиная с 1,0 г, 2,35 ммоль соединения D.5. Снятие защиты с помощью TFA не проводили. Реакционную смесь фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc = 9:1 → 1:4) с получением соответствующего первичного амина (0,12 г, 0,281 ммоль, выход: 12%) в виде твердого вещества бежевого цвета.
[0915] Стадия 4: Следуя процедуре общего синтеза Соединения D.7. После полного превращения реакционную смесь гасили водой. Продукт экстрагировали с применением EtOAc, объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (CH2Cl2MeOH = 1:0 → 96:4) с получением соответствующего сульфамоила (0,100 г, 0,198 ммоль, выход: 67%) в виде прозрачного масла.
[0916] Стадия 5: Следуя процедуре общего синтеза Соединения D.8, начиная с 80 мг, 0,16 ммоль D.7 и применяя NCS, получали указанное в заголовке соединение (0,044 г, 0,064 ммоль, выход: 40%, чистота: 77%) в виде твердого вещества бежевого цвета.
[0917] Выход: Соединение 236 выделяли в виде твердого вещества бежевого цвета (1% за 5 стадий).
[0918] Анализ: LCMS (Способ I): tR = 1,76 мин; m/z рассч. для [М+Н]+ = 561,2/563,2, обнаруж. = 561,0/563,0.
ПРИМЕР 114
Синтез Соединения 235
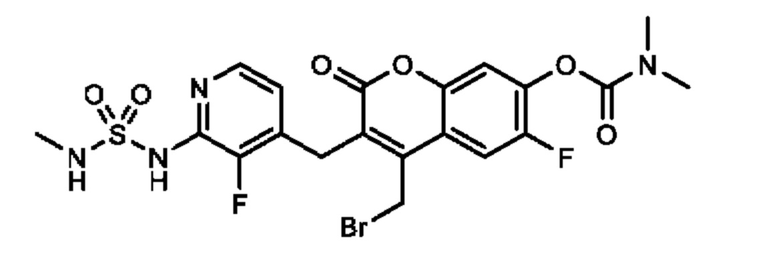
[0919] Соединение 237 получали в 5 стадии:
[0920] Стадия 1: Начиная с этил 2-((2-хлор-3-фторпиридин-4-ил)метил)-3-оксобутапоата (6,0 г, 18,42 ммоль) и 4-фторбензол-1,3-диола (1,27 экв.), следуя процедуре общего синтеза соединения D.4. После завершения реакции добавляли воду и образовавшуюся суспензию фильтровали. Остаток выпаривали совместно с EtOH и растирали в смеси EtOH/Et2O. Твердые вещества отфильтровывали, получая соответствующий кумарин (1,89 г, 4,53 ммоль, выход: 25%, чистота: 81%) в виде не совсем белого твердого вещества.
[0921] Стадия 2: Следуя процедуре общего синтеза Соединения D.5, начиная с 2,0 г, 5,92 ммоль кумарина. После полного превращения реакционную смесь выливали в 0,1 М HCl. Образовавшуюся суспензию фильтровали, а остаток упаривали с EtOH. Остаток растирали с DIPE в течение ночи и фильтровали с получением соответствующего диметилкарбамата (1,54 г, 3,77 ммоль, выход: 64%) в виде твердого вещества бежевого цвета.
[0922] Стадия 3: Следуя процедуре общего синтеза Соединения D.6, начиная с 0,75 г, 1,83 ммоль соединения D.5. Снимали защиту с помощью TFA и перемешивали в течение 48 часов. Реакционную смесь выливали в насыщ. водн. NaHCO3 и экстрагировали с применением EtOAc. Объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением желтого масла. Продукт очищали колоночной хроматографией методом «флеш» (MeOH/DCM 1:0 → 96:4) с получением желтого масла. Полученное вещество растворяли в CH2Cl2 (0,12 М), добавляли TFA (5,0 экв.) и перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь концентрировали и дважды упаривали с применением CH2Cl2 с получением соответствующего первичного амина (0,45 г, 1,05 ммоль, выход: 58%, чистота: 91%) в виде твердого вещества желтого цвета.
[0923] Стадия 4: Следуя процедуре общего синтеза Соединения D.7. После полного превращения реакционную смесь гасили насыщ. водн. NH4Cl. Продукт экстрагировали с применением EtOAc, объединенные органические слои промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией методом «флеш» (гептан/EtOAc=9:1 → 0:1) с получением соответствующего сульфамоила17 (0,100 г, 0,203 ммоль, выход: 17%) в виде твердого вещества желтого цвета.
[0924] Стадия 5: Следуя процедуре общего синтеза Соединения D.8. Реакцию гасили 1 М серной кислотой вместо 1 М HCl. После экстракции соединение очищали колоночной хроматографией методом «флэш» (гептан/EtOAc = 9:1 → 0:1) с получением указанного в заголовке соединения (0,10 г, 0,102 ммоль, выход: 49%, чистота: 57%) в виде твердого вещества бежевого цвета.
[0925] Выход: Соединение 237 выделяли в виде твердого вещества бежевого цвета (1% за 5 стадий).
[0926] Анализ: LCMS (Способ I): tR = 1,91 мин; m/z рассч. для [М+Н]+ = 533,0/535,0, обнаруж. = 533,0/535,0.
ПРИМЕР 115 Материалы и методы
[0927] Компоненты среды, реагенты и буферы для вестерн-блоттинга: Все компоненты среды для культивирования клеток были получены от ThermoFisher Scientific. Реагент для лизиса клеток/выделения белка (Cell Signal Technology, №по каталогу: 9803). 20 мМ Tris-HCl (рН 7,5), 150 мМ NaCl, 1 мМ Na2EDTA, 1 мМ EGTA, 1% тритона, 2,5 мМ пирофосфата натрия, 1 мМ бета-глицерофосфата, 1 мМ Na3 VO4, 1 мкг/мл лейпептина, ингибиторы протеазы (Roche, № по каталогу 11873580001), ингибиторы фосфатазы (Cell Signaling Technologies, № по каталогу 5870). Реагент для анализа белка Кумасси (Thermo Fisher Scientific, № по каталогу 1856209). Буфер Laemmli для загрузки образцов 4Х (Thermo Fisher Scientific, № по каталогу NP0007). Рабочий буфер для электрофореза MOPS/SDS (GenScript, № по каталогу М00138). Трис-буференный физиологический солевой раствор с Tween 20 (буфер TBST): 20 мМ трис-HCl (рН 7,5), 150 мМ NaCl, 0,1% Tween 20 NuPAGE гели, 4-12% (ThermoFisher Scientific, №по каталогу NP0322BOX), Набор для переноса нитроцеллюлозы iBLOT (ThermoFisher Scientific, №по каталогу IB301002). Блокирующий буфер (LICOR, № по каталогу 927-50000).
[0928] Антитела: Phospho-STAT3 (S727), мышиные поликлональные антитела были получены от BD Biosciences (№ по каталогу 612542), следующие 5 антител были получены от Cell Signaling Technologies. Ahth-STAT3, кроличьи моноклональные антитела (№ по каталогу 12640), анти-phospho-MEK1/2 (S218/S222), кроличьи поликлональные антитела (№ по каталогу 9121), анти-MEK-1/2, кроличьи моноклональные антитела (№ по каталогу 9122), анти-ERK, мышиные моноклональные антитела (№ по каталогу 9107) и анти-phospho-ERK, кроличьи моноклональные антитела (№ по каталогу 4377).
[0929] Вторичные антитела: IRDye 800CW козьи антикроличьи антитела (LICOR № по каталогу 926-32211), IRDye 680RD козьи антикроличьи антитела (LICOR № по каталогу 926-68071), IRDye 800CW козьи антимышиные антитела (LICOR № по каталогу 926-32210) и IRDye 680RD козьи антимышиные антитела (LICOR № по каталогу 926-68070).
[0930] Линии опухолевых клеток: Линии клеток и условия культурирования тканей: Клеточная линия А549 (№ по каталогу CCL-185) была получена из Американской коллекции типовых культур (АТСС) и выращена в колбах Т75 в среде DMEM, содержащей 10% FBS и Pen-Strep, при 37°С во влажном инкубаторе с 5%
со2.
[0931] Сингенная клеточная линия аденокарциномы Colon26 была получена из Национального института рака. Опухолевые клетки Colon26 поддерживали в виде экспоненциально растущих культур в среде RPMI-1640, содержащей 10% фетальной бычьей сыворотки, 2 мМ глутамина, 100 единиц/мл пенициллина G натрия, 100 мкг/мл сульфата стрептомицина, 25 мкг/мл гентамицина, 10 мМ HEPES и 0,075% бикарбоната натрия. Опухолевые клетки выращивали в колбах для тканевых культур во влажном инкубаторе при 37°С, в атмосфере 5% CO2 и 95% воздуха.
[0932] Условия субкуль ту рирования: Адгезивные клетки выращивали примерно до 90% слияния, культуральную среду отсасывали и клеточный слой промывали PBS. В колбу добавляли 2 мл раствора трипсина (0,25%) и наблюдали под инвертированным микроскопом до тех пор, пока клеточный слой не диспергировался. Добавляли 8 мл среды, клетки центрифугировали при 1000×g в течение 5 минут. Осадок клеток ресуспендировали в 10 мл среды и соответствующий объем инокулировали в новый культуральный флакон.
[0933] Обработка соединением (препаратом): Клетки высевали в 6-луночный планшет с плотностью 250000 - 300000 клеток/лунку в 3 мл среды и инкубировали при 37°С во влажном инкубаторе с 5% СО2. На следующий день 10 мМ исходные растворы соединений разбавляли 1О- и 10О-кратно в DMSO с получением 100 и 10 мкМ растворов соответственно. Эти растворы добавляли к клеткам (3 мкл/лунку), перемешивали, вращая планшет, и инкубировали при 37°С во влажном инкубаторе с 5% СО2 в течение 2 часов.
[0934] Оценка лизиса клеток и белка: Клетки промывали PBS и соскребали в 50 мкл буфера для лизиса, содержащего ингибиторы протеазы и фосфатазы. Клеточные лизаты хранили при -20°С. Клеточные лизаты оттаивали и вращали при 12000 об/мин в течение одной минуты, 3 мкл супернатанта добавляли к 500 мкл реагента Кумасси синего, а затем к 500 мкл воды. Поглощение считывали при 595 нм через 10 минут инкубации. Белковые стандарты применяли (О-20 мг/мл) для расчета концентрации белка в тестируемых образцах.
[0935] Вестерн-блоттинг: Для электрофореза 20 мкг белка смешивали с 5 мкл 4Х буфера для образцов Лэммля и 1 мкл 0,4 М DTT в объеме 20 мкл, заправленного буфером для лизиса. Все образцы нагревали при 95°С в течение 5 минут, охлаждали до комнатной температуры и центрифугировали. Образцы белков загружали в 4-12% полиакриламидные гели и выдерживали при 100 В в течение примерно 1,5 часов, пока синий краситель не достигал дна. После операционного цикла гель удаляли, а перенос белка выполняли с помощью iBlot в течение 7 минут в соответствии с рекомендациями производителя. После переноса нитроцеллюлозную мембрану инкубировали на шейкере в 5 мл блокирующего буфера при комнатной температуре в течение 1 часа. Затем блот инкубировали в течение ночи на шейкере в 5 мл блокирующего буфера, содержащего 0,2% Tween-20 и первичное антитело, при комнатной температуре. Антитело анти-phospho-STAT3 применяли в разведении 1:500, остальные 3 первичных антитела применяли в разведении 1:1000.
[0936] На следующий день блот промывали 3 раза по 10 мин 10 мл TBST с последующей инкубацией на шейкере в 5 мл блокирующего буфера, содержащего 0,2% Tween-20 и 0,5 мкл вторичных антител, меченных IRDye, в разведении 1:10000, при комнатной температуре в течение 1 часа. Затем блот промывали 3 раза по 10 мин 10 мл TBST и сушили между листами бумажных полотенец. Визуализацию осуществляли с помощью системы визуализации LICOR Odyssey, количественный анализ выполняли с помощью программного обеспечения Image Studio версии 3.1.
[0937] Исследования на животных: Самки мышей BALB/c (BALB/cAnNCrl, Charles River) были в возрасте девяти недель в День 1 исследования и имели диапазон массы тела (BW) от 15,8 до 21,4 г. Животным давали воду без ограничений (обратный осмос, 1 ppm Cl) и модифицированный и облученный лабораторный рацион NIH 31 (NIH 31 Modified and Irradiated Lab Diet®), состоящий из 18,0% сырого белка, 5,0% сырого жира и 5,0% сырой клетчатки. Мышей содержали на облученной подстилке Enrich-o'cobsTM в статических микроизоляторах с 12-часовым световым циклом при температуре 2О-22°С (68-72°F) и влажности 4О-60%. Charles River Discovery Services, Северная Каролина (CR Discovery Services), строго соблюдает рекомендации Руководства по уходу и использованию лабораторных животных в отношении ограничений, содержания, хирургических процедур, регулирования приема пищи и жидкости, а также ветеринарной помощи. Программа ухода за животными и их использования в CR Discovery Services аккредитована Международной ассоциацией по оценке и аккредитации по уходу за лабораторными животными (AAALAC), что обеспечивает соблюдение принятых стандартов ухода за лабораторными животными и их использования.
[0938] Имплантация и рост in vivo: Опухолевые клетки Colon26, применяемые для имплантации, собирали во время логарифмической фазы роста и повторно суспендировали в концентрации 1×107 клеток/мл в холодном фосфатно-солевом буфере (PBS). Каждой мыши вводили подкожно в правый бок 1×106 опухолевых клеток (в 0,1 мл клеточной суспензии). Опухоли измеряли штангенциркулем в двух измерениях для контроля размера по мере того, как средний объем приближался к желаемому диапазону от 80 до 120 мм3. Размер опухоли рассчитывали по формуле: объем опухоли (мм3)=(w2⋅l)/ 2, где w = ширина и  = длина опухоли в мм. Массу опухоли можно оценить, исходя из предположения, что 1 мг эквивалентен 1 мм3 объема опухоли. Опухоли измеряли штангенциркулем два раза в неделю на протяжении всего исследования.
= длина опухоли в мм. Массу опухоли можно оценить, исходя из предположения, что 1 мг эквивалентен 1 мм3 объема опухоли. Опухоли измеряли штангенциркулем два раза в неделю на протяжении всего исследования.
[0939] Лечение: Мыши BALB/c с опухолями были рандомизированы в группы лечения после достижения целевого диапазона (n=5 на группу). Все виды лечения вводили перорально (п.о.) один раз в день в течение четырнадцати дней (1 р/д х 14) в объеме 10 мл/кг (0,2 мл на 20 г мыши) в соответствии с массой тела каждого животного.
[0940] Отбор образцов для фармакокинетического анализа: Кровь, скелетные мышцы, печень и опухоли собирали у трех животных каждой из указанных групп через два часа после того, как животные получили разовую дозу. Полный объем крови собирали путем терминальной пункции сердца под анестезией изофлураном, обрабатывали для получения плазмы в присутствии антикоагулянта K2EDTA и хранили при -80°С. Группы скелетных мышц, состоящие из правой и левой икроножных, болыпеберцовых и камбаловидных мышц, собирали как единое целое, быстро замораживали и хранили при -80°С. Образцы печени собирали, быстро замороживали и отправляли в CRL-Worcester для биоаналитического анализа. Образцы описи прилагаются
[0941] Анализ данных: Опухоли измеряли штангенциркулем два раза в неделю, при этом данные выражали либо в виде медианы +/- межквартильный размах, либо в виде отдельных графиков в днях. Ингибирование роста опухоли (TGI) рассчитывали следующим образом: %TGI = 1 - (Т/С) × 100, где: Т = медианный объем опухоли для группы лечения и С= медианный объем опухоли для назначенной контрольной группы.
ПРИМЕР 116
Фармакокинетические свойства
[0942] Фиг. 3 демонстрирует результаты фармакокинетики (PK) икроножной мышцы для одного момента времени 2 часа в модели опухоли С26 для Эталона-1, Эталона-2, Соединения-7, Соединения-10, Соединения- 9, Соединения-11, Соединения-12, Соединения-13, Соединения-14, Соединения-15 и Соединения-16. Мыши с опухолью Colon26 получали однократную дозу (3 мыши/лечение) и через 2 часа после введения дозы подвергались гуманной эвтаназии. Кровь получали путем пункции сердца в пробирки с K+EDTA, перемешивали переворачиванием и центрифугировали для получения плазмы. Ткани иссекали и очищали от окружающих тканей. Все образцы немедленно замораживали в жидком азоте перед анализом LC-MS/MS (с применением колонки Waters HSS Т3 2,1×50 мм (1,8 мкм) и МС-блока API-6500 Electrospray).
[0943] Фиг. 4 демонстрирует результаты опухолевой фармакокинетики (PK) для одного момента времени 2 часа в модели опухоли С26 для Эталона-1, Эталона-2, Соединения-7, Соединения-10, Соединения- 9, Соединения-11, Соединения-12, Соединения-13, Соединения-14, Соединения-15 и Соединения-16. Мыши с опухолью Со1оп26 получали однократную дозу (3 мыши/лечение) и через 2 часа после введения дозы подвергались гуманной эвтаназии. Кровь получали путем пункции сердца в пробирки с K+EDTA, перемешивали переворачиванием и центрифугировали для получения плазмы. Ткани иссекали и очищали от окружающих тканей. Все образцы немедленно замораживали в жидком азоте перед анализом LC-MS/MS (с применением колонки Waters HSS Т3 2,1×50 мм (1,8 мкм) и МС-блока API-6500 Electrospray).
[0944] Фиг. 5 демонстрирует результаты фармакокинетики (PK) плазмы для одного момента времени 2 часа в модели опухоли С26 для Эталона-1, Эталона-2, Соединения-7, Соединения-10, Соединения-9, Соединения-11, Соединения-12, Соединения-13, Соединения-14, Соединения-15 и Соединения-16. Мыши с опухолью Colon26 получали однократную дозу (3 мыши/лечение) и через 2 часа после введения дозы подвергались гуманной эвтаназии. Кровь получали путем пункции сердца в пробирки с K+EDTA, перемешивали переворачиванием и центрифугировали для получения плазмы. Ткани иссекали и очищали от окружающих тканей. Все образцы немедленно замораживали в жидком азоте перед анализом LC-MS/MS (с применением колонки Waters HSS Т3 2,1×50 мм (1,8 мкм) и МС-блока API-6500 Electrospray).
[0945] Фиг. 6 демонстрирует результаты печеночной фармакокинетики (РК) для одного момента времени 2 часа в модели опухоли С26 для Эталона-1, Эталона-2, Соединения-7, Соединения-10, Соединения-9, Соединения-11, Соединения-12, Соединения-13, Соединения-14, Соединения-15 и Соединения-16. Мыши с опухолью Colon26 получали однократную дозу (3 мыши/лечение) и через 2 часа после введения дозы подвергались гуманной эвтаназии. Кровь получали путем пункции сердца в пробирки с K+EDTA, перемешивали переворачиванием и центрифугировали для получения плазмы. Ткани иссекали и очищали от окружающих тканей. Все образцы немедленно замораживали в жидком азоте перед анализом LC-MS/MS (с применением колонки Waters HSS Т3 2,1×50 мм (1,8 мкм) и МС-блока API-6500 Electrospray).
[0946] Фиг. 7А демонстрирует сравнительное исследование MTD, несущего опухоль С-26, между Эталоном-1 и Соединением-9 в дозе 100 мг/кг 1 р/д. Эффективность Эталона-1 и Соединения-9 в общепризнанном аллотрансплантате сингенной опухоли Colon26 (С26) после п. о. введения (один раз в день (1 р/д) в течение 14 дней мышам в дозе 100 мг/кг. Каждая сплошная жирная линия представляет собой средний объем опухоли ± межквартильный диапазон для n=5 животных. Пунктирные линии одного цвета (с одинаковыми символами данных меньшего размера) представляют отдельные объемы опухолей мышей, соответствующих одной и той же группе лечения. Заштрихованная область под осью абсцисс - дни приема препарата. Ингибирование роста опухоли (TGI) рассчитывается как 1-Т/С, где Т = медианный объем опухоли в группе, получающей лечение, и С = медианный объем опухоли в контрольной группе, получающей лечение, и выражается в процентах.
[0947] Фиг. 7 В демонстрирует сравнительное исследование MTD, несущего опухоль С26, между Соединением-13 и Соединением-14 в дозе 100 мг/кг 1 р/д. Эффективность Соединения-13 и Соединения-14 в общепризнанном аллотрансплантате сингенной опухоли Colon26 (С26) после п.о. введения (один раз в день (1 р/д) в течение 14 дней мышам в дозе 100 мг/кг. Каждая сплошная жирная линия представляет собой средний объем опухоли ± межквартильный диапазон для n=5 животных. Пунктирные линии одного цвета (с одинаковыми символами данных меньшего размера) представляют отдельные объемы опухолей мышей, соответствующих одной и той же группе лечения. Заштрихованная область под осью абсцисс - дни приема препарата. Ингибирование роста опухоли (TGI) рассчитывается как 1-Т/С, где Т = медианный объем опухоли в группе, получающей лечение, и С = медианный объем опухоли в контрольной группе, получающей лечение, и выражается в процентах.
[0948] Фиг. 8А демонстрирует сравнительное исследование MTD, несущего опухоль С26, между Эталоном-1 и Соединением-9 в дозе 100 мг/кг 2 р/д. Эффективность Эталона-1 и Соединения-9 в общепризнанном аллотрансплантате сингенной опухоли Colon26 (С26) после п.о. введения (два раза в день (2 р/д) в течение 14 дней мышам в дозе 100 мг/кг (общая суточная доза 200 мг/кг с интервалом не менее 8 ч между дозами). Каждая сплошная жирная линия представляет собой средний объем опухоли ± межквартильный диапазон для n=5 животных. Пунктирные линии одного цвета (с одинаковыми символами данных меньшего размера) представляют отдельные объемы опухолей мышей, соответствующих одной и той же группе лечения. Заштрихованная область под осью абсцисс - дни приема препарата. Ингибирование роста опухоли (TGI) рассчитывается как 1-Т/С, где Т = медианный объем опухоли в группе, получающей лечение, и С = медианный объем опухоли в контрольной группе, получающей лечение, и выражается в процентах.
[0949] Фиг. 8 В демонстрирует сравнительное исследование MTD, несущего опухоль С26, между Соединением-13 и Соединением-14 в дозе 100 мг/кг 2 р/д. Эффективность Соединения-13 и Соединения-14 в общепризнанном аллотрансплантате сингенной опухоли Colon26 (С26) после п. о. введения (два раза в день (2 р/д) в течение 14 дней мышам в дозе 100 мг/кг (общая суточная доза 200 мг/кг с интервалом не менее 8 ч между дозами). Каждая сплошная жирная линия представляет собой средний объем опухоли ± межквартильный диапазон для n=5 животных. Пунктирные линии одного цвета (с одинаковыми символами данных меньшего размера) представляют отдельные объемы опухолей мышей, соответствующих одной и той же группе лечения. Заштрихованная область под осью абсцисс - дни приема препарата. Ингибирование роста опухоли (TGI) рассчитывается как 1-Т/С, где Т = медианный объем опухоли в группе, получающей лечение, и С = медианный объем опухоли в контрольной группе, получающей лечение, и выражается в процентах.
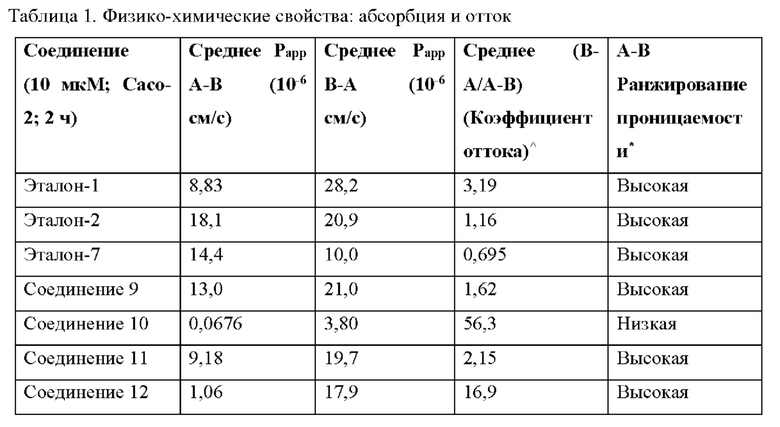

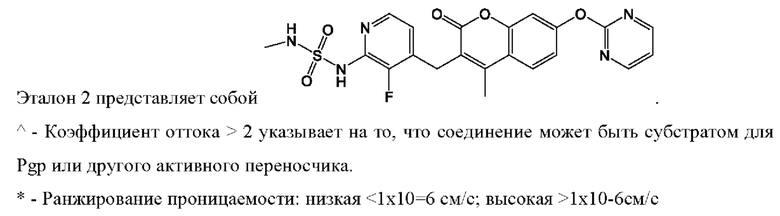
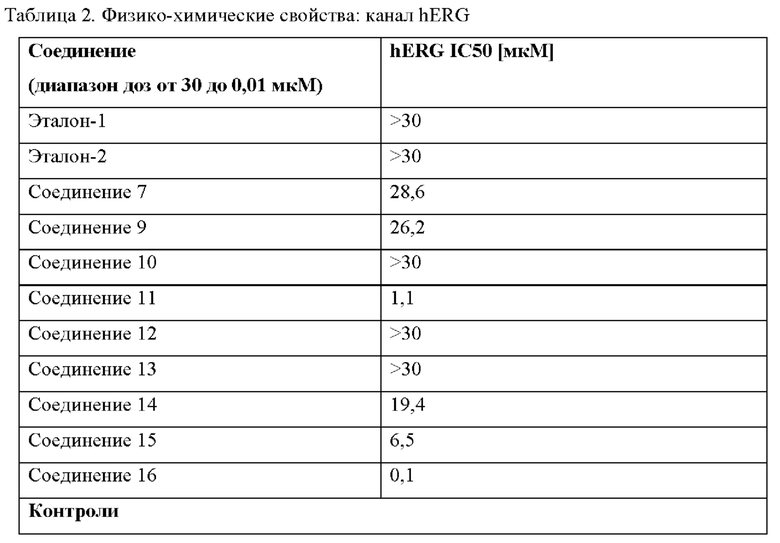


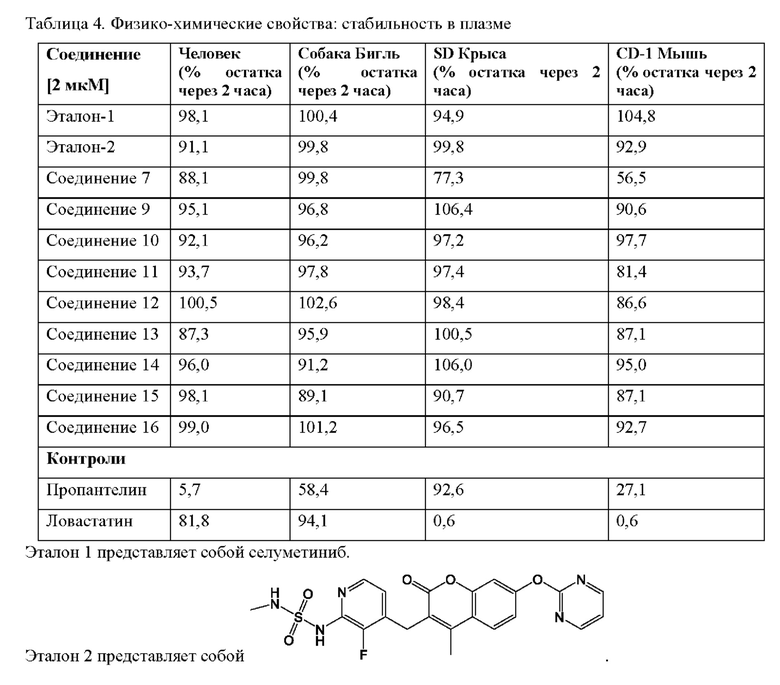

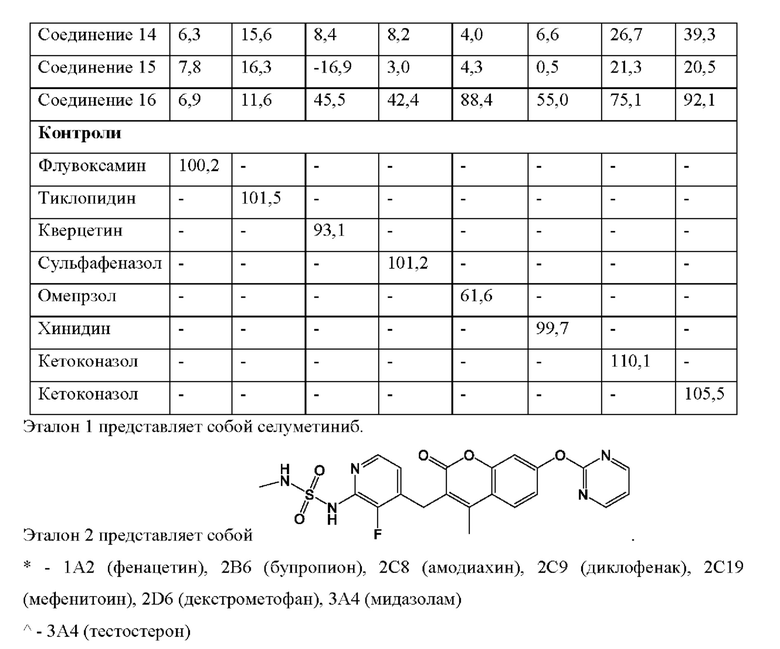
Исследование ответа на дозу pERK на основе клеток
[0950] Материалы и способы: Клетки А549 или А375 высевали в 6-луночные планшеты с соответствующей плотностью посева в день 0. На день 2 или 3, после проверки состояния и слияния клеток, среду аспирировали и заменяли 1 мл среды, содержащей заданную концентрацию соединения, и инкубировали в течение 2 часов. Через 2 часа среду аспирировали и клетки дважды промывали холодным PBS. Клетки лизировали на льду с применением 50 мкл лизирующего буфера IX CST + 1 мМ PMSF в течение 5 минут. Через 5 минут клетки удаляли с помощью скребка и переносили в холодные 1,5 мл пробирки и центрифугировали в течение 10 минут, 4°С, 14000g. Супернатант осторожно удаляли и быстро замораживали в жидком азоте. Концентрацию белка в лизате определяли с применением реагента Брэдфорда (анализировали с помощью SpectraMax М2Е) и разбавляли до 1 мг/мл или pERK или 1,5 мг/мл для анализа pMEK. Затем клеточные лизаты анализировали на уровни фосфор-ERK/общий-ERK в системе Jess (ProteinSimple; №по каталогу JS3346) с применением следующих антител: fERK1/2 (CST 4696; 1:50) и pERK1/2 (CST 4377; 1:50). Для pMEK/tMEK применяли следующие антитела: tMEK1/2 (CST 4694; 1:15) и pMEK1/2 (CST 9154; 1:400). Все разведения осуществляли в разбавителе антител, не содержащем молока.
[0951] Микросомы мыши и человека (t1/2 мин), Clint мыши и человека (мкл/мин/мг)
[0952] Тестируемые соединения растворяли в DMSO до концентрации 10 мМ и дополнительно разбавляли до 100 мкМ с применением ацетонитрила. Микросомы печени выбранных видов инкубировали в двух повторностях с тестируемым соединением в конечной концентрации 1 мкМ в 0,1 М калий-фосфатном буфере (рН 7,4), содержащем 3,3 мМ MgCl2, 0,5 мг/мл микросомального белка, в присутствии или в отсутствие NADPH (1 мМ). Инкубацию проводили при 37°С в общем объеме 500 мкл. Для каждого эксперимента включали контрольные инкубации с эталонными веществами.
[0953] В разные моменты времени (t = 0, 5, 15, 30, 45 мин) 50 мкл инкубационной смеси переносили в охлажденный до 4°С планшет, содержащий ацетонитрил и внутренний стандарт (200 нМ лабеталола). После последнего момента времени планшеты для гашения тщательно перемешивали и центрифугировали в течение 15 минут при 3700 об/мин и 10°С (Eppendorf 5804R). Супернатант переносили в новые 96-луночные планшеты и подвергали анализу LC-MS. Определяли исчезновение исходного соединения.
[0954] Анализ всех образцов выполняли с помощью системы Vanquish Horizon UHPLC, оснащенной автоматическим пробоотборником, бинарным насосом, отделением для колонки и детектором с диодной матрицей, соединенным с масс-спектрометром с гибридным квадрупольно-орбитальным захватом Q Exactive focus (Thermo Fisher Scientific), оснащенным электрораспылительным ионным источником с подогревом.
[0955] Процент оставшегося тестируемого соединения определяли как отношение площади пика тестируемого соединения в конкретный момент времени к площади пика в образцах t = 0 мин, умноженное на 100%.
[0956] Метаболическую стабильность оценивали путем построения графика натурального логарифма процентного содержания оставшегося тестируемого соединения в зависимости от времени и проведения линейной регрессии. С помощью этого графика рассчитывали следующие параметры: константа элиминации k (мин-1) = -наклон, in vitro период полувыведения (t1/2) = ln(2)/k, in vitro внутренний клиренс Clint (в мкл/мин/мг белка) = [ln(2) х инкубационный объем в мкл/мг белка] / t1/2.
[0957] Кинетическая растворимость (PBSpH = 7,4; 4 часа)
[0958] Тестируемые соединения растворяли в DMSO до концентрации 10 мМ и дополнительно разбавляли до 100 мкМ в буфере (10 мМ PBS, рН 7,4) в 96-луночном планшете при конечной концентрации DMSO 1%. Планшеты встряхивали в течение 4 ч при комнатной температуре в термомиксере Eppendorf. После инкубации планшеты центрифугировали в течение 20 минут при 4680 об/мин. Из супернатанта 150 мкл переносили в новый 96-луночный планшет и добавляли 50 мкл DMSO для обеспечения непрерывного растворения. Образцы измеряли с помощью LC-UV при объемах введения 1 и 8 мкл. Площади пиков определяли и сравнивали с площадями пиков, полученными с помощью калибровочных кривых тестируемых соединений в DMSO. Все анализы образцов проводили с помощью системы Agilent 1290 HPLC, оснащенной автоматическим пробоотборником, бинарным насосом, отделением для колонки и детектором с диодной матрицей.
[0959] eLogD (липофилъностъ; рН = 7.4)
[0960] Тестируемые соединения растворяли в DMSO в концентрации 10 мМ и дополнительно разбавляли смесью метанол:вода 1:1. Образцы анализировали с применением градиентной HPLC с тремя различными изократическими подвижными фазами 0,25% октанола в метаноле (60, 65 и 70%) и 20 мМ буфера MOPS (рН 7,4) с дециламином. При необходимости (для соединений с низким ElogDoct) изократические подвижные фазы доводили, например, до 40, 45 и 50% метанола. Пики считывали с помощью диодной матрицы при поглощении 22О-320 нм.
[0961] Данные коэффициентов мощности 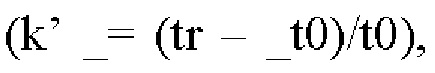 полученные при различных количествах метанола, эстраполировали на 0% метанола, а значения k'w определяли с использованием линейной процедуры. ElogDoct (7.4) рассчитывали с применением ряда эталонных стандартов с известными значениями LogD. Каждый эксперимент проводили в трех повторностях.
полученные при различных количествах метанола, эстраполировали на 0% метанола, а значения k'w определяли с использованием линейной процедуры. ElogDoct (7.4) рассчитывали с применением ряда эталонных стандартов с известными значениями LogD. Каждый эксперимент проводили в трех повторностях.
[0962] Все анализы образцов проводили с помощью системы Agilent HPLC, оснащенной автоматическим пробоотборником, бинарным насосом, отделением для колонки и детектором с диодной матрицей.
[0963] РАМРА (рН = 7,4; Рарр 1О-6 см/с)
[0964] Исследования РАМРА проводили с применением набора РАМРА Explorer (pION Inc.) и протокола Double-Sink (Avdeef, 2005). Исходные растворы всех тестируемых соединений растворяли в DMSO до концентрации 10 мМ. Каждый исходный раствор разводили до 50 мкМ в буфере Prisma НТ (pION) с рН 7,4 и добавляли по 200 мкл в каждую лунку донорного планшета в трех повторностях. Мембрану фильтра из поливинилиденфторида (PVDF, 0,45 мкм) на акцепторном планшете покрывали 5 мкл липидного состава желудочно-кишечного тракта (GIT-0, pION), а в каждую лунку акцепторного планшета добавляли 200 мкл акцепторного поглотительного буфера (acceptor sink buffer) (pION). Затем акцепторный фильтровальный планшет осторожно помещали поверх донорного планшета с образованием сэндвича. Сэндвич инкубировали при 25°С в течение 4 ч без перемешивания. UV-видимые спектры растворов в контрольных, эталонных, акцепторных и донорных планшетах измеряли с помощью устройства для считывания микропланшетов (Tecan Infinite 200PRO М Nano Plus). Значения проницаемости рассчитывали с помощью программного обеспечения РАМРА explorer v. 3.8.0.2 (pION). В каждый эксперимент включали контрольные инкубации с кетопрофеном (низкая проницаемость) и верапамилом (высокая проницаемость).
[0965] Фиг. 9 демонстрирует исследование ответа на дозу А549 (KRAS-G12S) pERK. Результаты также приведены в Таблице 6.


[0966] Результаты исследования скрининга phospho-ERK в А549 (KRAS G12S) описаны в Таблицах 7, 7А, 7В и 8 ниже

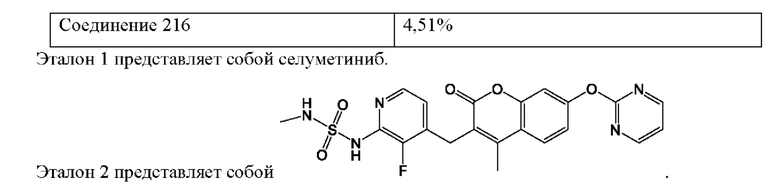
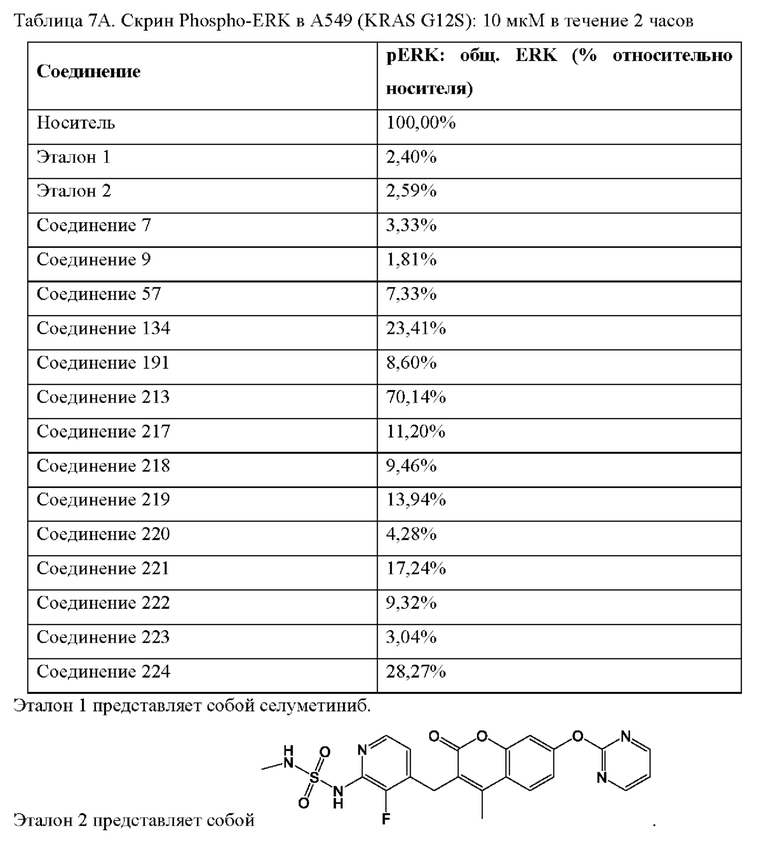
ПРИМЕР 118
Исследование ID метаболита
[0967] Исследования на животных: Соединение 9 тестировали с применением гепатоцитов шести видов в исследовании ID метаболита (Т=60 мин). Результаты этих исследований представлены в Таблице 8.

[0968] Тестируемые соединения растворяли в DMSO до концентрации 10 мМ и дополнительно разбавляли до 100 мкМ раствора в DMSO:MQ 1:1. Криоконсервированные гепатоциты выбранных видов оттаивали и инкубировали в двух повторностях с 10 мкМ соединения 9 в буфере Кребса-Хензелейта. Инкубации проводили в общем объеме 350 мкл, при 0,5×106 клеток/мл. Для каждого вида были включены контрольные инкубации с эталонными веществами: верапамилом, 7-гидроксикумарином, пропранололом и дилтиаземом. Жизнеспособность гепатоцитов после размораживания составляла >70%.
[0969] В разные моменты времени 50 мкл инкубационной смеси переносили в охлажденный до 4°С планшет, содержащий ацетонитрил и внутренний стандарт. После последнего момента времени (t=60 минут) планшеты для гашения тщательно перемешивали и центрифугировали в течение 15 минут при 3700 об/мин и 10°С (Eppendorf 5804R). Супернатант переносили в новые 96-луночные планшеты и подвергали анализу LC-MS. Определяли исчезновение исходного соединения и оценивали образование метаболитов. Метаболиты, присутствующие в количестве более 1% от общего материала, связанного с соединением (на основании площади пика), идентифицировали путем интерпретации данных LC-MS/MS.
[0970] Анализ всех образцов выполняли с помощью системы Vanquish Horizon UHPLC, оснащенной автоматическим пробоотборником, бинарным насосом, отделением для колонки и детектором с диодной матрицей, соединенным с масс-спектрометром с гибридным квадрупольно-орбитальным захватом Q Exactive focus (Thermo Fisher Scientific), оснащенным электрораспылительным ионным источником с подогревом. Настройки MS были оптимизированы для скорости потока. Спектры полного сканирования получали в сочетании с зависимым от данных MS2.
[0971] Образование и идентификацию метаболитов оценивали в соответствии со следующим подходом:
[0972] Спектры, полученные от всех образцов, подвергали скринингу на наличие значений m/z, отсутствующих в холостых инкубациях (инкубации с гепатоцитами без соединения и с контролем носителя и инкубации с соединением в буфере без гепатоцитов). В качестве начального скрининга использовали инкубацию Т=60 мин. Все возможные наблюдаемые метаболиты полуколичественно оценивали по ответу MS (площадь пика). Спектры MS2 интерпретировали для определения возможной локализации реакции метаболизма. Наличие идентифицированных метаболитов сравнивали для выбранных видов.
[0973] Соединение 9 не подвергалось экстенсивному метаболизму в гепатоцитах разных видов. В процентах от общего материала, связанного с соединением, на MS-хроматограммах инкубации гепатоцитов оставалось примерно от 92 до 98% исходного соединения (на основании площади пика). Первичный метаболит продемонстрирован для каждого вида жирным шрифтом. Несколько обнаруженных масс также присутствовали при инкубации с соединением в буфере и не считались метаболитами.
ПРИМЕР 119
Модель Colon-26 (KRAS G12D CRQ: эффективность и безопасность
[0974] В этих исследованиях использовали самок бестимусных мышей «BALB/c nude» или «BALB/c» (Beijing Vital River Laboratory Animal Technology Co., Ltd.) в возрасте приблизительно 8-10 недель. Животных содержали в индивидуально вентилируемых клетках с 12-часовым циклом «свет-темнота». Пища и вода были доступны ad libitum. Опухолевые клетки Colon-26 поддерживали in vitro в среде RPMI1640 с добавлением 10% эмбриональной бычьей сыворотки при 37°С в атмосфере с 5% СО2 в воздухе. Клетки в фазе экспоненциального роста собирали и количественно определяли с помощью счетчика клеток перед инокуляцией опухоли. Каждой мыши инокулировали подкожно в правый бок опухолевые клетки Colon-26 (5×105) в 0,1 мл PBS. Рандомизацию начинали, когда средний размер опухоли достиг приблизительно 125 мм3. Всего в исследование было включено 84 мыши с опухолями, которые были разделены на 7 групп лечения (по 12 мышей в группе). Также 12 мышей без опухолей были отнесены к группе, не подвергавшейся лечению.
[0975] Животным вводили либо носитель (10% DMSO/90% [20% SBE-β-CD в физиологическом солевом растворе], рН 5), либо соединения, содержащие носитель, в указанных дозах через желудочный зонд (п.о.) два раза в день в течение приблизительно 28-42 дней (2 р/д х 28-42 п.о.), или до достижения этических критериев оценки (BWL>20%, медианный объем опухоли (MTV) > 2000 мм3, индивидуальный TV > 3000 мм3, клинические признаки патологического состояния). Клинические признаки патологического состояния характеризовались, но не ограничивались следующим. Выраженное обезвоживание, гипотермия, аномальное/затрудненное дыхание, вялость, выраженная боль, диарея, поражения кожи, неврологические симптомы, нарушение подвижности (неспособность есть или пить) из-за значительного асцита и увеличения живота, астазия, постоянное положение на животе или на боку, признаки мышечной атрофии, паралитическая походка, клонические судороги, тонические судороги, упорное кровотечение из физиологических отверстий тела. Введение дозы, а также измерения массы опухоли и тела проводили в боксе с ламинарным потоком.
[0976] Животных ежедневно анализировали на заболеваемость и смертность. В ходе планового мониторинга животных анализировали на любое влияние роста опухоли и лечения на поведение, такое как подвижность, потребление пищи и воды, прибавка/потеря массы тела (массу тела измеряли два раза в неделю после рандомизации), патологию глаз/спутывание шерсти и любые другие аномалии. Подробно регистрировали частоту смертности и наблюдаемые клинические признаки для отдельных животных.
[0977] Объемы опухолей измеряли два раза в неделю после рандомизации в двух измерениях с помощью штангенциркуля, и объем выражали в мм3 по формуле: V = (L × W × W)/2, где V - объем опухоли, L - длина опухоли (самый длинный размер опухоли), a W - ширина опухоли (самый длинный размер опухоли, перпендикулярный L). Результаты были представлены в виде медианного объема опухоли, выраженного в мм3 +/- межквартильного диапазона для каждой группы. Ингибирование роста опухоли; TGI% = [1-(Ti/(Ci)]×100; где Ti - медианный объем опухоли в группе лечения в день измерения, Ci - медианный объем опухоли в контрольной группе в день измерения.
[0978] Массу тела и объемы опухоли измеряли с помощью программного обеспечения Study DirectorTM (версия 3.1.399.19).
[0979] Протокол и любые поправки или процедуры, связанные с уходом за животными и их использованием в этом исследовании, были рассмотрены и одобрены Институциональным комитетом по уходу и использованию животных (IACUC) CrownBio перед исполнением. Во время исследования уход за животными и их использование проводились в соответствии с правилами Ассоциации по оценке и аккредитации ухода за лабораторными животными (AAALAC).
[0980] Таблица 9 и Фиг. 10, 11А, 11В и 12 иллюстрируют результаты этого исследования.

ПРИМЕР 120
Двойной RAF/MEK. устойчивый к обходу CRAF
[0981] Клетки А549 или 375 обрабатывали дважды в течение двух часов соединениями в различных концентрациях. Через два часа клетки лизировали, мгновенно замораживали и хранили при -80°С. После хранения лизат количественно определяли с помощью анализа Брэдфорда. Перед тем как лизаты готовили для запуска на Jess, лизаты разбавляли до концентрации 1 мг/мл для анализа pERK и анализа pMEK до 1,5 мг/мл с помощью количественного вестерн-блоттинга. Уровни фосфорилирования ERK и МЕК оценивали, взяв отношение фосфопротеина к общему белку и нормализовав его по отношению к контролю DMSO. На Фиг. 13, 14А, 14В, 15А и 15В приведены результаты этого исследования.
ПРИМЕР 121 Кривые «доза-ответ»
[0982] А549 (номер по каталогу CCL-185) клеточную линию получали из Американской коллекции типовых культур (АТСС). Их выращивали в колбах Т75 в среде DMEM, содержащей 10% FBS и Pen-Strep, при 37°С во влажном инкубаторе с 5% СО2. Адгезивные клетки выращивали примерно до 90% слияния, культуральную среду аспирировали и клеточный слой промывали PBS. В колбу добавляли 2 мл раствора трипсина (0,25%) и наблюдали под инвертированным микроскопом до тех пор, пока клеточный слой не диспергировался. Добавляли 8 мл среды, клетки центрифугировали при 1000×g в течение 5 минут. Осадок клеток ресуспендировали в 10 мл среды и соответствующий объем инокулировали в новый культуральный флакон. Клетки высевали в 6-луночный планшет с плотностью 250000 - 300000 клеток/лунку в 3 мл среды и инкубировали при 37°С во влажном инкубаторе с 5% СО2. На следующий день 10 мМ исходные растворы соединений разбавляли 10- и 100-кратно в DMSO с получением 100 и 10 мкМ растворов соответственно. Эти растворы добавляли к клеткам (3 мкл/лунку), перемешивали, вращая планшет, и инкубировали при 37°С во влажном инкубаторе с 5% СО2 в течение 2 часов. Клетки промывали PBS и соскребали в 50 мкл буфера для лизиса, содержащего ингибиторы протеазы и фосфатазы. Клеточные лизаты хранили при -20°С. Клеточные лизаты оттаивали и вращали при 12000 об/мин в течение одной минуты, 3 1 мкл супернатанта добавляли к 500 мкл реагента Кумасси синего, а затем к 500 мкл воды. Поглощение считывали при 595 нм через 10 минут инкубации. Белковые стандарты применяли (О-20 мг/мл) для расчета концентрации белка в тестируемых образцах. Для электрофореза 20 мкг белка смешивали с 5 мкл 4Х буфера для образцов Лэммля и 1 мкл 0,4 М DTT в объеме 20 мкл, заправленного буфером для лизиса. Все образцы нагревали при 95°С в течение 5 минут, охлаждали до комнатной температуры и центрифугировали. Образцы белков загружали в 4-12% полиакриламидные гели и выдерживали при 100 В в течение около 1,5 часов, пока синий краситель не достигал дна. После операционного цикла гель удаляли, а перенос белка выполняли с помощью iBlot в течение 7 минут в соответствии с рекомендациями производителя. После переноса нитроцеллюлозную мембрану инкубировали на шейкере в 5 мл блокирующего буфера при комнатной температуре в течение 1 часа. Затем блот инкубировали в течение ночи на шейкере в 5 мл блокирующего буфера, содержащего 0,2% Tween-20 и первичное антитело, при комнатной температуре. Антитело анти-phospho-STAT3 применяли в разведении 1:500, остальные 3 первичных антитела применяли в разведении 1:1000. На следующий день блот промывали 3 раза по 10 мин 10 мл TBST с последующей инкубацией на шейкере в 5 мл блокирующего буфера, содержащего 0,2% Tween-20 и 0,5 мкл вторичных антител, меченных IRDye, в разведении 1:10000, при комнатной температуре в течение 1 часа. Затем блот промывали 3 раза по 10 мин 10 мл TBST и сушили между листами бумажных полотенец.
[0983] Антитела: Phospho-STAT3 (S727), мышиные поликлональные антитела были получены от BD Biosciences (№ по каталогу 612542), следующие 3 антитела были получены от Cell Signaling Technologies. Ahth-STAT3, кроличьи моноклональные антитела (№ по каталогу 12640), анти-ERK, мышиные моноклональные антитела (№ по каталогу 9107) и анти-phospho-ERK, кроличьи моноклональные антитела (№ по каталогу 4377).
[0984] Вторичные антитела: IRDye 800CW козьи антикроличьи антитела (LICOR № по каталогу 926-32211), IRDye 680RD козьи антикроличьи антитела (LICOR № по каталогу 926-68071), IRDye 800CW козьи антимышиные антитела (LICOR № по каталогу 926-32210) и IRDye 680RD козьи антимышиные антитела (LICOR № по каталогу 926-68070).
[0985] Визуализацию осуществляли с помощью системы визуализации LICOR Odyssey, количественный анализ выполняли с помощью программного обеспечения Image Studio версии 3.1.
ПРИМЕР 122 Фармакокинетика
[0986] Самок мышей (бестимусных мышей BALC/c nude или мышей BALB/c) инокулировали однократной подкожной инъекцией 0,2 мл суспензии клеток Colon-26 мыши (1x105 клеток на животное) в паховую область. Мыши с опухолями Colon26 (С26) получали разовую дозу (3 мыши/лечение) носителя (10% DMSO/90% [20% SBE-β-CD в физиологическом солевом растворе], рН 5), содержащего соединения в количестве 100 мг/кг через желудочный зонд (п.о.) и были гуманно усыплены через 2 часа после введения дозы.
[0987] Кровь получали путем пункции сердца в пробирки с K+EDTA, перемешивали переворачиванием и центрифугировали для получения плазмы. Ткани иссекали и очищали от окружающих тканей. Все образцы немедленно замораживали в жидком азоте перед анализом LC-MS/MS (с применением колонки Waters HSS Т3 2,1×50 мм (1,8 мкм) и МС-блока API-6500 Electrospray). Результаты этих исследований представлены в Таблице 10.

ПРИМЕР 123
Фармакокинетический профиль для Соединений 9 и 197
[0988] Самок мышей (бестимусных мышей BALC/c nude или мышей BALB/c) инокулировали однократной подкожной инъекцией 0,1 мл суспензии клеток Colon-26 мыши (1×105 клеток на животное) область правого бока. Мыши с опухолями Со1оп26 (С26) получали разовую дозу (3-4 мыши/лечение) носителя (10% DMSO/90% [20% SBE-β-CD в физиологическом солевом растворе], рН 5), содержащего соединения в указанной дозе, через желудочный зонд (п.о.) или внутривенное введение (в.в.) и в различные моменты времени после введения дозы (0,16, 0,5, 1, 2, 4, 8, 12, 16, 24 часа) были гуманно усыплены. Кровь получали путем пункции сердца в пробирки с K+EDTA, перемешивали переворачиванием и центрифугировали для получения плазмы. Ткани иссекали и очищали от окружающих тканей. Все образцы немедленно замораживали в жидком азоте перед анализом LC-MS/MS (с применением колонки Agilent Poroshell-120 ЕС-С18 (4,0 мкм) 2,1x50 мм и MS -блока Water+ API-4000 Electrospray). Результаты этого исследования представлены на Фиг. 16 и 17. В Таблице 11 описан РК-профиль однократной дозы (плазма), а в Таблице 12 описан РК-профиль однократной дозы (опухоль).
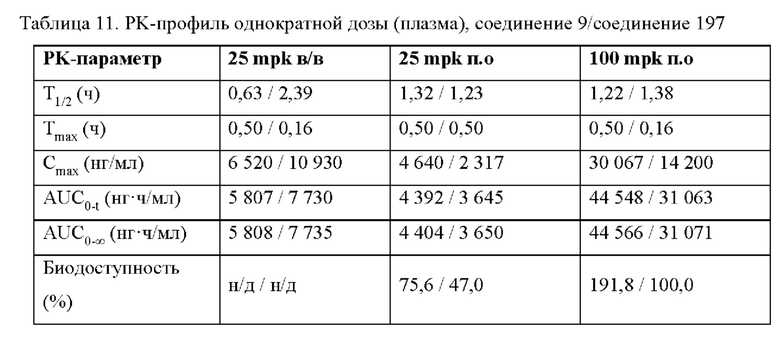
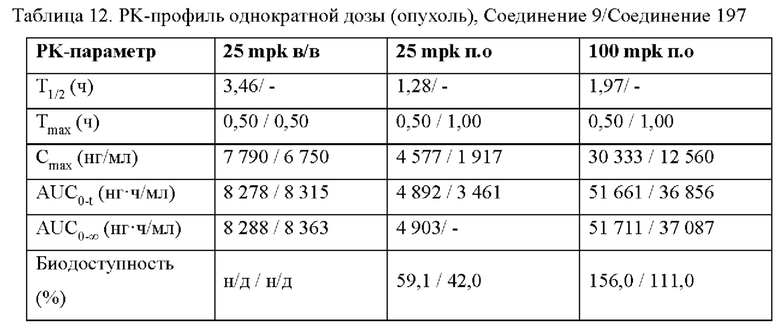
Пример 124:
А549 Масса тела ксенотрансплантата (23 дня. 2 р/д. п. о введение
[0989] В этих исследованиях использовали самок бестимусных мышей BALB/c nude (Beijing Anikeeper Biotech Co., Ltd (Пекин, Китай)), возрастом приблизительно 8-9 недель. Животных содержали в индивидуально вентилируемых клетках с 12-часовым циклом «свет-темнота». Пища и вода были доступны ad libitum. Опухолевые клетки А549 поддерживали in vitro в среде Хэма F12K с добавлением 10% фетальной телячьей сыворотки при 37°С в атмосфере с 5% СО2 в воздухе. Клетки в фазе экспоненциального роста собирали и количественно определяли с помощью счетчика клеток перед инокуляцией опухоли. Каждой мыши инокулировали подкожно в правый бок опухолевые клетки А549 (5×105) в 0,1 мл PBS. Рандомизацию для инокуляции начинали, когда средний размер опухоли достигал приблизительно 144 мм3. Всего в исследование было включено 48 мышей, которые были разделены на 8 групп, как описано в Разделе 4, по 6 мышей в группе.
[0990] Животным вводили либо носитель (10% DMSO/90% [20% SBE-β-CD в физиологическом солевом растворе], рН 5), либо соединения, содержащие носитель, в указанных дозах через желудочный зонд (п.о.) два раза в день в течение 23 дней (2 р/д х 23, п. о.) или до достижения этических критериев оценки (BWL > 20%, медианный объем опухоли (MTV) > 2000 мм3, индивидуальный TV > 3000 мм3, клинические признаки патологического состояния). Клинические признаки патологического состояния характеризовались, но не ограничивались следующим. Выраженное обезвоживание, гипотермия, аномальное/затрудненное дыхание, вялость, выраженная боль, диарея, поражения кожи, неврологические симптомы, нарушение подвижности (неспособность есть или пить) из-за значительного асцита и увеличения живота, астазия, постоянное положение на животе или на боку, признаки мышечной атрофии, паралитическая походка, клонические судороги, тонические судороги, упорное кровотечение из физиологических отверстий тела. Введение дозы, а также измерения массы опухоли и тела проводили в боксе с ламинарным потоком.
[0991] Животных ежедневно анализировали на заболеваемость и смертность. В ходе планового мониторинга животных анализировали на любое влияние роста опухоли и лечения на поведение, такое как подвижность, потребление пищи и воды, прибавка/потеря массы тела (массу тела измеряли два раза в неделю после рандомизации), патологию глаз/спутывание шерсти и любые другие аномалии. Подробно регистрировали частоту смертности и наблюдаемые клинические признаки для отдельных животных.
[0992] Объемы опухолей измеряли два раза в неделю после рандомизации в двух измерениях с помощью штангенциркуля, и объем выражали в мм3 по формуле: V=(L × W × W)/2, где V - объем опухоли, L - длина опухоли (самый длинный размер опухоли) и W - ширина опухоли (самый длинный размер опухоли, перпендикулярный L). Результаты были представлены в виде медианного объема опухоли, выраженного в мм3 ± межквартильного диапазона для каждой группы. Ингибирование роста опухоли; TGI% = [1-(Ti/(Ci)]×100; где Ti - медианный объем опухоли в группе лечения в день измерения, Ci - медианный объем опухоли в контрольной группе в день измерения.
[0993] Массу тела и объемы опухоли измеряли с помощью программного обеспечения Study DirectorTM (версия 3.1.399.19).
[0994] Протокол и любые поправки или процедуры, связанные с уходом за животными и их использованием в этом исследовании, были рассмотрены и одобрены Институциональным комитетом по уходу и использованию животных (IACUC) CrownBio перед исполнением. Во время исследования уход за животными и их использование проводились в соответствии с правилами Ассоциации по оценке и аккредитации ухода за лабораторными животными (AAALAC). Полученные результаты описаны на Фиг. 18.
Пример 125:
Профили препаратов
[0995] В таблице 13 описаны характеристики двух соединений и эталонного соединения.
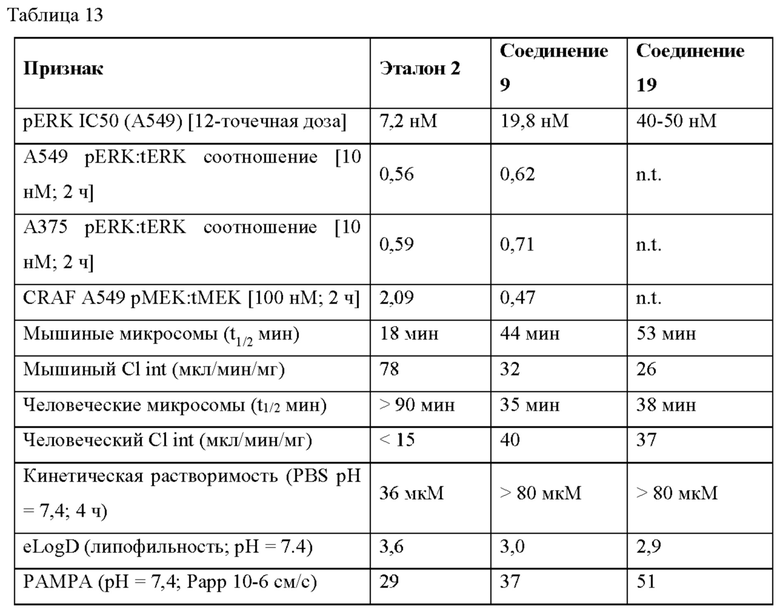
Пример 126:
A549-pERK 10 нМ
[0996] Клетки А549 или 375 обрабатывали дважды в течение двух часов соединениями в различных концентрациях. Через два часа клетки лизировали, мгновенно замораживали и хранили при -80°С. После хранения лизат количественно определяли с помощью анализа Брэдфорда. Перед тем, как лизаты готовили для запуска на Jess, лизаты разбавляли до концентрации 1 мг/мл для анализа pERK и анализа pMEK до 1,5 мг/мл с помощью количественного вестерн-блоттинга. Уровни фосфорилирования ERK и MEK оценивали, взяв отношение фосфопротеина к общему белку и нормализовав его по отношению к контролю DMSO. Результаты этого исследования представлены в Таблицах 14-16.




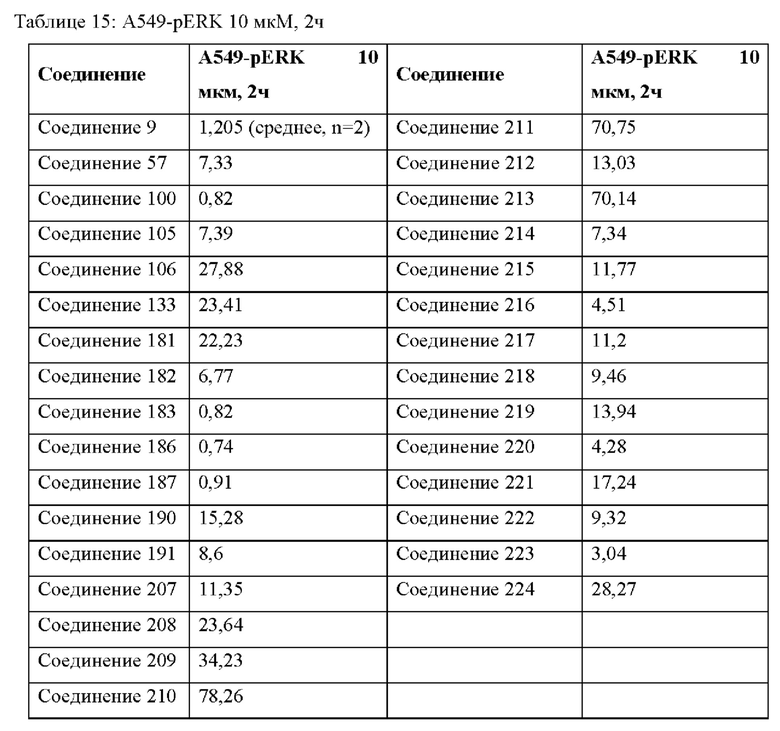


[0997] Соответственно, некоторые аспекты, описанные в настоящем документе, относятся к следующим пронумерованным альтернативным вариантам:
[0998] 1. Соединение, имеющее структуру Формулы (I):

включая его фармацевтически приемлемые соли, где:
Кольцо А представляет собой 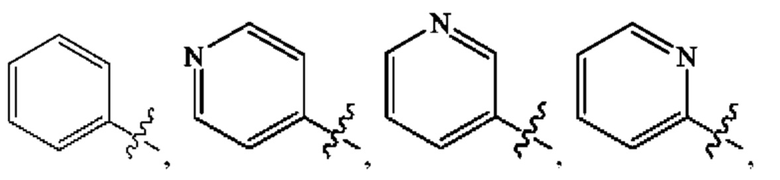
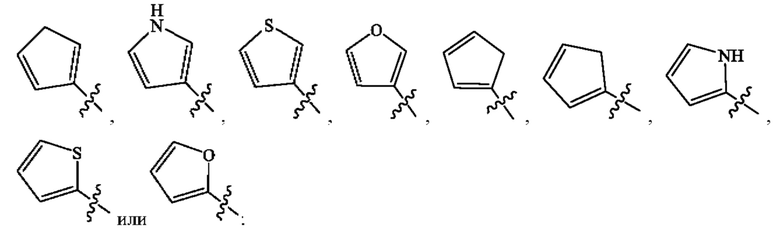
R1, R2, R3 и R4 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-С6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С3-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, и L;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-С6 алкокси, необязательно замещенного C1-С6 алкила, необязательно замещенного С2-С6 алкенила и необязательно замещенного С2-С6 алкинила;
X представляет собой C(R5)2, CH(R5), СН2, -О- 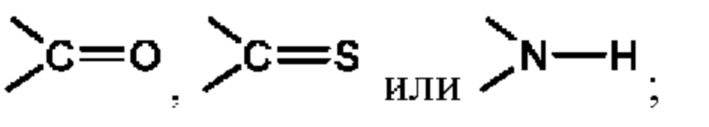
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2, и Z3 независимо выбран из группы, состоящей из следующих элементов: СН2- -О- -S-, S=O, -SO2- С=O, -CO2- -NO2, -NH-, -СН2ССН, -CH2CN, -NR5 R5', -NH(CO) -, -(CO)NH-, -(CO)NR5 R5'-, -NH-SO2-, -SO2-NH-, -R5CH2- -R5O- - R5S- R5-S=O, R5SO2, R5-C=O, R5CO2, R5NH, R5NH(CO), R5(CO)NH, R5NH-SO2, R5SO2-NH- -NHCH2CO-, -CH2R5-, -OR5-, -SR5-, S=O2R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, - (CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C1-C6 алкил, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -CH2-(необязательно замещенный арил), -CH2-(необязательно замещенный С3-C8 циклоалкил) и -СН2-(необязательно замещенный С3-С10 гетероарил);
каждый R5 и R5 независимо выбран из Н, дейтерия, необязательно замещенного C1-Се алкил, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила и необязательно замещенного С3-С10 гетероарила; и
Y представляет собой СН2, NH или О,
при условии, что R1 не является пиримидилом.
[0999] 2. Соединение по альтернативному варианту 1, отличающееся тем, что
Кольцо А представляет собой 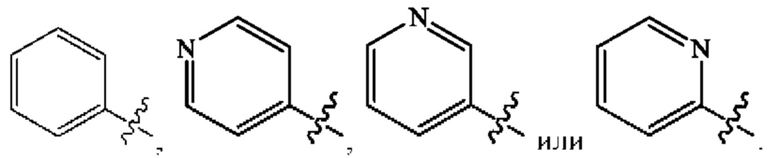
[1000] 3. Соединение по альтернативному варианту 1 или 2, отличающееся тем, что R2 представляет собой -СН3.
[1001] 4. Соединение по альтернативному варианту 1 или 2, отличающееся тем, что R2 представляет собой L.
[1002] 5. Соединение по альтернативному варианту 4, отличающееся тем, что L представляет собой -Z1-Z2.
[1003] 6. Соединение по альтернативному варианту 5, отличающееся тем, что Z1 представляет собой -СН2-.
[1004] 7. Соединение по альтернативному варианту 5 или 6, отличающееся тем, что Z2 выбран из необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила, - NR5R5, -СН2ССН или -CH2CN.
[1005] 8. Соединение по альтернативному варианту 7, отличающееся тем, что R5 и R5 каждый независимо выбран из Н или СН3.
[1006] 9. Соединение по альтернативному варианту 4, отличающееся тем, что L представляет собой -Z1-Z2-Z3.
[1007] 10. Соединение по альтернативному варианту 9, отличающееся тем, что Z1 представляет собой -CH2-, Z2 выбран из группы, состоящей из NR5R5, -NHCH2CO-, С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила и Z3 выбран из группы, состоящей из Н, дейтерия, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного Се-С10 арила, или -СН2-(необязательно замещенный арил).
[1008] 11. Соединение по альтернативному варианту 4, отличающееся тем, что Z1 представляет собой -CH2-, а Z2 необязательно представляет собой замещенный С3-C8 гетероциклил.
[1009] 12. Соединение по альтернативному варианту 11, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой 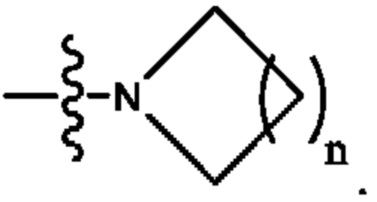 где n равно 1, 2, 3 или 4.
где n равно 1, 2, 3 или 4.
[1010] 13. Соединение по альтернативному варианту 11 или 12, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой
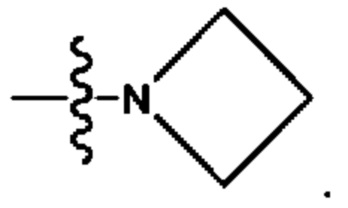
[1011] 14. Соединение по альтернативному варианту 1, отличающееся тем, что R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена и необязательно замещенного C1-C6 алкила.
[1012] 15. Соединение по альтернативному варианту 1, имеющее структуру
Формулы (Ia):

включая его фармацевтически приемлемые соли, где:
Кольцо А представляет собой 

R2, R3 и R4 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-С6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-С6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила и необязательно замещенного С2-С6 алкинила;
X представляет собой C(R5)2, CH(R5), СН2, -О- 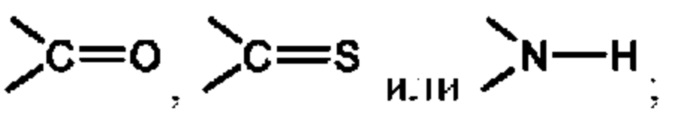
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -СН2-, -О-, -S-, S=O, -SO2-, С=O, -СО2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5, -NH(CO) -, -(CO)NH-, -(CO)NR5R5 - -NH-SO2-, -SO2-NH-, -R5CH2- -R5O- -R5S- R5-S=O, - R5SO2- R5-C=O, - R5CO2- -R5NH, R5NH(CO), -NHCH2CO-, R5(CO)NH, R5NH-SO2, R5SO2-NH, CH2R5, OR5-, -SR5-, S=O2R5, -SO2R5-, C=O2R5, -CO2R5-, -NHR5-, -NH(CO)R5-, - (CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C1-C6 алкил, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил);
каждый R5 и R5' каждый независимо выбран из Н, дейтерия, необязательно замещенного C1-С6 алкил, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила или необязательно замещенного С3-С10 гетероарила; и
Y представляет собой СН2, NH или О,
при условии, что R1 не является пиримидилом.
[1013] 16. Соединение по альтернативному варианту 15, отличающееся тем, что Кольцо А представляет собой 
[1014] 17. Соединение по альтернативному варианту 15 или 16, отличающееся тем, что R2 представляет собой -СН3.
[1015] 18. Соединение по альтернативному варианту 15 или 16, отличающееся тем, что R2 представляет собой L.
[1016] 19. Соединение по альтернативному варианту 18, отличающееся тем, что L представляет собой -Z1-Z2.
[1017] 20. Соединение по альтернативному варианту 19, отличающееся тем, что Z1 представляет собой -CH2-.
[1018] 21. Соединение по альтернативному варианту 19 или 20, отличающееся тем, что Z2 выбран из необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила, -NR5R5', -СН2СН или -CH2CN.
[1019] 22. Соединение по альтернативному варианту 21, отличающееся тем, что R5 выбран из Н или СН3.
[1020] 23. Соединение по альтернативному варианту 18, отличающееся тем, что L представляет собой -Z1-Z2-Z3.
[1021] 24. Соединение по альтернативному варианту 23, отличающееся тем, что Z1 представляет собой -CH2-, Z2 выбран из группы, состоящей из -NR5R5, С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила и Z3 выбран из группы, состоящей из Н, дейтерия, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, или -СН2-(необязательно замещенный арил).
[1022] 25. Соединение по альтернативному варианту 19, отличающееся тем, что Z1 представляет собой -СН2-, a Z2 необязательно представляет собой замещенный С3-C8 гетероциклил.
[1023] 26. Соединение по альтернативному варианту 25, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой 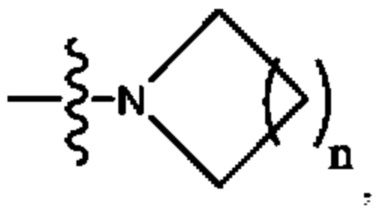 где n равно 1, 2, 3 или 4.
где n равно 1, 2, 3 или 4.
[1024] 27. Соединение по альтернативному варианту 25 или 26, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой
[1025] 28. Соединение по альтернативному варианту 1, имеющее структуру
Формулы (Ib):
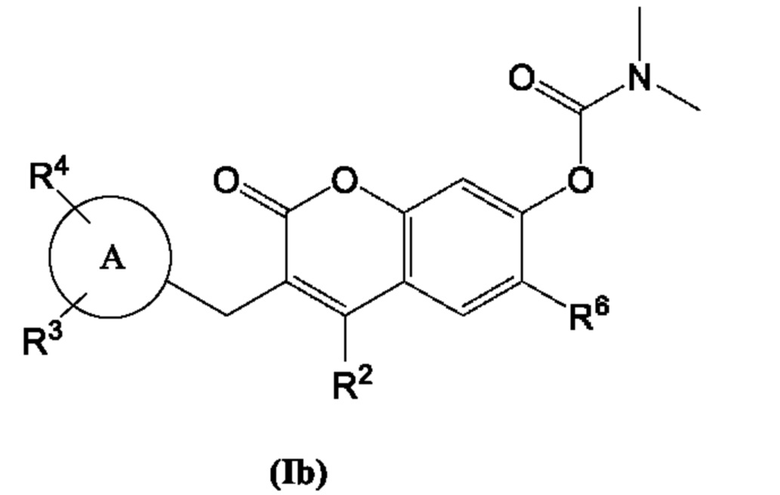
включая его фармацевтически приемлемые соли, где:
Кольцо А представляет собой 
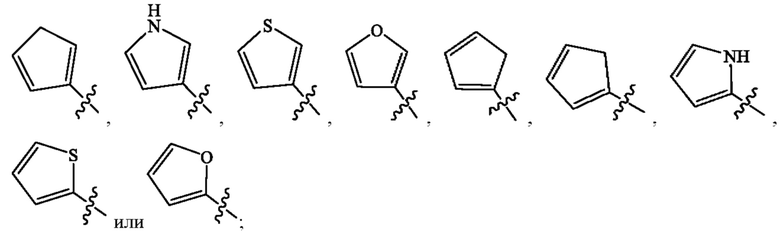
R2, R3 и R4 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-С6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-С6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила и необязательно замещенного С2-С6 алкинила;
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2, и Z3 независимо представляют собой -СН2-, -О-, S, S=O, -SO2-, С=O, СО2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5, -NH(CO) -, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, -SO2-NH-, -R5CH2- -R5O- - R5S- R5-S=O, - R5SO2- R5-C=O, - R5CO2- -R5NH, -NHCH2CO-, R5NH(CO), R5(CO)NH, R5NH-SO2, R5SO2-NH, CH2R5, OR5, SR5, S=O-R5, SO2R5, C=O-R5, -CO2R5, NHR5, NH(CO)R5, (CO)NHR5, NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C1-С6 алкил, необязательно замещенный С3-С8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2- (необязательно замещенный арил), -СН2- (необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил);
каждый R5 и R5 независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный С2-С6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-С8 гетероциклил илинеобязательно замещенный С3-С10 гетероарил; и
при условии, что R1 не является пиримидилом.
[1026] 29. Соединение по альтернативному варианту 28, отличающееся тем, что
Кольцо А представляет собой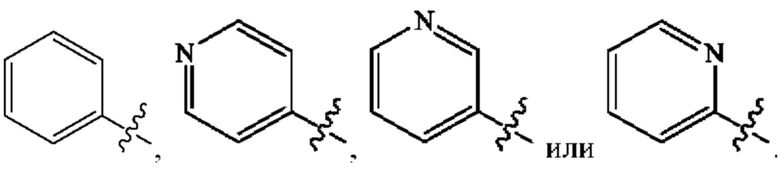
[1027] 30. Соединение по альтернативному варианту 28 или 29, отличающееся тем, что R2 представляет собой -СН3.
[1028] 31. Соединение по альтернативному варианту 28 или 29, отличающееся тем, что R2 представляет собой L.
[1029] 32. Соединение по альтернативному варианту 31, отличающееся тем, что L представляет собой -Z1-Z2.
[1030] 33. Соединение по альтернативному варианту 32, отличающееся тем, что Z1 представляет собой -СН2-.
[1031] 34. Соединение по альтернативному варианту 32 или 33, отличающееся тем, что Z2 выбран из необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила, -NR5R5, -СН2СН или -CH2CN.
[1032] 35. Соединение по альтернативному варианту 34, отличающееся тем, что R5 и R5' каждый выбран из Н или CH3.
[1033] 36. Соединение по альтернативному варианту 31, отличающееся тем, что L представляет собой -Z1-Z2-Z3.
[1034] 37. Соединение по альтернативному варианту 36, отличающееся тем, что Zi представляет собой -CH2-, Z2 выбран из группы, состоящей из NR5R5, -NHCH2CO-, С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила и Z3 выбран из группы, состоящей из Н, дейтерия, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного Се-С10 арила, или -CH2-(необязательно замещенный арил).
[1035] 38. Соединение по альтернативному варианту 32, отличающееся тем, что Z1 представляет собой -CH2-, а Z2 необязательно представляет собой замещенный С3-C8 гетероциклил.
[1036] 39. Соединение по альтернативному варианту 38, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой  где n равно 1, 2, 3 или 4.
где n равно 1, 2, 3 или 4.
[1037] 40. Соединение по альтернативному варианту 38 или 39, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой
[1038] 41. Соединение по альтернативному варианту 1, имеющее структуру
Формулы (Ic):

включая его фармацевтически приемлемые соли, где:
Кольцо А представляет собой 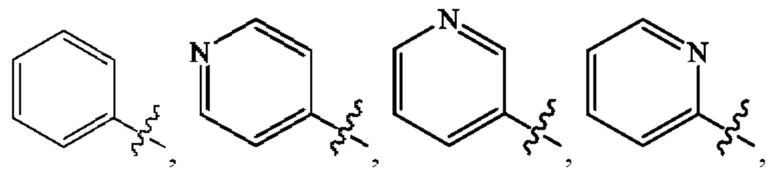
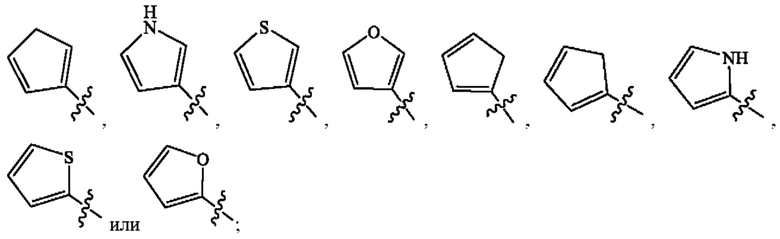
R1, R2, R3 и R4 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного C2-C6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила и необязательно замещенного С2-С6 алкинила;
X представляет собой C(R5)2, CH(R5), CH2, -О-, 
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -СН2-, -О-, -S-, S=O, -SO2-, С=O, -СО2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5, -NH(CO)-, -(CO)NH-, -(CO)NR5R5-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -NHCH2CO-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C1-C6 алкил, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил);
каждый R5 и R5' независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный C2-C6 алкенил, необязательно замещенный C2-C6 алкинил, необязательно замещенный С3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил илинеобязательно замещенный С3-С10 гетероарил; и
Y представляет собой СН2, NH или О,
при условии, что R1 не является пиримидилом.
[1039] 42. Соединение по альтернативному варианту 41, отличающееся тем, что
Кольцо А представляет собой 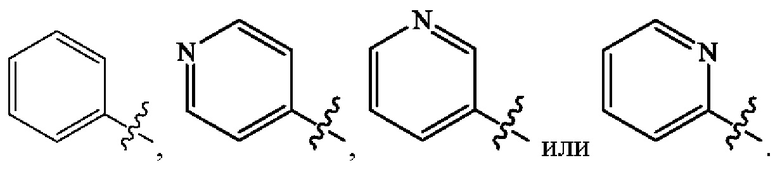
[1040] 43. Соединение по альтернативному варианту 41 или 42, отличающееся тем, что R2 представляет собой -СН3.
[1041] 44. Соединение по альтернативному варианту 41 или 42, отличающееся тем, что R2 представляет собой L.
[1042] 45. Соединение по альтернативному варианту 44, отличающееся тем, что L представляет собой -Z1-Z2.
[1043] 46. Соединение по альтернативному варианту 45, отличающееся тем, что Z1 представляет собой -СН2-.
[1044] 47. Соединение по альтернативному варианту 45 или 46, отличающееся тем, что Z2 выбран из необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила, -NR5R5, -СН2СН или -CH2CN.
[1045] 48. Соединение по альтернативному варианту 47, отличающееся тем, что R5 и R5 каждый выбран из Н или СН3.
[1046] 49. Соединение по альтернативному варианту 44, отличающееся тем, что L представляет собой -Z1-Z2-Z3.
[1047] 50. Соединение по альтернативному варианту 45, отличающееся тем, что Z1 представляет собой -CH2-, Z2 выбран из группы, состоящей из NR5R5, -NHCH2CO-, С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила и Z3 выбран из группы, состоящей из Н, дейтерия, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, или -СН2-(необязательно замещенный арил).
[1048] 51. Соединение по альтернативному варианту 45, отличающееся тем, что Z1 представляет собой -CH2-, a Z2 необязательно представляет собой замещенный С3-C8 гетероциклил.
[1049] 52. Соединение по альтернативному варианту 45, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой 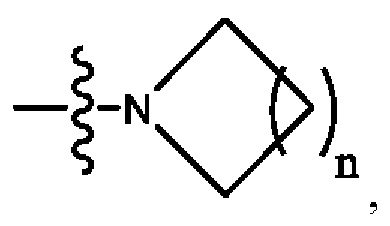 где n равно 1, 2, 3 или 4.
где n равно 1, 2, 3 или 4.
[1050] 53. Соединение по альтернативному варианту 45 или 46, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой 
[1051] 54. Соединение по альтернативному варианту 1, имеющее структуру Формулы (Id):
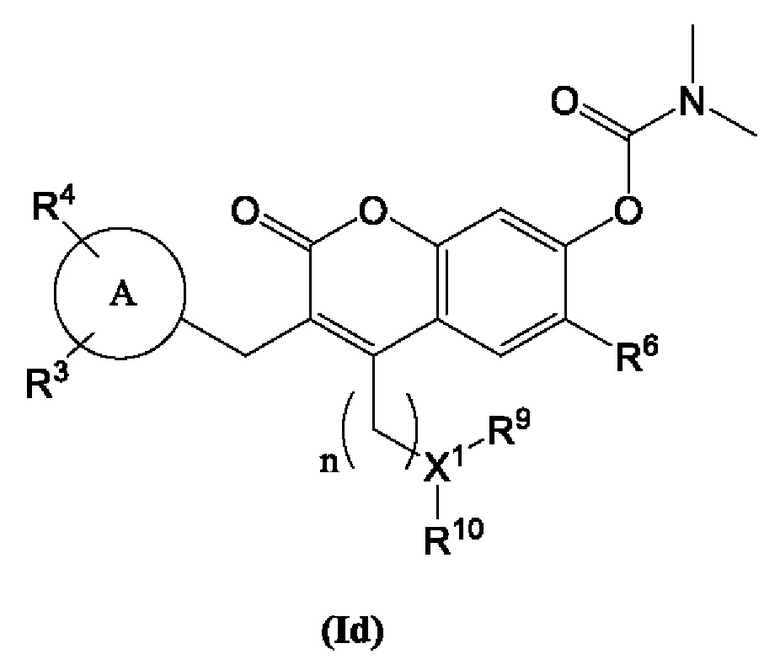
включая его фармацевтически приемлемые соли, где: Кольцо А представляет собой 

R3 и R4 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного Сз-Cs циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, и L;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного C2-C6 алкенила и необязательно замещенного C2-C6 алкинила;
каждый независимо выбран из водорода, дейтерия, необязательно замещенного C1-C6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил);
X1 выбран из группы, состоящей из СН, В, N или РО4;
n выбран из 1, 2, 3 или 4;
каждый R5 и R5' независимо выбран из Н, дейтерия, необязательно замещенного C1-C6 алкил, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила и необязательно замещенного С3-С10 гетероарила; и
Y представляет собой CH2, NH или О,
при условии, что R1 не является пиримидилом.
[1052] 55. Соединение по альтернативному варианту 54, отличающееся тем, что n равно 1 или 2.
[1053] 56. Соединение по альтернативному варианту 54 или 55, отличающееся тем, что X1 представляет собой -СН или N.
[1054] 57. Соединение по альтернативному варианту 54-56, отличающееся тем, что R9 выбран из необязательно замещенного C1-C6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила.
[1055] 58. Соединение по альтернативному варианту 54-56, отличающееся тем, что R10 выбран из необязательно замещенного C1-C6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила.
[1056] 59. Соединение по альтернативному варианту 1, отличающееся тем, что указанное соединение выбран из соединения из Таблицы А.
[1057] 60. Соединение, имеющее структуру формулы (II):
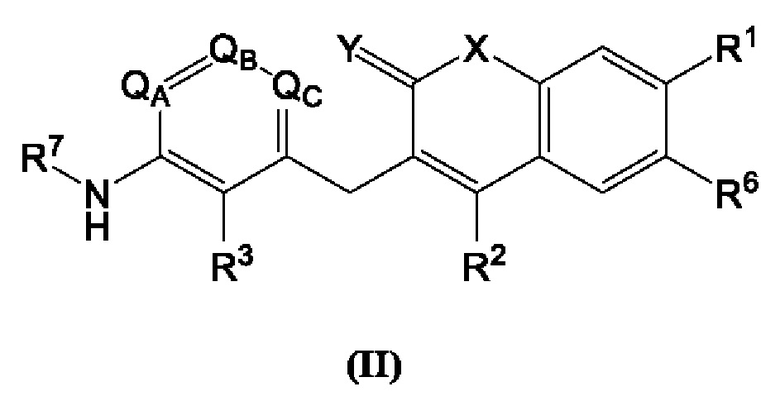
включая его фармацевтически приемлемые соли, где: QA, QB, QC независимо представляют собой С или N;
R1, R2, R3 и R7 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила и необязательно замещенного С2-С6 алкинила;
X представляет собой C(R5)2, CH(R5), СН2, -О-, 
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -СН2-, -О-, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5', -NH(CO)-, -(CO)NH-, -(CO)NR5R5'-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, - R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -R5(CO)NH-, -NHCH2CO-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C1-C6 алкил, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил);
каждый R5 и R5' независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный С2-С6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил илинеобязательно замещенный С3-С10 гетероарил;
Y представляет собой СН2, NH или О, и
Z представляет собой С или N;
при условии, что R1 не является пиримидилом.
[1058] 61. Соединение по альтернативному варианту 60, отличающееся тем, что R2 представляет собой -CH3.
[1059] 62. Соединение по альтернативному варианту 60, отличающееся тем, что R2 представляет собой L.
[1060] 63. Соединение по альтернативному варианту 62, отличающееся тем, что L представляет собой -Z1-Z2.
[1061] 64. Соединение по альтернативному варианту 63, отличающееся тем, что Z1 представляет собой -СН2-.
[1062] 65. Соединение по альтернативному варианту 63 или 64, отличающееся тем, что Z2 выбран из необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила, - NR5R5', -СН2СН или -CH2CN.
[1063] 66. Соединение по альтернативному варианту 65, отличающееся тем, что R5 и R5' каждый выбран из Н или СН3.
[1064] 67. Соединение по альтернативному варианту 62, отличающееся тем, что L представляет собой -Z1-Z2-Z3.
[1065] 68. Соединение по альтернативному варианту 67, отличающееся тем, что Z1 представляет собой -СН2-, Z2 представляет собой необязательно замещенный С3-C8 гетероциклил и Z3 представляет собой -СН2-(необязательно замещенный арил).
[1066] 69. Соединение по альтернативному варианту 63, отличающееся тем, что Z1 представляет собой -CH2-, a Z2 необязательно представляет собой замещенный С3-C8 гетероциклил.
[1067] 70. Соединение по альтернативному варианту 69, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой  где n равно 1, 2, 3 или 4.
где n равно 1, 2, 3 или 4.
[1068] 71. Соединение по альтернативному варианту 69 или 70, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой 
[1069] 72. Соединение по альтернативному варианту 60, имеющее структуру Формулы (IIa):
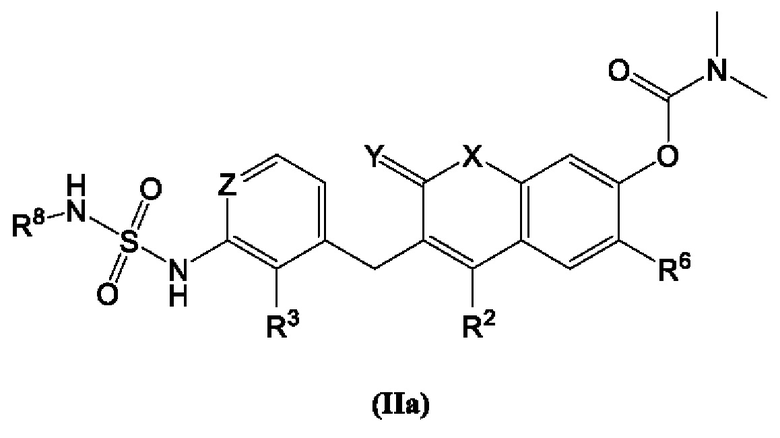
включая его фармацевтически приемлемые соли, где:
R2, R3, R6 и R8 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L;
X представляет собой C(R5)2, CH(R5), СН2, -О-, 
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой гало, -СН2- -О-, -S-, S=O, -SO2-, С=O, -СО2-, -NO2, -NH-, -CH2CCH, -CH2CN, -NR5R5', -NH(CO)-, -(CO)NH-, -(CO)NR5R5'-, NH-SO2-, SO2-NH-, R5CH2-, R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -NHCH2CO-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C1-C6 алкил, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил);
каждый R5 и R5' независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный С2-С6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил илинеобязательно замещенный С3-С10 гетероарил;
Y представляет собой СН2, NH или О, и
Z представляет собой С или N.
[1070] 73. Соединение по альтернативному варианту 72, отличающееся тем, что R2 представляет собой -СН3.
[1071] 74. Соединение по альтернативному варианту 72, отличающееся тем, что R2 представляет собой L.
[1072] 75. Соединение по альтернативному варианту 74, отличающееся тем, что L представляет собой -Z1-Z2.
[1073] 76. Соединение по альтернативному варианту 75, отличающееся тем, что Z1 представляет собой -СН2-.
[1074] 77. Соединение по альтернативному варианту 75 или 76, отличающееся тем, что Z2 выбран из необязательно замещенного С3-С8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила, -NR5R5', -CH2CCH или CH2CN.
[1075] 78. Соединение по альтернативному варианту 77, отличающееся тем, что R5 и R5' каждый выбран из Н или СН3.
[1076] 79. Соединение по альтернативному варианту 74, отличающееся тем, что L представляет собой -Z1-Z2-Z3.
[1077] 80. Соединение по альтернативному варианту 75, отличающееся тем, что Z1 представляет собой -СН2-, Z2 выбран из группы, состоящей из -NR5R5', -NHCH2CO-, С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила и Z3 выбран из группы, состоящей из Н, дейтерия, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, или -СН2-(необязательно замещенный арил).
[1078] 81. Соединение по альтернативному варианту 75, отличающееся тем, что Z1 представляет собой -CH2-, а Z2 необязательно представляет собой замещенный С3-C8 гетероциклил.
[1079] 82. Соединение по альтернативному варианту 81, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой  где n равно 1, 2, 3 или 4.
где n равно 1, 2, 3 или 4.
[1080] 83. Соединение по альтернативному варианту 81 или 82, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой 
[1081] 84. Соединение по альтернативному варианту 51, отличающееся тем, что указанное соединение выбран из соединения из Таблицы А.
[1082] 85. Соединение по альтернативному варианту 51, выбранное из группы, состоящей из:
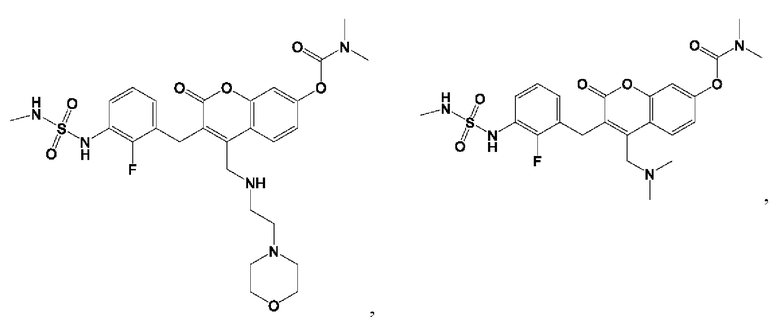
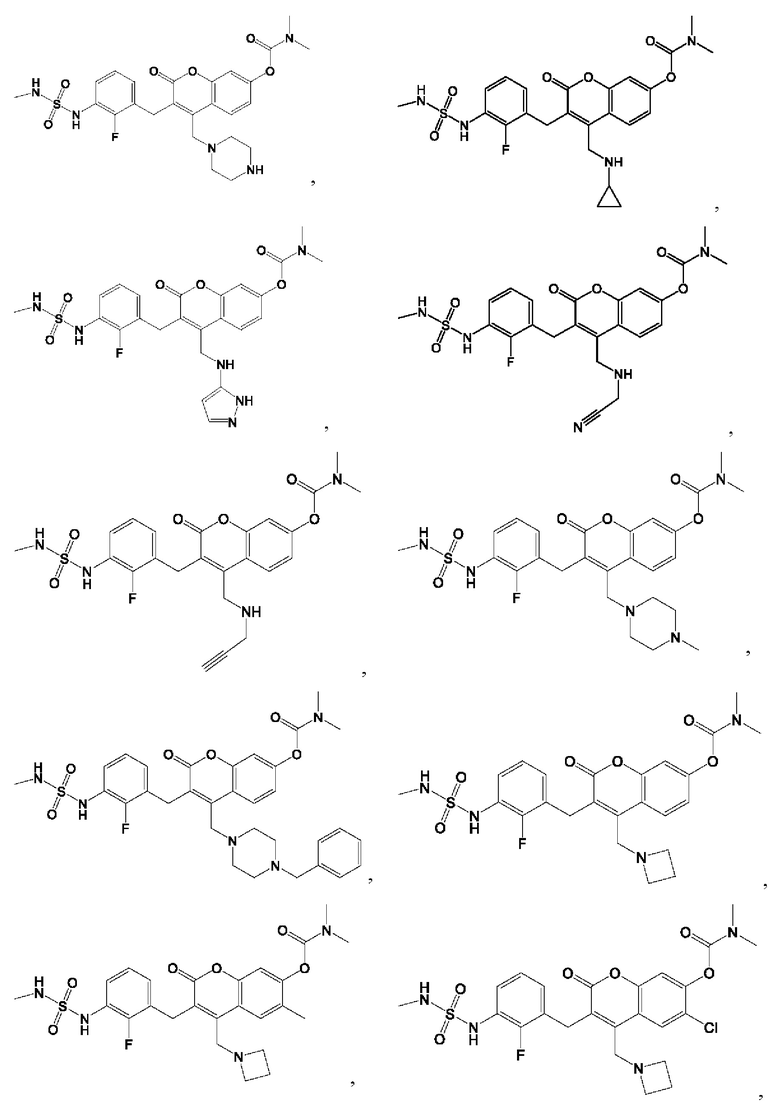
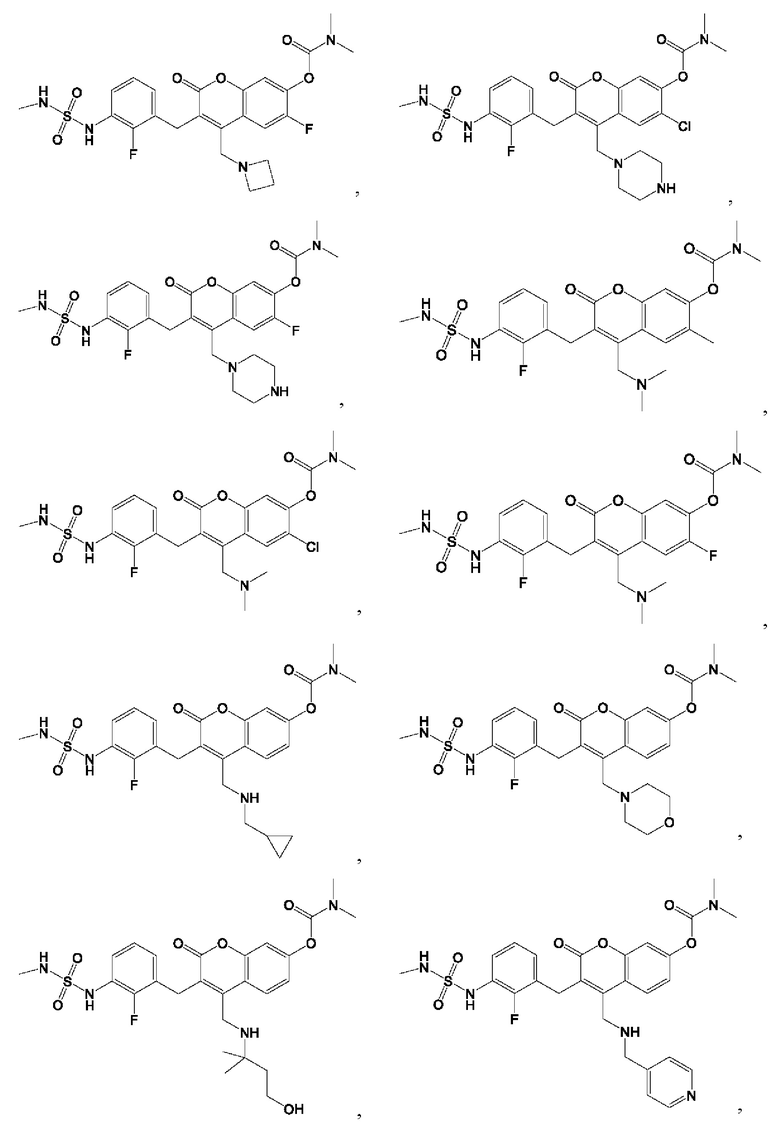

и их фармацевтически приемлемых солей.
[1083] 86. Соединение по альтернативному варианту 60, имеющее структуру Формулы (IIb):
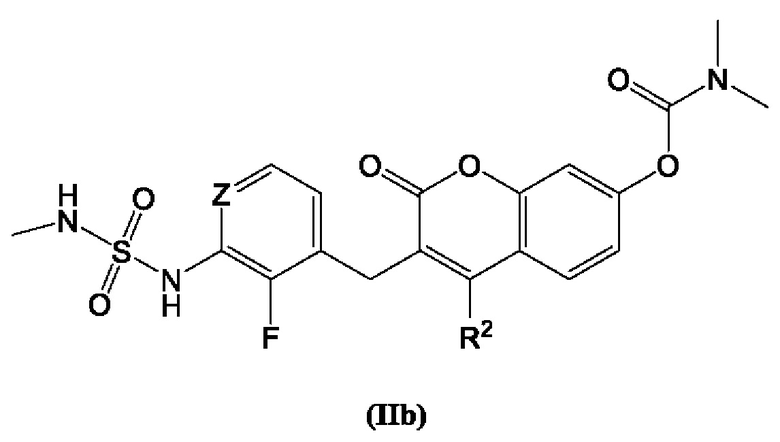
включая его фармацевтически приемлемые соли, где:
R2 представляет собой L;
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -СН2-, -О-, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5', -NH(CO)-, -(CO)NH-, -(CO)NR5R5'-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -NHCH2CO-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, -NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C1-C6 алкил, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил);
каждый R5 и R5' независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный С2-С6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил илинеобязательно замещенный С3-С10 гетероарил; и
Z представляет собой С или N.
[1084] 87. Соединение по альтернативному варианту 86, отличающееся тем, что L представляет собой -Z1-Z2.
[1085] 88. Соединение по альтернативному варианту 87, отличающееся тем, что Z1 представляет собой -СН2-.
[1086] 89. Соединение по альтернативному варианту 86 или 87, отличающееся тем, что Z2 выбран из необязательно замещенного С3-С8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила, - NR5R5', -СН2ССН или -CH2CN.
[1087] 90. Соединение по альтернативному варианту 89, отличающееся тем, что R5 и R5' каждый выбран из Н или СН3.
[1088] 91. Соединение по альтернативному варианту 86, отличающееся тем, что L представляет собой -Z1-Z2-Z3.
[1089] 92. Соединение по альтернативному варианту 87, отличающееся тем, что Z1 представляет собой -СН2-, Z2 представляет собой необязательно замещенный С3-C8 гетероциклил и Z3 представляет собой -СН2-(необязательно замещенный арил).
[1090] 93. Соединение по альтернативному варианту 87, отличающееся тем, что Z1 представляет собой -CH2-, a Z2 необязательно представляет собой замещенный С3-C8 гетероциклил.
[1091] 94. Соединение по альтернативному варианту 93, отличающееся тем, что необязательно замещенный С3-С8 гетероциклил представляет собой  где n равно 1, 2, 3 или 4.
где n равно 1, 2, 3 или 4.
[1092] 95. Соединение по альтернативному варианту 93 или 94, отличающееся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой 
[1093] 96. Соединение по альтернативному варианту 86, выбранное из группы, состоящей из:
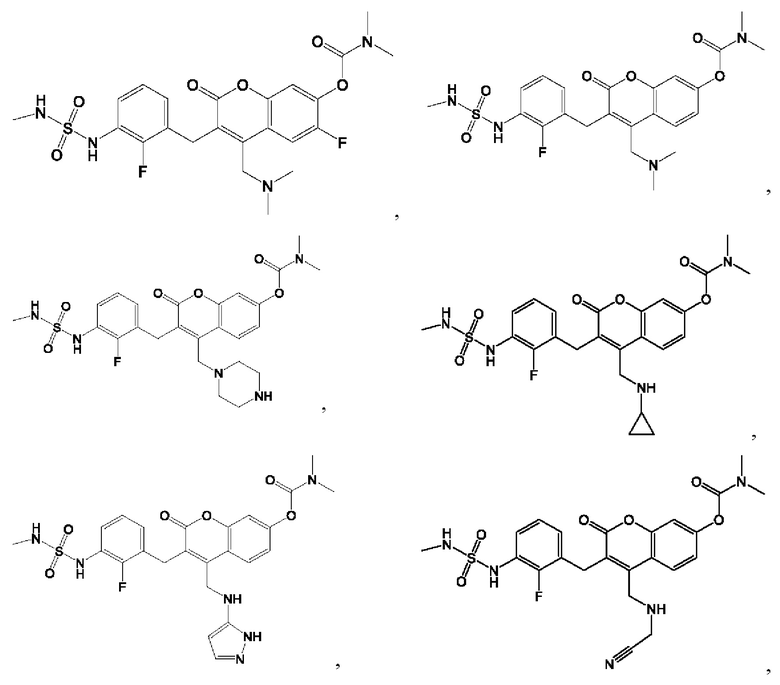

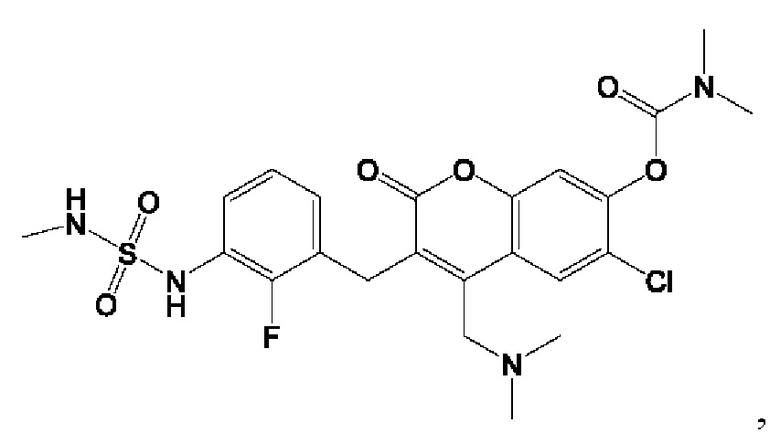
и их фармацевтически приемлемых солей.
[1094] 97. Соединение по альтернативному варианту 60, имеющее структуру Формулы (IIc):
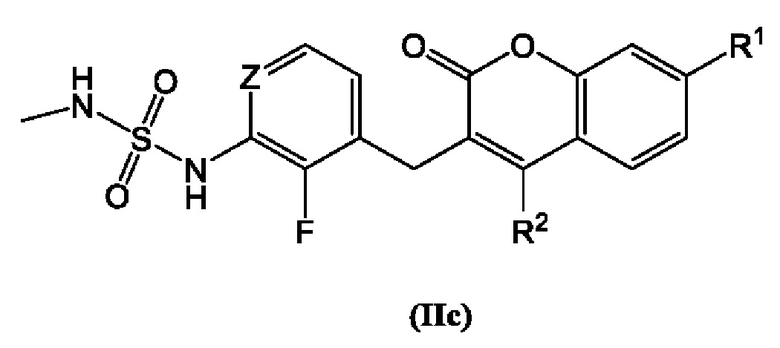
включая его фармацевтически приемлемые соли, где:
R1 и R2 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L;
L представляет собой -Z1-Z2 или -Z11-Z2-Z3;
Z1, Z2, и Z3 независимо представляют собой -CH2-, -О-, -S-, S=O, -SO2-, С=O, СО2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5', -NH(CO)-, -(CO)NH-, -(CO)NR5R5'-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -R5(CO)NH-, -NHCH2CO-, -R5NH-SO2-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, -NHR5-, -NH(CO)R5-, -(CO)NHR5-, NH-SO2R5-, -SO2-NHR5-, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил,-СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил);
каждый R5 и R5' независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный С2-С6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил илинеобязательно замещенный С3-С10 гетероарил; и
Z представляет собой С или N;
при условии, что R1 не является пиримидилом.
[1095] 98. Соединение по альтернативному варианту 97, отличающееся тем, что R2 представляет собой -СН3.
[1096] 99. Соединение по альтернативному варианту 97, отличающееся тем, что R2 представляет собой L.
[1097] 100. Соединение по альтернативному варианту 97 или 99, отличающееся тем, что L представляет собой -Z1-Z2.
[1098] 101. Соединение по альтернативному варианту 101, отличающееся тем, что Z1 представляет собой -СН2-.
[1099] 102. Соединение по альтернативному варианту 100 или 101, отличающееся тем, что Z2 выбран из необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила, NR5R5', -СН2ССН или -CH2CN.
[1100] 103. Соединение по альтернативному варианту 102, отличающееся тем, что R5 и R5' каждый выбран из Н или СН3.
[1101] 104. Соединение по альтернативному варианту 99, отличающееся тем, что L представляет собой Z1-Z2-Z3.
[1102] 105. Соединение по альтернативному варианту 104, отличающееся тем, что Z1 представляет собой -CH2-, Z2 выбран из N или необязательно замещенного С3-C8 гетероциклила, и Z3 выбран из необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила илинеобязательно замещенного С3-С10 гетероарила.
[1103] 106. Соединение по альтернативному варианту 60, имеющее структуру Формулы (IId):
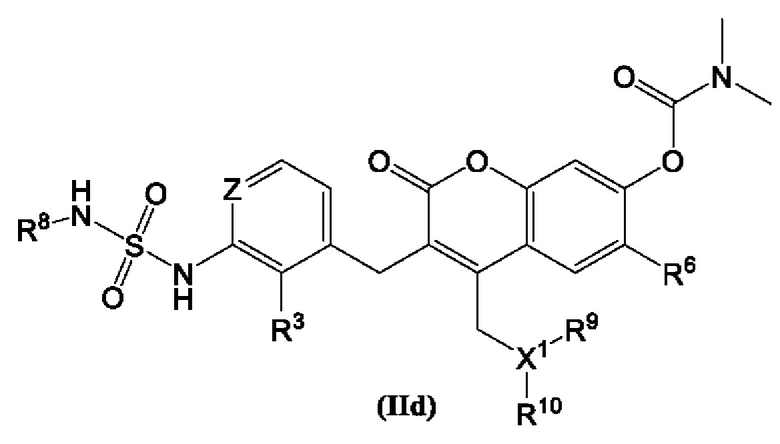
включая его фармацевтически приемлемые соли, где:
R3 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила и необязательно замещенного С2-С6 алкинила;
R8 выбран из Н, дейтерия, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 карбоциклила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила;
каждый R9 и R10 независимо выбран из водорода, дейтерия, необязательно замещенного C1-C6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил); и
X1 выбран из группы, состоящей из СН, В, N или РО4.
[1104] 107. Соединение по альтернативному варианту 106, отличающееся тем, что R3 выбран из Н, дейтерия, C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила.
[1105] 108. Соединение по любому из альтернативных вариантов 106-107, отличающееся тем, что R6 выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила.
[1106] 109. Соединение по любому из альтернативных вариантов 106-108, отличающееся тем, что R8 выбран из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила.
[1107] 110. Соединение по любому из альтернативных вариантов 106-109, отличающееся тем, что R9 выбран из Н, дейтерия, C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила.
[1108] 111. Соединение по любому из альтернативных вариантов 106-110, отличающееся тем, что R10 выбран из Н, дейтерия, C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила.
[1109] 112. Соединение по любому из альтернативных вариантов 1-111, отличающееся тем, что фармацевтически приемлемая соль представляет собой соль щелочного металла или соль аммония.
[1110] 113. Фармацевтическая композиция, содержащая терапевтически эффективное количество по меньшей мере одного соединения, имеющего структуру Формулы (I):
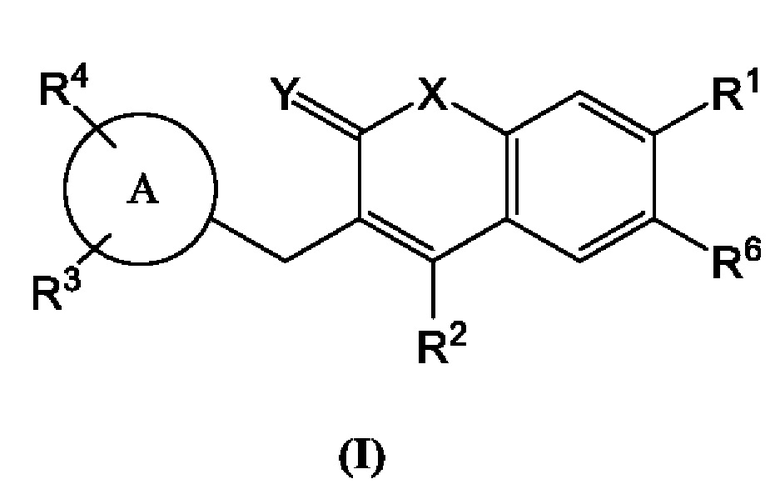
включая его фармацевтически приемлемые соли, где: Кольцо А представляет собой

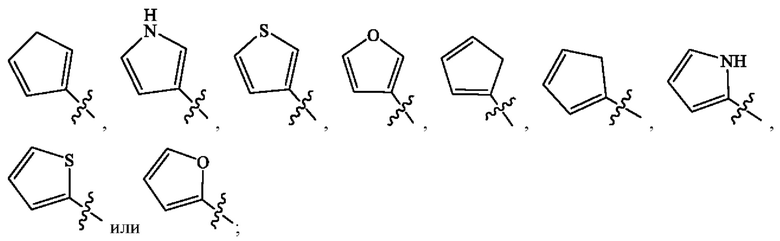
R1, R2, R3 и R4 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила и необязательно замещенного С2-С6 алкинила;
X представляет собой C(R5)2, CH(R5), СН2, -О-, 
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2, и Z3 независимо представляют собой -СН2-, -О-, -S-, S=O, -SO2-, С=O, -СО2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5', -NH(CO)-, -(CO)NH-, -(CO)NR5R5'-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -R5(CO)NH-, -R5NH-SO2-, -NHCH2CO-, -R5SO2-NH-, -CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, NHR5-, NH(CO)R5-, (CO)NHR5-, NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C1-C6 алкил, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил);
каждый R5 и R5' независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный С2-С6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил или необязательно замещенный С3-С10 гетероарил; и
Y представляет собой CH2, NH или О,
при условии, что R1 не является пиримидилом.
[1111] 114. Фармацевтическая композиция по альтернативному варианту 113, отличающаяся тем, что R2 представляет собой -СН3.
[1112] 115. Фармацевтическая композиция по альтернативному варианту 113, отличающаяся тем, что R2 представляет собой L.
[1113] 116. Фармацевтическая композиция по альтернативному варианту 115, отличающаяся тем, что L представляет собой -Z1-Z2.
[1114] 117. Фармацевтическая композиция по альтернативному варианту 116, отличающаяся тем, что Z1 представляет собой -CH2-.
[1115] 118. Фармацевтическая композиция по альтернативному варианту 116 или 117, отличающаяся тем, что Z2 выбран из необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила, -NR5R5', -СН2ССН или -CH2CN.
[1116] 119. Фармацевтическая композиция по альтернативному варианту 118, отличающаяся тем, что R5 и R5' каждый выбран из Н или СН3.
[1117] 120. Фармацевтическая композиция по альтернативному варианту 113, отличающаяся тем, что L представляет собой -Z1-Z2-Z3.
[1118] 121. Фармацевтическая композиция по альтернативному варианту 113, отличающаяся тем, что Z1 представляет собой -CH2-, Z2 выбран из группы, состоящей из -NR5R5', С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила и Z3 выбран из группы, состоящей из Н, дейтерия, галогена, необязательно замещенного C1-C6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, или -СН2-(необязательно замещенный арил).
[1119] 122. Фармацевтическая композиция по альтернативному варианту 116, отличающаяся тем, что Z1 представляет собой -СН2- a Z2 необязательно представляет собой замещенный С3-C8 гетероциклил.
[1120] 123. Фармацевтическая композиция по альтернативному варианту 122, отличающаяся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой  где n равно 1, 2, 3 или 4.
где n равно 1, 2, 3 или 4.
[1121] 124. Фармацевтическая композиция по альтернативному варианту 122 или 123, отличающаяся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой 
[1122] 125. Фармацевтическая композиция по альтернативному варианту 113, содержащая терапевтически эффективное количество по меньшей мере одного соединения, выбранного из Таблицы А.
[1123] 126. Фармацевтическая композиция по альтернативному варианту 113, содержащая терапевтически эффективное количество по меньшей мере одного соединения, выбранного из группы, состоящей из:
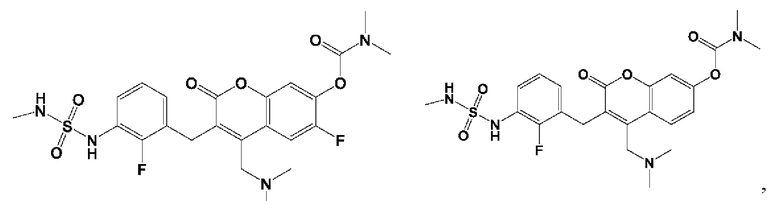
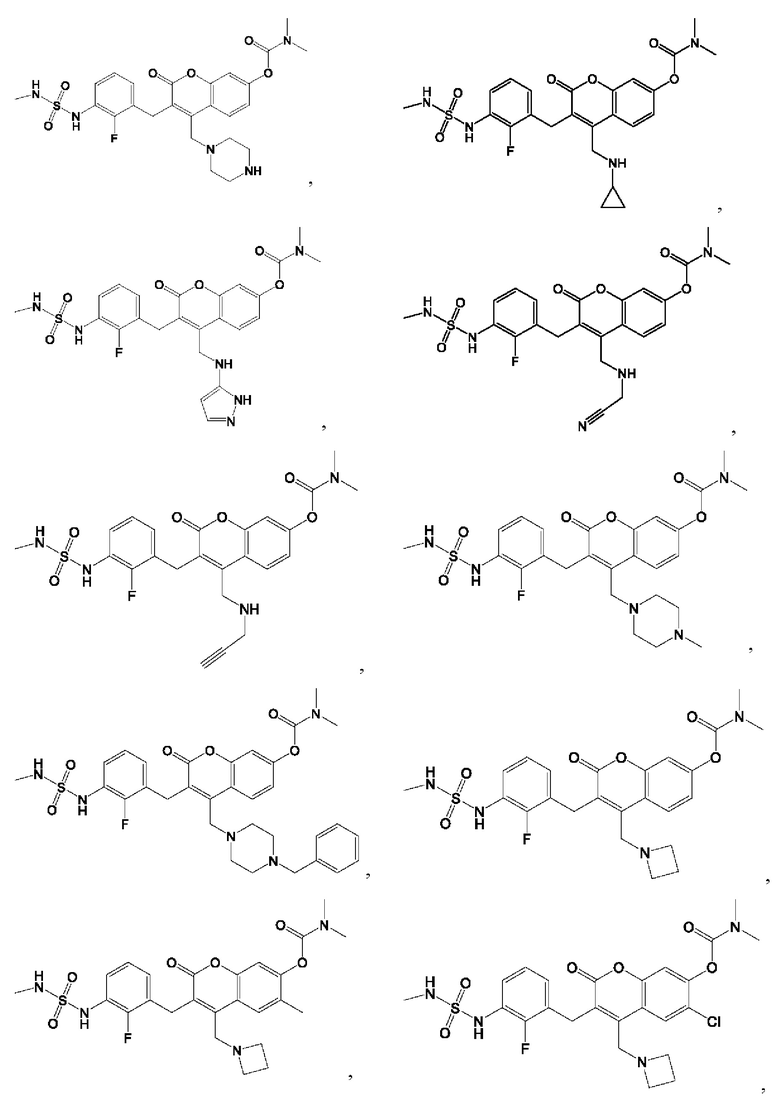
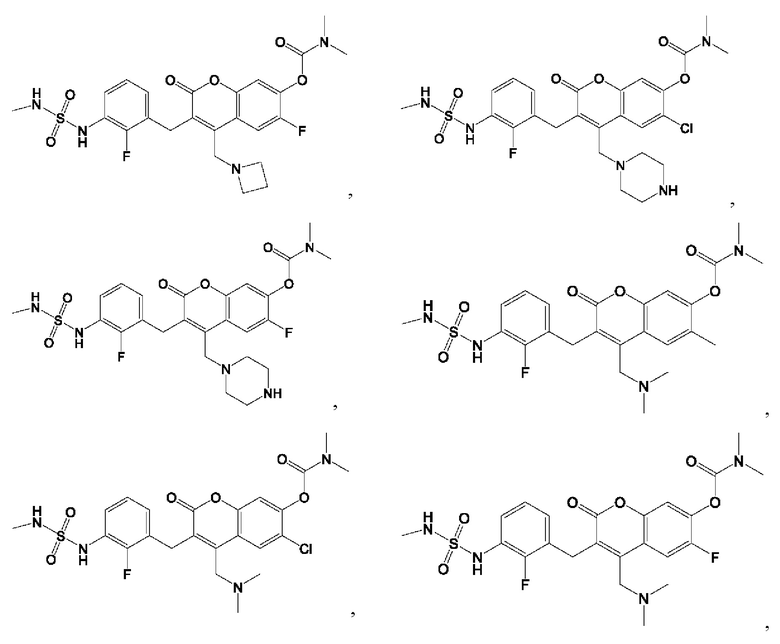
и их фармацевтически приемлемых солей вместе по меньшей мере с одним фармацевтически приемлемым эксципиентом.
[1124] 127. Фармацевтическая композиция, содержащая терапевтически эффективное количество по меньшей мере одного соединения, имеющего структуру Формулы (II):

включая его фармацевтически приемлемые соли, где: QA, QB, QC независимо представляют собой С или N;
R1, R2, R3 и R7 каждый независимо выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно замещенного С-амидо, необязательно замещенного N-амидо, необязательно замещенного сложного эфира, необязательно замещенного сульфонила, необязательно замещенного S-сульфонамидо, необязательно замещенного N-сульфонамидо, необязательно замещенного сульфоната, необязательно замещенного О-тиокарбамила, необязательно замещенного N-тиокарбамила, необязательно замещенного N-карбамила, необязательно замещенного О-карбамила, необязательно замещенной мочевины, необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила, необязательно замещенного С2-С6 алкинила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-С10 гетероарила, или L;
R6 выбран из группы, состоящей из Н, дейтерия, гидроксила, галогена, циано, нитро, необязательно замещенного амино, необязательно необязательно замещенного C1-C6 алкокси, необязательно замещенного C1-C6 алкила, необязательно замещенного С2-С6 алкенила и необязательно замещенного С2-С6 алкинила;
X представляет собой C(R5)2, CH(R5), СН2, -О-, 
L представляет собой -Z1-Z2 или -Z1-Z2-Z3;
Z1, Z2 и Z3 независимо представляют собой -CH2-, -О-, -S-, S=O, -SO2-, С=O, -CO2-, -NO2, -NH-, -СН2ССН, -CH2CN, -NR5R5', -NH(CO)-, -(CO)NH-, -(CO)NR5R5'-, -NH-SO2-, -SO2-NH-, -R5CH2-, -R5O-, -R5S-, R5-S=O, -R5SO2-, R5-C=O, -R5CO2-, -R5NH-, -R5NH(CO)-, -NHCH2CO-, -R5(CO)NH-, -R5NH-SO2-, -R5SO2-NH-, CH2R5-, -OR5-, -SR5-, S=O-R5, -SO2R5-, C=O-R5, -CO2R5-, NHR5-, -NH(CO)R5-, -(CO)NHR5-, NH-SO2R5-, -SO2-NHR5-, необязательно замещенный C1-C6 алкил, необязательно замещенный С3-C8 циклоалкил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил, необязательно замещенный С3-С10 гетероарил, -СН2-(необязательно замещенный арил), -СН2-(необязательно замещенный С3-C8 циклоалкил) или -СН2-(необязательно замещенный С3-С10 гетероарил);
каждый R5 и R5' независимо представляет собой Н, дейтерий, необязательно замещенный C1-C6 алкил, необязательно замещенный С2-С6 алкенил, необязательно замещенный С2-С6 алкинил, необязательно замещенный С3-C8 карбоциклил, необязательно замещенный С6-С10 арил, необязательно замещенный С3-C8 гетероциклил илинеобязательно замещенный С3-С10 гетероарил;
Y представляет собой СН2, NH или О, и
Z представляет собой С или N;
при условии, что R1 не является пиримидилом.
[1125] 128. Фармацевтическая композиция по альтернативному варианту 127, отличающаяся тем, что R2 представляет собой -СН3.
[1126] 129. Фармацевтическая композиция по альтернативному варианту 127, отличающаяся тем, что R2 представляет собой L.
[1127] 130. Фармацевтическая композиция по альтернативному варианту 129, отличающаяся тем, что L представляет собой -Z1-Z2.
[1128] 131. Фармацевтическая композиция по альтернативному варианту 129, отличающаяся тем, что Z1 представляет собой -CH2-.
[1129] 132. Фармацевтическая композиция по альтернативному варианту 129 или 130, отличающаяся тем, что Z2 выбран из необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С3-С8 гетероциклила, необязательно замещенного С3-C8 гетероарила, -NR5R5', -CH2CCH или -CH2CN.
[1130] 133. Фармацевтическая композиция по альтернативному варианту 132, отличающаяся тем, что R5 и R5' каждый выбран из Н или СН3.
[1131] 134. Фармацевтическая композиция по альтернативному варианту 129, отличающаяся тем, что L представляет собой -Z1-Z2-Z3.
[1132] 135. Фармацевтическая композиция по альтернативному варианту 134, отличающаяся тем, что Z1 представляет собой -СН2-, Z2 выбран из группы, состоящей из NR5R5', С3-C8 циклоалкила, необязательно замещенного С3-C8 гетероциклила, необязательно замещенного С3-C8 гетероарила и Z3 выбран из группы, состоящей из Н, дейтерия, галогена, необязательно замещенного C1-С6 алкила, необязательно замещенного С3-C8 циклоалкила, необязательно замещенного С6-С10 арила, или -СН2-(необязательно замещенный арил).
[1133] 136. Фармацевтическая композиция по альтернативному варианту 130, отличающаяся тем, что Z1 представляет собой -СН2-, a Z2 необязательно представляет собой замещенный С3-C8 гетероциклил.
[1134] 137. Фармацевтическая композиция по альтернативному варианту 136, отличающаяся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой  где n равно 1, 2, 3 или 4.
где n равно 1, 2, 3 или 4.
[1135] 138. Фармацевтическая композиция по альтернативному варианту 136 или 137, отличающаяся тем, что необязательно замещенный С3-C8 гетероциклил представляет собой 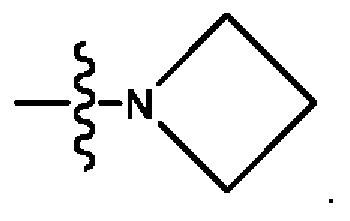
[1136] 139. Фармацевтическая композиция по альтернативному варианту 126, содержащая терапевтически эффективное количество по меньшей мере одного соединения, выбранного из Таблицы А.
[1137] 140. Фармацевтическая композиция по альтернативному варианту 127, содержащая терапевтически эффективное количество по меньшей мере одного соединения, выбранного из группы, состоящей из:


и их фармацевтически приемлемых солей вместе по меньшей мере с одним фармацевтически приемлемым эксципиентом.
[1138] 141. Способ лечения млекопитающего, страдающего заболеванием или нарушением, включающий введение указанному млекопитающему терапевтически эффективного количества соединения по любому из вариантов 1-140.
[1139] 142. Способ лечения млекопитающего, страдающего заболеванием или нарушением, включающий введение указанному млекопитающему терапевтически эффективного количества фармацевтической композиции по любому из альтернативных вариантов 113-140.
[1140] 143. Способ по альтернативному варианту 141 или 142, отличающийся тем, что млекопитающее представляет собой человека.
[1141] 144. Способ по любому из альтернативных вариантов 141 или 142, дополнительно включающий введение субъекту дополнительного лекарственного средства.
[1142] 145. Способ лечения заболевания или нарушения, включающий введение субъекту, страдающему от указанного заболевания или нарушения, эффективного количества соединения по любому из альтернативных вариантов 1-140 или его фармацевтически приемлемой соли.
[1143] 146. Способ лечения заболевания, включающий введение субъекту, страдающему указанным заболеванием, эффективного количества фармацевтической композиции по любому из альтернативных вариантов 113-140.
[1144] 147. Способ по альтернативному варианту 141 или 142, отличающийся тем, что указанное заболевание представляет собой рак.
[1145] 148. Способ по альтернативному варианту 147, отличающийся тем, что рак выбран из группы, состоящей из рака головного мозга, рака молочной железы, рака легких, немелкоклеточного рака легкого, рака яичников, рака поджелудочной железы, рака желудка, рака предстательной железы, рака почки, колоректального рака или лейкоза. В других или дополнительных вариантах осуществления фиброгенетическое нарушение представляет собой склеродермию, полимиозит, системную волчанку, ревматоидный артрит, цирроз печени, образование келоидов, интерстициальный нефрит или легочный фиброз.
[1146] 149. Способ по альтернативному варианту 147 или 148, отличающийся тем, что рак ассоциирован с мутацией RAS.
[1147] 150. Способ по альтернативному варианту 149, отличающийся тем, что мутация RAS представляет собой мутацию KRAS, выбранную из группы, состоящей из G12C, G12S, G12R, G12F, G12L, G12N, G12A, G12D, G12V, G13C, G13S, G13D, G13V, G13P, S17G, P34S, А59Е., A59G, А59Т, Q61K, Q61L, Q61R и Q61H.
[1148] 151. Способ по альтернативному варианту 141 или 142, отличающийся тем, что указанное заболевание представляет собой раковую кахексию.
[1149] 152. Способ ингибирования пролиферации клетки, включающий приведение клетки в контакт с эффективным количеством соединения по любому из альтернативных вариантов 1-112 или фармацевтической композиции по любому из альтернативных вариантов 113-140.
[1150] 153. Способ по альтернативному варианту 152, отличающийся тем, что клетка имеет мутацию RAS.
[1151] 154. Способ индукции апоптоза в клетке, включающий приведение клетки в контакт с эффективным количеством соединения по любому из альтернативных вариантов 1-112 или фармацевтической композиции по любому из альтернативных вариантов 113-140.
[1152] 155. Способ лечения субъекта с раком, устойчивым к лечению ингибитором протеинкиназы МЕК, при этом указанный способ включает приведение клетки в контакт с эффективным количеством соединения по любому из альтернативных вариантов 1-112 или фармацевтической композиции по любому из альтернативных вариантов 113-140.
[1153] 156. Способ лечения субъекта с раком, устойчивым к лечению ингибитором протеинкиназы RAF, при этом указанный способ включает приведение клетки в контакт с эффективным количеством соединения по любому из альтернативных вариантов 1-112 или фармацевтической композиции по любому из альтернативных вариантов 113-140.
[1154] 157. Способ лечения раковой кахексии у млекопитающего, больного раком, включающий введение эффективного количества соединения по любому из альтернативных вариантов 1-112 или фармацевтической композиции по любому из альтернативных вариантов 113-140.
[1155] 158. Способ по любому из альтернативных вариантов 141-157, отличающийся тем, что соединение по любому из альтернативных вариантов 1-112 или фармацевтическую композицию по любому из альтернативных вариантов 113-140 вводят в виде однократной дозы.
[1156] 159. Способ по любому из альтернативных вариантов 141-157, отличающийся тем, что соединение по любому из альтернативных вариантов 1-112 или фармацевтическую композицию по любому из альтернативных вариантов 113-140 вводят в виде однократной дозы.
[1157] 160. Способ по любому из альтернативных вариантов 141-157, отличающийся тем, что соединение по любому из альтернативных вариантов 1-112 или фармацевтическую композицию по любому из альтернативных вариантов 113-140 вводят в виде однократной дозы один раз в день.
[1158] 161. Способ по любому из альтернативных вариантов 141-157, отличающийся тем, что соединение по любому из альтернативных вариантов 1-112 или фармацевтическую композицию по любому из альтернативных вариантов 113-140 вводят в виде многократных доз более одного раза в день
[1159] 162. Способ по любому из альтернативных вариантов 141-157, отличающийся тем, что соединение по любому из альтернативных вариантов 1-112 или фармацевтическую композицию по любому из альтернативных вариантов 113-140 вводят два раза в день.
[1160] 163. Способ по любому из альтернативных вариантов 141-157, отличающийся тем, что соединение по любому из альтернативных вариантов 1-112 или фармацевтическую композицию по любому из альтернативных вариантов 113-140 вводят три раза в день.
[1161] 164. Способ по любому из альтернативных вариантов 141-157, отличающийся тем, что соединение по любому из альтернативных вариантов 1-112 или фармацевтическую композицию по любому из альтернативных вариантов 113-140 вводят в дозе от 0,1 мг до 2000 мг.
[1162] 165. Способ по любому из альтернативных вариантов 141-157, отличающийся тем, что соединение по любому из альтернативных вариантов 1-112 или фармацевтическую композицию по любому из альтернативных вариантов 113-140 вводят в дозе от около 0,001 до около 1000 мг/кг массы тела/день.
[1163] 166. Соединение по любому из альтернативных вариантов 1-112 или фармацевтическая композиция по любому из альтернативных вариантов 113-140, отличающееся тем, что указанное соединение обладает лекарственным профилем устойчивости к RAF, вводится два раза в день, характеризуется сбалансированным метаболизмом и активностью в течение от около 3 до около 6 часов.
[1164] 167. Соединение по любому из альтернативных вариантов 1-112 или фармацевтическая композиция по любому из альтернативных вариантов 113-140, отличающееся тем, что указанное соединение взаимодействует с первой областью, включающей L115, L118, V127 и М143 киназы MEK.
[1165] 168. Соединение по альтернативному варианту 167, отличающееся тем, что указанное соединение взаимодействует со второй областью, содержащей К97 киназы МЕК.
[1166] 169. Соединение по альтернативному варианту 167 или 168, отличающееся тем, что указанное соединение взаимодействует с третьей областью, включающей S212,1215 и М219 киназы MEK.
[1167] 170. Способ разработки молекул, основанный на оценке и балансе двух нижерасположенных молекулярных мишеней, при этом указанный способ включает:
введение соединения, нацеленного на pERK (T202/Y204) и pSTAT3(S727).
[1168] 171. Способ предотвращения повторной активации MEK посредством обхода CRAF, при этом указанный способ включает:
введение эффективного количества соединения по любому из альтернативных вариантов 1-112 или фармацевтической композиции по любому из альтернативных вариантов 113-140.
[1169] 172. Способ разработки лекарственного терапевтического окна для двойных ингибиторов RAF/MEK, при этом указанный способ включает:
введение терапевтического агента с периодом полувыведения из плазмы менее 12 часов, введение дозы 1 р/д или 2 р/д, устойчивость к реактивации MEK путем обхода CRAF и оптимальный метаболический баланс между ингибированием pERK и pSTAT3(S727).
[1170] Хотя вышеизложенный материал был описан довольно подробно посредством иллюстраций и примеров для целей ясности и понимания, специалистам в данной области техники будет понятно, что могут быть сделаны многочисленные и разнообразные модификации, не отступая от сущности настоящего изобретения. Следовательно, следует четко понимать, что формы, описанные в данном документе, являются только иллюстративными и не предназначены для ограничения объема настоящего раскрытия, а скорее также охватывают все модификации и альтернативы, соответствующие истинному объему и духу изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТИЕНОПИРРОЛА ДЛЯ ПРИМЕНЕНИЯ ДЛЯ НАЦЕЛИВАНИЯ НА БЕЛКИ, КОМПОЗИЦИИ С УКАЗАННЫМИ ПРОИЗВОДНЫМИ, СПОСОБЫ И ПРИМЕНЕНИЯ | 2017 |
|
RU2771166C2 |
| СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ 2-АМИНОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2795914C1 |
| СОЕДИНЕНИЕ, НАЦЕЛЕННОЕ НА БЕЛОК И ЕГО ДЕГРАДАЦИЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2829459C1 |
| ПРОИЗВОДНЫЕ БОРОНОВОЙ КИСЛОТЫ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2017 |
|
RU2773346C2 |
| ДИГИДРОБЕНЗОДИАЗЕПИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2000 |
|
RU2247115C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА | 2020 |
|
RU2839897C2 |
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА | 2018 |
|
RU2779477C2 |
| β-D-2'-ДЕЗОКСИ-2'-α-ФТОР-2'-β-С-ЗАМЕЩЕННЫЕ-2-МОДИФИЦИРОВАННЫЕ-N6-ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ НУКЛЕОТИДЫ ДЛЯ ЛЕЧЕНИЯ ВЫЗВАННЫХ HCV ЗАБОЛЕВАНИЙ | 2016 |
|
RU2764767C2 |
| СОЕДИНЕНИЕ ИЗОИНДОЛИН, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2813232C2 |
| ПИПЕРИДИНИЛ-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИЗОХИНОЛОНА КАК ИНГИБИТОРЫ Rho-КИНАЗЫ | 2006 |
|
RU2414467C2 |


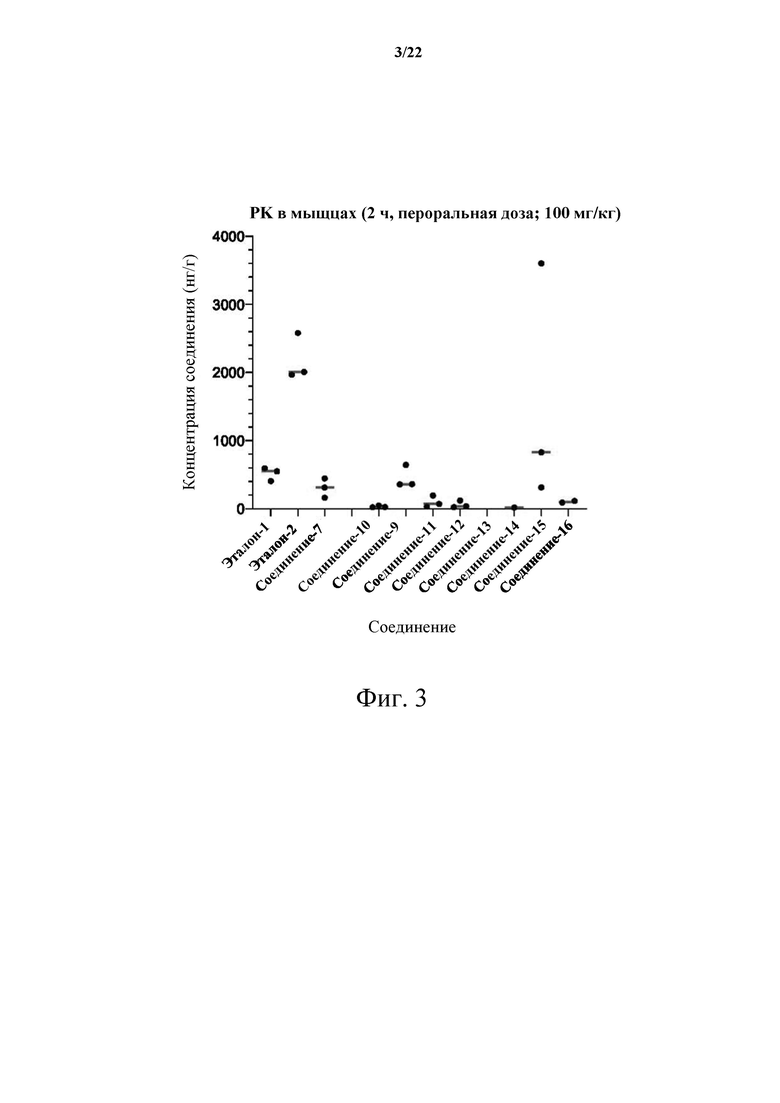


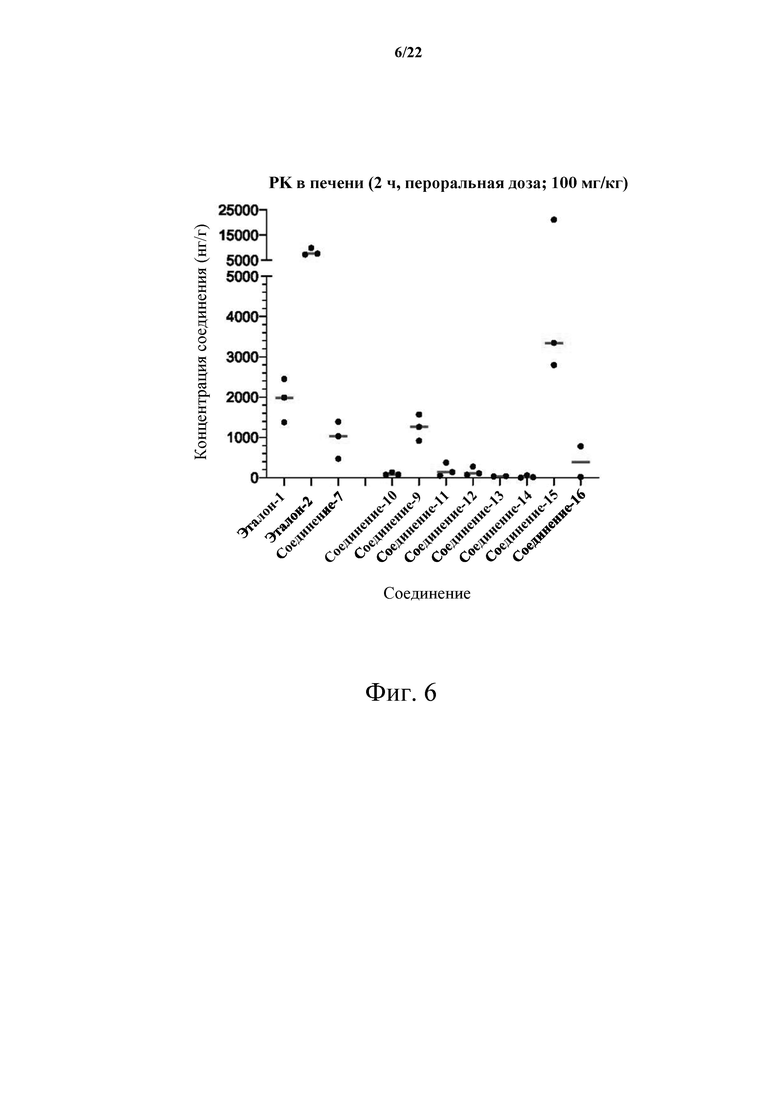
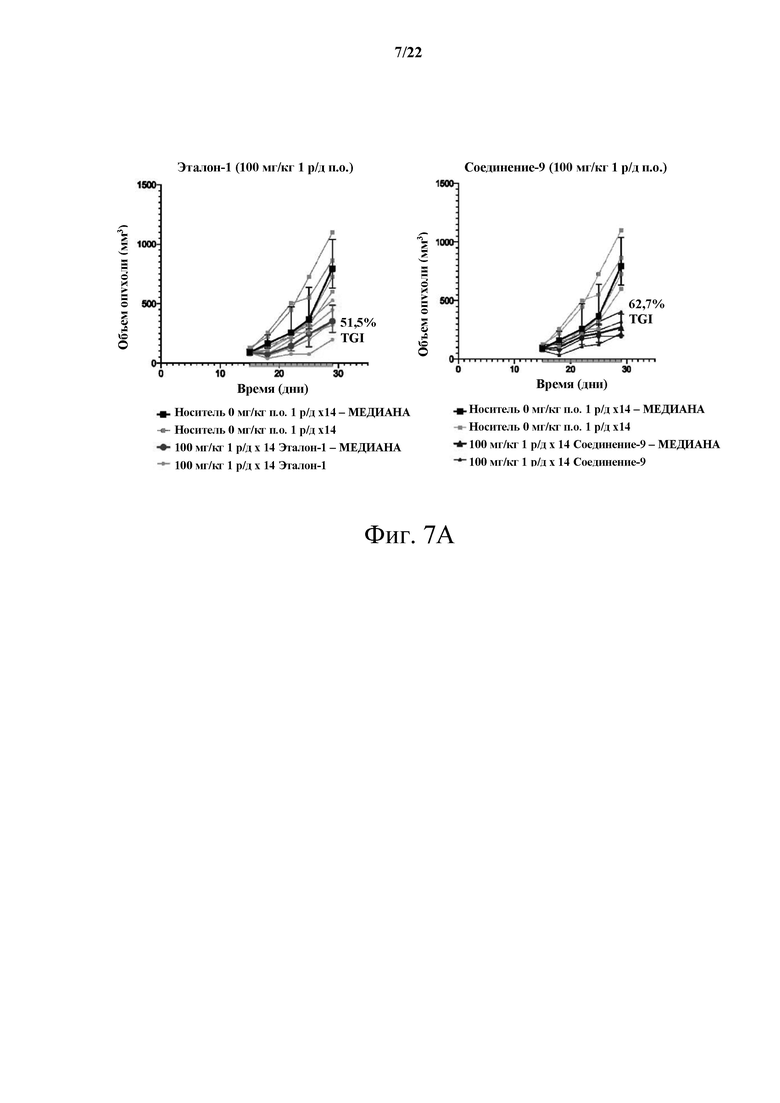
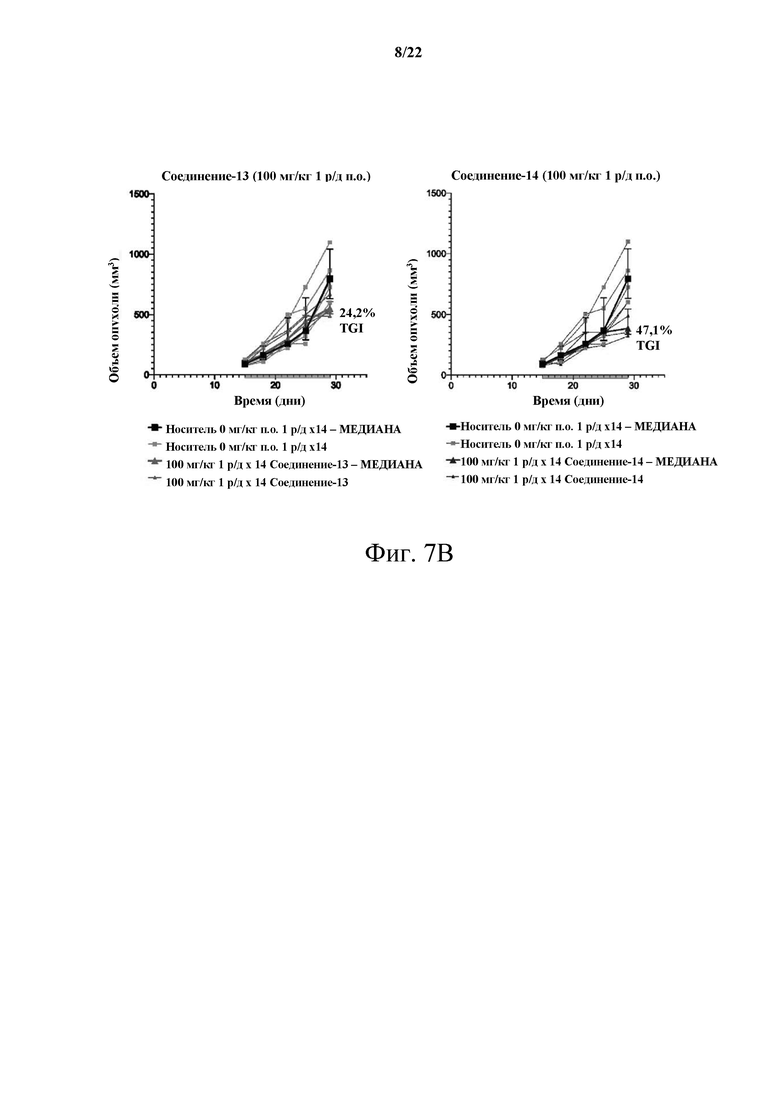
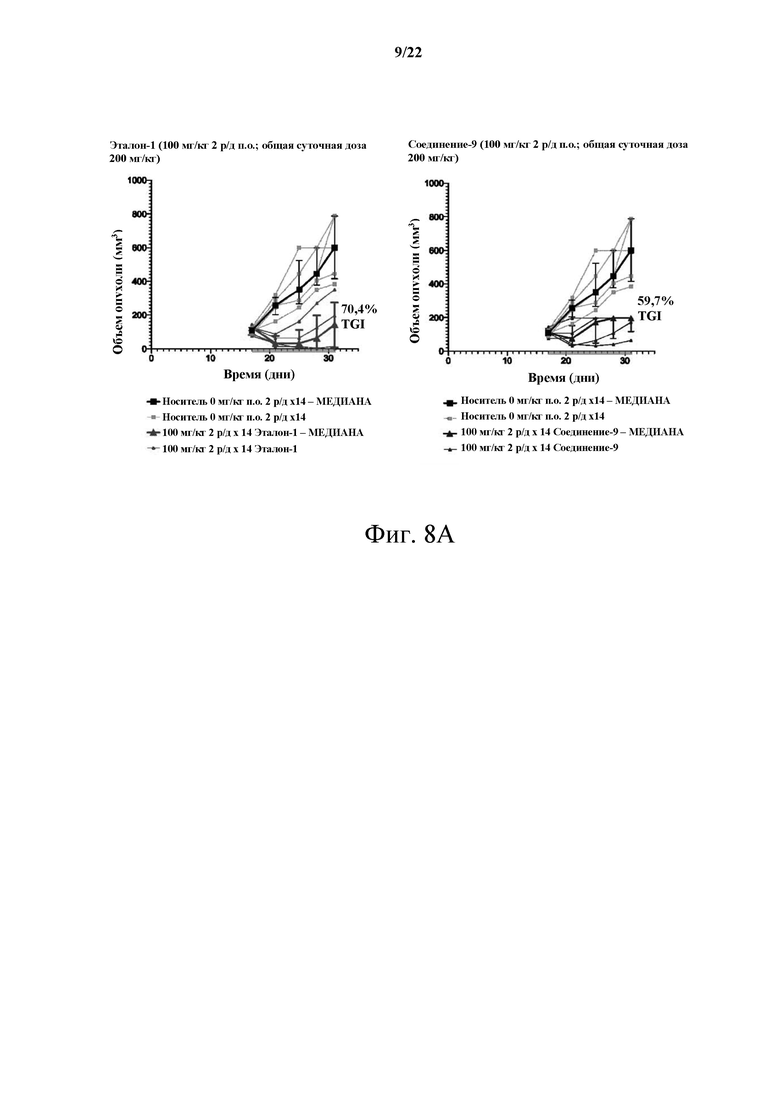
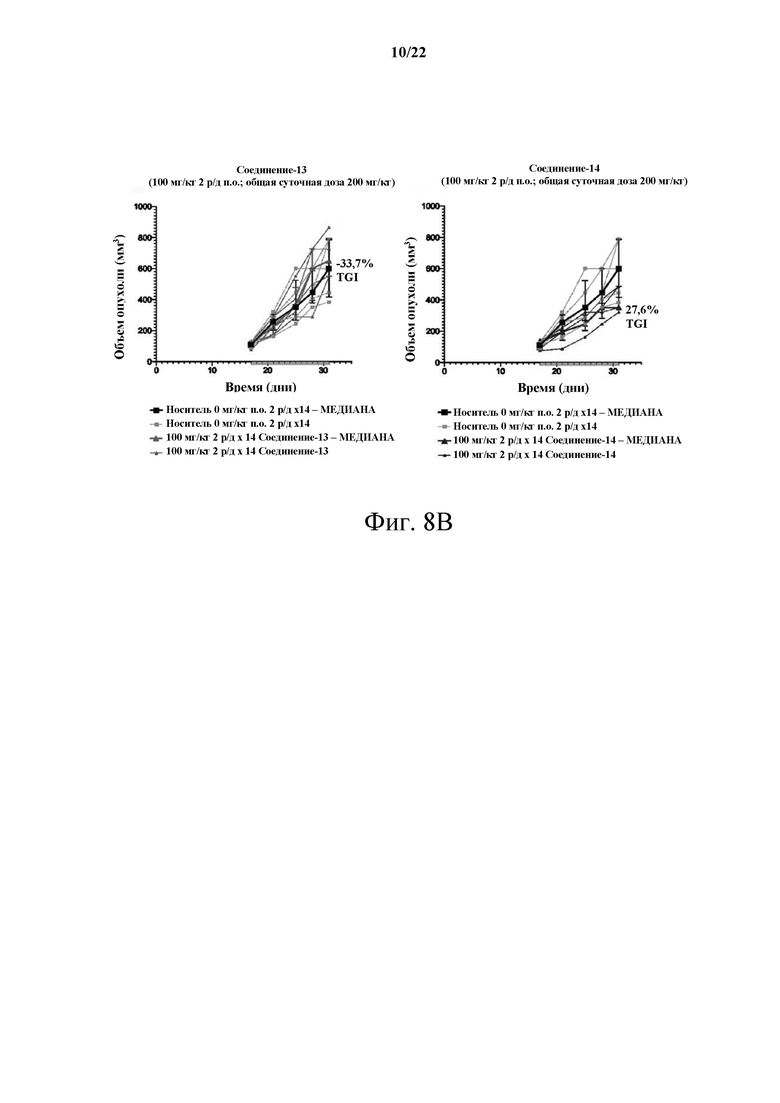
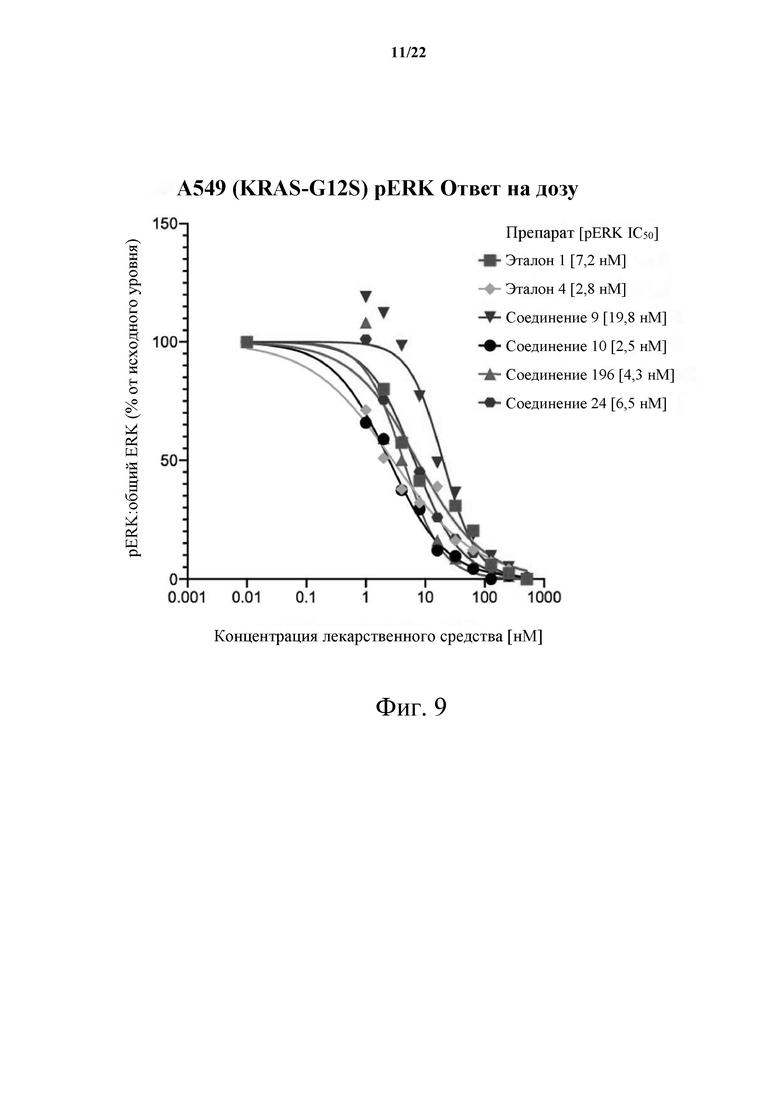
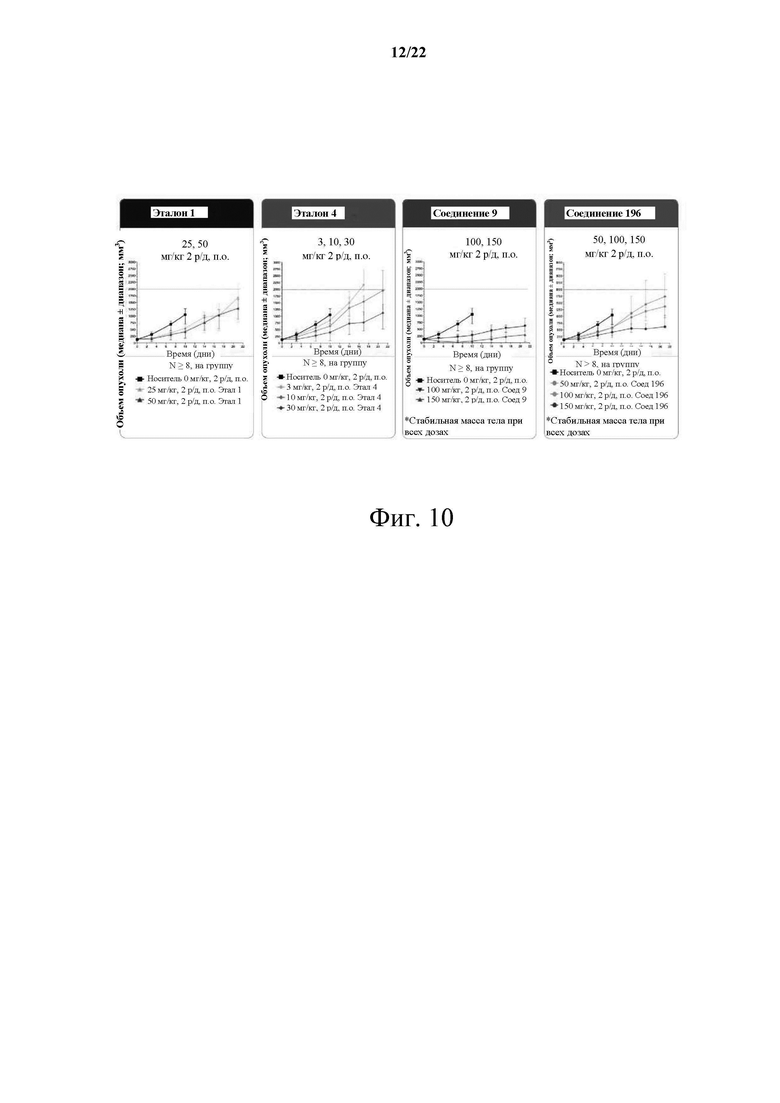
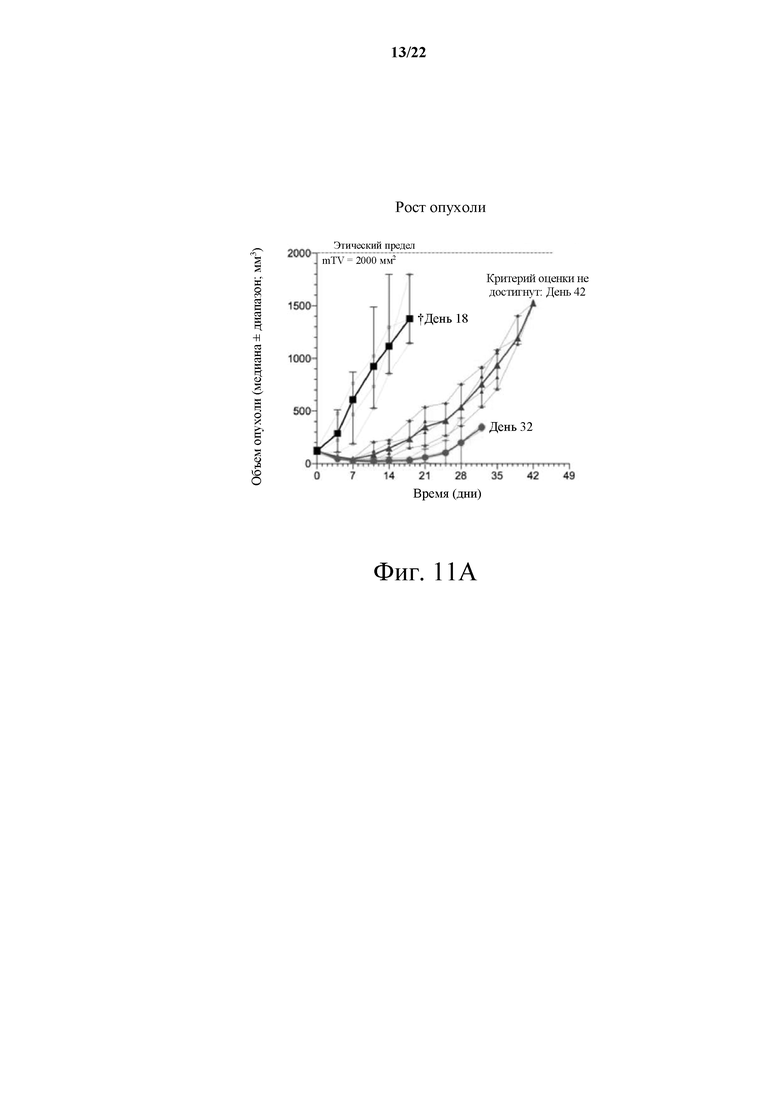
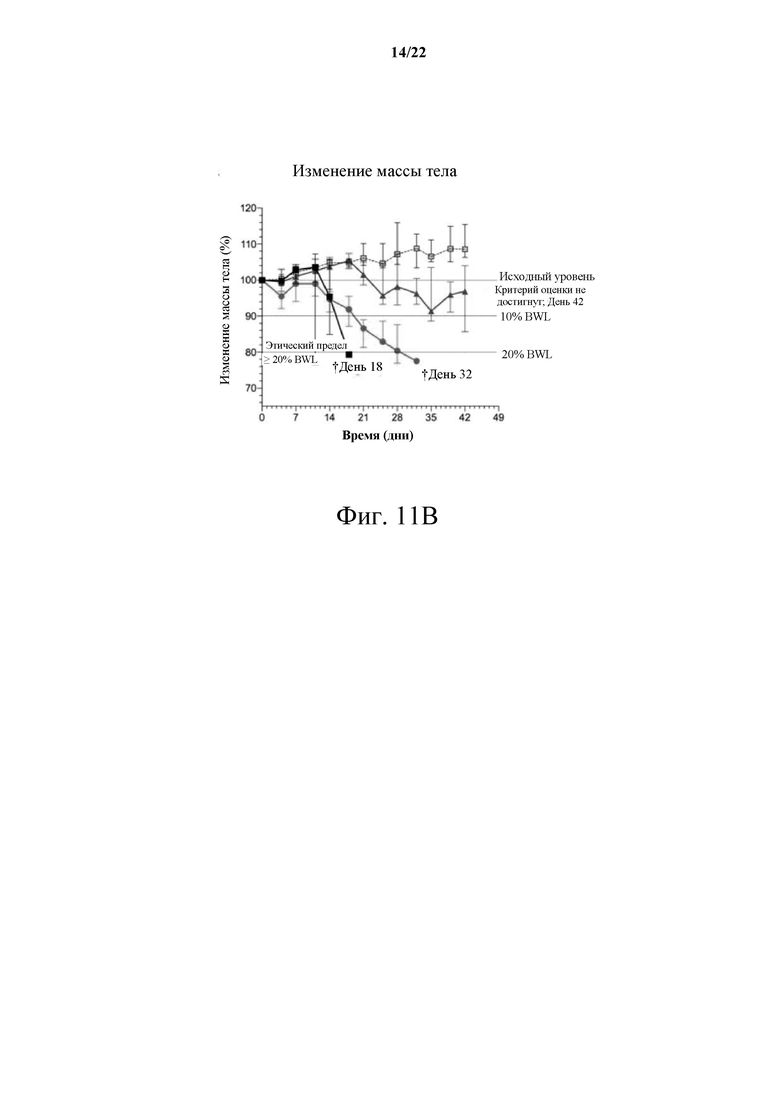

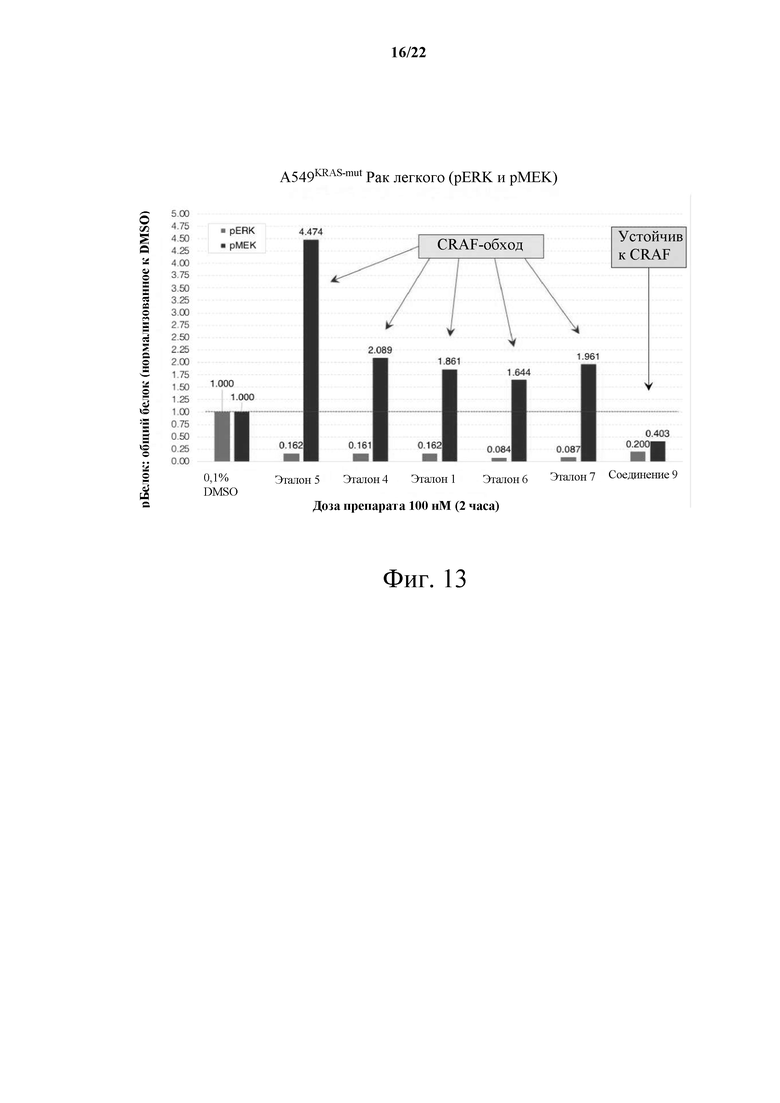
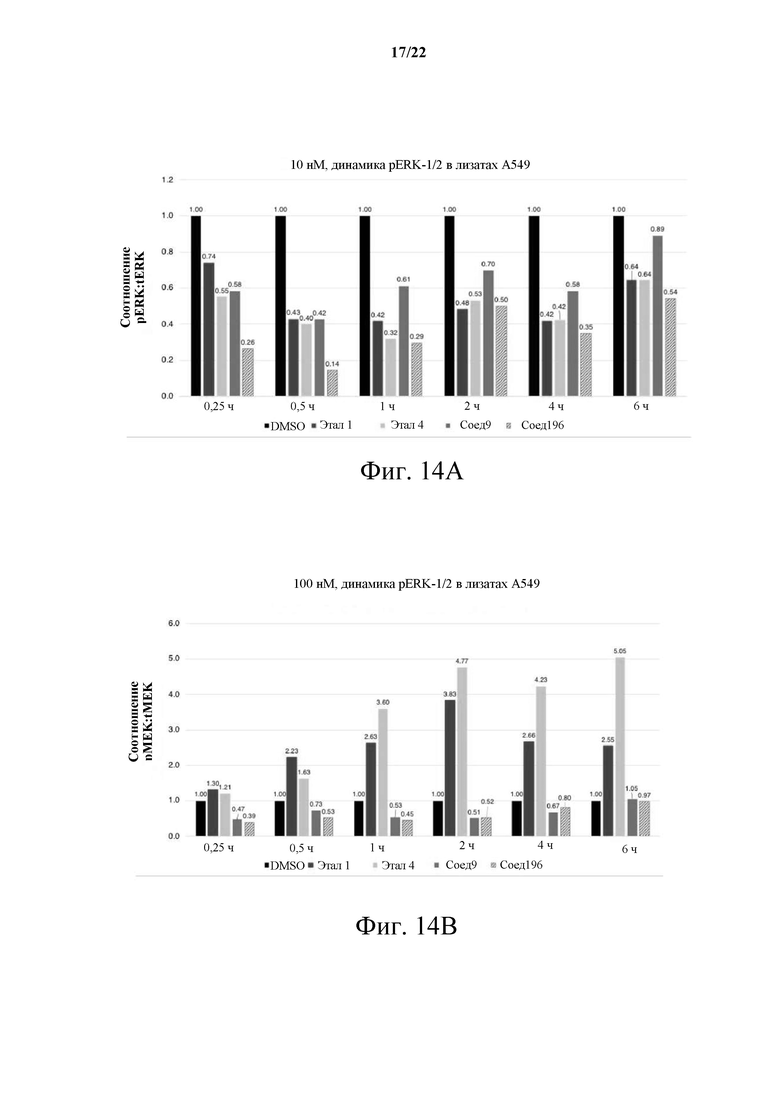
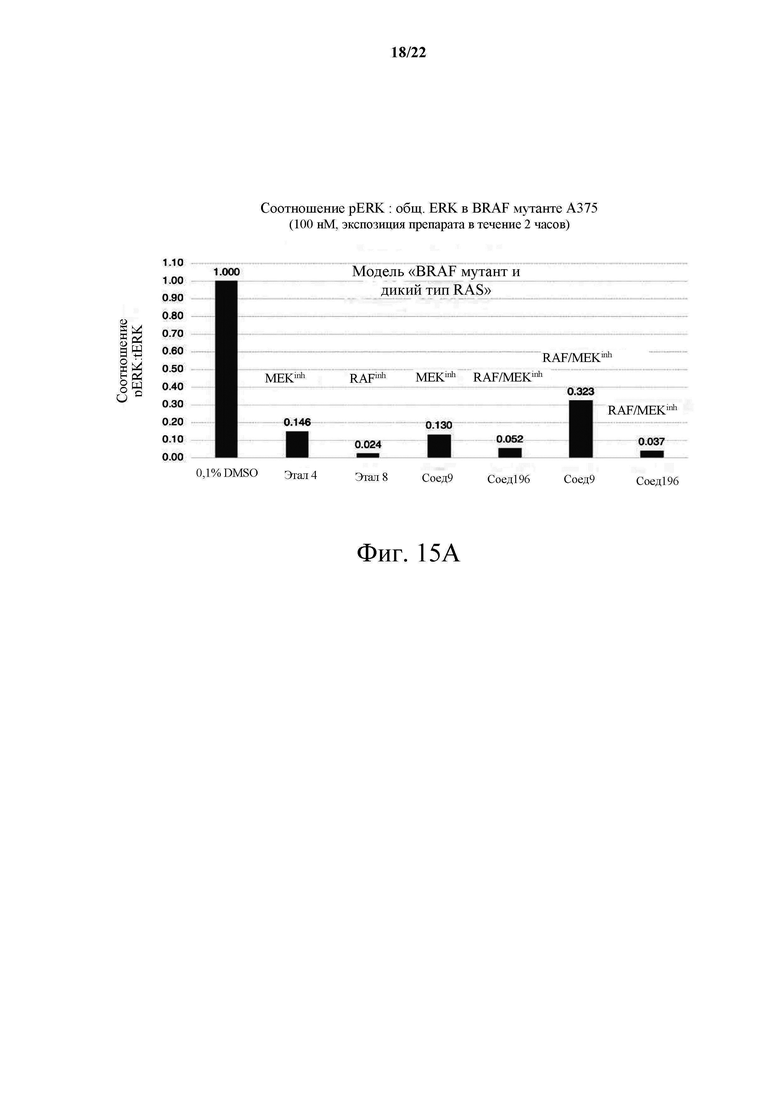

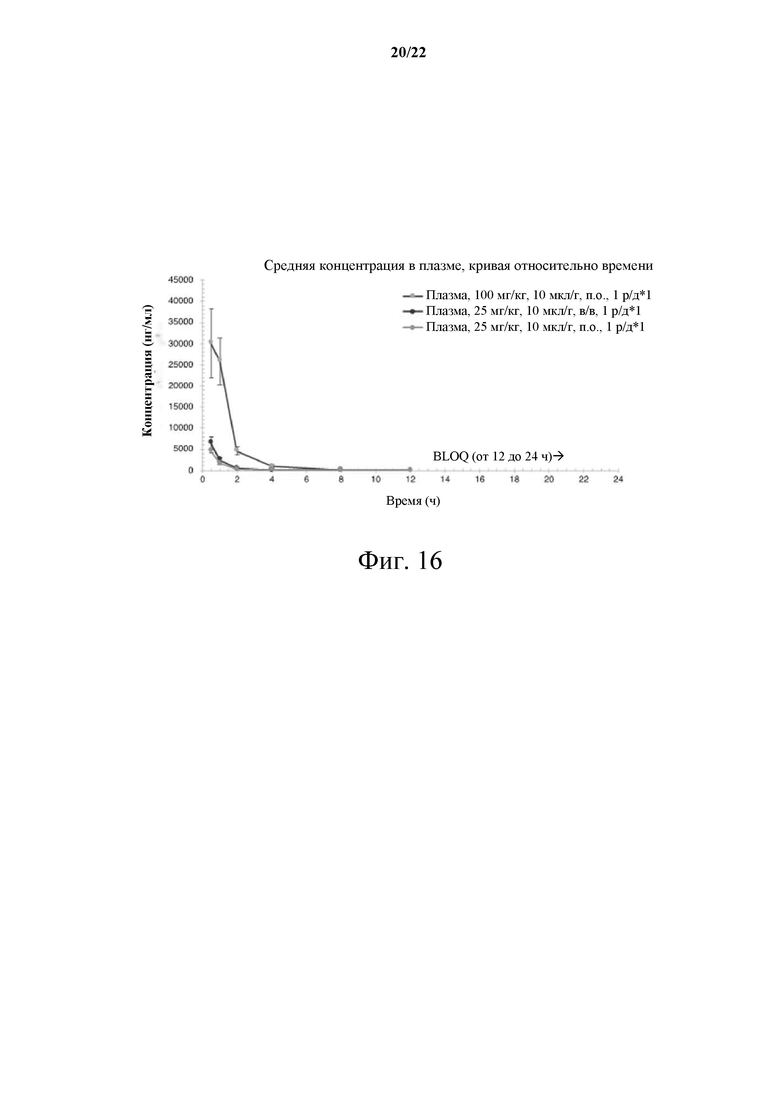

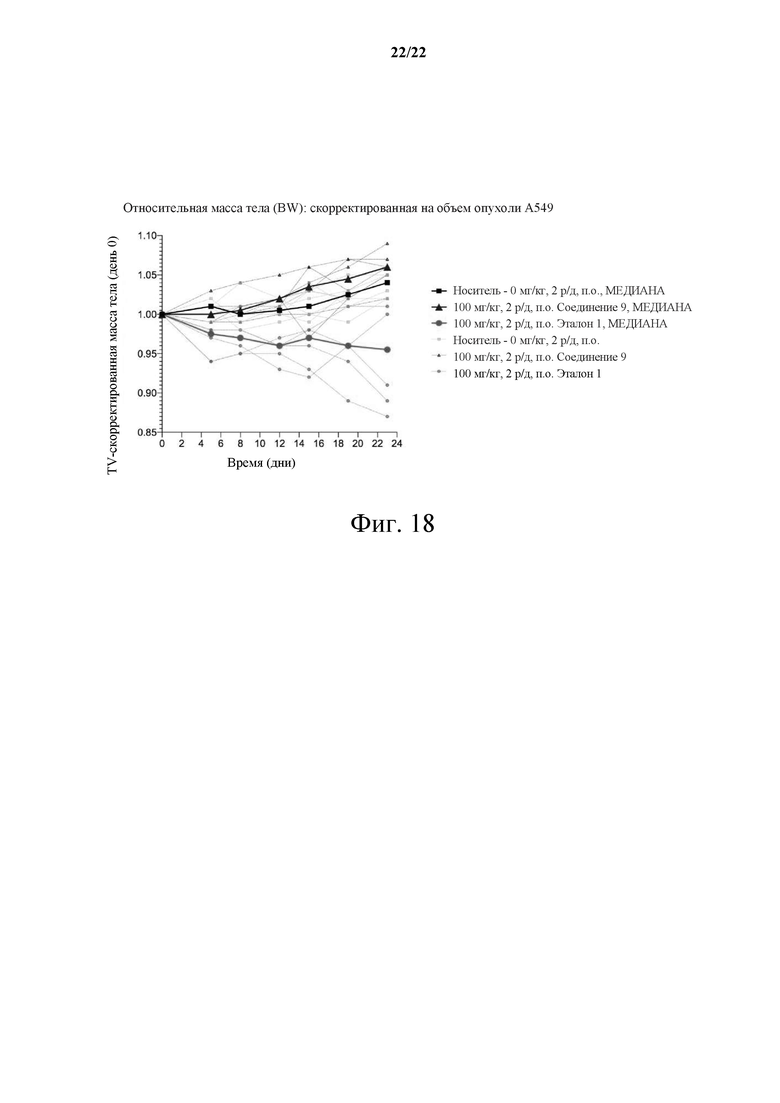
Группа изобретений относится к органической химии и включает соединение формулы (IIa), его фармацевтически приемлемую соль, фармацевтическую композицию, применение и способ предотвращения реактивации MEK путем обхода CRAF на его основе. Где в формуле (IIa) R2 представляет собой L; R3 представляет собой фтор; R6 представляет собой H, галоген или C1-C6 алкил; R8 представляет собой C1-C6 алкил; L представляет собой -Z1-Z2; Z1 представляет собой -CH2; Z2 выбран из C3-C8 гетероциклила, имеющего 1-2 гетероатома, выбранных из O и N, необязательно замещённых одним или более заместителями, индивидуально и независимо выбранных из C1-C4 алкила, циано, галогена, амино, амино(C1-C4 алкила), амидо, оксо; или -NR5R5´; каждый R5 и R5´ независимо представляет собой C1-C6 алкил; X представляет собой O; Y представляет собой O; Z представляет собой C или N. Технический результат – соединения формулы (IIa), обладающие свойствами ингибиторов MEK, которые максимизируют реверсирование патологического пути MAPK/ERK и являются эффективными агентами против рака. 4 н. и 26 з.п. ф-лы, 22 ил., 16 табл., 126 пр.
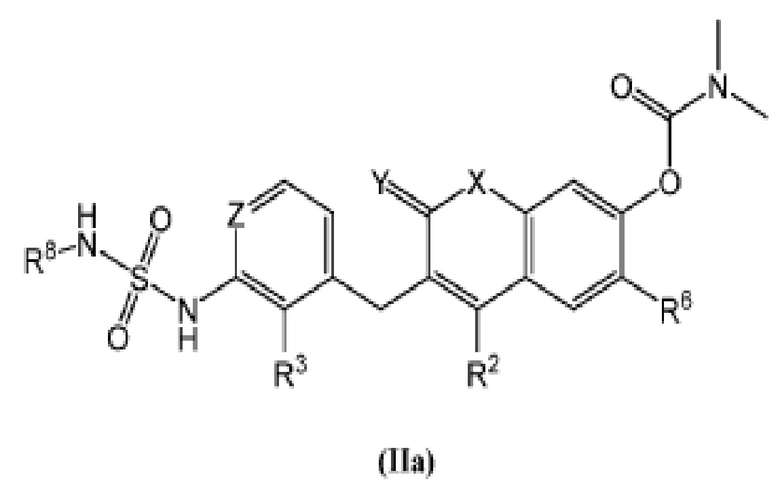
1. Соединение, имеющее структуру формулы (IIa)

или его фармацевтически приемлемая соль, где:
R2 представляет собой L;
R3 представляет собой фтор;
R6 представляет собой H, галоген или C1-C6 алкил;
R8 представляет собой C1-C6 алкил;
L представляет собой -Z1-Z2;
Z1 представляет собой -CH2;
Z2 выбран из C3-C8 гетероциклила, имеющего 1-2 гетероатома, выбранных из O и N, необязательно замещённых одним или более заместителями, индивидуально и независимо выбранных из C1-C4 алкила, циано, галогена, амино, амино(C1-C4 алкила), амидо, оксо; или -NR5R5';
каждый R5 и R5' независимо представляет собой C1-C6 алкил;
X представляет собой O;
Y представляет собой O; и
Z представляет собой C или N.
2. Соединение по п. 1, в котором Z2 представляет собой -NR5R5'.
3. Соединение по п. 2, в котором R5 представляет собой CH3 и R5' представляет собой C1-C6 алкил.
4. Соединение по п. 2, в котором каждый R5 и R5' независимо представляет собой -CH2CH3.
5. Соединение по п. 2, в котором R5 и R5' представляет собой CH3.
6. Соединение по п. 1, в котором Z2 представляет собой  , необязательно замещенный одним или более заместителями, выбранными из метила или галогена, и n равен 1, 2, 3 или 4.
, необязательно замещенный одним или более заместителями, выбранными из метила или галогена, и n равен 1, 2, 3 или 4.
7. Соединение по п. 6, в котором Z2 представляет собой  .
.
8. Соединение по п. 1, в котором Z2 представляет собой  , необязательно замещенный метилом.
, необязательно замещенный метилом.
9. Соединение по любому из пп. 1-8, в котором R8 представляет собой CH3.
10. Соединение по любому из пп. 1-9, в котором R6 представляет собой H.
11. Соединение по любому из пп. 1-9, в котором R6 представляет собой галоген.
12. Соединение по п. 11, в котором R6 представляет собой хлор.
13. Соединение по п. 11, в котором R6 представляет собой фтор.
14. Соединение по любому из пп. 1-9, в котором R6 представляет собой -CH3.
15. Соединение по любому из пп. 10-14, в котором каждый R5 и R5' независимо представляет собой CH3.
16. Соединение по любому из пп. 1-15, в котором Z представляет собой C.
17. Соединение по любому из пп. 1-15, в котором Z представляет собой N.
18. Соединение по п. 1, выбранное из:
соединения, выбранного из группы, состоящей из:
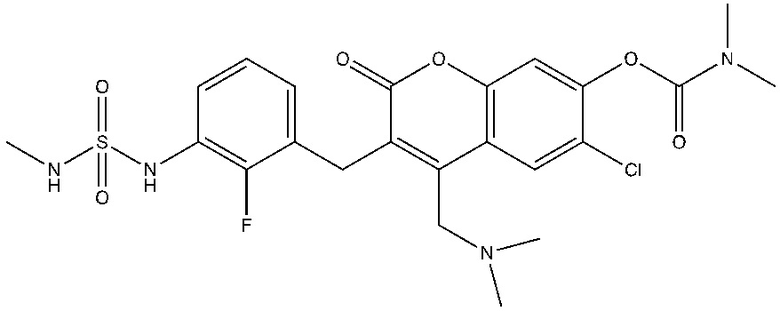 ,
, ,
, ,
,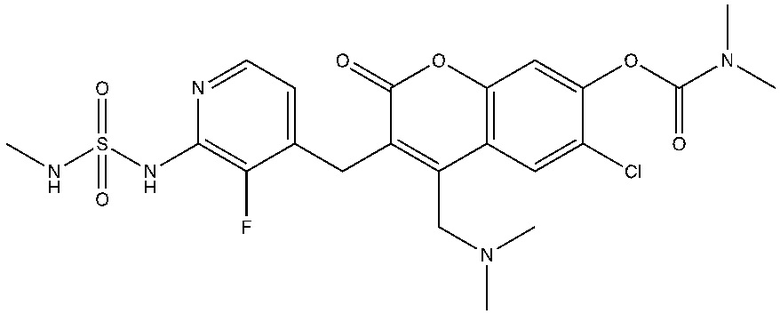 и
и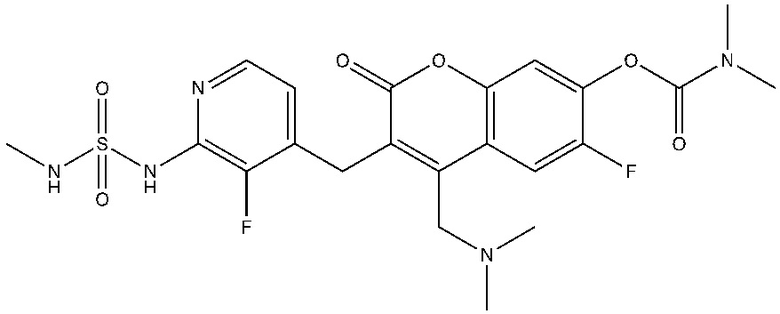 ;
;
соединения, выбранного из группы, состоящей из:
 ,
, ,
, ,
, ,
,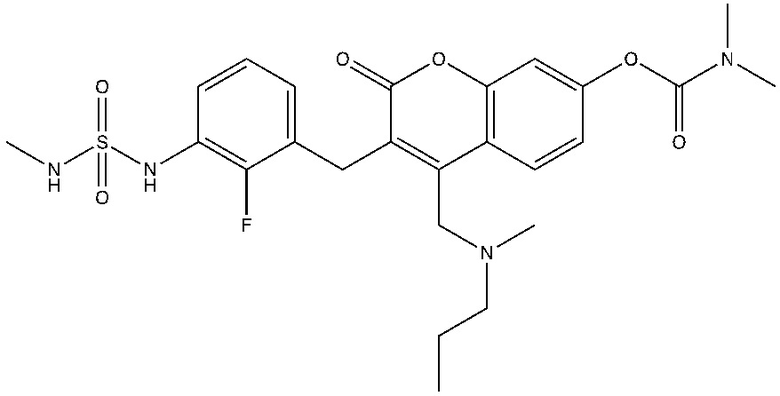 ,
, и
и ; или
; или
соединения, выбранного из группы, состоящей из:
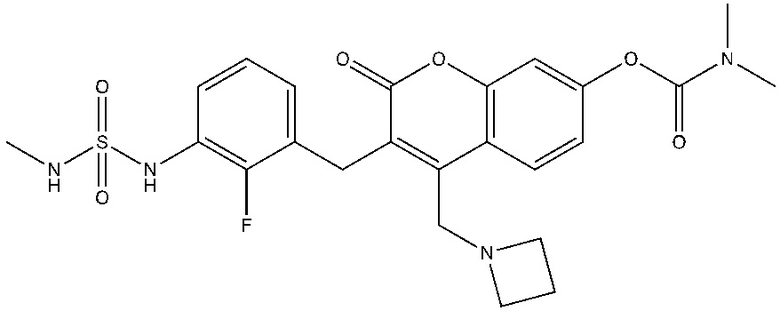 ,
,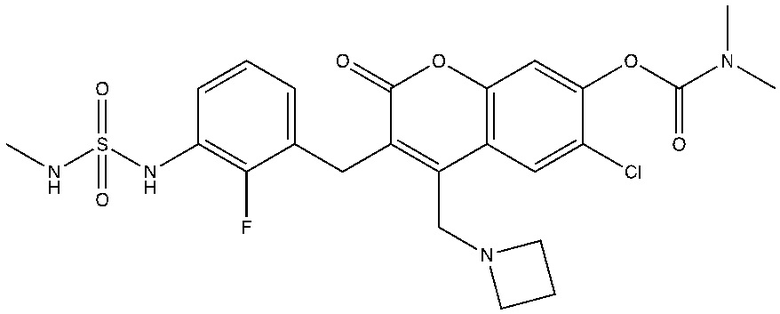 ,
, ,
,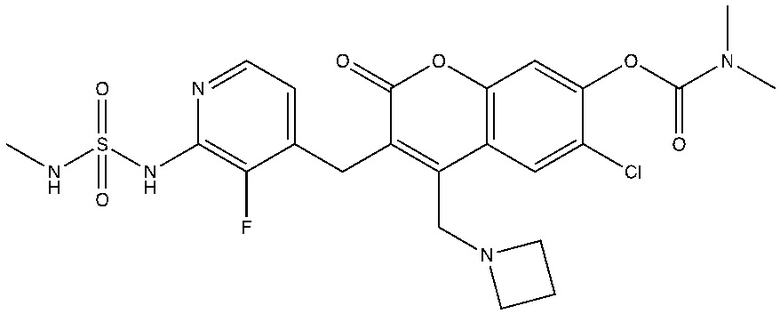 ,
, ,
,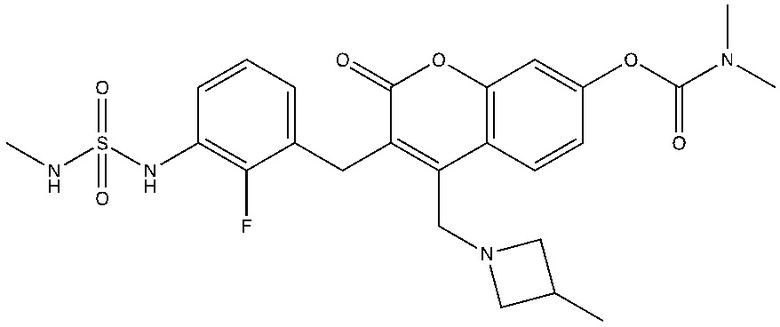 ,
,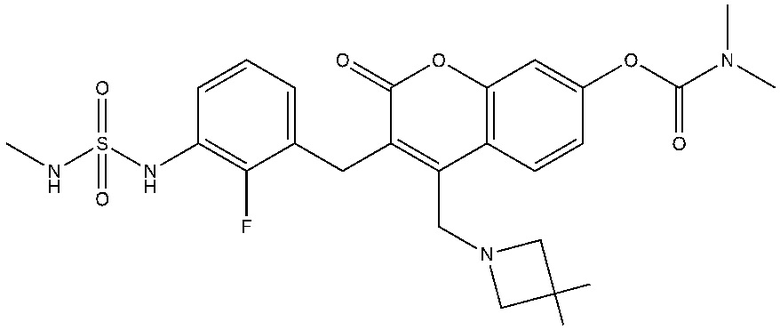 ,
,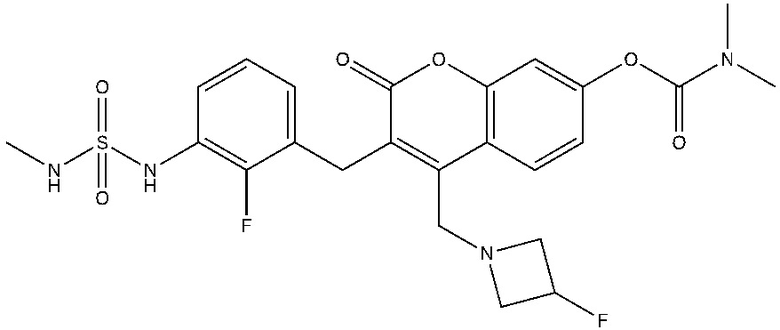 ,
,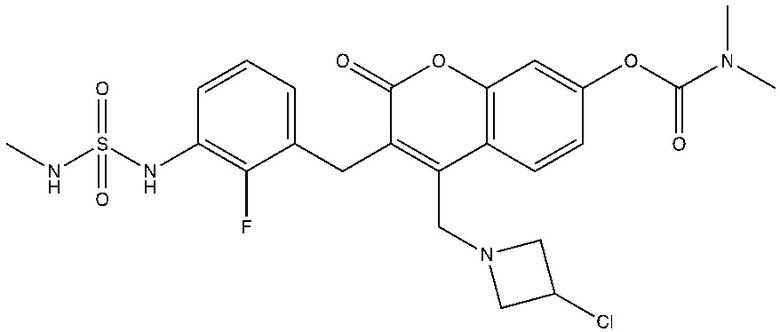 ,
,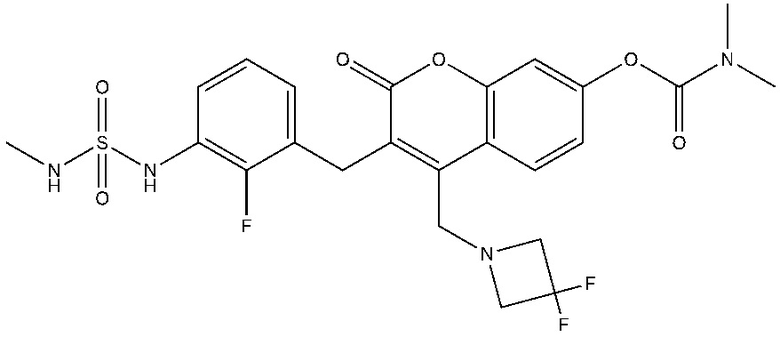 и
и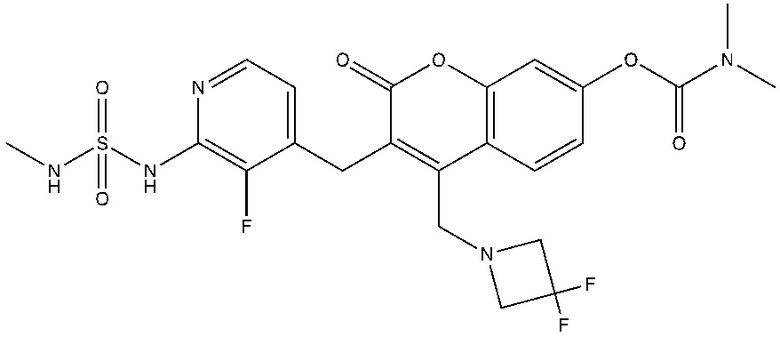 , или
, или
соединения, выбранного из группы, состоящей из:
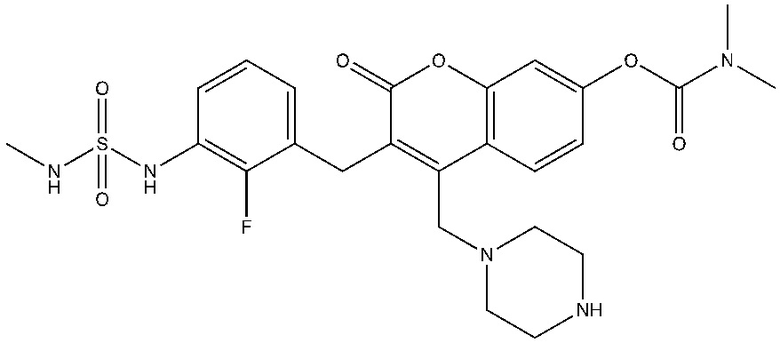 ,
,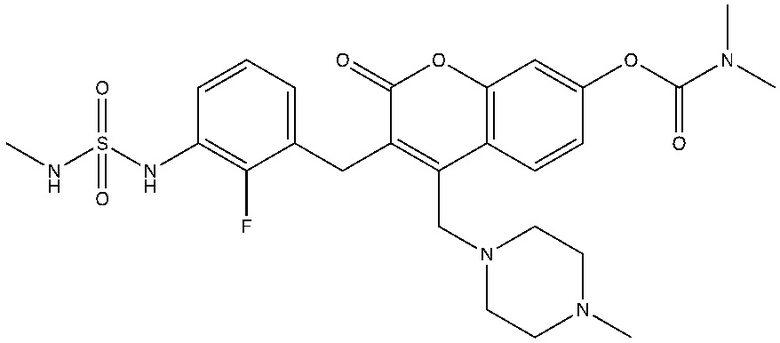 ,
,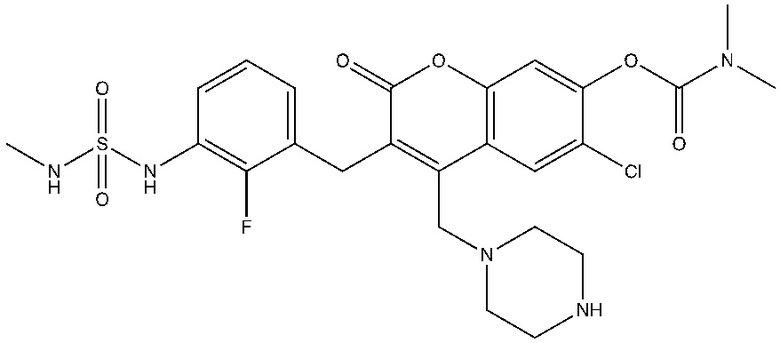 ,
, ,
, и
и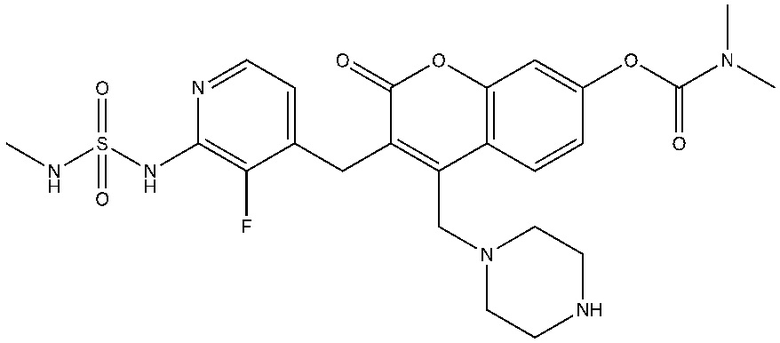 .
.
19. Соединение по п. 1, представляющее собой: 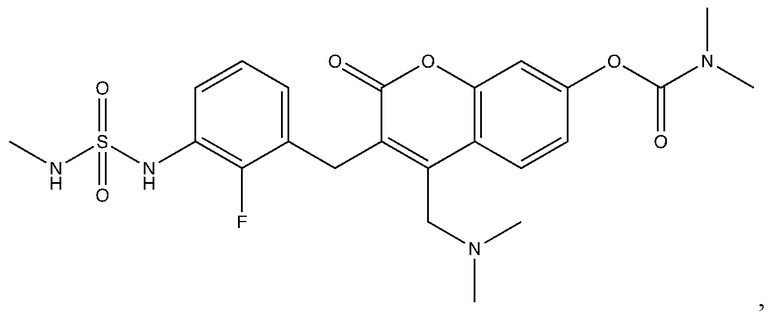 или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
20. Соединение по п. 1, в котором указанное соединение представляет собой:  или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
21. Соединение по п. 1, представляющее собой:  или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
22. Соединение по п. 1, представляющее собой: 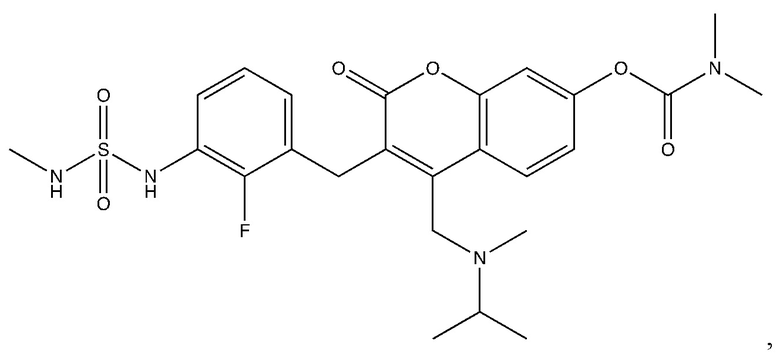 или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
23. Соединение по п. 1, представляющее собой: 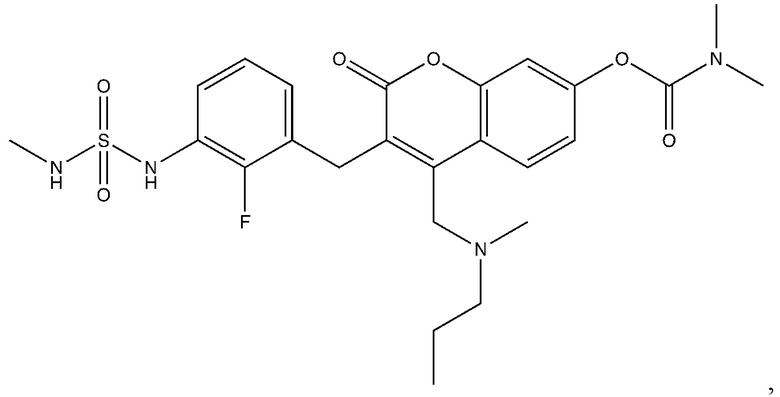 или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
24. Соединение по п. 1, представляющее собой: 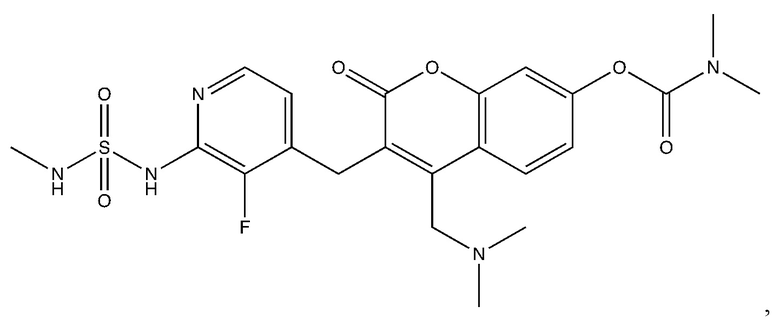 или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
25. Соединение по п. 1, представляющее собой:  или его фармацевтически приемлемая соль.
или его фармацевтически приемлемая соль.
26. Фармацевтическая композиция для лечения рака, содержащая терапевтически эффективное количество соединения по любому из пп. 1-25 и один или более фармацевтически приемлемый носитель, разбавитель, эксципиент или их комбинацию.
27. Применение соединения по любому из пп. 1-25 или фармацевтической композиции по п. 26 для лечения у субъекта рака, устойчивого к лечению ингибитором протеинкиназы MEK.
28. Применение по п. 27, в котором указанный рак выбран из группы, состоящей из рака головного мозга, рака молочной железы, рака легкого, немелкоклеточного рака легкого, рака яичника, рака поджелудочной железы, рака желудка, рака предстательной железы, рака почки, колоректального рака или лейкоза.
29. Способ предотвращения реактивации MEK путем обхода CRAF, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества терапевтического агента, который представляет собой соединение по любому из пп. 1-25, или фармацевтической композиции по п. 26.
30. Способ по п. 29, в котором указанный терапевтический агент имеет период полувыведения из плазмы менее 12 часов, устойчив к реактивации MEK путем обхода CRAF и к мишеням pERK и pSTAT3(S727).
| US 20100004233 A1, 07.01.2010 | |||
| US 20160002212 A1, 07.01.2016 | |||
| КОЛЕСО ОБОЗРЕНИЯ | 2000 |
|
RU2172198C1 |
| JP 2012092038 A, 17.05.2012 | |||
| Тормоз бобин в гильзовых машинах | 1929 |
|
SU20523A1 |
Авторы
Даты
2024-02-05—Публикация
2021-01-07—Подача