Настоящее изобретение относится к эффективному способу получения пара-терфенила (п-терфенила) из бензола, позволяющему получать высокочистый п-терфенил сцинцилляционного качества с высоким выходом, 100% селективностью и без образования примесей неотделяемых продуктов.
Органические люминофоры могут быть с полным основанием отнесены к важным материалам для новой техники, поскольку они уже нашли применение в ядерной физике, квантовой электронике, люминесцентной дефектоскопии, в промышленности пластмасс, в биологии и медицине, в геологии и гидрогеологии, аналитической химии, криминалистике и т.д.
В последнее время из-за повышения требований к радиационной безопасности особое значение приобретают органические люминофоры, использующиеся для создания пластмассовых сцинцилляционных детекторов в составе аппаратуры контроля в атомной энергетике, производстве радиоактивных материалов, в системах экологического контроля и системах контроля за хранением и перемещением ядерных материалов, в металлургической, химической промышленности и в других областях науки и техники, где требуется обнаружение радионуклидов естественного и искусственного происхождения.
В состав такой аппаратуры входят специальные сенсорные (сцинцилляционные) пленки, основными компонентами которых являются: п-терфенил и разнообразные добавки-шифтеры: 1,4-бис(5-фенилоксазол-2-ил)бензол (POPOP) (CAS 1806-34-3), 2-(4-бифенилил)-5-фенил-1,3,4-оксадиазол (PBD) (CAS 852-38-0), 2-(4-трет-бутилфенил)-5-(4-бифенилил)-1,3,4-оксадиазол (butyl-PBD) (CAS 15082-28-7), которые улучшают свойства п-терфенила. В настоящий момент в РФ и странах ЕАС нет производства ни одного из вышеуказанных продуктов, несмотря на постоянно растущую потребность.
Одним из наиболее важных компонентов вышеуказанных пленок является п-терфенил.
Несмотря на то, что в литературе описано несколько способов получения п-терфенила, в промышленности п-терфенил получают разделением смеси терфенилов, которая образуется в качестве побочного продуктов в промышленной пиролитической дегидроконденсации бензола при производстве дифенила. При дальнейшем разделении смеси терфенилов, орто-производное (о-терфенил) легко отделяет путем дистилляции; м- и п-терфенил дистиллируют вместе и далее разделяют путем зонального рафинирования. (Gerhartz, W. (exec ed.). Ullmann's Encyclopedia of Industrial Chemistry. 5th ed.Vol A1: Deerfield Beach, FL: VCH Publishers, 1985 to Present., p. VA3 528).
Недостатком данного - единственного на настоящее время промышленного способа получения п-терфенила - является присутствие в полученном п-терфениле ряда трудно отделимых, до сих пор не идентифицированных примесей, которое требует трудоемкой дополнительной очистки, которая однако не дает 100% результата и затрудняет достижение воспроизводимых результатов в готовой продукции на основе п-терфенила.
Известен способ получения п-терфенила путем алкилирования бензола циклогексанолом в присутствии серной кислоты в качестве катализатора, с последующим дегидрированием полученных дициклогексилбензолов в жидкой фазе при атмосферном давлении и температуре 270-320°С на алюмоплатиновых или алюмопалладиевых катализаторах, с последующей перекристаллизацией полученного п-терфенила (Кузнецова Е.А. Синтез терфенила и ряда его производных на основе нефтехимического сырья. Диссертация на соискание ученой степени кандидата химических наук: 05.17.04. Ярославль, ЯГТУ, 2004 г., с.7; RU 2349572 C1).
Известен способ получения п-терфенила посредством взаимодействия динитрозодиацетил-п-фенилендиамина и бензола в соотношении 11:260 при перемешивании при 35°С в течение 12 часов с выделением азота и последующей перегонкой для удаления избытка бензола. После удаления избытка бензола остаток подвергают сублимации или перегонке при пониженном давлении, в результате чего п-терфенил получают с хорошим выходом (US 2301206 A).
Известен альтернативный способ получения п-терфенила при помощи реакции Сузуки (реакция Сузуки — Мияуры) (N. Miyaura and A. Suzuki Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds, Chem. Rev., 1995, 95(7), pp. 2457–2483 (doi:10.1021/cr00039a007)) из 1,4-дибромбензола с использованием катализаторов на основе палладия.
Описан способ получения п-терфенила путем взаимодействия 1,4-дибромбензола с эфиром пинакол фенилборонатом в атмосфере аргона с использованием дибензоилацетона палладия, в результате которого выход п-терфенила составляет 73% (US 9109081 B2).
Использование различных растворителей в реакции кросс-сочетания 1,4-дибромбензола с фенилборной кислотой в присутствии катализатора ацетата палладия (основание-карбонат калия) приводит к образованию п-терфенила с различной чистотой продукта. Так, известно что при использовании в качестве растворителя смеси диоксан-вода в течении 5 часов выход продукта составляет 52 % (A. R. Chaudhary, A. V. Bedekar, 1-(α-Aminobenzyl)-2-naphthol as phosphine-free ligand for Pd-catalyzed Suzuki and one-pot Wittig-Suzuki reaction. Applied Organometallic Chemistry, 2012, 26(8), pp. 430–437 (doi:10.1002/aoc.2877)); использование в качестве растворителя полиэтиленгликоля при длительном перемешивании в течении 24 часов дает продукт с выходом 92%. (W. Mai, L. Gao, PEG-supported dipyridyl ligand for palladium-catalyzed Suzuki and Suzuki-type reactions in PEG and aqueous media, Synlett, 2006, 16, pp. 2553–2558 (doi:10.1055/s-2006-951488)); использование смеси толуол-метанол при перемешивании в течении 12 часов 91% выход продукта. (Z. H. Li et al., Two-dimensional oligoarylenes: synthesis and structure–properties relationships, Tetrahedron, 2005, 61(22), pp. 5277–5285 (doi:10.1016/j.tet.2005.03.077); X. Zhang et al. Synthesis and Functional Properties of Symmetrically Naphthyl-Based Oligoarylenes with High Glass-Transition Temperatures, Chinese Journal of Chemistry, 2010, 28(6), pp. 1034–1040 (doi:10.1002/cjoc.201090162)). Использование диметилформамида (ДМФА) и карбоната цезия в качестве основания при перемешивании в течение 3 часов приводит к выходу продукта 80% (J. H. Li et al., β-Oxo Amides: Inexpensive and Efficient Ligands for the Palladium-Catalyzed Suzuki-Miyaura Cross-Coupling Reaction, Synthesis, 2007, 19, pp. 2957–2966. (doi:10.1055/s-2007-983891)).
Наиболее близким аналогом к предлагаемому является способ получения п-терфенила путем реакции кросс-сочетания 1,4-дибромбензола и фенилборной кислоты в шестикратном избытке с использованием в качестве катализатора ацетата палладия (Pd(OAc)2) в растворе ДМФА-вода с использованием в качестве основания карбоната натрия. Время проведения реакции 12 часов. Температура 60°С. Выход продукта составляет 96%. (L. Liu et al., Synthesis of Biaryls and Polyaryls by Ligand-Free Suzuki Reaction in Aqueous Phase, J. Organic Chemistry, 2006, 71(10), 3994–3997. (doi:10.1021/jo060122v)).
Однако процесс получения длителен и энергоемок, поскольку имеется необходимость поддержания постоянной температуры 60°С.
Технической задачей данного изобретения является ускорение процесса, снижение энергозатрат при его проведении и получение продукта высокой чистоты.
Данная техническая задача решается в способе селективного получения п-терфенила из бензола, который включает следующие стадии:
i) взаимодействие бензола и брома с получением смеси бромбензола и 1,4-дибромбензола в условиях, позволяющих селективно выделить 1,4-дибромбензол без примеси 1,2-дибромбензола;
ii) добавление к полученному на стадии i) бромбензолу магния в полярном апротонном растворителе, пригодном для получения реактива Гриньяра;
iii) добавление к полученному на стадии ii) реактиву Гриньяра избытка триметилбората при температуре ниже -60ºC c последующим получением фенилборной кислоты Ph-B(OH)2;
iv) добавление к полученной на стадии iii) фенилборной кислоте 1,4-дибромбензола, полученного на стадии i), в отношении 4:1, и каталитических количеств ацетата палладия (Pd(OAc)2) с последующим нагреванием полученной смеси до температуры 40-60 ºC;
v) удаление апротонного растворителя из реакционной смеси, полученной на стадии iv) и выделение п-терфенила из смеси методом перекристаллизации, с выходом продукта более 94%;
при этом стадию i) проводят при нагревании до 20-60ºC в течение 1-2 часов без дополнительного растворителя в присутствии катализатора, выбранного из Fe, Mg3Hg или пиридина (Py);
где апротонный растворитель представляет диэтиловый эфир, и стадия iv) проводится при перемешивании в течение 8 часов.
Пример 1. Получение бромбензола.
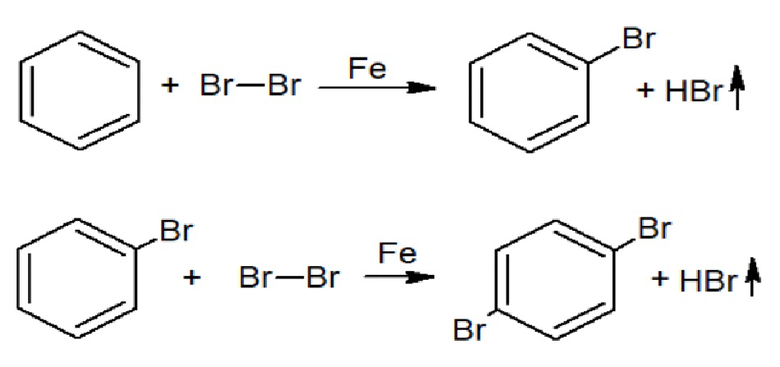
Схема 1. Реакция синтеза C6H5Br и п-C6H4Br2.
В прибор, содержащий круглодонную колбу на 500 мл, оснащённый обратным холодильником, помещают 90 мл (1 моль) бензола и 1,2 г железных опилок, при перемешивании по каплям добавляют 160 г (1 моль) брома. Прибавив вначале небольшое количество брома, выжидают, пока не начнется реакция, сопровождающаяся выделением бромистого водорода; в дальнейшем прибавление брома регулируют таким образом, чтобы реакция шла достаточно интенсивно, но не становилась бурной. Во избежание излишней задержки реакции поддержание нагрева колбы происходит на водяной бане. После добавления всего брома реакционную смесь нагревают на водяной бане в течении часа до температуры 20-30ºC и затем нагревают до температуры 60ºC до момента, пока не прореагирует весь бром. Затем, раствор фильтруют, отделяя его от железных опилок, промывают водой, сушат хлоридом кальция и перегоняют в вакууме. При появлении первых кристаллов п-дибромбензола (1,4-дибромбензола) меняют приемник и продолжают перегонку до тех пор, пока не будет конденсироваться одна вода. Железные опилки можно заменить на другие катализаторы, например, на амальгаму магния (Mg3Hg) или пиридин (Py).
Выход бромбензола 108 г (68.7%). Остаток от первой перегонки перекристаллизовывают из этанола с активированным углем. Выход 1,4-дибромбензола 11 г (4.6 %).
Пример 2. Получение фенилборной кислоты.
Реакцию проводят в приборе, состоящем из четырехгорлой 1-литровой круглодонной колбы, снабженной термометром, капельной воронкой на 250 мл, капельной воронкой на 100 мл, механической мешалкой и трубкой для подачи азота. Прибор тщательно продувают сухим азотом и в реакционную колбу помещают 0.25 л абсолютного эфира, который передавливают струей сухого азота.
Затем в трехгорлой колбе на 1 л, снабженной обратным холодильником, капельной воронкой на 100 мл, механической мешалкой и трубкой для подачи азота приготавливают фенилмагний бромид из 78.5 г бромбензола (0.5 моль) и 12.5 г магния (0.5 моль) в 200 мл диэтилового эфира.

Схема 2. Синтез реактива Гриньяра.
Незадолго до проведения синтеза перегоняют 56 мл, (52 г, 0.5 моля) метилового эфира борной кислоты непосредственно в капельную воронку емкостью 100 мл. В 0.25-литровую капельную воронку передавливают сухим азотом раствор бромистого фенилмагния в эфире (0.5 моль). При последующих операциях, вплоть до стадии гидролиза, во всей системе поддерживают избыточное давление азота), пользуясь ртутным счетчиком пузырьков, для того чтобы предотвратить поглощение влаги из воздуха. Эфир охлаждают до температуры ниже -60ºC при помощи бани с сухим льдом и ацетоном и поддерживают указанную температуру в течение всей реакции. Реагенты прибавляют к тщательно перемешиваемой реакционной смеси попеременно и небольшими порциями: сначала 10 мл метилового эфира борной кислоты, затем 30 мл раствора бромистого фенилмагния, причем скорость прибавления должна не допускать разогревания смеси выше температуры -60ºC.

Схема 3. Получение фенилборной кислоты.
После окончания загрузки реагентов перемешивание продолжают еще 20 мин., поддерживая температуру ниже -60ºC. Поддерживая температуру смеси равной 0ºC или даже более низкой и не прекращая перемешивания, смесь гидролизуют, для чего в течение 5 мин. к ней прибавляют 34 мл дистиллированной воды. После этого смесь нейтрализуют, приливая в течение 15 мин. раствор 14 мл концентрированной серной кислоты в 0.28 л дистиллированной воды. Затем смесь переносят в 1-литровую делительную воронку, эфирный слой отделяют, а водный слой экстрагируют тремя порциями эфира по 50 мл. Эфирный слой и вытяжки соединяют и переносят в 1-литровую круглодонную колбу. После того как от смеси при перемешивании отогнано около половины всего количества эфира, медленно прибавляют 0.25 л дистиллированной воды, не прерывая перегонки до тех пор, пока температура в парах не достигнет 100ºC. Продолжая перемешивание, оставшийся водный раствор охлаждают в бане со льдом. Фенилборную кислоту, выпавшую в виде мелких бесцветных кристаллов, отфильтровывают на воронке Бюхнера и промывают петролейным эфиром. Последний удаляет следы дифенилборной кислоты, которая находится в горячем маточном растворе в виде масляных шариков бурого цвета и может окрасить конечный продукт.
Выход фенилборной кислоты 37 г (60 %).
Пример 3. Получение п-терфенила.
В колбу на 500 мл загружают фенилборную кислоту, 1,4-дибромбензол, Na2CO3, Pd(OAc)2, приливают при перемешивании смесь ДМФА и воды. Реакционная масса немного разогревается и темнеет. Температуру в колбе доводят до 40-60 ºC. Перемешивание продолжают 8 часов. Затем реакционную массу выливают в 500 мл воды и отфильтровывают, промывают водой. Остаток на фильтре растворяют в горячем толуоле и пропускают через слой оксида алюминия. Фильтрат охлаждают, выпавшие кристаллы терфенила отфильтровывают.

Схема 4. Получение п-терфенила
Таблица 1. Синтез п-терфенила
Время проведения реакции по сравнению с прототипом снижено на 4 часа с достижением высокого выхода целевого продукта.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТЕТРАМЕТИЛЬНЫХ ПРОИЗВОДНЫХ ДИФЕНИЛОВОГО ЭФИРА | 2016 |
|
RU2643519C1 |
| СПОСОБ ЭКОЛОГИЧЕСКИ ЧИСТОГО СИНТЕЗА БРОМБЕНЗОЛА | 2003 |
|
RU2321576C1 |
| Способ получения разветвленных олигоарилсиланов на основе фенилоксазолов | 2016 |
|
RU2620088C1 |
| СПОСОБ ПОЛУЧЕНИЯ П-ТЕРФЕНИЛА | 2007 |
|
RU2349572C1 |
| УСОВЕРШЕНСТВОВАННЫЙ СПОСОБ ПОЛУЧЕНИЯ 5-(2,6-ДИ-4-МОРФОЛИНИЛ-4-ПИРИМИДИНИЛ)-4-ТРИФТОРМЕТИЛПИРИДИН-2-АМИНА | 2013 |
|
RU2646760C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИАРИЛОВ | 2009 |
|
RU2433112C2 |
| Способ получения динитропроизводных дифениловых и трифениловых эфиров | 2017 |
|
RU2671581C1 |
| Способ получения 2-арилпропионовой кислоты | 1978 |
|
SU963462A3 |
| ТЕРАПЕВТИЧЕСКИЙ АГЕНТ ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА | 1997 |
|
RU2174114C2 |
| СПОСОБ ПОЛУЧЕНИЯ (C-КАРБОНИЛ)ДИМЕТИЛФТАЛАТА | 2011 |
|
RU2470008C1 |
Изобретение относится к способу селективного получения п-терфенила из бензола, включающему стадии: i) взаимодействие бензола и брома с получением смеси бромбензола и 1,4-дибромбензола в условиях, позволяющих селективно выделить 1,4-дибромбензол без примеси 1,2-дибромбензола; ii) добавление к полученному на стадии i) бромбензолу магния в полярном апротонном растворителе, пригодном для получения реактива Гриньяра; iii) добавление к полученному на стадии ii) реактиву Гриньяра избытка триметилбората при температуре ниже -60ºC c последующим получением фенилборной кислоты Ph-B(OH)2; iv) добавление к полученной на стадии iii) фенилборной кислоте 1,4-дибромбензола, полученного на стадии i), в соотношении 4:1 и каталитических количеств ацетата палладия (Pd(OAc)2) с последующим нагреванием полученной смеси до температуры 40-60 ºC; v) удаление апротонного растворителя из реакционной смеси, полученной на стадии iv), и выделение п-терфенила из смеси методом перекристаллизации с выходом продукта более 94%; при этом стадию i) проводят при нагревании до 20-60ºC в течение 1-2 часов без дополнительного растворителя в присутствии катализатора, выбранного из Fe, Mg3Hg или пиридина (Py); где апротонный растворитель представляет собой диэтиловый эфир, и стадия iv) проводится при перемешивании в течение 8 часов. Использование предлагаемого способа позволяет ускорить процесс, снизить энергозатраты при его проведении и получать продукт высокой чистоты. 3 пр., 1 табл.
Способ селективного получения п-терфенила из бензола, включающий стадии:
i) взаимодействие бензола и брома с получением смеси бромбензола и 1,4-дибромбензола в условиях, позволяющих селективно выделить 1,4-дибромбензол без примеси 1,2-дибромбензола;
ii) добавление к полученному на стадии i) бромбензолу магния в полярном апротонном растворителе, пригодном для получения реактива Гриньяра;
iii) добавление к полученному на стадии ii) реактиву Гриньяра избытка триметилбората при температуре ниже -60ºC c последующим получением фенилборной кислоты Ph-B(OH)2;
iv) добавление к полученной на стадии iii) фенилборной кислоте 1,4-дибромбензола, полученного на стадии i), в соотношении 4:1 и каталитических количеств ацетата палладия (Pd(OAc)2) с последующим нагреванием полученной смеси до температуры 40-60 ºC;
v) удаление апротонного растворителя из реакционной смеси, полученной на стадии iv), и выделение п-терфенила из смеси методом перекристаллизации с выходом продукта более 94%;
при этом стадию i) проводят при нагревании до 20-60ºC в течение 1-2 часов без дополнительного растворителя в присутствии катализатора, выбранного из Fe, Mg3Hg или пиридина (Py);
где апротонный растворитель представляет собой диэтиловый эфир, и стадия iv) проводится при перемешивании в течение 8 часов.
| Liu L | |||
| et al | |||
| Synthesis of Biaryls and Polyaryls by Ligand-Free Suzuki Reaction in Aqueous Phase, The Journal of Organic Chemistry, 2006, 71(10), 3994-3997 | |||
| Способ получения п-терфенила | 1973 |
|
SU438244A1 |
| СПОСОБ ПОЛУЧЕНИЯ П-ТЕРФЕНИЛА | 2007 |
|
RU2349572C1 |
| CN 104072327 A, 01.10.2014. | |||
Авторы
Даты
2022-03-17—Публикация
2021-08-20—Подача