Область техники
Настоящее изобретение относится к новому Fab-фрагменту антитела против MUC1 человека. Настоящее изобретение также относится к композиции для диагностики и/или лечения, содержащей Fab-фрагмент антитела против MUC1 человека, и к способу диагностики и/или лечения злокачественного новообразования с использованием Fab-фрагмента.
Уровень техники
Муцин 1 (MUC1) представляет собой связанный с мембраной гликопротеин, который экспрессируется в полости эпителиальных клеток, образующих эпителиальные ткани молочной железы, трахеи и желудочно-кишечного тракта и т.д. (Nat. Rev. Cancer, 2004 Jan; 4 (1): 45-60). MUC1 сверхэкспрессируется в опухолевых клетках рака молочной железы (Mod. Pathol., 2005 Oct; 18 (10): 1295-304), рака легкого (Hum. Pathol., 2008 Jan; 39 (1): 126-36), колоректального рака (Int. J. Oncol., 2000 Jan; 16 (1): 55-64), рака мочевого пузыря (PLoS One, 2014 Mar; 9 (3): e92742), рака кожи (Histopathology, 2000 Sep; 37 (3): 218-23), рака щитовидной железы (J. Pathol., 2003 Jul; 200 (3): 357-69), рака желудка (J. Pathol., 2000 март; 190 (4): 437-43), рака поджелудочной железы (Int. J. Oncol., 2004 Jan; 24 (1): 107-13), рака почки (Mod. Pathol., 2004 Feb; 17 (2): 180-8), рака яичника (Gynecol. Oncol., 2007 Jun; 105 (3): 695-702) и рака шейки матки (Am. J. Clin. Pathol., 2004 Jul; 122 (1): 61-9) и т. д. MUC1 пригоден в качестве молекулы-мишени для выявления очага злокачественного новообразования (Nat. Rev. Cancer, 2004 Jan; 4 (1): 45-60; и Pathol.Res. Pract., 2010 Aug 15; 206 (8): 585-9).
MUC1 подвергается O-гликозилированию треонина в положении 9 последовательности тандемного повтора из 20 аминокислот HGVTSAPDTRPAPGSTAPPA (SEQ ID NO: 15), присутствующей во внеклеточном домене. В опухолевых клетках это О-гликозилирование является неполным, и О-гликозилирование, такое как Т(Galβα1-3GalNAc1-O-Ser/Thr), Tn(GalNAcα1-O-Ser/Thr) и 2,3ST(Neu5Acαβ2-3Gal1-3GalNAcα-O-Ser/Thr), как известно, происходит опухолеспецифическим образом (PTL 1 и NPL 1). Поскольку MUC1 в нормальных тканях не подвергается такому опухолеспецифическому O-гликозилированию, опухолеспецифический MUC1 человека особенно полезен в качестве молекулы-мишени для лечения различных видов злокачественных новообразований у людей.
Например, антитело 1B2 (PTL 1), антитело PankoMab (NPL 2) и антитело 5E5 (PTL 2) известны как антитела против такого опухолеспецифического MUC1 человека. Сообщалось, что среди этих антител антитело 1B2 обладает высокой специфичностью к опухолеспецифическому MUC1 человека по сравнению с антителом PankoMab (PTL 1). Сообщалось также, что константа диссоциации антитела 1B2 составляет 3,7×10-10 М (PTL 1), а константа диссоциации антитела 5E5 составляет 1,7×10-9 М (NPL 1).
Между тем, также существует большая потребность в визуализации очага злокачественного новообразования. Во-первых, есть необходимость в раннем выявлении очага злокачественного новообразования. Современные методы диагностики, такие как рентгенография, эхография, компьютерная томография (КТ), магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОФЭКТ), не могут чувствительно детектирвать микроопухоли. Если можно детектировать микроопухоли, то первичную опухоль можно вылечить с помощью операции или лучевой терапии, или даже метастатический рак излечим для поддержания жизни путем раннего фармацевтического вмешательства. Далее, необходимо провести различие между очагом злокачественного новообразования и доброкачественной опухолью. Современные методы диагностики часто ошибочно диагностируют доброкачественную опухоль как очаг злокачественного новообразования. Если можно провести различие между очагом злокачественного новообразования и доброкачественной опухолью, можно уменьшить количество необязательной биопсии. Кроме того, существует потребность в визуализации очага злокачественного новообразования во время операции. В настоящее время положение или степень очага злокачественного новообразования не могут быть точно определены во время операции злокачественного новообразования, включая рак молочной железы, рак мочевого пузыря и рак кожи. Следовательно, очаг злокачественного новообразования не может быть полностью удален, и существует риск прекращения операции, оставив при этом опухолевые клетки. Кроме того, есть необходимость в правильном определении локализации очага злокачественного новообразования. Даже если подозревается послеоперационный рецидив и метастазирование из-за повышения уровня опухолевого маркера в крови, современные методы диагностики не могут визуализировать метастатическую микроопухоль. Следовательно, оптимальное лечение не может быть выбрано, потому что невозможно определить, действительно ли опухоль метастазировала или в какой орган метастазировала опухоль. Таким образом, это также полезно для визуализации очагов злокачественного новообразования с помощью методов молекулярной визуализации, таких как флуоресцентная визуализация и визуализация γ-лучей (ПЭТ и ОФЭКТ) с использованием антитела, специфически связывающегося с опухолеспецифическим MUC1 человека в качестве диагностического препарата in vivo. Однако ранее не было известно каких-либо случаев использования антитела против опухолеспецифического MUC1 человека в качестве диагностического препарата in vivo.
Существует дополнительная потребность в лекарственном препарате для лечения злокачественного новообразования, таком как антитело, конъюгированное с лекарственным средством. Лекарственное средство на основе антител предполагается в качестве метода лечения рака с меньшим количеством побочных реакций, что обусловлено специфической доставкой к очагу опухоли. Сообщалось о радиоиммунотерапии с использованием антител, связанных с радиоизотопом (Takashi Tsuruo, «Molecular Target Therapy of Cancer», NANZANDO Co., Ltd., published on Sep. 15, 2008, p. 332-336; J. Nucl. Med., 2016 Jul; 57 (7): 1105-1111; и Nucl. Med. Biol., 2010 Nov; 37 (8): 949-955), фотоиммунотерапии с использованием антитела, связанного с IRDye700DX (Nat. Med., 2011 Dec; 17 (12): 1685-91), и тому подобное. IRDye700DX - флуоресцентный краситель ближней инфракрасной области, который также может быть использован в диагностике. Сообщалось, что гибель клеток может быть индуцирована опухолеспецифическим образом посредством фототоксического эффекта IRDye700DX, связывая его с антителом против антигена, экспрессируемого на мембране опухолевых клеток, и позволяя полученному продукту специфически накапливаться в опухолевых тканях путем облучения ближним инфракрасным светом (Nat. Med., 2011 Dec; 17 (12): 1685-91). Однако ни один предыдущий случай клинического применения лекарственного препарата антитела в виде антитела против опухолеспецифического MUC1 человека, связанного с противоопухолевым терапевтическим лекарственным средством, не был известен.
В общем, антитела после введения в организм имеют длительный период полужизни в крови, и требуется периода до 4-5 дней для достижения соотношения опухоли к крови, которое обеспечивает достаточное отношение сигнал-фон для визуализации опухоли (Clin.Pharmacol. Ther., 2010 май; 87 (5): 586-92). Кроме того, Fc-области антител вызывают фармакологический эффект, такой как антителозависимая клеточная цитотоксичность (ADCC) или комплементзависимая цитотоксичность (CDC) (NPL 1; и Curr. Opin. Biotechnol., 2002 Dec; 13 (6): 609-14). Кроме того, высокий уровень антител накапливаются в печени независимо от мишени, а опухолевые клетки, такие как клетки рака молочной железы сильно метастазируют в печень. Накопление в печени мешает детектированию метастазов в печени во время диагностики системного очага опухоли (Clin. Pharmacol. Ther., 2010 май; 87 (5): 586-92).
Например, ожидается, что низкомолекулярные рекомбинантные фрагменты антител, такие как Fab, scFv, диатело и минитело, будут использоваться в качестве терапевтических антител благодаря легкости достижения очагов с помощью их высокой способности проникновения в ткани и низкой стоимости продукта при использовании системы экспрессии в E. coli или дрожжах. А также, как сообщается, они используются в качестве диагностического препарата благодаря их коротким периодам полужизни в крови и особенностям почечной экскреции (Nat. Biotechnol., 2005 Sep; 23 (9): 1126-36).
Список цитирования
Патентная литература
PTL 1: WO2010/050528
PTL 2: WO2008/040362
Непатентная литература
NPL 1: Glycoconj. J., апрель 2013 г.; 30 (3): 227-36
NPL 2: Cancer Immunol Immunother, 2006 Nov; 55 (11): 1337-47
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая проблема
Одновалентные Fab-фрагменты имеют молекулярную массу приблизительно 50 кДа, что меньше, чем антитела, которые имеют молекулярную массу приблизительно 150 кДа, удаляются почечной экскрецией, а также имеют короткий период полужизни в крови. Следовательно, они достигают отношения опухоли к крови, которое обеспечивает отношение сигнал-фон, достаточное для визуализации опухоли, в течение 2-32 часов после введения. Они лишены Fc-области, и поэтому не вызывают ни ADCC, ни CDC. Fab-фрагменты обычно удаляются почечной экскрецией и, следовательно, не влияют на обнаружение метастазов в печени. На основе этих признаков можно ожидать, что Fab-фрагменты будут более эффективными в качестве in vivo диагностических лекарственных средств по сравнению с антителами.
Однако активность связывания Fab-фрагментов часто ослабевает из-за того, что они одновалентные, а не двухвалентные. Антитела должны быть помечены детектируемым веществом, таким как флуоресцентный краситель или контрастное вещество, для их использования в качестве диагностических лекарственных средств in vivo или в качестве лекарственных средств для использования в методах фотоиммунотерапии. Еще одной проблемой является ослабление их активности связывания, обусловленное мечением таким веществом.
Целью настоящего изобретения является создание Fab-фрагмента антитела против MUC1 человека, который обладает превосходной активностью связывания и, как ожидается, накапливается в очаге опухоли в течение заданного времени (например, 24 часов) после введения. Другая цель настоящего изобретения состоит в том, чтобы предложить композицию для диагностики, содержащую Fab-фрагмент, и способ диагностики с ее использованием, и предложить композицию для лечения, содержащую Fab-фрагмент, и способ лечения, использующий ее.
РЕШЕНИЕ ПРОБЛЕМЫ
Авторы настоящего изобретения провели значительные тщательные исследования по приготовлению Fab-фрагмента антитела против MUC1 человека, обладающего превосходной активностью связывания по отношению к опухолеспецифическому MUC1 человека, и, следовательно, получили Fab-фрагмент антитела против MUC1 человека, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8 или SEQ ID NO: 10, и вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12 (Пример 1), и обнаружили, что: Fab-фрагмент антитела против MUC1 человека обладает превосходной активностью связывания в отношении опухолеспецифического MUC1 человека (Пример 3) и не проявляет ослабления активности связывания в отношении опухолеспецифического MUC1 человека при флуоресцентном мечении и мечении хелатирующим агентом (Пример 5 и Пример 7); и конъюгат, содержащий Fab-фрагмент антитела против MUC1 человека, полезен при диагностике злокачественных новообразований (Пример 8, Пример 12 и Пример 13) и проявляет противоопухолевый эффект в моделях, несущих подкожную опухоль (Пример 15).
В результате обеспечивается подход диагностики и лечения, использующий Fab-фрагмент антитела против MUC1 человека и конъюгат, содержащий Fab-фрагмент антитела против MUC1 человека.
Настоящее изобретение включает аспекты, приведенные ниже в качестве веществ или способов, полезных с медицинской или промышленной точки зрения.
В частности, в одном аспекте настоящее изобретение может быть следующим:
[1] Fab-фрагмент антитела против MUC1 человека, выбранный из группы, состоящей из следующих (а) и (b):
(a) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8 или SEQ ID NO: 10, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12; и
(b) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 8 или SEQ ID NO: 10, посредством модификации глутамина в положении аминокислоты 1 SEQ ID NO: 8 или SEQ ID NO: 10 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
[2] Fab-фрагмент антитела против MUC1 человека по п.[1], который выбран из группы, состоящей из следующих (а) и (b):
(a) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2 или SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6; и
(b) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2 или SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 2 или SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
[3] Fab-фрагмент антитела против MUC1 человека по п.[1], который выбран из группы, состоящей из следующих (а) и (b):
(a) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12; и
(b) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 10, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 10 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
[4] Fab-фрагмент антитела против MUC1 человека по п.[3], который выбран из группы, состоящей из следующих (а) и (b):
(a) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6; и
(b) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
[5] Fab-фрагмент антитела против MUC1 человека по п.[4], который представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
[6] Fab-фрагмент антитела против MUC1 человека по п.[4], который представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
[7] Конъюгат, содержащий одну или более метящих частей и Fab-фрагмент антитела против MUC1 человека по любому из пп.[1]-[6].
[8] Конъюгат по п.[7], отличающийся тем, что метящая часть представляет собой (i) лиганд и линкер, (ii) лиганд, (iii) флуоресцентный краситель и линкер или (iv) флуоресцентный краситель.
[9] Конъюгат по п.[8], отличающийся тем, что метящая часть представляет собой (i) лиганд и линкер или (ii) лиганд.
[10] Конъюгат по п.[9], отличающийся тем, что лиганд представляет собой лиганд, представленный следующей формулой (А):
[Химическая Формула 1]
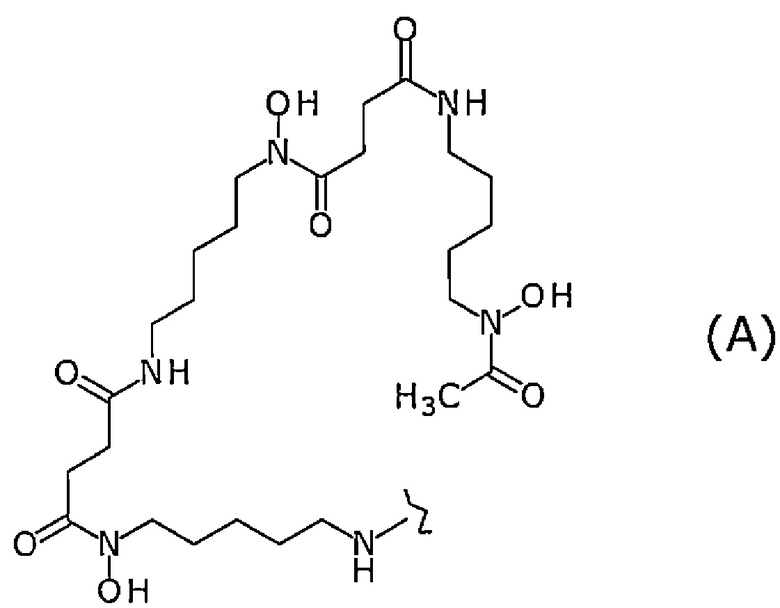
где волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека или линкером.
[11] Конъюгат по п.[10], отличающийся тем, что метящая часть представляет собой лиганд и линкер, представленные следующей формулой (A'):
[Химическая Формула 2]
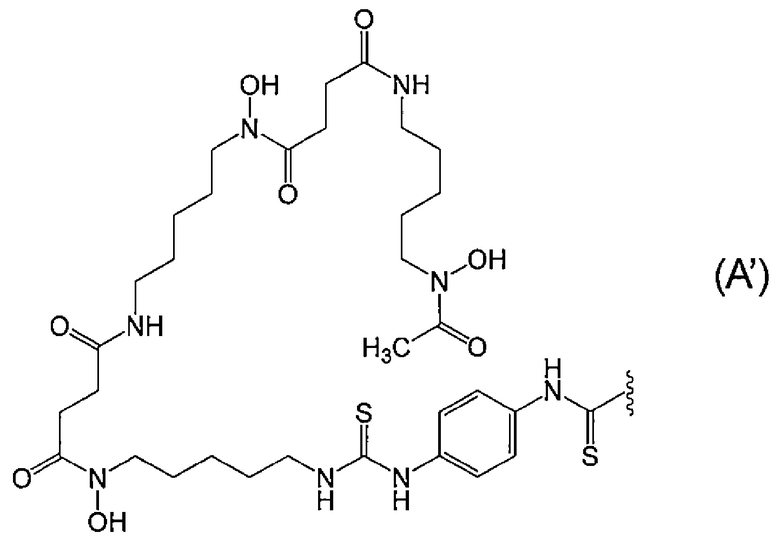
где волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека.
[12] Конъюгат по п.[11], отличающийся тем, что Fab-фрагмент антитела против MUC1 человека связан через его аминогруппу с атомом углерода концевой группы C(=S) метящей части.
[13] Конъюгат, выбранный из группы, состоящей из следующих (а)-(с):
(а) конъюгат по п.[12], отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.[5];
(b) конъюгат по п.12, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.[6]; и
(с) конъюгат, который представляет собой смесь (a) и (b).
[14] Конъюгат по любому из пп.[9]-[13], дополнительно содержащий металл.
[15] Конъюгат по п.[14], отличающийся тем, что металл представляет собой радиоизотоп металла.
[16] Конъюгат по п.[15], отличающийся тем, что металл представляет собой 89Zr.
[17] Конъюгат по п.[13], дополнительно содержащий 89Zr.
[18] Конъюгат по п.[8], отличающийся тем, что метящая часть представляет собой (i) флуоресцентный краситель и линкер или (ii) флуоресцентный краситель.
[19] Конъюгат по п.[18], отличающийся тем, что флуоресцентный краситель представляет собой флуоресцентный краситель, выбранный из группы, состоящей из следующей формулы (B) и следующей формулы (C):
[Химическая Формула 3]
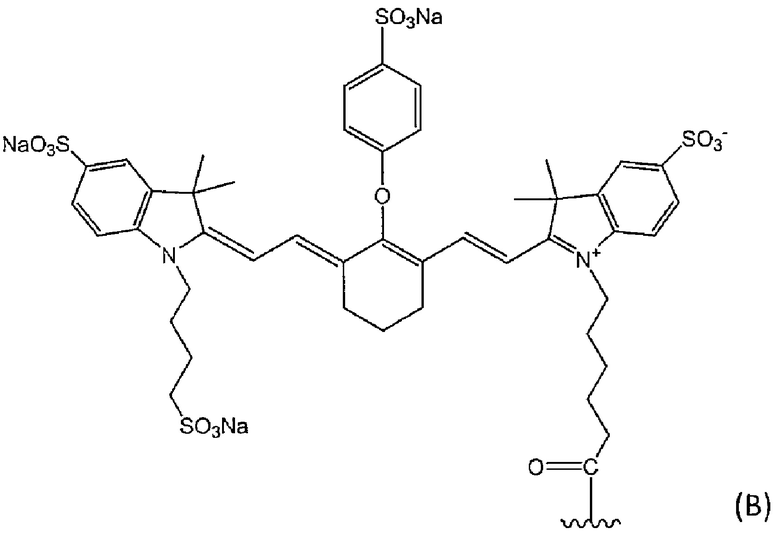
[Химическая Формула 4]
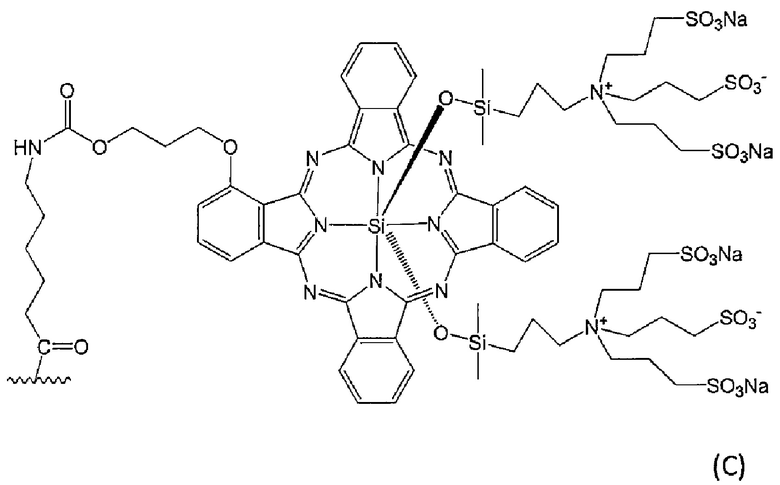
где волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека или линкером.
[20] Конъюгат по п.[19], отличающийся тем, что волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека, и Fab-фрагмент антитела против MUC1 человека связывается через его аминогруппу с атомом углерода концевой группы C(=О) метящей части.
[21] Конъюгат по п.[20], отличающийся тем, что метящая часть представляет собой флуоресцентный краситель, представленный формулой (B).
[22] Конъюгат, выбранный из группы, состоящей из следующих (а)-(с):
(а) конъюгат по п.[21], отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.[5];
(b) конъюгат по п.[21], отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.[6]; и
(с) конъюгат, который представляет собой смесь (a) и (b).
[23] Конъюгат по п.[20], отличающийся тем, что метящая часть представляет собой флуоресцентный краситель, представленный формулой (С).
[24] Конъюгат, выбранный из группы, состоящей из следующих (а)-(с):
(а) конъюгат по п.[23], отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.[5];
(b) конъюгат по п.[23], отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.[6]; и
(с) конъюгат, который представляет собой смесь (a) и (b).
[25] Полинуклеотид, выбранный из группы, состоящей из следующих (a) и (b):
(а) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[1]; и
(b) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[1].
[26] Полинуклеотид, выбранный из группы, состоящей из следующих (a) и (b):
(а) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[5]; и
(b) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[5].
[27] Экспрессирующий вектор, содержащий следующие (а) и/или (b):
(а) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[1]; и
(b) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[1].
[28] Экспрессирующий вектор, содержащий следующие (а) и/или (b):
(а) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[5]; и
(b) полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[5].
[29] Клетка-хозяин, выбранная из группы, состоящей из следующих (a)-(d):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[1];
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[1];
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[1], и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[1]; и
(d) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[1], и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[1].
[30] Клетка-хозяин, выбранная из группы, состоящей из следующих (a)-(d):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[5];
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[5];
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[5], и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь антитела Fab-фрагмента антитела против MUC1 человека по п.[5]; и
(d) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[5], и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[5].
[31] Способ получения Fab-фрагмента антитела против MUC1 человека, включающий стадию культивирования клетки-хозяина, выбранной из группы, состоящей из следующих (a)-(c), для экспрессии Fab-фрагмента антитела против MUC1 человека:
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[1], и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь антитела Fab-фрагмент антитела против MUC1 человека по п.[1];
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[1], и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[1]; и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[1], и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[1].
[32] Способ получения Fab-фрагмента антитела против MUC1 человека, включающий стадию культивирования клетки-хозяина, выбранной из группы, состоящей из следующих (a)-(c), для экспрессии Fab-фрагмента антитела против MUC1 человека:
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[5], и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[5];
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.[5], и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против человека MUC1 по п.[5]; и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека, по п.[5], и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.[5].
[33] Способ получения конъюгата, включающего метящую часть и Fab-фрагмент антитела против MUC1 человека, включающий стадии: получения Fab-фрагмента антитела против MUC1 человека способом по п.[31] или [32]; и ковалентное связывание Fab-фрагмента с метящей частью.
[34] Способ получения конъюгата по п.[33], отличающийся тем, что стадия ковалентного связывания Fab-фрагмента с метящей частью представляет собой стадию i) связывания Fab-фрагмента через линкер с лигандом или ii) ковалентного связывания Fab-фрагмента непосредственно с лигандом.
[35] Способ получения конъюгата по п.[34], дополнительно включающий стадию мечения лиганда конъюгата радиоизотопом металла.
[36] Способ получения конъюгата по п.[33], отличающийся тем, что стадия ковалентного связывания Fab-фрагмента с метящей частью представляет собой стадию i) связывания Fab-фрагмента через линкер с флуоресцентным красителем или ii) ковалентного связывания Fab-фрагмента непосредственно с флуоресцентным красителем.
[37] Композиция для диагностики, содержащая один или более конъюгатов по любому из пп.[7]-[24] и фармацевтически приемлемый носитель.
[38] Композиция для диагностики по п.[37], отличающаяся тем, что конъюгат представляет собой конъюгат по любому из пп.[17], [22] и [24].
[39] Композиция для диагностики по п.[38], отличающаяся тем, что конъюгат представляет собой конъюгат по п.[17].
[40] Композиция для диагностики по п.[38], отличающаяся тем, что конъюгат представляет собой конъюгат по п.[22].
[41] Композиция для диагностики по п.[38], отличающаяся тем, что конъюгат представляет собой конъюгат по п.[24].
[42] Композиция для диагностики по любому из пп.[37]-[41], которая используется для диагностики злокачественного новообразования, клетки которого экспрессируют MUC1 человека.
[43] Композиция для диагностики по п.[42], отличающаяся тем, что злокачественное новообразование представляет собой рак молочной железы или рак мочевого пузыря.
[44] Фармацевтическая композиция, содержащая один или более конъюгатов по любому из пп.[7]-[24] и фармацевтически приемлемый носитель.
[45] Фармацевтическая композиция по п.[44], отличающаяся тем, что конъюгат представляет собой конъюгат по любому из пп.[17], [22] и [24].
[46] Фармацевтическая композиция по п.[45], отличающаяся тем, что конъюгат представляет собой конъюгат по п.[24].
[47] Фармацевтическая композиция по любому из пп.[44]-[46], которая представляет собой фармацевтическую композицию для лечения злокачественного новообразования, клетки которого экспрессируют MUC1 человека.
[48] Фармацевтическая композиция по п.[47], отличающаяся тем, что злокачественное новообразование представляет собой рак молочной железы или рак мочевого пузыря.
[49} Применение конъюгата по любому из пп.[7]-[24] для получения композиции для диагностики рака молочной железы или рака мочевого пузыря и/или для получения фармацевтической композиции для лечения рака молочной железы или рака мочевого пузыря.
[50] Конъюгат по любому из пп.[7]-[24] для применения при диагностике и/или лечении рака молочной железы или рака мочевого пузыря.
[51] Способ диагностики рака молочной железы или рака мочевого пузыря, включающий введение пациенту до или после операции конъюгата по любому из пп.[7]-[24].
[52] Способ лечения рака молочной железы или рака мочевого пузыря, включающий стадию введения терапевтически эффективного количества конъюгата по любому из пп.[7]-[24].
Полезные эффекты изобретения
Fab-фрагмент антитела против MUC1 человека по настоящему изобретению обладает превосходной активностью связывания в отношении опухолеспецифического MUC1 человека и, как ожидается, будет полезен при диагностике и/или лечении онкологических заболеваний, таких как рак молочной железы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой график и таблицу, показывающие активность связывания P10-1 Fab, P10-2 Fab и 1B2 Fab Сравнительного Примера в отношении опухолеспецифического MUC1 человека.
Фиг.2 представляет собой график и таблицу, показывающие активность связывания P10-1 Fab Dye, красителя P10-2 Fab Dye и 1B2 Fab Dye из сравнительного примера в отношении опухолеспецифического MUC1 человека.
Фиг.3 представляет собой график и таблицу, показывающие активность связывания P10-2 Fab DFO и P10-2 Fab против опухолеспецифического MUC1 человека.
Фиг. 4 представляет собой график, показывающий активность связывания P10-2 Fab против клеток MDA-MB-468 клеточной линии рака молочной железы (также называемых клетками MM-468) и клеток 647-V клеточной линии рака мочевого пузыря, экспрессирующих опухолеспецифичный MUC1 человека. Горизонтальная ось показывает концентрацию (Log (мг/мл)) P10-2 Fab, а вертикальная ось показывает люминесценцию.
На Фиг.5А представлены типичные фотографии, сделанные обычной камерой (слева) и флуоресцентной камерой ближнего инфракрасного диапазона (в центре и справа) через 6 часов после введения P10-2 Fab Dye, который вводили внутривенно в дозе 3 мг/кг моделям подкожного введения опухоли.
Фиг. 5B представляет собой график количественного определения соотношения опухоль/фон в опухолевом участке и в участке перитуморального фона и показывает среднее значение+стандартная ошибка. Горизонтальная ось показывает дозу и время после введения P10-2 Fab Dye.
Фиг. 6 представляет собой график количественной люминесценции участков опухоли при введении P10-2 Fab IR700 мышам с трансплантированными клетками MM-468, с умерщвлением животных через 2 часа после введения, иссечением опухоли, и фотографированием с помощью IVIS SPECTRUM. Вертикальная ось соответствует люминесценции.
Фиг.7 представляет собой график, показывающий результаты измерения цитотоксичности реакции P10-2 Fab IR700 на клетки MM-468, клетки 647-V или клетки CHO-K1 при облучении светом Сравнительного Примера. В верхнем столбце горизонтальной оси каждого графика показана концентрация P10-2 Fab IR700, а в нижнем столбце - экспозиция света. Вертикальная ось отображает люминесценцию и указывает среднее значение+стандартная ошибка.
Фиг.8 представляет собой график, показывающий результаты измерения противоопухолевого эффекта в зависимости от присутствия или отсутствия светового излучения (0 Дж или 200 Дж) во время введения P10-2 Fab IR700 с использованием голых мышей, трансплантированных клетками MM-468. Горизонтальная ось показывает количество дней, когда день, в который объем опухоли достиг 300 мм3, был определен как день 1. Вертикальная ось показывает объем опухоли (мм3) и указывает среднее+стандартная ошибка.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Далее настоящее изобретение будет описано подробно. Однако настоящее изобретение этим не ограничивается. Научные термины и технические термины, используемые в отношении настоящего изобретения, имеют значения, обычно понятные специалистам в данной области техники, если в настоящем описании не указано иное.
Авторы настоящего изобретения провели обширные тщательные исследования по приготовлению антитела против опухолеспецифического MUC1 человека или его антигенсвязывающего фрагмента и, следовательно, успешно получили Fab-фрагмент антитела против MUC1 человека, обладающий способностью прочно связываться с опухолеспецифическим MUC1.
Основная структура молекулы антитела является общей для классов и состоит из тяжелых цепей с молекулярной массой от 50000 до 70000 и легких цепей с молекулярной массой от 20000 до 30000. Тяжелая цепь, как правило, состоит из полипептидной цепи, содержащей приблизительно 440 аминокислот, имеет структуру, характерную для каждого класса, и называется γ, μ, α, δ, и ε цепи, соответствующие IgG, IgM, IgA, IgD и IgE. IgG, кроме того, имеет IgG1, IgG2, IgG3 и IgG4, которые называются γ1, γ2, γ3 и γ4, соответственно. Легкая цепь обычно состоит из полипептидной цепи, содержащей приблизительно 220 аминокислот и известны два типа, L и K, которые называются λ и κ цепями, соответственно. Что касается пептидной конфигурации базовой структуры молекулы антитела, то две гомологичные тяжелые цепи и две гомологичные легкие цепи связаны через дисульфидные связи (связи S-S) и нековалентные связи с образованием молекулярной массы от 150000 до 190000. Две легкие цепи могут соединяться с любой из тяжелых цепей. Отдельная молекула антитела постоянно состоит из двух идентичных легких цепей и двух идентичных тяжелых цепей.
Четыре (или пять для цепей μ и ε) и две внутрицепочечные S-S-связи присутствуют в тяжелой цепи и легкой цепи, соответственно, и каждая составляет одну петлю на 100-110 аминокислотных остатков. Эта конформация похожа на петли и называется структурной единицей или доменом. Как для тяжелой цепи, так и для легкой цепи домен, расположенный на N-конце, не имеет постоянной аминокислотной последовательности даже среди препаратов одного и того же класса (подкласса) животных одного и того же вида и поэтому называется вариабельной областью. Соответствующие домены называются вариабельной областью тяжелой цепи (домен VH) и вариабельной областью легкой цепи (домен VL). Аминокислотная последовательность на С-концевой стороне от нее является почти постоянной на уровне класса или подкласса и называется константной областью. Соответствующие домены представлены CH1, CH2, CH3 и CL.
Специфичность связывания антитела с антигеном зависит от аминокислотной последовательности фрагмента, состоящего из вариабельной области тяжелой цепи и вариабельной области легкой цепи. С другой стороны, биологическая активность, такая как связывание с белками комплемента или различными клетками, отражает разницу в структуре между константными областями Ig соответствующих классов. Известно, что вариабельность вариабельных областей тяжелой цепи и легкой цепи существенно ограничена тремя небольшими гипервариабельными областями, присутствующими в обеих цепях. Эти области называются областями, определяющими комплементарность (CDR; CDR1, CDR2 и CDR3 по порядку со стороны N-конца). Остальные фрагменты вариабельной области называются каркасными областями (FR) и являются относительно постоянными.
Область между доменом CH1 и доменом CH2 константной области тяжелой цепи антитела называется шарнирной областью. Эта область богата остатками пролина и содержит множество межцепочечных связей S-S, которые соединяют две тяжелые цепи. Например, шарнирные области человеческого IgG1, IgG2, IgG3 и IgG4 содержат 2, 4, 11 и 2 остатка цистеина, соответственно, которые образуют связи S-S между тяжелыми цепями. Шарнирная область является областью, очень чувствительной к протеолитическому ферменту, такому как папаин или пепсин. В случае расщепления антитела папаином тяжелые цепи отщепляются в положении на N-концевой стороне от связей SS между тяжелыми цепями шарнирной области и, таким образом, разлагаются на два Fab-фрагмента и один Fc-фрагмент. Fab-фрагмент состоит из фрагмента легкой цепи и фрагмента тяжелой цепи, включающего вариабельную область тяжелой цепи (VH), домен CH1 и часть шарнирной области. Fab-фрагмент содержит вариабельные области и обладает антигенсвязывающей активностью.
Fab-фрагмент антитела против MUC1 человека по настоящему изобретению
Fab-фрагмент антитела против MUC1 человека по настоящему изобретению представляет собой Fab-фрагмент, имеющий следующую особенность:
Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8 или SEQ ID NO: 10, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотная последовательность, представленную SEQ ID NO: 12.
В одном варианте осуществления Fab-фрагмент антитела против MUC1 человека по настоящему изобретению представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO 10, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
Любая константная область Igγ1, Igγ2, Igγ3 или Igγ4 и т.д., может быть выбрана в качестве константной области тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению. В одном варианте осуществления константная область тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению представляет собой константную область человеческого Igγ1.
Любая константная область Igλ или Igκ может быть выбрана в качестве константной области легкой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению. В одном варианте осуществления изобретения константная область легкой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению является константной областью человеческого Igκ.
В одном варианте осуществления Fab-фрагмент антитела против MUC1 человека по настоящему изобретению представляет собой следующий Fab-фрагмент:
Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2 или SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6; и
В одном варианте осуществления Fab-фрагмент антитела против MUC1 человека по настоящему изобретению представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
Известно, что в случае экспрессии в клетках антитела, включающего Fab-фрагмент, антитело подвергается посттрансляционной модификации. Примеры посттрансляционной модификации включают расщепление С-концевого лизина тяжелой цепи карбоксипептидазой, модификацию N-концевого глутамина или глутаминовой кислоты тяжелой цепи и легкой цепи до пироглутаминовой кислоты путем пироглутамилирования, гликозилирования, окисления, дезамидирования и гликирования. Известно, что такая посттрансляционная модификация встречается в различных антителах (J. Pharm. Sci., 2008; 97: 2426-2447).
Fab-фрагмент антитела против MUC1 человека по настоящему изобретению также может включать Fab-фрагмент, полученный в результате посттрансляционной модификации. Примеры Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, полученного в результате посттрансляционной модификации, включают Fab-фрагмент антитела против MUC1 человека, имеющий пироглутамилированную по N-концу тяжелую цепь. В данной области техники известно, что такая посттрансляционная модификация с помощью N-концевого пироглутамилирования не влияет на активность антитела (Anal. Biochem., 2006; 348: 24-39).
В одном варианте осуществления Fab-фрагмент антитела против MUC1 человека по настоящему изобретению представляет собой Fab-фрагмент антитела против MUC1 человека, имеющий следующую особенность:
Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 8 или SEQ ID NO: 10, посредством модификация глутамина в положении аминокислоты 1 SEQ ID NO: 8 или SEQ ID NO: 10 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
В определенном варианте осуществления Fab-фрагмент антитела против MUC1 по настоящему изобретению представляет собой Fab-фрагмент антитела против MUC1, имеющий следующую особенность:
Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 10, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 10 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
В альтернативном варианте осуществления Fab-фрагмент антитела против MUC1 по настоящему изобретению представляет собой Fab-фрагмент антитела против MUC1 человека, имеющий следующую особенность:
Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2 или SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 2 или SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
В определенном варианте осуществления Fab-фрагмент антитела против MUC1 человека по настоящему изобретению представляет собой Fab-фрагмент антитела против MUC1 человека, имеющий следующую особенность:
Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
Fab-фрагмент антитела против MUC1 человека по настоящему изобретению связывается с опухолеспецифическим MUC1 человека. Опухолеспецифический MUC1 экспрессируется при злокачественных новообразованиях, таких как рак молочной железы, рак легких, колоректальный рак, рак мочевого пузыря, рак кожи, рак щитовидной железы, рак желудка, рак поджелудочной железы, рак почки, рак яичника или рак шейки матки. Способ измерения активности связывания полученного Fab-фрагмента антитела против MUC1 человека в отношении опухолеспецифического MUC1 человека включает такие методы, как ИФА и FACS. В случае использования, например, ИФА, клетки, положительные по опухолеспецифическому MUC1 человека (например, клетки T-47D), иммобилизуются на планшете для ИФА, к которому затем добавляется и реагирует Fab-фрагмент, а затем вступает в реакцию антитело против Igκ или подобное, меченное пероксидазой хрена или аналогичным образом. Затем связывание вторичного антитела идентифицируют путем измерения активности с использованием реагента для определения его активности (например, хемилюминесцентного субстрата пероксидазы хрена для метки пероксидазы хрена) или тому подобного.
Специалист в данной области может легко получить Fab-фрагмент антитела против MUC1 человека по настоящему изобретению, используя способ, известный в данной области, на основе информации о последовательности фрагмента тяжелой цепи и легкой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, раскрытой в настоящем описании. Fab-фрагмент антитела против MUC1 человека по настоящему изобретению может быть получен согласно, но не ограничиваясь этим, способу, описанному, например, в «Способе получения Fab-фрагмента антитела против MUC1 человека по настоящему изобретению», упомянутом позже.
Конъюгат по настоящему изобретению
Конъюгат по настоящему изобретению представляет собой конъюгат, содержащий метящую часть и Fab-фрагмент антитела против MUC1 человека по настоящему изобретению.
«Метящая часть» представляет собой (i) лиганд и линкер, (ii) лиганд, (iii) флуоресцентный краситель и линкер, или (iv) флуоресцентный краситель. Определенный вариант осуществления представляет собой (i) лиганд и линкер или (ii) лиганд. Определенный вариант осуществления представляет собой (i) флуоресцентный краситель и линкер или (ii) флуоресцентный краситель. Лиганд «метящей части» может дополнительно содержать металл. Определенный вариант осуществления представляет собой (i) лиганд и линкер или (ii) лиганд, содержащий металл, и, другими словами, представляет собой (i) лиганд, который образует хелатный комплекс с металлом, и линкер, или (ii) лиганд, который образует хелатный комплекс с металлом.
Конъюгат по настоящему изобретению, содержащий металл или флуоресцентный краситель, может быть использован в различных контрастных средах и/или противоопухолевых терапевтических агентах, и используется, например, в контрастной среде МРТ, ПЭТ-трассере, флуоресцентно-меченном молекулярном средстве визуализации и лекарственном средстве для использования в методах фотоиммунотерапии.
В настоящем описании термин «металл» означает ион парамагнитного металла или радиоизотоп металла.
Ион парамагнитного металла подходящим образом используется в контрастной среде для МРТ. Примеры вариантов иона парамагнитного металла включают, но не ограничиваются ими, Fe2+, Fe3+, Cu2+, Ni2+, Rh2+, Co2+, Gd3+, Eu3+, Dy3+, Tb3+, Pm3+, Nd3+, Tm3+, Ce3+, Y3+, Ho3+, Er3+, La3+, Yb3+, Mn3+ и Mn2+. Определенным вариантом является Gd3+, Mn3+, Mn2+, Fe2+ или Fe3+. Определенным вариантом осуществления является Mn3+ или Mn2+. В этом случае галоген или нечто подобное можно использовать в качестве противоаниона в конъюгате. Альтернативно, противоанионом может быть C(=O)O- лиганда. Конъюгат может дополнительно иметь противокатион, такой как Na+.
Радиоизотоп металла используется, например, в ПЭТ-трассере. Примеры определенного варианта осуществления включают, но не ограничиваются ими, 89Zr, 51Mn, 52Fe, 60Cu, 67Ga, 68Ga, 72As, 99mTc и 111In. Определенным вариантом осуществления является 89Zr, 60Cu, 67Ga, 68Ga, 99mTc или 111In. Определенным вариантом осуществления является радиоизотоп циркония. Определенным вариантом осуществления является 89Zr.
«Лиганд» представляет собой фрагмент, способный образовывать хелатный комплекс с металлом в конъюгате, и означает группу, состоящую из хелатирующего агента. Составленная группа представляет собой группу, имеющую связь, полученную путем удаления протона из хелатирующего агента.
«Хелатирующий агент» представляет собой соединение, которое может образовывать координационную связь с металлом.
Примеры «хелатирующего агента» включают сидерофор и не сидерофор. Примеры сидерофора включают тип гидроксамовой кислоты, тип катехина и тип смешанного лиганда. Примеры сидерофоров типа гидроксамовой кислоты включают феррихром, дефероксамин (DFO), представленный следующей формулой:
[Химическая формула 5]
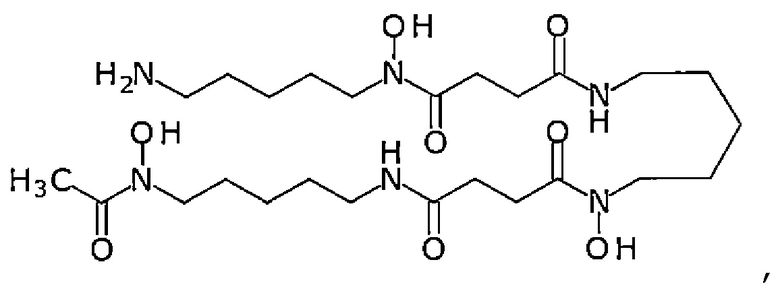
фузаринин С, орнибактин и родоторуловую кислоту. Примеры сидерофоров катехинового типа включают энтеробактин, бациллобактин и вибриобактин. Примеры сидерофора смешанного лигандного типа включают азотобактин, пиовердин и иерсиниабактин. В случае сидерофора DFO может реагировать через его реакционноспособную функциональную группу -NH2 с линкером или Fab-фрагментом, и сидерофор, отличный от DFO, также может реагировать через его реакционноспособную функциональную группу, такую как карбоксигруппа, гидроксигруппа или аминогруппа с линкером или Fab-фрагментом способом, обычно используемым специалистами в данной области.
Примеры не-сидерофоров включают DTPA (диэтилентриаминпентауксусная кислота, CAS №: 67-43-6), DTPA-BMA (1,7-бис(метилкарбамоилметил)-1,4,7-триазагептан-1,4,7-триуксусная кислота, № CAS: 119895-95-3), EOB-DTPA (DTPA, связанный с этоксибензильной группой, № CAS: 158599-72-5), TTHA (триэтилентетрамингексауксусная кислота, № CAS: 869-52-3), DO3A (1,4,7,10-тетраазациклододекан-1,4,7-триуксусная кислота, CAS №: 217973-03-0), HP-DO3A (10-(2-гидроксипропил)-1,4,7,10-тетраазациклододекан-1,4,7-триуксусная кислота, № CAS: 120041-08-9), DOTA (1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота, № CAS: 60239-18-1) и их известные реакционноспособные производные.
Описанные в настоящем документе соединения и конъюгаты также включают свободные формы и их соли, если не указано иное. В этом контексте «его соль» представляет собой соль, которая может быть образована соединением или конъюгатом, которые могут образовывать кислотно-аддитивную соль или соль с основанием, в зависимости от типа заместителя в соединении или конъюгате. Конкретные их примеры включают кислотно-аддитивные соли с неорганическими кислотами, такими как соляная кислота, бромоводородная кислота, йодоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, или органические кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, миндальная кислота, винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота, лимонная кислота, метансульфокислота, этансульфокислота, бензолсульфокислота, п-толуолсульфокислота, аспарагиновая кислота и глутаминовая кислота; соли с неорганическими основаниями, такими как натрий, калий, магний, кальций и алюминий, или органическими основаниями, такими как метиламин, этиламин, этаноламин, лизин и орнитин; соли с различными аминокислотами и производными аминокислот, такими как ацетиллейцин; и соли аммония. Например, DFO существует в виде метансульфоната дефероксамина или существует в виде других солей. DTPA существует как в свободной форме, так и в виде натриевой соли.
Определенный вариант осуществления «хелатирующего агента» для использования в контрастной среде МРТ представляет собой хелатирующий агент сидерофора или не сидерофора, описанный выше.
Определенный вариант осуществления «хелатирующего агента» для использования в ПЭТ-трассере представляет собой хелатирующий агент сидерофора или не сидерофора, описанный выше. Определенным вариантом осуществления является MAG3 (меркапто-ацетил-глицин-глицин-глицин, CAS №: 66516-09-4). Определенным вариантом осуществления является DFO.
Примеры определенного варианта осуществления «хелатирующего агента», составляющего лиганд, содержащийся в конъюгате по настоящему изобретению, включают DFO, DTPA, DTPA-BMA, EOB-DTPA, DO3A, HP-DO3A и DOTA. Определенным вариантом осуществления является DFO, DTPA или DOTA. Определенным вариантом осуществления является DFO.
«Линкер» представляет собой группу, которая создает расстояние между Fab-фрагментом антитела против MUC1 человека и лигандом. Примеры определенного варианта осуществления «линкера» в конъюгате включают следующую формулу:
[Химическая формула 6]
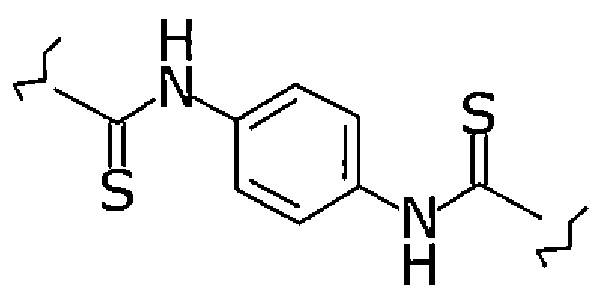
(далее называемый -C(=S)-NH-(1,4-фенилен)-NH-C(=S)-), -CH2-(1,4-фенилен)-NH-C(=S)- и -C(=O)-(C1-20алкилен)-C(=O)-. В этом контексте «C1-20алкилен» представляет собой линейный или разветвленный алкилен, имеющий от 1 до 20 атомов углерода. Определенным вариантом осуществления С1-20алкилена является С1-10алкилен или С1-2алкилен. Определенным вариантом осуществления С1-20алкилена является этилен. Определенным вариантом осуществления является -C(=S)-NH-(1,4-фенилен)-NH-C(=S)-. Определенным вариантом осуществления является -C(=O)-C2H4-C(=O)-. Примеры реагента, который можно использовать в качестве линкера, включают HO-C(=O)-(C1-20алкилен)-C(=O)-OH, янтарную кислоту и п-ди-NCS-бензол(п-диизоцианобензол).
Конъюгат по настоящему изобретению, содержащий флуоресцентный краситель, можно использовать в качестве флуоресцентно меченного молекулярного визуализирующего агента, лекарственного средства для использования в способах фотоиммунотерапии или флуоресцентно меченного молекулярного визуализирующего агента и лекарственного средства для использования в способах фотоиммунотерапии.
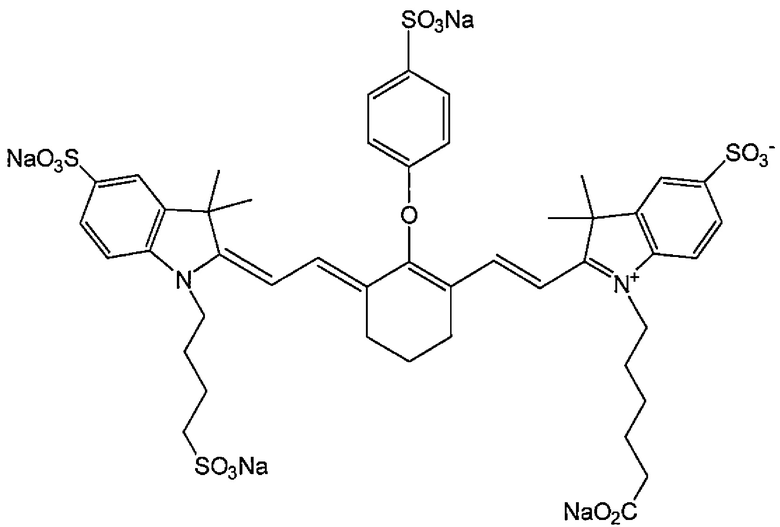
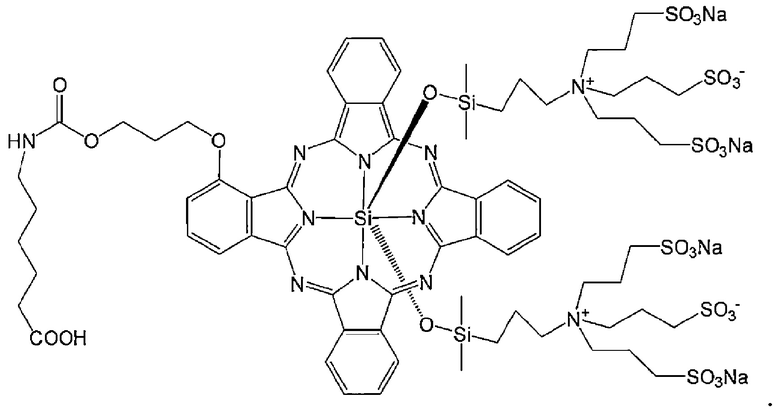
В качестве флуоресцентного красителя для использования в конъюгате по настоящему изобретению можно использовать краситель, имеющий максимум поглощения и максимум излучения при длине волны ближнего инфракрасного диапазона (от 650 до 1000 нм), обычно используемом при фотоизображении. Примеры определенного варианта осуществления флуоресцентного красителя включают соединения цианина и индоцианина. Примеры определенного варианта осуществления включают IRDye800CW и IRDye700DX (LI-COR Bioscience, Inc.), Cy (Molecular Probes, Inc.), Alexa Fluor, BODIPY и DyLight (Thermo Fisher Scientific Inc.), CF790 (Biotium, Inc.), DY (Dyomics GmbH), HiLyte Fluor 680 и HiLyte Fluor 750 (AnaSpec Inc.), а также PULSAR650 и QUASAR670 (LGC Biosearch Technologies). Определенным вариантом осуществления является IRDye800CW, представленный следующей формулой:
[Химическая формула 7]
или IRDye700DX, представленный следующей формулой:
[Химическая формула 8]
Флуоресцентный краситель может реагировать через его карбоксигруппу, гидроксигруппу, аминогруппу или тому подобное или через активную группу, вводимую способом, обычно используемым специалистами в данной области, с Fab-фрагментом или линкером. Определенным вариантом осуществления флуоресцентного красителя, имеющего введенную активную группу, является флуоресцентный краситель, этерифицированный N-гидроксисукцинимидной (NHS) группой. Например, NHS-эфиры IRDye800CW и IRDye700DX, упомянутые выше, являются коммерчески доступными, и их можно использовать.
Связывание Fab-фрагмента антитела против MUC1 человека по настоящему изобретению с метящей частью может быть надлежащим образом выполнено специалистами в данной области с использованием известного подхода. Например, метящая часть может быть связана с одной или более аминогруппами (например, N-концевой аминогруппой и аминогруппой боковой цепи аминокислоты), одной или несколькими тиольными группами (например, тиольной группой аминокислотной боковой цепи) или с одной или более карбоксильными группами (например, карбоксильные группы С-конца и аминокислотной боковой цепи) Fab-фрагмента антитела против MUC1 человека по настоящему изобретению. Определенным вариантом осуществления конъюгата по настоящему изобретению является конъюгат, в котором метящая часть связана с одной или более аминогруппами Fab-фрагмента антитела против MUC1 человека по настоящему изобретению.
Когда метящая часть представляет собой лиганд и линкер, конъюгат по настоящему изобретению можно получить путем взаимодействия хелатирующего агента с веществом, полученным в результате реакции Fab-фрагмента антитела против MUC1 человека по настоящему изобретению с линкером. Он может быть получен путем взаимодействия Fab-фрагмента антитела против MUC1 человека по настоящему изобретению с веществом, полученным в результате реакции хелатирующего агента с линкером. В качестве примера реакции вещество, полученное в результате реакции аминогруппы хелатирующего агента с линкером, может реагировать с одной или более аминогруппами (например, N-концевой аминогруппой и аминогруппой боковой цепи лизина) Fab-фрагмента антитела против MUC1 человека по настоящему изобретению. Реакция синтеза тиомочевины путем добавления изотиоцианата к амину, реакция синтеза амида путем добавления амина и карбоновой кислоты или тому подобное могут быть использованы для получения конъюгата. Реакция может быть осуществлена с применением метода, известного специалистам в данной области. В качестве исходного материала может быть использовано соединение хелатирующего агента, заранее связанного с линкером. Примеры соединения хелатирующего агента, связанного с линкером, включают p-SCN-Bn-DFO (DFO, связанный с p-изотиоцианофениламинотиокарбонильной группой, № CAS: 1222468-90-7), представленный следующей формулой:
[Химическая формула 9]
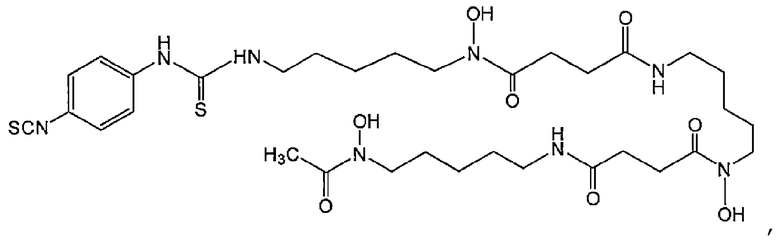
DTPA, связанный с p-изотиоцианобензильной группой (p-NCS-Bn-DTPA, CAS No: 102650-30-6), DOTA, связанный с p-изотиоцианобензильной группой (p-NCS-Bn-DOTA, CAS No: 127985-74-4) и p-SCN-Bn-CHX-A"-DTPA ([(R)-2-амино-3-(4-изотиоцианатофенил)пропил]-транс-(S,S)-циклогексан-1,2)-диамин-пентауксусная кислота, CAS No: 157380-45-5).
Металл (ион парамагнитного металла или радиоизотоп металла) может быть добавлен к Fab-фрагменту антитела против MUC1 человека по настоящему изобретению, связанному с одной или более метящими частями, таким образом, полученными способом получения конъюгата по настоящему изобретению, содержащего металл.
Кроме того, конъюгат по настоящему изобретению может быть получен в виде конъюгата, который представляет собой Fab-фрагмент, связанный через его аминогруппу с одной или более метящими частями, путем взаимодействия одной или более аминогрупп (например, N-концевой аминогруппы и аминогруппы аминокислотной боковой цепи) Fab-фрагмента с метящей частью, имеющей карбоксильную группу или группу изотиоциановой кислоты, активированной N-гидроксисукцинимидом (NHS).
Конъюгат по настоящему изобретению представляет собой конъюгат, содержащий одну или более метящих частей и Fab-фрагмент антитела против MUC1 человека по настоящему изобретению. Определенным вариантом осуществления является Fab-фрагмент антитела против MUC1 человека, связанный с 1-27 метящими частями. Определенным вариантом осуществления является Fab-фрагмент антитела против MUC1 человека, связанный с 1-23 метящими частями. Определенным вариантом осуществления является Fab-фрагмент антитела против MUC1 человека, связанный с 1-15 метящими частями. Определенным вариантом осуществления является Fab-фрагмент антитела против MUC1 человека, связанный с 1-11 метящими частями. Определенным вариантом осуществления является Fab-фрагмент антитела против MUC1 человека, связанный с 1-9 метящими частями. Определенным вариантом осуществления является Fab-фрагмент антитела против MUC1 человека, связанный с 1-7 метящими частями. Определенным вариантом осуществления является Fab-фрагмент антитела против MUC1 человека, связанный с 1-5 метящими частями. Определенным вариантом осуществления является Fab-фрагмент антитела против MUC1 человека, связанный с 1-4 метящими частями. Определенным вариантом осуществления является Fab-фрагмент антитела против MUC1 человека, связанный с одной или более метящими частями, дополнительно содержащими металл.
В одном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, в котором метящая часть представляет собой (i) лиганд и линкер, (ii) лиганд, (iii) флуоресцентный краситель и линкер, или (iv) флуоресцентный краситель.
В определенном варианте осуществления примеры конъюгата по настоящему изобретению включают в себя следующее:
(1) конъюгат, в котором Fab-фрагмент антитела против MUC1 человека по настоящему изобретению представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO 10, и легкую цепь, содержащую вариабельную область легкой цепи, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 12.
(2) конъюгат по п.(1), где Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6;
(3) конъюгат, в котором Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 10, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 10 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12;
(4) конъюгат по п.(2), где Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6;
(5) конъюгат по любому из (1)-(4), где метящей частью является (i) лиганд и линкер или (ii) лиганд;
(6) конъюгат по любому из (1)-(4), где лиганд представляет собой группу, состоящую из хелатирующего агента, выбранного из группы, состоящей из DFO, DTPA, DTPA-BMA, EOB-DTPA, DO3A, HP-DO3A и DOTA, и линкер представляет собой линкер, выбранный из группы, состоящей из -C(=S)-NH-(1,4-фенилен)-NH-C(=S)-, -CH2-(1,4-фенилен)-NH-C(= S)- и -C(=O)-(C1-20алкилен)-C(=O)-;
(7) конъюгат по п.(6), где лиганд представляет собой группу, состоящую из хелатирующего агента, выбранного из группы, состоящей из DFO, DTPA и DOTA;
(8) конъюгат по п.(6), где лиганд представляет собой группу, состоящую из DFO, и линкер представляет собой -C(=S)-NH-(1,4-фенилен)-NH-C(=S)-;
(9) конъюгат по любому из (5)-(8), дополнительно содержащий металл;
(10) конъюгат по п.(9), где металл представляет собой радиоизотоп металла; и
(11) конъюгат по п.(10), где металл представляет собой 89Zr.
В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, в котором метящая часть представляет собой (i) лиганд и линкер или (ii) лиганд.
В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, в котором лиганд представляет собой лиганд, представленный следующей формулой (А):
[Химическая формула 10]
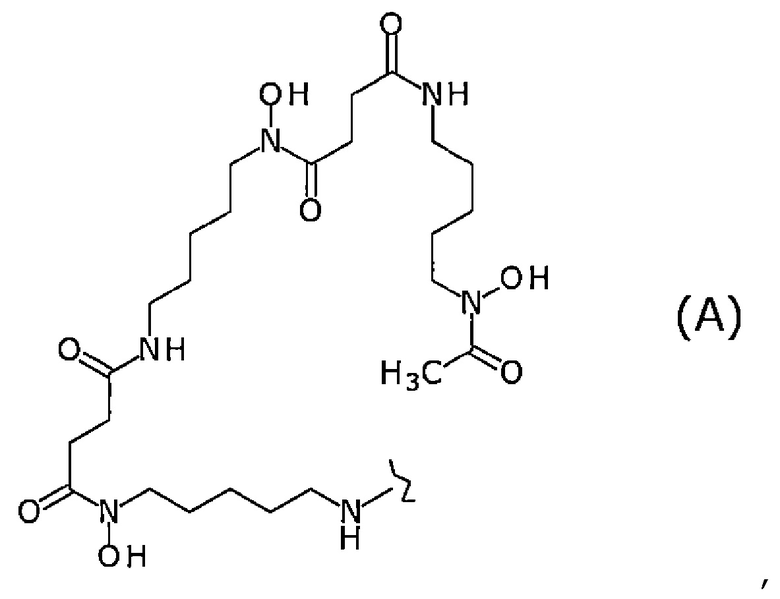
где волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека или линкером.
В определенном варианте осуществления конъюгат по настоящему изобретению, в котором лиганд представляет собой лиганд, представленный формулой (A), представляет собой конъюгат, в котором метящая часть представляет собой лиганд и линкер, представленный следующей формулой (A'):
[Химическая формула 11]
 ,
,
где волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека.
Fab-фрагмент антитела против MUC1-человека связан через его аминогруппу с атомом углерода концевой группы C(=S) метящей части.
В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, в котором метящая часть представляет собой (i) лиганд и линкер или (ii) лиганд, причем конъюгат дополнительно содержит металл. Определенным вариантом осуществления металла является радиоизотоп металла. Определенным вариантом осуществления радиоизотопа металла является 89Zr.
В альтернативном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, в котором метящая часть представляет собой (i) флуоресцентный краситель и линкер, или (ii) флуоресцентный краситель.
В определенном варианте осуществления конъюгат по настоящему изобретению, в котором метящая часть содержит флуоресцентный краситель, представляет собой конъюгат, в котором флуоресцентный краситель представляет собой флуоресцентный краситель, выбранный из группы, состоящей из следующей формулы (B) и следующей формулы (С):
[Химическая формула 12]

[Химическая формула 13]

где волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека или линкером.
В определенном варианте осуществления конъюгат по настоящему изобретению, в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (B), представляет собой конъюгат, в котором волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека, и Fab-фрагмент антитела против MUC1 человека связан через его аминогруппу с атомом углерода концевой группы C(=O) метящей части.
В определенном варианте осуществления конъюгат по настоящему изобретению, в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (C), представляет собой конъюгат, в котором волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека, и Fab-фрагментом антитела против MUC1 человека связан через его аминогруппу с атомом углерода концевой группы C (= O) метящей части.
Некоторые варианты осуществления конъюгата по настоящему изобретению будут дополнительно представлены ниже:
(1) конъюгат, в котором метящая часть представляет собой лиганд и линкер, представленный формулой (A'), и Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12;
(2) конъюгат по п.(1), где Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6;
(3) конъюгат, в котором метящая часть представляет собой лиганд и линкер, представленный формулой (A'), и Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 10, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 10 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12;
(4) конъюгат по п.(3), в котором Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6;
(5) конъюгат по (2) или (4), который представляет собой Fab-фрагмент антитела против MUC1 человека, связанный с 1-11 метящими частями;
(6) конъюгат по (2) или (4), который представляет собой Fab-фрагмент антитела против MUC1 человека, связанный с 1-4 метящими частями;
(7) конъюгат по любому из (1)-(6), дополнительно содержащий металл;
(8) конъюгат по п.(7), в котором металл представляет собой радиоизотоп металла;
(9) конъюгат по п.(8), где металл представляет собой 89Zr;
(10) конъюгат, в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (B) или формулой (C), и Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12;
(11) конъюгат по п.(10), в котором Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6;
(12) конъюгат, в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (B) или формулой (C), и Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 10, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 10 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12;
(13) конъюгат по п.(12), где Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6;
(14) конъюгат по любому из (10)-(13), где метящая часть представляет собой флуоресцентный краситель, представленный формулой (C);
(15) конъюгат по п.(14), который представляет собой Fab-фрагмент антитела против MUC1 человека, связанный с 1-11 метящими частями;
(16) конъюгат по п.(15), который представляет собой Fab-фрагмент антитела против MUC1 человека, связанный с 1-5 метящими частями;
(17) конъюгат по любому из (10)-(13), в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (B);
(18) конъюгат по п.(17), который представляет собой Fab-фрагмент антитела против MUC1 человека, связанный с 1-11 метящими частями; и
(19) конъюгат по п.(18), который представляет собой Fab-фрагмент антитела против MUC1 человека, связанный с 1-5 метящими частями.
В альтернативном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат, представленный следующей формулой (I):
[Химическая формула 14]

где Ab представляет собой Fab-фрагмент антитела против MUC1 человека,
L представляет собой (i) лиганд или (ii) флуоресцентный краситель,
Х представляет собой линкер или связь, и
р натуральное число от 1 до 27. Определенным вариантом осуществления р является натуральное число от 1 до 23. Определенным вариантом осуществления является натуральное число от 1 до 15. Определенным вариантом осуществления является натуральное число от 1 до 11. Определенным вариантом осуществления является натуральное число от 1 до 9. Определенным вариантом осуществления является натуральное число от 1 до 7. Определенным вариантом осуществления является натуральное число от 1 до 5. Определенным вариантом осуществления является натуральное число от 1 до 4.
В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат формулы (I), причем этот конъюгат дополнительно содержит металл. Определенным вариантом осуществления металла является радиоизотоп металла. Определенным вариантом осуществления радиоизотопа металла является 89Zr.
В определенном варианте осуществления конъюгат формулы (I) представляет собой конъюгат по настоящему изобретению, в котором метящая часть представляет собой лиганд и линкер, представленные формулой (A'). В определенном варианте осуществления этот конъюгат представляет собой конъюгат, представленный следующей формулой (II):
[Химическая формула 15]
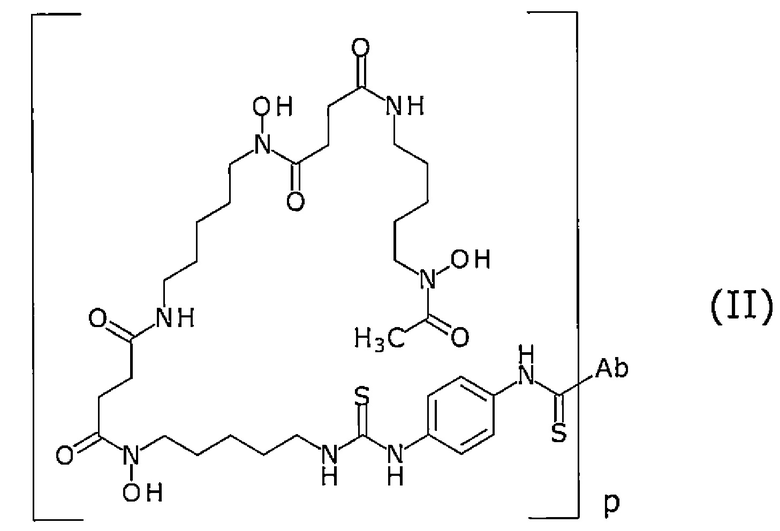
где Ab представляет собой Fab-фрагмент антитела против MUC1 человека, и
р натуральное число от 1 до 27. Определенным вариантом осуществления р является натуральное число от 1 до 23. Определенным вариантом осуществления является натуральное число от 1 до 15. Определенным вариантом осуществления является натуральное число от 1 до 11. Определенным вариантом осуществления является натуральное число от 1 до 9. Определенным вариантом осуществления является натуральное число от 1 до 7. Определенным вариантом осуществления является натуральное число от 1 до 5. Определенным вариантом осуществления является натуральное число от 1 до 4.
Ab связано через его аминогруппу с атомом углерода концевой группы C(=S) метящей части.
В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой конъюгат формулы (II), причем этот конъюгат дополнительно содержит металл. Определенным вариантом осуществления металла является радиоизотоп металла. Определенным вариантом осуществления радиоизотопа металла является 89Zr.
В определенном варианте осуществления конъюгат формулы (I) представляет собой конъюгат по настоящему изобретению, в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (B). В определенном варианте осуществления конъюгат представляет собой конъюгат, представленный следующей формулой (III):
[Химическая формула 16]
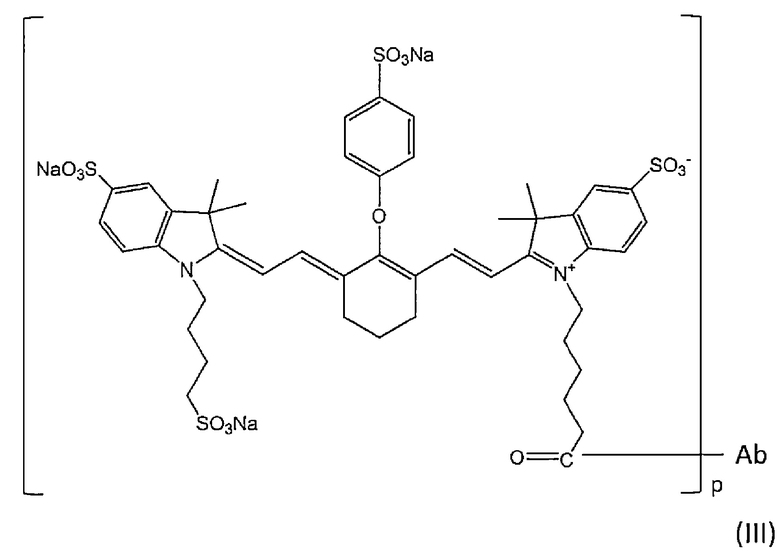
где Ab представляет собой Fab-фрагмент антитела против MUC1 человека, и
р натуральное число от 1 до 27. Определенным вариантом осуществления р является натуральное число от 1 до 23. Определенным вариантом осуществления является натуральное число от 1 до 15. Определенным вариантом осуществления является натуральное число от 1 до 11. Определенным вариантом осуществления является натуральное число от 1 до 9. Определенным вариантом осуществления является натуральное число от 1 до 7. Определенным вариантом осуществления является натуральное число от 1 до 5. Определенным вариантом осуществления является натуральное число от 1 до 4.
Ab связано через его аминогруппу с атомом углерода концевой группы C(=O) метящей части.
В определенном варианте осуществления конъюгат формулы (I) представляет собой конъюгат по настоящему изобретению, в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (C). В определенном варианте осуществления этот конъюгат представляет собой конъюгат, представленный следующей формулой (IV):
[Химическая формула 17]
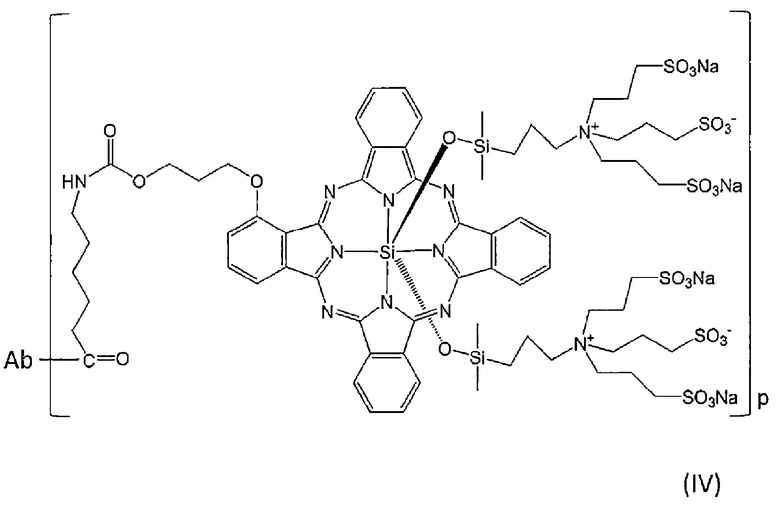
где Ab представляет собой Fab-фрагмент антитела против MUC1 человека, и
р натуральное число от 1 до 27. Определенным вариантом осуществления р является натуральное число от 1 до 23. Определенным вариантом осуществления является натуральное число от 1 до 15. Определенным вариантом осуществления является натуральное число от 1 до 11. Определенным вариантом осуществления является натуральное число от 1 до 9. Определенным вариантом осуществления является натуральное число от 1 до 7. Определенным вариантом осуществления является натуральное число от 1 до 5. Определенным вариантом осуществления является натуральное число от 1 до 4.
Ab связано через его аминогруппу с атомом углерода концевой группы C(=O) метящей части.
В определенном варианте осуществления конъюгат по настоящему изобретению представляет собой Fab-фрагмент антитела против MUC1 человека по настоящему изобретению, меченный детектируемой молекулой. Fab-фрагмент антитела против MUC1 человека по настоящему изобретению, меченный детектируемой молекулой, представляет собой Fab-фрагмент антитела против MUC1 человека по настоящему изобретению и детектируемую молекулу, связанные непосредственно через ковалентную связь или через соответствующий линкер. В настоящем описании под детектируемой молекулой подразумевается каждый фрагмент, детектируемый в методике диагностики изображений, известной в данной области. Когда метод визуальной диагностики представляет собой, например, флуоресцентную визуализацию, детектируемая молекула представляет собой флуоресцентный краситель. Когда метод визуальной диагностики представляет собой ПЭТ, детектируемая молекула представляет собой соединение, которое можно визуализировать с помощью ПЭТ. Определенным вариантом осуществления является соединение, содержащее лиганд, меченный радионуклидом, или остаток сахара, меченный неметаллическим радионуклидом. Определенным вариантом осуществления соединения, содержащего лиганд, меченный радионуклидом, является лиганд, который образовал хелатный комплекс с радиоизотопом металла. Когда в качестве метода визуальной диагностики используется МРТ, детектируемая молекула представляет собой соединение, которое можно детектировать методом МРТ. Определенным вариантом осуществления является соединение, содержащее меченый лиганд, имеющий ион парамагнитного металла. Определенный вариант осуществления соединения, содержащего меченый лиганд, имеющий ион парамагнитного металла, представляет собой лиганд, который образовал хелатный комплекс с ионом парамагнитного металла.
Когда Fab-фрагмент антитела против MUC1 человека по настоящему изобретению, меченный детектируемой молекулой, используют в контексте детектируемой молекулы, соединение, визуализируемое с помощью PET, называется PET-трассером, а соединение, детектируемое с помощью метода МРТ, называется контрастным веществом МРТ.
Примеры некоторых вариантов осуществления Fab-фрагмента антитела против MUC1 по настоящему изобретению, меченного детектируемой молекулой, включают следующие:
(1) Fab-фрагмент антитела против MUC1 человека, где детектируемой молекулой является флуоресцентный краситель, ПЭТ-трассер или контрастное вещество МРТ;
(2) Fab-фрагмент антитела против MUC1 человека по п.(1), где детектируемой молекулой является флуоресцентный краситель;
(3) Fab-фрагмент антитела против MUC1 человека по п.(2), где детектируемая молекула представляет собой флуоресцентный краситель, представленный формулой (B);
(4) Fab-фрагмент антитела против MUC1 человека по п.(2), где детектируемая молекула представляет собой флуоресцентный краситель, представленный формулой (C);
(5) Fab-фрагмент антитела против MUC1 человека по п.(1), где детектируемой молекулой является ПЭТ-трассер или контрастное вещество МРТ;
(6) Fab-фрагмент антитела против MUC1 человека, где детектируемая молекула представляет собой контрастное вещество МРТ, содержащее лиганд, представленный формулой (A), и ион парамагнитного металла, или ПЭТ-трассер, содержащий лиганд и радиоизотоп металла; и
(7) Fab-фрагмент антитела против MUC1 человека по п.(6), где детектируемая молекула и линкер представляют собой контрастное вещество МРТ, содержащее лиганд и линкер, представленные формулой (A'), и ион парамагнитного металла или PET-трассер, включающий лиганд и линкер, а также радиоизотоп металла.
Упомянутый выше способ можно использовать для связывания Fab-фрагмента антитела против MUC1 человека по настоящему изобретению с детектируемой молекулой.
Конъюгат по настоящему изобретению также включает конъюгат, который представляет собой смесь множества конъюгатов по настоящему изобретению. Например, конъюгат, который представляет собой смесь конъюгата, содержащего метящую часть и Fab-фрагмент немодифицированного посттрансляционно антитела против MUC1 человека по настоящему изобретению, и конъюгат, содержащий метящую часть и Fab-фрагмент антитела против MUC1 человека по настоящему изобретению, полученный в результате посттрансляционной модификации Fab-фрагмента антитела против MUC1 человека, также включены в конъюгат по настоящему изобретению.
Некоторые варианты осуществления конъюгата по настоящему изобретению, который представляет собой смесь множества конъюгатов по настоящему изобретению, будут представлены ниже:
(1) конъюгат, который представляет собой смесь конъюгата, в котором метящая часть представляет собой лиганд и линкер, представленный формулой (A'), и Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6, и конъюгата, в котором метящая часть представляет собой лиганд и линкер, представленный формулой (A'), и Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, с помощью модификации глутамина в положении аминокислоты 1 SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6;
(2) конъюгат по п.(1), дополнительно содержащий металл;
(3) конъюгат по п.(2), в котором металл представляет собой радиоизотоп металла;
(4) конъюгат по п.(3), в котором металл представляет собой 89Zr;
(5) конъюгат, который представляет собой смесь конъюгата, в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (B), и Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6, и конъюгата, в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (B), и Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 из SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6; и
(6) конъюгат, который представляет собой смесь конъюгата, в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (C), и Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6, и конъюгата, в котором метящая часть представляет собой флуоресцентный краситель, представленный формулой (C), и Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
Полинуклеотид по настоящему изобретению
Полинуклеотид по настоящему изобретению включает полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по настоящему изобретению.
В одном варианте осуществления полинуклеотид по настоящему изобретению представляет собой полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8, или полинуклеотид, содержащий нуклеотидную последовательность, кодирующая фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10.
Примеры полинуклеотидов, содержащих нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8, включают полинуклеотид, содержащий нуклеотидную последовательность, представленную SEQ ID NO: 7. Примеры полинуклеотида, содержащего нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10, включают полинуклеотид, содержащий нуклеотидную последовательность, представленную SEQ ID NO: 9.
В одном варианте осуществления, полинуклеотид по настоящему изобретению представляет собой полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, или полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4.
Примеры полинуклеотида, содержащего нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2, включают полинуклеотид, содержащий нуклеотидную последовательность, представленную SEQ ID NO: 1. Примеры полинуклеотидов, содержащих нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, включают полинуклеотид, содержащий нуклеотидную последовательность, представленную SEQ ID NO: 3.
В одном варианте осуществления, полинуклеотид по настоящему изобретению представляет собой полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
Примеры полинуклеотидов, содержащих нуклеотидную последовательность, кодирующую легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12, включают полинуклеотид, содержащий нуклеотидную последовательность, представленную SEQ ID NO: 11.
В одном варианте осуществления полинуклеотид по настоящему изобретению представляет собой полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
Примеры полинуклеотидов, содержащих нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6, включают полинуклеотид, содержащий нуклеотидную последовательность, представленную SEQ ID NO: 5.
Полинуклеотид по настоящему изобретению можно синтезировать посредством метода синтеза генов, известного в данной области техники, на основе нуклеотидных последовательностей, сконструированных из аминокислотных последовательностей фрагмента тяжелой цепи и легкой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению. В качестве таких способов синтеза генов можно использовать различные способы, известные специалистам в данной области, такие как способы синтеза генов антитела, описанные в международной публикации № WO 90/07861.
Экспрессирующий вектор по настоящему изобретению
Экспрессирующий вектор по настоящему изобретению включает экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, и экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующая легкую цепь Fab-фрагмента антитела против MUC1 человека по настоящему изобретению.
Экспрессирующий вектор по настоящему изобретению предпочтительно включает экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6, и экспрессирующий вектор, содержащий полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
Экспрессирующий вектор по настоящему изобретению конкретно ничем не ограничен при условии, что полипептид, кодируемый полинуклеотидом по настоящему изобретению, может продуцироваться в различных клетках-хозяевах, представляющих собой прокариотические и/или эукариотические клетки. Примеры такого экспрессирующего вектора включают плазмидные векторы и вирусные векторы (например, аденовирусные и ретровирусные). Предпочтительно можно использовать pEE6.4 или pEE12.4 (Lonza Ltd.).
Экспрессирующий вектор по настоящему изобретению может содержать промотор, функционально связанный с геном, кодирующим фрагмент тяжелой цепи и/или легкую цепь в полинуклеотиде по настоящему изобретению. Примеры промотора для экспрессии Fab-фрагмента по настоящему изобретению в клетке-хозяине, включают Trp-промотор, LAC-промотор, RecA-промотор, λPL-промотор , lpp-промотор и tас-промотор, когда клетка-хозяина представляет собой бактерию рода Escherichia. Примеры промотора для экспрессии в дрожжах включают промотор PH05, промотор PGK, промотор GAP и промотор ADH. Примеры промотора для экспрессии в бактериях рода Bacillus включают промотор SL01, промотор SP02 и промотор penP. Примеры промоторов включают промоторы, полученные из вирусов, такие как CMV, RSV и SV40, ретровирусный промотор, промотор актина, промотор EF (фактор элонгации) 1α и промотор белка теплового шока, когда хозяин представляет собой эукариотическую клетку, такую как клетка млекопитающего.
В случае использования бактерии, в частности, E.coli, в качестве клетки-хозяина, экспрессирующий вектор по настоящему изобретению может дополнительно содержать старт-кодон, стоп-кодон, область терминации и реплицируемую единицу. С другой стороны, в случае использования дрожжей, клеток животных или насекомых в качестве хозяина, экспрессирующий вектор по настоящему изобретению может содержать старт-кодон и стоп-кодон. В этом случае в нем могут содержаться последовательность энхансера, 5'- и 3'-нетранслируемых областей гена, кодирующего фрагмент тяжелой цепи и/или легкую цепь по настоящему изобретению, сигнальную последовательность секреции, соединение сплайсинга, сайт полиаденилирования или реплицируемую единицу и т. д. Кроме того, обычно используется маркер селекции (например, ген устойчивости к тетрациклину, ген устойчивости к ампициллину, ген устойчивости к канамицину, ген устойчивости к неомицину, ген дигидрофолатредуктазы) в зависимости от цели.
Трансформированная клетка-хозяин по настоящему изобретению
Трансформированная клетка-хозяин по настоящему изобретению включает клетку-хозяина, трансформированную экспрессирующим вектором по настоящему изобретению, выбранную из группы, состоящей из следующих (а)-(d):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по настоящему изобретению;
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь антитела Fab-фрагмент антитела против MUC1 человека по настоящему изобретению; и
(d) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, и экспрессирующим вектор, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по настоящему изобретению.
В одном варианте осуществления, трансформированная клетка-хозяин по настоящему изобретению представляет собой клетку-хозяина, трансформированную экспрессирующим вектором по настоящему изобретению, выбранную из группы, состоящей из следующих (а)-(d):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6;
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотная последовательность, представленная SEQ ID NO: 6; и
(d) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
Клетка-хозяин, подлежащая трансформации, конкретно ничем не ограничена при условии, что она совместима с используемым экспрессирующим вектором и может быть трансформирована экспрессирующим вектором для экспрессии Fab-фрагмента. Их примеры включают различные клетки, такие как природные клетки и искусственно созданные клетки, обычно используемые в области техники настоящего изобретения (например, бактерии (бактерии рода Escherichia и бактерии рода Bacillus), дрожжи (род Saccharomyces, род Pichia) и т.д.), клетки животных и клетки насекомых (например, Sf9)) и клеточные линии млекопитающих (например, культивируемые клетки, такие как клетки CHO-K1SV, клетки CHO-DG44 и клетки 293). Сама трансформация может быть выполнена известным способом, например, кальций фосфатным методом или методом электропорации.
Способ получения Fab-фрагмента антитела против MUC1 человека в соответствии с настоящим изобретением
Способ получения Fab-фрагмента антитела против MUC1 человека в соответствии с настоящим изобретением включает стадию культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека.
В одном варианте осуществления трансформированную клетку-хозяин по настоящему изобретению для культивирования в способе получения Fab-фрагмента антитела против MUC1 человека в соответствии с настоящим изобретением выбирают из группы, состоящей из следующих (а)-(с):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по настоящему изобретению;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по настоящему изобретению; и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 по настоящему изобретению.
Определенную форму трансформированной клетки-хозяина по настоящему изобретению, которую следует культивировать в способе получения Fab-фрагмента антитела против MUC1 человека в соответствии с настоящим изобретением, выбирают из группы, состоящей из следующих (а)-(с):
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6; и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
Предпочтительно, используемая трансформированная клетка-хозяин по настоящему изобретению представляет собой клетку-хозяина, трансформированную экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, или клетку-хозяина, трансформированную экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 по настоящему изобретению, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по настоящему изобретению.
В способе получения Fab-фрагмента антитела против MUC1 человека в соответствии с настоящим изобретением трансформированную клетку-хозяина можно культивировать в питательной среде. Питательная среда предпочтительно содержит источник углерода, источник неорганического азота или источник органического азота, необходимые для роста трансформированной клетки-хозяина. Примеры источника углерода включают глюкозу, декстран, растворимый крахмал и сахарозу. Примеры источника неорганического азота или источника органического азота включают соли аммония, нитраты, аминокислоты, кукурузный отвар, пептон, казеин, мясные экстракты, соевую муку и картофельные экстракты. Также при желании в них могут содержаться другие питательные вещества (например, неорганические соли (например, хлорид кальция, дигидрофосфат натрия и хлорид магния), витамины и антибиотики (например, тетрациклин, неомицин, ампициллин и канамицин)).
Само культивирование трансформированной клетки-хозяина выполняется известным способом. Условия культивирования, например, температура, рН среды и время культивирования, выбираются соответствующим образом. Когда хозяином является, например, клетка животного происхождения, то в качестве среды может использоваться среда MEM (Science; 1952; 122: 501), среда DMEM (Virology; 1959; 8: 396-97), среда RPMI1640 (J. Am. Med. Assoc.; 1967; 199: 519-24), среда 199 (Proc. Soc. Exp. Biol. Med.; 1950; 73: 1-8) или тому подобное, содержащая приблизительно 5-20% эмбриональной бычьей сыворотки. РН среды предпочтительно составляет приблизительно от 6 до 8. Культивирование обычно проводят при температуре приблизительно от 30 до 40°С в течение приблизительно от 15 до 336 часов с аэрацией или перемешиванием, если это необходимо. Когда хозяином является клетка насекомого, примеры сред включают среду Грейса (PNAS; 1985; 82: 8404-8), содержащую эмбриональную бычью сыворотку. Ее рН предпочтительно составляет приблизительно от 5 до 8. Культивирование обычно проводят при температуре приблизительно от 20 до 40°С в течение 15 до 100 часов с аэрацией или перемешиванием, если это необходимо. Когда хозяином является бактерия, актиномицеты, дрожжи или нитчатый гриб, то подходит, например, жидкая среда, содержащая источник питательных веществ, описанный выше. Среда с pH от 5 до 8 является предпочтительной. Когда хозяином является E.coli, предпочтительные примеры среды включают среду LB и среду М9 (Miller et al., Exp. Mol. Genet, Cold Spring Harbor Laboratory; 1972: 431). В таком случае, как правило, культивирование может быть выполнено при 14 до 43°С в течение приблизительно от 3 до 24 часов с аэрацией или перемешиванием, если это необходимо. Когда хозяином является бактерия из рода Bacillus, то культивирование обычно может быть выполнено при температуре от 30 до 40°С в течение приблизительно 16 до 96 часов с аэрацией или перемешиванием, если это необходимо. Когда хозяин представляет собой дрожжи, примеры среды включают минимальную среду Burkholder (PNAS; 1980; 77: 4505-8). Ее рН желательно поддерживать от 5 до 8. Культивирование обычно выполняют при температуре приблизительно от 20 до 35°С в течение примерно 14 до 144 часов с аэрацией или перемешиванием, если это необходимо.
Способ получения Fab-фрагмента антитела против MUC1 человека в соответствии с настоящим изобретением может включать стадию выделения, предпочтительно выделения или очистки экспрессированного Fab-фрагмента антитела против MUC1 человека в дополнение к стадии культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека. Примеры метода выделения или очистки включают: методы с использованием растворимости, такие как высаливание, и метод осаждения растворителем; методы, использующие разницу в молекулярной массе, такие как диализ, ультрафильтрация, гель-фильтрация и электрофорез в полиакриламидном геле с додецилсульфатом натрия; методы с использованием заряда, такие как ионообменная хроматография и гидроксилапатитная хроматография; методы, использующие специфическую аффинность, такие как аффинная хроматография; методы, использующие разницу в гидрофобности, такие как высокоэффективная жидкостная хроматография с обращенной фазой; и способы, использующие разницу в изоэлектрической точке, такие как изоэлектрическое фокусирование.
Способ получения конъюгата согласно настоящему изобретению
Способ получения конъюгата согласно настоящему изобретению включает стадию ковалентного связывания Fab-фрагмента антитела против MUC1 человека по настоящему изобретению с метящей частью. Способ получения конъюгата по настоящему изобретению может также включать стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; и ковалентное связывание Fab-фрагмента с метящей частью. Способ получения конъюгата по настоящему изобретению может также включать стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; восстановление экспрессированного Fab-фрагмента; и ковалентное связывание Fab-фрагмента с метящей частью. Способ получения конъюгата согласно настоящему изобретению может дополнительно включать стадию добавления металла. Могут быть использованы линкер, хелатирующий агент, металл или флуоресцентный краситель и т.д., и метод связывания такие, которые описаны в разделе «Конъюгат по настоящему изобретению».
В одном варианте осуществления способ получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; и ковалентное связывание Fab-фрагмента с метящей частью. Определенный вариант осуществления способа получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; извлечение экспрессированного Fab-фрагмента; и ковалентное связывание Fab-фрагмента с метящей частью.
Определенный вариант осуществления способа получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; и i) связывание Fab-фрагмента через линкер с лигандом или ii) ковалентное связывание Fab-фрагмента непосредственно с лигандом. Определенный вариант осуществления способа получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; извлечение экспрессированного Fab-фрагмента; и i) связывание Fab-фрагмента через линкер с лигандом или ii) ковалентное связывание Fab-фрагмента непосредственно с лигандом.
Определенный вариант осуществления способа получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; i) связывание Fab-фрагмента через линкер с лигандом или ii) ковалентное связывание Fab-фрагмента непосредственно с лигандом; и мечение лиганда конъюгата металлом (то есть образование хелатного комплекса). Определенный вариант осуществления способа получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; извлечение экспрессированного Fab-фрагмента; i) связывание Fab-фрагмента через линкер с лигандом или ii) ковалентное связывание Fab-фрагмента непосредственно с лигандом; и мечение лиганда конъюгата металлом.
Определенный вариант осуществления способа получения конъюгата согласно настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; i) связывание Fab-фрагмента через линкер с лигандом или ii) ковалентное связывание Fab-фрагмента непосредственно с лигандом; и мечение лиганда конъюгата радиоизотопом металла (т.е. образование хелатного комплекса). Определенный вариант осуществления способа получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; извлечение экспрессированного Fab-фрагмента; i) связывание Fab-фрагмента через линкер с лигандом или ii) ковалентное связывание Fab-фрагмента непосредственно с лигандом; и мечение лиганда конъюгата радиоизотопом металла.
Определенным вариантом осуществления способа получения конъюгата по настоящему изобретению является способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; и i) связывание Fab-фрагмента через линкер с флуоресцентным красителем или ii) ковалентное связывание Fab-фрагмента непосредственно с флуоресцентным красителем. Определенный вариант осуществления способа получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; восстановление экспрессированного Fab-фрагмента; и i) связывание Fab-фрагмента через линкер с флуоресцентным красителем или ii) ковалентное связывание Fab-фрагмента непосредственно с флуоресцентным красителем.
Определенный вариант осуществления способа получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; и мечения Fab-фрагмента детектируемой молекулой. Определенный вариант осуществления способа получения конъюгата по настоящему изобретению представляет собой способ, включающий стадии: культивирования трансформированной клетки-хозяина по настоящему изобретению для экспрессии Fab-фрагмента антитела против MUC1 человека; восстановления экспрессированного Fab-фрагмента; и мечения Fab-фрагмента детектируемой молекулой.
Способ получения конъюгата в соответствии с настоящим изобретением может осуществляться как способ, включающий две или более стадии, определенных выше, в виде последовательности стадий, или может выполняться как способ, включающий по меньшей мере одну из стадий, определенных выше. Например, способ, включающий стадию связывания Fab-фрагмента антитела против MUC1 человека по настоящему изобретению с метящей частью, и способ, включающий стадию мечения Fab-фрагмента антитела против MUC1 человека по настоящему изобретению, связанного с метящей частью с металлом, также включен в способ получения конъюгата согласно настоящему изобретению. Кроме того, способ получения конъюгата согласно настоящему изобретению включает способ, имеющий различный порядок стадий. Например, способ, включающий мечение хелатирующего агента металлом и затем ковалентное связывание хелатирующего агента с Fab-фрагментом антитела против MUC1 человека по настоящему изобретению, также включен в способ получения конъюгата согласно настоящему изобретению.
Композиция для диагностики и способ диагностики
Настоящее изобретение относится к композиции для диагностики, содержащей конъюгат по настоящему изобретению, содержащий металл или флуоресцентный краситель (далее называемый детектируемым конъюгатом по настоящему изобретению). Композиция для диагностики по настоящему изобретению может содержать один или более конъюгатов по настоящему изобретению. В частности, композиция для диагностики по настоящему изобретению может содержать один конъюгат по настоящему изобретению или может содержать два или более конъюгатов по настоящему изобретению в комбинации. Детектируемый конъюгат по настоящему изобретению может быть приготовлен в соответствии с обычным способом и использоваться в качестве лекарственного средства для ранней диагностики, лекарственного средства для определенной стадии или интраоперационного диагностического лекарственного средства (в частности, лекарственного средства для диагностики злокачественного новообразования). Интраоперационное диагностическое лекарственное средство означает диагностическое лекарственное средство, способное идентифицировать участок поражения во время операции, такой как операция или эндоскопическая операция, и исследовать его природу. В случае использования композиции для диагностики по настоящему изобретению в качестве интраоперационного диагностического лекарственного средства композицию для диагностики вводят пациенту, например, от 2 до 32 часов, от 6 до 24 часов в определенном варианте осуществления или в другом варианте осуществления за 2 часа перед операцией.
Лекарственное средство ранней диагностики означает диагностическое лекарственное средство, предназначенное для постановки диагноза, когда патологическое состояние не наблюдается или имеет место его ранняя стадия. Например, для злокачественных новообразований это означает диагностическое лекарственное средство, которое используется, когда не наблюдается никаких патологических состояний, или на стадии 0 или стадии 1.
Лекарственное средство определения стадии означает диагностическое лекарственное средство, способное определять степень прогрессирования патологического состояния. Например, для злокачественного новообразования это означает диагностическое лекарственное средство, способное исследовать его стадию.
Злокачественное новообразование, которое, как ожидается, будет диагностировано композицией для диагностики по настоящему изобретению, представляет собой злокачественное новообразование, клетки которого экспрессируют MUC1 человека. Примеры определенного варианта осуществления включают рак молочной железы, рак легкого, колоректальный рак, рак мочевого пузыря, рак кожи, рак щитовидной железы, рак желудка, рак поджелудочной железы, рак почки, рак яичника и рак шейки матки. Предпочтительно злокачественное новообразование представляет собой рак молочной железы или рак мочевого пузыря.
Количество конъюгата по настоящему изобретению, добавляемое к составу композиции для диагностики по настоящему изобретению, различается в зависимости от степени симптомов или возраста пациента, используемой лекарственной формы или титра связывания. Fab-фрагмента и т.д. Например, приблизительно от 0,001 до 100 мг/кг в расчете на массу Fab-фрагмента можно использовать на единицу массы тела пациента.
Примеры лекарственной формы композиции для диагностики по настоящему изобретению могут включать парентеральные агенты, такие как инъекции, и агенты для капельной инфузии. Введение может быть выполнено путем внутривенной инъекции, локальной внутримышечной инъекции в ткань-мишень, подкожной инъекции, интравезикального введения или тому подобное. Для состава можно использовать носитель или добавку, подходящую для этих лекарственных форм, в фармацевтически приемлемом диапазоне. Тип фармацевтически приемлемого носителя или добавки конкретно ничем не ограничен, и можно использовать носитель или добавку, хорошо известные специалистам в данной области.
Настоящее изобретение также относится к применению детектируемого конъюгата по настоящему изобретению для производства композиции для ранней диагностики, композиции для определения стадии или композиции для интраоперационной диагностики злокачественного новообразования. Настоящее изобретение также относится к детектируемому конъюгату по настоящему изобретению для применения при ранней диагностике, определении стадии или интраоперационной диагностике злокачественного новообразования.
Кроме того, настоящее изобретение также относится к способу диагностики злокачественного новообразования, включающему предоперационное или интраоперационное введение детектируемого конъюгата по настоящему изобретению пациенту. В этом контексте «пациент» - это человек или любое другое млекопитающее, нуждающееся в постановке диагноза. В определенном варианте осуществления пациентом является человек, нуждающийся в постановке диагноза. Эффективное количество детектируемого конъюгата по настоящему изобретению в способе диагностики по настоящему изобретению может быть таким же, как эффективное количество конъюгата по настоящему изобретению для композиции, описанной выше. В способе диагностики по настоящему изобретению детектируемый конъюгат по настоящему изобретению предпочтительно вводят путем локальной внутримышечной инъекции в целевую ткань, подкожной инъекции или похожим образом. В способе диагностики по настоящему изобретению, в случае предоперационного введения конъюгата по настоящему изобретению, конъюгат вводят пациенту, например, от 2 до 48 часов, от 6 до 24 часов в определенном варианте осуществления и за 2 часа перед операцией в другом варианте осуществления.
В альтернативном варианте осуществления настоящее изобретение также относится к применению Fab-фрагмента антитела против MUC1 человека по настоящему изобретению для получения конъюгата по настоящему изобретению. В определенном варианте осуществления настоящее изобретение также относится к применению Fab-фрагмента антитела против MUC1 человека по настоящему изобретению для получения композиции для диагностики, содержащей конъюгат по настоящему изобретению.
Что касается варианта осуществления, в котором предоставляется композиция для диагностики по настоящему изобретению, содержащая радиоизотоп металла, то она может быть помечена радиоизотопом металла непосредственно перед использованием или может быть предоставлена в виде композиции для диагностики, содержащей радиоизотоп металла.
Композиция для лечения и способ лечения
Настоящее изобретение включает фармацевтическую композицию, содержащую один или более конъюгатов по настоящему изобретению и фармацевтически приемлемое вспомогательное вещество. Конкретно, композиция для лечения по настоящему изобретению может содержать один конъюгат по настоящему изобретению или может содержать два или более конъюгатов по настоящему изобретению в комбинации. Конъюгат по настоящему изобретению можно использовать при получении фармацевтической композиции способом, обычно используемым с использованием вспомогательного вещества, обычно используемого в данной области, то есть фармацевтического вспомогательного вещества, фармацевтического носителя или тому подобного. Примеры лекарственных форм этих фармацевтических композиций включают парентеральные агенты, такие как инъекции, и агенты для капельной инфузии. Введение может быть выполнено путем внутривенной инъекции, подкожной инъекции, интравезикального введения или тому подобного. Для состава вспомогательное вещество, носитель, добавка или тому подобное, подходящие для этих лекарственных форм, могут быть использованы в фармацевтически приемлемом диапазоне.
Количество конъюгата по настоящему изобретению, добавляемое к описанной выше композиции, различается в зависимости от степени симптомов или возраста пациента, используемой лекарственной формы или титра связывания Fab-фрагмента и т.д. Например, приблизительно от 0,001 до 100 мг/кг в расчете на массу Fab-фрагмента можно использовать на единицу массы тела пациента.
Фармацевтическую композицию, содержащую конъюгат по настоящему изобретению, можно использовать для лечения злокачественного новообразования. Предполагается, что злокачественное новообразование, которое можно подвергать лечению фармацевтической композицией, содержащей конъюгат по настоящему изобретению, представляет собой злокачественное новообразование, клетки которого экспрессируют MUC1 человека. Его примеры включают рак молочной железы, рак легких, колоректальный рак, рак мочевого пузыря, рак кожи, рак щитовидной железы, рак желудка, рак поджелудочной железы, рак почки, рак яичника и рак шейки матки.
Определенный вариант осуществления фармацевтической композиции, содержащей конъюгат по настоящему изобретению, представляет собой фармацевтическую композицию, содержащую конъюгат, содержащий флуоресцентный краситель, и его можно использовать при лечении злокачественного новообразования путем применения в методе фотоиммунотерапии. Метод фотоиммунотерапии представляет собой способ, позволяющий конъюгату, содержащему флуоресцентный краситель, специфически накапливаться в опухолевых тканях с последующим облучением светом, длина волны которого возбуждает флуоресцентный краситель, содержащийся в конъюгате, для индукции гибели клеток опухолеспецифическим образом посредством фототоксического эффекта флуоресцентного красителя. В случае использования конъюгата по настоящему изобретению, содержащего флуоресцентный краситель, в способе фотоиммунотерапии, длина волны света для облучения может быть длиной волны, близкой к инфракрасной (от 650 до 1000 нм).
Настоящее изобретение включает фармацевтическую композицию для лечения рака молочной железы или рака мочевого пузыря, содержащую конъюгат по настоящему изобретению. Настоящее изобретение также включает способ лечения рака молочной железы или рака мочевого пузыря, включающий стадию введения терапевтически эффективного количества конъюгата по настоящему изобретению, который может включать выполнение стадии облучения светом с длиной волны, близкой к инфракрасному излучению (от 650 до 1000 нм, например, от 660 до 740 нм, например, 680 нм), в дополнение к описанной выше стадии. В определенном варианте осуществления доза облучения светом составляет, по меньшей мере, 1 Дж/см2. Определенный вариант осуществления составляет по меньшей мере 10 Дж/см2. Определенный вариант осуществления составляет по меньшей мере 100 Дж/см2. Определенный вариант осуществления составляет от 1 до 500 Дж/см2. Определенный вариант осуществления составляет от 50 до 200 Дж/см2. В определенном варианте осуществления облучение может проводиться множество раз после введения конъюгата по настоящему изобретению. Настоящее изобретение также включает способ индукции гибели опухолевых клеток рака молочной железы или рака мочевого пузыря, включающий стадию введения терапевтически эффективного количества конъюгата по настоящему изобретению.
Фармацевтическая композиция для лечения злокачественного новообразования также может быть использована для диагностики злокачественного новообразования. Например, фармацевтическая композиция для лечения рака молочной железы или рака мочевого пузыря также может быть использована для диагностики злокачественного новообразования.
Настоящее изобретение также включает конъюгат по настоящему изобретению для применения при лечении рака молочной железы или рака мочевого пузыря. Настоящее изобретение также включает применение конъюгата по настоящему изобретению для производства фармацевтической композиции для лечения рака молочной железы или рака мочевого пузыря.
В альтернативном варианте осуществления настоящее изобретение также относится к применению Fab-фрагмента антитела против MUC1 человека по настоящему изобретению для получения фармацевтической композиции, содержащей конъюгат по настоящему изобретению.
Настоящее изобретение в целом описано выше. Конкретные примеры будут предоставлены в настоящем описании для справки, чтобы получить дополнительное понимание. Однако они приведены в иллюстративных целях и не ограничивают настоящее изобретение.
ПРИМЕРЫ
(Пример 1: Получение Fab-фрагмента антитела против MUC1 человека)
Были получены два Fab-фрагмента против антитела MUC1 человека, обозначенные как P10-1 Fab и P10-2 Fab.
Аминокислотные последовательности вариабельных областей тяжелой цепи и вариабельных областей легкой цепи P10-1 Fab и P10-2 Fab были специально сконструированы как последовательности, которые, как ожидается, улучшают аффинность и не ослабляют аффинность даже путем связывания метящей части, используя молекулярную модель гуманизированного антитела, сконструированную в соответствии с публикацией (Proteins, 2014 Aug; 82 (8): 1624-35) после гуманизации антитела 1B2, которое представляет собой антитело мышиного происхождения против опухолеспецифического MUC1 человека, со ссылкой на метод, описанный в публикации (Front Biosci., 2008 Jan 1; 13: 1619-33).
Готовили GS-вектор pEE6.4 (Lonza Ltd.), содержащий вставку гена фрагмента тяжелой цепи, образованную путем присоединения гена, кодирующего сигнальную последовательность (MEWSWVFLFFLSVTTGVHS (SEQ ID NO: 13)), к 5'-области гена вариабельной области тяжелой цепи P10-1 Fab или P10-2 Fab и путем присоединения гена константной области Igγ1 человека (состоящей из нуклеотидной последовательности положений нуклеотидов с 355 по 669 SEQ ID NO: 1 или 3) к его 3'-области. Здесь, чтобы экспрессировать каждый Fab-фрагмент, в 3'-область относительно кодона Asp вставляли стоп-кодон в положении 221 на основании индекса EU согласно Kabat et al. (соответствует Asp в положении 222 в аминокислотных последовательностях SEQ ID NO: 2 и 4, упомянутых позже) в гене константной области тяжелой цепи. Также готовили GS-вектор pEE12.4 (Lonza Ltd.), содержащий вставку гена легкой цепи, образованную путем соединения гена, кодирующего сигнальную последовательность (MSVPTQVLGLLLLWLTDARC (SEQ ID NO: 14)), с 5'-областью общей вариабельной области легкой цепи гена P10-1 Fab и P10-2 Fab, и соединения гена константной области κ-цепи человека (состоящий из нуклеотидной последовательности от положения нуклеотида 340 до 660 в SEQ ID NO: 5) с его 3'-областью.
Экспрессию каждого Fab-фрагмента осуществляли методом транзиторной экспрессии. Клетки Expi293F (Thermo Fisher Scientific Inc.), культивированные до приблизительно 2500000 клеток/мл в среде экспрессии Expi293 (Thermo Fisher Scientific Inc.), трансфецировали векторами GS фрагмента тяжелой цепи и легкой цепи, упомянутых выше, с использованием набора для трансфекции ExpiFectamine 293 (Thermo Fisher Scientific Inc.) и культивировали в течение 8 дней. После экспрессии культуральный супернатант очищали с использованием KappaSelect (GE Healthcare Japan Corp.) для получения каждого Fab-фрагмента.
Нуклеотидная последовательность фрагмента тяжелой цепи P10-1 Fab показана в SEQ ID NO: 1, а кодированная аминокислотная последовательность представлена в SEQ ID NO: 2. Нуклеотидная последовательность вариабельной области тяжелой цепи P10-1 Fab показана в SEQ ID NO: 7. Аминокислотная последовательность, кодируемая таким образом, представлена в SEQ ID NO: 8.
Нуклеотидная последовательность фрагмента тяжелой цепи P10-2 Fab представлена в SEQ ID NO: 3. Аминокислотная последовательность, кодируемая таким образом, представлена в SEQ ID NO: 4. Нуклеотидная последовательность вариабельной области тяжелой цепи P10-2 Fab представлена в SEQ ID NO: 9. Аминокислотная последовательность, кодируемая таким образом, представлена в SEQ ID NO: 10.
Легкая цепь является общей для P10-1 Fab и P10-2 Fab. Их нуклеотидная последовательность представлена в SEQ ID NO: 5. Аминокислотная последовательность, кодируемая таким образом, представлена в SEQ ID NO: 6. Нуклеотидная последовательность вариабельной области легкой цепи P10-1 Fab и P10-2 Fab представлена в SEQ ID NO: 11. Аминокислотная последовательность, кодируемая таким образом, представлена в SEQ ID NO: 12.
(Пример 2: Анализ модификации аминокислот Fab-фрагмента)
В результате анализа аминокислотной модификации очищенного P10-2 Fab предположили, что N-концевой глутамин тяжелой цепи был модифицирован в пироглутаминовую кислоту в подавляющем большинстве очищенных антител.
(Пример 3: Оценка активности связывания Fab-фрагмента)
Активность связывания в отношении опухолеспецифического MUC1 человека сравнивали как для P10-1 Fab, так и для P10-2 Fab, экспрессируемых указанным выше способом, с фрагментом Fab химерного антитела 1B2 (далее называемого 1B2 Fab; полученного путем связывания CH1-домена человеческого IgG1 и CL домена κ-цепи с доменом VH и доменом VL (информация о последовательности взята из патентной литературы 1), соответственно, из 1B2 антител (патентная литература 1), для удобства связывания домена CH1 и домена CL остаток аланина в положении 113 на основе индекса EU (Kabat et al.) в домене VH заменяли остатком серина, а остаток аланина в положении 109 на основе индекса EU (Kabat et al.) в домене VL заменяли остатком треонина с помощью клеточного ИФА. В частности, клетки клеточной линии рака молочной железы T-47D (приобретаемые у ATCC; HTB-133), экспрессирующие опухолеспецифический MUC1 человека, инокулировали при 0,75×104 клеток на лунку в 96-луночный планшет для ИФА, покрытый коллагеном I, и культивировали в течение ночи. Затем клетки фиксировали в формалине, и P10-1 Fab, P10-2 Fab или 1B2 Fab, описанные выше, реагировали с ними. Затем, в реакцию вводили меченое пероксидазой хрена (HRP) козье антитело против человеческого Igκ (Southern Biotechnology Associates, Inc.) в качестве вторичного антитела. Реагент ECL Prime Western Blotting Detection (GE Healthcare Japan Corp.) добавляли туда для люминесценции и исследовали степень люминесценции. В результате, как показано на Фиг.1, было подтверждено, что P10-1 Fab и P10-2 Fab обладают приблизительно в 10 или более раз более высокой активностью связывания в отношении опухолеспецифического MUC1 человека по сравнению с 1B2 Fab.
(Пример 4: флуоресцентное мечение Fab-фрагмента)
Впоследствии авторы настоящего изобретения метили P10-1 Fab, P10-2 Fab и 1B2 Fab флуоресцентным красителем, упомянутым выше.
В частности, каждый раствор Fab-фрагмента, доведенный приблизительно до 1 мг/мл фосфатно-солевым буферным раствором (рН 7,4), доводили до рН 8,5 путем добавления 1/10 количества 1 М раствора гидрофосфата дикалия (рН 9). К нему добавляли сложный эфир IRDye800CW NHS (LI-COR Bioscience, Inc.) в конечной концентрации 310,8 мкг/мл, и полученную смесь перемешивали при комнатной температуре при затенении в течение 2 часов. Сложный эфир IRDye800CW NHS имеет N-гидроксисукцинимидную группу и поэтому немедленно реагирует с Lys Fab-фрагмента. Его извлекали через центрифужный фильтр Amicon Ultra 3K-0,5 мл (Merck Millipore) для очистки флуоресцентно меченного Fab-фрагмента. P10-1 Fab, P10-2 Fab и 1B2 Fab, несущие этот флуоресцентный краситель, были обозначены как P10-1 Fab Dye, P10-2 Fab Dye и 1B2 Fab Dye.
(Пример 5: Оценка активности связывания флуоресцентно меченного Fab-фрагмента)
Активность связывания в отношении опухолеспецифического MUC1 человека сравнивали в отношении P10-1 Fab Dye и P10-2 Fab Dye, меченных по методу, указанному выше, с 1B2 Fab Dye с помощью клеточного ИФА. В частности, клетки клеточной линии рака молочной железы T-47D, экспрессирующие опухолеспецифический MUC1 человека, инокулировали при 0,75×104 клеток на лунку в 96-луночный планшет для ИФА, покрытый коллагеном I, и культивировали в течение ночи. Затем клетки фиксировали в формалине, и P10-1 Fab Dye, P10-2 Fab Dye или 1B2 Fab Dye, описанные выше, реагировали с ними. Затем HRP-меченое козье антитело против человеческого Igκ (Southern Biotechnology Associates, Inc.) вступало в реакцию в качестве вторичного антитела. Реагент ECL Prime Western Blotting Detection (GE Healthcare Japan Corp.) добавляли туда для люминесценции и исследовали степень люминесценции. В результате, как показано на Фиг.2, активность связывания 1B2 Fab Dye ослаблялась мечением, тогда как было подтверждено, что активности связывания P10-1 Fab Dye и P10-2 Fab Dye не ослабевали из-за мечения.
(Пример 6: Мечение Fab-фрагмента хелатирующим агентом)
Затем авторы настоящего изобретения метили P10-2 Fab хелатирующим агентом, упомянутым выше.
В частности, раствор Fab-фрагмента, доведенный до 12,5 мг/мл фосфатно-солевым буферным раствором (рН 7,4), доводили до рН 9 путем добавления 100 М раствора карбоната натрия при 10 мМ. п-SCN-Bn-Дефероксамин (Macrocyclics, Inc.) добавляли до конечной концентрации 1 мМ, и полученная смесь реагировала при 37°С в течение 2 часов. p-SCN-Bn-дефероксамин имеет изотиоцианатную группу и поэтому немедленно реагирует с Lys Fab-фрагмента. Его извлекали через центрифужный фильтр Amicon Ultra 10K-0,5 мл для очистки меченного хелатирующим агентом Fab-фрагмента. Этот меченый хелатирующим агентом P10-2 Fab обозначали как P10-2 Fab DFO.
(Пример 7: Оценка активности связывания меченного хелатирующим агентом Fab-фрагмента)
Активность связывания в отношении опухолеспецифического MUC1 человека сравнивали как с P10-2 Fab DFO, меченным по методу, указанному выше, с P10-2 Fab с помощью клеточного ИФА. В частности, клетки T-47D, экспрессирующие опухолеспецифический MUC1 человека, инокулировали при 0,75×104 клеток в 96-луночный планшет для ИФА, покрытый коллагеном I, и культивировали в течение ночи. Затем клетки фиксировали в формалине, и P10-2 Fab DFO или P10-2 Fab, описанные выше, реагировали с ними. Затем HRP-меченое козье антитело против человеческого Igκ (Southern Biotechnology Associates, Inc.) вступало в реакцию в качестве вторичного антитела. Реагент ECL Prime Western Blotting Detection (GE Healthcare Japan Corp.) добавляли туда для люминесценции и исследовали степень люминесценции. В результате, как показано на Фиг. 3, P10-2 Fab DFO и P10-2 Fab имели эквивалентную активность связывания. Подтверждено, что активность связывания P10-2 Fab не ослабевала из-за мечения хелатирующим агентом.
(Пример 8: Реактивность Р10-2 в образце ткани рака мочевого пузыря человека)
Чтобы изучить реактивность P10-2 Fab при раке мочевого пузыря человека, исследование было проведено путем иммуноокрашивания с использованием тканевого эррея рака мочевого пузыря человека (US Biomax, Inc., BC12011b). Когда P10-2 Fab используется в качестве первичного антитела, антитело против Ig человека, используемое в качестве вторичного антитела, перекрестно реагирует с тканями человека. Таким образом, готовили и использовали в качестве первичного антитела мышиный химерный P10-2 IgG (антитело, в котором домен VH и домен VL из P10-2 Fab были слиты с мышиными доменами IgG2a CH1-CH3 и доменом CL мышиной κ-цепи, соответственно). Образец тканевого эррея рака мочевого пузыря человека подвергали взаимодействию с 3%-ным раствором перекиси водорода в течение 5 минут и затем промывали фосфатно-солевым буферным раствором с pH 7,4. Затем, реагировал мышиный химерный P10-2 IgG (0,25 мкг/мл), а затем реагировало One-Step Polymer-HRP антитело (BioGenex) в качестве вторичного антитела. Сверхчувствительный DAB (BioGenex) добавляли туда для проявки цвета. Положительная реакция окрашивания на опухолевые ткани была определена как±: очень умеренно положительная, +: положительная, ++: умеренно положительная и +++: высоко положительная, и был исключен один случай, когда опухолевые ткани были неясными. В результате положительная реакция была обнаружена в 57 из 59 исследованных случаев: 11 случаев для±, 24 случая для +, 17 случаев для ++ и 5 для +++ (положительный показатель: 97%).
(Пример 9: Мечение хелатированного Fab-фрагмента с помощью 89Zr)
Используемый 89Zr растворяли в 1 М водном растворе щавелевой кислоты и получали в виде 89Zr-оксалата (Университет Окаяма). 20 мкл 89Zr-оксалата (21,4 МБк) нейтрализовали 10 мкл 2 М водного раствора карбоната натрия. Затем к нему добавляли 70 мкл 5 мг/мл раствора гентизиновой кислоты, растворенной в 250 мМ водного раствора ацетата натрия. Кроме того, туда добавляли 200 мкл 500 мМ водного раствора HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты), содержащего 0,1% полисорбата 80 и 20% глицерина. К этому раствору, содержащему 89Zr, добавляли 100 мкл 9,5 мг/мл P10-2 Fab DFO и проводили реакцию при комнатной температуре в течение 30 минут. Полученную реакционную смесь очищали с помощью центрифужного фильтра Amicon Ultra 10K-0,5 мл (Merck Millipore) и затем фильтровали через мембранный фильтр (Millex-GV 0,22 мкм 13 мм, Merck Millipore), чтобы получить интересующий 89Zr-меченый P10-2 Fab DFO (16,1 МБк). Этот меченный 89Zr P10-2 Fab DFO обозначали как P10-2 Fab DFO 89Zr. Полученный раствор P10-2 Fab DFO 89Zr анализировали с помощью высокоэффективной жидкостной хроматографии (серия 20AD; Shimadzu Corp.). Время удерживания (УФ: 10,192 мин) P10-2 Fab DFO сравнивали с временем удерживания (УФ: 10,178 мин, RI: 10,515 мин) P10-2 Fab DFO 89Zr. Соответствующие значения времени удерживания были эквивалентны, подтверждая, что P10-2 Fab DFO был помечен 89Zr. Анализ ВЭЖХ проводили в следующих условиях: колонка: BioSep SEC s3000 300×7,8 мм (Phenomenex Inc.), температура колонки: комнатная температура, длина волны УФ-детектора: 280 нм, подвижная фаза: фосфатный буферный раствор (Gibco, 10010- 023), скорость потока: 1 мл/мин.
(Пример 10: Мечение Fab-фрагмента с помощью IRDye700DX)
IRDye700DX NHS сложный эфир (LI-COR Bioscience, Inc.) использовали для мечения P10-2 Fab с помощью IRDye700DX.
В частности, в раствор P10-2 Fab, доведенный до 1 мг/мл фосфатно-буферным солевым раствором (рН 7,4), добавляли 1/10 количества 1 М раствора дикалий гидрофосфата (рН 9). К нему добавляли сложный эфир NHS IRDye700DX до конечной концентрации 154 мкг/мл, и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После реакции IRDye700DX-меченный P10-2 Fab очищали путем извлечения через центрифужный фильтр Amicon Ultra 10K-15 мл (Merck Millipore). Этот IRDye700DX-меченый P10-2 Fab обозначали как P10-2 Fab IR700.
(Пример 11: Оценка активности связывания Fab-фрагмента в отношении клеток клеточной линии рака молочной железы и клеток клеточной линии рака мочевого пузыря)
Изучали активность связывания P10-2 Fab при раке молочной железы человека и раке мочевого пузыря.
В частности, клетки клеточной линии MDA-MB-468 рака молочной железы человека (приобретаемые у ATCC; HTB-132; далее обозначенные клетками MM-468) или клетки клеточной линии 647-V рака мочевого пузыря человека (приобретаемые у DSMZ; ACC 414), экспрессирующие опухолеспецифический MUC1 человека, инокулировали по 1×104 клеток на лунку в 96-луночный планшет для ИФА и культивировали в течение ночи. Затем P10-2 Fab, описанный выше, реагировал в концентрации от 0,0000003 до 0,001 мг/мл. Затем козье антитело против человеческого IgG, меченное пероксидазой хрена (HRP), (Medical & Biological Laboratories Co., Ltd.), реагировало как вторичное антитело. Реагент ECL Prime Western Blotting Detection (GE Healthcare Japan Corp.) добавляли туда для люминесценции и исследовали степень люминесценции. В результате, как показано на Фиг.4, было обнаружено, что P10-2 Fab обладает активностью связывания в отношении клеток клеточной линии MM-468 рака молочной железы человека и клеток клеточной линии 647-V рака мочевого пузыря человека.
(Пример 12. Оценка контрастности флуоресцентно меченного Fab-фрагмента в модели подкожно-введенной опухоли)
3×106 клеток клеточной линии ММ-468 рака молочной железы человека подкожно трансплантировали в качестве клеток, положительных по опухолеспецифическому MUC1 человека, в правый бок каждой иммунодефицитной мыши (SCID мыши, Charles River Laboratories Japan, Inc.). Мышей с развитием опухоли отбирали примерно через месяц после трансплантации. P10-2 Fab Dye, растворенный в фосфатно-солевом буфере (pH 7,4), вводили внутривенно в дозе 0,1, 0,3, 1 или 3 мг/кг (N=2 для группы введения 0,1 мг/кг и N=3 для группы введения 0,3, 1 и 3 мг/кг). Снимки делали с помощью обычной камеры и флуоресцентной камеры ближнего инфракрасного диапазона (Fluobeam (фильтр 800 нм); Fluoptics) через 6 часов и 24 часа после введения P10-2 Fab Dye. Измеряли флуоресцентную яркость участка опухоли и перитуморального фона на изображении, полученном с помощью инфракрасной флуоресцентной камеры. В результате, как показано на фиг. 5А, было обнаружено, что P10-2 Fab Dye накапливается в участке опухоли MM-468, положительной по опухолеспецифическому MUC1 человека, и хорошо виден на флуоресцентном изображении через 6 часов после введения. Как показано на Фиг.5В, было обнаружено, что отношение опухоль/фон повышается дозозависимым образом в зависимости от дозы P10-2 Fab Dye в диапазоне от 0,1 до 3 мг/кг. Было также очевидно, что эффект сохранялся даже через 24 часа после введения. Эти результаты продемонстрировали, что P10-2 Fab Dye позволяет детектировать положительные по MUC1 человека опухолевые клетки через 6-24 часа после введения.
(Пример 13: Детектирование опухоли с помощью меченного IRDye700DX Fab-фрагмента)
5×106 клеток MM-468 трансплантировали подкожно в правый бок каждой иммунодефицитной мыши (голые мыши; Charles River Laboratories Japan, Inc.). Этот тест проводили при N=2. P10-2 Fab IR700 (3 мг/кг) или носитель (физиологический раствор с фосфатным буфером) вводили внутривенно через 40 дней после трансплантации. Животных умерщвляли через 2 часа после введения P10-2 Fab IR700. Опухоль иссекали и люминесценцию участков опухоли измеряли путем возбуждения при длине волны 675 нм и детектирования при длине волны 740 нм в IVIS SPECTRUM (PerkinElmer, Inc.). В результате, как показано на Фиг.6, было обнаружено, что P10-2 Fab IR700 накапливается в клетках MM-468 через 2 часа после введения.
(Пример 14: Оценка цитотоксичности меченного IRDye700DX Fab-фрагмента)
Чтобы изучить использование P10-2 Fab IR700 в лечении злокачественного новообразования, оценивали цитотоксичность при фотоиммунотерапии.
В частности, клетки клеточной линии MM-468 рака молочной железы человека, клетки клеточной линии 647-V рака мочевого пузыря человека или клетки CHO-K1 сравнительного примера (приобретаемые у ATCC; CCL-61) инокулировали по 5×103 клеток на лунку в 384-луночноый белый планшет и культивировали в течение ночи. Затем P10-2 Fab IR700 реагировал при 0, 0,01, 0,1, 1 или мкг/мл, и затем проводили облучение светом с длиной волны 680 нм от 0 до 30 Дж/см2. После облучения светом проводили ночное культивирование. CellTiter-Glo (Promega Corp.) добавляли туда для люминесценции и люминесценцию измеряли для измерения количества живых клеток. Этот тест проводили с использованием 3 лунок на каждое условие. В результате, как показано на Фиг.7, было очевидно, что P10-2 Fab IR700 проявляет цитотоксичность способом, специфичным для экспрессии опухолеспецифического MUC1 человека при облучении светом.
(Пример 15: Оценка противоопухолевой активности меченного IRDye700DX Fab-фрагмента)
5×106 клеток MM-468 трансплантировали подкожно в правый бок каждой иммунодефицитной мыши (голые мыши; Charles River Laboratories Japan, Inc.). Этот тест проводили при N=4. После того как объем опухоли достигал 300 мм3, внутривенно вводили P10-2 Fab IR700 (0,3, 1 или 3 мг/кг) в дни 1, 5, 8, 12 и 15. Фосфатно-буферный солевой раствор аналогичным образом вводили группе введения носителя. На следующий день после введения лекарственного средства проводили облучение светом 0 или 200 Дж/см2 с длиной волны 680 нм и измеряли объем опухоли во времени. В результате, как показано на Фиг.8, было очевидно, что P10-2 Fab IR700 проявлял противоопухолевый эффект в зависимости от дозы и светового излучения.
Промышленная применимость
Ожидается, что Fab-фрагмент антитела против MUC1 человека по настоящему изобретению будет полезен при диагностике и/или лечении злокачественного новообразования, такого как рак молочной железы, рак легкого, колоректальный рак, рак мочевого пузыря, рак кожи, рак щитовидной железы, рак желудка, рак поджелудочной железы, рак почки, рак яичника или рак шейки матки.
Список последовательностей в свободной форме
SEQ ID NO: 1: нуклеотидная последовательность ДНК, кодирующая фрагмент тяжелой цепи P10-1 Fab
SEQ ID NO: 2: аминокислотная последовательность фрагмента тяжелой цепи P10-1 Fab
SEQ ID NO: 3: нуклеотидная последовательность ДНК, кодирующая фрагмент тяжелой цепи P10-2 Fab
SEQ ID NO: 4: аминокислотная последовательность фрагмента тяжелой цепи P10-2 Fab
SEQ ID NO: 5: нуклеотидная последовательность ДНК, кодирующая легкую цепь антитела
SEQ ID NO: 6: аминокислотная последовательность легкой цепи антитела
SEQ ID NO: 7: нуклеотидная последовательность ДНК, кодирующая вариабельную область тяжелой цепи P10-1 Fab
SEQ ID NO: 8: аминокислотная последовательность вариабельной области тяжелой цепи P10-1 Fab
SEQ ID NO: 9: нуклеотидная последовательность ДНК, кодирующая вариабельную область тяжелой цепи P10-2 Fab
SEQ ID NO: 10: аминокислотная последовательность вариабельной области тяжелой цепи P10-2 Fab
SEQ ID NO: 11: нуклеотидная последовательность ДНК, кодирующая вариабельную область легкой цепи антитела
SEQ ID NO: 12: аминокислотная последовательность вариабельной области легкой цепи антитела
SEQ ID NO: 13: сигнальная последовательность тяжелой цепи
SEQ ID NO: 14: сигнальная последовательность легкой цепи
SEQ ID NO: 15: последовательность тандемных повторов внеклеточного домена MUC1.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Astellas Pharma Inc.
<120> НОВЫЙ FAB-ФРАГМЕНТ АНТИТЕЛА ПРОТИВ MUC1 ЧЕЛОВЕКА
<130> A17011A00
<150> JP2016-224811
<151> 2016-11-18
<160> 15
<170> PatentIn version 3.5
<210> 1
<211> 669
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК, кодирующая фрагмент тяжелой цепи P10-1 Fab
<400> 1
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac caggcgccag cgtgaaggtg 60
tcctgcaagg ccagcggcta caccttcacc aactacggcc tgagctgggt gcgccaggct 120
cctggacagg gactggaatg gatgggcgag aaccaccctg gcagcggcat catctaccac 180
aacgagaagt tccggggcag agtgaccctg accgccgacc ggagcaccag caccgcctac 240
atggaactga gcagcctgcg gagcgaggac accgccgtgt actactgtgc cagaagcagc 300
ggcaccagag gctttgccta ttggggacag ggcaccctcg tgaccgtgtc ctcagcctcc 360
accaagggcc catcggtctt ccccctggca ccctcctcca agagcacctc tgggggcaca 420
gcggccctgg gctgcctggt caaggactac ttccccgaac cggtgacggt gtcgtggaac 480
tcaggcgccc tgaccagcgg cgtgcacacc ttcccggctg tcctacagtc ctcaggactc 540
tactccctta gtagcgtggt gaccgtgccc tccagcagct tgggcaccca gacctacatc 600
tgcaacgtga atcacaagcc cagcaacacc aaggtggaca agaaagttga gcccaaatct 660
tgtgactga 669
<210> 2
<211> 222
<212> PRT
<213> Искусственная последовательность
<220>
<223> фрагмент тяжелой цепи P10-1 Fab
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Asn His Pro Gly Ser Gly Ile Ile Tyr His Asn Glu Lys Phe
50 55 60
Arg Gly Arg Val Thr Leu Thr Ala Asp Arg Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Ser Gly Thr Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
<210> 3
<211> 669
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК, кодирующая фрагмент тяжелой цепи P10-2 Fab
<400> 3
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac caggcgccag cgtgaaggtg 60
tcctgcaagg ccagcggcta caccttcacc aactacggcc tgagctgggt gcgccaggct 120
cctggacagg gactggaatg gatgggcgag aaccaccctg gcagcggcat catctaccac 180
aacgagaagt tccggggcag agtgaccctg accgccgacc ggagcaccag caccgcctac 240
atggaactga gcagcctgcg gagcgaggac accgccgtgt actactgtgc cagaagcagc 300
ggcaccagag gctttgacta ttggggacag ggcaccctcg tgaccgtgtc ctcagcctcc 360
accaagggcc catcggtctt ccccctggca ccctcctcca agagcacctc tgggggcaca 420
gcggccctgg gctgcctggt caaggactac ttccccgaac cggtgacggt gtcgtggaac 480
tcaggcgccc tgaccagcgg cgtgcacacc ttcccggctg tcctacagtc ctcaggactc 540
tactccctta gtagcgtggt gaccgtgccc tccagcagct tgggcaccca gacctacatc 600
tgcaacgtga atcacaagcc cagcaacacc aaggtggaca agaaagttga gcccaaatct 660
tgtgactga 669
<210> 4
<211> 222
<212> PRT
<213> Искусственная последовательность
<220>
<223> Фрагмент тяжелой цепи P10-2 Fab
<400> 4
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Asn His Pro Gly Ser Gly Ile Ile Tyr His Asn Glu Lys Phe
50 55 60
Arg Gly Arg Val Thr Leu Thr Ala Asp Arg Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Ser Gly Thr Arg Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
<210> 5
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК, кодирующая легкую цепь антитела
<400> 5
gacgtcgtga tgacccagac ccctctgagc ctgagcgtga cacctggaca gcctgccagc 60
atcagctgca gatccagcca gagcatcgtg cacagcaacg gcaacaccta cctggaatgg 120
tatctgcaga agcccggcca gagcccccag ctgctgatct acagggtgtc caaccggttc 180
agcggcgtgc ccgacagatt ttctggcagc ggctccggca ccgacttcac cctgaagatc 240
tcccgggtgg aagccgagga cgtgggcgtg tactactgtt ttcaaggcag ccacggcccc 300
tggacctttg gccagggaac aaagctggaa atcaagcgta cggtggctgc accatctgtc 360
ttcatcttcc cgccatctga tgagcagttg aaatctggaa ctgcctctgt tgtgtgcctg 420
ctgaataact tctatcccag agaggccaaa gtacagtgga aggtggataa cgccctccaa 480
tcgggtaact cccaggagag tgtcacagag caggacagca aggacagcac ctacagcctg 540
agcagcaccc tgacgctgag caaagcagac tacgagaaac acaaagtcta cgcctgcgaa 600
gtcacccatc agggcctgag ctcgcccgtc acaaagagct tcaacagggg agagtgttag 660
<210> 6
<211> 219
<212> PRT
<213> Искусственная последовательность
<220>
<223> Легкая цепь антитела
<400> 6
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Gly Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 7
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК, кодирующая вариабельную область тяжелой цепи P10-1 Fab
<400> 7
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac caggcgccag cgtgaaggtg 60
tcctgcaagg ccagcggcta caccttcacc aactacggcc tgagctgggt gcgccaggct 120
cctggacagg gactggaatg gatgggcgag aaccaccctg gcagcggcat catctaccac 180
aacgagaagt tccggggcag agtgaccctg accgccgacc ggagcaccag caccgcctac 240
atggaactga gcagcctgcg gagcgaggac accgccgtgt actactgtgc cagaagcagc 300
ggcaccagag gctttgccta ttggggacag ggcaccctcg tgaccgtgtc ctca 354
<210> 8
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи P10-1 Fab
<400> 8
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Asn His Pro Gly Ser Gly Ile Ile Tyr His Asn Glu Lys Phe
50 55 60
Arg Gly Arg Val Thr Leu Thr Ala Asp Arg Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Ser Gly Thr Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 9
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК, кодирующая вариабельную область тяжелой цепи P10-2 Fab
<400> 9
caggtgcagc tggtgcagtc tggcgccgaa gtgaagaaac caggcgccag cgtgaaggtg 60
tcctgcaagg ccagcggcta caccttcacc aactacggcc tgagctgggt gcgccaggct 120
cctggacagg gactggaatg gatgggcgag aaccaccctg gcagcggcat catctaccac 180
aacgagaagt tccggggcag agtgaccctg accgccgacc ggagcaccag caccgcctac 240
atggaactga gcagcctgcg gagcgaggac accgccgtgt actactgtgc cagaagcagc 300
ggcaccagag gctttgacta ttggggacag ggcaccctcg tgaccgtgtc ctca 354
<210> 10
<211> 118
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи P10-2 Fab
<400> 10
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Leu Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Asn His Pro Gly Ser Gly Ile Ile Tyr His Asn Glu Lys Phe
50 55 60
Arg Gly Arg Val Thr Leu Thr Ala Asp Arg Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Ser Gly Thr Arg Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 11
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК, кодирующая вариабельную область легкой цепи антитела
<400> 11
gacgtcgtga tgacccagac ccctctgagc ctgagcgtga cacctggaca gcctgccagc 60
atcagctgca gatccagcca gagcatcgtg cacagcaacg gcaacaccta cctggaatgg 120
tatctgcaga agcccggcca gagcccccag ctgctgatct acagggtgtc caaccggttc 180
agcggcgtgc ccgacagatt ttctggcagc ggctccggca ccgacttcac cctgaagatc 240
tcccgggtgg aagccgagga cgtgggcgtg tactactgtt ttcaaggcag ccacggcccc 300
tggacctttg gccagggaac aaagctggaa atcaagcgt 339
<210> 12
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи антитела
<400> 12
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Gly Pro Trp Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 13
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Сигнальная последовательность тяжелой цепи
<400> 13
Met Glu Trp Ser Trp Val Phe Leu Phe Phe Leu Ser Val Thr Thr Gly
1 5 10 15
Val His Ser
<210> 14
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Сигнальная последовательность легкой цепи
<400> 14
Met Ser Val Pro Thr Gln Val Leu Gly Leu Leu Leu Leu Trp Leu Thr
1 5 10 15
Asp Ala Arg Cys
20
<210> 15
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность тандемного повтора внеклеточного домена MUC1
<400> 15
His Gly Val Thr Ser Ala Pro Asp Thr Arg Pro Ala Pro Gly Ser Thr
1 5 10 15
Ala Pro Pro Ala
20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКС, СОДЕРЖАЩИЙ Fab-ФРАГМЕНТ АНТИТЕЛА ПРОТИВ MUC1 ЧЕЛОВЕКА, ПЕПТИДНЫЙ ЛИНКЕР И/ИЛИ ЛИГАНД | 2019 |
|
RU2814073C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КОМПЛЕКС МАРКИРУЮЩИЙ САЙТ - FAB-ФРАГМЕНТ АНТИЧЕЛОВЕЧЕСКОГО АНТИТЕЛА | 2019 |
|
RU2800924C2 |
| КОНЪЮГАТ, ВКЛЮЧАЮЩИЙ ЛИГАНД, СПЕЙСЕР, ПЕПТИДНЫЙ ЛИНКЕР И БИОМОЛЕКУЛУ | 2020 |
|
RU2807081C2 |
| НОВЫЙ FAB-ФРАГМЕНТ АНТИТЕЛА ПРОТИВ CEACAM5 ЧЕЛОВЕКА | 2018 |
|
RU2779165C2 |
| АНТИТЕЛО ПРОТИВ MUC1 | 2019 |
|
RU2792347C2 |
| КОНЪЮГАТ АНТИТЕЛО ПРОТИВ MUC1-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2019 |
|
RU2804703C2 |
| НУКЛЕИНОВЫЕ КИСЛОТЫ, КОДИРУЮЩИЕ АНТИТЕЛА ПРОТИВ СИАЛИРОВАННОГО АНТИГЕНА ЛЬЮИСА ЧЕЛОВЕКА | 2014 |
|
RU2699289C2 |
| НУКЛЕИНОВЫЕ КИСЛОТЫ, КОДИРУЮЩИЕ АНТИТЕЛА ПРОТИВ СИАЛИРОВАННОГО АНТИГЕНА ЛЬЮИСА ЧЕЛОВЕКА | 2014 |
|
RU2791967C2 |
| АНТИ-CDH6-АНТИТЕЛО И КОНЪЮГАТ АНТИ-CDH6-АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2018 |
|
RU2798285C2 |
| АНТИТЕЛО, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕЕСЯ С MUC1, И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2746413C1 |
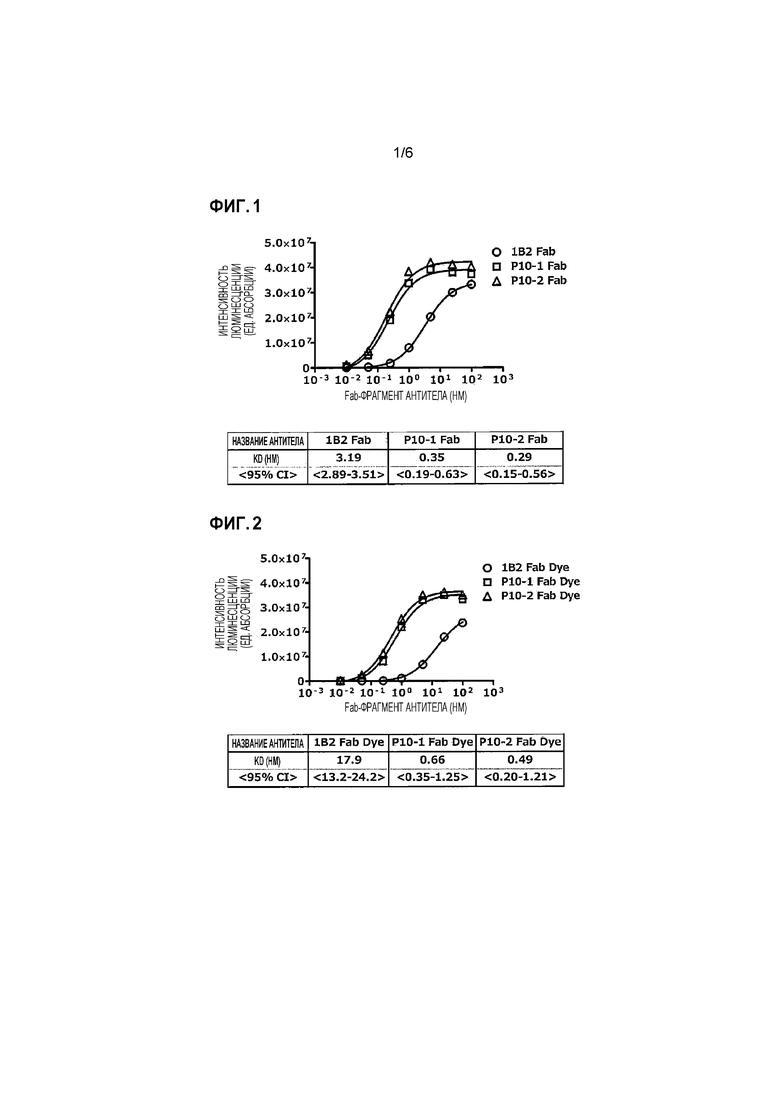
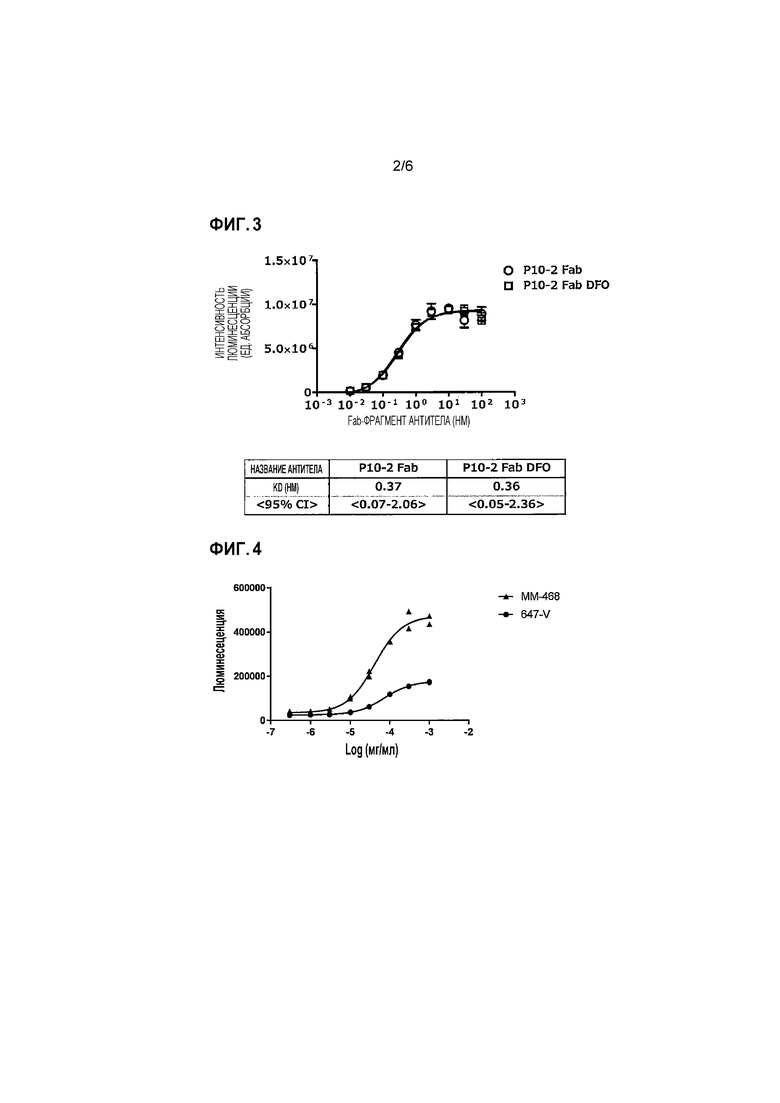
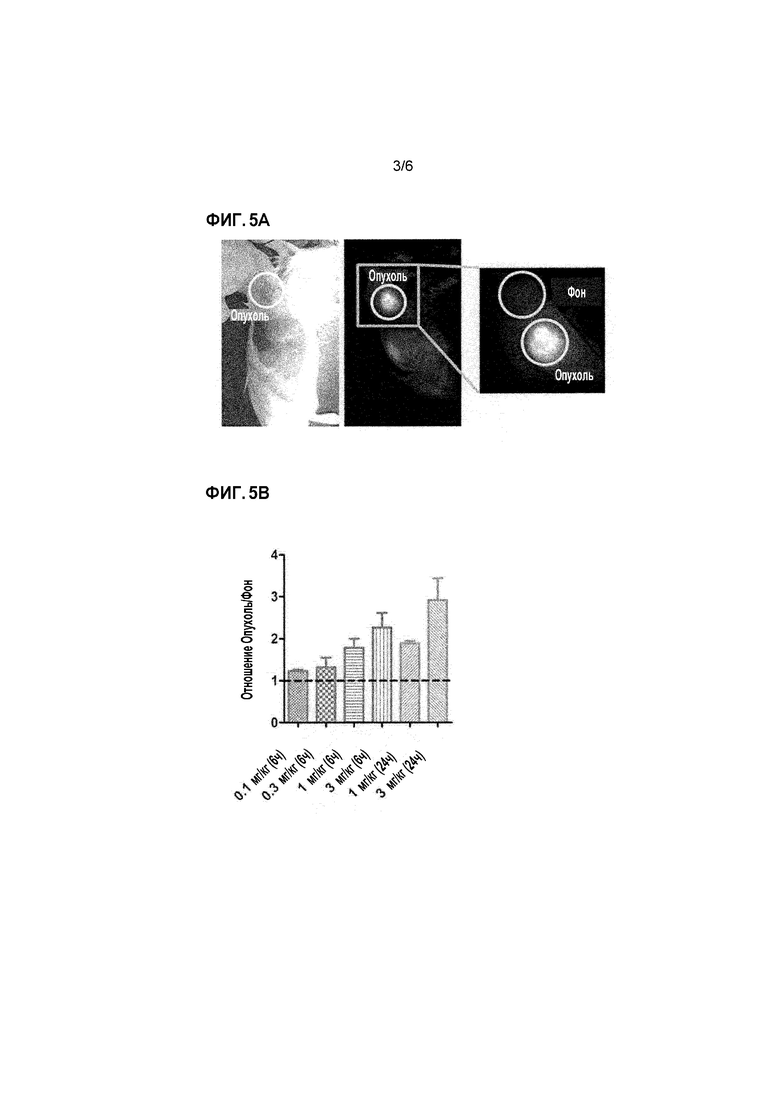
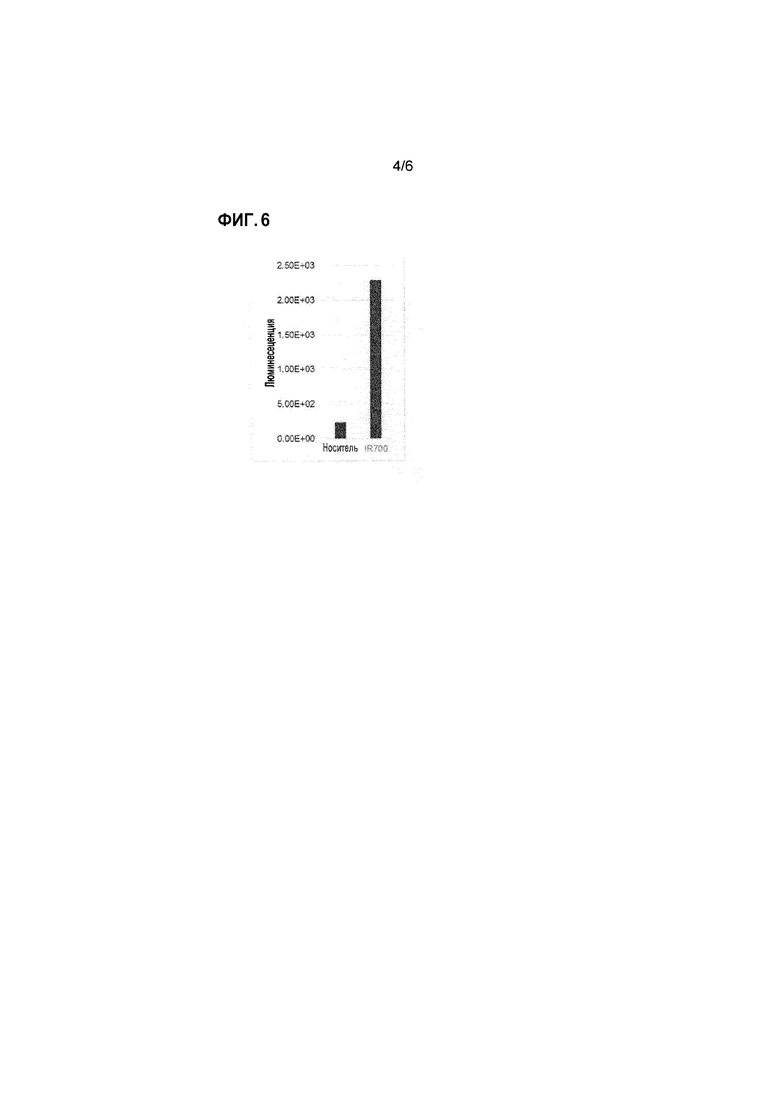
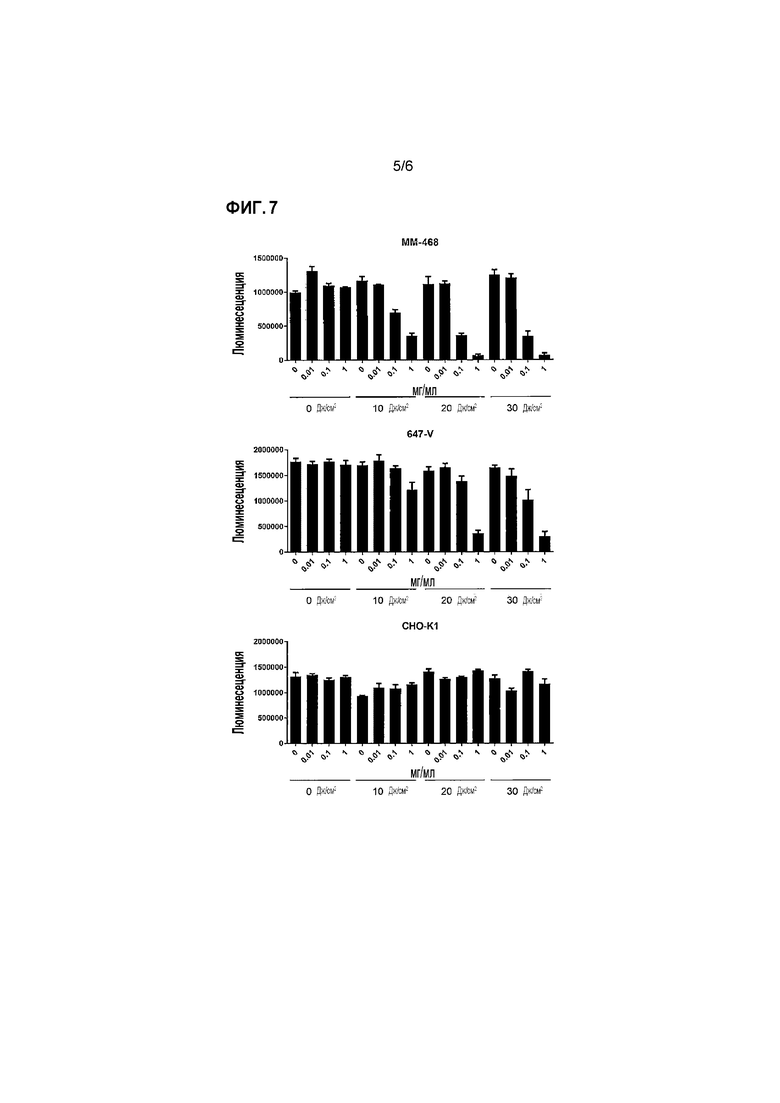
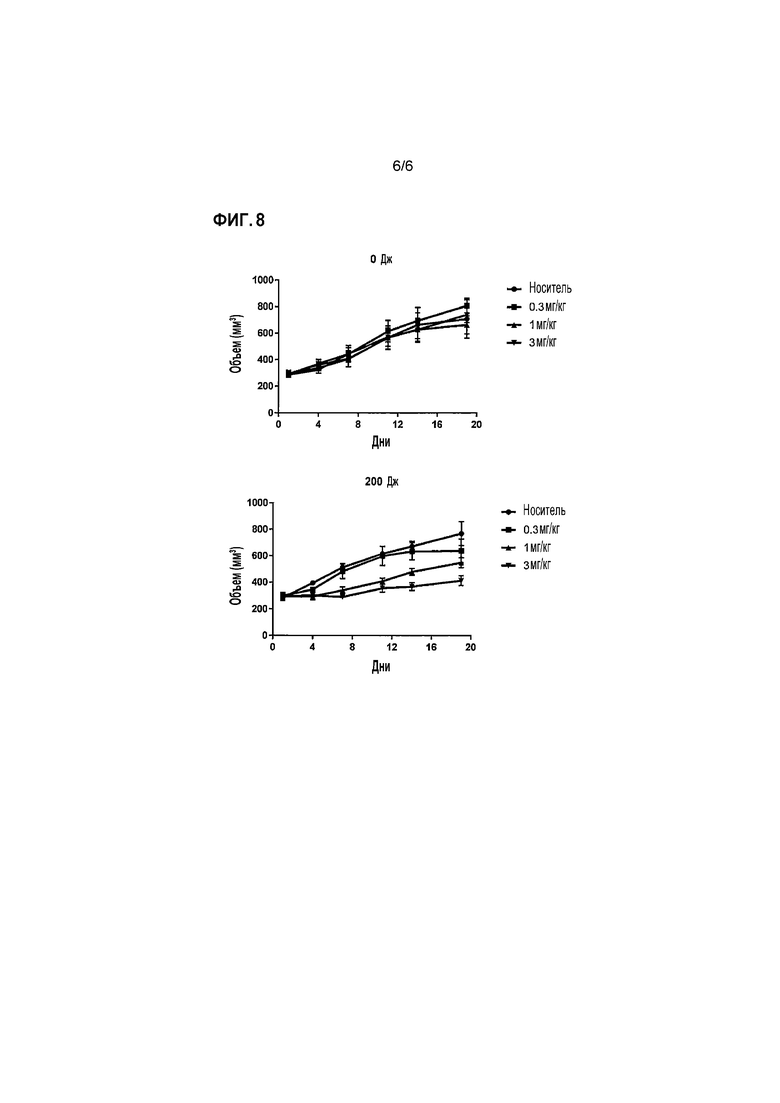
Изобретение относится к области биотехнологии. Предложен Fab-фрагмент антитела против MUC1 человека. Также предложены содержащие указанный Fab-фрагмент конъюгаты для связывания с MUC1 человека, экспрессируемым при раке. Конъюгаты применяются для диагностики и лечения злокачественных новообразований, таких, как рак молочной железы или рак мочевого пузыря. Кроме того, изобретение относится к полинуклеотидам, кодирующим Fab-фрагмент по изобретению, экспрессирующим векторам и клеткам-хозяевам для экспрессии Fab-фрагмента, а также к способам получения Fab-фрагментов и конъюгатов. Изобретение обеспечивает высокую активность связывания Fab-фрагмента антитела с опухолеспецифическим MUC1 человека, не ослабевающую при флуоресцентном мечении Fab-фрагмента и мечении его хелатирующим агентом. 25 н. и 30 з.п. ф-лы, 9 ил., 15 пр.
1. Fab-фрагмент антитела против MUC1 человека, выбранный из группы, состоящей из следующих (а) и (b):
(a) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 8 или SEQ ID NO: 10, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12; и
(b) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 8 или SEQ ID NO: 10, посредством модификации глутамина в положении аминокислоты 1 SEQ ID NO: 8 или SEQ ID NO: 10 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
2. Fab-фрагмент антитела против MUC1 человека по п.1, который выбран из группы, состоящей из следующих (а) и (b):
(a) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 2 или SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6; и
(b) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2 или SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 2 или SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
3. Fab-фрагмент антитела против MUC1 человека по п.1, который выбран из группы, состоящей из следующих (а) и (b):
(a) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 10, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12; и
(b) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, содержащий вариабельную область тяжелой цепи, полученную из вариабельной области тяжелой цепи, состоящей из аминокислотной последовательности, представленной SEQ ID NO: 10, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 10 в пироглутаминовую кислоту, и легкую цепь, содержащую вариабельную область легкой цепи, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 12.
4. Fab-фрагмент антитела против MUC1 человека по п.3, который выбран из группы, состоящей из следующих (а) и (b):
(a) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6; и
(b) Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
5. Fab-фрагмент антитела против MUC1 человека по п.4, который представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, состоящий из аминокислотной последовательности, представленной SEQ ID NO: 4, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
6. Fab-фрагмент антитела против MUC1 человека по п.4, который представляет собой Fab-фрагмент антитела против MUC1 человека, содержащий фрагмент тяжелой цепи, полученный из фрагмента тяжелой цепи, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 4, путем модификации глутамина в положении аминокислоты 1 SEQ ID NO: 4 в пироглутаминовую кислоту, и легкую цепь, состоящую из аминокислотной последовательности, представленной SEQ ID NO: 6.
7. Конъюгат для связывания с MUC1 человека, экспрессируемым при раке, содержащий от 1 до 27 метящих частей и Fab-фрагмент антитела против MUC1 человека по любому из пп. 1-6.
8. Конъюгат по п.7, отличающийся тем, что метящая часть представляет собой (i) лиганд и линкер, (ii) лиганд, (iii) флуоресцентный краситель и линкер или (iv) флуоресцентный краситель.
9. Конъюгат по п.8, отличающийся тем, что метящая часть представляет собой (i) лиганд и линкер или (ii) лиганд.
10. Конъюгат по п.9, отличающийся тем, что лиганд представляет собой лиганд, представленный следующей формулой (А):
[Химическая Формула 1]
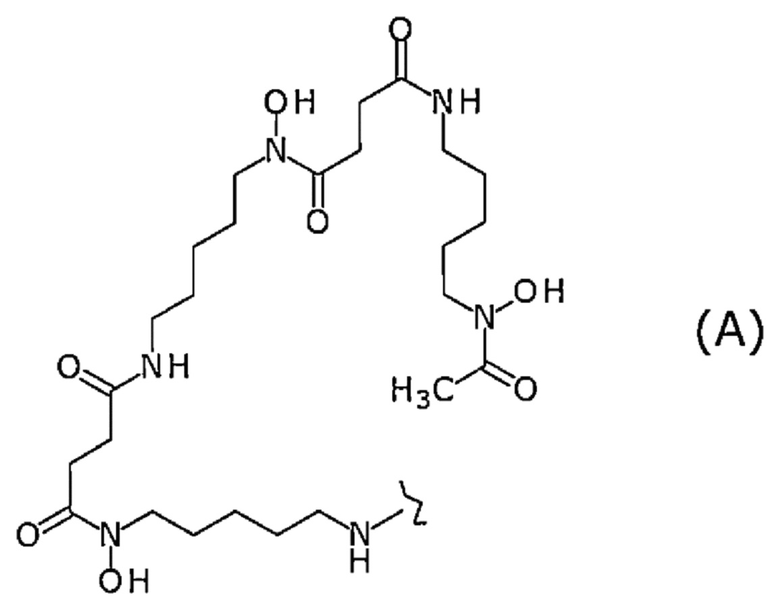
где волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека или линкером.
11. Конъюгат по п.10, отличающийся тем, что метящая часть представляет собой лиганд и линкер, представленные следующей формулой (A'):
[Химическая Формула 2]
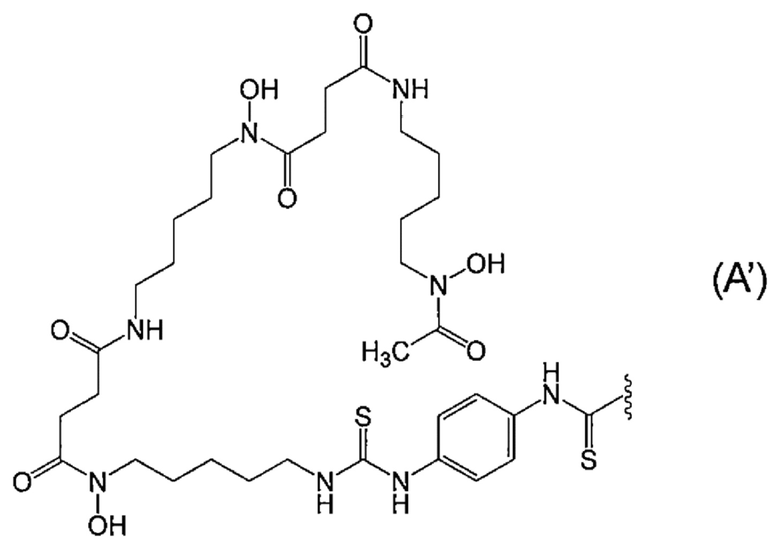
где волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека.
12. Конъюгат по п.11, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека связан через его аминогруппу с атомом углерода концевой группы C(=S) метящей части.
13. Конъюгат для связывания с MUC1 человека, экспрессируемым при раке, выбранный из группы, состоящей из следующих (а)-(b):
(а) конъюгат по п.12, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.5; и
(b) конъюгат по п.12, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.6.
14. Конъюгат для связывания с MUC1 человека, экспрессируемым при раке, состоящий из смеси (а) и (b):
(а) конъюгат по п.12, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.5;
(b) конъюгат по п.12, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.6.
15. Конъюгат по любому из пп.9-14, дополнительно содержащий металл.
16. Конъюгат по п.15, отличающийся тем, что металл представляет собой радиоизотоп металла.
17. Конъюгат по п.16, отличающийся тем, что металл представляет собой 89Zr.
18. Конъюгат по п.13 или 14, дополнительно содержащий 89Zr.
19. Конъюгат по п.8, отличающийся тем, что метящая часть представляет собой (i) флуоресцентный краситель и линкер или (ii) флуоресцентный краситель.
20. Конъюгат по п.19, отличающийся тем, что флуоресцентный краситель представляет собой флуоресцентный краситель, выбранный из группы, состоящей из следующей формулы (B) и следующей формулы (C):
[Химическая Формула 3]
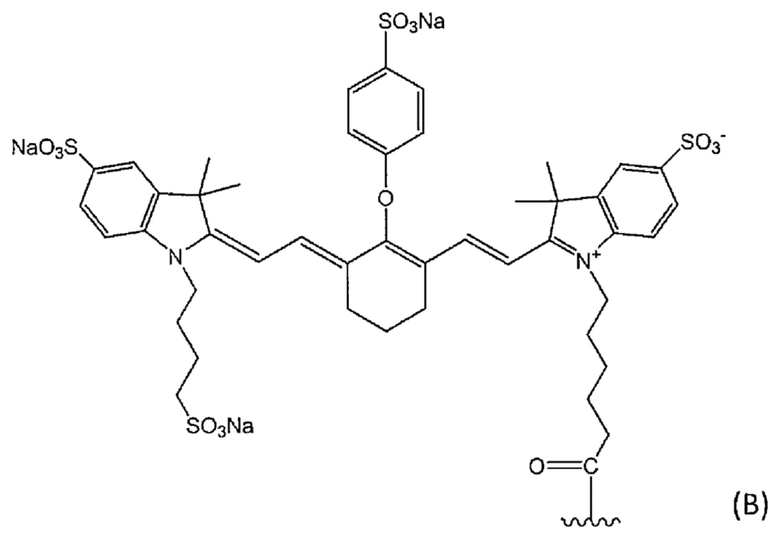
[Химическая Формула 4]
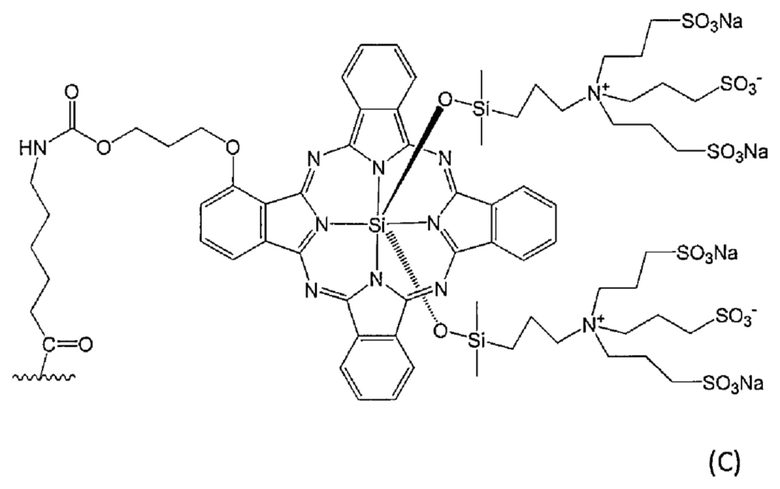
где волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека или линкером.
21. Конъюгат по п.20, отличающийся тем, что волнистая линия представляет собой связывание с Fab-фрагментом антитела против MUC1 человека, и Fab-фрагмент антитела против MUC1 человека связывается через его аминогруппу с атомом углерода концевой группы C(=О) метящей части.
22. Конъюгат по п.21, отличающийся тем, что метящая часть представляет собой флуоресцентный краситель, представленный формулой (B).
23. Конъюгат для связывания с MUC1 человека, экспрессируемым при раке, выбранный из группы, состоящей из следующих (а)-(b):
(а) конъюгат по п.22, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.5; и
(b) конъюгат по п.22, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.6.
24. Конъюгат для связывания с MUC1 человека, экспрессируемым при раке, состоящий из смеси (а) и (b):
(а) конъюгат по п.22, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.5;
(b) конъюгат по п.22, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.6.
25. Конъюгат по п.21, отличающийся тем, что метящая часть представляет собой флуоресцентный краситель, представленный формулой (С).
26. Конъюгат для связывания с MUC1 человека, экспрессируемым при раке, выбранный из группы, состоящей из следующих (а)-(b):
(а) конъюгат по п.25, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.5; и
(b) конъюгат по п.25, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.6.
27. Конъюгат для связывания с MUC1 человека, экспрессируемым при раке, состоящий из смеси (а) и (b):
(а) конъюгат по п.25, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.5;
(b) конъюгат по п.25, отличающийся тем, что Fab-фрагмент антитела против MUC1 человека представляет собой Fab-фрагмент антитела против MUC1 человека по п.6.
28. Полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.1, и легкую цепь Fab-фрагмента антитела против MUC1 человека по п.1.
29. Полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.5, и легкую цепь Fab-фрагмента антитела против MUC1 человека по п.5.
30. Экспрессирующий вектор, содержащий полинуклеотид по п.28.
31. Экспрессирующий вектор, содержащий полинуклеотид по п.29.
32. Клетка-хозяин для получения Fab-фрагмента антитела против MUC1 человека, выбранная из группы, состоящей из следующих (a) и (b):
(a) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.1 и легкую цепь Fab-фрагмента антитела против MUC1 человека по п.1; и
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.1, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.1.
33. Клетка-хозяин для получения Fab-фрагмента антитела против MUC1 человека, выбранная из группы, состоящей из следующих (a) и (b):
(a) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.5 и легкую цепь антитела Fab-фрагмента антитела против MUC1 человека по п.5; и
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.5, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.5.
34. Способ получения Fab-фрагмента антитела против MUC1 человека, включающий стадию культивирования клетки-хозяина, выбранной из группы, состоящей из следующих (a)-(c), для экспрессии Fab-фрагмента антитела против MUC1 человека:
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.1, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь антитела Fab-фрагмент антитела против MUC1 человека по п.1;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.1, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.1; и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.1, и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.1.
35. Способ получения Fab-фрагмента антитела против MUC1 человека, включающий стадию культивирования клетки-хозяина, выбранной из группы, состоящей из следующих (a)-(c), для экспрессии Fab-фрагмента антитела против MUC1 человека:
(а) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.5, и полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.5;
(b) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека по п.5, и экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против человека MUC1 по п.5; и
(c) клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую фрагмент тяжелой цепи Fab-фрагмента антитела против MUC1 человека, по п.5, и клетка-хозяин, трансформированная экспрессирующим вектором, содержащим полинуклеотид, содержащий нуклеотидную последовательность, кодирующую легкую цепь Fab-фрагмента антитела против MUC1 человека по п.5.
36. Способ получения конъюгата, включающего метящую часть и Fab-фрагмент антитела против MUC1 человека, включающий стадии: получения Fab-фрагмента антитела против MUC1 человека способом по п.34 или 35; и ковалентное связывание Fab-фрагмента с метящей частью.
37. Способ получения конъюгата по п.36, отличающийся тем, что стадия ковалентного связывания Fab-фрагмента с метящей частью представляет собой стадию i) связывания Fab-фрагмента через линкер с лигандом или ii) ковалентного связывания Fab-фрагмента непосредственно с лигандом.
38. Способ получения конъюгата по п.37, дополнительно включающий стадию мечения лиганда конъюгата радиоизотопом металла.
39. Способ получения конъюгата по п.36, отличающийся тем, что стадия ковалентного связывания Fab-фрагмента с метящей частью представляет собой стадию i) связывания Fab-фрагмента через линкер с флуоресцентным красителем или ii) ковалентного связывания Fab-фрагмента непосредственно с флуоресцентным красителем.
40. Композиция для диагностики злокачественного новообразования, клетки которого экспрессируют MUC1 человека, содержащая один или более конъюгатов по любому из пп.7-27 и фармацевтически приемлемый носитель.
41. Композиция для диагностики по п.40, отличающаяся тем, что конъюгат представляет собой конъюгат по любому из пп.18, 23, 24, 26 и 27.
42. Композиция для диагностики по п.41, отличающаяся тем, что конъюгат представляет собой конъюгат по п.18.
43. Композиция для диагностики по п.41, отличающаяся тем, что конъюгат представляет собой конъюгат по п.23 или 24.
44. Композиция для диагностики по п.41, отличающаяся тем, что конъюгат представляет собой конъюгат по п.26 или 27.
45. Композиция для диагностики по любому из пп. 40-44, отличающаяся тем, что злокачественное новообразование представляет собой рак молочной железы или рак мочевого пузыря.
46. Фармацевтическая композиция для лечения злокачественного новообразования, клетки которого экспрессируют MUC1 человека, содержащая один или более конъюгатов по любому из пп. 7-27 и фармацевтически приемлемый носитель.
47. Фармацевтическая композиция по п.46, отличающаяся тем, что конъюгат представляет собой конъюгат по любому из пп. 18, 23, 24, 26 и 27.
48. Фармацевтическая композиция по п.47, отличающаяся тем, что конъюгат представляет собой конъюгат по п.26 или 27.
49. Фармацевтическая композиция по любому из пп. 46-48, отличающаяся тем, что злокачественное новообразование представляет собой рак молочной железы или рак мочевого пузыря.
50. Применение конъюгата по любому из пп. 7-27 для получения композиции для диагностики рака молочной железы или рака мочевого пузыря.
51. Применение конъюгата по любому из пп. 7-27 для получения композиции для лечения рака молочной железы или рака мочевого пузыря.
52. Применение конъюгата по любому из пп.7-27 в диагностике рака молочной железы или рака мочевого пузыря.
53. Применение конъюгата по любому из пп. 7-27 в лечении рака молочной железы или рака мочевого пузыря.
54. Способ диагностики рака молочной железы или рака мочевого пузыря, включающий введение пациенту до или после операции конъюгата по любому из пп. 7-27.
55. Способ лечения рака молочной железы или рака мочевого пузыря, включающий стадию введения терапевтически эффективного количества конъюгата по любому из пп. 7-27.
| WO 2010050528 A1, 06.05.2010 | |||
| WO2011135869 A1, 03.11.2011 | |||
| US 2014005366 A1, 02.01.2014 | |||
| ВЕРХНЕЕ СТРОЕНИЕ ЗДАНИЯ ГИДРОЭЛЕКТРОСТАНЦИИ | 0 |
|
SU175110A1 |
| НАНОАНТИТЕЛО, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕЕ БЕЛОК MUC1, СПОСОБ ДЕТЕКЦИИ БЕЛКА MUC1 С ПОМОЩЬЮ НАНОАНТИТЕЛ | 2012 |
|
RU2493165C1 |
Авторы
Даты
2022-03-21—Публикация
2017-11-17—Подача