ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
1. ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу выделения полидезоксирибонуклеотида (PDRN) высокой чистоты из семенников лосося, и, более конкретно, к способу выделения PDRN высокой чистоты путем гормональной обработки незрелых семенников, которые в настоящее время используют в других применениях.
2. ОПИСАНИЕ БЛИЖАЙШЕГО УРОВНЯ ТЕХНИКИ
Полидезоксирибонуклеотид (PDRN) присутствует в активных веществах для регенерации ткани (анагенез) у живых организмов. PDRN представляет собой смесь образующих цепь дезоксирибонуклеотидных полимеров, состоящих из от 50 до 2000 пар оснований. PDRN является активатором клеточного роста, имеющим особые эффекты в отношении регенерации тканей в организме человека, таких как связки, сухожилия и кожа, и облегчения воспаления.
В человеческой плаценте присутствует только очень небольшое количество PDRN. С PDRN связаны этические вопросы, а его получение для фармацевтики сопряжено с трудностями. По этим причинам в качестве альтернативы человеческому PDRN был предложен PDRN рыб. Сперма и семенники форели и лосося богаты нуклеиновыми кислотами, однако более важное значение имеет их качественное превосходство. ДНК состоит из нуклеотидов, каждый из которых включает сахар пентозу, фосфатную группу и азотистое основание, такое как аденин, гуанин, тимин или цитозин. Соотношение в этой комбинации у форели и лосося на 96,5% идентично таковому у человека. Это сходство имеет большую важность, поскольку можно использовать все нуклеиновые кислоты без отбраковки.
PDRN был одобрен для применения в лечении ран и в области красоты в странах Европы и других странах. PDRN в основном получают путем сбора спермы от лосося или форели, выделения ДНК из спермы и фрагментирования ДНК. Выделение ДНК для получения PDRN было технически разработано и применяется у млекопитающих и других видов. Например, для выделения ДНК из тканей рыб используют фенол и хлороформ.
Полидезоксирибонуклеотид (PDRN) в виде фрагмента ДНК получают из спермы лососевых рыб, содержащей спермин, и применяют в терапии и косметике в качестве материала с превосходными фармакологическими активностями.
PDRN в виде фрагмента ДНК высокой чистоты применяют в фармакологических целях. В данном случае для получения PDRN спермальную жидкость (или семенную жидкость) центрифугируют, промывают буфером и экстрагируют смесью этанола или ацетата натрия и изопропанола. Этот процесс экстрагирования является основным принципом, применяемым во многих патентах и производителями.
В сперме из семенников содержится большое количество сперматид, сперматоцитов и сперматогониев, все из которых дифференцируются в спермин в ходе гаметогенеза. В частности, в сперме содержится большее количество сустентоцитов, чем этих половых клеток. Сустентоциты служат для обеспечения половых клеток питательными веществами.
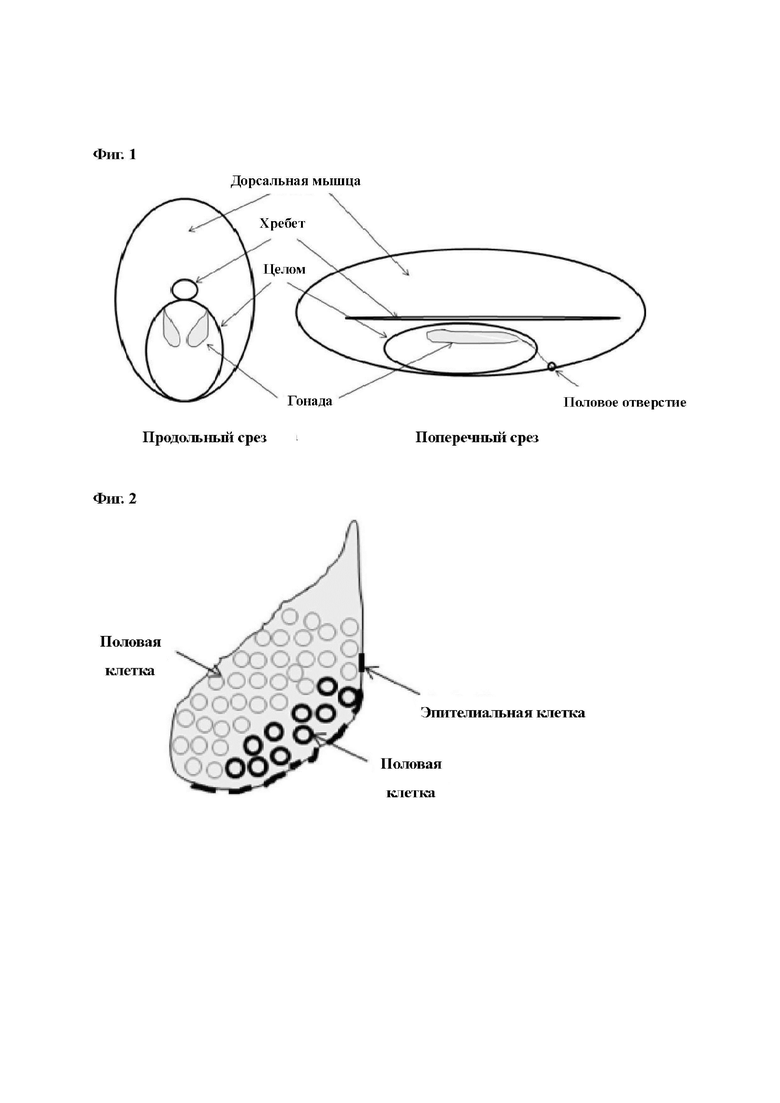
Как показано на Фиг. 1, семенники рыбы созревают, будучи прикрепленными к дорсальной стенке целома. Рост половых клеток во время половой зрелости приводит к увеличению гонадо-соматического индекса (GSI). GSI увеличивается до 20-50% у самок рыб и до 1-5% у самцов рыб. Таким образом, число семенников, полученных от самцов рыб не является существенным.
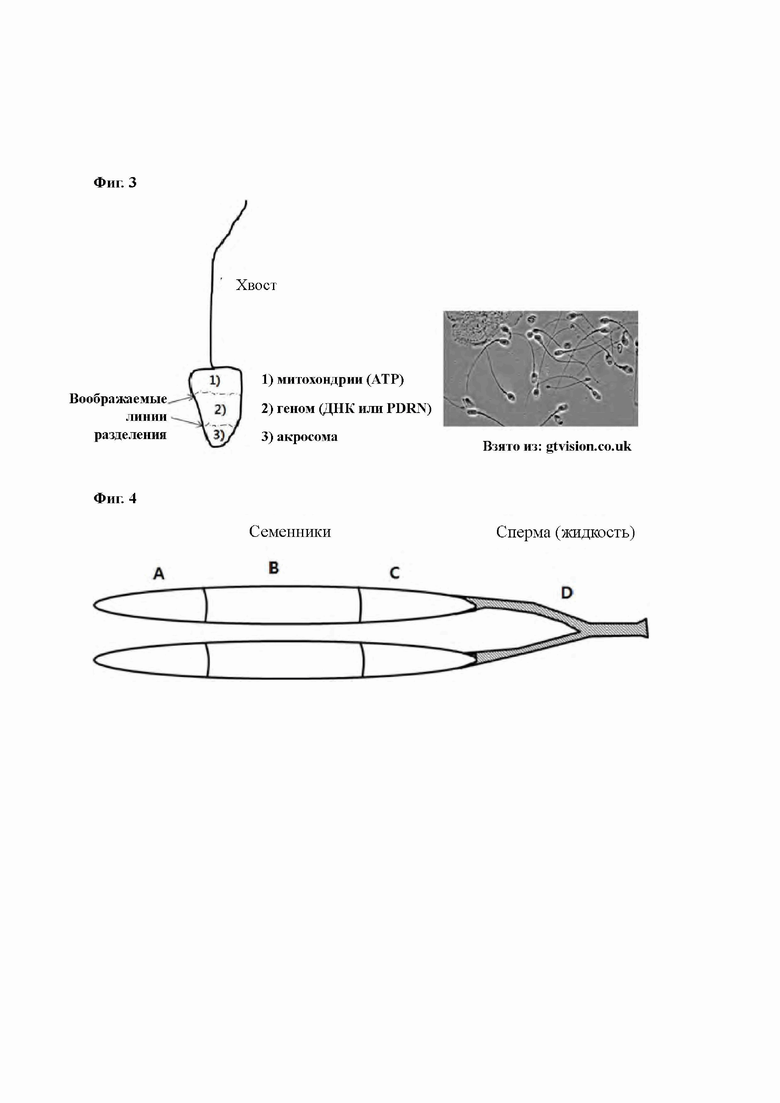
С другой стороны, выделение PDRN обязательно включает центрифугирование спермы, обогащение спермиями (или сперматозоидами) и выделение спермиев с использованием органического растворителя. Спермий состоит из ДНК (то есть PDRN) в качестве генома, митохондрий, содержащих АТР (аденозинтрифосфат), вызывающих движение хвостика, и акросомы, позволяющей спермию проникать в оолемму. PDRN является целевым веществом по настоящему изобретению.
Количество PDRN в продуктах экстракции спермы органическим растворителем принципиально отличается от такового в семенниках. Из спермы можно получать PDRN большей чистоты. В отличие от этого, когда PDRN выделяют с использованием органического растворителя из семенников, содержащих сустентоциты, неизбежно экстрагируются различные вещества, растворимые в органическом растворителе.
В CN107287186A («патентный документ 1») PDRN получают из семенной жидкости, которая обозначена как сперма. В KR10-2018-0066331 («патентный документ 2»), получившем окончательное решение об отказе в выдаче патента в Корее, описано, что семенники лиофилизируют и экстрагируют органическим растворителем для получения PDRN. В заявке на Корейский патент признано, что чистота PDRN, полученного из спермы, отличается от чистоты PDRN, полученного из семенников, и раскрыто, что PDRN высокой чистоты может быть выделен с наибольшей эффективностью из спермиев (спермы).
Таким образом, в качестве основных методик выделения PDRN были признаны промывание и экстрагирование органическим растворителем. Так, в последнее время было выдано много патентов и опубликовано статей, касающихся применения PDRN, основанного на его фармакологической активности или косметических эффектах, а не способов выделения PDRN.
После образования спермиев в семенниках лососевых рыб сперму собирают. Затем брюшную полость вскрывают, незрелые семенники собирают с последующей обработкой, такой как лиофилизация. Авторы настоящего изобретения неожиданно обнаружили, что разведение семенников лососевых рыб семенной плазмой, в зависимости от степени зрелости семенников, и последующая обработка таким гормоном, как хорионический гонадотропин человека (hCG), приводит к получению намного большего количества спермиев (или спермы). Например, у одного вида лососевых можно получить в 100-200 раз большее количество спермы.
Состав семенной плазмы (NaCl, 40 мМ KCl, 1 мМ CaCl2, 20 мМ Tris-HCl) определен на основании информации о концентрации минералов в сперме, как описано в публикации "Rosengrave Р, Taylor Н, Montgomerie R, Metcalf V, McBride К and Gemmell NJ, 2008. Chemical composition of seminal and ovarian fluids of chinook salmon (Oncorhynchus tshawytscha) and their effects on sperm motility traits. СВР A 152, 123-129" и информации об искусственной семенной жидкости, представленной в публикации "Bartlett MJ, Steeves ТЕ, Gemmell NJ and Rosengrave PC, 2017. Sperm competition risk drives rapid ejaculate adjustments mediated by seminal fluid. eLIFE 6:e28811".
Семенная жидкость, которая упоминается в качестве исходного материала для PDRN в патентном документе 1, представляет собой сперму лососевых рыб, а не экстракт из семенников.
В ЕР 0226254 В1 («патентный документ 3») изложен способ выделения PDRN из плаценты. Однако в этом патенте упомянуто только то, что способ можно также применять и для других тканей других животных, и не приведено ни одного случая. В отличие от этого, в настоящем изобретении предложен способ выделения PDRN из семенников лосося, начинающийся от сбора семенников у живого или свежего лосося и промывания семенников для удаления крови, и фундаментально отличающийся от способа получения PDRN из подвижных спермиев, образованных в семенниках, несмотря на использование того же источника PDRN (то есть семенников) в обоих способах.
Авторы настоящего изобретения предприняли попытку выделить PDRN из незрелых семенников вместо спермы или зрелых семенников, широко используемых в данной области техники, и в результате обнаружили, что обработка незрелых семенников подходящим гормоном, в частности, хорионическим гонадотропином человека (hCG), приводит к образованию зрелых спермиев, из которых можно выделить PDRN высокой чистоты. Настоящее изобретение основано на этом наблюдении.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
(Патентный документ 1) CN107287186A под названием "Polydeoxyribonucleotide for separate the method for polydeoxyribonucleotide from the seminal fluid of fish, obtaining by methods described and application thereof.
(Патентный документ 2) KR10-2018-0066331 под названием "Method for extracting PDRN from semen and testes of fish".
(Патентный документ 3) ЕР 0226254B1 под названием "Process for obtaining non informational substantially pure polydesoxyribonucleotides having biologic activities, and respective product".
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
(Непатентный документ 1) (статья в журнале 1) Нуо Won KIM, Jeong Hyeon KIM, Dae Geun KIM, Min Hwan JEONG, Seung Chul JI, Sang Keun SANG, Cheol Min AHN, Jeong In MYEONG, Dae Jung KIM. 2018. Effect of artificially sexual maturation by hCG dose and injection interval in cultured male eel, Anguilla japonica. The Journal of the Korean Society for Fisheries and Marine Sciences Education, 30, 1578-1586.
(Непатентный документ 2) (статья в журнале 2) Ohta Н. and Tanaka Н., 1997. Relationship between serum levels of human chorionic gonadotropin (hCG) and 11-ketotestosterone after a single injection of hCG and induced maturity in the male Japanese ee1, Anguilla japonica. Aquaculture 153, 123-134.
(Непатентный документ 3) (отчет о программе 1) Dal Young KIM, Seong Gon KIM, Tong Soo KIM. 2016. A study on the acclimation of Korean mandarin fish to formulated feed - Test on the growth rate of 1-year-old individuals acclimated to formulated feed. Отчет по научно-практическому проекту 2016 г института морских исследований и рыболовства провинции Gyeonggi, Корея. 84-91.
(Непатентный документ 4) (отчет о программе 2) Университет Soonchunhyang, Корея, 2011. Artificial breeding manual of endangered freshwater fish. Министерство окружающей среды Кореи, с. 93.
КАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является обеспечение способа получения спермиев искусственным путем посредством обработки семенников hCG для выделения большого количества PDRN из спермиев.
Способ выделения полидезоксирибонуклеотида (PDRN) высокой чистоты из семенников лосося по настоящему изобретению включает (1) выделение спермы и незрелых участков семенников из семенников лососевой рыбы, (2) осторожное измельчение незрелых участков семенников с последующим разведением искусственной семенной плазмой, (3) обработку разведения хорионическим гонадотропином человека (hCG) в заданной концентрации для индуцирования искусственного полового созревания клеток семенников в спермин, (4) центрифугирование разведения семенников по истечении заданного времени после обработки hCG и сбор потенциально подвижных спермиев и (5) выделение PDRN из собранных спермиев.
Далее настоящее изобретение будет описано более подробно.
В способе по настоящему изобретению лососевая рыба предпочтительно представляет собой вид рыб, принадлежащий к подсемейству, выбранному из группы, состоящей из Salmoninae, Thymallinae и Coregoninae, и предпочтительно представляет собой речного лосося, пойманного в зоне, простирающейся на 10 км выше по течению от устья реки.
В способе по настоящему изобретению на стадии (1) незрелые участки семенников различаются по своей степени зрелости и имеют относительно высокие степени зрелости, представляющие собой подвижность спермиев по меньшей мере 0,7%, а на стадии (3) hCG используют в количестве от 25 до 200 IU (международных единиц) на грамм семенников.
В способе по настоящему изобретению на стадии (4) заданное время предпочтительно составляет от 10 минут до 1 часа, а незрелые участки семенников предпочтительно включают сперматогонии или сперматоциты. Предпочтительно, способ по настоящему изобретению дополнительно включает перед стадией (5) суспендирование спермиев и добавление к суспензии свежей воды для обеспечения истощения спермиями их АТР с получением PDRN высокой чистоты.
hCG - это аббревиатура для хорионического гонадотропина человека, обозначающая гормон, который можно выявить в моче беременных женщин.
Когда hCG инъецируют карпу, обыкновенному карасю или золотой рыбке, которых выращивали при температуре 12°С или ниже в течение года, оплодотворенные икринки можно получить в любое время. В частности, инъекция hCG в количестве 500 IU/кг или 500 IU/особь обеспечивает созревание гонад самок и самцов, в результате чего оплодотворенные икринки можно получить естественным путем через 12-18 часов после инъекции (от заката до утра следующих суток). Инъекция экстракта гипофиза лосося самкам угря приводит к половому созреванию гамет (икринок), тогда как еженедельные инъекции hCG в концентрации 500 IU/кг обеспечивают созревание спермиев через 3 месяца. При слиянии зрелых яйцеклеток самок и зрелых спермиев образуются оплодотворенные икринки.
В одном воплощении настоящего изобретения сперму и незрелые участки семенников, имеющие различные степени зрелости, выделяют из семенников лососевой рыбы, собирают незрелые участки семенников, имеющие высокие степени зрелости, собранные незрелые участки семенников осторожно измельчают и разводят искусственной семенной плазмой, разведение обрабатывают hCG в заданной концентрации, после обработки hCG разведенные семенники центрифугируют в течение 10-30 минут и собирают потенциально подвижные спермин и используют в качестве исходного материала для PDRN.
Таким образом, настоящее изобретение направлено на получение PDRN высокой чистоты из подвижных спермиев, полученных искусственным путем в семенниках свежей лососевой рыбы. Степень зрелости свежих семенников варьирует в зависимости от участка, но чем ближе к половому отверстию, тем более зрелыми становятся сперматогонии. В результате созревания под действием hCG один сперматогоний проходит мейоз с образованием сперматид и клеток спермиев (до четырех), с достижением более высокого выхода, чем общая сырая масса использованных семенников, что в конечном итоге приводит к увеличению выхода PDRN. В разделе Примеры, приведенном ниже, обработка hCG увеличивала сухую массу (за исключением осадка) клеток спермиев, имеющих происхождение от сперматид, в 1,6 раза, и PDRN был выделен с итоговой чистотой по меньшей мере 82% в 2,3-3,9 раз большем количестве в группе, получавшей обработку hCG, по сравнению с группой, не получавшей обработку. Кроме того, получали PDRN высокой чистоты с выходом в среднем в 40,1 раз выше, из спермы, собранной единовременно у одного самца, и получали PDRN более высокой чистоты, когда зрелые спермин приводили в контакт с водой из окружающей среды для истощения в них АТР.
От одного самца лососевой рыбы получают приблизительно 30-50 мл спермы, но в настоящее время доступно только ограниченное количество (приблизительно 10-20 мл), поскольку в Южной Корее большую часть спермы используют для оплодотворения.
Способ по настоящему изобретению обеспечивает получение из 20 мл (максимум 50 мл) спермиев (спермы), полученных естественным путем и собранных единовременно у лососевой рыбы, исходного материала для PDRN с чистотой, повышенной в 100-200 раз. Таким образом, PDRN, полученный из семенников лососевой рыбы способом по настоящему изобретению, является более концентрированным и чистым по сравнению с тем, который получают из дорогой активной спермы. Согласно способу по настоящему изобретению, PDRN можно получать с высоким выходом из спермы и семенников форели или лосося. Кроме того, способ по настоящему изобретению обеспечивает более рентабельное и экономически выгодное выделение PDRN по сравнению с обычными способами других компаний.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Эти и/или другие аспекты и преимущества изобретения станут очевидны и более понятны, исходя из приведенного ниже описания воплощений, взятого вместе с сопровождающими графическими материалами, в которых:
на Фиг. 1 показаны диаграммы поперечного и продольного среза, иллюстрирующие пространственное расположение незрелых гонад (общее для самцов и самок рыб) в целоме обычной рыбы;
Фиг. 2 представляет собой увеличенное изображение продольного среза, иллюстрирующее незрелую гонаду (общее для самцов и самок рыб) в целоме обычной рыбы;
на Фиг. 3 приведены диаграмма среза, иллюстрирующая структуру клетки спермия обычной рыбы (слева) и микрофотография, иллюстрирующая спермин в сперме обычной рыбы (справа); и
Фиг. 4 представляет собой схематичную диаграмму, иллюстрирующую расположение различных участков семенника зрелого самца лососевой рыбы.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее будут описаны отдельные стадии способа по настоящему изобретению.
Стадия 1: Выделение спермы и незрелых участков семенников
Сперму и незрелые участки семенников выделяют из семенников лососевой рыбы. Сперму, вытекающую из участка D, показанного на Фиг. 4, собирают и используют в качестве исходного материала. После полного извлечения спермы из участка D, участок С отделяют от участка D путем разрезания в заданном положении.
Если обратиться к Фиг. 4, семенник подразделяется на участок D, откуда вытекает сперма, и незрелые участки семенника А, В и С. В частности, большая часть спермиев из участков семенников А и В являются неподвижными до обработки hCG и приблизительно 1% спермиев из участка семенников С являются подвижными. Спермин в зрелой сперме из участка семенников D обладают подвижностью 100%.
Стадия 2: Измельчение и разведение незрелых участков семенников
Незрелые участки семенников А, В и С измельчают и разводят искусственной семенной плазмой. Измельчение осуществляют согласно следующей процедуре. Вначале семенники нарезают на мелкие кусочки ножницами так, чтобы снять мембраны, окружающие сперматиды семенников. Затем обнажившиеся участки семенников А, В и С осторожно раздавливают руками в перчатках.
Семенная плазма имеет состав, включающий 80 мМ NaCl, 40 мМ KCl, 1 мМ CaCl2 и 20 мМ Tris-HCl, конкретно 159,26±8,84 мМ натрия (Na), 33,72±2,01 мМ калия (К), 133,04±5,96 мМ хлора (Cl), 1,68±0,2 мМ кальция (Са) и 0,988±0,13 мМ магния (Mg) (см. Hatef A, et. al., 2007. Aquaculture Research 38, 1175-1181). В качестве органических компонентов семенная плазма включает общий белок (0,75±0,14 мг/100 мл), холестерин (2,86±0,58 мг/л) и глюкозу (3,81±1,04 мМ/л).
Стадия 3: обработка hCG
hCG это аббревиатура для хорионического гонадотропина человека. Разведение обрабатывают hCG в концентрации 25-200 IU/г для индуцирования искусственного полового созревания клеток семенников в спермин. Конкретно, разведение обрабатывают заданным количеством hCG при медленном помешивании на лопастной мешалке с низкой скоростью. При этом следует соблюдать осторожность, поскольку высокая скорость мешалки вызывает разрушение клеток, повышая вероятность увеличения примесей.
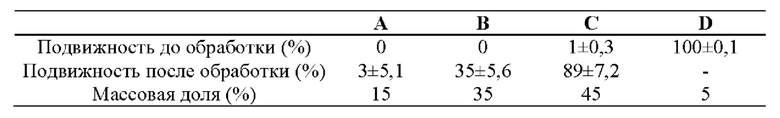
Обработка hCG улучшает подвижность спермиев из участков семенников А до приблизительно 3%, тогда как подвижность спермиев из участков В и С она увеличивает до 35% и 89%, соответственно. В заключение, использование участков семенников С, на которые приходится 45% общей массы семенников, для получения зрелых спермиев будет приводить к получению PDRN высокой чистоты с малым количеством примесей (см. Фиг. 4 и Таблицу 1).
Стадия 4: Центрифугирование
Разведение семенников центрифугируют при 1000-10000 RCF (относительная сила центрифугирования) в течение по меньшей мере 20 минут и собирают потенциально подвижные спермин в виде осадка.
Стадия 5: Выделение PDRN
Из собранных спермиев выделяют полидезоксирибонуклеотид (PDRN). В данной области техники известны различные способы, которые можно применять для выделения PDRN, поэтому их описание в данном документе не приведено. Настоящее изобретение характеризуется скорее получением искусственной спермы, из которой можно выделить PDRN высокой чистоты, как описано выше, нежели выделением PDRN.
Например, PDRN можно выделять согласно следующей процедуре. Вначале спермин обрабатывают лизирующим буфером, замораживают и измельчают в порошок. Выделяют ДНК путем центрифугирования и очищают путем удаления белков. Затем осаждают ДНК путем центрифугирования и очищают путем промывания. Наконец, ДНК фрагментируют одним из следующих способов: (1) расщепление рестриктазами, (2) передача высокочастотной акустической энергии, (3) силы небулизации, (4) воздействие ультразвука и (5) разрезание с помощью иглы.
Далее настоящее изобретение будет объяснено более подробно с отсылкой к следующим Примерам. Однако эти примеры приведены для обеспечения лучшего понимания изобретения специалистами в области техники, могут быть изменены до нескольких других вариантов и не предназначены для ограничения объема заявленного изобретения.
Пример 1. Подвижность (%) спермиев из различных участков семенников лосося до и после обработки hCG
Незрелые участки (за исключением участков D, из которых вытекает сперма, см. Фиг. 4) собирали путем отрезания семенников самца лосося. Подвижность спермиев из участков семенников А и В до обработки hCG практически равнялась нулю. Подвижность спермиев из участков семенников С составляла всего 1%, а подвижность спермиев в зрелой сперме составляла 100%. После обработки hCG подвижность спермиев из участков семенников А улучшалась приблизительно до 3%, тогда как подвижность спермиев из участков семенников В и С увеличивалась до 35% и 89%, соответственно. Эти результаты позволяют заключить, что использование участков семенников С, на которые приходится 45% общей массы семенников, для получения зрелых спермиев приведет к получению PDRN высокой чистоты с малым количеством примесей (см. Фиг. 4 и Табл. 1).

Участки С семенников самца лосося, пойманного в реке в октябре, обрабатывали тремя различными типами гормонов: hCG, рилизинг-фактором лютеинизирующего гормона (LhRH) и DHP (дигидропрогестероном). При обработке LHRH и DHP подвижность спермиев составляла всего 5 и 4%, соответственно. В отличие от этого, подвижность спермиев в экспериментальной группе, получившей обработку hCG, доходила до 80%, что позволяло получать сперму с малым количеством примесей (Таблица 2).

Подвижность спермиев лосося, пойманного в море, не увеличивалась даже после обработки hCG (Таблица 3). Участки С семенников лосося, вернувшегося в реку между сентябрем и декабрем, обрабатывали hCG. В результате существенных различий в подвижности спермиев не было, поскольку речной лосось был уже зрелым (Таблица 4). Сравнивали подвижность спермиев в зависимости от расстояния от плотины в устье реки. Подвижность спермиев самца лосося, пойманного у плотины в устье реки (расстояние=0 м) и в точке 1 км выше по течению от плотины в устье реки, составляла 65% и 85%, соответственно. В отличие от этого, подвижность спермиев самца лосося, пойманного в точках 2 км и 3 км выше по течению от плотины в устье реки, составляла 97% и 98%, соответственно (Таблица 5).



Расстояние от устья реки означает расстояние от устья реки до места, куда лосось мигрировал выше по течению, прежде чем быть пойманным. hCG почти не оказывал влияния на морского лосося, тогда как hCG влиял на лосося, вернувшегося в реку, поскольку его половое созревание уже началось. Как свидетельствуют результаты, приведенные в Таблице 5, hCG лучше влиял на лосося, пойманного выше по течению реки, чем на лосося, пойманного вблизи моря.
Пример 2. Подвижность (%) спермиев из участков С семенников лосося при различных условиях обработки hCG
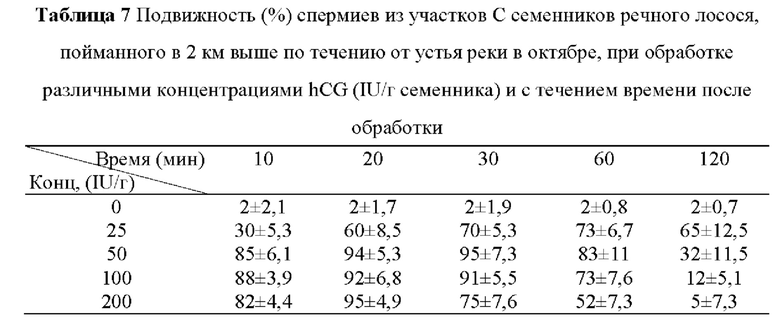
Участки С семенников самца речного лосося разводили буферным раствором и обрабатывали различными концентрациями hCG. Подвижность спермиев была очень низкой (2%), когда участки С не подвергались обработке, постепенно повышалась с увеличением концентрации hCG до 50 IU/г и составляла не менее 82% при обработке hCG в концентрациях 50-200 IU/г (Таблица 6).

Сравнивали подвижность спермиев с течением времени после обработки hCG в концентрациях, показанных в Таблице 6. В контроле, не получавшем обработку, подвижность спермиев не различалась даже с течением времени. Подвижность спермиев в группе, получавшей обработку 25 IU/г семенника, повышалась до максимального значения 73% через 1 ч после обработки и доходила до 85% через 10 мин после обработки. Подвижность спермиев в группе, получавшей обработку 50 IU/г семенника, составляла не менее 94% через 20-30 мин после обработки. Однако подвижность спермиев понижалась до 83% с 60 мин после обработки и резко понижалась до 32% с 60 мин после обработки. Подвижность спермиев в группах, получавших обработку 100 IU/г семенника и 200 IU/г семенника, начинала понижаться с 30 мин и 20 мин после обработки, соответственно. Таким образом, подвижность спермиев в группах, получавших обработку 50-200 IU/г семенника, понижалась с того момента, как время обработки превышало 20 мин (Таблица 7).
Пример 3. Выход выделенного PDRN (%) при обработке участков С семенников hCG в различных условиях
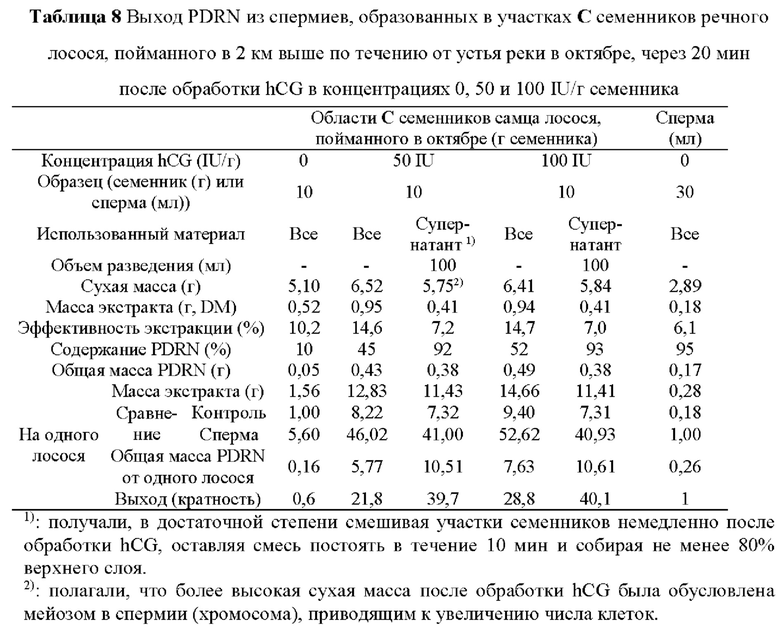
В данном примере использовали 10 г участков С семенников самца речного лосося. Для сравнения использовали 30 мл спермы, полученной у самца речного лосося обычным способом (Таблица 8). Участки семенников обрабатывали hCG в концентрациях 50 и 100 IU/г семенника. После обработки hCG собирали не менее 80% каждого верхнего слоя и обозначали как супернатант.
Сухая масса в группе, не получавшей обработку, составляла 5,10 г, что было меньше чем в группах, получавших обработку hCG, и больше, чем у спермы (2,89 г). Полагали, что сухая масса в группе, не получавшей обработку, превышавшая таковую спермы, была обусловлена присутствием более тяжелых сустентоцитов. Полагали, что сухая масса в группах, получавших обработку hCG, превышавшая таковую в группе, не получавшей обработку, была обусловлена тем, что обработка hCG стимулировала мейоз сперматогониев в сперматиды, что приводило к увеличению количества клеток. Полагали, что низкая сухая масса супернатантов после обработки hCG была обусловлена тем, что некоторые компоненты (приблизительно 20%), такие как сустентоциты, оставались не дифференцированными в сперматиды.
В группе, не получавшей обработку, и в участках семенников, обработанных hCG, достигалась эффективность выделения 10,2% и приблизительно 14,7%, соответственно. В супернатантах и сперме достигалась эффективность выделения 7,0-7,2% и 6,1%, соответственно. В группе, не получавшей обработку, и 10 г участков семенников, обработанных hCG, достигалось содержание PDRN (или чистота) 10% и 45-52%. В отличие от этого, в супернатантах и сперме достигалась чистота PDRN не менее 92%.
На основании этих результатов рассчитывали количество PDRN, выделенного у одного самца лосося. В результате из спермы одного самца лосося получали 0,26 г PDRN, а из необработанных участков семенников одного самца лосося получали 0,16 г PDRN. В отличие от этого, из участков семенников, обработанных hCG в концентрациях 50 и 100 IU/г семенника, получали 5,77 и 7,63 г PDRN, соответственно. Из супернатантов получали PDRN высокой чистоты (не менее 10,51 г) независимо от концентрации hCG. Выход PDRN в группе, не получавшей обработку, и в участках семенников, обработанных 50 IU hCG, был выше выхода PDRN из спермы в 0,6 раза и 21,8 раз, соответственно. В отличие от этого, выход PDRN в супернатантах после обработки hCG в концентрациях 50 и 100 IU/г семенника был выше выхода PDRN из спермы в 39,7 раза и 40,1 раз, соответственно.
Поскольку супернатанты представляли собой суспензии, содержащие высокую долю спермиев, при воздействии воды из окружающей среды (свежей воды) спермин становилась подвижными с истощением АТР в их митохондриях. Полагают, что этот эффект приводил к более высокой чистоте PDRN. Поскольку в ходе этого неподвижные спермин осаждались и удалялись, их следовало учитывать в отношении эффективности. Однако это учитывание не приводило к существенному улучшению эффективности, поскольку содержание PDRN, выделенного из спермиев, было высоким (не менее 92%).
Несмотря на то, что предпочтительные воплощения настоящего изобретения были объяснены подробно, объем настоящего изобретения не ограничен ими. Специалисту в области техники понятно, что возможны различные модификации без отступления от существа и объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СТИМУЛЯТОР ПРОЦЕССОВ РЕПАРАТИВНОЙ РЕГЕНЕРАЦИИ ТЕСТИКУЛЯРНОЙ ТКАНИ | 2019 |
|
RU2778238C2 |
| Способ получения потомства севрюги и атлантического лосося в морской воде | 2022 |
|
RU2788707C1 |
| Применение комплекса 9-фенил-2,3,4,5,6,7,8,9-октагидро-1Н-селеноксантена с β-циклодекстрином для коррекции нарушений сперматогенеза, вызванных цитотоксическим воздействием | 2019 |
|
RU2782758C2 |
| СРЕДСТВО КОРРЕКЦИИ ОТДАЛЕННЫХ ПОСЛЕДСТВИЙ НАРУШЕНИЙ СПЕРМАТОГЕНЕЗА, ВЫЗВАННЫХ ЦИТОСТАТИЧЕСКИМ ВОЗДЕЙСТВИЕМ | 2013 |
|
RU2535002C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ПРОХОДНЫХ ТИХООКЕАНСКИХ ЛОСОСЕЙ | 2001 |
|
RU2206988C1 |
| Применение комплекса 9-фенил-2,3,4,5,6,7,8,9-октагидро-1Н-селеноксантена с β-циклодекстрином для лечения патозооспермии | 2019 |
|
RU2782140C2 |
| Применение фармацевтической композиции β-циклодекстрина с 9-фенил-2,3,4,5,6,7,8,9-октагидро-1Н-селеноксантеном для повышения/восстановления либидо | 2019 |
|
RU2782133C2 |
| СПОСОБ ВЫРАЩИВАНИЯ ПРЕСНОВОДНОГО ЛОСОСЯ | 2015 |
|
RU2614601C1 |
| БИСАМИДНОЕ ПРОИЗВОДНОЕ ДИКАРБОНОВОЙ КИСЛОТЫ В КАЧЕСТВЕ СРЕДСТВА, СТИМУЛИРУЮЩЕГО РЕГЕНЕРАЦИЮ ТКАНЕЙ И ВОССТАНОВЛЕНИЕ СНИЖЕННЫХ ФУНКЦИЙ ТКАНЕЙ | 2015 |
|
RU2647438C2 |
| СПОСОБ КОРРЕКЦИИ НАРУШЕНИЙ СПЕРМАТОГЕНЕЗА, ВЫЗВАННЫХ ЦИТОСТАТИЧЕСКИМ ВОЗДЕЙСТВИЕМ | 2009 |
|
RU2406527C1 |
Изобретение относится к биотехнологии и биохимии. Предложен способ выделения полидезоксирибонуклеотида PDRN из семенников лосося, включающий выделение спермы и незрелых участков семенников лососевой рыбы, измельчение незрелых участков семенников с последующим разведением искусственной семенной плазмой, обработкой хорионическим гонадотропином человека hCG и центрифугированием, сбор потенциально подвижных спермиев и выделение PDRN из собранных спермиев. Изобретение обеспечивает получение PDRN более высокой чистоты из подвижных спермиев, полученных искусственным путем в семенниках свежей лососевой рыбы. 6 з.п. ф-лы, 4 ил., 8 табл., 3 пр.
1. Способ выделения полидезоксирибонуклеотида (PDRN) высокой чистоты из семенников лосося, включающий (1) выделение спермы и незрелых участков семенников из семенников лососевой рыбы, (2) измельчение незрелых участков семенников с последующим разведением искусственной семенной плазмой, (3) обработку разведения хорионическим гонадотропином человека (hCG) в количестве от 25 до 200 IU (международных единиц) на грамм семенников для индуцирования искусственного полового созревания клеток семенников в спермии, (4) центрифугирование разведения семенников по истечении 10 минут - 2 часов после обработки hCG и сбор потенциально подвижных спермиев и (5) выделение PDRN из собранных спермиев.
2. Способ по п. 1, где лососевая рыба представляет собой вид рыб, относящихся к подсемейству, выбранному из группы, состоящей из Salmoninae, Thymallinae и Coregoninae.
3. Способ по п. 1, где лососевая рыба представляет собой речного лосося, пойманного в зоне, простирающейся на 10 км выше по течению от устья реки.
4. Способ по п. 1, где на стадии (1) незрелые участки семенников различаются по своей степени зрелости и имеют относительно высокие степени зрелости, представляющие собой подвижность спермиев по меньшей мере 0,7%.
5. Способ по п. 1, где на стадии (4) время после обработки hCG составляет от 10 минут до 1 часа.
6. Способ по п. 1, где незрелые участки семенников содержат сперматогонии или сперматоциты.
7. Способ по п. 1, дополнительно включающий перед стадией (5) суспендирование спермиев и добавление к суспензии свежей воды для обеспечения истощения спермиями их АТР (аденозинтрифосфат) с получением PDRN высокой чистоты.
| CN 107287186 A, 24.10.2017 | |||
| EP 0226254 A2, 24.06.1987 | |||
| ФОСФАТМОБИЛИЗУЮЩИЙ ШТАММ ПОЧВЕННЫХ БАКТЕРИЙ LELLIOTTIA NIMIPRESSURALIS CCM 32-3 И БИОПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ОПТИМИЗАЦИИ МИНЕРАЛЬНОГО ПИТАНИЯ РАСТЕНИЙ, СТИМУЛЯЦИИ ИХ РОСТА И ПОВЫШЕНИЯ УРОЖАЙНОСТИ | 2018 |
|
RU2676926C1 |
| ИНЪЕКЦИОННАЯ КОМПОЗИЦИЯ ПОЛИДЕЗОКСИРИБОНУКЛЕОТИДОВ ДЛЯ ЛЕЧЕНИЯ КОСТНО-СУСТАВНЫХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2508115C2 |
Авторы
Даты
2022-03-23—Публикация
2021-09-02—Подача