Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к производным амида, которые являются блокаторами натриевых каналов и могут применяться в терапии, особенно при лечении боли.
Уровень техники
[0002] Производные амида по настоящему изобретению являются блокаторами натриевых каналов и могут применяться в терапии, особенно для лечения боли. Точнее, амидные производные по настоящему изобретению являются модуляторами Nav1.7 и Nav1.8 каналов. В последующем обсуждении изобретение иллюстрируется ссылкой на блокирование каналов Nav1.7 и Nav1.8. Соединения проявляют сродство к Nav1.7 и Nav1.8 каналам, которое значительно превосходит их сродство к каналу Nav1.5. Производные амида по настоящему изобретению показывают хорошую селективность в отношении Nav1.7 и Nav1.8 каналов по сравнению с Nav1.5 каналом.
[0003] Потенциалзависимые натриевые каналы (voltage-gated sodium channels - VGSC, Nav1.x) играют решающую роль в инициации и распространении потенциалов действия в возбудимых тканях. VGSC представляют собой цельные белки плазматической мембраны, состоящие из большой альфа-субъединицы и одной или нескольких более мелких бета-субъединиц. У человека было идентифицировано девять альфа-субъединиц (Nav1.1-Nav1.9) с различными биофизическими свойствами и профилями экспрессии. Nav1.7, Nav1.8 и Nav1.9 экспрессируются преимущественно в периферической нервной системе (NPL1). Биофизические характеристики Nav1.7 предполагают его участие в инициировании потенциалов действия, в то время как Nav1.8 вносит основной вклад в повышение потенциалов действия. Nav1.9 создает постоянный ток, который участвует в настройке мембранного потенциала покоя.
[0004] Nav1.7 высоко экспрессируется в нейронах дорсального корешкового ганглия (dorsal root ganglion - DRG), а также в симпатических нейронах, и его экспрессия распространяется как на центральный, так и на периферический терминал аксона. Nav1.7 активируется в доклинических моделях воспалительной и невропатической боли, включая диабетическую невропатию (NPL 2 и NPL 3). Роль Nav1.7 в боли была подтверждена в нокаутных исследованиях. У условной Nav1.7 нокаутной мыши, в организме которой Nav1.7 избирательно нокаутирован в Nav1.8-позитивных сенсорных нейронах, воспалительные болевые реакции, вызванные введением стимулирующих воздействий, таких как формалин, полный адъювант Фрейнда (complete Freund’s adjuvant - CFA) или фактор роста нервов (nerve growth factor - NGF), были снижены или отменены. Однако невропатическая боль развивалась нормально (NPL 4 и NPL 5). Условная абляция Nav1.7 в сенсорных и в симпатических нейронах или глобальная делеция Nav1.7 повторяет безболезненный фенотип, наблюдаемый у пациентов с врожденной нечувствительностью к боли, ассоциированной с каналопатией (channelopathy-associated congenital insensitivity to pain - CIP), устраняя воспалительную или невропатическую боль без какой-либо аномальной вегетативной дисфункции (NPL 5 и NPL 6).
[0005] У человека мутации в SCN9A, который кодирует Nav1.7, связаны с тремя болевыми расстройствами - наследственной эритромелалгией (inherited erythromelalgia - IEM), пароксизмальным экстремальным болевым расстройством (paroxysmal extreme pain disorder - PEPD) и врожденной нечувствительностью к боли, связанной с каналопатией (CIP). Мутации с усилением функции, повышающие активность канала и повышающие возбудимость DRG нейронов, вызывают тяжелые болевые синдромы: наследственную эритромелалгию (IEM) или пароксизмальное экстремальное болевое расстройство (PEPD). Мутации с потерей функции, вызывающие полную потерю функционального Nav1.7 вследствие усечения канала, неправильного сплайсинга или дефектного перемещения, приводят к неспособности чувствовать боль - врожденной нечувствительности к боли, связанной с каналопатией (CIP) (NPL 7).
[0006] Nav1.8 высоко экспрессируется как в немиелинизированных небольших C-волокнах, так и в тонко миелинизированных DRG нейронах A-дельта-волокон, и их уровень экспрессии значительно повышается при воспалительных состояниях (NPL 8). Несколько линий доказательств показали, что Nav1.8 несет большую часть тока натрия, лежащего в основе повышения потенциала действия в ноцицептивных нейронах. Мыши с глобальным нокаутом Nav1.8 показывали снижение болевых реакций на холодные раздражители и механическое давление, но нормальное развитие нейропатической боли (NPL 9 и NPL 10). Однако нокдаунные исследования с использованием антисмысловой или малой интенферирующей РНК (миРНК) Nav1.8 показали, что Nav1.8 участвует как в нейропатической боли, так и в воспалительной боли [NPL 11 и NPL 12]. Мутации усиления функции в SCN10A в организме человека, который кодирует Nav1.8, были недавно идентифицированы у пациентов с невропатией мелких волокон (SFN) без мутаций в Nav1.7 (NPL 6 и NPL 13). Описано моноклональное антитело, которое направлено на датчик напряжения Nav1.7 канала для облегчения боли и зуда (NPL 14).
[0007] Для лечения боли в условиях клиник использовались блокаторы потенциалзависимых натриевых каналов (например, лидокаин, галотан), но их применение зачастую ограничено недостаточной эффективностью вследствие низкой активности и нежелательных побочных эффектов, обусловленных селективностью, не относящейся к подтипу, особенно в отношении Nav1.5 (например, сердечной аритмией). Nav1.7 и Nav1.8 коэкспрессируются в периферической нервной системе и передают болезненные сигналы, функционируя в тандеме, причем Nav1.7 выступает в качестве порогового тока, а Nav1.8 вырабатывает большую часть тока натрия, лежащего в основе повышения потенциала действия во время повторного «выстрела». Следовательно, блокатор натриевых каналов с более высоким сродством к Nav1.7 и Nav1.8, чем к Nav1.5, может предоставить более благоприятный клинический профиль, чем существующие препараты.
Список цитированной литературы
Непатентная литература (non patent literature - NPL)
[0008]
{NPL 1} Cummins T.R., et al. Pain 2007; 131:243-257
{NPL 2} Dib-Hajj S.D., et al. Nat. Rev. Neurosci. 2013; 14: 49-62
{NPL 3} Hong S., et al. Journal of Biological Chemistry. 2004; 279: 29341-29350
{NPL 4} Massar M.A., et al. PNAS 2004; 101: 12706-12711
{NPL 5} Minett M.S., et al. Cell Report 2014; 6: 301-312
{NPL 6} Gingras J., et al. PLOS ONE 2014; 9: e105895
{NPL 7} Waxman S.G., et al. Lancet Neurol 2014; 13: 1152-1160
{NPL 8} Coggeshal R.E., et al. Neuroscience Letters 2004; 355: 45-48
{NPL 9} Akopian A.N., et al. Nat. Neurosci 1999; 2: 541-548
{NPL 10} Kerr B.J., et al. Neuroreport 2001; 12: 3077-3080
{NPL 11} Joshi S.K., et al. Pain 2006; 123: 75-82
{NPL 12} Dong X.W., et al. Neuroscience 2007; 146: 812-821
{NPL 13} Faber C.G., et al. PNAS 2012; 109: 19444-19449
{NPL 14} Lee J.H., et al. Cell. 2014; 157, 1393-1404
Сущность изобретения
Техническая проблема
[0009] Предметом настоящего изобретения является создание новых блокаторов Nav1.7 и Nav1.8 каналов, которые являются хорошими кандидатами применения в качестве лекарственных средств. Предпочтительные соединения эффективно связываются с Nav1.7 и Nav1.8 каналами, одновременно демонстрируя слабое сродство к другим натриевым каналам, в частности к Nav1.5 каналу. Они обладают благоприятными фармакокинетическими свойствами, такими как абсорбция, распределение, метаболизм и экскреция, для лечения состояния или расстройства, в которое вовлечены блокаторы Nav1.7 и Nav1.8 каналов. Они нетоксичны и демонстрируют мало побочных эффектов. Кроме того, идеальный кандидат на применение в качестве лекарственного средства будет существовать в физической форме, которая является стабильной, негигроскопичной и удобной для получения препарата.
[0010] В частности, амидные производные по настоящему изобретению селективны в отношении Nav1.7 и Nav1.8 каналов относительно Nav1.5 канала, что приводит к улучшению профиля побочных эффектов.
Следовательно, производные амида по настоящему изобретению могут применяться для лечения широкого спектра расстройств, в частности боли, острой боли, хронической боли, невропатической боли, воспалительной боли, висцеральной боли, ноцицептивной боли, включая послеоперационную боль и боли смешанных типов, в которые вовлечены внутренние органы, желудочно-кишечный тракт, черепно-мозговые структуры, костно-мышечная система, позвоночник, мочеполовая система, сердечно-сосудистая система и ЦНС (центральная нервная система), включая онкологическую боль, боль в спине, орофациальную боль и боль, вызванную химическими веществами.
[0011] Другие состояния, которые можно лечить с помощью амидных производных по настоящему изобретению, включают зуд, рассеянный склероз, нейродегенеративные расстройства, синдром раздраженного кишечника, остеоартрит, ревматоидный артрит, невропатологические расстройства, функциональные расстройства кишечника, воспалительные заболевания кишечника, боль, связанную с дисменореей, боль в области таза, цистит, панкреатит, мигрень, кластерные головные боли и головные боли напряжения, диабетическую невропатию, периферическую невропатичесую боль, ишиас, фибромиалгию, болезнь Крона, эпилепсию или эпилептические состояния, биполярную депрессию, тахиаритмию, расстройство настроения, биполярное расстройство, психические расстройства, такие как тревога и депрессия, миотонию, аритмию, двигательные расстройства, нейроэндокринные расстройства, атаксию, недержание, висцеральную боль, тригеминальную невралгию, герпетическую невралгию, общую невралгию, постгерпетическую невралгию, корешковую боль, боль в спине, головную боль или боль в шее, сильную или неустранимую боль, прорывную боль, послеоперационную боль, инсульт, онкологическую боль, судорожное расстройство и каузалгию.
[0012] Соединения показывают активность в отношении Nav1.7 и Nav1.8 каналов. Кроме того, они показывают селективность в отношении Nav1.7 и Nav1.8 каналов по сравнению с Nav1.5 каналом.
Решение проблемы
[0013] При лечении состояния или расстройства, в которое вовлечены блокаторы Nav1.7 и Nav1.8 каналов, соединения по настоящему изобретению по сравнению с другими соединениями, раскрытыми в данной области, могут проявлять меньшую токсичность; оптимальные поглощение, распределение, метаболизм и выведение; благоприятную растворимость; благоприятное связывание с белками плазмы; меньшее взаимодействие с другими лекарственными средствами; снижение ингибирующей активности в HERG канале; и/или меньшее удлинение интервала QT.
[0014] Настоящее изобретение обеспечивает следующие предметы.
[1] Соединение, представленное приведенной далее формулой (I):
[Хим. формула 1]

где
A представляет собой арил или гетероарил;
R1 выбран из группы, состоящей из -CF3, -CHF2, -OCF3, -SF5, -OCHF2, -OCH2CHF2, -OCH2CF3, -OCH2CH2CF3, -OCH(CH3)CF3, -OCH2C(CH3)F2, -OCH2CF2CHF2, -OCH2CF2CF3, -OCH2CH2OCH2CF3, -NHCH2CF3, -SCF3, -SCH2CF3, -CH2CF3, -CH2CH2CF3, -CH2OCH2CF3, -OCH2CH2OCF3 и фторбензилокси;
R2 независимо выбран из группы, состоящей из
(1) водорода, (2) галогена, (3) гидроксильной группы, (4) C1-6 алкила, (5) -O-C1-6 алкила, (6) C2-6 алкенила, (7) C3-7 циклоалкила, (8) -CN и (9) -(C=O)-NR6R7, где C1-6 алкил, -O-C1-6 алкил, C2-6 алкенил или C3-7 циклоалкил является незамещенным или замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и гидроксильной группы;
R1 и R2 могут быть одинаковыми или разными;
p равно 0, 1, 2, 3 или 4;
когда p равно двум или более, R2 являются одинаковыми или разными;
R1 и R2 могут находиться в любом положении на кольце А;
X выбран из группы, состоящей из -CR8aR8b-, -O-, -O-CR8aR8b-, -NR9-, -NR9-CR8aR8b-, -S- и -S-CR8aR8b-;
Z представляет собой CH, CR3 или N;
R3 независимо выбран из группы, состоящей из
(1) водорода, (2) галогена, (3) гидроксильной группы, (4) C1-6 алкила и (5) -O-C1-6 алкила;
q равно 0, 1, 2, или 3; когда q равно двум или более, R3 являются одинаковыми или разными;
R4 выбран из группы, состоящей из
(1) водорода, (2) C1-6 алкила, (3) C2-6 алкенила, (4) C3-7 циклоалкила, где C1-6 алкил, C2-6 алкенил или C3-7 циклоалкил является незамещенным или замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена, гидроксильной группы, -C1-6 алкила, -O-C1-6 алкила и C3-7 циклоалкила, и (5) арила, который является незамещенным или замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена, гидроксильной группы, C1-6 алкила, -O-C1-6 алкила, -C3-7 циклоалкила и -O-C3-7 циклоалкила;
R5a и R5c независимо выбраны из группы, состоящей из
(1) водорода, (2) галогена, (3) гидроксильной группы, (4) C1-6 алкила, (5) -O-C1-6 алкила и (6) C1-6 алкоксиC1-6 алкила, где C1-6 алкил, -O-C1-6 алкил и C1-6 алкоксиC1-6 алкил является незамещенным или замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и гидроксильной группы;
R5b и R5d независимо выбраны из группы, состоящей из (1) водорода, (2) галогена и (3) C1-6 алкила;
R5a может образовывать C3-6 циклоалкил с R5b;
R5c может образовывать C3-6 циклоалкил с R5d;
R6 и R7 независимо выбраны из группы, состоящей из (1) водорода, (2) C1-6 алкила и (3) C1-6 алкоксиC1-6 алкила, где C1-6 алкил или C1-6 алкоксиC1-6 алкил является незамещенным или замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и гидроксильной группы; R6 может образовывать 4-7 членное кольцо с R7, которое может содержать атом азота, атом кислорода, атом серы или двойную связь;
R8a и R8b независимо выбраны из группы, состоящей из
(1) водорода, (2) галогена, (3) гидроксильной группы, (4) C1-6 алкила и (5) -O-C1-6 алкила;
R9 выбран из группы, состоящей из (1) водорода и (2) C1-6 алкила;
или его пролекарство или фармацевтически приемлемая соль,
[00015] [2] Соединение, описанное в пункте [1], где
A представляет собой фенил, пиридил, пиразил, пиримидил, хинолил, изохинолил, хиноксалил или нафтил;
X выбран из группы, состоящей из -CR8aR8b-, -O-, -O-CR8aR8b-, -NR9-, -NR9-CR8aR8b- и -S-;
R5a и R5c независимо выбраны из группы, состоящей из
(1) водорода, (2) галогена, (3) гидроксильной группы и (4) C1-6 алкила, где C1-6 алкил является незамещенным или замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и гидроксильной группы;
R5b представляет собой водород;
R5d выбран из группы, состоящей из (1) водорода, (2) галогена и (3) C1-6 алкила;
R5c может образовывать C3-6 циклоалкил с R5d;
или его пролекарство или фармацевтически приемлемая соль,
[00016] [3] Соединение, представленное приведенной далее формулой (II):
[Хим. формула 2]
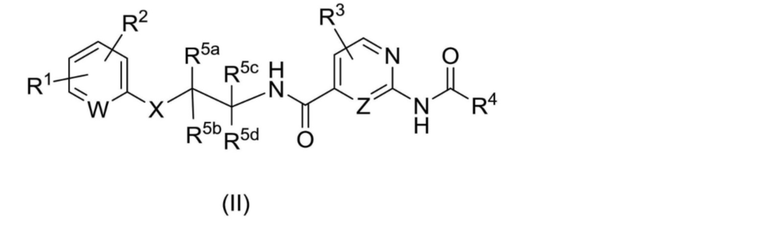
где
W представляет собой CH, CR1, CR2 или N;
R1 выбран из группы, состоящей из -CF3, -CHF2, -OCF3, -SF5, -OCH2CF3 и фторбензилокси;
R2 выбран из группы, состоящей из (1) водорода, (2) галогена, (3) гидроксильной группы, (4) C1-6 алкила, (5) -O-C1-6 алкила и (8) -CN;
X выбран из группы, состоящей из -CR8aR8b-, -O-, -O-CR8aR8b-, -NR9-, -NR9-CR8aR8b- и -S-;
Z представляет собой CH, CR3 или N;
R3 выбран из группы, состоящей из
(1) водорода, (2) галогена, (3) гидроксильной группы, (4) C1-6 алкила и (5) -O-C1-6 алкила;
R4 выбран из группы, состоящей из (1) C1-6 алкила и (2) C3-7 циклоалкила, где C1-6 алкил или C3-7 циклоалкил является незамещенным или замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена, гидроксильной группы, -C1-6 алкила, -O-C1-6 алкила и C3-7 циклоалкила;
R5a и R5c независимо выбраны из группы, состоящей из (1) водорода, (2) галогена, (3) гидроксильной группы и (4) C1-6 алкила, который является незамещенным или замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и гидроксильной группы;
R5b представляет собой водород;
R5d выбран из группы, состоящей из (1) водорода, (2) галогена и (3) C1-6 алкила;
R5c может образовывать C3-6 циклоалкил с R5d;
R8a и R8b независимо выбраны из группы, состоящей из
(1) водорода, (2) галогена, (3) гидроксильной группы, (4) C1-6 алкила и (5) -O-C1-6 алкила;
R9 выбран из группы, состоящей из (1) водорода и (2) C1-6 алкила;
или его пролекарство или фармацевтически приемлемая соль.
[0017] [4] Соединение, представленное приведенной далее формулой (III):
[Хим. формула 3]

где
W представляет собой CH или N;
R2 выбран из группы, состоящей из (1) водорода, (2) галогена, (3) гидроксильной группы, (4) C1-6 алкила, (5) -O-C1-6 алкила и (6) -CN;
X выбран из группы, состоящей из -CR8aR8b-, -O-, -O-CR8aR8b-, -NR9-, -NR9-CR8aR8b- и -S-;
Z представляет собой CH или N;
R3 выбран из группы, состоящей из
(1) водорода, (2) галогена, (3) гидроксильной группы, (4) C1-6 алкила и (5) -O-C1-6 алкила;
R4 выбран из группы, состоящей из (1) C1-6 алкила и (2) C3-7 циклоалкила, где C1-6 алкил или C3-7 циклоалкил является незамещенным или замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и гидроксильной группы;
R5a и R5c независимо выбраны из группы, состоящей из (1) водорода, (2) галогена, (3) гидроксильной группы и (4) C1-6 алкила, который является незамещенным или замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена и гидроксильной группы;
R5b и R5d представляют собой водород;
R8a и R8b представляют собой водород;
R9 представляет собой водород;
или его пролекарство или фармацевтически приемлемая соль,
[0018] [5] Соединение, описанное в пункте [4], где
W представляет собой N;
или его пролекарство или фармацевтически приемлемая соль.
[0019] [6] Соединение, которое выбрано из группы, состоящей из следующих соединений:
2-(циклопропанкарбоксамидо)-N-(2-(4-(трифторметил)фенокси)пропил)изоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-6-метилизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-(циклопропанкарбоксамидо)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-изобутирамидоизоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-6-метилизоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-6-метилпиримидин-4-карбоксамид;
2-метил-6-пропионамидо-N-(2-((5-(трифторметил)пиридин-2-ил)окси)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-изобутирамидоизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-(циклопропанкарбоксамидо)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксамид;
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-изобутирамидоизоникотинамид;
2-изобутирамидо-N-(2-(3-(трифторметокси)фенокси)этил)изоникотинамид;
2-ацетамидо-6-метил-N-(2-(3-(трифторметокси)фенокси)этил)изоникотинамид;
2-ацетамидо-N-(2-(2-хлор-4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-пропионамидоизоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-изобутирамидоизоникотинамид;
2-ацетамидо-N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
2-ацетамидо-6-метил-N-(2-(4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
N-(3-(3-хлор-5-(трифторметил)пиридин-2-ил)пропил)-2-(циклопропанкарбоксамидо)изоникотинамид;
2-ацетамидо-N-(3-(3-хлор-5-(трифторметил)пиридин-2-ил)пропил)-6-метилизоникотинамид;
N-(2-((3-фтор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(3-(3-хлор-5-(трифторметил)пиридин-2-ил)пропил)-2-пропионамидоизоникотинамид;
2-ацетамидо-6-метил-N-(2-(4-(пентафторсульфанил)фенокси)этил)изоникотинамид;
2-пропионамидо-N-(2-(4-(пентафторсульфанил)фенокси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(4-(пентафторсульфанил)фенокси)этил)изоникотинамид;
2-изобутирамидо-N-(2-(4-(пентафторсульфанил)фенокси)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксамид;
N-(2-((3-хлор-5-(трифторметил)пиримидин-2-ил)амино)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-(циклопропанкарбоксамидо)изоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксамид;
2-метил-6-пропионамидо-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-изобутирамидо-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-изобутирамидо-N-(2-((6-(трифторметил)хинолин-2-ил)амино)этил)изоникотинамид;
2-метил-6-пропионамидо-N-(2-((6-(трифторметил)изохинолин-1-ил)окси)этил)изоникотинамид;
2-метил-6-пропионамидо-N-(2-((6-(2,2,2-трифторэтокси)нафталин-2-ил)окси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-((6-(2,2,2-трифторэтокси)нафталин-2-ил)окси)этил)изоникотинамид;
2-изобутирамидо-N-(2-((6-(2,2,2-трифторэтокси)нафталин-2-ил)окси)этил)изоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)тио)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)тио)этил)-2-изобутирамидоизоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)тио)этил)-6-метилизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)тио)этил)-2-метил-6-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-пропионамидо-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-ацетамидо-6-метил-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-6-метил-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-изобутирамидо-6-метил-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)пиримидин-4-карбоксамид;
2-(2-гидрокси-2-метилпропанамидо)-6-метил-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
(R)-2-ацетамидо-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)изоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-пропионамидоизоникотинамид;
(R)-2-ацетамидо-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-6-метилизоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-метил-6-пропионамидоизоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-(циклопропанкарбоксамидо)изоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-изобутирамидоизоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-изобутирамидо-6-метилизоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксамид;
(S)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-метил-6-пропионамидоизоникотинамид;
(R)-2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-6-метилизоникотинамид;
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-метил-6-пропионамидоизоникотинамид;
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-(циклопропанкарбоксамидо)изоникотинамид;
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-изобутирамидо-6-метилизоникотинамид;
2-метил-6-пропионамидо-N-(2-((7-(трифторметил)хинолин-4-ил)окси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-((7-(трифторметил)хинолин-4-ил)окси)этил)изоникотинамид;
2-изобутирамидо-N-(2-((7-(трифторметил)хинолин-4-ил)окси)этил)изоникотинамид;
N-(2-((3-фтор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-((5-хлор-3-(трифторметил)пиридин-2-ил)окси)этил)-2-метил-6-пропионамидоизоникотинамид;
2-пропионамидо-N-(2-((4-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-метил-6-пропионамидо-N-(2-((4-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-изобутирамидо-N-(2-((4-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-((4-(трифторметил)хинолин-2-ил)окси)этил)пиримидин-4-карбоксамид;
2-бутирамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-пиваламидоизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-6-метил-2-пропионамидопиримидин-4-карбоксамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-изобутирамидо-6-метилпиримидин-4-карбоксамид;
2-ацетамидо-N-(2-(2-фтор-4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-2-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-фтор-4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-2-изобутирамидоизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-2-изобутирамидо-6-метилизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-фтор-4-(трифторметил)фенокси)этил)пиримидин-4-карбоксамид;
N-(2-(4-хлор-3-(трифторметил)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-(4-хлор-3-(трифторметил)фенокси)этил)-2-изобутирамидоизоникотинамид;
N-(2-(4-хлор-3-(трифторметил)фенокси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-(2-хлор-5-(трифторметил)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-(2-хлор-5-(трифторметил)фенокси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-(циклопропанкарбоксамидо)изоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-изобутирамидоизоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)-2-метилпропан-2-ил)-2-пропионамидоизоникотинамид;
N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)-2-метилпропан-2-ил)-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксамид;
N-(1-(((3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)циклопропил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-((3-циано-5-(трифторметил)пиридин-2-ил)окси)этил)-2-метил-6-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)изоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-пропионамидоизоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
2-ацетамидо-N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-6-метилизоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксамид;
2-ацетамидо-N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)пропил)изоникотинамид;
N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)пропил)-2-пропионамидоизоникотинамид
N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)пропил)-2-изобутирамидоизоникотинамид;
2-ацетамидо-N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)пропил)-6-метилизоникотинамид;
2-ацетамидо-N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)изоникотинамид;
N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-изобутирамидоизоникотинамид;
2-ацетамидо-N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-6-метилизоникотинамид;
N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксамид;
2-ацетамидо-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-2-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)изоникотинамид;
2-изобутирамидо-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
2-изобутирамидо-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)пиримидин-4-карбоксамид;
N-(1-(((3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)циклопропил)-2-изобутирамидо-6-метилпиримидин-4-карбоксамид;
N-(1-(((3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)циклопропил)-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксамид;
2-бутирамидо-N-(1-(((3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)циклопропилизоникотинамид;
2-ацетамидо-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-(2-метил-4-(трифторметил)фенокси)этил)-2-пропионамидоизоникотинамид;
2-ацетамидо-6-метил-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
2-метил-N-(2-(2-метил-4-(трифторметил)фенокси)этил)-6-пропионамидоизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
2-изобутирамидо-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-6-метил-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
2-изобутирамидо-6-метил-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-метил-4-(трифторметил)фенокси)этил)пиримидин-4-карбоксамид;
N-(2-(4-хлор-3-(трифторметил)фенокси)этил)-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксамид;
N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)-2-пропионамидоизоникотинамид;
N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)-2-изобутирамидоизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)пиримидин-4-карбоксамид;
2-(циклопропанкарбоксамидо)-N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)изоникотинамид;
2-ацетамидо-N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)-6-метилизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)-6-метилпиримидин-4-карбоксамид;
2-ацетамидо-N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)изоникотинамид; и
N-(2-(3-фтор-4-(трифторметил)фенокси)этил)-2-изобутирамидоизоникотинамид;
или его пролекарство или фармацевтически приемлемая соль.
[0020] [7] Соединение, описанное в пункте [6], которое выбрано из группы, состоящей из следующих соединений:
2-(циклопропанкарбоксамидо)-N-(2-(4-(трифторметил)фенокси)пропил)изоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-6-метилизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-(циклопропанкарбоксамидо)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-изобутирамидоизоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-6-метилизоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-6-метилпиримидин-4-карбоксамид;
2-метил-6-пропионамидо-N-(2-((5-(трифторметил)пиридин-2-ил)окси)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-изобутирамидоизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-(циклопропанкарбоксамидо)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксамид;
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-изобутирамидоизоникотинамид;
2-изобутирамидо-N-(2-(3-(трифторметокси)фенокси)этил)изоникотинамид;
2-ацетамидо-6-метил-N-(2-(3-(трифторметокси)фенокси)этил)изоникотинамид;
2-ацетамидо-N-(2-(2-хлор-4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-пропионамидоизоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-изобутирамидоизоникотинамид;
2-ацетамидо-N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
2-ацетамидо-6-метил-N-(2-(4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
N-(3-(3-хлор-5-(трифторметил)пиридин-2-ил)пропил)-2-(циклопропанкарбоксамидо)изоникотинамид;
2-ацетамидо-N-(3-(3-хлор-5-(трифторметил)пиридин-2-ил)пропил)-6-метилизоникотинамид;
N-(2-((3-фтор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(3-(3-хлор-5-(трифторметил)пиридин-2-ил)пропил)-2-пропионамидоизоникотинамид;
2-ацетамидо-6-метил-N-(2-(4-(пентафторсульфанил)фенокси)этил)изоникотинамид;
2-пропионамидо-N-(2-(4-(пентафторсульфанил)фенокси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(4-(пентафторсульфанил)фенокси)этил)изоникотинамид;
2-изобутирамидо-N-(2-(4-(пентафторсульфанил)фенокси)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-(циклопропанкарбоксамидо)изоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)тио)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)тио)этил)-2-изобутирамидоизоникотинамид;
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)тио)этил)-6-метилизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)тио)этил)-2-метил-6-пропионамидоизоникотинамид;
(R)-2-ацетамидо-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)изоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-пропионамидоизоникотинамид;
(R)-2-ацетамидо-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-6-метилизоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-метил-6-пропионамидоизоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-(циклопропанкарбоксамидо)изоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-изобутирамидоизоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-изобутирамидо-6-метилизоникотинамид;
(R)-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксамид;
(S)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-метил-6-пропионамидоизоникотинамид;
(R)-2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-6-метилизоникотинамид;
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-метил-6-пропионамидоизоникотинамид;
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-(циклопропанкарбоксамидо)изоникотинамид;
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-((3-фтор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-((5-хлор-3-(трифторметил)пиридин-2-ил)окси)этил)-2-метил-6-пропионамидоизоникотинамид;
2-бутирамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)изоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-пиваламидоизоникотинамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-6-метил-2-пропионамидопиримидин-4-карбоксамид;
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-изобутирамидо-6-метилпиримидин-4-карбоксамид;
2-ацетамидо-N-(2-(2-фтор-4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-2-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-фтор-4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-2-изобутирамидоизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
N-(2-(2-фтор-4-(трифторметил)фенокси)этил)-2-изобутирамидо-6-метилизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-фтор-4-(трифторметил)фенокси)этил)пиримидин-4-карбоксамид;
N-(2-(4-хлор-3-(трифторметил)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-(4-хлор-3-(трифторметил)фенокси)этил)-2-изобутирамидоизоникотинамид;
N-(2-(4-хлор-3-(трифторметил)фенокси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-(2-хлор-5-(трифторметил)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-(2-хлор-5-(трифторметил)фенокси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-(циклопропанкарбоксамидо)изоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-изобутирамидоизоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-изобутирамидо-6-метилизоникотинамид;
N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)-2-метилпропан-2-ил)-2-пропионамидоизоникотинамид;
N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)-2-метилпропан-2-ил)-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксамид;
N-(1-(((3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)циклопропил)-2-изобутирамидо-6-метилизоникотинамид;
N-(2-((3-циано-5-(трифторметил)пиридин-2-ил)окси)этил)-2-метил-6-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)изоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-пропионамидоизоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид;
2-ацетамидо-N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-6-метилизоникотинамид;
N-(2-(2-хлор-4-(трифторметокси)фенокси)этил)-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксамид;
2-ацетамидо-N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)пропил)изоникотинамид;
N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)пропил)-2-пропионамидоизоникотинамид;
N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)пропил)-2-изобутирамидоизоникотинамид;
2-ацетамидо-N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)пропил)-6-метилизоникотинамид;
2-ацетамидо-N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)изоникотинамид;
N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-изобутирамидоизоникотинамид;
2-ацетамидо-N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-6-метилизоникотинамид;
N-(3-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксамид;
2-ацетамидо-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-2-пропионамидоизоникотинамид;
2-ацетамидо-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-2-метил-6-пропионамидоизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)изоникотинамид;
2-изобутирамидо-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
2-изобутирамидо-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)пиримидин-4-карбоксамид;
N-(1-(((3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)циклопропил)-2-изобутирамидо-6-метилпиримидин-4-карбоксамид;
N-(1-(((3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)циклопропил)-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксамид;
2-бутирамидо-N-(1-(((3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)циклопропилизоникотинамид;
2-ацетамидо-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
N-(2-(2-метил-4-(трифторметил)фенокси)этил)-2-пропионамидоизоникотинамид;
2-ацетамидо-6-метил-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
2-метил-N-(2-(2-метил-4-(трифторметил)фенокси)этил)-6-пропионамидоизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
2-изобутирамидо-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-6-метил-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
2-изобутирамидо-6-метил-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(2-метил-4-(трифторметил)фенокси)этил)пиримидин-4-карбоксамид;
N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)-2-пропионамидоизоникотинамид;
N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)-2-изобутирамидоизоникотинамид;
2-(циклопропанкарбоксамидо)-N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)пиримидин-4-карбоксамид;
2-(циклопропанкарбоксамидо)-N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)изоникотинамид;
2-ацетамидо-N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)-6-метилизоникотинамид;
2-ацетамидо-N-(2-(3-фтор-4-(трифторметокси)фенокси)этил)изоникотинамид; и
N-(2-(3-фтор-4-(трифторметил)фенокси)этил)-2-изобутирамидоизоникотинамид;
или его пролекарство или фармацевтически приемлемая соль.
[0021] [8] Фармацевтическая композиция, включающая соединение или его пролекарство или фармацевтически приемлемую соль, которые описаны в любом из пунктов [1]-[7], и фармацевтически приемлемый носитель.
[0022] [9] Фармацевтическая композиция, которая описана в пункте [8], дополнительно включающая другое фармакологически активное средство.
[0023] [10] Способ лечения состояния или расстройства, в которое вовлечены блокаторы Nav1.7 и Nav1.8 каналов, у животного, в том числе человека, который включает введение животному, нуждающемуся в таком лечении, терапевтически эффективного количество соединения или его пролекарства или фармацевтически приемлемой соли, которые описаны в любом из пунктов [1]-[7].
[0024] [11] Способ, описанный в пункте [10], где указанное состояние или расстройство выбрано из группы, состоящей из боли, острой боли, хронической боли, невропатической боли, воспалительной боли, висцеральной боли, ноцицептивной боли, зуда, рассеянного склероза, нейродегенеративного расстройства, синдрома раздраженного кишечника, остеоартрита, ревматоидного артрита, невропатологических расстройств, функциональных расстройств кишечника, воспалительных заболеваний кишечника, боли, связанной с дисменореей, тазовой боли, цистита, панкреатита, мигрени, кластерных головных болей и головных болей напряжения, диабетической невропатии, периферической невропатической боли, ишиаса, фибромиалгии, болезни Крона, эпилепсии или эпилептических состояний, биполярной депрессии, тахиаритмии, расстройства настроения, биполярного расстройства, психических расстройств, таких как беспокойство и депрессия, миотонии, аритмии, двигательных расстройств, нейроэндокринных расстройств, атаксии, недержания, висцеральной боли, тригеминальной невралгии, герпетической невралгии, общей невралгии, постгерпетической невралгии, корешковой боли, боли в спине, головной боли или боли в шее, сильной или неустранимой боли, прорывной боли, послеоперационной боли, инсульта, онкологической боли, судорожного расстройства, каузалгии, боли, вызванной химическими веществами, и их комбинаций.
[0025] [12] Применение соединения, описанного в любом из пунктов [1]-[7], или его фармацевтически приемлемой соли, пролекарства, сольвата или композиции для производства лекарственного средства для лечения состояния или расстройства, в которое вовлечены блокаторы Nav1.7 и Nav1.8 каналов.
[0026] [13] Применение, которое описано в пункте [12], где указанное состояние или расстройство выбрано из группы, состоящей из боли, острой боли, хронической боли, невропатической боли, воспалительной боли, висцеральной боли, ноцицептивной боли, зуда, рассеянного склероза, нейродегенеративного расстройства, синдрома раздраженного кишечника, остеоартрита, ревматоидного артрита, невропатологических расстройств, функциональных расстройств кишечника, воспалительных заболеваний кишечника, боли, связанной с дисменореей, тазовой боли, цистита, панкреатита, мигрени, кластерных головных болей и головных болей напряжения, диабетической невропатии, периферической невропатической боли, ишиаса, фибромиалгии, болезни Крона, эпилепсии или эпилептических состояний, биполярной депрессии, тахиаритмии, расстройства настроения, биполярного расстройства, психических расстройств, таких как беспокойство и депрессия, миотонии, аритмии, расстройств движения, нейроэндокринных расстройств, атаксии, недержания, висцеральной боли, тригеминальной невралгии, герпетической невралгии, общей невралгии, постгерпетической невралгии, корешковой боли, боли в спине, головной боли или боли в шее, сильной или неустранимой боли, прорывной боли, послеоперационной боли, инсульта, онкологическовой боли, судорожного расстройства, каузалгии, боли, вызванной химическими веществами,и их комбинаций.
[0027] [14] Соединение, описанное в любом из пунктов [1]-[7], или его пролекарство или фармацевтически приемлемая соль для применения в лечении состояния или расстройства, в которое вовлечены блокаторы Nav1.7 и Nav1.8 каналов.
[0028] [15] Способ получения фармацевтической композиции, включающий смешивание соединения или его пролекарства или фармацевтически приемлемой соли, которые описаны в любом из пунктов [1]-[7], и фармацевтически приемлемого носителя или эксципиента.
Полезные эффекты изобретения
[0029] Амидные производные по настоящему изобретению являются блокаторами натриевых каналов и могут применяться для терапевтического лечения, в частности для лечения боли. Точнее, амидные производные по настоящему изобретению являются селективными блокаторами Nav1.7 и Nav1.8 каналов. Они показывают сродство к Nav1.7 и Nav1.8 каналам, которое значительно превосходит их сродство к Nav1.5 каналу.
[0030] В частности, амидные производные по настоящему изобретения являются селективными в отношении Nav1.7 и Nav1.8 каналов относительно Nav1.5 канала, что приводит к улучшению профиля побочных эффектов. Следовательно, амидные производные по настоящему изобретению могут применяться при лечении широкого спектра расстройств, в частности боли, острой боли, хронической боли, невропатической боли, воспалительной боли, висцеральной боли, ноцицептивной боли, включая послеоперационную боль, и болей смешанных типов, в которые вовлечены внутренние органы, желудочно-кишечный тракт, черепно-мозговые структуры, костно-мышечная система, позвоночник, мочеполовая система, сердечно-сосудистая система и ЦНС, включая онкологическую боль, боль в спине, орофациальную боль и боль, вызванную химическими веществами.
[0031] Другие состояния, которые можно лечить с помощью амидных производных по настоящему изобретению, включают зуд, рассеянный склероз, нейродегенеративные расстройства, синдром раздраженного кишечника, остеоартрит, ревматоидный артрит, невропатологические расстройства, функциональные расстройства кишечника, воспалительные заболевания кишечника, боль, связанную с дисменореей, боль в области таза, цистит, панкреатит, мигрень, кластерные головные боли и головные боли напряжения, диабетическую невропатию, периферическую невропатическую боль, ишиас, фибромиалгию, болезнь Крона, эпилепсию или эпилептические состояния, биполярную депрессию, тахиаритмию, расстройство настроения, биполярное расстройство, психические расстройства, такие как беспокойство и депрессия, миотонию, аритмию, двигательные расстройства, нейроэндокринные расстройства, атаксию, недержание, висцеральную боль, тригеминальную невралгию, герпетическую невралгию, общую невралгию, постгерпетическую невралгию, корешковую боль, боль в спине, головную боль или боль в шее, сильную или неустранимую боль, прорывную боль, послеоперационную боль, инсульт, онкологическую боль, судорожное расстройство и каузалгию.
[0032] Как показано на приведенных выше формулах (I), (II) и (III), настоящее изобретение характеризуется амидным фрагментом в правой части. Bayer CropScience раскрывает структурно близкие соединения в WO2014/076015, WO2015/144657 и EP2730570. Считается, что наиболее близкими соединениями являются соединения примеров № 1-63 и № 1-3 в WO2014/076015. Различие между настоящим изобретением и структурно близким уровнем техники четко выявляется следующим образом.
[0033] Активности в отношении Nav1.7 канала типичных химических структур по настоящему изобретению и близких к ним структур представлены в приведенной далее таблице 1. Соединение (A) примера 13 и соединение (B) примера 35 настоящего изобретения обладают ингибирующей активностью в отношении Nav1.7 каналов со значениями IC50 0,37 мкМ и 0,19 мкМ, соответственно. Сравнительное соединение (C) № 1-63 и сравнительное соединение (D) № 1-3 структурно близкого уровня техники проявляют ингибирующую активность в отношении канала Nav1.7 со значениеями IC50 > 3 мкМ. Соединения примеров 13 и 35 также показывают хорошую активность в отношении Nav1.8 канала. Кроме того, соединения структурно близкого уровня техники примененяются для контроля эндопаразитов и нематод, а также вредных микроорганизмов в растениях.
[0034]
[Таблица 1]

[0035] Кроме того, соединения с амидным фрагментом в правой части раскрыты в WO 2015/069593 и WO 2012/053186. Однако соединения с О-связью в средней части никогда не встречаются в упомянутой литературе.
[0036] Примеры состояний или расстройств, опосредуемых Nav1.7 и Nav1.8 каналами, включают, но без ограничения, заболевания, связанные с Nav1.7 и Nav1.8 каналами. Соединения по настоящему изобретению проявляют блокирующую активность в отношении Nav1.7 и Nav1.8 каналов. Соединения по настоящему изобретению могут проявлять меньшую токсичность; благоприятное поглощение, распределение, метаболизм и выведение; благоприятную растворимость; благоприятную аффинность связывания белков, отличных от Nav1.7 и Nav1.8; меньшее взаимодействие с другими лекарственными средствами; меньшую ингибирующую активность в отношении HERG канала; и/или меньшее удлинение интервала QT.
Описание вариантов осуществления изобретения
[0037] Специалистам в данной области понятно, что термин «галоген» или «галоген», используемый в данном документе, включает фтор, хлор, бром и йод. Аналогично, «1-6», как в C1-6, определяется для идентификации числа, составляющего 1, 2, 3, 4, 5 или 6. Согласно определению, «C1-6», как, например, в термине «C1-6 алкил», идентифицирует алкильную группу, содержащую 1, 2, 3, 4, 5 или 6 атомов углерода. Точно так же, C2-6 алкенил определяется для идентификации алкенильной группы как содержащей 2, 3, 4, 5 или 6 атомов углерода. Группа, которая определена как независимо замещенная заместителями, может быть независимо замещена множеством таких заместителей.
[0038] Термин «алкил», используемый в настоящем документе, означает линейный насыщенный одновалентный углеводородный радикал, содержащий от одного до шести атомов углерода, или разветвленный насыщенный одновалентный углеводородный радикал, содержащий от трех до шести атомов углерода, например метил, этил, пропил, 2-пропил, бутил (включая все изомерные формы), пентил (включая все изомерные формы) и т.п.
[0039] Термин «алкокси», когда используется в настоящем описании, означает -O-алкил, такой как, но без ограничения, метокси, этокси, пропокси, 2-пропокси, бутокси (включая все изомерные формы) и т.п.
[0040] Термин «алкенил», когда используется в настоящем описании, означает углеводородный радикал, содержащий по меньшей мере одну двойную связь с E- или Z-пространственной конфигурацией, включая, но без ограничения, этенил, пропенил, 1-бутенил, 2-бутенил и т.п.
[0041] Термин «циклоалкил», когда используется в настоящем описании, означает моно-, би- или трициклическое кольцо, такое как, но без ограничения, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, норборнил, адамантил и т.п.
[0042] Термин «арил», когда используется в настоящем описании, означает ненасыщенное или частично насыщенное моно- или бициклическое 5-15-членное кольцо, которое состоит из атомов углерода. Примеры такого арила включают, но без ограничения, фенил, нафтил, инданил, инденил, 1,2,3,4-тетрагидронафтил, 1,2-дигидронафтил, 2,3-дигидро-1Н-инденил, циклогексенил, циклопентенил, (1S,4S)-бицикло[2.2.2]окт-2-енил и (1R,4S)-бицикло[2.2.1]гепт-2-енил и т.п.
[0043] Термин «гетероарил», когда используется в настоящем описании, означает ненасыщенное и частично насыщенное моно- или бициклическое 5-15-членное кольцо, предпочтительно 5-10-членное кольцо, которое может содержать 1-4 гетероатома, выбранных из атомов O, N и S. Примеры такого гетероарила включают, но без ограничения, тиофенил, тиазолил, изоксазолил, пиразолил, пиразил, тетразолил, фуранил, пирролил, имидазолил, оксазолил, изотиазолил, триазолил, тиадиазолил, пиридил, пиримидил, пиридазинил, пиразинил, триазинил, бензофуранил, бензотиофенил, бензотриазолил, индолил, индазолил, бензоимидазолил, пирролопиридил, пирролопиримидинил, пиразолопиридил, пиразолопиримидил, имидазопиридинил, фуропиридил, бензоизоксазолил, имидазопиразинил, имидазопиридазинил, имидазопиримидинил, хинолил, изохинолил, хиноксалил, хиназолинил, фталазинил, хиноксалинил, нафтиридинил, пиридопиримидинил, их N-оксиды и S-оксиды и т.п.
[0044] Термин «лечение», когда используется в настоящем описании, включает подавление, ограничение, замедление, остановку или обращение развития или тяжести существующего симптома или расстройства. Термин «предотвращение» или «предотвращать», когда используется в настоящем описании, включает подавление, ограничение или ингибирование появления или проявления симптома или расстройства.
[0045] Артикль “а” или “an”, когда используется в настоящем описании, относится как к единственной, так и к множественной форме объекта, к которому он относится, если не указано иное.
[0046] В объем термина «соединения по настоящему изобретению» включены все соли, сольваты, гидраты, комплексы, полиморфы, пролекарства, производные с радиоактивной меткой, стереоизомеры и оптические изомеры соединений формул (I), (II) и (III).
[0047] Соединения формул (I), (II) и (III) могут образовывать кислотно-аддитивные соли. Понятно, что для применения в медицине соли соединений формул (I), (II) и (III) должны быть фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли будут очевидны для специалистов в данной области и включают соли, описанные в J. Pharm. Sci., 1977, 66, 1-19, такие как кислотно-аддитивные соли, образованные с неорганическими кислотами, например, но без ограничения, с соляной, бромистоводородной, серной, азотной или фосфорной кислотой; и с органическими кислотами, например, но без ограничения, с янтарной, малеиновой, муравьиной, уксусной, трифторуксусной, пропионовой, фумаровой, лимонной, винной, бензойной, п-толуолсульфоновой, метансульфоновой или нафталинсульфоновой кислотой. Некоторые из соединений формул (I), (II) и (III) могут образовывать кислотно-аддитивные соли с одним или несколькими эквивалентами кислоты. Настоящее изобретение включает все возможные стехиометрические и нестехиометрические формы. Кроме того, некоторые соединения, содержащие кислотную функцию, такую как карбоксильная группа, могут быть выделены в форме неорганической соли, в которой противоион может быть выбран из натрия, калия, лития, кальция, магния и т.п., а также из органических оснований, такихе как холин, аргинин, бензатин, диэтиламин, глицин, лизин, меглюмин, оламин, 2-амино-2-метилпропан-1-ол, бенетамин, трет-бутиламин, эполамин, этилендиамин, гидрабамин, морфолин, пиперазин, прокаин, триэтаноламин, диэтаноламин, моноэтаноламин, триизопропаноламин и трометамин.
[0048] В объем изобретения входят так называемые «пролекарства» соединений формул (I), (II) и (III). Таким образом, некоторые производные соединений формул (I), (II) и (III), которые сами могут обладать незначительной фармакологической активностью или вообще не проявлять фармакологическую активность, могут при введении в организм или в организме превращаться в соединения формул (I), (II) и (III), обладающие желаемой активностью, например в результате гидролитического расщепления. Такие производные называются «пролекарствами». Дополнительную информацию о применении пролекарств можно найти в Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T. Higuchi and W. Stella) и Bioreversible Carriers in Drug Design, Pergamon Press, 1987 (ed. E.B. Roche, American Pharmaceutical Association).
[0049] Термин «животное», когда используется в настоящем описании, включает субъекта-млекопитающего или субъекта, не являющегося млекопитающим. Примеры подходящего субъекта-млекопитающего могут включать, но без ограничения, человека, грызунов, домашних животных, домашний скот и приматов. Подходящие грызуны могут включать, но без ограничения, мышей, крыс, хомяков, песчанок и морских свинок. Подходящие домашние животные могут включать, но без ограничения, кошек, собак, кроликов и хорьков. Подходящий домашний скот может включать, но без ограничения, лошадей, коз, овец, свиней, крупный рогатый скот, лам и альпак. Подходящие приматы могут включать, но без ограничения, шимпанзе, лемуров, макак, мартышек, паукообразных обезьян, беличьих обезьян и зеленых мартышек. Примеры подходящего субъекта, не являющегося млекопитающим, могут включать, без ограничения, птиц, рептилий, амфибий и рыб. Примеры птиц включают, но без ограничения, кур, индеек, уток и гусей. Предпочтительным субъектом-млекопитающим является человек.
[0050] Пролекарства по настоящему изобретению могут быть получены, например, заменой соответствующих функциональных групп, присутствующих в соединениях формул (I), (II) и (III), на определенные группы, известные специалистам в данной области техники как «про-фрагменты», как описано, например, в монографии Bundgaard H. Design of Prodrugs (Elsevier, 1985). Некоторые примеры пролекарств по настоящему изобретению включают следующие производные:
(i) когда соединение формул (I), (II) и (III) содержит спиртовую функциональность (-OH), соединения, в которых гидроксильная группа замещена фрагментом, способным в условиях in vivo превращаться в гидроксильную группу. Указанный фрагмент, способный превращаться in vivo в гидроксильную группу, представляет собой фрагмент, который способен in vivo превращаться в гидроксильную группу посредством, например, гидролиза и/или под действием фермента, например эстеразы. Примеры указанного фрагмента включают, но без ограничения, сложноэфирные и эфирные группы, которые в условиях in vivo могут легко гидролизоваться. Предпочтительные фрагменты замещают водород гидроксильной группы на ацилоксиалкил, 1-(алкоксикарбонилокси)алкил, фталидил и ацилоксиалкилоксикарбонил, такой как пивалоилоксиметилоксикарбонил;
(ii) когда соединение формул (I), (II) и (III) содержит аминогруппу, амидное производное, полученное взаимодействием с подходящим галогенангидридом кислоты или подходящим ангидридом кислоты, является примером пролекарства. Особенно предпочтительным амидным производным в качестве пролекарства является -NHCO(CH2)2OCH3, -NHCOCH(NH2)CH3 или т.п.
[0051] Дополнительные примеры замещающих групп в соответствии с приведенными выше примерами и примерами других типов пролекарств можно найти в вышеупомянутых ссылках.
[0052] Соединения формул (I), (II) и (III) и их соли могут быть получены в кристаллической или некристаллической форме и, если они кристаллические, необязательно могут быть гидратированными или сольватированными. В объем настоящего изобретения входят стехиометрические гидраты или сольваты, а также соединения, содержащие различные количества воды и/или растворителя.
[0053] Соли и сольваты, содержащие фармацевтически не приемлемые противоионы или связанные растворители, входят в объем настоящего изобретения, например для применения в качестве промежуточных соединений при получении других соединений формул (I), (II) и (III) и их фармацевтически приемлемых солей.
[0054] Соединения формул (I), (II) и (III) могут иметь полиморфы в кристаллической форме, которые входят в объем настоящего изобретения.
[0055] Кроме того, соединения формул (I), (II) и (III) могут вводиться в виде пролекарств. Термин «пролекарство» в отношении соединения формул (I), (II) и (III), когда используется в настоящем описании, включает собой функциональное производное соединения, которое при введении пациенту в условиях in vivo в конечном итоге высвобождает соединение формул (I), (II) и (III). Введение соединения формул (I), (II) и (III) в форме пролекарства может позволить специалисту в данной области выполнить одно или несколько из следующих действий: (а) модифицировать начало действия соединения in vivo; (b) модифицировать продолжительность действия соединения in vivo; (c) модифицировать транспорт или распределение соединения in vivo; (d) модифицировать растворимость соединения in vivo; и (d) подавить побочный эффект или другие ограничения, которые мешают применению соединения. Типичные функциональные производные, используемые для получения пролекарств, включают модификации соединения, которые химически или ферментативно расщепляются in vivo. Такие модификации, которые включают фосфаты, амиды, сложные эфиры, тиоэфиры, карбонаты и карбаматы, хорошо известны специалистам в данной области.
[0056] Некоторые соединения формул (I), (II) и (III) могут содержать один или несколько хиральных атомов углерода. В таких случаях соединения формул (I), (II) и (III) существуют в виде стереоизомеров. Изобретение распространяется на все оптические изомеры, такие как стереоизомерные формы соединений формул (I), (II) и (III), включая энантиомеры, диастереоизомеры и их смеси, такие как рацематы. Различные стереоизомерные формы могут быть выделены или разделены одна от другой обычными методами, или любой данный изомер может быть получен обычным стереоселективным или асимметричным синтезом.
[0057] Некоторые из соединений по настоящему изобретению могут существовать в различных таутомерных формах, и следует представлять, что изобретение включает все такие таутомерные формы.
[0058] Изобретение также включает изотопно-меченые соединения, которые идентичны соединениям, описанным в настоящем изобретении, но с тем отличием, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть введены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, йода и хлора, такие как 2H, 3H, 11C, 13C, 14C, 18F, 123I и 125I. Соединения по настоящему изобретению, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, входят в объем настоящего изобретения. Изотопно-меченые соединения по настоящему изобретению, например соединения, в которые введены радиоактивные изотопы, такие как 3H, 14C, могут применяться в анализах распределения лекарственного средства и/или субстрата в ткани. Тритированные изотопы, то есть изотопы, содержащие 3H, и изотопы, содежащие углерод-14, то есть 14C, являются особенно предпочтительными вследствие простоты их получения и обнаружения. Изотопы 11C и 18F особенно полезны в ПЭТ (позитронно-эмиссионная томографии), а изотопы 123I особенно полезны в SPECT (single photon emission computerized tomography - однофотонной эмиссионной компьютерной томографии), все они могут применяться для визуализации мозга. Кроме того, замена более тяжелыми изотопами, такими как дейтерий, то есть 2H, может дать определенные терапевтические преимущества, обусловленные большей метаболической стабильностью, например увеличенным периодом полувыведения in vivo или сниженными требованиями к дозировке, и, следовательно, может быть предпочтительной в некоторых обстоятельствах. Изотопно-меченые соединения по настоящему изобретению, как правило, могут быть получены в соответствии с методиками, раскрытыми на схемах и/или в приведенных ниже примерах, с последующим замещением легко доступного изотопно-меченого реагента изотопно не меченным.
[0059] Что касается других соединений, раскрытых в данной области техники, некоторые соединения проявляют неожиданные свойства, например связанные с продолжительностью действия и/или метаболизмом, такие как повышенная метаболическая стабильность, повышенная пероральная биодоступность или абсорбция и/или пониженное взаимодействие «лекарственное средство-лекарственное средство».
[0060] Соединения формул (I), (II) и (III), являющиеся блокаторами Nav1.7 и Nav1.8 каналов, потенциально применимы в лечении ряда расстройств. Лечение боли, в частности хронической, воспалительной, невропатической, ноцицептивной и висцеральной боли, является предпочтительным применением.
[0061] Физиологическая боль является важным защитным механизмом, предназначенным для предупреждения об опасности потенциально вредных раздражителей внешней среды. Система работает через определенный набор первичных сенсорных нейронов и активируется вредными стимулами через механизмы периферической трансдукции (см. обзор Millan, 1999, Prog. Neurobiol., 57, 1-164). Эти сенсорные волокна известны как ноцицепторы и являются аксонами характерно малого диаметра с медленными скоростями проводимости. Ноцицепторы кодируют интенсивность, длительность и качество вредного стимула и в силу своей топографически организованной проекции на спинной мозг - расположение стимула. Ноцицепторы обнаруживаются на ноцицептивных нервных волокнах, которые делятся на два основных типа: A-дельта-волокна (миелинизированные) и С-волокна (немиелинизированные). Активность, генерируемая входом ноцицептора, после сложной обработки в дорсальном роге непосредственно или через ретрансляционные ядра ствола мозга передается в вентробазальный таламус, а затем в кору головного мозга, где возникает ощущение боли.
[0062] Боль обычно может классифицироваться как острая или хроническая. Острая боль начинается внезапно и является непродолжительной (обычно в течение двенадцати недель или менее). Она обычно связана с конкретной причиной, такой как специфическое повреждение, и зачастую является сильной и серьезной. Острая боль представляет собой разновидность боли, которая может возникнуть после определенных травм, полученных в результате хирургического вмешательства, стоматологических манипуляций, напряжения или растяжения связок. Острая боль обычно не приводит к какой-либо стойкой психологической реакции. Хроническая боль, напротив, является долговременной, обычно продолжается более трех месяцев и приводит к значительным психологическим и эмоциональным проблемам. Типичными примерами хронической боли являются невропатическая боль (например, болезненная диабетическая невропатия, постгерпетическая невралгия), синдром запястного канала, боль в спине, головная боль, онкологическая боль, суставная боль и хроническая послеоперационная боль.
[0063] Когда происходит серьезное повреждение тканей тела в результате заболевания или травмы, характеристики активации ноцицепторов изменяются, и происходит сенсибилизация на периферии, локально вокруг повреждения и в центре, где заканчиваются ноцицепторы. Эти эффекты приводят к усилению ощущения боли. При острой боли эти механизмы могут быть полезны в продвижении защитного поведения, которое может более эффективно способствовать процессам восстановления. Нормально было бы ожидать, что чувствительность вернется к норме после заживления травмы. Однако при многих хронических болевых состояниях гиперчувствительность значительно опережает процесс заживления и зачастую обусловлена повреждением нервной системы. Это повреждение нередко приводит к нарушениям чувствительных нервных волокон, связанным с дезадаптацией и аберрантной активностью (Woolf & Salter, 2000, Science, 288, 1765-1768).
[0064] Клиническая боль имеет место, когда характерными симптомами у пациента являются дискомфортом и аномальная чувствительность. Пациенты, как правило, весьма неоднородны, и болевые симптомы у них могут различаться. Такие симптомы включают 1) спонтанную боль, которая может быть тупой, жгучей или колющей; 2) повышенные болевые реакции на вредные раздражители (гипералгезия); и 3) боль, вызванную обычно безвредными стимулами (аллодиния - Meyer et al., 1994, Textbook of Pain, 13-44). Хотя у пациентов, страдающих различными формами острой и хронической боли, могут наблюдаться сходные симптомы, лежащие в их основе механизмы могут быть разными и, следовательно, могут потребоваться различные стратегия лечения. Поэтому боль также может быть разделена на ряд различных подтипов в соответствии с различной патофизиологией, включая ноцицептивную, воспалительную и невропатическую боль.
[0065] Ноцицептивная боль вызывается повреждением ткани или интенсивными раздражителями, которые могут стать причиной травмы. Афферентные проводники болевой чувствительности активируются через передачу стимулов ноцицепторами в месте повреждения и активируют нейроны спинного мозга на уровне их окончания. Затем сигнал передается по позвоночнику в мозг, где ощущается боль (Meyer et al., 1994, Textbook of Pain, 13-44). Активация ноцицепторов активирует два типа афферентных нервных волокон. Миелиновые А-дельта волокна проводят сигнал быстро и отвечают за острые и колющие болевые ощущения, в то время как немиелинизированные С-волокна проводят сигнал с меньшей скоростью и передают тупую или ноющую боль. Острая ноцицептивная боль от умеренной до тяжелой является выраженным признаком боли в результате травмы центральной нервной системы, деформации/растяжения связок, ожогов, инфаркта миокарда и острого панкреатита, послеоперационной боли (боль после любого типа хирургического вмешательства), посттравматической боли, почечных колик, онкологической боли и боли в спине. Онкологическая боль может представлять собой хроническую боль, такую как боль, связанная с опухолью (например, боль в костях, головная боль, лицевая боль или висцеральная боль), или боль, связанную с лечением онкологического заболевания (например, синдром постхимиотерапии, синдром хронической послеоперационной боли или пострадиационный синдром). Онкологическая боль также может возникать в ответ на химиотерапию, иммунотерапию, гормональную терапию или лучевую терапию. Боль в спине может быть вызваны межпозвоночной грыжей, разрывом межпозвоночных дисков, нарушениями поясничных фасеточных суставов, крестцово-подвздошных суставов, параспинальных мышц или задней продольной связки. Боль в спине может проходить естественным путем, но у некоторых пациентов, когда длится более 12 недель, она становится хроническим заболеванием, которое может быть особенно изнурительным.
[0066] Нейропатическая боль в настоящее время определяется как боль, инициируемая или вызванная первичным поражением или дисфункцией нервной системы. Повреждение нерва может быть вызвано травмой и заболеванием, и, таким образом, термин «невропатическая боль» охватывает большое количество расстройств с различной этиологией. Он включает, но без ограничения, периферическую невропатию, диабетическую невропатию, постгерпетическую невралгию, тригеминальную невралгию, боль в спине, онкологическую невропатию, невропатию ВИЧ, фантомную боль в конечностях, синдром запястного канала, центральную постинсультную боль и боль, связанную с хроническим алкоголизмом, гипотиреоз, уремию, рассеянный склероз, повреждение спинного мозга, болезнь Паркинсона, эпилепсию и авитаминоз. Нейропатическая боль является патологической, поскольку она не имеет защитной роли. Зачастую она присутствует в течение длительного времени после исчезновения первоначальной причины и обычно длится годами, значительно снижая качество жизни пациента (Woolf and Mannion, 1999, Lancet, 353, 1959-1964). Симптомы нейропатической боли трудно поддаются лечению, поскольку даже у пациентов с одним и тем же заболеванием они могут быть разными (Woolf & Decosterd, 1999, Pain Supp., 6, S141-S147; Woolf & Mannion, 1999, Lancet, 353, 1959 -1964). Они включают спонтанную боль, которая может быть непрерывной, и пароксизмальную или аномально спровоцированную боль, такую как гипералгезия (повышенная чувствительность к вредному раздражителю) и аллодиния (чувствительность к обычно безвредному раздражителю).
[0067] Воспалительный процесс представляет собой сложную серию биохимических и клеточных событий, активируемых в ответ на повреждение ткани или присутствие посторонних веществ, что приводит к разбуханию и боли (Levine and Taiwo, 1994, Textbook of Pain, 45-56). Боль при артрите является наиболее распространенной воспалительной болью. Ревматоидное заболевание является одним из наиболее распространенных хронических воспалительных состояний в развитых странах, а ревматоидный артрит является распространенной причиной инвалидности. Точная этиология ревматоидного артрита неизвестна, но современные гипотезы предполагают, что могут быть важны как генетические, так и микробиологические факторы (Grennan & Jayson, 1994, Textbook of Pain, 397-407). Было подсчитано, что почти у 16 миллионов американцев, большинство из которых старше 60 лет, наблюдается симптоматический остеоартрит (ОА) или дегенеративное заболевание суставов, и ожидается, что по мере увеличения возраста населения этот показатель возрастет до 40 миллионов, что делает это заболеванием проблемой общественного здравоохранения огромного масштаба (Houge & Mersfelder, 2002, Ann Pharmacother., 36, 679-686; McCarthy et al., 1994, Textbook of Pain, 387-395). Большинство пациентов с остеоартритом обращаются за медицинской помощью из-за сопутствующей боли. Артрит оказывает значительное влияние на психосоциальную и физическую функцию и, как известно, является основной причиной инвалидности в дальнейшей жизни. Анкилозирующий спондилит также является ревматическим заболеванием, которое вызывает артрит позвоночника и крестцово-подвздошных суставов. Он изменяется от периодических болей в спине, возникающих в течение всей жизни, до тяжелого хронического заболевания, которое поражает позвоночник, периферические суставы и другие органы тела.
[0068] Другим типом воспалительной боли является висцеральная боль, которая включает боль, связанную с воспалительным заболеванием кишечника (inflammatory bowel disease - IBD). Висцеральная боль - это боль, связанная с внутренними органами, к которым относятся органы брюшной полости. Эти органы включают половые органы, селезенку и часть пищеварительной системы. Боль, связанную с внутренними органами, можно разделить на пищеварительную висцеральную боль и непищеварительную висцеральную боль. Часто встречающиеся желудочно-кишечные (gastrointestinal - GI) расстройства, которые вызывают боль, включают функциональное расстройство кишечника (functional bowel disorder - FBD) и воспалительное заболевание кишечника (IBD). Эти желудочно-кишечные расстройства включают широкий спектр болезненных состояний, которые в настоящее время контролируются лишь умеренно, включая, в отношении FBD, гастроэзофагеальный рефлюкс, диспепсию, синдром раздраженного кишечника (irritable bowel syndrome - IBS) и функциональный болевой абдоминальный синдром (functional abdominal pain syndrome - FAPS) и, в отношении IBD, болезнь Крона, илеит и язвенный колит, и все эти расстройства регулярно вызывают висцеральную боль. Другие типы висцеральной боли включают боль, связанную с дисменореей, циститом и панкреатитом, и тазовую боль.
[0069] Следует отметить, что некоторые типы боли имеют несколько причин и, следовательно, могут быть отнесены к более чем одной области, например боль в спине и онкологическая боль имеют ноцицептивный и невропатический компоненты.
[0070] Другие виды боли включают
(i) боль, обусловленную скелетно-мышечными расстройствами, включая миалгию, фибромиалгию, спондилит, серонегативные (не ревматоидные) артропатии, фиброзит, дистрофинопатию, гликогенолиз, полимиозит и пиомиозит;
(ii) сердечную и сосудистую боль, включая боль, вызванную стенокардией, инфарктом миокарда, митральным стенозом, перикардитом, феноменом Рейно (Raynaud), склеродермией и ишемией скелетных мышц;
(iii) головную боль, такую как мигрень (включая мигрень с аурой и мигрень без ауры), кластерную головную боль, головную боль напряжения, смешанную головную боль и головную боль, связанную с сосудистыми расстройствами; и
(vi) орофациальную боль, включая зубную боль, ушную боль, синдром жжения во рту и височно-нижнечелюстную миофасциальную боль.
[0071] Также ожидается, что соединения формул (I), (II) и (III) будут полезны при лечении рассеянного склероза.
[0072] Изобретение также относится к терапевтическому применению соединений формул (I), (II) и (III) в качестве средств для лечения или облегчения симптомов нейродегенеративных расстройств. Такие нейродегенеративные расстройства включают, например, болезнь Альцгеймера, болезнь Хантингтона, болезнь Паркинсона и амиотрофический латеральный склероз. Настоящее изобретение также относится к лечению нейродегенеративных расстройств, называемых острым повреждением головного мозга. Они включают, но без ограничения, инсульт, травму головы и асфиксию. Инсульт относится к церебральному сосудистому заболеванию, которое может также упоминаться как острое нарушение мозгового кровообращения (cerebral vascular accident - CVA) и включает острый тромбоэмболический инсульт. Инсульт включает как очаговую, так и глобальную ишемию. Он также включает преходящие церебральные ишемические атаки и другие сосудистые проблемы головного мозга, сопровождающиеся церебральной ишемией. Эти сосудистые нарушения могут возникать у пациента, подвергшегося, в частности, каротидной эндартерэктомии, или другим цереброваскулярным или сосудистым хирургическим процедурам в целом или диагностическим сосудистым процедурам, включая церебральную ангиографию и т.п. Другими предпосылками сосудистых нарушений являются травма головы, травма спинного мозга или повреждение, которое является результатом общей аноксии, гипоксии, гипогликемии и гипотонии, а также аналогичные повреждения, наблюдаемые в результате закупорки кровеносных сосудов, гиперперфузии и гипоксии. Настоящее изобретение будет полезно в ряде случаев, например, во время операции по шунтированию сердца, в случаях внутричерепного кровоизлияния, при перинатальной асфиксии, при остановке сердца и эпилептическом состоянии.
[0073] Опытный врач сможет определить подходящую ситуацию, в которой субъекты чувствительны или подвержены риску, например, инсульта, а также выявить пациентов, страдающих от инсульта, для введения способами по настоящему изобретению.
[0074] Каналы Nav1.7 и Nav1.8 задействованы в широком спектре биологических функций. Это предполагает потенциальную роль этих рецепторов в различных процессах развития заболевания у людей или других видов. Соединения по настоящему изобретению могут применяться для лечения, предотвращения, уменьшения интенсивности симптомов, контроля или снижения риска различных неврологических и психических расстройств, связанных с Nav1.7 и Nav1.8 каналами, включая одно или несколько из следующих состояний или заболеваний: боль, острая боль, хроническая боль, невропатическая боль, воспалительная боль, висцеральная боль, ноцицептивная боль, зуд, рассеянный склероз, нейродегенеративное расстройство, синдром раздраженного кишечника, остеоартрит, ревматоидный артрит, невропатологические расстройства, функциональные расстройства кишечника, воспалительные заболевания кишечника, боль, связанная с дисменореей, боль в области таза, цистит, панкреатит, мигрень, кластерные головные боли и головные боли напряжения, диабетическая невропатия, периферическая невропатическая боль, ишиас, фибромиалгия, болезнь Крона, эпилепсия или эпилептические состояния, биполярная депрессия, тахиаритмия, расстройство настроения, биполярное расстройство, психические расстройства, такие как тревога и депрессия, миотония, аритмия, двигательные расстройства, нейроэндокринные расстройства, атаксия, недержание, висцеральная боль, тригеминальная невралгия, герпетическая невралгия, общая невралгия, постгерпетическая невралгия, корешковая боль, боль в спине, головная боль или боль в шее, сильная или неустранимая боль, прорывная боль, послеоперационная боль, инсульт, онкологическая боль, судорожное расстройство, каузалгия и боль, вызванная химическими веществами.
[0075] Дозировка активного ингредиента в композициях по настоящему изобретению может варьироваться, однако необходимо, чтобы количество активного ингредиента было таким, обеспечивалась подходящая лекарственная форма. Активный ингредиент может вводиться пациентам (животным и людям), нуждающимся в таком лечении, в дозах, которые обеспечивают оптимальную фармацевтическую эффективность.
[0076] Выбираемая дозировка зависит от желаемого терапевтического эффекта, способа введения и от продолжительности лечения. Доза будет варьироваться от пациента к пациенту в зависимости от характера и тяжести заболевания, массы тела пациента, специальных диет, которым следует пациент, сопутствующей лекарственной терапии и других факторов, которые должны учитывать специалисты в данной области.
[0077] Общая суточная доза соединений по изобретению для введения пациентам-людям обычно находится в интервале от 0,1 мг до 1000 мг в зависимости, резумеется, от способа введения. Например, при пероральном введении может потребоваться общая суточная доза от 1 до 1000 мг, тогда как при внутривенном введении может потребоваться только от 0,1 до 100 мг. Общая суточная доза может вводиться в виде однократной дозы или разделяться на несколько доз и может, по усмотрению врача, выходить за пределы стандартного интервала доз, приведенного в настоящем изобретении.
[0078] Эти дозы представлены из расчета на «среднего» субъекта-человека с массой тела примерно от 60 до 70 кг. Врач легко сможет определить дозы для субъектов, масса тела которых выходит за пределы этого диапазона, таких как дети и пожилые люди.
[0079] В одном варианте осуществления настоящего изобдретения интервал доз будет составлять примерно от 0,5 до 500 мг на пациента в день; в другом варианте осуществления - примерно от 0,5 до 200 мг на пациента в день; в еще одном варианте осуществления - примерно от 1 до 100 мг на пациента в день; в еще одном варианте осуществления от 5 до 50 мг на пациента в день; и в еще одном варианте осуществления - от 1 до 30 мг на пациента в день. Фармацевтические композиции по настоящему изобретению могут быть представлены в виде твердого лекарственного препарата, например содержащего примерно от 0,5 до 500 мг активного ингредиента или содержащего примерно от 1 до 250 мг активного ингредиента. Фармацевтическая композиция может быть представлена в твердой лекарственной форме, содержащей примерно 1 мг, 5 мг, 10 мг, 25 мг, 50 мг, 100 мг, 200 мг или 250 мг активного ингредиента. Композиции для перорального введения могут быть представлены в форме таблеток, содержащих от 1,0 до 1000 мг активного ингредиента, например содержащих 1, 5, 10, 15, 20, 25, 50, 75, 100, 150, 200, 250, 300, 400, 500, 600, 750, 800, 900 и 1000 мг активного ингредиента, для симптоматической корректировки дозы, вводимой пациенту, подлежащему лечению. Соединения могут вводиться по схеме от 1 до 4 раз в день, например один или два раза в день.
[0080] Соединения по настоящему изобретению могут применяться в сочетании с одним или несколькими другими лекарственными средствами для лечения, предотвращения, контроля, снижения интенсивности симптомов или уменьшения риска развития заболеваний или состояний, при которых могут быть полезны соединения по настоящему изобретению или другие лекарственные средства, где комбинация лекарственных средств более безопасна или более эффективна, чем любое одно из указанных лекарственных средств. Такое(ие) другое(ие) лекарственное(ые) средство(а) может(гут) вводиться способом и в количестве, которые обычно используются, одновременно или последовательно с соединением по настоящему изобретению. Когда соединение по настоящему изобретению используется одновременно с одним или несколькими другими лекарственными средствами, предусматривается фармацевтическая композиция лекарственной формы стандартной дозы, содержащая такие другие лекарственные средства и соединение по настоящему изобретению. Однако комбинированная терапия может также включать терапию, при которой соединение по настоящему изобретению и одно или несколько других лекарств вводятся в соответствии с разными перекрывающимися схемами. Предполагается также, что при использовании в сочетании с одним или несколькими другими активными ингредиентами соединения по настоящему изобретению и другие активные ингредиенты могут использоваться в более низких дозах, чем когда каждый ингредиент используется отдельно.
[0081] Соответственно, фармацевтические композиции по настоящему изобретению включают фармацевтические композиции, которые помимо соединения по настоящему изобретению содержат один или несколько других активных ингредиентов. Вышеуказанные комбинации включают комбинации соединения по настоящему изобретению не только с одним другим активным соединением, но также с двумя или несколькими другими активными соединениями.
[0082] Аналогичным образом, соединения по настоящему изобретению могут использоваться в комбинации с другими лекарственными средствами, которые используются для предотвращения, лечения, контроля, снижения интенсивности симптомов или уменьшения риска развития заболеваний или состояний, при которых полезны соединения по настоящему изобретению. Такие другие лекарственные средства могут вводиться способом и в количестве, которые обычно используются, одновременно или последовательно с соединением по настоящему изобретению. Когда соединение по настоящему изобретению используется одновременно с одним или несколькими другими лекарственными средствами, предусматривается фармацевтическая композиция, содержащая такие другие лекарственные средства в дополнение к соединению по настоящему изобретению. Соответственно, фармацевтические композиции по настоящему изобретению включают фармацевтические композиции, которые в дополнение к соединению по настоящему изобретению также содержат один или несколько других активных ингредиентов.
[0083] Массовое соотношение соединения по настоящему изобретению и второго активного ингредиента может варьироваться и будет зависеть от эффективной дозы каждого ингредиента. Обычно будет использоваться эффективная доза каждого ингредиента. Таким образом, например, когда соединение по настоящему изобретению объединяют с другим лекарственным средством, массовое соотношение соединения по настоящему изобретению и другого лекарственного средства обычно находится в интервале от примерно 1000:1 до примерно 1:1000, включая от примерно 200:1 до примерно 1:200. Комбинации соединения по настоящему изобретению с другими активными ингредиентами, как правило, также находятся в вышеуказанном диапазоне, но в каждом случае следует использовать эффективную дозу каждого активного ингредиента. В таких комбинациях соединение по настоящему изобретению и другие активные лекарственные средства могут вводиться отдельно или вместе. Кроме того, введение одного элемента может осуществляться до введения, одновременно с введением или после введения другого(их) лекарственного(ых) средства(средств).
[0084] Блокатор Nav1.7 и Nav1.8 каналов может эффективно комбинироваться с другим фармакологически активным соединением или с двумя или более другими фармакологически активными соединениями, особенно при лечении воспалительных заболеваний или расстройств, боли, урологических заболеваний или расстройств. Например, блокатор Nav1.7 и Nav1.8 каналов, в частности соединение формул (I), (II) и (III) или его пролекарство или фармацевтически приемлемая соль или сольват, которые определены выше, может вводиться одновременно, последовательно или раздельно в комбинации с одним или несколькими лекарственными средствами, выбранными из следующего перечня:
[0085] - опиоидный анальгетик, например морфин, героин, гидроморфон, оксиморфон, леворфанол, леваллорфан, метадон, меперидин, фентанил, кокаин, кодеин, дигидрокодеин, оксикодон, гидрокодон, пропоксифен, налмефен, налорфин, налоксон, налтрексон, бупренорфин, буторфанол, налбуфин или пентазоцин;
[0086] - нестероидное противовоспалительное лекарственное средство (НПВЛС), например аспирин, диклофенак, дифлунисал, этодолак, фенбуфен, фенопрофен, флуфенисал, флурбипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, меклофенамовая кислота, мефенамовая кислота, мелоксикам, набуметон, напроксен, нимесулид, нитрофлурбипрофен, олсалазин, оксапрозин, фенилбутазон, пироксикам, сульфасалазин, сулиндак, толметин или зомепирак;
[0087] - барбитуратное седативное лекарственное средство, например амобарбитал, апробарбитал, бутабарбитал, буталбитал, мефобарбитал, метарбитал, метогекситал, пентобарбитал, фенобарбитал, секобарбитал, талбутал, тиамилал или тиопентал;
[0088] - бензодиазепин, обладающий седативным действием, например хлордиазепоксид, клоразепат, диазепам, флуразепам, лоразепам, оксазепам, темазепам или триазолам;
[0089] - антагонист H1, обладающий седативным действием, например дифенгидрамин, пириламин, прометазин, хлорфенирамин или хлорциклизин; - седативное средство, такое как глютетимид, мепробамат, метаквалон или дихлоралфеназон;
[0090] - миорелаксант, например баклофен, карисопродол, хлорзоксазон, циклобензаприн, метокарбамол или орфенадрин;
[0091] - антагонист NMDA рецептора, например декстрометорфан ((+)-3-гидрокси-N-метилморфинан) или его метаболит декстрорфан ((+)-3-гидрокси-N-метилморфинан), кетамин, мемантин, пирролохинолинхинон, цис-4-(фосфонометил)-2-пиперидинкарбоновая кислота, будипин, EN-3231 (MorphiDex (зарегистрированный товарный знак), комбинированный препарат морфина и декстрометорфана), топирамат, нерамексан или перзинфотел, включая антагонист NR2B, например ифенпродил, траксопродил или (-)-(R)-6-{2-[4-(3-фторфенил)-4-гидрокси-1-пиперидинил]-1-гидроксиэтил-3,4-дигидро-2(1Н)-хинолинон;
[0092] - блокатор альфа-адренорецепторов, например доксазозин, тамсулозин, клонидин, гуанфацин, дексмедетомидин, модафинил или 4-амино-6,7-диметокси-2-(5-метан-сульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолин;
[0093] - трициклический антидепрессант, например дезипрамин, имипрамин, амитриптилин или нортриптилин;
[0094] - противосудорожное средство, например карбамазепин, ламотриджин, топирамат или вальпроат;
[0095] - антагонист тахикинина (NK), в частности антагонист NK-3, NK-2 или NK-1, например (альфаR,9R)-7-[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7Н[1,4]диазоцино[2,1-g][1,7]-нафтиридин-6,13-дион (TAK-637), 5-[[(2R,3S)-2-[(1R)-1-[3,5-бис(трифторметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]метил]-1,2-дигидро-3Н-1,2,4-триазол-3-он (МК-869), апрепитант, ланепитант, дапитант или 3-[[2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенилпиперидин (2S,3S);
[0096] - антагонист мускоринового рецептора, например оксибутинин, толтеродин, пропиверин, троспиума хлорид, дарифенацин, солифенацин, темиверин или ипратропий;
[0097] - селективный ингибитор СОХ-2, например целекоксиб, рофекоксиб, парекоксиб, вальдекоксиб, деракоксиб, эторикоксиб или лумиракоксиб;
[0098] - анальгетик, являющийся производным анилина, например парацетамол;
[0099] - нейролептик, такой как дроперидол, хлорпромазин, галоперидол, перфеназин, тиоридазин, мезоридазин, трифлуперазин, флуфеназин, клозапин, оланзапин, рисперидон, зипрасидон, кветиапин, сертиндол, арипипразол, сонепипразол, блонансерин, илоперидон, пероспирон, раклоприд, зотепин, бифепрунокс, асенапин, лурасидон, амисулприд, балаперидон, палиндор, эпливансерин, осанетант, римонабант, меклинертант, Miraxion (зарегистрированный товарный знак) или саризотан;
[0100] - агонист ваниллоидных рецепторов (например, смолифератоксин) или антагонист ваниллоидных рецепторов (например, капсазепин);
[0101] - агонист или антагонист подтипа катионного канала транзиторного рецепторного потенциала (V1, V2, V3, V4, M8, M2, A1);
[0102] - бета-адреноблокатор, такой как пропранолол;
[0103] - местный анестетик, такой как мексилетин;
[0104] - кортикостероид, такой как дексаметазон;
[0105] - агонист или антагонист 5-НТ-рецептора, в частности агонист 5-НТ1В/1D, такой как элетриптан, суматриптан, наратриптан, золмитриптан или ризатриптан;
[0106] - антагонист рецептора 5-HT2A, такой как R(+)- альфа-(2,3-диметоксифенил)-1-[2-(4-фторфенилэтил)]-4-пиперидинметанол (MDL-100907);
[0107] - холинергический (никотиновый) анальгетик, такой как испрониклин (TC-1734), (E)-N-метил-4-(3-пиридинил)-3-бутен-1-амин (RJR-2403), (R)-5-(2-азетидинилметокси)-2-хлорпиридин (ABT-594) или никотин;
[0108] - Tramadol (зарегистрированный торговый знак);
[0109]- ингибитор PDEV, такой как
5-[2-этокси-5-(4-метил-1-пиперазинилсульфонил)фенил]-1-метил-3-н-пропил-1,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он (силденафил),
(6R,12aR)-2,3,6,7,12,12a-гексагидро-2-метил-6-(3,4-метилендиоксифенил)пиразино[2',1':6,1]пиридо[3,4-b]индол-1,4-дион (IC-351 или тадалафил),
2-[2-этокси-5-(4-этилпиперазин-1-ил)сульфонил)фенил]-5-метил-7-пропил-3Н-имидазо[5,1-f][1,2,4]триазин-4-он (варденафил),
5-(5-ацетил-2-бутокси)-3-пиридинил)-3-этил-2-(1-этил-3-азетидинил)-2,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он,
5-(5-ацетил)-2-пропокси-3-пиридинил)-3-этил-2-(1-изопропил-3-азетидинил)-2,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-он,
5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)пиридин-3-ил]-3-этил-2-[2-метоксиэтил]-2,6-дигидро-7H-пиразоло[4,3-d]пиримидин-7-он,
4-[(3-хлор-4-метоксибензил)амино]-2-[(2S)-2-(гидроксиметил)пирролидин-1-ил]-N-(пиримидин-2-илметил)пиримидин-5-карбоксамид или 3-(1-метил-7-оксо-3-пропил-6,7-дигидро-1Н-пиразоло[4,3-d]пиримидин-5-ил)-N-[2-(1-метилпирролидин-2-ил)этил]-4-пропоксибензолсульфонамид;
[0110] - альфа-2-дельта-лиганд, такой как габапентин, прегабалин, 3-метилгабапентин, мирогабалин, (3-(аминометил)бицикло[3.2.0]гепт-3-ил)уксусная кислота, (3S,5R)-3-(аминометил)-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилгептановая кислота, (3S,5R)-3-амино-5-метилоктановая кислота, (2S,4S)-4-(3-хлорфенокси)пролин, (2S,4S)-4-(3-фторбензил)пролин, [(1R,5R,6S)-6-(аминометил)бицикло[3.2.0]гепт-6-ил]уксусная кислота, 3-((1-(аминометил)циклогексил)метил)-4H-[1,2,4]оксадиазол-5-он, C-[1-((1H-тетразол-5-ил)метил)циклогептил]метиламин, (3S,4S)-(1-(аминометил)-3,4-диметилциклопентил)уксусная кислота, (3S,5R)-3-(аминометил)-5-метилоктановая кислота, (3S,5R)-3-амино-5-метилнонановая кислота, (3S,5R)-3-амино-5-метилоктановая кислота, (3R,4R,5R)-3-амино-4,5-диметилгептановая кислота или (3R,4R,5R)-3-амино-4,5-диметилоктановая кислота;
[0111] - каннабиноид;
[0112] - антагонист метаботропных глутаматных рецепторов (mGluR), таких как mGluR1, mGluR2, mGluR3, mGluR5 или mGluR7;
[0113] - ингибитор обратного захвата серотонина, такой как сертралин, метаболит сертралина десметилсертралин, флуоксетин, норфлуоксетин (метаболит флуоксетиндесметила), флувоксамин, пароксетин, циталопрам, метаболит циталопрама десметилциталопрам, эсциталопрам, d, l-фенфлурамин, фемоксетин, ифоксетин, цианодотиепин, литоксетин, дапоксетин, нефазодон, церикламин или тразодон;
[0114] - ингибитор обратного захвата норадреналина (норэпинефрина), такой как мапротилин, лофепрамин, миртазапин, оксапротилин, фезоламин, томоксетин, миансерин, бупропион, метаболит бупропиона гидроксибупропион, номифензин и вилоксазин (Vivalan (зарегистрированный товарный знак)), особенно селективный ингибитор обратного захвата норадреналина, такой как ребоксетин, в частности (S, S)-ребоксетин;
[0115] - двойной ингибитор обратного захвата серотонина-норадреналина, такой как венлафаксин, метаболит венлафаксина О-десметилвенлафаксин, кломипрамин, метаболит кломипрамина дезметилкломипрамин, дулоксетин, милнаципран или имипрамин;
[0116] - ингибитор индуцибельной синтазы оксида азота (iNOS), такой как S-[2-[(1-иминоэтил)амино]этил]-L-гомоцистеин, S-[2-[(1-иминоэтил)амино]этил]-4,4-диоксо-L-цистеин, S-[2-[(1-иминоэтил)амино]этил]-2-метил-L-цистеин, (2S,5Z)-2-амино-2-метил-7-[(1-иминоэтил)амино]-5-гептеновая кислота, 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлор-3-пиридинкарбонитрил; 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-4-хлорбензонитрил, (2S,4R)-2-амино-4-[[2-хлор-5-(трифторметил)фенил]тио]-5-тиазобутанол, 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-6-(трифторметил))-3-пиридинкарбонитрил, 2-[[(1R,3S)-3-амино-4-гидрокси-1-(5-тиазолил)бутил]тио]-5-хлорбензонитрил, N-[4-[2-(3)-хлорбензиламино)этил]фенил]тиофен-2-карбоксамидин или гуанидиноэтилдисульфид;
[0117] - ингибитор ацетилхолинэстеразы, такой как донепезил;
[0118] - антагонист простагландина E2 подтипа 4 (EP4), такой как N-[({2-[4-(2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-1-ил)фенил)]этил}амино)карбонил]-4-метилбензолсульфонамид или 4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойная кислота;
[0119] - антагонист лейкотриена В4; такой как 1-(3-бифенил-4-илметил-4-гидроксихроман-7-ил)циклопентанкарбоновая кислота (CP-105696), 5-[2-(2-карбоксиэтил)-3-[6-(4)-метоксифенил)-5E-гексенил]оксифенокси]валериановая кислота (ONO-4057) или DPC-11870,
[0120] - ингибитор 5-липоксигеназы, такой как зилеутон, 6-[(3-фтор-5-[4-метокси-3,4,5,6-тетрагидро-2Н-пиран-4-ил])феноксиметил]-1-метил-2-хинолон (ZD-2138) или 2,3,5-триметил-6-(3-пиридилметил)-1,4-бензохинон (CV-6504);
[0121] блокатор натриевых каналов, такой как лидокаин;
[0122] - блокатор кальциевых каналов, такой как зиконотид, зонисамид, мифефрадил;
[123] - антагонист 5-НТ3, такой как ондансетрон;
- химиотерапевтическое лекарственное средство, такое как оксалиплатин, 5-фторурацил, лейковорин, паклитаксел;
- ингибитор янус-киназы (JAK), такой как тофацитиниб;
- антагонист кальцитотин-ген-связанного пептида (CGRP);
- антагонист брадикинина (ВК1 и ВК2);
- блокатор потенциалзависимых натриевых каналов (Nav1.3, Nav1.7, Nav1.8, Nav1.9);
- блокатор потенциалзависимых кальциевых каналов (N-типа, T-типа);
- антагонист P2X рецепторов (АТФ рецепторов ионных каналов);
- антагонист кислотно-чувствительных ионных каналов (ASIC1a, ASIC3);
- антагонист ангиотензина AT2;
- антагонист рецептора хемокина CCR2B;
- ингибитор катепсина (B, S, K);
- агонист или антагонист рецептора сигма-1;
- связующий или ингибитор фактора роста нервов (NGF), такой как танезумаб;
- ингибитор рецептора тропомиозина киназы А (TrkA);
- ингибитор амидгидролазы жирных кислот (FAAH);
- ингибитор моноацилглицероллипазы (MAGL);
- ингибитор микросомальной простагландин-синтазы типа 1 (mPGES-1);
- модулятор GABAA;
- агонист или положительный модулятор GlyR3;
- антагонист рецептора AMPA, такой как перампанель;
- открыватель или положительный модулятор калиевых каналов KCNQ/Kv7, такой как ретигабин или флупиртин;
- открыватель или положительный модулятор G-белок-связанных калиевых каналов (GIRK);
- открыватель или положительный модулятор калиевых каналов, активируемых кальцием (Kca);
- открыватель или положительный модулятор кальций-активируемых потенциалзависимых калиевых, таких как представители подсемейства A (например, Kv1.1), подсемейства B (например, Kv2.2) или подсемейства K (например, TASK, TREK или TRESK);
[0124] или их фармацевтически приемлемые соли или сольваты.
[0125] Такие комбинации предоставляют значительные преимущества в терапии, в том числе синергическую активность.
[0126] Фармацевтическая композиция по настоящему изобретению, которая может быть получена смешиванием, желательно при температуре окружающей среды и атмосферном давлении, обычно адаптирована для перорального, парентерального или ректального введения и, как таковая, может быть представлена в форме таблеток, капсул, жидких препаратов для перорального применения, порошков, гранул, пастилок, восстанавливаемых порошков, растворов для инъекций или инфузий или суспензий или суппозиториев. Обычно предпочтительными являются композиции для перорального введения. Таблетки и капсулы для перорального введения могут быть представлены в лекарственной форме стандартной дозы и могут содержать обычные наполнители, такие как связующие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлозу); наполнители (например, лактозу, микрокристаллическую целлюлозу или гидрофосфат кальция); смазывающие вещества для таблетирования (например, стеарат магния, тальк или диоксид кремния); дезинтегранты (например, картофельный крахмал или крахмалгликолят натрия); и подходящие смачивающие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой в соответствии со способами, хорошо известными в обычной фармацевтической практике.
[0127] Жидкие препараты для перорального введения могут быть представлены в форме, например, водной или масляной суспензии, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в форме сухого продукта для разведения водой или другим подходящим носителем перед использованием. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты (например, сироп сорбита, производные целлюлозы или гидрогенизированные пищевые жиры), эмульгаторы (например, лецитин или акацию), неводные носители (которые могут включать пищевые масла, например миндальное масло, маслянистые сложные эфиры, этиловый спирт или фракционированные растительные масла), консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновую кислоту) и, если желательно, обычные ароматизаторы или красители, буферные соли и подсластители, когда это подходит. Препараты для перорального введения могут быть получены соответствующим образом для предоставления контролируемого высвобождения активного соединения или его фармацевтически приемлемой соли.
[0128] Жидкие лекарственные формы стандартной дозы для парентерального введения получают с использованием соединения формул (I), (II) и (III) или его фармацевтически приемлемой соли и стерильного носителя. Препараты для инъекций могут быть представлены в лекарственной форме стандартной дозы, например в ампулах, или в форме, содержащей несколько доз, с использованием соединения формул (I), (II) и (III) или его фармацевтически приемлемой соли и стерильного носителя или его фармацевтически приемлемой соли и стерильного носителя, необязательно с добавленным консервантом. Композиции могут принимать форму суспензий, растворов или эмульсий в масляных или водных носителях и могут содержать вспомогательные вещества, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть представлен в форме порошка для смешивания перед применением с подходящим носителем, например стерильной апирогенной водой. Соединение, в зависимости от используемого носителя и концентрации, может быть суспендировано или растворено в носителе. При получении растворов для инъекций соединение может быть растворено и стерилизовано фильтрованием перед заполнением им подходящего флакона или ампулы и герметизацией. Преимущественно адъюванты, такие как местные анестетики, консерванты и буферные агенты, растворяют в носителе. Для повышения стабильности композиция может замораживаться после введения во флакон и вода удаляться в вакууме. Суспензии для парентерального введения получают по существу таким же образом, но с тем отличием, что соединение не растворяют, а суспендируют в носителе, и стерилизация не может выполняться фильтрацией. Соединение можно стерилизовать с помощью этиленоксида перед суспендированием в стерильном носителе. Преимущественно, в композицию может быть введено поверхностно-активное вещество или смачивающий агент для облегчения равномерного распределения соединения.
[0129] Лосьоны могут быть получены на водной или масляной основе и обычно будут также содержать один или несколько эмульгаторов, стабилизаторов, дисперсантов, суспендирующих агентов, загустителей или красителей. Препараты в форме капель могут быть получены на водной или неводной основе, содержащей также один или несколько дисперсантов, стабилизаторов, солюбилизирующих агентов или суспендирующих агентов. Они могут также содержать консервант.
[0130] Соединения формул (I), (II) и (III) или их фармацевтически приемлемые соли также могут быть представлены в форме композиций для ректального введения, таких как суппозитории или микроклизмы с удержанием, которые содержат, например, обычные основы для суппозиториев, такие как масло какао или другие глицериды.
[0131] Соединения формул (I), (II) и (III) или их фармацевтически приемлемые соли также могут быть представлены в виде депо-препаратов. Такие препараты длительного действия могут вводиться посредством имплантации (например, подкожно или внутримышечно) или внутримышечной инъекцией. Так, например, соединения формул (I), (II) и (III) или их фармацевтически приемлемые соли могут быть введены в препарат с подходящими полимерными или гидрофобными материалами (например, в форме эмульсии в приемлемом масле), ионообменными смолами или в виде труднорастворимых производных, например в виде труднорастворимой соли.
[0132] Для назального введения соединения формул (I), (II) и (III) или их фармацевтически приемлемые соли могут быть представлены в форме растворов для введения с помощью подходящего устройства отмеренной или однократной дозы или, альтернативно, в виде порошковой смеси с подходящим носителем для введения с использованием подходящего устройства для доставки. Таким образом, соединения формул (I), (II) и (III) или их фармацевтически приемлемые соли могут быть представлены в форме препарата для перорального, буккального, парентерального, местного (в том числе дермального, офтальмологического и назального) введения, депо-препарата, препарата для ректального введения или в форме препарата, подходящего для введения ингаляцией или инсуффляцией (через рот или нос). Соединения формул (I), (II) и (III) или их фармацевтически приемлемые соли могут быть представлены для местного введения в форме мазей, кремов, гелей, эмульсий, лосьонов, пессариев, аэрозолей или капель (например, глазных, ушных капель или капель в нос). Мази и кремы могут быть приготовлены, например, на водной или масляной основе с добавлением подходящих загустителей и/или гелеобразующих агентов. Мази для введения в глаза могут быть получены стерильным способом с использованием стерилизованных компонентов.
[0133] Общий синтез
Далее представлены сокращения, используемые в настоящей заявке, с соответствующими значениями
ДМФА:
DMA:
DME:
ДМСО:
диметилформамид
N, N-диметилацетамид
1,2-диметоксиэтан
диметилсульфоксид
[0134] Термин «основание» также не ограничивается конкретной природой используемых оснований, и любое основание, обычно используемое в реакциях этого типа, в равной степени может использоваться в настоящем изобретении. Примеры таких оснований включают, но без ограничения, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия, фосфат калия и гидроксид бария; гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия и трет-бутоксид калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат калия и карбонат цезия; гидрокарбонаты щелочных металлов, такие как гидрокарбонат лития, гидрокарбонат натрия и гидрокарбонат калия; амины, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, пиколин, 2,6-ди(трет-бутил)-4-метилпиридин, хинолин, N, N-диметиланин, N, N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO), 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), лутидин и колидин; амиды щелочных металлов, такие как амид лития, амид натрия, амид калия, диизопропиламид лития, диизопропиламид калия, диизопропиламид натрия, бис(триметилсилил)амид лития и бис(триметилсилил)амид калия. Предпочтительными среди них являются триэтиламин, диизопропилэтиламин, DBU, DBN, DABCO, пиридин, лутидин, колидин, карбонат натрия, гидрокарбонат натрия, гидроксид натрия, карбонат калия, гидрокарбонат калия, гидроксид калия, фосфат калия, гидроксид бария и карбонат цезия.
[0135] Реакции обычно и предпочтительно проводят в присутствии инертного растворителя. Природа используемого растворителя конкретно не ограничена при условии, что он не оказывает вредного влияния на реакцию или задействованные реагенты и может растворять реагенты, по меньшей до некоторой степени. Примеры подходящих растворителей включают, но без ограничения, галогенированные углеводороды, такие как ДХМ, хлороформ, четыреххлористый углерод и дихлорэтан; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, ТГФ и диоксан; ароматические углеводороды, такие как бензол, толуол и нитробензол; амиды, такие как ДМФА, DMA и триамид гексаметилфосфорной кислоты; амины, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин, N-метилпиперидин, пиридин, 4-пирролидинопиридин, N, N-диметиланилин и N, N-диэтиланилин; спирты, такие как метанол, этанол, пропанол, изопропанол и бутанол; нитрилы, такие как ацетонитрил и бензонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО) и сульфолан; кетоны, такие как ацетон и диэтилкетон. Предпочтительными среди этих растворителей являются ДМФА, DMA, ДМСО, ТГФ, диэтиловый эфир, диизопропиловый эфир, диметоксиэтан, ацетонитрил, ДХМ, дихлорэтан и хлороформ.
Примеры
[0136] Изобретение иллюстрируется приведенными далее неограничивающими примерами, в которых, если не указано иное, все реагенты являются коммерчески доступными, все операции проводят при комнатной температуре или температуре окружающей среды, то есть в интервале температур примерно 18-25°С; микроволновые реакции проводят с использованием Biotage Initiator или Biotage Initiator+; выпаривание растворителя проводят с использованием роторного испарителя при пониженном давлении и температуре бани примерно 60°C; реакции контролируются с помощью тонкослойной хроматографии (ТСХ), и продолжительность реакции дана только для иллюстрации; структуру и чистоту всех выделенных соединений обеспечивают по меньшей мере одним из следующих методов: ТСХ (пластины ТСХ Merck, покрытые силикагелем 60 F254, или пластины ВЭЖХ Merck, покрытые оболочкой Merck NH2 F254), масс-спектрометрия или ЯМР. Выходы даны только в иллюстративных целях. Колоночную флэш-хроматографию проводят с использованием Biotage SNAP KP-Sil, Biotage SNAP Isolute NH2, силикагеля Merck 60 (230-400 меш ASTM), колонок Fuji Silysia Chromatorex (зарегистрированный товарный знак) NH-DM1020 и NH-DM2035, Wako Wakogel C300-HG, Колонка Yamazen Hi-FLASH или YMC DispoPack-SIL. Ионообменную хроматографию проводятся с использованием сильного катионообменного картриджа (ISOLUTE (зарегистрированный товарный знак) SCX, 1 г/6 мл, Biotage) или сильного анионообменного картриджа (ISOLUTE (зарегистрированный товарный знак) PE-AX, 1 г/6 мл, Biotage). Очистку соединений с помощью ВЭЖХ (препаративная ЖХ-МС) выполняют с помощью представленных далее аппаратов и в описанных далее условиях.
Аппарат: система Waters MS-trigger AutoPurification (зарегистрированный товарный знак);
Колонка: Waters XTerra C18, 19×50 мм, частицы 5 мкм.
Условие A: метанол или ацетонитрил/0,01% (об./об.) водный раствор аммиака
Условие B: метанол или ацетонитрил/0,05% (об./об.) водный раствор муравьиной кислоты
Масс-спектральные данные низкого разрешения (ESI) получают с помощью следующих устройств и условий:
Аппарат: система Waters Alliance HPLC на ZQ или ZMD масс-спектрометре и УФ-детекторе. Данные ЯМР получают при 270 МГц (спектрометр JEOL JNM-LA 270), 300 МГц (JEOL JNM-LA300) или 400 МГц (JEOL JNM-ECZ400S) с использованием в качестве растворителя дейтерированного хлороформа (99,8% D) или диметилсульфоксида (99,9% D), если не указано иное, относительно тетраметилсилана (TMS), используемого в качестве внутреннего стандарта, в частях на миллион (м.д.); используются стандартные сокращения: с=синглет, l=дублет, т=триплет, кв=квартет, квинт=квинтет, м=мультиплет, уш. = уширенный и т. д. Химические символы имеют свои обычные значения; мкл (микролитр(ы)), мкг (микрограмм(ы)), M (моль(ей) на литр), л (литр(ы)), мл (миллилитр(ы)), г (грамм(ы)), мг (миллиграмм(ы)), моль (моль), ммоль (миллимоль).
Каждое полученное соединение обычно называют с использованием ChemBioDraw (Ultra, версия 12.0, CambridgeSoft).
[0137] Условия определения времени удерживания ВЭЖХ:
Метод А
Аппарат: Waters Acquity Ultra Performance LC на детекторе TUV и масс-спектрометре ZQ
Колонка: Waters ACQUITY C18, 2,1 х 100 мм, частицы 1,7 мкм
Температура колонки: 60°C
Детектирование с фотодиодной матрицей: сканирование 210 нм
МС детектирование: ESI, режим положительного/отрицательного ионообразования
Растворители:
A1: 10 мМ водный раствор ацетата аммония
B1: ацетонитрил

[0138] Метод В
Аппарат: Waters Acquity Ultra Performance LC на КПК-детекторе и ZQ масс-спектрометр
Колонка: Waters ACQUITY C18, 2,1 х 100 мм, частицы 1,7 мкм
Температура колонки: 60°C
Детектирование с фотодиодной матрицей: сканирование 200-400 нм
МС детектирование: ESI, режим положительного/отрицательного ионообразования
Растворители:
A1: 10 мМ водный раствор ацетата аммония
B1: ацетонитрил
[0139] Метод С
Аппарат: Waters Acquity Ultra Performance LC на детекторе с фотодиодной матрицей и ZQ масс-спектрометр
Колонка: YMC Triart C18, 2,1 х 100 мм, частицы 1,9 мкм
Температура колонки: 60°C
Детектирование с фотодиодной матрицей: сканирование 200-400 нм
МС детектирование: ESI, режим положительного/отрицательного ионообразования
Растворители:
A1: 10 мМ водный раствор ацетата аммония
B1: ацетонитрил

[0140] Все амидные производные формул (I), (II) и (III) могут быть получены с помощью методик, описанных ниже в общих способах, с помощью специальных методов, описанных в части Примеры синтеза и в части Синтез промежуточных продуктов, или с помощью обычных модификаций указанных способов. Настоящее изобретение также включает любой один или несколько из этих способов получения амидных производных формул (I), (II) и (III) в дополнение к способам получения любых новых промежуточных соединений, используемым в них.
[0141] В представленных далее общих способах дескрипторы принимают значения, определенные ранее для амидных производных формул (I), (II) и (III), если не указано иное. Все исходные материалы в представленных далее общих способах синтеза могут быть коммерчески доступными или могут быть получены обычными способами, известными специалистам в данной области, или, в противном случае, указаны в части синтеза промежуточных соединений.
[0142] <Схема A>
[Хим. формула 4]

[0143] На стадии A соединение формулы (I) может быть получено из соединения формулы (IV-a) амидированием с соединением формулы (IV-b) с использованием подходящего агента реакции конденсации, такого как HBTU, HATU, T3P (зарегистрированный товарный знак) и EDC-HOBT, предпочтительно в присутствии основания, такого как триэтиламин и N, N-диизопропилэтиламин, в подходящем растворителе, таком как ДМФА, DMA и ДХМ, при температуре примерно от 5 до 60°С в течение примерно 1-24 часов. Кроме того, соединение формулы (I) также может быть получено из соединения формулы (IV-a) амидированием галогенангидридом кислоты, полученным из соединения формулы (IV-b), с использованием тионилхлорида или оксалилхлорида, предпочтительно в присутствии основания, такого как триэтиламин, пиридин и N, N-диизопропилэтиламин, в подходящем растворителе, таком как ДХМ, при температуре примерно от 5 до 40°С в течение примерно 1-24 часов.
[0144] <Схема B>
{Хим. формула 5}
[0145] На стадии B-a соединение формулы (IV-a) может быть получено из соединения формулы (Va) и соединения формулы (Vb) реакцией SN-Ar, предпочтительно в присутствии основания, такого как гидроксид натрия, гидроксид калия, карбонат калия, карбонат натрия, карбонат цезия, трет-бутоксид калия и гидрид натрия, в подходящем растворителе, таком как ДМФА, DMA и ДХМ, при температуре примерно от 5 до 100°С в течение примерно 1-24 часов.
[0146] В случае, когда X представляет собой -O-, -NR9- или -S-, соединение формулы (IV-a) может быть получено в соответствии со стадией B-b алкилированием соединения формулы (V-c) алкилирующим реагентом (V-d) с использованием подходящего основания, такого как гидрид натрия, карбонат калия, карбонат цезия и трет-бутоксид калия, в подходящем растворителе, таком как ДМФА, DMA, ТГФ и ДХМ, при температуре примерно от 5 до 100°С в течение примерно 1-24 часов. В случае, когда X представляет собой -O-CR8aR8b-, -NR9-CR8aR8b- или -S-CR8aR8b-, соединение формулы (IV-a) может быть получено в соответствии со стадией B-c из соединения формулы (Ve) и алкилирующего агента (V-f) аналогично стадии B-b, где X в формуле (IV-a) представляет собой T-CR8aR8b.
[0147] На стадиях B-a, B-b и B-c удаление защитной группы может быть осуществлено обычными способами, известными специалистам в данной области (типичные защитные группы аминогруппы описаны в "Protective Groups in Organic Synthesis Forth Edition" edited by T. W. Greene et al. (John Wiley & Sons, 2007)).
[0148] <Схема С>
{Хим. формула 6}
[0149] Когда удаляемая группа в формуле (VI-a) на стадии C-a представляет собой O-трифторметансульфонат, O-тозилат, O-мезилат, йодид, бромид и хлорид, соединение формулы (VI-c) может быть получено реакцией сочетания соединения формулы (VI-a) с подходящим карбоксамидом формулы (VI-b) в условиях реакции сочетания в подходящих органических растворителях в присутствии подходящего катализатора на основе переходного металла и в присутствии или в отсутствие основания. Примеры подходящих катализаторов на основе переходных металлов включают тетракис(трифенилфосфин)палладий(0), хлорид бис(трифенилфосфин)палладия(II), медь(0), ацетат меди(I), бромид меди(I), хлорид меди(I), йодид меди(I), оксид меди(I), трифторметансульфонат меди(II), ацетат меди(II), бромид меди(II), хлорид меди(II), йодид меди(II), оксид меди(II), трифторметансульфонат меди(II), ацетат палладия(II), хлорид палладия(II), бис(ацетонитрил)дихлорпалладий(II), бис(дибензилиденацетон)палладий (0), трис(дибензилиденацетон)дипалладий(0) и дихлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия(II). Предпочтительными катализаторами являются тетракис(трифенилфосфин)палладий(0), хлорид бис(трифенилфосфин)палладия(II), ацетат палладия(II), хлорид палладия(II), бис(ацетонитрил)дихлорпалладий (0), бис(дибензилиденацетон)палладий(0), трис(дибензилиденацетон)дипалладий(0) и дихлорид [1,1-бис(дифенилфосфино)ферроцен]палладия(II). Примеры подходящего карбоксамида включают, но без ограничения, ацетамид, пропионамид, изобутирамид и циклопропанкарбоксамид. Примеры подходящего органического растворителя включают ТГФ, 1,4-диоксан, ДМФА, MeCN; спирты, такие как метанол или этанол; галогенированные углеводороды, такие как ДХМ, 1,2-дихлорэтан, хлороформ или четыреххлористый углерод; и диэтиловый эфир; в присутствии или в отсутствии основания, такого как трикалийфосфат, бикарбонат натрия, карбонат натрия или карбонат калия. Эта реакция может быть проведена в присутствии подходящего вспомогательного реагента. Примеры таких вспомогательных реагентов включают 4,5-бис(дифенилфосфино)-9,9-диметилксантен, трифенилфосфин, три-трет-бутилфосфин, 1,1'-бис(дифенилфосфино)ферроцен, три-2-фурилфосфин, три-о-толилфосфин, 2-(дихлоргексилфосфино)бифенил, трифенилсин. Реакция может быть проведена при температуре примерно от 50 до 200°С, более предпочтительно примерно от 80 до 150°С. Продолжительность реакции обычно составляет примерно от 5 минут до 48 часов, более предпочтительно примерно от 30 минут до 24 часов. В альтернативном случае реакция может осуществляться с помощью микроволновой системы. Реакция может быть проведена при температуре в интервале примерно от 100 до 200°С, предпочтительно в интервале примерно от 120 до 160°С. Продолжительность реакции обычно составляет примерно от 10 минут до 3 часов, предпочтительно примерно от 15 минут до 1 часа.
[0150] Альтернативно, соединение формулы (VI-c) может быть получено в соответствии со стадией C-b ацилированием подходящим галогенангидридом формулы (VI-e) с использованием подходящего основания, такого как пиридин, и подходящего растворителя, такого как DMA, при температуре примерно от 5 до 120°С в течение примерно 1-24 часов. Примеры подходящего галогенангидрида включают, но бз ограничения, ацетилхлорид, пропионилхлорид, изобутирилхлорид и циклопропанкарбонилхлорид.
[0151] В соответствии со стадией С-с, соединение формулы (IV-b) может быть получено гидролизом сложноэфирного соединения формулы (VI-с). Гидролиз может быть осуществлен в соответствии со стандартными методиками. В типичной методике гидролиз проводят в основных условиях, например в присутствии гидроксида натрия, гидроксида калия или гидроксида лития. Подходящие растворители включают, например, спирты, такие как вода, метанол, этанол, пропанол, бутанол, 2-метоксиэтанол и этиленгликоль; простые эфиры, такие как ТГФ, DME и 1,4-диоксан; амиды, такие как ДМФА и гексаметилфосфортриамид; и сульфоксиды, такие как ДМСО. Предпочтительными растворителями являются вода, метанол, этанол, пропанол, ТГФ, ДМЭ, 1,4-диоксан, ДМФА и ДМСО. Эту реакцию можно проводить при температуре в интрвале примерно от -20 до 100°С в течение примерно от 30 минут до 24 часов.
[0152] Синтез средней части
Все исходные материалы в синтезе средней части являются коммерчески доступными или могут быть получены обычными способами, известными специалистам в данной области, если не указано иное.
[0153] <Аминная часть>
Амин-5: гидрохлорид (R)-2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-1-амина
<Стадия-1>: трет-бутил-(R)-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)карбамат
К перемешиваемому раствору трет-бутил-(R)-(2-гидроксипропил)карбамата (389 мг, 2,22 ммоль) и гидрида натрия (60%, 89 мг, 2,22 ммоль) в ДМФА (12 мл) и ТГФ (2 мл) добавляют 2,3-дихлор-5-(трифторметил)пиридин (400 мг, 1,85 ммоль) при 0°С. Полученную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в ледяную воду (50 мл) и экстрагируют смесью EtOAc/гексан (4:1, 50 мл). Органический слой промывают водой (50 мл × 2) и сушат над сульфатом натрия. После удаления растворителя остаток очищают колоночной хроматографией на силикагеле (элюирование с градиентом: н-гексан/EtOAc от 100:1 до 20:1) с получением 166 мг (выход 25%) указанного в заголовке соединения в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ 8,31 (1H, д, J=1,8 Гц), 7,85 (1H, д, J=1,8 Гц), 5,43-5,34 (1H, м), 4,87 (1H, уш.с), 3,60-3,50 (1H, м), 3,42-3,32 (1H, м), 1,43 (9H, с), 1,38 (3H, д, J=6,4 Гц).
МС (ESI) m/z: 355 (М+Н)+.
[0154] <Стадия-2>: гидрохлорид (R)-2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-1-амина
Смесь трет-бутил-(R)-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)карбамата (166 мг, 0,47 ммоль, стадия-1) и 4М раствора хлористого водорода в 1,4-диоксане (8 мл) перемешивают при комнатной температуре в течение 1 часа. После удаления растворителя оставшееся твердое вещество промывают изопропиловым эфиром и гексаном с получением 134 мг (выход 98%) указанного в заголовке соединения в виде белого твердого вещества.
МС (ESI) m/z: 255 (М+Н)+.
[0155] Амин-10: гидрохлорид 2-((3-фтор-5-(трифторметил)пиридин-2-ил)окси)этанамина
<Стадия-1>: 2-(2-((3-фтор-5-(трифторметил)пиридин-2-ил)окси)этил)изоиндолин-1,3-дион
К перемешиваемому раствору 2-(2-гидроксиэтил)изоиндолин-1,3-диона (459 мг, 2,40 ммоль) и гидрида натрия (60%, 96 мг, 2,40 ммоль) в ДМФА (8 мл) и ТГФ (2 мл) при 0°С добавляют 2,3-дифтор-5-(трифторметил)пиридин (400 мг, 2,19 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в ледяную воду (50 мл) и экстрагируют смесью EtOAc/гексан (4:1, 50 мл). Органический слой промывают водой (50 мл × 2) и сушат над сульфатом натрия. После удаления растворителя остаток очищают колоночной хроматографией на силикагеле (элюирование: н-гексан/EtOAc 4:1) с получением 390 мг (выход 50%) указанного в заголовке соединения в виде твердого белого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 8,13-8,12 (1H, м), 7,87-7,82 (2H, м), 7,75-7,71 (2H, м), 7,51 (1H, дд, J=9,1, 1,8 Гц) 4,75 (2H, т, J=5,5 Гц), 4,15 (2H, т, J=5,5 Гц). МС (ESI) m/z: 355 (М+Н)+.
[0156] <Стадия-2>: гидрохлорид 2-((3-фтор-5-(трифторметил)пиридин-2-ил)окси)этанамина Смесь 2-(2-((3-фтор-5-(трифторметил)пиридин-2-ил)окси)этил)изоиндолин-1,3-диона (390 мг, 1,10 ммоль, стадия-1), моногидрата гидразина (0,17 мл, 5,50 ммоль) и метанола (8 мл) перемешивают при 50°С в течение 4 часов. После охлаждения до комнатной температуры осадок удаляют фильтрацией. После выпаривания фильтрата остаток растворяют в 1 М NaOH (50 мл) и экстрагируют ДХМ (50 мл × 2). Объединенную органическую фракцию сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток обрабатывают 2М раствором соляной кислоты в 1,4-диоксане (8 мл) при комнатной температуре в течение 5 минут. После удаления растворителя оставшееся твердое вещество промывают изопропиловым эфиром и гексаном, получая 185 мг (выход 65%) указанного в заголовке соединения в виде твердого белого вещества.
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,43 (1H, с), 8,26 (1H, дд, J=10,5, 1,8 Гц), 8,12 (2H, уш.с), 4,64-4,60 (2H, м) 3,27-3,24 (2Н, м).
МС (ESI) m/z: 225 (М+Н)+.
[0157] Амин-11: 2-(4-(пентафторсульфанил)фенокси)этанамин
<Стадия-1>: трет-бутил-(2-(4-(пентафторсульфанил)фенокси)этил)карбамат
К перемешиваемому раствору трет-бутил-(2-гидроксиэтил)карбамата (419 мг, 2,60 ммоль) и гидрида натрия (60%, 144 мг, 3,60 ммоль) в ДМФА (10 мл) при 0°С добавляют пентафторид п-фторфенилсеры (444 мг, 2,00 ммоль). Полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают в ледяную воду (50 мл) и экстрагируют смесью EtOAc/гексан (4:1, 50 мл). Органический слой промывают водой (50 мл × 2) и сушат над сульфатом натрия. Растворитель удаляют выпариванием, получая 727 мг (> 99% выход) указанного в заголовке соединения. Полученный продукт используют в следующей реакции (стадия-2) без дополнительной очистки.
МС (ESI) m/z: 408 (М+HCOO)-.
[0158] <Стадия-2>: 2-(4-(пентафторсульфанил)фенокси)этанамин
Смесь трет-бутил-(2-(4-(пентафторсульфанил)фенокси)этил)карбамата (182 мг, 0,50 ммоль, стадия 1) и 4М раствора соляной кислоты в EtOAc (3 мл) перемешивают при комнатной температуре в течение 0,5 часа. После удаления растворителя остаток разбавляют метанолом (12 мл) и наносят на сильный катионообменный картридж (ISOLUTE (зарегистрированная торговая марка) SCX, 1 г/6 мл × 4, Biotage), и твердофазную матрицу промывают метанолом (5 мл × 4). Материал элюируют 1 М раствором аммиака в метаноле (5 мл × 4) и концентрируют объединенный элюат при пониженном давлении, получая 83 мг (выход 63%) указанного в заголовке соединения.
МС (ESI) m/z: 264 (М+Н)+.
[0159] Амин-12: гидрохлорид 2-((6-(трифторметил)хинолин-2-ил)окси)этанамина
<Стадия-1>: трет-бутил-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)карбамат
Указанное в заголовке соединение получают с выходом 54% (167 мг, твердое белое вещество) из 2-хлор-6-(трифторметил)хинолина (200 мг, 0,86 ммоль) и трет-бутил-(2-гидроксиэтил)карбамата (167 мг, 1,04 ммоль) способом, представленным на стадии-1 получения амина-5.
1H-ЯМР (400 МГц, CDCl3) δ 8,06 (1H, д, J=8,7 Гц), 8,02 (1H, с), 7,91 (1H, д, J=8,7 Гц), 7,80 (1H, дд, J=8,7 , 1,8 Гц), 6,99 (1Н, д, J=8,7 Гц), 5,11 (1Н, уш.с), 4,59-4,56 (2Н, м), 3,64-3,58 (2Н, м), 1,45 (9Н, с). МС (ESI) m/z: 357 (М+Н)+.
[0160] <Стадия-2>: гидрохлорид 2-((6-(трифторметил)хинолин-2-ил)окси)этанамина
Указанное в заголовке соединение получают с выходом >99% (137 мг, твердое белое вещество) из трет-бутил-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)карбамата (167 мг, 0,47 ммоль, стадия-1) способом, аналогичным представленному на стадии-2 получения амина-5.
МС (ESI) m/z: 257 (М+Н)+.
[0161] Амин-13: гидрохлорид N1-(6-(трифторметил)хинолин-2-ил)этан-1,2-диамин
<Стадия-1>: трет-бутил-(2-((6-(трифторметил)хинолин-2-ил)амино)этил)карбамат
Смесь 2-хлор-6-(трифторметил)хинолина (110 мг, 0,48 ммоль), трет-бутил-(2-аминоэтил)карбамата (91 мг, 0,57 ммоль) и карбоната калия (197 мг, 1,43 ммоль) в ДМФА ( 3 мл) перемешивают при 100°С в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь выливают в воду (20 мл) и экстрагируют смесью EtOAc/гексан (4:1, 30 мл). Органический слой промывают водой (20 мл × 2) и сушат над сульфатом натрия. После удаления растворителя остаток очищают колоночной хроматографией на силикагеле, элюируя смесью н-гексан/EtOAc (от 5:1 до 4: 1), с получением 50 мг (выход 30%) указанного в заголовке соединения в виде белой пены.
1H-ЯМР (400 МГц, CDCl3) δ 7,85-7,81 (2H, м), 7,74-7,67 (2H, м), 6,69 (1H, д, J=8,7 Гц), 5,59 (1H, уш.с), 5,49 (1Н, уш.с), 3,70-3,65 (2Н, м), 3,47-4,42 (2Н, м), 1,43 (9Н, с).
МС (ESI) m/z: 356 (М+Н)+.
[0162] <Стадия-2>: гидрохлорид N1-(6-(трифторметил)хинолин-2-ил)этан-1,2-диамина
Указанное в заголовке соединение получают с выходом >99% (42 мг, твердое белое вещество) из трет-бутил-(2-((6-(трифторметил)хинолин-2-ил)амино)этил)карбамата (50 мг, 0,14 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения амина-5.
МС (ESI) m/z: 256 (М+Н)+.
[0163] Амин-14: гидрохлорид 2-((6-(трифторметил)изохинолин-1-ил)окси)этанамина
<Стадия-1>: трет-бутил-(2-((6-(трифторметил)изохинолин-1-ил)окси)этил)карбамат
Указанное в заголовке соединение получают с выходом 43% (66 мг, бесцветное масло) из 1-хлор-6-(трифторметил)изохинолина (100 мг, 0,43 ммоль) и трет-бутил-(2-гидроксиэтил)карбамата (84 мг, 0,52 ммоль) способом, аналогичным описанному на стадии-1 получения амина-5.
1H-ЯМР (400 МГц, CDCl3) δ 8,38 (1H, д, J=8,7 Гц), 8,07 (1H, дд, J=5,9, 1,8 Гц), 8,04 (1H, с), 7,71 (1H, дд, J=8,7, 1,8 Гц), 7,31 (1Н, д, J=5,9 Гц), 5,01 (1Н, уш.с), 4,62-4,59 (2Н, м), 3,70-3,60 (2Н, м), 1,45 (9Н, s) МС (ESI) m/z: 357 (М+Н)+.
[0164] <Стадия-2>: гидрохлорид 2-((6-(трифторметил)изохинолин-1-ил)окси)этанамина
Указанное в заголовке соединение получают с выходом >99% (54 мг, твердое белое вещество) из трет-бутил-(2-((6-(трифторметил)изохинолин-1-ил)окси)этил)карбамата (66 мг, 0,19 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения амина-5.
МС (ESI) m/z: 257 (М+Н)+.
[0165] Амин-15: гидрохлорид 2-((6-(2,2,2-трифторэтокси)нафталин-2-ил)окси)этанамина
<Стадия-1>: 6-(2,2,2-трифторэтокси)нафталин-2-ол
Смесь нафталин-2,6-диола (500 мг, 3,12 ммоль), 2,2,2-трифторэтилтрифторметансульфоната (797 мг, 3,43 ммоль) и карбоната калия (863 мг, 6,24 ммоль) в ДМФА (10 мл) перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь разбавляют 1 М HCl (100 мл) и экстрагируют смесью EtOAc/гексан (4:1, 100 мл). Органический слой промывают водой (100 мл × 2) и сушат над сульфатом натрия. После удаления растворителя остаток очищают колоночной хроматографией на силикагеле, элюируя смесью н-гексан/EtOAc (4: 1) с получением 265 мг (выход 35%) указанного в заголовке соединения в виде твердого белого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,66-7,63 (2H, м), 7,18 (1H, дд, J=9,1, 2,7 Гц), 7,14-7,09 (3H, м), 4,94 (1H, с), 4,44 (2H, кв, J=8,2 Гц).
МС (ESI) m/z: 241 (MH)-.
[0166] <Стадия-2>: трет-бутил-(2-((6-(2,2,2-трифторэтокси)нафталин-2-ил)окси)этил)карбамат
Смесь 6-(2,2,2-трифторэтокси)нафталин-2-ола (265 мг, 1,09 ммоль, стадия-1), трет-бутил-(2-бромэтил)карбамата (294 мг, 1,31 ммоль) и карбоната калия (454 мг, 3,28 ммоль) в ДМФА (6 мл) перемешивают при 60°С в течение 4 часов. После охлаждения до комнатной температуры реакционную смесь выливают в воду (50 мл) и экстрагируют смесью EtOAc/гексан (4:1, 50 мл). Органический слой промывают водой (50 мл × 2) и сушат над сульфатом натрия. После удаления растворителя остаток очищают колоночной хроматографией на силикагеле, элюируя смесью н-гексан/EtOAc (4:1), с получением 288 мг (выход 68%) указанного в заголовке соединения в виде твердого белого вещества.
1H-ЯМР (400 МГц, CDCl3) δ 7,66 (2H, т, J=9,6 Гц), 7,20-7,10 (4H, м), 5,03 (1H, уш.с), 4,45 (2H, кв, J=8,2 Гц)), 4,14-4,10 (2Н, м), 3,62-3,58 (2Н, м), 1,46 (9Н, с).
МС (ESI) m/z: 430 (М+HCOO)-.
[0167] <Стадия 3>: гидрохлорид 2-((6-(2,2,2-трифторэтокси)нафталин-2-ил)окси)этанамина
Указанное в заголовке соединение получают с выходом 93% (223 мг, твердое белое вещество) из трет-бутил-(2-((6-(2,2,2-трифторэтокси)нафталин-2-ил)окси)этил)карбамата (288 мг, 0,75 ммоль, стадия-2) способом, аналогичным описанному на стадии-2 получения амина-5.
МС (ESI) m/z: 286 (М+Н)+.
[0168] Амин-17: гидрохлорид (R)-1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-амина
<Стадия-1>: трет-бутил-(R)-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)карбамат
Указанное в заголовке соединение получают с выходом 74% (483 мг, твердое белое вещество) из 2,3-дихлор-5-(трифторметил)пиридина (400 мг, 1,85 ммоль) и трет-бутил-(R)-(1-гидроксипропан-2-ил)карбамата (389 мг, 2,22 ммоль) способом, аналогичным описанному на стадии-1 получения амина-5.
1H-ЯМР (400 МГц, CDCl3) δ 8,31 (1Н, с), 7,85 (1Н, д, J=2,3 Гц), 4,72 (1Н, уш.с), 4,45-4,34 (2Н, м), 4,16 (1Н , уш.с), 1,44 (9H, с), 1,29 (3H, д, J=6,9 Гц).
МС (ESI) m/z: 399 (М+HCOO)-.
[0169] <Стадия-2>: гидрохлорид (R)-1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-амина
Указанное в заголовке соединение получают с выходом 97% (383 мг, твердое белое вещество) из трет-бутил-(R)-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-2-ил)карбамата (483 мг, 1,36 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения амина-5.
МС (ESI) m/z: 255 (М+Н)+.
[0170] Амин-18: гидрохлорид (S)-2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-1-амина
<Стадия-1>: трет-бутил-(S)-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)карбамата
Указанное в заголовке соединение получают с выходом 32% (213 мг, бесцветное масло) из 2,3-дихлор-5-(трифторметил)пиридина (400 мг, 1,85 ммоль) и трет-бутил-(S)-(2-гидроксипропил)карбамата (389 мг, 2,22 ммоль) способом, аналогичным описанному на стадии-1 получения амина-5.
1H-ЯМР (400 МГц, CDCl3) δ 8,31 (1H, д, J=1,8 Гц), 7,85 (1H, д, J=1,8 Гц), 5,43-5,34 (1H, м), 4,87 (1H, уш.с), 3,60-3,50 (1H, м), 3,42-3,32 (1H, м), 1,43 (9H, с), 1,38 (3H, д, J=6,4 Гц).
МС (ESI) m/z: 355 (М+Н)+.
[0171] <Стадия-2>: гидрохлорид (S)-2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропан-1-амина
Указанное в заголовке соединение получают с выходом 99% (173 мг, твердое белое вещество) из трет-бутил-(S)-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)карбамата (213 мг, 0,60 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения амина-5.
МС (ESI) m/z: 255 (М+Н)+.
[0172] Амин-19: трифторацетат 2-((7-(трифторметил)хинолин-4-ил)окси)этанамина
<Стадия-1>: трет-бутил-(2-((7-(трифторметил)хинолин-4-ил)окси)этил)карбамат
Указанное в заголовке соединение получают с выходом 8% (48 мг, твердое вещество бледно-желтого цвета) из 4-хлор-7-(трифторметил)хинолина (400 мг, 1,73 ммоль) и трет-бутил-(2-гидроксиэтил)карбамата (334 мг, 2,07 ммоль) способом, аналогичным описанному на стадии-1 получения амина-5.
1H-ЯМР (400 МГц, CDCl3) δ 8,64 (1H, д, J=5,0 Гц), 8,27 (1H, с), 7,89 (1H, д, J=8,7 Гц), 7,60 (1H, д, J=8,7 Гц), 6,50 (1H, д, J=5,0 Гц), 5,83-5,79 (1H, м), 4,50-4,46 (2H, м), 3,65-3,60 (2H, м), 1,50 (9H, с).
МС (ESI) m/z: 357 (М+Н)+.
[0173] <Стадия-2>: трифторацетат 2-((7-(трифторметил)хинолин-4-ил)окси)этанамина
Смесь трет-бутил-(2-((7-(трифторметил)хинолин-4-ил)окси)этил)карбамата (48 мг, 0,14 ммоль, стадия-1), ТФУК (2 мл) и ДХМ (2 мл) перемешивают при комнатной температуре в течение 1 часа. Растворитель выпаривают при пониженном давлении, получая 50 мг (>99% выход) указанного в заголовке соединения в виде бесцветного масла.
МС (ESI) m/z: 257 (М+Н)+.
[0174] Амин-20: гидрохлорид 2-((5-хлор-3-(трифторметил)пиридин-2-ил)окси)этанамина
<Стадия-1>: 2-(2-((5-хлор-3-(трифторметил)пиридин-2-ил)окси)этил)изоиндолин-1,3-дион
Указанное в заголовке соединение получают с выходом 49% (475 мг, твердое белое вещество) из 2,5-дихлор-3-(трифторметил)пиридина (570 мг, 2,64 ммоль) и 2-(2-гидроксиэтил)изоиндолин-1,3-диона (555 мг, 2,90 ммоль) способом, аналогичным описанному на стадии-1 получения амина-10.
1H-ЯМР (400 МГц, CDCl3) δ 8,20 (1H, д, J=1,8 Гц), 7,88-7,82 (2H, м), 7,80 (1H, д, J=1,8 Гц), 7,74-7,70 (2H, м), 4,68 (2H, т, J=5,7 Гц), 4,14 (2H, т, J=5,7 Гц).
МС (ESI) m/z: 371 (М+Н)+.
[0175] <Стадия-2>: гидрохлорид 2-((5-хлор-3-(трифторметил)пиридин-2-ил)окси)этанамина
Указанное в заголовке соединение получают с выходом >99% (355 мг, твердое белое вещество) из 2-(2-((5-хлор-3-(трифторметил)пиридин-2-ил)окси)этил)изоиндолин-1,3-диона (475 мг, 1,28 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения амина-10.
МС (ESI) m/z: 241 (М+Н)+.
[0176] Амин-21: гидрохлорид 2-((4-(трифторметил)хинолин-2-ил)окси)этанамин
<Стадия-1>: 2-(2-((4-(трифторметил)хинолин-2-ил)окси)этил)изоиндолин-1,3-дион
Указанное в заголовке соединение получают с выходом 32% (213 мг, твердое белое вещество) из 2-хлор-4-(трифторметил)хинолина (400 мг, 1,73 ммоль) и 2-(2-гидроксиэтил)изоиндолин-1,3-диона (363 мг, 1,90 ммоль) способом, аналогичным описанному на стадии-1 получения амина-10.
1H-ЯМР (400 МГц, CDCl3) δ 7,97 (1H, д, J=8,2 Гц), 7,87-7,78 (3H, м), 7,73-7,61 (3H, м), 7,48-7,43 (1H, м), 7,19 (1Н, с), 4,81-4,78 (2Н, м), 4,21-4,18 (2Н, м).
МС (ESI) m/z: 387 (М+Н)+.
[0177] <Стадия-2>: гидрохлорид 2-((4-(трифторметил)хинолин-2-ил)окси)этанамина
Указанное в заголовке соединение получают с выходом >99% (161 мг, твердое белое вещество) из 2-(2-((4-(трифторметил)хинолин-2-ил)окси)этил)изоиндолин-1,3-диона (213 мг, 0,55 ммоль, стадия 1) способом, аналогичным описанному на стадии-2 получения амина-10.
МС (ESI) m/z: 257 (М+Н)+.
[0178] Амин-25: гидрохлорид 2-(2-хлор-4-(трифторметокси)фенокси)этанамин
<Стадия-1>: трет-бутил-(2-(2-хлор-4-(трифторметокси)фенокси)этил)карбамат
Указанное в заголовке соединение получают с выходом >99% (669 мг, твердое белое вещество) из 2-хлор-4-(трифторметокси)фенола (400 мг, 1,88 ммоль) и трет-бутил-(2-бромэтил)карбамата (506 мг, 2,26 ммоль) способом, аналогичным описанному на стадии-2 получения амина-15.
1H-ЯМР (400 МГц, CDCl3) δ 7,30-7,28 (1Н, м), 7,11-7,08 (1Н, м), 6,91 (1Н, д, J=8,7 Гц), 5,03 (1Н, уш.с), 4,09 -4,06 (2H, м), 3,61-3,54 (2H, м), 1,45 (9H, с).
[0179] <Стадия 2>: гидрохлорид 2-(2-хлор-4-(трифторметокси)фенокси)этанамина
Указанное в заголовке соединение получают с выходом 93% (510 мг, твердое белое вещество) из трет-бутил-(2-(2-хлор-4-(трифторметокси)фенокси)этил)карбамата (669 мг, 1,88 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения амина-5.
МС (ESI) m/z: 256 (М+Н)+.
[0180] Амин-28: трифторацетат 2-(2-аминоэтокси)-5-(трифторметил)никотинонитрила
<Стадия-1>: трет-бутил-(2-((3-циано-5-(трифторметил)пиридин-2-ил)окси)этил)карбамат
Указанное в заголовке соединение получают с выходом 66% (425 мг, твердое белое вещество) из 2-хлор-5-(трифторметил)никотинонитрила (400 мг, 1,94 ммоль) и трет-бутил-(2-гидроксиэтил)карбамата (375 мг, 2,32 ммоль) способом, аналогичным описанному на стадии-1 получения амина-5.
1H-ЯМР (400 МГц, CDCl3) δ 8,61 (1H, д, J=1,8 Гц), 8,12 (1H, д, J=1,8 Гц), 4,94 (1H, уш.с), 4,57 (2H, т, J=5,3 Гц), 3,62-3,58 (2H, м), 1,45 (9H, с).
МС (ESI) m/z: 332 (М+Н)+.
[0181] <Стадия-2>: трифторацетат 2-(2-аминоэтокси)-5-(трифторметил)никотинонитрила
Указанное в заголовке соединение получают с выходом >99% (443 мг, твердое белое вещество) из трет-бутил-(2-((3-циано-5-(трифторметил)пиридин-2-ил)окси)этил)карбамата (425 мг, 1,28 ммоль, стадия 1) способом, аналогичным описанному на стадии-2 получения амина-19.
МС (ESI) m/z: 232 (М+Н)+.
[0182] Амин-31: гидрохлорид 2-(2-метокси-4-(трифторметил)фенокси)этанамина
<Стадия-1>: трет-бутил-(2-(2-метокси-4-(трифторметил)фенокси)этил)карбамат
Указанное в заголовке соединение получают с выходом >99% (436 мг, твердое белое вещество) из 2-метокси-4-(трифторметил)фенола (250 мг, 1,30 ммоль) и трет-бутил-(2-бромэтил)карбамата (350 мг, 1,56 ммоль) способом, аналогичным описанному на стадии-2 получения амина-15.
1H-ЯМР (400 МГц, CDCl3) δ 7,19 (1H, дд, J=8,2, 1,8 Гц), 7,08 (1H, д, J=1,8 Гц), 6,94 (1H, д, J=8,2 Гц), 5,10 ( 1H, уш.с), 4,11 (2H, т, J=5,0 Гц), 3,91 (3H, с), 3,62-3,54 (2H, м), 1,45 (9H, с).
[0183] <Стадия 2>: гидрохлорид 2-(2-метокси-4-(трифторметил)фенокси)этанамина
Указанное в заголовке соединение получают с выходом 98% (347 мг, твердое белое вещество) из трет-бутил-(2-(2-метокси-4-(трифторметил)фенокси)этил)карбамата (436 мг, 1,30 ммоль, стадия 1) способом, аналогичным описанному на стадии-2 получения амина-5. МС (ESI) m/z: 236 (М+Н)+.
[0184] Амин-32: гидрохлорид 2-(2-метил-4-(трифторметил)фенокси)этанамина
<Стадия-1>: трет-бутил-(2-(2-метил-4-(трифторметил)фенокси)этил)карбамат
Указанное в заголовке соединение получают с выходом >99% (181 мг, твердое белое вещество) из 2-метил-4-(трифторметил)фенола (100 мг, 0,57 ммоль) и трет-бутил-(2-бромэтил)карбамата (153 мг, 0,68 ммоль) способом, аналогичным описанному на стадии-2 получения амина-15.
1H-ЯМР (400 МГц, CDCl3) δ 7,43-7,38 (2H, м), 6,84 (1H, д, J=8,2 Гц), 4,94 (1H, уш.с), 4,06 (2H, т, J=5,0 Гц), 3,62-3,52 (2H, м), 2,26 (3H, с), 1,46 (9H, с).
[0185] <Стадия-2>: гидрохлорид 2-(2-метил-4-(трифторметил)фенокси)этанамина
Указанное в заголовке соединение получают с выходом >99% (145 мг, твердое белое вещество) из трет-бутил-(2-(2-метил-4-(трифторметил)фенокси)этил)карбамата (181 мг, 0,57 ммоль, стадия 1) способом, аналогичным описанному на стадии-2 получения амина-5.
МС (ESI) m/z: 220 (М+Н)+.
[0186] Амин-33: гидрохлорид 2-(3-фтор-4-(трифторметокси)фенокси)этанамина
<Стадия-1>: трет-бутил-(2-(3-фтор-4-(трифторметокси)фенокси)этил)карбамат
Указанное в заголовке соединение получают с выходом 89% (230 мг, бесцветное масло) из 3-фтор-4-(трифторметокси)фенола (150 мг, 0,77 ммоль) и трет-бутил-(2-бромэтил)карбамата (206 мг, 0,92). ммоль) способом, аналогичным описанному на стадии-2 получения амина-15.
1H-ЯМР (400 МГц, CDCl3) δ 7,24-7,17 (1H, м), 6,73 (1H, дд, J=11,6, 2,9 Гц), 6,66 (1H, ддд, J=9,0, 2,9, 1,5 Гц), 4,93 (1H, уш.с), 4,00 (2H, т, J=5,2 Гц), 3,53 (2H, кв, J=5,2 Гц), 1,45 (9H, с).
МС (ESI) m/z: 340 (М+Н)+.
[0187] <Стадия-2>: гидрохлорид 2-(3-фтор-4-(трифторметокси)фенокси)этанамина
Указанное в заголовке соединение получают с выходом 83% (156 мг, твердое белое вещество) из трет-бутил-(2-(3-фтор-4-(трифторметокси)фенокси)этил)карбамата (230 мг, 0,68 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения амина-5. 1H-ЯМР (400 МГц, ДМСО-d6) δ 8,25 (3H, уш.с), 7,57-7,49 (1H, м), 7,18 (1H, дд, J=1, 2,3, 3,0 Гц), 6,92 (1H, ддд) , J=9,2, 3,0, 1,6 Гц), 4,24 (2H, т, J=5,0 Гц), 3,21 (2H, т, J=5,0 Гц).
МС (ESI) m/z: 240 (М+Н)+.
[0188] Амин-34: гидрохлорид 2-(3-фтор-4-(трифторметил)фенокси)этанамина
<Стадия-1>: трет-бутил-(2-(3-фтор-4-(трифторметил)фенокси)этил)карбамат
Указанное в заголовке соединение получают с выходом 87% (78 мг, бесцветное масло) из 3-фтор-4-(трифторметил)фенола (50 мг, 0,28 ммоль) и трет-бутил-(2-бромэтил)карбамата (81 мг, 0,36). ммоль) способом, аналогичным описанному на стадии-2 получения амина-15.
1H-ЯМР (400 МГц, CDCl3) δ 7,50 (1Н, т, J=8,4 Гц), 6,79-6,63 (2Н, м), 4,94 (1Н, уш.с), 4,05 (2Н, т, J=5,1 Гц), 3,55 (2H, кв, J=5,1 Гц), 1,45 (9H, с).
МС (ESI) m/z: 324 (M+H)+.
[0189] <Стадия-2>: гидрохлорид 2-(3-фтор-4-(трифторметил)фенокси)этанамина
Указанное в заголовке соединение получают с выходом 93% (58 мг, твердое белое вещество) из трет-бутил-(2-(3-фтор-4-(трифторметил)фенокси)этил)карбамата (78 мг, 0,24 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения амина-5.
1H-ЯМР (400 МГц, ДМСО-d6) δ 8,18 (3Н, уш.с), 7,73 (1Н, т, J=8,8 Гц), 7,18 (1Н, дд, J=12,7, 2,2 Гц), 7,00 (1Н , дд, J=8,8, 2,2 Гц), 4,29 (2H, т, J=5,1 Гц), 3,24 (2H, т, J=5,1 Гц).
МС (ESI) m/z: 224 (М+Н)+.
[0190] <Синтез части карбоновой кислоты>
Карбоновая кислота-1: 2-пропионамидоизоникотиновая кислота
<Стадия-1>: метил-2-пропионамидоизоникотинат
К перемешиваемому раствору метил-2-аминоизоникотината (1,00 г, 6,57 ммоль) в пиридине (22 мл) при 0°С добавляют пропионилхлорид (0,69 мл, 7,89 ммоль). Смесь перемешивают при 0°С в течение 2 часов, затем выливают в 2 М соляную кислоту (100 мл) и экстрагируют EtOAc (100 мл). Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении, получая 1,07 г (выход 78%) указанного в заголовке соединения в виде желтого твердого вещества. Полученный продукт используют в следующей реакции (стадия-2) без дополнительной очистки.
1H-ЯМР (300 МГц, ДМСО-d6) δ 10,71 (1H, с), 8,60 (1H, с), 8,47 (1H, д, J=5,1 Гц), 7,50 (1H, дд, J=5,1, 1,1 Гц), 3,88 (3Н, с), 2,40 (2Н, кв, J=7,7 Гц), 1,06 (3Н, т, J=7,7 Гц).
МС (ESI) m/z: 209 (М+Н)+.
[0191] <Стадия-2>: 2-пропионамидоизоникотиновая кислота
Смесь метил-2-пропионамидоизоникотината (1,07 г, 5,15 ммоль), 2 М водного раствора гидроксида натрия (5 мл) и метанола (25 мл) перемешивают при 50°С в течение 2 часов. Метанол удаляют выпариванием, раствор подкисляют 2М соляной кислотой и экстрагируют EtOAc. Органический слой сушат над сульфатом натрия и концентрируют в вакууме. Твердый остаток промывают тетрагидрофураном и н-гексаном, получая 0,76 г (выход 76%) указанного в заголовке соединения в виде твердого белого вещества.
1H-ЯМР (300 МГц, ДМСО-d6) δ 10,65 (1H, с), 8,57 (1H, с), 8,44 (1H, д, J=5,1 Гц), 7,48 (1H, д, J=5,1 Гц), 2,40 (2H, кв, J=7,3 Гц), 1,06 (3H, т, J=7,3 Гц).
МС (ESI) m/z: 195 (М+Н)+.
[0192] Карбоновая кислота-2: 2-(циклопропанкарбоксамидо)изоникотиновая кислота
<Стадия-1>: метил-2-(циклопропанкарбоксамидо)изоникотинат
Указанное в заголовке соединение получают с выходом 92% (1,60 г, желтое твердое вещество) из метил-2-аминоизоникотината (1,20 г, 7,89 ммоль) и циклопропанкарбонилхлорида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-1.
1H-ЯМР (300 МГц, ДМСО-d6) δ 8,73 (1H, с), 8,39 (1H, д, J=4,4 Гц), 8,28 (1H, уш.с), 7,59 (1H, дд, J=5,1, 1,4 Гц), 3,93 (3Н, с), 1,59-1,50 (1Н, м), 1,17-1,12 (2Н, м), 0,96-0,89 (2Н, м).
МС (ESI) m/z: 221 (М+Н)+, 219 (МН)-.
[0193] <Стадия-2>: 2-(циклопропанкарбоксамидо)изоникотиновая кислота
Указанное в заголовке соединение получают с выходом 94% (1,41 г, твердое белое вещество) из метил-2-(циклопропанкарбоксамидо)изоникотината (1,60 г, 7,27 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-1.
1H-ЯМР (300 МГц, ДМСО-d6) δ 11,02 (1Н, с), 8,57 (1Н, с), 8,47 (1Н, д, J=5,1 Гц), 7,49 (1Н, дд, J=5,1, 1,5 Гц), 2,07-1,98 (1Н, м), 0,85-0,79 (4Н, м).
МС (ESI), m/z: 207 (М+Н)+, 205 (МН)-.
[0194] Карбоновая кислота-3: 2-изобутирамидоизоникотиновая кислота
<Стадия-1>: метил-2-изобутирамидоизоникотинат Указанное в заголовке соединение получают с выходом 93% (2,20 г, желтое твердое вещество) из гидрохлорида метил-2-аминоизоникотината (2,00 г, 10,6 ммоль) и изобутирилхлорида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-1.
1H-ЯМР (270 МГц, CDCl3) δ 8,78 (1H, с), 8,39 (1H, д, J=5,3 Гц), 7,99 (1H, уш.с), 7,60 (1H, дд, J=5,3, 1,3 Гц), 3,94 (3Н, с), 2,58 (1Н, септет, J=7,3 Гц), 1,28 (6Н, д, J=7,3 Гц).
МС (ESI) m/z: 223 (М+Н)+.
[0195] <Стадия-2>: 2-изобутирамидоизоникотиновая кислота
Указанное в заголовке соединение получают с выходом 87% (1,79 г, твердое белое вещество) из метил-2-изобутирамидоизоникотината (2,20 г, 7,27 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-1.
1H-ЯМР (270 МГц, ДМСО-d6) δ 10,65 (1H, с), 8,60 (1H, с), 8,47 (1H, д, J=5,3 Гц), 7,50 (1H, дд, J=5,3, 1,3 Гц), 2,77 (1H, септет, J=6,6 Гц), 1,10 (6H, д, J=6,6 Гц).
МС (ESI) m/z: 207 (MH)-.
[0196] Карбоновая кислота-4: 2-ацетамидо-6-метилизоникотиновая кислота
<Стадия-1>: метил-2-ацетамидо-6-метилизоникотинат
Смесь метил-2-хлор-6-метилисоникотината (2,00 г, 10,8 ммоль), ацетамида (1,27 г, 21,6 ммоль), трис(дибензилиденацетон)дипалладия (0) (0,20 г, 0,22 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантена (0,37 г, 0,65 ммоль), трикалийфосфата (2,74 г, 12,9 ммоль) и 1,4-диоксана (26 мл) подвергают обработке микроволновым излучением при 150°С в течение 1 часа. После охлаждения до комнатной температуры смесь фильтруют через слой целита. Фильтрат концентрируют при пониженном давлении и очищают остаток колоночной хроматографией на силикагеле, элюируя смесью н-гексан/EtOAc (от 4:1 до 1:3), с получением 1,99 г (выход 89%) указанного в заголовке соединения в виде твердого вещества желтого цвета.
1H-ЯМР (270 МГц, CDCl3) δ 8,50 (1Н, уш.с), 8,17 (1Н, уш.с), 7,47 (1Н, уш.с), 3,94 (3Н, с), 2,50 (3Н, с) 2,22 (3Н, с).
МС (ESI) m/z: 209 (М+Н)+.
[0197] <Стадия-2>: 2-ацетамидо-6-метилизоникотиновая кислота
Смесь метил-2-ацетамидо-6-метилисоникотината (1,99 г, 9,56 ммоль, стадия-1), 0,5 М водного раствора гидроксида натрия (20 мл, 10,0 ммоль) и тетрагидрофурана (64 мл) перемешивают при комнатной температуре в течение 2,5 часов. Смесь подкисляют 2 М соляной кислотой и удаляют органический растворитель выпариванием. Осадок собирают фильтрацией и промывают диизопропиловым эфиром с получением 0,81 г (выход 44%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета.
1H-ЯМР (270 МГц, ДМСО-d6) δ 10,60 (1Н, с), 8,34 (1Н, с), 7,36 (1Н, с), 2,45 (3Н, с), 2,08 (3Н, с).
МС (ESI) m/z: 195 (M+H)+.
[0198] Карбоновая кислота-5: 2-изобутирамидо-6-метилизоникотиновая кислота
<Стадия-1>: метил-2-изобутирамидо-6-метилисоникотинат
Указанное в заголовке соединение получают с количественным выходом (1,27 г, желтый сироп) из метил-2-хлор-6-метилисоникотината (1,00 г, 5,39 ммоль) и изобутирамида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, CDCl3) δ 8,57 (1Н, с), 7,89 (1Н, уш.с), 7,47 (1Н, с), 3,93 (3Н, с), 2,54 (1Н, септет, J=6,6 Гц).), 2,51 (3Н, с), 1,27 (6Н, д, J=6,6 Гц).
МС (ESI) m/z: 237 (М+Н)+.
[0199] <Стадия-2>: 2-изобутирамидо-6-метилизоникотиновая кислота
Указанное в заголовке соединение получают с выходом 88% (1,05 г, твердое вещество бледно-розового цвета) из метил-2-изобутирамидо-6-метилисоникотината (1,00 г, 5,39 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-1.
1H-ЯМР (300 МГц, ДМСО-d6) δ 10,58 (1H, с), 8,39 (1H, с), 7,37 (1H, с), 2,74 (1H, септет, J=6,6 Гц), 2,46 (3H, с)) 1,06 (6H, д, J=6,6 Гц).
МС (ESI) m/z: 223 (М+Н)+.
[0200] Карбоновая кислота-6: 2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоновая кислота
<Стадия-1>: метил-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксилат
Указанное в заголовке соединение получают с выходом 71% (2,70 г, масло коричневого цвета) из метил-2-хлор-6-метилпиримидин-4-карбоксилата (3,00 г, 16,1 ммоль) и циклопропанкарбоксамида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-4.
МС (ESI) m/z: 236 (М+Н)+, 234 (М-Н)-.
[0201] <Стадия-2>: 2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоновая кислота
Указанное в заголовке соединение получают с выходом 73% (1,85 г, твердое вещество бледно-желтого цвета) из метил-2-(циклопропанкарбоксамидо)-6-метилпиримидин-4-карбоксилата (2,70 г, 11,5 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, ДМСО-d6) δ 11,16 (1Н, с), 2,48 (3Н, с), 2,18-2,09 (1Н, м), 0,86-0,82 (4Н, м).
МС (ESI) m/z: 222 (М+Н)+.
[0202] Карбоновая кислота-7: 2-(циклопропанкарбоксамидо)пиримидин-4-карбоновая кислота
<Стадия-1>: метил-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксилат
Указанное в заголовке соединение получают с количественным выходом (1,93 г, твердое вещество бледно-желтого цвета) из метил-2-хлорпиримидин-4-карбоксилата (1,50 г, 8,69 ммоль) и циклопропанкарбоксамида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, CDCl3) δ 8,86 (1H, д, J=5,1 Гц), 8,38 (1H, уш.с), 7,67 (1H, д, J=5,1 Гц), 4,03 (3H, с), 2,20-2,08 (1Н, м), 1,23-1,18 (2Н, м), 0,99-0,93 (2Н, м).
МС (ESI) m/z: 222 (М+Н)+.
[0203] <Стадия-2>: 2-(циклопропанкарбоксамидо)пиримидин-4-карбоновая кислота
Указанное в заголовке соединение получают с выходом 66% (1,19 г, твердое не совсем белое вещество) из метил-2-(циклопропанкарбоксамидо)пиримидин-4-карбоксилата (1,93 г, 8,72 ммоль, стадия 1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, ДМСО-d6) δ 11,20 (1Н, с), 8,89 (1Н, д, J=4,4 Гц), 7,63 (1Н, д, J=4,4 Гц), 2,20-2,10 (1Н, м) 0,83 (4H, д, J=6,6 Гц).
МС (ESI) m/z: 206 (МН)-.
[0204] Карбоновая кислота-8: 2-бутирамидоизоникотиновая кислота
<Стадия-1>: метил-2-бутирамидоизоникотинат
Указанное в заголовке соединение получают с выходом 82% (1,94 г, твердое белое вещество) из гидрохлорида метил-2-аминоизоникотината (2,00 г, 10,6 ммоль) и бутирилхлорида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-1.
1H-ЯМР (300 МГц, CDCl3) δ 8,76 (1H, с), 8,39 (1H, д, J=5,1 Гц), 8,08 (1H, уш.с), 7,60 (1H, дд, J=5,1, 1,5 Гц)), 3,95 (3H, с), 2,41 (2H, т, J=7,3 Гц), 1,80 (2H, секстет, J=7,3 Гц), 1,02 (3H, т, J=7,3 Гц).
МС (ESI) m/z: 223 (М+Н)+.
[0205] <Стадия-2>: 2-бутирамидоизоникотиновая кислота
Указанное в заголовке соединение получают с выходом 76% (1,28 г, твердое белое вещество) из метил-2-бутирамидоизоникотината (1,94 г, 8,71 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-1.
1H-ЯМР (300 МГц, ДМСО-d6) δ 10,66 (1H, с), 8,58 (1H, с), 8,45 (1H, д, J=5,1 Гц), 7,48 (1H, дд, J=5,1, 1,5 Гц), 2,37 (2H, т, J=7,3 Гц), 1,59 (2H, секстет, J=7,3 Гц), 0,89 (3H, т, J=7,3 Гц).
МС (ESI) m/z: 209 (М+Н)+, 207 (МН)-.
[0206] Карбоновая кислота-9: 2-пиваламидоизоникотиновая кислота
<Стадия-1>: метил-2-пиваламидоизоникотинат
Указанное в заголовке соединение получают с количественным выходом (1,25 г, бесцветный сироп) из гидрохлорида метил-2-аминоизоникотината (1,00 г, 5,30 ммоль) и пивалоилхлорида способом, аналогичным описанному на стадии-1 из карбоновой кислоты-1.
1H-ЯМР (270 МГц, CDCl3) δ 8,81 (1H, с), 8,39 (1H, д, J=5,3 Гц), 8,24 (1H, уш.с), 7,61 (1H, дд, J=5,3, 1,3 Гц), 3,94 (3Н, с), 1,35 (9Н, с).
[0207] <Стадия-2>: 2-пиваламидоизоникотиновая кислота
Указанное в заголовке соединение получают с выходом 61% (0,72 г, твердое белое вещество) из метил-2-пиваламидоизоникотината (1,25 г, 5,30 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-1.
1H-ЯМР (270 МГц, ДМСО-d6) δ 10,07 (1H, с), 8,55 (1H, с), 8,49 (1H, д, J=5,3 Гц), 7,53 (1H, д, J=5,3 Гц), 1,25 (9H, с).
МС (ESI) m/z: 223 (М+Н)+.
[0208] Карбоновая кислота-10: 2-метил-6-пропионамидоизоникотиновая кислота
<Стадия-1>: метил-2-метил-6-пропионамидоизоникотинат
Указанное в заголовке соединение получают с выходом 60% (2,16 г, твердое вещество бледно-желтого цвета) из метил-2-хлор-6-метилисоникотината (3,00 г, 16,2 ммоль) и пропионамида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, CDCl3) δ 8,55 (1Н, с), 7,93 (1Н, уш.с), 7,47 (1Н, с), 3,93 (3Н, с), 2,51 (3Н, с), 2,44 (2Н, кв, J=7,3 Гц), 1,26 (3H, т, J=7,3 Гц).
МС (ESI) m/z: 223 (М+Н)+.
[0209] <Стадия-2>: 2-метил-6-пропионамидоизоникотиновая кислота
Указанное в заголовке соединение получают с выходом 96% (1,95 г, твердое белое вещество) из метил-2-метил-6-пропионамидоизоникотината (2,16 г, 9,72 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-1.
1H-ЯМР (300 МГц, ДМСО-d6) δ 10,60 (1Н, с), 8,40 (1Н, с), 7,38 (1Н, с), 2,47 (3Н, с), 2,40 (2Н, кв, J=7,3 Гц), 1,06 (3H, т, J=7,3 Гц).
МС (ESI) m/z: 209 (M+H)+.
[0210] Карбоновая кислота-11: 2-(циклопропанкарбоксамидо)-6-метилизоникотиновая кислота
<Стадия-1>: метил-2-(циклопропанкарбоксамидо)-6-метилисоникотинат
Указанное в заголовке соединение получают с выходом 66% (1,3 г, твердое вещество бледно-желтого цвета) из метил-2-хлор-6-метилисоникотината (1,5 г, 8,1 ммоль) и циклопропанкарбоксамида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, CDCl3) δ 8,52 (1Н, с), 8,17 (1Н, уш.с), 7,46 (1Н, с), 3,92 (3Н, с), 2,52 (3Н, с), 1,60-1,50 (1Н, м), 1,15-1,10 (2Н, м), 0,93-0,88 (2Н, м).
МС (ESI) m/z: 235 (М+Н)+, 233 (МН)-.
[0211] <Стадия-2>: 2-(циклопропанкарбоксамидо)-6-метилизоникотиновая кислота
Указанное в заголовке соединение получают с выходом 89% (1,1 г, твердое белое вещество) из метил-2-(циклопропанкарбоксамидо)-6-метилисоникотината (1,3 г, 5,3 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты -1.
1H-ЯМР (300 МГц, ДМСО-d6) δ 10,96 (1Н, с), 8,38 (1Н, с), 7,37 (1Н, с), 2,48 (3Н, с), 2,04-1,90 (1Н, м), 0,83-0,70 (4H, м).
МС (ESI) m/z: 221 (М+Н)+, 219 (МН)-.
[0212] Карбоновая кислота-12: 2-ацетамидо-6-метилпиримидин-4-карбоновая кислота
<Стадия-1>: метил-2-ацетамидо-6-метилпиримидин-4-карбоксилат
Указанное в заголовке соединение получают с выходом 68% (0,76 г, твердое вещество желтого цвета) из метил-2-хлор-6-метилпиримидин-4-карбоксилата (1,0 г, 5,4 ммоль) и ацетамида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, CDCl3) δ 8,01 (1Н, уш.с), 7,54 (1Н, с), 4,00 (3Н, с), 2,59 (3Н, с), 2,53 (3Н, с).
МС (ESI) m/z: 210 (М+Н)+.
[0213] <Стадия-2>: 2-ацетамидо-6-метилпиримидин-4-карбоновая кислота
Указанное в заголовке соединение получают с выходом 30% (0,21 г, твердое вещество желтого цвета) из метил-2-ацетамидо-6-метилпиримидин-4-карбоксилата (1,3 г, 5,3 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, ДМСО-d6) δ 10,76 (1Н, с), 7,55 (1Н, с), 2,49 (3Н, с), 2,20 (3Н, с).
МС (ESI) m/z: 196 (М+Н)+.
[0214] Карбоновая кислота-13: 6-метил-2-пропионамидопиримидин-4-карбоновая кислота
<Стадия-1>: метил-6-метил-2-пропионамидопиримидин-4-карбоксилат
Указанное в заголовке соединение получают с выходом 61% (0,73 г, твердое вещество желтого цвета) из метил-2-хлор-6-метилпиримидин-4-карбоксилата (1,0 г, 5,4 ммоль) и пропионамида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, CDCl3) δ 8,05 (1Н, уш.с), 7,54 (1Н, с), 4,00 (3Н, с), 2,77 (2Н, кв, J=7,3 Гц), 2,59 (3Н, с), 1,24 (3H, т, J=7,3 Гц).
МС (ESI) m/z: 224 (М+Н)+.
[0215] <Стадия-2>: 6-метил-2-пропионамидопиримидин-4-карбоновая кислота
Указанное в заголовке соединение получают с выходом 19% (0,13 г, желтое твердое вещество) из метил-6-метил-2-пропионамидопиримидин-4-карбоксилата (0,73 г, 3,3 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, CDCl3) δ 8,10 (1Н, уш.с), 7,68 (1Н, с), 2,66 (2Н, кв, J=7,3 Гц), 2,60 (3Н, с), 1,26 (3Н, т , J=7,3 Гц).
МС (ESI) m/z: 210 (М+Н)+.
[0216] Карбоновая кислота-14: 2-изобутирамидо-6-метилпиримидин-4-карбоновая кислота
<Стадия-1>: метил-2-изобутирамидо-6-метилпиримидин-4-карбоксилат
Указанное в заголовке соединение получают с выходом 88% (1,1 г, желтое твердое вещество) из метил-2-хлор-6-метилпиримидин-4-карбоксилата (1,0 г, 5,4 ммоль) и изобутирамида способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, CDCl3) δ 8,22 (1Н, уш.с), 7,56 (1Н, с), 4,01 (3Н, с), 2,90 (1Н, септ, J=7,3 Гц), 2,61 (3Н, с) 1,26 (6H, д, J=7,3 Гц).
МС (ESI) m/z: 238 (М+Н)+, 236 (МН)-.
[0217] <Стадия-2>: 2-изобутирамидо-6-метилпиримидин-4-карбоновая кислота
Указанное в заголовке соединение получают с выходом 46% (0,49 г, желтое твердое вещество) из метил-2-изобутирамидо-6-метилпиримидин-4-карбоксилата (1,1 г, 4,7 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-4.
1H-ЯМР (270 МГц, ДМСО-d6) δ 10,89 (1Н, уш.с), 7,55 (1Н, с), 2,84 (1Н, септет, J=7,3 Гц), 2,47 (3Н, с), 1,10 (6Н , д, J=7,3 Гц). МС (ESI) m/z: 224 (М+Н)+.
[0218] Карбоновая кислота-15: 2-(2-гидрокси-2-метилпропанамидо)-6-метилизоникотиновая кислота
<Стадия-1>: метил-2-(2-ацетокси-2-метилпропанамидо)-6-метилисоникотинат
Указанное в заголовке соединение получают с выходом 80% (0,89 г, твердое вещество желтого цвета) из метил-2-хлор-6-метилисоникотината (0,70 г, 3,8 ммоль) и 1-амино-2-метил-1-оксопропан-2-илацетата способом, аналогичным описанному на стадии-1 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, CDCl3) δ 8,58 (1Н, с), 8,34 (1Н, уш.с), 7,50 (1Н, с), 3,93 (3Н, с), 2,52 (3Н, с), 2,16 (3Н, s), 1,73 (6H, с).
МС (ESI) m/z: 295 (М+Н)+.
[0219] <Стадия-2>: 2-(2-гидрокси-2-метилпропанамидо)-6-метилизоникотиновая кислота
Указанное в заголовке соединение получают с выходом 80% (0,54 г, твердое белое вещество) из метил-2-(2-ацетокси-2-метилпропанамидо)-6-метилисоникотината (0,83 г, 2,8 ммоль, стадия-1) способом, аналогичным описанному на стадии-2 получения карбоновой кислоты-4.
1H-ЯМР (300 МГц, ДМСО-d6) δ 9,50 (1Н, уш.с), 8,39 (1Н, с), 7,45 (1Н, с), 6,07 (1Н, уш.с), 2,48 (3Н, с) 1,37 (6H, с).
МС (ESI) m/z: 239 (М+Н)+.
[0220] Пример синтеза
Пример 1: 2-(циклопропанкарбоксамидо)-N-(2-(4-(трифторметил)фенокси)пропил)изоникотинамид
К смеси 2-(4-(трифторметил)фенокси)пропан-1-амина (15 мг, 0,068 ммоль, амин-1), 2-(циклопропанкарбоксамидо)изоникотиновой кислоты (14 мг, 0,068 ммоль, карбоновая кислота-2) и N, N-диизопропилэтиламина (0,047 мл, 0,27 ммоль) в ДМФА (1 мл) при комнатной температуре добавляют HBTU (39 мг, 0,10 ммоль). Смесь перемешивают при 60°C в течение 2 часов, затем разбавляют EtOAc (6 мл), промывают водой и сушат над сульфатом натрия. Органический слой очищают колоночной хроматографией на NH-силикагеле, элюируя EtOAc, и затем препаративной ЖХ-МС с получением 8,6 мг указанного в заголовке соединения.
[0221] Соединения других примеров получают в соответствии с методикой, аналогичной описанной в примере 1, используя соответствующий амин и карбоновую кислоту (см. таблицу 2). Реагенты являются коммерчески доступными материалами или получены обычными способами, известными специалистам в данной области, в противном случае это указано в систезе промежуточной части.
[0222] Наблюдаемые значения МС (режим положительного или отрицательного ионообразования) и время удерживания, полученное с помощью ЖХ-MС, для соединений всех примеров представлены в таблице 3. Каждая химическая структура аминной части для синтеза соединения примера представлена как свободное основание в таблице 2. 1H-ЯМР соединений примеров 2, 7, 13, 15, 22, 35, 42, 53, 68 и 96 представлены в таблице 4.
[0223] [Таблица 2-1]

Пример 1
2-(Циклопропанкарбоксамидо)-N-(2-(4-
(трифторметил)фенокси)пропил)
изоникотинамид
Амин-1
Карбоновая кислота-2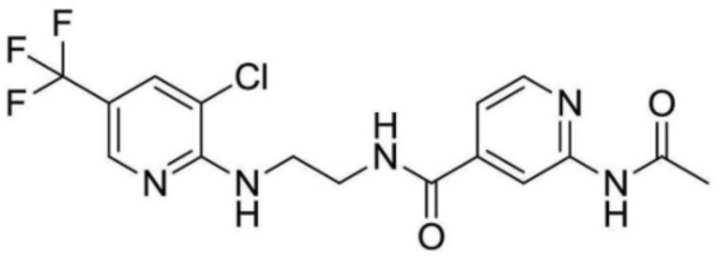
Пример 2
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)изоникотинамид
Амин-2
Карбоновая кислота-16
Пример 3
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-пропионамидоизоникотинамид
Амин-2
Карбоновая кислота-1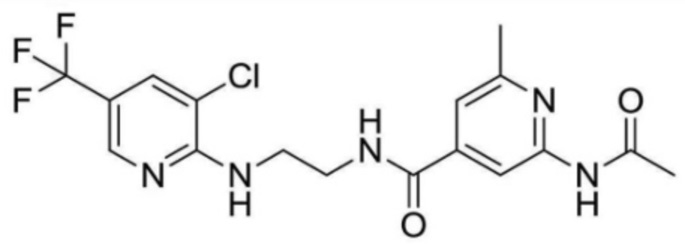
Пример 4
2-ацетамидо-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-6-метилизоникотинамид
Амин-2
Карбоновая кислота-4
Пример 5
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-метил-6-пропионамидоизоникотинамид
Амин-2
Карбоновая кислота-10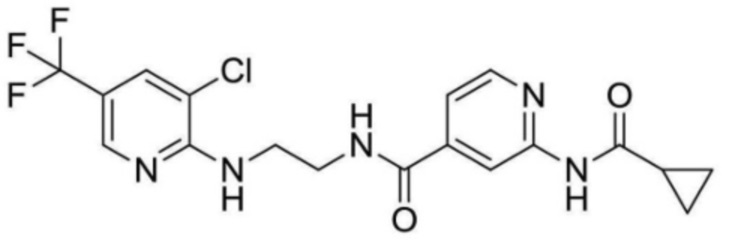
Пример 6
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)
этил)-2-(циклопропанкарбоксамидо)
изоникотинамид
Амин-2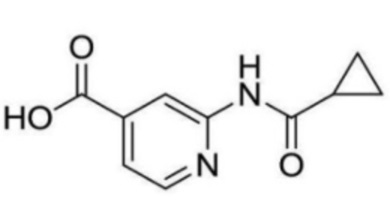
Карбоновая кислота-2
Пример 7
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-изобутил
амидоизоникотинамид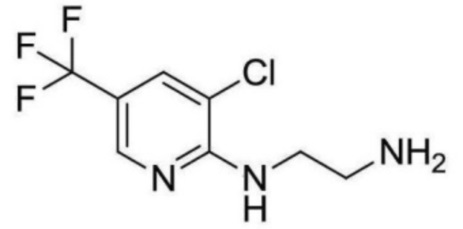
Амин-2
Карбоновая кислота-3
[Таблица 2-2]

Пример 8
2-ацетамидо-N-(2-((3-хлор-5-
(трифторметил)пиридин-2-ил)окси)этил)
изоникотинамид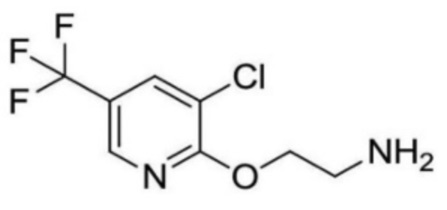
Амин-3
Карбоновая кислота-16
Пример 9
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-
пропионамидоизоникотинамид
Амин-3
Карбоновая кислота-1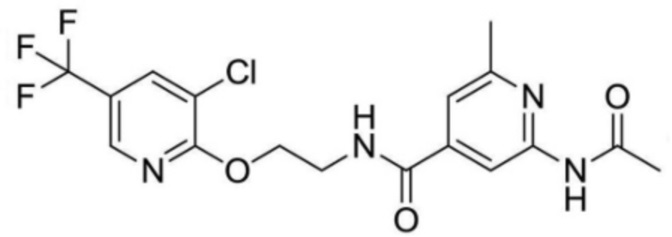
Пример 10
2-ацетамидо-N-(2-((3-хлор-5-
(трифторметил)пиридин-2-ил)окси)
этил)-6-метилизоникотинамид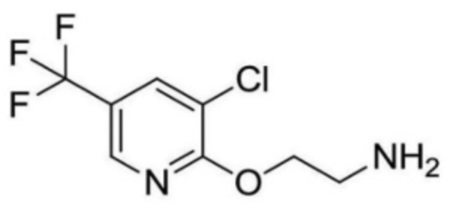
Амин-3
Карбоновая кислота-4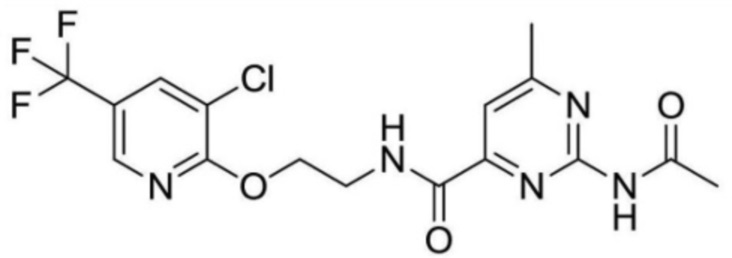
Пример 11
2-ацетамидо-N-(2-((3-хлор-5-
(трифторметил)пиридин-2-ил)окси)этил)-6-метилпиримидин-4-карбоксамид
Амин-3
Карбоновая кислота-12
Пример 12
2-метил-6-пропионамидо-N-(2-((5-
(трифторметил)пиридин-2-ил)окси)этил)изоникотинамид
Амин-4
Карбоновая кислота-10
Пример 13
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-
изобутиламидоизоникотинамид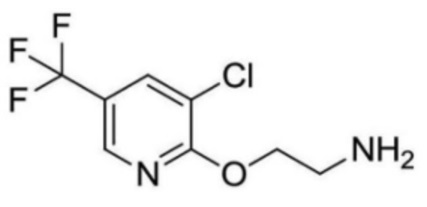
Амин-3
Карбоновая кислота-3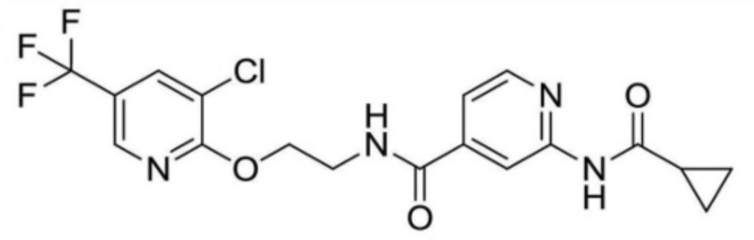
Пример 14
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-
(циклопропанкарбоксамидо)
изоникотинамид
Амин-3
Карбоновая кислота-2
[Таблица 2-3]

Пример 15
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-метил-6-
пропионамидоизоникотинамид
Амин-3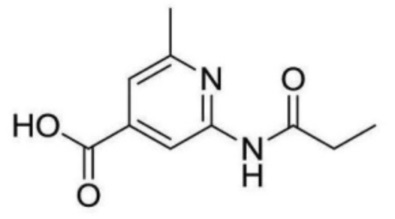
Карбоновая кислота-10
Пример 16
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-
(циклопропанкарбоксамидо)-6-
метилпиримидин-4-карбоксамид
Амин-3
Карбоновая кислота-6
Пример 17
(R)-N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)пропил)-2-изобутиламидоизоникотинамид
Амин-5
Карбоновая кислота-3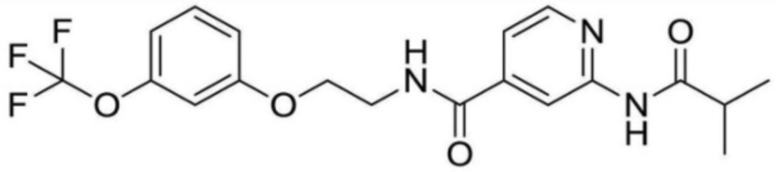
Пример 18
2-изобутиламидо-N-(2-(3-
(трифторметокси)фенокси)этил)изоникотинамид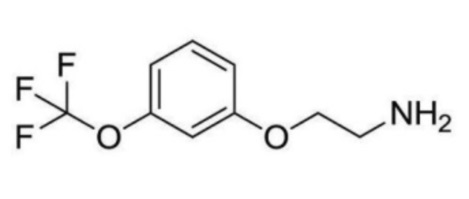
Амин-6
Карбоновая кислота-3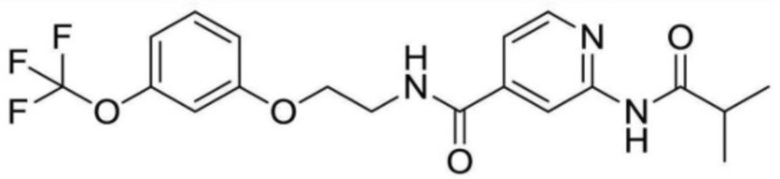
Пример 19
2-ацетамидо-6-метил-N-(2-(3-
(трифторметокси)фенокси)этил)изоникотинамид Амин-6
Амин-6
Карбоновая кислота-4
Пример 20
2-ацетамидо-N-(2-(2-хлор-4-
(трифторметил)фенокси)этил)изоникотинамид
Амин-7
Карбоновая кислота-16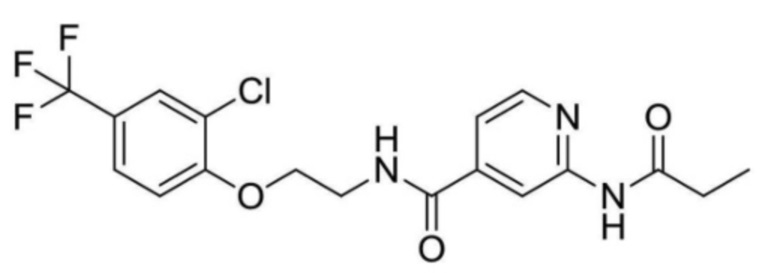
Пример 21
N-(2-(2-хлор-4-(трифторметил)
фенокси)этил)-2-
пропионамидоизоникотинамид
Амин-7
Карбоновая кислота-1
[Таблица 2-4]

Пример 22
N-(2-(2-хлор-4-(трифторметил)
фенокси)этил)-2-
изобутиламидоизоникотинамид
Амин-7
Карбоновая кислота-3
Пример 23
2-ацетамидо-N-(2-(2-хлор-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид
Амин-7
Карбоновая кислота-4
Пример 24
2-ацетамидо-6-метил-N-(2-(4-
(трифторметил)фенокси)этил)
изоникотинамид
Амин-8
Карбоновая кислота-4
Пример 25
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)этил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид
Амин-3
Карбоновая кислота-11
Пример 26
N-(2-((3-хлор-5-(трифторметил)пиридин-2-ил)амино)этил)-2-(циклопропанкарбоксамидо)-6-метилизоникотинамид
Амин-2
Карбоновая кислота-11
Пример 27
N-(3-(3-хлор-5-(трифторметил)пиридин-2-ил)пропил-2-(циклопропанкарбоксамидо)изоникотинамид
Амин-9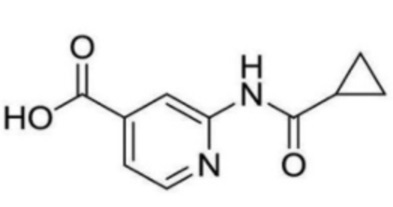
Карбоновая кислота-2
Пример 28
2-ацетамидо-N-(3-(3-хлор-5-
(трифторметил)пиридин-2-ил)пропил)-
6-метилизоникотинамид Амин-9
Амин-9
Карбоновая кислота-4
[Таблица 2-5]

Пример 29
N-(2-((3-фтор-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-
изобутиламидо-6-метилизоникотинамид
Амин-10
Карбоновая кислота-5
Пример 30
N-(3-(3-хлор-5-(трифторметил)
пиридин-2-ил)пропил-2-
пропионамидоизоникотинамид
Амин-9
Карбоновая кислота-1
Пример 31
2-ацетамидо-6-метил-N-(2-(4-
(пентафторсульфанил)фенокси)этил)
изоникотинамид
Амин-11
Карбоновая кислота-4
Пример 32
2-пропионамидо-N-(2-(4-
(пентафторсульфанил)фенокси)этил)
изоникотинамид
Амин-11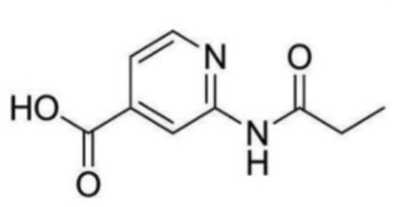
Карбоновая кислота-1
Пример 33
2-(циклопропанкарбоксамидо)-N-(2-(4-(пентафторсульфанил)фенокси)этил)
изоникотинамид
Амин-11
Карбоновая кислота-2
Пример 34
2-изобутиламидо-N-(2-(4-
(пентафторсульфанил)фенокси)этил)
изоникотинамид
Амин-11
Карбоновая кислота-3
Пример 35
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-
изобутиламидо-6-метилизоникотинамид
Амин-3
Карбоновая кислота-5
[Таблица 2-6]

Пример 36
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-
(циклопропанкарбоксамидо)
пиримидин-4-карбоксамид
Амин-3
Карбоновая кислота-7
Пример 37
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)амино)этил)-2-
изобутиламидо-6-метилизоникотинамид
Амин-2
Карбоновая кислота-5
Пример 38
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)амино)этил)-2-
(циклопропанкарбоксамидо)пиримидин-
4-карбоксамид
Амин-2
Карбоновая кислота-7
Пример 39
N-(2-(2-хлор-4-(трифторметил)
фенокси)этил)-2-метил-6-
пропионамидоизоникотинамид
Амин-7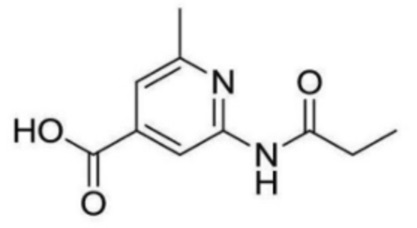
Карбоновая кислота-10
Пример 40
N-(2-(2-хлор-4-(трифторметил)
фенокси)этил)-2-
(циклопропанкарбоксамидо)
изоникотинамид
Амин-7
Карбоновая кислота-2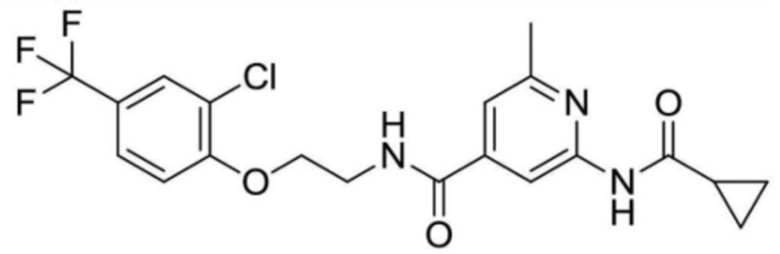
Пример 41
N-(2-(2-хлор-4-(трифторметил)
фенокси)этил)-2-
(циклопропанкарбоксамидо)-6-
метилизоникотинамид
Амин-7
Карбоновая кислота-11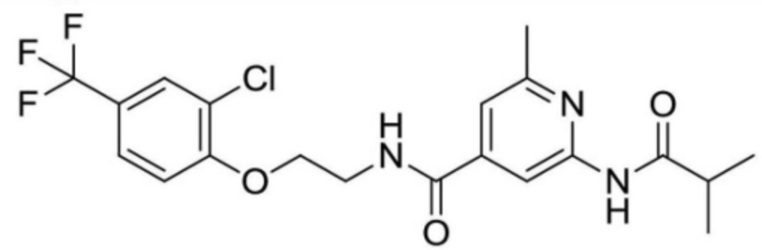
Пример 42
N-(2-(2-хлор-4-(трифторметил)
фенокси)этил)-2-изобутиламидо-6-
метилизоникотинамид
Амин-7
Карбоновая кислота-5
[Таблица 2-7]
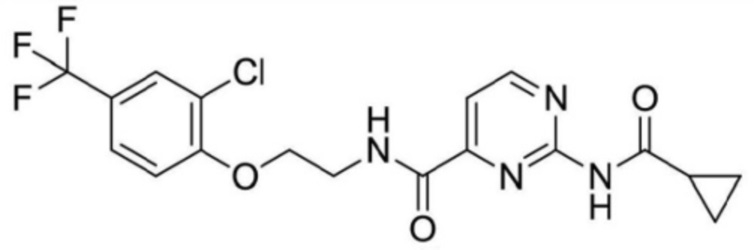
Пример 43
N-(2-(2-хлор-4-(трифторметил)
фенокси)этил)-2-
(циклопропанкарбоксамидо)пиримидин-
4-карбоксамид
Амин-7
Карбоновая кислота-7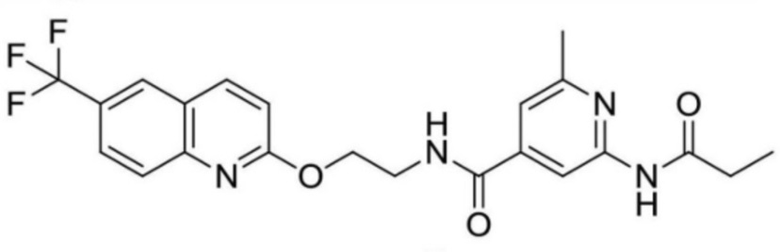
Пример 44
2-метил-6-пропионамидо-N-(2-((6-
(трифторметил)хинолин-2-ил)окси)
этил)изоникотинамид
Амин-12
Карбоновая кислота-10
Пример 45
2-(циклопропанкарбоксамидо)-N-(2-
((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид
Амин-12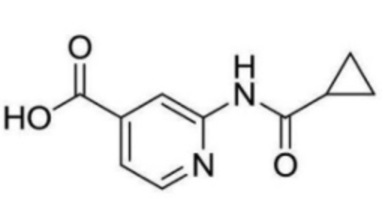
Карбоновая кислота-2
Пример 46
2-изобутиламидо-N-(2-((6-
(трифторметил)хинолин-2-ил)окси)
этил)изоникотинамид
Амин-12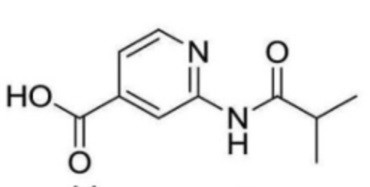
Карбоновая кислота-3
Пример 47
2-изобутиламидо-N-(2-((6-
(трифторметил)хинолин-2-ил)амино)
этил)изоникотинамид
Амин-13
Карбоновая кислота-3
Пример 48
2-метил-6-пропионамидо-N-(2-((6-
(трифторметил)изохинолин-1-ил)окси)
этил)изоникотинамид
Амин-14
Карбоновая кислота-10
Пример 49
2-метил-6-пропионамидо-N-(2-((6-
(2,2,2-трифторэтокси)нафталин-2-ил)
окси)этил)изоникотинамид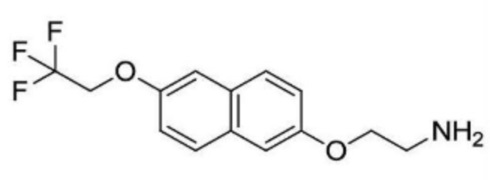
Амин-15
Карбоновая кислота-10
[Таблица 2-8]
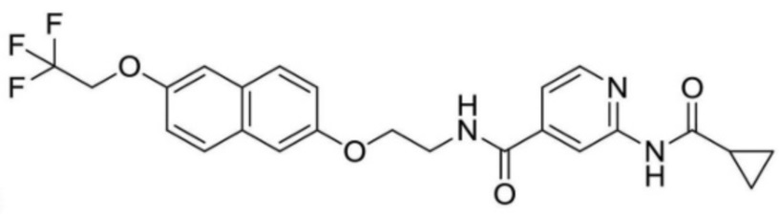
Пример 50
2-(циклопропанкарбоксамидо)-N-(2-
((6-(2,2,2-трифторэтокси)нафталин-
2-ил)окси)этил)изоникотинамид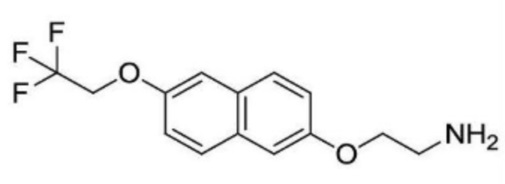
Амин-15
Карбоновая кислота-2 Пример 51
Пример 51
2-изобутиламидо-N-(2-((6-(2,2,2-
трифторэтокси)нафталин-2-
ил)окси)этил)изоникотинамид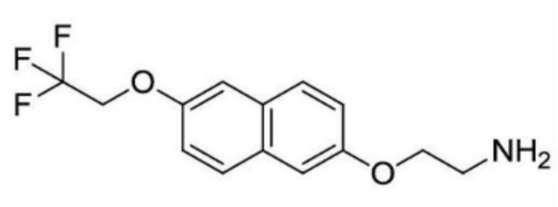
Амин-15
Карбоновая кислота-3
Пример 52
2-ацетамидо-N-(2-((3-хлор-5-
(трифторметил)пиридин-2-ил)тио)
этил)изоникотинамид
Амин-16
Карбоновая кислота-16
Пример 53
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)тио)этил)-2-
изобутиламидоизоникотинамид
Амин-16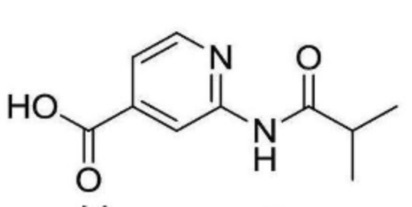
Карбоновая кислота-3
Пример 54
2-ацетамидо-N-(2-((3-хлор-5-
(трифторметил)пиридин-2-ил)тио)
этил)-6-метилизоникотинамид
Амин-16
Карбоновая кислота-4
Пример 55
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)тио)этил)-2-метил-6-
пропионамидоизоникотинамид
Амин-16
Карбоновая кислота-10
Пример 56
2-ацетамидо-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид
Амин-12
Карбоновая кислота-16
[Таблица 2-9]

Пример 57
2-пропионамидо-N-(2-((6-
(трифторметил)хинолин-2-ил)окси)
этил)изоникотинамид
Амин-12
Карбоновая кислота-1
Пример 58
2-ацетамидо-6-метил-N-(2-((6-
(трифторметил)хинолин-2-ил)окси)
этил)изоникотинамид
Амин-12
Карбоновая кислота-4
Пример 59
2-(циклопропанкарбоксамидо)-6-метил-N-(2-((6-(трифторметил)хинолин-2-ил)окси)этил)изоникотинамид
Амин-12
Карбоновая кислота-11
Пример 60
2-изобутиламидо-6-метил-N-(2-((6-
(трифторметил)хинолин-2-ил)окси)
этил)изоникотинамид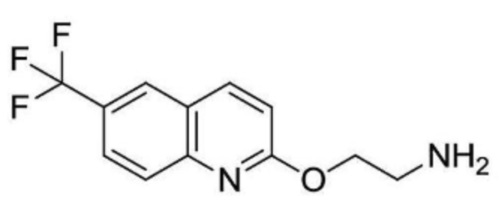
Амин-12
Карбоновая кислота-5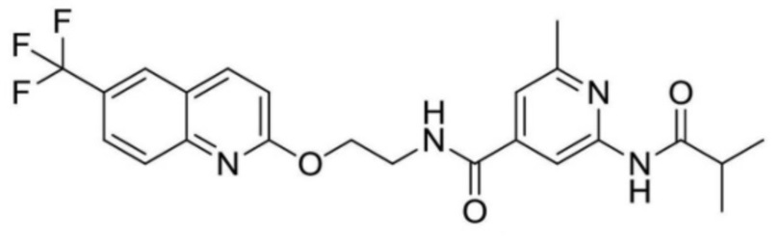
Пример 61
2-(циклопропанкарбоксамидо)-N-(2-
((6-(трифторметил)хинолин-2-ил)
окси)этил)пиримидин-4-карбоксамид
Амин-12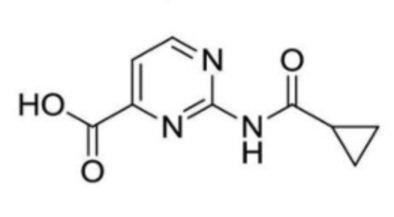
Карбоновая кислота-7
Пример 62
2-(2-гидрокси-2-метилпропанамидо)-
6-метил-N-(2-((6-(трифторметил)
хинолин-2-ил)окси)этил)
изоникотинамид
Амин-12
Карбоновая кислота-15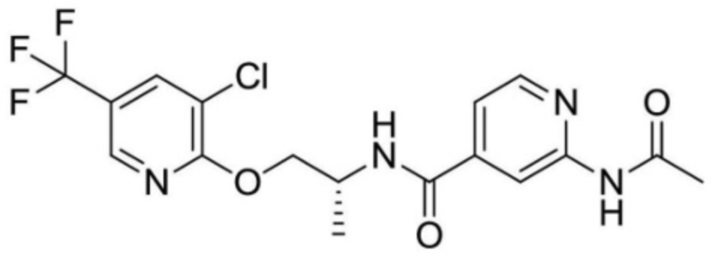
Пример 63
(R)-2-ацетамидо-N-(1-((3-хлор-5-
(трифторметил)пиридин-2-ил)окси)
пропан-2-ил)изоникотинамид
Амин-17
Карбоновая кислота-16
[Таблица 2-10]
Пример 64
(R)-N-(1-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропан-2-ил)-2-
пропионамидоизоникотинамид
Амин-17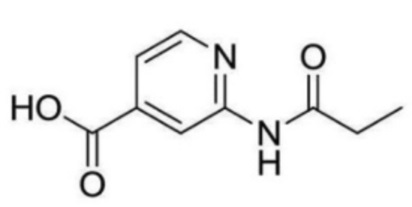
Карбоновая кислота-1
Пример 65
(R)-2-ацетамидо-N-(1-((3-хлор-5-(трифторметил)пиридин-2-ил)окси)
пропан-2-ил)-6-метилизоникотинамид
Амин-17
Карбоновая кислота-4
Пример 66
(R)-N-(1-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропан-2-ил)-2-
метил-6-пропионамидоизоникотинамид
Амин-17
Карбоновая кислота-10
Пример 67
(R)-N-(1-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропан-2-ил)-2-
(циклопропанкарбоксамидо)
изоникотинамид
Амин-17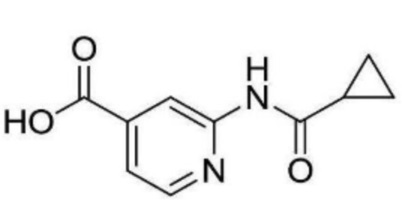
Карбоновая кислота-2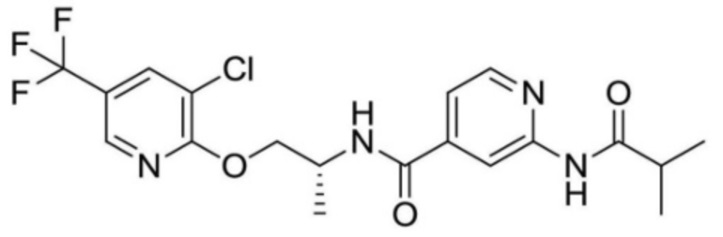
Пример 68
(R)-N-(1-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропан-2-ил)-2-изобутиламидоизоникотинамид
Амин-17
Карбоновая кислота-3
Пример 69
(R)-N-(1-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропан-2-ил)-2-
(циклопропанкарбоксамидо)-6-
метилизоникотинамид
Амин-17
Карбоновая кислота-11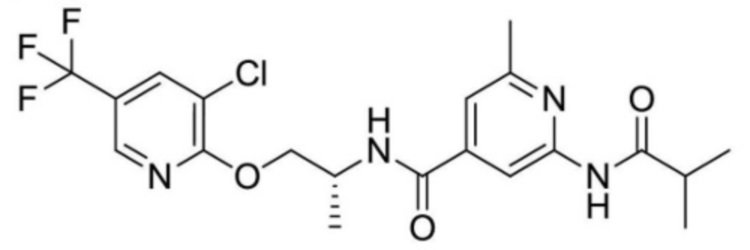
Пример 70
(R)-N-(1-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропан-2-ил)-2-изобутиламидо-6-метилизоникотинамид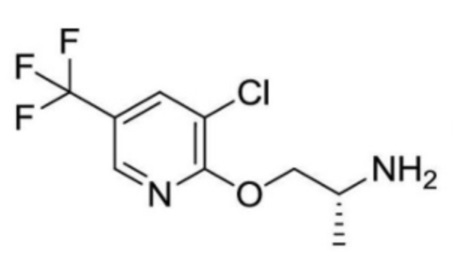
Амин-17
Карбоновая кислота-5
[Таблица 2-11]

Пример 71
(R)-N-(1-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропан-2-ил)-2-
(циклопропанкарбоксамидо)пиримидин-4-карбоксамид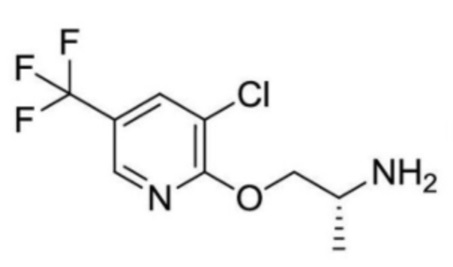
Амин-17
Карбоновая кислота-7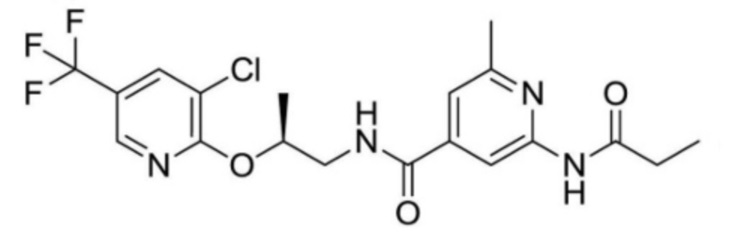
Пример 72
(S)-N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропил)-2-метил-
6-пропионамидоизоникотинамид
Амин-18
Карбоновая кислота-10
Пример 73
(R)-2-ацетамидо-N-(2-((3-хлор-5-
(трифторметил)пиридин-2-ил)окси)
пропил)-6-метилизоникотинамид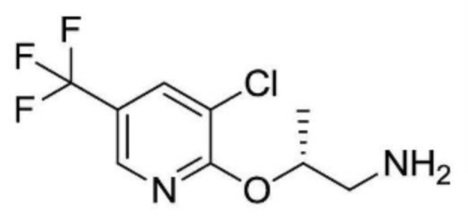
Амин-5
Карбоновая кислота-4
Пример 74
(R)-N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропил)-2-метил-
6-пропионамидоизоникотинамид
Амин-5
Карбоновая кислота-10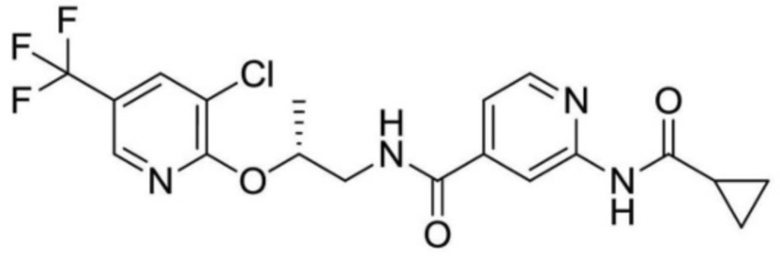
Пример 75
(R)-N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропил)-2-
(циклопропанкарбоксамидо)
изоникотинамид
Амин-5
Карбоновая кислота-2
Пример 76
(R)-N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропил)-2-
(циклопропанкарбоксамидо)-6-
метилизоникотинамид Амин-5
Амин-5 Карбоновая кислота-11
Карбоновая кислота-11
Пример 77
(R)-N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропил)-2-
изобутиламидо-6-метилизоникотинамид
Амин-5
Карбоновая кислота-5
[Таблица 2-12]
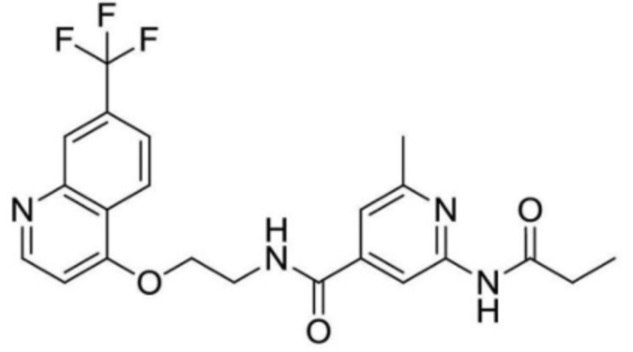
Пример 78
2-метил-6-пропионамидо-N-(2-((7-
(трифторметил)хинолин-4-ил)окси)
этил)изоникотинамид
Амин-19
Карбоновая кислота-10
Пример 79
2-(циклопропанкарбоксамидо)-N-(2-
((7-(трифторметил)хинолин-4-ил)
окси)этил)изоникотинамид
Амин-19
Карбоновая кислота-2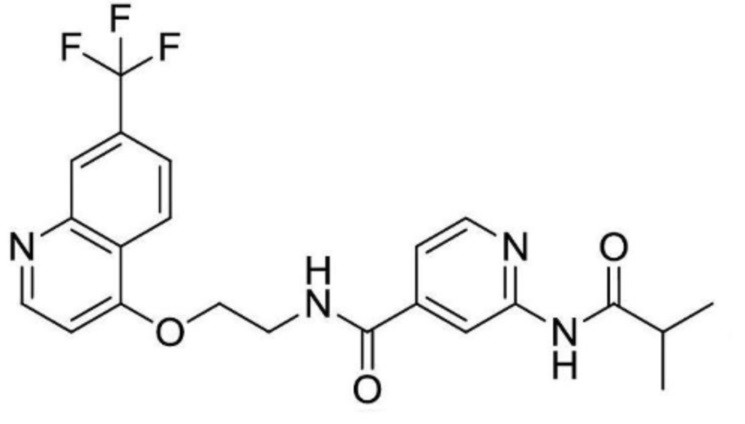
Пример 80
2-изобутиламидо-N-(2-((7-
(трифторметил)хинолин-4-ил)окси)
этил)изоникотинамид
Амин-19
Карбоновая кислота-3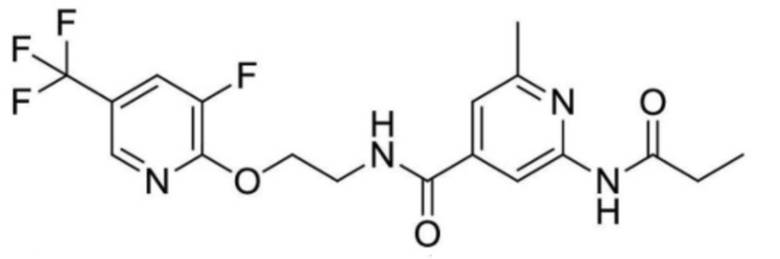
Пример 81
N-(2-((3-фтор-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-метил-
6-пропионамидоизоникотинамид
Амин-10
Карбоновая кислота-10
Пример 82
N-(2-((5-хлор-3-(трифторметил)
пиридин-2-ил)окси)этил)-2-метил-6-
пропионамидоизоникотинамид
Амин-20
Карбоновая кислота-10
Пример 83
2-пропионамидо-N-(2-((4-
(трифторметил)хинолин-2-ил)окси)
этил)изоникотинамид
Амин-21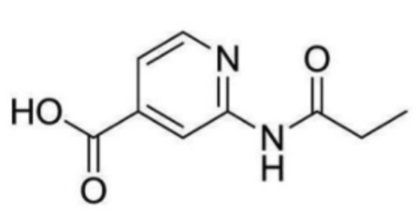
Карбоновая кислота-1
[Таблица 2-13]

Пример 84
2-метил-6-пропионамидо-N-(2-((4-
(трифторметил)хинолин-2-ил)окси)
этил)изоникотинамид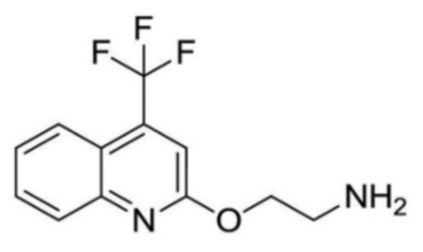
Амин-21
Карбоновая кислота-10
Пример 85
2-изобутиламидо-N-(2-((4-
(трифторметил)хинолин-2-ил)окси)
этил)изоникотинамид
Амин-21
Карбоновая кислота-3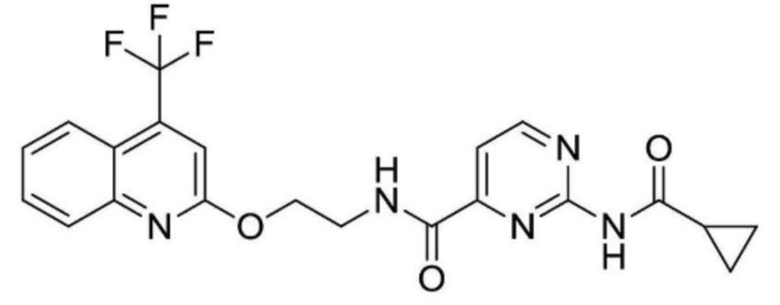
Пример 86
2-(циклопропанкарбоксамидо)-N-(2-
((4-(трифторметил)хинолин-2-ил)
окси)этил)пиримидин-4-карбоксамид
Амин-21
Карбоновая кислота-7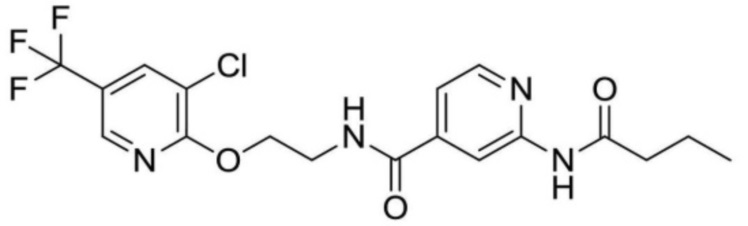
Пример 87
2-бутирамидо-N-(2-((3-хлор-5-
(трифторметил)пиридин-2-ил)окси)
этил)изоникотинамид
Амин-3
Карбоновая кислота-8
Пример 88
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-
пиваламидоизоникотинамид
Амин-3
Карбоновая кислота-9
Пример 89
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)этил)-6-метил-2-
пропионамидопиримидин-4-карбоксамид
Амин-3
Карбоновая кислота-13
Пример 90
N-(2-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-
изобутиламидо-6-метилпиримидин-4-
карбоксамид
Амин-3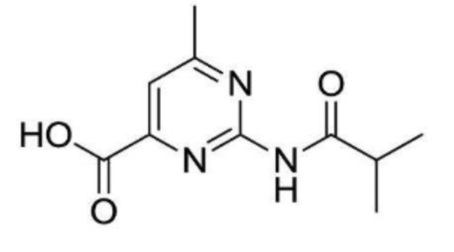
Карбоновая кислота-14
[Таблица 2-14]

Пример 91
2-ацетамидо-N-(2-(2-фтор-4-
(трифторметил)фенокси)этил)
изоникотинамид
Амин-22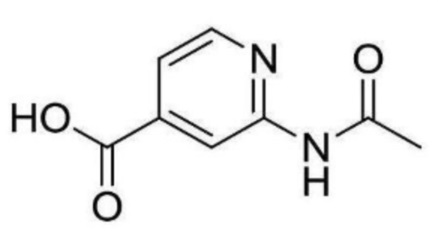
Карбоновая кислота-16
Пример 92
N-(2-(2-фтор-4-(трифторметил)
фенокси)этил)-2-
пропионамидоизоникотинамид
Амин-22
Карбоновая кислота-1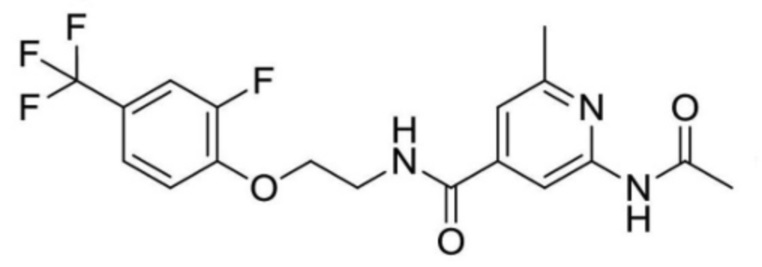
Пример 93
2-ацетамидо-N-(2-(2-фтор-4-
(трифторметил)фенокси)этил)-6-
метилизоникотинамид
Амин-22
Карбоновая кислота-4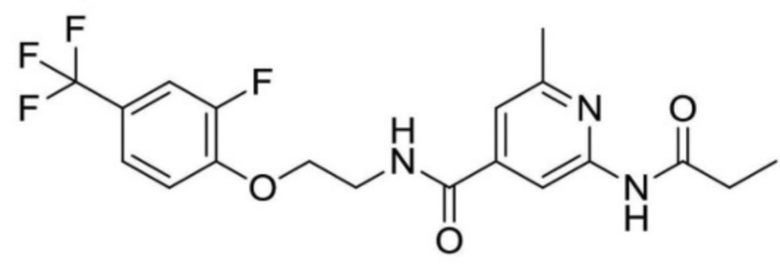
Пример 94
N-(2-(2-фтор-4-(трифторметил)
фенокси)этил)-2-метил-6-
пропионамидоизоникотинамид
Амин-22
Карбоновая кислота-10
Пример 95
2-(циклопропанкарбоксамидо)-N-(2-
(2-фтор-4-(трифторметил)фенокси)
этил)изоникотинамид
Амин-22
Карбоновая кислота-2
Пример 96
N-(2-(2-фтор-4-(трифторметил)
фенокси)этил)-2-
изобутиламидоизоникотинамид
Амин-22
Карбоновая кислота-3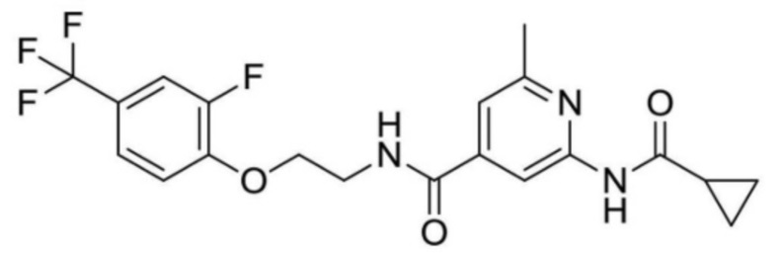
Пример 97
2-(циклопропанкарбоксамидо)-N-(2-
(2-фтор-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид
Амин-22
Карбоновая кислота-11
[Таблица 2-15]

Пример 98
N-(2-(2-фтор-4-(трифторметил)
фенокси)этил)-2-изобутиламидо-6-
метилизоникотинамид
Амин-22
Карбоновая кислота-5
Пример 99
2-(циклопропанкарбоксамидо)-N-(2-
(2-фтор-4-(трифторметил)фенокси)
этил)пиримидин-4-карбоксамид
Амин-22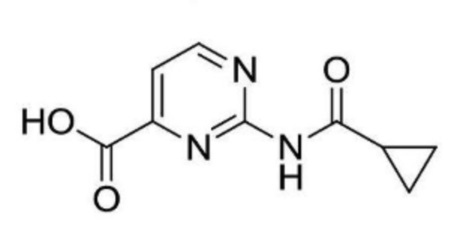
Карбоновая кислота-7
Пример 100
N-(2-(4-хлор-3-(трифторметил)
фенокси)этил)-2-метил-6-
пропионамидоизоникотинамид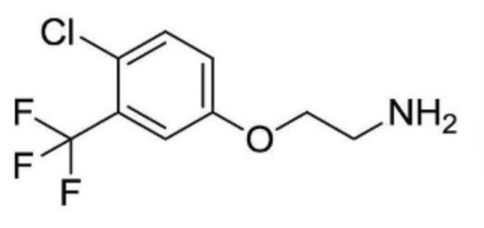
Амин-23
Карбоновая кислота-10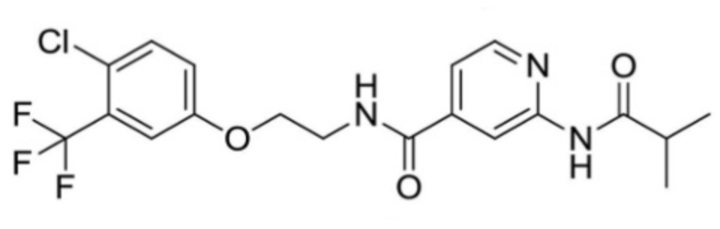
Пример 101
N-(2-(4-хлор-3-(трифторметил)
фенокси)этил)-2-
изобутиламидоизоникотинамид
Амин-23
Карбоновая кислота-3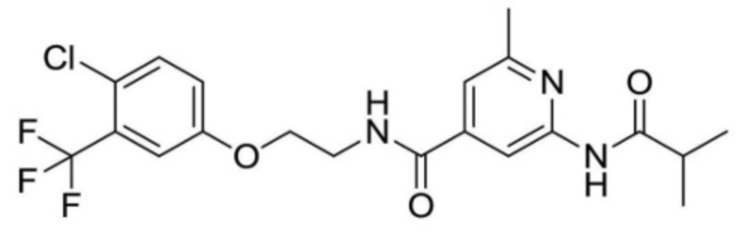
Пример 102
N-(2-(4-хлор-3-(трифторметил)
фенокси)этил)-2-изобутиламидо-6-
метилизоникотинамид
Амин-23 Карбоновая кислота-5
Карбоновая кислота-5
Пример 103
N-(2-(2-хлор-5-(трифторметил)
фенокси)этил)-2-метил-6-
пропионамидоизоникотинамид
Амин-24
Карбоновая кислота-10
Пример 104
N-(2-(2-хлор-5-(трифторметил)
фенокси)этил)-2-изобутиламидо-6-
метилизоникотинамид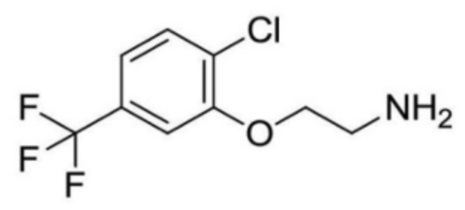
Амин-24
Карбоновая кислота-5
[Таблица 2-16]

Пример 105
N-(2-(2-хлор-4-(трифторметокси)
фенокси)этил)-2-метил-6-
пропионамидоизоникотинамид
Амин-25
Карбоновая кислота-10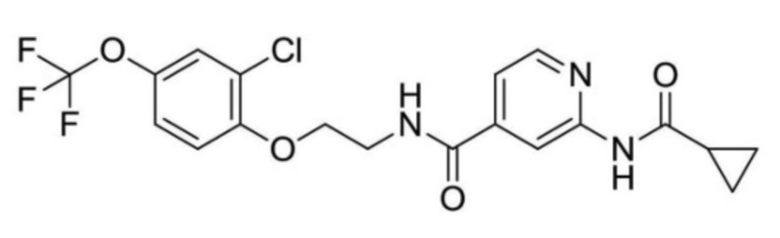
Пример 106
N-(2-(2-хлор-4-(трифторметокси)
фенокси)этил)-2-
(циклопропанкарбоксамидо)
изоникотинамид
Амин-25
Карбоновая кислота-2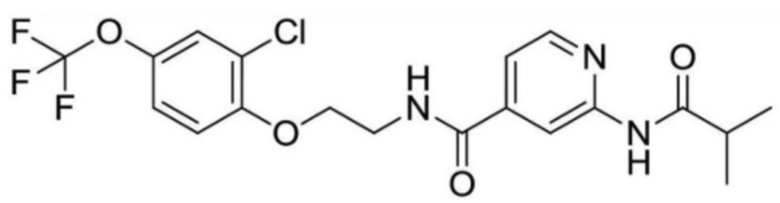
Пример 107
N-(2-(2-хлор-4-(трифторметокси)
фенокси)этил)-2-
изобутиламидоизоникотинамид
Амин-25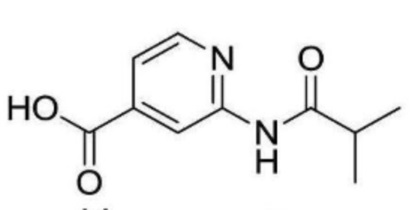
Карбоновая кислота-3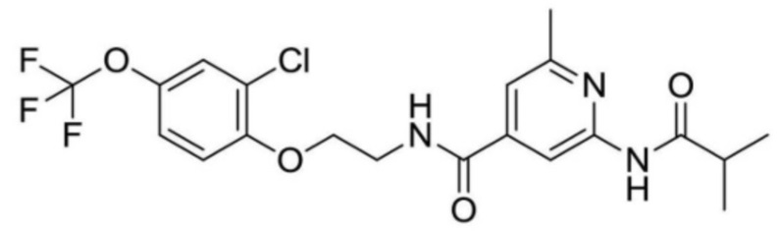
Пример 108
N-(2-(2-хлор-4-(трифторметокси)
фенокси)этил)-2-изобутиламидо-6-
метилизоникотинамид
Амин-25
Карбоновая кислота-5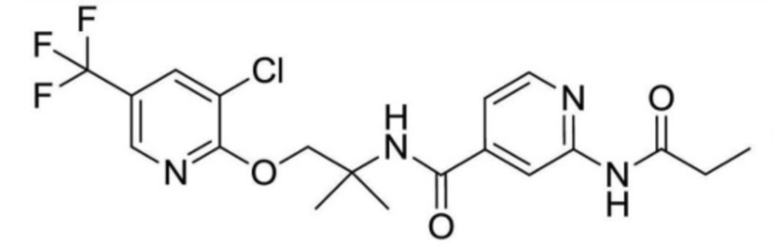
Пример 109
N-(1-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)-2-метилпропан-2-ил)-2-пропионамидоизоникотинамид
Амин-26
Карбоновая кислота-1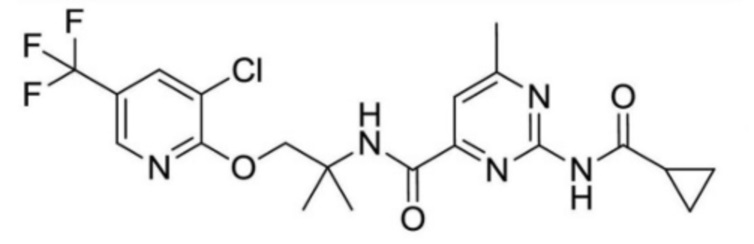
Пример 110
N-(1-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)-2-метилпропан-2-ил)-2-(циклопропанкарбоксамидо)-6-
метилпиримидин-4-карбоксамид
Амин-26
Карбоновая кислота-6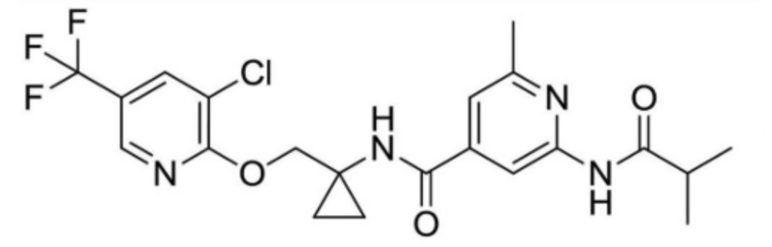
Пример 111
N-(1-(((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)метил)
циклопропил)-2-изобутиламидо-6-
метилизоникотинамид
Амин-27
Карбоновая кислота-5
[Таблица 2-17]

Пример 112
N-(2-((3-циано-5-(трифторметил)
пиридин-2-ил)окси)этил)-2-метил-6-
пропионамидоизоникотинамид
Амин-28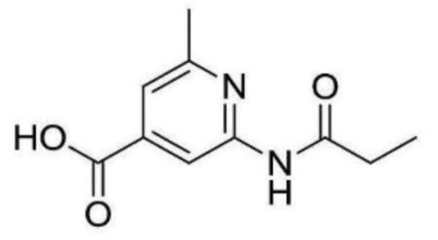
Карбоновая кислота-10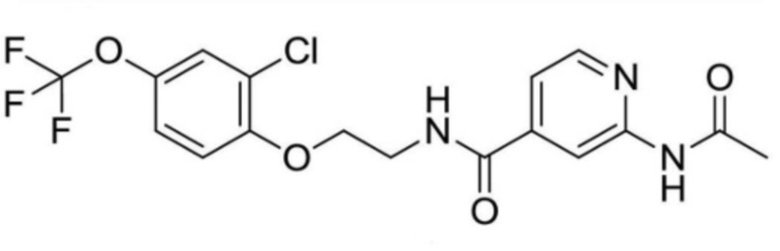
Пример 113
2-ацетамидо-N-(2-(2-хлор-4-
(трифторметокси)фенокси)этил)
изоникотинамид
Амин-25
Карбоновая кислота-16
Пример 114
N-(2-(2-хлор-4-(трифторметокси)
фенокси)этил)-2-
пропионамидоизониконитамид
Амин-25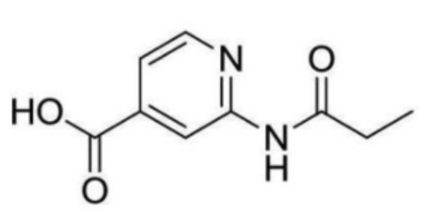
Карбоновая кислота-1
Пример 115
N-(2-(2-хлор-4-(трифторметокси)
фенокси)этил)-2-
(циклопропанкарбоксамидо)-6-
метилизоникотинамид
Амин-25
Карбоновая кислота-11
Пример 116
2-ацетамидо-N-(2-(2-хлор-4-
(трифторметокси)фенокси)этил)-6-
метилизоникотинамид
Амин-25
Карбоновая кислота-4
Пример 117
N-(2-(2-хлор-4-(трифторметокси)
фенокси)этил)-2-
(циклопропанкарбоксамидо)
пиримидин-4-карбоксамид
Амин-25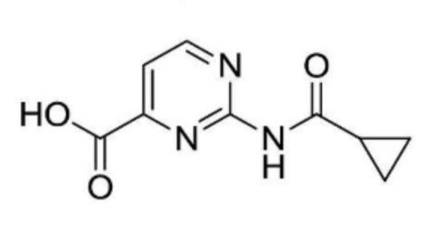 Карбоновая кислота-7
Карбоновая кислота-7
Пример 118
2-ацетамидо-N-(3-((3-хлор-5-
(трифторметил)пиридин-2-ил)амино)
пропил)изоникотинамид
Амин-29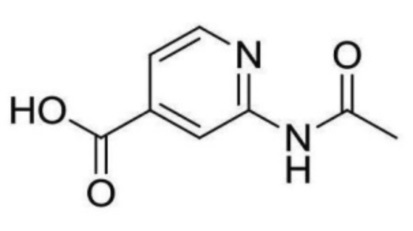
Карбоновая кислота-16
[Таблица 2-18]
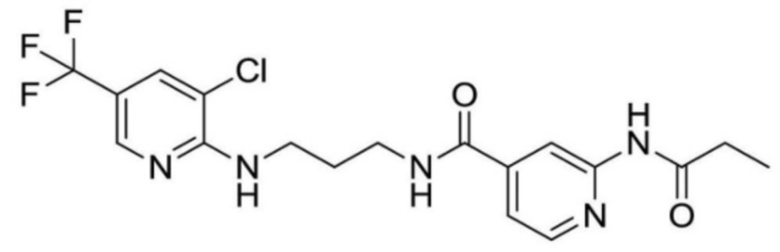
Пример 119
N-(3-((3-хлор-5-(трифторметил)
пиридин-2-ил)амино)пропил-2-
пропионамидоизоникотинамид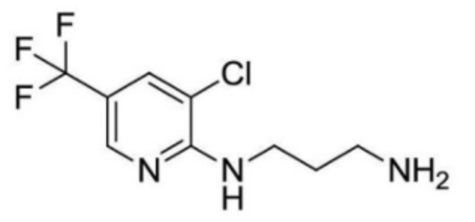
Амин-29
Карбоновая кислота-1
Пример 120
N-(3-((3-хлор-5-(трифторметил)
пиридин-2-ил)амино)пропил-2-
изобутиламидоизоникотинамид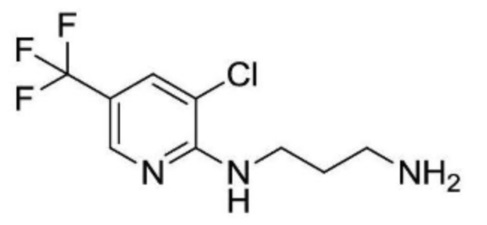
Амин-29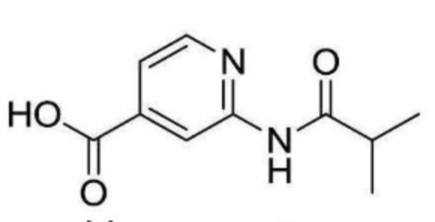
Карбоновая кислота-3
Пример 121
2-ацетамидо-N-(3-((3-хлор-5-
(трифторметил)пиридин-2-ил)амино)
пропил)-6-метилизоникотинамид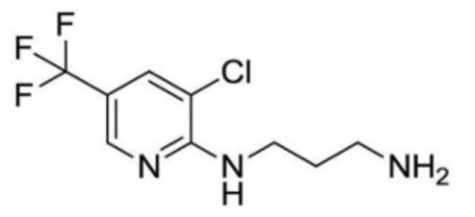
Амин-29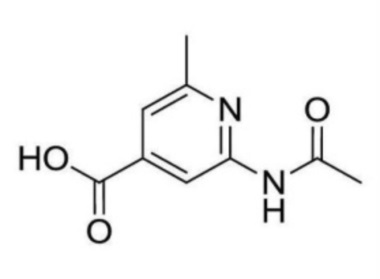
Карбоновая кислота-4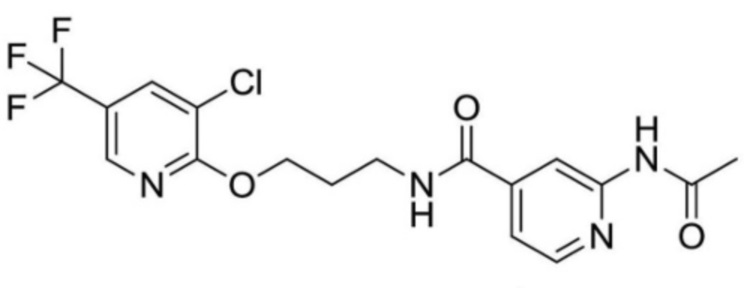
Пример 122
2-ацетамидо-N-(3-((3-хлор-5-
(трифторметил)пиридин-2-ил)окси)пропил)изоникотинамид
Амин-30
Карбоновая кислота-16
Пример 123
N-(3-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропил)-2-
изобутиламидоизоникотинамид
Амин-30
Карбоновая кислота-3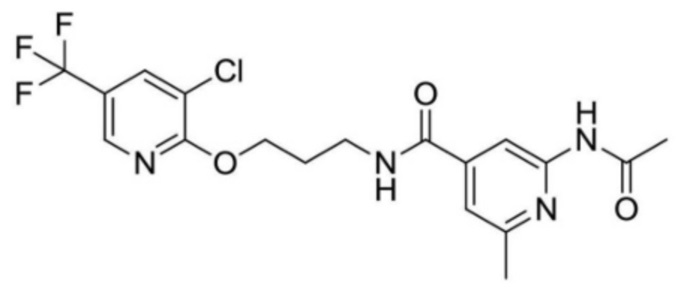
Пример 124
2-ацетамидо-N-(3-((3-хлор-5-
(трифторметил)пиридин-2-ил)окси)
пропил)-6-метилизоникотинамид
Амин-30
Карбоновая кислота-4
[Таблица 2-19]
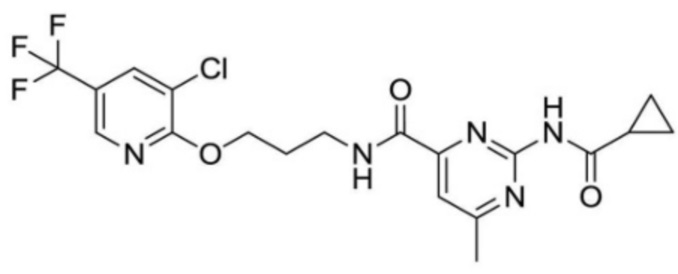
Пример 125
N-(3-((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)пропил)-2-
(циклопропанкарбоксамидо)-6-
метилпиримидин-4-карбоксамид
Амин-30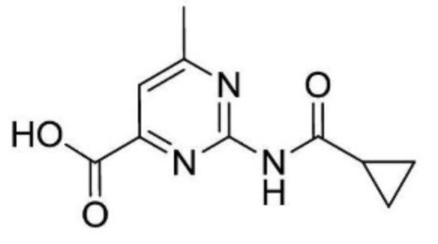
Карбоновая кислота-6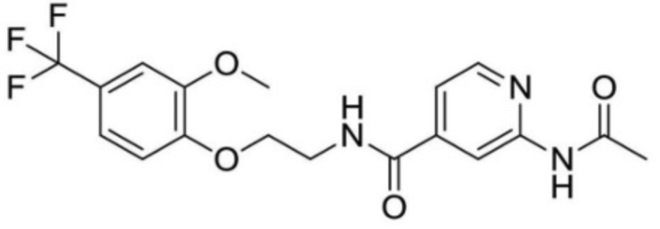
Пример 126
2-ацетамидо-N-(2-(2-метокси-4-
(трифторметил)фенокси)этил)
изоникотинамид
Амин-31
Карбоновая кислота-16
Пример 127
N-(2-(2-метокси-4-(трифторметил)
фенокси)этил)-2-
пропионамидоизоникотинамид
Амин-31
Карбоновая кислота-1
Пример 128
2-ацетамидо-N-(2-(2-метокси-4-
(трифторметил)фенокси)этил)-6-
метилизоникотинамид
Амин-31
Карбоновая кислота-4
Пример 129
N-(2-(2-метокси-4-(трифторметил)
фенокси)этил)-2-метил-6-
пропионамидоизоникотинамид
Амин-31
Карбоновая кислота-10
Пример 130
2-(циклопропанкарбоксамидо)-N-(2-(2-метокси-4-(трифторметил)фенокси)
этил)изоникотинамид
Амин-31
Карбоновая кислота-2
Пример 131
2-изобутиламидо-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)
изоникотинамид
Амин-31
Карбоновая кислота-3
[Таблица 2-20]
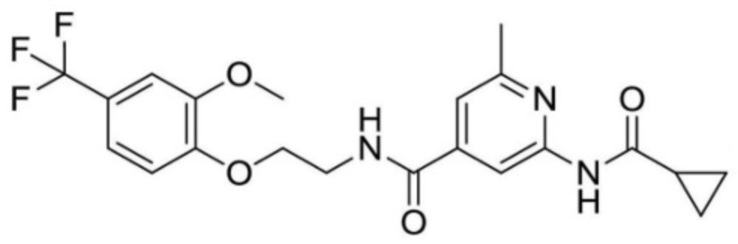
Пример 132
2-(циклопропанкарбоксамидо)-N-(2-(2-метокси-4-(трифторметил)фенокси)этил)-6-метилизоникотинамид
Амин-31
Карбоновая кислота-11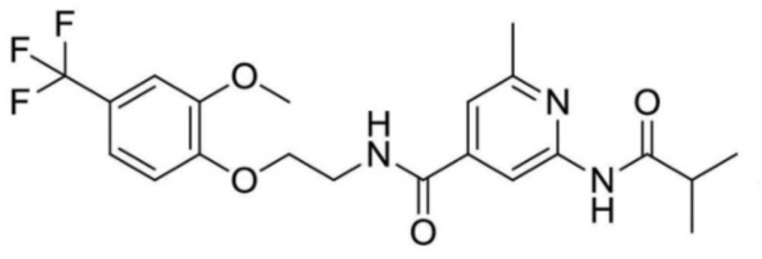
Пример 133
2-изобутиламидо-N-(2-(2-метокси-4-
(трифторметил)фенокси)этил)-6-
метилизоникотинамид
Амин-31
Карбоновая кислота-5
Пример 134
2-(циклопропанкарбоксамидо)-N-(2-
(2-метокси-4-(трифторметил)фенокси)этил)пиримидин-4-карбоксамид
Амин-31
Карбоновая кислота-7
Пример 135
N-(1-(((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)метил)
циклопропил)-2-изобутиламидо-6-
метилпиримидин-4-карбоксамид
Амин-27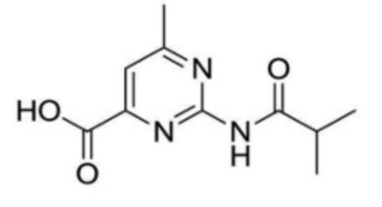
Карбоновая кислота-14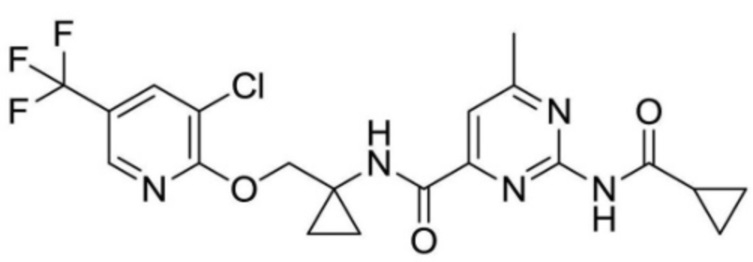
Пример 136
N-(1-(((3-хлор-5-(трифторметил)
пиридин-2-ил)окси)метил)
циклопропил)-2-
(циклопропанкарбоксамидо)-6-
метилпиримидин-4-карбоксамид
Амин-27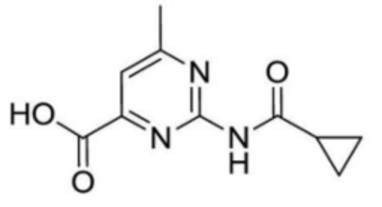
Карбоновая кислота-6
Пример 137
2-бутирамидо-N-(1-(((3-хлор-5-(трифторметил)пиридин-2-ил)окси)метил)циклопропил)
изоникотинамид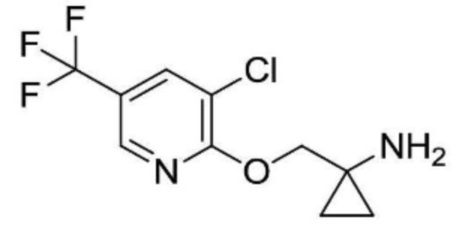
Амин-27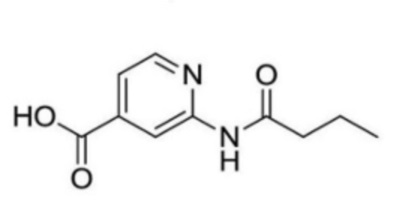
Карбоновая кислота-8
[Таблица 2-21]

Пример 138
2-ацетамидо-N-(2-(2-метил-4-
(трифторметил)фенокси)этил)
изоникотинамид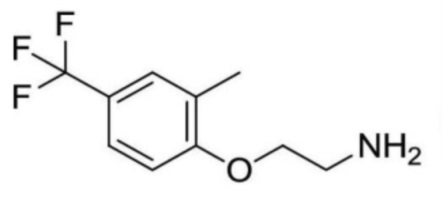
Амин-32
Карбоновая кислота-16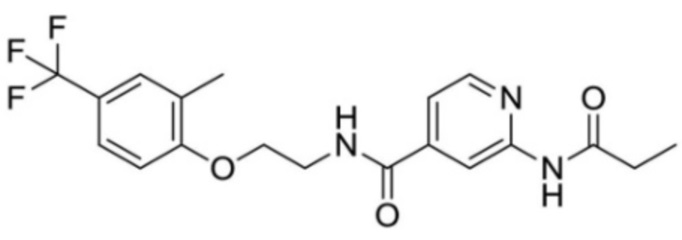
Пример 139
N-(2-(2-метил-4-(трифторметил)
фенокси)этил)-2-
пропионамидоизоникотинамид
Амин-32
Карбоновая кислота-1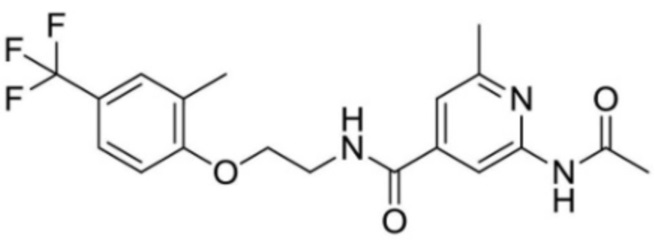
Пример 140
2-ацетамидо-6-метил-N-(2-(2-метил-
4-(трифторметил)фенокси)этил)
изоникотинамид
Амин-32
Карбоновая кислота-4
Пример 141
2-метил-N-(2-(2-метил-4-
(трифторметил)фенокси)этил)-6-
пропионамидоизоникотинамид
Амин-32
Карбоновая кислота-10
Пример 142
2-(циклопропанкарбоксамидо)-N-(2-
(2-метил-4-(трифторметил)фенокси)
этил)изоникотинамид
Амин-32
Карбоновая кислота-2
Пример 143
2-изобутиламидо-N-(2-(2-метил-4-
(трифторметил)фенокси)этил)
изоникотинамид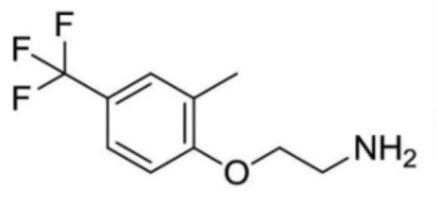
Амин-32
Карбоновая кислота-3
[Таблица 2-22]

Пример 144
2-(циклопропанкарбоксамидо)-6-метил-N-(2-(2-метил-4-(трифторметил)фенокси)этил)изоникотинамид
Амин-32
Карбоновая кислота-11
Пример 145
2-изобутиламидо-6-метил-N-(2-(2-
метил-4-(трифторметил)фенокси)
этил)изоникотинамид
Амин-32
Карбоновая кислота-5
Пример 146
2-(циклопропанкарбоксамидо)-N-(2-
(2-метил-4-(трифторметил)фенокси)
этил)пиримидин-4-карбоксамид
Амин-32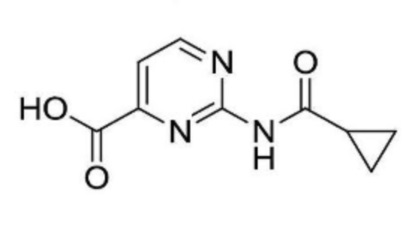
Карбоновая кислота-7
Пример 147
N-(2-(4-хлор-3-(трифторметил)
фенокси)этил)-2-
(циклопропанкарбоксамидо)-6-
метилпиримидин-4-карбоксамид
Амин-23
Карбоновая кислота-6
Пример 148
N-(2-(3-фтор-4-(трифторметокси)
фенокси)этил)-2-
пропионамидоизоникотинамид
Амин-33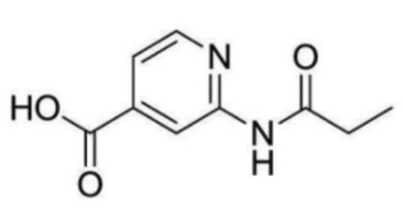
Карбоновая кислота-1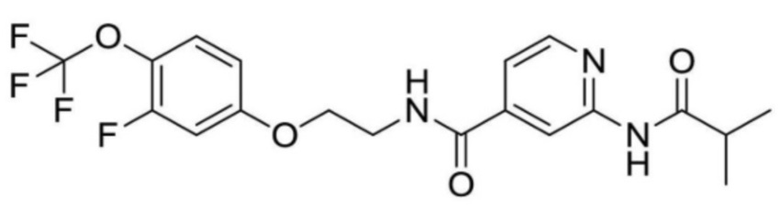
Пример 149
N-(2-(3-фтор-4-(трифторметокси)
фенокси)этил)-2-
изобутиламидоизоникотинамид
Амин-33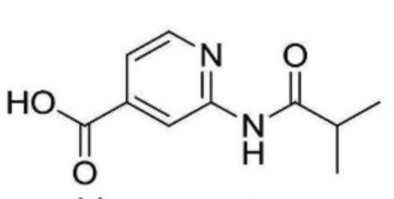
Карбоновая кислота-3
Пример 150
2-(циклопропанкарбоксамидо)-N-(2-
(3-фтор-4-(трифторметокси)фенокси)этил)пиримидин-4-карбоксамид
Амин-33
Карбоновая кислота-7
[Таблица 2-23]

Пример 151
2-(циклопропанкарбоксамидо)-N-(2-
(3-фтор-4-(трифторметокси)фенокси)
этил)изоникотинамид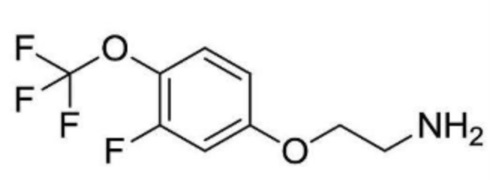
Амин-33
Карбоновая кислота-2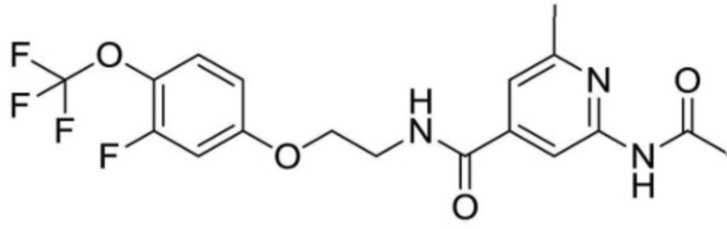
Пример 152
2-ацетамидо-N-(2-(3-фтор-4-
(трифторметокси)фенокси)этил)-6-
метилизоникотинамид
Амин-33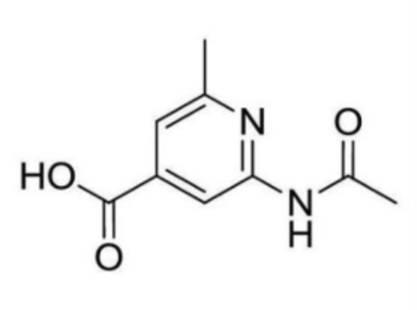
Карбоновая кислота-4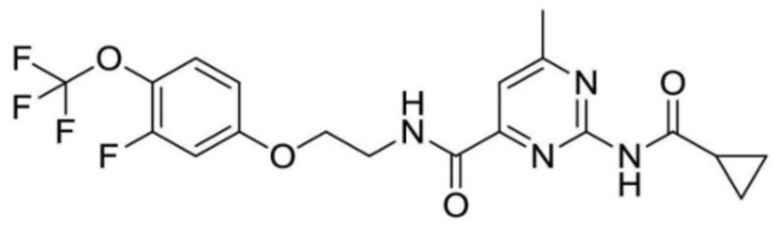
Пример 153
2-(циклопропанкарбоксамидо)-N-(2-
(3-фтор-4-(трифторметокси)фенокси)
этил)-6-метилпиримидин-4-
карбоксамид
Амин-33
Карбоновая кислота-6
Пример 154
2-ацетамидо-N-(2-(3-фтор-4-
(трифторметокси)фенокси)этил)
изоникотинамид
Амин-33
Карбоновая кислота-16
Пример 155
N-(2-(3-фтор-4-(трифторметил)
фенокси)этил)-2-
изобутиламидоизоникотинамид
Амин-34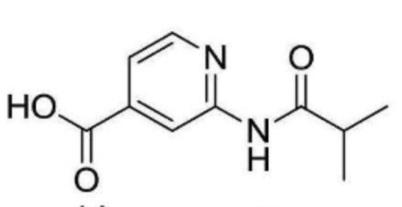
Карбоновая кислота-3
[0224]
[Таблица 3-1]

[Таблица 3-2]

[Таблица 3-3]
[0225]
[Таблица 4-1]
[Таблица 4-2]
[0226] Фармакологические анализы
Активность в отношении потенциалзависимых натриевых каталов человека в условиях in vitro
Ингибирующую активность соединений в отношении потенциалзависимых натриевых каналов определяют в соответствии с методикой, хорошо известной в данной области.
Способность амидных производных формул (I), (II) и (III) ингибировать Nav1.7, Nav1.8 и Nav1.5 каналы измеряют с помощью метода резонансного переноса энергии флуоресценции (Fluorescence Resonance Energy Transfer - FRET) и электрофизиологического анализа, которые описаны ниже.
[0227]
EFS-FRET анализ
Даный скрининг используют для определения влияния соединений на Nav1.7 каналы человека с использованием системы стимулирования электрическим полем (electrical field stimulation - EFS) в формате 96-луночного планшета на FDSS (Hamamatsu Photonics) платформе. Изменение мембранного потенциала контролируют парой FRET красителей - DiSBAC2 (3) и PTS18.
[0228] Условия содержания клеток
Клетки СНО (яичника китайского хомячка), экспрессирующие Nav1.7 каналы человека, выращивают в колбах T225 во влажной камере с 5% CO2 до примерно 80% слияния. Композиция среды включает HAM/F12 с Glutamax I, 10% FCS, 100 единиц/мл пенициллина и 100 мкг/мл гигромицина.
[0229] Протокол:
- Перед экспериментом клеточные линии высевают (1 × 105 клеток/лунку) в 96-луночные планшеты.
- Клетки инкубируют при 37°C в 5% CO2 в течение 24 часов.
- Каждую лунку дважды промывают буфером для анализа (140 мМ NaCl, 4,5 мМ KCl, 10 мМ D-глюкозы, 2 мМ CaCl2, 1 мМ MgCl2, 10 мМ HEPES, pH 7,4, скорректированная с помощью NaOH).
- Добавляют 1-й раствор для внесения, содержащий 10 мкМ PTS18 и 0,06% Pluronic F-127 в буфере для анализа.
- Планшет инкубируют при комнатной температуре в темноте в течение 1 часа.
- Удаляют 1-й раствор для внесения и добавляют 2-й раствор для внесения, содержащий 12,5 мкМ DiSBAC2 (3), 1,25 мМ Xylene Fast Yellow и 0,0075% Pluronic F-127 в буфере для анализа.
- Планшет выдерживают в темноте при комнатной температуре в течение 25 минут.
- В планшет для анализа добавляют растворы соединений.
- Планшет для анализа устанавливают в FDSS и на планшет помещают устройство EFS.
- Измеряют EFS-индуцированный флуоресцентный ответ с помощью FDSS.
[0230] Данные анализируют и представляют в виде нормализованных соотношений интенсивностей, измеренных при 440 нм. Расчет этих соотношений выполняют следующим образом:
[0231] A1
[Мат. Формула 1]


[0232] Анализ выполняют с использованием специальной компьютерной программы, разработанной для данных, сгенерированных FDSS. Значения соотношения флуоресценций наносят на график с использованием XLfit для определения значения IC50 каждого соединения.
[0233] В описанных выше испытаниях все тестируемые соединения примеров показывают значения IC50 в отношении Nav1.7 менее примерно 1 мкМ. Предпочтительные соединения в описанных выше испытаниях показывают значения IC50 в отношении Nav1.7 менее примерно 0,5 мкМ.
Значения IC50 в отношении Nav1.7 <0,5 мкМ показывают соединения примеров 2, 3, 4, 5, 6, 7, 9, 10, 12, 13, 14, 15, 16, 19, 21, 22, 23, 25, 26, 28, 30, 31, 32, 33, 34 , 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 49, 54, 56, 57, 58, 59, 60, 61, 64, 65, 66, 67, 68 , 69, 70, 71, 73, 74, 76, 77, 80, 87, 89, 90, 93, 94, 96, 97, 98, 105, 106, 107, 108, 113, 114, 115, 116, 117 , 119, 123, 126, 127, 128, 129, 130, 131, 132, 133, 134, 138, 139, 140, 141, 142, 143, 144, 145, 145, 146, 148, 149, 150, 151, 152 и 154.
[0234] FRET анализ
Данный скрининг используют для определения воздействия соединений на каналы Nav1.8 и Nav1.5 человека с использованием технологии визуализации клеток на основе Системы функционального скрининга лекарственных средств (Functional Drug Screening System - FDSS) Hamamatsu Photonics (FDSS). Изменения мембранного потенциала контролируют с помощью пары флуоресцентных красителей мембранного потенциала DiSBAC2 (3) и CC2-DMPE, используя технологию FRET.
[0235] Условия содержания клеток
Клетки HEK293, экспрессирующие каналы Nav1.8 человека или каналы Nav1.5 человека, выращивают в колбах T225, во влажной камере с 5% CO2 до приблизительно 80% слияния. Композиция среды НЕК293 клеток, экспрессирующих каналы Nav1.8 человека, включает модифицированную по Дульбекко среду Игла (с высоким содержанием глюкозы), 10% эмбриональной телячьей сыворотки (fetal calf serum - FCS), 100 единиц/мл пенициллина, 100 микрограммов/мл стрептомицина, 200 мкг/мл зеоцина и 500 мкг/мл генетина. Клетки HEK293, экспрессирующие каналы Nav1.5 человека, содержатся в модифицированной по Дульбекко среде Игла (с высоким содержанием глюкозы), дополненной 10% фетальной телячьей сывороткой (FCS), 100 ед./мл пенициллина, 100 мкг/мл стрептомицина и 500 мкг/мл генетицина.
[0236] Протокол:
- Перед экспериментом клеточные линии (1,5 × 104 клеток/лунку) высевают в 384-луночные планшеты.
- Планшеты инкубируют при 37°C в 5% CO2 в течение 24 часов.
- Каждую лунку дважды промывают буфером № 1 (140 мМ NaCl, 4,5 мМ KCl, 10 мМ D-глюкозы, 2 мМ CCaCl2, 1 мМ CaCl2, 10 мМ HEPES, pH 7,4, отрегулированный с помощью NaOH), используя устройство для мойки планшетов.
- Добавляют 1-й раствор для внесения, содержащий 7,5 мкМ CC2-DMPE и 0,06% Pluronic F-127 в буфере № 1.
- Планшет инкубируют при комнатной температуре в темноте в течение 0,5 часа.
- дважды промывают каждую лунку буфером № 2 (160 мМ холина, 10 мМ D-глюкозы, 0,1 мМ CaCl2, 1 мМ MgCl2, 10 мМ HEPES, pH 7,4, скорректированнаяй с помощью KOH), используя устройство для промывки планшетов.
- Добавляют 2-й раствор для внесения, содержащий 75 мкМ DiSBAC2 (3), 2,5 мМ Xylene Fast Yellow, 10 мкМ дельтаметрина или 100 мкМ вератридина и 0,02% Pluronic F-127 в буфере # 2.
- В планшет для анализа добавляют растворы соединений и выдерживают планшет в течение 30 минут в темноте при комнатной температуре.
- Регистрируют флуоресцирующие потенциалы мембран до и после добавления буфера № 2 с помощью FDSS.
[0237] Данные анализируют и представляют в виде нормализованных соотношений интенсивностей, измеренных в 465 нм и 575 нм каналах. Расчет этих соотношений выполняется следующим образом:
[0238] [Мат. формула 2]
FR = (Fl465Max/Fl575Min) - (Fl465B/Fl575B)
“FR” = соотношение флуоресценций
“Fl465B” = среднее значение интенсивности флуоресценции в качестве базовой линии (перед добавлением Na+ лиганда) при 465 нм
“Fl575B” = среднее значение интенсивности флуоресценции в качестве базовой линии (перед добавлением Na+ лиганда) при 575 нм
“Fl465Max” = максимальная интенсивность флуоресценции при 465 нм после Na+ стимуляции
“Fl575Min” = минимальная интенсивность флуоресценции при 575 нм после Na+ стимуляции
[0239]
[Мат. формула 3]

[0240] Анализ выполняют с использованием специальной компьютерной программы, разработанной для данных, полученных с помощью FDSS. Значения отношения флуоресценций наносят на график с использованием XLfit для определения значения IC50 для каждого соединения.
[0241] Все тестируемые соединения примеров в описанных выше анализах показывают значение IC50 в отношении Nav1.7 и/или Nav1.8 менее примерно 5 мкМ. Предпочтительные соединения в описанных выше анализах показывают значеня IC50 в отношении Nav1.7 и/или Nav1.8 менее примерно 3 мкМ. Значение IC50 соединения примера 1 в отношении Nav1.8 составляет 0,65 мкМ.
[0242] Что касается всех протестированных соединений, соотношение активностей в отношении Nav1.5 и в отношении Nav1.7 или Nav1.8 составляет более трех. Например, активности соединения примера 1 в отношении Nav1.5 и в отношении Nav1.8 составляют более 30 мкМ и 0,65 мкМ, соответственно.
[0243] Электрофизиологический анализ
Для оценки эффективности или селективности блокатора Na-каналов в потенциалзависимых натриевых каналах используют запись фиксации потенциала (пэтч-кламп) цельных клеток. Клетки, экспрессирующие Na-канал, распределяют в 0,05% трипсин-ЭДТА или Accutase, затем высевают на покровное стекло и оставляют на 2-24 часа.
[0244] Записи фиксированных потенциалов в ручном режиме проводят при комнатной температуре с использованием амплификатора фиксации напряжения (Axon Instruments или HEKA electronicik). Электроды вытягивают с помощью пуллера электродов P-97 (Sutter Instrument). Сопротивления электродов составляют 1-3 Мом при заполнении внутриклеточном раствором. Токи фильтруют на низких частотах в интервале 2-5 кГц и измеряют при 10 кГц.
[0245] Композиции внеклеточного и межклеточного растворов для каналов Nav1.7 и Nav1.5 человека:
внеклеточный регистрирующий раствор (мМ): 135 NaCl, 5 KCl, 2 CaCl2, 1 MgCl2, 10 HEPES и 10 глюкозы, pH 7,4, скорректированная с помощью NaOH; и
межклеточный раствор (мМ): 120 CsF, 15 NaCl, 10 EGTA и 10 HEPES, pH 7,2, скорректированная с помощью CsOH.
Композиции внеклеточного и межклеточного растворов для канала Nav1.8 человека:
внеклеточный регистрирующий раствор (мМ): 160 NaCl, 1 KCl, 2 CaCl2, 1 MgCl2, 10 HEPES и 10 глюкозы, pH 7,4, скорректированная с помощью NaOH;
межклеточный раствор (мМ): 120 CsF, 30 CsCl, 1 NaCl, 10 EGTA и 10 HEPES, pH 7,2, скорректированная с помощью CsOH.
[0246] Двухимпульсный протокол
После достижения конфигурация цельной клетки, клетки подвергают контролю в течение по меньшей мере 10 минут для проведения клеточного диализа раствором из пипетки. Для оценки ингибирующего действия тестируемых соединений клетки фиксируют при -100 или -120 мВ. Первый тестовый импульс до 0 мВ (тестовый импульс 1) применяют после подготовительного импульса в течение 8 секунд, во время которого инактивируется примерно 50% каналов, после чего следует период восстановления в течение 10 или 20 мсек при -100 или -120 мВ и второй импульс до 0 мВ (тестовый импульс 2). Командные импульсы выдают с интервалом 30 секунд. Растворы испытываемого соединения наносят последовательно. Пиковые токи, вызванные тестовым импульсом 1 и тестовым импульсом 2, определяют с помощью Clampex (Axon Instruments) или Pulse+Pulse Fit (HEKA). Усредненные пиковые токи под разбавителем или испытуемыми соединениями рассчитывают по данным 3 точек в конце каждого состояния. Ингибирующий эффект (% ингибирования) тестируемого соединения рассчитывают следующим образом:
[0247] [Мат. формула 4]

[0248] Ингибирующее действие (% ингибирования) в отношении пиковых токов при тестовом импульсе 1 или тестовом импульсе 2 наносят на график в зависимости от тестовой концентрации, значения IC50 в тесте 1 (замкнутая IC50) или тесте 2 (инактивированная IC50) рассчитывают по уравнению Хилла, соответственно. Анализ данных выполняют с использованием XLfit (версия 5.2.0.0.).
[0249] Зависимое от применения ингибирование тестируемых соединений
После достижения конфигурация цельной клетки, клетки подвергают контролю в течение по меньшей мере 10-15 минут для проведения клеточного диализа раствором из пипетки. Клетки удерживают на мембранном потенциале, при котором инактивируется примерно от 10 до 20% каналов. Тестовые импульсы 0 мВ с длительностью 10 мсек применяют при 10 Гц 100 раз в отсутствии или в присутствии испытуемых соединений. Сбор данных осуществляют с помощью программ Clampex (Axon Instruments) или Pulse+Pulse Fit (HEKA).
[0250] Зависимые от применения активности тестируемого соединения представлены как «Тоническое ингибирование» и «Фазовое ингибирование».
Тоническое ингибирование рассчитывается по следующему уравнению:
[0251]
[Мат. формула 5]
Тоническое ингибирование (%) = (1 - I1й/соед/I1й/контроль) × 100%
где I1й/контроль и I1й/соед представляют собой амплидуду пикового тока, вызванного 1-м импульсом в контрольном растворителе и в присутствии тестируемого соединения, соответственно.
[0252] Фазовое ингибирование определяют как снижение общего тока в присутствии испытуемого соединения во время применения импульса с повторением и рассчитывают по следующему уравнению:
[0253] [Мат. формула 6]
Фазовое ингибирование (%) = (1 - I100й/соед/I100й/контроль) × 100%
где I100й/контроль и I100й/соед представляют собой амплидуду пикового тока, вызванного 100-м импульсом в контрольном растворителе и в присутствии тестируемого соединения, соответственно.
[0254] Ожидаемое значение IC50 (ожид. IC50) рассчитывают по следующему уравнению, предполагая, что соединения взаимодействуют с Na каналами в соответствии с обычной моделью связывания 1:1.
[0255] [Мат. формула 7]
Ожид. значение IC50 = (100/% ингбирования - 1)х[тестируемая доза]
[0256] Сродство к состоянию покоя (Kr) и инактивированному состоянию (Ki) тестируемого соединения
Нормализованную кривую стационарного состояния строят с использованием 2-секундного (для растворителя) или 60-секундного (для лекарственных средств) импульса кондиционирования до различных потенциалов с последующим немедленным тестовым импульсом до -10 мВ. Пиковые токи наносят на график как часть максимального тока при потенциалах кондиционирования в диапазоне от -120 до 0 мВ для Nav1.7. Значения V1/2 и k рассчитывают по методу Больцмана. Сродство тестируемого соединения к состоянию покоя Na каналов (Kresting или Kr) оценивают деполяризационным тестовым импульсом с отрицательным потенциалом удерживания -130 мВ, когда практически все каналы находятся в состоянии покоя. Значение Kr рассчитывают с помощью обычной модели связывания 1:1:
[0257] [Мат. формула 8]
Кresting(Кr)={[лекарство]Imax,лекарство/(Imax,контроль-Imax,лекарство)}
где
Кresting(=Кr) = константа диссоциации для состояния покоя,
[лекарство] = концентрация соединения,
Imax,контроль и Imax,лекарство=пиковые токи в отсутствии и в присутствии соединения, соответственно.
[0258] Сродство тестируемого соединения к инактивированному состоянию Na каналов (Kinact или Ki) определяют по индуцированному соединением левому сдвигу стационарной кривой инактивации. Взаимодействие соединения с каналом в инактивированном состоянии оценивают по следующему уравнению:
[0259] [Мат. формула 9]
Kinact(Ki) = {[лекарство]/((1+[лекарство]/Kr)*exp(-δV/k)-1)}
где
Kinact(Ki) = константа диссоциации для инактивированного состояния;
δV=индуцированный соединением сдвиг потенциала на половину максимального напряжения кривой Больцмана;
k=коэффициент загрязнения вследствие присутствии соединения.
[0260] Стеклянные пипетки вытягивают до диаметра кончика 1-2 микрометра с помощью устройства для вытягивания пипеток. Пипетки заполняют внутриклеточным раствором, и по всей их длине вставляют хлорированный серебряный провод, который затем подключают к головной части вольт-кламп амплификатора (Axon Instruments или HEKA electronicik). Внеклеточный регистрирующий раствор (мМ): 140 NaCl, 5 KCl, 2 CaCl2, 1 MgCl2, 10 HEPES и 10 глюкозы, pH 7,4, скорректированная с помощью NaOH. Внутренний раствор (мМ): 120 CsF, 15 NaCl, 10 EGTA и 10 HEPES, pH 7,2, скорректированная с помощью CsOH; после введения кончика пипетки в ванну отмечают сопротивление пипетки (допустимый диапазон составляет 1-3 мегаом). Потенциал соединения пипетки и раствора ванны обнуляется на амплификаторе. После установления конфигурации цельной клетки в течение примерно 10 минут раствор пипетки уравновешивают внутри клетки перед началом записи. Токи фильтруют на низких частотах в интервале 2-5 кГц и измеряют при 10 кГц.
[0261] Нормализованную стационарную кривую инактивации строят с использованием 2-секундного (для растворителя) или 60-секундного (для лекарственных препаратов) импульса кондиционирования до различных потенциалов, за которым сразу следует тестовый импульс до -10 мВ. Пиковые токи представляют в виде доли максимального тока при потенциалах кондиционирования в диапазоне от -120 мВ до -40 мВ для Nav1.3 и от -130 мВ до -60 мВ для Nav1.7. Значения V1/2 или k оценивают в соответствии с методом Больцмана. Сродство лекарственных средств к состоянию покоя Na каналов (Kresting или Kr) оценивают по 30-мсекундному тестовому импульсу от отрицательного удерживающего потенциала -120 или -130 мВ, где практически все каналы находятся в состоянии покоя. Значение Kr рассчитывают с помощью обычной модели связывания 1:1:
[0262] [Мат. формула 10]
Kresting(Kr)={[лекарство]Imax,лекарство/(Imax,контроль-Imax,лекарство)}
где
Кresting(=Кr) = константа диссоциации для состояния покоя,
[лекарство] = концентрация соединения,
Imax,контроль и Imax,лекарство=пиковые токи в отсутствии и в присутствии соединения, соответственно.
[0263] Сродство лекарственного средства к инактивированному состоянию Na каналов (Kinact или Ki) оценивают по смещению кривой доступности под действием соединения. Взаимодействие соединения с каналом в инактивированном состоянии оценивают по следующему уравнению:
[0264] [Мат. формула 11]
Kinact(Ki) = {[лекарство]/((1+[лекарство]/Kr)*exp(-δV/k)-1)}
где
Kinact(=Ki) = константа диссоциации для инактивированного состояния;
δV=индуцированный соединением сдвиг потенциала на половину максимального напряжения кривой Больцмана;
k=коэффициент загрязнения вследствие присутствии соединения.
[0265] Все протестированные соединения по изобретению проявляют сильные активности в этой модели. Например, активности (Ki) соединений примеров 3 и 4 в отношении Nav1.7 составляют 0,96 мкМ и 0,52 мкМ, соответственно.
[0266] Испытание в условиях in vivo
Статическая аллодиния у крыс, вызванная хронической компрессией (сhronic constriction injury - CCI)
Самцов крыс Sprague-Dawley в возрасте 7 недель приобретают у Charles River Japan Inc. и размещают группами по две особи на клетку с 12-часовым циклом свет/темнота (освещение включают в 07:00) со свободным доступом к пище и воде. Индуцированную CCI статическую аллодинию оценивают тестом с использованием нитей фон Фрея (von Frey hair - VFH). Операцию проводят по методике Беннетта GJ и Xie YK (Pain 1988, 33: 87-107). Животных анестезируют внутрибрюшинной инъекцией пентобарбитала натрия. Левый общий седалищный нерв обнажают на уровне середины бедра, освобождют от налипшей ткани и накладывают вокруг него четыре лигатуры с помощью шелковой нити 4-0. Разрез зашивают и крысам дают возможность восстановиться в клетках с мягкими подстилками. Ложную операцию проводят таким же образом, но без перевязки седалищного нерва. Животных по отдельности помещают в испытательный бокс из оргстекла на приподнятой решетке для акклиматизации перед днем испытания. На 14-28 день после операции (POD) проводят оценку с использованием серии калиброванных VFH (моноволокна Семмса-Винштейна) с силой 0,4, 0,6, 1, 2, 4, 6, 8 и 15 г. Тест с VFH, начиная с силы 2 г, применяют восходящим или нисходящим способом согласно модифицированному методу Диксона «вверх и вниз», описанному Chaplan S.R. et al. (J. Neurosci Methods 1994, 53: 55-63). Каждый тест VFH проводят на поверхности подошвы оперированной задней лапы с постоянным повышением давления до сгибания в течение приблизительно 6 секунд. При отсутствии отгергивания лапы применяют более сильный стимул. В случае отдергивания лапы выбирают следующий более слабый стимул. После первоначального изменения с положительного на отрицательный ответ или наоборот применяют еще 4 стимуляции. 6-балльную схему положительных и отрицательных ответов преобразуют в 50% порог отдергивания лапы (PWT) по следующей формуле:
[0267] [Мат. формула 12]
50% PWT (г) = (10[Xf +kδ])/10000
где Xf=значение (в log единицах) финальных используемых VFH,
k=табличное значение для шаблона положительного/отрицательного ответов,
δ = средняя разница между стимулами в log единицах (здесь 0,224).
[0268] В случаях, когда непрерывные положительные или отрицательные ответы наблюдаются до конца спектра стимулов, присваиваются значения 0,25 и 15 г соответственно. Животных, демонстрирующих статическую аллодинию (<4 г 50% PWT) при операции CCI, отбирают для оценки и рандомизируют так, чтобы во всех группах значение PWT было практически равно среднему значению 50% PWT. Соединения по изобретению или их носители вводят системно. Крыс приучают к камере в течение по меньшей мере 20 минут перед проведением измерения. 50% PWT измеряют в соответствующее время после введения соединения. Статистический анализ выполняют с помощью непарного t-критерия или одностороннего дисперсионного анализа (ANOVA) с использованием специального критерия Даннетта и в сравнении с группой, получавшей растворитель.
Все протестированные соединения по изобретению проявляют сильные активности в этой модели.
[0269] Термическая гипералгезия у крыс, вызванная полным адъювантом Фрейнда (Complete Freund's Adjuvant - CFA)
Самцов крыс Sprague-Dawley в возрасте 6 недель приобретают у Charles River Japan Inc. и размещают группами по две особи на клетку с 12-часовым циклом свет/темнота (освещение включают в 07:00) с неограниченным доступом к пище и воде. Термическую гипералгезию, вызванную CFA, оценивают с использованием подошвенного тест-аппарата (Ugo Basile), как описано в публикации Hargreaves K. et al. (Pain 1988, 32: 77-88). Животных помещают в аппарат, состоящий из индивидуального отдельного испытательного бокса на приподнятом стеклянном столе и дают им возможность привыкнуть к нему в течение по меньшей мере 10 минут. После привыкания под столом помещают переносной излучаемого тепла, а на подошвенную поверхность правой задней лапы применяют тепловую стимуляцию. Задержка отведения задней лапы определяют как задержку отдерживания лапы (PWL) в сек. Точку завершения сбора данных устанавливают на 30 секунд для предотвращения повреждения ткани. CFA готовят в концентрации 2-3 мг/мл Mycobacterium tuberculosis H37 RA в жидком парафине. После дезинфекции 70% этанолом крысам в правую заднюю лапу внутриподошвенно вводят 100 мкл CFA (200-300 мкг). Через два дня после инъекции CFA способом, описанным выше, количественно определяют PWL. Животных, у которых в результате инъекции CFA наблюдается снижение PWL (гипералгезия), отбирают для оценки и рандомизируют так, чтобы среднее значение PWL во всех группах было практически одинаковым. Соединения по изобретению или их носители вводят системно. Крысам дают возможность привыкнуть к аппаратуре в течение по меньшей мере 10 минут перед каждым измерением. PWL измеряют в соответствующее время после введения соединения. Статистический анализ выполняют с помощью непарного t-критерия или ANOVA с использованием специального критерия Даннета и в сравнении с группой, получавшей растворитель.
Все протестированные соединения по изобретению проявляют сильные активности в этой модели.
[0270] CFA-индуцированный дефицит способности выдерживать весовую нагрузку у крыс
Самцов крыс Sprague-Dawley в возрасте 7 недель приобретают у Charles River Japan Inc. и размещают в клетки группами по две особи на клетку с 12-часовым циклом свет/темнота (освещение включают в 07:00) с неограниченным доступом к пище и воде. Дефицит способности выдерживать весовую нагрузку (weight bearing - WB), вызванный CFA, оценивают с помощью тестера недееспособности (Linton Instrumentation). Животных приучают к пластиковому футляру, который поставляется с тестером недееспособности до дня инъекции CFA. В день инъекции CFA распределение веса тела каждой задней лапы у каждой крысы измеряют 3 раза с помощью тестера, и разницу в распределении веса, вес правой (инъецированной) лапы минус вес левой (неинъецированной) лапы, определяют как дефицит снижения WВ в граммах. Продолжительность каждого измерения устанавливают на 3 секунды. CFA готовят в концентрации 2-3 мг/мл Mycobacterium tuberculosis H37 RA в жидком парафине. После дезинфекции 70% этанолом крысам внутрипланетно вводят 100 мкл CFA (200-300 мкг) в правую заднюю лапу. Через два дня после введения CFA измеряют распределение веса на каждой задней лапе и рассчитывают величину дефицита WB, как описано выше. Животных, у которых наблюдается снижение дефицита WB (> 30%), вызванного инъекцией CFA, отбирают для оценки и рандомизируют так, чтобы оно было практически равными во всех группах. Соединения по изобретению или их носители вводятся системно. Распределение веса каждой задней лапы измеряют в соответствующее время после введения соединения, и значение дефицита WB рассчитывают, как описано выше. Статистический анализ выполняют с помощью непарного t-критерия или ANOVA с использованием специального критерия Даннета и в сравнении с группой, которой вводился растворитель.
Все протестированные соединения по изобретению проявляют сильные активности в этой модели.
[0271] Статическая аллодиния у крыс, вызванная разрезом лапы
Самцов крыс Sprague-Dawley возраста 7 недель приобретают у Charles River Japan Inc. и размещают в клетки группами по две особи на клетку с 12-часовым циклом свет/темнота (освещение включают в 07:00) с неограниченным доступом к пище и воде. Статическую аллодинию, вызванную разрезом лапы, оценивают с помощью теста VFH. Операция проводится в соответствии с методикой, описанной Brennan et al. (Pain 1996, 64: 493-501). Животных изначально анестезируют смесью 3-4% изофлуран/O2 в анестезиологической камере и выдерживают с доставкой 2-3% через носовой конус. Поверхность подошвы правой задней лапы стерилизуют 7,5% раствором повидон-йода. Продольный разрез длиной 1 см делают лезвием № 11 через кожу и фасцию подошвы лапы, начиная с 0,5 см от проксимального края пятки и до пальцев. Подошвенную мышцу поднимают с помощью щипцов и смещают назад. Начало и место прикрепления мышцы оставляют нетронутыми. После гемостаза с легким надавливании на кожу накладывают 2 шва из нейлона 5-0. Участок раны покрывают мазью террамицина и дают возможность крысам восстановиться в клетках с мягкими подстилками. Животных по отдельности помещают в испытательную камеру из оргстекла на приподнятой решетке для привыкания за 1 час до дня операции. На POD1 оценку выполняют с использованием серии калиброванных VFH (0,008, 0,02, 0,04, 0,07, 0,16, 0,4, 0,6, 1, 1,4, 2, 4, 6, 8, 10, 15 и 26 г). Начиная с силы 0,16 г в восходящем или нисходящем порядке, каждый VFH помещают на проксимальном конце раны около боковой поверхности пятки с постоянным повышением давления до сгибания в течение приблизительно 6 секунд. В отсутствие отдергивания лапы (отрицательный ответ) применяют более сильный стимул. В случае оттергивания лапы (положительный ответ) подбирают более слабый стимул. Наименьшее усилие, необходимое для получения двух положительных ответов, определяется как PWT в g. В случаях, когда непрерывные положительные или отрицательные ответы наблюдаются вплоть до конца спектра стимула, присваиваются значения 0,008 и 26 г соответственно. Животных, у которых с помощью послеоперационной хирургии выявляют PWT <1,4 г PWT, отбирают для оценки и рандомизируют таким образом, чтобы их значения PWT были практически равны среднему значению PWT во всех группах. Соединения по изобретению или растворители вводят системно. Крыс приучают к камере в течение по меньшей мере 20 минут перед измерением. PWT измеряют в соответствующее время после введения соединения. Статистический анализ проводят с помощью U-критерия Манна-Уитни или Крускала-Уоллиса с последующим тестом Данна и в сравнении с группой, принимающей растворитель.
Все протестированные соединения по изобретению проявляют сильные активности в этой модели.
[0272] Индуцированная паклитакселом статическая аллодиния у крыс
Самцов крыс Sprague-Dawley в возрасте 7 недель приобретают у Charles River Japan Inc. и размещают группами в клетки по две особи на клетку с 12-часовым циклом свет/темнота (освещение включают в 07:00) с неограниченным доступом к пище и воде. Индуцированную паклитакселом статическую аллодинию оченивают с помощью VFH теста. Обработку паклитакселом проводят по методике, описанной в Polomano R.C. et al. (Pain 2001, 94: 293-304). Паклитаксел (2 мг) вводят внутрибрюшинно в четыре альтернавивных дня (дни 1, 3, 5 и 7) в объеме 1 мл/кг. Накопленная доза составляет 8 мг/кг. В контрольной по такому же графику вводят растворитель (смесь 16,7% Cremophor EL и 16,7% этанола в физиологическом растворе). Животных по отдельности помещают в испытательную камеру из оргстекла на приподнятой решетке для акклиматизации перед днем испытания. В 15-29 дни проводят оценку с использованием серии калиброванных VFH с силой 0,4, 0,6, 1, 2, 4, 6, 8 и 15 г. Тест VFH, начиная с силы 2 г, применяют восходящим или нисходящим способом согласно модифицированному методу Диксона «вверх-вниз», описанному Chaplan S.R. et al. (J. Neurosci Methods 1994, 53: 55-63). Каждый тест VFH проводят на поверхности подошвы оперированной задней лапы с постоянным повышением давления до сгибания в течение приблизительно 6 секунд. При отсутствии отгергивания лапы применяют более сильный стимул. В случае отдергивания лапы выбирают следующий более слабый стимул. После первоначального изменения с положительного на отрицательное или наоборот применяются еще 4 стимуляции. 6-балльную схему положительных и отрицательных ответов преобразуется в 50% PWT по следующей формуле:
[Мат. формула 13]
50% PWT (г) = (10[Xf +kδ])/10000
где Xf=значение (в log единицах) финальных используемых VFH,
k=табличное значение для шаблона положительного/отрицательного ответов,
δ = средняя разница между стимулами в log единицах (здесь 0,224).
В случаях, когда непрерывные положительные или отрицательные ответы наблюдаются вплоть до конца спектра стимула, присваиваются значения 0,25 и 15 г, соответственно. Животных, показывающих статическую аллодинию (<4 г 50% PWT) при введении паклитаксела, отбирают для оценки и рандомизируют так, чтобы во всех группах значение PWT было практически равно среднему значению 50% PWT. Соединения по изобретению или их растворители вводят системно. Крыс приучают к камере в течение по меньшей мере 20 минут перед проведением измерения. 50% PWT измеряют в соответствующее время после введения соединения. Статистический анализ выполняют с помощью непарного t-критерия или ANOVA с использованием специального критерия Даннета и в сравнении с группой, получавшей растворитель.
Все протестированные соединения по изобретению проявляют сильные активности в этой модели.
[0273] Индуцированное формалином ноцицептивное поведение у крыс
Самцов крыс Sprague-Dawley в возрасте 6 недель приобретают у Charles River Japan Inc. и размещают группами по две особи на клетку с 12-часовым циклом свет/темнота (освещение включают в 07:00) с неограниченным доступом к пище и воде. Формалиновый тест проводят во время светового цикла. Животных акклиматизируют в испытательной камере не менее чем за 30 минут до инъекции формалина. Для удобства наблюдения позади камеры и/или под камерой размещают зеркало. 50 мкл 5% раствора формалина вводят подкожно в подошвенную поверхность правой задней лапы. Сразу после инъекции крыс помещают в отдельную камеру и регистрируют поведение, связанное с болью. После испытания время, потраченное на зализывание и/или прикусывание инъецированной лапы, подсчитывается в 5-минутных бункерах в течение 45 минут после обработки формалином. Суммарное время, потраченное на зализывание/прикусывание в секундах, от времени 0 до 5 минут, считают ранней фазой, тогда как поздней фазой считают суммарное временя, потраченное на зализывание/прикусывание, которое обычно составляе от 15 до 45 минут. Соединения по изобретению или растворитель вводят системно в соответствующий момент времени перед инъекцией формалина. Статистический анализ выполняют с помощью непарного t-критерия или ANOVA с использованием специального критерия Даннета и в сравнении с группой, получавшей растворитель.
Все протестированные соединения по изобретению проявляют сильные активности в этой модели.
[0274] Анализ связывания дофетилида человека
Клетки HEK293S человека, трансфицированные HERG, получают и выращивают в собственном производстве. Собранные клетки суспендируют в 50 мМ Трис-HCl (pH 7,4 при 4°С) и гомогенизируют с помощью ручного дисраптора Polytron PT 1200, установленного на полную мощность, в течение 20 секунд на льду. Гомогенаты центрифугируют со скоростью 48000 g при 4°С в течение 20 минут. Затем пеллеты ресуспендируют, гомогенизируют и снова центрифугируют таким же образом. Конечные пеллеты снова суспендируют в подходящем объеме 50 мМ Трис-HCl, 10 мМ KCl, 1 мМ MgCl2 (рН 7,4 при 4°С), гомогенизируют, разделяют на аликвоты и хранят при -80°С до использования. Аликвоту мембранных фракций используют для определения концентрации белка с использованием набора для анализа белка BCA (PIERCE) и планшет-ридера ARVOsx (Wallac). Анализы связывания проводят в общем объеме 30 мкл в 384-луночных планшетах. Активность измеряют с помощью PHERAstar (BMG LABTECH) с использованием технологии флуоресцентной поляризации. Десять мкл тестируемых соединений инкубируют с 10 мкл флуоресцентного лиганда (6 нМ Cy3B-меченое производное дофетилида) и 10 мкл мембранного гомогената (6 мкг белка) в течение 120 минут при комнатной температуре Неспецифическое связывание определяют с помощью 10 мкМ E4031 в конечной концентрации.
Все испытанные соединения по изобретению показывают более высокие значения IC50 в связывании дофетилида человека, чем значения IC50 в отношении Nav1.7 или Nav1.8 в FRET анализе. Высокие значения IC50 в активности связывания дофетилида человека приводят к снижению риска возникновения нежелательных сердечно-сосудистых осложнений.
[0275] Анализ метаболической стабильности
Период полувыведения в микросомах печени человека (human liver microsomes -HLM)
Испытываемые соединения (1 мкМ) инкубируют с 3,3 мМ MgCl2 и 0,78 мг/мл HLM (HL101) или 0,74 мг/мл HLM (Gentest UltraPool 150) в 100 мМ калий-фосфатном буфере (pH 7,4) при 37°C в 96-луночном планшете с глубокими лунками. Реакционную смесь разделяют на две части: не содержащую P450 и содержащую P450. Никотинамид-аденин-динуклеотид-фосфат (NADPH) добавляют только в реакционную смесь группы P450. (Систему генерирования NADPH также используют вместо NADPH.) Аликвоту образцов группы P450 собирают в момент времени 0, 10, 30 и 60 минут, где момент времени 0 минут указывает время, когда NADPH добавляют в реакционную смесь P450 группы. Аликвоту образцов группы, не содержащей к P450, собирают в моменты времени -10 и 65 минут. Собранные аликвоты экстрагируют раствором ацетонитрила, содержащим внутренний стандарт. Осажденный белок центрифугируют в центрифуге (2000 об./мин., 15 мин). Концентрацию соединения в супернатанте измеряется с помощью системы ЖХ/МС/МС.
[0276] Значение периода полураспада получают путем построения графика зависимости натурального логарифма отношения площади пика соединения/внутреннего стандарта от времени. Наклон линии наилучшего соответствия через точки дает скорость метаболизма (k). Это значение преобразуют в значение периода полувыведения с использованием следующих уравнений:
[0277] [Мат. формула 14]
Период полувыведения=ln 2/k
[0278] Соединения по настоящему изобретению демонстрируют предпочтительную стабильность, которая устанавливает возможность их описанного выше практического применения.
[0279] Анализ взаимодействия «лекарственное средство-лекарственное средство»
Этот метод по существу включает определение ингибирования в процентах образования метаболитов из зондов (Tacrine (Sigma A3773-1G) 2 мкМ, декстрометорфана (Sigma D-9684) 5 мкМ, диклофенака (Sigma D-6899-10G) 5 мкМ и мидазолама (ULTRAFINE UC) -429) 2 мкМ) при 3 мкМ каждого соединения.
[0280] Точнее, анализ проводят следующим образом. Соединения (60 мкМ, 10 мкл) предварительно инкубируют в 170 мкл смеси, включающей 0,1 мг белка/мл микросом печени человека, 100 мМ калий-фосфатного буфера (рН 7,4), 1 мМ MgCl2 и зонды в качестве субстрата в течение 5 минут. Реакцию начинают инициируют добавлением 20 мкл 10 мМ NADPH (также используют 20 мкл генерирующей системы NADPH, которая состоит из 10 мМ NADP+, 50 мМ DL-изоцитриновой кислоты и 10 ед/мл изоцитрадегидрогеназы). Планшет для анализа инкубируют при 37°С. К инкубационному раствору в подходящее время (например, 8 мин.) добавляют ацетонитрил. Концентрацию метаболитов в супернатанте количественно определяют с помощью системы ЖХ/МС/МС.
Степень взаимодействия «лекарственное средство-лекарственное средство» определяют исходя из % образования метаболитов в присутствии или в отсутствие тестируемого соединения.
Соединения по настоящему изобретению демонстрируют предпочтительные результаты, что устанавливает возможность их описанного выше практического применения.
[0281] Анализ связывания с белками плазмы
Связывание с белками плазмы тестируемого соединения (1 мкМ) измеряют методом равновесного диализа с использованием оборудования с 96-луночным планшетом. HTD96a (зарегистрированный торговый знак), регенерированные целлюлозные мембраны (граница отсечки по молекулярной массе 12000-14000, 22 мм × 120 мм) замачивают в течение ночи в дистиллированной воде, затем в течение 15 минут в 30% этаноле и, наконец, в течение 20 минут в буфере для диализа (фосфатно-солевой буфер Дульбекко, рН 7,4). Используют замороженную плазму человека, крыс Sprague-Dawley и собак породы биглей. Собирают оборудование для диализа и добавляют 150 мкл обогащенной соединениями плазмы на одну сторону каждой лунки и 150 мкл буфера для диализа на другую сторону каждой лунки. После 4 часов инкубации при 37°C смесь центрифугируют со скоростью 150 об./мин. и отбирают аликвоты плазмы и буфера. Соединение в плазме и в буфере экстрагируют 300 мкл ацетонитрила, содержащего соединения внутреннего стандарта для анализа. Концентрацию соединения определяют с помощью системы ЖХ/МС/МС.
Долю несвязанного соединения рассчитывают по представленным далее уравнениям (A) или (B):
[0282] [Мат. Формула 15]
(А) fu=1-{([плазма]eq-[буфер]eq)/[плазма]eq}
где [плазма]eq и [буфер]eq=концентрации соединения в плазме и в буфере, соответственно
[0283] [Мат. формула 16]

где
Cp=площадь пика соединения в образце плазмы;
Cis, p=площадь пика внутреннего стандарта в образце плазмы;
Cb=площадь пика соединения в образце буфера;
Cis, b=площадь внутреннего стандарта в образце буфера;
4 и 4/3=величины, обратные скорости растворения в плазме и в буфере, соответственно
[0284] Соединения по настоящему изобретению демонстрируют предпочтительное связывание с белками плазмы, что устанавливает возможность описанного выше практического применения.
[0285] Исследование равновесной растворимости в воде
Раствор ДМСО (2 мкл, 30 мМ) каждого соединения помещают в каждую лунку 96-луночного планшета со стеклянным дном. В каждую лунку добавляют калийно-фосфатный буферный раствор (50 мМ, 198 мкл, pH 6,5) и инкубируют смесь при 37°C со встряхиванием с вращением в течение 24 часов. После центрифугирования при 2000 g в течение 5 минут супернатант фильтруют через изопористую мембрану из поликарбоната. Концентрацию образцов определяют методом ВЭЖХ с градиентом (J. Pharm. Sci. 2006, 95, 2115-2122).
[0286] Все публикации, включая, но без ограничения, выданные патенты, заявки на патенты и журнальные статьи, цитируемые в этой заявке, включены в настоящее описание в качестве ссылки во всей их полноте. Хотя изобретение было описано выше со ссылкой на раскрытые варианты осуществления, специалисты в данной области легко поймут, что подробные конкретные эксперименты являются только иллюстрацией изобретения. Следует понимать, что различные модификации могут быть сделаны без выделения их из сущности изобретения. Соответственно, изобретение ограничено только приведенной далее формулой изобретения.
[Промышленная применимость]
[0287] Производные амида по настоящему изобретению могут применяться для лечения широкого спектра расстройств, в которые вовлечены блокаторы каналов Nav1.7 и/или Nav1.8, в частности боли, острой боли, хронической боли, невропатической боли, воспалительной боли, висцеральной боли, ноцицептивной боли, зуда, рассеянного склероза, нейродегенеративного расстройства, синдрома раздраженного кишечника, остеоартрита, ревматоидного артрита, невропатологических расстройств, функциональных расстройств кишечника, воспалительных заболеваний кишечника, боли, связанной с дисменореей, тазовой боли, цистита, панкреатита, мигрени, кластерных головных болей и головных болей напряжения, диабетической невропатии, периферической невропатической боли, ишиаса, фибромиалгии, болезни Крона, эпилепсии или эпилептических состояний, биполярной депрессии, тахиаритмии, расстройства настроения, биполярного расстройства, психических расстройств, таких как тревога и депрессия, миотонии, аритмии, двигательных расстройств, нейроэндокринных расстройств, атаксии, недержания, висцеральной боли, тригеминальной невралгии, герпетической невралгии, общей невралгии, постгерпетической невралгии, корешковой боли, боли в спине, головной боли или боли в шее, сильной или неустранимой боли, прорывной боли, послеоперационной боли, инсульта, онкологической боли, судорожного расстройства, каузалгии и боли, вызванной химическими веществами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ АРИЛАМИДОВ В КАЧЕСТВЕ БЛОКАТОРОВ TTX-S | 2011 |
|
RU2535671C1 |
| АМИДОПРОИЗВОДНЫЕ КАК БЛОКАТОРЫ TTX-S | 2013 |
|
RU2632899C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИДИНА В КАЧЕСТВЕ БЛОКАТОРОВ TTX-S | 2013 |
|
RU2652117C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИДИНОНА В КАЧЕСТВЕ TTX-S БЛОКАТОРОВ | 2013 |
|
RU2646754C2 |
| АРИЛ-ЗАМЕЩЕННЫЕ КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ БЛОКАТОРОВ КАЛЬЦИЕВЫХ ИЛИ НАТРИЕВЫХ КАНАЛОВ | 2010 |
|
RU2575168C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ - МОДУЛЯТОРЫ СИГНАЛЬНОГО ПУТИ HEDGEHOG | 2007 |
|
RU2423354C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
| ЛЕЧЕНИЕ МИОДИСТРОФИИ ДЮШЕНА | 2007 |
|
RU2462458C2 |
| АГОНИСТ РЕЦЕПТОРА GLP-1, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЕГО, И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2021 |
|
RU2800290C1 |
| ГЕРБИЦИДНОЕ СРЕДСТВО НА ОСНОВЕ АРИЛСУЛЬФОНИЛАМИНОКАРБОНИЛТРИАЗОЛИНОНОВ | 1997 |
|
RU2240691C2 |
Изобретение относится к производным амида, которые обладают блокирующей активностью в отношении потенциалзависимых натриевых каналов, таких как Nav1.7 и Nav1.8, и могут применяться в лечении или предотвращении расстройств и заболеваний, в которые вовлечены потенциалзависимые натриевые каналы. Изобретение также относится к фармацевтическим композициям, включающим указанные соединения, и к применению этих соединений и композиций в предотвращении или лечении заболеваний, в которые вовлечены потенциалзависимые натриевые каналы. 8 н. и 5 з. п. ф-лы, 4 табл., 155 пр.
1. Соединение, представленное приведенной далее формулой (I):
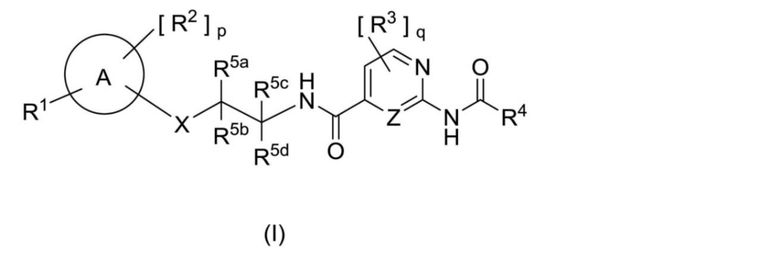
где
A представляет собой ненасыщенное моно- или бициклическое 5-15-членное углеродное кольцо или ненасыщенное моно- или бициклическое 5-15-членное кольцо, содержащее 1 или 2 гетероатома, выбранных из группы, состоящей из кислорода, азота и серы;
R1 выбран из группы, состоящей из –CF3, –CHF2, –OCF3, –SF5,
–OCHF2, –OCH2CHF2, –OCH2CF3, –OCH2CH2CF3, –OCH(CH3)CF3, –OCH2C(CH3)F2, –OCH2CF2CHF2, –OCH2CF2CF3, –NHCH2CF3, –SCF3, –SCH2CF3, –CH2CF3 и
–CH2CH2CF3;
R2 независимо выбран из группы, состоящей из
(1) водорода, (2) галогена, (4) C1–6 алкила, (5) –O–C1–6 алкила, (8) –CN, где C1–6 алкил или –O–C1–6 алкил является незамещенным;
p равно 0 или 1;
R1 и R2 могут находиться в любом положении на кольце А;
X выбран из группы, состоящей из –CR8aR8b–, –O–, –O–CR8aR8b–,
–NR9–, –NR9–CR8aR8b– и –S–;
Z представляет собой CH или N;
R3 независимо выбран из группы, состоящей из
(1) водорода или (4) C1–6 алкила;
q равно 0 или 1;
R4 выбран из группы, состоящей из
(2) C1–6 алкила, (4) C3–7 циклоалкила, где C1–6 алкил или C3–7 циклоалкил является незамещенным или замещен одной гидроксильной группой;
R5a и R5c независимо выбраны из группы, состоящей из
(1) водорода и (4) C1–6 алкила, где C1–6 алкил является незамещенным;
R5b и R5d независимо выбраны из группы, состоящей из (1) водорода и (3) C1–6 алкила;
R5c может образовывать C3–6 циклоалкил с R5d;
R8a и R8b каждый представляют собой (1) водород;
R9 представляет собой (1) водород;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где
A представляет собой фенил, пиридил, пиразил, пиримидил, хинолил, изохинолил, хиноксалил или нафтил;
X выбран из группы, состоящей из –CR8aR8b–, –O–, –O–CR8aR8b–,
–NR9–, –NR9–CR8aR8b– и –S–;
R5a и R5c независимо выбраны из группы, состоящей из
(1) водорода и (4) C1–6 алкила, где C1–6 алкил является незамещенным;
R5b представляет собой водород;
R5d выбран из группы, состоящей из (1) водорода и (3) C1–6 алкила;
R5c может образовывать C3–6 циклоалкил с R5d;
или его фармацевтически приемлемая соль.
3. Соединение, представленное приведенной далее формулой (II):

где
W представляет собой CH или N;
R1 выбран из группы, состоящей из –CF3, –CHF2, –OCF3, –SF5 и
–OCH2CF3;
R2 выбран из группы, состоящей из (1) водорода, (2) галогена, (4) C1–6 алкила, (5) –O–C1–6 алкила и (8) –CN;
X выбран из группы, состоящей из –CR8aR8b–, –O–, –O–CR8aR8b–, –NR9–, –NR9–CR8aR8b– и –S–;
Z представляет собой CH или N;
R3 выбран из группы, состоящей из
(1) водорода и (4) C1–6 алкила;
R4 выбран из группы, состоящей из (1) C1–6 алкила и (2) C3–7 циклоалкила, где C1–6 алкил или C3–7 циклоалкил является незамещенным или замещен одной гидроксильной группой;
R5a и R5c независимо выбраны из группы, состоящей из (1) водорода и (4) C1–6 алкила, который является незамещенным;
R5b представляет собой водород;
R5d выбран из группы, состоящей из (1) водорода и (3) C1–6 алкила;
R5c может образовывать C3–6 циклоалкил с R5d;
R8a и R8b каждый представляет собой водород;
R9 представляет собой водород;
или его фармацевтически приемлемая соль.
4. Соединение, представленное приведенной далее формулой (III):

где
W представляет собой CH или N;
R2 выбран из группы, состоящей из (1) водорода, (2) галогена, (4) C1–6 алкила, (5) –O–C1–6 алкила и (6) –CN;
X выбран из группы, состоящей из –CR8aR8b–, –O–, –O–CR8aR8b–,
–NR9–, –NR9–CR8aR8b– и –S–;
Z представляет собой CH или N;
R3 выбран из группы, состоящей из
(1) водорода и (4) C1–6 алкила;
R4 выбран из группы, состоящей из (1) C1–6 алкила и (2) C3–7 циклоалкила, где C1–6 алкил или C3–7 циклоалкил является незамещенным или замещен одной гидроксильной группой;
R5a и R5c независимо выбраны из группы, состоящей из (1) водорода и (4) C1–6 алкила, который является незамещенным;
R5b и R5d каждый представляют собой водород;
R8a и R8b каждый представляют собой водород;
R9 представляет собой водород;
или его фармацевтически приемлемая соль.
5. Соединение по п.4, где
W представляет собой N;
или его фармацевтически приемлемая соль.
6. Соединение, которое выбрано из группы, состоящей из следующих соединений:
2–(циклопропанкарбоксамидо)–N–(2–(4–(трифторметил)фенокси)пропил)изоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–6–метилизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–(циклопропанкарбоксамидо)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–изобутирамидоизоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–6–метилизоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–6–метилпиримидин–4–карбоксамид;
2–метил–6–пропионамидо–N–(2–((5–(трифторметил)пиридин–2–ил)окси)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–изобутирамидоизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–(циклопропанкарбоксамидо)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–(циклопропанкарбоксамидо)–6–метилпиримидин–4–карбоксамид;
(R)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–изобутирамидоизоникотинамид;
2–изобутирамидо–N–(2–(3–(трифторметокси)фенокси)этил)изоникотинамид;
2–ацетамидо–6–метил–N–(2–(3–(трифторметокси)фенокси)этил)изоникотинамид;
2–ацетамидо–N–(2–(2–хлор–4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–пропионамидоизоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–изобутирамидоизоникотинамид;
2–ацетамидо–N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
2–ацетамидо–6–метил–N–(2–(4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
N–(3–(3–хлор–5–(трифторметил)пиридин–2–ил)пропил)–2–(циклопропанкарбоксамидо)изоникотинамид;
2–ацетамидо–N–(3–(3–хлор–5–(трифторметил)пиридин–2–ил)пропил)–6–метилизоникотинамид;
N–(2–((3–фтор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(3–(3–хлор–5–(трифторметил)пиридин–2–ил)пропил)–2–пропионамидоизоникотинамид;
2–ацетамидо–6–метил–N–(2–(4–(пентафторсульфанил)фенокси)этил)изоникотинамид;
2–пропионамидо–N–(2–(4–(пентафторсульфанил)фенокси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(4–(пентафторсульфанил)фенокси)этил)изоникотинамид;
2–изобутирамидо–N–(2–(4–(пентафторсульфанил)фенокси)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–(циклопропанкарбоксамидо)пиримидин–4–карбоксамид;
N–(2–((3–хлор–5–(трифторметил)пиримидин–2–ил)амино)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–(циклопропанкарбоксамидо)пиримидин–4–карбоксамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–(циклопропанкарбоксамидо)изоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–(циклопропанкарбоксамидо)пиримидин–4–карбоксамид;
2–метил–6–пропионамидо–N–(2–((6–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–((6–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–изобутирамидо–N–(2–((6–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–изобутирамидо–N–(2–((6–(трифторметил)хинолин–2–ил)амино)этил)изоникотинамид;
2–метил–6–пропионамидо–N–(2–((6–(трифторметил)изохинолин–1–ил)окси)этил)изоникотинамид;
2–метил–6–пропионамидо–N–(2–((6–(2,2,2–трифторэтокси)нафталин–2–ил)окси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–((6–(2,2,2–трифторэтокси)нафталин–2–ил)окси)этил)изоникотинамид;
2–изобутирамидо–N–(2–((6–(2,2,2–трифторэтокси)нафталин–2–ил)окси)этил)изоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)тио)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)тио)этил)–2–изобутирамидоизоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)тио)этил)–6–метилизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)тио)этил)–2–метил–6–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–((6–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–пропионамидо–N–(2–((6–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–ацетамидо–6–метил–N–(2–((6–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–6–метил–N–(2–((6–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–изобутирамидо–6–метил–N–(2–((6–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–((6–(трифторметил)хинолин–2–ил)окси)этил)пиримидин–4–карбоксамид;
2–(2–гидрокси–2–метилпропанамидо)–6–метил–N–(2–((6–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
(R)–2–ацетамидо–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)изоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–пропионамидоизоникотинамид;
(R)–2–ацетамидо–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–6–метилизоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–метил–6–пропионамидоизоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–(циклопропанкарбоксамидо)изоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–изобутирамидоизоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–изобутирамидо–6–метилизоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–(циклопропанкарбоксамидо)пиримидин–4–карбоксамид;
(S)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–метил–6–пропионамидоизоникотинамид;
(R)–2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–6–метилизоникотинамид;
(R)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–метил–6–пропионамидоизоникотинамид;
(R)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–(циклопропанкарбоксамидо)изоникотинамид;
(R)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
(R)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–изобутирамидо–6–метилизоникотинамид;
2–метил–6–пропионамидо–N–(2–((7–(трифторметил)хинолин–4–ил)окси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–((7–(трифторметил)хинолин–4–ил)окси)этил)изоникотинамид;
2–изобутирамидо–N–(2–((7–(трифторметил)хинолин–4–ил)окси)этил)изоникотинамид;
N–(2–((3–фтор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–((5–хлор–3–(трифторметил)пиридин–2–ил)окси)этил)–2–метил–6–пропионамидоизоникотинамид;
2–пропионамидо–N–(2–((4–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–метил–6–пропионамидо–N–(2–((4–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–изобутирамидо–N–(2–((4–(трифторметил)хинолин–2–ил)окси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–((4–(трифторметил)хинолин–2–ил)окси)этил)пиримидин–4–карбоксамид;
2–бутирамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–пиваламидоизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–6–метил–2–пропионамидопиримидин–4–карбоксамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–изобутирамидо–6–метилпиримидин–4–карбоксамид;
2–ацетамидо–N–(2–(2–фтор–4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–2–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–фтор–4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–2–изобутирамидоизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–2–изобутирамидо–6–метилизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–фтор–4–(трифторметил)фенокси)этил)пиримидин–4–карбоксамид;
N–(2–(4–хлор–3–(трифторметил)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–(4–хлор–3–(трифторметил)фенокси)этил)–2–изобутирамидоизоникотинамид;
N–(2–(4–хлор–3–(трифторметил)фенокси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–(2–хлор–5–(трифторметил)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–(2–хлор–5–(трифторметил)фенокси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–(циклопропанкарбоксамидо)изоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–изобутирамидоизоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)–2–метилпропан–2–ил)–2–пропионамидоизоникотинамид;
N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)–2–метилпропан–2–ил)–2–(циклопропанкарбоксамидо)–6–метилпиримидин–4–карбоксамид;
N–(1–(((3–хлор–5–(трифторметил)пиридин–2–ил)окси)метил)циклопропил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–((3–циано–5–(трифторметил)пиридин–2–ил)окси)этил)–2–метил–6–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)изоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–пропионамидоизоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
2–ацетамидо–N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–6–метилизоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–(циклопропанкарбоксамидо)пиримидин–4–карбоксамид;
2–ацетамидо–N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)пропил)изоникотинамид;
N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)пропил)–2–пропионамидоизоникотинамид;
N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)пропил)–2–изобутирамидоизоникотинамид;
2–ацетамидо–N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)пропил)–6–метилизоникотинамид;
2–ацетамидо–N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)изоникотинамид;
N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–изобутирамидоизоникотинамид;
2–ацетамидо–N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–6–метилизоникотинамид;
N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–(циклопропанкарбоксамидо)–6–метилпиримидин–4–карбоксамид;
2–ацетамидо–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–(2–метокси–4–(трифторметил)фенокси)этил)–2–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
N–(2–(2–метокси–4–(трифторметил)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)изоникотинамид;
2–изобутирамидо–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
2–изобутирамидо–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)пиримидин–4–карбоксамид;
N–(1–(((3–хлор–5–(трифторметил)пиридин–2–ил)окси)метил)циклопропил)–2–изобутирамидо–6–метилпиримидин–4–карбоксамид;
N–(1–(((3–хлор–5–(трифторметил)пиридин–2–ил)окси)метил)циклопропил)–2–(циклопропанкарбоксамидо)–6–метилпиримидин–4–карбоксамид;
2–бутирамидо–N–(1–(((3–хлор–5–(трифторметил)пиридин–2–ил)окси)метил)циклопропилизоникотинамид;
2–ацетамидо–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–(2–метил–4–(трифторметил)фенокси)этил)–2–пропионамидоизоникотинамид;
2–ацетамидо–6–метил–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
2–метил–N–(2–(2–метил–4–(трифторметил)фенокси)этил)–6–пропионамидоизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
2–изобутирамидо–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–6–метил–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
2–изобутирамидо–6–метил–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–метил–4–(трифторметил)фенокси)этил)пиримидин–4–карбоксамид;
N–(2–(4–хлор–3–(трифторметил)фенокси)этил)–2–(циклопропанкарбоксамидо)–6–метилпиримидин–4–карбоксамид;
N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)–2–пропионамидоизоникотинамид;
N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)–2–изобутирамидоизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)пиримидин–4–карбоксамид;
2–(циклопропанкарбоксамидо)–N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)изоникотинамид;
2–ацетамидо–N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)–6–метилизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)–6–метилпиримидин–4–карбоксамид;
2–ацетамидо–N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)изоникотинамид
и
N–(2–(3–фтор–4–(трифторметил)фенокси)этил)–2–изобутирамидоизоникотинамид;
или его фармацевтически приемлемая соль.
7. Соединение по п.6, которое выбрано из группы, состоящей из следующих соединений:
2–(циклопропанкарбоксамидо)–N–(2–(4–(трифторметил)фенокси)пропил)изоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–6–метилизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–(циклопропанкарбоксамидо)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–изобутирамидоизоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–6–метилизоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–6–метилпиримидин–4–карбоксамид;
2–метил–6–пропионамидо–N–(2–((5–(трифторметил)пиридин–2–ил)окси)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–изобутирамидоизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–(циклопропанкарбоксамидо)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–(циклопропанкарбоксамидо)–6–метилпиримидин–4–карбоксамид;
(R)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–изобутирамидоизоникотинамид;
2–изобутирамидо–N–(2–(3–(трифторметокси)фенокси)этил)изоникотинамид;
2–ацетамидо–6–метил–N–(2–(3–(трифторметокси)фенокси)этил)изоникотинамид;
2–ацетамидо–N–(2–(2–хлор–4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–пропионамидоизоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–изобутирамидоизоникотинамид;
2–ацетамидо–N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
2–ацетамидо–6–метил–N–(2–(4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
N–(3–(3–хлор–5–(трифторметил)пиридин–2–ил)пропил)–2–(циклопропанкарбоксамидо)изоникотинамид;
2–ацетамидо–N–(3–(3–хлор–5–(трифторметил)пиридин–2–ил)пропил)–6–метилизоникотинамид;
N–(2–((3–фтор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(3–(3–хлор–5–(трифторметил)пиридин–2–ил)пропил)–2–пропионамидоизоникотинамид;
2–ацетамидо–6–метил–N–(2–(4–(пентафторсульфанил)фенокси)этил)изоникотинамид;
2–пропионамидо–N–(2–(4–(пентафторсульфанил)фенокси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(4–(пентафторсульфанил)фенокси)этил)изоникотинамид;
2–изобутирамидо–N–(2–(4–(пентафторсульфанил)фенокси)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–(циклопропанкарбоксамидо)пиримидин–4–карбоксамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)этил)–2–(циклопропанкарбоксамидо)пиримидин–4–карбоксамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–(циклопропанкарбоксамидо)изоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–(2–хлор–4–(трифторметил)фенокси)этил)–2–(циклопропанкарбоксамидо)пиримидин–4–карбоксамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)тио)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)тио)этил)–2–изобутирамидоизоникотинамид;
2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)тио)этил)–6–метилизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)тио)этил)–2–метил–6–пропионамидоизоникотинамид;
(R)–2–ацетамидо–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)изоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–пропионамидоизоникотинамид;
(R)–2–ацетамидо–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–6–метилизоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–метил–6–пропионамидоизоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–(циклопропанкарбоксамидо)изоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–изобутирамидоизоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–изобутирамидо–6–метилизоникотинамид;
(R)–N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропан–2–ил)–2–(циклопропанкарбоксамидо)пиримидин–4–карбоксамид;
(S)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–метил–6–пропионамидоизоникотинамид;
(R)–2–ацетамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–6–метилизоникотинамид;
(R)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–метил–6–пропионамидоизоникотинамид;
(R)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–(циклопропанкарбоксамидо)изоникотинамид;
(R)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
(R)–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–((3–фтор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–((5–хлор–3–(трифторметил)пиридин–2–ил)окси)этил)–2–метил–6–пропионамидоизоникотинамид;
2–бутирамидо–N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)изоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–пиваламидоизоникотинамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–6–метил–2–пропионамидопиримидин–4–карбоксамид;
N–(2–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)этил)–2–изобутирамидо–6–метилпиримидин–4–карбоксамид;
2–ацетамидо–N–(2–(2–фтор–4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–2–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–фтор–4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–2–изобутирамидоизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
N–(2–(2–фтор–4–(трифторметил)фенокси)этил)–2–изобутирамидо–6–метилизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–фтор–4–(трифторметил)фенокси)этил)пиримидин–4–карбоксамид;
N–(2–(4–хлор–3–(трифторметил)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–(4–хлор–3–(трифторметил)фенокси)этил)–2–изобутирамидоизоникотинамид;
N–(2–(4–хлор–3–(трифторметил)фенокси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–(2–хлор–5–(трифторметил)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–(2–хлор–5–(трифторметил)фенокси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–(циклопропанкарбоксамидо)изоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–изобутирамидоизоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–изобутирамидо–6–метилизоникотинамид;
N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)–2–метилпропан–2–ил)–2–пропионамидоизоникотинамид;
N–(1–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)–2–метилпропан–2–ил)–2–(циклопропанкарбоксамидо)–6–метилпиримидин–4–карбоксамид;
N–(1–(((3–хлор–5–(трифторметил)пиридин–2–ил)окси)метил)циклопропил)–2–изобутирамидо–6–метилизоникотинамид;
N–(2–((3–циано–5–(трифторметил)пиридин–2–ил)окси)этил)–2–метил–6–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)изоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–пропионамидоизоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–(циклопропанкарбоксамидо)–6–метилизоникотинамид;
2–ацетамидо–N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–6–метилизоникотинамид;
N–(2–(2–хлор–4–(трифторметокси)фенокси)этил)–2–(циклопропанкарбоксамидо)пиримидин–4–карбоксамид;
2–ацетамидо–N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)пропил)изоникотинамид;
N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)пропил)–2–пропионамидоизоникотинамид;
N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)пропил)–2–изобутирамидоизоникотинамид;
2–ацетамидо–N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)амино)пропил)–6–метилизоникотинамид;
2–ацетамидо–N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)изоникотинамид;
N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–изобутирамидоизоникотинамид;
2–ацетамидо–N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–6–метилизоникотинамид;
N–(3–((3–хлор–5–(трифторметил)пиридин–2–ил)окси)пропил)–2–(циклопропанкарбоксамидо)–6–метилпиримидин–4–карбоксамид;
2–ацетамидо–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–(2–метокси–4–(трифторметил)фенокси)этил)–2–пропионамидоизоникотинамид;
2–ацетамидо–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
N–(2–(2–метокси–4–(трифторметил)фенокси)этил)–2–метил–6–пропионамидоизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)изоникотинамид;
2–изобутирамидо–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
2–изобутирамидо–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)–6–метилизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–метокси–4–(трифторметил)фенокси)этил)пиримидин–4–карбоксамид;
N–(1–(((3–хлор–5–(трифторметил)пиридин–2–ил)окси)метил)циклопропил)–2–изобутирамидо–6–метилпиримидин–4–карбоксамид;
N–(1–(((3–хлор–5–(трифторметил)пиридин–2–ил)окси)метил)циклопропил)–2–(циклопропанкарбоксамидо)–6–метилпиримидин–4–карбоксамид;
2–бутирамидо–N–(1–(((3–хлор–5–(трифторметил)пиридин–2–ил)окси)метил)циклопропилизоникотинамид;
2–ацетамидо–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
N–(2–(2–метил–4–(трифторметил)фенокси)этил)–2–пропионамидоизоникотинамид;
2–ацетамидо–6–метил–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
2–метил–N–(2–(2–метил–4–(трифторметил)фенокси)этил)–6–пропионамидоизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
2–изобутирамидо–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–6–метил–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
2–изобутирамидо–6–метил–N–(2–(2–метил–4–(трифторметил)фенокси)этил)изоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(2–метил–4–(трифторметил)фенокси)этил)пиримидин–4–карбоксамид;
N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)–2–пропионамидоизоникотинамид;
N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)–2–изобутирамидоизоникотинамид;
2–(циклопропанкарбоксамидо)–N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)пиримидин–4–карбоксамид;
2–(циклопропанкарбоксамидо)–N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)изоникотинамид;
2–ацетамидо–N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)–6–метилизоникотинамид;
2–ацетамидо–N–(2–(3–фтор–4–(трифторметокси)фенокси)этил)изоникотинамид
и
N–(2–(3–фтор–4–(трифторметил)фенокси)этил)–2–изобутирамидоизоникотинамид;
или его фармацевтически приемлемая соль.
8. Фармацевтическая композиция для лечения состояния или расстройства, в которое вовлечены блокаторы Nav1.7 и Nav1.8 каналов, где указанное состояние или расстройство выбрано из группы, состоящей из боли, острой боли, хронической боли, невропатической боли, воспалительной боли, висцеральной боли, ноцицептивной боли, зуда, остеоартрита, диабетической невропатии, периферической невропатической боли, ишиаса, эпилепсии или эпилептических состояний, психических расстройств, таких как беспокойство и депрессия, тригеминальной невралгии, герпетической невралгии, постгерпетической невралгии, сильной боли, боли, вызванной химическими веществами; и их комбинаций, где композиция включает соединение или его фармацевтически приемлемую соль по любому из пп.1–7 и фармацевтически приемлемый носитель.
9. Фармацевтическая композиция по п.8, дополнительно включающая другое фармакологически активное средство.
10. Способ лечения состояния или расстройства, в которое вовлечены блокаторы Nav1.7 и Nav1.8 каналов, у животного, который включает введение животному, нуждающемуся в таком лечении, терапевтически эффективного количество соединения или его фармацевтически приемлемой соли по любому из пп.1–7, в котором указанное состояние или расстройство выбрано из группы, состоящей из боли, острой боли, хронической боли, невропатической боли, воспалительной боли, висцеральной боли, ноцицептивной боли, зуда, остеоартрита, диабетической невропатии, периферической невропатической боли, ишиаса, эпилепсии или эпилептических состояний, психических расстройств, таких как беспокойство и депрессия, тригеминальной невралгии, герпетической невралгии, постгерпетической невралгии, сильной боли, боли, вызванной химическими веществами, и их комбинаций.
11. Применение соединения по любому из пп.1–7 или его фармацевтически приемлемой соли для производства лекарственного средства для лечения состояния или расстройства, в которое вовлечены блокаторы Nav1.7 и Nav1.8 каналов, где указанное состояние или расстройство выбрано из группы, состоящей из боли, острой боли, хронической боли, невропатической боли, воспалительной боли, висцеральной боли, ноцицептивной боли, зуда, остеоартрита, диабетической невропатии, периферической невропатической боли, ишиаса, эпилепсии или эпилептических состояний, психических расстройств, таких как беспокойство и депрессия, тригеминальной невралгии, герпетической невралгии, постгерпетической невралгии, сильной боли, боли, вызванной химическими веществами, и их комбинаций.
12. Соединение по любому из пп.1–7 или фармацевтически приемлемая соль для применения в лечении состояния или расстройства, в которое вовлечены блокаторы Nav1.7 и Nav1.8 каналов.
13. Способ получения фармацевтической композиции, включающий смешивание соединения или фармацевтически приемлемой соли по любому из пп.1–7 и фармацевтически приемлемого носителя или эксципиента.
| WO 2012053186 A1, 26.04.2012 | |||
| WO 2010137351 A1, 02.12.2010 | |||
| WO 2006058905 A1, 08.06.2006 | |||
| ПРИМЕНЕНИЕ (ГАЛОБЕНЗИЛОКСИ)БЕНЗИЛАМИНО-ПРОПАНАМИДОВ ДЛЯ ПРОИЗВОДСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ, ДЕЙСТВУЮЩИХ КАК СЕЛЕКТИВНЫЕ МОДУЛЯТОРЫ НАТРИЕВЫХ И/ИЛИ КАЛЬЦИЕВЫХ КАНАЛОВ | 2005 |
|
RU2391973C2 |
| Беликов В | |||
| Г | |||
| "Фармацевтическая химия" | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| - М.: МЕДпресс-информ, 2007, С | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Berge S | |||
| M | |||
| et al | |||
| "Pharmaceutical Salts", Journal of | |||
Авторы
Даты
2022-03-23—Публикация
2018-06-20—Подача