Изобретение относится к области ветеринарии и биотехнологии, в частности молекулярной гепатологии. Предлагается метод использования циркулирующих микроРНК (miRNA) canine familiaris (cfa), полученных из гепатоцитов, в качестве новых неинвазивных диагностических биомаркеров сыворотки для ранней диагностики и дифференциации двух форм первичного гепатита [острого гепатита (ОГ) и хронического активного гепатита (ХАГ)] и раннего прогнозирования фиброза печени до его прогрессирования в цирроз путем выделения общей РНК из образцов сыворотки крови собак, у которых гистологическими методами подтверждены некроз или фиброз печени, с последующей обратной транскрипцией, с последующей амплификацией в режиме ПЦР-РВ с использованием праймеров специфичных для собак, для cfa-miRNA-122-5p и cfa-miRNA-21-5p. Все исследования были применены в трех последовательностях для каждого образца, и полученный средний порог цикла (Ct) каждой тестируемой cfa-miRNA был нормализован относительно среднего Ct cfa-miRNA-16 (стабильно экспрессируемый эндогенный контроль) и cel-miRNA-39-3р (экзогенный дополнительный контроль) и относительное кратное изменение каждой протестированной cfa-miRNA у собак групп ОГ и ХАГ по сравнению с соответствующими здоровыми контролями определяли с использованием метода 2-ΔΔCt. Тесты доказали, что cfa-miRNA-122 при относительном кратном изменении ≥ 1, 79 является диагностическим для ОГ и диагностическим для ХАГ при относительном кратном изменении ≥ 1, 64, cfa-miRNA-21 при относительном кратном изменении ≥ 1,51 является диагностическом маркером для ХАГ. Изобретение позволяет использовать выбранные сывороточные cfa-miRNA-122 и -21 в качестве новых неинвазивных диагностических биомаркеров для дифференциации ОГ от ХАГ с высокой чувствительностью и специфичностью и для раннего прогнозирования фиброза печени, ведущего к циррозу.
Результаты изобретения могут быть использованы для ранней дифференциальной диагностики между ОГ и ХАГ у собак, что может быть полезно для мониторинга результатов лечения собак с первичным гепатитом, либо для разработки эффективных терапевтических средств с использованием анти-miRNA, либо для раннего прогнозирования фиброза печени у собак с ХАГ до его прогрессирования в цирроз. Следовательно, не возникает потребности в использовании менее чувствительных методов диагностики визуализации (УЗИ и КТ) и инвазивных биопсий печени, которые имеют потенциальные риски осложнений.
Первичный гепатит (ПГ) является одним из наиболее часто диагностируемых паренхиматозных заболеваний печени у собак, и их наиболее часто определяемыми формами являются острый (ОГ) и хронический (ХАГ) гепатоцеллюлярный апоптоз или некроз с высокой распространенностью хронической формы, для которой фиброз печени является определяющим (Bayton, W., Watson, P. J., Bexfield, N. Η. Prednisolone therapy for chronic hepatitis in English springer spaniels: a prospective study of 12 cases. Veterinary Record, 2020; 105642). Часто ПГ являются причиной заболеваемости и летальности среди различных пород собак, включая Лабрадор ретривера, английского кокер спаниеля, доберман пинчера, шотландского терьера и бедлингтон терьера (Bexfield, Ν. Η., Buxton, R. J., Vicek, T. J., Day, M. J., Bailey, S. M., Haugland, S. P., Watson, P. J. Breed, age and gender distribution of dogs with chronic hepatitis in the United Kingdom. The Veterinary Journal, 2012, 193(1), 124-128; Ватников Ю.А., Куликов E.B., Попова И.А., Сахно Н.В., Петряева А.В., Лыхина B.C., Газин А.А. Изменение клинических и биохимических показателей крови при хроническом гепатите у собак. Вестник Красноярского государственного аграрного университета, 2018, 2(137), 62-69).
Фактически, клинические признаки обычно не информативны в большинстве случаев с первичным гепатитом, за исключением фиброза или цирроза печени на конечной стадии (DAVIES, D. Common inflammatory liver diseases in the dog (part 1). Vet. Ireland J, 2016, 6: 556-6; Eman SR, Kubesy AA, Baraka ТА, Torad FA, Shaymaa IS, Mohammed FF. Evaluation of hepatocyte-derived microRNA-122 for diagnosis of acute and chronic hepatitis of dogs. Veterinary World. 2018; ll(5):667-673; Webster, C. R., Center, S. Α., Cullen, J. M, Penninck, D. G., Richter, K. P., Twedt, D. C, & Watson, P. J. (2019). ACVIM consensus statement on the diagnosis and treatment of chronic hepatitis in dogs. Journal of veterinary internal medicine, 33(3), 1173-1200). Неинвазивные стандартные биомаркеры печени объективны для диагностики и мониторинга печеночных некровоспалительных изменений при остром и хроническом гепатите, однако при ней невозможно выявить раннее отложение компонентов фибриллярного внеклеточного матрикса (коллагены типа I и типа III) и прогрессирующее рубцевание печени в связи с гепатоцеллюлярным повреждением или воспалением (Eulenberg V, Lidbury J. Hepatic Fibrosis in Dogs. Journal of Veterinary Internal Medicine. 2017; 32(1):26-41; Raghu C, Ekena J, Cullen JM, Webb CB, Trepanier LA. Evaluation of potential serum biomarkers of hepatic fibrosis and necroinflammatory activity in dogs with liver disease. Journal of Veterinary Internal Medicine. 2018; 32(3):1009-1018).
С другой стороны, УЗИ брюшной полости не является точным инструментом для распознавания или дифференциации различных легких форм первичного гепатита и эффективно только на поздних стадиях заболевания (Murakami Τ, Feeney DA, Bahr KL. Analysis of clinical and ultrasonographic data by use of logistic regression models for prediction of malignant versus benign causes of ultrasonographically detected focal liver lesions in dogs. Am J Vet Res 2012; 73 (6):821-829; Мезикова, Ε.Α., Завадовская, В.Д., Белобородова, Е В., Долгалев, И.В., Тонких, О.С. Перфузионная мультисрезовая компьютерная томография гепатолиенальной зоны у больных диффузными заболеваниями печени. Фарматека, 2019, 26(2), 42-47). Острый гепатит гистологически характеризуется гепатоцеллюлярным апоптозом или некрозом, связанным с инфильтрацией смешанных воспалительных клеток в ткани печени (Eman SR, Kubesy АА, Baraka ТА, Torad FA, Shaymaa IS, Mohammed FF. Evaluation of hepatocyte-derived microRNA-122 for diagnosis of acute and chronic hepatitis of dogs. Veterinary World. 2018; 11(5):667-673; Meunier, L., Meszaros, M., Pageaux, G. P., Delay, J. M., Herrero, Α., Pinzani, V., Dominique, Η. B. (2020). Acute liver failure requiring transplantation caused by ulipristal acetate. Clinics and Research in Hepatology and Gastroenterology. 2020; 44 (3): e45-e49). Гистологические признаки хронического гепатита у собак включают искажение дольчатого рисунка, инфильтрацию мононуклеарных клеток (лимфоцитов и клеток Купфера), гепатоцеллюлярный некроз, апоптоз и фиброз (Eman SR, Kubesy АА, Baraka ТА, Torad FA, Shaymaa IS, Mohammed FF. Evaluation of hepatocyte-derived microRNA-122 for diagnosis of acute and chronic hepatitis of dogs. Veterinary World. 2018; 11(5):667-673; Bexfield, N. (2020). Canine Inflammatory Liver Disease. Clinical Small Animal Internal Medicine, 695-704 Ватников, Ю. Α., Куликов, Ε. В., Попова, И. Α., и др. Изменение клинических и биохимических показателей крови при хроническом гепатите у собак. Вестник Красноярского государственного аграрного университета, 2018; 2 (137):62-69). Следовательно, гистологическое исследование печени в настоящее время является единственным средством диагностики степени поражения печени (Poldervaart, J.H., Favier, R.P., Penning, L.C. et al. Primary hepatitis in dogs: A retrospective review (2002-2006). Journal of Veterinary Internal Medicine, 2009, 23(1), 72-80; Favier, R. P., Poldervaart, J. Η., van den Ingh, T. S., et al. A retrospective study of oral prednisolone treatment in canine chronic hepatitis.
VeterinaryQuarterly, 2013, 33, 113-120), но, несмотря на это, не может использоваться регулярно, поскольку является инвазивным и дорогостоящим (Cadranel, J. F., Rufat, P., Degos, F. Practices of liver biopsy in France: results of a prospective nationwide survey. Hepatology, 2000, 32(3), 477-481). Таким образом, выявление неинвазивных сывороточных биомаркеров, которые могут точно диагностировать степень воспалительной активности печени и фиброза на ранней стадии, необходимо в ранней дифференции ОГ и ХАГ (Li, S., Zhu, J., Fu, Η., Wan, J., et al. Hepato-specific microRNA-122 facilitates accumulation of newly synthesized miRNA through regulating PRKRA. Nucleic Acids Research, 2012, 40(2), 884-891), следовательно, предотвращение поздней диагностики и плохого прогноза после необратимого фиброза и цирроза печени.
Зрелые микроРНК (miRNA) представляют собой класс коротких некодирующих молекул РНК (приблизительно 18-25 нуклеотидов в длину), которые действуют как важные регуляторы посттранскрипционной экспрессии генов в различных физиологических и патологических путях, связанных с окислительным стрессом печени, апоптозом, некрозом и фиброзом (Szabo G, Bala S. MicroRNAs in liver disease. Nat Rev Gastroenterol Hepatol. 2013, 10, 542-552). Недавние исследования показали, что концентрации miRNA в сыворотке и тканях значительно коррелируют.Таким образом, miRNA превратились в стабильные и чувствительные неинвазивные диагностические биомаркеры крови при различных повреждениях печени (Dirksen K, Verzijl Τ, van den Ingh TS et al. Hepatocyte-derived microRNAs as sensitive serum biomarkers of hepatocellular injury in Labrador retrievers. Vet J. 2016, 211, 75-81). Исследования, посвященные воспалительному поражению печени у людей (Schueller F, Roy S, Vucur Μ et al. The role of miRNAs in the pathophysiology of liver diseases and toxicity. Int J Mol Sci. 2018, 19, 261) и гепатобилиарные заболевания у собак (Dirksen K, Verzijl Τ, van den Ingh TS et al. Hepatocyte-derived microRNAs as sensitive serum biomarkers of hepatocellular injury in Labrador retrievers. Vet J. 2016, 211, 75-81) Было выявлено, что профилирование сывороточной miRNA может использоваться в качестве ценного диагностического, прогностического и прогностического инструмента в отношении степени гистологических аномалий печени. В настоящее время miRNA-122 представляет 70% всех miRNA в печени, и она играет точную роль в регуляции воспаления, некроза и стеатоза печени, следовательно, циркулирующая miRNA-122 может быть ранним специфическим и чувствительным биомаркером сыворотки для определения степени воспаления печени (Dirksen K, Verzijl Τ, Grinwis G, Favier R, Penning L, Burgener I, Laan LVD, Fieten H, Spee B. Use of Serum MicroRNAs as Biomarker for Hepatobiliary Diseases in Dogs. Journal of Veterinary Internal Medicine. 2016; 30(6): 1816-1823). Недавние исследования определили miRNA-21 как одну из основных движущих сил для прогрессирования повреждения печени в фиброз, поскольку она косвенно активирует HSC для синтеза ЕСМ (коллагена tpe I и III) через активацию TGF-β1 / Smads, ERK, PTEN / Akt и сигнальные пути NF-κΒ (Нао XJ, Xu CZ, Wang JT et al. miR-21 promotes proliferation and inhibits apoptosis of hepatic stellate cells through targeting PTEN/PI3K/AKT pathway. J Recept Signal Transduct Res. 2018, 38, 455-461: Huang Q, Zhang X Bai F et al. Methyl helicterte ameliorates liver fibrosis by regulating miR-21-mediated ERK and TGF-β1/Smads pathways. Int Immunopharmacol. 2019, 66, 41-51).
Анализ уровня техники показал, что никакие предыдущие аналоги не были связаны с использованием cfa-miRNA специфичных для собак в качестве биомаркеров сыворотки крови для ранней диагностики и дифференциации ОГ и ХАГ у собак с первичным гепатитом которые могут улучшить раннее прогнозирование фиброза печени у собак с ХАГ до его развития в цирроз, в то время как следующие непатентные документы в некоторых аспектах аналогичны заявленному нами:
1 - Способ дифференциальной диагностики острого и хронического гепатита у собак с использованием сывороточных miRNA в качестве нового молекулярного диагностического биомаркера (Eman SR, Kubesy АА, Baraka ТА, Torad FA, Shaymaa IS, Mohammed FF. Evaluation of hepatocyte-derived microRNA-122 for diagnosis of acute and chronic hepatitis of dogs. Veterinary World. 2018; 11(5):667-673). Авторы предложили измерять сывороточные концентрации miRNA-122 в качестве нового биомаркера для ранней диагностики и дифференциальной острого и хронического гепатита собак. Дана оценка miRNA-122 в качестве биомаркера ОГ и ХАГ, а относительное кратное изменение miRNA было оценено с использованием метода 2-ΔΔCt, но уровни экспрессии были нормализованы с использованием только эндогенных контрольных эталонных генов (GAPDH) без проверки. Это неприемлемо, поскольку согласно справочнику Qiagen miScript PCR Array и другим предыдущим исследованиям (Hellemans J, Vandesompele J. Selection of reliable reference genes for RT-qPCR analysis. In Quantitative Real-Time PCR. Humana Press, New York, N.2014, pp.19-26; Wang X, Fu Y, Ban L, Wang Z, Feng G, Li J, Gao H. Selection of reliable reference genes for quantitative realtime RT-PCR in alfalfa. Genes & genetic systems. 2015. 90, 175-180): Для получения точных и воспроизводимых результатов количественной оценки miRNA с помощью ПЦР в реальном времени необходимо нормализовать количество тестируемой miRNA с помощью подходящей эндогенной и экзогенной эталонной РНК, чтобы нейтрализовать влияние биологических различий. Кроме того, miRNAs-122 оценивали с использованием последовательности праймеров, полученной из литературы, основанной на исследованиях на людях и не специфичной для собак (cfa - canine familiaris).
2 - Способ раннего выявления субклинических гепатоцеллюлярных повреждений у лабрадоров-ретриверов с использованием сывороточной miRNA-122 в качестве высокочувствительного нового биомаркера (Dirksen K, Verzijl Τ, van den Ingh Τ S G et al. Hepatocyte-derived microRNAs as sensitive serum biomarkers of hepatocellular injury in Labrador retrievers. Vet J. 2016, 211, 75-81) в дополнение к методу исследования ассоциации сывороточных miRNA-122 и -29а со стадией фиброза и прогрессированием хронического гепатита у лабрадоров-ретриверов (Sakai Μ, Spee В, Grinwis GC et al. Association of circulating microRNA-122 and microiRNA-29a with stage of fibrosis and progression of chronic hepatitis in Labrador Retrievers. J Vet Intern Med. 2019, 33, 151-157). В этих методах только miRNA-122 была оценена для дифференциации острого и хронического гепатита только у одной породы собак (Лабрадор ретривер). Также в этом методе проверенный уровень экспрессии miRNA был нормализован с использованием только cel-miRNA-39-Зр в качестве экзогенных эталонных генов (spike-in control).
3- Метод дифференциальной диагностики гепатобилиарных заболеваний у собак с использованием сывороточных miRNA в качестве нового биомаркера (Dirksen K, Verzijl Τ, Grinwis, GC et al. Use of Serum MicroRNAs as Biomarker for Hepatobiliary Diseases in Dogs. J Vet Intern Med. 2016, 30, 1816-1823). Авторы предложили измерять сывороточные концентрации miRNA-122 и -21 в качестве диагностических биомаркеров у собак с острым и хроническим гепатитом, а также у здоровых контрольных собак. Концентрация концентрации протестированных miRNA были количественно определены путем абсолютного количественного определения с помощью стандартной кривой, и все количества были нормализованы только для cel-miRNA-39-3р в качестве эталонных генов (экзогенный контроль с добавлением импульсов), выбранных из литературы, без проверки на конкретные условия. Кроме того, все протестированные miRNA оценивались с использованием последовательностей праймеров, полученных из литературы, основанной на исследованиях на людях и не специфичных для собак (cfa - canine familiaris).
Определяющими отличиями заявляемого способа, по сравнению с прототипом, являются:
1 - Способ основан на сравнении относительной экспрессии экспериментально выбранных cfa-miRNA-122 и -21 специфичных для собак, которые опосредуют различные гены и пути в гепатоцитах, а затем значительно повышаются в сыворотке крови в зависимости от степени дегенерации, некроза и фиброза печени у собак с первичным гепатитом. Это изобретение позволяет снизить стоимость, упростить и значительно ускорить процедуру тестирования для ранней диагностики ОГ и ХАГ, связанных с фиброзом печени до его прогрессирования в терминальную стадию цирроза без необходимости подтверждения диагноза с использованием опасной для жизни инвазивной биопсии.
2 - В заявленном способе, определение относительного уровня экспрессии cfa-miRNAs в образцах сыворотки осуществлялось с помощью ГЩР в реальном времени с использованием специфичных для собак прямого и обратного праймеров каждой измеренной miRNA и двух эталонных генов, включая cel-miRNA-39-3р (экзогенный контроль с добавлением импульсов), и cfa-miRNA-16 (стабильно экспрессируемый эндогенный контроль), которая была отобрана и подтверждена, поскольку она стабильно транскрибируется среди четырех исследованных кандидатов на эндогенные референсные гены (SNORD61-1, RNU6-2, SNORD95-1 и miRNA-16) на основе на результат анализа программного обеспечения NormFinder и geNorm, что увеличивает точность, специфичность и чувствительность процедур тестирования.
3 - В этом способе, собаки с подозрением на поражение печени и здоровые контрольные собаки были предварительно идентифицированы на основе наблюдаемых клинических признаков, биохимических изменений в сыворотке крови и УЗИ брюшной полости, после чего тип патологии печени был точно идентифицирован и подтвержден как ОГ или ХАГ путем гистологического исследования собранной печени биопсии с использованием стандартной окраски гематоксилином и эозином. Кроме того, краситель Picrosirus Red использовался для выявления случаев фиброза путем окрашивания в красный цвет волокон соединительной ткани (коллаген типов I и III) в исследованных биопсиях печени в группе ХАГ.
Предварительные исследования показали, что cfa-miRNA-122 и -21 значительно экспрессировались в сыворотке крови в корреляции с типом гистологических изменений печени у собак с ОГ или ХАГ с высокой чувствительностью и специфичностью.
Техническим результатом заявленного изобретения является создание новых эффективных, специфичных для печени неинвазивных диагностических биомаркеров на основе генов для ранней диагностики и дифференциации ОГ и ХАГ с высокой чувствительностью и специфичностью у собак с первичным гепатитом, которые могут быть использованы для мониторинга результатов лечения собак с гепатитом, для разработки эффективных терапевтических средств с использованием анти-miRNAs, либо для раннего прогнозирования фиброза печени у собак с ХАГ, до его прогрессирования в цирроз, без проведения биопсии печени.
Технический результат достигается на основе анализа относительной экспрессии cfa-miRNAs-122 и-21 в сыворотке, а также путем выделения общей РНК из образцов сыворотки собак, гистологически подтвержденных как пораженные ОГ или ХАГ, затем обратная транскрипция с последующей амплификацией в ПЦР в реальном времени (RT-PCR) с использованием праймеров, специфичных для собак, для cfa-miRNA-122-5р и cfa-miRNA-21-5р. Все анализы применяли в трех экземплярах для каждого образца, и полученный средний порог цикла (Ct) каждой тестируемой микроРНК был нормализован относительно среднего Ct cfa-miRNA-16 (стабильно экспрессируемый эндогенный контроль) и cel-miRNA-39-3р (экзогенный контроль всплеска), чтобы получить ΔCt, используя следующее уравнение ΔCt = cfa_miRNA(интересующий маркер) - 0.5 × (Ct cel miRNA_39+Ct miRNA_16), а затем полученный ΔCt использовали для определения относительного кратного изменения каждой протестированной cfa-miRNA в группах ОГ или ХАГ по сравнению с соответствующими здоровыми контролями с использованием метода 2-ΔΔCt. Согласно наблюдаемым гистологическим критериям, ПЦР в реальном времени доказала, что при относительном кратном изменении cfa-miRNA-122 ≥ 1,79 диагностируют острый гепатит, при относительном кратном изменении cfa-miRNA-122 ≥ 1,64 диагностируют хронический активный гепатит, при относительном кратном изменении cfa-miRNA-21 ≥ 1,51 диагностируют наличие хронического активного гепатита и фиброза печени у собак. Следовательно, гистологическое присутствие ОГ может быть легко идентифицировано, когда cfa-miRNA-122 активируется только в сыворотке, в то время как ХАГ идентифицируется, когда обе cfa-miRNA-122 и -21 активируются в сыворотке собак с клиническими признаками и биохимические изменения сыворотки, указывающие на печеночную недостаточность.
Заявленный способ осуществляется следующим образом: После ультразвукового и гистологического исследования каждой собаки с подозрением на заболевание печени и здоровых контрольных собак образцы крови брали через головную вену у каждой собаки, а затем отделяли сыворотку и хранили при -80°С в отсутствие циклов замораживания-оттаивания до анализ cfa-miRNAs. Общая РНК, включая представляющие интерес miRNA, была выделена из каждого образца с использованием QIAzol Lysis Reagent в составе набора miRNeasy для сыворотки / плазмы (Qiagen®, Германия) в соответствии с инструкциями производителя. Для измерения эффективности выделения РНК 3,5 мкл синтетической miRNA-39 Caenorhabditis elegans (Qiagen®, Германия) добавляли в качестве дополнительного контроля к каждому образцу денатурированной сыворотки из расчета 1,6 × 108 копий / мкл рабочего раствора. В конце концор, концентрация и чистота выделенных образцов РНК были оценены путем измерения их оптической плотности при 280 нм с помощью ΝΑΝΟ photometer® NP80 (Германия), и отношения РНК (А260:А280), превышающие и/или равные 1,6, были включены в наше расследование. Выделенную РНК из каждого образца подвергали обратной транскрипции с использованием набора miScript II RT (Qiagen®, Германия) для получения комплементарной ДНК (кДНК) согласно инструкциям производителя. После этого для определения относительной экспрессии выбранных cfa-miRNA-122 и-21, а также экзогенного (cel-miRNA-39) и эндогенного эталонных генов (miRNA-16) была проведена RT-PCR на CFX-96 система® обнаружения ПЦР в реальном времени (Bio-Rad, США) с использованием разбавленной кДНК и набора miScript SYBR Green PCR (Qiagen®, Германия) согласно miScript-PCR- Система-справочник. Условия реакции ПЦР-амплификации были: 1 цикл начальной денатурации при 95°С в течение 15 минут и 45 циклов трехступенчатой ПЦР, включая 15 секунд денатурации при 94°С, фазу отжига при 55°С в течение 30 секунд и затем фазу элонгации в течение 30 секунд при 70°С. Все анализы применяли в трех экземплярах для каждого образца, и средний пороговый цикл (Ct) оценивали и использовали в последующем анализе. Наконец, полученные с помощью ПЦР значения Ct каждой протестированной cfa-miRNA были нормализованы относительно cfa-miRNA-16 в качестве эндогенного эталонного гена (из-за их относительно стабильной экспрессии), и cel-miRNA-39 в качестве экзогенного синтетического эталонного гена (добавленного во время выделения РНК) для получения ΔCt с использованием следующего уравнения: ΔCt = cfa_miRNA(интересующий маркер) - 0.5 × (Ct cel miRNA_39 + Ct miRNA_16), а затем все данные были относительно выражены как кратное изменение по сравнению с контролями с использованием сравнительного метода Ct (метод 2-ΔΔCt). Специфические прямые праймеры к интересующим cfa-miRNA, а также эндогенный референсный ген были разработаны и синтезированы компанией Evrogen (Москва, Россия) с использованием баз данных MirBase, NCBI GenBank и программы Primer-BLAST (http://www.mirbase.org/index.shtml) как показано в таблице (1), в то время как специфический прямой праймер cel-miRNA-39 и универсальный обратный праймер уже были включены в коммерчески приобретенные наборы (Qiagen®, Германия).

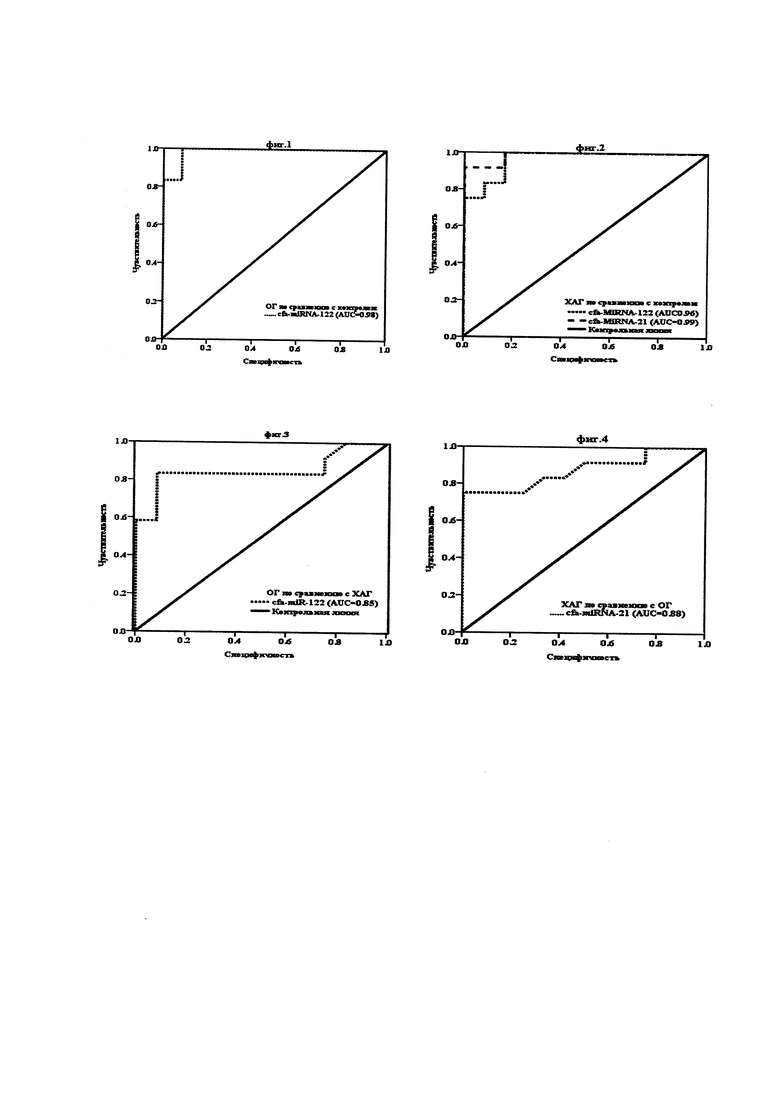
Диагностическая ценность дифференциально экспрессируемых cfa-miRNA-122 и-21 для ранней диагностики и дифференциации между ОГ и ХАГ и прогнозирования фиброза печени у собак с ХАГ с высокой чувствительностью и специфичностью была определена путем расчета площади под кривой ошибок (AUC-ROC) и пороговые значения для получения оптимального процента чувствительности и специфичности. Было показано, что cfa-miRNA-122 достоверно экспрессировалась в сыворотке крови собак с ОГ (среднее кратное изменение=9,48, Ρ < 0,001) или с ХАГ (среднее кратное изменение = 4,94, Ρ < 0,01) по сравнению с контрольной группой, и выражали диагностический потенциал для дифференциации групп ОГ и ХАГ от здоровых контролей (фиг. 1, 2) с AUC 0,98 (Р < 0,0001) и 0,96 (Р < 0,001), соответственно, с высокой чувствительностью и специфичностью (91,7 и 91,7% при изменении отсечки в 1,79 раза), (83,3 и 91,7% при изменении отсечки в 1,64 раза) соответственно. При AUC 0,85 cfa-miR-122 проявляет потенциальную роль (Р < 0,01) в дифференциации ОГ от группы ХАГ с чувствительностью 83,3% и специфичностью 91,7% при изменении отсечки в 6,46 раза (фиг. 3). Принимая во внимание, что cfa-miR-21 был значительно (Р < 0,001) повышен только в сыворотке крови собак в группе ХАГ (среднее кратное изменение = 10,57) и при AUC 0,99 (Р < 0,0001, при отсечении 1,51-кратного изменения) и при AUC 0,88 (Р < 0,01, при отсечении 1,84-кратного изменения) показали потенциальную роль в дифференциации группы ХАГ от контроля (фиг. 2) и групп ОГ (фиг. 4), соответственно, с высокой чувствительностью (83,3 и 100%).) и специфичность (85% и 91,7%) соответственно.
Чтобы доказать диагностическую ценность предложенного метода, мы исследовали сорок пять принадлежащих клиентам собак разных пород, веса тела, пола и возраста в Инновационном ветеринарном центре (ИВЦ МВА) Московской государственной академии ветеринарной медицины и биотехнологии, Москва, Россия, в период с октября 2018 г.по сентябрь 2019 г. У тридцати собак был подтвержден первичный гепатит, когда все подозреваемые случаи были представлены в нашу клинику с повышенными гепатобилиарными ферментами, аномальной эхогенностью печени при ультразвуковом исследовании, а также гистологическими аномалиями, такими как апоптоз печени и некровоспаление у собак группы ОГ или фиброз у собак группы ХАГ. Для сравнения в качестве контрольной группы случайным образом были выбраны пятнадцать здоровых собак с нормальным биохимическим анализом крови вместе с ничем не примечательными результатами ультразвукового исследования печени и гистологическими данными во время периодического осмотра. Cfa-miRNAs -122 и -21 были определены в сыворотке крови, чтобы исследовать его эффективность в качестве биомаркеров сыворотки для ранней диагностики и дифференциации ОГ и ХАГ у собак с первичным гепатитом, что облегчает раннее прогнозирование фиброза печени у собак с ХАГ до его прогрессирования в опасный для жизни цирроз печени.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ диагностики патологий печени у собак с использованием cfa-miRNAs | 2020 |
|
RU2758950C1 |
| СПОСОБ ЛЕЧЕНИЯ СОБАК, БОЛЬНЫХ ЭНДОКАРДИОЗОМ МИТРАЛЬНОГО КЛАПАНА | 2020 |
|
RU2745653C1 |
| СПОСОБ ЛЕЧЕНИЯ СОБАК С ВНУТРИПЕЧЁНОЧНЫМИ СОСУДИСТЫМИ ШУНТАМИ С ИСПОЛЬЗОВАНИЕМ УНИВЕРСАЛЬНОГО КАВА-ФИЛЬТРА И ЭМБОЛИЗИРУЮЩИХ СПИРАЛЕЙ | 2018 |
|
RU2717074C1 |
| СПОСОБ РАСЧЕТА РАЗМЕРОВ ЭНДОТРАХЕАЛЬНОГО СТЕНТА ДЛЯ ЛЕЧЕНИЯ СОБАК ДЕКОРАТИВНЫХ ПОРОД С КОЛЛАПСОМ ТРАХЕИ | 2017 |
|
RU2652062C1 |
| СПОСОБ ВЫПОЛНЕНИЯ ДОРСАЛЬНОЙ ЛАМИНЭКТОМИИ С СОХРАНЕНИЕМ ОСТИСТЫХ, СУСТАВНЫХ ОТРОСТКОВ И НАДОСТИСТОЙ СВЯЗКИ У СОБАК | 2024 |
|
RU2840361C1 |
| Способ дифференциальной диагностики хронического гепатита В, хронического гепатита С и аутоиммунных заболеваний печени у пациентов с тяжелым фиброзом и циррозом печени | 2024 |
|
RU2834902C1 |
| СПОСОБ ПРЕДУПРЕЖДЕНИЯ ВОЗНИКНОВЕНИЯ ОКСИДАТИВНОГО СТРЕССА ПРИ ИСПОЛЬЗОВАНИИ ИНСЕКТИЦИДНОГО СРЕДСТВА ПУТЕМ ДОПОЛНИТЕЛЬНОГО ПРИМЕНЕНИЯ ВИТАМИНА Е И СЕЛЕНА | 2022 |
|
RU2788470C1 |
| Способ дифференциальной диагностики хронического гепатита В и аутоиммунных заболеваний печени у пациентов с тяжелым фиброзом и циррозом печени | 2024 |
|
RU2834900C1 |
| Способ дифференциальной диагностики хронического гепатита С и аутоиммунных заболеваний печени у пациентов с тяжелым фиброзом и циррозом печени | 2024 |
|
RU2834898C1 |
| СПОСОБ ДИАГНОСТИКИ КРОВИ НА НАЛИЧИЕ ПАРАЗИТАРНЫХ ЗАБОЛЕВАНИЙ ПО ИЗМЕНЕНИЮ ЛЕЙКОГРАММЫ ПОСЛЕ УЛЬТРАЗВУКОВОГО ВОЗДЕЙСТВИЯ | 2015 |
|
RU2623860C2 |
Изобретение относится к области ветеринарии и биотехнологии, в частности к молекулярной гепатологии. Предложен способ дифференциальной диагностики между острым гепатитом (ОГ) и хроническим активным гепатитом (ХАГ), а также раннего прогнозирования фиброза печени у собак с ХАГ. Проводят анализ экспрессии cfa-miRNA-122 и -21 в сыворотке крови собак с первичным гепатитом. Анализы применяют в трех экземплярах для каждого образца, и полученный средний порог цикла (Ct) каждой тестируемой микроРНК нормализуют относительно среднего Ct cfa-miRNA-16 и cel-miRNA-39-3р, чтобы получить ΔCt. При экспрессии cfa-miRNA-122≥1,79 диагностируют острый гепатит. При экспрессии cfa-miRNA-122≥1,64 и экспрессии cfa-miRNA-21≥1,51 диагностируют наличие хронического активного гепатита и фиброза печени у собак. Изобретение обеспечивает создание новых эффективных, специфичных для печени неинвазивных диагностических биомаркеров на основе генов для ранней диагностики и дифференциации ОГ и ХАГ с высокой чувствительностью и специфичностью у собак с первичным гепатитом. 4 ил., 1 табл.
Способ дифференциальной диагностики между острым гепатитом (ОГ) и хроническим активным гепатитом (ХАГ), а также раннего прогнозирования фиброза печени у собак с ХАГ, основанный на анализе экспрессии cfa-miRNA-122 и -21 в сыворотке крови собак с первичным гепатитом, а также путем выделения общего РНК из образцов сыворотки больных собак, включающий обратную транскрипцию с последующей амплификацией в RT-PCR с использованием праймеров, специфичных для собак, включая:
cfa-miRNA-122 5р: 5'CAAACACCATTGTCACACTCCA'3,
cfa-miRNA-21-5p: 5'TCAACATCAGTCTGATAAGCTA'3,
cfa-miRNA-16-5р: 5'CGCCAATATTTACGTGCTGCTA'3,
при этом анализы применяют в трех экземплярах для каждого образца, и полученный средний порог цикла (Ct) каждой тестируемой микроРНК нормализуют относительно среднего Ct cfa-miRNA-16 и cel-miRNA-39-3р, чтобы получить ΔCt, используют следующее уравнение: ΔCt=cfa_miRNA-0,5×(Ct cel miRNA_39+Ct miRNA_16), затем полученный ΔCt используют для определения экспрессии каждой протестированной cfa-miRNA в группах ОГ или ХАГ по сравнению с соответствующими здоровыми контролями с использованием метода 2-ΔΔCt, и при экспрессии cfa-miRNA-122≥1,79 диагностируют острый гепатит, при экспрессии cfa-miRNA-122≥1,64 и экспрессии cfa-miRNA-21≥1,51 диагностируют наличие хронического активного гепатита и фиброза печени у собак.
| ЖАТКА ДЛЯ ОЧЕСА КОЛОСА, ПРЕИМУЩЕСТВЕННО МЕЛКОСЕМЯННЫХ КУЛЬТУР | 2013 |
|
RU2530157C1 |
| КРАСНОЛОБОВА Е.П | |||
| Клинико-морфологические проявления гепатопатий собак в условиях города Тюмени | |||
| Автореф | |||
| дисс | |||
| канд | |||
| вет | |||
| наук | |||
| Омск, 2015, 18 c | |||
| DIRKSEN K | |||
| et al | |||
| Use of Serum MicroRNAs as Biomarker for Hepatobiliary Diseases in Dogs | |||
| J Vet Intern Med | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| EMAN S.R | |||
| et al | |||
| Evaluation of | |||
Авторы
Даты
2022-03-23—Публикация
2021-03-23—Подача