Область техники
[0001]
Настоящее изобретение относится к гетероциклическому соединению, обладающему антагонистической активностью по отношению к кальцийчувствительному рецептору и применимому в качестве средства для профилактики или лечения сердечной недостаточности, легочной гипертензии или тому подобного.
Уровень техники
[0002]
Сердечная недостаточность представляет собой заболевание, характеризующееся состоянием, при котором сердечный выброс снижается из–за дисфункции кардиомиоцитов, и состоянием, возникающим в результате нагрузки на организм, вызванной механизмами поддержания сердечного выброса. Функция кардиомиоцитов заключается в сокращении и расслаблении, а для сокращения и расслабления требуются ионы Ca2+. Сокращение кардиомиоцитов генерируется стадией, где потенциал действия передается в поперечную трубочку и мембрана поперечной трубочки деполяризуется; стадией, на которой ионы Ca2+ поступают из потенциал–зависимого Ca2+ канала L–типа поперечной трубочки в клетку; и стадией, на которой поступающие ионы Ca2+ связываются с каналами высвобождения Ca2+ (рианодиновые рецепторы или RYR) саркоплазматического ретикулума для высвобождения ионов Ca2+ из саркоплазматического ретикулума в цитоплазму; и стадией, на которой ионы Ca2+, высвобождаемые в клетки, связываются с тропонином С, вызывая сокращение кардиомиоцитов. Кроме того, расслабление кардиомиоцитов генерируется путем включения ионов Ca2+ в саркоплазматический ретикулум Ca2+ (SERCA), которые уменьшают цитоплазматические ионы Ca2+ и отклоняют ионы Ca2+ от тропонина C. Если аномалия возникает на любой из вышеперечисленных стадий и ионы Ca2+ не выделяются в цитоплазму, кардиомиоциты вызывают дисфункцию, приводящую к сердечной недостаточности.
[0003]
В качестве терапии сердечной недостаточности, например, бета–блокаторы, анти–альдостероновые препараты, диуретики, дигиталис и кардиотоники используются в клинических условиях для улучшения краткосрочных симптомов и стабилизации гемодинамики. Однако эти терапевтические средства недостаточны для улучшения показателей реадмиссии или отдаленного прогноза. Таким образом, в последние годы желательны новые терапевтические средства при сердечной недостаточности, которые улучшают показатели реадмиссии и отдаленный прогноз.
[0004]
Легочная гипертензия представляет собой заболевание с очень плохим прогнозом, при котором давление в легочной артерии увеличивается из–за аномальной пролиферации, ремоделирования и сокращения сердечной мышцы или сосудистых тканей легких, и по мере прогрессирования заболевания возникает сердечная недостаточность, ведущая к смерти. Основные терапевтические средства, используемые при легочной гипертензии, включают антагонисты рецепторов эндотелина, ингибиторы фосфодиэстеразы 5, аналоги простациклина, стимуляторы растворимой гуанилатциклазы (sGC). Эти терапевтические средства улучшают некоторые симптомы, но прогноз остается плохим. В последние годы было установлено, что в патогенезе этого заболевания участвуют несколько молекул. Поскольку эффекты только существующих лекарственных средств ограничены, является желательной разработка новых лекарственных средств.
[0005]
Кальцийчувствительные рецепторы (CaSR) представляют собой рецепторы, сопряженные с G–белком (GPCR), которые определяют изменения концентрации внеклеточного кальция и, как известно, связаны с различными заболеваниями.
[0006]
В патентной литературе 1 описаны гетероциклические соединения или их соли, представленные формулами ниже. В этой литературе также описано, что эти соединения или их соли обладают контролирующим действием на кальцийчувствительный рецептор (CaSR) (агонистическая активность или антагонистическая активность) и, таким образом, действием по контролю секреции паратиреоидного гормона (PTH).
[0007]
[Формула 1]
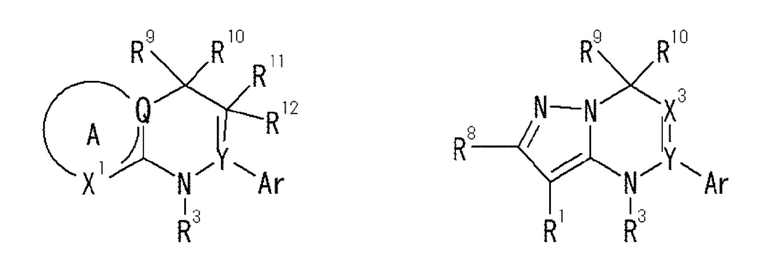
[0008]
В патентной литературе 2 описаны соединения или их соли, представленные формулой ниже. В этой литературе также описано, что эти соединения или их соли обладают контролирующим действием на кальцийчувствительный рецептор (CaSR) (агонистическая активность или антагонистическая активность) и, таким образом, действием по контролю секреции паратиреоидного гормона (PTH).
[0009]
[Формула 2]
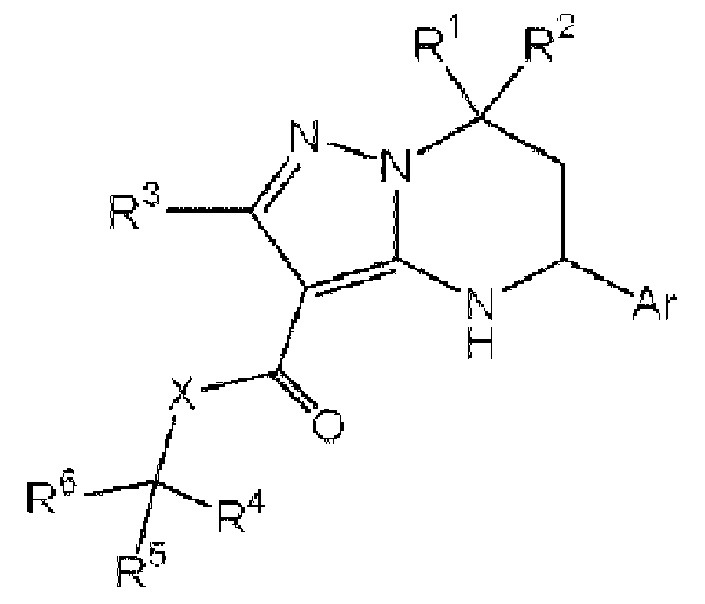
[0010]
В отношении сердечной недостаточности, в непатентной литературе 1 и 2 описано, что лечение паратиреоидного гормона улучшает сердечную функцию, в то время как в непатентной литературе 3 описано, что лечение паратиреоидного гормона ухудшает сердечную функцию. Таким образом, связь между лечением паратиреоидного гормона и улучшением сердечной функции еще не полностью выяснена.
[0011]
В непатентной литературе 4 описано, что ингибитор CaSR Calhex231 улучшает гипертрофию сердца в моделях бандажирования аорты (TAC), но эффект после гипофункции сердца не выяснен. В непатентной литературе 5 описан результат введения Calhex231 и показано, что введения Calhex231 после сердечной нагрузки не улучшает гипофункцию сердца. Кроме того, в патентной литературе 6 описано, что антагонисты CaSR сводят на нет кардиозащитные эффекты в моделях ишемического прекондиционирования. Таким образом, взаимосвязь ингибирования CaSR и улучшения сердечной гипофункции или выживаемости еще полностью не выяснена.
[0012]
В отношении легочной гипертензии недавно сообщалось, что в клетках гладких мышц легочной артерии (PASMC), выделенных от пациентов с легочной гипертензией, CaSR сверхэкспрессирован, и гиперактивность, таким образом, вызывает, например, аномальную пролиферацию сосудистых тканей легкого. Кроме того, сообщалось, что соединение NPS–2143, которое обладает антагонистической активностью в отношении CaSR, подавляет сердечную гипертрофию, повышенное систолическое давление в правом желудочке, фиброз сердечной мышечной ткани, ремоделирование легочных сосудов или тому подобное у крыс с монокроталин (MCT)–индуцированной легочной гипертензией и крыс с гипоксия–индуцированной легочной гипертензией (HPH) (непатентная литература 7–11). Однако медицинская потребность в терапевтических средствах для лечения легочной гипертензии все еще высока, и была желательна разработка лекарственного средства для профилактики или лечения легочной гипертензии, обладающего превосходными свойствами с точки зрения эффективности, специфичности и низкой токсичности.
Список цитированной литературы
Патентная литература
[0013]
Патентная литература 1:
WO 2004/017908
Патентная литература 2:
JP 2005–239611 A
Непатентная литература
[0014]
Непатентная литература 1:
Cardiovascular research, 77: 722–731, 2008
Непатентная литература 2:
Cardiovascular research, 93: 330–339, 2012
Непатентная литература 3:
Experimental and molecular medicine 42, 61–68, 2010
Непатентная литература 4:
Cell Physiol. Biochem., 36: 1597–1612, 2015
Непатентная литература 5:
Cell Physiol. Biochem., 33: 557–568, 2014
Непатентная литература 6:
Am. J. Physiol. Heart Circ. Physiol., 299: H1309–H1317, 2010
Непатентная литература 7:
Circ. Res., 111(4): 469–481, 2012
Непатентная литература 8:
Circ. Res., 112(4): 640–650, 2013
Непатентная литература 9:
YAKUGAKU ZASSHI, 133(12):1351–1359, 2013
Непатентная литература 10:
J. Smooth Muscle Res., 50: 8–17, 2014
Непатентная литература 11:
Hypertens Res. 37(2): 116–124, 2014
Сущность изобретения
Техническая задача
[0015]
Целью настоящего изобретения является предоставление соединения или его соли, обладающего антагонистической активностью по отношению к кальцийчувствительному рецептору и, как ожидается, пригодного в качестве средства для профилактики или лечения сердечной недостаточности, легочной гипертензии или тому подобного.
Решение задачи
[0016]
Авторы настоящего изобретения обнаружили, что соединение, представленное приведенной ниже формулой (1), или его соль обладает антагонистической активностью по отношению к кальцийчувствительному рецептору, и ожидается, что оно будет полезным в качестве средства для профилактики или лечения сердечной недостаточности, легочной гипертензии или тому подобное. На основании полученных данных авторы настоящего изобретения провели интенсивные исследования и, таким образом, осуществили настоящее изобретение.
[0017]
То есть настоящее изобретение заключается в следующем.
[1] Соединение, представленное формулой (I):
[Формула 3]
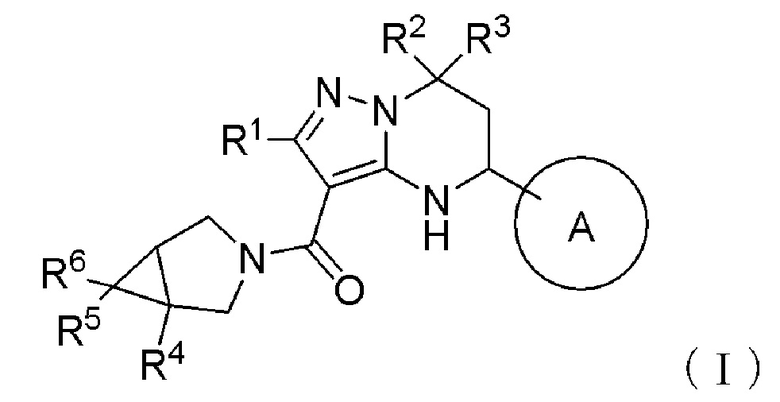
где
Кольцо А представляет собой необязательно дополнительно замещенное ароматическое кольцо;
R1 представляет собой атом водорода, необязательно замещенную алкильную группу, необязательно замещенную алкилтиогруппу или необязательно замещенную алкоксигруппу;
R2 и R3, каждый независимо, представляет необязательно замещенную алкильную группу, или R2 и R3 могут образовывать необязательно дополнительно замещенное кольцо вместе со смежным атомом углерода;
R4 представляет собой необязательно замещенную ароматическую кольцевую группу или необязательно замещенную алкильную группу;
R5 и R6, каждый независимо, представляет атом водорода или атом галогена,
или его соль (далее также называемое «соединение (I)»).
[2] Соединение или его соль по пункту [1], где кольцо А представляет собой бензольное кольцо.
[3] Соединение или его соль по пункту [1], где R1 представляет собой атом водорода.
[4] Соединение или его соль по пункту [1], где каждый из R2 и R3 представляет собой C1–6 алкильную группу.
[5] Соединение или его соль по пункту [1], где R4 представляет собой C6–14 арильную группу, 5– или 6–членную моноциклическую ароматическую гетероциклическую группу или C1–6 алкильную группу, каждая из которых необязательно замещена одним или двумя заместителями, выбранными из группы, состоящей из
(a) атома галогена,
(b) C1–6 алкильной группы, которая необязательно замещена одним–тремя атомами галогена, и
(c) C1–6 алкоксигруппы, которая необязательно замещена одним–тремя атомами галогена.
[6] Соединение или его соль по пункту [1], где R5 и R6, каждый независимо, представляет атом водорода или атом фтора.
[7] Соединение или его соль по пункту [1], где
Кольцо А представляет собой бензольное кольцо;
R1 представляет собой атом водорода;
каждый из R2 и R3 представляет собой C1–6 алкил;
R4 представляет собой C6–14 арильную группу, 5– или 6–членную моноциклическую ароматическую гетероциклическую группу или C1–6 алкильную группу, каждая из которых необязательно замещена одним или двумя заместителями, выбранными из группы, состоящей из
(a) атома галогена,
(b) C1–6 алкильной группы, которая необязательно замещена одним–тремя атомами галогена, и
(c) C1–6 алкоксигруппы, которая необязательно замещена одним–тремя атомами галогена;
R5 и R6, каждый независимо, представляет атом водорода или атом фтора.
[8] Соединение или его соль по пункту [1], где
Кольцо А представляет собой бензольное кольцо;
R1 представляет собой атом водорода;
каждый из R2 и R3 представляет собой C1–6 алкил;
R4 представляет собой фенильную группу, которая замещена одним или двумя заместителями, выбранными из группы, состоящей из
(a) атома галогена, и
(b) C1–6 алкильной группы, которая необязательно замещена одним–тремя атомами галогена; и
каждый из R5 и R6 представляет собой атом водорода.
[9] ((1S,5R)–1–(3,4–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон или его соль.
[10] (1–(3,5–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон или его соль.
[11] (1–(4–хлор–3–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон или его соль.
[12] Лекарственное средство, включающее соединение или его соль по пункту [1].
[13] Лекарственное средство по пункту [12], где лекарственное средство представляет собой антагонист кальцийчувствительного рецептора.
[14] Лекарственное средство по пункту [12], где лекарственное средство представляет собой средство для профилактики или лечения сердечной недостаточности.
[15] Лекарственное средство по пункту [12], где лекарственное средство представляет собой средство для профилактики или лечения легочной гипертензии.
[16] Соединение или его соль по пункту [1] для применения в профилактике или лечении сердечной недостаточности.
[17] Соединение или его соль по пункту [1] для применения в профилактике или лечении легочной гипертензии.
[18] Способ антагонизации кальцийчувствительного рецептора у млекопитающего, включающий введение млекопитающему эффективного количества соединения или его соли по пункту [1].
[19] Способ профилактики или лечения сердечной недостаточности у млекопитающего, включающий введение млекопитающему эффективного количества соединения или его соли по пункту [1].
[20] Способ профилактики или лечения легочной гипертензии у млекопитающего, включающий введение млекопитающему эффективного количества соединения или его соли по пункту [1].
[21] Применение соединения или его соли по пункту [1], для получения средства для профилактики или лечения сердечной недостаточности.
[22] Применение соединения или его соли по пункту [1], для получения средства для профилактики или лечения легочной гипертензии.
Положительные эффекты изобретения
[0018]
В соответствии с настоящим изобретением предоставлено соединение, обладающее антагонистической активностью по отношению к кальцийчувствительному рецептору, и, как ожидается, пригодное в качестве средства для профилактики или лечения сердечной недостаточности, легочной гипертензии или тому подобного.
Краткое описание чертежей
[0019]
Фиг. 1 представляет собой график, показывающий результат примера исследования 5 «Эффект соединения примера 1 на уровень выживаемости животной модели сердечной недостаточности», то есть уровни выживаемости каждой из группы введения носителя и группы введения соединения примера 1 (лог–ранговый критерий, р<0,025).
Фиг. 2 представляет собой график, показывающий результат примера исследования 5 «Эффект соединения примера 1 на уровень выживаемости животной модели сердечной недостаточности», то есть уровни выживаемости каждой из группы с моно–введением кандесартан цилексетила и группы совместного введения кандесартан цилексетила и соединения примера 1 при 10 мг/кг массы тела/день (лог–ранговый критерий, р <0,001).
[0020]
(Подробное описание изобретения)
Далее настоящее изобретение будет описано подробно.
[0021]
Определение каждого заместителя, используемого в настоящем описании, подробно описано ниже. Если не указано иное, каждый заместитель имеет следующее определение.
В настоящем описании примеры «атома галогена» включают фтор, хлор, бром и йод.
В настоящем описании примеры «C1–6 алкильной группы» включают метил, этил, пропил, изопропил, бутил, изобутил, втор–бутил, трет–бутил, пентил, изопентил, неопентил, 1–этилпропил, гексил, изогексил, 1,1–диметилбутил, 2,2–диметилбутил, 3,3–диметилбутил и 2–этилбутил.
В настоящем описании примеры «необязательно галогенированной C1–6 алкильной группы» включают C1–6 алкильную группу, необязательно имеющую от 1 до 7, предпочтительно, от 1 до 5, атомов галогена. Конкретные примеры включают метил, хлорметил, дифторметил, трихлорметил, трифторметил, этил, 2–бромэтил, 2,2,2–трифторэтил, тетрафторэтил, пентафторэтил, пропил, 2,2–дифторпропил, 3,3,3–трифторпропил, изопропил, бутил, 4,4,4–трифторбутил, изобутил, втор–бутил, трет–бутил, пентил, изопентил, неопентил, 5,5,5–трифторпентил, гексил и 6,6,6–трифторгексил.
В настоящем описании примеры «C2–6 алкенильной группы» включают этенил, 1–пропенил, 2–пропенил, 2–метил–1–пропенил, 1–бутенил, 2–бутенил, 3–бутенил, 3–метил–2–бутенил, 1–пентенил, 2–пентенил, 3–пентенил, 4–пентенил, 4–метил–3–пентенил, 1–гексенил, 3–гексенил и 5–гексенил.
В настоящем описании примеры «C2–6 алкинильной группы» включают этинил, 1–пропинил, 2–пропинил, 1–бутинил, 2–бутинил, 3–бутинил, 1–пентинил, 2–пентинил, 3–пентинил, 4–пентинил, 1–гексинил, 2–гексинил, 3–гексинил, 4–гексинил, 5–гексинил и 4–метил–2–пентинил.
В настоящем описании примеры «C3–10 циклоалкильной группы» включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, бицикло[2.2.1]гептил, бицикло[2.2.2]октил, бицикло[3.2.1]октил и адамантил.
В настоящем описании примеры «необязательно галогенированной C3–10 циклоалкильной группы» включают C3–10 циклоалкильную группу, необязательно имеющую от 1 до 7, предпочтительно, от 1 до 5, атомов галогена. Конкретные примеры включают циклопропил, 2,2–дифторциклопропил, 2,3–дифторциклопропил, циклобутил, дифторциклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
В настоящем описании примеры «C3–10 циклоалкенильной группы» включают циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил и циклооктенил.
В настоящем описании примеры «C6–14 арильной группы» включают фенил, 1–нафтил, 2–нафтил, 1–антрил, 2–антрил и 9–антрил.
В настоящем описании примеры «C7–16 аралкильной группы» включают бензил, фенетил, нафтилметил и фенилпропил.
[0022]
В настоящем описании примеры «C1–6 алкоксигруппы» включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор–бутокси, трет–бутокси, пентилокси и гексилокси.
В настоящем описании примеры «необязательно галогенированной C1–6 алкоксигруппы» включают C1–6 алкоксигруппу, необязательно имеющую от 1 до 7, предпочтительно, от 1 до 5, атомов галогена. Конкретные примеры включают метокси, дифторметокси, трифторметокси, этокси, 2,2,2–трифторэтокси, пропокси, изопропокси, бутокси, 4,4,4–трифторбутокси, изобутокси, втор–бутокси, пентилокси и гексилокси.
В настоящем описании примеры «C3–10 циклоалкилоксигруппы» включают циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси и циклооктилокси.
В настоящем описании примеры «C1–6 алкилтиогруппы» включают метилтио, этилтио, пропилтио, изопропилтио, бутилтио, втор–бутилтио, трет–бутилтио, пентилтио и гексилтио.
В настоящем описании примеры «необязательно галогенированной C1–6 алкилтиогруппы» включают C1–6 алкилтиогруппу, необязательно имеющую от 1 до 7, предпочтительно, от 1 до 5, атомов галогена. Конкретные примеры включают метилтио, дифторметилтио, трифторметилтио, этилтио, пропилтио, изопропилтио, бутилтио, 4,4,4–трифторбутилтио, пентилтио и гексилтио.
В настоящем описании примеры «C1–6 алкилкарбонильной группы» включают ацетил, пропаноил, бутаноил, 2–метилпропаноил, пентаноил, 3–метилбутаноил, 2–метилбутаноил, 2,2–диметилпропаноил, гексаноил и гептаноил.
В настоящем описании примеры «необязательно галогенированной C1–6 алкилкарбонильной группы» включают C1–6 алкилкарбонильную группу, необязательно имеющую от 1 до 7, предпочтительно, от 1 до 5, атомов галогена. Конкретные примеры включают ацетил, хлорацетил, трифторацетил, трихлорацетил, пропаноил, бутаноил, пентаноил и гексаноил.
В настоящем описании примеры «C1–6 алкоксикарбонильной группы» включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор–бутоксикарбонил, трет–бутоксикарбонил, пентилоксикарбонил и гексилоксикарбонил.
В настоящем описании примеры «C6–14 арилкарбонильной группы» включают бензоил, 1–нафтоил и 2–нафтоил.
В настоящем описании примеры «C7–16 аралкилкарбонильной группы» включают фенилацетил и фенилпропионил.
В настоящем описании примеры «5–14–членной ароматической гетероциклилкарбонильной группы» включают никотиноил, изоникотиноил, теноил и фуроил.
В настоящем описании примеры «3–14–членной неароматической гетероциклилкарбонильной группы» включают морфолинилкарбонил, пиперидинилкарбонил и пирролидинилкарбонил.
[0023]
В настоящем описании примеры «моно– или ди–C1–6 алкилкарбамоильной группы» включают метилкарбамоил, этилкарбамоил, диметилкарбамоил, диэтилкарбамоил и N–этил–N–метилкарбамоил.
В настоящем описании примеры «моно– или ди–C7–16 аралкилкарбамоильной группы» включают бензилкарбамоил и фенетилкарбамоил.
В настоящем описании примеры «C1–6 алкилсульфонильной группы» включают метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, втор–бутилсульфонил и трет–бутилсульфонил.
В настоящем описании примеры «необязательно галогенированной C1–6 алкилсульфонильной группы» включают C1–6 алкилсульфонильную группу, необязательно имеющую от 1 до 7, предпочтительно, от 1 до 5, атомов галогена. Конкретные примеры включают метилсульфонил, дифторметилсульфонил, трифторметилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, 4,4,4–трифторбутилсульфонил, пентилсульфонил и гексилсульфонил.
В настоящем описании примеры «C6–14 арилсульфонильной группы» включают фенилсульфонил, 1–нафтилсульфонил и 2–нафтилсульфонил.
[0024]
В настоящем описании примеры «заместителя» включают атом галогена, циано группу, нитро группу, необязательно замещенную углеводородную группу, необязательно замещенную гетероциклическую группу, ацильную группу, необязательно замещенную аминогруппу, необязательно замещенную карбамоильную группу, необязательно замещенную тиокарбамоильную группу, необязательно замещенную сульфамоильную группу, необязательно замещенную гидрокси группу, необязательно замещенную сульфанильную (SH) группу и необязательно замещенную силильную группу.
В настоящем описании примеры «углеводородной группы» (включая «углеводородную группу» в составе «необязательно замещенной углеводородной группы») включают C1–6 алкильную группу, C2–6 алкенильную группу, C2–6 алкинильную группу, C3–10 циклоалкильную группу, C3–10 циклоалкенильную группу, C6–14 арильную группу и C7–16 аралкильную группу.
[0025]
В настоящем описании примеры «необязательно замещенной углеводородной группы» включают углеводородную группу, необязательно имеющую заместитель(и), выбранный из следующей группы заместителей A.
[группа заместителей A]
(1) атом галогена,
(2) нитро группа,
(3) циано группа,
(4) оксо группа,
(5) гидрокси группа,
(6) необязательно галогенированная C1–6 алкоксигруппа,
(7) C6–14 арилокси группа (например, фенокси, нафтокси),
(8) C7–16 аралкилокси группа (например, бензилокси),
(9) 5–14–членная ароматическая гетероциклилокси группа (например, пиридилокси),
(10) 3–14–членная неароматическая гетероциклилокси группа (например, морфолинилокси, пиперидинилокси),
(11) C1–6 алкилкарбонилокси группа (например, ацетокси, пропаноилокси),
(12) C6–14 арилкарбонилокси группа (например, бензоилокси, 1–нафтоилокси, 2–нафтоилокси),
(13) C1–6 алкоксикарбонилокси группа (например, метоксикарбонилокси, этоксикарбонилокси, пропоксикарбонилокси, бутоксикарбонилокси),
(14) моно– или ди–C1–6 алкилкарбамоилокси группа (например, метилкарбамоилокси, этилкарбамоилокси, диметилкарбамоилокси, диэтилкарбамоилокси),
(15) C6–14 арилкарбамоилокси группа (например, фенилкарбамоилокси, нафтилкарбамоилокси),
(16) 5–14–членная ароматическая гетероциклилкарбонилокси группа (например, никотиноилокси),
(17) 3–14–членная неароматическая гетероциклилкарбонилокси группа (например, морфолинилкарбонилокси, пиперидинилкарбонилокси),
(18) необязательно галогенированная C1–6 алкилсульфонилокси группа (например, метилсульфонилокси, трифторметилсульфонилокси),
(19) C6–14 арилсульфонилокси группа, необязательно замещенная C1–6 алкильной группой (например, фенилсульфонилокси, толуолсульфонилокси),
(20) необязательно галогенированная C1–6 алкилтиогруппа,
(21) 5–14–членная ароматическая гетероциклическая группа,
(22) 3–14–членная неароматическая гетероциклическая группа,
(23) формильная группа,
(24) карбокси группа,
(25) необязательно галогенированная C1–6 алкилкарбонильная группа,
(26) C6–14 арилкарбонильная группа,
(27) 5–14–членная ароматическая гетероциклилкарбонильная группа,
(28) 3–14–членная неароматическая гетероциклилкарбонильная группа,
(29) C1–6 алкоксикарбонильная группа,
(30) C6–14 арилоксикарбонильная группа (например, фенилоксикарбонил, 1–нафтилоксикарбонил, 2–нафтилоксикарбонил),
(31) C7–16 аралкилоксикарбонильная группа (например, бензилоксикарбонил, фенетилоксикарбонил),
(32) карбамоильная группа,
(33) тиокарбамоильная группа,
(34) моно– или ди–C1–6 алкилкарбамоильная группа,
(35) C6–14 арилкарбамоильная группа (например, фенилкарбамоил),
(36) 5–14–членная ароматическая гетероциклилкарбамоильная группа (например, пиридилкарбамоил, тиенилкарбамоил),
(37) 3–14–членная неароматическая гетероциклилкарбамоильная группа (например, морфолинилкарбамоил, пиперидинилкарбамоил),
(38) необязательно галогенированная C1–6 алкилсульфонильная группа,
(39) C6–14 арилсульфонильная группа,
(40) 5–14–членная ароматическая гетероциклилсульфонильная группа (например, пиридилсульфонил, тиенилсульфонил),
(41) необязательно галогенированная C1–6 алкилсульфинильная группа,
(42) C6–14 арилсульфинильная группа (например, фенилсульфинил, 1–нафтилсульфинил, 2–нафтилсульфинил),
(43) 5–14–членная ароматическая гетероциклилсульфинильная группа (например, пиридилсульфинил, тиенилсульфинил),
(44) аминогруппа,
(45) моно– или ди–C1–6 алкиламиногруппа (например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, диметиламино, диэтиламино, дипропиламино, дибутиламино, N–этил–N–метиламино),
(46) моно– или ди–C6–14 ариламиногруппа (например, фениламино),
(47) 5–14–членная ароматическая гетероциклиламино группа (например, пиридиламино),
(48) C7–16 аралкиламиногруппа (например, бензиламино),
(49) формиламино группа,
(50) C1–6 алкилкарбониламиногруппа (например, ацетиламино, пропаноиламино, бутаноиламино),
(51) (C1–6 алкил)(C1–6 алкилкарбонил)аминогруппа (например, N–ацетил–N–метиламино),
(52) C6–14 арилкарбониламиногруппа (например, фенилкарбониламино, нафтилкарбониламино),
(53) C1–6 алкоксикарбониламиногруппа (например, метоксикарбониламино, этоксикарбониламино, пропоксикарбониламино, бутоксикарбониламино, трет–бутоксикарбониламино),
(54) C7–16 аралкилоксикарбониламиногруппа (например, бензилоксикарбониламино),
(55) C1–6 алкилсульфониламиногруппа (например, метилсульфониламино, этилсульфониламино),
(56) C6–14 арилсульфониламино группа, необязательно замещенная C1–6 алкильной группой (например, фенилсульфониламино, толуолсульфониламино),
(57) необязательно галогенированная C1–6 алкильная группа,
(58) C2–6 алкенильная группа,
(59) C2–6 алкинильная группа,
(60) C3–10 циклоалкильная группа,
(61) C3–10 циклоалкенильная группа и
(62) C6–14 арильная группа.
[0026]
Число вышеуказанных заместителей в «необязательно замещенной углеводородной группе» составляет, например, от 1 до 5, предпочтительно, от 1 до 3. Когда число заместителей составляет два или более, соответствующие заместители могут быть одинаковыми или различными.
В настоящем описании примеры «гетероциклической группы» (включая «гетероциклическую группу» в составе «необязательно замещенной гетероциклической группы») включают (i) ароматическую гетероциклическую группу, (ii) неароматическую гетероциклическую группу и (iii) 7–10–членную мостиковую гетероциклическую группу, каждая из которых содержит, в качестве составляющих кольцо атомов, помимо атома углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода.
[0027]
В настоящем описании примеры «ароматической гетероциклической группы» (включая «5–14–членную ароматическую гетероциклическую группу») включают 5–14–членную (предпочтительно 5–10–членную) ароматическую гетероциклическую группу, содержащую в качестве составляющих кольцо атомов, помимо атома углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода.
Предпочтительные примеры «ароматической гетероциклической группы» включают 5– или 6–членные моноциклические ароматические гетероциклические группы, такие как тиенил, фурил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, 1,2,4–оксадиазолил, 1,3,4–оксадиазолил, 1,2,4–тиадиазолил, 1,3,4–тиадиазолил, триазолил, тетразолил, триазинил и тому подобное; и
8–14–членные конденсированные полициклические (предпочтительно, би или трициклические) ароматические гетероциклические группы, такие как бензотиофенил, бензофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензотриазолил, имидазопиридинил, тиенопиридинил, фуропиридинил, пирролопиридинил, пиразолoпиридинил, оксазолопиридинил, тиазолопиридинил, имидазопиразинил, имидазопиримидинил, тиенопиримидинил, фуропиримидинил, пирролопиримидинил, пиразолoпиримидинил, оксазолопиримидинил, тиазолопиримидинил, пиразолoтриазинил, нафто[2,3–b]тиенил, феноксатиинил, индолил, изоиндолил, 1H–индазолил, пуринил, изохинолил, хинолил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, карбазолил, бета–карболинил, фенантридинил, акридинил, феназинил, фенотиазинил, феноксазинил и тому подобное.
[0028]
В настоящем описании примеры «неароматической гетероциклической группы» (включая «3–14–членную неароматическую гетероциклическую группу») включают 3–14–членную (предпочтительно, 4–10–членную) неароматическую гетероциклическую группу, содержащую в качестве составляющих кольцо атомов, помимо атома углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода.
Предпочтительные примеры «неароматической гетероциклической группы» включают 3–8–членные моноциклические неароматические гетероциклические группы, такие как азиридинил, оксиранил, трииранил, азетидинил, оксетанил, тиетанил, тетрагидротиофен, тетрагидропиранил, пирролидинил, пирролидинил, имидазолинил, имидазолидинил, оксазолинил, оксазолидинил, пиразолинил, пиразолидинил, тиазолинил, тиазолидинил, тетрагидроизотиазолил, тетрагидрооксазолил, тетрагидроизооксазолил, пиперидинил, пиперазинил, тетрагидропиридинил, дигидропиридинил, дигидротиопиранил, тетрагидропиримидинил, тетрагидропиридазинил, дигидропиранил, тетрагидропиранил, тетрагидротиопиранил, морфолинил, тиоморфолинил, азепанил, диазепанил, азепинил, оксепанил, азоканил, диазоканил и тому подобное; и
9–14–членные конденсированные полициклические (предпочтительно, би– или трициклические) неароматические гетероциклические группы, такие как дигидробензофуранил, дигидробензимидазолил, дигидробензоксазолил, дигидробензотиазолил, дигидробензизотиазолил, дигидронафто[2,3–b]тиенил, тетрагидроизохинолил, тетрагидрохинолил, 4H–хинолизинил, индолинил, изоиндолинил, тетрагидротиено[2,3–c]пиридинил, тетрагидробензазепинил, тетрагидрохиноксалинил, тетрагидрофенантридинил, гексагидрофенотиазинил, гексагидрофеноксазинил, тетрагидрофталазинил, тетрагидронафтиридинил, тетрагидрохиназолинил, тетрагидроциннолинил, тетрагидрокарбазолил, тетрагидро–β–карболинил, тетрагидроакридинил, тетрагидрофеназинил, тетрагидротиоксантенил, октагидроизохинолил и тому подобное.
[0029]
В настоящем описании предпочтительные примеры «7–10–членной мостиковой гетероциклической группы» включают хинуклидинил и 7–азабицикло[2.2.1]гептанил.
В настоящем описании примеры «азотсодержащей гетероциклической группы» включают «гетероциклическую группу», содержащую в качестве образующего кольцо атома, по меньшей мере, один атом азота.
В настоящем описании примеры «необязательно замещенной гетероциклической группы» включают гетероциклическую группу, необязательно имеющую заместитель(и), выбранную(ые) из вышеуказанной группы заместителей A.
Число заместителей в «необязательно замещенной гетероциклической группе» составляет, например, от 1 до 3. Когда число заместителей составляет два или более, соответствующие заместители могут быть одинаковыми или различными.
[0030]
В настоящем описании примеры «ацильной группы» включают формильную группу, карбоксигруппу, карбамоильную группу, тиокарбамоильную группу, сульфиногруппу, сульфогруппу, сульфамоильную группу и фосфоногруппу, каждая из которых необязательно содержит «1 или 2 заместителя, выбранные из C1–6алкильной группы, C2–6 алкенильной группы, C3–10 циклоалкильной группы, C3–10 циклоалкенильной группы, C6–14 арильной группы, C7–16 аралкильной группы, 5–14–членной ароматической гетероциклической группы и 3–14–членной неароматической гетероциклической группы, каждая из которых необязательно имеет от 1 до 3 заместителей, выбранные из атома галогена, необязательно галогенированной C1–6 алкоксигруппы, гидроксигруппы, нитрогруппы, цианогруппы, аминогруппы и карбамоильной группы».
Примеры «ацильной группы» включают также углеводородную–сульфонильную группу, гетероциклилсульфонильную группу, углеводородную–сульфинильную группу и гетероциклилсульфинильную группу.
В настоящем документе углеводородная–сульфонильная группа означает связанную с углеводородной группой сульфонильную группу, гетероциклилсульфонильная группа означает связанную с гетероциклической группой сульфонильную группу, углеводородная–сульфинильная группа означает связанную с углеводородной группой сульфинильную группу, и гетероциклилсульфинильная группа означает связанную с гетероциклической группой сульфинильную группу.
Предпочтительные примеры «ацильной группы» включают формильную группу, карбоксигруппу, C1–6 алкилкарбонильную группу, C2–6 алкенилкарбонильную группу (например, кротоноил), C3–10 циклоалкилкарбонильную группу (например, циклобутанкарбонил, циклопентанкарбонил, циклогексанкарбонил, циклогептанкарбонил), C3–10 циклоалкенилкарбонильную группу (например, 2–циклогексанкарбонил), C6–14 арилкарбонильную группу, C7–16 аралкилкарбонильную группу, 5–14–членную ароматическую гетероциклилкарбонильную группу, 3–14–членную неароматическую гетероциклилкарбонильную группу, C1–6 алкоксикарбонильную группу, C6–14 арилоксикарбонильную группу (например, фенилоксикарбонил, нафтилоксикарбонил), C7–16 аралкилоксикарбонильную группу (например, бензилоксикарбонил, фенетилоксикарбонил), карбамоильную группу, моно– или ди–C1–6 алкилкарбамоильную группу, моно– или ди–C2–6 алкенилкарбамоильную группу (например, диаллилкарбамоил), моно– или ди–C3–10 циклоалкилкарбамоильную группу (например, циклопропилкарбамоил), моно– или ди–C6–14 арилкарбамоильную группу (например, фенилкарбамоил), моно– или ди–C7–16 аралкилкарбамоильную группу, 5–14–членную ароматическую гетероциклилкарбамоильную группу (например, пиридилкарбамоил), тиокарбамоильную группу, моно– или ди–C1–6 алкилтиокарбамоильную группу (например, метилтиокарбамоил, N–этил–N–метилтиокарбамоил), моно– или ди–C2–6 алкенилтиокарбамоильную группу (например, диаллилтиокарбамоил), моно– или ди–C3–10 циклоалкилтиокарбамоильную группу (например, циклопропилтиокарбамоил, циклогексилтиокарбамоил), моно– или ди–C6–14 арилтиокарбамоильную группу (например, фенилтиокарбамоил), моно– или ди–C7–16 аралкилтиокарбамоильную группу (например, бензилтиокарбамоил, фенетилтиокарбамоил), 5–14–членную ароматическую гетероциклилтиокарбамоильную группу (например, пиридилтиокарбамоил), сульфино группу, C1–6 алкилсульфинил группу (например, метилсульфинил, этилсульфинил), сульфо группу, C1–6 алкилсульфонильную группу, C6–14 арилсульфонильную группу, фосфоногруппу и моно– или ди–C1–6 алкилфосфоногруппу (например, диметилфосфоно, диэтилфосфоно, диизопропилфосфоно, дибутилфосфоно).
[0031]
В настоящем описании примеры «необязательно замещенной аминогруппы» включают аминогруппу, необязательно имеющую «1 или 2 заместителя, выбранных из C1–6 алкильной группы, C2–6 алкенильной группы, C3–10 циклоалкильной группы, C6–14 арильной группы, C7–16 аралкильной группы, C1–6 алкилкарбонильной группы, C6–14 арилкарбонильной группы, C7–16 аралкилкарбонильной группы, 5–14–членной ароматической гетероциклилкарбонильной группы, 3–14–членной неароматической гетероциклилкарбонильной группы, C1–6алкоксикарбонильной группы, 5–14–членной ароматической гетероциклической группы, карбамоильной группы, моно– или ди–C1–6 алкилкарбамоильной группы, моно– или ди–C7–16 аралкилкарбамоильной группы, C1–6алкилсульфонильной группы и C6–14 арилсульфонильной группы, каждая из которых необязательно имеет от 1 до 3 заместителей, выбранных из «группы заместителей A».
Предпочтительные примеры необязательно замещенной аминогруппы включают аминогруппу, моно– или ди–(необязательно галогенированный C1–6 алкил)аминогруппу (например, метиламино, трифторметиламино, диметиламино, этиламино, диэтиламино, пропиламино, дибутиламино), моно– или ди–C2–6 алкениламиногруппу (например, диаллиламино), моно– или ди–C3–10 циклоалкиламиногруппу (например, циклопропиламино, циклогексиламино), моно– или ди–C6–14 ариламиногруппу (например, фениламино), моно– или ди–C7–16 аралкиламиногруппу (например, бензиламино, дибензиламино), моно– или ди–(необязательно галогенированный C1–6 алкил)–карбониламиногруппу (например, ацетиламино, пропиониламино), моно– или ди–C6–14 арилкарбониламиногруппу (например, бензоиламино), моно– или ди–C7–16 аралкилкарбониламино группу (например, бензилкарбониламино), моно– или ди–5–14–членную ароматическую гетероциклилкарбониламиногруппу (например, никотиноиламино, изоникотиноиламино), моно– или ди–3–14–членную неароматическую гетероциклилкарбониламиногруппу (например, пиперидинилкарбониламино), моно– или ди–C1–6 алкоксикарбониламиногруппу (например, трет–бутоксикарбониламино), 5–14–членную ароматическую гетероциклиламино группу (например, пиридиламино), карбамоиламиногруппу, (моно– или ди–C1–6 алкилкарбамоил)аминогруппу (например, метилкарбамоиламино), (моно– или ди–C7–16 аралкилкарбамоил)аминогруппу (например, бензилкарбамоиламино), C1–6 алкилсульфониламиногруппу (например, метилсульфониламино, этилсульфониламино), C6–14 арилсульфониламиногруппу (например, фенилсульфониламино), (C1–6 алкил)(C1–6 алкилкарбонил)аминогруппу (например, N–ацетил–N–метиламино) и (C1–6 алкил)(C6–14 арилкарбонил)аминогруппу (например, N–бензоил–N–метиламино).
[0032]
В настоящем описании примеры «необязательно замещенной карбамоильной группы» включают карбамоильную группу, необязательно имеющую «1 или 2 заместителя, выбранных из C1–6 алкильной группы, C2–6 алкенильной группы, C3–10 циклоалкильной группы, C6–14 арильной группы, C7–16 аралкильной группы, C1–6алкилкарбонильной группы, C6–14 арилкарбонильной группы, C7–16 аралкилкарбонильной группы, 5–14–членной ароматической гетероциклилкарбонильной группы, 3–14–членной неароматической гетероциклилкарбонильной группы, C1–6 алкоксикарбонильной группы, 5–14–членной ароматической гетероциклической группы, карбамоильной группы, моно– или ди–C1–6 алкилкарбамоильной группы и моно– или ди–C7–16 аралкилкарбамоильной группы, каждая из которых необязательно имеет от 1 до 3 заместителей, выбранных из «группы заместителей A».
Предпочтительные примеры необязательно замещенной карбамоильной группы включают карбамоильную группу, моно– или ди–C1–6 алкилкарбамоильную группу, моно– или ди–C2–6 алкенилкарбамоильную группу (например, диаллилкарбамоил), моно– или ди–C3–10 циклоалкилкарбамоильную группу (например, циклопропилкарбамоил, циклогексилкарбамоил), моно– или ди–C6–14 арилкарбамоильную группу (например, фенилкарбамоил), моно– или ди–C7–16 аралкилкарбамоильную группу, моно– или ди–C1–6алкилкарбонилкарбамоильную группу (например, ацетилкарбамоил, пропионилкарбамоил), моно– или ди–C6–14 арилкарбонилкарбамоильную группу (например, бензоилкарбамоил) и 5–14–членную ароматическую гетероциклилкарбамоильную группу (например, пиридилкарбамоил).
[0033]
В настоящем описании примеры «необязательно замещенной тиокарбамоильной группы» включают тиокарбамоильную группу, необязательно имеющую «1 или 2 заместителя, выбранных из C1–6 алкильной группы, C2–6 алкенильной группы, C3–10 циклоалкильной группы, C6–14 арильной группы, C7–16 аралкильной группы, C1–6 алкилкарбонильной группы, C6–14 арилкарбонильной группы, C7–16 аралкилкарбонильной группы, 5–14–членной ароматической гетероциклилкарбонильной группы, 3–14–членной неароматической гетероциклилкарбонильной группы, C1–6 алкоксикарбонильной группы, 5–14–членной ароматической гетероциклической группы, карбамоильной группы, моно– или ди–C1–6 алкилкарбамоильной группы и моно– или ди–C7–16 аралкилкарбамоильной группы, каждая из которых необязательно имеет от 1 до 3 заместителей, выбранных из «группы заместителей A».
Предпочтительные примеры необязательно замещенной тиокарбамоильной группы включают тиокарбамоильную группу, моно– или ди–C1–6 алкилтиокарбамоильную группу (например, метилтиокарбамоил, этилтиокарбамоил, диметилтиокарбамоил, диэтилтиокарбамоил, N–этил–N–метилтиокарбамоил), моно– или ди–C2–6 алкенилтиокарбамоильную группу (например, диаллилтиокарбамоил), моно– или ди–C3–10 циклоалкилтиокарбамоильную группу (например, циклопропилтиокарбамоил, циклогексилтиокарбамоил), моно– или ди–C6–14 арилтиокарбамоильную группу (например, фенилтиокарбамоил), моно– или ди–C7–16 аралкилтиокарбамоильную группу (например, бензилтиокарбамоил, фенетилтиокарбамоил), моно– или ди–C1–6 алкилкарбонилтиокарбамоильную группу (например, ацетилтиокарбамоил, пропионилтиокарбамоил), моно– или ди–C6–14 арилкарбонил–тиокарбамоильную группу (например, бензоилтиокарбамоил) и 5–14–членную ароматическую гетероциклилтиокарбамоильную группу (например, пиридилтиокарбамоил).
[0034]
В настоящем описании примеры «необязательно замещенной сульфамоильной группы» включают сульфамоильную группу, необязательно имеющую «1 или 2 заместителя, выбранных из C1–6 алкильной группы, C2–6 алкенильной группы, C3–10 циклоалкильной группы, C6–14 арильной группы, C7–16 аралкильной группы, C1–6 алкилкарбонильной группы, C6–14 арилкарбонильной группы, C7–16 аралкилкарбонильной группы, 5–14–членной ароматической гетероциклилкарбонильной группы, 3–14–членной неароматической гетероциклилкарбонильной группы, C1–6 алкоксикарбонильной группы, 5–14–членной ароматической гетероциклической группы, карбамоильной группы, моно– или ди–C1–6 алкилкарбамоильной группы и моно– или ди–C7–16аралкилкарбамоильной группы, каждая из которых необязательно имеет от 1 до 3 заместителей, выбранных из «группы заместителей A».
Предпочтительные примеры необязательно замещенной сульфамоильной группы включают сульфамоильную группу, моно– или ди–C1–6 алкилсульфамоильную группу (например, метилсульфамоил, этилсульфамоил, диметилсульфамоил, диэтилсульфамоил, N–этил–N–метилсульфамоил), моно– или ди–C2–6алкенилсульфамоильную группу (например, диаллилсульфамоил), моно– или ди–C3–10 циклоалкилсульфамоильную группу (например, циклопропилсульфамоил, циклогексилсульфамоил), моно– или ди–C6–14 арил–сульфамоильную группу (например, фенилсульфамоил), моно– или ди–C7–16 аралкилсульфамоильную группу (например, бензилсульфамоил, фенетилсульфамоил), моно– или ди–C1–6 алкилкарбонилсульфамоильную группу (например, ацетилсульфамоил, пропионилсульфамоил), моно– или ди–C6–14 арилкарбонилсульфамоильную группу (например, бензоилсульфамоил) и 5–14–членную ароматическую гетероциклилсульфамоильную группу (например, пиридилсульфамоил).
[0035]
В настоящем описании примеры «необязательно замещенной гидрокси группы» включают гидроксильную группу, необязательно имеющую «заместитель, выбранный из C1–6 алкильной группы, C2–6 алкенильной группы, C3–10 циклоалкильной группы, C6–14 арильной группы, C7–16 аралкильной группы, C1–6 алкилкарбонильной группы, C6–14 арилкарбонильной группы, C7–16 аралкилкарбонильной группы, 5–14–членной ароматической гетероциклилкарбонильной группы, 3–14–членной неароматической гетероциклилкарбонильной группы, C1–6 алкоксикарбонильной группы, 5–14–членной ароматической гетероциклической группы, карбамоильной группы, моно– или ди–C1–6 алкилкарбамоильной группы, моно– или ди–C7–16 аралкилкарбамоильной группы, C1–6 алкилсульфонильной группы и C6–14 арилсульфонильной группы, каждая из которых необязательно имеет от 1 до 3 заместителей, выбранных из «группы заместителей A».
Предпочтительные примеры необязательно замещенной гидрокси группы включают гидрокси группу, C1–6 алкоксигруппу, C2–6 алкенилоксигруппу (например, аллилокси, 2–бутенилокси, 2–пентенилокси, 3–гексенилокси), C3–10 циклоалкилоксигруппу (например, циклогексилокси), C6–14 арилоксигруппу (например, фенокси, нафтилокси), C7–16 аралкилоксигруппу (например, бензилокси, фенетилокси), C1–6 алкилкарбонилокси группу (например, ацетилокси, пропионилокси, бутирилокси, изобутирилокси, пивалоилокси), C6–14 арилкарбонилокси группу (например, бензоилокси), C7–16 аралкилкарбонилокси группу (например, бензилкарбонилокси), 5–14–членную ароматическую гетероциклилкарбонилоксигруппу (например, никотиноилокси), 3–14–членную неароматическую гетероциклилкарбонилоксигруппу (например, пиперидинилкарбонилокси), C1–6алкоксикарбонилоксигруппу (например, трет–бутоксикарбонилокси), 5–14–членную ароматическую гетероциклилоксигруппу (например, пиридилокси), карбамоилокси группу, C1–6 алкилкарбамоилокси группу (например, метилкарбамоилокси), C7–16 аралкилкарбамоилоксигруппу (например, бензилкарбамоилокси), C1–6 алкилсульфонилоксигруппу (например, метилсульфонилокси, этилсульфонилокси) и C6–14 арилсульфонилоксигруппу (например, фенилсульфонилокси).
[0036]
В настоящем описании примеры «необязательно замещенной сульфанильной группы» включают сульфанильную группу, необязательно имеющую «заместитель, выбранный из C1–6 алкильной группы, C2–6 алкенильной группы, C3–10 циклоалкильной группы, C6–14 арильной группы, C7–16 аралкильной группы, C1–6 алкилкарбонильной группы, C6–14 арилкарбонильной группы и 5–14–членной ароматической гетероциклической группы, каждая из которых, необязательно, имеет от 1 до 3 заместителей, выбранных из «группы заместителей A» и галогенированной сульфанильной группы.
Предпочтительные примеры необязательно замещенной сульфанильной группы включают сульфанильную (–SH) группу, C1–6 алкилтио группу, C2–6 алкенилтиогруппу (например, аллилтио, 2–бутенилтио, 2–пентенилтио, 3–гексенилтио), C3–10 циклоалкилтиогруппу (например, циклогексилтио), C6–14 арилтиогруппу (например, фенилтио, нафтилтио), C7–16 аралкилтиогруппу (например, бензилтио, фенетилтио), C1–6алкилкарбонилтиогруппу (например, ацетилтио, пропионилтио, бутирилтио, изобутирилтио, пивалоилтио), C6–14арилкарбонилтиогруппу (например, бензоилтио), 5–14–членную ароматическую гетероциклилтио группу (например, пиридилтио) и галогенированную тиогруппу (например, пентафтортио).
[0037]
В настоящем описании примеры «необязательно замещенной силильной группы» включают силильную группу, необязательно имеющую «от 1 до 3 заместителей, выбранных из C1–6 алкильной группы, C2–6 алкенильной группы, C3–10 циклоалкильной группы, C6–14 арильной группы и C7–16 аралкильной группы, каждая из которых необязательно имеет от 1 до 3 заместителей, выбранных из «группы заместителей A».
Предпочтительные примеры необязательно замещенной силильной группы включают три–C1–6 алкилсилильную группу (например, триметилсилил, трет–бутил(диметил)силил).
3H7)–, –CH(CH(CH3)2)–, –(CH(CH3))2–, –CH2–CH(CH3)–, –CH(CH3)–CH2–, –CH2–CH2–C(CH3)2–, –C(CH3)2–CH2–CH2–, –CH2–CH2–CH2–C(CH3)2– и –C(CH3)2–CH2–CH2–CH2–.
В настоящем описании примеры «C2–6 алкениленовой группы» включают –CH=CH–, –CH2–CH=CH–, –CH=CH–CH2–, –C(CH3)2–CH=CH–, –CH=CH–C(CH3)2–, –CH2–CH=CH–CH2–, –CH2–CH2–CH=CH–, –CH=CH–CH2–CH2–, –CH=CH–CH=CH–, –CH=CH–CH2–CH2–CH2– и –CH2–CH2–CH2–CH=CH–.
В настоящем описании примеры «C2–6 алкиниленовой группы» включают –C≡C–, –CH2–C≡C–, –C≡C–CH2–, –C(CH3)2–C≡C–, –C≡C–C(CH3)2–, –CH2–C≡C–CH2–, –CH2–CH2–C≡C–, –C≡C–CH2–CH2–, –C≡C–C≡C–, –C≡C–CH2–CH2–CH2– и –CH2–CH2–CH2–C≡C–.
[0038]
В настоящем описании примеры «углеводородного кольца» включают C6–14 ароматическое углеводородное кольцо, C3–10 циклоалкан и C3–10 циклоалкен.
В настоящем описании примеры «C6–14 ароматического углеводородного кольца» включают бензол и нафталин.
В настоящем описании примеры «C3–10 циклоалкана» включают циклопропан, циклобутан, циклопентан, циклогексан, циклогептан и циклооктан.
В настоящем описании примеры «C3–10 циклоалкена» включают циклопропен, циклобутен, циклопентен, циклогексен, циклогептен и циклооктен.
В настоящем описании примеры «гетероцикла» включают ароматический гетероцикл и неароматический гетероцикл, каждый содержащий в качестве составляющих кольцо атомов, помимо атома углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода.
[0039]
В настоящем описании примеры «ароматического гетероцикла» включают 5–14–членный (предпочтительно, 5–10–членный) ароматический гетероцикл, содержащий в качестве составляющих кольцо атомов, помимо атома углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода. Предпочтительные примеры «ароматического гетероцикла» включают 5– или 6–членные моноциклические ароматические гетероциклы, такие как тиофен, фуран, пиррол, имидазол, пиразол, тиазол, изотиазол, оксазол, изоксазол, пиридин, пиразин, пиримидин, пиридазин, 1,2,4–оксадиазол, 1,3,4–оксадиазол, 1,2,4–тиадиазол, 1,3,4–тиадиазол, триазол, тетразол, триазин и тому подобное; и
8–14–членные конденсированные полициклические (предпочтительно, би– или трициклические) ароматические гетероциклы, такие как бензотиофен, бензофуран, бензимидазол, бензоксазол, бензизоксазол, бензотиазол, бензизотиазол, бензотриазол, имидазопиридин, тиенопиридин, фуропиридин, пирролопиридин, пиразолoпиридин, оксазолопиридин, тиазолопиридин, имидазопиразин, имидазопиримидин, тиенопиримидин, фуропиримидин, пирролопиримидин, пиразолoпиримидин, оксазолопиримидин, тиазолопиримидин, пиразолoпиримидин, пиразолoтриазин, нафто[2,3–b]тиофен, феноксатиин, индол, изоиндол, 1H–индазол, пурин, изохинолин, хинолин, фталазин, нафтиридин, хиноксалин, хиназолин, циннолин, карбазол, β–карболин, фенантридин, акридин, феназин, фенотиазин, феноксазин и тому подобное.
[0040]
В настоящем описании примеры «неароматического гетероцикла» включают 3–14–членный (предпочтительно, 4–10–членный) неароматический гетероцикл, содержащий в качестве составляющих кольцо атомов, помимо атома углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода. Предпочтительные примеры «неароматического гетероцикла» включают 3–8–членные моноциклические неароматические гетероциклы, такие как азиридин, оксиран, тииран, азетидин, оксетан, тиетан, тетрагидротиофен, тетрагидрофуран, пирролин, пирролидин, имидазолин, имидазолидин, оксазолин, оксазолидин, пиразолин, пиразолидин, тиазолин, тиазолидин, тетрагидроизотиазол, тетрагидрооксазол, тетрагидроизоксазол, пиперидин, пиперазин, тетрагидропиридин, дигидропиридин, дигидротиопиран, тетрагидропиримидин, тетрагидропиридазин, дигидропиран, тетрагидропиран, тетрагидротиопиран, морфолин, тиоморфолин, азепанин, диазепан, азепин, азокан, диазокан, оксепан и тому подобное; и
9–14–членные конденсированные полициклические (предпочтительно, би– или трициклические) неароматические гетероциклы, такие как дигидробензофуран, дигидробензимидазол, дигидробензоксазол, дигидробензотиазол, дигидробензизотиазол, дигидронафто[2,3–b]тиофен, тетрагидроизохинолин, тетрагидрохинолин, 4H–хинолизин, индолин, изоиндолин, тетрагидротиено[2,3–c]пиридин, тетрагидробензазепин, тетрагидрохиноксалин, тетрагидрофенантридин, гексагидрофенотиазин, гексагидрофеноксазин, тетрагидрофталазин, тетрагидронафтиридин, тетрагидрохиназолин, тетрагидроциннолин, тетрагидрокарбазол, тетрагидро–β–карболин, тетрагидроакридин, тетрагидрофеназин, тетрагидротиоксантен, октагидроизохинолин и тому подобное.
В настоящем описании примеры «азотсодержащего гетероцикла» включают «гетероцикл», содержащий, по меньшей мере, один атом азота в качестве образующего кольцо атома.
[0041]
Используемые в настоящем описании примеры «ароматического кольца» включают «C6–14 ароматическое углеводородное кольцо» и «ароматический гетероцикл».
Используемые в настоящем описании примеры «ароматической кольцевой группы» включают «C6–14 арильную группу» и «ароматическую гетероциклическую группу»
Используемые в настоящем описании примеры «кольца» включают «углеводородное кольцо» (например, C6–14 ароматическое углеводородное кольцо, C3–10 циклоалкан, C3–10 циклоалкен) и «гетероцикл» (например, ароматический гетероцикл, неароматический гетероцикл).
[0042]
Определение каждого символа в соединении (I) описано подробно далее.
Кольцо А представляет собой ароматическое кольцо, которое необязательно дополнительно замещено.
В одном варианте осуществления «ароматическое кольцо» в «необязательно дополнительно замещенном ароматическом кольце» кольца А представляет собой C6–14 ароматическое углеводородное кольцо (предпочтительно бензольное кольцо), и «ароматическое кольцо» в «необязательно дополнительно замещенном ароматическом кольце» кольца А может иметь от 1 до 5 заместителей в замещаемых положениях. Примеры заместителя включают заместитель, выбранный из [группы заместителей A]. Когда число заместителей составляет два или более, соответствующие заместители могут быть одинаковыми или различными.
[0043]
Кольцо A представляет собой предпочтительно необязательно дополнительно замещенное бензольное кольцо и более предпочтительно бензольное кольцо.
[0044]
R1 представляет собой атом водорода, необязательно замещенную алкильную группу, необязательно замещенную алкилтиогруппу или необязательно замещенную алкоксигруппу.
Примеры "алкильной группы" в "необязательно замещенной алкильной группе" R1 включают "C1–6 алкильную группу".
Примеры "алкилтиогруппы" в "необязательно замещенной алкилтиогруппе" R1 включают "C1–6 алкилтиогруппу".
Примеры «алкоксигруппы» в «необязательно замещенной алкоксигруппе» R1 включают «C1–6 алкоксигруппу».
«Алкильная группа» в «необязательно замещенной алкильной группе», «алкилтиогруппа» в «необязательно замещенной алкилтиогруппе» и «алкоксигруппа» в «необязательно замещенной алкоксигруппе» R1, каждый, необязательно имеют от одного до трех заместителей в замещаемых положениях. Примеры таких заместителей включают заместитель, выбранный из [группы заместителей A]. Когда число заместителей составляет два или более, каждый из заместителей могут быть одинаковыми или отличаться друг от друга.
[0045]
R1 предпочтительно представляет собой атом водорода или необязательно замещенную C1–6 алкильную группу (например, метил), более предпочтительно атом водорода или C1–6 алкильную группу (например, метил), более предпочтительно атом водорода.
[0046]
R2 и R3 каждый независимо представляет необязательно замещенную алкильную группу, или R2 и R3 образуют необязательно дополнительно замещенное кольцо вместе со смежным атомом углерода.
Примеры «алкильной группы» в «необязательно замещенной алкильной группе» R2 и R3 включают «C1–6 алкильную группу». «Алкильная группа» в «необязательно замещенной алкильной группе» необязательно имеет от одного до трех заместителей в замещаемых положениях. Примеры таких заместителей включают заместитель, выбранный из [группы заместителей A]. Когда число заместителей составляет два или более, каждый из заместителей могут быть одинаковыми или отличаться друг от друга.
«Кольцо» в «необязательно дополнительно замещенном кольце», образованном R2 и R3 со смежным атомом углерода, включает «C3–10 циклоалкан». «Кольцо» в «необязательно дополнительно замещенном кольце» необязательно имеет от одного до трех заместителей в замещаемых положениях. Примеры таких заместителей включают заместитель, выбранный из [группы заместителей A]. Когда число заместителей составляет два или более, каждый из заместителей могут быть одинаковыми или отличаться друг от друга.
[0047]
R2 предпочтительно представляет собой атом водорода или необязательно замещенную C1–6 алкильную группу (например, метил), более предпочтительно атом водорода или C1–6 алкильную группу (например, метил), и, кроме того, предпочтительно C1–6 алкильную группу (например, метил).
R3 представляет собой предпочтительно атом водорода или необязательно замещенную C1–6 алкильную группу (например, метил), более предпочтительно атом водорода или C1–6 алкильную группу (например, метил), и, кроме того, предпочтительно C1–6 алкильную группу (например, метил).
[0048]
R4 представляет собой необязательно замещенную ароматическую кольцевую группу или необязательно замещенную алкильную группу.
Примеры «ароматической кольцевой группы» в «необязательно замещенной ароматической кольцевой группе» R4 включают «C6–14 арильную группу» или «ароматическую гетероциклическую группу». «Ароматическая кольцевая группа» в «необязательно замещенной ароматической кольцевой группе» необязательно имеет от одного до трех заместителей в замещаемых положениях. Примеры таких заместителей включают заместитель, выбранный из [группы заместителей A]. Когда число заместителей составляет два или более, каждый из заместителей могут быть одинаковыми или отличаться друг от друга.
Пример "алкильной группы" в "необязательно замещенной алкильной группе" R4 включает "C1–6 алкильную группу". «Алкильная группа» в «необязательно замещенной алкильной группе» необязательно имеет от одного до трех заместителей в замещаемых положениях. Примеры таких заместителей включают заместитель, выбранный из [группы заместителей A]. Когда число заместителей составляет два или более, каждый из заместителей могут быть одинаковыми или отличаться друг от друга.
[0049]
R4 представляет собой предпочтительно C6–14 арильную группу (например, фенильную группу), 5– или 6–членную моноциклическую ароматическую гетероциклическую группу (например, пиридильную группу, тиенильную группу), или C1–6 алкильную группу (например, изопропильную группу), каждая из которых необязательно замещена.
[0050]
R4 представляет собой более предпочтительно C6–14 арильную группу (например, фенильную группу), 5– или 6–членную моноциклическую ароматическую гетероциклическую группу (например, пиридильную группу, тиенильную группу) или C1–6 алкильную группу (например, изопропильную группу), каждая из которых необязательно замещена одним или двумя заместителями, выбранными из группы, состоящей из
(a) атома галогена (например, атом фтора, атом хлора),
(b) C1–6 алкильной группы (например, метил, изопропил), которая необязательно замещена одним–тремя атомами галогена (например, атом фтора, атом хлора), и
(c) C1–6 алкоксигруппы (например, метокси), которая необязательно замещена одним–тремя атомами галогена (например, атом фтора, атом хлора).
[0051]
R4 представляет собой, более предпочтительно C6–14 арильную группу (например, фенильную группу), которая необязательно замещена одним или двумя заместителями, выбранными из группы, состоящей из
(a) атома галогена (например, атом фтора, атом хлора), и
(b) C1–6 алкильной группы (например, метил, изопропил), которая необязательно замещена одним–тремя атомами галогена (например, атом фтора, атом хлора).
[0052]
R4 еще более предпочтительно представляет собой фенильную группу, которая необязательно замещена одним или двумя заместителями, выбранными из группы, состоящей из
(a) атома галогена (например, атом хлора), и
(b) C1–6 алкильной группы (например, метил), которая необязательно замещена одним–тремя атомами галогена (например, атом фтора).
[0053]
R5 и R6, каждый независимо, представляет атом водорода или атом галогена (например, атом фтора).
R5 представляет собой предпочтительно атом водорода или атом фтора и, более предпочтительно, атом водорода.
R6 представляет собой предпочтительно атом водорода или атом фтора и, более предпочтительно, атом водорода.
[0054]
Примеры предпочтительного аспекта соединения (I) включают следующие соединения.
[Соединение A]
Соединение (I), где
Кольцо А представляет собой необязательно дополнительно замещенное бензольное кольцо;
R1 представляет собой атом водорода или необязательно замещенную C1–6 алкильную группу (например, метил);
R2 представляет собой атом водорода или необязательно замещенную C1–6 алкильную группу (например, метил);
R3 представляет собой атом водорода или необязательно замещенную C1–6 алкильную группу (например, метил);
R4 представляет собой необязательно замещенную C6–14 арильную группу (например, фенильную группу), ароматическую гетероциклическую группу (например, пиридильную группу, тиенильную группу), или C1–6 алкильную группу (например, изопропильная группа); и
R5 и R6, каждый независимо, представляет атом водорода или атом галогена (например, атом фтора).
[0055]
[Соединение A']
Соединение (I), где
Кольцо А представляет собой бензольное кольцо;
R1 представляет собой атом водорода;
R2 представляет собой C1–6 алкильную группу (например, метил);
R3 представляет собой C1–6 алкильную группу (например, метил);
R4 представляет собой C6–14 арильную группу (например, фенильную группу), 5– или 6–членную моноциклическую ароматическую гетероциклическую группу (например, пиридильную группу, тиенильную группу), или C1–6 алкильную группу (например, изопропильную группу), каждая из которых необязательно замещена одним или двумя заместителями, выбранными из группы, состоящей из
(a) атома галогена (например, атом фтора, атом хлора),
(b) C1–6 алкильной группы (например, метил, изопропил), которая необязательно замещена одним–тремя атомами галогена (например, атом фтора, атом хлора), и
(c) C1–6 алкоксигруппы (например, метокси), которая необязательно замещена одним–тремя атомами галогена (например, атом фтора, атом хлора); и
R5 и R6, каждый, представляет собой атом водорода или атом фтора.
[0056]
[Соединение B]
Соединение (I), где
Кольцо А представляет собой бензольное кольцо;
R1 представляет собой атом водорода или C1–6 алкильную группу (например, метил);
R2 представляет собой атом водорода или C1–6 алкильную группу (например, метил);
R3 представляет собой атом водорода или C1–6 алкильную группу (например, метил);
R4 представляет собой C6–14 арильную группу (например, фенильную группу), 5– или 6–членную моноциклическую ароматическую гетероциклическую группу (например, пиридильную группу, тиенильную группу) или C1–6 алкильную группу (например, изопропильную группу), каждая из которых необязательно замещена одним или двумя заместителями, выбранными из группы, состоящей из
(a) атома галогена (например, атом фтора, атом хлора),
(b) C1–6 алкильной группы (например, метил, изопропил), которая необязательно замещена одним–тремя атомами галогена (например, атом фтора, атом хлора), и
(c) C1–6 алкоксигруппы (например, метокси), которая необязательно замещена одним–тремя атомами галогена (например, атом фтора, атом хлора); и
R5 и R6, каждый, представляет собой атом водорода.
[0057]
[Соединение C]
Соединение (I), где
Кольцо А представляет собой бензольное кольцо;
R1 представляет собой атом водорода или C1–6 алкильную группу (например, метил);
R2 представляет собой атом водорода или C1–6 алкильную группу (например, метил);
R3 представляет собой атом водорода или C1–6 алкильную группу (например, метил);
R4 представляет собой C6–14 арильную группу (например, фенильную группу), которая необязательно замещена одним или двумя заместителями, выбранными из группы, состоящей из
(a) атома галогена (например, атом фтора, атом хлора), и
(b) C1–6 алкильной группы (например, изопропил), которая необязательно замещена одним–тремя атомами галогена (например, атом фтора, атом хлора), и
R5 и R6, каждый, представляет собой атом водорода.
[0058]
[Соединение D]
Соединение (I), где
Кольцо А представляет собой бензольное кольцо;
R1 представляет собой атом водорода или C1–6 алкильную группу (например, метил);
R2 представляет собой атом водорода или C1–6 алкильную группу (например, метил);
R3 представляет собой атом водорода или C1–6 алкильную группу (например, метил);
R4 представляет собой фенильную группу, замещенную одним или двумя атомами галогена (например, атом хлора); и
R5 и R6, каждый, представляет собой атом водорода.
[0059]
[Соединение E]
Соединение (I), где
Кольцо А представляет собой бензольное кольцо;
R1 представляет собой атом водорода;
R2 представляет собой C1–6 алкильную группу (например, метил);
R3 представляет собой C1–6 алкильную группу (например, метил);
R4 представляет собой фенильную группу, замещенную одним или двумя заместителями, выбранными из группы, состоящей из (a) атома галогена (например, атом хлора) или (b) C1–6 алкильной группы (например, метил), которая необязательно замещена одним–тремя атомами галогена (например, атом фтора); и
R5 и R6, каждый, представляет собой атом водорода.
[0060]
Конкретные примеры соединения (I) включают соединения примеров 1–52, описанные ниже.
Предпочтительные примеры соединения (I) конкретно включают
((1S,5R)–1–(3,4–дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (Пример 1) или его соль;
(1–(3,5–дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (Пример 4) или его соль;
(1–(4–хлор–3–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (Пример 13) или его соль.
[0061]
Когда соединение (I) представляет собой соль, примеры соли включают соль с неорганическим основанием, соль аммония, соль с органическим основанием, соль с неорганической кислотой, соль с органической кислотой и соль с основной или кислой аминокислотой.
[0062]
Предпочтительные примеры соли с неорганическим основанием включают соли щелочного металла, такие как натриевая соль или калиевая соль; соли щелочноземельного металла, такие как кальциевая соль, магниевая соль или бариевая соль; и алюминиевая соль.
[0063]
Предпочтительные примеры соли с органическим основанием включают соли с триметиламином, триэтиламином, пиридином, пиколином, этаноламином, диэтаноламином, триэтаноламином, дициклогексиламином и N, N'–дибензилэтилендиамином.
[0064]
Предпочтительные примеры соли с неорганической кислотой включают соли с хлористоводородной кислотой, бромистоводородной кислотой, азотной кислотой, серной кислотой и фосфорной кислотой.
[0065]
Предпочтительные примеры соли с органической кислотой включают соли с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой и п–толуолсульфоновой кислотой.
[0066]
Предпочтительные примеры соли с основной аминокислотой включают соли с аргинином, лизином и орнитином.
[0067]
Предпочтительные примеры соли с кислотной аминокислотой включают соли с аспарагиновой кислотой и глутаминовой кислотой.
[0068]
Среди этих солей фармацевтически приемлемые соли будут предпочтительными.
[0069]
Далее описаны способы получения соединения (I).
[0070]
Исходные вещества и реагенты, используемые на каждой стадии следующих способов получения, а также полученные соединения, каждый может образовывать соль. Примеры соли включают соли, подобные солям соединения (I), упомянутым выше.
[0071]
Когда соединение, полученное на каждой стадии, является свободным соединением, соединение может быть преобразовано в интересующую соль хорошо известным способом. С другой стороны, когда соединение, полученное на каждой стадии, является солью, соединение может быть преобразовано в свободную форму или другой тип соли, представляющий интерес, хорошо известным способом.
[0072]
Соединение, полученное на каждой стадии, может быть использовано в последующей реакции непосредственно в виде его реакционного раствора или после того, как получено в виде сырого продукта. Альтернативно, соединение, получаемое на каждой стадии, может быть выделено и/или очищено из реакционной смеси путем разделения, таким как концентрирование, кристаллизация, перекристаллизация, перегонка, экстракция растворителем, фракционирование или хроматография, в соответствии с обычным способом.
[0073]
Когда соединения исходных веществ или реагентов на каждой стадии являются коммерчески доступными, такие коммерчески доступные продукты могут быть использованы напрямую.
[0074]
При осуществлении реакции на каждой стадии время реакции может изменяться в зависимости от используемого реагента или используемого растворителя, но, если не указано иное, оно обычно составляет от 1 минуты до 48 часов, предпочтительно, от 10 минут до 16 часов.
[0075]
При осуществлении реакции на каждой стадии температура реакции может изменяться в зависимости от используемого реагента или используемого растворителя, но, если не указано иное, обычно она составляет от –78°C до 300°C, предпочтительно, от –78°C до 150°C.
[0076]
При осуществлении реакции на каждой стадии давление может изменяться в зависимости от используемого реагента или используемого растворителя, и обычно оно составляет от 1 атм до 20 атм, предпочтительно, от 1 атм до 3 атм, если не указано иное.
[0077]
При осуществлении реакции на каждой стадии может быть использован, например, микроволновой реактор, такой как Initiator, производства Biotage Co. Температура реакции может изменяться в зависимости от используемого реагента или используемого растворителя и обычно составляет от комнатной температуры до 300°C, предпочтительно, от 50°C до 250°C, если не указано иное. Время реакции может изменяться в зависимости от используемого реагента или используемого растворителя и обычно составляет от 1 минуты до 48 часов, предпочтительно, от 1 минуты до 8 часов, если не указано иное.
[0078]
При осуществлении реакции на каждой стадии реагент используют в количестве от 0,5 до 20 эквивалентов, предпочтительно, от 0,8 до 5 эквивалентов, по отношению к субстрату, если не указано иное. Когда реагент используют в качестве катализатора, реагент используют в количестве от 0,001 до 1 эквивалента, предпочтительно, от 0,01 до 0,2 эквивалента относительно субстрата. Когда реагент также служит растворителем для реакции, то указанный реагент используют в количестве растворителя.
[0079]
В реакциях каждой стадии, если не указано иное, реакции проводят без растворителя или проводят в подходящем растворителе в форме раствора или суспензии. Конкретные примеры растворителя включают растворитель, описанный в примерах, или следующие растворители:
спирты: метанол, этанол, трет–бутиловый спирт, 2–метоксиэтанол и тому подобное;
простые эфиры: диэтиловый эфир, дифениловый эфир, тетрагидрофуран, 1,2–диметоксиэтан и тому подобное;
ароматические углеводороды: хлорбензол, толуол, ксилол и тому подобное;
насыщенные углеводороды: циклогексан, гексан и тому подобное;
амиды: N, N–диметилформамид, N–метилпирролидон и тому подобное;
галогенированные углеводороды: дихлорметан, терахлорид углерода и тому подобное;
нитрилы: ацетонитрил и тому подобное;
сульфоксиды: диметилсульфоксид и тому подобное;
ароматические органические основания: пиридин и тому подобное;
ангидриды кислот: уксусный ангидрид и тому подобное;
органические кислоты: муравьиная кислота, уксусная кислота, трифторуксусная кислота и тому подобное;
неорганические кислоты: хлористоводородная кислота, серная кислота и тому подобное;
сложные эфиры: этилацетат и тому подобное;
кетоны: ацетон, метилэтилкетон и тому подобное; и
вода.
Указанные растворители могут быть использованы в комбинации двух или более растворителей в подходящем соотношении.
[0080]
При использовании основания в реакции на каждой стадии, примеры основания, которое можно использовать, включают основание, описанное в примерах, или следующие основания.
Неорганические основания: гидроксид натрия, гидроксид магния и тому подобное;
основные соли: карбонат натрия, карбонат кальция, бикарбонат натрия и тому подобное;
органические основания: триэтиламин, диэтиламин, пиридин, 4–диметиламинопиридин, N, N–диметиланилин, 1,4–диазабицикло[2.2.2]октан, 1,8–диазабицикло[5.4.0]–7–ундецен, имидазол, пиперидин и тому подобное;
алкоксиды металлов: этоксид натрия, трет–бутоксид калия и тому подобное;
гидриды щелочных металлов: гидрид натрия и тому подобное;
амиды металлов: амид натрия, диизопропиламид лития, гексаметилдисилазид лития и тому подобное; и
литийорганические соединения: н–бутиллитий и тому подобное.
[0081]
При использовании кислоты или кислотного катализатора в реакции на каждой стадии, примеры кислот или кислотного катализатора, которые могут быть использованы, включают кислоту или кислотные катализаторы, описанные в примерах, или следующие кислоты или кислотные катализаторы:
Неорганические кислоты: хлористоводородная кислота, серная кислота, азотная кислота, бромистоводородная кислота, фосфорная кислота и тому подобное;
органические кислоты: уксусная кислота, трифторуксусная кислота, лимонная кислота, п–толуолсульфоновая кислота, 10–камфорсульфоновая кислота и тому подобное; и
кислоты Льюиса: комплекс трифторид бора–диэтиловый эфир, йодид цинка, безводный хлорид алюминия, безводный хлорид цинка, безводный хлорид железа и тому подобное.
[0082]
Реакцию на каждой стадии, если не указано иное, осуществляют в соответствии с хорошо известным способом, например, способом, описанным в "Jikken Kagaku Kouza (Series of experimental chemistry), 5th Edition", Volume 13 to Volume 19 (edited by The Chemical Society of Japan); "Shin Jikken Kagaku Kouza (New series of experimental chemistry)", Volume 14 to Volume 15 (edited by The Chemical Society of Japan); "Seimitsu Yuki Kagaku (Fine Organic Chemistry), Revised 2nd Edition" (L. F. Tietze, Th. Eicher, Nankodo Co., Ltd.); "Organic named reactions: the reaction mechanism and essence", Revised version (written by Togo Hideo, KODANSHA LTD.); "ORGANIC SYNTHESES", Collective Volume I–VII (John Wiley & Sons Inc.; Modern Organic Synthesis in the Laboratory A Collection of Standard Experimental Procedures (written by Jie Jack Li, published by OXFORD UNIVERSITY); "Comprehensive Heterocyclic Chemistry III", Vol. 1 to Vol. 14 (Elsevier Japan Co., Ltd.); "Strategic applications of named reactions in organic synthesis" (translation supervised by Tomioka Kiyoshi, published by Kagaku–Dojin Publishing Co., Inc); "Comprehensive Organic Transformations" (VCH Publishers Inc.) опубликованный в 1989; или тому подобное, или способом, описанным в примерах.
[0083]
Реакцию введения или удаления защитной функциональной группы на каждой стадии осуществляют в соответствии с хорошо известным способом, например, способом, описанным в "Protective Groups in Organic Synthesis, 4th Ed." (written by Theodora W. Greene, Peter G. M. Wuts), published by Wiley–Interscience, 2007; "Protecting Groups 3rd Ed." (written by P. J. Kocienski) published by Thieme Corporation, 2004; или тому подобное, или способом, описанным в примерах.
Примеры защитных групп для гидроксильной группы, такой как в спирте или фенольной гидроксильной группы, включают защитные группы типа простого эфира, такие как метоксиметиловый эфир, бензиловый эфир, трет–бутилдиметилсилиловый эфир или тетрагидропираниловый эфир; защитные группы карбоксиэфирного типа, такие как ацетат; защитные группы типа сложного эфира сульфоновой кислоты, такие как сложный эфир метансульфоновой кислоты; защитные группы карбонатного типа, такие как трет–бутилкарбонат.
[0084]
Примеры защитных групп для карбонильной группы в альдегиде включают защитные группы типа ацеталя, такие как диметилацеталь; и защитные группы типа циклического ацеталя, такие как циклический 1,3–диоксан.
[0085]
Примеры защитных групп для карбонильной группы кетона включают защитные группы типа кеталя, такие как диметилкеталь; защитные группы типа циклического кеталя, такие как циклический 1,3–диоксан; защитные группы типа оксима, такие как O–метилоксим; и защитные группы типа гидразона, такие как N, N–диметилгидразон.
[0086]
Примеры защитных групп для карбоксильной группы включают защитные группы типа сложного эфира, такие как метиловый сложный эфир; и защитные группы типа амида, такие как N, N–диметиламид.
Примеры защитных групп для тиола включают защитные группы типа простого эфира, такие как бензилтиоэфир; и защитные группы типа сложного эфира, такие как тиоацетат, тиокарбонат, тиокарбамат.
[0087]
Примеры защитной группы для аминогруппы или ароматического гетероцикла, такого как имидазол, пиррол и индол, включают защитную группу карбаматного типа, такую как бензилкарбамат; защитную группу амидного типа, такую как ацетамид; защитную группу алкиламинового типа, такую как N–трифенилметиламин; и защитную группу сульфонамидного типа, такую как метансульфонамид.
[0088]
Защитная группа может быть удалена известным способом, например, способом с использованием кислоты, основания, ультрафиолетового излучения, гидразина, фенилгидразина, натрий N–метилдитиокарбамата, фторида тетрабутиламмония, ацетата палладия, триалкилсилил галогенида (например, триметилсилил йодид, триметилсилил бромид) и способом восстановления.
[0089]
В случае осуществления реакции восстановления, на каждой стадии примеры используемого восстанавливающего агента включают гидриды металлов, такие как литийалюминийгидрид, натрий триацетоксиборгидрид, натрий цианоборгидрид, диизобутилалюминийгидрид (DIBAL–H), боргидрид натрия, триацетоксиборгидрид тетраметиламмония; бораны, такие как комплекс боран–тетрагидрофуран; никель Ренея; кобальт Ренея; водород; и муравьиная кислота. При восстановлении углерод–углеродной двойной связи или тройной связи может быть использован способ с использованием катализатора, такого как палладий–углерод или катализатор Линдлара.
[0090]
В случае осуществления реакции окисления, на каждой стадии примеры используемого окислительного агента включают перкислоты, такие как м–хлорпероксибензойная кислота (MCPBA), пероксид водорода, трет–бутилгидропероксид; перхлораты, такие как тетрабутиламмония перхлорат; хлораты, такие как хлорат натрия; хлориты, такие как хлорит натрия; периодные кислоты, такие как перйодат натрия; реагенты йода высокой валентности, такие как йодосилбензол; реагенты, содержащие марганец, такие как диоксид марганца, перманганат калия; соединения свинца, такие как тетраацетат свинца; хромсодержащие реагенты, такие как пиридиния хлорхромат (PCC), пиридиния дихромат (PDC), реагенты Джонса; соединения галогенов, такие как N–бромсукцинимид (NBS); кислород; озон; комплекс триоксид серы–пиридин; тетраоксид осмия; диоксид селена; и 2,3–дихлор–5,6–дициано–1,4–бензохинон (DDQ).
[0091]
В случае осуществления реакции радикальной циклизации, на каждой стадии примеры используемых радикальных инициаторов включают азо соединения, такие как азобисизобутиронитрил (AIBN); водорастворимые радикальные инициаторы, такие как 4–4'–азобис–4–цианопентановая кислота (ACPA); триэтилборон в присутствии воздуха или кислорода; и бензоилпероксид. Кроме того, примеры используемого реагента радикальной реакции включают трибутилстаннан, трис–триметилсилилсилан, 1,1,2,2–тетрафенилдисилан, дифенилсилан и йодид самария.
[0092]
В случае осуществления реакции Виттига, на каждой стадии примеры используемого реагента Виттига включают алкилиденфосфораны. Алкилиденфосфораны могут быть получены известным способом, например, взаимодействием соли фосфония с сильным основанием.
[0093]
В случае осуществления реакции Хорнера–Эммонса, на каждой стадии примеры используемых реагентов включают сложные эфиры фосфоноуксусной кислоты, такие как метилдиметилфосфоноацетат, этилдиэтилфосфоноацетат; и основания, такие как гидриды щелочных металлов, литийорганические соединения.
[0094]
В случае осуществления реакции Фриделя–Крафтса, на каждой стадии примеры используемых реагентов включают кислоту Льюиса и хлорангидрид кислоты или алкилирующие агенты (например, алкил галогениды, спирты и олефины). Альтернативно, вместо кислоты Льюиса могут быть использованы органические кислоты или неорганические кислоты, и вместо хлорангидрида кислоты может быть использован ангидрид кислоты, такой как уксусный ангидрид.
[0095]
В случае реакции ароматического нуклеофильного замещения, на каждой стадии примеры реагентов, которые можно использовать, включают нуклеофилы (например, амины, имидазол) и основания (например, основные соли, органические основания).
[0096]
В случае осуществления реакции нуклеофильного присоединения с карбанионом, нуклеофильной реакции 1,4–присоединения с карбанионом (реакция присоединения Михаэля) или реакции нуклеофильного замещения с карбанионами, на каждой стадии примеры используемого основания для образования карбаниона включают литийорганические соединения, алкоксиды металлов, неорганические основания и органические основания.
[0097]
В случае осуществления реакции Гриньяра, на каждой стадии примеры используемого реактива Гриньяра включают арилмагнийгалогениды, такие как фенилмагнийбромиды; и алкил магний галогениды, такие как метилмагнийбромиды. Реактив Гриньяра может быть получен хорошо известным способом, например, путем взаимодействия алкилгалогенида или арилгалогенида с металлическим магнием в присутствии простого эфира или тетрагидрофурана в качестве растворителя.
[0098]
В случае осуществления реакции конденсации Кневенагеля, на каждой стадии примеры реагентов, которые можно использовать, включают соединение, имеющее активный метилен, расположенный между двумя электроноакцепторными группами (например, малоновая кислота, диэтилмалонат или малононитрил) и основанием (например, органические основания, алкоксиды металлов, неорганические основания).
[0099]
В случае осуществления реакции Вильсмайера–Хаака, на каждой стадии примеры используемых реагентов включают фосфорилхлорид и производное амида (например, N, N–диметилформамид).
[0100]
В случае осуществления реакции азидирования спиртов, алкилгалогенидов или сульфонатов, на каждой стадии примеры используемого агента азидирования включают дифенилфосфорилазид (DPPA), триметилсилилазид и азид натрия. Например, при осуществлении азидирования спиртов можно использовать способ с использованием дифенилфосфорилазида и 1,8–диазабицикло[5,4,0]ундец–7–ена (DBU) и способ с использованием триметилсилил азида и кислоты Льюиса.
[0101]
В случае осуществления реакции восстановительного аминирования, на каждой стадии примеры используемого восстанавливающего агента включают триацетоксиборгидрид натрия, цианоборгидрид натрия, водород и муравьиную кислоту. Когда субстрат представляет собой соединение амина, примеры используемого карбонильного соединения включают альдегиды, такие как параформальдегид и ацетальдегид, и кетоны, такие как циклогексанон. Когда субстрат представляет собой карбонильное соединение, примеры используемых аминов включают первичные амины, такие как аммиак и метиламин; вторичные амины, такие как диметиламины.
[0102]
В случае осуществления реакции Мицунобу, на каждой стадии примеры реагента, который можно использовать, включают сложные эфиры азодикарбоновой кислоты (например, диэтилазодикарбоксилат (DEAD), диизопропил азодикарбоксилат (DIAD) и трифенилфосфин.
[0103]
В случае осуществления реакции этерификации, реакции амидирования или реакции образования мочевины, на каждой стадии примеры используемых реагентов включают ацилгалогениды, такие как хлорангидрид кислоты и бромиды кислот; и активированные карбоновые кислоты, такие как ангидриды кислот, активный сложный и сульфатные эфиры. Примеры активатора для карбоновых кислот включают карбодиимидные конденсирующие агенты, такие как 1–этил–3–(3–диметиламинопропил)карбодиимид гидрохлорид (WSCD); триазиновые конденсирующие агенты, такие как 4–(4,6–диметокси–1,3,5–триазин–2–ил)–4–метилморфолиния хлорид–н–гидрохлорид (DMT–MМ); конденсирующие агенты на основе карбоната, такие как 1,1–карбонилдиимидазол (CDI); дифенилфосфорилазид (DPPA); соль бензотриазол–1–илокси–трисдиметиламинофосфония (реагент BOP); 2–хлор–1–метил–пиридиния йодид (реагент Мукаяма); тионилхлорид; низший алкилгалогенформиаты, такие как этилхлорформиат; O–(7–азабензотриазол–1–ил)–N, N,N',N'–тетраметилурония гексафторфосфат (HATU); серная кислота; их сочетания. В случае использования карбодиимидного конденсирующего агента в реакционную смесь могут быть, кроме того, добавлены добавки, такие как 1–гидроксибензотриазол (HOBt) и N–гидроксисукцинимид (HOSu), диметиламинопиридин (DMAP).
[0104]
В случае осуществления реакции сочетания, на каждой стадии примеры используемого металлического катализатора включают соединения палладия, такие как ацетат палладия(II), тетракис(трифенилфосфин)палладий(0), дихлорбис(трифенилфосфин)палладий(II), дихлорбис(триэтил)фосфин палладий(II), трис(дибензилиденацетон)дипалладий(0), хлорид 1,1'–бис(дифенилфосфино)ферроцен палладия(II) и ацетат палладия(II); соединения никеля, такие как тетракис(три)фенилфосфин)никель(0); соединения родия, такие как трис(трифенилфосфин)родий(III) хлорид; соединения кобальта; соединения меди, такие как оксид меди и йодид меди(I); и соединения платины. Кроме того, к реакции может быть добавлено основание, и примеры такого основания включают неорганические основания и основные соли.
[0105]
В случае осуществления реакции тиокарбонилирования, на каждой стадии типичные примеры агента тиокарбонилирования, который можно использовать, включают пентасульфид дифосфора, но вместо пентасульфида дифосфора может быть использован реагент, имеющий структуру 1,3,2,4–дитиадифосфетан–2,4–дисульфида, такой как 2,4–бис(4–метоксифенил–1,3,2,4–дитиадифосфетан–2,4–дисульфид (реагент Лавессона).
[0106]
В случае осуществления реакции Воля–Циглера, на каждой стадии примеры используемого галогенирующего агента включают N–йодсукцинимид, N–бромсукцинимид (NBS), N–хлорсукцинимид (NCS), бром и сульфурилхлорид. Кроме того, реакция может быть ускорена путем добавления к реакции воздействия нагревания, света или инициатора радикальной полимеризации, такого как пероксид бензоила и азобисизобутиронитрил.
[0107]
В случае осуществления реакции галогенирования гидроксигруппы, на каждой стадии примеры используемых галогенирующих агентов включают галогенангидридное соединение галоидоводородной кислоты и неорганической кислоты. В частности, в случае хлорирования примеры галогенангидрида кислоты включают хлористоводородную кислоту, тионилхлорид или оксихлорид фосфора, а в случае бромирования примеры галогенангидрида кислоты включают 48% бромистоводородную кислоту. Альтернативно, может быть использован способ получения алкилгалогенида из спирта путем воздействия, например, трифенилфосфина и четыреххлористого углерода или четырехбромистого углерода. Еще альтернативно, может быть использован способ синтеза алкилгалогенида посредством двухстадийной реакции, включающий преобразование спирта в сульфонат и затем взаимодействие сульфоната с бромидом лития, хлоридом лития или йодидом натрия.
[0108]
В случае осуществления реакции Арбузова, на каждой стадии примеры используемых реагентов включают алкилгалогениды, такие как этилбромацетат; и фосфиты, такие как триэтилфосфит и три(изопропил)фосфит.
[0109]
В случае осуществления реакции сульфоновой этерификации, на каждой стадии примеры используемого сульфонирующего агента включают метансульфонилхлорид, п–толуолсульфонилхлорид, метансульфоновый ангидрид, п–толуолсульфоновый ангидрид.
[0110]
В случае осуществления реакции гидролиза, на каждой стадии примеры реагента, который можно использовать, включают кислоту или основание. Кроме того, при осуществлении кислотного гидролиза трет–бутилового эфира, для восстановительного улавливания побочных продуктов трет–бутилового катиона могут быть добавлены муравьиная кислота, триэтилсилан или тому подобное.
[0111]
В случае осуществления реакции дегидратации, на каждой стадии примеры используемого дегидратирующего агента включают серную кислоту, дифосфор пентаоксид, оксихлорид фосфора, N, N'–дициклогексилкарбодиимид, оксид алюминия и полифосфорную кислоту.
[0112]
[формула реакции 1]
Соединение (1) может быть получено путем реакции амидирования с использованием соединений (2) и (3).
[0113]
[Формула 4]
где каждый символ имеет значение, определенное выше.
[0114]
Соединения (2) и (3), каждое, может быть коммерчески доступным реагентом или может быть получено в соответствии с хорошо известным способом.
[0115]
[формула реакции 2]
Соединение (3–1) можно получить из соединений (4) и (5) следующим способом.
[0116]
[Формула 5]
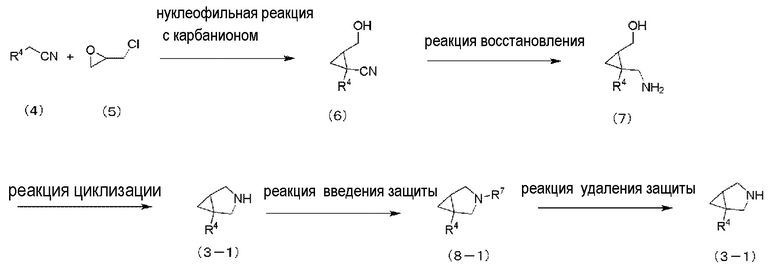
где R7 представляет собой защитную группу для аминогруппы, и другие символы имеют значения, определенные выше.
[0117]
Соединение (3–1) может быть получено с помощью реакции циклизации путем активации соединения (7) тионилхлоридом или тому подобным и затем взаимодействия активированного соединения с основанием.
[0118]
Соединение (3–1) также можно получить реакцией удаления защиты с (8–1), полученного реакцией защиты неочищенного вещества (3–1).
Соединения (4) и (5), каждое, может быть коммерчески доступным реагентом или может быть получено в соответствии с хорошо известным способом.
[0119]
[формула реакции 3]
Соединение (3–2) может быть получено из соединений (9) и (10) или соединений (12) и (13) следующим способом.
[0120]
[Формула 6]
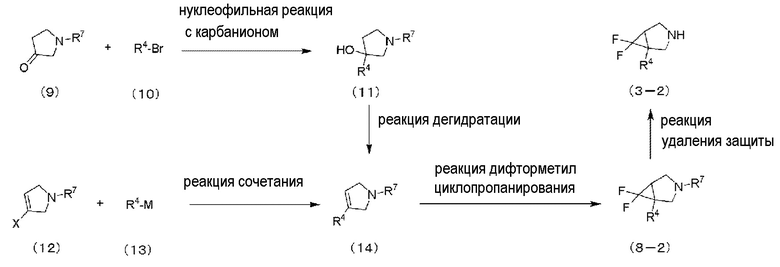
где Х представляет собой хлор, бром, йод или трифлат, М представляет собой необязательно замещенный металл, и другие символы имеют значения, определенные выше.
[0121]
Соединение (14) можно получить реакцией дегидратации, активируя соединение (11) с метансульфонилхлоридом или тому подобным, и затем путем взаимодействия активированного соединения с основанием.
[0122]
Соединение (14) также можно получить реакцией сочетания соединений (12) и (13).
[0123]
Соединение (8–2) можно получить реакцией дифторметил циклопропанирования соединения (14). Примеры дифторметил циклопропанирующих агентов включают комбинацию (трифторметил)триметилсилана и йодида натрия.
[0124]
Соединения (9), (10), (12) и (13), каждое, может быть коммерчески доступным реагентом или может быть получено в соответствии с хорошо известным способом.
[0125]
Когда соединение (I) имеет оптический изомер, стереоизомер, региоизомер или ротамер, они также могут быть включены в виде соединения (I) или, альтернативно, каждое из них может быть получено в виде отдельного продукта с помощью хорошо известного способа синтеза или способа разделения (например, концентрация, экстракция растворителем, колоночная хроматография или рекристаллизация). Например, когда соединение (I) имеет оптический изомер, оптический изомер, выделенный из соединения, также охватывается как соединение (I).
[0126]
Оптические изомеры могут быть получены хорошо известным способом. В частности, оптический изомер получают с использованием оптически активного синтетического промежуточного соединения или оптического расщепления рацемата конечного продукта в соответствии с общепринятым способом.
[0127]
Примеры способа оптического расщепления, который можно использовать, включают хорошо известный способ, такой как способ фракционной рекристаллизации, способ хиральной колоночной хроматографии или способ получения диастереомера.
[0128]
1) Способ фракционной рекристаллизации
Способ получения соли рацемата и оптически активного соединения (например, (+)–миндальная кислота, (–)–миндальная кислота, (+)–винная кислота, (–)–винная кислота, (+)–1–фенетиламин, (–)–1–фенетиламин, цинхонин, (–)–цинхонидин или бруцин), отделение соли методом фракционной рекристаллизации и, по желанию, проведение стадии нейтрализации для получения свободного оптического изомера.
[0129]
2) Способ хиральной колоночной хроматографии
Способ разделения рацемата или его соли с помощью колонки для разделения оптических изомеров (хиральная колонка). Например, при использовании жидкостной хроматографии, смесь оптических изомеров добавляют в хиральную колонку, такую как ENANTIO–OVM (производства Tosoh Corp.) или серии CHIRAL (производства Daicel Chemical Industries Ltd.), а затем разрабатывается с использованием раствора воды, различных буферных растворов (например, фосфорный буферный раствор) или органического растворителя (например, этанол, метанол, 2–пропанол, ацетонитрил, трифторуксусная кислота, диэтиламин) отдельно или в комбинации для разделения оптических изомеров. Кроме того, когда используется газовая хроматография, для разделения оптических изомеров используют хиральную колонку, такую как CP–Chirasil–DeX CB (производства GL Sciences Inc.).
[0130]
3) Способ получения диастереомера
Способ превращения смеси рацематов в смесь диастереомеров путем химической реакции с использованием оптически активного реагента; подвергание смеси диастереомеров общепринятым способам разделения (например, фракционной рекристаллизации или хроматографии) с получением одного вещества; подвергание вещества химической обработке, такой как гидролиз; и отсечение оптически активного участка реагента для получения оптического изомера. Например, когда соединение (I) имеет гидрокси или первичную или вторичную аминогруппу в молекуле, соединение подвергают реакции конденсации с оптически активной органической кислотой (например, MTPA [α–метокси–α–(трифторметил)фенилуксусная кислота] или (–)–ментоксиуксусная кислота) с получением каждого диастереомера в форме сложного эфира или в форме амида. С другой стороны, когда соединение имеет карбоксигруппу, соединение (I) подвергают реакции конденсации с оптически активным реагентом амином или спиртом с получением каждого диастереомера в форме амида или в форме сложного эфира. Разделенные диастереомеры превращают в оптические изомеры исходного соединения, подвергая диастереомеры кислотному гидролизу или основному гидролизу.
[0131]
Соединение (I) может быть кристаллом.
Кристалл соединения (I) может быть получен путем кристаллизации соединения (I) хорошо известным способом кристаллизации.
[0132]
Примеры способа кристаллизации включают способ кристаллизации из раствора, способ кристаллизации из пара и способ кристаллизации из расплава.
[0133]
«Способ кристаллизации из раствора» обычно представляет собой способ перехода из ненасыщенного состояния в пересыщенное состояние путем изменения факторов, связанных с растворимостью соединения (композиция растворителя, pH, температура, ионная сила, окислительно–восстановительный статус и тому подобное) или количества растворителя. Конкретные примеры способа включают метод концентрирования, метод медленного охлаждения, метод реакции (метод диффузии, метод электролиза), метод гидротермального культивирования и метод с веществом, понижающим температуру замерзания. Примеры растворителя, который можно использовать, включают ароматические углеводороды (например, бензол, толуол, ксилол), галогенированные углеводороды (например, дихлорметан, хлороформ), насыщенные углеводороды (например, гексан, гептан, циклогексан), простые эфиры (например, диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан), нитрилы (например, ацетонитрил), кетоны (например, ацетон), сульфоксиды (например, диметилсульфоксид), амиды кислот (например, N, N–диметилформамид), сложные эфиры (например, этилацетат), спирты (например, метанол, этанол, 2–пропанол) и воду. Эти растворители можно использовать отдельно или в комбинации двух или более в подходящем соотношении (например, от 1:1 до 1:100 (объемное соотношение)). Кроме того, затравочные кристаллы могут быть использованы по мере необходимости.
[0134]
Примеры «способа кристаллизации из пара» включают метод испарения (метод уплотнения, метод воздушного потока), метод реакции в паровой фазе и метод химического транспорта.
[0135]
Примеры «метода кристаллизации из расплава» включают метод нормального замораживания (метод вытягивания, метод температурного градиента, метод Бриджмена), способ зональной плавки (метод зонного выравнивания, метод зонной плавки), специальный метод выращивания (метод VLS, метод жидкофазной эпитаксии).
[0136]
Предпочтительные примеры способа кристаллизации включают способ растворения соединения (I) в подходящем растворителе (например, спирте, таком как метанол и этанол) при температуре от 20 до 120°C и охлаждении полученного раствора до температуры при растворении или более низкой температуры (например, от 0°C до 50°C,, предпочтительно 0°C до 20°C).
[0137]
Кристаллы настоящего изобретения, полученные таким образом, могут быть выделены, например, фильтрацией.
[0138]
В качестве метода анализа полученных кристаллов обычно используют метод анализа кристалла с помощью порошковой рентгеновской дифракции. Примеры способа определения ориентации кристалла включают механический метод или оптический метод.
[0139]
Ожидается, что кристалл соединения (I), полученный указанным выше способом получения, будет очень чистым и высококачественным, с низкой гигроскопичностью, не разрушаться даже при длительном хранении в обычных условиях и будет иметь превосходную стабильность. Кристалл соединения (I) также обладает превосходными биологическими свойствами (например, фармакокинетикой in vivo (абсорбция, распределение, метаболизм, выведение) и лекарственной эффективностью) и может быть полезен в качестве лекарственного средства.
[0140]
Пролекарство соединения (I) относится к соединению, которое превращается в соединение (I) путем реакции с ферментом или желудочной кислотой или тому подобным в физиологических условиях in vivo. Другими словами, пролекарство соединения (I) относится к соединению, которое подвергается ферментативному окислению, восстановлению, гидролизу или тому подобному для превращения в соединение (I), или соединению, которое гидролизуется желудочной кислотой или тому подобным для превращения в соединение (I). Примеры пролекарства соединения (I) включают соединение, в котором аминогруппа соединения (I) ацилирована, алкилирована или фосфорилирована [например, соединение, в котором аминогруппа соединения (I) эйкозаноилирована, аланилирована, пентиламинокарбонилирована, (5–метил–2–оксо–1,3–диоксолен–4–ил)метоксикарбонилирована, тетрагидрофуранилирована, пирролидилметилирована, пивалоилоксиметилирована или трет–бутилирована]; соединение, в котором гидроксильная группа соединения (I) ацилирована, алкилирована, фосфорилирована или борирована (например, соединение, в котором гидроксильная группа соединения (I) ацетилирована, пальмитоилирована, пропаноилирована, пивалоилирована, сукцинилирована, фумарилирована, аланилирована или диметиламинометилкарбонилирована); соединение, в котором карбоксильная группа соединения (I) этерифицирована или амидирована [например, соединение, в котором карбоксильная группа соединения (I) этилэтерифицирована, фенилэтерифицирована, карбоксиметилэтерифицирована, диметиламинометилэтерифицирована, пивалоилоксиметилэтерифицирована, этоксикарбонилоксиэтилэтерифицирована, фталидилэтерифицирована, (5–метил–2–оксо–1,3–диоксолен–4–ил)метилэтерифицирована и циклогексилоксикарбонилэтилэтерифицирована, метиламидирована]. Эти соединения могут быть получены из соединения (I) хорошо известным способом.
[0141]
Пролекарство соединения (I) также может быть пролекарством, которое превращается в соединение (I) в физиологических условиях, как описано в "Pharmaceutical research and development", volume 7, molecular design, pp. 163–198, 1990, published by Hirokawa–Shoten Ltd.
[0142]
Как используется в настоящем документе, соединение (I) и пролекарство соединения (I) иногда вместе обозначают как «соединение по настоящему изобретению».
[0143]
Соединение (I) может быть несольватом или сольватом. Растворителем сольвата может быть растворитель, такой как этанол или вода. Когда включенный растворитель представляет собой воду, сольват представляет собой гидрат. Гидрат включает не только стехиометрический гидрат, но также гидрат, содержащий различные количества воды.
[0144]
Соединение (I) может быть мечено изотопами (например, 3H, 13C, 14C, 18F, 35S, 125I) или тому подобным, и соединения, меченные или замещенные с изотопами, могут быть использованы, например, в позитронно–эмиссионной томографии (PET) как трассеры (ПЭТ–трассеры) и могут быть полезны в области медицинской диагностики и тому подобного.
[0145]
Кроме того, соединения дейтерия, в которых 1Н преобразован в 2H(D), также охватываются соединением (I). Таутомеры также охватываются соединением (I).
[0146]
Соединение (I) может представлять собой фармацевтически приемлемый сокристалл или сокристаллическую соль. Сокристалл или сокристаллическая соль относится к кристаллическому веществу, состоящему из двух или более отдельных веществ, которые являются твердыми при комнатной температуре, причем каждое из твердых веществ имеет различные физические свойства (например, структура, температура плавления, теплота плавления, гигроскопичность, растворимость и стабильность). Сокристалл и сокристаллическая соль могут быть получены хорошо известным способом сокристаллизации.
[0147]
Соединение (I) обладает превосходной антагонистической активностью в отношении кальцийчувствительных рецепторов.
[0148]
Соединение (I) имеет низкую токсичность и может безопасно вводиться млекопитающим (например, людям, крысам, мышам, собакам, кроликам, кошкам, крупному рогатому скоту, лошадям, свиньям).
[0149]
Таким образом, лекарственное средство, включающее соединение по настоящему изобретению, представляет собой антагонист кальцийчувствительного рецептора и, как ожидается, будет полезным для профилактики или лечения заболеваний, с которыми связан кальцийчувствительный рецептор, таких как сердечная недостаточность; легочная гипертензия; гипертиреоз; гипокальциемия; остеоартропатия (например, постменопаузальный остеопороз, старческий остеопороз, вторичный остеопороз, остеомаляция, почечная остеодистрофия, переломы, остеоартрит, ревматоидный артрит, остеосаркома, миелома); и заболевания центральной нервной системы.
[0150]
Применение соединения по настоящему изобретению для профилактики или лечения сердечной недостаточности будет описано более подробно.
[0151]
Клинические состояния сердечной недостаточности классифицированы Нью–Йоркской кардиологической ассоциацией (NYHA) на четыре категории, как показано в таблице 1, в зависимости от степени тяжести.
[0152]
[Таблица 1]
Таблица 1: Классификация NYHA сердечной недостаточности
Ежедневная физическая активность не вызывает значительной усталости, сердцебиение, одышку или стенокардическую боль.
Ежедневная физическая активность вызывает усталость, сердцебиение, одышку или стенокардическую боль.
Физической активности меньше обычной вызывает усталость, сердцебиение, одышку или стенокардическую боль.
Симптомы сердечной недостаточности или стенокардическая боль, даже в состоянии покоя. Эти симптомы ухудшаются даже при небольшой нагрузке.
*функциональный класс IIs: Незначительное ограничение физической активности
функциональный класс IIm: Умеренное ограничение физической активности
[0153]
Клинические состояния также классифицируются в соответствии с классификацией функциональных классов AHA/ACC (Американская кардиологическая ассоциация/Американская коллегия кардиологов) на четыре категории, как показано в таблице 2, в зависимости от степени тяжести.
[0154]
[Таблица 2]
Таблица 2: Классификация функциональных классов AHA/ACC сердечной недостаточности
[0155]
Отношение соответствия между классификацией NYHA и классификацией AHA/ACC функциональных классов обычно рассматривается, как показано в следующей таблице 3.
[0156]
[Таблица 3]
Таблица 3: Отношение соответствия между классификацией NYHA и классификацией AHA/ACC функциональных классов
[0157]
Соединение по настоящему изобретению также используют в качестве средства для профилактики или лечения сердечной недостаточности, снижения сердечного выброса, ишемической сердечной недостаточности или неишемической сердечной недостаточности, декомпенсированной сердечной недостаточности, острой сердечной недостаточности и острой декомпенсированной сердечной недостаточности, как определено вышеупомянутыми отчетами.
Соединение по настоящему изобретению также можно использовать для улучшения уменьшения фракции выброса или увеличения фракции выброса у субъекта, страдающего сердечной недостаточностью.
Кроме того, соединение по настоящему изобретению может также подавлять ухудшение сердечной функции или подавлять прогрессирование ухудшения у субъекта, страдающего сердечной недостаточностью. Соединение по настоящему изобретению также может снижать нагрузку на сердце, может подавлять гипертрофию сердца, может подавлять интерстициальный фиброз и может подавлять увеличение апоптоза у субъекта, страдающего сердечной недостаточностью.
[0158]
Применение соединения по настоящему изобретению для профилактики или лечения легочной гипертензии будет описано более подробно.
[0159]
Критерии определения легочной гипертензии описаны, например, в Guideline for the Treatment of Pulmonary Hypertension (Revised, 2012) by the Japanese Circulation Society.
[0160]
Диагноз легочной гипертензии у людей обычно ставится на основании среднего давления в легочной артерии (среднего PAP), измеренного катетеризацией правого сердца в покое, и диагноз легочной гипертензии может быть поставлен, если среднее давление в легочной артерии составляет 25 мм рт.ст. или более. Развитие эхокардиографии сердца в последние годы позволило неинвазивно оценивать артериальное давление легких, а диагностика легочной гипертензии иногда проводится на основе оценок артериального давления легких.
[0161]
Легочная гипертензия клинически классифицируется на пять групп от 1 группы до 5 группы по классификации Dana Point. Группа 1 включает легочную артериальную гипертензию (ЛАГ), группа 2 включает легочную гипертензию вследствие заболеваний левых отделов сердца, группа 3 включает легочную гипертензию с заболеванием легких и/или гипоксемией, группа 4 включает хроническую тромбоэмболическую легочную гипертензию, и группа 5 включает легочную гипертензию, вызванную сочетанием неуточненных факторов. В качестве подтипов группы 1 известны группа 1' (эмболия легочной вены и/или легочный капиллярный гемангиоматоз) и группа 1" (неонатальная прогрессирующая легочная гипертензия).
[0162]
Легочная артериальная легочная гипертензия в группе 1 является наиболее типичной легочной гипертензией и приблизительно классифицируется на спонтанную ЛАГ, наследственную ЛАГ, ЛАГ, вызванную лекарственными средствами/токсинами, и ЛАГ, связанную с каждым заболеванием.
[0163]
Соединение по настоящему изобретению можно использовать в качестве средства для профилактики или лечения легочной гипертензии, как определено вышеупомянутыми отчетами. Соединение по настоящему изобретению также может ослаблять различные симптомы (такие как повышенное давление в правом желудочке), связанные с легочной гипертензией, например, снижением легочного артериального давления у субъекта.
[0164]
Соединение по настоящему изобретению можно использовать для профилактики или лечения заболеваний сердца, таких как кардиомиопатия и аритмия.
[0165]
Соединение по настоящему изобретению может быть использовано для кардиомиопатий, описанных ниже, в качестве средства для профилактики или лечения гипертрофии миокарда, ремоделирования миокарда, повреждения кардиомиоцитов, возникновения аритмии, нарушения функции сердечного насоса или внезапной смерти.
[0166]
Существует несколько классификаций кардиомиопатии, которые определены предложениями (i) WHO/ISFC (1995), (ii) Американской кардиологической ассоциации (AHA, 2006), (iii) Европейского общества кардиологов (ESC, 2008), например. Описания типа кардиомиопатии приведены ниже.
[0167]
(i) Предложения WHO/ISFC на 1995 (Таблица 4)
В предложении WHO/ISFC (1995) кардиомиопатии определяются как «заболевания миокарда, связанные с сердечной дисфункцией». На основании клинического состояния кардиомиопатии подразделяются на типы: 1) дилатационная кардиомиопатия, 2) гипертрофическая кардиомиопатия, 3) рестриктивная кардиомиопатия, 4) аритмогенная правожелудочковая кардиомиопатия и 5) неклассифицированная кардиомиопатия. Кроме того, заболевания миокарда, которые имеют конкретную причину или явно связаны с причинами или системными заболеваниями, классифицируются как специфическая кардиомиопатия. Примеры специфической кардиомиопатии включают кардиомиопатию, связанную с ишемией (такой как стенокардия, инфаркт миокарда), аномалией клапанов сердца (такой как порок сердца), гипертензией, воспалением (таким как вызванный инфекцией, миокардит), метаболизмом (таким как дисфункция щитовидной железы, эндокринные заболевания, такие как как адренокортикальная дисфункция, амилоидоз, пищевые расстройства, гликогеноз, наследственные метаболические расстройства, такие как болезнь Фабри), гиперчувствительностью/интоксикацией (например, алкогольная кардиомиопатия, лекарственная, радиологическая), послеродовым периодом (таким как дисрегуляция беременности и родов), миодистрофией (такой как анкилозирующая мышечная атрофия), неврологическими и мышечными заболеваниями (такими как синдром Нунана, атаксия Фридрейха) и системными заболеваниями (такими как коллагеновая болезнь, саркоидоз, ревматоидный артрит, склеродермия).
[0168]
[Таблица 4]
Таблица 4 Определение и классификация по типу кардиомиопатий 1995 г. WHO/ISFC рабочая группа
1. дилатационная кардиомиопатия (DCМ)
2. гипертрофическая кардиомиопатия (HCМ)
3. рестриктивная кардиомиопатия (RCМ)
4. аритмогенная правожелудочковая кардиомиопатия
5. неклассифицированная кардиомиопатия
специфические кардиомиопатии
Circulation 1996, 93 841–842, modified (cited from "guidelines for diagnosis and treatment of patients with hypertrophic cardiomyopathy" (2012, пересмотренное издание))
[0169]
(ii) Предложение Американской кардиологической ассоциации (AHA, 2006) (Таблица 5)
Согласно предложению AHA (2006), кардиомиопатия определяется как «гетерогенная группа заболеваний миокарда, связанных с механической или электрической дисфункцией, которая обычно проявляется неадекватной гипертрофией или дилатацией желудочков и обусловлены множеством причин, которые часто являются генетическими." (Определения и классификация кардиомиопатий (предложение AHA) (Таблица 5)). Основываясь на месте поражения, кардиомиопатия делится на первичную кардиомиопатию, при которой поражение преимущественно ограничивается сердцем; и вторичная кардиомиопатия, при которой поражения миокарда является частью системного заболевания. Кроме того, первичная кардиомиопатия подразделяется на три типа: наследственную, приобретенную и смешанную. Примеры наследственного типа включают гипертрофическую кардиомиопатию, аритмогенную правожелудочковую кардиомиопатию, некомпактность левого желудочка, гликогенозы (PPKA2, болезнь Данона), нарушения проводимости, митохондриальную кардиомиопатию, нарушения ионных каналов (синдром удлиненного QТ, синдром Бругада, синдром Short QТ, катехоламинергическая полиморфная желудочковая тахикардия и азиатский SUNDS (синдром внезапной ночной смерти)). Примеры приобретенного типа включают воспалительную кардиомиопатию (миокардит), кардиомиопатию, индуцированную стрессом (кардиомиопатия Такоцубо), послеродовую кардиомиопатию, кардиомиопатию, индуцированную тахикардией, и кардиомиопатию младенца, рожденного от инсулинзависимой матери. Примеры смешанного типа включают дилатационную кардиомиопатию и рестриктивную кардиомиопатию (гипертрофия левого желудочка без увеличения).
[0170]
[Таблица 5]
Таблица 5: Определения и классификация кардиомиопатий (предложение AHA)
Первичные кардиомиопатии (при которых клинически значимые патологические процессы преимущественно затрагивают сердце) подразделяются на генетические, негенетические и смешанные типы.
*Преимущественно смешанный тип; семейное заболевание с генетическим происхождением было зарегистрировано в меньшинстве случаев.
Circulation 2006; 113: 1807–1816
[0171]
(iii) Предложение Европейского общества кардиологов (ESC, 2008) (Таблица 6)
Предложение ESC (2008) определяет кардиомиопатию как «нарушение миокарда, при котором сердечная мышца структурно и функционально аномальна, при отсутствии поражения коронарных артерий, гипертензии, клапанных пороков и врожденных аномалий, достаточных для того, чтобы вызвать наблюдаемую аномалию миокарда» (Таблица 6). Подобно классификации WHO/ISFC, кардиомиопатия подразделяется на 5 основных типов 1) дилатационная кардиомиопатия, 2) гипертрофическая кардиомиопатия, 3) рестриктивная кардиомиопатия, 4) аритмогенная правожелудочковая кардиомиопатия, и 5) неклассифицированная кардиомиопатия. Подобно классификации AHA, была введена концепция генетические/негенетические, и эти заболевания были классифицированы на две группы: семейные/генетические и не–семейные/не–генетические.
[0172]
[Таблица 6]
Таблица 6: Определения и классификация кардиомиопатий (предложение ESC)
ARVC: аритмогенная правожелудочковая кардиомиопатия, DCM: дилатационная кардиомиопатия, HCM: гипертрофическая кардиомиопатия, RCM: рестриктивная кардиомиопатия
Eur Heat J 2008; 29: 270–276
[0173]
Соединение по настоящему изобретению можно использовать в качестве средства для профилактики или лечения аритмии, показанного ниже, включая возникновение аритмии или внезапную смерть от аритмии.
[0174]
Аритмия, с точки зрения симптомов, примерно подразделяется на брадиаритмию и тахиаритмию. Механизм возникновения аритмии рассматривается как (i) нарушение образования импульсов и (ii) нарушение проведения импульсов (нарушение проведения возбуждения), которые в основном связаны с заболеваниями сердца. Когда сердечная мышца повреждена различными причинами (генетическая предрасположенность, воздействие окружающей среды или тому подобное), участки, где электрические сигналы легко передаются или где происходит аномальное возбуждение, генерируются в сердечной мышце локально, что приводит к аритмиям.
[0175]
Аритмия также классифицируется в соответствии с механизмом образования (причина) следующим образом.
(i) Типы аритмий вследствие нарушения образования импульсов и их основные причины
– Синусовая брадикардия (в основном, вызванная инфарктом миокарда; синдромом слабости синусового узла; гипотиреозом; желтухой (тяжелая форма); лекарственными средствами, такими как дигоксин, бета–блокаторы и антагонисты кальция; внутричерепной гипертензией; идиопатией; или тому подобное)
– Предсердная экстрасистолия (в основном вызванная гипертензивной болезнью сердца; стенокардией; инфарктом миокарда; пороком сердца; кардиомиопатией; миокардитом; сердечной недостаточностью; врожденным пороком сердца; заболеванием легких; гипертиреоз; лекарственными средствами, такими как бронхолитические средства и катехоламины; идиопатией; или тому подобное)
– Наджелудочковая пароксизмальная тахикардия (в основном, вызванная гипертиреозом; гипертензивной болезнью сердца; лекарственными средствами, такими как атропин; идиопатией; или тому подобное)
– Фибрилляция предсердий (в основном, вызванная стенозом митрального клапана; гипертиреозом; ишемической болезнью сердца; повышенным внутрипредсердным давлением; гипоксемией; синдромом синусовой недостаточности; кардиомиопатией; заболеванием легких: идиопатией (изолированной); или тому подобное)
– Трепетание предсердий (в основном, вызванное заболеванием митрального или трикуспидального клапана; легочным сердцем; коронарной болезнью сердца; кардиомиопатией; миокардитом; гипертиреозом; нарушением баланса электролитов; лекарственными средствами, такими как катехоламин; идиопатией; или тому подобное)
– Ритм атриовентрикулярного соединения (в основном, вызванный острым инфарктом миокарда; другой ишемической болезнью сердца; гипертензией; миокардитом; идиопатией; или тому подобное)
– Желудочковая экстрасистолия (в основном, вызванная острым инфарктом миокарда; кардиомиопатией; идиопатией; или тому подобное)
– Фибрилляция желудочков (в основном, вызванная острым инфарктом миокарда; кардиомиопатией; синдром WPW; синдром удлиненного QT; синдром Бругада, катехоламинергическая полиморфная желудочковая тахикардия; идиопатией; или тому подобное)
– Желудочковая тахикардия (в основном, вызванная острым инфарктом миокарда; кардиомиопатией; порок сердца; идиопатией; или тому подобное)
(ii) Типы аритмий из–за нарушение проведения импульсов и их основные причины
– Брадикардическая фибрилляция предсердий (в основном вызванная отравлением дигиталисом; идиопатией; или тому подобное)
– Синдром слабости синусового узла (в основном, вызванная старением; коронарной болезнью сердца; лекарственными средствами, такими как хинидин и дигоксин; идиопатией; или тому подобное)
– синоатриальная блокада (в основном вызвана инфарктом миокарда; окклюзией коронарной артерии; лекарственными средствами, такими как дигоксин, антиаритмические препараты, бета–блокаторы и антагонисты кальция; идиопатией; или тому подобное)
– Атриовентрикулярная блокада (в основном, вызванная острым инфарктом миокарда; пороком сердца; кардиомиопатией; лекарственными средствами, такими как дигоксин и бета–блокаторы; старением; врожденная; идиопатией; или тому подобное)
– Межжелудочковая блокада (в основном, вызванная гипертензивной болезнью сердца; инфарктом миокарда; кардиомиопатией; травмой ноги, вызванной операцией на сердце; врожденной; идиопатией; или тому подобное)
– Преждевременное сокращение желудочков (в основном вызванное отравлением дигиталисом, инфарктом миокарда, кардиомиопатией, нарушением баланса электролитов, идиопатией; или тому подобное).
[0176]
Среди этих аритмических заболеваний есть заболевания, в частности, характеризующиеся генетическими аномалиями ионных каналов миокарда или тому подобное. Эти заболевания представляют собой группу трудноизлечимых заболеваний, которые развивают фатальные аритмии и вызывают внезапную смерть в относительно молодых поколениях. Таким образом, можно ожидать, что эффективная профилактика и лечение этих заболеваний не только улучшат качество жизни пациентов, но и обеспечат социально–экономические эффекты. Примеры наследственных аритмий включают врожденный синдром удлиненного QТ, синдром укороченного QТ, синдром Бругада, катехоламинергическую полиморфную желудочковую тахикардию, прогрессирующие нарушения сердечной проводимости (семейная блокада сердца), врожденный синдром слабости синусового узла, семейная фибрилляция предсердий, аритмогенная правожелудочковая кардиомиопатия, приобретенный синдром удлиненного QТ, и синдром ранней реполяризации.
[0177]
В определенном аспекте настоящего изобретения лекарственное средство по настоящему изобретению можно использовать для профилактики и лечения легочной гипертензии, выбранной из легочной гипертензии: легочная артериальная легочная гипертензия; легочная гипертензия вследствие тромбоэмболии легочной артерии; легочная гипертензия вследствие легочного капиллярного гемангиоматоза; стойкая легочная гипертензия у новорожденных; систолическая дисфункция левого желудочка, дисплазия левого желудочка, аномалия клапанов сердца или легочная гипертензия с врожденной/приобретенной окклюзией канала притока/оттока левого сердца; хроническая обструктивная болезнь легких, интерстициальная болезнь легких, другие легочные заболевания с высокой скоростью и окклюзионными смешанными нарушениями, нарушение дыхания во сне, нарушение гиповентиляции легких, хроническое воздействие высокогорья или легочная гипертензия из–за нарушения развития; систолическая дисфункция левого желудочка, хроническая тромбоэмболическая легочная гипертензия; гематологические заболевания (хроническая гемолитическая анемия, миелопролиферативное заболевание или спленэктомия), системное заболевание (саркоидоз, легочный гистиоцитоз клеток Лангерганса, лимфангиомиома, нейрофиброматоз или васкулярное воспаление), метаболическое заболевание (гликогенозы, болезнь Гоше или заболевание щитовидной железы) и другая артериальная гипертензия, сопровождающаяся компрессией легочных сосудов (опухолевая эмболия, фиброзный медиастинит или хроническая почечная недостаточность). Лекарственное средство по настоящему изобретению предпочтительно используют для профилактики или лечения легочной артериальной легочной гипертензии.
[0178]
В дополнительном конкретном аспекте настоящего изобретения лекарственное средство по настоящему изобретению представляет собой лекарственное средство для улучшения одного или нескольких состояний, выбранных из группы, состоящей из давления в правом желудочке, давления в правом желудочке, степени выживаемости и гипертрофии сердца у субъекта, имеющего легочну гипертензию.
[0179]
Лекарственное средство по настоящему изобретению включает соединение, представленное формулой (I) или его соль. Лекарственное средство по настоящему изобретению может дополнительно включать фармацевтически приемлемый носитель и необязательно добавку к композиции, при необходимости.
[0180]
В качестве фармацевтически приемлемого носителя используют различные органические или неорганические вещества–носители, обычно используемые в качестве фармацевтических ингредиентов. Примеры таких веществ–носителей включают эксципиент, смазывающее вещество, связующее или дезинтегрант в твердых препаратах; и растворитель, суспендирующий агент, регулятор тоничности, буферный агент или успокаивающий агент в жидких препаратах. При необходимости можно также использовать добавку к композиции, такую как консервант, антиоксидант, стабилизатор, краситель или подсластитель.
[0181]
Лекарственное средство по настоящему изобретению может быть, в одном аспекте, лекарственным средством для парентерального введения или перорального введения.
[0182]
Лекарственное средство для перорального введения может представлять собой любой из твердых препаратов, таких как порошки, гранулы, таблетки или капсулы, или жидких препаратов, таких как сиропы или эмульсии.
[0183]
Лекарственное средство по настоящему изобретению может быть получено обычными способами, такими как смешивание, перемешивание, гранулирование, таблетирование, нанесение покрытия, стерилизация или эмульгирование в зависимости от формы препарата. Относительно изготовления препаратов, например, могут быть упомянуты соответствующие пункты общих правил получения в Японской Фармакопее. Лекарственное средство по настоящему изобретению также может быть составлено в виде средства с замедленным высвобождением, включающего активный ингредиент и биоразлагаемое полимерное соединение.
[0184]
Доза варьируется в зависимости от субъекта для введения, пути введения, заболевания, симптомов и т.п. Например, когда лекарственное средство по настоящему изобретению вводят с целью лечения сердечной недостаточности или легочной гипертензии, для перорального введения человеку (около 50 кг массы тела), доза может быть выбрана в диапазоне от около 0,1 мг до около 500 мг, предпочтительно от около 1 мг до около 100 мг в переводе на соединение (I); и для парентерального введения доза может быть выбрана в диапазоне от около 0,01 мг до около 100 мг, предпочтительно от около 0,1 мг до около 10 мг в переводе на соединение (I). Дозу можно вводить в виде однократной или разделенной дозы от одного до нескольких раз в день (например, от одного до трех раз в день).
[0185]
Лекарственное средство по настоящему изобретению можно использовать в комбинации с другими лекарственными средствами (комбинированные лекарственные средства).
[0186]
В определенном аспекте настоящего изобретения лекарственное средство по настоящему изобретению используется в комбинации с другими лекарственными средствами с целью лечения или профилактики сердечной недостаточности. Примеры других лекарственных средств, которые можно использовать, включают любое одно или несколько из следующих лекарственных средств:
(1) Лекарственные средства при сердечной недостаточности
(i) антагонисты бета–рецепторов: карведилол, метопролол, атенолол;
(ii) диуретики: гидрохлоротиазид, спиронолактон, фуросемид, индапамид, бендрофлуразид, циклопентиазид, буметанид, этакриловая кислота;
(iii) кардиотоники: дигоксин, добутамин;
(iv) анти–альдостероновые лекарственные средства: спиронолактон, эплеренон;
(v) лекарственные средства для снижения частоты сердцебиения: ивабрадин;
(vi) внутривенные кардиотоники: h–ANP;
(vii) другие: релаксин;
(2) Другие
(viii) препараты, усиливающие Ca–чувствительность: MCC–135;
(ix) антагонисты Ca–канала: нифедипин, дилтиазем, верапамил, ломеризин гидрохлорид, амлодипина безилат;
(x) антиагреганты, антикоагулянты: гепарин, аспирин, варфарин, дабигатран, ривароксабан, пиксабан, эдоксабан;
(xi) ингибитор HMG–CoA редуктазы: аторвастатин, симвастатин;
(xii) лекарственные средства, снижающие уровень мочевой кислоты: пробенецид, аллопринол, фебуксостат;
(xiii) альфа–блокаторы: доксазозин;
(xiv) пероральные адсорбенты: кремезин;
(xv) терапии высокого содержания калия в плазме: кальцикол;
(xvi) терапии высокого содержания фосфора в плазме: севеламер, лантана карбонат;
(xvii) препараты, улучшающие метаболический ацидоз: бикарбонат натрия;
(xviii) другие: активные витамины.
[0187]
В другом аспекте настоящего изобретения лекарственное средство по настоящему изобретению представляет собой лекарственное средство для профилактики или лечения легочной гипертензии у субъекта, нуждающегося в этом. Лекарственное средство по настоящему изобретению включает соединение (I) и может использоваться в комбинации с другими лекарственными средствами (комбинированные лекарственные средства).
[0188]
В конкретном аспекте настоящего изобретения лекарственное средство по настоящему изобретению используется в комбинации с другими лекарственными средствами с целью лечения или профилактики легочной гипертензии. Примеры других лекарственных средств, которые можно использовать, включают любое одно или несколько из следующих лекарственных средств:
(i) антагонисты рецепторов эндотелина: антагонисты рецепторов эндотелина, такие как мацитентан, бозентан и амбрисентан;
(ii) препараты простагландина: препараты простагландина (или препараты простациклина), такие как эпопростенол, велапрост, трепростинил, иропрост и селексипаг;
(iii) ингибиторы фосфодиэстеразы–5: ингибиторы фосфодиэстеразы–5, такие как силденафил и тадалафил;
(iv) растворимые стимуляторы аденилатциклазы: растворимые стимуляторы аденилатциклазы, такие как риоцигуат;
(v) антагонисты кальциевых каналов: антагонисты кальциевых каналов, такие как нифедипин, дилтиазем и амлодипин;
(vi) ингибиторы Rho–киназы: ингибиторы Rho–киназы, такие как фасудил;
(vii) другие: ингибиторы тирозинкиназы, такие как иматиниб и сорафениб; антикоагулянты, такие как варфарин и аспирин; диуретики, такие как фуросемид и спиронолактон; и сердечные стимуляторы, такие как дофамин и дигоксин.
[0189]
Примеры лекарственных средств, в которых лекарственное средство по настоящему изобретению и другое лекарственное средство используют в комбинации, или лекарственное средство, полученное путем формулирования лекарственного средства по настоящему изобретению с другим лекарственным средством, включают как лекарственное средство, в котором соединение (I) и комбинированное лекарственное средство сформулированы в одно средство в качестве лекарственного средства, включающего соединение (I) и комбинированное лекарственное средство, так и лекарственное средство, в котором соединение (I) и комбинированное лекарственное средство сформулированы в виде отдельных средств. Далее они в совокупности называются комбинированным лекарственным препаратом по настоящему изобретению.
[0190]
Комбинированный лекарственный препарат по настоящему изобретению может быть сформулирован таким же образом, как и лекарственное средство, содержащее соединение (I), описанное выше, путем смешивания соединения (I) и комбинированного лекарственного средства по отдельности или одновременно, каждое из которых используется отдельно или вместе с фармацевтически приемлемым носителем, или тому подобное.
[0191]
Суточная доза комбинированного лекарственного препарата по настоящему изобретению варьируется в зависимости от степени выраженности симптомов; возраста, пола, массы тела, разницы восприимчивости субъекта, подлежащего введению; времени и интервала введения; природы, композиции, типа лекарственного средства, типа активного ингредиента; и тому подобное, и этим особо не ограничивается.
[0192]
При введении комбинированного лекарственного препарата по настоящему изобретению соединение (I) и комбинированное лекарственное средство можно вводить одновременно; и комбинированное лекарственное средство вводят, а затем можно вводить соединение (I) или его соль; или соединение (I) или его соль вводят, и затем комбинированное лекарственное средство может быть введено. Когда комбинированный лекарственный препарат вводят с разницей во времени, разница во времени варьируется в зависимости от вводимого активного ингредиента, лекарственной формы и способа введения. Например, когда комбинированное лекарственное средство вводят заранее, пример способа включает способ введения соединения (I) или его соли в течение от 1 минуты до 3 дней, предпочтительно в течение от 10 минут до 1 дня, более предпочтительно в течение от 15 минут до 1 часа после введения комбинированного лекарственного средства. Когда соединение (I) вводят заранее, примеры способа включают способ введения комбинированного лекарственного средства в течение от 1 минуты до 1 дня, предпочтительно в течение от 10 минут до 6 часов, более предпочтительно в течение от 15 минут до 1 часа после введения ингредиента.
[0193]
Для комбинированного лекарственного препарата по настоящему изобретению, в котором соединение (I) и комбинированное лекарственное средство содержатся вместе в средстве, содержание соединения (I) и комбинированного лекарственного средства, каждое, варьируется в зависимости от формы препарата, но обычно составляет около 0,01–90% масс., предпочтительно около 0,1–50% масс., и более предпочтительно около 0,5–20% масс. по отношению ко всей композиции.
[0194]
Содержание носителя в комбинированном лекарственном препарате по настоящему изобретению обычно составляет около 0–99,8% масс., предпочтительно около 10–99,8% масс. и, более того, предпочтительно около 10–90% масс. по отношению ко всей композиции.
[0195]
Для комбинированного лекарственного препарата по настоящему изобретению, в котором соединение (I) или его соль и комбинированное лекарственное средство содержатся в отдельных средствах, комбинированный лекарственный препарат, включающий комбинированное лекарственное средство, может быть получен и использован таким же образом, как соединение (I) или его соль.
[0196]
Изобретение, относящееся к соединениям и лекарственным средствам по настоящему изобретению, может быть преобразовано в изобретения других вариантов осуществления, таких как способ профилактики или лечения заболевания, и применение соединения для изготовления лекарственного средства.
[0197]
В определенном аспекте настоящего изобретения предложен способ профилактики или лечения сердечной недостаточности у субъекта, нуждающегося в этом, включающий введение соединения (I) субъекту.
[0198]
В определенном аспекте настоящего изобретения предложено применение соединения (I) в производстве лекарственного средства для профилактики или лечения сердечной недостаточности у субъекта, нуждающегося в этом.
[0199]
В определенном аспекте настоящего изобретения предложен способ профилактики или лечения легочной гипертензии у субъекта, нуждающегося в этом, включающий введение соединения (I) субъекту.
[0200]
В конкретном аспекте настоящего изобретения предложено применение соединения (I) для изготовления лекарственного средства для профилактики или лечения легочной гипертензии у субъекта, нуждающегося в этом.
[0201]
Эти технические вопросы, относящиеся к способу по настоящему изобретению, такие как заболевания и состояния, подлежащие лечению, могут быть такими же, как описанные выше для лекарственного средства по настоящему изобретению. В способе по настоящему изобретению, когда вводят соединение (I), вместо него можно вводить лекарственное средство, включающее соединение (I) или его соль.
Примеры
[0202]
Настоящее изобретение будет описано более подробно со следующими примерами, примерами испытаний и примерами лекарственных форм, но эти примеры не являются ограничениями настоящего изобретения и могут варьироваться в той степени, в которой они не выходят за пределы объема изобретения.
[0203]
В следующих примерах «комнатная температура» обычно относится от примерно 10°С до примерно 35°С. Соотношение, указанное для смешанного растворителя, обозначает объемное соотношение, если не указано иное. % указывает % по массе, если не указано иное.
[0204]
В примерах элюирование в колоночной хроматографии наблюдали с помощью ТСХ (тонкослойной хроматографии), если специально не указано. В наблюдении ТСХ в качестве пластины для ТСХ использовали 60 F254, изготовленный Merck, и растворители для элюирования, использованные в колоночной хроматографии, использовали в качестве проявляющих растворителей. Для детектирования использовали УФ–детектор. В колоночной хроматографии на силикагеле описание NH означает, что использовали связанный с аминопропилсиланом силикагель, а описание Diol означает, что был использован связанный с 3–(2,3–дигидроксипропокси)пропилсиланом силикагель. В препаративной ВЭЖХ (высокоэффективная жидкостная хроматография) описание С18 означает, что использовали октадецил–силикагель. Соотношения, указанные для растворителя для элюирования, обозначают объемные соотношения, если не указано иное.
[0205]
Анализ 1Н ЯМР проводили с использованием программного обеспечения ACD/SpecManager (торговое наименование) или тому подобного. Очень широкие пики, такие как протонные пики гидроксильных групп и аминогрупп, могут быть не описаны.
[0206]
МС измеряли методом LC/MS. Для ионизации использовали метод ESI или метод APCI. Данные указаны измеренными значениями (Найдено). Наблюдаемые пики обычно представляют собой пики молекулярных ионов, но иногда пики фрагментных ионов. Для солей наблюдаемые пики обычно представляют собой пики молекулярных ионов свободной формы или пики фрагментных ионов.
[0207]
Единица концентрации (с) образца при оптическом вращении ([α]D) составляет г/100 мл.
[0208]
Значения элементного анализа (Анал.) указаны расчетными значениями (Вычислено) и измеренными значениями (Найдено).
[0209]
Пики порошковой дифракции рентгеновских лучей в примерах показывают пики, измеренные при комнатной температуре с помощью Ultima IV (Rigaku Corporation, Japan) с использованием излучения Cu Kα в качестве источника излучения. Условия измерения были следующими.
Электрическое напряжение/Сила тока:40 кВ/50 мA
Скорость сканирования: 6 градусов/мин
Диапазон сканирования 2 тета: 2–35 градусов
Степень кристалличности по порошковой рентгеновской дифракции в примерах рассчитывали по методу Германса.
[0210]
Следующие сокращения используются в Примерах.
т.пл.: температура плавления
MS: масс–спектр
M: молярность
н: нормальная концентрация
CDCl3: дейтерированный хлороформ
DMSO–d6: дейтерированный диметилсульфоксид
1H ЯМР: протонный ядерный магнитный резонанс
LC/MS: жидкостная хроматография с масс–спектрометрией
LC/MS/MS: жидкостная хроматография с тандемной масс–спектрометрией
ESI: электрораспылительная ионизация
APCI: химическая ионизация при атмосферном давлении
HATU: (диметиламино)–N, N–диметил(3H–[1,2,3]триазоло[4,5–b]пиридин–3–илокси)метаниминий гексафторфосфат
DIPEA: N–этил–N–изопропилпропан–2–амин
COMU: (((Z)–(1–циано–2–этокси–2–оксоэтилиден)амино)окси)–N, N–диметилморфолин–4–илметаниминий гексафторфосфат
DMA: N, N–диметилацетамид
DMF: N, N–диметилформамид
THF: тетрагидрофуран
[0211]
[Пример 1]
((1S,5R)–1–(3,4–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон
[0212]
Смесь (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (1,272 г), COMU (2,108 г), DIPEA (1,719 мл) и DMF (25 мл) перемешивали при комнатной температуре в течение 15 минут. Потом, добавляли (1S,5R)–1–(3,4–дихлорфенил)–3–азабицикло[3.1.0]гексан гидрохлорид (1,24 г) и полученную смесь перемешивали при 70°C в течение 3 часов. К реакционной смеси добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (NH, гексан/этилацетат). Полученную фракцию концентрировали при пониженном давлении и остаток снова очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (2,00 г).
1H ЯМР (300 МГц, DMSO–d6) δ 0,77 (1H, т, J=4,7 Гц), 1,09–1,17 (1H, м), 1,49 (3H, с), 1,52 (3H, с), 1,99–2,26 (3H, м), 3,37–4,00 (3H, м), 4,22 (1H, д, J=10,4 Гц), 4,69 (1H, дд, J=11,4, 3,1 Гц), 6,87 (1H, с), 7,26–7,49 (6H, м), 7,52–7,89 (3H, м).
[0213]
[Пример 2]
((1R,5S)–1–(3,4–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон
[0214]
Смесь (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (86 мг), HATU (86 мг), DIPEA (0,079 мл) и DMA (1 мл) перемешивали при комнатной температуре в течение 15 минут. Затем, добавляли (1R,5S)–1–(3,4–дихлорфенил)–3–азабицикло[3.1.0]гексан гидрохлорид (50,0 мг) и полученную смесь перемешивали при 70°C в течение 4 часов. К реакционной смеси добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (53,6 мг).
1H ЯМР (300 МГц, DMSO–d6) δ 0,77 (1H, т, J=4,7 Гц), 1,10–1,17 (1H, м), 1,48 (3H, с), 1,52 (3H, с), 1,99–2,23 (3H, м), 3,38–4,15 (3H, м), 4,27 (1H, д, J=10,7 Гц), 4,69 (1H, дд, J=11,2, 2,8 Гц), 6,87 (1H, с), 7,26–7,49 (6H, м), 7,51–7,84 (3H, м).
[0215]
[Пример 3]
(1–(3,5–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон
[0216]
A) трет–бутил 1–(3,5–дихлорфенил)–3–азабицикло[3.1.0]гексан–3–карбоксилат
К раствору (3,5–дихлорфенил)ацетонитрила (5,00 г) и 2–(хлорметил)оксирана (3,31 г) в THF (40 мл), добавляли по каплям натрий бис(триметилсилил)амид (1,0 M раствор THF, 47,3 мл) при –10°C до 5°C в атмосфере азота. Полученную смесь перемешивали при от 0°C до 5°C в течение 3 часов, а затем при от 10°C до 15°C в течение 16 часов. После этого добавляли по каплям комплекс боран–диметилсульфид (10,0 М раствор диметилсульфида, 8,33 мл) при 0°C. Полученную смесь нагревали до 40°C в течение 1 часа и перемешивали при 40°C в течение 2 часов в атмосфере азота, и затем добавляли 2 М хлористоводродной кислоты (50 мл) при комнатной температуре. Полученную смесь перемешивали при 40°C в течение 1 часа в атмосфере азота, затем добавляли 28% водный раствор аммиака (10,5 г), и после отделения водного слоя, водный слой экстрагировали этилацетатом (100 мл × 2). Органические слои объединяли и промывали насыщенным солевым раствором (100 мл × 2), сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток смешивали с изопропилацетатом (150 мл) и полученную смесь добавляли к раствору тионилхлорида (4,83 г) в изопропилацетате (150 мл) при 0°C. Полученную смесь перемешивали при 0°C в течение 10 минут и затем добавляли 5 М водный раствор гидроксида натрия (31 мл). Полученную смесь перемешивали при 20°C в течение 30 минут в атмосфере азота, затем добавляли ди–трет–бутилдикарбонат (11,7 г), и полученную смесь перемешивали при 20°C в течение 30 минут. Реакционную смесь разбавляли насыщенным солевым раствором (150 мл) и экстрагировали этилацетатом (200 мл × 2). Экстракт промывали насыщенным солевым раствором (300 мл), сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (петролейный эфир/этилацетат) с получением указанного в заголовке соединения (2,10 г).
1H ЯМР (400 МГц, CDCl3) δ 0,80–1,00 (1H, м), 1,04–1,15 (1H, м), 1,46 (9H, с), 1,77–1,89 (1H, м), 3,45–3,58 (2H, м), 3,58–3,77 (1H, м), 3,77–4,00 (1H, м), 7,00–7,06 (2H, м), 7,21 (1H, с).
[0217]
B) 1–(3,5–Дихлорфенил)–3–азабицикло[3.1.0]гексан гидрохлорид
Смесь трет–бутил 1–(3,5–дихлорфенил)–3–азабицикло[3.1.0]гексан–3–карбоксилата (2,10 г) и 4 M хлороводород/этилацетата (30 мл) перемешивали при 20°C в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат (40 мл), затем смесь концентрировали при пониженном давлении. Этилацетат (40 мл) снова добавляли к полученному остатку, и смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,57 г).
1H ЯМР (400 МГц, DMSO–d6) δ 1,19 (1H, т, J=7,6 Гц), 1,37 (1H, т, J= 5,6 Гц), 2,21–2,30 (1H, м), 3,29–3,41 (1H, м), 3,47 (2H, д, J=11,2 Гц), 3,71 (1H, д, J=11,2 Гц), 7,39 (2H, д, J=2,0 Гц), 7,49 (1H, т, J=2,0 Гц), 9,39 (1H, шир.с), 9,70 (1H, шир.с).
[0218]
C) (1–(3,5–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон
Смесь (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (51,3 мг), HATU (86 мг), DIPEA (0,079 мл) и DMA (1 мл) перемешивали при комнатной температуре в течение 5 минут. Затем, добавляли 1–(3,5–дихлорфенил)–3–азабицикло[3.1.0]гексан гидрохлорид (50,0 мг) и полученную смесь перемешивали при 70°C в течение 2 часов. К реакционной смеси добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (70,9 мг).
[0219]
[Пример 4]
(1–(3,5–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
(1–(3,5–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (70,9 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK IC (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/этанол=600/400 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более короткое время удерживания (24,2 мг).
Оптическая чистота: >99,9% д.и.
Одно из них имело более короткое время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/этанол=600/400 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,77 (1H, т, J=4,8 Гц), 1,13–1,21 (1H, м), 1,49 (3H, с), 1,52 (3H, с), 1,97–2,25 (3H, м), 3,35–4,11 (3H, м), 4,23 (1H, д, J=10,4 Гц), 4,69 (1H, дд, J=11,3, 3,0 Гц), 6,88 (1H, с), 7,29–7,53 (8H, м), 7,80 (1H, шир.с).
[0220]
[Пример 5]
(1–(3,5–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
(1–(3,5–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (70,9 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK IC (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/этанол=600/400 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более длительное время удерживания (19,2 мг).
Оптическая чистота: >99,9% д.и.
Одно из них имело более длительное время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/этанол=600/400 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,77 (1H, т, J=4,8 Гц), 1,12–1,21 (1H, м), 1,48 (3H, с), 1,52 (3H, с), 1,99–2,31 (3H, м), 3,40–3,98 (3H, м), 4,27 (1H, д, J=10,6 Гц), 4,69 (1H, дд, J=11,3, 2,8 Гц), 6,88 (1H, с), 7,21–7,48 (8H, м), 7,72 (1H, шир.с).
[0221]
[Пример 6]
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон
Смесь (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (49,0 мг), HATU (82 мг), DIPEA (0,076 мл) и DMA (1 мл) перемешивали при комнатной температуре в течение 5 минут. Затем, добавляли 1–(4–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан гидрохлорид (50,0 мг) и полученную смесь перемешивали при 70°C в течение 3 часов. К реакционной смеси добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (63,5 мг).
[0222]
[Пример 7]
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (оптический изомер)
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (63,5 мг) фракционировали с помощью SFC (CHIRALPAK IC (торговое название), 20 мм в.д. × 250 мм длина), подвижная фаза: диоксид углерода/этанол=740/260 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более короткое время удерживания (24,0 мг).
Оптическая чистота: >99,9% д.и.
Одно из них имело более короткое время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 150 мм длина
Подвижная фаза: диоксид углерода/этанол=700/300 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,83 (1H, т, J=4,8 Гц), 1,12–1,21 (1H, м), 1,49 (3H, с), 1,52 (3H, с), 1,98–2,30 (3H, м), 3,37–4,06 (3H, м), 4,26 (1H, д, J=10,5 Гц), 4,70 (1H, дд, J=11,4, 3,0 Гц), 6,88 (1H, с), 7,31–7,57 (7H, м), 7,66 (2H, д, J=8,3 Гц), 7,72 (1H, шир.с).
[0223]
[Пример 8]
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (оптический изомер)
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (63,5 мг) фракционировали с помощью SFC (CHIRALPAK IC (торговое название), 20 мм в.д. × 250 мм длина), подвижная фаза: диоксид углерода/этанол=740/260 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более длительное время удерживания (23,7 мг).
Оптическая чистота: 98,9% д.и.
Одно из них имело более длительное время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 150 мм длина
Подвижная фаза: диоксид углерода/этанол=700/300 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,84 (1H, т, J=4,8 Гц), 1,08–1,21 (1H, м), 1,49 (3H, с), 1,52 (3H, с), 1,98–2,26 (3H, м), 3,35–4,19 (3H, м), 4,31 (1H, д, J=10,7 Гц), 4,70 (1H, дд, J=11,4, 3,0 Гц), 6,89 (1H, с), 7,27–7,56 (7H, м), 7,63–7,79 (3H, м).
[0224]
[Пример 9]
(1–(3–хлор–5–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
[0225]
A) 1–(3–хлор–5–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан гидрохлорид
К раствору (3–хлор–5–(трифторметил)фенил)ацетонитрила (2,81 г) и 2–(хлорметил)оксирана (1,55 г) в THF (40 мл), добавляли по каплям натрий бис(триметилсилил)амид (1,9 M раствор THF, 10 мл) при от –10°C до 0°C. Полученную смесь перемешивали при 0°C в течение 3 часов в атмосфере азота, и затем перемешивали в течение ночи при комнатной температуре. После этого добавляли по каплям комплекс боран–диметилсульфид (10,0 М раствор диметилсульфида, 4,0 мл) при 0°C. Полученную смесь нагревали до 40°C в течение 1 часа и перемешивали при 40°C в течение 2 часов в атмосфере азота. Затем добавляли 2 М хлористоводродную кислоту при комнатной температуре. Полученную смесь перемешивали при 40°C в течение 1 часа в атмосфере азота, затем добавляли 28% водный раствор аммиака (6,0 мл) и удаляли водный слой. После добавления этилацетата (300 мл) и 5% водного раствора карбоната натрия, органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток смешивали с изопропилацетатом (80 мл), и полученную смесь добавляли к раствору тионилхлорида (1,5 мл) в изопропилацетате (40 мл) при 0°C. Полученную смесь перемешивали при 0°C в течение 10 минут и затем добавляли 5 М водный раствор гидроксида натрия (13 мл). Полученную смесь перемешивали при комнатной температуре в течение 30 минут, затем к реакционной смеси добавляли 5% водный раствор хлорида натрия при комнатной температуре и экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. К раствору остатка в THF (30 мл), добавляли ди–трет–бутил дикарбонат (4 мл) и DIPEA (4 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь добавляли в воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, затем растворитель отгоняли при пониженном давлении, и остаток очищали с помощью колоночной хроматографии на силикагеле (NH, гексан/этилацетат). Полученную фракцию концентрировали при пониженном давлении, и остаток (1,29 г) затем смешивали с 4 М хлороводород/этилацетат (5 мл) и этилацетатом (2 мл), и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, и остаток затем промывали диизопропиловым эфиром с получением указанного в заголовке соединения (0,890 г).
1H ЯМР (300 МГц, DMSO–d6) δ 1,11–1,31 (1H, м), 1,34–1,57 (1H, м), 2,17–2,39 (1H, м), 3,20–3,61 (3H, м), 3,75 (1H, д, J=11,0 Гц), 7,46–7,87 (3H, м), 9,25–10,02 (2H, м).
[0226]
B) (1–(3–хлор–5–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
Смесь (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (69,3 мг), HATU (117 мг), DIPEA (0,107 мл) и DMA (1 мл) перемешивали при комнатной температуре в течение 5 минут. Затем, добавляли 1–(3–хлор–5–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан гидрохлорид (80,0 мг), и полученную смесь перемешивали в течение ночи при 70°C. К реакционной смеси добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), и полученную фракцию концентрировали при пониженном давлении. Полученный остаток (93,7 мг) фракционировали с помощью ВЭЖХ (CHIRALCEL AD (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/этанол= 450/550 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более короткое время удерживания (36,5 мг).
Оптическая чистота: >99,9% д.и.
Одно из них имело более короткое время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK AD–H (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/этанол=250/750 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,81 (1H, т, J=4,8 Гц), 1,18–1,27 (1H, м), 1,49 (3H, с), 1,52 (3H, с), 1,98–2,35 (3H, м), 3,36–4,11 (3H, м), 4,28 (1H, д, J=10,5 Гц), 4,69 (1H, дд, J=11,4, 3,1 Гц), 6,88 (1H, с), 7,28–7,49 (5H, м), 7,56–8,00 (4H, м).
[0227]
[Пример 10]
(1–(3–хлор–5–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
Смесь (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (69,3 мг), HATU (117 мг), DIPEA (0,107 мл) и DMA (1 мл) перемешивали при комнатной температуре в течение 5 минут. Затем, добавляли 1–(3–хлор–5–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан гидрохлорид (80,0 мг) и полученную смесь перемешивали в течение ночи при 70°C. К реакционной смеси добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), и полученную фракцию концентрировали при пониженном давлении. Полученный остаток (93,7 мг) фракционировали с помощью ВЭЖХ (CHIRALCEL AD (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/этанол= 450/550 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более длительное время удерживания (25,6 мг).
Оптическая чистота: 99,9% д.и.
Одно из них имело более длительное время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK AD–H (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/этанол=250/750 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,81 (1H, т, J=4,7 Гц), 1,10–1,29 (1H, м), 1,49 (3H, с), 1,52 (3H, с), 1,94–2,32 (3H, м), 3,40–4,09 (3H, м), 4,33 (1H, д, J=10,7 Гц), 4,69 (1H, дд, J=11,2, 3,1 Гц), 6,88 (1H, с), 7,31–7,49 (5H, м), 7,54–7,88 (4H, м).
[0228]
[Пример 11]
(1–(3–хлор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
[0229]
A) трет–бутил 1–(3–хлор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан–3–карбоксилат
К раствору (3–хлор–4–(трифторметил)фенил)ацетонитрила (3,0 г) и 2–(хлорметил)оксирана (1,517 г) в THF (30 мл), добавляли по каплям натрий бис(триметилсилил)амид (1,9 M раствор THF, 12,58 мл) при –10°C до 0°C. Полученную смесь перемешивали при 0°C в течение 3 часов в атмосфере азота, и затем перемешивали в течение ночи при комнатной температуре. После этого добавляли по каплям комплекс боран–диметилсульфид (10,0 М раствор диметилсульфида, 4,24 мл) при 0°C. Полученную смесь нагревали до 40°C в течение 1 часа, затем перемешивали при 40°C в течение 2 часов в атмосфере азота, и затем добавляли 2 М хлористоводродной кислоты (21,18 мл) при комнатной температуре. Полученную смесь перемешивали при 40°C в течение 1 часа в атмосфере азота, затем добавляли 28% водный раствор аммиака (5,91 мл) и удаляли водный слой. После добавления этилацетата (300 мл) и 5% водного раствора карбоната натрия, органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток смешивали с изопропилацетатом (80 мл) и смесь добавляли к раствору тионилхлорида (1,495 мл) в изопропилацетате (30 мл) при 0°C. Полученную смесь перемешивали при 0°C в течение 10 минут, и затем добавляли 4 М водный раствор гидроксида натрия (19,13 мл). Затем полученную смесь перемешивали при комнатной температуре в течение 30 минут в атмосфере азота, реакционную смесь добавляли к 5% водному раствору хлорида натрия при комнатной температуре и затем экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. К раствору остатка и DIPEA (11,90 мл) в DMF (30 мл), добавляли ди–трет–бутилд икарбонат (6,34 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа в атмосфере азота. Реакционную смесь добавляли в воду, и полученную смесь экстрагировали этилацетатом. Экстракт промыли водой и насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (0,83 г).
1H ЯМР (300 МГц, CDCl3) δ 0,92–1,07 (1H, м), 1,09–1,19 (1H, м), 1,38–1,52 (9H, м), 1,82–1,97 (1H, м), 3,42–4,05 (4H, м), 7,07–7,18 (1H, м), 7,21–7,34 (1H, м), 7,54–7,68 (1H, м).
[0230]
B) 1–(3–хлор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан гидрохлорид
К смеси трет–бутил 1–(3–хлор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан–3–карбоксилата (0,83 г) и этилацетата (10 мл), добавляли 4 M хлороводород/CPME (2 мл) при комнатной температуре. Полученную смесь перемешивали при 50°C в атмосфере азота. Осадок отфильтровывали с получением указанного в заголовке соединения (510 мг).
1H ЯМР (300 МГц, DMSO–d6) δ 1,13–1,32 (1H, м), 1,47–1,66 (1H, м), 2,20–2,41 (1H, м), 3,27–3,58 (3H, м), 3,68–3,83 (1H, м), 7,37–7,50 (1H, м), 7,59–7,73 (1H, м), 7,76–7,83 (1H, м), 9,19–10,47 (2H, м).
[0231]
C) (1–(3–хлор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
Смесь (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (69,3 мг), HATU (117 мг), DIPEA (0,107 мл) и DMA (1 мл) перемешивали при комнатной температуре в течение 5 минут. Затем, добавляли 1–(3–хлор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан гидрохлорид (80,0 мг), и полученную смесь перемешивали в течение ночи при 70°C. К реакционной смеси добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) и полученную фракцию концентрировали при пониженном давлении. Полученный остаток (104 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK AD (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/2–пропанол=600/400 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более короткое время удерживания (33,6 мг).
Оптическая чистота: >99,9% д.и.
Одно из них имело более короткое время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK AD–H (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/2–пропанол=600/400 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,86 (1H, т, J=4,8 Гц), 1,17–1,29 (1H, м), 1,49 (3H, с), 1,52 (3H, с), 1,98–2,33 (3H, м), 3,35–4,08 (3H, м), 4,26 (1H, д, J=10,5 Гц), 4,70 (1H, дд, J=11,4, 2,8 Гц), 6,88 (1H, с), 7,30–7,50 (6H, м), 7,54–7,97 (3H, м).
[0232]
[Пример 12]
(1–(3–хлор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
Смесь (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (69,3 мг), HATU (117 мг), DIPEA (0,107 мл) и DMA (1 мл) перемешивали при комнатной температуре в течение 5 минут. Затем, добавляли 1–(3–хлор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан гидрохлорид (80,0 мг), и полученную смесь перемешивали в течение ночи при 70°C. К реакционной смеси добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) и полученную фракцию концентрировали при пониженном давлении. Полученный остаток (104 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK AD (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/2–пропанол=600/400 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более длительное время удерживания (37,2 мг).
Оптическая чистота: 99,5% д.и.
Одно из них имело более длительное время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK AD–H (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/2–пропанол=600/400 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,86 (1H, т, J=4,9 Гц), 1,18–1,31 (1H, м), 1,49 (3H, с), 1,52 (3H, с), 1,99–2,38 (3H, м), 3,41–4,12 (3H, м), 4,31 (1H, д, J=10,7 Гц), 4,70 (1H, дд, J=11,3, 3,0 Гц), 6,88 (1H, с), 7,29–7,50 (6H, м), 7,52–7,88 (3H, м).
[0233]
[Пример 13]
(1–(4–хлор–3–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
[0234]
Смесь (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (72,8 мг), HATU (122 мг), DIPEA (0,112 мл) и DMA (1 мл) перемешивали при комнатной температуре в течение 5 минут. Затем, добавляли 1–(4–хлор–3–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан гидрохлорид (80,0 мг) и полученную смесь перемешивали в течение ночи при 70°C. К реакционной смеси добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) и полученную фракцию концентрировали при пониженном давлении. Полученный остаток (93,4 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK IC (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/2–пропанол=550/450 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более короткое время удерживания (27,3 мг).
Оптическая чистота: >99,9% д.и.
Одно из них имело более короткое время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/2–пропанол=550/450 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,79 (1H, т, J=4,7 Гц), 1,20 (1H, дд, J=11,7, 6,2 Гц), 1,48 (3H, с), 1,52 (3H, с), 1,99–2,29 (3H, м), 3,34–4,08 (3H, м), 4,26 (1H, д, J=10,2 Гц), 4,69 (1H, дд, J=11,4, 3,1 Гц), 6,88 (1H, с), 7,27–7,50 (5H, м), 7,56–7,87 (4H, м).
[0235]
[Пример 14] (1–(4–хлор–3–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
Смесь (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (72,8 мг), HATU (122 мг), DIPEA (0,112 мл) и DMA (1 мл) перемешивали при комнатной температуре в течение 5 минут. Затем, добавляли 1–(4–хлор–3–(трифторметил)фенил)–3–азабицикло[3.1.0]гексан гидрохлорид (80,0 мг) и полученную смесь перемешивали в течение ночи при 70°C. К реакционной смеси добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) и полученную фракцию концентрировали при пониженном давлении. Полученный остаток (93,4 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK IC (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/2–пропанол=550/450 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более длительное время удерживания (33,8 мг).
Оптическая чистота: 99,4% д.и.
Одно из них имело более длительное время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/2–пропанол=550/450 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,80 (1H, т, J=4,8 Гц), 1,16–1,25 (1H, м), 1,48 (3H, с), 1,52 (3H, с), 1,93–2,28 (3H, м), 3,33–4,10 (3H, м), 4,31 (1H, д, J=10,7 Гц), 4,69 (1H, дд, J=11,4, 3,0 Гц), 6,87 (1H, с), 7,25–7,49 (5H, м), 7,55–7,84 (4H, м).
[0236]
[Пример 16] (1–(3–Хлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
(1–(3–Хлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (75 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK IC (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/этанол=600/400 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более короткое время удерживания (23,8 мг).
Оптическая чистота: >99,9% д.и.
Одно из них имело более короткое время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/этанол=600/400 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,75 (1H, т, J=4,6 Гц), 1,06–1,20 (1H, м), 1,49 (3H, с), 1,52 (3H, с), 1,97–2,23 (3H, м), 3,37–4,10 (3H, м), 4,22 (1H, д, J=10,6 Гц), 4,69 (1H, дд, J=11,2, 2,9 Гц), 6,88 (1H, с), 7,18–7,55 (9H, м), 7,72 (1H, шир.с).
[0237]
[Пример 17] (1–(3–Хлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (оптический изомер)
(1–(3–Хлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон (75 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK IC (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/этанол=600/400 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более длительное время удерживания (25,5 мг).
Оптическая чистота: 99,9% д.и.
Одно из них имело более длительное время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/этанол=600/400 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,75 (1H, т, J=4,7 Гц), 1,12 (1H, дд, J=7,8, 4,9 Гц), 1,48 (3H, с), 1,52 (3H, с), 1,91–2,25 (3H, м), 3,42–4,19 (3H, м), 4,27 (1H, д, J=10,7 Гц), 4,69 (1H, дд, J=11,3, 2,9 Гц), 6,88 (1H, с), 7,19–7,51 (9H, м), 7,71 (1H, шир.с).
[0238]
[Пример 19] ((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–метоксифенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (оптический изомер)
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–метоксифенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (81,5 мг) фракционировали с помощью SFC (CHIRALPAK AS–H (торговое название), 20 мм в.д. × 250 мм длина), подвижная фаза: диоксид углерода/этанол=820/180 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более короткое время удерживания (24,7 мг).
Оптическая чистота: >99,9% д.и.
Одно из них имело более короткое время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK AS–H (торговое навание) 4,6 мм в.д. × 150 мм длина
Подвижная фаза: диоксид углерода/этанол=800/200 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,71 (1H, т, J=4,6 Гц), 1,08 (1H, дд, J=7,7, 4,8 Гц), 1,49 (3H, с), 1,52 (3H, с), 1,97–2,23 (3H, м), 3,37–4,11 (6H, м), 4,20 (1H, д, J=10,4 Гц), 4,69 (1H, дд, J=11,3, 3,0 Гц), 6,71–6,93 (4H, м), 7,23 (1H, т, J=8,0 Гц), 7,30–7,51 (5H, м), 7,69 (1H, шир.с).
[0239]
[Пример 20] ((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–метоксифенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (оптический изомер)
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–метоксифенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (81,5 мг) фракционировали с помощью SFC (CHIRALPAK AS–H (торговое название), 20 мм в.д. × 250 мм длина), подвижная фаза: диоксид углерода/этанол=820/180 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более длительное время удерживания (26,1 мг).
Оптическая чистота: >99,9% д.и.
Одно из них имело более длительное время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK AS–H (торговое название) 4,6 мм в.д. × 150 мм длина
Подвижная фаза: диоксид углерода/этанол=800/200 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,71 (1H, т, J=4,6 Гц), 1,08 (1H, дд, J=7,9, 4,6 Гц), 1,48 (3H, с), 1,52 (3H, с), 1,96–2,26 (3H, м), 3,39–4,15 (6H, м), 4,25 (1H, д, J=10,7 Гц), 4,69 (1H, дд, J=11,3, 2,9 Гц), 6,70–6,92 (4H, м), 7,23 (1H, т, J=8,0 Гц), 7,29–7,50 (5H, м), 7,67 (1H, шир.с).
[0240]
[Пример 22] ((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–метилфенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (оптический изомер)
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–метилфенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (163 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK IC (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/2–пропанол=500/500 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более короткое время удерживания (43,9 мг).
Оптическая чистота: >99,9% д.и.
Одно из них имело более короткое время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/2–пропанол=500/500 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,70 (1H, т, J=4,5 Гц), 1,06 (1H, дд, J=7,7, 4,8 Гц), 1,49 (3H, с), 1,52 (3H, с), 1,95–2,23 (3H, м), 2,30 (3H, с), 3,36–4,11 (3H, м), 4,19 (1H, д, J=10,4 Гц), 4,69 (1H, дд, J=11,6, 3,0 Гц), 6,88 (1H, с), 6,99–7,15 (3H, м), 7,16–7,25 (1H, м), 7,29–7,52 (5H, м), 7,69 (1H, шир.с).
[0241]
[Пример 23] ((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–метилфенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (оптический изомер)
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–метилфенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (163 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK IC (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/2–пропанол=500/500 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более длительное время удерживания (49,3 мг).
Оптическая чистота: 99,8% д.и.
Одно из них имело более длительное время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/2–пропанол=500/500 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,70 (1H, т, J=4,5 Гц), 1,06 (1H, дд, J=7,8, 5,0 Гц), 1,48 (3H, с), 1,52 (3H, с), 1,95–2,24 (3H, м), 2,29 (3H, с), 3,35–4,17 (3H, м), 4,24 (1H, д, J=10,7 Гц), 4,69 (1H, дд, J=11,3, 3,1 Гц), 6,89 (1H, с), 6,99–7,15 (3H, м), 7,16–7,25 (1H, м), 7,33–7,53 (5H, м), 7,67 (1H, шир.с).
[0242]
[Пример 25]
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (оптический изомер)
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (145 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK IA (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/этанол=500/500 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более короткое время удерживания (51,8 мг).
Оптическая чистота: 99,4% д.и.
Одно из них имело более короткое время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IA (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/этанол=500/500 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,79 (1H, т, J=4,7 Гц), 1,13–1,20 (1H, м), 1,49 (3H, с), 1,52 (3H, с), 1,98–2,25 (3H, м), 3,36–4,19 (3H, м), 4,27 (1H, д, J=10,5 Гц), 4,70 (1H, дд, J=11,4, 3,0 Гц), 6,88 (1H, с), 7,28–7,49 (5H, м), 7,52–7,66 (4H, м), 7,74 (1H, шир.с).
[0243]
[Пример 26]
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (оптический изомер)
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(3–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (145 мг) фракционировали с помощью ВЭЖХ (CHIRALPAK IA (торговое название), 50 мм в.д. × 500 мм длина), подвижная фаза: гексан/этанол=500/500 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более длительное время удерживания (57,4 мг).
Оптическая чистота: 99,9% д.и.
Одно из них имело более длительное время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IA (торговое название) 4,6 мм в.д. × 250 мм длина
Подвижная фаза: гексан/этанол=500/500 (об/об)
1H ЯМР (300 МГц, DMSO–d6) δ 0,79 (1H, т, J=4,7 Гц), 1,17 (1H, дд, J=7,8, 4,9 Гц), 1,49 (3H, с), 1,52 (3H, с), 1,95–2,31 (3H, м), 3,40–4,11 (3H, м), 4,32 (1H, д, J=10,7 Гц), 4,70 (1H, дд, J=11,3, 2,8 Гц), 6,88 (1H, с), 7,30–7,50 (5H, м), 7,52–7,64 (4H, м), 7,68 (1H, шир.с).
[0244]
[Пример 28]
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(2–фтор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (оптический изомер)
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(2–фтор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (93,8 мг) фракционировали с помощью SFC (CHIRALPAK IC (торговое название), 20 мм в.д. × 250 мм длина), подвижная фаза: диоксид углерода/этанол=770/230 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более короткое время удерживания (22,0 мг).
Оптическая чистота: 99,6% д.и.
Одно из них имело более короткое время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 150 мм длина
Подвижная фаза: диоксид углерода/этанол=770/230 (об/об)
1H ЯМР (400 МГц, DMSO–d6) δ 0,74–0,91 (1H, м), 1,12–1,31 (2H, м), 1,48 (3H, с), 1,51 (3H, с), 1,95–2,21 (3H, м), 3,41–3,92 (1H, м), 4,01 (1H, д, J=10,8 Гц), 4,17 (1H, д, J=10,4 Гц), 4,69 (1H, д, J=9,5 Гц), 6,85 (1H, с), 7,29–7,50 (5H, м), 7,53–7,74 (4H, м).
[0245]
[Пример 29]
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(2–фтор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (оптический изомер)
((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)(1–(2–фтор–4–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)метанон (93,8 мг) фракционировали с помощью SFC (CHIRALPAK IC (торговое название), 20 мм в.д. × 250 мм длина), подвижная фаза: диоксид углерода/этанол=770/230 (об/об)), и в качестве указанного в заголовке соединения брали соединение, имеющее более длительное время удерживания (26,9 мг).
Оптическая чистота: >99,2% д.и.
Одно из них имело более длительное время удерживания при следующих условиях оптического анализа
Колонка: CHIRALPAK IC (торговое название) 4,6 мм в.д. × 150 мм длина
Подвижная фаза: диоксид углерода/этанол=770/230 (об/об)
1H ЯМР (400 МГц, DMSO–d6) δ 0,72–0,83 (1H, м), 1,11–1,27 (2H, м), 1,48 (3H, с), 1,51 (3H, с), 1,97–2,22 (3H, м), 3,47–3,99 (2H, м), 4,22 (1H, д, J=10,0 Гц), 4,69 (1H, д, J=11,2 Гц), 6,86 (1H, с), 7,31–7,50 (5H, м), 7,52–7,75 (4H, м).
[0246]
[Пример 48]
(6,6–дифтор–1–(4–метилфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон
[0247]
A) трет–бутил 3–(4–метилфенил)–2,5–дигидро–1H–пиррол–1–карбоксилат
К раствору трет–бутил 3–(((трифторметил)сульфонил)окси)–2,5–дигидро–1H–пиррол–1–карбоксилата (0,5 г) в диоксане (20 мл) и воды (1 мл), добавляли (4–метилфенил)бороновую кислоту (257 мг), карбонат натрия (0,544 г) и аддукт [1,1'–бис(дифенилфосфино)ферроцен]палладий (II) дихлорида дихлорметана (0,064 г) и полученную смесь перемешивали при 80°C в течение 16 часов в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры и после добавления воды (15 мл) перемешивали в течение 15 минут. Смесь фильтровали с использованием целита (торговое название) и экстрагировали этилацетатом (60 мл × 3). Экстракт сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (140 мг).
1H ЯМР (CDCl3, 400 МГц) δ 1,41–1,63 (9H, м), 2,21–2,41 (3H, м), 3,66–3,81 (2H, м), 4,23–4,33 (1H, м), 4,40–4,51 (1H, м), 6,01–6,12 (1H, м), 7,15 (1H, д, J=7,4 Гц), 7,32 (1H, д, J= 7,4Hz), 7,38 (2H, д, J=7,8 Гц).
[0248]
B) трет–бутил 6,6–дифтор–1–(4–метилфенил)–3–азабицикло[3.1.0]гексан–3–карбоксилат
К раствору трет–бутил 3–(4–метилфенил)–2,5–дигидро–1H–пиррол–1–карбоксилата (4,4 г) в THF (10 мл), добавляли (трифторметил)триметилсилан (12,58 мл) и иодид натрия (7,64 г), и полученную смесь перемешивали при 110°C в течение 36 часов. Реакционную смесь охлаждали до комнатной температуры, и разбавляли этилацетатом (100 мл), а затем полученный продукт фильтровали через целит (торговое название), и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (4,5 г).
1H ЯМР (400 МГц, DMSO–d6) δ 1,45 (9H, с), 2,34 (3H, с), 2,39–2,41(1H, м), 3,60–3,68 (1H, м), 3,78–3,81 (1H, м), 3,90–3,99 (1H, м), 4,11–4,26 (1H, м), 7,15–7,25 (4H, м).
[0249]
C) 6,6–дифтор–1–(4–метилфенил)–3–азабицикло[3.1.0]гексан гидрохлорид
К раствору трет–бутил 6,6–дифтор–1–(4–метилфенил)–3–азабицикло[3.1.0]гексан–3–карбоксилата (4,5 г) в диоксане (2 мл), 4M хлороводород/диоксан (30 мл) добавляли при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток промывали гексаном с получением указанного в заголовке соединения (3,0 г).
1H ЯМР (400 МГц, DMSO–d6) δ 2,31 (3H, с), 3,22–3,27 (1H, м), 3,56–3,60 (1H, м), 3,65–3,68 (1H, м), 3,83–3,86 (1H, м), 4,03–4,06 (1H, м), 7,12–7,31 (4H, м), 9,28 (1H, шир.с), 10,33 (1H, шир.с).
[0250]
D) (6,6–дифтор–1–(4–метилфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон
К раствору (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (0,022 г), HATU (0,037 г), DMAP (0,977 мг) и DIPEA (0,042 мл) в DMA (0,8 мл), добавляли 6,6–дифтор–1–(4–метилфенил)–3–азабицикло[3.1.0]гексан гидрохлорид (0,029 г), и полученную смесь перемешивали при 80°C в течение 5 часов. К реакционной смеси добавляли воду (0,2 мл) и полученный продукт очищали с помощью ВЭЖХ (C18, ацетонитрил/10 мМ водный раствор гидрокарбоната аммония) с получением указанного в заголовке соединения (0,034 мг).
[0251]
[Пример 51]
(6,6–дифтор–1–(3–метоксифенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон
[0252]
A) трет–бутил 3–(3–метоксифенил)–2,5–дигидро–1H–пиррол–1–карбоксилат
К раствору 1–бром–3–метоксибензола (5,56 г) в THF (50 мл), добавляли по каплям н–бутиллитий (1,74 M раствор в гексане, 17 мл) при –78°C в течение 15 минут, и полученную смесь перемешивали при –78°C в течение 45 минут. Реакционную смесь добавляли к раствору трет–бутил–3–оксопирролидин–1–карбоксилата (5,0 г) в THF (20 мл) при –78°C и полученную смесь перемешивали при –78°C в течение 1 часа, и затем, после того, как температура поднялась до комнатной температуры, смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь снова охлаждали до –78°С и к охлажденной смеси медленно добавляли метансульфонилхлорид (8,35 мл) и триэтиламин (24,44 мл). Полученную смесь перемешивали при –78°C в течение 1 часа, и затем перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония (100 мл) и полученную смесь экстрагировали этилацетатом (100 мл × 2). Экстракт промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (3,5 г).
1H ЯМР (400 МГц, DMSO–d6) δ 1,45 (9H, с), 3,78 (3H, с), 4,18–4,21 (2H, м), 4,39 (2H, шир.с), 6,37–6,40 (1H, м), 6,87–6,89 (1H, м), 7,00–7,04 (2H, м), 7,26–7,30 (1H, м).
[0253]
B) трет–бутил 6,6–дифтор–1–(3–метоксифенил)–3–азабицикло[3.1.0]гексан–3–карбоксилат
К раствору трет–бутил 3–(3–метоксифенил)–2,5–дигидро–1H–пиррол–1–карбоксилата (3,0 г) в THF (12 мл), добавляли (трифторметил)триметилсилан (5,42 мл) и иодид натрия (1,87 г) и полученную смесь перемешивали в течение 36 часов при 110°C. Реакционную смесь охлаждали до комнатной температуры, и разбавляли этилацетатом (100 мл), а затем полученный продукт фильтровали через целит (торговое название), и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат) с получением указанного в заголовке соединения (1,5 г).
1H ЯМР (400 МГц, DMSO–d6) δ 1,40 (9H, с), 2,95–2,98 (1H, м), 3,49–3,56 (1H, м), 3,76–3,83 (5H, м), 4,15–4,24 (1H, м), 6,89–6,93 (3H, м), 7,27–7,31 (1H, м).
[0254]
C) 6,6–дифтор–1–(3–метоксифенил)–3–азабицикло[3.1.0]гексан гидрохлорид
К раствору трет–бутил 6,6–дифтор–1–(3–метоксифенил)–3–азабицикло[3.1.0]гексан–3–карбоксилата (1,4 г) в диоксане (2 мл), 4M хлороводород/диоксан (25 мл) добавляли при комнатной температуре, и полученную смесь перемешивали в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток промывали пентаном с получением указанного в заголовке соединения (1,1 г).
1H ЯМР (400 МГц, DMSO–d6) δ 3,32–3,37 (1H, м), 3,46–3,47 (1H, м), 3,49–3,66 (1H, м), 3,77 (3H, с), 3,81–4,08 (2H, м), 6,94–7,01 (3H, м), 7,31–7,34 (1H, м), 9,88 (2H, шир.с)
[0255]
D) (6,6–дифтор–1–(3–метоксифенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон
К раствору (5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–карбоновой кислоты (0,022 г), HATU (0,037 г), DMAP (0,977 мг) и DIPEA (0,042 мл) в DMA (0,8 мл), добавляли 6,6–дифтор–1–(3–метоксифенил)–3–азабицикло[3.1.0]гексан гидрохлорид (0,031 г) и полученную смесь перемешивали при 80°C в течение 5 часов. К реакционной смеси добавляли воду (0,2 мл) и полученный продукт очищали с помощью ВЭЖХ (C18, ацетонитрил/10 мМ водный раствор гидрокарбоната аммония) с получением указанного в заголовке соединения (0,024 мг).
[0256]
Соединения примеров приведены в следующих таблицах. МС в таблице означает измеренные значения. В соответствии со способом, показанным в приведенных выше примерах, или способом, соответствующим им, были получены соединения примеров 15, 18, 21, 24, 27, 30–47, 49, 50 и 52, показанные в следующих таблицах.
[0257]
[Таблица 7–1]
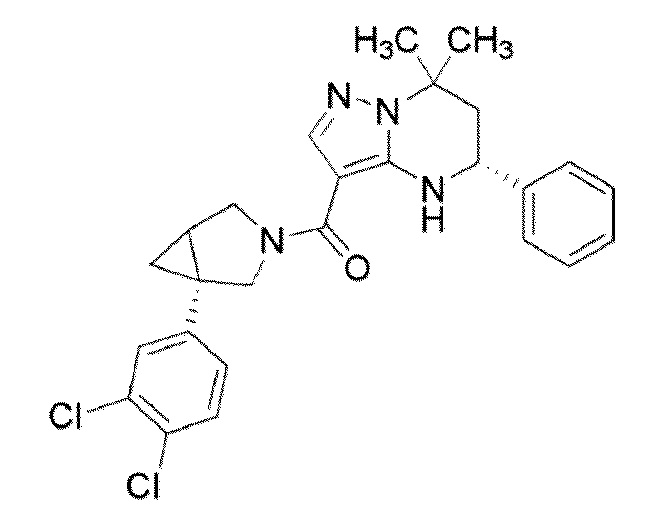
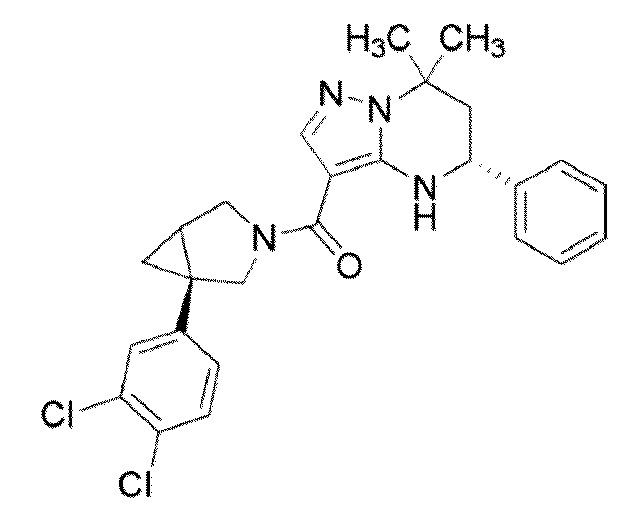
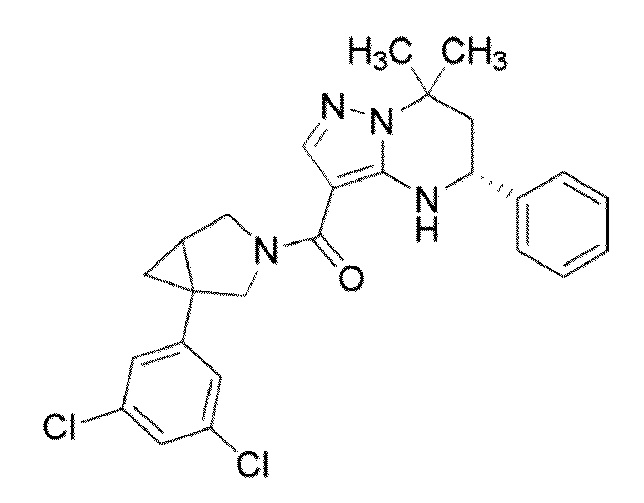
[Таблица 7–2]
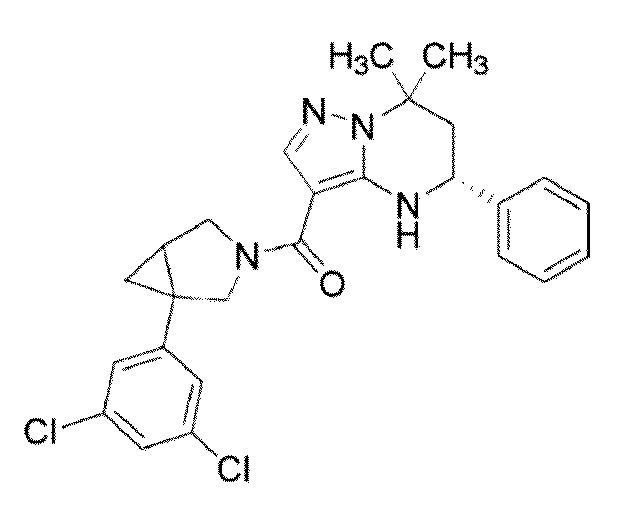
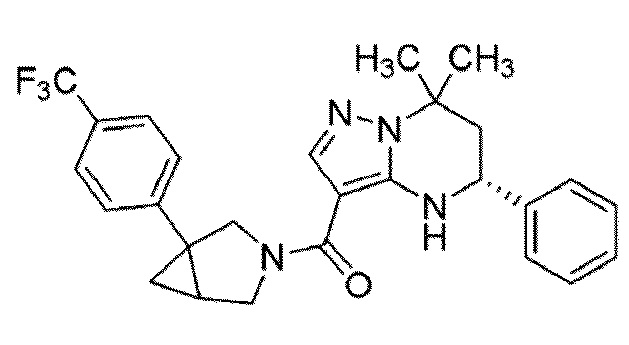
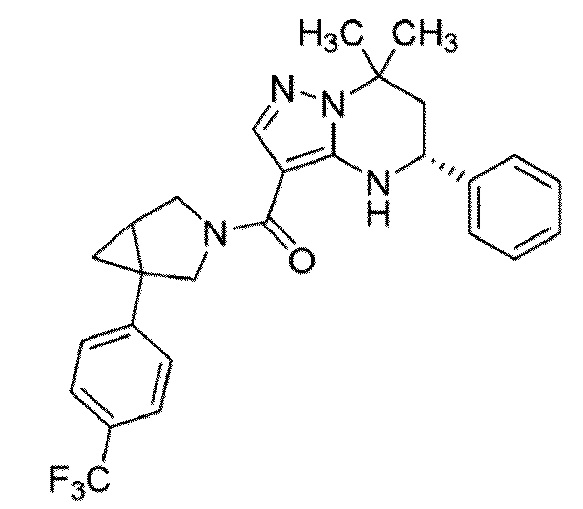
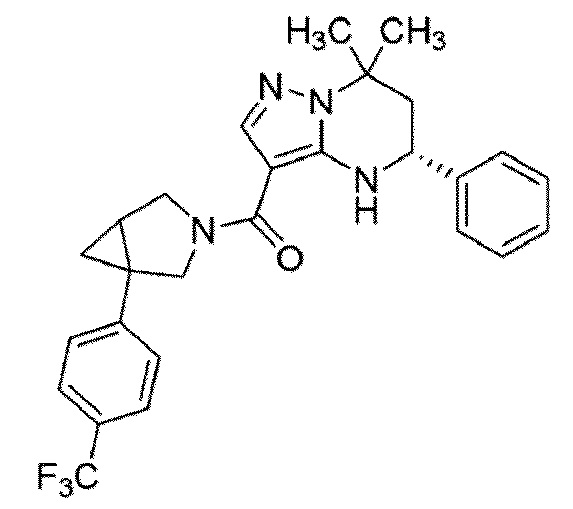
[Таблица 7–3]
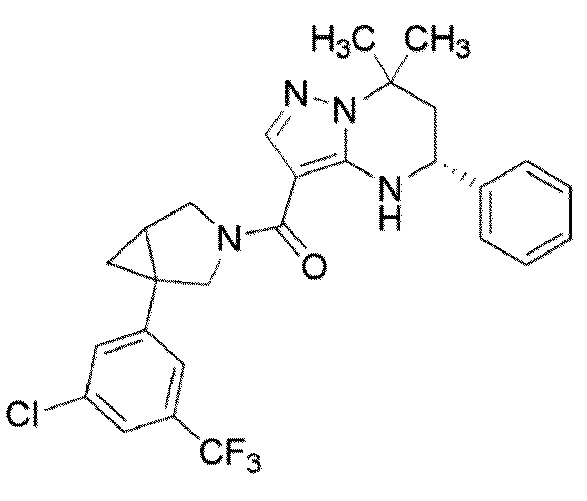
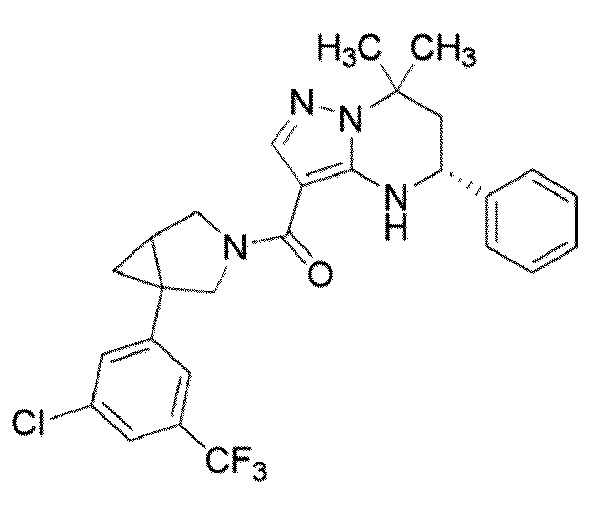
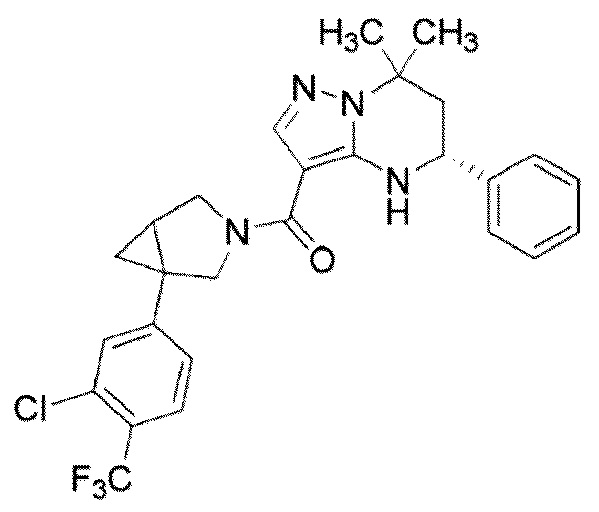
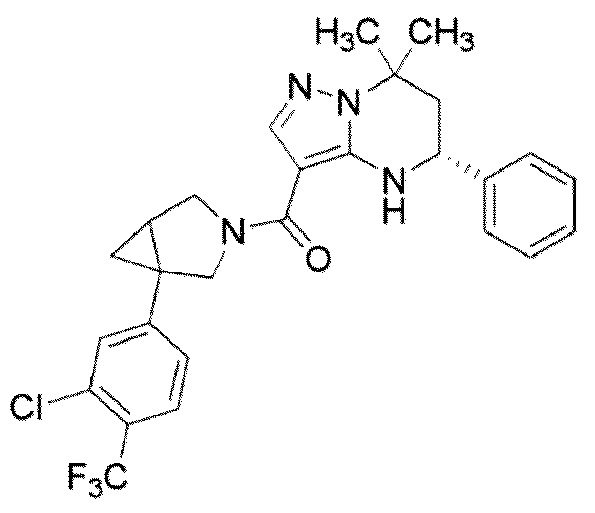
[Таблица 7–4]
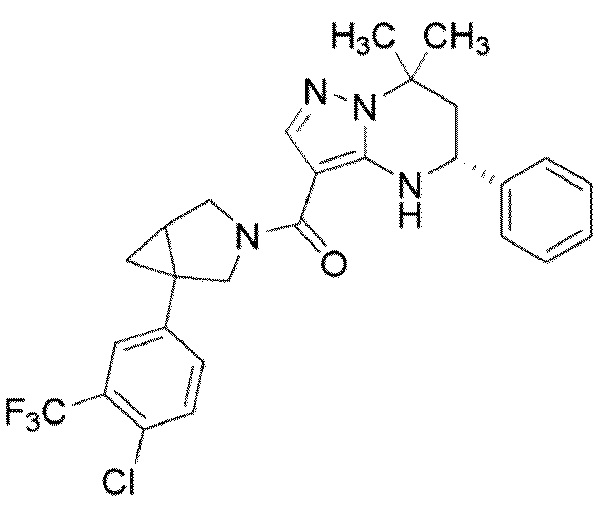
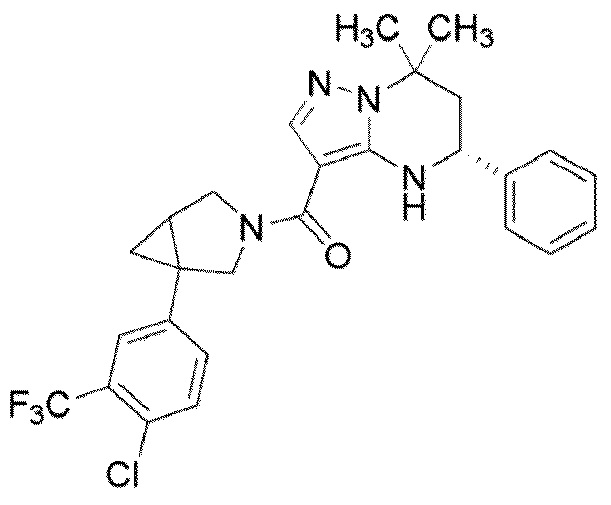
[Таблица 7–5]
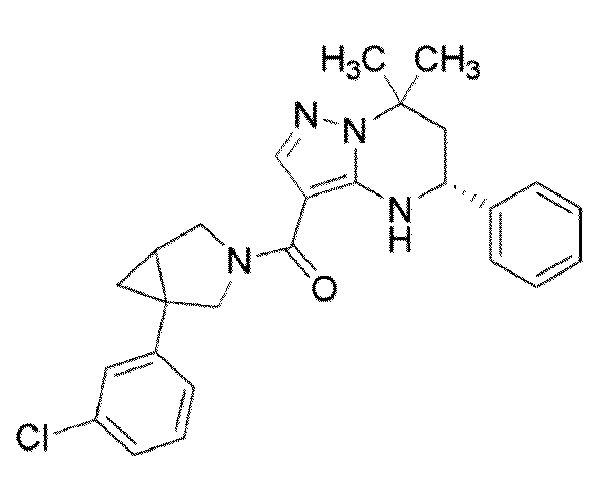
[Таблица 7–6]
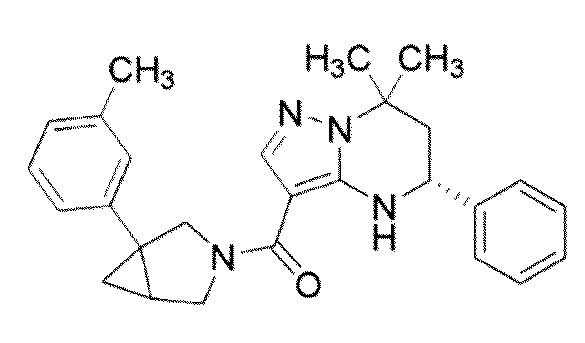
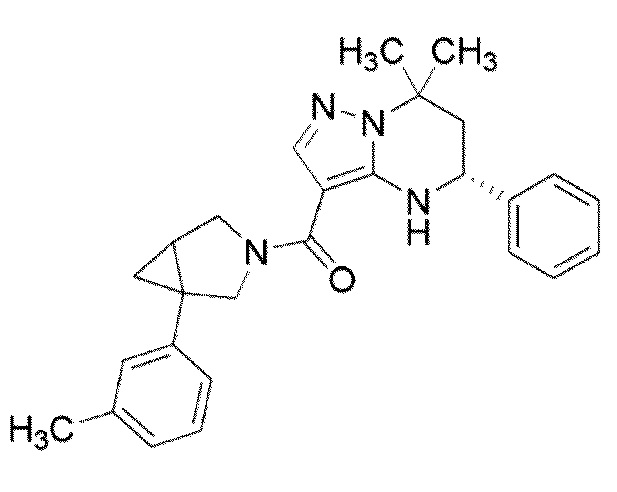
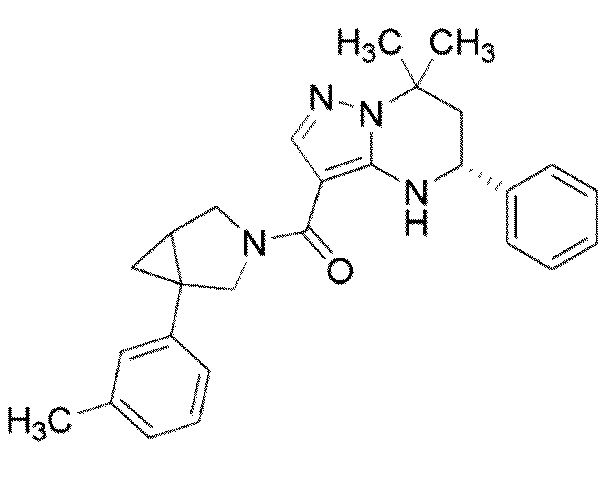
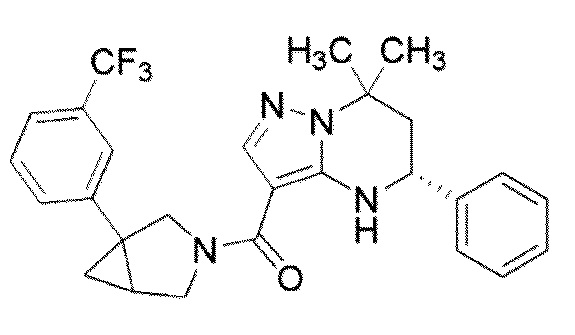
[Таблица 7–7]
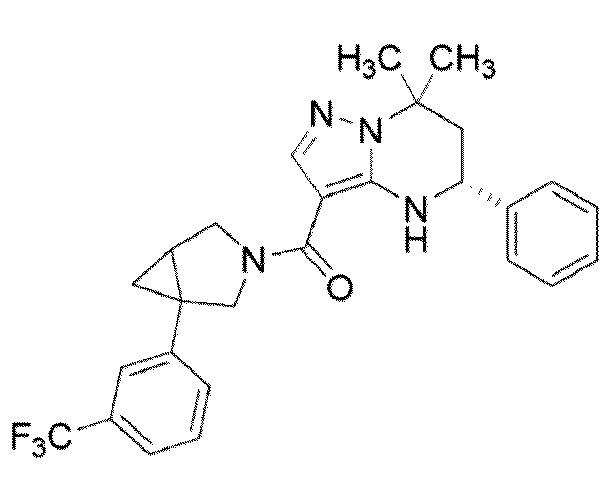
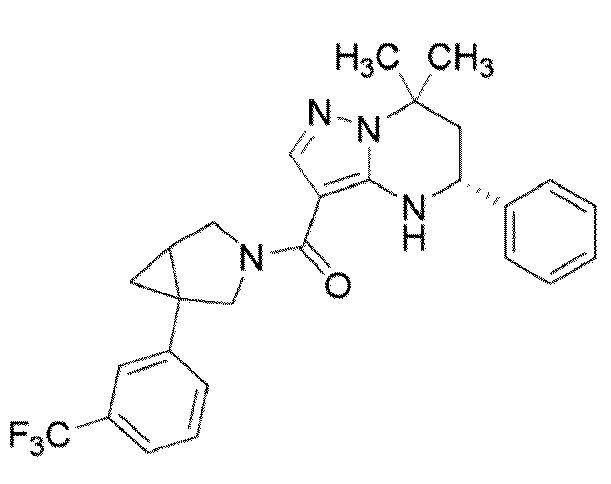
[Таблица 7–8]
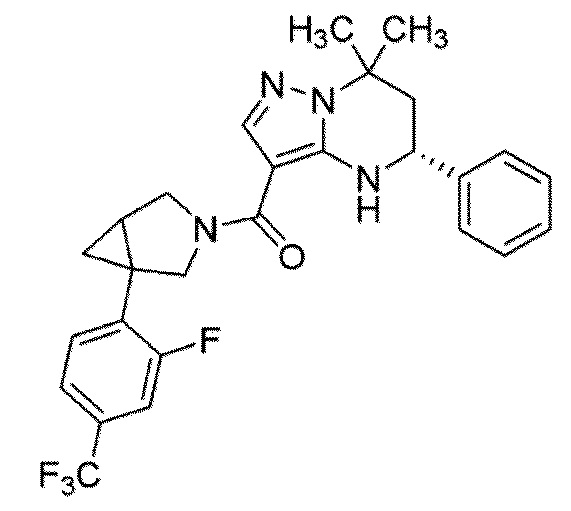
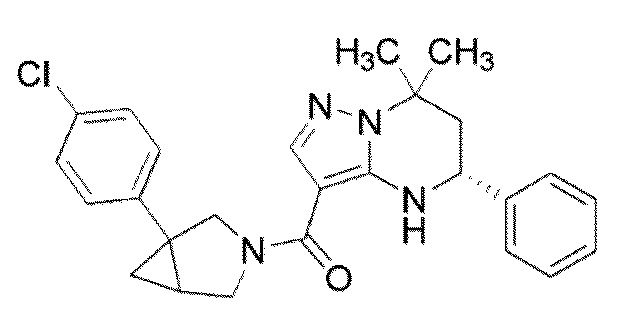
[Таблица 7–9]
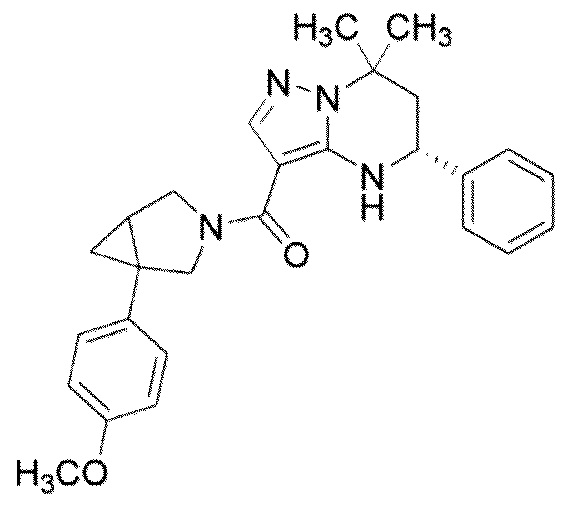
[Таблица 7–10]
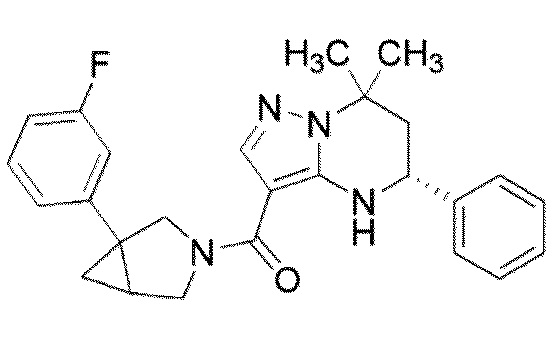
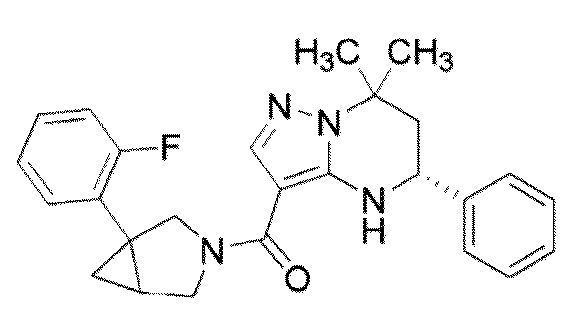
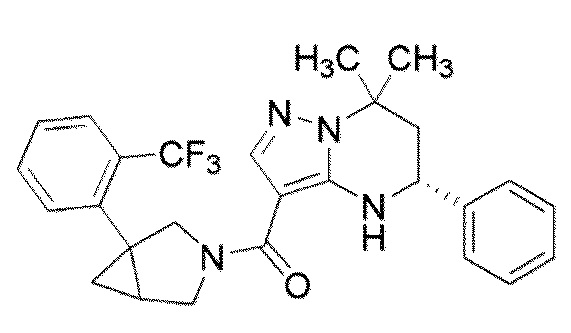
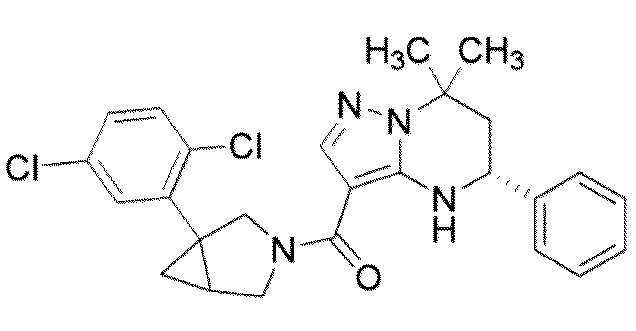
[Таблица 7–11]
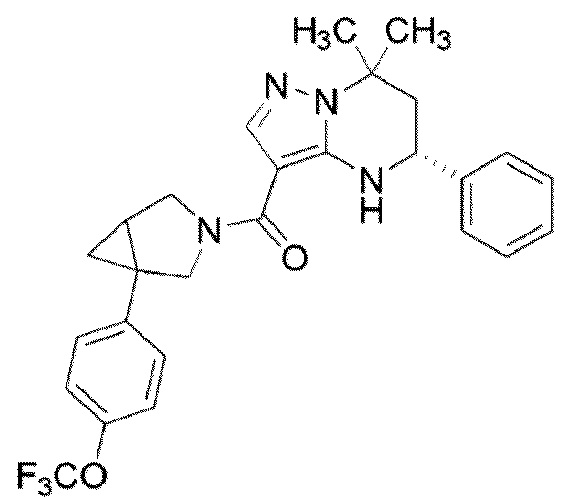
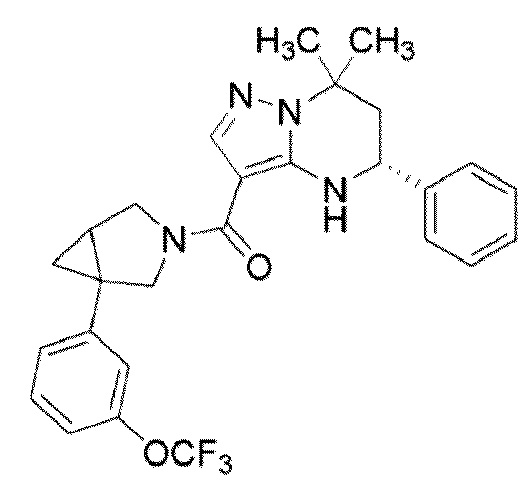
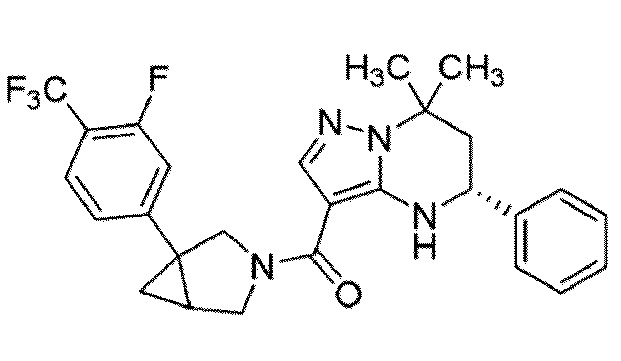
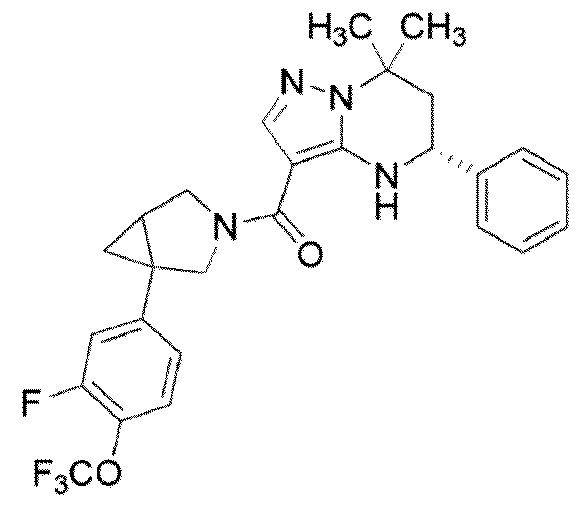
[Таблица 7–12]
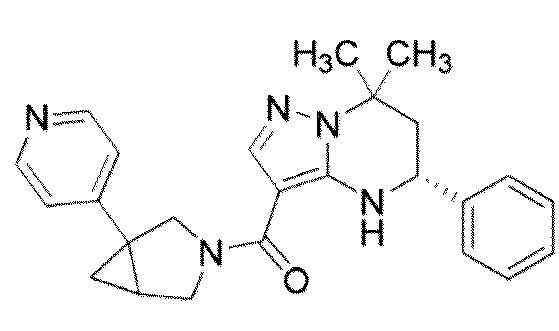
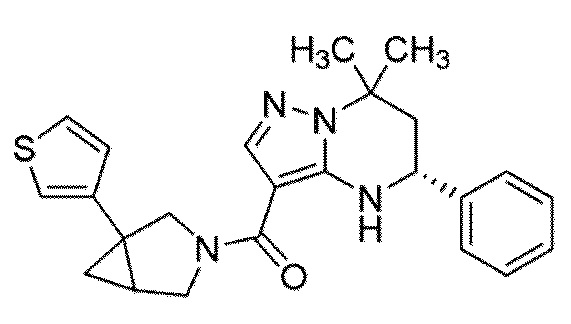
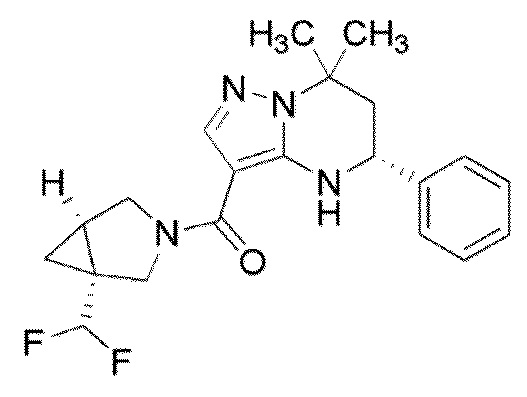
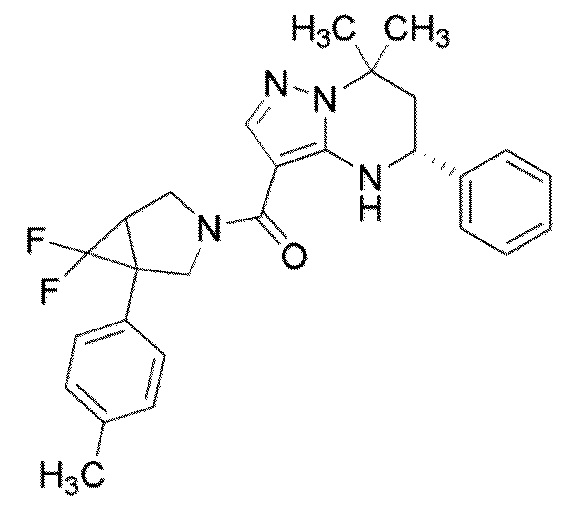
[Таблица 7–13]
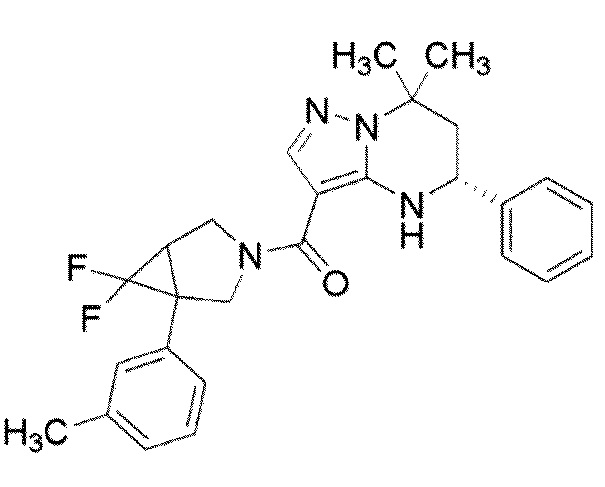
[0258]
[Пример исследования 1] Индукция CYP
Криоконсервированные гепатоциты оттаивали в культуральной среде (In VitroGROTM CP Medium, Celsis In Vitro Technologies, U.S.A.), и полученный продукт добавляли в лунки BioCoatTM Matrigel(R)TM Matrix Thin–Layer 96 well (Becton, Dickinson and Company, U.S.A.) в концентрации 40000 клеток/лунка. После культивирования в течение 24 часов культуральную среду удаляли и заменяли инкубационной средой (In VitroGROTM, HI Medium with Torpedo Antibiotic Mix, Celsis In Vitro Technologies, U.S.A.). Клетки культивировали в течение дополнительных 3 дней. Среду удаляли на 4 день, и оставшиеся клетки обрабатывали в индукционной среде, содержащей исследуемое соединение, в течение 3 дней в присутствии или в отсутствие 10 мкмоль/л рифампицина. Индукционную среду заменяли каждый день. Лунки для добавления исследуемого соединения в присутствии 10 мкмоль/л рифампицина использовали для оценки ингибирующего действия исследуемого соединения на индуцируемость активности CYP3A рифампицином. Активность CYP3A оценивали путем измерения количества генерирующего люциферин после добавления 2 мкмоль/л люциферина–IPA с использованием аналитических систем IPA P450–GloTM CYP3A4 (Promega Corporation, U.S.A.). Во всех случаях культивирования проводили во влажной среде при 37°C, 5% CO2. Индуцируемость рифампицином определяли как 100%, и индуцируемость для исследуемого соединения (% положительного контроля) рассчитывали по следующему уравнению:
[(интенсивность флуоресценции люциферина в отсутствие рифампицина и в присутствии исследуемого соединения) – (интенсивность флуоресценции люциферина в отсутствие рифампицина и исследуемого соединения)/(интенсивность флуоресценции люциферина в присутствии рифампицина и в отсутствие исследуемого соединения) – (интенсивность флуоресценции люциферина в отсутствие рифампицина и исследуемого соединения)] × 100.
[0259]
Результаты приведены в таблице 8.
[0260]
[Таблица 8]
[0261]
[Пример исследования 2] TDI CYP3A4
Использовали микросомы печени человека, приобретенные у XenoTech, LLC (Lenexa, KS). Исследуемые соединения растворяли в ацетонитриле, ацетонитриле/метаноле (1:1, об/об) или DMSO/ацетонитриле (1:4, об/об). К раствору микросом печени человека, отрегулированному фосфатным буфером (рН 7,4), добавляли раствор исследуемого соединения для получения реакционного раствора микросом печени человека, имеющего концентрацию исследуемого соединения 30 мкМ. К реакционному раствору микросом печени человека добавляли систему продуцирования NADPH и смесь предварительно инкубировали при 37°C в течение 0 или 60 минут. После предварительной инкубации добавляли маркерный субстрат тестостерон и анализировали метаболит тестостерона 6β–гидрокситестостерон методом LC/MS/MS для оценки ферментативной активности CYP3A4.
[0262]
Активность фермента (% от контроля) в каждой точке предварительной инкубации рассчитывали по следующему уравнению:
% от контроля = [(активность группы добавления исследуемого соединения)/(активность группы без добавления исследуемого соединения)] × 100.
Остаточную активность (% остаточной) после 60 минут предварительной инкубации рассчитывали по следующему уравнению:
Остаточная активность (%) = [активность через 60 минут (% от контроля60 мин)]/[активность через 0 минут (% от контроля0 мин)] × 100.
[0263]
Результаты приведены в таблице 9.
[0264]
[Таблица 9]
[0265]
[Пример исследования 3] Активность антагонистов CaSR человека
Измерение активности антагониста CaSR проводили с использованием системы анализа люциферазы Bright–Glo (Promega Corporation). Клетки CHO, в которых человеческий CaSR и NFAT–люцифераза репортерный ген был принудительно экспрессирован, суспендировали в MEM–альфа (Wako Pure Chemical Industries, Ltd.), содержащей 10% диализированную сыворотку (HyClone). Клетки в суспензии высевали в 384–луночный белый планшет (Corning) при 10000/20 мкл/лунку и культивировали в инкубаторе при 37°C, 5% CO2 в течение одного дня. Разбавитель испытуемого соединения получали с помощью буфера для анализа (MEM альфа, включающего 10 мМ HEPES (Life Technologies) и 10% сыворотку для диализа). Разбавитель добавляли в планшет при 5 мкл/лунку и оставляли стоять при 37°C в течение 10 минут. Кроме того, разбавитель 7,8 мМ CaCl2, приготовленный с буфером для анализа (конечная концентрация 1,3 мМ), добавляли при 5 мкл/лунку и оставляли стоять в инкубаторе при 37°C, 5% CO2 в течение 2 часов. Реагенты Bright–Glo (Promega Corporation) добавляли при 10 мкл/лунку, и полученную смесь перемешивали в течение 5 минут, и затем измеряли интенсивность люминесценции с использованием ридера Multi–label reader Envision (PerkinElmer, Inc.). Активность (%) исследуемого соединения рассчитывали с помощью определений, в которых интенсивность люминесценции при добавлении DMSO вместо исследуемого соединения определяется как 0% ингибирования; и интенсивность люминесценции при добавлении (5R)–N–(1–этил–1–(4–этилфенил)пропил)–2,7,7–триметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–а]пиримидин–3–карбоксамида в конечной концентрации 10 мкМ определяется как 100% ингибирование.
[0266]
Результаты приведены в таблице 10. Как показано ниже, было обнаружено, что соединение (I) обладает превосходной антагонистической активностью в отношении CaSR.
[0267]
[Таблица 10]
[0268]
[Пример исследования 4] Эффект соединения примера 1 на снижение массы сердца на животной модели сердечной недостаточности
В этом примере исследования эффект соединения примера 1 на снижение массы сердца оценивали с использованием мышей CSQ–Tg в качестве животной модели сердечной недостаточности.
[0269]
Соединение примера 1 суспендируют в 0,5% водном растворе метилцеллюлозы (далее, в примерах исследования, иногда называемых «носитель») (10 мл/кг). Полученную суспензию перорально вводили самкам мышей CSQ–Tg в возрасте 5 недель с развивающейся сердечной недостаточностью в дозе 10 мг/кг массы тела/день (n=7) или 30 мг/кг массы тела/день (n=10) один раз в день (р/день) в течение 21 дня. Для отрицательного контроля (группа введения носителя) вводили 0,5% водный раствор метилцеллюлозы (n=7). Затем измеряли массу сердца. Измерение массы проводили путем фракционирования каждого сердца на четыре: левый желудочек, правый желудочек, левое предсердие и правое предсердие. Сумма масс четырех фракций была определена как масса сердца. Полученная масса сердца показана в таблице 11, а масса каждой фракции показана в таблице 12.
[0270]
[Таблица 11]
(10 мг/кг массы тела/день)
(30 мг/кг массы тела/день)
[0271]
[Таблица 12]
(10 мг/кг массы тела/день)
(30 мг/кг массы тела/день)
** критерий множественного сравнения Уильямса (p < 0,025)
[0272]
[Пример исследования 5] Эффект соединения примера 1 на уровень выживаемости животной модели сердечной недостаточности
В этом примере исследования эффект соединения примера 1 на уровень выживаемости исследовали с использованием животных моделей сердечной недостаточности. Мыши, описанные у Larry R. Jones et al., J. Clin. Invest. 101: 1385–1393, 1998, были получены из Пенсильванского университета и выращены в лаборатории, были кардио–специфическими трансгенными мышами по кальсекестрину (CSQ) (мыши CSQ–Tg) в качестве животных моделей с сердечной недостаточностью. В исследовании использовали самок мышей, и дозирование начинали с возраста 5 недель. Животные получали корм (CE–2, CLEA Japan, Inc.) и водопроводную воду при комнатной температуре от 20 до 26°C, влажности 40–70% и времени освещения 12 часов/день (7:00 до 19:00). Как уже сообщалось, у мышей CSQ–Tg подавлялось внутриклеточное высвобождение Ca2+, сокращение миокарда уменьшилось, снижался сердечный выброс, а также развивались гипертрофия сердца и сердечная недостаточность.
[0273]
5–недельным самкам мышей CSQ–Tg соединение примера 1 перорально вводили в дозе 10 мг/кг массы тела/день с частотой один раз в день (р/день) в течение 47 дней (n=24). В то же время контрольной группе вводили носитель (0,5% водный раствор метилцеллюлозы) (n=24). Результат был таким, как показано на фиг. 1.
[0274]
5–недельным самкам мышей CSQ–Tg соединение примера 1 перорально вводили в дозе 10 мг/кг массы тела/день в комбинации с кандесартан цилексетилом (1 мг/кг массы тела/день) с частотой один раз в день (р/день) в течение 68 дней (n=18). Контрольной группе вводили кандесартан цилексетил (1 мг/кг массы тела/день) (n=18). Результат был таким, как показано на фиг. 2.
[0275]
[Пример лекарственной формы 1] Получение капсул
Ингредиенты 1), 2), 3) и 4) смешивали, и полученной смесью заполняли желатиновые капсулы.
[0276]
[Пример лекарственной формы 2] Получение таблеток
Все количества ингредиентов 1), 2) и 3) и 30 г ингредиента 4) замешивали с водой, и полученную смесь сушили в вакууме, а затем подвергали гранулированию частиц. С полученными частицами смешивали 14 г ингредиента 4) и 1 г ингредиента 5), и полученную смесь прессовали с помощью таблеточного пресса. Таким образом, получали 1000 таблеток, каждая из которых содержала 30 мг соединения примера 1.
Промышленная применимость
[0277]
Соединение по настоящему изобретению обладает антагонистической активностью в отношении кальцийчувствительного рецептора, и, как ожидается, будет полезным в качестве средства для профилактики или лечения таких заболеваний, как сердечная недостаточность или легочная гипертензия.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2018 |
|
RU2773441C2 |
| ПРОИЗВОДНЫЕ АЗАБИЦИКЛО [3.1.0]ГЕКСАНА, ПРИМЕНИМЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДОПАМИНОВЫХ РЕЦЕПТОРОВ D3 | 2005 |
|
RU2434011C2 |
| СОЕДИНЕНИЯ ТЕТРАГИДРОПИРАЗОЛОПИРИМИДИНА | 2013 |
|
RU2677291C2 |
| СОЕДИНЕНИЕ, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ KDM5, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2840256C1 |
| БИЦИКЛИЧЕСКИЕ 6-АЛКИЛИДЕНПЕНЕМЫ В КАЧЕСТВЕ ИНГИБИТОРОВ β-ЛАКТАМАЗ | 2003 |
|
RU2339640C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛИДИНА | 2016 |
|
RU2740019C1 |
| ПРОЛЕКАРСТВА СОПРЯЖЕННО-БИЦИКЛИЧЕСКИХ АНТАГОНИСТОВ C5aR | 2019 |
|
RU2794327C2 |
| ЗАМЕЩЁННЫЕ ПИРАЗОЛОПИРИМИДИНЫ КАК АКТИВАТОРЫ ГЛЮКОЦЕРЕБРОЗИДАЗЫ | 2011 |
|
RU2603637C2 |
| ПРОИЗВОДНЫЕ 2-АЗА-БИЦИКЛО[3.1.0.]ГЕКСАНА В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА ОРЕКСИНА | 2007 |
|
RU2460732C2 |
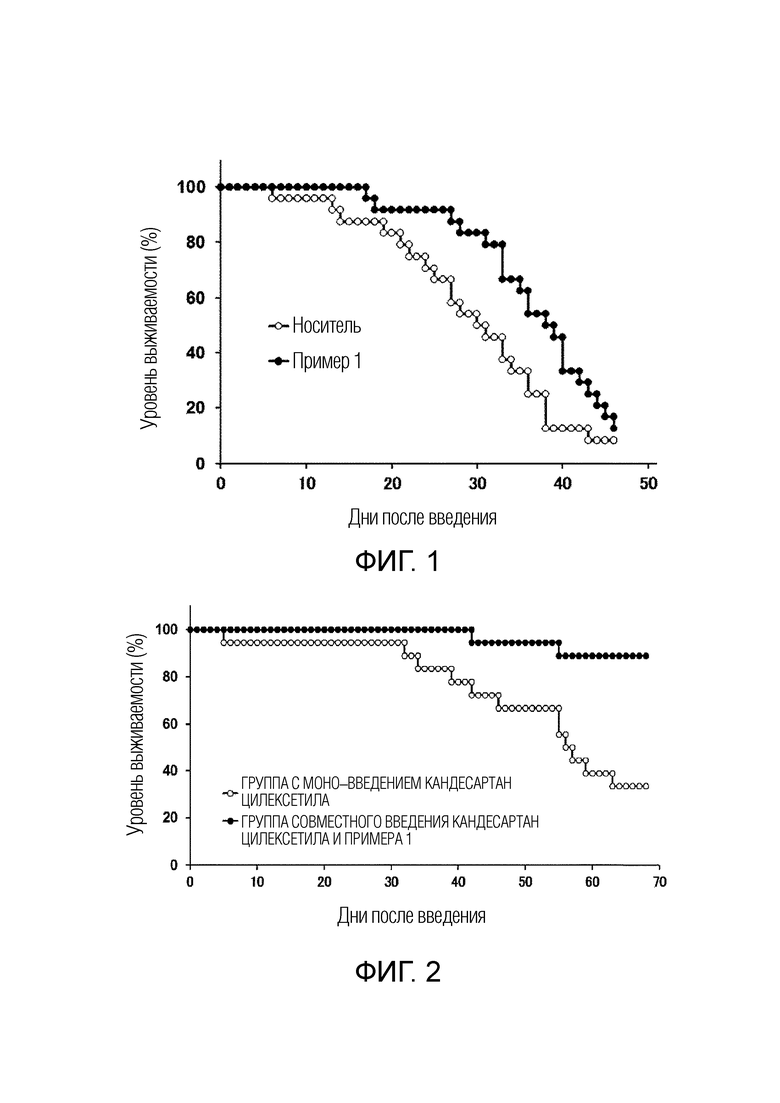
Изобретение относится к соединению, представленному формулой (I), где кольцо А представляет собой бензольное кольцо; R1 представляет собой атом водорода; каждый из R2 и R3 независимо представляет собой C1-6 алкильную группу; R4 представляет собой фенильную группу, необязательно замещенную одним или двумя заместителями, выбранными из группы, состоящей из атома галогена, С1-6 алкокси группы и С1-6 алкильной группы, необязательно замещенной одним-тремя атомами галогена, 5- или 6-членную моноциклическую ароматическую гетероциклическую группу, содержащую 1 гетероатом, выбранный из атома азота или атома серы, или С1-6 алкильную группу, замещенную одним-тремя атомами галогена, каждый из R5 и R6 независимо представляет собой атом водорода или атом галогена, или его фармацевтически приемлемой соли. Изобретение также относится к лекарственному средству, включающему соединение или его фармацевтически приемлемую соль формулы (I) и фармацевтически приемлемый носитель, где лекарственное средство представляет собой средство для лечения сердечной недостаточности или легочной гипертензии путем антагонизации кальцийчувствительного рецептора. Технический результат - соединения, обладающие антагонистической активностью по отношению к кальцийчувствительному рецептору и применимые в качестве средства для профилактики или лечения сердечной недостаточности, легочной гипертензии. 8 н. и 3 з.п. ф-лы, 2 ил., 12 табл., 59 пр.
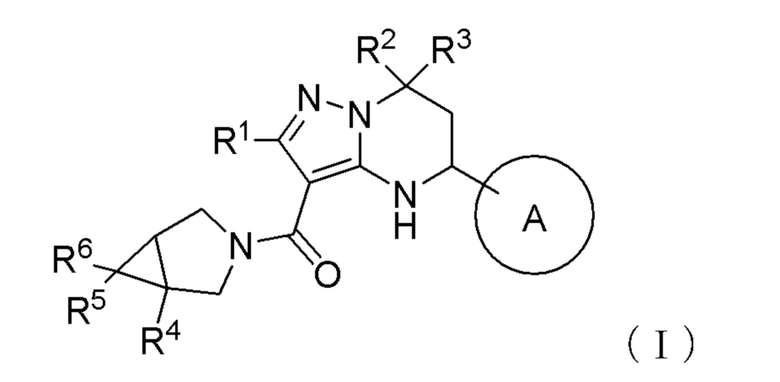
1. Соединение, представленное формулой (I):
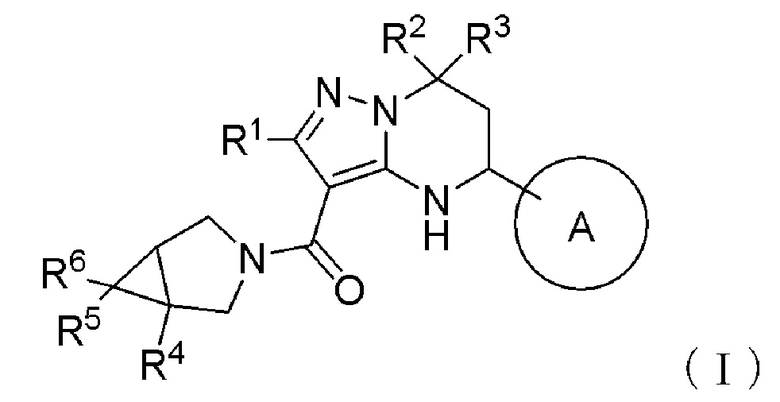 ,
,
где
кольцо А представляет собой бензольное кольцо;
R1 представляет собой атом водорода;
каждый из R2 и R3 независимо представляет собой C1-6 алкильную группу;
R4 представляет собой фенильную группу, необязательно замещенную одним или двумя заместителями, выбранными из группы, состоящей из атома галогена, С1-6 алкокси группы и С1-6 алкильной группы, необязательно замещенной одним-тремя атомами галогена,
5- или 6-членную моноциклическую ароматическую гетероциклическую группу, содержащую 1 гетероатом, выбранный из атома азота или атома серы, или
С1-6 алкильную группу, замещенную одним-тремя атомами галогена,
каждый из R5 и R6 независимо представляет собой атом водорода или атом галогена,
или его фармацевтически приемлемая соль.
2. Соединение или его соль по п. 1, где
кольцо А представляет собой бензольное кольцо;
R1 представляет собой атом водорода;
каждый из R2 и R3 представляет собой C1–6 алкильную группу;
R4 представляет собой фенильную группу, замещенную одним или двумя заместителями, выбранными из группы, состоящей из атома галогена и C1–6 алкильной группы, которая необязательно замещена одним–тремя атомами галогена; и
каждый из R5 и R6 представляет собой атом водорода.
3. ((1S,5R)–1–(3,4–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон или его фармацевтически приемлемая соль.
4. (1–(3,5–Дихлорфенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон или его фармацевтически приемлемая соль.
5. (1–(4–Хлор–3–(трифторметил)фенил)–3–азабицикло[3.1.0]гекс–3–ил)((5R)–7,7–диметил–5–фенил–4,5,6,7–тетрагидропиразоло[1,5–a]пиримидин–3–ил)метанон или его фармацевтически приемлемая соль.
6. Лекарственное средство, включающее соединение или его фармацевтически приемлемую соль по п. 1 и фармацевтически приемлемый носитель, где лекарственное средство представляет собой средство для лечения сердечной недостаточности путем антагонизации кальцийчувствительного рецептора.
7. Лекарственное средство, включающее соединение или его фармацевтически приемлемую соль по п. 1 и фармацевтически приемлемый носитель, где лекарственное средство представляет собой средство для лечения легочной гипертензии путем антагонизации кальцийчувствительного рецептора.
8. Соединение или его фармацевтически приемлемая соль по п. 1 для применения в лечении сердечной недостаточности путем антагонизации кальцийчувствительного рецептора.
9. Соединение или его фармацевтически приемлемая соль по п. 1 для применения в лечении легочной гипертензии путем антагонизации кальцийчувствительного рецептора.
10. Способ лечения сердечной недостаточности у млекопитающего, включающий введение млекопитающему эффективного количества соединения или его фармацевтически приемлемой соли по п. 1 и антагонизации кальцийчувствительного рецептора у млекопитающего.
11. Способ лечения легочной гипертензии у млекопитающего, включающий введение млекопитающему эффективного количества соединения или его фармацевтически приемлемой соли по п. 1 и антагонизации кальцийчувствительного рецептора у млекопитающего.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| JP 2005239611 A, 08.09.2005 | |||
| M | |||
| Yoshida et al | |||
| "Synthesis and structure-activity relationship of tetrahydropyrazolopyrimidine derivatives--a novel structural class of potent calcium-sensing receptor antagonists" Bioorganic & Medicinal Chemistry, vol.18, N24, 2010, 8501-8511 | |||
| M | |||
| Yoshida et al | |||
| "Novel and potent | |||
Авторы
Даты
2022-03-24—Публикация
2018-04-26—Подача