Изобретение относится к области медицины и химико-фармацевтической промышленности и касается препаратов против тромбоцитопении.
 - состояние, характеризующееся снижением количества тромбоцитов, которое сопровождается повышенной кровоточивостью и проблемами с остановкой кровотечений. Цель лечения нарушения - сведение к минимуму риска геморрагических осложнений путем повышения числа тромбоцитов до безопасного уровня, не вызывая выраженных побочных эффектов, с использованием минимально токсичных вариантов лечения, что особенно важно при длительной терапии пациентов с рефрактерным или рецидивирующим течением заболевания. Основным цитокином, стимулирующим образование тромбоцитов, является тромбопоэтин (ТПО).
- состояние, характеризующееся снижением количества тромбоцитов, которое сопровождается повышенной кровоточивостью и проблемами с остановкой кровотечений. Цель лечения нарушения - сведение к минимуму риска геморрагических осложнений путем повышения числа тромбоцитов до безопасного уровня, не вызывая выраженных побочных эффектов, с использованием минимально токсичных вариантов лечения, что особенно важно при длительной терапии пациентов с рефрактерным или рецидивирующим течением заболевания. Основным цитокином, стимулирующим образование тромбоцитов, является тромбопоэтин (ТПО).
В настоящее время применение агонистов рецептора тромбопоэтина (аТПО-р) представляет собой новый подход к лечению пациентов с тромбоцитопенией при неэффективности предшествующих методов.
Одним из таких прошедших клинические испытания агонистов является аватромбопаг, представляющий собой 1- [3-хлор-5 - [[[4- (4-хлор-2-тиенил) -5- (4-циклогексил-1-пиперазинил) -2-тиазолил] амино] карбонил] -2 пиридинил]-4-пиперидинкарбоновую кислоту формулы:
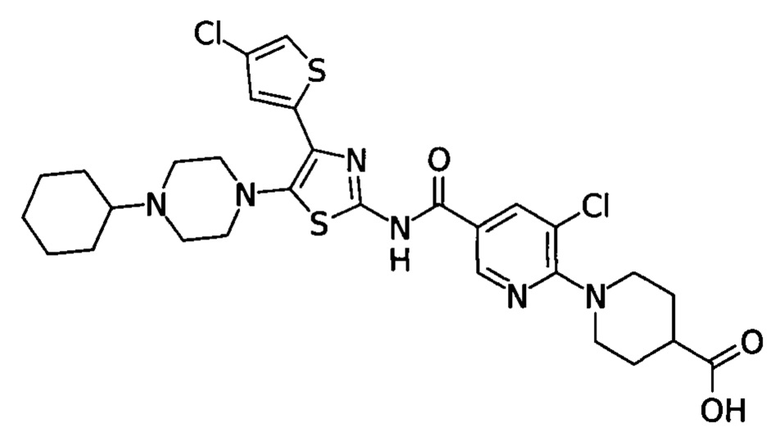
Аватромбопаг - это биодоступный перорально, низкомолекулярный агонист рецептора ТПО, который стимулирует пролиферацию и дифференцировку мегакариоцитов из клеток-предшественников костного мозга, что приводит к увеличению продукции тромбоцитов. Препарат не конкурирует с ТПО за связывание с рецептором ТПО и оказывает аддитивное действие с ТПО на продукцию тромбоцитов.
Способ получения субстанции описан, например, в международной заявке WO03062233 (А1), опубл. 2003-07-31, заявке CN107383000 (А), опубл. 2017-11-24.
В фармакопеях ведущих зарубежных стран сведения о лекарственном средстве для перорального применения для лечения тромбоцитопении (недостатка тромбоцитов в крови) у взрослых с хроническим заболеванием печени на основе субстанции аватромбопаг отсутствуют.
На сегодняшний день аватромбопаг выпускается в виде препарата Doptelet®, таблетки покрытые оболочкой 20 мг (Dova Pharmaceuticals, Inc.) (https://www.drugs.com/doptelet.html). Способ получения таблеток в уровне техники не раскрывается.
Известен способ получения таблеток, содержащих соединение, обладающее агонистической активностью рецептора тромбопоэтина 15 мг, Лактозу 15 мг Стеарат кальция 3 мг, где компоненты, отличные от стеарата кальция, гомогенно смешиваются, и смесь измельчается, гранулируется и сушится для получения гранул подходящего размера, затем к ней добавляют стеарат кальция и смесь прессуют для получения таблеток (US 10085973 В2).
Известен способ получения таблетированной формы, согласно которому сахарозу, микрокристаллическую целлюлозу и непептидный агонист рецептора тромбопоэтина (ТПО) смешивают и гранулируют с 10% раствором желатина, влажные гранулы просеивают, сушат, смешивают с крахмалом, тальком и стеариновой кислотой, затем просеивают и прессуют в таблетку (US 8637563 В2).
Технологии не обеспечивают высокую стабильность формы, точность дозирования и однородность.
Задачей настоящего изобретения является разработка таблетированной лекарственной формы аватромбопага с высокой стабильностью и биодоступностью и способа ее получения.
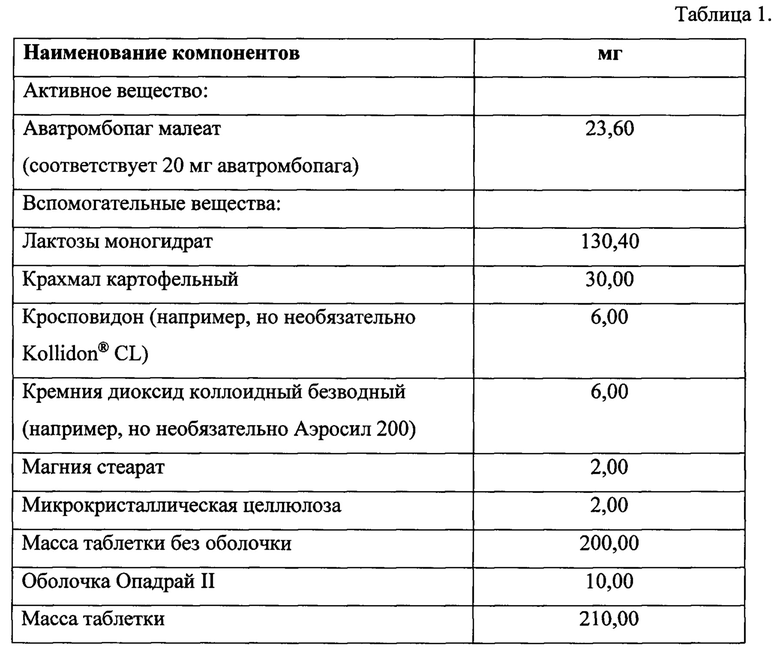
Задача решается новым способом получения и составом таблетки, содержащей покрытое пленочной оболочкой Опадрай II ядро, включающее в качестве активного компонента Аватромбопаг или его фармацевтически приемлемую соль, в качестве наполнителя - смесь лактозы моногидрата (например, Таблетозы™), крахмала и микрокристаллической целлюлозы (например, Компрецел™), в качестве дезинтегранта - кросповидон, качестве опудривающего агента - смесь фармацевтически приемлемой соли стеариновой кислоты с компрецелом, в качестве скользящего агента - кремния диоксид коллоидный безводный, при следующем соотношении компонентов, масс. %:
В качестве фармацевтически приемлемой соли аватромбопага может быть использована, например, хлористоводородная, нитратная, сукцинатная, глютаматная, малеатная соль и т.п. Предпочтительно использование аватромбопага малеатной соли.
В качестве наполнителя, обеспечивающего улучшенные свойства, состав включает смесь определенных количеств крахмала, лактозы моногидрата, например, в виде «Таблетозы»™ и микрокристаллической целлюлозы, например, в виде «Компрецела»™. Крахмал может быть выбран из картофельного, кукурузного крахмала, их прежелатинизированных форм. Крахмал соединяет в себе многочисленные функциональные свойства связующего вещества, дезинтегранта, смазывающего вещества и вещества для улучшения текучести. Продукт лактозы моногидрат изготавливается методом непрерывной агломерации при распылении, где вода используется в качестве связующего вещества и распыляется на псевдоожиженные мелко измельченные частицы лактозы, создавая жидкие мостики с образованием агломерированной лактозы. Гранулометрический состав лактозы моногидрата: частиц с размером менее 63 мкм - не более 25%; менее 250 мкм - 60-90%; менее 500 мкм - не менее 96%.
Компрецел - микрокристаллическая целлюлоза в виде гранулированного порошка, с насыпной плотностью 0,28-0,35 г/мл, с распределением частиц: размер частиц +60 МЕШ (250 мкм) - не более 8%, размер частиц +200 МЕШ (75 мкм) - не менее 45%. В настоящем изобретении компрецел включен в две фазы состава: внутреннюю - в качестве связующего и внешнюю - в качестве опудривающего агента в смеси с фармацевтически приемлемой солью стеариновой кислоты.
Кросповидон представляет собой дезинтергатор и солюбилизатор, обеспечивающий высвобождение активного вещества без гелеобразования.
Кремния диоксид коллоидный безводный введен в качестве скользящего агента.
В состав пленочной оболочки Опадрай II входят: в качестве пленкообразователя -гидроксипропилметилцеллюлоза (гипромеллоза) или поливиниловый спирт, в качестве пластификатора - полиэтиленгликоль (макрогол), придающий помимо пластифицирующего действия блеск таблетке, триацетин, помимо пластифицирующего действия уменьшающий образование пены в процессе приготовления суспензии, пигменты - двуокись титана, а также, возможно, полисахариды: лактоза, мальтодекстрин, полидекстроза. Использование Опадрай II (Opadry II) обеспечивает хорошее и быстрое прилипание пленки к таблеткам и превосходную их защиту, что позволяет увеличить срок годности таблеток вследствие большей стабильности лекарственной формы.
Для получения таблеток компоненты смешивают в следующем порядке: к лактозе моногидрату добавляют аватромбопаг или его фармацевтически приемлемую соль при массовом соотношении 1:1-1,5:1, измельчают, к полученной измельченной смеси добавляют оставшийся лактозы моногидрат, не подвергавшийся измельчению, крахмал картофельный, кросповидон, кремния диоксид коллоидный безводный, микрокристаллическую целлюлозу и перемешивают до однородности. Полученную смесь опудривают фармацевтически приемлемой солью стеариновой кислоты с добавлением 1-2% от общего количества опудривающей смеси микрокристаллической целлюлозы (например, Компрецел™). На основе полученной таблетмассы получают ядра таблеток с необходимой дозировкой (20-75 мг). Полученные ядра таблеток покрывают пленочной оболочкой из Опадрай II.
Предложенный способ позволяет получить более высокую точность массы таблетки при дозировании. В процессе технологического процесса уменьшается запыленность и снижаются потери таблетируемого продукта, в том числе за счет уменьшения количества некондиционных таблеток.
Возможность осуществления изобретения продемонстрирована следующими примерами:
Пример 1.
Таблетки, покрытые пленочной оболочкой, дозировка 20 мг. Состав представлен в Таблице 1.
Средняя масса и однородность по массе ядер: от 196,25 мг до 205,75 мг, 18/20 таблеток - ±5,5%, 2/20 таблеток - ±10% (ГФ XIV ОФС. 1.4.2.0009.15).
Распадаемость таблетки: не более 30 минут (ГФ XIV ОФС.1.4.2.0013.15).
Растворение: не менее 75% аватромбопага через 45 мин (ГФ XIV ОФС. 1.4.2.0014.15, прибор типа Лопастная мешалка, ВЭЖХ).
Однородность дозирования: высокая в соответствии с требованиями ГФ XIV ОФС. 1.4.2.0008.18.
Количественное определение: содержание аватромбопага малеата, определенное методом ВЭЖХ: от 22,83 до 24,37 мг/табл.
Микробиологическая чистота: категория ЗА (ГФ XIV ОФС. 1.2.4.0002.18).
Пример 2.
Способ получения таблеток по примеру 1.
1. Приготовление концентрата.
В смеситель отвешивают на весах лактозы моногидрат, перетирают 2 минуты, прибавляют аватромбопага малеат при соотношении 1:1 из расчета на основание, перетирают 3-5 минут.
2. Смешивание компонентов и опудривание таблетмассы.
В смеситель отвешивают на весах остальное количество лактозы моногидрата, прибавляют концентрата аватромбопага малеата, полученный на стадии 1. Таблетмассу перемешивают в течение 3-4 минут. В смеситель отвешивают на весах крахмал картофельный, кросповидон, кремния диоксид коллоидный, микрокристаллическую целлюлозу (например, Компрецел™), таблетмассу перемешивают в течение 3-4 минут.
Для опудривания к таблетмассе добавляют отвешенный на весах магния стеарат, перемешивают в течение 3-4 минут. Добавляют 2% от общего количества опудривателя микрокристаллической целлюлозы, перемешивают 2-3 минуты. Таблетмассу переносят в сборник.
Далее отбирают пробу таблетмассы для определения количественного содержания аватромбопага малеата, при получении удовлетворительных результатов таблетмассу передают на стадию таблетирования.
3. Получение таблеток-ядер.
На данной стадии получают таблетки массой 200 мг, используя пресс-инструмент 8 мм.
Изготовленные таблетки пропускают через установку барабанного типа для обеспыливания и галтовки таблеток. Обеспыленные качественные таблетки помещают в сухую, чистую и заранее взвешенную емкость.
Далее отбирают пробу таблеток-ядер для определения количественного содержания аватромбопага, при получении удовлетворительных результатов таблетки-ядра передают на стадию 4.
Содержание аватромбопага малеата в таблетках-ядрах должна быть: от 22,83 до 24,37 мг/табл.
4. Покрытие таблеток оболочкой.
Суспензию для нанесения оболочки готовят в реакторе, непосредственно перед стадией нанесения. В реактор загружают воду очищенную, отмерянную с помощью цилиндра, включают мешалку и при работающей мешалке (200-250 об/мин) добавляют Опадрай II, отвешенный на весах, проводят перемешивание до получения однородной суспензии. Время перемешивания должно составлять не менее 45 минут.
Нанесение пленочного покрытия проводится в коатере для нанесения покрытия.
Процесс покрытия таблеток-ядер пленкообразующей суспензией осуществляют в четыре стадии:
1) прогрев таблеток-ядер (температура воздуха на входе 78°С; температура воздуха на выходе 43°С);
2) нанесение суспензии (температура воздуха на входе 78°С; температура воздуха на выходе 43°С; давление воздуха, подаваемого для распыления, 1,2-1,4 бар; скорость перистальтического насоса для подачи суспензии 6-8 г/мин; скорость ротора 10 об/мин);
3) сушка таблеток, покрытых оболочкой (температура воздуха на входе 78°С; сушка таблеток после нанесения покрытия в течение 15 минут);
4) охлаждение таблеток, покрытых оболочкой (температура воздуха на входе 25-30°С).
После нанесения и высушивания пленочного покрытия таблетки выгружают из машины и собирают в сборник. Некондиционные таблетки отбраковывают.
Количество некондиционных таблеток составляет 0,0080 кг в пересчете на 1 кг конечного продукта производства. При использовании лактозы моногидрата без добавления крахмала - 0,0101 кг, без микрокристаллической целлюлозы - 0,0104 кг.
Пример 3.
Фармакологические исследования препаративной формы для лечения мышей с идиопатической тромбоцитопенической пурпурой.
Испытания проводили на здоровых мышах BALB/C уровня SPF (Specefic pathogen Free), масса 18-22 г, самцы.
Разбивка животных на группы: контрольная группа, группа аватромбопага (таблетки по примеру 1).
Моделирование проводили путем забора крови из орбитальной вены мышей BALB/C с последующей антикоагуляционной обработкой EDTA-Na2, и затем тромбоциты отделяли и промывали. Готовый раствор суспензии тромбоцитов смешивали с равным количеством полного адъюванта Фройнда и неполного адъюванта Фройнда, соответственно. В первую неделю антиген, содержащий полный адъювант Фройнда, подкожно вводили в заднюю лапу, спину и пах морской свинки. Инъекции проводили всего 4 раза, с 5 точками для каждой инъекции и 100 мкл для каждой точки. На 6-ую неделю не подвергнутую антикоагуляционной обработке цельную кровь забирали от морских свинок и центрифугировали в течение 10 мин при 3000 об/мин, получая супернатант, который является сывороткой антимышиных тромбоцитов (GP-APS) морских свинок. Супернатант помещали на водяную баню (56°С) на 30 мин для инактивации комплемента, и затем инактивированный супернатант разбавляли нормальным солевым раствором, после чего проводили тест на титры антител методом диффузии в агаре и наконец сохраняли в холодильнике при -20°С для более позднего использования. Мышам вводили сыворотку антимышиных тромбоцитов (APS) морской свинки с дозой 100 мкл/20 г массы тела внутрибрюшинной инъекций, в 1-ый, 3-ий, 5-ый, 7-ой, 9-ый, 11-ый и 13-ый день эксперимента.
Наблюдение развившейся подкожной пурпуры:
Класс I, легкое кровотечение наблюдают в местах инъекции, и геморрагические пятна распространяются в другие места (35% мышей);
Класс II, явное кровотечение наблюдают в местах инъекции, и экхимозы и петехии наблюдают в других местах (35%);
Класс III, тяжелое кровотечение наблюдают в местах инъекции, большое количество экхимоз и петехий появилась на коже, и изъязвление и почернение отмечают на коже (20%).
После введения таблеток аватромбопага измерение количества тромбоцитов проводилось в течение 2-х недель.
Количество тромбоцитов (среднее) до моделирования:
Контроль - 739,2 × 109/л
Группа аватромбопага - 745,2 × 109/л
Количество тромбоцитов на 14 день:
Контроль - 385,4 × 109/л
Группа аватромбопага- 593,5 × 109/л.
Количество тромбоцитов у мышей показало, что аватромбопаг может эффективно ограничивать уменьшение количества тромбоцитов и быть использован при тромбопении.
Отмечено незначительное проявление побочных эффектов.
Биодоступность: пиковое время в плазме: 6 часов, пиковая концентрация в плазме: 169 нг/мл, AUC: 4203 нг⋅ч/мл.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ АНЕМИИ, СВЯЗАННОЙ С ХРОНИЧЕСКИМ ЗАБОЛЕВАНИЕМ ПОЧЕК, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2020 |
|
RU2756312C1 |
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ АНЕМИИ, СВЯЗАННОЙ С ХРОНИЧЕСКИМ ЗАБОЛЕВАНИЕМ ПОЧЕК, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2020 |
|
RU2749719C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ФОРМЕ ТАБЛЕТКИ, ПОКРЫТОЙ ОБОЛОЧКОЙ | 2022 |
|
RU2786073C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА АНТИОКСИДАНТНОГО ДЕЙСТВИЯ В ФОРМЕ ТАБЛЕТКИ | 2020 |
|
RU2749718C1 |
| ТАБЛЕТКИ КЛОЗАПИНА С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ | 2016 |
|
RU2613192C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ФОРМЕ ТАБЛЕТОК, ПОКРЫТЫХ КИШЕЧНОРАСТВОРИМОЙ ОБОЛОЧКОЙ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2015 |
|
RU2668499C2 |
| ПРОТИВОВИРУСНОЕ И ИММУНОСТИМУЛИРУЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2015 |
|
RU2593570C1 |
| ФАРМАЦЕВТИЧЕСКАЯ ПРОТИВОДИАБЕТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ЗАМЕЩЕННОГО ТИОФЕНКАРБОКСИЛАТА И СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2018 |
|
RU2688235C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОЙ ФОРМЫ ТРИМЕТАЗИДИНА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ | 2012 |
|
RU2530558C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ТЕТРАМЕТИЛТЕТРААЗОБИЦИКЛООКТАНДИОНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2611194C2 |
Группа изобретений относится к области медицины, а именно к гематологии, и предназначена для лечения тромбоцитопении. Состав для лечения тромбоцитопении в форме таблетки содержит покрытое пленочной оболочкой Опадрай II ядро, включающее в качестве активного компонента аватромбопаг или его фармацевтически приемлемую соль, в качестве наполнителя - смесь лактозы моногидрата, крахмала и микрокристаллической целлюлозы, в качестве дезинтегранта - кросповидон, качестве опудривающего агента - смесь фармацевтически приемлемой соли стеариновой кислоты с микрокристаллической целлюлозой, в качестве скользящего агента - кремния диоксид коллоидный безводный. Компоненты используются в заявленных количествах. В другом воплощении представлен способ получения указанного состава для лечения тромбоцитопении в форме таблетки. Использование группы изобретений обеспечивает получение состава в таблетированной форме с высокой стабильностью и биодоступностью, при этом способ изготовления указанного состава позволяет получить более высокую точность массы таблетки при дозировании. 2 н. и 1 з.п. ф-лы, 1 табл., 3 пр.
1. Состав для лечения тромбоцитопении в форме таблетки, характеризующийся тем, что содержит покрытое пленочной оболочкой Опадрай II ядро, включающее в качестве активного компонента аватромбопаг или его фармацевтически приемлемую соль, в качестве наполнителя - смесь лактозы моногидрата, крахмала и микрокристаллической целлюлозы, в качестве дезинтегранта - кросповидон, качестве опудривающего агента - смесь фармацевтически приемлемой соли стеариновой кислоты с микрокристаллической целлюлозой, в качестве скользящего агента - кремния диоксид коллоидный безводный, при следующем соотношении компонентов, масс. %:
2. Способ получения состава для лечения тромбоцитопении в форме таблетки по п. 1, характеризующийся тем, что к лактозе моногидрату добавляют аватромбопаг или его фармацевтически приемлемую соль при массовом соотношении 1:1-1,5:1, измельчают, к полученной измельченной смеси добавляют оставшийся лактозы моногидрат, не подвергавшийся измельчению, крахмал картофельный, кросповидон, кремния диоксид коллоидный безводный, микрокристаллическую целлюлозу и перемешивают до однородности, полученную смесь опудривают фармацевтически приемлемой солью стеариновой кислоты с добавлением 1-2% от общего количества опудривающей смеси микрокристаллической целлюлозы, формируют прессованием ядро таблетки с последующим покрытием пленочной оболочкой из Опадрай II.
3. Способ по п. 2, характеризующийся тем, что для покрытия пленочной оболочкой на прогретые ядра таблеток при температуре воздуха на входе 78°С и температуре воздуха на выходе 43°С наносят суспензию Опадрай II под давлением воздуха, подаваемого для распыления 1,2-1,4 бар, скорости перистальтического насоса 6-8 г/мин, скорости ротора 10 об/мин, осуществляют сушку при температуре воздуха 78°С в течение 15 мин, охлаждают полученные таблетки, покрытые оболочкой.
| CLINICAL STUDY PROTOCOL | |||
| An Open-Label Study to Evaluate the Efficacy and Safety of Avatrombopag for the Treatment of Subjects with Thrombocytopenia Scheduled for a Surgical Procedure | |||
| Investigational Product: Avatrombopag tablets, Protocol Number: AVA-PST-320, 17 September 2018, с.16, 26 [найдено 09.03.2021], [найдено в Интернет]: |
Авторы
Даты
2022-04-07—Публикация
2020-10-08—Подача