Изобретение относится к области химико-фармацевтической промышленности и касается средств группы нейролептиков.
В настоящее время психическое здоровье принадлежит к числу наиболее серьезных проблем, стоящих перед всеми странами, поскольку в тот или иной период жизни такие проблемы возникают, по крайней мере, у каждого четвертого человека. На их долю выпадает 19,5% всех лет жизни, утраченных в результате инвалидности. По данным ВОЗ, только в Европейском регионе свыше 4 млн человек страдают шизофренией; примерно 4 млн - биполярными аффективными расстройствами и немного больше - паническими расстройствами.
Лечение психических больных, в частности больных шизофренией, сопряжено с рядом трудностей, среди которых надо отметить отсутствие выраженного терапевтического влияния классических нейролептиков на негативную симптоматику, довольно высокую частоту случаев резистентности при их применении и наличие выраженных побочных эффектов. В последние годы многие проблемы удалось разрешить за счет внедрения в практику психиатрии так называемых атипичных нейролептиков.
Одним из значимых событий в истории антипсихотических средств стало появление атипичного нейролептика - клозапина. Описание первого опыта использования клозапина было представлено в источнике [Gross Н, Langner Е. Effect profile of a chemically new broad spectrum neuroleptic of the dibenzo-diazepine group / Wien Med Wochenschr. - 1966. - Vol. 116. - pp. 814-816]. Клозапин был исторически первым представителем класса так называемых атипичных антипсихотиков, то есть антипсихотиков, отличающихся от традиционных малой вероятностью экстрапирамидных побочных явлений, лучшей переносимостью и меньшим влиянием на секрецию пролактина. Механизм действия клозапина несколько отличается от механизма действия многих нейролептиков. Эти отличия определяют значительные особенности профиля его психотропных эффектов. Антипсихотическое действие клозапина обычно объясняется его способностью блокировать дофаминовые D2- и серотониновые 5-НТ2-рецепторы головного мозга.
В настоящее время клозапин применяют при следующих заболеваниях: шизофрения (в том числе при резистентности к терапии другими нейролептиками или их непереносимости), маниакальные состояния, маниакально-депрессивный психоз, психомоторное возбуждение при психопатиях, эмоциональные и поведенческие расстройства (в том числе у детей), тяжелые расстройства сна [http://www.vidal.ru/drugs/molecule/259].
В клинической практике используется выпускаемый препарат Лепонекс (Leponex®), таблетки немедленного высвобождения в дозах по 25 мг и 100 мг, владельцем регистрационного удостоверения на который является компания «Novartis Pharmaceuticals UK Ltd». Активной фармацевтической субстанцией является клозапин. Каждая таблетка с риской содержит в качестве активного агента 25 мг или 100 мг клозапина, а в качестве вспомогательных веществ магния стеарат, кремния диоксид коллоидный, крахмал кукурузный, тальк, лактозы моногидрат, повидон К30.
Прием клозапина, как правило, рекомендуется начинать с дозы 12,5 мг один или два раза в день с постепенным повышением дозы с 25 мг до 50 мг в сутки, а при хорошей переносимости препарата достигается запланированная доза от 300 мг до 450 мг в сутки (прием раздельными дозами) к концу второй недели. Максимальная суточная доза - 900 мг. Средний терминальный период полураспада клозапина составляет 12 часов, поэтому для поддержания установившегося состояния необходим многократный прием препарата. Таким образом, желательно получать и применять состав клозапина с замедленным высвобождением.
Из уровня техники [патент RU №2441651 С1, опубл. 10.02.2012] известны таблетки клозапина со следующим соотношением компонентов, мас.%:
Способ их получения заключается в том, что предварительно полученную сухую смесь лактозы, крахмала картофельного и клозапина увлажняют 10%-ным водным раствором Коллидона 25, проводят влажную грануляцию, сушку при температуре 45-50°C. Полученные гранулы подвергают сухой грануляции до получения гранул со средним диаметром 1,0-1,5 мм, опудривают аэросилом и стеариновой кислотой и/или ее солью, полученную смесь таблетируют. В указанном источнике решается задача повышения биодоступности клозапина.
Однако указанные таблетки клозапина не являются составом с замедленным высвобождением.
Из уровня техники также известен состав клозапина с замедленным высвобождением, содержащий клозапин, поливинилпирролидон, полиэтиленгликоль, этилцеллюлозу, тальк, ацетон, спирт и воду [заявка на патент WO №2006059194 А2, опубл. 08.06.2006]. Методом влажного гранулирования получают гранулы с активным веществом, сушат, покрывают оболочкой и загружают в капсулы.
Недостатком такого состава является использование в технологии его получения токсичных растворителей.
Ближайшим аналогом настоящего изобретения является [патент RU №2414903 С1, опубл. 27.03.2011] фармацевтический состав пролонгированного действия для перорального введения, включающий в качестве действующего вещества клозапин и в качестве вспомогательных веществ гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, соль стеариновой кислоты при следующем соотношении компонентов, мас.%:
Таблетки могут быть покрыты оболочкой, включающей поливиниловый спирт, тальк, полиэтиленгликоль, титана диоксид, приемлемые красители. Способ получения такого состава характеризуется тем, что в смеситель загружают просеянные гидроксипропилметилцеллюлозу, клозапин, комплекс микрокристаллической целлюлозы и двуокиси кремния, перемешивают в течение 7-10 минут при скорости вращения главной мешалки 80-100 об/мин, добавляют просеянный стеарат магния и продолжают смешивать в течение 2-3 минут, таблеточную массу выгружают из смесителя и передают на стадию таблетирования.
В качестве недостатков можно отметить отсутствие в указанном источнике достаточного количества экспериментов по изучению фармакинетики указанного состава клозапина, что не позволяет оценить воспроизводимость кинетики высвобождения активного вещества, а также отсутствие данных по изучению стабильности указанной лекарственной формы.
Технический результат настоящего изобретения заключается в получении стабильного фармацевтического состава клозапина в виде таблеток замедленного высвобождения с устойчивыми технологическими свойствами, а также воспроизводимой кинетикой высвобождения активного вещества.
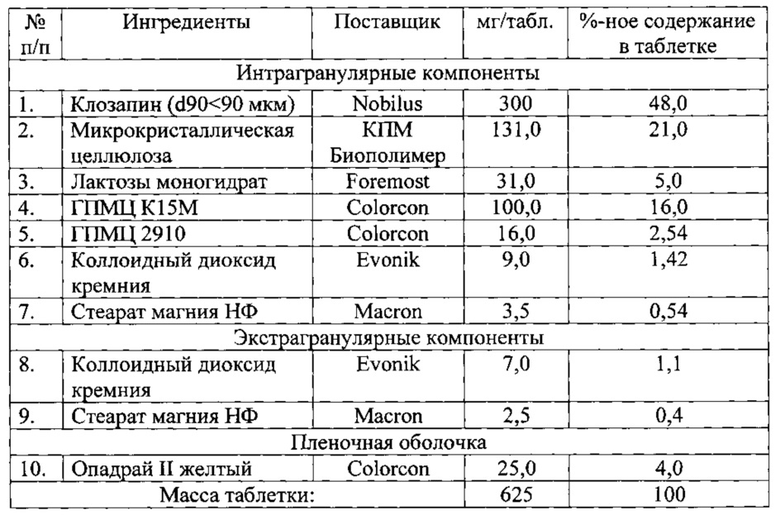
Технический результат достигается новым фармацевтическим составом клозапина с замедленным высвобождением в виде таблетки, покрытой пленочной оболочкой, содержащим следующие компоненты, мас.%:
Пленочная оболочка включает поливиниловый спирт (например, 1,0-2,0 мас.% от массы таблетки), диоксид титана (например, 0,5-1,0 мас.% от массы таблетки), макрогол (например, 0,5-1,0 мас.% от массы таблетки), приемлемые красители (например, алюминиевый лак хинолиновый желтый и оксид железа красный в количестве 0,05-1,0 мас.% от массы таблетки) или смесь Опадрай II желтый.
В качестве фармацевтически приемлемой соли стеариновой кислоты могут использоваться стеарат магния, стеарат кальция или их смесь.
Целевой профиль замедленного высвобождения составляет по меньшей мере 21±2 часа.
Активный фармацевтический ингредиент, а именно клозапин способен к сцеплению и проявляет плохую подвижность, что подтверждается коэффициентом сжимаемости. Низкая подвижность материала может давать таблетки с повышенной вариабельностью веса и содержания вследствие неравномерного распределения активного вещества в смеси, неравномерную насыпную плотность до уплотнения и, как результат, неравномерное заполнение полости матрицы таблеточного пресса. В связи с этим выбранные производственная формула и процесс должны обеспечивать хорошую текучесть и сжимаемость в готовой смеси.
Нами было обнаружено, что влажная грануляция проявляет тенденцию к потенциальному воздействию на стабильность вследствие влияния влаги и вероятности термического разложения лекарственного вещества во время сушки. Для сухой грануляции методом вальцевания порошкообразные частицы лекарственного вещества и наполнители соединяются под высоким давлением для образования ленты, а перед прессованием (таблетирование) разбиваются для образования гранул размалыванием. Также было обнаружено, что риск неудовлетворительной однородности состава таблетки и отклонение массы таблетки с клозапином могут быть снижены при осуществлении контроля фракционного состава и свойств сыпучести. Еще одним объектом изобретения является способ получения таблеток клозапина замедленного высвобождения методом вальцевания, предпочтительно при использовании субстанции клозапина микронизированной с распределением частиц по размеру d90<50 микрон. В частности гранулометрический состав частиц с d 90<50 мкм: d 90-62.62 мкм, d 50-25.86 мкм, d 10-8.23 мкм.
Способ получения фармацевтического состава клозапина с замедленным высвобождением в виде таблетки характеризуется тем, что клозапин, микрокристаллическую целлюлозу, лактозы моногидрат и комбинацию гидроксипропилметилцеллюлозы ГПМЦ К15М и гидроксипропилметилцеллюлозы ГПМЦ 2910 просеивают вместе, перемешивают до однородности, добавляют фармацевтически приемлемую соль стеариновой кислоты и коллоидный диоксид кремния, перемешивают, смесь уплотняют вальцеванием, добавляют коллоидный диоксид кремния и перемешивают вместе с предварительно уплотненными гранулами с последующим добавлением фармацевтически приемлемой соли стеариновой кислоты, перемешиванием, прессованием таблеток и нанесением на таблетки пленочного покрытия.
Перемешивание предпочтительно ведут при скорости мешалки 20 об/мин. Любую из стадий перемешивания осуществляют до однородного состояния, предпочтительно в течение 3-6 минут. На стадии вальцевания может использоваться сетка размером 1.6 мм для предварительной грануляции и 0.63 мм для тонкой грануляции. Процесс осуществляют предпочтительно при гидравлическом давлении 90 бар.
Стадию покрытия пленочной оболочкой предпочтительно осуществляют на установке BGB-10 в присутствии водной суспензии, содержащей компоненты оболочки в соответствии с предлагаемым составом.
Наличие пленочной оболочки обеспечивает стабильность предлагаемой лекарственной формы при хранении (не менее 2-3 лет), а также улучшает ее внешний вид и органолептические свойства.
Предложенный способ обеспечивает хорошую текучесть и сжимаемость в готовой смеси за счет использования комбинации определенных вспомогательных компонентов согласно предлагаемому составу.
Настоящее изобретение может быть проиллюстрировано следующими примерами:
В примерах 1-3 представлены предлагаемые согласно настоящему изобретению фармацевтические составы клозапина.
Пример 1

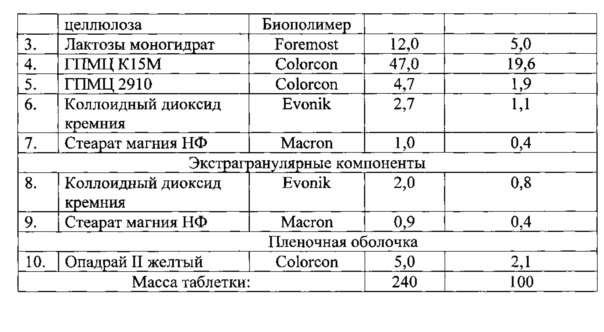
Пример 2

Пример 3
Способ получения фармацевтических составов в соответствии с примерами 1-3 включает:
1. Просеивание интрагранулярных компонентов. Через сито ASTM#30 просеивали вместе субстанцию клозапина, микрокристаллическую целлюлозу, лактозы моногидрат, комбинацию ГПМЦ К15М и ГПМЦ 2910. Через сито ASTM#20 просеивали коллоидный диоксид кремния. Через сито ASTM#60 просеивали стеарат магния.
2. Смешивание (предварительное компактирование). Просеянные вспомогательные вещества перемешивали в смесителе. Длительность перемешивания составила 6 минут при 20 об/мин. Просеянный стеарат магния добавляли к предыдущей фазе и вновь перемешивали. Длительность перемешивания составила 3 минуты при 20 об/мин.
3. Уплотнение (компактирование) вальцеванием. Вышеуказанную смесь поместили в роликовый пресс (Alexanderwerk WP120), оснащенный вальцами 25 мм. Пресс был запущен в работу согласно нижеприведенным параметрам, использовалась сетка размером 1.6 мм для предварительной грануляции и 0.63 мм для тонкой грануляции.

4. Просеивание экстрагранулярных вспомогательных субстанций. Через сито ASTM#20 просеивали коллоидный диоксид кремния. Через сито ASTM#60 просеивали стеарат магния.
5. Смешивание (предварительное смазывание). В смеситель емкостью 1 л помещали просеянный коллоидный диоксид кремния вместе с предварительно уплотненными гранулами. Длительность перемешивания составила 4 мин при 20 об/мин. Просеянный стеарат магния поместили в вышеупомянутый смеситель. Смеситель запустили в работу на 2 минуты при 20 об/мин.
6. Прессование. Пластифицированную смесь помещают в таблеточный пресс с пуансонами типа D (используются 2 станции), прессуют согласно следующим параметрам: насыпная плотность 0,516 г/мл; плотность после уплотнения 0,727 г/мл; индекс Карра 29,03%; соотношение по Хауснеру 1,41. Прессование составов по примерам 1-3 было равномерным, с минимизированным отклонением от установленных параметров (менее 0,31% в отличие от прототипа с 0,96%).
Среднее значение прочности 20,63 Кр.
7. Нанесение пленочной оболочки. Нанесение пленочной оболочки осуществляли на установке BGB-10 в присутствии водной суспензии, содержащей компоненты оболочки в соответствии с предлагаемым составом.
Пример 4. Изучение стабильности таблеток клозапина по заявленному изобретению
Таблетки клозапина, полученные в соответствии с примерами 1-3 и в соответствии с прототипом ,были упакованы в блистеры из алюминиевой фольги ('Alu-Alu') и помещены в климатическую камеру на 6 месяцев в условия ускоренных и долгосрочных («в реальном времени») испытаний. Содержание примесей определялось методом ВЭЖХ с использованием стандартов. Полученные результаты представлены в таблице 1.

Полученные данные показали, что предложенные в заявленном изобретении составы клозапина, отличающиеся концентрацией активного вещества и вспомогательных ингредиентов, обладают практически равноценными показателями стабильности и являются более стабильными по сравнению с прототипом.
Пример 5. Исследование кинетики высвобождения таблеток клозапина по заявленному изобретению
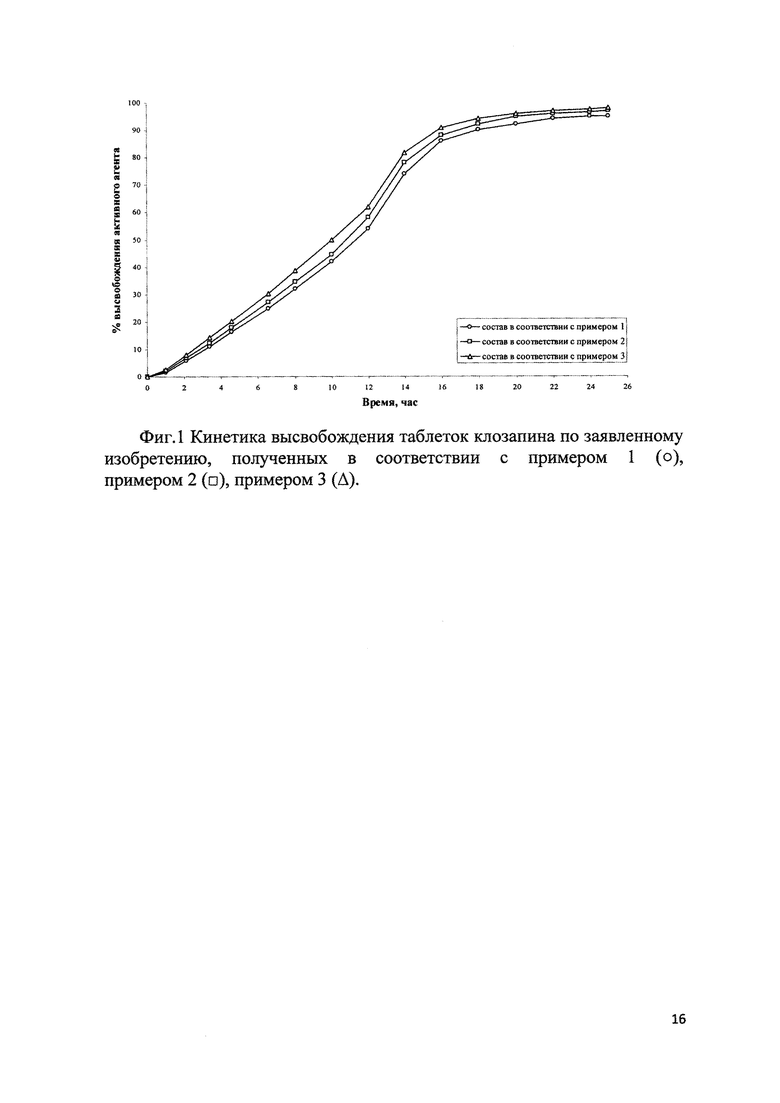
При исследовании на собаках заявленные составы клозапина показали необходимое замедленное действие, максимальная концентрация клозапина в плазме крови достигается постепенно и не ранее, чем через 8-10 часов и поддерживается более 23 часов. Относительная биодоступность составила более 50% от состава немедленного высвобождения с эквивалентной дневной дозой на фоне двукратного приема в сутки.
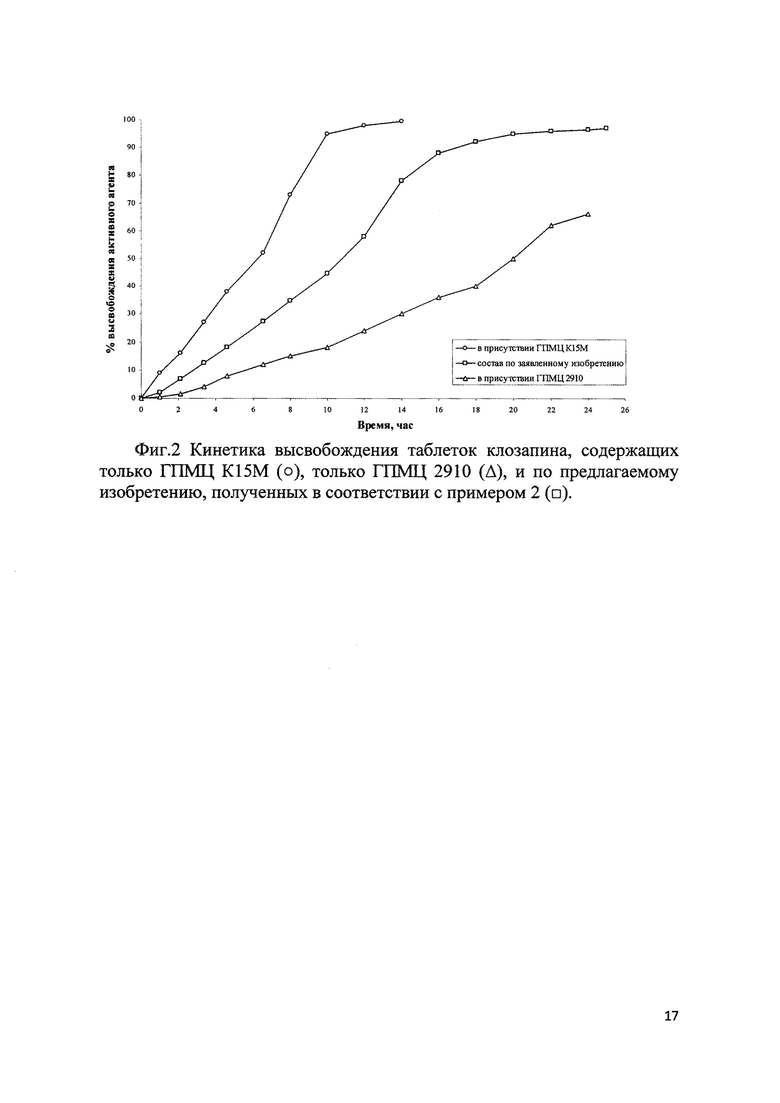
Было обнаружено, что применение комбинации ГПМЦ К15М и ГПМЦ 2910 в таблетках клозапина обеспечивает более высокие результаты стабильности и воспроизводимой кинетики высвобождения активного вещества, максимальная концентрация клозапина в плазме крови достигается постепенно и не ранее чем через 8-10 часов и поддерживается более 23 часов (фиг. 1), в то время как использование одной из ГПМЦ К15М или ГПМЦ 2910 демонстрирует или слишком быстрый, или слишком медленный профиль растворения и всасывания действующего вещества (фиг. 2). Стоит отметить, что фармацевтические составы клозапина согласно прототипу обеспечивают достижение максимальной концентрации клозапина в крови через 6 часов, в то время как составы по предлагаемому изобретению - через 8-10 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая композиция с модифицированным высвобождением на основе полиморфов клозапина | 2024 |
|
RU2836778C1 |
| Таблетки клозапина с замедленным высвобождением и способ их получения | 2015 |
|
RU2624229C2 |
| ТАБЛЕТКИ В ОБОЛОЧКЕ | 2004 |
|
RU2362549C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА АНТИОКСИДАНТНОГО ДЕЙСТВИЯ В ФОРМЕ ТАБЛЕТКИ С ПРОЛОНГИРОВАННЫМ ЭФФЕКТОМ | 2019 |
|
RU2712445C1 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ НА ОСНОВЕ КЛОЗАПИНА ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2009 |
|
RU2414903C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОЙ ФОРМЫ ТРИМЕТАЗИДИНА ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ | 2012 |
|
RU2530558C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ТЕТРАМЕТИЛТЕТРААЗОБИЦИКЛООКТАНДИОНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2611194C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ДОРАВИРИН, ТЕНОФОВИРА ДИЗОПРОКСИЛА ФУМАРАТ И ЛАМИВУДИН | 2016 |
|
RU2736941C2 |
| КОМПОЗИЦИЯ ДВУХСЛОЙНОЙ ТАБЛЕТКИ | 2010 |
|
RU2583920C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ МЕЛАТОНИН И ДИФЕНГИДРАМИН ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМУЮ СОЛЬ, ЛЕКАРСТВЕННАЯ ФОРМА НА ОСНОВЕ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ, ВКЛЮЧАЮЩЕЙ МЕЛАТОНИН И ДИФЕНГИДРАМИН ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМУЮ СОЛЬ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ЛЕКАРСТВЕННОЙ ФОРМЫ НА ОСНОВЕ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ, ВКЛЮЧАЮЩЕЙ МЕЛАТОНИН И ДИФЕНГИДРАМИН ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМУЮ СОЛЬ | 2021 |
|
RU2818092C1 |
Группа изобретений относится к области химико-фармацевтической промышленности, а именно к фармацевтическому составу клозапина с замедленным высвобождением в виде таблетки, покрытой пленочной оболочкой, содержащему 30,0-50,0 мас.% клозапина, 20,0-30,0 мас.% микрокристаллической целлюлозы, 4,0-6,0 мас.% моногидрата лактозы, 15,0-25,0 мас.% гидроксипропилметилцеллюлозы ГПМЦ К15М, 1,0-3,0 мас.% гидроксипропилметилцеллюлозы ГПМЦ 2910, 1,0-3,0 мас.% коллоидного диоксида кремния, 0,05-1,5 мас.% фармацевтически приемлемой соли стеариновой кислоты и 2,0-4,0 мас.% пленочной оболочки, которая включает поливиниловый спирт, диоксид титана, макрогол и приемлемые красители или смесь Опадрай II желтый; а также к способу получения такого фармацевтического состава. Группа изобретений обеспечивает получение стабильного фармацевтического состава клозапина в виде таблеток замедленного высвобождения с устойчивыми технологическими свойствами, а также воспроизводимой кинетикой высвобождения активного вещества. 2 н. и 7 з.п. ф-лы, 5 пр., 1 табл., 2 ил.
1. Фармацевтический состав клозапина с замедленным высвобождением в виде таблетки, покрытой пленочной оболочкой, содержащий следующие компоненты, мас.%:
при этом пленочная оболочка включает поливиниловый спирт, диоксид титана, макрогол и приемлемые красители или смесь Опадрай II желтый.
2. Фармацевтический состав клозапина по п. 1, отличающийся тем, что количество поливинилового спирта составляет 1,0-2,0 мас.% от массы таблетки, количество диоксида титана составляет 0,5-1,0 мас.% от массы таблетки, количество макрогола составляет 0,5-1,0 мас.% от массы таблетки, а количество приемлемых красителей составляет 0,05-1,0 мас.% от массы таблетки.
3. Фармацевтический состав клозапина по пп. 1 и 2, отличающийся тем, что в качестве приемлемых красителей используются алюминиевый лак хинолиновый желтый и оксид железа красный.
4. Фармацевтический состав клозапина по п. 1, отличающийся тем, что пленочная оболочка включает Опадрай II желтый в количестве 2,0-4,0 мас.% от массы таблетки.
5. Фармацевтический состав клозапина по п. 1, отличающийся тем, что в качестве фармацевтически приемлемой соли стеариновой кислоты используются стеарат магния, стеарат кальция или их смесь.
6. Способ получения фармацевтического состава клозапина с замедленным высвобождением в виде таблетки по п. 1, характеризующийся тем, что клозапин, микрокристаллическую целлюлозу, лактозы моногидрат и комбинацию гидроксипропилметилцеллюлозы ГПМЦ К15М и гидроксипропилметилцеллюлозы ГПМЦ 2910 просеивают вместе, перемешивают до однородности, добавляют фармацевтически приемлемую соль стеариновой кислоты и коллоидный диоксид кремния, перемешивают, смесь уплотняют вальцеванием, добавляют коллоидный диоксид кремния и перемешивают вместе с предварительно уплотненными гранулами с последующим добавлением фармацевтически приемлемой соли стеариновой кислоты, перемешиванием, прессованием таблеток и нанесением на таблетки пленочного покрытия.
7. Способ по п. 6, отличающийся тем, что перемешивание ведут при скорости мешалки 20 об/мин.
8. Способ по п. 6, отличающийся тем, что любую из стадий перемешивания осуществляют в течение 3-6 минут.
9. Способ по п. 6, отличающийся тем, что на стадии вальцевания использовалась сетка размером 1,6 мм для предварительной грануляции и сетка размером 0,63 мм для тонкой грануляции, и процесс осуществляют при гидравлическом давлении 90 бар.
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ НА ОСНОВЕ КЛОЗАПИНА ПЕРОРАЛЬНОГО ВВЕДЕНИЯ | 2009 |
|
RU2414903C1 |
| КОМПОЗИЦИИ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ, ВКЛЮЧАЮЩИЕ ЛАМОТРИГИН | 2003 |
|
RU2325163C2 |
| US 2014030249 A1, 30.01.2014 | |||
| Praveen S | |||
| Hiremath et al | |||
| Controlled Release Hydrophilic Matrix Tablet Formulations of Isoniazid: Design and In Vitro Studies / AAPS PharmSciTech, 2008, Vol.9, N.4, pp.1171-1178. | |||
Авторы
Даты
2017-03-15—Публикация
2016-02-18—Подача