Предлагаемое изобретение относится к области медицинской микробиологии и касается способа получения антигенной конъюгированной субстанции гемофильного типа b микроба для создания гемофильной типа b конъюгированной вакцины (Hib), а также комбинированных вакцин, содержащих АДС + Hib, АКДС + Hib.
Известен способ получения антигенного препарата Haemophilusinfluenzae типа b, который включает культивирование микроорганизмов на жидких питательных средах и извлечение полисахарида из полученной биомассы методом ультрафильтрации на молекулярных волоконных фильтрах.
Концентрат клеток обрабатывают 2,5%-ным раствором натрия хлорида с натриевой солью ЭДТА и из полученного экстракта ультрафильтрацией на молекулярных волоконных фильтрах выделяют капсульный полисахарид Hib в комплексе с белком, который соединяют с экзогенным полисахаридом Hib в соотношении 1:1 (см. патент России № RU 2185191 С1, МПК А61К 39/02, опубл. 20.07.2002).
Недостатками данного способа является то, что
- полученный антигенный препарат Haemophilusinfluenzae типа b не подвергается очистке от эндотоксинов, нуклеиновых кислот, белка, что может вызвать нежелательные реакции при введении готовой вакцины в организм человека;
- отсутствует процесс конъюгации полученного антигенного препарата с белком, в качестве которого используют столбнячный анатоксин.
В заявляемом же способе создания антигенной субстанции гемофильного типа b микроба, используется метод выделения и очистки капсульного полисахарида Hib, дополнительно применяется метод, который дает возможность осуществить конъюгацию столбнячного анатоксина и капсульного полисахарида Hib. Это позволяет получать вакцину со слабой реактогенностью и высокой иммунологической активностью, а также использовать антигенную конъюгированную субстанцию гемофильного типа b микроба для получения гемофильной типа b конъюгированной вакцины (Hib), а также комбинированных вакцин.
Известен также способ получения вакцины гемофильной типа b конъюгированной, который включает в себя следующие этапы:
- культивирование штамма Haemophilusinfluenzae типа b на жидкой питательной среде с добавлением рибозы;
- инактивацию культуры нагреванием до 55±5°С и выдерживанием 15±3 мин;
- отделение биомассы центрифугированием и выделение полирибозилрибитолфосфата (ПРФ) путем осаждения 10%-ным раствором цетилтриметиламмония бромида (ЦТАБ);
- концентрация, очистка, осветление, активация ПРФ и смешивание его со столбнячным анатоксином.
(см. патент России №2704452; МПК А61К 39/02; опубл. 28.10.2019 г.) Недостатками данного способа является то, что:
1) для извлечения капсульного антигена Hib в патенте используется 10% раствор цетилтриметиламмония бромида без учета содержания в полуфабрикате капсульного полисахарида, что делает процесс извлечения капсульного полисахарида плохо контролируемым, как в сторону завышения, так и в сторону уменьшения дозы цетавлона для оптимального извлечения капсульного полисахарида из культуральной жидкости полуфабриката;
2) в данной технологии для очистки капсульного полисахарида и конъюгата с белком носителем используются многоэтапные системы очистки фильтрационными методами и методом гель-хроматографии, что усложняет технологию, увеличивает время проведения и ведет к удорожанию технологического процесса очистки;
3) в технологическом процессе конъюгации капсульного полисахарида со столбнячным анатоксином не применяются линкеры, обеспечивающие улучшение конформационных свойств конъюгированных антигенов, что может оказывать влияние на биологические свойства конъюгатов. В мировой практике, как правило, используют технологии конъюгации с линкерами.
Цель изобретения. Разработка новых технологий при упрощении процесса получения антигенной конъюгированной субстанции гемофильного типа b микроба с сохранением уровня его высокой антигенной активности для создания вакцин.
Технический результат изобретения заключается в создании антигенной конъюгированной субстанции гемофильного типа b микроба для получения гемофильной типа b конъюгированной вакцины (Hib), а также комбинированных вакцин, содержащих АДС + Hib, АКДС + Hib.
Технический результат достигается тем, что способ получения антигенной конъюгированной субстанции гемофильного типа b микроба для создания вакцинных препаратов включает следующие стадии производства:
- культивирование штамма Haemophilusinfluenzae типа b (Hib) № В-7519 проводили на шоколадном агаре, с добавлением бацитрацина и последующим переводом на жидкую питательную среду следующего состава, г/л: солянокислотный гидролизат казеина - 12; глюкоза - 7; экстракт дрожжевой - 3,9; никотинамиддинуклеотид (NAD) - 0,05; гемин - 0,05; витамин В12 - 0,05; витамин B1 - 0,05; витамин В6 - 0,05; NaHPO4 - 2,4; КН2 РО4 - 0,27; рН среды - 7,5;
- инактивирование культуры осуществляли путем ее обработки 0,1% раствором формальдегида в течение 2 часов и отделение клеток Hib от культуральной жидкости путем фильтрации на пластинчатых мембранных фильтрах с диаметром пор 0,22 мкм в тангенциальном потоке;
- при выделении капсульного полисахарида (КП) Hib использовали цетилтриметиламмония бромида (цетавлон), при этом расчет количества цетавлона проводили с учетом содержания в концентрате КП по формуле: mЦ = Р х 48, где mЦ - количество цетавлона, Р - количество фосфора в объеме концентрата ультрафильтрата, 48 - коэффициент пересчета;
- очищение КП проводили методом горячей фенольной обработки с последующим спиртовым осаждением;
- стандартизацию продолжительности оптимального процесса активации столбнячного анатоксина проводили путем отслеживания суммарного изменения рН реакционной среды в зависимости от продолжительности реакции;
-конъюгацию осуществляли путем соединения столбнячного анатоксина с линкером ADH (дигидрозид адипиновой кислоты) карбодиимидным методом и добавляли к нему очищенный КП, обработанный цианилирующим агентом, в качестве которого применяли помимо BrCN(бромциан) также CDAP (1-циано-4-диметиламинопиридин тетрафлюороборат).
Сущность заявляемого способа в подробностях раскрывается следующим образом. Для достижения поставленной цели разработана и доведена до промышленного производства технология получения антигенной конъюгированной субстанции гемофильного типа b микроба, включающая следующие стадии производства:
1. Стадия культивирования и накопления биомассы производственного штамма Hib.
Операция 1.1. Используется производственный штамм Haemophilusinfluenzae типа b № В-7519, задепонированный 24.12.2013 в Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск» Федерального бюджетного учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии (ФБУН ГНЦ ПМБ).
Область применения штамма: получение вакцинного препарата для профилактики заболеваний, вызванных Haemophilusinfluenzae типа b. Особенностью штамма является его способность выделять в культуральную жидкую среду капсульный полисахарид.
Операция 1.2. Культивирование штамма Haemophilusinfluenzae типа b № В-7519 ведется последовательно на шоколадном агаре, с добавлением бацитрацина и последующим переводом на жидкую питательную среду следующего состава, г/л: солянокислотный гидролизат казеина - 12;глюкоза - 7; экстракт дрожжевой - 3,9; никотинамиддинуклеотид (NAD) - 0,05; гемин - 0,05; витамин В12 - 0,05; витамин В1 - 0,05; витамин В6-0,05; NaHPO4 - 2,4; КН2 РО4 - 0,27; рН среды - 7,5.
Бактериологическая чистота полученной биомассы оценивалась и подтверждалась методами: окраска по Граму, латекс-агглютинация, высев на мясо-пептонныйагар, наличие капсулообразования- окраской по Гинсу-Бури.
2. Стадия разделения клеточной биомассы Hib и культуральной жидкости, ее очистка и концентрирование.
Операция 2.1. Разделение клеточной биомассы и культуральной жидкости. Полученную жидкую биомассу Hib обрабатывают 0,1% раствором формальдегида в течение 2 часов и отделяют клетки Hib от культуральной жидкости с помощью фильтрации на пластинчатых мембранных полиамидных или полисульфоновых фильтрах с диаметром пор 0,22 мкм в тангенциальном потоке.
Операция 2.2. Очистка культуральной жидкости от ингредиентов питательной среды, формальдегида и ее концентрирование осуществляют путем тангенциальной ультрафильтрации на установке с полиамидными или полисульфоновыми полыми волокнами с молекулярными параметрами концентрирования с пределом задержания 100 кДа. В полуфабрикате определяют содержание фосфора, капсульного полисахарида, формальдегида, рибозы.
3. Стадия выделения и очистки капсульного полисахарида Hib.
Операция 3.1. Выделение капсульного полисахарида Hib. Из полученного концентрата на стадии 2 выделяют капсульный полисахарид Hib путем использования методики комплексообразования фосфатной группы капсульного полисахарида Hib с цетилтриметиламмонием бромидом (цетавлоном). Расчет количества цетавлона брали с учетом содержания в концентрате капсульного полисахарида. Расчет количества цетавлона проводили по формуле: mЦ = Р х 48, где mЦ - количество цетавлона, Р - количество фосфора в объеме концентрата ультрафильтрата, 48 - коэффициент пересчета.
Выпавший осадок комплекса (цетавлон + капсульный полисахарид Hib) отделяли центрифугированием при 3000 об/мин на холоду (8±2°С) в течение 30 минут.
Осадок растворяли в 0,5 Μ растворе натрия хлорида. Полученную суспензию осаждали 5 объемами охлажденного (- 20°С) этилового спирта. Далее очистку капсульного полисахарида от белка, остаточных количеств цетавлона проводили методом горячей фенольной обработки с последующим спиртовым осаждением. После экстракции осуществляли центрифугирование на холоду при температуре 8±2°С в течение 30-40 минут при 6000 об/мин. Полученный осадок растворяли в 0,5 Μ растворе натрия хлорида и подвергали диализу против дистиллированной воды до отрицательной или слабо положительной реакции препарата с реактивом Фолина, подтверждающим очистку от остаточных количеств белка и фенола.
Полученный очищенный капсульный полисахарид Hib контролировали по показателям: «Фосфор», «Капсульный полисахарид», «Рибоза»,«Нуклеиновые кислоты», «Формальдегид», «Белок», «Стерильность», «Подлинность», «Токсичность», «Пирогенность».
Предлагаемое изобретение поясняется иллюстративным материалом.
На фиг. 1 в таблице 1 представлены результаты контроля очищенного капсульного полисахарида Hib.
Дополнительно, используя метод ядерно-магнитного резонанса, было подтверждено, что получаемый по разработанной технологии капсульный полисахарид Hib представляет собой по структуре полирибозилрибитол фосфат.
4. Стадия конъюгирования капсульного полисахарида Hib со столбнячным анатоксином.
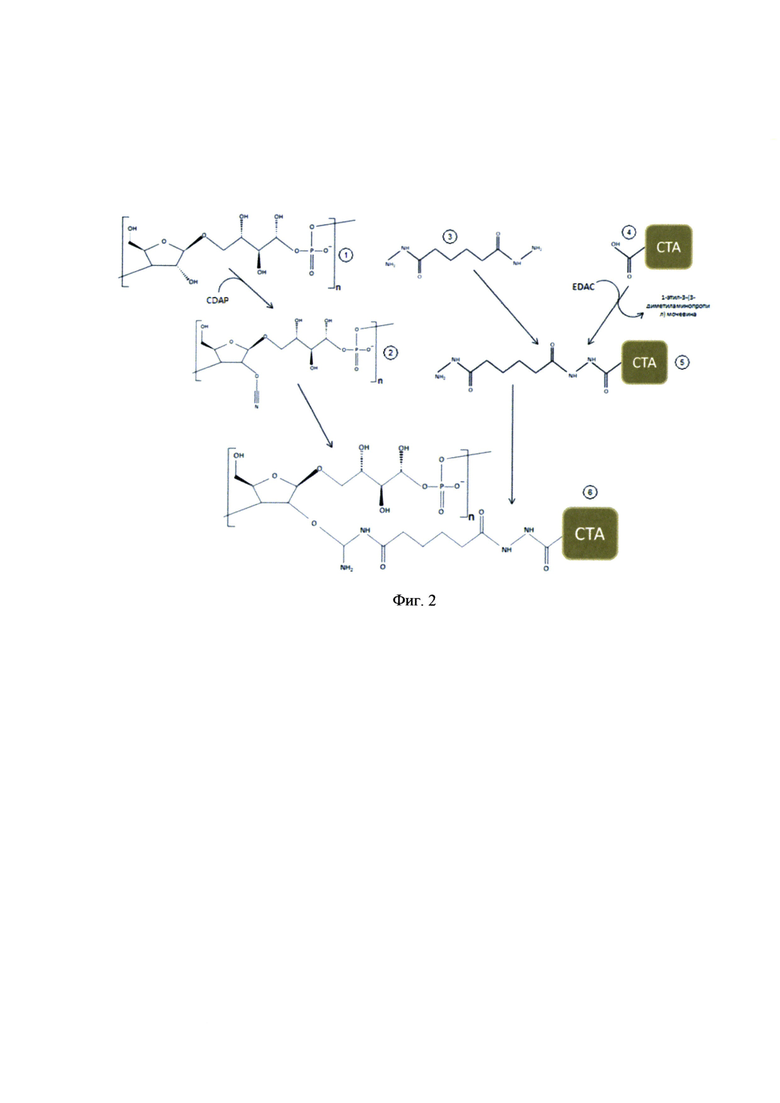
Очищенный капсульный полисахарид Hib конъюгировали со столбнячным анатоксином производства НПО «Микроген» по схеме, представленной на фиг. 2, где 1 - капсульный полисахарид (полирибозилрибитолфосфат); 2 - дериват капсульного полисахарида; 3 - дигидразид адипиновой кислоты; 4 - столбнячный анатоксин; 5 - активированный столбнячный анатоксин; 6 - конъюгат активированного столбнячного анатоксина и капсульного полисахарида.
Химическая схема синтеза субстанции Hib включает:
- активацию карбоксильных групп столбнячного анатоксина с присоединением к нему линкера (дигидразида адипиновой кислоты) карбодиимидным методом; - получение деривата капсульного полисахарида обработкой капсульного полисахарида цианилирующим агентом, который обеспечивает связывание активированного столбнячного анатоксина с капсульным полисахаридом ковалентной связью;
Необходимо отметить, что были проведены работы по совершенствованию технологии конъюгации, которые заключались в том, что при получении деривата капсульного полисахарида в качестве цианилирующего агента, помимо BrCN (бромциан) применялся CDAP (1-циано-4-диметиламинопиридинтетрафлюороборат), который обладает меньшей токсичностью и более высокими конъюгирующими свойствами, чем BrCN.
Связывание столбнячного анатоксина и капсульного полисахарида подтверждается результатами аналитической гель-хроматографии на носителях Сефароза 4 В и ToyopearlH W65.
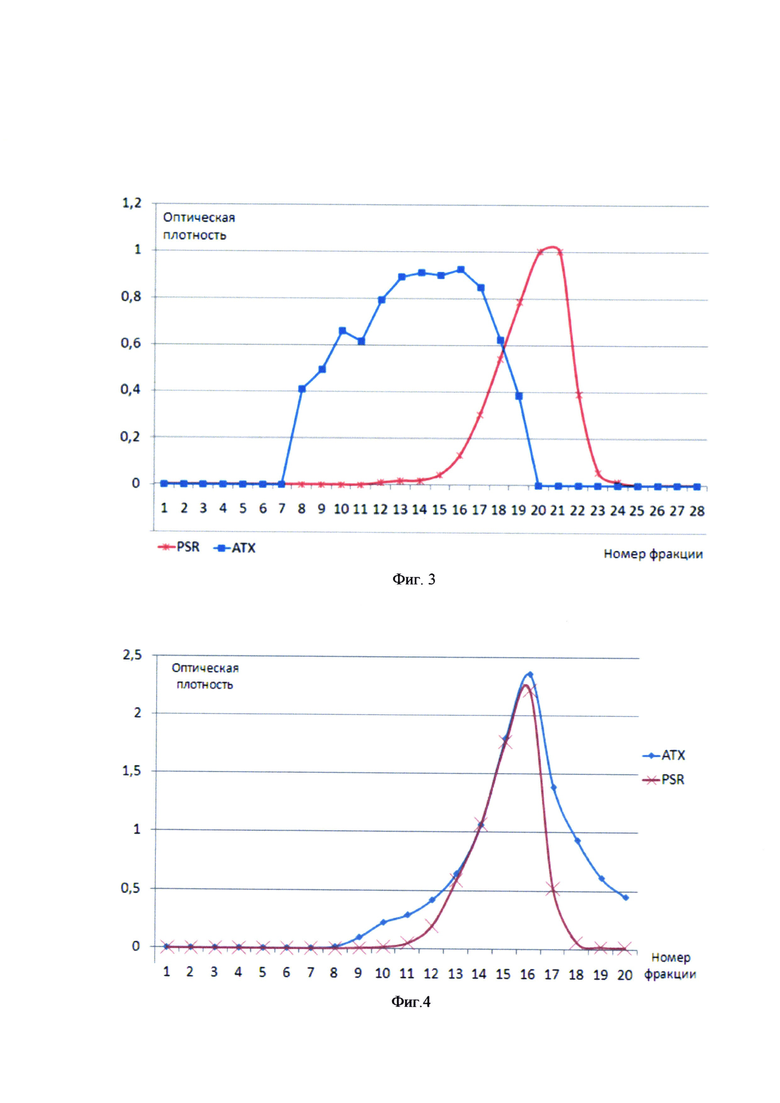
На фиг. 3 представлены результаты гель-хроматографии на Сефарозе 4 В препаратов до конъюгации.
На фиг. 4 представлены результаты гель-хроматографииконъюгата на Сефарозе 4 В. Где PSR - капсульный полисахарид Hib (по реакции на рибозу с орцином), АТХ - анатоксин столбнячный (по методу Лоури).
По нашему мнению, этот метод анализа более наглядно отражает процесс конъюгации, т.к. идет регистрация по двум показателям (содержание белка по методу Лоури и содержание рибозы с орциновым реактивом), в отличие от регистрации единого коэффициента поглощения при 260 нм, стандартной для систем ВЭЖХ.
В процессе выполнения исследования были усовершенствованы и стандартизованы и другие технологические процессы. Так, экспериментальным путем было установлено, что при избыточной продолжительности процесса активации столбнячного анатоксина происходит полимеризация со сшивкой отдельных молекул анатоксина между собой и снижение растворимости полученных продуктов, приводящее к снижению эффективности дальнейших этапов биохимического синтеза. В связи с этим потребовалось стандартизировать продолжительность процесса активации, чтобы не допустить сшивки молекул столбнячного анатоксина между собой.
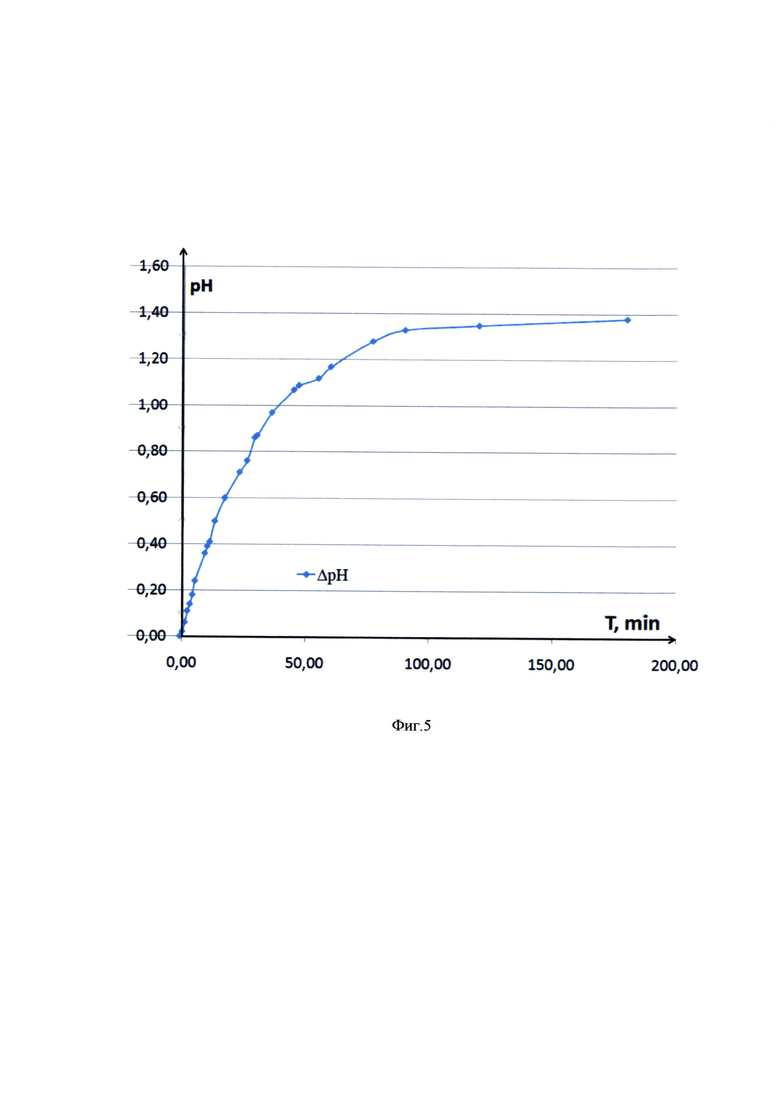
Также было установлено, что в процессе активации столбнячного анатоксина реакционная среда защелачивается из-за участия карбоксильных групп столбнячного анатоксина в образовании связей с остатком ADH и корректируется внесением 0,1 Μ раствора HCl, при изменении рН на 0,05-0,1 от целевого значения (реакция идет при рН менее 6,0). На основании контроля изменения рН и регистрации объема вносимого раствора HCl для коррекции рН был составлен график зависимости суммарного изменения рН за единицу времени. В ходе насыщения изменение рН за единицу времени снижается и отражает скорость образования связей между столбнячным анатоксином и ADH.
Пример зависимости суммарного изменения рН реакционной среды от продолжительности реакции показан на фиг. 5.
Из графика видно, что более 95% изменений рН(в результате образования ковалентных связей СООН-группами белка) происходит за 100 минут. За оставшиеся 50 минут рН изменяется менее, чем на 0,05 единиц и дальнейшая реакция активации практически останавливается. Таким образом, отслеживание зависимости изменения рН за единицу времени позволяет установить степень связывания карбоксильными группами столбнячного анатоксина ADH и установить оптимальную продолжительность активации.
Продолжительность активации является критической точкой (КТ) данного процесса, контроль которой необходим, чтобы снизить время негативного воздействия кислой среды на столбнячный анатоксин, избежать частичной денатурации и повышения молекулярных параметров в результате сшивания компонентов субстанции.
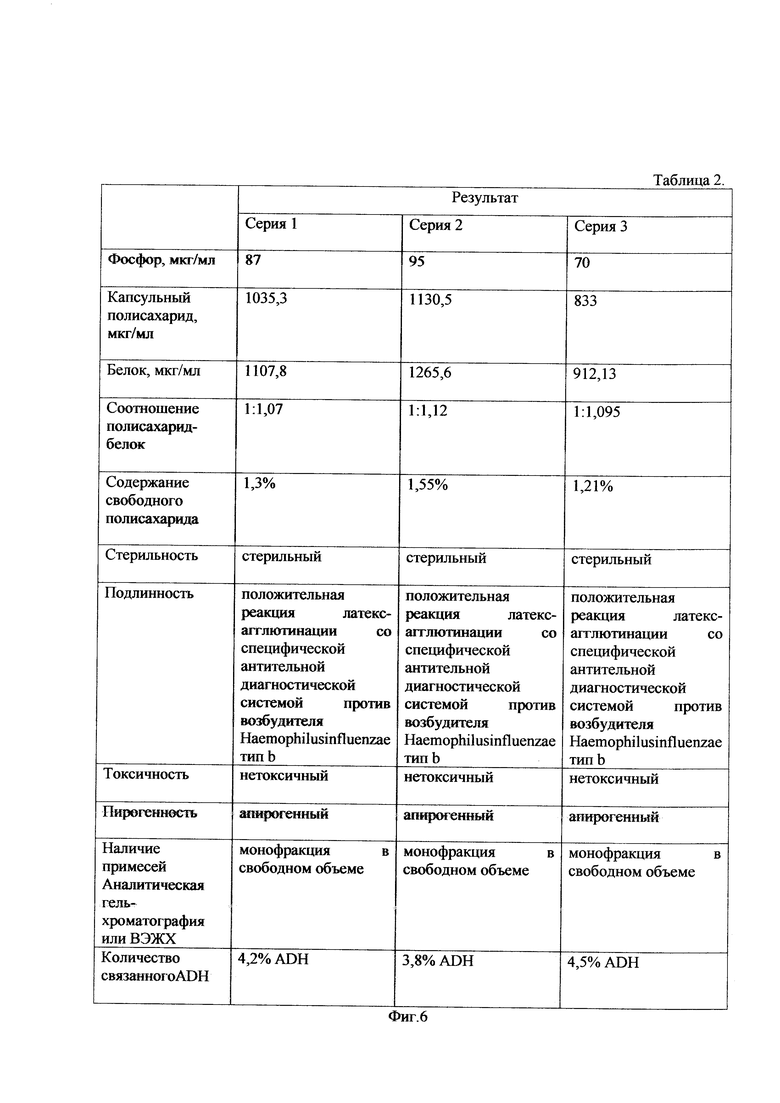
Полученный конъюгат капсульного полисахарида Hib и столбнячного анатоксина, который является действующим веществом антигенной субстанции гемофильного микроба,в количестве трех экспериментальных серий был проконтролирован по показателям,представленным на фиг. 6 в табл. 2.
Результаты контроля свидетельствуют о том, что субстанция на основе конъюгата очищенного капсульного полисахарида Hib и столбнячного анатоксина обладает достаточной степенью конъюгации, не токсична, апирогенна и не содержит примесей и следов реагентов, применявшихся в процессе изготовления препарата.
Заключение
1. Полученный экзогенный антигенный капсульный полисахарид Hib, очищенный фенольной экстракцией, является химически чистым, а его структура представляет собой полирибозилрибитолфосфат.Данная технология позволяет очистить капсульный полисахарид Hib от белковых примесей, компонентов питательной среды, нуклеиновых кислот, гексозы. Подлинность субстанции, содержащей капсульный полисахарид Hib, подтверждена положительной реакцией латекс-агглютинации. Субстанция апирогенна и не токсична.
2. Разработана формула расчета количества цетавлона, необходимого для выделения капсульного полисахарида.
3. Полученные данные об экспериментальных сериях субстанции гемофильной типа b конъюгированной свидетельствуют о том, что предложенный способ получения антигенного капсульного полисахарида Haemophilusinfluenzae типа b (Hib) позволяет проводить синтез субстанции с заданными свойствами и характеристиками.
В процессе работы над изобретением был усовершенствован ряд технологических процессов:
- при получении деривата капсульного полисахарида в качестве цианилирующего агента, помимо BrCN, был применен CDAP;
- для определения оптимальной продолжительности активации столбнячного анатоксина использована корреляция, которая позволила установить степень связывания карбоксильными группами столбнячного анатоксина с ADH при изменении рН за единицу времени и стандартизовать время проведения реакции;
- разработан метод определения степени конъюгации столбнячного анатоксина и капсульного полисахарида Hib с использованием избирательного осаждения дезоксихолевой кислотой.
Анализируя результаты проведенного исследования, можно сказать, что, антигенная субстанция гемофильного типа b микроба применима как для получения моновакцин, так и комбинированных вакцин с конъюгированным типа b полисахаридом.
В настоящее время в связи с увеличением числа инфекционных заболеваний, контролируемых методами вакцинопрофилактики, актуальное значение приобретает разработка комбинированных вакцин.
Проведены экспериментальные исследования по совместному введению лабораторным животным антигенной конъюгированной субстанции гемофильного типа b микроба и адсорбированной дифтерийно-столбнячной вакцины (выпускаемая в России АДС вакцина). Полученные экспериментальные данные показали, что комбинированный препарат, содержащий антигенную конъюгированную субстанцию гемофильного типа b микроба и АДС вакцины в человеко-дозе, не обладал токсичностью и не вызывал гибели животных. Патоморфологические методы исследования не выявили изменений в органах экспериментальных животных.
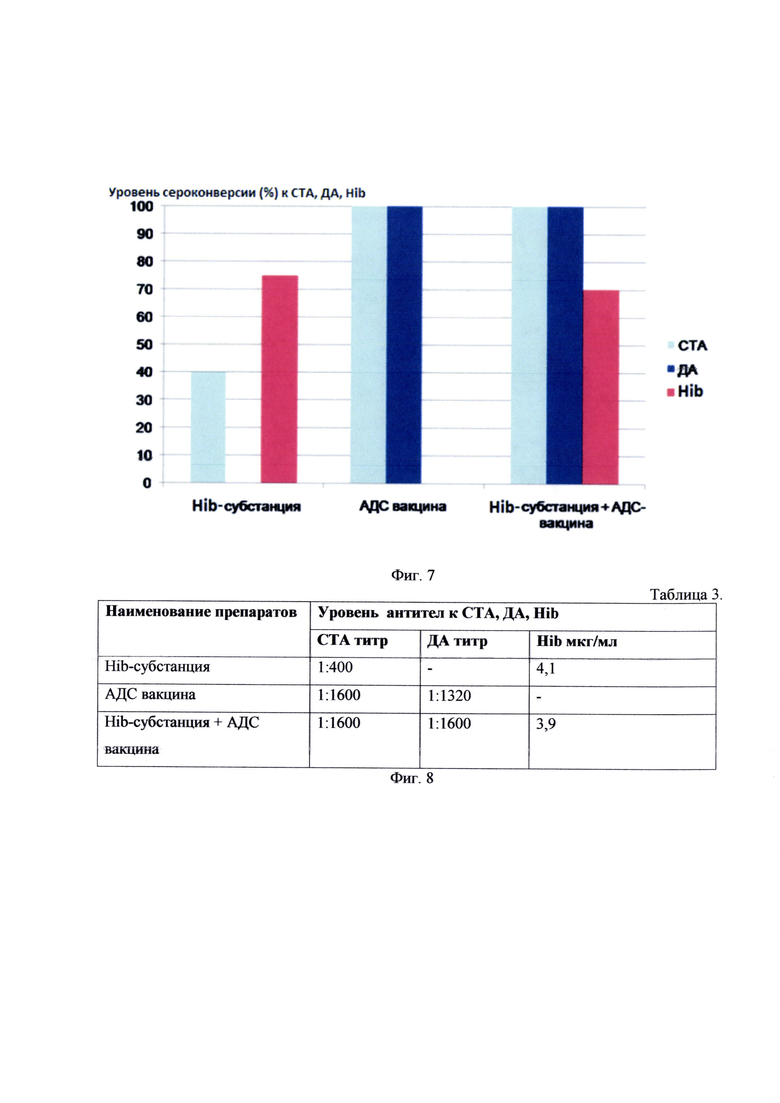
Данные иммунологических исследований на экспериментальных животных представлены на фиг. 7 и фиг. 8 в таблице 3, где СТА - столбнячный анатоксин, ДА -дифтерийный анатоксин, Hib - гемофильный капсульный полисахарид. На фиг. 7 показан уровень сероконверсии (%) к СТА, ДА, Hib.
Полученная иммуногенная субстанция гемофильного типа b микроба обеспечивает достаточный уровень антигенности и может использоваться при создании конъюгированных Hib-вакцин и как компонент в комбинированных вакцинах.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения вакцины гемофильной тип b конъюгированной | 2019 |
|
RU2704452C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОНЪЮГАТА КАПСУЛЬНОГО ПОЛИСАХАРИДА Haemophilus influenzae ТИП b (Hib) C АНТИГЕНАМИ ДЛЯ СОЗДАНИЯ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ | 2013 |
|
RU2542393C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕННОГО ПРЕПАРАТА HAEMOPHILUS INFLUENZAE ТИПА B (HIB) | 2001 |
|
RU2185191C1 |
| ВАКЦИНАЦИЯ МЕНИНГОКОККОВЫМИ КОНЪЮГАТАМИ | 2006 |
|
RU2429011C2 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ ГЕМОФИЛЬНОЙ ИНФЕКЦИИ "b" У ДЕТЕЙ | 2006 |
|
RU2310852C1 |
| КОМБИНИРОВАННЫЕ ВАКЦИНЫ С АНТИГЕНОМ КОКЛЮША ЦЕЛЬНЫХ КЛЕТОК | 2006 |
|
RU2420315C2 |
| ВАКЦИНАЦИЯ МЕНИНГОКОККОВЫМИ КОНЪЮГАТАМИ | 2005 |
|
RU2379052C2 |
| ОБЪЕДИНЕННЫЕ МЕНИНГОКОККОВЫЕ КОНЪЮГАТЫ С ОБЩИМ БЕЛКОМ-НОСИТЕЛЕМ | 2005 |
|
RU2385737C2 |
| МНОЖЕСТВЕННАЯ ВАКЦИНАЦИЯ, ВКЛЮЧАЮЩАЯ МЕНИНГОКОККИ СЕРОГРУППЫ С | 2012 |
|
RU2641969C2 |
| МНОЖЕСТВЕННАЯ ВАКЦИНАЦИЯ, ВКЛЮЧАЮЩАЯ МЕНИНГОКОККИ СЕРОГРУППЫ С | 2006 |
|
RU2457858C2 |

Изобретение относится к области медицинской микробиологии. Описан способ получения антигенной конъюгированной субстанции гемофильного типа b микроба для создания гемофильной типа b конъюгированной вакцины (Hib), а также комбинированных вакцин, содержащих АДС+Hib, АКДС+Hib. Культивируют штамм Haemophilus influenzae типа b (Hib) № В-7519 на шоколадном агаре с добавлением бацитрацина и последующим переводом на жидкую питательную среду следующего состава: солянокислотный гидролизат казеина, глюкоза, экстракт дрожжевой, никотинамиддинуклеотид (NAD), гемин, витамины группы В, NaHPO4, KH2PO4. Инактивируют культуру путем ее обработки 0,1% раствором формальдегида. Далее отделяют клетки Hib от культуральной жидкости путем фильтрации на пластинчатых мембранных фильтрах в тангенциальном потоке. При выделении капсульного полисахарида (КП) Hib используют цетилтриметиламмония бромид (цетавлон), при этом расчет количества цетавлона проводят с учетом содержания в концентрате КП по формуле: mЦ=Рх48, где mЦ - количество цетавлона, Ρ - количество фосфора в объеме концентрата ультрафильтрата, 48 - коэффициент пересчета. Очищают КП методом горячей фенольной обработки с последующим спиртовым осаждением. Для стадии конъюгации используют столбнячный анатоксин, активируя его карбодиимидным методом, присоединяя к нему молекулу-линкер ADH (дигидразид адипиновой кислоты). Конъюгацию осуществляют путем добавления к активированному столбнячному анатоксину очищенного капсульного полисахарида Hib, обработанного цианилирующим агентом. Изобретение позволяет создать антигенную конъюгированную субстанцию гемофильного типа b микроба для получения гемофильной типа b конъюгированной вакцины (Hib), а также комбинированных вакцин, содержащих АДС+Hib, АКДС+Hib. 6 з.п. ф-лы, 8 ил., 1 пр.
1. Способ получения антигенной конъюгированной субстанции гемофильного типа b микроба для создания вакцинных препаратов, характеризующийся тем, что он включает следующие стадии:
- культивирование штамма Haemophilus influenzae типа b (Hib) № В-7519 проводят на шоколадном агаре с добавлением бацитрацина и последующим переводом на жидкую питательную среду следующего состава: солянокислотный гидролизат казеина, глюкоза, экстракт дрожжевой, никотинамиддинуклеотид (NAD), гемин, витамины группы В, NaHPO4, KH2PO4;
- инактивирование культуры осуществляют путем ее обработки 0,1% раствором формальдегида и отделение клеток Hib от культуральной жидкости - путем фильтрации на пластинчатых мембранных фильтрах в тангенциальном потоке;
- при выделении капсульного полисахарида (КП) Hib используют цетилтриметиламмония бромид (цетавлон), при этом расчет количества цетавлона проводят с учетом содержания в концентрате КП по формуле: mЦ=Рх48, где mЦ - количество цетавлона, Ρ - количество фосфора в объеме концентрата ультрафильтрата, 48 - коэффициент пересчета;
- очищение КП проводят методом горячей фенольной обработки с последующим спиртовым осаждением;
- для стадии конъюгации используют столбнячный анатоксин, активируя его карбодиимидным методом, присоединяя к нему молекулу-линкер ADH (дигидразид адипиновой кислоты);
- конъюгацию осуществляют путем добавления к активированному столбнячному анатоксину очищенного капсульного полисахарида Hib, обработанного цианилирующим агентом.
2. Способ по п. 1, характеризующийся тем, что при культивировании штамма Haemophilus influenzae типа b (Hib) № В-7519 используют жидкую питательную среду следующего состава, г/л: солянокислотный гидролизат казеина - 12; глюкоза - 7; экстракт дрожжевой - 3,9; никотинамиддинуклеотид (NAD) - 0,05; гемин - 0,05; витамин В12 - 0,05; витамин В1 - 0,05; витамин В6 - 0,05; NaHPO4 - 2,4; KH2PO4 - 0.27; рН среды - 7,5.
3. Способ по п. 1, характеризующийся тем, что культуру при инактивировании обрабатывают 0,1% раствором формальдегида в течение 2 часов.
4. Способ по п. 1, характеризующийся тем, что для фильтрации культуральной жидкости при отделении от нее клеток Hib используют пластинчатые мембранные фильтры с диаметром пор 0,22 мкм.
5. Способ по п. 1, характеризующийся тем, что в качестве цианилирующего агента используют BrCN (бромциан).
6. Способ по п. 1, характеризующийся тем, что в качестве цианилирующего агента используют CDAP (1-циано-4-диметиламинопиридин тетрафлюороборат).
7. Способ по п. 1, характеризующийся тем, что стандартизацию продолжительности оптимального процесса активации столбнячного анатоксина и капсульного полисахарида Hib проводят путем отслеживания суммарного изменения рН реакционной среды в зависимости от продолжительности реакции.
| Способ получения вакцины гемофильной тип b конъюгированной | 2019 |
|
RU2704452C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕННОГО ПРЕПАРАТА HAEMOPHILUS INFLUENZAE ТИПА B (HIB) | 2001 |
|
RU2185191C1 |
| CN 103623404 B, 03.08.2016 | |||
| CN 105431446 A, 23.03.2016 | |||
| НОВЫЕ КОНЪЮГАТЫ ПОЛИСАХАРИДА С БЕЛКОМ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2758090C2 |
| Затвор для люков товарного вагона | 1928 |
|
SU13374A1 |
| М.В | |||
| АБРАМЦЕВА, А.П | |||
| ТАРАСОВ и др | |||
| Гемофильная инфекция типа b | |||
| Заболеваемость и вакцинопрофилактика, БИО-препараты, профилактика, диагностика, лечение, 2017, т.17, N2, стр.78-86. | |||
Авторы
Даты
2022-04-22—Публикация
2021-04-08—Подача