Изобретение относится к микробиологии и биотехнологии и касается получения штаммов дрожжей Ogataea haglerorum, способных продуцировать фермент фитазу.
Фосфор является важным минералом, необходимым для роста и развития животных. Источником фосфора являются фитаты (мио-инозитол гексакисфосфаты), которые содержатся в зерновых и бобовых культурах - основных ингредиентах кормов в животноводстве [Adv. Food Res. 1982, 28, 1-92]. Некоторые животные, такие как домашняя птица, свиньи и рыбы не способны утилизировать фитатный фосфор из-за отсутствия ферментов для гидролиза фитатов в их пищеварительной системе, что снижает пищевую ценность корма [Can. J. Anim. Sci. 2013, 93, 9-21]. Фитаты препятствуют эффективному усвоению кальция, натрия, магния и других минеральных веществ из кормов, а также могут связываться с белками в широком диапазоне рН, образуя нерастворимые белково-фитатные или белок-минерал-фитатные комплексы, недоступные для переваривания [J. Sci. Food Agric. 2015, 95, 878-896].
Фитаза является одним из наиболее востребованных кормовых ферментов. Фитазы (мио-инозитол гексакисфосфат 3- или 6-фосфогидролазы, ЕС 3.1.3.8 или ЕС 3.1.3.26) гидролизуют фитат до мио-инозитол производных и неорганического фосфата и с успехом используются в качестве кормовой добавки, значительно повышая усвоение фосфора [J. Sci. Food Agric, 2015, 95, 878-896. doi: 10.1002/jsfa.6998]. Они обеспечивают высвобождение не только фитат-связанного фосфора, но также белков, макро- и микроэлементов, повышая питательные свойства кормов и устраняя дефицит фосфатов [British Poultry Science, 2004, 45(1), 101-108].
В настоящее время фитазы получают микробиологическим путем с использованием рекомбинантных штаммов-продуцентов, потребность промышленности в которых постоянно растет [Afr. J. Biotechnol., 2009, 8(17), 4229-4232.]. Наиболее часто для высокоэффективной продукции гетерологичных белков используются метилотрофные дрожжи Pichia pastoris [Journal of Biotechnology. 2015, 202, 118-134. doi.org/10.1016/j.jbiotec.2015.01.027; J. Cell Physiol. 2020, 1-15. DOI: 10.1002/jcp.29583], которые обладают мощными системами экспрессии и секреции рекомбинантных белков (в том числе, фитаз) и для которых разработаны питательные среды и отработан процесс ферментации с использованием культуры высокой плотности. Процесс культивирования метилотрофных дрожжей достаточно прост, поскольку их рост не блокируется продуктами метаболизма [FEMS Microbiol. Rev., 2000, 24, 45-66. doi: 10.1111/j.1574-6976.2000.tb00532.x].
Еще одной известной метилотрофной системой для гетерологичной экспрессии являются термотолерантные дрожжи Ogataea (Hansenula). Дрожжи рода Ogataea, как и дрожжи Pichia pastoris, обладают уникальной организацией и регуляцией метаболизма в присутствии метанола благодаря наличию сильных промоторов, индуцируемых метанолом. Подобно Pichia pastoris, дрожжи рода Ogataea сочетают преимущества простоты выращивания на недорогой ростовой среде с высокой секретирующей способностью, а также при культивировании в биореакторе позволяют получать биомассу с высокой плотностью клеток, что способствует высокому выходу целевого продукта [FEMS Yeast Res. 2005, 5, 1079-1096; Microb. Cell Fact. 2006, 5, 39; Curr Microbiol. 2014, 69, 143-148; FEMS Microbiology Letters, 2019, 366, fnz052].
В отличие от Pichia pastoris дрожжи рода Ogataea являются термотолерантными, что позволяет проводить ферментацию при температуре не ниже 37°С. Повышение температуры процесса ферментации снижает контаминацию и затраты на охлаждение биореактора [Appl. Microbiol. Biotechnol. 2010, 85, 861-867. doi: 10.1007/s00253-009-2248-5] и в результате сокращает длительность ферментации.
Известны примеры создания высокопродуктивных рекомбинантных штаммов-продуцентов фитазы на основе дрожжей Ogataea (Hansenula) polymorpha, в которых ген фитазы из грибов рода Aspergillus находится под контролем промотора гена FMD, кодирующего формат дегидрогеназу, и имеет природную сигнальную последовательность. Так штаммы О. polymorpha за 160 ч культивирования в 15 л ферментере на минеральной среде с глюкозой продуцируют фитазы из грибов Aspergillus terreus, Aspergillus fumigatus (вариант Q27L) и Aspergillus fumigatus (вариант консенсус) в количестве 4,46 г/л, 6,11 г/л и 13,5 г/л, соответственно, [Biotechnology and Bioengineering. 1999, 63 (3), 373-381], что иллюстрирует высокий потенциал системы экспрессии дрожжей рода Ogataea для производства рекомбинантного белка.
Штамм О. thermomethanolica, содержащий ген фитазы Aspergillus niger ВСС18081 под контролем конститутивного промотора гена GAP, кодирующего глицеральдегид-3-фосфат дегидрогеназу, и с сигнальной последовательностью MFα из дрожжей Saccharomyces cerevisiae, продуцирует фитазу с активностью 134 ед./мл КЖ за 41 ч культивировании в 15 л ферментере на минеральной среде при температуре 34°С и использовании в качестве источника углерода столового сахара [Appl Biochem Biotechnol. 2016. DOI 10.1007/s12010-016-2191-8].
Вид Ogataea haglerorum выделен из дрожжей рода Ogataea в 2017 г. в результате проведения анализа последовательностей D1/D1 гена LSU rRNA, ITS1-5.8S-ITS2, фактора элонгации трансляции EF-1α и комплексного генетического анализа Наумовым Г.И. с соавторами [Int. J. Syst. Evol. Microbiol. 2017, 67, 2465-2469. DOI 10.1099/ijsem.0.002012].
Для дрожжей Ogataea haglerorum разработаны генетические технологии конструирования штаммов-продуцентов, включая экспрессионный вектор и метод введения ДНК в клетки реципиента [Биотехнология, 2019, 35 (6), 51-56]. Описано использование штамма Ogataea haglerorum ВКПМ Y-2584 для экспрессии генов фитазы из бактерий Citrobacter freundii и Yersinia intermedia, показано, что при культивировании в пробирках активность фитазы в КЖ составляет 56,2 ед./мл и 135,2 ед./мл, соответственно [Биотехнология, 2019, 35 (6), 51-56].
Одним из востребованных на сегодняшний день ферментов является фитаза Escherichia coli. Ген аррА, кодирующий фитазу Е. coli, был клонирован в 1985 г, затем секвенирован, а фитаза охарактеризована [Mol. Gen. Genet. 1985, 200:68-73; J. Bacteriol. 1990, 172:5497-5500; Arch. Biochem. Biophys. 1993, 303, 107-113]. Рекомбинантная фитаза Ε. coli, наработанная клетками дрожжей P. pastoris, обладает промышленно-ценными свойствами и в настоящее время коммерчески доступна в форме препаратов Quantum® и OptiPhos® [J. Sci. Food Agric. 2015, 95:878-896. doi:10.1002/jsfa.6998]. Введение в корма фитазы Ε. coli более эффективно влияет на зоотехнические показатели, чем добавление фитаз из грибов Aspergillus и Peniophora, так как фитаза Е. coli более устойчива к действию пепсина, работает в более кислой области рН, что соответствует физиологическим условиям желудочно-кишечного тракта животных, а также характеризуется высокой удельной активностью по сравнению с фитазами из других организмов [J. Anim. Sci. 2003, 81(2):474-483; Octa Journal of Biosciences, 2013, 1(2):158-169].
На основе дрожжей Ρ pastoris получены штаммы, секретирующие фитазу Е. coli, при культивировании которых в колбах активность фермента составляет 112,5 ед./мл за 72 ч [J Agric Food Chem. 2013, 61(25), 6007-6015. doi: 10.1021/jf401853b], 114 ед./мл за 72 ч [Biochem Biophys Res Commun. 1999, 257, 117-123.], 117 ед./мл за 48 ч [Biotechnol Lett. 2003, 25(10), 827-831. doi: 10.1023/a:1023568826461], 204 ед./мл за 96 ч [Enzym Microb Technol. 2004; 35(4):315-320], 237,2 ед./мл за 72 ч [Jundishapur J Microbiol. 2015, 8(12), e27553. doi: 10.5812/jjm.27553], 814 ед./мл за 96 ч [RU 2737621], 978 ед./мл за 216 ч [CN101935617].
Для увеличения продуктивности рекомбинантных штаммов Р, pastoris и улучшения промышленно-важных свойств фермента используют оптимизированные по кодоновому составу синтетические производные гена аррА Е. coli, кодирующего фитазу [J.Agric. Food Chem., 2013, 61(25), 6007-6015; Biotechnol. Lett. 2013, 35(10), 1669-1676. doi: 10.1007/sl0529-013-1255-x; Jundishapur J Microbiol. 2015, 8(12), e27553. doi: 10.5812/jjm.27553; CN 102586294; CN 102943083].
В источниках информации не обнаружено сведений об экспрессии гена фитазы из Е. coli в дрожжах рода Ogataea.
Создание высокоэффективных штаммов с повышенной продукцией фитазы Е. coli остается актуальной задачей.
Технической проблемой, на решение которой направлено заявляемое изобретение, является расширение арсенала рекомбинантных микроорганизмов, продуцирующих фитазу Е. coli.
Техническим результатом заявляемого изобретения является рекомбинантный штамм дрожжей Ogataea haglerorum, продуцирующий фитазу из Escherichia coli, содержащий в составе хромосомной ДНК оптимизированный синтетический ген phyEc-mod, кодирующий указанную фитазу и имеющий нуклеотидную последовательность SEQ ID NO:1, которая адаптирована для экспрессии в метилотрофных дрожжах на основании данных о частоте встречаемости кодонов. Ранее использование оптимизированного синтетического гена phyEc-mod описано для получения трансформантов дрожжей Р. pastoris [RU 2737623].
В заявляемом изобретении термотолерантные метилотрофные дрожжи рода Ogataea впервые использованы для гетерологичной экспрессии гена фитазы из Е. coli.
Получение заявляемого трансформанта включает:
- трансформацию в клетки дрожжей Ogataea haglerorum экспрессионной кассеты, содержащей синтетический ген phyEc-mod, кодирующий фитазу Е. coli, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO:1, промотор, работающий в дрожжах Ogataea (Hansenula), сигнальный пептид для осуществления секреции фермента в культуральную жидкость, терминатор, маркерный ген с регуляторными элементами, HARS и, предпочтительно, сайт для гомологичной интеграции в хромосомную ДНК; процесс трансформации экспрессионной кассеты в клетки дрожжей Ogataea (Hansenula) осуществляют, в частности, методом электоропорации [Yeast Metabolic Engineering: Methods and Protocols, Methods in Molecular Biology. 2014, 1152, 43-62. DOI 10.1007/978-1-4939-0563-8_3] или методом с использованием ацетата лития [Curr. Genet. 1990, 18, 169-170. https://doi.org/10.1007/BF003126061], а интеграцию экспрессионной кассеты осуществляют путем или гомологичной, или негомологичной рекомбинации;
- увеличение числа копий экспрессионной кассеты в хромосомной ДНК трансформанта О. haglerorum осуществляют путем повторной трансформации кассетой;
- анализ полученных трансформантов на способность секретировать активную фитазу в культуральную жидкость в процессе ферментации.
Конструирование экспрессионной кассеты осуществляют стандартными методами генетической инженерии [Sambrook J., Maniatis Т., Fritsch Ε. Molecular cloning: a laboratory manual. - N.Y: Cold Spring Harbor Laboratory, 1989] с использованием генетических элементов, подходящих для работы с дрожжами рода Ogataea (Hansenula). В качестве промоторов могут быть использованы МОХ, FMD, DAS, TPS1, FLD1, PHO1, YNT1, YNI1, YNR1, GAP, ACT, РМА1, АОХ, MAL, АМО, TEF1, РЕХ14, РЕХ11 [FEMS Yeast Research, 2005, 5, 1079-1096; Curr Microbiol., 2014, 69, 143-148; FEMS Microbiol Lett., 2018, 365, 1-6; FEMS Yeast Res., 2012, 12, 271-278].
В качестве сигнальных пептидов используют лидерную последовательность PHO1, пре-про-лидерную последовательность MFα из Saccharomyces cerevisiae или Ogataea thermomethanolica, GAM1 из Schwanniomyces occidentalis [FEMS Yeast Research, 2005, 5, 1079-1096; Curr Microbiol., 2014, 69, 143-148; Appl Biochem Biotechnol., 2016, 178, 710-724].
В качестве терминаторов транскрипции используют МОХ, AMO1, ΡНО5, АОХ1 [Appl. Microbiol. Biotechnol., 2000, 54, 741-750; FEMS Yeast Res., 2012, 12, 271-278; FEMS Yeast Research, 2003, 4, 185-193; FEMS Yeast Research, 2003, 4, 175-184].
В качестве селективных маркеров используют гены резистентности к антибиотикам или зеоцину, или генетицину (G418), или гигромицину В, или норзеотрицину, или бластицидину, а также гены, комплементирующие ауксотрофные мутации в геноме дрожжей рода Ogataea, такие как LEU2, HIS3, TRP3, ADE2, URA3, МЕТ6, ADE11 [FEMS Yeast Res., 2012, 12, 271-278; Yeast, 1995, 11, 343-353].
В качестве последовательностей, обеспечивающих эффективную трансформацию и автономную репликацию, используют HARS1, HARS2, HARS3, HARS 36 [Mol. Gen Genet. 1986, 202, 302-308; Yeast, 1995, 11, 343-353; Journal of Bacteriology, 1996, 178 (15), 4420-4428].
В качестве сайтов для гомологичной интеграции используют последовательности генов МОХ, TRP, URA3, LEU2, GAP, кластер генов для рибосомальной ДНК, HARS, АМО, TEF1 [FEMS Yeast Research, 2005, 5, 1079-1096; FEMS Yeast Research, 2003, 4, 185-193; FEMS Yeast Res., 2012, 12, 271-278] или другие последовательности, гомологичные участкам хромосомы дрожжей рода Ogataea.
Изобретение проиллюстрировано следующей фигурой графического изображения.
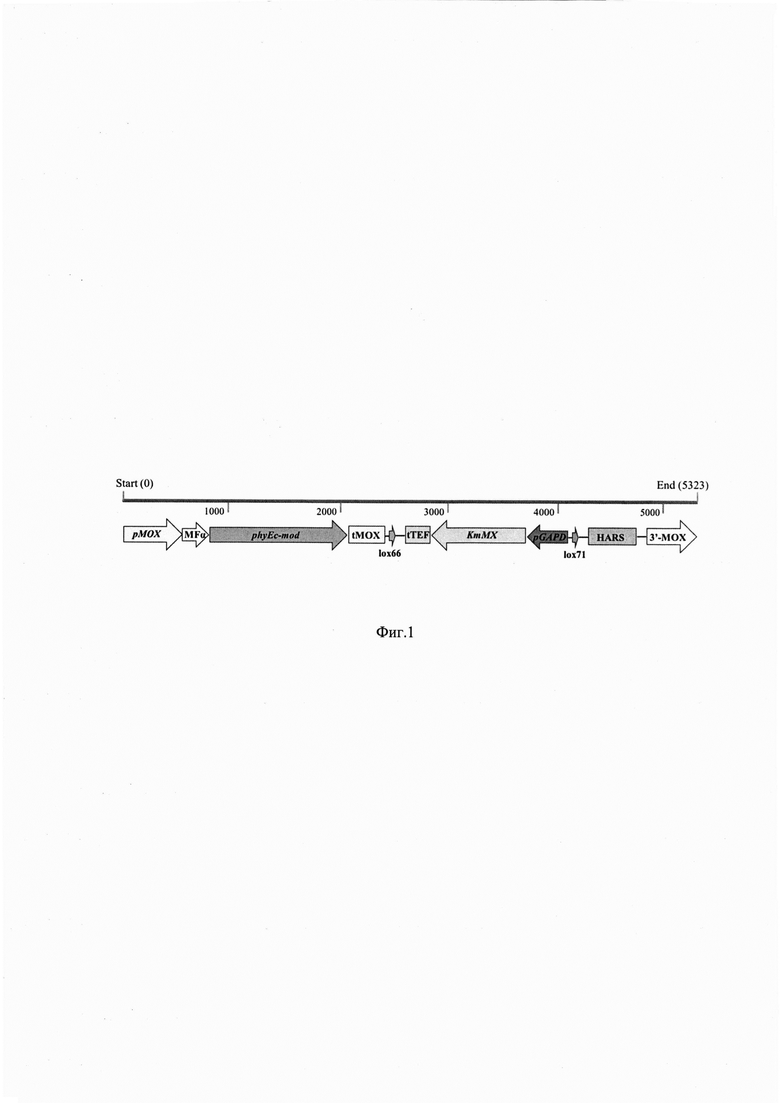
Фиг. 1. Экспрессионная кассета
Пример 1. Конструирование трансформанта дрожжей О. haslerorum, продуцирующего фитазу Е. coli
Ген phyEc-mod, кодирующий фитазу E.coli, синтезируют известным методом [J. Microbiol. Methods, 2010, 81(2), 147-152]. Полученную последовательность ДНК, приведенную в перечне последовательностей под номером SEQ ID NO:1, по сайтам EcoRI и NotI встраивают в состав экспрессионного вектора pMOX-Km-HARS [Биотехнология. 2019, 35(6), 51-56], созданного на основе коммерческого вектора pBluescript II KS+(Х52327, Stratagene).
Получают плазмиду, содержащую экспрессионную кассету (фиг.1), в состав которой входят следующие генетические элементы.
1. Синтетический ген phyEc-mod, встроенный в рамку считывания с нуклеотидной последовательностью сигнального пептида MFα из дрожжей Saccharomyces cerevisiae, транскрипция которого находится под контролем промотора рМОХ, наработанного с использованием хромосомной ДНК штамма Ogataea polymorpha ВКПМ Y-1546 (линия CBS4732).
2. Терминатор транскрипции tMOX, наработанный с использованием хромосомной ДНК штамма Ogataea polymorpha ВКПМ Υ-1546.
3. Дрожжевой селективный маркер KтМХ, фланкированный сайтами lox66 и lox71, транскрипция которого находится под контролем промотора pGAPD гена глицеральдегид-3-фосфат дегидрогеназы, наработанного с использованием хромосомной ДНК штамма Ogataea polymorpha ВКПМ Y-1546 и терминатора транскрипции tTEF. Устойчивость дрожжей Ogataea haglerorum к антибиотику генетицину (G418) обеспечивает маркер KтМХ.
4. Последовательность HARS, наработанную с использованием хромосомной ДНК штамма Ogataea polymorpha ВКПМ Y-916 (линия DL1), обеспечивающую сохранение трансформируемой ДНК в клетках реципиентного штамма и являющуюся возможным местом интеграции.
5. Область интеграции - нуклеотидная последовательность 3'-области региона МОХ.
Экспрессионную кассету трансформируют в штамм О. haglerorum ВКПМ Y-2584, который предварительно выращивают в жидкой питательной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) с добавлением глюкозы (2 мас. %) при 37°С в течение 6 ч до достижения культурой оптической плотности (OD600) 1,5. Клетки собирают центрифугированием (здесь и далее 6000 об/мин.) в течение 10 мин. при комнатной температуре, ресуспендируют в буфере TED состава: 100 мМ Tris-HCl, 50 мМ EDTA, рН 8.0, 25 мМ дитиотрейтола в 1 л воды SQ, инкубируют при 37°С в течение 15 мин. и собирают центрифугированием в течение 10 мин. при комнатной температуре. Далее клетки промывают дважды холодным буфером STM состава: 270 мМ сахароза, 10 мМ Tris-HCl, рН 8.0, 1 мМ MgCl2 в 1 л воде SQ, собирают центрифугированием в течение 10 мин при температуре 5°С. Обработанные таким образом клетки ресуспендируют в холодном растворе STM в концентрации 1-5×109 клеток на 1 мл. Аликвоту объемом 60 мкл клеточной суспензии переносят в охлажденный эппендорф, добавляют 500 нг ДНК экспрессионной кассеты и инкубируют на льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при 1500 В, 200 Ом, 25uF. После электропорации к клеткам добавляют 1 мл жидкой среды YP с глюкозой (2 мас. %), переносят клеточную суспензию в стерильные пробирки на 1,5 мл и инкубируют при 37°С в течение 60 мин. при качании.
Селекцию трансформантов проводят на агаризованной среде YP с глюкозой (2 мас. %) и генетицином (G418) в количестве 300 мкг/мл при температуре 37°С в течение 4-х суток.
Наличие целевого гена в составе хромосомной ДНК полученных трансформантов подтверждают методом ПЦР с использованием олигонуклеотидов PhyEc-F (5'-cagagtgagcctgagttgaaac-3'), PhyEc-R (5'-gcaagctgggattctagcttcg-3') и Taq полимеразы. Режим реакции ПЦР: 96°С - 3 мин - 1 цикл; 30 циклов: 96°С - 30 с, 53°С - 30 с, 68°С - 150 с; 68°С - 5 мин. - 1 цикл. Присутствие в реакционной смеси ПЦР-фрагмента размером 1223 п. н. подтверждает наличие синтетического гена в составе хромосомной ДНК полученных трансформантов
Отбор наиболее продуктивных трансформантов осуществляют по результатам их культивирования по следующей схеме:
- Посевную культуру выращивают в пробирках (50 мл) с 5 мл жидкой питательной среды YP с добавлением глюкозы (2 мас. %) при 37°С в течение 24 ч на качалке (250 об/мин). Посев ферментационной среды осуществляют в соотношении 1/10.
- Ферментацию проводят при 37°С на качалке (250 об/мин) в питательной среде YP с добавлением глюкозы (2 мас. %) в течение 5 дней. Через 24 ч культивирования начинают индукцию метанолом, который добавляют в количестве 3 об.%, затем такое же количество метанола добавляют на 48 ч культивирования. В качестве контроля используют штамм Ogataea haglerorum ВКПМ Y-2584, содержащий экспрессионный вектор pMOX-Km-HARS.
Продуктивность трансформантов О. haglerorum оценивают по активности секретированной фитазы. Для этого клетки трансформантов осаждают центрифугированием, а супернатант используют для определения фитазной активности модифицированным методом Фиске-Субарроу [J. Biol. Chem. 1925, 66, 376-400; J. Microbiol. Methods. 1999, 39(1), 17-22]. За единицу ферментативной активности фитазы (1 ед.) принимают количество фермента, способного высвободить 1 мкмоль неорганического фосфата из фитата натрия за 1 мин. в стандартных условиях (температура 37°С, значение рН 4,5, продолжительность гидролиза 30 минут).
Двенадцать независимо отобранных трансформантов культивируют в пробирках и определяют активность фитазы в бесклеточной культуральной жидкости. Результаты определения приведены в табл.1. В качестве контрольного образца используют штамм О. haglerorum ВКПМ Y-2584, содержащий экспрессионный вектор pMOX-Km-HARS, активность фитазы у контрольного штамма не тестируется.
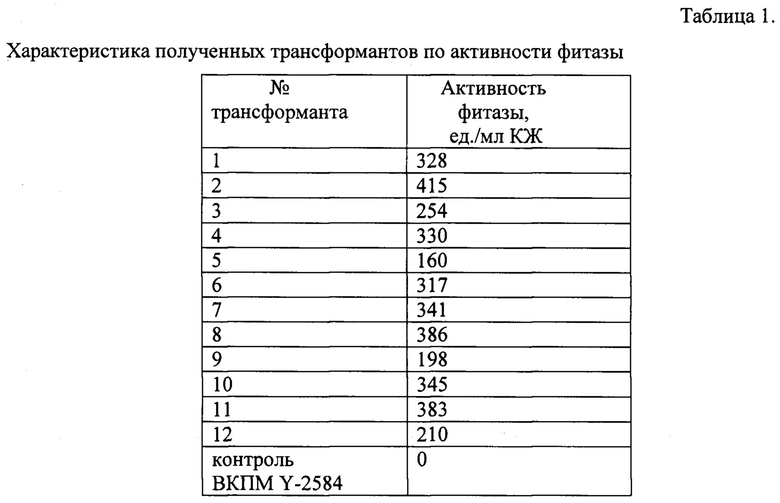
По результатам ферментации отбирают трансформант №2 с наибольшей активностью фитазы.
Повышения фитазной активности трансформанта достигают путем повторной трансформации штамма экспрессионной кассетой. Такую процедуру повторяют несколько раз.
Из хромосомной ДНК трансформанта №2 удаляют селективный маркер КтМХ методом рекомбинации по lox сайтам в присутствии Cre рекомбиназы [FEMS Yeast Res. 2014, 14, 1048-1054. DOI: 10.1111/1567-1364.12197]. Отбирают колонию, которая не растет на среде YP с глюкозой (2 мас. %) и генетицином в количестве 300 мкг/мл, но растет на полной среде без антибиотика.
Клетки из отобранной колонии трансформируют экспрессионной кассетой (фиг.1) и проводят ферментацию в пробирках 36 независимых трансформантов, из которых отбирают 10 трансформантов О. haglerorum, содержащих ген phyEc-mod и имеющих наибольшие значения активности (табл.2).

Трансформант О. haglerorum №25, продуцирует фитазу Е. coli с активностью 806 ед./мл за 120 ч ферментации в пробирках при температуре 37°С.
Представленные в таблице 2 значения активности фитазы трансформантов О. haglerorum - продуцентов фитазы Е. coli свидетельствуют об эффективной экспрессии синтетического гена phyEc-mod в дрожжах О. haglerorum.
Отобранный по результатам ферментации наиболее продуктивный трансформант №25, который синтезирует фитазу с активностью 806 ед./мл, депонируют в Биоресурсном центре Всероссийская Коллекция Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» - ГосНИИгенетика (117545 Москва, 1-ый Дорожный проезд, д.1) как Ogataea haglerorum 255 ВКПМ Y-4856.
Штамм характеризуется следующими признаками:
Культурально-морфологические характеристики заявляемого штамма:
При культивировании при температуре 37°С в течение 48 ч на агаризованной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы - 2 (мас. %) клетки имеют овальную форму, 3-4 мкм в диаметре. Клетки почкуются, при этом почкование истинное, многостороннее. Истинного мицелия не образуют.
Споруляция происходит при инкубации культуры на агаризованной среде следующего состава (мас. %): хлорид калия - 0.5, ацетат натрия - 1.0, агар - 2.0, вода - остальное при 25°С в течение 3-4 дней. Аски имеют тетраэдрическую форму, включают 4 аскоспоры.
На агаризованной среде YP с добавлением глюкозы (2, мас. %) колонии светло-бежевого цвета с ровным краем, матовой поверхностью, линзовидным профилем и пастообразной консистенцией.
При росте в жидкой среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) с добавлением глюкозы - 2 (мас. %), при 37°С в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок не образует.
Физиолого-биохимические признаки заявляемого штамма:
Штамм способен к росту как в аэробных, так и в анаэробных условиях. В качестве единственного источника углерода штамм способен использовать глюкозу, глицерин, метанол, этанол, L-рамнозу, сахарозу, мальтозу; не способен ассимилировать D-глюконат, L-арабинозу, сукцинат, лактозу, крахмал.
Штамм способен синтезировать фитазу при культивировании в жидкой среде YP с глюкозой (2 мас. %) с последующей индукцией метанолом.
Активность фитазы заявляемого трансформанта Ogataea haglerorum 255 ВКПМ Y-составляет 806 ед./мл, что сравнимо с показателями известного продуцента фитазы P. pastoris. Заявляемый трансформант, в отличие от продуцента фитазы Р. pastoris, способен синтезировать и секретировать фермент при температуре культивирования 37°С. Эта особенность заявляемого трансформанта термотолерантных дрожжей О. haglerorum является перспективной для разработки более экономичной технологии культивирования и получения товарной формы ферментного препарата фитазы.
--->
Перечень последовательностей
<110> Федеральное государственное бюджетное учреждение "Государственный
научно-исследовательский институт генетики и селекции промышленных
микроорганизмов Национального исследовательского центра "Курчатовский
институт" (НИЦ «Курчатовский институт» - ГосНИИгенетика).
Акционерное общество «Биоамид».
State Research Institute for Genetics and Selection of Industrial
Microorganisms of National Research Center «Kurchatov Institute»
(NRC «Kurchatov Institute» – GOSNIIGENETIKA).
Joint-stock Venture Bioamide.
<120> Трансформант дрожжей Ogataea haglerorum - продуцент фитазы
Escherichia coli.
<130>
<141>
<160> 1
<210> 1
<211> 1233
<212> DNA
<213> Artificial Sequence
<220>
<223> синтетический ген PhyEc-mod, кодирующий фитазу Escherichia coli
<400> 1
cagagtgagc ctgagttgaa actggaatcc gttgtcatcg tctctagaca tggtgttaga 60
gcaccaacca aggccaccca acttatgcaa gatgtcaccc cagacgcttg gccaacctgg 120
ccagtcaagc tgggttggtt gacacctaga ggtggtgagc tcgttgctta cttgggtcaa 180
taccaaagac agcgtcttgt tgccaacgga ttgttggccg ataagggttg tccacaacca 240
ggtcaagtag ctattattgc tgacgtcgac gaaagaaccc gtaagacagg tgaagccttc 300
gccgccggtc ttgctcctga ctgtgccatt accgttcaca cccaagctga cacttctaga 360
ccagatccat tattcaaccc tttgaagact ggtgtttgcc aattggaccc agctaacgtt 420
actgacgcta tcttgtccag agctggagga tccattgctg acttcaccca acactaccag 480
actgccttca gagagttgga aagagttctt aacttcccac aatccaaatt gtgctttaac 540
cgtgagaagc aagacgaatc ctgttccttg actcaagcat taccatctga gttgaaggtc 600
tccgccgaca acgtctcttt gaccggtgct gtcagcttgg cttccatgtt gactgaaatc 660
tttcttctgc aacaagctca aggtatgcct gagccaggtt ggggtagaat caccgactct 720
caccaatgga acaccttgtt gtccttgcac aacgctcaat tcgacttgct gcagagaact 780
ccagaggttg ctagatccag agccacccca ttgttggact tgatcatggc tgctttgact 840
cctcacccac ctcaaaagca agcctacggt gttaccttgc ccacttctgt cttgttcatt 900
gccggtcacg atactaactt ggcaaatctc ggcggtgctt tggagttgaa ctggactctt 960
cctggtcaac ctgataacac tccaccaggt ggtgagctcg ttttcgaaag atggcgtaga 1020
ctatctgata actctcaatg gattcaggtt tcgttggtct accaaacttt gcagcagatg 1080
agagacaaga ctccactgtc tttgaacacg cctccaggag aagtcaaatt gaccttgcct 1140
ggatgtgaag agagaaatgc tcagggtatg tgttccttgg ctggtttcac tcaaatcgtt 1200
aacgaagcta gaatcccagc ttgttccttg taa 1233
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Трансформант Ogataea haglerorum - продуцент термостабильной α-амилазы | 2022 |
|
RU2795707C1 |
| Рекомбинантный штамм дрожжей Ogataea haglerorum - продуцент фитазы Escherichia coli | 2021 |
|
RU2785901C1 |
| Рекомбинантный штамм дрожжей Ogataea haglerorum, продуцирующий бета-маннаназу Bacillus subtilis | 2020 |
|
RU2747782C1 |
| Трансформант дрожжей Ogataea haglerorum, продуцирующий бета-маннаназу, содержащий в составе хромосомы синтетический ген MANS | 2020 |
|
RU2764793C1 |
| Трансформант Ogataea haglerorum - продуцент рекомбинантного химозина в активной форме | 2022 |
|
RU2815882C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент фитазы Escherichia coli | 2019 |
|
RU2751595C2 |
| Рекомбинантный штамм дрожжей Pichia pastoris с увеличенной продукцией фитазы Escherichia coli | 2019 |
|
RU2737623C1 |
| Трансформант дрожжей Pichia pastoris, продуцирующий фитазу Escherichia coli | 2019 |
|
RU2737621C1 |
| Трансформант дрожжей Komagataella phaffi - продуцент фитазы Citrobacter gillenii | 2020 |
|
RU2771582C1 |
| Трансформант дрожжей Komagataella phaffii, продуцирующий фитазу Cronobacter turicensis | 2021 |
|
RU2756330C1 |
Изобретение относится к области биотехнологии. Предложен трансформант дрожжей Ogataea haglerorum, продуцирующий фитазу и несущий в составе хромосомной ДНК оптимизированный синтетический ген PhyEc-mod, кодирующий фитазу Escherichia coli, нуклеотидная последовательность которого приведена в перечне последовательностей под номером SEQ ID NO: 1. Изобретение обеспечивает расширение арсенала рекомбинантных микроорганизмов, продуцирующих фитазу Е. coli. 1 ил., 2 табл., 1 пр.
Трансформант дрожжей Ogataea haglerorum, продуцирующий фитазу Escherichia coli, содержащий в составе хромосомной ДНК оптимизированный синтетический ген PhyEc-mod, имеющий нуклеотидную последовательность SEQ ID NO: 1.
| ТАРУТИНА М.Г | |||
| И ДР | |||
| Сравнительная характеристика фитаз из Citrobacter freundii и Yersinia intermedia, экспрессированных в метилотрофных дрожжах Ogataea polymorpha и Pichia pastoris | |||
| Биотехнология, 2019, Т | |||
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
| Найдено онлайн: https://www.elibrary.ru/download/elibrary_41601469_27702767.pdf Дата обращения 26.01.2022 | |||
| Рекомбинантный штамм дрожжей Pichia pastoris с увеличенной продукцией фитазы Escherichia coli | 2019 |
|
RU2737623C1 |
Авторы
Даты
2022-04-26—Публикация
2021-04-05—Подача