Изобретение относится к области микробиологии и биотехнологии и касается получения рекомбинантных штаммов дрожжей Ogataea haglerorum - продуцентов фитазы.
Фосфор является важным минералом, необходимым для роста и развития животных. Источником фосфора являются фитаты (мио-инозитол гексакисфосфаты), которые содержатся в зерновых и бобовых культурах - основных ингредиентах кормов в животноводстве [Adv. Food Res. 1982, 28, 1-92]. Некоторые животные, такие как домашняя птица, свиньи и рыбы не способны утилизировать фитатный фосфор из-за отсутствия ферментов для гидролиза фитатов в их пищеварительной системе, что снижает пищевую ценность корма [Can. J. Anim. Sci. 2013, 93, 9-21]. Фитаты препятствуют эффективному усвоению кальция, натрия, магния и других минеральных веществ из кормов, а также могут связываться с белками в широком диапазоне рН, образуя нерастворимые белково-фитатные или белок-минерал-фитатные комплексы, недоступные для переваривания [J. Sci. Food Agric. 2015, 95, 878-896].
Фитаза является одним из наиболее востребованных кормовых ферментов. Фитазы (мио-инозитол гексакисфосфат 3- или 6-фосфогидролазы, ЕС 3.1.3.8 или ЕС 3.1.3.26) гидролизуют фитат до лшо-инозитол производных и неорганического фосфата и с успехом используются в качестве кормовой добавки, значительно повышая усвоение фосфора [J. Sci. Food Agric, 2015, 95, 878-896. doi: 10.1002/j sfa.6998]. Они обеспечивают высвобождение не только фитат-связанного фосфора, но также белков, макро- и микроэлементов, повышая питательные свойства кормов и устраняя дефицит фосфатов [British Poultry Science, 2004, 45(1), 101-108].
В настоящее время фитазы получают микробиологическим путем с использованием рекомбинантных штаммов-продуцентов, потребность промышленности в которых постоянно растет [Afr. J. Biotechnol., 2009, 8(17), 4229-4232.]. Наиболее часто для высокоэффективной продукции гетерологичных белков используются метилотрофные дрожжи Pichia pastoris [Journal of Biotechnology. 2015, 202, 118-134. doi.org/10.1016/j.jbiotec.2015.01.027; J. Cell Physiol. 2020, 1-15. DOI: 10.1002/jcp.29583], которые обладают мощными системами экспрессии и секреции рекомбинантных белков (в том числе, фитаз) и для которых разработаны питательные среды и отработан процесс ферментации с использованием культуры высокой плотности. Процесс культивирования метилотрофных дрожжей достаточно прост, поскольку их рост не блокируется продуктами метаболизма [FEMS Microbiol. Rev., 2000, 24, 45-66. doi: 10.1111/j.l574-6976.2000.tb00532.x].
Еще одной известной метилотрофной системой для гетерологичной экспрессии являются термотолерантные дрожжи Ogataea (Hansenula). Дрожжи рода Ogataea, как и дрожжи Pichia pastoris, обладают уникальной организацией и регуляцией метаболизма в присутствии метанола благодаря наличию сильных промоторов, индуцируемых метанолом. Подобно Pichia pastoris, дрожжи рода Ogataea сочетают преимущества простоты выращивания на недорогой ростовой среде с высокой секретирующей способностью, а также при культивировании в биореакторе позволяют получать биомассу с высокой плотностью клеток, что способствует высокому выходу целевого продукта [FEMS Yeast Res. 2005, 5, 1079-1096; Microb. Cell Fact. 2006, 5, 39; Curr Microbiol. 2014, 69, 143-148; FEMS Microbiology Letters, 2019, 366, fhz052].
В отличие от Pichia pastoris дрожжи рода Ogataea являются термотолерантными, что позволяет проводить ферментацию при температуре не ниже 37°С. Повышение температуры процесса ферментации снижает контаминацию и затраты на охлаждение биореактора [Appl. Microbiol. Biotechnol. 2010, 85, 861-867. doi: 10.1007/s00253-009-2248-5] и в результате сокращает длительность ферментации.
Известны примеры создания высокопродуктивных рекомбинантных штаммов-продуцентов фитазы на основе дрожжей Ogataea {Hansenula) polymorpha, в которых ген фитазы из грибов рода Aspergillus находится под контролем промотора гена FMD, кодирующего формат дегидрогеназу, и имеет природную сигнальную последовательность. Так штаммы О. polymorpha за 160 ч культивирования в 15 л ферментере на минеральной среде с глюкозой продуцируют фитазы из грибов Aspergillus terreus, Aspergillus fumigatus (вариант Q27L) и Aspergillus fumigatus (вариант консенсус) в количестве 4,46 г/л, 6,11 г/л и 13,5 г/л, соответственно, [Biotechnology and Bioengineering. 1999, 63 (3), 373-381], что иллюстрирует высокий потенциал системы экспрессии дрожжей рода Ogataea для производства рекомбинантного белка.
Штамм О. thermomethanolica, содержащий ген фитазы Aspergillus niger ВСС18081 под контролем конститутивного промотора гена GAP, кодирующего глицеральдегид-3-фосфат дегидрогеназу, и с сигнальной последовательностью MFα из дрожжей Saccharomyces cerevisiae, продуцирует фитазу с активностью 134 ед./мл КЖ за 41 ч культивировании в 15 л ферментере на минеральной среде при температуре 34°С и использовании в качестве источника углерода столового сахара [Appl Biochem Biotechnol. 2016. DOI 10.1007/s12010-016-2191-8].
Описано использование штамма Ogataea haglerorum ВКПМ Y-2584 для экспрессии генов фитазы из бактерий Citrobacter freundii и Yersinia intermedia, и показано, что при культивировании в пробирках активность фитазы в КЖ составляет 56,2 ед./мл и 135,2 ед./мл, соответственно [Биотехнология, 2019, 35 (6), 51-56].
Одним из востребованных на сегодняшний день ферментов является фитаза Escherichia coli. Ген аррА, кодирующий фитазу Е. coli, был клонирован в 1985 г, затем секвенирован, а фитаза охарактеризована [Mol. Gen. Genet. 1985, 200, 68-73; J. Bacteriol. 1990, 172, 5497-5500; Arch. Biochem. Biophys. 1993, 303, 107-113]. Рекомбинантная фитаза E.coli, наработанная клетками дрожжей P. pastoris, обладает промышленно-ценными свойствами и в настоящее время коммерчески доступна в форме препаратов Quantum® и OptiPhos® [J. Sci. Food Agric. 2015, 95, 878-896. doi:10.1002/jsfa.6998; Annu. Rev. Anim. Biosci. 2013, 1, 1.1-1.27. doi: 10.1146/annurev-animal-031412-103717]. Введение в корма фитазы Е. coli более эффективно влияет на зоотехнические показатели, чем добавление фитаз из грибов Aspergillus и Peniophora, так как фитаза Е. coli более устойчива к действию пепсина, работает в более кислой области рН, что соответствует физиологическим условиям желудочно-кишечного тракта животных, а также характеризуется высокой удельной активностью по сравнению с фитазами из других организмов [J. Anim. Sci. 2003, 81(2), 474-483. doi: 10.2527/2003.812474х; Octa Journal of Biosciences, 2013, 1(2):158-169].
Получен продуцент KM71-61 на основе штамма P. pastoris КМ71 (his4 aoxl::ARG4 arg4 MutS; Invitrogen), содержащий природный ген аррА E.coli, транскрипция которого находится под контролем промотора гена АОХ1. Штамм КМ71-61 во время ферментации в культуре с высокой плотностью клеток продуцирует 6,4 мг/мл белка, активность фитазы составляет 4946 ед./мл КЖ через 192 ч культивирования при 30°С в 5 л ферментере [Enzyme and Microbial Technology. 2004, 35, 315-320].
Задачей заявляемого изобретения является расширение арсенала рекомбинантных микроорганизмов, продуцирующих фитазу Е. coli.
Техническим результатом заявляемого изобретения является рекомбинантный штамм дрожжей Ogataea haglerorum, продуцирующий фитазу, содержащий в составе хромосомы оптимизированную последовательность гена phyEc-mod и чувствительный к генетицину (G418).
Заявляемый штамм получают из штамма-продуцента фитазы Ogataea haglerorum 255 ВКПМ Y-4856, содержащего более 2-х копий синтетического гена phyEc-mod, кодирующего фитазу Е. coli, и маркерного гена КтМХ, обеспечивающего устойчивость к генетицину (G418), путем удаления маркерного гена из хромосомной ДНК.
Чувствительность заявляемого штамма к антибиотикам существенно упрощает его промышленное использование, так как облегчает утилизацию клеточной биомассы.
Штамм является продуцентом фитазы и депонирован в Биоресурсном центре Всероссийская Коллекция Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт»-ГосНИИгенетика как Ogataea haglerorum N260 ВКПМ Y-4951.
Штамм характеризуется следующими признаками:
Культурально-морфологические характеристики заявляемого штамма:
При культивировании при температуре 37°С в течение 48 ч на агаризованной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, агар - 2, вода - остальное) с добавлением глюкозы - 2 (мас. %) клетки имеют овальную форму, 3-4 мкм в диаметре. Клетки почкуются, при этом почкование истинное, многостороннее. Истинного мицелия не образуют.
Споруляция происходит при инкубации культуры на агаризованной среде следующего состава (мас. %): хлорид калия - 0.5, ацетат натрия - 1.0, агар - 2.0, вода - остальное при 25°С в течение 3-4 дней. Аски имеют тетраэдрическую форму, включают до 4 аскоспор.
На агаризованной среде YP с добавлением глюкозы (2, мас. %) колонии светло-бежевого цвета с ровным краем, матовой поверхностью, линзовидным профилем и пастообразной консистенцией.
При росте в жидкой среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода -остальное) с добавлением глюкозы - 2 (мас. %), при 37°С в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок не образует.
Физиолого-биохимические признаки заявляемого штамма:
Штамм способен к росту как в аэробных, так и в анаэробных условиях.
В качестве единственного источника углерода штамм способен использовать глюкозу, глицерин, метанол, этанол, L-рамнозу, сахарозу, мальтозу; не способен ассимилировать D-глюконат, L-арабинозу, сукцинат, лактозу, крахмал.
Штамм способен синтезировать фитазу при культивировании в жидкой среде YP с глюкозой (2 мас. %) с последующей индукцией метанолом.
Пример 1. Конструирование заявленного штамма дрожжей О. haglerorum, продуцирующего фитазу Е. coli
Заявляемый штамм получают из штамма Ogataea haglerorum 255 ВКПМ Y-4856 путем удаления из хромосомной ДНК селективного маркера КтМХ методом рекомбинации по 1ох сайтам в присутствии Сrе рекомбиназы [FEMS Yeast Res. 2014, 14, 1048-1054. DOI: 10.1111/1567-1364.12197].
Штамм Ogataea haglerorum 255 ВКПМ Y-4856 выращивают в жидкой питательной среде YP (мас. %: дрожжевой экстракт - 1, пептон - 2, вода - остальное) с добавлением глюкозы (2 мас. %) и генетицина в количестве 300 мкг/мл при 37°С в течение 6 ч до достижения культурой оптической плотности (OD600) 1,5. Клетки собирают центрифугированием (здесь и далее 6000 об/мин.) в течение 10 мин. при комнатной температуре, ресуспендируют в буфере TED состава: 100 мМ Tris-HCl, 50 мМ EDTA, рН 8.0, 25 мМ дитиотрейтола, приготовленном на воде SQ, инкубируют при 37°С в течение 15 мин. и собирают центрифугированием в течение 10 мин. при комнатной температуре. Далее клетки промывают дважды холодным буфером STM состава: 270 мМ сахароза, 10 мМ Tris-HCl, рН 8.0, 1 мМ MgCl2, приготовленном на воде SQ, собирают центрифугированием в течение 10 мин при температуре 5°С. Обработанные таким образом клетки ресуспендируют в холодном растворе STM в концентрации 1-5×109 клеток на 1 мл. Аликвоту объемом 60 мкл клеточной суспензии переносят в охлажденный эппендорф, добавляют 200 нг ДНК плазмиды с Сrе рекомбиназой и инкубируют на льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при 1500 В, 200 Ом, 25uF. После электропорации к клеткам добавляют 1 мл жидкой среды YP с глюкозой (2 мас. %), переносят клеточную суспензию в стерильные пробирки на 1,5 мл и инкубируют при 37°С в течение 60 мин. при качании.
Селекцию трансформантов проводят на агаризованной среде YP с глюкозой (2 мас. %) и гигромицином в количестве 200 мкг/мл при температуре 37°С в течение 4-х суток.
Биомассу трех независимых трансформантов переносят в три пробирки с 3 мл среды YP с гигромицином в количестве 200 мкг/мл и метанолом, используемым в качестве источника углерода и индуктора биосинтеза Сrе рекомбиназы. Пробирки инкубируют при 37°С в течение 48 ч при качании. Затем делают рассев культуры из пробирок до отдельных колоний на среду YP с глюкозой (2 мас. %) на три чашки Петри. Чашки инкубируют в термостате при 37°С в течение 72 ч. Анализируют 100 независимо отобранных колоний с каждой чашки. В лунки репликатора добавляют 200 мкл стерильной воды, в каждую лунку репликатора переносят с помощью зубочистки биомассу одной колонии, затем делают реплику из репликатора на три чашки Петри со средами YP с глюкозой (2 мас. %), YP с глюкозой (2 мас. %) и генетицином в количестве 300 мкг/мл и YP с глюкозой (2 мас. %) и гигромицином в количестве 200 мкг/мл. Чашки инкубируют в термостате при 37°С в течение 48 ч. Отбирают колонии, которые растут на среде YP с глюкозой (2 мас. %), но не растут на средах с антибиотиками.
Проводят культивирование отобранных колоний в пробирках по следующей схеме:
- Посевную культуру выращивают в пробирках (50 мл) с 5 мл жидкой питательной среды YP с добавлением глюкозы (2 мас. %) при 37°С в течение 24 ч на качалке (250 об/мин). Посев ферментационной среды осуществляют в соотношении 1/10.
- Ферментацию проводят при 37°С на качалке (250 об/мин) в питательной среде YP с добавлением глюкозы (2 мас. %) в течение 5 дней. Через 24 ч культивирования начинают индукцию метанолом, который добавляют в количестве 3 об.%, затем такое же количество метанола добавляют на 48 ч культивирования. В качестве контроля используют штамм Ogataea haglerorum 255 ВКПМ Y-4856.
Продуктивность оценивают по активности фитазы в среде культивирования. Для этого клетки трансформантов осаждают центрифугированием, а супернатант используют для определения фитазной активности модифицированным методом Фиске-Субарроу [J. Biol. Chem. 1925, 66, 376-400; J. Microbiol. Methods. 1999, 39(1), 17-22]. За единицу ферментативной активности фитазы (1 ед.) принимают количество фермента, способного высвободить 1 мкмоль неорганического фосфата из фитата натрия за 1 мин. в стандартных условиях (температура 37°С, значение рН 4,5, продолжительность гидролиза 30 минут).
Отбирают наиболее продуктивный клон №260, который продуцирует фитазу Е. coli с активностью 915 ед./мл за 120 ч ферментации в пробирках при температуре 37°С (против активности 806 ед./мл у штамма О. haglerorum 255 ВКПМ Y-4856).
Клон Ogataea haglerorum N260 является продуцентом фитазы и депонирован в Биоресурсном центре Всероссийская Коллекция Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» - ГосНИИгенетика (117545 Москва, 1-ый Дорожный проезд, д.1) как штамм Ogataea haglerorum N260 ВКПМ Y-4951.
Пример 2. Получение фитазы путем культивирования заявляемого штамма Ogataea haglerorum N260 в колбах
Посевную культуру готовят в пробирках в 5 мл среды YP с глюкозой (2 мас. %). Пробирки инкубируют при 37°С в течение 24 ч на качалке (250 об/мин). В колбу на 0,75 л с 50 мл жидкой среды YP с глюкозой (2 мас. %) переносят 5 мл посевной культуры и колбу инкубируют при 37°С на качалке (250 об/мин.) в течение 6 дней. Метанол (2 об.%) добавляют к культуре через 24, 48 и 72 часа культивирования. Биомассу отделяют центрифугированием в течение 15 мин.
Культуральную жидкость без биомассы (КЖ) используют для определения активности фитазы по методу ДНС и определения количества секретируемого белка по методу Бредфорд с использованием кита Quick Start Bradford Protein Assay (Bio-Rad, США).
Рекомбинантный штамм Ogataea haglerorum N260 ВКПМ Y-4951 продуцирует белок в количестве 1.3±0.2 мг/мл, активность фермента фитазы составляет 1030±60 ед./мл.
Пример 3. Получение фитазы путем культивирования заявляемого штамма Ogataea haglerorum N260 ВКПМ Y-4951 в 10 л ферментере
В качестве образца сравнения используется штамм О. haglerorum 255 ВКПМ Y-4856.
Из суточной биомассы штамма Ogataea haglerorum N260 с чашки Петри со средой YP с глюкозой (2 мас. %) готовят суспензию клеток в стерильной дистиллированной воде для определения оптической плотности (OD600). В качалочные колбы объемом 750 мл с рабочим объемом 110 мл жидкой посевной среды YP с глюкозой (2 мас. %) вносят приготовленную суспензию клеток до получения OD600, равной 0.1 единиц. Колбы инкубируют при температуре 37°С на качалке при 220 об/мин. до достижения культурой оптической плотности равной 12.
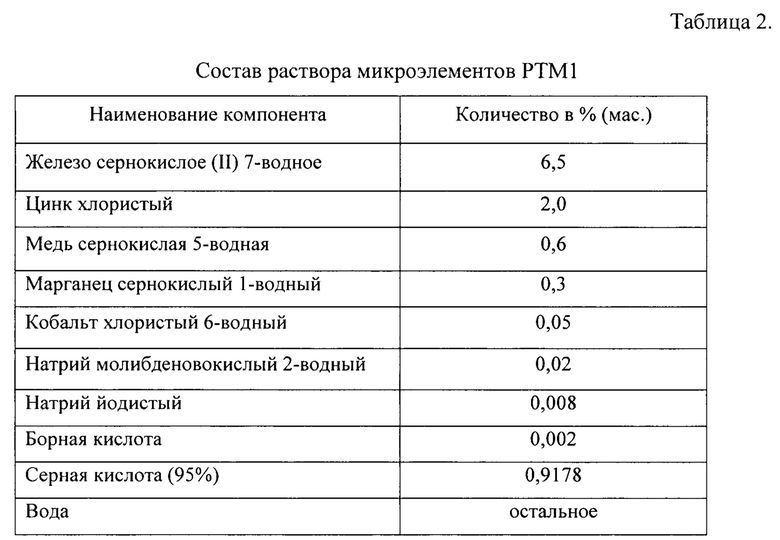
Основную ферментацию проводят в ферментере объемом 10 литров, входящим в состав линии ферментеров BLBIO-10-10-100 SLA (Lianyungang Bailun Bio -Technology Co., Ltd), содержащем 5 л среды следующего состава (табл.1).
Условия ферментации: температура 37°С; начальное перемешивание: 350 об/мин., начальная аэрация: 1.0 л воздуха на каждый л начальной среды в мин. Уровень рН поддерживают на значении 4.6 путем титрования 25%-ным водным раствором аммиака, а значение рО2 - на уровне 20.0% (от насыщения среды воздухом) путем использования каскадной регулировки скорости вращения мешалки.
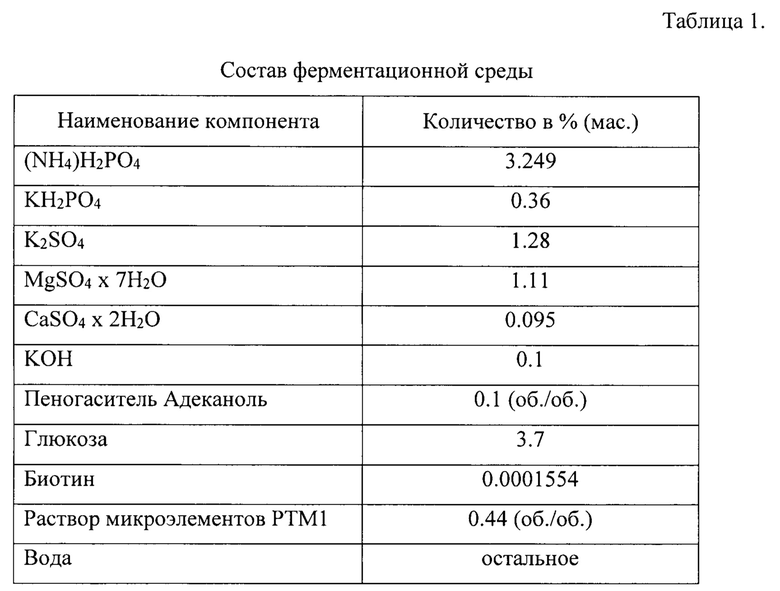
Раствор микроэлементов РТМ1 имеет состав (табл. 2).
В рабочий ферментер вносят культуру, выращенную на качалке в колбах, достартового значения оптической плотности, равной 2.0. Наращивание биомассы осуществляют в два этапа. На первом этапе рост биомассы производят на глюкозе, введенной в ферментер с начальной средой (10 часов). На втором - наращивание биомассы обеспечивают путем подачи в ферментер глюкозной подпитки состава (мас. %): глюкоза - 36.0, раствор микроэлементов РТМ1 -1.2 (об./об.), биотин - 0.0005167, вода - остальное до значения сырого веса биомассы 15±1 (мас. %).
Далее в ферментер со скоростью 6,25 мл/л н.с.в час подают раствор метанольной подпитки состава (мас. %): метанол - 95.9, раствор микроэлементов РТМ1 - 1.2 об./об., биотин - 0.00044, вода - остальное. Индукция метанолом продолжается в течение 164 ч.
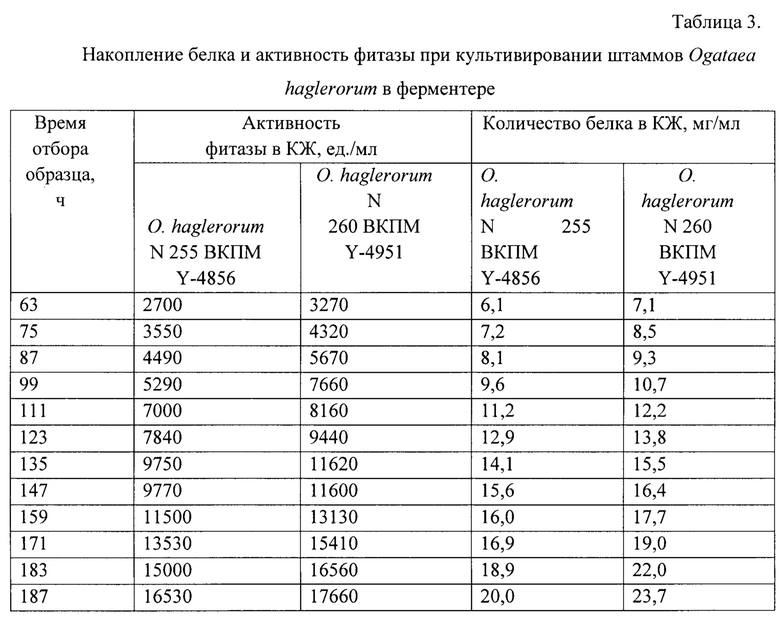
В процессе культивирования заявляемого штамма периодически отбирают образцы КЖ для определения активности фитазы при рН 4.03 и температуре 37°С с использованием молибдата аммония и метаванадата аммония, на основании модифицированной методики определения активности фитазы по ГОСТ 31487-2012 «Препараты ферментные. Методы определения ферментативной активности фитазы» [ГОСТ 31487-2012]. Концентрацию белка в отобранных образцах КЖ определяют по методу, предложенному Layne [Layne, Е. "Spectrophotometric and turbidimetric methods for measuring proteins." Methods in Enzymology 3 (1957): 447-454.]. Результаты приведены в табл. 3.
Приведенные результаты показывают, что при культивировании в 10-ти литровом ферментере штамм Ogataea haglerorum N260 продуцирует 23,7 мг/мл белка, при этом активность фитазы через 187 ч культивирования при 37°С составляет 17660 ед./мл КЖ (против 20 мг/мл белка и активности 16530 ед./мл КЖ у штамма Ogataea haglerorum 255 ВКПМ Y-4856).
Таким образом, заявляемый штамм обладает большей продукцией (15%) и не содержит генов устойчивости к антибиотикам, что делает его использование в промышленности более выгодным и экологичным.
Следует также отметить, что штаммы О. haglerorum в отличие от продуцентов фитазы P. pastoris, способны синтезировать и секретировать фермент при температуре культивирования 37°С, что перспективно для разработки более экономичной технологии культивирования и получения товарной формы ферментного препарата фитазы.
Заявляемый штамм по своим биотехнологическим показателям сравним с лучшими зарубежными штаммами - продуцентами фитазы.
| название | год | авторы | номер документа |
|---|---|---|---|
| Трансформант дрожжей Ogataea haglerorum - продуцент фитазы Escherichia coli | 2021 |
|
RU2771079C1 |
| Рекомбинантный штамм дрожжей Ogataea haglerorum, продуцирующий бета-маннаназу Bacillus subtilis | 2020 |
|
RU2747782C1 |
| Трансформант Ogataea haglerorum - продуцент рекомбинантного химозина в активной форме | 2022 |
|
RU2815882C1 |
| Трансформант дрожжей Ogataea haglerorum, продуцирующий бета-маннаназу, содержащий в составе хромосомы синтетический ген MANS | 2020 |
|
RU2764793C1 |
| Трансформант Ogataea haglerorum - продуцент термостабильной α-амилазы | 2022 |
|
RU2795707C1 |
| Трансформант Komagataella phaffii, содержащий ген HAC1, продуцент рекомбинантного химозина Vicugna pacos в активной форме | 2023 |
|
RU2828277C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент фитазы | 2018 |
|
RU2701498C1 |
| Трансформант Komagataella phaffii - продуцент рекомбинантного химозина в активной форме | 2022 |
|
RU2805486C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент фитазы Escherichia coli | 2019 |
|
RU2751595C2 |
| Рекомбинантный штамм дрожжей Pichia pastoris с увеличенной продукцией фитазы Escherichia coli | 2019 |
|
RU2737623C1 |
Изобретение относится к биотехнологии. Предложен рекомбинантный штамм дрожжей Ogataea haglerorum ВКПМ Y-4951 - продуцент фермента фитазы Еscherichia coli. Штамм не содержит генов устойчивости к антибиотикам и способен синтезировать и секретировать фермент при температуре культивирования 37°С. При ферментации в 10-ти литровом ферментере указанный штамм продуцирует 23,7 мг/мл белка, при этом активность продуцируемой штаммом фитазы через 187 ч культивирования при 37°С составляет 17660 ед./мл культуральной жидкости. 3 табл., 3 пр.
Рекомбинантный штамм дрожжей Ogataea haglerorum ВКПМ Y-4951 - продуцент фитазы Escherichia coli.
| ТAРУТИНA М.Г | |||
| и др | |||
| Cравнительная характеристика фитаз из Citrobacter freundii и Yersinia intermedia, экспрессированных в метилотрофных дрожжах Ogataea polymorpha и Pichia pastoris | |||
| Биотехнология, 2019, Т | |||
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
| Рекомбинантный штамм дрожжей Pichia pastoris с увеличенной продукцией фитазы Escherichia coli | 2019 |
|
RU2737623C1 |
| MAYER A.F | |||
| et al | |||
| An expression system matures: a highly efficient and cost-effective process for | |||
Авторы
Даты
2022-12-14—Публикация
2021-09-16—Подача