Изобретение относится к радиологии, а именно к ингаляционной низкодозной радионуклидной терапии у пациентов с COVID-19.
Лучевая терапия (ЛТ) использовалась для лечения пневмонии в первой половине 20 века. В литературе имеются данные о лечении более 800 случаев бактериальной, вирусной, атипичной пневмонии с применением низких доз ионизирующего излучения.
Исследователи применяли различные режимы облучения, основываясь на результатах лечения воспалительных заболеваний, таких как карбункул, артрит. Диапазон суммарных очаговых доз при облучении легких составил 50–100 рентген в воздухе (до 0,9 Гр).
Oppenheimer (1943 г.) пришел к выводу, что облучение на ранних стадиях болезни (2-5 день) приводило к наилучшим результатам лечения, в то время как облучение после 14 дня болезни имело успех лишь в 50% случаев.
Необходимо подчеркнуть, что последнее клиническое исследование по данной проблеме было проведено в 1946 году. В большинстве исследований отсутствуют контрольные группы или они плохо организованы. Отсутствует контроль доз, слабое методическое обеспечение, нет информации по разбросу доз по мишени и т.п., что в современных условиях не позволило бы данные исследования считать правомерными.
Возможным механизмом радиационного воздействия в случае пневмонии, не поддающейся терапии антибактериальными препаратами, может быть воспалительная реакция – сложный патофизиологический механизм, реализуемый каскадом межклеточного взаимодействия посредством иммунных реакций. Недавние лабораторные исследования показали, что разовые дозы облучения в диапазоне 0,3–0,7 Гр могут быть эффективны в отношении влияния на патофизиологию воспаления, а значит они оказывают противовоспалительный эффект. Противовоспалительное действие низкодозной лучевой терапии (НДЛТ) реализуется на всех этапах воспалительного процесса.
НДЛТ влияет на выработку биологически активных веществ во всех фракциях лейкоцитов, индуцируя выработку противовоспалительных цитокинов: трансформирующего ростового фактора бета (TGF-ß1), интерлейкина -10 (IL-10 и интерлейкина 4), и снижение выработки цитокинов воспаления, в частности интерлейкинов -6 (IL-6), 12 ( IL-12) и колониестимулирующих факторов ( КСФ); а также происходит массивное снижение выброса L-селектина из лейкоцитов.
Ионизирующее излучение способно уменьшать воспаление с помощью различных механизмов, включая индукцию апоптоза в иммунных клетках, секрецию противовоспалительных факторов и снижение функции макрофагов (Arenas M., Sabater S., Hernández V. Anti-inflammatory effects of low-dose radiotherapy. Indications, dose, and radiobiological mechanisms involved. Strahlenther Onkol. 2012;188(1):975–981).
Что касается применения низкодозной лучевой терапии при пневмонии, связанной с SARS-CoV-2 у больных с высоким уровнем IL-6, то роль лучевой терапии в векторе моноцит-макрофаг может быть очень актуальной.
Авторы в статье «Low dose lung radiotherapy for COVID-19 pneumonia. The rationale for a cost-effective anti-inflammatory treatment» доказали что применение низкодозной дистанционной лучевой терапии (0,5 Гр), способствует реализации противовоспалительного эффекта в пораженной легочной ткани (Pedro C. Laraa, Javier Burgosa, David Maciasa. Low dose lung radiotherapy for COVID-19 pneumonia. The rationale for a cost-effective anti-inflammatory treatment. Clinical and Translational Radiation Oncology Volume 23, 2020).
Низкодозная дистанционная лучевая терапия это доступный метод, обладающий минимальной токсичностью и высокой экономической эффективностью.
В статье «Low dose radiation therapy as a potential life saving treatment for COVID-19-induced acute respiratory distress syndrome (ARDS)» авторы рекомендуют использовать низкодозную дистанционную лучевую терапию (0,3–0,5Гр) в острой фазе заболевания, когда происходит всплеск цитокинов, с целью снижения вероятности молниеносных и долгосрочных побочных эффектов (Gaurav Dhawan, Rachna Kapoor, Rajiv Dhawan, Ravinder Singh, Bharat Monga, James Giordano, and Edward J. Low dose radiation therapy as a potential life saving treatment for COVID-19-induced acute respiratory distress syndrome (ARDS). Calabreseh Radiother Oncol. 2020 Jun; 147: 212–216).
На сегодняшний день опубликовано несколько пилотных статей, в которых авторы продемонстрировали возможность и безопасность проведения низкодозного облучения у пациентов с COVID-19, ассоциированной вирусной пневмонии.
Самым близким по назначению (прототип) является способ низкой дозы облучения всего легкого при пневмонии COVID-19 («Low-Dose Whole-Lung Radiation for COVID-19 Pneumonia: Planned Day-7 Interim Analysis of a Registered Clinical Trial» (Hess C.B., Zachary S., et al. Low-Dose Whole-Lung Radiation for COVID-19 Pneumonia: Planned Day-7 Interim Analysis of a Registered Clinical Trial; Ameri A., Rahnama N., Bozorgmehr R., et al. Low-Dose Whole-Lung Irradiation for COVID-19 Pneumonia: Short Course Results Int J Radiation Oncol Biol Phys 2020). Пациентам провели облучение всего объема легких дозой 1,5 Гр за 1 фракцию у пятерых пациентов с различными сопутствующими заболеваниями, и наличием выраженных респираторных нарушений, требующих кислородной поддержки. В течение 24 часов после сеанса 3 (60%) больных были сняты со вспомогательных методов оксигенации, у 4-х человек (80%) была достигнута КТ-подтверждённая регрессия пневмонии, острой токсичности, связанной с ЛТ, отмечено не было.
Однако использования данной методики ограничено стационарами оснащёнными отделениями лучевой терапии, к которым в основном относятся онкологические учреждения, а не многопрофильные больницы контингентом которых является представленная группа пациентов. Кроме того мобильность генератора TechnegasPlus позволяет его использовать в рамках передвижных мобильных комплексов.
Техническим решением заявляемого изобретения является разработка способа безопасной доставки терапевтической дозы для проведения ингаляционной низкодозной радионуклидной терапии, в том числе, у пациентов с COVID-19.
Техническое решение решается тем, что так же, как и в известном способе используют ионизирующее излучение в терапевтических целях.
Особенностью заявляемого способа является то, что дозу облучения подводят ингаляционно, посредством вдыхания пациентом в течение 2 мин ультрадисперсного аэрозоля углеродных наночастиц, меченных 99mTc (УДАУНЧ, 99mTc ), полученного путем загрузки в тигель генератора раствора пертехнетата натрия (Na99mTcO4) с активностью не менее 12 ГБк.
Изобретение поясняется подробным описанием, таблицами, клиническим примером и иллюстрациями, на которых изображено:
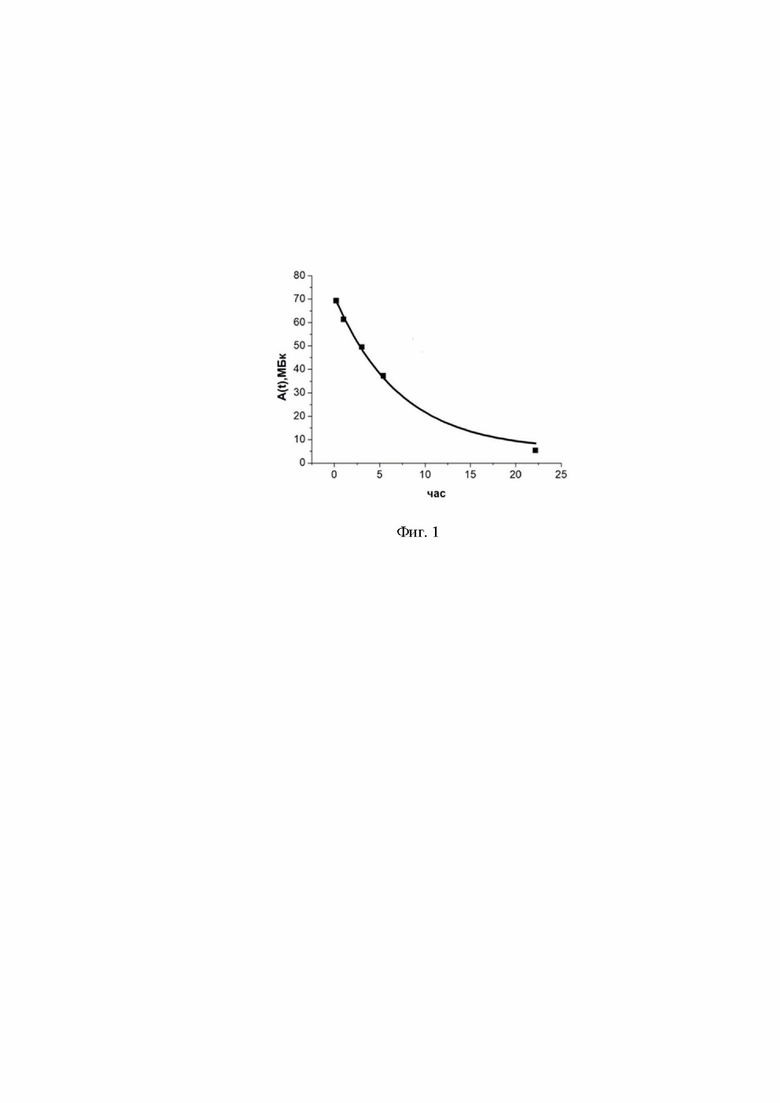
Фиг. 1 – Диаграмма добровольца К.В.Н. (легкие Тс 99-m): изменение активности 99mTc в легких добровольца К.В.Н. со временем после ингаляционного поступления РФП.
Способ выполняют следующим образом.
Подключают газовый баллон с аргоном к генератору TechnegasPlus и открывают газовый баллон. Подключают генератор TechnegasPlus к сети, включают генератор TechnegasPlus и открывают выдвижную секцию. Достают угольный тигель из упаковки и помещают его на часовое стекло. Перед добавлением натрия пертехнетата, 99mTc (Na99mTcO4) - тигель смачивают, используя абсолютный или 95% этиловый спирт, затем смоченный тигель помещают между контактами выдвижной секции генератора TechnegasPlus. Далее тигель заполняют натрием пертехнетатом, 99mTc (Na99mTcO4) объёмом от 0,1 до 0,3 мл с необходимой активностью (не менее 12 ГБк) и закрывают выдвижную секцию. Запускают цикл медленного нагревания по окончании, которого, при необходимости, можно повторно заполнить тигель натрием пертехнетатом, 99mTc (Na99mTcO4) для увеличения удельной активности и повторить цикл медленного нагревания.
При достижении необходимой активности запускают цикл обжига, заключающегося в кратковременном повышении температуры до 2700°С в среде аргона, по окончании которого УДАУНЧ, 99mTc - используют в течение 10 минут. После чего газовый баллон закрывают и отсоединяют его от генератора TechnegasPlus, генератор TechnegasPlus выключают и отсоединяют от сети.
Для достижения наилучших результатов УДАУНЧ, 99mTc вводят в организм пациента сразу после его получения. Пациент получает дыхательную смесь посредством серии глубоких и медленных вдохов с 5 секундной задержкой каждого вдоха через специальную систему (входят в состав генератора TechnegasPlus) трубок и фильтров с обратным клапаном в течение 2 мин.
Изобретение поясняется экспериментальными исследованиями.
Измерения на фантоме человека проводят для получения коэффициентов перехода от скорости счета импульсов над областью интереса, полученной по данным планарной сцинтиграфии в режиме «все тело» в передней и задней прямой проекциях (в имп./мин), к абсолютной активности 99mTc в области интереса (в кБк).
Для измерений используют имеющиеся в МРНЦ им.А.Ф. Цыба унифицированные сборные антропометрические фантомы человека УФ-02Т производства НТЦ “РАДЭК” с различной массой тела.
Фантомы состоят из полиэтиленовых блоков прямоугольной формы массой 1,0 кг и 0,5кг. В торакальной области фантома расположены фантомы легких человека, изготовленные из тканеэквивалентного материала плотностью 0,26 г/см3 и массой от 400г до 1100г, в зависимости от массы тела фантома. В фантомах легких имеются сквозные каналы для размещения в них герметичных пробирок с известной активностью 99mTc (кБк), полученной из генератора 99mTc непосредственно перед измерениями. Измерения с помощью планарной сцинтиграфии со следующими параметрами сканирования: коллиматоры low energy high resolution (LEHR), фотопик 140 КэВ (99mTc), ширина окна дискриминатора ±7.5%, скорость движения деки стола 16см/мин, матрица 256×1024, проводятся и протоколируются в строгом соответствии с режимами и геометрией измерений, применяемыми при соответствующих измерениях пациентов и с оконтуриванием областей интереса.
По результатам измерений на фантомах получают величины коэффициентов перехода от скорости счета импульсов в области интереса (легких), полученной по данным планарной сцинтиграфии в режиме «все тело» в передней и задней прямой проекциях (в имп./мин), к абсолютной активности 99mTc в области интереса (в кБк) – в зависимости от массы тела человека. Полученные коэффициенты используют для определения абсолютной активности 99mTc в легких пациентов с различными массами тела.
Для определения группы пациентов, включенных в основную исследуемую группу, было проведено скриниговое исследование в день предполагаемой процедурой ингаляционной низкодозной радионуклидной терапии. На этапе скрининга оценивались клинико-лабораторные показатели, позволяющие выявить пациентов с клинико-лабораторными признаками системной воспалительной реакции и высокой вероятностью развития цитокинового шторма.
В скрининговое исследование включено 22 пациента с подтвержденной COVID-19 инфекцией. Исследовались цельная кровь и сыворотка предполагаемых к включению в исследование/включенных в исследование больных.
Проанализировано 38 показателей крови, отражающих состояние гомеостаза, в том числе 7 основных показателей иммунной системы, позволяющих выявить интенсивность воспалительной реакции в ответ на патоген.
17 человек в результате проведенного лабораторного анализа и в соответствии с критериями включения могли войти в исследование.
Однако 2 больных исключены, так как выявлен диагноз опухолевого заболевания крови. 2 больных отказались от включения в исследование. У 1 больного констатирован по КТ COVID 4, что послужило основанием для его исключения из протокола.
На основании проведенного скрининга оптимальными лабораторными показателями для включения в протокол приняты значения лейкоцитов, нейтрофилов, лимфоцитов, тромбоцитов, фибриногена, ферритина, Д-димера, С-реактивного белка, лактатдегидрогеназы.
Результаты планарной сцинтиграфии с использованием фантомов человека, содержащих в фантомах легких стандартную радиоактивность 99mTc, с последующей планарной сцинтиграфией добровольцев после ингаляции УДАУНЧ, 99mTc, данные анализа индивидуальной динамики радиоактивности РФЛП и определение на этой основе индивидуальных поглощенных доз внутреннего облучения легких добровольцев пациентов по методологии MIRD, с учетом рассчитанными методом Монте-Карло величин удельных поглощенных долей энергии в органах людей с различной массой тела, полного состава и спектра излучений 99mTc, позволили сделать нижеследующие выводы.
Установлено, что после ингаляции исследуемого УДАУНЧ, 99mTc, доля ингалированной начальной радиоактивности 99mTc в легких варьировала от человека к человеку в пределах от 5,5% до 12,4% (в среднем - 9,72%) по отношению к исходной радиоактивности в тигле (Таблица 1).
Таблица 1.
Результаты определения накопленных доз внутреннего облучения легких у пяти добровольцев после ингаляции РФП с 99mTc
(9,72%)
По итогам предварительного сравнительного анализа в контрольной группе больных в дебюте заболевания прослеживаются те же особенности гомеостаза, что и в исследуемой группе, однако на основании анализа отдельных показателей клиник-лабораторных показателей (лейкоцитарная формула, уровни лактата, Д-димера, ферритин, ЛДГ) можно было прогнозировать у больных, включенных в исследование более тяжелое течение болезни.
При сравнении изученных показателей на третьи и седьмые сутки в контрольной группе и группе больных, получавших ингаляционную НРНТ, наблюдается тенденция пролонгированной активации системы гемостаза у больных, не получавших ингаляционную НРНТ. Это свидетельствует как о наличии, так и о прогрессировании микротромбозов у больных, не получавших ингаляционную НРНТ, и в конечном итоге может привести к развитию декомпенсированного ДВС-синдрома и полиорганной недостаточности. Полученные данные свидетельствуют о положительном влиянии ингаляционной НРНТ на гомеостаз в целом, и на гемостаз в частности.
Клинические примеры выполнения.
Пример 1 (здоровый доброволец).
Пациент К.В.Н., 1969 г.р., дата проведения исследований: 02.11.2020 - 03.11.2020, масса тела 55 кг, рост 164 см,
Аппарат для изготовления газа для ингаляций TechnegasPlus Generator TP 25000.
Начало ингаляции:10:39, окончание ингаляции 10:41. Исходная активность на время ингаляции – 897 МБк. Длительность ингаляции: 2 мин. Число вдохов/выдохов: 43 (дыхание поверхностное). Положение пациента при ингаляции: сидя.
Аппарат для сканирования и ОФЭКT/КТ: Discovery NM/CT 670. Скорость при сканировании: 16 см/мин. Скорость сканирования при планарном сканировании: 19 см/мин. Объем легких по данным ОФЭКТ /КТ: 5191,2 мл.
Исходная активность в тигле на время ингаляции – 897 МБк. Указаны суммарные результаты сканирования в передней и задней прямых проекциях (Таблица 2). Коэффициент перехода 723 - (имп/мин)/МБк.
Таблице 2
Результаты сканирования (изменение активности в легких добровольца с течением времени)
сканирования
имп/мин
сканирования, минуты
Изменение активности 99mTc в легких добровольца К.В.Н. со временем после ингаляционного поступления РФП отражены в диаграмме (Фиг. 1).
Аналитический вид функции изменения активности 99mTc в легких добровольца К.В.Н. со временем после ингаляционного поступления РФП представлен в соотношении 1.
Интеграл по времени от этой функции использован для определения дозы внутреннего облучения легких РФП с 99mTc – в соответствии с выражением 2.
A(t) = А1×exp(-t/Tд), МБк (1)
где:
A(t) – экспоненциальная функция изменения со временем t(час) активности РФП с 99mTc, МБк, в легких добровольца К.В.Н. после ингаляционного поступления в легкие препарата (получена нелинейной аппроксимацией экспериментальных данных сцинтиграфии с использованием метода наименьших квадратов);
A1 = 65,66228 МБк, (SD=± 1,7238 МБк);
Tд = 7,2031 час, (SD=±0,5926 час).
Коэффициент нелинейной корреляции экспоненциальной функции, аппроксимирующий экспериментальные данные, R2=0,9952.
Период эффективного полувыведения активности из легких добровольца К.В.Н равен Tэфф = ln2×Тд = 0,6931×7,2031 час = 4,9928 час, (SD=±0,4106 час).
В соответствии с методологией Medical Internal Dose Committee величина накопленной дозы в органе интереса («орган-мишень») при её облучении «органами-источниками» определяется следующим соотношением:
HT = k∑Аs∑fi×Ei×Фi(T←S)×Qi /mT (2)
где: HT – накопленная поглощенная доза в органе-мишени “T” (мГр);
АS – число распадов, которые произошли за некоторый период времени в органе-источнике “S” (1 распад равен 1 Бк×сек) – это так называемая “накопленная активность” в органе-источнике. При самооблучении орган-источник и орган-мишень совпадают;
fi – доля излучения определенного типа с энергией Ei, излученная за один акт снятия энергетического возбуждения (или распада) нуклида (таблица 3);
Ei – энергия излучения i (МэВ) (таблица 3);
Фi (T←S) - доля энергии, поглощенная в огане-мишени “T” по отношению ко всей энергии, излученной органом-источником “S”;
Qi – фактор качества для излучения i, (мЗв/мГр) -здесь следует отметить, что для электронного, бета и квантового излучения фактор качества равен единице;
mT – масса органа-мишени (кг);
k – константа, которая приводит в соответствие все использованные единицы, 1,602×10-10 (мГр×кг)/(Бк×сек×МэВ);
Таблица 3
Спектр и состав излучений 99mTc (период полураспада: 6,01 час)
Пример 2 - пациент с COVID-19.
Пациент В.В.Н., 65лет, поступил в клинику с диагнозом: коронавирусная инфекция, вызванная COVID-19 подтверждённая (средняя степень тяжести). Осложнение: внебольничная двухсторонняя долевая пневмония. Сопутствующие заболевания: ИБС, Артериальная гипертензия, хронический гастрит.
Был проведен комплексный анализ крови до и через 1, 3, 7 суток после проведения ингаляционной низкодозной радионуклидной терапии (Таблица 4).
Таблица 4
Характеристика показателей крови пациента В.В.Н.
После проведения ингаляционной НРНТ отмечено снижение большинства показателей, особо внимания из которых требуют уровень ферритина (с 485 до 194 нг/мл), Д-димера (с 1813нг/мл до 772 нг/мл), активность лактатдегидрогеназы (с 204 ед/л до 176 ед/л), нормализация концентрации С-реактивного белка (СРБ) (с 66,5 мг/л до 8,2 мг/л) и нормализацией числа тромбоцитов (с 427 х109 /л до 294х109/л) которые являются прогностически важными факторами. Под влиянием проведенного метода отмечено снижение уровня лейкоцитов крови с 12,4х109/л до 9,5х109/л. По результатам лабораторного исследования крови отмечена положительная динамика на фоне проведения ингаляционной НРНТ.
Предложенный способ ингаляционного НРНТ лечения в клинической практике позволяет нормализовать показатель клеточного и гуморального иммунитета, а также и снизить уровень специфических IgM SARS-CoV-2, характеризующих острую фазу процесса, достигнуть нормализацию уровней основного провоспалительного цитокина – IL-6, играющего центральную роль в патогенезе развития острого респираторного дистресс-синдрома.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ исследования состояния легких при подозрении на COVID-19 с помощью низкодозной компьютерной томографии | 2020 |
|
RU2744552C1 |
| ЛИОФИЛИЗАТ ДЛЯ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКОГО РАДИОФАРМАЦЕВТИЧЕСКОГО ЛЕКАРСТВЕННОГО ПРЕПАРАТА НА ОСНОВЕ РАДИОНУКЛИДА Tc | 2022 |
|
RU2799325C2 |
| Способ лечения начальных стадий рака полости рта | 2019 |
|
RU2713940C1 |
| Способ прицельной брахитерапии рака предстательной железы под навигацией гибридной ПСМА-рецепторной сцинтиграфии | 2022 |
|
RU2788859C2 |
| Способ диагностики поражения дыхательной системы методами радионуклидной индикации у пациентов с дисплазией соединительной ткани | 2021 |
|
RU2784840C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ИНДИВИДУАЛЬНОЙ АКТИВНОСТИ 131-ЙОДА ДЛЯ ПРОВЕДЕНИЯ РАДИОЙОДТЕРАПИИ ТИРЕОТОКСИКОЗА И ПРОГНОЗИРОВАНИЯ ВРЕМЕНИ ДОСТИЖЕНИЯ БЕЗОПАСНОГО УРОВНЯ АКТИВНОСТИ 131-ЙОДА В ОРГАНИЗМЕ ПАЦИЕНТА ПОСЛЕ ВВЕДЕНИЯ ИНДИВИДУАЛЬНОЙ АКТИВНОСТИ 131-ЙОДА | 2019 |
|
RU2722568C1 |
| Способ радионуклидной диагностики рака легкого | 2020 |
|
RU2751103C1 |
| СПОСОБ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ СТЕПЕНИ УДЕРЖАНИЯ КЛЕТОЧНОГО ПРЕПАРАТА В ПРЕДЕЛАХ ЦЕЛЕВОГО ОРГАНА ПРИ ВНУТРИОРГАННОМ ВВЕДЕНИИ С ИСПОЛЬЗОВАНИЕМ РАДИОНУКЛИДНОГО МЕТОДА | 2022 |
|
RU2809526C2 |
| Способ лечения больных с новой коронавирусной инфекцией COVID-19 при высокопоточной оксигенации | 2022 |
|
RU2787175C1 |
| СПОСОБ ЛЕЧЕНИЯ РАКА ПОЛОСТИ РТА | 2019 |
|
RU2713530C2 |
Изобретение относится к медицине, а именно к радиологии, и может быть использовано для доставки терапевтической дозы для проведения ингаляционной низкодозной радионуклидной терапии у пациентов с COVID-19. Дозу облучения подводят ингаляционно посредством вдыхания пациентом в течение 2 мин ультрадисперсного аэрозоля углеродных наночастиц, меченных 99mTc, полученного путем загрузки в тигель генератора раствора пертехнетата натрия с удельной активностью не менее 12 ГБк. Способ обеспечивает доставку терапевтической дозы для проведения низкодозной радионуклидной терапии за счет ингаляционного подведения дозы облучения. 1 ил., 4 табл., 2 пр.
Способ доставки терапевтической дозы для проведения ингаляционной низкодозной радионуклидной терапии у пациентов с COVID-19, отличающийся тем, что дозу облучения подводят ингаляционно посредством вдыхания пациентом в течение 2 мин ультрадисперсного аэрозоля углеродных наночастиц, меченных 99mTc, полученного путем загрузки в тигель генератора раствора пертехнетата натрия с активностью не менее 12 ГБк.
| Поршневой измеритель жидкости | 1931 |
|
SU26453A1 |
| US 20110077572 A1, 31.03.2011 | |||
| US 20040136904 A1, 15.07.2004 | |||
| RODEL F | |||
| et al | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Мост | 1912 |
|
SU679A1 |
| SANMAMED N | |||
| et al | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
Авторы
Даты
2022-05-19—Публикация
2021-07-15—Подача