По настоящей заявке испрашивается приоритет на основании заявки США № 62/286897, поданной 25 января 2016 года, которая включена в настоящее описание посредством ссылки во всей ее полноте.
УРОВЕНЬ ТЕХНИКИ
Идентификацию и/или количественное определение микроорганизмов применяют во многих областях. Культивирование микроорганизмов является одним из этапов в различных анализах, и для его выполнения требуется один или более дней. Ускорение этапа культивирования стало бы полезным улучшением для различных микробиологических анализов.
Пищевая промышленность подчиняется множеству требований в отношении мониторинга многочисленных параметров безопасности пищевых продуктов. Например, производители продуктов питания, как правило, обязаны анализировать и контролировать биологические, химические и физические опасности, начиная с получения, закупок и обработки сырья, и заканчивая производством, дистрибуцией и потреблением готового пищевого продукта. Один из аспектов этих требований включает подсчет микробиологических показателей качества продуктов (QI). Такой подсчет QI показывает гигиеническое качество тестируемого продукта. Эта информация о гигиеническом качестве показывает вероятность наличия патогенных организмов в пищевых продуктах, а также срок хранения пищевых продуктов. Типовые методики подсчета QI включают в себя подсчет колоний и методики определения наиболее вероятного количества (MPN). Как правило, такие методики могут быть подвержены ошибкам человека или внутренней изменчивости анализов. Более того, для таких методик могут потребоваться специализированные реагенты для подсчета различных микроорганизмов-мишеней. Кроме того, данные методики могут потребовать длительного времени инкубации (например, от 18 до 24 часов или до 5 дней) до получения результата. Кроме того, данные методики могут потребовать чрезмерного объема ручного вмешательства.
В клинических условиях патогенные микроорганизмы могут демонстрировать разную степень восприимчивости к противомикробным агентам. Таким образом, клиницистам часто необходимо идентифицировать как вид, так и штамм патогена, и его восприимчивость к различным классам противомикробных препаратов и их комбинациям. Однако способы клинической оценки микробных инфекций, применяемые в данной области техники, обычно требуют, по меньшей мере, 16-48 ч для определения восприимчивости к противомикробным препаратам. Более того, типовые способы тестирования на чувствительность к противомикробным препаратам могут быть подвержены ошибкам человека или внутренней изменчивости анализов. Более того, для таких методик могут потребоваться специализированные реагенты для подсчета различных микроорганизмов-мишеней. Кроме того, данные методики могут потребовать чрезмерного объема ручного вмешательства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем раскрытии описаны способы и композиции для определения наличия или отсутствия микроорганизма в образце. Также в настоящем раскрытии описаны способы быстрого анализа матрицы пищевых продуктов в отношении количества микроорганизмов-мишеней на единицу массы или объема. Кроме того, в настоящем раскрытии описаны способы (например, тесты восприимчивости) для быстрого анализа микроорганизма-мишени в отношении минимальной подавляющей концентрации тестируемого противомикробного средства.
В одном из вариантов осуществления способ определения наличия или отсутствия микроорганизма в образце включает в себя: i) инкапсуляцию образца во множестве капель эмульсии типа «вода-в-масле», при этом капли эмульсии типа «вода-в-масле» дополнительно инкапсулируют микробиологическую питательную среду; ii) инкубацию множества капель эмульсии типа «вода-в-масле» при температуре, допускающей микробиологический рост, и в течение периода времени, достаточного для того, чтобы микроорганизмы-мишени могли пройти через 5-45 периодов времени удвоения; iii) определение капель эмульсии типа «вода-в-масле», содержащих микроорганизмы-мишени; и iv) в ответ на идентификацию микроорганизма-мишени по меньшей мере в одной капле эмульсии типа «вода-в-масле», определение того, что микроорганизм-мишень присутствует в образце.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1A-1J проиллюстрирован эксперимент для проверки обоснованности концепции, в котором клетки E. coli разделяли по каплям, инкубировали в течение указанного количества периодов роста и наблюдали с помощью либо световой, либо флуоресцентной микроскопии. Результаты показывают, что бактерии могут быть обнаружены через 6 часов или менее, а сильная автофлуоресценция может быть обнаружена через 8 часов или менее.
На фиг. 2А-2В проиллюстрированы результаты эксперимента, в котором указанные матрицы пищевых продуктов были протестированы на совместимость с образованием капель.
На фиг. 3A-3O проиллюстрирован быстрый подсчет E. coli из матрицы пищевых продуктов для ветчины с использованием капель типа «вода-в-масле».
На фиг. 4A-4J проиллюстрировано быстрое обнаружение различных бактерий с использованием капель типа «вода-в-масле».
На фиг. 5A-5F проиллюстрировано быстрое обнаружение различных дрожжей и плесени с использованием капель типа «вода-в-масле».
На фиг. 6A-6B проиллюстрирован точный подсчет бактерий-мишеней путем подсчета положительных и отрицательных капель в автоматическом считывателе капель.
На фиг. 7А-7В показан точный подсчет бактерий-мишеней и дрожжей путем подсчета положительных и отрицательных капель в автоматическом считывателе капель.
На фиг. 8А-8D проиллюстрировано использование субстрата β-галактозидазы для специфичного обнаружения и/или подсчета микроорганизма-мишени, который экспрессирует фермент β-галактозидазу.
На фиг. 9A-9B проиллюстрировано обнаружение C. albicans в каплях без инкубации.
На фиг. 10А-10C проиллюстрирован инокулят C. albicans, эквивалентный 0,1 McFarland и конъюгату в соотношении 1/200 после 5 часов инкубации.
На фиг. 11A-11C проиллюстрирован инокулят C. albicans, эквивалентный 0,1 McFarland и конъюгату в соотношении 1/200 после 24 часов.
На фиг. 12A-12B проиллюстрирован инокулят C. parapsilosis, эквивалентный 1 McFarland и конъюгату в соотношении 1/200 без инкубации.
Фиг. 13А-13В представляют собой образец S. aureus («SA»)+пропидиум иодид («PI») без цефокситина («FOX») после 6 часов инкубации.
Фиг. 14A-14C представляют собой образец SA+PI+0,25 мг/л FOX после 6 часов инкубации.
Фиг. 15A-15C представляют собой образец SA+PI+0,5 мг/л FOX после 6 часов инкубации.
Фиг. 16A-16C представляют собой образец SA+PI+4 мг/л FOX после 6 часов инкубации.
На фиг. 17A-17F проиллюстрировано применение пропидиум иодида и этапа нагревания для усиления флуоресцентного сигнала, детектируемого из капель, имеющих бактериальный рост (G). Капли были сформированы из буферизованного пептонного водного бульона с внесенными E. coli АТСС 25922 в отсутствие (фиг.17А и 17D) или в присутствии (фиг.17В-17С и 17Е-17F) пропидиум иодида. Капли инкубировали 24 часа при 37°C. Капли, показанные на фиг. 17C и 17F, также нагревали при 90°C в течение 5 минут.
На фиг. 18A-18D проиллюстрировано использование индикатора pH для обнаружения микроорганизмов. Капли были сформированы из триптон-глюкозного бульона с внесенными E. coli АТСС 25922 в отсутствие (фиг.18А и 18С) или в присутствии (фиг.18В и 18D) pHrodo® Red.
На фиг. 19A-19D проиллюстрировано использование β-глюкозидного субстрата для специфичного обнаружения и/или подсчета микроорганизма-мишени, который экспрессирует фермент β-глюкозидазу. Капли были сформированы из буферизованного пептонного водного бульона с внесенными Enterobacter aerogenes ATCC 13048 в отсутствие (фиг. 19A и 19C) или в присутствии (фиг. 19B и 19D) ALDOL®518-β-глюкозида.
На фиг. 20A-20B проиллюстрированы контрольные условия, при которых масляная фаза капель типа «вода-в-масле», содержащих споры плесени (то есть, Fusarium graminearum DSM 1096) в водной фазе, не содержала противогрибковое соединение. После 48 часов инкубации гифы плесени могли пересекать капельные мембраны, что приводило к слиянию капель (фиг. 20А). Дальнейший рост приводил к споруляции (фиг. 20В).
На фиг. 21A-21B проиллюстрировано ингибирование роста плесени за пределами водной фазы, когда 60 мг/л диклорана было добавлено в масляную фазу капель типа «вода-в-масле». На фиг. 21A и 21B показан рост Mucor racemosus CECT 20821 в бульоне YCG после 48 часов инкубации в отсутствие или в присутствии, соответственно, диклорана в масляной фазе.
На фиг. 22A-22D проиллюстрировано ингибирование роста плесени за пределами водной фазы, когда 40 мг/л диклорана было добавлено в масляную фазу капель типа «вода-в-масле». Mucor racemosus CECT 20821 в бульоне YCG инкубировали в течение 48 часов в присутствии диклорана в масляной фазе. Флуорогенный субстрат 5,6 карбоксифлуоресцеиндиацетат (25 мг/дл) добавляли в бульон для изображений, показанных на фиг. 22C и 22D).
На фиг. 23A-23B проиллюстрировано ингибирование роста плесени за пределами водной фазы, когда 80 мг/л диклорана было добавлено в масляную фазу капель типа «вода-в-масле». На фиг. 23А и 23В показан рост Aspergillus restrictus CECT 20807 в бульоне YCG после 24 часов инкубации в отсутствие или в присутствии, соответственно, диклорана в масляной фазе. На фиг. 23А впускное отверстие для пластинки находится на правой стороне фигуры.
На фиг. 24A-24B проиллюстрировано ингибирование роста плесени за пределами водной фазы, когда 100 мг/л диклорана было добавлено в масляную фазу капель типа «вода-в-масле». На фиг. 24А и 24В показан рост Aspergillus restrictus CECT 20807 в бульоне YCG после 48 часов инкубации в отсутствие или в присутствии, соответственно, диклорана в масляной фазе. На фиг. 24А впускное отверстие для пластинки находится на правой стороне фигуры.
На фиг. 25А-25В показано ингибирование роста плесени за пределами водной фазы, когда 80 мг/л диклорана было добавлено в масляную фазу капель типа «вода-в-масле». На фиг. 25А и 25В показан рост Penicillium hirsutum ATCC 16025 в бульоне YCG после 24 часов инкубации в отсутствие или в присутствии, соответственно, диклорана в масляной фазе. Впускное отверстие для пластинки находится в левой части фиг. 25А и правой части фиг. 2.
На фиг. 26A-26B проиллюстрировано ингибирование роста плесени за пределами водной фазы, когда 60 мг/л диклорана было добавлено в масляную фазу капель типа «вода-в-масле». На фиг. 26А и 26В показан рост Erotium rubrum CECT 20807 в бульоне YCG после 24 часов инкубации в отсутствие или в присутствии, соответственно, диклорана в масляной фазе.
На фиг. 27А-27В показано ингибирование роста плесени за пределами водной фазы, когда 80 мг/л диклорана было добавлено в масляную фазу капель типа «вода-в-масле». На фиг. 27А и 27В показан рост Erotium rubrum CECT 20807 в бульоне YCG после 48 часов инкубации в отсутствие или в присутствии, соответственно, диклорана в масляной фазе. На фиг. 27А впускное отверстие для пластинки находится на правой стороне фигуры.
На фиг. 28А-28В проиллюстрировано ингибирование роста Erotium rubrum CECT 20807 за пределами водной фазы, когда 80 мг/л диклорана было добавлено в масляную фазу капель типа «вода-в-масле». К бульону добавляли флуорогенный субстрат 5,6 карбоксифлуоресцеиндиацетат (25 мг/л).
На фиг. 29A-29B проиллюстрировано ингибирование роста плесени за пределами водной фазы, когда 100 мг/л диклорана было добавлено в масляную фазу капель типа «вода-в-масле». На фиг. 29А и 29В показан рост Fusarium graminearum DSM 1096 в бульоне YCG после 48 часов инкубации в отсутствие или в присутствии, соответственно, диклорана в масляной фазе. На фиг. 29А впускное отверстие для пластинки находится на правой стороне фигуры.
На фиг. 30A-30B проиллюстрировано ингибирование роста плесени за пределами водной фазы, когда 150 мг/л бенгальского розового было добавлено в масляную фазу капель типа «вода-в-масле». На фиг. 30А и 30В показан рост Aspergillus restrictus CECT 20807 после 48 часов инкубации в отсутствие или в присутствии, соответственно, бенгальского розового в масляной фазе.
На фиг. 31A-31B проиллюстрировано ингибирование роста плесени за пределами водной фазы, когда 0,5 мг/л имазалила было добавлено в масляную фазу капель типа «вода-в-масле». На фиг. 31А и 31В показан рост Penicillium hirsutum ATCC 16025 после 48 часов инкубации в отсутствие или в присутствии, соответственно, имазалила в масляной фазе.
На фиг. 32-35 проиллюстрировано применение лектина для обнаружения микроорганизмов. Фиг. 32 представляет собой изображение капель, содержащих C. glabrata и меченый флуоресцеином конканавалин A (ConA). Фиг. 33 представляет собой изображение капель, имеющих C. tropicalis и ConA. Фиг. 34 представляет собой изображение капель, имеющих E. coli и ConA. Фиг. 35 представляет собой объединенное изображение видимого изображения и зеленого флуоресцентного изображения для капель, имеющих C. krusei и ConA.
На фиг. 36А и 36В проиллюстрирован рост Candida albicans АТСС 10231 в не подвергавшейся образованию геля (фиг. 36А) и подвергшейся образованию геля капле (фиг. 36В).
На фиг. 37A-37D проиллюстрированы контрольные условия, чтобы гарантировать, что гелеобразование не было связано только с присутствием гелеобразующего агента. Капли содержали Candida albicans ATCC 10231 в бульоне YGC в водной фазе и 0,1% (об./об.) уксусной кислоты в масляной фазе. Стрелками указаны примеры капель, положительных по Candida albicans.
На фиг. 38A-38D проиллюстрированы контрольные условия, чтобы гарантировать, что гелеобразование не было связано только с присутствием гелеобразующего агента. Капли содержали Saccharomyces cerecisiae DSM 1333 в бульоне YGC в водной фазе и 0,1% (об./об.) уксусной кислоты в масляной фазе. Стрелками указаны примеры капель, положительных по Saccharomyces cerecisiae.
На фиг. 39А-39С и фиг. 40A-40C проиллюстрировано гелеобразование в присутствии подкисляющего дрожжевого штамма Saccharomyces cerecisiae DSM 1333 (фиг. 39B и 40B) и не подкисляющего дрожжевого штамма Debaryomyces hansenii CLIB 197 (фиг. 39C и 40C). Штаммы выращивали в течение 24 часов в бульоне YGC с добавлением 1 г/л карбоната кальция. В масло не добавляли уксусную кислоту. Фиг. 39А и 40А являются отрицательными контролями. Стрелками указаны примеры капель, положительных по микроорганизму.
На фиг. 41А-41D проиллюстрировано гелеобразование в отсутствие (фиг. 41А и 41С) и в присутствии (фиг. 41В и 41D) уксусной кислоты после инкубирования капель, содержащих Saccharomyces cerecisiae DSM 1333, в течение 24 часов.
На фиг. 42А-42D проиллюстрировано гелеобразование в отсутствие (фиг.42А и 42С) и в присутствии (фиг. 42В и 42D) уксусной кислоты после инкубирования капель, содержащих Candida albicans ATCC 10231, в течение 48 часов.
На фиг. 43A-45B проиллюстрировано применение субстрата 5(6)-карбоксифлуоресцеина диацетата (CFDA) для специфичного обнаружения и/или подсчета микроорганизмов-мишеней, которые экспрессируют фермент эстеразу. На фиг. 43А и 43В показано обнаружение Candida albicans АТСС 10231 в отсутствие и в присутствии, соответственно, CFDA. На фиг. 44A и 44B показано обнаружение Kluyveromyces lactis CLIB 196 в отсутствие и в присутствии, соответственно, CFDA. На фиг. 45А и 45В показано обнаружение Zygosaccharomyces rouxii DSM 7525 в отсутствие и в присутствии, соответственно, CFDA. В каждом эксперименте микроорганизмы инкубировали 24 часа в бульоне YGC с 25 мг/л CFDA.
На фиг. 46A-46D проиллюстрировано специфичное обнаружение и/или подсчет Mucor racemosus CECT 20821 в отсутствие (фиг. 46A и 46B) и в присутствии (фиг. 46C и 46D), соответственно, 25 мг/л CFDA после 48 часов инкубации в бульоне YGC. Диклоран добавляли к масляной фазе для ограничения роста гиф в водной фазе.
На фиг. 47A-47D проиллюстрировано специфичное обнаружение и/или подсчет Eurotium rubrum CECT 20808 в отсутствие (фиг. 47A и 47B) и в присутствии (фиг. 47C и 47D), соответственно, 25 мг/л CFDA после 24 часов инкубации в бульоне YGC. Диклоран добавляли к масляной фазе для ограничения роста гиф в водной фазе.
На фиг. 48A-48D проиллюстрировано специфичное обнаружение и/или подсчет Fusarium graminearum DSM 1096 в отсутствие (фиг.48А и 48В) и в присутствии (фиг.48C и 48D), соответственно, 25 мг/л CFDA после 48 часов инкубации в бульоне YGC. Диклоран добавляли к масляной фазе для ограничения роста гиф в водной фазе.
На фиг. 49A и 49B проиллюстрировано специфичное обнаружение и/или подсчет Candida tropicalis ATCC 750 в отсутствие (фиг. 49A) и в присутствии (фиг. 49B), соответственно, 50 мг/л ALDOL®515 фосфата после 24 часов инкубации в бульоне YGC.
На фиг. 50A и 50B проиллюстрировано специфичное обнаружение и/или подсчет Sacchraromyces cerevisiae DSM 1333 в отсутствие (фиг. 55A) и в присутствии (фиг. 55B), соответственно 50 мг/л ALDOL®515 фосфата после 24 часов инкубации в бульоне YGC.
На фиг. 51A-51D проиллюстрировано специфичное обнаружение и/или подсчет Fusarium graminearum DSM 1096 в отсутствие (фиг. 51A и 51B) и в присутствии (фиг. 55C и 51D), соответственно, 25 мг/л ALDOL®515 фосфата после 24 часов инкубации в бульоне YGC. Диклоран добавляли к масляной фазе для ограничения роста гиф в водной фазе.
На фиг. 52A-52D проиллюстрировано специфичное обнаружение и/или подсчет Mucor racemosus CECT 20821 в отсутствие (фиг. 52A и 52B) и в присутствии (фиг. 55C и 52D), соответственно 25 мг/л ALDOL®515 фосфата после 24 часов инкубации в бульоне YGC. Диклоран добавляли к масляной фазе для ограничения роста гиф в водной фазе.
На фиг. 53А и 53В проиллюстрировано применение субстрата β-глюкуронидазы для специфичного обнаружения и/или подсчета микроорганизма-мишени, который экспрессирует фермент β-глюкуронидазу. Капли были сформированы из буферизованного пептонного водного бульона с внесенными E. coli АТСС 25922 в отсутствие (фиг. 35А) или в присутствии (фиг. 53В) резоруфин-β-D-глюкуроновой кислоты.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Обзор
В настоящем раскрытии описаны способы, композиции и наборы, в которых на этапе культивирования требуется меньшее время удвоения, что позволяет быстро анализировать наличие или отсутствие микроорганизма и/или рост или количество микроорганизмов в образце. Эти способы являются выгодными в областях показателей качества (QI) для пищевых продуктов и окружающей среды и клинической диагностики микробных инфекций.
При анализе продуктов питания способ выполняют на любой подходящей пищевой матрице от сырья до готовых пищевых продуктов. Продукты питания и пищевые продукты включают, но не ограничиваются указанным, твердые продукты питания и напитки, включая воду. Подсчет QI для пищевых продуктов также включает в себя анализ среды, в которой продукты питания готовятся, обрабатываются и хранятся. Такие образцы окружающей среды представляют собой образцы, взятые с оборудования, поверхностей и т.д., на которых продукты питания готовятся, обрабатываются и хранятся. Примеры включают мазки с рабочих столов на кухне и оборудования для нарезки.
Описанные способы, композиции и наборы также являются полезными для определения QI окружающей среды. Окружающая среда, подлежащая тестированию, представляет собой среду любого типа, в которой микроорганизмы, в случае их наличия, будут наносить ущерб людям или животным. Такие среды могут находиться в помещении или на открытом воздухе и включают, но не ограничиваются указанным, воду, используемую для отдыха (например, бассейн, озера), фермы и поверхности в зданиях.
Способы, композиции и наборы, описанные в настоящем раскрытии, могут также обеспечивать быстрое тестирование восприимчивости к противомикробным препаратам и, необязательно, специфичную идентификацию без какой-либо инкубации или за небольшое количество периодов времени удвоения микроорганизма(-ов). Время удвоения (также называемое средним временем генерации) представляет собой время, необходимое для того, чтобы заданная популяция (n) удвоилась по количеству (2n) при оптимальных условиях роста. Время удвоения для различных микроорганизмов известно и опубликовано в литературе. Необязательно, идентификацию микроорганизмов осуществляют без добавления какого-либо маркера для усиления сигнала идентифицированного микроорганизма (например, посредством автофлуоресценции). В других вариантах осуществления реагенты связываются с микроорганизмом-мишенью, чтобы способствовать его идентификации и/или количественной оценке.
Такая быстрая оценка микробного качества или восприимчивости к противомикробным препаратам включает в себя разделение образца, содержащего один или более микроорганизмов-мишеней, на множество капель эмульсии типа "вода-в-масле", содержащих антибиотик, восприимчивость к которому будут проверять, инкубацию капель в течение, или по меньшей мере в течение, от 1 до 35 (например, от 1 до 30, от 1 до 25, от 1 до 20, от 1 до 15, от 1 до 10, от 5 до 35, от 5 до 30, от 5 до 25, от 5 до 20, от 5 до 15, от 5 до 10, от 10 до 35, от 10 до 30, от 10 до 25, от 10 до 20, от 10 до 15) периодов времени удвоения и обнаружение наличия или отсутствия микроорганизмов-мишеней в каплях. В вариантах осуществления, в которых оценивают восприимчивость к противомикробным препаратам, капли содержат антибиотик или противогрибковый препарат. В некоторых вариантах осуществления тестируют различные концентрации противомикробных препаратов. Какая капля содержит какую концентрацию антибиотика известно по добавленному к каждой капле идентификатору. Такие идентификаторы могут представлять собой красители или штрих-коды. В некоторых вариантах осуществления инкубацию не проводят.
II. Композиции
Описанные в настоящем раскрытии химические среды капель типа «вода-в-масле» включают капли с оболочкамми и двухфазные капли сурфактантов. При использовании в настоящем раскрытии, двухфазные капли сурфактантов содержат масло и масляно-фазный сурфактант в качестве неводной фазы, и воду и сурфактант водной фазы в качестве водной фазы. Такие капли типа "вода-в-масле" могут быть приспособлены для совместимости с: (i), компонентами роста микробов и культуральной среды; (ii), матрицами пищевых продуктов; (iii) реагентами обнаружения (например, флуоресцентным реагентом обнаружения); (iv), противомикробными средствами; (v), клиническими образцами; или (vi) длительными (например, более 4, 8, 24 или 36 часов) периодами инкубации посредством повышения стабильности, или к комбинации из двух, трех, четырех или пяти перечисленных выше пунктов. Изобретатели неожиданно обнаружили, что некоторые описанные в настоящем раскрытии химические составы капель типа «вода-в-масле» совместимы с широким спектром матриц пищевых продуктов или клинических матриц. Кроме того, авторы неожиданно обнаружили, что некоторые химические среды капель типа «вода-в-масле» и способы их применения могут обеспечить улучшенный подсчет QI, идентификацию микроорганизмов и/или восприимчивость к противомикробным препаратам в течение ограниченного времени. Кроме того, неожиданно, некоторые микроорганизмы могут быть обнаружены посредством детектирования автофлуоресценции капель, в которых выращивают микроорганизмы, в результате чего устраняется необходимость добавления реагента обнаружения. Альтернативно, интеркалирующий краситель можно использовать для обнаружения определенных микроорганизмов. Удивительно, но некоторые красители являются эффективными без лизирования клеток микроорганизма и не нарушают клеточный рост.
A. Композиции капель с оболочками
Капли эмульсии типа "вода-в-масле", описанные в настоящем раскрытии, включают, но не ограничиваются указанным, капли, которые содержат «оболочку» или "наружную оболочку" на границе раздела между водной и неводной фазой. Такие оболочки состоят из формирующих оболочку компонентов. Формирующим оболочку компонентом является любое вещество или комбинация веществ, которые способствуют формированию оболочки вблизи или на границе водной/неводной фазы.
i. формирующие оболочку белки
Формирующий оболочку компонент может содержать по меньшей мере один формирующий оболочку белок. Формирующий оболочку белок может быть предоставлен в водной фазе до объединения с неводной фазой с образованием капель. Альтернативно, формирующий оболочку компонент может быть относительно гидрофобным и, таким образом, может быть предоставлен в неводной фазе до объединения с водной фазой с образованием капель. После объединения водной и неводной фаз формирующий оболочку белок может быть доставлен на границу водной/неводной фазы до или во время формирования оболочки.
Формирующий оболочку белок может присутствовать в концентрации, эффективной для детектируемого формирования оболочки при условиях формирования оболочки (например, при нагревании). Типовые эффективные концентрации включают, но не ограничиваются указанным, по меньшей мере около 0,01% или 0,03%, от 0,03 до 3%, от 0,05 до 2%, от 0,1% до 1% или около 0,1% по массе. Белок может представлять собой «неспецифично блокирующий» формирующий оболочку белок или «неспецифично связывающий» формирующий оболочку белок. Используемая в настоящем раскрытии фраза «неспецифичное блокирование» или «неспецифичное связывание» относится в целом к способности неспецифично связываться с поверхностями, то есть с гидрофобными и/или гидрофильными поверхностями, иногда с помощью нагревания. Неспецифично блокирующие/связывающие белки обычно являются водорастворимыми белками, могут представлять собой относительно большие сывороточные или молочные белки (помимо прочего) и/или могут не взаимодействовать с каким-либо из других компонентов водной фазы посредством специфичного связывания. Типичные неспецифично блокирующие/связывающие белки, которые могут являться подходящими в качестве формирующих оболочку белков, включают, но не ограничиваются указанным, альбумины (такие как сывороточный альбумин (например, из сыворотки быка (BSA), человека, кролика, козы, овцы или лошади, помимо прочего)), глобулины (например, бета-лактоглобулин), казеин и желатин (например, желатин бычьей кожи типа В), и фрагменты указанного (например, протеолитические фрагменты).
II. Сурфактанты водной фазы
Капли эмульсии типа "вода-в-масле", которые содержат оболочку, могут быть сформированы с водной фазой, содержащей сурфактант, поверхностно-активное вещество, способное снижать поверхностное натяжение жидкости, в которой оно присутствует. Сурфактант может представлять собой детергент и/или смачивающий агент. В некоторых вариантах осуществления сурфактант содержит гидрофильную и гидрофобную часть и, таким образом, является амфипатическим. Водная фаза может содержать по меньшей мере один неионный сурфактант, по меньшей мере один ионный сурфактант или по меньшей мере один неионный и по меньшей мере один ионный сурфактант. Типовые сурфактанты включают, но не ограничиваются указанным, блочные сополимеры полипропиленоксида и полиэтиленоксида (например, полоксамеры). Примеры полоксамеров включают, но не ограничиваются указанным, продукты, продаваемые под торговыми наименованиями PLURONIC® и TETRONIC®. В некоторых вариантах осуществления водная фаза содержит сурфактант PLURONIC® F-68. В некоторых вариантах осуществления водная фаза содержит водорастворимый и/или гидрофильный фторсурфактант. В некоторых случаях водная фаза содержит фторсурфактант, продаваемый под торговым наименованием ZONYL®,например, фторсурфактант ZONYL® FSN. В некоторых случаях водная фаза может содержать сурфактант полисорбат 20.
Концентрацию конкретного сурфактанта или суммарную концентрацию сурфактантов водной фазы до, во время или после объединения с неводной фазой для образования капель эмульсии типа «вода-в-масле» с оболочками могут выбирать для стабилизации капель эмульсии до формирования оболочки (например, нагревания). Типовая концентрация сурфактанта водной фазы включает, но не ограничивается указанным, от около 0,01% до около 10%, от 0,05 до около 5%, от 0,1% до около 1% или 0,5% мас./мас., мас./об. или об./об.
III. Масляная фаза
Капли эмульсии типа «вода-в-масле», которые содержат оболочку, могут быть сформированы в водной фазе и/или сформированы посредством объединения водной фазы с неводной фазой. Неводная фаза может представлять собой несмешивающуюся с водой жидкость-носитель непрерывной фазы. Альтернативно, неводная фаза может представлять собой дисперсную фазу. В настоящем раскрытии неводную фазу могут называть масляной фазой, содержащей, по меньшей мере, одно масло, но она также может содержать дополнительные жидкие (или сжижаемые) соединения или смеси, которые не смешиваются с водой. Масло может быть синтетическим или природным. Масло может представлять собой масло на основе углерода (например, алкил) и/или кремния (например, силоксан). Масло может представлять собой углеводород и/или силиконовое масло. Масло может быть частично или полностью фторированным. Масло может быть в принципе смешиваемым или несмешиваемым с одним или несколькими классами органических растворителей. Типовые масла включают, но не ограничиваются указанным, по меньшей мере одно из силиконового масла (например, полидиметилсилоксана), минерального масла, фторуглеродного масла, растительного масла, или комбинацию указанного.
В типовом варианте осуществления масло представляет собой фторированное или перфторированное масло. Фторированное масло может являться основным маслом или добавкой к основному маслу. Типовые фторированные масла включают, но не ограничиваются указанными, продукты, продаваемые под торговым наименованием FLUORINERT®, такие как FLUORINERT® электронная жидкость FC-3283, FC-40, FC-43, FC-70, или комбинации указанного. Дополнительные или альтернативные типовые фторированные масла включают, но не ограничиваются указанным, продукты, продаваемые под торговым наименованием NOVEC®, включая инженерную жидкость NOVEC® HFE 7500.
B. Двухфазные капли сурфактанта
Способы и композиции двухфазных капель сурфактанта включают, но не ограничиваются указанным, те, в которых используется масляная фаза, содержащая фторсурфактант, и водная фаза, содержащая неионный фторсурфактант. В некоторых случаях масло представляет собой фторированное масло. В некоторых случаях фторсурфактант является неионным.
i. Фторсурфактанты масляной фазы
В некоторых случаях фторсурфактант масляной фазы (например, фторсурфактант масляной фазы, содержащей фторированное масло) представляет собой триблочный сополимер с формулой I:
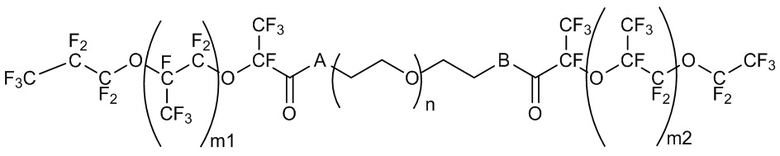
Формула I.
Формула I представляет собой триблочный сополимер, содержащий полимер полиэтиленгликоля (PEG), ковалентно связанный с полигексафторпропиленом (PFPE) на обоих концах. В одном из вариантов осуществления ковалентная связь между блоком PEG и блоками PFPE на обоих концах представляет собой амидную связь (А и В представляют собой азот). В другом варианте осуществления связь между блоком PEG и двумя блоками PFPE представляет собой сложноэфирную связь (А и В представляют собой кислород). В другом примере один конец может являться сложноэфирной связью, и один конец - амидной связью (A представляет собой O и B представляет собой N; или A представляет собой N, а B представляет собой O).
Длины цепей PFPE и блока PEG могут влиять на свойства фторсурфактанта формулы I. В некоторых аспектах настоящего изобретения и m1, и m2 независимо находятся в диапазоне около 10-100. В некоторых случаях и m1, и m2 независимо находятся в диапазоне около 10-20, около 10-30, около 10-40, около 10 до 50, около 10-60, около 10-70, около 10-80, около 10-90, около 20-30, около 20-40, около 20-50; около 20-60, около 20-70, около 20-80, около 20-90, около 20-100, около 30-40, около 30-50, около 30-60, около 30-70, около 30-80, около 30-90, около 30-100, около 40-50, около 40-60, около 40-70, около 40-80, около 40-90, около 40-100, около 50-60, около 50-70, около 50-80, около 50-90, около 50-100, около 60-70, около 60-80, около 60-90, около 60-100, около 70-80, около 70-90, около 70-100, около 80-90, около 80-100 или около 90-100. В некоторых случаях m1 находится в диапазоне около 10-20, около 10-30, около 10-40, около 10-50, около 10-60, около 10-70, около 10-80, около 10-90, около 20-30, около 20-40, около 20-50; около 20-60, около 20-70, около 20-80, около 20-90, около 20-100, около 30-40, около 30-50, 30-60, около 30-70, около 30-80, около 30-90, около 30-100, около 40-50, около 40-60, около 40-70, около 40-80, около 40-90, около 40-100, около 50-60, около 50-70, около 50-80, около 50-90, около 50-100, около 60-70, около 60-80, около 60-90, около 60-100, около 70-80, около 70-90, около 70-100, около 80-90, около 80-100 или около 90-100. В некоторых случаях m2 находится в диапазоне около 10-20, около 10-30, около 10-40, около 10-50, около 10-60, около 10-70, около 10-80, около 10-90, около 20-30, около 20-40, около 20-50; около 20-60, около 20-70, около 20-80, около 20-90, около 20-100, около 30-40, около 30-50, около 30-60, около 30-70, около 30-80, около 30-90, около 30-100, около 40-50, около 40-60, около 40-70, около 40-80, около 40-90, около 40-100, около 50-60, около 50-70, около 50-80, около 50-90, около 50-100, около 60-70, около 60-80, около 60-90, около 60-100, около 70-80, около 70-90, около 70-100, около 80-90, около 80-100 или около 90-100.
Значение «n» формулы I может находиться в диапазоне около 10-60. В некоторых случаях значение «n» находится в диапазоне около 10-20, около 10-30, около 10-40, около 10-50, около 15-20, около 15-30, около 15-40, около 15-50, около 15-60, около 20-30, около 20-40, около 20-50, около 20-60, около 25-30, около 25-40, около 25-50, около 25-60, около 30-40, около 30-50, около 30-60, около 35-40, около 35-50, около 35-60, около 40-50, около 40-60, около 45-50, около 45-60, около 50-50, около 55-60. В некоторых вариантах осуществления каждый из m1 и m2 составляет около 35, а n составляет около 22.
В некоторых случаях фторсурфактант масляной фазы (например, фторсурфактант масляной фазы, содержащей фторированное масло) представляет собой полимер с формулой II:

Формула II.
Сурфактант с формулой II представляет собой диблочный сополимер PEG и PFPE. Значение m3, которое представляет собой длину блока PFPE, находится в диапазоне около 10-100. В некоторых аспектах m3 находится в диапазоне около 10-20, около 10-30, около 10-40, около 10-50, около 10-60, около 10-70, около 10-80, около 10-90, около 20-30, около 20-40, около 20-50; около 20-60, около 20-70, около 20-80, около 20-90, около 20-100, около 30-40, около 30-50, около 30-60, около 30-70, около 30-80, около 30-90, около 30-100, около 40-50, около 40-60, около 40-70, около 40-80, около 40-90, около 40-100, около 50-60, около 50-70, около 50-80, около 50-90, около 50-100, около 60-70, около 60-80, около 60-90, около 60-100, около 70-80, около 70-90, около 70-100, около 80-90, около 80-100 или около 90-100. Длина блока PEG, «n2», находится в диапазоне около 10-60. В некоторых случаях значение «n2» находится в диапазоне около 10-20, около 10-30, около 10-40, около 10-50, около 15-20, около 15-30, около 15-40, около 15-50, около 15-60, около 20-30, около 20-40, около 20-50, около 20-60, около 25-30, около 25-40, около 25-50, около 25-60, около 30-40, около 30-50, около 30-60, около 35-40, около 35-50, около 35-60, около 40-50, около 40-60, около 45-50, около 45-60, около 50-50 или около 55-60. Конец блока PEG, -OR, может представлять собой либо гидроксильную группу (то есть, -ОН), алкоксигруппу или амин (R может быть водородом, алкильной группой или амином).
В некоторых случаях фторсурфактант масляной фазы (например, фторсурфактант масляной фазы, содержащей фторированное масло) представляет собой полимер с формулой III:
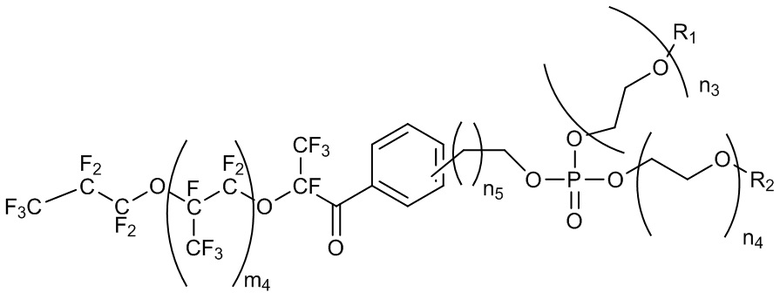
Формула III.
Сурфактант с формулой III представляет собой триблочный сополимер, в котором две единицы PEG (одинаковой или различной длины) и одна единица PFPE соединены фосфатным линкером (PO4). Длина цепи PFPE m4 находится в диапазоне около 10-100. В некоторых случаях m4 находится в диапазоне около 10-20, около 10-30, около 10-40, около 10-50, около 10-60, около 10-70, около 10-80, около 10-90, около 20-30, около 20-40, около 20-50; около 20-60, около 20-70, около 20-80, около 20-90, около 20-100, около 30-40, около 30-50, около 30-60, около 30-70, около 30-80, около 30-90, около 30-100, около 40-50, около 40-60, около 40-70, около 40-80, около 40-90, около 40-100, около 50-60, около 50-70, около 50-80, около 50-90, около 50-100, около 60-70, около 60-80, около 60-90, около 60-100, около 70-80, около 70-90, около 70-100, около 80-90, около 80-100 или около 90-100. Длины двух блоков PEG, n3 и n4, независимо находятся в диапазоне около 10-60. В некоторых случаях n3 и n4 независимо находятся в диапазоне около 10-20, около 10-30, около 10-40, около 10-50, около 15-20, около 15-30, около 15-40, около 15-50, около 15-60, около 20-30, около 20-40, около 20-50, около 20-60, около 25-30, около 25-40, около 25-50, около 25-60, около 30-40, около 30-50, около 30-60, около 35-40, около 35-50, около 35-60, около 40-50, около 40-60, около 45-50, около 45-60, около 50-50 или около 55- 60. В некоторых случаях n3 находится в диапазоне около 10-20, около 10-30, около 10-40, около 10-50, около 15-20, около 15-30, около 15-40, 15-50, около 15-60, около 20-30, около 20-40, около 20-50, около 20-60, около 25-30, около 25-40, около 25-50, около 25-60, около 30-40, около 30-50, около 30-60, около 35-40, около 35-50, около 35-60, около 40-50, около 40-60, около 45-50, около 45-60, около 50-50 или около 55-60. В некоторых случаях n4 находится в диапазоне около 10-20, около 10-30, около 10-40, около 10-50, около 15-20, около 15-30, около 15-40, около 15-50, около 15-60, около 20-30, около 20-40, около 20-50, около 20-60, около 25-30, около 25-40, около 25-50, около 25-60, около 30-40, около 30-50, около 30-60, около 35-40, около 35-50, около 35-60, около 40-50, около 40-60, около 45-50, около 45-60, около 50-50, или около 55-60. Спейсер CH2 (n5) может иметь длину 0, 1, 2 или 3 атома углерода.
В некоторых случаях фторсурфактант содержит смесь формулы I, формулы II и/или формулы III. В некоторых случаях фторсурфактант содержит смесь формулы I и формулы II, смесь формулы I и формулы III или смесь формулы II и формулы III. В некоторых примерах фторсурфактант может содержать, по меньшей мере, около 5%, около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50% около 55%, около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 91%, около 92%, около 93%, около 94%, около 95%, около 96%, около 97%, около 98%, около 99%, около 99,5% или около 99,9% (мас./мас.) смеси формулы I и формулы II. Например, фторсурфактант может содержать по меньшей мере около 80%, около 90% или 95% (мас./мас.) смеси формулы I и формулы II.
Кроме того, смесь формулы I и формулы II может иметь соотношение более чем около 1:199, около 1:99, около 2:98, около 3:97, около 4:96, около 5:95, около 10:90, около 15:85, около 20:80, около 25:75, около 30:70, около 35:65, около 40:60, около 45:55, около 50:50, около 55:45, около 60:40, около 65:35, около 70:30, около 75:25, около 80:20, около 85:15, около 90:10, около 95:5, около 96:4, около 97:3, около 98:2, около 99:1 или около 199:1 (мас./мас.). Например, смесь формулы I и формулы II может находиться в соотношении более чем около 80:20, около 90:10 или около 95:5 (мас./мас.).
В некоторых примерах смесь может дополнительно содержать соединение с формулой XI:
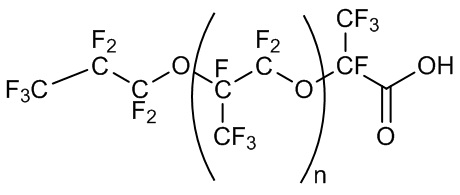
Формула XI,
где n может составлять от около 10 до около 100, от около 10 до около 80, от около 15 до около 80, от около 15 до около 50 или от около 20 до около 50.
Например, смесь фторсурфактантов может содержать от около 0,1 до 50%, от около 0,1% до около 20%, от около 0,2% до около 20%, от около 0,2% до около 10%, от около 0,5% до около 10%, от около 0,5% до 5% или от около 1% до 5% (мас./мас.) формулы XI.
Кроме того, смесь фторсурфактантов может содержать более чем около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,5%, около 2%, около 2,5%, около 3%, около 3,5%, около 4%, около 4,5%, около 5%, около 6%, около 7%, около 8%, около 9% около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45% или около 50% (мас./мас.) формулы XI. Например, смесь фторсурфактантов может содержать более чем от около 0,1 до около 0,5%, более около 1%, более около 2% или около 5% (мас./мас.) формулы XI.
В качестве альтернативы, смесь фторсурфактантов может содержать менее чем около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,5%, около 2%, около 2,5%, около 3%, около 3,5%, около 4%, около 4,5%, около 5%, около 6%, около 7%, около 8%, около 9% около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45% или около 50% (мас./мас.) формулы XI. Например, смесь фторсурфактантов может содержать менее чем около 1%, около 2%, около 5%, около 10% или около 20% (мас./мас.) формулы XI.
В некоторых случаях состав масла может содержать менее чем около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,5%, около 2%, около 2,5%, около 3%, около 3,5%, около 4%, около 4,5%, около 5%, около 6%, около 7%, около 8%, около 9%, около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45% или около 50% (мас./мас.) формулы XI. Например, состав масла может содержать менее чем около 1%, около 2%, около 5%, около 10% или около 20% (мас./мас.) формулы XI.
В других случаях состав масла может содержать больше чем около 0,1%, около 0,2%, около 0,3%, около 0,4%, около 0,5%, около 0,6%, около 0,7%, около 0,8%, около 0,9%, около 1%, около 1,5%, около 2%, около 2,5%, около 3%, около 3,5%, около 4%, около 4,5%, около 5%, около 6%, около 7%, около 8%, около 9%, около 10%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45% или около 50% (мас./мас.) формулы XI. Например, состав масла может содержать более чем около 0,1%, около 0,5%, около 1%, около 2% или около 5% (мас./мас.) формулы XI.
Сурфактант может быть охарактеризован в соответствии со значением гидролипидного баланса (HLB), которое может быть определено как отношение молекулярной массы (MW) гидрофильной части соединения к суммарному MW соединения. HLB можно регулировать путем изменения длин/MW гидрофобной части (PFPE) и гидрофильной части (PEG) молекулы. В некоторых вариантах осуществления капли, содержащие фторсурфактанты масляной фазы, имеющие более длинные (с более высоким MW) перфторполиэфирные цепи, могут обладать повышенной устойчивостью к слиянию, вызываемому нагревом.
В некоторых вариантах осуществления MW перфторполиэфирной цепи составляет по меньшей мере около 3000, по меньшей мере около 4000, по меньшей мере около 5000, по меньшей мере около 6000, по меньшей мере около 7000, по меньшей мере около 8000, по меньшей мере около 9000, или по меньшей мере около 10000. В некоторых других вариантах осуществления MW перфторполиэфирной цепи составляет около 3000, около 4000, около 5000, около 6000, около 7000, около 8000, около 9000 или около 10000.
В некоторых аспектах настоящего раскрытия значение HLB фторсурфактанта находится в диапазоне около 0-20. В некоторых случаях значения HLB неионного сурфактанта находятся в диапазоне около 0-10, около 0-20, около 5-10, около 5-15, около 5-20 или около 10-20. В некоторых других аспектах значение HLB фторсурфактанта составляет около 1, около 2, около 3, около 4, около 5, около 6, около 7, около 8, около 9, около 10, около 11, около 12, около 13, около 14, около 15, около 16, около 17, около 18, около 19 или около 20.
Как правило, фторсурфактанты, полученные в настоящем раскрытии, представляют собой фторсурфактанты высокой чистоты и могут быть успешно использованы в анализах количества и/или роста микробов, при этом позволяя избежать выщелачивания реагента обнаружения и/или избежать детектируемого или существенного ингибирования роста микроорганизмов. Ингибирование роста микроорганизмов можно обнаружить путем сравнения времени удвоения микроорганизма-мишени в обычных средах того же состава и температуры, что и среда и температура, используемые в водной фазе капли. Как правило, подходящие уровни роста составляют, по меньшей мере, около 10% от времени удвоения в обычной среде.
В некоторых случаях фторсурфактанты могут иметь чистоту более чем около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8%, около 9%, около 10% около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50%, около 55%, около 60%, около 65%, около 70%, около 75%, около 80%, около 85%, около 85,5%, около 86%, около 86,5%, около 87%, около 87,5%, около 88%, около 88,5%, около 89%, около 89,5%, около 90% около 90,5%, около 91,5%, около 92%, около 92,5%, около 93%, около 93,5%, около 94%, около 94,5%, около 95%, около 96,5%, около 97%, около 97,5%, около 98%, около 98,5%, около 99% или около 99,5% процентов по массе (мас./мас.). В некоторых примерах фторсурфактанты имеют чистоту более чем около 90% процентов по массе (мас./мас.). Например, фторсурфактанты могут содержать по меньшей мере 90% (мас./мас.) смеси формулы I и формулы II. В некоторых случаях массовая процентная чистота фторсурфактанта находится в диапазоне около 90%-91% мас./мас., около 90%-92% мас./мас., около 90%-93% мас./мас., около 90%-94% мас./мас., около 90%-95% мас./мас., около 90-96% мас./мас., около 90-97% мас./мас., около 90-98% мас./мас., около 90%-99% мас./мас., около 91-92% мас./мас., около 91%-93% мас./мас., около 91%-94% мас./мас., около 91%-95% мас./мас., около 91%-96% мас./мас., около 91%-97% мас./мас., около 91%-98% мас./мас., 91%-99 мас./мас., около 92%-93% мас./мас., около 92%-94% мас./мас., около 92%-95% мас./мас., около 92%-96% мас./мас., около 92%-97% мас./мас., около 92%-98% мас./мас., около 92%-99% мас./мас., около 93%-94% мас./мас., около 93%-95% мас./мас., около 93%-96% мас./мас., около 93%-97% мас./мас., около 93%-98% мас./мас., около 93%-99% мас./мас., около 94%-95% мас./мас., около 94%-96% мас./мас., около 94%-97% мас./мас., около 94-98% мас./мас. или около 94%-99% мас./мас.
В некоторых случаях фторсурфактанты имеют чистоту более чем около 95% (массовых процентов). Например, фторсурфактанты могут содержать по меньшей мере 95% (мас./мас.) смеси формулы I и формулы II. В некоторых случаях массовая процентная чистота фторсурфактанта находится в диапазоне около 95-96% мас./мас., около 95%-97% мас./мас., около 95%-98% мас./мас., около 95%-99% мас./мас., около 96%-97% мас./мас., около 96%-98% мас./мас., около 96%-99% мас./мас., около 97%-98% мас./мас., около 97%-99% мас./мас. или около 98%-99% мас./мас. В некоторых случаях фторсурфактанты могут иметь массовую процентную чистоту около 90% мас./мас., около 91% мас./мас., около 92% мас./мас., около 93% мас./мас., около 94% мас./мас., около 95% мас./мас., около 96% мас./мас., около 97% мас./мас., около 98% мас./мас. или около 99% мас./мас.
Концентрация фторсурфактанта может влиять на стабильность капель. В некоторых случаях концентрация фторсурфактанта может находиться в диапазоне 0,1-10,0 мМ. В некоторых вариантах осуществления концентрация фторсурфактанта находится в диапазоне около 0,1 мМ-1,0 мМ, около 0,1 мМ-2,0 мМ, около 0,1 мМ-3,0 мМ, около 0,1 мМ-4,0 мМ, около 0,1 мМ-5,0 мМ, около 0,1 мМ-6,0 мМ, около 0,1 мМ-7,0 мМ, около 0,1 мМ-8,0 мМ, около 0,1 мМ-9,0 мМ, около 0,5 мМ-1,0 мМ, около 0,5 мМ-2,0 мМ, около 0,5 мМ-3,0 мМ, около 0,5 мМ-4,0 мМ, около 0,5 мМ-5,0 мМ, около 0,5 мМ-6,0 мМ, около 0,5 мМ-7,0 мМ, около 0,5 мМ-8,0 мМ, около 0,5 мМ-9,0 мМ, около 0,5 мМ-10,0 мМ, около 1,0 мМ- 2,0 мМ, около 1,0 мМ-3,0 мМ, около 1,0 мМ-4,0 мМ, около 1,0 мМ-5,0 мМ, около 1,0 мМ-6,0 мМ, около 1,0 мМ-7,0 мМ, около 1,0 мМ-8,0 мМ, около 1,0 мМ-9,0 мМ, около 1,0 мМ-10,0 мМ, около 1,5 мМ-2,0 мМ, около 1,5 мМ-3.0 мМ, около 1,5 мМ-4,0 мМ, около 1,5 мМ-5,0 мМ, около 1,5 мМ-6,0 мМ, около 1,5 мМ-7,0 мМ, около 1,5 мМ-8,0 мМ, около 1,5 мМ-9,0 мМ, около 1,5 мМ-10,0 мМ, около 2,0 мМ-3,0 мМ, около 2,0 мМ-4,0 мМ, около 2,0 мМ-5,0 мМ, около 2,0 мМ-6,0 мМ, около 2,0 мМ-7,0 мМ, около 2,0 мМ-8,0 мМ, около 2,0 мМ-9,0 мМ, около 2,0 мМ-10,0 мМ, около 2,5 мМ-3,0 мМ, около 2,5 мМ-4,0 мМ, около 2,5 мМ-5,0 мМ, около 2,5 мМ-6,0 мМ, около 2,5 мМ-7,0 мМ, около 2,5 мМ-8,0 мМ, около 2,5 мМ-9,0 мМ, около 2,5 мМ-10,0 мМ, около 3,0 мМ-4,0 мМ, около 3,0 мМ-5,0 мМ, около 3,0 мМ-6,0 мМ, около 3,0 мМ-7,0 мМ, около 3,0 мМ-8,0 мМ, около 3,0 мМ-9,0 мМ, около 3,0 мМ-10,0 мМ, около 3,5 мМ-4,0 мМ, около 3,5 мМ-5,0 мМ, около 3,5 мМ-6,0 мМ, около 3,5 мМ-7,0 мМ, около 3,5 мМ-8,0 мМ, около 3,5 мМ-9,0 мМ, около 3,5 мМ-10,0 мМ, около 4,0 мМ-5,0 мМ, около 4,0 мМ-6,0 мМ, около 4,0 мМ-7,0 мМ, около 4.0 мМ-8,0 мМ, около 4,0 мМ-9,0 мМ, около 4,0 мМ-10,0 мМ, около 4,5 мМ-5,0 мМ, около 4,5 мМ-6,0 мМ, около 4,5 мМ-7,0 мМ, около 4,5 мМ-8,0 мМ, около 4,5 мМ-9,0 мМ, около 4,5 мМ-10,0 мМ, около 5,0 мМ-6,0 мМ, около 5,0 мМ-7,0 мМ, около 5,0 мМ-8,0 мМ, около 5,0 мМ-9,0 мМ, около 5,0 мМ-10,0 мМ, около 5,5 мМ -6,0 мМ, около 5,5 мМ-7,0 мМ, около 5,5 мМ-8,0 мМ, около 5,5 мМ-9,0 мМ, около 5,5 мМ-10,0 мМ, около 6,0 мМ-7,0 мМ, около 6,0 мМ-8,0 мМ, около 6,0 мМ- 9,0 мМ, около 6,0 мМ-10,0 мМ, около 6,5 мМ-7,0 мМ, около 6,5 мМ-8,0 мМ, около 6,5 мМ-9,0 мМ, около 6,5 мМ-10,0 мМ, около 7,0 мМ-8,0 мМ, около 7,0 мМ-9,0 мМ, около 7,0 мМ-10,0 мМ, около 7,5 мМ-8,0 мМ, около 7,5 мМ-9,0 мМ, около 7,5 мМ-10,0 мМ, около 8,0 мМ-9,0 мМ, около 8,0 мМ-10,0 мМ, около 8,5 мМ-9,0 мМ, около 8,5 мМ-10,0 мМ, около 9,0 мМ-10,0 мМ или около 9,5 мМ-10,0 мМ. В некоторых вариантах осуществления концентрация фторсурфактанта составляет около 0,5 мМ, около 1,0 мМ, около 1,5 мМ, около 2,0 мМ, около 2,5 мМ, около 3,0 мМ, около 3,5 мМ, около 4,0 мМ, около 4,5 мМ, около 5,0 мМ, около 5,5 мМ, около 6,0 мМ, около 6,5 мМ, около 7,0 мМ, около 7,5 мМ, около 8,0 мМ, около 8,5 мМ, около 9,0 мМ или около 9,5 мМ.
II. Масляная фаза
Масляная фаза, или непрерывная фаза, используемая для двухфазных капель типа "вода-в-масле", может представлять собой любое жидкое соединение или смесь жидких соединений, которая не смешивается с водой. Используемое масло может представлять собой, или содержать, по меньшей мере одно из силиконового масла, минерального масла, углеводородного масла, фторуглеродного масла, растительного масла, или комбинации указанного. В масляной фазе могут присутствовать любые другие подходящие компоненты, такие как, по меньшей мере один сурфактант, реагент, другая добавка, консервант, частицы, или произвольная комбинация указанного.
В некоторых случаях масло представляет собой фторированное масло. Фторированное масло может представлять собой любое фторированное органическое соединение. В некоторых случаях фторированное масло представляет собой перфторуглерод, такой как перфтороктан или перфторгексан. В некоторых случаях фторсодержащее соединение представляет собой частично фторированный углеводород, такой как 1,1,1-трифтороктан или 1,1,1,2,2-петантафтордекан. Фторированные органические вещества могут быть линейными, циклическими или гетероциклическими. В дополнение к углероду и фтору фторированное органическое соединение может дополнительно содержать атомы водорода, кислорода, азота, серы, хлора или брома, или комбинацию указанного.
В некоторых случаях фторированное масло представляет собой перфторалкильный эфир, такой как метилнонафторизобутиловый эфир, продаваемый под наименованием NOVEC™ HFE-7100 инженерная жидкость. В некоторых случаях фторсодержащее соединение представляет собой этокси-нонафторбутан или смесь этокси-нонафторбутана, продаваемую как NOVEC™ HFE-7200 инженерная жидкость. В некоторых случаях фторсодержащее соединение представляет собой 3-этокси-1,1,1,2,3,4,4,5,5,6,6,6-додекафтор-2-трифторметилгексан, продаваемый как NOVEC™ HFE-7500 инженерная жидкость. В некоторых случаях фторсодержащее соединение может представлять собой 1,1,1,2,2,3,4,5,5,5-декафтор-3-метокси-4-трифторметилпентан, продаваемый как NOVEC™ HFE-7300 инженерная жидкость.
В некоторых вариантах осуществления настоящего изобретения фторсурфактанты находятся в основном в масляной фазе. В некоторых случаях по меньшей мере около 90%, около 91%, около 92%, около 93%, около 94%, около 95%, около 96%, около 97%, около 98% или около 99% фторсурфактанта находится в масляной фазе.
III. Водная фаза
Водная фаза может содержать любой жидкий или сжижаемый компонент, который при смешивании с водой при комнатной температуре образует стабильный однофазный водный раствор. В некоторых вариантах осуществления водная фаза может содержать один или более физиологически приемлемых реагентов и/или растворителей и т.д. в концентрации, совместимой с ростом и/или подсчетом микроорганизмов. Некоторые неограничивающие примеры компонентов водной фазы включают воду, DMF, DMSO, метанол или этанол. Водная фаза также может содержать буферный агент, как описано ниже. В некоторых вариантах осуществления водная фаза может содержать частицы, такие как шарики. Водная фаза может также содержать среды-переносчики, которые обеспечивают замедленное высвобождение реагентов.
iv. Неионный нефторированный сурфактант
Водная фаза двухфазных капель типа "вода-в-масле" может содержать неионный нефторированный сурфактант. В некоторых вариантах осуществления неионный нефторированный сурфактант представляет собой сурфактант из блочного сополимера полиалкиленоксида. В некоторых случаях неионный нефторированный сурфактант представляет собой блочный сополимер полипропиленгликоля (H-(O-CH(CH3)-CH2)n-OH, PPG) и полиэтиленгликоля (H-(O-CH2-CH2)n-OH, PEG), имеющий общую формулу [PPGn-PEGm].
Неионный нефторированный сурфактант может представлять собой ди-, три-, тетра-, пента- или даже более длинный блочный полимер PEG и PPG. В некоторых случаях неионный нефторированный сурфактант представляет собой сополимер с чередованием, содержащий регулярно чередующиеся единицы PEG и PPG с общей формулой (PEG-PPG)х, где х находится в диапазоне около 10-100. В некоторых случаях х находится в диапазоне около 10-20, около 10-30, около 10-40, около 10-50, около 10-60, около 10-70, около 10-80, около 10-90, около 20-30, около 20-40, около 20-50, около 20-60, около 20-70, около 20-80, около 20-90, около 20-100, около 30-40, около 30-50, около 30-60, около 30-70, около 30-80, около 30-90, около 30-100, около 40-50, около 40-60, около 40-70, около 40-80, около 40-90, около 40-100, около 50-60, около 50-70, около 50-80, около 50-90, около 50-100, около 60-70, около 60-80, около 60-90, около 60-100, около 70-80, около 70-90, около 70-100, около 80-90, около 80-100 или около 90-100. В некоторых случаях неионный нефторированный сурфактант представляет собой статистический сополимер PEG и PPG с мономерными блоками PEG и PPG, присоединенными в случайной последовательности.
В некоторых случаях молекулярная масса блочного сополимера PEG и PPG находится в диапазоне около 4000 дальтон(«Да»)-25000 Да. В некоторых случаях молекулярная масса неионного нефторированного сурфактанта находится в диапазоне около 10000 Да-25000 Да; около 15000 да-25000 Да; около 20000 да-25000 Да; около 4000 Да-20000 Да; около 10000 Да-20000 Да; около 15000 Да-20000 Да; около 4000 Да-15000 Да; около 10000 да-15000 Да; или около 4000 Да-10000 Да. В некоторых случаях молекулярная масса неионного нефторированного поверхностно-активного сурфактанта составляет около 4000 Да; около 4500 Да; около 5000 Да; около 5500 Да; около 6000 Да; около 6500 Да; около 7000 Да; около 7500 Да; около 8000 Да; около 8500 Да; около 9000 Да; около 9500 Да; около 10000 Да; около 10500 Да; около 11000 Да; около 11500 Да; около 12000 Да; около 12500 Да; около 13000 Да; около 13500 Да; около 14000 Да; около 14500 Да; около 15000 Да; около 15500 Да; около 16000 Да; около 16500 Да; около 17000 Да; около 17500 Да; около 18000 Да; около 18500 Да; около 19000 Да; около 19500 Да; около 20000 Да; около 20500 Да; около 21000 Да; около 21500 Да; около 22000 Да; около 22500 Да; около 23000 Да; около 23500 Да; около 24000 Да; около 24500 Да; или около 25000 Да.
В некоторых случаях неионный нефторированный сурфактант представляет собой триблочный сополимер полипропиленоксида и полиэтиленоксида, известный как полоксамер. В некоторых случаях неионный нефторированный сурфактант представляет собой полоксамер, продаваемый под торговым наименованием PLURONIC® или TETRONIC®. В некоторых вариантах осуществления сурфактант Pluronic® представляет собой Pluronic® F-38, Pluronic® F-68, Pluronic® F-77, Pluronic® F-87, Pluronic® F-88, Pluronic®F-98, Pluronic® F-108 или Pluronic® F-127 (a=101, b=56).
В некоторых вариантах осуществления неионный нефторированный сурфактант представляет собой Nonidet® Р40. Общая структура Nonidet® включает в себя гидрофильную полиэтиленовую цепь и ароматическую углеводородную липофильную группу, как показано в формуле VII:
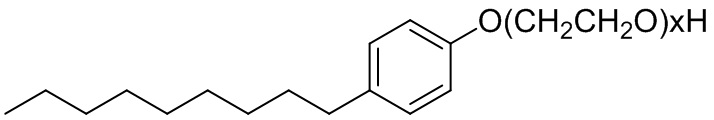
Формула VII.
В некоторых случаях неионный нефторированный сурфактант может представлять собой производное полиэтиленгликоля. В некоторых случаях неионный нефторированный сурфактант представляет собой производное полиэтиленгликоля с формулой VIII:
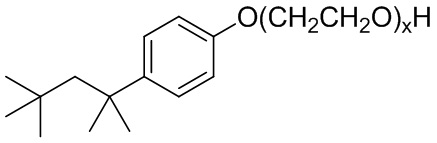
Формула VIII.
Типовые неионные нефторированные сурфактанты, являющиеся производными полиэтиленгликоля с формулой VIII, включают, но не ограничиваются указанным, сурфактанты Triton®. Примеры сурфактантов Triton® включают, но не ограничиваются указанным, Triton® X-15 (x=1,5 avg), Triton® X-35 (x=3 avg), Triton® X-45 (x=4,5 avg), Triton® X-100 (x=9,5 avg), Triton® X-102 (x=12 avg), Triton® X-114 (x=7,5 avg), Triton® X-165 (x=16 avg), Triton® X-305 (x=30 avg), Triton® X-405 (x=35 avg) или Triton® X-705 (x=1,5 avg).
В некоторых вариантах осуществления неионный нефторированный сурфактант представляет собой полиоксиэтиленовое производное сорбитанмонолаурата с формулой IX:
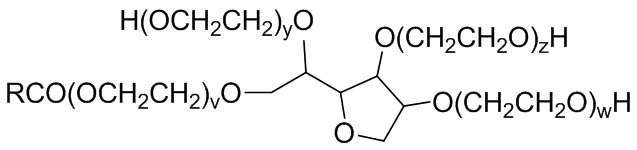
v+w+у+z=20
Формула IX.
Примеры полиоксиэтиленовых производных сорбитанмонолаурата c формулой IX включают, но не ограничиваются указанным, коммерчески доступные под торговым наименованием Tween®. В некоторых случаях неионный нефторированный сурфактант представляет собой Tween® 20 (R=CH2(CH2)9CH3)), Tween® 40 (R=CH2(CH2)13CH3), Tween® 60(R=CH2(CH2)15CH3) или Tween®-80 (R=(CH2)7CH=CH(CH2)8.
Концентрация неионного нефторированного сурфактанта может находиться в диапазоне около 0,1-5,0% по массе. В некоторых вариантах осуществления концентрация неионного нефторированного сурфактанта составляет менее около 1,5% по массе («мас./мас.»). В некоторых случаях концентрация Pluronic® составляет менее около 1,4% мас./мас., около 1,3% мас./мас., около 1,2% мас./мас., около 1,1% мас./мас., около 1,0% мас./мас., около 0,9% мас./мас., около 0,8% мас./мас., около 0,7% мас./мас., около 0,6% мас./мас., около 0,5% мас./мас., около 0,4% мас./мас., около 0,3% мас./мас., около 0,2% мас./мас. или около 0,1% мас./мас. В некоторых вариантах осуществления концентрация Pluronic® F-98 находится в диапазоне около 0,50% мас./мас.-1,5% мас./мас. В некоторых вариантах осуществления концентрация Pluronic® F-98 находится в диапазоне около 0,50% мас./мас.-0,60% мас./мас., около 0,50% мас./мас.-0,65% мас./мас., около 0,50% мас./мас.-0,70% мас./мас., около 0,55% мас./мас.-0,60% мас./мас., около 0,55% мас./мас.-0,65% мас./мас., около 0,55% мас./мас.-0,70% мас./мас., около 0,55% мас./мас.-0,75% мас./мас., около 0,60% мас./мас.-0,65% мас./мас., около 0,60% мас./мас.-0,70% мас./мас., около 0,60% мас./мас.-0,75 мас./мас., около 0,65% мас./мас.-0,70% мас./мас., около 0,65% мас./мас.-0,75% мас./мас. или около 0,70% мас./мас.-0,75% мас./мас. В некоторых других вариантах осуществления концентрацию неионного нефторированного сурфактанта могут настраивать для оптимизации стабильности капель и размера капель без ингибирования анализа подсчета микробов или роста микробов.
В некоторых вариантах осуществления концентрация фторсурфактанта находится в диапазоне около 1,0-6,0 мМ, а концентрация неионного нефторированного сурфактанта находится в диапазоне около 0,1%-3,0% по массе. В другом варианте осуществления фторсурфактант имеет структуру формулы I и концентрацию около 2,5 мМ, а неионный нефторированный сурфактант представляет собой Pluronic® F-98 и имеет концентрацию около 0,5% мас./мас.-1,5% мас./мас. В некоторых случаях фторсурфактант имеет структуру формулы I и концентрацию около 2,5 мМ, а неионный нефторированный сурфактант представляет собой Pluronic® F-98 и имеет концентрацию около 0,50% мас./мас.-0,60% мас./мас., около 0,50% мас./мас.-0,65% мас./мас., около 0,50% мас./мас.-0,70% мас./мас., около 0,55% мас./мас.-0,60% мас./мас., около 0,55% мас./мас.-0,65% мас./мас., около 0,55% мас./мас.-0,70% мас./мас., около 0,55% мас./мас. -0,75% мас./мас., около 0,60% мас./мас.-0,65% мас./мас., около 0,60% мас./мас.-0,70% мас./мас., около 0,60% мас./мас.-0,75% мас./мас., около 0,65% мас./мас.-0,70% мас./мас., около 0,65% мас./мас.-0,75% мас./мас. или около 0,70% мас./мас.-0,75% мас./мас.
В некоторых вариантах осуществления неионные нефторированные сурфактанты находятся в основном в водной фазе. В некоторых случаях по меньшей мере около 90%, около 91%, около 92%, около 93%, около 94%, около 95%, около 96%, около 97%, около 98% или около 99% неионного нефторированного сурфактанта находится в водной фазе капель эмульсии типа "вода-в-масле".
C. Соли и буферные агенты капель
Водная фаза капель типа "вода-в-масле", описанных в настоящем раскрытии (например, капель с оболочкой и/или двухфазных капель) может содержать различные соли, буферные агенты, агенты компонентов микробной питательной среды, реагенты обнаружения (например, красители, зонды или флуорогенные или колориметрические субстраты), микроорганизмы, матрицы пищевых продуктов и/или любые дополнительные компоненты, необходимые для определения роста и/или количества микроорганизмов. Все такие дополнительные компоненты могут быть выбраны по совместимости с предполагаемым анализом.
Подходящий(-е) буфер(-ы) или буферный(-е) агент(-ы) может(-гут) присутствовать в водной фазе. Буфер или буферный агент могут быть сконфигурированы таким образом, чтобы поддерживать рН водной фазы вблизи значения или на любом подходящем значении рН, таком как значение рН, близкое либо равное значению, при котором рост и/или обнаружение микроорганизмов являются оптимальными. Например, рН может быть выбран таким образом, чтобы он находился на оптимальном значении рН или превышал его для активности фермента, которая может быть обнаружена флуорогенным или колориметрическим субстратом. В качестве другого примера, рН может быть выбран таким образом, чтобы он находился на оптимальном значении рН для роста микроорганизма-мишени или значении, близком к нему. В качестве еще одного примера, рН, буферный агент и/или концентрация буферного агента могут быть выбраны для обеспечения детектируемого снижения рН, вызванного ростом микроорганизмов, например, с помощью чувствительного к рН флуорофора. Аналогично, подходящие соли, которые могут присутствовать в водной фазе, включают, но не ограничиваются указанным, соли, совместимые с ростом и/или обнаружением микроорганизмов. Типичные соли включают, но не ограничиваются указанным, любую соль или комбинацию солей из NaCl, KCl, CaCl2, MgCl2, MgSO4, фосфатных солей и т.п.
В некоторых случаях концентрация калиевой соли (например, KCl) и/или натриевой соли (например, NaCl), может составлять около, более чем около, или менее чем около 10 мМ, около 20 мМ, около 30 мМ, около 40 мМ, около 50 мМ, около 60 мМ, около 80 мМ, около 100 мМ, около 200 мМ. В некоторых случаях концентрация магниевой соли (например, MgCl2) имеет концентрацию около, более чем около или менее чем около 1,0 мМ, около 2,0 мМ, около 3,0 мМ, около 4,0 мМ или около 5,0 мМ. В некоторых случаях буферный агент составляет около, более чем около или менее чем около 1 мМ,5 мМ, 10 мМ, 15 мМ, 20 мМ, 30 мМ,50 мМ, 80 мМ, 160 мМ или 200 мМ.
В некоторых случаях рН может, например, приближаться к физиологическому рН, например, от около 5 до 9, от 5 до 6,5, от 6,5 до 8,5, от 7 до 8 или около 7,5. Может быть выбран конкретный буферный агент, который имеет pKa, относительно близкую к требуемому рН, который должен поддерживаться, и который является совместимым с реакцией(-ями), которая(-ые) должна(-ы) быть выполнена(-ы). Буферный агент может быть физиологически совместимым. Примерами буферных агентов, которые могут быть подходящими, являются, но не ограничиваются указанным, трис(2-амино-2-гидроксиметилпропан-1,3-диол), MES (2-(N-морфолино) этансульфоновая кислота), MOPS (3-морфолинопропан-1-сульфоновая кислота), HEPES (2-[4-(2-гидроксиэтил) пиперазин-1-ил] этансульфоновая кислота) и т.п. В некоторых случаях буферный агент представляет собой фосфатный буфер или содержит фосфатный буфер, такой как моно-, ди- и/или три-основной натриевый или калиевый фосфатный буфер, или комбинацию указанного. В некоторых случаях буферный агент по существу обеспечивается одним или несколькими компонентами минимальной, сложной, определенной и/или неопределенной микробной среды. Например, компоненты триптонов, различных пептонов, фитонов, аминокислотных смесей, физиологических натриевых, калиевых или магниевых солей, и т.д., могут обеспечить достаточную буферизующую способность для способов и композиций по настоящему изобретению. Альтернативно, в некоторых случаях, хотя минимальная, сложная, определенная и/или неопределенная микробная среда может обеспечить буферизующую способность, дополнительный буферный агент, такой как один или более из вышеперечисленных буферных агентов, включают в водную фазу капель типа "вода-в-масле".
F. Питательная среда в каплях
В качестве компонента водной фазы капель типа «вода-в-масле» можно выбрать широкий спектр питательных сред. Сусловая среда (также называемая питательной или культуральной средой), при использовании в настоящем описании, включает в себя любую среду, используемую для микробиологического культивирования, включая определенные и неопределенные компоненты. Как правило, выбирают питательную среду, подходящую, совместимую или оптимальную для роста одного или более микроорганизмов-мишеней, подлежащих подсчету или анализу на восприимчивость к противомикробным препаратам. Как правило, питательная среда будет содержать источник азота, источник углерода и различные существенные элементы.
Источник азота может представлять собой, или включать в себя, белок или смесь белков. Например, источником азота может быть экстракт говядины или дрожжевой экстракт. Источник азота может представлять собой, или включать в себя, частично или полностью гидролизованный белок или смесь белков, таких как пептон, триптон, казаминокислоты и т.д. Источник азота может представлять собой, или включать в себя, аминокислоту или смесь аминокислот. В некоторых случаях источником азота является азотная (например, нитратная) соль, такая как сульфат аммония.
Источник углерода может представлять собой, или включать в себя, глюкозу, галактозу, арабинозу, сукцинат, глицерин, пируват, глутамат, ксилозу, или комбинацию указанного. В некоторых случаях в сложных средах, содержащих один или несколько неопределенных источников азота (например, экстракт говядины, дрожжевой экстракт, триптон или пептон), источник углерода является внутренним компонентом неопределенного источника азота. Существенные элементы включают, но не ограничиваются указанным, натрий, калий, кальций, магний, железо, азот, фосфор и серу.
Типовая питательная среда для использования в водной фазе капель эмульсии типа "вода-в-масле" включают в себя, но не ограничиваются указанным, триптон-соевый бульон (TSB), буферизованную пептонную воду (например, BAM Media M192), и комбинацию указанного. В некоторых случаях селективную среду используют в качестве компонента водной фазы капель эмульсии типа "вода-в-масле". Такие селективные среды включают, но не ограничиваются указанным, хромогенные среды, агар Берда-Паркера, агар бромкрезоловый пурпурный («BCP»), агар желчного экулина («BEA»), среду Брайанта и Берки, буферную пептонную воду, среду чапмена, шоколадный агар, бессолевой лактозный питательный агар с цистином («CLED»), колет, колумбийский агар, агар Дригальски, Фразера, Гранада, агар GVPC, агар Ag Hektoen, king A & B, Левентштейна-Йенсена, LT100, агар МакКонки, бульон или агар MRS, бульон или агар Мюллера-Хинтона, Мюллера-Кауфмана, агарозную основу для идентификации листерии («PALCAM»), PCB, RPMI, RVS, сабуро, бульон или агар Шадлера, селенитовый бульон, среду Сланеца и Бартли, SPS-агар, TGY, TSB, TSI, TTC тергитол, VRBG, XLD и т.д.
G. Противомикробные средства в каплях
В некоторых аспектах водная фаза капель эмульсии типа "вода-в-масле" может содержать противомикробное средство. Противомикробное средство может быть включено для обеспечения того, чтобы анализ не искажался в результате присутствия искажающих микроорганизмов. Например, если требуется подсчет QI, когда микроорганизмы-мишени являются бактериями, то противогрибковый агент может быть включен в водную фазу, чтобы избежать роста грибов, которые не являются организмами-мишенями. В качестве другого примера, если требуется подсчет QI, когда микроорганизмы-мишени представляют собой грибы или плесень, противобактериальный агент может быть включен в водную фазу. Альтернативно, противомикробный препарат может быть включен для оценки восприимчивости к противомикробным препаратам микроорганизма-мишени или класса микроорганизмов-мишеней. Например, минимальная подавляющая концентрация (МПК) для противомикробного средства может быть определена путем анализа роста микроорганизма(-ов)-мишени(-ей), по меньшей мере, при двух (например, 3-10) различных концентрациях тестируемого противомикробного средства в водной фазе. Также может использоваться гораздо больше различных концентраций, например, при использовании градиента концентраций противомикробного препарата в каплях. Градиент концентраций может быть линейным или нелинейным. В другом примере одна концентрация используется при определении того, является ли микроорганизм восприимчивым к тестируемому противомикробному препарату. Одна выбранная концентрация представляет собой пограничную концентрацию, которая отличает восприимчивые организмы от нечувствительных.
В водной фазе капель эмульсии типа "вода-в-масле" можно использовать широкий спектр противомикробных средств. Как правило, противомикробные средства выбирают таким образом, чтобы не нарушать существование капель. Например, могут быть выбраны противомикробные средства, которые, по существу, находятся в водной фазе, и не могут, по существу, попадать в неводную фазу. Альтернативно, частичное попадание противомикробного средства в масляную фазу можно учесть до определения МПК противомикробного средства. В качестве еще одной альтернативы, противомикробное средство может быть включено как в масляную фазу, так и в водную фазу, если противомикробный материал демонстрирует существенную растворимость в обеих фазах. В качестве еще одной альтернативы, химический состав капель может быть скорректирован в целях минимизации такого попадания противомикробного средства в неводную фазу. Например, двухфазную систему можно заменить каплями с системой оболочки, или наоборот, или может быть использован сурфактант (например, неионный нефторированный сурфактант или фторсурфактант) с повышенным или пониженным HLB.
Типовые противомикробные средства включают, но не ограничиваются указанным, бета-лактамовые противомикробные средства, цефамициновые противомикробные средства, цефалоспориновые противомикробные средства, хинолоновые противомикробные средства, фторхинолоновые микробные средства, нафтиридиновые противомикробные средства, поликетидные противомикробные средства, ингибиторы дигидрофолатредуктазы, полимиксиновые противомикробные средства, нитрофурановые противомикробные средства, противомикробные средства класса амфеникола, аминогликозидные противомикробные средства, гликопептидные противомикробные средства, полиеновые противогрибковые средства, имидазольные или триазольные противогрибковые средства, такие как ингибиторы имидазол- или триазольного класса грибковой ланостерол 14 α-деметилазы, тиазольные противогрибковые средства, аллиламиновые противогрибковые средства, эхинокандиновые противогрибковые средства, 5-фторцитозиновые противогрибковые средства или комбинацию указанного. В некоторых случаях противомикробным средством является цефокситин, пиперациллин, налидиксовая кислота, тетрациклин, ванкомицин, триметоприм, нитрофурантоин, колистин, нитрофуран, хлорамфеникол, гентамицин, амфотерицин В, флуконазол, или комбинация указанного.
H. Противогрибковые препараты
В некоторых аспектах, масляная фаза капель эмульсии типа "вода-в-масле" может содержать одно или более противогрибковых средств. Противогрибковое средство могут включать для предотвращения роста микроорганизмов за пределами водной фазы или для создания «изгороди» вокруг водной фазы. Противогрибковые средства могут включать в масляную фазу, чтобы предотвратить образование плесени за пределами водной фазы. Типичные противогрибковые средства включают, но не ограничиваются указанным, 2,6-дихлор-4-нитроанилин (или диклоран), 4,5,6,7-тетрахлор-2',4',5',7'-тетрайодфлуоресцеин (или бензол), (RS)-1-[2-(аллилокси)-2-(2,4-дихлорфенил) этил]-1H-имидазол (или имазалил, хлорамизол) и/или хитозан.
В некоторых вариантах осуществления масляная фаза содержит диклоран в концентрации от около 5 мг/л до около 200 мг/л, от около 10 мг/л до около 100 мг/л, от около 20 мг/л до около 100 мг/л, от около 40 мг/л до около 100 мг/л или от около 20 мг/л до около 200 мг/л. В некоторых вариантах осуществления масляная фаза содержит диклоран в концентрации около 5 мг/л, около 10 мг/л, около 20 мг/л, около 25 мг/л, около 30 мг/л, около 40 мг/л, около 50 мг/л, около 60 мг/л, около 70 мг/л, около 80 мг/л, около 90 мг/л, около 100 мг/л, около 125 мг/л, около 150 мг/л, около 175 мг/л, или около 200 мг/л.
В некоторых вариантах осуществления масляная фаза содержит бенгальский розовый в концентрации от около 50 мг/л до около 375 мг/л, от около 100 мг/л до около 200 мг/л или от около 50 мг/л до около 150 мг/л. В некоторых вариантах осуществления масляная фаза содержит бенгальский розовый в концентрации около 50 мг/л, около 75 мг/л, около 100 мг/л, около 125 мг/л, около 150 мг/л, около 175 мг/л, около 200 мг/л, около 250 мг/л, около 300 мг/л, около 350 мг/л или около 375 мг/л.
В некоторых вариантах осуществления масляная фаза содержит имазалил в концентрации от около 0,1 мг/л до около 2,5 г/л, от около 0,1 мг/л до около 1,0 г/л, от около 0,5 до около 1,0 г/л или от около 0,5 мг/л до около 2,5 г/л. В некоторых вариантах осуществления масляная фаза содержит имазалил в концентрации около 0,1 мг/л, 0,25 мг/л, 0,5 мг/л, 0,75 мг/л, около 1 мг/л, около 2 мг/л, около 5 мг/л, около 10 мг/л, около 100 мг/л, около 1,0 г/л или около 2,5 г/л.
В некоторых вариантах осуществления, масляная фаза содержит хитозан, и концентрация хитозана в масляной фазе составляет около 0,3% или менее.
I. Гелеобразующие агенты капель
В некоторых аспектах водная фаза или масляная фаза капель эмульсии типа "вода-в-масле" содержит один или более гелеобразующих агентов. В некоторых вариантах осуществления, в которых микроорганизм-мишень представляет собой дрожжи, гелеобразующий агент может быть включен в водную фазу для предотвращения изменения размера капель (например, для предотвращения уменьшения размера капель). В одном из вариантов осуществления водная фаза содержит гидрогель, такой как альгиновая кислота, который может быть превращен в гель посредством добавления ионов кальция. В процессе гелеобразования альгинат и карбонат кальция включаются в водную фазу капель, а уксусная кислота включается в масляную фазу капель. Во время процесса гелеобразования, ионы H+ из уксусной кислоты диффундируют из масляной фазы в водную фазу капли, вызывая снижение рН водной фазы и диссоциацию ионов кальция из карбоната кальция в соответствии со следующим уравнением:
СаСО3+2Н+ → CaHCO3+Н+ → Са2+Н2О+СО2
В некоторых вариантах осуществления изобретения концентрация альгината в водной фазе составляет около 3,5 г/л или менее. В некоторых вариантах осуществления концентрация альгината в водной фазе составляет около 1, 2, 2,5, 3 или 3,5 г/л. В некоторых вариантах осуществления концентрация ионов кальция в водной фазе составляет около 1 г/л или менее. В некоторых вариантах осуществления концентрация ионов кальция в водной фазе составляет около 0,25, 0,5, 0,75 или 1 г/л.
Другие примеры полимерных материалов, которые могут быть использованы в качестве гелеобразующих агентов, включают, но не ограничиваются указанным, каппа-каррагинан, йота-каррагинан, фурцелларан, зеин, сукцинилированный зеин, сукцинилированную целлюлозу и/или сукцинилированную этилцеллюлозу. Типовые синтетические водорастворимые полимерные материалы, которые могут быть использованы в качестве гелеобразующих агентов, включают, но не ограничиваются указанным, соединения, образованные из винилпиролидона, сополимера 2-метил-5-винилпирридин-метилакрилата-метакриловой кислоты, винилового спирта, винилпирридина, сополимера винилпиридин-стирола.
J. Реагенты обнаружения капель
Капли эмульсии типа "вода-в-масле" могут содержать один или более реагентов обнаружения. Реагенты обнаружения могут представлять собой реагенты для обнаружения нуклеиновой кислоты, специфичные для генотипа, белки (например, антитела, лектины, фибриноген) и другие молекулы. Типовые реагенты для обнаружения нуклеиновых кислот, специфичные для генотипа, включают, но не ограничиваются указанным, зонды нуклеиновых кислот. Специфичные для генотипа реагенты обнаружения могут являться специфичными для конкретного рода, вида или штамма микроорганизма. Типовые зонды нуклеиновых кислот включают, но не ограничиваются указанным, двухцепочечные зонды, такие как двухцепочечные зонды, описанные в патентах США №5928862; или 9194400; зонды "молекулярных маяков", такие как описанные в WO 98/10096; TaqMan, например, описанные в патентах США №5210015; 5487972; 5538848; 5723591; и 6258569; зонды Scorpions®; светочувствительные зонды; LUX-зонды; и амплифтористые зонды. Такие зонды могут быть использованы для обнаружения, например, посредством инкубирования капель, содержащих зонды, в условиях роста микроорганизма(-ов)-мишени(-ей), последующего лизирования микроорганизмов-мишеней после инкубации, например, путем нагревания, необязательно, амплифицирования локуса-мишени, и выявления наличия или отсутствия генотипа с помощью зонда нуклеиновой кислоты. В некоторых вариантах осуществления используются меченые антитела или другие молекулы, специфичные для конкретных микроорганизмов. Такие меченые молекулы могут являться специфичными также для штаммов микроорганизмов, что позволяет идентифицировать микроорганизмы, которые являются восприимчивыми к конкретному противомикробному агенту.
Реагенты для обнаружения могут представлять собой неспецифичные для генотипа реагенты для обнаружения нуклеиновой кислоты, включая, но не ограничиваясь указанным, интеркалирующие красители. Интеркалирующие красители, как правило, представляют собой ароматические катионы с плоскими структурами, которые вставляют между уложенными друг на друга парами оснований в дуплексе ДНК, получая структуру, которая обеспечивает зависящее от окружающей среды усиление флуоресценции для молекул красителя и создает значительное повышение сигнала флуоресценции относительно свободного красителя в растворе. Усиление сигнала обеспечивает пропорциональный отклик, позволяющий проводить прямые количественные измерения ДНК. Предпочтительные интеркалирующие красители в настоящем описании включают флуоресцентные красители. Краситель может представлять собой цианиновый или нецианиновый интеркалирующий краситель. В некоторых случаях интеркалирующий краситель представляет собой цианиновый краситель. В некоторых случаях цианиновый краситель может представлять собой тиазольный оранжевый, SYBR® (например, Sybr Green I, Syber Green II, Sybr Gold, SYBR DX), Oil Green, CyQuant GR, SYTOX Green, SYT09, SYTO10, SYT017, SYBR14, оксазиловый желтый, тиазоновый оранжевый, SYTO, TOTO, YOYO, BOBO и POPO. В некоторых случаях краситель представляет собой нецианиновый краситель. В некоторых случаях нецианиновый краситель представляет собой пентацен, антрацен, нафталин, ферроцен, метилвиологен, триморфолмоаммоний, пропидий (например, пропидиум иодид) или другое ароматическое или гетероароматическое производное. В некоторых случаях интеркалирующий краситель выбирают из группы, состоящей из DAPI (4',6-диамидино-2-фенилиндола), акридинового оранжевого, моноазида этидия (EMA), моноазида пропидия (PMA), SYBR® Green I, SYBR® Gold, бромида этидия, бромида пропидия, Pico Green, Hoechst 33258, YO-PRO-I и YO-YO-I, SYTO®9, LC Green®, LC Green® Plus+ и EvaGreen®. В некоторых случаях интеркалирующий краситель представляет собой EvaGreen®. Такие интеркалирующие красители могут быть использованы для обнаружения, например, посредством инкубирования капель, содержащих зонды, в условиях роста микроорганизма(-ов)-мишени(-ей), последующего лизирования микроорганизмов-мишеней после инкубации, например, путем нагревания, необязательно, амплифицирования локуса-мишени и выявления наличия или отсутствия двухцепочечной нуклеиновой кислоты с помощью интеркалирующего красителя. В некоторых вариантах осуществления инкубация не требуется. Альтернативно, для обнаружения микроорганизма-мишени и мониторинга роста микроорганизма-мишени может не требоваться лизирование клеток.
Реагент обнаружения может являться специфичным для фенотипа. Например, реагент обнаружения может являться реагентом, который обнаруживает наличие активности фермента, указывающей на наличие организма, продуцирующего такой фермент. Соответственно, реагент обнаружения может являться чувствительным к рН хромофором или флуорофором, который изменяет поглощение (например, видимого света) и/или флуоресценцию в результате изменения рН. Примерный флуоресцентный зонд, чувствительный к pH, является обнаруживаемо флуоресцентным при длине волны обнаружения в водном растворе, имеющем рН менее примерно 5, и не обнаруживаемо флуоресцентным на длине волны обнаружения в водном растворе, имеющем рН более примерно 6,5.
Например, микроорганизмы, такие как определенные бактерии, такие как Enterobacteriaceae, которые, как известно, резко снижают рН среды, в которой они растут, в отсутствие сильного буферного агента при достаточной концентрации, могут быть обнаружены с помощью маркера (например, зонда или другого идентификатора), который меняет цвет или флуоресцирует при низком рН. Альтернативно, реагент обнаружения может являться субстратом фермента, указывающего на микроорганизм или класс микроорганизмов. В некоторых вариантах осуществления реагент обнаружения представляет собой продукт реакции между субстратом и ферментом, продуцируемым микроорганизмом-мишенью. Субстрат может быть колориметрическим или флуорогенным. Примеры ферментов, типовых микроорганизмов и соответствующих субстратов включают, но не ограничиваются указанным, описанные в таблице I.
Таблица I:
Как правило, реагенты для обнаружения выбирают таким образом, чтобы они были совместимы с используемым химическим составом капли. Например, могут быть выбраны реагенты обнаружения, которые, в основном, находятся в водной фазе и не могут, по существу, попадать в неводную фазу. В некоторых случаях химический состав капель можно настраивать, чтобы свести к минимуму попадание реагента обнаружения в неводную фазу. Например, двухфазную систему могут заменять на капли с системой оболочек, или наоборот, или могут использовать сурфактант (например, неионный нефторированный сурфактант или фторсурфактант) с повышенным или пониженным HLB.
J. Образцы
Образцы для разделения по каплям типа "вода-в-масле" могут включать любой образец, о котором известно, или в отношении которого предполагают, что он содержит микроорганизм-мишень. Для подсчета QI образец может представлять собой, или может содержать, пищевой продукт (например, пищевой продукт для человека или животных), образцы окружающей среды, взятые с поверхностей или оборудования. Образцы могут содержать один или более микроорганизмов-мишеней. Микроорганизм(-ы)-мишень(-и) может(-гут) представлять собой или содержать бактерии, дрожжи или плесени. Клинические образцы включают различные жидкости организма или разведенные образцы.
Любой микроорганизм может быть идентифицирован с применением раскрытых способов. Пример микроорганизма(-ов)-мишени(ей) может представлять собой или содержать грамположительные и грамотрицательные бактерии, Enterobacteriaceae (Escherichia spp., Klebsiella spp., Enterobacter spp., Serratia marscescens, и Citrobacter spp., Shigella spp., Salmonella spp., Cronobacter spp.,...), Pseudomonas spp., Acinetobacter spp., Campylobacter spp., Staphylococcus spp., Legionella spp., Corynebacterium spp., Listeria spp., Enterococcus spp., Streptococcus spp., Clostridium spp., Bacillus spp., Candida spp., Aspergillus spp., Cryptococcus spp., Debaromyces spp., Geotrichum spp., Hanseniaspora spp., Kluyveromyces spp., Pichia spp., Rhodotula spp., Saccharomyces spp., Trichosporon spp., Zygosaccharomyces spp., Alternaria spp., Fusarium spp., Mucor spp., Penicillium spp., Pullularia spp., Trichothecium spp., или комбинации указанного.
Микроорганизм(-ы)-мишень(-и) может(-гут) представлять собой или содержать Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Serratia marcescens, Enterobacter cloacae, Enterobacter aerogenes, Proteus mirabilis, Pseudomonas aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophilia, Staphylococcus aureus, Staphylococcus epidermis, Staphylococcus haemolyticus, Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus mitis, Enterococcus faecium, Enterococcus faecalis, Candida albicans, Candida tropicalis, Candida parapsilosis, Candida krusei, Candida glabrata, Mycobacterium tuberculosis, Cryptococcus albidus, Debaromyces hansenii, Geotrichum candidum, Hanseniaspora guillermonii, Kluyveromyces lactis, Pichia angusta, Rhodotula glutinis, Saccharomyces cerevisiae, Trichosporon pullulans, Zygosaccharomyces rouxii, Alternaria alternata, Fusarium graminearum, Mucor miehei, Penicillium patulum, Pullularia pullulans, Trichothecium roseum, Aspergillus niger или Aspergillus fumigatus, или комбинацию указанного.
i. Матрицы пищевых продуктов
Матрица пищевых продуктов может представлять собой пищевые продукты для человека или животного, таких как корм для домашних животных или корм для скота. Изобретатели неожиданно обнаружили, что химический состав капель типа "вода-в-масле" и способы их применения, описанные в настоящем раскрытии, совместимы с широким спектром матриц пищевых продуктов. Типовые матрицы пищевых продуктов включают, но не ограничиваются указанным, матрицы, которые содержат пищевые продукты на основе животных (например, мясо, такое как говядина или ветчина, молочные продукты, такие как молоко или сыр) или пищевые продукты на основе растений (например, овощи или фрукты), напитки, или комбинацию указанного. В некоторых случаях содержащая мясо матрица пищевых продуктов представляет собой говяжий фарш (например, 85% или 95% нежирного говяжьего фарша). В некоторых случаях содержащая молоко пищевая матрица представляет собой цельное молоко, сливки, смесь молока и сливок в равных количествах, 2%, 1% или не содержащее жира (обезжиренное) молоко.
Широкое разнообразие содержания жира в матрицах пищевых продуктов является совместимым с химическими составами типа "вода-в-масле", описанными в настоящей заявке. Неожиданно было установлено, что значительное количество жира может находиться в матрице пищевых продуктов, и при этом не нарушать образование капель. Возможное содержание жира составляет около 0%, менее чем около 0,5%, около 0,5%, около 1%, около 2%, около 3%, около 4%, около 5%, около 6%, около 7%, около 8% около 9%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 20%, около 25%, около 30%, около 35%, около 40%, около 45%, около 50% или около 60%. В некоторых случаях содержание жира составляет от около 0% до около 20%, или от около 0% до около 25%, или от около 20 до 45%.
Обычно матрицу пищевых продуктов суспендируют, смешивают, перемешивают, или гомогенизируют в одном или более, или всех, компонентах водной фазы капель типа "вода-в-масле". Например, матрицу пищевых продуктов для человека могут смешивать с одним или более, или всеми, компонентами водной фазы капель типа «вода-в-масле» в соотношении около 1:10, около 10:90, около 15:85, около 20:80 или около 25:75 массы матрицы пищевых продуктов к общему объему компонентов водной фазы.
II. Образцы окружающей среды
При анализе окружающей среды, образцы могут происходить из любой представляющей интерес окружающей среды, в помещении или на открытом воздухе. Примерами сред, для которых подходит QI, являются рекреационная вода, песок пляжа и поверхности. Дополнительным примером является окружающая среда на ферме, бойне или в любом другом месте, где обрабатывают пищевые продукты (например, мясокомбинаты). Образцы с фермы будут включать образцы почвы, поверхностей на строениях и оборудовании фермы. Рекреационная вода представляет собой любую воду, предназначенную для отдыха, и включает в себя рекреационные водоемы, такие как бассейны, озера, реки, океаны и т.д. Поверхности относятся, в частности, к больницам, школам, предприятиям пищевой промышленности и т.д. Образцы будут представлять собой мазки, взятые с поверхности, и мазок затем вводят в среду, из которой создают капли.
III. Клинические образцы
В настоящем раскрытии описаны способы и композиции для обнаружения наличия или отсутствия или чувствительности к противомикробным препаратам для одного или более микроорганизмов-мишеней в клиническом образце. В некоторых случаях образец представляет собой образец субъекта (например, человека), который, как известно, или как предполагают, заражен патогенным микроорганизмом. Образец может представлять собой кровь или ее фракцию, такую как плазма или сыворотка; ткань, мочу, слюну; перикардиальные, плевральные или спинальные жидкости; мокроту, концентрат стволовых клеток костного мозга, концентрат тромбоцитов; носовые, ректальные, вагинальные или паховые мазки; раны; образцы с кожи, рта, языка, горла; асцит; фекалии и тому подобное. Такие образцы могут быть проанализированы с целью определения количества микробов и, следовательно, для оценки вероятности инфицирования патогенами.
В качестве альтернативы, клинический образец может представлять собой чистую или, по существу, чистую культуру микроорганизма-мишени известной идентичности. Такая чистая культура или, по существу, чистая культура микроорганизма-мишени с известной идентичностью может быть проанализирована с помощью раскрытых способов определения восприимчивости к противомикробным препаратам. Например, образец субъекта могут предоставлять или получать и оценивать в отношении наличия или отсутствия микроорганизмов-мишеней, например, путем нанесения образца субъекта или культивированного образца субъекта на подходящую среду. Отдельную колонию или множество колоний микроорганизма-мишени могут выбирать, необязательно, культивировать и разделять на множество капель эмульсии типа "вода-в-масле", которые содержат тестируемый противомикробный препарат. Тестируемый противомикробный препарат может присутствовать в одной концентрации или в нескольких концентрациях во множестве капель эмульсии типа "вода-в-масле".
Анализ образцов
Образцы могут быть проанализированы с помощью флуорогенного или колориметрического субстрата в водной фазе капель типа "вода-в-масле", чтобы определить наличие или отсутствие микроорганизма-мишени, который экспрессирует фермент, который распознает субстрат, посредством чего диагностируют наличие или отсутствие рода, или вида, или класса микроорганизма(-ов)-мишени(-ей). Альтернативно, связывающий партнер, специфичный для интересующего микроорганизма (например, антитело) используют для определения наличия или отсутствия микроорганизма-мишени. В другом варианте осуществления микроорганизм-мишень идентифицируют как присутствующий, если внутренность капли является мутной. Образцы могут быть проанализированы параллельно или без теста на чувствительность к противомикробным препаратам и, необязательно, при нескольких разных концентрациях противомикробных препаратов, чтобы одновременно оценить чувствительность к противомикробным препаратам микроорганизма(-ов)-мишени(-ей).
Общий объем компонентов водной фазы зависит от количества капель, которые генерирует система, и объема каждой капли. В некоторых случаях общий объем компонентов водной фазы, который используют для получения капель, составляет от 5 мкл, 10 мкл, 15 мкл, 20 мкл, 30 мкл, 40 мкл, 50 мкл, 60 мкл, 70 мкл, 80 мкл, 90 мкл, 100 мкл, 150 мкл, 175 мкл, 200 мкл, 225 мкл, 250 мкл, 275 мкл, 300 мкл, 325 мкл, 350 мкл, 375 мкл, 400 мкл, 425 мкл, 450 мкл, 475 мкл, 500 мкл, 500 мкл, 550 мкл, 600 мкл, 650 мкл, 700 мкл, 750 мкл, 800 мкл, 850 мкл, 900 мкл, 950 мкл, 1 мл, 2 мл, 3 мл, 4 мл. В некоторых случаях общий объем компонентов водной фазы, включая, но не ограничиваясь указанным, клинический образец или чистую культуру из клинического образца, который используется для получения капель, составляет от около 10 мкл до около 1 мл, от около 20 мкл до около 1 мл, от около 25 мкл до около 500 мкл, от около 50 мкл до около 400 мкл, от около 75 мкл до около 300 мкл или от около 100 мкл до около 200 мкл.
В некоторых случаях, общее количество капель во множестве капель (например, содержащих матрицу пищевых продуктов для человека или клинический образец) составляет, по меньшей мере, около 1000; 2000; 3000; 4000; 5000; 6000; 7000; 8000; 9000; 10000; 15000; 20000; 25000; 30000; 35000; 40000; 50000; 60000; 70000; 80000; 90000; 100000. В других вариантах осуществления образуется до миллиона капель. В некоторых случаях общее количество капель во множестве капель (например, содержащих матрицу пищевых продуктов для человека или клинический образец) составляет от около 1000 до около 100000; от около 2000 до около 90000; от около 3000 до около 80000; от около 4000 до около 70000; от около 5000 до около 60000; от около 7500 до около 50000; от около 10000 до около 40000; от около 15000 до около 30000, или около 20000.
III. Способы
В настоящем раскрытии описаны способы для быстрого анализа роста или количества одного или более микроорганизмов-мишеней в образце путем разделения образца на множество капель эмульсии типа "вода-в-масле", инкубации капель в течение, или по меньшей мере, от 1 до 50 (например, от 5 до 20) удвоений и обнаружения наличия или отсутствия микроорганизмов-мишеней в каплях.
Обычно раскрытые способы включают в себя инкапсуляцию образца во множестве капель эмульсии типа «вода-в-масле», при этом капли эмульсии типа «вода-в-масле» дополнительно инкапсулируют микробиологическую питательную среду; инкубацию множества капель эмульсии типа "вода-в-масле" при температуре, допускающей микробиологический рост, и в течение периода времени, достаточного для того, чтобы микроорганизмы-мишени прошли через от 5 до 45 периодов удвоения; идентификацию капель эмульсии типа "вода-в-масле", содержащих микроорганизмы-мишени; и, в ответ на идентификацию микроорганизма-мишени по меньшей мере в одной капле эмульсии типа «вода-в-масле», определение того, что микроорганизм-мишень присутствует в образце. В некоторых вариантах осуществления инкубацию не применяют, и капли анализируют без предварительной инкубации.
В некоторых вариантах осуществления капли типа «вода-в-масле» содержат одно или более из интеркалирующего красителя, меченого белка (например, антитело, лектин или фибриноген), бычий сывороточный альбумин.
Обычный способ для анализа матрицы пищевых продуктов с целью определения количества микроорганизма-мишени включает в себя гомогенизацию части матрицы пищевых продуктов, при этом указанная часть матрицы имеет известную массу или объем; инкубацию множества капель эмульсии типа "вода-в-масле" при температуре, допускающей микробиологический рост, и в течение периода времени, достаточного для того, чтобы микроорганизмы-мишени удвоились от 5 до 45 раз; и определение в инкубированных каплях эмульсии типа "вода-в-масле": количества капель эмульсии типа "вода-в-масле", которые содержат микроорганизмы, посредством чего определяют количество положительных капель; и количества капель эмульсии типа "вода-в-масле", которые не содержат микроорганизмов, посредством чего определяют количество отрицательных капель; и определение по количеству положительных капель и отрицательных капель общего количества микроорганизмов-мишеней, посредством чего определяют количество микроорганизмов-мишеней на единицу массы или объема матрицы пищевых продуктов. Пример микробиологической питательной среды включает частично расщепленный белок (например, частичный триптический гидролизат казеина или частичный папаиновый гидролизат соевой муки, или комбинацию указанного). Капли типа «вода-в-масле» также, необязательно, содержат одно или более из буферизованной пептонной воды (такой как среда BAM M192) и сурфактант. Например, сурфактант может быть неионным, таким как полоксамер. Пример полоксамера имеет молекулярную массу около 1800 г/моль. В некоторых вариантах осуществления полоксамер содержит около 80% полиоксиэтилена. Сурфактанты могут иметь концентрации от по меньшей мере около 0,01% до не более чем около 5%, или около 1%. Инкапсулированная микробиологическая питательная среда имеет pH около 7,2 в некоторых вариантах осуществления.
Обычный способ для анализа микроорганизма-мишени в отношении минимальной подавляющей концентрации тестируемого противомикробного средства включает в себя: i) инкапсуляцию множества микроорганизмов-мишеней во множестве капель эмульсии типа "вода-в-масле", содержащих микробиологическую питательную среду, при этом: первая часть капель типа «вода-в-масле» инкапсулирует тестируемый противомикробный препарат в первой концентрации или не инкапсулирует тестируемый противомикробный препарат; вторая часть капель типа «вода-в-масле» инкапсулирует тестируемый противомикробный препарат во второй концентрации, отличной от первой концентрации; ii) инкубацию множества капель эмульсии типа "вода-в-масле" при температуре, допускающей микробиологический рост, в отсутствие тестируемого противомикробного препарата и в течение периода времени, достаточного для того, чтобы микроорганизмы-мишени, если они не были ингибированы тестируемым противомикробным препаратом, поделились от 5 до 20 раз или более; и iii) определение в каждой части инкубированных капель эмульсии типа "вода-в-масле": количества капель эмульсии типа "вода-в-масле", которые содержат микроорганизмы-мишени в количестве выше порогового, посредством чего определяют количество положительных капель; и количества капель эмульсии типа "вода-в-масле", которые содержат микроорганизмы-мишени в количестве ниже порогового, посредством чего определяют количество отрицательных капель; и iv) определение минимальной подавляющей концентрации тестируемого противомикробного препарата по количеству положительных и отрицательных капель в каждой части капель. В некоторых вариантах осуществления имеется шесть частей капель, и первая-пятая части имеют концентрации, которые представляют собой серийные двукратные разведения концентрации шестой части.
В некоторых вариантах осуществления определение количества положительных капель и определение количества отрицательных капель включает в себя обнаружение наличия или отсутствия бактериальных спор, или гиф дрожжей или плесени, в каплях с помощью зрительной или компьютерной визуализации, при этом количество положительных капель представляет собой количество капель, демонстрирующих наличие бактериальных спор, или гиф дрожжей или плесени, во множестве капель типа «вода-в-масле», а количество отрицательных капель представляет собой количество капель, демонстрирующих отсутствие бактериальных спор, или гиф дрожжей или плесени, во множестве капель типа «вода-в-масле».
A. Обработка водной фазы и/или образца
Образец и/или водную фазу могут обрабатывать до генерации капель, чтобы способствовать образованию капель. Обработка может являться особенно предпочтительной при относительно высокой концентрации и/или относительно длинных грибковых волокнах или микробных кластерах в водной фазе. Когда капли образуются в стандартных условиях, водную фазу могут подвергать быстрому уменьшению площади поперечного сечения, удлинению, с последующим разделением и образованием капли. Когда микроорганизмы присутствуют в количестве выше определенных концентраций или с определенной морфологией (например, хлопьевидной, имеющей гифы и т.д.), способность образовывать капли может быть нарушена. Например, эти микроорганизмы могут запутываться друг с другом при быстром процессе образования капель и могут не иметь достаточного времени для разделения посредством диффузии, в результате чего образуется шнур, который не позволяет каплям эффективно образовываться. Шнур может привести к образованию струй, микросателлитам и слиянию, а также к другим характеристикам плохого образования эмульсии. Альтернативно, или в дополнение к указанному, микроорганизмы могут взаимодействовать с границей раздела капель, уменьшая поверхностное натяжение и препятствуя образованию капель.
В некоторых случаях требуется подход к преодолению такого влияния на формирование капель. Один из типовых подходов заключается в замедлении скорости образования капель, чтобы капля имела достаточно времени для смыкания и образования. Другим механическим решением может быть перепроектирование генератора капель, с тем чтобы инициировать образование капель в этих условиях высокой концентрации. Другой типовой подход заключается в обработке образца, который должен быть включен в водную фазу, чтобы уменьшить скопление, агрегацию, флокуляцию, длину гиф и т. д. В некоторых случаях такое уменьшение может быть выполнено путем термообработки образца при температуре, по меньшей мере, около 40-50°С, в течение, по меньшей мере, около 1, 2, 5, 10, 15 или 30 минут, помимо прочего. Применяемую температуру определяют на основе термостабильности анализируемого микроорганизма.
Другой типовой подход состоит в механическом разделении крупных комков, агрегатов, структур гиф и т.д. Такое механическое разделение может быть выполнено как отдельный этап или во время гомогенизации или смешивания образца (например, матрицы пищевых продуктов) с другими компонентами водной фазы. Например, образец матрицы пищевых продуктов может быть гомогенизирован или смешан с компонентами водной фазы с помощью гомогенизатора Stomacher, взбивальной машины, вихревой мешалки или другого подходящего устройства, при этом такая гомогенизация или смешивание также разделяет скопления, агрегаты, структуры гиф и т.п. для одного или более микроорганизмов-мишеней. В качестве другого примера образец, такой как чистая культура микроорганизма-мишени, могут подвергать короткому механическому перемешиванию (например, с применением вихревой мешалки) до или после объединения с одним или несколькими компонентами водной фазы.
B. Образование капель
Водные и неводные фазы, содержащие компоненты, обсуждаемые выше, в том числе, но не ограничиваясь указанным, микроорганизмы-мишени, питательные среды и, необязательно, тестируемый противомикробный препарат, могут предоставлять (например, получать и/или приготовлять) и затем использовать для формирования эмульсии, посредством чего генерируется множество капель типа «вода-в-масле», содержащих микроорганизмы-мишени.
Эмульсия обычно содержит капли дисперсной фазы (например, водной фазы), расположенной в несмешивающейся непрерывной фазе (например, неводной фазе, такой как масляная фаза), которая выполняет функцию несущей жидкости для капель. И диспергированная, и непрерывная фазы обычно представляют собой, по меньшей мере преимущественно, жидкости.
Любой подходящий способ и структуру можно использовать для образования эмульсии. Как правило, для образования эмульсии требуется энергия, такая как встряхивание, взбалтывание, ультразвуковая обработка, перемешивание или другая гомогенизация эмульсии. Однако эти подходы могут приводить к получению полидисперсных эмульсий, в которых капли имеют диапазон размеров в результате по существу неконтролируемой генерации капель. В качестве альтернативы, монодисперсные эмульсии (с очень однородным размером капель) могут быть созданы путем контролируемой последовательной генерации капель с помощью, по меньшей мере, одного генератора капель. В типовых вариантах осуществления генератор капель работает посредством фокусировки на микроканальном потоке для получения эмульсии монодисперсных капель. Другие подходы и структуры для генерации капель, которые могут являться подходящими, описаны, например, в предварительной заявке на патент США № 61/341218, поданной 25 марта 2010 года; предварительной заявке на патент США № 61/409106, поданной 1 ноября 2010 года; предварительной заявке на патент США № 61/409473, поданной 2 ноября 2010 года; предварительной заявке на патент США № 61/410769, поданной 5 ноября 2010 года; заявке на патент США № 12/862542, поданной 24 августа 2010 года; публикации патентной заявки США № 2010/0173394 A1, опубликованной 8 июля 2010 года; 2014/0179544; и публикации международных патентных заявках № WO 2014/138711; и WO 2011/109546, содержание каждой из которых включено в настоящее раскрытие во всей его полноте для всех целей и, в частности, для раскрытия информации, относящейся к образованию капель, химическому составу капель, микрожидкостной обработке капель, модуляции температуры капель и способам обнаружения.
Сурфактант, присутствующий в водной фазе, может способствовать образованию водных капель в неводной фазе. Сурфактант может это сделать посредством физического взаимодействия как с неводной фазой, так и с водной фазой, стабилизируя границу раздела между фазами и формируя самоорганизующийся межфазный слой. Сурфактант может повышать кинетическую стабильность капель, уменьшать слияние капель, уменьшать агрегацию капель, или выполнять комбинацию указанного. Капли могут являться относительно устойчивыми к сдвиговым силам, создаваемым потоком жидкости во время манипулирования жидкостью. Например, капли могут являться устойчивыми к скоростям потока, составляющим по меньшей мере 40 л/мин или 50 л/мин в канале 100 мкм или 200 мкм при использовании выбранных комбинаций составов неводной и водной фаз. Полученные капли могут иметь любую подходящую форму и размер. Капли могут быть сферическими, когда форма не ограничена. Средний диаметр капель может составлять от около 1 до 500 мкм, от 5 до 500 мкм или от 50 до 500 мкм, а средний объем капель может составлять от около 50 до 500 нл, от 100 пл до 10 нл, от 200 мкл до 5 нл, около 0,5 нл, около 1 нл, около 2 нл, около 3 нл или около 5 нл. Количество генерируемых капель может зависеть от множества факторов, включая, но не ограничиваясь указанным, используемые устройства и способ генерации капель (например, объемное перемешивание или последовательная генерация), химический состав капель, объем капель, объем водных и/или неводных фаз, потребляемый при образовании капель, объем анализируемого образца и количество микроорганизмов-мишеней, подлежащих разделению.
Капли могут быть сформированы и затем собраны в форме эмульсии в резервуаре, таком как флакон, пробирка, лунка планшета, камера или тому подобное. В некоторых вариантах осуществления капли могут собирать в форме эмульсии в ПЦР-пробирке или микропланшете, которые затем инкубируют в инкубаторе, предназначенном для удержания одной или более ПЦР-пробирок или микропланшетов. Альтернативно, или в дополнение, капли могут собирать в резервуаре, а затем переносить в другой контейнер для инкубации при температуре роста микроорганизмов и/или манипулировать ими и/или транспортировать их посредством жидкостей, таких как микрожидкости, в место размещения инкубатора. В альтернативном варианте осуществления капли образуются и входят в микрожидкостный канал. В таком варианте осуществления в канале образуется одиночная колонна капель.
Отсутствует необходимость в определенной концентрации микроорганизмов в водной фазе до генерации капель. В целях достижения того, чтобы по существу все капли содержали не более одного микроорганизма каждая, при генерации капель исходная водная фаза находится в концентрации, при которой одна из десяти капель содержит микроорганизм. В других вариантах осуществления в каждой капле может находиться несколько микроорганизмов.
Капли могут быть диспергированы в разделяющей жидкости. В некоторых случаях разделяющая жидкость может способствовать жидкостным манипуляциям с каплями, которые являются плотно упакованными, и/или способствовать диспергированию липких капель или капсул. Например, капли могут генерировать, необязательно, трансформировать в капсулы, инкубировать при одной или нескольких температурах (например, температурах роста микроорганизмов и/или обнаружения), а затем диспергировать в разделяющей жидкости. Альтернативно, капли могут диспергировать в разделяющей жидкости до одной или более инкубаций. В некоторых случаях разделяющая жидкость содержит компонент масляной фазы неводной фазы, используемый для генерации капель. В некоторых случаях разделяющая жидкость содержит масляную фазу, но не содержит неводный сурфактант, используемый для генерации капель.
D. Трансформация капель
Компоненты химического состава капель, содержащие один или несколько формирующих оболочку компонентов (например, формирующих оболочку белков), могут быть трансформированы из капель в капсулы для повышения стабильности. Такая трансформация может быть полезна для анализа медленно растущих микроорганизмов. В таких случаях слияние или агрегация капель во время расширенной инкубации при температуре роста микробов могут быть уменьшены или устранены. Более того, в некоторых случаях рост гиф микроорганизма-мишени может проникать сквозь стенки нетрансформированных капель, снижая стабильность капель. В таких случаях трансформация капель в капсулы может быть полезной для уменьшения или устранения такого проникновения гиф. Альтернативно, образование капсул может быть осуществлено после инкубации капель при температуре роста микроорганизмов. Такое образование капсул может, например, обеспечить образование капсул и одновременное уничтожение микроорганизмов-мишеней. Такие капсулы могут быть, необязательно, сохранены и/или проанализированы позднее. В некоторых случаях образование капсул путем нагревания после инкубации капель при температуре роста микроорганизмов может быть выполнено с целью обнаружения внутреннего эпитопа или выделения нуклеиновой кислоты из микроорганизмов в каплях, если они имеются, и обнаружения нуклеиновой кислоты с помощью одного или более зондов или интеркалирующих красителей.
Как правило, капли трансформируют путем нагревания. Капли, непрерывную фазу и/или эмульсию могут нагревать до температуры, достаточной для образования оболочки, и в течение времени, достаточного для получения оболочки. Между температурой и временем, являющимися достаточными для такой трансформации, может существовать обратная зависимость. То есть, для нагревания капель при относительно низкой температуре может потребоваться более длительный период времени нагревания, чем для нагревания капель при относительно высокой температуре. Однако образование оболочек может происходить быстро при температуре выше пороговой и намного медленнее при температуре на несколько градусов ниже пороговой. Например, образование оболочки может происходить или может быть завершено менее чем за около пяти минут или менее чем за около одной минуты, когда эмульсия нагрета выше пороговой температуры. Трансформация капель в капсулы может понизить растворимость одного или нескольких формирующих оболочку белков (и/или другого(-их) формирующего(-их) оболочку компонента (-ов)) в водной фазе, в результате чего формирующий(-е) оболочку компонент(-ы) становится(-ятся) менее растворимым(-и) (например, становятся практически нерастворимыми) в водной фазе. Соответственно, оболочка может являться по существу нерастворимой в водной фазе.
В некоторых вариантах осуществления изобретения пороговое значение температуры может соответствовать температуре денатурации формирующего оболочку белка в водной фазе. Соответственно, формирование оболочки может являться следствием денатурации белка, которая происходит намного быстрее при температуре выше пороговой, чем при температуре ниже пороговой. В качестве примера, как сообщается, BSA денатурирует при температуре от 50 до 55°C, и капли, содержащие BSA в качестве формирующего оболочку белка, могут быть индуцированы для быстрого формирования оболочки при приблизительно такой же температуре. Соответственно, использование другого формирующего оболочку белка с другой температурой денатурации может потребовать нагревания до соответствующей другой температуры до формирования оболочки.
В некоторых случаях могут выбирать формирующий оболочку компонент, имеющий температуру формирования оболочки (например, денатурации), которая является совместимой с жизнеспособностью микроорганизма-мишени. Например, относительно низкая температура формирования оболочки может быть выбрана для формирования капсул из капель, с тем чтобы микроорганизм-мишень мог оставаться по существу жизнеспособным после инкубации в течение, или по меньшей мере в течение, около 1-5 минут при температуре формирования оболочки формирующего оболочку компонента. Альтернативно, могут выбирать формирующий оболочку компонент, имеющий температуру формирования оболочки (например, денатурации), которая является совместимой с уничтожением микроорганизмов-мишеней или высвобождением нуклеиновой кислоты из микроорганизмов-мишеней. Например, относительно высокая температура формирования оболочки может быть выбрана для формирования капсул из капель, с тем чтобы микроорганизмы-мишени могли быть по существу убиты или лизированы после инкубации в течение, или по меньшей мере в течение, около 1-30 минут при температуре формирования оболочки формирующего оболочку компонента.
Нагревание капель до температуры выше температуры формирования оболочки может преобразовать самоорганизующейся граничный слой на границе раздела фаз оболочки. Оболочка может состоять из белка, или белка и сурфактанта, помимо прочего. В некоторых случаях капли могут нагревать посредством термического циклирования, например, в течение ПЦР-амплификации. Профиль термоциклирования может включать в себя изменения температуры от около 4°С до около 99°С. Капли, необязательно, могут нагревать посредством термического циклирования в результате переноса капель через поточную систему термоциклирования. Дальнейшие аспекты типовой поточной системы термоциклирования раскрыты в публикации заявки на патент США № 2010/0173394 A1, опубликованной 8 июля 2010 года, которая включена в настоящее раскрытие посредством ссылки.
D. Инкубация
После формирования капель или капсул, капли или капсулы могут инкубировать при выбранной температуре или температурах. Например, капли или капсулы могут инкубировать при одной или более температурах, подходящих для роста микроорганизмов, лизиса, ферментативной обработки колориметрического или флуорогенного субстрата или обнаружения нуклеиновой кислоты, или комбинации указанного. Флуорогенные субстраты подвергаются внутримолекулярной альдольной конденсации после расщепления ферментом микроорганизма-мишени, получая в результате этого флуоресцентное индикаторное соединение. Типичная температура роста микроорганизмов включает, но не ограничивается указанным, 20°C, 25°C, 30°C, 35°C, 37°C, 40°C, 41°C, 41,5°C, 42°C, 43°С, 44°С, 45°С или 50°С. В некоторых случаях температуру роста микроорганизмов оптимизируют для конкретного микроорганизма-мишени или класса микроорганизмов-мишеней. Например, если микроорганизмом-мишенью является E. coli, то температура роста микробов может составлять 37°C. Альтернативно, могут выбирать целевую температуру роста микроорганизмов, которая подходит для роста нескольких микроорганизмов, имеющих несколько разных оптимальных температур роста. Например, рост дрожжей, плесени и бактерий можно анализировать одновременно, используя температуру роста микробов 25°C, 30°C, 35°C или 37°C.
Капли или капсулы могут инкубировать при температуре микробного роста в течение выбранного количества периодов удвоения. Авторы настоящего изобретения неожиданно обнаружили, что описанные в настоящем раскрытии способы и композиции могут обеспечить точные значения количества микробов или результаты восприимчивости к противомикробным препаратам до того, как пройдет время удвоения, или после относительно небольшого количества периодов удвоения (например, 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40 или 45; 5-45, 10-40, 15-30, 20-25, 10-20, 10-15 или 5-15), что позволяет проводить быстрый анализ по сравнению со стандартным культивированием в методиках, основанных на жидкости (бульоне) и/или посеве. Специалисту в данной области техники будет понятно, что микроорганизм-мишень, который инкубируют в течение выбранного количества периодов удвоения при температуре роста микроорганизмов, не обязательно удваивается по количеству выбранное число раз вследствие наличия латентной фазы, фазы ускорения, экспоненциальной фазы, стационарной фазы, фазы замедления, фазы смерти или их комбинации, которые обычно демонстрируют микроорганизмы.
Такие выбранные количества периодов удвоения могут соответствовать, по меньшей мере, около 15 мин, 20 мин, 30 мин,... 1 ч, 2 ч, 3 ч, 4 ч, 5 ч, 6 ч, 7 ч, 8 ч, 9 ч, 10 ч, 11 ч, 12 ч, 13 ч, 14 ч, 15 ч, 16 ч, 17 ч, 18 ч, 19 ч, 20 ч, 21 ч, 22 ч, 23 ч, 24 ч, 25 ч, 26 ч, 27 ч, 28 ч, 29 ч, 30 ч, 32 ч, 34 ч, 36 ч, 38 ч, 40 ч, 44 ч, 48 ч, 52 ч, 58 ч, 60 ч, 66 ч или 72 ч.
Выбранное количество периодов удвоения может соответствовать:
по меньшей мере, от около 4 часов и не более чем около 16 часов, или по меньшей мере, от около 4 часов и не более чем около 8 часов, когда микроорганизмами-мишенями являются бактерии;
по меньшей мере, от около 6 часов и не более чем около 12 часов, или по меньшей мере, от около 8 часов и не более чем около 12 часов, когда микроорганизмами-мишенями являются дрожжи; и
по меньшей мере, от около 8 часов и не более чем около 36 часов, или, по меньшей мере, от около 8 часов и не более чем около 24 часов, когда микроорганизмами-мишенями являются плесени.
от около 2 часов до около 8 часов, от 2 часов до около 6 часов, от около 4 часов до около 8 часов или от около 4 часов до около 12 часов для быстрорастущего микроорганизма, такого как E. coli, при или вблизи оптимальной температуры роста, такой как 37°С;
от около 4 ч до около 12 ч, от около 4 ч до около 16 ч, от около 4 ч до около 18 ч, от около 4 ч до около 24 ч, от около 4 ч до около 48 ч, от около 6 ч до около 12 ч, от около 6 ч до около 16 ч, от около 6 ч до около 18 ч, от около 6 ч до около 24 ч, от около 6 ч до около 48 ч, от около 8 ч до около 16 ч, от около 8 часов до около 18 часов, от около 8 часов до около 24 часов или от около 8 часов до около 48 часов для растущего более медленно микроорганизма, такого как Listeria spp. при или вблизи оптимальной температуры роста, такой как 37°С;
от около 4 ч до около 12 ч, от около 6 ч до около 12 ч, от около 6 ч до около 16 ч, от около 6 ч до около 18 ч, от около 6 ч до около 24 ч, от около 6 ч до около 48 ч, от около 8 ч до около 12 ч, от около 8 ч до около 16 ч, от около 8 ч до около 18 ч, от около 8 ч до около 24 ч, от около 8 ч до около 48 ч, от около 12 часов до около 16 часов, от около 12 часов до около 18 часов, от около 12 часов до около 24 часов или от около 12 до около 48 часов для дрожжей или плесени.
В некоторых случаях, после инкубации при температуре микробного роста, капли или капсулы инкубируют при второй температуре. Вторая температура может быть ниже (например, 4°C) для кратковременного хранения. Вторая температура может быть выше (например, 65°C или 95°C) для образования капсул, лизирования микроорганизмов-мишеней, высвобождения нуклеиновой кислоты и/или инициирования амплификации и/или детектирования посредством термоциклирования. В некоторых случаях после инкубации при температуре роста микробов капли или капсулы инкубируют при температуре, выбранной для флуорогенного или колориметрического детектирования фермента, который по существу не является активным в отношении флуорогенного или колориметрического субстрата при температуре роста микроорганизмов. Альтернативно, фермент может являться активным при температуре роста микроорганизмов, и дополнительные температуры инкубации не требуются. В некоторых случаях, хотя фермент может быть активен при температуре роста микроорганизмов, он изолируется внутри клеток микроорганизма-мишени. В таких случаях этап высокотемпературной инкубации после микробного роста могут выполнять с целью выделения фракции фермента для последующего обнаружения.
E. Обнаружение
Наличие или отсутствие микроорганизмов-мишеней во множестве капель или капсул может быть обнаружено с помощью различных способов. Например, изобретатели неожиданно обнаружили, что капли, содержащие микроорганизмы-мишени в концентрации выше пороговой (например, после инкубации капель в течение подходящего количества периодов удвоения или делений микроорганизма-мишени), демонстрируют детектируемую автофлуоресценцию. Поэтому после инкубации при температуре роста микроорганизмов капли могут быть проанализированы на наличие или отсутствие автофлуоресценции, при этом автофлуоресценция указывает на наличие микроорганизма-мишени.
В некоторых случаях обнаружение может представлять собой обнаружение мутности в каплях. Таким образом, капли, в которых произошло существенное деление инкапсулированных микроорганизмов, могут быть обнаружены. В некоторых случаях обнаружение может представлять собой обнаружение флуоресценции или абсорбции флуорофора или хромофора. Например, расщепление флуорогенного или колориметрического субстрата, такого как один из субстратов из таблицы I, может быть обнаружено путем обнаружения капель, которые демонстрируют характерную абсорбцию или флуоресценцию. В качестве другого примера можно использовать флуорогенные зонды или интеркалирующие красители, чтобы, соответственно, обнаруживать наличие или отсутствие последовательности нуклеиновой кислоты или двухцепочечной нуклеиновой кислоты в целом. В качестве еще одного примера, чувствительный к рН хромофор или флуорофор может быть использован для обнаружения наличия или отсутствия изменения рН в каплях, что указывает на наличие или отсутствие микроорганизмов-мишеней в каплях, соответственно. В других вариантах осуществления детектируемую молекулу, которая специфично связывает представляющий интерес микроорганизм, используют для определения наличия или отсутствия микроорганизма. Такой детектируемый фрагмент может представлять собой меченый белок (например, антитело, лектин, фибриноген). Такие маркеры могут использовать с применением и без применения лизирующих агентов.
Обычно капли идентифицируют как положительные или отрицательные. Положительными являются капли, которые содержат микроорганизмы или содержат количество микроорганизмов, превышающее пороговое, и отрицательными являются капли, которые не содержат микроорганизмов или содержат количество микроорганизмов ниже порогового. В некоторых анализах капли анализируют до и после инкубации. В таком анализе положительными являются капли, количество микроорганизмов в которых выросло относительно исходного анализа, и отрицательными являются капли, количество микроорганизмов в которых не выросло относительно исходного анализа. Анализ могут выполнять вручную, например, с помощью оптического микроскопа, или в автоматическом режиме. В некоторых случаях автоматическое обнаружение выполняют посредством последовательного прохождения капель через область обнаружения, сконфигурированную для обнаружения поглощения, передачи или излучения (например, флуоресценции) на одной или нескольких длинах волн. В некоторых случаях разделяющую жидкость добавляют к каплям, протекающим по каналу в область обнаружения, которая размещена функционально относительно детектора и/или источника света возбуждения. В некоторых случаях автоматическое обнаружение выполняют с помощью высокопроизводительной системы подсчета трехмерных частиц в объеме капель, как описано в Nature Communications 5, номер статьи: 5427, doi: 10.1038/ncomms6427, 13 ноября 2014. Например, высокопроизводительный подсчет трехмерных частиц могут применять для обнаружения одной флуоресцентной капли в пуле объемом несколько миллилитров, содержащем нефлуоресцирующие капли.
Образец могут анализировать в отношении общей микробной нагрузки, общей бактериальной нагрузки, суммарного количества колиформных бактерий, дрожжей, плесени, или комбинации указанного. Альтернативно, определенные микроорганизмы идентифицируют и, необязательно, определяют их количество.
F. Определение количества микроорганизмов
После того, как капли будут проверены на наличие или отсутствие микроорганизмов, в результате чего будет получено количество положительных капель и количество отрицательных капель, данные могут быть проанализированы для определения количественного результата, например, микробной нагрузки образца матрицы пищевых продуктов, или наличия микроорганизма-мишени в клиническом образце. В некоторых случаях долю положительных капель (то есть, отношение количества положительных капель к общему количеству капель) рассчитывают по количеству положительных и отрицательных капель. В некоторых случаях долю корректируют путем подгонки доли к распределению Пуассона. Оценки коррекции Пуассона предполагают, что микроорганизмы-мишени случайным образом разбиваются на капли во время образования капель, и поэтому несколько микроорганизмов-мишеней могут попадать в одну каплю с конечной зависимой от концентрации и поддающейся оценке вероятностью. В некоторых случаях значение ln(1-p), где p-доля положительных капель, определяет количество микроорганизмов-мишеней на каплю и, следовательно, количество микроорганизмов-мишеней в образце, из которого были сгенерированы капли.
IV. Наборы
В настоящем раскрытии описаны наборы для подсчета одного или нескольких микроорганизмов-мишеней, определения чувствительности микроорганизма-мишени к противомикробным препаратам, или комбинации указанного. Наборы могут включать в себя реагенты неводной фазы для образования двухфазных капель и/или капель с оболочками, такие как масло (например, фтористое масло) и неводный сурфактант (например, фторсурфактант или смесь, содержащую один или более фторсурфактантов). Набор может включать в себя реагенты водной фазы, такие как формирующие оболочку компоненты (например, BSA). Дополнительные или альтернативные реагенты водной фазы включают водный сурфактант (например, неионный нефторированный сурфактант или смесь, содержащую неионный нефторированный сурфактант). Набор может включать в себя реагенты масляной фазы, такие как противогрибковые агенты (например, диклоран, розовый бенгальский и/или хитозан). Набор может включать в себя реагенты обнаружения, включая, но не ограничиваясь указанным, один или более субстратов ферментов из таблицы I, интеркалирующий краситель, антитело, лектин, фибриноген или зонд нуклеиновой кислоты. Набор может включать в себя один или более контрольных микроорганизмов. Набор может включать в себя один или более тестовых противомикробных препаратов. Набор может включать в себя инструкции для выполнения описанных в настоящем раскрытии способов.
Примеры
Пример I: Обнаружение восприимчивости к противомикробным препаратам
Материалы и методы
Штаммы с хорошо охарактеризованными минимальными подавляющими концентрациями (МПК) к широкому ряду препаратов (CLSI: M100S21 Performance standards for antimicrobial susceptibility testing; twenty-first informational supplement, Wayne, PA:. Институт клинических и лабораторных стандартов; 2011) были выбранных из изолятов, полученных из Американской коллекции типовых культур (ATCC®). Они включали Escherichia coli (ATCC®25922TM), Staphylococcus aureus (ATCC®29212TM), Enterococcus faecalis (ATCC®29212TM) и Candida albicans (ATCC®24433TM). Был изучен другой штамм S. aureus ATCC®43300, для которого МПК не была охарактеризована в документе CLSI, но была определена Витте и соавт. (Clin Microbiol Infect 2007, 13: 408-412). Известно, что этот штамм несет гетерогенный резистентный фенотип, и его использовали также с индукцией или без индукции цефалоспоринами.
Каждый штамм хранили замороженным на -80°C. За исключением тех случаев, когда это указано, после ночного культивирования в трипто-казеин-соевом бульоне (TCS; Bio-Rad, Marnes la Coquette, Франция) все штаммы бактерий начинали с одной и той же скорректированной мутности, которая была эквивалентна 1:100 из 0,5 McFarland в TCS. Для Candida albicans исходная мутность была эквивалентна 1:10 0,1 McFarland.
Тестирование восприимчивости
Капли были получены в соответствии с инструкциями производителя (Bio-Rad) с использованием масла для генерации капель QX200™ для EvaGreen (+сурфактант) с параметрами смешивания, настроенными по объему образца и приблизительному количеству микроорганизмов. Культуры со скорректированной мутностью разводили в реагентах водной фазы с известной концентрацией антибиотиков или противогрибковых агентов в соотношении 1:1 TCS-культуры к водным фазам (объем/объем, 10 мкл/10 мкл).
Протестированные антибиотики и противогрибковые средства включали цефокситин, пиперациллин, налидиксовую кислоту, тетрациклин, ванкомицин, триметоприм, нитрофурантоин, колистин, нитрофуран, хлорамфеникол, гентамицин, амфотерицин В, флуконазол.
Как только были получены капли, картриджи, защищенные клейкой пленкой, непосредственно инкубировали при 37°С (при 30°C для C. albicans).
После 4 и 6 часов инкубации капли пипетировали и вводили в пластинки для подсчета клеток (Bio-Rad). Затем микроорганизмы наблюдали в каплях с использованием микроскопа (объектив 100x или 400x). Регистрировали приблизительное количество капель, несущих микроорганизмы, в процессе их роста внутри капель.
Минимальную подавляющую концентрацию (МПК) определяли как самую низкую концентрацию противомикробного препарата, которая предотвращала видимый рост микроорганизма (то есть, с помощью микроскопа наблюдалось полное отсутствие бактерий или полное отсутствие роста грибов в каплях).
Результаты
I. E. coli ATCC®25922
1 - пиперациллин: ожидаемая МПК (CLSI): 1-4 мг/л
Наблюдаемая МПК: 2 мг/л
2 - налидиксовая кислота: Ожидаемая МПК (CLSI): 1-4 мг/л
Наблюдаемая МПК: 4 мг/л
3 - Тетрациклин: ожидаемая МПК (CLSI): 0,5-2 мг/л
Наблюдаемая МПК: 0,5 мг/л
4 - триметоприм: ожидаемая МПК (CLSI): 0,5-2 мг/л
Наблюдаемая МПК: 1 мг/л (4 ч) или 2 мг/л (6 ч)
5 - колистин: ожидаемая МПК (CLSI): 0,5-2 мг/л
Концентрация антибиотика
Наблюдаемая МПК: 1 мг/л
6 - нитрофуран: ожидаемая МПК (CLSI): 4-16 мг/л
Концентрация антибиотика
Наблюдаемая МПК: 8 мг/л
7 - Хлорамфеникол: Ожидаемая МПК (CLSI): 2-8 мг/л
Концентрация антибиотика
Наблюдаемая МПК: 2-4 мг/л
8 - Гентамицин: ожидаемая МПК (CLSI): 0,25-1 мг/л
Концентрация антибиотика
Наблюдаемая МПК: 2 мг/л
II. S. aureus ATCC®29213 TM
1 - ванкомицин: ожидаемая МПК (CLSI): 0,25-1 мг/л
Концентрация антибиотика
Наблюдаемая МПК: 1 мг/л
2 - цефокситин: Ожидаемая МПК (CLSI): 1-4 мг/л
Концентрация антибиотика
Наблюдаемая МПК: 2 мг/л
III. E. faecalis ATCC®29212 TM
1-ванкомицин: ожидаемая МПК (CLSI): 1-4 мг/л
Концентрация антибиотика
Наблюдаемая МПК: 1- 2 мг/л
IV C. albicans ATCC®24433 TM
1 - Амфотерицин B: ожидаемая МПК (CLSI): 0,25-1 мг/л
Концентрация антибиотика
Наблюдаемая МПК: 2- 4 мг/л
2 - Флуконазол: ожидаемая МПК (CLSI): 0,25-1 мг/л
Концентрация антибиотика
Наблюдаемая МПК: 8 мг/л
V. S. aureus ATCC®43300TM:
Ожидаемая МПК (JCM): 16-32 мг/л
Индуцирование резистентности проводили путем инокуляции этого штамма на MRSASELECTII (Bio-Rad) с последующим инкубированием в течение ночи. Колонии собирали для выполнения суспендирования бактерий в TCS.
Концентрация антибиотика
Наблюдаемая МПК: 2-4 мг/л с использованием неиндуцированного штамма
Концентрация антибиотика
Наблюдаемая МПК: 16-32 мг/л с индуцированным штаммом
Как показано в приведенных выше результатах, МПК для ряда протестированных противомикробных препаратов может быть точно и быстро определена для различных микроорганизмов-мишеней с использованием композиций и способов на основе капель типа "вода-в-масле", описанных в настоящем раскрытии.
Пример II: Подсчет микроорганизмов
1. Инкапсуляция и рост
Цель: исследовать, i) могут ли бактериальные клетки быть инкапсулированы в форме капель с использованием химического состава капель типа "вода-в-масле", ii) могут ли бактериальные клетки расти внутри капель и iii) могут ли бактериальные клетки метаболизировать субстрат в каплях с генерацией флуоресцентного сигнала. Для этой цели чистую культуру клеток Escherichia coli инкапсулировали в каплю в присутствии 4-метилумбеллиферил-β-D-глюкуронида и инкубировали при 37°C в течение различных периодов времени. Затем капли наблюдали с помощью либо видимой, либо флуоресцентной микроскопии.
Материалы и методы:
E. coli ATCC 25922 выращивали в триптон-соевом бульоне.
Культуру разбавляли, чтобы получить:
Культуру капель: 105 КОЕ/мл бактериальной суспензии в буферизованной пептонной воде, дополненной 4-метилбуллиферил-β-D-глюкуронидом (100 мг/л) и Pluronic F-98 (1%). 20 мкл данной суспензии смешивали с 50 мкл масла для генерации капель QX200™ для EvaGreen (+сурфактант) (поставляется Bio-Rad Laboratories) с системой генератора капель Bio-Rad. Затем капли переносили в 96-луночный микропланшет.
Полная реакция: бактериальная суспензия 50 КОЕ/мл в 5 мл буферизованной пептонной воды, дополненная 4-метилбуллиферил-β-D-глюкуронидом (100 мг/л) и Pluronic F-98 (1%).
Оба микропланшета и трубки инкубировали при 37±1°С в течение 24 часов.
После 0, 4, 6, 8 и 24 часов инкубации:
Образец капель наблюдали с помощью устройства для флуоресцентной визуализации клеток ZOE (Bio-Rad) в видимом канале и синем флуоресцентном канале.
Образец капель тестировали с помощью считывателя капель Bio-Rad QX200.
В то же время пробирку объемом 5 мл наблюдали под ультрафиолетовым светом с использованием лампы Wood на 365 нм.
Результаты: Как показано на фиг. 1, бактериальный рост можно обнаружить через 6 часов после инкапсуляции. За ростом можно следить либо путем непосредственного наблюдения капель, заполненных бактериями, либо по синему флуоресцентному излучению. Контрольные эксперименты без субстрата MUG (не показаны), а также эксперименты с другими бактериями (см. 4) показали, что данная синяя флуоресценция обусловлена автофлуоресценцией капли, заполненной бактериями. Субстрат, вероятно, вымывался в масляную фазу. Напротив, метаболизм субстрата наблюдался в полной реакции (не показан). Это отсутствие метаболизма было подтверждено с помощью Listeria, Тем не менее, этот эксперимент показал, что в течение короткого времени можно инкапсулировать и вырастить бактерии в каплях. Явление автофлуоресценции в каплях ранее не описывалось.
2. Матрицы пищевых продуктов
Цель: исследовать, является ли генерация капель совместимой с суспензией, полученной из матрицы пищевоых продуктов, разведенной в 10 раз в буферизованной пептонной воде. Для эксперимента по проверке концепции использовали несколько матриц.
Материалы и методы:
25 г матрицы пищевых продуктов (говяжий фарш с 5% и 15% жира, ветчина, сырое молоко, камамбер из сырого молока и тертая морковь) взвешивали в мешке гомогенизатора Stomacher, содержащем фильтр 280 мкм.
В мешок добавляли 225 мл буферизованной пептоновой воды, дополненной 4-метиламбеллиферил-β-D-глюкуронидом (100 мг/л) и Pluronic F-98 (1%).
Образец пищевых продуктов суспендировали в бульоне, используя систему Stomacher, в течение 2 минут.
20 мкл пищевой суспензии смешивали с 50 мкл масла для генерации капель QX200™ для EvaGreen (+сурфактант) с помощью системы генерации капель Bio-Rad.
Пищевые суспензии и полученные капли наблюдали с помощью с помощью устройства для флуоресцентной визуализации клеток ZOE в видимом канале.
Результаты: Визуальный осмотр капель (микроскопия в видимом канале) показал, что капли фактически генерировались независимо от матрицы пищевых продуктов. Все капли были однородными по размеру, и их стабильность с течением времени была сопоставимой. Этот результат показал, что стандартный протокол для подготовки образцов из матриц пищевых продуктов является совместимым с генерацией капель в пределах матриц, проверенных до настоящего момента (фиг. 2).
3. Время до получения результата
Цель: определить, может ли рост бактерий, инкапсулированных из суспензии пищевых продуктов, быть обнаружен быстрее, чем когда ту же самую суспензию высевают штрихом на чашках Петри. Для этой цели матрицу ветчины загрязняли E. coli, и образец гомогенизированной матрицы либо инкапсулировали, либо высеивали на чашке Петри перед инкубацией при 37°C в течение различных перидов времени.
Материалы и методы:
25 г ветчины суспендировали в 225 мл буферизованной пептонной воды и Pluronic F-98 (1%) в мешке Stomacher с фильтром 280 мкм с использованием системы Stomacher в течение 2 минут.
Ночную культуру из E.coli ATCC 25922 в триптон-соевом бульоне разводили для того, чтобы внести ее в суспензию ветчины на уровне 105 КОЕ/мл.
20 мкл этой суспензии смешивали с 50 мкл масла для генерации капель QX200™ для EvaGreen (+сурфактант) с помощью системы для генерации капель Bio-Rad. Капли переносили в микропланшет Эппендорф.
Проводили последовательные разведения суспензии ветчины и наносили их на агар TBX.
Микропланшет Эппендорф и пластины TBX инкубировали при 37±1°C в течение 24 часов.
После 0, 4, 6, 8 и 24 часов инкубации:
o образец капель наблюдали с помощью с помощью устройства для флуоресцентной визуализации клеток ZOE (Bio-Rad) в видимом канале и синем флуоресцентном канале.
o образец капель тестировали с помощью считывателя капель Bio-Rad QX200.
В то же время наблюдали пластины агара TBX.
Результаты: Рост бактерий, инкапсулированных в форме капель, было легко обнаружить либо посредством микроскопии в видимом канале, либо посредством флуоресцентной микроскопии вследствие явления автофлуоресценции, описанного выше. Бактерии были обнаружены уже через 6 ч после инкапсуляции, тогда как колонии не были обнаружены до 24 ч на чашке Петри. Прямой визуальный подсчет положительных капель или считывание положительных капель с помощью считывателя QX дало оценку, близкую к ожидаемому числу бактерий, и соответствовало визуальному подсчету на чашке Петри. В целом эти результаты показали, что инкапсуляцию капель можно использовать для подсчета бактерий, присутствующих в суспензии образца пищевых продуктов (фиг. 3).
4. Другие бактерии, дрожжи и плесени
Цель: доказать, что принцип раннего выявления бактериального роста в капле может быть распространен и на другие бактерии и микроорганизмы.
Материалы и методы (бактерии и дрожжи):
Enterobacter cloacae ATCC 13047, Enterobacter aerogenes ATCC 13048, Citrobacter freundii ATCC 8090, Bacillus subtilis ATCC 6633, Staphylococcus aureus ATCC 25923 и Candida albicans ATCC 10231 выращивали в течение ночи в триптон-соевом бульоне.
Затем культуры разводили с получением суспензии 105 КОЕ/мл в буферизованной пептонной воде, дополненной Pluronic F-98 (1%). 20 мкл этих суспензий смешивали с 50 мкл масла для генерации капель QX200™ для Eva Green (+сурфактант) с помощью системы генерации капель Bio-Rad. Полученные капли переносили в лунку микропланшета Эппендорф.
Микропланшет инкубировали при 37±1°С в течение 24 часов.
После 0, 4, 6, 8 и 24 часов инкубации:
образец капель наблюдали с помощью с помощью устройства для флуоресцентной визуализации клеток ZOE (Bio-Rad) в видимом канале и синем флуоресцентном канале.
подсчет в образце капель осуществляли с помощью считывателя капель Bio-Rad QX200.
Результаты: Все бактерии (грамотрицательные, а также грамположительные) и дрожжи можно обнаружить посредством визуального осмотра капель в пределах различных периодов времени после инкапсуляции (см. фиг. 4 и 5.). Была обнаружена автофлуоресценция, хотя и с различной интенсивностью. Enterobacteriaceae давали сильную автофлуоресценцию в течение 8 часов, тогда как для получения аналогичного сигнала для Bacillus subtilis потребовалось 24 часа. Staphylococcus aureus давал слабый сигнал, а Listeria (см. также 6) не давала сигнала флуоресценции. Все микроорганизмы могли быть подсчитаны с использованием считывателя QX200, хотя интенсивности положительных капель варьируют в зависимости от интенсивности аутофлуоресценции (см. фиг. 6 и 7).
Материалы и методы (плесень):
Aspergillus niger T646 (внутренний номер коллекции штаммов Bio-Rad) выращивали в течение 5 дней на агаре сабуро.
Затем споры собирали петлей и суспендировали в буферизованной пептонной воде.
Суспензию спор разбавляли с получением суспензии спор 105 КОЕ/мл в буферизованной пептонной воде, дополненной Pluronic F-98 (1%). 20 мкл этих суспензий смешивали с 50 мкл QX200™ масла для генерации капель для EvaGreen (+сурфактант) с помощью системы для генерации капель Bio-Rad. Полученные капли переносили в лунку микропланшета Эппендорф.
Микропланшет инкубировали при 37±1°С в течение 24 часов.
После 0, 4, 6, 8 и 24 часов инкубации:
Образец капель наблюдали с помощью устройства для флуоресцентной визуализации клеток ZOE (Bio-Rad) в видимом канале и синем флуоресцентном канале.
образец капель тестировали с помощью считывателя капель Bio-Rad QX200.
Результаты: можно было наблюдать рост плесени в каплях, хотя, в отличие от бактерий и дрожжей, выращивание плесени привело к наблюдаемому объему слияния капель, вероятно, вследствие выступания гиф через мембрану капель (фиг. 5). Альтернативные химические составы капель можно использовать для предотвращения этого эффекта слияния. Рост плесени вызывал слабую, но обнаруживаемую автофлуоресценцию.
5. Виды Listeria
Цель: Listeria является медленно растущей бактерией. Данный эксперимент был проведен с целью определения, может ли рост Listeria в каплях быть обнаружен в течение 24 ч. Кроме того, мы также изучили, можно ли использовать конкретный субстрат для обнаружения. Три вида Listeria смешивали вместе, чтобы представить популяции Listeria spp., и выращивали в каплях в присутствии 4-метилумбеллиферил-β-D-глюкозида.
Материалы и методы:
Listeria monocytogenes ATCC 13932, Listeria innocua ATCC 33090 и Listeria grayi ATCC 19120 выращивали в течение ночи в триптон-соевом бульоне.
Затем культуры разводили с получением:
105 КОЕ/мл бактериальной суспензии в буферизованной пептонной воде, дополненной 4-метилумбеллиферил-β-D-глюкозидом (100 мг/л) и Pluronic F-98 (1%). 20 мкл этой суспензии смешивали с 50 мкл QX200™ масла для генерации капель для EvaGreen (+сурфактант) с помощью системы генерации капель Bio-Rad QX200™. Полученные капли переносили в лунку микропланшета.
50 КОЕ/мл бактериальной суспензии в 5 мл буферизованной пептонной воды, дополненной 4-метилумбеллиферил-β-D-глюкозидом (100 мг/л) и Pluronic F-98 (1%).
Микропланшет и пробирки инкубировали при 37±1°С в течение 24 часов.
После 0, 4, 6, 8 и 24 часов инкубации:
Образец капель наблюдали с помощью устройства для флуоресцентной визуализации клеток ZOE (Bio-Rad) в видимом канале и синем флуоресцентном канале.
образец капель тестировали с помощью считывателя капель Bio-Rad QX200.
В то же время пробирку объемом 5 мл наблюдали под ультрафиолетовым светом с использованием лампы Wood на 365 нм.
Результаты: как показано на фиг. 4, нижняя правая панель, бактериальный рост можно обнаружить в течение 24 часов путем непосредственного наблюдения капель, заполненных бактериями. Флуоресценции не было обнаружено, что указывает на то, что i) автофлуоресценция не была вызвана в результате роста Listeria и ii) субстрат MUG не метаболизировался или не был достаточно метаболизирован для того, чтобы выявить детектируемый сигнал, как уже отмечалось для E. coli. Вероятно, рост может быть обнаружен за более короткое время при оптимизированных условиях. Более чувствительные субстраты можно легко проверить. Кроме того, данный эксперимент проводили со средой, которая не оптимизирована для роста Listeria. Для специализированного бульона можно ожидать лучших результатов.
6. Использование субстрата ALDOL® для обнаружения колиформных бактерий (E. coli)
Цель: зеленый флуоресцентный субстрат, специфичный для экспрессирующих бета-галактозидазу колиформ, таких как E.coli, использовали для оценки, могут ли альтернативные субстраты работать лучше, чем MUG.
Материалы и методы (бактерии и дрожжи):
E. coli АТСС 25922 выращивали в течение ночи в триптон-соевом бульоне.
Культуру разводили с получением 105 КОЕ/мл бактериальной суспензии в буферизованной пептонной воде, дополненной Aldol® 458-β-D-галактозидом (100 мг/л) и Pluronic F-98 (1%). 20 мкл этой суспензии смешивали с 50 мкл QX200™ масла для генерации капель для EvaGreen (+сурфактант) с помощью системы генерации капель Bio-Rad QX200™. Полученные капли переносили на микропланшет.
Микропланшет инкубировали при 37±1° С в течение 24 часов.
После 0, 4, 6, 8 и 24 часов инкубации:
образец капель наблюдали с помощью устройства для флуоресцентной визуализации клеток ZOE (Bio-Rad) в видимом канале и зеленом флуоресцентном канале.
образец капель тестировали с помощью считывателя капель Bio-Rad QX200.
Результаты: через 6 ч можно было наблюдать ясный зеленый флуоресцентный сигнал (см. 8). Этот сигнал отличался от синей флуоресценции, полученной в аналогичных условиях в отсутствие субстрата. Флуоресценцию можно было считывать в канале FAM считывателя QX (не показано), и она была более сильной, чем синяя автофлуоресценция, тем самым демонстрируя, что специфичный субстрат можно использовать для идентификации бактерий в каплях.
7. Обнаружение микроорганизмов с использованием антитела в качестве маркера
Антитело против Candida Ас EBCA1 (Bio-Rad Laboratories), которое распознает C. albicans, метили с использованием набора Lynx LNK024RPE (ABD Serotec). После ночного культивирования в агаре сабуро (Bio-Rad Laboratories) капли сначала получали путем добавления смеси (об./об.) C. albicans ATCC®24433TM (1McFarland) к разведениям конъюгата в соотношении 1/25 до 1/200. Образцы считывали с помощью устройства для флуоресцентной визуализации клеток ZOETM (Bio-Rad Laboratories). На фиг. 9A и 9B показана явная флуоресценция при (T0) с использованием инокулята, эквивалентного смеси 1McFarland и конъюгата в соотношении 1/200.
В дополнительном эксперименте капли получали путем добавления смеси (об./об.) восстановленного инокулята C. albicans ATCC®24433TM (0,1 McFarland) и разведений конъюгата в соотношении от 1/25 до 1/200, а затем инкубировали при 30°С. Образцы считывали с помощью устройства для флуоресцентной визуализации клеток ZOETM (Bio-Rad Laboratories) через 5 часов или 24 часа. На фиг. 10A-10C приведены изображения инокулята, эквивалентного смеси 0,1 McFarland и конъюгата в соотношении 1/200 после 5 часов. На фиг. 11A-11C приведены изображения инокулята, эквивалентного смеси 0,1 McFarland и конъюгата в соотношении 1/200 после 24 часов.
С. parapsilosis (ATCC®22019 ТМ), с которым антитело не связывается специфично, исследовали таким же образом, как C. albicans выше. На фиг. 12A и 12B приведены изображения инокулята, эквивалентного смеси 1 McFarland и конъюгата в соотношении 1/200 при T0. Никаких микроорганизмов не видно, как и можно было ожидать, поскольку антитело не связывает специфично C. parapsilosis.
В другом эксперименте антитела против PBP2a (клон M0071933 Biosource), который распознает PBP2a, указывающий на устойчивость к метициллину у Staphylococcus aureus (SA), было помечено с использованием Kit Lynx LNK174PETR (ABD Serotec). После ночного культивирования на планшетах с кровяным агаром (Bio-Rad Laboratories) капли сначала получали путем добавления колоний каждого из 4 тестируемых штаммов MSSA и MRSA (1/50 0,5 McFarland, что эквивалентно приблизительно 1-10 бактериальным клеткам в 20 капель) к конъюгату в соотношении 1/200, и дополняли бычьим сывороточным альбумином (BSA) +/- цефокситин (FOX в концентрации 0 или 2 мг/л) в бульоне. После инкубации при 37°С в течение 3 часов образцы считывали с помощью устройства для флуоресцентной визуализации клеток ZOETM (Bio-Rad Laboratories). В приведенных ниже таблицах показан рост (видимый) и метки (флуоресценция), полученные для тестируемых штаммов MSSA и MRSA.
ATCC 6538
ATCC 29213
ATCC 49476
ATCC BAA 2312
ATCC 6538
ATCC 29213
ATCC 49476
BN (+)
ATCC BAA 2312
BSA был добавлен к бульону, чтобы увеличить рост и способствовать идентификации штаммов SA. Добавление BSA способствует продуцированию микроколонии бактериальных клеток (то есть, бактериальные клетки образуют кластер, а не являются одиночными), которая, в свою очередь, излучает более сильный сигнал обнаружения, тем самым способствуя обнаружению микроорганизма.
Антитело позволяло обнаружить как MRSA, так и MSSA, когда оно должно было быть специфичным для MRSA, затем добавляли FOX для специфичного ингибирования роста MSSA и получения флуоресцентного сигнала, ограниченного MRSA. Фоновый шум (BN) наблюдался вследствие флуоресценции, не связанной с бактериальными клетками. Концентрация антитела может быть скорректирована для уменьшения фоновой флуоресценции.
Результаты показывают, что MRSA может быть обнаружен в каплях даже при низкой концентрации в течение 3 часов с использованием комбинации меченого антитела, BSA и цефамицина.
8. Обнаружение микроорганизмов с использованием фибриногена в качестве маркера
Фибриноген (Sigma Aldrich), который связывается с Staphylococcus aureus (клетки S. aureus экспрессируют поверхностные белки, которые способствуют прикреплению к белкам хозяина, таким как фибронектин), метили с использованием набора Lynx LNK174PETR (ABD Serotec). После ночного культивирования на планшетах с кровяным агаром (Bio-Rad Laboratories) капли сначала получали путем добавления суспензии колоний каждого из 4 тестируемых штаммов MSSA и MRSA (1/50 0,5 McFarland, что эквивалентно приблизительно 1-10 бактериальным клеткам в 20 каплях) к конъюгату в соотношении 1/200, и дополняли бычьим сывороточным альбумином (BSA) +/- цефокситин (FOX в концентрации 0 или 2 мг/л) в бульоне. После инкубации при 37°С в течение 3 часов образцы считывали с помощью устройства для флуоресцентной визуализации клеток ZOETM (Bio-Rad Laboratories). В приведенных ниже таблицах показан рост (видимый) и метки (флуоресценция), полученные для тестируемых штаммов MSSA и MRSA.
ATCC 6538
ATCC 29213
ATCC 49476
ATCC BAA 2312
ATCC 6538
ATCC 29213
BN (+)
ATCC 49476
BN (+)
ATCC BAA 2312
Результаты показывают, что MRSA можно обнаружить в каплях даже при низкой концентрации в течение 3 часов с использованием комбинации меченого фибриногена, бычьего сывороточного альбумина и цефамицина.
9. Обнаружение микроорганизмов с использованием интеркалирующего агента в качестве маркера
Приготовляли раствор 1 мг/мл пропидиум иодида («PI» производства Sigma Aldrich), и 400 мкл добавляли в 9 мл бульона TKS (Bio-Rad Laboratories), в который ранее был внесен Staphylococcus aureus ATCC®29213ТМ («SA») при 0,005 McFarland. Для приготовления капель использовали 10 мкл этой смеси с 10 мкл различных концентраций цефокситина («FOX»). Образцы считывали с помощью устройства для флуоресцентной визуализации клеток ZOETM (Bio-Rad Laboratories) в течение периода времени вплоть до 8 часов. Результаты показывают, что PI можно использовать для идентификации наличия или отсутствия определенного микроорганизма в образце без добавления лизирующего агента к реакции.
На фиг. 13А и 13В представлен образец SA+PI без FOX после 6 ч инкубации. На фиг. 14A-14C представлен SA+PI+0,25 мг/л FOX после 6 часов инкубации. На фиг. 15А-15С представлен SA+PI+0,5 мг/л FOX после 6 ч инкубации. На фиг. 16А-16С представлен SA+PI+4 мг/л FOX после 6 часов инкубации. PI вытесняется из жизнеспособных клеток и проникает в клеточные мембраны мертвых или умирающих клеток. Неожиданно, PI пометил все жизнеспособные клетки в этом эксперименте. Интеркалирующие агенты считаются токсичными для роста клеток, поскольку они реагируют с ДНК, блокируя репликацию клеток. Однако посредством исследования мутности бактериальной культуры с течением времени в присутствии и отсутствии PI, авторы обнаружили, что PI допускает рост бактерий или дрожжей и оказывает тольго ограниченное воздействие.
10. Обнаружение микроорганизмов с использованием интеркалирующего агента в качестве маркера и использованием дополнительного этапа нагревания
Цель: определить, позволяет ли использование интеркалирующего агента вместе с дополнительным этапом нагревания усилить флуоресцентный сигнал, обнаруженный из капель, имеющих бактериальные клетки.
Материалы и методы:
В бульон из буферизованной пептонной воды в отсутствие и в присутствии 15 мкМ пропидиум иодида (PI) был внесен Escherichia coli ATCC 25922.
Затем капли производили с помощью генератора капель Bio-Rad QX200™ и масла EvaGreen таким образом, чтобы одна из десяти капель содержала одну бактериальную клетку. Капли переносили в микролунку и инкубировали в течение 24 часов при 37°C.
Часть капель с пропидиум иодидом также нагревали при 90°C в течение 5 минут.
Затем капли визуализировали с помощью устройства для флуоресцентной визуализации клеток ZOETM с использованием канала светлого поля (фиг. 17A-17C) или с красным флуоресцентным фильтром (фиг. 17D-17F).
Результаты: Как показано на фиг. 17A-17C, бактериальный рост (G) наблюдали в буферизованной пептонной воде без PI, с PI, и с PI плюс дополнительный этап нагревания. Однако какой-либо флуоресцентный сигнал не наблюдали ни от одной из капель в отсутствие PI (фиг. 17D). Слабый флуоресцентный сигнал наблюдали из капель, имеющих бактерии и PI (фиг. 17Е), что указывает на то, что PI можно использовать для дифференциации капель, имеющих бактериальный рост, и пустых капель. Как показано на фиг. 17F нагревание капель, имеющих бактерии и PI, при 90°C в течение 5 минут усиливает сигнал флуоресценции.
11. Обнаружение микроорганизмов с использованием pHrodo® Red в качестве индикатора pH
Цель: определить, могут ли микроорганизмы быть обнаружены с помощью pHrodo® Red.
Материалы и методы (бактерии и дрожжи):
В триптон-глюкозный бульон без и с 5 мкМ pHrodo® Red был внесен Escherichia coli ATCC 25922.
Затем капли производили с помощью генератора капель Bio-Rad QX200™ и масла EvaGreen таким образом, чтобы одна из десяти капель содержала одну бактериальную клетку. Капли переносили в микролунку и инкубировали в течение 24 часов при 37°C.
Затем капли визуализировали с помощью устройства для флуоресцентной визуализации клеток ZOETM с использованием канала светлого поля (фиг. 18А и 18С) или с красным флуоресцентным фильтром (фиг. 18В и 18D).
Результаты: при отсутствии pHrodo®Red не наблюдали флуоресценции в каплях, имеющих бактериальный рост G (фиг. 18B). В присутствии pHrodo® Red капли, имеющие бактериальный рост, продуцируют красную флуоресценцию вследствие изменения показателей рН в присутствии кислоты после ферментации глюкозы (фиг. 18D), посредством чего демонстрируется, что индикатор рН может быть использован для идентификации бактерий в каплях.
12. Использование субстрата ALDOL518® для обнаружения колиформных бактерий (Enterobacter aerogenes)
Цель: красный флуоресцентный субстрат, специфичный для экспрессирующих бета-глюкозидазу колиформ, таких как Enterobacter aerogenes АТСС 13048, использовали для оценки, могут ли альтернативные субстраты работать лучше, чем MUG.
Материалы и методы:
В бульон из буферизованной пептонной воды без добавления и с добавлением ALDOL518®-β-гликозида в концентрации 250 мг/л вносили Enterobacter aerogenes АТСС 13048.
Капли производили с помощью генератора капель Bio-Rad QX200™ и масла EvaGreen с получением 10000 бактерий на каплю. Эти капли были затем разведены с каплями, содержащими тот же бульон, но без бактерий. Полученные капли переносили в лунку микропланшета.
Микропланшет инкубировали при 37±1°С в течение 24 часов. Капли визуализировали с помощью устройства для флуоресцентной визуализации клеток ZOETM с использованием канала светлого поля (фиг. 19А и 19В) или с красным флуоресцентным фильтром (фиг. 19С и 19D).
Результаты: в отсутствие ALDOL518®-β-глюкозида не наблюдали флуоресценции в каплях, имеющих рост бактерий (фиг. 19C). В присутствии ALDOL518®-β-глюкозида, β-глюкозидазная активность Enterobacter aerogenes АТСС 13048 гидролизует субстрат и высвобождает флуоресцентное соединение ALDOL, в результате чего капли, имеющие бактериальный рост, продуцируют красную флуоресценцию (фиг. 19D), посредством чего демонстрируется, что специфичный субстрат может быть использован для идентификации бактерий в каплях.
13. Подавление роста плесени за пределами водной фазы капель с использованием диклорана
Цель: определить, подавляет ли добавление противогрибкового агента (например, диклорана) в масляную фазу капель рост плесени вне водной фазы капель.
материалы:
(2,6-дихлор-4-нитроанилин)
(5 (6) -карбоксифлуоресцеиндиацетат)
(Диметилсульфоксид)
- Экстракт дрожжей
- глюкоза
- Хлорамфеникол
20 г/л
0,3 г/л
Методы:
Приготовление базовой суспензии спор
Обычные пищевые штаммы плесени выращивали до состояния спорообразования (как правило, в течение от 5 до 7 дней) на соответствующей культуральной среде при 28°С. Затем споры очищали в 0,05% стерильном растворе Tween 80. Собранные суспензии фильтровали на нескольких слоях сетки, спрессованных для удаления большинства гиф и фрагментов мицелия. При необходимости суспензии выдерживали при перемешивании в темноте и при комнатной температуре до стадии фильтрации для обеспечения оптимального высвобождения спор из грибковых структур. Концентрацию спор определяли в гемоцитометрической камере и/или путем нанесения покрытия на чашки Петри с агаром.
Затем суспензии центрифугировали в течение 5 минут на 10000 оборотов в минуту и удаляли супернатант. Гранулы ресуспендировали с использованием соответствующего объема бульона YGC, содержащего 30% глицерина, и аликвоты хранили при -20°C в течение 6 месяцев.
Подготовка образцов для генерации капель
Аликвоты растапливали при комнатной температуре и промывали один раз в бульоне YGC, чтобы удалить глицерин. Затем споры разбавляли до концентрации 105 спор/мл в бульоне YGC, содержащем 5% сурфактанта Pluronic F68.
Для анализа по обнаружению флуорогенный субстрат CFDA (5(6)-карбоксифлуоресцеин диацетат) добавляли к бульону YGC. Субстрат приготовляли путем растворения 10 мг в 1 мл DMSO (диметилсульфоксида), и 28,75 мкл этого раствора добавляли к 10 мл бульона YGC.
CFDA использовали в конечной концентрации 25 мг/л с учетом 15% фактора разбавления за счет объемов сурфактанта и инокулята.
Добавление диклорана к маслу Eva Green
Базовый раствор диклорана приготовляли в концентрации 40 мг/мл в ацетоне. Базовый раствор затем разбавляли для получения рабочих растворов в соответствии с приведенной ниже таблицей.
10 мкл объем соответствующего рабочего раствора затем добавляли к 2 мл масла для Eva Green с получением целевых конечных концентраций (0,5% об./об.) (см. таблицу ниже).
Генерация и анализ капель
Для генерации капель с использованием генератора капуль QX200ТМ лунки «образец» и «масло» картриджа DG8 заполняли, соответственно, 20 мкл приготовленной суспензии спор (с CFDA или без него) и 70 мкл указанного масла для Eva Green (с диклораном или без него). После процесса генерации эмульсии капель (30-35 мкл/лунку) переносили в 96-луночный планшет Эппендорф и выдерживали на 28°С в течение 24-48 часов. Для проведения анализа эмульсии капель (20 мкл/образец) наблюдали с помощью устройства для флуоресцентной визуализации клеток ZOETM.
Результаты: при отсутствии противогрибкового соединения (контроль) гифы плесени были способны пересечь мембраны капель и распространиться через образец, что приводило к слиянию капель (фиг. 20А). Дальнейший рост приводил к споруляции штамма, и споры можно было случайным образом наблюдать в более крупных каплях (фиг. 20В). В некоторых случаях штаммы продуцировали мицелий, который приводил к засорению на входе пластинки для наблюдения.
Когда диклоран добавляли к маслу для EvaGreen в концентрациях в диапазоне от 40 до 100 мг/л, распространение гиф подавлялось, и рост плесени был ограничен пределами капель. На фиг. 21А-29В показаны примеры подавления распространения плесени диклораном для нескольких обычных пищевых штаммов плесени (например, Fusarium graminearum DSM 1096, Mucor racemosus CECT 20821, Aspergillus restrictus CECT 20807, Penicillium hirsutum ATCC 16025 и Eurotium rubrum CECT 20807). Фиг. 22 и 28 иллюстрируют, каким образом удержание гиф в капле улучшает обнаружение капель, положительных по плесени, когда флуорогенный субстрат CFDA добавляли в бульон YGC. Следует отметить, что, поскольку раствор диклорана был приготовлен в ацетоне, то отсутствие ингибирования штамма только ацетоном (0,5% об./об.) проверяли для каждого протестированного штамма плесени.
14. Подавление роста плесени за пределами водной фазы капель с использованием розового бенгальского или имазалила
Цель: определить, подавляет ли добавление противогрибкового агента (например, бенгальского розового или имазалила) в масляную фазу капель рост плесени вне водной фазы капель.
материалы:
- Экстракт дрожжей
- Глюкоза
- Хлорамфеникол
5 г/л
20 г/л
0,3 г/л
Методы:
Розовый бенгальский растворяли в этаноле и добавляли в масло для Eva Green в концентрации 150 мг/л. Конечная концентрация этанола в масляной фазе составляла 0,5% (об./об.).
Имазалил приготовляли в ацетоне и добавляли в масло для Eva Green в концентрации 0,5 мг/л. Конечная концентрация ацетона в масляной фазе составляла 0,1% (об./об.).
Суспензии спор инкапсулировали в концентрации 105 спор/мл в бульоне YGC с получением соотношения 1 положительной капли (содержащей 1 клетку) из 10. Эмульсии капель готовили с использованием масла для Eva Green с добавлением соответствующего фунгицида.
Затем капли переносили при 28°С в течение 24-48 часов.
После инкубации образцы капель наблюдали с помощью устройства для флуоресцентной визуализации клеток ZOETM.
Следует отметить, что было проверено отсутствие влияния этанола на рост штаммов, использованных для тестирования розового бенгальского, как и отсутствие влияния ацетона на рост штаммов, использованных для тестирования имазалила.
Результаты: при отсутствии противогрибкового соединения (контроль) гифы плесени были способны пересечь мембраны капель и распространиться через образец, что приводило к слиянию капель (фиг. 30А и 31А). Когда 150 мг/л розового бенгальского (фиг. 30В) или 0,5 мг/л имазалила (фиг. 33В) добавляли к маслу для EvaGreen, распространение гиф было подавлено, и рост плесени был ограничен пределами капель.
15. Обнаружение микроорганизмов с использованием лектина в качестве маркера
Раствор 5 мг/мл меченого флуоресцеином конканавалина А ( «ConA» производства ThermoFisher) в бикарбонате натрия разводили в бульоне TCS (Bio-Rad Laboratories) или RPMI, в который ранее были внесены штаммы (1 McFarland для дрожжей и 0,5 McFarland для бактерий), принадлежащие к следующим видам: Candida albicans, C. parapsilosis, C. tropicalis, C. krusei, C. glabrata, Cryptococcus neoformans, Bacillus subtilis, E. coli, S. aureus. 20 мкл этой смеси использовали для приготовления капель, которые были прочитаны с помощью устройства для флуоресцентной визуализации клеток ZOETM (Bio-Rad Laboratories) без инкубации.
Результаты (фиг. 32, 33 и 34 для C. glabrata, C. tropicalis, и Е. coli, соответственно) и приведенная ниже таблица показывают, что Candida (например, C. albicans, С. parapsilosis, С. tropicalis, C. krusei, C. glabrata) могут быть непосредственно и специфично обнаружены, тогда как бактерии, такие как E. coli, не флуоресцируют и не могут быть обнаружены.
В другом анализе с использованием С. krusei, вплоть до 10% крови добавляли до этапа получения капель. Образцы считывали с помощью устройства для флуоресцентной визуализации клеток ZOETM (Bio-Rad Laboratories) при T0. Фиг. 35 представляет собой объединенное изображение видимого изображения и зеленого флуоресцентного изображения для образца. На фиг. 35 эритроциты были серыми, а клетки Candida krusei были зелеными флуоресцентными. Результаты показывают, что ConA можно использовать для специфичного определения присутствия видов Candida в образце, хотя он содержит 10% крови.
16. Образование геля из капель
Цель: определить, предотвращает ли добавление гелеобразующего агента уменьшение размера капель при росте дрожжевых штаммов в каплях.
Материалы:
- Экстракт дрожжей
- Глюкоза
- Хлорамфеникол
5 г/л
20 г/л
0,3 г/л
(вязкость 100-300 сП)
Методы:
В качестве культуральной среды использовали стерильный бульон YGC с добавлением карбоната кальция (0, 0,5 или 1 г/л) и альгината натрия (0, 2,5 или 3,5 г/л).
Клетки Candida albicans ATCC 10231, Saccharomyces cerevisiae DSM 1333 и Debaryomyces hansenii CLIB 197 инкапсулировали, чтобы наблюдать эффективное образования геля из капель.
Капли были получены с помощью масла для Eva Green, содержащего 0,1% (об./об.) уксусной кислоты, если не указано иное.
Эмульсии капель инкубировали в течение 22-48 часов при 28°С и наблюдали с помощью устройства для визуализации клеток ZOETM
Результаты: фиг. 36A-42D иллюстрируют результаты образования геля для капель. На фиг. 36А и 36В показан рост Candida albicans АТСС 10231 в не подергавшейся образованию геля (фиг. 36А) и подвергшейся образованию геля (фиг. 36В) капле после 22 часов инкубации. Гелеобразование достигали путем добавления к культуральному бульону YGC 3,5 г/л альгината натрия и 1 г/л карбоната кальция. Подвергшиеся образованию геля капли не меняли формы. Образование геля наблюдалось только при росте клеток. Клетки демонстрировали движение и рассеяние в не подергавшихся образованию геля каплях. Клетки выглядели внедренными и росли в виде микроколоний в подвергшихся образованию геля каплях.
Для подтверждения того, что присутствие только альгината натрия или только карбоната кальция не вызывает гелеобразование, альгинат натрия и карбонат кальция тестировали отдельно в контрольном анализе с Candida albicans АТСС 10231 (фиг. 37A-37D) или Saccharomyces cerevisiae DSM 1333 (фиг. 38А-38D). На фиг. 37А-37D и фиг. 38А-38D показан рост микроорганизмов в каплях после 24 часов инкубации. Рост микроорганизмов происходил в (A) бульоне YGC; (B) YGC с добавлением 2,5 г/л альгината; (C) YGC с добавлением 0,5 г/л карбоната кальция; или (D) YGC с добавлением 2,5 г/л альгината и 0,5 г/л карбоната кальция. Формирование геля из капель происходило только тогда, когда одновременно присутствовали альгинат натрия и карбонат кальция, о чем свидетельствует образование микроколоний в положительных каплях (фиг. 37D и 38D). В других анализах (фиг. 37А-37С и 38А-38С) клетки были подвижными и рассеянными. Стрелками показаны примеры положительных капель.
На фиг. 39А-39С и 40А-40C показаны результаты экспериментов с использованием подкисляющих и не подкисляющих дрожжевых штаммов и без добавления уксусной кислоты в масляную фазу. Фиг. 39А и 40А являются отрицательными контролями. Saccharomyces cerevisiae DSM 1333 (фиг. 39B и 40B) или Debaryomyces hansenii CLIB 197 (фиг. 39C и 40C) выращивали в бульоне YGC, дополненном 1 г/л карбоната кальция, после 24 часов инкубации. Карбонат кальция частично диссоциировал в присутствии только подкисляющего штамма Saccharomyces. С неподкисляющим штаммом Debaryomyces частицы карбоната кальция наблюдали так же, как в отрицательном контроле. Стрелками показаны примеры положительных капель.
На фиг. 41А-41D показаны результаты эксперимента по формированию геля в отсутствие (фиг. 41А и 41С) и в присутствии (фиг. 41В и 41D) уксусной кислоты после инкубации капель, содержащих Saccharomyces cerecisiae DSM 1333, в течение 24 часов. На фиг. 41A и 41B штамм Saccharomyces выращивали только в бульоне YGC. На фиг. 41C и 41B штамм Saccharomyces выращивали в бульоне YGC, дополненном 2,5 г/л альгината и 0,5 г/л карбоната кальция. Формирование геля происходило в присутствии или в отсутствие уксусной кислоты.
На фиг. 42А-42D показаны результаты эксперимента по формированию геля в отсутствие (фиг. 42А и 42С) и в присутствии (фиг. 42В и 42D) уксусной кислоты после инкубации капель, содержащих Candida albicans АТСС 10231, в течение 24 часов. На фиг. 42A и 42B штамм Candida выращивали только в бульоне YGC. На фиг. 42C и 42B штамм Candida выращивали в бульоне YGC с добавлением 2,5 г/л альгината и 0,5 г/л карбоната кальция. Формирование геля происходило в присутствии или в отсутствие уксусной кислоты.
Результаты показывают, что гелеобразующий агент может предотвратить уменьшение размера капель, когда дрожжи растут в каплях. Результаты также показывают, что уксусная кислота не требуется в масляной фазе, когда подкисляющие дрожжевые штаммы растут в бульоне YGC, дополненном альгинатом и карбонатом кальция.
17. Использование субстрата эстеразы или субстрата фосфатазы для обнаружения различных штаммов дрожжей и плесени
Материалы:
- Экстракт дрожжей
- Глюкоза
- Хлорамфеникол
5 г/л
20 г/л
0,3 г/л
5 (6)-карбоксифлуоресцеин диацетат
λExc max=492 нм
λEm max=517 нм
λExc max=500 нм
λEm max=610 нм
Методы:
Субстраты CFDA и ALDOL®515 фосфата растворяли в DMSO и добавляли к бульону YGC в конечной концентрации 25 мг/л. Некоторые эксперименты также проводили с 50 мг/л фосфата ALDOL®515.
Концентрация DMSO составляла 0,14% (об./об.).
Клеточные суспензии инкапсулировали в концентрации 105 клеток или спор/мл в бульоне YGC с получением соотношения 1 положительной капли (содержащей 1 клетку) из 10. Эмульсии капель готовили с помощью масла для Eva Green с добавлением диклорана для анализа плесени (чтобы ограничить рост гиф пределами капель).
Затем капли переносили при 28°С в течение 24 часов (фиг. 47А-45В, 47А-47D, 49А-52D) или 48 ч (фиг. 46А-46D, 48А-48D).
После инкубации образцы капель наблюдали с помощью устройства для флуоресцентной визуализации клеток ZOETM для обнаружения активности эстеразы (гидролиз CFDA) или фосфатазы (гидролиз ALDOL®515 фосфата).
Результаты: на фиг. 43A-48D показаны изображения различных штаммов дрожжей и плесени, выращенных в отсутствие или в присутствии 25 мг/л CFDA. См. приведенную выше таблицу штаммов дрожжей и плесени для фигуры, имеющей указанный микроорганизм. В отсутствие CFDA флуоресценция не наблюдалась в каплях, имеющих рост дрожжей или плесени. В присутствии CFDA эстеразная активность микроорганизма гидролизует субстрат и высвобождает флуоресцентное соединение, в результате чего капли, имеющие рост дрожжей или плесени, дают зеленую флуоресценцию, тем самым демонстрируя, что конкретный субстрат можно использовать для идентификации микроорганизма в каплях.
На фиг. 49A-52D показаны изображения различных штаммов дрожжей и плесени, выращенных в отсутствие или в присутствии 50 мг/л ALDOL® 515 фосфата (фиг. 49А-50В) или 25 мг/л ALDOL® 515 фосфата (фиг. 52А-52D), см. приведенную выше таблицу штаммов дрожжей и плесени для фигуры, имеющей заданный микроорганизм. В отсутствие ALDOL® 515 фосфата флуоресценция не наблюдалась в каплях, имеющих рост дрожжей или плесени. В присутствии ALDOL® 515 фосфата фосфатазная активность микроорганизма гидролизует субстрат и высвобождает флуоресцентное соединение, в результате чего капли, имеющие рост дрожжей или плесени, дают красную флуоресценцию, тем самым демонстрируя, что конкретный субстрат можно использовать для идентификации микроорганизма в каплях.
18. Использование субстрата глюкуронидазы для обнаружения E. coli
Материалы и методы:
В пептон-альгинат-солевой бульон с добавлением метилового эфира резоруфин-бета-D-глюкуроновой кислотыТМ в концентрации 100 мг/л был внесен Escherichia coli ATCC 25922.
Затем капли получали с помощью генератора капель Bio-Rad и масла EvaGreen с получением 1/10 капель, содержащих 1 единичную бактериальную клетку.
Капли инкубировали в монослое в течение 6 часов при 37°С и затем визуализировали с помощью системы флуоресцентной визуализации клеток ZOETM с использованием канала светлого поля (фиг. 53А) или с использованием красного флуоресцентного фильтра (фиг. 53В).
Результаты: капли, демонстрирующие рост бактерий (G), давали ярко-красную флуоресценцию вследствие расщепления субстрата метилового эфира резоруфин-бета-D-глюкуроновой кислотыТМ глюкуронидазой из штамма Е. coli. Показано, что конкретный субстрат можно использовать для идентификации микроорганизма в каплях.
Хотя настоящее изобретение было описано с некоторыми подробностями в качестве иллюстрации и примера в целях ясности понимания, специалисту в данной области техники будет очевидно, что определенные изменения и модификации могут быть применены на практике в пределах объема прилагаемой формулы изобретения. Кроме того, каждая ссылка, представленная в настоящем раскрытии, такая как патенты, патентные заявки, патентные публикации, журналы, книги, документы и веб-контент во всем настоящем раскрытии, включена посредством ссылки во всей ее полноте и для всех целей в той же степени, как если бы каждая ссылка была включена отдельно посредством ссылки. Если существует конфликт между настоящей заявкой и ссылкой, приведенной в настоящем раскрытии, то настоящая заявка является приоритетной.
При использовании в настоящем описании и прилагаемой формуле изобретения, формы единственного числа включают ссылки на множественное число, если из контекста явно не следует иное. Используемый в настоящем раскрытии термин «около» относится к указанному числу и любому значению в пределах 10% от указанного числа. Таким образом, «около 5» относится к любому значению от 4,5 до 5,5, включая 4,5 и 5,5.
| название | год | авторы | номер документа |
|---|---|---|---|
| КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ СКРИНИНГА ИЛИ ОБОГАЩЕНИЯ МЕТИЦИЛЛИН-РЕЗИСТЕНТНЫХ s. aureus | 2010 |
|
RU2567807C2 |
| НОВЫЙ ЭПИТОП BNP (1-32) И АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ УКАЗАННОГО ЭПИТОПА | 2008 |
|
RU2511033C2 |
| БИОАКТИВНЫЕ КОМПОЗИЦИИ И МЕТАБОЛИТЫ CHROMOBACTERIUM | 2011 |
|
RU2580105C2 |
| СПОСОБ ОДНОВРЕМЕННОГО ОБНАРУЖЕНИЯ АНТИГЕНОВ И АНТИТЕЛ ПРОТИВ ИНФЕКЦИОННОГО МИКРООРГАНИЗМА | 2003 |
|
RU2300769C2 |
| ПЕСТИЦИДНАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ИЗОЛИРОВАННЫЙ ШТАММ BURKHOLDERIA SP., СОЕДИНЕНИЯ, ВЫДЕЛЕННЫЕ ИЗ BURKHOLDERIA SP., ИХ СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2011 |
|
RU2577970C2 |
| МОДИФИЦИРОВАННЫЕ ПЕПТИДЫ ВИЧ-1 И ИХ ПРИМЕНЕНИЕ ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ ПРОТИВ ВИЧ | 2005 |
|
RU2352579C2 |
| СИНТЕТИЧЕСКИЕ ПЕПТИДЫ, ПРИМЕНЯЕМЫЕ В БИОЛОГИЧЕСКИХ ТЕСТАХ ДЛЯ ОБНАРУЖЕНИЯ ИНФЕКЦИЙ, ВЫЗВАННЫХ ВИРУСАМИ ВИЧ-1 ГРУППЫ 0 | 1998 |
|
RU2184742C2 |
| СОСТАВ И СПОСОБ ПОЛУЧЕНИЯ ГЛАЗНЫХ КАПЕЛЬ | 2014 |
|
RU2595837C2 |
| ВНЕКЛЕТОЧНАЯ ГИАЛУРОНИДАЗА ИЗ Streptomyces koganeiensis | 2010 |
|
RU2553205C2 |
| СПОСОБЫ ЛЕЧЕНИЯ МЕСТНЫХ МИКРОБНЫХ ИНФЕКЦИЙ | 2014 |
|
RU2675360C2 |






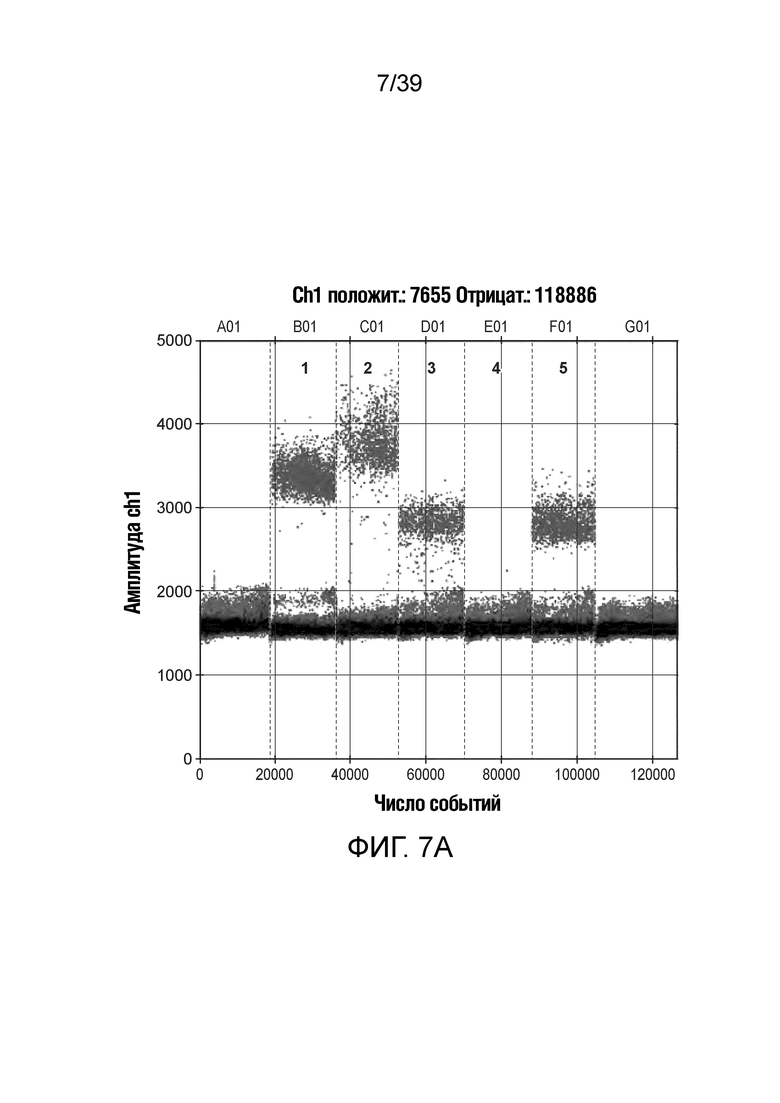
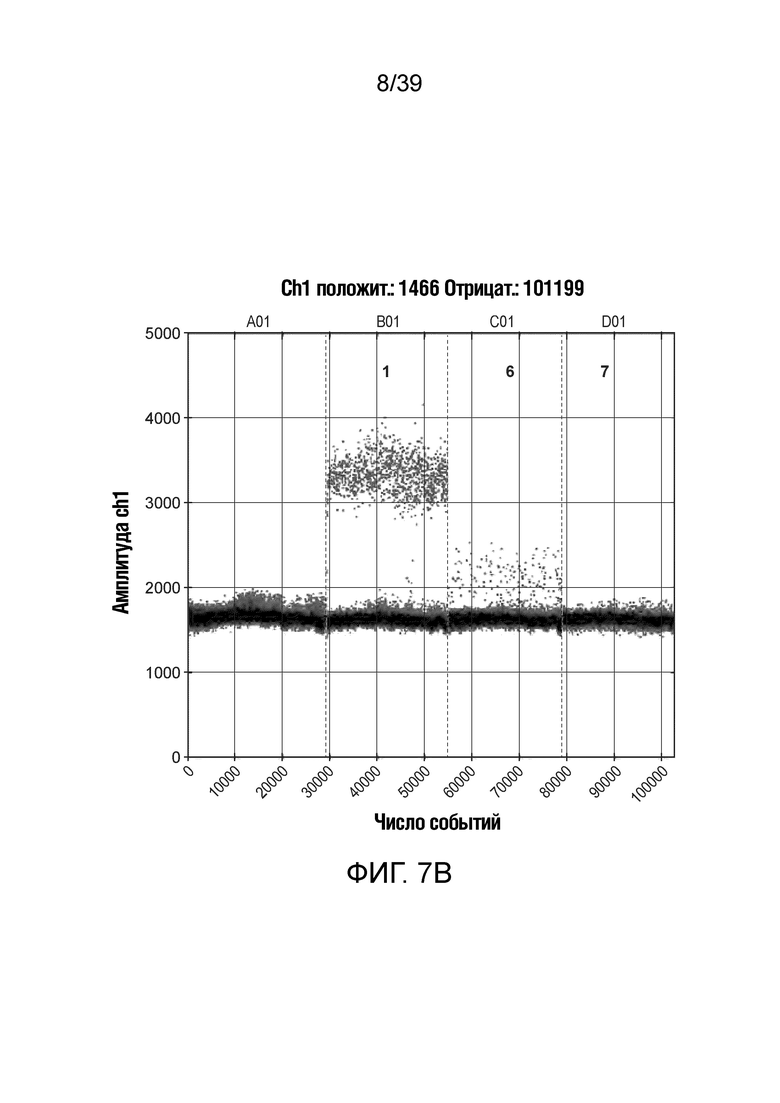
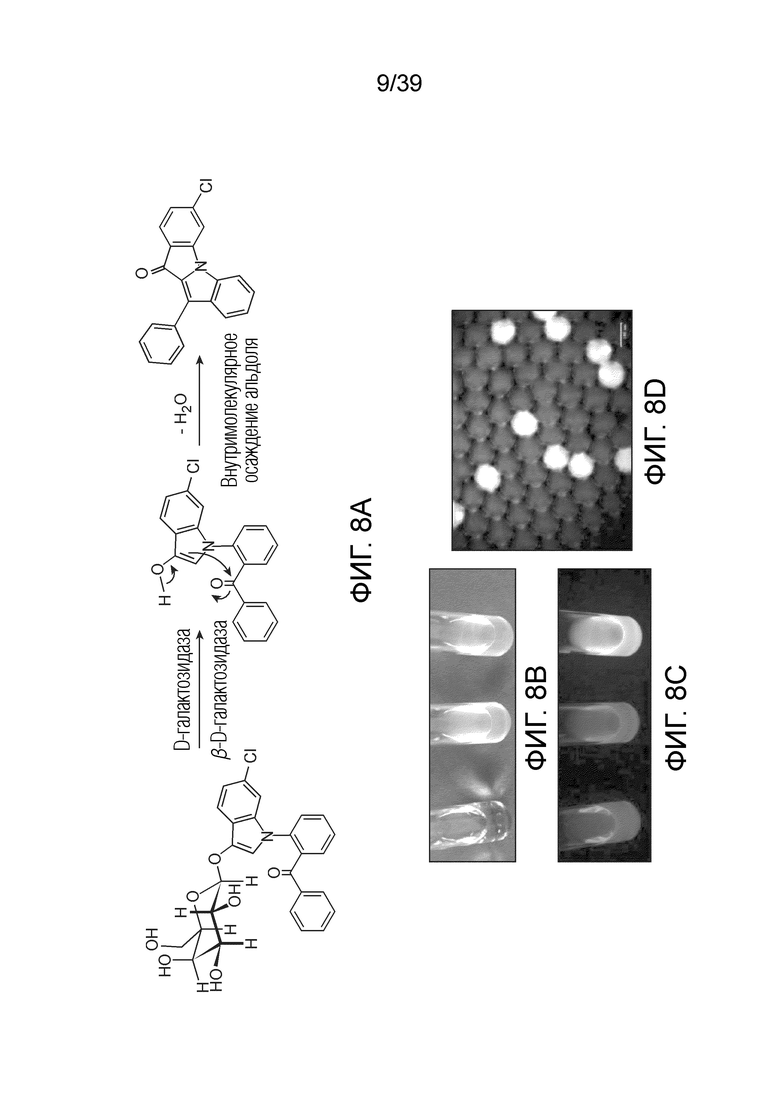






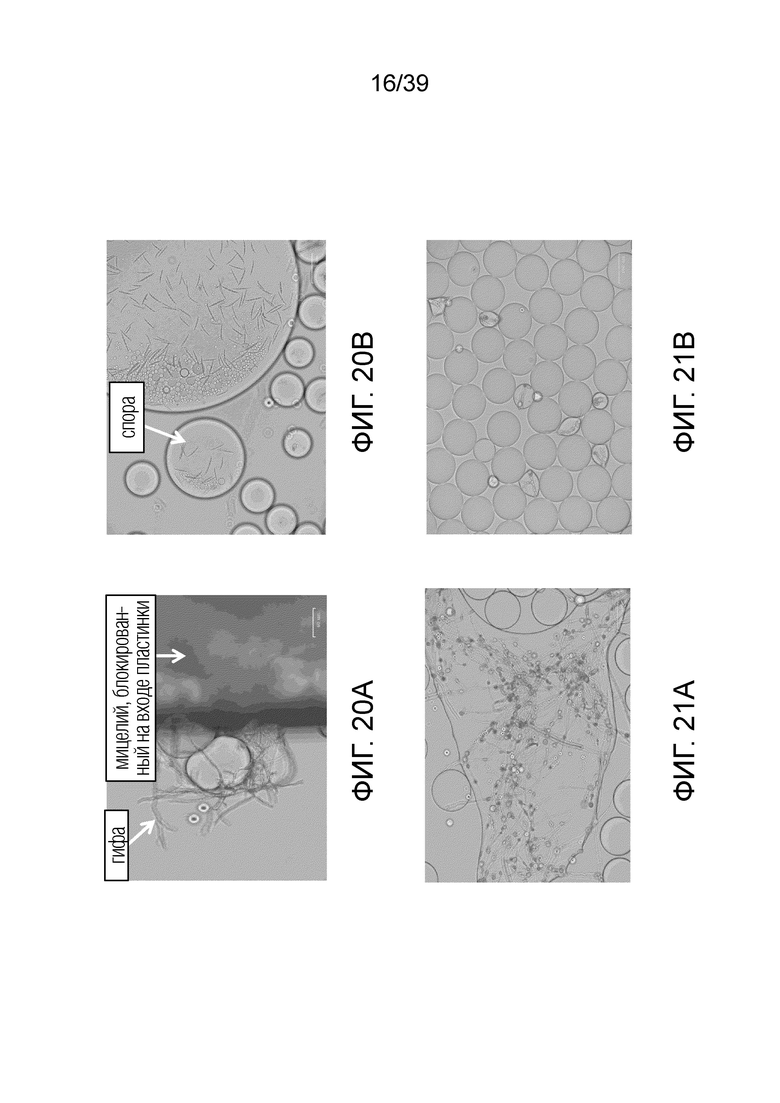







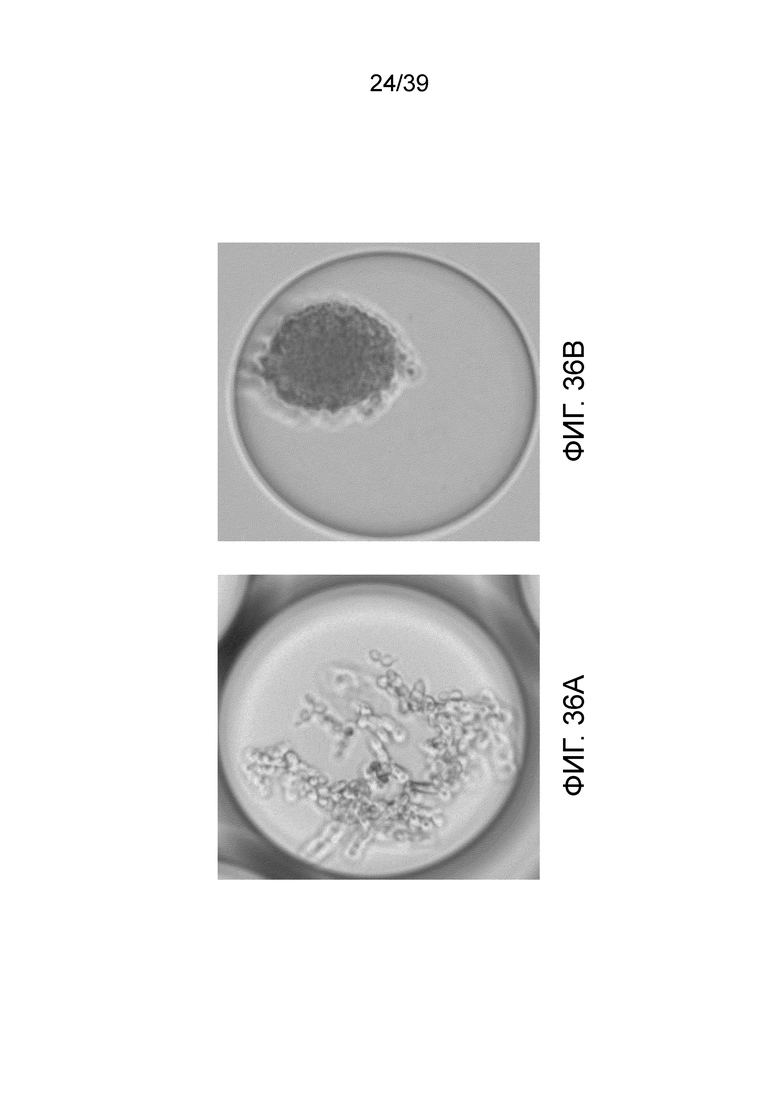
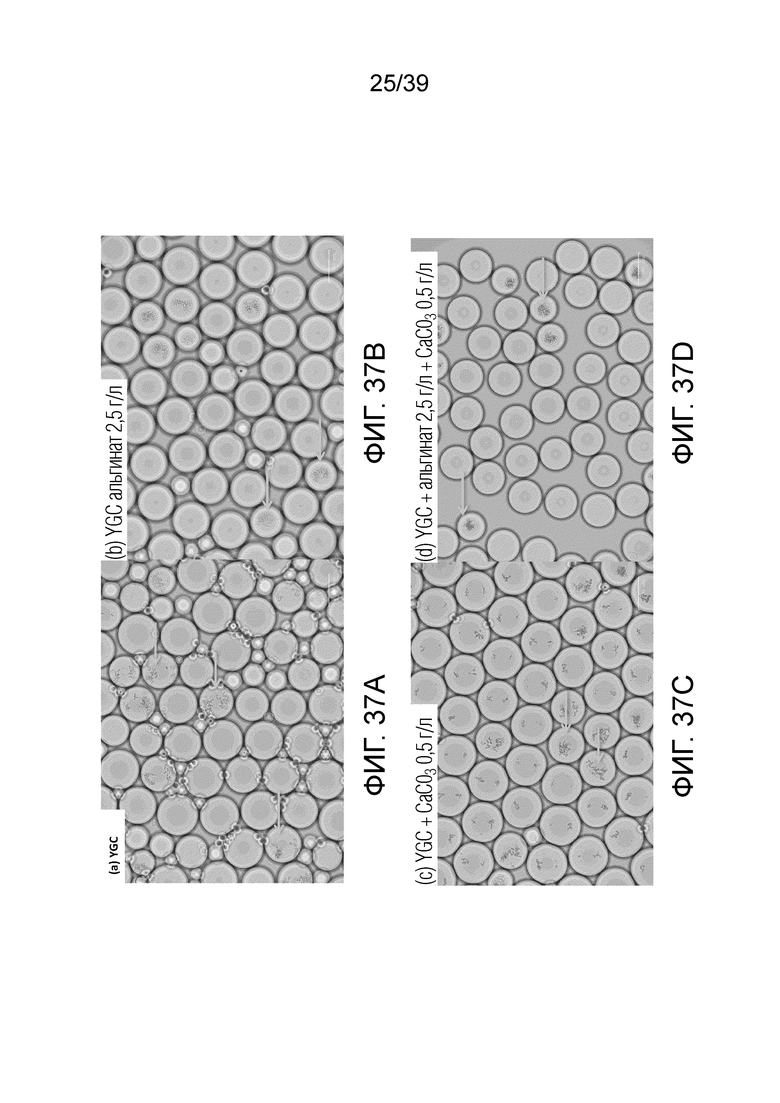










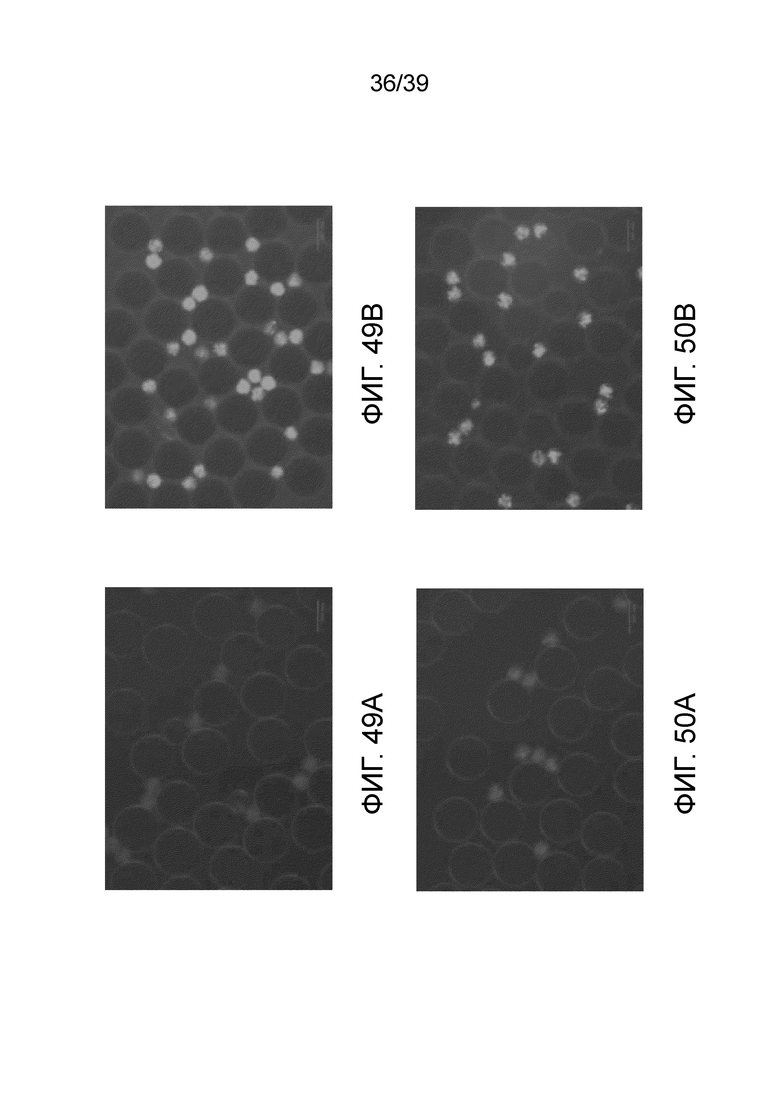



Изобретение относится к идентификации микроорганизмов. Предложен способ определения наличия или отсутствия микроорганизма в матрице пищевых продуктов. Осуществляют гомогенизацию части матрицы пищевых продуктов. Инкапсулируют гомогенизированную матрицу, содержащую микроорганизм, во множестве капель эмульсии типа «вода-в-масле», в которые также инкапсулируют микробиологическую питательную среду. Инкубируют множество капель эмульсии при температуре, допускающей микробиологический рост, и в течение периода времени, чтобы микроорганизмы могли пройти через 5-45 периодов времени удвоения. Идентифицируют капли эмульсии, содержащие микроорганизмы, по обнаружению автофлуоресценции во множестве капель. Способ обеспечивает точные значения количества микробов и позволяет проводить быстрый анализ по сравнению со стандартным культивированием. 12 з.п. ф-лы, 2 пр., 53 ил.
1. Способ определения наличия или отсутствия микроорганизма в матрице пищевых продуктов, включающий:
i) гомогенизацию части матрицы пищевых продуктов;
ii) инкапсуляцию гомогенизированной матрицы, содержащей микроорганизм, во множестве капель эмульсии типа «вода-в-масле», при этом капли эмульсии типа «вода-в-масле» инкапсулируют микробиологическую питательную среду, подходящую, совместимую или оптимальную для роста микроорганизма, и указанный образец;
iii) инкубацию множества капель эмульсии типа «вода-в-масле» при температуре, допускающей микробиологический рост, и в течение периода времени, достаточного для того, чтобы микроорганизмы могли пройти через 5-45 периодов времени удвоения;
iv) идентификацию капель эмульсии типа «вода-в-масле», содержащих микроорганизмы; и
v) в ответ на идентификацию микроорганизмов по меньшей мере в одной капле эмульсии типа «вода-в-масле», определение того, что микроорганизм присутствует в гомогенизированной матрице, где стадия идентификации стадии iii) содержит обнаружение автофлуоресценции во множестве капель типа «вода-в-масле», где автофлуоресценция указывает на присутствие капель, содержащих микроорганизмы, и микроорганизмы представляют собой микроорганизмы родов Enterobacteriaceae, Staphylococcus spp., Pseudomonas spp., Acinetobacter spp., Campylobacter spp., Staphylococcus spp., Legionella spp., Corynebacterium spp., Enterococcus spp., Streptococcus spp., Clostridium spp., Bacillus spp., Candida spp., Aspergillus spp., Cryptococcus spp., Debaromyces spp., Geotrichum spp., Hanseniaspora spp., Kluyveromyces spp., Pichia spp., Rhodotula spp., Saccharomyces spp., Trichosporon spp., Zygosaccharomyces spp., Alternaria spp., Fusarium spp., Mucor spp., Penicillium spp., Pullularia spp., Trichothecium spp. или их комбинации.
2. Способ по п. 1, в котором инкубацию выполняют в течение периода времени, соответствующего:
по меньшей мере около 4 часов и не более чем около 16 часов, когда микроорганизмами являются бактерии;
по меньшей мере около 6 часов и не более чем около 12 часов, когда микроорганизмами являются дрожжи; и
по меньшей мере около 8 часов и не более чем около 36 часов, когда микроорганизмами являются плесени.
3. Способ по п. 1 или 2, в котором:
капля типа «вода-в-масле» дополнительно содержит меченый белок;
капля типа «вода-в-масле» не содержит лизирующий агент; и
определение капель типа «вода-в-масле», содержащих микроорганизмы-мишени, включает в себя обнаружение меченого белка, предпочтительно капля типа «вода-в-масле» дополнительно содержит бычий сывороточный альбумин.
4. Способ по любому из пп. 1-3, в котором часть матрицы пищевых продуктов имеет известную массу или объем.
5. Способ по любому из пп. 1-4, в котором микробиологическая питательная среда содержит:
(а) частично расщепленный белок, или
(b) буферную пептонную воду, или
(c) сурфактант.
6. Способ по п. 5, в котором
(i) сурфактант представляет собой неионный сурфактант,
предпочтительно, неионный сурфактант представляет собой полоксамер, более предпочтительно, полоксамер имеет молекулярную массу около 1800 г/моль, наиболее предпочтительно, полоксамер содержит около 80% полиоксиэтилена; или
(ii) микробиологическая питательная среда содержит сурфактант в концентрации, по меньшей мере, около 0,01% и не более около 5%.
7. Способ по любому из пп. 1-6, в котором перед инкубацией инкапсулированная микробиологическая питательная среда имеет рН около 7,2.
8. Способ по любому из пп. 4-7, в котором матрица пищевых продуктов содержит животный белок, молочный продукт, сыр, говяжий фарш, ветчину, непастеризованное молоко, растительный материал или от 20 до 45% жира.
9. Способ по любому из пп. 1-4, в котором
(a) определение количества положительных капель и определение количества отрицательных капель включает обнаружение автофлуоресценции во множестве капель типа «вода-в-масле», при этом количество положительных капель представляет собой количество капель, демонстрирующих наличие автофлуоресценции, а количество отрицательных капель представляет собой количество капель, демонстрирующих отсутствие автофлуоресценции; или
(b) определение количества положительных и отрицательных капель включает параллельную визуализацию множества капель типа «вода-в-масле»; или
(с) определение количества положительных капель дополнительно включает в себя корректировку количества посредством применения поправки по распределению Пуассона для учета содержания нескольких микроорганизмов-мишеней в одной капле.
10. Способ по любому из пп. 1-4, в котором определение количества положительных и отрицательных капель включает сбор данных из капель, перемещаемых последовательно через область обнаружения устройства обнаружения.
11. Способ по п. 10, в котором микроорганизм-мишень представляет собой плесень, и масляная фаза содержит по меньшей мере один противогрибковый агент, предпочтительно, по меньшей мере один противогрибковый агент выбирают из 2,6-дихлор-4-нитроанилина, 4,5,6,7-тетрахлор-2',4',5',7'-тетрайодфлуоресцеина, (RS)-1-[2-(аллилокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола и хитозана, наиболее предпочтительно,
(а) концентрация 2,6-дихлор-4-нитроанилина находится в интервале от 5 до 200 мг/л;
(b) концентрация 4,5,6,7-тетрахлор-2',4',5',7'-тетрайодфлуоресцеина составляет от 50 до 375 мг/л; или
(с) концентрация (RS)-1-[2-(аллилокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола находится в диапазоне от 0,1 до 2,5 г/л.
12. Способ по п. 1, где микроорганизмы представляют собой микроорганизмы родов Enterobacteriaceae, Bacillus spp., Staphylococcus spp., Candida spp., Aspergillus spp., Debaromyces spp., Geotrichum spp., Hanseniaspora spp., Kluyveromyces spp., Pichia spp., Rhodotula spp., Saccharomyces spp., Trichosporon spp., Zygosaccharomyces spp., Alternaria spp., Fusarium spp., Mucor spp., Penicillium spp., Pullularia spp., Trichothecium spp. или их комбинации.
13. Способ по п. 5, где буферная пептонная вода представляет собой BAM Media M192.
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| MARCOUX P | |||
| R | |||
| ET AL.: "Micro-confinement of bacteria into w/o emulsion droplets for rapid detection and enumeration", COLLOIDS AND SURFACES A: PHYSIOCHEMICAL AND ENGINEERING ASPECTS, 2010, v.377, no.1, p.54-62, doi:10.1016/j.colsurfa.2010.12.013 | |||
| ROTHROCK M | |||
| J | |||
| et al | |||
| "Quantification of Zoonotic Bacterial Pathogens | |||
Авторы
Даты
2022-05-26—Публикация
2017-01-25—Подача