Изобретение относится к синтетическим пептидам, используемым в биологических тестах с целью обнаружения инфекций, вызванных вирусами ВИЧ-1 группы 0, способу их получения, композициям, наборам, содержащие такие пептиды и биологическим тестам с использованием этих пептидов.
Из уровня техники известны ретровирусы ВИЧ-1 группы 0. В европейском патенте 0345375 и в заявке на европейский патент 0657532 описаны изоляты ANT 70 и ANT 70 NA, выделенные у больных из Камеруна. Точнее, в этих материалах описаны антигены и антигенные композиции, содержащие лизаты или протеины упомянутых изолятов, нуклеиновые кислоты, соответствующие геномной РНК, методы гибридизации с использованием указанных нуклеиновых кислот, методы получения упомянутых выше изолятов, а также способы получения протеинов р12, р16, р25, gр41, gр120 указанных ретровирусов.
В заявке на европейский патент 0591914 описан изолят MVP 5180/91. Данный изолят, охарактеризованный с помощью метода Western Blot, имеет, как и предыдущий изолят, отличия от давно известных изолятов ретровируса ВИЧ-1. В заявке на европейский патент 0591914 описывается, в частности, ДНК-последовательность изолята MVP 5180/91 и точно приводится локализация генов gag, pol и env. Кроме того в заявке на европейский патент 0591914 приводится описание синтетических пептидов петлевой последовательности V3, а также иммунодоминантной области (др41). Последние могут применяться в биологических тестах, в частности in vitro для обнаружения антител к ВИЧ-1 группы 0.
В заявке на европейский патент 0673948 описываются синтетические или рекомбинтные пептиды, состоящие из 15-50 аминокислот (АА) и содержащие последовательность -VWGIRQLRARLQALETLIQNQQRLNLWGXKGKLIXYTSVKWNTSWSGR-, в которой Х означает остаток либо цистеина, либо серина. Эти пептиды применяются в диагностической сфере для выявления инфекций, вызываемых некоторыми изолятами ретровируса ВИЧ-1 группы 0.
Известна также заявка на европейский патент 0727483, в которой описывается изолят MVP 2901/94, как составная часть ретровируса семейства ВИЧ-1 группы 0. В этой заявке описываются некоторые антигены с четко определенными пептидными последовательностями. Эти пептидные последовательности соответствуют частично последовательности gp120 и частично последовательности gp41 (иммунодоминантная область) изолята MVP 2901/94.
В заявке WO 96/12809 описаны два новых изолята из семейства ВИЧ-1 группы 0. Имеются в виду изоляты VAU и DUR. В этой же заявке описываются и некоторые последовательности пептидов, выделенных из указанных вирусов, которые могут применяться для обнаружения антител, распознающих пептидные последовательности ВИЧ-1 VAU или DUR.
В заявке WO 96/32293 описаны два антигена из последовательности изолята ANT 70. Имеются в виду антигены MDL061 и MDL056 в иммунодоминантной области др41. Согласно этому изобретению для обнаружения 100% проб в ограниченной коллекции сывороток больных, инфицированных вирусом ВИЧ-1 группы 0, необходимо применять композиции, содержащие эти два пептида, поскольку каждый пептид в отдельности не обеспечивает получения удовлетворительных результатов.
Действительно, ввиду генетической вариабельности изолятов вируса группы 0 почти невозможно гарантировать серологическое выявление зараженных индувидуумов при использовании антигенов одного и того же изолята. Это означает невозможность получения реактивов, гарантирующих 100%-ную чувствительность. Таким образом впервые группа 0 обусловила появление серьезной проблемы: неадекватность некоторых серологических реактивов для распознавания индивидуумов, зараженных неодинаковыми группами или подтипами. Это относится, в частности, к ВИЧ-1 группы 0.
В заявке WO 96/40763 утверждается существование больших различий внутри группы 0. В ней описываются пептиды, включающие в естественной последовательности ВИЧ-1 типа В, несколько незначительных модификаций (одна или две аминокислотные замены). Согласно данной заявке такие гибридные пептиды способны взаимодействовать с антителами к группе 0.
В заявке WO 96/27013 описана серия новых вирусов ВИЧ-1 группы 0, обозначенных, как: BCF 01, BCF 02, BCF 03, BCF 06, BCF 07, BCF 08, BCF 09, BCF 11, BCF 12, BCF 13 и BCF 14, а также соответствующая серия пептидов доминантной области gр41, обозначенных, как ESS/BCF02, FAN/BCF01, LOB/BCF06, MAN/BCF07, NKO/BCF08, POC/BCF03, MAN/BCF11, BCF09, BCF12, BCF13 и BCF14.
Некоторое число этих пептидов мало пригодно в диагностике вследствие их слабой растворимости, в частности пептид BCF 13.
В настоящее время неожиданно было обнаружено, что некоторые синтетические пептиды являются высококачественными диагностическими реактивами, позволяющими достичь хороших результатов в выявлении больных, инфицированных ретровирусами ВИЧ-1 группы 0. Такие пептиды состоят из разных последовательностей, расположенных вокруг коротких, очень консервативных последовательностей, присутствующих в изолятах ретровирусов ВИЧ-1 группы 0. Пептиды согласно изобретению позволяют получать результаты, значительно превосходящие результаты, получаемые при использовании синтетических пептидов, несущих иммунодоминантные эпитопы др41 (env) некоторых изолятов ВИЧ-1 группы 0.
Для обозначения аминокислот ниже применяется трехбуквенная номенклатура.
Синтетические пептиды согласно изобретению соответствуют общей формуле (I):
Δ-Z-Trp Gly Cys-Θ-Cys Tyr Thr Ser-Ω, (1)
вкоторойΔозначаетбиотинил,биоцитинил,атомводорода,ацетил(СН3СО-), алифатическую цепь, способную содержать одну или несколько тиоловых, альдегидных или аминных функций, при этом алифатическая цепь представляет собой преимущественно алкильную цепь с 1-6 атомами углерода или алкенильную цепь с 2-6 атомами углерода или аминоалкилкарбонильную цепь с 2-6 атомами углерода,
Z означает последовательность пептидов одной из формул
-Ξ1-Ser-Ξ2-; (II)
-Ξ1-Gln-Ξ2-; (V)
-Ξ1-Asn-Ξ2-; (VIII)
в которых Ξ1 означает пептидную последовательность с 2-9 аминокислотами, Ξ2 - пептидную последовательность с 0-5 аминокислотами, Θ - пептидную последовательность формулы (XI)
-(AA1)-(AA2)-(AA3)-(AA4)-(AA5)-, (XI)
в которой (AA1) - остаток либо лизина, либо аргинина; (АА2) - остаток глицина; (АА3) - остаток либо лизина, либо аргинина; (АА4) - остаток либо лейцина, либо аланина; (АА5) - остаток валина при условии, что (AA1), (АА2), (АА3), (АА4), (АА5) никогда не образуют вместе пептидные последовательности -Lys Gly Lys Leu Ile- и -Lys Gly Lys Leu Val-
Ω, зафиксированная на группе -СО серина, означает гидроксил (-ОН), пептидную последовательность формулы (XII)
-Val-Σ-Ψ, (XII)
в которой Σ означает последовательность формулы (XIII)
(AA6)-Trp Asn-(AA7-(AA8) (XIII),
в которой (АА6) - глутамин или аргинин, (АА7) - глутамин или серин, (АА8) - треонин, и в которой Ψ, зафиксированная на остатке -СО- свободной аминокислоты АА8, означает группу ОН,
пептидную последовательность формулы (XV)
-Val-Ψ, (XV)
в которой Ψ имеет указанное выше значение.
Пептиды формулы (I) относятся к мономерному типу и их размер может составлять от 13 до 33 аминокислот.
Пептиды согласно изобретению могут существовать либо в линейной форме, либо в циклической, образованной с помощью интерцистеиновых дисульфидных мостиков.
Предпочтительными являются пептиды формулы (I), в которой Δ означает биотинил, атом водорода или алифатическую цепь, которая может содержать одну или две тиоловых, альдегидных или аминных функций, причем алифатическая цепь является предпочтительно алкильной цепью с 1-6 атомами углерода или аминоалкилкарбонильной цепью с 2-6 атомами углерода; Z - пептидную последовательность формулы (II) или (V), в которой Ξ1 означает пептидную последовательность из двух аминокислот, Ξ2 - аминокислоту или пептидную последовательность формулы (VIII), в которой Ξ1 означает пептидную последовательность из девяти, восьми или трех аминокислот, а Ξ2 - пептидную последовательность из пяти аминокислот; Θ означает пептидную последовательность формулы -Lys Gly Arg Leu Val-; -Arg Gly Lys Ala Val-; -Arg Gly Arg Leu Val-; или -Arg Gly Arg Ala Val-; Ω - гидроксильную группу, пептидную последовательность (XV) или одну из следующих последовательностей, соответствующих пептидной последовательности формулы (XII) -Val Arg Trp Asn Glu Thr-Ψ; -Val Gln Trp Asn Glu Thr-Ψ или -Val Gln Trp Asn Ser Thr-Ψ.
Предпочтительно Z означает пептидную последовательность формулы -Leu Leu Ser Ser-; -Leu Leu Asn Ser-; -Leu Leu Gln Ser-; -Arg Leu Asn Ser-; -Ala Leu Glu Thr Leu Gln Asn Gln Gln Leu Leu Asn Ser- или -Ala Leu Glu Thr Leu Leu Gln Asn Gln Gln Leu Leu Asp Leu-; -Ala Leu Glu Thr Leu Leu Gln Asn Gln Gln Leu Leu Asn Ile-; -Leu Asn Gln Gln Leu Leu Asn Ser-; -Arg Ala Leu Glu Thr Leu Leu Asn Gln Gln Arg Leu Leu Asn Ser-.
В состав изобретения входят также синтетические пептиды, содержащие 20-50 аминокислот и соответствующие формуле (Iа):
Δ-Za-Trp Gly Cys-Θ-Cys Tyr Thr Ser-Ωa, (Ia)
в которой Za - радикал формул
Ξ1a-Ser-Ξ2a; (IIa)
Ξ1a-Gln-Ξ2a; (Va)
Ξ1a-Asn-Ξ2a, (VIIIa)
в которых Ξ1a означает пептидную последовательность с 2-5 аминокислотами; Ξ2a - аминокислоту; Ωa - пептидную последовательность формулы (XII), такую, как приведена для формулы (I); Δ, Θ, Σ, Ψ имеют те же значения, что и в формуле (I).
Предпочтительными являются пептиды формулы (I) или (Iа), содержащие одну из следующих последовательностей. Последовательности приведены в соответствии с одно- или трехбуквенными номенклатурами.
Синтетические пептиды формулы (I), которые являются предметом настоящего изобретения, могут быть получены твердофазным синтезом с помощью традиционных методов: R.B.Merrifield, J. Amer. Chem. Soc. (1963), 85, стр. 2149-2154; R. C. Sheppard, "Peptides 1971", Nesvadba H. (ed.) North Holland, Amsterdam, стр. 111; E. Atherton and R.L.Sheppard, "Solid phase peptide synthesis, a practical approach", IRL PRESS, 1989, Oxford University Press, стр. 25-34. В качестве автоматического синтезатора может использоваться синтезатор "9050 Plus Pep Synthesizer" Миллипора (Millipore) или аналогичный ему.
Твердая основа, применяемая при синтезах, должна быть совместимой с используемой техникой и химией. Так, например, для синтеза на синтезаторе "9050 Plus pep. Synthesizer" рекомендуется применять смолу, предназначенную для так называемой технологии "непрерывного потока"; таким критериям отвечают смолы PEG PS. Указанные основы состоят из спейсера на основе полиэтиленгликоля (PEG), расположенного между функциональной группой из полистероловых шариков и точкой закрепления первой аминокислоты. Тип такой точки фиксации может варьироваться в зависимости от выбранной С-терминальной функции. В данном случае применяются различные смолы PEG-PS.
Исходная смола и применяемые в качестве сырья аминокислоты имеются в продаже (PerSeptive-Biosystem или Neosystem).
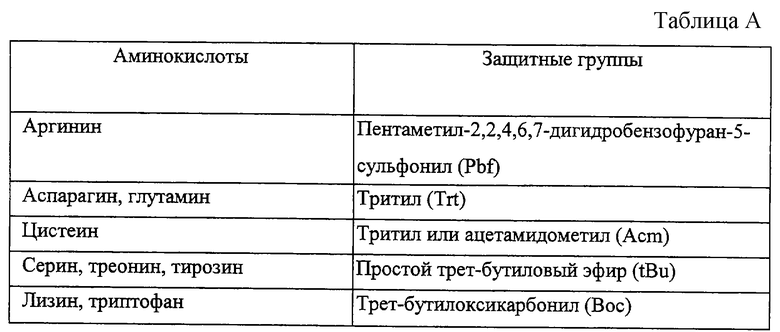
При синтезе пептидов применяли следующие защитные группы боковых цепей (см. табл. А).
Временная защита первичной аминной функции в положении α применяемых аминокислот обеспечивается группой 9-фторэнилметилоксикарбонил (Fmoc). Удаление защитных групп осуществляется посредством 20%-го раствора пиперидина в диметилформамиде.
Для связи предпочтительно применяется избыточное количество диизопропилкарбодиимида (DIPCDI) и гидрокси-1-бензотриазола (HOBt).
По окончании синтеза смолу промывают органическими растворителями (диметилформамидом, затем дихлорметаном), сушат в вакууме, затем обрабатывают раствором на основе трифторуксусной кислоты (TFA), охлажденным до 0oС и содержащим соответствующие "очистители" (scavengers). Можно применять, например, реактив К с содержанием 82% трифторуксусной кислоты, 5% фенола, 5% воды, 5% тиоанизола и 3% этандитиола.
После фильтрования смолы пептиды выпадают в осадок и промываются простым эфиром.
После этого искусственные пептиды очищают с помощью жидкостной хроматографии с обратной фазой и определяют их чистоту масс-спектрометрией.
В качестве твердой фазы можно использовать, например, фазу Бондапака (Bondapak) C-18. Пептиды элюируют с применением линейного градиента между двумя буферными растворами, из которых первый раствор преимущественно водный (например, "вода - 0,1%-ая трифторуксусная кислота"), а второй раствор скорее органический (например, смесь, содержащая 60% ацетонитрила, 39,92% воды и 0,08% трифторуксусной кислоты). Полученные чистые фракции объединяют, концентрируют в условиях вакуума и лиофилизуют.
При циклизации искусственные очищенные пептиды растворяют в растворе ацетата аммония (10 мМ). Показатель рН доводят до 8,5 добавкой гидроксида аммония 1 М. Раствор интенсивно перемешивают. Полная циклизация наступает через 18 часов. После этого показатель рН снижают до 6 добавлением уксусной кислоты. Циклизованные пептиды лиофилизуют, затем очищают с помощью жидкостной хроматографии с обратной фазой, как описано выше.
Иммунореактивность пептидов согласно изобретению оценивали с помощью сывороток больных, которые в большинстве своем происходили из Камеруна и были инфицированы ретровирусом ВИЧ-1 группы 0. Проведенные тесты подтвердили, что пептиды согласно изобретению, взятые отдельно или в комбинации (пептидные композиции), позволяют выявить 100% сывороток, инфицированных ретровирусом ВИЧ-1 группы 0.
Синтетические пептиды согласно изобретению могут, следовательно, найти применение при проведении иммунологических тестов для обнаружения инфекций, вызванных ретровирусом ВИЧ-1 группы 0. Возможно также применять комбинации из нескольких синтетических пептидов формулы I. Такие комбинации, в которых могут содержаться два и более пептида формулы I, также входят в состав изобретения. Предпочтительными комбинациями являются те, в которых содержатся пептиды 1 (2В) и 3 (4В).
Также возможно использовать синтетические пептиды формулы (I) согласно настоящему изобретению в сочетании с рекомбинантными пептидами (рекомбинантные протеины) ВИЧ-1 группы 0, такими, которые могут быть получены традиционными методами и которые содержат последовательности, описанные, например, в заявке на европейский патент 0591914. Такие композиции также являются составной частью настоящего изобретения.
Синтетические пептиды согласно изобретению могут применяться, кроме того, в сочетании с другими синтетическими или рекомбинантными пептидами ВИЧ-1 (рекомбинантные протеины) и/или ВИЧ-2, такими, как пептиды, описанные в патентных заявках или в европейских патентах 0387914, 0239425, 0220273, 0267802. Этот перечень патентных заявок и патентов не является исчерпывающим и приводится в качестве примера.
Композиции, содержащие один или несколько синтетических пептидов формулы (I), а также один или несколько синтетических или рекомбинантных пептидов ВИЧ-1 или ВИЧ-2 находят свое применение в диагностике при обнаружении больных, инфицированных ретровирусом ВИЧ. Такие композиции также входят в состав настоящего изобретения.
Способы иммунного дозирования с применением одного или нескольких синтетических пептидов формулы (I), используемых отдельно или в сочетании с рекомбинантными пептидами ВИЧ-1 группы 0, или синтетическими или рекомбинантными пептидами ВИЧ-1 или ВИЧ-2 также относятся к изобретению.
Целью изобретения являются кроме того наборы, предназначенные для использования при иммунодозировании и содержащие пептид формулы (I) или композицию, содержащую по меньшей мере один пептид формулы (I).
Приводимые ниже примеры иллюстрируют изобретение и не являются ограничительными.
ПРИМЕР 1:
Получение соединения согласно изобретению; пептид 2 (3В)
LLSLWGCRGRLVCYTSVQWNET или
Данный пептид был синтезирован в твердой фазе. Технология, разработанная в 1963 году Меррифельдом (Merrifield) (J. Am. Chem. Soc., 1963, 85, стр. 2149-2154), состоит в фиксации первой аминокислоты на полимерной (выполненной из смолы) твердой основе посредством ее кислотной функции и в удлинении пептидной последовательности, начиная с указанной первой аминокислоты, при этом в процессе синтеза пептид сохраняется зафиксированным на смоле.
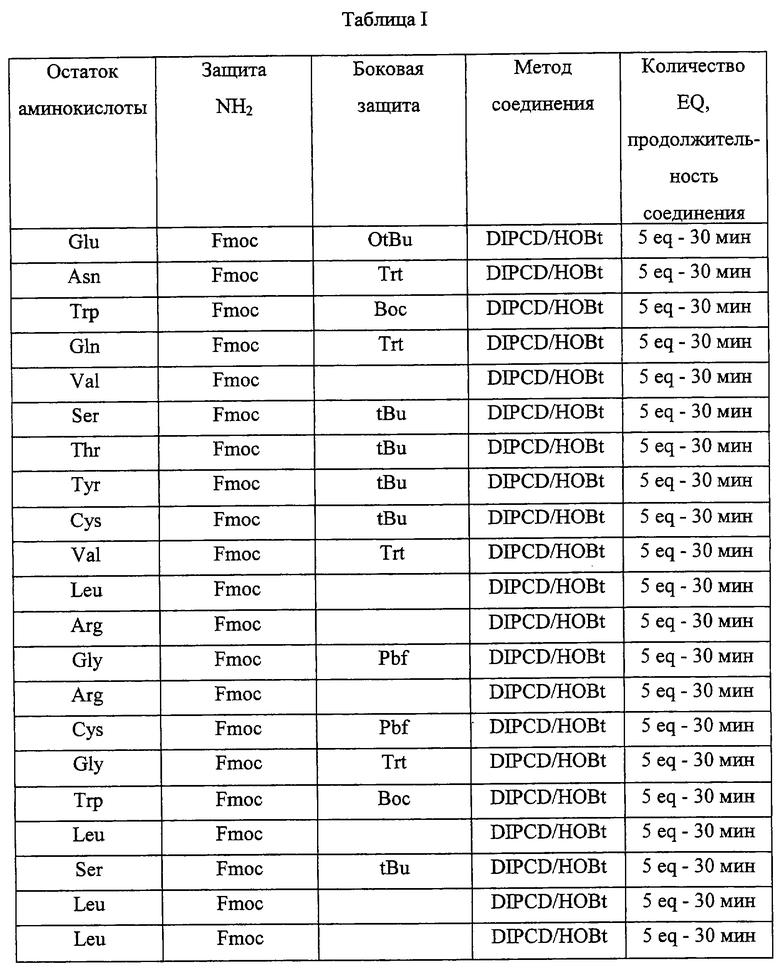
При синтезе пептида 2 использовали синтезатор "9050 Plus Pep ithesizer" и смолу Fmoc Thr (OtBu) PEG PS.
В таблице I указаны различные этапы синтеза.
По окончании синтеза смолу промывали диметилформамидом, затем хлорметаном и сушили в вакууме.
После этого смолу обрабатывали реактивом к (82% трифторуксусной кислоты, 5% фенола, 5% воды, 5% тиоанизола, 3% этандитиола). Пептид 2 (3В), выделенный осаждением окисью диэтила, промывали тем же растворителем. Таким образом было получено 140 мг пептида 2 (3В).
После этого пептид 2 (3В) очистили с помощью жидкостной хроматографии с обратной фазой. В качестве твердой фазы применяли фазу Бондапака (Bondapak) C-18. Пептид элюировали, применяя линейный градиент между двумя буферными растворами, из которых первый раствор был в основном водным (например, вода-трифторуксусная кислота 0,1%), второй скорее органическим (например, смесь, содержащая 60% ацетонитрила, 39,92% воды и 0,08% трифторуксусной кислоты). Собранные чистые фракции объединяли, концентрировали в вакууме и лиофилизовали.
При циклизации полученный очищенный искусственный пептид растворили в растворе ацетата аммония (10 мМ). Показатель рН довели до 8,5 добавлением гидроксида аммония 1 М. Раствор интенсивно перемешали. Полная циклизация завершилась через 18 часов. Показатель рН снизили после этого до 6 добавлением уксусной кислоты. Циклизованный пептид лиофилизовали, затем очищали с помощью жидкостной хроматографии с обратной фазой, как описано выше.
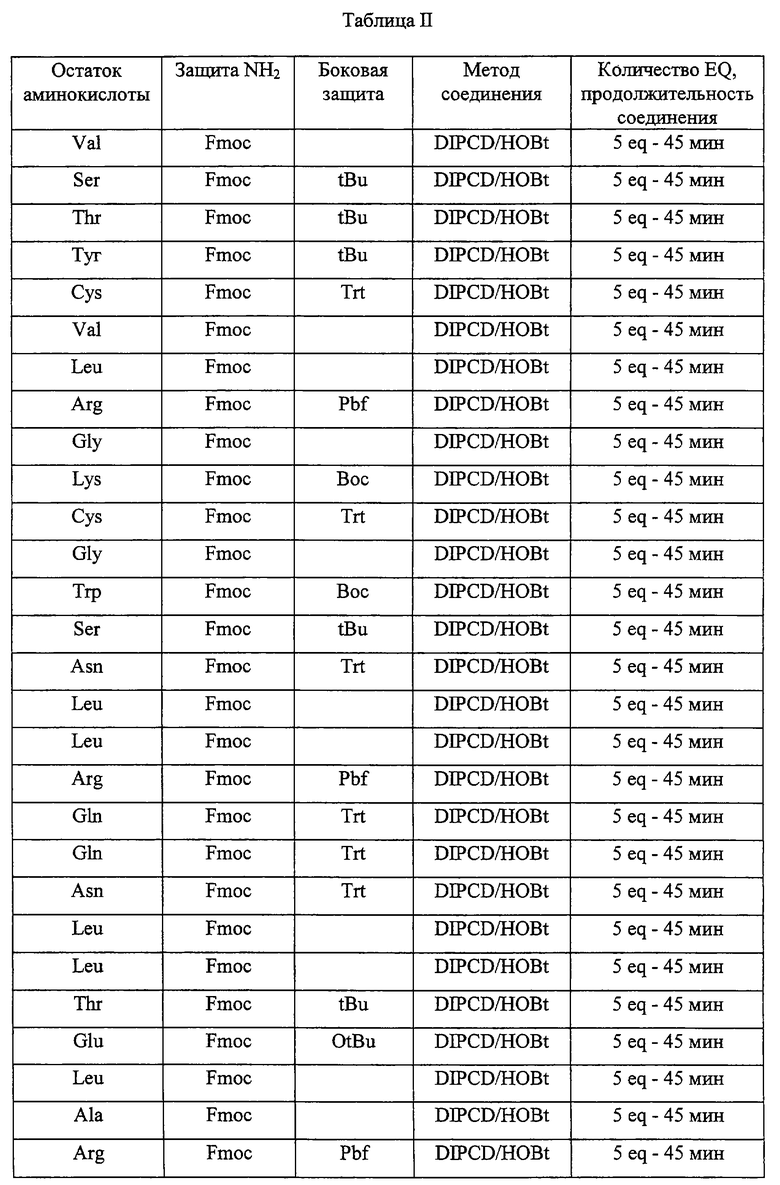
Получение соединения согласно изобретению "пептид 15 (22В)"
Этот пептид синтезировали подобно пептиду 2 (3В), но в качестве смолы использовали смолу FmocPAL PEG-PS.
В приводимой ниже таблице II указаны различные этапы синтеза.
По окончании синтеза смолу промывали диметилформамидом, затем дихлорметаном и сушили в вакууме.
После этого смолу обрабатывали реактивом К (82% трифторуксусной кислоты, 5% фенола, 5% воды, 5% тиоанизола, 3% этандитиола). Пептид 7 (22В), выделенный осаждением окисью диэтила, промывали тем же растворителем. Таким образом было получено 140 мг пептида 15 (22В).
После этого пептид 15 (22В) очистили жидкостной хроматографией с обратной фазой, циклизовали, лиофилизовали и очищали, как описано выше, для пептида 2 (3В).
Аналогичным образом синтезировали другие соединения согласно изобретению с использованием смол и соответствующих аминокислот.
В таблице III указан молекулярный вес некоторых пептидов формулы (I) в нециклизованном виде, который определяли масс-спектрометрией.
ПРИМЕР 2:
Определение иммунореактивности пептидов согласно изобретению с помощью иммунно-ферментативного теста. Тест 1
Применявшиеся сыворотки ESS, DUR, VAU и HAD были получены от больных французской национальности, инфицированных ретровирусами ВИЧ-1 группы 0. Другие сывороточные пробы, взятые у больных, инфицированных ретровирусами ВИЧ-1 группы 0, были получены Институтом Пастера из Яунде, Камерун, и серотипизированы как группа 0 в соответствии с серологическим алгоритмом, описанным в AIDS, 1977 г., 77, стр. 445-453.
ВИЧ-отрицательные сыворотки (ВИЧ) (n=48) были получены от здоровых доноров.
Применявшиеся синтетические пептиды растворяли в воде в концентрации 1 мг/мл (маточный раствор). На этапе сенсибилизации твердой фазы (coating) 110 мкл раствора с содержанием 2 мкг/мл каждого пептида (получен разбавлением маточного раствора карбонатным буферным раствором 0,1 М) добавляли в каждую лунку плашек для микротитрования MicrotiterTM (NUNC). После инкубации в течение ночи при комнатной температуре микроплашки сначала промывали буферным раствором Tris NaCl, рН 7,4, с содержанием 0,1% Tween® 20 и 0,001% мертиолата натрия, затем насыщали раствором PBS с содержанием 0,5% RegilaitTM (порошок обезжиренного молока). После отсоса раствора насыщения плашки нагревали при 50oС в течение 10 минут.
Сывороточные пробы разводили в пропорции 1/5 раствором обезжиренного молока (цитратный буфер с добавкой 0,01% фенолового красного, 0,25% хлороформа и 0,25% Kathon®), помещали в лунки плашек и инкубировали в течение 30 минут при 40oС.
После промывки буферным раствором Tris NaCl, pH 7,4, содержавшим 0,1% Tween® 20 и 0,001% мертиолата натрия 100 мкл раствора коньюгата антител козы anti IgG и IgM человека, меченных пероксидазой хрена, с содержанием в качестве консерванта 0,01% мертиолата натрия в виде раствора в буферном цитратном растворе с добавкой 30% глицерола и 25% нормальной сыворотки эмбриона теленка добавляли в каждую лунку плашки, после чего последние инкубировали в течение 30 минут при 40oC.
После промывки буфером Tris NaCl, pH 7,4, с содержанием 0,1% Tween® 20 и 0,001% мертиолата натрия окраску получали добавкой в каждую лунку 100 мкл 0-фенилендиамина в виде раствора в перекиси водорода. Затем микроплашки инкубировали в течение 30 минут в темноте при комнатной температуре. После этого прерывали реакцию окрашивания добавкой 100 мкл серной кислоты 4N. Удельное поглощение (А) определялось при 490 и 620 нм.
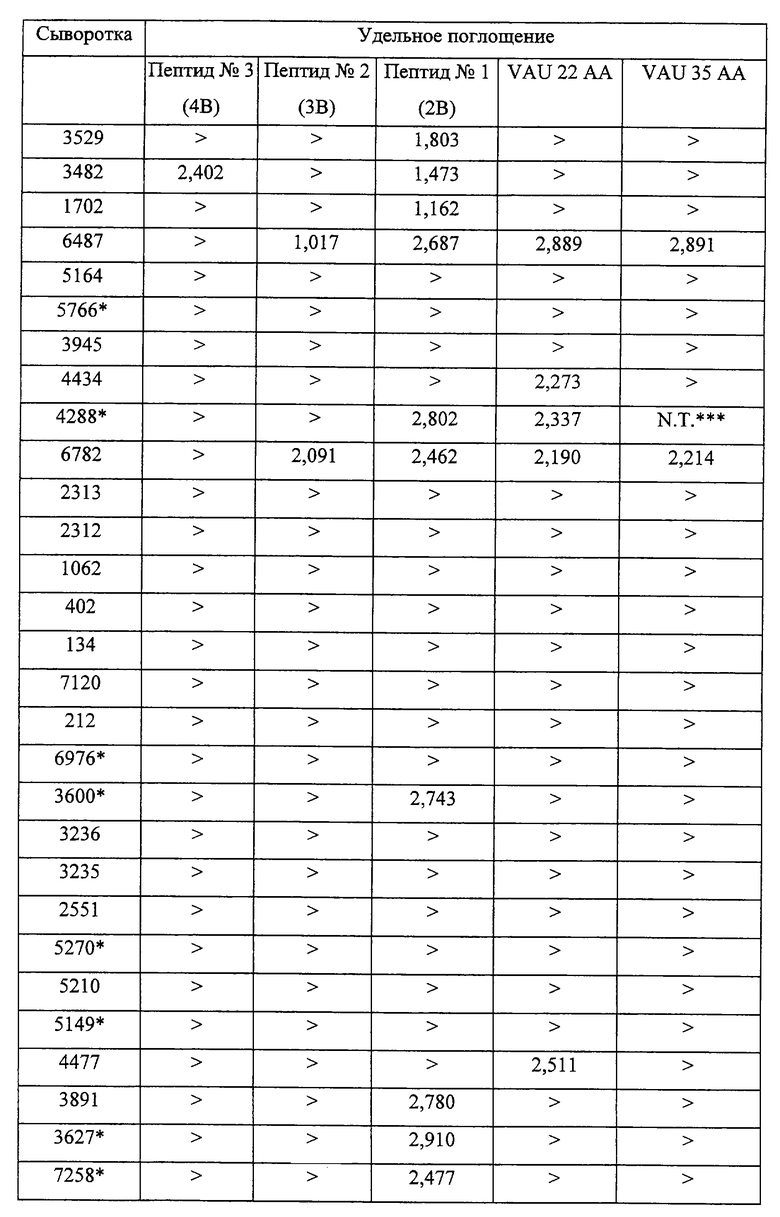
Относительное удельное поглощение (А490-А620), считываемое в каждой лунке, пропорционально иммунореактивности каждого пептида. Это указывает на способность каждого пептида вступать в реакцию с биологической пробой, используемой в тесте. Пороговая величина (cut-off) удельного поглощения была определена равной 0,15. Она соответствует средней величине отрицательных значений (n=48) плюс 12 типовых отклонений. Реакционную способность пептидов согласно изобретению (пептид 3 (4В), пептид 2 (3В) и пептид 1 (2В), все в циклизованном виде) сравнивали с реакционной способностью двух синтетических пептидов, последовательность которых является частью натуральной последовательности оболочки изолята VAU (ретровирус ВИЧ-1 группы 0) и которые содержат иммунодоминантный эпитоп gр41.
Эти оба пептида имеют последовательность, А (см. в конце описания).
При исследовании пептиды применялись в циклизованном виде. Результаты этого исследования приведены в таблице IV.
Результаты таблицы IV свидетельствуют о том, что пептид 3 (4В) обладает более эффективными свойствами по сравнению с другими пептидами. Этот пептид позволяет более эффективно обнаруживать сыворотки больных, инфицированных ретровирусом ВИЧ-1 группы 0, по сравнению с двумя пептидами, содержащими частично последовательность изолята VAU, соответствующего иммунодоминантному эпитопу gр41. В частности пептиды 2 (3В) и 1 (2В) согласно изобретению обладают более выраженной иммунной реактивностью, чем пептид VAU 22 АА, содержащий такое же число аминокислот.
ПРИМЕР 3:
Оценка иммунореактивности пептидов согласно изобретению с помощью иммунно-ферментативного теста. Тест 2
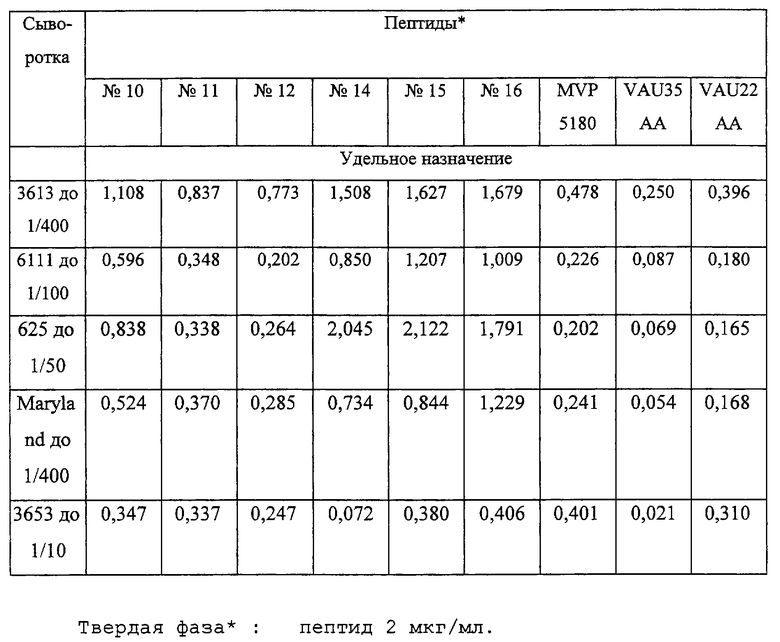
Сывороточные пробы больных, инфицированных ретровирусом ВИЧ-1 группы 0, были получены Институтом Пастера из Яунде, Камерун, серотипизированы как группа 0 по серологическому алгоритму, описанному в AIDS, 1977 г., 11, стр. 445-453. Одна генотипическая проба (Maryland) поступила из США. Указанные пробы предварительно разбавили в отрицательной человеческой сыворотке до разведении, приведенных в таблице V, с тем, чтобы располагать достаточным объемом при проведении различных тестов на иммунореактивность.
Используемые синтетические пептиды растворили в воде в концентрации 1 мг/мл (маточный раствор). На этапе сенсибилизации твердой фазы (coating) поступали, как описано в примере 2.
Сывороточные пробы разбавили в пропорции 1/5 раствором обезжиренного молока (в нитратном буфере с добавкой фенолового красного 0,01%, хлороформа 0,25% и Kathon® 0,25%), поместили в лунки плашек и инкубировали в течение 30 минут при 40oС.
После промывки буфером Tris NaCl, pH 7,4, с содержанием 0,1% Tween® и 0,001% мертиолата натрия 100 мкл раствора конъюгата антител козы антиIgG и человеческих IgM, меченых пероксидазой хрена, содержащего в качестве консерванта мертиолат натрия (0,01%) в виде раствора в цитратном буферном растворе с добавкой глицерина (30%) и нормальной эмбриональной телячьей сыворотки (25%), добавили в каждую лунку, после чего плашки инкубировали в течение 30 минут при 40oC.
После промывки буфером Tris NaCl, pH 7,4, с содержанием 0,1% Tween® 20 и 0,001%, мертиолата натрия окраску проявляли, как описано в примере 2.
Удельное относительное поглощение (DO)(А490-А620), считанное в каждой лунке, пропорционально иммунореактивности каждого пептида. Это указывает на способность каждого пептида вступать в реакцию с биологической пробой, используемой в тесте.
Реакционную способность пептидов согласно изобретению (пептиды 10 (14В), 11 (18В), 12 (19В), 14 (21В), 15 (22В), 16 (23В), все в циклизованном виде, сравнивали с реакционной способностью трех гомологичных синтетических пептидов, последовательность которых является частью натуральной последовательности оболочки ретровируса ВИЧ-1 группы 0. Этими пептидами явились два пептида, производных изолята VAU: пептид VAU 22 АА и пептид MVP 5180 (в таблице V обозначен, как "MVP 5180"). Пептиды VAU 22 АА и VAU 35 АА (их структура приведена в примере 2), а также пептид MVP 5180 содержат иммунодоминантный эпитоп gр41.
Все эти пептиды применялись в циклизованном виде. Последовательность пептида MVP 5180 имеет следующий вид (см. в конце описания).
Результаты данного исследования приведены в таблице V.
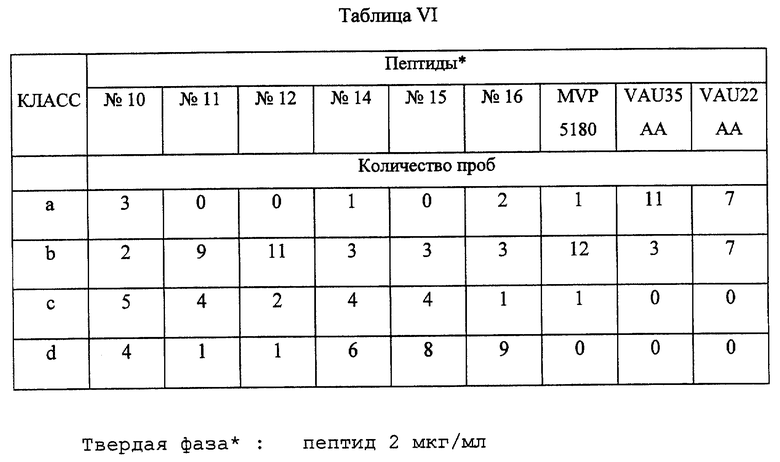
Для каждого тестируемого пептида пробы были разбиты на четыре класса (а, b, с, d), которые соответствуют разным уровням относительного удельного хюглощения, считываемого при длине волны А492-А620:
для a: DO<0,100,
для b: 0,100<DO<0,500,
для с: 0,500<DO<1,00,
для d: DO<1,00,
что позволило определить степень иммунной реактивности пептидов. Наиболее иммуннореактивными пептидами оказались те, для которых наибольшее количество проб отнесено к классам, соответствующим наиболее высоким показателям удельного поглощения.
Результаты приведены в таблице VI.
Результаты свидетельствуют о том, что все тестированные пептиды согласно изобретению обладают более высокой иммунной реакционной способностью, чем эталонные пептиды из уровня техники, происходящие из естественных иэолятов (MVP 5180, VAU). Пептиды 15 (22В), 14 (21В) и 16 (23В) согласно изобретению оказались наиболее иммуннореактивными.
ПРИМЕР 4:
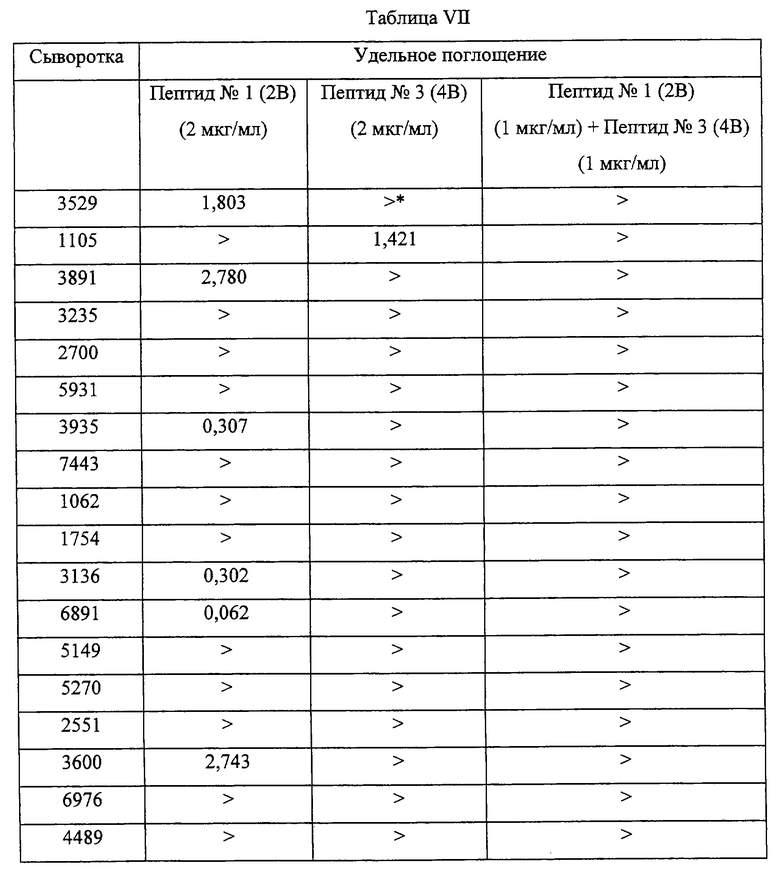
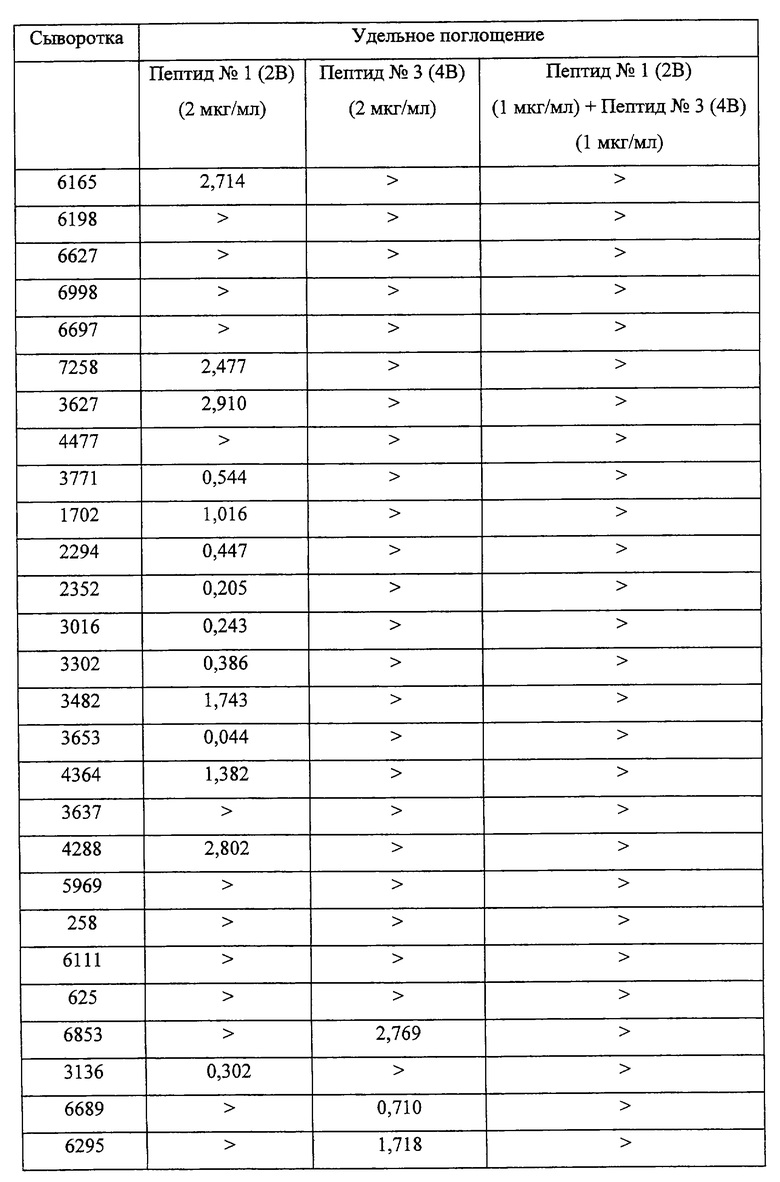
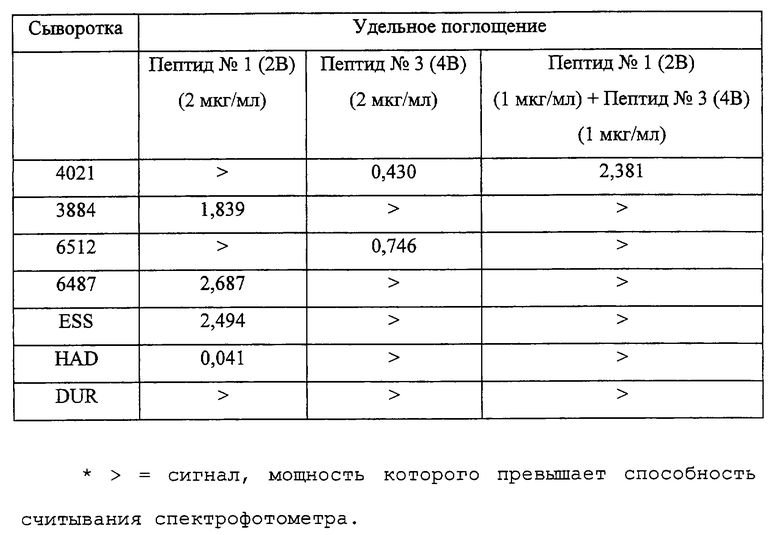
Оценка иммунореактивности композиций, содержащих пептиды согласно изобретению, посредством иммунно-ферментативного теста
При этом исследовании поступали в соответствии с протоколом, описанным в примере 2, причем применялись одни и те же сыворотки. Применявшиеся микроплашки сенсибилизировали либо циклизованным пептидом 1 (2В), либо циклизованным пептидом 3 (4В), либо композицией, содержащей оба этих пептида (1:1 в отношении частей). В каждую из лунок помещали либо 100 мкл раствора с содержанием 2 мкг/мл пептида 1 (2В), либо 100 мкл раствора с содержанием 2 мкг/мл пептида 3 (4В), либо 100 мкл раствора с содержанием 1 мкг/мл пептида 1 (2В) и 1 мкг/мл пептида 3 (4В).
Результаты исследования приведены в таблице VII.
Приведенные в таблице VII результаты показывают, что композиции из пептидов согласно изобретению в случае их применения в диагностике позволяют обнаружить все сыворотки больных, инфицированных ретровирусами ВИЧ-1 группы 0.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ, КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ЭНДОНУКЛЕАЗЫ CBLB | 2018 |
|
RU2779097C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ К BCMA | 2015 |
|
RU2747457C2 |
| ВАРИАНТЫ, КОМПОЗИЦИИ И МЕТОДЫ ПРИМЕНЕНИЯ ХОМИНГ-ЭНДОНУКЛЕАЗЫ PD-1 | 2017 |
|
RU2781083C2 |
| Способ получения пептидов | 1985 |
|
SU1530097A3 |
| ЛИНКЕРЫ НА ОСНОВЕ СУЛЬФОМАЛЕИМИДА И СООТВЕТСТВУЮЩИЕ КОНЪЮГАТЫ | 2019 |
|
RU2815199C2 |
| ВИРУСОПОДОБНЫЕ ЧАСТИЦЫ С ВЫСОКОПЛОТНЫМ ПОКРЫТИЕМ ДЛЯ ИНДУКЦИИ ЭКСПРЕССИИ АНТИТЕЛ | 2017 |
|
RU2813282C2 |
| Способ получения пептидов | 1984 |
|
SU1426455A3 |
| Способ получения пептидов | 1984 |
|
SU1477248A3 |
| Способ получения пептидов | 1986 |
|
SU1575944A3 |
| МОДИФИЦИРОВАННЫЕ ПЕПТИДЫ ВИЧ-1 И ИХ ПРИМЕНЕНИЕ ДЛЯ ОБНАРУЖЕНИЯ АНТИТЕЛ ПРОТИВ ВИЧ | 2005 |
|
RU2352579C2 |






























Изобретение относится к новым синтетическим пептидам мономерного типа с 13-33 аминокислотами или димерного типа с 26-66 аминокислотами линейной или циклизованной интерцистеиновыми дисульфидными мостиками формы, соответствующей формуле (I)
Δ-Z-Trp Gly Cys-Θ-Cys Tyr Thr Ser-Ω, (I)
вкоторойΔозначаетбиотинил,биоцитинил,атомводорода,ацетил(СН3СО-), алифатическую цепь, которая может содержать одну или несколько тиоловых, альдегидных или аминных функций, при этом алифатическая цепь представляет собой преимущественно алкильную цепь с 1-6 атомами углерода, или алкенильную цепь с 2-6 атомами углерода, или аминоалкилкарбонильную цепь с 2-6 атомами углерода; Z - последовательность пептидов одной из формул
в которых Ξ1 означает пептидную последовательность с 2-9 аминокислотами; Ξ2 - пептидную последовательность с 0-5 аминокислотами, Θ - пептидную последовательность формулы (XI) -(АА1)-(АА2)-(АА3)-(АА4)-(АА5)- (XI), в которой (AA1) - остаток лизина либо аргинина; (АА2) - остаток глицина, (АА3) - остаток лизина либо аргинина, (АА4) - остаток лейцина либо аланина, (АА5) - остаток валина при условии, что (AA1), (AA2), (АА3), (АА4), (AA5) никогда не образуют вместе пептидные последовательности -Lys Gly Lys Leu Ile- и -Lys Gly Lys Leu Val-; Ω зафиксированная на группе -СО серина, означает: гидроксил, пептидную последовательность формулы (ХII) -Val-Σ-Ψ, где Σ - последовательность формулы (ХIII) -(АА6)-Тrр-Asn-(АА7)-(AA8), в которой (АА6) - глутамин или аргинин, (АА7) - глутамин или серин, (AA8) - треонин и в которой Ψ, зафиксированная на остатке -СО - свободной аминокислоты AA8, означает группу ОН, пептидную последовательность формулы (ХУ) -Val-Ψ, в которой Ψ имеет указанное выше значение; композициям для обнаружения инфекции, вызванной ВИЧ-1 группы 0, способам диагностики инфекций, вызванных ВИЧ-1 группы 0 и диагностическому набору. Описываемые пептиды при использовании их в композициях, способах диагностики инфекций и в диагностических наборах позволяют получить результаты превосходящие те, что получены при использовании известных пептидов. 7 с. и 7 з.п. ф-лы, 8 табл.
Δ-Z-Trp Gly Cys-Θ-Cys Try Thr Ser-Ω, (I)
в которой Δ означает биотинил, биоцитинил, атом водорода, ацетил (СН3СO-), алифатическую цепь, которая может содержать одну или несколько тиоловых, альдегидных или аминных функций, при этом алифатическая цепь представляет собой преимущественно алкильную цепь с 1-6 атомами углерода, или алкенильную цепь с 2-6 атомами углерода, или аминоалкилкарбонильную цепь с 2-6 атомами углерода;
Z - последовательность пептидов одной из формул:
-Ξ1-Ser-Ξ2-; (II)
-Ξ1-Gln-Ξ2-; (V)
-Ξ1-Asn-Ξ2-; (VIII)
в которых Ξ1 означает пептидную последовательность с 2-9 аминокислотами, Ξ2 - пептидную последовательность с 0-5 аминокислотами, Θ - пептидную последовательность формулы (ХI)
-(АА1)-(АА2)-(АА3)-(АА4)-(АА5)-, (ХI)
в которой (АА1) - остаток либо лизина, либо аргинина, (АА2) - остаток глицина, (АА3) - остаток либо лизина, либо аргинина, (АА4) - остаток либо лейцина, либо аланина, (АА5) - остаток валина при условии, что (АА1), (АА2), (АА3), (АА4), (АА5) никогда не образуют вместе пептидные последовательности -Lys Gly Lys Leu Ile- и -Lys Gly Lys Leu Val-
Ω, зафиксированная на группе -СО серина, означает гидроксил (-ОН), пептидную последовательность формулы (ХII)
-Val-Σ-Ψ, (XII)
в которой Σ - последовательность формулы (ХIII)
-(АА6)-Trp-Asn-(АА7)-(АА8), (ХIII)
в которой (АА6) - глутамин или аргинин, (АА7) - глутамин или серин, (АА8) - треонин и в которой Ψ, зафиксированная на остатке -СО- свободной аминокислоты АА8, означает группу ОН,
пептидную последовательность формулы (ХV)
-Val-Ψ, (XV)
в которой Ψ имеет указанное выше значение.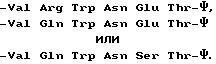
4. Синтетические пептиды формулы (I) по одному из пп. 1-3, в которой Z означает пептидную последовательность формул -Leu Leu Ser Ser-; -Leu Leu Asn Ser-; -Leu Leu Gln Ser-; -Arg Leu Asn Ser-; -Ala Leu Glu Thr Leu Gln Asn Gln Gln Leu Leu Asn Ser-; -Ala Leu Glu Thr Leu Leu Gln Asn Gln Gln Leu Leu Asp Leu-; -Ala Leu Glu Thr Leu Leu Gln Asn Gln Gln Leu Leu Asn Ile-; -Leu Asn Gln Gln Leu Leu Asn Ser- или -Arg Ala Leu Glu Thr Leu Leu Asn Gln Gln Arg Leu Leu Asn Ser-.
Δ-Za-Trp Gly Cys-Θ-Cys Tyr Thr Ser-Ωa (Ia)
в которой Zа - радикал формул
Ξ1a-Ser-Ξ2a; (IIa)
Ξ1a-Gln-Ξ2a; (Va)
Ξ1a-Asn-Ξ2a, (VIIIa)
в которых Ξ1a - пептидная последовательность из 2-5 аминокислот, Ξ2a - аминокислота, Ωa - пептидная последовательность формулы (ХII), такая, как приведена для формулы (I),
Δ, Θ, Σ, Ψ имеют те же значения, что и в формуле (I).
Приоритет по признакам:
09.04.1997 - пептиды 2В: 3В: 4В, 5В, 6В, N6 и N7;
24.02.1998 - пептиды 12В, 14В, 18В, 19В, 20В, 21В, 22В, 23В.
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
Авторы
Даты
2002-07-10—Публикация
1998-04-06—Подача