Изобретение относится к области медицины, а именно к хирургии и оториноларингологии, и может быть использовано в комплексном лечении пациентов с протяженными рубцовыми стенозами гортани и трахеи при этапных реконструктивных операциях.
Хронический рубцовый стеноз гортани и трахеи - патологический процесс, связанный с замещением нормальных структур гортани и трахеи грубой рубцовой тканью, разрушению хрящевой ткани с нарушением их каркасной функции, приводящий к сужению просвета или полной его облитерации.
Наиболее распространенными причинами хронического рубцового стеноза гортани и трахеи являются: интубация трахеи с искусственной вентиляцией легких (ИВЛ); экстренная и плановая трахеостомия; неспецифическое поражение гортани при системных заболеваниях крови и соединительной ткани; травматическое поражение гортани и трахеи; термоингаляционная травма; ранее проведенное хирургическое лечение гортани и шейного отдела трахеи.
При длительной искусственной интубации легких патологические изменения в гортани и трахее возникают у 30% пациентов [1, 2, 3]. Известно, что даже непродолжительная по времени искусственная вентиляция легких (ИВЛ), погрешности в технике трахеостомии оказывают отрицательное воздействие на состояние слизистой оболочки гортани и трахеи, способствуют образованию эрозий и формированию в последующем стеноза различной степени выраженности. Интубационная и трахеостомическая трубки могут приводить к ишемическому некрозу стенки трахеи, хондроперихондриту гортани и трахеи и трахеомаляции с развитием рубцового стеноза. Самой частой постинтубационной травмой является изъязвление слизистой оболочки трахеи (31%), кровоизлияние в подслизистую оболочку (21%) и острые эрозии трахеи (20%), которые в последующем приводят к замещению нормальных структур рубцовой тканью с исходом в циркулярное сужение или полную атрезию просвета [4, 5, 6].
При развивающемся постинтубационном стенозе в стенке гортани и трахеи происходят морфологические изменения, которые проходят последовательные стадии в виде эрозивно-язвенного трахеита, разрастания грануляционной ткани с лимфолейкоцитарной инфильтрацией и последующей плоскоклеточной метаплазией эпителиальной выстилки с деструкцией хрящевых элементов и их очаговой оссификацией, что приводит на заключительных этапах к образованию хронического рубцового стеноза гортани и шейного отдела трахеи [7, 8].
Нарушение микроциркуляции слизистой оболочки в области развития рубцового стеноза влечет за собой нарушение репаративных процессов и снижению устойчивости к инфекционным агентам, что приводит к развитию хронической воспалительной реакции [9].
Применение новых медицинских технологий, поиск новых реконструктивных материалов, усовершенствование существующих и разработка новых подходов к лечению пациентов с обширной рубцовой облитерацией гортани и шейного отдела трахеи является актуальной и востребованной задачей.
Известен метод циркулярной резекции трахеи с восстановлением целостности дыхательного пути с помощью трахеального анастомоза. При данном способе лечения полностью удаляют все пораженные рубцовым процессом участки трахеи, сшивая, как правило, неизмененные ткани [10].
Основные требования для эффективности оперативного лечения при циркулярной резекции трахеи - непротяженный рубцовый стеноз трахеи, отсутствие вовлеченности в рубцовый процесс истинных голосовых складок и распространение рубцового процесса в подскладковом отделе в непосредственной близости от них (менее 0,5 см), отсутствие выраженной сопутствующей патологии со стороны других органов и систем и т.д., что значительно уменьшает количество больных, которым может быть рекомендован данный метод хирургического лечения [11].
Недостатками метода циркулярной резекции трахеи являются высокая вероятность неблагоприятного исхода при наличии функционирующей трахеостомы. Трахеостома является очагом хронической инфекции и поддерживает хроническое воспаление стенок гортани и трахеи различной степени выраженности. При наличии функционирующей трахеостомы в непосредственной близости от перстневидного хряща существует вероятность резекции подскладкового отдела гортани с фигурной линией трахеогортанного анастомоза, что требует высокоспециализированной медицинской помощи и опыта работы в области перстневидного хряща. Зона воспаления в измененной стенке гортани и трахеи гистологически может быть больше видимой и определяемой при компьютерной томографии. В случае недостаточно резецированного фрагмента трахеи с сохранением зоны поражения существует высокая вероятность несостоятельности анастомоза. При протяженной резекции гортанно-трахеального участка также существует вероятность расхождения анастомоза и неэффективности оперативного лечения с развитием осложнений вплоть до летального исхода [10].
Наиболее широко применяется классический этапный метод хирургического лечения хронического рубцового стеноза гортани и трахеи наружным доступом, заключающийся в иссечении рубцовой ткани суженного участка и формировании нового просвета дыхательных путей. В большинстве случаев протяженные рубцовые стенозы сопровождаются частичным или полным отсутствием хрящевой ткани на уровне поражения, что требует применения различных имплантационных материалов и модификации методов хирургического лечения, с целью сохранения сформированного послеоперационного просвета. Эпителизация раневой поверхности проходит длительный период времени и представляет собой сложный динамический процесс, заключающийся в появлении и росте новых клеток, и образовании соединительной ткани. Склонность к послеоперационным рецидивам рубцовой ткани делает лечение многоэтапным, длительным и трудным. Для поддержания сформированного послеоперационного просвета используются протезы различной конфигурации. Наиболее распространено длительное протезирование силиконовыми Т-образными трахеостомическими трубками [6, 12].
Основной целью каркасных материалов является поддержание стойкого просвета дыхательных путей, противодействие разрывным нагрузкам, возникающим при кашле и вовремя форсированного дыхания, препятствие спадению просвета трахеи на вдохе, то есть выполнение опорной функции. Пиковые значения интратрахеального давления у человека во время кашля в момент закрытия голосовой щели равняется внутригрудному и может достигать 300 мм рт. ст., что должен компенсировать предел прочности имплантата [13].
Существуют различные варианты пластики гортанно-трахеального дефекта и реконструкции нижних дыхательных путей с использованием аутохрящей ребра, ушной раковины, кожно-мышечных лоскутов, сформированных из разных областей шеи и грудной клетки. Однако кожно-мышечная пластика гортани и трахеи характеризуется низкими функциональными результатами, что связано с отсутствием каркасной функции. Костные порции лоскутов сложно моделировать по полукруглой форме органа, невозможно замещать дефекты гортани и трахеи более 1/3 от их окружности, травматизацией донорской области, что ограничивает использование этого материала в качестве каркаса верхних дыхательных путей [14].
Недостатками использования аутохрящей являются необходимость в дополнительном оперативном вмешательстве, связанном с забором и изготовлением имплантационного материала. К тому же количество имплантационного материала и возможность перемещения его в необходимую область ограничены и бывают недостаточны для достижения необходимого результата оперативного лечения. Получение аутологичных хрящей ведет к анатомо-функциональным и косметическим дефектам в донорской зоне, что может вызвать необходимость их пластического восстановления, что влечет за собой дополнительное оперативное вмешательство в донорской области. Зачастую использование сложных многокомпонентных префабрикованных реваскуляризованных кожно-мышечно-костных и кожно-мышечно-хрящевых аутотрансплантатов сопряжено с применением микрохирургической техники. У пациентов с обширными рубцовыми изменениями и вялотекущими септическими процессами окружающих тканей использование микрохирургической техники невозможно [15].
Известны исследования с применением синтетического материала в виде сетки из марлекса в качестве имплантационного материала.
Ягудин Р.К. и соавт. выполняли окаймляющий разрез кожи вокруг трахеостомы, кожу сшивали над трахеостомой эпидермисом в просвет. Вторым слоем сшивали передние мышцы шеи. На мышцы третьим слоем помещали полипропиленовую сетку. Использовали сетчатые протезы фирмы «эсфил» и «пролен». Для эвакуации раневого отделяемого над имплантированной сеткой оставляли 2 вакуум-дренажа. Окончательно трахеостомическое отверстие закрывали с помощью перемещения двух треугольных кожных лоскутов, которые выкраивали по бокам от трахеостомы (четвертый слой). У 3 больных (все с четырехслойной пластикой) в сроки от 1 до 27 суток после операции возник ранний рецидив стеноза, связанный с баллотированием боковых стенок трахеи [16].
При использовании марлекса пациентов нередко беспокоят боли в области имплантации, нагноение раны с образованием свищей и секвестрацией протеза, экструзия сетки в позднем послеоперационном периоде сквозь кожу или в просвет дыхательных путей и аррозивные кровотечения из крупных сосудов.
Все современные сетчатые протезы считаются инертными. Однако гистологические данные, полученные при изучении удаленных по разным причинам протезов через месяцы и годы после имплантации, показывают, что в промежутках между волокнами полимера и тканями реципиента сохраняется персистирующая воспалительная реакция. К тому же материал инкапсулируется толстой капсулой без фиксации и прорастания его соединительной тканью, что не исключает миграцию имплантата [17].
Известен способ пластики боковой стенки гортани и трахеи (RU 2615272, A61B 17/00 опубликовано 04.04.2017), заключающийся в установке ксеноматериала на основе политетрафторэтилена в мягкие ткани, прилежащие к ларинготрахеостоме. Разрез кожи выполняют на расстоянии 2 см от края ларинготрахеостомы, формируют полнослойный кожно-подкожно-платизмальный лоскут и создают ложе для ксеноматериала на основе политетрафторэтилена в толще медиальной ножки грудино-ключично-сосцевидной мышцы с последующей фиксацией ее к боковой стенке ларинготрахеостомы [18].
Прототипом настоящего изобретения является способ пластики дефекта передней стенки трахеи (RU 2295923 A61B17/24, опубликовано 27.03.2007). Устранение трахеального дефекта в области передней стенки осуществляют с помощью полоски из аллохряща, которую помещают в поперечном направлении в области трахеального дефекта и комбинированного лоскута из артериализированных мышечно-фасциальных лоскутов из грудинно-ключично-сосцевидных мышц и фасциальным ограничителем для предупреждения лизиса аллохрящевой ткани. [19] Однако это изобретение преимущественно используется при ограниченных дефектах передней стенки трахеи и не применимо для протяженных сочетанных дефектов переднебоковых стенок и дефектов боковых стенок дыхательных путей. При ларинготрахеомаляции, когда отсутствуют опорные жизнеспособные структуры и создаются условия для патологической флотации опорного каркаса гортани и трахеи с последующим развитием стеноза, необходимо также укрепление боковых стенок гортани и трахеи, чего не может обеспечить использование вышеуказанного способа.
Вышеуказанные способы оперативного лечения рубцового стеноза гортани и трахеи применяются при наличии сохранившихся боковых фрагментов полуколец трахеогортанного сегмента, которые несут основную каркасную функцию, что ограничивает их использование у пациентов с обширными протяженными рубцовыми стенозами при имеющемся дефиците опорных жизнеспособных тканей в зоне сужения, обширной деструкции хрящевых элементов в сочетании с хондромаляцией либо полным отсутствием опорных хрящевых структур в области реконструкции гортанно-трахеального дефекта, несущих ключевую функцию для поддержания стойкого просвета дыхательных путей.
Таким образом, сохраняется потребность в эффективном способе пластики протяженных сочетанных дефектов гортани и трахеи больным гортанно-трахеальной атрезией, когда после иссечения рубцовой ткани в просвете дыхательных путей обнаруживается дефицит либо отсутствие жизнеспособных тканей, способных выполнять опорную функцию.
Цель изобретения
Повысить эффективность хирургического лечения пациентов с протяженной гортанно-трахеальной рубцовой деформацией с полной или частичной облитерацией просвета при помощи усовершенствования метода пластики гортанно-трахеального дефекта.
Нами предложен способ пластики переднебоковых стенок гортани и трахеи с протяженной (2-5 см) гортанно-трахеальной рубцовой деформацией просвета при помощи специально подготовленных аллогенных хрящевых трансплантатов, имеющих форму дуги, максимально приближенную к нормальной анатомической форме полукольца трахеи.
Аллогенный хрящ Аллоплант® - это пересадочный материал, химически обработанный и подвергнутый селективной радиационной стерилизации, что сводит к минимуму реакции тканевой несовместимости при операциях с трансплантацией данных биоматериалов. Аллопланты доступны в неограниченном количестве (в отличие от аутотрансплантатов), они легко моделируются под конкретную задачу и относительно универсальны для разных пациентов.
Достигаемым техническим результатом от заявленного способа является повышение эффективности и сокращение этапов реконструктивных операций при лечении больных с протяженной гортанно-трахеальной облитерацией, сокращение количества послеоперационных осложнений, профилактика рестенозирования гортанно-трахеального просвета и необходимости в повторных хирургических вмешательствах, что позволяет сократить длительность стационарного лечения, сроки реабилитации пациентов.
Технический результат достигается за счет того, что интраоперационно из аллогенного хряща моделируют трансплантаты в виде фрагментов полукольца трахеи. Конструируют трансплантаты при использовании наглядной трехмерной модели-прототипа, созданной из синтетического материала при помощи 3D-печати. Модель-прототип воссоздает в натуральную величину нормальные анатомические параметры полукольца трахеи, которые были определены на основании статистического анализа данных компьютерной томографии полых органов шеи. Сконструированные трансплантаты в преимущественном исполнении выполняют из аллогенного хряща ребра, способного выполнять опорную функцию, имеют форму дуги, и перфорированы по всему периметру сквозными отверстиями. Сквозные отверстия по периметру аллотрансплатата способствуют прорастанию окружающих тканей в имплантационный материал. Предпочтительно использовать реберный аллохрящ вследствие его бóльшей упругости в сравнении с аллохрящом трахеи, который теряет свою нативную упругость после обработки. Реберный хрящ частично изогнутой формы, что облегчает моделирование аллохрящевого трансплантата для перемещения его в область недостающих участков хрящевой ткани трахеи, имеющей дугообразную форму. Реберный аллохрящ способен адекватно выполнять опорную функцию и поддерживать каркас дыхательных путей на должном уровне, препятствующем флотации и спадению стенок при дыхании, в том числе форсированном, и кашле.
Технический результат также достигается за счет способа установки подготовленных трансплантатов, который заключается в имплантации двух или трех пар фрагментов реберных аллохрящей в область боковых стенок трахеи. Количество трансплантатов определяют в зависимости от протяженности дефекта стенок дыхательных путей. Трансплантаты устанавливают с сохранением между ними промежутка, который также способствует прорастанию окружающих тканей в трансплантат и предотвращает его инкапсулирование. В данной ситуации конструкция, состоящая из нескольких аллохрящевых трансплантатов с промежутком между ними анатомически более функциональна и максимально приближена к нормальной анатомии трахеи, состоящей из хрящевых полуколец с мембранозной соединительнотканной частью между ними. Дополнительно проводят имплантацию фрагментов аллохряща в область передней стенки перстневидного хряща гортани и передней стенки трахеи для предупреждения ее флотирования.
Описание чертежей
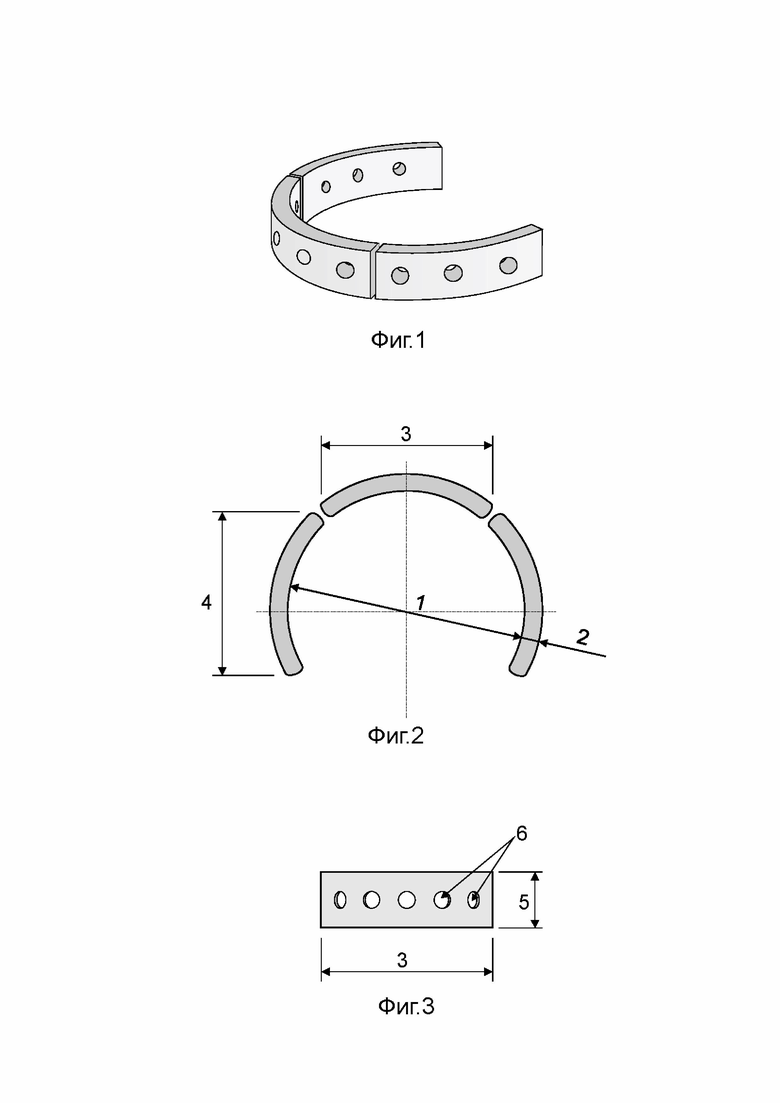
Фигура 1. Трехмерная модель-прототип полукольца трахеи, состоящая из трех фрагментов.
Фигура 2. Трансплантаты из реберного аллохряща (вид сбоку):
1 - диаметр полукольца 30 мм,
2 - ширина дуги 2 мм,
3 - передний трансплантат, длина проекции дуги 20 мм,
4 - боковой трансплантат, длина проекции дуги 25 мм.
Фигура 3. Передний трансплантат (вид сверху):
5 - высота дуги 3 мм,
6 - сквозные отверстия диаметром 1мм.
Осуществление изобретения.
Перед операцией из стерильного реберного аллохряща скальпелем моделируют необходимое количество трансплантатов, которое подбирается индивидуально в зависимости от протяженности дефекта стенок дыхательных путей. При этом в качестве визуального примера используют трехмерную модель-прототип, которая воссоздает в натуральную величину нормальные анатомические параметры полукольца трахеи. Модель-прототип создана из синтетического материала при помощи 3D-печати и имеет форму разрезанного на три части полукольца диаметром 30 мм (фиг. 1). Трансплантаты вырезают скальпелем из реберного аллохряща в соответствии с размерами модели-прототипа, при этом изготавливают две или три пары боковых трансплантатов и два или три передних трансплантата. Длина проекции дуги бокового трансплантата составляет 25 мм, а длина проекции дуги переднего трансплантата составляет 20 мм, высота трансплантатов 5 мм, ширина - 3 мм (фиг. 2, 3). Затем с помощью микродрели полученные трансплантаты перфорируют сквозными отверстиями диаметром 1 мм с шагом 5 мм. Подготовленные трансплантаты на время операции помещают в физиологический раствор 0.9% NaCl. Дополнительной стерилизации не требуется.
Далее проводят две последовательные реконструктивные операции пластики переднебоковых стенок гортани и шейного отдела трахеи у пациентов с протяженной гортанно-трахеальной облитерацией просвета. Операции проводят под общим наркозом.
На первой реконструктивно-пластической операции после иссечения рубцовой ткани, облитерирующей просвет дыхательных путей, формируют новый просвет гортани и трахеи. При отсутствии опорных хрящевых структур в зоне стеноза паратрахеально формируют мышечно-фасциальные карманы. Смоделированные боковые трансплантаты помещают в мышечно-фасциальные карманы, фиксируют к окружающим тканям викрилом 3.0. В один этап операции имплантируется две или три пары боковых трансплантатов в зависимости от протяженности дефекта стенок дыхательных путей. Далее трансплантат послойно укрывают мышцами, фасцией, подкожно-жировой клетчаткой и кожу фиксируют к трахеальной стенке, тем самым формируя стойкую ларинготрахеостому. В дальнейшем осуществляется протезирование на Т-образной трахеостомической трубке от 3 до 6 месяцев. Впоследствии проводится контрольный период без трахеостомической трубки с герметично заклеенным ларинготрахеостомическим отверстием. В контрольном периоде оценивается состоятельность опорной функции боковых стенок трахеи, отсутствии реакции отторжения и миграции материала, оценивается ригидность боковых стенок гортани и трахеи.
На второй реконструктивно-пластической операции формируется передняя стенка гортани и трахеи с имплантацией двух или трех передних трансплантатов (зависит от протяженности дефекта стенок дыхательных путей) с целью исключения риска пролабирования передней стенки в просвет дыхательных путей. Передние трансплататы фиксируют к ранее имплантированным боковым трансплантатам. Впоследствии производится ушивание ларинготрахеостомического дефекта и закрытие ларинготрахеостомы.
В НИКИО им. Л.И. Свержевского ДЗМ за период с 2020 по 2021 гг. прооперировано 20 пациентов с сочетанным рубцовым стенозом гортани и трахеи с протяженной ларинготрахеальной облитерацией просвета. Пациентам проведена реконструктивно-пластическая операция с использованием боковых и переднего фрагмента дуги аллохрящевого трансплантата. Период послеоперационного наблюдения составил 12 месяцев.
Возможность использования нескольких не связанных между собой фрагментов имплантационного материала при протяженных дефектах (2-5 см) переднебоковых стенок снижает риск отторжения трансплантата, гиперреактивности окружающих тканей и инкапсулирования с последующей миграцией в окружающие ткани. При рассасывании аллогенных трансплантатов в отдаленном послеоперационном периоде происходит их замещение грубоволокнистой фиброзной тканью, которая выполняет опорную функцию, способную поддерживать адекватный просвет дыхательных путей и препятствовать флотированию стенок гортани и трахеи при дыхании и кашле.
Пример конкретного выполнения № 1
Пациентка К., 20 лет, поступила с жалобами на дыхание через трахеостомическую трубку.
Из анамнеза пациентки известно, что год назад находилась на длительной интубации в реанимации по поводу наркотического отравления психотропными веществами. Впоследствии после выписки через неделю поступила в стационар с отечно-инфильтративным ларингитом, была произведена трахеостомия.
На амбулаторном этапе при осмотре пациентки выявлена протяженная ларинготрахеальная облитерация просвета выше трахеостомической трубки. При изучении серии компьютерных томограмм с последующей трехмерной реконструкцией дыхательных путей была определена протяженность рубцового стеноза гортани и трахеи 3 см.
Пациентке была проведена реконструктивно-пластическая операция на гортани и шейном отделе трахеи с иссечением рубцовой ткани на всем протяжении. Обнаружен значительный дефект боковых стенок трахеи, неспособных самостоятельно выполнять опорную функцию. Согласно протяженности дефекта боковых стенок интраоперационно было сформировано 2 пары трансплантатов из реберного аллохряща, состоящих из двух боковых фрагментов, максимально анатомически приближенной к нормальной форме трахеального полукольца. Аллохрящевой трансплантат перфорирован по всему периметру. Были сформированы мышечно-фасциальные карманы паратрахеально. Смоделированные аллохрящи имплантированы в область мышечно-фасциальных карманов, с надежной фиксацией к окружающим тканям викрилом 3.0. Далее трансплантат послойно укрыт мышцами, фасцией, подкожно-жировой клетчаткой и кожа фиксирована к трахеальной стенке, тем самым сформирована стойкая ларинготрахеостома. Сформированы боковые стенки трахеи, способные выполнять адекватную опорную функцию.
В послеоперационном периоде пациентке проводилась антибактериальная, противоотечная, ингаляционная терапия. Проводилось протезирование гортанно-трахеального комплекса на Т-образной трахеостомической трубке с последующим проведением, спустя 6 месяцев, контрольного периода без трахеостомической трубки с герметично заклеенным трахеостомическим отверстием.
На второй реконструктивно-пластической операции произведено хирургическое закрытие трахеостомы. с имплантацией сформированного переднего трансплантата, фиксированного к ранее имплантированным боковым трансплантатам.
Пример конкретного выполнения № 2
Пациент С., 27 лет, поступил с жалобами на дыхание через трахеостомическую трубку.
Из анамнеза пациента известно, что после отравления угарным газом попал в реанимационное отделение, где была произведена длительная интубация трахеи с последующей трахеостомией.
На амбулаторном этапе при осмотре пациента выявлена протяженная ларинготрахеальная облитерация просвета выше трахеостомической трубки. При изучении серии компьютерных томограмм с последующей трехмерной реконструкцией дыхательных путей была определена протяженность рубцового стеноза гортани и трахеи 5 см, хрящевая ткань полуколец трахеи не визуализируется.
Пациенту была проведена реконструктивно-пластическая операция на гортани и шейном отделе трахеи с иссечением рубцовой ткани на всем протяжении. Боковые стеки трахеи представлены соединительной тканью, хрящевые полукольца не обнаруживаются. В связи с отсутствием опорных структур интраоперационно было сформировано 3 пары трансплантатов из реберного аллохряща, состоящих из трех боковых фрагментов, максимально анатомически приближенной к нормальной форме трахеального полукольца. Аллохрящевой трансплантат перфорирован по всему периметру. Были сформированы мышечно-фасциальные карманы паратрахеально. Смоделированные аллохрящи имплантированы в область мышечно-фасциальных карманов, с надежной фиксацией к окружающим тканям викрилом 3,0. Далее трансплантат послойно укрыт мышцами, фасцией, подкожно-жировой клетчаткой и кожу фиксирована к трахеальной стенке, тем самым сформирована стойкая ларинготрахеостома. Сформированы боковые стенки трахеи, способные выполнять адекватную опорную функцию.
В послеоперационном периоде пациенту проводилась антибактериальная, противоотечная, ингаляционная терапия. Проводилось протезирование гортанно-трахеального комплекса на Т-образной трахеостомической трубке с последующим проведением, спустя 6 месяцев, контрольного периода без трахеостомической трубки с герметично заклеенным трахеостомическим отверстием.
Вторым этапом произведено хирургическое закрытие трахеостомы с имплантацией трех фрагментов сформированного переднего трансплантата, фиксированного к ранее имплантированным боковым трансплантатам.
Таким образом, предлагаемый способ позволяет повысить эффективность и снизить травматичность лечения больных с протяженными дефектами боковых стенок гортани и трахеи за счет определенной последовательности хирургических манипуляций с имплантацией необходимого количества специально подготовленных аллотрансплантатов, а также снизить частоту послеоперационных осложнений. Применение аллохряща ребра в предлагаемом способе позволяет добиться восстановления опорного скелета гортани и трахеи, не вызывает реакции отторжения и позволяет обеспечить максимально раннюю социальную и трудовую реабилитацию пациентов.
Источники информации
1. Егорова Е.В. Комплексная диагностика и лечение больных хроническими стенозами гортани и трахеи различной этиологии // Дис. канд. мед. наук. - М. -2005. - С. 114-116.
2. Литвиненко И.В. Ростовцев М.В. Братникова Г.И. К вопросу о комплексной лучевой диагностике патологии гортани // Медицинская визуализация. - 2008. - № 5. - С. 81-87.
3. Jaquot AL, Vega E, Molders X, Daveluy W, Kopciuch F, Benoit A, Allart E. Tracheal lesions after tracheotomy in patients with acquired brain injury: Incidence, associated factors and impact on rehabilitation. Ann PhysRehabil Med. 2016 Sep; 59S:e153. doi: 10.1016/j.rehab.2016.07.341
4. Панферова А.В. Эндоскопические методы диагностики и лечения больных со стенозами гортани и трахеи различной этиологии: Дис. канд мед наук. М., 2003; 120.
5. Келехсаева А.С. Эндоскопическая диагностика постинтубационных изменений гортани трахеи и пищевода: Дис. канд мед наук. М., 2007;107.
6. Цветков Э.А. Восстановительная хирургия гортани и шейного отдела трахеи при рубцовых стенозах у детей. Дис. д-ра мед наук. М. - 1990
7. Есаков Ю.С., Дубова Е.А., Жестков К.Г., Щеголев А.И. Морфологические изменения при постинтубационном стенозе трахеи. Хирургия. Журнал им. Н.И. Пирогова. 2010; 2: 60-62.
8. Зенгер В.Г., Наседкин В.Д., Паршин В.Д. Хирургия повреждений гортани и трахеи. М.: Медкнига, 2007: 368.
9. Паршин В.Д. Хирургия рубцовых стенозов трахеи. М.: Медицина. 2003, 152.
10. Паршин В. Д., Титов В. А., Паршин В. В., Паршин А. В., Берикханов З., Амангельдиев Д. М. Циркулярная резекция при рубцовом стенозе трахеи и функционирующей трахеостоме. Хирургия. Журнал им. Н.И. Пирогова. 2017;(9):23-32.
11. Чекан В. Л. Лечение сочетанных рубцовых стенозов гортани и трахеи. Вестник оториноларингологии. 2013;78(1):64-67.
12. Черный С.С. Реконструктивная хирургия протяженных и мультифокальных рубцовых стенозов трахеи. Дис. д-ра мед наук. М. - 2011
13. Селезнева Л.В. Современный взгляд на проблему пластики ларинготрахеального дефекта у больных с сочетанными стенозами гортани. Вестник оториноларингологии. 2017; 1: 73-76.
14. Ребрикова И.В., Решетов И.В., Васильев А.В., Батухтина Е.В., Киселева Е.В. Реконструкция верхних дыхательных путей у онкологических больных. Онкохирургия. 2013; 5:1: 73-79.
15. Паршин В.Д., Порханов В.А. Хирургия трахеи с атласом оперативной хирургии. М.: Альди-принт. 2010; 248-261
16. Ягудин Р.К., Ягудин К.Ф. Аллопластика ларинготрахео-стомы полипропиленовой сеткой «Эсфил». Вестник оториноларингологии. 2007; 1: 32-36
17. Симонов С.В. Пластика стойких ларинготрахеальных дефектов у больных хроническими стенозами гортани и трахеи. Бюллетень сибирской медицины. 2011; 6: 66-73.
18. Патент RU 2615272, A61B 17/00, опубликовано 04.04.2017 г. Способ пластики боковой стенки гортани и трахеи. Решульский С.С., Виноградов В.В.
19. Патент RU 2295923 A61B17/24, опубликовано 27.03.2007 г. Способ пластики дефекта передней стенки трахеи. Гюсан С.А.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ реконструкции переднебоковых отделов гортани и шейного отдела трахеи у пациентов с протяжённой ларинготрахеальной облитерацией просвета | 2022 |
|
RU2791388C1 |
| Гидрогелевый тампон для послеоперационного протезирования сформированного гортанно-трахеального просвета у пациентов с сочетанным гортанно-трахеальным стенозом и способ протезирования | 2020 |
|
RU2735055C1 |
| Стент-дилататор для лечения и профилактики рестеноза у пациентов с рубцовым стенозом вестибулярного и голосового отдела гортани и способ его установки | 2024 |
|
RU2824255C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ШЕЙНОГО ОТДЕЛА ТРАХЕИ ПРИ ЕГО РУБЦОВОМ ЗАРАЩЕНИИ С ЛИЗИРОВАНИЕМ ХРЯЩЕВОГО КАРКАСА | 2003 |
|
RU2242172C2 |
| Протектор-дилататор для лечения и профилактики рестеноза у пациентов с рубцовым стенозом складкового отдела гортани и способ протезирования | 2022 |
|
RU2782113C1 |
| Протектор-дилататор для лечения и профилактики рестеноза у пациентов с подскладковым рубцовым стенозом гортани и начального шейного отдела трахеи и способ протезирования | 2021 |
|
RU2766303C1 |
| Способ хирургического лечения рубцового стеноза шейного отдела трахеи или гортанно-трахеального стеноза и зонд для визуализации стеноза при выполнении хирургического лечения рубцового стеноза шейного отдела трахеи или гортанно-трахеального стеноза | 2016 |
|
RU2615724C1 |
| СПОСОБ ПЛАСТИКИ ТРАХЕИ МЕСТНЫМИ ТКАНЯМИ С УКРЕПЛЕНИЕМ ПЕРЕДНЕЙ СТЕНКИ ПЛАСТИНОЙ ИЗ ПОРИСТОГО НИКЕЛИДА ТИТАНА И ГРУДИНО-КЛЮЧИЧНО-СОСЦЕВИДНЫМИ МЫШЦАМИ | 2010 |
|
RU2449733C1 |
| Способ пластического замещения пострезекционных хрящевых дефектов на трахеогортанном сегменте | 2023 |
|
RU2801771C1 |
| Способ послеоперационного протезирования голосового отдела гортани после ларингопластики и стент для его осуществления | 2016 |
|
RU2609777C1 |
Изобретение относится к области медицины, а именно к хирургии и оториноларингологии. Перед операцией моделируют необходимое количество трансплантатов из стерильного реберного аллохряща в соответствии с размерами трехмерной модели-прототипа. Модель-прототип воссоздает в натуральную величину нормальные анатомические параметры полукольца трахеи и имеет форму разрезанного на три части полукольца диаметром 30 мм. Длина проекции дуги бокового трансплантата составляет 25 мм, длина проекции дуги переднего трансплантата составляет 20 мм, высота трансплантата – 5 мм, ширина – 3 мм. Полученные трансплантаты перфорируют сквозными отверстиями. Затем на первой реконструктивно-пластической операции после иссечения рубцовой ткани формируют новый просвет гортани и трахеи. В зоне стеноза паратрахеально формируют мышечно-фасциальные карманы, в которые помещают необходимое количество боковых трансплантатов. Фиксируют к окружающим тканям викрилом 3.0, послойно укрывают мышцами, фасцией, подкожно-жировой клетчаткой и кожу фиксируют к трахеальной стенке. Осуществляют протезирование на Т-образной трахеостомической трубке от 3 до 6 месяцев. Затем проводят контрольный период без трахеостомической трубки с герметично заклеенным ларинготрахеостомическим отверстием. На второй реконструктивно-пластической операции имплантируют необходимое количество передних трансплантатов с целью формирования передней стенки гортани и трахеи. Фиксируют передние трансплататы к ранее имплантированным боковым трансплантатам. Ушивают ларинготрахеостомический дефект и закрывают ларинготрахеостому. Способ позволяет повысить эффективность лечения, сократить количество этапов реконструктивных операций при лечении больных с протяженной гортанно-трахеальной облитерацией, снизить вероятность послеоперационных осложнений, предотвратить рестенозирование гортанно-трахеального просвета, исключить необходимость повторных хирургических вмешательств, сократить длительность стационарного лечения и сроки реабилитации пациентов. 4 з.п. ф-лы, 3 ил., 2 пр.
1. Способ пластики переднебоковых стенок гортани и шейного отдела трахеи у пациентов с протяженной гортанно-трахеальной облитерацией просвета, отличающийся тем, что перед операцией моделируют необходимое количество трансплантатов из стерильного реберного аллохряща в соответствии с размерами трехмерной модели-прототипа, которая воссоздает в натуральную величину нормальные анатомические параметры полукольца трахеи и имеет форму разрезанного на три части полукольца диаметром 30 мм, причем длина проекции дуги бокового трансплантата составляет 25 мм, а длина проекции дуги переднего трансплантата составляет 20 мм, высота трансплантата – 5 мм, ширина – 3 мм, полученные трансплантаты перфорируют сквозными отверстиями, затем на первой реконструктивно-пластической операции после иссечения рубцовой ткани формируют новый просвет гортани и трахеи, в зоне стеноза паратрахеально формируют мышечно-фасциальные карманы, в которые помещают необходимое количество боковых трансплантатов, фиксируют к окружающим тканям викрилом 3.0, послойно укрывают мышцами, фасцией, подкожно-жировой клетчаткой и кожу фиксируют к трахеальной стенке, осуществляют протезирование на Т-образной трахеостомической трубке от 3 до 6 месяцев, проводят контрольный период без трахеостомической трубки с герметично заклеенным ларинготрахеостомическим отверстием, затем на второй реконструктивно-пластической операции имплантируют необходимое количество передних трансплантатов с целью формирования передней стенки гортани и трахеи, фиксируют передние трансплататы к ранее имплантированным боковым трансплантатам, ушивают ларинготрахеостомический дефект и закрывают ларинготрахеостому.
2. Способ по п.1, отличающийся тем, что в зависимости от протяженности дефекта стенок дыхательных путей изготавливают две или три пары боковых трансплантатов и два или три передних трансплантата.
3. Способ по п.1, отличающийся тем, что изготовленные трансплантаты перфорируют сквозными отверстиями с помощью микродрели, при этом диаметр отверстий 1 мм, шаг 5 мм.
4. Способ по п.1, отличающийся тем, что на первой реконструктивной операции имплантируют две или три пары боковых трансплантатов в зависимости от протяженности дефекта стенок дыхательных путей.
5. Способ по п.1, отличающийся тем, что на второй реконструктивной операции имплантируют два или три передних трансплантата в зависимости от протяженности дефекта стенок дыхательных путей.
| СПОСОБ ПЛАСТИКИ ДЕФЕКТА ПЕРЕДНЕЙ СТЕНКИ ТРАХЕИ | 2005 |
|
RU2295923C1 |
| СПОСОБ ПЛАСТИКИ СТЕНКИ ШЕЙНОГО ОТДЕЛА ТРАХЕИ | 2004 |
|
RU2285462C2 |
| US 5258027 А, 02.11.1993 | |||
| Ягудин Р.К | |||
| Опыт применения двухэтапной ларинготрахеопластики в лечении подскладковых и подскладково-трахеальных рубцовых стенозов у взрослых | |||
| Вестник оториноларингологии, 2, 2015, стр | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
| Stoelben E | |||
| et al., Technique of laryngotracheal resection in subglottic | |||
Авторы
Даты
2022-05-30—Публикация
2021-12-03—Подача