1. Область техники, к которой относится изобретение.
Изобретение относится к области люминесцентных соединений с гетероциклическим 2,2′:6′,2′′-терпиридиновым ядром 1. Изобретение может быть использовано в качестве люминесцентного хемосенсора (зонда) на ион Zn2+ и может найти применение в биологии и медицине, а также в научно-исследовательских лабораториях.
2. Уровень техники.
Цинк является важным компонентом многих ферментов, например, в белках карбоангидразы [P. Koutnik, E.G. Shcherbakova, S. Gozem, M.G. Caglayan, T. Minami, P. Anzenbacher, Fluorescence-Based Assay for Carbonic Anhydrase Inhibitors, Chem. 2 (2017) 271–282. doi:10.1016/j.chempr.2017.01.011] и «цинковых пальцев» [J.M. Berg, Zinc Finger Domains: Hypotheses and Current Knowledge, Annu. Rev. Biophys. Biophys. Chem. 19 (1990) 405–421. doi:10.1146/annurev.bb.19.060190.002201]. Цинк играет важную роль в регуляции ферментов, экспрессии генов, нейротрансмиссии и т.д [J. Yu, C.J. Fahrni, In Situ Imaging of Zinc with Synthetic Fluorescent Probes, in: Zinc Signal., Springer Singapore, 2019: pp. 365–388. doi:10.1007/978-981-15-0557-7_18].
Уникальность химической структуры терпиридина состоит в сочетании флуорофора в виде (а)симметрично замещенных пиридиновых колец с азотсодержащим рецептором [A.P. Demchenko, Introduction to Fluorescence Sensing, Springer International Publishing, 2015. doi:10.1007/978-3-319-20780-3, B. Valeur, Molecular Fluorescence: Principles and Applications, Wiley-VCH Verlag GmbH, Weinheim, FRG, 2001. doi:10.1002/3527600248]. Оптические свойства (а)симметричных 2,2':6',2"-терпиридиновых флуорофоров с разделением заряда с разнообразным по природе и геометрии периферийным окружением можно разумно настраивать в широком диапазоне, просто варьируя тип и положение донорных фрагментов на базе акцепторного терпиридинового домена через π-конъюгированный линкер и/или через комплексообразование с катионами металлов. Фундаментальный тип взаимодействия в таких терпиридин-содержащих молекулах обычно происходит за счет эффективной трансдукции сигнала из локального возбуждения (LE) во внутримолекулярный перенос заряда (ICT), создавая таким образом большие разницы между дипольным моментом в основном и возбужденном состоянии (Δμeg) и смещение в сторону более низкой энергии, т.е. батохромному сдвигу максимумов поглощения и испускания [J.R. Lakowicz, Principles of Fluorescence Spectroscopy, Springer US, Boston, MA, 2006. doi:10.1007/978-0-387-46312-4]. Комплексообразование лиганда с катионами Zn2+ за счет связывания неподеленных электронных пар азотов терпиридинового рецептора существенно трансформирует динамику процесса локального возбуждения через эффективную трансдукцию сигнала, что приводит к изменению интенсивности флуоресценции, проявляя яркое состояние «включения» пробы.
Комплексы с переходными металлами, содержащие 2,2':6',2''-терпиридиновый лиганд, интенсивно используются в супрамолекулярной химии [E.C. Constable, 2,2′:6′,2″-Terpyridines: From chemical obscurity to common supramolecular motifs, Chem. Soc. Rev. 36 (2007) 246–253. doi:10.1039/B601166G; A. Wild, A. Winter, F. Schlütter, U.S. Schubert, Advances in the field of π-conjugated 2,2′:6′,2″-terpyridines, Chem. Soc. Rev. 40 (2011) 1459–1511. doi:10.1039/C0CS00074D] из-за их больших констант связывания, обратимой природы, и уникальных окислительно-восстановительных и фотофизических свойств [A. Wild, A. Winter, F. Schlütter, U.S. Schubert, Advances in the field of π-conjugated 2,2′:6′,2″-terpyridines, Chem. Soc. Rev. 40 (2011) 1459–1511. doi:10.1039/C0CS00074D; H. Hofmeier, U.S. Schubert, Recent developments in the supramolecular chemistry of terpyridine–metal complexes, Chem. Soc. Rev. 33 (2004) 373–399. doi:10.1039/B400653B]. Несмотря на значительное число публикаций по терпиридиновым производным, практически не описано получение несимметрично функционализированных 2,2’:6’,2’’-терпиридинов, за редким исключением [N. Belfrekh, C. Dietrich-Buchecker, J.P. Sauvage, Synthesis of multifunctional ligands: A 2,9-diaryl-1,10-phenanthroline/2,2′:6′,2″-terpyridine conjugate, Tetrahedron Lett. 42 (2001) 2779–2781. doi:10.1016/S0040-4039(01)00279-9; F. Durola, J. Lux, J.-P. Sauvage, A Fast-Moving Copper-Based Molecular Shuttle: Synthesis and Dynamic Properties, Chem. - A Eur. J. 15 (2009) 4124–4134. doi:10.1002/chem.200802510; J.-P. Collin, F. Durola, J. Lux, J.-P. Sauvage, A Rapidly Shuttling Copper-Complexed [2]Rotaxane with Three Different Chelating Groups in Its Axis, Angew. Chemie Int. Ed. 48 (2009) 8532–8535. doi:10.1002/anie.200903311]. Широкий выбор динамических взаимодействий был использован в литературе для разработки как терпиридинсодержащих лигандов, так и комплексов (в т.ч. цинксодержащих) на их основе с целью получения материалов и проб. Например, Yun Ma et al. [Y. Ma, S. Liu, H. Yang, Y. Zeng, P. She, N. Zhu, C.-L. Ho, Q. Zhao, W. Huang, W.-Y. Wong, Luminescence Color Tuning by Regulating Electrostatic Interaction in Light-Emitting Devices and Two-Photon Excited Information Decryption, Inorg. Chem. 56 (2017) 2409–2416. doi:10.1021/acs.inorgchem.6b02319] представили серию Zn(II)-бис(терпиридиновых) комплексов (Zn-AcO, Zn-BF4, Zn-ClO4 и Zn-PF6), содержащих различные противоионы цинка, изменяющих цвет от зеленого от желтого до оранжево-красного (от 549 до 622 нм) в растворе CH2Cl2. На основе управляемого возбужденного состояния излучения белого света было изготовлено устройство излучения белого света.
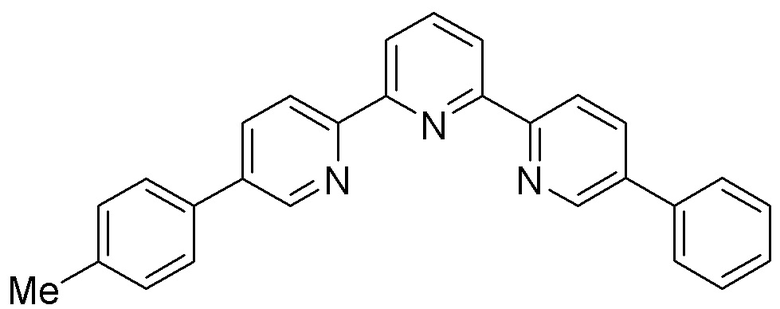
Так как нами не было обнаружено в литературе подобия полученного нами лиганда 1, нами предлагается новый хемосенсор (зонд) на ион Zn2+ - 5-фенил-5′′-п-толил-2,2′:6′,2′′-терпиридин.
3. Сущность изобретения.
Сущность изобретения составляет растворимый в органических растворителях 5-фенил-5′′-п-толил-2,2′:6′,2′′-терпиридин 1, лиганд 2,2′:6′,2′′-терпиридинового ряда, структура которого обеспечивает насыщение координационной сферы иона Zn2+ (цинк : лиганд – 1:2) с одновременным увеличением эмиссии фотовозбуждением полученного комплекса, что делает его “turn-on” хемосенсором (зондом) на ионы Zn2+.
Представляемое изобретение демонстрирует хорошие результаты при обнаружении ионов цинка в пробах, а также пригодно для качественной оценки присутствия ионов цинка в продуктах питания, косметических средствах и моче человека в период острого респираторного заболевания.
4. Сведения, подтверждающие возможность осуществления изобретения
4.1. Для подтверждения возможности осуществления изобретения приводится способ получения соединения 1
Графически схема синтеза представлена ниже. Исходные материалы: гидразоны изонитрозоацетофенонов 2 и 5, [B.B. Dey, C.—Hydrazoximes of methyl- and phenyl-glyoxals, J. Chem. Soc., Trans. 105 (1914) 1039–1046. doi:10.1039/CT9140501039.], 6-гидроксиметилпиридин-2-карбальдегид [B. Join, K. Möller, C. Ziebart, K. Schröder, D. Gördes, K. Thurow, A. Spannenberg, K. Junge, M. Beller, Selective Iron-Catalyzed Oxidation of Benzylic and Allylic Alcohols, Adv. Synth. Catal. 353 (2011) 3023–3030. doi:10.1002/adsc.201100210] были получены по литературной методике.
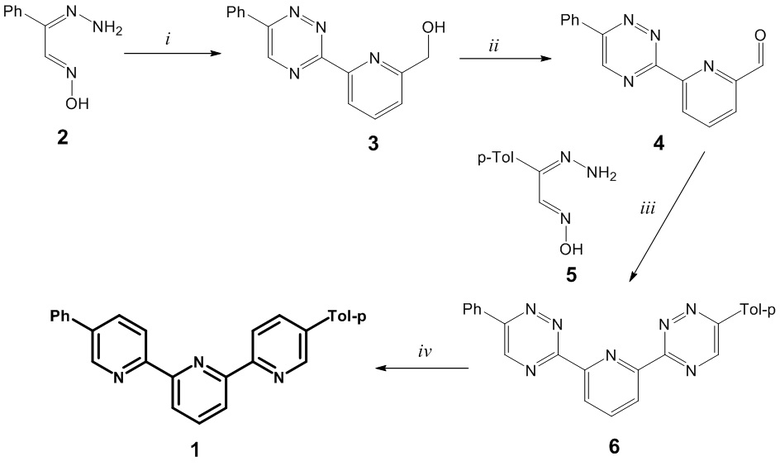
Реагенты и условия: i) 6-гидроксиметилпиридин-2-карбальдегид; ii) SeO2, 1,4-диоксан, 101 ºC, 10 ч.; iii) EtOH, 20 ºC, 10 ч, затем AcOH, 118 ºC, 5 мин.; iv) 2,5-норборнадиен, о-ксилол, 143 ºC, 18 ч.
Синтез (6- (6-Фенил-1,2,4-триазин-3-ил) пиридин-2-ил) метанола 3
Гидразон 2 (1.71 г, 10,5 ммоль) растворили в AcOH (10 мл). Добавили раствор 6-гидроксиметилпиридин-2-карбальдегида (1.43 г, 10,5 ммоль) в АсОН (10 мл), полученную смесь перемешивали при комнатной температуре в течение 3 часов, а затем кипятили с обратным холодильником в течение 5 минут. Реакционную массу охладили до комнатной температуры. Добавили воду (10 мл). Полученный осадок отфильтровали и перекристаллизовали (этанол). Выход 2.11 г (76%). ЯМР 1Н (ДМСО-d6): 4.39 (т, 2Н, 3J 5.6 Гц, CH2OH), 5.24 (т, 1Н, 3J 5.6 Гц, CH2OH), 7.61 (м, 3Н, Ph), 8.28 (м, 4Н, Ph , H-3,4), 7,71 (м, 1Н, H-5), 9,52 (с, 1Н, H-5 (триазин)). ESI-MS, m / z: требуется 265.11, обнаружено 265.11 [M+H]+.
Синтез 6- (6-Фенил-1,2,4-триазин-3-ил) пиколинальдегида 4
Соединение 3 (2 ммоль) растворили в 1,2-дихлорэтане (30 мл). Добавили активированный MnO2 (15 экв.) и полученную смесь перемешивали при 50° C в течение 15 ч. Затем осадок отфильтровали, растворитель из фильтрата удалили при пониженном давлении. Неочищенный продукт использовали на следующей стадии без дополнительной очистки. Выход 0.73 г (75%). 1Н ЯМР (ДМСО-d6): 7,61 (м, 3H, Ph), 8,12 (м, 1H, H-3), 8,21-8,40 (м, 3H, H-4, Ph), 8,82 (м, 1H, H -5), 9,53 (с, 1H, H-5 (триазин)), 10,19 (с, 1H, CHO). ESI-MS, m/z: расч. 263,09, найдено 263,09 [M+H]+.
Синтез 6-Фенил-3-(6-(6-п-толил-1,2,4-триазин-3-ил)пиридин-2-ил)-1,2,4-триазина 6
Соответствующий гидразон 5 (1 ммоль) растворили в этаноле (20 мл). Добавили раствор альдегида 4 (1 ммоль) в этаноле (20 мл) и полученную смесь выдержали при комнатной температуре в течение 10 часов. Растворитель удалили при пониженном давлении. К остатку добавили ледяную уксусную кислоту (25 мл), полученную смесь кипятили с обратным холодильником в течение 5 мин. Растворитель удалили при пониженном давлении и остаток обработали этанолом. Образовавшийся осадок отфильтровали и промыли этанолом. Аналитические образцы получали перекристаллизацией (этанол). Выход 234 мг (58%). ЯМР 1Н (ДМСО-d6): 2,50 (с, 3Н, СН3), 7,42 (м, 2H, Tol), 7,57-7,66 (м, 3H, Ph), 8,22 (м, 2H, Tol), 8,28 (дд, 1H, 3J 7,8, 7,8 Гц, H-4 (py)), 8,33 (м, 2H, Ph), 8,74 (м, 2H, H-3,5 (Py)), 9,51 и 9,56 (оба с, 1H, Н-5 (триазин)). ESI-MS, m / z: расч. 404,16, найдено 404,16 [M+H]+. Расч. для С24Н17N7: С 71.45, Н 4.25, N 24.30%; Найдено: С 71.27, Н 4.41, N 24,13%.
Синтез 5-Фенил-5’’-п-толил-2,2’:6’,2’’-терпиридина 1.
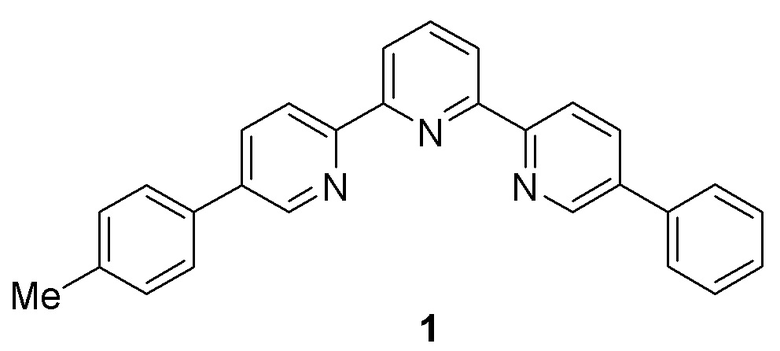
Триазин 6 (0.8 ммоль) суспендировали в о-ксилоле (30 мл). Добавили 2,5-норборнадиен (0.325 мл, 3,2 ммоль) и полученную смесь кипятили с обратным холодильником в течение 18 ч с добавлением 2,5-норборнадиена (0,325 мл, 3,2 ммоль) через каждые 6 ч. Затем растворитель удалили при пониженном давлении, остаток очистили флэш-хроматографией (смесь ДХМ и этилацетата (10: 1) в качестве элюента). Аналитические образцы получили перекристаллизацией (этанол). Выход 255 мг (80%). 1Н ЯМР (ДМСО-d6): 2,43 (с, 3H, Me), 7,31 (м, 2H, Tol), 7,42 (м, 1H, Ph), 7,51 (м, 2H, Ph), 7,62 (м, 2H, Тол), 7,73 (м, 2H, Ph), 8,03 (дд, 1H, 3J 7,6, 7,6 Гц, H-4′), 8,10-8,18 (м, 2H), 8,49 (м, 2H), 8,70 (м, 2H), 8,91 и 8,93 (оба д, 1H, 3J 2,2 Гц, H-6,6′′). 13C ЯМР (CDCl3): 21,2, 120,9, 121,0, 121,1, 121,1, 127,0, 127,2, 128,2, 129,2, 129,9, 134,8, 135,0, 135,2, 136,5, 136,6, 137,8, 138,0, 138,2, 147,5, 147,7, 154,8, 155,1, 155,2, 155,3. ESI-MS, m / z: расч. 400,18, найдено 400,18 [M+H]+. Расч. для С28Н21N3: С 84.18, Н 5.30, N 10,52%; Найдено: С 84.01, Н 5.15, N 10.46%.
Заявленное соединение представляет собой бесцветное порошкообразное вещество, умеренно растворимое в органических растворителях, нерастворимое в воде.
4.2. Подтверждение флуорофорных свойств сенсора 1 и его комплекса с ионом Zn2+
4.2.1. Флуоресцентные свойства соединения 1
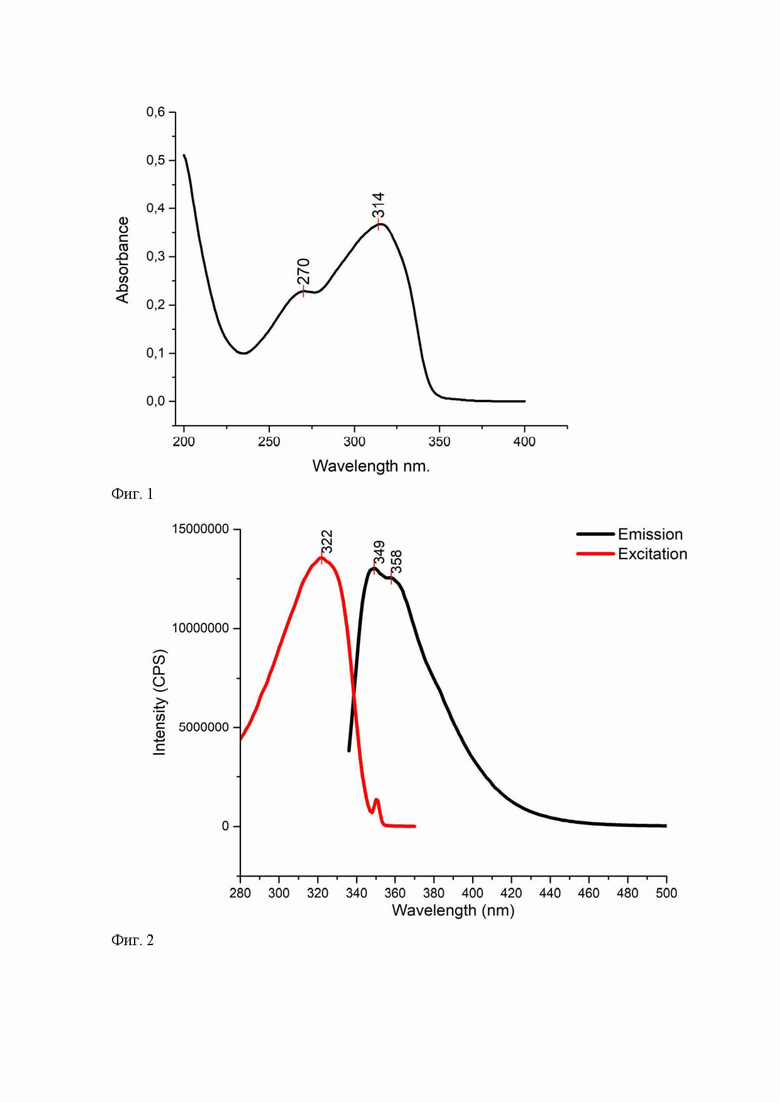
Исследованы спектрально-абсорбционные и спектрально-люминесцентные свойства полученного лиганда 1 в растворе ацетонитрила при 296 К. Электронные спектры поглощения регистрировали с использованием стандартной программы Shimadzu Scan на двулучевом спектрофотометре UV-2600 (“Shimadzu”, Япония) в диапазоне 190 – 700 нм с точностью установки длины волны ± 0,1 нм (Табл. 1).
Сенсор характеризуется высокой поглощательной способностью: наибольшее поглощение с молярным коэффициентом экстинкции 36700 M-1 cm-1 наблюдалось при λabs max =314 нм (Фиг.1, Табл.1). Спектры возбуждения и излучения измеряли на спектрофлуориметре Horiba FluoroMax-4, в качестве импульсного источника возбуждения которого использовалась ксеноновая лампа, с точностью установки длины волны ±0.5 нм. Установлено, что максимум флуоресценции лиганда при возбуждении излучением с длиной волны 314 нм, находится при 349 нм (Фиг.2, Табл.1). Низкое значение Стоксова сдвига (<50 нм) при максимуме эмиссии менее 350 нм и наличии структурированности спектра излучения свидетельствуют о коротковолновой сине-фиолетовой люминесценции лиганда с локальным возбуждением (LE).
Процедуры измерения абсолютного квантового выхода и времени жизни возбужденного состояния люминофора 1 . Для исследования были использованы растворители уровня очистки HPLC, деионизированная вода, очищенная через фильтр Millipore. Флуорофор 1 был очищен колоночной хроматографией. Для измерений применялись фирменные стандартные четырехоконные кварцевые кюветы SUPRASIL 111-QS 10 (“Hellma”, Германия) объемом 4 мл, длиной оптического пути 1 см.
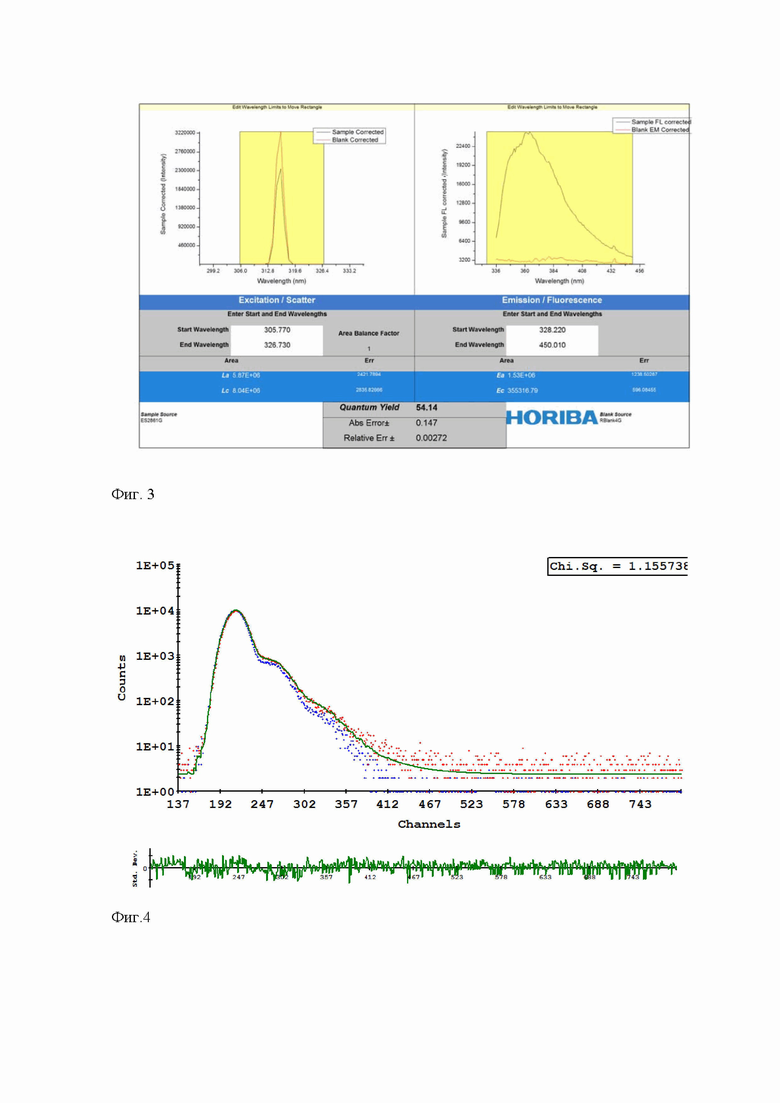
Измерение абсолютного квантового выхода флуорофора 1 проводилось в ацетонитриле при 296 К с использованием спектрофлуориметра Horiba-Fluoromax-4 в интегрирующей сфере Quanta-Phi, покрытой изнутри материалом Spectralon® после калибровки монохроматора возбуждения. С целью избежать эффекта внутреннего фильтра и/или самотушения для хемосенсора измерялся спектр поглощения, чтобы выбрать длину волны возбуждения, где оптическая плотность меньше 0,1. Далее регистрировались спектры эмиссии и рэлеевского рассеяния чистого растворителя и раствора хемосенсора. Абсолютное значение квантового выхода фотолюминесценции рассчитывали с использованием стандартной программы Origin на спектрофлуориметре Horiba-Fluoromax-4 (Фиг.3).
Измерение времени жизни возбужденного состояния флуорофора 1 проводилось в ацетонитриле при 296 К с использованием однофотонного возбуждения (time-correlated single-photon counting, TCSPC) с наносекундным светодиодом (370 нм) на спектрофлуориметре Horiba-Fluoromax-4. С целью избежать эффекта внутреннего фильтра и/или самотушения для хемосенсора измерялся спектр поглощения, чтобы выбрать длину волны возбуждения, где оптическая плотность меньше 0,1. Для измерения времени жизни возбужденного состояния использовалось не менее 3-х параллелей с усреднением результатов, χ2 ≤ 1,2. Значение времени жизни рассчитывали с использованием специальной программы DataStation на спектрофлуориметре Horiba-Fluoromax-4 (Фиг.4).
Опираясь на данные таблицы 1, значение абсолютного квантового выхода как эффективности преобразования поглощенного света в излучаемый выше среднего (<30%) и долгоживущая эмиссия (<2 нс) характеризуют соединение 1, как весьма эффективный флуорофор.
4.2.2. Флуоресцентные свойства лиганда 1 в присутствии катионов Zn2+
Для исследования пробы по изменению интенсивности флуоресценции в присутствии катионов Zn2+ к ацетонитрильному раствору соединения 1 (С = 5 × 10-6 М) добавили 25 мкл водного раствора ацетата цинка(II) (С = 2 × 10-4 М), что составляло ~0,4 мол. экв., до полного растворения соли. После чего осуществили процедуры измерения абсолютного квантового выхода и времени жизни возбужденного состояния люминофора 1 в присутствии катионов Zn2+, описанные в п. 4.2.1, на базе снятых спектров абсорбции и эмиссии (Табл. 2).
При наблюдаемом батохромном смещении максимумов поглощения и эмиссии значение Стоксова сдвига для пробы 1 в присутствии Zn2+ возросло на 45%, а ΦEM -на 30% (Табл. 2).
4.2.3. Аналитические свойства динамического комплекса Zn2+
Для выявления природы фотоиндуцированного процесса, который отвечает за фотофизические изменения при связывании катиона, проведены дополнительные аналитические исследования по определению константы устойчивости динамического металлокомплекса (ZnL2)2+ и значения предела обнаружения цинка (LOD).
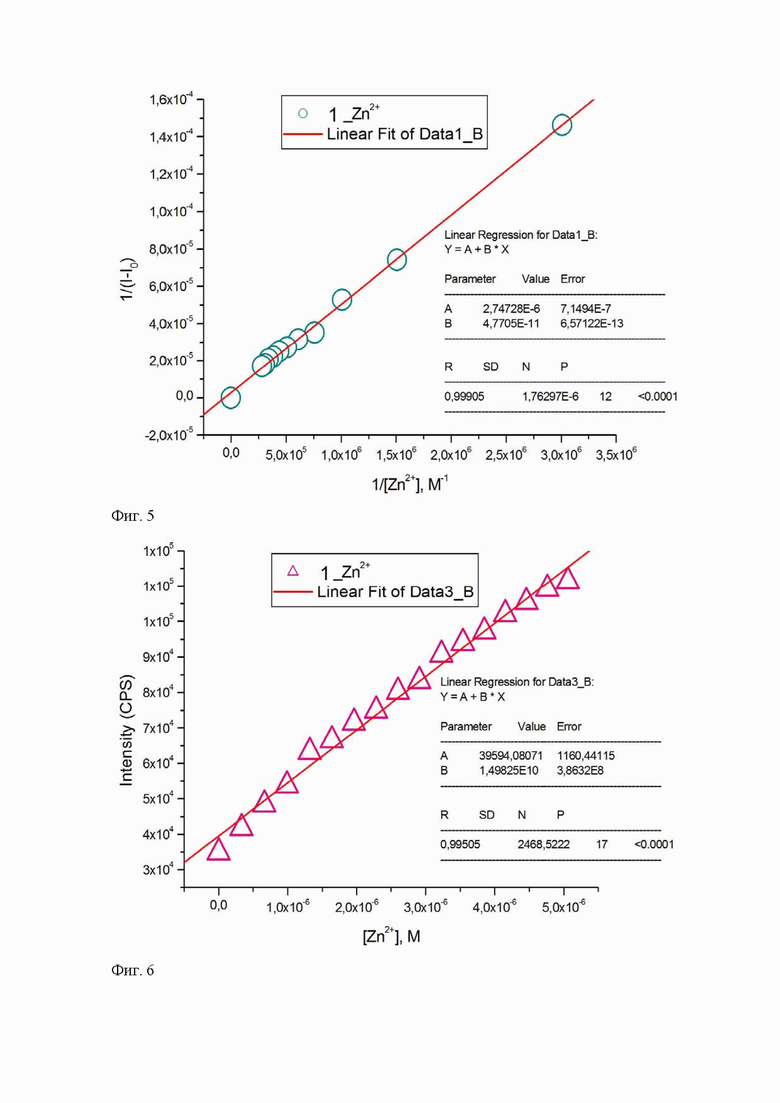
Процедура флуоресцентного титрования с использованием метода Бенези-Хильдебранда с целью определения константы связывания заключалась в следующем [H.A. Benesi, J.H. Hildebrand, A Spectrophotometric Investigation of the Interaction of Iodine with Aromatic Hydrocarbons, J. Am. Chem. Soc. 71 (1949) 2703–2707].
Ацетонитрильный раствор сенсора (C = 10-5М) помещали в кварцевую кювету и добавляли к нему последовательно 10-15 аликвот объемом по 5 мкл водного раствора ацетата цинка (C =10-4 М). Спектры эмиссии измеряли на спектрофлуориметре Horiba FluoroMax-4 при длине волны возбуждения 314 нм. Исходя из полученных данных титрования, графически была определена константа связывания (Ks) терпиридинового лиганда с Zn2+ с использованием уравнения Бенези-Хильдебранда (R2>0,99) формула (1):
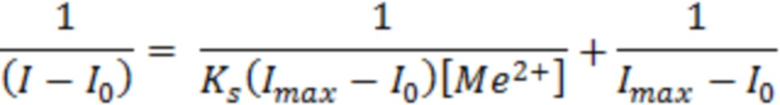 , (1)
, (1)
где I – текущая интенсивность эмиссии; I0 – начальная величина интенсивность эмиссии; Imax – максимальная величина эмиссии в эксперименте; [Me2+] – текущая концентрация металла в растворе
На основе полученных данных титрования также определили предел обнаружения ионов цинка (R2>0,99) по уравнению в соответствии с ранее описанной методикой [Shrivastava A. G. V. Methods for the determination of limit of detection and limit of quantitation of the analytical methods // Chronicles Young Sci. 2011. Vol. 2, № 1. P. 21–25], формула (2):
LOD = 3×σ/k, (2)
где σ - стандартное отклонение интенсивности флуорофора в отсутствие аналита и k – наклон калибровочной кривой.
Исходя из данных таблицы 3, высокий порядок константы связывания (<105 M-1) (Фиг. 5, Табл. 3,) при пределе обнаружения цинка, достигающем значения 10-8 M (Фиг.6, Табл.3), определили пробу 1, как перспективную для качественного обнаружения ионов цинка в полевых условиях, в том числе для образцов природного происхождения.
4.2.4. Подтверждение насыщения координационной сферы Zn2+ соединением 1
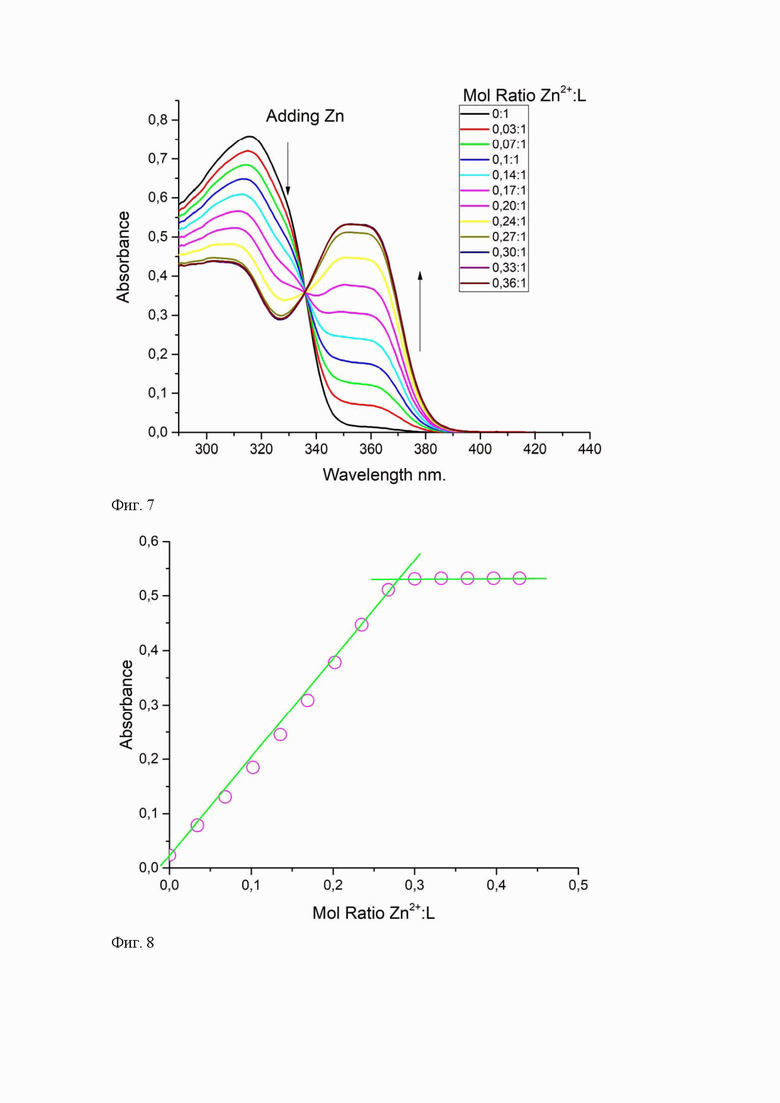
Проведен расчет стехиометрического соотношения Zn2+/лиганд в металлокомплексе по данным титрования раствора соединения 1 с постоянной концентрацией по методу насыщения координационной сферы Zn2+ лигандом. Для этого ацетонитрильный раствор лиганда 1 (С = 2×10-5 М) помещали в кювету спектрофотометра UV-2600 (“Shimadzu”, Япония) при 296 К и по мере добавления аликвот объемом 5 мкл водного раствора ацетата цинка (С = 2×10−4 M) в диапазоне от 0 до 0,36 мол. экв. измеряли спектры абсорбции (Фиг. 7). По данным титрования был построен график зависимости оптической плотности для характерной длинноволновой полосы поглощения (λmax = 354 нм) от мольного соотношения металл:лиганд, точка перегиба которого составила ниже 0,5, что указывает на образование комплекса 1:2 (ZnL2)2+(Фиг. 8).
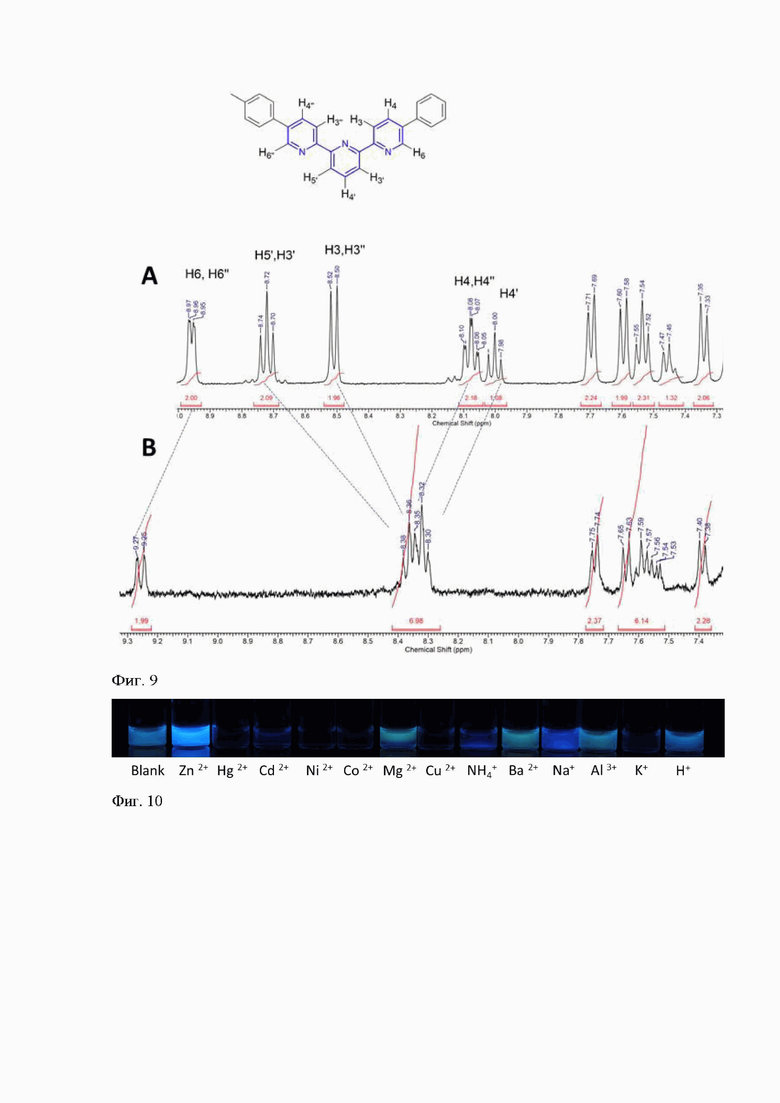
Для более детального изучения динамики взаимодействия лиганда 1 с Zn2+ в растворе был проведен 1Н ЯМР эксперимент на спектрометре Bruker Avance-400. Были сняты спектры 1H ЯМР свободного лиганда 1 и цинкового комплекса (ZnL2)2+ в одном том же растворителе (CDCl3). Установлено, что в спектре комплекса наблюдался значительный сдвиг в слабое поле протонов H6, H6'' терпиридиновых ядер в комплексе (ZnL2)2+, что подтверждает усиление конъюгации всей терпиридиновой системы (Фиг. 9).
4.2.5. Подтверждение работоспособности сенсора 1 в присутствии ионов других металлов
С целью избежать перекрестной чувствительности и проверить на интерференцию ионы металлов в исследовании поведения ионов Zn2+ по отношению к рецептору 1, было проведено три эксперимента.
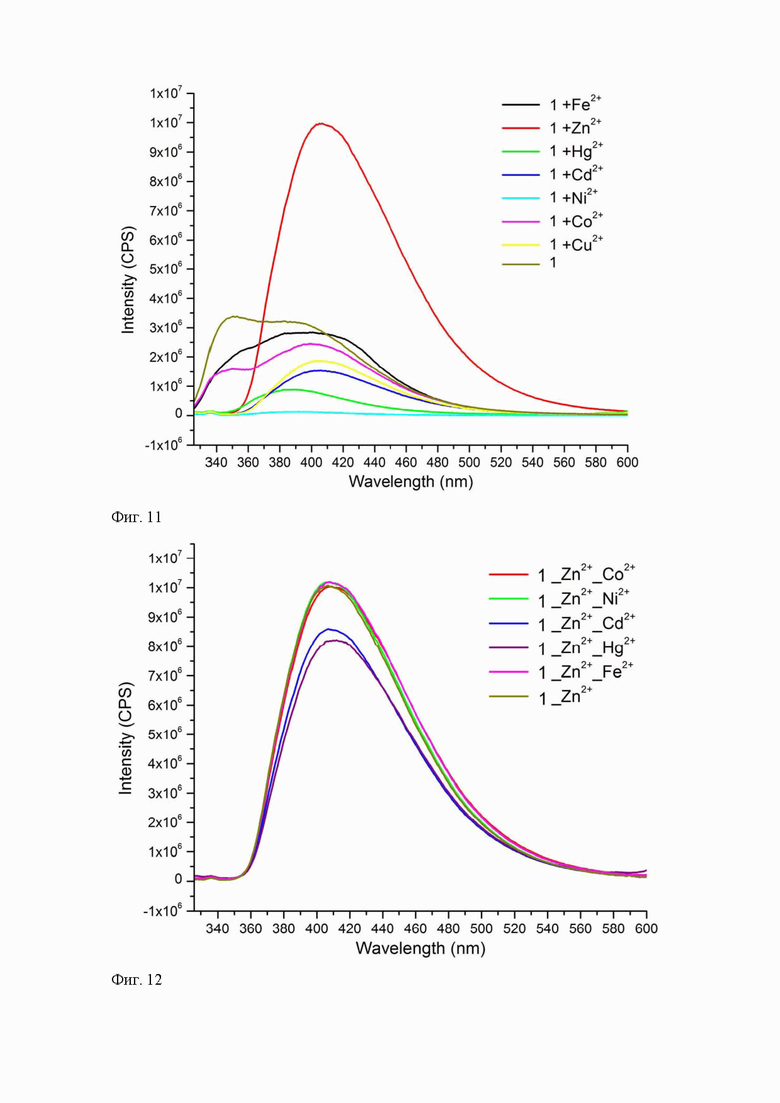
1. К ацетонитрильному раствору соединения 1 (С = 10-5 M) добавляли 50 мкл водного раствора ацетата металла (Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+, Hg2+) (1,2×10-3 М,), что составляло ~0,8 мол. экв., до полного растворения соли. Фотоснимок облучения проб УФ лампой при длине волны 365 нм выявил существенное изменение во флуоресцентном отклике сенсора 1 на присутствие ионов Zn2+ (Фиг. 10).
2. К ацетонитрильному раствору соединения 1 (С = 10-5 M) добавляли расчетный шестикратный мольный избыток ацетата металла (Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+, Hg2+) до полного растворения соли. Далее снимали спектры флуоресценции соединения 1 в присутствии катиона металла. У пробы 1 наблюдалась наиболее интенсивная широкая полоса излучения с максимумом 418 нм только для Zn2+ (Фиг. 11). Расчет относительного изменения интенсивности флуоресценции dI проводили по формуле (3):
dI = I/I0 (3)
где I0 – исходная интенсивность флуоресценции раствора соединения 1; I – интенсивность флуоресценции раствора соединения 1 после добавления шестикратного мольного избытка катиона.
Относительная интенсивность флуоресценции в присутствии катионов Zn2+ увеличилась в ~3,5 раза, что свидетельствует о проявлении высокой селективной сенсорной активности по отношению к катионам Zn2+ исследуемого хемосенсора 1.
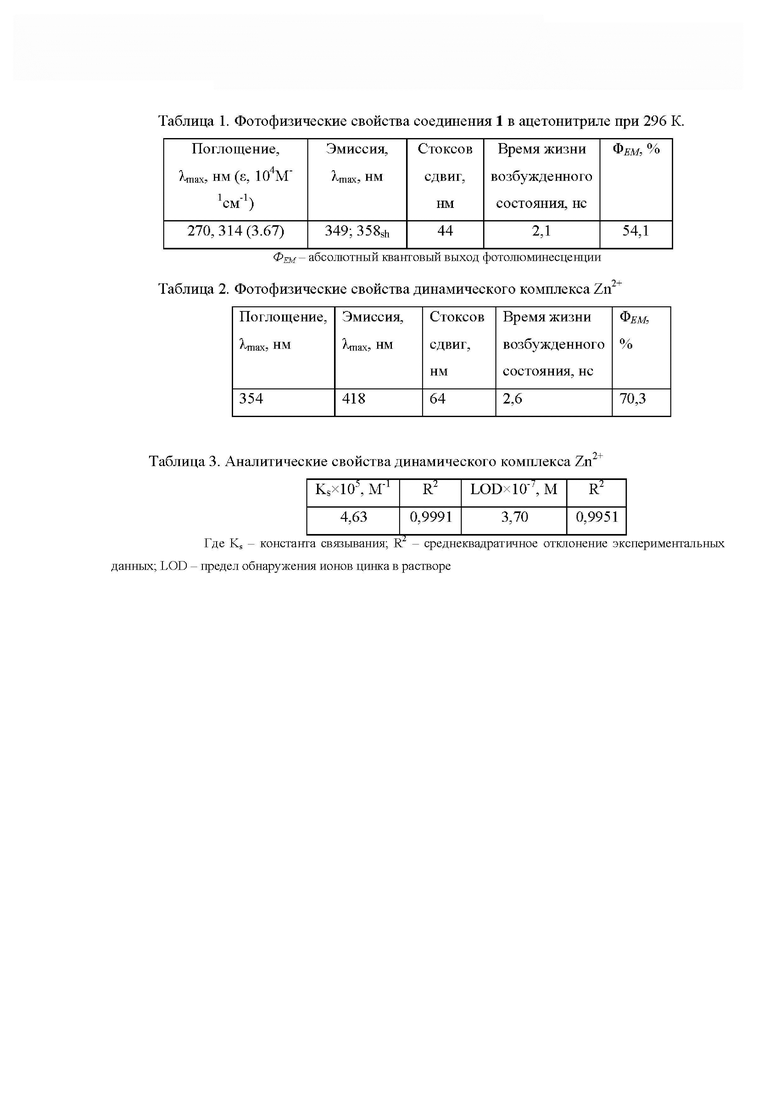
3. К ацетонитрильному раствору соединения 1 (С = 10-5 M) в присутствии Zn2+ (1:1) добавляли расчетный шестикратный мольный избыток ацетата металла (Fe2+, Co2+, Ni2+, Cd2+, Hg2+) до полного растворения соли. Далее снимали спектры флуоресценции соединения 1 в присутствии Zn2+ и катиона металла. Во всех случаях отклонение интенсивности флуоресценции составило менее 3%, что свидетельствует о высокой селективности пробы 1 по отношению к ионам Zn2+ (Фиг.12)
4.4. Подтверждение работоспособности сенсора 1 при обнаружении цинка в образцах продуктов питания и косметических средств
Процедура качественной оценки наличия ионов Zn2+ в ряде пищевых продуктов (овсяные хлопья, льняное семя, миндаль, какао, мидии) известные, как продукты богатые цинком и содержащие 0,1-0,8 мг Zn2+ на 100 г продукта [K.H. Brown, S.E. Wuehler, J.M. Peerson, The Importance of Zinc in Human Nutrition and Estimation of the Global Prevalence of Zinc Deficiency, Food Nutr. Bull. 22 (2001) 113–125].
Качественная оценка определения цинка в ряде пищевых продуктов проводилась при комнатной температуре. Навеску продукта 1,5 г помещали в стакан, заливали водой MilliQ и кипятили в течение 2 минут. В каждую кювету помещали ацетонитрильный раствор пробы 1 (1,5 × 10-4 М) и добавляли 50 мкл водного экстракта каждого продукта.
Далее шесть кювет (одна с ацетонитрильным раствором пробы 1 без добавления образцов, остальные пять кювет с добавлением аликвоты водного экстракта овсяных хлопьев, льняного семени, миндаля, какао и мидии, соответственно) облучали УФ светом при 365 нм. Фотоснимок облучения проб УФ лампой при длине волны 365 нм выявил существенное изменение во флуоресцентном отклике сенсора 1 на присутствие ионов Zn2+ в пяти кюветах по сравнению с первой (Фиг. 13).
Процедура качественной оценки наличия катионов Zn2+ в креме Balea® от прыщей с цинком и маски Гарнье® для лица с цинком.
Качественная оценка определения цинка в ряде косметических средств (крем Balea® от прыщей и маски Гарнье® для лица) проводилась при комнатной температуре. Навеску косметического средства 1,5 г помещали в стакан, заливали водой MilliQ и перемешивали в течение нескольких минут при комнатной температуре. В каждую кювету помещали ацетонитрильный раствор пробы 1 (1,5 × 10-4 М) и добавляли 50 мкл водного экстракта каждого продукта. Далее три кюветы (одна с ацетонитрильным раствором пробы 1 без добавления образцов, две кюветы с добавлением аликвоты водного экстракта крема Balea® и маски Гарнье®) облучали УФ светом при 365 нм. Фотоснимок облучения проб УФ лампой при длине волны 365 нм выявил существенное изменение во флуоресцентном отклике сенсора 1 на присутствие ионов Zn2+ в двух кюветах по сравнению с первой (Фиг. 14).
4.5. Подтверждение работоспособности сенсора 1 при обнаружении цинка в моче человека в период острого респираторного заболевания
В ходе многочисленных экспериментов было обнаружено, что леденцы, содержащие соли цинка, такие как глюконат и ацетат, являются наиболее оптимальными для лечения простудных заболеваний, поскольку эти соли выделяют максимальную концентрацию цинка в виде свободного катиона, который имеет терапевтический эффект [N. K. A. Bakar, D. M. Taylor and D. R. Williams, Chem. Speciat. Bioavailab., 1999, 11, 95–101.; G. A. Eby, Biosci. Rep., 2004, 24, 23–39.; M. Singh and R. R. Das, Expert Rev. Respir. Med., 2011, 5, 301–303. И пр.] После приема цинксодержащих леденцов плазма крови насыщается цинком, избыток выводится с мочой [W. Al-Nakib, P. G. Higgins, I. Barrow, G. Batstone and D. A. J. Tyrrell, J. Antimicrob. Chemother., 1987, 20, 893–901]. Поэтому была использована моча в качестве объекта для качественного определения цинка с помощью синтезированного нами зонда 1. У женщины 26 лет (масса тела 46 кг, рост 1,56 м) появились симптомы простуды (головная боль, лихорадка, чихание, выделения из носа, заложенность носа, боль в горле), поэтому ей было назначено лечение леденцами с цинком. Были использованы ароматизированные леденцы с глюконатом и цитратом цинка. Каждая таблетка содержит 23 мг цинка в виде глюконата цинка и цитрата цинка, 100 мг витамина С в виде аскорбиновой кислоты, 20 мг эхинацеи пурпурной в виде стебля, листа, цветка. Пастилки были произведены Nature’s Way® (Висконсин, США) и включают вспомогательные вещества: сорбит, фруктозу, маннит, натуральный ароматизатор, бикарбонат натрия, стеарат магния, ароматизатор французской ванили, экстракт листьев стевии. Доза представляла собой пять леденцов, растворенных во рту в течение 3-5 минут каждая, одна за другой. Перед началом лечения первый образец мочи (I сбор) собирали по методу Нечипоренко (первое количество мочи (15-20 мл) отбрасывается, и моча в середине потока помещается в подготовленную чистую и сухую емкость). После сбора образцов лечение было начато около 23:30. Через 9 ч после приема цинка вторую пробу мочи (II сбор) брали так же, как и первую.
Качественная оценка определения цинка в моче проводилась при комнатной температуре. В первую кювету помещали ацетонитрильный раствор пробы 1 (1,5 × 10-4 М) и добавляли 50 мкл мочи I сбора. Во вторую кювету помещали ацетонитрильный раствор пробы 1 (1,5 × 10-4 М) и добавляли 50 мкл мочи II сбора. Далее обе кюветы облучали УФ светом при 365 нм. Фотоснимок облучения проб УФ лампой при длине волны 365 нм выявил существенное изменение во флуоресцентном отклике сенсора 1 на присутствие ионов Zn2+ во второй кювете по сравнению с первой (Фиг. 15).
| название | год | авторы | номер документа |
|---|---|---|---|
| N-([1,1'-БИФЕНИЛ]-3-ИЛ)-4-ФЕНИЛ-1-(ПИРИДИН-2-ИЛ)-6,7-ДИГИДРО-5H-ЦИКЛОПЕНТА[C]ПИРИДИН-3-АМИН - МОНОМОЛЕКУЛЯРНЫЙ ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ОБНАРУЖЕНИЯ НИТРОАРОМАТИЧЕСКИХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ | 2022 |
|
RU2786741C1 |
| 1-(4-(4-МЕТОКСИФЕНИЛ)-[2,2'-БИПИРИДИН]-6-ИЛ)-N,N-БИС(ПИРИДИН-2-ИЛМЕТИЛ)МЕТАНАМИН - МОНОМОЛЕКУЛЯРНЫЙ ХИМИЧЕСКИЙ СЕНСОР ДЛЯ ФЛУОРЕСЦЕНТНОГО ОПРЕДЕЛЕНИЯ КАТИОНОВ Zn IN VITRO | 2023 |
|
RU2822106C1 |
| (ЭТАН-1,2-ДИИЛБИС(ОКСИ))БИС(ЭТАН-2,1-ДИИЛ)БИС(ПИРЕН-1-КАРБОКСИЛАТ) - МОНОМОЛЕКУЛЯРНЫЙ ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ОБНАРУЖЕНИЯ НИТРОАРОМАТИЧЕСКИХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ | 2022 |
|
RU2812671C1 |
| ((ОКСИБИС(ЭТАН-2,1-ДИИЛ))БИС(ОКСИ))БИС(ЭТАН-2,1-ДИИЛ)БИС(ПИРЕН-1-КАРБОКСИЛАТ) - МОНОМОЛЕКУЛЯРНЫЙ ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ОБНАРУЖЕНИЯ НИТРОАЛИФАТИЧЕСКИХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ | 2022 |
|
RU2816695C1 |
| 2-(4-МЕТОКСИФЕНИЛ)-5-(4-(4-(ПИРЕН-1-ИЛ)-1H-1,2,3-ТРИАЗОЛ-1-ИЛ)ФЕНИЛ)-1,3,4-ОКСАДИАЗОЛ-МОНОМОЛЕКУЛЯРНЫЙ ХИМИЧЕСКИЙ СЕНСОР НА НИТРОАЛИФАТИЧЕСКОЕ ВЗРЫВЧАТОЕ ВЕЩЕСТВО ТЕТРАНИТРОПЕНТАЭРИТРИТ | 2023 |
|
RU2820003C1 |
| ЕВРОПИЕВЫЙ КОМПЛЕКС МОНОНАТРИЕВОЙ СОЛИ 2,2',2'',2'''-(2,2'-((5'-(4-АМИНОФЕНИЛ)-2,2'-БИПИРИДИН-6-ИЛ)МЕТИЛАЗАДИИЛ)БИС-(ЭТАН-2,1-ДИИЛ))-БИС(АЗАТРИИЛ)ТЕТРАУКСУСНОЙ КИСЛОТЫ | 2020 |
|
RU2791044C2 |
| 4-(2-(ПИРИДИН-2-ИЛ)-9H-ПИРИДО[2,3-b]ИНДОЛ-8-ИЛ)АНИЛИН - КЛЕТОЧНЫЙ ФЛУОРЕСЦЕНТНЫЙ КРАСИТЕЛЬ | 2024 |
|
RU2836779C1 |
| ДИМЕТИЛ 4-ФЕНИЛ-5-(2-ФЕНИЛ-1H-ИНДОЛ-3-ИЛ)-1-(4-ТОЛИЛ)-1H-ПИРРОЛ-2,3-ДИКАРБОКСИЛАТ - ОПТИЧЕСКИЙ ХИМИЧЕСКИЙ СЕНСОР ДЛЯ ОБНАРУЖЕНИЯ НИТРОАРОМАТИЧЕСКИХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ | 2023 |
|
RU2820149C1 |
| ЕВРОПИЕВЫЙ КОМПЛЕКС МОНОНАТРИЕВОЙ СОЛИ 2,2',2'',2'''-(2,2'-((4-(4-АМИНОФЕНИЛ)-2,2'-БИПИРИДИН-6-ИЛ)МЕТИЛАЗАДИИЛ)БИС-(ЭТАН-2,1-ДИИЛ))-БИС(АЗАТРИИЛ)ТЕТРАУКСУСНОЙ КИСЛОТЫ | 2020 |
|
RU2790836C2 |
| 6,7-ДИФТОР-2-(ПИРИДИН-2-ИЛ)-9H-ПИРИДО[2,3-b]ИНДОЛ - ЛЮМИНЕСЦЕНТНЫЙ ХИМИЧЕСКИЙ СЕНСОР ДЛЯ ОБНАРУЖЕНИЯ 2,4,6-ТРИНИТРОФЕНОЛА (ПИКРИНОВОЙ КИСЛОТЫ) | 2023 |
|
RU2828883C1 |

Изобретение относится к области люминесцентных соединений с гетероциклическим 2,2′:6′,2′′-терпиридиновым ядром, которые могут быть применимы в биологии и медицине, а также в научно-исследовательских лабораториях. Предложено новое соединение 5-Фенил-5′′-п-толил-2,2′:6′,2′′-терпиридин 1 - “turn-on” хемосенсор (зонд) на ионы Zn2+. Технический результат: обеспечение эффективного люминесцентного хемосенсора (зонда) на ион Zn2+, для качественной оценки присутствия ионов цинка в продуктах питания, косметических средствах и моче человека. 15 ил., 3 табл., 5 пр.
5-Фенил-5′′-п-толил-2,2′:6′,2′′-терпиридин 1 - “turn-on” хемосенсор (зонд) на ионы Zn2+
| MA, YUN et al | |||
| Luminescence Color Tuning by Regulating Electrostatic Interaction in Light-Emitting Devices and Two-Photon Excited Information Decryption | |||
| Inorganic Chemistry, 2017, 56 (5), 2409-2416 | |||
| VALERY N | |||
| KOZHEVNIKOV et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2022-06-01—Публикация
2021-06-24—Подача