Перекрестная ссылка на связанные заявки
Эта заявка заявляет о преимуществах предварительной заявки на патент США № 62/240624, поданной 13 октября 2015 года, которая включена в настоящее описание ссылкой в полном объеме.
Перечень последовательностей
В настоящем описании дается ссылка на список последовательностей, представленных в электронном виде в виде .txt-файла с названием «ETI-2015-11_ST25.txt». Файл .txt был создан 5 октября 2016 года и имеет размер 178 524 байта. Все содержимое списка последовательностей включено в данный документ ссылкой.
Предшествующий уровень техники
С появлением технологий на основе антител разработка новых терапевтических средств на основе антител для лечения рака вызвала огромный интерес в течение последнего десятилетия. Действительно, продолжают развиваться различные форматы (например, химерные, гуманизированные, человеческие, радиоактивно меченые, конъюгированные с лекарственными средствами, мультиспецифичные и т.д.), и некоторые продемонстрировали значительные перспективы при лечении рака. В перечне 2015 года сообщалось, что почти два десятка терапевтических антительных агентов получили одобрение на продажу или были просмотрены в Соединенных Штатах или Европе по различным показаниям рака (см. Janice M. Reichert, PhD, Reichert Biotechnology Consulting LLC, 26 мая 2015 г.). Тем не менее, разработка особенно эффективных антительных агентов остается проблемой.
Сущность изобретения
Настоящее изобретение относится, помимо прочего, к агентам на основе антитела человека, мультиспецифическим связывающим агентам (например, биспецифическим антителам) и химерным антигенных рецепторам, которые специфически связывают CD19, в частности CD19 человека. В некоторых воплощениях, при условии, что агенты на основе антитела человека, мультиспецифичные связывающие агенты и химерные антигенные рецепторы демонстрируют высокую специфичность к CD19 человека в нативном формате (например, экспрессируемому на поверхности клетки) по сравнению с одним или несколькими контрольными агентами на основе антитела человека, мультиспецифичными связывающими агентами и/или химерными антигенными рецепторами. В некоторых воплощениях, предлагаемые агенты на основе антитела человека, мультиспецифичные связывающие агенты (например, биспецифичные антитела) и химерные антигенные рецепторы преодолевают субоптимальную селективность, связанную с анти-CD19 терапевтическими средствами на основе антител, разработанными с использованием известных технологий (например, сконструированных животных, не являющихся человеком, фагового дисплея, гуманизированных антител, полученных из антител мышиного происхождения и т.д.). В некоторых воплощениях предлагаемые агенты на основе антитела человека, мультиспецифичные связывающие агенты (например, биспецифичные антитела) и химерные антигенные рецепторы эффективно опосредуют уничтожение раковых клеток, характеризующихся экспрессией CD19 (например, лимфом и/или лейкозов).
Хотя воплощения, в которых используются антительные агенты, которые включают последовательности человека (то есть последовательности вариабельной области тяжелой и легкой цепей человека, включая последовательности CDR человека), подробно обсуждаются в данном документе, настоящее изобретение также относится к агентам на основе антител нечеловеческой природы. В некоторых воплощениях агенты из антител нечеловеческой природы включают последовательности CDR человека из антительного агента, как описано в данном документе, и каркасные последовательности нечеловеческой природы. Каркасные последовательности нечеловеческой природы, включают в некоторых воплощениях любую последовательность, которая может быть использована для получения вариабельных областей синтетической тяжелой и/или легкой цепи с использованием одной или нескольких последовательностей CDR человека, как описано в данном документе, включая, например, последовательности млекопитающих, например мыши, крысы, кролика, свиньи, крупного рогатого скота (например, коровы, быка, буйвола), оленя, овцы, козы, курицы, кошки, собаки, хорька, примата (например, мартышки, макаки-резуса) и т.д. В некоторых воплощениях предлагаемый антительный агент включает антительный агент, продуцируемый путем прививки одной или нескольких последовательностей CDR человека, как описано в данном документе, в последовательность каркаса нечеловеческой природы (например, последовательность каркаса мыши или курицы). Во многих воплощениях предлагаемые антительные агенты являются агентами на основе антитела человека (например, человеческим моноклональным антителом или его фрагментом, человеческим антигенсвязывающим белком или полипептидом, человеческим мультиспецифическим связывающим агентом [например, человеческим биспецифическим антителом], полипептидом человека имеющий один или несколько структурных компонентов полипептида иммуноглобулина человека).
В некоторых воплощениях настоящее изобретение относится к антительному агенту, который специфически связывает CD19 человека, где антительный агент включает CDR1 (HC-CDR1) тяжелой цепи, CDR2 тяжелой цепи (HC-CDR2) и CDR3 тяжелой цепи (HC-CDR3), CDR1 легкой цепи (LC-CDR1), CDR2 легкой цепи (LC-CDR2) и CDR3 легкой цепи (LC-CDR3),
где HC-CDR1 включает GX1-X2-fx3-SX4-X5 (SEQ ID NO: 291), и где Х1 представляет собой F, G, Y или V, X2 представляет собой S или T, X3 представляет собой S или T, X4 представляет собой N или Y, а X5 представляет собой A, W или Y;
где HC-CDR2 включает IX6-PX7-X8-X9-X10-T (SEQ ID NO: 292) и где X6 представляет собой S, D или Y, X7 представляет собой E, S, G или I, X8 представляет собой D, F или V, X9 представляет собой G или S, а X10 представляет собой K, E, Y, D или T;
где LC-CDR1 включает SSNX11-GX12-X13-X14 (SEQ ID NO: 293) или NIGSX15-S (SEQ ID NO: 294), и где X11 представляет собой I или V, X12 представляет собой N, S или T, X13 представляет собой N, H или K, X14 представляет собой Y, A или T, а X15 представляет собой K или E; и/или
где LC-CDR2 включает X16-X17-X18 (SEQ ID NO: 295) и где X16 представляет собой D, E, S, R или Y, X17 представляет собой N или D, а X18 представляет собой N, Y, S или D.
В некоторых воплощениях настоящее изобретение относится к агенту на основе антитела человека, который специфически связывает CD19 человека, где агент на основе антитела человека включает одну или несколько CDR тяжелой цепи, каждый из которых имеет последовательность, которая идентична, по меньшей мере, на 50% (например, по меньшей мере, на около 55% 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) одной или нескольким CDR тяжелой цепи, выбранным из Таблицы 2, и/или одной или нескольким CDR легкой цепи, каждый из которых имеет последовательность, которая идентична, по меньшей мере, на 50% (например, по меньшей мере, на около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% 95%, 96%, 97%, 98% или 99%), одной или нескольким CDR легкой цепи, выбранным из таблицы 3.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 75 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, изложенных в SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 184, SEQ ID NO: 185 и SEQ ID NO: 186.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 79, SEQ ID NO: 80 и SEQ ID NO: 81 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 187, SEQ ID NO: 188 и SEQ ID NO: 189.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 82, SEQ ID NO: 83 и SEQ ID NO: 84 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 190, SEQ ID NO: 191 и SEQ ID NO: 192.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 85, SEQ ID NO: 86 и SEQ ID NO: 87 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 193, SEQ ID NO: 194 и SEQ ID NO: 195.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 90 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 196, SEQ ID NO: 197 и SEQ ID NO: 198.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 91, SEQ ID NO: 92 и SEQ ID NO: 93 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 199, SEQ ID NO: 200 и SEQ ID NO 201.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 94, SEQ ID NO: 95 и SEQ ID NO: 96 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 202, SEQ ID NO: 203 и SEQ ID NO: 204.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 97, SEQ ID NO: 98 и SEQ ID NO: 99 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 205, SEQ ID NO: 206 и SEQ ID NO: 207.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 208, SEQ ID NO: 209 и SEQ ID NO: 210.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 105 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 211, SEQ ID NO: 212 и SEQ ID NO: 213.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 106, SEQ ID NO: 107 и SEQ ID NO: 108 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 214, SEQ ID NO: 215 и SEQ ID NO: 216.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 109, SEQ ID NO: 110 и SEQ ID NO: 111 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 217, SEQ ID NO: 218 и SEQ ID NO: 219.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 220, SEQ ID NO: 221 и SEQ ID NO: 222.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 115, SEQ ID NO: 116 и SEQ ID NO: 117 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 223, SEQ ID NO: 224 и SEQ ID NO: 225.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 118, SEQ ID NO: 119 и SEQ ID NO: 120 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 226, SEQ ID NO: 227 и SEQ ID NO: 228.
В некоторых воплощениях агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, представленных в SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123 и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой из CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, представленных в SEQ ID NO: 229, SEQ ID NO: 230 и SEQ ID NO: 231.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 75, и CDR легкой цепи SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78 и CDR легкой цепи SEQ ID NO: 184, SEQ ID NO: 185 и SEQ ID NO: 186.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 79, SEQ ID NO: 80 и SEQ ID NO: 81 и CDR легкой цепи SEQ ID NO: 187, SEQ ID NO: 188 и SEQ ID NO: 189.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 82, SEQ ID NO: 83 и SEQ ID NO: 84 и CDR легкой цепи SEQ ID NO: 190, SEQ ID NO: 191 и SEQ ID NO: 192.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 85, SEQ ID NO: 86 и SEQ ID NO: 87, и CDR легкой цепи SEQ ID NO: 193, SEQ ID NO: 194 и SEQ ID NO: 195.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 90 и CDR легкой цепи SEQ ID NO: 196, SEQ ID NO: 197 и SEQ ID NO: 198.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 91, SEQ ID NO: 92 и SEQ ID NO: 93 и CDR легкой цепи SEQ ID NO: 199, SEQ ID NO: 200 и SEQ ID NO: 201.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 94, SEQ ID NO: 95 и SEQ ID NO: 96, и CDR легкой цепи SEQ ID NO: 202, SEQ ID NO: 203 и SEQ ID NO: 204.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 97, SEQ ID NO: 98 и SEQ ID NO: 99, и CDR легкой цепи SEQ ID NO: 205, SEQ ID NO: 206 и SEQ ID NO: 207.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102, и CDR легкой цепи SEQ ID NO: 208, SEQ ID NO: 209 и SEQ ID NO: 210.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 105, и CDR легкой цепи SEQ ID NO: 211, SEQ ID NO: 212 и SEQ ID NO: 213.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 106, SEQ ID NO: 107 и SEQ ID NO: 108, и CDR легкой цепи SEQ ID NO: 214, SEQ ID NO: 215 и SEQ ID NO: 216.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 109, SEQ ID NO: 110 и SEQ ID NO: 111, и CDR легкой цепи SEQ ID NO: 217, SEQ ID NO: 218 и SEQ ID NO: 219.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114, и CDR легкой цепи SEQ ID NO: 220, SEQ ID NO: 221 и SEQ ID NO: 222.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 115, SEQ ID NO: 116 и SEQ ID NO: 117, и CDR легкой цепи SEQ ID NO: 223, SEQ ID NO: 224 и SEQ ID NO: 225.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 118, SEQ ID NO: 119 и SEQ ID NO: 120, и CDR легкой цепи SEQ ID NO: 226, SEQ ID NO: 227 и SEQ ID NO: 228.
В некоторых воплощениях агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123, и CDR легкой цепи SEQ ID NO: 229, SEQ ID NO: 230 и SEQ ID NO: 231.
В некоторых воплощениях настоящее изобретение относится к агенту на основе антитела человека, который конкурирует за связывание CD19 с агентом на основе антитела человека, который включает (а) CDR тяжелой цепи SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 75, и CDR легкой цепи SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183; (b) CDR тяжелой цепи SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78 и CDR легкой цепи SEQ ID NO: 184, SEQ ID NO: 185 и SEQ ID NO: 186; (c) CDR тяжелой цепи SEQ ID NO: 79, SEQ ID NO: 80 и SEQ ID NO: 81 и CDR легкой цепи SEQ ID NO: 187, SEQ ID NO: 188 и SEQ ID NO: 189; (d) CDR тяжелой цепи SEQ ID NO: 82, SEQ ID NO: 83 и SEQ ID NO: 84 и CDR легкой цепи SEQ ID NO: 190, SEQ ID NO: 191 и SEQ ID NO: 192; (e) CDR тяжелой цепи SEQ ID NO: 85, SEQ ID NO: 86 и SEQ ID NO: 87 и CDR легкой цепи SEQ ID NO: 193, SEQ ID NO: 194 и SEQ ID NO: 195; (f) CDR тяжелой цепи SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 90 и CDR легкой цепи SEQ ID NO: 196, SEQ ID NO: 197 и SEQ ID NO: 198; (g) CDR тяжелой цепи SEQ ID NO: 91, SEQ ID NO: 92 и SEQ ID NO: 93 и CDR легкой цепи SEQ ID NO: 199, SEQ ID NO: 200 и SEQ ID NO 201; (h) CDR тяжелой цепи SEQ ID NO: 94, SEQ ID NO: 95 и SEQ ID NO: 96 и CDR легкой цепи SEQ ID NO: 202, SEQ ID NO: 203 и SEQ ID NO: 204; (i) CDR тяжелой цепи SEQ ID NO: 97, SEQ ID NO: 98 и SEQ ID NO: 99 и CDR легкой цепи SEQ ID NO: 205, SEQ ID NO: 206 и SEQ ID NO: 207; (j) CDR тяжелой цепи SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102 и CDR легкой цепи SEQ ID NO: 208, SEQ ID NO: 209 и SEQ ID NO: 210; (k) CDR тяжелой цепи SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 105, и CDR легкой цепи SEQ ID NO: 211, SEQ ID NO: 212 и SEQ ID NO: 213; (l) CDR тяжелой цепи SEQ ID NO: 106, SEQ ID NO: 107 и SEQ ID NO: 108 и CDR легкой цепи SEQ ID NO: 214, SEQ ID NO: 215 и SEQ ID NO: 216; (m) CDR тяжелой цепи SEQ ID NO: 109, SEQ ID NO: 110 и SEQ ID NO: 111 и CDR легкой цепи SEQ ID NO: 217, SEQ ID NO: 218 и SEQ ID NO: 219; (n) CDR тяжелой цепи SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114, и CDR легкой цепи SEQ ID NO: 220, SEQ ID NO: 221 и SEQ ID NO: 222; (o) CDR тяжелой цепи SEQ ID NO: 115, SEQ ID NO: 116 и SEQ ID NO: 117, и CDR легкой цепи SEQ ID NO: 223, SEQ ID NO: 224 и SEQ ID NO: 225; (p) CDR тяжелой цепи SEQ ID NO: 118, SEQ ID NO: 119 и SEQ ID NO: 120 и CDR легкой цепи SEQ ID NO: 226, SEQ ID NO: 227 и SEQ ID NO: 228; или (q) CDR тяжелой цепи SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123 и CDR легкой цепи SEQ ID NO: 229, SEQ ID NO: 230 и SEQ ID NO: 231.
В некоторых воплощениях агент на основе антитела человека дополнительно включает одну или несколько аминокислотных замен в CDR тяжелой цепи и/или CDR легкой цепи.
В некоторых воплощениях агент на основе антитела человека дополнительно включает, по меньшей мере, одну или вплоть до пяти аминокислотных замен в CDR тяжелой цепи и/или CDR легкой цепи.
В некоторых воплощениях агент на основе антитела человека дополнительно включает, по меньшей мере, одну или вплоть до трех аминокислотных замен в CDR тяжелой цепи и/или CDR легкой цепи.
В некоторых воплощениях агент на основе антитела человека включает одну или несколько аминокислотных замен в каркасе тяжелой цепи и/или в структуре легкой цепи. В некоторых определенных воплощениях агент на основе антитела человека включает 1-5 аминокислотных замен в каркасе тяжелой цепи и/или в структуре легкой цепи.
В некоторых определенных воплощениях одна или несколько аминокислотных замен (например, 1-5 аминокислотных замен) находятся в каркасной области (т.е. каркас тяжелой и/или легкой цепи) и/или CDR (т.е. CDR тяжелой и/или легкой цепи).
В некоторых воплощениях агент на основе антитела человека включает одну или несколько аминокислотных замен, которые представлены в таблице 8. В некоторых воплощениях агент на основе антитела человека включает аминокислотную замену(ы), обнаруженную в варианте клона, который представлен в таблице 8.
В некоторых воплощениях настоящее изобретение относится к агенту на основе антитела человека, который специфически связывает CD19 человека, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая составляет, по меньшей мере, на 50% (например, по меньшей мере, около 55%, 60% 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) идентична последовательности вариабельной области тяжелой цепи, которая представлена в таблице 1, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 50% (например, по меньшей мере, около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97 %, 98% или 99%) идентична последовательности вариабельной области легкой цепи, которая представлена в таблице 1.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 2, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 2.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 4, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 4.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 6, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 6.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 8, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 8.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 10, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 10.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 12, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 12.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 14, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 14.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 16, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 16.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 18, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 18.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 20, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 20.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 22, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 22.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 24, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 24.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 26, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 26.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 28, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 28.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 30, и вариабельной области легкой цепи, имеющей последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 30.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 32, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 32.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 34, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 34.
В некоторых воплощениях агент на основе антитела человека включает последовательности вариабельной области тяжелой и легкой цепей, которые представлены в любом из SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:12, SEQ ID NO:14, SEQ ID NO:16, SEQ ID NO:18, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32 и SEQ ID NO:34.
В некоторых воплощениях настоящее изобретение относится к агенту на основе антитела человека, который специфически связывает CD19 человека, где агент на основе антитела человека включает одну или несколько аминокислотных замен по сравнению с исходным (или эталонным) агентом на основе антитела человека и в котором агент на основе антитела человека включает (a) CDR тяжелой цепи SEQ ID NO: 124, SEQ ID NO: 125 и SEQ ID NO: 126 и CDR легкой цепи SEQ ID NO: 232, SEQ ID NO: 233 и SEQ ID NO: 234; (b) CDR тяжелой цепи SEQ ID NO: 127, SEQ ID NO: 128 и SEQ ID NO: 129, и CDR легкой цепи SEQ ID NO: 235, SEQ ID NO: 236 и SEQ ID NO: 237; (c) CDR тяжелой цепи SEQ ID NO: 130, SEQ ID NO: 131 и SEQ ID NO: 132 и CDR легкой цепи SEQ ID NO: 238, SEQ ID NO: 239 и SEQ ID NO: 240; (d) CDR тяжелой цепи SEQ ID NO: 133, SEQ ID NO: 134 и SEQ ID NO: 135 и CDR легкой цепи SEQ ID NO: 241, SEQ ID NO: 242 и SEQ ID NO: 243; (e) CDR тяжелой цепи SEQ ID NO: 136, SEQ ID NO: 137 и SEQ ID NO: 138 и CDR легкой цепи SEQ ID NO: 244, SEQ ID NO: 245 и SEQ ID NO: 246; (f) CDR тяжелой цепи SEQ ID NO: 139, SEQ ID NO: 140 и SEQ ID NO: 141 и CDR легкой цепи SEQ ID NO: 247, SEQ ID NO: 248 и SEQ ID NO: 249; (g) CDR тяжелой цепи SEQ ID NO: 142, SEQ ID NO: 143 и SEQ ID NO: 144, и CDR легкой цепи SEQ ID NO: 250, SEQ ID NO: 251 и SEQ ID NO: 252; (h) CDR тяжелой цепи SEQ ID NO: 145, SEQ ID NO: 146 и SEQ ID NO: 147 и CDR легкой цепи SEQ ID NO: 253, SEQ ID NO: 254 и SEQ ID NO: 255; (i) CDR тяжелой цепи SEQ ID NO: 148, SEQ ID NO: 149 и SEQ ID NO: 150, и CDR легкой цепи SEQ ID NO: 256, SEQ ID NO: 257 и SEQ ID NO: 258; (j) CDR тяжелой цепи SEQ ID NO: 151, SEQ ID NO: 152 и SEQ ID NO: 153 и CDR легкой цепи SEQ ID NO: 259, SEQ ID NO: 260 и SEQ ID NO: 261; (k) CDR тяжелой цепи SEQ ID NO: 154, SEQ ID NO: 155 и SEQ ID NO: 156 и CDR легкой цепи SEQ ID NO: 262, SEQ ID NO: 263 и SEQ ID NO: 264; (l) CDR тяжелой цепи SEQ ID NO: 157, SEQ ID NO: 158 и SEQ ID NO: 159 и CDR легкой цепи SEQ ID NO: 265, SEQ ID NO: 266 и SEQ ID NO: 267; (m) CDR тяжелой цепи SEQ ID NO: 160, SEQ ID NO: 161 и SEQ ID NO: 163 и CDR легкой цепи SEQ ID NO: 268, SEQ ID NO: 269 и SEQ ID NO: 270; (n) CDR тяжелой цепи SEQ ID NO: 163, SEQ ID NO: 164 и SEQ ID NO: 165, и CDR легкой цепи SEQ ID NO: 271, SEQ ID NO: 272 и SEQ ID NO: 273; (o) CDR тяжелой цепи SEQ ID NO: 166, SEQ ID NO: 167 и SEQ ID NO: 168, и CDR легкой цепи SEQ ID NO: 274, SEQ ID NO: 275 и SEQ ID NO: 276; (p) CDR тяжелой цепи SEQ ID NO: 169, SEQ ID NO: 170 и SEQ ID NO: 171 и CDR легкой цепи SEQ ID NO: 277, SEQ ID NO: 278 и SEQ ID NO: 279; (q) CDR тяжелой цепи SEQ ID NO: 172, SEQ ID NO: 173 и SEQ ID NO: 174 и CDR легкой цепи SEQ ID NO: 280, SEQ ID NO: 281 и SEQ ID NO: 282; (r) CDR тяжелой цепи SEQ ID NO: 175, SEQ ID NO: 176 и SEQ ID NO: 177, и CDR легкой цепи SEQ ID NO: 283, SEQ ID NO: 284 и SEQ ID NO: 285; или (s) CDR тяжелой цепи SEQ ID NO: 178, SEQ ID NO: 179 и SEQ ID NO: 180, и CDR легкой цепи SEQ ID NO: 286, SEQ ID NO: 287 и SEQ ID NO: 288. В некоторых определенных воплощениях антительный агент, как описано в данном документе, включает 1-5 аминокислотных замен по сравнению с исходным (или эталонным) антителом, как описано в данном документе.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи, который включает одну или несколько аминокислотных замен в любом из аминокислотных положений, выбранных из группы, состоящей из 10, 16, 25, 34, 52, 54, 68, 69, 72, 75, 93, 95 и их комбинации. В некоторых определенных воплощениях одна или несколько аминокислотных замен включают V10M, K16E, S25N, V34I, D52N, L54Q, N68T, T69M, L72M, S75N, S93T, D95E, D95G или их комбинацию.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи, который включает одну или несколько аминокислотных замен в любом из аминокислотных положений, выбранных из группы, состоящей из 3, 12, 16, 17, 25, 26, 32, 63, 69, 97, 102, 106, 108, 109, 113, 116, 117 и их комбинации. В некоторых определенных воплощениях одна или несколько аминокислотных замен включают Q3R, K12E, E16G, S17F, S25A, G26A, Y32F, S63F, T69A, A97V, T102S, M106L, Y108N, D109E, Q113L, L116M, M117L или их комбинацию.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой S75N. В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой T69M. В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотными заменами D52N и D95E. В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотными заменами V10M и D95G. В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой S93T и вариабельная область тяжелой цепи с аминокислотными заменами S17F и T69A. В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой N68T и вариабельная область тяжелой цепи с аминокислотными заменами S17F и Y108N. В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотной заменой S63F. В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотными заменами Q3R, Y32F и A97V. В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой K16E. В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотной заменой M117L.
В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой L72M и вариабельную область тяжелой цепи с аминокислотной заменой S25A. В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотными заменами T102S и L116M. В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотными заменами S25N и V34I и вариабельная область тяжелой цепи с аминокислотными заменами K12E и D109E. В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотной заменой E16G. В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой L54Q и вариабельную область тяжелой цепи с аминокислотной заменой M106L. В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой S25N. В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотными заменами G26A и Q113L. В некоторых воплощениях агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой L54Q. В некоторых воплощениях агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотной заменой T102S.
В некоторых воплощениях аминокислотные замены выбраны из таблицы 8.
В некоторых воплощениях настоящее изобретение относится к агенту на основе антитела человека, который специфически связывает CD19 человека, где агент на основе антитела человека включает одну или несколько аминокислотных замен (например, 1-5 аминокислотных замен) по сравнению с исходным (или эталонным) агентом на основе антитела человека и где агент на основе антитела человека включает последовательности вариабельной области тяжелой и легкой цепей, которые представлены в любой из SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72. В некоторых определенных воплощениях исходный (или эталонный) антительный агент включает HCVR и LCVR из SEQ ID NO: 30 или SEQ ID NO: 32.
В некоторых воплощениях агент на основе антитела человека представляет собой моноклональное антитело человека или его фрагмент.
В некоторых воплощениях агент на основе антитела человека представляет собой человеческое моноклональное антитело, которое включает вариант Fc-области. В некоторых воплощениях вариант Fc-области включает одну или несколько аминокислотных замен по сравнению с исходной (или эталонной) Fc-областью. В некоторых воплощениях человеческое моноклональное антитело включает вариант гликозилирования по сравнению с исходным моноклональным антителом человека, который включает Fc-область дикого типа (или исходную или эталонную). В некоторых воплощениях человеческое моноклональное антитело представляет собой антитело IgG1, IgG2, IgG3 или IgG4. В некоторых определенных воплощениях человеческое моноклональное антитело представляет собой IgG1.
В некоторых воплощениях агент на основе антитела человека конъюгирован с терапевтическим агентом или детектирующим агентом.
В некоторых воплощениях агент на основе антитела человека конъюгирован с цитотоксическим агентом или фрагментом.
В некоторых воплощениях агент на основе антитела человека конъюгирован с радиоизотопом.
В некоторых воплощениях агент на основе антитела человека представляет собой или включает иммуноглобулин, Fab, F(ab')2, Fd, Fv, одноцепочечный Fv (scFv) или dAb. В некоторых определенных воплощениях агент на основе антитела человека представляет собой scFv. В некоторых воплощениях scFv включает линкерную последовательность. В некоторых воплощениях scFv конъюгирован с терапевтическим агентом или детектирующим агентом. В некоторых воплощениях scFv является частью химерного антигенного рецептора.
В некоторых воплощениях настоящее изобретение относится к агенту на основе антитела человека, как описано в данном документе для применения при терапии или диагностике.
В некоторых воплощениях настоящее изобретение относится к агенту на основе антитела человека, как описано в данном документе, для применения при лечении, профилактике или улучшении заболевания, характеризующегося экспрессией CD19.
В некоторых воплощениях настоящее изобретение относится к агенту на основе антитела человека, как описано в данном документе, для применения при лечении, профилактике или облегчении рака.
В некоторых воплощениях настоящее изобретение относится к конъюгату антитело-лекарственное средство, содержащему антигенсвязывающий сайт (или сайты связывания антигена) агента на основе антитела человека, как описано в данном документе, и цитотоксический агент или группу.
В некоторых воплощениях цитотоксический агент или фрагмент представляет собой или включает монометилауристатин E (MMAE), монометилауристатин F (MMAF) или майтансин.
В некоторых воплощениях настоящее изобретение относится к биспецифическому антителу, содержащему первый антигенсвязывающий сайт из (или на основе) агента на основе антитела человека, как описано в данном документе, и второго антигенсвязывающего сайта.
В некоторых воплощениях первый и/или второй антигенсвязывающие сайты выбирают из группы, состоящей из молекулы иммуноглобулина, scFv, scFab, Fab, Fv и их комбинации. В некоторых воплощениях первый и второй антигенсвязывающие сайты, сконфигурированы таким образом, что они образуют единую полипептидную цепь. В некоторых воплощениях первый и второй сайты, связывающие антиген, представляют собой scFv. В некоторых воплощениях первый и второй антигенсвязывающие сайты связаны пептидным линкером. В некоторых воплощениях второй антигенсвязывающий сайт связан с С-концом первого антигенсвязывающего сайта. В некоторых воплощениях второй антигенсвязывающий сайт связан с N-концом первого антигенсвязывающего сайта.
В некоторых воплощениях первый антигенсвязывающий сайт состоит из молекулы иммуноглобулина, а второй антигенсвязывающий сайт состоит из scFv, scFab, Fab или Fv.
В некоторых воплощениях второй антигенсвязывающий сайт связывает иммунную клетку, выбранную из группы, состоящей из Т-клеток, NK-клеток, В-клеток, дендритных клеток, моноцитов, макрофагов, нейтрофилов, мезенхимальных стволовых клеток и нервных стволовых клеток. В некоторых воплощениях второй антигенсвязывающий сайт связывает CD3 на Т-клетках.
В некоторых воплощениях настоящее изобретение обеспечивает биспецифическое Т-клеточное моноклональное антитело, содержащее антигенсвязывающий сайт агента на основе антитела человека, как описано в данном документе.
В некоторых воплощениях настоящее изобретение обеспечивает биспецифическое антитело, состоящее из первого scFv, которое специфически связывает CD19 и второй scFv, который специфически связывает CD3 на Т-клетках, причем первый scFv включает любую из числа SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72.
В некоторых воплощениях N-конец первого scFv связан с C-концом второго scFv. В некоторых воплощениях С-конец первого scFv связан с N-концом второго scFv.
В некоторых воплощениях N-конец первого scFv связан с C-концом второго scFv посредством линкерной последовательности. В некоторых воплощениях С-конец первого scFv связан с N-концом второго scFv через линкерную последовательность.
В некоторых воплощениях настоящее изобретение обеспечивает биспецифическое антитело, как описано в данном документе для применения при терапии или диагностике.
В некоторых воплощениях настоящее изобретение относится к биспецифическому антителу, как описано в данном документе для применения при лечении, профилактике или улучшении заболевания, характеризующегося экспрессией CD19.
В некоторых воплощениях настоящее изобретение относится к химерному антигенному рецептору, содержащему антигенсвязывающий сайт агента на основе антитела человека, как описано в данном документе. В некоторых воплощениях химерный антигенный рецептор включает антигенсвязывающий сайт агента на основе антитела человека, как описано в данном документе, и дополнительно включает трансмембранный домен и/или внутриклеточный сигнальный домен нативного клеточного рецептора. В некоторых определенных воплощениях рецептор нативной клетки представляет собой Т-клеточный рецептор (TCR). В некоторых воплощениях химерный антигенный рецептор включает антигенсвязывающий сайт агента на основе антитела человека, как описано в данном документе, и дополнительно включает трансмембранный домен и внутриклеточный сигнальный домен, где внутриклеточный сигнальный домен включает внутриклеточную сигнальную последовательность CD3 (например, CD3ξ) и внутриклеточную сигнальную последовательность CD28.
В некоторых воплощениях антигенсвязывающий сайт химерного антигенного рецептора представляет собой scFv.
В некоторых воплощениях антигенсвязывающий сайт химерного антигенного рецептора, как описано в данном документе, представляет собой область VL. В некоторых определенных воплощениях область VL включает CDR легкой цепи из (a) SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183; (b) SEQ ID NO: 184, SEQ ID NO: 185 и SEQ ID NO: 186; (c) SEQ ID NO: 187, SEQ ID NO: 188 и SEQ ID NO: 189; (d) SEQ ID NO: 190, SEQ ID NO: 191 и SEQ ID NO: 192; (e) SEQ ID NO: 193, SEQ ID NO: 194 и SEQ ID NO: 195; (f) SEQ ID NO: 196, SEQ ID NO: 197 и SEQ ID NO: 198; (g) SEQ ID NO: 199, SEQ ID NO: 200 и SEQ ID NO 201; (h) SEQ ID NO: 202, SEQ ID NO: 203 и SEQ ID NO: 204; (i) SEQ ID NO: 205, SEQ ID NO: 206 и SEQ ID NO: 207; (j) SEQ ID NO: 208, SEQ ID NO: 209 и SEQ ID NO: 210; (k) SEQ ID NO: 211, SEQ ID NO: 212 и SEQ ID NO: 213; (1) SEQ ID NO: 214, SEQ ID NO: 215 и SEQ ID NO: 216; (m) SEQ ID NO: 217, SEQ ID NO: 218 и SEQ ID NO: 219; (n) SEQ ID NO: 220, SEQ ID NO: 221 и SEQ ID NO: 222; (o) SEQ ID NO: 223, SEQ ID NO: 224 и SEQ ID NO: 225; (p) SEQ ID NO: 226, SEQ ID NO: 227 и SEQ ID NO: 228; (q) SEQ ID NO: 229, SEQ ID NO: 230 и SEQ ID NO: 231; (r) SEQ ID NO: 232, SEQ ID NO: 233 и SEQ ID NO: 234; (ы) SEQ ID NO: 235, SEQ ID NO: 236 и SEQ ID NO: 237; (t) SEQ ID NO: 238, SEQ ID NO: 239 и SEQ ID NO: 240; (u) SEQ ID NO: 241, SEQ ID NO: 242 и SEQ ID NO: 243; (v) SEQ ID NO: 244, SEQ ID NO: 245 и SEQ ID NO: 246; (w) SEQ ID NO: 247, SEQ ID NO: 248 и SEQ ID NO: 249; (x) SEQ ID NO: 250, SEQ ID NO: 251 и SEQ ID NO: 252; (y) SEQ ID NO: 253, SEQ ID NO: 254 и SEQ ID NO: 255; (z) SEQ ID NO: 256, SEQ ID NO: 257 и SEQ ID NO: 258; (ab) SEQ ID NO: 259, SEQ ID NO: 260 и SEQ ID NO: 261; (AC) SEQ ID NO: 262, SEQ ID NO: 263 и SEQ ID NO: 264; (ad) SEQ ID NO: 265, SEQ ID NO: 266 и SEQ ID NO: 267; (ae) SEQ ID NO: 268, SEQ ID NO: 269 и SEQ ID NO: 270; (af) SEQ ID NO: 271, SEQ ID NO: 272 и SEQ ID NO: 273; (ag) SEQ ID NO: 274, SEQ ID NO: 275 и SEQ ID NO: 276; (а) SEQ ID NO: 277, SEQ ID NO: 278 и SEQ ID NO: 279; (ai) SEQ ID NO: 280, SEQ ID NO: 281 и SEQ ID NO: 282; (aj) SEQ ID NO: 283, SEQ ID NO: 284 и SEQ ID NO: 285; или (ak) SEQ ID NO: 286, SEQ ID NO: 287 и SEQ ID NO: 288. В некоторых определенных воплощениях область VL включает последовательность, которая представлена в любой из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72.
В некоторых воплощениях антигенсвязывающий сайт химерного рецептора, как описано в данном документе, представляет собой область VH. В некоторых определенных воплощениях область VH включает CDR тяжелой цепи (a) SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 75; (b) SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78; (c) SEQ ID NO: 79, SEQ ID NO: 80 и SEQ ID NO: 81; (d) SEQ ID NO: 82, SEQ ID NO: 83 и SEQ ID NO: 84; (e) SEQ ID NO: 85, SEQ ID NO: 86 и SEQ ID NO: 87; (f) SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 90; (g) SEQ ID NO: 91, SEQ ID NO: 92 и SEQ ID NO: 93; (h) SEQ ID NO: 94, SEQ ID NO: 95 и SEQ ID NO: 96; (i) SEQ ID NO: 97, SEQ ID NO: 98 и SEQ ID NO: 99; (j) SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102; (k) SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 105; (1) SEQ ID NO: 106, SEQ ID NO: 107 и SEQ ID NO: 108; (m) SEQ ID NO: 109, SEQ ID NO: 110 и SEQ ID NO: 111; (n) SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114; (o) SEQ ID NO: 115, SEQ ID NO: 116 и SEQ ID NO: 117; (p) SEQ ID NO: 118, SEQ ID NO: 119 и SEQ ID NO: 120; (q) SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123; (r) SEQ ID NO: 124, SEQ ID NO: 125 и SEQ ID NO: 126; (ы) SEQ ID NO: 127, SEQ ID NO: 128 и SEQ ID NO: 129; (t) SEQ ID NO: 130, SEQ ID NO: 131 и SEQ ID NO: 132; (u) SEQ ID NO: 133, SEQ ID NO: 134 и SEQ ID NO: 135; (v) SEQ ID NO: 136, SEQ ID NO: 137 и SEQ ID NO: 138; (w) SEQ ID NO: 139, SEQ ID NO: 140 и SEQ ID NO: 141; (x) SEQ ID NO: 142, SEQ ID NO: 143 и SEQ ID NO: 144; (y) SEQ ID NO: 145, SEQ ID NO: 146 и SEQ ID NO: 147; (z) SEQ ID NO: 148, SEQ ID NO: 149 и SEQ ID NO: 150; (ab) SEQ ID NO: 151, SEQ ID NO: 152 и SEQ ID NO: 153; (AC) SEQ ID NO: 154, SEQ ID NO: 155 и SEQ ID NO: 156; (ad) SEQ ID NO: 157, SEQ ID NO: 158 и SEQ ID NO: 159; (ae) SEQ ID NO: 160, SEQ ID NO: 161 и SEQ ID NO: 163; (af) SEQ ID NO: 163, SEQ ID NO: 164 и SEQ ID NO: 165; (ag) SEQ ID NO: 166, SEQ ID NO: 167 и SEQ ID NO: 168; (а) SEQ ID NO: 169, SEQ ID NO: 170 и SEQ ID NO: 171; (ai) SEQ ID NO: 172, SEQ ID NO: 173 и SEQ ID NO: 174; (aj) SEQ ID NO: 175, SEQ ID NO: 176 и SEQ ID NO: 177; или (ak) SEQ ID NO: 178, SEQ ID NO: 179 и SEQ ID NO: 180. В некоторых определенных воплощениях область VH включает последовательность, которая представлена в любой из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72.
В некоторых воплощениях настоящее изобретение относится к химерному антигенному рецептору, как описано в данном документе для применения при терапии или диагностике.
В некоторых воплощениях настоящее изобретение относится к химерному антигенному рецептору, как описано в данном документе, для применения при лечении, профилактике или облегчении заболевания, характеризующегося экспрессией CD19.
В некоторых воплощениях настоящее изобретение обеспечивает иммунную эффекторную клетку, которая экспрессирует химерный антигенный рецептор (или антительный агент или биспецифическое антитело), как описано в данном документе. В некоторых воплощениях иммунная эффекторная клетка представляет собой Т-клетку (например, цитотоксическую Т-клетку, хелперную Т-клетку или Т-клетку естественного киллера) или NK-клетку.
В некоторых воплощениях настоящее изобретение обеспечивает иммунную эффекторную клетку, как описано в данном документе для применения при терапии или диагностике.
В некоторых воплощениях настоящее изобретение обеспечивает иммунную эффекторную клетку, как описано в данном документе, для применения при лечении, профилактике или улучшении заболевания, характеризующегося экспрессией CD19.
В некоторых воплощениях настоящее изобретение обеспечивает выделенную молекулу нуклеиновой кислоты, кодирующую (или которая кодирует), полностью или частично, агент на основе антитела человека, полипептидную цепь биспецифичного антитела или биспецифическое антитело или химерный антигенный рецептор, как описано в данном документе. В некоторых воплощениях выделенная последовательность нуклеиновой кислоты включает последовательность, оптимизированную по кодонам.
В некоторых воплощениях выделенная последовательность нуклеиновой кислоты представляет собой последовательность, которая представлена в любой из числа SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 55, SEQ ID NO: 57, SEQ ID NO: 59, SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67, SEQ ID NO: 69 и SEQ ID NO: 71.
В некоторых воплощениях настоящее изобретение обеспечивает вектор, содержащий выделенную молекулу нуклеиновой кислоты, как описано в данном документе. В некоторых воплощениях вектор представляет собой рекомбинантный, экспрессирующий, лентивирусный или ретровирусный вектор.
В некоторых воплощениях настоящее изобретение обеспечивает клетку, содержащую молекулу вектора или нуклеиновой кислоты, или экспрессирующую антительный агент, биспецифическое антитело или химерный антигенный рецептор, как описано в данном документе. В некоторых воплощениях клетка выбирается из клетки бактерий, дрожжей, насекомых или млекопитающих. В некоторых воплощениях клетка представляет собой лимфоцит млекопитающих (например, лимфоцит человека).
В некоторых воплощениях настоящее изобретение относится к набору, содержащему агент на основе антитела человека, биспецифическое антитело, химерный антигенный рецептор, выделенную молекулу нуклеиновой кислоты, вектор или клетку, как описано в данном документе.
В некоторых воплощениях настоящее изобретение предлагает набор для диагностики объекта, страдающего заболеванием, связанным с CD19, или предрасположением к нему или для обеспечения прогноза состояния объекта, причем набор включает средство обнаружения для определения концентрации CD19, присутствующего в образце из испытуемого объекта, где средство обнаружения включает антигенсвязывающий сайт агента на основе антитела человека, как описано в данном документе, биспецифичного связывающего агента, как описано в данном документе, химерного антигенного рецептора, как описано в данном документе, или иммунной эффекторной клетки, как описано в данном документе, причем каждый из них необязательно дериватизирован, причем присутствие CD19 в образце указывает на то, что объект страдает от заболевания, связанного с CD19.
В некоторых воплощениях настоящее изобретение обеспечивает вакцину, содержащую выделенную молекулу нуклеиновой кислоты, как описано в данном документе.
В некоторых воплощениях настоящее изобретение относится к композиции, содержащей агент на основе антитела человека, биспецифическое антитело или химерный антигенный рецептор, как описано в данном документе. В некоторых определенных воплощениях агент на основе антитела человека или биспецифическое антитело композиции, описанной в данном документе, конъюгируют с цитотоксическим агентом или группой.
В некоторых воплощениях настоящее изобретение относится к фармацевтической композиции, содержащей агент на основе антитела человека, биспецифическое антитело, химерный антигенный рецептор или иммунную клетку (или ее популяцию), экспрессирующую химерный антигенный рецептор, как описано в данном документе, и дополнительно включающей фармацевтически приемлемый носитель или разбавитель.
В некоторых воплощениях настоящее изобретение относится к способу получения агента на основе антитела человека, биспецифичного антитела или химерного антигенного рецептора (или клетки, экспрессирующей химерный антигенный рецептор), как описано в данном документе, включающему стадию культивирования клетки, как описано в данном документе, в культуре среды в условиях, позволяющих экспрессию агента на основе антитела человека, биспецифичного антитела или химерного антигенного рецептора (или клетки, экспрессирующего химерный антигенный рецептор), и отделения агента на основе антитела человека, биспецифичного антитела или химерного антигенного рецептора (или клетки, экспрессирующей химерный антигенный рецептор) из культуральной среды.
В некоторых воплощениях настоящее изобретение относится к способу лечения медицинского состояния, характеризующегося экспрессией CD19 у объекта, включающему стадию введения терапевтически эффективного количества агента на основе антитела человека, биспецифичного антитела, химерного антигенного рецептора (или иммунной эффекторной клетки, экспрессирующей химерный антигенный рецептор), молекулы нуклеиновой кислоты или вектора, как описано в данном документе, указанному объекту.
В некоторых воплощениях медицинское состояние, характеризующееся экспрессией CD19, представляет собой В-клеточную лимфому, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, лимфому Беркитта, неходжкинскую лимфому или острый миелоидный лейкоз.
В некоторых воплощениях медицинское состояние, характеризующееся экспрессией CD19, представляет собой ревматоидный артрит (RA), системную красную волчанку (SLE), диабет или склеродермию.
В некоторых воплощениях настоящее изобретение относится к способу лечения рака, при этом способ включает стадию введения объекту агента на основе антитела человека, биспецифичного антитела, химерного антигенного рецептора (или иммунной эффекторной клетки, экспрессирующей химерный антигенный рецептор) нуклеотидные молекулы или вектора, как описано в данном документе.
В некоторых воплощениях настоящее изобретение относится к способу ингибирования роста опухоли, причем способ включает стадию контакта опухолевых клеток с биспецифическим антителом (или агентом на основе антитела человека, как описано в данном документе, химерным антигенным рецептором, как описано в данном документе, или иммунной эффекторной клеткой, как описано в данном документе, молекулой нуклеиновой кислоты, как описано в данном документе, или вектора, как описано в данном документе), причем биспецифическое антитело состоит из первого антигенсвязывающего сайта на базе агента на основе антитела человека, как описано в данном документе, и второго антигенсвязывающего сайта, который связывает иммунную клетку, где контакт проводят в условиях и в течение времени, достаточного для того, чтобы наблюдалось уничтожение опухолевых клеток (или для того, чтобы иммунные клетки, с которыми связывается биспецифическое антитело, ингибировали рост опухолевых клеток).
В некоторых воплощениях настоящее изобретение относится к способу уничтожения опухолевых клеток, причем способ включает стадию контакта опухолевых клеток с биспецифическим антителом (или агентом на основе антитела человека, как описано в данном документе, химерным антигенным рецептором, как описано в данном документе, или иммунной эффекторной клеткой, как описано в данном документе, молекулой нуклеиновой кислоты, как описано в данном документе, или вектором, как описано в данном документе), причем биспецифическое антитело состоит из первого антигенсвязывающего сайта на базе агента на основе антитела человека, как описано в данном документе, и второго антигенсвязывающего сайта, который связывает иммунную клетку, контакт проводят в условиях и в течение времени, достаточного для того, чтобы наблюдалось ингибирование роста опухолевых клеток (или для того, чтобы иммунные клетки, с которыми биспецифическое антитело связывается опосредовали уничтожение опухолевых клеток).
В некоторых воплощениях настоящее изобретение относится к способу диагностики медицинского состояния, характеризующегося экспрессией CD19 у объекта, причем способ включает стадию введения антительного агента (или биспецифичного антитела или химерного антигенного рецептора, как описано в данном документе), как описано в данном документе, и измерение связывания указанного антительного агента (или биспецифичного антитела или химерного антигенного рецептора) с клеткой, экспрессирующей CD19, у указанного объекта.
В некоторых воплощениях способа диагностики медицинского состояния способ дополнительно включает стадию измерения одной или более активностей одной или нескольких клеток указанного объекта. В некоторых определенных воплощениях один или несколько видов активности включают рост клеток и/или апоптоз.
В некоторых воплощениях настоящее изобретение обеспечивает биспецифическое антитело, состоящее из первого антигенсвязывающего сайта на базе агента на основе антитела человека, как описано в данном документе, и второго антигенсвязывающего сайта, который связывает иммунную клетку, для применения в ингибировании роста опухоли.
В некоторых воплощениях настоящее изобретение обеспечивает биспецифическое антитело, состоящее из первого антигенсвязывающего сайта на базе агента на основе антитела человека, как описано в данном документе, и второго антигенсвязывающего сайта, который связывает иммунную клетку, для применения при уничтожении опухолевых клеток.
В некоторых воплощениях иммунная клетка представляет собой Т-клетку или NK-клетку.
В некоторых воплощениях первый и второй антигенсвязывающие сайты представляют собой scFv.
В некоторых воплощениях второй антигенсвязывающий сайт связывает CD3 на Т-клетках.
В некоторых воплощениях настоящее изобретение относится к способу направления Т-клеток для уничтожения клеток-мишеней, экспрессирующих CD19, причем способ включает стадию контакта одной или нескольких клеток-мишеней, экспрессирующих CD19, с одной или несколькими Т-клетками и/или биспецифическим антителом (или агентом на основе агента на основе антитела человека, как описано в данном документе, химерным антигенным рецептором, как описано в данном документе, или иммунной эффекторной клеткой, как описано в данном документе), причем биспецифическое антитело включает первый антигенсвязывающий сайт агента на основе антитела человека, как описано в данном документе, и второй антигенсвязывающий сайт, который связывает CD3 на Т-клетках, причем контакт выполняется в условиях и в течение времени, достаточного для того, чтобы Т-клетки, с которыми связывалось биспецифическое антитело, опосредовали уничтожение клеток-мишеней, экспрессирующих CD19. В некоторых определенных воплощениях первый и второй антигенсвязывающие сайты являются scFv.
В некоторых воплощениях настоящее изобретение относится к биспецифическому антителу, состоящему из первого антигенсвязывающего сайта на базе агента на основе антитела человека, как описано в данном документе, и второго антигенсвязывающего сайта, который связывает CD3 на Т-клетках, для применения при нацеливании Т-клеток на уничтожение клеток-мишеней, экспрессирующих CD19.
В различных воплощениях линкерная последовательность представляет собой или включает последовательность (G4S)n. В некоторых воплощениях n равно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более.
В различных воплощениях линкерная последовательность представляет собой SRGGGGGGGGGGGGGGGGEMEMA (SEQ ID NO: 289).
В различных воплощениях CD19 представляет собой CD19 человека.
В некоторых воплощениях настоящее изобретение предусматривает применение агента на основе антитела человека, биспецифичного антитела или химерного антигенного рецептора (или иммунной эффекторной клетки, экспрессирующей химерный антигенный рецептор), как описано в данном документе для лечения или обнаружения состояния, связанного с экспрессией CD19,
В некоторых воплощениях настоящее изобретение предусматривает применение антитела на основе антитела человека, биспецифичного антитела или химерного антигенного рецептора (или иммунной эффекторной клетки, экспрессирующей химерный антигенный рецептор), как описано в данном документе, при изготовлении лекарственного средства для применения в медицине.
В некоторых воплощениях настоящее изобретение предусматривает применение антитела на основе антитела человека, биспецифичного антитела или химерного антигенного рецептора (или иммунной эффекторной клетки, экспрессирующей химерный антигенный рецептор), как описано в данном документе, при изготовлении лекарственного средства для применения в диагностическом тесте или анализе.
В некоторых воплощениях настоящее изобретение предусматривает применение антитела на основе антитела человека, биспецифичного антитела или химерного антигенного рецептора (или иммунной эффекторной клетки, экспрессирующей химерный антигенный рецептор), как описано в данном документе, при изготовлении лекарственного средства для применения при диагностике или лечении рака.
В некоторых воплощениях настоящее изобретение предусматривает применение антитела на основе антитела человека, биспецифичного антитела или химерного антигенного рецептора (или иммунной эффекторной клетки, экспрессирующей химерный антигенный рецептор), как описано в данном документе, при изготовлении лекарственного средства для применения при диагностике или лечении медицинского состояния, характеризующегося экспрессией CD19.
Краткое описание чертежей
Чертежи, включенные в настоящее описание, которые состоят из следующих фигур, предназначены только для иллюстративных целей, а не для ограничения.
На фиг. 1 показано типичное связывание фагового клона с человеческим CD19 для выбранных анти-CD19 агентов на основе агента на основе антитела человека. На фиг. 1А показано типичное связывание фагового клона (в OD450) рекомбинантного человеческого CD19-Fc. На фиг. 1В показано типичное связывание фагового клона (как средняя интенсивность флуоресценции, MFI) CD19 человека, экспрессируемого на клеточной поверхности. Контроль 1: не связывающий CD19 фаговый клон антитела scFv; Контроль 2: коммерческое мышиное антитело против CD19 человека (Biolegend); Контроль 3: только вторичное антитело.
На фиг. 2 показана типичная средняя интенсивность флуоресценции (MFI) связывания фагового клона с клетками Raji, положительными по CD19 человека (Raji), клетками Raji, нокаутированными по CD19 (Raji-CD19 k.o.) и клетками Jurkat, отрицательными по CD19 человека (Jurkat) в анализе проточной цитометрии для выбранных анти-CD19 агентов на основе антитела человека. Контроль 1: только вторичное антитело, включая мышиное антитело против M13 и PE-меченное антитело против мышиных антител.
На фиг. 3 показано репрезентативное изображение SDS-PAGE, иллюстрирующее выбранные биспецифичные антитела, описанные в Примере 2. Номера дорожек указаны в верхней части изображения геля. Дорожка 1: маркер; Дорожка 2: CD19xCD3 биспецифическое антитело с использованием клона 2; Дорожка 3: биспецифическое антитело CD19xCD3 с использованием клона 3; Дорожка 4: CD19xCD3 биспецифическое антитело с использованием клона 4; Дорожка 5: CD19xCD3 биспецифическое антитело с использованием клона 37; Дорожка 6: BL19 (биспецифическое антитело для сравнения, см. SEQ ID NO: 30 в патенте США № 7,635,472).
На фиг. 4 показаны типичные октетные кривые ассоциации/диссоциации для связывания (ось y, в нм) примерных молекул биспецифичных антител с рекомбинантным химерным белком CD19 ECD-Fc человека с течением времени (ось х, в секундах). Кинетические стадии (разделенные вертикальными пунктирными линиями) указываются над каждой сенсорной диаграммой. a: базовый уровень; b: биотинилированный CD19-Fc человека (5 мкг/мл); c: повторное уравновешивание; d: связывание антитела с CD19-Fc человека (10 мкг/мл); e: диссоциация антител. Бифункциональные тестируемые антитела включали биспецифическое антитело CD19xCD3 на основе фаговых клонов 4, 5, 6, 7, 37 и BL19 (биспецифическое антитело для сравнения, см. SEQ ID NO: 30 в патенте США № 7,635,472).
На фиг. 5А показан репрезентативный проточный цитометрический анализ человеческих РВМС, окрашенных CD20 (осью y) и CD3 (ось х), и «ворота» популяции В-клеток, используемые для анализа связывания биспецифичного антитела на фиг. 5В.
На фиг. 5В показано типичное уничтожение раковых клеток (в % специфичного клеточного лизиса, у-ось) различных линий клеток для примерных молекул биспецифичных антител на основе клонов 4, 5, 6 и 37.
На фиг. 6А показано репрезентативное связывание клеток (измеренное с помощью MFI в анализе проточной цитометрии) примерных вариантов фаговых клонов антител, полученных путем созревания аффинности отдельных фаговых клонов исходного антитела. Варианты клонов обозначаются дефисом (т.е. клоны 5-1, 5-3, 5-4 и т.д. были получены из исходного клона 5, клоны 6-1, 6-2 и т.д. были получены из исходного клона 6). Звездочка: клон 5-13 не тестировался на связывание с клеточными линиями Jeko-1, aji-CD19 k.o. или Jurkat.
На фиг. 6В показано репрезентативное связывание клеток выбранными вариантами фаговых клонов антител по сравнению с соответствующими исходными клонами с клетками Raji. Варианты клонов отмечены дефисом, то есть клоны 5-1, 5-3, 5-4 и т.д. были получены из исходного клона 5; клоны 6-1, 6-2 и т.д. были получены из исходного клона 6. Пунктирные линии указывают на исходное связывание соответствующего исходного клона при конкурентном связывании соответствующего биспецифичного антитела.
На фиг. 7А показаны репрезентативные изображения SDS-PAGE, иллюстрирующие выбранные биспецифичные антитела, сконструированные из фаговых клонов аффинно-зрелых антител, которые описаны в Примере 4. На каждой дорожке указаны номера клонов.
На фиг. 7В показано репрезентативное уничтожение раковых клеток (в % специфичного клеточного лизиса, ось y) различных линий клеток для выбранных молекул биспецифичных антител, сконструированных из агентов на основе аффинно-зрелого анти-CD19 антитела человека.
На фиг. 8 показано типичное уничтожение раковых клеток (в % специфичного клеточного лизиса, ось y) различных клеточных линий для выбранных Т-клеток, экспрессирующих химерный антигенный рецептор (CAR-T), полученный из анти-CD19 агентов на основе антитела человека. Целевые клеточные линии (CD19+) включают Raji и Jeko-1; отрицательные контрольные клеточные линии (CD19-) включают клетки Jurkat и Raji-CD19 k.o.; BL19: компаратор CAR основанный на SEQ ID NO: 30 патента США № 7,635,472; FMC63: компаратор CAR, основанный на учетном номере GenBank DD064902, патент США № 7446179; Контроль: ложно-трансдуцированные Т-клетки.
На фиг. 9 показана типичная экспрессия CAR (верхняя панель) и уничтожение клеток in vitro (нижняя панель) различных линий раковых клеток с использованием выбранных анти-CD19 CAR-T или контрольных Т-клеток (ложно-трансдуцированных). Клетки CD19+: Raji, CA46, Jeko-1 и Daudi; клетки CD19-: Raji-CD19KO (т.е. Raji-CD19 k.o.), Jurkat, THP-1, HeLa, MDA-MB-231, MCF-7, SK-Hep-1 и HepG2.
На фиг. 10 показано репрезентативное высвобождение цитокинов ложно-трансдуцированными Т-клетками (ложно-трансдцированные) или Т-клетками, трансдуцированными анти-CD19 CAR (Car, основанными на клоне 5-3) после совместного культивирования с различными CD19+- (Raji, CA46) и CD19--клеточными линиями (Raji-K/O, т.е. Raji-CD19 k.o., Jurkat).
Фиг. 11 демонстрирует репрезентативное ингибирование роста опухоли in vivo у мышей NSG с помощью примерного анти-CD19 CAR-T на основе клонов 5-9 анти-CD19 агента на основе антитела человека. Слева: репрезентативная кинетика излучения фотонов у мышей, несущих опухоли NSG, представленных и проанализированных по площади под кривой (AUC). Справа: репрезентативные фотонные эмиссионные изображения мышей, несущих опухоли Raji-luc-GFP на третьей неделе из каждой группы лечения.
На фиг. 12 показаны гистограммы FACS экспрессии CD19 в линиях клеток 3T3 (слева) и Raji (справа).
На фиг. 13 показана репрезентативная биолюминесценция опухоли из ксенотрансплантатов Raji-лимфомы у мышей NSG, которым вводили примерное анти-CD19 CAR-T на основе клонов 5-13 анти-CD19 агента на основе антитела человека. Фиг. 13A: репрезентативные радужные изображения биолюминесценции опухоли из ксенотрансплантатов Raji-лимфомы у мышей NSG, которые один раз обрабатывали фосфатно-солевым буферным раствором (носитель, n = 5), Т-клетками, трансдуцированными без CAR-кодирующей конструкции (ложная трансдукция, n = 6) или Т-клетками, трансдуцированными с помощью клонов 5-13 анти-CD19-CAR-T-кодирующей конструкции (CAR-T 5-13, n = 7; 5x106 CAR + Т-клеток на мышь, дни - после имплантации опухоли, дозу вводили в день 5). Преобразованная в шкалу серых тонов тепловая диаграмма показывает общие фотоны/в секунду в месте расположения опухоли, которые появляются как темные пятна, наложенные на изображения мыши; фиг. 13B: репрезентативное количественное определение роста опухоли для ложно-трансдуцированных и CAR-T 5-13-групп лечения, представленное как общий поток (p/s) относительно дней после имплантации ксенотрансплантатов Raji-лимфомы у мышей NSG; C: репрезентативное количественное определение роста опухоли для ложно-трансдуцированных и CAR-T 5-13-групп лечения, представленные как общий поток (p/s) относительно дней после повторного заражения у мышей NSG, повторно зараженных опухолевыми клетками через семь недель после первоначальной имплантации и лечения (n = 3, 0,5×106 клеток Raji на мышь, вводимых на 35 день после первоначальной имплантации). Наивным мышам (n = 2) имплантировали клетки Raji через один день после инъекции 1x106 ложно-трансдуцированных Т-клеток в качестве контроля.
На фиг. 14 показана репрезентативная биолюминесценция опухоли из ксенотрансплантатов лейкоза NALM-6 у мышей NSG, которым вводили примерным анти-CD19 CAR-T на основе анти-CD19 агента на основе антитела человека, клонов 5-13. Фиг. 14A: репрезентативные радужные изображения биолюминесценции опухоли из ксенотрансплантатов лейкоза NALM-6 у мышей NSG, которых один раз обрабатывали фосфатно-солевым буферным раствором (носитель, n=6), Т-клетками, трансдуцированными без кодирующей CAR конструкции (ложная трансдукция, n = 6), или Т-клетками, трансдуцированными с помощью клонов 5-13 анти-CD19 CAR-T -кодирующей конструкции (CAR-T 5-13, n = 6; 5×106 CAR+ Т-клеток на мышь, дни - после имплантации опухоли; проведенные на 5-й день, дни после имплантации опухоли, введение дозы осуществляли на 5-й день). Фиг. 14B: репрезентативное количественное определение роста опухоли для групп лечения с носителем, ложно-трансдуцированными клетками и CAR-T 5-13, представленными как общий поток (p/s) относительно дней после имплантации ксенотрансплантатов лейкоза NALM-6 у мышей NSG.
На фиг. 15 показана типичная экспрессия CAR (нижняя панель) и уничтожение клеток in vitro (верхняя панель) различных линий раковых клеток с использованием выбранных анти-CD19 CAR-T или контрольных Т-клеток (ложно-трансдуцированных). Клетки CD19+: Raji, IM9 и Jeko-1; клетки CD19-: Raji-CD19KO (т.е. Raji-CD19 k.o.) и THP-1.
Определения
Объем настоящего изобретения определяется прилагаемой формулой изобретения и не ограничивается конкретными воплощениями, описанными в данном документе; специалисты в данной области, прочитав настоящее раскрытие, будут знать о различных модификациях, которые могут быть эквивалентны таким описанным воплощениям или иным образом в пределах объема формулы изобретения.
В общем, терминология, используемая в данном документе, соответствует понятному значению в данной области техники, если явно не указано иное. Явные определения конкретных терминов приведены ниже; значения этих и других терминов в конкретных случаях в рамках этого описания будут понятны специалистам в данной области из контекста.
Для того чтобы настоящее изобретение было более понятным, некоторые термины сначала определяются ниже. Дополнительные определения для следующих терминов и других терминов указаны в описании.
Введение: При использовании в данном документе термин «введение» относится к введению композиции объекту или в систему (например, в клетку, орган, ткань, организм или релевантную часть или набор частей). Специалистам в данной области техники будет понятно, что способ введения может варьировать в зависимости, например, от объекта или системы, в которую вводится композиция, характера композиции, цели введения и т.д. Например, в некоторых воплощениях введение объекту животному (например, человеку) может быть бронхиальным (в том числе путем бронхиальной инстилляции), трансбуккальным, энтеральным, внутрикожным, внутриартериальным, внутрикожным, внутрижелудочным, внутрипеченочным, интрамедуллярным, внутримышечным, интраназальным, внутрибрюшинным, интратекальным, внутриутробным, внутривенным, внутрижелудочковым, слизистым, назальным, оральным, ректальным, подкожным, сублингвальным, актуальным, трахеальным (в том числе путем интратрахеальной инстилляции), трансдермальным, вагинальным и/или витреальным. В некоторых воплощениях введение может включать прерывистое дозирование. В некоторых воплощениях введение может включать непрерывное дозирование (например, перфузию) в течение, по меньшей мере, выбранного периода времени.
Аффинность. Как известно в данной области, «аффинность» является мерой степени плотности взаимодействия с конкретным лигандом, связывающимся со своим партнером. Аффинности можно измерять по-разному. В некоторых воплощениях аффинность измеряется количественным анализом. В некоторых таких воплощениях концентрация связующего партнера может быть зафиксирована так, чтобы она превышала концентрацию лиганда, чтобы имитировать физиологические условия. Альтернативно или дополнительно, в некоторых воплощениях концентрация связывающего партнера и/или концентрация лиганда могут варьировать. В некоторых таких воплощениях аффинность можно сравнить с эталоном в сопоставимых условиях (например, концентрациях).
С созревшей аффинностью (или антитело с созревшей аффинностью): используемый в данном документе термин относится к антителу с одним или несколькими изменениями в одной или нескольких CDR (или, в некоторых воплощениях, каркасных областях), которые приводят к улучшению аффинности антитела к антигену, по сравнению с исходным антителом, которое не обладает этими изменениями. В некоторых воплощениях антитела с созревшей аффинностью будут обладать наномолярными или даже пикомолярными аффинностями к целевому антигену. Антитела с созревшей аффинностью могут быть получены любым из множества способов, известных в данной области. Marks et al., 1992, BioTechnology 10: 779-783 описывает созревание аффинности путем перетасовки доменов VH и VL. Случайный мутагенез CDR и/или каркасных остатков описывается в: Barbas et al., 1994, Proc. Nat. Acad. Sci., U.S.A. 91:3809-3813; Schier et al., 1995, Gene 169: 147-155; Yelton et al., 1995. J. Immunol. 155:1994-2004; Jackson et al., 1995, J. Immunol. 154(7):3310-9; и Hawkins et al., 1992, J. Mol. Biol. 226:889-896. Выбор связующих с улучшенными свойствами связывания описан Thie et al., 2009, Methods Mol. Bio. 525:309-22.
Агент: При использовании в данном документе, может относиться к соединению или сущности любого химического класса, включая, например, полипептиды, нуклеиновые кислоты, сахариды, липиды, низкомолекулярные соединения, металлы или их комбинации. В некоторых воплощениях агент представляет собой или включает природный продукт, в том, в чем он был обнаружен и/или получен из природы. В некоторых воплощениях агент представляет собой или включает одно или несколько объектов, которые созданы человеком, поскольку они спроектированы, сконструированы и/или созданы посредством действия рук человека и/или не обнаруживаются в природе. В некоторых воплощениях агент может быть использован в выделенной или чистой форме; в некоторых воплощениях агент может быть использован в сырой форме. В некоторых воплощениях потенциальные агенты предлагаются в виде коллекций или библиотек, например, которые могут быть подвергнуты скринингу для идентификации или характеризации активных агентов среди них. Некоторые конкретные воплощения агентов, которые могут быть использованы в соответствии с настоящим изобретением, включают низкомолекулярные соединения, антитела, фрагменты антител, аптамеры, нуклеиновые кислоты (например, миРНК, кшРНК, гибриды ДНК/РНК, антисмысловые олигонуклеотиды, рибозимы), пептиды, пептидные миметики и т.д. В некоторых воплощениях агент является или включает полимер. В некоторых воплощениях агент не является полимером и/или практически не включает какого-либо полимера. В некоторых воплощениях агент включает, по меньшей мере, один полимерный фрагмент. В некоторых воплощениях агент отсутствует или практически не включает какой-либо полимерной части.
Облегчение: при использовании в данном документе, относится к предотвращению, сокращению или ослаблению состояния или улучшению состояния объекта. Облегчение включает, но не требует полного выздоровления или полной профилактики заболевания, расстройства или состояния (например, радиационного повреждения).
Аминокислота: При использовании в данном документе термин «аминокислота» в самом широком смысле относится к любому соединению и/или веществу, которое может быть включено в полипептидную цепь. В некоторых воплощениях аминокислота имеет общую структуру H2N-C (H) (R) -COOH. В некоторых воплощениях аминокислота представляет собой природную аминокислоту. В некоторых воплощениях аминокислота представляет собой синтетическую аминокислоту; в некоторых воплощениях аминокислота представляет собой D-аминокислоту; в некоторых воплощениях аминокислота представляет собой L-аминокислоту. «Стандартная аминокислота» относится к любой из 20 стандартных L-аминокислот, обычно встречающихся в природных пептидах. «Нестандартная аминокислота» относится к любой аминокислоте, отличной от стандартных аминокислот, независимо от того, получена ли она синтетически или получена из природного источника. При использовании в данном документе термин «синтетическая аминокислота» охватывает химически модифицированные аминокислоты, включая, без ограничения указанным, соли, производные аминокислот (такие как амиды) и/или замещения. Аминокислоты, включая карбокси- и/или аминоконцевые аминокислоты в пептидах, могут быть модифицированы метилированием, амидированием, ацетилированием, защитными группами и/или замещением другими химическими группами, которые могут изменять период полувыведения пептида без неблагоприятного воздействия на их активность. Аминокислоты могут участвовать в дисульфидной связи. Аминокислоты могут содержать одну или посттрансляционных модификаций, такие как ассоциация с одним или несколькими химическими объектами (например, метильные группы, ацетатные группы, ацетильные группы, фосфатные группы, формильные фрагменты, изопреноидные группы, сульфатные группы, полиэтиленгликолевые фрагменты, липидные фрагменты, углеводные фрагменты, фрагменты биотина и т.д.). Термин «аминокислота» используется взаимозаменяемо с «аминокислотным остатком» и может относиться к свободной аминокислоте и/или к аминокислотному остатку пептида. Из контекста, в котором этот термин используется, будет понятно, относится ли он к свободной аминокислоте или остатку пептида.
Животное: при использовании в данном документе, относится к любому представителю животного мира. В некоторых воплощениях «животное» относится к людям, любого пола и на любой стадии развития. В некоторых воплощениях «животное» относится к животным, не являющимся человеком, на любой стадии развития. В некоторых воплощениях животное, не являющееся человеком, представляет собой млекопитающее (например, грызуна, мышь, крысу, кролика, обезьяну, собаку, кошку, овцу, крупный рогатый скот, примата и/или свинью). В некоторых воплощениях животные включают, без ограничения указанным, млекопитающих, птиц, рептилий, амфибий, рыб, насекомых и/или червей. В некоторых воплощениях животное может быть трансгенным животным, генетически модифицированным животным и/или клоном.
Антитело: При использовании в данном документе термин имеет значение, понимаемое в данной области, и относится к иммуноглобулину (Ig), который специфически связывается с конкретным антигеном. Как известно специалистам в данной области, антитела, полученные в природе, обычно состоят из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей. Каждая тяжелая и легкая цепь состоит из вариабельной области (сокращенно обозначается как HCVR или VH и LCVR или VL, соответственно) и константной области. Константная область тяжелой цепи включает домен CH1, CH2 и CH3 (и, необязательно, домен CH4 в случае IgM и IgE). Константная область легкой цепи состоит из одного домена, CL. В VH и VL область дополнительно включает участки гипервариабельности, называемые области, определяющие комплементарность (CDR), чередующуюся с участками, которые являются более консервативными, называемыми каркасными областями (FR). Каждый VH и VL состоит из трех CDR и четырех FR, расположенных от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Молекулы иммуноглобулина могут быть любого типа (например, IgM, IgD, IgG, IgA и IgE), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса.
Антительный агент: При использовании в данном документе термин «антительный агент» относится к агенту, который специфически связывается с определенным антигеном. В некоторых воплощениях этот термин охватывает любой полипептид со структурными элементами иммуноглобулина, достаточными для придания специфичного связывания. В различных воплощениях подходящие антительные агенты могут включать, без ограничения указанным, моноклональные антитела, поликлональные антитела, гуманизированные антитела, приматизированные антитела, химерные антитела, человеческие антитела, биспецифичные или мультиспецифичные антитела, однодоменные антитела (например, однодоменные антитела акулы (например, IgNAR или их фрагменты)), конъюгированные антитела (т.е. антитела, конъюгированные или слитые с другими белками, радиоактивными метками, цитотоксинами), малые модульные иммунофармацевтические препараты (SMIPsTM), одноцепочечные антитела, верблюжьи антитела, фрагменты антител, и т.д. В некоторых воплощениях этот термин может относиться к сшитому пептиду. В некоторых воплощениях этот термин может относиться к антителоподобному пептидомиметику. В некоторых воплощениях этот термин может относиться к антителоподобному связующему каркасному белку. В некоторых воплощениях этот термин может относиться к монотелам или аднектинам. Во многих воплощениях антительный агент представляет собой полипептид или его полипептид, аминокислотная последовательность которого включает один или несколько структурных элементов, признанных специалистами в данной области как область определения комплементарности (CDR); в некоторых воплощениях антительный агент представляет собой или включает полипептид, аминокислотная последовательность которого включает, по меньшей мере, одну CDR (например, по меньшей мере, один CDR тяжелой цепи и/или, по меньшей мере, одну CDR легкой цепи), который по существу идентичен таковому, обнаруженному в контрольном антителе (например, исходном антителе). В некоторых воплощениях включенная CDR по существу идентична эталонной CDR в том смысле, что он либо идентичен в последовательности, либо включает от 1 до 5 аминокислотных заменам по сравнению с эталонной CDR. В некоторых воплощениях включенная CDR по существу идентична эталонной CDR в том, что она демонстрирует, по меньшей мере, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% 95%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с эталонной CDR. В некоторых воплощениях включенная CDR по существу идентична эталонной CDR в том, что она демонстрирует, по меньшей мере, 96%, 96%, 97%, 98%, 99% или 100% идентичности последовательности с эталонной CDR. В некоторых воплощениях включенная CDR по существу идентична эталонной CDR в том, что, по меньшей мере, одна аминокислота внутри включенной CDR удаляется, добавляется или замещается по сравнению с эталонной CDR, но включенная CDR имеет аминокислотную последовательность, которая в противном случае идентична с эталонной CDR. В некоторых воплощениях включенная CDR по существу идентична эталонной CDR в том, что 1-5 аминокислот во включенной CDR удаляются, добавляются или замещаются по сравнению с эталонной CDR, но включенная CDR имеет аминокислотную последовательность, которая в противном случае идентична эталонной CDR. В некоторых воплощениях включенная CDR по существу идентична эталонной CDR в том, что, по меньшей мере, одна аминокислота внутри включенной CDR заменена по сравнению с эталонной CDR, но включенная CDR имеет аминокислотную последовательность, которая в остальном идентична последовательности аминокислот ссылка CDR. В некоторых воплощениях включенная CDR по существу идентична эталонной CDR в том, что 1-5 аминокислот внутри включенной CDR замещается по сравнению с эталонной CDR, но включенная CDR имеет аминокислотную последовательность, которая в остальном идентична эталонной CDR. В некоторых воплощениях антительный агент представляет собой или включает полипептид, аминокислотная последовательность которого включает структурные элементы, признанные специалистами в данной области как вариабельный домен иммуноглобулина. В некоторых воплощениях антительный агент представляет собой полипептидный белок, имеющий связывающий домен, который является гомологичным или в значительной степени гомологичным домену, связывающему иммуноглобулин. В некоторых воплощениях антительный агент представляет собой полипептид, включающий все CDR, обнаруженные в конкретной цепи или цепях контрольных антител (например, тяжелой цепи и/или легкой цепи).
Компонент антитела. При использовании в данном документе термин относится к полипептидному элементу (который может быть полным полипептидом или частью более крупного полипептида, таким как, например, химерный полипептид, как описано в данном документе), который специфически связывается с эпитопом или антигеном и включает один или несколько структурных признаков иммуноглобулина. В общем, компонентом антитела является любой полипептид, аминокислотная последовательность которого включает элементы, характерные для области связывания антитела (например, легкой цепи антитела или ее вариабельной области или одной или нескольких областей определения комплементарности («CDR») или тяжелой цепи антитела или ее вариабельной области или одной или нескольких CDR, необязательно в присутствии одной или нескольких каркасных областей). В некоторых воплощениях компонент антитела представляет собой или включает полноразмерное антитело. В некоторых воплощениях компонент антитела меньше, чем полный, но включает, по меньшей мере, один сайт связывания (содержащий, по меньшей мере, одну и предпочтительно, по меньшей мере, две последовательности со структурой «вариабельных областей» известных антител»). В некоторых воплощениях термин «компонент антитела» охватывает любой белок, имеющий связывающий домен, который является гомологичным или в значительной степени гомологичным домену, связывающему иммуноглобулин. В конкретных воплощениях включенный «компонент антитела» охватывает полипептиды, имеющие связывающий домен, который показывает, по меньшей мере, 99% идентичности с доменом, связывающим иммуноглобулин. В некоторых воплощениях включенный «компонент антитела» представляет собой любой полипептид, имеющий домен связывания, который показывает, по меньшей мере, 70%, 75%, 80%, 85%, 90%, 95% или 98% идентичности с доменом, связывающим иммуноглобулин, например, с эталонным доменом, связывающим иммуноглобулин. Включенный «компонент антитела» может иметь аминокислотную последовательность, идентичную аминокислотной последовательности антитела (или его части, например его антигенсвязывающей части), которая находится в природном источнике. Компонент антитела может быть моноспецифическим, биспецифическим или мультиспецифичным. Компонент антитела может включать структурные элементы, характерные для любого класса иммуноглобулина, включая любой из классов человека: IgG, IgM, IgA, IgD и IgE. Было показано, что антигенсвязывающая функция антитела может быть выполнена фрагментами полноразмерного антитела. Такие воплощения антител могут также быть биспецифичными, двойными специфичными или мультиспецифичными форматами; специфически связывающийся с двумя или более разными антигенами. Примеры фрагментов связывания, включенных в термин «антигенсвязывающая часть» антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VH, VL, CH1 и CL; (ii) фрагмент F(ab')2, двухвалентный фрагмент, содержащий два Fab-фрагмента, соединенных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VH и VL одного плеча антитела, (v) фрагмент dAb (Ward et al, 1989, Nature 341: 544-546), который включает один вариабельный домен; и (vi) выделенную область определения комплементарности (CDR). Кроме того, хотя два домена Fv-фрагмента VH и VL кодируются отдельными генами, их можно объединить, используя рекомбинантные способы, синтетическим линкером, который позволяет их превращать в одну белковую цепь, в которой пары VH и VL образуют моновалентные молекулы (известные как одноцепочечные Fv (scFv), см., например, Bird et al., 1988, Science 242: 423-426, Huston et al., 1988, Proc. Natl. Acad. Sci. U.S.A. 85:5879-5883). В некоторых воплощениях «компонент антитела», как описано в данном документе, является или включает такое одноцепочечное антитело. В некоторых воплощениях «компонент антитела» представляет собой или включает диатело. Диатела являются бивалентными, биспецифичными антителами, в которых VH- и VL-домены экспрессируются в одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы обеспечить спаривание между двумя доменами в одной и той же цепи, тем самым заставляя домены спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающего сайта (см., например, Holliger, P., et al. Acad. Sci. U.S.A. 90:6444-6448; Poljak, R. J., et al., 1994, Structure 2:1121-1123). Такие связывающие антитела части известны в данной области (Kontermann and Dubel eds., Antibody Engineering, 2001, Springer-Verlag. New York. 790 pp. ISBN 3-540-41354-5). В некоторых воплощениях компонент антитела представляет собой или включает одноцепочечное «линейное антитело», содержащее пару тандемных сегментов Fv (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пара антигенсвязывающих областей (Zapata et al., 1995, Protein Eng., 8 (10): 1057-1062 и патент США № 5641870). В некоторых воплощениях компонент антитела может иметь структурные элементы, характерные для химерных, гуманизированных или человеческих антител. В общем, гуманизированными антителами являются человеческие иммуноглобулины (антитело-реципиент), в которых остатки из области определения комплементарности (CDR) реципиента заменяются остатками CDR нечеловеческого (донорского) антитела, такого как мышиное, крысиное или кроличье, имеющего искомую специфичность, аффинность и способность. В некоторых воплощениях компонент антитела может иметь структурные элементы, характерные для человеческого антитела. В некоторых воплощениях компонент антитела может быть включен в химерную молекулу, причем химерная молекула дополнительно включает один или несколько дополнительных полипептидов или полипептидных фрагментов (например, сигнальный компонент, трансмембранный компонент и т.д.).
Фрагмент антитела: При использовании в данном документе, «фрагмент антитела» включает часть интактного антитела, такую как, например, антигенсвязывающая или вариабельная область антитела. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv; триатела; тетратела; линейные антитела; молекулы одноцепочечных антител; и CDR-содержащие группы, включенные в мультиспецифичные антитела, образованные из фрагментов антител. Специалистам в данной области техники будет понятно, что термин «фрагмент антитела» не подразумевает и не ограничивается каким-либо конкретным способом получения. Фрагмент антитела может быть получен с использованием любой подходящей методологии, включая, без ограничения указанным, расщепление интактного антитела, химический синтез, рекомбинантное производство и т.д.
Полипептид антитела. При использовании в данном документе термин «полипептид антитела» или «антитело» или его антигенсвязывающий фрагмент, которые могут быть взаимозаменяемы, относятся к полипептиду(-ам), способному связываться с эпитопом. В некоторых воплощениях полипептид антитела является полноразмерным антителом, а в некоторых воплощениях он имеет меньше, чем полную длину, но включает, по меньшей мере, один сайт связывания (содержащий, по меньшей мере, одну и предпочтительно, по меньшей мере, две последовательности со структурой «вариабельных областей» антитела»). В некоторых воплощениях термин «полипептид антитела» охватывает любой белок, имеющий связывающий домен, который является гомологичным или в значительной степени гомологичным домену, связывающему иммуноглобулин. В конкретных воплощениях «полипептиды антител» включают полипептиды, имеющие связывающий домен, который показывает, по меньшей мере, 99% идентичность с доменом, связывающим иммуноглобулин. В некоторых воплощениях «полипептид антитела» представляет собой любой белок, имеющий связывающий домен, который показывает, по меньшей мере, 70%, 80%, 85%, 90% или 95% идентичность с доменом, связывающим иммуноглобулин, например эталонным доменом, связывающим иммуноглобулин. Включенный «полипептид антитела» может иметь аминокислотную последовательность, идентичную аминокислотной последовательности антитела, которая находится в природном источнике. Полипептиды антител в соответствии с настоящим изобретением могут быть получены любыми доступными способами, включая, например, выделение из библиотеки естественного источника или антитела, рекомбинантное продуцирование в или с помощью системы-хозяина, химический синтез и т.д. или их комбинации. Полипептид антитела может быть моноклональным или поликлональным. Полипептид антитела может быть представителем любого класса иммуноглобулинов, включая любой из классов человека: IgG, IgM, IgA, IgD и IgE. В некоторых воплощениях антитело может быть представителем класса иммуноглобулинов IgG. Используемые в данном документе термины «полипептид антитела» или «характерная часть антитела» используются взаимозаменяемо и относятся к любому производному антитела, которое обладает способностью связываться с представляющим интерес эпитопом. В некоторых воплощениях «полипептид антитела» представляет собой фрагмент антитела, который сохраняет, по меньшей мере, значительную часть специфической связывающей способности полноразмерного антитела. Примеры фрагментов антител включают, без ограничения указанным, Fab, Fab', F(ab')2, scFv, Fv, dsFv диатело и фрагменты Fd. Альтернативно или дополнительно фрагмент антитела может содержать многочисленные цепи, которые связаны, например, дисульфидными связями. В некоторых воплощениях полипептид антитела может представлять собой человеческое антитело. В некоторых воплощениях полипептид антитела может быть гуманизированным антителом. Полипептиды гуманизированного антитела включают химерные иммуноглобулины, цепи иммуноглобулина или полипептиды антител (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, полученную из иммуноглобулина не человеческой природы. В общем, гуманизированными антителами являются человеческие иммуноглобулины (антитело-реципиент), в которых остатки из области, определяющей комплементарность (CDR) реципиента заменяются остатками CDR из вида, не являющегося человеком (донорского антитела), такого как мышь, крыса или кролик, имеющие искомую специфичность, аффинность и емкость.
Антигенсвязывающий фрагмент. Термин «антигенсвязывающий фрагмент», при использовании в данном документе, относится к одному или нескольким фрагментам антитела, которые сохраняют способность связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может быть выполнена фрагментами интактного антитела. Примеры связывающих фрагментов, включенных в термин «антигенсвязывающий фрагмент» антитела, включают (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2, двухвалентный фрагмент, содержащий два Fab-фрагмента, соединенных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела, (v) фрагмент dAb (Ward et al., (1989) Nature 341: 544-546), который состоит из VH-домена; (vi) выделенную область определения комплементарности (CDR), например VH CDR3, содержащую или не содержащую дополнительную последовательность (линкер, каркасную область (области) и т.д.) и (vii) комбинацию из двух-шести выделенных CDR, содержащих или не содержащих дополнительную последовательность (линкер, каркасная область и т.д.). Кроме того, хотя две области фрагмента Fv, VL и VH, кодируются отдельными генами, их можно объединить, используя рекомбинантные способы, синтетическим линкером, который позволяет получить одиночную белковую цепь, в которой VL- и VH-пары образуют одновалентные молекулы (известные как одноцепочечные Fv (scFv), см., например, Bird et al. (1988) Science 242:423-426; and Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также предназначены для включения в термин «антигенсвязывающий фрагмент» антитела. Кроме того, антигенсвязывающие фрагменты включают химерные белки связывающего домена иммуноглобулина, содержащие (i) полипептид связывающего домена (такой как вариабельная область тяжелой цепи, вариабельная область легкой цепи или вариабельная область тяжелой цепи, слитая с вариабельной областью легкой цепи через линкерный пептид), который слит с полипептидом шарнирной области иммуноглобулина, (ii) константной области СН2 тяжелой цепи иммуноглобулина, слит с шарнирной областью, и (iii) константной области CН3 тяжелой цепи иммуноглобулина, слитой с СН2. Область шарнира может быть модифицирована путем замены одного или нескольких остатков цистеина остатками серина, чтобы предотвратить димеризацию. Такие химерные белки связывающего домена иммуноглобулина далее раскрыты в публикации патентной заявки США № 2003/0118592 A1 и публикации заявки на патент США № 2003/0133939 A1. Эти фрагменты антител получают обычными методами, известными специалистам в данной области, и фрагменты подвергают скринингу на предмет полезности таким же образом, что и интактные антитела. Кроме того, антигенсвязывающие фрагменты включают двухвалентные (или двухвалентные) одноцепочечные вариабельные фрагменты (di-scFv, bi-scFv) или, в ином случае, так называемые диатела, которые могут быть сконструированы стандартными молекулярно-биологическими средствами.
Биологическая активность: При использовании в данном документе термин относится к наблюдаемому биологическому эффекту или результату, достигаемому представляющим интерес агентом или объектом. Например, в некоторых воплощениях специфическое связывание является биологической активностью. В некоторых воплощениях модуляция (например, индукция, усиление или ингибирование) биологического пути или события является биологической активностью. В некоторых воплощениях присутствие или степень биологической активности оценивают посредством обнаружения прямого или косвенного продукта, продуцируемого биологическим путем или событием, представляющим интерес.
Биспецифическое антитело: При использовании в данном документе термин относится к биспецифическому связывающему агенту, в котором, по меньшей мере, один и, как правило, оба, связывающих фрагмента являются или содержат компонент антитела. В данной области известно множество различных биспецифичных структур антител. В некоторых воплощениях каждый связывающий фрагмент в биспецифическом антителе, который представляет собой или включает компонент антитела, включающий области VH и/или VL; в некоторых таких воплощениях области VH и/или VL представляют собой области, обнаруженные в конкретном моноклональном антителе. В некоторых воплощениях, когда биспецифическое антитело включает две антительные связывающие группы, каждая включает области VH и/или VL из разных моноклональных антител.
Биспецифичный связывающий агент: При использовании в данном документе термин относится к полипептидному агенту с двумя дискретными связывающими группами, каждая из которых связывает отдельную мишень. В некоторых воплощениях биспецифичный связывающий агент представляет собой одиночный полипептид; в некоторых воплощениях биспецифичный связывающий агент представляет собой или включает множество пептидов, которые в некоторых таких воплощениях могут быть ковалентно связаны друг с другом, например, путем перекрестного сшивания. В некоторых воплощениях две связывающие группы биспецифичного связывающего агента распознают разные сайты (например, эпитопы) одной и той же мишени (например, антигена); в некоторых воплощениях они распознают разные мишени. В некоторых воплощениях биспецифичный связывающий агент способен одновременно связываться с двумя мишенями, которые имеют разную структуру.
Носитель: При использовании в данном документе термин относится к разбавителю, адъюванту, эксципиенту или несущей среде, с которыми вводится композиция. В некоторых иллюстративных воплощениях носители могут включать стерильные жидкости, такие как, например, вода и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как, например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. В некоторых воплощениях носители являются или включают один или несколько твердых компонентов.
CDR: При использовании в данном документе термин относится к области, определяющей комплементарность в вариабельной области антитела. Существует три CDR в каждой из вариабельных областей тяжелой цепи и легкой цепи, которые обозначены как CDR1, CDR2 и CDR3 для каждой из вариабельных областей. «Набор CDR» или «CDR-набор» относится к группе из трех или шести CDR, которые встречаются либо в отдельной вариабельной области, способной связываться с антигеном, либо CDR когнатных вариабельных областей тяжелой и легкой цепей, способных связывать антиген. Границы CDR были определены по-разному в зависимости от системы, которых в данной области известно несколько (например, Kabat, Chothia, IMGT и т.д.).
Химерные антигенные рецепторы (CAR): антительные агенты настоящего изобретения, включая одноцепочечные вариабельные фрагменты (scFv), могут быть использованы для получения химерных антигенных рецепторов, подготовка и применение которых общеизвестно в данной области. Химерный антигенный рецептор (CAR) обычно представляет собой искусственно сконструированный гибридный белок или полипептид, содержащий антигенсвязывающий домен scFv или другого антительного агента, связанный с сигнальными доменами иммунной клетки (например, Т-клеток или NK-клеток). Характеристики CAR включают их способность перенаправлять специфичность и реакционную способность иммунной клетки (например, Т-клеток или NK-клеток) на выбранную мишень либо в MHC-рестрицированных (в случае TCR-имитирующих антител), либо в MHC-нерестрицированных (в случае антитела против белков клеточной поверхности), используя антигенсвязывающие свойства моноклональных антител. MHC-нерестрецированное распознавание антигена дает иммунным клеткам (например, Т-клеткам или NK-клеткам), экспрессирующим CAR, способность распознавать антиген, независимо от процессирования антигенов, тем самым минуя основной механизм ухода опухоли от уничтожения.
Терапия химерным антигенным рецептором (CAR) (или адоптивная клеточная терапия): При использовании в данном документе термин относится к применению химерных антигенных рецепторов для терапевтического лечения, включая, например, для адоптивной клеточной терапии. Адоптивная клеточная терапия - терапевтический подход, который обычно включает выделение и ex vivo размножение и/или манипулирование иммунными клетками (например, NK-клетками или Т-клетками) и последующее введение этих клеток пациенту, например, для лечения рака. Введенные клетки могут быть аутологичными или аллогенными. Клетками можно манипулировать путем экспрессии химерных антигенных рецепторов любым из известных способов, включая, например, применение трансфекции РНК и ДНК, вирусную трансдукцию, электропорацию, все из которых являются технологиями, известными в данной области.
Сравнимый: при использовании в данном документе, относится к двум или более агентам, сущностям, ситуациям, наборам условий и т.д., которые могут быть не идентичными друг другу, но которые достаточно похожи, чтобы обеспечить сопоставление между ними, чтобы можно было разумно провести выводы на основании различий или сходства. В некоторых воплощениях сопоставимые совокупности условий, обстоятельств, индивидуумов или популяций характеризуются множеством по существу идентичных признаков и одним или небольшим количеством различных признаков. Специалисты в данной области техники поймут в контексте, какая степень идентичности требуется в любом случае для двух или более таких агентов, сущностей, ситуаций, наборов условий и т.д., которые считаются сравнимыми. Например, специалистам в данной области техники будет понятно, что совокупности обстоятельств, индивидуумов или популяций сопоставимы друг с другом, когда они характеризуются достаточным количеством и типом по существу идентичных признаков для того, чтобы обеспечить разумный вывод о том, что различия в полученных результатах или явлениях наблюдаемые под или с разными наборами обстоятельств, индивидуумами или популяциями вызваны или указывают на изменение различных характеристик.
Контроль. При использовании в данном документе термин относится к понимаемому в данной области значению «контроля», являющегося стандартом, с которым сравниваются результаты. Как правило, контроли используются для усиления целостности в экспериментах путем выделения переменных, чтобы сделать вывод о таких переменных. В некоторых воплощениях контроль представляет собой реакцию или анализ, который выполняется одновременно с тестовой реакцией или анализом для обеспечения компаратора. При использовании в данном документе термин «контроль» может относиться к «контрольному антителу». «Контрольным антителом» может быть человеческое, химерное, гуманизированное CDR-привитое, мультиспецифическое или биспецифическое антитело, как описано в данном документе, антитело, которое отличается, как описано в данном документе, фрагментом антитела или компонентом антитела или исходным антителом. В одном эксперименте применяется «тест» (т.е. тестируемая переменная). Во втором эксперименте «контроль», тестируемая переменная, не применяется. В некоторых воплощениях контроль представляет собой исторический контроль (т.е. теста или анализа, выполненного ранее, или количество или результат, который ранее был известен). В некоторых воплощениях контроль представляет собой или включает печатную или иную сохраненную запись. Контроль может быть положительным или отрицательным.
Соответствующий: При использовании в данном документе обозначает положение/идентичность аминокислотного остатка в представляющем интерес полипептиде. Обычным специалистам будет понятно, что для целей простоты остатки в полипептиде часто обозначаются с использованием системы канонической нумерации на основе эталонного родственного полипептида, так что аминокислота, «соответствующая» остатку в положении 190, например, не обязательно должна быть 190-й аминокислотой в определенной аминокислотной цепи, а скорее соответствует остатку, найденному при 190 в эталонном полипептиде; специалисты в данной области техники легко понимают, как идентифицировать «соответствующие» аминокислоты.
Объект/детектирующий агент: При использовании в данном документе термин относится к любому элементу, молекуле, функциональной группе, соединению, фрагменту или части, которые можно обнаружить. В некоторых воплощениях объект обнаружения предоставляется или используется отдельно. В некоторых воплощениях объект обнаружения предоставляется и/или используется совместно (например, будучи соединенным с) с другим агентом. Примеры детектирующих объектов включают, без ограничения указанным: различные лиганды, радионуклиды (например, 3 H, 14C, 18F, 19F, 32P, 35S, 135I, 125I, 123I, 64Cu, 187Re, 111In, 90Y, 99mTc, 177Lu, 89Zr и т.д.), флуоресцентные красители (конкретные иллюстративные флуоресцентные красители, см. ниже), хемилюминесцентные агенты (такие как, например, сложные эфиры акридина, стабилизированные диоксаны и (например, золото, серебро, медь, платина и т.д.), нанокластеры, парамагнитные ионы металлов, ферменты (конкретные примеры ферментов см. ниже), колориметрические метки (такие как, например, красители, коллоидное золото и т.п.), биотин, диоксигенин, гаптены и белки, для которых доступны антисыворотки или моноклональные антитела.
Эффекторная функция: При использовании в данном документе термин относится к биохимическому событию, которое возникает в результате взаимодействия Fc-области антитела с Fc-рецептором или лигандом. Эффекторные функции включают, без ограничения указанным, антителозависимую клеточно-опосредованную цитотоксичность (ADCC), связанный с антителом фагоцитоз, опосредованный клетками (ADCP), и цитотоксичность, опосредованную комплементом (CMC). В некоторых воплощениях эффекторная функция представляет собой функцию, которая действует после связывания антигена, которая действует независимо от связывания антигена или и тем, и другим способом.
Эффекторная клетка: При использовании в данном документе термин относится к клетке иммунной системы, которая опосредует одну или несколько эффекторных функций. В некоторых воплощениях эффекторные клетки могут включать, без ограничения указанным, один или несколько моноцитов, макрофаги, нейтрофилы, дендритные клетки, эозинофилы, тучные клетки, тромбоциты, крупные гранулированные лимфоциты, клетки Лангерганса, клетки-естественные киллеры (NK), Т-лимфоциты, В-лимфоциты и могут быть из любого организма, включая, без ограничения указанным, людей, мышей, крыс, кроликов и обезьян.
Сконструированный: при использовании в данном документе, в целом относится к аспекту манипулирования рукой человека. Например, в некоторых воплощениях полинуклеотид может считаться «сконструированным», когда две или несколько последовательностей, которые не связаны друг с другом в этом порядке в природе, подвергаются манипуляциям руками человека так, чтобы быть напрямую связанными друг с другом в сконструированном полинуклеотиде. В некоторых конкретных таких воплощениях сконструированный полинуклеотид может содержать регуляторную последовательность, которая находится в природе в функциональной связи с первой кодирующей последовательностью, но не в функциональной связи со второй кодирующей последовательностью, которая связана руками человека, так что она функционально связана со второй кодирующей последовательностью. Альтернативно или дополнительно, в некоторых воплощениях первая и вторая нуклеотидные последовательности, каждая из которых кодирует полипептидные элементы или домены, которые в природе не связаны друг с другом, могут быть связаны друг с другом в одном сконструированном полинуклеотиде. Аналогично, в некоторых воплощениях клетка или организм могут считаться «сконструированными», если они были обработаны так, что их генетическая информация была изменена (например, был введен новый генетический материал, который ранее не был представлен, или ранее представленный генетический материал был изменен или удален). Согласно общепринятой практике и согласно пониманию специалистами в данной области, потомство сконструированного полинуклеотида или клетки обычно по-прежнему называют «сконструированным», даже если фактическая манипуляция выполнялась на предыдущем объекте. Кроме того, как понятно специалистам в данной области техники, доступны различные методологии, посредством которых может быть достигнуто «конструирование», описанное в данном документе. Например, в некоторых воплощениях «конструирование» может включать отбор или дизайн (например, последовательностей нуклеиновых кислот, полипептидных последовательностей, клеток, тканей и/или организмов) с использованием компьютерных систем, запрограммированных для проведения анализа или сравнения, или иным словами для анализирования, рекомендации и/или отбора последовательностей, изменений и т.д.). Альтернативно или дополнительно, в некоторых воплощениях «сконструированное» может включать применение методологий химического синтеза in vitro и/или технологий рекомбинантных нуклеиновых кислот, таких как, например, амплификация нуклеиновой кислоты (например, посредством полимеразной цепной реакции), мутация, трансформация, трансфекция и т.д. и/или любой из множества методик контролируемого спаривания. Как понятно специалистам в данной области, множество известных способов (например, для рекомбинантной ДНК, синтеза олигонуклеотидов, и культура тканей и трансформация (например, электропорация, липофекция и т.д.)) хорошо известны в данной области и описанных в различных общих и более конкретных источниках, которые цитируются и/или обсуждаются в настоящем описании. См., например, Sambrook et al., Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989).
Эпитоп: При использовании в данном документе термин включает любой фрагмент, который специфически распознается компонентом, связывающим иммуноглобулин (например, антитело или рецептор). В некоторых воплощениях эпитоп состоит из множества химических атомов или групп на антигене. В некоторых воплощениях такие химические атомы или группы экспонированы на поверхности, когда антиген принимает соответствующую трехмерную конформацию. В некоторых воплощениях такие химические атомы или группы физически близки друг к другу в пространстве, когда антиген принимает такую конформацию. В некоторых воплощениях, по меньшей мере, некоторые такие химические атомы являются группами, физически отделенными друг от друга, когда антиген принимает альтернативную конформацию (например, линеаризуется).
Эксципиент: При использовании в данном документе термин относится к нетерапевтическому агенту, который может быть включен в фармацевтическую композицию, например, чтобы обеспечить или способствовать желаемой консистенции или стабилизирующему эффекту. Подходящие фармацевтические эксципиенты включают, например, крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, вода, этанол и тому подобное.
Fc-лиганд. При использовании в данном документе термин относится к молекуле, предпочтительно полипептиду, из любого организма, который связывается с Fc-областью антитела с образованием комплекса Fc-лиганда. Fc-лиганды включают, без ограничения указанным, FcγRIIA (CD32A), FcγRIIB (CD32B), FcγRIIIA (CD16A), FcγRIIIB (CD16B), FcγRI (CD64), FcεRII (CD23), FcRn, Clq, C3, стафилококковый белок A, стрептококковый белок G и вирусные FcγR. Fc-лиганды могут включать еще не открытые молекулы, которые связываются с Fc.
Каркас или каркасная область: при использовании в данном документе, относится к последовательностям вариабельной области за вычетом CDR. Поскольку последовательность CDR может быть определена различными системами, аналогично каркасная последовательность подчиняется соответствующим образом различным интерпретациям. Шесть CDR разделяют каркасные области на тяжелую и легкую цепи в четырех субобластях (FR1, FR2, FR3 и FR4) на каждой цепи, в которой CDR1 находится между FR1 и FR2, CDR2 между FR2 и FR3 и CDR3 между FR3 и FR4. Без указания конкретных субобластей, таких как FR1, FR2, FR3 или FR4 каркасная область, как упоминается другими, представляет объединенные FR в пределах вариабельной области одной естественной цепи иммуноглобулина. При использовании в данном документе, FR представляет собой одну из четырех субобластей, например FR1, представляет собой первую область каркаса, наиболее близкую к аминоконцу вариабельной области, и 5' относительно CDR1, а FR представляют собой две или несколько субобластей, составляющих каркасную область.
Клетка-хозяин: При использовании в данном документе термин относится к клетке, в которую была введена экзогенная ДНК (рекомбинантная или иная). Специалисты при чтении этого раскрытия поймут, что такие термины относятся не только к конкретной испытуемой клетке, но также к потомству такой клетки. Поскольку определенные изменения могут произойти в последующих поколениях из-за мутаций или воздействий окружающей среды, такое потомство не может, по сути, быть идентичным исходной клетке, но все еще включено в объем термина «клетка-хозяин», используемого в данном документе. В некоторых воплощениях клетки-хозяева включают прокариотические и эукариотические клетки, выбранные из любого из царств, которые пригодны для экспрессии экзогенной ДНК (например, рекомбинантной последовательности нуклеиновой кислоты). Типичные клетки включают клетки прокариот и эукариот (одноклеточные или многоклеточные), бактериальные клетки (например, штаммы E.coli, Bacillus spp., Streptomyces spp. и т.д.), клетки микобактерий, грибные клетки, дрожжевые клетки (например, S. cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, инфицированные бакуловирусом клетки насекомых, Trichoplusia ni и т.д.), клетки животных, отличные от человека, клетки человека или химерные клетки, такие как, например, гибридомы или квадромы. В некоторых воплощениях клетка-хозяин представляет собой клетку человека, примата, высшего примата, хомяка, крысы или мыши. В некоторых воплощениях клетка-хозяин является эукариотической и выбрана из следующих клеток: CHO (например, CHO Kl, DXB-1 1 CHO, Veggie-CHO), COS (например, COS-7), клетка сетчатки, Vero, CV1, почки (например, HEK293, 293 EBNA, MSR 293, MDCK, HaK, BHK), HeLa, HepG2, WI38, MRC 5, Colo205, HB 8065, HL-60 (например, BHK21), Jurkat, Daudi, A431 (эпидермальный), CV-1, U937, 3T3, L-клетки, клетки C127, SP2/0, NS-0, MMT 060562, клетки Sertoli, клетки BRL 3, клетки HT1080, клетки миеломы, опухолевой клетки и клеточной линии, полученной из вышеупомянутой клетки. В некоторых воплощениях клетка-хозяин включает один или несколько вирусных генов, например клетка сетчатки, которая экспрессирует вирусный ген (например, клетку PER.C6 ™).
Антитело человека: При использовании в данном документе термин предназначен для включения антител, имеющих вариабельные и константные области, генерируемые (или собранные) из последовательностей иммуноглобулина человека. В некоторых воплощениях антитела (или компоненты антитела) можно считать «человеческими», даже если их аминокислотные последовательности включают остатки или элементы, не кодируемые последовательностями иммуноглобулина человека зародышевой линии (например, включают вариации последовательности, например, которые могут (первоначально) были введены случайным или сайт-специфическим мутагенезом in vitro или соматической мутацией in vivo), например, в одну или более CDR и, в частности, CDR3.
Гуманизированный: Как известно в данной области, термин «гуманизированный» обычно используется для обозначения антител (или компонентов антител), аминокислотная последовательность которых включает последовательности области VH и VL из эталонного антитела, выращенного в не являющихся человеком видах (например, в мыши), но также включает модификации в этих последовательностях относительно эталонного антитела, предназначенного для того, чтобы сделать их более «похожими на человеческие», то есть более похожими на вариабельные последовательности зародышевой линии человека. В некоторых воплощениях «гуманизированное» антитело (или компонент антитела) представляет собой антитело, которое иммуноспецифически связывается с представляющим интерес антигеном и которое имеет каркасную (FR) область, имеющую по существу аминокислотную последовательность, такую как аминокислотная последовательность человеческого антитела, и область, определяющую комплементарность (CDR), имеющую по существу аминокислотную последовательность, такую как у антитела, не являющегося человеческим. Гуманизированное антитело включает по существу все, по меньшей мере, одно и, как правило, два вариабельных домена (Fab, Fab ', F(ab')2, FabC, Fv), в которых все или практически все области CDR соответствуют областям иммуноглобулина, не происходящего из человека (т.е. донорного иммуноглобулина), и все или практически все каркасные области представляют собой консенсусную последовательность иммуноглобулина человека. В некоторых воплощениях гуманизированное антитело также содержит, по меньшей мере, часть константной области иммуноглобулина (Fc), как правило, константной области иммуноглобулина человека. В некоторых воплощениях гуманизированное антитело включает как легкую цепь, так и, по меньшей мере, вариабельный домен тяжелой цепи. Антитело также может включать CH1, шарнир, СН2, CH3 и, необязательно, область CH4 константной области тяжелой цепи. В некоторых воплощениях гуманизированное антитело включает только гуманизированную область VL. В некоторых воплощениях гуманизированное антитело включает только гуманизированную область VH. В некоторых конкретных воплощениях гуманизированное антитело включает гуманизированные области VH и VL.
Гидрофильный. При использовании в данном документе термин «гидрофильный» и/или «полярный» относится к тенденции смешиваться или легко растворяться в воде.
Гидрофобный: При использовании в данном документе термин «гидрофобный» и/или «неполярный» относится к тенденции отталкивать, не сочетаться с, или к неспособности легко растворяться в воде.
Улучшить, увеличить или уменьшить: при использовании их в данном документе, или их грамматических эквивалентов, указывают значения, которые относятся к измерению исходного уровня, например измерению в одном и том же индивидууме до начала лечения, описанной в данном документе, или измерению у контрольного индивидуума (или нескольких контрольных индивидуумов) в отсутствие описанного в данном документе лечения. «Контрольный индивидуум» - это индивидуум, страдающий той же формой заболевания или травмы, что и индивидуум, которого подвергают лечению.
In vitro: При использовании в данном документе термин относится к событиям, которые происходят в искусственной среде, например, в пробирке или реакционном сосуде, в культуре клеток и т.д., а не в многоклеточном организме.
In vivo: При использовании в данном документе термин относится к событиям, которые происходят в многоклеточном организме, таком как человек и животное, не являющееся человеком. В контексте клеточных систем этот термин может использоваться для обозначения событий, происходящих в живой клетке (в отличие от, например, систем in vitro).
Выделенный: При использовании в данном документе термин относится к веществу и/или сущности, которая были (1) отделены от, по меньшей мере, некоторых компонентов, с которыми они были связаны при первоначальном продуцировании (вне зависимости, в природе и/или в экспериментальной установке), и/или (2) с которыми они были сконструированы, продуцированы, получены и/или изготовлены руками человека. Выделенные вещества и/или сущности могут быть отделены от около 10%, около 20%, около 30%, около 40%, около 50%, около 60%, около 70%, около 80%, около 90%, около 91% около 92%, около 93%, около 94%, около 95%, около 96%, около 97%, около 98%, около 99% или более 99% других компонентов, с которыми они первоначально были связаны. В некоторых воплощениях выделенные агенты имеют около 80%, около 85%, около 90%, около 91%, около 92%, около 93%, около 94%, около 95%, около 96%, около 97%, около 98%, около 99% или более 99% чистоты. При использовании в данном документе, вещество является «чистым», если оно практически не включает других компонентов. В некоторых воплощениях, как будет понятно специалистам в данной области, вещество может по-прежнему считаться «выделенным» или даже «чистым» после того, как оно было объединено с некоторыми другими компонентами, такими как, например, один или несколько носителей или эксципиентов (например, буфер, растворитель, вода и т.д.); в таких воплощениях процент выделения или чистоты вещества рассчитывают без включения таких носителей или эксципиентов. Чтобы дать только один пример, в некоторых воплощениях биологический полимер, такой как полипептид или полинуклеотид, который встречается в природе, считается «выделенным», когда: а) в силу его происхождения или источника происхождения не связан с некоторыми или всеми компонентов, которые сопровождают его в природном состоянии по своей природе; b) он практически не включает других полипептидов или нуклеиновых кислот того же вида из видов, которые продуцируют его в природе; c) экспрессируется или иным образом ассоциируется с компонентами из клетки или другой экспрессирующей системы, которая не относится к виду, который продуцирует их в природе. Так, например, в некоторых воплощениях полипептид, который химически синтезируется или синтезируется в клеточной системе, отличной от той, которая продуцирует его в природе, считается «выделенным» полипептидом. Альтернативно или дополнительно в некоторых воплощениях полипептид, который был подвергнут одному или нескольким методам очистки, можно рассматривать как «выделенный» полипептид в той мере, в какой он был отделен от других компонентов а), с которыми он связан в природе; и/или b), с которыми он был связан при первоначальном продуцировании.
KD: При использовании в данном документе термин относится к константе диссоциации связывающего агента (например, антительного агента или его связывающего компонента) из комплекса с его партнером (например, эпитопом, с которым связывается антительный агент или его связывающий компонент).
koff: При использовании в данном документе термин относится к константе скорости диссоциации связующего агента (например, антительного агента или его связывающего компонента) из комплекса с его партнером (например, эпитопом, с которым связывается антительный агент или его связывающий компонент).
kon: При использовании в данном документе термин относится к константе скорости ассоциации связывающего агента (например, антительного агента или его связывающего компонента) со своим партнером (например, эпитопом, с которым связывается антительный агент или его связывающий компонент).
Линкер: При использовании в данном документе термин используется для обозначения той части многоэлементного полипептида, который соединяет разные элементы друг с другом. Например, специалисты в данной области техники считают, что полипептид, структура которого включает два или более функциональных или организационных домена, часто включает участок аминокислот между такими доменами, который связывает их друг с другом. В некоторых воплощениях полипептид, содержащий линкерный элемент, имеет общую структуру общей формы S1-L-S2, где S1 и S2 могут быть одинаковыми или различными и представлять собой два домена, связанных друг с другом линкером. В некоторых воплощениях линкер представляет собой, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более аминокислот. В некоторых воплощениях линкер отличается тем, что он не принимает жесткую трехмерную структуру, а скорее обеспечивает гибкость для полипептида. Множество различных линкерных элементов, которые могут быть надлежащим образом использованы при разработке полипептидов (например, химерных полипептидов), известно в данной области (см., например, Holliger, P., et al., 1993, Proc. Natl.Acad. Sci. U.S.A. 90:6444-6448; Poljak, R. J. et al., 1994, Structure 2:1121-1123).
Мультивалентный связывающий агент (или мультиспецифичный связывающий агент): При использовании в данном документе термин относится к связывающему агенту, способному связываться с двумя или более антигенами, которые могут находиться на одной и той же молекуле или на разных молекулах. Мультивалентные связывающие агенты, описанные в данном документе, в некоторых воплощениях сконструированы так, чтобы иметь два или более антигенсвязывающих сайта и обычно не являются белками, встречающимися в природе. Мультивалентные связывающие агенты, описанные в данном документе, относятся к связывающим агентам, способным связывать две или более родственных или неродственных мишени. Мультивалентные связывающие агенты могут состоять из нескольких копий одного компонента антитела или нескольких копий различных компонентов антитела. Такие связывающие агенты способны связываться с двумя или более антигенами и являются тетравалентными или мультивалентными связывающими агентами. Мультивалентные связывающие агенты могут дополнительно содержать терапевтический агент, такой как, например, иммуномодулятор, токсин или РНКаза. Мультивалентные связывающие агенты, как описано в данном документе, в некоторых воплощениях способны одновременно связываться, по меньшей мере, с двумя мишенями, которые имеют разную структуру, например, два разных антигена, два разных эпитопа на одном и том же антигене или гаптен и/или антиген или эпитоп. Во многих воплощениях многовалентные связывающие агенты настоящего изобретения представляют собой белки, сконструированные с характеристиками поливалентных связывающих агентов, описанных в данном документе. Мультивалентные связывающие агенты настоящего изобретения могут быть моноспецифичными (способными связывать один антиген) или мультиспецифичными (способными связывать два или более антигена) и могут состоять из двух полипептидов тяжелой цепи и двух полипептидов легкой цепи. Каждый сайт связывания в некоторых воплощениях состоит из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи всего с шестью CDR, участвующих в связывании антигена, на антигенсвязывающий сайт.
Нуклеиновая кислота. При использовании в данном документе в самом широком смысле относится к любому соединению и/или веществу, которое является или может быть включено в олигонуклеотидную цепь. В некоторых воплощениях нуклеиновая кислота представляет собой соединение и/или вещество, которое является или может быть включено в олигонуклеотидную цепь посредством фосфодиэфирной связи. Как будет понятно из контекста, в некоторых воплощениях «нуклеиновая кислота» относится к отдельным остаткам нуклеиновой кислоты (например, нуклеотидам и/или нуклеозидам); в некоторых воплощениях «нуклеиновая кислота» относится к олигонуклеотидной цепи, содержащей отдельные остатки нуклеиновой кислоты. В некоторых воплощениях «нуклеиновая кислота» представляет собой или включает РНК; в некоторых воплощениях «нуклеиновая кислота» представляет собой или включает ДНК. В некоторых воплощениях нуклеиновая кислота является, включает или состоит из одного или нескольких природных остатков нуклеиновой кислоты. В некоторых воплощениях нуклеиновая кислота является, включает или состоит из одного или нескольких аналогов нуклеиновой кислоты. В некоторых воплощениях аналог нуклеиновой кислоты отличается от нуклеиновой кислоты тем, что она не использует фосфодиэфирный каркас. Например, в некоторых воплощениях нуклеиновая кислота представляет собой или состоит из одной или нескольких «пептидных нуклеиновых кислот», которые известны в данной области и имеют пептидные связи вместо фосфодиэфирных связей в каркасе, рассматриваются в рамках настоящего изобретения. Альтернативно или дополнительно, в некоторых воплощениях нуклеиновая кислота имеет одну или несколько фосфоротиоатных и/или 5'-N-фосфорамидитных связей, а не фосфодиэфирные связи. В некоторых воплощениях нуклеиновая кислота представляет собой или состоит из одного или нескольких природных нуклеозидов (например, аденозина, тимидина, гуанозина, цитидина, уридина, дезоксиаденозина, дезокситимидина, дезоксигуанозина и дезоксицитидина). В некоторых воплощениях нуклеиновая кислота состоит из одного или нескольких нуклеозидных аналогов (примером которых являются 2-аминоаденозин, 2-тиотимидин, инозин, пирролопиримидин, 3-метиладенозин, 5-метилцитидин, C-5-пропинил-цитидин, C-5-пропинил-уридин, 2-аминоаденозин, C5-бромуридин, C5-фторуридин, C5-йодуридин, C5-пропинил-уридин, C5-пропинил-цитидин, C5-метилцитидин, 2-аминоаденозин, 7-деазааденозин, 7 -дезазагуанозин, 8-оксоаденозин, 8-оксогуанозин, 0(6)-метилгуанин, 2-тиоцитидин, метилированные основания, интеркалированные основания и их комбинации). В некоторых воплощениях нуклеиновая кислота включает один или несколько модифицированных сахаров (например, 2'-фторрибозу, рибозу, 2'-дезоксирибозу, арабинозу и гексозу) по сравнению с теми, которые содержатся в природных нуклеиновых кислотах. В некоторых воплощениях нуклеиновая кислота имеет нуклеотидную последовательность, которая кодирует продукт функционального гена, такой как РНК или белок. В некоторых воплощениях нуклеиновая кислота включает один или несколько интронов. В некоторых воплощениях нуклеиновые кислоты получают одним или несколькими выделениями из природного источника, ферментативным синтезом путем полимеризации на основе комплементарной матрицы (in vivo или in vitro), репродуцированием в рекомбинантной клетке или системе, и химическим синтезом. В некоторых воплощениях нуклеиновая кислота имеет, по меньшей мере, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 1 10, 120, 130, 140, 150, 160, 170, 180, 190, 20, 225, 250, 275, 300, 325, 350, 450, 475, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000 или более остатков в длину. В некоторых воплощениях нуклеиновая кислота является одноцепочечной; в некоторых воплощениях нуклеиновая кислота является двухцепочечной. В некоторых воплощениях нуклеиновая кислота имеет нуклеотидную последовательность, содержащую, по меньшей мере, один элемент, который кодирует или является комплементарным последовательности, которая кодирует полипептид. В некоторых воплощениях нуклеиновая кислота обладает ферментативной активностью.
Функционально связанный: при использовании в данном документе, относится к сопоставлению, при котором описанные компоненты находятся в отношениях, позволяющих им функционировать предназначенным образом. Контролирующая последовательность, «функционально связанная» с кодирующей последовательностью, лигируется таким образом, чтобы экспрессия кодирующей последовательности достигалась в условиях, совместимых с контрольными последовательностями. «Функционально связанные» последовательности включают как последовательности управления экспрессией, которые смежны с представляющим интерес геном, так и последовательности управления экспрессией, которые действуют в транс или на расстоянии, чтобы контролировать указанный ген, представляющий интерес. При использовании в данном документе термин «последовательность управления экспрессией» относится к полинуклеотидным последовательностям, которые необходимы для осуществления экспрессии и обработки кодирующих последовательностей, с которыми они лигируются. Контрольные последовательности экспрессии включают соответствующие последовательности инициации транскрипции, терминации, промотора и энхансера; эффективные сигналы обработки РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые повышают эффективность трансляции (то есть консенсусная последовательность Козак); последовательности, которые повышают стабильность белка; и, при желании, последовательности, которые усиливают секрецию белка. Характер таких контрольных последовательностей отличается в зависимости от организма-хозяина. Например, в прокариотах такие контрольные последовательности обычно включают промотор, сайт рибосомного связывания и последовательность терминации транскрипции, тогда как в эукариотах обычно такие контрольные последовательности включают промоторы и последовательность терминации транскрипции. Термин «контрольные последовательности» предназначен для включения компонентов, присутствие которых является существенным для экспрессии и обработки, а также может включать дополнительные компоненты, присутствие которых выгодно, например, лидерные последовательности и последовательности партнеров слияния.
Пептид. Термин «пептид» относится к двум или нескольким аминокислотам, соединенным друг с другом пептидными связями или модифицированными пептидными связями. В конкретных воплощениях «пептид» относится к полипептиду, имеющему длину менее чем около 100 аминокислот, менее чем около 50 аминокислот, менее чем около 20 аминокислот или менее чем около 10 аминокислот.
Физиологические условия: При использовании в данном документе термин имеет понятное в данной области значение, ссылающееся на условия, при которых клетки или организмы живут и/или воспроизводятся. В некоторых воплощениях термин относится к условиям внешней или внутренней среды, которые могут иметь место в природе для организма или клеточной системы. В некоторых воплощениях физиологическими условиями являются те условия, которые присутствуют в организме человека или животного, не являющегося человеком, особенно тех условий, которые присутствуют на и/или в хирургическом участке. Физиологические условия обычно включают, например, температурный диапазон 20-40°С, атмосферное давление 1, рН 6-8, концентрацию глюкозы 1-20 мМ, концентрацию кислорода при атмосферных уровнях и гравитацию, какой она встречается на Земле. В некоторых воплощениях условия в лаборатории регулируются и/или поддерживаются в физиологических условиях. В некоторых воплощениях физиологические условия встречаются в организме.
Полипептид. При использовании в данном документе термин относится к любой полимерной цепи аминокислот. В некоторых воплощениях полипептид имеет аминокислотную последовательность, которая встречается в природе. В некоторых воплощениях полипептид имеет аминокислотную последовательность, которая не встречается в природе. В некоторых воплощениях полипептид имеет аминокислотную последовательность, которая сконструирована таким образом, что она спроектирована и/или продуцируется действием рук человека. В некоторых воплощениях полипептид может содержать или состоять из природных аминокислот, неприродных аминокислот или того и другого. В некоторых воплощениях полипептид может содержать или состоять только из природных аминокислот или только из неприродных аминокислот. В некоторых воплощениях полипептид может включать D-аминокислоты, L-аминокислоты или и то, и другое. В некоторых воплощениях полипептид может содержать только D-аминокислоты. В некоторых воплощениях полипептид может содержать только L-аминокислоты. В некоторых воплощениях полипептид может включать одну или несколько подвесных групп или другие модификации, например модификацию или присоединение к одной или нескольким боковым цепям аминокислот, на N-конце полипептида, на С-конце полипептида или в любой их комбинации. В некоторых воплощениях такие подвесные группы или модификации могут быть выбраны из группы, состоящей из ацетилирования, амидирования, липидации, метилирования, пегилирования и т.д., включая их комбинации. В некоторых воплощениях полипептид может быть циклическим и/или может содержать циклическую часть. В некоторых воплощениях полипептид не является циклическим и/или не включает какой-либо циклической части. В некоторых воплощениях полипептид является линейным. В некоторых воплощениях полипептид может быть или содержать сшитый полипептид. В некоторых воплощениях термин «полипептид» может быть присоединен к названию эталонного полипептида, активности или структуры; в таких случаях он используется в данном документе для обозначения полипептидов, которые разделяют соответствующую активность или структуру и, таким образом, могут считаться представителями одного и того же класса или семейства полипептидов. Для каждого такого класса в настоящем описании предлагаются и/или специалисты в данной области будут знать примерные полипептиды в пределах класса, чьи аминокислотные последовательности и/или функции известны; в некоторых воплощениях такие примерные полипептиды являются эталонными полипептидами для класса полипептида. В некоторых воплощениях представитель класса или семейства полипептидов демонстрирует значительную гомологию последовательности или идентичность с, разделяет общий мотив последовательности (например, характерный элемент последовательности) с, и/или разделяет общую активность (в некоторых воплощениях на сопоставимом уровне или в пределах заданного диапазона) с эталонным полипептидом класса; в некоторых воплощениях со всеми полипептидами внутри класса). Например, в некоторых воплощениях полипептид-представитель показывает общую степень гомологии или идентичности последовательности с эталонным полипептидом, которая составляет, по меньшей мере, от 30 до 40%, и часто превышает около 50%, 60%, 70%, 80%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и более и/или включает, по меньшей мере, одну область (т.е. консервативную область, которая может в некоторых воплощениях быть или включать характерный элемент последовательности), которая показывает очень высокую идентичность последовательности, часто превышающую 90% или даже 95%, 96%, 97%, 98% или 99%. Такая консервативная область обычно охватывает, по меньшей мере, от трех до четырех и часто до 20 или более аминокислот; в некоторых воплощениях консервативная область охватывает, по меньшей мере, один участок, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более смежных аминокислот. В некоторых воплощениях полезный полипептид может содержать или состоять из фрагмента исходного полипептида. В некоторых воплощениях полезный полипептид, который может содержать или состоять из множества фрагментов, каждый из которых находится в одном и том же исходном полипептиде в другом пространственном расположении относительно друг друга, чем в интересующем полипептиде (например, фрагменты, которые непосредственно связаны в исходном пептиде, могут быть пространственно разделены в интересующем полипептиде или наоборот, и/или фрагменты могут присутствовать в другом порядке в интересующем полипептиде, чем в исходном), так что представляющий интерес полипептид представляет собой производное его исходного полипептида.
Предотвратить или предотвращение: При использовании в данном документе в связи с возникновением заболевания, расстройства и/или состояния относится к уменьшению риска развития заболевания, расстройства и/или состояния и/или к задержке начала одной или нескольких характеристик или симптомов заболевания, расстройства или состояния. Профилактика может считаться полной, когда наступление болезни, расстройства или состояния было отложено на предопределенный период времени.
Рекомбинант: при использовании в данном документе, предназначен для обозначения полипептидов (например, антител или компонентов антитела или мультиспецифичных связывающих агентов, как описано в данном документе), которые сконструированы, спроектированы, получены, экспрессированы, созданы или выделены рекомбинантными средствами, например, как полипептиды экспрессируемые с использованием рекомбинантного экспрессирующего вектора, трансфицированного в клетку-хозяина, полипептиды, выделенные из рекомбинантной комбинаторной библиотеки полипептидов человека (Hoogenboom HR, 1997, TIB Tech. 15: 62-70; Azzazy H. and Highsmith WE, 2002, Clin. Biochem. 35:425-45; Gavilondo J.V., and Larrick J.W., 2002, BioTechniques 29:128-45; Hoogenboom H., and Chames P., 2000, Immunol. Today 21:371-8), антитела, выделенные из животного (например, мыши), которое является трансгенным для генов человеческого иммуноглобулина (см., например, Taylor, LD, et al., 1992, Nucl. Acids Res. 20:6287-95; Kellermann S-A., and Green L.L., 2002, Curr. Opin. Biotech. 13:593-7; Little, M. et al., 2000, Immunol. Today 21:364-70; Murphy, A.J. et al., 2014, Proc. Natl. Acad. Sci. USA 111 (14): 5153-8) или полипептиды, полученные, экспрессированные, созданные или выделенные любым другим способом, который включает сплайсинг отобранных элементов последовательности друг с другом. В некоторых воплощениях один или несколько таких отобранных элементов последовательности встречаются в природе. В некоторых воплощениях один или несколько таких отобранных элементов последовательности спроектированы in silico. В некоторых воплощениях один или несколько таких отобранных элементов последовательности являются результатом мутагенеза (например, in vivo или in vitro) известного элемента последовательности, например, из природного или синтетического источника. Например, в некоторых воплощениях полипептид рекомбинантного антитела состоит из последовательностей, обнаруженных в зародышевой линии интересующего организма-источника (например, человека, мыши и т.д.). В некоторых воплощениях рекомбинантное антитело имеет аминокислотную последовательность, которая является результатом мутагенеза (например, in vitro или in vivo, например, у трансгенного животного), так что аминокислотные последовательности областей VH и VL рекомбинантного антитела представляют собой последовательности, которые, будучи источником и связанными с последовательностями VH и VL зародышевой линии, могут не существовать естественным образом в репертуаре антител зародышевой линии in vivo.
Эталон: При использовании в данном документе, описывается стандарт, контроль или другой соответствующий эталон, относительно которого делается сравнение, как описано в данном документе. Например, в некоторых воплощениях эталон ка является стандартным или контрольным агентом, животным, индивидуумом, популяцией, образцом, последовательностью, рядом стадий, множеством условий или значением, относительно которых сравниваются представляющие интерес агент, животное, индивидуум, популяция, образец, последовательность, серия стадий, набор условий или значение. В некоторых воплощениях эталон тестируется и/или определяется, по существу, одновременно с тестированием или определением интереса. В некоторых воплощениях эталон является историческим эталоном, необязательно воплощенным в материальной среде. Как правило, как должно быть понятно специалистам в данной области, эталон определяется или характеризуется в условиях, сопоставимых с условиями, используемыми в оценке, представляющей интерес.
Специфическое связывание. При использовании в данном документе термин относится к способности связующего агента различать возможных партнеров в среде, в которой должно происходить связывание. Считается, что связывающий агент, который взаимодействует с одной конкретной мишенью, в присутствии других потенциальных мишеней, «специфически связывается» с мишенью, с которой он взаимодействует. В некоторых воплощениях специфическое связывание оценивают путем обнаружения или определения степени ассоциации между связывающим агентом и его партнером; в некоторых воплощениях специфическое связывание оценивают путем обнаружения или определения степени диссоциации комплекса связывающего агента-партнера; в некоторых воплощениях специфическое связывание оценивается путем обнаружения или определения способности связующего агента конкурировать с альтернативным взаимодействием между его партнером и другим объектом. В некоторых воплощениях специфическое связывание оценивают путем проведения таких обнаружений или определений в диапазоне концентраций. В некоторых воплощениях специфическое связывание оценивают, определяя разницу в аффинности связывания между когнатными и некогнатными мишенями. Например, связующий агент может иметь аффинность связывания к когнатной мишени, которое составляет около 3, 4, 5, 6, 7, 8, 9, 10 или более чем аффинность связывания с некогнатной мишенью.
Специфичность. Как известно в данной области техники, «специфичность» является мерой способности конкретного лиганда отличать его связывающего партнера от других потенциальных партнеров по связыванию.
Объект: При использовании в данном документе термин означает любое млекопитающее, включая человека. В некоторых воплощениях настоящего изобретения объектом является взрослый, подросток или младенец. В некоторых воплощениях термины «индивидуум» или «пациент» используются и предназначены для взаимозаменяемости с «объектом». Также согласно настоящему изобретению предлагается введение фармацевтических композиций и/или эффективность способов лечения в утробе.
По существу: при использовании в данном документе, термин «по существу» относится к качественному состоянию экспонирования общей или почти полной меры или степени характеристики или свойства, представляющего интерес. Любой из обычных специалистов в области биологии поймет, что биологические и химические явления редко, если вообще когда-либо, идут к завершению и/или приступают к завершенности или достигают или избегают абсолютного результата. Поэтому термин «по существу» используется в данном документе для определения потенциального недостатка завершенности, присущей многим биологическим и химическим явлениям.
Существенная гомология последовательности. При использовании в данном документе термин «существенная гомология» относится к сравнению между аминокислотными или нуклеотидными последовательностями. Как будет понятно специалистам в данной области техники, две последовательности обычно считаются «по существу гомологичными», если они содержат гомологичные остатки в соответствующих положениях. Гомологичные остатки могут быть одинаковыми остатками. В ином случае, гомологичные остатки могут быть неидентичными остатками, и будут иметь сходные структурные и/или функциональные характеристики. Например, как хорошо известно специалистам в данной области, некоторые аминокислоты обычно классифицируются как «гидрофобные» или «гидрофильные» аминокислоты и/или имеющие «полярные» или «неполярные» боковые цепи. Замена одной аминокислоты на другую такого же типа часто можно рассматривать как «гомологичную» замену. Типичные классификации аминокислот формулируются следующим образом:
Как хорошо известно в данной области, аминокислотные или нуклеотидные последовательности можно сравнить с использованием любого из множества алгоритмов, в том числе доступных в коммерческих компьютерных программах, таких как BLASTN для нуклеотидных последовательностей и BLASTP, gapped BLAST и PSI-BLAST для аминокислотных последовательностей. Пример таких программ описан в Altschul et al., 1990, J. Mol. Biol., 215(3):403-410; Altschul et al., 1996, Meth. Enzymology 266:460-480; Altschul et al., 1997, Nucleic Acids Res. 25:3389-3402; Baxevanis et al, Bioinformatics: A Practical Guide to the Analysis of Genes and Proteins, Wiley, 1998; and Misener, et al, (eds.), Bioinformatics Methods and Protocols (Methods in Molecular Biology, Vol. 132), Humana Press, 1999. В дополнение к идентификации гомологичных последовательностей упомянутые выше программы обычно указывают на степень гомологии. В некоторых воплощениях две последовательности считаются по существу гомологичными, если, по меньшей мере, 50%, по меньшей мере, 55%, по меньшей мере, 60%, по меньшей мере, 65%, по меньшей мере, 70%, по меньшей мере, 75%, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 91%, по меньшей мере, 92%, по меньшей мере, 93%, по меньшей мере, 94%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или более их соответствующих остатков являются гомологичными по сравнению с соответствующим количеством остатков. В некоторых воплощениях релевантный фрагмент представляет собой полную последовательность. В некоторых воплощениях релевантный фрагмент составляет, по меньшей мере, 10, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 25, по меньшей мере, 30, по меньшей мере, 35, по меньшей мере, 40, по меньшей мере, 45, по меньшей мере, 50, по меньшей мере, 55, по меньшей мере, 60, по меньшей мере, 65, по меньшей мере, 70, по меньшей мере, 75, по меньшей мере, 80, по меньшей мере, 85, по меньшей мере, 90, по меньшей мере, 95, по меньшей мере, 100, по меньшей мере, 125, по меньшей мере, 150, по меньшей мере, 175, по меньшей мере, 200, по меньшей мере, 225, по меньшей мере, 250, по меньшей мере, 275, по меньшей мере, 300, по меньшей мере, 325, по меньшей мере, 350, по меньшей мере, 375, по меньшей мере, 400, по меньшей мере, 425, по меньшей мере, 450, по меньшей мере, 475, по меньшей мере, 500 или более остатков.
Существенная идентичность. При использовании в данном документе термин «существенная идентичность» относится к сравнению между аминокислотными или нуклеотидными последовательностями. Как будет понятно специалистам в данной области техники, две последовательности обычно считаются «по существу идентичными», если они содержат одинаковые остатки в соответствующих положениях. Как хорошо известно в данной области, аминокислотные или нуклеотидные последовательности можно сравнить с использованием любого из множества алгоритмов, в том числе доступных в коммерческих компьютерных программах, таких как BLASTN для нуклеотидных последовательностей и BLASTP, gapped BLAST и PSI-BLAST для аминокислотных последовательностей. Пример таких программ описан в Altschul, et al, 1990, J. Mol. Biol., 215(3):403-410, 1990; Altschul et al, 1996, Methods in Enzymology 266:460-480; Altschul et al, 1997, Nucleic Acids Res. 25:3389-3402; Baxevanis et al, Bioinformatics: A Practical Guide to the Analysis of Genes and Proteins, Wiley, 1998; and Misener, et al, (eds.), Bioinformatics Methods and Protocols (Methods in Molecular Biology, Vol. 132), Humana Press, 1999. Помимо идентификации идентичных последовательностей, упомянутые выше программы обычно указывают на степень идентичности. В некоторых воплощениях две последовательности считаются по существу идентичными, если, по меньшей мере, 50, 55, 60, 65, 70, 75, 80, 85, 90, 91, 92, 93, 94%, 95%, 96%, 97%, 98%, 99% или более их соответствующих остатков идентичны по сравнению с релевантным фрагментом остатков. В некоторых воплощениях соответствующий фрагмент представляет собой полную последовательность. В некоторых воплощениях релевантный фрагмент составляет, по меньшей мере, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500 или более. В контексте CDR ссылка на «существенную идентичность» обычно относится к CDR, имеющей аминокислотную последовательность, по меньшей мере, 80%, предпочтительно, по меньшей мере, 85%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98% или при не менее 99%, идентичную последовательности эталонной CDR.
Поверхностный плазмонный резонанс. При использовании в данном документе термин относится к оптическому явлению, которое позволяет анализировать специфичные связывающие взаимодействия в реальном времени, например, путем обнаружения изменений концентрации белка в матрице биосенсора, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Уппсала, Швеция и Пискатауэй, Нью-Джерси). Для дополнительных описаний см. В Jonsson, U. et al., 1993, Ann. Biol. Clin. 51:19-26; Jonsson, U. et al., 1991, Biotechniques 11:620-627; Johnsson, B. et al., 1995, J. Mol. Recognit. 8:125-131; and Johnnson, B. et al., 1991, Anal. Biochem. 198:268-277.
Терапевтический агент: При использовании в данном документе, обычно относится к любому агенту, который вызывает искомый фармакологический эффект при введении в организм. В некоторых воплощениях агент считается терапевтическим агентом, если он демонстрирует статистически значимый эффект для соответствующей популяции. В некоторых воплощениях соответствующая популяция может быть популяцией модельных организмов. В некоторых воплощениях соответствующая популяция может определяться различными критериями, такими как определенная возрастная группа, пол, генетический фон, ранее существовавшие клинические условия и т.д. В некоторых воплощениях терапевтический агент представляет собой вещество, которое можно использовать для облегчения, улучшения, ослабления, ингибирования, предотвращения, задержки возникновения, уменьшения тяжести и/или снижения заболеваемости одним или несколькими симптомами или особенностями заболевания, расстройства и/или состояния. В некоторых воплощениях «терапевтический агент» является агентом, который был или должен быть одобрен государственным учреждением, прежде чем он может быть продан для введения людям. В некоторых воплощениях «терапевтический агент» является агентом, для которого требуется медицинское назначение для введения людям.
Терапевтически эффективное количество: При использовании в данном документе, подразумевается количество, которое дает искомый эффект, для которого он вводится. В некоторых воплощениях этот термин относится к количеству, которое является достаточным, когда оно вводится популяции, страдающей или подверженной заболеванию, расстройству и/или состоянию в соответствии с режимом терапевтического дозирования, для лечения заболевания, расстройства и/или состояния. В некоторых воплощениях терапевтически эффективное количество представляет собой то, которое уменьшает заболеваемость и/или тяжесть и/или задерживает начало одного или нескольких симптомов заболевания, расстройства и/или состояния. Специалисты в данной области поймут, что термин «терапевтически эффективное количество» на самом деле не требует успешного лечения у конкретного индивидуума. Скорее, терапевтически эффективным количеством может быть такое количество, которое обеспечивает конкретный искомый фармакологический ответ у значительного числа субъектов при введении пациентам, нуждающимся в таком лечении. В некоторых воплощениях ссылка на терапевтически эффективное количество может быть ссылкой на количество, измеренное в одной или более конкретных тканях (например, ткань, поражаемая заболеванием, расстройством или состоянием) или жидкости (например, кровь, слюна, сыворотка, пот, слезы, моча и т.д.). Специалистам в данной области техники будет понятно, что в некоторых воплощениях терапевтически эффективное количество конкретного агента или терапии может быть составлено и/или введено в разовой дозе. В некоторых воплощениях терапевтически эффективное средство может быть составлено и/или введено во множестве доз, например, как часть режима дозирования.
Трансформация. При использовании в данном документе термин относится к любому способу, посредством которого экзогенная ДНК вводится в клетку-хозяина. Трансформация может происходить в естественных или искусственных условиях с использованием различных способов, хорошо известных в данной области. Трансформация может основываться на любом известном способе введения инородных последовательностей нуклеиновой кислоты в прокариотическую или эукариотическую клетку-хозяина. В некоторых воплощениях конкретная методология преобразования выбирается на основе трансформированной клетки-хозяина и может включать, без ограничения указанным, вирусную инфекцию, электропорацию, спаривание, липофекцию. В некоторых воплощениях «трансформированная» клетка стабильно трансформируется тем, что вставленная ДНК способна к репликации либо как автономно реплицирующаяся плазмида, либо как часть хромосомы хозяина. В некоторых воплощениях трансформированная клетка временно экспрессирует введенную нуклеиновую кислоту в течение ограниченного периода времени.
Лечение: При использовании в данном документе термин «лечение» (также «лечить» или «подвергать лечению») в самом широком смысле относится к любому введению вещества (например, предлагаемых композиций), которое частично или полностью смягчает, улучшает, облегчает, ингибирует, задерживает начало возникновения, уменьшает тяжесть и/или уменьшает распространенность одного или нескольких симптомов, признаков и/или причин конкретного заболевания, расстройства и/или состояния. В некоторых воплощениях такое лечение может вводиться объекту, который не проявляет признаков соответствующего заболевания, расстройства и/или состояния и/или объекта, который проявляет только ранние признаки заболевания, расстройства и/или состояния. Альтернативно или дополнительно, в некоторых воплощениях лечение может быть назначено объекту, который демонстрирует один или несколько установленных признаков соответствующего заболевания, расстройства и/или состояния. В некоторых воплощениях лечение может быть проведено для объекта, который был диагностирован как страдающий от соответствующего заболевания, расстройства и/или состояния. В некоторых воплощениях лечение может быть проведено для объекта, который, как известно, имеет один или несколько факторов восприимчивости, которые статистически коррелируют с повышенным риском развития соответствующего заболевания, расстройства и/или состояния.
Вариант: При использовании в данном документе термин «вариант» относится к объекту, который показывает значительную структурную идентичность с эталонным объектом, но отличается структурно от эталонного объекта по присутствию или уровню одного или нескольких химических фрагментов по сравнению с эталонным объектом. Во многих воплощениях вариант также функционально отличается от его эталонного объекта. В целом, должна ли конкретная сущность рассматриваться должным образом как «вариант» эталонной сущности, основывается на ее степени структурной идентичности с эталонной сущностью. Как будет понятно специалистам в данной области, любая биологическая или химическая эталонная сущность имеет определенные характерные структурные элементы. Вариант, по определению, представляет собой отдельную химическую сущность, которая имеет общие один или несколько таких характерных структурных элементов. В качестве нескольких примеров, полипептид может иметь характерный элемент последовательности, состоящий из множества аминокислот, имеющих обозначенные положения относительно друг друга в линейном или трехмерном пространстве и/или способствующих конкретной биологической функции, нуклеиновая кислота может иметь характерный элемент последовательности, состоящий из множества нуклеотидных остатков, имеющих обозначенные положения относительно другой в линейном или трехмерном пространстве. Например, вариантный полипептид может отличаться от эталонного полипептида в результате одного или нескольких различий в аминокислотной последовательности и/или одного или нескольких различий в химических компонентах (например, углеводах, липидах и т.д.), ковалентно связанных с полипептидной основой. В некоторых воплощениях вариантный полипептид показывает общую идентичность последовательности с эталонным полипептидом, который составляет, по меньшей мере, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% 95%, 96%, 97% или 99%. Альтернативно или дополнительно, в некоторых воплощениях вариантный полипептид не разделяет, по меньшей мере, один характерный элемент последовательности с эталонным полипептидом. В некоторых воплощениях эталонный полипептид имеет одну или несколько биологических активностей. В некоторых воплощениях вариантный полипептид разделяет одну или несколько биологических активностей эталонного полипептида. В некоторых воплощениях вариантный полипептид не имеет одной или нескольких биологических активностей эталонного полипептида. В некоторых воплощениях вариантный полипептид показывает снижение уровня одной или нескольких биологических активностей по сравнению с эталонным полипептидом. Во многих воплощениях представляющий интерес полипептид считается «вариантом» исходного или эталонного полипептида, если представляющий интерес полипептид имеет аминокислотную последовательность, которая идентична последовательности аминокислот исходной последовательности, но с небольшим количеством изменений последовательности в конкретных положениях. Как правило, менее 20%, 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% остатков в варианте заменены по сравнению с исходной последовательностью. В некоторых воплощениях вариант имеет 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 замененный остаток по сравнению с исходной последовательностью. Часто вариант имеет очень небольшое количество (например, менее 5, 4, 3, 2 или 1) замененных функциональных остатков (то есть остатков, которые участвуют в определенной биологической активности). Кроме того, вариант обычно имеет не более 5, 4, 3, 2 или 1 вставки или делеции и часто не имеет вставок или делеций по сравнению с исходной последовательностью. Более того, любые добавления или делеции обычно составляют менее около 25, около 20, около 19, около 18, около 17, около 16, около 15, около 14, около 13, около 10, около 9, около 8, около 7, около 6 и обычно составляют менее около 5, около 4, около 3 или около 2 остатков. В некоторых воплощениях исходный или эталонный полипептид является одним из обнаруженных в природе. Как будет понятно специалистам в данной области техники, в природе обычно можно найти множество вариантов конкретного представляющего интерес полипептида, особенно когда представляющий интерес полипептид является полипептидом инфекционного агента.
Вектор: При использовании в данном документе термин относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Один тип вектора представляет собой «плазмиду», которая относится к циклической двухцепочечной петле ДНК, в которую могут быть лигированы дополнительные сегменты ДНК. Другим типом вектора является вирусный вектор, в котором дополнительные сегменты ДНК могут быть лигированы в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они вводятся (например, бактериальные векторы, имеющие бактериальную точку начала репликации и эписомальные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина при введении в клетку-хозяин и, таким образом, реплицируются вместе с геномом хозяина. Более того, некоторые векторы способны направлять экспрессию генов, с которыми они функционально связаны. Такие векторы упоминаются в данном документе как «экспрессирующие векторы».
Дикий тип: при использовании в данном документе, термин «дикий тип» имеет свое понимаемое в данной области значение, которое относится к объекту, имеющему структуру и/или активность, которые найдены в природе в «нормальном» (в отличие от мутантного, вариантного, больного, измененного и т.д.) состоянии или контексте. Специалисты в данной области техники поймут, что гены и полипептиды дикого типа часто существуют в нескольких разных формах (например, аллелях).
Подробное описание некоторых воплощений
Настоящее изобретение основано, в частности, на признании того, что агенты на основе антитела человека (например, человеческие моноклональные антитела), которые обладают высокой специфичностью к CD19, в частности, к CD19 человека, могут быть получены с преимущественным связыванием с CD19 в нативном формате (то есть, форме, экспрессированной на поверхности клетки). Кроме того, такие агенты на основе антитела человека обычно имеют лучшие in vivo свойства по сравнению с антительными агентами, которые преимущественно связываются с рекомбинантными или иммобилизованными формами CD19 (например, с CD19, связанным с планшетом). Настоящее изобретение также основано на признании того, что агенты на основе антитела человека, разработанные из наивных репертуаров, в некоторых воплощениях могут не обеспечивать агенты на основе антитела человека, имеющие специфичность к клинически значимым эпитопам. В качестве одного примера, настоящее раскрытие конкретно демонстрирует, что описанные в данном документе агенты на основе анти-CD19 антитела человека, в частности, агент на основе антитела человека, разработанный с использованием библиотеки антител, образованной из последовательностей, полученных из объекта с аутоиммунным заболеванием, продемонстрировали связывание с CD19, экспрессируемым на поверхности клеток, но не с рекомбинантным человеческим CD19 в контексте химерного белка. Таким образом, предлагаемые агенты на основе антитела человека могут быть охарактеризованы в некоторых воплощениях высокой специфичностью к нативным человеческим CD19, а не к ненативным формам человеческого CD19, которые потенциально не имеют практически никакой терапевтической значимости.
Настоящее изобретение, среди прочего, демонстрирует успешное производство мультиспецифичных связывающих агентов (например, биспецифичных антител), которые связывают CD19 человека, экспрессируемый на поверхности нескольких линий раковых клеток и первичных В-клеток человека. В частности, в настоящем изобретении главным образом предлагаются мультиспецифичные связывающие агенты (например, биспецифичные антитела), которые связывают несколько линий раковых клеток CD19-специфичным образом и опосредуют высокую эффективность лизиса клеток-мишеней. Такие мультиспецифичные связывающие агенты характеризуются высокой специфичностью и эффективностью в анализах цитотоксичности.
Настоящее изобретение также демонстрирует успешное производство химерных антигенных рецепторов (CAR), с помощью предлагаемых агентов на основе антитела человека и последующей экспрессии в трансдуцированных Т-клетках, в результате чего создаются сконструированные CAR-T-клетки (CAR-T). В частности, в настоящем раскрытии предлагаются CAR-T, которые специфически распознают CD19 человека, экспрессируемый на поверхности различных линий раковых клеток. Как описано в данном документе, предлагаемые анти-CD19 CAR-T демонстрируют эффективное уничтожение клеток-мишеней, которое в некоторых воплощениях превосходит CAR-T, получаемых из компонентов других анти-CD19-антител. Кроме того, как описано в данном документе, предлагаемые анти-CD19 CAR-T эффективно уничтожают опухоли у животных, которым имплантированы ксенотрансплантаты лимфомы человека. Таким образом, настоящее раскрытие, по меньшей мере, в некоторых воплощениях охватывает разработку агентов на основе антитела человека, имеющих высокую специфичность к нативному CD19 человека для применения при диагностике и лечении рака, и обеспечивает источник компонентов антитела для получения мультиспецифичных связывающих агентов и CAR-экспрессирующих иммунных клеток для применения у людей.
CD19
Кластер дифференцировки 19 или CD19 представляет собой трансмембранный гликопротеин, который экспрессируется на В-клетках, в частности, большом количестве линий В-клеток, за исключением плазматических клеток. CD19 также экспрессируется на ряде злокачественных В-клеток. CD19 функционирует как ко-рецептор на поверхности В-клеток при регуляции порога стимуляции для взаимодействия антиген-BCR. CD19 также взаимодействует с другими молекулами на поверхности клеток, такими как CD21, CD81 и CD82. Активация CD19 (т.е. фосфорилирование цитоплазматического домена) вызывает различные пути передачи сигнала, включающие различные киназы (например, Src-семейства) и приводит к различным процессам в иммунной клетке. CD19 был вовлечен в различные виды рака и аутоиммунных заболеваний. Действительно, CD19 интенсивно исследуется как мишень для разработки терапевтических средств на основе антител для лечения рака (см., например, Hammer, 2012, mAb 4: 5, 571-577, Reichert, JM и E. Dhimolea, 2012, Drug Discovery Today 17 (17/18): 954-963; Suresh, T. et al., 2014, J. Hematol. 7:58); однако большинство таких терапевтических средств на основе антител являются гуманизированными и/или химерными вариантами мышиных антител. В идеале, агенты полностью на основе антитела человека являются предпочтительными для лечения пациентов-людей. Ниже представлена аминокислотная последовательность CD19 человека (сигнальная последовательность подчеркнута).
(SEQ ID NO:290)
Анти-CD19 антительные агенты
Хотя анти-CD19 антитела известны и продемонстрировали себя в качестве терапевтических агентов при лечении рака и аутоиммунных нарушений у людей, многие из них имеют мышиное происхождение. В этом контексте, в частности, предпочтительным является применение агентов на основе антитела человека, поскольку это уменьшает вероятность иммунного ответа против введенного антитела. Таким образом, настоящее изобретение обеспечивает полностью агенты на основе антитела человека (например, человеческие моноклональные антитела и их фрагменты), разработанные из библиотек В-клеток человека, которые демонстрируют высокую специфичность к CD19 человека и в некоторых воплощениях преодолевают ограничения, связанные с существующими гуманизированными и/или химерными версиями антител нечеловеческой природы (например, мышиного).
Настоящее изобретение относится к способам и композициям для лечения связанных с CD19 заболеваний, расстройств и состояний и связанных с ними раков, на основе введения анти-CD19 агентов на основе антител человека (например, моноклональных антител) и в некоторых воплощениях мультиспецифичных связывающих агентов (например, биспецифичных антител), имеющих первый антигенсвязывающий сайт, который связывает CD19 человека и второй антигенсвязывающий сайт, который связывает иммунную клетку (например, Т-клетку).
В настоящем изобретении в частности предлагаются определенные последовательности антител человека, а также некоторые аффинно-зрелые последовательности антител, которые связывают CD19 человека и, в частности, его нативную форму (т.е. экспрессированную на клеточной поверхности). Например, в частности, примером в данном документе являются агенты на основе антитела человека (например, полноразмерные антитела, их фрагменты, одноцепочечные антитела, биспецифичные антитела или другие форматы антительных агентов, как описано в данном документе или известные в данной области), которые включают полипептиды, содержащие элементы последовательности, описанные в данном документе.
Примерные агенты на основе антитела человека (например, scFv), которые связывают CD19 человека, представлены в таблице 1 (последовательности вариабельной области легкой цепи (ДНК и аминокислотная) представлены жирным шрифтом; последовательности вариабельной области тяжелой цепи (ДНК и аминокислотная) представлены курсивом, линкерные последовательности представлены в виде подчеркнутого текста).
Таблица 1





























В различных воплощениях анти-CD19 агента на основе антитела человека в соответствии с настоящим изобретением состоит из вариабельных областей тяжелой и легкой цепей, где вариабельная область тяжелой цепи имеет последовательность, которая идентична, по меньшей мере, на около 50% (например, по меньшей мере, около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%), вариабельной области тяжелой цепи, которая представлена в таблице 1.
В различных воплощениях анти-CD19 агент на основе антитела человека в соответствии с настоящим изобретением состоит из вариабельных областей тяжелой и легкой цепей, где вариабельная область тяжелой цепи имеет последовательность, которая по существу идентична или идентична вариабельной области тяжелой цепи, которая представлена в таблице 1.
В различных воплощениях анти-CD19-человеческий антитело в соответствии с настоящим изобретением состоит из вариабельных областей тяжелой и легкой цепей, где вариабельная область легкой цепи имеет последовательность, которая составляет, по меньшей мере, около 50% (например, по меньшей мере, около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%), идентичные вариабельной области легкой цепи, которая представлена в таблице 1.
В различных воплощениях анти-CD19 агент на основе антитела человека в соответствии с настоящим изобретением состоит из вариабельных областей тяжелой и легкой цепей, где вариабельная область легкой цепи имеет последовательность, которая по существу идентична или идентична вариабельной области легкой цепи, которая представлена в таблице 1.
В различных воплощениях анти-CD19 агент на основе антитела человека в соответствии с настоящим изобретением состоит из вариабельных областей тяжелой и легкой цепей, причем вариабельная область тяжелой цепи имеет последовательность, которая составляет, по меньшей мере, около 50% (например, по меньшей мере, около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%), идентичные вариабельной области тяжелой цепи, которая представлена в Таблице 1, и в которой вариабельная область легкой цепи имеет последовательность, которая идентична, по меньшей мере, на около 50% (например, по меньшей мере, около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96 %, 97%, 98% или 99%) вариабельной области легкой цепи, которая представлена в таблице 1.
В различных воплощениях анти-CD19 агент на основе антитела человека в соответствии с настоящим изобретением состоит из вариабельных областей тяжелой и легкой цепей, причем вариабельная область тяжелой цепи имеет последовательность, которая по существу идентична или идентична вариабельной области тяжелой цепи, которая представлена в таблице 1, и причем вариабельная область легкой цепи имеет последовательность, которая по существу идентична или идентична вариабельной области легкой цепи, которая представлена в таблице 1.
В различных воплощениях анти-CD19 агент на основе антитела человека в соответствии с настоящим изобретением состоит из вариабельных областей тяжелой и легкой цепей, которые выбраны из последовательностей вариабельной области тяжелой и легкой цепей, которые представлены в таблице 1.
В различных воплощениях анти-CD19 агент на основе антитела человека в соответствии с настоящим изобретением представляет собой или включает одноцепочечный вариабельный фрагмент (scFv), причем scFv включает последовательность, которая идентична, по меньшей мере, на около 50% (например, по меньшей мере, на около 55%, 60 %, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%), scFv, которая представлена в таблице 1.
В различных воплощениях анти-CD19 агент на основе антитела человека в соответствии с настоящим изобретением представляет собой или включает одноцепочечный вариабельный фрагмент (scFv), причем scFv включает последовательность, которая по существу идентична или идентична scFv, которая представлена в таблице 1.
В различных воплощениях анти-CD19 агент на основе антитела человека в соответствии с настоящим изобретением представляет собой или включает одноцепочечный вариабельный фрагмент (scFv), причем scFv выбран из таблицы 1.
Предлагаемые антитела, включая антитела и/или их характерные части, или нуклеиновые кислоты, кодирующие их, могут быть получены любыми доступными способами. Например, протоколы для производства антител описаны Harlow and Lane, Antibodies: A Laboratory Manual (1988). Технологии для получения антител (например, моноклональных антител и/или поликлональных антител) хорошо известны в данной области. Понятно, что широкий спектр видов животных, в том числе кроликов, мышей, крыс, хомяков, морских свинок или коз, можно использовать для производства антисывороток. Выбор животного может определяться легкостью манипулирования, затратами или искомым количеством сыворотки, как было бы известно специалисту в данной области. Понятно, что антительные агенты также могут быть получены трансгенно путем получения млекопитающего или растения, которое является трансгенным по интересующим последовательностям тяжелой и легкой цепей иммуноглобулина (например, грызуна, трансгенного по генам тяжелой и легкой цепи человеческого иммуноглобулина). В связи с трансгенным продуцированием в млекопитающих антитела могут быть получены и извлечены из молока коз, коров или других млекопитающих (см., например, патенты США № 5827690, 5 756 687, 5750172 и 5749557, включенные в данный документ ссылкой во всей полноте). Как правило, антитела могут быть получены из мыши, крысы, морской свинки, хомяка, верблюда, ламы, акулы или другого подходящего хозяина. В ином случае антитела могут быть получены из цыплят, продуцирующих молекулы IgY (Schade et al., 1996, ALTEX 13 (5): 80-85). В некоторых воплощениях антитела, подходящие для настоящего изобретения, являются антителами человекообразной обезьяны. Например, общие методы индукции терапевтически полезных антител у бабуинов можно найти, например, в публикации международной патентной заявки № 1991/11465 и в Losman et al., 1990, Int. J. Cancer 46: 310. В некоторых воплощениях моноклональные антитела могут быть получены с использованием гибридомных способов (Milstein and Cuello, 1983, Nature 305 (5934): 537-40). В некоторых воплощениях моноклональные антитела также могут быть получены рекомбинантными способами (см., например, патент США № 4,166,452).
Многие из трудностей, связанных с генерацией моноклональных антител путем иммортализации В-клеток, можно преодолеть путем конструирования и экспрессии фрагментов антител в E.coli (или дрожжах) с использованием фагового дисплея. Для обеспечения восстановления с высокой аффинностью моноклональные антитела библиотеки комбинаторных иммуноглобулинов обычно должны содержать большой размер репертуара. Типичная стратегия использует мРНК, полученную из лимфоцитов или клеток селезенки иммунизированных мышей, для синтеза кДНК с использованием обратной транскриптазы. Гены тяжелой и легкой цепей амплифицируют отдельно ПЦР и лигируют в фаговые клонирующие векторы. Получают две разные библиотеки: одна включает гены тяжелой цепи, а другая включает гены легкой цепи. Библиотеки могут быть наивными или могут быть полусинтетическими, в которых синтезируется CDR3 тяжелой цепи, причем все аминокислоты (за исключением цистеина) одинаково вероятны для присутствия в любом данном положении в области CDR3 тяжелой цепи. Фаговую ДНК выделяют из каждой библиотеки, а последовательности тяжелых и легких цепей лигируют вместе и упаковывают с образованием комбинаторной библиотеки. Каждый фаг включает случайную пару кДНК тяжелой и легкой цепей и при заражении E.coli управляет экспрессией цепей антител в инфицированных клетках. Чтобы идентифицировать антитело, которое распознает представляющий интерес антиген (например, CD19), фаговая библиотека высевается и молекулы антитела, присутствующие в бляшках, переносятся на фильтры. Фильтры инкубируют с радиоактивно меченым антигеном и затем промывают для удаления избыточного несвязанного лиганда. Радиоактивное пятно на авторадиограмме идентифицирует бляшку, которая включает антитело, которое связывает антиген. В ином случае, идентификация антитела, которое распознает представляющий интерес антиген (например, CD19), может быть достигнута путем итеративного связывания фага с антигеном, который связан с твердой подложкой, например, шариками или клетками млекопитающих с последующим удалением несвязанного фага и элюированием специфически связанного фага. В таких воплощениях антигены сначала биотинилируются для иммобилизации, например, для сопряжения стрептавидина Dynabeads M-280. Библиотеку фагов инкубируют с клетками, шариками или другой твердой подложкой, а несвязавшийся фаг удаляют промыванием. Клоны фагового антитела, которые связывают представляющий интерес антиген, отбирают и тестируют для дальнейшей характеризации.
После отбора положительные scFv-клоны тестируют на их связывание с представляющим интерес антигеном, экспрессированным на поверхности живых клеток, с помощью косвенной проточной цитометрии. Вкратце, фаговые клоны инкубируют с клетками (например, сконструированными для экспрессии представляющего интерес антигена или теми, которые естественным образом экспрессируют антиген), которые либо экспрессируют, либо не экспрессируют антиген. Клетки промывают и затем метят мышиным моноклональным антителом против белка оболочки M13. Клетки снова промывают и метят вторичным антителом конъюгированным с флуоресцентным красителем (например, FITC-козьим (Fab)2 против мышиного IgG) перед проточной цитометрией. Клонирующие и экспрессирующие векторы, которые полезны для получения фаговой библиотеки иммуноглобулинов человека, могут быть получены, например, из систем клонирования Stratagene (Ла-Хойя, Калифорния).
Аналогичную стратегию можно использовать для получения высокоаффинного scFv (см., например, Vaughn et al., 1996, Nat. Biotechnol., 14: 309-314). Библиотека scFv с большим репертуаром может быть построена путем выделения V-генов из неиммунизированных людей-доноров с использованием ПЦР-праймеров, соответствующих широко известным семействам генов VH, Vκ и Vλ. После амплификации пулы Vκ и Vλ объединяются для формирования одного пула. Эти фрагменты лигируют в вектор-фагмиду. Затем линкер scFv (например, (G4S)n) лигируется в фагмиду перед VL-фрагментом (или выше VH-фрагмента по желанию). Фрагменты VH и линкер-VL (или фрагменты VL и линкер-VH), амфплифицируют и собирают на области JH. Полученные фрагменты VH-линкер-VL (или VL-линкер-VH) лигируют в вектор-фагмиду. Библиотека фагмид может быть отсортирована с использованием фильтров, как описано выше, или с использованием иммунотрубок (Nunc, Maxisorp). Подобные результаты могут быть достигнуты путем создания библиотеки комбинаторных иммуноглобулинов из лимфоцитов или клеток селезенки иммунизированных кроликов и путем экспрессии scFv-конструкций в P.pastoris (см., например, Ridder et al., 1995, Biotechnology, 13: 255-260). Кроме того, после выделения подходящего scFv, фрагменты антител с более высокой аффинностью связывания и более медленными скоростями диссоциации могут быть получены с помощью процессов созревания аффинности, таких как мутагенез CDR3 и перетасовка цепи (см., например, Jackson et al., 1998, Br. J. Cancer, 78:181-188); Osbourn et al., 1996, Immunotechnology, 2: 181-196).
Другой формой фрагмента антитела является пептид, кодирующий одиночную CDR. CDR-пептиды («единицы минимального распознавания») могут быть получены путем конструирования генов, кодирующих CDR интересующего антитела. Такие гены получают, например, с использованием полимеразной цепной реакции для синтеза вариабельной области из РНК клеток, продуцирующих антитела (см., например, Larrick et al., 1991, Methods: Companion to Methods in Enzymology 2: 106; Courtenay-Luck, "Genetic Manipulation of Monoclonal Antibodies," in Monoclonal Antibodies: Production, Engineering And Clinical Application, Ritter et al., eds., p. 166-179, Cambridge University Press 1995; и Ward et al., "Genetic Manipulation and Expression of Antibodies," in Monoclonal Antibodies: Principles And Applications, Birch et al., eds., p. 137-185, Wiley-Liss, Inc. 1995).
Человеческие антитела могут быть получены с использованием различных методов, включая библиотеки фагового дисплея (Hoogenboom et al., 1991, Mol. Immunol. 28(9):1027-37; Marks et al., 1991, J. Mol. Biol. 222 (3): 581-97) и получения человеческих моноклональных антител (Reisfeld and Sell, 1985, Cancer Surv.4 (l): 271-90). В ином случае, введение генов человеческого Ig в трансгенных животных, у которых эндогенные гены Ig были частично или полностью инактивированы, можно использовать для синтеза антител человека (см., например, Fishwild et al., 1996, Nat. Biotechnol. 14(7):845-51; Lonberg et al., 1994, Nature 368(6474):856-9; Lonberg and Huszar, 1995, Int. Rev. Immunol. 13:65-93; Taylor, L.D., et al., 1992, Nucl. Acids Res. 20:6287-95; Kellermann S-A., and Green L.L., 2002, Curr. Opin. Biotechnol. 13:593-7; Little, M. et al., 2000, Immunol. Today 21:364-70; Murphy, A.J. et al., 2014, Proc. Natl. Acad. Sci. U.S.A. 111(14):5153-8). После заражения наблюдается образование антител человека. В некоторых воплощениях антитела против CD19 человека производятся иммунизацией животных, не относящихся к человеку, сконструированных для получения человеческих антител в ответ на стимуляцию антигеном CD19 человека.
Предлагаемые агенты на основе антитела человека (включая антитела и/или характерные части) могут быть получены, например, с использованием системы клеток-хозяев, сконструированной для экспрессии нуклеиновой кислоты, кодирующей антитело по изобретению. Альтернативно или дополнительно предлагаемые агенты на основе антитела человека могут быть частично или полностью получены химическим синтезом (например, с использованием автоматизированного синтезатора пептидов или генного синтеза нуклеиновых кислот, кодирующих антительный агент).
Представляющие интерес агенты на основе антитела человека могут быть экспрессированы с использованием любого подходящего вектора. В данной области известны различные векторы (например, вирусные векторы); клетки, в которые были введены такие векторы (или потомство таких клеток), могут быть культивированы, как известно в данной области (например, с использованием систем непрерывного культивирования или культивирования с подпиткой). В некоторых воплощениях клетки могут быть генно-инженерными; технологии для генно-сконструированных клеток для экспрессии сконструированных полипептидов (например, полипептидов антительного агента, как описано в данном документе) хорошо известны в данной области (см., например, Ausabel et al., eds., 1990, Current Protocols in Molecular Biology (Wiley, New York)).
В некоторых воплощениях предлагаемые агенты на основе антитела человека могут быть очищены, при необходимости, с использованием фильтрации, центрифугирования и/или различных хроматографических технологий, таких как ВЭЖХ или аффинная хроматография. В некоторых воплощениях фрагменты предлагаемых агентов на основе антитела человека получают способами, которые включают гидролиз ферментами, такими как пепсин или папаин, и/или расщепление дисульфидных связей путем химического восстановления.
В некоторых воплощениях, как описано в данном документе, предлагаемые агенты на основе антитела человека могут быть или включают, например, поликлональное антитело; моноклональное антитело или его антигенсвязывающий фрагмент; модифицированное антитело, такое как антитело с созревшей аффинностью, вариантное антитело (например, имеющее одну или несколько аминокислотных замен по сравнению с эталонным антителом) или его фрагмент (например, Fab', Fab, F(ab')2); или биосинтетическое антитело, например одноцепочечное антитело, однодоменное антитело (DAB), Fv, одноцепочечное Fv (scFv), мультиспецифичные связывающие агенты (например, биспецифичные антитела), химерные антигенные рецепторы (CAR) или т.п.
Понятно, что предлагаемые агенты на основе антитела человека могут быть сконструированы, произведены и/или очищены таким образом, чтобы улучшить характеристики и/или активность антительных агентов. Например, улучшенные характеристики предлагаемых антительных агентов включают, без ограничения указанным, повышенную стабильность, улучшенную аффинность связывания и/или авидность, повышенную специфичность связывания, повышенное продуцирование, снижение агрегации, снижение неспецифичного связывания, наряду с прочим.
В некоторых воплощениях предлагаемые агенты на основе антитела человека могут содержать одну или несколько аминокислотных замен (например, в каркасной области в контексте иммуноглобулина или его фрагмента (например, scFv)), которые улучшают стабильность белка, связывание антигена, уровень экспрессии или обеспечивает сайт или место для конъюгации терапевтического, диагностического или детектора.
В некоторых воплощениях предлагаемые агенты на основе антитела человека представляют собой или включают иммуноглобулин (т.е. антитело), который является представителем класса антител (то есть изотипа), выбранного из группы, состоящей из IgG, IgM, IgA, IgD, IgE, или его фрагмент.
В некоторых воплощениях, предлагаемые агенты на основе антитела человека включают человеческие моноклональные антитела, которые включают вариантную Fc-область, где указанная вариантная Fc-область содержит, по меньшей мере, одну модификацию аминокислоты относительно эталонной Fc-области (или исходной Fc-области). В таких воплощениях агенты на основе антитела человека, содержащие вариантные Fc-области, могут демонстрировать измененную аффинность к Fc-рецептору (например, FcR), при условии, что упомянутые вариантные Fc-области не имеют замены в положениях, которые непосредственно контактируют с Fc-рецептором на основании кристаллографического и структурного анализа взаимодействий Fc-Fc-рецептора, таких как описанные Sondermann et al., 2000, Nature, 406: 267-273. Примерами положений в Fc-области, которые непосредственно контактируют с Fc-рецептором, таким как FcR, являются аминокислоты 234-239 (шарнирная область), аминокислоты 265-269 (петля B/C), аминокислоты 297-299 (петля C'/E) и аминокислоты 327-332 (петля F/G). В некоторых воплощениях предлагаемые агенты на основе антитела человека по настоящему изобретению, содержащие вариантные Fc-области, содержат модификацию, по меньшей мере, одного остатка, который обеспечивает прямой контакт с FcR на основании структурного и кристаллографического анализа.
В некоторых воплощениях указанный агент на основе антитела человека представляет собой моноклональное антитело против CD19 человека, имеющее вариантную Fc-область с одной или несколькими модификациями аминокислот по сравнению с исходной Fc-областью (или исходной Fc-областью). Аминокислотные модификации в Fc-областях для создания вариантных Fc-областей, которые, например, изменяют аффинность к активационным и/или ингибирующим рецепторам, приводят к улучшенной эффекторной функции, такой как, например, антителозависимая цитотоксичность, связанная с антителом (ADCC) и комплементарная зависимая цитотоксичность (CDC), увеличивают аффинность связывания с C1q, уменьшают или устраняют связывание FcR, увеличивают период полувыведения, известны в данной области (см., например, патенты США № 9,051,373, 9,040,041, 8,937,158, 8,883,973, 8,883,147, 8,858,937, 8,852,586, 8,809,503, 8,802,823, 8,802,820, 8,795,661, 8,753,629, 8,753,628, 8,735,547, 8,735,545, 8,734,791, 8,697,396, 8,546,543, 8,475,792, 8,399,618, 8,394,925, 8,388,955, 8,383,109, 8,367,805, 8,362,210, 8,338,574, 8,324,351, 8,318,907, 8,188,231, 8,124,731, 8,101,720, 8,093,359, 8,093,357, 8,088,376, 8,084,582, 8,039,592, 8,012,476, 7,799,900, 7,790,858, 7,785,791, 7,741,072, 7,704,497, 7,662,925, 7,416,727, 7,371,826, 7,364,731, 7,335,742, 7,332,581, 7,317,091, 7,297,775, 7,122,637, 7,083,784, 6,737,056, 6,538,124, 6,528,624 и 6,194,551).
В некоторых воплощениях указанный агент на основе антитела человека представляет собой моноклональное антитело против CD19 человека, имеющее Fc-область с вариантным гликозилированием по сравнению с исходной Fc-областью (например, агликозилированной). В некоторых воплощениях вариантное гликозилирование является результатом экспрессии в сконструированной линии клеток (см., например, Umana, P. et al., 1999, Nat. Biotechnol. 17(2):176-80; Yamane-Ohnuki, N. et al., 2004, Biotechnol. Bioeng. 87(5):614-22; von Horsten, H.H. et al., 2010, Glycobiol. 20(12):1607-18; Beck, A. et al., 2010, Expert Opin. Drug Discov. 5(1):95-111; и патенты США № 8,080,415 и 8,084,222; все из которых включены в настоящее описание посредством ссылки). В некоторых воплощениях настоящее изобретение относится к мультиспецифическим связывающим агентам, имеющим компонент антитела против CD19 человека, который включает вариантную Fc-область. В некоторых воплощениях предлагаемый мультиспецифичный связывающий агент включает компонент антитела, который показывает вариантное гликозилирование (например, является агликозилированным) по сравнению с исходным антителом, из которого может быть получен компонент.
В некоторых воплощениях настоящее изобретение обеспечивает и/или использует антитела или антительные агенты, содержащие вариантную Fc-область (то есть Fc-область включает одно или несколько добавлений, делеций и/или замен относительно соответствующего эталонного Fc), которые характеризуются тем, что измененная (например, увеличенная и/или уменьшенная) эффекторная функция и/или аффинность к FcR, усиливается или уменьшается относительно эталонной Fc. Эти вариации находятся в компетенции специалиста в данной области техники.
Таким образом, среди прочего, настоящее изобретение относится к антительным агентам и мультиспецифическим связывающим агентам (например, к агентам антител), содержащим вариантные Fc-области, которые связываются с большей аффинностью с одним или несколькими FcR. Такие агенты предпочтительно более эффективно опосредуют эффекторную функцию, как описано ниже. В некоторых воплощениях настоящее изобретение относится к антительным агентам и мультиспецифическим связывающим агентам (например, биспецифическим антителам), содержащим вариантную Fc-область, которая связывается с более слабой аффинностью с одним или несколькими FcR. Снижение или исключение эффекторной функции желательно в некоторых случаях, например, в случае антител, механизм действия которых связан с блокированием или антагонизмом, но не с уничтожением клеток, несущих целевой антиген. Кроме того, исключение эффекторной функции желательно в некоторых воплощениях при создании биспецифичных антител, что обсуждается ниже. Снижение или исключение эффекторной функции было бы желательно в случаях аутоиммунного заболевания, где можно было бы блокировать рецепторы активации FcγR в эффекторных клетках (этот тип функции присутствовал бы в клетках-хозяевах). Как правило, повышенная эффекторная функция может быть направлена на опухоль и клетки, экспрессирующие чужеродные антигены; в некоторых воплощениях эффекторная функция может быть направлена не на опухолевые клетки.
Варианты Fc для применения в соответствии с настоящим изобретением могут быть объединены с другими модификациями Fc, включая, например, модификации, которые изменяют эффекторную функцию. Настоящее изобретение включает объединение варианта Fc, как описано в данном документе, с другими модификациями Fc для обеспечения аддитивных, синергических или новых свойств в антителах или химерах Fc. В некоторых таких воплощениях варианты Fc могут усиливать фенотип модификации, с которой они объединены. Например, если вариант Fc объединяют с мутантом, который, как известно, связывает FcγRIIIA с более высокой аффинностью, чем сравниваемая молекула, содержащая Fc-область дикого типа, то комбинация с мутантом приводит к кратному усилению аффинности FcγRIIIA.
В некоторых воплощениях в соответствии с настоящим изобретением варианты Fc, описанные в данном документе, включены в антитело или Fc-химеру для получения сконструированного агента, который включает одну или несколько гликоформ Fc (то есть один или несколько полипептидов Fc, к которым ковалентно присоединены один или несколько углеводов) к молекуле, содержащей Fc-область, где углеводная композиция гликоформы отличается химически от гликоформы исходной молекулы, содержащей Fc-область.
В некоторых воплощениях мультиспецифичный связывающий агент (например, антительный агент), как описано в данном документе, может включать вариант Fc, который демонстрирует вариант гликозилирования и/или может быть экспрессирован в линии клеток с дефицитом гликозилирования, так что Fc-область агента продуцируется с утратой гликозилирования по сравнению с соответствующей эталонной Fc-областью (например, исходной Fc-областью), или Fc-областью, экспрессированной в клеточной линии, не дефицитной по гликозилированию.
В некоторых воплощениях антитела, используемые в соответствии с настоящим изобретением, могут иметь модифицированный сайт гликозилирования относительно соответствующего контрольного антитела, который связывается с представляющим интерес антигеном (например, CD19), предпочтительно без изменения функциональности антитела, например активности связывания антигена. При использовании в данном документе «сайты гликозилирования» включают любую специфическую аминокислотную последовательность в антителе, к которой олигосахарид (то есть углеводы, содержащие два или более простых сахаров, связанных друг с другом) будет специфически и ковалентно прикрепляться. Олигосахаридные боковые цепи обычно связаны с основой антитела через N-или O-связи. N-связанное гликозилирование относится к присоединению олигосахаридной части к боковой цепи аспарагинового остатка. O-связанное гликозилирование относится к присоединению олигосахаридной части к гидроксиаминокислоте, например серину, треонину. Например, Fc-гликоформа, которая утратила определенные олигосахариды, включая фукозу и концевой N-ацетилглюкозамин, может быть получена в специальных клетках CHO и проявлять усиленную эффекторную функцию ADCC.
В некоторых воплощениях настоящее изобретение охватывает способы модификации содержания углеводов в антителе, как описано в данном документе, путем добавления или удаления сайта гликозилирования. Способы модификации содержания углеводов в антителах хорошо известны в данной области и включены в настоящее описание (см., например, патенты США № 6,218,149, 6,472,511, публикации патента США № 2003-0115614 A1, 2002-0028486 A1, Публикация международной патентной заявки WO 2003/035835, Европейский патент № 0 359 096 B1). В некоторых воплощениях настоящее изобретение относится к способам модификации содержания углеводов антитела (или его соответствующей части или его компонента) путем удаления одной или нескольких эндогенных углеводных фрагментов антитела.
Сконструированные гликоформы могут быть полезны для различных целей, включая, без ограничения указанным, усиление или уменьшение эффекторной функции. Сконструированные гликоформы могут быть получены любым способом, известным специалисту в данной области, например, с использованием сконструированных или вариантных экспрессирующих штаммов путем совместной экспрессии с одним или несколькими ферментами, например N-ацетилглюкозаминилтрансферазой I (GnTI), путем экспрессии молекулы, содержащей Fc-область (или вариантную Fc-область) в различных организмах или клеточных линиях из различных организмов или путем модификации углевода (углеводов) после того, как молекула, содержащая Fc-область, была экспрессирована. Способы получения сконструированных гликоформ известны в данной области и включают, без ограничения указанным, способы, описанные в Umana et al., 1999, Nat. Biotechnol. 17:176-180; Davies et al., 2001, Biotechnol. Bioeng. 74:288-294; Shields et al., 2002, J. Biol. Chem. 277:26733-26740; Shinkawa et al., 2003, J. Biol. Chem. 278: 3466-3473; Патент США № 6602684; Заявка на патент США № 2003-0157108 A1, 2003-0003097 A1; Международные патентные публикации WO 2000/61739, WO 2001/292246, WO 2002/311140 и WO 2002/30954; Технология POTILLEGENT™ (Biowa, Inc. Принстон, Нью-Джерси); Инженерная технология гликозилирования GLYCOMAB™ (GLYCART biotechnology AG, Цюрих, Швейцария). См., например, Okazaki et al., 2004, JMB, 336: 1239-49; Патентная публикация США № 2003-0115614 A1; Международная патентная публикация № WO 2000/061739.
Конкретные примерные воплощения - Иммуноглобулиновые комбинации тяжелых и легких цепей
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 2 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 2. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 2 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 2.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 4 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 4. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 4 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 4.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 6 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 6. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 6 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 6.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 8 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 8. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 8 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 8.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 10 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 10. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 10, и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 10.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 12 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 12. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 12, и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 12.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 14 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 14. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 14 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 14.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 16 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 16. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 16 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 16.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 18 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 18. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 18 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 18.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 20 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 20. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 20 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 20.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 22 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 22. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 22 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 22.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 24 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 24. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 24 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 24.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 26 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 26. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 26 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 26.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 28 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 28. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 28 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 28.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 30 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 30. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 30 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 30.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 32 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 32. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 32 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 32.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 34 и/или вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 34. В некоторых воплощениях агент на основе антитела человека представляет собой антитело, которое включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO: 34 и вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO: 34.
Конкретные иллюстративные воплощения - Специфические аминокислотные замены
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая включает одну или несколько аминокислотных замен в любом из аминокислотных положений 3, 12, 16, 17, 25, 26, 32, 63, 69, 97, 102, 106, 108, 109, 113, 116, 117 и их комбинации. В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая включает, по меньшей мере, от одной и вплоть до пяти аминокислотных замен в каркасной и/или CDR-области.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая представлена в SEQ ID NO., выбранных из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32 и 34 и дополнительно включает одну или несколько аминокислотных замен в любом из аминокислотных положений 3, 12, 16, 17, 25, 26, 32, 63, 69, 97, 102, 106, 108, 109, 113, 116, 117 и их комбинаций.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая включает одну или несколько замен, выбранных из группы, состоящей из Q3R, K12E, E16G, S17F, S25A, G26A, Y32F, S63F, T69A, A97V, T102S, M106L, Y108N, D109E, Q113L, L116M, M117L и их комбинации.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область тяжелой цепи иммуноглобулина, которая включает одну или несколько замен по сравнению с вариабельной областью тяжелой цепи контрольного вариабельного иммуноглобулина, и вариабельную область тяжелой цепи иммуноглобулина имеет последовательность, которая представлена в любой один из SEQ ID NO: 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70 и 72.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область легкой цепи иммуноглобулина, которая включает одну или несколько аминокислотных замен в любом из аминокислотных положений 10, 16, 25, 34, 52, 54, 68, 69, 72, 75, 93, 95 и их комбинации. В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область легкой цепи иммуноглобулина, которая включает, по меньшей мере, одну и вплоть до пяти аминокислотных замен в каркасной области и/или области CDR.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область легкой цепи иммуноглобулина, которая представлена в SEQ ID NO. выбранных из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32 и 34 и дополнительно включает одну или несколько аминокислотных замен в любом из аминокислотных положений 10, 16, 25, 34, 52, 54, 68, 69, 72, 75, 93, 95 и их комбинации.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область легкой цепи иммуноглобулина, которая включает один или несколько заместителей, выбранных из группы, состоящей из V10M, K16E, S25N, V34I, D52N, L54Q, N68T, T69M, L72M, S75N, S93T, D95E, D95G и их комбинации.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельную область легкой цепи иммуноглобулина, которая включает одну или несколько замен по сравнению с вариабельной областью легкой цепи контрольного иммуноглобулина и в которой вариабельная область легкой цепи иммуноглобулина имеет последовательность, которая представлена в любой последовательности из числа SEQ ID NO: 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70 и 72.
В некоторых воплощениях агент на основе антитела человека по настоящему изобретению включает вариабельные области тяжелой и легкой цепи иммуноглобулина, которые вместе содержат, по меньшей мере, одну и вплоть до пяти аминокислотных замен в каркасной области и/или области CDR.
Среди прочего, настоящее раскрытие демонстрирует, что присутствие таких аминокислотных замен в агенте на основе анти-CD19 антитела человека по настоящему изобретению увеличивает аффинность и/или специфичность связывания агента на основе антитела человека с CD19 человека относительно исходного агента на основе антитела человека. То есть введение таких аминокислотных замен в анти-CD19 агент на основе антитела человека улучшает его аффинность связывания с CD19 и, в частности, с нативным CD19 (т.е. экспрессированным на поверхности клетки).
Специалисты в данной области техники знают о различных технологиях, известных в данной области техники для осуществления такого введения, или в ином случае для подготовки, получения или изготовления полипептидов, содержащих такие последовательности. Иллюстративные технологии, полезные в этом отношении, представлены, например, в Green & Sambrook, Molecular Cloning: The Laboratory Manual, Cold Spring Harbor Laboratory Press 2012.
Конкретные иллюстративные воплощения - Специфические CDR
Как известно в данной области техники, моноклональные антитела состоят из двух тяжелых цепей и двух легких цепей, каждая из которых включает вариабельные области и константные области. Вариабельная область тяжелой цепи обычно включает три CDR, обозначенные в данном документе как HCDR1, HCDR2 и HCDR3, фланкированные каркасными областями (см., например, William E. Paul, Fundamental Immunology (7th ed.), Lippincott Williams & Wilkins 2013). Вариабельная область легкой цепи обычно включает три области, определяющие комплементарность (CDR), идентифицированные в данном документе как LCDR1, LCDR2 и LCDR3, фланкированные каркасными областями.
В настоящем изобретении предлагаются агенты на основе антитела человека, включающие CDR, представленные в таблицах 2 (HCDR) и 3 (LCDR) в любой возможной комбинации. В качестве примера, который не предназначен для ограничения, настоящее изобретение включает агенты на основе антитела человека, включающие HCDR1, HCDR2, HCDR3, LCDR1, LCDR2 и LCDR3, которые являются SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183, соответственно.
Изготовление антител, имеющих искомые CDR и/или каркасные области, широко известно в данной области и описано, например, в Strohl & Strohl, Therapeutic Antibody Engineering, Woodhead Publishing Limited 2012.
Таблица 2
(SEQ ID NO:73)
(SEQ ID NO:74)
(SEQ ID NO:75)
(SEQ ID NO:76)
(SEQ ID NO:77)
(SEQ ID NO:78)
(SEQ ID NO:79)
(SEQ ID NO:80)
(SEQ ID NO:81)
(SEQ ID NO:82)
(SEQ ID NO:83)
(SEQ ID NO:84)
(SEQ ID NO:85)
(SEQ ID NO:86)
(SEQ ID NO:87)
(SEQ ID NO:88)
(SEQ ID NO:89)
(SEQ ID NO:90)
(SEQ ID NO:91)
(SEQ ID NO:92)
(SEQ ID NO:93)
(SEQ ID NO:94)
(SEQ ID NO:95)
(SEQ ID NO:96)
(SEQ ID NO:97)
(SEQ ID NO:98)
(SEQ ID NO:99)
(SEQ ID NO:100)
(SEQ ID NO:101)
(SEQ ID NO:102)
(SEQ ID NO:103)
(SEQ ID NO:104)
(SEQ ID NO:105)
(SEQ ID NO:106)
(SEQ ID NO:107)
(SEQ ID NO:108)
(SEQ ID NO:109)
(SEQ ID NO:110)
(SEQ ID NO:111)
(SEQ ID NO:112)
(SEQ ID NO:113)
(SEQ ID NO:114)
(SEQ ID NO:115)
(SEQ ID NO:116)
(SEQ ID NO:117)
(SEQ ID NO:118)
(SEQ ID NO:119)
(SEQ ID NO:120)
(SEQ ID NO:121)
(SEQ ID NO:122)
(SEQ ID NO:123)
(SEQ ID NO:124)
(SEQ ID NO:125)
(SEQ ID NO:126)
(SEQ ID NO:127)
(SEQ ID NO:128)
(SEQ ID NO:129)
(SEQ ID NO:130)
(SEQ ID NO:131)
(SEQ ID NO:132)
(SEQ ID NO:133)
(SEQ ID NO:134)
(SEQ ID NO:135)
(SEQ ID NO:136)
(SEQ ID NO:137)
(SEQ ID NO:138)
(SEQ ID NO:139)
(SEQ ID NO:140)
(SEQ ID NO:141)
(SEQ ID NO:142)
(SEQ ID NO:143)
(SEQ ID NO:144)
(SEQ ID NO:145)
(SEQ ID NO:146)
(SEQ ID NO:147)
(SEQ ID NO:148)
(SEQ ID NO:149)
(SEQ ID NO:150)
(SEQ ID NO:151)
(SEQ ID NO:152)
(SEQ ID NO:153)
(SEQ ID NO:154)
(SEQ ID NO:155)
(SEQ ID NO:156)
(SEQ ID NO:157)
(SEQ ID NO:158)
(SEQ ID NO:159)
(SEQ ID NO:160)
(SEQ ID NO:161)
(SEQ ID NO:162)
(SEQ ID NO:163)
(SEQ ID NO:164)
(SEQ ID NO:165)
(SEQ ID NO:166)
(SEQ ID NO:167)
(SEQ ID NO:168)
(SEQ ID NO:169)
(SEQ ID NO:170)
(SEQ ID NO:171)
(SEQ ID NO:172)
(SEQ ID NO:173)
(SEQ ID NO:174)
(SEQ ID NO:175)
(SEQ ID NO:176)
(SEQ ID NO:177)
(SEQ ID NO:178)
(SEQ ID NO:179)
(SEQ ID NO:180)
Таблица 3
В различных воплощениях агент на основе антитела человека по настоящему изобретению включает, по меньшей мере, одну из HCDR, которая показана в таблице 2 и/или, по меньшей мере, одну из LCDR, которая показана в таблице 3.
В различных воплощениях агент на основе антитела человека по настоящему изобретению включает, по меньшей мере, две из HCDR, которые представлены в таблице 2 и/или, по меньшей мере, две из LCDR, которые представлены в таблице 3.
В различных воплощениях агент на основе антитела человека по настоящему изобретению включает любые три HCDR, которые представлены в таблице 2, и/или любые три LCDR, которые представлены в таблице 3.
В различных воплощениях агент на основе антитела человека по настоящему изобретению включает набор из трех HCDR, которые представлены в таблице 2, и/или соответствующий набор из трех LCDR, которые представлены в таблице 3.
В различных воплощениях агент на основе антитела человека по настоящему изобретению включает три HCDR, причем каждая из трех HCDR имеет последовательность, которая идентична, по меньшей мере, на около 50% (например, по меньшей мере, около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%), трем HCDR, которые представлены в таблице 2.
В различных воплощениях агент на основе антитела человека по настоящему изобретению включает три LCDR, причем каждая из трех LCDR имеет последовательность, которая идентична, по меньшей мере, около 50% (например, по меньшей мере, около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) трем LCDR, которые представлены в таблице 3.
В различных воплощениях агент на основе антитела человека по настоящему изобретению включает три HCDR и три LCDR, причем каждая из трех HCDR имеет последовательность, которая идентична, по меньшей мере, на около 50% (например, по меньшей мере, около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) трем HCDR, которые представлены в таблице 2, и каждая из трех LCDR имеет последовательность, которая идентична, по меньшей мере, на около 50% (например, по меньшей мере, около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%), трем LCDR, которые представлены в таблице 3.
В различных воплощениях агент на основе антитела человека по настоящему изобретению включает три HCDR и/или три LCDR, причем каждый из HCDR и LCDR имеет последовательность, которая по существу идентична или идентична HCDR и LCDR, которые представлены в таблицах 2 и 3, соответственно.
В различных воплощениях агент на основе антитела человека по настоящему изобретению представляет собой или включает иммуноглобулин (например, моноклональное антитело), который включает HCDR и LCDR, выбранные из таблиц 2 и 3, соответственно.
Одноцепочечный Fv (scFv)
Одноцепочечные Fv (scFv) широко известны и используются в данной области техники. Одноцепочечный Fv представляет собой химерный белок вариабельных областей тяжелой (VH) и легкой цепей (VL) иммуноглобулинов, иногда соединенных коротким линкерным пептидом (см., например, см., например, Benny K. C. Lo (ed.), Antibody Engineering – Methods and Protocols, Humana Press 2004, и источники, цитируемые в ней).
Настоящее изобретение относится к одноцепочечным Fv (scFv), которые специфически связывают CD19 человека, и в некоторых воплощениях предлагаемые scFv содержат линкерную последовательность. В некоторых воплощениях области VH и VL из scFv, представленные в данном документе, включают линкерную последовательность, которая представляет собой SRGGGGSGGGGSGGGGSLEMA (SEQ ID NO: 289). В некоторых воплощениях линкерная последовательность представляет собой последовательность (G4S)n, где n равно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более.
В некоторых воплощениях линкер представляет собой, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более аминокислот. В некоторых воплощениях линкер отличается тем, что он не принимает жесткую трехмерную структуру, а скорее обеспечивает гибкость для полипептида (например, первого и/или второго связывающих компонентов).
В некоторых воплощениях представленный полипептид scFv включает последовательность, которая представлена в любой из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO:: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO:: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72.
В различных воплощениях агент на основе антитела человека по настоящему изобретению представляет собой или включает одноцепочечный вариабельный фрагмент (scFv), причем scFv включает HCDR и LCDR, выбранные из таблиц 2 и 3, соответственно.
В различных воплощениях агент на основе антитела человека по настоящему изобретению представляет собой или включает одноцепочечный вариабельный фрагмент (scFv), причем scFv включает последовательность вариабельной области тяжелой и/или легкой цепи, которая представлена в таблице 1.
В некоторых воплощениях предлагаемый полипептид scFv конъюгирован с терапевтическим или детектирующим агентом.
Как известно специалистам в данной области, получение scFv и их модификация в соответствии с настоящим изобретением известны в данной области техники (см., например, Benny K. C. Lo (ed.), Antibody Engineering – Methods and Protocols, Humana Press 2004, и источники, процитированные в ней).
Мультиспецифичные связывающие агенты
Как известно специалистам в данной области, мультиспецифичный связывающий агент представляет собой молекулярный объект или комплекс, который включает связывающие компоненты, которые специфически связываются с двумя или более мишенями (например, эпитопами). Такие мультиспецифичные связывающие агенты находят множество применений в данной области, включая терапевтические применения. Так, например, как известно специалистам в данной области, мультиспецифичные связывающие агенты были сконструированы для облегчения уничтожения опухолевых клеток путем направления (или рекрутирования) цитотоксических Т-клеток в сайт опухоли. Примеры опухолевых антигенов включают, без ограничения указанным, альфа-фетопротеин (AFP), CA15-3, CA27-29, CA19-9, CA-125, калькретинин, карциноэмбриональный антиген, CD34, CD99, CD117, хромогранин, цитокератин, десмин, эпителиальный мембранный белок (EMA), фактор VIII, CD31 FL1, глиальный фибриллярный кислый белок (GFAP), белок жидкости при обширном кистозном заболевании-15 (GCDFP-15), HMB-45, хорионический гонадотропин человека (hCG), ингибин, кератин, CD45, лимфоцитарный маркер, MART-1 (Melan-A), Myo Dl, мышечно-специфичный актин (MSA), нейрофиламент, нейроспецифическая энолаза (NSE), плацентарная щелочная фосфатаза (PLAP), простатспецифичный антиген, белок S100, гладкий мышечный актин (SMA), синаптофизин, тиреоглобулин, транскрипционный фактор щитовидной железы-1, опухолевый M2-PK и виментин.
В некоторых воплощениях мультиспецифичные связывающие агенты для применения в соответствии с настоящим изобретением являются биспецифичными связывающими агентами. Во многих воплощениях такие биспецифичные связывающие агенты способны связываться с опухолевыми клетками. Во многих воплощениях такие биспецифичные связывающие агенты способны связываться с клетками CD19+ или клетками, которые экспрессируют полипептид CD19 на поверхности клетки (например, опухолевой клетки).
В некоторых воплощениях мультиспецифичные связывающие агенты (например, биспецифичные связывающие агенты), представленные в данном документе, являются или содержат компоненты антитела. В данной области техники известно множество технологий для проектирования, конструирования и/или получения мультиспецифичных связывающих агентов, содержащих компоненты антитела.
Например, были сконструированы мультиспецифичные связывающие агенты, которые либо используют полную структуру иммуноглобулина (например, IgG), одноцепочечный вариабельный фрагмент (scFv), либо их комбинации. Было показано, что биспецифичные связывающие агенты, состоящие из двух единиц scFv в тандеме, являются клинически успешным биспецифическим форматом антител. В случае противоопухолевой иммунотерапии биспецифичные связывающие агенты, которые содержат два одноцепочечных вариабельных фрагмента (scFv) в тандеме, были сконструированы таким образом, что scFv, который связывает опухолевой антиген, был связан с scFv, который захватывает Т-клетки путем связывания CD3 (например, CD3γ, CD3δ, CD3ε, CD3ζ, и т.д.). Таким образом, Т-клетки рекрутируются в опухолевый сайт в надежде, что они могут опосредовать уничтожение опухолевых клеток цитотоксическими свойствами, которыми обладают определенные Т-клетки. Был приведен пример такого биспецифичного связывающего агента, который нацелен на CD19 и CD3 для лимфомы (который упоминается как биспецифичный, привлекающий T-клетки или BiTE, например, см. Dreier et al., 2003, J. Immunol .170:4397-4402; Wolf, E. et al., 2005, Drug Discovery Today 10(18):1237-1244; Molhoj, M. et al. 2007, Mol. Immunol. 44:1935-43; Bargou et al., 2008, Science 321:974-977; Baeuerle, P.A. и C. Reinhardt, 2009, Cancer Res. 69(12):4941-44; Hoffman, L.M and L. Gore, Frontiers in Oncol. 4 (статья 63), 5 стр.), оказавшегося успешным в предотвращении роста опухоли в исследованиях на животных с ксенотрансплантатами. В исследованиях на человеке этот биспецифичный связывающий агент продемонстрировал объективную реакцию опухоли, включая пять неполных и две полные ремиссии.
Типичные биспецифичные связывающие агенты включают те, которые содержат первый компонент антитела, специфичный к опухолевому антигену (например, CD19), и второй компонент антитела, специфичный к иммунной клетке (например, Т-клетке, NK-клетке и т.д.). Биспецифичные связывающие агенты могут быть получены, например, путем объединения тяжелых цепей и/или легких цепей, которые распознают различные эпитопы одного и того же или другого антигена. В некоторых воплощениях, посредством молекулярной функции, биспецифичный связывающий агент связывает один антиген (или эпитоп) одним из двух его связывающих плечей (одна пара VH/VL) и связывает другой антиген (или эпитоп) его вторым плечом (другая пара VH/VL). По этому определению биспецифичный связывающий агент имеет два различных антигенсвязывающих плеча (как в специфичности, так и в CDR-последовательностях) и является моновалентным для каждого антигена, с которым он связывается.
В некоторых воплощениях биспецифичные связывающие агенты по настоящему изобретению характеризуются способностью одновременно связываться с двумя мишенями, которые имеют разную структуру. В некоторых воплощениях биспецифичные связывающие агенты по настоящему изобретению имеют, по меньшей мере, один компонент, который специфически связывается, например, с B-клеткой, Т-клеткой, миелоидом, плазмой или антигеном или эпитопом тучных клеток и, по меньшей мере, одним другим компонентом, который специфически связывает CD19, в частности, CD19, экспрессируемый на поверхности клетки.
В различных воплощениях биспецифичный связывающий агент (например, биспецифическое антитело) в соответствии с настоящим изобретением состоит из первого связывающего компонента и второго связывающего компонента. Во многих воплощениях первый и второй связывающие компоненты биспецифичного связывающего агента, как описано в данном документе, каждый состоят из компонентов антитела, характеризующихся различными особенностями. Во многих воплощениях компоненты антитела выбраны из таблицы 1.
В различных воплощениях биспецифичный связывающий агент в соответствии с настоящим изобретением включает первый связывающий компонент и второй связывающий компонент. В различных воплощениях биспецифичный связывающий агент в соответствии с настоящим изобретением включает первый связывающий компонент, второй связывающий компонент и линкер, который соединен как с первым, так и с вторым связывающим компонентом (например, расположенным между первым и вторым связующими компонентами).
В различных воплощениях первый и/или второй связывающие компоненты, как описано в данном документе, содержат или являются компонентами антител. В различных воплощениях первый и/или второй связывающие компоненты, как описано в данном документе, содержат линкерную последовательность или связаны посредством линкерной последовательности.
В некоторых воплощениях линкер представляет собой, по меньшей мере, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более аминокислот. В некоторых воплощениях линкер отличается тем, что он не принимает жесткую трехмерную структуру, а скорее обеспечивает гибкость для полипептида (например, первого и/или второго связывающих компонентов). В некоторых воплощениях линкер используется в биспецифическом связывающем агенте, описанном в данном документе, на основе конкретных свойств, придаваемых биспецифическому связывающему агенту, таких как, например, снижение агрегации и/или повышение стабильности. В некоторых воплощениях биспецифичный связывающий агент по настоящему изобретению включает линкер G4S. В некоторых определенных воплощениях биспецифичный связывающий агент по настоящему изобретению включает линкер (G4S)n, где n равно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более.
В некоторых воплощениях первый и/или второй связывающие компоненты, как описано в данном документе, являются или содержат иммуноглобулины (например, IgG). В некоторых воплощениях компоненты связывания первых и/или вторых связывающих компонентов, как описано в данном документе, представляют собой фрагменты антитела (например, scFv). В некоторых воплощениях первые связывающие компоненты, как описано в данном документе, являются или содержат фрагменты антитела, а вторые связывающие компоненты представляют собой или содержат иммуноглобулины. В некоторых воплощениях первые связывающие компоненты, как описано в данном документе, являются или содержат иммуноглобулины, а вторые связывающие компоненты представляет собой или включает фрагменты антител. В некоторых определенных воплощениях первые связывающие компоненты являются иммуноглобулинами, а вторыми связывающими компонентами являются фрагментами антител. В некоторых определенных воплощениях первыми связывающими компонентами являются IgG, а вторыми связывающими компонентами являются scFv.
В некоторых определенных воплощениях биспецифичный связывающий агент в соответствии с настоящим изобретением включает первый и второй scFv. В некоторых определенных воплощениях первый scFv связан с C-концом второго scFv. В некоторых определенных воплощениях второй scFv связан с C-концом первого scFv. В некоторых определенных воплощениях scFv связаны друг с другом посредством линкерной последовательности. В некоторых определенных воплощениях scFv связаны друг с другом без линкерных последовательностей.
В некоторых воплощениях биспецифичный связывающий агент по настоящему изобретению включает две различные тяжелые цепи или вариабельные области тяжелой цепи и две различные легкие цепи или вариабельные области легкой цепи.
В некоторых воплощениях биспецифичный связывающий агент по настоящему изобретению имеет две специфичности, одна из которых связывает CD19 человека, а другая связывает CD3 человека (например, CD3γ, CD3δ, CD3ε, CD3ζ и т.д.) на T-клетке.
В некоторых воплощениях биспецифичный связывающий агент по настоящему изобретению включает одну или несколько последовательностей, которые идентичны, по меньшей мере, на около 50% (например, по меньшей мере, около 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%), одной или нескольким последовательностям, которые представлены в таблице 1.
В некоторых воплощениях биспецифичный связывающий агент по настоящему изобретению включает одну или несколько последовательностей, которые по существу идентичны или идентичны одной или нескольким последовательностям, которые представлены в таблице 1.
В различных воплощениях первый связывающий компонент биспецифичного связывающего агента, как описано в данном документе, включает одну или несколько HCDR и одну или несколько LCDR, причем каждая одна или несколько HCDR имеет последовательность, которая идентична, по меньшей мере, на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более), одной или нескольким HCDR, которые представлены в таблице 2, и причем каждая одна или несколько HCDR имеет последовательность, которая идентична, по меньшей мере, на 50% (например, 50%, 55%, 60%, 65%, 70%, 75 %, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и более) одной или нескольким LCDR, которые представлены в таблице 3.
В различных воплощениях первый связывающий компонент биспецифичного связывающего агента, как описано в данном документе, включает три HCDR и три LCDR, причем каждая из трех HCDR имеет последовательность, которая идентична, по меньшей мере, на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и более) HCDR, которые представлены в таблице 2, и каждая из трех LCDR имеет последовательность, которая идентична, по меньшей мере, на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и более), идентичные трем LCDR, которые представлены в таблице 3.
В различных воплощениях первый связывающий компонент биспецифичного связывающего агента, как описано в данном документе, включает набор из трех HCDR и набор из трех LCDR, причем набор их каждых трех HCDR имеет последовательность, которая идентична, по меньшей мере, на 50% (например, 50 %, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 99% или более), набору из трех HCDR, которые представлены в таблице 2, и каждый набор из трех LCDR имеет последовательность, которая идентична, по меньшей мере, на 50% (например, 50%, 55%, 60%, 65%, 70 %, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и более) набору из трех LCDR, которые приведены в таблице 3.
В различных воплощениях первый связывающий компонент биспецифичного связывающего агента, как описано в данном документе, включает набор из трех HCDR, которые представлены в таблице 2, и набор из трех LCDR, которые представлены в таблице 3.
В различных воплощениях первый связывающий компонент биспецифичного связывающего агента, как описано в данном документе, включает компонент антитела, имеющий последовательность, идентичную, по меньшей мере, на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и более) компоненту антитела, который представлен в таблице 1.
В различных воплощениях первый связывающий компонент биспецифичного связывающего агента, как описано в данном документе, включает компонент антитела, имеющий последовательность, которая по существу идентична или идентична компоненту антитела, который представлен в таблице 1.
В различных воплощениях второй связывающий компонент биспецифичного связывающего агента, как описано в данном документе, включает компонент антитела, который связывает Т-клетку. Типичные маркеры Т-клеток, которые могут быть использованы в качестве мишеней для второго связывающего компонента биспецифичного связывающего агента, как описано в данном документе, включают CD3 (e.g., CD3γ, CD3δ, CD3ε, CD3ζ, и т.д.), CD4, CD8, CD28, OX40 (TNFRSF4 или CD134), GITR (TNFRSF18 или CD357), CD137 (TNFRSF9 или 4-1BB), CD27 (TNFRSF7), CD40L (TNFSF5 или CD154), HVEM (TNFRSF14 или CD270) и т.д. В некоторых воплощениях, второй связывающий компонент биспецифичного связывающего агента, как описано в данном документе, включает компонент антитела, который связывает CD3. В некоторых определенных воплощениях второй связывающий компонент биспецифичного связывающего агента, как описано в данном документе, включает компонент антитела, который связывает CD3ε. Иллюстративные компоненты анти-CD3-антитела, которые могут быть использованы в биспецифичных связывающих агентах по настоящему изобретению, известны в данной области и могут быть найдены, например, в Routledge et al., 1991, Eur. J. Immunol. 21:2717-25; Adair et al., 1994, Hum. Antibodies Hybridomas 5:41-7; Norman et al., 2000, Clin. Transplant. 70(12):1707-12; Chatenoud, 2003, Nat. Rev. Immunol. 3(2):123-32; Cheadle, 2006, Curr. Opin. Mol. Ther. 8(1):62-8; Herold et al., 2009, Clin. Immunol. 132:166-73; Heiss and Murawa, 2010, Int. J. Cancer 127(9):2209-21; Keymeulen et al., 2010, Diabetologia, 53: 614-23; Silke and Gires, 2011, MAbs, 3(1):31-7; Cioffi, M. et al., 2012, Clin. Cancer Res. 18:465-474; Dean et al., 2012, Swiss Med. Wkly. 142:w13711; Labrijn et al., 2013, Proc. Nat. Acad. Sci. U.S.A. 110(13):5145-50; Portell et al., 2013, Clin. Pharmacol. 5:5-11; Патенты США № 712324, 7575923, 8 076 459, 8 1017222, которые все включены в настоящее описание ссылкой во всей полноте.
В ином случае, существующие компоненты, анти-CD3-антитела не человеческой природы (например, из мыши), обеспечивают ценный источник компонентов антитела для применения в биспецифичных связывающих агентах по настоящему изобретению (см., например, легкую цепь мышиного OKT3 по учетному номеру EMBL A22259.1 GL641464 и тяжелой цепи мышиного OKT3 по учетному номеру EMBL A22261.1 GL21727144). Хотя такие компоненты антител не человеческой природы полезны, их гуманизированные формы являются предпочтительными при лечении людей, поскольку, среди прочего, это уменьшает вероятность иммунных реакций против введенного антитела (или биспецифичного связывающего агента). Способы получения гуманизированных антител обычно известны в данной области.
Химерные антигенные рецепторы
Настоящее изобретение также относится к химерным антигенным рецепторам, содержащим агент на основе антитела человека и/или мультиспецифичный связывающий агент, как описано в данном документе. CAR могут быть сконструированы способами, известными в данной области (см., например, публикации международной патентной заявки № 2012/079000, 2013/126726, 2015/177789 и 2015/080981; публикации заявки на патент США № 2012/0213783 A1, патент США № 7,446,179 и 5912172; Milone, MC et al., 2009, Mol.Therapy 17(8):1453-64; Kochenderfer, J.N. et al., 2010, Blood 116(19):3875-86; 2011, N. Engl. J. Med. 365(20):1937-9; Grupp, S.A. et al., 2013, N. Engl. J. Med. 368(16):1509-18; Romas, C.A. et al., 2014, Cancer J. 20(2):112-18; Singh, H. et al., 2014, Immunol. Rev. 257(1):181-90; Fujiwara, H., 2014, Pharmaceuticals 7:1049-68; Maude, S.L. et al., 2015, Blood 125(26):4017-23; все из которых включены в данный документ ссылкой). Иммунные эффекторные клетки (например, Т-клетки, NK-клетки и т.д.) могут быть сконструированы для экспрессии химерного антигенного рецептора, который включает компонент антитела, описанного в данном документе, в результате чего создаются противоопухолевые иммунные эффекторные клетки, которые преодолевают механизмы надзора иммунной системы, используемые раковыми клетками для предотвращения обнаружения. В некоторых воплощениях настоящее изобретение относится к иммунной клетке, которая экспрессирует химерный антигенный рецептор, причем химерный антигенный рецептор включает один или несколько антигенсвязывающих сайтов агента на основе антитела человека или мультиспецифичного связывающего агента, как описано в данном документе. В некоторых воплощениях иммунные клетки включают Т-клетки, сконструированные для экспрессии антигенсвязывающего сайта агента на основе антитела человека, описанного в данном документе. В некоторых воплощениях антигенсвязывающий сайт представляет собой или включает компонент антитела, описанный в данном документе.
В некоторых воплощениях иммунные клетки включают химерный антигенный рецептор, который является человеческим и/или сконструирован человеком (например, включает одну или несколько аминокислотных замен). В некоторых воплощениях химерный антигенный рецептор включает один, два, три, четыре, пять или более компонентов (например, компоненты антитела, связывающие компоненты, сигнальные компоненты и т.д.). В некоторых воплощениях химерный антигенный рецептор включает трансмембранный компонент и/или внутриклеточный сигнальный компонент. В некоторых воплощениях химерный антигенный рецептор включает компоненты, нативные для иммунной клетки, из которых экспрессируется указанный химерный антигенный рецептор (например, нативный рецептор иммунных клеток). В некоторых воплощениях химерный антигенный рецептор включает один или несколько трансмембранных и/или один или несколько внутриклеточных компонентов полипептида Т-клеточного рецептора (TCR).
Термин «T-клеточный рецептор» или «TCR», при использовании в данном документе, относится к гетеродимерному рецептору, состоящему из цепей αβ или γδ, которые спариваются на поверхности Т-клетки. Каждая цепь α, β, γ и δ состоит из двух Ig-подобных доменов: вариабельной области (V), которая обеспечивает распознавание антигена через CDR в TCR, после которой следует константная область (C), которая привязана к клеточной мембране посредством соединяющего пептид и трансмембранная (ТМ) область, которая, в свою очередь, соединяется с цитоплазматической последовательностью/внутриклеточным компонентом. Область ТМ ассоциирована с инвариантными субъединицами сигнального аппарата CD3. Каждый из доменов TCR V имеет три CDR. Эти CDR взаимодействуют с комплексом между антигенным пептидом, связанным с белком, кодируемым основным комплексом гистосовместимости (pMHC) (см., например, Davis and Bjorkman, 1988, Nature 334: 395-402, Davis et al., 1998, Annu. Rev. Immunol. 16:523-44; Murphy, Kenneth P. Janeway’s Immunobiology. 8th Edition. New York: Garland Science, Taylor & Francis Group, LLC, 2012. Print. Chapters 5 & 6). Последовательности V-домена TCR и CDR, как правило, очень отличаются от последовательностей V-домена и CDR антитела.
В некоторых воплощениях предлагаемый химерный антигенный рецептор (CAR) состоит из гетеродимера первого и второго полипептидов, причем первый полипептид включает вариабельную область тяжелой цепи против CD19, как описано в данном документе, и область ТМ γ-цепи TCR, а второй полипептид включает вариабельную область легкой цепи против CD19, как описано в данном документе, и область ТМ δ-цепи TCR. В некоторых воплощениях первый полипептид гетеродимера CAR включает вариабельную область тяжелой цепи против CD19, как описано в данном документе, и область TM δ-цепи TCR, и второй полипептид включает вариабельную область легкой цепи против CD19, как описано в данном документе, и область ТМ γ-цепи TCR. В некоторых воплощениях предлагаемый химерный антигенный рецептор включает область TM αβ-цепей TCR. В некоторых воплощениях предлагаемый химерный антигенный рецептор включает внутриклеточный домен TCR. В конкретных воплощениях предлагаемый химерный антигенный рецептор включает как область ТМ, так и внутриклеточную область TCR.
В некоторых воплощениях компоненты химерного антигенного рецептора, как описано в данном документе, облегчают связывание иммунной клетки с CD19 + клеткой. В некоторых воплощениях химерный антигенный рецептор, как описано в данном документе, включает компонент антитела, который является или основан на антительном агенте, как описано в данном документе. В некоторых воплощениях описанный в данном документе химерный антигенный рецептор включает компонент антитела, который связывает CD19 человека и дополнительно включает один или несколько цитоплазматических сигнальных доменов полностью или частично и одну или несколько костимулирующих молекул полностью или частично. В некоторых воплощениях компонент антитела химерного антигенного рецептора, как описано в данном документе, представляет собой scFv; в некоторых определенных воплощениях scFv выбирается из таблицы 1.
Мишени
Среди прочего, настоящее изобретение охватывает признание того, что мультиспецифичные связывающие агенты (и/или химерные антигенные рецепторы) и особенно биспецифичные связывающие агенты, такие как биспецифичные антитела, являются особенно полезными и/или эффективными при облегчении уничтожения клеток. В частности, настоящее изобретение демонстрирует, что активность мультиспецифичных связывающих агентов, которые специфически связываются как с эпитопом, связанным с клеткой-мишенью (например, CD19 на раковых клетках), так и с ассоциированным с лимфоцитом эпитопом (например, поверхностным белком Т-клеток), может быть эффективной иммунотерапией B-клеточного заболевания и рака.
Например, в некоторых воплощениях настоящего изобретения мультиспецифичный связывающий агент специфически связывается с эпитопом, ассоциированным с опухолевыми клетками, и с Т-клеточным эпитопом. В соответствии с такими воплощениями мультиспецифичный связывающий агент может облегчать связывание агента с одним или обоими целевыми эпитопами и/или может усиливать уничтожение целевой опухолевой клетки, опосредованное целевой Т-клеткой. Так, например, в некоторых воплощениях настоящего изобретения химерный антигенный рецептор связывает CD19 на раковой клетке. В соответствии с такими воплощениями иммунная клетка может способствовать уничтожению клетки CD19+ после взаимодействия химерного антигенного рецептора с его целевым эпитопом.
В некоторых воплощениях клетки-мишени, подлежащие уничтожению, включают, например, клетки, которые экспрессируют CD19 (например, клетки лимфомы или лейкоза). Специалисты в данной области техники будут знать подходящие целевые эпитопы на таких клетках, с которыми желательно связывать многоспецифичные связывающие агенты, как описано в данном документе.
В некоторых воплощениях клетки лимфоцитов, которые могут опосредовать уничтожение клеток-мишеней, как описано в данном документе, включают Т-клетки (например, CD8+ Т-клетки), клетки-естественные киллеры (NK), макрофаги, гранулоциты и антителозависимые цитотоксические клетки. Специалистам в данной области техники будет известно о соответствующих целевых эпитопах на таких лимфоцитах, с которыми желательно связывать мультиспецифичные связывающие агенты, описанные в данном документе. Такие репрезентативные эпитопы можно найти на антигенах, таких как, например, Fc-рецептор IgG (например, FcγRIIB), CD1d, CD3 (например, CD3γ, CD3δ, CD3ε, CD3ζ и т.д.), CD4, CD7, CD8, CD13, CD14, CD16, CD27, CD28, CD31, CD38, CD40L, CD56, CD68, MAC-l/MAC-3, IL-2Ra, OX40, GITR, HVEM, Ly49 и CD94, CD137.
Нуклеотидная конструкция и экспрессия
Агенты на основе антитела человека (например, человеческие моноклональные антитела, scFv и т.д.), мультиспецифичные связывающие агенты (например, биспецифичные антитела) и химерные антигенные рецепторы, как описано в данном документе, могут быть получены из молекул нуклеиновых кислот с использованием молекулярно-биологических способов, известных в данной области, Молекулы нуклеиновой кислоты вводят в вектор, который способен экспрессировать химерные белки при введении в соответствующую клетку-хозяина. Соответствующие клетки-хозяева включают, без ограничения указанным, клетки бактерий, дрожжей, насекомых и млекопитающих. Любой из способов, известных специалисту в данной области для введения фрагментов ДНК в вектор, может быть использован для конструирования экспрессирующих векторов, кодирующих химерные белки по настоящему изобретению, под контролем сигналов транскрипционного/трансляционного управления. Эти способы могут включать in vitro рекомбинантную ДНК и синтетические методы и рекомбинацию in vivo (см. Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Harbor Laboratory, Current Protocols in Molecular Biology, Eds. Ausubel, et al, Greene Publ. Assoc., Wiley-Interscience, NY).
Экспрессия молекул нуклеиновых кислот в соответствии с настоящим изобретением может регулироваться второй последовательностью нуклеиновой кислоты, так что молекула экспрессируется в хозяине, трансформированном молекулой рекомбинантной ДНК. Например, экспрессия нуклеотидных молекул по изобретению может контролироваться промоторным и/или энхансерным элементом, которые известны в данной области.
Нуклеотидные конструкции включают области, которые кодируют мультиспецифичные связывающие белки (или химерные антигенные рецепторы), полученные из антител и/или компонентов антитела. Как правило, такие мультиспецифичные связывающие белки (или химерные антигенные рецепторы) будут получены из областей VH и/или VL. После идентификации и отбора антител, проявляющих требуемые связывающие и/или функциональные свойства, вариабельные области каждого антитела выделяют, амплифицируют, клонируют и секвенируют. Модификации могут быть внесены в нуклеотидные последовательности VH и VL, включая добавления нуклеотидных последовательностей, кодирующих аминокислоты и/или несущие сайты рестрикции, делеции нуклеотидных последовательностей, кодирующих аминокислоты, или замены нуклеотидных последовательностей, кодирующих аминокислоты. Антитела и/или антительные компоненты могут быть получены из человеческих, нечеловеческих (например, из грызунов), гуманизированных или химерных антител.
Нуклеотидные конструкции по настоящему изобретению вводят в экспрессирующий вектор или вирусный вектор способами, известными в данной области, и нуклеотидные молекулы функционально связаны с последовательностью контроля экспрессии.
При необходимости нуклеотидные последовательности, которые кодируют агенты на основе антитела человека, мультиспецифичные связывающие агенты и химерные антигенные рецепторы, как описано в данном документе, могут быть модифицированы так, чтобы включать кодоны, которые оптимизированы для экспрессии в конкретном типе клеток или в организме (например, см. Патент США № 5,670,356 и 5,874,304). Оптимизированные по кодонам последовательности представляют собой синтетические последовательности и предпочтительно кодируют идентичный полипептид (или биологически активный фрагмент полноразмерного полипептида, который имеет практически такую же активность, как и полный полипептид), кодируемый исходным полинуклеотидом, не оптимизированным по кодонам. В некоторых воплощениях кодирующая область генетического материала, кодирующего компоненты антитела, полностью или частично может включать измененную последовательность для оптимизации использования кодонов для конкретного типа клеток (например, эукариотической или прокариотической клетки). Например, кодирующая последовательность для вариабельной области тяжелой (или легкой) цепи человека, как описано в данном документе, может быть оптимизирована для экспрессии в бактериальных клетках. В ином случае, кодирующая последовательность может быть оптимизирована для экспрессии в клетке млекопитающего (например, CHO). Такая последовательность может быть описана как последовательность, оптимизированная по кодонам.
Экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, трансформируют в подходящую клетку-хозяина, чтобы обеспечить получение белка, кодируемого нуклеотидными конструкциями. Примеры клеток-хозяев включают прокариоты (например, E.coli) и эукариоты (например, COS или клетка CHO). Клетки-хозяева, трансформированные экспрессирующим вектором, выращивают в условиях, позволяющих продуцировать агент на основе антитела человека, мультиспецифичный связывающий агент или химерный антигенный рецептор по настоящему изобретению с последующим извлечением человеческого моноклонального антитела, мультиспецифичного связывающего агента или химерного антигенного рецептора. В некоторых воплощениях клетки-хозяева включают те, которые демонстрируют вариантный паттерн гликозилирования в одном или нескольких экспрессированных полипептидах (см., например, патенты США № 8,080,415 и 8,084,222).
Агенты на основе антитела человека и/или мультиспецифичные связывающие агенты настоящего изобретения могут быть очищены любым способом, который позволяет последующее образование стабильного антитела или молекулы связывающего агента. Например, не желая связывать себя какой-либо конкретной теорией, отметим, что агенты на основе антитела человека и/или мультиспецифичные связывающие агенты могут быть выделены из клеток либо в виде растворимых полипептидов, либо в виде телец включения, из которых они могут быть экстрагированы количественно 8М гуанидингидрохлоридом и диализом. Для дальнейшей очистки агентов на основе антитела человека и/или мультиспецифичных связывающих агентов по настоящему изобретению может быть использована обычная ионообменная хроматография, хроматография с гидрофобным взаимодействием, обратная фазовая хроматография или гель-фильтрация. Агенты на основе антитела человека и/или мультиспецифичные связывающие агенты по настоящему изобретению также могут быть выделены из кондиционированных сред после секреции из эукариотических или прокариотических клеток.
Химерные антигенные рецепторы, экспрессируемые на поверхности иммунных клеток, могут быть получены способами, известными в данной области. Как правило, экспрессирующий вектор, несущий нуклеотидную последовательность, которая кодирует полипептид химерного антигенного рецептора, трансформируется в клетку-хозяина для экспрессии. Как описано выше, такая клетка-хозяин может представлять собой клеточную линию или первичные изоляты клеток человека, такие как Т-клетки из РВМС. Экспрессирующий вектор также может включать последовательность, которая кодирует сигнальный пептид и/или трансмембранный домен и/или сигнальный домен таким образом, чтобы экспрессия химерного антигенного рецептора была направлена на клеточную мембрану. Такие сигнальные пептиды известны специалистам в данной области. Экспрессирующий вектор, который кодирует полипептид химерного антигенного рецептора, вводится в клетку-хозяин способами, известными в данной области, которые включают, например, трансфекцию ДНК, электропорацию, трансфекцию и инфекцию (например, с вирусом, таким как аденовирус или ретровирус).
В некоторых воплощениях нуклеотидные молекулы, кодирующие химерный антигенный рецептор, как описано в данном документе, обеспечивают экспрессию в Т-клетке, тем самым позволяя получить Т-клетки с химерным антигенным рецептором (CAR-T). Нуклеотидная молекула, кодирующая химерный антигенный рецептор, может быть включена в один или несколько векторов (например, лентивирусный или ретровирусный вектор) для экспрессии в иммунной эффекторной клетке-хозяине, такой как Т-клетка. Примерные иммунные клетки включают Т-клетки, клетки-естественные киллеры (NK), цитотоксические Т-лимфоциты (CTL) и регуляторные Т-клетки. Способы получения нуклеотидных молекул, кодирующих химерные антигенные рецепторы и Т-клетки, включая такие химерные антигенные рецепторы, известны в данной области (см., например, Till, B.G. et al., 2008, Blood 112(6):2261-71; Brentjens, R. et al., 2010, Molecular Therapy 18(4):666-8; Morgan, R.A. et al., 2010, Molecular Therapy 18(4):843-51; Park, T.S. et al., 2011, Trends Biotechnol. 29(11):550-7; Grupp, S.A. et al., 2013, N. Engl. J. Med. 368(16):1509-18; Han, E.Q. et al., 2013, J. Hematol. Oncol. 6:47; WO 2012/079000, WO 2013/126726; и публикацию заявки на патент США № 2012/0213783).
Конъюгаты
В данной области известно несколько технологий присоединения или конъюгации терапевтического или детектирующего агента к антительному агенту. Некоторые технологии прикрепления включают использование металлического хелатного комплекса, использующего, например, присоединенный к антителу органический хелатирующий агент, такой ангидрид диэтилентриаминпентауксусной кислоты (DTPA); этилентриаминтетрауксусная кислота; N-хлор-p-толуолсульфонамид; и/или тетрахлор-3α-6α-дифенилгликурид-3, (см., например, патенты США № 4,472,509 и 4,938,948). Предлагаемые агенты на основе антитела человека также могут взаимодействовать с ферментом в присутствии сшивающего агента, такого как глутаровый альдегид или периодат. Например, конъюгаты с флуоресцеиновыми маркерами готовят в присутствии этих сшивающих агентов или путем взаимодействия с изотиоцианатом.
В некоторых воплощениях агент на основе антитела человека, описанный в данном документе, связан с объектом полезной нагрузки. В некоторых воплощениях объект полезной нагрузки представляет собой терапевтический агент или включает его; в некоторых воплощениях объект полезной нагрузки представляет собой или включает детектирующий агент.
Защитные группы
Агенты на основе антитела человека (или мультиспецифичные связывающие агенты или химерные антигенные рецепторы) по настоящему изобретению могут быть снабжены защитными группами, которые известны в данной области. Не желая связывать себя какой-либо конкретной теорией, отметим, что добавление защитной группы может в некоторых воплощениях улучшить одну или несколько характеристик полипептида или пептида, к которому добавлена защитная группа, например, стабильность и/или эффективность. В некоторых воплощениях агенты на основе антитела человека (или мультиспецифичные связывающие агенты или химерные антигенные рецепторы), описанные в данном документе, могут содержать одну или несколько (например, одну, две, три, четыре, пять или более) защитных групп. Защитные группы могут быть соединены с N- и/или С-концевым полипептидом или полипептидной цепью агента на основе антитела человека (или мультиспецифичного связывающего агента или химерного антигенного рецептора), как описано в данном документе. Защитные группы, подходящие для применения в соответствии с настоящим изобретением, включают те, которые описаны в предварительной заявке на патент США № 62/131, 128, которая включена в данном документе в качестве ссылки.
Терапевтические агенты
Терапевтические агенты могут быть или содержать любой класс химического вещества, включая, например, белки, углеводы, липиды, нуклеиновые кислоты, малые органические молекулы, небиологические полимеры, металлы, ионы, радиоизотопы и т.д. В некоторых воплощениях, терапевтические агенты для применения в соответствии с настоящим изобретением могут иметь биологическую активность, относящуюся к лечению одного или нескольких симптомов или причин рака. В некоторых воплощениях терапевтические агенты для применения в соответствии с настоящим изобретением могут иметь биологическую активность, относящуюся к модуляции иммунной системы и/или к усилению опосредованной Т-клетками цитотоксичности. В некоторых воплощениях терапевтические агенты для применения в соответствии с настоящим изобретением имеют одно или несколько других видов активностей.
В некоторых воплощениях конъюгированный терапевтический агент представляет собой радиоизотоп, лекарственный конъюгат, наночастицу, иммунный токсин или любую другую терапевтическую полезную нагрузку.
Детектирующие агенты
Детектирующий агент включает любую часть, которая может быть обнаружена с использованием анализа, например, из-за его конкретных функциональных свойств и/или химических характеристик. Неограничивающие примеры таких агентов включают ферменты, радиоактивные метки, гаптены, флуоресцентные метки, фосфоресцирующие молекулы, хемилюминесцентные молекулы, хромофоры, люминесцентные молекулы, молекулы фотоаффинности, цветные частицы или лиганды, такие как биотин.
В данной области известно множество детектирующих агентов, а также системы их присоединения к антителам (см., например, патенты США № 5021236, 4938948 и 447509). Примеры таких детектирующих агентов включают парамагнитные ионы, радиоактивные изотопы, флуорохромы, ЯМР-детектируемые вещества, рентгеновские средства визуализации и другие. Например, в некоторых воплощениях парамагнитный ион представляет собой один или несколько из числа хрома (III), марганца (II), железа (III), железа (II), кобальта (II), никеля (II), меди (II) неодимия (III), самария (III), иттербия (III), гадолиния (III), ванадия (II), тервия (III), диспрозия (III), гольмия (III), эрбия (III), лантана (III) золота (III), свинца (II) и/или висмута (III).
Радиоактивный изотоп может быть одним или несколькими из числа актиния-225, астатина-211, висмута-212, углерода-14, хрома-51, хлора-36, кобальта-57, кобальта-58, меди-67, европиума-152, галлия -67, водорода-3, йода-123, йода-124, йода-125, йода-131, индия-111, железа-59, свинца-212, лютеция-177, фосфора-32, радия-223, радия-224, рения-186, рения-188, селена-75, серы-35, технеция-99м, тория-227, иттрия-90 и циркония-89. Радиоактивно меченные агенты на основе антитела человека могут быть получены в соответствии с хорошо известными технологиями в данной области. Например, моноклональные антитела могут иодироваться путем контакта с иодидом натрия и/или калия и химическим окисляющим агентом, таким как гипохлорит натрия, или ферментативным окислителем, таким как лактопероксидаза. Предлагаемые агенты на основе антитела человека могут быть помечены технецием-99m процессом обмена лиганда, например, путем восстановления пертехнатата раствором олова, хелатирования восстановленного технеция на колонке Sephadex и нанесения антитела на эту колонку. В некоторых воплощениях, предлагаемые агенты на основе антитела человека помечены с использованием методов прямого мечения, например, путем инкубации пертехната, восстанавливающего агента, такого как SNCl2, буферного раствора, такого как раствор фталата натрия и калия, и антитела. В некоторых воплощениях, предлагаемые агенты на основе антитела человека могут быть конъюгированы с промежуточными функциональными группами. Промежуточные функциональные группы часто используются для связывания радиоизотопов, которые существуют в виде металлических ионов, с антителами. Радиоактивные изотопы могут быть обнаружены, например, путем дозиметрии.
Флуоресцентная метка может представлять собой или включать один или несколько из числа Alexa 350, Alexa 430, AMCA, BODIPY 630/650, BODIPY 650/665, BODIPY-FL, BODIPY-R6G, BODIPY-TMR, BODIPY-TRX, Cascade Blue, Cy3, Cy5,6-FAM, изотиоцианата флуоресцеина, HEX, 6-JOE, Oregon Green 488, Oregon Green 500, Oregon Green 514, Pacific Blue, REG, Rhodamine Green, Rhodamine Red, Renographin, ROX, TAMRA, TET, Tetramethylrhodamine и/или Texas Red, наряду с прочими.
В некоторых воплощениях конъюгированный детектирующий агент является диагностическим или визуализирующим агентом.
Скрининг, детекция и терапевтические способы
Агенты на основе антитела человека, мультиспецифичные связывающие агенты и/или химерные антигенные рецепторы по настоящему изобретению также могут быть использованы в способах скрининга in vitro или in vivo, когда желательно обнаруживать и/или измерять одно или несколько активностей клетки или клеток (например, апоптоз или рост клеток). Способы скрининга хорошо известны в данной области и включают бесклеточные, клеточные и животные анализы. Анализы in vitro могут представлять собой детекцию молекулы-мишени либо в твердом состоянии, либо в растворимом и могут быть осуществлены множеством путей, известных в данной области, включая применение метки или детектируемой группы, способной идентифицировать агент на основе антитела человека, мультиспецифичный связывающий агент или химерный антигенный рецептор, который связан с молекулой-мишенью (например, антигеном клеточной поверхности). Детектируемые метки могут применяться в сочетании с анализами с использованием агентов на основе антител человека, мультиспецифичных связывающих агентов или химерных антигенных рецепторов по настоящему изобретению.
Способность агентов на основе антитела человека, мультиспецифичных связывающих агентов и/или химерных антигенных рецепторов по настоящему изобретению проявлять высокую аффинность и/или специфичность к CD19 делает их терапевтически полезными для эффективного нацеливания клеток, экспрессирующих CD19 (например, клеток лимфомы или лейкоза). Таким образом, в некоторых воплощениях может быть желательно увеличить аффинность агента на основе антитела человека или мультиспецифичного связывающего агента для одного целевого антигена (например, CD19), а не другого целевого антигена, который также связывается с помощью мультиспецифичного связывающего агента (или Fc-рецептора в случае человеческого моноклонального антитела). Например, в контексте уничтожения опухоли определенные состояния могут выиграть от увеличения аффинности к опухолевому антигену (например, CD19), но не к антигену на поверхности клетки, способного опосредовать уничтожение опухоли (например, Т-клетки). Таким образом, может быть полезным увеличить аффинность связывания и/или специфичность агента на основе антитела человека, мультиспецифичного связывающего агента или химерного антигенного рецептора к опухолевому антигену у пациента, имеющего опухоль, которая экспрессирует опухолевый антиген посредством применения агента на основе антитела человека, мультиспецифичного связывающего агента или химерного антигенного рецептора, описанных в данном документе.
Настоящее изобретение относится к агенту на основе антитела человека, мультиспецифичному связывающему агенту и/или химерному антигенному рецептору, как описано в данном документе, в качестве терапевтического средства для лечения пациентов с опухолью, которая экспрессирует антиген, который способен связываться с ними. Такие агенты на основе антитела человека, мультиспецифичные связывающие агенты и/или химерные антигенные рецепторы могут быть использованы в способе лечения организма человека или животного или в способе диагностики.
В некоторых воплощениях предлагаемый агент, на основе антитела человека, мультиспецифичный связывающий агент или химерный антигенный рецептор полезен в медицине. В некоторых воплощениях агент на основе антитела человека, мультиспецифичный связывающий агент или химерный антигенный рецептор, полезен (например, в качестве профилактического средства) при лечении или профилактике ассоциированного с CD19 заболевания или рака. В некоторых воплощениях предлагаемый агент на основе антитела человека, мультиспецифичный связывающий агент или химерный антигенный рецептор полезен для лечения пациентов, которые демонстрируют отрицательные последствия, связанные или коррелирующие с CD20-ассоциированным заболеванием или раком (например, неэффективная интернализация). В некоторых воплощениях предлагаемый агент на основе антитела человека, мультиспецифичный связывающий агент или химерный антигенный рецептор полезны в терапевтических применениях, например, у индивидуумов, страдающих или связанных с ассоциированным с CD19 заболеванием или раком.
Введение
Настоящее изобретение относится к способам введения эффективного количества терапевтического активного вещества, описанного в данном документе (например, агента на основе антитела человека, мультиспецифичного связывающего агента или химерного антигенного рецептора) объекту, нуждающемуся в лечении.
Агенты на основе антитела человека, мультиспецифичные связывающие агенты или химерный антигенный рецептор, описанные в данном документе, могут вводиться различными способами, известными в данной области, для терапевтической доставки агентов, таких как белки или нуклеиновые кислоты, могут быть использованы для терапевтической доставки агента на основе антитела человека, мультиспецифичного связывающего агента или химерного антигенного рецептора или нуклеиновой кислоты, кодирующей агент на основе антитела человека, мультиспецифичный связывающий агент или химерный антигенный рецептор по настоящему изобретению для уничтожения или ингибирования роста клеток-мишеней у объекта, например, клеточной трансфекцией, генной терапией, прямым введением с носителем доставки или фармацевтически приемлемым носителем, непрямой доставкой путем обеспечения рекомбинантных клеток, содержащих нуклеиновую кислоту, кодирующую агент на основе антитела человека, мультиспецифичный связывающий агент или химерный антигенный рецептор по настоящему изобретению.
Различные системы доставки известны и могут быть использованы для введения агента на основе антитела человека, мультиспецифичного связывающего агента или химерного антигенного рецептора по настоящему изобретению, например, инкапсулирование в липосомах, микрочастицах, микрокапсулах, рекомбинантных клетках, способных экспрессировать указанный антительный агент, мультиспецифичный связывающий агент или химерный антигенный рецептор, рецептор-опосредованный эндоцитоз (см., например, Wu and Wu, 1987, J. Biol.Chem. 262:4429-32), конструирование нуклеиновой кислоты как части ретровирусного или другого вектора и т.д. Пути введения могут быть энтеральными или парентеральными и включают, без ограничения указанным, внутривенный, подкожный, внутримышечный, парентеральный, трансдермальный или трансмукозальный (например, оральный или носовой). В некоторых воплощениях агенты на основе антитела человека, мультиспецифичные связывающие агенты или химерные антигенные рецепторы по настоящему изобретению вводят внутривенно. В некоторых воплощениях агенты на основе антитела человека, мультиспецифичные связывающие агенты или химерные антигенные рецепторы по настоящему изобретению вводят подкожно. В некоторых воплощениях агенты на основе антитела человека, мультиспецифичные связывающие агенты или химерные антигенные рецепторы по настоящему изобретению вводят вместе с одним или несколькими биологически активными агентами.
Фармацевтические композиции
Настоящее изобретение также относится к фармацевтическим композициям, содержащим агенты на основе антитела человека, мультиспецифичные связывающие агенты или химерные антигенные рецепторы по настоящему изобретению и фармацевтически приемлемый носитель или эксципиент. Композиция, при необходимости, может также содержать одно или несколько дополнительных терапевтически активных веществ.
В некоторых воплощениях фармацевтические композиции, содержащие химерный антигенный рецептор, могут быть предоставлены в виде вируса (например, лентивируса или ретровируса), используемого для инфицирования аутологичных Т-клеток, выделенных из объекта. В таких воплощениях аутологичные Т-клетки инфицируются вирусом, который был сконструирован для экспрессии химерного антигенного рецептора, как описано в данном документе, при этом создаются Т-клетки химерного антигенного рецептора для реинфузии в объект (например, в пациента-человека).
В некоторых воплощениях фармацевтические композиции, содержащие химерный антигенный рецептор, могут быть снабжены клеткой-хозяином (или их популяциями), экспрессирующими указанный химерный антигенный рецептор, и фармацевтически-акцепторным носителем. Примеры клеток-хозяев включают Т-клетки или NK-клетки и могут быть аутологичными или аллогенными. Таким образом, клетки-хозяева, экспрессирующие химерный антигенный рецептор, как описано в данном документе, могут быть включены в фармацевтическую композицию для введения объекту (например, человеку). Такие фармацевтические композиции могут содержать популяцию клеток-хозяев, экспрессирующих те же или разные (два, три, четыре и т.д.) химерные антигенные рецепторы, описанные в данном документе. В ином случае, фармацевтическая композиция, содержащая клетку-хозяин, экспрессирующую химерный антигенный рецептор, описанный в данном документе, может дополнительно содержать один или несколько дополнительных фармацевтически активных агентов или лекарственных средств, таких как, например, химиотерапевтические агенты, например аспарагиназа, бусульфан, карбоплатин, цисплатин, даунорубицин, доксорубицин, фторурацил, гемцитабин, гидроксимочевина, метотрексат, паклитаксел, ритуксимаб, винбластин, винкристин и т.д. В различных воплощениях фармацевтическая композиция, содержащая химерный антигенный рецептор, описанный в данном документе, предлагается в виде клетки-хозяина, экспрессирующей указанный химерный антигенный рецептор, или ее популяции.
Хотя описания фармацевтических композиций, представленные в данном документе, в основном направлены на фармацевтические композиции, которые подходят для этического введения людям, специалисту в данной области техники будет понятно, что такие композиции обычно подходят для введения животным всех видов. Модификация фармацевтических композиций, подходящих для введения людям с тем, чтобы сделать композиции, подходящие для введения различным животным, хорошо понятна, и квалифицированный ветеринарный фармаколог может спроектировать и/или осуществить такую модификацию с помощью простых, в случае необходимости, экспериментов.
Фармацевтические композиции могут быть представлены в стерильной инъекционной форме (например, форме, подходящей для подкожной инъекции или внутривенной инфузии). Например, в некоторых воплощениях фармацевтические композиции предлагаются в жидкой лекарственной форме, которая подходит для инъекций. В некоторых воплощениях фармацевтические композиции предлагаются в виде порошков (например, лиофилизированных и/или стерилизованных), необязательно под вакуумом, которые перед инъекцией восстанавливают водным разбавителем (например, водой, буфером, солевым раствором и т.д.). В некоторых воплощениях фармацевтические композиции разбавляют и/или восстанавливают в воде, растворе хлорида натрия, растворе ацетата натрия, растворе бензилового спирта, забуференном фосфатом физиологическом растворе и т.д. В некоторых воплощениях порошок следует осторожно смешать с водным разбавителем (например, не встряхивая).
Составы фармацевтических композиций, описанных в данном документе, могут быть получены любым способом, известным или в дальнейшем разработанным в области фармакологии. В общем, такие подготовительные способы включают стадию привнесения активного ингредиента к разбавителю или другому эксципиенту и/или одному или нескольким другим вспомогательным ингредиентам, а затем, при необходимости и/или желании, формование и/или упаковывание продукта в желаемую одно- или многодозовую единицу.
Фармацевтическая композиция по настоящему изобретению может быть приготовлена, упакована и/или продана в насыпную, в виде единичной дозы и/или в виде множества единичных доз. При использовании в данном документе термин «единичная доза» представляет собой дискретное количество фармацевтической композиции, содержащее заданное количество активного ингредиента. Количество активного ингредиента обычно равно дозе активного ингредиента, которая вводится объекту и/или удобной фракции такой дозы, такой как, например, половина или одна треть такой дозы.
Относительные количества активного ингредиента, фармацевтически приемлемого эксципиента и/или любых дополнительных ингредиентов в фармацевтической композиции по настоящему изобретению будут варьировать в зависимости от идентичности, размера и/или состояния объекта, подвергаемого лечению, а также в зависимости от пути, которым вводится композиция. В качестве примера композиция может содержать от 0,1% до 100% (масс./масс.) активного ингредиента.
Фармацевтические композиции могут дополнительно содержать фармацевтически приемлемый эксципиент, который, при использовании в данном документе, включает любые и все растворители, дисперсионные среды, разбавители или другие жидкие носители, дисперсионные или суспензионные средства, поверхностно-активные вещества, изотонические агенты, загущающие или эмульгирующие агенты, консерванты, твердые связующие вещества, смазывающие вещества и тому подобное, в соответствии с искомой конкретной дозированной формой. Remington's Science and Practice of Pharmacy, 21-е издание, AR Gennaro (Lippincott, Williams & Wilkins, Baltimore, MD, 2006) раскрывает различные эксципиенты, используемые при составлении фармацевтических композиций и известных методах их получения. За исключением случаев, когда любая обычная среда-эксципиент несовместима с веществом или его производными, например, путем индукции какого-либо нежелательного биологического эффекта или иным образом взаимодействуя вредным образом с любым другим компонентом(ами) фармацевтической композиции, предполагается, что ее применение находится в пределах объема настоящего изобретения.
В некоторых воплощениях фармацевтически приемлемый эксципиент имеет чистоту, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100%. В некоторых воплощениях эксципиент одобрен для применения на людях. В некоторых воплощениях эксципиент одобрен для применения в ветеринарии. В некоторых воплощениях эксципиент одобрен Управлением по контролю за продуктами и лекарствами США. В некоторых воплощениях эксципиент имеет фармацевтическую степень чистоты. В некоторых воплощениях эксципиент соответствует стандартам Фармакопеи США (USP), Европейской фармакопеи (EP), Британской фармакопеи и/или Международной фармакопеи.
Фармацевтически приемлемые эксципиенты, используемые при изготовлении фармацевтических композиций, включают, без ограничения указанным, инертные разбавители, диспергирующие и/или гранулирующие агенты, поверхностно-активные вещества и/или эмульгаторы, агенты для улучшения распадаемости, связывающие агенты, консерванты, буферные агенты, смазывающие агенты, и/или масла. Такие эксципиенты могут быть необязательно включены в фармацевтические составы. Вспомогательные вещества, такие как масло какао и суппозиторные воски, красители, агенты для покрытия, подсластители, ароматизаторы и/или отдушки, могут присутствовать в композиции в соответствии с суждением составителя рецептуры.
В некоторых воплощениях предлагаемые фармацевтические композиции содержат один или несколько фармацевтически приемлемых эксципиентов (например, консервант, инертный разбавитель, диспергирующий агент, поверхностно-активный агент и/или эмульгатор, буферный агент и т.д.). В некоторых воплощениях фармацевтические композиции содержат один или несколько консервантов. В некоторых воплощениях фармацевтические композиции не содержат консервантов.
В некоторых воплощениях фармацевтические композиции предлагаются в форме, которая может быть охлаждена и/или заморожена. В некоторых воплощениях фармацевтические композиции предлагаются в форме, которая не может быть охлаждена и/или заморожена. В некоторых воплощениях восстановленные растворы и/или жидкие лекарственные формы могут храниться в течение определенного периода времени после восстановления (например, 2 часа, 12 часов, 24 часа, 2 дня, 5 дней, 7 дней, 10 дней, 2 недели, месяц, два месяца или более). В некоторых воплощениях хранение композиций на основе антител дольше, чем указанное время, приводит к деградации объекта на основе антитела.
Жидкие лекарственные формы и/или восстановленные растворы могут включать взвешенные частицы и/или обесцвечивание перед введением. В некоторых воплощениях раствор не следует использовать, если он обесцвечивается или мутный и/или если взвешенные частицы остаются после фильтрации.
Общие соображения в составлении и/или изготовлении фармацевтических агентов можно найти, например, в Remington: Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005.
Наборы
Кроме того, настоящее изобретение относится к фармацевтической упаковке или набору, содержащему один или несколько контейнеров, заполненных, по меньшей мере, одним агентом на основе антитела человека, мультиспецифическим связывающим агентом (например, биспецифическим антителом) или химерным антигенным рецептором (или иммунной эффекторной клеткой с химерным антигенным рецептором), которые описаны в данном документе. Наборы могут использоваться в любом применимом способе, включая, например, диагностический. Необязательно с таким контейнером (контейнерами) может быть ассоциировано уведомление в форме, предписанной правительственным учреждением, регулирующим производство, применение или продажу фармацевтических средств или биологических продуктов, уведомление о которых отражает (а) одобрение органом по производству, применение или продажу для введения людям, (b) направления для применения, или и то, и другое.
Другие признаки изобретения станут очевидными в ходе следующих описаний примерных воплощений, которые приведены для иллюстрации изобретения и не предназначены для его ограничения. Вся патентная и непатентная литература, приведенная в данном документе, включена в настоящее описание ссылкой полностью.
Примеры
Следующие примеры предлагаются для того, чтобы дать специалистам в данной области описание того, как создавать и использовать способы и композиции по изобретению, и не предназначены для ограничения объема того, что авторы считают своим изобретением. Если не указано иное, температура указана в градусах Цельсия, а давление равно или вблизи атмосферного.
Пример 1. Получение и отбор агентов на основе антитела человека, специфичных к CD19 человека
Этот пример демонстрирует продуцирование агентов на основе антитела человека, специфичных к CD19 человека. В частности, этот пример демонстрирует получение человеческих одноцепочечных вариабельных фрагментов (scFv), которые специфически связывают CD19 человека в нативном формате. Агенты на основе антитела человека, описанные в данном документе, были разработаны с использованием наивных или полусинтетических библиотек человеческих антител, полученных из нормальных доноров и/или доноров с аутоиммунными заболеваниями, и отобранных на основе высокой специфичности к CD19 человека пэннингом на CD19 человека, экспрессируемого на клеточной поверхности, в его нативной конформации. Таким образом, такие агенты на основе антитела человека обеспечивают ценный источник компонентов антитела для создания, среди прочего, полноразмерных IgG, мультиспецифичных связывающих агентов и химерных антигенных рецепторов, которые в противном случае могут быть удалены из репертуаров, обнаруженных в природе.
Вкратце примерный план разработке анти-CD19 антительных агентов приведен в Таблице 4. Способ начинался с идентификации анти-CD19 человека и биологически активных антительных агентов из фаговой библиотеки Eureka ALPHA™. Лучшие кандидаты на антительные агенты подвергались созреванию аффинности с образованием антительных агентов с улучшенной аффинностью связывания и лучшей цитотоксичностью против раковых клеток-мишеней.
Для отбора агентов на основе антитела человека, специфичных к CD19 человека, была использована коллекция библиотек для фагового дисплея человеческих scFv-антител (разнообразие = 10×1010), сконструированных в Eureka Therapeutics, и обозначенных как фаговые библиотеки ALPHA™. Фаговые библиотеки ALPHA™ включали наивные библиотеки, состоящие из полностью наивных репертуаров тяжелой и легкой цепи человека и полусинтетические библиотеки, содержащие полностью наивные репертуары легкой цепи человека и полусинтетические тяжелые цепи с полностью рандомизированными регионами CDR3 тяжелой цепи. Наивные рецепторы антител клонировали из РВМС и селезенки здоровых доноров или из РВМС доноров аутоиммунных заболеваний (таких как системная красная волчанка и ревматоидный артрит). Библиотеки scFv использовали для пэннинга против рекомбинантного химерного белка CD19 ECD-Fc человека и положительных по CD19 человека клеток, включая клетки Raji и 3T3-CD19 (описанные ниже). Для белкового пэннинга Fc-химерный белок непосредственно наносили на 96-луночные планшеты и смешивали с фаговыми библиотеками scFv человека. После продолжительной промывки буфером PBS, связанные клоны элюировали и использовали для заражения E.coli XL1-Blue. Для клеточного пэннинга, клетки 3T3-CD19 или Raji сначала смешивали с фаговыми библиотеками с scFv человека. После продолжительной промывки PBS клетки со связанным фагом с scFv-антителом, центрифугировали. Связанные клоны затем элюировали и использовали для инфицирования клеток E.coli XL1-Blue. Фаговые клоны экспрессировали в бактериях и очищали. Пэннинг проводили в течение трех-четырех раундов, чтобы обогатить клоны scFv-фага, которые специфически связывали внеклеточный участок человеческого CD19.
Как показано в таблице 5 (Сводка фагового дисплея ALPHA ™), в тех случаях, когда белковый пэннинг был включен в стадии пэннинга, а связывание ELISA против рекомбинантного химерного белка CD19 ECD-Fc человека использовали в качестве метода скрининга первичного фагового клона, только один уникальный клон антитела был идентифицирован как связывающий CD19 человека на клеточной поверхности после скрининга 762 фаговых клонов из пулов, обогащенных пэннингом. Авторы затем выполняли только клеточный пэннинг и использовали положительную по CD19 человека клеточную линию в анализе FACS в качестве основного метода скрининга. Семь дополнительных уникальных клонов, которые связывали CD19 человека на клеточной поверхности, были идентифицированы из 690 клонов, подвергнутых скринингу с использованием этой кампании пэннинга.
Для анализа ELISA стандартные планшеты для ELISA были покрыты человеческим CD19 ECD-Fc или отрицательным контролем 901-Fc, соответственно. Отдельные фаговые клоны из обогащенных пэннингом пулов фагового дисплея инкубировали в покрытых планшетах. Связывание фаговых клонов детектировали HRP-конъюгированными антителами против M13 и окрашивали с помощью HRP-субстрата. Абсорбцию считывали при 450 нм. Было идентифицировано несколько человеческих CD19-ELISA-специфичных фаговых клонов, и примерные клоны представлены на фиг. 1A. Среди подвергнутых скринингу 762 фаговых клонов было обнаружено, что 85 уникальных клонов антител являются специфичными к hCD19, в соответствии с определением с помощью ELISA.
ELISA-положительные фаговые клоны затем тестировали на связывание CD19 на клеточной поверхности с помощью проточной цитометрии с использованием положительных по CD19 человека клеточных линий Raji и 3T3-hCD19 и отрицательных по CD19 человека линий Jurkat и 3T3 (фиг. 1B). Клетки сначала окрашивали очищенными scFv-фаговыми клонами с последующим смешиванием с моноклональным антителом против M13 мыши и, наконец, конъюгированным с R-PE IgG лошади против мышиных антител (Vector Labs). Каждую стадию окрашивания проводили в диапазоне 30-60 мин. на льду и клетки дважды промывали между окрашиваниями. Один уникальный клон, 37, был идентифицирован как специфически связывающий положительные по CD19 человека клетки Raji и 3T3-CD19, а не отрицательные по hCD19 клетки Jurkat и 3T3 (фиг. 1B).
Результаты поиска после второго скрининга, при котором фаговые клоны отбирали клеточным пэннингом, были протестированы только на связывание с CD19 человека непосредственно на клеточной поверхности без использования скрининга связывания ELISA. Как показано на фиг. 2, примерные клоны 4, 5 и 6 продемонстрировали специфическое связывание с клетками Raji, тогда как клон 7 также продемонстрировал некоторое обнаруживаемое связывание с нокаут-клетками Raji-CD19.
Как показано в этом примере, эффективность фагового пэннинга антитела к CD19 человека была очень низкой, поскольку из 1452 отдельных фаговых клонов, идентифицированных с помощью первичных скринингов, было идентифицировано только восемь специфичных и уникальных (по последовательностям) клонов. Один клон (37) был получен из наивной библиотеки аутоиммунных заболеваний, а семь других клонов были получены из наивных или полусинтетических библиотек антител человека, полученных из нормальных донорных В-клеток.
Таблица 4
Таблица 5
(Скрининг ELISA)
(Скрининг FACS)
Пример 2. Получение биспецифичных антительных конструкций с использованием агентов на основе антитела человека против CD19 человека
Этот пример демонстрирует конструирование мультиспецифичных связывающих агентов с использованием человеческих scFv-фрагментов, специфичных к CD19 человека. В частности, этот пример конкретно демонстрирует конструирование биспецифичных антител, имеющих первый антигенсвязывающий сайт, который связывает CD19 человека в нативном формате (экспрессированный на клеточной поверхности) и второй антигенсвязывающий сайт, который связывает CD3 на Т-клетках. Таким образом, настоящий пример иллюстрирует, что в некоторых воплощениях, используя мультиспецифичные связывающие агенты, которые содержат компоненты антитела, как описано в данном документе, Т-клетки могут быть направлены на уничтожение клеток-мишеней, которые экспрессируют CD19 человека.
Биспецифичные антитела были получены с использованием scFv-последовательностей фаговых клонов, специфичных к CD19 человека. Биспецифичные антитела были сконструированы с использованием одноцепочечного формата, включающий последовательность VL-VH scFv фагового клона, специфичного к CD19 человека, на N-конце и мышиного моноклонального scFv против CD3ε человека на C-конце (например, см. Brischwein, K. et al., Mol. Immunol. 43:1129-1143, 2006). Фрагменты ДНК, кодирующие scFv против CD19 человека и scFv против CD3ε человека, были синтезированы Genewiz или Genscript и субклонированы в экспрессирующий вектор для млекопитающих pQD-T (Eureka Therapeutics, Inc.) с использованием стандартной технологии рекомбинантной ДНК. Для очистки и обнаружения на С-конце была вставлена гексагистаминовая метка. Клетки HEK293 трансфицировали биспецифическим вектором экспрессии антител и культивировали в течение семи дней для получения биспецифичного антитела. Биспецифичные антитела очищали из надосадочных жидкостей клеток HEK293 с использованием колонки HisTrap HP (GE healthcare) системой FPLC AKTA. Культуру клеток HEK293 очищали и загружали в колонку с низкой концентрацией имидазола (20 мМ), а затем для элюирования связанных биспецифичных антител использовали изократический элюирующий буфер с высоким содержанием имидазола (500 мМ). Молекулярные массы очищенных биспецифичных антител против CD19 человека измеряли в невосстанавливающих условиях с помощью гель-электрофореза. Белок (4 мкг) смешивали с 2,5 мкл буфера для образцов NuPAGE LDS (Life Technologies, NP0008) и доводили до 10 мкл деионизированной водой. Образцы нагревали до 70°С в течение 10 минут и наносили на гели. Гель-электрофорез проводили при 180 В в течение 1 часа. Полосы (~ 55 кДа), соответствующие биспецифическим антителам, наблюдались как основные виды на геле (фиг. 3).
В совокупности этот пример демонстрирует успешное конструирование биспецифичных молекул, имеющих первый антигенсвязывающий сайт, который специфичен для CD19 человека, экспрессируемого на поверхности клетки (т.е. в нативном формате), и второго антигенсвязывающего сайта, который специфичен для CD3. Дальнейшая характеризация таких биспецифичных молекул описана в следующих примерах.
Пример 3. Характеризация биспецифичных антител против CD19 человека
Этот пример демонстрирует профиль связывания CD19 для выбранных биспецифичных молекул. В частности, этот пример конкретно описывает профиль связывания молекул выбранных биспецифичных антител для рекомбинантного CD19 человека (т.е. CD19 ECD-Fc человека) в растворе.
Связывание с рекомбинантным химерным белком CD19 ECD-Fc человека. Фаговые клоны, которые были идентифицированы как связующие, специфичные к CD19 человека клеточной поверхности, были протестированы на предмет связывания с рекомбинантным химерным белком CD19 ECD-Fc человека в растворе с использованием Fortebio Octet. Биотинилированные химерные белки CD19 ECD-Fc человека (5 мкг/мл) загружали на биосенсор со стрептавидином. После отмывания избыточного антигена биспецифичные антитела испытывали при 10 мкг/мл в буфере PBS для ассоциации и диссоциации. Ни один из протестированных клонов, которые распознавали CD19 человека, экспрессированный на клеточной поверхности, не продемонстрировали связывание с рекомбинантным химерным белком CD19 ECD-Fc человека, включая клон 37, который был ELISA-положительным клоном. На фиг. 4 показаны данные связывания октета hCD19 примерных клонов и BL19, сравнительного биспецифического антитела против CD19. Таким образом, авторы предположили, что рекомбинантный белок hCD19 может иметь отличающуюся структурную конформацию по сравнению с нативным CD19 человека (то есть на поверхности клетки), а также с CD19 человека, связанным с планшетом для ELISA. Покрытие планшета для ELISA рекомбинантным человеческим CD19 может вызывать образование определенной конформации(-ий), которые имитируют нативный hCD19, но с чрезвычайно низкой эффективностью. Только один из 85 клонов антител, специфичных к CD19 человека согласно ELISA, продемонстрировал специфичность к CD19 человека клеточной поверхности. Клеточный пэннинг с клетками, экспрессирующими CD19 человека, дал больше положительных клонов антител, которые были специфичны к CD19 человека, экспрессируемого на клеточной поверхности.
Связывание с первичными В-клетками человека. В-клетки человека тестировали на связывание с антителами против CD19 путем совместного окрашивания человеческих РВМС с конъюгированным с PerCP антителом против CD20 человека, APC-меченым антителом против CD3 человека и анти-CD19-биспецифичными антителами. После раунда кратковременной промывки буфером PBS к смеси добавляли FITC-меченое антитело против His-метки в качестве вторичного антитела для обнаружения биспецифичного антитела. Для анализа проточной цитометрией человеческие В-клетки были отобраны выше порогового значения по положительному окрашиванию CD20 и отрицательному окрашиванию CD3 (см. вставку на фиг. 5А). Биспецифичные антитела против CD19 оценивали по их способности распознавать CD19 человека, экспрессируемый на этих CD20 + CD3- клетках.
Уровень анти-CD19 связывания с CD20+ CD3- клетками измеряли с помощью средней интенсивности флуоресценции (MFI) в канале FITC. Как показано в таблице 6, отрицательное контрольное биспецифическое антитело (NC-ET901) не связывает В-клетки человека. Напротив, все протестированные биспецифичные клоны против CD19 человека распознавали В-клетки человека и демонстрировали положительные сигналы связывания.
Анализ на уничтожение Т-клетками. Опухолевую цитотоксичность анализировали с использованием анализа цитотоксичности LDH (Promega). Человеческие Т-клетки (AllCells) или очищенные с помощью фиколла клетки из цельной крови (Тихоокеанские центры крови) активировали и размножали с помощью CD3/CD28 «Dynabeads» (Invitrogen) в соответствии с техническими характеристиками производителя. Активированные Т-клетки культивировали и поддерживали в среде RPMI1640 с 10% FBS плюс 100 Ед./мл IL-2 и использовали в течение 7-14 дней после активации. Т-клетки составляли> 99% CD3+ по результатам анализа FACS. Активированные Т-клетки и клетки-мишени совместно культивировали в соотношении 5:1 с биспецифичными антителами в течение 16 часов. Цитотоксичность определяли путем измерения активности LDH в культуральных надосадочных жидкостях.
Как показано на фиг. 5В, молекулы биспецифичных антител, основанные на клонах 4, 5 и 6, при 0,2 мкг/мл, эффективно опосредуют уничтожение раковых клеток специфическим по отношению к CD19 человека образом. Кроме того, молекула биспецифического антитела, основанная на клоне 37, продемонстрировала некоторое детектируемое уничтожение по отношению к отрицательным по CD19 клеточным линиям (Jurkat и THP-1). В контексте scFv клон 37 не демонстрировал связывание с клетками Jurkat согласно проточной цитометрии (фиг. 1B).
Таблица 6
Клон биспецифичного антитела
(MFI) в канале FITC
(NC-ET901: контроль)
Пример 4. Аффинное созревание антительных агентов против CD19 человека
Этот пример демонстрирует созревание аффинности антительных агентов против CD19 человека. В частности, этот пример конкретно демонстрирует образование ряда вариантов антител путем включения случайных мутаций в отобранные антительные агенты против CD19 человека (клоны 4, 5 и 6) с последующим скринингом и характеризацией вариантов антител.
Получение вариантных фаговых библиотек. ДНК, кодирующая scFv против CD19 человека, подвергали случайному мутагенезу с использованием набора GeneMorph II Random Mutagenesis (Agilent Technologies) в соответствии с описанием производителя. После мутагенеза ДНК-последовательности клонировали в scFv-экспрессирующий фагмидный вектор для создания фаговых библиотек вариантных антител. Мутационные библиотеки создавали для каждого отдельного клона, специфичного к CD19 человека. Каждая библиотека мутаций содержала около 5 × 108 уникальных фаговых клонов. В среднем вариантные клоны имеют две нуклеотидные мутации по сравнению с исходными клонами против CD19 человека, в пределах от 1 до 4 нуклеотидных мутаций на каждую последовательность scFv. Три библиотеки были построены на исходных клонах 4, 5 и 6 (таблица 7). Примерные мутации в областях VH и VL, отобранных антительных агентов против CD19 человека с созревшей аффинностью, по сравнению с соответствующими исходными клонами, приведены в таблице 8.
Отдельные фаговые клоны из обогащенных пэннингом фаговых пулов, называемые вариантными клонами, были протестированы на предмет улучшения связывания с CD19 человека на поверхности клеток по сравнению с их соответствующими исходными клонами. Как показано на фиг. 6А, несколько вариантных фаговых клонов специфически распознают линии раковых клеток, положительных по CD19 человека, включая клетки Raji и Jeko-1. Ни один из клонов не продемонстрировал связывание с клеточными линиями, отрицательными по CD19 человека, такими как клетки Raji-CD19 k.o. или Jurkat. Примечательно, что множественные клоны продемонстрировали усиленное связывание с клетками Raji и Jeko-1 по сравнению с соответствующими исходными клонами.
Проведен анализ конкурентного клеточного связывания для сравнения аффинности связывания вариантных клонов по сравнению с исходными клонами (фиг. 6В). Вкратце, вариантные фаговые клоны смешивали с клетками Raji, которые предварительно инкубировали с их соответствующим исходным клоном биспецифического антитела, с последующим окрашиванием мышиным антителом против M13 и конъюгированным с ПЭ антителом против мышиных антител.
Варианты клонов 5-1, 5-3, 5-4, 5-9, 5-13 и 6-1 продемонстрировали улучшенное связывание с мишенью по сравнению с их исходными клонами. В присутствии исходного клона биспецифичного антитела, эти фаговые клоны проявляют повышенное связывание с клетками Raji по сравнению с исходными фаговыми клонами, клоном 5 или 6. Более точное измерение аффинности связывания антител было получено с помощью титрования биспецифического антитела проточной цитометрией (см. таблицу 9 ниже).
Таблица 7
Таблица 8
Пример 5. Получение и характеризация молекул биспецифичных антител на основе вариантов антительных агентов против CD19 человека
Этот пример демонстрирует конструирование мультиспецифичных связывающих агентов с использованием различных фрагментов scFv человека, специфичных к CD19 человека. В частности, этот пример конкретно демонстрирует конструирование биспецифичных антител, имеющих первый антигенсвязывающий сайт, который связывает CD19 человека в нативном формате (экспрессированным на клеточной поверхности) и второй антигенсвязывающий сайт, который связывает CD3 на Т-клетках. Таким образом, настоящий пример иллюстрирует, что в некоторых воплощениях, используя мультиспецифичные связывающие агенты, которые содержат компоненты антитела, описанные в данном документе, Т-клетки могут быть направлены на уничтожение клеток-мишеней, которые экспрессируют CD19 человека.
Получение биспецифичных антител вариантного клона. Биспецифичные антитела, полученные из вариантных клонов антител с улучшенной аффинностью были получены, как описано в Примере 2. Большинство клонов продемонстрировали одиночные полосы на SDS-PAGE с чистотой> 90% (фиг. 7А).
Определение аффинности связывания для вариантных биспецифичных антител. Ни исходные антитела, ни их производные (вариантные клоны) не распознают рекомбинантный CD19 человека, хотя все они связывают CD19 человека, экспрессированный на клеточной поверхности. Таким образом, авторы определили относительную аффинность связывания вариантных клонов по сравнению с исходными антителами с помощью титрования антител проточной цитометрией с использованием раковых клеток, положительных по CD19 человека (таблица 9).
Клоны биспецифичных антител в последовательно разведенных концентрациях смешивали с одинаковым количеством клеток Raji. EC50 и кажущееся KD антитела рассчитывали на основе сигналов связывания проточной цитометрии. Как показано в таблице 9, многие из вариантных клонов на основе исходного клона 5, за исключением клона 5-4, демонстрируют слегка повышенную аффинность (более низкий EC50 и кажущийся KD). Для вариантных клонов на основе исходного клона 6 клоны 6-1 и 6-4 также демонстрировали повышенную аффинность (более низкий EC50 и кажущийся KD) по сравнению с их соответствующим исходным клоном.
Анализ Т-клеточной цитотоксичности. Опухолевую цитотоксичность определяли с использованием анализа цитотоксичности LDH (Promega). Т-клетки человека активировали и размножали с помощью CD3/CD28 «Dynabeads» (Invitrogen) в соответствии с описаниями производителя. Активированные Т-клетки культивировали и поддерживали в среде RPMI1640 с 10% FBS плюс 100 Ед/мл IL-2 и использовали в течение 7-14 дней после активации. Т-клетки составляли> 99% CD3+ по результатам анализа FACS. Активированные Т-клетки и клетки-мишени совместно культивировали при соотношении 5:1 с биспецифичными антителами в течение 16 часов. Цитотоксичность определяли путем измерения активности LDH в культуральных надосадочных жидкостях (фиг. 7B).
Как показано на фиг. 8, тестируемые вариантные клоны сохраняли оригинальную специфичность связывания их исходных антител. Для анализа цитотоксичности, показанного на фиг. 11, протестировали примерные вариантные клоны, а также клон 37 (используемый в качестве положительного контрольного биспецифичного антитела, поскольку этот клон продемонстрировал детектируемую неспецифическую цитотоксичность против клеток, отрицательных по CD19 человека, Raji-CD19 k.o., Jurkat и THP-1). Тестируемые множественные варианты клонов продемонстрировали эквивалентную или повышенную эффективность уничтожения клеток против одной или обеих человеческих CD19-положительных клеточных линий (Raji и Jeko-1) по сравнению с их соответствующими исходными клонами.
Таблица 9
(NC-ET901: контроль)
Пример 6. Характеризация Т-клеток, экспрессирующих химерных антигенных рецепторов (CAR-T) против CD19 человека
Этот пример демонстрирует конструирование химерных антигенных рецепторов (CAR) с использованием агентов на основе антител против CD19 человека, описанных в предыдущих примерах. В частности, этот пример конкретно демонстрирует конструкцию CAR, которая включает антигенсвязывающий сайт агента на основе антитела человека против CD19, и экспрессируется на поверхности Т-клеток. Кроме того, CAR, экспрессируемые Т-клетками, использовали в анализах цитотоксичности против моделей ксенотрансплантата лимфомы человека. Таким образом, настоящий пример иллюстрирует, что в некоторых воплощениях использование CAR, которые включают сайт связывания антигена из агентов на основе антитела человека, описанных в данном документе, полезны для уничтожения клеток-мишеней, которые экспрессируют CD19 человека (например, лимфомы).
In vitro цитотоксичность Т-клеток, трансформированных CD19 человека
Лентивирусы, содержащие химерные антигенные рецепторы (CAR), специфичные к CD19 человека, продуцировали трансфекцией клеток 293T с помощью CAR-векторов. Т-клетки человека использовали для трансдукции после однодневной стимуляции с помощью гранул CD3/CD28 (Dynabeads®, Invitrogen) в присутствии IL-2 при 100 Ед/мл. Концентрированные лентивирусы применяли к Т-клеткам в 6-луночных планшетах покрытых ретронектином (Takara) в течение 72 часов. Функциональную оценку трансдуцированных Т-клеток (клеток CD19/CAR-T) осуществляли с использованием анализа цитотоксичности LDH. Соотношения эффектор-мишень составляли 5:1. Репрезентативные результаты представлены на фиг. 8.
Как показано на фиг. 8, три CAR, основанные на клонах вариантных антител (клоны 5-3, 5-9 и 5-13), продемонстрировали значимо повышенную эффективность уничтожения раковых клеток против клеточных линий Raji и Jeko-1 по сравнению с исходным клоном 5. Соотношение эффектор-мишень, используемое в этом эксперименте, составляло 5: 1. Было подтверждено, что специфичность уничтожения была CD19-специфичной, что подтверждается низким уровнем уничтожения человеческих CD19-отрицательных клеток (Raji-CD19 k.o. и Jurkat). Кроме того, Т-клетки, экспрессирующие CAR, полученные с использованием агентов на основе антитела человека, описанных в данном документе, продемонстрировали сходную или более высокую эффективность уничтожения клеток, чем CAR-T, полученные с другими анти-CD19 антителами (BL19, FMC63).
В аналогичном эксперименте CAR-T против CD19 человека (описанный выше) тестировали с использованием большой панели CD19-положительных и отрицательных линий раковых клеток. Вкратце, первичные Т-клетки были ложно-трансдуцированы (Ложно-трансдуцированные) или трансдуцированы отобранными CAR, кодирующими антитела против CD19. Трансдуцированные Т-клетки анализировали с помощью FACS с использованием анти-myc антитела для обнаружения myc-метки во внеклеточном домене CAR-конструкций.
Результаты показали, что анти-CD19 CAR-T-клетки, полученные из агентов на основе антитела человека, описанных выше, имеют эффективность трансдукции ~ 80% (фиг. 9, верхняя часть). Способность клеток CAR-T специфически убивать CD19-экспрессирующие раковые клетки тестировали при соотношении эффектор-мишень 5: 1. Как показано на фиг. 9 (внизу), CAR-Т - клетки, экспрессирующие оба протестированных анти-CD19 клона, специфически уничтожали CD19+ клетки (Raji, CA46, JeKo-1 и Daudi), но не CD19- клетки (Raji-CD19 - KO, Jurkat, THP-1, HeLa, MDA-MB-231, MCF-7, SK-Hep-1 и HepG2).
В другом аналогичном эксперименте CAR-T, полученные из отобранных агентов на основе антитела человека, описанных в данном документе, и антитела не человеческого происхождения (например, мышиного), тестировали с использованием панели из CD19-положительных и отрицательных линий раковых клеток, как описано выше. Вкратце, первичные Т-клетки были ложно-трансдуцированы (Ложно-трансдуцированные) или трансдуцированы отобранными CAR, кодирующими scFv против CD19 человека, описанными в данном документе (CAR-T 5, CAR-T 5-9 или CAR-T 5-13) или CAR, кодирующими scFv против CD19 человека, который имеет вариабельные области последовательностей из мышиного антитела mAb FMC63 против человеческого CD19 (Zola, H. et al., 1991, Immunol. Cell Biol. 69(Pt 6):411-22). Последовательность мышиного анти-CD19 ScFv, приведенная ниже, имеет формат VL-линкер-VH. Трансдуцированные Т-клетки анализировали с помощью FACs, как описано выше.
(SEQ ID NO:296)
Последовательностями CDR мышиного анти-CD19 scFv, представленного в SEQ ID NO: 296, являются:
LC-CDR1 QDISKY (SEQ ID NO:297)
LC-CDR2 HTS (SEQ ID NO:298)
LC-CDR3 QQGNTLPYT (SEQ ID NO:299)
HC-CDR1 GVSLPDYG (SEQ ID NO:300)
HC-CDR2 IWGSETT (SEQ ID NO:301)
HC-CDR3 AKHYYYGGSYAMDY (SEQ ID NO:302)
Результаты показали, что анти-CD19 CAR-T-клетки, полученные из человеческого scFv-клона 5 и двух вариантов с созревшей аффинностью (5-9, 5-13), продемонстрировали более высокую эффективность трансдукции и значительно более высокий CD19-специфичный лизис раковых клеток, чем анти-CD19 CAR- Т-клетки, полученные из мышиного анти-CD19-антитела (фиг. 15).
В другом эксперименте определяли примерный профиль высвобождения цитокина активированными CD19-человека-CAR-T-клетками. Ложно-трансдуцированные Т-клетки (ложно-трансдуцированные) или отобранные анти-CD19 CAR-T (показан клон 5-3) совместно инкубировали с клетками-мишенями. Высвобождение IL-2, IL-4, IL-6, IL-8, IL-10, GM-CSF, IFN-γ и TNF-α в среду после уничтожения in vitro измеряли с использованием мультиплексной системы Magpix (Luminex) с помощью анализов Bio-plex Pro Human Cytokine 8-plex Assays (BioRad). Концентрации цитокинов определяли с помощью известной стандартной кривой, после вычитания высвобождения из среды, только клетки-мишени и только Т-клетки, трансдуцированной клоном 5-3. Репрезентативные результаты представлены на фиг. 10.
Как показано на фиг. 10, высвобождение цитокинов был обнаружено только тогда, когда анти-CD19 CAR-Т - клетки совместно инкубировали с CD19+ клетками (Raji и CA46), но не CD19 - клеток (Raji-CD19 k.o. и Jurkat). Ложно-трансдуцированные Т-клетки, совместно культивируемые с CD19+ раковыми клетками, высвобождали только минимальное количество цитокинов. Аналогичным образом, профиль высвобождения цитокинов активированных CD19 человека-CAR-Т-клеток на основе клона 5-13 продемонстрировал высвобождение цитокинов (IL-2, GM-CSF, IFN-γ, и TNF-α) только тогда, когда анти-CD19 CAR-Т - клетки совместно инкубировали с CD19+ клетками (Raji и JeKo-1), но не с CD19- клетками (Raji-CD19 k.o.). Кроме того, ложно-трансдуцированные Т-клетки, совместно культивируемые с CD19+ раковыми клетками, высвобождали либо минимально количество цитокинов, либо не высвобождали вовсе.
Эффективность in vivo CD19 CAR-T-клеток в ксенотрансплантатах лимфомы человека. In vivo противоопухолевую активностью примерной клетки CAR-Т - (на основе клона 5-9) протестировали в модели ксенотрансплантата CD19-положительной лимфомы человека в NOD SCID гамма (NSG) мышах. Вкратце, клетки Raji-luc-GFP приобретали у Comparative Biosciences, Inc. (Саннивилль, Калифорния 94085) и культивировали в среде RPMI среда + 10% FBS и 1% L-глутамина при 37°С в увлажненной атмосфере с 5% CO2. Клетки Raji-luc-GFP были получены из CD19-положительной линии клеток лимфомы Беркитта, Raji, после стабильной трансфекции с двойными репортерными генами, кодирующими люциферазу светлячков (luc) и зеленый флуоресцентный белок, что дало клетки, которые можно проследить in vivo, используя биолюминесцентную визуализацию. Мышей NSG приобретали у Jackson Laboratories (Бар-Харбор, Мэн, США 04609) и акклиматизировали не менее чем за 7 дней до эксперимента. Клетки Raji-luc-GFP повторно суспендировали в PBS и имплантировали внутривенно (в.в.) в мышей NSG через хвостовую вену по 1 × 106 клеток/100 мкл/мышь. Через пять дней после имплантации животных визуализировали с использованием системы визуализации Xenogen IVIS для оценки опухолевой массы. Мыши были рандомизированы на основе эмиссии фотонов на три группы (n = 6 мышей на группу) при средней фотонной эмиссии 6,7 × 105 фотонов: (i) нет лечения, (ii) ложно-трансдуцированные (нетрансдуцированные активированные человеческие Т-клетки из того же донора, что и CAR-T-клетки) и (iii) 5-9 CAR-T. Животных лечили внутривенно с помощью ложно-трансдуцированных клеток или клеток клонов 5-9 CAR-T сразу после рандомизации в дозе 107 Т-клеток на мышь (включая 6-8 × 106 CAR + Т-клеток на дозу для группы (iii)), один раз каждые две недели для 3 доз. Животных тщательно отслеживали после дозирования. Биолюминесцентную визуализацию с использованием системы Xenogen IVIS осуществляли один раз в неделю. Животные со следующими состояниями были подвергнуты эвтаназии и зарегистрированы как «условная смерть»: (i) потеря массы тела более чем на 25% от первоначальной массы тела и (ii) паралич конечностей, который влияет на подвижность мыши. Репрезентативные результаты представлены на фиг. 11.
Как ложно-трансдуцированные клетки, так и клетки 5-9 CAR-T хорошо переносились при текущей дозе и схеме (фиг. 11). На протяжении всего исследования не наблюдалось никаких побочных эффектов, связанных с дозированием. Лечение с помощью ложно-трансдуцированных T-клеток замедляло рост опухолей Raji-luc-GFP (p <0,05), однако лечение CAR-T 5-9 значительно ингибировала рост опухоли (p <0,05, фиг. 11, справа).
В аналогичном эксперименте противоопухолевую активность in vivo другой примерной CAR-T-клетки (на основе клона 5-13) тестировали на модели ксенотрансплантата CD19-положительно лимфомы человека (Raji) в мышах NSG. Эксперименты проводили, как описано выше, для клона 5-9, за исключением того, что каждой мыши вводили только одну дозу анти-CD19 CAR-трансдуцированных Т-клеток (5 × 106 CAR+ Т-клеток на основе клона 5-13). Репрезентативные результаты представлены на фиг. 13.
Как показано на фиг. 13А, в то время как опухоли быстро росли у мышей из групп, которым вводили носитель и ложно-трансдуцированными клетками, мыши NSG, которым вводили Т-клетки, которые были трансдуцированы анти-CD19 CAR 5-13 клетками, продемонстрировали ингибирование роста опухоли. Действительно, значительное различие в опухолевом росте между группами лечения было обнаружено уже на 11-й день (p <0,0001, тесты Даннетта, фиг. 13B). Кроме того, мыши NSG, которым вводили Т-клетки, которые трансдуцированы анти-CD19 CAR 5-13, продемонстрировали регресс опухолей даже через 45 дней после имплантации.
Через 35 дней после имплантации опухоли трех репрезентативных мышей из группы, которой вводили анти-CD19 CAR 5-13 трансформированными Т-клетками, были повторно подвергнуты повторной вакцинации с помощью имплантации 5 × 105 клеток лимфомы Raji для того, чтобы определить, сохраняют и поддерживают ли анти-CD19-CAR-трансдуцированные T-клетки способность реагировать на антиген (CD19). Наивным мышам NSG (т.е. мышам, которым не имплантировали клетками лимфомы Raji или которые ранее не обрабатывались Т-клетками, n = 2) имплантировали 5 × 105 клеток лимфомы Raji через один день после инъекции 1 × 106 ложно-трансдуцированных Т-клеток (инъецированных на 34 день) в качестве контроля. Авторы предположили, что такие ложно-трансдуцированные Т-клетки будут имитировать состояние Т-клеток с низким уровнем циркуляции у мышей до имплантации клеток лимфомы Raji. Опухолевую нагрузку в каждой группе измеряли с помощью люциферазной активности (как описано выше). Репрезентативные результаты представлены на фиг. 13C.
Как показано на фиг. 13С, опухоли быстро росли в группе лечения ложно-трансдуцированными клетками. Напротив, предшествующая лечение анти-CD19 CAR 5-13-трансдуцированными Т-клетками предотвращала рост опухолей после повторного заражения клетками лимфомы Raji (p <0,01). Таким образом, эти данные указывают на то, что Т-клетки, трансформированные CD19-CAR, сохраняются у этих мышей даже через 35 дней после имплантации и сохраняют способность реагировать на CD19 и убивать CD19 + -опухолевые клетки, тем самым обеспечивая защиту от повторной опухолевой нагрузки.
В другом аналогичном эксперименте противоопухолевую активность in vivo примерной CAR-T-клетки (на основе клона 5-13) тестировали на модели ксенотрансплантата CD19-положительной лейкемии человека в мышах NSG (NALM). NALM-6-luc-GFP-клетки (любезный подарок от доктора Эрика Смита из Мемориального онкологического центра Слоана-Кеттеринга) были получены из CD19-положительной клеточной линии острого лимфобластного лейкоза NALM-6 после стабильной трансфекции двойными репортерными генами, кодирующими люциферазу светлячков (luc) и зеленый флуоресцентный белок (GFP), в результате чего клетки прослеживаются in vivo с использованием биолюминесцентной визуализации.
Вкратце, NALM-6-luc-GFP культивировали в среде RPMI + + 10% FBS при 37°C в увлажненной атмосфере с 5% CO2. Мышей NSG приобретали у Jackson Laboratories (Бар-Харбор, Мэн, США 04609) и акклиматизировали, по меньшей мере, за три дня до проведения экспериментов. Клетки NALM-6-luc-GFP повторно суспендировали в фосфатно-солевом буферном растворе (PBS) и внутривенно (iv) имплантировали в самок мышей NSG (n = 20, 6-8 недель) при 5 × 105 клеток/100 мкл/мышь через инъекцию в хвостовой вене. Через четыре дня после имплантации животных визуализировали с использованием системы визуализации Xenogen IVIS для оценки опухолевой нагрузки. Мышей NSG рандомизировали на основе эмиссии фотонов на три группы: (i) носитель (PBS, n = 6); (ii) 107 ложно-трансдуцированных человеческих Т-клеток (n = 6); и (iii) 5x106 клонов 5-13 анти-CD19 CAR-трансдуцированных Т-клеток (CAR-T 5-13, n = 8). Животных тщательно контролировали после имплантации и дозирования Т-клетками или носителем, как описано выше. Репрезентативные результаты представлены на фиг. 14.
Как показано на фиг. 14, панели A и B, группы лечения носителем и ложно-трансдуцированными клетками, продемонстрировали быстрое прогрессирование роста опухолей NALM-6. Напротив, лечение с помощью анти-CD19 CAR-T клеток (на основе клона 5-13) значительно (p <0,0001) ингибировала и даже обращала рост опухоли уже на 11-й день. Эти данные показывают, что клетки CAR-T 5-13 нацеливались на и лизировали опухоли CD19+ NALM-6 in vivo, тем самым демонстрируя эффективность антител против CD19, представленных в данном документе, в примерном формате CAR для того, чтобы ингибировать рост опухоли во многих моделях рака.
В совокупности этот пример демонстрирует успешное получение и применение Т-клеток, экспрессирующих химерный антигенный рецептор (CAR) на основе анти-CD19 агентов на основе антитела человека, полученных согласно предыдущим примерам. Кроме того, такие анти-CD19 CAR-T-клетки продемонстрировали эффективное клеточное уничтожение различных линий раковых клеток CD19-специфичным образом. Таким образом, описанные в данном документе агенты на основе антитела человека могут быть использованы для лечения и диагностики различных В-клеточных заболеваний и пака, в частности тех, которые характеризуются экспрессией CD19.
Способы
Клеточные линии Raji, Jeko-1, Jurkat, THP-1 и NIH/3T3 были получены из Американской коллекции типовых культур. Raji является CD19-положительной линией клеток лимфомы Беркитта (ATCC CCL-86). Jeko-1 является CD19-положительной клеточной линией лимфомы из клеток мантии (ATCC CRL-3006). Jurkat является линией клеток лимфоцитов человека, полученной из Т-клеточного лейкоза, и является CD19-отрицательной. THP-1, клеточная линия острого моноцитарного лейкоза, также является CD19-отрицательной (ATCC TIB-202). NIH/3T3 представляет собой линию клеток эмбриональных фибробластов мыши (ATCC CRL-1658). Клеточную линию Raji-CD19 нокаут (Raji-CD19 k.o.), получали путем нокаута CD19, используя коммерческий вектор CRISPR-Cas9 (Origene). Клетки Raji-CD19 k.o. были подтверждены как CD19-отрицательные путем секвенирования и FACS (фиг. 12) с использованием коммерческого мышиного антитела против человеческого CD19 (Biolegend). 3T3-CD19 получали путем трансдуирования клеточной линии NIH/3T3 экспрессирующим вектором млекопитающих с человеческим CD19 (hCD19), что приводит к высокому уровню экспрессии hCD19 на поверхности клеток (фиг. 16). Другие клеточные линии, протестированные а анализах цитотоксичности CAR-T, такие как CA46, Daudi, Hela, HepG2, SK-Hep1, MDA-MB-231 и MCF7, также были приобретены у ATCC. Клеточные линии культивировали в RPMI 1640 или DMEM с добавлением 10% FBS при 37°C/5% CO2.
Мышиное моноклональное антитело против фага M13 было приобретено у GE (Cat 27-9421-01). PE-меченное антитело против мышиного IgG было приобретено у Vector labs (Cat EI-2007). PE-конъюгированное мышиное антитело против hCD19 было приобретено у Biolegend (Cat 302208). 901-Fc и биспецифичное антитело NC-ET901 представляющие собой антитела отрицательного контроля, и имеющие формат человеческого IgG1 и биспецифичного антитела, соответственно, получали в Eureka Therapeutics, Inc. Антитело не распознает человеческий антиген. FITC-меченное анти-His антитело было приобретено у Thermo Fisher Scientific (Cat MA1-81891) для обнаружения биспецифичного антитела, которое имеет 6xHis-метку на С-конце. PerCP-конъюгированное антитело против человеческого CD20 было приобретено у BD (9Cat 302208) для обнаружения В-клеток человека.
Рекомбинантный гибридный белок CD19 ECD-Fc человека включает внеклеточный домен человеческого CD19, слитый с Fc человеческого IgG1, не имеет домена CH1, и имеет шарнирную область. Клетки HEK293 (Invitrogen) трансфицировали вектором, кодирующим слитый белок CD19 ECD-Fc человека, с помощью липофектамина 3000 (Invitrogen). Химерный белок очищали из культуральных надосадочных жидкостей с помощью аффинной хроматографии на протеине А.
Специфические перечисленные аспекты
Настоящее изобретение также обеспечивает следующие пронумерованные аспекты:
1. Агент на основе антитела человека, который специфически связывает CD19 человека, где агент на основе антитела человека включает одну или несколько CDR тяжелой цепи, каждая из которых имеет последовательность, которая, по меньшей мере, на 95% идентична одной или нескольким CDR тяжелой цепи, выбранным из таблицы 2, и/или одну или несколько CDR легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична одной или нескольким CDR легкой цепи, выбранной из таблицы 3.
2. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, которые представлены в SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 75, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, которые представлены в SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183.
3. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 184, SEQ ID NO: 185 и SEQ ID NO: 186.
4. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 79, SEQ ID NO: 80 и SEQ ID NO: 81, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 187, SEQ ID NO: 188 и SEQ ID NO: 189.
5. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 82, SEQ ID NO: 83 и SEQ ID NO: 84, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 190, SEQ ID NO: 191 и SEQ ID NO: 192.
6. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 85, SEQ ID NO: 86 и SEQ ID NO: 87, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 193, SEQ ID NO: 194 и SEQ ID NO: 195.
7. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 90, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 196, SEQ ID NO: 197 и SEQ ID NO: 198.
8. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 91, SEQ ID NO: 92 и SEQ ID NO: 93, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 199, SEQ ID NO: 200 и SEQ ID NO 201.
9. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 94, SEQ ID NO: 95 и SEQ ID NO: 96, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 202, SEQ ID NO: 203 и SEQ ID NO: 204.
10. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 97, SEQ ID NO: 98 и SEQ ID NO: 99, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 205, SEQ ID NO: 206 и SEQ ID NO: 207.
11. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 208, SEQ ID NO: 209 и SEQ ID NO: 210.
12. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 105, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 211, SEQ ID NO: 212 и SEQ ID NO: 213.
13. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 106, SEQ ID NO: 107 и SEQ ID NO: 108, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 214, SEQ ID NO: 215 и SEQ ID NO: 216.
14. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 109, SEQ ID NO: 110 и SEQ ID NO: 111, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 217, SEQ ID NO: 218 и SEQ ID NO: 219.
15. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 220, SEQ ID NO: 221 и SEQ ID NO: 222.
16. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 115, SEQ ID NO: 116 и SEQ ID NO: 117, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 223, SEQ ID NO: 224 и SEQ ID NO: 225.
17. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 118, SEQ ID NO: 119 и SEQ ID NO: 120, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 226, SEQ ID NO: 227 и SEQ ID NO: 228.
18. Агент на основе антитела человека по аспекту 1, где агент на основе антитела человека включает CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 тяжелой цепи, CDR2 тяжелой цепи и CDR3 тяжелой цепи, из представленных в SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123, и CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, каждый из которых имеет последовательность, которая, по меньшей мере, на 95% идентична каждой CDR1 легкой цепи, CDR2 легкой цепи и CDR3 легкой цепи, из представленных в SEQ ID NO: 229, SEQ ID NO: 230 и SEQ ID NO: 231.
19. Агент на основе антитела человека по аспекту 2, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 75, и CDR легкой цепи SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183.
20. Агент на основе антитела человека по аспекту 3, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78, и CDR легкой цепи SEQ ID NO: 184, SEQ ID NO: 185 и SEQ ID NO: 186.
21. Агент на основе антитела человека по аспекту 4, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 79, SEQ ID NO: 80 и SEQ ID NO: 81 и CDR легкой цепи SEQ ID NO: 187, SEQ ID NO: 188 и SEQ ID NO: 189.
22. Агент на основе антитела человека по аспекту 5, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 82, SEQ ID NO: 83 и SEQ ID NO: 84, и CDR легкой цепи SEQ ID NO: 190, SEQ ID NO: 191 и SEQ ID NO: 192.
23 Агент на основе антитела человека по аспекту 6, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 85, SEQ ID NO: 86 и SEQ ID NO: 87, и CDR легкой цепи SEQ ID NO: 193, SEQ ID NO: 194 и SEQ ID NO: 195.
24. Агент на основе антитела человека по аспекту 7, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 90 и CDR легкой цепи SEQ ID NO: 196, SEQ ID NO: 197 и SEQ ID NO: 198.
25. Агент на основе антитела человека по аспекту 8, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 91, SEQ ID NO: 92 и SEQ ID NO: 93, и CDR легкой цепи SEQ ID NO: 199, SEQ ID NO: 200 и SEQ ID NO 201.
26. Агент на основе антитела человека по аспекту 9, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 94, SEQ ID NO: 95 и SEQ ID NO: 96, и CDR легкой цепи SEQ ID NO: 202, SEQ ID NO: 203 и SEQ ID NO: 204.
27. Агент на основе антитела человека по аспекту 10, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 97, SEQ ID NO: 98 и SEQ ID NO: 99, и CDR легкой цепи SEQ ID NO: 205, SEQ ID NO: 206 и SEQ ID NO: 207.
28. Агент на основе антитела человека по аспекту 11, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102, и CDR легкой цепи SEQ ID NO: 208, SEQ ID NO: 209 и SEQ ID NO: 210.
29. Агент на основе антитела человека по аспекту 12, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 105, и CDR легкой цепи SEQ ID NO: 211, SEQ ID NO: 212 и SEQ ID NO: 213.
30. Агент на основе антитела человека по аспекту 13, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 106, SEQ ID NO: 107 и SEQ ID NO: 108, и CDR легкой цепи SEQ ID NO: 214, SEQ ID NO: 215 и SEQ ID NO: 216.
31. Агент на основе антитела человека по аспекту 14, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 109, SEQ ID NO: 110 и SEQ ID NO: 111, и CDR легкой цепи SEQ ID NO: 217, SEQ ID NO: 218 и SEQ ID NO: 219.
32. Агент на основе антитела человека по аспекту 15, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114, и CDR легкой цепи SEQ ID NO: 220, SEQ ID NO: 221 и SEQ ID NO: 222.
33. Агент на основе антитела человека по аспекту 16, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 115, SEQ ID NO: 116 и SEQ ID NO: 117, и CDR легкой цепи SEQ ID NO: 223, SEQ ID NO: 224 и SEQ ID NO: 225.
34. Агент на основе антитела человека по аспекту 17, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 118, SEQ ID NO: 119 и SEQ ID NO: 120, и CDR легкой цепи SEQ ID NO: 226, SEQ ID NO: 227 и SEQ ID NO: 228.
35. Агент на основе антитела человека по аспекту 18, где агент на основе антитела человека включает CDR тяжелой цепи SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123, и CDR легкой цепи SEQ ID NO: 229, SEQ ID NO: 230 и SEQ ID NO: 231.
36. Агент на основе антитела человека, который конкурирует за связывание CD19 с агентом на основе антитела человека, который включает (а) CDR тяжелой цепи SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 75, и CDR легкой цепи SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183; (b) CDR тяжелой цепи SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78 и CDR легкой цепи SEQ ID NO: 184, SEQ ID NO: 185 и SEQ ID NO: 186; (c) CDR тяжелой цепи SEQ ID NO: 79, SEQ ID NO: 80 и SEQ ID NO: 81 и CDR легкой цепи SEQ ID NO: 187, SEQ ID NO: 188 и SEQ ID NO: 189; (d) CDR тяжелой цепи SEQ ID NO: 82, SEQ ID NO: 83 и SEQ ID NO: 84 и CDR легкой цепи SEQ ID NO: 190, SEQ ID NO: 191 и SEQ ID NO: 192; (e) CDR тяжелой цепи SEQ ID NO: 85, SEQ ID NO: 86 и SEQ ID NO: 87 и CDR легкой цепи SEQ ID NO: 193, SEQ ID NO: 194 и SEQ ID NO: 195; (f) CDR тяжелой цепи SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 90 и CDR легкой цепи SEQ ID NO: 196, SEQ ID NO: 197 и SEQ ID NO: 198; (g) CDR тяжелой цепи SEQ ID NO: 91, SEQ ID NO: 92 и SEQ ID NO: 93 и CDR легкой цепи SEQ ID NO: 199, SEQ ID NO: 200 и SEQ ID NO 201; (h) CDR тяжелой цепи SEQ ID NO: 94, SEQ ID NO: 95 и SEQ ID NO: 96 и CDR легкой цепи SEQ ID NO: 202, SEQ ID NO: 203 и SEQ ID NO: 204; (i) CDR тяжелой цепи SEQ ID NO: 97, SEQ ID NO: 98 и SEQ ID NO: 99 и CDR легкой цепи SEQ ID NO: 205, SEQ ID NO: 206 и SEQ ID NO: 207; (j) CDR тяжелой цепи SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102 и CDR легкой цепи SEQ ID NO: 208, SEQ ID NO: 209 и SEQ ID NO: 210; (k) CDR тяжелой цепи SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 105, и CDR легкой цепи SEQ ID NO: 211, SEQ ID NO: 212 и SEQ ID NO: 213; (l) CDR тяжелой цепи SEQ ID NO: 106, SEQ ID NO: 107 и SEQ ID NO: 108 и CDR легкой цепи SEQ ID NO: 214, SEQ ID NO: 215 и SEQ ID NO: 216; (m) CDR тяжелой цепи SEQ ID NO: 109, SEQ ID NO: 110 и SEQ ID NO: 111 и CDR легкой цепи SEQ ID NO: 217, SEQ ID NO: 218 и SEQ ID NO: 219; (n) CDR тяжелой цепи SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114, и CDR легкой цепи SEQ ID NO: 220, SEQ ID NO: 221 и SEQ ID NO: 222; (o) CDR тяжелой цепи SEQ ID NO: 115, SEQ ID NO: 116 и SEQ ID NO: 117, и CDR легкой цепи SEQ ID NO: 223, SEQ ID NO: 224 и SEQ ID NO: 225; (p) CDR тяжелой цепи SEQ ID NO: 118, SEQ ID NO: 119 и SEQ ID NO: 120 и CDR легкой цепи SEQ ID NO: 226, SEQ ID NO: 227 и SEQ ID NO: 228; или (q) CDR тяжелой цепи SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123 и CDR легкой цепи SEQ ID NO: 229, SEQ ID NO: 230 и SEQ ID NO: 231.
37. Агент на основе антитела человека по любому из аспектов 1-36, где агент на основе антитела человека дополнительно включает одну или несколько аминокислотных замен в CDR тяжелой цепи и/или CDR легкой цепи.
38. Агент на основе антитела человека по аспекту 37, где агент на основе антитела человека дополнительно включает, по меньшей мере, одну или вплоть до пяти аминокислотных замен в CDR тяжелой цепи и/или CDR легкой цепи.
39. Агент на основе антитела человека по аспекту 38, где агент на основе антитела человека дополнительно включает, по меньшей мере, одну или вплоть до трех аминокислотных замен в CDR тяжелой цепи и/или CDR легкой цепи.
40. Агент на основе антитела человека, который специфически связывает CD19 человека, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в таблице 1, а вариабельная область легкой цепи имеет последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в таблице 1.
41. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 2, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 2.
42. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 4, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 4.
43. Агент на основе антитела человека по аспекту 40, в котором агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 6, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 6.
44. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 8, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична свету последовательность вариабельной области цепи, которая представлена в SEQ ID NO: 8.
45. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 10, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 10.
46. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 12, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 12.
47. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 14, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 14.
48. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 16, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 16.
49. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 18, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 18.
50. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 20, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 20.
51. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 22, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 22.
52. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 24, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 24.
53. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 26, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 26.
54. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 28, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 28.
55. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 30, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 30.
56. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 32, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 32.
57. Агент на основе антитела человека по аспекту 40, где агент на основе антитела человека включает вариабельную область тяжелой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области тяжелой цепи, которая представлена в SEQ ID NO: 34, и вариабельную область легкой цепи, имеющую последовательность, которая, по меньшей мере, на 95% идентична последовательности вариабельной области легкой цепи, которая представлена в SEQ ID NO: 34.
58. Агент на основе антитела человека по любому из аспектов 40-57, где агент на основе антитела человека включает последовательности вариабельной области тяжелой и легкой цепей, которые представлены в любой из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32 и SEQ ID NO: 34.
59. Агент на основе антитела человека, который специфически связывает CD19 человека, где агент на основе антитела человека включает одну или несколько аминокислотных замен по сравнению с исходным агентом на основе антитела человека и где агент на основе антитела человека включает (а) CDR тяжелой цепи SEQ ID NO: 124, SEQ ID NO: 125 и SEQ ID NO: 126, и CDR легкой цепи SEQ ID NO: 232, SEQ ID NO: 233 и SEQ ID NO: 234; (b) CDR тяжелой цепи SEQ ID NO: 127, SEQ ID NO: 128 и SEQ ID NO: 129, и CDR легкой цепи SEQ ID NO: 235, SEQ ID NO: 236 и SEQ ID NO: 237; (c) CDR тяжелой цепи SEQ ID NO: 130, SEQ ID NO: 131 и SEQ ID NO: 132 и CDR легкой цепи SEQ ID NO: 238, SEQ ID NO: 239 и SEQ ID NO: 240; (d) CDR тяжелой цепи SEQ ID NO: 133, SEQ ID NO: 134 и SEQ ID NO: 135 и CDR легкой цепи SEQ ID NO: 241, SEQ ID NO: 242 и SEQ ID NO: 243; (e) CDR тяжелой цепи SEQ ID NO: 136, SEQ ID NO: 137 и SEQ ID NO: 138 и CDR легкой цепи SEQ ID NO: 244, SEQ ID NO: 245 и SEQ ID NO: 246; (f) CDR тяжелой цепи SEQ ID NO: 139, SEQ ID NO: 140 и SEQ ID NO: 141 и CDR легкой цепи SEQ ID NO: 247, SEQ ID NO: 248 и SEQ ID NO: 249; (g) CDR тяжелой цепи SEQ ID NO: 142, SEQ ID NO: 143 и SEQ ID NO: 144, и CDR легкой цепи SEQ ID NO: 250, SEQ ID NO: 251 и SEQ ID NO: 252; (h) CDR тяжелой цепи SEQ ID NO: 145, SEQ ID NO: 146 и SEQ ID NO: 147 и CDR легкой цепи SEQ ID NO: 253, SEQ ID NO: 254 и SEQ ID NO: 255; (i) CDR тяжелой цепи SEQ ID NO: 148, SEQ ID NO: 149 и SEQ ID NO: 150, и CDR легкой цепи SEQ ID NO: 256, SEQ ID NO: 257 и SEQ ID NO: 258; (j) CDR тяжелой цепи SEQ ID NO: 151, SEQ ID NO: 152 и SEQ ID NO: 153 и CDR легкой цепи SEQ ID NO: 259, SEQ ID NO: 260 и SEQ ID NO: 261; (k) CDR тяжелой цепи SEQ ID NO: 154, SEQ ID NO: 155 и SEQ ID NO: 156 и CDR легкой цепи SEQ ID NO: 262, SEQ ID NO: 263 и SEQ ID NO: 264; (l) CDR тяжелой цепи SEQ ID NO: 157, SEQ ID NO: 158 и SEQ ID NO: 159 и CDR легкой цепи SEQ ID NO: 265, SEQ ID NO: 266 и SEQ ID NO: 267; (m) CDR тяжелой цепи SEQ ID NO: 160, SEQ ID NO: 161 и SEQ ID NO: 163 и CDR легкой цепи SEQ ID NO: 268, SEQ ID NO: 269 и SEQ ID NO: 270; (n) CDR тяжелой цепи SEQ ID NO: 163, SEQ ID NO: 164 и SEQ ID NO: 165, и CDR легкой цепи SEQ ID NO: 271, SEQ ID NO: 272 и SEQ ID NO: 273; (o) CDR тяжелой цепи SEQ ID NO: 166, SEQ ID NO: 167 и SEQ ID NO: 168, и CDR легкой цепи SEQ ID NO: 274, SEQ ID NO: 275 и SEQ ID NO: 276; (p) CDR тяжелой цепи SEQ ID NO: 169, SEQ ID NO: 170 и SEQ ID NO: 171 и CDR легкой цепи SEQ ID NO: 277, SEQ ID NO: 278 и SEQ ID NO: 279; (q) CDR тяжелой цепи SEQ ID NO: 172, SEQ ID NO: 173 и SEQ ID NO: 174 и CDR легкой цепи SEQ ID NO: 280, SEQ ID NO: 281 и SEQ ID NO: 282; (r) CDR тяжелой цепи SEQ ID NO: 175, SEQ ID NO: 176 и SEQ ID NO: 177, и CDR легкой цепи SEQ ID NO: 283, SEQ ID NO: 284 и SEQ ID NO: 285; или (s) CDR тяжелой цепи SEQ ID NO: 178, SEQ ID NO: 179 и SEQ ID NO: 180, и CDR легкой цепи SEQ ID NO: 286, SEQ ID NO: 287 и SEQ ID NO: 288.
60. Агент на основе антитела человека по аспекту 59, где агент на основе антитела человека включает вариабельную область легкой цепи, которая включает одну или несколько аминокислотных замен в любом из аминокислотных положений, выбранных из группы, состоящей из 10, 16, 25, 34, 52, 54, 68, 69, 72, 75, 93, 95 и их комбинации.
61. Агент на основе антитела человека по аспекту 60, где одна или несколько аминокислотных замен включают V10M, K16E, S25N, V34I, D52N, L54Q, N68T, T69M, L72M, S75N, S93T, D95E, D95G или их комбинацию.
62. Агент на основе антитела человека по любому из аспектов 59-61, где агент на основе антитела человека включает вариабельную область тяжелой цепи, которая включает одну или несколько аминокислотных замен в любом из аминокислотных положений, выбранных из группы, состоящей из 3, 12, 16, 17, 25, 26, 32, 63, 69, 97, 102, 106, 108, 109, 113, 116, 117 и их комбинации.
63. Агент на основе антитела человека по аспекту 62, где одна или несколько аминокислотных замен включают Q3R, K12E, E16G, S17F, S25A, G26A, Y32F, S63F, T69A, A97V, T102S, M106L, Y108N, D109E, Q113L, L116M, M117L или их комбинации.
64. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой S75N.
65. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой T69M.
66. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотными заменами D52N и D95E.
67. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотными заменами V10M и D95G.
68. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой S93T и вариабельная область тяжелой цепи с аминокислотными заменами S17F и T69A.
69. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой N68T и вариабельную область тяжелой цепи с аминокислотными заменами S17F и Y108N.
70. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотной заменой S63F.
71. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотными заменами Q3R, Y32F и A97V.
72. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой K16E.
73. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотной заменой M117L.
74. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой L72M и вариабельную область тяжелой цепи с аминокислотной заменой S25A.
75. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотными заменами T102S и L116M.
76. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотными заменами S25N и V34I и вариабельную область тяжелой цепи с аминокислотными заменами K12E и D109E.
77. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотной заменой E16G.
78. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой L54Q и вариабельную область тяжелой цепи с аминокислотной заменой M106L.
79. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой S25N.
80. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотными заменами G26A и Q113L.
81. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область легкой цепи с аминокислотной заменой L54Q.
82. Агент на основе антитела человека по любому из аспектов 59-63, где агент на основе антитела человека включает вариабельную область тяжелой цепи с аминокислотной заменой T102S.
83. Агент на основе антитела человека по любому из аспектов 59-82, где агент на основе антитела человека включает последовательности вариабельной области тяжелой и легкой цепей, которые представлены в любой из SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72.
84. Агент на основе антитела человека по любому из аспектов 1-83, где агент на основе антитела человека представляет собой человеческое моноклональное антитело, которое включает вариантную Fc-область.
85. Агент на основе антитела человека по аспекту 84, где человеческое моноклональное антитело включает паттерн вариантного гликозилирования по сравнению с исходным человеческим моноклональным антителом, которое включает Fc-область дикого типа.
86. Агент на основе антитела человека по любому из аспектов 1-85, где агент на основе антитела человека конъюгирован с терапевтическим агентом или детектирующим агентом.
87. Агент на основе антитела человека по любому из аспектов 1-85, где агент на основе антитела человека конъюгирован с цитотоксическим агентом или группой.
88. Агент на основе антитела человека по любому из аспектов 1-85, где агент на основе антитела человека конъюгирован с радиоизотопом.
89. Агент на основе антитела человека по любому из аспектов 1-88, где агент на основе антитела человека представляет собой или включает иммуноглобулин, Fab, F (ab')2, Fd, Fv, одноцепочечный Fv (scFv) или dAb.
90. Агент на основе антитела человека по аспекту 89, где агент на основе антитела человека представляет собой scFv или включает его.
91. Агент на основе антитела человека по аспекту 90, где scFv включает линкерную последовательность.
92. Агент на основе антитела человека по аспекту 90 или 91, где scFv конъюгирован с терапевтическим агентом или детектирующим агентом.
93. Агент на основе антитела человека по аспекту 90 или 91, где scFv является частью химерного антигенного рецептора.
94. Агент на основе антитела человека по любому из аспектов 1-93 для применения при терапии или диагностике.
95. Агент на основе антитела человека по любому из аспектов 1-93 для применения при лечении, профилактике или улучшении заболевания, характеризующегося экспрессией CD19.
96. Применение агента на основе антитела человека по любому из аспектов 1-93 для применения при лечении, профилактике или облегчении рака.
97. Выделенная молекула нуклеиновой кислоты, кодирующая агент на основе антитела человека по любому из аспектов 1-93.
98. Выделенная молекула нуклеиновой кислоты по аспекту 97, где выделенная молекула нуклеиновой кислоты включает последовательность, оптимизированную по кодонам.
99. Выделенная молекула нуклеиновой кислоты по аспекту 97, где выделенная молекула нуклеиновой кислоты представляет собой последовательность, которая представлена в любой из SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 9, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25, SEQ ID NO: 27, SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 55, SEQ ID NO: 57, SEQ ID NO: 59, SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67, SEQ ID NO: 69 и SEQ ID NO: 71.
100. Вектор, включающий выделенную молекулу нуклеиновой кислоты по любому из аспектов 97-99.
101. Клетка, содержащая вектор по аспекту 100.
102. Набор, включающий агент на основе антитела человека по любому из аспектов 1-93, выделенную молекулу нуклеиновой кислоты по любому из аспектов 97-99, вектор по аспекту 100 или клетку по аспекту 101.
103. Вакцина, включающая выделенную молекулу нуклеиновой кислоты по любому из аспектов 97-99.
104. Способ получения агента на основе антитела человека по любому из аспектов 1-93, включающий стадию культивирования клетки согласно аспекту 101 в культуральной среде в условиях, позволяющих экспрессию агента на основе антитела человека и отделения агента на основе антитела человека от культуральной среды.
105. Композиция, содержащая агент на основе антитела человека по любому из аспектов 1-93.
106. Композиция по аспекту 105, в которой агент на основе антитела человека конъюгирован с цитотоксическим агентом или фрагментом.
107. Фармацевтическая композиция, содержащая композицию по варианту 105 или 106 или агент на основе антитела человека по любому из аспектов 1-93 и дополнительно содержащий фармацевтически приемлемый носитель или разбавитель.
108. Способ лечения медицинского состояния, характеризующегося экспрессией CD19 у объекта, включающий стадию введения терапевтически эффективного количества агента на основе антитела человека по любому из аспектов 1-93 у объекта.
109. Способ аспекта 108, где медицинское состояние, характеризуемое экспрессией CD19, представляет собой В-клеточную лимфому, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, лимфому Беркитта, неходжкинскую лимфому или острый миелоидный лейкоз.
110. Способ аспекта 108, где медицинское состояние, характеризующееся экспрессией CD19, представляет собой ревматоидный артрит (RA), системную красную волчанку (SLE), диабет или склеродермию.
111. Способ лечения рака, включающий стадию введения объекту агента на основе антитела человека по любому из аспектов 1-93.
112. Применение антительного агента по любому из аспектов 1-93 для лечения или обнаружения состояния, связанного с экспрессией CD19.
113. Биспецифическое антитело, содержащее первый антигенсвязывающий сайт из агента на основе антитела человека по любому из аспектов 1-93 и второго антигенсвязывающего сайта.
114. Биспецифическое антитело по аспекту 113, где первый и второй антигенсвязывающие сайты являются scFv.
115. Биспецифическое антитело по аспекту 113, в котором первый антигенсвязывающий сайт состоит из молекулы иммуноглобулина, а второй антигенсвязывающий сайт состоит из scFv, scFab, Fab или Fv.
116. Биспецифическое антитело по любому из аспектов 113-115, где второй антигенсвязывающий сайт связывает иммунную клетку, выбранную из группы, состоящей из Т-клеток, NK-клеток, В-клеток, дендритных клеток, моноцитов, макрофагов, нейтрофилов, мезенхимальные стволовые клетки и нервные стволовые клетки.
117. Биспецифическое антитело по аспекту 116, где второй антигенсвязывающий сайт связывает CD3 на Т-клетках.
118. Биспецифическое Т-клеточное моноклональное антитело, содержащее антигенсвязывающий сайт агента на основе антитела человека по любому из аспектов 1-93.
119. Биспецифическое антитело по любому из аспектов 113-118 для применения при терапии или диагностике.
120. Выделенная молекула нуклеиновой кислоты, которая целиком или частично кодирует полипептидную цепь биспецифичного антитела по любому из аспектов 113-118.
121. Выделенная молекула нуклеиновой кислоты по аспекту 120, где молекула нуклеиновой кислоты включает последовательность, оптимизированную по кодонам.
122. Вектор, включающий последовательность нуклеиновой кислоты по аспекту 120 или 121.
123. Клетка, включающая вектор по аспекту 122.
124. Набор, включающий биспецифическое антитело по любому из аспектов 113-118, выделенные нуклеотидные молекулы по аспекту 120 или 121, вектора по аспекту 122 или клетки по аспекту 123.
125. Композиция, включающая биспецифическое антитело по любому из аспектов 113-118.
126. Фармацевтическая композиция, включающая композицию по аспекту 125 или биспецифическое антитело по любому из аспектов 113-118 и дополнительно содержащую фармацевтически приемлемый носитель или разбавитель.
127. Химерный антигенный рецептор, включающий антигенсвязывающий сайт агента на основе антитела человека по любому из аспектов 1-93.
128. Химерный антигенный рецептор по аспекту 127, где антигенсвязывающий сайт представляет собой или включает scFv.
129. Химерный антигенный рецептор по аспекту 127, где антигенсвязывающий сайт представляет собой область VL.
130. Химерный антигенный рецептор по аспекту 129, где область VL включает CDR легкой цепи (a) SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183; (b) SEQ ID NO: 184, SEQ ID NO: 185 и SEQ ID NO: 186; (c) SEQ ID NO: 187, SEQ ID NO: 188 и SEQ ID NO: 189; (d) SEQ ID NO: 190, SEQ ID NO: 191 и SEQ ID NO: 192; (e) SEQ ID NO: 193, SEQ ID NO: 194 и SEQ ID NO: 195; (f) SEQ ID NO: 196, SEQ ID NO: 197 и SEQ ID NO: 198; (g) SEQ ID NO: 199, SEQ ID NO: 200 и SEQ ID NO 201; (h) SEQ ID NO: 202, SEQ ID NO: 203 и SEQ ID NO: 204; (i) SEQ ID NO: 205, SEQ ID NO: 206 и SEQ ID NO: 207;
(j) SEQ ID NO:208, SEQ ID NO:209 и SEQ ID NO:210; (k) SEQ ID NO:211, SEQ ID NO:212 и SEQ ID NO:213; (l) SEQ ID NO:214, SEQ ID NO:215 и SEQ ID NO:216;
(m) SEQ ID NO: 217, SEQ ID NO: 218 и SEQ ID NO: 219; (n) SEQ ID NO: 220, SEQ ID NO: 221 и SEQ ID NO: 222; (o) SEQ ID NO: 223, SEQ ID NO: 224 и SEQ ID NO: 225; (p) SEQ ID NO: 226, SEQ ID NO: 227 и SEQ ID NO: 228; (q) SEQ ID NO: 229, SEQ ID NO: 230 и SEQ ID NO: 231; (r) SEQ ID NO: 232, SEQ ID NO: 233 и SEQ ID NO: 234; (ы) SEQ ID NO: 235, SEQ ID NO: 236 и SEQ ID NO: 237; (t) SEQ ID NO: 238, SEQ ID NO: 239 и SEQ ID NO: 240; (u) SEQ ID NO: 241, SEQ ID NO: 242 и SEQ ID NO: 243; (v) SEQ ID NO: 244, SEQ ID NO: 245 и SEQ ID NO: 246; (w) SEQ ID NO: 247, SEQ ID NO: 248 и SEQ ID NO: 249; (x) SEQ ID NO: 250, SEQ ID NO: 251 и SEQ ID NO: 252; (y) SEQ ID NO: 253, SEQ ID NO: 254 и SEQ ID NO: 255; (z) SEQ ID NO: 256, SEQ ID NO: 257 и SEQ ID NO: 258; (ab) SEQ ID NO: 259, SEQ ID NO: 260 и SEQ ID NO: 261; (AC) SEQ ID NO: 262, SEQ ID NO: 263 и SEQ ID NO: 264; (ad) SEQ ID NO: 265, SEQ ID NO: 266 и SEQ ID NO: 267; (ae) SEQ ID NO: 268, SEQ ID NO: 269 и SEQ ID NO: 270; (af) SEQ ID NO: 271, SEQ ID NO: 272 и SEQ ID NO: 273; (ag) SEQ ID NO: 274, SEQ ID NO: 275 и SEQ ID NO: 276; (а) SEQ ID NO: 277, SEQ ID NO: 278 и SEQ ID NO: 279; (ai) SEQ ID NO: 280, SEQ ID NO: 281 и SEQ ID NO: 282; (aj) SEQ ID NO: 283, SEQ ID NO: 284 и SEQ ID NO: 285; или (ak) SEQ ID NO: 286, SEQ ID NO: 287 и SEQ ID NO: 288.
131. Химерный антигенный рецептор по аспекту 129, где область VL включает последовательность, которая представлена в любой из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72.
132. Химерный антигенный рецептор по аспекту 127, где антигенсвязывающий сайт представляет собой область VH.
133. Химерный антигенный рецептор по аспекту 132, где область VH включает CDR тяжелой цепи (a) SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 75; (b) SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78; (c) SEQ ID NO: 79, SEQ ID NO: 80 и SEQ ID NO: 81; (d) SEQ ID NO: 82, SEQ ID NO: 83 и SEQ ID NO: 84; (e) SEQ ID NO: 85, SEQ ID NO: 86 и SEQ ID NO: 87; (f) SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 90; (g) SEQ ID NO: 91, SEQ ID NO: 92 и SEQ ID NO: 93; (h) SEQ ID NO: 94, SEQ ID NO: 95 и SEQ ID NO: 96; (i) SEQ ID NO: 97, SEQ ID NO: 98 и SEQ ID NO: 99; (j) SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102; (k) SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 105; (1) SEQ ID NO: 106, SEQ ID NO: 107 и SEQ ID NO: 108; (m) SEQ ID NO: 109, SEQ ID NO: 110 и SEQ ID NO: 111; (n) SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114; (o) SEQ ID NO: 115, SEQ ID NO: 116 и SEQ ID NO: 117; (p) SEQ ID NO: 118, SEQ ID NO: 119 и SEQ ID NO: 120; (q) SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123; (r) SEQ ID NO: 124, SEQ ID NO: 125 и SEQ ID NO: 126; (ы) SEQ ID NO: 127, SEQ ID NO: 128 и SEQ ID NO: 129; (t) SEQ ID NO: 130, SEQ ID NO: 131 и SEQ ID NO: 132; (u) SEQ ID NO: 133, SEQ ID NO: 134 и SEQ ID NO: 135; (v) SEQ ID NO: 136, SEQ ID NO: 137 и SEQ ID NO: 138; (w) SEQ ID NO: 139, SEQ ID NO: 140 и SEQ ID NO: 141; (x) SEQ ID NO: 142, SEQ ID NO: 143 и SEQ ID NO: 144; (y) SEQ ID NO: 145, SEQ ID NO: 146 и SEQ ID NO: 147; (z) SEQ ID NO: 148, SEQ ID NO: 149 и SEQ ID NO: 150; (ab) SEQ ID NO: 151, SEQ ID NO: 152 и SEQ ID NO: 153; (AC) SEQ ID NO: 154, SEQ ID NO: 155 и SEQ ID NO: 156; (ad) SEQ ID NO: 157, SEQ ID NO: 158 и SEQ ID NO: 159; (ae) SEQ ID NO: 160, SEQ ID NO: 161 и SEQ ID NO: 163; (af) SEQ ID NO: 163, SEQ ID NO: 164 и SEQ ID NO: 165; (ag) SEQ ID NO: 166, SEQ ID NO: 167 и SEQ ID NO: 168; (а) SEQ ID NO: 169, SEQ ID NO: 170 и SEQ ID NO: 171; (ai) SEQ ID NO: 172, SEQ ID NO: 173 и SEQ ID NO: 174; (aj) SEQ ID NO: 175, SEQ ID NO: 176 и SEQ ID NO: 177; или (ak) SEQ ID NO: 178, SEQ ID NO: 179 и SEQ ID NO: 180.
134. Химерный антигенный рецептор по аспекту 132, где область VH включает последовательность, которая представлена в любой из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72.
135. Химерный антигенный рецептор по любому из аспектов 127-134 для применения при терапии или диагностике.
136. Химерный антигенный рецептор по любому из аспектов 127-134 для применения при лечении, профилактике или облегчении заболевания, характеризующегося экспрессией CD19.
137. Выделенная молекула нуклеиновой кислоты, которая кодирует химерный антигенный рецептор по любому из аспектов 127-134.
138. Выделенная молекула нуклеиновой кислоты по аспекту 137, где молекула нуклеиновой кислоты включает последовательность, оптимизированную по кодонам.
139. Эффекторная иммунная клетка, которая экспрессирует химерный антигенный рецептор по любому из аспектов 127-134.
140. Эффекторная иммунная клетка по аспекту 139, где клетка представляет собой Т-клетку или NK-клетку.
141. Эффекторная иммунная клетка в аспекте 139 или 140 для применения при терапии или диагностике.
142. Эффекторная иммунная клетка по аспекту 139 или 140 для применения при лечении, профилактике или облегчении заболевания, характеризующегося экспрессией CD19.
143. Набор, включающий химерный антигенный рецептор по любому из аспектов 127-134, выделенную молекулу нуклеиновой кислоты по аспекту 137 или 138 или иммунную эффекторную клетку по аспекту 139 или 140.
144. Применение химерного антигенного рецептора по любому из аспектов 127-134 для лечения или обнаружения медицинского состояния, связанного с экспрессией CD19.
145. Способ ингибирования роста опухоли, включающий стадию контакта опухолевых клеток с биспецифическим антителом, причем биспецифическое антитело состоит из первого антигенсвязывающего сайта на базе агента на основе антитела человека по любому из аспектов 1-93 и второй антигенсвязывающий сайт, который связывает иммунную клетку, причем контакт проводят в условиях и в течение времени, достаточного для того, чтобы наблюдалось уничтожение опухолевых клеток.
146. Способ уничтожения опухолевых клеток, включающий стадию контакта опухолевых клеток с биспецифическим антителом, причем биспецифическое антитело состоит из первого антигенсвязывающего сайта на базе агента на основе антитела человека по любому из аспектов 1-93 и второй антигенсвязывающий сайт, который связывает иммунную клетку, причем контакт проводят в условиях и в течение времени, достаточного для ингибирования роста опухолевых клеток.
147. Способ по аспекту 145 или 146, где иммунная клетка представляет собой Т-клетку или NK-клетку.
148. Способ по любому из аспектов 145-147, где первый и второй антигенсвязывающие сайты являются scFv.
149. Способ аспекта 148, где второй антигенсвязывающий сайт связывает CD3 на Т-клетках.
150. Биспецифическое антитело, состоящее из первого антигенсвязывающего сайта на базе агента на основе антитела человека по любому из аспектов 1-93 и второго антигенсвязывающего сайта, который связывает иммунную клетку, для применения при ингибировании роста опухоли.
151. Биспецифическое антитело, состоящее из первого антигенсвязывающего сайта на базе агента на основе антитела человека по любому из аспектов 1-93 и второго антигенсвязывающего сайта, который связывает иммунную клетку, для применения при уничтожении опухолевых клеток.
152. Способ управления Т-клетками для уничтожения клеток-мишеней, экспрессирующих CD19, причем способ включает стадию контакта одной или нескольких клеток-мишеней, экспрессирующих CD19, с биспецифическим антителом, причем биспецифическое антитело включает первый антигенсвязывающий сайт агента на основе антитела человека по любому из аспектов 1-93 и второй антигенсвязывающий сайт, который связывает CD3 на Т-клетках, причем контакт выполняется в условиях и в течение времени, достаточном для того, чтобы Т-клетки, с которыми биспецифическое антитело связывается, опосредовали уничтожение клеток-мишеней, экспрессирующих CD19.
153. Способ по аспекту 152, где первый и второй антигенсвязывающие сайты представляют собой scFv.
154. Биспецифическое антитело, состоящее из первого антигенсвязывающего сайта на базе агента на основе антитела человека по любому из аспектов 1-93 и второго антигенсвязывающего сайта, который связывает CD3 на Т-клетках, для применения при нацеливании Т-клеток на уничтожение клеток-мишеней, экспрессирующих CD19.
155. Биспецифическое антитело, состоящее из первого scFv, который специфически связывает CD19, и второго scFv, который специфически связывает CD3 на Т-клетках, где N-конец первого scFv связан с C-концом второго scFv и где первый scFv включает любой из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72.
156. Биспецифическое антитело по аспекту 155, где N-конец первого scFv связан с C-концом второго scFv посредством линкерной последовательности.
157. Биспецифическое антитело по аспекту 156, где линкерная последовательность включает линкер (G4S)n.
158. Биспецифическое антитело по аспекту 157, где n равно 1, 2, 3, 4 или 5.
159. Биспецифическое антитело по аспекту 156, где линкерная последовательность представляет собой SRGGGGGGGGGGGGGGGGEMEMA (SEQ ID NO: 289).
160. Фармацевтическая композиция, содержащая биспецифическое антитело по любому из аспектов 155-159 и дополнительно содержащая фармацевтически приемлемый носитель или разбавитель.
161. Биспецифическое антитело по любому из аспектов 155-159 для применения при терапии или диагностике.
162. Конъюгат антитело-лекарственное средство, содержащий антигенсвязывающий сайт агента на основе антитела человека по любому из аспектов 1-93 и цитотоксические агент или группу.
163. Набор для диагностики объекта, страдающего заболеванием, связанным с CD19, или предрасположением к нему, или для обеспечения прогноза состояния объекта, где набор, включает детектирующее средство для обнаружения концентрации CD19, присутствующего в образце из испытуемого объекта, где детектирующее средство включает антигенсвязывающий сайт агента на основе антитела человека по любому из аспектов 1-93, биспецифичный связывающий агент по любому из аспектов 113-118 и 155-159, химерный антигенный рецептор по любому из аспектов 127-134 или иммунная эффекторная клетка в отношении аспекта 138 или 139, каждая из которых необязательно дериватизирована, причем присутствие CD19 в образце указывает на то, что объект страдает от заболевания, связанного с CD19.
Эквиваленты
Применение порядковых терминов, таких как «первый», «второй», «третий» и т.д. в формуле изобретения для модификации элемента пункта, само по себе не означает любого приоритета, предпочтения или порядка одного элемента пункта над другим или временного порядка, в котором выполняются действия способа, но используются просто как метки для различения одного элемента способа, имеющего определенное название от другого элемента, имеющего такое же название (но для применения порядкового термина) для того, чтобы различать элементы пункта.
Следует понимать, что слова в единственном числе, используемые в данном документе в описании и в формуле изобретения, если явно не указано обратное, включают множественное число. Формула изобретения или описания, которые включают «или» между одним или несколькими представителями группы, считаются удовлетворенными, если один, более одного или все представители группы присутствуют, применяются или имеют отношение к определенному продукту или способу, если не указанно противоположное или иное не очевидно из контекста. Изобретение включает воплощения, в которых ровно один представитель группы присутствует в, применяется в или иным образом относится к данному продукту или способу. Изобретение также включает воплощения, в которых более одного или все представители группы присутствуют, применяются или имеют отношение к определенному продукту или способу. Кроме того, следует понимать, что изобретение охватывает все варианты, комбинации и перестановки, в которых один или несколько ограничений, элементов, положений, описательных терминов и т.д. из одного или нескольких перечисленных пунктов вводятся в другой пункт, зависящий от того же базового пункта (или, если применимо, любого другого пункта), если не указано иное, или если бы специалисту в данной области не было очевидно, что возникнет противоречие или несогласованность. Если элементы представлены в виде списков (например, в группе Маркуша или в аналогичном формате), следует понимать, что каждая подгруппа элементов также раскрывается, и любой элемент (элементы) можно удалить из группы. Следует понимать, что в общем случае, когда изобретение или аспекты изобретения упоминаются как содержащие конкретные элементы, признаки и т.д., некоторые воплощения изобретения или аспекты изобретения состоят или состоят в основном из, таких элементов, признаков и т.д. Для простоты эти воплощения не были в каждом конкретном случае специфически изложены в таком количестве слов в данном документе. Следует также понимать, что любое воплощение или аспект изобретения может быть явно исключен из формулы изобретения независимо от того, указано ли конкретное исключение в описании. Публикации, веб-сайты и другие справочные материалы, упомянутые в данном документе для описания предыстории изобретения и предоставления дополнительных подробностей относительно его практического осуществления, включены в данный документ ссылкой.
Таким образом, описав несколько аспектов, по меньшей мере, одного воплощения настоящего изобретения, следует понимать, что различные изменения, модификации и улучшения будут очевидны для специалистов в данной области. Такие изменения, модификации и улучшения предназначены для частичного раскрытия и предназначены для того, чтобы быть в пределах сущности и объема изобретения. Соответственно, приведенное выше описание и чертежи приведены только в качестве примера, и изобретение подробно описано в формуле изобретения ниже.
--->
SEQUENCE LISTING
<110> Eureka Therapeutics Inc
<120> ANTIBODY AGENTS SPECIFIC FOR HUMAN CD19 AND USES THEREOF
<130> ET-2015-11-WO-PCT
<140> US 62/240,624
<141> 2015-10-13
<160> 302
<170> PatentIn version 3.5
<210> 1
<211> 747
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 1
cagactgtgg tgactcagga gccctcagtg tctgcggccc caggacagaa ggtcaccatc 60
tcctgctctg gaagcagctc caacattggg aataattatg tatcctggta ccagcagctc 120
ccaggaacag cccccaaact cctcatttat gacaataata agcgaccctc agggattcct 180
gaccgattct ctggctccaa gtctggcacg tcagccaccc tgggcatcac cggactccag 240
actggggacg aggccgatta ttactgcgga acatgggata gcagcctgag tgctggtgtc 300
ttcggaactg ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggcccagg tgcagctggt ggagactggg 420
ggaggcttgg tacagcctgg ggggtccctg agactctcct gtgcagcctc tggattcacc 480
tttagcagct atgccatgag ctgggtccgc caggctccag ggaaggggct ggagtgggtc 540
tcagctatta gtggtagtgg tggtagcaca tactacgcag actccgtgaa gggccggttc 600
accatctcca gagacaattc caagaacacg ctgtatctgc aaatgaacag cctgagagcc 660
gaggacacgg ccgtatatta ctgtgcgcgc tactactact ctcgtctgga ttactggggt 720
caaggtactc tggtgaccgt ctcctca 747
<210> 2
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 2
Gln Thr Val Val Thr Gln Glu Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Tyr Val Ser Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Asp Asn Asn Lys Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Thr Leu Gly Ile Thr Gly Leu Gln
65 70 75 80
Thr Gly Asp Glu Ala Asp Tyr Tyr Cys Gly Thr Trp Asp Ser Ser Leu
85 90 95
Ser Ala Gly Val Phe Gly Thr Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Gln Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val
130 135 140
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
145 150 155 160
Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
165 170 175
Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr
180 185 190
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
195 200 205
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
210 215 220
Val Tyr Tyr Cys Ala Arg Tyr Tyr Tyr Ser Arg Leu Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 3
<211> 747
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 3
cagtctgtgc tgacgcagcc gccctcagtg tctgcggccc caggacagaa ggtcaccatc 60
tcctgctctg gaagcagctc caacattggg aataattatg tatcctggta ccggcaactc 120
ccaggaacag cccccaaact cctcatctat gaaaataata agcgaccctc agggattcct 180
gaccgattct ctggctccaa gtctggcacg tcagccaccc tgggcatcac cggactccag 240
actggggacg aggccgatta ttactgcgga acatgggata gcagcctgcg tgctggggtc 300
ttcggaactg ggaccaaggt caccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggcccagg tgcagctggt ggagtctggg 420
ggaggcttgg tacagcctgg ggggtccctg agactctcct gtgcagcctc tggattcacc 480
tttagcagct atgccatgag ctgggtccgc caggctccgg ggaaggggct ggagtgggtc 540
tcaggtatta gtgctagtgg tggtagcaca tactacgcag actccgtgaa gggccgcttc 600
accatctcca gagacaattc caagaatacg ctgtatctgc aaatgaacag cctgagagcc 660
gaggacacgg ccgtatatta ctgtgcgcgc tactacctgt ctcagatcga ttcttggggt 720
caaggtactc tggtgaccgt ctcctca 747
<210> 4
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 4
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Ala Ala Pro Gly Gln
1 5 10 15
Lys Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Tyr Val Ser Trp Tyr Arg Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Glu Asn Asn Lys Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Thr Leu Gly Ile Thr Gly Leu Gln
65 70 75 80
Thr Gly Asp Glu Ala Asp Tyr Tyr Cys Gly Thr Trp Asp Ser Ser Leu
85 90 95
Arg Ala Gly Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
130 135 140
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
145 150 155 160
Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
165 170 175
Leu Glu Trp Val Ser Gly Ile Ser Ala Ser Gly Gly Ser Thr Tyr Tyr
180 185 190
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
195 200 205
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
210 215 220
Val Tyr Tyr Cys Ala Arg Tyr Tyr Leu Ser Gln Ile Asp Ser Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 5
<211> 753
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 5
cagtctgtgt tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcgga agtaatactg taaactggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcggccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgtgca gcatgggatg acagcctgaa tggccatgtg 300
gtattcggcg gagggaccaa gctgaccgtc ctaggttcta gaggtggtgg tggtagcggc 360
ggcggcggct ctggtggtgg tggatccctc gagatggccg aggtccagct ggtgcagtct 420
ggggctgagg tgaagaagcc tggggctaca gtgaaaatct cctgcaaggt ttctggatac 480
accttcaccg actactacat gcactgggtg caacaggccc ctggaaaagg gcttgagtgg 540
atgggacttg ttgatcctga agatggtgaa acaatatacg cagagaagtt ccagggcaga 600
gtcaccataa ccgcggacac gtctacagac acagcctaca tggagctgag cagcctgaga 660
tctgaggaca cggccgtgta ttactgtgca accggaatct atagcagacc tctgggctac 720
tggggccagg gaaccctggt caccgtctcc tca 753
<210> 6
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 6
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Thr Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly His Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
Ser Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Leu Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
130 135 140
Lys Lys Pro Gly Ala Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr
145 150 155 160
Thr Phe Thr Asp Tyr Tyr Met His Trp Val Gln Gln Ala Pro Gly Lys
165 170 175
Gly Leu Glu Trp Met Gly Leu Val Asp Pro Glu Asp Gly Glu Thr Ile
180 185 190
Tyr Ala Glu Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Thr Ser
195 200 205
Thr Asp Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
210 215 220
Ala Val Tyr Tyr Cys Ala Thr Gly Ile Tyr Ser Arg Pro Leu Gly Tyr
225 230 235 240
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 7
<211> 759
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 7
tcctatgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcgga agtcatactg taaactggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcggccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgtgca gcatgggatg acagcctgaa tggttatgtc 300
ttcggaactg ggaccaaggt caccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggccgagg tgcagctggt ggagactggg 420
ggaggcttgg tacagcctgg ggggtccctg agactctcct gtgcagcctc tggattcacc 480
tttagcagct atgccatgag ctgggtccgc caggctccag ggaaggggct ggagtgggtc 540
tcagctatta gtggtagtgg tggtagcaca tactacgcag actccgtgaa gggccgattc 600
accatctcca gagacaattc caagaacacg ctgtatcttc aaatgaacag cctgagagct 660
gaggacacgg ccgtgtatta ctgtgcgcgc tctgacggta aacatttctg gcagcagtac 720
gatgcttggg gtcaaggtac tctggtgacc gtctcctca 759
<210> 8
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 8
Ser Tyr Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser His
20 25 30
Thr Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val
130 135 140
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
145 150 155 160
Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
165 170 175
Leu Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr
180 185 190
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
195 200 205
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
210 215 220
Val Tyr Tyr Cys Ala Arg Ser Asp Gly Lys His Phe Trp Gln Gln Tyr
225 230 235 240
Asp Ala Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 9
<211> 729
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 9
gacatccagt tgacccagtc tccatcctcc ctgtctgcat atgtgggaga cagagtcacc 60
atcacttgtc gggcgagtca gggcattacc aattctttag cctggtatca gcagaagcca 120
gggaaagccc ctaagctcct gctacatgct gcatccagat tggagtctgg ggtcccatcc 180
aggttcagtg gcagtggatt tgggacggat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg cagtttatta ctgtcaacac tatttaggta ccccgtactc ttttggccag 300
gggaccaagg tggagatcaa acgttctaga ggtggtggtg gtagcggcgg cggcggctct 360
ggtggtggtg gatccctcga gatggccgag gtgcagctgg tggagtctgg aggaggcttg 420
gtccagcctg gggggtccct gagactctcc tgtgcagcct ctgggttcac cgtcagtagc 480
aactacatga gctgggtccg ccaggctcca gggaaggggc tggagtgggt ctcagctatt 540
agtggtagtg gtggtagcac atactacgca gactccgtga agggccggtt caccatctcc 600
agagacaatt ccaagaacac gctgtatctg caaatgaaca gcctgagagc cgaggacacg 660
gccgtatatt actgtgcgcg catgaacatc gattactggg gtcaaggtac tctggtgacc 720
gtctcctca 729
<210> 10
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 10
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Tyr Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Thr Asn Ser
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Leu
35 40 45
His Ala Ala Ser Arg Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Phe Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Tyr Leu Gly Thr Pro Tyr
85 90 95
Ser Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Ser Arg Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu Met
115 120 125
Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
130 135 140
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val Ser Ser
145 150 155 160
Asn Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
165 170 175
Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser
180 185 190
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu
195 200 205
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr
210 215 220
Cys Ala Arg Met Asn Ile Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser
<210> 11
<211> 759
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 11
gaaattgtgc tgactcagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atctcttgcc gggcaagtca gagcgttagc agatttttaa attggtatca gcagaaaccg 120
ggtaaagccc ctaagctcct gatctatggt gtatccactt tggaacgtgg ggtcccttca 180
aggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag tctgcaacct 240
gaagattttg caacttacta ctgtcaagag agttacatta tcccgctcac tttcggcgga 300
gggaccaagc tggagatcaa acgttctaga ggtggtggtg gtagcggcgg cggcggctct 360
ggtggtggtg gatccctcga gatggccgag gtgcagctgg tgcagtctgg agcagaggtg 420
aaaaggcccg gggagtctct gacgatctcc tgtaagggtt ctgaatacag ctttgccagc 480
tactggatca cctgggtgcg ccagatgccc gggaaaggcc tggagtggat ggggaggatt 540
gatcctagtg actcttatac caactacagc ccgtccttcc aaggccacgt caccatctca 600
gctgacaagt ccatcagcac tgcctacttg cagtggagca gcctgaaggc ctcggacacc 660
gccatatatt actgtgcgag accttttcag tacgactacg gtggttactc cgatgctttt 720
gatatctggg gccaagggac aatggtcacc gtctcttca 759
<210> 12
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 12
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Ser Val Ser Arg Phe
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Val Ser Thr Leu Glu Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Glu Ser Tyr Ile Ile Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Ser Arg Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu Met
115 120 125
Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Arg Pro Gly
130 135 140
Glu Ser Leu Thr Ile Ser Cys Lys Gly Ser Glu Tyr Ser Phe Ala Ser
145 150 155 160
Tyr Trp Ile Thr Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp
165 170 175
Met Gly Arg Ile Asp Pro Ser Asp Ser Tyr Thr Asn Tyr Ser Pro Ser
180 185 190
Phe Gln Gly His Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala
195 200 205
Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Ile Tyr Tyr
210 215 220
Cys Ala Arg Pro Phe Gln Tyr Asp Tyr Gly Gly Tyr Ser Asp Ala Phe
225 230 235 240
Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
245 250
<210> 13
<211> 753
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 13
gaaattgtga tgacgcagtc tccactctcc ctgtccgtca cccctggaga gccggcctcc 60
atctcctgca ggtctagtca gagcctcttg gacagcaatg gattcaactc tttggattgg 120
tacctgcaga agccagggca gtctccacaa ctcctgatcc atttaggttc tgatcgggcc 180
tccggggtcc ctgacaggtt cagcggcagt ggatcaggca cagattttac actgaaaatc 240
agcagagtgg aggctgagga tgttggaatt tattactgca tgcagtctct acaaattccg 300
acgttcggcc aagggaccaa ggtggaaatc aaacgttcta gaggtggtgg tggtagcggc 360
ggcggcggct ctggtggtgg tggatccctc gagatggccc agatgcagct ggtgcaatct 420
ggggctgagg tgaagaaggc tgggtcctcg gtgaaggtct cctgcgagac ttctggaggc 480
accttcagca gctctagtgt caactgggtg cgacaggccc ctggacaagg gcttgagtgg 540
atgggaggaa tcatccctat cgttggaaca ccaaactacg cacagaagtt ccaggacaga 600
gtcacgatta ccgcggtcga atccaccttt acagcctaca tggagctgag cggcctgaga 660
tctgaggaca cggccgttta ttactgtgcg cgggggggat atcgcgacta tatggatgtc 720
tggggcagag ggaccacggt caccgtctcc tca 753
<210> 14
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 14
Glu Ile Val Met Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asn Gly Phe Asn Ser Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile His Leu Gly Ser Asp Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Ile Tyr Tyr Cys Met Gln Ser
85 90 95
Leu Gln Ile Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Ser Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Leu Glu Met Ala Gln Met Gln Leu Val Gln Ser Gly Ala Glu Val
130 135 140
Lys Lys Ala Gly Ser Ser Val Lys Val Ser Cys Glu Thr Ser Gly Gly
145 150 155 160
Thr Phe Ser Ser Ser Ser Val Asn Trp Val Arg Gln Ala Pro Gly Gln
165 170 175
Gly Leu Glu Trp Met Gly Gly Ile Ile Pro Ile Val Gly Thr Pro Asn
180 185 190
Tyr Ala Gln Lys Phe Gln Asp Arg Val Thr Ile Thr Ala Val Glu Ser
195 200 205
Thr Phe Thr Ala Tyr Met Glu Leu Ser Gly Leu Arg Ser Glu Asp Thr
210 215 220
Ala Val Tyr Tyr Cys Ala Arg Gly Gly Tyr Arg Asp Tyr Met Asp Val
225 230 235 240
Trp Gly Arg Gly Thr Thr Val Thr Val Ser Ser
245 250
<210> 15
<211> 747
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 15
tcctatgagc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcgga agtaattatg tatactggta ccagcagctc 120
ccaggaacgg cccccaaact cctcatctat aggaataatc agcggccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccgg 240
tccgaggatg aggctgatta ttactgtgca gcatgggatg acagcctgag tggttatgtc 300
ttcggaactg ggaccaaggt caccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggccgagg tgcagctggt ggagtctgga 420
ggaggcttga tccagcctgg ggggtccctg agactctcct gtgcagcctc tgggttcacc 480
gtcagtagca actacatgag ctgggtccgc caggctccag ggaaggggct ggagtgggtc 540
tcagttattt atagcggtgg tagcacatac tacgcagact ccgtgaaggg ccgattcacc 600
atctccagag acaattccaa gaacacgctg tatcttcaaa tgaacagcct gagagccgag 660
gacacggccg tgtattactg tgcgaggggg gggtttggag ctgaatttga ctactggggc 720
cagggaaccc tggtcaccgt ctcctca 747
<210> 16
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 16
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Tyr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Arg Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Ser Gly Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Ile
130 135 140
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
145 150 155 160
Val Ser Ser Asn Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
165 170 175
Leu Glu Trp Val Ser Val Ile Tyr Ser Gly Gly Ser Thr Tyr Tyr Ala
180 185 190
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
195 200 205
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ala Arg Gly Gly Phe Gly Ala Glu Phe Asp Tyr Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 17
<211> 756
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 17
tcctatgtgc tgactcagcc accctcagtg tccgtgtccc caggacagac agccagcatc 60
acctgctctg gagataaatt gggggataaa tatgcttcct ggtatcagca gaagccaggc 120
cagtcccctg tactggtcat ctatcaagat aacaagcggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacagcc actctgacca tcagcgggac ccaggctatg 240
gatgaggctg actattactg tcaggcgtgg gacagcagca ctgaggatgt cttcggacct 300
gggaccaagg tcaccgtcct aggttctaga ggtggtggtg gtagcggcgg cggcggctct 360
ggtggtggtg gatccctcga gatggccgag gtgcagctgg tggagtctgg aggaggcttg 420
atccagcctg gggggtccct gagactctcc tgtgcagcct ctgggttcac cgtcagtagc 480
aactacatga gctgggtccg ccaggctcca gggaaggggc tggagtgggt ctcagttatt 540
tatagcggtg gtagcacata ctacgcagac tccgtgaagg gccgattcac catctccaga 600
gacaattcca agaacacgct gtatcttcaa atgaacagcc tgagagccga ggacacggcc 660
gtgtattact gtgcgagagg tggtatttcg gacgattact atggttcggg gagttatgat 720
aactggggcc agggaaccct ggtcaccgtc tcctca 756
<210> 18
<211> 252
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 18
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Lys Leu Gly Asp Lys Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Asn Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ala Trp Asp Ser Ser Thr Glu Asp
85 90 95
Val Phe Gly Pro Gly Thr Lys Val Thr Val Leu Gly Ser Arg Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu Met
115 120 125
Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Ile Gln Pro Gly
130 135 140
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val Ser Ser
145 150 155 160
Asn Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
165 170 175
Val Ser Val Ile Tyr Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
180 185 190
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
195 200 205
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
210 215 220
Ala Arg Gly Gly Ile Ser Asp Asp Tyr Tyr Gly Ser Gly Ser Tyr Asp
225 230 235 240
Asn Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 19
<211> 741
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 19
gacatccagt tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca gagcattagc agctatttaa attggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgct gcatccagtt tgcaaagtgg ggtcccatca 180
aggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag tctgcaacct 240
gaagattttg caacttacta ctgtcaacag agttacagta cccccttcac tttcggcgga 300
gggaccaagg tggagatcaa acgttctaga ggtggtggtg gtagcggcgg cggcggctct 360
ggtggtggtg gatccctcga gatggccgag gtgcagctgg tggagtctgg gggaggcttg 420
gtccagcctg gggggtccct gagactctcc tgtgcagcct ctggattcac cgtcagtagc 480
aactacatga gctgggtccg ccaggctcca gggaaggggc tggagtgggt ctcagttatt 540
tatagcggtg gtagcacata ctacgcagac tccgtgaagg gccgattcac catctccaga 600
gacaattcca agaacacgct gtatcttcaa atgaacagcc tgagagctga ggacacggct 660
gtgtattact gtgcgagaga aagggggatg ggatatgctt ttgatatctg gggccaaggg 720
acaatggtca ccgtctcttc a 741
<210> 20
<211> 247
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 20
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Ser Arg Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu Met
115 120 125
Ala Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
130 135 140
Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val Ser Ser
145 150 155 160
Asn Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
165 170 175
Val Ser Val Ile Tyr Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
180 185 190
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
195 200 205
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
210 215 220
Ala Arg Glu Arg Gly Met Gly Tyr Ala Phe Asp Ile Trp Gly Gln Gly
225 230 235 240
Thr Met Val Thr Val Ser Ser
245
<210> 21
<211> 720
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 21
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggccagtca gggcattggc agttatttag cctggtatca gcaaaaacca 120
gggaaagccc ctaaactcct gatctatcct gcatccacgt tgcaaagtgg ggtcccatca 180
agattcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcaacaa cttaatagtc tcttcggcca agggacacga 300
ctggagatta aacgttctag aggtggtggt ggtagcggcg gcggcggctc tggtggtggt 360
ggatccctcg agatggccca gctgcagctg caggagtcgg gcccaggact ggtgaagcct 420
tcggagaccc tgtccctcac ctgctctgtc tctggtgtct ccatgagtga aaactactgg 480
agctggatcc ggcagccccc agggaagcga ctggagtgga ttgggtgtgc ccattacact 540
ggggacaccc actacaaccc ctccctcaag ggtcgagtca ccatatcact agacacgtcc 600
atgaaccagt tctccctgag gctgaactct gtgaccgctg cggacacggc cgtctattac 660
tgtgcgagtt atcatccctt taactactgg ggccagggaa ccctggtcac cgtctcctca 720
<210> 22
<211> 240
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 22
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Gly Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Pro Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Leu Asn Ser Leu Phe Gly
85 90 95
Gln Gly Thr Arg Leu Glu Ile Lys Arg Ser Arg Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu Met Ala Gln Leu
115 120 125
Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu
130 135 140
Ser Leu Thr Cys Ser Val Ser Gly Val Ser Met Ser Glu Asn Tyr Trp
145 150 155 160
Ser Trp Ile Arg Gln Pro Pro Gly Lys Arg Leu Glu Trp Ile Gly Cys
165 170 175
Ala His Tyr Thr Gly Asp Thr His Tyr Asn Pro Ser Leu Lys Gly Arg
180 185 190
Val Thr Ile Ser Leu Asp Thr Ser Met Asn Gln Phe Ser Leu Arg Leu
195 200 205
Asn Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Ser Tyr
210 215 220
His Pro Phe Asn Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
<210> 23
<211> 774
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 23
caggctgtgc tgactcagcc accctcggcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcgga actaaaactg taaactggta tcaggtgctc 120
ccaggaacgg cccccaaact cctcatctat agtaattatc gccggccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgacgatg aggctgatta ttactgtgca ctatgggatg acagcctgga tggttatgtc 300
ttcggaactg ggaccaaggt caccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggccgagg tccagctggt gcagtctggg 420
gctgaggtga ggaggcctgg ggctacagtg aaaatctcct gcaaggtttc tggatacacc 480
ttcaacgact tctacttaca ctgggtgcga caggcccctg gaaaagggct tgagtggatg 540
ggacgtattg atcctgaaga tggtaaaaca agatatgcag agaagttcca gggcagactc 600
accattaccg cggacacgtc tacagacact ctttacatgc aactgggcgg cctgacatct 660
gacgacacgg ccgtctatta ctgtacaact gattggggct atagcagttc cctacgtgag 720
gaggacatct ggtacgactg ctggggccag ggaaccctgg tcaccgtctc ctca 774
<210> 24
<211> 258
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 24
Gln Ala Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Thr Lys
20 25 30
Thr Val Asn Trp Tyr Gln Val Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Tyr Arg Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Asp Asp Glu Ala Asp Tyr Tyr Cys Ala Leu Trp Asp Asp Ser Leu
85 90 95
Asp Gly Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Arg
130 135 140
Arg Pro Gly Ala Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr
145 150 155 160
Phe Asn Asp Phe Tyr Leu His Trp Val Arg Gln Ala Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Arg Ile Asp Pro Glu Asp Gly Lys Thr Arg Tyr
180 185 190
Ala Glu Lys Phe Gln Gly Arg Leu Thr Ile Thr Ala Asp Thr Ser Thr
195 200 205
Asp Thr Leu Tyr Met Gln Leu Gly Gly Leu Thr Ser Asp Asp Thr Ala
210 215 220
Val Tyr Tyr Cys Thr Thr Asp Trp Gly Tyr Ser Ser Ser Leu Arg Glu
225 230 235 240
Glu Asp Ile Trp Tyr Asp Cys Trp Gly Gln Gly Thr Leu Val Thr Val
245 250 255
Ser Ser
<210> 25
<211> 756
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 25
tcctatgagc tgactcagcc accctcagtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcat ctattatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgatcatta tgtcttcgga 300
actgggacca aggtcaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaggtgcagc tggtgcagtc tggggctgag 420
gtgaagaagc ctgggtcctc ggtgaaggtc tcctgcaagg cttctggagg caccttcagc 480
agctatgcta tcagctgggt gcgacaggcc cctggacaag ggcttgagtg gatgggaggg 540
atcatcccta tctttggtac agcaaactac gcacagaagt tccagggcag agtcacgatt 600
accgcggacg aatccacgag cacagcctac atggagctga gcagcctgag atctgaggac 660
acggccgtgt attactgtgc gagagattat gggtacggtg actacggtga tgcttttgat 720
atctggggcc aagggacaat ggtcaccgtc tcttca 756
<210> 26
<211> 252
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 26
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Tyr Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser
145 150 155 160
Ser Tyr Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu
165 170 175
Trp Met Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln
180 185 190
Lys Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr
195 200 205
Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr
210 215 220
Tyr Cys Ala Arg Asp Tyr Gly Tyr Gly Asp Tyr Gly Asp Ala Phe Asp
225 230 235 240
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
245 250
<210> 27
<211> 753
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 27
tcctatgtgc tgactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaggccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg aaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattcctg tcaggtgtgg gatagcagta gtgatcatta tgtcttcgga 300
cctgggacca aggtcaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgtaagg gttctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgcgttgtt ggtactatct actctatgca gtacgatgtt 720
tggggtcaag gtactctggt gaccgtctcc tca 753
<210> 28
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 28
Ser Tyr Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Ser Cys Gln Val Trp Asp Ser Ser Ser Asp His
85 90 95
Tyr Val Phe Gly Pro Gly Thr Lys Val Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Val Val Gly Thr Ile Tyr Ser Met Gln Tyr Asp Val
225 230 235 240
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 29
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 29
ctgcctgtgc tgactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgattatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgtaagg gttctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgccaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtgac cgtctcctca 780
<210> 30
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 30
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 31
<211> 759
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 31
caggctgtgc tgactcagcc accctcggtg tctgaagccc ccaggcagag ggtcaccatc 60
tcctgttctg gaagcagctc caacgtcgga aataatgctg taaactggta ccagcaggtc 120
ccaggaaagg ctcccaaact cctcatctat tatgatgatc tgctgtcctc aggggtctct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggccgatta ttattgtgca gcatgggatg acagcctgaa tggtccggta 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggccgaag tgcagctggt gcagtctgga 420
gcagaggtga aaaagcccgg ggagtctctg aagatctcct gtaagggttc tggatacagc 480
tttaccagct actggatcgg ctgggtgcgc cagatgcccg ggaaaggcct ggagtggatg 540
gggatcatct atcctggtga ctctgatacc agatacagcc cgtccttcca aggccaggtc 600
accatctcag ccgacaagtc catcagcacc gcctacctgc agtggagcag cctgaaggcc 660
tcggacaccg ccatgtatta ctgtgcgcgc tggtcttcta cttgggactc tatgtacatg 720
gattactggg gtcaaggtac tctggtgacc gtctcctca 759
<210> 32
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 32
Gln Ala Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Val Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Ser Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
130 135 140
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
145 150 155 160
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
180 185 190
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
195 200 205
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
210 215 220
Met Tyr Tyr Cys Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 33
<211> 756
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 33
cagcctgtgc tgactcagcc accctcagtg tcagtggccc caggaaagac ggccaggatc 60
acctgtggag gaaacaacat tggaagtgaa agtgtgcact ggtaccagca gaagccaggc 120
caggccccta tggtggtcat ctattatgat agcaaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgaccg tcagcagggt cgaagccgag 240
gatgaggccg actattactg tcaggtgtgg aatagtagta gtgatcatcg aggagtgttc 300
ggcggaggga ccaagctgac cgtcctaggt tctagaggtg gtggtggtag cggcggcggc 360
ggctctggtg gtggtggatc cctcgagatg gccgaagtgc agctggtgca gtctggagca 420
gaggtgaaaa agcccgggga gtctctgagg atctcctgta agggttctgg atacagcttt 480
accagctact ggatcggctg ggtgcgccag atgcccggga aaggcctgga gtggatgggg 540
atcatctatc ctggtgactc tgataccaga tacagcccgt ccttccaagg ccaggtcacc 600
atctcagccg acaagtccat cagcaccgcc tacctgcagt ggagcagcct gaaggcctcg 660
gacaccgcca tgtattactg tgcgcgcgtt acttactcta tggactctta ctacttcgat 720
tcttggggtc aaggtactct ggtgaccgtc tcctca 756
<210> 34
<211> 252
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 34
Gln Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Glu Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Met Val Val Ile Tyr
35 40 45
Tyr Asp Ser Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Val Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asn Ser Ser Ser Asp His
85 90 95
Arg Gly Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu
115 120 125
Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
130 135 140
Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe
145 150 155 160
Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu
165 170 175
Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser
180 185 190
Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser
195 200 205
Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met
210 215 220
Tyr Tyr Cys Ala Arg Val Thr Tyr Ser Met Asp Ser Tyr Tyr Phe Asp
225 230 235 240
Ser Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 35
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 35
ctgcctgtgc ttactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcaacagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgattatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ctggggagtc tctgaagatc tcctgtaagg gttctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgccaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtgac tgtctcctca 780
<210> 36
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 36
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Asn Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 37
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 37
ctgcctgtgc tgactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgattatgt ggtatttggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcggc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgcaagg gttctggata cagctttacc 480
agcttctgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgcgatgt attactgtgt gcgccaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtaac cgtctcctca 780
<210> 38
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 38
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Arg Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Phe Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Val Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 39
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 39
ctgcctgtgc tgactcagcc accctcggtg tcagtggccc caggagagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgattatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggca gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgtaagg gttctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgccaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtgac cgtctcctca 780
<210> 40
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 40
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Glu
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 41
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 41
ctgcctgtgc tgactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgattatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggcggtg gtggatccct cgagatggcc gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgtaagg gttctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgccaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaactt ggattcttgg ggtcaaggta ctctggtgac cgtctcctca 780
<210> 42
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 42
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Leu Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 43
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 43
ctgcctgtgc tgactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accatgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgattatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgtaagg gtgctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgccaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtgac cgtctcctca 780
<210> 44
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 44
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Met Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ala Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 45
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 45
ctgcctgtgc tgactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacatggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgattatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgtaagg gttctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgccaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtgac cgtctcctca 780
<210> 46
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 46
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Met Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 47
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 47
ctgcctgtgc tgactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcaaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgagtatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgtaagg gttctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgtcaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtgac cgtctcctca 780
<210> 48
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 48
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Glu Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 49
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 49
ctgcctgtgc tgactcagcc accctcgatg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtggttatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgtaagg gttctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgccaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtgac cgtctcctca 780
<210> 50
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 50
Leu Pro Val Leu Thr Gln Pro Pro Ser Met Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Gly Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 51
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 51
ctgcctgtgc tgactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctacgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtacta gtgattatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtt tctgaagatc tcctgtaagg gttctggata cagcttcacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgtcct tccaaggcca ggtcgccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgccaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtgac cgtctcctca 780
<210> 52
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 52
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Thr Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Phe Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Ala Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 53
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 53
ctgcctgtgc tgactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaccactgcc accctgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgattatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagcgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcagc tagtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgtaagg gttctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactccga taccagatac agcccgtcct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgccaggtt tggggttggc agggtggtat gaacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtgac cgtctcctca 780
<210> 54
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 54
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Thr Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Asn Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 55
<211> 780
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 55
ctgcctgtgc tgactcagcc accctcggtg tcagtggccc caggaaagac ggccaggatt 60
acctgtgggg gaaacaacat tggaagtaaa agtgtgcact ggtaccagca gaagccaggc 120
caggcccctg tgctggtcgt ctatgatgat agcgaccggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacggcc accttgacca tcagcagggt cgaagccggg 240
gatgaggccg actattactg tcaggtgtgg gatagtagta gtgattatgt ggtattcggc 300
ggagggacca agctgaccgt cctaggttct agaggtggtg gtggtagtgg cggcggcggc 360
tctggtggtg gtggatccct cgagatggcc gaagtgcagc tggtgcagtc tggagcagag 420
gtgaaaaagc ccggggagtc tctgaagatc tcctgtaagg gttctggata cagctttacc 480
agctactgga tcggctgggt gcgccagatg cccgggaaag gcctggagtg gatggggatc 540
atctatcctg gtgactctga taccagatac agcccgttct tccaaggcca ggtcaccatc 600
tcagccgaca agtccatcag caccgcctac ctgcagtgga gcagcctgaa ggcctcggac 660
accgccatgt attactgtgc gcgccaggtt tggggttggc agggtggtat gtacccgcgt 720
tctaactggt ggtacaacat ggattcttgg ggtcaaggta ctctggtgac cgtctcctca 780
<210> 56
<211> 260
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 56
Leu Pro Val Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Lys
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ser Ser Ser Asp Tyr
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser Arg Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Glu
115 120 125
Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro
130 135 140
Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr
145 150 155 160
Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu
165 170 175
Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro
180 185 190
Phe Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr
195 200 205
Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr
210 215 220
Tyr Cys Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg
225 230 235 240
Ser Asn Trp Trp Tyr Asn Met Asp Ser Trp Gly Gln Gly Thr Leu Val
245 250 255
Thr Val Ser Ser
260
<210> 57
<211> 759
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 57
caggctgtgc tgactcagcc accctcggtg tctgaagccc ccaggcagag ggtcaccatc 60
tcctgttctg gaagcagctc caacgtcgga aataatgctg taaactggta ccagcaggtc 120
ccaggaaagg ctcccaaact cctcatctat tatgatgatc tgctgtcctc aggggtctct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggccgatta ttattgtgca gcatgggatg acagcctgaa tggtccggta 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggccgaag tgcagctggt gcagtccgga 420
gcagaggtga aaaagcccgg ggagtctctg aagatctcct gtaagggttc tggatacagc 480
tttaccagct actggatcgg ctgggtgcgc cagatgcccg ggaaaggcct ggagtggatg 540
gggatcatct atcctggtga ctctgatacc agatacagcc cgtccttcca aggccaggtc 600
accatctcag ccgacaagtc catcagcacc gcctacctgc agtggagcag cctgaaggcc 660
tcggacaccg ccatgtatta ctgtgcgcgc tggtcttctt cttgggactc tatgtacatg 720
gattactggg gtcaaggtac tatggtgacc gtctcctca 759
<210> 58
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 58
Gln Ala Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Val Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Ser Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
130 135 140
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
145 150 155 160
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
180 185 190
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
195 200 205
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
210 215 220
Met Tyr Tyr Cys Ala Arg Trp Ser Ser Ser Trp Asp Ser Met Tyr Met
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
245 250
<210> 59
<211> 759
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 59
caggctgtgc ttactcagcc accctcggtg tctgaagccc ccaggcagag ggtcaccatc 60
tcctgttctg gaaacagctc caacgtcgga aataatgcta taaactggta ccagcaggtc 120
ccaggaaagg ctcccaaact cctcatctat tatgatgatc tgctgtcctc aggggtctct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggccgatta ttattgtgca gcatgggatg acagcctgaa tggtccggta 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggccgaag tgcagctggt gcagtctgga 420
gcagaggtgg aaaagcccgg ggagtctctg aagatctcct gtaagggttc tggatacagc 480
tttaccagct actggatcgg ctgggtgcgc cagatgcccg ggaaaggcct ggagtggatg 540
gggatcatct atcctggtga ctctgatacc agatacagcc cgtccttcca aggccaggtc 600
accatctcag ccgacaagtc catcagcacc gcctacctgc agtggagcag cctgaaggcc 660
tcggacaccg ccatgtatta ctgtgcgcgc tggtcttcta cttgggactc tatgtacatg 720
gaatactggg gtcaaggtac tctggtgacc gtctcctca 759
<210> 60
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 60
Gln Ala Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Asn Ser Ser Asn Val Gly Asn Asn
20 25 30
Ala Ile Asn Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Ser Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Glu
130 135 140
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
145 150 155 160
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
180 185 190
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
195 200 205
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
210 215 220
Met Tyr Tyr Cys Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met
225 230 235 240
Glu Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 61
<211> 760
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 61
caggctgtgc tgactcagcc accctcggtg tctgaagccc ccaggcagag ggtcaccatc 60
tcctgttctg gaagcagctc caacgtcgga aataatgctg taaactggta ccagcaggtc 120
ccaggaaagg ctcccaaact cctcatctat tatgatgatc tgctgtcctc aggggtctct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggccgatta ttattgtgca gcatgggatg acagcctgaa tggtccggta 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggccgaag tgcagctggt gcagtctgga 420
gcagaggtga aaaagcccgg ggggtctctg aagatctcct gtaagggttc tggatacagc 480
tttaccagct actggatcgg ctgggtgcgc cagatgcccg ggaaaggcct ggagtggatg 540
gggatcatct atcctggtga ctctgatacc agatacagcc cgtccttcca aggccaggtc 600
accatctcag ccgacaagtc catcagcacc gcctacctgc agtggagcag cctgaaggcc 660
tcggacaccg ccatgtatta ctgtgcgcgc tggtcttcta cttgggactc tatgtacatg 720
gattactggg gtcaaggtac tctggtgacc gtctcctcaa 760
<210> 62
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 62
Gln Ala Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Val Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Ser Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
130 135 140
Lys Pro Gly Gly Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
145 150 155 160
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
180 185 190
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
195 200 205
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
210 215 220
Met Tyr Tyr Cys Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 63
<211> 759
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 63
caggctgtgc tgactcagcc accctcggtg tctgaagccc ccaggcagag ggtcaccatc 60
tcctgttctg gaagcagctc caacgtcgga aataatgctg taaactggta ccagcaggtc 120
ccaggaaagg ctcccaaact cctcatctat tatgatgatc agctgtcctc aggggtctct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggccgatta ttattgtgca gcatgggatg acagcctgaa tggtccggta 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggccgaag tgcagctggt gcagtctgga 420
gcagaggtga aaaagcccgg ggagtctctg aagatctcct gtaagggttc tggatacagc 480
tttaccagct actggatcgg ctgggtgcgc cagatgcccg ggaaaggcct ggagtggatg 540
gggatcatct atcctggtga ctctgatacc agatacagcc cgtccttcca aggccaggtc 600
accatctcag ccgacaagtc catcagcacc gcctacctgc agtggagcag cctgaaggcc 660
tcggacaccg ccatgtatta ctgtgcgcgc tggtcttcta cttgggactc tttgtacatg 720
gattactggg gtcaaggtac tctggtgacc gtctcctca 759
<210> 64
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 64
Gln Ala Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Val Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Gln Leu Ser Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
130 135 140
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
145 150 155 160
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
180 185 190
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
195 200 205
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
210 215 220
Met Tyr Tyr Cys Ala Arg Trp Ser Ser Thr Trp Asp Ser Leu Tyr Met
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 65
<211> 759
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 65
caggctgtgc tgactcagcc accctcggtg tctgaagccc ccaggcagag ggtcaccatc 60
tcctgttctg gaaacagctc caacgtcgga aataatgctg taaactggta ccagcaggtc 120
ccaggaaagg ctcccaaact tctcatctat tatgatgatc tgctgtcctc aggggtctct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggccgatta ttattgtgca gcatgggatg acagcctgaa tggtccggta 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggccgaag tgcagctggt gcagtctgga 420
gcagaggtga aaaagcccgg ggagtctctg aagatctcct gtaagggttc tggatacagc 480
tttaccagct actggatcgg ctgggtgcgc cagatgcccg ggaaaggcct ggagtggatg 540
gggatcatct atcctggtga ctctgatacc agatacagcc cgtccttcca aggccaggtc 600
accatctcag ccgacaagtc catcagcacc gcctacctgc agtggagcag cctgaaggcc 660
tcggacaccg ccatgtatta ctgtgcgcgc tggtcttcta cttgggactc tatgtacatg 720
gattactggg gtcaaggtac tctggtgacc gtctcctca 759
<210> 66
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 66
Gln Ala Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Asn Ser Ser Asn Val Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Ser Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
130 135 140
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
145 150 155 160
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
180 185 190
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
195 200 205
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
210 215 220
Met Tyr Tyr Cys Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 67
<211> 759
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 67
caggctgtgc tgactcagcc accctcggtg tccgaagccc ccaggcagag ggtcaccatc 60
tcctgttctg gaagcagctc caacgtcgga aataatgctg taaactggta ccagcaggtc 120
ccaggaaagg ctcccaaact cctcatctat tatgatgatc tgctgtcctc aggggtctct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggccgatta ttattgtgca gcatgggatg acagcctgaa tggtccggta 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg ttccctcgag atggccgaag tacagctggt gcagtcagga 420
gcagaggtga aaaagcccgg ggaatctctg aagatctcct gtaagggttc tgcatacagc 480
tttaccagct actggatcgg ctgggtgcgc cagatgcccg ggaaaggcct ggagtggatg 540
gggatcatct atcctggtga ctctgatacc agatacagcc cgtccttcca aggccaggtc 600
accatctcag ccgacaagtc catcagcacc gcctacctgc agtggagcag cctgaaggcc 660
tcggacaccg ccatgtatta ctgtgcgcgc tggtcttcta cttgggactc tatgtacatg 720
gattactggg gtctaggtac tctggtgacc gtctcctca 759
<210> 68
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 68
Gln Ala Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Val Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Ser Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
130 135 140
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Ala Tyr Ser
145 150 155 160
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
180 185 190
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
195 200 205
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
210 215 220
Met Tyr Tyr Cys Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met
225 230 235 240
Asp Tyr Trp Gly Leu Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 69
<211> 759
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 69
caggctgtgc tgactcaacc accctcggtg tctgaagccc ccaggcagag ggtcaccatc 60
tcctgttctg gaagcagctc caacgtcgga aataatgctg taaactggta ccagcaggtc 120
ccaggaaagg ctcccaaact cctcatctat tatgatgatc agctgtcctc aggggtctct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggccgatta ttattgtgca gcatgggatg acagcctgaa tggtccggta 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcggg atggccgaag tgcagctggt gcagtctgga 420
gcagaggtga aaaagcccgg ggagtctctg aagatctcct gtaagggttc tggatacagc 480
tttaccagct actggatcgg ctgggtgcgc cagatgcccg ggaaaggcct ggagtggatg 540
gggatcatct atcctggtga ctctgatacc agatacagcc cgtccttcca aggccaggtt 600
accatctcag ccgacaagtc catcagcacc gcctacctgc agtggagcag cctgaaggcc 660
tcggacaccg ccatgtatta ctgtgcgcgc tggtcttcta cttgggactc tatgtacatg 720
gattactggg gtcaaggtac tctggtaacc gtctcctca 759
<210> 70
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 70
Gln Ala Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Val Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Gln Leu Ser Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Gly Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
130 135 140
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
145 150 155 160
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
180 185 190
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
195 200 205
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
210 215 220
Met Tyr Tyr Cys Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 71
<211> 759
<212> DNA
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 71
caggctgtgc tgactcagcc accctcggtg tctgaagccc ccaggcagag ggtcaccatc 60
tcctgttctg gaagcagctc caacgtcggt aataatgctg taaactggta ccagcaggtc 120
ccaggaaagg ctcccaaact cctcatctat tatgatgatc tgctgtcctc aggggtctct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggccgatta ttattgtgca gcatgggatg acagcctgaa tggtccggta 300
ttcggcggag ggaccaagct gaccgtccta ggttctagag gtggtggtgg tagcggcggc 360
ggcggctctg gtggtggtgg atccctcgag atggccgaag tgcagctggt gcagtctgga 420
gcagaggtga aaaagcccgg ggagtctctg aagatctcct gtaagggttc tggatacagc 480
tttaccagct actggatcgg ctgggtgcgc cagatgcccg ggaaaggcct ggagtggatg 540
gggatcatct atcctggtga ctctgatacc agatacagcc cgtccttcca aggccaggtc 600
accatctcag ccgacaagtc catcagcacc gcctacctgc agtggagcag cctgaaggcc 660
tcggacaccg ccatgtatta ctgtgcgcgc tggtcttctt cttgggactc tatgtacatg 720
gattactggg gtcaaggtac tctggtgacc gtctcctca 759
<210> 72
<211> 253
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 72
Gln Ala Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Val Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Val Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Ser Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Ser
100 105 110
Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Leu Glu Met Ala Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
130 135 140
Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser
145 150 155 160
Phe Thr Ser Tyr Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly
165 170 175
Leu Glu Trp Met Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr
180 185 190
Ser Pro Ser Phe Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile
195 200 205
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
210 215 220
Met Tyr Tyr Cys Ala Arg Trp Ser Ser Ser Trp Asp Ser Met Tyr Met
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 73
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 73
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 74
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 74
Ile Ser Gly Ser Gly Gly Ser Thr
1 5
<210> 75
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 75
Ala Arg Tyr Tyr Tyr Ser Arg Leu Asp Tyr
1 5 10
<210> 76
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 76
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 77
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 77
Ile Ser Ala Ser Gly Gly Ser Thr
1 5
<210> 78
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 78
Ala Arg Tyr Tyr Leu Ser Gln Ile Asp Ser
1 5 10
<210> 79
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 79
Gly Tyr Thr Phe Thr Asp Tyr Tyr
1 5
<210> 80
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 80
Val Asp Pro Glu Asp Gly Glu Thr
1 5
<210> 81
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 81
Ala Thr Gly Ile Tyr Ser Arg Pro Leu Gly Tyr
1 5 10
<210> 82
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 82
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 83
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 83
Ile Ser Gly Ser Gly Gly Ser Thr
1 5
<210> 84
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 84
Ala Arg Ser Asp Gly Lys His Phe Trp Gln Gln Tyr Asp Ala
1 5 10
<210> 85
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 85
Gly Phe Thr Val Ser Ser Asn Tyr
1 5
<210> 86
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 86
Ile Ser Gly Ser Gly Gly Ser Thr
1 5
<210> 87
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 87
Ala Arg Met Asn Ile Asp Tyr
1 5
<210> 88
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 88
Glu Tyr Ser Phe Ala Ser Tyr Trp
1 5
<210> 89
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 89
Ile Asp Pro Ser Asp Ser Tyr Thr
1 5
<210> 90
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 90
Ala Arg Pro Phe Gln Tyr Asp Tyr Gly Gly Tyr Ser Asp Ala Phe Asp
1 5 10 15
Ile
<210> 91
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 91
Gly Gly Thr Phe Ser Ser Ser Ser
1 5
<210> 92
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 92
Ile Ile Pro Ile Val Gly Thr Pro
1 5
<210> 93
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 93
Ala Arg Gly Gly Tyr Arg Asp Tyr Met Asp Val
1 5 10
<210> 94
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 94
Gly Phe Thr Val Ser Ser Asn Tyr
1 5
<210> 95
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 95
Ile Tyr Ser Gly Gly Ser Thr
1 5
<210> 96
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 96
Ala Arg Gly Gly Phe Gly Ala Glu Phe Asp Tyr
1 5 10
<210> 97
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 97
Gly Phe Thr Val Ser Ser Asn Tyr
1 5
<210> 98
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 98
Ile Tyr Ser Gly Gly Ser Thr
1 5
<210> 99
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 99
Ala Arg Gly Gly Ile Ser Asp Asp Tyr Tyr Gly Ser Gly Ser Tyr Asp
1 5 10 15
Asn
<210> 100
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 100
Gly Phe Thr Val Ser Ser Asn Tyr
1 5
<210> 101
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 101
Ile Tyr Ser Gly Gly Ser Thr
1 5
<210> 102
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 102
Ala Arg Glu Arg Gly Met Gly Tyr Ala Phe Asp Ile
1 5 10
<210> 103
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 103
Gly Val Ser Met Ser Glu Asn Tyr
1 5
<210> 104
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 104
Ala His Tyr Thr Gly Asp Thr
1 5
<210> 105
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 105
Ala Ser Tyr His Pro Phe Asn Tyr
1 5
<210> 106
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 106
Gly Tyr Thr Phe Asn Asp Phe Tyr
1 5
<210> 107
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 107
Ile Asp Pro Glu Asp Gly Lys Thr
1 5
<210> 108
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 108
Thr Thr Asp Trp Gly Tyr Ser Ser Ser Leu Arg Glu Glu Asp Ile Trp
1 5 10 15
Tyr Asp Cys
<210> 109
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 109
Gly Gly Thr Phe Ser Ser Tyr Ala
1 5
<210> 110
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 110
Ile Ile Pro Ile Phe Gly Thr Ala
1 5
<210> 111
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 111
Ala Arg Asp Tyr Gly Tyr Gly Asp Tyr Gly Asp Ala Phe Asp Ile
1 5 10 15
<210> 112
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 112
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 113
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 113
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 114
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 114
Ala Arg Val Val Gly Thr Ile Tyr Ser Met Gln Tyr Asp Val
1 5 10
<210> 115
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 115
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 116
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 116
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 117
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 117
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 118
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 118
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 119
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 119
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 120
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 120
Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met Asp Tyr
1 5 10
<210> 121
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 121
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 122
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 122
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 123
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 123
Ala Arg Val Thr Tyr Ser Met Asp Ser Tyr Tyr Phe Asp Ser
1 5 10
<210> 124
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 124
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 125
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 125
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 126
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 126
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 127
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 127
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 128
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 128
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 129
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 129
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 130
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 130
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 131
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 131
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 132
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 132
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 133
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 133
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 134
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 134
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 135
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 135
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 136
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 136
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 137
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 137
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 138
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 138
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 139
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 139
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 140
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 140
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 141
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 141
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Asn Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 142
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 142
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 143
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 143
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 144
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 144
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 145
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 145
Gly Tyr Ser Phe Thr Ser Phe Trp
1 5
<210> 146
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 146
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 147
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 147
Val Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 148
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 148
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 149
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 149
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 150
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 150
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 151
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 151
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 152
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 152
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 153
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 153
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Leu Asp Ser
20
<210> 154
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 154
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 155
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 155
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 156
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 156
Ala Arg Gln Val Trp Gly Trp Gln Gly Gly Met Tyr Pro Arg Ser Asn
1 5 10 15
Trp Trp Tyr Asn Met Asp Ser
20
<210> 157
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 157
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 158
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 158
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 159
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 159
Ala Arg Trp Ser Ser Ser Trp Asp Ser Met Tyr Met Asp Tyr
1 5 10
<210> 160
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 160
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 161
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 161
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 162
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 162
Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met Glu Tyr
1 5 10
<210> 163
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 163
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 164
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 164
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 165
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 165
Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met Asp Tyr
1 5 10
<210> 166
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 166
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 167
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 167
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 168
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 168
Ala Arg Trp Ser Ser Thr Trp Asp Ser Leu Tyr Met Asp Tyr
1 5 10
<210> 169
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 169
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 170
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 170
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 171
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 171
Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met Asp Tyr
1 5 10
<210> 172
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 172
Ala Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 173
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 173
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 174
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 174
Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met Asp Tyr
1 5 10
<210> 175
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 175
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 176
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 176
Ile Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 177
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 177
Ala Arg Trp Ser Ser Thr Trp Asp Ser Met Tyr Met Asp Tyr
1 5 10
<210> 178
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 178
Gly Tyr Ser Phe Thr Ser Tyr Trp
1 5
<210> 179
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 179
Tyr Pro Gly Asp Ser Asp Thr
1 5
<210> 180
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 180
Ala Arg Trp Ser Ser Ser Trp Asp Ser Met Tyr Met Asp Tyr
1 5 10
<210> 181
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 181
Ser Ser Asn Ile Gly Asn Asn Tyr
1 5
<210> 182
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 182
Asp Asn Asn
1
<210> 183
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 183
Gly Thr Trp Asp Ser Ser Leu Ser Ala Gly Val
1 5 10
<210> 184
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 184
Ser Ser Asn Ile Gly Asn Asn Tyr
1 5
<210> 185
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 185
Glu Asn Asn
1
<210> 186
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 186
Gly Thr Trp Asp Ser Ser Leu Arg Ala Gly Val
1 5 10
<210> 187
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 187
Ser Ser Asn Ile Gly Ser Asn Thr
1 5
<210> 188
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 188
Ser Asn Asn
1
<210> 189
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 189
Ala Ala Trp Asp Asp Ser Leu Asn Gly His Val Val
1 5 10
<210> 190
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 190
Ser Ser Asn Ile Gly Ser His Thr
1 5
<210> 191
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 191
Ser Asn Asn
1
<210> 192
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 192
Ala Ala Trp Asp Asp Ser Leu Asn Gly Tyr Val
1 5 10
<210> 193
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 193
Gln Gly Ile Thr Asn Ser
1 5
<210> 194
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 194
Ala Ala Ser
1
<210> 195
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 195
Gln His Tyr Leu Gly Thr Pro Tyr Ser
1 5
<210> 196
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 196
Gln Ser Val Ser Arg Phe
1 5
<210> 197
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 197
Gly Val Ser
1
<210> 198
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 198
Gln Glu Ser Tyr Ile Ile Pro Leu Thr
1 5
<210> 199
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 199
Gln Ser Leu Leu Asp Ser Asn Gly Phe Asn Ser
1 5 10
<210> 200
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 200
Leu Gly Ser
1
<210> 201
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 201
Met Gln Ser Leu Gln Ile Pro Thr
1 5
<210> 202
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 202
Ser Ser Asn Ile Gly Ser Asn Tyr
1 5
<210> 203
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 203
Arg Asn Asn
1
<210> 204
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 204
Ala Ala Trp Asp Asp Ser Leu Ser Gly Tyr Val
1 5 10
<210> 205
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 205
Lys Leu Gly Asp Lys Tyr
1 5
<210> 206
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 206
Gln Asp Asn
1
<210> 207
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 207
Gln Ala Trp Asp Ser Ser Thr Glu Asp Val
1 5 10
<210> 208
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 208
Gln Ser Ile Ser Ser Tyr
1 5
<210> 209
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 209
Ala Ala Ser
1
<210> 210
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 210
Gln Gln Ser Tyr Ser Thr Pro Phe Thr
1 5
<210> 211
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 211
Gln Gly Ile Gly Ser Tyr
1 5
<210> 212
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 212
Pro Ala Ser
1
<210> 213
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 213
Gln Gln Leu Asn Ser Leu
1 5
<210> 214
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 214
Ser Ser Asn Ile Gly Thr Lys Thr
1 5
<210> 215
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 215
Ser Asn Tyr
1
<210> 216
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 216
Ala Leu Trp Asp Asp Ser Leu Asp Gly Tyr Val
1 5 10
<210> 217
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 217
Asn Ile Gly Ser Lys Ser
1 5
<210> 218
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 218
Tyr Asp Ser
1
<210> 219
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 219
Gln Val Trp Asp Ser Ser Ser Asp His Tyr Val
1 5 10
<210> 220
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 220
Asn Ile Gly Ser Lys Ser
1 5
<210> 221
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 221
Asp Asp Ser
1
<210> 222
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 222
Gln Val Trp Asp Ser Ser Ser Asp His Tyr Val
1 5 10
<210> 223
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 223
Asn Ile Gly Ser Lys Ser
1 5
<210> 224
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 224
Asp Asp Ser
1
<210> 225
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 225
Gln Val Trp Asp Ser Ser Ser Asp Tyr Val Val
1 5 10
<210> 226
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 226
Ser Ser Asn Val Gly Asn Asn Ala
1 5
<210> 227
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 227
Tyr Asp Asp
1
<210> 228
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 228
Ala Ala Trp Asp Asp Ser Leu Asn Gly Pro Val
1 5 10
<210> 229
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 229
Asn Ile Gly Ser Glu Ser
1 5
<210> 230
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 230
Tyr Asp Ser
1
<210> 231
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 231
Gln Val Trp Asn Ser Ser Ser Asp His Arg Gly Val
1 5 10
<210> 232
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 232
Asn Ile Gly Ser Lys Ser
1 5
<210> 233
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 233
Asp Asp Ser
1
<210> 234
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 234
Gln Val Trp Asp Ser Ser Ser Asp Tyr Val Val
1 5 10
<210> 235
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 235
Asn Ile Gly Ser Lys Ser
1 5
<210> 236
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 236
Asp Asp Ser
1
<210> 237
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 237
Gln Val Trp Asp Ser Ser Ser Asp Tyr Val Val
1 5 10
<210> 238
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 238
Asn Ile Gly Ser Lys Ser
1 5
<210> 239
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 239
Asp Asp Ser
1
<210> 240
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 240
Gln Val Trp Asp Ser Ser Ser Glu Tyr Val Val
1 5 10
<210> 241
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 241
Asn Ile Gly Ser Lys Ser
1 5
<210> 242
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 242
Asp Asp Ser
1
<210> 243
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 243
Gln Val Trp Asp Ser Ser Ser Gly Tyr Val Val
1 5 10
<210> 244
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 244
Asn Ile Gly Ser Lys Ser
1 5
<210> 245
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 245
Asp Asp Ser
1
<210> 246
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 246
Gln Val Trp Asp Ser Thr Ser Asp Tyr Val Val
1 5 10
<210> 247
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 247
Asn Ile Gly Ser Lys Ser
1 5
<210> 248
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 248
Asp Asp Ser
1
<210> 249
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 249
Gln Val Trp Asp Ser Ser Ser Asp Tyr Val Val
1 5 10
<210> 250
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 250
Asn Ile Gly Ser Lys Ser
1 5
<210> 251
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 251
Asp Asp Ser
1
<210> 252
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 252
Gln Val Trp Asp Ser Ser Ser Asp Tyr Val Val
1 5 10
<210> 253
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 253
Asn Ile Gly Ser Lys Ser
1 5
<210> 254
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 254
Asp Asp Ser
1
<210> 255
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 255
Gln Val Trp Asp Ser Ser Ser Asp Tyr Val Val
1 5 10
<210> 256
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 256
Asn Ile Gly Ser Lys Ser
1 5
<210> 257
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 257
Asp Asp Ser
1
<210> 258
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 258
Gln Val Trp Asp Ser Ser Ser Asp Tyr Val Val
1 5 10
<210> 259
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 259
Asn Ile Gly Ser Lys Ser
1 5
<210> 260
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 260
Asp Asp Ser
1
<210> 261
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 261
Gln Val Trp Asp Ser Ser Ser Asp Tyr Val Val
1 5 10
<210> 262
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 262
Asn Ile Gly Ser Lys Ser
1 5
<210> 263
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 263
Asp Asp Ser
1
<210> 264
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 264
Gln Val Trp Asp Ser Ser Ser Asp Tyr Val Val
1 5 10
<210> 265
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 265
Ser Ser Asn Val Gly Asn Asn Ala
1 5
<210> 266
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 266
Tyr Asp Asp
1
<210> 267
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 267
Ala Ala Trp Asp Asp Ser Leu Asn Gly Pro Val
1 5 10
<210> 268
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 268
Ser Ser Asn Val Gly Asn Asn Ala
1 5
<210> 269
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 269
Tyr Asp Asp
1
<210> 270
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 270
Ala Ala Trp Asp Asp Ser Leu Asn Gly Pro Val
1 5 10
<210> 271
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 271
Ser Ser Asn Val Gly Asn Asn Ala
1 5
<210> 272
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 272
Tyr Asp Asp
1
<210> 273
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 273
Ala Ala Trp Asp Asp Ser Leu Asn Gly Pro Val
1 5 10
<210> 274
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 274
Ser Ser Asn Val Gly Asn Asn Ala
1 5
<210> 275
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 275
Tyr Asp Asp
1
<210> 276
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 276
Ala Ala Trp Asp Asp Ser Leu Asn Gly Pro Val
1 5 10
<210> 277
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 277
Ser Ser Asn Val Gly Asn Asn Ala
1 5
<210> 278
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 278
Tyr Asp Asp
1
<210> 279
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 279
Ala Ala Trp Asp Asp Ser Leu Asn Gly Pro Val
1 5 10
<210> 280
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 280
Ser Ser Asn Val Gly Asn Asn Ala
1 5
<210> 281
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 281
Tyr Asp Asp
1
<210> 282
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 282
Ala Ala Trp Asp Asp Ser Leu Asn Gly Pro Val
1 5 10
<210> 283
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 283
Ser Ser Asn Val Gly Asn Asn Ala
1 5
<210> 284
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 284
Tyr Asp Asp
1
<210> 285
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 285
Ala Ala Trp Asp Asp Ser Leu Asn Gly Pro Val
1 5 10
<210> 286
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 286
Ser Ser Asn Val Gly Asn Asn Ala
1 5
<210> 287
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 287
Tyr Asp Asp
1
<210> 288
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (4)..(7)
<223> Xaa can be any naturally occurring amino acid
<400> 288
Ile Xaa Pro Xaa Xaa Xaa Xaa Thr
1 5
<210> 289
<211> 556
<212> PRT
<213> Homo sapeins
<400> 289
Met Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met
1 5 10 15
Glu Val Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp
20 25 30
Asn Ala Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln
35 40 45
Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu
50 55 60
Ser Leu Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile
65 70 75 80
Trp Leu Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu
85 90 95
Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr
100 105 110
Val Asn Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp
115 120 125
Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro
130 135 140
Ser Ser Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala
145 150 155 160
Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Leu Pro Pro
165 170 175
Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro
180 185 190
Gly Ser Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser
195 200 205
Arg Gly Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser
210 215 220
Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp
225 230 235 240
Val Met Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala
245 250 255
Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu
260 265 270
Glu Ile Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly
275 280 285
Gly Trp Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu
290 295 300
Cys Ser Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu Arg
305 310 315 320
Arg Lys Arg Lys Arg Met Thr Asp Pro Thr Arg Arg Phe Phe Lys Val
325 330 335
Thr Pro Pro Pro Gly Ser Gly Pro Gln Asn Gln Tyr Gly Asn Val Leu
340 345 350
Ser Leu Pro Thr Pro Thr Ser Gly Leu Gly Arg Ala Gln Arg Trp Ala
355 360 365
Ala Gly Leu Gly Gly Thr Ala Pro Ser Tyr Gly Asn Pro Ser Ser Asp
370 375 380
Val Gln Ala Asp Gly Ala Leu Gly Ser Arg Ser Pro Pro Gly Val Gly
385 390 395 400
Pro Glu Glu Glu Glu Gly Glu Gly Tyr Glu Glu Pro Asp Ser Glu Glu
405 410 415
Asp Ser Glu Phe Tyr Glu Asn Asp Ser Asn Leu Gly Gln Asp Gln Leu
420 425 430
Ser Gln Asp Gly Ser Gly Tyr Glu Asn Pro Glu Asp Glu Pro Leu Gly
435 440 445
Pro Glu Asp Glu Asp Ser Phe Ser Asn Ala Glu Ser Tyr Glu Asn Glu
450 455 460
Asp Glu Glu Leu Thr Gln Pro Val Ala Arg Thr Met Asp Phe Leu Ser
465 470 475 480
Pro His Gly Ser Ala Trp Asp Pro Ser Arg Glu Ala Thr Ser Leu Gly
485 490 495
Ser Gln Ser Tyr Glu Asp Met Arg Gly Ile Leu Tyr Ala Ala Pro Gln
500 505 510
Leu Arg Ser Ile Arg Gly Gln Pro Gly Pro Asn His Glu Glu Asp Ala
515 520 525
Asp Ser Tyr Glu Asn Met Asp Asn Pro Asp Gly Pro Asp Pro Ala Trp
530 535 540
Gly Gly Gly Gly Arg Met Gly Thr Trp Ser Thr Arg
545 550 555
<210> 290
<211> 488
<212> PRT
<213> Homo sapiens
<400> 290
Met Pro Pro Pro Arg Leu Leu Phe Phe Leu Leu Phe Leu Thr Pro Met
1 5 10 15
Glu Val Arg Pro Glu Glu Pro Leu Val Val Lys Val Glu Glu Gly Asp
20 25 30
Asn Ala Val Leu Gln Cys Leu Lys Gly Thr Ser Asp Gly Pro Thr Gln
35 40 45
Gln Leu Thr Trp Ser Arg Glu Ser Pro Leu Lys Pro Phe Leu Lys Leu
50 55 60
Ser Leu Gly Leu Pro Gly Leu Gly Ile His Met Arg Pro Leu Ala Ile
65 70 75 80
Trp Leu Phe Ile Phe Asn Val Ser Gln Gln Met Gly Gly Phe Tyr Leu
85 90 95
Cys Gln Pro Gly Pro Pro Ser Glu Lys Ala Trp Gln Pro Gly Trp Thr
100 105 110
Val Asn Val Glu Gly Ser Gly Glu Leu Phe Arg Trp Asn Val Ser Asp
115 120 125
Leu Gly Gly Leu Gly Cys Gly Leu Lys Asn Arg Ser Ser Glu Gly Pro
130 135 140
Ser Ser Pro Ser Gly Lys Leu Met Ser Pro Lys Leu Tyr Val Trp Ala
145 150 155 160
Lys Asp Arg Pro Glu Ile Trp Glu Gly Glu Pro Pro Cys Leu Pro Pro
165 170 175
Arg Asp Ser Leu Asn Gln Ser Leu Ser Gln Asp Leu Thr Met Ala Pro
180 185 190
Gly Ser Thr Leu Trp Leu Ser Cys Gly Val Pro Pro Asp Ser Val Ser
195 200 205
Arg Gly Pro Leu Ser Trp Thr His Val His Pro Lys Gly Pro Lys Ser
210 215 220
Leu Leu Ser Leu Glu Leu Lys Asp Asp Arg Pro Ala Arg Asp Met Trp
225 230 235 240
Val Met Glu Thr Gly Leu Leu Leu Pro Arg Ala Thr Ala Gln Asp Ala
245 250 255
Gly Lys Tyr Tyr Cys His Arg Gly Asn Leu Thr Met Ser Phe His Leu
260 265 270
Glu Ile Thr Ala Arg Pro Val Leu Trp His Trp Leu Leu Arg Thr Gly
275 280 285
Gly Trp Lys Val Ser Ala Val Thr Leu Ala Tyr Leu Ile Phe Cys Leu
290 295 300
Cys Ser Leu Val Gly Ile Leu His Leu Gln Arg Ala Leu Val Leu Arg
305 310 315 320
Arg Lys Arg Lys Arg Met Thr Asp Pro Thr Arg Arg Phe Phe Lys Val
325 330 335
Thr Pro Pro Pro Gly Ser Gly Pro Gln Asn Gln Tyr Gly Asn Val Leu
340 345 350
Ser Leu Pro Thr Pro Thr Ser Gly Leu Gly Arg Ala Gln Arg Trp Ala
355 360 365
Ala Gly Leu Gly Gly Thr Ala Pro Ser Tyr Gly Asn Pro Ser Ser Asp
370 375 380
Val Gln Ala Asp Gly Ala Leu Gly Ser Arg Ser Pro Pro Gly Val Gly
385 390 395 400
Pro Glu Glu Glu Glu Gly Glu Gly Tyr Glu Glu Pro Asp Ser Glu Glu
405 410 415
Asp Ser Glu Phe Tyr Glu Asn Asp Ser Asn Leu Gly Gln Asp Gln Leu
420 425 430
Ser Gln Asp Gly Ser Gly Tyr Glu Asn Pro Glu Asp Glu Pro Leu Gly
435 440 445
Pro Glu Asp Glu Asp Ser Phe Ser Asn Ala Glu Ser Tyr Glu Asn Glu
450 455 460
Asp Glu Glu Leu Thr Gln Pro Val Ala Arg Thr Met Asp Phe Leu Ser
465 470 475 480
Pro His Gly Ser Ala Trp Asp Pro
485
<210> 291
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> misc_feature
<222> (2)..(8)
<223> X2 is F, G, Y or V, X3 is S or T, X5 is S or T, X7 is N or Y, and
X8 is A, W or Y
<400> 291
Gly Xaa Xaa Phe Xaa Ser Xaa Xaa
1 5
<210> 292
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> misc_feature
<222> (2)..(7)
<223> X2 is S, D or Y, X4 is E, S, G or I, X5 is D, F or V, X6 is G or
S, and X7 is K, E, Y, D or T
<400> 292
Ile Xaa Pro Xaa Xaa Xaa Xaa Thr
1 5
<210> 293
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> misc_feaure
<222> (4)..(8)
<223> X4 is I or V, X6 is N, S or T, X7 is N, H or K, X8 is Y, A or T
<400> 293
Ser Ser Asn Xaa Gly Xaa Xaa Xaa
1 5
<210> 294
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> misc_feature
<222> (5)..(5)
<223> X5 is K or E
<400> 294
Asn Ile Gly Ser Xaa Ser
1 5
<210> 295
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> misc_feature
<222> (1)..(3)
<223> X1 is D, E, S, R or Y, X2 is N or D, X3 is N, Y, S or D
<400> 295
Xaa Xaa Xaa
1
<210> 296
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 296
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Lys
115 120 125
Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser
130 135 140
Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser
145 150 155 160
Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile
165 170 175
Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu
180 185 190
Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn
195 200 205
Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr
210 215 220
Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
225 230 235 240
Val Thr Val Ser Ser
245
<210> 297
<211> 6
<212> PRT
<213> Mus musculus
<400> 297
Gln Asp Ile Ser Lys Tyr
1 5
<210> 298
<211> 3
<212> PRT
<213> Mus musculus
<400> 298
His Thr Ser
1
<210> 299
<211> 9
<212> PRT
<213> Mus musculus
<400> 299
Gln Gln Gly Asn Thr Leu Pro Tyr Thr
1 5
<210> 300
<211> 8
<212> PRT
<213> Mus musculus
<400> 300
Gly Val Ser Leu Pro Asp Tyr Gly
1 5
<210> 301
<211> 7
<212> PRT
<213> Mus musculus
<400> 301
Ile Trp Gly Ser Glu Thr Thr
1 5
<210> 302
<211> 14
<212> PRT
<213> Mus musculus
<400> 302
Ala Lys His Tyr Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ АНТИ-CD19-АНТИТЕЛА | 2018 |
|
RU2791445C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2732591C2 |
| Комбинация антитела к CD19 и ингибитора тирозинкиназы брутона и их применение | 2016 |
|
RU2756010C2 |
| МОНОКЛОНАЛЬНЫЕ АГЕНТЫ, СВЯЗЫВАЮЩИЕ сМЕТ, ИХ КОНЪЮГАТЫ С ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2744914C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО | 2020 |
|
RU2814713C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CD19 ЧЕЛОВЕКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2731156C1 |
| КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ ХИМЕРНЫЕ АКТИВИРУЮЩИЕ РЕЦЕПТОРЫ И ХИМЕРНЫЕ СТИМУЛИРУЮЩИЕ РЕЦЕПТОРЫ, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2780020C2 |
| НОВЫЕ БИСПЕЦИФИЧНЫЕ ПОЛИПЕПТИДНЫЕ КОМПЛЕКСЫ ПРОТИВ CD3/CD19 | 2018 |
|
RU2788127C2 |
| C3-СВЯЗЫВАЮЩИЕ АГЕНТЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2802307C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
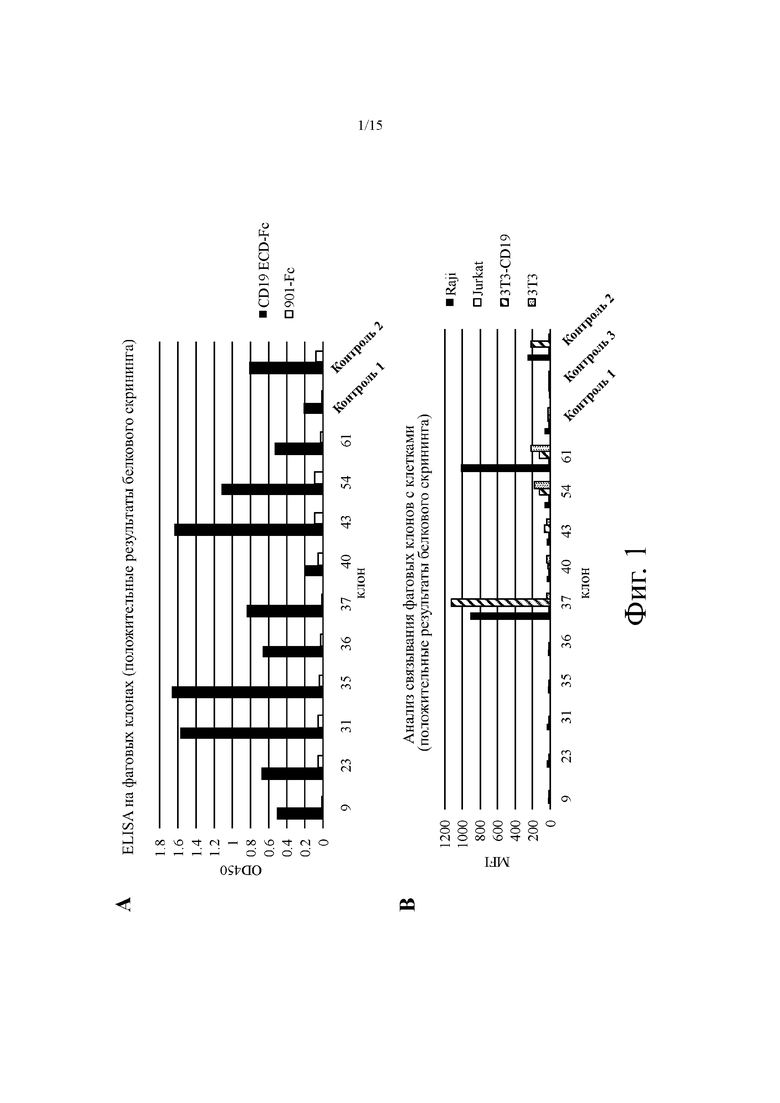
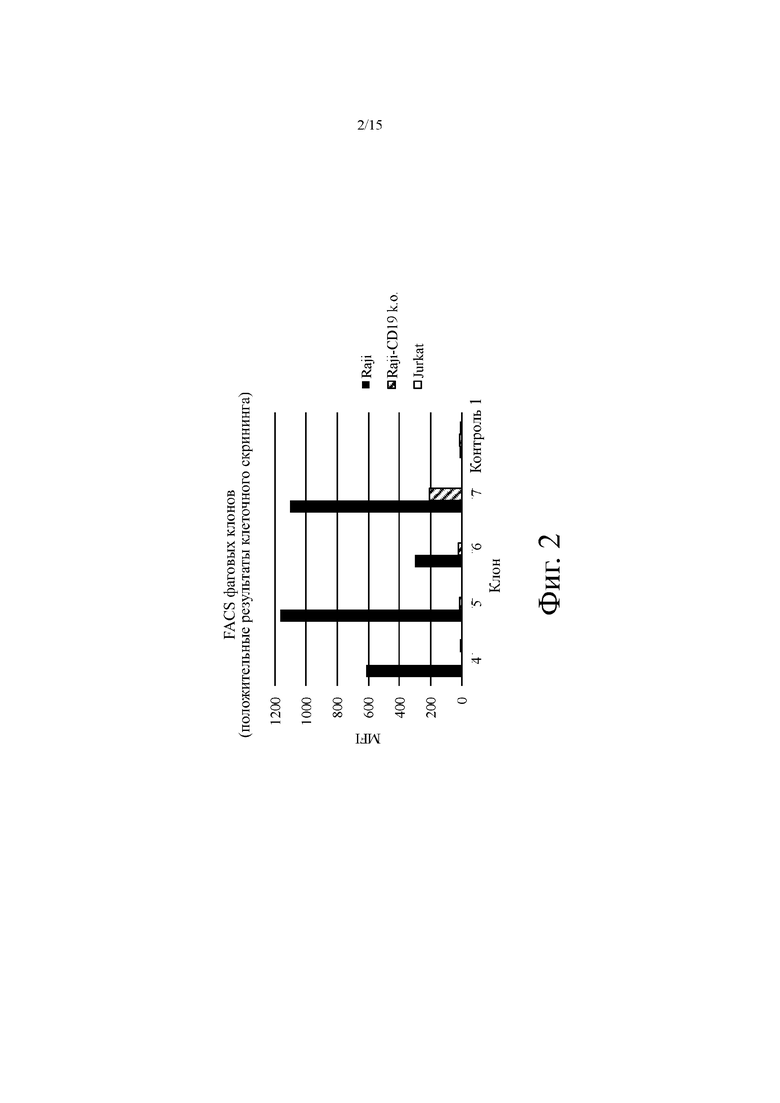
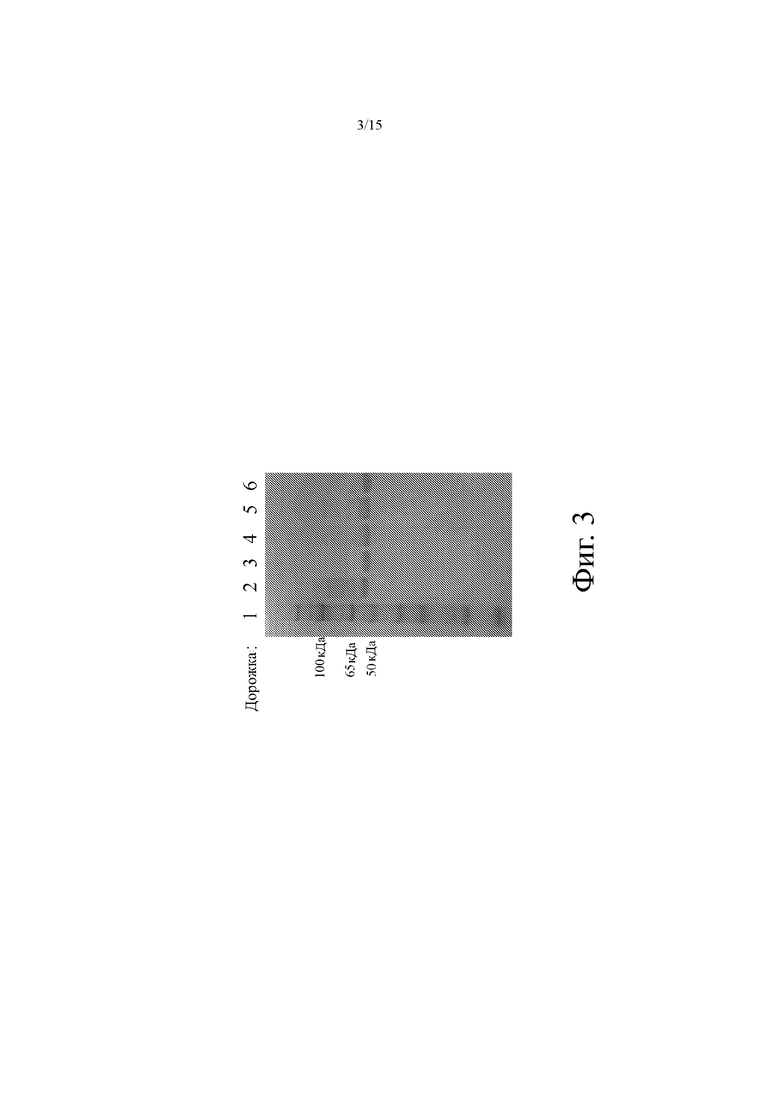
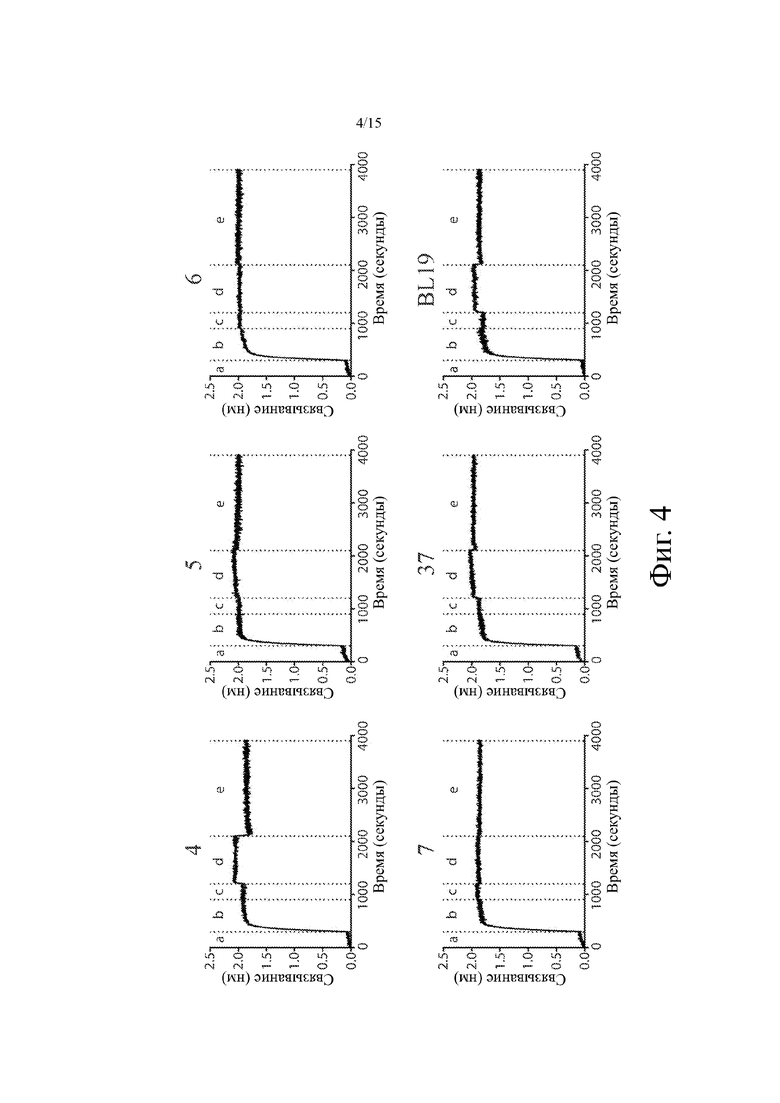
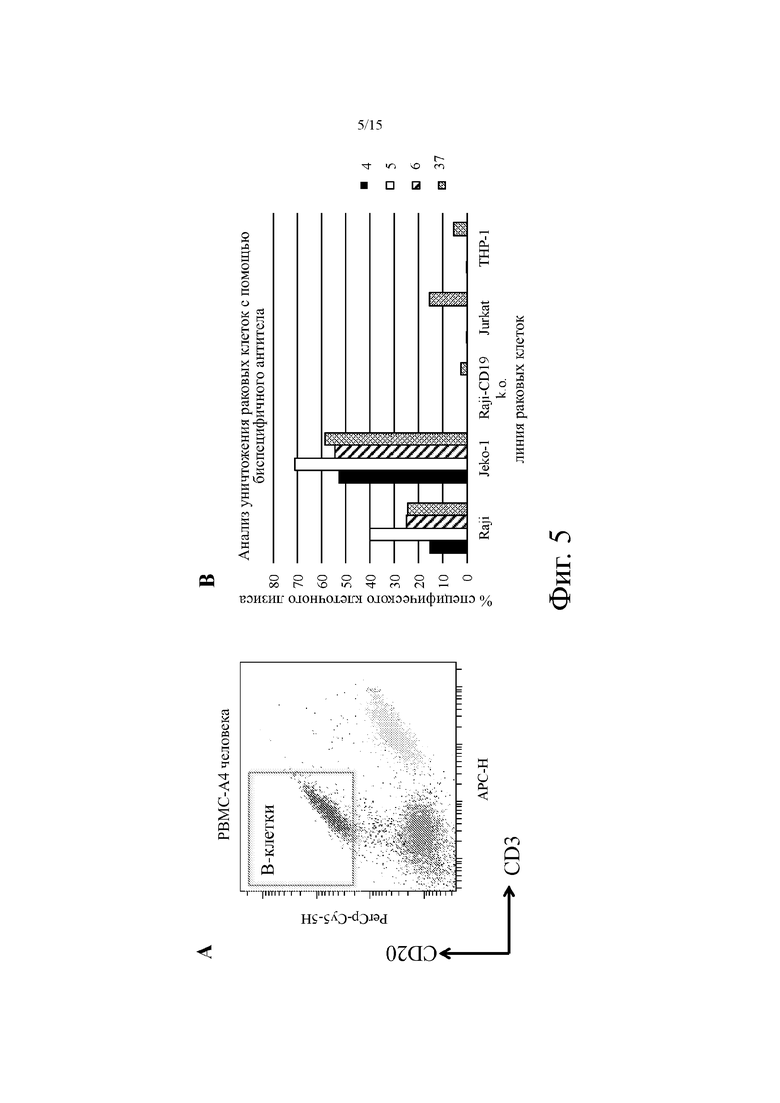
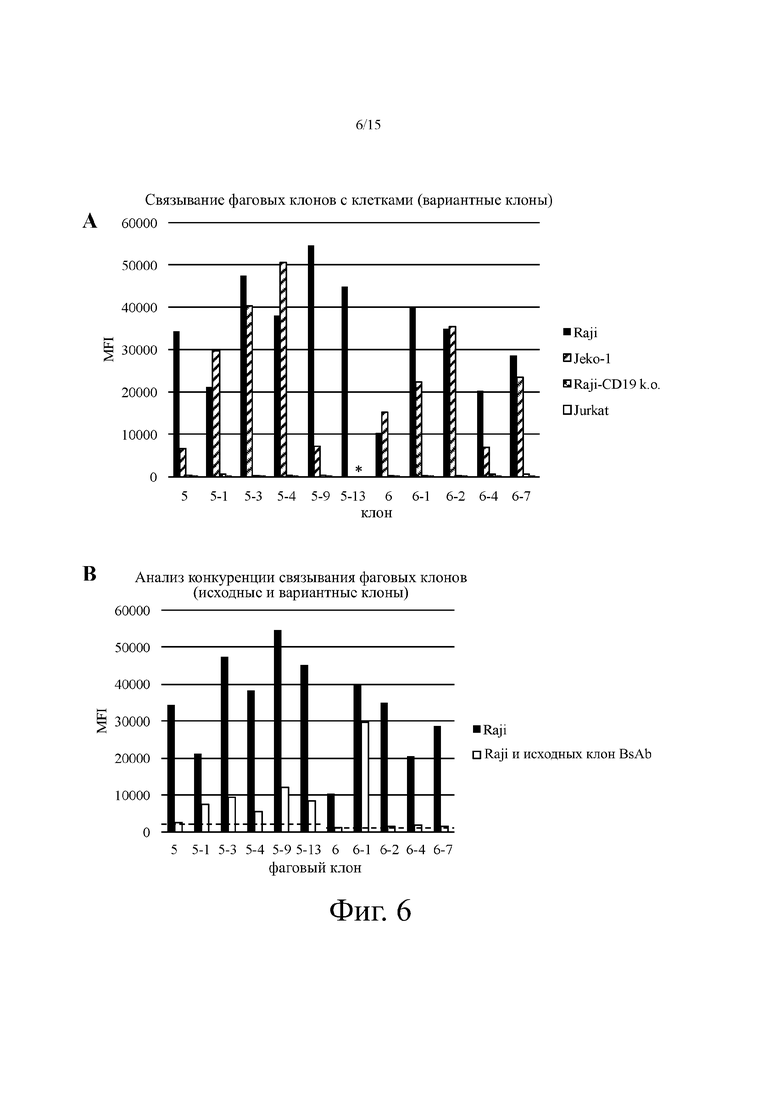
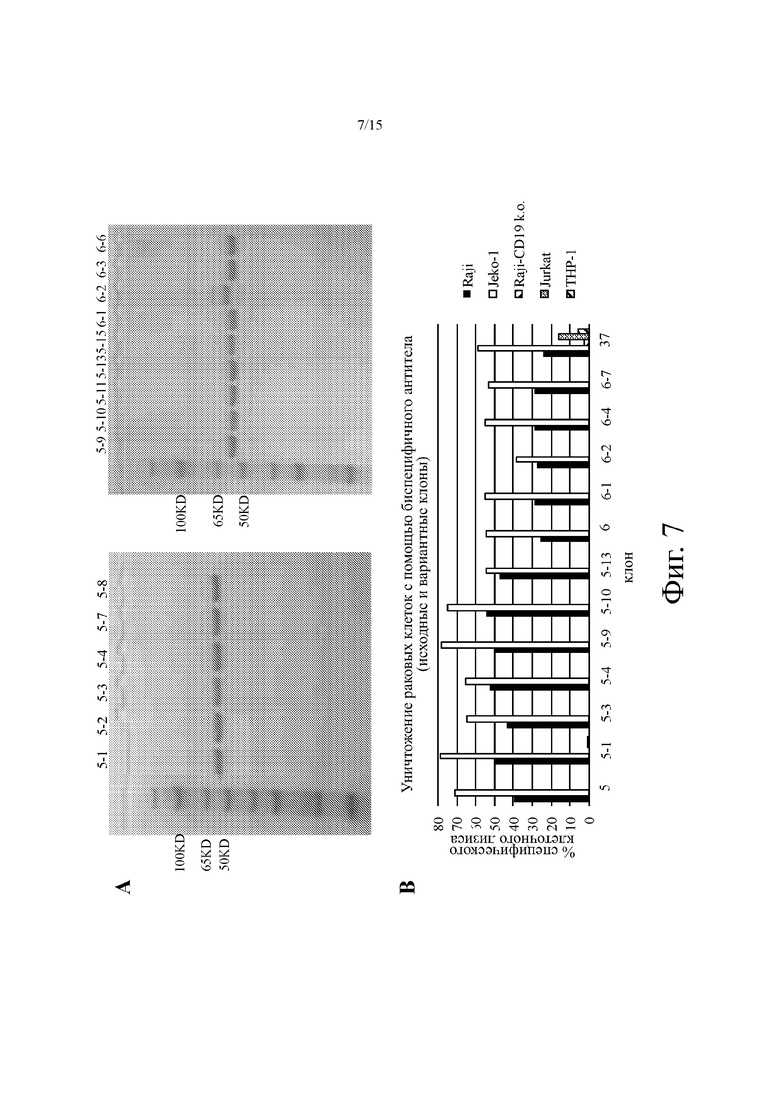
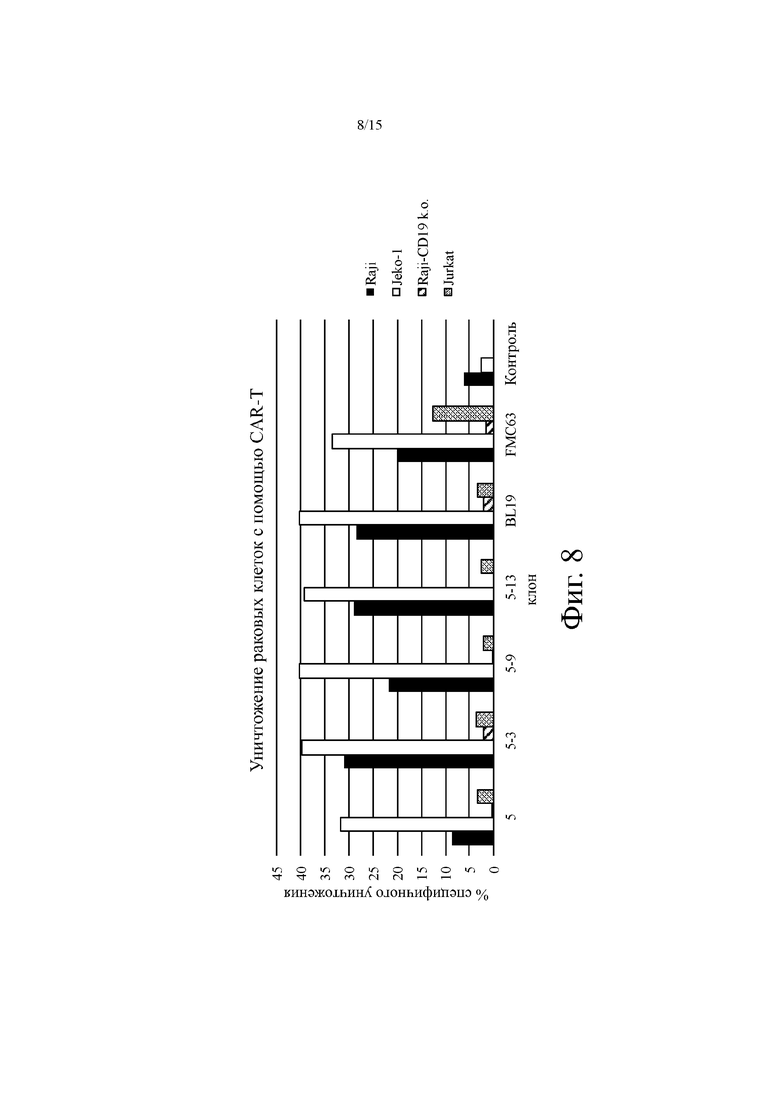
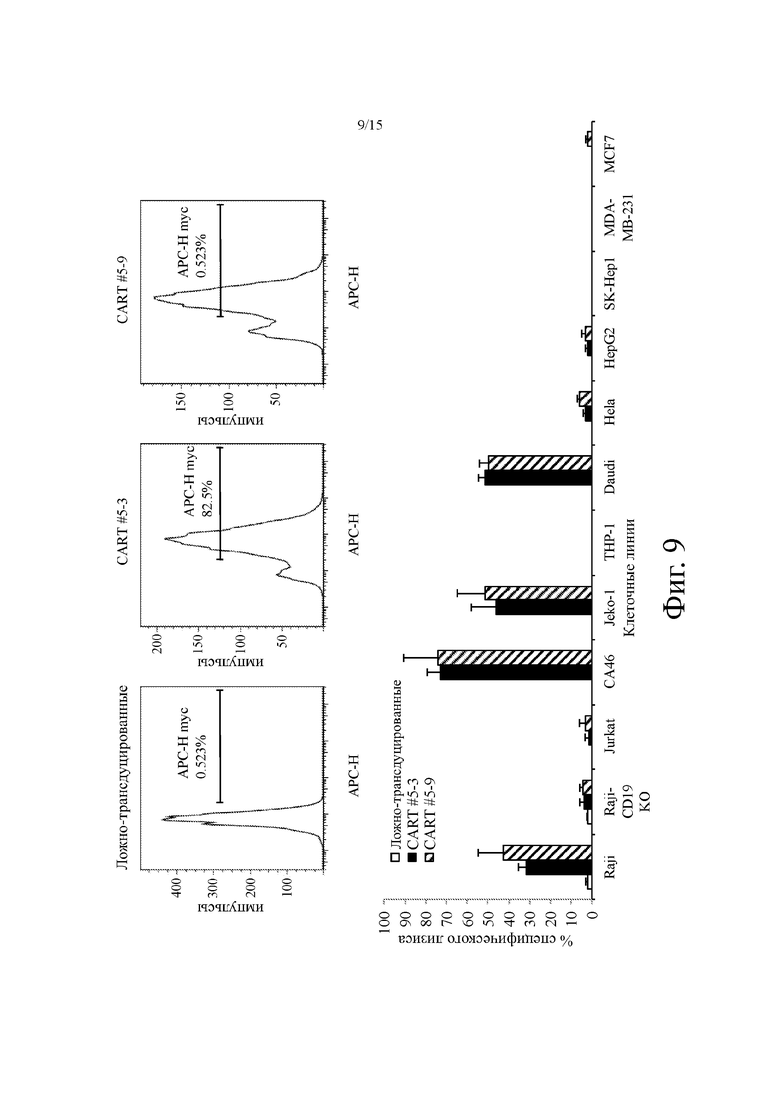
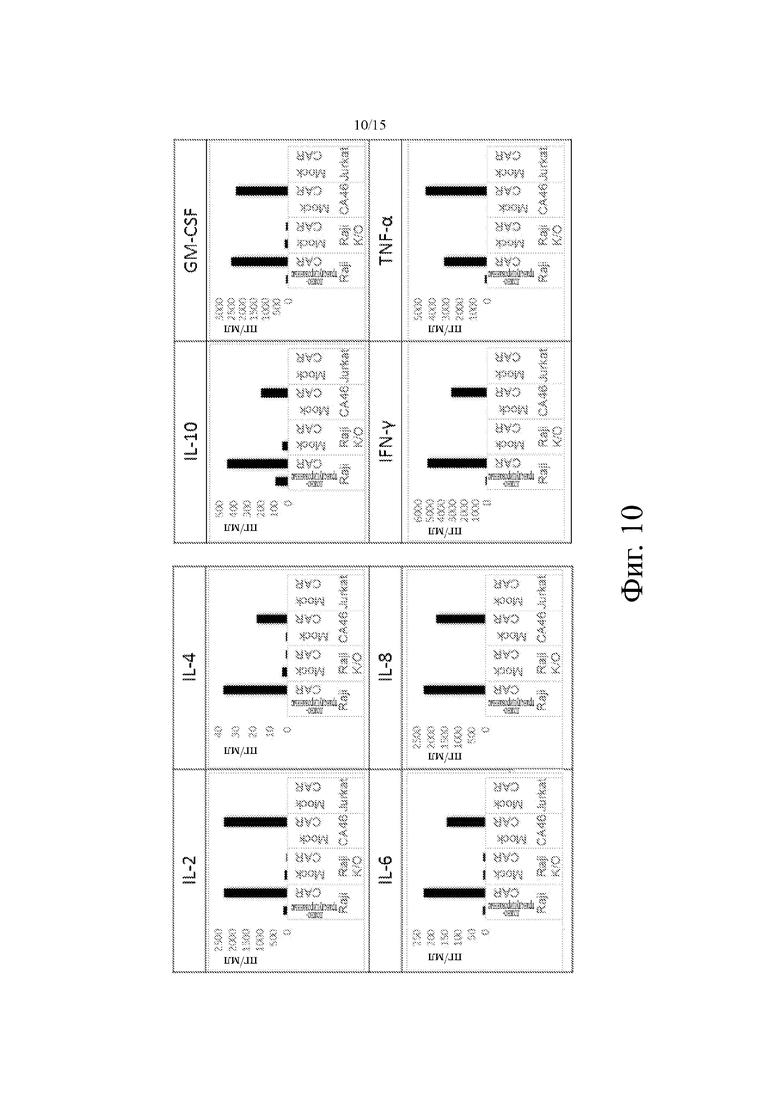
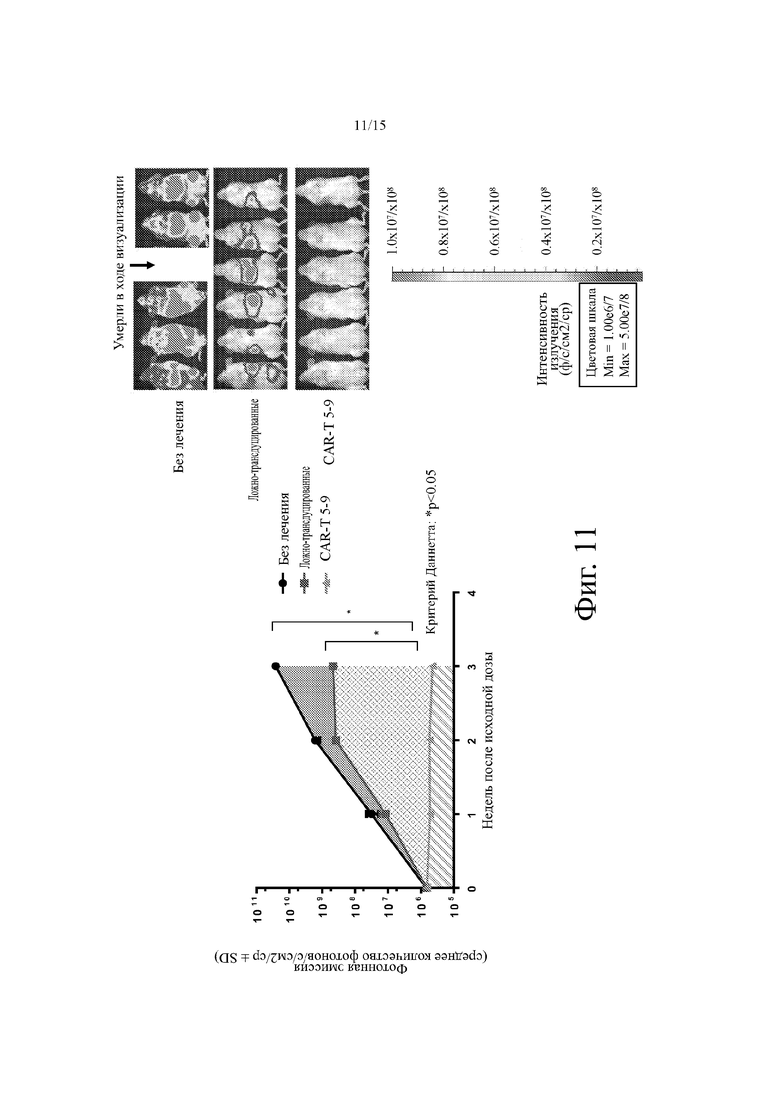
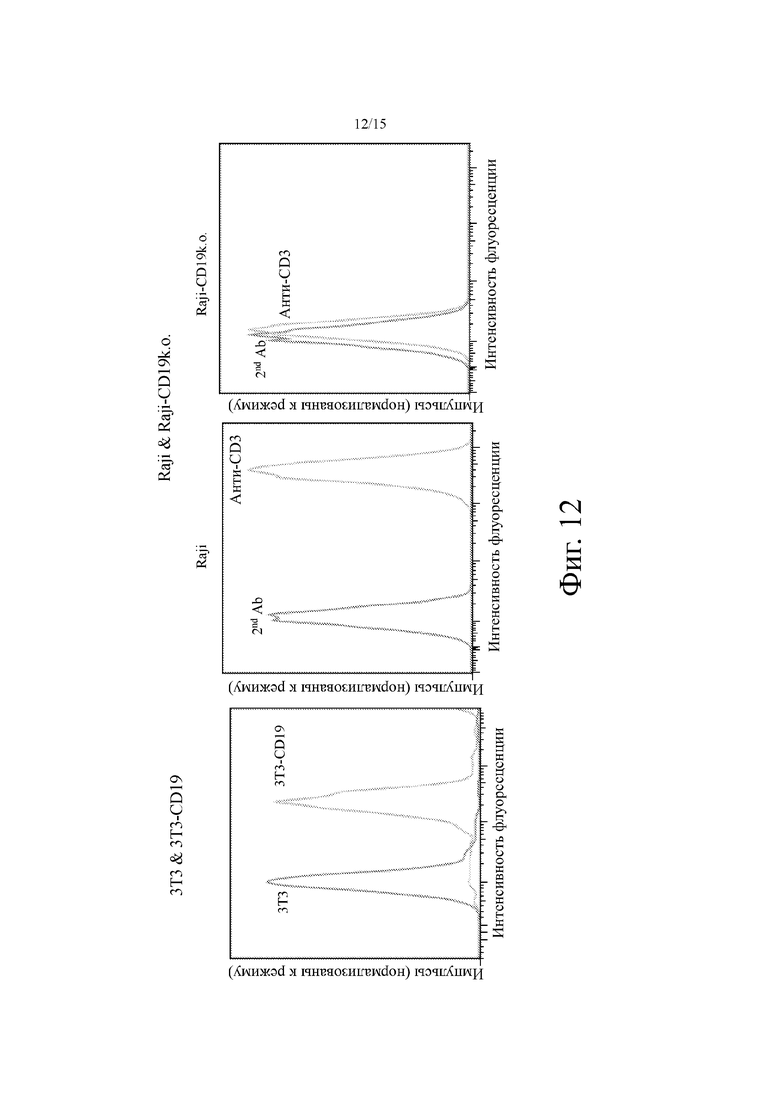
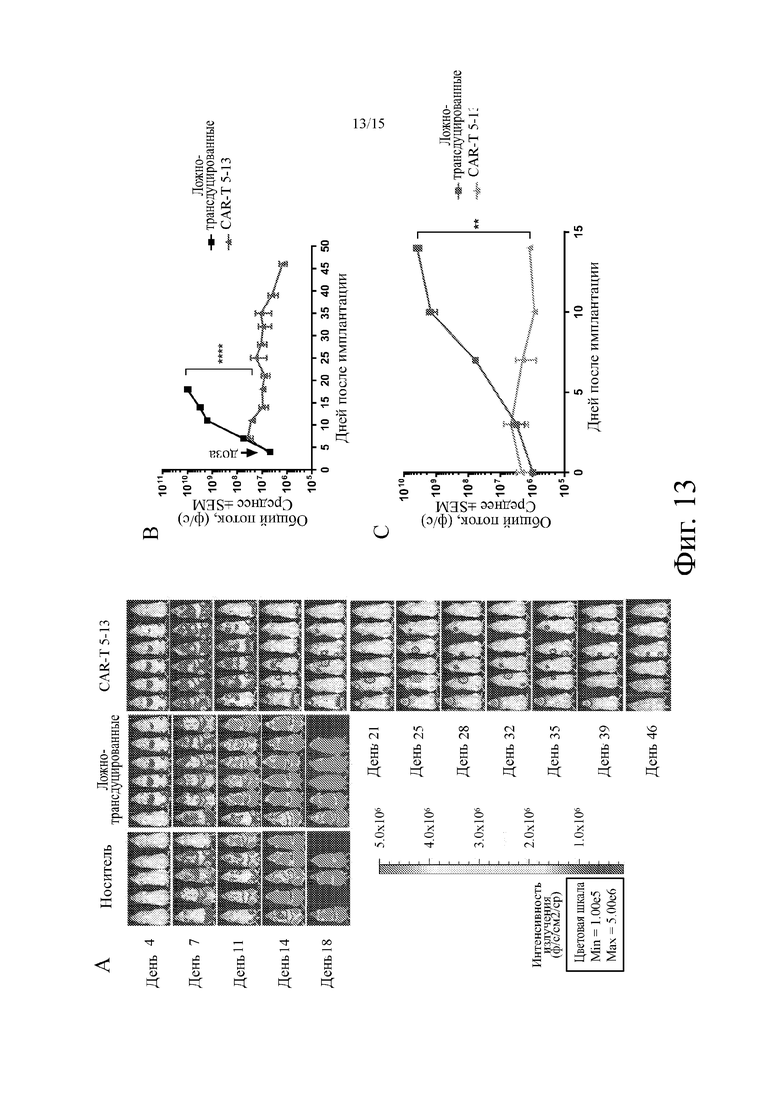
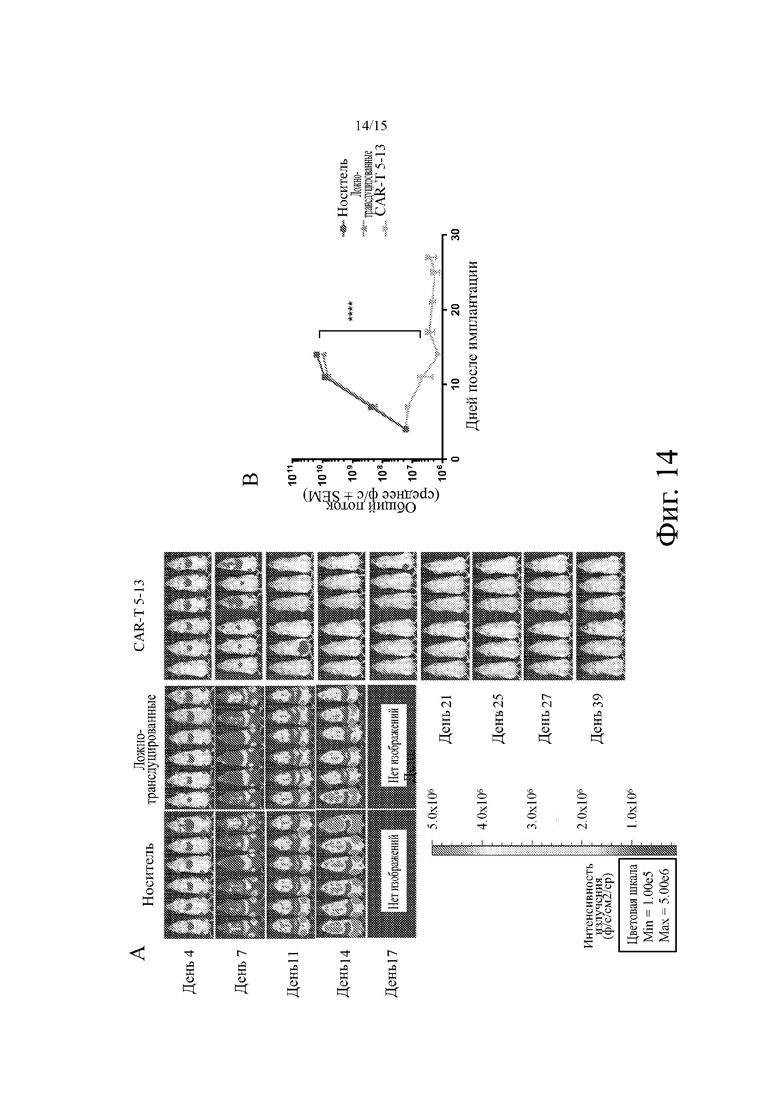
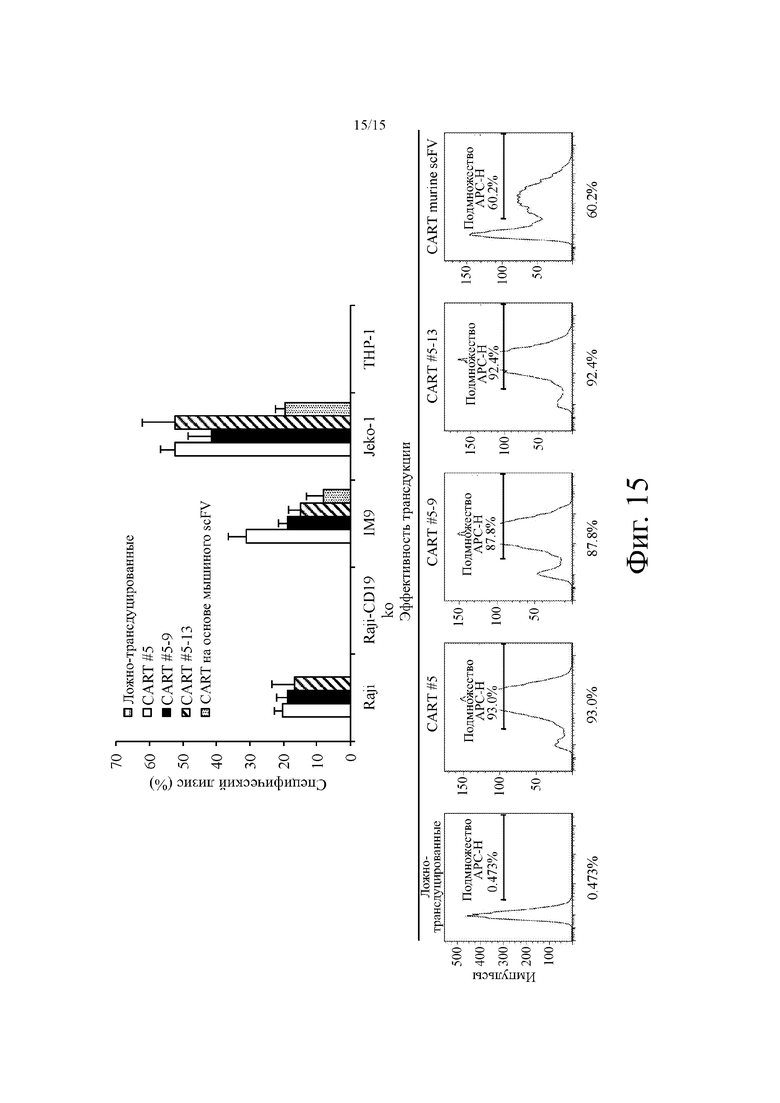
Изобретение относится к области биохимии, в частности к антителу или его антигенсвязывающему фрагменту, которые специфически связывают CD19 человека. Также раскрыты химерный антигенный рецептор, содержащий указанное антитело; молекула нуклеиновой кислоты, кодирующая указанное антитело; клетка, содержащая указанную молекулу нуклеиновой кислоты. Раскрыты способ лечения медицинского состояния, характеризующегося экспрессией CD19 с помощью указанного антитела; способ управления Т-клетками для уничтожения клеток-мишеней, экспрессирующих CD19. Изобретение позволяет эффективно лечить медицинское состояние, характеризующегося экспрессией CD19. 8 н. и 24 з.п. ф-лы, 6 пр., 9 табл., 15 ил.
1. Антитело или его антигенсвязывающий фрагмент, которые специфически связывают CD19 человека, где указанные антитело или антигенсвязывающий фрагмент включают CDR1 тяжелой цепи (HC-CDR1), CDR2 тяжелой цепи (HC-CDR2) и CDR3 тяжелой цепи (HC-CDR3) и CDR1 легкой цепи (LC -CDR1), CDR2 легкой цепи (LC-CDR2) и CDR3 легкой цепи (LC-CDR3),
где HC-CDR1 включает G-X1-X2-F-X3-S-X4-X5 (SEQ ID NO: 291) и где Х1 представляет собой F, G, Y или V, X2 представляет собой S или T, X3 представляет собой S или T, X4 представляет собой N или Y, а X5 представляет собой A, W или Y;
где HC-CDR2 включает I-X6-P-X7-X8-X9-X10-T (SEQ ID NO: 292) и где X6 представляет собой S, D или Y, X7 представляет собой E, S, G или I, X8 представляет собой D, F или V, X9 представляет собой G или S, а X10 представляет собой K, E, Y, D или T;
где HC-CDR3 выбран из SEQ ID NO: 75, 78, 81, 84, 87, 90, 93, 96, 99, 102, 105, 108, 211, 114, 117, 120 или 123,
где LC-CDR1 включает S-S-N-X11-G-X12-X13-X14 (SEQ ID NO: 293) или N-I-G-S-X15-S (SEQ ID NO: 294) и где X11 представляет собой I или V, X12 представляет собой N, S или T, X13 представляет собой N, H или K, X14 представляет собой Y, A или T, а X15 представляет собой K или E; и/или
где LC-CDR2 включает X16-X17-X18 (SEQ ID NO: 295) и где X16 представляет собой D, E, S, R или Y, X 17 представляет собой N или D, а X18 представляет собой N, Y, S или D,
где LC-CDR3 выбран из SEQ ID NO: 183, 186, 189, 192, 195, 198, 201, 204, 207, 210, 213, 216, 219, 222, 225, 228 или 231.
2. Антитело или его антигенсвязывающий фрагмент по п. 1, где указанные антитело или антигенсвязывающий фрагмент включают:
по меньшей мере один CDR (HC-CDR) тяжелой цепи, содержащий последовательность, которая по меньшей мере на 95% идентична любой из последовательностей SEQ ID NO: 73-123, и/или
по меньшей мере один CDR (LC-CDR) легкой цепи, содержащий последовательность, которая по меньшей мере на 95% идентична любой из последовательностей SEQ ID NO: 181-231.
3. Антитело или его антигенсвязывающий фрагмент по п. 2, где указанные антитело или антигенсвязывающий фрагмент включают:
(a) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 75 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183 соответственно;
(b) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 184, SEQ ID NO: 185 и SEQ ID NO: 186 соответственно;
(c) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 79, SEQ ID NO: 80 и SEQ ID NO: 81 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 187, SEQ ID NO: 188 и SEQ ID NO: 189 соответственно;
(d) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 82, SEQ ID NO: 83 и SEQ ID NO: 84 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 190, SEQ ID NO: 191 и SEQ ID NO: 192 соответственно;
(e) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 85, SEQ ID NO: 86 и SEQ ID NO: 87 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 193, SEQ ID NO: 194 и SEQ ID NO: 195 соответственно;
(f) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 90 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична последовательности аминокислот, представленной в SEQ ID NO: 196, SEQ ID NO: 197 и SEQ ID NO: 198 соответственно;
(g) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 91, SEQ ID NO: 92 и SEQ ID NO: 93 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 199, SEQ ID NO: 200 и SEQ ID NO 201 соответственно;
(h) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 94, SEQ ID NO: 95 и SEQ ID NO: 96 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 202, SEQ ID NO: 203 и SEQ ID NO: 204 соответственно;
(i) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 97, SEQ ID NO: 98 и SEQ ID NO: 99 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 205, SEQ ID NO: 206 и SEQ ID NO: 207 соответственно;
(j) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 208, SEQ ID NO: 209 и SEQ ID NO: 210 соответственно;
(k) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 105 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 211, SEQ ID NO: 212 и SEQ ID NO: 213 соответственно;
(1) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 106, SEQ ID NO: 107 и SEQ ID NO: 108 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 214, SEQ ID NO: 215 и SEQ ID NO: 216 соответственно;
(m) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 109, SEQ ID NO: 110 и SEQ ID NO: 111 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 217, SEQ ID NO: 218 и SEQ ID NO: 219 соответственно;
(n) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 220, SEQ ID NO: 221 и SEQ ID NO: 222 соответственно;
(o) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 115, SEQ ID NO: 116 и SEQ ID NO: 117 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 223, SEQ ID NO: 224 и SEQ ID NO: 225 соответственно;
(p) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 118, SEQ ID NO: 119 и SEQ ID NO: 120 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 226, SEQ ID NO: 227 и SEQ ID NO: 228 соответственно; или
(q) HC-CDR1, HC-CDR2 и HC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123 соответственно, и LC-CDR1, LC-CDR2 и LC-CDR3, каждый из которых имеет последовательность, которая по меньшей мере на 95% идентична аминокислотным последовательностям, представленным в SEQ ID NO: 229, SEQ ID NO: 230 и SEQ ID NO: 231 соответственно.
4. Антитело или его антигенсвязывающий фрагмент по п. 3, где указанные антитело или антигенсвязывающий фрагмент включают:
(а) HC-CDR из SEQ ID NO: 73, SEQ ID NO: 74 и SEQ ID NO: 75 и LC-CDR из SEQ ID NO: 181, SEQ ID NO: 182 и SEQ ID NO: 183;
(b) HC-CDR из SEQ ID NO: 76, SEQ ID NO: 77 и SEQ ID NO: 78 и LC-CDR из SEQ ID NO: 184, SEQ ID NO: 185 и SEQ ID NO: 186;
(c) HC-CDR из SEQ ID NO: 79, SEQ ID NO: 80 и SEQ ID NO: 81 и LC-CDR из SEQ ID NO: 187, SEQ ID NO: 188 и SEQ ID NO: 189;
(d) HC-CDR из SEQ ID NO: 82, SEQ ID NO: 83 и SEQ ID NO: 84 и LC-CDR из SEQ ID NO: 190, SEQ ID NO: 191 и SEQ ID NO: 192;
(e) HC-CDR из SEQ ID NO: 85, SEQ ID NO: 86 и SEQ ID NO: 87 и LC-CDR из SEQ ID NO: 193, SEQ ID NO: 194 и SEQ ID NO: 195;
(f) HC-CDR из SEQ ID NO: 88, SEQ ID NO: 89 и SEQ ID NO: 90 и LC-CDR из SEQ ID NO: 196, SEQ ID NO: 197 и SEQ ID NO: 198;
(g) HC-CDR из SEQ ID NO: 91, SEQ ID NO: 92 и SEQ ID NO: 93 и LC-CDR из SEQ ID NO: 199, SEQ ID NO: 200 и SEQ ID NO 201;
(h) HC-CDR из SEQ ID NO: 94, SEQ ID NO: 95 и SEQ ID NO: 96 и LC-CDR из SEQ ID NO: 202, SEQ ID NO: 203 и SEQ ID NO: 204;
(i) HC-CDR из SEQ ID NO: 97, SEQ ID NO: 98 и SEQ ID NO: 99 и LC-CDR из SEQ ID NO: 205, SEQ ID NO: 206 и SEQ ID NO: 207;
(j) HC-CDR из SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102 и LC-CDR из SEQ ID NO: 208, SEQ ID NO: 209 и SEQ ID NO: 210;
(k) HC-CDR из SEQ ID NO: 103, SEQ ID NO: 104 и SEQ ID NO: 105 и LC-CDR из SEQ ID NO: 211, SEQ ID NO: 212 и SEQ ID NO: 213;
(l) HC-CDR из SEQ ID NO: 106, SEQ ID NO: 107 и SEQ ID NO: 108 и LC-CDR из SEQ ID NO: 214, SEQ ID NO: 215 и SEQ ID NO: 216;
(m) HC-CDR из SEQ ID NO: 109, SEQ ID NO: 110 и SEQ ID NO: 111 и LC-CDR из SEQ ID NO: 217, SEQ ID NO: 218 и SEQ ID NO: 219;
(n) HC-CDR из SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114 и LC-CDR из SEQ ID NO: 220, SEQ ID NO: 221 и SEQ ID NO: 222;
(o) HC-CDR из SEQ ID NO: 115, SEQ ID NO: 116 и SEQ ID NO: 117, и LC-CDR из SEQ ID NO: 223, SEQ ID NO: 224 и SEQ ID NO: 225;
(p) HC-CDR из SEQ ID NO: 118, SEQ ID NO: 119 и SEQ ID NO: 120 и LC-CDR из SEQ ID NO: 226, SEQ ID NO: 227 и SEQ ID NO: 228; или
(q) HC-CDR из SEQ ID NO: 121, SEQ ID NO: 122 и SEQ ID NO: 123 и LC-CDR из SEQ ID NO: 229, SEQ ID NO: 230 и SEQ ID NO: 231.
5 Антитело или его антигенсвязывающий фрагмент по любому из пп. 2-4, где указанные антитело или антигенсвязывающий фрагмент включают
вариабельную область тяжелой цепи (HCVR), имеющую последовательность, которая по меньшей мере на 95% идентична HCVR любого из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32 и 34 и
вариабельную область легкой цепи (LCVR), имеющую последовательность, которая по меньшей мере на 95% идентична LCVR любого из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32 и 34.
6. Антитело или его антигенсвязывающий фрагмент п. 5, где указанные антитело или антигенсвязывающий фрагмент включают:
(a) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 2, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 2;
(b) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 4, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 4;
(c) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 6, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 6;
(d) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 8, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 8;
(e) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 10, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 10;
(f) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 12, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 12;
(g) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 14, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 14;
(h) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 16, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 16;
(i) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 18, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 18;
(j) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 20, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 20;
(k) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 22, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 22;
(1) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 24, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 24;
(m) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 26, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 26;
(n) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 28, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 28;
(o) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 30, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 30;
(p) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 32, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 32; или
(q) HCVR, имеющую последовательность, которая по меньшей мере на 95% идентична HCVR из SEQ ID NO: 34, и LCVR, имеющую последовательность, которая по меньшей мере на 95% идентична LCVR из SEQ ID NO: 34.
7. Антитело или его антигенсвязывающий фрагмент по п. 5 или 6, где указанные антитело или антигенсвязывающий фрагмент включают последовательности HCVR и LCVR любой из SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 24, SEQ ID NO: 26, SEQ ID NO: 28, SEQ ID NO: 30, SEQ ID NO: 32 и SEQ ID NO: 34.
8. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-7, где указанные антитело или антигенсвязывающий фрагмент дополнительно включают от одной до пяти аминокислотных замен в HC-CDR, HC-каркасе, LC-CDR, LC-каркасе или их комбинациях.
9. Антитело или его антигенсвязывающий фрагмент по п. 8, где указанные антитело или антигенсвязывающий фрагмент включают:
вариабельную область легкой цепи с аминокислотными заменами D52N и D95E,
вариабельную область тяжелой цепи с аминокислотной заменой S63F,
вариабельную область тяжелой цепи с аминокислотными заменами Q3R, Y32F и A97V,
вариабельную область тяжелой цепи с аминокислотной заменой M117L или
вариабельную область легкой цепи с аминокислотными заменами S25N и V34I и вариабельную область тяжелой цепи с аминокислотными заменами K12E и D109E.
10. Антитело или его антигенсвязывающий фрагмент по п. 8, где указанные антитело или антигенсвязывающий фрагмент включают:
(a) HC-CDR из SEQ ID NO: 124, SEQ ID NO: 125 и SEQ ID NO: 126 и LC-CDR из SEQ ID NO: 232, SEQ ID NO: 233 и SEQ ID NO: 234;
(b) HC-CDR из SEQ ID NO: 127, SEQ ID NO: 128 и SEQ ID NO: 129 и LC-CDR из SEQ ID NO: 235, SEQ ID NO: 236 и SEQ ID NO: 237;
(c) HC-CDR из SEQ ID NO: 130, SEQ ID NO: 131 и SEQ ID NO: 132 и LC-CDR из SEQ ID NO: 238, SEQ ID NO: 239 и SEQ ID NO: 240;
(d) HC-CDR из SEQ ID NO: 133, SEQ ID NO: 134 и SEQ ID NO: 135 и LC-CDR из SEQ ID NO: 241, SEQ ID NO: 242 и SEQ ID NO: 243;
(e) HC-CDR из SEQ ID NO: 136, SEQ ID NO: 137 и SEQ ID NO: 138 и LC-CDR из SEQ ID NO: 244, SEQ ID NO: 245 и SEQ ID NO: 246;
(f) HC-CDR из SEQ ID NO: 139, SEQ ID NO: 140 и SEQ ID NO: 141 и LC-CDR из SEQ ID NO: 247, SEQ ID NO: 248 и SEQ ID NO: 249;
(g) HC-CDR из SEQ ID NO: 142, SEQ ID NO: 143 и SEQ ID NO: 144 и LC-CDR из SEQ ID NO: 250, SEQ ID NO: 251 и SEQ ID NO: 252;
(h) HC-CDR из SEQ ID NO: 145, SEQ ID NO: 146 и SEQ ID NO: 147 и LC-CDR из SEQ ID NO: 253, SEQ ID NO: 254 и SEQ ID NO: 255;
(i) HC-CDR из SEQ ID NO: 148, SEQ ID NO: 149 и SEQ ID NO: 150 и LC-CDR из SEQ ID NO: 256, SEQ ID NO: 257 и SEQ ID NO: 258;
(j) HC-CDR из SEQ ID NO: 151, SEQ ID NO: 152 и SEQ ID NO: 153 и LC-CDR из SEQ ID NO: 259, SEQ ID NO: 260 и SEQ ID NO: 261;
(k) HC-CDR из SEQ ID NO: 154, SEQ ID NO: 155 и SEQ ID NO: 156 и LC-CDR из SEQ ID NO: 262, SEQ ID NO: 263 и SEQ ID NO: 264;
(l) HC-CDR из SEQ ID NO: 157, SEQ ID NO: 158 и SEQ ID NO: 159 и LC-CDR из SEQ ID NO: 265, SEQ ID NO: 266 и SEQ ID NO: 267;
(m) HC-CDR из SEQ ID NO: 160, SEQ ID NO: 161 и SEQ ID NO: 163 и LC-CDR из SEQ ID NO: 268, SEQ ID NO: 269 и SEQ ID NO: 270;
(n) HC-CDR из SEQ ID NO: 163, SEQ ID NO: 164 и SEQ ID NO: 165 и LC-CDR из SEQ ID NO: 271, SEQ ID NO: 272 и SEQ ID NO: 273;
(o) HC-CDR из SEQ ID NO: 166, SEQ ID NO: 167 и SEQ ID NO: 168 и LC-CDR из SEQ ID NO: 274, SEQ ID NO: 275 и SEQ ID NO: 276;
(p) HC-CDR из SEQ ID NO: 169, SEQ ID NO: 170 и SEQ ID NO: 171 и LC-CDR из SEQ ID NO: 277, SEQ ID NO: 278 и SEQ ID NO: 279;
(q) HC-CDR из SEQ ID NO: 172, SEQ ID NO: 173 и SEQ ID NO: 174 и LC-CDR из SEQ ID NO: 280, SEQ ID NO: 281 и SEQ ID NO: 282;
(r) HC-CDR из SEQ ID NO: 175, SEQ ID NO: 176 и SEQ ID NO: 177 и LC-CDR из SEQ ID NO: 283, SEQ ID NO: 284 и SEQ ID NO: 285; или
(s) HC-CDR из SEQ ID NO: 178, SEQ ID NO: 179 и SEQ ID NO: 180 и LC-CDR из SEQ ID NO: 286, SEQ ID NO: 287 и SEQ ID NO: 288.
11. Антитело или его антигенсвязывающий фрагмент п. 8, где указанные антитело или антигенсвязывающий фрагмент включают последовательности HCVR и LCVR любой из SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72.
12. Антитело или его антигенсвязывающий фрагмент по п. 8, чья последовательность включает 1-5 аминокислотных замен по сравнению с родительским антителом, имеющим HCVR и LCVR из SEQ ID NO: 30 или SEQ ID NO: 32.
13. Антитело или его антигенсвязывающий фрагмент по п. 12, где 1-5 аминокислотных замен находятся в каркасной области и/или CDR.
14. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-13, которые представляет собой или включает иммуноглобулин, Fab, F (ab')2, Fd, Fv, одноцепочечный Fv (scFv) или dAb.
15. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-14, где указанное антитело или антигенсвязывающий фрагмент конъюгированы с терапевтическим агентом, детектирующим агентом, цитотоксическим агентом или фрагментом или радиоизотопом.
16. Антитело или его антигенсвязывающий фрагмент по любому из пп. 1-15, где антитело или антигенсвязывающий фрагмент основаны на антителе человека.
17. Биспецифическое антитело, которое специфически связывает CD19 и второй антиген, содержащее первый антигенсвязывающий сайт и второй антигенсвязывающий сайт, отличающееся тем, что первый антигенсвязывающий сайт происходит из или основан на антителе или его антигенсвязывающем фрагменте по любому из пп. 1-16.
18. Биспецифическое антитело по п. 17, отличающееся тем, что второй антигенсвязывающий сайт связывает иммунную клетку, выбранную из группы, состоящей из Т-клетки, NK-клетки, В-клетки, дендритной клетки, моноцита, макрофага, нейтрофила, мезенхимальной стволовой клетки и нейрональной стволовой клетки.
19. Химерный антигенный рецептор, который специфически связывает CD19 человека и содержит антигенсвязывающий сайт антитела или его антигенсвязывающего фрагмента по любому из пп. 1-16.
20. Химерный антигенный рецептор по п. 19, дополнительно включающий трансмембранный домен и внутриклеточный сигнальный домен, внутриклеточный сигнальный домен которого включает внутриклеточную сигнальную последовательность CD3ζ и внутриклеточную сигнальную последовательность CD28.
21. Химерный антигенный рецептор по п. 19, дополнительно включающий трансмембранный домен и/или внутриклеточный сигнальный домен нативного клеточного рецептора.
22. Химерный антигенный рецептор по п. 21, где нативный клеточный рецептор представляет собой Т-клеточный рецептор (TCR).
23. Молекула нуклеиновой кислоты, кодирующая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-16,
биспецифическое антитело по п. 17 или 18 или
химерный антигенный рецептор по любому из пп. 19-22.
24. Клетка, включающая молекулу нуклеиновой кислоты по п. 23 и экспрессирующая антитело или его антигенсвязывающий фрагмент по любому из пп. 1-16, биспецифическое антитело по п. 17 или 18 или химерный антигенный рецептор по любому из пп. 19-22.
25. Клетка по п. 24, где клетка является эффекторной клеткой.
26. Клетка по п. 25, где эффекторная клетка представляет собой Т-клетку.
27. Способ лечения медицинского состояния, характеризующегося экспрессией CD19 у объекта, включающий стадию введения указанному объекту антитела или его антигенсвязывающего фрагмента по любому из пп. 1-16, биспецифичного антитела по п. 17 или 18, химерного антигенного рецептора по любому из пп. 19-22, молекулы нуклеиновой кислоты по п. 23, эффекторной клетки по п. 25 или 26.
28. Способ по п. 27, где медицинское состояние, характеризующееся экспрессией CD19, представляет собой ревматоидный артрит (RA), системную красную волчанку (SLE), диабет или склеродермию.
29. Способ по п. 27, где медицинское состояние, характеризующееся экспрессией CD19, представляет собой В-клеточную лимфому, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, лимфому Беркитта, неходжкинскую лимфому или острый миелоидный лейкоз.
30. Способ по п. 27, где медицинское состояние, характеризующееся экспрессией CD19, является раком.
31. Способ ингибирования роста опухоли или уничтожения опухолевых клеток, где опухоль экспрессирует CD19, причем способ включает стадию
контакта опухолевых клеток с антителом или его антигенсвязывающим фрагментом по любому из пп. 1-16, биспецифическим антителом по п. 17 или 18, химерным антигенным рецептором по любому из пп. 19-22, молекулой нуклеиновой кислоты по п. 23 или эффекторной клеткой по п. 25 или 26,
причем контакт выполняется в условиях и в течение времени, достаточного для ингибирования роста опухоли или уничтожения опухолевых клеток.
32. Способ управления Т-клетками для уничтожения клеток-мишеней, экспрессирующих CD19, причем способ включает стадию
контакта одной или нескольких клеток-мишеней, экспрессирующих CD19, с одной или несколькими Т-клетками и антителом или его антигенсвязывающим фрагментом по любому из пп. 1-16 или биспецифическим антителом по п. 17 или 18 или
контакта одной или нескольких клеток-мишеней, экспрессирующих CD19, с эффекторной клеткой по п. 25 или 26, где эффекторная клетка представляет собой Т-клетку,
причем контакт выполняется в условиях и в течение времени, достаточных для того, чтобы Т-клетки, с которыми связывались антитело или его антигенсвязывающий фрагмент или биспецифическое антитело, опосредовали уничтожение клеток-мишеней или чтобы эффекторная клетка опосредовала уничтожение клеток-мишеней.
| СПОСОБ ГЕНЕРИРОВАНИЯ АКТИВНЫХ АНТИТЕЛ К АНТИГЕНУ УСТОЙЧИВОСТИ, АНТИТЕЛА, ПОЛУЧЕННЫЕ ЭТИМ СПОСОБОМ, И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2515904C2 |
| РЕЖИМ ДОЗИРОВАНИЯ ДЛЯ ВВЕДЕНИЯ БИСПЕЦИФИЧНОГО АНТИТЕЛА CD19×CD3 | 2010 |
|
RU2548746C2 |
| CD19XCD3-СПЕЦИФИЧЕСКИЕ ПОЛИПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ | 1999 |
|
RU2228202C2 |
Авторы
Даты
2022-06-01—Публикация
2016-10-11—Подача