Область техники, к которой относится изобретение
Воплощения изобретения относятся к композициям, содержащим связывающие агенты, которые специфически связываются с cMET, и к их применениям.
Предшествующий уровень техники
Белок cMET, иногда называемый MET или рецептор фактора роста гепатоцитов (HGFR), представляет собой белок, который у человека кодируется геном MET (протоонкоген MET, рецепторная тирозинкиназа). cMET является рецептором, один раз пересекающим клеточную поверхность, который обладает тирозинкиназной активностью. Первичный одноцепочечный белок-предшественник продукта трансляции МЕТ посттрансляционно расщепляется с образованием альфа- и бета-субъединицы, которые связаны дисульфидным мостиком, образуя зрелый рецептор клеточной поверхности cMET. cMET экспрессируется на клетках эпителиального происхождения, а также на стволовых клетках, клетках-предшественниках и клетках других типов. Фактор роста гепатоцитов/рассеивающий фактор (HGF/SF) и его сплайсинговые изоформы (NK1, NK2) были идентифицированы как лиганды cMET.
Предполагается, что cMET необходим для нормального развития эмбрионов, органогенеза и заживления ран. Аномальная экспрессия и/или активность cMET связана с некоторыми неопластическими нарушениями и злокачественными новообразованиями (например, рак почки, печени, желудка, молочной железы и мозга), где cMET участвует в росте опухоли, ангиогенезе и метастазировании. Сверхэкспрессия cMET, а также его аутокринная активация путем коэкспрессии его лиганда, также участвуют в онкогенезе.
Сущность изобретения
В данном документе представлены новые связывающие агенты, моноклональные антитела и их связывающие части, которые специфически связываются с cMET, их фармацевтические композиции и способы их применения.
В некоторых аспектах в настоящем документе представлен связывающий агент, который специфически связывается с cMET, внеклеточным доменом cMET или их частью. В некоторых воплощениях связывающий агент, описанный в данном документе, специфически связывается с белком или полипептидом, который включает cMET, внеклеточный домен cMET или их часть. В некоторых воплощениях связывающий агент специфически связывается с одним или несколькими cMET млекопитающих, выбранными из cMET человека, cMET не являющегося человеком примата (например, cMET обезьяны), cMET крысы и cMET мыши. В определенных воплощениях связывающий агент специфически связывается с вариантом cMET человека и/или с внеклеточным доменом cMET человека, включающим один или несколько встречающихся в природе вариантов. В некоторых воплощениях связывающий агент специфически связывается с вариантом cMET человека, содержащим вариант E168D и/или N375S.
В некоторых аспектах связывающий агент, который специфически связывается с cMET, включает CDR-L1, CDR-L2 и/или CDR-L3, которые представляют собой три полипептидные последовательности определяющих комплементарность областей легкой цепи (CDR-L), где CDR-L1 выбрана из таблицы 1, CDR-L2 выбрана из таблицы 2, а CDR-L3 выбрана из таблицы 3. В некоторых аспектах связывающий агент, который специфически связывается с cMET, включает CDR-H1, CDR-H2 и/или CDR-H3, которые представляют собой три полипептидные последовательности определяющих комплементарность областей тяжелой цепи (CDR-H), где CDR -H1 выбрана из таблицы 6, CDR-H2 выбрана из таблицы 7, а CDR-H3 выбрана из таблицы 8. В некоторых аспектах связывающий агент, который специфически связывается с cMET, включает CDR-L1, выбранную из таблицы 1, CDR-L2, выбранную из таблицы 2, CDR-L3, выбранную из таблицы 3, CDR-H1, выбранную из таблицы 6, CDR-H2 выбранную из таблицы 7, а CDR-H3 выбранную из таблицы 8. В некоторых воплощениях CDR-L1 выбрана из SEQ ID NO: 2, 4, 6, 8, 10, 12 и 14. В некоторых воплощениях CDR-L2 выбрана из SEQ ID NO: 17, 19, 21, 23 и 25. В некоторых воплощениях CDR-L3 выбрана из SEQ ID NO: 27, 29, 31, 33 и 35. В некоторых воплощениях CDR-H1 выбрана из SEQ ID NO: 51, 53, 55, 57 и 59. В некоторых воплощениях CDR-H2 выбрана из SEQ ID NO: 63, 65, 67, 69, 73 и 75. В некоторых воплощениях CDR-H3 выбрана из таблицы 8 и выбрана из SEQ ID NO: 80, 82, 84, 86, 88, 91 и 93. В некоторых воплощениях связывающий агент представляет собой антитело или его фрагмент, связывающий cMET.
В некоторых воплощениях связывающий агент включает вариабельную область легкой цепи, имеющую аминокислотную последовательность, выбранную из таблицы 4 или 5, и/или вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, выбранную из таблицы 9 или 10. Вариабельная область легкой цепи в таблице 4 или 5 или вариабельная область тяжелой цепи в таблице 9 или 10 могут включать от одной до двадцати или в некоторых воплощениях от одной до десяти модификаций аминокислот, выбранных из добавления аминокислоты, делеции аминокислоты и замены аминокислоты, где связывающий агент сохраняет специфическое связывание с cMET.
В некоторых воплощениях связывающий агент представляет собой моноклональное антитело или его фрагмент, связывающий cMET. В некоторых воплощениях связывающий агент включает константную область IgG1, IgG2, IgG3 или IgG4. В некоторых воплощениях связывающий агент включает константную область IgD, IgE, IgA или IgM. В некоторых воплощениях связывающий агент является гуманизированным и/или включает, по меньшей мере, от одной до четырех гуманизированных или человеческих каркасных областей. В определенных воплощениях связывающий агент включает, по меньшей мере, от одной до четырех каркасных областей мыши. В некоторых воплощениях связывающий агент представляет собой фрагмент антитела Fab, Fab', F(ab')2, Fv или scFV.
В некоторых аспектах связывающий агент, описанный в данном документе, обладает одним или несколькими функциональными свойствами. В определенных воплощениях связывающий агент индуцирует или стимулирует интернализацию cMET в злокачественной опухолевой клетке человека. В некоторых воплощениях связывающий агент индуцирует или способствует деградации cMET на злокачественной опухолевой клетке человека. В некоторых воплощениях связывающий агент не обладает детектируемой активностью агониста cMET. В некоторых воплощениях связывающий агент индуцирует или способствует гибели клетки, с которой он связывается. В некоторых воплощениях связывающий агент конъюгирован с противоопухолевым агентом.
В некоторых аспектах связывающий агент, описанный в данном документе, специфически связывается с cMET или его частью. В некоторых аспектах связывающий агент, описанный в данном документе, специфически связывается с cMET или его частью с KD 10 нМ или менее или 1 нМ или менее. В некоторых аспектах аффинность связывающего агента к cMET или его части включает KD 10 нМ или менее или 1 нМ или менее.
В некоторых воплощениях связывающий агент, который специфически связывается с cMET, дополнительно включает вторую антигенсвязывающую часть, которая специфически связывается с другим антигеном (например, антигеном, который не является cMET, или его частью). Например, в некоторых воплощениях связывающий агент включает первый антигенсвязывающий домен, который специфически связывается с cMET, и второй антигенсвязывающий домен, который специфически связывается с другим полипептидом.
В некоторых аспектах в настоящем документе представлены способы лечения объекта, имеющего или подозреваемого на наличие неопластического расстройства или онкологического заболевания. В одном воплощении способ включает введение терапевтически эффективного количества связывающего агента, описанного в данном документе, объекту. В некоторых воплощениях способ включает контакт клетки объекта (например, опухолевой или злокачественной опухолевой клетки) со связывающим агентом. В определенных воплощениях связывающий агент сконфигурирован для специфического связывания с внеклеточным доменом cMET, экспрессированным на одной или нескольких клетках объекта. В некоторых воплощениях связывающий агент снижает, ингибирует или уменьшает митоз и/или способствует или индуцирует гибель одной или нескольких клеток, экспрессирующих cMET. В некоторых воплощениях неопластическое расстройство или онкологическое заболевание включают карциному легкого, карциному молочной железы, карциному яичника, карциному почки, карциному толстой кишки, карциному желудка, карциному щитовидной железы, карциному поджелудочной железы, нейробластому или плоскоклеточную карциному головы и шеи, рак шейки матки, гепатоцеллюлярный рак, саркомы, мезотелиому, глиобластому, множественную миелому, меланому, карциному предстательной железы и пищевода.
В некоторых воплощениях предлагается фармацевтическая композиция, которая включает связывающий агент. В некоторых воплощениях фармацевтическая композиция включает, в дополнение к связывающему агенту, фармацевтически приемлемый наполнитель, разбавитель, добавку и/или носитель. В некоторых воплощениях фармацевтическая композиция составлена в виде стерильного лиофилизированного порошка, который после разведения подходит для внутривенного введения млекопитающему.
Определенные аспекты технологии ниже дополнительно описаны в описании, примерах, формуле изобретения и чертежах.
Чертежи иллюстрируют воплощения технологии и не являются ограничительными. Для ясности и простоты иллюстрации чертежи выполнены не в масштабе, и в некоторых случаях различные аспекты могут быть показаны преувеличенными или увеличенными для облегчения понимания конкретных воплощений.
Краткое описание чертежей
На фиг. 1 представлена сводка рабочего процесса, использованного для получения моноклональных антител (примерных связывающих агентов), которые специфически связываются с cMET. Ведущее моноклональное Ab P3D12 было получено из мыши, иммунизированной рекомбинантным интактным внеклеточным доменом cMET, слитым с человеческим Fc.
На фиг. 2 показана схема иммунизации, используемая для получения моноклональных антител (типичных связывающих агентов), которые специфически связываются с cMET. Мышей первоначально иммунизировали путем внутрибрюшинной инъекции (i.p.) 100 мкг гибридного белка cMET-Fc человека (cMET-Fc) или 50-100 мкг конъюгированного с KLH пептида cMET в полном адъюванте Фрейнда (CFA), как указано. cMET-Fc включает внеклеточный домен человеческого cMET, слитый с Fc-частью антитела. Пептиды cMET были стратегически выбраны из части внеклеточного домена cMET. Иммунизированные мыши получали одну или несколько бустерных иммунизаций, включающих 25 или 50 мкг cMET-Fc или пептида в неполном адъюванте Фрейнда (IFA), как указано. Некоторые мыши получали повторные иммунизации в нескольких местах (RIMMS). Иммунизации включали гибридные белки Met-Fc, пептиды, традиционные и RIMMS. Получали селезенки иммунизированных мышей и сливали с подходящим партнером по слиянию. Получили более 20000 гибридомных клонов, которые подвергли скринингу.
На фиг. 3 показана трехмерная структура домена MET SEMA, связанного с Fab агониста антитела Met-mAb (5D5 Fab) и бета-субъединицы HGF (HGFb). Нижняя стрелка указывает положение части cMET, используемой для конструирования пептида 3.
На фиг. 4 показаны результаты характеризации примерного слияния (FUSION 6B1, планшет 3). Гибридомы анти-cMet были отобраны, частично, по наличию специфического связывания с cMet, проанализированное с помощью ELISA (см. колонку с меткой «MET Binding ELISA OD450nm»), и на способность индуцировать интернализацию cMET на линиях злокачественных опухолевых клеток человека, измеренную с помощью проточной цитометрии (см. колонку «FACS Geom. Mean»). Среднее значение FACS Geo ниже отрицательного контроля указывает на интернализацию cMet. Стрелка указывает на ведущую гибридому F6B1P3D12.
На фиг. 5 показаны результаты анализа деградации МЕТ. Анти-cMET антитела, выделенные из указанных лунок (ось x), были протестированы и отобраны по их способности индуцировать деградацию cMET на линиях злокачественных опухолевых клеток человека, что измерялось с помощью количественного определения белка cMet в Mesoscale (MSD). Относительные значения деградации Met указаны на оси Y как % контроля (процент от контроля). Значения ниже 100% контроля (уровень отрицательного контроля) указывают на интернализацию и деградацию cMet. Деградация указывает не только на интернализацию, но и на лизосомальный трафик, что является важным свойством для конъюгата антитело-лекарственное средство. Стрелка указывает результаты для ведущей гибридомы F6B1P3D12.
На фиг. 6 показаны результаты анализа фосфо-ERK (анализ P-ERK), который измеряет агонистическую активность анти-cMET антител путем косвенного измерения фосфорилирования ERK, индуцированного связыванием анти-cMET антитела с cMET на поверхности клетки. Показано количество фосфорилированного ERK (показано как % от контроля, ось Y), обнаруженное в клеточных лизатах после обработки жизнеспособных клеток анти-cMET антителом. Анти-cMET антитела, полученные из различных анти-cMET гибридом (ось x), тестировали при 6 мкг/мл или 30 мкг/мл (как указано на оси x) и отбирали в соответствии с их неспособностью индуцировать значительное фосфорилирование ERK (т.е. их способность не вызывать пролиферацию, т.е. отсутствие агонистической активности). Ведущее моноклональное антитело (mAb) P3D12 указано стрелкой.
На фиг. 7 показаны результаты некоторых cMet mAb, которые были проанализированы с помощью ELISA на связывание с cMet человека, обезьяны (яванский макак, «Cyno»), собаки, крысы и мыши. Все моноклональные антитела связывают cMet человека и обезьяны. P3D12 продемонстрировало значительную перекрестную реактивность с cMet крысы. Различные концентрации каждого антитела указаны на оси х. Относительные количества указаны на оси Y (OD 450 нм).
На фиг. 8А показано выравнивание аминокислотных последовательностей вариабельных областей легкой цепи девяти мышиных моноклональных анти-сМЕТ антител, названия которых указаны слева от каждой последовательности. SEQ ID NO указаны справа от каждой последовательности. Аминокислотные последовательности вариабельных областей легкой цепи LC F6B1P1E2 и F6BP3E2 идентичны на 100%. Также аминокислотные последовательности вариабельных областей легкой цепи LC F6B1P3D12 и F6B1P3E9 идентичны на 100%.
На фиг. 8В показано выравнивание аминокислотных последовательностей вариабельных областей тяжелой цепи девяти мышиных моноклональных анти-cMET антител, названия которых указаны слева от каждой последовательности. SEQ ID NO указаны справа от каждой последовательности. Аминокислотные последовательности вариабельных областей тяжелой цепи F6B1P3D12H7913 и F6B1P3E9 идентичны на 100%. Кроме того, аминокислотные последовательности вариабельных областей тяжелой цепи F6B1P1E2H7819 и F6BP3E2 идентичны на 100%.
Фиг. 9А и 9В демонстрируют результаты на мышиной модели ксенотрансплантата in vivo, оценивающие эффективность указанных конъюгатов с анти-cMET антителом (ADC) с использованием модели опухоли MKN45 (модель cMet+ рак желудка) на голых мышах. Животных обрабатывали один раз ADC в дозе 2,5 мг/кг (9А) или 5,0 мг/кг (9В). Эффективность каждого связанного с лекарственным средством анти-cMET-связывающего агента сравнивали с PBS или неродственным нецелевым моноклональным антителом (IgG-ADC). Объем опухоли (ось Y) измеряли в различные моменты времени после инокуляции (ось Y, дни (после инокуляции)). Ингибирование роста опухоли указывает на положительную эффективность. Анти-cMET-связывающие агенты и нецелевое моноклональное антитело (IgG) конъюгировали с монометилауристатином F (MMAF).
На фиг. 10 показаны результаты анализа фосфо-ERK (анализ P-ERK), который измеряет агонистическую активность анти-cMET антител путем косвенного измерения фосфорилирования ERK, индуцированного связыванием анти-cMET антитела с cMET на поверхности клетки. Показано количество фосфорилированного ERK (показано как % от контроля, ось Y), обнаруженное в клеточных лизатах после обработки жизнеспособных клеток анти-cMET антителом. Константные области тяжелой и легкой цепей выделенного моноклонального антитела мыши, обозначенные как P3D12, были заменены константными областями антитела человеческого IgG1 (P3D12 (hIgG1)) или человеческого IgG2 (P3D12 (hIgG2)), как указано на оси х. Каждое антитело тестировали в концентрации 0,00064 мкг/мл, 0,0032 мкг/мл, 0,016 мкг/мл, 0,08 мкг/мл, 0,4 мкг/мл, 2 мкг/мл, 10 мкг/мл и 50 мкг/мл, как указано на оси х. «Контроль» обозначает необработанный отрицательный контроль. HGF (EC90) является положительным контролем и указывает на клетки, обработанные фактором роста гепатоцитов (HGF), естественным лигандом рецептора cMet. Эти данные указывают на то, что человеческий изотип IgG2 не проявляет детектируемой активности агониста.
На фиг. 11 показаны результаты анализа деградации МЕТ. Деградация является мерой интернализации рецептора cMET при связывании антител. Химерные анти-cMET антитела были протестированы на их способность индуцировать деградацию cMET на линиях злокачественных опухолевых клеток человека, что измерялось с помощью количественного определения белка cMet с помощью Mesoscale (MSD). Относительные значения деградации Met указаны на оси Y как % контроля (процент от контроля). Значения ниже 100% контроля указывают на интернализацию и деградацию cMet. Химерные антитела получали путем замены константных областей тяжелой и легкой цепей выделенного моноклонального антитела мыши, обозначенного как P3D12 (P3D12 (мышь)), константными областями антитела человеческого IgG1 (P3D12 (hIgG1)) или человеческого IgG2 (P3D12 (hIgG2)), как указано на оси х. Каждое антитело тестировали в концентрации 0,00064 мкг/мл, 0,0032 мкг/мл, 0,016 мкг/мл, 0,08 мкг/мл, 0,4 мкг/мл, 2 мкг/мл, 10 мкг/мл и 50 мкг/мл, как указано на оси х. Химерные антитела cMet к P3D12 проявляли сходную интернализационную/деградационную активность, что и родительское мышиное антитело к P3D12.
На фиг. 12 показана блок-схема разработки процесса для тестирования и отбора ведущих моноклональных анти-cMET связывающих агентов.
На фиг. 13 показано выравнивание пяти вариабельных областей гуманизированной легкой цепи гуманизированных версий мышиного анти-cMET-клона P3D12, названия и SEQ ID NO которых указаны слева от каждой последовательности. Для гуманизации мышиных анти-cMET mAb были использованы пять независимых способов. Два способа дали один и тот же результат, поэтому показаны 4 разных легких цепи.
На фиг. 14 показано выравнивание пяти гуманизированных вариабельных областей тяжелой цепи гуманизированных версий мышиного клона P3D12, названия и SEQ ID NO которых указаны слева от каждой последовательности. Для гуманизации мышиных анти-cMET mAb были использованы пять независимых способов. Два способа дали один и тот же результат, поэтому имеется 4 разных легких цепи (см. фиг. 13) и 4 разных тяжелых цепи, которые могут образовывать комбинацию из 16 разных связывающих агентов.
На фиг. 15 показаны результаты in vivo на мышиной модели ксенотрансплантата, в которой тестировалась эффективность указанных конъюгатов лекарственного средства и гуманизированного анти-cMET антитела (ADC) при 2,5 мг/кг (2,5 mpk) или при 5 мг/кг (5 mpk), продемонстрированная с использованием модели опухоли MKN45 (модель рака желудка cMet +). Животных однократно обрабатывали указанными ADC в дозе 2,5 или 5,0 мг/кг. Эффективность каждого анти-cMET-связывающего агента сравнивали с PBS или нецелевым моноклональным антителом ритуксимабом (Retux), которое представляет собой противоопухолевое моноклональное антитело, нацеленное на CD20, который в основном обнаруживается на поверхности В-клеток иммунной системы. Объем опухоли (ось Y) измеряли в различные моменты времени (ось Y) после инокуляции. Ингибирование роста опухоли указывает на положительную эффективность. Анти-cMET-связывающие агенты были конъюгированы с монометилауристатином F (MMAF).
На фиг. 16 показано связывание анти-cMET моноклональных связывающих агентов hD12 и MET IgG2 с рекомбинантными гибридными белками cMET-Fc и мутантный cMET (E168D) Fc. Мутация E168D является соматической мутацией, обнаруженной при мелкоклеточном раке легкого (SCLC). Мутация находится в домене Sema и приводит к конститутивной активации рецептора cMet. Представленность соматических мутаций cMet очень низкая. E168D встречается у 0,8% - 3% пациентов с SCLC. ELISA связывания проводили с внеклеточными доменами cMET ил cMET E168D человека, слитыми с Fc человеческого IgG1. Белки cMET наносили на планшет в течение ночи, а образцы титровали и детектировали козьим антителом против IgG человека (H + L)-HRP. EC50 определяли с использованием сигмоидальной апроксимации дозозависимого эффекта.
Описание воплощений
Представленное в данном документе, в некоторых воплощениях, представляет собой моноклональные связывающие агенты, которые связывают cMET или его часть, а также композиции и их применения. Трансляционный продукт протоонкогена МЕТ включает фактор мезенхимально-эпителиального перехода (МЕТ). MET используется в данном документе как синоним термина «cMET». cMET также известен как рецептор фактора роста гепатоцитов (HGFR). cMET человека (например, SEQ ID NO: 109) включает незрелую полипептидную последовательность из 1390 аминокислот и включает N-концевую одиночную последовательность из аминокислот 1-24, внеклеточный домен человеческого cMET около из аминокислот 24-932, трансмембранный домен около из аминокислот 933-955 и цитоплазматический домен около из аминокислот 956-1390, согласно нумерации от N-конца к C-концу. Известны способы идентификации лидерных последовательностей, внеклеточных доменов, трансмембранных доменов и цитоплазматических доменов рецептора cMET, и любой подходящий способ можно использовать для идентификации таких доменов или областей в полипептидной последовательности cMET, полученной из подходящих видов млекопитающих. Полипептид cMET человека может включать несколько известных вариантов (например, см. URL: http: //www.uniprot.org/uniprot/P08581, по состоянию на 5 мая 2016 г.), при этом варианты cMET и альтернативные последовательности включены в настоящее описание ссылкой). Неограничивающие примеры встречающихся в природе вариантов cMET человека включают аминокислотные замены в 143, 150, 156, 168, 238, 316, 320, 375, 385, 773, 970, 991 и/или 992 в cMET человека (SEQ ID NO: 109). В некоторых воплощениях cMET или внеклеточный домен cMET включают замену E на D в положении 168 cMET человека, обозначенную в данном документе как E168D. В некоторых воплощениях cMET или внеклеточный домен cMET включает замену N на S в положении 375 cMET человека, обозначенную в данном документе как N375S.
В некоторых воплощениях cMET представляет собой cMET млекопитающего. В некоторых воплощениях cMET представляет собой cMET приматов. В некоторых воплощениях cMET представляет собой cMET человека. В некоторых воплощениях cMET представляет собой cMET обезьяны. В некоторых воплощениях cMET представляет собой cMET грызуна (например, крысы и/или мыши). В некоторых воплощениях cMET представляет собой cMET собачьих (например, cMET собаки). Неограничивающие примеры cMET млекопитающих представлены в Примере 5 и/или в перечне последовательностей данной заявки. В некоторых воплощениях внеклеточный домен cMET включает N-концевой участок полипептида cMET, который обычно экспрессируется на поверхности интактной клетки млекопитающего. Внеклеточный домен cMET может содержать две или более полипептидных цепей, полученных из продукта трансляции MET. В некоторых воплощениях внеклеточный домен cMET может быть экспрессирован в растворимой и/или мембранно-несвязанной форме, в которой отсутствует цитоплазматический и/или трансмембранный домен. В некоторых воплощениях внеклеточный домен cMET экспрессируется, выделяется и/или очищается в виде гибридного белка. Например, внеклеточный домен cMET млекопитающего может быть сконструирован и экспрессирован в виде гибридного белка, содержащего Fc-часть иммуноглобулина (например, cMET-Fc). В некоторых воплощениях cMET и/или внеклеточный домен cMET включает одну или несколько аминокислотных добавлений, делеций или замен. Полипептид cMET может составлять, по меньшей мере, 80%, по меньшей мере, 85%, по меньшей мере, 90% или, по меньшей мере, 95% по отношению к полипептиду cMET, описанному в данном документе. В некоторых воплощениях полипептид cMET включает часть (например, субпоследовательность) белка cMET. В некоторых воплощениях часть cMET включает внеклеточный домен cMET или его часть.
Представленное в данном документе, в некоторых воплощениях, представляет собой композиции (например, фармацевтические композиции), содержащие один или несколько связывающих агентов, которые специфически связываются с cMET или его частью. В некоторых воплощениях связывающий агент, представленный в настоящем документе, используется для лечения, профилактики и/или диагностики неопластического расстройства и/или онкологического заболевания у объекта.
Термин «объект» относится к млекопитающему. Любое подходящее млекопитающее можно лечить способом или композицией, описанными в данном документе. Неограничивающие примеры млекопитающих включают людей, не являющихся человеком приматов (например, человекообразных обезьян, гиббонов, шимпанзе, орангутангов, мартышек, макак и тому подобное), домашних животных (например, собак и кошек), сельскохозяйственных животных (например, лошадей, коров, коз, овец, свиней) и экспериментальных животных (например, мышей, крыс, кроликов, морских свинок). В некоторых воплощениях млекопитающее является человеком. Млекопитающее может быть любого возраста или на любой стадии развития (например, может быть взрослым, подростком, ребенком, младенцем или млекопитающим в утробе матери). Млекопитающее может быть самцом или самкой. Млекопитающее может быть беременной самкой.
В некоторых воплощениях объект нуждается в лечении или композиции, которые описаны в данном документе. В определенных воплощениях объект имеет или подозревается на наличие неопластического расстройства или онкологического заболевания. В некоторых воплощениях объект, нуждающийся в лечении или композиции, описанной в настоящем документе, имеет или подозревается на наличие неопластического расстройства или онкологического заболевания. В некоторых воплощениях связывающий агент или композиция, описанные в настоящем документе, используются для лечения объекта, имеющего или подозреваемого на наличие неопластического расстройства или онкологического заболевания.
В определенных воплощениях связывающий агент включает или состоит из одного или нескольких полипептидов или одного или нескольких белков, которые специфически связываются, по меньшей мере, с одним антигеном (например, cMET или его частью). Связывающий агент часто включает, по меньшей мере, одну антигенсвязывающую часть (то есть связывающую часть). Антигенсвязывающая часть связывающего агента представляет собой ту часть, которая специфически связывается с антигеном. В некоторых воплощениях связывающая часть связывающего агента включает или состоит из одного полипептида (например, одноцепочечного антитела). В некоторых воплощениях связывающая часть связывающего агента включает или состоит из двух полипептидов. В некоторых воплощениях связывающая часть связывающего агента включает или состоит из 2, 3, 4 или более полипептидов. В некоторых воплощениях связывающий агент включает одну или несколько структурных частей (например, каркасы, структурные полипептиды, константные области и/или каркасные области). В некоторых воплощениях связывающий агент или его связывающая часть прикрепляется к подложке (например, полимер, неорганический материал, кремний, шарик и тому подобное).
Связывающий агент может содержать одну антигенсвязывающую часть или несколько антигенсвязывающих частей. Например, связывающий агент, который включает одну связывающую часть, иногда называют одновалентным. Связывающий агент, который включает две связующие части, иногда называют двухвалентным. В некоторых воплощениях связывающий агент включает 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более связующих частей. В определенных воплощениях все связывающие части многовалентного связывающего агента связываются с одним и тем же антигеном. В определенных воплощениях все связывающие части многовалентного связывающего агента содержат одну или несколько полипептидных последовательностей, которые, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 99% или на 100% идентичны.
В определенных воплощениях две или более связывающих частей связывающего агента связываются с различными антигенами. Такие связывающие агенты иногда называют биспецифическими или мультиспецифическими связывающими агентами (например, антителами). Таким образом, в некоторых воплощениях связывающий агент включает первую антигенсвязывающую часть, которая специфически связывает cMET или ее часть, и вторую антигенсвязывающую часть, которая специфически связывает другой антиген (например, полипептид, который не является cMET, или его часть). Связывающий агент, который специфически связывает cMET, в некоторых воплощениях ковалентно или нековалентно связан с другим связывающим агентом, который не связывается специфически с cMET или его частью. В определенных воплощениях связывающий агент, который специфически связывает cMET, включает второй связывающий агент, который специфически связывается с другим антигеном.
В некоторых воплощениях связывающий агент включает антитело или его часть (например, его связывающую часть). В некоторых воплощениях связывающий агент включает или состоит из подходящего антитела, фрагмента антитела и/или антигенсвязывающей части антитела (например, связывающего фрагмента, то есть его связывающей части). В некоторых воплощениях связывающий агент представляет собой антитело (например, моноклональное антитело и/или рекомбинантное антитело). Связывающий агент или антитело может быть получено, изготовлено или изготовлено подходящим способом. В некоторых воплощениях связывающий агент является моноклональным. В некоторых воплощениях связывающий агент представляет собой моноклональное антитело, полученное из подходящего вида. Некоторые неограничивающие примеры связывающего агента включают моноклональные антитела, химерные антитела, связывающие фрагменты антитела (например, антигенсвязывающую часть антитела), антитело с привитыми CDR, гуманизированное антитело, человеческое антитело, или их части. Человеческие антитела могут быть получены любым подходящим способом. Например, человеческие антитела могут быть получены от трансхромосомных животных, сконструированных для получения полностью человеческих антител. В определенных воплощениях связывающий агент не является поликлональным, не является поликлональным антителом, и термин «связывающий агент» не относится к поликлональным антителам.
В некоторых воплощениях связывающий агент извлекают, продуцируют, получают, выделяют и/или очищают из подходящих видов. В некоторых воплощениях связывающий агент извлекают, продуцируют, получают, выделяют и/или очищают, например, из кролика, козы, лошади, коровы, крысы, мыши, рыбы, птицы или ламы. В некоторых воплощениях связывающий агент извлекают, продуцируют, получают, выделяют и/или очищают из птицы (например, курицы или птичьего яйца). В некоторых воплощениях связывающий агент извлекают, продуцируют, получают, выделяют и/или очищают из растения (например, рекомбинантный связывающий агент, продуцируемый растением, полученным генно-инженерным образом). В некоторых воплощениях связывающий агент извлекают, продуцируют, получают, выделяют и/или очищают из подходящего млекопитающего. В некоторых воплощениях подходящим млекопитающим является генетически измененное млекопитающее (например, трансхромосомное или трансгенное млекопитающее), сконструированное для получения антител, содержащих тяжелые цепи человека и/или легкие цепи человека или их части. В некоторых воплощениях связывающий агент продуцируют, получают, выделяют или очищают из прокариотической или эукариотической клетки (например, рекомбинантный связывающий агент, продуцируемый клеткой, полученной генно-инженерным образом). В некоторых воплощениях связывающий агент продуцируют, получают, выделяют или очищают из вируса (например, рекомбинантный связывающий агент, продуцируемый вирусом, полученным генно-инженерным образом). Связывающий агент может быть экспрессирован, выделен и/или очищен из подходящей системы экспрессии, неограничивающие примеры которой включают подходящую систему экспрессии в бактериях, фаге, насекомом, вирусе, растении или млекопитающем. Например, нуклеиновая кислота, кодирующая связывающий агент, может быть введена в подходящую клеточную линию млекопитающего, которая экспрессирует и секретирует связывающий агент в среду для культивирования клеток.
В некоторых воплощениях связывающий агент не обнаруживается в природе и не встречается в природе. Например, в некоторых воплощениях связывающий агент генерируется искусственно у животного при введении эмульгированного коктейля, который включает чужеродный рекомбинантный антиген, мощный адъювант и часто минеральное масло и/или детергент, что позволяет вызвать искусственный иммунный ответ на чужеродный рекомбинантный антиген (например, cMET, cMET-Fc).
В некоторых воплощениях моноклональное антитело или моноклональное связывающий агент представляет собой по существу гомогенную популяцию связывающих агентов или их связывающих фрагментов, где каждый отдельный связывающий агент в популяции по существу идентичен и/или связывается с одним и тем же эпитопом, за исключением возможных вариантов, которые могут возникнуть при выработке моноклонального связывающего агента. В некоторых воплощениях такие варианты обычно отсутствуют или могут присутствовать в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно включают популяцию разных антител, направленных против разных детерминант (эпитопов), каждый связывающий агент из популяции моноклональных связывающих агентов часто связывается с одной детерминантой антигена. Моноклональные связывающие агенты часто не загрязнены другими иммуноглобулинами. Один или несколько различных моноклональных связывающих агентов могут быть преднамеренно добавлены в композицию для образования смеси.
Модификатор «моноклональный» не следует истолковывать как требующий получения связывающего агента каким-либо конкретным способом. Моноклональный связывающий агент может быть получен любым подходящим способом. Например, в определенных воплощениях моноклональное антитело получают способом гибридом (например, как описано Kohler et al., Nature, 256: 495 (1975)) или его разновидностью. В некоторых воплощениях моноклональный связывающий агент получают способом рекомбинантных ДНК. Например, моноклональный связывающий агент может быть получен путем скрининга рекомбинантной библиотеки с использованием подходящей системы экспрессии (например, системы экспрессии фагового дисплея). В некоторых воплощениях моноклональный связывающий агент выделяют из фаговой библиотеки связывающих агентов, например, с использованием методики, описанной в Clackson et al., Nature, 352: 624-628 (1991) и/или Marks et al., J. Mol Biol., 222: 581-597 (1991) или их разновидности.
В определенных воплощениях связывающий агент включает одну или несколько структурных или основных частей, иногда называемых каркасами. Связывающий агент может содержать каркас, неограничивающие примеры которого включают каркас, полученный из антитела, Z-домен протеина A, гамма-B кристаллина, убиквитина, цистатина, Sac7d, суперспирали с тройной спиралью, липокалина, мотива с анкириновым повтором, домена SH3 Fyn, домена Kunitz подходящего ингибитора протеазы, домена фибронектина, полимера нуклеиновой кислоты и т.п., их части или их комбинации. В некоторых воплощениях связывающий агент не включает каркас. В определенных воплощениях связывающий агент включает одну или несколько структурных частей антитела млекопитающего.
В некоторых воплощениях связывающий агент включает одну или несколько константных областей (например, константные области, полученные из антитела, например антитела млекопитающего). В некоторых воплощениях связывающий агент включает константную область легкой цепи антитела и/или константную область тяжелой цепи антитела. В антителе млекопитающего существуют, по меньшей мере, два типа легких цепей иммуноглобулина, которые называются лямбда (λ) и каппа (κ). Связывающий агент может содержать любую подходящую константную область антитела или одну или несколько его частей. В некоторых воплощениях связывающий агент включает константную область легкой цепи лямбда или ее часть. В некоторых воплощениях связывающий агент включает константную область легкой цепи каппа или ее часть. В некоторых воплощениях связывающий агент включает полипептид, который, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95% или, по меньшей мере, на 99% идентичен полипептидной последовательности константной области, или ее части, легкой цепи антитела млекопитающего. В некоторых воплощениях связывающий агент включает полипептид, который, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95% или, по меньшей мере, на 99% идентичен полипептидной последовательности константной области легкой цепи человеческого антитела. В некоторых воплощениях связывающий агент не включает константную область легкой цепи.
В некоторых воплощениях связывающий агент включает константную область тяжелой цепи антитела. У млекопитающих антитело может иметь, по меньшей мере, пять типов/классов тяжелых цепей Ig, обозначаемых как IgA, IgD, IgE, IgG и IgM, которые определяются наличием различных константных областей тяжелой цепи или их части (например, домены CH1, CL, CH2, CH3). Связывающий агент может включать любую подходящую константную область тяжелой цепи или ее часть. В некоторых воплощениях связывающий агент включает константную область тяжелой цепи IgG1, IgG2, IgG3 или IgG4 или одну или несколько их частей. В некоторых воплощениях связывающий агент включает одну или несколько константных областей тяжелой цепи изотипа IgM, IgD, IgA или IgE или их часть. В некоторых воплощениях связывающий агент включает полипептид, который, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 99% идентичен или на 100% идентичен полипептидной последовательности константной области или ее части тяжелой цепи антитела млекопитающего. В некоторых воплощениях связывающий агент включает полипептид, который, по меньшей мере, на 75%, по меньшей мере, на 80%, по меньшей мере, на 85%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 99% идентичен или на 100% идентичен полипептидной последовательности константной области тяжелой цепи человеческого антитела. В некоторых воплощениях связывающий агент включает одно или несколько добавлений, делеций и/или модификаций в константную область. Связывающий агент иногда модифицируют для изменения класса антител или изотипа связывающего агента. В некоторых воплощениях связывающий агент включает одно или несколько добавлений, делеций и/или модификаций (одну или несколько аминокислотных замен, делеций или добавлений) для модификации одной или нескольких функций связывающего агента, например, для отмены, усиления или уменьшения периода полужизни в сыворотке, связывания с Fc-рецептором, связывания с комплементом (например, связывания с C1q), гликозилирования, сиалилирования, клеточной токсичности, антитело-зависимого клеточного фагоцитоза (ADCP), антителозависимой клеточной цитотоксичности (ADCC) и т.п. В некоторых воплощениях связывающий агент не включает одну или несколько частей константной области тяжелой цепи или константной области легкой цепи. В некоторых воплощениях связывающий агент не включает константную область тяжелой цепи.
В некоторых воплощениях связывающий агент включает или состоит из одной или нескольких вариабельных областей антитела или его части. В некоторых воплощениях связывающий агент включает одну или несколько вариабельных областей легкой цепи или их часть. В некоторых воплощениях связывающий агент включает одну или несколько вариабельных областей тяжелой цепи или их часть. В некоторых воплощениях связывающий агент включает, по меньшей мере, одну вариабельную область легкой цепи и, по меньшей мере, одну вариабельную область тяжелой цепи. Вариабельная область легкой цепи и вариабельная область тяжелой цепи могут находиться на одном и том же или разных полипептидах. В определенных воплощениях антигенсвязывающая часть связывающего агента состоит из одной или нескольких вариабельных областей тяжелой цепи. В определенных воплощениях антигенсвязывающая часть связывающего агента состоит из одной или нескольких вариабельных областей легкой цепи. В определенных воплощениях антигенсвязывающая часть связывающего агента состоит из одной или нескольких вариабельных областей легкой цепи и одной или нескольких вариабельных областей тяжелой цепи.
В некоторых воплощениях связывающий агент включает или состоит из Fab, Fab', F(ab')2, фрагмента Fv, одноцепочечного Fv (scFv), диатела (Dab), синтела, т.п. и/или комбинации или части его. В некоторых воплощениях связывающий агент представляет собой Fab, Fab', F(ab')2, фрагмент Fv, одноцепочечный Fv (scFv), диатело (Dab), синтело, тому подобное и/или комбинацию, или их часть (см., например, патенты США № 6 099 842 и 5 990 296). В некоторых воплощениях связывающий агент включает одноцепочечный полипептид, содержащий одну или несколько антигенсвязывающих частей. Например, одноцепочечный связывающий агент может быть сконструирован путем соединения вариабельной области тяжелой цепи или ее антигенсвязывающей части с вариабельной областью легкой цепи или ее антигенсвязывающей части с линкером (например, аминокислотой, полипептидным линкером) с использованием рекомбинантных процессов используемых в молекулярной биологии. Такие одноцепочечные связывающие агенты часто проявляют специфичность и аффинность к антигену, сходному с исходным двухцепочечным моноклональным связывающим агентом. Связующие агенты часто включают сконструированные участки, такие как привитые CDR или гуманизированные участки. В некоторых воплощениях связывающий агент представляет собой интактный двухцепочечный иммуноглобулин, а в других воплощениях связывающий агент представляет собой Fab-мономер или Fab-димер.
Нуклеиновые кислоты или их части, которые кодируют полипептид связывающего агента, могут быть клонированы, субклонированы, перегруппированы или модифицированы для рекомбинантной экспрессии с помощью подходящей процедуры клонирования и впоследствии экспрессированы с использованием подходящей системы экспрессии способом, известным специалистам в данной области техники. (Например, см. Maniatis et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, 1982; Antibody Engineering: Methods and Protocols, Vol. 248 of Methods in molecular biology, edited by Benny K. C. Lo, Springer Science & Business Media, 2004; Antibody Engineering, Vol. 1, Roland E. Kontermann, Stefan Duebel, Edition 2, Publisher Springer Science & Business Media, 2010; Antibody Phage Display: Methods and Protocols, Biomed Protocols, Vol. 178 of Methods in molecular biology, Editors Philippa M. O’Brien, Robert Aitken, Springer Science & Business Media, 2004).
У млекопитающих вариабельная область тяжелой цепи и вариабельная область легкой цепи антитела каждая содержит три CDR (области, определяющие комплементарность), обычно называемые CDR1, CDR2 и CDR3, которые разделены и/или фланкированы каркасными областями (например, FR1, FR2, FR3 и FR4). Используемый в данном документе термин «CDR» относится к аминокислотной последовательности полипептида, идентифицированного как область, определяющая комплементарность. В некоторых воплощениях окончательное определение полипептидной последовательности CDR и идентификация остатков, включающих сайт связывания связывающего агента, достигается путем определения структуры связывающего агента и/или определения структуры комплекса связывающий агент-антиген. В определенных воплощениях это может быть выполнено любым подходящим способом, таким как рентгеновская кристаллография и/или компьютерное моделирование. В определенных воплощениях могут использоваться различные методы анализа для идентификации или приблизительного определения последовательностей CDR связывающего агента или антитела. Например, аминокислотная последовательность и/или расположение CDR в полипептидной последовательности связывающего агента, антитела, его связывающей части или его вариабельной области могут быть идентифицированы с использованием подходящего способа, неограничивающие примеры которого включают систему Kabat (например, см. Kabat, E. A., et al., 1991; Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication No. 91-3242, а также Johnson, G. and Wu, T. T. 2000, Nucleic Acids Research), и/или схему нумерации Chothia (e.g., Chothia & Lesk, (1987) J. Mol. Biol, 196:901-917; Chothia et al, Nature, (1989) 342:878-883; и Al-Lazikani et al., (1997) JMB 273,927-948). В некоторых воплощениях аминокислотная последовательность и/или местоположение CDR антитела могут быть идентифицированы с использованием способа AbM и/или контактного способа. Определение «AbM» использует интегрированный набор компьютерных программ, выпускаемых Oxford Molecular Group, которые моделируют структуру антител (см., например, Martin et al., Proc. Natl. Acad. Sci. (USA), 86:9268-9272 (1989); "AbMTM, A Computer Program for Modeling Variable Regions of Antibodies," Oxford, UK; Oxford Molecular, Ltd.). Определение AbM моделирует третичную структуру антитела из первичной последовательности, используя комбинацию баз данных знаний и способов ab initio, таких как описанные Samudrala et al., "Ab Initio Protein Structure Prediction Using a Combined Hierarchical Approach," in PROTEINS, Structure, Function and Genetics Suppl, 3:194-198 (1999). В некоторых воплощениях определение контакта основано на анализе доступных сложных кристаллических структур (см., например, MacCallum et al., J. Mol.Biol, 5:732-45 (1996)).
В некоторых воплощениях связывающий агент и/или антигенсвязывающая часть связывающего агента содержит, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 CDR. В некоторых воплощениях связывающий агент включает от 3 до 60 CDR (например, для связывающих агентов, имеющих несколько антигенсвязывающих участков). В некоторых воплощениях связывающий агент включает от 3 до 12 CDR. В некоторых воплощениях антигенсвязывающая часть связывающего агента включает от 1 до 6 полипептидных последовательностей CDR.
В некоторых воплощениях связывающий агент и/или антигенсвязывающая часть связывающего агента включает одну, две или три CDR вариабельной области легкой цепи. В некоторых воплощениях вариабельная область легкой цепи связывающего агента включает одну или несколько CDR (например, одну, две, три или более CDR). Аминокислотные последовательности, представляющие CDR в вариабельной области легкой цепи антитела или связывающего агента, обозначаются как CDR-L1, CDR-L2 и CDR-L3, которые пронумерованы последовательно (то есть L1, L2 и L3) в направление от аминоконца (N-конца) к карбоксиконцу (C-концу) вариабельной области легкой цепи. Например, в полипептиде, представляющем вариабельную область легкой цепи связывающего агента, CDR-L1, если она присутствует, является наиболее N-концевой CDR легкой цепи; CDR-L3, если она присутствует, является наиболее С-концевой CDR легкой цепи; и CDR-L2, если она присутствует, расположена (i) между CDR-L1 и CDR-L3, (ii) на N-концевой стороне CDR-L3 или (iii) на C-концевой стороне CDR-L1, вариабельной области легкой цепи или связывающей части связывающего агента. Термины «CDR-L1», «CDR-L2» и «CDR-L3» относятся, частично, к аминокислотной последовательности полипептида, идентифицированного или раскрытого в настоящем документе как область, определяющая комплементарность, связывающего агента (например, CDR вариабельной области легкой цепи). Неограничивающие примеры аминокислотных последовательностей CDR-L1, CDR-L2 и CDR-L3 представлены в таблицах 1-3, соответственно. Вариабельная область легкой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, может содержать любую комбинацию CDR-L1, CDR-L2 и CDR-L3, раскрытых в данном документе, где связывающий агент сохраняет специфическое связывание с cMET или его частью. В некоторых воплощениях вариабельная область легкой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, включает одну CDR легкой цепи, включающую аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-L3, выбранному из таблицы 3. В некоторых воплощениях вариабельная область легкой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, включающую аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-L3, выбранному из таблицы 3, и любой другой подходящей полипептидной последовательности CDR-L2 и/или CDR-L1, где связывающий агент сохраняет специфическое связывание с cMET или его частью. В некоторых воплощениях CDR легкой цепи вариабельной области легкой цепи или антигенсвязывающей части связывающего агента состоит из CDR-L3 и CDR-L2, где CDR-L3 включающую аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-L3, выбранную из таблицы 3, и CDR-L2 включающую аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-L2, выбранной из таблицы 2. В некоторых воплощениях вариабельная область легкой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, включающую аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-L3, выбранной из таблицы 3, и аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-L2, выбранной из таблицы 2 и любой другой подходящей полипептидной последовательности CDR-L1, где связывающий агент сохраняет специфическое связывание с cMET или его частью. В некоторых воплощениях вариабельная область легкой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, включает три CDR легкой цепи, состоящие из аминокислотной последовательности, по меньшей мере, на 70% идентичной CDR-L3, выбранной из таблицы 3, аминокислотной последовательности, по меньшей мере, на 70% идентичной CDR-L2, выбранной из таблицы 2, и аминокислотной последовательности, выбранной, по меньшей мере, на 70%, идентичной CDR-L1 из таблицы 1. В некоторых воплощениях вариабельная область легкой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, включает аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-L3, выбранной из таблицы 3, аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-L2, выбранной из таблицы 2, и аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-L1, выбранной из таблицы 1, где связывающий агент сохраняет специфическое связывание с cMET или его частью.
В некоторых воплощениях связывающий агент включает одну или несколько CDR легкой цепи, которые, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентичны любой из последовательностей CDR, перечисленных в таблицах 1, 2 или 3. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L1, которая, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентична любой из последовательностей, представленных в таблице 1. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L1 любой из последовательностей, представленных в таблице 1.
Последовательности CDR-L1
Таблица 1
Названия клонов, представленные в таблицах 1-10, указывают номер гибрида («F»), номер планшета («P») и номер лунки (от А1 до H12) 96-луночного планшета, из которого был получен клон. Соответственно, клон F6AP12F12 был получен, например, из гибрида 6A, планшета 12, лунки F12. Номера гибридов каждого клона соответствуют гибридам, указанным на фиг. 2.
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L2, которая, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентична любой из последовательностей, представленных в таблице 2. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L2 любой из последовательностей, представленных в таблице 2.
Последовательности CDR-L2
Таблица 2
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L3, которая, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентична любой из последовательностей, представленных в таблице 3. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L3 любой из последовательностей, представленных в таблице 3.
Последовательности CDR-L3
Таблица 3
F6B1_P3_E9_L /F6B_P2_D4_L /F6B1_P1_E2_L/
F6B РЗ E2 L
где X1 представляет собой H, Q или G;
X2 представляет собой W, S или Y; X 3 является S
или Y; X4 представляет собой S или T; и
X5 представляет собой P или L.
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает вариабельную область легкой цепи, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91% 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентичную аминокислотной последовательности из таблицы 4. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента содержат последовательность вариабельной области легкой цепи из таблицы 4.
Вариабельные последовательности легкой цепи
Таблица 4
F6B1_P3_E9_L
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает вариабельную область гуманизированной легкой цепи, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91 %, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентичную последовательности из таблицы 5. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает последовательность вариабельной области гуманизированной легкой цепи из таблицы 5.
Гуманизированные легкие цепи P3D12
Таблица 5
В некоторых воплощениях связывающий агент и/или антигенсвязывающая часть связывающего агента включает одну, две или три CDR вариабельной области тяжелой цепи. В некоторых воплощениях вариабельная область тяжелой цепи включает одну или несколько CDR (например, одну, две, три или более CDR). Аминокислотные последовательности, представляющие CDR в вариабельной области тяжелой цепи антитела или связывающего агента, обозначаются как CDR-H1, CDR-H2 и CDR-H3, которые нумеруются последовательно (то есть H1, H2 и H3) в направление от аминоконца (N-конца) к карбоксиконцу (C-концу) вариабельной области тяжелой цепи. Например, в полипептиде, представляющем вариабельную область тяжелой цепи связывающего агента, CDR-H1, в случае наличия, является наиболее N-концевой CDR; CDR-H3, в случае наличия, является наиболее С-концевой CDR; и CDR-H2, в случае наличия, расположена (i) между CDR-H1 и CDR-H3, (ii) на N-концевой стороне CDR-H3 или (iii) на C-концевой стороне CDR-H, вариабельной области тяжелой цепи. Термины «CDR-H1», «CDR-H2» и «CDR-H3» относятся, частично, к аминокислотной последовательности полипептида, идентифицированного или раскрытого в настоящем документе как область, определяющая комплементарность связывающего агента (например, CDR вариабельной области тяжелой цепи связывающего агента). Неограничивающие примеры аминокислотных последовательностей CDR-H1, CDR-H2 и CDR-H3 представлены в таблицах 6-8, соответственно. Вариабельная область тяжелой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, может содержать любую комбинацию CDR-H1, CDR-H2 и CDR-H3, раскрытых в данном документе, при которой связывающий агент сохраняет специфическое связывание с cMET или частью его. В некоторых воплощениях вариабельная область тяжелой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, включает одну CDR тяжелой цепи, состоящую из аминокислотной последовательности, по меньшей мере, на 70% идентичной CDR-H3, выбранной из таблицы 8. В определенных воплощениях вариабельная область тяжелой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, включает аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-H3, выбранной из таблицы 8, и любую другую подходящую полипептидную последовательность CDR-H2 и/или CDR-H1, при которых связывающий агент сохраняет специфическое связывание с cMET или его частью. В некоторых воплощениях CDR тяжелой цепи вариабельной области тяжелой цепи или антигенсвязывающей части связывающего агента состоит из CDR-H3 и CDR-H2, где CDR-H3 включающую аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-H3, выбранную из таблицы 8, и включает аминокислотную последовательность CDR-H2, по меньшей мере, на 70% идентичную CDR-H2, выбранной из таблицы 7. В некоторых воплощениях вариабельная область тяжелой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, включает аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-H3, выбранной из таблицы 8, и аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-H2, выбранной из таблицы 7, и любую другую подходящую полипептидную последовательность CDR-H1, при которых связывающий агент сохраняет специфическое связывание с cMET или его частью. В некоторых воплощениях вариабельная область тяжелой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, включает три CDR тяжелой цепи, состоящие из аминокислотной последовательности, по меньшей мере, на 70% идентичной CDR-H3, выбранной из таблицы 8, аминокислотной последовательности, по меньшей мере, на 70% идентичной CDR-H2, выбранной из таблицы 7, и аминокислотной последовательности, по меньшей мере, на 70% идентичной а CDR-H1, выбранной из таблицы 6. В некоторых воплощениях вариабельная область тяжелой цепи или антигенсвязывающая часть связывающего агента, описанного в настоящем документе, включает аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-H3, выбранной из таблицы 8, аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-H2, выбранной из таблицы 7, и аминокислотную последовательность, по меньшей мере, на 70% идентичную CDR-H1, выбранной из таблицы 6, при которых связывающий агент сохраняет специфическое связывание с cMET или его частью.
В некоторых воплощениях связывающий агент включает одну или несколько CDR тяжелых цепей, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94 %, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентичную с любой из CDR Таблиц 6, 7 или 8. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-H1, которая, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентична любой из последовательностей, представленных в таблице 6. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-H1 любой из последовательностей, представленных в таблице 6.
Последовательности CDR-H1
Таблица 6
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-H2, которая, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентична любой из последовательностей, представленных в таблице 7. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-H2 любой из последовательностей, представленных в таблице 7.
Последовательности CDR-H2
Таблица 7
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-H3, которая, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентична любой из последовательностей, представленных в таблице 8. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-H3 любой из последовательностей, представленных в таблице 8.
Последовательности CDR-H3
Таблица 8
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает вариабельную область тяжелой цепи, имеющую, по меньшей мере, 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентичную последовательности из таблицы 9. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента содержат последовательность вариабельной области тяжелой цепи, приведенную в таблице 9.
Последовательности вариабельной области тяжелой цепи
Таблица 9
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает вариабельную область гуманизированной тяжелой цепи, по меньшей мере, на 70%, 75%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или, по меньшей мере, 99% идентичную последовательности из таблицы 10. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает последовательность вариабельной области гуманизированной тяжелой цепи из таблицы 10.
Гуманизированные тяжелые цепи P3D12
Таблица 10
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 75%, по меньшей мере, 85%, по меньшей мере, 86%, по меньшей мере, 87 %, по меньшей мере, 88%, по меньшей мере, 89%, по меньшей мере, 90%, по меньшей мере, 91%, по меньшей мере, 92%, по меньшей мере, 93%, по меньшей мере, 94%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97 %, по меньшей мере, 98%, по меньшей мере, на 99% или 100% идентичную любой из аминокислотных последовательностей SEQ ID NO: 26-36 (например, последовательности CDR-L3, выбранной из таблицы 3) и CDR-H3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 75%, по меньшей мере, 85%, по меньшей мере, 86%, по меньшей мере, 87%, по меньшей мере, 88%, по меньшей мере, 89%, по меньшей мере, 90%, по меньшей мере, 91%, по меньшей мере, 92%, по меньшей мере, 93%, по меньшей мере, 94%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100% идентичную любой из аминокислотных последовательностей SEQ ID NO 79-93 (например, последовательность CDR-H3, выбранную из таблицы 8). В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 98%, по меньшей мере, на 99 % или 100% идентичную аминокислотной последовательности SEQ ID NO: 34 или 35, и CDR-H3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 90%, по меньшей мере, 95%, по меньшей мере, 98%, по меньшей мере, 99% или 100% идентичную аминокислотной последовательности SEQ ID NO: 87, 88, 92 или 93.
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или 100%, идентичную любой из аминокислотных последовательностей SEQ ID NO 26-36 (например, последовательность CDR-L3, выбранную из таблицы 3), CDR-L2, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или на 100% идентичную любой из аминокислотных последовательностей SEQ ID NO: 16-25 (например, последовательность CDR-L2, выбранную из таблицы 2), CDR-H3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или на 100%, идентичную любой из аминокислотных последовательностей SEQ ID NO: 79-93 (например, последовательность CDR-H3, выбранную из таблицы 8) и CDR-H2, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или на 100% идентичную любой из аминокислотных последовательностей SEQ ID NO: 62-78 (например, последовательность CDR-H2, выбранную из таблицы 7). В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или 100%, идентичную аминокислотной последовательности SEQ ID NO: 34 или 35, CDR-L2, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 90% или 100%, идентичную аминокислотной последовательности SEQ ID NO: 24 или 25, CDR-H3, включающую аминокислоту последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или 100%, идентичную аминокислотной последовательности SEQ ID NO: 87, 88, 92 или 93 и CDR-H2, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 90 % или 100% идентичную аминокислотной последовательности SEQ ID NO: 70, 71 или 78.
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или 100%, идентичную любой из аминокислотных последовательностей SEQ ID NO 26-36 (например, последовательность CDR-L3, выбранная из таблицы 3), CDR-L2, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или на 100% идентична любой из аминокислот последовательности SEQ ID NO: 16-25 (например, последовательность CDR-L2, выбранная из таблицы 2), CDR-L1, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или на 100%, идентичную любой из аминокислотных последовательностей SEQ ID NO: 1-15 (например, последовательность CDR-L1, выбранная из таблицы 1), CDR-H3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или на 100% идентичную любой из аминокислотных последовательностей SEQ ID NO: 79-93 (например, последовательность CDR-H3, выбранную из таблицы 8), CDR-H2, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 90% или 100%, идентичную любой из аминокислотных последовательностей SEQ ID NO: 62-78 (например, последовательность CDR-H2, выбранную из таблицы 7) и CDR-H1, включающую аминокислотную последовательность, по меньшей мере, на 70% по меньшей мере, 90% или 100%, идентичную любой из аминокислотных последовательностей SEQ ID NO: 50-61 (например, последовательность CDR-H1, выбранную из таблицы 6). В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 90% или 100%, идентичную аминокислотной последовательности SEQ ID NO: 34 или 35, CDR-L2, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 90% или 100%, идентичную аминокислотной последовательности SEQ ID NO: 24 или 25, CDR-L1, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 90% или 100% идентичную аминокислотной последовательности SEQ ID NO: 9, 10 или 15, CDR-H3, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 90%, или 100% идентичную аминокислотной последовательности SEQ ID NO: 87 или 88, CDR-H2 включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 90% или 100%, идентичную аминокислотной последовательности SEQ ID NO: 70, 71 или 78, и CDR-H1, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, 90% или 100%, идентичную аминокислотной последовательности SEQ ID NO: 58 или 59.
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает вариабельную область тяжелой цепи, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 85%, по меньшей мере, на 86%, по меньшей мере, на 87%, по меньшей мере, на 88%, по меньшей мере, на 89%, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или 100% идентичную любой из аминокислотных последовательностей SEQ ID NO: 94–108 (например, вариабельной области тяжелой цепи, выбранной из таблиц 9 и 10) и вариабельную область легкой цепи, включающую аминокислотную последовательность, по меньшей мере, на 70%, по меньшей мере, на 75%, по меньшей мере, на 85%, по меньшей мере, на 86%, по меньшей мере, на 87%, по меньшей мере, на 88%, по меньшей мере, на 89%, по меньшей мере, на 90%, по меньшей мере, на 91%, по меньшей мере, на 92%, по меньшей мере, на 93%, по меньшей мере, на 94%, по меньшей мере, на 95%, по меньшей мере, на 96%, по меньшей мере, на 97%, по меньшей мере, на 98%, по меньшей мере, на 99% или 100% идентичную любой из аминокислотных последовательностей SEQ ID NO: 37-49 (например, вариабельную область легкой цепи, выбранную из таблиц 4 и 5). В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает вариабельную область тяжелой цепи, включающую аминокислотную последовательность, по меньшей мере, на 90% идентичную любой из аминокислотных последовательностей SEQ ID NO: 104-110 (например, вариабельную область тяжелой цепи, выбранную из таблицы 10), и вариабельную область легкой цепи, включающую аминокислотную последовательность, по меньшей мере, на 90% идентичную любой из аминокислотных последовательностей SEQ ID NO: 45-49 (например, вариабельную область легкой цепи, выбранную из таблицы 5).
Аббревиатуры «abb», «sdr», «fra», «ven» и «cdr», используемые в данном документе, поясняются ниже. Аббревиатура «cdr» или «CDR» относится к области, определяющей комплементарность. Аббревиатура «abb» относится к сокращенной CDR согласно Padlan et al. (1995) "Identification of specificity-determining residues in antibodies" FASEB J 9:133-139. В некоторых воплощениях сокращенные CDR определены как остатки 27D-34, 50-55 и 89-96 в легкой цепи и 31-35B, 50-58 и 95-101 в тяжелой цепи, которые привиты на соответствующий человеческий каркас. Критические остатки каркаса часто сохраняются. Аббревиатура «sdr» относится к «остаткам, определяющим специфичность» согласно Padlan et al. (1995), которые считаются остатками, участвующими в связывании антигена. Аббревиатура «fra» относится к «подходу Франкенштейна», основанному на предложении Wu and Kabat (1992) "Possible use of similar framework region amino acid sequences between human and mouse immunoglobulins for humanizing mouse antibodies" Mol Immunol 29:1141-1146. Аббревиатура «ven» относится к «венированию» согласно Padlan (1991), "A possible procedure for reducing the immunogenicity of antibody variable domains while preserving their ligand-binding properties" Mol Immunol 28:489-498.
Термин «идентичный процент» или «процент идентичности» относится к идентичности последовательности между двумя аминокислотными последовательностями. Идентичность может быть определена путем сравнения положения в каждой последовательности, которая может быть выровнена для целей сравнения. Когда эквивалентный сайт в сравниваемых последовательностях занят одной и той же аминокислотой, то молекулы в этом положении идентичны. Когда эквивалентный сайт занят тем же или сходным аминокислотным остатком (например, сходным по стерическому и/или электронному характеру), то молекулы могут упоминаться как гомологичные (сходные) в этом положении. Выражение в процентах от гомологии, сходства или идентичности относится к функции количества идентичных или сходных аминокислот в положениях, общих для сравниваемых последовательностей. Выражение в процентах от гомологии, сходства или идентичности относится к функции количества идентичных или сходных аминокислот в положениях, общих для сравниваемых последовательностей. Могут использоваться различные алгоритмы и/или программы выравнивания, включая FASTA, BLAST или ENTREZ. FASTA и BLAST, доступные как часть пакета анализа последовательности GCG (Университет Висконсина, Мэдисон, Висконсин) и могут использоваться, например, с настройками по умолчанию. ENTREZ доступен через Национальный центр биотехнологической информации, Национальную медицинскую библиотеку, Национальные институты здравоохранения, Бетесда, Мэриленд. В одном воплощении процентная идентичность двух последовательностей может быть определена программой GCG с штрафом за открытие гэпа 1, например, каждый аминокислотный гэп оценивается так, как если бы это было одно аминокислотное или нуклеотидное несоответствие между двумя последовательностями.
Другие методы выравнивания описаны в Methods in Enzymology, vol. 266: Computer Methods for Macromolecular Sequence Analysis (1996), ed. Doolittle, Academic Press, Inc., a division of Harcourt Brace & Co., San Diego, Calif., USA. В некоторых воплощениях программа выравнивания, которая допускает пропуски в последовательности, используется для выравнивания последовательностей. Smith-Waterman представляет собой один из типов алгоритмов, допускающих гэпы в выравнивании последовательностей. См. Meth. Mol. Biol. 70:173-187 (1997). Кроме того, для выравнивания последовательностей может использоваться программа GAP, использующая способ выравнивания по Needleman и Wunsch. Альтернативная стратегия поиска использует программное обеспечение MPSRCH, которое работает на компьютере MASPAR. Для оценки последовательностей MPSRCH использует алгоритм Smith-Waterman на компьютере с массовым параллелизмом. Этот подход улучшает способность находить отдаленно связанные совпадения и особенно терпим к небольшим гэпам и ошибкам нуклеотидных последовательностей. Аминокислотные последовательности, кодируемые нуклеиновой кислотой, можно использовать для поиска в базах данных как белков, так и ДНК.
В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает один или несколько CDR, выбранных из вариабельной области легкой цепи в таблицах 4 и 5. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает один или несколько CDR, выбранных из вариабельной области тяжелой цепи в таблицах 9 и 10. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает один или несколько CDR, выбранных из вариабельной области легкой цепи в таблицах 4 и 5, и один или несколько CDR, выбранных из вариабельной области тяжелой цепи в таблицах 9 и 10. В некоторых воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает CDR-L1, CDR-L2 и CDR-L3, каждая из которых выбрана из любой одной из вариабельных областей легкой цепи в таблицах 4 и 5, и CDR-H1, CDR-H2 и CDR-H3, каждая из которых выбрана из любой одной из вариабельных областей тяжелой цепи в таблицах 9 и 10. Аминокислотная последовательность CDR (например, CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) может быть идентифицирована в вариабельной области тяжелой цепи или легкой цепи, раскрытой в данном документе, любым подходящим способом, описанным в данном документе или известным специалистам в данной области.
В некоторых воплощениях связывающий агент включает одну или несколько подходящих последовательностей, выбранных из таблиц 1-10, где выбранная полипептидная последовательность включает от 0 до 5, от 1 до 5, от 0 до 10, от 1 до 10, от 0 до 15 или от 1 до 15 аминокислотных модификаций, где аминокислотная модификация может быть добавлением аминокислоты, делецией аминокислоты и/или заменой аминокислоты. В некоторых воплощениях связывающий агент, раскрытый в данном документе, включает один или несколько аналогов аминокислот, ненативных аминокислот или производных аминокислот.
В определенных воплощениях связывающий агент или антигенсвязывающая часть связывающего агента включает одну или несколько каркасных областей (FR). Каркасные области часто расположены между CDR и/или фланкируют последовательности CDR вариабельной области тяжелой или легкой цепи антитела или связывающего агента. У млекопитающих вариабельная область тяжелой цепи часто включает четыре каркасных области, и вариабельная область легкой цепи часто включает четыре каркасных области. Любой подходящий способ может быть использован для идентификации одной или нескольких каркасных областей в антителе, в вариабельной области антитела или в связывающем агенте. Связывающий агент может содержать синтетические или встречающиеся в природе каркасные области, которые не модифицированы или модифицированы (например, оптимизированы), как обсуждается ниже.
В некоторых воплощениях связывающий агент или его антигенсвязывающая часть является химерной, привитой и/или гуманизированной. Химерные, привитые и/или гуманизированные связывающие агенты часто содержат модифицированные или замещенные константные области и/или каркасные области, сохраняя при этом специфичность связывания с cMET или его частью. В некоторых воплощениях связывающий агент или его антигенсвязывающая часть включает константные области, каркасные области или их части, полученные из человеческого антитела. В некоторых воплощениях связывающий агент или его антигенсвязывающая часть включает полностью синтетические части, одну или несколько аминокислот или последовательности аминокислот, которые не обнаруживаются в молекулах нативного антитела.
Встречающиеся в природе каркасные области или их части могут быть получены из любых подходящих видов. В некоторых воплощениях области, определяющие комплементарность (CDR), вариабельных областей легкой и тяжелой цепи связывающего агента или его антигенсвязывающей части прививают в каркасные области того же или другого вида. Например, одна или несколько каркасных областей связывающего агента могут быть получены из вида грызунов (например, мыши или крысы) или вида приматов (например, человека).
В некоторых воплощениях CDR вариабельных областей легкой и/или тяжелой цепи связывающего агента или его антигенсвязывающей части могут быть привиты к консенсусным каркасным областям человека. Для создания консенсусных каркасных областей человека в некоторых воплощениях каркасные области из нескольких аминокислотных последовательностей тяжелой или легкой цепи человека могут быть выровнены для идентификации консенсусной последовательности. В некоторых воплощениях каркасные области тяжелой цепи или легкой цепи антитела или связывающего агента заменены одной или несколькими каркасными областями или их частями из другой вариабельной области тяжелой цепи или легкой цепи. В некоторых воплощениях связывающий агент или его антигенсвязывающая часть включает одну или несколько каркасных областей человека. В некоторых воплощениях связывающий агент или его антигенсвязывающая часть включает, по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 каркасных областей человека. В некоторых воплощениях связывающий агент или его антигенсвязывающая часть включает одну или несколько каркасных областей мыши. В некоторых воплощениях связывающий агент или его антигенсвязывающая часть включает, по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 каркасных областей мыши. В некоторых воплощениях связывающий агент или его антигенсвязывающая часть включает одну или несколько каркасных областей человека и одну или несколько каркасных областей мыши.
Известны способы получения химерных, гуманизированных и/или оптимизированных антител или связывающих агентов, например, путем модификации, замены или удаления каркасных областей или их частей. Неограничивающие примеры прививки CDR описаны, например, в патентах США № 6180370, 6054297, 5693762, 5859205, 5693761, 5565332, 5585089 и 5530101, а также в Jones et al, Nature, 321: 522- 525 (1986); Verhoeyen et al., Science, 239: 1534-1536 (1988) и Winter, FEBS Letts., 430: 92-94 (1998). Дополнительные неограничивающие примеры получения химерных, привитых и/или гуманизированных связывающих агентов включают пат. США № 5530101; пат. США № 5,707,622; пат. США № 5,994,524; пат. США № 6,245,894; Queen et al., (1988) PNAS 86:10029-10033; Riechmann et al., Nature (1988) 332:323-327; Antibody Engineering: Methods and Protocols, Vol. 248 of Methods in molecular biology, edited by Benny K. C. Lo, Springer Science & Business Media, (2004); and Antibody Engineering, Vol. 1, Roland E. Kontermann, Stefan Duebel, Edition 2, Publisher Springer Science & Business Media, (2010). В некоторых воплощениях связывающий агент может быть гуманизирован путем замены одной или нескольких каркасных областей или их частей (например, одной или нескольких аминокислот) на одну или несколько каркасных областей или их частей из человеческого антитела. В некоторых воплощениях антитело или связывающий агент могут быть гуманизированы или привиты путем переноса одной или нескольких CDR (например, 1, 2, 3, 4, 5 или всех 6 CDR) из донорного связывающего агента (например, моноклонального антитела мыши) на акцепторный связывающий агент (например, человеческое антитело) при сохранении специфичности связывания донорного связывающего агента. В некоторых воплощениях способ получения химерного, привитого или гуманизированного связывающего агента включает выполнение одной или нескольких аминокислотных замен, добавлений или делеций в константной области или каркасной области связывающего агента. В некоторых воплощениях такие технологии, как «изменение формы», «гиперхимеризация» или «венирование/изменение поверхности», могут использоваться для получения гуманизированных связывающих агентов (например, см. Vaswami et al., Annals of Allergy, Asthma, & Immunol. 81: 105 (1998); Roguska et al. Prot. Engin., 9: 895-904 (1996); и Патент США № 6072035). В некоторых аспектах связывающий агент модифицируют способом, описанным выше, или другим подходящим способом, для того чтобы снизить иммуногенность (например, см. Gilliland et al., J. Immunol., 62 (6): 3663-71 (1999)).
В некоторых воплощениях аминокислотная последовательность связывающего агента модифицируется для оптимизации аффинности связывания с мишенью (например, cMET), видовой перекрестной реактивности, растворимости и/или функции (например, активности агониста или ее отсутствия). В некоторых воплощениях конкретная комбинация CDR, раскрытых в данном документе, может быть оптимизирована для связывания с cMET и/или для оптимизации функции или характеристики связывающего агента, раскрытого в данном документе. Например, описанная в данном документе охарактеризованная вариабельная область легкой цепи (например, вариабельная область легкой цепи SEQ ID NO: 48) может быть коэкспрессирована с использованием подходящей системы экспрессии с библиотекой вариабельных областей тяжелой цепи, содержащей CDR-H1 и CDR-H2 охарактеризованной вариабельной области тяжелой цепи (например, вариабельной области тяжелой цепи SEQ ID NO: 107), где CDR-H3 заменен библиотекой последовательностей CDR-H3, которая может включать, например, одну или несколько областей CDR-H3 из таблицы 8. Полученные в результате связывающие агенты легкой цепи/тяжелой цепи могут быть подвергнуты скринингу на связывание с cMET и/или определенной функции. Оптимизированные связывающие агенты могут быть идентифицированы, а аминокислотная последовательность CDR-H3 может быть идентифицирована подходящим способом. Вышеуказанный способ скрининга может быть использован для идентификации связывающих агентов, содержащих конкретные комбинации CDR или специфических оптимизированных последовательностей CDR (например, последовательностей CDR, содержащих аминокислотные замены, добавления или делеции), которые обеспечивают связывающему агенту улучшенную специфичность связывания, аффинность связывания и/или функцию. Такие способы скрининга и оптимизации связывающих агентов известны (например, см. Portolano et al., (1993) Journal of Immunology 150: 880-887; и Clarkson et al., (1991) Nature 352: 624-628). Эти источники описывают способы получения антител, которые связывают специфический антиген с использованием известных вариабельных областей легких цепей, известных вариабельных областей тяжелых цепей или их частей (например, их CDR) путем скрининга библиотеки комплементарных вариабельных областей.
В некоторых воплощениях связывающий агент модифицируют для удаления или добавления сайтов гликозилирования для оптимизации аффинности и/или функции связывающего агента (например, см. Co et al., Mol. Immunol, 30:1361-1367 (1993)). В некоторых воплощениях количество и/или тип сайтов гликозилирования в связывающем агенте модифицируется или изменяется. Сайт N-связанного гликозилирования часто характеризуется последовательностью Asn-X-Ser или Asn-X-Thr, где аминокислотный остаток, обозначенный как X, может быть любым аминокислотным остатком, кроме пролина. Замена аминокислотных остатков для создания этой последовательности обеспечивает потенциальный новый сайт для добавления N-связанной углеводной цепи. Альтернативно, замены, которые устраняют эту последовательность, будут удалять существующую N-связанную углеводную цепь. В некоторых воплощениях также обеспечивается перегруппировка N-связанных углеводных цепей, при которой один или несколько сайтов N-гликозилирования (обычно тех, которые встречаются в природе) удаляются и создаются один или несколько новых сайтов N-гликозилирования. В некоторых воплощениях связывающий агент модифицируют удалением одного или нескольких остатков цистеина или заменой одного или нескольких остатков цистеина на другую аминокислоту (например, серин) по сравнению с немодифицированным связывающим агентом. В некоторых воплощениях варианты цистеина могут быть полезны для оптимизации экспрессии, секреции и/или растворимости.
В некоторых воплощениях связывающий агент модифицируют так, чтобы он включал определенные аминокислотные добавления, замены или делеции, спроектированные или предназначенные, например, для уменьшения восприимчивости связывающего агента к протеолизу, уменьшения восприимчивости связывающего агента к окислению, увеличения периода полужизни в сыворотке и/или придания или изменения других физико-химических, фармакокинетических или функциональных свойств связывающего агента.
В некоторых воплощениях связывающий агент специфически связывается с cMET млекопитающего или с его частью. В некоторых воплощениях связывающий агент специфически связывается с внеклеточным доменом или внеклеточными областями cMET млекопитающего или их частью. В определенных аспектах связывающий агент специфически связывается с cMET дикого типа, продуцируемым клеткой неизмененного (не модифицированного генетически) млекопитающего, обнаруженного в природе. В определенных аспектах связывающий агент специфически связывается с встречающимся в природе вариантом cMET. В определенных аспектах связывающий агент специфически связывается с cMET, включающим одну или несколько аминокислотных замен, добавлений или делеций. В некоторых воплощениях связывающий агент специфически связывается с cMET, продуцируемым и/или экспрессируемым на поверхности клетки человека, примата, не являющегося человеком, собаки, кошки или грызуна (например, мыши или крысы). В некоторых воплощениях связывающий агент специфически связывается с одним или несколькими полипептидами cMET или их частью, имеющими аминокислотную последовательность любого из SEQ ID NO: 109-113. В определенных воплощениях связывающий агент специфически связывается с cMET человека. В определенных воплощениях связывающий агент специфически связывается с внеклеточным доменом cMET человека. В некоторых воплощениях связывающий агент специфически связывается с cMET человека и/или его внеклеточным доменом, где cMET человека включает замену E168-D168 (то есть вариант cMET E168D). В некоторых воплощениях связывающий агент специфически связывается с человеческим cMET и/или его внеклеточным доменом, где человеческий cMET включает замену N375-S375 (то есть вариант N375S человеческого cMET).
Термин «специфически связывает» относится к связывающему агенту, который связывает пептид-мишень предпочтительнее связывания других молекул или других пептидов, как определено, например, как определено подходящим анализом in vitro (например, ELISA, иммуноблоттинг, проточная цитометрия, и т.п.). Взаимодействие специфического связывания различает взаимодействия неспецифического связывания около в 2 раза или более, часто около в 10 или более раз, а иногда около в 100 раз или более, в 1000 раз или более, в 10000 раз или более, в 100 000 раз или более, или 1 000 000 раз или более.
В некоторых воплощениях связывающий агент, который специфически связывается с cMET или его частью, представляет собой связывающий агент, который связывает cMET или его часть (например, внеклеточный домен cMET), с константой аффинности связывания (KD), равной или менее 100 нМ, равной или менее 50 нМ, равной или менее 25 нМ, равной или менее 10 нМ, равной или менее 5 нМ, равной или менее 1 нМ, равной или менее 900 пМ, равной или менее 800 пМ, равной или менее 750 пМ, равной или менее 700 пМ, равной или менее 600 пМ, равной или менее 500 пМ, равной или менее 400 пМ равной или менее 300 пМ, равной или менее 200 пМ или равной или менее 100 пМ. В некоторых воплощениях связывающий агент, который специфически связывается с cMET или его частью, представляет собой связывающий агент, который связывает человеческий cMET или его часть (например, внеклеточный домен человеческого cMET) с константой аффинности связывания (KD), равной или менее 100 нМ, равной или менее 50 нМ, равной или менее 25 нМ, равной или менее 10 нМ, равной или менее 5 нМ, равной или менее 1 нМ, равной или менее 900 пМ, равной или менее 800 пМ, равной или менее 750 пМ, равной или менее 700 пМ, равной или менее 600 пМ, равной или менее 500 пМ, равной или менее 400 пМ, равной или менее 300 пМ, равной или менее 200 пМ, или равной или менее 100 пМ. В некоторых воплощениях связывающий агент, который специфически связывается с cMET или его частью, представляет собой связывающий агент, который специфически связывается с cMET или его частью, полученной из не являющегося человеком вида (например, примата, не являющегося человеком, или грызуна, например, мыши или крысы), с аффинностью связывания константа (KD), равной или менее 100 нМ, равной или менее 50 нМ, равной или менее 25 нМ, равной или менее 10 нМ, равной или менее 5 нМ, равной или менее 1 нМ, равной или менее 900 пМ, равной или менее 800 пМ, равной или менее 750 пМ, равной или менее 700 пМ, равной или менее 600 пМ, равной или менее 500 пМ, равной или менее 400 пМ, равной или менее 300 пМ, равной или менее 200 пМ или равной или менее 100 пМ. В определенных воплощениях раскрываемый в данном документе связывающий агент специфически связывается с cMET человека или его частью и, в частности, связывается с cMET или его частью, полученных из примата, не являющегося человеком. В определенных воплощениях раскрываемый в данном документе связывающий агент специфически связывается с cMET человека или его частью и, в частности, связывается с cMET или его частью, полученной из грызуна (например, мыши или крысы). В некоторых воплощениях связывающий агент (i) специфически связывается с cMET человека или его частью (например, внеклеточным доменом cMET человека) с KD 10 нМ или менее или 1 нМ или менее, и (ii) специфически связывается cMET крысы или мыши или его частью (например, внеклеточного домена cMET крысы или мыши) с KD 100 нМ или менее, 90 нМ или менее, 80 нМ или менее, 70 нМ или менее, 60 нМ или менее 50 нМ или менее, 40 нМ или менее, 30 нМ или менее, 20 нМ или менее или 10 нМ или менее.
В некоторых воплощениях связывающий агент включает метку. Используемый в данном документе термин «метка» или «меченый» относится к включению детектируемого маркера, например, путем включения меченой аминокислоты или присоединения к полипептиду биотиновых фрагментов, которые могут быть обнаружены с помощью меченого авидина (например, с помощью содержащего стрептавидин флуоресцентного маркера или ферментативной активности, которая может быть обнаружена оптическими или колориметрическими методами). В некоторых воплощениях метка или маркер могут быть присоединены к связывающему агенту для создания терапевтического или диагностического агента. Связывающий агент может быть присоединен ковалентно или нековалентно к любой подходящей метке или маркеру. Специалистам в данной области известны различные способы мечения полипептидов и гликопротеинов, которые можно использовать. Неограничивающие примеры меток для полипептидов включают, без ограничения указанным, следующие: радиоизотопы или радионуклиды (например, 3H, 14C, 15N, 35S, 90Y, 99Tc, 125I, 131I), флуоресцентные метки, ферментные метки (например, пероксидазу хрена, β-галактозидазу, люциферазу, щелочную фосфатазу), хемилюминесцентные метки, металлическую метку, хромофор, электрохемилюминесцентную метку, фосфоресцентную метку, гаситель (например, гаситель флуорофора) пару флуоресцентного резонансного переноса энергии (FRET) (например, донор и акцептор), краситель, субстрат фермента, малую молекулу, массовую метку, квантовые точки, наночастицы, биотинильные группы, заранее определенные полипептидные эпитопы, распознаваемые вторичным репортером (например, последовательности пар лейциновой застежки, сайты связывания для вторичных антител, домены, связывающие металлы, эпитопные метки) и т.п. или их комбинации.
В некоторых воплощениях связывающий агент включает подходящий носитель. Связывающий агент может быть присоединен ковалентно или нековалентно к подходящему носителю. Неограничивающие примеры носителя включают агенты или молекулы, которые изменяют или увеличивают период полувыведения in vivo связывающего агента, полиэтиленгликоля, гликогена (например, путем гликозилирования связывающего агента), декстрана, носителя или несущей среды, которые описаны в пат. США № 6660843, и т.п. или их комбинации.
В некоторых воплощениях связывающий агент включает подходящий терапевтический агент. Связывающий агент может быть присоединен ковалентно или нековалентно к любому подходящему терапевтическому агенту. Неограничивающие примеры терапевтического агента включают лекарство, токсин, радиоизотоп, лиганд, рецептор, цитокин, антитело, противоопухолевый агент, ингибитор (например, антагонист рецептора, ингибитор фермента), цитокин или агент, раскрытый в пат. США № 6660843, который включен в данный документ ссылкой, и т.п. или их комбинации. Неограничивающие примеры противоопухолевых агентов включают ауристатин (например, монометилауристатин E (MMAE), монометилауристатин F (MMAF) и т.п.), доластатин, майтансин, тубулизин, иринотекан или их производное или метаболит (например, SN38), калихеамицин, пирролобензодиазепин (PBD), дуокармицин, доксорубицин, псевдомонадный экзотоксин A (например, PE38), их производные, и т.п. или их комбинации. Соответственно, в определенных воплощениях связывающий агент, раскрытый в настоящем документе, включает противоопухолевый агент.
В некоторых воплощениях метка, терапевтический агент или носитель связаны со связывающим агентом с использованием подходящего линкера. Неограничивающие примеры подходящего линкера включают силаны, тиолы, фосфоновую кислоту, полиэтиленгликоль (ПЭГ), аминокислоты и пептиды, их полимеры, их производные и т.п., и их комбинации. Способы присоединения двух или более молекул с использованием линкера известны специалистам в данной области и иногда упоминаются как «перекрестное сшивание».
В некоторых воплощениях метка, терапевтический агент, носитель или линкер присоединены к подходящей тиольной группе связывающего агента (например, тиольной группе остатка цистеина). Любой подходящий аминокислотный остаток константной области или каркасной области связывающего агента может быть заменен аминокислотным остатком, содержащим тиольную группу (например, цистеин), с целью присоединения метки, терапевтического агента, носителя или линкера. Неограничивающие примеры аминокислот, которые могут быть замещены содержащим тиол аминокислотным остатком, включают A118, S119, S239, V282, T289, N361 и V422 IgG2, S115, S252, V289, T306 и N384 IgG1. или соответствующие положения в IgG1, IgG2, IgG3 или IgG4. Другие неограничивающие примеры присоединения метки, терапевтического агента, носителя и/или линкера к связывающему агенту включают взаимодействие амина с эфиром N-гидроксисукцинимида (NHS), имидоэфиром, эфиром пентафторфенила (PFP), гидроксиметилфосфином, оксиран или любое другое карбонильное соединение; взаимодействие карбоксила с карбодиимидом; взаимодействие сульфгидрила с малеимидом, галоацетилом, пиридилдисульфидом и/или винилсульфоном; взаимодействие альдегида с гидразином; взаимодействие любой неселективной группы с диазирином и/или арилазидом; взаимодействие гидроксила с изоцианатом; взаимодействие гидроксиламина с карбонильным соединением; и т.п., и их комбинации.
В определенных воплощениях связывающий агент имеет одну или несколько функциональных характеристик. Соответственно, связывающий агент может быть описан структурно и функционально (например, тем, что он делает, или тем, что он способен делать). Связывающие агенты, раскрытые в данном документе, могут специфически связываться с внеклеточной частью сМЕТ, например, с внеклеточной частью сМЕТ, присутствующей на поверхности клетки. В некоторых воплощениях клетка представляет собой злокачественную опухолевую клетку человека или опухолевую клетку человека, которая экспрессирует cMET. В определенных воплощениях при связывании cMET на поверхности клетки определенные связывающие агенты, раскрытые в данном документе, индуцируют интернализацию cMET. В некоторых воплощениях связывающий агент специфически связывается с cMET или его частью и вызывает деградацию cMET на клетке (например, на злокачественной опухолевой клетке). Интернализация и/или деградация рецепторов, связанных с клеточной поверхностью, вызванная связыванием лиганда или связывающего агента, является известным биологическим процессом. Способность связывающего агента индуцировать интернализацию и/или деградацию cMET легко наблюдается без проведения ненужных экспериментов с использованием подходящего экспериментального анализа. Соответственно, в некоторых воплощениях связывающий агент специфически связывается с cMET или его частью на поверхности клетки и вызывает интернализацию и/или деградацию cMET.
В некоторых воплощениях связывающий агент специфически связывается с cMET или его частью и индуцирует или стимулирует передачу сигналов (например, тирозинкиназную активность). В некоторых воплощениях связывающий агент специфически связывается с cMET на поверхности клетки и не обнаруживает или не стимулирует передачу сигналов (например, активность тирозинкиназы). Соответственно, в определенных воплощениях анти-cMET-связывающий агент, раскрытый в данном документе, не обладает детектируемой активностью агониста cMET. В некоторых воплощениях анти-cMET-связывающий агент не обладает агонистической активностью при связывании с cMET на клеточной поверхности и/или не способен индуцировать или стимулировать детектируемую тирозинкиназную активность при связывании с cMET на клеточной поверхности. В некоторых воплощениях анти-cMET-связывающий агент представляет собой антагонист cMET. В некоторых воплощениях анти-cMET-связывающий агент уменьшает, ингибирует, редуцирует, блокирует или предотвращает передачу сигналов через рецептор cMET и/или уменьшает, ингибирует, редуцирует, блокирует или препятствует тому, чтобы рецептор cMET индуцировал или стимулировал детектируемую тирозинкиназную активность. В некоторых воплощениях анти-cMET-связывающий агент, раскрытый в настоящем документе, уменьшает, ингибирует, редуцирует, предотвращает или блокирует cMET от связывания с его нативным родственным лигандом (например, фактором роста гепатоцитов или его изоформой).
В определенных воплощениях контакт клетки объекта со связывающим агентом, раскрытым в данном документе, вызывает или способствует гибели клетки. В определенных воплощениях контакт клетки объекта со связывающим агентом, раскрытым в данном документе, вызывает или способствует гибели клеток посредством апоптоза или некроза клетки, экспрессирующей cMET. В определенных воплощениях контакт клетки объекта со связывающим агентом, раскрытым в данном документе, вызывает или способствует гибели клетки посредством процесса ADCC, ADCP или комплемент-зависимой клеточной цитотоксичности (CDCC).
В определенных воплощениях контакт клетки объекта со связывающим агентом, раскрытым в данном описании, уменьшает, ингибирует или уменьшает митоз клетки. В определенных воплощениях контакт клетки объекта со связывающим агентом, раскрытым в данном документе, уменьшает, ингибирует или уменьшает метастазирование клетки.
В некоторых воплощениях в настоящем документе представлена композиция или фармацевтическая композиция, содержащая один или несколько связывающих агентов, которые специфически связываются с cMET или его частью (например, внеклеточным доменом cMET или его частью).
Фармацевтическая композиция может быть составлена для подходящего пути введения. В некоторых воплощениях фармацевтическая композиция составлена для подкожного (s.c.), внутрикожного, внутримышечного, внутрибрюшинного и/или внутривенного (i.v.) введения. В определенных воплощениях фармацевтическая композиция может содержать материалы рецептуры для изменения, поддержания или сохранения, например, pH, осмолярности, вязкости, прозрачности, цвета, изотоничности, запаха, стерильности, стабильности, скорости растворения или высвобождения, адсорбции или проникновения композиции. В определенных воплощениях подходящие материалы состава включают, без ограничения указанным, аминокислоты (такие как глицин, глутамин, аспарагин, аргинин или лизин); противомикробные агенты; антиоксиданты (такие как аскорбиновая кислота, сульфит натрия или гидросульфит натрия); буферы (такие как борат, бикарбонат, трис-HCl, цитраты, фосфаты (например, фосфатно-солевой буферный раствор) или подходящие органические кислоты); наполнители (такие как маннит или глицин); хелатирующие агенты (такие как этилендиаминтетрауксусная кислота (EDTA)); комплексообразующие агенты (такие как кофеин, поливинилпирролидон, бета-циклодекстрин или гидроксипропил-бета-циклодекстрин); белки (такие как сывороточный альбумин, желатин или иммуноглобулины); красители, ароматизаторы и разбавители; эмульгаторы; гидрофильные полимеры (такие как поливинилпирролидон); низкомолекулярные полипептиды; солеобразующие противоионы (такие как натрий); растворители (такие как глицерин, пропиленгликоль или полиэтиленгликоль); разбавители; вспомогательные вещества и/или фармацевтические адъюванты (Remington's Pharmaceutical Sciences, 18th Ed., AR Gennaro, ed., Mack Publishing Company (1995)).
В некоторых воплощениях фармацевтическая композиция включает подходящий эксципиент, неограничивающий пример которого включает антиадгезивы (например, стеарат магния), связующее вещество, наполнители, моносахариды, дисахариды, другие углеводы (например, глюкозу, маннозу или декстрины), сахарные спирты (например, маннит или сорбит), покрытия (например, целлюлоза, гидроксипропилметилцеллюлоза (HPMC), микрокристаллическая целлюлоза, синтетические полимеры, шеллак, желатин, зеин из кукурузного белка, энтеросолюбильные или другие полисахариды), крахмал (например, картофель, кукуруза или пшеничный крахмал), диоксид кремния, красители, агенты для улучшения распадаемости, ароматизаторы, смазывающие вещества, консерванты, сорбенты, подсластители, наполнители, суспендирующие агенты, поверхностно-активные вещества и/или смачивающие агенты (такие как плюроники, ПЭГ, сложные эфиры сорбита, полисорбаты, такие как полисорбат 20, полисорбат 80, тритон, трометамин, лецитин, холестерин, тилоксапал), агенты, улучшающие стабильность (такие как сахароза или сорбит), и агенты, повышающие тонус (такие как галогениды щелочных металлов, хлорид натрия или калия, маннит, сорбит) и/или любой эксципиент, раскрытый в Remington's Pharmaceutical Sciences, 18th Ed., AR Gennaro, ed., Mack Publishing Company (1995). Используемый в данном документе термин «связующее» относится к соединению или ингредиенту, которые помогают объединять фармацевтическую смесь. Подходящие связующие вещества для приготовления фармацевтических композиций и часто используемые при приготовлении фармацевтических таблеток, капсул и гранул известны специалистам в данной области. Для пояснения термин «связывающий агент», используемый в данном документе, не относится к «связующему», которое используется в определенных фармацевтических составах. Хотя в некоторых воплощениях фармацевтическая композиция может содержать связывающий агент, который специфически связывается с cMET, а также связующее.
В некоторых воплощениях фармацевтическая композиция включает подходящую фармацевтически приемлемую добавку и/или носитель. Неограничивающие примеры подходящих добавок включают подходящий регулятор pH, успокаивающий агент, буфер, серосодержащий восстановитель, антиоксидант и тому подобное. Неограничивающие примеры серосодержащего восстановителя включают те, которые имеют сульфгидрильную группу, такую как N-ацетилцистеин, N-ацетилгомоцистеин, тиоктовая кислота, тиодигликоль, тиоэтаноламин, тиоглицерин, тиосорбит, тиогликолевая кислота и их соли, тиосульфат натрия, глутатион, и C1-C7 тиоалкановая кислота. Неограничивающие примеры антиоксиданта включают эриторбиновую кислоту, дибутилгидрокситолуол, бутилгидроксианизол, альфа-токоферол, токоферол ацетат, L-аскорбиновую кислоту и ее соль, L-аскорбилпальмитат, L-аскорбилстеарат, натрий бисульфит, сульфит натрия, галит, триамат пропилгаллат, а также хелатообразующие агенты, такие как динатрий этилендиаминтетраацетат (EDTA), пирофосфат натрия и метафосфат натрия. Кроме того, разбавители, добавки и наполнители могут включать другие обычно используемые ингредиенты, например, неорганические соли, такие как хлорид натрия, хлорид калия, хлорид кальция, фосфат натрия, фосфат калия и бикарбонат натрия, а также органические соли, такие как цитрат натрия, цитрат калия и ацетат натрия.
Используемые в данном документе фармацевтические композиции могут быть стабильными в течение продолжительного периода времени, например, порядка месяцев или лет. В некоторых воплощениях фармацевтическая композиция включает один или несколько подходящих консервантов. Неограничивающие примеры консервантов включают хлорид бензалкония, бензойную кислоту, салициловую кислоту, тимеросал, фенетиловый спирт, метилпарабен, пропилпарабен, хлоргексидин, сорбиновую кислоту, перекись водорода и т.п. и/или их комбинации. Консервант может содержать четвертичное аммониевое соединение, такое как хлорид бензалкония, хлорид бензоксония, хлорид бензетония, цетримид, хлорид сепазония, хлорид цетилпиридиния или бромид домифена (BRADOSOL®). Консервант может содержать алкил-ртутную соль тиосалициловой кислоты, такую как тимеросал, фенилртутный нитрат, фенилртутный ацетат или фенилртутный борат. Консервант может содержать парабен, такой как метилпарабен или пропилпарабен. Консервант может содержать спирт, такой как хлорбутанол, бензиловый спирт или фенилэтиловый спирт. Консервант может содержать производное бигуанида, такое как хлоргексидин или полигексаметилен бигуанид. Консервант может включать перборат натрия, имидазолидинил мочевину и/или сорбиновую кислоту. Консервант может содержать стабилизированные оксихлорокомплексы, такие как известные и коммерчески доступные под торговым названием PURITE®. Консервант может содержать полигликоль-полиаминовые конденсационные смолы, такие как известные и коммерчески доступные под торговым наименованием POLYQUART® от Henkel KGaA. Консервант может включать стабилизированную перекись водорода. Консервантом может быть хлорид бензалкония. В некоторых воплощениях фармацевтическая композиция не включает консервантов.
В некоторых воплощениях композиция, фармацевтическая композиция или связывающий агент по существу не содержат крови или загрязняющих веществ в продукте крови (например, клетки крови, тромбоциты, полипептиды, минеральные вещества, соединения или химические вещества, переносимые с кровью, и т.п.). В некоторых воплощениях композиция, фармацевтическая композиция или связывающий агент по существу не содержат сыворотку и сывороточные контаминирующие вещества (например, сывороточные белки, сывороточные липиды, сывороточные углеводы, сывороточные антигены и тому подобное). В некоторых воплощениях композиция, фармацевтическая композиция или связывающий агент по существу не содержат патоген (например, вирус, паразит или бактерии). В некоторых воплощениях композиция, фармацевтическая композиция или связывающий агент по существу не содержат эндотоксина. В некоторых воплощениях композиция, фармацевтическая композиция или связывающий агент являются стерильными. В определенных воплощениях композиция или фармацевтическая композиция включает связывающий агент, который специфически связывает внеклеточный домен cMET и разбавитель (например, забуференный фосфатом физиологический раствор). В некоторых воплощениях композиция или фармацевтическая композиция включает связывающий агент, который специфически связывает внеклеточный домен cMET, и наполнитель (например, дегидрат цитрата натрия или моноолеат полиоксиэтилен-сорбитана-20 (полисорбат 80)).
Фармацевтические композиции, описанные в настоящем документе, могут быть предназначены для введения объекту в любой подходящей форме и/или количестве в соответствии с терапией, в которой они применяются. Например, фармацевтическая композиция, предназначенная для парентерального введения (например, путем инъекции или инфузии), может принимать форму суспензии, раствора или эмульсии в масляном или водном носителе и она может содержать составные агенты, наполнители, добавки и/или разбавители, такие как водные или неводные растворители, сорастворители, суспендирующие растворы, консерванты, стабилизирующие агенты и/или диспергирующие агенты. В некоторых воплощениях фармацевтическая композиция, подходящая для родительского введения, может включать один или несколько наполнителей. В некоторых воплощениях фармацевтическая композиция лиофилизирована в форме сухого порошка. В некоторых воплощениях фармацевтическую композицию лиофилизуют до формы сухого порошка, которая подходит для восстановления подходящим фармацевтическим растворителем (например, водой, физиологическим раствором, изотоническим буферным раствором (например, PBS) и т.п.). В некоторых воплощениях восстановленные формы лиофилизированной фармацевтической композиции являются подходящими для парентерального введения (например, внутривенного введения) млекопитающему.
В некоторых воплощениях фармацевтические композиции, описанные в настоящем документе, могут быть предназначены для местного введения и могут включать один или несколько связующих и/или смазывающих агентов, полимерных гликолей, желатинов, масла какао или других подходящих восков или жиров. В некоторых воплощениях фармацевтическая композиция, описанная в данном документе, включена в состав для местного применения, содержащий носитель для местного применения, который обычно подходит для местного введения лекарственного средства, и содержащий любой подходящий материал, известный специалистам в данной области. В определенных воплощениях состав для местного применения фармацевтической композиции составлен для введения связывающего агента из топического пластыря.
В определенных воплощениях специалист в данной области определит оптимальную фармацевтическую композицию в зависимости, например, от предполагаемого пути введения, формата доставки и искомой дозировки (см., например, Remington's Pharmaceutical Sciences, выше). В определенных воплощениях такие композиции могут влиять на физическое состояние, стабильность, скорость высвобождения in vivo и скорость выведения in vivo антител по изобретению.
В некоторых воплощениях композицию, фармацевтическую композицию или связывающий агент, описанные в данном документе, используют для лечения объекта, имеющего или предположительно имеющего неопластическое расстройство или онкологическое заболевание. В определенных воплощениях связывающий агент или фармацевтическая композиция, описанная в настоящем документе, используется для лечения неопластического расстройства или онкологического заболевания у объекта, где связывающий агент специфически связывается с внеклеточным доменом cMET человека. В некоторых воплощениях, представленный в настоящем документе, представляет собой способ лечения объекта, имеющего или подозреваемого на наличие неопластического расстройства или онкологического заболевания. В некоторых воплощениях способ лечения объекта, имеющего или подозреваемого на наличие неопластического расстройства или онкологического заболевания, включает введение объекту терапевтически эффективного количества композиции, фармацевтической композиции или связывающего агента, описанных в настоящем документе. В определенных воплощениях способ лечения включает контакт клетки (например, одной или нескольких клеток) объекта с терапевтически эффективным количеством композиции, фармацевтической композиции или связывающего агента, описанных в данном документе. В некоторых воплощениях способ лечения включает контакт клетки (например, одной или нескольких клеток) объекта с терапевтически эффективным количеством связывающего агента, который специфически связывается с внеклеточной частью человеческого cMET или его вариантом. Клетка объекта часто представляет собой клетку, которая экспрессирует внеклеточную часть cMET. Клетка объекта может быть найдена внутри объекта (например, in vivo) или вне объекта (например, in vitro или ex vivo).
Композиция, фармацевтическая композиция или связывающий агент, раскрытые в данном документе, могут быть использованы для лечения подходящего неопластического поражения или онкологического заболевания, включающего тип клетки, который экспрессирует cMET. Неограничивающие примеры неопластического расстройства или онкологического заболевания, которые можно лечить с помощью способа, описанного в данном документе, включают карциному легкого, карциному молочной железы, карциному яичника, карциному почки, карциному толстой кишки, карциному желудка, карциному щитовидной железы, карциному поджелудочной железы, нейробластому или плоскоклеточную карциному головы и шеи, рак шейки матки, гепатоцеллюлярный рак, саркомы, мезотелиому, глиобластому, множественную миелому, меланому, карциному предстательной железы и пищевода. В некоторых воплощениях неопластическая клетка злокачественного новообразования или неопластического поражения может быть быстро проанализирована на экспрессию cMET с использованием подходящего анти-cMET-связывающего агента или нового связывающего агента, описанного в настоящем документе, с использованием подходящего способа (например, ELISA на цельных клетках, FACS, любого подходящего иммуноанализа и т.п.).
Может быть использован любой подходящий способ введения объекту композиции, фармацевтической композиции или связывающего агента. Точный состав и способ введения композиции для применения в соответствии со способами по изобретению, описанными в данном документе, могут быть выбраны врачом с учетом состояния пациента. См., например, Fingl et al. 1975, в "The Pharmacological Basis of Therapeutics," Ch. 1, p. 1; который включен в данный документ ссылкой во всей своей полноте. Любой подходящий путь введения может быть использован для введения фармацевтической композиции или связывающего агента, описанного в данном документе. Неограничивающие примеры путей введения включают топическое или местное (например, трансдермально или накожно, (например, на коже или эпидермисе), внутри или на глаз, интраназально, через слизистую оболочку, в ухе, внутри уха (например, позади барабанной перепонки)), энтерально (например, доставкой через желудочно-кишечный тракт, например, перорально (например, в виде таблетки, капсулы, гранулы, жидкости, эмульгирующего средства, пастилки или их комбинации), сублингвально, через желудочный зонд, ректально, и т.п.), путем парентерального введения (например, парентерально, например, внутривенной, внутриартериальной, внутримышечной, внутрибрюшинной, внутрикожной, подкожной, внутриполостной, внутричерепной, внутрисуставной, в суставную щель, внутрисердечной (в сердце), внутрикавернозной инъекцией, интралезионально (в поражение кожи), внутрикостной инфузией (в костный мозг), интратекально (в спинномозговой канал), внутриматочно, интравагинально, интравезикулярной инфузией, интравитреально) и т.п., или их комбинацию.
В некоторых воплощениях композиция в данном документе предоставляется объекту. Композиция, которая предоставляется объекту, иногда предоставляется объекту для самостоятельного введения или для введения объекту другим (например, немедицинским специалистом). Например, композиция, описанная в данном документе, может быть предоставлена в виде инструкции, написанной практикующим врачом, которая разрешает пациенту получить композицию или лечение, описанные в данном документе (например, рецепт). В другом примере композиция может быть предоставлена объекту, где объект самостоятельно вводит композицию, например, перорально, внутривенно или с помощью ингалятора.
Альтернативно, можно вводить композиции для применения в соответствии со способами изобретения локальным, а не системным способом, например, путем непосредственного нанесения на кожу, слизистую оболочку или область, представляющую интерес для лечения, включая использование депо или композиции с замедленным высвобождением.
В некоторых воплощениях фармацевтическую композицию, содержащую связывающий агент, можно вводить отдельно (например, в виде одного активного ингредиента (AI или, например, в качестве одного активного фармацевтического ингредиента (API)). В других воплощениях фармацевтическую композицию, содержащую связывающий агент, можно вводить в сочетании с одним или несколькими дополнительными AI/API, например, в виде двух отдельных композиций или в виде одной композиции, где один или несколько дополнительных AI/API смешивают или формулируют вместе со связывающим агентом в фармацевтической композиции.
Фармацевтическая композиция может быть изготовлена любым подходящим способом, включая, например, обычные процессы смешивания, растворения, гранулирования, изготовления драже, левитации, эмульгирования, капсулирования, захвата или таблетирования.
В некоторых воплощениях фармацевтическую композицию, содержащую связывающий агент, вводят с подходящей частотой или интервалом, необходимым для достижения эффективного терапевтического результата. Эффективный терапевтический результат может быть определен путем мониторинга количества, жизнеспособности, роста, митоза или метастазирования опухолевых или злокачественных опухолевых клеток у объекта, пораженного неопластическим расстройством или онкологическим заболеванием. Соответственно, в определенных воплощениях уменьшение количества, жизнеспособности, роста, митоза или метастазирования опухолевых или злокачественных опухолевых клеток у объекта считается эффективным терапевтическим результатом. В некоторых воплощениях фармацевтическую композицию, содержащую связывающий агент, можно вводить ежечасно, один раз в день, два раза в день, три раза в день, четыре раза в день, пять раз в день и/или с регулярными интервалами, например, каждые день, через день, три раза в неделю, еженедельно, каждую вторую неделю, один раз в месяц и/или просто с частотой или интервалом, как это необходимо или рекомендовано медицинским работником.
В некоторых воплощениях количество связывающего агента в композиции представляет собой количество, необходимое для получения эффективного терапевтического результата. В определенных воплощениях количество связывающего агента в композиции (например, фармацевтической композиции) представляет собой количество, достаточное для предотвращения, лечения, снижения тяжести, задержки начала и/или облегчения симптома неопластического расстройства или онкологического заболевания, как предполагается в данном документе.
«Терапевтически эффективное количество» означает количество, достаточное для получения эффективного терапевтического результата, и/или количество, необходимое для предотвращения, лечения, снижения тяжести, задержки начала и/или облегчения симптома неопластического расстройства или онкологического заболевания. В некоторых воплощениях «терапевтически эффективное количество» означает количество, достаточное для прекращения роста и/или замедления роста неоплазии или злокачественного новообразования. В некоторых воплощениях «терапевтически эффективное количество» означает количество, достаточное для ингибирования репликации и/или индукции гибели одной или нескольких неопластических клеток. Определение терапевтически эффективного количества находится в пределах компетенции специалистов в данной области, особенно в свете подробного описания, представленного в данном документе.
В некоторых воплощениях количество связывающего агента в композиции представляет собой количество, которое представляет собой, по меньшей мере, терапевтически эффективное количество и количество, достаточно низкое, чтобы минимизировать нежелательные побочные реакции. Точное количество связывающего агента или требуемых комбинаций активных агентов будет варьировать от объекта к объекту в зависимости от возраста, массы и общего состояния объекта, тяжести состояния, подлежащего лечению, и конкретной комбинации вводимых лекарственных средств. Таким образом, не всегда возможно указать точное терапевтически эффективное количество для лечения неопластического расстройства у разнообразной группы объектов. Как хорошо известно, конкретная доза для конкретного пациента в определенных условиях и для конкретного заболевания будет обычно варьировать, но определение оптимального количества в каждом случае может быть легко осуществлено с помощью простых рутинных процедур. Таким образом, терапевтически эффективное количество связывающего агента, используемого для лечения опухолевого расстройства, может быть определено специалистом в данной области с использованием рутинных экспериментов.
В некоторых воплощениях количество связывающего агента в композиции вводят в подходящем терапевтически эффективном количестве или дозе (например, в подходящем объеме и концентрации, которые иногда зависят, частично, от конкретного пути введения). В некоторых воплощениях связывающий агент (например, связывающий агент в композиции) можно вводить в дозе от около 0,01 мг/кг (например, на кг массы тела объекта) до 500 мг/кг, от 0,1 мг/кг до 500 мг/кг, от 0,1 мг/кг до 400 мг/кг, от 0,1 мг/кг до 300 мг/кг, от 0,1 мг/кг до 200 мг/кг, от 0,1 мг/кг до 150 мг/кг, от 0,1 мг/кг до 100 мг/кг, от 0,1 мг/кг до 75 мг/кг, от 0,1 мг/кг до 50 мг/кг, от 0,1 мг/кг до 25 мг/кг, от 0,1 мг/кг до 10 мг/кг, от 0,1 мг/кг до 5 мг/кг или от 0,1 мг/кг до 1 мг/кг. В некоторых аспектах количество связывающего агента может составлять около 10 мг/кг, 9 мг/кг, 8 мг/кг, 7 мг/кг, 6 мг/кг, 5 мг/кг, 4 мг/кг, 3 мг/кг, 2 мг/кг, 1 мг/кг, 0,9 мг/кг, 0,8 мг/кг, 0,7 мг/кг, 0,6 мг/кг, 0,5 мг/кг, 0,4 мг/кг, 0,3 мг/кг, 0,2 мг/кг или 0,1 мг/кг. В некоторых воплощениях терапевтически эффективное количество связывающего агента составляет от около 0,1 мг/кг до 500 мг/кг или от около 1 мг/кг до около 300 мг/кг. Объемы, подходящие для внутривенного введения, хорошо известны.
В некоторых воплощениях связывающий агент используется для обнаружения cMET in vitro или in vivo. В некоторых воплощениях связывающий агент используется для обнаружения cMET на поверхности клетки и/или для определения наличия или отсутствия опухолевой клетки (например, злокачественной клетки), где клетка экспрессирует cMET. В некоторых воплощениях связывающий агент используется для определения, наличия у объекта неопластического расстройства или онкологического заболевания. В некоторых воплощениях способ обнаружения cMET включает определение наличия или отсутствия cMET на клетке в образце (например, образце, полученном прямо или косвенно из объекта).
Любой подходящий способ может использоваться для обнаружения и/или количественного определения наличия, отсутствия и/или количества связывающего агента, конкретно связанного с cMET, или его частью, неограничивающие примеры таких способов можно найти в Immunology, Werner Luttmann; Academic Press, 2006 и/или Medical Detection and Quantification of Antibodies to Biopharmaceuticals: Practical and Applied Considerations, Michael G. Tovey; John Wiley & Sons, July 12, 2011. Дополнительные неограничивающие примеры способов, которые можно использовать для обнаружения и/или количественного определения наличия, отсутствия и/или количества связывающего агента, специфически связанного с cMET или его частью, включают применение конкурентного иммуноанализа, неконкурентного иммуноанализа, вестерн-блоттинга, радиоиммуноанализа, ELISA (твердофазного иммуноферментного анализа), конкурентного или сэндвич-ELISA, сэндвич-иммуноанализа, иммунопреципитационного анализа, иммунорадиометрического анализа, флуоресцентого иммуноанализа, иммуноанализа с протеином A, реакции преципитации, реакции диффузной преципитации в геле, иммунодиффузионого анализа, анализа агглютинации, анализа фиксации комплемента, иммуногистохимического анализа, вестерн-блоттинга, иммуногистологического анализа, иммуноцитохимического анализа, дот-блот-анализа, флуоресцентого поляризационого анализа, сцинтилляционного анализа сближения, гомогенной флуоресценции с временным разрешением, анализа IAsys, анализа BIAcore и т.п. или их комбинации.
Фармацевтическая композиция, содержащая количество или дозу связывающего агента, может, при желании, быть предоставлена в наборе, упаковке или дозирующем устройстве, которое может содержать одну или несколько доз связывающего агента. Упаковка может, например, содержать металлическую или пластиковую фольгу, такую как блистерная упаковка. Упаковка или дозирующее устройство могут сопровождаться инструкциями по применению. Упаковка или дозатор могут также сопровождаться уведомлением, связанным с контейнером, в форме, предписанной государственным органом, регулирующим производство, использование или продажу фармацевтических препаратов, причем это уведомление отражает одобрение агентством формы препарата для введения людям или животным. Например, таким уведомлением может быть маркировка, одобренная Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для отпускаемых по рецепту лекарств, или утвержденный листок-вкладыш.
В некоторых воплощениях набор или упаковка включают количество связывающего агента, достаточное для лечения пациента в течение от 1 дня до 1 года, от 1 дня до 180 дней, от 1 дня до 120 дней, от 1 дня до 90 дней, от 1 дня до 60 дней, от 1 дня до 30 дней или любой день или количество дней в этих интервалах, 1-4 часов, 1-12 часов или 1-24 часов.
Набор необязательно включает этикетку продукта или листки-вкладыши, включающие описание компонентов или инструкции по применению компонентов в нем in vitro, in vivo или ex vivo. Примерные инструкции включают инструкции для диагностического способа, протокола лечения или терапевтического режима. В определенных воплощениях набор включает упаковочный материал, который относится к компонентам физической структуры набора. Упаковочный материал может содержать компоненты в стерильном состоянии и может быть изготовлен из материала, обычно используемого для таких целей (например, бумаги, гофрированного волокна, стекла, пластика, фольги, ампул, флаконов, пробирок и т.д.). Этикетки или вкладыши в продукт включают «печатные материалы», например, бумагу или картон, или отдельные или прикрепленные к компоненту, комплекту или упаковочному материалу (например, коробке), или прикрепленные к ампуле, пробирке или флакону, содержащему компонент набора. Этикетки или вкладыши могут дополнительно включать машиночитаемую среду, оптический диск, такой как CD- или DVD-ROM/RAM, DVD, MP3, магнитную ленту, или электрический носитель данных, такой как RAM и ROM, или их гибриды, такие как магнитный/оптический носители, флэш-носители или карты памяти. Этикетки продукта или вкладыши могут включать идентификационную информацию об одном или нескольких компонентах в нем, дозах, клинической фармакологии активного ингредиента(ов), включая механизм действия, фармакокинетику (PK) и фармакодинамику (PD). Этикетки или вкладыши продукта могут включать информацию, идентифицирующую информацию производителя, номера партий, местоположение производителя, дату, информацию об указанном состоянии, расстройстве, заболевании или симптоме, для которого может использоваться компонент набора. Этикетки или вкладыши продукта могут включать инструкции для врача или объекта по применению одного или нескольких компонентов набора в способе, протоколе лечения или схеме лечения. Инструкции могут включать дозировки, продолжительности и частоты, а также инструкции для практического осуществления любого из способов, протоколов лечения или терапевтических режимов, указанных в настоящем документе. Поэтому наборы по изобретению могут дополнительно включать этикетки или инструкции для практического применения любого из способов и применений изобретения, описанных в данном документе. Этикетки или вкладыши могут содержать информацию о потенциальных побочных эффектах и/или предупреждениях.
В определенных воплощениях набор включает один или несколько контролей, имеющих известное количество cMET. В некоторых воплощениях набор включает клетки, экспрессирующие cMET. Клетки в наборе могут поддерживаться в соответствующих условиях хранения до тех пор, пока клетки не будут готовы к применению.
В некоторых воплощениях набор представляет собой диагностический набор, содержащий связывающий агент. Связывающий агент, входящий в диагностический набор, может принимать любую подходящую форму. В некоторых воплощениях диагностической набор включает связывающий агент и детектируемую метку. В определенных воплощениях, например, диагностический набор включает или состоит из тест-полоски, включающей необходимые реагенты для выполнения способа по изобретению и для получения, например, колориметрического результата, который можно сравнить с цветовой диаграммой или стандартной кривой. Диагностический набор также может содержать компоненты, необходимые для обнаружения связывающего агента, который специфически связывается с cMET, например, вторичного антитела.
Пример 1
Получение антител
Чтобы вызвать ответ анти-cMET антител, мышей иммунизировали пептидом cMET-Fc или cMET, как описано на фиг. 1 и 2. В некоторых воплощениях для иммунизации был выбран пептид, полученный из стратегических областей. Фиг. 3 иллюстрирует пример структурной петли на MET, которая вдохновила на конструирование пептида 3. Были получены селезенки от иммунизированных мышей и спленоциты были слиты с подходящим партнером по слиянию для получения гибридом с использованием стандартного протокола. Гибридомные клоны выделяли и гибридомную среду тестировали на связывание с МЕТ и/или на способность индуцировать интернализацию cMET на линиях злокачественных опухолевых клеток человека, что измеряли проточной цитометрией (фиг. 4). Отобранные гибридомные антитела были отобраны по их способности вызывать деградацию МЕТ (фиг. 5) или неспособность индуцировать фосфорилирование ERK (фиг. 6).
Были проведены дополнительные анализы для отбора идеальных кандидатов анти-cMET антител. Например, анти-cMET антитела тестировали на перекрестную реактивность видов путем определения способности антитела связываться с cMET человека, cMET обезьяны (например, Macaca flavicularis, то есть яванский макак), cMET крысы и cMET мыши, измеренной с помощью ELISA. (фиг. 7 и таблица 1). Период полувыведения in vivo и другие фармакокинетические характеристики также были оценены (данные не показаны). Эффективность и специфичность конъюгатов антитело-лекарственное средство (ADC) также определяли на клеточных линиях с высокой, средней и отрицательной экспрессией cMET с использованием анти-cMET антител, которые были конъюгированы с MMAF) (фиг. 9 и 15, таблицы 11 и 12). ADC тестировали на эффективность in vivo с использованием модели ксенотрансплантата MKN45.
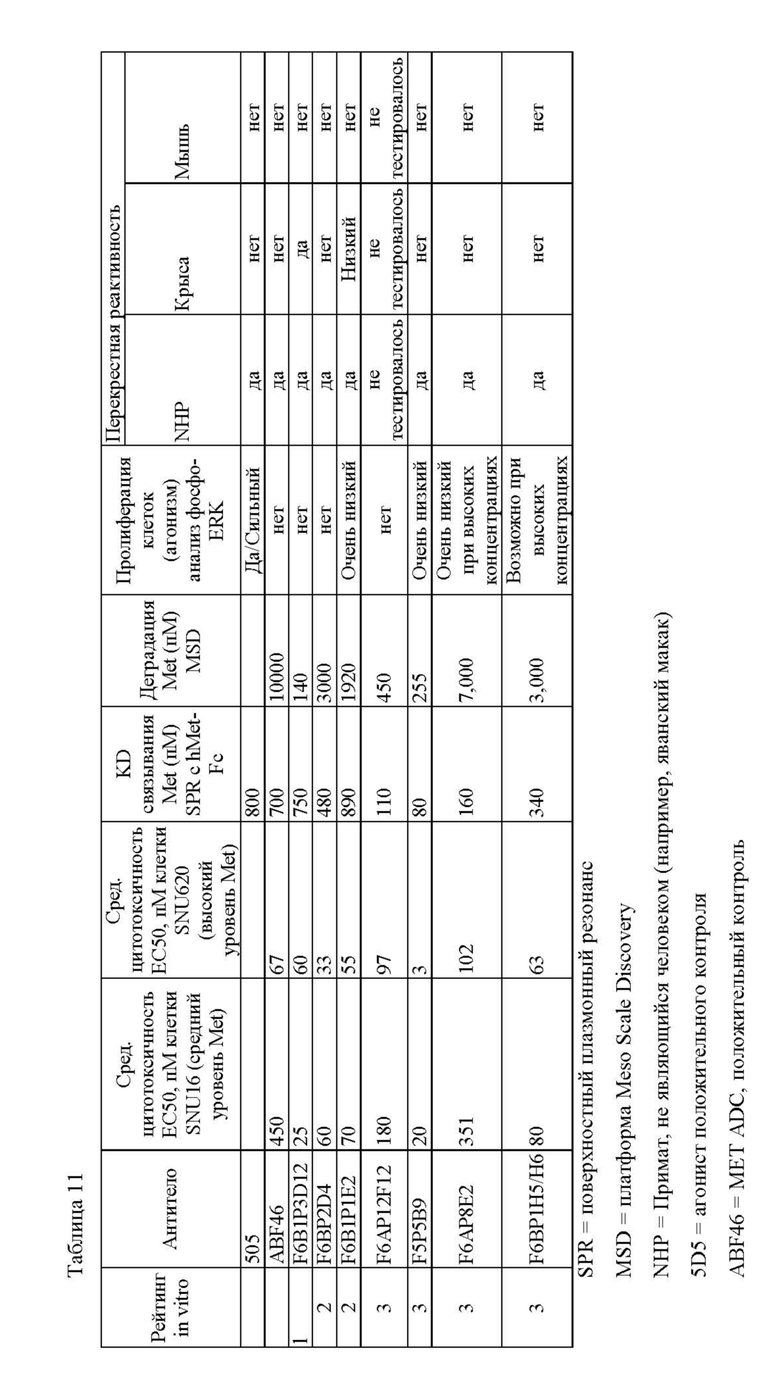
Пример 2
Краткое описание характеристик выбранных гуманизированных моноклональных связывающих агентов
Были получены гуманизированные моноклональные связывающие агенты с переключением изотипа, которые включают CDR тяжелой цепи и CDR легкой цепи мышиного моноклонального антитела P3D12. Шестнадцать различных комбинаций тяжелых цепей (HC) и легких цепей (LC) испытывали на растворимость в PBS, связывание с cMET человека, связывание с cMET крысы, аффинность связывания с cMET человека и крысы, что определялось с помощью поверхностного плазмонного резонанса (SPR), на наличие агонистической активности и деградации cMET, данные о которых были получены с помощью платформы Meso Scale Discovery (MSD). Результаты суммированы в таблице 12 ниже.
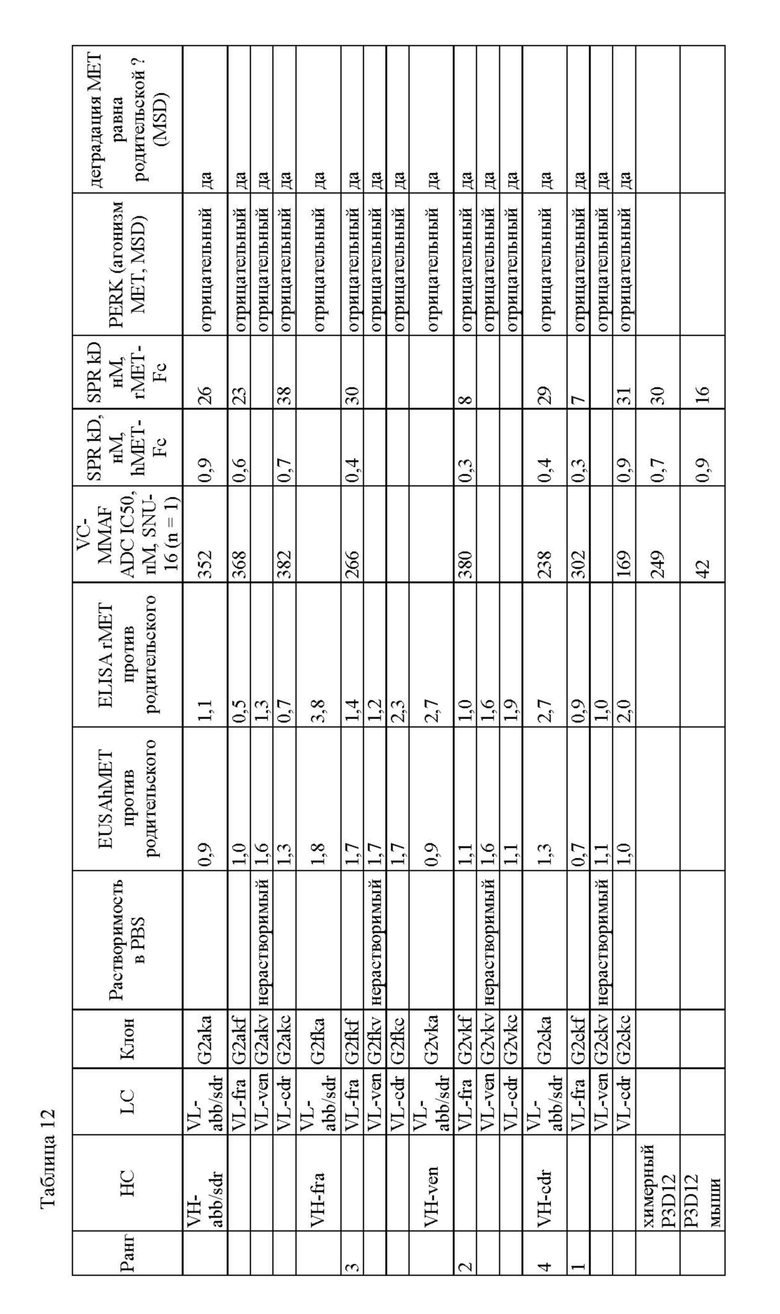
Пример 3
У пациента-человека наблюдались множественные метастатические карциномы размером 2 см или более, присутствующие в печени и легких. Биопсия проводилась, чтобы определить, экспрессируют ли клетки карциномы cMET на своей клеточной поверхности. Наличие экспрессии cMET на клеточной поверхности подтвердилась результатами биопсии.
Пациенту-человеку вводили связывающий агент, который специфически связывается с внеклеточным доменом cMET человека. Связывающий агент необязательно включает константные области тяжелой цепи каппа и IgG1 человека, вариабельной области легкой цепи SEQ ID NO: 41 и вариабельных областей тяжелой цепи SEQ ID NO: 98. Связывающий агент можно вводить в дозе 30 мг/кг, внутривенно, в объеме 300 мл в течение 2 часов, один раз в день в течение шести недель. Наличие, размер и жизнеспособность опухоли определяется с помощью последующей биопсии и УЗИ. Объект был определен как находящийся в состоянии ремиссии после шести недель лечения.
Пример 4
У пациента-человека наблюдались множественные метастатические карциномы размером 2 см или более, присутствующие в печени и легких. Биопсия проводилась, чтобы определить, экспрессируют ли клетки карциномы cMET на своей клеточной поверхности. Наличие экспрессии cMET на клеточной поверхности подтвердилась результатами биопсии.
Пациенту-человеку вводили связывающий агент, который специфически связывается с внеклеточным доменом cMET человека. Связывающий агент необязательно включает константные области тяжелой цепи человека каппа и IgG2a, вариабельный участок гуманизированной легкой цепи SEQ ID NO: 48 и вариабельный участок гуманизированной тяжелой цепи SEQ ID NO: 107. Связывающий агент необязательно конъюгирован с MMAF. Связывающий агент вводили в дозе 1 мг/кг, внутривенно, в объеме 300 мл в течение 2 часов, один раз в день в течение шести недель. Наличие, размер и жизнеспособность опухоли определяется с помощью последующей биопсии и УЗИ. Объект определен как находящийся в состоянии ремиссии после шести недель лечения.
Пример 5
Последовательности cMET
SEQ ID NO: 109 (cMET человека - UniProtKB - P08581 (MET_HUMAN)) * Остатки E168 и N375 выделены жирным шрифтом и подчеркнуты.
MKAPAVLAPGILVLLFTLVQRSNGECKEALAKSEMNVNMKYQLPNFTAETPIQNVILHEHHIFLGATNYIYVLNEEDLQKVAEYKTGPVLEHPDCFPCQDCSSKANLSGGVWKDNINMALVVDTYYDDQLISCGSVNRGTCQRHVFPHNHTADIQSEVHCIFSPQIEEPSQCPDCVVSALGAKVLSSVKDRFINFFVGNTINSSYFPDHPLHSISVRRLKETKDGFMFLTDQSYIDVLPEFRDSYPIKYVHAFESNNFIYFLTVQRETLDAQTFHTRIIRFCSINSGLHSYMEMPLECILTEKRKKRSTKKEVFNILQAAYVSKPGAQLARQIGASLNDDILFGVFAQSKPDSAEPMDRSAMCAFPIKYVNDFFNKIVNKNNVRCLQHFYGPNHEHCFNRTLLRNSSGCEARRDEYRTEFTTALQRVDLFMGQFSEVLLTSISTFIKGDLTIANLGTSEGRFMQVVVSRSGPSTPHVNFLLDSHPVSPEVIVEHTLNQNGYTLVITGKKITKIPLNGLGCRHFQSCSQCLSAPPFVQCGWCHDKCVRSEECLSGTWTQQICLPAIYKVFPNSAPLEGGTRLTICGWDFGFRRNNKFDLKKTRVLLGNESCTLTLSESTMNTLKCTVGPAMNKHFNMSIIISNGHGTTQYSTFSYVDPVITSISPKYGPMAGGTLLTLTGNYLNSGNSRHISIGGKTCTLKSVSNSILECYTPAQTISTEFAVKLKIDLANRETSIFSYREDPIVYEIHPTKSFISGGSTITGVGKNLNSVSVPRMVINVHEAGRNFTVACQHRSNSEIICCTTPSLQQLNLQLPLKTKAFFMLDGILSKYFDLIYVHNPVFKPFEKPVMISMGNENVLEIKGNDIDPEAVKGEVLKVGNKSCENIHLHSEAVLCTVPNDLLKLNSELNIEWKQAISSTVLGKVIVQPDQNFTGLIAGVVSISTALLLLLGFFLWLKKRKQIKDLGSELVRYDARVHTPHLDRLVSARSVSPTTEMVSNESVDYRATFPEDQFPNSSQNGSCRQVQYPLTDMSPILTSGDSDISSPLLQNTVHIDLSALNPELVQAVQHVVIGPSSLIVHFNEVIGRGHFGCVYHGTLLDNDGKKIHCAVKSLNRITDIGEVSQFLTEGIIMKDFSHPNVLSLLGICLRSEGSPLVVLPYMKHGDLRNFIRNETHNPTVKDLIGFGLQVAKGMKYLASKKFVHRDLAARNCMLDEKFTVKVADFGLARDMYDKEYYSVHNKTGAKLPVKWMALESLQTQKFTTKSDVWSFGVLLWELMTRGAPPYPDVNTFDITVYLLQGRRLLQPEYCPDPLYEVMLKCWHPKAEMRPSFSELVSRISAIFSTFIGEHYVHVNATYVNVKCVAPYPSLLSSEDNADDEVDTRPASFWETS
SEQ ID NO: 110 (cMET крысы-UniProtKB - P97523 (MET_RAT))
MKAPTALAPGILLLLLTLAQRSHGECKEALVKSEMNVNMKYQLPNFTAETPIHNVVLPGHHIYLGATNYIYVLNDKDLQKVSEFKTGPVVEHPDCFPCQDCSSKANVSGGVWKDNVNMALLVDTYYDDQLISCGSVNRGTCQRHVLPPDNAADIQSEVHCMFSPLAEEESGQCPDCVVSALGAKVLLSEKDRFINFFVGNTINSSYPPDYSLHSISVRRLKETQDGFKFLTDQSYIDVLPEFRDSYPIKYIHAFESNHFIYFLTVQKETLDAQTFHTRIIRFCSVDSGLHSYMEMPLECILTEKRRKRSTREEVFNILQAAYVSKPGANLAKQIGASPYDDILYGVFAQSKPDSAEPMNRSAVCAFPIKYVNDFFNKIVNKNNVRCLQHFYGPNHEHCFNRTLLRNSSGCEVRSDEYRTEFTTALQRVDLFMGRLNHVLLTSISTFIKGDLTIANLGTSEGRFMQVVLSRTAHFTPHVNFLLDSYPVSPEVIVEHPSNQNGYTLVVTGKKITKIPLNGLGCGHFQSCSQCLSPPYFIQCGWCHNRCVHSNECPSGTWTQEICLPAVYKVFPTSAPLEGGTMLTICGWDFGFKKNNKFDLRKTKVLLGNESCTLTLSESTTNTLKCTVGPAMSEHFNVSVIVSNSRETTQYSAFSYVDPVITSISPRYGPHAGGTLLTLTGKYLNSGNSRHISIGGKTCTLKSVSDSILECYTPGHTVSAEFPVKLKIDLADRVTSSFSYREDPVVSEIHPTKSFISGGSTITGIGKNLNSVSTPKLVIEVHDVGVNYTVACQHRSSSEIICCTTPSLRQLDLQLPLKTKAFFLLDGILSKHFDLTYVHDPMFKPFEKPVMISMGNENVVEIKGDDIDPEAVKGEVLKVGNKSCENLHWHSEALLCTVPSDLLKLNGGELNIEWKQAVSSTVLGKVIVQPDQNFAGLIIGAVSISVVVLLVSGLFLWLRKRKHKDLGSELVRYDARVHTPHLDRLVSARSVSPTTEMVSNESVDYRATFPEDQFPNSSQNGACRQVQYLLTDLSPILTSGDSDISSPLLQNTVHIDLSALNPELVQAVPHVVIGPSSLIVHFNEVIGRGHFGCVYHGTLLDSDGKKIHCAVKSLNRITDIEEVSQFLTEGIIMKDFSHPNVLSLLGICLRSEGSPLVVLPYMKHGDLRNFIRNETHNPTVKDLIGFGLQVAKGMKYLVSKKFVHRDLAARNCMLDEKFTVKVADFGLARDMYDKEYYSVHNKTGAKLPVKWMALESLQTQKFTTKSDVWSFGVLLWELMTRGAPPYPDVNTFDITIYLLQGRRLLQPEYCPDALYEVMLKCWHPKAEMRPSVSELVSRISSIFSTFIGEHYVHVNATYVNVKCVAPYPSLLPSQDNIDGEANT
SEQ ID NO: 111 (cMET мыши- UniProtKB - P16056 (MET_MOUSE))
MKAPTVLAPGILVLLLSLVQRSHGECKEALVKSEMNVNMKYQLPNFTAETPIQNVVLHGHHIYLGATNYIYVLNDKDLQKVSEFKTGPVLEHPDCLPCRDCSSKANSSGGVWKDNINMALLVDTYYDDQLISCGSVNRGTCQRHVLPPDNSADIQSEVHCMFSPEEESGQCPDCVVSALGAKVLLSEKDRFINFFVGNTINSSYPPGYSLHSISVRRLKETQDGFKFLTDQSYIDVLPEFLDSYPIKYIHAFESNHFIYFLTVQKETLDAQTFHTRIIRFCSVDSGLHSYMEMPLECILTEKRRKRSTREEVFNILQAAYVSKPGANLAKQIGASPSDDILFGVFAQSKPDSAEPVNRSAVCAFPIKYVNDFFNKIVNKNNVRCLQHFYGPNHEHCFNRTLLRNSSGCEARSDEYRTEFTTALQRVDLFMGRLNQVLLTSISTFIKGDLTIANLGTSEGRFMQVVLSRTAHLTPHVNFLLDSHPVSPEVIVEHPSNQNGYTLVVTGKKITKIPLNGLGCGHFQSCSQCLSAPYFIQCGWCHNQCVRFDECPSGTWTQEICLPAVYKVFPTSAPLEGGTVLTICGWDFGFRKNNKFDLRKTKVLLGNESCTLTLSESTTNTLKCTVGPAMSEHFNVSVIISNSRETTQYSAFSYVDPVITSISPRYGPQAGGTLLTLTGKYLNSGNSRHISIGGKTCTLKSVSDSILECYTPAQTTSDEFPVKLKIDLANRETSSFSYREDPVVYEIHPTKSFISGGSTITGIGKTLNSVSLPKLVIDVHEVGVNYTVACQHRSNSEIICCTTPSLKQLGLQLPLKTKAFFLLDGILSKHFDLTYVHNPVFEPFEKPVMISMGNENVVEIKGNNIDPEAVKGEVLKVGNQSCESLHWHSGAVLCTVPSDLLKLNSELNIEWKQAVSSTVLGKVIVQPDQNFAGLIIGAVSISVVVLLLSGLFLWMRKRKHKDLGSELVRYDARVHTPHLDRLVSARSVSPTTEMVSNESVDYRATFPEDQFPNSSQNGACRQVQYPLTDLSPILTSGDSDISSPLLQNTVHIDLSALNPELVQAVQHVVIGPSSLIVHFNEVIGRGHFGCVYHGTLLDNDGKKIHCAVKSLNRITDIEEVSQFLTEGIIMKDFSHPNVLSLLGICLRSEGSPLVVLPYMKHGDLRNFIRNETHNPTVKDLIGFGLQVAKGMKYLASKKFVHRDLAARNCMLDEKFTVKVADFGLARDMYDKEYYSVHNKTGAKLPVKWMALESLQTQKFTTKSDVWSFGVLLWELMTRGAPPYPDVNTFDITIYLLQGRRLLQPEYCPDALYEVMLKCWHPKAEMRPSFSELVSRISSIFSTFIGEHYVHVNATYVNVKCVAPYPSLLPSQDNIDGEGNT
SEQ ID NO: 112 (cMET собаки)
MKAPAVLAPGILVLLFTLVQKSYGECKEALVKSEMNVNMKYQLPNFTAETPIQNVVLHKHHIYLGAVNYIYVLNDKDLQKVAEYKTGPVLEHPDCSPCQDCSHKANLSGGVWEDNINMALLVDTYYDDQLISCGSVHRGTCQRHILPPSNIADIQSEVHCMYSSQADEEPSQCPDCVVSALGTKVLISEKDRFINFFVGNTINSSDHPDHSLHSISVRRLKETQDGFKFLTDQSYIDVLPEFRDSYPIKYVHAFESNHFIYFLTVQRETLDAQTFHTRIIRFCSVDSGLHSYMEMPLECILTEKRRKRSTREEVFNILQAAYVSKPGAHLAKQIGANLNDDILYGVFAQSKPDSAEPMNRSAVCAFPIKYVNEFFNKIVNKNNVRCLQHFYGPNHEHCFNRTLLRNSSGCEARNDEYRTEFTTALQRVDLFMGQFNQVLLTSISTFIKGDLTIANLGTSEGRFMQVVVSRSGLSTPHVNFRLDSHPVSPEAIVEHPLNQNGYTLVVTGKKITRIPLNGLGCEHFQSCSQCLSAPPFVQCGWCHDRCVHLEECPTGAWTQEVCLPAIYEVFPTSAPLEGGTVLTVCGWDFGFRRNNKFDLKKTKVFLGNESCTLTLSESTTNMLKCTVGPAVNEHFNISIIISNGRGTAQYSTFSYVDPIITSISPSYGPKNGGTLLTLTGKYLNSGNSRHISMGGKTCTLKSVSDSILECYTPAQATATEFPIKLKIDLANREMNSFSYQEDPIVYAIHPTKSFISGGSTITAVGKNLNSVSVLRMVIDVHETRRNFTVACQHRSNSEIICCTTPSLQQLNLQLPLKTKAFFMLDGIHSKYFDLIYVHNPVFKPFEKPVMISIGNENVLEIKGNDIDPEAVKGEVLKVGNKSCETIYSDSKAVLCKVPNDLLKLNNELNIEWKQAVSSTVLGKVIVQPDQNFTGLIAGVISISTIVLLLLGLFLWLKRKKQIKDLGSELVRYDARVHTPHLDRLVSARSVSPTTEMVSNESVDYRATFPEDQFPNSSQNGSCRQVQYPLTDLSPMLTSGDSDISSPLLQNTVHIDLSALNPELVQAVQHVVIGPSSLIVHFNEVIGRGHFGCVYHGTLLDNDDKKIHCAVKSLNRITDIGEVSQFLTEGIIMKDFSHPNVLSLLGICLRSEGSPLVVLPYMKHGDLRNFIRNETHNPTVKDLIGFGLQVAKGMKYLASKKFVHRDLAARNCMLDEKFTVKVADFGLARDMYDKEYYSVHNKTGAKLPVKWMALESLQTQKFTTKSDVWSFGVLLWELMTRGAPPYPDVNTFDITVYLLQGRRLLQPEYCPDPLYEVMLKCWHPRAELRPSFSELVSRISAIFSTFIGEHYVHVNATYVNVKCVAPYPSLLSSQDNIDGEGDT
SEQ ID NO: 113 (cMET Macaca mulatta, Rhesus - контрольная последовательность NCBI: NP_001162100.1)
MKAPAVLVPGILVLLFTLVQRSNGECKEALAKSEMNVNMKYQLPNFTAETAIQNVILHEHHIFLGATNYIYVLNEEDLQKVAEYKTGPVLEHPDCFPCQDCSSKANLSGGVWKDNINMALVVDTYYDDQLISCGSVNRGTCQRHVFPHNHTADIQSEVHCIFSPQIEEPNQCPDCVVSALGAKVLSSVKDRFINFFVGNTINSSYFPHHPLHSISVRRLKETKDGFMFLTDQSYIDVLPEFRDSYPIKYIHAFESNNFIYFLTVQRETLNAQTFHTRIIRFCSLNSGLHSYMEMPLECILTEKRKKRSTKKEVFNILQAAYVSKPGAQLARQIGASLNDDILFGVFAQSKPDSAEPMDRSAMCAFPIKYVNDFFNKIVNKNNVRCLQHFYGPNHEHCFNRTLLRNSSGCEARRDEYRAEFTTALQRVDLFMGQFSEVLLTSISTFVKGDLTIANLGTSEGRFMQVVVSRSGPSTPHVNFLLDSHPVSPEVIVEHPLNQNGYTLVVTGKKITKIPLNGLGCRHFQSCSQCLSAPPFVQCGWCHDKCVRSEECPSGTWTQQICLPAIYKVFPTSAPLEGGTRLTICGWDFGFRRNNKFDLKKTRVLLGNESCTLTLSESTMNTLKCTVGPAMNKHFNMSIIISNGHGTTQYSTFSYVDPIITSISPKYGPMAGGTLLTLTGNYLNSGNSRHISIGGKTCTLKSVSNSILECYTPAQTISTEFAVKLKIDLANRETSIFSYREDPIVYEIHPTKSFISGGSTITGVGKNLHSVSVPRMVINVHEAGRNFTVACQHRSNSEIICCTTPSLQQLNLQLPLKTKAFFMLDGILSKYFDLIYVHNPVFKPFEKPVMISMGNENVLEIKGNDIDPEAVKGEVLKVGNKSCENIHLHSEAVLCTVPNDLLKLNSELNIEWKQAISSTVLGKVIVQPDQNFTGLIAGVVSISIALLLLLGLFLWLKKRKQIKDLGSELVRYDARVHTPHLDRLVSARSVSPTTEMVSNESVDYRATFPEDQFPNSSQNGSCRQVQYPLTDMSPILTSGDSDISSPLLQNTVHIDLSALNPELVQAVQHVVIGPSSLIVHFNEVIGRGHFGCVYHGTLLDNDGKKIHCAVKSLNRITDIGEVSQFLTEGIIMKDFSHPNVLSLLGICLRSEGSPLVVLPYMKHGDLRNFIRNETHNPTVKDLIGFGLQVAKGMKYLASKKFVHRDLAARNCMLDEKFTVKVADFGLARDMYDKEYYSVHNKTGAKLPVKWMALESLQTQKFTTKSDVWSFGVLLWELMTRGAPPYPDVNTFDITVYLLQGRRLLQPEYCPDPLYEVMLKCWHPKAEMRPSFSELVSRISAIFSTFIGEHYVHVNATYVNVKCVAPYPSLLSSEDNADDEVDT
Пример 6
Воплощения
A1. Связывающий агент, который специфически связывается с cMET или его частью, где связывающий агент включает CDR-L1, CDR-L2 и CDR-L3, каждая из которых независимо выбрана из вариабельного домена легкой цепи, выбранного из таблицы 4 или таблицы 5.
A2. Связывающий агент, который специфически связывается с cMET или его частью, где связывающий агент включает CDR-H1, CDR-H2 и CDR-H3, каждая из которых независимо выбрана из вариабельного домена тяжелой цепи, выбранного из таблицы 9 или таблицы 10.
A3. Связывающий агент, который специфически связывается с cMET или его частью, где связывающий агент включает (i) CDR-L1, CDR-L2 и CDR-L3, каждая из которых независимо выбрана из вариабельного домена легкой цепи, выбранного из таблицы 4 или таблица 5 и (ii) CDR-H1, CDR-H2 и CDR-H3, каждая из которых независимо выбрана из вариабельного домена тяжелой цепи, выбранного из таблицы 9 или таблицы 10.
A4. Связывающий агент, который специфически связывается с CMET или его частью, где связывающий агент включает три CDR вариабельного домена легкой цепи, выбранных из CDR в таблицах 1, 2 и 3, и три CDR вариабельного домена тяжелой цепи, выбранных из CDR таблиц 4, 5 и 6.
A5. Связывающий агент, который специфически связывается с CMET или его частью, где связывающий агент включает CDR-L1, выбранную из таблицы 1, CDR-L2, выбранную из таблицы 2, CDR-L3, выбранную из таблицы 3, CDR-H1 выбранную из таблицы 4, CDR-H2, выбранную из таблицы 5, и CDR-H3, выбранную из таблицы 6.
A6. Связывающий агент, который специфически связывается с CMET или его частью, где связывающий агент включает CDR-L1, который, по меньшей мере, на 80% идентичен CDR, выбранной из таблицы 1, CDR-L2, который, по меньшей мере, на 80% идентичен CDR, выбранной из таблицы 2, CDR-L3, который, по меньшей мере, на 80% идентичен CDR, выбранной из таблицы 3, CDR-H1, который, по меньшей мере, на 80% идентичен CDR, выбранной из таблицы 4, CDR-H2, который, по меньшей мере, на 80% идентичен CDR, выбранной из таблицы 5, и CDR-H3, который, по меньшей мере, на 80% идентичен CDR, выбранной из таблицы 6.
A7. Связывающий агент по любому из воплощений А1-А6, где связывающий агент представляет собой рекомбинантное моноклональное антитело.
A8. Фармацевтическая композиция, включающая:
связывающий агент по любому из воплощений А1-А7; и
фармацевтически приемлемый наполнитель, разбавитель, добавку или носитель.
A9. Фармацевтическая композиция по воплощению A8, где связывающий агент включает константную область IgG1, IgG2, IgG3 или IgG4.
A10. Фармацевтическая композиция по воплощению A8 или A9, в которой связывающий агент включает константную область IgD, IgE, IgA или IgM.
A11. Фармацевтическая композиция по любому из воплощений A8-A10, где связывающий агент является гуманизированным.
B1. Рекомбинантное моноклональное антитело, включающее:
CDR-L1, которая, по меньшей мере, на 80% идентична CDR, выбранной из таблицы 1, CDR-L2, которая, по меньшей мере, на 80% идентична CDR, выбранной из таблицы 2, CDR-L3, которая, по меньшей мере, на 80% идентична CDR, выбранной из таблицы 3, CDR-H1, которая, по меньшей мере, на 80% идентична CDR, выбранной из таблицы 4, CDR-H2, которая, по меньшей мере, на 80% идентична CDR, выбранной из таблицы 5, и CDR-H3, которая, по меньшей мере, на 80% идентична CDR, выбранной из таблицы 6, где антитело специфически связывается с внеклеточным доменом cMET человека.
B2. Антитело по воплощению B1, где антитело является гуманизированным, химерным или CDR-привитым.
C1. Связывающее антитело средство, фармацевтическая композиция или антитело по любому из воплощений А1-А11, В1 и В2 для применения при лечении неопластического расстройства или онкологического заболевания у объекта.
Полное описание каждого патента, заявки на патент, публикации или любой другой ссылки или документа, процитированного в данном документе, включено в данный документ ссылкой. В случае конфликта, описание, включая определения, будет превалировать.
Цитирование какого-либо патента, заявки на патент, публикации или любого другого документа не является признанием того, что что-либо из вышеизложенного относится к предшествующему уровню техники, и не является признанием содержания или даты этих публикаций или документов.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, что и обычно понимаемые специалистом в области, к которой принадлежит данное изобретение. Хотя способы и материалы, подобные или эквивалентные тем, которые описаны в данном документе, могут использоваться при практическом применении или испытании настоящего изобретения, подходящие способы и материалы описаны в данном документе.
Все раскрытые в данном документе признаки могут быть объединены в любой комбинации. Каждый признак, раскрытый в описании, может быть заменен альтернативным признаком, служащим той же, эквивалентной или аналогичной цели. Таким образом, если прямо не указано иное, раскрытые признаки (например, антитела) являются примером вида эквивалентных или сходных признаков.
При использовании в данном документе, все числовые значения или числовые диапазоны включают целые числа в таких диапазонах и доли значений или целые числа в пределах диапазонов, если контекст явно не указывает на иное. Кроме того, когда в данном документе описан список значений (например, около 50%, 60%, 70%, 80%, 85% или 86%), список включает все его промежуточные и дробные значения (например, 54%, 85,4%). Таким образом, для иллюстрации, ссылка на 80% или более идентичности включает 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94% и т.д., а также 81,1%, 81,2%, 81,3%, 81,4%, 81,5% и т.д., 82,1%, 82,2%, 82,3%, 82,4%, 82,5% и т.д., и т.п.
Ссылка на целое число с упоминанием более или менее, включает любое число, большее или меньшее, чем число ссылки, соответственно. Так, например, ссылка на менее 100 включает 99, 98, 97 и т.д. вплоть до числа один (1); а на менее 10, включая 9, 8, 7 и т.д. вплоть до числа один (1).
При использовании в данном документе, все числовые значения или диапазоны включают доли значений и целых чисел в таких диапазонах и доли целых чисел в таких диапазонах, если контекст явно не указывает на иное. Таким образом, для иллюстрации ссылка на числовой диапазон, такой как 1-10, включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, а также 1,1, 1,2, 1,3, 1,4, 1,5, и т.д. и т.п. Ссылка на диапазон 1-50, следовательно, включает 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, и т. д. до 50 включительно, а также 1,1, 1,2, 1,3, 1,4, 1,5 и т.д., 2,1, 2,2, 2,3, 2,4, 2,5 и т.д. и т.п.
Ссылка на серию диапазонов включает диапазоны, которые объединяют значения границ различных диапазонов в пределах ряда. Таким образом, чтобы проиллюстрировать ссылку на ряд диапазонов, например, 1-10, 10-20, 20-30, 30-40, 40-50, 50-60, 60-75, 75-100, 100-150, 150-200, 200-250, 250-300, 300-400, 400-500, 500-750, 750-1000, 1000-1500, 1500-2000, 2000-2500, 2500-3000, 3000-3500, 3500 -4000, 4000-4,500, 4500-5000, 5500-6000, 6000-7000, 7000-8000 или 8000-9000, включает диапазоны 10-50, 50-100, 100-1000, 1000-3000, 2000-4000, и т.д.
Модификации могут быть сделаны в соответствии с вышесказанным, не отступая от основных аспектов технологии. Хотя технология была описана достаточно подробно со ссылкой на один или несколько конкретных воплощений, специалисты в данной области техники поймут, что могут быть сделаны изменения в воплощениях, конкретно раскрытых в настоящей заявке, однако эти модификации и улучшения находятся в пределах объема и дух технологии.
Изобретение в целом раскрыто в данном документе с использованием утвердительных формулировок для описания многочисленных воплощений и аспектов. Кроме того, изобретение конкретно включает воплощения, в которых конкретный объект изобретения исключается, в полном объеме или частично, например, вещества или материалы, стадии способа и состояния, протоколы, процедуры или процедуры. Например, в определенных воплощениях или аспектах изобретения материалы и/или стадии способа исключаются. Таким образом, несмотря на то, что изобретение в целом не выражено в данном документе в том смысле, что данное изобретение не включает аспекты, которые прямо не исключены из изобретения, оно тем не менее является раскрытым в данном документе.
Технология, для иллюстрации описанная в данном документе, может быть применена на практике при отсутствии какого-либо элемента(ов), конкретно не раскрытого в данном документе. Таким образом, например, в каждом случае в данном документе любой из терминов «включающий», «состоящий по существу из» и «состоящий из» может быть заменен любым из двух других терминов. Используемые термины и выражения используются в качестве терминов описания, а не ограничения, и использование таких терминов и выражений не исключает каких-либо эквивалентов показанных и описанных признаков или их сегментов, и в рамках объема заявленной технологии возможны различные модификации. Термин в единственном числе может относиться к одному из или множеству элементов (например, «реагент» может означать один или несколько реагентов), если только в контексте не ясно, что описан один из элементов или более одного элементов. Используемый в данном документе термин «около» относится к значению в пределах 10% от базового параметра (то есть плюс или минус 10%), а использование термина «около» в начале строки значений изменяет каждое из значений (то есть «около 1, 2 и 3» относится к около 1, около 2 и около 3). Например, масса «около 100 грамм» может включать массы от 90 грамм до 110 грамм. Используемый в данном документе термин «по существу» относится к модификатору значения, означающему «по меньшей мере, 95%», «по меньшей мере, 96%», «по меньшей мере, 97%», «по меньшей мере, 98%» или «по меньшей мере, 99%» и может включать 100%. Например, композиция, которая по существу не включает Х, может включать менее 5%, менее 4%, менее 3%, менее 2% или менее 1% Х, и/или Х может отсутствовать или не обнаруживается в составе.
Таким образом, следует понимать, что, хотя настоящая технология была конкретно раскрыта посредством типичных воплощений и необязательных признаков, к специалистам в данной области техники могут быть применены модификации и вариации раскрытых в данном документе концепций, и такие модификации и варианты рассматриваются в рамках сферы применения этой технологии.
Объектами настоящего изобретения являются.
1. Связывающий агент, включающий:
CDR-L1, CDR-L2 и CDR-L3, которые представляют собой три полипептидные последовательности определяющих комплементарность областей легкой цепи (CDR-L),
где CDR-L1 выбрана из SEQ ID NO: 1-15, CDR-L2 выбрана из SEQ ID NO: 16-25, а CDR-L3 выбрана из SEQ ID NO: 26-36, и
где связывающий агент специфически связывается с внеклеточным доменом фактора мезенхимально-эпителиального перехода (cMET).
2. Связывающий агент, включающий:
CDR-H1, CDR-H2 и CDR-H3, которые представляют собой три полипептидные последовательности определяющих комплементарность областей тяжелой цепи (CDR-H),
где CDR-H1 выбрана из SEQ ID NO: 50-61, CDR-H2 выбрана из SEQ ID NO: 62-78, а CDR-H3 выбрана из SEQ ID NO: 79-93, и
где связывающий агент специфически связывается с внеклеточным доменом фактора мезенхимально-эпителиального перехода (cMET).
3. Связывающий агент, включающий:
CDR-L1 выбрана из SEQ ID NO. 1-15, CDR-L2 выбрана из SEQ ID NO. 16-25, CDR-L3 выбрана из SEQ ID NO. 26-36, CDR-H1, выбрана из SEQ ID NO50-61, CDR-H2, выбрана из SEQ ID NO. 62-78, и CDR-H3, выбрана из SEQ ID NO 79-93.
где связывающий агент специфически связывается с внеклеточным доменом фактора мезенхимально-эпителиального перехода (cMET).
4. Связывающий агент по п. 1 или 3, отличающийся тем, что CDR-L1 выбрана из SEQ ID NO: 2, 4, 6, 8, 10, 12 и 14.
5. Связывающий агент по п. 1, отличающийся тем, что CDR-L2 выбрана из SEQ ID NO: 17, 19, 21, 23 и 25.
6. Связывающий агент по п. 1, 3, 4 или 5, отличающийся тем, что CDR-L3 выбрана из SEQ ID NO: 27, 29, 31, 33 и 35.
7. Связывающий агент по п. 2 или 3, отличающийся тем, что CDR-H1 выбрана из SEQ ID NO: 51, 53, 55, 57 и 59.
8. Связывающий агент по пп. 2, 3 или 7, отличающийся тем, что CDR-H2, выбранная из SEQ ID NO: 62-78, выбрана из SEQ ID NO: 63, 65, 67, 69, 73 и 75.
9. Связывающий агент по пп. 2, 3 или 8, отличающийся тем, что CDR-H3 выбрана из SEQ ID NO: 80, 82, 84, 86, 88, 91 и 93.
10. Связывающий агент по любому из пп. 1-9, отличающийся тем, что связывающий агент представляет собой антитело или его связывающий фрагмент.
11. Связывающий агент по п. 10, отличающийся тем, что связывающий агент представляет собой моноклональное антитело или его связывающий фрагмент.
12. Связывающий агент по любому из пп. 1-11, отличающийся тем, что связывающий агент включает константную область IgG1, IgG2, IgG3 или IgG4.
13. Связывающий агент по любому из пп. 1-11, отличающийся тем, что связывающий агент включает константную область IgD, IgE, IgA или IgM.
14. Связывающий агент по любому из пп. 1-13, отличающийся тем, что связывающий агент является гуманизированным.
15. Связывающий агент по любому из пп. 1-13, отличающийся тем, что связывающий агент включает, по меньшей мере, одну гуманизированную или человеческую каркасную область.
16. Связывающий агент по п. 15, отличающийся тем, что связывающий агент включает, по меньшей мере, три гуманизированных или человеческих каркасных участка.
17. Связывающий агент по любому из пп. 1-13, отличающийся тем, что связывающий агент включает, по меньшей мере, одну каркасную область мыши.
18. Связывающий агент по п. 17, отличающийся тем, что связывающий агент включает, по меньшей мере, три каркасных области мыши.
19. Связывающий агент по любому из пп. 1-18, отличающийся тем, что связывающий агент представляет собой фрагмент антитела Fab, Fab', F(ab')2, Fv или scFV.
20. Связывающий агент по любому из пп. 1-19, отличающийся тем, что связывающий агент состоит из одноцепочечного полипептида.
21. Связывающий агент по любому из пп. 1-13, отличающийся тем, что связывающий агент включает вариабельную область легкой цепи, имеющую аминокислотную последовательность, выбранную из SEQ ID NO: 37-44.
22. Связывающий агент по любому из пп. 1-13, отличающийся тем, что связывающий агент включает вариабельную область тяжелой цепи, имеющую аминокислотную последовательность, выбранную из SEQ ID NO: 94-103.
23. Связывающий агент по любому из пп. 1-13, отличающийся тем, что связывающий агент включает последовательность легкой цепи, выбранную из SEQ ID NO: 45-49.
24. Связывающий агент по любому из пп. 1-13, отличающийся тем, что связывающий агент включает последовательность тяжелой цепи, выбранную из SEQ ID NO: 104-108.
25. Связывающий агент по п. 23 или 24, отличающийся тем, что последовательность легкой цепи, выбранная из SEQ ID NO 45-49, и/или последовательность тяжелой цепи, выбранная из SEQ ID NO 104-108, включает от одной до пяти аминокислотных модификаций, выбранных из добавления аминокислоты, делеции аминокислоты и замены аминокислоты.
26. Связывающий агент по любому из пп. 1-25, отличающийся тем, что связывающий агент индуцирует интернализацию cMET в злокачественной опухолевой клетке человека.
27. Связывающий агент по любому из пп. 1-25, отличающийся тем, что связывающий агент вызывает деградацию cMET на злокачественной опухолевой клетке человека.
28. Связывающий агент по любому из пп. 1-25, отличающийся тем, что связывающий агент не является агонистом cMET.
29. Связывающий агент по любому из пп. 1-28, отличающийся тем, что связывающий агент специфически связывается с cMET млекопитающего.
30. Связывающий агент по п. 29, отличающийся тем, что cMET млекопитающего представляет собой cMET человека, cMET обезьяны или cMET крысы.
31. Связывающий агент по п. 30, отличающийся тем, что связывающий агент специфически связывается с cMET человека, cMET обезьяны или cMET крысы.
32. Связывающий агент по п. 30, отличающийся тем, что связывающий агент специфически связывается с cMET человека.
33. Связывающий агент по любому из пп. 1-32, отличающийся тем, что связывающий агент специфически связывается с внеклеточным доменом cMET дикого типа.
34. Связывающий агент по любому из пп. 1-32, отличающийся тем, что связывающий агент специфически связывается с внеклеточным доменом варианта cMET.
35. Связывающий агент по п. 34, отличающийся тем, что вариант cMET включает вариант cMET E168D или N375S.
36. Связывающий агент по любому из пп. 1-34, отличающийся тем, что связывающий агент специфически связывает внеклеточный домен cMET человека с KD 10 нМ или менее.
37. Связывающий агент по п. 36, отличающийся тем, что связывающий агент специфически связывает внеклеточный домен cMET человека с KD 1 нМ или менее.
38. Связывающий агент по любому из пп. 1-37, отличающийся тем, что связывающий агент включает противоопухолевый агент.
39. Композиция, содержащая первый связывающий агент, который является связывающим агентом по любому из пп. 1-38, и второй связывающий агент, который не связывается специфически с cMET.
40. Композиция по п. 39, отличающаяся тем, что первый связывающий агент представляет собой связывающий агент, который специфически связывается с внеклеточным доменом cMET, а второй связывающий агент конъюгирован с первым связывающим агентом.
41. Способ лечения объекта, имеющего неопластическое расстройство или онкологическое заболевание, включающий:
а) обеспечение объекта, имеющего или подозреваемого на наличие опухолевого расстройства; и
b) введение объекту терапевтически эффективного количества связывающего агента по любому из пп. 1-38 или композиции по любому из пп. 39-40.
42. Способ по п. 41, отличающийся тем, что связывающий агент специфически связывается с внеклеточным доменом cMET, экспрессированным на одной или нескольких клетках объекта.
43. Способ по п. 41 или 42, отличающийся тем, что связывающий агент ингибирует митоз и/или индуцирует гибель одной или нескольких клеток, экспрессирующих cMET.
44. Способ по любому из пп. 41-43, отличающийся тем, что неопластическое расстройство или онкологическое заболевание включают карциному легкого, карциному молочной железы, карциному яичника, карциному почки, карциному толстой кишки, карциному желудка, карциному щитовидной железы, карциному поджелудочной железы, нейробластому или плоскоклеточную карциному головы и шеи, рак шейки матки, гепатоцеллюлярный рак, саркомы, мезотелиому, глиобластому, множественную миелому, меланому, карциному предстательной железы и пищевода.
45. Фармацевтическая композиция, содержащая связывающий агент по любому из пп. 1-38 и фармацевтически приемлемый эксципиент, разбавитель, добавку или носитель.
46. Фармацевтическая композиция по п. 45, отличающаяся тем, что добавка включает консервант.
47. Фармацевтическая композиция по п. 45 или 46, отличающаяся тем, что разбавитель включает фосфатно-солевой буферный раствор.
48. Фармацевтическая композиция по п. 45, отличающаяся тем, что эксципиент включает дегидрат цитрата натрия или моноолеат полиоксиэтилен-сорбитана-20 (полисорбат 80).
49. Фармацевтическая композиция по п. 45, отличающаяся тем, что носитель включает рекомбинантный белок.
50. Фармацевтическая композиция по п. 45, отличающаяся тем, что композиция является стерильной.
51. Фармацевтическая композиция по п. 45, отличающаяся тем, что композиция составлена в виде стерильного лиофилизированного порошка, подходящего для внутривенного введения млекопитающему.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MITSUBISHI TANABE PHARMA CORPORATION
<120> cMET MONOCLONAL BINDING AGENTS DRUG CONJUGATES THEREOF AND USES
THEREOF
<130> 673513
<150> US 62/401,428
<151> 2016-09-29
<160> 113
<170> PatentIn version 3.5
<210> 1
<211> 16
<212> PRT
<213> Mus musculus
<400> 1
Arg Ser Ser Gln Thr Ile Val His Gly Thr Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 2
<211> 11
<212> PRT
<213> Mus musculus
<400> 2
Gln Thr Ile Val His Gly Thr Gly Asn Thr Tyr
1 5 10
<210> 3
<211> 11
<212> PRT
<213> Mus musculus
<400> 3
Lys Ala Ser Glu Asn Val Gly Thr Tyr Val Ser
1 5 10
<210> 4
<211> 6
<212> PRT
<213> Mus musculus
<400> 4
Glu Asn Val Gly Thr Tyr
1 5
<210> 5
<211> 17
<212> PRT
<213> Mus musculus
<400> 5
Arg Ser Ser Gln Ser Leu Leu Tyr Ser Ile Asn Gln Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 6
<211> 12
<212> PRT
<213> Mus musculus
<400> 6
Gln Ser Leu Leu Tyr Ser Ile Asn Gln Lys Asn Tyr
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Mus musculus
<400> 7
Arg Ala Ser Glu Asn Ile Tyr Asn Thr Leu Ala
1 5 10
<210> 8
<211> 6
<212> PRT
<213> Mus musculus
<400> 8
Glu Asn Ile Tyr Asn Thr
1 5
<210> 9
<211> 12
<212> PRT
<213> Mus musculus
<400> 9
Ser Ala Ser Ser Ser Val Thr Ser Asn Tyr Leu Tyr
1 5 10
<210> 10
<211> 7
<212> PRT
<213> Mus musculus
<400> 10
Ser Ser Val Thr Ser Asn Tyr
1 5
<210> 11
<211> 12
<212> PRT
<213> Mus musculus
<400> 11
Ser Ala Ser Ser Ser Val Ser Ser Asn Tyr Leu Tyr
1 5 10
<210> 12
<211> 7
<212> PRT
<213> Mus musculus
<400> 12
Ser Ser Val Ser Ser Asn Tyr
1 5
<210> 13
<211> 12
<212> PRT
<213> Mus musculus
<220>
<221> misc_feature
<222> (7)..(7)
<223> Xaa can be Ser or Thr
<400> 13
Ser Ala Ser Ser Ser Val Xaa Ser Asn Tyr Leu Tyr
1 5 10
<210> 14
<211> 7
<212> PRT
<213> Mus musculus
<400> 14
Gln Ser Val Thr Ser Asn Tyr
1 5
<210> 15
<211> 12
<212> PRT
<213> Mus musculus
<400> 15
Arg Ala Ser Gln Ser Val Thr Ser Asn Tyr Leu Tyr
1 5 10
<210> 16
<211> 7
<212> PRT
<213> Mus musculus
<400> 16
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 17
<400> 17
000
<210> 18
<211> 7
<212> PRT
<213> Mus musculus
<400> 18
Gly Ala Ser Asn Arg Tyr Thr
1 5
<210> 19
<400> 19
000
<210> 20
<211> 7
<212> PRT
<213> Mus musculus
<400> 20
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 21
<400> 21
000
<210> 22
<211> 7
<212> PRT
<213> Mus musculus
<400> 22
Ala Ala Thr Asn Leu Ala Asp
1 5
<210> 23
<400> 23
000
<210> 24
<211> 7
<212> PRT
<213> Mus musculus
<400> 24
Ser Thr Ser Asn Leu Ala Ser
1 5
<210> 25
<400> 25
000
<210> 26
<211> 20
<212> PRT
<213> Mus musculus
<400> 26
Phe Gln Gly Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu
1 5 10 15
Glu Ile Lys Arg
20
<210> 27
<211> 9
<212> PRT
<213> Mus musculus
<400> 27
Phe Gln Gly Ser His Val Pro Tyr Thr
1 5
<210> 28
<211> 20
<212> PRT
<213> Mus musculus
<400> 28
Gly Gln Ser Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu
1 5 10 15
Glu Leu Lys Arg
20
<210> 29
<211> 9
<212> PRT
<213> Mus musculus
<400> 29
Gly Gln Ser Tyr Ser Tyr Pro Leu Thr
1 5
<210> 30
<211> 19
<212> PRT
<213> Mus musculus
<400> 30
Gln Gln Tyr Tyr Thr Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu
1 5 10 15
Glu Leu Lys
<210> 31
<211> 9
<212> PRT
<213> Mus musculus
<400> 31
Gln Gln Tyr Tyr Thr Tyr Pro Leu Thr
1 5
<210> 32
<211> 19
<212> PRT
<213> Mus musculus
<400> 32
Gln His Phe Trp Gly Thr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu
1 5 10 15
Glu Ile Lys
<210> 33
<211> 9
<212> PRT
<213> Mus musculus
<400> 33
Gln His Phe Trp Gly Thr Pro Tyr Thr
1 5
<210> 34
<211> 19
<212> PRT
<213> Mus musculus
<400> 34
His Gln Trp Ser Ser Tyr Pro Pro Thr Phe Gly Ser Gly Thr Lys Leu
1 5 10 15
Glu Ile Lys
<210> 35
<211> 9
<212> PRT
<213> Mus musculus
<400> 35
His Gln Trp Ser Ser Tyr Pro Pro Thr
1 5
<210> 36
<211> 9
<212> PRT
<213> Mus musculus
<220>
<221> misc_feature
<222> (1)..(1)
<223> Xaa can be His, Gln or Gly
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa can be Trp, Ser or Tyr
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa can be Ser or Tyr
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa can be Ser or Thr
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa can be Pro or Leu
<400> 36
Xaa Gln Xaa Xaa Xaa Tyr Pro Xaa Thr
1 5
<210> 37
<211> 113
<212> PRT
<213> Mus musculus
<400> 37
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Ile Val His Gly
20 25 30
Thr Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 38
<211> 108
<212> PRT
<213> Mus musculus
<400> 38
Asp Ile Val Met Thr Gln Ser Pro Lys Ser Met Ser Met Ser Val Gly
1 5 10 15
Glu Arg Val Thr Leu Ser Cys Lys Ala Ser Glu Asn Val Gly Thr Tyr
20 25 30
Val Ser Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Ala Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Asp Tyr His Cys Gly Gln Ser Tyr Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 39
<211> 114
<212> PRT
<213> Mus musculus
<400> 39
Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Val Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Arg Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Ile Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Ile Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Arg Val Lys Ala Glu Asp Leu Ala Leu Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Thr Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys Arg
<210> 40
<211> 110
<212> PRT
<213> Mus musculus
<400> 40
Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser
1 5 10 15
Val Gly Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr
20 25 30
Asn Thr Leu Ala Trp Tyr Leu Gln Lys Gln Gly Lys Ser Pro Gln Leu
35 40 45
Leu Val Tyr Ala Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu
65 70 75 80
Gln Ser Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His Phe Trp Gly Thr
85 90 95
Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 41
<211> 109
<212> PRT
<213> Mus musculus
<400> 41
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Ser Ala Ser Ser Ser Val Thr Ser Asn
20 25 30
Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro
85 90 95
Pro Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 42
<211> 109
<212> PRT
<213> Mus musculus
<400> 42
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Ser Ala Ser Ser Ser Val Ser Ser Asn
20 25 30
Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro
85 90 95
Pro Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 43
<211> 109
<212> PRT
<213> Mus musculus
<400> 43
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Ser Ala Ser Ser Ser Val Ser Ser Asn
20 25 30
Tyr Leu Tyr Trp Tyr His Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro
85 90 95
Pro Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 44
<211> 108
<212> PRT
<213> Mus musculus
<220>
<221> misc_feature
<222> (38)..(38)
<223> Xaa can be His or Gln
<220>
<221> misc_feature
<222> (61)..(61)
<223> Xaa can be Ala or Arg
<400> 44
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Ser Ala Ser Ser Ser Val Ser Ser Asn
20 25 30
Tyr Leu Tyr Trp Tyr Xaa Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Xaa Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala
65 70 75 80
Glu Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro Pro
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 45
<211> 109
<212> PRT
<213> Artificial
<220>
<223> Humanized Light Chain
<400> 45
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Ser Ala Ser Ser Ser Val Thr Ser Asn
20 25 30
Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro
85 90 95
Pro Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 46
<211> 109
<212> PRT
<213> Artificial
<220>
<223> Humanized Light Chain
<400> 46
Gln Ile Val Leu Thr Gln Ser Pro Ala Thr Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Leu Ser Cys Ser Ala Ser Ser Ser Val Thr Ser Asn
20 25 30
Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Arg Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Thr Leu Thr Ile Ser Arg Met Glu
65 70 75 80
Pro Glu Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro
85 90 95
Pro Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 47
<211> 109
<212> PRT
<213> Artificial
<220>
<223> Humanized Light Chain
<400> 47
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Ser Ala Ser Ser Ser Val Thr Ser Asn
20 25 30
Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Thr Leu Thr Ile Ser Ser Leu Glu
65 70 75 80
Ala Glu Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro
85 90 95
Pro Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 48
<211> 109
<212> PRT
<213> Artificial
<220>
<223> Humanized Light Chain
<400> 48
Gln Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Thr Ser Asn
20 25 30
Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Arg Leu Leu
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro
85 90 95
Pro Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 49
<211> 109
<212> PRT
<213> Artificial
<220>
<223> Humanized Light Chain
<400> 49
Gln Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Ser Ala Ser Ser Ser Val Thr Ser Asn
20 25 30
Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Arg Leu Leu
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Tyr Pro
85 90 95
Pro Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 50
<211> 10
<212> PRT
<213> Mus musculus
<400> 50
Gly Phe Ser Leu Thr Asn Tyr Gly Val Asn
1 5 10
<210> 51
<211> 8
<212> PRT
<213> Mus musculus
<400> 51
Gly Phe Ser Leu Thr Asn Tyr Gly
1 5
<210> 52
<211> 10
<212> PRT
<213> Mus musculus
<400> 52
Gly Phe Asn Ile Asn Asp Tyr Phe Met His
1 5 10
<210> 53
<211> 7
<212> PRT
<213> Mus musculus
<400> 53
Phe Asn Ile Asn Asp Tyr Phe
1 5
<210> 54
<211> 10
<212> PRT
<213> Mus musculus
<400> 54
Gly Phe Thr Phe Thr Asp Tyr Tyr Met Ser
1 5 10
<210> 55
<211> 8
<212> PRT
<213> Mus musculus
<400> 55
Gly Phe Thr Phe Thr Asp Tyr Tyr
1 5
<210> 56
<211> 10
<212> PRT
<213> Mus musculus
<400> 56
Gly Tyr Thr Phe Thr Asp Tyr Asn Met Asp
1 5 10
<210> 57
<211> 7
<212> PRT
<213> Mus musculus
<400> 57
Tyr Thr Phe Thr Asp Tyr Asn
1 5
<210> 58
<211> 10
<212> PRT
<213> Mus musculus
<400> 58
Gly Tyr Thr Phe Thr Ser Tyr Trp Met His
1 5 10
<210> 59
<211> 7
<212> PRT
<213> Mus musculus
<400> 59
Tyr Thr Phe Thr Ser Tyr Trp
1 5
<210> 60
<211> 8
<212> PRT
<213> Mus musculus
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa can be Asp or Ser
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa can be Asn or Trp
<400> 60
Gly Tyr Thr Phe Thr Xaa Tyr Xaa
1 5
<210> 61
<211> 10
<212> PRT
<213> Mus musculus
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa can be Tyr or Phe
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa can be Asp or Ser
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa can be Asn, Trp or Tyr
<220>
<221> misc_feature
<222> (10)..(10)
<223> Xaa can be His or Ser
<400> 61
Gly Xaa Thr Phe Thr Xaa Tyr Xaa Met Xaa
1 5 10
<210> 62
<211> 16
<212> PRT
<213> Mus musculus
<400> 62
Leu Ile Trp Gly Gly Gly Asp Thr Asp Tyr Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 63
<211> 7
<212> PRT
<213> Mus musculus
<400> 63
Ile Trp Gly Gly Gly Asp Thr
1 5
<210> 64
<211> 17
<212> PRT
<213> Mus musculus
<400> 64
Trp Ile Asp Pro Glu Asn Gly Asn Thr Ile Tyr Asp Pro Lys Phe Gln
1 5 10 15
Gly
<210> 65
<211> 8
<212> PRT
<213> Mus musculus
<400> 65
Ile Asp Pro Glu Asn Gly Asn Thr
1 5
<210> 66
<211> 19
<212> PRT
<213> Mus musculus
<400> 66
Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Lys Tyr Ser Ala Ser
1 5 10 15
Val Lys Gly
<210> 67
<211> 10
<212> PRT
<213> Mus musculus
<400> 67
Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr
1 5 10
<210> 68
<211> 17
<212> PRT
<213> Mus musculus
<400> 68
Asp Ile Asn Pro Asn Asn Gly Gly Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 69
<211> 8
<212> PRT
<213> Mus musculus
<400> 69
Ile Asn Pro Asn Asn Gly Gly Thr
1 5
<210> 70
<211> 17
<212> PRT
<213> Mus musculus
<400> 70
Tyr Ile Lys Pro Ser Thr Asp Asn Thr Glu Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 71
<211> 8
<212> PRT
<213> Mus musculus
<400> 71
Ile Lys Pro Ser Thr Asp Asn Thr
1 5
<210> 72
<211> 17
<212> PRT
<213> Mus musculus
<400> 72
Tyr Ile Asn Pro Ser Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 73
<211> 8
<212> PRT
<213> Mus musculus
<400> 73
Ile Asn Pro Ser Thr Asp Tyr Thr
1 5
<210> 74
<211> 17
<212> PRT
<213> Mus musculus
<400> 74
Tyr Ile Asn Pro Ser Thr Asp Tyr Ile Glu Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 75
<211> 8
<212> PRT
<213> Mus musculus
<400> 75
Ile Asn Pro Ser Thr Asp Tyr Ile
1 5
<210> 76
<211> 8
<212> PRT
<213> Mus musculus
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa can be Ile or Thr
<400> 76
Ile Asn Pro Ser Thr Asp Tyr Xaa
1 5
<210> 77
<211> 17
<212> PRT
<213> Mus musculus
<220>
<221> misc_feature
<222> (1)..(1)
<223> Xaa can be Tyr or Asp
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa can be Lys or Asn
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa can be Asn or Tyr
<220>
<221> misc_feature
<222> (9)..(9)
<223> Xaa can be Thr or Ile
<220>
<221> misc_feature
<222> (12)..(12)
<223> Xaa can be Ala or Asn
<220>
<221> misc_feature
<222> (16)..(16)
<223> Xaa can be Gln or Lys
<220>
<221> misc_feature
<222> (17)..(17)
<223> Xaa can be Gly or Asp
<400> 77
Xaa Ile Xaa Pro Ser Thr Asp Xaa Xaa Glu Tyr Xaa Gln Lys Phe Xaa
1 5 10 15
Xaa
<210> 78
<211> 17
<212> PRT
<213> Mus musculus
<400> 78
Tyr Ile Lys Pro Ser Thr Asp Asn Thr Glu Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 79
<211> 10
<212> PRT
<213> Mus musculus
<400> 79
Cys Ala Arg Asp Tyr Tyr Gly Phe Asp Tyr
1 5 10
<210> 80
<211> 7
<212> PRT
<213> Mus musculus
<400> 80
Asp Tyr Tyr Gly Phe Asp Tyr
1 5
<210> 81
<211> 18
<212> PRT
<213> Mus musculus
<400> 81
Cys Ala Arg Gly Gly Asn Tyr Leu Arg Glu Ser Tyr Tyr Tyr Ala Met
1 5 10 15
Asp Tyr
<210> 82
<211> 16
<212> PRT
<213> Mus musculus
<400> 82
Arg Gly Gly Asn Tyr Leu Arg Glu Ser Tyr Tyr Tyr Ala Met Asp Tyr
1 5 10 15
<210> 83
<211> 10
<212> PRT
<213> Mus musculus
<400> 83
Cys Ser Lys Asp Arg Gly Tyr Phe Asp Tyr
1 5 10
<210> 84
<211> 7
<212> PRT
<213> Mus musculus
<400> 84
Asp Arg Gly Tyr Phe Asp Tyr
1 5
<210> 85
<211> 18
<212> PRT
<213> Mus musculus
<400> 85
Arg Ala Arg Gly Asp Tyr Tyr Gly Ser Ser Arg Tyr Tyr Tyr Ala Met
1 5 10 15
Asp Tyr
<210> 86
<211> 16
<212> PRT
<213> Mus musculus
<400> 86
Arg Gly Asp Tyr Tyr Gly Ser Ser Arg Tyr Tyr Tyr Ala Met Asp Tyr
1 5 10 15
<210> 87
<211> 13
<212> PRT
<213> Mus musculus
<400> 87
Cys Ala Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr
1 5 10
<210> 88
<211> 10
<212> PRT
<213> Mus musculus
<400> 88
Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr
1 5 10
<210> 89
<211> 13
<212> PRT
<213> Mus musculus
<400> 89
Cys Val Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr
1 5 10
<210> 90
<211> 13
<212> PRT
<213> Mus musculus
<400> 90
Cys Ala Arg Ser Tyr Gly Asn Phe Pro Leu Met Asp Tyr
1 5 10
<210> 91
<211> 11
<212> PRT
<213> Mus musculus
<400> 91
Arg Ser Tyr Gly Asn Phe Pro Leu Met Asp Tyr
1 5 10
<210> 92
<211> 13
<212> PRT
<213> Mus musculus
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa can be Ala or Val
<220>
<221> misc_feature
<222> (8)..(8)
<223> Xaa can be Phe or Tyr
<400> 92
Cys Xaa Arg Ser Tyr Gly Asn Xaa Pro Leu Met Asp Tyr
1 5 10
<210> 93
<211> 11
<212> PRT
<213> Mus musculus
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa can be Phe or Tyr
<400> 93
Arg Ser Tyr Gly Asn Xaa Pro Leu Met Asp Tyr
1 5 10
<210> 94
<211> 117
<212> PRT
<213> Mus musculus
<400> 94
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Leu Ile Trp Gly Gly Gly Asp Thr Asp Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Glu Thr Asn Ser Leu Gln Thr Asp Asp Thr Ala Arg Tyr Tyr
85 90 95
Cys Ala Arg Asp Tyr Tyr Gly Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 95
<211> 118
<212> PRT
<213> Mus musculus
<400> 95
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Thr Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Gly Phe Ile Arg Asn Lys Ala Asn Gly Tyr Thr Thr Lys Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Thr Leu Arg Ala Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Ser Lys Asp Arg Gly Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 96
<211> 127
<212> PRT
<213> Mus musculus
<400> 96
Val Asn Ser Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg
1 5 10 15
Pro Gly Ala Leu Val Lys Leu Ser Cys Lys Ala Ser Gly Phe Asn Ile
20 25 30
Asn Asp Tyr Phe Met His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu
35 40 45
Glu Trp Ile Gly Trp Ile Asp Pro Glu Asn Gly Asn Thr Ile Tyr Asp
50 55 60
Pro Lys Phe Gln Gly Lys Ala Ser Ile Thr Ala Asp Thr Ser Ser Asn
65 70 75 80
Thr Ala Tyr Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Gly Gly Asn Tyr Leu Arg Glu Ser Tyr Tyr Tyr
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120 125
<210> 97
<211> 127
<212> PRT
<213> Mus musculus
<400> 97
Val Leu Ser Glu Val Leu Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
1 5 10 15
Pro Gly Ala Ser Val Lys Ile Pro Cys Lys Ala Ser Gly Tyr Thr Phe
20 25 30
Thr Asp Tyr Asn Met Asp Trp Val Lys Gln Ser His Gly Lys Ser Leu
35 40 45
Glu Trp Ile Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ile Tyr Asn
50 55 60
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser
65 70 75 80
Thr Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Arg Ala Arg Gly Asp Tyr Tyr Gly Ser Ser Arg Tyr Tyr Tyr
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120 125
<210> 98
<211> 119
<212> PRT
<213> Mus musculus
<400> 98
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Arg Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Lys Pro Ser Thr Asp Asn Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 99
<211> 119
<212> PRT
<213> Mus musculus
<400> 99
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Arg Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Lys Pro Ser Thr Asp Asn Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 100
<211> 119
<212> PRT
<213> Mus musculus
<400> 100
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 101
<211> 119
<212> PRT
<213> Mus musculus
<400> 101
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Thr Asp Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 102
<211> 119
<212> PRT
<213> Mus musculus
<400> 102
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Thr Asp Tyr Ile Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Gly Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Gly Asn Phe Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 103
<211> 119
<212> PRT
<213> Mus musculus
<220>
<221> misc_feature
<222> (23)..(23)
<223> Xaa can be Lys or Arg
<220>
<221> misc_feature
<222> (46)..(46)
<223> Xaa can be Glu or Asp
<220>
<221> misc_feature
<222> (52)..(52)
<223> Xaa can be Lys or Asn
<220>
<221> misc_feature
<222> (57)..(57)
<223> Xaa can be Tyr or Asn
<220>
<221> misc_feature
<222> (58)..(58)
<223> Xaa can be Thr or Ile
<220>
<221> misc_feature
<222> (77)..(77)
<223> Xaa can be Ser or Thr
<220>
<221> misc_feature
<222> (97)..(97)
<223> Xaa can be Ala or Val
<220>
<221> misc_feature
<222> (103)..(103)
<223> Xaa can be Tyr or Phe
<400> 103
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Xaa Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Xaa Trp Ile
35 40 45
Gly Tyr Ile Xaa Pro Ser Thr Asp Xaa Xaa Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Xaa Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Xaa Arg Ser Tyr Gly Asn Xaa Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 104
<211> 119
<212> PRT
<213> artificial
<220>
<223> Humanized Heavy Chain
<400> 104
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Arg Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Lys Pro Ser Thr Asp Asn Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 105
<211> 119
<212> PRT
<213> artificial
<220>
<223> Humanized Heavy Chain
<400> 105
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Lys Pro Ser Thr Asp Asn Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Asn Leu Ile Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 106
<211> 119
<212> PRT
<213> artificial
<220>
<223> Humanized Heavy Chain
<400> 106
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Lys Pro Ser Thr Asp Asn Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 107
<211> 119
<212> PRT
<213> artificial
<220>
<223> Humanized Heavy Chain
<400> 107
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Asp Trp Met
35 40 45
Gly Tyr Ile Lys Pro Ser Thr Asp Asn Thr Glu Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 108
<211> 119
<212> PRT
<213> artificial
<220>
<223> Humanized Heavy Chain
<400> 108
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Tyr Ile Lys Pro Ser Thr Asp Asn Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Gly Asn Tyr Pro Leu Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 109
<211> 1390
<212> PRT
<213> homo sapience
<400> 109
Met Lys Ala Pro Ala Val Leu Ala Pro Gly Ile Leu Val Leu Leu Phe
1 5 10 15
Thr Leu Val Gln Arg Ser Asn Gly Glu Cys Lys Glu Ala Leu Ala Lys
20 25 30
Ser Glu Met Asn Val Asn Met Lys Tyr Gln Leu Pro Asn Phe Thr Ala
35 40 45
Glu Thr Pro Ile Gln Asn Val Ile Leu His Glu His His Ile Phe Leu
50 55 60
Gly Ala Thr Asn Tyr Ile Tyr Val Leu Asn Glu Glu Asp Leu Gln Lys
65 70 75 80
Val Ala Glu Tyr Lys Thr Gly Pro Val Leu Glu His Pro Asp Cys Phe
85 90 95
Pro Cys Gln Asp Cys Ser Ser Lys Ala Asn Leu Ser Gly Gly Val Trp
100 105 110
Lys Asp Asn Ile Asn Met Ala Leu Val Val Asp Thr Tyr Tyr Asp Asp
115 120 125
Gln Leu Ile Ser Cys Gly Ser Val Asn Arg Gly Thr Cys Gln Arg His
130 135 140
Val Phe Pro His Asn His Thr Ala Asp Ile Gln Ser Glu Val His Cys
145 150 155 160
Ile Phe Ser Pro Gln Ile Glu Glu Pro Ser Gln Cys Pro Asp Cys Val
165 170 175
Val Ser Ala Leu Gly Ala Lys Val Leu Ser Ser Val Lys Asp Arg Phe
180 185 190
Ile Asn Phe Phe Val Gly Asn Thr Ile Asn Ser Ser Tyr Phe Pro Asp
195 200 205
His Pro Leu His Ser Ile Ser Val Arg Arg Leu Lys Glu Thr Lys Asp
210 215 220
Gly Phe Met Phe Leu Thr Asp Gln Ser Tyr Ile Asp Val Leu Pro Glu
225 230 235 240
Phe Arg Asp Ser Tyr Pro Ile Lys Tyr Val His Ala Phe Glu Ser Asn
245 250 255
Asn Phe Ile Tyr Phe Leu Thr Val Gln Arg Glu Thr Leu Asp Ala Gln
260 265 270
Thr Phe His Thr Arg Ile Ile Arg Phe Cys Ser Ile Asn Ser Gly Leu
275 280 285
His Ser Tyr Met Glu Met Pro Leu Glu Cys Ile Leu Thr Glu Lys Arg
290 295 300
Lys Lys Arg Ser Thr Lys Lys Glu Val Phe Asn Ile Leu Gln Ala Ala
305 310 315 320
Tyr Val Ser Lys Pro Gly Ala Gln Leu Ala Arg Gln Ile Gly Ala Ser
325 330 335
Leu Asn Asp Asp Ile Leu Phe Gly Val Phe Ala Gln Ser Lys Pro Asp
340 345 350
Ser Ala Glu Pro Met Asp Arg Ser Ala Met Cys Ala Phe Pro Ile Lys
355 360 365
Tyr Val Asn Asp Phe Phe Asn Lys Ile Val Asn Lys Asn Asn Val Arg
370 375 380
Cys Leu Gln His Phe Tyr Gly Pro Asn His Glu His Cys Phe Asn Arg
385 390 395 400
Thr Leu Leu Arg Asn Ser Ser Gly Cys Glu Ala Arg Arg Asp Glu Tyr
405 410 415
Arg Thr Glu Phe Thr Thr Ala Leu Gln Arg Val Asp Leu Phe Met Gly
420 425 430
Gln Phe Ser Glu Val Leu Leu Thr Ser Ile Ser Thr Phe Ile Lys Gly
435 440 445
Asp Leu Thr Ile Ala Asn Leu Gly Thr Ser Glu Gly Arg Phe Met Gln
450 455 460
Val Val Val Ser Arg Ser Gly Pro Ser Thr Pro His Val Asn Phe Leu
465 470 475 480
Leu Asp Ser His Pro Val Ser Pro Glu Val Ile Val Glu His Thr Leu
485 490 495
Asn Gln Asn Gly Tyr Thr Leu Val Ile Thr Gly Lys Lys Ile Thr Lys
500 505 510
Ile Pro Leu Asn Gly Leu Gly Cys Arg His Phe Gln Ser Cys Ser Gln
515 520 525
Cys Leu Ser Ala Pro Pro Phe Val Gln Cys Gly Trp Cys His Asp Lys
530 535 540
Cys Val Arg Ser Glu Glu Cys Leu Ser Gly Thr Trp Thr Gln Gln Ile
545 550 555 560
Cys Leu Pro Ala Ile Tyr Lys Val Phe Pro Asn Ser Ala Pro Leu Glu
565 570 575
Gly Gly Thr Arg Leu Thr Ile Cys Gly Trp Asp Phe Gly Phe Arg Arg
580 585 590
Asn Asn Lys Phe Asp Leu Lys Lys Thr Arg Val Leu Leu Gly Asn Glu
595 600 605
Ser Cys Thr Leu Thr Leu Ser Glu Ser Thr Met Asn Thr Leu Lys Cys
610 615 620
Thr Val Gly Pro Ala Met Asn Lys His Phe Asn Met Ser Ile Ile Ile
625 630 635 640
Ser Asn Gly His Gly Thr Thr Gln Tyr Ser Thr Phe Ser Tyr Val Asp
645 650 655
Pro Val Ile Thr Ser Ile Ser Pro Lys Tyr Gly Pro Met Ala Gly Gly
660 665 670
Thr Leu Leu Thr Leu Thr Gly Asn Tyr Leu Asn Ser Gly Asn Ser Arg
675 680 685
His Ile Ser Ile Gly Gly Lys Thr Cys Thr Leu Lys Ser Val Ser Asn
690 695 700
Ser Ile Leu Glu Cys Tyr Thr Pro Ala Gln Thr Ile Ser Thr Glu Phe
705 710 715 720
Ala Val Lys Leu Lys Ile Asp Leu Ala Asn Arg Glu Thr Ser Ile Phe
725 730 735
Ser Tyr Arg Glu Asp Pro Ile Val Tyr Glu Ile His Pro Thr Lys Ser
740 745 750
Phe Ile Ser Gly Gly Ser Thr Ile Thr Gly Val Gly Lys Asn Leu Asn
755 760 765
Ser Val Ser Val Pro Arg Met Val Ile Asn Val His Glu Ala Gly Arg
770 775 780
Asn Phe Thr Val Ala Cys Gln His Arg Ser Asn Ser Glu Ile Ile Cys
785 790 795 800
Cys Thr Thr Pro Ser Leu Gln Gln Leu Asn Leu Gln Leu Pro Leu Lys
805 810 815
Thr Lys Ala Phe Phe Met Leu Asp Gly Ile Leu Ser Lys Tyr Phe Asp
820 825 830
Leu Ile Tyr Val His Asn Pro Val Phe Lys Pro Phe Glu Lys Pro Val
835 840 845
Met Ile Ser Met Gly Asn Glu Asn Val Leu Glu Ile Lys Gly Asn Asp
850 855 860
Ile Asp Pro Glu Ala Val Lys Gly Glu Val Leu Lys Val Gly Asn Lys
865 870 875 880
Ser Cys Glu Asn Ile His Leu His Ser Glu Ala Val Leu Cys Thr Val
885 890 895
Pro Asn Asp Leu Leu Lys Leu Asn Ser Glu Leu Asn Ile Glu Trp Lys
900 905 910
Gln Ala Ile Ser Ser Thr Val Leu Gly Lys Val Ile Val Gln Pro Asp
915 920 925
Gln Asn Phe Thr Gly Leu Ile Ala Gly Val Val Ser Ile Ser Thr Ala
930 935 940
Leu Leu Leu Leu Leu Gly Phe Phe Leu Trp Leu Lys Lys Arg Lys Gln
945 950 955 960
Ile Lys Asp Leu Gly Ser Glu Leu Val Arg Tyr Asp Ala Arg Val His
965 970 975
Thr Pro His Leu Asp Arg Leu Val Ser Ala Arg Ser Val Ser Pro Thr
980 985 990
Thr Glu Met Val Ser Asn Glu Ser Val Asp Tyr Arg Ala Thr Phe Pro
995 1000 1005
Glu Asp Gln Phe Pro Asn Ser Ser Gln Asn Gly Ser Cys Arg Gln
1010 1015 1020
Val Gln Tyr Pro Leu Thr Asp Met Ser Pro Ile Leu Thr Ser Gly
1025 1030 1035
Asp Ser Asp Ile Ser Ser Pro Leu Leu Gln Asn Thr Val His Ile
1040 1045 1050
Asp Leu Ser Ala Leu Asn Pro Glu Leu Val Gln Ala Val Gln His
1055 1060 1065
Val Val Ile Gly Pro Ser Ser Leu Ile Val His Phe Asn Glu Val
1070 1075 1080
Ile Gly Arg Gly His Phe Gly Cys Val Tyr His Gly Thr Leu Leu
1085 1090 1095
Asp Asn Asp Gly Lys Lys Ile His Cys Ala Val Lys Ser Leu Asn
1100 1105 1110
Arg Ile Thr Asp Ile Gly Glu Val Ser Gln Phe Leu Thr Glu Gly
1115 1120 1125
Ile Ile Met Lys Asp Phe Ser His Pro Asn Val Leu Ser Leu Leu
1130 1135 1140
Gly Ile Cys Leu Arg Ser Glu Gly Ser Pro Leu Val Val Leu Pro
1145 1150 1155
Tyr Met Lys His Gly Asp Leu Arg Asn Phe Ile Arg Asn Glu Thr
1160 1165 1170
His Asn Pro Thr Val Lys Asp Leu Ile Gly Phe Gly Leu Gln Val
1175 1180 1185
Ala Lys Gly Met Lys Tyr Leu Ala Ser Lys Lys Phe Val His Arg
1190 1195 1200
Asp Leu Ala Ala Arg Asn Cys Met Leu Asp Glu Lys Phe Thr Val
1205 1210 1215
Lys Val Ala Asp Phe Gly Leu Ala Arg Asp Met Tyr Asp Lys Glu
1220 1225 1230
Tyr Tyr Ser Val His Asn Lys Thr Gly Ala Lys Leu Pro Val Lys
1235 1240 1245
Trp Met Ala Leu Glu Ser Leu Gln Thr Gln Lys Phe Thr Thr Lys
1250 1255 1260
Ser Asp Val Trp Ser Phe Gly Val Leu Leu Trp Glu Leu Met Thr
1265 1270 1275
Arg Gly Ala Pro Pro Tyr Pro Asp Val Asn Thr Phe Asp Ile Thr
1280 1285 1290
Val Tyr Leu Leu Gln Gly Arg Arg Leu Leu Gln Pro Glu Tyr Cys
1295 1300 1305
Pro Asp Pro Leu Tyr Glu Val Met Leu Lys Cys Trp His Pro Lys
1310 1315 1320
Ala Glu Met Arg Pro Ser Phe Ser Glu Leu Val Ser Arg Ile Ser
1325 1330 1335
Ala Ile Phe Ser Thr Phe Ile Gly Glu His Tyr Val His Val Asn
1340 1345 1350
Ala Thr Tyr Val Asn Val Lys Cys Val Ala Pro Tyr Pro Ser Leu
1355 1360 1365
Leu Ser Ser Glu Asp Asn Ala Asp Asp Glu Val Asp Thr Arg Pro
1370 1375 1380
Ala Ser Phe Trp Glu Thr Ser
1385 1390
<210> 110
<211> 1382
<212> PRT
<213> Rattus norvegicus
<400> 110
Met Lys Ala Pro Thr Ala Leu Ala Pro Gly Ile Leu Leu Leu Leu Leu
1 5 10 15
Thr Leu Ala Gln Arg Ser His Gly Glu Cys Lys Glu Ala Leu Val Lys
20 25 30
Ser Glu Met Asn Val Asn Met Lys Tyr Gln Leu Pro Asn Phe Thr Ala
35 40 45
Glu Thr Pro Ile His Asn Val Val Leu Pro Gly His His Ile Tyr Leu
50 55 60
Gly Ala Thr Asn Tyr Ile Tyr Val Leu Asn Asp Lys Asp Leu Gln Lys
65 70 75 80
Val Ser Glu Phe Lys Thr Gly Pro Val Val Glu His Pro Asp Cys Phe
85 90 95
Pro Cys Gln Asp Cys Ser Ser Lys Ala Asn Val Ser Gly Gly Val Trp
100 105 110
Lys Asp Asn Val Asn Met Ala Leu Leu Val Asp Thr Tyr Tyr Asp Asp
115 120 125
Gln Leu Ile Ser Cys Gly Ser Val Asn Arg Gly Thr Cys Gln Arg His
130 135 140
Val Leu Pro Pro Asp Asn Ala Ala Asp Ile Gln Ser Glu Val His Cys
145 150 155 160
Met Phe Ser Pro Leu Ala Glu Glu Glu Ser Gly Gln Cys Pro Asp Cys
165 170 175
Val Val Ser Ala Leu Gly Ala Lys Val Leu Leu Ser Glu Lys Asp Arg
180 185 190
Phe Ile Asn Phe Phe Val Gly Asn Thr Ile Asn Ser Ser Tyr Pro Pro
195 200 205
Asp Tyr Ser Leu His Ser Ile Ser Val Arg Arg Leu Lys Glu Thr Gln
210 215 220
Asp Gly Phe Lys Phe Leu Thr Asp Gln Ser Tyr Ile Asp Val Leu Pro
225 230 235 240
Glu Phe Arg Asp Ser Tyr Pro Ile Lys Tyr Ile His Ala Phe Glu Ser
245 250 255
Asn His Phe Ile Tyr Phe Leu Thr Val Gln Lys Glu Thr Leu Asp Ala
260 265 270
Gln Thr Phe His Thr Arg Ile Ile Arg Phe Cys Ser Val Asp Ser Gly
275 280 285
Leu His Ser Tyr Met Glu Met Pro Leu Glu Cys Ile Leu Thr Glu Lys
290 295 300
Arg Arg Lys Arg Ser Thr Arg Glu Glu Val Phe Asn Ile Leu Gln Ala
305 310 315 320
Ala Tyr Val Ser Lys Pro Gly Ala Asn Leu Ala Lys Gln Ile Gly Ala
325 330 335
Ser Pro Tyr Asp Asp Ile Leu Tyr Gly Val Phe Ala Gln Ser Lys Pro
340 345 350
Asp Ser Ala Glu Pro Met Asn Arg Ser Ala Val Cys Ala Phe Pro Ile
355 360 365
Lys Tyr Val Asn Asp Phe Phe Asn Lys Ile Val Asn Lys Asn Asn Val
370 375 380
Arg Cys Leu Gln His Phe Tyr Gly Pro Asn His Glu His Cys Phe Asn
385 390 395 400
Arg Thr Leu Leu Arg Asn Ser Ser Gly Cys Glu Val Arg Ser Asp Glu
405 410 415
Tyr Arg Thr Glu Phe Thr Thr Ala Leu Gln Arg Val Asp Leu Phe Met
420 425 430
Gly Arg Leu Asn His Val Leu Leu Thr Ser Ile Ser Thr Phe Ile Lys
435 440 445
Gly Asp Leu Thr Ile Ala Asn Leu Gly Thr Ser Glu Gly Arg Phe Met
450 455 460
Gln Val Val Leu Ser Arg Thr Ala His Phe Thr Pro His Val Asn Phe
465 470 475 480
Leu Leu Asp Ser Tyr Pro Val Ser Pro Glu Val Ile Val Glu His Pro
485 490 495
Ser Asn Gln Asn Gly Tyr Thr Leu Val Val Thr Gly Lys Lys Ile Thr
500 505 510
Lys Ile Pro Leu Asn Gly Leu Gly Cys Gly His Phe Gln Ser Cys Ser
515 520 525
Gln Cys Leu Ser Pro Pro Tyr Phe Ile Gln Cys Gly Trp Cys His Asn
530 535 540
Arg Cys Val His Ser Asn Glu Cys Pro Ser Gly Thr Trp Thr Gln Glu
545 550 555 560
Ile Cys Leu Pro Ala Val Tyr Lys Val Phe Pro Thr Ser Ala Pro Leu
565 570 575
Glu Gly Gly Thr Met Leu Thr Ile Cys Gly Trp Asp Phe Gly Phe Lys
580 585 590
Lys Asn Asn Lys Phe Asp Leu Arg Lys Thr Lys Val Leu Leu Gly Asn
595 600 605
Glu Ser Cys Thr Leu Thr Leu Ser Glu Ser Thr Thr Asn Thr Leu Lys
610 615 620
Cys Thr Val Gly Pro Ala Met Ser Glu His Phe Asn Val Ser Val Ile
625 630 635 640
Val Ser Asn Ser Arg Glu Thr Thr Gln Tyr Ser Ala Phe Ser Tyr Val
645 650 655
Asp Pro Val Ile Thr Ser Ile Ser Pro Arg Tyr Gly Pro His Ala Gly
660 665 670
Gly Thr Leu Leu Thr Leu Thr Gly Lys Tyr Leu Asn Ser Gly Asn Ser
675 680 685
Arg His Ile Ser Ile Gly Gly Lys Thr Cys Thr Leu Lys Ser Val Ser
690 695 700
Asp Ser Ile Leu Glu Cys Tyr Thr Pro Gly His Thr Val Ser Ala Glu
705 710 715 720
Phe Pro Val Lys Leu Lys Ile Asp Leu Ala Asp Arg Val Thr Ser Ser
725 730 735
Phe Ser Tyr Arg Glu Asp Pro Val Val Ser Glu Ile His Pro Thr Lys
740 745 750
Ser Phe Ile Ser Gly Gly Ser Thr Ile Thr Gly Ile Gly Lys Asn Leu
755 760 765
Asn Ser Val Ser Thr Pro Lys Leu Val Ile Glu Val His Asp Val Gly
770 775 780
Val Asn Tyr Thr Val Ala Cys Gln His Arg Ser Ser Ser Glu Ile Ile
785 790 795 800
Cys Cys Thr Thr Pro Ser Leu Arg Gln Leu Asp Leu Gln Leu Pro Leu
805 810 815
Lys Thr Lys Ala Phe Phe Leu Leu Asp Gly Ile Leu Ser Lys His Phe
820 825 830
Asp Leu Thr Tyr Val His Asp Pro Met Phe Lys Pro Phe Glu Lys Pro
835 840 845
Val Met Ile Ser Met Gly Asn Glu Asn Val Val Glu Ile Lys Gly Asp
850 855 860
Asp Ile Asp Pro Glu Ala Val Lys Gly Glu Val Leu Lys Val Gly Asn
865 870 875 880
Lys Ser Cys Glu Asn Leu His Trp His Ser Glu Ala Leu Leu Cys Thr
885 890 895
Val Pro Ser Asp Leu Leu Lys Leu Asn Gly Gly Glu Leu Asn Ile Glu
900 905 910
Trp Lys Gln Ala Val Ser Ser Thr Val Leu Gly Lys Val Ile Val Gln
915 920 925
Pro Asp Gln Asn Phe Ala Gly Leu Ile Ile Gly Ala Val Ser Ile Ser
930 935 940
Val Val Val Leu Leu Val Ser Gly Leu Phe Leu Trp Leu Arg Lys Arg
945 950 955 960
Lys His Lys Asp Leu Gly Ser Glu Leu Val Arg Tyr Asp Ala Arg Val
965 970 975
His Thr Pro His Leu Asp Arg Leu Val Ser Ala Arg Ser Val Ser Pro
980 985 990
Thr Thr Glu Met Val Ser Asn Glu Ser Val Asp Tyr Arg Ala Thr Phe
995 1000 1005
Pro Glu Asp Gln Phe Pro Asn Ser Ser Gln Asn Gly Ala Cys Arg
1010 1015 1020
Gln Val Gln Tyr Leu Leu Thr Asp Leu Ser Pro Ile Leu Thr Ser
1025 1030 1035
Gly Asp Ser Asp Ile Ser Ser Pro Leu Leu Gln Asn Thr Val His
1040 1045 1050
Ile Asp Leu Ser Ala Leu Asn Pro Glu Leu Val Gln Ala Val Pro
1055 1060 1065
His Val Val Ile Gly Pro Ser Ser Leu Ile Val His Phe Asn Glu
1070 1075 1080
Val Ile Gly Arg Gly His Phe Gly Cys Val Tyr His Gly Thr Leu
1085 1090 1095
Leu Asp Ser Asp Gly Lys Lys Ile His Cys Ala Val Lys Ser Leu
1100 1105 1110
Asn Arg Ile Thr Asp Ile Glu Glu Val Ser Gln Phe Leu Thr Glu
1115 1120 1125
Gly Ile Ile Met Lys Asp Phe Ser His Pro Asn Val Leu Ser Leu
1130 1135 1140
Leu Gly Ile Cys Leu Arg Ser Glu Gly Ser Pro Leu Val Val Leu
1145 1150 1155
Pro Tyr Met Lys His Gly Asp Leu Arg Asn Phe Ile Arg Asn Glu
1160 1165 1170
Thr His Asn Pro Thr Val Lys Asp Leu Ile Gly Phe Gly Leu Gln
1175 1180 1185
Val Ala Lys Gly Met Lys Tyr Leu Val Ser Lys Lys Phe Val His
1190 1195 1200
Arg Asp Leu Ala Ala Arg Asn Cys Met Leu Asp Glu Lys Phe Thr
1205 1210 1215
Val Lys Val Ala Asp Phe Gly Leu Ala Arg Asp Met Tyr Asp Lys
1220 1225 1230
Glu Tyr Tyr Ser Val His Asn Lys Thr Gly Ala Lys Leu Pro Val
1235 1240 1245
Lys Trp Met Ala Leu Glu Ser Leu Gln Thr Gln Lys Phe Thr Thr
1250 1255 1260
Lys Ser Asp Val Trp Ser Phe Gly Val Leu Leu Trp Glu Leu Met
1265 1270 1275
Thr Arg Gly Ala Pro Pro Tyr Pro Asp Val Asn Thr Phe Asp Ile
1280 1285 1290
Thr Ile Tyr Leu Leu Gln Gly Arg Arg Leu Leu Gln Pro Glu Tyr
1295 1300 1305
Cys Pro Asp Ala Leu Tyr Glu Val Met Leu Lys Cys Trp His Pro
1310 1315 1320
Lys Ala Glu Met Arg Pro Ser Val Ser Glu Leu Val Ser Arg Ile
1325 1330 1335
Ser Ser Ile Phe Ser Thr Phe Ile Gly Glu His Tyr Val His Val
1340 1345 1350
Asn Ala Thr Tyr Val Asn Val Lys Cys Val Ala Pro Tyr Pro Ser
1355 1360 1365
Leu Leu Pro Ser Gln Asp Asn Ile Asp Gly Glu Ala Asn Thr
1370 1375 1380
<210> 111
<211> 1379
<212> PRT
<213> Mus musculus
<400> 111
Met Lys Ala Pro Thr Val Leu Ala Pro Gly Ile Leu Val Leu Leu Leu
1 5 10 15
Ser Leu Val Gln Arg Ser His Gly Glu Cys Lys Glu Ala Leu Val Lys
20 25 30
Ser Glu Met Asn Val Asn Met Lys Tyr Gln Leu Pro Asn Phe Thr Ala
35 40 45
Glu Thr Pro Ile Gln Asn Val Val Leu His Gly His His Ile Tyr Leu
50 55 60
Gly Ala Thr Asn Tyr Ile Tyr Val Leu Asn Asp Lys Asp Leu Gln Lys
65 70 75 80
Val Ser Glu Phe Lys Thr Gly Pro Val Leu Glu His Pro Asp Cys Leu
85 90 95
Pro Cys Arg Asp Cys Ser Ser Lys Ala Asn Ser Ser Gly Gly Val Trp
100 105 110
Lys Asp Asn Ile Asn Met Ala Leu Leu Val Asp Thr Tyr Tyr Asp Asp
115 120 125
Gln Leu Ile Ser Cys Gly Ser Val Asn Arg Gly Thr Cys Gln Arg His
130 135 140
Val Leu Pro Pro Asp Asn Ser Ala Asp Ile Gln Ser Glu Val His Cys
145 150 155 160
Met Phe Ser Pro Glu Glu Glu Ser Gly Gln Cys Pro Asp Cys Val Val
165 170 175
Ser Ala Leu Gly Ala Lys Val Leu Leu Ser Glu Lys Asp Arg Phe Ile
180 185 190
Asn Phe Phe Val Gly Asn Thr Ile Asn Ser Ser Tyr Pro Pro Gly Tyr
195 200 205
Ser Leu His Ser Ile Ser Val Arg Arg Leu Lys Glu Thr Gln Asp Gly
210 215 220
Phe Lys Phe Leu Thr Asp Gln Ser Tyr Ile Asp Val Leu Pro Glu Phe
225 230 235 240
Leu Asp Ser Tyr Pro Ile Lys Tyr Ile His Ala Phe Glu Ser Asn His
245 250 255
Phe Ile Tyr Phe Leu Thr Val Gln Lys Glu Thr Leu Asp Ala Gln Thr
260 265 270
Phe His Thr Arg Ile Ile Arg Phe Cys Ser Val Asp Ser Gly Leu His
275 280 285
Ser Tyr Met Glu Met Pro Leu Glu Cys Ile Leu Thr Glu Lys Arg Arg
290 295 300
Lys Arg Ser Thr Arg Glu Glu Val Phe Asn Ile Leu Gln Ala Ala Tyr
305 310 315 320
Val Ser Lys Pro Gly Ala Asn Leu Ala Lys Gln Ile Gly Ala Ser Pro
325 330 335
Ser Asp Asp Ile Leu Phe Gly Val Phe Ala Gln Ser Lys Pro Asp Ser
340 345 350
Ala Glu Pro Val Asn Arg Ser Ala Val Cys Ala Phe Pro Ile Lys Tyr
355 360 365
Val Asn Asp Phe Phe Asn Lys Ile Val Asn Lys Asn Asn Val Arg Cys
370 375 380
Leu Gln His Phe Tyr Gly Pro Asn His Glu His Cys Phe Asn Arg Thr
385 390 395 400
Leu Leu Arg Asn Ser Ser Gly Cys Glu Ala Arg Ser Asp Glu Tyr Arg
405 410 415
Thr Glu Phe Thr Thr Ala Leu Gln Arg Val Asp Leu Phe Met Gly Arg
420 425 430
Leu Asn Gln Val Leu Leu Thr Ser Ile Ser Thr Phe Ile Lys Gly Asp
435 440 445
Leu Thr Ile Ala Asn Leu Gly Thr Ser Glu Gly Arg Phe Met Gln Val
450 455 460
Val Leu Ser Arg Thr Ala His Leu Thr Pro His Val Asn Phe Leu Leu
465 470 475 480
Asp Ser His Pro Val Ser Pro Glu Val Ile Val Glu His Pro Ser Asn
485 490 495
Gln Asn Gly Tyr Thr Leu Val Val Thr Gly Lys Lys Ile Thr Lys Ile
500 505 510
Pro Leu Asn Gly Leu Gly Cys Gly His Phe Gln Ser Cys Ser Gln Cys
515 520 525
Leu Ser Ala Pro Tyr Phe Ile Gln Cys Gly Trp Cys His Asn Gln Cys
530 535 540
Val Arg Phe Asp Glu Cys Pro Ser Gly Thr Trp Thr Gln Glu Ile Cys
545 550 555 560
Leu Pro Ala Val Tyr Lys Val Phe Pro Thr Ser Ala Pro Leu Glu Gly
565 570 575
Gly Thr Val Leu Thr Ile Cys Gly Trp Asp Phe Gly Phe Arg Lys Asn
580 585 590
Asn Lys Phe Asp Leu Arg Lys Thr Lys Val Leu Leu Gly Asn Glu Ser
595 600 605
Cys Thr Leu Thr Leu Ser Glu Ser Thr Thr Asn Thr Leu Lys Cys Thr
610 615 620
Val Gly Pro Ala Met Ser Glu His Phe Asn Val Ser Val Ile Ile Ser
625 630 635 640
Asn Ser Arg Glu Thr Thr Gln Tyr Ser Ala Phe Ser Tyr Val Asp Pro
645 650 655
Val Ile Thr Ser Ile Ser Pro Arg Tyr Gly Pro Gln Ala Gly Gly Thr
660 665 670
Leu Leu Thr Leu Thr Gly Lys Tyr Leu Asn Ser Gly Asn Ser Arg His
675 680 685
Ile Ser Ile Gly Gly Lys Thr Cys Thr Leu Lys Ser Val Ser Asp Ser
690 695 700
Ile Leu Glu Cys Tyr Thr Pro Ala Gln Thr Thr Ser Asp Glu Phe Pro
705 710 715 720
Val Lys Leu Lys Ile Asp Leu Ala Asn Arg Glu Thr Ser Ser Phe Ser
725 730 735
Tyr Arg Glu Asp Pro Val Val Tyr Glu Ile His Pro Thr Lys Ser Phe
740 745 750
Ile Ser Gly Gly Ser Thr Ile Thr Gly Ile Gly Lys Thr Leu Asn Ser
755 760 765
Val Ser Leu Pro Lys Leu Val Ile Asp Val His Glu Val Gly Val Asn
770 775 780
Tyr Thr Val Ala Cys Gln His Arg Ser Asn Ser Glu Ile Ile Cys Cys
785 790 795 800
Thr Thr Pro Ser Leu Lys Gln Leu Gly Leu Gln Leu Pro Leu Lys Thr
805 810 815
Lys Ala Phe Phe Leu Leu Asp Gly Ile Leu Ser Lys His Phe Asp Leu
820 825 830
Thr Tyr Val His Asn Pro Val Phe Glu Pro Phe Glu Lys Pro Val Met
835 840 845
Ile Ser Met Gly Asn Glu Asn Val Val Glu Ile Lys Gly Asn Asn Ile
850 855 860
Asp Pro Glu Ala Val Lys Gly Glu Val Leu Lys Val Gly Asn Gln Ser
865 870 875 880
Cys Glu Ser Leu His Trp His Ser Gly Ala Val Leu Cys Thr Val Pro
885 890 895
Ser Asp Leu Leu Lys Leu Asn Ser Glu Leu Asn Ile Glu Trp Lys Gln
900 905 910
Ala Val Ser Ser Thr Val Leu Gly Lys Val Ile Val Gln Pro Asp Gln
915 920 925
Asn Phe Ala Gly Leu Ile Ile Gly Ala Val Ser Ile Ser Val Val Val
930 935 940
Leu Leu Leu Ser Gly Leu Phe Leu Trp Met Arg Lys Arg Lys His Lys
945 950 955 960
Asp Leu Gly Ser Glu Leu Val Arg Tyr Asp Ala Arg Val His Thr Pro
965 970 975
His Leu Asp Arg Leu Val Ser Ala Arg Ser Val Ser Pro Thr Thr Glu
980 985 990
Met Val Ser Asn Glu Ser Val Asp Tyr Arg Ala Thr Phe Pro Glu Asp
995 1000 1005
Gln Phe Pro Asn Ser Ser Gln Asn Gly Ala Cys Arg Gln Val Gln
1010 1015 1020
Tyr Pro Leu Thr Asp Leu Ser Pro Ile Leu Thr Ser Gly Asp Ser
1025 1030 1035
Asp Ile Ser Ser Pro Leu Leu Gln Asn Thr Val His Ile Asp Leu
1040 1045 1050
Ser Ala Leu Asn Pro Glu Leu Val Gln Ala Val Gln His Val Val
1055 1060 1065
Ile Gly Pro Ser Ser Leu Ile Val His Phe Asn Glu Val Ile Gly
1070 1075 1080
Arg Gly His Phe Gly Cys Val Tyr His Gly Thr Leu Leu Asp Asn
1085 1090 1095
Asp Gly Lys Lys Ile His Cys Ala Val Lys Ser Leu Asn Arg Ile
1100 1105 1110
Thr Asp Ile Glu Glu Val Ser Gln Phe Leu Thr Glu Gly Ile Ile
1115 1120 1125
Met Lys Asp Phe Ser His Pro Asn Val Leu Ser Leu Leu Gly Ile
1130 1135 1140
Cys Leu Arg Ser Glu Gly Ser Pro Leu Val Val Leu Pro Tyr Met
1145 1150 1155
Lys His Gly Asp Leu Arg Asn Phe Ile Arg Asn Glu Thr His Asn
1160 1165 1170
Pro Thr Val Lys Asp Leu Ile Gly Phe Gly Leu Gln Val Ala Lys
1175 1180 1185
Gly Met Lys Tyr Leu Ala Ser Lys Lys Phe Val His Arg Asp Leu
1190 1195 1200
Ala Ala Arg Asn Cys Met Leu Asp Glu Lys Phe Thr Val Lys Val
1205 1210 1215
Ala Asp Phe Gly Leu Ala Arg Asp Met Tyr Asp Lys Glu Tyr Tyr
1220 1225 1230
Ser Val His Asn Lys Thr Gly Ala Lys Leu Pro Val Lys Trp Met
1235 1240 1245
Ala Leu Glu Ser Leu Gln Thr Gln Lys Phe Thr Thr Lys Ser Asp
1250 1255 1260
Val Trp Ser Phe Gly Val Leu Leu Trp Glu Leu Met Thr Arg Gly
1265 1270 1275
Ala Pro Pro Tyr Pro Asp Val Asn Thr Phe Asp Ile Thr Ile Tyr
1280 1285 1290
Leu Leu Gln Gly Arg Arg Leu Leu Gln Pro Glu Tyr Cys Pro Asp
1295 1300 1305
Ala Leu Tyr Glu Val Met Leu Lys Cys Trp His Pro Lys Ala Glu
1310 1315 1320
Met Arg Pro Ser Phe Ser Glu Leu Val Ser Arg Ile Ser Ser Ile
1325 1330 1335
Phe Ser Thr Phe Ile Gly Glu His Tyr Val His Val Asn Ala Thr
1340 1345 1350
Tyr Val Asn Val Lys Cys Val Ala Pro Tyr Pro Ser Leu Leu Pro
1355 1360 1365
Ser Gln Asp Asn Ile Asp Gly Glu Gly Asn Thr
1370 1375
<210> 112
<211> 1382
<212> PRT
<213> Canis familiaris
<400> 112
Met Lys Ala Pro Ala Val Leu Ala Pro Gly Ile Leu Val Leu Leu Phe
1 5 10 15
Thr Leu Val Gln Lys Ser Tyr Gly Glu Cys Lys Glu Ala Leu Val Lys
20 25 30
Ser Glu Met Asn Val Asn Met Lys Tyr Gln Leu Pro Asn Phe Thr Ala
35 40 45
Glu Thr Pro Ile Gln Asn Val Val Leu His Lys His His Ile Tyr Leu
50 55 60
Gly Ala Val Asn Tyr Ile Tyr Val Leu Asn Asp Lys Asp Leu Gln Lys
65 70 75 80
Val Ala Glu Tyr Lys Thr Gly Pro Val Leu Glu His Pro Asp Cys Ser
85 90 95
Pro Cys Gln Asp Cys Ser His Lys Ala Asn Leu Ser Gly Gly Val Trp
100 105 110
Glu Asp Asn Ile Asn Met Ala Leu Leu Val Asp Thr Tyr Tyr Asp Asp
115 120 125
Gln Leu Ile Ser Cys Gly Ser Val His Arg Gly Thr Cys Gln Arg His
130 135 140
Ile Leu Pro Pro Ser Asn Ile Ala Asp Ile Gln Ser Glu Val His Cys
145 150 155 160
Met Tyr Ser Ser Gln Ala Asp Glu Glu Pro Ser Gln Cys Pro Asp Cys
165 170 175
Val Val Ser Ala Leu Gly Thr Lys Val Leu Ile Ser Glu Lys Asp Arg
180 185 190
Phe Ile Asn Phe Phe Val Gly Asn Thr Ile Asn Ser Ser Asp His Pro
195 200 205
Asp His Ser Leu His Ser Ile Ser Val Arg Arg Leu Lys Glu Thr Gln
210 215 220
Asp Gly Phe Lys Phe Leu Thr Asp Gln Ser Tyr Ile Asp Val Leu Pro
225 230 235 240
Glu Phe Arg Asp Ser Tyr Pro Ile Lys Tyr Val His Ala Phe Glu Ser
245 250 255
Asn His Phe Ile Tyr Phe Leu Thr Val Gln Arg Glu Thr Leu Asp Ala
260 265 270
Gln Thr Phe His Thr Arg Ile Ile Arg Phe Cys Ser Val Asp Ser Gly
275 280 285
Leu His Ser Tyr Met Glu Met Pro Leu Glu Cys Ile Leu Thr Glu Lys
290 295 300
Arg Arg Lys Arg Ser Thr Arg Glu Glu Val Phe Asn Ile Leu Gln Ala
305 310 315 320
Ala Tyr Val Ser Lys Pro Gly Ala His Leu Ala Lys Gln Ile Gly Ala
325 330 335
Asn Leu Asn Asp Asp Ile Leu Tyr Gly Val Phe Ala Gln Ser Lys Pro
340 345 350
Asp Ser Ala Glu Pro Met Asn Arg Ser Ala Val Cys Ala Phe Pro Ile
355 360 365
Lys Tyr Val Asn Glu Phe Phe Asn Lys Ile Val Asn Lys Asn Asn Val
370 375 380
Arg Cys Leu Gln His Phe Tyr Gly Pro Asn His Glu His Cys Phe Asn
385 390 395 400
Arg Thr Leu Leu Arg Asn Ser Ser Gly Cys Glu Ala Arg Asn Asp Glu
405 410 415
Tyr Arg Thr Glu Phe Thr Thr Ala Leu Gln Arg Val Asp Leu Phe Met
420 425 430
Gly Gln Phe Asn Gln Val Leu Leu Thr Ser Ile Ser Thr Phe Ile Lys
435 440 445
Gly Asp Leu Thr Ile Ala Asn Leu Gly Thr Ser Glu Gly Arg Phe Met
450 455 460
Gln Val Val Val Ser Arg Ser Gly Leu Ser Thr Pro His Val Asn Phe
465 470 475 480
Arg Leu Asp Ser His Pro Val Ser Pro Glu Ala Ile Val Glu His Pro
485 490 495
Leu Asn Gln Asn Gly Tyr Thr Leu Val Val Thr Gly Lys Lys Ile Thr
500 505 510
Arg Ile Pro Leu Asn Gly Leu Gly Cys Glu His Phe Gln Ser Cys Ser
515 520 525
Gln Cys Leu Ser Ala Pro Pro Phe Val Gln Cys Gly Trp Cys His Asp
530 535 540
Arg Cys Val His Leu Glu Glu Cys Pro Thr Gly Ala Trp Thr Gln Glu
545 550 555 560
Val Cys Leu Pro Ala Ile Tyr Glu Val Phe Pro Thr Ser Ala Pro Leu
565 570 575
Glu Gly Gly Thr Val Leu Thr Val Cys Gly Trp Asp Phe Gly Phe Arg
580 585 590
Arg Asn Asn Lys Phe Asp Leu Lys Lys Thr Lys Val Phe Leu Gly Asn
595 600 605
Glu Ser Cys Thr Leu Thr Leu Ser Glu Ser Thr Thr Asn Met Leu Lys
610 615 620
Cys Thr Val Gly Pro Ala Val Asn Glu His Phe Asn Ile Ser Ile Ile
625 630 635 640
Ile Ser Asn Gly Arg Gly Thr Ala Gln Tyr Ser Thr Phe Ser Tyr Val
645 650 655
Asp Pro Ile Ile Thr Ser Ile Ser Pro Ser Tyr Gly Pro Lys Asn Gly
660 665 670
Gly Thr Leu Leu Thr Leu Thr Gly Lys Tyr Leu Asn Ser Gly Asn Ser
675 680 685
Arg His Ile Ser Met Gly Gly Lys Thr Cys Thr Leu Lys Ser Val Ser
690 695 700
Asp Ser Ile Leu Glu Cys Tyr Thr Pro Ala Gln Ala Thr Ala Thr Glu
705 710 715 720
Phe Pro Ile Lys Leu Lys Ile Asp Leu Ala Asn Arg Glu Met Asn Ser
725 730 735
Phe Ser Tyr Gln Glu Asp Pro Ile Val Tyr Ala Ile His Pro Thr Lys
740 745 750
Ser Phe Ile Ser Gly Gly Ser Thr Ile Thr Ala Val Gly Lys Asn Leu
755 760 765
Asn Ser Val Ser Val Leu Arg Met Val Ile Asp Val His Glu Thr Arg
770 775 780
Arg Asn Phe Thr Val Ala Cys Gln His Arg Ser Asn Ser Glu Ile Ile
785 790 795 800
Cys Cys Thr Thr Pro Ser Leu Gln Gln Leu Asn Leu Gln Leu Pro Leu
805 810 815
Lys Thr Lys Ala Phe Phe Met Leu Asp Gly Ile His Ser Lys Tyr Phe
820 825 830
Asp Leu Ile Tyr Val His Asn Pro Val Phe Lys Pro Phe Glu Lys Pro
835 840 845
Val Met Ile Ser Ile Gly Asn Glu Asn Val Leu Glu Ile Lys Gly Asn
850 855 860
Asp Ile Asp Pro Glu Ala Val Lys Gly Glu Val Leu Lys Val Gly Asn
865 870 875 880
Lys Ser Cys Glu Thr Ile Tyr Ser Asp Ser Lys Ala Val Leu Cys Lys
885 890 895
Val Pro Asn Asp Leu Leu Lys Leu Asn Asn Glu Leu Asn Ile Glu Trp
900 905 910
Lys Gln Ala Val Ser Ser Thr Val Leu Gly Lys Val Ile Val Gln Pro
915 920 925
Asp Gln Asn Phe Thr Gly Leu Ile Ala Gly Val Ile Ser Ile Ser Thr
930 935 940
Ile Val Leu Leu Leu Leu Gly Leu Phe Leu Trp Leu Lys Arg Lys Lys
945 950 955 960
Gln Ile Lys Asp Leu Gly Ser Glu Leu Val Arg Tyr Asp Ala Arg Val
965 970 975
His Thr Pro His Leu Asp Arg Leu Val Ser Ala Arg Ser Val Ser Pro
980 985 990
Thr Thr Glu Met Val Ser Asn Glu Ser Val Asp Tyr Arg Ala Thr Phe
995 1000 1005
Pro Glu Asp Gln Phe Pro Asn Ser Ser Gln Asn Gly Ser Cys Arg
1010 1015 1020
Gln Val Gln Tyr Pro Leu Thr Asp Leu Ser Pro Met Leu Thr Ser
1025 1030 1035
Gly Asp Ser Asp Ile Ser Ser Pro Leu Leu Gln Asn Thr Val His
1040 1045 1050
Ile Asp Leu Ser Ala Leu Asn Pro Glu Leu Val Gln Ala Val Gln
1055 1060 1065
His Val Val Ile Gly Pro Ser Ser Leu Ile Val His Phe Asn Glu
1070 1075 1080
Val Ile Gly Arg Gly His Phe Gly Cys Val Tyr His Gly Thr Leu
1085 1090 1095
Leu Asp Asn Asp Asp Lys Lys Ile His Cys Ala Val Lys Ser Leu
1100 1105 1110
Asn Arg Ile Thr Asp Ile Gly Glu Val Ser Gln Phe Leu Thr Glu
1115 1120 1125
Gly Ile Ile Met Lys Asp Phe Ser His Pro Asn Val Leu Ser Leu
1130 1135 1140
Leu Gly Ile Cys Leu Arg Ser Glu Gly Ser Pro Leu Val Val Leu
1145 1150 1155
Pro Tyr Met Lys His Gly Asp Leu Arg Asn Phe Ile Arg Asn Glu
1160 1165 1170
Thr His Asn Pro Thr Val Lys Asp Leu Ile Gly Phe Gly Leu Gln
1175 1180 1185
Val Ala Lys Gly Met Lys Tyr Leu Ala Ser Lys Lys Phe Val His
1190 1195 1200
Arg Asp Leu Ala Ala Arg Asn Cys Met Leu Asp Glu Lys Phe Thr
1205 1210 1215
Val Lys Val Ala Asp Phe Gly Leu Ala Arg Asp Met Tyr Asp Lys
1220 1225 1230
Glu Tyr Tyr Ser Val His Asn Lys Thr Gly Ala Lys Leu Pro Val
1235 1240 1245
Lys Trp Met Ala Leu Glu Ser Leu Gln Thr Gln Lys Phe Thr Thr
1250 1255 1260
Lys Ser Asp Val Trp Ser Phe Gly Val Leu Leu Trp Glu Leu Met
1265 1270 1275
Thr Arg Gly Ala Pro Pro Tyr Pro Asp Val Asn Thr Phe Asp Ile
1280 1285 1290
Thr Val Tyr Leu Leu Gln Gly Arg Arg Leu Leu Gln Pro Glu Tyr
1295 1300 1305
Cys Pro Asp Pro Leu Tyr Glu Val Met Leu Lys Cys Trp His Pro
1310 1315 1320
Arg Ala Glu Leu Arg Pro Ser Phe Ser Glu Leu Val Ser Arg Ile
1325 1330 1335
Ser Ala Ile Phe Ser Thr Phe Ile Gly Glu His Tyr Val His Val
1340 1345 1350
Asn Ala Thr Tyr Val Asn Val Lys Cys Val Ala Pro Tyr Pro Ser
1355 1360 1365
Leu Leu Ser Ser Gln Asp Asn Ile Asp Gly Glu Gly Asp Thr
1370 1375 1380
<210> 113
<211> 1381
<212> PRT
<213> Macaca mulatta
<400> 113
Met Lys Ala Pro Ala Val Leu Val Pro Gly Ile Leu Val Leu Leu Phe
1 5 10 15
Thr Leu Val Gln Arg Ser Asn Gly Glu Cys Lys Glu Ala Leu Ala Lys
20 25 30
Ser Glu Met Asn Val Asn Met Lys Tyr Gln Leu Pro Asn Phe Thr Ala
35 40 45
Glu Thr Ala Ile Gln Asn Val Ile Leu His Glu His His Ile Phe Leu
50 55 60
Gly Ala Thr Asn Tyr Ile Tyr Val Leu Asn Glu Glu Asp Leu Gln Lys
65 70 75 80
Val Ala Glu Tyr Lys Thr Gly Pro Val Leu Glu His Pro Asp Cys Phe
85 90 95
Pro Cys Gln Asp Cys Ser Ser Lys Ala Asn Leu Ser Gly Gly Val Trp
100 105 110
Lys Asp Asn Ile Asn Met Ala Leu Val Val Asp Thr Tyr Tyr Asp Asp
115 120 125
Gln Leu Ile Ser Cys Gly Ser Val Asn Arg Gly Thr Cys Gln Arg His
130 135 140
Val Phe Pro His Asn His Thr Ala Asp Ile Gln Ser Glu Val His Cys
145 150 155 160
Ile Phe Ser Pro Gln Ile Glu Glu Pro Asn Gln Cys Pro Asp Cys Val
165 170 175
Val Ser Ala Leu Gly Ala Lys Val Leu Ser Ser Val Lys Asp Arg Phe
180 185 190
Ile Asn Phe Phe Val Gly Asn Thr Ile Asn Ser Ser Tyr Phe Pro His
195 200 205
His Pro Leu His Ser Ile Ser Val Arg Arg Leu Lys Glu Thr Lys Asp
210 215 220
Gly Phe Met Phe Leu Thr Asp Gln Ser Tyr Ile Asp Val Leu Pro Glu
225 230 235 240
Phe Arg Asp Ser Tyr Pro Ile Lys Tyr Ile His Ala Phe Glu Ser Asn
245 250 255
Asn Phe Ile Tyr Phe Leu Thr Val Gln Arg Glu Thr Leu Asn Ala Gln
260 265 270
Thr Phe His Thr Arg Ile Ile Arg Phe Cys Ser Leu Asn Ser Gly Leu
275 280 285
His Ser Tyr Met Glu Met Pro Leu Glu Cys Ile Leu Thr Glu Lys Arg
290 295 300
Lys Lys Arg Ser Thr Lys Lys Glu Val Phe Asn Ile Leu Gln Ala Ala
305 310 315 320
Tyr Val Ser Lys Pro Gly Ala Gln Leu Ala Arg Gln Ile Gly Ala Ser
325 330 335
Leu Asn Asp Asp Ile Leu Phe Gly Val Phe Ala Gln Ser Lys Pro Asp
340 345 350
Ser Ala Glu Pro Met Asp Arg Ser Ala Met Cys Ala Phe Pro Ile Lys
355 360 365
Tyr Val Asn Asp Phe Phe Asn Lys Ile Val Asn Lys Asn Asn Val Arg
370 375 380
Cys Leu Gln His Phe Tyr Gly Pro Asn His Glu His Cys Phe Asn Arg
385 390 395 400
Thr Leu Leu Arg Asn Ser Ser Gly Cys Glu Ala Arg Arg Asp Glu Tyr
405 410 415
Arg Ala Glu Phe Thr Thr Ala Leu Gln Arg Val Asp Leu Phe Met Gly
420 425 430
Gln Phe Ser Glu Val Leu Leu Thr Ser Ile Ser Thr Phe Val Lys Gly
435 440 445
Asp Leu Thr Ile Ala Asn Leu Gly Thr Ser Glu Gly Arg Phe Met Gln
450 455 460
Val Val Val Ser Arg Ser Gly Pro Ser Thr Pro His Val Asn Phe Leu
465 470 475 480
Leu Asp Ser His Pro Val Ser Pro Glu Val Ile Val Glu His Pro Leu
485 490 495
Asn Gln Asn Gly Tyr Thr Leu Val Val Thr Gly Lys Lys Ile Thr Lys
500 505 510
Ile Pro Leu Asn Gly Leu Gly Cys Arg His Phe Gln Ser Cys Ser Gln
515 520 525
Cys Leu Ser Ala Pro Pro Phe Val Gln Cys Gly Trp Cys His Asp Lys
530 535 540
Cys Val Arg Ser Glu Glu Cys Pro Ser Gly Thr Trp Thr Gln Gln Ile
545 550 555 560
Cys Leu Pro Ala Ile Tyr Lys Val Phe Pro Thr Ser Ala Pro Leu Glu
565 570 575
Gly Gly Thr Arg Leu Thr Ile Cys Gly Trp Asp Phe Gly Phe Arg Arg
580 585 590
Asn Asn Lys Phe Asp Leu Lys Lys Thr Arg Val Leu Leu Gly Asn Glu
595 600 605
Ser Cys Thr Leu Thr Leu Ser Glu Ser Thr Met Asn Thr Leu Lys Cys
610 615 620
Thr Val Gly Pro Ala Met Asn Lys His Phe Asn Met Ser Ile Ile Ile
625 630 635 640
Ser Asn Gly His Gly Thr Thr Gln Tyr Ser Thr Phe Ser Tyr Val Asp
645 650 655
Pro Ile Ile Thr Ser Ile Ser Pro Lys Tyr Gly Pro Met Ala Gly Gly
660 665 670
Thr Leu Leu Thr Leu Thr Gly Asn Tyr Leu Asn Ser Gly Asn Ser Arg
675 680 685
His Ile Ser Ile Gly Gly Lys Thr Cys Thr Leu Lys Ser Val Ser Asn
690 695 700
Ser Ile Leu Glu Cys Tyr Thr Pro Ala Gln Thr Ile Ser Thr Glu Phe
705 710 715 720
Ala Val Lys Leu Lys Ile Asp Leu Ala Asn Arg Glu Thr Ser Ile Phe
725 730 735
Ser Tyr Arg Glu Asp Pro Ile Val Tyr Glu Ile His Pro Thr Lys Ser
740 745 750
Phe Ile Ser Gly Gly Ser Thr Ile Thr Gly Val Gly Lys Asn Leu His
755 760 765
Ser Val Ser Val Pro Arg Met Val Ile Asn Val His Glu Ala Gly Arg
770 775 780
Asn Phe Thr Val Ala Cys Gln His Arg Ser Asn Ser Glu Ile Ile Cys
785 790 795 800
Cys Thr Thr Pro Ser Leu Gln Gln Leu Asn Leu Gln Leu Pro Leu Lys
805 810 815
Thr Lys Ala Phe Phe Met Leu Asp Gly Ile Leu Ser Lys Tyr Phe Asp
820 825 830
Leu Ile Tyr Val His Asn Pro Val Phe Lys Pro Phe Glu Lys Pro Val
835 840 845
Met Ile Ser Met Gly Asn Glu Asn Val Leu Glu Ile Lys Gly Asn Asp
850 855 860
Ile Asp Pro Glu Ala Val Lys Gly Glu Val Leu Lys Val Gly Asn Lys
865 870 875 880
Ser Cys Glu Asn Ile His Leu His Ser Glu Ala Val Leu Cys Thr Val
885 890 895
Pro Asn Asp Leu Leu Lys Leu Asn Ser Glu Leu Asn Ile Glu Trp Lys
900 905 910
Gln Ala Ile Ser Ser Thr Val Leu Gly Lys Val Ile Val Gln Pro Asp
915 920 925
Gln Asn Phe Thr Gly Leu Ile Ala Gly Val Val Ser Ile Ser Ile Ala
930 935 940
Leu Leu Leu Leu Leu Gly Leu Phe Leu Trp Leu Lys Lys Arg Lys Gln
945 950 955 960
Ile Lys Asp Leu Gly Ser Glu Leu Val Arg Tyr Asp Ala Arg Val His
965 970 975
Thr Pro His Leu Asp Arg Leu Val Ser Ala Arg Ser Val Ser Pro Thr
980 985 990
Thr Glu Met Val Ser Asn Glu Ser Val Asp Tyr Arg Ala Thr Phe Pro
995 1000 1005
Glu Asp Gln Phe Pro Asn Ser Ser Gln Asn Gly Ser Cys Arg Gln
1010 1015 1020
Val Gln Tyr Pro Leu Thr Asp Met Ser Pro Ile Leu Thr Ser Gly
1025 1030 1035
Asp Ser Asp Ile Ser Ser Pro Leu Leu Gln Asn Thr Val His Ile
1040 1045 1050
Asp Leu Ser Ala Leu Asn Pro Glu Leu Val Gln Ala Val Gln His
1055 1060 1065
Val Val Ile Gly Pro Ser Ser Leu Ile Val His Phe Asn Glu Val
1070 1075 1080
Ile Gly Arg Gly His Phe Gly Cys Val Tyr His Gly Thr Leu Leu
1085 1090 1095
Asp Asn Asp Gly Lys Lys Ile His Cys Ala Val Lys Ser Leu Asn
1100 1105 1110
Arg Ile Thr Asp Ile Gly Glu Val Ser Gln Phe Leu Thr Glu Gly
1115 1120 1125
Ile Ile Met Lys Asp Phe Ser His Pro Asn Val Leu Ser Leu Leu
1130 1135 1140
Gly Ile Cys Leu Arg Ser Glu Gly Ser Pro Leu Val Val Leu Pro
1145 1150 1155
Tyr Met Lys His Gly Asp Leu Arg Asn Phe Ile Arg Asn Glu Thr
1160 1165 1170
His Asn Pro Thr Val Lys Asp Leu Ile Gly Phe Gly Leu Gln Val
1175 1180 1185
Ala Lys Gly Met Lys Tyr Leu Ala Ser Lys Lys Phe Val His Arg
1190 1195 1200
Asp Leu Ala Ala Arg Asn Cys Met Leu Asp Glu Lys Phe Thr Val
1205 1210 1215
Lys Val Ala Asp Phe Gly Leu Ala Arg Asp Met Tyr Asp Lys Glu
1220 1225 1230
Tyr Tyr Ser Val His Asn Lys Thr Gly Ala Lys Leu Pro Val Lys
1235 1240 1245
Trp Met Ala Leu Glu Ser Leu Gln Thr Gln Lys Phe Thr Thr Lys
1250 1255 1260
Ser Asp Val Trp Ser Phe Gly Val Leu Leu Trp Glu Leu Met Thr
1265 1270 1275
Arg Gly Ala Pro Pro Tyr Pro Asp Val Asn Thr Phe Asp Ile Thr
1280 1285 1290
Val Tyr Leu Leu Gln Gly Arg Arg Leu Leu Gln Pro Glu Tyr Cys
1295 1300 1305
Pro Asp Pro Leu Tyr Glu Val Met Leu Lys Cys Trp His Pro Lys
1310 1315 1320
Ala Glu Met Arg Pro Ser Phe Ser Glu Leu Val Ser Arg Ile Ser
1325 1330 1335
Ala Ile Phe Ser Thr Phe Ile Gly Glu His Tyr Val His Val Asn
1340 1345 1350
Ala Thr Tyr Val Asn Val Lys Cys Val Ala Pro Tyr Pro Ser Leu
1355 1360 1365
Leu Ser Ser Glu Asp Asn Ala Asp Asp Glu Val Asp Thr
1370 1375 1380
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННЫЕ КОНЪЮГАТЫ ИЗ МОНОКЛОНАЛЬНЫХ АГЕНТОВ, СВЯЗЫВАЮЩИХ cMET, И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2813828C2 |
| CD37-СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ИММУНОКОНЪЮГАТЫ | 2011 |
|
RU2742743C2 |
| Антитела против ингибитора пути тканевого фактора и их применения | 2016 |
|
RU2815681C1 |
| БИСПЕЦИФИЧЕСКИЕ ТРЕХВАЛЕНТНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С КЛАУДИНОМ 6 ИЛИ КЛАУДИНОМ 18.2, И CD3, ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ С ЭКСПРЕССИЕЙ КЛАУДИНА | 2017 |
|
RU2798988C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ИЗ АНТИТЕЛА К ПРОГАСТРИНУ И ИММУНОТЕРАПИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2784604C2 |
| АНТИТЕЛА К C10ORF54 И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2714232C2 |
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18.2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2822550C2 |
| СОБАЧЬИ АНТИТЕЛА С МОДИФИЦИРОВАННЫМИ ПОСЛЕДОВАТЕЛЬНОСТЯМИ CH2-CH3 | 2014 |
|
RU2815059C2 |
| АНТИТЕЛА К C10ORF54 И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2819627C1 |
| УСОВЕРШЕНСТВОВАННЫЕ АГЕНТЫ, СВЯЗЫВАЮЩИЕ СЫВОРОТОЧНЫЙ АЛЬБУМИН | 2018 |
|
RU2797270C2 |

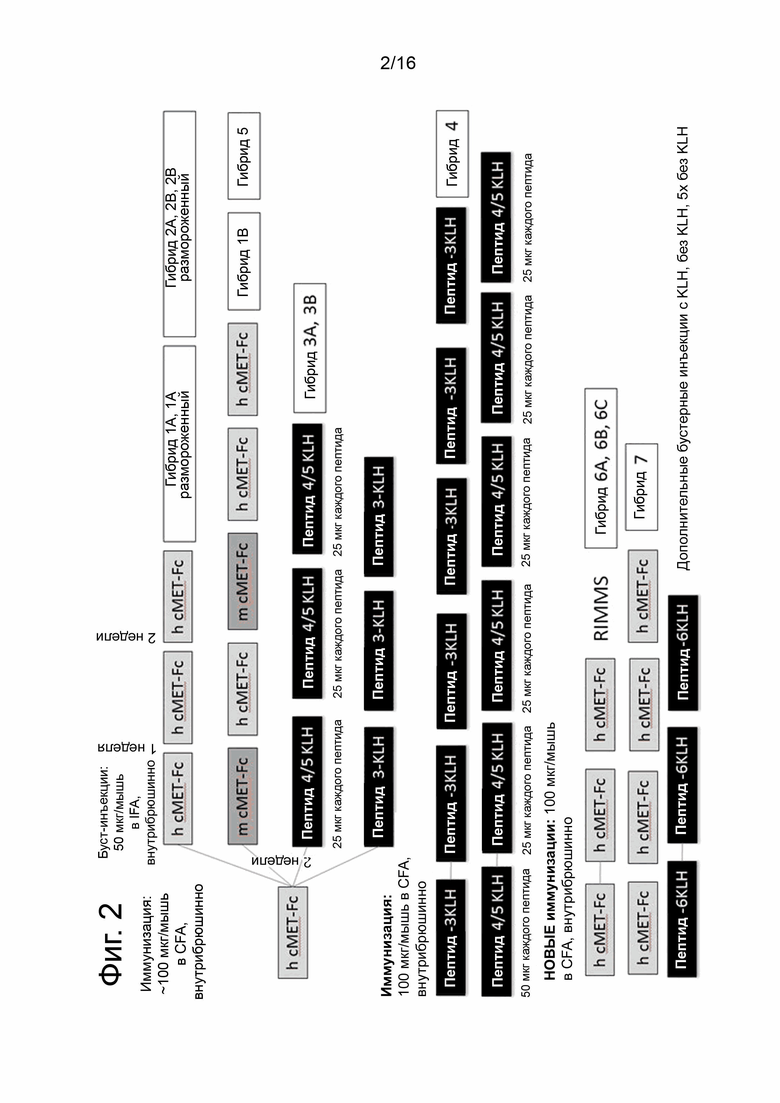
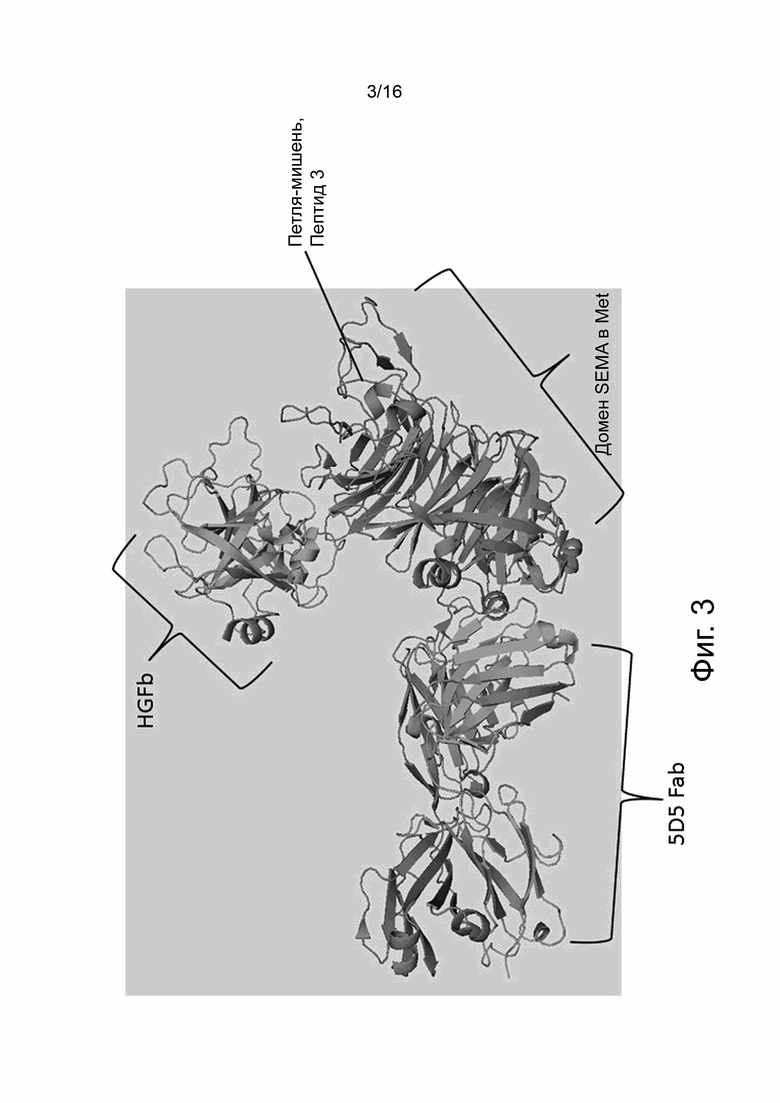
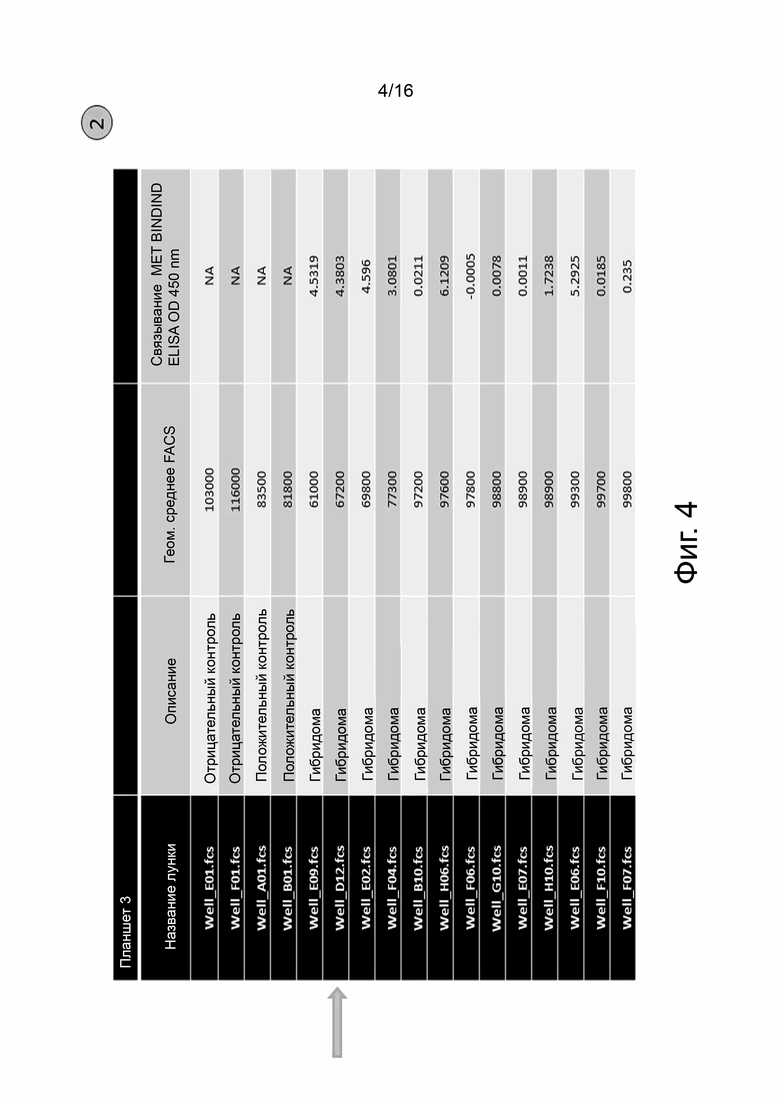
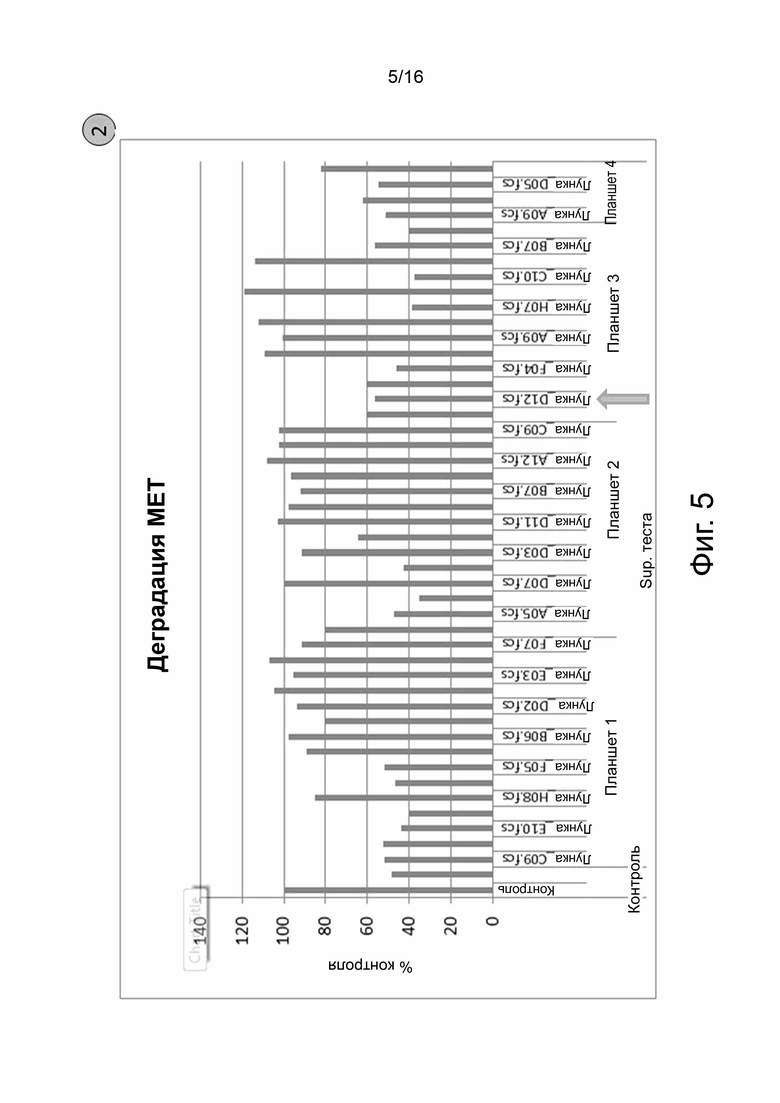
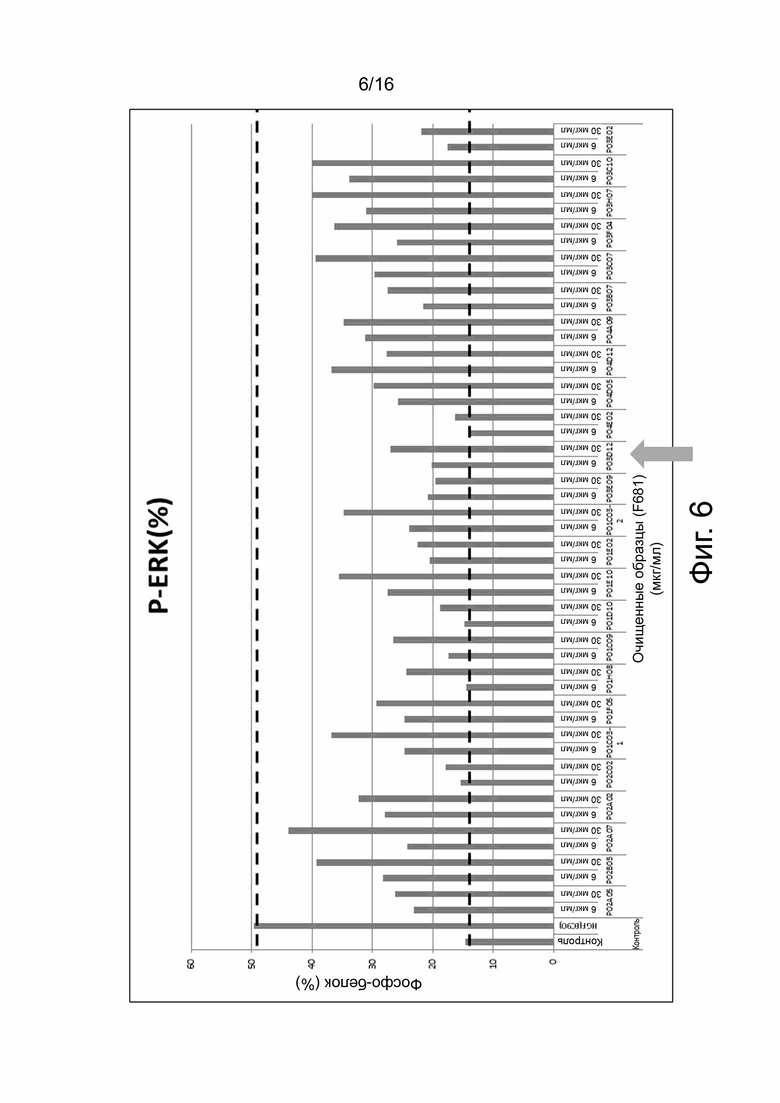

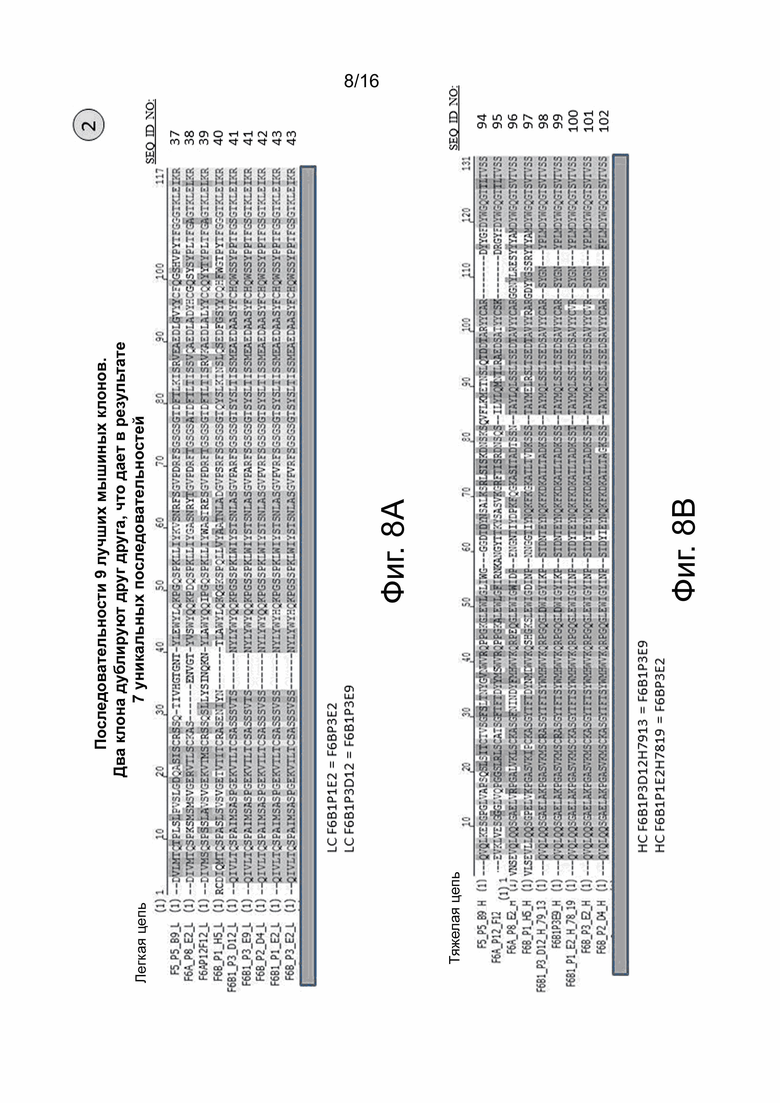
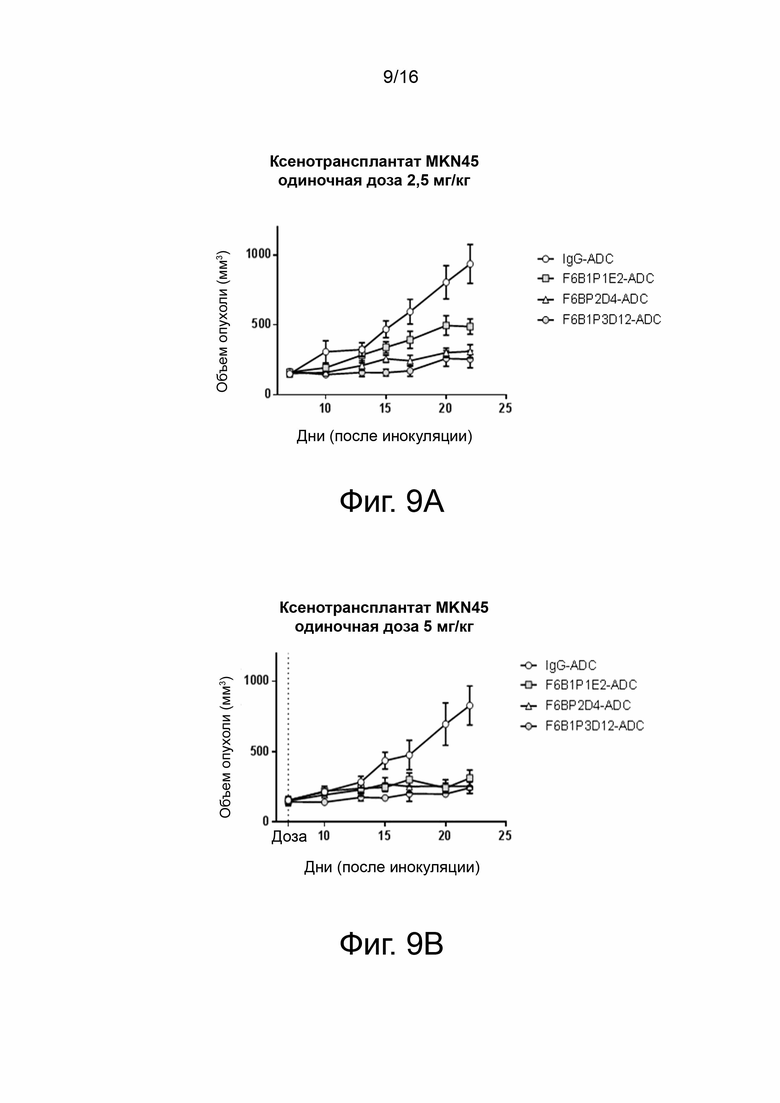
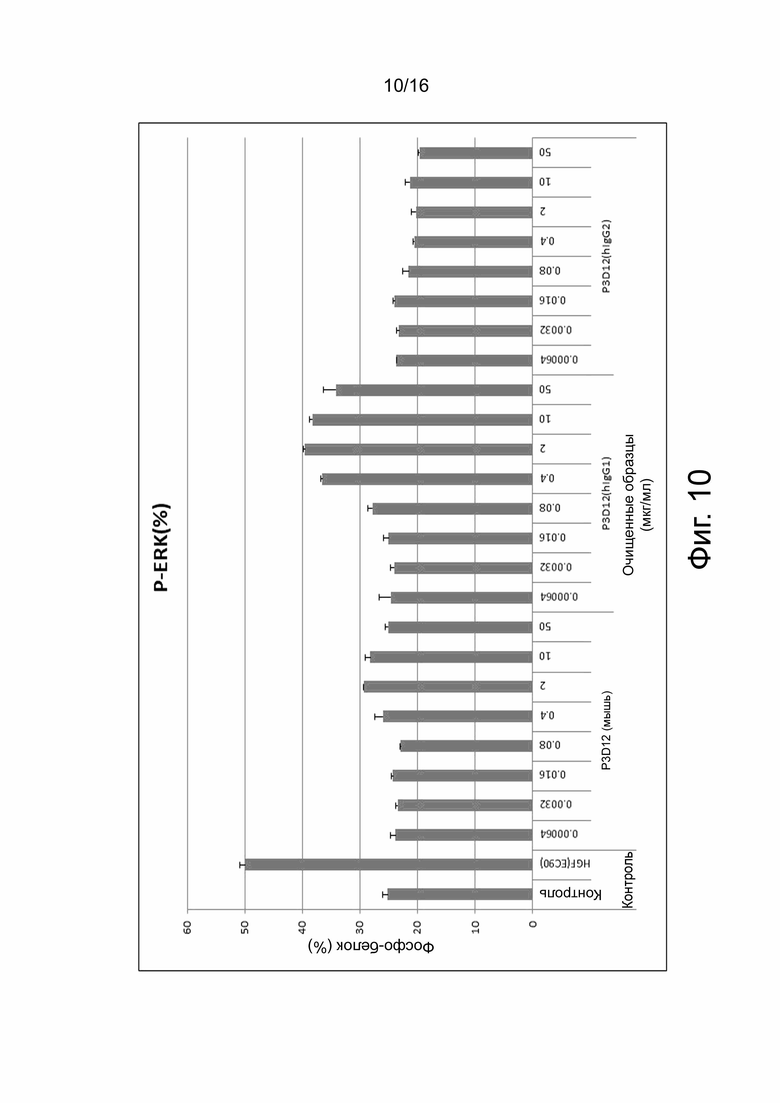
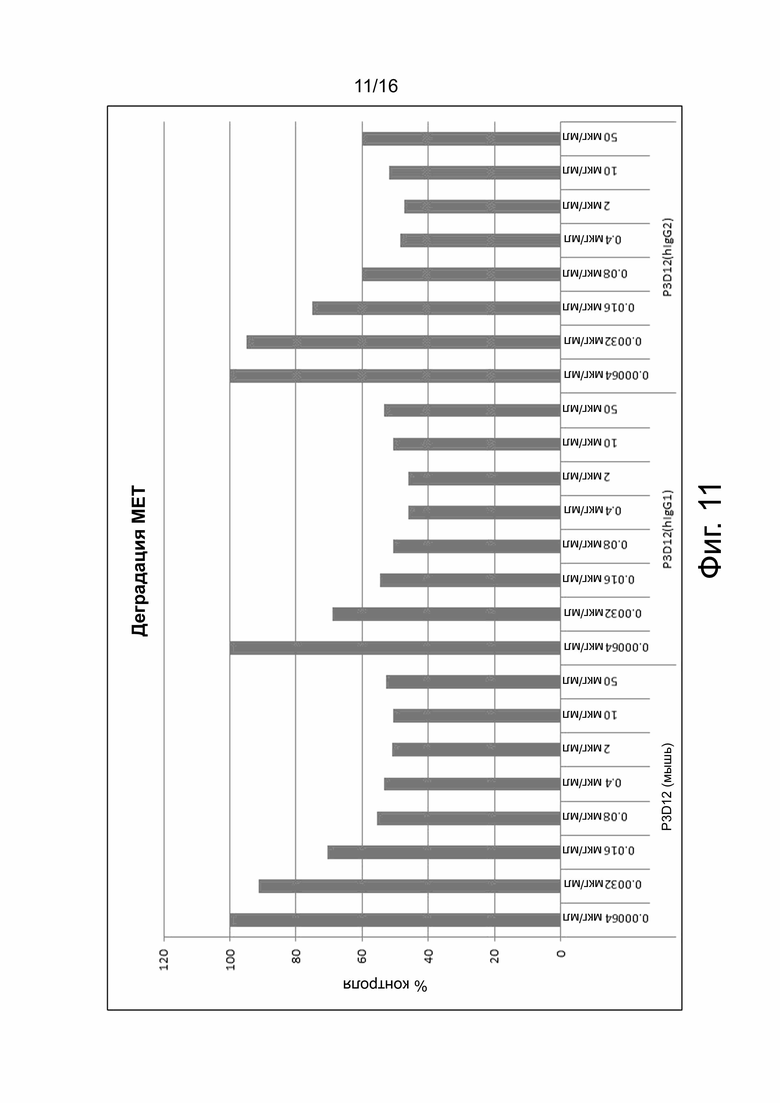
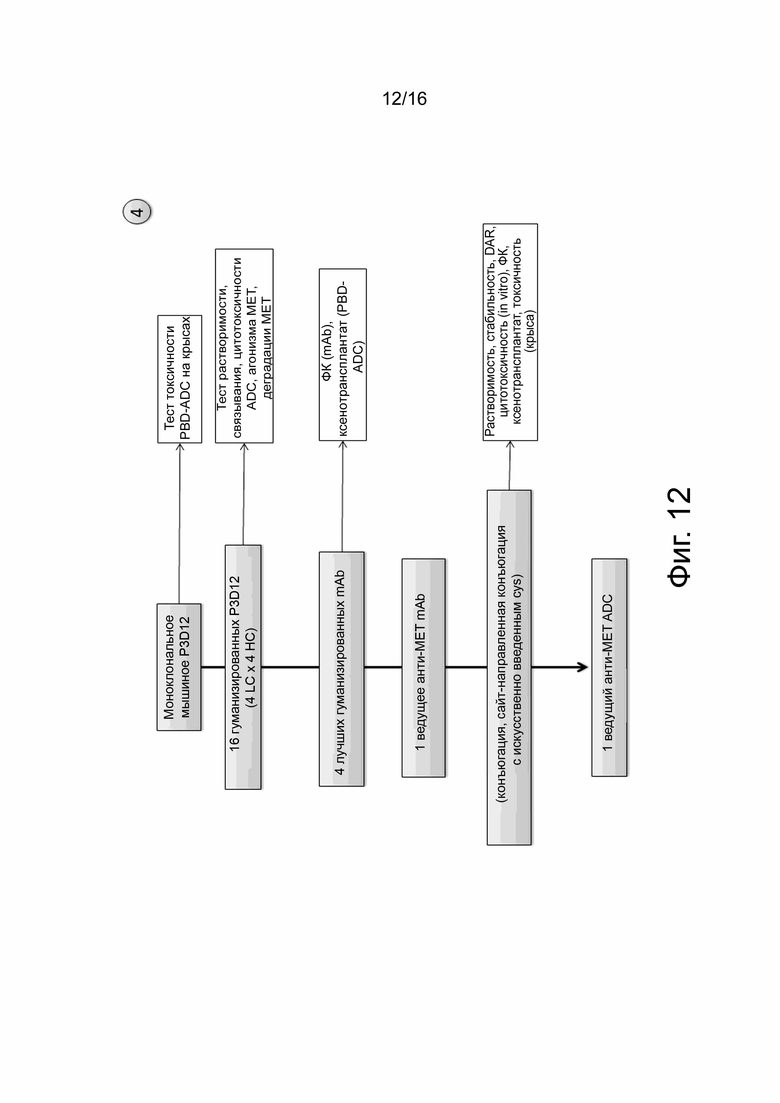

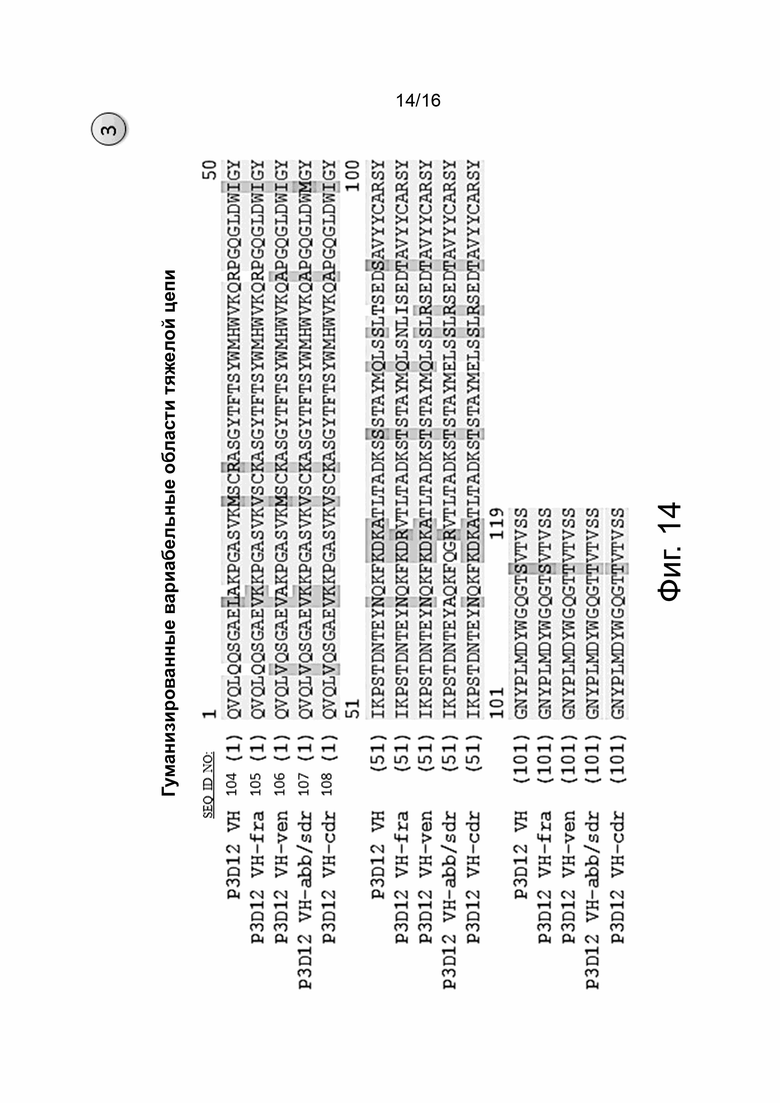
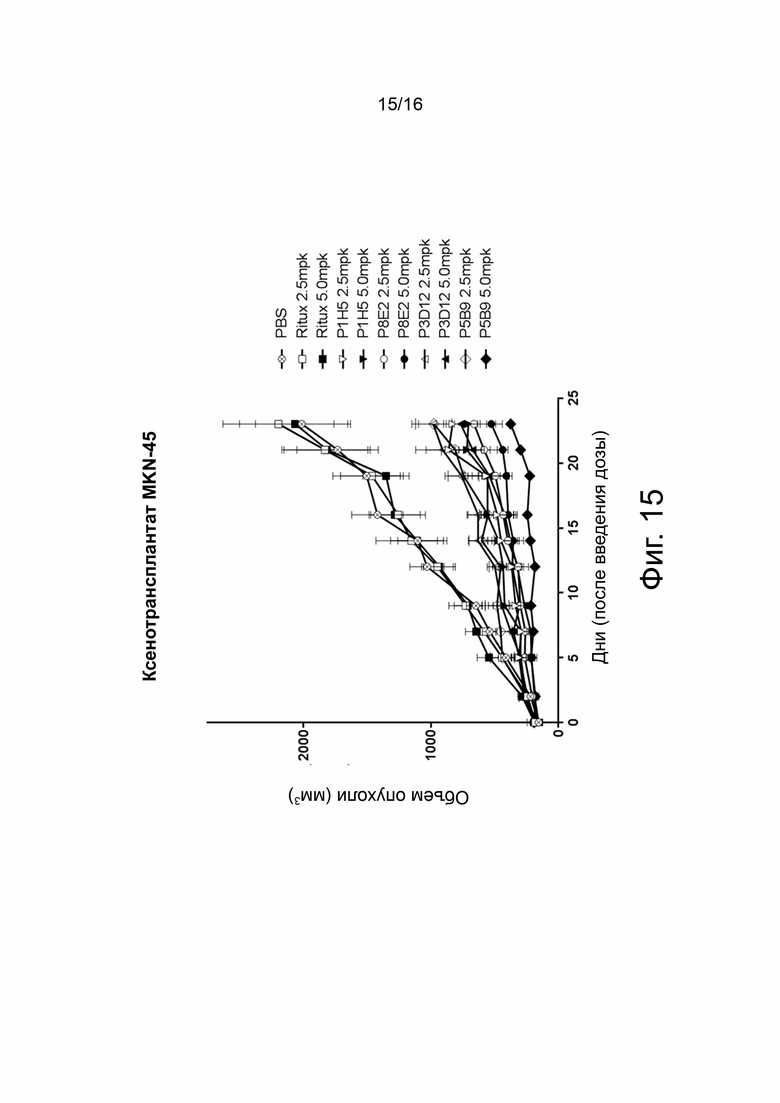
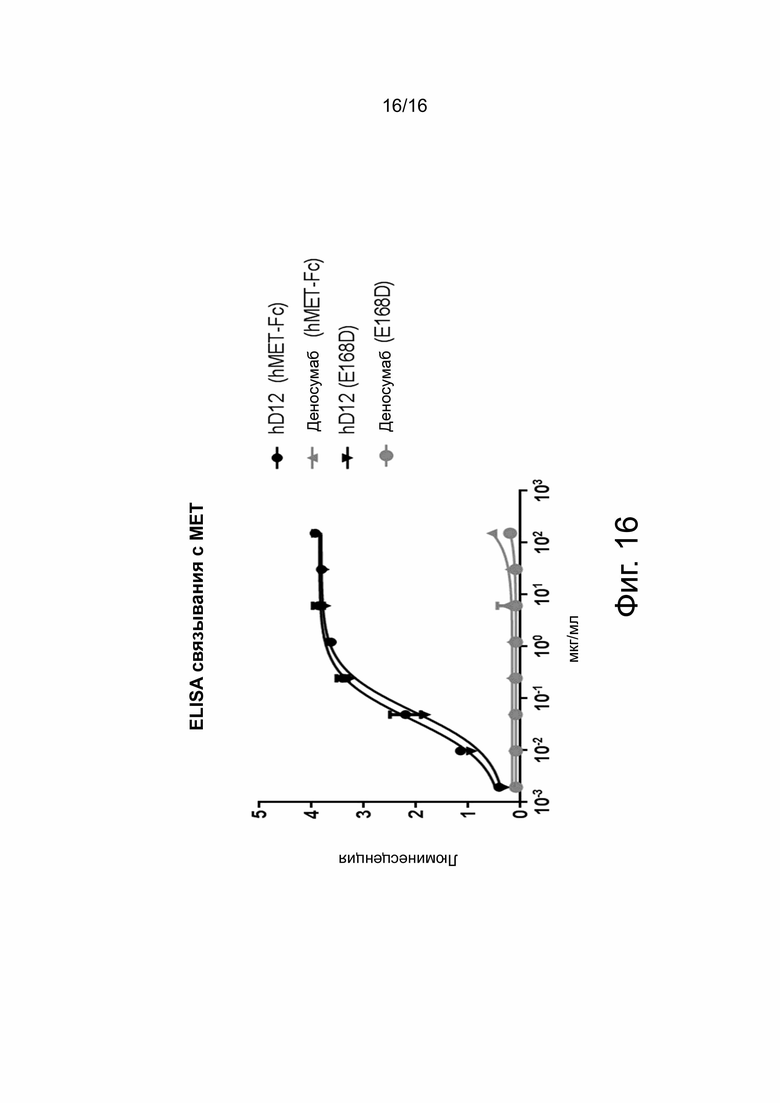
Настоящая группа изобретений относится к иммунологии. Предложен связывающий агент, который представляет собой антитело или его антигенсвязывающий фрагмент и специфически связывается с внеклеточным доменом фактора мезенхимально-эпителиального перехода (cMET). Также описан способ лечения объекта, имеющего неопластическое расстройство или рак, и фармацевтическая композиция. Даная группа изобретений может найти применение в терапии различных заболеваний, связанных с cMET. 3 н. и 12 з.п. ф-лы, 12 табл., 6 пр., 16 ил.
1. Связывающий агент, выбранный из группы, состоящей из:
(i) связывающего агента, включающего
CDR-L1 последовательности SEQ ID NO 9 или 10,
CDR-L2 последовательности SEQ ID NO 24 или 25,
CDR-L3 последовательности SEQ ID NO 34 или 35,
CDR-H1 последовательности SEQ ID NO 58 или 59,
CDR-H2 последовательности SEQ ID NO 70 или 71, и
CDR-H3 последовательности SEQ ID NO 87 или 88;
(ii) связывающего агента, включающего
CDR-L1 последовательности SEQ ID NO 11 или 12,
CDR-L2 последовательности SEQ ID NO 24 или 25,
CDR-L3 последовательности SEQ ID NO 34 или 35,
CDR-H1 последовательности SEQ ID NO 58 или 59,
CDR-H2 последовательности SEQ ID NO 74 или 75, и
CDR-H3 последовательности SEQ ID NO 90 или 91; и
(iii) связывающего агента, включающего
CDR-L1 последовательности SEQ ID NO 11 или 12,
CDR-L2 последовательности SEQ ID NO 24 или 25,
CDR-L3 последовательности SEQ ID NO 34 или 35,
CDR-H1 последовательности SEQ ID NO 58 или 59,
CDR-H2 последовательности SEQ ID NO 72 или 73, и
CDR-H3 последовательности SEQ ID NO 88 или 89;
где связывающий агент является антителом или его антигенсвязывающим фрагментом, и
где связывающий агент специфически связывается с внеклеточным доменом фактора мезенхимально-эпителиального перехода (cMET).
2. Связывающий агент по п.1, отличающийся тем, что CDR-L1 является SEQ ID NO: 9 или 10, что CDR-L2 является SEQ ID NO: 24 или 25, что CDR-L3 является SEQ ID NO: 34 или 35, что CDR-H1 является SEQ ID NO: 58 или 59, CDR-H2 является SEQ ID NO: 70 или 71, и CDR-H3 является SEQ ID NO: 87 или 88.
3. Связывающий агент по п.1, содержащий SEQ ID NO 47 и 108.
4. Связывающий агент по п.1, содержащий SEQ ID NO 47 и 106.
5. Связывающий агент по п.1, содержащий SEQ ID NO 47 и 105.
6. Связывающий агент по п.1, содержащий SEQ ID NO 48 и 108.
7. Связывающий агент по любому из пп. 1-6, отличающийся тем, что связывающий агент представляет собой антитело.
8. Связывающий агент по любому из пп. 1-7, отличающийся тем, что связывающий агент индуцирует интернализацию cMET в раковой клетке человека.
9. Связывающий агент по любому из пп. 1-7, отличающийся тем, что связывающий агент вызывает деградацию cMET на раковой клетке человека.
10. Связывающий агент по любому из пп. 1-9, отличающийся тем, что связывающий агент включает анти-неопластический агент.
11. Способ лечения объекта, имеющего неопластическое расстройство или рак, включающий:
а) обеспечение объекта, имеющего или подозреваемого на наличие неопластического расстройства; и
b) введение объекту терапевтически эффективного количества связывающего агента по любому из пп. 1-10.
12. Способ по п. 11, отличающийся тем, что связывающий агент специфически связывается с внеклеточным доменом cMET, экспрессированным на одной или нескольких клетках объекта.
13. Способ по п. 11 или 12, отличающийся тем, что связывающий агент ингибирует митоз и/или индуцирует гибель одной или нескольких клеток, экспрессирующих cMET.
14. Способ по любому из пп. 11-13, отличающийся тем, что неопластическое расстройство или рак включают карциному легкого, карциному молочной железы, карциному яичника, карциному почки, карциному толстой кишки, карциному желудка, карциному щитовидной железы, карциному поджелудочной железы, нейробластому или плоскоклеточную карциному головы и шеи, рак шейки матки, гепатоцеллюлярный рак, саркомы, мезотелиому, глиобластому, множественную миелому, меланому, карциному предстательной железы и пищевода.
15. Фармацевтическая композиция, содержащая терапевтически эффективное количество связывающего агента по любому из пп. 1-10 и фармацевтически приемлемый эксципиент, разбавитель, добавку или носитель, где фармацевтическая композиция предназначена для лечения, профилактики или диагностики неопластического расстройства или рака у субъекта.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Способ получения препарата рибонуклеопротеинового комплекса CRISPR/Cas14 и препарат для выявления РНК вируса SARS-CoV-2 в ультранизких концентрациях | 2021 |
|
RU2764024C1 |
| GONZALEZ, Alexandra, et al | |||
| "A novel antagonist anti cMet antibody with antitumor activities targeting both ligand dependent and ligand independent cMet receptors." International journal of cancer, | |||
Авторы
Даты
2021-03-17—Публикация
2017-09-28—Подача