ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение, в целом, относится к новым анти-PD-L1 антителам, которые специфически связываются с PD-L1.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
PD-1, представитель семейства CD28, представляет собой ингибирующий рецептор, экспрессированный на поверхности T-клеток, который действует, физиологически ограничивая активацию и пролиферацию T-клеток. Его лиганд, PD-L1 (B7-H1/CD274), экспрессируется на антигенпредставляющих клетках и клетках опухолей. Связывание PD-L1 с его рецептором ингибирует активацию T-клеток и уравновешивает стимулирующие сигналы T-клеток, такие как связывание B7 с CD28.
PD-L1 не экспрессируется нормальными эпителиальными тканями, но он аберрантно экспрессируется на широком спектре раковых опухолей человека. В этом контексте, PD-L1 может стимулировать прогрессирование рака за счет блокирования противоопухолевого ответа хозяина. Была установлена связь его экспрессии на клетках опухолей с более неблагоприятным прогнозом при почечноклеточном раке, раке легкого, раке молочной железы, раке поджелудочной железы, раке яичника, уротелиальном раке, раке желудка, раке пищевода и печеночно-клеточной карциноме.
Были получены различные антитела, нацеленные на PD-1, которые продемонстрировали эффективность в подавлении опухолевого роста и продлении общей выживаемости в рандомизированных контролируемых исследованиях. Было обнаружено несколько нацеленных на PD-L1 антител, которые продемонстрировали активность в ингибировании опухолевого роста. Поскольку такие антитела интернализируются экспрессирующими PD-L1 клетками и быстро разрушаются в эндосомном и лизосомном компартменте, эти антитела быстро элиминируются экспрессирующими PD-L1 клетками и, таким образом, способность этих антител ингибировать опухолевый рост ограничена доставляемым количеством антител. Стабильное ингибирование опухолевого роста требует непрерывной инфузии большого количества антител для поддержания концентрации антител в зоне опухоли на уровне, достаточно высоком, чтобы блокировать активность PD-L1. Таким образом, ожидается, что затраты на предоставление таких средств будут очень высоки из-за необходимости введения большого количества антител пациенту. Еще более важно, что возможность достижения полного ответа также будет ограничена. Таким образом, существует потребность в создании антител с гораздо более высокой эффективностью, чем современные анти-PD-L1 антитела.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым моноклональным анти-PD-L1 антителам (в частности, химерным и гуманизированным антителам), полинуклеотидам, кодирующим их, способам их применения и связывающим их эпитопам на белке PD-L1 человека.
В конкретных вариантах осуществления настоящее изобретение относится к выделенному антителу против PD-L1, содержащему последовательности HCDR1, HCDR2 и HCDR3 тяжелой цепи и LCDR1, LCDR2 и LCDR3 легкой цепи, при этом
последовательность HCDR1 представляет собой TYWX1H (SEQ ID NO: 1) или гомологичную последовательность, имеющую по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ней;
последовательность HCDR2 представляет собой MIQPNSGGTKYNX2X3FKX4 (SEQ ID NO: 2) или гомологичную последовательность, имеющую по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ней;
последовательность HCDR3 представляет собой GAGTVDYFDY (SEQ ID NO: 3) или гомологичную последовательность, имеющую по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ней;
последовательность LCDR1 представляет собой RASESVDIYGNSFMH (SEQ ID NO: 4) или гомологичную последовательность, имеющую по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ней;
последовательность LCDR2 представляет собой RASNLES (SEQ ID NO: 5) или гомологичную последовательность, имеющую по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ней;
последовательность LCDR3 представляет собой X5QSX6X7DPYT (SEQ ID NO: 6) или гомологичную последовательность, имеющую по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ней;
при этом X1 представляет собой I или M; X2 представляет собой D или E; X3 представляет собой Q или K; X4 представляет собой N или K; X5 представляет собой Q или H; X6 представляет собой N или T; X7 представляет собой D или E.
В конкретных вариантах осуществления X1 представляет собой I или M; X2 представляет собой D или E; X3 представляет собой Q или K; X4 представляет собой N или K; X5 представляет собой Q; X6 представляет собой N или T; X7 представляет собой D или E. В конкретных вариантах осуществления X1 представляет собой I; X2 представляет собой D; X3 представляет собой Q; X4 представляет собой N; X5 представляет собой Q; X6 представляет собой N, X7 представляет собой D. В конкретных вариантах осуществления X1 представляет собой M; X2 представляет собой E; X3 представляет собой K; X4 представляет собой K; X5 представляет собой Q; X6 представляет собой T; X7 представляет собой E. В конкретных вариантах осуществления X1 представляет собой I; X2 представляет собой D; X3 представляет собой Q; X4 представляет собой N; X5 представляет собой H; X6 представляет собой N; X7 представляет собой D. В конкретных вариантах осуществления X1 представляет собой M; X2 представляет собой E; X3 представляет собой K; X4 представляет собой K; X5 представляет собой H; X6 представляет собой T; X7 представляет собой E.
В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит 1, 2, 3, 4, 5 или 6 областей CDR, выбранных из SEQ ID NOs: 7-12, или гомологов, имеющих по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ними. В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит 3 области CDR тяжелой цепи, выбранные из SEQ ID NOs: 7-9. В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит 3 области CDR легкой цепи, выбранные из SEQ ID NOs: 10-12. В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит 6 областей CDR, выбранных из SEQ ID NOs: 7-12.
В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит каркасные последовательности HFR1, HFR2, HFR3 и HFR4 тяжелой цепи и каркасные последовательности LFR1, LFR2, LFR3 и LFR4 легкой цепи, при этом последовательности вариабельной области тяжелой цепи соответствуют формуле: HFR1-HCDR1-HFR2-HCDR2-HFR3-HCDR3-HFR4, и последовательности вариабельной области легкой цепи соответствуют формуле LFR1-LCDR1-LFR2-LCDR2-LFR3-LCDR3-LFR4.
В конкретных вариантах осуществления последовательность HFR1 представляет собой Xa1VQLXa2QXa3GAEXa4Xa5KPGASVKXa6SCKASGYXa7FT (SEQ ID NO: 13);
последовательность HFR2 представляет собой WVXa8QXa9PGQGLEWIG (SEQ ID NO: 14);
последовательность HFR3 представляет собой Xa10Xa11TLTVDXa12SXa13Xa14TAXa15MXa16LSXa17LXa18SXa19DXa20AVYYCAR (SEQ ID NO: 15);
последовательность HFR4 представляет собой WGQGXa21TLXa22Xa23SS (SEQ ID NO: 16);
последовательность LFR1 представляет собой DIVLTXa24SPXa25SLXa26VSXa27GQRATIXa28C (SEQ ID NO: 17);
последовательность LFR2 представляет собой WYQQKPGQXa29PKLLIY (SEQ ID NO: 18);
последовательность LFR3 представляет собой GIPARFSGSGSRTDFTLTINPVEAXa30DXa31ATYYC (SEQ ID NO: 19);
последовательность LFR4 представляет собой FGGGTKLEXa32K (SEQ ID NO: 20);
при этом Xa1 представляет собой Q или L; Xa2 представляет собой Q или V; Xa3 представляет собой S или P; Xa4 представляет собой L или V; Xa5 представляет собой V или K; Xa6 представляет собой L или V; Xa7 представляет собой T, S или I; Xa8 представляет собой W, K или R; Xa9 представляет собой R или A; Xa10 представляет собой R или K; Xa11 представляет собой V или A; Xa12 представляет собой K или T; Xa13 представляет собой S или I; Xa14 представляет собой S или T; Xa15 представляет собой Y или S; Xa16 представляет собой Q или E; Xa17 представляет собой S, G или R; Xa18 представляет собой T или R; Xa19 представляет собой E или D; Xa20 представляет собой S или T; Xa21 представляет собой T или S; Xa22 представляет собой S или T; Xa23 представляет собой V или I; Xa24 представляет собой Q или H; Xa25 представляет собой A или V; Xa26 представляет собой A или T; Xa27 представляет собой L, A или V; Xa28 представляет собой S или T; Xa29 представляет собой S, P или A; Xa30 представляет собой D, N или Q; Xa31 представляет собой V или T; Xa32 представляет собой L, T или I; Xa33 представляет собой F или Y; Xa34 представляет собой T или Q; Xa35 представляет собой V или L; Xa36 представляет собой D или S; Xa37 представляет собой M или L; Xa38 представляет собой T или S; Xa39 представляет собой F или S; Xa40 представляет собой D или Q; Xa41 представляет собой V или A; Xa42 представляет собой V или I; Xa43 представляет собой D или A; Xa44 представляет собой T или S; Xa45 представляет собой Y или S; Xa46 представляет собой G или R; Xa47 представляет собой F или L; Xa48 представляет собой S или N; Xa49 представляет собой T или P; Xa50 представляет собой Q или E; Xa51 представляет собой V или T; Xa52 представляет собой F или Y; Xa53 представляет собой A или G.
В конкретных вариантах осуществления Xa1 представляет собой Q; Xa2 представляет собой V; Xa3 представляет собой S; Xa4 представляет собой V; Xa5 представляет собой K; Xa6 представляет собой L; Xa7 представляет собой I; Xa8 представляет собой K; Xa9 представляет собой R; Xa10 представляет собой R или K; Xa11 представляет собой A; Xa12 представляет собой K; Xa13 представляет собой I; Xa14 представляет собой S; Xa15 представляет собой Y; Xa16 представляет собой E; Xa17 представляет собой R; Xa18 представляет собой T; Xa19 представляет собой D; Xa20 представляет собой T; Xa21 представляет собой T или S; Xa22 представляет собой T или S; Xa23 представляет собой I или V; Xa24 представляет собой Q; Xa25 представляет собой A; Xa26 представляет собой A; Xa27 представляет собой V; Xa28 представляет собой T; Xa29 представляет собой A или P; Xa30 представляет собой Q; Xa31 представляет собой T; Xa32 представляет собой T или I; Xa33 представляет собой Y; Xa34 представляет собой Q; Xa35 представляет собой L; Xa36 представляет собой D; Xa37 представляет собой L; Xa38 представляет собой S; Xa39 представляет собой S; Xa40 представляет собой Q; Xa41 представляет собой A; Xa42 представляет собой I; Xa43 представляет собой A; Xa44 представляет собой S; Xa45 представляет собой S; Xa46 представляет собой R; Xa47 представляет собой L; Xa48 представляет собой N; Xa49 представляет собой P; Xa50 представляет собой E; Xa51 представляет собой T; Xa52 представляет собой Y; Xa53 представляет собой G.
В конкретных вариантах осуществления Xa1 представляет собой Q; Xa2 представляет собой V; Xa3 представляет собой S; Xa4 представляет собой V; Xa5 представляет собой K; Xa6 представляет собой L; Xa7 представляет собой I; Xa8 представляет собой K; Xa9 представляет собой R; Xa10 представляет собой R; Xa11 представляет собой A; Xa12 представляет собой K; Xa13 представляет собой I; Xa14 представляет собой S; Xa15 представляет собой Y; Xa16 представляет собой E; Xa17 представляет собой R; Xa18 представляет собой T; Xa19 представляет собой D; Xa20 представляет собой T; Xa21 представляет собой T; Xa22 представляет собой S; Xa23 представляет собой I; Xa24 представляет собой Q; Xa25 представляет собой A; Xa26 представляет собой A; Xa27 представляет собой V; Xa28 представляет собой T; Xa29 представляет собой A; Xa30 представляет собой Q; Xa31 представляет собой T; Xa32 представляет собой T; Xa33 представляет собой Y; Xa34 представляет собой Q; Xa35 представляет собой L; Xa36 представляет собой D; Xa37 представляет собой L; Xa38 представляет собой S; Xa39 представляет собой S; Xa40 представляет собой Q; Xa41 представляет собой A; Xa42 представляет собой I; Xa43 представляет собой A; Xa44 представляет собой S; Xa45 представляет собой S; Xa46 представляет собой R; Xa47 представляет собой L; Xa48 представляет собой N; Xa49 представляет собой P; Xa50 представляет собой E; Xa51 представляет собой T; Xa52 представляет собой Y; Xa53 представляет собой G.
В конкретных вариантах осуществления Xa1 представляет собой Q; Xa2 представляет собой V; Xa3 представляет собой S; Xa4 представляет собой V; Xa5 представляет собой K; Xa6 представляет собой L; Xa7 представляет собой I; Xa8 представляет собой K; Xa9 представляет собой R; Xa10 представляет собой K; Xa11 представляет собой A; Xa12 представляет собой K; Xa13 представляет собой I; Xa14 представляет собой S; Xa15 представляет собой Y; Xa16 представляет собой E; Xa17 представляет собой R; Xa18 представляет собой T; Xa19 представляет собой D; Xa20 представляет собой T; Xa21 представляет собой S; Xa22 представляет собой T; Xa23 представляет собой V; Xa24 представляет собой Q; Xa25 представляет собой A; Xa26 представляет собой A; Xa27 представляет собой V; Xa28 представляет собой T; Xa29 представляет собой P; Xa30 представляет собой Q; Xa31 представляет собой T; Xa32 представляет собой I; Xa33 представляет собой Y; Xa34 представляет собой Q; Xa35 представляет собой L; Xa36 представляет собой D; Xa37 представляет собой L; Xa38 представляет собой S; Xa39 представляет собой S; Xa40 представляет собой Q; Xa41 представляет собой A; Xa42 представляет собой I; Xa43 представляет собой A; Xa44 представляет собой S; Xa45 представляет собой S; Xa46 представляет собой R; Xa47 представляет собой L; Xa48 представляет собой N; Xa49 представляет собой P; Xa50 представляет собой E; Xa51 представляет собой T; Xa52 представляет собой Y; Xa53 представляет собой G.
В конкретных вариантах осуществления Xa1 представляет собой L или Q; Xa2 представляет собой V; Xa3 представляет собой S; Xa4 представляет собой V; Xa5 представляет собой K; Xa6 представляет собой L; Xa7 представляет собой I; Xa8 представляет собой K; Xa9 представляет собой R; Xa10 представляет собой R; Xa11 представляет собой A; Xa12 представляет собой K; Xa13 представляет собой I; Xa14 представляет собой S; Xa15 представляет собой Y; Xa16 представляет собой E; Xa17 представляет собой R; Xa18 представляет собой T; Xa19 представляет собой D; Xa20 представляет собой T; Xa21 представляет собой T; Xa22 представляет собой S; Xa23 представляет собой I; Xa24 представляет собой Q; Xa25 представляет собой A; Xa26 представляет собой A; Xa27 представляет собой V; Xa28 представляет собой T; Xa29 представляет собой S; Xa30 представляет собой N; Xa31 представляет собой T; Xa32 представляет собой T; Xa33 представляет собой Y; Xa34 представляет собой Q; Xa35 представляет собой L; Xa36 представляет собой D; Xa37 представляет собой L; Xa38 представляет собой S; Xa39 представляет собой S; Xa40 представляет собой Q; Xa41 представляет собой A; Xa42 представляет собой I; Xa43 представляет собой A; Xa44 представляет собой S; Xa45 представляет собой S; Xa46 представляет собой R; Xa47 представляет собой L; Xa48 представляет собой N; Xa49 представляет собой P; Xa50 представляет собой E; Xa51 представляет собой T; Xa52 представляет собой Y; Xa53 представляет собой G.
В конкретных вариантах осуществления Xa1 представляет собой L; Xa2 представляет собой V; Xa3 представляет собой S; Xa4 представляет собой V; Xa5 представляет собой K; Xa6 представляет собой V; Xa7 представляет собой I; Xa8 представляет собой R; Xa9 представляет собой A; Xa10 представляет собой R; Xa11 представляет собой V; Xa12 представляет собой T; Xa13 представляет собой I; Xa14 представляет собой S; Xa15 представляет собой Y; Xa16 представляет собой E; Xa17 представляет собой R; Xa18 представляет собой R; Xa19 представляет собой D; Xa20 представляет собой T; Xa21 представляет собой T; Xa22 представляет собой S; Xa23 представляет собой I; Xa24 представляет собой Q; Xa25 представляет собой A; Xa26 представляет собой A; Xa27 представляет собой V; Xa28 представляет собой T; Xa29 представляет собой S; Xa30 представляет собой N; Xa31 представляет собой T; Xa32 представляет собой T; Xa33 представляет собой Y; Xa34 представляет собой Q; Xa35 представляет собой L; Xa36 представляет собой D; Xa37 представляет собой L; Xa38 представляет собой S; Xa39 представляет собой S; Xa40 представляет собой Q; Xa41 представляет собой A; Xa42 представляет собой I; Xa43 представляет собой A; Xa44 представляет собой S; Xa45 представляет собой S; Xa46 представляет собой R; Xa47 представляет собой L; Xa48 представляет собой N; Xa49 представляет собой P; Xa50 представляет собой E; Xa51 представляет собой T; Xa52 представляет собой Y; Xa53 представляет собой G.
В конкретных вариантах осуществления Xa1 представляет собой L; Xa2 представляет собой V; Xa3 представляет собой S; Xa4 представляет собой V; Xa5 представляет собой K; Xa6 представляет собой V; Xa7 представляет собой I; Xa8 представляет собой R; Xa9 представляет собой A; Xa10 представляет собой R; Xa11 представляет собой V; Xa12 представляет собой T; Xa13 представляет собой I; Xa14 представляет собой S; Xa15 представляет собой Y; Xa16 представляет собой E; Xa17 представляет собой R; Xa18 представляет собой R; Xa19 представляет собой D; Xa20 представляет собой T; Xa21 представляет собой T; Xa22 представляет собой S; Xa23 представляет собой I; Xa24 представляет собой Q; Xa25 представляет собой A; Xa26 представляет собой A; Xa27 представляет собой V; Xa28 представляет собой T; Xa29 представляет собой A; Xa30 представляет собой Q или N; Xa31 представляет собой T; Xa32 представляет собой T; Xa33 представляет собой Y; Xa34 представляет собой Q; Xa35 представляет собой L; Xa36 представляет собой D; Xa37 представляет собой L; Xa38 представляет собой S; Xa39 представляет собой S; Xa40 представляет собой Q; Xa41 представляет собой A; Xa42 представляет собой I; Xa43 представляет собой A; Xa44 представляет собой S; Xa45 представляет собой S; Xa46 представляет собой R; Xa47 представляет собой L; Xa48 представляет собой N; Xa49 представляет собой P; Xa50 представляет собой E; Xa51 представляет собой T; Xa52 представляет собой Y; Xa53 представляет собой G.
В конкретных вариантах осуществления Xa1 представляет собой Q; Xa2 представляет собой V; Xa3 представляет собой S; Xa4 представляет собой V; Xa5 представляет собой K; Xa6 представляет собой V; Xa7 представляет собой I; Xa8 представляет собой R; Xa9 представляет собой A; Xa10 представляет собой K; Xa11 представляет собой A; Xa12 представляет собой T; Xa13 представляет собой I; Xa14 представляет собой S; Xa15 представляет собой Y; Xa16 представляет собой E; Xa17 представляет собой R; Xa18 представляет собой R; Xa19 представляет собой D; Xa20 представляет собой T; Xa21 представляет собой S; Xa22 представляет собой T; Xa23 представляет собой V; Xa24 представляет собой Q; Xa25 представляет собой A; Xa26 представляет собой A; Xa27 представляет собой V; Xa28 представляет собой T; Xa29 представляет собой P; Xa30 представляет собой N; Xa31 представляет собой T; Xa32 представляет собой I; Xa33 представляет собой Y; Xa34 представляет собой Q; Xa35 представляет собой L; Xa36 представляет собой D; Xa37 представляет собой L; Xa38 представляет собой S; Xa39 представляет собой S; Xa40 представляет собой Q; Xa41 представляет собой A; Xa42 представляет собой I; Xa43 представляет собой A; Xa44 представляет собой S; Xa45 представляет собой S; Xa46 представляет собой R; Xa47 представляет собой L; Xa48 представляет собой N; Xa49 представляет собой P; Xa50 представляет собой E; Xa51 представляет собой T; Xa52 представляет собой Y; Xa53 представляет собой G.
В конкретных вариантах осуществления Xa1 представляет собой Q; Xa2 представляет собой V; Xa3 представляет собой S; Xa4 представляет собой V; Xa5 представляет собой K; Xa6 представляет собой V; Xa7 представляет собой I; Xa8 представляет собой R; Xa9 представляет собой A; Xa10 представляет собой K; Xa11 представляет собой A; Xa12 представляет собой T; Xa13 представляет собой I; Xa14 представляет собой S; Xa15 представляет собой Y; Xa16 представляет собой E; Xa17 представляет собой R; Xa18 представляет собой R; Xa19 представляет собой D; Xa20 представляет собой T; Xa21 представляет собой S; Xa22 представляет собой T; Xa23 представляет собой V; Xa24 представляет собой Q; Xa25 представляет собой A; Xa26 представляет собой A; Xa27 представляет собой V; Xa28 представляет собой T; Xa29 представляет собой P; Xa30 представляет собой N или Q; Xa31 представляет собой T; Xa32 представляет собой I; Xa33 представляет собой Y; Xa34 представляет собой Q; Xa35 представляет собой L; Xa36 представляет собой D; Xa37 представляет собой L; Xa38 представляет собой S; Xa39 представляет собой S; Xa40 представляет собой Q; Xa41 представляет собой A; Xa42 представляет собой I; Xa43 представляет собой A; Xa44 представляет собой S; Xa45 представляет собой S; Xa46 представляет собой R; Xa47 представляет собой L; Xa48 представляет собой N; Xa49 представляет собой P; Xa50 представляет собой E; Xa51 представляет собой T; Xa52 представляет собой Y; Xa53 представляет собой G.
В конкретных вариантах осуществления Xa1 представляет собой Q; Xa2 представляет собой V; Xa3 представляет собой S; Xa4 представляет собой V; Xa5 представляет собой K; Xa6 представляет собой L; Xa7 представляет собой I; Xa8 представляет собой K; Xa9 представляет собой R; Xa10 представляет собой K; Xa11 представляет собой A; Xa12 представляет собой K; Xa13 представляет собой I; Xa14 представляет собой S; Xa15 представляет собой Y; Xa16 представляет собой E; Xa17 представляет собой R; Xa18 представляет собой T; Xa19 представляет собой D; Xa20 представляет собой T; Xa21 представляет собой S; Xa22 представляет собой T; Xa23 представляет собой V; Xa24 представляет собой Q; Xa25 представляет собой A; Xa26 представляет собой A; Xa27 представляет собой V; Xa28 представляет собой T; Xa29 представляет собой P; Xa30 представляет собой N; Xa31 представляет собой T; Xa32 представляет собой I; Xa33 представляет собой Y; Xa34 представляет собой Q; Xa35 представляет собой L; Xa36 представляет собой D; Xa37 представляет собой L; Xa38 представляет собой S; Xa39 представляет собой S; Xa40 представляет собой Q; Xa41 представляет собой A; Xa42 представляет собой I; Xa43 представляет собой A; Xa44 представляет собой S; Xa45 представляет собой S; Xa46 представляет собой R; Xa47 представляет собой L; Xa48 представляет собой N; Xa49 представляет собой P; Xa50 представляет собой E; Xa51 представляет собой T; Xa52 представляет собой Y; Xa53 представляет собой G.
В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 61, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 62. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 71, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 72. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 71, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 70. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 69, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 72. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 69, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 70. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 73, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 74.
В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 63, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 64. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 75, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 76. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 77, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 78. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 75, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 78. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 77, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 76. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 79, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 80.
Настоящее изобретение также относится к антителам против PD-L1, которые содержат 1, 2, 3, 4, 5 или 6 областей CDR, выбранных из SEQ ID NOs: 7-12. В конкретных вариантах осуществления антитела содержат 3 области CDR тяжелой цепи, выбранные из SEQ ID NOs: 7-9. В конкретных вариантах осуществления антитела содержат 3 области CDR легкой цепи, выбранные из SEQ ID NOs: 10-12. В конкретных вариантах осуществления антитела содержат вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 21, или ее гуманизированный вариант. В конкретных вариантах осуществления антитела содержат вариабельную область легкой цепи, приведенную в SEQ ID NO: 22, или ее гуманизированный вариант. В конкретных вариантах осуществления антитела содержат вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 21, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 22, или их гуманизированные варианты.
Настоящее изобретение относится к выделенному антителу против PD-L1, демонстрирующему связывание с PD-L1 при кислом pH, измеряемое в аналитическом тесте, и связывание с PD-L1 при нейтральном pH, измеряемое в аналитическом тесте, при этом связывание с PD-L1 при кислом pH является значительно более слабым, чем связывание с PD-L1 при нейтральном pH. В конкретных вариантах осуществления связывание антитела против PD-L1 с PD-L1 при кислом pH составляет не более 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10% или 5% от связывания с PD-L1 при нейтральном pH в одном и том же анализе. В конкретных вариантах осуществления значение нейтрального pH составляет 7,4, и значение кислого pH составляет 6,0, 5,5, 5,0, 4,5 или 4,0. В конкретных вариантах осуществления связывание антитела против PD-L1, предложенного в настоящем документе, с PD-L1 при кислом pH 6,0, pH 5,5 или pH 5,0 является значительно более слабым, чем его связывание с PD-L1 при pH 7,4 в одном и том же анализе.
В конкретных вариантах осуществления в анализе определяют активность связывания или блокирования методами ELISA, FACS, поверхностного плазмонного резонанса, аффинного связывания с GST, эпитопной метки, иммунопреципитации, фар-вестерн-блоттинга, резонансного переноса энергии флуоресценции, флуоресцентных иммуноанализов с временным разрешением (TR-FIA), радиоиммунных анализов (RIA), иммуноферментных анализов, латекс-агглютинации, вестерн-блоттинга и иммуногистохимии, а также любым их сочетанием, in vitro.
В конкретных вариантах осуществления изобретение также относится к выделенному антителу против PD-L1, которое связывается с тем же эпитопом, что и антитело против PD-L1, предложенное в настоящем документе, или конкурирует с ним за связывание. В конкретных вариантах осуществления эпитоп содержит по меньшей мере один (например, по меньшей мере два, три, четыре или пять) из следующих аминокислотных остатков PD-L1: E58, K62, N63, I64, S80 и Y81. В конкретных вариантах осуществления эпитоп дополнительно содержит по меньшей мере один (например, по меньшей мере два или три) из следующих аминокислотных остатков PD-L1: R113, M115, Y123, K124 и R125. В конкретных вариантах осуществления эпитоп содержит одно из следующих сочетаний аминокислотных остатков PD-L1: 1) E58, R113, M115, Y123 и K124; 2) E58, S80, R113 и R125. В конкретных вариантах осуществления эпитоп дополнительно содержит по меньшей мере один (например, по меньшей мере два или три) из следующих аминокислотных остатков PD-L1: K62, N63, I64, Y81 и D122. В конкретных вариантах осуществления эпитоп содержит одно из следующих сочетаний аминокислотных остатков PD-L1: 1) E58, N63, I64, S80, Y81, R113 и R125; 2) E58, S80, R113, M115, D122, Y123, K124 и R125; 3) E58, K62, N63, S80, Y81, R113 и R125; 4) E58, N63, I64, S80, Y81, R113, K124 и R125.
Настоящее изобретение относится к способу лечения связанного с PD-L1 состояния у субъекта, который нуждается в этом, включающий введение субъекту выделенного антитела против PD-L1, связывание которого с PD-L1 при кислом pH значительно слабее, чем его связывание с PD-L1 при нейтральном pH, в одном и том же анализе, за счет чего происходит лечение состояния.
В конкретных вариантах осуществления антитело вводят в дозе, которая составляет не более 80%, 70%, 60%, 50%, 45%, 40%, 35%, 30%, 25%, 20%, 15% или 10% от эталонной дозы, при этом эталонную дозу определяют как дозу эталонного антитела, позволяющую достигать сопоставимого терапевтического эффекта in vivo, при этом эталонное антитело демонстрирует аналогичное связывание с PD-L1 как при кислом pH, так и при нейтральном pH, и при этом эталонное антитело и указанное антитело демонстрируют аналогичное связывание с PD-L1 при нейтральном pH.
В конкретных вариантах осуществления антитело вводят с частотой дозирования, меньшей, чем эталонная частота дозирования, при этом эталонную частоту дозирования определяют как частоту дозирования эталонного антитела, позволяющую достигать сопоставимого терапевтического эффекта in vivo, при этом эталонное антитело демонстрирует аналогичное связывание с PD-L1 как при кислом pH, так и при нейтральном pH, и при этом эталонное антитело и указанное антитело демонстрируют аналогичное связывание с PD-L1 при нейтральном pH.
В конкретных вариантах осуществления антитело имеет более длительное время полужизни in vivo в целевом органе, чем эталонное время полужизни in vivo, при этом эталонное время полужизни in vivo определяют как время полужизни in vivo эталонного антитела, при этом эталонное антитело демонстрирует аналогичное связывание с PD-L1 как при кислом pH, так и при нейтральном pH, и при этом эталонное антитело и указанное антитело демонстрируют аналогичное связывание с PD-L1 при нейтральном pH. В конкретных вариантах осуществления целевой орган включает одно или более из сыворотки, почки, легкого, поджелудочной железы, печени, желчного пузыря, мочевого пузыря, кожи, пищевода, яичника, молочной железы, толстой кишки, прямой кишки, желудка, селезенки или головного мозга.
Настоящее изобретение также относится к выделенному антителу против PD-L1, содержащему последовательности HCDR1', HCDR2' и HCDR3' тяжелой цепи и LCDR1', LCDR2' и LCDR3' легкой цепи, при этом
последовательность HCDR1' выбирают из группы, состоящей из DYYMN (SEQ ID NO: 23), SEQ ID NO: 29, 35, 41 и гомологичной последовательности, имеющей по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ними;
последовательность HCDR2' выбирают из группы, состоящей из DINPNNGGTSYNX'1KFX'2G (SEQ ID NO: 24), SEQ ID NO: 30, 36, 42 или гомологичной последовательности, имеющей по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ними;
последовательность HCDR3' выбирают из группы, состоящей из VKWGDGPFAY (SEQ ID NO: 25), SEQ ID NO: 31, 37, 43 и гомологичной последовательности, имеющей по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ними;
последовательность LCDR1' выбирают из группы, состоящей из X'3ASQNVGAAVA (SEQ ID NO: 26), SEQ ID NO: 32, 38, 44 и гомологичной последовательности, имеющей по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ними;
последовательность LCDR2' выбирают из группы, состоящей из SASNX'4X'5T (SEQ ID NO: 27), SEQ ID NO: 33, 39, 45 и гомологичной последовательности, имеющей по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ними;
последовательность LCDR3' выбирают из группы, состоящей из QQYSNYPT (SEQ ID NO: 28), SEQ ID NO: 34, 40, 46 и гомологичной последовательности, имеющей по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с ними;
при этом X'1 представляет собой H или Q; X'2 представляет собой K или Q; X'3 представляет собой K или Q; X'4 представляет собой R или L; X'5 представляет собой Y или E.
В конкретных вариантах осуществления X'1 представляет собой Q; X'2 представляет собой Q; X'3 представляет собой Q; X'4 представляет собой R; X'5 представляет собой Y.
В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит каркасные последовательности HFR1', HFR2', HFR3' и HFR4' тяжелой цепи и каркасные последовательности LFR1', LFR2', LFR3' и LFR4' легкой цепи, при этом последовательности вариабельной области тяжелой цепи соответствуют формуле: HFR1'-HCDR1'-HFR2'-HCDR1'-HFR3'-HCDR1'-HFR4' и последовательности вариабельной области легкой цепи соответствуют формуле LFR1'-LCDR1'-LFR2'-LCDR1'-LFR3'-LCDR1'-LFR4'.
В конкретных вариантах осуществления последовательность HFR1' представляет собой X'a1VQLX'a2QSGX'a3EX'a4X'a5KPGASVKX'a6SCKASGYVFT (SEQ ID NO: 47);
последовательность HFR2' представляет собой WVX'a7QX'a8X'a9GX'a10X'a11LEWIG (SEQ ID NO: 48);
последовательность HFR3' представляет собой X'a12X'a13TVTVDX'a14SX'a15X'a16TAYMELX'a17X'a18LX'a19SX'a20DX'a21AVYYC (SEQ ID NO: 49);
последовательность HFR4' представляет собой WGQGTLVTVSX'a22 (SEQ ID NO: 50);
последовательность LFR1' представляет собой DIX'a23MTQSX'a24X'a25X'a26X'a27SX'a28SVGDRVX'a29ITC (SEQ ID NO: 51);
последовательность LFR2' представляет собой WYQQKPGX'a30X'a31PKLLIY (SEQ ID NO: 52);
последовательность LFR3' представляет собой GVPX'a32RFX'a33GSGSGTDFTLTISX'a34X'a35QX'a36EDX'a37AX'a38YFC (SEQ ID NO: 53);
последовательность LFR4' представляет собой FGSGTKLGIK (SEQ ID NO: 54);
при этом X'a1 представляет собой Q или E; X'a2 представляет собой Q или V; X'a3 представляет собой A или P; X'a4 представляет собой L или V; X'a5 представляет собой V или K; X'a6 представляет собой I или V; X'a7 представляет собой K или R; X'a8 представляет собой S или A; X'a9 представляет собой H или P; X'a10 представляет собой Q или K; X'a11 представляет собой S или G; X'a12 представляет собой K или R; X'a13 представляет собой A или V; X'a14 представляет собой K или T; X'a15 представляет собой S, T или I; X'a16 представляет собой S или R; X'a17 представляет собой L или S; X'a18 представляет собой S или R; X'a19 представляет собой R или T; X'a20 представляет собой E или D; X'a21 представляет собой S или T; X'a22 представляет собой A или S; X'a23 представляет собой Q или V; X'a24 представляет собой Q или P; X'a25 представляет собой K или S; X'a26 представляет собой F или S; X'a27 представляет собой M или L; X'a28 представляет собой T или A; X'a29 представляет собой S или T; X'a30 представляет собой Q или K; X'a31 представляет собой S или A; X'a32 представляет собой S или D; X'a33 представляет собой S или T; X'a34 представляет собой S или N; X'a35 представляет собой M или L; X'a36 представляет собой S или P; X'a37 представляет собой L или I; X'a38 представляет собой D или T.
В конкретных вариантах осуществления X'a1 представляет собой Q; X'a2 представляет собой V; X'a3 представляет собой A; X'a4 представляет собой V; X'a5 представляет собой V; X'a6 представляет собой I; X'a7 представляет собой K; X'a8 представляет собой A; X'a9 представляет собой P; X'a10 представляет собой Q; X'a11 представляет собой G; X'a12 представляет собой R; X'a13 представляет собой A; X'a14 представляет собой K; X'a15 представляет собой T; X'a16 представляет собой R; X'a17 представляет собой S; X'a18 представляет собой R; X'a19 представляет собой R; X'a20 представляет собой D; X'a21 представляет собой T; X'a22 представляет собой S; X'a23 представляет собой Q; X'a24 представляет собой Q; X'a25 представляет собой S; X'a26 представляет собой S; X'a27 представляет собой L; X'a28 представляет собой A; X'a29 представляет собой T; X'a30 представляет собой K; X'a31 представляет собой A; X'a32 представляет собой S; X'a33 представляет собой S; X'a34 представляет собой S; X'a35 представляет собой M; X'a36 представляет собой P; X'a37 представляет собой I; X'a38 представляет собой T.
В конкретных вариантах осуществления X'a1 представляет собой Q; X'a2 представляет собой V; X'a3 представляет собой A; X'a4 представляет собой V; X'a5 представляет собой K; X'a6 представляет собой V; X'a7 представляет собой R; X'a8 представляет собой A; X'a9 представляет собой P; X'a10 представляет собой Q; X'a11 представляет собой G; X'a12 представляет собой R; X'a13 представляет собой V; X'a14 представляет собой T; X'a15 представляет собой I; X'a16 представляет собой R; X'a17 представляет собой S; X'a18 представляет собой R; X'a19 представляет собой R; X'a20 представляет собой D; X'a21 представляет собой T; X'a22 представляет собой S; X'a23 представляет собой Q; X'a24 представляет собой Q; X'a25 представляет собой S; X'a26 представляет собой S; X'a27 представляет собой L; X'a28 представляет собой A; X'a29 представляет собой T; X'a30 представляет собой K; X'a31 представляет собой A; X'a32 представляет собой S; X'a33 представляет собой S; X'a34 представляет собой S; X'a35 представляет собой M; X'a36 представляет собой P; X'a37 представляет собой I; X'a38 представляет собой T.
В конкретных вариантах осуществления X'a1 представляет собой Q; X'a2 представляет собой V; X'a3 представляет собой A; X'a4 представляет собой V; X'a5 представляет собой V; X'a6 представляет собой I; X'a7 представляет собой K; X'a8 представляет собой A; X'a9 представляет собой P; X'a10 представляет собой Q; X'a11 представляет собой G; X'a12 представляет собой R; X'a13 представляет собой A; X'a14 представляет собой K; X'a15 представляет собой T; X'a16 представляет собой R; X'a17 представляет собой S; X'a18 представляет собой R; X'a19 представляет собой R; X'a20 представляет собой D; X'a21 представляет собой T; X'a22 представляет собой S; X'a23 представляет собой Q; X'a24 представляет собой P; X'a25 представляет собой S; X'a26 представляет собой S; X'a27 представляет собой L; X'a28 представляет собой A; X'a29 представляет собой T; X'a30 представляет собой K; X'a31 представляет собой A; X'a32 представляет собой S; X'a33 представляет собой S; X'a34 представляет собой S; X'a35 представляет собой L; X'a36 представляет собой P; X'a37 представляет собой I; X'a38 представляет собой T.
В конкретных вариантах осуществления X'a1 представляет собой Q; X'a2 представляет собой V; X'a3 представляет собой A; X'a4 представляет собой V; X'a5 представляет собой K; X'a6 представляет собой V; X'a7 представляет собой R; X'a8 представляет собой A; X'a9 представляет собой P; X'a10 представляет собой Q; X'a11 представляет собой G; X'a12 представляет собой R; X'a13 представляет собой V; X'a14 представляет собой T; X'a15 представляет собой I; X'a16 представляет собой R; X'a17 представляет собой S; X'a18 представляет собой R; X'a19 представляет собой R; X'a20 представляет собой D; X'a21 представляет собой T; X'a22 представляет собой S; X'a23 представляет собой Q; X'a24 представляет собой P; X'a25 представляет собой S; X'a26 представляет собой S; X'a27 представляет собой L; X'a28 представляет собой A; X'a29 представляет собой T; X'a30 представляет собой K; X'a31 представляет собой A; X'a32 представляет собой A; X'a33 представляет собой S; X'a34 представляет собой S; X'a35 представляет собой L; X'a36 представляет собой P; X'a37 представляет собой I; X'a38 представляет собой T.
В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 65, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 66. В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 67, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 68. В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 65, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 68. В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 67, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 66. В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе, содержит вариабельную область тяжелой цепи, приведенную в SEQ ID NO: 85, и вариабельную область легкой цепи, приведенную в SEQ ID NO: 86.
Настоящее изобретение также относится к другому выделенному антителу против PD-L1, которое содержит по меньшей мере 1, 2, 3, 4, 5 или 6 областей CDR, выбранных из SEQ ID NOs: 29-46. В конкретных вариантах осуществления выделенное антитело против PD-L1 содержит 1) в тяжелой цепи HCDR1' с последовательностью SEQ ID NO: 29, HCDR2' с последовательностью SEQ ID NO: 30 и HCDR3' с последовательностью SEQ ID NO: 31; 2) в тяжелой цепи HCDR1' с последовательностью SEQ ID NO: 35, HCDR2' с последовательностью SEQ ID NO: 36 и HCDR3' с последовательностью SEQ ID NO: 37; или 3) в тяжелой цепи HCDR1' с последовательностью SEQ ID NO: 41, HCDR2' с последовательностью SEQ ID NO: 42 и HCDR3' с последовательностью SEQ ID NO: 43. В конкретных вариантах осуществления антитело против PD-L1 содержит 1) в легкой цепи LCDR1' с последовательностью SEQ ID NO: 32, LCDR2' с последовательностью SEQ ID NO: 33 и LCDR3' с последовательностью SEQ ID NO: 34; 2) в легкой цепи LCDR1' с последовательностью SEQ ID NO: 38, LCDR2' с последовательностью SEQ ID NO: 39 и LCDR3' с последовательностью SEQ ID NO: 40; или 3) в легкой цепи LCDR1' с последовательностью SEQ ID NO: 44, LCDR2' с последовательностью SEQ ID NO: 45 и LCDR3' с последовательностью SEQ ID NO: 46. В конкретных вариантах осуществления антитело против PD-L1 содержит 1) в тяжелой цепи HCDR1' с последовательностью SEQ ID NO: 29, HCDR2' с последовательностью SEQ ID NO: 30 и HCDR3' с последовательностью SEQ ID NO: 31, в легкой цепи LCDR1' с последовательностью SEQ ID NO: 32, LCDR2' с последовательностью SEQ ID NO: 33 и LCDR3' с последовательностью SEQ ID NO: 34; 2) в тяжелой цепи HCDR1' с последовательностью SEQ ID NO: 35, HCDR2' с последовательностью SEQ ID NO: 36 и HCDR3' с последовательностью SEQ ID NO: 37, в легкой цепи LCDR1' с последовательностью SEQ ID NO: 38, LCDR2' с последовательностью SEQ ID NO: 39 и LCDR3' с последовательностью SEQ ID NO: 40; или 3) в тяжелой цепи HCDR1' с последовательностью SEQ ID NO: 41, HCDR2' с последовательностью SEQ ID NO: 42 и HCDR3' с последовательностью SEQ ID NO: 43, в легкой цепи LCDR1' с последовательностью SEQ ID NO: 44, LCDR2' с последовательностью SEQ ID NO: 45 и LCDR3' с последовательностью SEQ ID NO: 46.
В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи, выбранную из SEQ ID NOs: 55, 57 и 59. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область легкой цепи, выбранную из SEQ ID NOs: 56, 58 и 60.
В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи SEQ ID NO: 55, или ее гуманизированный вариант, и вариабельную область легкой цепи SEQ ID NO: 56, или ее гуманизированный вариант. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи SEQ ID NO: 57, или ее гуманизированный вариант, и вариабельную область легкой цепи SEQ ID NO: 58, или ее гуманизированный вариант. В конкретных вариантах осуществления антитело против PD-L1 содержит вариабельную область тяжелой цепи SEQ ID NO: 59, или ее гуманизированный вариант, и вариабельную область легкой цепи SEQ ID NO: 60, или ее гуманизированный вариант.
Настоящее изобретение также относится к другому выделенному антителу против PD-L1, которое связывается с тем же эпитопом, что и антитело против PD-L1, предложенное в настоящем документе, или конкурирует с ним за связывание. В конкретных вариантах осуществления эпитоп содержит по меньшей мере аминокислотный остаток из E58 и S80. В конкретных вариантах осуществления эпитоп дополнительно содержит по меньшей мере один (например, по меньшей мере два, три или четыре) из следующих аминокислотных остатков PD-L1: Y56, R113, D122, Y123 и R125. В конкретных вариантах осуществления эпитоп содержит одно из следующих сочетаний аминокислотных остатков PD-L1: 1) E58, R113, D122, Y123 и R125; 2) Y56, E58 и R113; 3) E58, R113 и R125. В конкретных вариантах осуществления эпитоп дополнительно содержит по меньшей мере один (или по меньшей мере два) из следующих аминокислотных остатков PD-L1: S80 и D122. В конкретных вариантах осуществления эпитоп содержит одно из следующих сочетаний аминокислотных остатков PD-L1: 1) E58, S80, R113, D122, Y123 и R125; 2) E58, S80, R113 и R125.
Настоящее изобретение также относится к выделенному антителу против PD-L1, имеющему среднюю точку теплового перехода (Tm) более 76 (например, более 80, более 85, или более 90) градусов Цельсия при измерении методом дифференциальной сканирующей калориметрии. В конкретных вариантах осуществления антитело по настоящему изобретению представляет собой биспецифическое антитело, гуманизированное антитело, химерное антитело, моноклональное антитело, рекомбинантное антитело, меченое антитело, двухвалентное антитело или анти-идиотипическое антитело. В конкретных вариантах осуществления антитело представляет собой антигенсвязывающий фрагмент, выбранный из группы, состоящей из однодоменного антитела верблюдовых, диатела, scFv, димера scFv, BsFv, dsFv, (dsFv)2, dsFv-dsFv', Fv-фрагмента, Fab, Fab', F(ab')2, ds-диатела, нанотела, доменного антитела, выделенной области CDR и двухвалентного доменного антитела.
В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе (такое как 4B6, 26F5, 21F11, 23A11, 23F11 и 22C9), связывается с PD-L1 человека и приматов, но не связывается с PD-L1 мыши. В конкретных вариантах осуществления антитело против PD-L1, предложенное в настоящем документе (такое как 18G4), связывается как с человеческим, так и мышиным, PD-L1.
Настоящее изобретение также относится к фармацевтической композиции, содержащей антитело, описанное в настоящем документе.
Настоящее изобретение также относится к полинуклеотиду, кодирующему антитело, описанное в настоящем документе. Настоящее изобретение также относится к вектору, содержащему указанный полинуклеотид. Настоящее изобретение также относится к выделенной клетке-хозяину, содержащей указанный вектор. В конкретных вариантах осуществления клетка-хозяин продуцирует антитело, кодируемое полинуклеотидом.
Настоящее изобретение также относится к набору, содержащему антитело, описанное в настоящем документе.
Настоящее изобретение также относится к способу получения антитела, описанного в настоящем документе, включающему культивирование клетки-хозяина в условиях, при которых полинуклеотид экспрессируется.
Настоящее изобретение также относится к способу лечения связанного с PD-L1 состояния у субъекта, который нуждается в этом, включающему введение субъекту терапевтически эффективного количества антитела, описанного в настоящем документе. В конкретных вариантах осуществления второе терапевтическое средство представляет собой средство, используемое в лучевой терапии, химиотерапии, направленной терапии, генной терапии, иммунотерапии, гормональной терапии, ингибировании ангиогенеза, паллиативной терапии, хирургической операции или их сочетании. В конкретных вариантах осуществления второе терапевтическое средство представляет собой антитело против VEGFR2.
Настоящее изобретение также относится к фармацевтической композиции, содержащей антитело против PD-L1, предложенное в настоящем документе, и второе терапевтическое средство.
Настоящее изобретение также относится к способу лечения связанного с PD-L1 состояния у субъекта, который нуждается в этом, включающему введение субъекту терапевтически эффективного количества фармацевтической композиции.
Настоящее изобретение также относится к выделенной не принадлежащей человеку клетке опухоли, содержащей полинуклеотид, кодирующий белок PD-L1 человека. В конкретных вариантах осуществления не принадлежащая человеку клетка опухоли является клеткой опухоли грызуна (например, мыши, крысы или хомяка, и так далее).
Настоящее изобретение также относится к способу получения не принадлежащей человеку клетки опухоли, содержащей полинуклеотид, кодирующий белок PD-L1 человека, включающему введение в клетку полинуклеотида, кодирующего PD-L1 человека. В конкретных вариантах осуществления способ дополнительно включает инактивацию эндогенного не принадлежащего человеку гена PD-L1. В конкретных вариантах осуществления инактивация включает разрушение в гене кодирующей белок области, мутацию, добавление, выключение гена или делецию гена, за счет чего элиминируется или сводится к минимуму экспрессия гена-мишени или образуется функционально неактивный/укороченный белок. В конкретных вариантах осуществления сегмент гена PD-L1 человека функционально встраивают в локус эндогенного не принадлежащего человеку гена PD-L1. В конкретных вариантах осуществления сегмент гена PD-L1 человека встраивают в сайт, отличный от локуса эндогенного не принадлежащего человеку гена PD-L1. В конкретных вариантах осуществления сегмент гена PD-L1 человека имеет форму эписомного сегмента ДНК.
Настоящее изобретение относится к способу скрининга или оценки in vivo эффективности антитела против PD-L1 человека, включающему инокуляцию не принадлежащей человеку клетки опухоли, содержащей полинуклеотид, кодирующий белок PD-L1 человека, животному, отличному от человека, контактирование антитела с не принадлежащей человеку клеткой опухоли у животного, отличного от человека, и определение опухолевой нагрузки не принадлежащей человеку клетки опухоли. Клетка опухоли может представлять собой клетку солидной опухоли или клетку несолидной опухоли. В конкретных вариантах осуществления не принадлежащую человеку клетку инокулируют сингенному животному, отличному от человека, для создания модели сингенной опухоли. В конкретных вариантах осуществления животное, отличное от человека, является грызуном (например, мышью, крысой или хомяком, и так далее).
В одном аспекте настоящее изобретение относится к выделенному антителу против PD-L1, которое связывается, или конкурирует за связывание, с эпитопом, содержащим одно из следующих сочетаний аминокислотных остатков PD-L1: 1) E58 и S80; 2) E58 и R113; 3) E58 и D122; 4) E58 и R125. В конкретных вариантах осуществления эпитоп дополнительно содержит по меньшей мере один из следующих аминокислотных остатков PD-L1: Y56 и Y123. В конкретных вариантах осуществления эпитоп содержит одно из следующих сочетаний аминокислотных остатков PD-L1: 1) E58, R113, M115, Y123 и K124; 2) E58, S80, R113 и R125; 3) E58, R113, D122, Y123 и R125; 4) Y56, E58 и R113; 5) E58, R113 и R125. В конкретных вариантах осуществления эпитоп дополнительно содержит по меньшей мере один из следующих аминокислотных остатков PD-L1: K62, N63, I64 и Y81. В конкретных вариантах осуществления эпитоп содержит одно из следующих сочетаний аминокислотных остатков PD-L1: 1) E58, N63, I64, S80, Y81, R113 и R125; 2) E58, S80, R113, M115, D122, Y123, K124 и R125; 3) E58, K62, N63, S80, Y81, R113 и R125; 4) E58, N63, I64, S80, Y81, R113, K124 и R125; 5) E58, S80, R113, D122, Y123 и R125.
В одном аспекте изобретение также относится к выделенному антителу против PD-L1, которое связывается, или конкурирует за связывание, с эпитопом, состоящим из аминокислотного остатка S80 в PD-L1.
В одном аспекте настоящее изобретение относится к выделенному антителу против PD-L1, которое характеризуется продолжительностью устойчивой занятости рецепторов PD-L1 по меньшей мере 7 дней (например, по меньшей мере 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35 или 40 дней).
Настоящее изобретение относится к выделенному антителу против PD-L1, которое связывается с активированными T-клетками человека с величиной EC50, составляющей примерно 0,03 мкг/мл, при измерении методом ELISA (например, от 0,001 мкг/мл до 1 мкг/мл, например, 0,001-0,5 мкг/мл, 0,001-0,2 мкг/мл, 0,001-0,1 мкг/мл, 0,01-0,2 мкг/мл, 0,01-0,1 мкг/мл, 0,01-0,05 мкг/мл, 0,01-0,03 мкг/мл или 0,001-0,01 мкг/мл при измерении методом ELISA), или EC50, составляющей 0,01-1 мкг/мл (например, 0,01-0,5 мкг/мл, 0,01-0,2 мкг/мл, 0,02-1 мкг/мл, 0,02-0,5 мкг/мл, 0,02-0,2 мкг/мл или 0,02-0,1 мкг/мл), при измерении методом FACS.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фигуре 1A приведена гистограмма, показывающая способность мышиных анти-PD-L1 антител в супернатанте гибридомы блокировать связывание hPD-L1-Fc с hPD-1-his, нанесенным на планшет; на Фигуре 1B приведена гистограмма, показывающая способность мышиных анти-PD-L1 антител в супернатанте гибридомы блокировать связывание hPD-L1-Fc с hPD-1-his, нанесенным на планшет, и на Фигуре 1C также приведена гистограмма, показывающая способность мышиных анти-PD-L1 антител в супернатанте гибридомы блокировать связывание hPD-L1-Fc с hPD-1-his, нанесенным на планшет, при измерении в анализе ELISA.
На Фигуре 2A приведен график, показывающий pH-зависимое связывание мышиного анти-PD-L1 антитела 23A11 в супернатанте гибридомы с hPD-L1-his, с большим связыванием при pH 7,4 (треугольники) и меньшим связыванием при pH 6,0 (ромбы), при измерении в анализе ELISA. На Фигуре 2B показано pH-зависимое связывание мышиного антитела клона 23F11 в супернатанте гибридомы с hPD-L1, с большим связыванием при pH 7,4 (треугольники) и меньшим связыванием при pH 6,0 (ромбы), при измерении в анализе ELISA.
На Фигуре 3 показано связывание серийно разведенных очищенных мышиных моноклональных антител против PD-L1 (21F11 (кресты), 23F11 (ромбы), 26F5 (незаштрихованные кружки), 22C9 (незаштрихованные треугольники), 4B6 (заштрихованные квадраты), 23A11 (заштрихованные треугольники)) разных клонов с hPD-L1 при измерении в анализе ELISA.
На Фигуре 4A показана активность серийно разведенных очищенных мышиных моноклональных антител против PD-L1 (23A11 (светло-серые заштрихованные квадраты), 23F11 (заштрихованные треугольники), 4B6 (заштрихованные кружки), 22C9 (заштрихованные ромбы), 26F5 (темные заштрихованные квадраты), 21F11 (перевернутые треугольники) и BM-GT (незаштрихованные кружки)) в блокировании связывания hPD-1-Fc с конъюгатом hPD-1-N297A-биотин при измерении методом ELISA; на Фигуре 4B показана активность антител против PD-L1 с концентрацией 10 мкг/мл в блокировании связывания hPD-1-Fc N297A с hPD-L1, экспрессированным на HCC827, при измерении в FACS-анализе.
На Фигуре 5A показано зависимое от дозы связывание очищенных мышиных антител против PD-L1 с hPD-L1, экспрессированным на HCC827; на Фигуре 5B показана зависимая от дозы активность очищенных мышиных антител против PD-L1 в блокировании связывания hPD-1-N297A с hPD-L1, экспрессированным на HCC827. 21F11 (кружки), 23A11 (треугольники), 23F11 (перевернутые треугольники), 22C9 (ромбы) и 4B6 (большие кружки).
На Фигуре 6A (4B6-C), Фигуре 6B (23A11), Фигуре 6C (23F11), Фигуре 6D (22C9) и Фигуре 6E (21F11) показано, что мышиные и/или химерные антитела против PD-L1 связываются с PD-L1-his человека и яванского макака аналогично, при этом антитела, специфически связывающиеся с PD-L1 человека и яванского макака, не связываются с PD-L1-his мыши, при измерении методом ELISA, за исключением 18G4, которое связывается как с человеческим, так и с мышиным PD-L1 (Фигура 6F). На Фигуре 6G показано, что все антитела могут связываться с hPD-L1, но не с hPD-L2, при измерении методом ELISA.
На Фигуре 7 показано связывание химерных и/или гуманизированных антител против PD-L1 с hPD-L1, экспрессированным на HCC827, при измерении методом FACS.
На Фигуре 8 показана активность химерных и/или гуманизированных антител против PD-L1 в блокировании связывания PD-1 с hPD-L1, экспрессированным на HCC827, при измерении методом FACS.
На Фигуре 9A (18G4), Фигуре 9B (4B6) и Фигуре 9C (23A11) приведены гистограммы, показывающие результаты связывания антител против PD-L1 с эпитопами hPD-L1-Fc в присутствии конкурирующих антител 4B6, 23A11, 23F11, 22C9 и 21F11, при измерении в конкурентном анализе ELISA, соответственно.
На Фигуре 10A (23F11-C), Фигуре 10B (23A11-C), Фигуре 1C (22C9-C), Фигуре 10D (21F11-C), Фигуре 10E (4B6-C) и Фигуре 10F (26F5-C) приведены графики, демонстрирующие pH-зависимое связывание химерных антител против PD-L1 с hPD-L1-his при pH 7,4 и pH 5,5, соответственно, при измерении в анализе ELISA.
На Фигуре 11A показан средний объем опухоли, измеренный с течением времени, у животных в нокин модели опухоли MC38/человеческий PD-L1, демонстрирующий in vivo противоопухолевую активность очищенных мышиных анти-PD-L1 антител (4B6 (заштрихованные ромбы), 23A11 (незаштрихованные перевернутые треугольники), 23F11 (заштрихованные полосатые ромбы) и 26F5 (незаштрихованные ромбы)) и растворителя (заштрихованные кружки) в ингибировании роста опухоли; на Фигуре 11B показан средний объем опухоли в день 29 при использовании тех же антител; на Фигуре 11C показана средняя масса тела, измеренная с течением времени, при использовании тех же антител. Мышам (n=8 в каждой группе) вводили в/б инъекцией антитела в дозе 10 мг/кг (то есть, mpk) 3 раза/неделю в течение 3 недель, результаты представлены в виде среднего значения ± S.E.M.
На Фигуре 12A показан средний объем опухоли, измеренный с течением времени, в нокин модели опухоли MC38/человеческий PD-L1 у животных, которым вводили инъекцией очищенные мышиные/химерные антитела против PD-L1 (4B6-C (светло-серые заштрихованные треугольники), 23F11 (заштрихованные темные перевернутые треугольники)) и эталонные антитела BM-GT (незаштрихованные кружки) и BM-ME (незаштрихованные квадраты) или контроль PBS (заштрихованные кружки), в экспериментах по ингибированию роста опухоли, демонстрирующий in vivo противоопухолевую активность антител; На Фигуре 12B показан средний объем опухоли в день 20, соответственно, у мышей (n=8 в каждой группе), которым вводили в/б инъекцией указанные антитела в дозе 1 mpk (мг/кг) 3 раза/неделю в течение 3 недель; на Фигуре 12C показан средний объем опухоли, измеренный с течением времени, и на Фигуре 12D показан средний объем опухоли в день 25 у мышей (n=8 в каждой группе), которым вводили в/в инъекцией в дозе 1 mpk (светло-серые перевернутые заштрихованные треугольники) или 3 mpk (заштрихованные ромбы) мышиное антитело 18G4; На Фигуре 12E показан средний объем опухоли, измеренный с течением времени, и на Фигуре 12F показан средний объем опухоли в день 25, соответственно, у мышей (n=8 в каждой группе), которым вводили в/в инъекцией в дозе 1 mpk (незаштрихованные кружки) или 3 mpk (незаштрихованные квадраты) мышиное антитело 22C9; результаты представлены в виде среднего значения ± S.E.M.
На Фигуре 13A показан средний объем опухоли, измеренный с течением времени, у животных в нокин модели опухоли MC38/человеческий PD-L1, демонстрирующий in vivo противоопухолевую активность очищенных pH-зависимых химерных антител против PD-L1 (23A11-C, незаштрихованные кружки; 23F11-C, незаштрихованные треугольники) в экспериментах по ингибированию роста опухоли; на Фигуре 13B показан средний объем опухоли в день 29; мышам (n=8 в каждой группе) вводили в/б инъекцией антитела в дозе 1 mpk 3 раза/неделю в течение 3 недель, результаты представлены в виде среднего значения ± S.E.M, P <0,05. Данные для растворителя представлены заштрихованными кружками и данные для эталонного GT представлены перевернутыми заштрихованными треугольниками.
На Фигуре 14A приведены аминокислотные последовательности зародышевой линии и гуманизированные последовательности вариабельных областей тяжелой цепи 4B6 (4B6-зародышей линии, 4B6-Hzd-HC-V3 и 4B6-HC-V4) и на Фигуре 14B приведены аминокислотные последовательности зародышевой линии и гуманизированные последовательности вариабельных областей легкой цепи 4B6 (4B6-LC-зародышей линии, 4B6-Hzd-LC-V3 и 4B6-LC-V4).
На Фигуре 15A приведены аминокислотные последовательности зародышевой линии и гуманизированные последовательности вариабельных областей тяжелой цепи антитела 23A11 (23A11-HC-зародышей линии, 23A11-HC-V3 и 23A11-HC-V5) и на Фигуре 15B приведены аминокислотные последовательности зародышевой линии и гуманизированные последовательности вариабельных областей легкой цепи антитела 23A11 (23A11-LC-зародышей линии, 23A11-LC-V3 и 23A11-LC-V5).
На Фигуре 16A приведены аминокислотные последовательности зародышевой линии и гуманизированные последовательности вариабельных областей тяжелой цепи антитела 23F11 (23F11-зародышей линии HC, 23F11-HC-V4 и 23F11-HC-V6) и на Фигуре 16B приведены аминокислотные последовательности зародышевой линии и гуманизированные последовательности вариабельных областей легкой цепи антитела 23F11 (23F11-зародышей линии LC, 23F11-LC-V4 и 23F11-LC-V6).
На Фигуре 17A приведена гистограмма, показывающая связывание антитела 23F11 (H4L4, H4L6, H6L4, H6L6 и химерные) и на Фигуре 17B показано связывание гуманизированного антитела 23A11 (H3L3, H3L5, H5L3 и H5L5) с hPD-L1-his при измерении методом ELISA.
На Фигурах 18A - 18D приведены гистограммы, показывающие активность гуманизированных антител против PD-L1 в блокировании связывания hPD-L1-Fc с hPD-1-N297A при измерении методом ELISA. Показаны результаты для гуманизированного 4B6 (H3L3, H3L4, H4L3 и H4L4, Фигура 18A), 23F11 (H4L4, H4L6, H6L4, H6L6 и химерные (C), Фигура 18B), гуманизированного 23A11 (H3L3, H3L5, H5L3 и H5L5, Фигура 18C), гуманизированного 23A11 (H3L3 и H3L5) и гуманизированного 23F11 (H4L4), а также для эталонных антител (BM-GT и BM-ME, смотри Фигуру 18D), соответственно.
На Фигуре 19 показано связывание гуманизированных антител против PD-L1 (BM-GT, BM-ME, 4B6-H3L4, 4B6-H4L3, 23F11-H4L4, 23F11-H4L6, 23F11-H6L4, 23F11-H6L6, 23A11-H3L3, 23A11-H3L5, 23A11-H5L3 и 23A11-H5L5) с hPD-L1, экспрессированным на HCC827, при измерении методом FACS.
На Фигуре 20A приведена гистограмма, показывающая активность гуманизированного 4B6 (H3L4 и H4L3) и эталонных антител (BM-GT и BM-ME) в блокировании связывания hPD-1-N297A с hPD-L1, экспрессированным на HCC827, при измерении методом FACS. На Фигуре 20B показано блокирующее действие гуманизированного 23A11 H3L5 (продуцированного в CHO и 293, соответственно), гуманизированного 23F11 H4L4 (продуцированного в CHO и 293, соответственно) и эталонных антител (BM-GT и BM-ME) на связывание hPD-1-N297A с hPD-L1, экспрессированным на HCC827, при измерении методом FACS.
На Фигуре 21A приведена гистограмма, показывающая продуцирование IL-2 в активированных CD4 T-клетках донора 5, стимулированных гуманизированным антителом 4B6-H3L3, hIgG1, BM-GT и BM-ME, в реакции смешанной культуры лимфоцитов (СКЛ). На Фигуре 21B показано продуцирование IFN-γ в активированных CD4 T-клетках донора 5, стимулированных гуманизированным антителом 4B6-H3L3, hIgG1, BM-GT и BM-ME, в том же тесте. На Фигуре 21C показано продуцирование IL-2 в активированных CD4 T-клетках донора 6, стимулированных гуманизированными антителами 23A11-H3L3, 23A11-H3L5, 23F11-H4L4 и 23F11-H6L4, hIgG1, BM-GT и BM-ME, в том же тесте. На Фигуре 21D показано продуцирование IFN-γ в активированных CD4 T-клетках донора 6, стимулированных гуманизированными антителами 23A11-H3L3, 23A11-H3L5, 23F11-H4L4 и 23F11-H6L4, hIgG1, BM-GT и BM-ME, в том же тесте.
На Фигурах 22A и 22C показано pH-зависимое связывание гуманизированного 23A11-H3L5, продуцированного в клетках CHO и клетках 293, с hPD-L1-his при pH 7,4 (треугольники) и pH 5,5 (ромбы), соответственно, при измерении в анализе ELISA; на Фигурах 22B и 22D показано такое же связывание гуманизированного 23F11-H4L4 с hPD-L1-his при pH 7,4 (треугольники) и pH 5,5 (ромбы), при измерении в анализе ELISA; на Фигуре 22E приведены результаты такого же теста для связывания эталонного антитела BM-GT с hPD-L1-his при pH 7,4 (треугольники) и pH 5,5 (ромбы), соответственно, при измерении в анализе ELISA.
На Фигуре 23A показано pH-зависимое связывание 23A11-H3L5 с hPD-L1-his при нейтральном pH (то есть, 7,4) и кислом pH (то есть, 6,0, 5,5, 5,0, 4,5, 4,0) при измерении в анализе ELISA; на Фигуре 23B показаны те же результаты, представленные в виде процентной доли сигнала, нормированного на сигнал при pH 7,4; на Фигуре 23C показано pH-зависимое связывание 23F11-H4L4 с hPD-L1-his при нейтральном pH (то есть, 7,4) и кислом pH (то есть, 6,0, 5,5, 5,0, 4,5, 4,0) при измерении в анализе ELISA; на Фигуре 23D показаны те же результаты, представленные в виде процентной доли сигнала, нормированного на сигнал при pH 7,4; на Фигуре 23E показано pH-зависимое связывание 22C9-C с hPD-L1-his при нейтральном pH (то есть, 7,4) и кислом pH (то есть, 6,0, 5,5, 5,0, 4,5, 4,0) при измерении в анализе ELISA; на Фигуре 23F показаны те же результаты, представленные в виде процентной доли сигнала, нормированного на сигнал при pH 7,4. Обозначения на всех фигурах Фигуры 23: pH 7,4 (серые кружки), pH 6,0 (темные кружки), pH 5,5 (темные квадраты), pH 5,0 (перевернутые серые треугольники), pH 4,5 (серые ромбы), pH 4,0 (серые треугольники).
На Фигурах 24A - 24I приведены гистограммы, показывающие связывание антител против PD-L1 (23F11 (Фигура 24A), 23A11 (Фигура 24B), 26F5 (Фигура 24C), 18G4 (Фигура 24D), 4B6 (Фигура 24E), 21F11 (Фигура 24F), 22C9 (Фигура 24G), 23F11-H4L4 (Фигура 24H) и 23A11-H3L5 (Фигура 24I)) с аланиновыми мутантами hPD-L1-Fc (полученными в примере 18) при измерении методом ELISA.
На Фигуре 25 показана in vivo противоопухолевая активность гуманизированных антител против PD-L1 (растворитель, заштрихованные кружки; BT-GM, незаштрихованные квадраты, и 4B6-H3L3-N297A, незаштрихованные кружки) в экспериментах по ингибированию роста опухоли у животных в нокин модели опухоли MC38/человеческий PD-L1, представленная в виде среднего объема опухоли с течением времени. Мышам (n=8 в каждой группе) вводили в/б инъекцией антитела в дозе 3 mpk 3 раза/неделю в течение 3 недель, результаты представлены в виде среднего значения ± S.E.M.
На Фигуре 26A показан средний объем опухоли, измеренный с течением времени, у животных в нокин модели опухоли MC38/человеческий PD-L1, которым вводили растворитель (заштрихованные кружки), BM-ME (незаштрихованные квадраты), BM-GT (незаштрихованные ромбы), 23A11-H3L5 (незаштрихованные треугольники) и 23F11-H4L4 (незаштрихованные перевернутые треугольники), демонстрирующий in vivo противоопухолевую активность гуманизированных антител против PD-L1 в виде ингибирования роста опухоли; на Фигуре 26B показан средний объем опухоли в день 28 у мышей, которым вводили антитела в дозе 1 mpk; на Фигуре 26C показаны результаты такого же теста, как на Фигуре 26A, но с использованием антител в дозе 10 mpk, соответственно; на Фигуре 26D показаны результаты такого же теста, как на Фигуре 26B, но с использованием антител в дозе 10 mpk, соответственно; на Фигуре 26E приведено сравнение объемов опухолей у мышей, которым вводили разные антитела в разных дозах (растворитель, заштрихованные кружки; BM-GT в дозе 1 mpk, заштрихованные ромбы; BM-GT в дозе 3 mpk, перевернутые заштрихованные треугольники; BM-GT в дозе 10 mpk, заштрихованные квадраты; и 23F11-H4L4 в дозе 1 mpk, незаштрихованные кружки). Мышам (n=8 в каждой группе) вводили в/б инъекцией антитела 3 раза/неделю в течение 3 недель, результаты представлены в виде среднего значения ± S.E.M.
На Фигуре 27A показан средний объем опухоли, измеренный с течением времени, у животных в нокин модели опухоли MC38/человеческий PD-L1, демонстрирующий in vivo противоопухолевую активность антител (растворитель, незаштрихованные кружки; BM-GT, незаштрихованные треугольники; 23A11-H3L5, незаштрихованные кружки; и 23F11-H4L4, незаштрихованные кружки с точкой) в виде ингибирования роста опухоли. На Фигуре 27B показан средний объем опухоли в день 26 у мышей, которым вводили антитела (растворитель, заштрихованные кружки; BM-GT, заштрихованные треугольники; 23A11-H3L5, перевернутые заштрихованные треугольники; и 23F11-H4L4, незаштрихованные кружки). Мышам (n=12 в каждой группе) вводили в/в инъекцией антитела в дозе 1 mpk в день 0 и день 15, результаты представлены в виде среднего значения ± S.E.M.
На Фигурах 28A - 28D приведены каскадные диаграммы, показывающие изменение размера опухоли, нормированного на размер в начальный момент времени, у мышей, получавших в/в инъекцию антител против PD-L1 в дозе 1 мг/кг (растворитель (Фигура 28A), BM-GT (Фигура 28B), 23A11-H3L5 (Фигура 28C) и 23F11-H4L4 (Фигура 28D).
На Фигуре 29A показан средний объем опухоли, измеренный с течением времени, в экспериментах по ингибированию роста опухоли у животных в нокин модели опухоли MC38/человеческий PD-L1, которым в/в вводили разные дозы антител против PD-L1 (растворитель, заштрихованные кружки; BM-GT в дозе 1 mpk, незаштрихованные квадраты; BM-GT в дозе 10 mpk, заштрихованные квадраты; 23F11-H4L4 в дозе 1 mpk, заштрихованные ромбы; 23F11-H4L4 в дозе 10 mpk, перевернутые заштрихованные треугольники; 23A11-H3L5 в дозе 1 mpk, незаштрихованные кружки; 23A11-H3L5 в дозе 10 mpk, заштрихованные треугольники), демонстрирующий in vivo противоопухолевую активность. На Фигуре 29B показан средний объем опухоли в день 15 у мышей, которым вводили разные антитела (растворитель, заштрихованные кружки; BM-GT в дозе 1 mpk, темные незаштрихованные квадраты; BM-GT в дозе 10 mpk, светлые незаштрихованные квадраты; 23A11-H3L5 в дозе 1 mpk, светлые незаштрихованные кружки; 23A11-H3L5 в дозе 10 mpk, темные незаштрихованные треугольники; 23F11-H4L4 в дозе 1 mpk, темные незаштрихованные кружки; и 23F11-H4L4 в дозе 10 mpk, перевернутые темные незаштрихованные треугольники). Мышам (n=12 в каждой группе) вводили в/в инъекцией антитела в день 0, результаты представлены в виде среднего значения ± S.E.M.
На Фигуре 30 показана in vivo противоопухолевая активность гуманизированных антител против PD-L1 23A11-H3L5 (треугольники) и 23F11-H4L4 (кружки) у животных в нокин модели опухоли MC38/человеческий PD-L1, которым повторно вводили клетки опухоли в день 35.
На Фигуре 31A приведены иллюстративные изображения излучаемого сигнала меченых pH-зависимого антитела против PD-L1 23F11-H4L4 и антитела BM-GT, которые проникают в клетки опухоли MC38/hPD-L1 в разные моменты времени после внутривенного введения дозы 1 мг/кг; на Фигуре 31B показано соотношение излучаемый сигнал/объем опухоли, измеренное в течение нескольких часов у каждой мыши (для BM-GT, 2-1 (перевернутые серые треугольники), 2-2 (заштрихованные серые ромбы), 2-3 (незаштрихованные серые кружки) и для 23F11-H4L4, 4-1 (незаштрихованные темные ромбы), 4-2 (заштрихованные темные ромбы), 4-3 (темные звезды)); на Фигуре 31C показан объем опухоли, измеренный в течение нескольких дней у каждой мыши, получавшей BM-GT (квадраты) или 23F11-H4L4 (перевернутые треугольники), и линии, соответствующие средним значениям.
На Фигуре 32A показан средний объем опухоли, измеренный с течением времени, в модели опухоли hPD-L1/MC38 у мышей, получавших растворитель (заштрихованные кружки), только DC101 (анти-VEGFR2 антитело, незаштрихованные квадраты), только 23A11-C (незаштрихованные перевернутые треугольники) и сочетание 23A11-C и DC101 (незаштрихованные кружки), соответственно, демонстрирующий in vivo противоопухолевую активность сочетания; на Фигуре 32B показан средний объем опухоли в день 29 у мышей, которым инъекцией вводили растворитель (заштрихованные кружки), только DC101 (анти-VEGFR2 антитело, заштрихованные квадраты), только 23A11-C (перевернутые заштрихованные треугольники) и сочетание 23A11-C и DC101 (заштрихованные ромбы), соответственно; на Фигуре 32C показана средняя масса тела с течением времени, измеренная в том же тесте, у мышей, получавших растворитель (заштрихованные кружки), только DC101 (анти-VEGFR2 антитело, заштрихованные квадраты), только 23A11-C (перевернутые заштрихованные треугольники) и сочетание 23A11-C и DC101 (заштрихованные ромбы), соответственно; мышам (n=8 в каждой группе) вводили в/в инъекцией дозу 0,3 mpk 23A11-C и/или дозу 20 mpk DC101 3 раза в неделю в течение 3 недель. На Фигуре 32D показан средний объем опухоли, измеренный с течением времени, у мышей, получавших дозу 10 mpk контрольных IgG (заштрихованные кружки), только 1 mpk DC101 (заштрихованные квадраты), только 1 mpk 23A11-H3L5 (заштрихованные ромбы) и сочетание 1 mpk 23A11-H3L5 и 1 mpk DC101 (заштрихованные треугольники), соответственно; на Фигуре 32E показан средний объем опухоли, измеренный с течением времени, у мышей, получавших дозу 10 mpk контрольных IgG (заштрихованные кружки), только 3 mpk DC101 (заштрихованные треугольники), только 3 mpk 23A11-H3L5 (незаштрихованные кружки) и сочетание 3 mpk 23A11-H3L5 и 3 mpk DC101 (незаштрихованные перевернутые треугольники), соответственно. Мышам (n=8 в каждой группе) вводили в/в инъекцией антитела один раз в неделю в течение 2-3 недель. Результаты представлены в виде среднего значения ± S.E.M.
На Фигуре 33A приведен график, показывающий среднюю точку теплового перехода (Tm) для 23F11-H4L4 и на Фигуре 33B показана средняя точка теплового перехода (Tm) для 23A11-H3L5, соответственно, при измерении методом дифференциальной сканирующей калориметрии (ДСК).
На Фигуре 34 приведен список последовательностей по настоящему изобретению.
На Фигуре 35 показан график интернализации 23F11-H4L4 в клетках MC38/hPD-L1. На оси Y показан флуоресцентный сигнал 23F11-H4L4 в клетках при разных концентрациях антитела, измеренный на приборе Varioskan Flash. Мелкие серые кружки представляют данные для 23F11-H4L4, измеренные через 24 часа, и крупные черные кружки представляют данные для 23F11-H4L4, измеренные через 6 часов.
На Фигурах 36A и 36B показано связывание 23F11-H4L4 с активированными T-клетками человека. На Фигуре 36A показано связывание 23F11-H4L4 с CD3- и CD28-положительными моноцитами, при этом очень незначительное связывание было обнаружено в случае CD3- и CD28-отрицательных моноцитов.
На Фигурах 37A - 37C приведены результаты исследования in vivo эффективности антитела против PD-L1 в мышиной модели опухоли из клеток MC38/hPD-L1 с нокином hPD-1. На Фигуре 37A показан объем опухоли с течением времени у мышей C57BL/6 с нокином гена PD-1 человека, которым вводили PBS и 23F11-H4L4, соответственно. На Фигуре 37B показано изменение размера опухоли, нормированного на размер в начальный момент времени, у отдельных мышей, получавших в/в инъекцию PBS или антитела против PD-L1 в дозе 3 мг/кг, соответственно. На Фигуре 37C показана средняя масса тела с течением времени, измеренная в том же тесте, у мышей, получавших PBS (заштрихованные кружки) и 23F11-H4L4 (заштрихованные квадраты), соответственно.
На Фигурах 38A - 38C приведены результаты исследования in vivo эффективности антитела против PD-L1 в мышиной модели опухоли из клеток MC38/hPD-L1 с нокином hPD-1. На Фигурах 38A и 38B показан объем опухоли с течением времени у мышей C57BL/6 с нокином гена PD-1 человека, которым вводили 23F11-H4L4 (1 мг/кг, 3 мг/кг и 10 мг/кг), контрольные hIgG (AB160160, 10 мг/кг) и BM-GT (10 мг/кг), соответственно. На Фигуре 37C показано изменение размера опухоли, нормированного на размер в начальный момент времени, у отдельных мышей, получавших в/б инъекцию антител против PD-L1, контрольных hIgG или BM-GT, соответственно.
На Фигуре 39 показана занятость рецепторов PD-L1 для 23F11-H4L4 и BM-GT, измеренная в день 2, 7 и 14 после в/в введения мышам с опухолями MC38/hPD-L1.
На Фигуре 40 приведено репрезентативное изображение проникновения 23F11-H4L4 и ОИЛ на замороженных срезах опухоли MC38/hPD-L1 CDx в день 7 после введения дозы 10 mpk. Фигура A: 23F11-H4L4, окрашенные конъюгированным с Alexa Fluor® 488 вторичным антителом козы против IgG (H+L) человека (зеленый цвет); Фигура B: ОИЛ, окрашенные конъюгированным с Alexa Fluor® 594 антителом против CD8b.2 мыши (красный цвет); Фигура C: окрашивание сосудов конъюгированным с Alexa Fluor® 594 антителом против CD31 мыши (красный цвет); Фигура D: Отрицательный контроль. Ядра, окрашенные DAPI (синий цвет).
подробное описание изобретения
Приведенное далее описание изобретения предназначено лишь для иллюстрации различных вариантов осуществления изобретения. Вследствие этого, конкретные описанные модификации не следует толковать, как ограничения объема изобретения. Специалисту в данной области понятно, что различные эквиваленты, изменения и модификации могут быть использованы без отклонения от объема изобретения, и понятно, что такие эквивалентные варианты осуществления должны входить в объем изобретения. Содержание всех литературных источников, цитируемых в настоящем документе, включая публикации, патенты и патентные заявки, включено в настоящий документ посредством ссылки в полном объеме.
Определения
Используемый в настоящем документе термин «PD-L1» (также известный как B7-H1/CD274), означает лиганд 1 программируемой гибели клеток (PD-L1, смотри, например, Freeman et al. (2000) J. Exp. Med. 192: 1027). Он экспрессируется в плаценте, селезенке, лимфатических узлах, тимусе, сердце, эмбриональной печени, и также присутствует на многих опухолевых или раковых клетках. «PD-L2» означает лиганд 2 программируемой гибели клеток (PD-L2, смотри, например, Latchman et al. (2001) Nat. Immunol. 2: 261). «PD-1» (также известный как CD279) означает белок 1 программируемой гибели клеток, член семейства CD28, он кодируется геном PDCD 1 и представляет собой ингибирующий рецептор, экспрессированный на поверхности T-клеток, который действует, физиологически ограничивая активацию и пролиферацию T-клеток. Репрезентативная аминокислотная последовательность PD-1 человека раскрыта под регистрационным номером NCBI: NP_005009.2, и репрезентативная нуклеотидная последовательность, кодирующая PD-1 человека, приведена под регистрационным номером NCBI: NM_005018.2. Термин «PD-1 лиганд» включает любой, или оба, из PD-L1 и PD-L2, а также любые варианты или изоформы, которые естественным образом экспрессируются клетками, и/или их фрагменты, обладающие по меньшей мере одной биологической активностью полноразмерных полипептидов. Последовательность PD-L1 человека раскрыта под регистрационным номером NCBI: NP_054862.1 (репрезентативная аминокислотная последовательность) и регистрационным номером NCBI: NM_014143,3 (репрезентативная нуклеотидная последовательность).
Используемый в настоящем документе термин «антитело» включает любой иммуноглобулин, моноклональное антитело, поликлональное антитело, мультивалентное антитело, мультиспецифическое антитело или биспецифическое (двухвалентное) антитело, либо его функциональный фрагмент, который связывается с конкретным антигеном. Природное интактное антитело содержит две тяжелые (H) цепи и две легкие (L) цепи, связанные между собой дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области (VH) и первой, второй и третьей константных областей (CH1, CH2 и CH3, соответственно), в то время как легкая цепь состоит из вариабельной области (VL) и константной области (CL). Тяжелые цепи антител млекопитающих классифицируют как α, δ, ε, γ и μ, и легкие цепи антител млекопитающих классифицируют как λ или κ. Вариабельные области легких и тяжелых цепей отвечают за связывание антигена. Вариабельные области в обеих цепях, как правило, подразделяют на три гипервариабельные области, называемые определяющими комплементарность областями (CDR) (области CDR легкой (L) цепи, включая LCDR1, LCDR2 и LCDR3, области CDR тяжелой (H) цепи, включая HCDR1, HCDR2, HCDR3). Границы областей CDR для антител и антигенсвязывающих фрагментов, раскрытых в настоящем документе, могут быть определены или идентифицированы в соответствии с принятыми правилами Kabat, Chothia, или Al-Lazikani (Al-Lazikani, B., Chothia, C., Lesk, A. M., J. Mol. Biol., 273(4), 927 (1997); Chothia, C. et al., J Mol Biol. Dec 5; 186(3): 651-63 (1985); Chothia, C. and Lesk, A.M., J. Mol. Biol., 196,901 (1987); Chothia, C. et al., Nature. Dec 21-28; 342(6252): 877-83 (1989); Kabat E.A. et al., National Institutes of Health, Bethesda, Md. (1991)). Три области CDR расположены между фланкирующими участками, известными как каркасные области (FR), которые более высоко консервативны, чем области CDR, и образуют каркас, поддерживающий гипервариабельные петли. Таким образом, каждая из VH и VL содержит три CDR и четыре FR, в следующем порядке (аминокислотные остатки от N-конца к C-концу): FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Константные области тяжелых и легких цепей не участвуют в связывании антигена, но обладают различными эффекторными функциями. Антитела относят к пяти основным классам на основании аминокислотной последовательности константной области их тяжелой цепи: IgA, IgD, IgE, IgG и IgM, которые характеризуются наличием тяжелых цепей α, δ, ε, γ и μ, соответственно. Подклассами некоторых из основных классов антител являются, например, IgG1 (тяжелая цепь γ1), IgG2 (тяжелая цепь γ2), IgG3 (тяжелая цепь γ3), IgG4 (тяжелая цепь γ4), IgA1 (тяжелая цепь α1) или IgA2 (тяжелая цепь α2).
Используемый в настоящем документе термин «антигенсвязывающий фрагмент» означает фрагмент антитела, образовавшийся из фрагмента антитела, содержащего одну или более областей CDR, либо любой другой части антитела, которая связывается с антигеном, но не имеет структуру интактного природного антитела. В конкретных вариантах осуществления антитело, описанное в настоящем документе, представляет собой антигенсвязывающий фрагмент. Примеры антигенсвязывающих фрагментов включают, без ограничения, диатело, Fab, Fab', F(ab')2, Fv-фрагмент, дисульфид-стабилизированный Fv-фрагмент (dsFv), (dsFv)2, биспецифический dsFv (dsFv-dsFv'), дисульфид-стабилизированное диатело (ds-диатело), одноцепочечное антитело (scFv), димер scFv (двухвалентное диатело), мультиспецифическое антитело, однодоменное антитело верблюдовых, нанотело, доменное антитело, выделенные CDR и двухвалентное доменное антитело. Антигенсвязывающий фрагмент способен связываться с тем же антигеном, с которым связывается родительское антитело. В конкретных вариантах осуществления антигенсвязывающий фрагмент может содержать одну или более областей CDR из конкретного антитела человека.
«Fab» применительно к антителу означает одновалентный антигенсвязывающий фрагмент антитела, состоящий из одной легкой цепи (как вариабельных, так и константных областей), связанной с вариабельной областью и первой константной областью одной тяжелой цепи дисульфидной связью. Fab можно получать путем расщепления антитела папаином на остатках, проксимальных в сторону N-конца относительно дисульфидной связи между тяжелыми цепями в шарнирной области.
«Fab'» означает Fab-фрагмент, включающий часть шарнирной области, который может быть получен путем расщепления антитела пепсином на остатках, проксимальных в сторону C-конца относительно дисульфидной связи между тяжелыми цепями в шарнирной области, и, таким образом, отличается от Fab небольшим числом остатков (включая один или более остатков цистеина) в шарнирной области.
«F(ab')2» означает димер Fab', который содержит две легкие цепи и часть двух тяжелых цепей.
«Fc» применительно к антителу означает фрагмент антитела, состоящий из второй и третьей константных областей первой тяжелой цепи, связанных со второй и третью константными областями второй тяжелой цепи дисульфидной связью. Fc-области IgG и IgM содержат три константные области тяжелой цепи (вторую, третью и четвертую константные области тяжелой цепи в каждой цепи). Этот фрагмент можно получать путем расщепления антитела папаином. Fc-фрагмент антитела отвечает за различные эффекторные функции, такие как ADCC и CDC, но не участвует в связывании антигена.
«Fv» применительно к антителу означает наименьший фрагмент антитела, содержащий полный антигенсвязывающий сайт. Fv-фрагмент состоит из вариабельной области одной легкой цепи, связанной с вариабельной областью одной тяжелой цепи. «dsFv» означает дисульфид-стабилизированный Fv-фрагмент, в котором связь между вариабельной областью одной легкой цепи и вариабельной областью одной тяжелой цепи представляет собой дисульфидную связь.
«Одноцепочечное Fv антитело» или «scFv» означает рекомбинантное антитело, состоящее из вариабельной области легкой цепи и вариабельной области тяжелой цепи, связанных друг с другом непосредственно или через последовательность пептидного линкера (Huston JS et al. Proc Natl Acad Sci USA, 85: 5879(1988)). «Димер scFv» означает одну цепь, содержащую две вариабельные области тяжелой цепи и две вариабельные области легкой цепи с линкером. В конкретных вариантах осуществления «димер scFv» представляет собой двухвалентное диатело, или двухвалентный scFv (BsFv), содержащее фрагмент VH-VL (связанные пептидным линкером) в виде димера с другим фрагментом VH-VL, так что VH одного фрагмента взаимодействуют с VL другого фрагмента и образуют два связывающих сайта, которые могут быть нацелены на одинаковые антигены (или эпитопы) или разные антигены (или эпитопы). В других вариантах осуществления «димер scFv» представляет собой биспецифическое диатело, содержащее VH1-VL2 (связанные пептидным линкером) в ассоциации с VL1-VH2 (также связанными пептидным линкером) так, что VH1 и VL1 взаимодействуют, и VH2 и VL2 взаимодействуют, и каждая скоординированная пара имеет отдельную антигенную специфичность.
«Одноцепочечное Fv-Fc антитело» или «scFv-Fc» означает рекомбинантное антитело, состоящее из фрагмента scFv, связанного с Fc-областью антитела.
«Однодоменное антитело верблюдовых», «антитело тяжелой цепи», «нанотело» или «HCAb» означает антитело, содержащее два домена VH и не содержащее легкие цепи (Riechmann L. and Muyldermans S., J Immunol Methods. Dec 10; 231(1-2): 25-38 (1999); Muyldermans S., J Biotechnol. Jun; 74(4): 277-302 (2001); WO 94/04678; WO 94/25591; патент США № 6005079). Антитела тяжелой цепи исходно были получены от представителей семейства Camelidae (двугорбые верблюды, одногорбые верблюды и ламы). Несмотря на отсутствие легких цепей, антитела верблюдовых имеют аутентичный репертуар антигенсвязывающих сайтов (Hamers-Casterman C. et al., Nature. Jun 3; 363(6428): 446-8 (1993); Nguyen VK. et al. «Heavy-chain antibodies in Camelidae; a case of evolutionary innovation», Immunogenetics. Apr; 54(1): 39-47 (2002); Nguyen VK. et al. Immunology. May; 109(1): 93-101 (2003)). Вариабельный домен антитела тяжелой цепи (домен VHH) представляет собой наименьшую известную антигенсвязывающую единицу, созданную в результате адаптивных иммунных ответов (Koch-Nolte F. et al., FASEB J. Nov; 21(13): 3490-8. Epub 2007 Jun 15 (2007)). «Диатела» включают небольшие фрагменты антител с двумя антигенсвязывающими сайтами, при этом фрагменты содержат домен VH, связанный с доменом VL в одной полипептидной цепи (VH-VL или VL-VH) (смотри, например, Holliger P. et al., Proc Natl Acad Sci USA. Jul 15; 90(14): 6444-8 (1993); EP404097; WO 93/11161). Два домена на одной и той же цепи не могут образовывать пары из-за слишком короткого линкера, таким образом, домены вынужденно образуют пары с комплементарными доменами другой цепи, за счет этого образуются два антигенсвязывающих сайта. Антигенсвязывающие сайты могут быть нацелены на одинаковые или разные антигены (или эпитопы).
«Доменное антитело» означает фрагмент антитела, содержащий только вариабельную область тяжелой цепи или вариабельную область легкой цепи. В конкретных вариантах осуществления два или более доменов VH ковалентно связаны пептидным линкером, образуя двухвалентное или мультивалентное доменное антитело. Два домена VH двухвалентного доменного антитела могут быть нацелены на одинаковые или разные антигены.
В конкретных вариантах осуществления «(dsFv)2» содержит три пептидные цепи: два фрагмента VH, связанные пептидным линкером и связанные дисульфидными связями с двумя фрагментами VL.
В конкретных вариантах осуществления «биспецифическое ds-диатело» содержит VH1-VL2 (связанные пептидным линкером), связанные с VL1-VH2 (также связанными пептидным линкером) дисульфидной связью между VH1 и VL1.
В конкретных вариантах осуществления «биспецифический dsFv» или «dsFv-dsFv'» содержит три пептидные цепи: фрагмент VH1-VH2, в котором тяжелые цепи связаны пептидным линкером (например, длинным гибким линкером) и образуют пары за счет дисульфидных связей с фрагментами VL1 и VL2, соответственно. Каждая связанная дисульфидными связями пара из тяжелой и легкой цепей имеет отдельную антигенную специфичность.
Используемые в настоящем документе термины «гуманизированное» или «гуманизированный вариант» применительно к антителу или антигенсвязывающему фрагменту означают, что антитело или антигенсвязывающий фрагмент содержит области CDR из антител животных, отличных от человека (например, грызунов, кроликов, собак, коз, лошадей или кур), области FR из антител человека и, в некоторых случаях, константные области из антител человека. В конкретных вариантах осуществления константные области из антитела человека слиты с вариабельными областями антител, не принадлежащих человеку. Гуманизированные антитела или антигенсвязывающие фрагменты полезны в качестве терапевтических средств для человека. В конкретных вариантах осуществления из-за сниженной иммуногенности или меньшей вероятности индукции иммунного ответа у человека, по сравнению с антителами животных, отличных от человека. В некоторых вариантах осуществления животное, отличное от человека, является млекопитающим, например, мышью, крысой, кроликом, козой, овцой, морской свинкой, хомяком или приматом, кроме человека (например, не человекообразной обезьяной (например, яванским макаком или резусом) или человекообразной обезьяной (например, шимпанзе, гориллой, другой человекообразной обезьяной)). В некоторых вариантах осуществления гуманизированное антитело, или антигенсвязывающий фрагмент, состоит практически из всех человеческих последовательностей, за исключением последовательностей CDR, которые не принадлежат человеку. В некоторых вариантах осуществления гуманизированное антитело, или антигенсвязывающий фрагмент, модифицировано для повышения эффективности антитела, например, связывания или аффинности связывания. Например, один или более аминокислотных остатков в одной или более не принадлежащих человеку областях CDR изменены для уменьшения потенциальной иммуногенности у человека, при этом измененные аминокислотные остатки либо не важны для иммуноспецифического связывания, либо изменения представляют собой консервативные изменения, так что связывание гуманизированного антитела с антигеном не меняется в значительной степени. В некоторых вариантах осуществления области FR из антитела человека могут содержать ту же аминокислотную последовательность, что и человеческое антитело, из которого они получены, или они могут иметь некоторые аминокислотные изменения, например, не более 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 изменения аминокислот. В некоторых вариантах осуществления такое изменение аминокислот может иметь место только в областях FR тяжелой цепи, только в областях FR легкой цепи, или в обеих цепях. В некоторых предпочтительных вариантах осуществления гуманизированные антитела содержат FR1-3 человека, а также JH и Jκ человека.
Используемый в настоящем документе термин «химерное» относится к антителу, или антигенсвязывающему фрагменту, которое содержит часть тяжелой и/или легкой цепи из антитела одного биологического вида и остальную тяжелую и/или легкую цепь из антитела другого биологического вида. В иллюстративном примере химерное антитело может содержать константную область из антитела человека и вариабельную область из антитела биологического вида, отличного от человека, например, мыши.
Используемый в настоящем документе термин «анти-PD-L1 антитело» означает антитело, которое способно к специфическому связыванию с PD-L1 (например, PD-1 человека или примата) с аффинностью, достаточной для диагностического и/или терапевтического применения антитела.
При использовании в настоящем документе выражения «существенно», «по существу одинаковые» означают высокую степень сходства между двумя числовыми значениями, и специалисты в данной области не признают или не учитывают значимую разницу между двумя значениями, или признают небольшую разницу с точки зрения статистики и/или биологической активности, выраженной в этих значениях. Напротив, «существенно ниже» означает, что числовое значение составляет менее примерно 50%, менее примерно 40%, менее примерно 30%, менее примерно 20%, менее примерно 10% от эталонного значения.
Используемый в настоящем документе термин «специфическое связывание» или «специфически связывает» означает неслучайную реакцию связывания между двумя молекулами, например, между антителом и антигеном. В конкретных вариантах осуществления антитела или антигенсвязывающие фрагменты, предложенные в настоящем документе, специфически связывают PD-1 человека и/или примата с аффинностью связывания (KD), составляющей от примерно 0,01 нМ до примерно 100 нМ, от примерно 0,1 нМ до примерно 100 нМ, от примерно 0,01 нМ до примерно 10 нМ, от примерно 0,1 нМ до примерно 10 нМ, от примерно 0,01 нМ до примерно 1 нМ, от примерно 0,1 нМ до примерно 1 нМ или от примерно 0,01 нМ до примерно 0,1 нМ при pH 7,4. Используемый в настоящем документе термин «KD» означает отношение константы скорости диссоциации к константе скорости ассоциации (koff/kon), этот показатель можно определять методом поверхностного плазмонного резонанса например, с использованием такого прибора, как Biacore.
Используемое в настоящем документе выражение «блокировать связывание» или «конкурировать за один и тот же эпитоп» означает способность антитела, или антигенсвязывающего фрагмента, ингибировать взаимодействие связывания между двумя молекулами (например, PD-L1 человека и анти-PD-L1 антителом) в любой измеримой степени. В конкретных вариантах осуществления антитело, или антигенсвязывающий фрагмент, которое блокирует связывание между двумя молекулами, ингибирует взаимодействие связывания между двумя молекулами по меньшей мере на 50%. В конкретных вариантах осуществления это ингибирование может превышать 60%, превышать 70%, превышать 80% или превышать 90%.
Используемый в настоящем документе термин «эпитоп» означает определенную группу атомов (например, сахарные боковые цепи, фосфорильные группы, сульфонильные группы) или аминокислот на антигене, которые связываются антигенсвязывающим белком, таким как антитело. Эпитоп может быть конформационным или линейным. Конформационный эпитоп может содержать несмежные, но сближенные в пространстве вследствие трехмерного третичного сворачивания белка аминокислотные остатки, причем эти остатки вносят непосредственный вклад в аффинность взаимодействия и теряют свою способность к взаимодействию под воздействием денатурирующих растворителей. Напротив, все точки взаимодействия линейного эпитопа расположены линейно вдоль составляющих первичную структуру аминокислотных остатков на белке, и небольшие сегменты смежных аминокислот могут отщепляться при связывании антигена с молекулами главного комплекса гистосовместимости (MHC) или сохраняться под воздействием денатурирующих растворителей (Salmerуn A et al., J Immunol. 1991 Nov 1; 147(9): 3047-52; Goldsby et al., Immunology (Fifth ed.). New York: W. H. Freeman and Company. pp. 57-75. ISBN 0-7167-4947-5). В одном варианте осуществления настоящего изобретения эпитопы, связываемые антителами против PD-L1, предложенными в настоящем документе, являются конформационными. В другом варианте осуществления настоящего изобретения эпитопы, связываемые антителами против PD-L1, предложенными в настоящем документе, являются линейными. Два антитела могут связывать один и тот же эпитоп в составе антигена, если они конкурируют за связывание с антигеном. Например, если антитело, или антигенсвязывающий фрагмент, блокирует связывание иллюстративных антител по настоящему изобретению, таких как 21F11, 18G4, 4B6, 26F5, 23A11, 23F11, 22C9, их химерные варианты, гуманизированное 4B6, гуманизированное 23A11 и гуманизированное 23F11, с PD-1 человека, то можно считать, что антитело, или антигенсвязывающий фрагмент, связывает тот же эпитоп, что и эти иллюстративные антитела.
Конкретный аминокислотный остаток в составе эпитопа может быть мутирован, например, путем аланин-сканирующего мутагенеза, и мутации, которые приводят к уменьшению или предотвращению связывания белка, могут быть идентифицированы. «Аланин-сканирующий мутагенез» представляет собой метод, который может быть использован для идентификации конкретных остатков или областей белка, влияющих на взаимодействие эпитопа с другим соединением или белком, который связывается с ним. Остаток или группу целевых остатков в составе белка заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно аланином или полиаланином, то есть, выполняют консервативную аминокислотную замену). Любая мутация аминокислотных остатков или кодирующих их кодонов, которая приводит к уменьшению связывания белка на величину более порогового значения или уменьшению связывания белка в максимальной степени в сравнении с другими мутациями, очевидно, затрагивает остатки, которые входят в состав эпитопа, связываемого белком. В конкретных вариантах осуществления настоящего изобретения эпитоп, который важен для pH-зависимого антитела против PD-L1, содержит по меньшей мере один из аминокислотных остатков E58, N63, S80, Y81 и I64.
Последовательности, описанные ниже, приведены на Фигуре 34.
При использовании в настоящем документе «18G4» означает мышиное моноклональное антитело, содержащее вариабельную область тяжелой цепи, имеющую SEQ ID NO: 55 (соответствующая кодирующая последовательность ДНК SEQ ID NO: 93), и вариабельную область легкой цепи, имеющую SEQ ID NO: 56 (соответствующая кодирующая последовательность ДНК SEQ ID NO: 94). Его химерный вариант (то есть, 18G4-C/18G4-химерное) содержит константную область человеческого антитела IgG1 изотипа, слитую с вариабельной областью антитела мыши.
При использовании в настоящем документе «4B6» означает мышиное моноклональное антитело, содержащее вариабельную область тяжелой цепи, имеющую SEQ ID NO: 85, и вариабельную область легкой цепи, имеющую SEQ ID NO: 86. Его химерный вариант (то есть, 4B6-C/4B6-химерное) содержит константную область человеческого антитела IgG1 изотипа, слитую с вариабельной областью антитела мыши. Тяжелая цепь и легкая цепь антитела были гуманизированы, с получением гуманизированных тяжелый цепей (H1 соответствует последовательности SEQ ID NO: 81; H2 соответствует последовательности SEQ ID NO: 83; H3 соответствует последовательности SEQ ID NO: 65 (с кодирующей последовательностью ДНК SEQ ID NO: 99); и H4 соответствует последовательности SEQ ID NO: 67) и легких цепей (L1 соответствует последовательности SEQ ID NO: 82, L2 соответствует последовательности SEQ ID NO: 84, L3 соответствует последовательности SEQ ID NO: 66 (с кодирующей последовательностью ДНК SEQ ID NO: 100) и L4 соответствует последовательности SEQ ID NO: 68), в результате чего были получены гуманизированные антитела, такие как 4B6-H3L3, 4B6-H3L4, 4B6-H4L3 и 4B6-H4L4. Гуманизированное антитело также может быть продуцировано в клетках CHO в случае мелко/крупномасштабного производства с мутацией N в A в положении 297 Fc-области.
При использовании в настоящем документе «26F5» означает мышиное моноклональное антитело, содержащее вариабельную область тяжелой цепи, имеющую SEQ ID NO: 59 (с кодирующей последовательностью ДНК SEQ ID NO: 97), и вариабельную область легкой цепи, имеющую SEQ ID NO: 60 (с кодирующей последовательностью ДНК SEQ ID NO: 98). Его химерный вариант (то есть, 26F5-C/26F5-химерное) содержит константную область человеческого антитела IgG1 изотипа, слитую с вариабельной областью антитела мыши.
При использовании в настоящем документе «21F11» означает мышиное моноклональное антитело, содержащее вариабельную область тяжелой цепи, имеющую SEQ ID NO: 57 (с кодирующей последовательностью ДНК SEQ ID NO: 95), и вариабельную область легкой цепи, имеющую SEQ ID NO: 58 (с кодирующей последовательностью ДНК SEQ ID NO: 96). Его химерный вариант (то есть, 21F11-C/21F11-химерное) содержит константную область человеческого антитела IgG1 изотипа, слитую с вариабельной областью антитела мыши.
При использовании в настоящем документе «23A11» означает мышиное моноклональное антитело, содержащее вариабельную область тяжелой цепи, имеющую SEQ ID NO: 73, и вариабельную область легкой цепи, имеющую SEQ ID NO: 74. Его химерный вариант (то есть, 23A11-C/23A11-химерное) содержит константную область человеческого антитела IgG1 изотипа, слитую с вариабельной областью антитела мыши. Тяжелая цепь и легкая цепь антитела были гуманизированы, с получением гуманизированных тяжелый цепей (H3 соответствует последовательности SEQ ID NO: 71 (с кодирующей последовательностью ДНК SEQ ID NO: 103); H5 соответствует последовательности SEQ ID NO: 69) и легких цепей (L3 соответствует последовательности SEQ ID NO: 72, L5 соответствует последовательности SEQ ID NO: 70 (с кодирующей последовательностью ДНК SEQ ID NO: 104)), при этом в клетках 293 были продуцированы гуманизированные антитела, такие как 23A11-H3L5, 23A11-H5L3, 23A11-H3L3 и 23A11-H5L5. Антитело также может быть продуцировано в клетках CHO в случае мелко/крупномасштабного производства, например, 23A11-H3L5 (соответствующие последовательности H3 и L5 представляют собой SEQ ID NO: 61 и SEQ ID NO: 62, соответственно) с мутацией N в A в положении 297 Fc-области.
При использовании в настоящем документе «23F11» означает мышиное моноклональное антитело, содержащее вариабельную область тяжелой цепи, имеющую SEQ ID NO: 79, и вариабельную область легкой цепи, имеющую SEQ ID NO: 80. Его химерный вариант (то есть, 23F11-C/23F11-химерное) содержит константную область человеческого антитела IgG1 изотипа, слитую с вариабельной областью антитела мыши. Тяжелая цепь и легкая цепь антитела были гуманизированы, с получением гуманизированных тяжелый цепей (H4 соответствует последовательности SEQ ID NO: 75 (с кодирующей последовательностью ДНК SEQ ID NO: 105); H6 соответствует последовательности SEQ ID NO: 77) и легких цепей (L4 соответствует последовательности SEQ ID NO: 76 (с кодирующей последовательностью ДНК SEQ ID NO: 106), L6 соответствует последовательности SEQ ID NO: 78), при этом в клетках 293 были продуцированы гуманизированные антитела, такие как 23F11-H4L4, 23F11-H6L4, 23F11-H4L6, 23F11-H6L6. Антитело также может быть продуцировано в клетках CHO в случае мелко/крупномасштабного производства, например, 23F11-H4L4 (соответствующие последовательности H4 и L4 представляют собой SEQ ID NO: 63 и SEQ ID NO: 64, соответственно) с мутацией N в A в положении 297 Fc-области.
При использовании в настоящем документе «22C9» означает мышиное моноклональное антитело, содержащее вариабельную область тяжелой цепи, имеющую SEQ ID NO: 21 (с кодирующей последовательностью ДНК SEQ ID NO: 101), и вариабельную область легкой цепи, имеющую SEQ ID NO: 22 (с кодирующей последовательностью ДНК SEQ ID NO: 102). Его химерный вариант (то есть, 22C9-C/22C9-химерное) содержит константную область человеческого антитела IgG1 изотипа, слитую с вариабельной областью антитела мыши.
«Консервативная замена» применительно к аминокислотной последовательности означает замену аминокислотного остатка другим аминокислотным остатком, имеющим боковую цепь с аналогичными физико-химическими свойствами, или замену тех аминокислот, которые не важны для активности полипептида. Например, консервативные замены можно выполнять между аминокислотными остатками, имеющими неполярные боковые цепи (например, Met, Ala, Val, Leu, и Ile, Pro, Phe, Trp), между остатками, имеющими незаряженные полярные боковые цепи (например, Cys, Ser, Thr, Asn, Gly и Gln), между остатками, имеющими кислые боковые цепи (например, Asp, Glu), между аминокислотами, имеющими основные боковые цепи (например, His, Lys и Arg), между аминокислотами, имеющими бета-разветвленные боковые цепи (например, Thr, Val и Ile), между аминокислотами, имеющими серосодержащие боковые цепи (например, Cys и Met), или между остатками, имеющими ароматические боковые цепи (например, Trp, Tyr, His и Phe). В конкретных вариантах осуществления замены, делеции или добавления также можно считать «консервативными заменами». Число аминокислот, которые вставляют или делетируют, может находиться в диапазоне примерно от 1 до 5. Как известно в данной области, консервативная замена, как правило, не приводит к значительному изменению в конформационной структуре белка и, таким образом, биологическая активность белка может быть сохранена.
«Процент (%) идентичности последовательности» применительно к аминокислотной последовательности (или нуклеотидной последовательности) определяют как процент аминокислотных (или нуклеотидных) остатков в последовательности-кандидате, которые идентичны аминокислотным (или нуклеотидным) остаткам в эталонной последовательности, после выравнивания последовательностей и, при необходимости, внесения делеций для достижения максимального соответствия. Консервативно замененные аминокислотные остатки можно считать или не считать идентичными остатками. Выравнивание для целей определения процента идентичности аминокислотных (или нуклеотидных) последовательностей можно осуществлять, например, с использованием общедоступных инструментов, таких как BLASTN, BLASTp (доступны на веб-сайте Национального центра биотехнологической информации (NCBI) США, смотри также, Altschul S.F. et al., J. Mol. Biol., 215: 403-410 (1990); Stephen F. et al., Nucleic Acids Res., 25: 3389-3402 (1997)), Clustal W2 (доступно на веб-сайте Европейского института биоинформатики, смотри также, Higgins D.G. et al., Methods in Enzymology, 266: 383-402 (1996); Larkin M.A. et al., Bioinformatics (Oxford, England), 23(21): 2947-8 (2007)) и программы ALIGN или Megalign (DNASTAR). Специалисты в данной области могут использовать параметры по умолчанию программы или могут изменять параметры, если это необходимо для выравнивания, например, путем выбора подходящего алгоритма.
В настоящем документе термины «последовательность гомолога» и «гомологичная последовательность» используются взаимозаменяемо и означают полинуклеотидные последовательности (или их комплементарные цепи) или аминокислотные последовательности, которые имеют идентичность последовательности по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) с другими последовательностями при оптимальном выравнивании.
Используемый в настоящем документе термин «T-клетка» относится к типу лимфоцитов, которые играют важную роль в опосредованном клетками иммунитете, сюда относятся T-хелперы (например, CD4+ T-клетки, T-хелперы 1 типа, T-хелперы 2 типа, T-хелперы 3 типа, T-хелперы 17 типа), цитотоксические T-клетки (например, CD8+ T-клетки), T-клетки памяти (например, центральные T-клетки памяти (TCM-клетки), эффекторные T-клетки памяти (TEM-клетки и TEMRA-клетки) и резидентные T-клетки памяти (TRM), которые представляют собой либо CD8+, либо CD4+ клетки), T-клетки - естественные киллеры (NKT) и ингибирующие T-клетки.
Используемые в настоящем документе термины «эффекторные функции» или «эффекторные функции антитела» означают виды биологической активности, обусловленные связыванием Fc-области антитела с его эффекторами, такими как комплекс C1 и Fc-рецептор. Иллюстративные эффекторные функции включают: комплементзависимую цитотоксичность (CDC), вызываемую взаимодействием антител и C1q на комплексе C1; антителозависимую опосредуемую клетками цитотоксичность (ADCC), вызываемую связыванием Fc-области антитела с Fc-рецептором на эффекторной клетке, и фагоцитоз. «Уменьшение или ослабление эффекторной функции» означает, что эффекторная функция антитела уменьшена на по меньшей мере 50% (например, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99%) в сравнении с родительским антителом. В конкретных вариантах осуществления эффекторная функция элиминирована в результате мутации в Fc-области для устранения гликозилирования, например, N297A или D265A (смотри Shields et al., J. Biol. Chem. 276 (9): 6591-6604 (2001)), K322A, L234A/L235A. Используемый в настоящем документе термин «Fc-область» означает C-концевую область тяжелой цепи иммуноглобулина.
Используемый в настоящем документе термин «рак» или «раковое состояние» означает медицинское состояние, характеризующееся ростом злокачественных клеток или новообразований, аномальной пролиферацией, инфильтрацией или метастазированием, и включает как солидные раковые опухоли, так и несолидные формы рака (гематологические злокачественные новообразования), такие как лейкоз. Солидные опухоли включают саркомы и карциномы. Саркомы представляют собой не эпителиальные опухоли в кровеносном сосуде, кости, жировой ткани, связке, лимфатических сосудах, мышце или сухожилии, в то время как карциномы представляют собой эпителиальные опухоли в коже, железах и выстилке органов. Используемый в настоящем документе термин «опухоль» означает солидную массу из неопластических и/или злокачественных клеток.
В настоящем документе термины «лечебная помощь», «лечение» или «терапия» состояния могут быть использованы взаимозаменяемо, и включают терапевтическое лечение, профилактические или превентивные меры, например, предотвращение или облегчение состояния, отсрочку начала или уменьшение скорости прогрессирования состояния, уменьшение риска развития состояния, предотвращение или отсрочку развития симптомов, связанных с состоянием, уменьшение или прекращение симптомов, связанных с состоянием, вызывание полной или частичной регрессии состояния, излечение состояния, или некоторые сочетания вышеперечисленного. Применительно к раку термины «лечебная помощь», «лечение» или «терапия» могут означать ингибирование или замедление роста неопластических или злокачественных клеток (например, уменьшение объема опухоли в сравнении с контролем), пролиферации, инфильтрации в другие органы или метастазирования, предотвращение, отсрочку или остановку роста неопластических или злокачественных клеток, пролиферации или метастазирования, или некоторые сочетания вышеперечисленного. Применительно к опухоли «лечебная помощь» или «лечение» включает уничтожение всей или части опухоли, ингибирование или замедление роста опухоли и метастазирования, предотвращение или отсрочку развития опухоли, или некоторые сочетания вышеперечисленного. «Выделенное» вещество было изменено относительно его естественного состояния за счет вмешательства человека. Если «выделенная» композиция, или вещество, существует в природе, то она была изменена или удалена из ее исходного окружения, либо и то, и другое. Например, «выделенный» полинуклеотид или полипептид представляет собой полинуклеотид или полипептид, который свободен от других полинуклеотидов или полипептидов, соответственно, и не связан с природными компонентами, которые окружают полинуклеотид или полипептид в естественном состоянии. В конкретных вариантах осуществления «выделенное» антитело очищено по меньшей мере в одну стадию до чистоты по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% при определении электрофоретическими методами (такими как SDS-ПААГ с окрашиванием кумасси голубым или серебром, изоэлектрическое фокусирование, капиллярный электрофорез), хроматографическими методами (такими как ионообменная хроматография или обращенно-фазовая ВЭЖХ) или методом Лоури.
Используемый в настоящем документе термин «вектор» означает носитель, в который полинуклеотид, кодирующий белок, может быть функционально встроен и перенесен для экспрессии этого белка в клетке-хозяине. Вектор может быть использован для трансформации, трансдукции или трансфекции клетки-хозяина, что приводит к экспрессии генетического элемента, который он несет, в клетке-хозяине. Иллюстративные виды векторов включают, но без ограничения, плазмиды (например, фагмиды, космиды, искусственные хромосомы дрожжей (YAC), искусственные хромосомы бактерий (BAC) или полученные из P1 искусственные хромосомы (PAC)), вирусные векторы (бактериофаги, такие как фаг лямбда или фаг M13, или вирусы животных), бактериальные векторы или не эписомные векторы млекопитающих. Категории вирусов животных, используемых в качестве векторов, включают ретровирус (в том числе лентивирус), аденовирус, аденоассоциированный вирус, вирус герпеса (например, вирус простого герпеса), поксвирус, бакуловирус, папилломавирус и паповавирус (например, SV40). Вектор может содержать различные элементы для контроля экспрессии, включая последовательности промотора, последовательности инициации транскрипции, последовательности энхансера, селективные элементы и гены репортеров. Кроме того, вектор (например, бактериальный вектор или эписомный вектор млекопитающих) может содержать точку начала репликации. Вектор также может включать материалы, способствующие его проникновению в клетку, в том числе, но без ограничения, вирусную частицу, липосому или белковое покрытие.
Используемый в настоящем документе термин «клетка-хозяин» означает клетку, в которую был введен экзогенный полинуклеотид и/или вектор для экспрессии одного или более экзогенных белков. Термин должен означать как конкретную клетку, так и ее потомство. Клетка-хозяин может представлять собой прокариотическую, эукариотическую, растительную клетку, животную клетку или гибридому. Она может представлять собой клетку, которая содержит нуклеиновую кислоту, но не экспрессирует белок на желательном уровне, кроме тех случаев, когда в клетку вводят регулирующее средство, либо в клетку-хозяина вводят регуляторную последовательность, которая функционально связана с нуклеиновой кислотой.
Используемый в настоящем документе термин «связанное с PD-L1 состояние» означает любое состояние, которое вызывается, усиливается или иным образом связано с увеличением или уменьшением экспрессии, или активности, PD-L1 (например, PD-L1 человека).
Используемый в настоящем документе термин «терапевтически эффективное количество» или «эффективная доза» означает дозу или концентрацию лекарственного средства, эффективную для лечения заболевания или состояния, связанного с PD-L1 человека. Например, в случае использования антител, или антигенсвязывающих фрагментов, раскрытых в настоящем документе, для лечения рака терапевтически эффективное количество представляет собой дозу или концентрацию антитела, или антигенсвязывающего фрагмента, способную приводить к уменьшению объема опухоли, уничтожению всей или части опухоли, ингибированию или замедлению роста опухоли, или инфильтрации раковых клеток в другие органы, ингибированию роста или пролиферации клеток, опосредующих раковое состояние, ингибированию или замедлению метастазирования клеток опухоли, уменьшению любого симптома или маркера, ассоциированного с опухолью или раковым состоянием, предотвращению или замедлению развития опухоли или ракового состояния, или некоторым сочетаниям вышеперечисленного.
Термин «фармацевтически приемлемые» указывает на то, что указанные носитель, растворитель, разбавитель, эксципиент(ы) и/или соль, в целом, химически и/или физически совместимы с другими ингредиентами, составляющими препарат, и физиологически совместимы с реципиентом препарата.
Термин «занятость рецепторов» означает отношение рецепторов, занятых лигандом в состоянии равновесия, к общему числу доступных рецепторов, как правило, выражаемое в виде процента от общего числа рецепторов. Продолжительность занятости рецепторов можно оценивать путем измерения и сравнения занятости рецепторов в разные моменты времени. Методы количественного определения занятости рецепторов известны в данной области, например, FACS, позитронно-эмиссионная компьютерная томография (ПЭТ), авторадиография и так далее.
Анти-PD-L1 антитело
Настоящее изобретение относится к анти-PD-L1 антителам и их антигенсвязывающим фрагментам. В конкретных вариантах осуществления настоящее изобретение относится к иллюстративным моноклональным антителам 21F11, 18G4, 4B6, 26F5, 23A11, 23F11, 22C9, их химерным вариантам, гуманизированному 4B6, гуманизированному 23A11 и гуманизированному 23F11.
В конкретных вариантах осуществления анти-PD-L1 антитела и их антигенсвязывающие фрагменты являются pH-зависимыми при связывании с антигеном (например, PD-L1 человека). Связывание антигена pH-зависимыми антителами при физиологическом нейтральном pH (то есть, pH 7,4) является более сильным, чем при кислом pH 5,5 или 6,0 (например, при pH в эндосомах). Такие pH-зависимые антитела, предпочтительно, диссоциируют от антигена в эндосоме. Это может способствовать увеличению времени полужизни антитела, когда антитело подвергается опосредованному антигеном клиренсу, поскольку pH-зависимое антитело может избегать опосредованной антигеном деградации в лизосоме за счет диссоциации от антигена в эндосоме и рециркуляции из клетки. Преимущества pH-зависимых антител включают использование более низких доз терапевтического pH-зависимого антитела (не более 80%, 70%, 60%, 50%, 40%, 30%, 20% или 10% от дозы, которая потребовалась бы для эталонного антитела против PD-L1, чтобы достичь сопоставимого in vivo терапевтического эффекта) или меньшей частоты дозирования вследствие улучшения рециркулируемости и увеличения времени полужизни в сыворотке, в сравнении с эталонным антителом против PD-L1, с достижением в обоих случаях сопоставимого in vivo терапевтического эффекта. Эталонное антитело не является pH-зависимым, то есть, оно связывается с PD-L1 аналогично как при кислом, так и при нейтральном pH, и имеет аналогичные параметры связывания при нейтральном pH в сравнении с pH-зависимыми антителами. В конкретных вариантах осуществления pH-зависимые антитела обладают вышеуказанными преимуществами в сравнении с их не зависимым от pH вариантом, имеющим такие же параметры связывания с PD-L1.
В конкретных вариантах осуществления специфическое связывание pH-зависимого анти-PD-L1 антитела и его антигенсвязывающих фрагментов с PD-L1 человека является более сильным при нейтральном pH (например, pH 7,4), чем при кислом pH (например, pH 6,0, 5,5, 5,0, 4,5 или 4,0). В конкретных вариантах осуществления связывание антитела с PD-L1 при кислом pH 5,5 существенно слабее, чем его связывание с PD-L1 при pH 7,4, в одном и том же анализе. В конкретных вариантах осуществления связывание антитела против PD-L1, и его антигенсвязывающих фрагментов, предложенного в настоящем документе, при кислых pH составляет не более 2%, 5%, 10%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80% или 85% от такового при нейтральном pH (то есть, 7,4), при измерении методом ELISA. В конкретных вариантах осуществления отношение показателей KD и/или показателей Koff при связывании pH-зависимого анти-PD-L1 антитела с PD-L1 человека при кислом pH/нейтральном pH составляет 2, 3, 4, 5, 8, 10, 15, 20, 30, 40 или 100, или более. В конкретных вариантах осуществления полупериод диссоциации (t1/2) при связывании pH-зависимого анти-PD-L1 антитела с PD-L1 человека составляет менее 5, 4, 3, 2, 1, 0,5, 0,2 или 0,1 мин в условиях кислого pH при 25°C или 37°C. В конкретных вариантах осуществления при связывании pH-зависимого анти-PD-L1 антитела, и его антигенсвязывающих фрагментов, описанного в настоящем документе, с PD-L1 человека имеет место уменьшение полупериода диссоциации (t.sub.1/2) при кислом pH, в сравнении с таковым у эталонного антитела против PD-L1 при нейтральном pH, по меньшей мере примерно в 2, 3, 5, 8, 10, 15, 20, 30, 50 или 100 раз. В конкретных вариантах осуществления уменьшение in vivo количества белка PD-1 является более продолжительным под воздействием pH-зависимого анти-PD-L1 антитела в сравнении с эталонным антителом против PD-L1, которое имеет аналогичные показатели связывания с PD-L1 при нейтральном pH. В конкретных вариантах осуществления pH-зависимое анти-PD-L1 антитело, и его антигенсвязывающие фрагменты, при связывании с PD-L1 человека имеет увеличенное время полужизни в целевом органе при введении определенной дозы в сравнении с таковым у эталонного антитела против PD-L1 в той же дозе. В конкретных вариантах осуществления антитело, и его антигенсвязывающие фрагменты, имеет in vivo время полужизни в целевом органе, которое было бы короче для антитела, если бы оно имело аналогичное связывание с PD-L1 как при кислом pH, так и при нейтральном pH. В конкретных вариантах осуществления целевой орган включает, но без ограничения, кровь или сыворотку, почку, легкое, поджелудочную железу, печень, желчный пузырь, мочевой пузырь, кожу, пищевод, яичник, молочную железу, толстую кишку, прямую кишку, желудок, селезенку или головной мозг.
Квалифицированный специалист понимает, что последовательности CDR, предложенные в настоящем документе, могут быть модифицированы для содержания одной или более замен (либо вставок или делеций) аминокислотных остатков, за счет чего у полученного антитела улучшается одно или более свойств (например, улучшается связывание или аффинность связывания, увеличивается фармакокинетическое время полужизни, pH-чувствительность, совместимость с конъюгацией, снижается риск гликозилирования и/или дезаминирования на остатке CDR, а также снижается иммуногенность), а в остальном оно сравнимо с родительским антителом (то есть, антителом, имеющим тот же набор последовательностей CDR за исключением вышеупомянутой модификации или изменения), или по меньшей мере по существу сохраняет антигенсвязывающую способность родительского антитела. Например, можно получать библиотеку вариантов антитела (например, вариантов Fab или scFv) и экспрессировать с использованием технологии фагового дисплея, а затем проводить скрининг на связывание или аффинность связывания с PD-L1 человека. В качестве другого примера, можно использовать компьютерную программу для виртуальной имитации связывания антител с PD-L1 человека и идентификации аминокислотных остатков на антителах, которые образуют поверхность связывания. Такие остатки либо не следует заменять для предотвращения уменьшения связывания или аффинности связывания, либо выбирать мишенью для замены с целью достижения более сильного связывания. В конкретных вариантах осуществления по меньшей мере одна (или все) из замен в последовательностях CDR представляет собой консервативную замену.
В конкретных вариантах осуществления антитела и их антигенсвязывающие фрагменты содержат одну или более последовательностей CDR, имеющих по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности с последовательностью (или последовательностями), предложенной в настоящем документе, и в то же время сохраняют активность связывания или аффинность связывания с PD-L1 человека на уровне, аналогичном или даже превышающем уровень у родительского антитела, имеющего по существу такую же последовательность, за исключением соответствующей последовательности CDR, которая имеет 100% идентичности последовательности с последовательностью (или последовательностями), предложенной в настоящем документе.
В конкретных вариантах осуществления анти-PD-L1 антитела и их антигенсвязывающие фрагменты являются химерными. Химерное антитело содержит одну или более областей из одного антитела и одну или более областей из других антител или биологических видов. В конкретных вариантах осуществления по меньшей мере одна область CDR химерного анти-PD-L1 антитела получена из антитела одного биологического вида. В конкретных вариантах осуществления все из областей CDR получены из антител другого биологического вида. В конкретных вариантах осуществления вариабельная область химерного анти-PD-L1 антитела получена из антитела одного биологического вида и связана с константной областью антитела другого биологического вида. Химерное антитело сохраняет активность связывания или аффинность связывания родительского антитела.
В конкретных вариантах осуществления анти-PD-L1 антитела и их антигенсвязывающие фрагменты являются гуманизированными. В конкретных вариантах осуществления гуманизированное антитело получено от биологического вида, отличного от человека, и несколько аминокислотных остатков в каркасной области и константные области тяжелой и легкой цепей были подвергнуты мутации для уменьшения или устранения иммуногенности в организме человека. В конкретных вариантах осуществления вариабельные области антитела биологического вида, отличного от человека, слиты с константными областями человеческого антитела. В конкретных вариантах осуществления гуманизированное антитело создано путем пересадки CDR, то есть, замены CDR человеческого антитела соответствующей CDR из антитела, не принадлежащего человеку. Вследствие этого, иммуногенность гуманизированного антитела в организме человека является низкой. В конкретных вариантах осуществления в каркасных областях антитела человека заменяют один или более аминокислотных остатков на остатки из антитела, не принадлежащего человеку (например, из каркасной области мышиного антитела), из которого получены последовательности CDR, например, для улучшения или сохранения активности связывания или аффинности связывания. В конкретных вариантах осуществления у гуманизированного антитела сохраняется, или увеличивается, активность связывания или аффинность связывания, присущие родительскому антителу.
В некоторых вариантах осуществления химерные или гуманизированные анти-PD-L1 антитела и их антигенсвязывающие фрагменты содержат вариабельную область тяжелой цепи, выбранную из группы, состоящей из: SEQ ID NO: 21, 47, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83 и 85, а также их гомологичных последовательностей, имеющих по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности; и/или вариабельную область легкой цепи, выбранную из группы, состоящей из: SEQ ID NO: 22, 48, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84 и 86, а также их гомологичных последовательностей, имеющих по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности. Эти гуманизированные антитела сохраняют активность связывания или аффинность связывания с PD-L1 человека, предпочтительно, на уровне, аналогичном уровню у одного из иллюстративных антител: 4B6, 18G4, 26F5, 21F11, 23A11, 23F11, 22C9, а также их химерных вариантов, гуманизированного 4B6, гуманизированного 23F11 и гуманизированного 23A11.
В конкретных вариантах осуществления антитела против PD-L1 4B6, 26F5, 21F11, 23A11, 23F11, 22C9, а также их химерные варианты, гуманизированное 4B6, гуманизированное 23F11 и гуманизированное 23A11 связываются с PD-L1 человека и приматов, но не с PD-L1 мыши. В конкретных вариантах осуществления антитела против PD-L1 (например, 18G4), их химерные варианты и их антигенсвязывающие фрагменты могут связываться как с человеческим, так и с мышиным PD-L1. Активность связывания или аффинность связывания определяют на основании анализа конкурентного связывания, такого как анализы ELISA, анализы конкурентного связывания радиоактивного лиганда и FACS-анализ.
В некоторых вариантах осуществления анти-PD-L1 антитела и их антигенсвязывающие фрагменты, предложенные в настоящем документе, способны специфически связывать PD-L1 человека с аффинностью связывания (Kd) примерно 10-7 M или менее (например, 10-8 M, 10-9 M, 10-10 M, 10-11 M, 10-12 M) при измерении в анализе связывания методом поверхностного плазмонного резонанса. Аффинность связывания может быть выражена величиной KD, которую рассчитывают, как отношение константы скорости диссоциации к константе скорости ассоциации (koff/kon), когда связывание между антигеном и антигенсвязывающей молекулой достигает равновесия. Аффинность связывания антигена (например, KD) можно определять соответствующими методами, известными в данной области, включая, например, анализ связывания методом поверхностного плазмонного резонанса с использованием таких приборов, как Biacore (смотри, например, Murphy, M. et al., Current protocols in protein science, Chapter 19, unit 19.14, 2006).
В конкретных вариантах осуществления антитела против PD-L1 и их антигенсвязывающие фрагменты способны связывать hPD-L1 с величиной EC50 (то есть, концентрацией 50% связывания), составляющей 0,001 мкг/мл - 1 мкг/мл (например, 0,001 мкг/мл - 0,5 мкг/мл, 0,001 мкг/мл - 0,2 мкг/мл, 0,001 мкг/мл - 0,1 мкг/мл, 0,01 мкг/мл - 0,2 мкг/мл, 0,01 мкг/мл - 0,1 мкг/мл, 0,01 мкг/мл - 0,05 мкг/мл, 0,01 мкг/мл - 0,03 мкг/мл или 0,001 мкг/мл - 0,01 мкг/мл,), при измерении методом ELISA, или величиной EC50, составляющей 0,01 мкг/мл - 1 мкг/мл (например, 0,01 мкг/мл - 0,5 мкг/мл, 0,01 мкг/мл - 0,2 мкг/мл, 0,05 мкг/мл - 1 мкг/мл, 0,05 мкг/мл - 0,5 мкг/мл или 0,05 мкг/мл - 0,2 мкг/мл), при измерении методом FACS. Связывание антител с PD-L1 человека можно измерять методами, известными в данной области, например, методами ELISA, FACS, поверхностного плазмонного резонанса, аффинного связывания с GST, эпитопной метки, иммунопреципитации, фар-вестерн-блоттинга, резонансного переноса энергии флуоресценции, флуоресцентных иммуноанализов с временным разрешением (TR-FIA), радиоиммунных анализов (RIA), иммуноферментных анализов, латекс-агглютинации, вестерн-блоттинга и иммуногистохимии, или в других анализах связывания. В иллюстративном примере тестируемому антителу (то есть, первому антителу) дают возможность связаться с иммобилизованным PD-L1 человека или клетками, экспрессирующими PD-L1 человека, затем отмывают не связавшееся антитело и вносят меченое вторичное антитело, которое может связываться со связанным первым антителом и, таким образом, делать возможным его обнаружение. Обнаружение можно осуществлять при помощи микропланшетного ридера в случае иммобилизованного PD-L1 или при помощи FACS-анализа в случае использования клеток, экспрессирующих PD-L1 человека.
В конкретных вариантах осуществления антитела и их фрагменты, предложенные в настоящем документе, ингибируют связывание PD-1 человека с PD-L1 человека с величиной IC50, составляющей 0,05 мкг/мл - 1 мкг/мл (например, 0,05 мкг/мл - 0,8 мкг/мл, 0,05 мкг/мл - 0,5 мкг/мл или 0,05 мкг/мл - 0,3 мкг/мл), при измерении методом FACS или величиной IC50, составляющей 0,001 мкг/мл - 0,5 мкг/мл (например, 0,001 мкг/мл - 0,2 мкг/мл, 0,001 мкг/мл - 0,1 мкг/мл, 0,001 мкг/мл - 0,05 мкг/мл, 0,001 мкг/мл - 0,02 мкг/мл, 0,005 мкг/мл - 0,05 мкг/мл, 0,005 мкг/мл - 0,02 мкг/мл или 0,005 мкг/мл - 0,01 мкг/мл), при измерении методом ELISA.
В конкретных вариантах осуществления антитела и их фрагменты, предложенные в настоящем документе, блокируют связывание PD-L1 человека с его рецептором (то есть, PD-1 человека) и тем самым обеспечивают биологическую активность, включая, например, индукцию продуцирования цитокинов активированными T-клетками (такими как CD4+ T-клетки и CD8+ T-клетки), индукцию пролиферации активированных T-клеток (таких как CD4+ T-клетки и CD8+ T-клетки) и обращение вспять супрессорной функции Treg. Иллюстративные цитокины включают IL-2 и IFNγ. Термин «IL-2» означает интерлейкин 2, вид сигнальной молекулы цитокина в иммунной системе, которая регулирует активность белых клеток крови (например, лейкоцитов). Термин «интерферон-гамма (IFNγ)» означает цитокин, продуцируемый клетками - естественными киллерами (NK), NK T-клетками, CD4+ и CD8+ T-клетками, который является важным активатором макрофагов и индуктором экспрессии молекул главного комплекса гистосовместимости (MHC). Продуцирование цитокинов можно определять методами, известными в данной области, например, методом ELISA. Также можно использовать методы для обнаружения пролиферации T-клеток, в том числе анализ с включением [3H]-тимидина и люминесцентный анализ жизнеспособности клеток.
Анти-PD-L1 антитела и их антигенсвязывающие фрагменты являются специфичными для PD-L1 человека и/или приматов. В конкретных вариантах осуществления антитела и их антигенсвязывающие фрагменты не связываются с PD-L2 (например, PD-L2 человека). Например, аффинность связывания с PD-L2 составляет менее 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% от таковой для PD-L1 человека.
В конкретных вариантах осуществления антитела и их антигенсвязывающие фрагменты связываются с PD-L1 приматов с величиной EC50, составляющей 0,001 мкг/мл - 0,5 мкг/мл (например, 0,001 мкг/мл - 0,2 мкг/мл, 0,001 мкг/мл - 0,1 мкг/мл, 0,001 мкг/мл - 0,05 мкг/мл, 0,001 мкг/мл - 0,02 мкг/мл, 0,005 мкг/мл - 0,05 мкг/мл, 0,005 мкг/мл - 0,02 мкг/мл или 0,005 мкг/мл - 0,01 мкг/мл), при измерении методом ELISA.
Анти-PD-L1 антитела и их антигенсвязывающие фрагменты являются специфичными для PD-L1 человека и/или PD-L1 приматов. В конкретных вариантах осуществления антитела и их антигенсвязывающие фрагменты не связываются с PD-L1 мыши. Например, аффинность связывания с PD-L1 мыши составляет менее 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% от таковой для PD-L1 человека.
В конкретных вариантах осуществления антитела и их антигенсвязывающие фрагменты не связываются с PD-L1 мыши, но связываются с PD-L1 приматов с активностью связывания или аффинностью связывания, аналогичным таковым для PD-L1 человека. Например, показатели связывания иллюстративных антител 4B6, 26F5, 21F11, 23A11, 23F11, 22C9, а также их химерных вариантов, гуманизированного 4B6, гуманизированного 23F11 и гуманизированного 23A11 с PD-L1 мыши являются очень низкими в обычных анализах связывания, таких как ELISA или FACS-анализ, в то время как показатели связывания этих антител с PD-L1 приматов аналогичны таковым для PD-L1 человека при измерении методом ELISA или FACS. В конкретных вариантах осуществления антитела и их антигенсвязывающие фрагменты (например, 18G4) связываются с PD-L1 мыши, а также с PD-L1 приматов с активностью связывания или аффинностью связывания, аналогичным таковым для PD-L1 человека.
В конкретных вариантах осуществления анти-PD-L1 антитела и их антигенсвязывающие фрагменты, предложенные в настоящем документе, могут быть использованы в сочетании с иммуногенными средствами, такими как клетки опухолей, очищенный опухолевый антиген и клетки, трансфицированные генами, кодирующими иммуностимулирующие цитокины, опухолевые вакцины. Кроме того, анти-PD-L1 антитела и их антигенсвязывающие фрагменты могут быть использованы в комбинированной терапии, включающей стандартную химиотерапию и лучевую терапию (например, радиотерапию, рентгенотерапию), направленную терапию низкомолекулярными средствами (например, ингибиторами тирозинкиназы иматинибом, гефитинибом; моноклональными антителами, фотодинамической терапией), иммунотерапию (например, антителами против опухолевых маркеров, таких как канцероэмбриональный антиген, простатический специфический антиген, ассоциированный с опухолью мочевыводящей системы антиген, эмбриональный антиген, тирозиназа (p97), gp68, TAG-72, HMFG, сиалил-Льюис-антиген, MucA, MucB, PLAP, рецептор эстрогенов, рецептор ламинина, erb B и p155, DLL4, Notch1, Notch2/3, Fzd7 или Wnt, r-спондин (RSPO) 1, RSPO2, RSPO3 или RSPO4), развивающиеся другие методы лечения на основе модуляторов иммунных контрольных точек (например, вакцин), гормональную терапию, ингибирование ангиогенеза (ингибитором ангиогенеза), генную терапию (индукторами клеточной пролиферации, ингибиторами клеточной пролиферации или регуляторами программируемой гибели клеток), паллиативную терапию (то есть, лечение, направленное на облегчение симптомов и уменьшение боли (например, морфином и оксикодоном), тошноты, рвоты (например, ондансетроном и апрепитантом), диареи и кровотечения) и хирургическое вмешательство. В конкретных вариантах осуществления антитела и их антигенсвязывающие фрагменты могут быть использованы в качестве основы для конъюгатов антитело-лекарственное средство, биспецифических или мультивалентных антител.
Анти-PD-L1 антитела и их антигенсвязывающие фрагменты, предложенные в настоящем документе, могут представлять собой моноклональное антитело, поликлональное антитело, гуманизированное антитело, химерное антитело, рекомбинантное антитело, биспецифическое антитело, меченое антитело, двухвалентное антитело или анти-идиотипическое антитело. Рекомбинантное антитело представляет собой антитело, полученное in vitro рекомбинантными методами, а не в организме животных. Биспецифическое или двухвалентное антитело представляет собой искусственное антитело, которое содержит фрагменты двух разных моноклональных антител и может связываться с двумя разными антигенами. Антитело, или его антигенсвязывающий фрагмент, которое является «двухвалентным», содержит два антигенсвязывающих сайта. Два антигенсвязывающих сайта могут связываться с одним и тем же антигеном, или каждый из них может связываться с отдельным антигеном, в этом случае антитело или антигенсвязывающий фрагмент называют «биспецифическим».
В некоторых вариантах осуществления анти-PD-L1 антитела и их антигенсвязывающие фрагменты, предложенные в настоящем документе, представляют собой гуманизированные или химерные антитела. В конкретных вариантах осуществления гуманизированные или химерные антитела получают рекомбинантными методами. Например, животное, отличное от человека, можно иммунизировать надлежащим антигеном, таким как белок PD-L1 человека. Генные фрагменты, кодирующие вариабельные области антитела, которые связываются с антигеном, вырезают из гена моноклонального антитела мыши, и эти фрагменты функционально связывают с геном константной области антитела из IgG1 человека. Рекомбинантный генный фрагмент вставляют в экспрессионный вектор, который затем вводят в клетку-хозяина для продуцирования химерного антитела (смотри патенты США №№ 4816397, 4816567, 5807715).
«Гуманизированное антитело» представляет собой антитело, полученное путем пересадки гена области CDR из антитела, не принадлежащего человеку, на ген человеческого антитела, так что каркас вариабельной области и константные области, при наличии, полностью или в значительной степени происходят из последовательностей человеческого антитела. Методы получения гуманизированных антител известны в данной области (смотри, например, патент США № 5225539, патент США № 5530101, патент США № 6407213, патент США № 5859205, патент США № 6881557, EP 239400, EP 125023, WO 90/07861 и WO 96/02576). В конкретных вариантах осуществления гуманизированное антитело содержит гуманизированную тяжелую цепь и гуманизированную легкую цепь. В конкретных вариантах осуществления последовательность пересаженной области CDR в гуманизированном антителе против PD-L1 по меньшей мере на 60%, 70%, 80%, 82%, 85%, 88%, 90%, 95% или 100% идентична соответствующей CDR. В конкретных вариантах осуществления не более 3 консервативных аминокислотных замен имеют место в CDR гуманизированного антитела против PD-L1. В конкретных вариантах осуществления аминокислотные остатки каркаса вариабельной области гуманизированного антитела против PD-L1 заменены с целью оптимизации последовательности. В конкретных вариантах осуществления последовательности каркаса вариабельной области цепи гуманизированного антитела против PD-L1 по меньшей мере на 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% идентичны соответствующим последовательностям каркаса вариабельной области антитела человека.
В некоторых вариантах осуществления анти-PD-L1 антитело, и его антигенсвязывающий фрагмент, представляет собой однодоменное антитело верблюдовых, диатело, scFv, димер scFv, BsFv, dsFv, (dsFv)2, dsFv-dsFv', Fv-фрагмент, Fab, Fab', F(ab')2, ds-диатело, нанотело, доменное антитело, выделенную CDR или двухвалентное доменное антитело.
В некоторых вариантах осуществления анти-PD-L1 антитела и их антигенсвязывающие фрагменты дополнительно содержат константную область иммуноглобулина. В некоторых вариантах осуществления константная область иммуноглобулина включает константную область тяжелой цепи и/или легкой цепи. Константная область тяжелой цепи содержит области CH1, CH1-CH2 или CH1-CH3. В некоторых вариантах осуществления константная область может дополнительно иметь одну или более модификаций для придания желательных свойств. Например, константная область может быть модифицирована для уменьшения, или устранения, одной или более эффекторных функций, для улучшения связывания FcRn-рецептора или для введения одного или более остатков цистеина.
В конкретных вариантах осуществления анти-PD-L1 антитела и их антигенсвязывающие фрагменты умеют улучшенную термостабильность. Используемый в настоящем документе термин «термостабильность» или «термотолерантность» означает функциональную стабильность анти-PD-L1 антитела вместо изменений под воздействием температуры и устойчивость антитела к необратимой денатурации, вызываемой изменением температуры и/или физических/химических условий, включая, но без ограничения, нагревание, охлаждение, замораживание, цикл замораживания-оттаивания, вибрацию, перемешивание на вихревой мешалке, обработку ультразвуком, воздействие химических денатурирующих веществ, pH, детергентов, солей, добавок, протеаз или температуры. Необратимая денатурация приводит к необратимому разворачиванию функциональных конформаций антитела, потере биологической активности и агрегации денатурированного белка. Повышение устойчивости к высоким температурам можно определять путем измерения связывания лиганда или с использованием спектроскопических методов, таких как измерение флуоресценции, кругового дихроизма (КД) или светорассеяния, которые чувствительны к изменению структуры при повышении температуры. Антитело против PD-L1, предложенное в настоящем документе, может иметь повышенную стабильность, что определяют по повышению термостабильности в функциональном конформационном состоянии на по меньшей мере 2°C, по меньшей мере 5°C, по меньшей мере 8°C, по меньшей мере 10°C, по меньшей мере 15°C, по меньшей мере 20°C или по меньшей мере 30°C. Термостабильность антител, предложенных в настоящем документе, может быть измерена, например, методом дифференциальной сканирующей флуориметрии (ДСФ) или дифференциальной сканирующей калориметрии (ДСК) (смотри He F et al., J Pharm Sci. 2011 Apr; 100(4): 1330-40), при этом измеряют среднюю точку теплового перехода (Tm), которая указывает на относительную стабильность белка в жидкости. В конкретных вариантах осуществления Tm антитела против PD-L1 составляет более 74°C, более 76°C, более 78°C, более 80°C, более 82°C, более 84°C, более 86°C, более 88°C, более 90°C или более 92°C, более 94°C, более 96°C или более 98°C. В конкретных вариантах осуществления антитело против PD-L1 с повышенной термостабильностью представляет собой 23F11 (например, 23F11-H4L4, 23A11-H6L4, 23A11-H4L6 или 23A11-H6L6), которое имеет среднюю точку теплового перехода (Tm) более 90°C.
В некоторых вариантах осуществления анти-PD-L1 антитела и их антигенсвязывающие фрагменты дополнительно используют для создания конъюгатов антитело-лекарственное средство (АЛСК). Предусмотрено, что различную полезную нагрузку можно связывать с антителами или антигенсвязывающими фрагментами, предложенными в настоящем документе (смотри, например, «Conjugate Vaccines», Contributions to Microbiology and Immunology, J. M. Cruse and R. E. Lewis, Jr. (eds.), Carger Press, New York, (1989)). Термин «полезная нагрузка(и)» используют взаимозаменяемо с термином «лекарственное средство(а»), и эти полезные нагрузки можно связывать с антителами или антигенсвязывающими фрагментами путем ковалентного связывания, аффинного связывания, интеркаляции, координационного связывания, комплексообразования, ассоциации, смешивания или добавления, в числе прочих способов. В конкретных вариантах осуществления антитела и антигенсвязывающие фрагменты, раскрытые в настоящем документе, могут быть сконструированы для содержания специфических сайтов за пределами эпитоп-связывающей части, которые могут быть использованы для связывания с одной или более полезными нагрузками, такими как пептиды, молекулы нуклеиновой кислоты, лекарственные средства, цитотоксины, полипептиды, белки, слитые белки, антитела, гаптены, малые молекулы, миметики, синтетические лекарственные средства, неорганические молекулы, органические молекулы, радиоактивные изотопы и репортерные группы. Например, такой сайт может содержать один или более реакционноспособных аминокислотных остатков, таких как, например, остатки цистеина или гистидина, для облегчения ковалентного связывания с полезной нагрузкой. В конкретных вариантах осуществления антитела могут быть связаны с полезной нагрузкой опосредованно через линкер или через другую полезную нагрузку. Например, антитело или антигенсвязывающие фрагменты можно конъюгировать с биотином, затем опосредованно конъюгировать со второй полезной нагрузкой, которая конъюгирована с авидином. Полезная нагрузка может представлять собой репортерную группу или детектируемую метку, модифицирующий фармакокинетику фрагмент, облегчающий очистку фрагмент или цитотоксический фрагмент. Примеры детектируемой метки могут включать флуоресцентные метки (например, флуоресцеин, родамин, дансил, фикоэритрин или техасский красный), фермент-субстратные метки (например, пероксидазу хрена, щелочную фосфатазу, люциферазы, глюкоамилазу, лизоцим, сахарид-оксидазы или β-D-галактозидазу), радиоактивные изотопы (например, 123I, 124I, 125I, 131I, 35S, 3H, 111In, 112In, 14C, 64Cu, 67Cu, 86Y, 88Y, 90Y, 177Lu, 211At, 186Re, 188Re, 153Sm, 212Bi и 32P, другие лантаниды, люминесцентные метки), хромофорный фрагмент, дигоксигенин, биотин/авидин, молекулу ДНК или золото для обнаружения. В конкретных вариантах осуществления полезная нагрузка может представлять собой модифицирующий фармакокинетику фрагмент, такой как ПЭГ, который способствует увеличению времени полужизни антител. Другие подходящие полимеры включают, например, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, сополимеры этиленгликоля/пропиленгликоля и тому подобное. В конкретных вариантах осуществления полезная нагрузка может представлять собой облегчающий очистку фрагмент, такой как магнитные гранулы. Полезная нагрузка, являющаяся «цитотоксическим фрагментом», может представлять собой любое средство, которое наносит вред клеткам, или которое может повреждать или уничтожать клетки. Примеры цитотоксических фрагментов включают, без ограничения, химиотерапевтическое средство, противоопухолевое средство, ингибитор роста, лекарственное средство, токсин, такой как таксол, цитохалазин B, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидрокси антрацин дион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, татракаин, лидокаин, пропранолол, пуромицин и его аналоги, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил декарбазин), алкилирующие средства (например, мехлорэтамин, тиотепа, хлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнит, стрептозотоцин, митомицин C и цис-дихлордиамин платина (II) (DDP) цисплатин), антрациклины (например, даунорубицин (прежнее название дауномицин) и доксорубицин), антибиотики (например, дактиномицин (прежнее название актиномицин), блеомицин, митрамицин, соединения платины (например, цисплатин и оксалиплатин), растительные алкалоиды (например, ингибиторы топоизомеразы, алкалоиды барвинка, таксаны и эпиподофиллотоксины) и антрамицин (AMC)), а также антимитотические средства (например, винкристин и винбластин). Используемые в настоящем документе термины «нагрузка» или «нагрузка лекарственного средства» или «количество полезной нагрузки» означают среднее число лекарственных средств/полезных нагрузок на одно антитело. Нагрузка лекарственного средства может находиться в диапазоне от 1 до 20 (например, 1-15, 1-10, 2-10, 1-8, 2-8, 2-6, 2-5 или 2-4) лекарственных средств на одно антитело (иными словами, соотношение лекарственного средства и антитела), что определяют соответствующими методами, известными в данной области, такими как масс-спектрометрия, спектроскопия в УФ/видимой области, анализ ELISA и ВЭЖХ. В конкретных вариантах осуществления нагрузка лекарственного средства составляет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10.
Полинуклеотиды и рекомбинантные методы
Настоящее изобретение относится к выделенным полинуклеотидам, кодирующим анти-PD-L1 антитела и их антигенсвязывающие фрагменты. В конкретных вариантах осуществления выделенные полинуклеотиды содержат одну или более нуклеотидных последовательностей, кодирующих последовательности CDR, предложенные в настоящем документе.
Способ получения моноклонального анти-PD-L1 антитела, или его антигенсвязывающих фрагментов, включает: иммунизацию соответствующего животного белком PD-L1 человека или продуцирующими hPD-L1 клетками. Животное может представлять собой мышь, крысу, овцу, козу, кролика или морскую свинку. Используя селезенку или лимфатические узлы животного, получают гибридому или собирают B-клетки от иммунизированного животного и измеряют титр антител против PD-L1. Клонируют полинуклеотиды, кодирующие антитела против PD-L1, или их антигенсвязывающие фрагменты, с соответствующим титром из гибридомы или B-клеточных клонов от иммунизированного животного. Клонированные или модифицированные (например, химерные, гуманизированные) полинуклеотиды вставляют в подходящий вектор, который затем вводят в клетки-хозяева для продуцирования антител по изобретению. Антитела и их антигенсвязывающие фрагменты, предложенные в настоящем документе, можно получать в практически чистой гомогенной форме путем культивирования клеток-хозяев, с последующим разделением и очисткой из клеток-хозяев или культуральной среды (например, супернатанта). Для разделения и очистки антител, или их антигенсвязывающих фрагментов, можно использовать обычный метод, используемый для очистки полипептидов.
В некоторых вариантах осуществления выделенные полинуклеотиды кодируют вариабельную область тяжелой цепи и содержат последовательность, выбранную из группы, состоящей из: SEQ ID NO: 93, 95, 97, 99, 101, 103 и 105, а также их гомологичных последовательностей, имеющих по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности. В некоторых вариантах осуществления выделенные полинуклеотиды кодируют вариабельную область легкой цепи и содержат последовательность, выбранную из группы, состоящей из: SEQ ID NO: 94, 96, 98, 100, 102, 104 и 106, а также их гомологичных последовательностей, имеющих по меньшей мере 80% (например, по меньшей мере 85%, 88%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%) идентичности последовательности. В конкретных вариантах осуществления процент идентичности обусловлен вырожденностью генетического кода, в то время как закодированная белковая последовательность остается неизменной.
Выделенный полинуклеотид, кодирующий анти-PD-L1 антитела и их антигенсвязывающие фрагменты, можно вставлять в вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии, с использованием рекомбинантных методов, известных в данной области. В другом варианте осуществления антитело можно получать путем гомологичной рекомбинации, известной в данной области. ДНК, кодирующую моноклональное антитело, можно с легкостью выделять и секвенировать с использованием общепринятых методов (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела). Доступно множество векторов. Компоненты вектора, как правило, включают, но без ограничения, одно или более из перечисленного: сигнальную последовательность (например, сигналы трансляции или лидерную последовательность), точку начала репликации, один или более генов селективных маркеров, элемент энхансера, промотор (например, SV40, CMV, EF-1α) и последовательность терминации транскрипции.
В некоторых вариантах осуществления векторная система включает векторные системы млекопитающих, бактерий, дрожжей и так далее, и включает плазмиды, такие как, но без ограничения, pALTER, pBAD, pcDNA, pCal, pL, pET, pGEMEX, pGEX, pCI, pCMV, pEGFP, pEGFT, pSV2, pFUSE, pVITRO, pVIVO, pMAL, pMONO, pSELECT, pUNO, pDUO, Psg5L, pBABE, pWPXL, pBI, p15TV-L, pPro18, pTD, pRS420, pLexA, pACT2.2, pCDM8, pCDNA1.1/amp, pcDNA3.1, pRc/RSV, pEF-1, pCMV-SCRIPT.RTM., pFB, pSG5, pXT1, pCDEF3, pSVSPORT, pEF-Bos, и так далее, а также другие лабораторные и коммерчески доступные экспрессионные векторы. Подходящие векторы могут включать плазмиды или вирусные векторы (например, репликативно-дефектные ретровирусы, аденовирусы и аденоассоциированные вирусы). Векторы могут сохраняться в одной копии или нескольких копиях, либо интегрироваться в геном клетки-хозяина. Векторы, содержащие полинуклеотидную последовательность, кодирующую антитело или антигенсвязывающий фрагмент, можно вводить в клетку-хозяина для репликации или экспрессии гена. Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах по настоящему изобретению представляют собой прокариотические, дрожжевые клетки, клетки насекомых или клетки высших эукариот, описанные выше. Подходящие для данной цели прокариоты включают эубактерии, такие как грамотрицательные или грамположительные микроорганизмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis, Pseudomonas, такие как P. aeruginosa, и Streptomyces, Bacillus, Streptococcus, Streptomyces, Staphylococcus, Enterococcus, Lactobacillus, Lactococcus, Clostridium, Geobacillus, Oceanobacillus, Pseudomonas, Salmonella, Campylobacter, Helicobacter, Flavobacterium, Fusobacterium, Ilyobacter, Neisseria и Ureaplasma. Подходящие клетки насекомых включают клетки Drosophila Schnieder S2 и Sf9). Подходящие дрожжи включают P. methanolica, P. pastoris, S. cerevisiae или обычные пекарские дрожжи. Предпочтительные клетки млекопитающих включают клетки CHO, клетки HEK293, лимфоциты и миеломы. В конкретных вариантах осуществления, если нет необходимости в гликозилировании и эффекторной функции Fc-области антитела, антитело можно продуцировать в бактериях.
В дополнение к приведенным выше примерам, множество других родов, видов и штаммов являются общедоступными и полезными по настоящему изобретению, например, Schizosaccharomyces pombe; Kluyveromyces, такие как, например, K. lactis, K. fragilis (ATCC 12.424), K. bulgaricus (ATCC 16.045), K. wickeramii (ATCC 24.178), K. waltii (ATCC 56.500), K. drosophilarum (ATCC 36.906), K. thermotolerans и K. marxianus; Yarrowia (EP 402.226); Pichia pastoris (EP 183.070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium и Aspergillus, такие как A. nidulans и A. niger.
Подходящие клетки-хозяева для экспрессии гликозилированных антител или антигенсвязывающих фрагментов, предложенных в настоящем документе, получают из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Известно множество бакуловирусных штаммов и вариантов, а также соответствующих пермиссивных клеток-хозяев насекомых, таких как клетки Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Различные вирусные штаммы для трансфекции являются общедоступными, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть использованы в качестве вирусов по настоящему изобретению, в частности, для трансфекции клеток Spodoptera frugiperda. Культуры клеток растений хлопчатника, кукурузы, картофеля, сои, петунии, томатов и табака также можно использовать в качестве хозяев.
Однако наибольший интерес представляют клетки позвоночных, и размножение клеток позвоночных в культуре (тканевой культуре) стало рутинной процедурой. Примерами полезных линий клеток-хозяев млекопитающих являются линии клеток CV1 почки обезьяны, трансформированные SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (клетки 293 или 293, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36: 59 (1977)); клетки почки новорожденного хомяка (BHK, ATCC CCL 10); клетки яичника китайского хомяка/-DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); мышиные клетки Сертоли (TM4, Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почки обезьяны (CV1 ATCC CCL 70); клетки почки африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки цервикальной карциномы человека (HELA, ATCC CCL 2); клетки почки собаки (MDCK, ATCC CCL 34); клетки печени крысы Buffalo (BRL 3A, ATCC CRL 1442); клетки человеческого легкого (W138, ATCC CCL 75); клетки печеночно-клеточной карциномы человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383: 44-68 (1982)); клетки MRC 5; клетки FS4; PC12; клеточная линия эмбриональных фибробластов мыши (3T3); клетки миеломы NSO (линия клеток мышиной миеломы, которые эндогенно не продуцируют никакие функциональные цепи иммуноглобулинов). Различные клетки-хозяева имеют разные характеристики и механизмы посттрансляционного процессинга и модификации белков и генных продуктов. Таким образом, подходящие линии клеток могут быть выбраны в качестве клеток-хозяев для обеспечения правильной модификации и процессинга (например, гликозилирования и фосфорилирования первичного транскрипта) экспрессируемых антител. В некоторых предпочтительных вариантах осуществления клетка-хозяин представляет собой клетку HEK293T. В некоторых предпочтительных вариантах осуществления клетка-хозяин представляет собой клетку CHO.
Клетки-хозяева трансформируют вышеописанными экспрессионными или клонирующими векторами для продуцирования анти-PD-L1 антитела и культивируют в обычной питательной среде, модифицированной, в зависимости от обстоятельств, для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности. В конкретных вариантах осуществления векторы можно переносить в клетку-хозяина методами, известными в данной области, такими как трансформация, электропорация, обработка фосфатом кальция, липофекция. В конкретных вариантах осуществления трансфекция вектора в эукариотическую клетку включает соосаждение фосфатом кальция, микроинъекцию, электропорацию, липофекцию и вирусную инфекцию. Эукариотическая клетка-хозяин может быть совместно трансформирована вторым полинуклеотидом, кодирующим антитело. В конкретных вариантах осуществления клетка-хозяин, содержащая перенесенный вектор, может временно экспрессировать анти-PD-L1 антитело.
Клетки-хозяева, используемые для продуцирования антител или антигенсвязывающих фрагментов, предложенных в настоящем документе, можно культивировать в различных средах. Коммерчески доступные среды, такие как среда Хэма F10 (Sigma), минимальная поддерживающая среда (MEM), (Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла (DMEM), Sigma), бульон Луриа (LB) и среда «Terrific broth» (TB), являются подходящими для культивирования клеток-хозяев. Кроме того, любую из сред, описанных в Ham et al., Meth. Enz. 58: 44 (1979), Barnes et al., Anal. Biochem. 102: 255 (1980), патентах США №№ 4767704, 4657866, 4927762, 4560655 или 5122469, WO 90/03430; WO 87/00195 или патенте США Re. 30985, можно использовать в качестве среды для культивирования клеток-хозяев. Любую из этих сред можно дополнять, по мере необходимости, гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид, или фосфат, натрия, кальция, магния), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство гентамицин™), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечных концентрациях, находящихся в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также можно включать в соответствующих концентрациях, которые известны специалистам в данной области. Условия культивирования, такие как температура, pH и тому подобное, являются такими, которые были использованы ранее для клеток-хозяев, выбранных для экспрессии, и будут очевидны для специалистов в данной области.
При использовании рекомбинантных методов антитело, и его антигенсвязывающие фрагменты, может продуцироваться внутри клетки, в периплазматическом пространстве, или непосредственно секретироваться в среду. Если антитело продуцируется внутри клетки, в качестве первого шага удаляют порошкообразный детрит, либо клетки-хозяева, либо лизированные фрагменты, например, центрифугированием или ультрафильтрацией. В публикации Carter et al., Bio/Technology 10: 163-167 (1992) описан метод выделения антител, которые секретируются в периплазматическое пространство E. coli. Вкратце, пасту из клеток размораживают в присутствии ацетата натрия (pH 3,5), ЭДТА и фенилметилсульфонилфторида (PMSF) в течение примерно 30 мин. Клеточный детрит можно удалять центрифугированием. Если антитело, и его антигенсвязывающие фрагменты, секретируется в среду, супернатанты от таких экспрессионных систем, как правило, сначала концентрируют с использованием коммерчески доступных фильтров для концентрирования белков, например, ячейки для ультрафильтрации Amicon или Millipore Pellicon. Можно включать ингибитор протеаз, такой как PMSF, на любой из вышеупомянутых стадий для ингибирования протеолиза и можно включать антибиотики для предотвращения роста нежелательных загрязняющих микроорганизмов.
Антитело, полученное из клеток, можно очищать с использованием, например, хроматографии на гидроксилапатите, гидрофобной хроматографии, обращенно-фазовой хроматографии, абсорбционной хроматографии, фильтрации, ультрафильтрации, осаждения растворителем, экстракции растворителем, дистилляции, электрофореза в SDS-полиакриламидном геле, диализа, ионообменной хроматографии на DEAE-целлюлозе, осаждения сульфатом аммония, высаливания, иммунопреципитации, изоэлектрического фокусирования, перекристаллизации и аффинной хроматографии, при этом аффинная хроматография является предпочтительным методом очистки. Пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в антителе. Белок A можно использовать для очистки антител, которые имеют тяжелые цепи гамма-1, гамма-2, или гамма-4 (Lindmark et al., J. Immunol. Meth. 62: 1-13 (1983)). Примеры колонок с белком A включают Hyper D, POROS и Sepharose FF (GE Healthcare Biosciences). Белок G рекомендован для очистки мышиных антител всех изотипов и человеческих антител изотипа гамма-3 (Guss et al., EMBO J. 5: 1567 1575 (1986)). Матрицей, с которой связан аффинный лиганд, чаще всего является агароза, однако доступны и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, позволяют использовать более высокие скорости потока и меньший период времени, чем в случае использования агарозы. Если антитело содержит домен CH3, для очистки полезно использовать смолу Bakerbond ABX.TM. (J. T. Baker, Phillipsburg, N.J.). Также можно использовать другие методы очистки белков, такие как фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на силикагеле, хроматография на гепарин-сефарозе™, хроматография на анионообменной или катионообменной смоле (например, колонке с полиаспарагиновой кислотой), хроматофокусирование, SDS-ПААГ и осаждение сульфатом аммония, в зависимости от антитела, которое предстоит извлекать.
После предварительной стадии(й) очистки смесь, содержащую интересующее антитело и примеси, можно подвергать хроматографии гидрофобного взаимодействия при низких значениях pH, с использованием элюирующего буфера со значением pH примерно 2,5-4,5, которую, предпочтительно, проводят при низкой концентрации соли (например, примерно 0-0,25 M соли).
Наборы
Настоящее изобретение относится к наборам, включающим анти-PD-L1 антитела или их антигенсвязывающие фрагменты, или фармацевтическую композицию, содержащую анти-PD-L1 антитела или их антигенсвязывающие фрагменты, предложенные в настоящем документе. В некоторых вариантах осуществления наборы являются полезными для определения присутствия или уровня PD-L1 в биологическом образце. Биологический образец может содержать клетку или ткань.
В некоторых вариантах осуществления анти-PD-L1 антитело, или его антигенсвязывающий фрагмент, которое находится в наборе, конъюгировано с детектируемой меткой (например, флуоресцентной, радиоактивной или ферментной меткой). В других конкретных вариантах осуществления набор включает немеченое анти-PD-L1 антитело или его антигенсвязывающие фрагменты, или фармацевтическую композицию, содержащую немеченое анти-PD-L1 антитело или его антигенсвязывающие фрагменты, и дополнительно включает вторичное меченое антитело, которое способно связываться с немеченым анти-PD-L1 антителом. Набор может дополнительно включать средства обнаружения метки (например, набор фильтров для обнаружения флуоресцентных меток, субстраты ферментов для ферментных меток, и так далее). Набор может включать дополнительные реагенты и буферы, используемые в конкретном способе. Набор также может включать инструкцию по применению и упаковку, которая отделяет каждый из компонентов в наборе. В конкретных вариантах осуществления набор включает реагенты для иммуноанализа для обнаружения антитела против PD-L1.
В конкретных вариантах осуществления анти-PD-L1 антитело, или его антигенсвязывающий фрагмент, которое входит в набор, связано с субстратом или устройством, полезным для проведения сэндвич-анализа, такого как ELISA, или иммунографического анализа. Полезным субстратом или устройством может быть, например, микропланшет для титрования и тест-полоски.
В конкретных вариантах осуществления предложен набор для определения уровня белка PD-L1. В некоторых вариантах осуществления набор используют для прогнозирования, диагностики, предотвращения или лечения связанных с PD-L1 состояний.
Фармацевтическая композиция и способ лечения
Настоящее изобретение также относится к фармацевтическим композициям, содержащим анти-PD-L1 антитела, или их антигенсвязывающие фрагменты, и один или более фармацевтически приемлемых носителей.
Фармацевтически приемлемые носители для использования в фармацевтических композициях, раскрытых в настоящем документе, могут включать, например, фармацевтически приемлемые жидкие, гелевые или твердые носители, водные среды, неводные среды, противомикробные средства, изотонические средства, буферы, антиоксиданты, анестетики, суспендирующие/диспергирующие средства, секвестрирующие или хелатирующие агенты, разбавители, адъюванты, эксципиенты или нетоксичные вспомогательные вещества, другие компоненты, известные в данной области, или их различные сочетания.
Подходящие компоненты могут включать, например, антиоксиданты, увлажняющие средства, наполнители, связывающие вещества, дезинтегрирующие средства, буферы, консерванты, смазывающие средства, ароматизаторы, загустители, красители, эмульгаторы или стабилизаторы, такие как сахара и циклодекстрины. Подходящие антиоксиданты могут включать, например, метионин, аскорбиновую кислоту, ЭДТА, тиосульфат натрия, платину, каталазу, лимонную кислоту, цистеин, тиоглицерин, тиогликолевую кислоту, тиосорбит, бутилированный гидроксианизол, бутилированный гидрокситолуол и/или пропилгаллат. Как описано в настоящем документе, включение одного или более антиоксидантов, таких как метионин, в композицию, содержащую антитело или антигенсвязывающий фрагмент и конъюгаты, предложенные в настоящем документе, уменьшает окисление антитела или антигенсвязывающего фрагмента. Такое уменьшение окисления предотвращает или уменьшает потерю активности связывания или аффинности связывания, тем самым повышая стабильность антитела и максимально увеличивая срок хранения. Таким образом, в конкретных вариантах осуществления предложены композиции, содержащие одно или более антител, или антигенсвязывающих фрагментов, раскрытых в настоящем документе, и один или более антиоксидантов, таких как метионин. Также предложены способы предотвращения окисления, продления срока хранения и/или повышения эффективности антитела, или антигенсвязывающего фрагмента, предложенного в настоящем документе, путем смешивания антитела, или антигенсвязывающего фрагмента, с одним или более антиоксидантами, такими как метионин. Подходящие увлажняющие средства включают этиленгликоль, глицерин или сорбит. Подходящие смазывающие средства включают, например, воск цетиловых эфиров, гидрогенизированное растительное масло, стеарат магния, метилстеарат, минеральное масло, сополимер полиоксиэтилена-полиоксипропилена, полиэтиленгликоль, поливиниловый спирт, лаурилсульфат натрия или белый воск, либо смесь двух или более из вышеперечисленных. Подходящие эмульгаторы включают карбомер, полиоксиэтилен(20)стеариловый эфир, цетостеариловый спирт, цетиловый спирт, холестерин, гликоль дистеарат, глицерил стеарат, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, ланолин, полиоксиэтилен лаурил эфир, метилцеллюлозу, полиоксиэтилен стеарат, полисорбат, пропиленгликоль моностеарат, сложные эфиры сорбитана или стеариновую кислоту.
В качестве дополнительной иллюстрации, фармацевтически приемлемые носители могут включать, например, водные среды, такие как хлорид натрия для инъекций, раствор Рингера для инъекций, изотонический раствор декстрозы для инъекций, стерильную воду для инъекций или декстрозу в растворе Рингера лактате для инъекций, неводные среды, такие как нелетучие масла растительного происхождения, масло семян хлопчатника, кукурузное масло, кунжутное масло или арахисовое масло, противомикробные средства в бактериостатических или фунгистатических концентрациях, изотонические средства, такие как хлорид натрия или декстроза, буферы, такие как фосфатные или цитратные буферы, антиоксиданты, такие как бисульфат натрия, местные анестетики, такие как прокаина гидрохлорид, суспендирующие и диспергирующие средства, такие как натрий-карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза или поливинилпирролидон, эмульгаторы, такие как полисорбат 80 (TWEEN-80), секвестрирующие или хелатирующие агенты, такие как ЭДТА (этилендиаминтетрауксусная кислота) или ЭГТА (этиленгликольтетрауксусная кислота), этиловый спирт, полиэтиленгликоль, пропиленгликоль, гидроксид натрия, соляная кислота, лимонная кислота или молочная кислота. К фармацевтическим композициям в многодозовых контейнерах могут быть добавлены используемые в качестве носителей противомикробные средства, которые включают фенолы или крезолы, соединения ртути, бензиловый спирт, хлорбутанол, метиловые и пропиловые сложные эфиры п-гидроксибензойной кислоты, тимеросал, бензалкония хлорид и бензэтония хлорид. Подходящие эксципиенты могут включать, например, воду, солевой раствор, декстрозу, глицерин или этанол. Подходящие нетоксичные вспомогательные вещества могут включать, например, увлажнители или эмульгаторы, регулирующие pH буферные средства, стабилизаторы, повышающие растворимость средства или такие средства, как ацетат натрия, сорбитан монолаурат, триэтаноламин олеат или циклодекстрин.
Фармацевтические композиции могут представлять собой жидкий раствор, суспензию, эмульсию, лосьон, пену, пилюлю, капсулу, таблетку, препарат с замедленным высвобождением, мазь, крем, пасту, гель, спрей, аэрозоль или порошок. Пероральные препараты могут содержать стандартные носители фармацевтической категории, такие как маннит, лактоза, крахмал, стеарат магния, поливинилпирролидон, сахаринат натрия, целлюлоза, карбонат магния и так далее.
В конкретных вариантах осуществления фармацевтические композиции формулируют в виде инъекционной композиции. Инъекционные фармацевтические композиции могут быть изготовлены в любой общепринятой форме, такой как, например, жидкий раствор, суспензия, эмульсия, или твердых формах, подходящих для получения жидкого раствора, суспензии или эмульсии. Препараты для инъекций могут включать стерильные и/или апирогенные растворы, готовые для инъекции, стерильные сухие растворимые препараты, такие как лиофилизированные порошки, готовые для объединения с растворителем непосредственно перед использованием, включая подкожные таблетки, стерильные готовые для инъекции суспензии, стерильные сухие нерастворимые препараты, готовые для объединения со средой непосредственно перед использованием, а также стерильные и/или апирогенные эмульсии. Растворы могут быть либо водными, либо неводными.
В конкретных вариантах осуществления стандартная доза парентеральных препаратов упакована в ампулу, флакон или шприц с иглой. Все препараты для парентерального введения должны быть стерильными и апирогенными, как известно и практикуется в данной области.
В конкретных вариантах осуществления стерильный лиофилизированный порошок готовят путем растворения антитела или антигенсвязывающего фрагмента, раскрытого в настоящем документе, в соответствующем растворителе. Растворитель может содержать эксципиент, который способствует повышению стабильности, или другие фармакологические компоненты порошка или восстановленного раствора, полученного из порошка. Эксципиенты, которые можно использовать, включают, но без ограничения, воду, декстрозу, сорбит, фруктозу, кукурузный сироп, ксилит, глицерин, глюкозу, сахарозу или другое подходящее средство. Растворитель может содержать буфер, такой как цитрат натрия или фосфат калия, либо другой такой буфер, известный специалистам в данной области, в одном варианте осуществления, при примерно нейтральном pH. Последующая стерилизация фильтрованием раствора, а затем лиофилизация в стандартных условиях, известных специалистам в данной области, позволяет получать желаемый препарат. В одном варианте осуществления полученный раствор будет распределен во флаконы для лиофилизации. Каждый флакон может содержать одну дозу или несколько доз анти-PD-L1 антитела или его антигенсвязывающего фрагмента, или его композиции. Внесение во флаконы небольшого дополнительного количества, сверх того, которое необходимо для дозы или набора доз (например, примерно 10%), приемлемо для облегчения точного отбора образца и точного дозирования. Лиофилизированный порошок можно хранить в подходящих условиях, например, при температуре от примерно 4°C до комнатной температуры.
Восстановление лиофилизированного порошка водой для инъекций позволяет получать препарат, используемый для парентерального введения. В одном варианте осуществления для восстановления стерильную и/или апирогенную воду или другой подходящий жидкий носитель добавляют к лиофилизированному порошку. Точное количество зависит от выбранного метода предоставляемого лечения, и может быть определено эмпирическим путем.
Также предложены терапевтические способы лечения связанного с PD-L1 состояния, включающие: введение субъекту терапевтически эффективного количества антитела против PD-L1, предложенного в настоящем документе, или его антигенсвязывающих фрагментов, и за счет этого лечение, или предотвращение, состояния или заболевания, связанного с PD-L1. В другом варианте осуществления предложены способы лечения состояния у субъекта, которому может принести пользу усиление иммунного ответа, включающие введение терапевтически эффективного количества антитела против PD-L1, предложенного в настоящем документе, субъекту, который нуждается в этом.
Терапевтически эффективное количество (при использовании отдельно или в сочетании с другими средствами, такими как химиотерапевтические средства) антитела, или антигенсвязывающего фрагмента, предложенного в настоящем документе, будет зависеть от различных факторов, известных в данной области, таких как, например, вид заболевания, которое подвергают лечению, вид антитела, масса тела, возраст, прошлая медицинская история, принимаемые в данный момент лекарственные препараты, состояние здоровья субъекта, состояние иммунитета и возможность перекрестной реакции, аллергия, чувствительность и неблагоприятные побочные эффекты, путь введения и вид, степень тяжести и стадия развития заболевания, а также решение, принятое лечащим врачом или ветеринаром. В конкретных вариантах осуществления антитело, или антигенсвязывающий фрагмент, предложенное в настоящем документе, можно вводить в терапевтически эффективной дозе от примерно 0,01 мг/кг до примерно 100 мг/кг один или более раз в сутки (например, примерно 0,01 мг/кг, примерно 0,3 мг/кг, примерно 0,5 мг/кг, примерно 1 мг/кг, примерно 3 мг/кг, примерно 5 мг/кг, примерно 10 мг/кг, примерно 15 мг/кг, примерно 20 мг/кг, примерно 25 мг/кг, примерно 30 мг/кг, примерно 35 мг/кг, примерно 40 мг/кг, примерно 45 мг/кг, примерно 50 мг/кг, примерно 55 мг/кг, примерно 60 мг/кг, примерно 65 мг/кг, примерно 70 мг/кг, примерно 75 мг/кг, примерно 80 мг/кг, примерно 85 мг/кг, примерно 90 мг/кг, примерно 95 мг/кг или примерно 100 мг/кг один или более раз в сутки). В конкретных вариантах осуществления антитело или антигенсвязывающий фрагмент вводят в дозе примерно 50 мг/кг или менее, и в некоторых вариантах осуществления доза составляет 20 мг/кг или менее, 10 мг/кг или менее, 3 мг/кг или менее, 1 мг/кг или менее, 0,3 мг/кг или менее, или 0,1 мг/кг или менее. В конкретных вариантах осуществления вводимая доза может изменяться на протяжении курса лечения. Например, в конкретных вариантах осуществления начальная вводимая доза может быть выше, чем последующие вводимые дозы. В конкретных вариантах осуществления вводимая доза может варьироваться на протяжении курса лечения в зависимости от реакции субъекта.
Режимы дозирования можно корректировать для достижения оптимального желательного ответа (например, терапевтического ответа). В конкретных вариантах осуществления антитело, или антигенсвязывающий фрагмент, предложенное в настоящем документе, вводят субъекту однократно или на протяжении ряда процедур. В конкретных вариантах осуществления антитело, или антигенсвязывающий фрагмент, предложенное в настоящем документе, вводят субъекту одним или более отдельными введениями, или путем непрерывной инфузии в зависимости от вида и степени тяжести заболевания. Руководство можно найти, например, в патентах США №№ 4657760, 5206344, 5225212.
Антитела и антигенсвязывающие фрагменты, раскрытые в настоящем документе, можно вводить любым путем введения, известным в данной области, например, парентеральным (например, подкожной, внутрибрюшинной, внутривенной, включая внутривенную инфузию, внутримышечной или внутрикожной инъекцией) или не парентеральным (например, пероральным, интраназальным, внутриглазным, подъязычным, ректальным или топическим) путями введения.
В конкретных вариантах осуществления антитела и антигенсвязывающие фрагменты, раскрытые в настоящем документе, можно вводить в препаратах с контролируемым высвобождением. Парентеральные препараты с контролируемым высвобождением могут быть выполнены в виде имплантатов, масляных инъекций или систем в форме частиц (например, микросфер, микрочастиц, микрокапсул, нанокапсул, наносфер и наночастиц) (смотри Banga, A. J., Therapeutic Peptides and Proteins: Formulation, Processing, and Delivery Systems, Technomic Publishing Company, Inc., Lancaster, Pa., (1995); Kreuter, J., Colloidal Drug Delivery Systems, J. Kreuter, ed., Marcel Dekker, Inc., New York, N.Y., pp. 219-342 (1994); Tice & Tabibi, Treatise on Controlled Drug Delivery, A. Kydonieus, ed., Marcel Dekker, Inc. New York, N.Y., pp. 315-339, (1992)). В конкретных вариантах осуществления антитела против PD-L1 и антигенсвязывающие фрагменты, раскрытые в настоящем документе, можно вводить в распадающихся или не распадающихся полимерных матрицах (смотри Langer, Accounts Chem. Res. 26: 537-542, 1993).
Состояния, связанные с PD-L1, могут представлять собой связанные с иммунитетом заболевания или нарушения. В конкретных вариантах осуществления состояния представляют собой солидные опухоли, гематологические заболевания, инфекционные заболевания, аутоиммунные заболевания или фиброзные заболевания. В конкретных вариантах осуществления солидные опухоли включают, например, немелкоклеточный рак легкого (плоскоклеточный/не плоскоклеточный), мелкоклеточный рак легкого, почечно-клеточный рак, колоректальный рак, рак толстого кишечника, рак яичника, рак молочной железы (включая базальную карциному молочной железы, протоковую карциному и дольковую карциному молочной железы), рак поджелудочной железы, карциному желудка, рак мочевого пузыря, рак пищевода, мезотелиому, меланому, рак головы и шеи, рак щитовидной железы, саркому, рак предстательной железы, глиобластому, рак шейки матки, карциному тимуса, меланому, миеломы, грибовидную гранулему, рак из клеток Меркеля, печеночно-клеточную карциному (HCC), фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому и другие саркомы, синовиому, мезотелиому, саркому Юинга, лейомиосаркому, рабдомиосаркому, злокачественные новообразования лимфоидной ткани, базально-клеточную карциному, аденокарциному, карциному потовых желез, медуллярную карциному щитовидной железы, папиллярную карциному щитовидной железы, феохромоцитому, карциному сальных желез, папиллярную карциному, папиллярные аденокарциномы, медуллярную карциному, бронхогенную карциному, гепатому, карциномы желчных протоков, хориокарциному, опухоль Вильмса, рак шейки матки, опухоль яичка, семиному. Гематологические заболевания включают такие заболевания, как классическая лимфома Ходжкина (CHL), первичная медиастинальная крупноклеточная B-клеточная лимфома, богатая T-клетками/гистиоцитами B-клеточная лимфома, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, острый миелогенный лейкоз, а также миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный и эритроцитарный лейкоз, хронический миелоцитарный (гранулоцитарный) лейкоз, хронический миелогенный лейкоз, хронический лимфоцитарный лейкоз, истинная полицитемия, опухоли из тучных клеток, EBV-положительные и -отрицательные PTLD, а также диффузная крупноклеточная B-клеточная лимфома (DLBCL), плазмобластная лимфома, экстранодальная NK/Т-клеточная лимфома, носоглоточная карцинома и HHV8-ассоциированная первичная эффузионная лимфома, неходжскинская лимфома, множественная миелома, макроглобулинемия Вальденстрема, болезнь тяжелых цепей, миелодиспластический синдром, волосатоклеточный лейкоз и миелодисплазия, злокачественное новообразование в центральной нервной системе (ЦНС), такое как первичная лимфома ЦНС, опухоль спинного мозга, глиома ствола головного мозга, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, невринома слухового нерва, олигодендроглиома, менингиома, меланома, нейробластома и ретинобластома. В конкретных вариантах осуществления опухоли и злокачественные новообразования являются метастатическими, в частности, метастатическими опухолями, экспрессирующими PD-L1. В конкретных вариантах осуществления опухоль представляет собой меланому или рак толстой кишки.
В конкретных вариантах осуществления связанные с PD-L1 состояния и заболевания включают аутоиммунные или воспалительные заболевания, такие как системная красная волчанка (SLE), воспаление слизистой оболочки кишечника, изнуряющая болезнь, связанная с колитом, рассеянный склероз, вирусные инфекции, ревматоидный артрит, остеоартрит, болезнь Крона и воспалительное заболевание кишечника, псориаз, системная склеродермия, аутоиммунный диабет и тому подобное. В конкретных вариантах осуществления связанные с PD-L1 состояния и заболевания включают инфекционное заболевание, такое как грибковая инфекция, вызываемая паразитами/простейшими инфекция или хроническая вирусная инфекция, например, кокцидиоидомикоз, гистоплазмоз, онихомикоз, аспергиллез, бластомикоз, кандидоз, паракокцидиомикоз, микроспоридиоз, акантамебный кератит, амебиаз, аскариоз, бабезиоз, балантидиаз, байлисаскаридоз, болезнь Шагаса, клонорхиоз, кохлиомия, криптоспоридиоз, дифиллоботриаз, дракункулез, эхинококкоз, элефантиаз, энтеробиоз, фасциолез, фасциолопсиаз, филяриоз, лямблиоз, гнатостомоз, гименолепидоз, изоспороз, лихорадка Катаямы, лейшманиоз, болезнь Лайма, малярия, метагонимоз, миаз, онхоцеркоз, педикулез, чесотка, шистосомоз, сонная болезнь, стронгилоидоз, тениоз, токсокароз, токсоплазмоз, трихинеллез, трихуроз, трипаносомоз, гельминтная инфекция, инфекция вируса гепатита B (HBV), гепатита C (HCV), вируса герпеса, вируса Эпштейна-Барр, ВИЧ, цитомегаловируса, вируса простого герпеса I типа, вируса простого герпеса II типа, вируса папилломы человека, аденовируса, вируса иммунодефицита человека I, вируса иммунодефицита человека II, эпидемии вируса герпеса, связанного с саркомой Капоши, тонкого кольцевого вируса (вируса гепатита TTV), T-лимфотропного вируса человека I, T-лимфотропного вируса человека II, вируса ветряной оспы и опоясывающего лишая, вируса JC или вируса BK. В конкретных вариантах осуществления связанные с PD-L1 состояния включают фиброзные заболевания, такие как гломерулонефрит, рубцевание нервной ткани, рубцевание кожи, пульмонарный фиброз, фиброз легких, вызываемый облучением фиброз, печеночный фиброз, миелофиброз.
Способы применения
Настоящее изобретение также относится к способам применения анти-PD-L1 антител или их антигенсвязывающих фрагментов.
В некоторых вариантах осуществления настоящее изобретение относится к способам лечения связанного с PD-L1 состояния у субъекта, включающим введение субъекту терапевтически эффективного количества антитела или его антигенсвязывающих фрагментов. В конкретных вариантах осуществления субъект был идентифицирован, как имеющий заболевание или состояние, которое предположительно будет отвечать на введение антагониста PD-L1. В конкретных вариантах осуществления настоящее изобретение относится к способам предотвращения, обнаружения или диагностики связанного с PD-L1 состояния, включающим создание контакта антитела против PD-L1, предложенного в настоящем документе, или его антигенсвязывающих фрагментов, с биологическим образцом, полученным от субъекта, предположительно имеющего, или имеющего, или имеющего риск развития связанного с PD-L1 состояния, и определение уровня антитела против PD-L1, или его антигенсвязывающих фрагментов, которое связывается с PD-L1 в биологическом образце.
Для лечения связанного с PD-L1 состояния, субъект при тестировании должен являться положительным в отношении экспрессии PD-L1 или при тестировании должен иметь повышенный уровень экспрессии PD-L1. Можно использовать различные методы для определения присутствия или уровня PD-L1 в тестируемом биологическом образце от индивидуума. Например, тестируемый биологический образец можно подвергать воздействию анти-PD-L1 антитела, или его антигенсвязывающего фрагмента, которое связывается с экспрессированным белком PD-L1 и обнаруживает его присутствие. Альтернативно, экспрессию PD-L1 также можно обнаруживать на уровне нуклеиновой кислоты с использованием таких методов, как кПЦР, ПЦР с обратной транскриптазой, микрочипы, SAGE, FISH и тому подобное. В некоторых вариантах осуществления тестируемый образец получают из раковой клетки или ткани (например, полученного при биопсии образца ткани из органа), инфильтрирующих опухоль иммуноцитов или жидкостей организма (например, крови или сыворотки). В конкретных вариантах осуществления присутствие или повышенный уровень PD-L1 в тестируемом биологическом образце указывает на вероятность ответа на лечение. Используемый в настоящем документе термин «повышенный уровень экспрессии» означает, в целом, увеличение не менее, чем на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80% или более, уровня белка PD-L1 в тестируемом образце при определении с использованием антител или антигенсвязывающих фрагментов, предложенных в настоящем документе, в сравнении с уровнем белка PD-L1 в эталонном образце при использовании того же антитела. Эталонный образец может представлять собой контрольный образец, полученный от здорового или не больного индивидуума, либо здоровый или не затронутый болезнью образец, полученный от того же индивидуума, от которого получен тестируемый образец, либо образец, полученный от того же индивидуума в более ранний момент времени во время лечения заболевания. Например, эталонный образец может представлять собой не затронутый болезнью образец, примыкающий или находящийся рядом с тестируемым образцом (например, опухолью).
Антитела, или антигенсвязывающие фрагменты, раскрытые в настоящем документе, можно вводить отдельно или в сочетании с одним или более дополнительными терапевтическими средствами или агентами. Например, антитела, или антигенсвязывающие фрагменты, раскрытые в настоящем документе, можно вводить в сочетании с вторым видом терапии, таким как лучевая терапия, химиотерапия, направленная терапия, генная терапия, иммунотерапия, гормональная терапия, ингибирование ангиогенеза, паллиативная терапия, хирургическое вмешательство для лечения рака (например, иссечение опухоли), с одним или более противорвотными средствами или другими терапевтическими средствами против осложнений, вызванных химиотерапией, или с вторым терапевтическим средством, используемым в лечении рака или любого медицинского нарушения, опосредованного PD-L1, например, другим антителом, терапевтическим полинуклеотидом, химиотерапевтическим средством(ами), антиангиогенным средством, цитокинами, другим цитотоксическим средством(ми), ингибирующим рост средством(ми). В некоторых из этих вариантов осуществления антитело, или антигенсвязывающий фрагмент, раскрытое в настоящем документе, которое вводят в сочетании с одним или более дополнительными терапевтическими средствами, можно вводить одновременно с одним или более дополнительными терапевтическими средствами, и в некоторых из этих вариантов осуществления антитело, или антигенсвязывающий фрагмент, и дополнительное терапевтическое средство(а) можно вводить в виде части одной и той же фармацевтической композиции. Однако антитело, или антигенсвязывающий фрагмент, вводимое «в сочетании» с другим терапевтическим средством, не обязательно должно быть введено одновременно или в той же композиции, что и средство. Антитело, или антигенсвязывающий фрагмент, вводимое до или после другого средства, считают введенным «в сочетании» с этим средством, как описано в настоящем документе, даже если антитело, или антигенсвязывающий фрагмент, и второе средство вводят разными путями введения. Когда это возможно, дополнительные терапевтические средства, вводимые в сочетании с антителами, или антигенсвязывающими фрагментами, раскрытыми в настоящем документе, вводят в соответствии со схемой введения, приведенной в информационном листке препарата дополнительного терапевтического средства или в соответствии со справочным руководством для врачей Physicians' Desk Reference 2003 (Physicians' Desk Reference, 57-е издание; Medical Economics Company; ISBN: 1563634457; 57-е издание (ноябрь 2002 г.)) или протоколами, хорошо известными в данной области. В конкретных вариантах осуществления антиангиогенное средство, вводимое в сочетании с антителом против PD-L1, предложенным в настоящем документе, представляет собой моноклональные антитело для антиваскулогенной терапии, такое как бевацизумаб (анти-VEGF антитело), IMC-1C11 или DC101 (анти-VEGFR-2 антитело), mF4-31C1 (анти-VEGFR-3 антитело) и витаксин (антитело против интегрина αvβ3).
В конкретных вариантах осуществления терапевтические средства могут индуцировать или стимулировать иммунный ответ против рака. Например, можно использовать противоопухолевую вакцину для индукции иммунного ответа против некоторых опухолей или форм рака. Также можно использовать цитокиновую терапию для повышения представленности опухолевых антигенов для иммунной системы. Примеры цитокинов для терапии включают, без ограничения, интерфероны, такие как интерферон-α, -β и -γ, колониестимулирующие факторы, такие как макрофагальный CSF, гранулоцитарно-макрофагальный CSF и гранулоцитарный CSF, инсулиноподобный фактор роста (IGF-1), фактор роста эндотелия сосудов (VEGF), трансформирующий фактор роста (TGF), фактор роста фибробластов (FGF), интерлейкины, такие как IL-1, IL-1α, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11 и IL-12, факторы некроза опухоли, такие как TNF-α и TNF-β, или любое их сочетание. Также можно использовать средства, инактивирующие иммуносупрессивные мишени, например, антагонист IL-1 (IL-1A), антагонист VEGFR2 (например, ваталаниб, сунитиниб, сорафениб, пазопаниб), ингибиторы TGF-бета, антагонисты FGFR, антагонисты рецепторов фактора роста тромбоцитов (PDGFR) (например, иматиниб, сунитиниб, сорафениб, пазопаниб), антагонисты рецепторов эпидермального фактора роста (EGFR, ErbB) (например, гефитиниб, лапатиниб, канертиниб), ингибиторы IL-10 и ингибиторы Fas-лиганда, или любое их сочетание. Другая группа средств включает средства, которые активируют иммунный ответ против опухоли или раковых клеток, например, те, которые усиливают активацию T-клеток (например, агонист T-клеточных костимулирующих молекул, таких как CTLA-4, ICOS и OX-40), и те, которые усиливают функцию дендритных клеток и презентацию антигена.
Скрининг и оценка in vivo эффективности анти-PD-L1 антитела
Для скрининга и/или оценки in vivo эффективности (например, активности связывания или аффинности связывания) антитела против PD-L1, или его антигенсвязывающих фрагментов, были получены не принадлежащие человеку клетки опухоли, экспрессирующие белок PD-L1 человека, для инокуляции животному, отличному от человека. В конкретных вариантах осуществления не принадлежащая человеку клетка опухоли представляет собой клетку грызуна (например, мыши, крысы или хомяка и так далее). В конкретных вариантах осуществления не принадлежащая человеку клетка опухоли представляет собой линию клеток меланомы (B16) или линию клеток рака толстого кишечника мыши (MC38). Не принадлежащая человеку клетка опухоли может содержать полинуклеотид, кодирующий белок PD-L1 человека, с инактивацией эндогенного не принадлежащего человеку сегмента гена PD-L1. Инактивация гена-мишени может быть вызвана разрушением кодирующей белок последовательности, мутацией, добавлением, выключением гена (например, РНКи антисмысловой последовательностью) или делецией гена (например, частичной или полной делецией кодирующей последовательности, либо кодирующей последовательности включая фланкирующие области) в локусе эндогенного гена, что приводит к элиминации или сведению к минимуму экспрессии не принадлежащего человеку гена-мишени, либо образованию функционально неактивного/укороченного полипептида, который не связывается его лигандами. Фланкирующая область кодирующей последовательности может находиться в пределах от примерно 1 п.н. до примерно 500 п.н. с обоих (5' и 3') концов, или фланкирующая область может иметь длину более 500 п.н., но, в соответствии с изобретением, не будет иметь место инактивация других генов. Используемый в настоящем документе термин «разрушение гена» означает добавление одного или более нуклеотидов, или аминокислот, к природной последовательности. Разрушение гена может представлять собой добавление или вставку гена маркера/репортера в кодирующую белок последовательность. В конкретных вариантах осуществления инактивация является необратимой. В конкретных вариантах осуществления инактивация приводит к получению клетки, в которой отсутствует поддающаяся определению активность гена-мишени или генного продукта. Инактивацию гена-мишени выполняют с использованием соответствующих средств, известных в данной области, например, гомологичной рекомбинации, РНК-интерференции (РНКи) или системы CRISPR/Cas9. В конкретных вариантах осуществления сегмент гена PD-L1 человека, кодирующий белок PD-L1 человека, функционально встраивают в локус эндогенного не принадлежащего человеку гена PD-L1 (замена гена). В конкретных вариантах осуществления встроенный полинуклеотид, кодирующий PD-L1 человека, интегрирован в случайный, неспецифический участок (добавление гена). В других вариантах осуществления полинуклеотид, кодирующий PD-L1 человека, может стабильно сохраняться в клетке в виде эписом, например, в форме отдельного эписомного сегмента ДНК, и репликация эписомной ДНК является независимой или синхронизированной с циклом клетки-хозяина.
Не принадлежащие человеку клетки опухолей с полностью инактивированным геном-мишенью могут быть идентифицированы путем FACS-анализа экспрессии на клеточной поверхности или обнаружения транскрипции гена-мишени. Полинуклеотид, кодирующий белок PD-L1 человека, можно вводить в клетки опухоли любым подходящим методом, известным в данной области, например, методом гомологичной рекомбинации и введения трансгена, с использованием любого подходящего экспрессионного вектора, описанного в настоящем документе (такого как лентивирусный вектор). Клетки опухоли с полностью инактивированным геном-мишенью и/или экспрессией введенного интересующего гена могут быть идентифицированы путем FACS-анализа экспрессии на клеточной поверхности или обнаружения транскрипции гена-мишени любым подходящим методом, известным в данной области.
Способ скрининга или оценки in vivo эффективности антитела против PD-L1 человека, или его антигенсвязывающих фрагментов, включает инокуляцию клетки опухоли, содержащей полинуклеотид, кодирующий белок PD-L1 человека, животному, отличному от человека, контактирование антитела с клетками опухоли в организме животного, отличного от человека, и определение опухолевой нагрузки клетки опухоли. Используемый в настоящем документе термин «опухолевая нагрузка» означает количество опухолевых клеток у индивидуума, которое может быть определено как объем, количество или масса опухолей. Клетка опухоли может представлять собой клетку солидной опухоли или клетку несолидной опухоли (такую как клетки крови). Клетка опухоли может представлять собой человеческую клетку опухоли или клетку опухоли, не принадлежащую человеку. В конкретных вариантах осуществления клетку опухоли инокулируют сингенному животному, отличному от человека, для создания модели сингенной опухоли. В конкретных вариантах осуществления клетку опухоли культивируют с несколькими пассажами перед инокуляцией животному, отличному от человека. В конкретных вариантах осуществления животное, отличное от человека, имеет человеческую иммунную систему. В конкретных вариантах осуществления in vivo эффективность антитела против PD-L1, или его антигенсвязывающих фрагментов, определяют на основании ингибирования увеличения объема опухоли у животного, отличного от человека, которому введены антитела против PD-L1, в сравнении с контролем.
Следующие примеры приведены для лучшей иллюстрации заявленного изобретения и не должны быть истолкованы, как ограничивающие объем изобретения. Все конкретные композиции, материалы и способы, описанные ниже, полностью или частично, входят в объем настоящего изобретения. Эти конкретные композиции, материалы и способы не предназначены для ограничения изобретения, но лишь для иллюстрации конкретных вариантов осуществления, входящих в объем изобретения. Специалист в данной области может разрабатывать эквивалентные композиции, материалы и способы, не обладающие признаками изобретения, без выхода за рамки данного изобретения. Понятно, что можно использовать различные вариации способов, описанных в настоящем документе, которые все-еще будут оставаться в пределах объема настоящего изобретения. Авторы изобретения считают, что такие вариации входят в объем изобретения.
Примеры
Пример 1: Получение и характеризация белка PD-L1
Белок PD-L1/CD274 человека: Рекомбинантный белок PD-L1/CD274 человека (регистрационный № NP_054862.1) (hPD-L1-his) был экспрессирован в клетках 293 человека (HEK293). Вкратце, для трансфекции использовали кодирующую область гена PD-L1 человека от Phe19 до Arg238 с 6×his-меткой на C-конце. Супернатант очищали с использованием аффинной колонки для His-метки. Полученный очищенный белок был охарактеризован методом электрофореза в SDS-полиакриламидном геле. Данный белок был приобретен у компании ACRObiosystems (PD1-H5229).
Белок PD-L1/CD274 человека с C-Fc меткой: Рекомбинантный белок PD-L1/CD274 человека (регистрационный № NP_054862.1) с C-Fc меткой (hPD-L1-Fc) был экспрессирован в клетках 293 человека (HEK293). Вкратце, для трансфекции использовали кодирующую область гена PD-L1 человека от Phe19 до Arg238, слитую с Fc-фрагментом IgG1 человека на C-конце. Супернатант очищали с использованием аффинной колонки для Fc-метки. Полученный очищенный белок был охарактеризован методом электрофореза в SDS-полиакриламидном геле. Данный белок был приобретен у компании ACRObiosystems (PD1-H5258).
Белок PD-L1/CD274 мыши: Рекомбинантный белок PD-L1/CD274 мыши (mPD-L1-his), Phe19-Arg238, (регистрационный № NP_068693) был слит с 6×his-меткой на C-конце и продуцирован в клетках 293 человека (HEK293). Супернатант от клеток HEK293 после трансфекции очищали с использованием аффинной колонки для His-метки. Полученный очищенный белок был охарактеризован методом электрофореза в SDS-полиакриламидном геле. Данный белок был приобретен у компании ACRObiosystems (PD1-M5220).
Белок PD-L1/CD274 мыши с C-Fc меткой: Рекомбинантный белок PD-L1/CD274 мыши (mPD-L1-Fc), Phe19-Arg238, (регистрационный № NP_068693) с C-Fc меткой был слит с Fc-фрагментом IgG1 человека на C-конце и продуцирован в клетках 293 человека (HEK293). Супернатант от клеток HEK293 после трансфекции очищали с использованием аффинной колонки для Fc-метки. Полученный очищенный белок был охарактеризован методом электрофореза в SDS-полиакриламидном геле. Данный белок был приобретен у компании ACRObiosystems (PD1-M5251).
Белок PD-L1/CD274 яванского макака с His-меткой: Рекомбинантный белок PD-L1/CD274 яванского макака (cPD-L1-His), Phe19-Arg238, (регистрационный № F6VEW6) был слит с полигистидиновой меткой на C-конце и продуцирован в клетках 293 человека (HEK293). Супернатант от клеток HEK293 после трансфекции очищали с использованием аффинной колонки для His-метки. Полученный очищенный белок был охарактеризован методом электрофореза в SDS-полиакриламидном геле. Данный белок был приобретен у компании ACRObiosystems (PD1-C52H4).
Белок PD-L1/CD274 яванского макака с C-Fc меткой: Рекомбинантный белок PD-L1/CD274 яванского макака (cynoPD-L1-Fc), Phe19-Arg238, (регистрационный № F6VEW6) с C-Fc меткой был слит с Fc-фрагментом IgG1 человека на C-конце и продуцирован в клетках 293 человека (HEK293). Супернатант от клеток HEK293 после трансфекции очищали с использованием аффинной колонки для Fc-метки. Полученный очищенный белок был охарактеризован методом электрофореза в SDS-полиакриламидном геле. Данный белок был приобретен у компании ACRObiosystems (PD1-C5253).
Описанные выше белки PD-L1 использовали в следующих экспериментах.
Пример 2: Получение антител
1. Конъюгация антигена и иммунизация
Для иммунизации рекомбинантный белок hPD-L1-Fc (или mPD-L1-Fc) конъюгировали с разными усиливающими иммунный ответ пептидами MabSpace. Вкратце, 2-8-кратный молярный избыток пептида смешивали с активированным сульфо-SMCC (сульфосукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилатом, Pierce № 22322) белком hPD-L1-Fc и инкубировали в течение одного часа при комнатной температуре. Реакцию останавливали, конъюгированный белок анализировали и проверяли на качество методом электрофореза в SDS-ПАА геле.
Конъюгированные, как описано выше, белки hPD-L1-Fc и mPD-L1-Fc эмульгировали в соотношении 1:1 в полном адъюванте Фрейнда (Pierce), соответственно, и затем подкожно и внутрибрюшинно иммунизировали мышей C57B/L6. Дополнительные иммунизации проводили с использованием CpG и квасцов для сохранения естественной конформации белка. Иммунизацию проводили по меньшей мере раз в 2 недели и антисыворотку от мышей собирали после 1-й иммунизации для анализа титров анти-PD-L1 антител методом ELISA. Для определения титра сыворотки 20 мкл мышиной сыворотки получали от каждой иммунизированной мыши. Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим PD-L1-his мыши или человека с концентрацией 1 мкг/мл в буфере для нанесения с высоким значением pH (0,16% Na2CO3, 0,3% NaHCO3, pH 9,8). Планшеты инкубировали в течение ночи при 4°C, а затем один раз промывали на устройстве для автоматического промывания планшетов, используя промывочный буфер PBS+0,1% Tween 20 (Sigma). 200 мкл блокирующего буфера (PBS+1% БСА+1% козьей сыворотки+0,05% Tween 20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. Затем блокирующий буфер аспирировали, 100 мкл сыворотки, серийно разведенной в буфере для разведения (PBS+1% БСА+1% козьей сыворотки+0,01% Tween 20), переносили в каждую лунку планшета для ELISA и оставляли для инкубации на 60 мин при комнатной температуре. Затем планшеты промывали 3 раза методом, описанным выше. В каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против Fc мыши (Abcam), разведенного в буфере для разведения. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, после чего планшеты промывали 3 раза по 250 мкл/лунку промывочным буфером. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ.
2. Слияния
За четыре дня до слияния каждой мыши выполняли внутрибрюшинную бустерную инъекцию не конъюгированного белка hPD-L1-Fc и mPD-L1-Fc в PBS. В день слияния селезенки мышей асептически удаляли и из этих органов получали одноклеточную суспензию. Эритроциты лизировали и спленоциты промывали средой DMEM (Gibco). Жизнеспособные клетки миеломы в логарифмической фазе роста (SP2/0) смешивали с мышиными спленоцитами в соотношении 1:4. Затем клетки промывали 2 раза перед слиянием с ПЭГ. Клетки после слияния промывали DMEM и суспендировали в среде для роста клеток с добавлением 10% ЭБС+HFCS+OPI+1X HAT. Эту клеточную суспензию в объеме 200 мкл на лунку вносили в 96-луночные планшеты для культивирования клеток и инкубировали в течение ночи при 37°C в инкубаторе с увлажненной атмосферой, содержащей 10% CO2. Культуры инкубировали в течение 7 дней, а затем ростовую среду аспирировали из лунок и заменяли на свежую ростовую среду. Скрининг супернатантов гибридом начинали через 2-3 дня после смены среды.
Пример 2: Скрининг антител
1. Скрининг на PD-L1-связывающие антитела в анализе ELISA
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим hPD-L1-his или mPD-L1-his с концентрацией 0,5 мкг/мл в буфере для нанесения с высоким значением pH, и инкубировали в течение ночи при 4°C. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер (PBS+0,1% Tween 20 (Sigma)). 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. 100 мкл супернатанта гибридом переносили в каждую лунку планшета для ELISA и оставляли для инкубации на 60 мин при комнатной температуре. Затем планшеты промывали 3 раза методом, описанным выше. В каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против Fc мыши (Abcam), разведенного в блокирующем растворе. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, после чего планшеты промывали 3 раза по 250 мкл/лунку промывочным буфером. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ. Клетки из лунок с гибридомами, положительными в анализе ELISA, впоследствии наращивали в среде для культивирования клеток для дальнейших исследований.
2. Оценка блокирующей активности супернатантов гибридом в ингибировании связывания PD-1 с PD-L1 в анализе ELISA
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим hPD-L1-Fc (Acrobiosystems, каталожный № PD1-H5258) с концентрацией 2 мкг/мл в буфере для нанесения с высоким значением pH, и инкубировали в течение ночи при 4°C. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер (PBS +0,1% Tween 20 (Sigma)). 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. 100 мкл супернатанта гибридом переносили в каждую лунку планшета для ELISA и оставляли для инкубации на 60 мин при комнатной температуре. Затем планшеты промывали 3 раза методом, описанным выше. 80 мкл hPD-1-his (ACRObiosystems, каталожный № PD1-H5221) с концентрацией 1 мкг/мл в буфере для разведения добавляли в каждую лунку. Затем в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного анти-his антитела (разведение 1:4000, CWBIO, каталожный № CW0285), разведенного в блокирующем растворе. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, затем планшеты промывали 3 раза промывочным буфером по 250 мкл/лунку. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ. Клетки из лунок с гибридомами, положительными в анализе ELISA, впоследствии наращивали в среде для культивирования клеток для дальнейших исследований (смотри Фигуры 1A-C).
3. Оценка блокирующей активности супернатанта гибридом в ингибировании связывания PD-1 с PD-L1 на клетках опухолей в FACS-анализе
Стимулированные IFN-γ (500 Ед/мл в течение 2 дней) клетки HCC827 в логарифмической фазе роста собирали и ресуспендировали в блокирующем буфере (5% БСА+PBS). 2×105 клеток добавляли в каждую пробирку и затем промывали один раз PBS (1500 об/мин, 5 мин, RT). В соответствующие пробирки добавляли по 100 мкл/пробирку супернатанты гибридом в блокирующем буфере и инкубировали при 4°C в течение 1 часа. Затем клетки дважды промывали по 1 мл PBS, с последующим добавлением по 100 мкл/пробирку биотинилированного hPD-1-Fc-N297A (ACRObiosystems) в концентрации 3 мкг/мл и инкубацией при 4°C в течение 1 часа. После трехкратного промывания PBS в каждую пробирку добавляли по 100 мкл/пробирку стрептавидин-PE (EBiosciences), разведенный 1:200 в блокирующем буфере. Клетки инкубировали при 4°C в течение 1 часа и затем дважды промывали PBS, с последующим ресуспендированием клеток в 150 мкл PBS для каждого образца. Затем клетки переносили в пробирки для FACS-анализа, и связывание антител с клетками обнаруживали методом проточной цитометрии (ACEA Bioscience Novocyte).
4. Скрининг на pH-зависимое связывание PD-L1 методом ELISA
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим hPD-L1-his с концентрацией 0,5 мкг/мл в буфере для нанесения с высоким значением pH, и инкубировали в течение ночи при 4°C. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер PBS+0,1% Tween 20 (Sigma). 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. 100 мкл супернатанта гибридом переносили в каждую лунку планшета для ELISA и оставляли для инкубации на 60 мин при комнатной температуре, либо при pH 7,4, либо при pH 6,0. Планшеты промывали 3 раза методом, описанным выше, используя буфер либо с pH 7,4, либо с pH 6,0. Затем в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против Fc мыши (Abcam), разведенного в блокирующем растворе с pH 7,4. Планшеты для ELISA оставляли для инкубации на 60 мин при RT и затем планшеты промывали 3 раза по 200 мкл/лунку промывочным буфером либо с pH 7,4, либо с pH 6,0. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ. Клетки из лунок с гибридомами, положительными в анализе ELISA, впоследствии наращивали в среде для культивирования клеток для дальнейших исследований. Показаны результаты для клона 23A11 (Фигура 2A) и клона 23F11 (Фигура 2B).
Пример 3: Субклонирование положительных клонов гибридом и мелкомасштабное производство антител
1. Субклонирование положительных клонов гибридом
Клетки из лунок с гибридомами, положительными в анализе ELISA, с желательным профилем связывания и блокирующей активностью выбирали и отдельно высевали, используя метод серийных разведений, в 96-луночные планшеты. Эти клетки оставляли расти в течение 7 дней. После достижения необходимой клеточной массы, супернатант из каждой лунки собирали и проводили повторный скрининг на антигенсвязывающую способность (смотри скрининг в примере 2).
В каждом 96-луночном планшете идентифицировали клоны с максимальной антигенсвязывающей активностью и переносили для наращивания, используя метод серийных разведений, в следующие 96-луночные планшеты, содержащие по 200 мкл на лунку ростовую среду для гибридом. Через 7 дней клетки из 96-луночных планшетов тестировали на связывание антигена. Субклонирование проводили более 2 раз. Когда более 90 лунок демонстрировали положительный сигнал связывания, идентифицировали два клона с наивысшей антигенсвязывающей активностью, переносили в 24-луночные планшеты со средой и оставляли для роста еще в течение 2 дней. После достижения конфлюэнтности в лунках 24-луночных планшетов клетки переносили в 6-луночные планшеты. Через 5 дней инкубации часть клеток замораживали. Остальные клетки переносили в колбу и оставляли для размножения. После достижения конфлюэнтности в колбах половину клеток замораживали (3 флакона на клон) для создания дополнительного резерва. Остальную половину оставляли для дальнейшего размножения в колбах со средой для продуцирования антител. Изотипы антител определяли стандартными методами.
2. Мелкомасштабное производство антител
Клетки гибридом инокулировали во вращающиеся флаконы и культивировали в течение 14 дней в 200-300 мл среды для культивирования гибридом (Invitrogen). Анти-PD-L1 моноклональные антитела (мАт) очищали из клеточной культуры гибридом следующим образом. Все стадии очистки проводили при комнатной температуре. Для очистки разных мАт использовали одну схему очистки и аффинную хроматографию.
Культуральную среду от клеток-хозяев (CCF) центрифугировали для удаления клеточного детрита. Затем супернатант CCF фильтровали, разбавляли, наносили на среду для хроматографии с белком G в форме колонки для высокоэффективной жидкостной хроматографии с белком G (Bio-Rad) и уравновешивали.
После нанесения колонку с белком G промывали до того момента, когда поглощение при 280 нм проточной жидкости возвращалось к базовой линии. Затем анти-PD-L1 мАт элюировали с колонки глициновым буфером, pH 2,5, и немедленно нейтрализовали добавлением 50 мкл маточного 1 M раствора основания Tris на мл объема элюата. Поглощение при 280 нм элюата контролировали, и фракции, содержащие белок, собирали, получая пул для очистки с белком A.
После очистки анти-PD-L1 мАт переводили в PBS посредством диализа, используя мембраны с 10000 MWCO (Pierce Slide-A-Lyzer или диализные трубки). После формулирования анти-PD-L1 мАт фильтровали.
Пример 4: Анализ очищенного PD-L1-связывающего антитела
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим hPD-L1-his с концентрацией 0,5 мкг/мл в буфере для нанесения с высоким значением pH, и инкубировали в течение ночи при 4°C. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер (PBS+0,1% Tween 20 (Sigma)). 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. Затем добавляли очищенные антитела, серийно разведенные в буфере для разведения (PBS+1% БСА+1% нормальной козьей сыворотки+0,01% Tween-20), и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза методом, описанным выше. Затем в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против Fc мыши (Abcam) в буфере для разведения. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, а затем планшеты промывали 3 раза по 250 мкл/лунку промывочным буфером. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуру 3).
Пример 5: Оценка блокирующей активности очищенных антител в ингибировании связывания PD-1 с PD-L1
1. Оценка методом ELISA
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим hPD-L1-Fc с концентрацией 0,5 мкг/мл, в течение ночи при 4°C. Затем промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер PBS+0,1% Tween 20 (Sigma). 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. Затем добавляли антитела (в концентрации от 10 мкг/мл до 0,0006 мкг/мл), серийно разведенные буфером для разведения (PBS+1% БСА+1% нормальной козьей сыворотки+0,01% Tween-20), и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза методом, описанным выше. Добавляли биотинилированный hPD-1-Fc-N297A (ACRObiosystems) в концентрации 1 мкг/мл и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза и в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного нейтравидина (Pierce) в буфере для разведения. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, затем промывали 3 раза по 250 мкл/лунку промывочным буфером. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуру 4A). BM-GT представляет собой эталонное антитело (MPDL-3280A), раскрытое в патенте США № 8217849.
2. Оценка на клетках опухоли методом FACS
Стимулированные IFN-γ (500 Ед/мл в течение 2 дней) клетки HCC827 в логарифмической фазе роста собирали и ресуспендировали в блокирующем буфере (5% БСА+PBS). 2×105 клеток добавляли в каждую пробирку и затем промывали один раз PBS (1500 об/мин, 5 мин, RT). В соответствующие пробирки добавляли по 100 мкл/пробирку разведенные в блокирующем буфере антитела до конечной концентрации 10 мкг/мл и инкубировали при 4°C в течение 1 часа. Затем клетки дважды промывали по 1 мл PBS, с последующим добавлением по 100 мкл/пробирку биотинилированного hPD-1-Fc-N297A (ACRObiosystems) в концентрации 3 мкг/мл и инкубацией при 4°C в течение 1 часа. После трехкратного промывания PBS в каждую пробирку добавляли по 100 мкл/пробирку стрептавидин-PE (EBiosciences), разведенный 1:200 в блокирующем буфере. Клетки инкубировали при 4°C в течение 1 часа и затем дважды промывали PBS, с последующим ресуспендированием клеток в 150 мкл PBS для каждого образца. Затем клетки переносили в пробирки для FACS-анализа, и связывание антител с клетками обнаруживали методом проточной цитометрии (ACEA Bioscience Novocyte) (смотри Фигуру 4B).
Пример 6: Дозозависимый ответ очищенных антител против PD-L1
1. Дозозависимый ответ в виде связывания очищенных антител против PD-L1 с HCC827, измеренный методом FACS
Стимулированные IFN-γ (500 Ед/мл в течение 2 дней) клетки HCC827 в логарифмической фазе роста собирали и ресуспендировали в блокирующем буфере (5% БСА+PBS). 2×105 клеток добавляли в каждую пробирку и затем промывали один раз PBS (1500 об/мин, 5 мин, RT). В соответствующие пробирки добавляли по 100 мкл/пробирку антитела против PD-L1, очищенные из супернатанта гибридом, серийно разведенные в блокирующем буфере, и инкубировали при 4°C в течение 1 часа. Затем клетки дважды промывали по 1 мл PBS, с последующим добавлением по 100 мкл/пробирку 2-го антитела (разведенное 1:400 анти-mIgG (H+L)-PE, Cell signaling) в блокирующем буфере. Клетки инкубировали при 4°C в течение 1 часа и затем дважды промывали PBS, с последующим ресуспендированием клеток в 150 мкл PBS для каждого образца. Затем клетки переносили в пробирки для FACS-анализа, и связывание антител с клетками обнаруживали методом проточной цитометрии (BD Accuri C6) (смотри Фигуру 5A).
2. Дозозависимая активность очищенных антител против PD-L1 в блокировании связывания hPD-1 с hPD-L1 на HCC827, измеренная методом FACS
Стимулированные IFN-γ (500 Ед/мл в течение 2 дней) клетки HCC827 в логарифмической фазе роста собирали и ресуспендировали в блокирующем буфере (5% БСА+PBS). 2×105 клеток добавляли в каждую пробирку и затем промывали один раз PBS (1500 об/мин, 5 мин, RT). В соответствующие пробирки добавляли по 100 мкл/пробирку антитела против PD-L1, очищенные из супернатанта гибридом, серийно разведенные в блокирующем буфере, и инкубировали при 4°C в течение 1 часа. Затем клетки дважды промывали по 1 мл PBS, с последующим добавлением по 100 мкл/пробирку биотинилированного hPD-1-N297A в концентрации 3 мкг/мл и инкубацией при 4°C в течение 1 часа. После трехкратного промывания PBS в каждую пробирку добавляли по 100 мкл/пробирку антитело (антитело кролика против hIgG-PE, Santa Cruz), разведенное 1:200 в блокирующем буфере. Клетки инкубировали при 4°C в течение 1 часа и затем дважды промывали PBS, с последующим ресуспендированием клеток в 150 мкл PBS для каждого образца. Затем клетки переносили в пробирки для FACS-анализа, и связывание антител с клетками обнаруживали методом проточной цитометрии (BD Accuri C6) (смотри Фигуру 5B).
Пример 7: Клонирование и секвенирование гибридомных антител
Последовательности вариабельных областей легкой цепи и тяжелой цепи мышиного антитела против PD-L1 человека определяли методом амплификации в полимеразной цепной реакции (ПЦР), известным как 5' RACE (быстрая амплификация концов кДНК). Суммарную РНК из продуцирующих антитела клеток гибридом 4B6/23A11/23F11/22C9/26F5/21F11/18G4 выделяли с использованием тризола (Invitrogen), и кДНК синтезировали, используя систему Superscript для синтеза первой цепи (Invitrogen) с олиго(дТ)12-18 праймером (Invitrogen). Гены вариабельных областей IgG мыши клонировали методом ПЦР с праймерами MuIgG VH3'-2 и MuIg-5'лидер для вариабельной области тяжелой цепи и праймерами MuIgK VL3'-1 и MuIg-5'лидер для вариабельной области легкой цепи (NOVAGEN). Полученную полосу для каждого антитела клонировали в клонирующий вектор TOPO TA, и ДНК из более чем 10 клонов была передана для секвенирования и определения с использованием инструментов секвенирования ABI DNA (Perkin Elmer). Консенсусные последовательности определяли с использованием программы Vector NTI Advance 10 (Invitrogen).
Получение химерных антител: После секвенирования и подтверждения каждый из вышеуказанных генов вариабельных областей клонировали в рекомбинантный экспрессионный вектор, например, последовательность вариабельной области легкой цепи (VL) клонировали в pCP-hIgG1, и последовательность вариабельной области тяжелой цепи (VH) клонировали в pCP-hIgG1, соответственно, для получения и очистки антител.
Пример 8:Экспрессия и очистка рекомбинантного химерного антитела
Экспрессию и очистку рекомбинантного белка химерного антитела, полученного, как описано выше, проводили следующими способами: клетки HEK293E, культивируемые в среде для экспрессии Freestyle 293 Expression Medium с 10% плюроника F-68 при плотности 1×106 клеток/мл, трансфицировали одинаковыми количествами вектора с ДНК тяжелой цепи и вектора с ДНК легкой цепи в конечной концентрации 0,5 мкг/мл и PEI (полиэтиленимин-линейный, Polyscience) в концентрации 1,0 мкг/мл. Соотношение ДНК и PEI составляло 1:2. Период образования комплексов ДНК и PEI в среде Opti-MEM должен составлять 15 минут при комнатной температуре. Трансфицированные клетки культивировали в колбах в атмосфере с 5% CO2 при 37°C и со скоростью встряхивания 125 об/мин. 1% пептонную среду добавляли через 22-26 часов после трансфекции. Кондиционированную среду собирали в день 6, и супернатант центрифугировали при 3000 об/мин в течение 30 минут. Осветленную кондиционированную среду затем наносили на колонку с белком A (G.E. Healthcare), промывали PBS плюс 0,1% Triton-X100 и, в завершение, связавшиеся IgG элюировали раствором, содержащим 0,1 M глицин, с pH 3,5. Элюированный белок антитела диализовали в PBS и хранили при -80°C. Для удаления эндотоксина очищенный белок дополнительно обрабатывали путем пропускания через колонку с Hitrap DEAE-сефарозой F.F., и полученное антитело анализировали для определения степени чистоты методом эксклюзионной хроматографии (Superdex 200 5/150 GL, G.E. Healthcare).
Пример 9: Перекрестная реактивность очищенных антител против PD-L1 с белком PD-L1 яванского макака и грызунов, и избирательность связывания hPD-L1 в сравнении с hPD-L2
1. Перекрестно-видовое связывание с белками PD-L1 яванского макака
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим PD-L1-his человека или яванского макака (cyno) с концентрацией 0,5 мкг/мл в буфере для нанесения с высоким значением pH, и инкубировали в течение ночи при 4°C. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер (PBS+0,1% Tween 20 (Sigma)). 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. Затем добавляли антитела, серийно разведенные в буфере для разведения (PBS+1% БСА+1% нормальной козьей сыворотки+0,01% Tween-20), и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза методом, описанным выше. Затем в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против Fc мыши (Abcam) в случае мышиных антител из гибридомы, или HRP-конъюгированного антитела козы против IgG Fc человека, предварительно абсорбированного (Abcam), в случае химерного антитела 4B6, в буфере для разведения. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, а затем планшеты промывали 3 раза по 250 мкл/лунку промывочным буфером. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуры 6A-6E).
Химерное антитело 4B6-C имеет аффинность связывания, аналогичную аффинности связывания родительского антитела 4B6. Аффинность связывания 4B6 с антигеном человека и обезьяны аналогична таковой у 4B6-C, как показано на Фигуре 6A, и аффинность связывания 4B6-C с антигеном мыши аналогична таковой у 4B6, как показано на Фигуре 6E.
2. Перекрестно-видовое связывание с белками PD-L1 мыши
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим PD-L1-his мыши с концентрацией 1 мкг/мл в буфере для нанесения с высоким значением pH, и инкубировали в течение ночи при 4°C. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер (PBS+0,1% Tween 20 (Sigma)). 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. Затем добавляли очищенные мышиные антитела из гибридомы с концентрацией 20 мкг/мл в буфере для разведения (PBS+1% БСА+1% нормальной козьей сыворотки+0,01% Tween-20) и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза по 250 мкл/лунку промывочным буфером. Затем в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против Fc мыши (Abcam) в буфере для разведения. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, затем планшеты промывали 3 раза по 250 мкл/лунку промывочным буфером. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуру 6F).
3. Перекрестно-семейное связывание с белком hPD-L2
Связывание очищенных антител (4B6, 23A11, 26F5, 23F11 и 22C9) с белком PD-L2 человека оценивали методом ELISA, аналогично тому, как описано выше для перекрестно-видового связывания. Вкратце, прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим PD-L1 человека-Fc (Acrobiosystems, каталожный № PD1-H5258) с концентрацией 0,5 мкг/мл, или 100 мкл/лунку раствором, содержащим hPD-L2-Fc (Acrobiosystems, каталожный № PD2-H5251) с концентрацией 1 мкг/мл, соответственно, в буфере для нанесения с высоким значением pH (0,16% Na2CO3+0,3% NaHCO3, pH 9,8) и инкубировали в течение ночи при 4°C. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер (PBS+0,1% Tween 20 (Amresco)). 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. Затем добавляли 100 мкл очищенных антител против PD-L1 с концентрацией 2 мкг/мл в буфере для разведения (PBS+1% БСА+1% нормальной козьей сыворотки+0,01% Tween-20) и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза промывочным буфером. Затем в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против IgG мыши (1:20000, Abcam) в буфере для разведения. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, затем планшеты промывали 3 раза по 250 мкл/лунку промывочным буфером. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB на 15 мин и реакцию останавливали, добавляя по 50 мкл/лунку 0,16 M раствор серной кислоты. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуру 6G).
Как показано на Фигуре 6G, все протестированные антитела могут связываться с hPD-L1, но не с hPD-L2.
Пример 10: Характеристика связывания очищенных анти-PD-L1 антител с PD-L1 на клетках опухолей: FACS-анализ связывания (клетки HCC827)
Стимулированные IFN-γ (500 Ед/мл в течение 2 дней) клетки HCC827 в логарифмической фазе роста собирали и ресуспендировали в блокирующем буфере (5% БСА+PBS). 2×105 клеток добавляли в каждую пробирку и затем промывали один раз PBS (1500 об/мин, 5 мин, RT). В соответствующие пробирки добавляли по 100 мкл/пробирку биотинилированные антитела против PD-L1, серийно разведенные в блокирующем буфере, и инкубировали при 4°C в течение 1 часа. Затем клетки дважды промывали по 1 мл PBS, с последующим добавлением по 100 мкл/пробирку 2-го антитела (или антитела кролика против IgG-PE человека (Santa Cruz)), разведенного 1:200 в блокирующем буфере. Клетки инкубировали при 4°C в течение 1 часа, затем дважды промывали PBS, с последующим ресуспендированием клеток в 150 мкл PBS для каждого образца. Затем клетки переносили в пробирки для FACS-анализа, и связывание антител с клетками обнаруживали методом проточной цитометрии (ACEA Bioscience Novocyte) (смотри Фигуру 7). Антитела с буквой «C» представляют собой химерные антитела, и антитело «4B6-H3L3» представляет собой гуманизированное 4B6 с сочетанием H3 тяжелой цепи и L3 легкой цепи, как описано в примере 15.
Пример 11: Оценка блокирующей активности очищенных анти-PD-L1 антител в ингибировании связывания PD-1 с PD-L1 на клетках опухолей
Стимулированные IFN-γ (500 Ед/мл в течение 2 дней) клетки HCC827 в логарифмической фазе роста собирали и ресуспендировали в блокирующем буфере (5% БСА+PBS). 2×105 клеток добавляли в каждую пробирку и затем промывали один раз PBS (1500 об/мин, 5 мин, RT). В соответствующие пробирки добавляли по 100 мкл/пробирку антитела против PD-L1 (смотри Фигуру 8), серийно разведенные в блокирующем буфере, и инкубировали при 4°C в течение 1 часа. Затем клетки дважды промывали по 1 мл PBS, с последующим добавлением по 100 мкл/пробирку биотинилированного hPD-1-N297A в концентрации 3 мкг/мл и инкубацией при 4°C в течение 1 часа. После трехкратного промывания PBS в каждую пробирку добавляли по 100 мкл/пробирку стрептавидин-PE (EBiosciences), разведенный 1:200 в блокирующем буфере. Клетки инкубировали при 4°C в течение 1 часа, затем дважды промывали PBS, с последующим ресуспендированием клеток в 150 мкл PBS для каждого образца. Затем клетки переносили в пробирки для FACS-анализа, и связывание антител с клетками обнаруживали методом проточной цитометрии (ACEA Bioscience Novocyte).
Как показано на Фигуре 8, результаты FACS-анализа продемонстрировали, что анти-PD-L1 антитела обладают зависимой от концентрации активностью ингибирования связывания hPD-1 с hPD-L1 на клетках опухоли HCC827.
Пример 12: Эпитоп-специфическая сортировка выбранных анти-PD-L1 антител в конкурентном анализе ELISA
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим hPD-L1-Fc с концентрацией 0,5 мкг/мл, в течение ночи при 4°C. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер (PBS+0,1% Tween 20 (Sigma)), с последующим добавлением в каждую лунку по 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20). Планшеты инкубировали в течение двух часов при комнатной температуре. Затем добавляли серийно разведенные конкурирующие антитела 4B6, 23A11, 23F11, 22C9 и 21F11 с концентрацией 20 мкг/мл в буфере для разведения (PBS+1% БСА+1% нормальной козьей сыворотки+0,01% Tween-20) и планшеты инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза промывочным буфером. Добавляли биотинилированные анти-PD-L1 антитела (например, 18G4, 23A11, 4B6) в разных концентрациях, приводящих к получению 80% от максимального сигнала связывания, и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза и в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного нейтравидина (Pierce) в буфере для разведения. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, затем промывали 3 раза по 250 мкл/лунку промывочным буфером. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуры 9A-9C).
Пример 13: Характеристика pH-зависимого связывания рекомбинантных химерных антител
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания покрывали по 100 мкл/лунку раствором, содержащим hPD-L1-his (Acrobiosystems) с концентрацией 0,5 мкг/мл в буфере для нанесения с высоким значением pH, и инкубировали в течение ночи при 4°C. Затем покрытые планшеты промывали один раз на устройстве для автоматического промывания планшетов буфером PBS+0,1% Tween 20 (Sigma). 200 мкл блокирующего буфера добавляли в каждую лунку и планшеты инкубировали в течение 2 часов при комнатной температуре. После аспирации блокирующего буфера добавляли химерные антитела, серийно разведенные в буфере для разведения с pH 7,4, и планшеты инкубировали в течение 40 минут при RT. Затем планшеты промывали один раз по 250 мкл/лунку промывочным буфером с pH 7,4 или 5,5, после чего добавляли по 100 мкл буфера для разведения антител с pH 7,4 или pH 5,5 и инкубацию продолжали в течение 2 часов при RT. Планшеты промывали 3 раза по 250 мкл промывочным буфером (встряхивали в течение 10 сек при каждом промывании) и затем в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против Fc человека (Abcam), разведенное 1:20000 в буфере для разведения с pH 7,4, и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза по 250 мкл промывочным буфером (встряхивали в течение 10 сек при каждом промывании). В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуры 10A-F).
Как показано на Фигурах 10A-10F, химерные антитела 23F11, 23A11 и 22C9 (Фигуры 10A-10C) демонстрировали pH-зависимое связывание с hPD-L1 (например, более сильное связывание при pH 7,4, чем при pH 5,5), при этом химерные антитела 21F11, 4B6, 26F5 (Фигуры 10D-10F) демонстрировали не зависимое от pH связывание с hPD-L1 (аналогичная аффинность связывания при pH 5,5/pH 7,4).
Пример 14: Оценка активности in vivo анти-PD-L1 антител
Активность in vivo полученных, как описано выше, анти-PD-L1 антител оценивали с использованием модифицированной мышиной модели ксенотрансплантата сингенной опухоли. Мышам инокулировали подкожно мышиные опухолевые клетки, в которых ген PD-L1 мыши был заменен геном PD-L1 человека, включая мышиную линию клеток MC38 рака толстого кишечника и линию клеток B16 меланомы. Антитела против PD-L1 человека вводили внутрибрюшинной (в/б) инъекцией в дозе 3 мг/кг, 10 мг/кг и/или 30 мг/кг три раза в неделю, или внутривенно в дозах 1, 3 или 10 мг/кг один раз в неделю. Эталонные антитела против PD-L1 BM-GT (то есть, YW243.55.S70 или MPDL3280A, раскрытые в патенте США № 8217149 (Genentech)) и BM-ME (то есть, 2.14H9OP, раскрытое в патенте США №: US8779108) использовали в качестве положительного контроля. Эффект антител на рост опухоли оценивали, когда опухоли в группе введения растворителя достигали объема 1000 мм3. Объем опухоли и массу тела измеряли дважды в неделю, как описано ниже, и эффект антител на рост опухоли рассчитывали, как ингибирование роста опухоли (ИРО) относительно группы введения растворителя.
1. Получение линий мышиных опухолевых клеток, экспрессирующих PD-L1 человека.
Выполняли нокаут эндогенного гена CD274/PD-L1 в линиях мышиных опухолевых клеток (B16 и MC38 приобретали у ATCC, соответственно) с использованием высокоэффективной системы CRISPR/Cas9, недавно разработанной авторами изобретения. Вкратце, были разработаны одиночные направляющие РНК (онРНК) (sgRNA), нацеленные на первый кодирующий экзон мышиного гена CD274/PD-L1, клетки были транфицированы конструктами CRISPR/Cas9+онРНК типа «ударил-убежал» и проведен отбор на клетки с нокаутом. Клетки с полным нокаутом эндогенного гена CD274/PD-L1 идентифицировали FACS-анализом экспрессии на клеточной поверхности CD274/PD-L1 в стационарном состоянии или при стимуляции интерфероном-гамма, и впоследствии подтверждали TA-клонированием и секвенированием целевой геномной области. Для получения линии клеток с заменой на человеческий ген CD274/PD-L1 кодирующую последовательность кДНК CD274/PD-L1 человека клонировали в полученный из FG12 лентивирусный вектор. Затем мышиные клетки с нокаутом CD274/PD-L1 инфицировали лентивирусом, экспрессирующим CD274/PD-L1 человека, и стабильную экспрессию на высоком уровне CD274/PD-L1 человека в созданной линии клеток подтверждали FACS-анализом. Рекомбинантные клетки B16 и MC38 получили названия B16-hPD-L1 KI и MC38-hPD-L1 KI, соответственно.
2. Противоопухолевая активность антител против PD-L1 в нокин модели опухоли B16/человеческий PD-L1
В клетках B16 генно-инженерными методами была проведена замена мышиного гена PD-L1 на человеческий ген PD-L1, и они получили название B16-hPD-L1 KI. Перед исследованием клетки B16-hPD-L1 KI субкультивировали в пределах 5 пассажей до инокуляции мышам. 2×106 клеток/0,2 мл вводили п/к инъекцией каждой из 10 самок мышей C57BL/6 категории SPF. Первую дозу (3 mpk или 10 mpk) антитела (например, BM-GT, 4B6-C и 23A11) вводили инъекцией через день после инъекции клеток опухоли. Размер опухоли измеряли дважды в неделю в двух измерениях при помощи штангенциркуля (INSIZE). Ингибирование роста опухоли (ИРО)% рассчитывали на основании значения, полученного при измерении в день 29. Результаты анализировали с использованием программы Prism GraphPad и выражали в виде среднего значения ± S.E.M. Сравнение между двумя группами проводили с использованием критерия Стьюдента, и разницу считали значимой при P <0,05 (смотри Таблицу 1).
Таблица 1. Дизайн исследования для тестирования противоопухолевой активности антител против PD-L1 в лечении мышиной модели сингенной опухоли B16/hPDL1
неделю*3
неделю*3
неделю*3
неделю*3
неделю*3
неделю*3
неделю*3
3. Противоопухолевая активность антител против PD-L1 в нокин (KI) модели опухоли MC38/человеческий PD-L1
Клетки MC-38, в которых генно-инженерными методами была произведена замена мышиного гена PD-L1 на человеческий ген PD-L1, были названы MC38-hPD-L1 KI. Опухолевые клетки MC38/hPDL1 KI поддерживали in vitro в виде монослойной культуры в среде RPMI 1640 (Thermo Fisher) с добавлением 10% инактивированной нагреванием эмбриональной бычьей сыворотки (ExCell Biology), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (Hyclone) при 37°C в атмосфере с 5% CO2. Опухолевые клетки обычно субкультивировали дважды в неделю путем обработки смесью трипсин-ЭДТА (Hyclone). Клетки в экспоненциальной фазе роста собирали и подсчитывали для проведения инокуляции опухоли. Каждой самке мышей C57BL/6 категории SPF инокулировали 2×106 клеток п/к инъекцией в правый бок. Примерно через 10 дней после инокуляции 40 мышей, имеющих опухоли с объемом примерно 100 мм3, отбирали и случайным образом разделяли на 5 групп (смотри схему в Таблице 2). Затем мышам в/б инъекцией вводили PBS или дозу 10 мг/кг массы тела каждого из очищенных гибридомных мышиных антител 4B6, 23A11, 23F11, 26F5, сформулированных в PBS в концентрации 1 мг/мл. Введение выполняли три раза в неделю на протяжении 4 недель с момента первой инъекции. В конце исследования животных умерщвляли ингаляцией CO2. Размер опухоли измеряли дважды в неделю в двух измерениях при помощи штангенциркуля (INSIZE), и объем, выраженный в мм3, определяли по формуле: V=0,5 a × b2, где a и b представляют собой длинный и короткий диаметры опухоли, соответственно. Результаты анализировали с использованием программы Prism GraphPad и выражали в виде среднего значения ± S.E.M. Сравнение между двумя группами проводили с использованием критерия Стьюдента, и разницу считали значимой при P *<0,05 и **<0,01 (смотри Таблицу 3).
Таблица 2. Дизайн исследования для тестирования противоопухолевой активности антител против PD-L1 в лечении мышиной модели сингенной опухоли MC38/hPDL1
Таблица 3. Объем опухолей
Примечание: a. среднее значение ± SEM, * P <0,05, **P <0,01
Как показано в Таблице 3 и на Фигурах 11A-11C, в конце исследования средний объем опухоли в контрольной группе в 6,7 раз превышал объем в начале эксперимента. У 4/8, 6/8, 7/8 и 7/8 мышей, получавших антитело 4B6, 23A11, 25F5 и 23F11, соответственно, отсутствовала поддающаяся обнаружению опухоль и, таким образом, это можно было считать полным ответом. У 2/8 мышей в группе введения 4B6 имело место уменьшение опухоли на >70% (смотри Фигуру 11B). Эти данные показывают, что эти антитела являются очень сильными ингибиторами роста сформировавшейся опухоли и обладают способностью уничтожать опухоль у большинства мышей.
4. Противоопухолевая активность pH-зависимых антител против PD-L1 в нокин модели опухоли MC38/человеческий PD-L1
Для оценки того, имеют ли pH-зависимые антитела какое-либо преимущество при in vivo ингибировании опухолей, авторы изобретения сравнивали активность одного pH-зависимого антитела 23F11 и одного независимо от pH связывающего антитела 4B6-C (смотри Фигуры 12A и 12B). Эти антитела обладают сильной нейтрализующей активностью и также способны в высоких дозах ингибировать рост опухоли. Для выявления потенциального преимущества pH-зависимых антител авторы изобретения тестировали антитела в низкой дозе: 1 мг/кг при в/б инъекции. Вкратце, каждой самке мышей C57BL/6 категории SPF инокулировали 2×106 клеток (то есть, MC38-hPD-L1 KI) п/к инъекцией в правый бок. Примерно через 10 дней после инокуляции 40 мышей, имеющих опухоли с объемом примерно 200 мм3, отбирали и случайным образом разделяли на 5 групп. Затем мышам в/б инъекцией вводили PBS или дозу 1 мг/кг массы тела каждого из очищенных антител: 4B6-химерного (4B6-C), 23F11, эталонных антител BM-GT (также называемого YW243.55.S70 или MPDL3280A в патенте США №: US 8217149) и BM-ME (также называемого 2.14H9OPT в патенте США №: US 8779108), сформулированных в PBS в концентрации 1 мг/мл. Введение выполняли три раза в неделю на протяжении 3 недель с момента первой инъекции. В конце исследования животных умерщвляли ингаляцией CO2. Размер опухоли измеряли дважды в неделю в двух измерениях при помощи штангенциркуля (INSIZE), и объем, выраженный в мм3, определяли по формуле: V=0,5 a × b2, где a и b представляют собой длинный и короткий диаметры опухоли, соответственно. Результаты анализировали с использованием программы Prism GraphPad и выражали в виде среднего значения ± S.E.M. Сравнение между двумя группами проводили с использованием критерия Стьюдента, и разницу считали значимой при P <0,05.
Данные на Фигурах 12A и 12B показывают, что антитела, обладающие свойством pH-зависимого связывания, ингибировали рост опухолей намного более эффективно, чем антитела, не обладающие свойством pH-зависимого связывания. Лечение антителом 23F11 в дозе 1 мг/кг приводило к полной элиминации опухолей у 3 из 8 мышей, и у 1 из 8 мышей имело место уменьшение объема опухоли более, чем на 70%, в сравнении с группой введения PBS. Введение независимо от pH связывающего антитела 4B6-C приводило к незначительному уменьшению объема опухолей, и каждая мышь имела опухоль большего размера, чем размер в начале исследования. Таким образом, антитело с pH-зависимым связыванием может действовать в более низких дозах, чем независимо от pH связывающие антитела, в ингибировании роста опухолей.
Ингибирование роста опухоли антителом 18G4 (смотри Фигуры 12C и 12D) и 22C9 (смотри Фигуры 12E и 12F) в модели опухоли MC38/человеческий PD-L1 KI также тестировали в случае внутривенной доставки. Вкратце, клетки опухоли MC38/hPD-L1 инокулировали, как описано выше, мышам C57/BL6 и позволяли расти в течение 6 дней. В это время мышей, имеющий средний объем опухоли примерно 120 мм3, отбирали и случайным образом разделяли на группы по 8 мышей в каждой группе. Каждое из тестируемых, очищенных из культур гибридом, антител 18G4 и 22C9 в/в вводили в дозе 1 или 3 мг/кг в равном объеме каждой мыши в день 0 и продолжали введение до дня 25. В конце исследования животных умерщвляли ингаляцией CO2. Размер опухоли измеряли дважды в неделю в двух измерениях при помощи штангенциркуля (INSIZE), и объем, выраженный в мм3, определяли по формуле: V=0,5 a × b2, где a и b представляют собой длинный и короткий диаметры опухоли, соответственно (смотри Таблицу 4 и Фигуры 12C-12F). Результаты регистрировали как частичную регрессию (ЧР) опухоли, если объем опухоли уменьшался до величины <50% от объема опухоли в начале лечения, без уменьшения до неподдающегося измерению размера, или как полную регрессию (ПР), если опухоль не обнаруживали при пальпации (смотри Таблицу 5). Результаты, представленные на Фигурах 12C-12F, анализировали с использованием программы Prism GraphPad и выражали в виде среднего значения ± S.E.M. Сравнение между двумя группами проводили с использованием критерия Стьюдента, и разницу считали значимой при P <0,05. Данные показали, что в дозе 1 или 3 мг/кг антитела 18G4 (смотри Таблицы 4 и 5, и Фигуры 12C и 12D) и 22C9 (смотри Таблицу 4 и 5, и Фигуры 12E и 12F) очень активно ингибировали рост опухолей в идентичных условиях.
Таблица 4. Ингибирование роста опухолей антителами 18G4 и 22C9 в модели сингенной опухоли MC38/hPD-L1
Примечание: *: p <0,05; среднее значение ± SD, n=8
Таблица 5. Регрессия опухолей в день 25
Примечание: ПР: Полная регрессия; ЧР: Частичная регрессия; ЧОО: Частота объективных ответов.
5. Противоопухолевая активность химерных pH-зависимых антител против PD-L1 в нокин модели опухоли MC38/человеческий PD-L1
Для дополнительного подтверждения того, что антитела с pH-зависимой антигенсвязывающей способностью могут ингибировать рост опухолей in vivo лучше, чем антитела без pH-зависимой антигенсвязывающей способности, и исключить потенциальный вклад Fc-домена, авторы изобретения повторно тестировали химерные антитела (то есть, 23A11-C и 23F11-C), полученные с тем же изотипом IgG (то есть, IgG1 человека), что и эталонные антитела, в клетках HEK293 (то есть, BM-GT).
Вкратце, клетки MC38/hPD-L1 KI были инокулированы и начато введение антител в дозе 1 мг/кг в/б инъекцией, когда объем опухоли достиг 100 мм3, и антитела вводили в/б инъекцией три раза в неделю. Результаты анализировали с использованием программы Prism GraphPad и выражали в виде среднего значения ± S.E.M. Сравнение между двумя группами (тестируемой и группой введения растворителя) проводили с использованием критерия Стьюдента, и разницу считали значимой при P <0,05.
Как показано на Фигурах 13A и 13B, объем опухоли у мышей с опухолью MC38/человеческий PD-L1, которым вводили химерные pH-зависимые антитела (то есть, 23A11-C и 23F11-C) в дозе 1 mpk, был меньше, чем объем у животных, которым вводили эталонное антитело (то есть, BM-GT) в дозе 1 mpk.
Пример 15: Получение и характеризация гуманизированных антител
1. Получение, экспрессия и очистка гуманизированных антител
Последовательности вариабельных доменов мышиных антител 4B6, 23A11 и 23F11 использовали для идентификации последовательности зародышей линии, имеющей максимальную гомологию с последовательностью каркаса мышиных антител. Использовали компьютерное моделирование для проектирования гуманизированных вариантов с пересаженными областями CDR и обратной мутацией.
4B6
Человеческую каркасную последовательность зародышей линии VK/1D-13 для легкой цепи и VH/1-2 для тяжелой цепи использовали для пересадки CDR, соответственно.
Варианты 3 и 4 тяжелой цепи (HC) получали путем прямой пересадки трех областей CDR на последовательность зародышей линии (SEQ ID NO: 87) и обратной мутации остатков K12V, T28V, V68A, R72V, T74K, S77R для HC варианта 3 (SEQ ID NO: 65) и T28V, R72V, S77R для HC варианта 4 (SEQ ID NO: 67), соответственно, (смотри Фигуру 14A).
Последовательность зародышей линии для 4B6 HC:
VH/1-2(4B6-зародышей линии, SEQ ID NO: 87):
QVQLVQSGAEVKKPGASVKVSCKASGYTFTGYYMHWVRQAPGQGLEWMGWINPNSGGTNYAQKFQGRVTMTRDTSISTAYMELSRLRSDDTAVYYCAR
VH/1-2 вариант 3 (4B6-Hzd-HC-V3, SEQ ID NO: 65):
QVQLVQSGAEVVKPGASVKISCKASGYVFTDYYMNWVKQAPGQGLEWIGDINPNNGGTSYNQKFQGRATVTVDKSTRTAYMELSRLRSDDTAVYYCVKWGDGPFAYWGQGTLVTVSS
VH/1-2 вариант 4 (4B6-HC-V4, SEQ ID NO: 67):
QVQLVQSGAEVKKPGASVKVSCKASGYVFTDYYMNWVRQAPGQGLEWIGDINPNNGGTSYNQKFQGRVTVTVDTSIRTAYMELSRLRSDDTAVYYCVKWGDGPFAYWGQGTLVTVSS
Варианты 3 и 4 легкой цепи (LC) получали путем прямой пересадки трех областей CDR на последовательность зародышей линии (SEQ ID NO: 88) и обратной мутации остатков L4M, P8Q, L78M, Y87F для LC варианта 3 (SEQ ID NO: 66) и L4M, Y87F для LC варианта 4 (SEQ ID NO: 68), соответственно, (смотри Фигуру 14B).
Последовательность зародышей линии для 4B6 LC:
VK/1D-13 (4B6 LC зародышей линии, SEQ ID NO: 88)
DIQLTQSPSSLSASVGDRVTITCRASQGISSALAWYQQKPGKAPKLLIYDASSLESGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQFNNYP
VK/1D-13 вариант 3 (4B6-Hzd-LC-V3, SEQ ID NO: 66)
DIQMTQSQSSLSASVGDRVTITCQASQNVGAAVAWYQQKPGKAPKLLIYSASNRYTGVPSRFSGSGSGTDFTLTISSMQPEDIATYFCQQYSNYPTFGSGTKLGIK
VK/1D-13 вариант 4 (4B6-LC-V4, SEQ ID NO: 68)
DIQMTQSPSSLSASVGDRVTITCQASQNVGAAVAWYQQKPGKAPKLLIYSASNLYTGVPSRFSGSGSGTDFTLTISSLQPEDIATYFCQQYSNYPTFGSGTKLGIK
23A11
Человеческую каркасную последовательность зародышей линии VH/1-2 для тяжелой цепи и VK/7-3 для легкой цепи использовали для пересадки CDR, соответственно.
Варианты 3 и 5 тяжелой цепи (HC) получали путем прямой пересадки трех областей CDR на последовательность зародышей линии (SEQ ID NO: 89) и обратной мутации остатков V20L, M48I, V68A, M70L, R72V, T75K, R87T для HC варианта 3 (SEQ ID NO: 71) и M48I, M70L, R72V для HC варианта 5 (SEQ ID NO: 189, первая аминокислота L в SEQ ID NO: 69 превращена в Q), соответственно, (смотри Фигуру 15A).
Последовательность зародышей линии для 23A11 HC:
VH/1-2(23A11-HC-зародышей линии, SEQ ID NO: 89):
QVQLVQSGAEVKKPGASVKVSCKASGYTFTGYYMHWVRQAPGQGLEWMGWINPNSGGTNYAQKFQGRVTMTRDTSISTAYMELSRLRSDDTAVYYCAR
VH/1-2 вариант 3 (23A11-HC-V3, SEQ ID NO: 61):
QVQLVQSGAEVKKPGASVKLSCKASGYIFTTYWIHWVKQRPGQGLEWIGMIQPNSGGTKYNDQFKNRATLTVDKSISTAYMELSRLTSDDTAVYYCARGAGTVDYFDYWGQGTTLSISS
VH/1-2 вариант 5 (23A11-HC-V5, SEQ ID NO: 189):
QVQLVQSGAEVKKPGASVKVSCKASGYIFTTYWIHWVRQAPGQGLEWIGMIQPNSGGTKYNDQFKNRVTLTVDTSISTAYMELSRLRSDDTAVYYCARGAGTVDYFDYWGQGTTLSISS
Варианты 3 и 5 легкой цепи получали путем прямой пересадки трех областей CDR на последовательность зародышей линии (SEQ ID NO: 90) и обратной мутации остатков P15V, P47S, Q54R, V62I, G72R, N89T, L93H для HC варианта 3 (SEQ ID NO: 72) и P15V, P47A, Q54R, V62I, G72R, N89T, L93Q для HC варианта 5 (SEQ ID NO: 70), соответственно, (смотри Фигуру 15B).
Последовательность зародышей линии для 23A11 LC
VK/7-3 (23A11-LC-зародышей линии, SEQ ID NO: 90):
DIVLTQSPASLAVSPGQRATITCRASESVSELGINLIHWYQQKPGQPPKLLIYQASNKDTGVPARFSGSGSGTDFTLTINPVEANDTANYYCLQSKNFP
VK/7-3 вариант 3 (23A11-LC-V3, SEQ ID NO: 72):
DIVLTQSPASLAVSVGQRATITCRASESVDIYGNSFMHWYQQKPGQSPKLLIYRASNLESGIPARFSGSGSRTDFTLTINPVEANDTATYYCHQSNDDPYTFGGGTKLETK
VK/7-3 вариант 5 (23A11-LC-V5, SEQ ID NO: 70):
DIVLTQSPASLAVSVGQRATITCRASESVDIYGNSFMHWYQQKPGQAPKLLIYRASNLESGIPARFSGSGSRTDFTLTINPVEANDTATYYCQQSNDDPYTFGGGTKLETK
23F11
Человеческую каркасную последовательность зародышей линии VH/1-2 для тяжелой цепи и VK/7-3 для легкой цепи использовали для пересадки CDR, соответственно.
Варианты 4 и 6 тяжелой цепи (HC) получали путем прямой пересадки трех областей CDR на последовательность зародышей линии (SEQ ID NO: 91) и обратной мутации остатков V20L, M48I, R67K, V68A, M70L, R72V, T74K, R87T для HC варианта 4 (SEQ ID NO: 75) и M48I, R67K, V68A, M70L, R72V для HC варианта 6 (SEQ ID NO: 77), соответственно, (смотри Фигуру 16A).
Последовательность зародышей линии для 23F11 HC:
VH/1-2 (23F11 зародышей линии HC, SEQ ID NO: 91):
VQLVQSGAEVKKPGASVKVSCKASGYTFTGYYMHWVRQAPGQGLEWMGWINPNSGGTNYAQKFQGRVTMTRDTSISTAYMELSRLRSDDTAVYYCAR
VH/1-2 вариант 4 (23F11-HC-V4, SEQ ID NO: 75):
QVQLVQSGAEVKKPGASVKLSCKASGYIFTTYWMHWVKQRPGQGLEWIGMIQPNSGGTKYNEKFKKKATLTVDKSISTAYMELSRLTSDDTAVYYCARGAGTVDYFDYWGQGSTLTVSS
VH/1-2 вариант 6 (23F11-HC-V6, SEQ ID NO: 77):
QVQLVQSGAEVKKPGASVKVSCKASGYIFTTYWMHWVRQAPGQGLEWIGMIQPNSGGTKYNEKFKKKATLTVDTSISTAYMELSRLRSDDTAVYYCARGAGTVDYFDYWGQGSTLTVSS
Варианты 4 и 6 легкой цепи получали путем прямой пересадки трех областей CDR на последовательность зародышей линии (SEQ ID NO: 92) и обратной мутации остатков P15V, Q54R, V62I, N89T, L93Q для LC варианта 4 (SEQ ID NO: 76) и P15V, Q54R, V62I, N89T, L93H для LC варианта 6 (SEQ ID NO: 78), соответственно, (смотри Фигуру 16B).
Последовательность зародышей линии для 23F11 LC
VK/7-3 (23F11 зародышевой линии LC, SEQ ID NO: 92):
DIVLTQSPASLAVSPGQRATITCRASESVSELGINLIHWYQQKPGQPPKLLIYQASNKDTGVPARFSGSGSGTDFTLTINPVEANDTANYYCLQSKNFP
VK/7-3 вариант 4 (23F11-LC-V4, SEQ ID NO: 76):
DIVLTQSPASLAVSVGQRATITCRASESVDIYGNSFMHWYQQKPGQPPKLLIYRASNLESGIPARFSGSGSRTDFTLTINPVEANDTATYYCQQSTEDPYTFGGGTKLEIK
VK/7-3 вариант 6 (23F11-LC-V6, SEQ ID NO: 78):
DIVLTQSPASLAVSVGQRATITCRASESVDIYGNSFMHWYQQKPGQPPKLLIYRASNLESGIPARFSGSGSRTDFTLTINPVEANDTATYYCHQSTEDPYTFGGGTKLEIK
кДНК вышеуказанных тяжелых цепей и легких цепей были синтезированы и слиты с константной областью IgG1 человека с мутацией N297A в Fc-области (нумерация остатков тяжелой цепи, приведенных в настоящем документе, соответствует EU-индексу Kabat (смотри Kabat et al., «Proteins of Immunological Interest», US Dept. of Health & Human Services (1983))) для уменьшения или сведения к минимуму эффекторной функции Fc-области, как хорошо известно в данной области. Гены вариабельных областей тяжелых цепей и легких цепей выбранных антител синтезировали и клонировали в экспрессионный вектор, и крупномасштабное получение ДНК проводили с использованием системы PureYield™ Plasmid Maxiprep System от компании Promega. Трансфекцию выполняли с использованием реагента ExpiFectamine™ 293 от компании Invitrogen в соответствии с протоколом производителя. Супернатанты собирали, когда жизнеспособность клеток составляла примерно 50%. Гранулы с белком A и чистые супернатанты инкубировали при 4°C в течение 2 часов при покачивании перед внесением в колонку. Гранулы с белком A внутри колонки промывали PBS, и 100 мМ глициновый буфер (pH 3,0) использовали для элюции антитела, которое диализовали в PBS буфере (137 мМ NaCl, 2,7 мМ KCl, 10 мМ Na2HPO4, 2 мМ KH2PO4, pH 7,4) в течение ночи при 4°C. В завершение, удаляли эндотоксин с использованием смолы для удаления эндотоксина Pierce High Capacity Endotoxin Removal Resin (Invitrogen, каталожный номер: 88271). Очищенное антитело характеризовали методом SDS-ПААГ и эксклюзионной ВЭЖХ.
2. Связывание гуманизированных антител с hPD-L1 в анализе ELISA
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим PD-L1-his человека (Acrobiosystems, каталожный № PD1-H5229) с концентрацией 0,5 мкг/мл в буфере для нанесения с высоким значением pH, и инкубировали в течение ночи при 4°C. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер PBS+0,1% Tween 20 (Sigma). 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. Добавляли гуманизированные антитела (полученные в клетках 293), серийно разведенные в буфере для разведения (PBS+1% БСА+1% нормальной козьей сыворотки+0,01% Tween-20), и инкубировали в течение 1 часа при RT. Затем планшеты промывали 3 раза промывочным буфером. В каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против Fc человека (Abcam) в буфере для разведения. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, после чего планшеты промывали 3 раза по 200 мкл/лунку промывочным буфером с pH 7,4. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуры 17A и 17B).
3. Блокирование связывания hPD-1 с hPD-L1 в анализе ELISA
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим hPD-L1-Fc с концентрацией 1 мкг/мл, в течение ночи при 4°C. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер (PBS+0,1% Tween 20 (Sigma)). 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20) добавляли в каждую лунку и инкубировали в течение 2 часов при комнатной температуре. Затем добавляли антитела (то есть, гуманизированные 4B6, 23F11, 23A11, полученные в клетках 293, и эталонные антитела BM-GT и BM-ME, также полученные в клетках 293), серийно разведенные в буфере для разведения (PBS+1% БСА+1% нормальной козьей сыворотки+0,01% Tween-20), и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза методом, описанным выше. Добавляли биотинилированный hPD-1-N297A (Acrobiosystem) с концентрацией 1 мкг/мл и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза, затем в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного нейтравидина (Pierce), разведенного 1:5000 в буфере для разведения. Планшеты для ELISA оставляли для инкубации на 60 мин при RT, затем планшеты промывали 3 раза по 250 мкл/лунку промывочным буфером. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуры 18A-18D).
Данные на Фигурах 18A-18D показывают, что некоторые гуманизированные антитела являются значительно более эффективными, чем другие, в ингибировании связывания PD-L1 человека с PD-1 человека.
4. Связывание анти-hPD-L1 антитела с hPD-L1 на клетках HCC827, измеренное в FACS-анализе
Стимулированные IFN-γ (500 Ед/мл в течение 2 дней) клетки HCC827 в логарифмической фазе роста собирали и ресуспендировали в блокирующем буфере (5% БСА+PBS). 2×105 клеток добавляли в каждую пробирку и затем промывали один раз PBS (1500 об/мин, 5 мин, RT). В соответствующие пробирки добавляли по 100 мкл/пробирку гуманизированные антитела против PD-L1 (полученные в клетках 293), серийно разведенные в блокирующем буфере, и инкубировали при 4°C в течение 1 часа. Затем клетки дважды промывали по 1 мл PBS, с последующим добавлением по 100 мкл/пробирку 2-го антитела (антитело кролика против IgG-PE человека), разведенного 1:200 в блокирующем буфере. Клетки инкубировали при 4°C в течение 1 часа, затем промывали дважды PBS, с последующим ресуспендированием клеток в 150 мкл PBS для каждого образца. Затем клетки переносили в пробирки для FACS-анализа, и связывание антител с клетками обнаруживали методом проточной цитометрии (ACEA Bioscience Novocyte) (смотри Фигуру 19).
5. Блокирование связывания hPD-1 с hPD-L1 на клетках HCC827, измеренное в FACS-анализе
Стимулированные IFN-γ (500 Ед/мл в течение 2 дней) клетки HCC827 в логарифмической фазе роста собирали и ресуспендировали в блокирующем буфере (5% БСА+PBS). 2×105 клеток добавляли в каждую пробирку и затем промывали один раз PBS (1500 об/мин, 5 мин, RT). В соответствующие пробирки добавляли по 100 мкл/пробирку гуманизированные антитела против PD-L1 (антитела, экспрессированные в клетках 293, были названы «старыми», и антитела, полученные в клетках CHO в процессе мелкомасштабного производства для последующих экспериментов, были названы «новыми». То есть, 4B6-H3L4, 4B6-H4L3, 23A11-H3L5 293 и 23F11 H4L4 293 были получены в клетках 293; 23A11-H3L5 CHO и 23F11 H4L4 CHO были получены в клетках CHO), серийно разведенные в блокирующем буфере, и инкубировали при 4°C в течение 1 часа. Затем клетки дважды промывали по 1 мл PBS, с последующим добавлением по 100 мкл/пробирку биотинилированного hPD-1-N297A в концентрации 3 мкг/мл и инкубацией при 4°C в течение 1 часа. После трехкратного промывания PBS в каждую пробирку добавляли по 100 мкл/пробирку стрептавидин-PE, разведенный 1:200 в блокирующем буфере. Клетки инкубировали при 4°C в течение 1 часа и затем дважды промывали PBS, с последующим ресуспендированием клеток в 150 мкл PBS для каждого образца. Затем клетки переносили в пробирки для FACS-анализа, и связывание антител с клетками обнаруживали методом проточной цитометрии (ACEA Bioscience Novocyte) (смотри Фигуры 20A и 20B).
Пример 16: Оценка способности очищенных гуманизированных антител стимулировать активацию T-клеток в реакции смешанной культуры лимфоцитов (СКЛ)
Для оценки способности анти-PD-L1 антител ослаблять опосредованное PD-1/PD-L1 ингибирование активации T-клеток, авторы изобретения проводили анализ реакции смешанной культуры лимфоцитов (СКЛ). В первом эксперименте ДК получали из прикрепляющихся мононуклеарных клеток периферической крови (МКПК), которые были выделены из свежей человеческой крови. МКПК высевали в 6-луночные планшеты при плотности 2×106 клеток/мл в бессывороточной среде. Через 2 часа суспензионные клетки отбрасывали, и прикрепившиеся клетки обрабатывали GM-CSF в концентрации 10 нг/мл и IL-4 в концентрации 30 нг/мл. Среду меняли каждые 3 дня и TNFα в концентрации 20 нг/мл добавляли на 6-й день для созревания ДК. Фенотип ДК определяли методом FACS с использованием анти-CD11c-PE (Biolegend) и анти-HLA-DR-APC (Biolegend) на 7-й день. CD4+ T-клетки выделяли из свежей крови другого донора с использованием набора для обогащения по CD4+ T-клеткам (Stem Cell Inc.). После обработки ДК митомицином C (10 мкг/мл в течение 2 часов), ДК, CD4+ T-клетки и антитела против PD-L1 добавляли по 200 мкл/лунку в соотношении 1:10 ДК:CD4+ T-клетки и инкубировали в течение 5 дней при 37°C в инкубаторе с 5% CO2. Затем IL-2 и IFN-γ в супернатанте определяли с использованием двойного набора для обнаружения IL-2 (R&D) и IFN-γ (Peprotech) (смотри Фигуры 21A и 21B). Пролиферацию T-клеток измеряли с использованием набора для анализа жизнеспособности клеток CellTiter-Glo luminescent cell viability assay kit (Promega).
Во втором эксперименте периферическую кровь собирали, и МКПК выделяли после добавления раствора фиколла (1:1 по объему), с последующим центрифугированием в течение 30 минут. МКПК использовали для выделения моноцитов и T-клеток с использованием CD14-покрытых магнитных гранул и CD4-отрицательных магнитных гранул. Проводили дифференциацию полученных, как описано выше, моноцитов, культивируя их в течение 7 дней в присутствии 500 Ед/мл IL-4 (R&D) и 250 Ед/мл GM-CSF (R&D), с последующим добавлением TNFα (R&D) в концентрации 100 нг/мл и продолжением культивирования в течение 3 дополнительных дней. Полученные, как описано выше, ДК подсчитывали, и 10000 ДК в объеме 100 мкл на лунку смешивали с 100000 T-клеток в объеме 50 мкл; тестируемые антитела или контрольные IgG добавляли в объеме 50 мкл и проводили культивирование в течение пяти дней в двойном повторе, с добавлением или без добавления PD-L1 человека (конечная концентрация 1 мкг/мл). Супернатант собирали, и концентрацию IL-2 и IFNγ определяли методом ELISA (R&D) (смотри Фигуры 21C и 21D).
Пример 17: Оценка аффинности связывания выбранного гуманизированного анти-PD-L1 антитела при помощи Biacore
Сенсорный чип CM5 активировали в каждой проточной ячейке путем 7-минутной инжекции (10 мкл/мин) свежеприготовленной смеси 1:1 50 мМ N-гидроксисукцинимида (NHS): 200 мМ 1-этил-3-(3-диметиламинопропил)-карбодиимида (EDC). Затем антитело против Fc человека (GE Healthcare) в концентрации 10 мкг/мл в 10 мМ ацетатном буфере, pH 5,0, инжектировали на активированный чип со скоростью 10 мкл/мин (проточный буфер HBS-EP: 10 мМ HEPES, 150 мМ NaCl, 3,4 мМ ЭДТА, 0,005% сурфактанта P20, pH 7,4). Оставшиеся активные сайты связывания блокировали пропусканием в течение 7 минут 1M этаноламина со скоростью 10 мкл/мин. Уровень иммобилизации в каждой проточной ячейке составлял ~9000 ЕО. Антитела были захвачены в FC2 с помощью IgG против Fc человека (GE Healthcare) до показателя 200~300 ЕО. FC1 использовали в качестве эталонной ячейки. После захвата антитела инжектировали антиген в различных концентрациях. Время ассоциации для связывания антитела с антигеном составляло 180 с. Условия регенерации поверхности: 120 с со скоростью 10 мкл/мин раствор Gly с pH 1,5. Сигналы, полученные с захваченным антителом, за вычетом сигналов, полученных без захваченного антитела, рассчитывали с использованием оценочной программы Biacore X100 версия 2.0 (Biacore).
Таблица 6. Параметры аффинности связывания антител с антигеном
Известно, что взаимодействие между PD-1 человека/hPD-L1 является слабым и характеризуется величиной KD примерно 7500 ± 2200 нМ (N=6, Cheng X et al., Structure and interactions of the human programmed cell death 1 receptor, J Biol Chem. 2013; 288(17): 11771-85). Таким образом, антитела, полученные авторами изобретения, как показано в Таблице 6, имеют примерно в 100 раз более высокую аффинность, чем PD-1 предшествующего уровня техники, при связывании с hPD-L1.
Пример 18: Оценка pH-зависимого связывания выбранных нейтрализующих гуманизированных антител против PD-L1
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания покрывали по 100 мкл/лунку раствором, содержащим PD-L1-his с концентрацией 0,5 мкг/мл в буфере для нанесения с высоким значением pH, и инкубировали в течение ночи при 4°C. Затем покрытые планшеты промывали один раз на устройстве для автоматического промывания планшетов буфером PBS+0,1% Tween 20 (Sigma). 200 мкл блокирующего буфера добавляли в каждую лунку и планшеты инкубировали в течение 2 часов при комнатной температуре. После аспирации блокирующего буфера добавляли антитела (то есть, 23A11 H3L5, 23F11 H4L4, полученные в клетках CHO или 293), серийно разведенные в буфере для разведения с pH 7,4, и планшеты инкубировали в течение 40 минут при RT. Планшеты промывали один раз по 250 мкл/лунку промывочным буфером с pH 7,4, а затем добавляли по 100 мкл/лунку промывочный буфер с pH 7,4 или pH 5,5 и инкубацию продолжали в течение 2 часов при RT со встряхиванием. Планшеты промывали 3 раза промывочным буфером с pH 7,4 и в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против Fc человека (Abcam) в буфере для разведения с pH 7,4. Планшеты оставляли для инкубации на 60 мин при комнатной температуре, с последующим трехкратным промыванием по 200 мкл/лунку промывочным буфером с pH 7,4. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуры 22A-22E).
Характеризация pH-зависимого связывания hPD-L1 в широком диапазоне значений pH
Аффинность pH-зависимого связывания далее измеряли при разных значениях pH, таких как pH 4, pH 4,5, pH 5,0, pH 5,5, pH 6,0, pH 7,4. Измерения в анализе ELISA выполняли методом, аналогичным методу, описанному выше. Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания покрывали по 100 мкл/лунку раствором, содержащим hPD-L1-his с концентрацией 0,5 мкг/мл в буфере для нанесения с высоким значением pH, и инкубировали в течение ночи при 4°C. Затем покрытые планшеты промывали 3 раза со встряхиванием в течение 10 с на устройстве для автоматического промывания планшетов, используя буфер PBS+0,1% Tween 20 (Amresco). 200 мкл блокирующего буфера (1% БСА (Solarbio)+1% нормальной козьей сыворотки (Solarbio)+0,05% Tween 20 (Amresco)) добавляли в каждую лунку, планшеты инкубировали в течение 2 часов при комнатной температуре и промывали 3 раза, как описано выше. После аспирации блокирующего буфера добавляли 100 мкл антител (то есть, 23A11 H3L5, 23F11 H4L4 и 22C9-C, полученных в клетках 293), серийно разведенных в буфере для разведения (1% БСА (Solarbio)+1% нормальной козьей сыворотки (Solarbio)+0,01% Tween 20 (Amresco)) с pH 7,4, и планшеты инкубировали в течение 40 минут при RT. Затем планшеты промывали один раз по 250 мкл/лунку промывочным буфером с pH 7,4, pH 6,0, pH 5,5, pH 5,0, pH 4,5 или pH 4,0, добавляли по 100 мкл/лунку промывочный буфер с pH 7,4 или pH 5,5 и инкубацию продолжали в течение 2 часов при RT со встряхиванием. Планшеты промывали 3 раза промывочным буфером с pH 7,4 и в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела козы против hIgG (1:20000, Abcam) в буфере для разведения с pH 7,4. Затем планшеты оставляли для инкубации на 60 мин при комнатной температуре, с последующим 3-кратным промыванием по 250 мкл/лунку промывочным буфером с pH 7,4. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB на 15 мин, и реакцию останавливали, добавляя по 50 мкл/лунку 0,16 M раствор H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуры 23A-23F). Измерения выполняли в тройном повторе.
В случае каждого антитела сигнал связывания при низком значении pH был слабее, чем сигнал при pH 7,4. Чем ниже было значение pH, тем слабее был сигнал связывания при конкретной концентрации антитела. При pH 5 сигнал связывания трех антител, протестированных в высокой концентрации, например, 0,1, 0,3 или 1 мкг/мл, составлял менее 50% от их сигнала при pH 7,4; при pH 5,5, сигнал трех протестированных антител составлял менее 75% от их сигнала при pH 7,4.
Пример 18: Эпитоп-специфическая сортировка выбранного анти-PD-L1 антитела методом аланин-сканирующего мутагенеза
1. Получение мутантных рекомбинантных белков PD-L1 человека
кДНК, кодирующую внеклеточный PD-L1 человека (аминокислоты 19-238) и Fc-фрагмент IgG1 человека синтезировали in vitro (SEQ ID NO: 107 представляет собой аминокислотную последовательность, и SEQ ID NO: 108 представляет собой соответствующую последовательность ДНК). Последовательности вариантов PD-L1 человека с одной аминокислотной заменой в определенном положении, приведенные ниже, были амплифицированы методом ПЦР с перекрывающимися праймерами, как описано ниже, с использованием указанных праймеров (Dr.Oligo BLP-192, Biolytic) (Таблица 7). Полученный фрагмент расщепляли ферментами рестрикции Hind III и BamH I на 5' и 3'-концах, соответственно. Затем продукт ПЦР клонировали в вектор pcDNA3.1 (+) методом гомологичной рекомбинации с использованием реагента Syno assembly mix (Synbio) в соответствии с инструкциями производителя. Плазмиду очищали при помощи набора QIAGEN Plasmid Mega Kit (QIAGEN).
Аминокислотная последовательность (SEQ ID NO: 107):
METDTLLLWVLLLWVPGSTGFTVTVPKDLYVVEYGSNMTIECKFPVEKQLDLAALIVYWEMEDKNIIQFVHGEEDLKVQHSSYRQRARLLKDQLSLGNAALQITDVKLQDAGVYRCMISYGGADYKRITVKVNAPYNKINQRILVVDPVTSEHELTCQAEGYPKAEVIWTSSDHQVLSGKTTTTNSKREEKLFNVTSTLRINTTTNEIFYCTFRRLDPEENHTAELVIPELPLAHPPNERENLYFQGAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
Последовательность ДНК (SEQ ID NO: 108):
AAGCTTgccgccaccATGGAAACCGACACTCTGCTGCTGTGGGTGCTGCTGCTGTGGGTGCCAGGGTCAACCGGGTTCACCGTGACAGTGCCCAAGGACCTGTACGTGGTGGAGTACGGCAGCAACATGACCATCGAGTGCAAGTTCCCCGTGGAGAAGCAGCTGGATCTGGCCGCCCTGATCGTGTATTGGGAGATGGAGGACAAGAACATCATCCAGTTCGTGCACGGCGAAGAGGACCTGAAGGTGCAGCACAGCAGCTACAGGCAGAGGGCCAGACTGCTGAAGGACCAGCTGTCTCTGGGAAACGCAGCTCTGCAGATCACCGACGTGAAGCTGCAGGACGCAGGAGTCTACCGCTGCATGATCAGCTACGGCGGAGCCGACTACAAGAGGATCACCGTGAAGGTCAACGCCCCCTACAACAAGATCAACCAGAGAATCCTGGTGGTGGACCCCGTGACCAGCGAGCACGAGCTGACTTGTCAGGCAGAGGGCTACCCCAAGGCCGAAGTGATTTGGACCAGCAGCGACCATCAGGTGCTGAGCGGAAAGACCACCACCACCAACAGCAAGCGGGAGGAGAAGCTGTTCAACGTGACCAGCACCCTGCGGATCAACACCACCACCAACGAGATCTTCTACTGCACCTTCCGGAGACTGGACCCAGAGGAGAACCACACAGCCGAGCTGGTCATCCCAGAACTGCCTCTGGCTCACCCTCCTAACGAGAGAGAGAATCTGTATTTTCAGGGAGCACCAGAACTGCTGGGAGGACCATCCGTGTTCCTGTTTCCACCCAAACCTAAGGACACCCTGATGATTAGCAGAACACCAGAAGTCACTTGCGTGGTCGTGGACGTGTCCCACGAGGACCCCGAAGTCAAATTCAACTGGTACGTGGATGGCGTCGAGGTGCATAATGCTAAGACCAAACCAAGAGAGGAACAGTACAACAGCACCTATAGGGTCGTGTCCGTCCTGACAGTGCTGCACCAGGACTGGCTGAACGGAAAGGAGTATAAATGCAAGGTGTCTAACAAGGCCCTGCCAGCTCCCATCGAGAAGACTATTAGTAAAGCTAAGGGCCAGCCCCGCGAACCTCAGGTGTACACCCTGCCTCCATCCCGAGACGAGCTGACCAAGAACCAGGTCTCTCTGACTTGTCTGGTGAAGGGATTCTATCCATCAGATATCGCAGTGGAGTGGGAAAGCAATGGCCAGCCCGAGAACAATTACAAGACTACCCCCCCTGTGCTGGACTCCGATGGCTCTTTCTTTCTGTATTCTAAACTGACCGTGGATAAGAGTCGGTGGCAGCAGGGGAATGTCTTTTCATGCAGCGTGATGCACGAGGCACTGCACAATCATTACACTCAGAAGTCCCTGTCACTGTCACCTGGAAAGtagGGATCC
С использованием плазмиды для PD-L1 дикого типа, полученной, как описано выше (SEQ ID NOs: 107 и 108), в качестве матрицы, получали два сегмента интегрированной последовательности с мега-праймерами (Таблица 7), и выполняли лигирование методом гомологичной рекомбинации. Затем продукт клонировали в вектор pcDNA3.1 (+); после скрининга отдельных положительных колоний путем секвенирования для идентификации вариантов, было подтверждено, что мутанты PD-L1 были успешно получены. Метод ПЦР и условия описаны ниже:
Таблица 7. Последовательности праймеров для мутантных вариантов
Примечание: ОП-обратный праймер, ПП-прямой праймер
Свыше 20 вариантов были сконструированы другой компанией, Genewiz (Suzhou, China). Методы, аналогичные методам Synbio Tech, были использованы для синтеза вариантов PD-L1. Мега-праймеры, использованные для мутантных сайтов, приведены в Таблице 8.
Таблица 8. Последовательности праймеров для мутантных вариантов
Примечание: ОП - обратный праймер, ПП - прямой праймер
Впоследствии эти плазмиды с мутантными и дикого типа вариантами PD-L1 были трансфицированы в клетки линии 293T (ATCC® CRL3216). Сначала высевали 5×106 клеток 293T в 60-мм чашки, проверяли, чтобы предварительное соотношение составляло 60%~80% для трансфекции. Затем разбавляли 10 мкг ДНК в 400 мкл 1×HBS, инкубировали в течение примерно 5 мин. Добавляли 10 мкл реагента для трансфекции 25 кДа линейного PEI (растворенного в 1×HBS, 1 мг/мл маточный раствор) в вышеуказанную смесь, проверяли, чтобы соотношение ДНК/PEI составляло 1:2,5. Затем смесь по каплям добавляли в чашку с клетками 293T. Через примерно 6-8 часов среду заменяли на полную среду DMEM. Через 72 часа супернатант клеточной культуры собирали, фильтровали через 0,22-мкм фильтр, соответственно, затем хранили при -80°C до использования.
2.Связывание антител против PD-L1 в анализе ELISA
Супернатант использовали для определения связывания антител против PD-L1 в анализе ELISA, как описано ниже.
2.1 Для мышиных Ат:
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим антитело против Fc человека (Abcam) с концентрацией 0,5 мкг/мл в буфере с высоким значением pH, в течение одного часа при комнатной температуре. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер (PBS+0,1% Tween 20 (Sigma)), с последующим добавлением в каждую лунку 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20). Планшеты инкубировали в течение ночи при 4°C. Затем планшеты промывали один раз промывочным буфером и добавляли в каждую лунку 160 мкл супернатанта в DMEM, содержащего различные мутантные белки PD-L1-Fc человека, или раствор белка дикого типа PD-L1-Fc человека в DMEM с концентрацией 500 нг/мл, и инкубировали в течение 1 часа при комнатной температуре. Планшеты промывали 3 раза методом, описанным выше. Добавляли мышиные анти-PD-L1 антитела с концентрацией 0,5 мкг/мл и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза по 200 мкл/лунку промывочным буфером с pH 7,4, затем в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела против IgG мыши (1:20000, Pierce), разведенного в буфере для разведения. Затем планшеты для ELISA оставляли для инкубации на 60 мин при RT, после чего трижды промывали по 200 мкл/лунку промывочным буфером с pH 7,4. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуру 24).
2.2 Для Ат с Fc человека (химерных или гуманизированных антител):
Прозрачные полистирольные 96-луночные планшеты с высокой эффективностью связывания (Nunc) покрывали по 100 мкл/лунку раствором, содержащим в концентрации 0,5 мкг/мл антитело против Fc человека (в случае мышиных антител) или анти-hPD-L1 антитело, которое могло бы сочетаться с другими антителами против PD-L1, в буфере с высоким значением pH на один час при комнатной температуре. Затем планшеты промывали один раз на устройстве для автоматического промывания планшетов, используя промывочный буфер (PBS+0,1% Tween 20 (Sigma)), с последующим добавлением в каждую лунку 200 мкл блокирующего буфера (PBS+1% БСА+1% нормальной козьей сыворотки+0,05% Tween-20). Планшеты инкубировали в течение ночи при 4°C. Затем планшеты промывали один раз промывочным буфером, добавляли в каждую лунку 160 мкл супернатанта в DMEM, содержащего различные мутантные белки PD-L1-Fc человека, или раствор белка дикого типа PD-L1-Fc человека в DMEM с концентрацией 500 нг/мл, и инкубировали в течение 1 часа при комнатной температуре. Планшеты промывали 3 раза методом, описанным выше. Добавляли биотинилированные гуманизированные анти-PD-L1 антитела (23F11-H4L4-bio и 23A11-H3L5-bio), полученные, как описано выше, или белок PD-1 с концентрацией 0,5 мкг/мл и инкубировали в течение 1 часа при RT. Планшеты промывали 3 раза по 200 мкл/лунку промывочным буфером с pH 7,4, затем в каждую лунку планшета добавляли по 100 мкл/лунку раствор HRP-конъюгированного антитела против Fc мыши (Abcam) или HRP-конъюгированного нейтравидина (1:5000, Pierce), разведенные в буфере для разведения. Затем планшеты для ELISA оставляли для инкубации на 60 мин при комнатной температуре, после чего трижды промывали по 200 мкл/лунку промывочным буфером с pH 7,4. В завершение, в каждую лунку добавляли по 100 мкл/лунку TMB, и реакцию останавливали 0,64 M раствором H2SO4. Планшеты просчитывали на приборе Thermo Multiscan FC при длине волны 450 нМ (смотри Фигуру 24).
В Таблице 9 приведена обобщенная информация по ключевым остаткам на hPD-L1, которые необходимы для связывания каждого отдельного протестированного антитела с PD-L1 человека в анализе ELISA. Отмечены мутации аминокислотных остатков на белках PD-L1 человека, которые приводят к значительно сниженному сигналу связывания в сравнении с сигналом для белка дикого типа.
Таблица 9. Сводная таблица ключевых остатков на hPD-L1 для связывания каждого антитела
Данные в Таблице 9 показывают, что антитела, обладающие свойством pH-зависимого связывания, используют больше указанных аминокислот при связывании с PD-L1 человека.
R125 и S80 являются важными для связывания PD-1 с антителами обоих типов против PD-L1 (например, pH-зависимыми и pH-независимыми), при этом о важности S80 для связывания настоящих антител против PD-L1, предложенных в настоящем документе, ранее не сообщалось.
E58 и R113 являются более важными для 22C9, 23A11, 23F11 и их гуманизированных вариантов в сравнении с антителами, отличающимися pH-независимым связыванием (включая эталонные антитела, такие как BM-ME), при этом E58 является новым сайтом, обнаруженным в анализе, проведенном авторами изобретения, для антител 22C9, 23A11, 23F11, который не был обнаружен ранее, поскольку он не важен для связывания PD-1 с PD-L1).
M115 и K124 являются уникальными для 22C9, однако известно, что эти два остатка важны для связывания PD-1 с PD-L1.
N63 и Y81 являются уникальными для 23F11 и его гуманизированного варианта 23F11, а также гуманизированного 23A11 (но не 23A11), при том, что они не важны для связывания PD-1 с PD-L1 и также не важны для связывания эталонных антител с hPD-L1, таким образом, они являются новыми сайтами.
I64 является уникальным для 23F11 и его гуманизированного варианта, и ранее не было известно о его важности для связывания PD-1 с PD-L1.
K62 является уникальным для гуманизированного варианта 23A11, и ранее не было известно о его важности для связывания PD-1 с PD-L1.
Y123 является наиболее важным для 4B6 и эталонных антител, но менее критичным для других антител, включая pH-зависимые антитела (он также важен для 22C9, другого связывающего pH-зависимым образом антитела).
Y56 является уникальным для 21F11, и ранее не было известно о его важности для связывания PD-1 с PD-L1.
Хотя сообщалось, что мутация либо R113, либо R125, на остаток A в анти-PD-L1 антителах приводит к потере их способности связываться с PD-L1 человека (смотри патент США №: 8779108), известно, что они важны для связывания PD-1 с PD-L1, как описано в публикации Lin DY et al., Proc Natl Acad Sci U S A. 2008 Feb. 26; 105(8): 3011-6.
Пример 19: Крупномасштабное производство анти-PD-L1 антител для in vivo исследований
Антитела получали, используя временную экспрессию в клетках CHO-K1. Полученные антитела очищали аффинной хроматографией на колонке с белком A и после обессоливания антитела формулировали в PBS в концентрации 5 мг/мл, с уровнем эндотоксина <3 единиц/мг. Степень чистоты полученных антител определяли методами электрофореза в SDS-ПАА геле и эксклюзионной ВЭЖХ.
Временная экспрессия и очистка рекомбинантного антитела при использовании клеток CHO-K1
Гены вариабельных областей тяжелой цепи и легкой цепи выбранного антитела синтезировали и клонировали в экспрессионный вектор. Полученный экспрессионный конструкт использовали для трансфекции клеток CHO-K1, адаптированных для роста в бессывороточной среде. После 10-дневного выращивания в 10-л биореакторе Applikon культуральную среду собирали, и клетки и клеточный детрит удаляли с использованием ультрафильтров. Затем осветленный супернатант концентрировали ультрафильтрацией и наносили на подготовленную колонку с белок A- (человеческие IgG) или G-сефарозой (мышиные IgG). После промывания уравновешивающим буфером до базовой линии под контролем УФ-спектрофотометра проводили элюцию с колонки 0,1 M лимонной кислотой, pH 3,5, элюированное антитело немедленно нейтрализовали 1,0 M Tris-HCl буфером, pH 8,0, и диализовали против PBS, pH 7,2 (Invitrogen), в течение ночи при 2-8°C с 2 сменами буфера. Очищенное антитело фильтровали через стерильные шприц-фильтры с диаметром пор мембраны 0,22 мкм и хранили в аликвотах при температуре -80°C или ниже.
Пример 20: In vivo оценка анти-PD-L1 гуманизированных антител
Активность in vivo гуманизированных анти-PD-L1 антител оценивали, как описано в Примере 14.
1. Противоопухолевая активность гуманизированных антител против PD-L1 в нокин модели опухоли MC38/человеческий PD-L1
Тестирование противоопухолевой активности гуманизированного антитела против PD-L1 4B6-H3L3-N297A в нокин модели опухоли MC38/человеческий PD-L1 проводили, как описано в Примере 14, и результаты приведены в Таблице 10 и на Фигуре 25 (показаны результаты лечения с использованием PBS, BM-GT и 4B6-H3L3-N297A).
Таблица 10. Дизайн исследования для тестирования противоопухолевой активности антител против PD-L1 в лечении мышиной модели сингенной опухоли MC38/hPDL1
2. Ингибирование роста опухоли MC38/hPD-L1 KI при в/б инъекции гуманизированных антител
Данное исследование было разработано для оценки эффекта гуманизированных анти-PD-L1 антител в ингибировании роста опухоли при внутрибрюшинной доставке в дозе 1 мг/кг, 3 мг/кг или 10 мг/кг. Вкратце, 2×106 клеток опухоли MC38/hPD-L1 инокулировали, как описано ранее, мышам C57/BL6 и позволяли расти в течение 6 дней. В это время мышей, имеющих средний объем опухоли 80-100 мм3, отбирали и случайным образом разделяли на группы по 8 мышей в каждой группе. Каждое из тестируемых антител вводили внутрибрюшинно отдельным мышам в дозе 1 мг/кг, 3 мг/кг или 10 мг/кг (для BM-GT) или 23F11-H4L4 (1 мг/кг) в одном и том же объеме, начиная с дня 6, три раза в неделю. В конце исследования (день 25) животных умерщвляли ингаляцией CO2. Размер опухоли измеряли дважды в неделю в двух измерениях при помощи штангенциркуля (INSIZE), и объем, выраженный в мм3, определяли по формуле: V=0,5 a × b2, где a и b представляют собой длинный и короткий диаметры опухоли, соответственно. Результаты регистрировали как частичную регрессию (ЧР) опухоли, если объем опухоли уменьшался до величины <50% от объема опухоли в начале лечения, без уменьшения до неподдающегося измерению размера, или как полную регрессию (ПР), если опухоль не обнаруживали при пальпации (смотри Таблицу 11). Результаты анализировали с использованием программы Prism GraphPad и выражали в виде среднего значения ± S.E.M. Сравнение между двумя группами проводили с использованием критерия Стьюдента, и разницу считали значимой при P <0,05. На Фигуре 26E показан объем опухоли, измеренный у отдельных мышей, которым вводили разные антитела (BM-GT, BM-ME, 23A11-H3L5 и 23F11-H4L4). ООО означает относительный объем опухоли в сравнении с объемом опухоли, измеренным в день 1 у той же мыши, и ОО означает объем опухоли, измеренный в последний день (то есть, день 25) исследования.
Таблица 11. Регрессия опухоли, измеренная в день 25
Примечание: против растворителя, * p <0,05; ** p <0,01.
ЧР (частичная регрессия): опухоль уменьшена до объема <50% от объема опухоли в начале лечения, без уменьшения до неподдающегося измерению размера
ПР (полная регрессия): опухоль не обнаруживают при пальпации
3. Ингибирование роста опухоли MC38/HPD-L1 KI при внутривенной инъекции гуманизированных антител против PD-L1
Данное исследование было разработано для оценки эффекта гуманизированных антител в ингибировании роста опухоли при внутривенной доставке, аналогичной способу доставки, используемой для пациентов. Вкратце, клетки опухоли MC38/hPD-L1 инокулировали, как описано ранее, мышам C57/BL6 и позволяли расти в течение 10 дней. В это время мышей, имеющих средний объем опухоли 80-100 мм3, отбирали и случайным образом разделяли на группы по 12 мышей в каждой группе. Каждое тестируемое антитело вводили в/в отдельным мышам в дозе 1 мг/кг в одном и том же объеме в день 0 и в день 15. В конце исследования животных умерщвляли ингаляцией CO2. Размер опухоли измеряли дважды в неделю в двух измерениях при помощи штангенциркуля (INSIZE), и объем, выраженный в мм3, определяли по формуле: V=0,5 a × b2, где a и b представляют собой длинный и короткий диаметры опухоли, соответственно. Результаты регистрировали как частичную регрессию (ЧР) опухоли, если объем опухоли уменьшался до величины <50% от объема опухоли в начале лечения, без уменьшения до неподдающегося измерению размера, или как полную регрессию (ПР), если опухоль не обнаруживали при пальпации (смотри Таблицу 12). Результаты анализировали с использованием программы Prism GraphPad и выражали в виде среднего значения ± S.E.M. Сравнение между двумя группами проводили с использованием критерия Стьюдента, и разницу считали значимой при p <0,05.
Данные на Фигуре 29 показывают, что в дозе 1 мг/кг антитела 23A11-H3L5 и 23F11-H4L4 были значительно более эффективны в ингибировании роста опухоли, чем при других дозах в идентичных условиях. На Фигуре 27A показано, что 23F11-H4L4 или 23A11-H3L5 в дозе 1 мг/кг ингибировали рост опухоли на 91% и 82%, соответственно, в то время как эталонное антитело в дозе 1 мг/кг ингибировало рост опухоли на 41,6% относительно контрольной группы с введением растворителя. На Фигуре 29A показано, что 23F11-H4L4 или 23A11-H3L5 в дозе 1 мг/кг ингибировали рост нокин опухоли MC38/hPD-L1 до уровня, аналогичного уровню, достигаемому при введении BM-GT в дозе 10 мг/кг, и не было отмечено никакой статистически значимой разницы в активности ингибирования роста опухоли в одних и тех же условиях. Таким образом, данные антитела, в качестве примера представленные антителами 23F11-H4L4 и 23A11-H3L5, обладают активностью in vivo, примерно в десять раз превышающей активность эталонного антитела BM-GT (также называемого MPDL-3280A), которое не связывается с антигеном pH-зависимым образом (смотри Фигуры 29A и 29B).
Таблица 12. Регрессия опухоли, измеренная в день 26
**p-значение <0,01 против контроля; *** p-значение <0,005 против контроля
ЧР: частичная регрессия, >50% уменьшение объема опухоли от объема в начале исследования
ПР: полная регрессия, 100% уменьшение объема опухоли от объема в начале исследования
Изменение размера опухоли у каждой мыши в конце исследования показано на каскадной диаграмме и выражено в виде изменения от размера в начале исследования (смотри Фигуры 28A-28D). Для тех мышей, у которых размер опухоли был увеличен на более чем 100%, было указано изменение 100%, а для тех, у которых размер опухоли увеличивался на менее, чем 100%, или уменьшался с начала исследования, было указано точное изменение в процентном выражении.
Вышеприведенные результаты показывают, что 23F11-H4L4 и 23A11-H3L5 являются значительно более эффективными в ингибировании роста опухоли, чем эталонное антитело BM-GT, в дозе 1 мг/кг (смотри Фигуру 27 и Фигуру 28). Кроме того, способность 23A11-H3L5 и 23F11-H4L4 к ингибированию роста опухоли в дозе 1 мг/кг сопоставима с активностью BM-GT в дозе 10 мг/кг (смотри Фигуры 29A и 29B). Более того, не наблюдалось дальнейшего увеличения ингибирующей рост опухоли активности антитела 23A11-H3L5 или 23H11-H4L4 при введении в дозе 10 мг/кг, в сравнении с активностью в дозе 1 мг/кг, хотя наблюдалось значительное увеличение активности в случае BM-GT. Таким образом, антитела с pH-зависимым связыванием антигена могут представлять собой новый класс антител, способных к ингибированию роста опухоли в очень низких дозах.
4. Исследование с повторной имплантацией опухоли
Для понимания того, могут ли мыши, достигшие полного избавления от опухоли при в/в введении антитела против PD-L1, иметь устойчивый иммунный ответ и контролировать заново появляющуюся опухоль, авторы изобретения повторно вводили свежие клетки опухоли подгруппе мышей, у которых был достигнут полный ответ при введении в дозе 1 мг/кг либо 23A11-H3L5, либо 23F11-H4L4, ко дню 10-35. Вкратце, каждой из мышей вводили инъекцией свежие клетки опухолей в количестве 2×106 клеток в день 35 после инокуляции. Заново введенные клетки опухоли могли расти в течение первых пяти-десяти дней после введения, но затем опухоль начинала уменьшаться в размерах и ко дню 50 (15 дней после повторной имплантации) ни у одной из мышей не наблюдали поддающуюся измерению опухоль. Это указывает на то, что у данных мышей развилась память на те же клетки опухоли и опухоль-ингибирующий ответ является устойчивым, хотя к тому времени ни одно из антител не присутствовало в организме (смотри Фигуру 30).
Пример 21: Оценка проникновения в опухоль выбранных pH-зависимых нейтрализующих антител
Для проявления своего эффекта антитело должно проникать в опухоль. Для оценки того, обладают ли pH-зависимые антитела преимуществом при проникновении в опухоль, а также того, отличается ли каким-либо образом время их удержания в опухоли, авторы изобретения использовали in vivo лучевое исследование.
Вкратце, тестируемые антитела BM-GT и 23F11-H4L4 метили маркирующим красителем с флуоресценцией в ближней инфракрасной области (CF750, каталожный номер: 99952, лот: 12M0413, BIOTIUM) следующим методом: антитела разбавляли в PBS до концентрации 0,1 мг/мл, затем 0,8 мл раствора каждого антитела переносили пипеткой в каждый флакон с предварительно нагретым 10x реакционным буфером в соотношении 1:9, так что раствор антитела содержал реакционный буфер в конечной концентрации 1x. После перемешивания растворов пипетированием вверх-вниз несколько раз, переносили весь раствор из каждого флакона во флакон, содержащий краситель CF, перемешивали содержимое флаконов в течение нескольких секунд и инкубировали флаконы в темноте в течение 30 минут. Затем примерно 0,2 мл раствора антитела с красителем вводили внутривенной инъекцией каждой мыши.
Модель сингенной опухоли MC38/hPD-L1
2×106 клеток MC38/hPD-L1 подкожно имплантировали 8-недельным мышам C57BL/6, 12 животных отбирали и случайным образом распределяли в 4 группы. Когда опухоль вырастала до размера примерно 220 мм3, животным вводили внутривенной инъекцией 0,2 мл раствора антитела с красителем.
Визуализацию зоны опухоли проводили у каждой мыши с использованием IVIS Lumina II после анестезии в следующие временные точки после введения дозы: 1 ч, 4 ч, 24 ч, 48 ч, 96 ч, день 7, день 11, день 15, день 18 и день 21. Вкратце, каждую мышь анестезировали пентобарбиталом натрия в дозе 50 мг/кг перед визуализацией при помощи IVIS в каждой временной точке. Когда животное переставало двигаться, его помещали в смотровой бокс (стороной, где находилась опухоль, вверх) и закрывали дверцу, затем использовали программу Living image для визуализации каждой мыши.
В качестве примера показан излучаемый сигнал BM-GT и гуманизированного 23F11 (то есть, 23F11-H4L4) (смотри Фигуру 31A). Средний излучаемый сигнал для каждой мыши количественно определяли в каждой временной точке и анализировали с использованием программы GraphPad prism; результаты представлены на Фигуре 31B. Результаты показали, что антитело 23F11-H4L4 имело значительно более сильный излучаемый сигнал, чем эталонное антитело, и, таким образом, в опухоли задерживалось намного больше антител по изобретению, чем эталонных антител. В соответствии с тем, что больше антител остается в опухоли с течением времени, у двух из трех мышей, которым вводили 23F11-H4L4, опухоли значительно уменьшились, в то время как ни у одной из мышей, получавших BM-GT, опухоль существенно не уменьшилась в размерах (смотри Фигуру 31C). Таким образом, 23F11-H4L4, антитело, имеющее свойство pH-зависимого связывания, может иметь уникальное преимущество и является более эффективным в ингибировании роста опухоли. 2-1, 2-2, 2-3, 4-1, 4-2 и 4-3 в подписи к Фигуре 31B обозначают отдельную мышь 1, 2 или 3 в группе № 2 и группе № 4, соответственно.
Пример 22: Комбинированная терапия выбранным гуманизированным анти-PD-L1 антителом и другими опухоль-модулирующими средствами
Для оценки того, может ли сочетание ингибитора контрольных точек анти-PD-L1 антитела и анти-VEGFR2 антитела (против ангиогенеза) лучше контролировать рост опухоли, на опухоли hPD-L1/MC38 воздействовали DC101, антителом с нейтрализующей активностью в отношении мышиного VEGFR2, в дозе 20 мг/кг; или антителом против PD-L1 23A11-химерным в субоптимальной дозе 0,3 мг/кг, либо и тем, и другим. Вкратце, 2×106 клеток опухоли MC38/hPD-L1 инокулировали, как описано ранее, мышам C57/BL6 и позволяли расти в течение 3 дней. В это время мышей случайным образом разделяли на группы по 8 мышей в каждой группе. Каждое тестируемое антитело вводили отдельным мышам внутрибрюшинно, 23A11-химерное в дозе 0,3 мг/кг или DC101 в дозе 20 мг/кг, либо оба антитела, начиная с дня 3, три раза в неделю в течение трех недель. В конце исследования животных умерщвляли ингаляцией CO2. Размер опухоли измеряли дважды в неделю в двух измерениях при помощи штангенциркуля (INSIZE), и объем, выраженный в мм3, определяли по формуле: V=0,5 a × b2, где a и b представляют собой длинный и короткий диаметры опухоли, соответственно. Результаты анализировали с использованием программы Prism GraphPad и выражали в виде среднего значения ± S.E.M. Сравнение между двумя группами проводили с использованием критерия Стьюдента, и разницу считали значимой при P <0,05. Данные показали, что комбинированное лечение было намного более эффективным в ингибировании роста клеток опухоли (смотри Фигуры 32A-32C).
Для дальнейшей демонстрации того, что комбинированная терапия является более эффективной, чем монотерапия, авторы изобретения начинали лечение, когда объем опухоли достигал примерно 180 мм3. Они вводили два антитела попарно в дозе либо 1 мг/кг, либо 3 мг/кг, мышам линии, которая не отличалась сильной чувствительностью к гуманизированному анти-PD-L1 антителу или анти-VEGFR2 антителу DC101. Препараты вводили в/в один раз в неделю в течение 2-3 недель. Данные показали, что оба препарата в сочетании являются значительно более эффективными, чем отдельное антитело, в ингибировании роста опухоли (смотри Фигуры 32D и 32E).
Таким образом, авторы изобретения продемонстрировали, что сочетание гуманизированных антител против PD-L1 с ингибирующими ангиогенез средствами, такими как анти-VEGFR2 антитело, может являться эффективным подходом для лечения сформировавшейся опухоли или остановки прогрессирования развивающейся опухоли.
Пример 23: Термостабильность антител против PD-L1
Дифференциальную сканирующую калориметрию (ДСК) с капиллярной ячейкой использовали для оценки термостабильности белков путем обнаружения вызываемых нагреванием различий между образцом и эталоном при повышении температуры. В частности, этот метод используют для измерения средней точки теплового перехода (Tm), которая является показателем относительной стабильности белка в жидкости. Антитела 23F11-H4L4 или 23A11-H3L5 (полученные в клетках CHO) разбавляли буфером (20 мМ His-His-HCl, 5% сахарозы, pH=6,0) до концентрации 1 мг/мл и добавляли в 96-луночный планшет для ДСК. Образцы анализировали на микрокалориметре MicroCal VP-DSC Capillary Cell Microcalorimeter (GE) в диапазоне температур 10~110°C со скоростью сканирования 200°C/час, и результат анализировали с использованием программы MicroCal VP Capillary DSC Automated Analysis Software. Результаты тестирования методом ДСК с капиллярной ячейкой приведены ниже в Таблице 13 и на Фигурах 33A и 33B.
Как показано в Таблице 13, антитело 23F11-H4L4 демонстрирует существенно увеличенное значение Tm (то есть, Tm2, которое представляет собой значение Tm для Fab-фрагмента, в то время как Tm1 представляет собой значение Tm для CH2-фрагмента).
Таблица 13
Пример 24: Эпитопное картирование E58 для анти-PD-L1 антител
Важность остатка E58 для связывания анти-PD-L1 антител, предложенных в настоящем документе, анализировали для антител в анализе связывания на основе метода ELISA, как описано в Примере 18. Получали либо белок PD-L1 дикого типа, либо мутант с заменой E58A, и относительное связывание антител с двумя белками оценивали на одном и том же планшете, результаты приведены в Таблице 14, ниже:
Таблица 14
Данные показали, что остаток E58 является критическим для связывания 23F11 и 23F11-H4L4, связывание которых уменьшалось на более, чем 90%, когда этот остаток был мутирован на аланин в PD-L1 человека. Аналогично, связывание 23A11-H3L5, 22C9, также уменьшалось до 8,3%, 17,2% от сигнала связывания для белка PD-L1 ДТ. С другой стороны, связывание BM-GT или BM-ME уменьшалось до 51% или 69,8% от связывания антител с PD-L1 дикого типа, когда E58 был мутирован на Ala. Аналогично, связывание 23A11, 26F5 и 4B6 также уменьшалось до 51,7%, 60,6% и 69,6% от связывания в случае белка PD-L1 дикого типа. Напротив, связывание 18G4 с PD-L1 совершенно не уменьшалось, когда E58 был мутирован на Ala. Таким образом, необходимость в E58 различна при связывании разных антител с белком PD-L1, и он является очень важным остатком для связывания 23F11, 23F11-H4L4 и 22C9.
Также было отмечено, что 18G4 представляет собой антитело, имеющее сильно отличающийся профиль связывания эпитопа, в сравнении с другими анти-PD-L1 антителами, раскрытыми в настоящем документе, которому необходим для связывания лишь остаток S80 в числе 39 разных аминокислот, проанализированных методом аланин-сканирующего мутагенеза. Данное антитело также является очень эффективным в ингибировании роста опухолей in vivo.
Пример 25: Интернализация гуманизированных антител против PD-L1
Для оценки того, может ли 23F11-H4L4 (полученное в клетках CHO) быть интернализовано, авторы изобретения проводили следующий эксперимент. Вторичное антитело козы против Fc человека сначала метили pH-чувствительным красителем pHAb Amine Reactive Dye (Sigma, G9845). Этот краситель не флуоресцирует при нейтральном pH, но становится высоко флуоресцентным при кислых pH. Когда антитело, меченое этим красителем, интернализуется во внутриклеточные эндосомы (pH 6,0-6,5) и лизосомы (4,5-5,5), можно обнаружить сильный флуоресцентный сигнал. В частности, клетки MC38-hPD-L1 (MabSpace) культивировали в среде RPMI-1640, содержащей 10% эмбриональной бычьей сыворотки (Hyclone). Клетки в логарифмической фазе роста собирали центрифугированием, высевали при плотности 2×104/лунку (50 мкл/лунку) в 96-луночный планшет и давали клеткам возможность прикрепляться в течение ночи. Затем антитело козы против Fc человека (Jackson ImmunoResearch, каталожный № 109-005-098) в концентрации 2 мкг/мл, меченое красителем pHAb Amine Reactive Dye (25 мкл/лунку), добавляли в каждую лунку, с последующим добавлением в каждую лунку серийно разведенных 23F11-H4L4 или hIgG1 (25 мкл/лунку). Антитела оставляли для инкубации с клетками на 6 часов или 24 часа при 37°C. После завершения инкубации культуральную среду удаляли и в каждую лунку добавляли по 100 мкл PBS. Сигнал антител в каждой лунке планшета определяли с использованием Varioskan Flash (Thermo Scientific), считывая в спектре длин волн возбуждения 532 нм/эмиссии 560 нм. Данные в графическом представлении показывают, что имеет место значительное увеличение флуоресцентного сигнала в клетках через 6 или 24 ч зависимым от концентрации образом. Эти результаты показывают, что 23F11-H4L4 может быть эффективно интернализовано при связывании с hPD-L1 на поверхности клеток MC38/hPD-L1 (смотри Фигуру 35).
Пример 26: Связывание гуманизированного антитела против PD-L1 с активированными T-клетками in vitro
Моноциты периферической крови выделяли из лейкаферезной массы центрифугированием в градиенте плотности фиколла и ресуспендировали в PBS плюс 2% ЭБС. Клетки разбавляли культуральной средой до плотности 0,5×107 клеток/мл, а затем вносили в планшеты, покрытые антителом против CD3 человека (OKT3, ebioscience, каталожный № 16-0037) (1 мкг/мл, 1 мл/лунку). В каждую лунку добавляли антитело против CD28 человека (BD, каталожный № 555725) и затем клетки культивировали в 6-луночном планшете со средой RPMI 1640 плюс 10% ЭБС в течение 3 дней при 37°C. После этого клетки собирали и помещали в 96-луночный круглодонный планшет в FACS-буфере (PBS+5% БСА). Проводили центрифугирование и супернатанты отбрасывали, добавляли серийно разведенное антитело 23F11-H4L4 или hIgG1 с мутацией N297A в качестве отрицательного контроля. Планшеты инкубировали в течение одного часа при 4°C, затем клетки три раза промывали PBS. После этого 2,5 мкл Chuman IgG-APC (Biolegend, каталожный № 409306) добавляли в каждую лунку и планшеты инкубировали в течение одного часа при 4°C, промывали три раза, затем анализировали методом проточной цитометрии (Beckman Cytoflex).
Данные на Фигурах 36A и 36B показывают, что 23F11-H4L4 может связываться с PD-L1, экспрессированным на активированных T-клетках, зависимым от дозы образом, хотя оно демонстрирует очень небольшое связывание с не активированными T-клетками.
Пример 27: In vivo исследование эффективности антитела против PD-L1 в модели с клетками MC38/hPD-L1 у мышей с нокином hPD-1
В предыдущих экспериментах (например, в Примерах 14 и 20) белок PD-1 у сингенных мышей был мышиным, и иммуносупрессия была опосредована связыванием hPD-L1 с мышиным PD-1. Для дополнительной оценки того, будут ли иметь место какие-либо различия при лечении антителами в сингенной модели MC38/hPD-L1, если мышиный PD-1 будет заменен на hPD-1, то есть, в ситуации, аналогичной ситуации у пациентов-людей, авторы исследования имплантировали клетки опухоли MC38/hPD-L1 мышам с нокином PD-1. В частности, клетки опухоли MC38/hPD-L1 поддерживали in vitro в виде монослойной культуры в среде RPMI 1640 (Thermo Fisher) с добавлением 10% инактивированной нагреванием эмбриональной бычьей сыворотки (ExCell Biology), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (Hyclone) при 37°C в атмосфере с 5% CO2. Клетки опухоли рутинно субкультивировали дважды в неделю путем обработки смесью трипсин-ЭДТА (Hyclone). Клетки в экспоненциальной фазе роста собирали и подсчитывали для подтверждения методом FACS экспрессии hPD-L1 и инокуляции опухоли. Каждой самке мышей с нокином PD-1 в возрасте 5-6 недель (C57BL/6-Pdcd/tm1 (hPDCD1), Beijing Biocytogen Co., Ltd) инокулировали подкожно в правый бок клетки опухоли MC38/hPD-L1 с подтвержденной экспрессией PD-L1 (2×106) в 0,1 мл PBS для развития опухолей. Лечение начинали примерно через 7 дней после инокуляции, когда размер опухоли достигал примерно 100 мм3. Каждая группа состояла из 10 несущих опухоль мышей (смотри Фигуру 37A). Тестируемый препарат (то есть, 23F11-H4L4) готовили путем аспирации 200 мкл маточного раствора с концентрацией 3 мг/мл и разбавления в 1,8 мл буфера для формулирования (гистидин 20 мМ, сахароза 250 мМ, полисорбат 80 0,02%, pH 6,0±0,2), с получением рабочего раствора с концентрацией 0,3 мг/мл, который вводили мышам внутривенной инъекцией. Размер опухоли измеряли дважды в неделю в двух измерениях при помощи штангенциркуля (INSIZE), и объем, выраженный в мм3, определяли по формуле: V=0,5 a × b2, где a и b представляют собой длинный и короткий диаметры опухоли, соответственно. Результаты регистрировали как частичную регрессию (ЧР) опухоли, если объем опухоли уменьшался до величины <50% от объема опухоли в начале лечения, без уменьшения до неподдающегося измерению размера, или как полную регрессию (ПР), если опухоль не обнаруживали при пальпации. Размер опухолей в каждой группе лечения приведен в Таблице 15 и на Фигурах 37B и 37C. Эти данные показывают, что лечение антителом 23F11-H4L4 приводило к значительному ингибированию роста опухоли с исчезновением опухоли, или полным ответом, у 5 из 10 мышей, получавших препарат, в то время как у мышей, получавших солевой раствор, все опухоли росли, и ни у одной из мышей не наблюдали регрессию опухоли.
Таблица 15: Степень ингибирования роста опухоли (ИРО) в день 31
(3 мг/кг)
Для дополнительного сравнения относительной in vivo эффективности ингибирования роста опухоли авторы изобретения проводили другой эксперимент. Аналогично, каждой самке мышей с нокином PD-1 в возрасте 5-6 недель (C57BL/6-Pdcd/tm1 (hPDCD1), Beijing Biocytogen Co., Ltd) инокулировали подкожно в правый бок клетки опухоли MC38/hPD-L1 с подтвержденной экспрессией PD-L1 (2×106) в 0,1 мл PBS для развития опухолей. Лечение начинали примерно через 7 дней после инокуляции, когда размер опухоли достигал примерно 100 мм3. Каждая группа состояла из 8 несущих опухоль мышей. Тестируемый препарат готовили путем аспирации 0,128 мл, 0,384 мл и 1,28 мл маточного раствора с концентрацией 3 мг/мл и разбавления в 3,712, 3,456 и 2,58 мл стерильного PBS (Hyclone, каталожный № SH30256.01), с получением рабочих растворов с концентрациями 0,1 мг/мл, 0,3 мг/мл или 1 мг/мл, которые вводили в объеме 200 мкл каждой мыши внутрибрюшинной инъекцией дважды в неделю, при этом вводимые дозы составляли 1, 3, 10 мг/кг. Аналогично, BM-GT (MABSPACE, полученные в клетках CHO) и контрольные IgG с мутацией N297A (CrownBio, AB160160 из клеток CHO) готовили путем аспирации 1,280 мл полученного в клетках CHO BM-GT с концентрацией 3 мг/мл в 2,560 мл PBS или 0,662 мл маточного раствора с концентрацией 5,8 мг/мл в 3,178 мл стерильного PBS, и вводили по 200 мкл раствора в конечном разведении каждой мыши внутрибрюшинной инъекцией дважды в неделю, при этом вводимая доза составляла 10 мг/кг в/б дважды в неделю. Размер опухоли измеряли дважды в неделю в двух измерениях при помощи штангенциркуля (INSIZE), и объем, выраженный в мм3, определяли по формуле: V=0,5 a × b2, где a и b представляют собой длинный и короткий диаметры опухоли, соответственно. Результаты регистрировали как частичную регрессию (ЧР) опухоли, если объем опухоли уменьшался до величины <50% от объема опухоли в начале лечения, без уменьшения до неподдающегося измерению размера, или как полную регрессию (ПР), если опухоль не обнаруживали при пальпации (смотри Таблицу 16 и Фигуры 38A-38C).
Таблица 16: Степень ингибирования опухолевого роста в сингенной модели опухоли MC38/hPD-L1 на мышах с hPD-1 (N=8, день 27)
N=8
N=8
N=8
N=8
N=8
**: против группы с контрольными IgG p <0,01; #: против BM-GT p <0,05
Данные вышеописанного эксперимента показали, что у мышей с нокином PD-1, которым имплантировали клетки MC38, экспрессирующие PD-L1 человека, 1) 23F11-H4L4 проявляло сильную зависимую от дозы ингибирующую рост опухоли активность с величиной суммарного ответа (ЧР+ПР), составляющей 12,5%, 62,5% и 100% при дозах 1, 3 и 10 мг/кг, соответственно (смотри Фигуру 38A); 2) 23F11-H4L4 в дозе 3 мг/кг является по меньшей мере таким же эффективным, как BM-GT в дозе 10 мг/кг (смотри Фигуры 38B и 38C); 4) 23F11-H4L4 в дозе 3 мг/кг, введенной либо в/б, либо в/в, проявляет аналогичную активность в достижении полной регрессии опухоли (50%) (смотри Фигуры 37A-37B и 38A-38C). 5) 23F11-H4L4 в дозе 10 мг/кг является значительно более эффективным, чем BM-GT в дозе 10 мг/кг, не только в отношении общего уменьшения размера опухоли, но и в отношении числа мышей, достигших полной регрессии опухоли (6/8 против 3/8) (смотри Фигуру 38C); таким образом, pH-зависимое связывание антигена и связанная с этим возможность рециркуляции, и, следовательно, более длительный период нахождения лекарственного средства в опухоли, может приводить к лучшему контролю опухоли и регрессии опухоли, особенно в максимально эффективной дозе для BM-GT.
Пример 28: Занятость рецепторов и фармакокинетика/фармакодинамика у мышей
Для измерения продолжительности связывания антитела с белком-мишенью PD-L1 человека в опухоли MC38/hPD-L1 при однократном внутривенном введении антител авторы изобретения измеряли методом FACS количество доступных сайтов связывания белка-мишени в одиночных клетках, полученных из опухоли, в разных временных точках после инъекции антитела. В частности, клетки опухоли MC38/hPD-L1 поддерживали in vitro в виде монослойной культуры в среде RPMI 1640 (Thermo Fisher) с добавлением 10% инактивированной нагреванием эмбриональной бычьей сыворотки (ExCell Biology), 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина (Hyclone) при 37°C в атмосфере с 5% CO2. Клетки опухоли рутинно субкультивировали дважды в неделю путем обработки смесью трипсин-ЭДТА (Hyclone). Клетки в экспоненциальной фазе роста собирали и подсчитывали для подтверждения методом FACS экспрессии hPD-L1 и инокуляции опухоли. Каждой самке мышей с нокином PD-1 в возрасте 5-6 недель инокулировали подкожно в правый бок клетки опухоли MC38/hPD-L1 с подтвержденной экспрессией PD-L1 (2×106) в 0,1 мл PBS для развития опухолей. Лечение начинали примерно через 12 дней после инокуляции, когда размер опухоли достигал примерно 200-300 мм3, животным вводили 23F11-H4L4 в дозе 3 mpk (смотри Таблицу 17). Опухоли собирали в день 2, день 7 и день 14 после введения для оценки занятости рецепторов. Опухоли собирали и измельчали на небольшие фрагменты, затем добавляли раствор ACCUMAX™ для разобщения клеток (STEMCELL, каталожный № 07921) в концентрации 10 мл/0,5 г ткани. Суспензию из фрагментов опухоли осторожно встряхивали при комнатной температуре в течение 1-2 часов и периодически пипетировали вверх-вниз в процессе инкубации для облегчения диссоциации клеток. После завершения инкубации клеточную суспензию пропускали через нейлоновую сетку с размером отверстий 40 мкм. Клетки три раза промывали холодным PBS и центрифугировали в течение 5 мин при 1500 об/мин. Собранные клетки ресуспендировали в 1-2 мл PBS и подсчитывали общее количество клеток. Затем 50 мкл клеточной суспензии (примерно 1000000 клеток) вносили в лунки 96-луночного планшета. Клетки дважды промывали FACS-буфером (1% БСА в PBS). Затем клетки инкубировали с антителом 23F11-H4L4 в концентрации 2 мкг/мл или PBS, или контрольным по изотипу антителом. Смесь инкубировали в течение по меньшей мере 30 мин при 2-8°C, или на льду, и защищали от света. Клетки три раза промывали FACS-буфером, затем центрифугировали в течение 5 минут при 1500 об/мин. Добавляли меченое FITC вторичное антитело против IgG FC человека и инкубировали в течение 30 мин при 2-8°C в темноте, с последующим трехкратным промыванием клеток FACS-буфером. В завершение, клетки ресуспендировали в 0,5 мл FACS-буфера и анализировали методом проточной цитометрии. Программу для анализа данных проточной цитометрии (Cytoflex) и программу GraphPad Prism использовали для расчета процентной доли PD-L1-положительных клеток и средней интенсивности флуоресценции (СИФ) в сравнении с клетками, окрашенными контрольным по изотипу антителом. Коэффициент изменения относительной средней интенсивности флуоресценции (ОСИФ) у клеток, преинкубированных in vitro с насыщающими количествами контрольного по изотипу антитела hIgG1-N197A (CrownBio, AB160160) (для определения in vivo связывания 23F11-H4L4 с PD-L1), или 23F11-H4L4, или BM-GT (для определения доступных сайтов связывания PD-L1) использовали для оценки занятости рецепторов (ЗР). Значения нормировали на показатели соответствующего контрольного по изотипу антитела hIgG1-N297A. Данные (смотри Таблицу 18) показали, что одна инъекция 23F11-H4L4 в дозе 3 мг/кг может приводить к устойчивой занятости рецепторов PD-L1 в опухоли в течение по меньшей мере 7 дней. С другой стороны, при использовании BM-GT в дозе 3 мг/кг занятость рецепторов PD-L1 в опухоли имела место в течение более 2 дней, но менее 7 дней, несмотря на изначально высокий показатель занятости, это свидетельствовало о том, что свойство pH-зависимого связывания PD-L1 у 23F11-H4L4 может позволять антителу оставаться в опухоли в течение более длительного времени и связываться с PD-L1 на клетках опухоли.
Таблица 17: Дизайн исследования
(мг/кг)
Примечание: Объем дозы скорректирован на массу тела; в/в: внутривенное введение.
Таблица 18: Результаты исследования занятости рецепторов
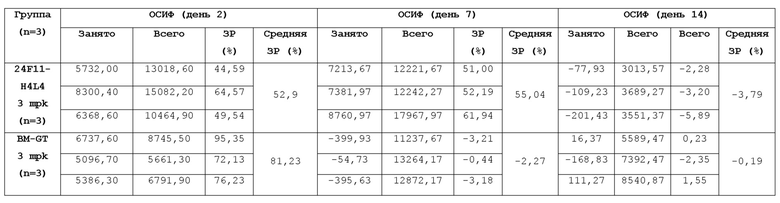
Пример 29: Результаты изучения проникновения в опухоль
Трем нормальным сингенным мышам C57B/L6 с растущей опухолью MC38/hPD-L1 выполняли одну внутривенную инъекцию 23F11-H4L4 в дозе 10 мг/кг, когда размер опухоли достигал 200-300 мм3. Опухоли собирали в день 7 после введения антитела для анализа проникновения антитела в опухоль и опухоль-инфильтрирующих лимфоцитов (ОИЛ). В частности, готовили блоки из опухоли с использованием Optimal Cutting Temperature (O.C.T.) (Tissue Tek) в соответствии с инструкциями производителя. Готовили срезы ткани толщиной 6 мкм, препараты ткани фиксировали метанолом, с последующим промыванием PBS, а затем пермеабилизировали 0,2% раствором Triton X-100 в течение 5 минут. Препараты промывали PBS и блокировали блокирующим буфером (3,0% БСА в 1× PBS) в течение 30-60 минут при комнатной температуре, с последующим промыванием препаратов PBS-T три раза по 5 минут каждый. Затем препараты обрабатывали вторичными антителами: конъюгированным с Alexa Fluor® 488 антителом козы против IgG (H+L) человека (Thermo, каталожный № A11013, для обнаружения 23F11-H4L4), конъюгированным с Alexa Fluor® 594 антителом против CD31 мыши (Biolegend, каталожный № 102520, для обнаружения сосудистой сети) и конъюгированным с Alexa Fluor® 594 антителом против CD8a мыши (Biolegend, каталожный № 100758, для обнаружения CD8 T-клеток), разведенными в PBS, и оставляли для инкубации в темноте на ночь при 4°C. После удаления вторичных антител и промывания препаратов PBS-T три раза (по 5 минут каждый), проводили контрастное окрашивание препаратов DAPI, покрывали покровным стеклом и хранили при 4°C в темноте. Использовали флуоресцентный микроскоп (Nikon Ni-U) для анализа очагов скопления и распределения 23F11-H4L4 и ОИЛ в сравнении с контрольными замороженными препаратами ткани.
Репрезентативное изображение проникновения 23F11-H4L4 и ОИЛ на замороженных срезах опухоли MC38/hPD-L1 CDx в день 7 после введения дозы 10 mpk показано на Фигуре 40.
Хотя изобретение было конкретно представлено и описано со ссылкой на конкретные варианты осуществления (некоторые из которых являются предпочтительными вариантами осуществления), специалистам в данной области следует понимать, что различные изменения формы и деталей могут быть внесены без отклонения от сущности и объема настоящего изобретения, раскрытого в настоящем документе.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> MABSPACE BIOSCIENCES (SUZHOU) CO.,LTD
<120> НОВЫЕ АНТИ-PD-L1 АНТИТЕЛА
<130> 063694-8001WO02
<160> 189
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> БЕЛОК
<213> Mus musculus
<220>
<221> прочий_признак
<222> (4)..(4)
<223> Xaa может представлять собой Ile или Met
<400> 1
Thr Tyr Trp Xaa His
1 5
<210> 2
<211> 17
<212> БЕЛОК
<213> Mus musculus
<220>
<221> прочий_признак
<222> (13)..(14)
<223> Xaa в положении 13 может представлять собой Asp или Glu, Xaa в
положении 14 может представлять собой Gln или Lys
<220>
<221> прочий_признак
<222> (17)..(17)
<223> Xaa может представлять собой Asn или Lys
<400> 2
Met Ile Gln Pro Asn Ser Gly Gly Thr Lys Tyr Asn Xaa Xaa Phe Lys
1 5 10 15
Xaa
<210> 3
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 3
Gly Ala Gly Thr Val Asp Tyr Phe Asp Tyr
1 5 10
<210> 4
<211> 15
<212> БЕЛОК
<213> Mus musculus
<400> 4
Arg Ala Ser Glu Ser Val Asp Ile Tyr Gly Asn Ser Phe Met His
1 5 10 15
<210> 5
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 5
Arg Ala Ser Asn Leu Glu Ser
1 5
<210> 6
<211> 9
<212> БЕЛОК
<213> Mus musculus
<220>
<221> прочий_признак
<222> (1)..(1)
<223> Xaa может представлять собой Gln или His
<220>
<221> прочий_признак
<222> (4)..(5)
<223> Xaa в положении 4 может представлять собой Asn или Thr, Xaa в
положении 5 может представлять собой Asp или Glu
<400> 6
Xaa Gln Ser Xaa Xaa Asp Pro Tyr Thr
1 5
<210> 7
<211> 5
<212> БЕЛОК
<213> Mus musculus
<400> 7
Ser Tyr Trp Met His
1 5
<210> 8
<211> 17
<212> БЕЛОК
<213> Mus musculus
<400> 8
Met Ile His Pro Asn Ser Asp Ile Thr Asn Cys Asn Glu Asn Phe Lys
1 5 10 15
His
<210> 9
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 9
Ser Asp Gly Ser Ser Tyr Trp Tyr Phe Asp Val
1 5 10
<210> 10
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 10
Lys Ala Gly Gln Ser Val Asn Asn Asp Val Ala
1 5 10
<210> 11
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 11
Tyr Ala Ser Asn Arg Tyr Thr
1 5
<210> 12
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 12
Gln Gln Asp Phe Ser Ser Pro Leu Thr
1 5
<210> 13
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (1)..(1)
<223> Xaa может представлять собой Gln или Leu
<220>
<221> прочий_признак
<222> (5)..(5)
<223> Xaa может представлять собой Gln или Val
<220>
<221> прочий_признак
<222> (7)..(7)
<223> Xaa может представлять собой Ser или Pro
<220>
<221> прочий_признак
<222> (11)..(12)
<223> Xaa в положении 11 может представлять собой Leu или Val, Xaa в
положении 12 может представлять собой Val или Lys
<220>
<221> прочий_признак
<222> (20)..(20)
<223> Xaa может представлять собой Leu или Val
<220>
<221> прочий_признак
<222> (28)..(28)
<223> Xaa может представлять собой Thr, Ser или Ile
<400> 13
Xaa Val Gln Leu Xaa Gln Xaa Gly Ala Glu Xaa Xaa Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Xaa Ser Cys Lys Ala Ser Gly Tyr Xaa Phe Thr
20 25 30
<210> 14
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (3)..(3)
<223> Xaa может представлять собой Trp, Lys или Arg
<220>
<221> прочий_признак
<222> (5)..(5)
<223> Xaa может представлять собой Arg или Ala
<400> 14
Trp Val Xaa Gln Xaa Pro Gly Gln Gly Leu Glu Trp Ile Gly
1 5 10
<210> 15
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (1)..(2)
<223> Xaa в положении 1 может представлять собой Arg, Lys или Thr,
Xaa в положении 2 может представлять собой Val или Ala
<220>
<221> прочий_признак
<222> (8)..(8)
<223> Xaa может представлять собой Lys или Thr
<220>
<221> прочий_признак
<222> (10)..(11)
<223> Xaa в положении 10 может представлять собой Ser или Ile, Xaa в
положении 11 может представлять собой Ser или Thr
<220>
<221> прочий_признак
<222> (14)..(14)
<223> Xaa может представлять собой Tyr или Ser
<220>
<221> прочий_признак
<222> (16)..(16)
<223> Xaa может представлять собой Gln или Glu
<220>
<221> прочий_признак
<222> (19)..(19)
<223> Xaa может представлять собой Ser, Gly или Arg
<220>
<221> прочий_признак
<222> (21)..(21)
<223> Xaa может представлять собой Thr или Arg
<220>
<221> прочий_признак
<222> (23)..(23)
<223> Xaa может представлять собой Glu или Asp
<220>
<221> прочий_признак
<222> (25)..(25)
<223> Xaa может представлять собой Ser или Thr
<220>
<221> прочий_признак
<222> (28)..(28)
<223> Xaa может представлять собой Phe или Tyr
<400> 15
Xaa Xaa Thr Leu Thr Val Asp Xaa Ser Xaa Xaa Thr Ala Xaa Met Xaa
1 5 10 15
Leu Ser Xaa Leu Xaa Ser Xaa Asp Xaa Ala Val Xaa Tyr Cys Ala Arg
20 25 30
<210> 16
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (3)..(3)
<223> Xaa может представлять собой Thr или Gln
<220>
<221> прочий_признак
<222> (5)..(5)
<223> Xaa может представлять собой Thr или Ser
<220>
<221> прочий_признак
<222> (7)..(9)
<223> Xaa в положении 7 может представлять собой Val или Leu, Xaa в
положении 8 может представлять собой Ser или Thr, Xaa в положении 9
может представлять собой Val или Ile
<400> 16
Trp Gly Xaa Gly Xaa Thr Xaa Xaa Xaa Ser Ser
1 5 10
<210> 17
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (1)..(1)
<223> Xaa может представлять собой Asp или Ser
<220>
<221> прочий_признак
<222> (4)..(4)
<223> Xaa может представлять собой Met или Leu
<220>
<221> прочий_признак
<222> (6)..(7)
<223> Xaa в положении 6 может представлять собой Gln или His, Xaa в
положении 7 может представлять собой Thr или Ser
<220>
<221> прочий_признак
<222> (9)..(10)
<223> Xaa в положении 9 может представлять собой Ala, Lys или Val, Xaa
в положении 10 может представлять собой Phe или Ser
<220>
<221> прочий_признак
<222> (12)..(12)
<223> Xaa может представлять собой Ala, Ser или Thr
<220>
<221> прочий_признак
<222> (15)..(15)
<223> Xaa может представлять собой Leu, Ala или Val
<220>
<221> прочий_признак
<222> (17)..(17)
<223> Xaa может представлять собой Asp или Gln
<220>
<221> прочий_признак
<222> (19)..(19)
<223> Xaa может представлять собой Val или Ala
<220>
<221> прочий_признак
<222> (22)..(22)
<223> Xaa может представлять собой Ser или Thr
<400> 17
Xaa Ile Val Xaa Thr Xaa Xaa Pro Xaa Xaa Leu Xaa Val Ser Xaa Gly
1 5 10 15
Xaa Arg Xaa Thr Ile Xaa Cys
20
<210> 18
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (9)..(9)
<223> Xaa может представлять собой Ser, Pro или Ala
<400> 18
Trp Tyr Gln Gln Lys Pro Gly Gln Xaa Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 19
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (2)..(2)
<223> Xaa может представлять собой Val или Ile
<220>
<221> прочий_признак
<222> (4)..(4)
<223> Xaa может представлять собой Asn или Ala
<220>
<221> прочий_признак
<222> (7)..(7)
<223> Xaa может представлять собой Thr или Ser
<220>
<221> прочий_признак
<222> (11)..(12)
<223> Xaa в положении 11 может представлять собой Tyr или Ser, Xaa в
положении 12 может представлять собой Gly или Arg
<220>
<221> прочий_признак
<222> (17)..(17)
<223> Xaa может представлять собой Phe или Leu
<220>
<221> прочий_признак
<222> (20)..(21)
<223> Xaa в положении 20 может представлять собой Ser или Asn, Xaa в
положении 21 может представлять собой Thr или Pro
<220>
<221> прочий_признак
<222> (23)..(23)
<223> Xaa может представлять собой Gln или Glu
<220>
<221> прочий_признак
<222> (25)..(25)
<223> Xaa может представлять собой Asp, Glu, Asn или Gln
<220>
<221> прочий_признак
<222> (27)..(27)
<223> Xaa может представлять собой Val, Leu или Thr
<220>
<221> прочий_признак
<222> (29)..(29)
<223> Xaa может представлять собой Val или Thr
<220>
<221> прочий_признак
<222> (31)..(31)
<223> Xaa может представлять собой Phe или Cys
<400> 19
Gly Xaa Pro Xaa Arg Phe Xaa Gly Ser Gly Xaa Xaa Thr Asp Phe Thr
1 5 10 15
Xaa Thr Ile Xaa Xaa Val Xaa Ala Xaa Asp Xaa Ala Xaa Tyr Xaa Cys
20 25 30
<210> 20
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (3)..(3)
<223> Xaa может представлять собой Ala или Gly
<220>
<221> прочий_признак
<222> (9)..(9)
<223> Xaa может представлять собой Leu, Thr или Ile
<400> 20
Phe Gly Xaa Gly Thr Lys Leu Glu Xaa Lys
1 5 10
<210> 21
<211> 120
<212> БЕЛОК
<213> Mus musculus
<400> 21
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Trp Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile His Pro Asn Ser Asp Ile Thr Asn Cys Asn Glu Asn Phe
50 55 60
Lys His Thr Val Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Phe Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Tyr Trp Tyr Phe Asp Val Trp Gly Thr
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 22
<211> 107
<212> БЕЛОК
<213> Mus musculus
<400> 22
Ser Ile Val Met Thr Gln Thr Pro Lys Phe Leu Ser Val Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Gly Gln Ser Val Asn Asn Asp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Phe Thr Ile Ser Thr Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Phe Cys Gln Gln Asp Phe Ser Ser Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 23
<211> 5
<212> БЕЛОК
<213> Mus musculus
<400> 23
Asp Tyr Tyr Met Asn
1 5
<210> 24
<211> 17
<212> БЕЛОК
<213> Mus musculus
<220>
<221> прочий_признак
<222> (13)..(13)
<223> Xaa может представлять собой His или Gln
<220>
<221> прочий_признак
<222> (16)..(16)
<223> Xaa может представлять собой Lys или Gln
<400> 24
Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Xaa Lys Phe Xaa
1 5 10 15
Gly
<210> 25
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 25
Val Lys Trp Gly Asp Gly Pro Phe Ala Tyr
1 5 10
<210> 26
<211> 11
<212> БЕЛОК
<213> Mus musculus
<220>
<221> прочий_признак
<222> (1)..(1)
<223> Xaa может представлять собой Lys или Gln
<400> 26
Xaa Ala Ser Gln Asn Val Gly Ala Ala Val Ala
1 5 10
<210> 27
<211> 7
<212> БЕЛОК
<213> Mus musculus
<220>
<221> прочий_признак
<222> (5)..(6)
<223> Xaa в положении 5 может представлять собой Arg или Leu, Xaa в
положении 6 может представлять собой Tyr или Glu
<400> 27
Ser Ala Ser Asn Xaa Xaa Thr
1 5
<210> 28
<211> 8
<212> БЕЛОК
<213> Mus musculus
<400> 28
Gln Gln Tyr Ser Asn Tyr Pro Thr
1 5
<210> 29
<211> 6
<212> БЕЛОК
<213> Mus musculus
<400> 29
Ser Ser Tyr Tyr Ile His
1 5
<210> 30
<211> 17
<212> БЕЛОК
<213> Mus musculus
<400> 30
Asn Ile Asn Pro Phe Asn Gly Gly Ser Ile Tyr Asn Glu Lys Phe Lys
1 5 10 15
Asn
<210> 31
<211> 5
<212> БЕЛОК
<213> Mus musculus
<400> 31
Trp His Phe Asp Tyr
1 5
<210> 32
<211> 17
<212> БЕЛОК
<213> Mus musculus
<400> 32
Lys Ser Ser Gln Ser Leu Leu Trp Ser Gly Asn Gln Asn Asn Tyr Leu
1 5 10 15
Ser
<210> 33
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 33
Gly Ala Ser Ile Arg Glu Ser
1 5
<210> 34
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 34
Gln His Asn His Gly Ser Phe Leu Pro Tyr Thr
1 5 10
<210> 35
<211> 5
<212> БЕЛОК
<213> Mus musculus
<400> 35
Ser Asn Trp Met His
1 5
<210> 36
<211> 17
<212> БЕЛОК
<213> Mus musculus
<400> 36
Met Met His Pro Asn Ser Gly Ser Ile Asn Tyr Asn Glu Lys Phe Lys
1 5 10 15
Asn
<210> 37
<211> 12
<212> БЕЛОК
<213> Mus musculus
<400> 37
Ser Tyr Tyr Gly Ser Ser Pro Tyr Tyr Phe Asp Tyr
1 5 10
<210> 38
<211> 11
<212> БЕЛОК
<213> Mus musculus
<400> 38
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 39
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 39
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 40
<211> 9
<212> БЕЛОК
<213> Mus musculus
<400> 40
Gln Gln Gly Asp Thr Leu Pro Trp Thr
1 5
<210> 41
<211> 5
<212> БЕЛОК
<213> Mus musculus
<400> 41
Ser Tyr Trp Met His
1 5
<210> 42
<211> 17
<212> БЕЛОК
<213> Mus musculus
<400> 42
Met Ile Gln Pro Ser Thr Ser Gly Thr Ile Tyr Asn Glu Arg Phe Lys
1 5 10 15
Asn
<210> 43
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 43
Gly Thr Gly Thr Val Asp Tyr Phe Asp Tyr
1 5 10
<210> 44
<211> 15
<212> БЕЛОК
<213> Mus musculus
<400> 44
Arg Ala Ser Glu Ser Val Asp Ser Tyr Gly Asn Ser Phe Ile His
1 5 10 15
<210> 45
<211> 7
<212> БЕЛОК
<213> Mus musculus
<400> 45
Arg Ala Ser Asn Leu Glu Ser
1 5
<210> 46
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 46
Gln Gln Ser Lys Glu Asp Pro Tyr Thr Phe
1 5 10
<210> 47
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (1)..(1)
<223> Xaa может представлять собой Gln или Glu
<220>
<221> прочий_признак
<222> (5)..(5)
<223> Xaa может представлять собой Gln или Val
<220>
<221> прочий_признак
<222> (9)..(9)
<223> Xaa может представлять собой Ala или Pro
<220>
<221> прочий_признак
<222> (11)..(12)
<223> Xaa в положении 11 может представлять собой Leu или Val, Xaa в
положении 12 может представлять собой Val или Lys
<220>
<221> прочий_признак
<222> (20)..(20)
<223> Xaa может представлять собой Ile или Val
<400> 47
Xaa Val Gln Leu Xaa Gln Ser Gly Xaa Glu Xaa Xaa Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Xaa Ser Cys Lys Ala Ser Gly Tyr Val Phe Thr
20 25 30
<210> 48
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (3)..(3)
<223> Xaa может представлять собой Lys или Arg
<220>
<221> прочий_признак
<222> (5)..(6)
<223> Xaa в положении 5 может представлять собой Ser или Ala, Xaa в
положении 6 может представлять собой His или Pro
<220>
<221> прочий_признак
<222> (8)..(9)
<223> Xaa в положении 8 может представлять собой Gln или Lys, Xaa в
положении 9 может представлять собой Ser или Gly
<400> 48
Trp Val Xaa Gln Xaa Xaa Gly Xaa Xaa Leu Glu Trp Ile Gly
1 5 10
<210> 49
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (1)..(2)
<223> Xaa в положении 1 может представлять собой Lys или Arg, Xaa в
положении 2 может представлять собой Ala или Val
<220>
<221> прочий_признак
<222> (8)..(8)
<223> Xaa может представлять собой Lys или Thr
<220>
<221> прочий_признак
<222> (10)..(11)
<223> Xaa в положении 10 может представлять собой Ser, Thr или Ile,
Xaa в положении 11 может представлять собой Ser или Arg
<220>
<221> прочий_признак
<222> (18)..(19)
<223> Xaa в положении 18 может представлять собой Leu или Ser, Xaa в
положении 19 может представлять собой Ser или Arg
<220>
<221> прочий_признак
<222> (21)..(21)
<223> Xaa может представлять собой Arg или Thr
<220>
<221> прочий_признак
<222> (23)..(23)
<223> Xaa может представлять собой Glu или Asp
<220>
<221> прочий_признак
<222> (25)..(25)
<223> Xaa может представлять собой Ser или Thr
<400> 49
Xaa Xaa Thr Val Thr Val Asp Xaa Ser Xaa Xaa Thr Ala Tyr Met Glu
1 5 10 15
Leu Xaa Xaa Leu Xaa Ser Xaa Asp Xaa Ala Val Tyr Tyr Cys
20 25 30
<210> 50
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (11)..(11)
<223> Xaa может представлять собой Ala или Ser
<400> 50
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Xaa
1 5 10
<210> 51
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (3)..(3)
<223> Xaa может представлять собой Gln или Val
<220>
<221> прочий_признак
<222> (8)..(11)
<223> Xaa в положении 8 может представлять собой Gln или Pro, Xaa в
положении 9 может представлять собой Lys или Ser, Xaa в положении 10
может представлять собой Phe или Ser, Xaa в положении 11 может
представлять собой Met или Leu
<220>
<221> прочий_признак
<222> (13)..(13)
<223> Xaa может представлять собой Thr или Ala
<220>
<221> прочий_признак
<222> (20)..(20)
<223> Xaa может представлять собой Ser или Thr
<400> 51
Asp Ile Xaa Met Thr Gln Ser Xaa Xaa Xaa Xaa Ser Xaa Ser Val Gly
1 5 10 15
Asp Arg Val Xaa Ile Thr Cys
20
<210> 52
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (8)..(9)
<223> Xaa в положении 8 может представлять собой Gln или Lys, Xaa в
положении 9 может представлять собой Ser или Ala
<400> 52
Trp Tyr Gln Gln Lys Pro Gly Xaa Xaa Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 53
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> прочий_признак
<222> (4)..(4)
<223> Xaa может представлять собой Ser или Asp
<220>
<221> прочий_признак
<222> (7)..(7)
<223> Xaa может представлять собой Ser или Thr
<220>
<221> прочий_признак
<222> (21)..(22)
<223> Xaa в положении 21 может представлять собой Ser или Asn, Xaa в
положении 22 может представлять собой Met или Leu
<220>
<221> прочий_признак
<222> (24)..(24)
<223> Xaa может представлять собой Ser или Pro
<220>
<221> прочий_признак
<222> (27)..(27)
<223> Xaa может представлять собой Leu или Ile
<220>
<221> прочий_признак
<222> (29)..(29)
<223> Xaa может представлять собой Asp или Thr
<400> 53
Gly Val Pro Xaa Arg Phe Xaa Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Xaa Xaa Gln Xaa Glu Asp Xaa Ala Xaa Tyr Phe Cys
20 25 30
<210> 54
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 54
Phe Gly Ser Gly Thr Lys Leu Gly Ile Lys
1 5 10
<210> 55
<211> 114
<212> БЕЛОК
<213> Mus musculus
<400> 55
Gln Val Gln Leu Gln Gln Pro Gly Thr Ala Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Pro Phe Asn Gly Gly Ser Ile Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Lys Ala Ser Leu Thr Val Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp His Phe Asp Tyr Trp Gly Gln Gly Thr Ser Leu Thr Val
100 105 110
Ser Ser
<210> 56
<211> 115
<212> БЕЛОК
<213> Mus musculus
<400> 56
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ala Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Leu Lys Cys Lys Ser Ser Gln Ser Leu Leu Trp Ser
20 25 30
Gly Asn Gln Asn Asn Tyr Leu Ser Trp Tyr Gln Gln Lys Gln Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Gly Ala Ser Ile Arg Glu Ser Trp Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Gly Asn Val Ser Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln His
85 90 95
Asn His Gly Ser Phe Leu Pro Tyr Thr Phe Gly Gly Gly Thr Arg Leu
100 105 110
Glu Ile Lys
115
<210> 57
<211> 121
<212> БЕЛОК
<213> Mus musculus
<400> 57
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Asn
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Met His Pro Asn Ser Gly Ser Ile Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Tyr Tyr Gly Ser Ser Pro Tyr Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 58
<211> 107
<212> БЕЛОК
<213> Mus musculus
<400> 58
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Ser Leu Thr Ile Ser Asn Leu Glu Glu
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asp Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 59
<211> 119
<212> БЕЛОК
<213> Mus musculus
<400> 59
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Pro Ser Tyr
20 25 30
Trp Met His Trp Met Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Gln Pro Ser Thr Ser Gly Thr Ile Tyr Asn Glu Arg Phe
50 55 60
Lys Asn Gln Val Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Gln Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Thr Gly Thr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser
115
<210> 60
<211> 111
<212> БЕЛОК
<213> Mus musculus
<400> 60
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
20 25 30
Gly Asn Ser Phe Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile His Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Thr Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 61
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 61
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Trp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Gln Pro Asn Ser Gly Gly Thr Lys Tyr Asn Asp Gln Phe
50 55 60
Lys Asn Arg Ala Thr Leu Thr Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Thr Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Gly Thr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Ser Ile Ser Ser
115
<210> 62
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 62
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Val Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ile Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Gln Asp Thr Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Asp Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Thr Lys
100 105 110
<210> 63
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 63
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Gln Pro Asn Ser Gly Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Lys Lys Ala Thr Leu Thr Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Thr Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Gly Thr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Thr Leu Thr Val Ser Ser
115
<210> 64
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 64
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Val Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ile Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Gln Asp Thr Ala Thr Tyr Tyr Cys Gln Gln Ser Thr
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 65
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 65
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Val Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Val Thr Val Asp Lys Ser Thr Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Trp Gly Asp Gly Pro Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 66
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 66
Asp Ile Gln Met Thr Gln Ser Gln Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asn Val Gly Ala Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Met Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Tyr Ser Asn Tyr Pro Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Gly Ile Lys
100 105
<210> 67
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 67
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Val Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Val Thr Val Asp Thr Ser Ile Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Trp Gly Asp Gly Pro Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 68
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 68
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asn Val Gly Ala Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Leu Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Tyr Ser Asn Tyr Pro Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Gly Ile Lys
100 105
<210> 69
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 69
Leu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Gln Pro Asn Ser Gly Gly Thr Lys Tyr Asn Asp Gln Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Gly Thr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Ser Ile Ser Ser
115
<210> 70
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 70
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Val Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ile Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asn Asp Thr Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Asp Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Thr Lys
100 105 110
<210> 71
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 71
Leu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Trp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Gln Pro Asn Ser Gly Gly Thr Lys Tyr Asn Asp Gln Phe
50 55 60
Lys Asn Arg Ala Thr Leu Thr Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Thr Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Gly Thr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Ser Ile Ser Ser
115
<210> 72
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 72
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Val Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ile Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asn Asp Thr Ala Thr Tyr Tyr Cys His Gln Ser Asn
85 90 95
Asp Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Thr Lys
100 105 110
<210> 73
<211> 119
<212> БЕЛОК
<213> Mus musculus
<400> 73
Leu Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Trp Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Gln Pro Asn Ser Gly Gly Thr Lys Tyr Asn Asp Gln Phe
50 55 60
Lys Asn Arg Ala Thr Leu Thr Val Asp Lys Ser Ser Thr Thr Ala Ser
65 70 75 80
Met Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Gly Thr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Ser Ile Ser Ser
115
<210> 74
<211> 111
<212> БЕЛОК
<213> Mus musculus
<400> 74
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Thr Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ile Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys His Gln Ser Asn
85 90 95
Asp Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Thr Lys
100 105 110
<210> 75
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 75
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Gln Pro Asn Ser Gly Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Lys Lys Ala Thr Leu Thr Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Thr Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Gly Thr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Thr Leu Thr Val Ser Ser
115
<210> 76
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 76
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Val Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ile Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asn Asp Thr Ala Thr Tyr Tyr Cys Gln Gln Ser Thr
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 77
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 77
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Gln Pro Asn Ser Gly Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Lys Lys Ala Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Gly Thr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Thr Leu Thr Val Ser Ser
115
<210> 78
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 78
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Val Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Asp Ile Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asn Asp Thr Ala Thr Tyr Tyr Cys His Gln Ser Thr
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 79
<211> 119
<212> БЕЛОК
<213> Mus musculus
<400> 79
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Gln Pro Asn Ser Gly Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Lys Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Thr Thr Ala Ser
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Gly Thr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Thr Leu Thr Val Ser Ser
115
<210> 80
<211> 111
<212> БЕЛОК
<213> Mus musculus
<400> 80
Asp Ile Val Leu Thr His Ser Pro Val Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ile Tyr
20 25 30
Gly Asn Ser Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Ser Thr
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 81
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 81
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Val Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Val Thr Val Asp Lys Ser Thr Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Trp Gly Asp Gly Pro Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 82
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 82
Asp Ile Gln Met Thr Gln Ser Gln Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asn Val Gly Ala Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Met Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Tyr Ser Asn Tyr Pro Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Gly Ile Lys
100 105
<210> 83
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 83
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Val Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Val Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Lys Trp Gly Asp Gly Pro Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 84
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 84
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asn Val Gly Ala Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Tyr Ser Asn Tyr Pro Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Gly Ile Lys
100 105
<210> 85
<211> 117
<212> БЕЛОК
<213> Mus musculus
<400> 85
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Val Phe Thr Asp Tyr
20 25 30
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asp Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn His Lys Phe
50 55 60
Lys Gly Lys Ala Thr Val Thr Val Asp Lys Ser Ser Arg Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Lys Trp Gly Asp Gly Pro Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 86
<211> 106
<212> БЕЛОК
<213> Mus musculus
<400> 86
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asn Val Gly Ala Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Met Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Asn Tyr Pro Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Gly Ile Lys
100 105
<210> 87
<211> 98
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 87
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 88
<211> 95
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 88
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ala
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Asn Asn Tyr Pro
85 90 95
<210> 89
<211> 98
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 89
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 90
<211> 99
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 90
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Ser Glu Leu
20 25 30
Gly Ile Asn Leu Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Gln Ala Ser Asn Lys Asp Thr Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asn Asp Thr Ala Asn Tyr Tyr Cys Leu Gln Ser Lys
85 90 95
Asn Phe Pro
<210> 91
<211> 97
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 91
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
1 5 10 15
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr Tyr
20 25 30
Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
35 40 45
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
50 55 60
Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr Met
65 70 75 80
Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg
<210> 92
<211> 99
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 92
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Gln Arg Ala Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Ser Glu Leu
20 25 30
Gly Ile Asn Leu Ile His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Gln Ala Ser Asn Lys Asp Thr Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asn Asp Thr Ala Asn Tyr Tyr Cys Leu Gln Ser Lys
85 90 95
Asn Phe Pro
<210> 93
<211> 342
<212> ДНК
<213> Mus musculus
<400> 93
caggtccagc tgcagcagcc tgggactgca ctggtgaagc ctggggcttc agtgaagctg 60
tcctgcaagg cttctggcta caccttctcc agctactaca tacactgggt gaaacagagg 120
cctggacaag gccttgagtg gattggaaat attaatcctt tcaatggtgg ttctatctac 180
aatgagaagt tcaagaacaa ggcctcgctg actgtagaca catcctccaa cacagcctac 240
atgcagctca gcagcctgac atctgaggac tctgcggtct attattgtgc aaggtggcac 300
tttgactact ggggccaagg cacctctctc acagtctcct ca 342
<210> 94
<211> 345
<212> ДНК
<213> Mus musculus
<400> 94
gacattgtga tgacccagtc tccatcctcc ctggctgtga cagcaggaga gaaggtcact 60
ttgaaatgca agtccagtca gagtcttttg tggagtggaa accaaaataa ctacttatcc 120
tggtaccagc agaaacaagg gcagcctcct aaactgctta tctatggggc atccattaga 180
gaatcttggg tccctgatcg attcacagga agtggatctg ggacagactt cactcttacc 240
attggcaatg tgtctgctga agacctagca gtttattact gtcagcacaa tcatggcagc 300
tttctcccct acacgttcgg aggggggacc aggctggaaa taaaa 345
<210> 95
<211> 363
<212> ДНК
<213> Mus musculus
<400> 95
caggtccaac tgcagcagcc tggggctgag ctggtaaagc ctggggcttc agtgaagttg 60
tcctgcaagg cttctggcta cactttcacc agcaactgga tgcactgggt gaagcagagg 120
cctggacaag gccttgagtg gattggaatg atgcatccta atagtggtag tatcaattac 180
aatgagaagt tcaagaacaa ggccacactg actgcagaca aatcctccag cacagcctac 240
atgcaactca gtagcctgac atctgaggac tctgcggtct actactgtgc aagatcctac 300
tacggtagta gcccgtacta ctttgactac tggggccaag gcaccactct cacagtctcc 360
tca 363
<210> 96
<211> 321
<212> ДНК
<213> Mus musculus
<400> 96
gatatccaga tgacacagac tacatcctcc ctgtctgcct ctctgggaga cagagtcacc 60
atcagttgca gggcaagtca ggacattagc aattatttaa actggtatca gcagaaacca 120
gatggaactg ttaaactcct gatctactac acatcaagat tacactcagg agtcccatca 180
aggttcagtg gcagtgggtc tggaacagat ttttctctca ccattagcaa cctggaggaa 240
gaagatattg ccacttactt ttgccagcag ggtgatacgc ttccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa a 321
<210> 97
<211> 357
<212> ДНК
<213> Mus musculus
<400> 97
caggtccaac ttcagcagcc tggggctgag ctggtaaagc ctggggcttc agtgaagttg 60
tcctgcaagg cttctggcta cactttcccc agctactgga tgcactggat gaagcagagg 120
cctggacaag gccttgagtg gattggaatg attcagccta gtacttctgg tactatctac 180
aatgagagat tcaagaacca ggtcacactg actgtagaca aatcttccag cacagcctac 240
atgcaactca gcagccagac atctgaggac tctgcggtct attactgtgc aagaggaact 300
gggacggtgg actactttga ttactggggc caaggcacca ctctcacagt ctcctca 357
<210> 98
<211> 333
<212> ДНК
<213> Mus musculus
<400> 98
gacattgtgc tgacccaatc tccagcttct ttggctgtgt ctctagggca gagggccacc 60
atatcctgca gagccagcga aagtgttgat agttatggca atagttttat acactggtac 120
caacagaagc caggacagcc acccaaactc ctcatccatc gtgcatccaa cctagaatct 180
gggatccctg ccacattcag cggcagtggg tctaggacag acttcaccct caccataaat 240
cctgtggagg ctgatgatgt tgcaacctat tactgtcaac aaagtaagga ggacccgtac 300
acgttcggag gggggaccaa gctggaaata aaa 333
<210> 99
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 99
caggtgcagc tggtgcagag cggcgcagaa gtggtcaagc caggagcctc agtgaagatc 60
agctgcaagg ccagcggcta cgtgttcacc gactactata tgaactgggt gaaacaggca 120
ccaggacagg gactggagtg gatcggggat attaacccta acaatggcgg aacaagctac 180
aatcagaagt ttcagggcag ggcaaccgtg acagtggaca aatctactag taccgcctat 240
atggaactgt ctcggctgag aagcgacgat accgctgtgt actattgtgt caagtggggc 300
gacggaccct tcgcatattg gggccagggg acactggtga ctgtcagctc c 351
<210> 100
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 100
gacattcaga tgacacagtc tcagagtagc ctgtcagcca gcgtgggcga ccgagtcacc 60
atcacatgcc aggccagtca gaacgtggga gccgctgtcg cttggtacca gcagaagcca 120
ggcaaagctc ccaagctgct gatctactcc gcatctaatc ggtacacagg ggtgcccagc 180
agattcagtg gctcagggag cggaactgac tttactctga ccatcagctc catgcagcct 240
gaagatattg ccacctactt ctgccagcag tactcaaact atccaacctt tggcagcggg 300
acaaaactgg ggatcaag 318
<210> 101
<211> 360
<212> ДНК
<213> Mus musculus
<400> 101
caggtccaac tgcagcagtc tggggctgag ttggtaaagc cgggggcttc agtgaagttg 60
tcctgcaagg cttctggcta cactttcacc agctactgga tgcactgggt gtggcagagg 120
cctggacaag gccttgagtg gattggaatg attcatccta atagtgatat tactaactgc 180
aatgagaatt tcaagcacac ggtcacactg actgttgaca aatcctccag tacagcctac 240
atgcaactca gcagcctgac atctgaggac tctgcggtct tttactgtgc aagatcggac 300
ggtagtagct actggtactt cgatgtctgg ggcacaggga ccacggtcac cgtctcctca 360
<210> 102
<211> 322
<212> ДНК
<213> Mus musculus
<400> 102
agtattgtga tgacccagac tcccaaattc ctgtctgtat cagcaggaga cagggttacc 60
ataacctgca aggccggtca gagtgtgaat aatgatgtag cttggtacca acagaagcca 120
gggcagtctc ctaaactgct gatatattat gcatccaatc gttatactgg agtccctgat 180
cgcttcactg gcagtggata tgggacggat ttcactttca ccatcagcac tgtgcaggct 240
gaagacctgg cagtttattt ctgtcagcag gattttagct ctccgctcac gttcggtgct 300
gggaccaagc tggaactgaa ac 322
<210> 103
<211> 322
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 103
agtattgtga tgacccagac tcccaaattc ctgtctgtat cagcaggaga cagggttacc 60
ataacctgca aggccggtca gagtgtgaat aatgatgtag cttggtacca acagaagcca 120
gggcagtctc ctaaactgct gatatattat gcatccaatc gttatactgg agtccctgat 180
cgcttcactg gcagtggata tgggacggat ttcactttca ccatcagcac tgtgcaggct 240
gaagacctgg cagtttattt ctgtcagcag gattttagct ctccgctcac gttcggtgct 300
gggaccaagc tggaactgaa ac 322
<210> 104
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 104
gacatcgtgc tgacccagag ccccgccagc ctggccgtga gcgtgggcca gagagccacc 60
atcacctgca gagccagcga gagcgtggac atctacggca acagcttcat gcattggtat 120
caacagaagc ccggccaggc ccccaagctg ctgatctatc gggccagcaa cctggagagc 180
ggcatccccg ccagattcag cggcagcggc agcagaaccg acttcaccct gaccatcaac 240
cccgtggagg ccaacgacac cgccacctac tactgccaac agagcaacga cgacccctac 300
accttcggcg gcggcaccaa gctggagacc aag 333
<210> 105
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 105
caggtgcagc tggtgcagag cggcgccgag gtgaagaagc ccggcgccag cgtgaagctg 60
agctgcaagg ccagcggcta catcttcacc acctactgga tgcactgggt gaagcagaga 120
cccggccagg gcctggagtg gatcggcatg atccagccca acagcggcgg caccaagtac 180
aacgagaagt tcaagaagaa ggccaccctg accgtggaca agagcatcag caccgcctac 240
atggagctga gcagactgac cagcgacgac accgccgtgt actactgcgc cagaggcgcc 300
ggcaccgtgg actacttcga ctactggggc cagggcagca ccctgaccgt ctcgagc 357
<210> 106
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 106
gacatcgtgc tgacccagag ccccgccagc ctggccgtga gcgtgggcca gagagccacc 60
atcacctgca gagccagcga gagcgtggac atctacggca acagcttcat gcattggtat 120
caacagaagc ccggccagcc ccccaagctg ctgatctatc gggccagcaa cctggagagc 180
ggcatccccg ccagattcag cggcagcggc agcagaaccg acttcaccct gaccatcaac 240
cccgtggagg ccaacgacac cgccacctac tactgccagc agagcaccga agacccctac 300
accttcggcg gcggcaccaa gctggagatc aag 333
<210> 107
<211> 464
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 107
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val
20 25 30
Glu Tyr Gly Ser Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys
35 40 45
Gln Leu Asp Leu Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys
50 55 60
Asn Ile Ile Gln Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His
65 70 75 80
Ser Ser Tyr Arg Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu
85 90 95
Gly Asn Ala Ala Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly
100 105 110
Val Tyr Arg Cys Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile
115 120 125
Thr Val Lys Val Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu
130 135 140
Val Val Asp Pro Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu
145 150 155 160
Gly Tyr Pro Lys Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val
165 170 175
Leu Ser Gly Lys Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu
180 185 190
Phe Asn Val Thr Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile
195 200 205
Phe Tyr Cys Thr Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala
210 215 220
Glu Leu Val Ile Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg
225 230 235 240
Glu Asn Leu Tyr Phe Gln Gly Ala Pro Glu Leu Leu Gly Gly Pro Ser
245 250 255
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
260 265 270
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
275 280 285
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
290 295 300
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
305 310 315 320
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
325 330 335
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
340 345 350
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
355 360 365
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
370 375 380
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
385 390 395 400
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
405 410 415
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
420 425 430
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
435 440 445
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 108
<211> 1416
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 108
aagcttgccg ccaccatgga aaccgacact ctgctgctgt gggtgctgct gctgtgggtg 60
ccagggtcaa ccgggttcac cgtgacagtg cccaaggacc tgtacgtggt ggagtacggc 120
agcaacatga ccatcgagtg caagttcccc gtggagaagc agctggatct ggccgccctg 180
atcgtgtatt gggagatgga ggacaagaac atcatccagt tcgtgcacgg cgaagaggac 240
ctgaaggtgc agcacagcag ctacaggcag agggccagac tgctgaagga ccagctgtct 300
ctgggaaacg cagctctgca gatcaccgac gtgaagctgc aggacgcagg agtctaccgc 360
tgcatgatca gctacggcgg agccgactac aagaggatca ccgtgaaggt caacgccccc 420
tacaacaaga tcaaccagag aatcctggtg gtggaccccg tgaccagcga gcacgagctg 480
acttgtcagg cagagggcta ccccaaggcc gaagtgattt ggaccagcag cgaccatcag 540
gtgctgagcg gaaagaccac caccaccaac agcaagcggg aggagaagct gttcaacgtg 600
accagcaccc tgcggatcaa caccaccacc aacgagatct tctactgcac cttccggaga 660
ctggacccag aggagaacca cacagccgag ctggtcatcc cagaactgcc tctggctcac 720
cctcctaacg agagagagaa tctgtatttt cagggagcac cagaactgct gggaggacca 780
tccgtgttcc tgtttccacc caaacctaag gacaccctga tgattagcag aacaccagaa 840
gtcacttgcg tggtcgtgga cgtgtcccac gaggaccccg aagtcaaatt caactggtac 900
gtggatggcg tcgaggtgca taatgctaag accaaaccaa gagaggaaca gtacaacagc 960
acctataggg tcgtgtccgt cctgacagtg ctgcaccagg actggctgaa cggaaaggag 1020
tataaatgca aggtgtctaa caaggccctg ccagctccca tcgagaagac tattagtaaa 1080
gctaagggcc agccccgcga acctcaggtg tacaccctgc ctccatcccg agacgagctg 1140
accaagaacc aggtctctct gacttgtctg gtgaagggat tctatccatc agatatcgca 1200
gtggagtggg aaagcaatgg ccagcccgag aacaattaca agactacccc ccctgtgctg 1260
gactccgatg gctctttctt tctgtattct aaactgaccg tggataagag tcggtggcag 1320
caggggaatg tcttttcatg cagcgtgatg cacgaggcac tgcacaatca ttacactcag 1380
aagtccctgt cactgtcacc tggaaagtag ggatcc 1416
<210> 109
<211> 65
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 109
tatagggaga cccaagctgg ctagcgttta aacttaagct tgccgccacc atggaaaccg 60
acact 65
<210> 110
<211> 70
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 110
tggatatctg cagaattcca ccacactgga ctagtggatc cctactttcc aggtgacagt 60
gacagggact 70
<210> 111
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 111
cacggggaac ttgcactcga tggtggcgtt gctgccgtac tccaccacgt acaggtcctt 60
gg 62
<210> 112
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 112
tacgtggtgg agtacggcag caacgccacc atcgagtgca agttccccgt ggagaagcag 60
ct 62
<210> 113
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 113
cttctccacg gggaacttgc actcggcggt catgttgctg ccgtactcca ccacgtacag 60
gt 62
<210> 114
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 114
gtggagtacg gcagcaacat gaccgccgag tgcaagttcc ccgtggagaa gcagctggat 60
ct 62
<210> 115
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 115
atccagctgc ttctccacgg ggaaggcgca ctcgatggtc atgttgctgc cgtactccac 60
ca 62
<210> 116
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 116
ggcagcaaca tgaccatcga gtgcgccttc cccgtggaga agcagctgga tctggccgcc 60
ct 62
<210> 117
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 117
cacgatcagg gcggccagat ccagggcctt ctccacgggg aacttgcact cgatggtcat 60
gt 62
<210> 118
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 118
gagtgcaagt tccccgtgga gaaggccctg gatctggccg ccctgatcgt gtattgggag 60
at 62
<210> 119
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 119
catctcccaa tacacgatca gggcgctcag atccagctgc ttctccacgg ggaacttgca 60
ct 62
<210> 120
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 120
cccgtggaga agcagctgga tctgagcgcc ctgatcgtgt attgggagat ggaggacaag 60
aa 62
<210> 121
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 121
tcttgtcctc catctcccaa tacacggcca gggcggccag atccagctgc ttctccacgg 60
gg 62
<210> 122
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 122
aagcagctgg atctggccgc cctggccgtg tattgggaga tggaggacaa gaacatcatc 60
ca 62
<210> 123
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 123
gaactggatg atgttcttgt cctcggcctc ccaatacacg atcagggcgg ccagatccag 60
ct 62
<210> 124
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 124
gccgccctga tcgtgtattg ggaggccgag gacaagaaca tcatccagtt cgtgcacggc 60
ga 62
<210> 125
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 125
gccgtgcacg aactggatga tgttggcgtc ctccatctcc caatacacga tcagggcggc 60
ca 62
<210> 126
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 126
atcgtgtatt gggagatgga ggacgccaac atcatccagt tcgtgcacgg cgaagaggac 60
ct 62
<210> 127
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 127
ttcgccgtgc acgaactgga tgatggcctt gtcctccatc tcccaataca cgatcagggc 60
gg 62
<210> 128
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 128
gtgtattggg agatggagga caaggccatc atccagttcg tgcacggcga agaggacctg 60
aa 62
<210> 129
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 129
ctcttcgccg tgcacgaact ggatggcgtt cttgtcctcc atctcccaat acacgatcag 60
gg 62
<210> 130
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 130
tattgggaga tggaggacaa gaacgccatc cagttcgtgc acggcgaaga ggacctgaag 60
gt 62
<210> 131
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 131
ctgcaccttc aggtcctctt cgccggccac gaactggatg atgttcttgt cctccatctc 60
cc 62
<210> 132
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 132
gacaagaaca tcatccagtt cgtggccggc gaagaggacc tgaaggtgca gcacagcagc 60
ta 62
<210> 133
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 133
cctctgcctg tagctgctgt gctgggcctt caggtcctct tcgccgtgca cgaactggat 60
ga 62
<210> 134
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 134
gtgcacggcg aagaggacct gaaggcccag cacagcagct acaggcagag ggccagactg 60
ct 62
<210> 135
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 135
cagcagtctg gccctctgcc tgtaggcgct gtgctgcacc ttcaggtcct cttcgccgtg 60
ca 62
<210> 136
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 136
gaggacctga aggtgcagca cagcgcctac aggcagaggg ccagactgct gaaggaccag 60
ct 62
<210> 137
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 137
cttcagcagt ctggccctct gcctggcgct gctgtgctgc accttcaggt cctcttcgcc 60
gt 62
<210> 138
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 138
gacctgaagg tgcagcacag cagcgccagg cagagggcca gactgctgaa ggaccagctg 60
tc 62
<210> 139
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 139
ctggtccttc agcagtctgg ccctggccct gtagctgctg tgctgcacct tcaggtcctc 60
tt 62
<210> 140
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 140
aaggtgcagc acagcagcta cagggccagg gccagactgc tgaaggacca gctgtctctg 60
gg 62
<210> 141
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 141
cagagacagc tggtccttca gcagggcggc cctctgcctg tagctgctgt gctgcacctt 60
ca 62
<210> 142
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 142
cacagcagct acaggcagag ggccgccctg ctgaaggacc agctgtctct gggaaacgca 60
gc 62
<210> 143
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 143
gtttcccaga gacagctggt ccttggccag tctggccctc tgcctgtagc tgctgtgctg 60
ca 62
<210> 144
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 144
agctacaggc agagggccag actggccaag gaccagctgt ctctgggaaa cgcagctctg 60
ca 62
<210> 145
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 145
gatctgcaga gctgcgtttc ccagggccag ctggtccttc agcagtctgg ccctctgcct 60
gt 62
<210> 146
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 146
gccagactgc tgaaggacca gctggccctg ggaaacgcag ctctgcagat caccgacgtg 60
aa 62
<210> 147
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 147
ggtgatctgc agagctgcgt ttccggcaga cagctggtcc ttcagcagtc tggccctctg 60
cc 62
<210> 148
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 148
agactgctga aggaccagct gtctgccgga aacgcagctc tgcagatcac cgacgtgaag 60
ct 62
<210> 149
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 149
ctgtgggtgc cagggtcaac cggggccacc gtgacagtgc ccaaggacct gtacgtggtg 60
ga 62
<210> 150
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 150
caggtccttg ggcactgtca cggtggcccc ggttgaccct ggcacccaca gcagcagcac 60
cc 62
<210> 151
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 151
tgggtgccag ggtcaaccgg gttcgccgtg acagtgccca aggacctgta cgtggtggag 60
ta 62
<210> 152
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 152
gtacaggtcc ttgggcactg tcacggcgaa cccggttgac cctggcaccc acagcagcag 60
ca 62
<210> 153
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 153
gggttcaccg tgacagtgcc caaggccctg tacgtggtgg agtacggcag caacatgacc 60
at 62
<210> 154
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 154
gctgccgtac tccaccacgt acagggcctt gggcactgtc acggtgaacc cggttgaccc 60
tg 62
<210> 155
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 155
accgtgacag tgcccaagga cctggccgtg gtggagtacg gcagcaacat gaccatcgag 60
tg 62
<210> 156
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 156
catgttgctg ccgtactcca ccacggccag ggccttgggc actgtcacgg tgaacccggt 60
tg 62
<210> 157
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 157
cccaaggacc tgtacgtggt ggaggccggc agcaacatga ccatcgagtg caagttcccc 60
gt 62
<210> 158
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 158
gcactcgatg gtcatgttgc tgccggcctc caccacgtac agggccttgg gcactgtcac 60
gg 62
<210> 159
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 159
ctggatctgg ccgccctgat cgtggcctgg gagatggagg acaagaacat catccagttc 60
gt 62
<210> 160
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 160
gatgttcttg tcctccatct cccaggccac gatcagggct tccagatcca gctgcttctc 60
ca 62
<210> 161
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 161
ctggccgccc tgatcgtgta ttgggccatg gaggacaaga acatcatcca gttcgtgcac 60
gg 62
<210> 162
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 162
ctggatgatg ttcttgtcct ccatggccca atacacgatc agggcttcca gatccagctg 60
ct 62
<210> 163
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 163
gccctgatcg tgtattggga gatggccgac aagaacatca tccagttcgt gcacggcgaa 60
ga 62
<210> 164
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 164
cacgaactgg atgatgttct tgtcggccat ctcccaatac acgatcaggg cttccagatc 60
ca 62
<210> 165
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 165
ctgatcgtgt attgggagat ggaggccaag aacatcatcc agttcgtgca cggcgaagag 60
ga 62
<210> 166
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 166
gtgcacgaac tggatgatgt tcttggcctc catctcccaa tacacgatca gggcttccag 60
at 62
<210> 167
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 167
gagatggagg acaagaacat catcgccttc gtgcacggcg aagaggacct gaaggtgcag 60
ca 62
<210> 168
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 168
caggtcctct tcgccgtgca cgaaggcgat gatgttcttg tcctccatct cccaatacac 60
ga 62
<210> 169
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 169
ttcgtgcacg gcgaagagga cctggccgtg cagcacagca gctacaggca gagggccaga 60
ct 62
<210> 170
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 170
ctgcctgtag ctgctgtgct gcacggccag gtcctcttcg ccgtgcacga actggatgat 60
gt 62
<210> 171
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 171
ctgaaggtgc agcacagcag ctacgcccag agggccagac tgctgaagga ccagctgtct 60
ct 62
<210> 172
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 172
gtccttcagc agtctggccc tctgggcgta gctgctgtgc tgcaccttca ggtcctcttc 60
gc 62
<210> 173
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 173
aagctgcagg acgcaggagt ctacgcctgc atgatcagct acggcggagc cgactacaag 60
ag 62
<210> 174
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 174
ggctccgccg tagctgatca tgcaggcgta gactcctgcg tcctgcagct tcacgtcggt 60
ga 62
<210> 175
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 175
caggacgcag gagtctaccg ctgcgccatc agctacggcg gagccgacta caagaggatc 60
ac 62
<210> 176
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 176
gtagtcggct ccgccgtagc tgatggcgca gcggtagact cctgcgtcct gcagcttcac 60
gt 62
<210> 177
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 177
gcaggagtct accgctgcat gatcgcctac ggcggagccg actacaagag gatcaccgtg 60
aa 62
<210> 178
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 178
cctcttgtag tcggctccgc cgtaggcgat ggcgcagcgg tagactcctg cgtcctgcag 60
ct 62
<210> 179
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 179
cgctgcatga tcagctacgg cggaagcgac tacaagagga tcaccgtgaa ggtcaacgcc 60
cc 62
<210> 180
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 180
cttcacggtg atcctcttgt agtcgcttcc gccgtagctg atggcgcagc ggtagactcc 60
tg 62
<210> 181
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 181
tgcatgatca gctacggcgg agccgcctac aagaggatca ccgtgaaggt caacgccccc 60
ta 62
<210> 182
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 182
gaccttcacg gtgatcctct tgtaggcggc tccgccgtag ctgatggcgc agcggtagac 60
tc 62
<210> 183
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 183
atgatcagct acggcggagc cgacgccaag aggatcaccg tgaaggtcaa cgccccctac 60
aa 62
<210> 184
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 184
gttgaccttc acggtgatcc tcttggcgtc ggctccgccg tagctgatgg cgcagcggta 60
ga 62
<210> 185
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 185
atcagctacg gcggagccga ctacgccagg atcaccgtga aggtcaacgc cccctacaac 60
aa 62
<210> 186
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 186
ggcgttgacc ttcacggtga tcctggcgta gtcggctccg ccgtagctga tggcgcagcg 60
gt 62
<210> 187
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 187
agctacggcg gagccgacta caaggccatc accgtgaagg tcaacgcccc ctacaacaag 60
at 62
<210> 188
<211> 62
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 188
gggggcgttg accttcacgg tgatgccctt gtagtcggct ccgccgtagc tgatggcgca 60
gc 62
<210> 189
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 189
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Thr Tyr
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Gln Pro Asn Ser Gly Gly Thr Lys Tyr Asn Asp Gln Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Val Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Gly Thr Val Asp Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Leu Ser Ile Ser Ser
115
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ АНТИ-PD-L1 АНТИТЕЛА | 2017 |
|
RU2744959C2 |
| АНТИТЕЛО К PD-L1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778085C2 |
| АНТИТЕЛО К PD-1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2807484C2 |
| PD-L1 специфические антитела | 2017 |
|
RU2756236C2 |
| Анти-PD-L1 и IL-2 цитокины | 2017 |
|
RU2769282C2 |
| ЛЕЧЕНИЕ РАКА КОМБИНАЦИЕЙ АНТАГОНИСТА PD-1 И ДИНАЦИКЛИБА | 2014 |
|
RU2705795C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2016 |
|
RU2733315C2 |
| АНТИТЕЛО К BAG2 И СПОСОБЫ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2020 |
|
RU2815586C2 |
| АНТИТЕЛА К PD-L1, СВЯЗЫВАЮЩИЕ PD-L1 СОБАКИ | 2015 |
|
RU2722562C2 |
| АНТИТЕЛА К PD-L1, СВЯЗЫВАЮЩИЕ PD-L1 СОБАКИ | 2015 |
|
RU2832918C2 |
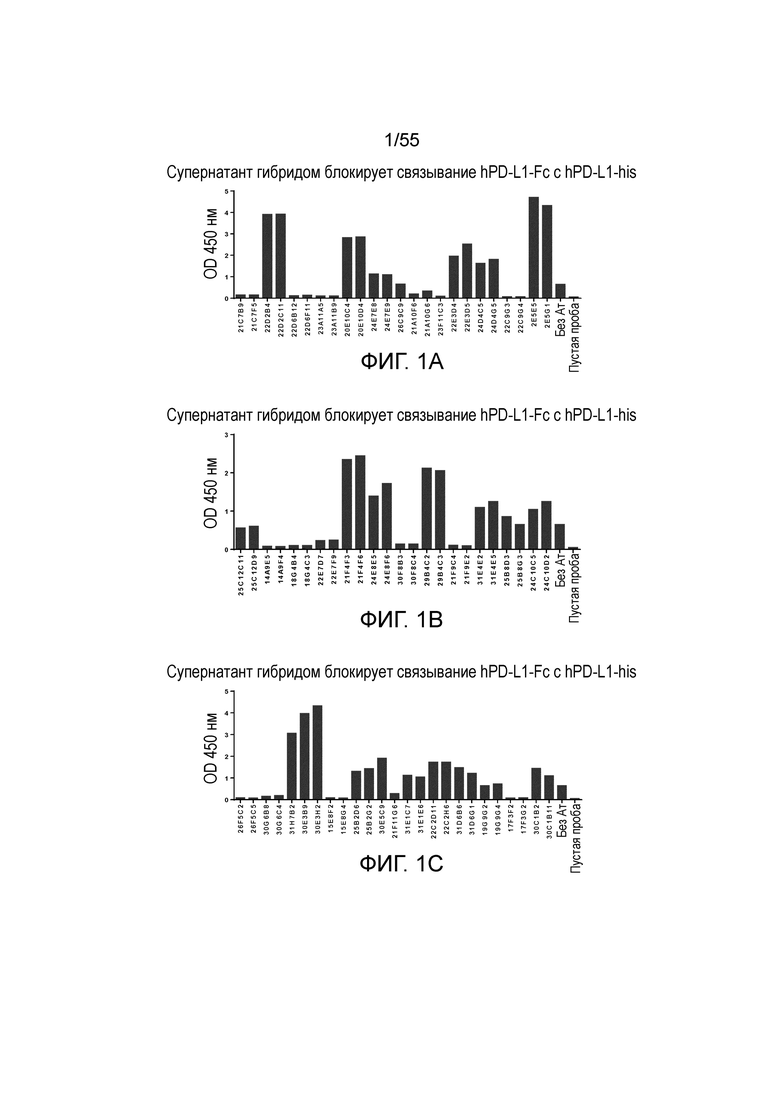
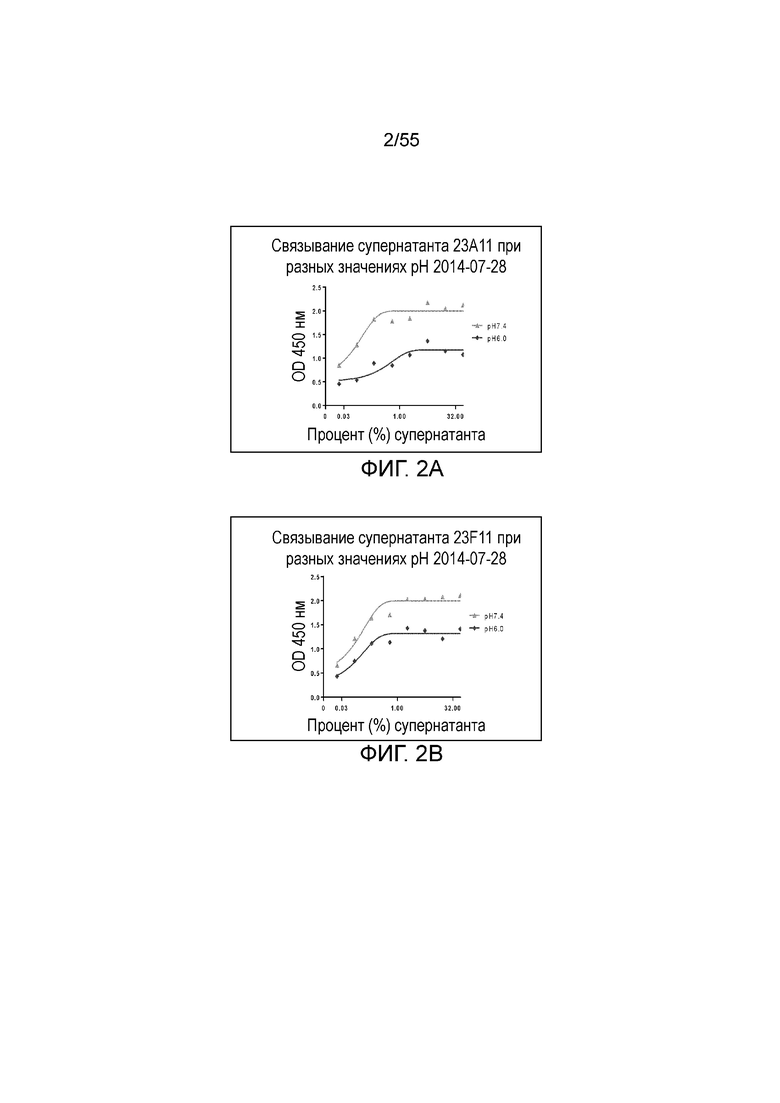
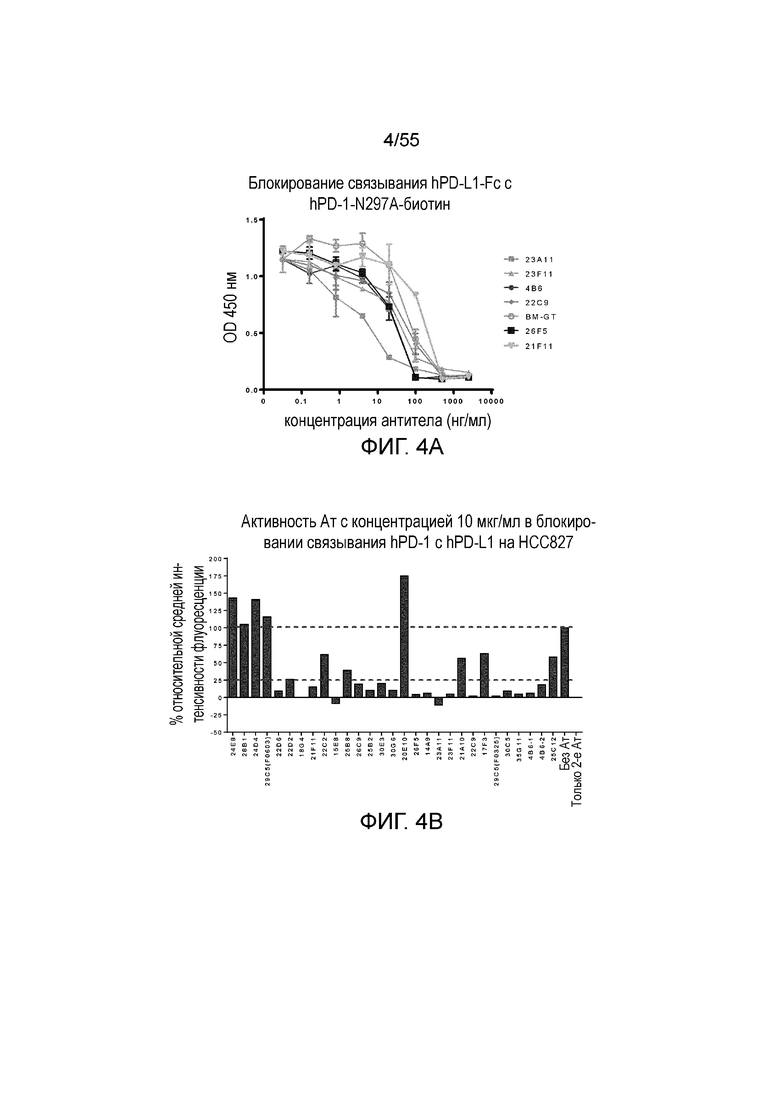
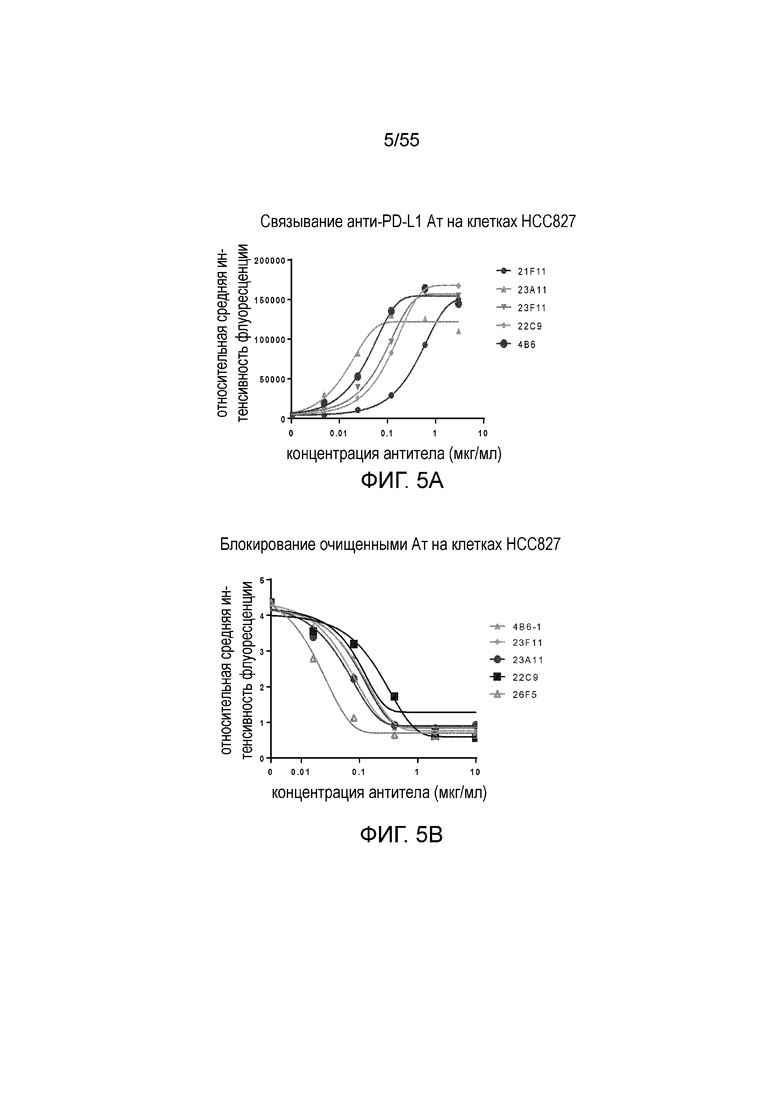
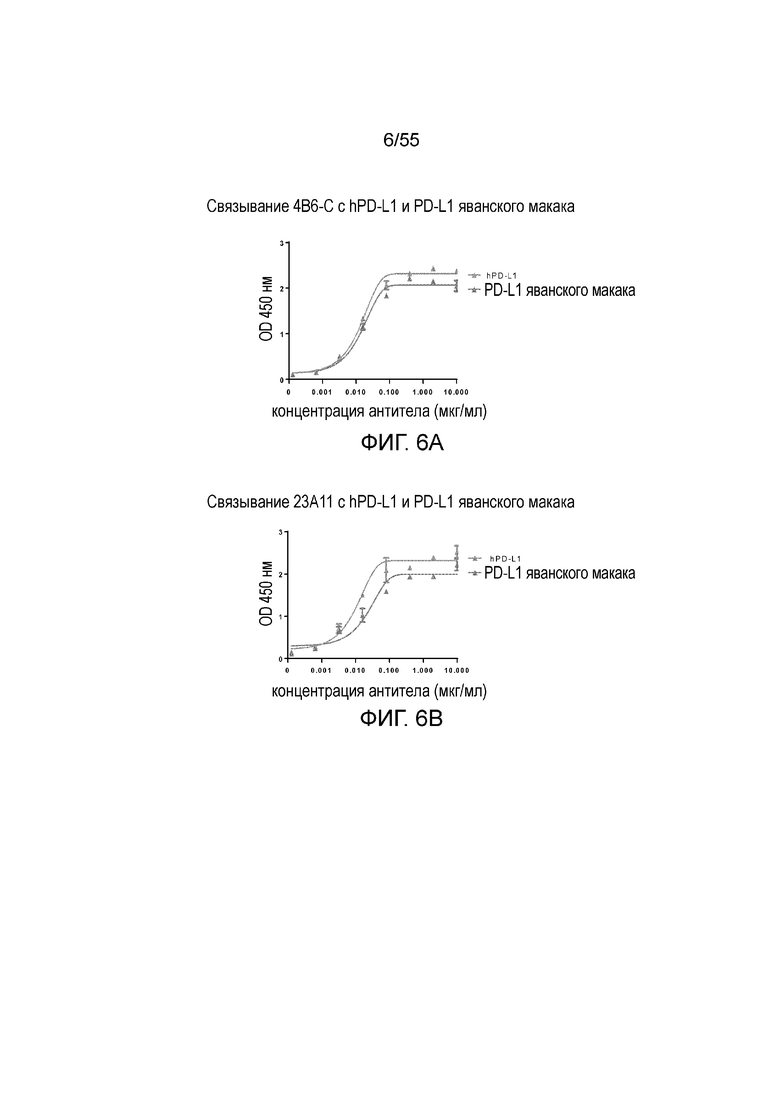
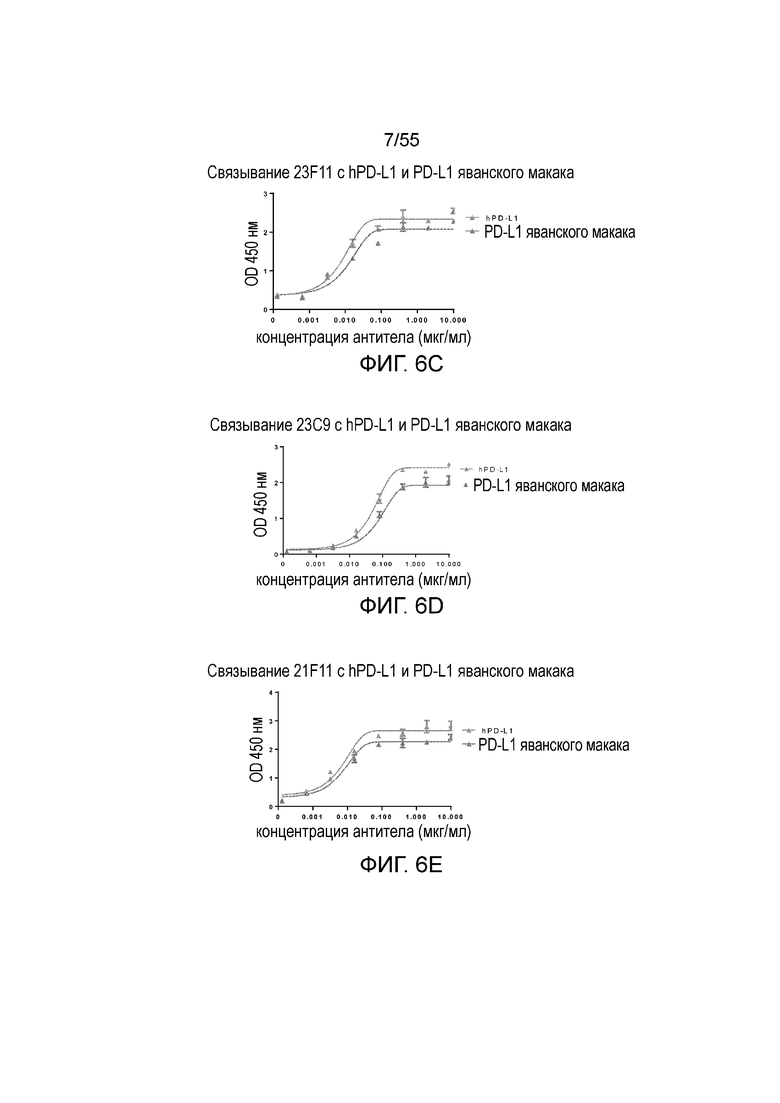
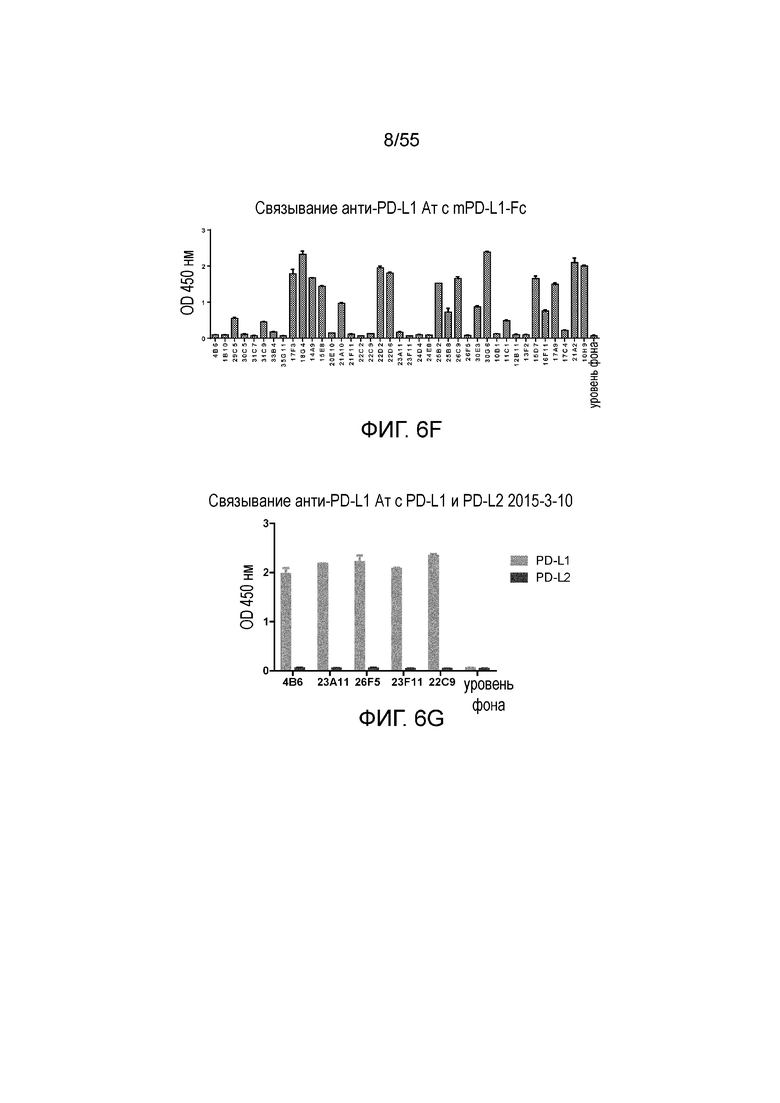
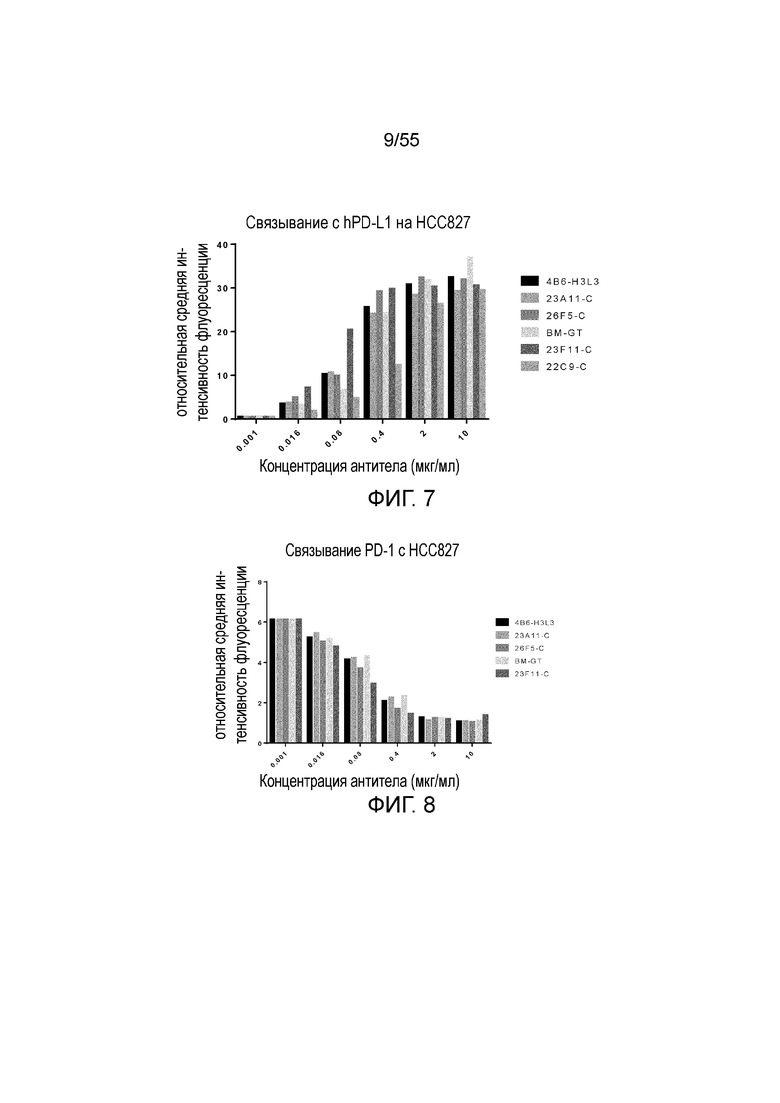
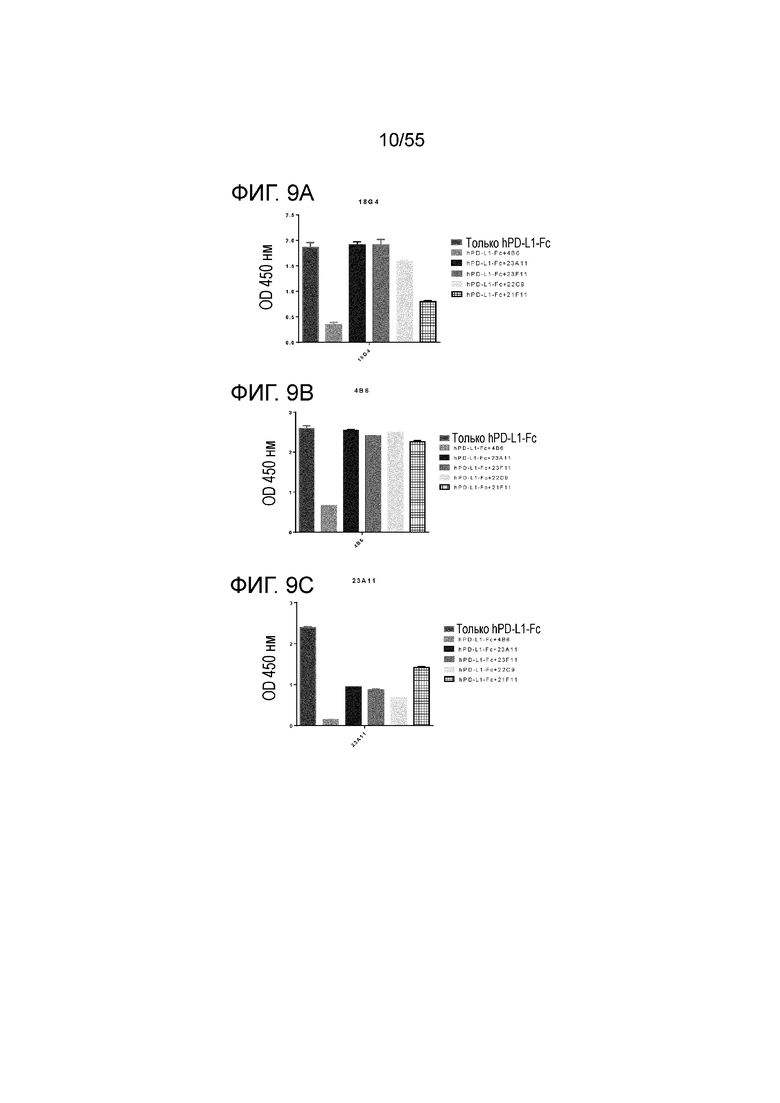
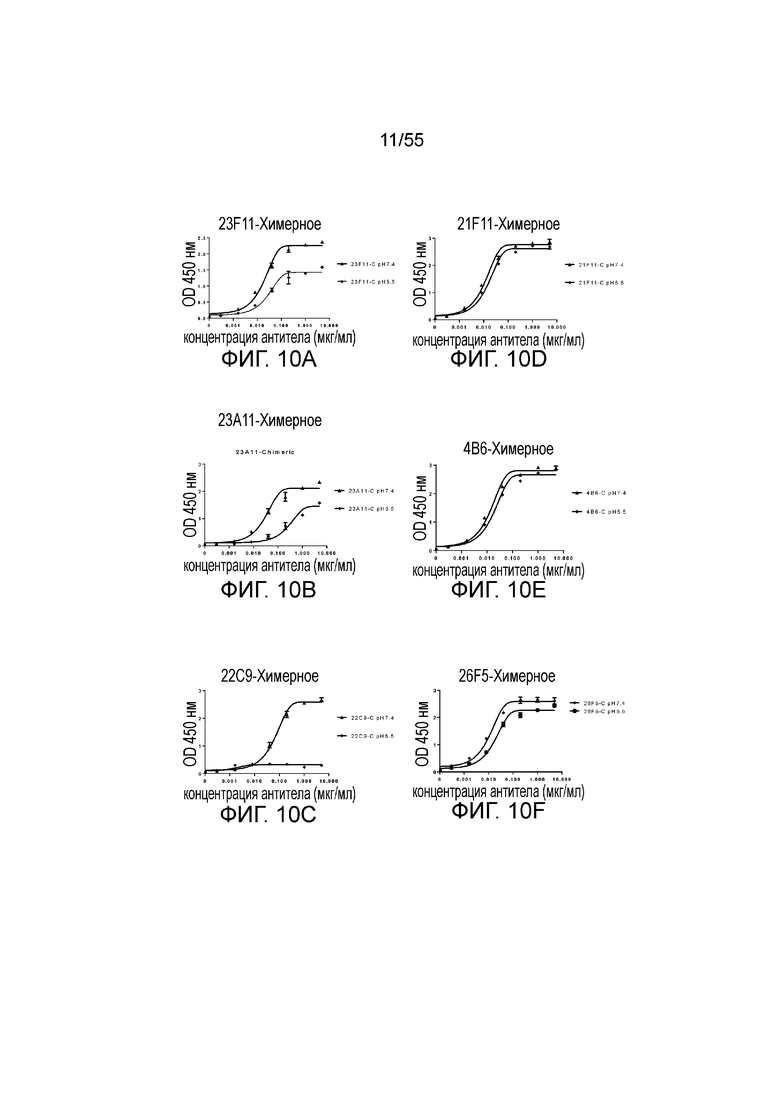
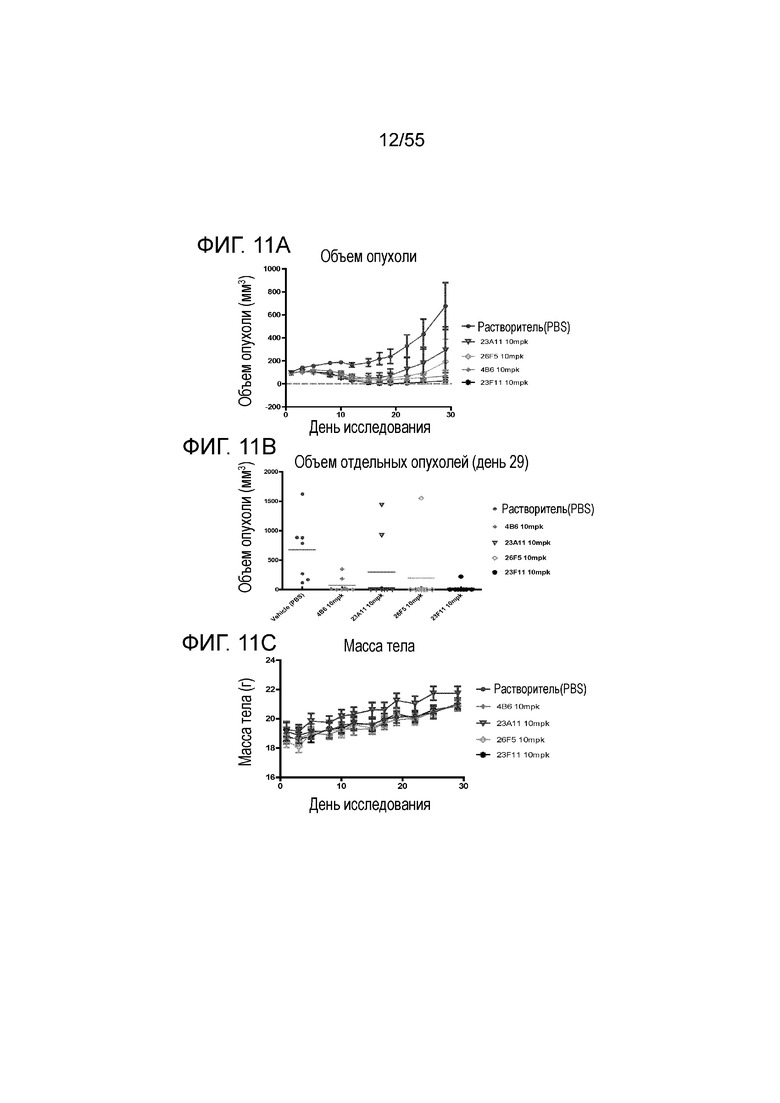
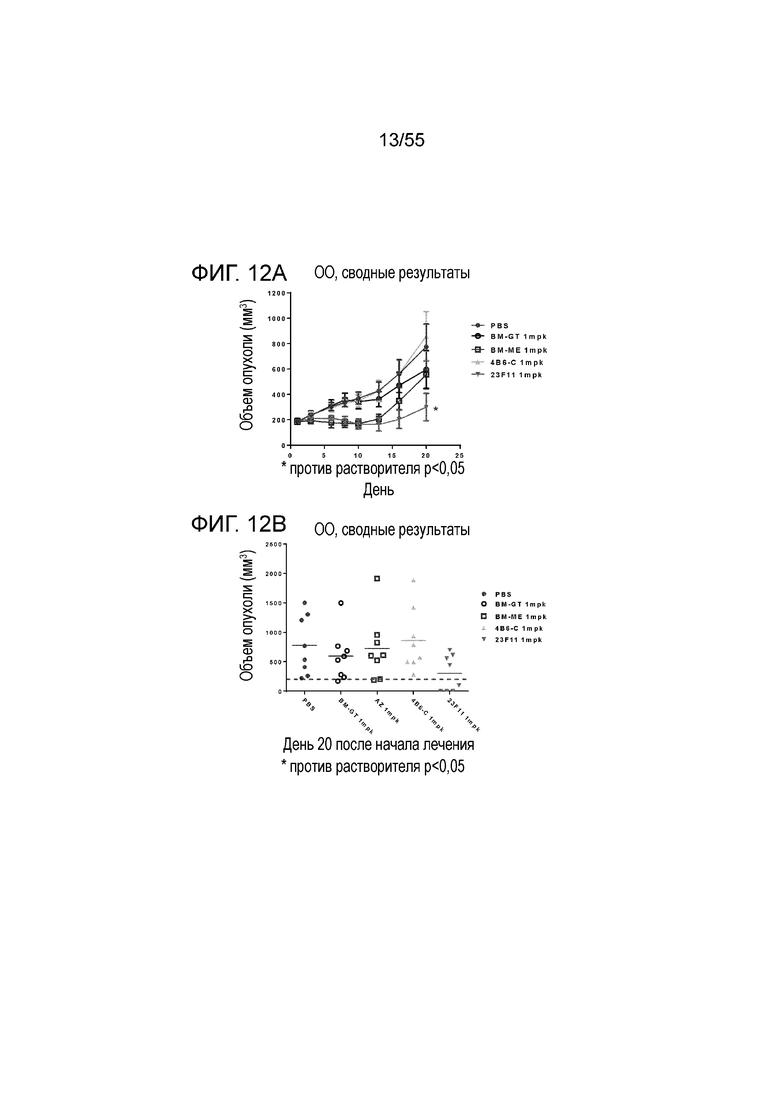
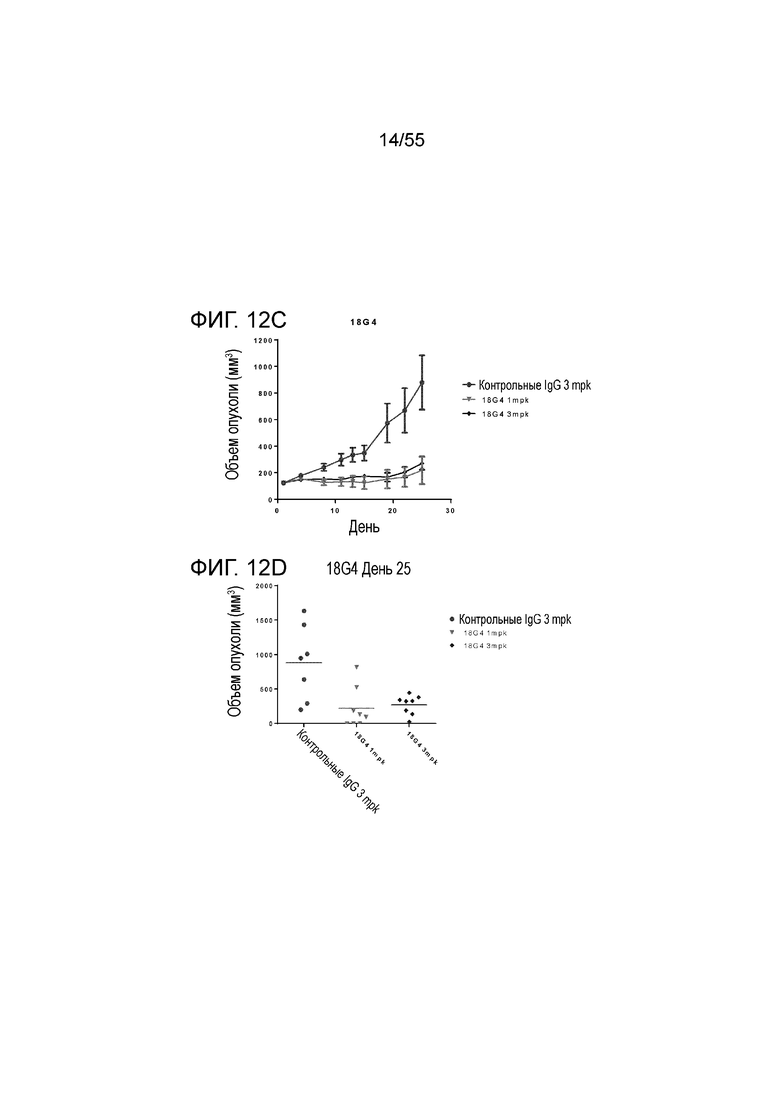
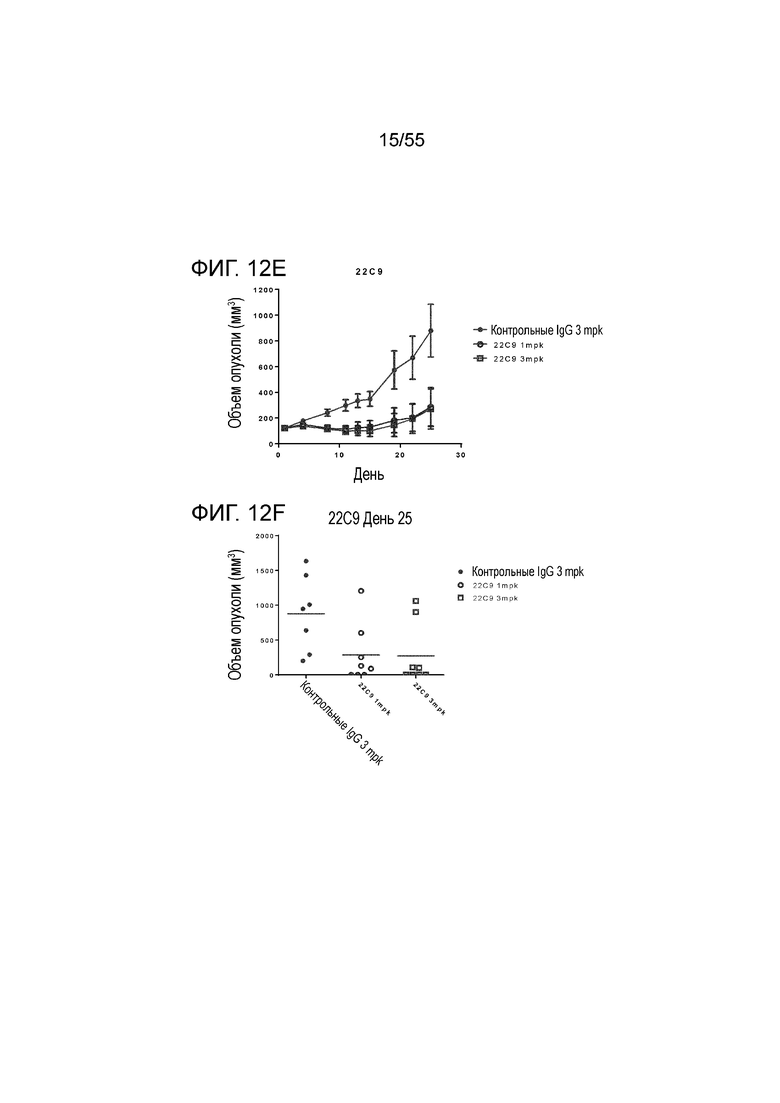
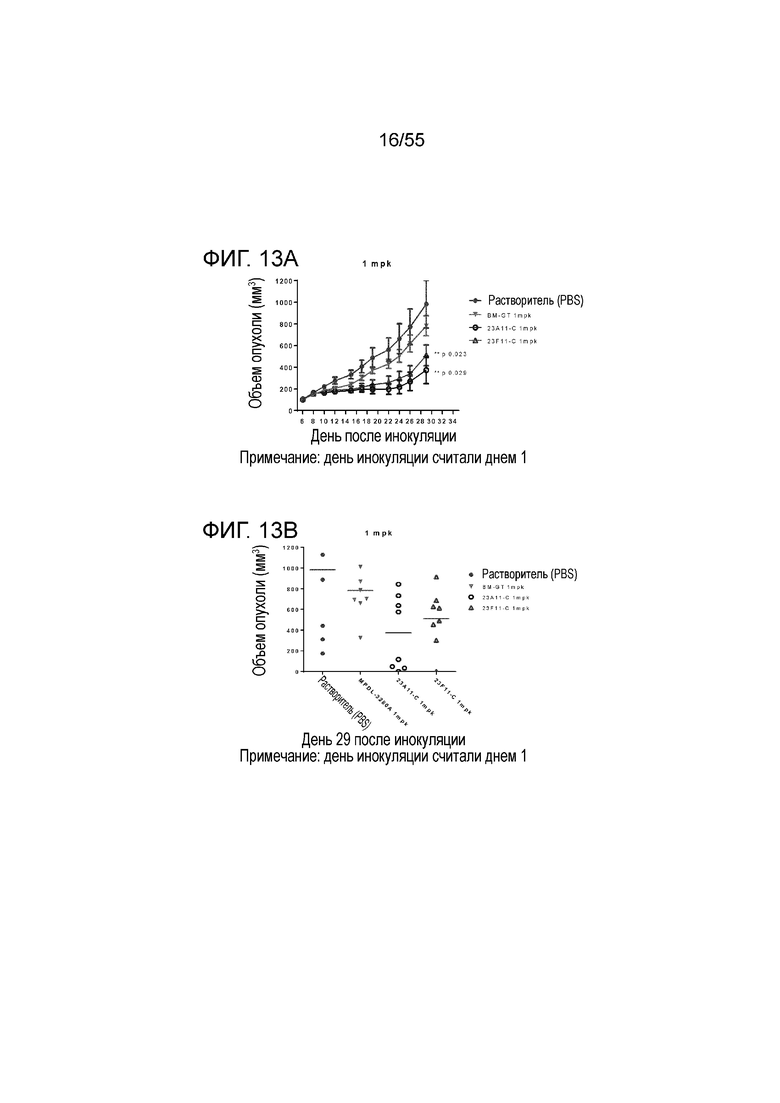
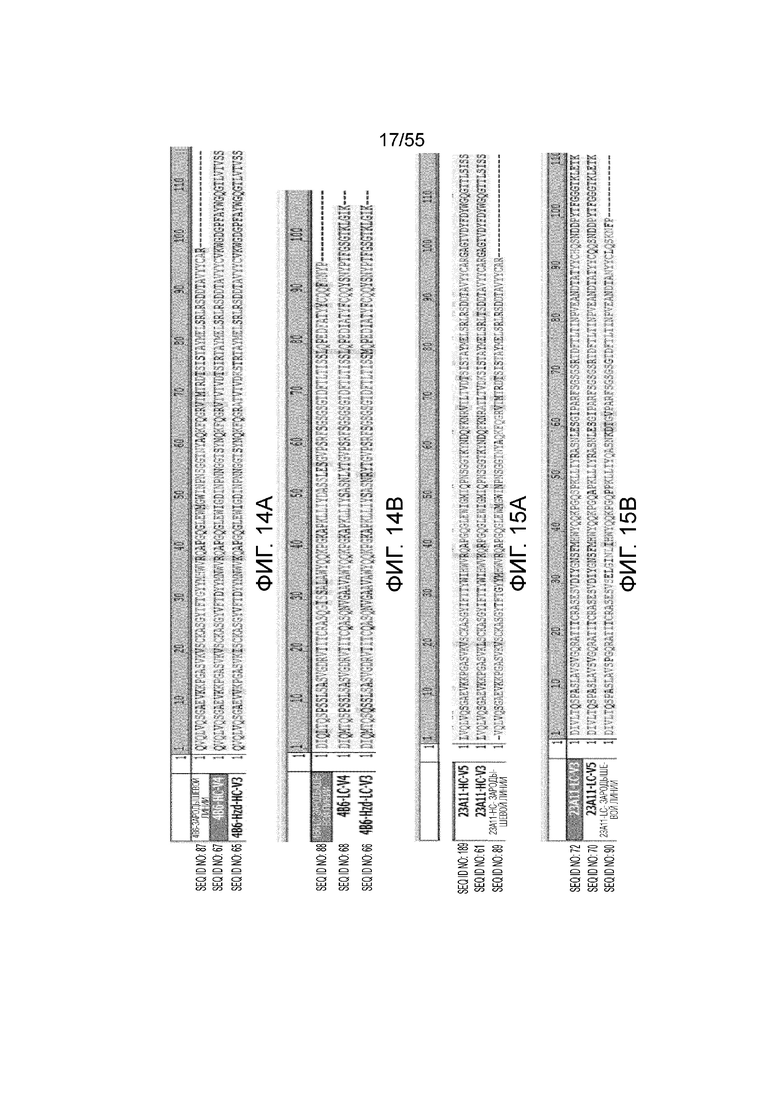
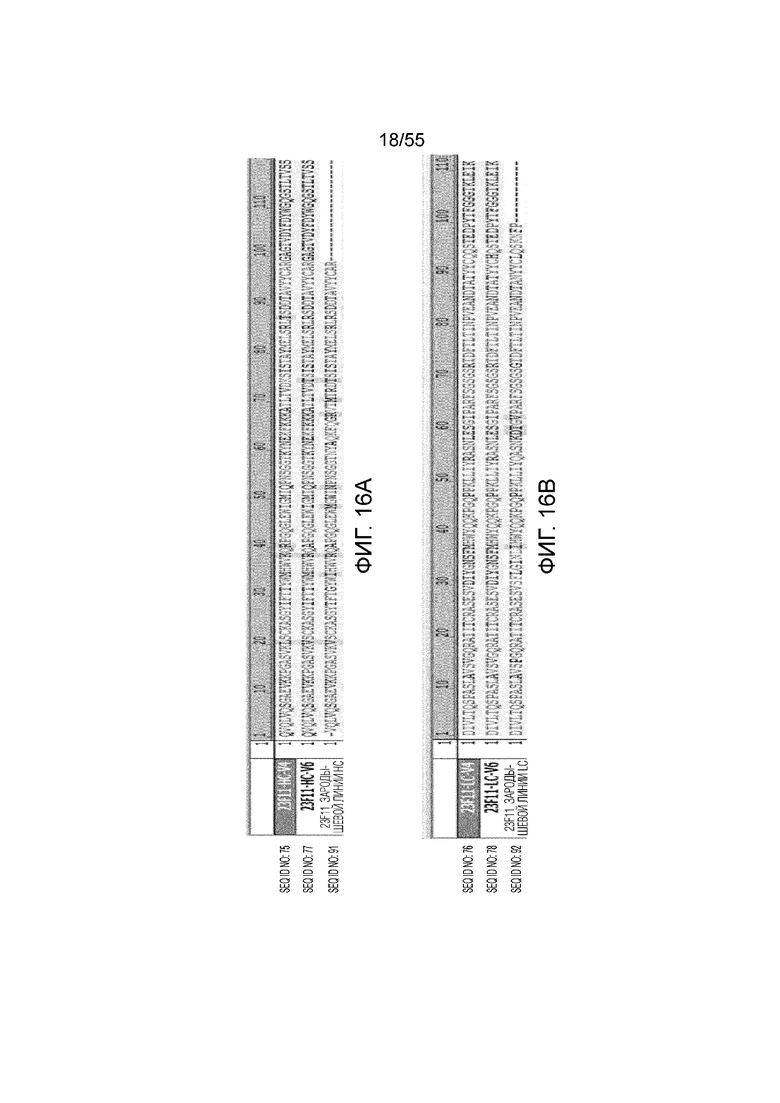
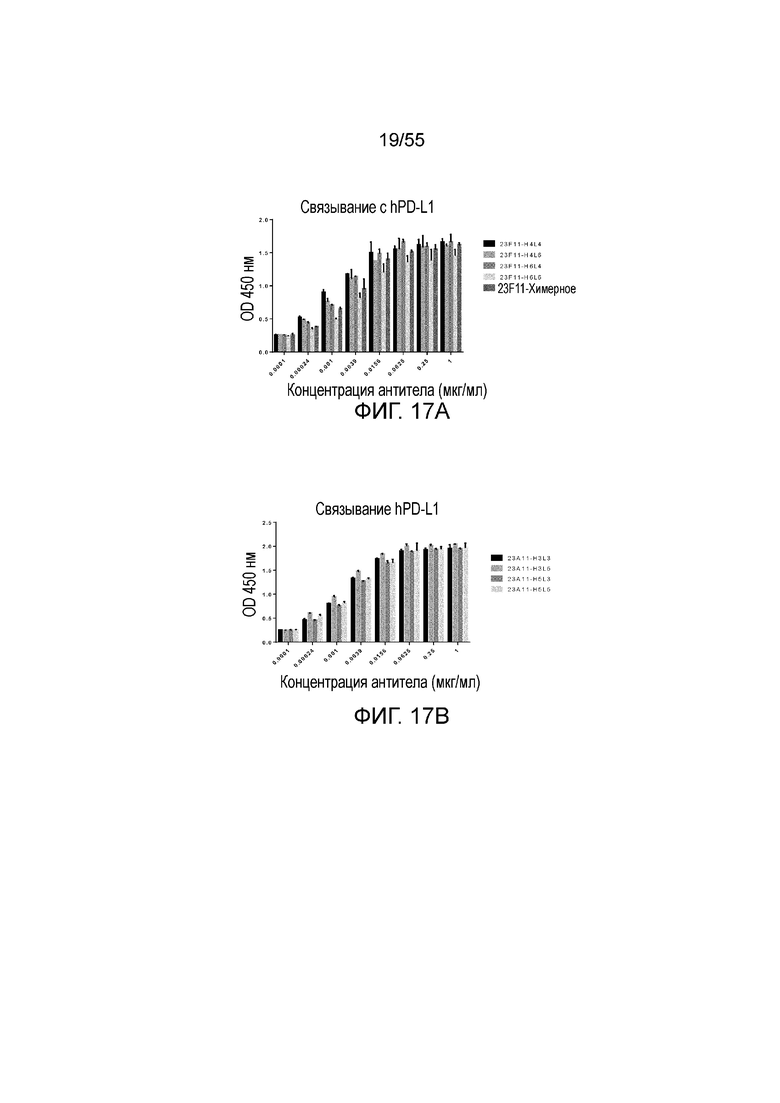
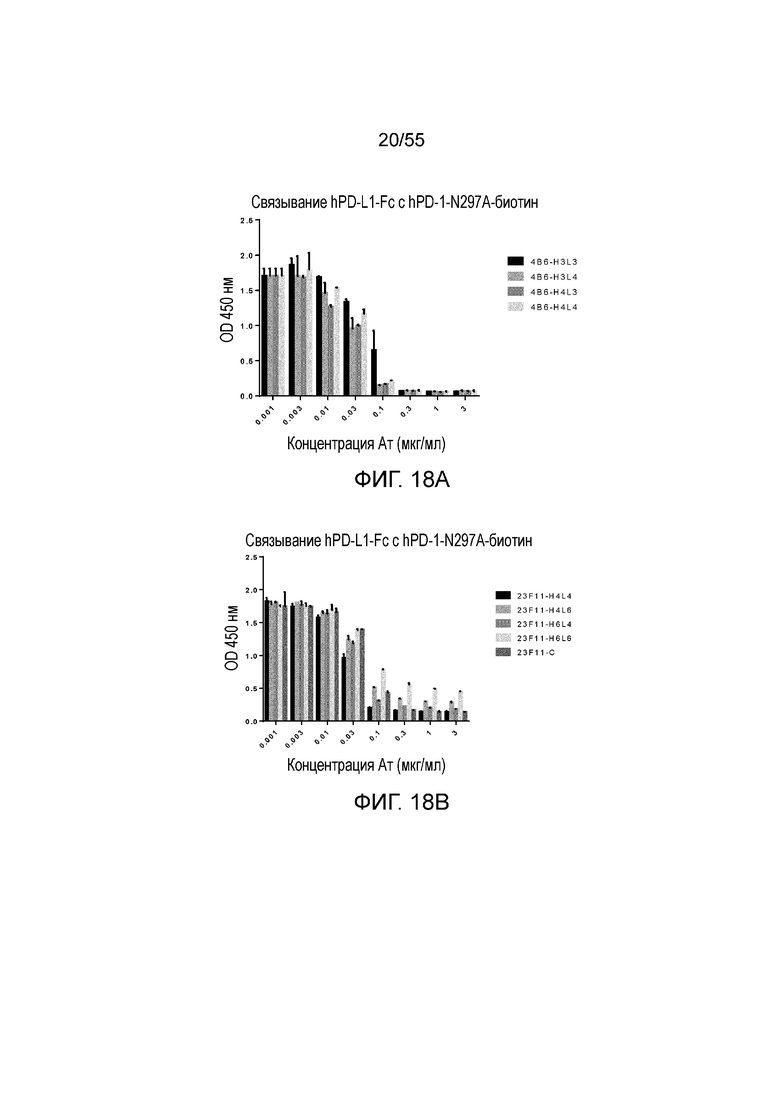
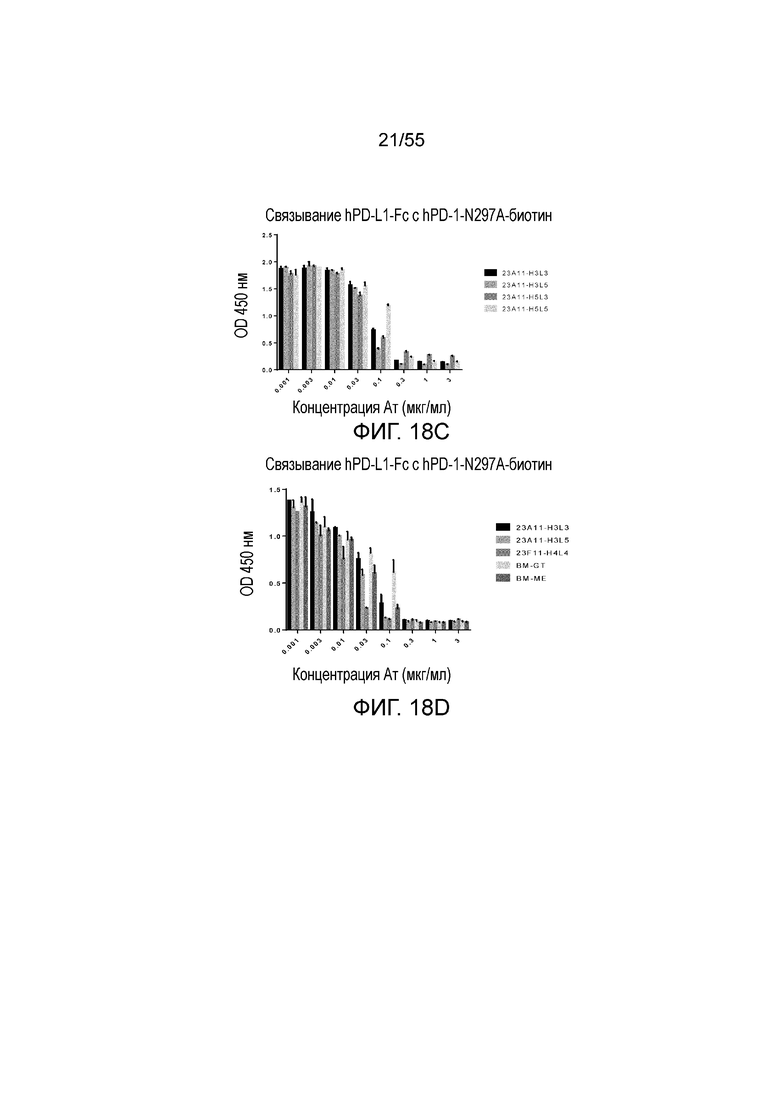
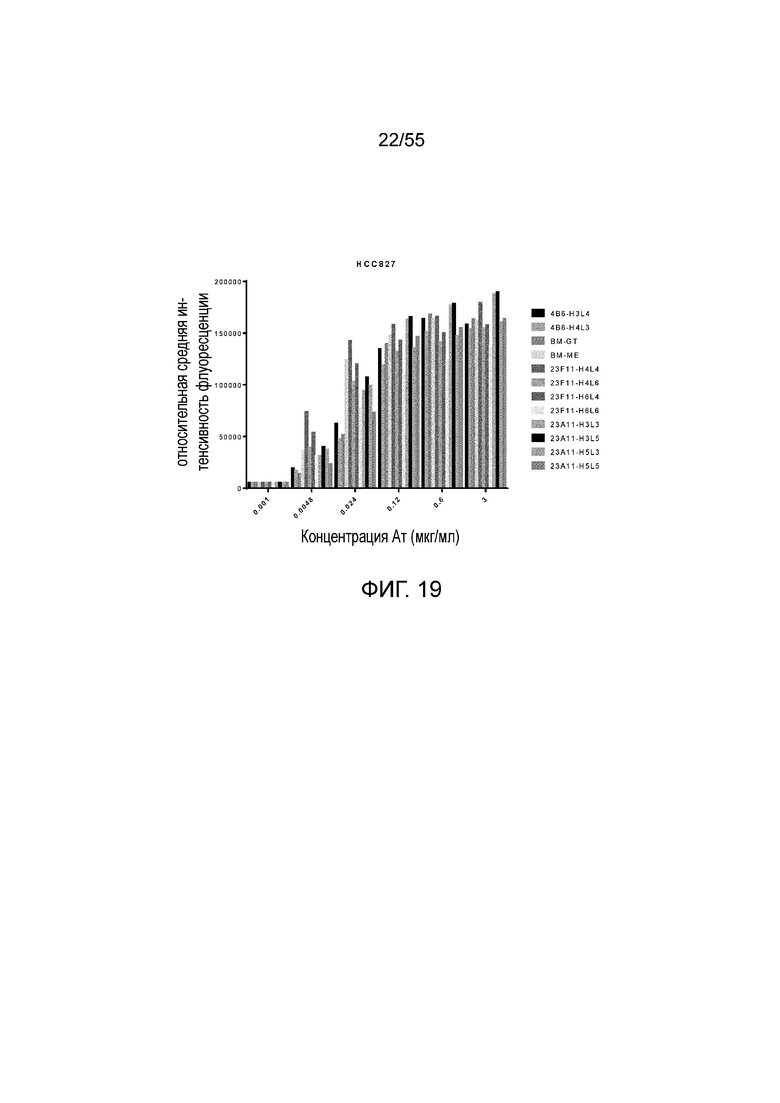
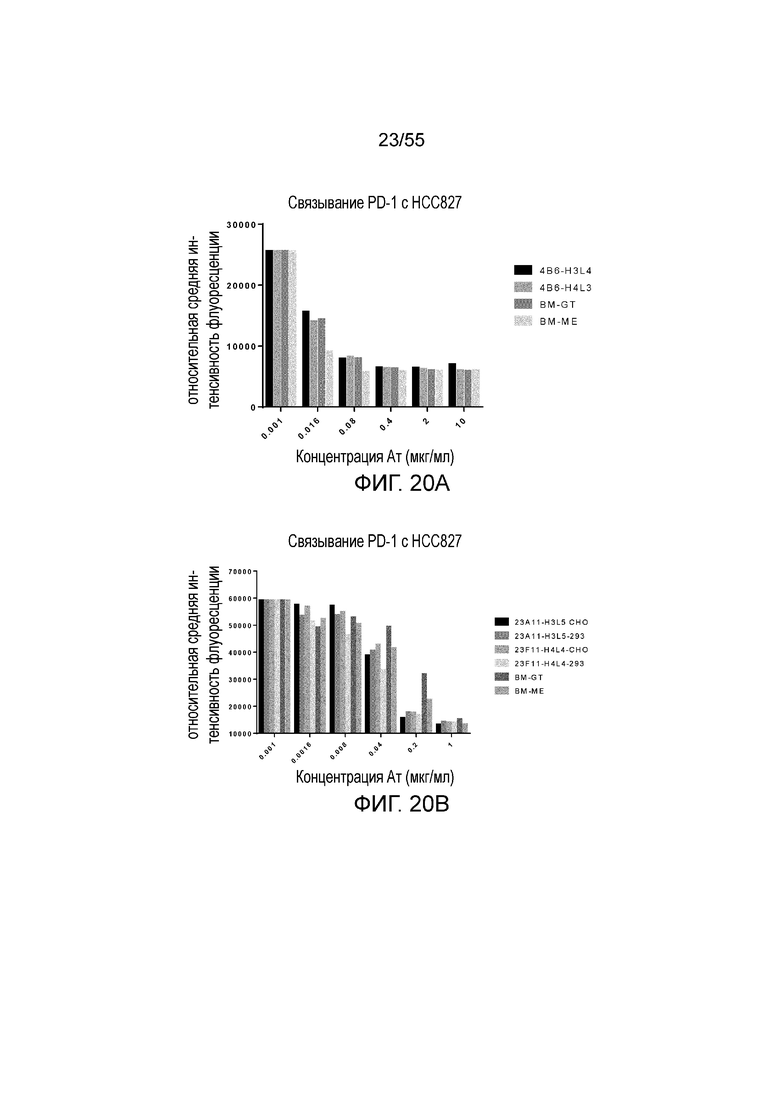
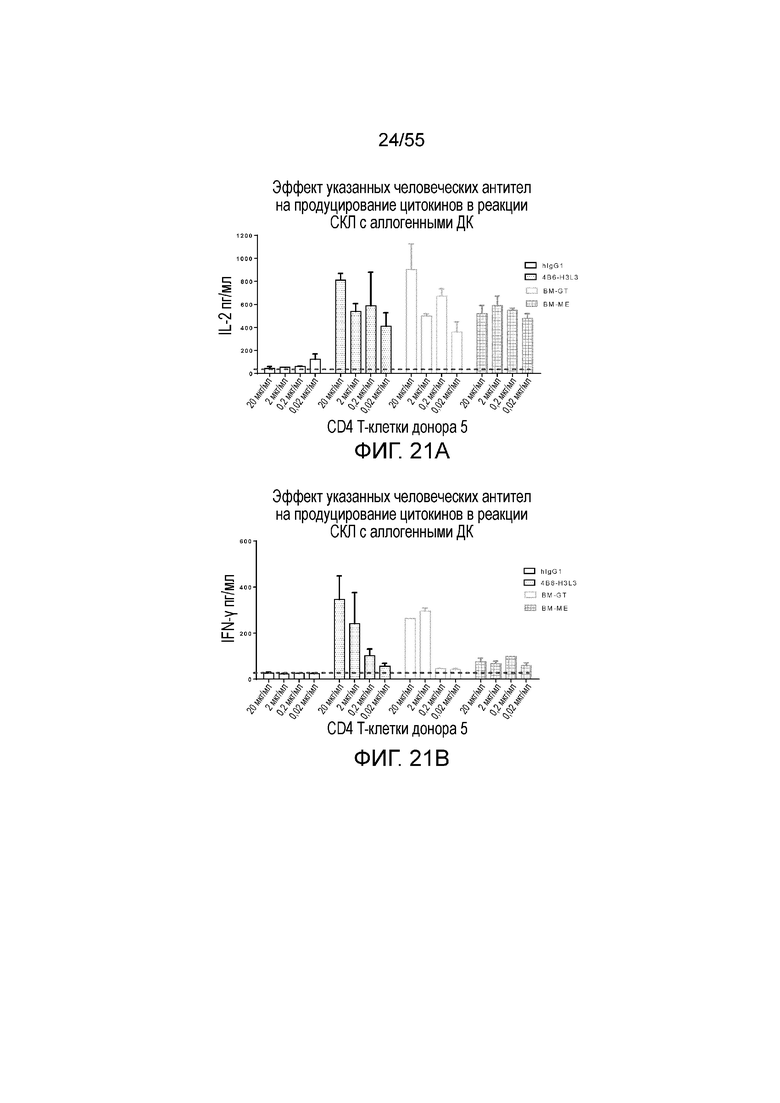
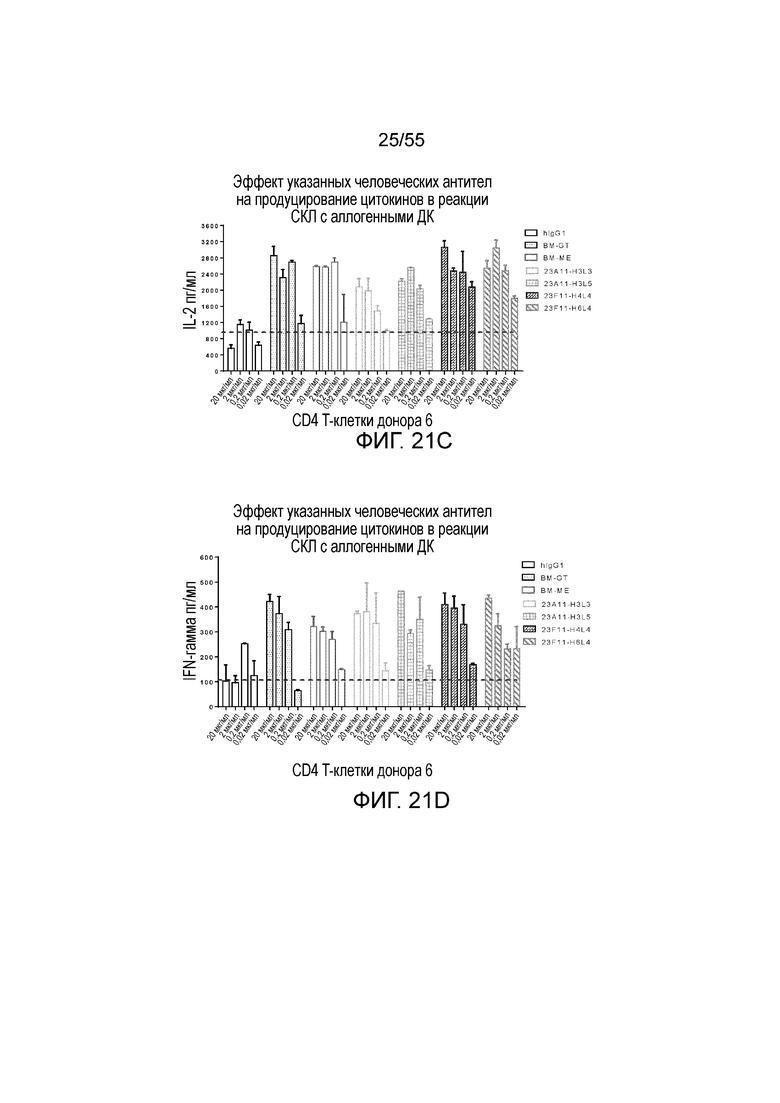

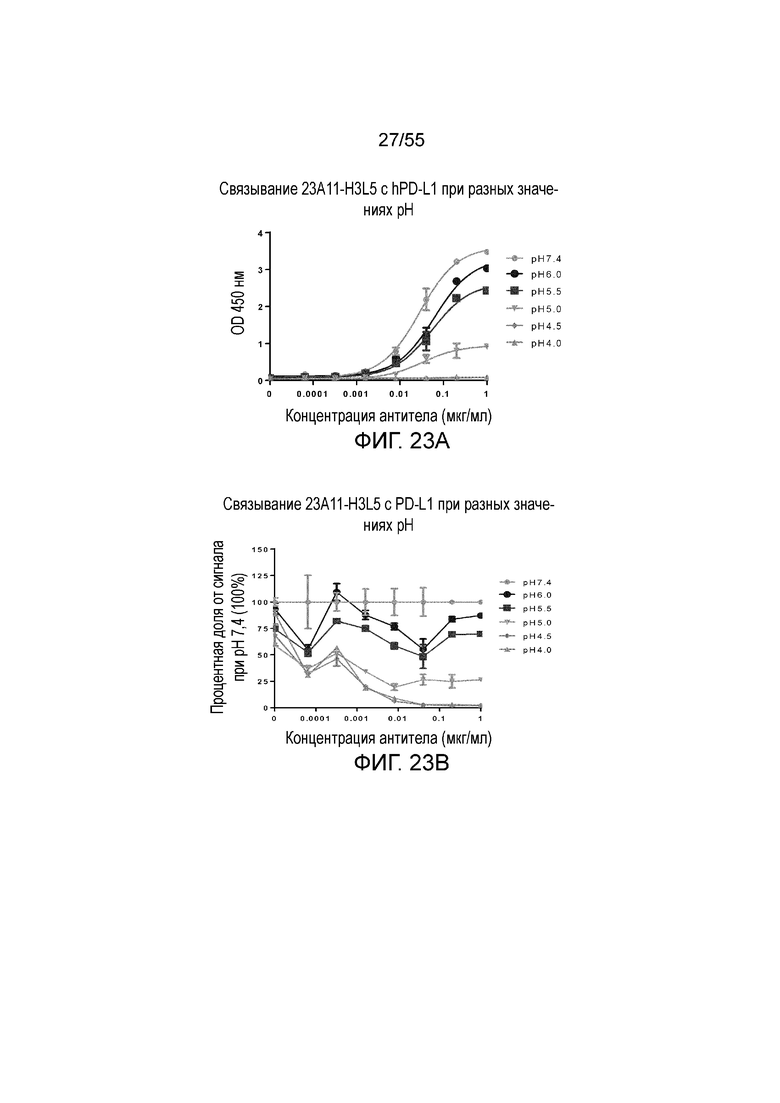
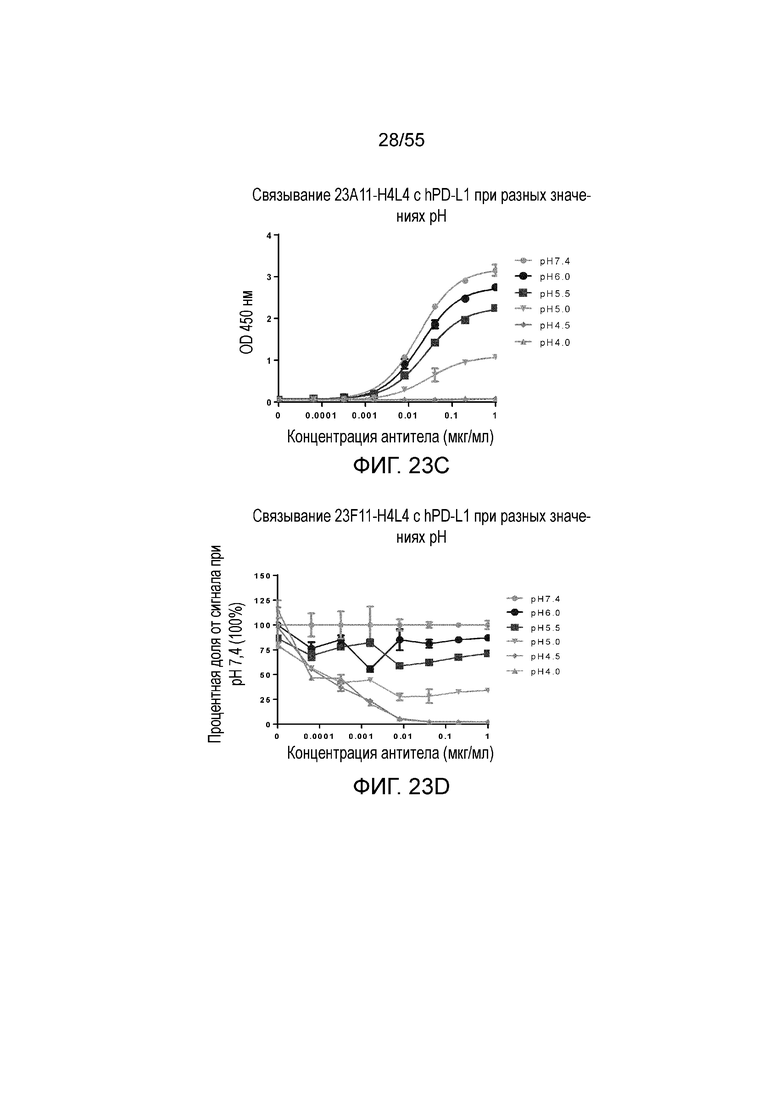
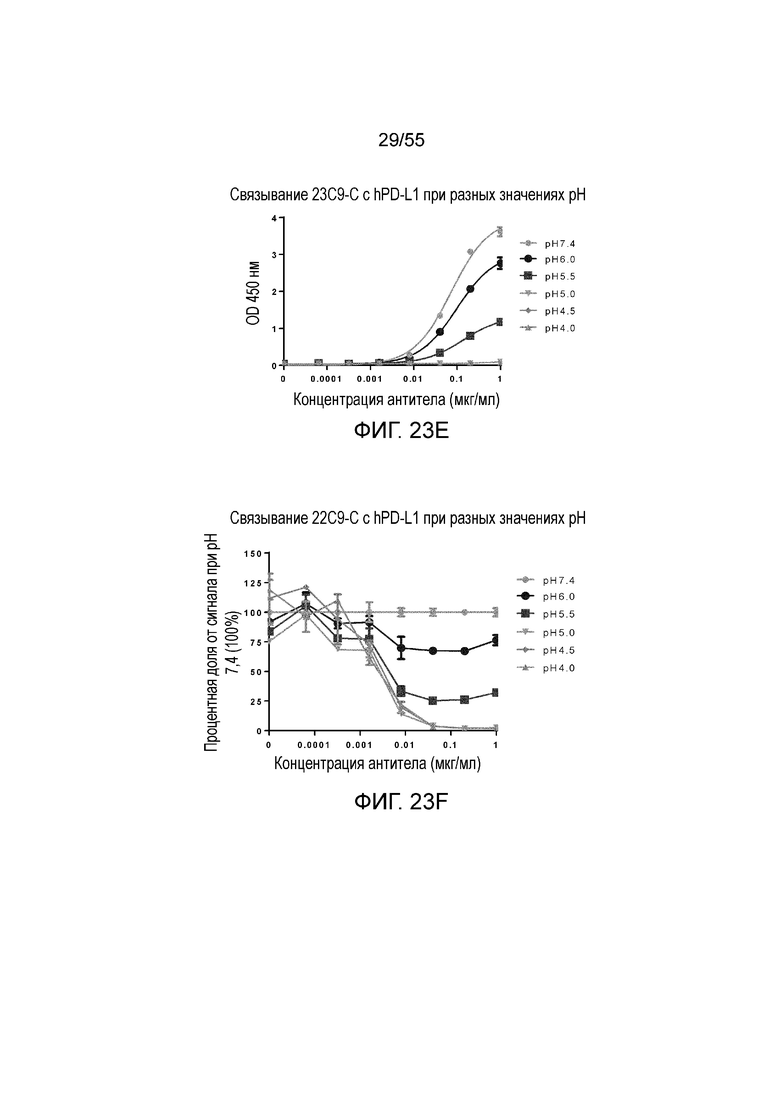
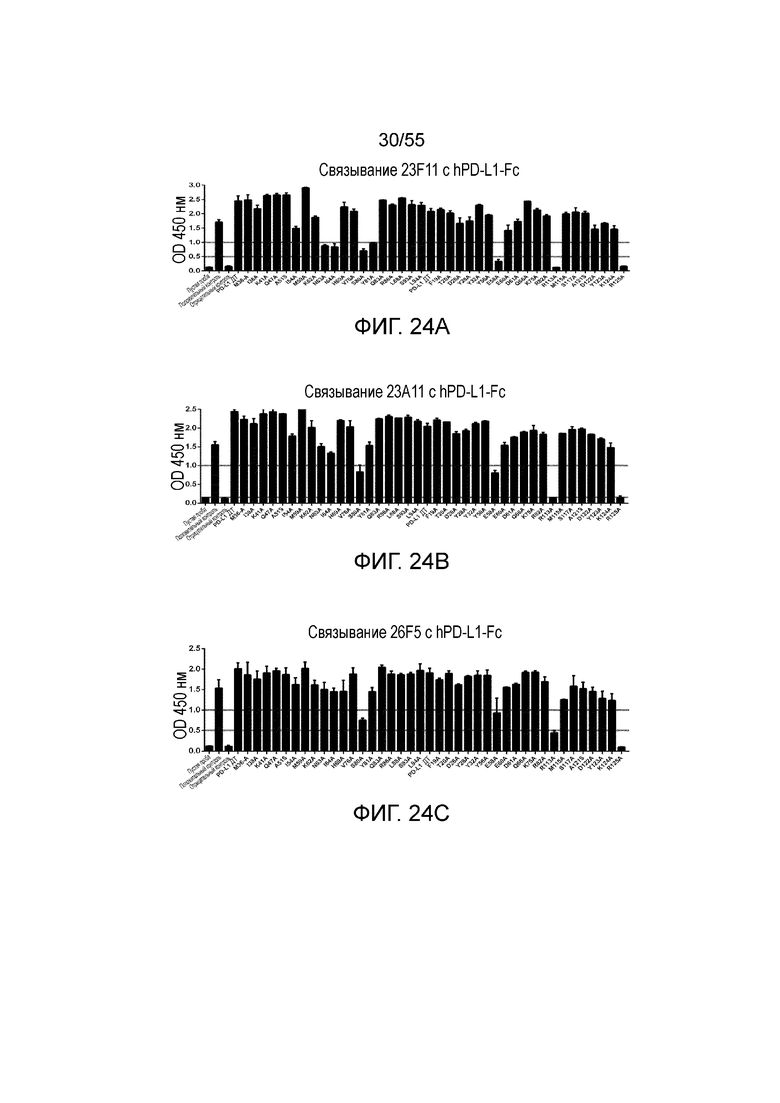
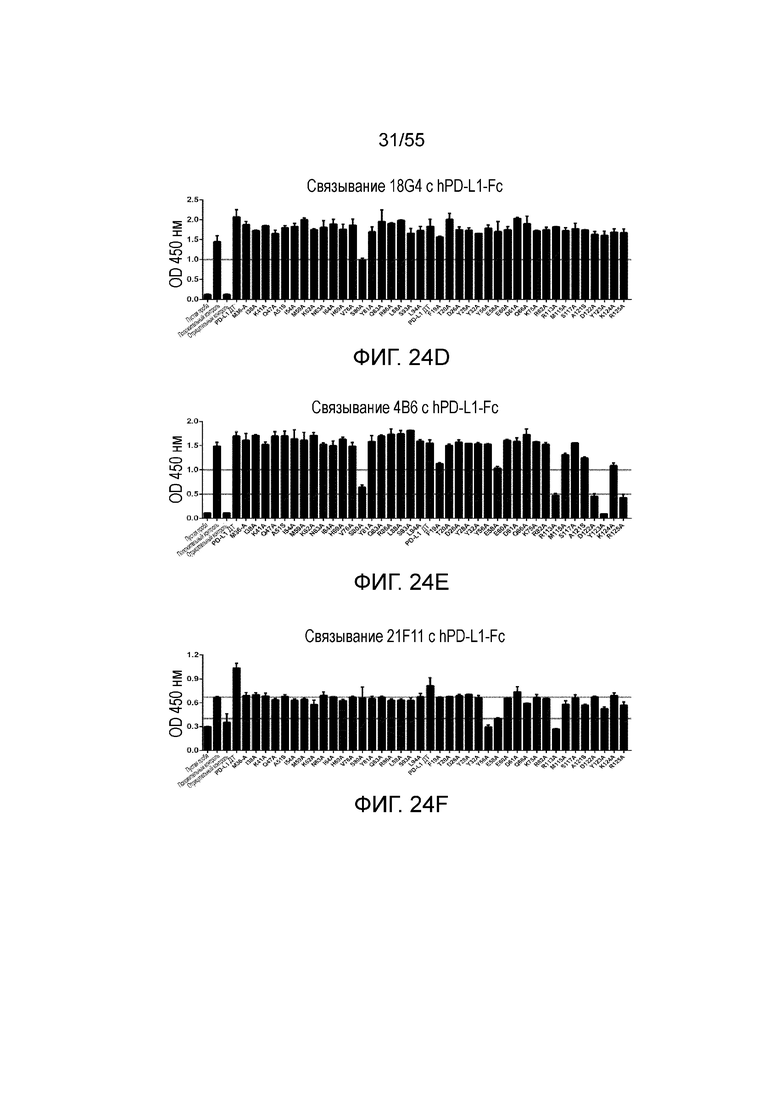
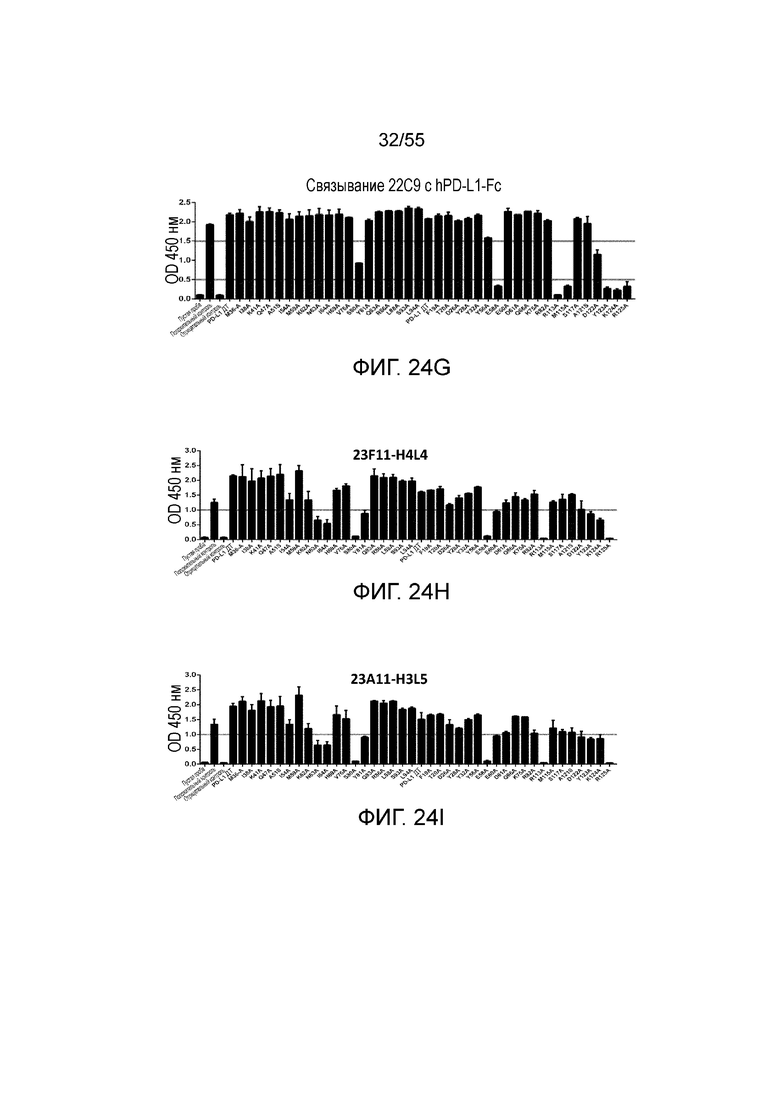
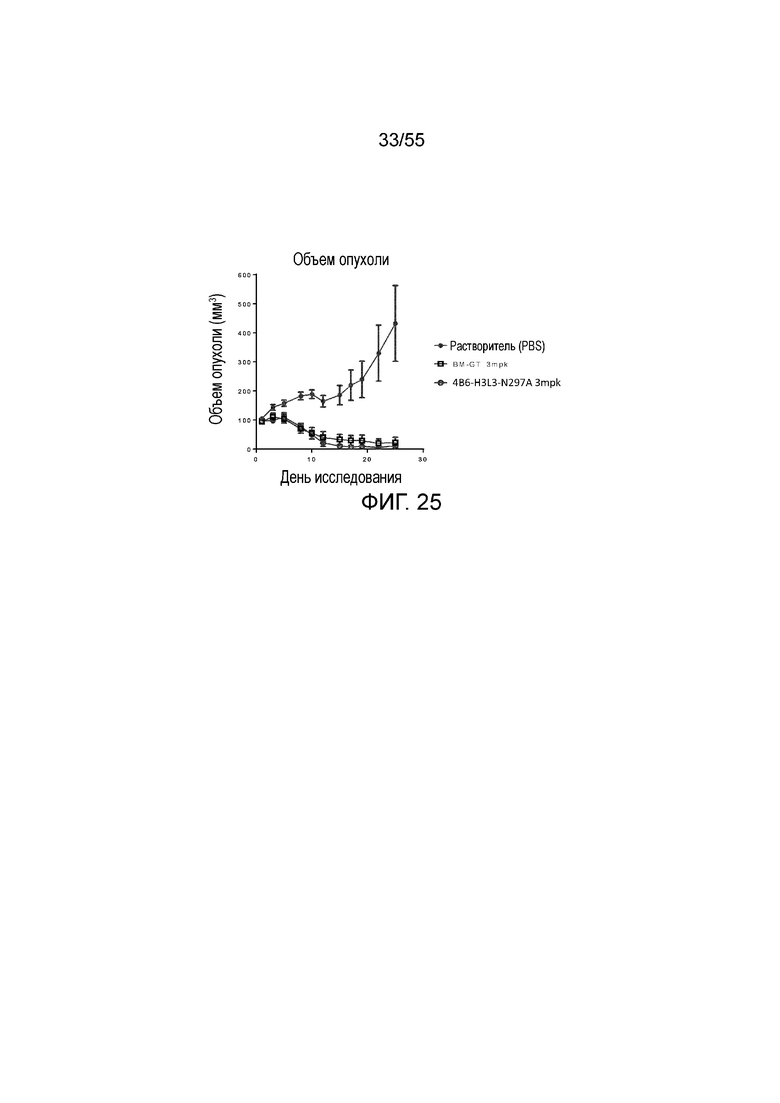
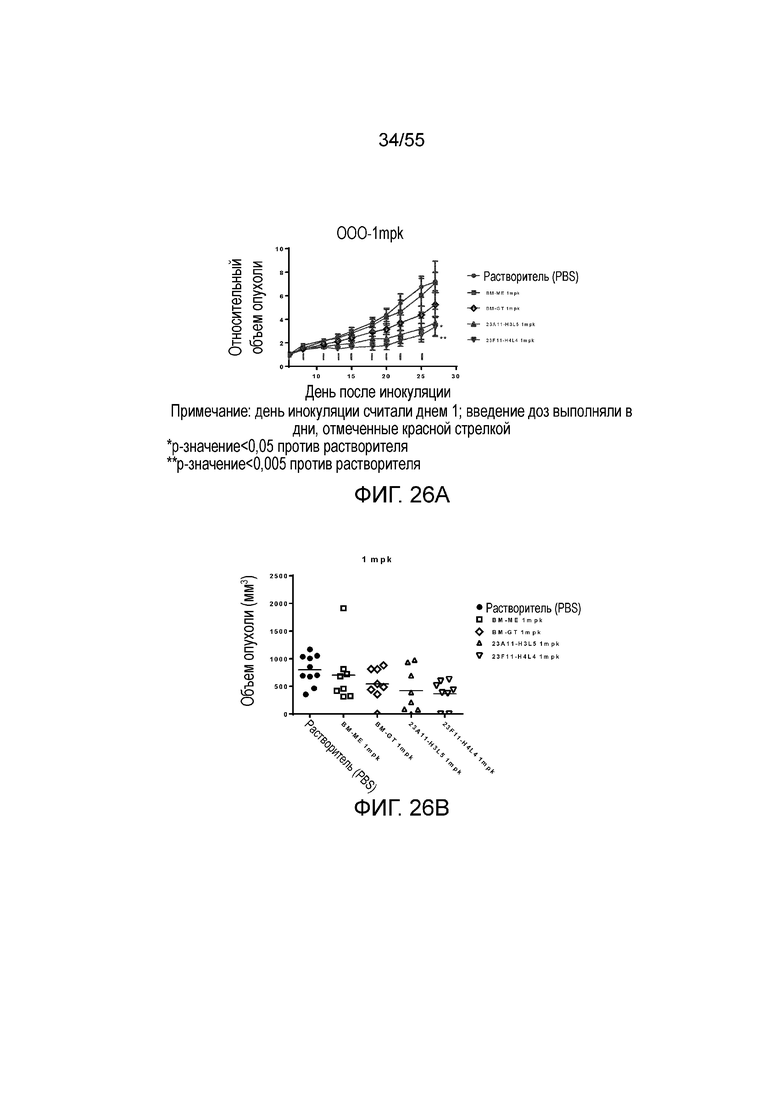
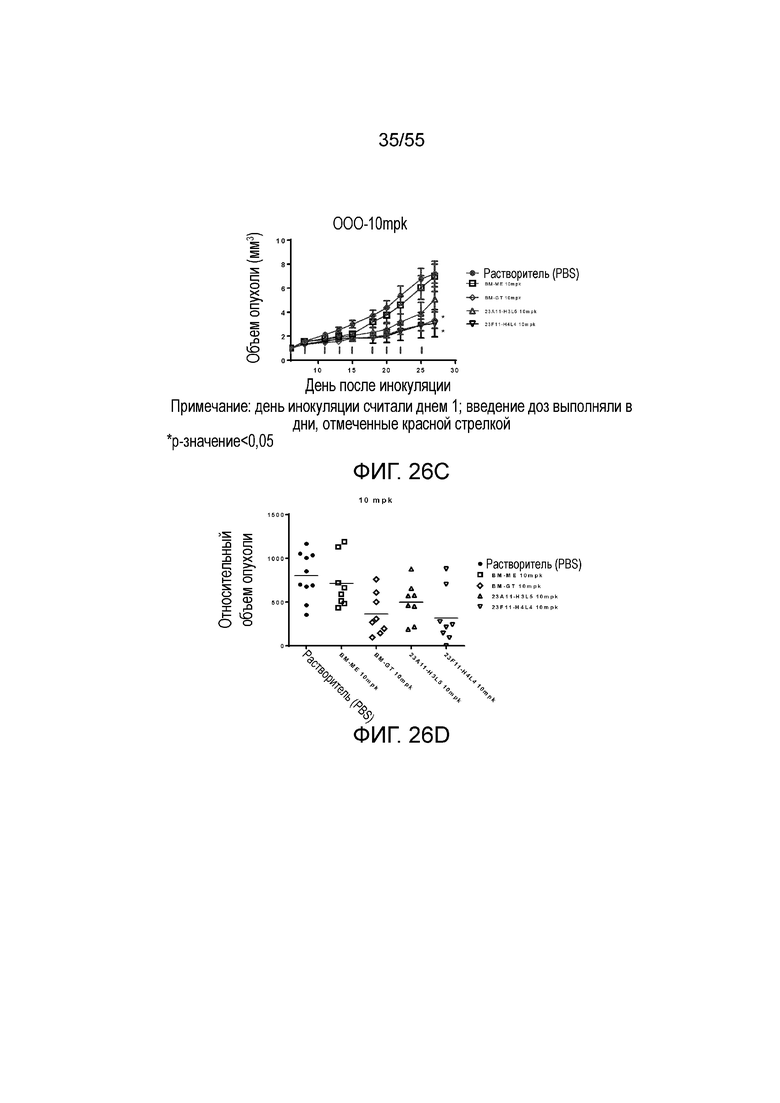
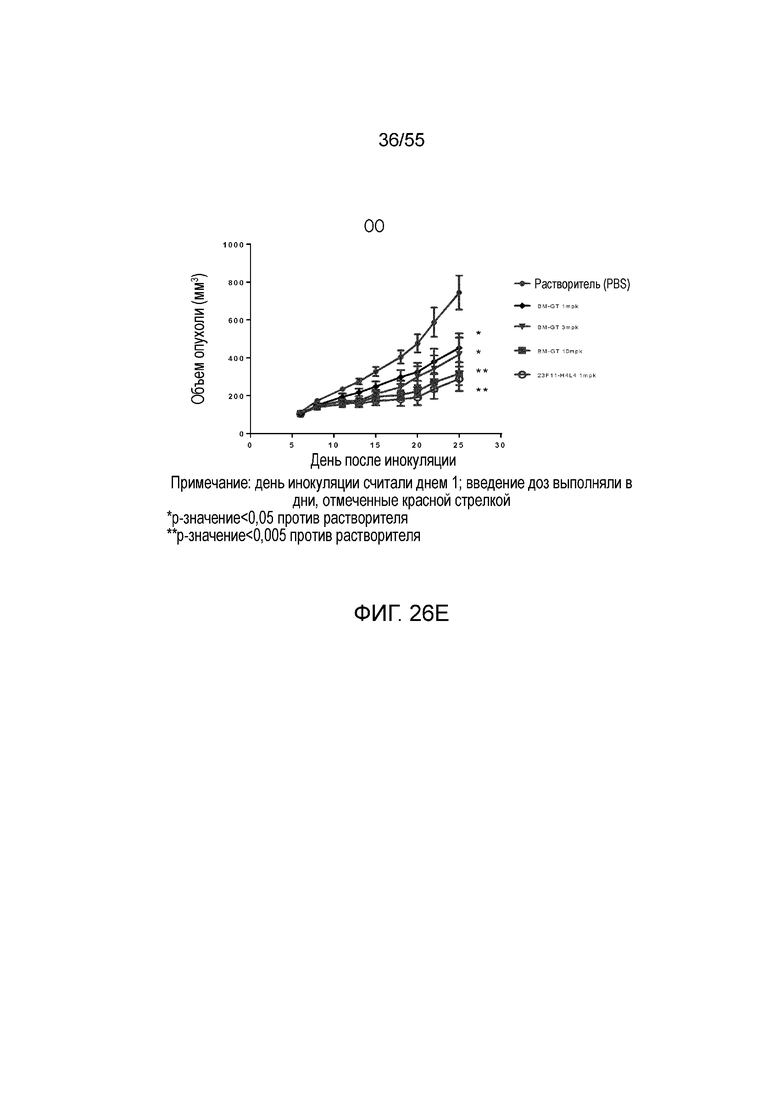
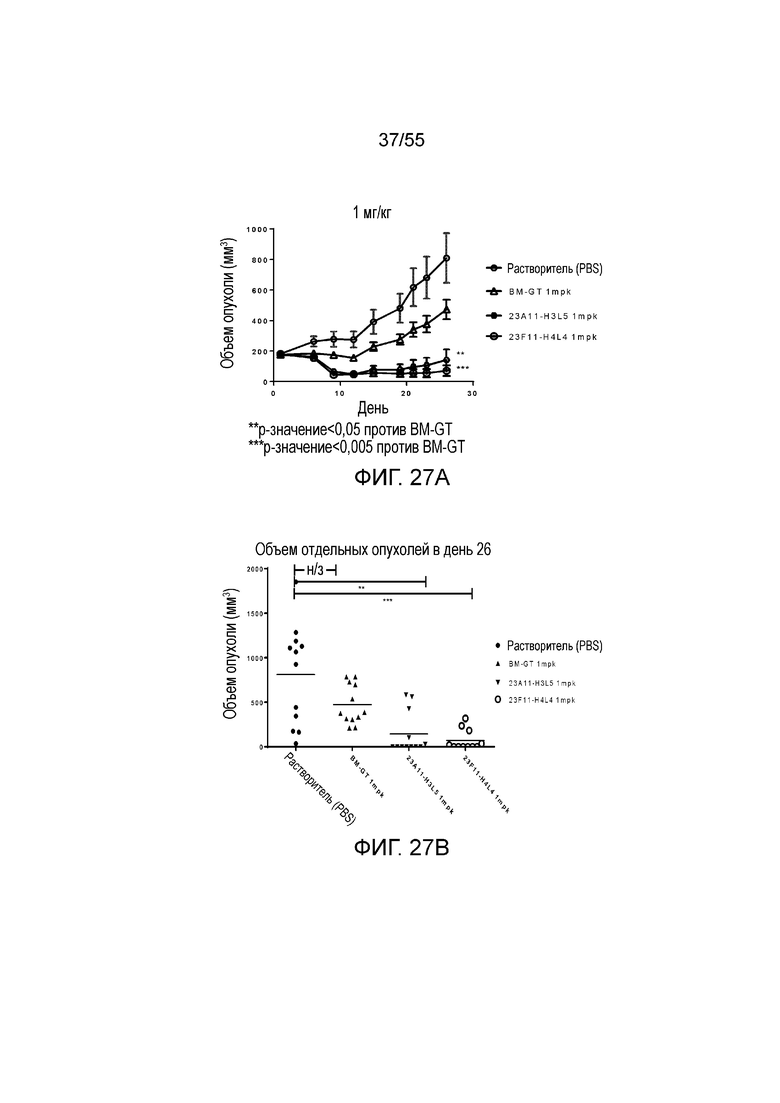
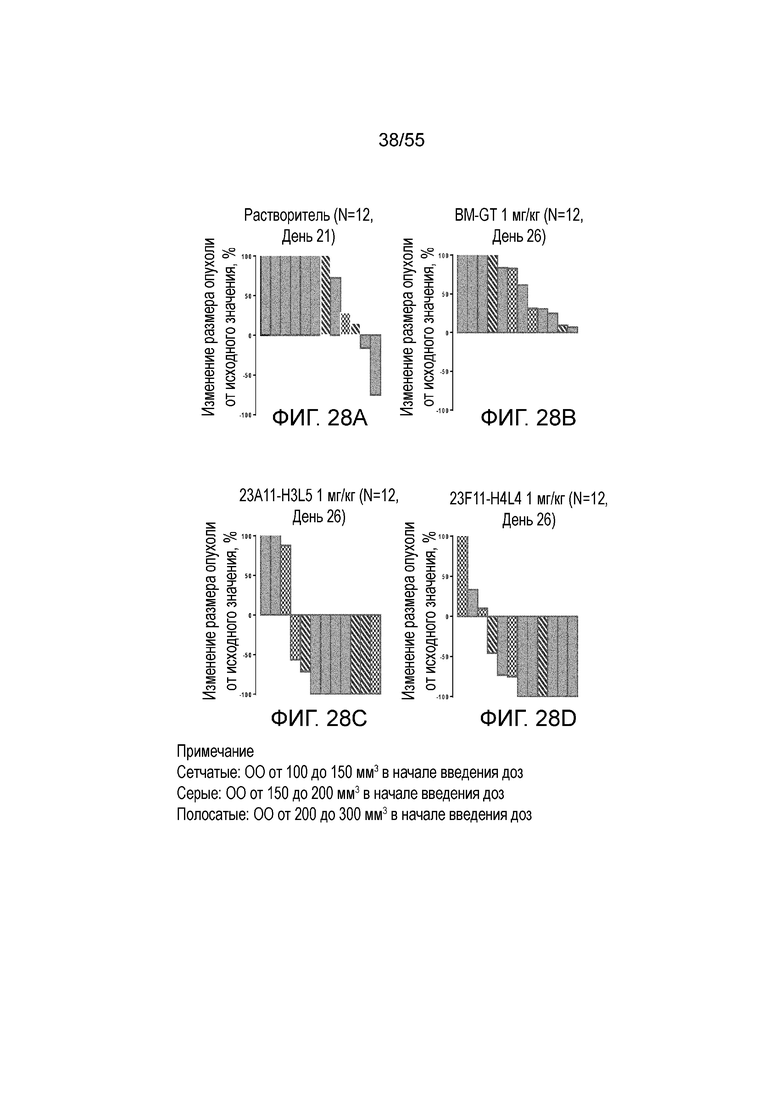
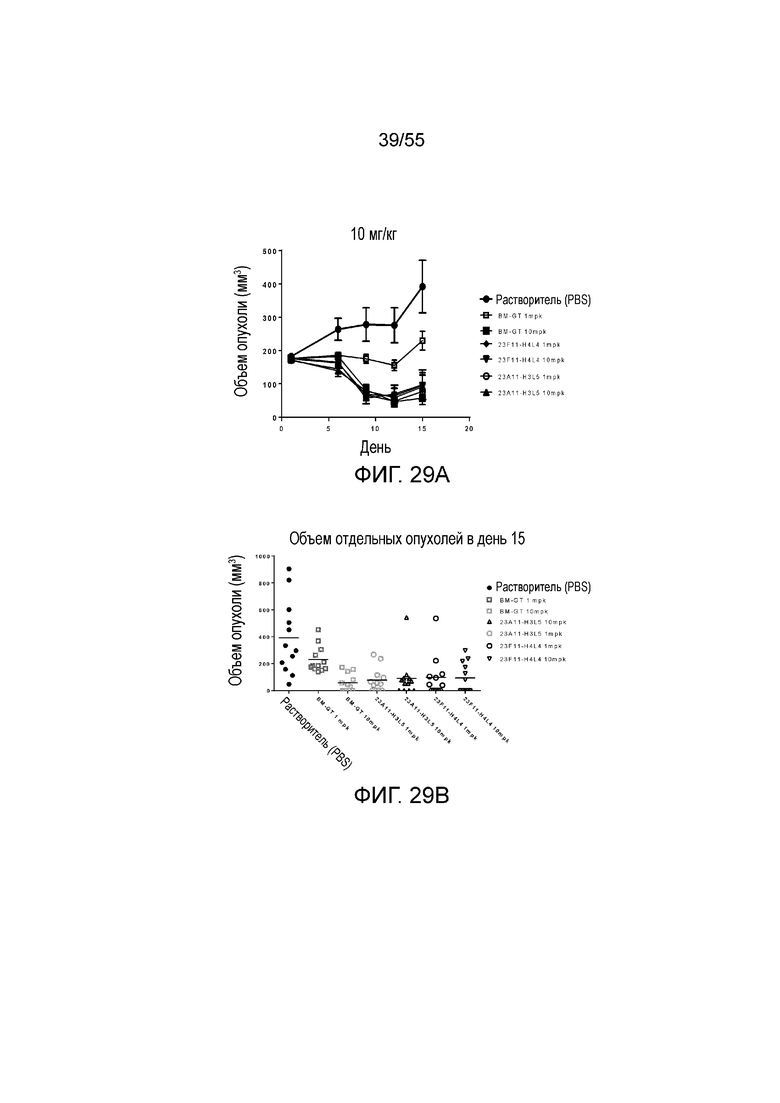
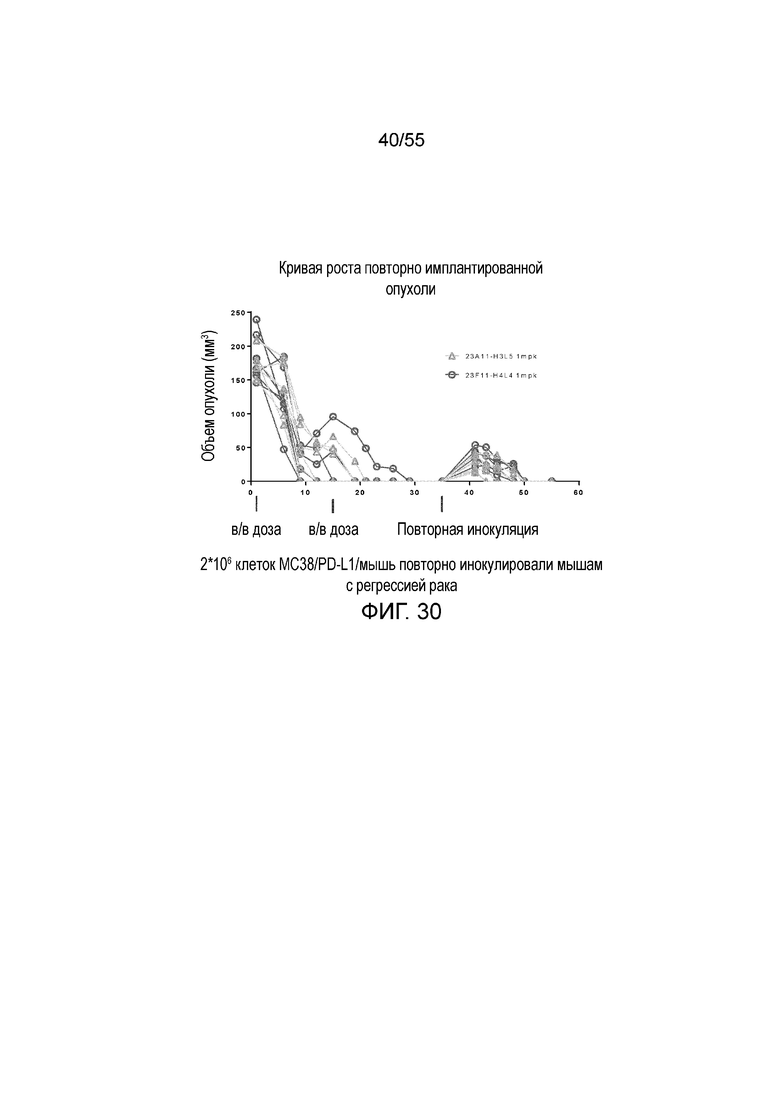
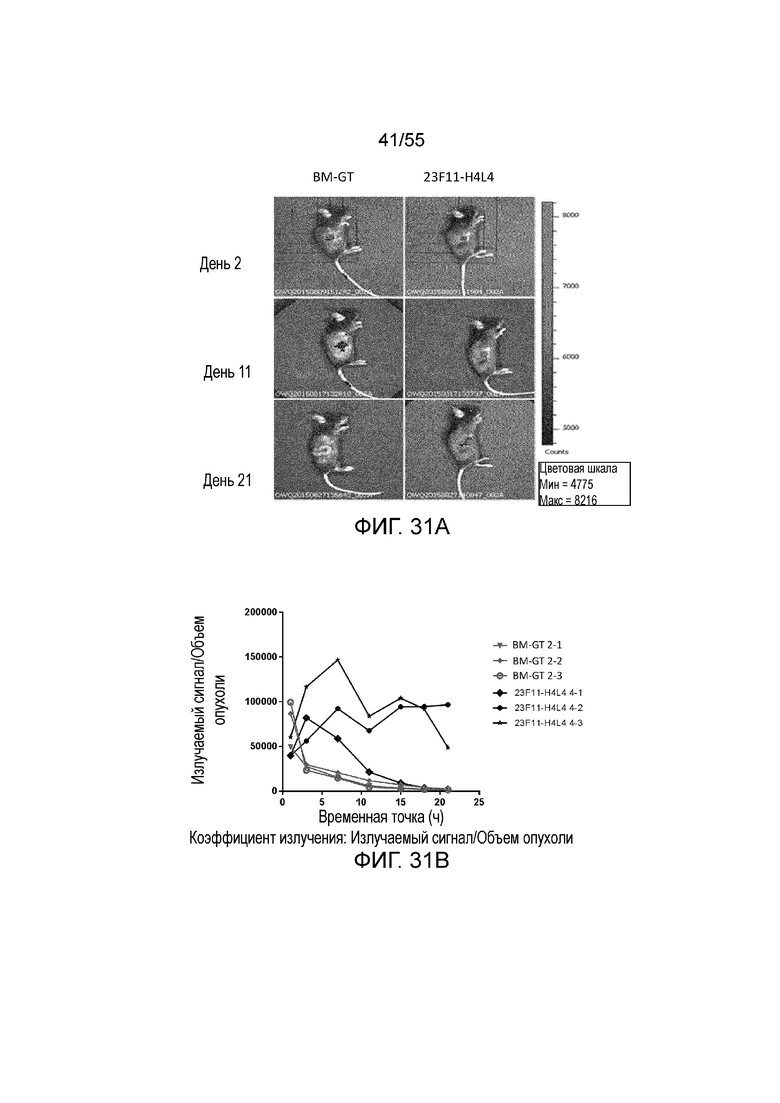
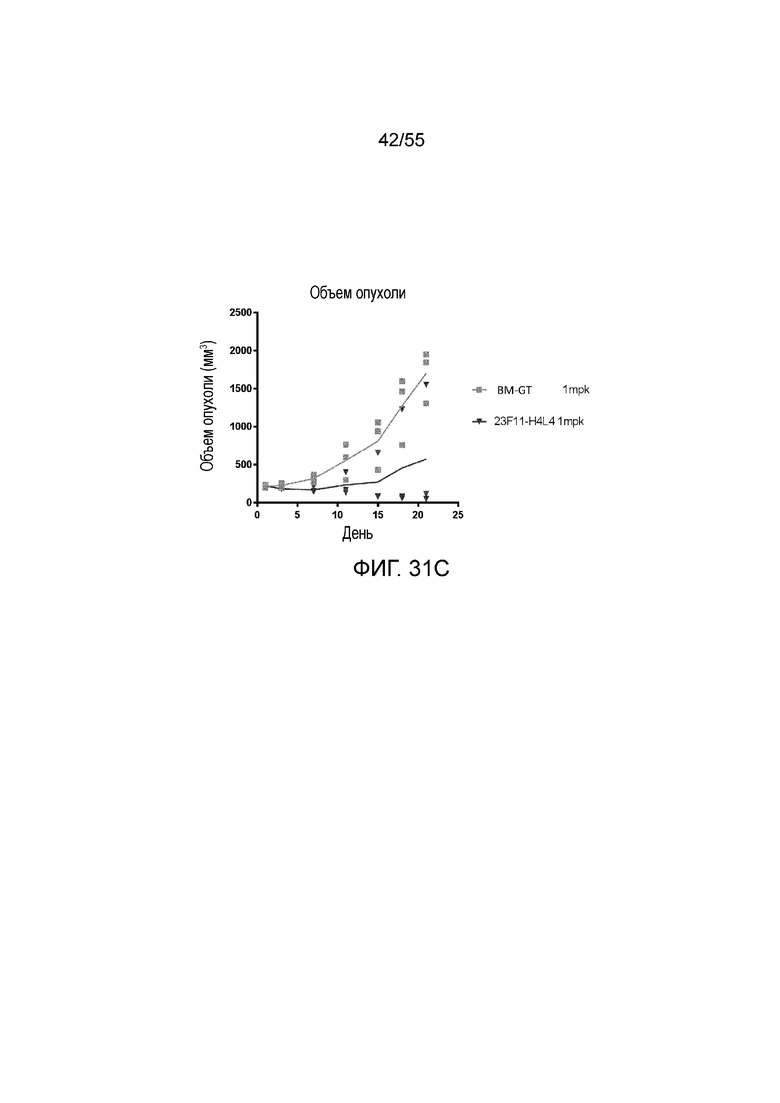
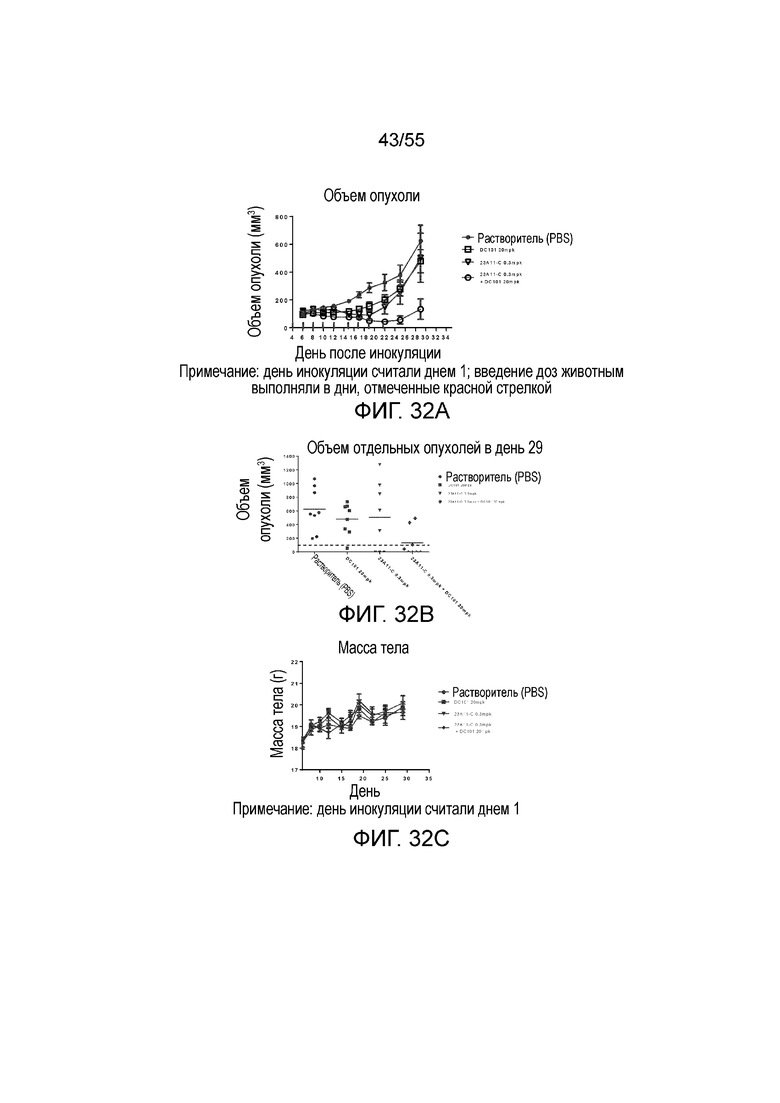
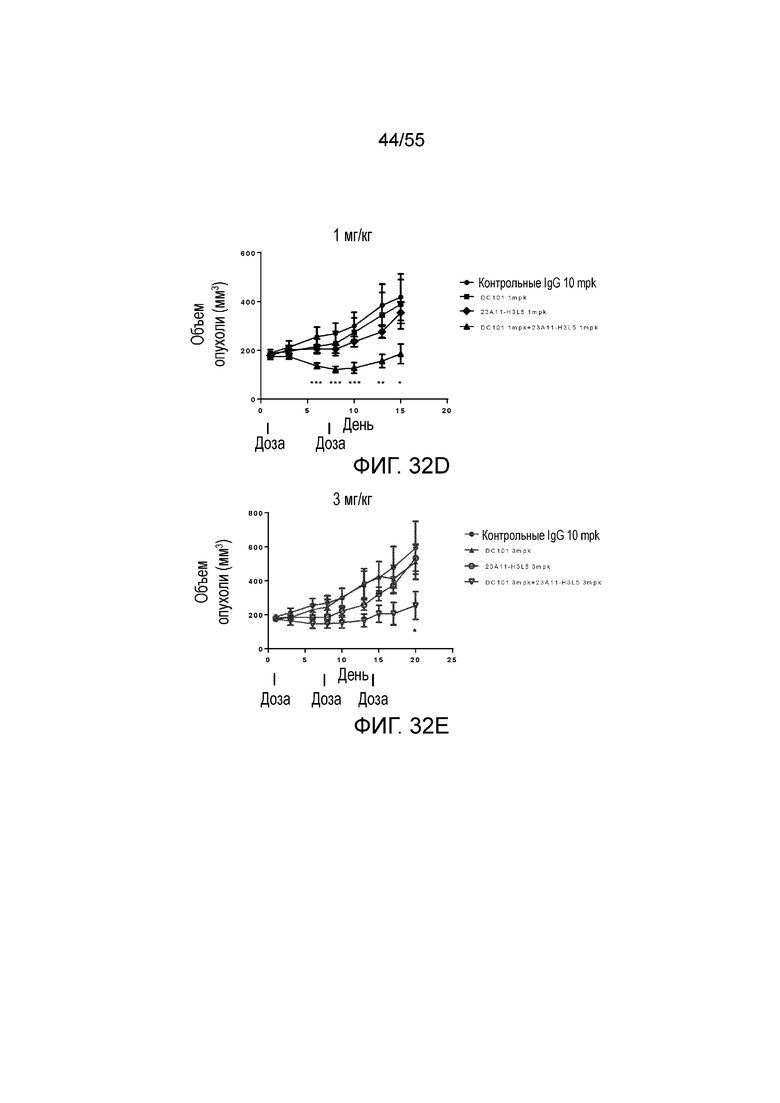
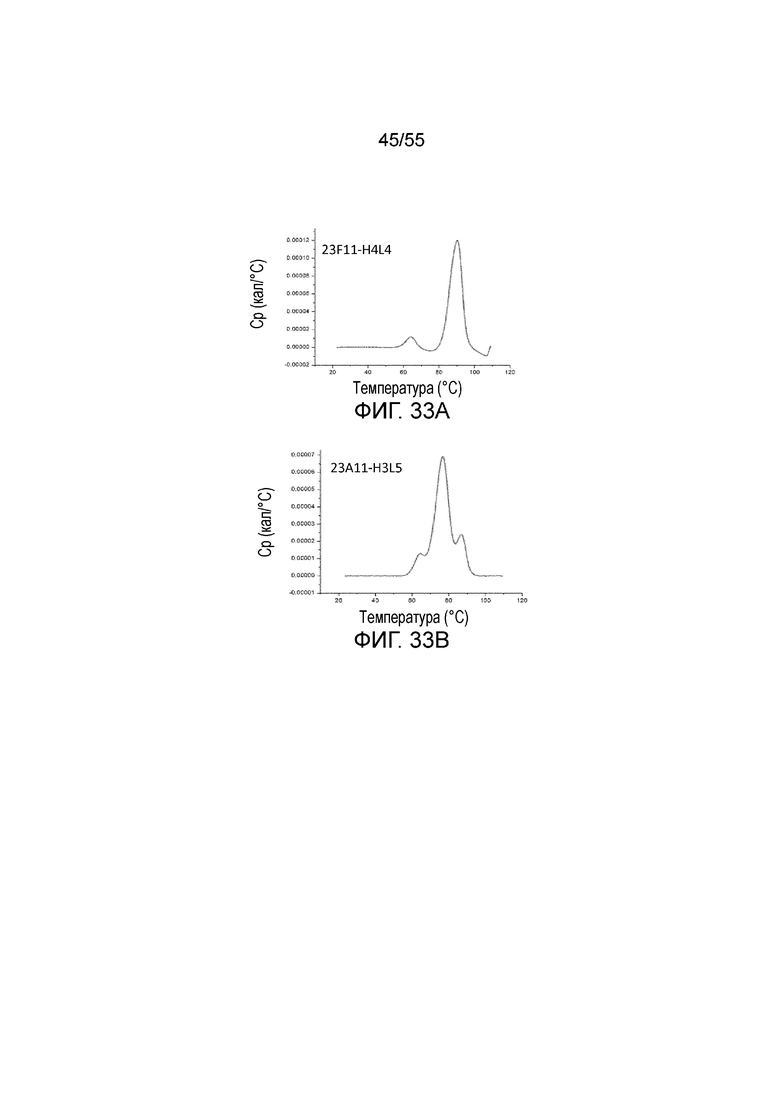


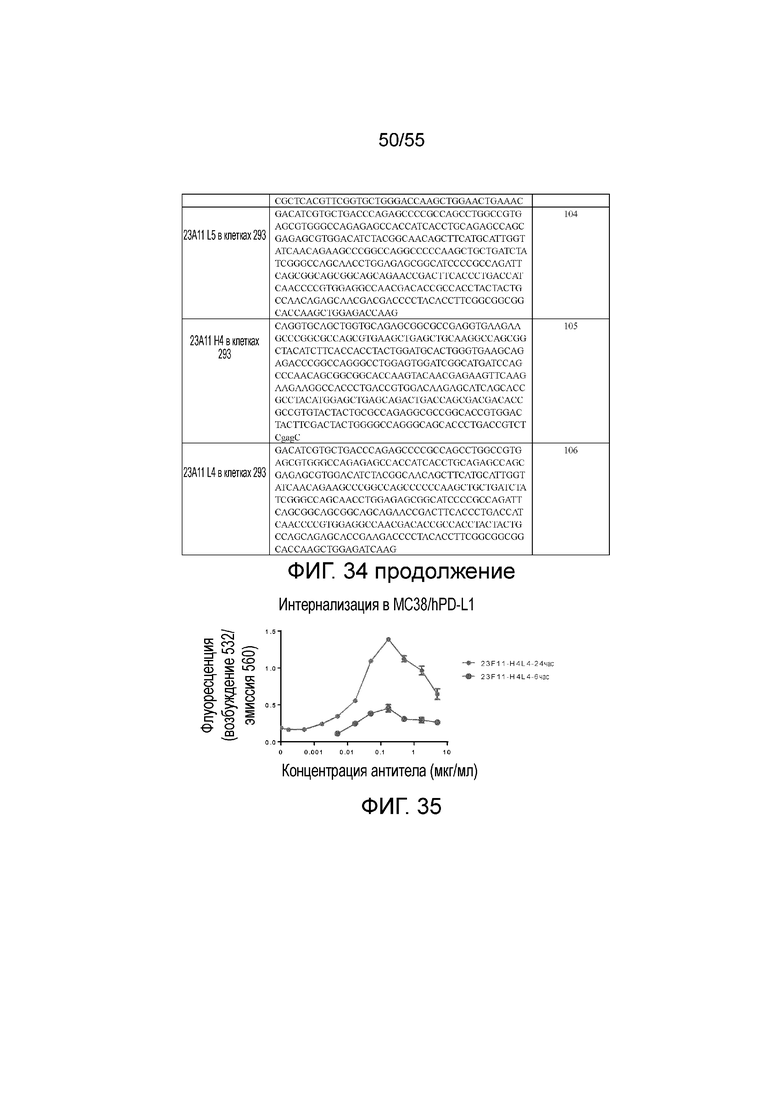
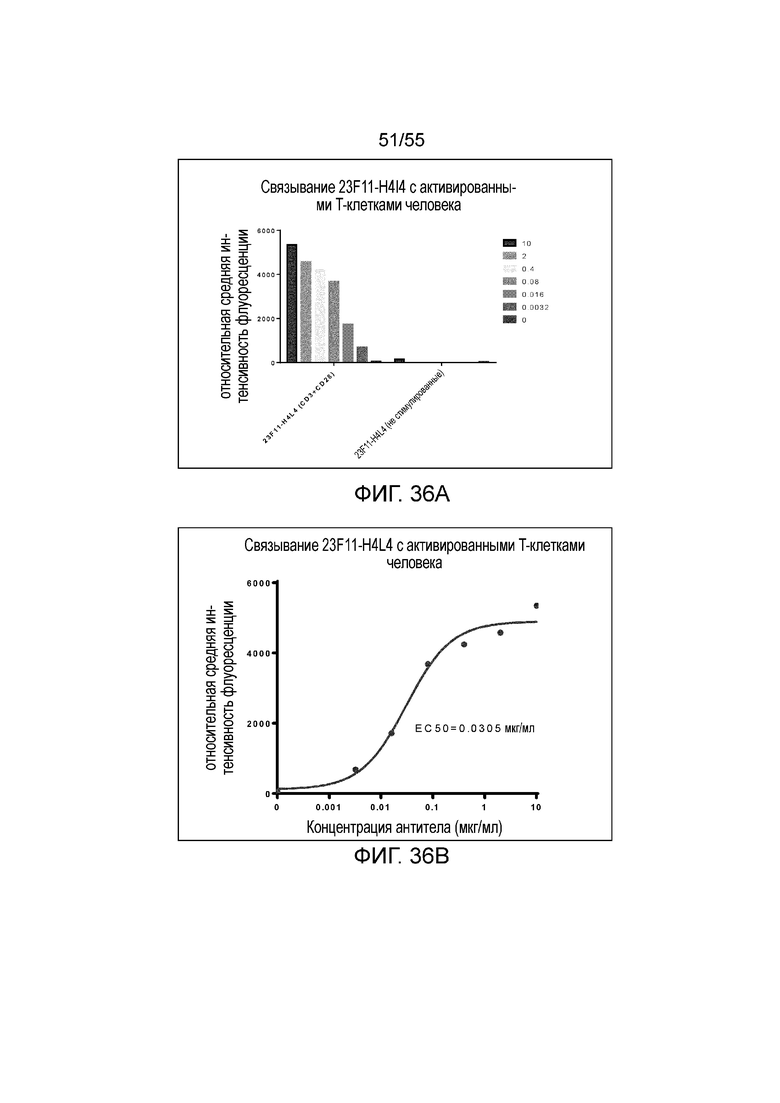
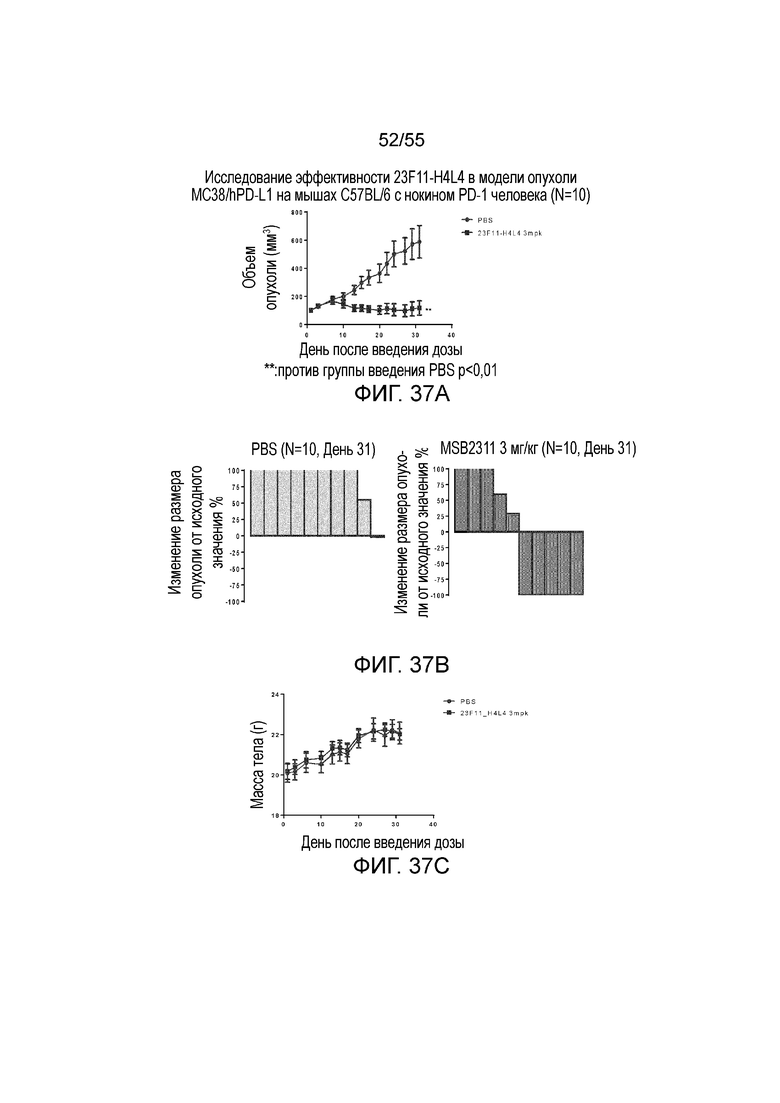
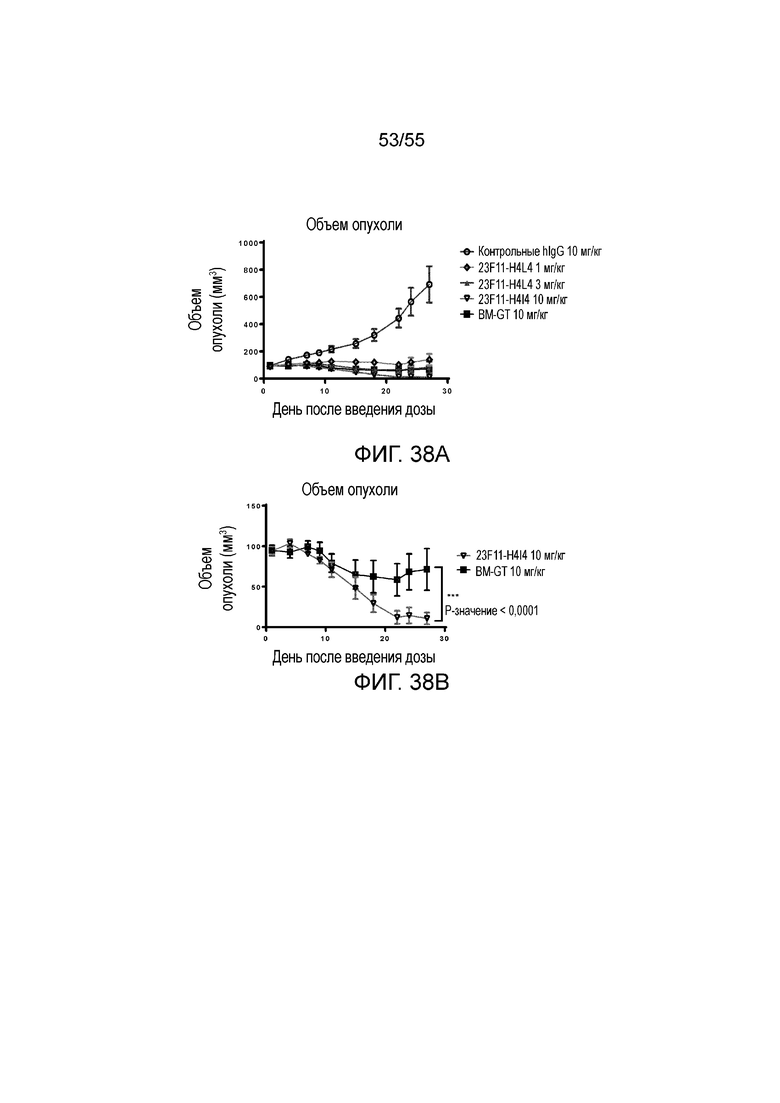
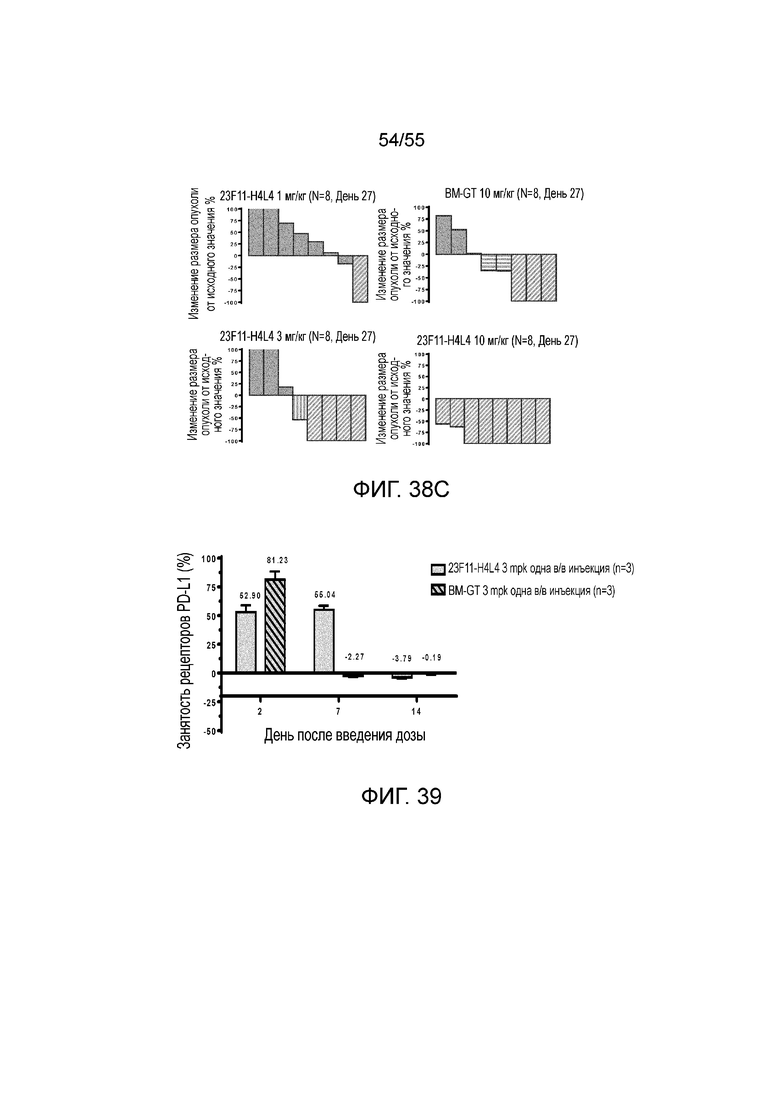

Изобретение относится к области биохимии, в частности к антителу, которое специфично связывается с PD-L1. Также раскрыты фармацевтическая композиция и набор, содержащие указанное антитело; полинуклеотид, кодирующий указанное антитело; вектор, содержащий указанный полинуклеотид; клетка-хозяин, содержащая указанный вектор. Раскрыты способ получения указанного антитела, способ лечения с помощью указанного антитела. Изобретение обладает способностью эффективно лечить заболевания, ассоциированные с PD-L1. 8 н. и 19 з.п. ф-лы, 29 пр., 18 табл., 40 ил.
1. Выделенное антитело против PD-L1, содержащее последовательности HCDR1', HCDR2' и HCDR3' тяжелой цепи и LCDR1', LCDR2' и LCDR3' легкой цепи, где
а) последовательность HCDR1' содержит DYYMN (SEQ ID NO: 23);
последовательность HCDR2' содержит DINPNNGGTSYNX'1KFX'2G (SEQ ID NO: 24);
последовательность HCDR3' содержит VKWGDGPFAY (SEQ ID NO: 25);
последовательность LCDR1' содержит X'3ASQNVGAAVA (SEQ ID NO: 26);
последовательность LCDR2' содержит SASNX'4X'5T (SEQ ID NO: 27);
последовательность LCDR3' содержит QQYSNYPT (SEQ ID NO: 28);
где X'1 представляет собой H; X'2 представляет собой K;
X'3 представляет собой K; X'4 представляет собой R; и
X'5 представляет собой Y; или
X’1 представляет собой Q; X’2 представляет собой Q;
X’3 представляет собой Q; X’4 представляет собой R; и
X’5 представляет собой Y; или
X’1 представляет собой Q; X’2 представляет собой Q;
X’3 представляет собой Q; X’4 представляет собой L; и
X’5 представляет собой Y; или
b) последовательность HCDR1' содержит SEQ ID NO: 29,
последовательность HCDR2' содержит SEQ ID NO: 30 и
последовательность HCDR3' содержит SEQ ID NO: 31,
последовательность LCDR1' содержит SEQ ID NO: 32,
последовательность LCDR2' содержит SEQ ID NO: 33 и
последовательность LCDR3' содержит SEQ ID NO: 34; или
c) последовательность HCDR1' содержит SEQ ID NO: 35,
последовательность HCDR2' содержит SEQ ID NO: 36 и
последовательность HCDR3' содержит SEQ ID NO: 37,
последовательность LCDR1' содержит SEQ ID NO: 38,
последовательность LCDR2' содержит SEQ ID NO: 39 и
последовательность LCDR3' содержит SEQ ID NO: 40; или
d) последовательность HCDR1' содержит SEQ ID NO: 41,
последовательность HCDR2' содержит SEQ ID NO: 42 и
последовательность HCDR3' содержит SEQ ID NO: 43,
последовательность LCDR1' содержит SEQ ID NO: 44,
последовательность LCDR2' содержит SEQ ID NO: 45 и
последовательность LCDR3' содержит SEQ ID NO: 46.
2. Антитело по п.1, содержащее каркасные последовательности HFR1', HFR2', HFR3' и HFR4' тяжелой цепи и каркасные последовательности LFR1', LFR2', LFR3' и LFR4' легкой цепи,
где последовательности вариабельной области тяжелой цепи соответствуют формуле: HFR1'-HCDR1'-HFR2'-HCDR2'-HFR3'-HCDR3'-HFR4' и
последовательности вариабельной области легкой цепи соответствуют формуле LFR1'-LCDR1'-LFR2'-LCDR2'-LFR3'-LCDR3'-LFR4', где
последовательность HFR1' содержит X'a1VQLX'a2QSGX'a3EX'a4X'a5KPGASVKX'a6SCKASGYVFT (SEQ ID NO: 47);
последовательность HFR2' содержит
WVX'a7QX'a8X'a9GX'a10X'a11LEWIG (SEQ ID NO: 48);
последовательность HFR3' содержит
X'a12X'a13TVTVDX'a14SX'a15X'a16TAYMELX'a17X'a18LX'a19SX'a20DX'a21AVYYC (SEQ ID NO: 49);
последовательность HFR4' содержит WGQGTLVTVSX'a22 (SEQ ID NO: 50);
последовательность LFR1' содержит
DIX'a23MTQSX'a24X'a25X'a26X'a27SX'a28SVGDRVX'a29ITC (SEQ ID NO: 51);
последовательность LFR2' содержи WYQQKPGX'a30X'a31PKLLIY (SEQ ID NO: 52);
последовательность LFR3' содержит
GVPX'a32RFX'a33GSGSGTDFTLTISX'a34X'a35QX'a36EDX'a37AX'a38YFC (SEQ ID NO: 53); и/или
последовательность LFR4' содержит FGSGTKLGIK (SEQ ID NO: 54);
где X’a1 представляет собой E; X’a2 представляет собой Q; X’a3 представляет собой P; X’a4 представляет собой L; X’a5 представляет собой V; X’a6 представляет собой I; X’a7 представляет собой K; X’a8 представляет собой S; X’a9 представляет собой H; X’a10 представляет собой K; X’a11 представляет собой S; X’a12 представляет собой K; X’a13 представляет собой A; X’a14 представляет собой K; X’a15 представляет собой S; X’a16 представляет собой R; X’a17 представляет собой L; X’a18 представляет собой S; X’a19 представляет собой T; X’a20 представляет собой E; X’a21 представляет собой S; X’a22 представляет собой A; X’a23 представляет собой V; X’a24 представляет собой Q; X’a25 представляет собой K; X’a26 представляет собой F; X’a27 представляет собой M; X’a28 представляет собой T; X’a29 представляет собой S; X’a30 представляет собой Q; X’a31 представляет собой S; X’a32 представляет собой D; X’a33 представляет собой T; X’a34 представляет собой N; X’a35 представляет собой M; X’a36 представляет собой S; X’a37 представляет собой L; X’a38 представляет собой D; или
X’a1 представляет собой Q; X’a2 представляет собой V; X’a3 представляет собой A; X’a4 представляет собой V; X’a5 представляет собой V; X’a6 представляет собой I; X’a7 представляет собой K; X’a8 представляет собой A; X’a9 представляет собой P; X’a10 представляет собой Q; X’a11 представляет собой G; X’a12 представляет собой R; X’a13 представляет собой A; X’a14 представляет собой K; X’a15 представляет собой T; X’a16 представляет собой R; X’a17 представляет собой S; X’a18 представляет собой R; X’a19 представляет собой R; X’a20 представляет собой D; X’a21 представляет собой T; X’a22 представляет собой S; X’a23 представляет собой Q; X’a24 представляет собой Q; X’a25 представляет собой S; X’a26 представляет собой S; X’a27 представляет собой L; X’a28 представляет собой A; X’a29 представляет собой T; X’a30 представляет собой K; X’a31 представляет собой A; X’a32 представляет собой S; X’a33 представляет собой S; X’a34 представляет собой S; X’a35 представляет собой M; X’a36 представляет собой P; X’a37 представляет собой I; X’a38 представляет собой T; или
X’a1 представляет собой Q; X’a2 представляет собой V; X’a3 представляет собой A; X’a4 представляет собой V; X’a5 представляет собой K; X’a6 представляет собой V; X’a7 представляет собой R; X’a8 представляет собой A; X’a9 представляет собой P; X’a10 представляет собой Q; X’a11 представляет собой G; X’a12 представляет собой R; X’a13 представляет собой V; X’a14 представляет собой T; X’a15 представляет собой I; X’a16 представляет собой R; X’a17 представляет собой S; X’a18 представляет собой R; X’a19 представляет собой R; X’a20 представляет собой D; X’a21 представляет собой T; X’a22 представляет собой S; X’a23 представляет собой Q; X’a24 представляет собой Q; X’a25 представляет собой S; X’a26 представляет собой S; X’a27 представляет собой L; X’a28 представляет собой A; X’a29 представляет собой T; X’a30 представляет собой K; X’a31 представляет собой A; X’a32 представляет собой S; X’a33 представляет собой S; X’a34 представляет собой S; X’a35 представляет собой M; X’a36 представляет собой P; X’a37 представляет собой I; X’a38 представляет собой T; или
X’a1 представляет собой Q; X’a2 представляет собой V; X’a3 представляет собой A; X’a4 представляет собой V; X’a5 представляет собой V; X’a6 представляет собой I; X’a7 представляет собой K; X’a8 представляет собой A; X’a9 представляет собой P; X’a10 представляет собой Q; X’a11 представляет собой G; X’a12 представляет собой R; X’a13 представляет собой A; X’a14 представляет собой K; X’a15 представляет собой T; X’a16 представляет собой R; X’a17 представляет собой S; X’a18 представляет собой R; X’a19 представляет собой R; X’a20 представляет собой D; X’a21 представляет собой T; X’a22 представляет собой S; X’a23 представляет собой Q; X’a24 представляет собой P; X’a25 представляет собой S; X’a26 представляет собой S; X’a27 представляет собой L; X’a28 представляет собой A; X’a29 представляет собой T; X’a30 представляет собой K; X’a31 представляет собой A; X’a32 представляет собой S; X’a33 представляет собой S; X’a34 представляет собой S; X’a35 представляет собой L; X’a36 представляет собой P; X’a37 представляет собой I; X’a38 представляет собой T; или
X’a1 представляет собой Q; X’a2 представляет собой V; X’a3 представляет собой A; X’a4 представляет собой V; X’a5 представляет собой K; X’a6 представляет собой V; X’a7 представляет собой R; X’a8 представляет собой A; X’a9 представляет собой P; X’a10 представляет собой Q; X’a11 представляет собой G; X’a12 представляет собой R; X’a13 представляет собой V; X’a14 представляет собой T; X’a15 представляет собой I; X’a16 представляет собой R; X’a17 представляет собой S; X’a18 представляет собой R; X’a19 представляет собой R; X’a20 представляет собой D; X’a21 представляет собой T; X’a22 представляет собой S; X’a23 представляет собой Q; X’a24 представляет собой P; X’a25 представляет собой S; X’a26 представляет собой S; X’a27 представляет собой L; X’a28 представляет собой A; X’a29 представляет собой T; X’a30 представляет собой K; X’a31 представляет собой A; X’a32 представляет собой A; X’a33 представляет собой S; X’a34 представляет собой S; X’a35 представляет собой L; X’a36 представляет собой P; X’a37 представляет собой I; X’a38 представляет собой T.
3. Антитело по п.1, содержащее
вариабельную область тяжелой цепи SEQ ID NO: 65 и вариабельную область легкой цепи SEQ ID NO: 66; или
вариабельную область тяжелой цепи SEQ ID NO: 67 и вариабельную область легкой цепи SEQ ID NO: 68, или
вариабельную область тяжелой цепи SEQ ID NO: 65 и вариабельную область легкой цепи SEQ ID NO: 68; или
вариабельную область тяжелой цепи в SEQ ID NO: 67 и вариабельную область легкой цепи SEQ ID NO: 66;
вариабельную область тяжелой цепи SEQ ID NO: 85 или ее гуманизированный вариант и вариабельную область легкой цепи SEQ ID NO: 86 или ее гуманизированный вариант.
4. Антитело по п.1, содержащее вариабельную область тяжелой цепи SEQ ID NO: 55 и вариабельную область легкой цепи SEQ ID NO: 56 или его гуманизированный вариант.
5. Антитело по п.1, содержащее вариабельную область тяжелой цепи SEQ ID NO: 57 и вариабельную область легкой цепи SEQ ID NO: 58 или его гуманизированный вариант.
6. Антитело по п.1, содержащее вариабельную область тяжелой цепи SEQ ID NO: 59 и вариабельную область легкой цепи SEQ ID NO: 60 или его гуманизированный вариант.
7. Антитело п. п.1, где антитело представляет собой биспецифическое антитело, гуманизированное антитело, химерное антитело, моноклональное антитело, рекомбинантное антитело, меченое антитело, двухвалентное антитело или анти-идиотипическое антитело.
8. Антитело по п.1, где антитело является биспецифическим антителом, которое дополнительно связывается с антигеном, отличным от PD-L1.
9. Антитело по п.1, где антитело представляет собой антигенсвязывающий фрагмент, выбранный из группы, состоящей из однодоменного антитела верблюдовых, диатела, scFv, димера scFv, BsFv, dsFv, (dsFv)2, dsFv-dsFv', Fv-фрагмента, Fab, Fab', F(ab')2, ds-диатела, нанотела, доменного антитела, выделенной области CDR и двухвалентного доменного антитела.
10. Фармацевтическая композиция для лечения PD-L1 связанного злокачественного новообразования или PD-L1 связанных состояний и заболеваний, содержащая эффективное количество антитела по любому из пп.1-9 и фармацевтически приемлемый носитель.
11. Набор для детекции наличия или уровня PD-L1 в биологическом образце, отличающийся тем, что содержит антитело по любому из пп.1-9.
12. Полинуклеотид, кодирующий антитело по любому из пп.1-9.
13. Вектор экспрессии, содержащий полинуклеотид по п.12.
14. Выделенная клетка-хозяин для экспрессии антител по любому из пп.1-9, содержащая вектор по п.13.
15. Способ получения антитела против PD-L1 антитела, включающий культивирование клетки-хозяина по п.14 в условиях, при которых экспрессируется полинуклеотид, где клетка-хозяин содержит вектор, содержащий полинуклеотид, кодирующий антитело по любому из пп.1-9.
16. Способ лечения состояния, связанного с PD-L1, у пациента, включающий введение пациенту антитела против PD-L1 антитела по любому из пп.1-9, таким образом осуществляя лечение этого заболевания.
17. Способ по п.16, дополнительно включающий введение второго терапевтического средства.
18. Способ по п.17, где второе терапевтическое средство представляет собой средство, используемое в лучевой терапии, химиотерапии, направленной терапии, генной терапии, иммунотерапии, гормональной терапии, ингибировании ангиогенеза, паллиативной терапии, хирургической операции или их сочетании.
19. Способ по п.18, где второе терапевтическое средство представляет собой антитело против VEGFR2.
20. Способ по п.16, где состояние, связанное с PD-L1, представляет собой злокачественное новообразование или опухоль.
21. Способ по п.20, где злокачественное новообразование или опухоль представляет собой метастатическую опухоль, экспрессирующую PD-L1.
22. Способ по п.21, где злокачественное новообразование или опухоль представляет собой солидную опухоль.
23. Способ по п.22, где солидная опухоль представляет собой немелкоклеточный рак легкого, мелкоклеточный рак легкого, почечно-клеточный рак, колоректальный рак, рак толстого кишечника, рак яичника, рак молочной железы, рак поджелудочной железы, карциному желудка, рак мочевого пузыря, рак пищевода, мезотелиому, меланому, рак головы и шеи, рак щитовидной железы, саркому, рак предстательной железы, глиобластому, рак шейки матки, карциному тимуса, меланому, миеломы, грибовидную гранулему, рак из клеток Меркеля, печеночно-клеточную карциному, фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому и другие саркомы, синовиому, мезотелиому, саркому Юинга, лейомиосаркому, рабдомиосаркому, злокачественные новообразования лимфоидной ткани, базально-клеточную карциному, аденокарциному, карциному потовых желез, медуллярную карциному щитовидной железы, папиллярную карциному щитовидной железы, феохромоцитому, карциному сальных желез, папиллярную карциному, папиллярные аденокарциномы, медуллярную карциному, бронхогенную карциному, гепатому, карциномы желчных протоков, хориокарциному, опухоль Вильмса, рак шейки матки, опухоль яичка или семиному.
24. Способ по п.20, где злокачественное новообразование или опухоль представляет собой немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак молочной железы, рак мочевого пузыря, гепатому, колоректальный рак, рак желудка, рак пищевода, меланому или рак толстой кишки.
25. Способ по п.16, где состояние, связанное с PD-L1, представляет собой гематологическое заболевание, инфекционное заболевание, аутоиммунное заболевание или фиброзное заболевание.
26. Способ по п.25, где гематологическое заболевание представляет собой классическую лимфому Ходжкина, первичную медиастинальную крупноклеточную B-клеточную лимфому, богатую T-клетками/гистиоцитами B-клеточную лимфому, острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, острый миелогенный лейкоз и миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный и эритроцитарный лейкоз, хронический миелоцитарный лейкоз, хронический миелогенный лейкоз, хронический лимфоцитарный лейкоз, истинную полицитемию, опухоли из тучных клеток, EBV-положительные и -отрицательные PTLD и диффузную крупноклеточную B-клеточную лимфому, плазмобластную лимфому, экстранодальную NK/Т-клеточную лимфому, носоглоточную карциному и HHV8-ассоциированную первичную эффузионную лимфому, неходжскинскую лимфому, множественную миелому, макроглобулинемию Вальденстрема, болезнь тяжелых цепей, миелодиспластический синдром, волосатоклеточный лейкоз и миелодисплазию.
27. Способ по п.16, где по данным теста пациент является положительным по экспрессии PD-L1 или по данным теста у него повышен уровень экспрессии PD-L1 по сравнению со здоровым или небольным индивидом.
| CN 104736168 A, 24.06.2015 | |||
| CN 103987405 A, 13.08.2014 | |||
| CN 104994873 A, 21.10.2015 | |||
| ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО, СВЯЗЫВАЮЩЕЕ ФАКТОР НЕКРОЗА ОПУХОЛИ АЛЬФА, ДНК, ПЛАЗМИДНАЯ ДНК И СПОСОБ ПОЛУЧЕНИЯ ОДНОЦЕПОЧЕЧНОГО АНТИТЕЛА | 2009 |
|
RU2416645C2 |
Авторы
Даты
2022-07-13—Публикация
2017-02-10—Подача