Область техники, к которой относится изобретение
Настоящее изобретение относится к комбинированным терапиям, применимым для лечения рака. В частности, настоящее изобретение относится к комбинированной терапии, которая включает антагонист белка запрограммированной смерти 1 (PD-1) и динациклиб, который представляет собой ингибитор пан-циклин-зависимой киназы (CDK).
Уровень техники
PD-1 признается в качестве важного игрока в иммунной регуляции и поддержании периферической толерантности. PD-1 умеренно экспрессируется в наивных Т-, В- и NKT-клетках и, его экспрессия увеличена с помощью передачи сигнала с Т/B- клеточного рецептора в лимфоцитах, моноцитах и миелоидных клетках (1).
Два известных лиганда для PD-1, PD-L1 (В7-H1) и PD-L2 (В7-DC), экспрессируются в злокачественных опухолях человека, возникающих в различных тканях. В больших выборочных совокупностях, например, раков яичников, почек, колоректального рака, рака поджелудочной железы, рака печени и меланомы, было установлено, что экспрессия PD-L1 коррелирует с плохим прогнозом и снижением общей выживаемости независимо от последующего лечения (2-13). Аналогично, было установлено, что экспрессия PD-1 в инфильтрующих опухоли лимфоцитах обозначает дисфункциональные Т-клетки при раке молочной железы и меланоме (14-15) и коррелирует с плохим прогнозом при раке почек (16). Соответственно, было сделано предположение, что экспрессирующие PD-L1 опухолевые клетки взаимодействуют с экспрессирующими PD-1 Т-клетками с ослаблением активации Т-клеток и уклонением от иммунного надзора, способствуя тем самым ослаблению иммунного ответа против опухоли.
Некоторые моноклональные антитела, которые ингибируют взаимодействие между PD-1 и одним или обоими из его лигандов PD-L1 и PD-L2 находятся на стадии клинической разработки для лечения рака. Было сделано предположение, что эффективность таких антител может быть увеличена в случае их введения в комбинации с другими одобренными или экспериментальными методами лечения рака, например, облучением, хирургическим вмешательством, химиотерапевтическими средствами, целенаправленными терапиями, агентами, которые ингибируют другие пути передачи сигналов, которые дисрегулированы в опухолях, и другими иммуностимулирующими средствами.
Дисрегуляция контроля клеточного цикла является отличительной чертой всех злокачественных опухолей человека и часто связана с аберрантной активацией/регуляцией циклин-зависимых киназ (CDK). Однако каскад CDK важен для поддержания нормальной работы Т-клеток зависимым от контекста образом. Таким образом, разработка ингибиторов CDK (CKDI) в качестве противораковых средств осложнялась токсичностями в отношении иммунных клеток и, как следствие, возможностью иммуносупрессивных эффектов (17). Динациклиб, ингибитор пан-CDK, который селективно ингибирует CDK1, CDK2, CDK5 и CDK9, был исследован в качестве возможной терапии при ряде раков, при этом нейтропения была самой распространенной, ограничивающей дозу токсичностью в клинических испытаниях (17, 18).
Сущность изобретения
Настоящее изобретение основано, отчасти, на неожиданном обнаружении того, что параллельное введение динациклиба и измененных с целью увеличения их подобия разновидностям антител мыши антител против PD-1 мыши имеющим опухоли мышам приводило к значительно более высокой противоопухолевой эффективности по сравнению с только одним из агентов. Это обнаружение было неожиданным, поскольку известное проявление активности динациклиба, заключающееся в сильном ингибировании транскрипции и клеточной пролиферации, как предсказывалось, противодействует эффективности анти-PD-1 терапии, которая, как полагают, в основном включает активацию и пролиферацию Т-клеток, присутствующих в опухоли и привлекаемых в нее.
Таким образом, в одном варианте осуществления настоящим изобретением обеспечивается способ лечения рака у индивидуума, включающий назначение индивидууму комбинированной терапии, которая включает антагонист PD-1 и соединение динациклиб.
В другом варианте осуществления настоящим изобретением обеспечивается лекарственное средство, включающее антагонист PD-1, для применения в комбинации с соединением динациклибом для лечения рака.
В еще одном варианте осуществления настоящим изобретением обеспечивается лекарственное средство, включающее соединение динациклиб, для применения в комбинации с антагонистом PD-1 для лечения рака.
Другие варианты осуществления обеспечивают применение антагониста PD-1 в производстве лекарственного средства для лечения рака у индивидуума при введении в комбинации с соединением динациклибом и применение соединения динациклиба в производстве лекарственного средства для лечения рака у индивидуума при введении в комбинации с антагонистом PD-1.
В еще одном варианте осуществления настоящим изобретением обеспечивается применение антагониста PD-1 и соединения динациклиба в производстве лекарственных средств для лечения рака у индивидуума. В некоторых предпочтительных вариантах осуществления лекарственные средства включают набор, и набор также включает листовку-вкладыш, содержащую инструкции по применению антагониста PD-1 в комбинации с соединением динациклибом для лечения рака у индивидуума.
Во всех из вышеотмеченного способа лечения, лекарственных средств и применений, антагонист PD-1 ингибирует связывание PD-L1 с PD-1 и предпочтительно также ингибирует связывание PD-L2 с PD-1. В некоторых предпочтительных вариантах осуществления вышеотмеченного способа лечения, лекарственных средств и применений, антагонист PD-1 представляет собой моноклональное антитело, или его антигенсвязывающий фрагмент, которое(ый) специфически связывается с PD-1 или PD-L1 и блокирует связывание PD-L1 с PD-1. В одном особенно предпочтительном варианте осуществления антагонист PD-1 представляет собой антитело против PD-1, которое включает тяжелую цепь и легкую цепь, и причем тяжелая и легкая цепи включают аминокислотные последовательности, представленные на фиг. 6 (SEQ ID NO:21 и SEQ ID NO:22).
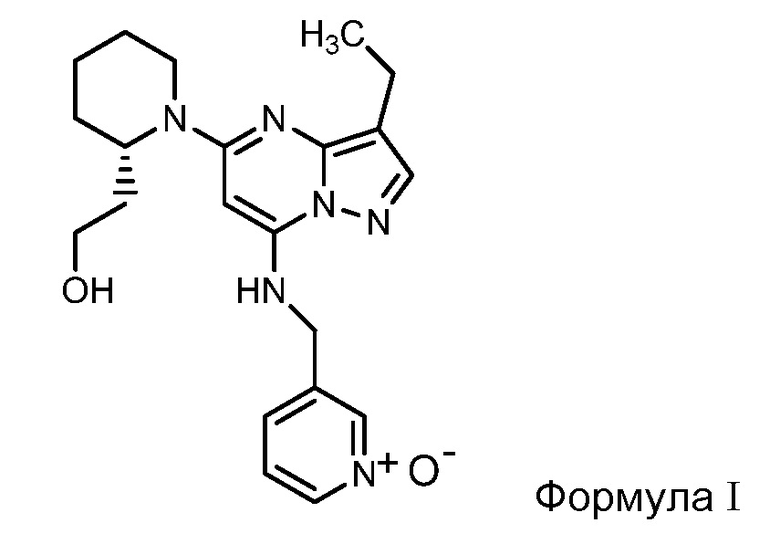
Во всех вышеотмеченных вариантах осуществления способа лечения, лекарственных средств и применений, соединение динациклиб представляет собой соединение формулы I

или фармацевтически приемлемую соль соединения формулы I.
В некоторых вариантах осуществления вышеотмеченного способа лечения, лекарственных средств и применений настоящего изобретения индивидуумом является человек, а раком является солидная опухоль, и в некоторых предпочтительных вариантах осуществления солидная опухоль представляет собой рак мочевого пузыря, рак молочной железы, светлоклеточный рак почки, плоскоклеточный рак головы/шеи, плоскоклеточный рак легких, злокачественную меланому, немелкоклеточный рак легких (NSCLC), рак яичников, рак поджелудочной железы, рак предстательной железы, почечно-клеточный рак, мелкоклеточный рак легких (SCLC) или тройной негативный рак молочной железы. В некоторых предпочтительных вариантах осуществления рак представляет собой не подвергнутую воздействию ипилимумаба запущенную меланому, а в других предпочтительных вариантах осуществления человек имеет резистентную к ипилимумабу запущенную меланому.
В других вариантах осуществления вышеотмеченного способа лечения, лекарственных средств и применений настоящего изобретения индивидуумом является человек, а раком является гемобластоз, и в некоторых предпочтительных вариантах осуществления гемобластозом является острый лимфобластный лейкоз (ALL), острый миелоидный лейкоз (AML), хронический лимфолейкоз (CLL), хронический миелоидный лейкоз (CML), крупноклеточная диффузная B-клеточная лимфома (DLBCL), EBV-позитивная DLBCL, первичная крупноклеточная диффузная B-клеточная лимфома средостения, богатая Т-клетками/гистиоцитами крупноклеточная диффузная B-клеточная лимфома, фолликулярная лимфома, лимфома Ходжкина (HL), лимфома из клеток мантийной зоны (MCL), множественная миелома (ММ), миелоидная клеточная лейкемия-1 (Mcl-1), миелодиспластический синдром (MDS), неходжкинская лимфома (NHL) или мелкоклеточная лимфоцитарная лимфома (SLL).
Также, в предпочтительных вариантах осуществления любого из вышеотмеченного способа лечения, лекарственных средств и применений, рак экспрессирует один или оба из PD-L1 и PD-L2. В особенно предпочтительных вариантах осуществления экспрессия PD-L1 увеличена в злокачественной опухоли.
В одном особенно предпочтительном варианте осуществления вышеотмеченного способа лечения, лекарственных средств и применений, индивидуумом является человек, и раком является хронический лимфолейкоз (SLL), который экспрессирует PD-L1 человека.
Краткое описание чертежей
На фиг. 1 представлены аминокислотные последовательности CDR легкой цепи и тяжелой цепи для приводимого в качестве примера моноклонального антитела против PD-1, применимого в настоящем изобретении (SEQ ID NO:1-6).
На фиг. 2 представлены аминокислотные последовательности CDR легкой цепи и тяжелой цепи для другого приводимого в качестве примера моноклонального антитела против PD-1, применимого в настоящем изобретении (SEQ ID NO:7-12).
На фиг. 3 представлены аминокислотные последовательности вариабельной области тяжелой и полноразмерной тяжелой цепи для приводимого в качестве примера моноклонального антитела против PD-1, применимого в настоящем изобретении (SEQ ID NO:13 и SEQ ID NO:14).
На фиг. 4 представлены аминокислотные последовательности вариабельных областей альтернативных легких цепей для приводимого в качестве примера моноклонального антитела против PD-1, применимого в настоящем изобретении (SEQ ID NO:15-17).
На фиг. 5 представлены аминокислотные последовательности альтернативных легких цепей для приводимого в качестве примера моноклонального антитела против PD-1, применимого в настоящем изобретении (SEQ ID NO:18-20).
На фиг. 6 представлены аминокислотные последовательности тяжелой и легкой цепей для МК-3475 (SEQ ID NO:21 и 22, соответственно).
На фиг. 7 представлены аминокислотные последовательности тяжелой и легкой цепей для ниволумаба (SEQ ID NO:23 и 24, соответственно).
На фиг. 8 продемонстрировано, что противоопухолевый эффект параллельного введения антагониста PD-1 и динациклиба лучше монотерапии с использованием только одного из двух агентов у имеющих опухоли мышей, при этом на фиг. 8A представлен средний объем опухоли в различные дни во время лечения контролем, мышиным мАт антителом против PD-1 мыши (анти-PDL), динациклибом или как анти-PDL, так и динациклибом, а на фиг. 8B представлены значения объемов опухолей для отдельных мышей в каждой группе лечения в первый день лечения (график слева, день 0) или после 25 дней лечения (график справа, день 25). Экспериментальные подробности описаны в примере 1, представленном ниже.
Подробное описание
Сокращения. На протяжении всего подробного описания и примеров настоящего изобретения будут использоваться следующие сокращения:
I. Определения
Чтобы настоящее изобретение можно было лучше понять, ниже специально определены некоторые технические и научные термины. Если специально не определено где-то в другом месте в этом документе, все другие технические и научные термины, используемые здесь, имеют значение, в котором они обычно понимаются специалистом со средним уровнем компетентности в области техники, к которой относится это изобретение.
В настоящем описании, в том числе в прилагаемой формуле изобретения, формы единственного числа таких слов, «a», «an» и «the», включают соответствующие им ссылки на множественное число, если из контекста явно не следует иное.
«Введение» и «лечение», когда оно относится к животному, человеку, экспериментальному объекту, клетке, ткани, органу или биологической жидкости, относится к приведению экзогенного фармацевтического, терапевтического, диагностического агента или композиции в контакт с животным, человеком, субъектом, клеткой, тканью, органом или биологической жидкостью. Лечение клетки включает приведение реагента в контакт с клеткой, а также приведение реагента в контакт с жидкостью, когда жидкость находится в контакте с клеткой. «Введение» и «лечение» также означает in vitro и ex vivo лечения, например, клетки, с помощью реагента, диагностического, связывающегося соединения или с помощью другой клетки. Термин «субъект» включает любой организм, предпочтительно животное, более предпочтительно млекопитающее (например, крысу, мышь, собаку, кошку, кролика) и наиболее предпочтительно человека.
Используемый здесь термин «антитело» относится к любой форме антитела, которая проявляет желаемую биологическую или связывающую активность. Таким образом, он используется в самом широком смысле и, в частности, охватывает, но без ограничения, моноклональные антитела (в том числе полноразмерные моноклональные антитела), поликлональные антитела, полиспецифические антитела (например, биспецифические антитела), гуманизированные, полностью человеческие антитела, химерные антитела и измененные с целью увеличения их подобия разновидностям антител животных семейства верблюдовых однодоменные антитела. «Родительские антитела» представляют собой антитела, полученные путем подвергания иммунной системы воздействию антигена до модификации антител для применения по назначению, например, гуманизации антитела для применения в качестве терапевтического средства для человека.
Обычно основная структурная единица антитела включает тетрамер. Каждый тетрамер включает две идентичные пары полипептидных цепей, при этом пара имеет одну «легкую» (приблизительно 25 кДа) и одну «тяжелую» цепь (приблизительно 50-70 кДа). N-концевая часть каждой цепи включает вариабельную область из приблизительно от 100 до 110 или более аминокислот, главным образом, ответственную за распознавание антигена. С-концевая часть тяжелой цепи может определять константную область, главным образом, ответственную за эффекторную функцию. Как правило, легкие цепи человека относят к легким цепям класса каппа и лямбда. Кроме того, тяжелые цепи человека, как правило, относят к классам мю, дельта, гамма, альфа или эпсилон и определяют изотип антитела как IgM, IgD, IgG, IgA и IgE, соответственно. В легких и тяжелых цепях вариабельные и константные области соединены с помощью «J-области» из приблизительно 12 или более аминокислот, при этом тяжелая цепь также включает «D-область» из приблизительно 10 или более аминокислот. Смотрите в целом Fundamental Immunology Ch. 7 (Paul, W., ed., 2nd ed. Raven Press, N.Y. (1989).
Вариабельные области каждой пары легкая/тяжелая цепь образуют сайт связывания антитела. Таким образом, обычно интактное антитело имеет два сайта связывания. За исключением бифункциональных или биспецифических антител, два сайта связывания являются обычно одинаковыми.
Как правило, вариабельные домены и тяжелой, и легкой цепей включают три гипервариабельных участка, называемых также определяющими комплементарность участками (CDR), которые расположены в относительно консервативных каркасных областях (FR). CDR обычно располагаются в нужном положении с помощью каркасных областей, что позволяет связываться со специфическим эпитопом. Обычно, от N-конца к С-концу, вариабельные домены как легких, так и тяжелых цепей включают FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Отнесение аминокислот к каждому домену осуществляется обычно в соответствии с определениями Sequences of Proteins of Immunological Interest, Kabat, et al.; National Institutes of Health, Bethesda, Md.; 5th ed.; NIH Publ. No. 91-3242 (1991); Kabat (1978) Adv. Prot. Chem. 32:1-75; Kabat, et al., (1977) J. Biol. Chem. 252:6609-6616; Chothia, et al., (1987) J Mol. Biol. 196:901-917 или Chothia, et al., (1989) Nature 342:878-883.
Используемый в данном описании термин «гипервариабельный участок» относится к аминокислотным остаткам антитела, которые ответственны за связывание антигена. Гипервариабельный участок включает аминокислотные остатки из «определяющего комплементарность участка» или «CDR» (т.е. CDRL1, CDRL2 и CDRL3 в вариабельном домене легкой цепи и CDRH1, CDRH2 и CDRH3 в вариабельном домене тяжелой цепи). Смотрите Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (определение CDR-участков антитела по последовательности); смотрите также Chothia and Lesk (1987) J. Mol. Biol. 196:901-917 (определение CDR-участков антитела по структуре). Используемый здесь термин остатки «каркасной области или «FR» относится к остаткам гипервариабельного домена, отличным от остатков гипервариабельного участка, определенных здесь как остатки CDR.
В настоящем описании, если не указано иное, «фрагмент антитела» или «антигенсвязывающий фрагмент» относится к антигенсвязывающим фрагментам антител, т.е. фрагментам антител, которые сохраняют способность к специфическому связыванию с антигеном, с которым связывается полноразмерное антитело, например, фрагментам, которые сохраняют один или более CDR-участков. Примеры связывающих фрагментов антител включают, но без ограничения, Fab-, Fab'-, F(аb')2- и Fv-фрагменты, диатела; линейные антитела; молекулы одноцепочечных антител, например, sc-Fc; нанотела и полиспецифические антитела, образованные из фрагментов антител.
Антитело, которое «специфически связывается с» определенным белком-мишенью, представляет собой антитело, которое проявляет предпочтительное связывание с этой мишенью по сравнению с другими белками, но эта специфичность не подразумевает абсолютную специфичность связывания. Антитело считается «специфическим» в отношении намеченной мишени, если его связывание является событием, определяющим присутствие белка-мишени в образце, например, без вызова нежелательных результатов, таких как ложные результаты. Антитела, или их связывающие фрагменты применимые в настоящем изобретении, будут связываться с белком-мишенью с аффинностью, которая в по крайней мере два раза выше, предпочтительно в по крайней мере десять раз выше, более предпочтительно в по крайней мере 20 раз выше и наиболее предпочтительно в по крайней мере 100 раз выше аффинности к не являющимся мишенями белкам. Говорят, что антитело, как здесь используется, специфически связывается с полипептидом, включающим данную аминокислотную последовательность, например, аминокислотную последовательность зрелой молекулы PD-1 человека или PD-L1 человека, если оно связывается с полипептидами, включающими эту последовательность, но не связывается с белками, в которых отсутствует эта последовательность.
«Химерное антитело» относится к антителу, в котором часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителе, полученном от конкретного вида (например, человека) или относящемся к конкретному классу или подклассу антител, в то время как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителе, полученном от другого вида (например, мыши) или относящемся к другому классу или подклассу антител, а также фрагментам таких антител, при условии, что они проявляют желаемую биологическую активность.
«Антитело человека» относится к антителу, которое включает только последовательности белка иммуноглобулина человека. Антитело человека может содержать мышиные углеводные цепи в случае продукции в организме мыши, в клетке мыши или в гибридоме, происходящей из клетки мыши. Аналогичным образом, «антитело мыши» или «антитело крысы» относится к антителу, которое включает только последовательности иммуноглобулина мыши или крысы, соответственно.
«Гуманизированное антитело» относится к формам антител, которые содержат последовательности из нечеловеческих (например, мышиных) антител, а также антител человека. Такие антитела содержат минимальную последовательность, происходящую из нечеловеческого иммуноглобулина. Обычно гуманизированное антитело будет включать по существу все из по крайней мере одного, а обычно двух вариабельных доменом, в которых все или по существу все гипервариабельные петлевые участки соответствуют таковым из нечеловеческого иммуноглобулина, и все или по существу все из FR-областей являются таковыми из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет включать по крайней мере часть константной области иммуноглобулина (Fc), обычно таковую иммуноглобулина человека. Префикс «hum», «hu» или «h» добавляется к названиям клонов антител клонов, когда необходимо отличать гуманизированные антитела от родительских антител грызунов. Гуманизированные формы антител грызунов обычно включают те же последовательности CDR родительских антител грызунов, хотя некоторые аминокислотные замены могут быть включены для увеличения аффинности, увеличения стабильности гуманизированного антитела или по другим причинам.
Термины «рак», «раковый» или «злокачественный» относятся к физиологическому состоянию у млекопитающих или описывают физиологическое состояние у млекопитающих, которое характеризуется неконтролируемым ростом клеток. Примеры рака включают, но без ограничения, карциному, лимфому, лейкоз, бластому и саркому. Более конкретные примеры таких раков включают плоскоклеточный рак, миелому, мелкоклеточный рак легкого, немелкоклеточный рак легкого, глиому, лимфому Ходжкина, неходжкинскую лимфому, острый миелоидный лейкоз (AML), множественную миелому, рак желудочно-кишечного тракта, рак почки, рак яичников, рак печени, лимфобластный лейкоз, лимфолейкоз, колоректальный рак, рак эндометрия, рак почки, рак предстательной железы, рак щитовидной железы, меланому, хондросаркому, нейробластому, рак поджелудочной железы, мультиформную глиобластому, рак шейки матки, рак головного мозга, рак желудка, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки и рак головы и шеи. Особенно предпочтительные виды рака, которые можно лечить в соответствии с настоящим изобретением, включают те, которые характеризуются увеличенной экспрессией одного или обоих из PD-L1 и PD-L2 в исследуемых образцах тканей.
«Биотерапевтический агент» означает биологическую молекулу, такую как антитело или слитый белок, которая блокирует передачу сигнала от лиганда/рецептора в любом биологическом пути, который поддерживает сохранение и/или рост опухоли или подавляет противоопухолевый иммунный ответ.
«CDR», как здесь используется, означает определяющий комплементарность участок (участки) в вариабельной области иммуноглобулина, определяемый с использованием системы нумерации Kabat, кроме особо оговоренных случаев.
«Химиотерапевтическое средство» представляет собой химическое соединение, применимое при лечении рака. Классы химиотерапевтических средств включают, но без ограничения: алкилирующие агенты, антиметаболиты, ингибиторы киназы, веретенный яд растительные алкалоиды, цитотоксические/противоопухолевые антибиотики, ингибиторы топоизомеразы, фотосенсибилизаторы, антиэстрогены и селективные модуляторы эстрогеновых рецепторов (SERM), антипрогестероны, ингибиторы эстрогеновых рецепторов (ERD), антагонисты эстрогеновых рецепторов, агонисты рилизинг-гормона лютеинизирующего гормона, антиандрогены, ингибиторы ароматазы, ингибиторы EGFR, ингибиторы VEGF, антисмысловые олигонуклеотиды, которые, которые ингибируют экспрессию генов, вовлеченных в аномальную пролиферацию клеток или рост опухоли. Химиотерапевтические средства, применимые в способах лечения настоящего изобретения, включают цитостатические и/или цитотоксические агенты.
«Clothia», как здесь используется, означает систему нумерации антител, описанную в Al-Lazikani et al., JMB 273:927-948 (1997).
«Консервативно модифицированные варианты» или «консервативная замена» относится к заменам аминокислот в белке другими аминокислотами, имеющими схожие характеристики (например, заряд, размер боковой цепи, гидрофобность/гидрофильность, конформацию основной цепи и жесткость, и т.д.), так что изменения часто могут быть осуществлены без изменения биологической активности или другого желательного свойства белка, такого как аффинность и/или специфичность к антигену. Квалифицированные в данной области техники специалисты признают, что, как правило, одиночные аминокислотные замены в несущественных областях полипептида не изменяют существенно биологическую активность (смотрите, например, Watson et al. (1987) Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., p.224 (4th Ed.)). Кроме того, замены структурно или функционально схожих аминокислот с меньшей долей вероятности будут нарушать биологическую активность. Приводимые в качестве примера консервативные замены приведены в таблице 3.
Приводимые в качестве примера
консервативные аминокислотные замены
«По существу состоит из» и его вариации, такие как «по существу состоят из» или «по существу состоящий из», как он использован в описании и формуле изобретения, означает включение любых перечисленных элементов или группы элементов и дополнительное включение других элементов схожей или другой природы по сравнению с перечисленными элементами, которые не изменяют существенно основные или новые свойства указанной схемы введения доз, способа или композиции. В качестве неограничивающего примера, антагонист PD-1, который по существу состоит из описанной аминокислотной последовательности, может также включать одну или более аминокислот, в том числе замен одного или более аминокислотных остатков, которые не влияют существенно на свойства связывающегося соединения.
«Диагностическое моноклональное антитело против PD-L» означает мАт, которое специфически связывается со зрелой формой указанного PD-L (PD-L1 или PD-L2), который представлен на поверхности некоторых клеток млекопитающих. В зрелом PD-L отсутствует предсекреторная лидерная последовательность, также называемая лидерным пептидом. Термины «PD-L» и «зрелый PD-L» используются здесь взаимозаменяемо и, как будет подразумеваться, означают одну и ту же молекулу, если не указано иное или не вытекает со всей очевидностью из контекста.
Как здесь используется, диагностическое мАт против PD-L1 человека или анти-HPD-L1 мАт относится к моноклональному антителу, которое специфически связывается со зрелой молекулой PD-L1 человека. Зрелая молекула PD-L1 состоит из аминокислот 19-290 следующей последовательности: MRIFAVFIFMTYWHLLNAFTVTVPKDLYVVEYGSNMTIECKFPVEKQLDLAALIVYWEMEDKNIIQFVHGEEDLKVQHSSYRQRARLLKDQLSLGNAALQITDVKLQDAGVYRCMISYGGADYKRITVKVNAPYNKINQRILVVDPVTSEHELTCQAEGYPKAEVIWTSSDHQVLSGKTTTTNSKREEKLFNVTSTLRINTTTNEIFYCTFRRLDPEENHTAELVIPELPLAHPPNERTHLVILGAILLCLGVALTFIFRLRKGRMMDVKKCGIQDTNSKKQSDTHLEET (SEQ ID NO:25).
Конкретными примерами диагностических мАт против PD-L1 человека, применимых в качестве диагностических мАт для иммуногистохимического (IHC) выявления экспрессии PD-L1 в фиксированных формалином, залитых парафином (FFPE) срезах опухолевой ткани, являются антитело 20C3 и антитело 22C3, которые описаны в одновременно рассматриваемой, предварительной заявке на патент США с № 61/745386, поданной в декабре 2012. Эти антитела включают аминокислотные последовательности вариабельных областей легкой цепи и тяжелой цепи, показанные в приведенной ниже таблице 2:
Моноклональные антитела 20C3 и 22C3
Другим мАт против PD-L1 человека, которое, как сообщалось, применимо для IHC выявления экспрессии PD-L1 в FFPE срезах тканей (Chen, B.J. et al., Clin Cancer Res 19:3462-3473 (2013)), является кроличье мАт против PD-L1 человека, общедоступное от Sino Biological, Inc. (Beijing, P.R. КНР; каталожный номер 10084-R015).
«Соединение динациклиб» означает соединение формулы I и фармацевтически приемлемые соли соединения формулы I. Химическим названием динациклиба является 1-[3-этил-7-[[(1-оксидо-3-пиридинил)метил]амино]пиразоло[1,5-а]пиримидин-5-ил]-2 (S)-пиперидинэтанол. Это соединение может быть синтезировано, как описано в патенте США с № US 7119200, или любым другим путем синтеза, который будет абсолютно очевиден квалифицированному в данной области специалисту.
Ссылка на соединение формулы I здесь, как подразумевается, включает ссылку на его соли, кроме особо оговоренных случаев. Термин «соль(и)», как здесь используется, обозначает кислотные соли, образованные с использованием неорганических и/или органических кислот, а также основные соли, образованные с использованием неорганических и/или органических оснований. Кроме того, когда соединение формулы I содержит как основную группу, такую как, но без ограничения, пиридин или имидазол, и кислотную группу, как, но без ограничения, карбоновая кислота, цвиттер-ионы («внутренние соли») могут быть образованы и включены в термин «соль(и)», используемый здесь. Фармацевтически приемлемые соли соединения формулы I могут быть образованы, например, путем взаимодействия соединения формулы I с некоторым количеством кислоты или основания, таким как эквивалентное количество, в среде, такой как та, в которой соль выпадает в осадок, или в водной среде с последующей лиофилизацией.
Приводимые в качестве примера кислотно-аддитивные соли соединения формулы I включают ацетаты, аскорбаты, бензоаты, бензолсульфонаты, бисульфаты, бораты, бутираты, цитраты, камфораты, камфорсульфонаты, фумараты, гидрохлориды, гидробромиды, гидроиодиды, лактаты, малеаты, метансульфонаты, нафталинсульфонаты, нитраты, оксалаты, фосфаты, пропионаты, салицилаты, сукцинаты, сульфаты, тартараты, тиоцианаты, толуолсульфонаты (также известные как тозилаты) и т.п. Кроме того, кислоты, которые обычно считаются подходящими для образования фармацевтически применимых солей из основных фармацевтических соединений, обсуждаются, например, в S. Berge et al, Journal of Pharmaceutical Sciences (1977) 66(1) 1-19; P. Gould, International J. of Pharmaceutics (1986) 33 201-217; Anderson et al, The Practice of Medicinal Chemistry (1996), Academic Press, New York; и в The Orange Book (Food & Drug Administration, Washington, D.C. на их Web-сайте). Эти описания включены сюда посредством ссылки на них.
Приводимые в качестве примера основные соли соединения формулы I включают соли аммония, соли щелочных металлов, такие как соли натрия, лития и калия, соли щелочноземельных металлов, такие как кальциевые и магниевые соли, соли с органическими основаниями (например, органическими аминами), такими как дициклогексиламины, трет-бутиламины, и соли с аминокислотами, такими как аргинин, лизин и т.п. Основные азотсодержащие группы могут быть квартернизованы с использованием таких агентов, как (низший алкил)галогениды (например, метил-, этил- и бутил- хлориды, бромиды и иодиды), диалкилсульфаты (например, диметил-, диэтил- и дибутилсульфаты), длинноцепочечные галогениды (например, децил-, лаурил- и стеарилхлориды, бромиды и иодиды), аралкилгалогениды (например, бензил- и фенетилбромиды) и другие.
Все такие кислые соли и основные соли, как подразумевается, являются фармацевтически приемлемыми солями в пределах объема соединения динациклиба, используемого в настоящем изобретении, и все кислые и основные соли считаются эквивалентными свободным формам соответствующего соединения для целей изобретения.
Пролекарства соединения формулы I также рассматриваются для использования в способах, лекарственных средствах и применениях настоящего изобретения. Термин «пролекарство», используемый здесь, означает соединение, которое является предшественником лекарственного средства, который при введении субъекту подвергается химическому превращению в результате метаболических или химических процессов с образованием соединения формулы I или его соли. Обсуждение пролекарств приводится в T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems (1987) 14 of the A.C.S. Symposium Series, и в Bioreversible Carriers in Drug Design, (1987) Edward B. Roche, ed., American Pharmaceutical Association and Pergamon Press, оба из которых включены сюда посредством ссылки на них.
«Каркасная область» или «FR», как здесь используется, означает вариабельные области иммуноглобулина за исключением CDR-участков.
«Гомология» относится к сходству последовательностей между двумя полипептидными последовательностями, когда они оптимально совмещены. Когда положение в обеих из двух сравниваемых последовательностей занята одной и той же субъединицей аминокислотным мономером, например, если позиция в CDR легкой цепи двух различных Ат занята аланином, то два Ат гомологичны в этом положении. Процент гомологии - это число гомологичных положений, общих для двух последовательностей, разделенное на общее число сравниваемых положений ×100. Например, если 8 из 10 положений в двух последовательностях совпадают или гомологичны, когда последовательности оптимально совмещены, то эти две последовательности гомологичны на 80%. Как правило, сравнение выполняют, когда две последовательности совмещены для обеспечения максимального процента гомологии. Например, сравнение может быть выполнено с помощью алгоритма BLAST, параметры которого выбраны так, чтобы обеспечить наибольшее количество совпадений между соответствующими последовательностями по всей длине соответствующих ссылочных последовательностей.
Следующие ссылки относятся к алгоритмам BLAST, часто используемым для анализа последовательности: АЛГОРИТМЫ BLAST: Altschul, S.F., et al., (1990) J. Mol. Biol. 215:403-410; Gish, W., et al., (1993) Nature Genet. 3:266-272; Madden, T.L., et al., (1996) Meth. Enzymol. 266:131-141; Altschul, S.F., et al., (1997) Nucleic Acids Res. 25:3389-3402; Zhang, J., et al., (1997) Genome Res. 7:649-656; Wootton, J.C., et al., (1993) Comput. Chem. 17:149-163; Hancock, J.M. et al., (1994) Comput. Appl. Biosci. 10:67-70; СИСТЕМЫ ОЦЕНКИ СОВМЕЩЕНИЙ: Dayhoff, M.O., et al., "A model of evolutionary change in proteins." in Atlas of Protein Sequence and Structure, (1978) vol. 5, suppl. 3. M.O. Dayhoff (ed.), pp. 345-352, Natl. Biomed. Res. Found., Washington, DC; Schwartz, R.M., et al., "Matrices for detecting distant relationships." in Atlas of Protein Sequence and Structure, (1978) vol. 5, suppl. 3." M.O. Dayhoff (ed.), pp. 353-358, Natl. Biomed. Res. Found., Washington, DC; Altschul, S.F., (1991) J. Mol. Biol. 219:555-565; States, D.J., et al., (1991) Methods 3:66-70; Henikoff, S., et al., (1992) Proc. Natl. Acad. Sci. USA 89: 10915-10919; Altschul, S.F., et al., (1993) J. Mol. Evol. 36: 290-300; СТАТИСТИКА СОВМЕЩЕНИЙ: Karlin, S., et al., (1990) Proc. Natl. Acad. Sci. USA 87:2264-2268; Karlin, S., et al., (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877; Dembo, A., et al., (1994) Ann. Prob. 22:2022-2039; и Altschul, S.F. "Evaluating the statistical significance of multiple distinct local alignments." in Theoretical and Computational Methods in Genome Research (S. Suhai, ed.), (1997) pp. 1-14, Plenum, New York.
«Выделенное антитело» и «выделенный фрагмент антитела» относится к состоянию очистки и в таком контексте означает, что названная молекула по существу свободна от других биологических молекул, таких как нуклеиновые кислоты, белки, липиды, углеводы или другие материалы, такие как клеточный дебрис и среды для роста. Вообще, термин «выделенный», как подразумевается, не относится к полному отсутствию такого материала или к отсутствию воды, буферов или солей, если они не присутствуют в количествах, которые сильно мешают экспериментальному или терапевтическому применению связывающегося соединения, описанного здесь.
«Kabat», как здесь используется, означает систему совмещения и нумерации для иммуноглобулинов, впервые введенную Elvin А. Kabat (((1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md.).
«Моноклональное антитело» или «мАт», как здесь используется, относится к популяции по существу гомогенных антител, т.е. молекулы антител, составляющие популяцию, являются идентичными по аминокислотной последовательности за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Напротив, обычные (поликлональные) препараты антител, как правило, включают множество различных антител, имеющих различные аминокислотные последовательности в своих вариабельных доменах, в частности своих CDR, которые часто специфичны для различных эпитопов. Определение «моноклональное» указывает на характер антитела, полученного из по существу гомогенной популяции антител, и не должно быть истолковано как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые будут использоваться в соответствии с настоящим изобретением, могут быть получены методом получения гибридом, впервые описанным в Kohler et al. (1975) Nature 256: 495, или могут быть получены методами рекомбинантных ДНК (смотрите, например, патент США с № 4816567). «Моноклональные антитела» также могут быть выделены из фаговых библиотек антител с использованием методов, описанных в Clackson et al. (1991) Nature 352:624-628, и Marks et al. (1991) J. Mol. Biol. 222:581-597, например. Смотрите также Presta (2005), J. Allergy Clin. Immunol. 116:731.
«Пациент» или «субъект» относится к какой-либо одному субъекту, для которого желательна терапия или который принимает участие в клиническом испытании, эпидемиологическом исследовании или используется в качестве контроля, в том числе людям и являющимся млекопитающими ветеринарным пациентам, таким как крупный рогатый скот, лошади, собаки и кошки.
«Антагонист PD-1» означает любое химическое соединение или биологическую молекулу, которое блокирует связывание PD-L1, представленного на раковой клетке, с PD-1, представленным на иммунной клетке (Т-клетке, В-клетке или NKT-клетке), а также предпочтительно блокирует связывание PD-L2, представленного на раковой клетке, с представленным на иммунной клетке PD-1. Альтернативные названия или синонимы для PD-1 и его лигандов включают: PDCD1, PD1, CD279 и SLEB2 для PD-1; PDCD1L1, PDL1, B7H1, B7-4, CD274 и В7-Н для PD-L1; и PDCD1L2, PDL2, В7-DC, Btdc и CD273 для PD-L2. В любом из способа лечения, лекарственных средств и применений настоящего изобретения, в котором являющегося человеком индивидуума подвергают лечению, антагонист PD-1 блокирует связывание PD-L1 человека с PD-1 человека и предпочтительно блокирует связывание и PD-L1, и PD-L2 человека с PD-1 человека. Аминокислотные последовательности PD-1 человека можно найти в № положения в NCBI: NP_005009. Аминокислотные последовательности PD-L1 и PD-L2 можно найти в № положения в NCBI: NP_054862 и NP_079515, соответственно.
Антагонисты PD-1, применимые в любом из способа лечения, лекарственных средств и применений настоящего изобретения, включают моноклональное антитело (мАт), или его антигенсвязывающий фрагмент, которое специфически связывается с PD-1 или PD-L1 и предпочтительно специфически связывается с PD-1 человека или PD-L1 человека. мАт может представлять собой антитело человека, гуманизированное антитело или химерное антитело и может включать человеческую константную область. В некоторых вариантах осуществления человеческую константную область выбирают из группы, состоящей из константных областей IgG1, IgG2, IgG3 и IgG4, а в предпочтительных вариантах осуществления человеческой константной областью является константная область IgG1 или IgG4. В некоторых вариантах осуществления антигенсвязывающий фрагмент выбирают из группы, состоящей из Fab-, Fab'-SH-, F(аb')2-, Fv- и ScFv-фрагментов.
Примеры мАт, которые связываются с PD-1 человека и применимы в способе лечения, лекарственных средствах и применениях настоящего изобретения, описаны в US7521051, US8008449 и US8354509. Конкретные мАт против PD-1 человека, применимые в качестве антагониста PD-1 в способе лечения, лекарственных средствах и применениях настоящего изобретения, включают: МК-3475, гуманизированное мАт изотипа IgG4, которое имеет структуру, описанную в WHO Drug Information, Vol. 27, No. 2, pages 161-162 (2013), и которое включает аминокислотные последовательности тяжелой и легкой цепей, представленные на фиг. 6, ниволумаб (BMS-936558), мАт изотипа IgG4 человека, которое имеет структуру, описанную в WHO Drug Information, Vol. 27, No. 1, pages 68-69 (2013), и которое включает аминокислотные последовательности тяжелой и легкой цепей, представленные на фиг. 7; пидилизумаб (CT-011, также известный как hBAT или hBAT-1); и гуманизированные антитела h409A11, h409A16 и h409A17, которые описаны в WO2008/156712.
Примеры мАт, которые связываются с PD-L1 человека и применимы в способе лечения, лекарственных средствах и применениях настоящего изобретения, описаны в WO2013/019906, W02010/077634 Al и US8383796. Специфические мАт против PD-L1 человека, применимые в качестве антагониста PD-1 в способе лечения, лекарственных средствах и применениях настоящего изобретения, включают MPDL3280A, BMS-936559, MEDI4736, MSB0010718C и антитело, которое включает вариабельные области тяжелой цепи и легкой цепи с SEQ ID NO:24 и SEQ ID NO:21, соответственно, из WO2013/019906.
Другие антагонисты PD-1, применимые в любом из способа лечения, лекарственных средств и применений настоящего изобретения, включают иммуноадгезин, который специфически связывается с PD-1 или PD-L1 и предпочтительно специфически связывается с PD-1 человека или PD-L1 человека, например, слитый белок, содержащий экстраклеточную или PD-1-связывающую часть PD-L1 или PD-L2, слитую с константной область, такой как Fc-область молекулы иммуноглобулина. Примеры молекул иммуноадгезии, которые специфически связываются с PD-1, описаны в WO2010/027827 и WO2011/066342. Конкретные слитые белки, применимые в качестве антагониста PD-1 в способе лечения, лекарственных средствах и применениях настоящего изобретения, включают AMP-224 (также известный как B7-DCIg), который представляет собой слитый белок PD-L2-FC и связывается с PD-1 человека.
В некоторых предпочтительных вариантах осуществления способа лечения, лекарственных средств и применений настоящего изобретения антагонист PD-1 представляет собой моноклональное антитело, или его антигенсвязывающий фрагмент, которое(ый) включает: (a) CDR легкой цепи с SEQ ID NO:1, 2 и 3 и CDR тяжелой цепи с SEQ ID NO:4, 5 и 6; или (b) CDR легкой цепи с SEQ ID NO:7, 8 и 9 и CDR тяжелой цепи с SEQ ID NO:10, 11 и 12.
В других предпочтительных вариантах осуществления способа лечения, лекарственных средств и применений настоящего изобретения, антагонист PD-1 представляет собой моноклональное антитело, или его антигенсвязывающий фрагмент, которое(ый) специфически связывается с PD-1 человека и включает (a) вариабельную область тяжелой цепи, включающую SEQ ID NO:13 или ее вариант, и (b) вариабельную область легкой цепи, включающую аминокислотную последовательность, выбираемую из группы, состоящей из SEQ ID NO:15 или ее варианта; SEQ ID NO:16 или ее варианта и SEQ ID NO:17 или ее варианта. Вариант последовательности вариабельной области тяжелой цепи идентичен ссылочной последовательности за исключением того, что он содержит вплоть до 17 консервативных аминокислотных замен в каркасной области (т.е. вне CDR) и предпочтительно содержит менее десяти, девяти, восьми, семи, шести или пяти консервативных аминокислотных замен в каркасной области. Вариант последовательности вариабельной области легкой цепи идентичен ссылочной последовательности за исключением того, что он содержит вплоть до пяти консервативных аминокислотных замен в каркасной области (т.е. вне CDR) и предпочтительно содержит менее четырех, трех или двух консервативных аминокислотных замен в каркасной области.
В другом предпочтительном варианте осуществления способа лечения, лекарственных средств и применений настоящего изобретения, антагонист PD-1 представляет собой моноклональное антитело, которое специфически связывается с PD-1 человека и включает (a) тяжелую цепь, включающую SEQ ID NO:14, и (b) легкую цепь, включающую SEQ ID NO:18, SEQ ID NO:19 или SEQ ID NO:20.
В еще одном предпочтительном варианте осуществления способа лечения, лекарственных средств и применений настоящего изобретения, антагонист PD-1 представляет собой моноклональное антитело, которое специфически связывается с PD-1 человека и включает (a) тяжелую цепь, включающую SEQ ID NO:14, и (b) легкую цепь, включающую SEQ ID NO:18.
В представленной ниже таблице 3 приводится список аминокислотных последовательностей приводимых в качестве примера мАт против PD-1 для применения в способе лечения, лекарственных средствах и применениях настоящего изобретения, и эти последовательности показаны на фиг. 1-5.
Приводимые в качестве примера антитела против PD-1 человека
Экспрессия «PD-L1» или «PD-L2», как здесь используется, означает любой детектируемый уровень экспрессии означенного белка PD-L на клеточной поверхности или мРНК для означенного PD-L в клетке или ткани. Экспрессию белка PD-L можно детектировать с помощью диагностического антитела против PD-L в IHC анализе среза опухолевой ткани или с помощью проточной цитометрии. Альтернативно, экспрессию белка PD-L опухолевыми клетками можно детектировать с помощью получения изображения с использованием позитронно-эмиссионной томографии, используя связующий агент (например, фрагмент антитела, аффибоди и т.п.), который специфически связывается с желаемым PD-L-мишенью, например, PD-L1 или PD-L2. Методы детектирования и измерения экспрессии мРНК для PD-L включают ОТ-ПЦР и количественную ОТ-PCR в реальном времени.
Несколько подходов были описаны для количественного определения экспрессию белка PD-L1 в IHC анализах срезов опухолевой ткани. Смотрите, например, Thompson, R. H., et al., PNAS 101 (49); 17174-17179 (2004); Thompson, R. H. et al., Cancer Res. 66:3381-3385 (2006); Gadiot, J., et al., Cancer 117:2192-2201 (2011); Taube, J. M. et al., Sci Transl Med 4, 127ra37 (2012); и Toplian, S. L. et al., New Eng. J Med. 366 (26):2443-2454 (2012).
В одном подходе используется простая бинарная конечная точка положительной или отрицательной для PD-L1 экспрессии, при этом положительный результат определяется в виде процента опухолевых клеток, которые проявляют гистологические признаки окрашивания мембраны клеточной поверхности. Срез опухолевой ткани принимают за положительный в отношении экспрессии PD-L1, если это значение составляет по крайней мере 1%, предпочтительно 5% от общего количества опухолевых клеток.
В другом подходе экспрессию PD-L1 в срезе опухолевой ткани количественно определяют в опухолевых клетках, а также в инфильтрующих иммунных клетках, которые преимущественно включают лимфоциты. Процент опухолевых клеток и инфильтрующих иммунных клеток, которые проявляют окрашивание мембраны, отдельно определяют как <5%, от 5 до 9%, а затем с шагом в 10% вплоть до 100%. В случае опухолевых клеток экспрессию PD-L1 принимают за отрицательную, если оценкой является оценка <5%, и за положительную, если оценка составляет ≥5%. Экспрессию PD-L1 в иммунном инфильтрате регистрируют в виде полуколичественного определения, называемого скорректированной оценкой воспаления (AIS), которую определяют путем умножения процента клеток с окрашиванием мембраны на интенсивность инфильтрата, которая оценивается как совсем нет (0), легкая (оценка 1, редкие лимфоциты), умеренная (оценка 2, очаговая инфильтрация опухоли лимфогистиоцитарными агрегатами) или сильная (оценка 3, диффузная инфильтрация). Срез опухолевой ткани принимают за положительный в отношении экспрессии PD-L1 иммунными инфильтратами, если AIS≥5.
Срез опухолевой ткани, который был окрашен в соответствии с IHC с использованием диагностического антитела против PD-L1, может быть также оценен в отношении экспрессии белка PD-LL путем оценки экспрессии PD-L1 как в опухолевых клеток, так и в инфильтрующих иммунных клетках в срезе ткани, используя новый способ оценки, описанный в одновременно рассматриваемой заявке 61/807581, поданной 2 апреля 2013 г. Этот способ оценки PD-L1 включает изучение каждого опухолевого очага на срезе ткани в отношении окрашивания и присвоение срезу одной или обеих из модифицированной Н оценки (MHS) и модифицированной оценки относительного содержания (MPS). Чтобы поставить MHS, четыре отдельных процентных значения оцениваются во всех жизнеспособных опухолевых клетках и окрашенных мононуклеарных воспалительных клетках во всех исследованных опухолевых очагах: (a) клетки, которые не имеют окрашивания (интенсивность=0), (b) слабое окрашивание (интенсивность=1+), (c) умеренное окрашивание (интенсивность=2+) и (d) сильное окрашивание (интенсивность=3+). Клетка должна иметь по крайней мере частичное окрашивание мембраны, чтобы она была включена в процентные значения, соответствующие слабому, умеренному или сильному окрашиванию. Затем оцененные процентные значения, сумма которых составляет 100%, вводят в формулу 1×(процент клеток со слабым окрашиванием)+2×(процент клеток с умеренным окрашиванием)+3×(процент клеток с сильным окрашиванием), и результат присваивается срезу ткани в качестве MHS. MPS ставится путем оценки, во всех жизнеспособных опухолевых клетках и окрашенных мононуклеарных воспалительных клетках во всех исследованных опухолевых очагах, процента клеток, которые имеют по крайней мере частичное окрашивание мембраны любой интенсивности, и полученный процент присваивается срезу ткани в качестве MPS. В некоторых вариантах осуществления, опухоль принимают за положительную в отношении экспрессии PD-L1, если MHS или MPS является положительной.
Уровень экспрессии мРНК для PD-L можно сравнить с уровнями экспрессии мРНК с одного или более контрольных генов, которые часто используются в количественной ОТ-ПЦР, таких как убиквитин C.
В некоторых вариантах осуществления уровень экспрессии PD-L1 (белка и/или мРНК) в злокачественных клетках и/или в инфильтрующих иммунных клетках в опухоли определяется как «сверхэкспрессированный» или «повышенный» на основе сравнения с уровнем экспрессии PD-L1 (белка и/или мРНК) в соответствующем контроле. Например, контрольным уровнем экспрессии белка PD-L1 или мРНК может быть уровень, определяемый в незлокачественных клетках того же типа или на срезе из соответствующей нормальной ткани. В некоторых предпочтительных вариантах осуществления экспрессия PD-L1 в образце опухоли определяется как повышенная, если белка PD-L1 (и/или мРНК для PD-L1) в образце на по крайней мере 10%, 20% или 30% больше, чем в контроле.
«Длительный ответ» означает длительный терапевтический эффект после прекращения лечения терапевтическим средством, или комбинированной терапией, описанной здесь. В некоторых вариантах осуществления длительный ответ характеризуется продолжительностью, которая является по крайней мере одинаковой с продолжительностью лечения или в по крайней мере 1,5, 2,0, 2,5 или 3 раза больше продолжительности лечения.
«Срез ткани» относится к отдельной части или кусочку образца ткани, например, тонкому срезу ткани, сделанному из образца нормальной ткани или опухоли.
«Лечить» или «лечение» рак(а), как здесь используется, означает назначение комбинированной терапии, состоящей из антагониста PD-1 и соединения динациклиба, субъекту, который имеет рак или у которого диагностирован рак, для достижения по крайней мере одного положительного терапевтического эффекта, такого как, например, уменьшение количества раковых клеток, уменьшение размера опухоли, уменьшение скорости инфильтрации раковых клеток в периферические органы или уменьшение скорости метастазирования опухоли или роста опухоли. Положительные терапевтические эффекты при раке можно измерить рядом способов (смотрите, WA Weber, J. Nucl Med 50:1S-10S (2009)). Например, что касается ингибирования роста опухоли, в соответствии со стандартами NCI, Т/С≤42% является минимальным уровнем противоопухолевой активности. T/C<10% считается высоким уровнем противоопухолевой активности, при этом Т/С(%)=Медиана объема опухоли у подвергнутых лечению субъектов/Медиана объема опухоли у контроля×100. В некоторых вариантах осуществления лечение, достигаемое с помощью терапевтически эффективного количества, представляет собой любую из выживаемости без прогрессирования (PFS), выживаемости без болезни (DFS) или общей выживаемости (OS). PFS, также называемая «Периодом время до прогрессирования опухоли», обозначает продолжительность времени во время и после лечения, когда рак не растет, и включает отрезок времени, когда пациенты проявляли полный ответ или частичный ответ, а также отрезок времени, когда пациенты проявляли стабильное заболевание. DFS относится к продолжительности времени в течение и после лечения, когда пациент остается свободным от болезни. OS относится к продлению продолжительности жизни по сравнению с не подвергнутыми лечению индивидуумами или пациентами. Схема введения доз комбинированной терапии, описанной здесь, которая является эффективной для лечения больного раком, может варьировать в зависимости от таких факторов, как болезненное состояние, возраст и вес пациента, а также от способности терапии к вызову противоракового ответа у субъекта. Хотя вариант осуществления способа лечения, лекарственных средств и применений настоящего изобретения может не быть эффективным в достижении положительного терапевтического эффекта у каждого субъекта, он должен быть эффективен у статистически значимого количества субъектов, определенного с помощью любого статистического критерия, известного в данной области, такого как критерий Стьюдента, критерий Хи-квадрат, U-критерий Манна и Уитни, критерий Крускала-Уоллиса (Н-критерий), критерий Джонкхиера-Терпстра и критерий Вилкоксона.
«Опухоль», когда этот термин распространяется на субъекта, у которого диагностирован рак или у которого подозревается наличие рака, относится к злокачественной или потенциально злокачественной неоплазме или массе ткани любого размера и включает первичные опухоли и вторичные неоплазмы. Солидной опухолью является характеризующаяся аномальным ростом масса ткани, которая обычно не содержит кисты или жидкие области. Различные типы солидных опухолей названы по типу клеток, которые их образуют. Примерами солидных опухолей являются саркомы, карциномы и лимфомы. Лейкозы (раки крови), как правило, не образуют солидные опухоли (National Cancer Institute, Dictionary of Cancer Terms).
«Опухолевая масса», также называемая «опухолевой нагрузкой», относится к общему количеству опухолевого материала, распределенного по всему телу. Опухолевая масса относится к общему количеству раковых клеток или общему размеру опухоли(ей), по всему телу, в том числе лимфатических узлах и костном мозге. Опухолевую массу можно определить с помощью ряда способов, известных в данной области, например, путем определения размеров опухоли(ей) после удаления у объекта, например, используя циркуль, или во время нахождения в организме, используя методы визуализации, например, УЗИ, сканирование костей, компьютерную томографию (CT) или магнитно-резонансную томографию (MRI).
Термин «размер опухоли» относится к общему размеру опухоли, который может быть измерен как длина и ширина опухоли. Размер опухоли может быть определен с помощью ряда способов, известных в данной области, например, путем определения размеров опухоли(ей) после удаления у субъекта, например, используя циркуль, или во время нахождения в организме, используя методы визуализации, например, сканирование костей, УЗИ, CT или MRI.
«Вариабельная область» или «V-область», как здесь используется, означает сегмент цепей IgG, который является вариабельным по последовательности между различными антителами. Она простирается до остатка 109 по Kabat в легкой цепи и 113 в тяжелой цепи.
II. СПОСОБЫ, ПРИМЕНЕНИЯ и ЛЕКАРСТВЕННЫЕ СРЕДСТВА
В одном аспекте настоящего изобретения настоящим изобретением обеспечивается способ лечения рака у индивидуума, включающий назначение индивидууму комбинированной терапии, которая включает антагонист PD-1 и соединение динациклиб.
Комбинированная терапия может также включать один или более дополнительных терапевтических средств. Дополнительным терапевтическим средством может быть, например, химиотерапевтическое средство, отличное от соединения динациклиба, биотерапевтический агент (в том числе, но без ограничения, антитела против VEGF, EGFR, Her2/neu, рецепторов VEGF, рецепторов других факторов, CD20, CD40, CD-40L, CTLA-4, OX-40, 4-1BB и ICOS), иммуногенный агент (например, аттенуированные раковые клетки, опухолевые антигены, антигенпрезентирующие клетки, такие как дендритные клетки, активированные происходящим из опухоли антигеном или нуклеиновыми кислотами, иммуностимулирующие цитокины (например, IL-2, IFNα2, GM-CSF), и клетки, трансфецированные генами, кодирующими иммуностимулирующие цитокины, такие как, но без ограничения, GM-CSF).
Примеры химиотерапевтических средств включают алкилирующие агенты, такие как тиотепа и циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредора и уредопа; этиленимины и метиламеламины, в том числе алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (в том числе синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (в том числе его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (в том числе синтетические аналоги, KW-2189 и CBI-TMI); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, окида мехлорэтамина гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин гаммаII и калихеамицин фиI1, смотрите, например, Agnew, Chem. Intl. Ed. Engl., 33:183-186 (1994); динемицин, в том числе динемицин А; бисфосфонаты, такие как клодронат; эсперамицин; а также неокарзиностатиновый хромофор и родственные хромофоры являющихся хромопротеинами энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, каминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (в том числе морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофенольную кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; ингибирущие функцию надпочечников средства, такие как аминоглютетимид, митотан, трилостан; пополнитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; алдофосфамидгликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элформитин; эллиптиния ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; майтансиноиды, такие как маитанзин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; разоксан; ризоксин; сизофуран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (в частности, Т-2 токсин, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепу; таксоиды, например паклитаксел и доксетаксел; хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселоду; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин и фармацевтически приемлемые соли, кислоты или производные любого из вышеприведенных соединений. Также включены антигормональные средства, которые регулируют или ингибируют действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы эстрогеновых рецепторов (SERM), в том числе, например, тамоксифен, ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Fareston); ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует выработку эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглютетимид, мегестролацетат, экземестан, форместан, фадрозол, ворозол, летрозол и анастрозол, и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеприведенных соединений.
Каждое терапевтическое средство в комбинированной терапии настоящего изобретения может быть введено по отдельности или в лекарственном средстве (также называемом здесь фармацевтической композицией), которое включает терапевтическое средство и один или более фармацевтически приемлемых носителей, наполнителей и разбавителей, в соответствии со стандартной фармацевтической практикой.
Каждое терапевтическое средство в комбинированной терапии настоящего изобретения может вводиться одновременно (т.е. в одном и том же лекарственном средстве), параллельно (т.е. в отдельных лекарственных средствах, вводимых одно за другим в любом порядке) или последовательно в любом порядке. Последовательное введение особенно полезно, когда терапевтические средства в комбинированной терапии находятся в различных лекарственных формах (одно средство представляет собой таблетку или капсулу, а другое средство представляет собой стерильную жидкость) и/или вводят в соответствии с различными схемами введения доз, например, химиотерапевтическое средство, которое вводят по крайней мере ежедневно, и биотерапевтический агент, который вводят менее часто, например, один раз в неделю, раз в две недели или раз каждые три недели.
В некоторых вариантах осуществления соединение динациклиб вводят перед введением антагониста PD-1, в то время как в других вариантах осуществления соединение динациклиб вводят после введения антагониста PD-1.
В некоторых вариантах осуществления по крайней мере одно из терапевтических средств в комбинированной терапии вводят, используя ту же схему введения доз (дозу, частоту и длительность лечения), которую обычно используют, когда средство используют в качестве монотерапии для лечения того же типа рака. В других вариантах осуществления пациент получает меньшее общее количество по крайней мере одного из терапевтических средств при комбинированной терапии, чем тогда, когда средство используется в качестве монотерапии, например, меньшие дозы, менее частые дозы и/или более короткую длительность лечения.
Каждое терапевтическое средство в комбинированной терапии настоящего изобретения может вводиться перорально или парентерально, включая внутривенный, внутримышечный, внутрибрюшинный, подкожный, ректальный, местный и трансдермальный пути введения.
Комбинированная терапия настоящего изобретения может использоваться до или после операции по удалению опухоли и может использоваться до, во время или после лучевой терапии.
В некоторых вариантах осуществления комбинированную терапию настоящего изобретения назначают пациенту, который ранее не подвергался лечению биотерапевтическим или химиотерапевтическим средством, т.е. является не подвергнутым такому лечению. В других вариантах осуществления комбинированную терапию назначают пациенту, которому не удалось достичь длительного ответа после предшествующей терапии с использованием биотерапевтического или химиотерапевтического агента, т.е. является испытавшим лечение.
Комбинированную терапию настоящего изобретения, как правило, используют для лечения опухоли, которая является достаточно большой, чтобы быть обнаруженной с помощью пальпации или методов визуализации, хорошо известных в данной области техники, таких как ЯМР-томография, УЗИ или компьютерная томография. В некоторых предпочтительных вариантах осуществления комбинированную терапию настоящего изобретения используют для лечения опухоли на запущенной стадии, имеющей размеры, составляющие по крайней мере приблизительно 200 мм3, 300 мм3, 400 мм3, 500 мм3, 750 мм3 или вплоть до 1000 мм3.
Комбинированную терапию настоящего изобретения предпочтительно назначают являющемуся человеком пациенту, который имеет рак, который дает положительный результат на экспрессию PD-L1. В некоторых предпочтительных вариантах осуществления экспрессия PD-L1 детектируется с использованием диагностического антитела против PD-L1 человека или его антигенсвязывающего фрагмента в IHC анализе на FFPE срезе ткани или срезе замороженной ткани образца опухоли, удаленного у пациента. Как правило, врач пациента будет заказать диагностический тест для определения экспрессии PD-L1 в образе опухолевой ткани, удаленном у пациента, до начала лечения антагонистом PD-1 и соединением динациклибом, но предполагается, что врач может заказать первый или последующий диагностические тесты в любое время после начала лечения, например, после завершения курса лечения.
Выбор схемы введения доз (также называемой здесь схемой введения) для комбинированной терапии настоящего изобретения зависит от нескольких факторов, в том числе скорости метаболизма частицы в сыворотке или тканях, степени симптомов, иммуногенности частицы и доступности клеток-, ткани- или органа-мишени(ей) у индивидуума, подвергаемого лечению. Предпочтительно, схема введения доз доводит до максимума количество каждого терапевтического агента, доставляемого пациенту, в соответствии с приемлемым уровнем побочных эффектов. Соответственно, количество доз и частота введения дозы каждого биотерапевтического и химиотерапевтического средства в комбинации зависит частично от конкретного терапевтического средства, тяжести рака, подвергаемого лечению, и характеристик пациента. Имеется руководство по выбору соответствующих доз антител, цитокинов и небольших молекул. Смотрите, например, Wawrzynczak (1996) Antibody Therapy, Bios Scientific Pub. Ltd, Oxfordshire, UK; Kresina (ed.) (1991) Monoclonal Antibodies, Cytokines and Arthritis, Marcel Dekker, New York, NY; Bach (ed.) (1993) Monoclonal Antibodies and Peptide Therapy in Autoimmune Diseases, Marcel Dekker, New York, NY; Baert et al. (2003) New Engl. J. Med. 348:601-608; Milgrom et al. (1999) New Engl. J. Med. 341:1966-1973; Slamon et al. (2001) New Engl. J. Med. 344:783-792; Beniaminovitz et al. (2000) New Engl. J. Med. 342:613-619; Ghosh et al. (2003) New Engl. J. Med. 348:24-32; Lipsky et al. (2000) New Engl. J. Med. 343:1594-1602; Physicians' Desk Reference 2003 (Physicians' Desk Reference, 57th Ed); Medical Economics Company; ISBN: 1563634457; 57th edition (November 2002). Определение соответствующей схемы введения доз может осуществлено врачом, например, используя параметры или факторы, которые как известно или как полагают в данной области техники, влияют на лечение или, по прогнозам, влияют на лечение, и будет зависеть, например, от истории болезни пациента (например, предшествующей терапии), типа и стадии рака, подвергаемого лечению, и биомаркеров ответа на одно или более из терапевтических средств в комбинированной терапии.
Биотерапевтические агенты в комбинированной терапии настоящего изобретения могут вводиться путем непрерывной инфузии или дозами с интервалами, например, ежедневно, через день, три раза в неделю или один раз в неделю, две недели, три недели, ежемесячно, два раза в месяц и т.д. Суммарная недельная доза, как правило, составляет по крайней мере 0,05 мкг/кг, 0,2 мг/кг, 0,5 мг/кг, 1 мкг/кг, 10 мкг/кг, 100 мкг/кг, 0,2 мг/кг, 1,0 мг/кг, 2,0 мг/кг, 10 мг/кг, 25 мг/кг, 50 мг/кг веса тела или больше. Смотрите, например, Yang et al. (2003) New Engl. J. Med. 349:427-434; Herold et al. (2002) New Engl. J. Med. 346:1692-1698; Liu et al. (1999) J. Neurol. Neurosurg. Psych. 67:451-456; Portielji et al. (2003) Cancer Immunol. Immunother. 52:133-144.
В некоторых вариантах осуществления, в которых используется мАт против PD-1 человека в качестве антагониста PD-1 в комбинированной терапии, схема введения доз будет включать введение мАт против PD-1 человека в дозе, составляющей 1, 2, 3, 5 или 10 мг/кг, с интервалами в приблизительно 14 дней (±2 дня) или приблизительно 21 день (±2 дня), или приблизительно 30 дней (±2 дня) на протяжении всего курса лечения.
В других вариантах осуществления, в которых используется мАт против PD-1 человека в качестве антагониста PD-1 в комбинированной терапии, схема введения доз будет включать введение мАт против PD-1 человека в дозе, составляющей от приблизительно 0,005 мг/кг до приблизительно 10 мг/кг, с увеличением дозы у одного и того же пациента. В других вариантах осуществления с увеличением доз, интервал между дозами будет постепенно сокращаться, например, приблизительно 30 дней (±2 дня) между первой и второй дозой, приблизительно 14 дней (±2 дня) между второй и третьей дозой. В некоторых вариантах осуществления интервал между введениями доз будет составлять приблизительно 14 дней (±2 дня), для доз после второй дозы.
В некоторых вариантах осуществления субъекту будет назначено внутривенное (IV) вливание лекарственного средства, включающего любой из антагонистов PD-1, описанных здесь.
В одном предпочтительном варианте осуществления настоящего изобретения антагонистом PD-1 в комбинированной терапии является ниволумаб, которое вводят внутривенно в дозе, выбираемой из группы, состоящей из: 1 мг/кг Q2W, 2 мг/кг Q2W, 3 мг/кг Q2W, 5 мг/кг Q2W, 10 мг Q2W, 1 мг/кг Q3W, 2 мг/кг Q3W, 3 мг/кг Q3W, 5 мг/кг Q3W и 10 мг Q3W.
В другом предпочтительном варианте осуществления настоящего изобретения антагонистом PD-1 в комбинированной терапии является МК-3475, который вводят в жидком лекарственном средстве в дозе, выбираемой из группы, состоящей из 1 мг/кг Q2W, 2 мг/кг Q2W, 3 мг/кг Q2W, 5 мг/кг Q2W, 10 мг Q2W, 1 мг/кг Q3W, 2 мг/кг Q3W, 3 мг/кг Q3W, 5 мг/кг Q3W и 10 мг Q3W. В некоторых особенно предпочтительных вариантах осуществления МК-3475 вводят в виде жидкого лекарственного средства, которое включает 25 мг/мл МК-3475, 7% (в отношении веса к объему) сахарозы, 0,02% (в отношении веса к объему) полисорбата 80 в 10 мМ гистидиновом буфере рН 5,5, и выбранную дозу лекарственного средства вводят путем внутривенной инфузии в течение периода времени, равного 30 минутам. Оптимальную дозу для МК-3475 в комбинации с динациклибом можно определить путем увеличения дозы, начиная с 2 мг/кг и повышая вплоть до 10 мг/кг, с частотой введения, соответствующей таковой, выбранной для динациклиба.
В некоторых вариантах осуществления инфузию жидкого лекарственного средства, включающего соединение динациклиб, осуществляют индивидууму, подвергаемому лечению, в дозе от 1 до 100 мг/м2 в течение периода времени от 1 часа до 24 часов в каждый из дней 1, 8 и 15 28-дневного цикла. В некоторых вариантах осуществления период времени для внутривенной инфузии составляет 2 часа, 8 часов или 25 часов. В других вариантах осуществления лекарственное средство динациклиб вводят путем 2-часовой инфузии в дозе, составляющей 50 мг/м2, один раз каждый 21 день. В некоторых вариантах осуществления, в которых раком является CLL, схема введения доз лекарственного средства динациклиба включает по крайней мере два 28-дневных цикла: в первом цикле динациклиб вводят в течение 2 часов инфузии в дозах, составляющих 7 мг/м2, 10 мг/м2 и 14 мг/м2, в дни 1, 8 и 15, соответственно, а во втором и последующих циклах динациклиб вводят в дни 1, 8 и 15 в дозе, составляющей 14 мг/м2, в течение 2 часов инфузии. В некоторых вариантах осуществления, в которых раком является гемобластоз или солидная опухоль, динациклиб доставляется один раз в две или три недели, а достигаемая доза может включать вплоть до 50 мг/м2. В некоторых вариантах осуществления самая высокая доза вплоть до 50 мг/м2 динациклиба в равновесном состоянии достигается при увеличении дозы при 2-часовых инфузиях, осуществляемых с интервалами в приблизительно 14 или 21 дней.
Настоящим изобретением также обеспечивается лекарственное средство, которое включает антагонист PD-1, описанный выше, и фармацевтически приемлемый наполнитель. Когда антагонистом PD-1 является биотерапевтический агент, например, мАт, антагонист можно продуцировать в клетках СНО, используя обычную культуру клеток и технологии выделения/очистки.
В некоторых вариантах осуществления лекарственное средство, включающее антитело против PD-1 в качестве антагониста PD-1, может быть предоставлено в виде жидкого препарата или приготовлено путем восстановления лиофилизированного порошка в стерильной воде для инъекций непосредственно перед использованием. В WO 2012/135408 описывается приготовление жидких и лиофилизированных лекарственных средств, включающих MK-3475, которые подходят для применения в настоящем изобретении. В некоторых предпочтительных вариантах осуществления лекарственное средство, включающее MK-3475, предоставляется в стеклянном флаконе, который содержит приблизительно 50 мг МК-3475.
Настоящим изобретением также обеспечивается лекарственное средство, которое включает соединение динациклиб и фармацевтически приемлемый наполнитель. Соединение динациклиб может быть получено, как описано в патенте США с № 7119200, и может быть приготовлено в виде лекарственного средства на водной основе для внутривенной инфузии, как описано в WO 2009/038701. В некоторых предпочтительных вариантах осуществления динациклиб готовят в дозе, составляющей 5 мг/мл, в стерильном, водном, забуференном цитратом растворе при рН от 3,0 до 4,2. Это лекарственное средство является стабильным при хранении в холодильнике (2°C-8°C) и при защите от света. Стерильный забуференный раствор динациклиба затем разбавляют 0,9% раствором хлорида натрия для инъекций (250 мл) Фармакопеи США (USP, в весовом отношении), чтобы приготовить различные дозы для внутривенного введения, которые должны быть введены в пределах 24 часов при хранении при контролируемой комнатной температуре (20°C-25°C или 68°F-77°F).
Лекарственные средства анти-PD-1 и динациклиб, описанные здесь, могут предоставляться в виде набора, который включает первый контейнер и второй контейнер, и листовку-вкладыш. Первый контейнер содержит по крайней мере одну дозу лекарственного средства, включающего анти-PD-1 антагонист, второй контейнер содержит по крайней мере одну дозу лекарственного средства, включающего соединение динациклиб, и листовку-вкладыш, или этикетку, которая содержит инструкции в отношении лечения пациента по поводу рака, используя лекарственные средства. Первый и второй контейнеры могут быть одинаковой или различной формы (например, изготовлены в виде флаконов, шприцов и бутылок) и/или быть изготовлены из одинакового или различного материала (например, пластмассы или стекла). Набор может, кроме того, включать другие материалы, которые могут быть полезны при введении лекарственных средств, такие как разбавители, фильтры, пакеты для IV инфузий и капельницы, иглы и шприцы. В некоторых предпочтительных вариантах осуществления набора, анти-PD-1 антагонистом является антитело против PD-1, и в инструкциях указывается, что лекарственные средства предназначены для применения в лечении пациента, имеющего рак, который дает положительный результат на экспрессию PD-Ll при IHC анализе.
Эти и другие аспекты настоящего изобретения, в том числе приведенные в качестве примера конкретные варианты, осуществления, перечисленные ниже, будут вытекать из учений, содержащихся здесь.
Приводимые в качестве примера конкретные варианты осуществления изобретения
1. Способ лечения рака у индивидуума, включающий назначение индивидууму комбинированной терапии, которая включает антагонист PD-1 и соединение динациклиб, причем соединение динациклиб представляет собой соединение формулы I
или фармацевтически приемлемую соль соединения формулы I.
2. Лекарственное средство, включающее антагонист PD-1, для применения в комбинации с соединением динациклибом для лечения рака у индивидуума.
3. Лекарственное средство, включающее соединение динациклиб, для применения в комбинации с антагонистом PD-1 для лечения рака у индивидуума.
4. Лекарственное средство варианта осуществления 3 или 4, которое, кроме того, включает фармацевтически приемлемый наполнитель.
5. Применение антагониста PD-1 в производстве лекарственного средства для лечения рака у индивидуума при введении в комбинации с соединением динациклибом.
6. Применение соединения динациклиба в производстве лекарственного средства для лечения рака у индивидуума при введении в комбинации с антагонистом PD-1.
7. Применение антагониста PD-1 и соединения динациклиба в производстве лекарственных средств для лечения рака у индивидуума.
8. Набор, который включает первый контейнер, второй контейнер и листовку-вкладыш, в котором первый контейнер содержит по крайней мере одну дозу лекарственного средства, включающего анти-PD-1 антагонист, второй контейнер содержит по крайней мере одну дозу лекарственного средства, включающего соединение динациклиб, а листовка-вкладыш содержит инструкции в отношении лечения индивидуума по поводу рака, используя лекарственные средства.
9. Набор варианта осуществления 8, в инструкциях которого указывается, что лекарственные средства предназначены для применения в лечении индивидуума, имеющего рак, который дает положительный результат на экспрессию PD-L1 при иммуногистохимическом (IHC) анализе.
10. Способ, лекарственное средство, применение или набор любого из вариантов осуществления 1-9, в котором индивидуумом является человек, а антагонист PD-1 представляет собой моноклональное антитело или его антигенсвязывающий фрагмент, которое(ый) специфически связывается с PD-L1 человека и блокирует связывание PD-L1 человека с PD-1 человека.
11. Способ, лекарственное средство, применение или набор варианта осуществления 9, в котором антагонистом PD-1 является MPDL3280A, BMS-936559, MEDI4736, MSB0010718C или моноклональное антитело, которое включает вариабельные области тяжелой цепи и легкой цепи с SEQ ID NO:24 и SEQ ID NO:21, соответственно, WO2013/019906.
12. Способ, лекарственное средство, применение или набор любого из вариантов осуществления 1-9, в котором индивидуумом является человек, а антагонист PD-1 представляет собой моноклональное антитело или его антигенсвязывающий фрагмент, которое(ый) специфически связывается с PD-1 человека и блокирует связывание PD-L1 человека с PD-1 человека.
13. Способ, лекарственное средство, применение или набор варианта осуществления 12, в котором антагонист PD-1 также блокирует связывание PD-L2 человека с PD-1 человека.
14. Способ, лекарственное средство, применение или набор варианта осуществления 13, в котором моноклональное антитело, или его антигенсвязывающий фрагмент, включает: (a) CDR легкой цепи с SEQ ID NO:1, 2 и 3 и CDR тяжелой цепи с SEQ ID NO:4, 5 и 6; или (b) CDR легкой цепи с SEQ ID NO:7, 8 и 9 и CDR тяжелой цепи с SEQ ID NO:10, 11 и 12.
15. Способ, лекарственное средство, применение или набор варианта осуществления 13, в котором моноклональное антитело, или его антигенсвязывающий фрагмент, включает CDR легкой цепи с SEQ ID NO:7, 8 и 9 и CDR тяжелой цепи с SEQ ID NO:10, 11 и 12.
16. Способ, лекарственное средство, применение или набор варианта осуществления 13, в котором антагонистом PD-1 является моноклональное антитело против PD-1, которое включает тяжелую цепь и легкую цепь, и в котором тяжелая цепь включает SEQ ID NO:21, а легкая цепь включает SEQ ID NO:22.
17. Способ, лекарственное средство, применение или набор варианта осуществления 13, в котором антагонистом PD-1 является моноклональное антитело против PD-1, которое включает тяжелую цепь и легкую цепь, и в котором тяжелая цепь включает SEQ ID NO:23, а легкая цепь включает SEQ ID NO:24.
18. Способ, лекарственное средство, применение или набор любого из вариантов осуществления 10-17, в котором раком является солидная опухоль.
19. Способ, лекарственное средство, применение или набор любого из вариантов осуществления 10-17, в котором раком является рак мочевого пузыря, рак молочной железы, светлоклеточный рак почки, плоскоклеточный рак головы/шеи, плоскоклеточный рак легких, злокачественная меланома, немелкоклеточный рак легких (NSCLC), рак яичников, рак поджелудочной железы, рак предстательной железы, почечно-клеточный рак, мелкоклеточный рак легких (SCLC) или тройной негативный рак молочной железы.
20. Способ, лекарственное средство, применение или набор любого из вариантов осуществления 10-17, в котором раком является не подвергнутая воздействию ипилимумаба запущенная меланома, а в других предпочтительных вариантах осуществления человек имеет резистентную к ипилимумабу запущенную меланому.
21. Способ, лекарственное средство, применение или набор любого из вариантов осуществления 10-17, в котором раком является гемобластоз.
22. Способ, лекарственное средство, применение или набор любого из вариантов осуществления 10-17, в котором раком является острый лимфобластный лейкоз (ALL), острый миелоидный лейкоз (AML), хронический лимфолейкоз (CLL), хронический миелоидный лейкоз (CML), крупноклеточная диффузная B-клеточная лимфома (DLBCL), фолликулярная лимфома, лимфома Ходжкина (HL), лимфома из клеток мантийной зоны (MCL), множественная миелома (ММ), миелоидная клеточная лейкемия-1 (Mcl-1), миелодиспластический синдром (MDS), неходжкинская лимфома (NHL) или мелкоклеточная лимфоцитарная лимфома (SLL).
23. Способ, лекарственное средство, применение или набор любого из вариантов осуществления 10-17, в котором раком является хронический лимфолейкоз (CLL).
24. Способ, лекарственное средство, применение или набор любого из вариантов осуществления 10-23, в котором рак экспрессирует PD-L1 человека.
25. Способ, лекарственное средство, применение или набор варианта осуществления 25, в котором экспрессия PD-L1 человека увеличена.
26. Способ, лекарственное средство, применение или набор варианта осуществления 24 или 25, в котором экспрессию PD-L1 человека выявляют, используя диагностическое мАт против hPD-L1, которое включает вариабельную область легкой цепи (LCVR) и вариабельную область тяжелой цепи (HCVR), причем LCVR включает SEQ ID NO:28, а HCVR включает SEQ ID NO:29.
27. Способ, лекарственное средство, применение или набор варианта осуществления 16, в котором антагонистом PD-1 является МК-3475 или ниволумаб, а соединением динациклибом является соединение формулы I.
28. Способ, лекарственное средство, применение или набор варианта осуществления 27, в котором МК-3475 готовят в виде жидкого лекарственного средства, которое включает 25 мг/мл МК-3475, 7% (в отношении веса к объему) сахарозы, 0,02% (в отношении веса к объему) полисорбата 80 в 10 мМ гистидиновом буфере рН 5,5, а соединение динациклиб готовят в виде жидкого лекарственного средства, включающего 5 мг/мл соединения формулы I в стерильном, водном, забуференном цитратом растворе при рН от 3,0 до 4,2.
29. Способ, лекарственное средство, применение или набор варианта осуществления 27 или 28, в котором раком является CLL.
30. Способ, лекарственное средство, применение или набор любого из вариантов осуществления 27-29, в котором экспрессию PD-L1 человека выявляют, используя диагностическое мАт против hPD-L1, которое включает вариабельную область легкой цепи (LCVR) и вариабельную область тяжелой цепи (HCVR), причем LCVR включает SEQ ID NO:28, а HCVR включает SEQ ID NO:29.
ОБЩИЕ МЕТОДЫ
Стандартные методы молекулярной биологии описаны в Sambrook, Fritsch and Maniatis (1982 & 1989 2nd Edition, 2001 3rd Edition) Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Sambrook and Russell (2001) Molecular Cloning, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Wu (1993) Recombinant DNA, Vol. 217, Academic Press, San Diego, CA). Стандартные методы также обнаруживаются в Ausbel, et al. (2001) Current Protocols in Molecular Biology, Vols.1-4, John Wiley and Sons, Inc. New York, NY, в которых описывается клонирование в бактериальных клетках и мутагенез ДНК (т. 1), клонирование в клетках млекопитающих и дрожжах (т. 2), гликоконъюгаты и экспрессия белка (т. 3), и биоинформатика (т. 4).
Способы очистки белков, в том числе иммунопреципитация, хроматография, электрофорез, центрифугирование и кристаллизация, описаны (Coligan, et al. (2000) Current Protocols in Protein Science, Vol. 1, John Wiley and Sons, Inc., New York). Химический анализ, химическая модификация, посттрансляционная модификация, получение слитых белков, гликозилирование белков описаны (смотрите, например, Coligan, et al. (2000) Current Protocols in Protein Science, Vol. 2, John Wiley and Sons, Inc., New York; Ausubel, et al. (2001) Current Protocols in Molecular Biology, Vol. 3, John Wiley and Sons, Inc., NY, NY, pp. 16.0.5-16.22.17; Sigma-Aldrich, Co. (2001) Products for Life Science Research, St. Louis, MO; pp. 45-89; Amersham Pharmacia Biotech (2001) BioDirectory, Piscataway, N.J., pp. 384-391). Продукция, очистка, и фрагментация поликлональных и моноклональных антител описаны (Coligan, et al. (2001) Current Protocols in Immunology, Vol. 1, John Wiley and Sons, Inc., New York; Harlow and Lane (1999) Using Antibodies, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Harlow and Lane, выше). Стандартные методы для характеристики взаимодействий лиганд/рецептор имеются в распоряжении (смотрите, например, Coligan, et al. (2001) Current Protocols in Immunology, Vol. 4, John Wiley, Inc., New York).
Моноклональные, поликлональные и гуманизированные антитела могут быть получены (смотрите, например, Sheperd and Dean (eds.) (2000) Monoclonal Antibodies, Oxford Univ. Press, New York, NY; Kontermann and Dubel (eds.) (2001) Antibody Engineering, Springer-Verlag, New York; Harlow and Lane (1988) Antibodies A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, pp. 139-243; Carpenter, et al. (2000) J. Immunol. 165:6205; He, et al. (1998) J. Immunol. 160:1029; Tang et al. (1999) J. Biol. Chem. 274:27371-27378; Baca et al. (1997) J. Biol. Chem. 272:10678-10684; Chothia et al. (1989) Nature 342:877-883; Foote and Winter (1992) J. Mol. Biol. 224:487-499; патент США с № 6329511).
Альтернативой гуманизации является использование библиотек антител человека с дисплеем на фаге или библиотек антител человека в трансгенных мышах (Vaughan et al. (1996) Nature Biotechnol. 14:309-314; Barbas (1995) Nature Medicine 1:837-839; Mendez et al. (1997) Nature Genetics 15:146-156; Hoogenboom and Chames (2000) Immunol. Today 21:371-377; Barbas et al. (2001) Phage Display: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York; Kay et al. (1996) Phage Display of Peptides and Proteins: A Laboratory Manual, Academic Press, San Diego, CA; de Bruin et al. (1999) Nature Biotechnol. 17:397-399).
Очистка антигена не является необходимой для образования антител. Животные могут быть иммунизированы клетками, несущими представляющий интерес антиген. Спленоциты могут быть затем выделены из иммунизированных животных, и спленоциты могут быть слиты с линией миеломных клеток для получения гибридомы (смотрите, например, Meyaard et al. (1997) Immunity 7:283-290; Wright et al. (2000) Immunity 13:233-242; Preston et al., выше; Kaithamana et al. (1999) J. Immunol. 163:5157-5164).
Антитела могут быть конъюгированы, например, с небольшими лекарственными молекулами, ферментами, липосомами, полиэтиленгликолем (ПЭГ). Антитела могут быть использованы для терапевтического средства, диагностического средства, набора или для других целей, и включают антитела, связанные, например, с красителями, радиоизотопами, ферментами или металлами, например, коллоидным золотом (смотрите, например, Le Doussal et al. (1991) J. Immunol. 146:169-175; Gibellini et al. (1998) J. Immunol. 160:3891-3898; Hsing and Bishop (1999) J. Immunol. 162:2804-2811; Everts et al. (2002) J. Immunol. 168:883-889).
Способы проточной цитометрии, в том числе сортировка клеток с активацией флуоресценции (FACS), имеются в распоряжении (смотрите, например, Owens, et al. (1994) Flow Cytometry Principles for Clinical Laboratory Practice, John Wiley and Sons, Hoboken, NJ; Givan (2001) Flow Cytometry, 2nd ed.; Wiley-Liss, Hoboken, NJ; Shapiro (2003) Practical Flow Cytometry, John Wiley and Sons, Hoboken, NJ). Флуоресцентные реагенты, подходящие для модификации нуклеиновых кислот, в том числе НК-праймеров и зондов, полипептидов и антител, для применения, например, в качестве диагностических реагентов, имеются в распоряжении (Molecular Probesy (2003) Catalogue, Molecular Probes, Inc., Eugene, OR; Sigma-Aldrich (2003) Catalogue, St. Louis, MO).
Стандартные методы гистологии иммунной системы описаны (смотрите, например, Muller-Harmelink (ed.) (1986) Human Thymus: Histopathology and Pathology, Springer Verlag, New York, NY; Hiatt, et al. (2000) Color Atlas of Histology, Lippincott, Williams, and Wilkins, Phila, PA; Louis, et al. (2002) Basic Histology: Text and Atlas, McGraw-Hill, New York, NY).
Пакеты программ и базы данных для определения, например, антигенных фрагментов, лидерных последовательностей, сворачивания белков, функциональных доменов, сайтов гликозилирования и совмещения последовательностей имеются в распоряжении (смотрите, например, GenBank, Vector NTI® Suite (Informax, Inc, Bethesda, MD); GCG Wisconsin Package (Accelrys, Inc., San Diego, CA); DeCypher® (TimeLogic Corp., Crystal Bay, Nevada); Menne, et al. (2000) Bioinformatics 16: 741-742; Menne, et al. (2000) Bioinformatics Applications Note 16:741-742; Wren, et al. (2002) Comput. Methods Programs Biomed. 68:177-181; von Heijne (1983) Eur. J. Biochem. 133:17-21; von Heijne (1986) Nucleic Acids Res. 14:4683-4690).
ПРИМЕРЫ
Пример 1. Противоопухолевая ответная реакция на параллельное введение антагониста PD-1 и динациклиба имеющим опухоли мышам.
В этом эксперименте сравнивали противораковую ответную реакцию у имеющих опухоли мышей на лечение с использованием одной из трех схем: монотерапии с использованием мышиного моноклонального антитела против PD-1 мыши (анти-PDL), монотерапии с использованием динациклиба и комбинированной терапии с использованием этих двух агентов, вводимых параллельно.
Хотя человеческие опухолевые клетки или опухолевые эксплантаты можно выращивать у животных с иммунодефицитом в виде ксенотрансплантатов, их нельзя использовать проверки иммунотерапевтических средств из-за отсутствия функциональной иммунной системы. Для значимой оценки иммунотерапевтических средств или комбинации иммунотерапевтических средств с другими агентами необходимо использовать сингенную модель, в которой сингенные опухоли выращивают у животных с интактной иммунной системы. МС38 представляет собой мышиную колоректальную аденокарциному, сингенную по отношении к линии C57BL/6. Она является соответствующей модельной системой для оценки механизма действия анти-PD-1 из-за реализуемого молекулярного профиля после анти-PD-1 терапии этой опухоли.
Начало имеющим опухоли мышам для этого исследования было положено путем имплантации 1×106 находящихся в лог-фазе и субконфлюэнтных клеток МС38 в правый нижний задний бок самок мышей C57BL/6 возрастом 8 недель со средней массой тела 20 граммов. Когда средний объем опухоли у этих мышей достигал ~ 150 кубических мм (фиг. 8В левая панель с обозначением день 0), то имеющих опухоли мышей распределяли случайным образом по 4 группам лечения с 12 мышами в каждой группе: (1) Изотип (Подобранное по изотипу Ат) + носитель в качестве контроля; (2) Анти-PDL + носитель в качестве контроля; (3) динациклиб + подобранное по изотипу Ат в качестве контроля и (4) Анти-PDL + динациклиб. Носителем в качестве контроля служил 20% гидроксипропил-β-D-циклодекстрин, приготовленный путем растворения Trappsol (Cyclodextrin Technologies Development Inc., Alachua, FL) в воде для инъекции. Подобранным по изотипу Ат в качестве контроля служило мышиное моноклональное антитело, специфическое в отношении аденовирусного гексона, и имело изотип IgG1. Анти-PD1 вводили группам лечения 2 и 4 в дозе 5 мг/кг, внутрибрюшинно каждые 5 дней в случае каждого из 5 циклов. Динациклиб вводили группам лечения 3 и 4 в дозе 40 мг/кг каждые 5 дней в случае каждого из 5 циклов.
Как показали результаты, которые представлены на фиг. 8 и 8В, средняя противоопухолевая ответная реакция на комбинированную терапию с использованием антагониста PD-1 и динациклиба была больше (р<0,05) противоопухолевой ответной реакции, отмечаемой при использовании одного из двух агентов в качестве монотерапии. Как показано на фиг. 8A, комбинация этих двух агентов обеспечила значительно более полные регрессии (CR), так что не оставалось определяемой опухоли, по сравнению с лучшей ответной реакцией на один агент, которая была равна 42% CR при использовании анти-PD-1. При сравнении средних объемов опухолей в конце исследования (8В, правая панель), используя однофакторный дисперсионный анализ, объемы опухолей у мышей, подвергнутых лечению комбинацией динациклиб+анти-PDL, были значительно меньше таковых у мышей, подвергнутых лечению только динациклибом.
Статистическую значимость ответных реакций на различные лечения определяли, используя точный парный критерий Фишера, и результаты показаны в таблице 4, представленной ниже.
Точный критерий Фишера: парное сравнение объемов опухолей в конце исследования
Содержит краткое описание последовательности в списке последовательностей
СПИСОК ЛИТЕРАТУРЫ
1. Sharpe, A.H, Wherry, E.J., Ahmed R., and Freeman G.J. The function of programmed cell death 1 and its ligands in regulating autoimmunity and infection. Nature Immunology (2007); 8:239-245.
2. Dong H et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med. 2002 Aug; 8(8):793-800.
3. Yang et al. PD-1 interaction contributes to the functional suppression of T-cell responses to human uveal melanoma cells in vitro. Invest Ophthalmol Vis Sci. 2008 Jun; 49(6 (2008): 49:2518-2525.
4. Ghebeh et al. The B7-H1 (PD-L1) T lymphocyte-inhibitory molecule is expressed in breast cancer patients with infiltrating ductal carcinoma: correlation with important high-risk propgnostic factors. Neoplasia (2006) 8:190-198.
5. Hamanishi J et al. Programmed cell death 1 ligand 1 and tumor-infiltrating CD8+ T lymphocytes are prognostic factors of human ovarian cancer. Proceeding of the National Academy of Sciences (2007): 104:3360-3365.
6. Thompson RH et al. Significance of B7-H1 overexpression in kidney cancer. Clinical genitourin Cancer (2006): 5:206-211.
7. Nomi, T. Sho, M., Akahori, T., et al. Clinical significance and therapeutic potential of the programmed death- 1 ligand/programmed death-1 pathway in human pancreatic cancer. Clinical Cancer Research (2007); 13:2151-2157.
8. Ohigashi Y et al. Clinical significance of programmed death-1 ligand-1 and programmed death-1 ligand 2 expression in human esophageal cancer. Clin. Cancer Research (2005): 11:2947-2953.
9. Inman et al. PD-L1 (B7-H1) expression by urothelial carcinoma of the bladder and BCG-induced granulomata: associations with localized stage progression. Cancer (2007): 109:1499-1505.
10. Shimauchi T et al. Augmented expression of programmed death-1 in both neoplasmatic and nonneoplastic CD4+ T-cells in adult T-cell Leukemia/ Lymphoma. Int. J. Cancer (2007): 121:2585-2590.
11. Gao et al. Overexpression of PD-L1 significantly associates with tumor aggressiveness and postoperative recurrence in human hepatocellular carcinoma. Clinical Cancer Research (2009) 15:971-979.
12. Nakanishi J. Overexpression of B7-H1 (PD-L1) significantly associates with tumor grade and postoperative prognosis in human urothelial cancers. Cancer Immunol Immunother. (2007) 56:1173-1182.
13. Hino et al. Tumor cell expression of programmed cell death-1 is a prognostic factor for malignant melanoma. Cancer (2010): 00:1-9.
14. Ghebeh H. Foxp3+ tregs and B7-H1+/PD-1+ T lymphocytes co-infiltrate the tumor tissues of high-risk breast cancer patients: implication for immunotherapy. BMC Cancer. 2008 Feb 23; 8:57.
15. Ahmadzadeh M et al. Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired. Blood (2009) 114:1537-1544.
16. Thompson RH et al. PD-1 is expressed by tumor infiltrating cells and is associated with poor outcome for patients with renal carcinoma. Clinical Cancer Research (2007) 15:1757-1761.
17. Guha, M. Cyclin-dependent kinase inhibitors move into Phase III. Nature Reviews Drug Discovery (2012) 11:892-894.
18. Parry D et al. Dinaciclib (SCH 727965), a Novel and Potent Cyclin-Dependent Kinase Inhibitor. Molecular Cancer Therapeutics (2010) 9:2344-2353.
Все приведенные здесь ссылки включены посредством ссылки в той же мере, как если бы было специально и отдельно указано, что каждая отдельная публикация, значение в базе данных (например, последовательности в GenBank или значения в GeneID), заявка на патент или патент, включена посредством ссылки. Это заявление о включении посредством ссылки, как подразумевается заявителями, в соответствии с § 1.57(b)(1) раздела 37 свода законов США, относится к каждой и всякой отдельной публикации, значению в базе данных (например, последовательностям в GenBank или значениям в GeneID), заявке на патент или патенту, каждая(ое) из которых четко определена в соответствии с § 1.57(b)(2) раздела 37 свода законов США, даже если такая ссылка не находится непосредственно рядом со специальным заявлением о включении посредством ссылки. Включение специальных заявлений о включении посредством ссылки, если таковые имеются, в описание изобретения не в коей мере не подрывает это общее заявление о включении посредством ссылки. Приведение ссылок здесь не имеется в виду признанием того, что ссылка относится к предшествующему уровню техники, а также оно не является каким-либо допущением в отношении содержания или даты этих публикаций или документов.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Merck Sharp & Dohme Corp.
<120> ЛЕЧЕНИЕ РАКА КОМБИНАЦИЕЙ АНТАГОНИСТА PD-1 И ДИНАЦИКЛИБА
<130> 23572
<150> 61/867760
<151> 2013-08-20
<160> 25
<170> Патент в версии 3.5
<210> 1
<211> 15
<212> Белок
<213> Искусственная
<220>
<223> CDR легкой цепи антитела
<400> 1
Arg Ala Ser Lys Ser Val Ser Thr Ser Gly Phe Ser Tyr Leu His
1 5 10 15
<210> 2
<211> 7
<212> Белок
<213> Искусственная
<220>
<223> CDR легкой цепи антитела
<400> 2
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 3
<211> 9
<212> Белок
<213> Искусственная
<220>
<223> CDR легкой цепи антитела
<400> 3
Gln His Ser Trp Glu Leu Pro Leu Thr
1 5
<210> 4
<211> 5
<212> Белок
<213> Искусственная
<220>
<223> CDR тяжелой цепи антитела
<400> 4
Ser Tyr Tyr Leu Tyr
1 5
<210> 5
<211> 17
<212> Белок
<213> Искусственная
<220>
<223> CDR тяжелой цепи антитела
<400> 5
Gly Val Asn Pro Ser Asn Gly Gly Thr Asn Phe Ser Glu Lys Phe Lys
1 5 10 15
Ser
<210> 6
<211> 11
<212> Белок
<213> Искусственная
<220>
<223> CDR тяжелой цепи антитела
<400> 6
Arg Asp Ser Asn Tyr Asp Gly Gly Phe Asp Tyr
1 5 10
<210> 7
<211> 15
<212> Белок
<213> Искусственная
<220>
<223> CDR легкой цепи антитела
<400> 7
Arg Ala Ser Lys Gly Val Ser Thr Ser Gly Tyr Ser Tyr Leu His
1 5 10 15
<210> 8
<211> 7
<212> Белок
<213> Искусственная
<220>
<223> CDR легкой цепи антитела
<400> 8
Leu Ala Ser Tyr Leu Glu Ser
1 5
<210> 9
<211> 9
<212> Белок
<213> Искусственная
<220>
<223> CDR легкой цепи антитела
<400> 9
Gln His Ser Arg Asp Leu Pro Leu Thr
1 5
<210> 10
<211> 5
<212> Белок
<213> Искусственная
<220>
<223> CDR тяжелой цепи антитела
<400> 10
Asn Tyr Tyr Met Tyr
1 5
<210> 11
<211> 17
<212> Белок
<213> Искусственная
<220>
<223> CDR тяжелой цепи антитела
<400> 11
Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe Lys
1 5 10 15
Asn
<210> 12
<211> 11
<212> Белок
<213> Искусственная
<220>
<223> CDR тяжелой цепи антитела
<400> 12
Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr
1 5 10
<210> 13
<211> 120
<212> Белок
<213> Искусственная
<220>
<223> Вариабельная область тяжелой цепи гуманизированного антитела
<400> 13
Gln Val Gln Leu Val Gln Ser Gly Val Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Thr Asp Ser Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Lys Ser Leu Gln Phe Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 14
<211> 447
<212> Белок
<213> Искусственная
<220>
<223> Тяжелая цепь гуманизированного антитела
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Val Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Thr Asp Ser Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Lys Ser Leu Gln Phe Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 15
<211> 111
<212> Белок
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела
<400> 15
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 16
<211> 111
<212> Белок
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела
<400> 16
Glu Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro
35 40 45
Gln Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 17
<211> 111
<212> Белок
<213> Искусственная
<220>
<223> Вариабельная область легкой цепи гуманизированного антитела
<400> 17
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro
35 40 45
Gln Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Leu Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 18
<211> 218
<212> Белок
<213> Искусственная
<220>
<223> Легкая цепь гуманизированного антитела
<400> 18
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 19
<211> 218
<212> Белок
<213> Искусственная
<220>
<223> Легкая цепь гуманизированного антитела
<400> 19
Glu Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro
35 40 45
Gln Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 20
<211> 218
<212> Белок
<213> Искусственная
<220>
<223> Легкая цепь гуманизированного антитела
<400> 20
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro
35 40 45
Gln Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Ala Phe Thr Leu Lys Ile Ser
65 70 75 80
Arg Val Glu Ala Glu Asp Val Gly Leu Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 21
<211> 447
<212> Белок
<213> Искусственная
<220>
<223> Тяжелая цепь гуманизированного антитела
<400> 21
Gln Val Gln Leu Val Gln Ser Gly Val Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Thr Asp Ser Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Lys Ser Leu Gln Phe Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 22
<211> 218
<212> Белок
<213> Искусственная
<220>
<223> Легкая цепь гуманизированного антитела
<400> 22
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 23
<211> 440
<212> Белок
<213> Homo sapiens
<400> 23
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 24
<211> 214
<212> Белок
<213> Homo sapiens
<400> 24
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 25
<211> 290
<212> Белок
<213> Homo sapiens
<220>
<221> зрелый_пептид
<222> (19)..(290)
<400> 25
Met Arg Ile Phe Ala Val Phe Ile Phe Met Thr Tyr Trp His Leu Leu
-15 -10 -5
Asn Ala Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr
-1 1 5 10
Gly Ser Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu
15 20 25 30
Asp Leu Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile
35 40 45
Ile Gln Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser
50 55 60
Tyr Arg Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn
65 70 75
Ala Ala Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr
80 85 90
Arg Cys Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val
95 100 105 110
Lys Val Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val
115 120 125
Asp Pro Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr
130 135 140
Pro Lys Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser
145 150 155
Gly Lys Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn
160 165 170
Val Thr Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr
175 180 185 190
Cys Thr Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu
195 200 205
Val Ile Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Thr His
210 215 220
Leu Val Ile Leu Gly Ala Ile Leu Leu Cys Leu Gly Val Ala Leu Thr
225 230 235
Phe Ile Phe Arg Leu Arg Lys Gly Arg Met Met Asp Val Lys Lys Cys
240 245 250
Gly Ile Gln Asp Thr Asn Ser Lys Lys Gln Ser Asp Thr His Leu Glu
255 260 265 270
Glu Thr
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО К PD-L1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778085C2 |
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811120C2 |
| АНТИТЕЛО К PD-1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2807484C2 |
| АНТИТЕЛА К PD-1 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2761640C2 |
| МОНОСПЕЦИФИЧЕСКИЕ И БИСПЕЦИФИЧЕСКИЕ БЕЛКИ С РЕГУЛИРОВАНИЕМ ИММУННОЙ КОНТРОЛЬНОЙ ТОЧКИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2793167C2 |
| НЕЙТРАЛИЗАЦИЯ ИНГИБИТОРНЫХ ПУТЕЙ В ЛИМФОЦИТАХ | 2015 |
|
RU2734771C2 |
| БИФУНКЦИОНАЛЬНЫЕ БЕЛКИ, КОМБИНИРУЮЩИЕ БЛОКАДУ КОНТРОЛЬНОЙ ТОЧКИ, ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ | 2019 |
|
RU2756899C1 |
| АНТИТЕЛА ПРОТИВ PD-L1 И ИХ ВАРИАНТЫ | 2017 |
|
RU2770590C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИТЕЛА К PD-L1 И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2766590C2 |
| СТАБИЛЬНЫЕ СОСТАВЫ АНТИТЕЛ ПРОТИВ TIGIT, ОТДЕЛЬНО И В КОМБИНАЦИИ С АНТИТЕЛАМИ ПРОТИВ РЕЦЕПТОРА 1 ПРОГРАММИРУЕМОЙ СМЕРТИ (PD-1), И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2820576C2 |



























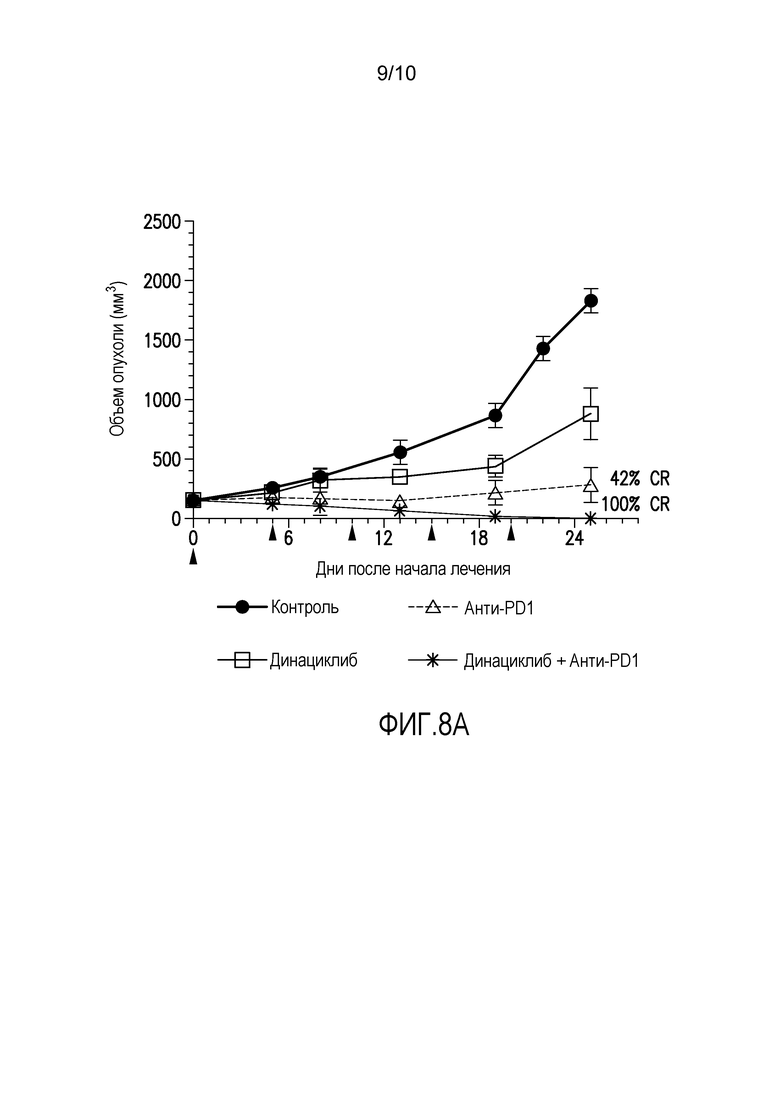
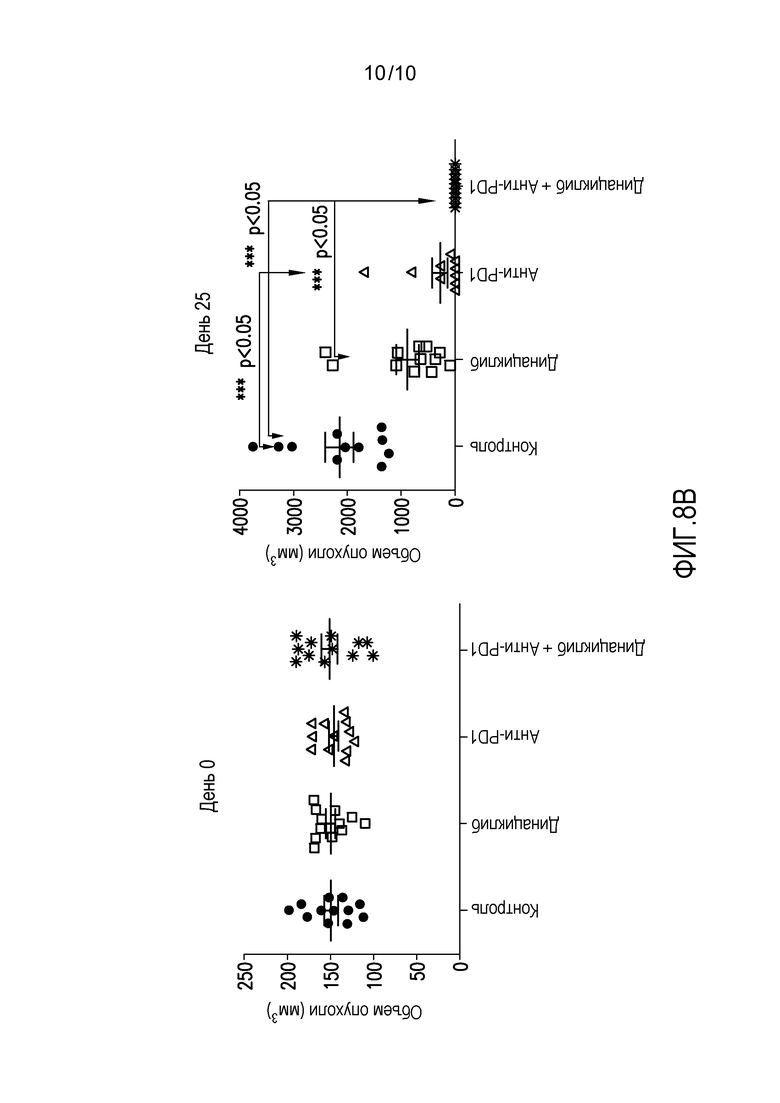
Настоящая группа изобретений относится к медицине, а именно к онкологии, и касается лечения рака. Для этого вводят эффективное количество антагониста белка запрограммированной смерти 1 (PD-1), представляющего собой моноклональное антитело, тяжелая и легкая цепи которого включают SEQ ID NO: 21 и SEQ ID NO: 22 соответственно, и ингибитора циклинзависимых киназ (CDK) – динациклиба. Это обеспечивает эффективное лечение рака за счет синергетического противоопухолевого действия указанных препаратов. 3 н. и 11 з.п. ф-лы, 5 табл., 10 ил., 1 пр.
1. Комбинация для лечения рака у индивидуума, включающая антагониста белка запрограммированной смерти 1 (PD-1) и соединение динациклиб, причем соединение динациклиб представляет собой соединение формулы I

или фармацевтически приемлемую соль соединения формулы I, и антагонист PD-1 представляет собой моноклональное антитело против PD-1, которое включает тяжелую цепь и легкую цепь, причем тяжелая и легкая цепи включают SEQ ID NO: 21 и SEQ ID NO: 22 соответственно.
2. Комбинация для лечения рака у индивидуума, включающая соединение динациклиб и антагониста белка запрограммированной смерти 1 (PD-1), причем соединение динациклиб представляет собой соединение формулы I
 ,
,
и антагонист PD-1 представляет собой моноклональное антитело против PD-1, которое включает тяжелую цепь и легкую цепь, причем тяжелая и легкая цепи включают SEQ ID NO: 21 и SEQ ID NO: 22 соответственно.
3. Комбинация по п. 1 или 2, причем индивидуумом является человек.
4. Комбинация по любому из пп.1-3, в которой раком является солидная опухоль.
5. Комбинация по любому из пп.1-4, в которой раком является гемобластоз.
6. Комбинация по п.4 или 5, в которой антагонистом PD-1 является МК-3475.
7. Комбинация по п. 6, в которой МК-3475 готовят в виде жидкого лекарственного средства, которое включает 25 мг/мл МК-3475, 7% (в отношении веса к объему) сахарозы, 0,02% (в отношении веса к объему) полисорбата 80 в 10 мМ гистидиновом буфере рН 5,5.
8. Комбинация по п. 2, в которой соединение динациклиб готовят в виде жидкого лекарственного средства, включающего 5 мг/мл соединения формулы I в стерильном, водном, забуференном цитратом растворе при рН от 3,0 до 4,2.
9. Комбинация по любому из пп. 1-4 или 6-8, в которой раком является рак мочевого пузыря, рак молочной железы, светлоклеточный рак почки, плоскоклеточный рак головы/шеи, плоскоклеточный рак легких, злокачественная меланома, немелкоклеточный рак легких (NSCLC), рак яичников, рак поджелудочной железы, рак предстательной железы, почечно-клеточный рак, мелкоклеточный рак легких (SCLC), тройной негативный рак молочной железы, острый лимфобластный лейкоз (ALL), острый миелоидный лейкоз (AML), хронический лимфолейкоз (CLL), хронический миелоидный лейкоз (CML), крупноклеточная диффузная B-клеточная лимфома (DLBCL), фолликулярная лимфома, лимфома Ходжкина (HL), лимфома из клеток мантийной зоны (MCL), множественная миелома (ММ), миелоидная клеточная лейкемия-1 (Mcl-1), миелодиспластический синдром (MDS), неходжкинская лимфома (NHL) или мелкоклеточная лимфоцитарная лимфома (SLL).
10. Набор для лечения рака у индивидуума, который включает первый контейнер, второй контейнер и листовку-вкладыш, в котором первый контейнер содержит по крайней мере одну дозу лекарственного средства, включающего антагониста белка запрограммированной смерти 1 (PD-1), второй контейнер содержит по крайней мере одну дозу лекарственного средства, включающего соединение динациклиб, а листовка-вкладыш содержит инструкции в отношении лечения индивидуума по поводу рака, используя лекарственные средства, причем соединение динациклиб представляет собой соединение формулы I
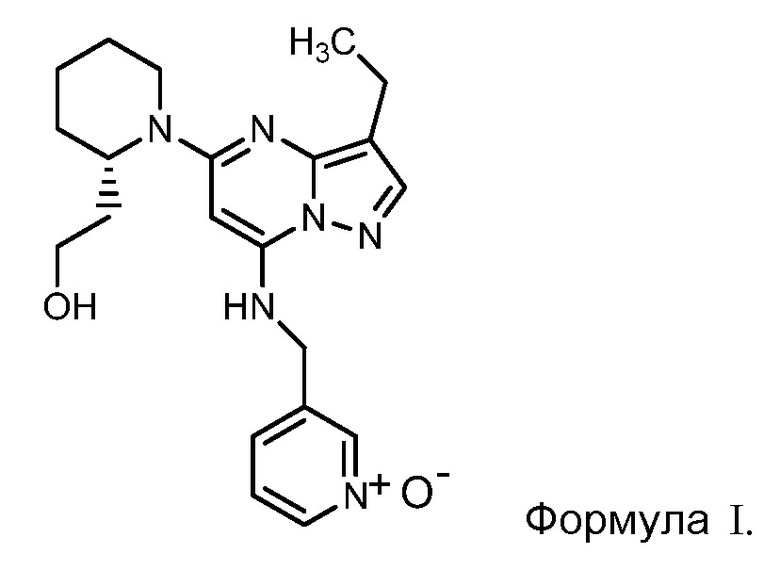 ,
,
где антагонист PD-1 представляет собой моноклональное антитело против PD-1, которое включает тяжелую цепь и легкую цепь, причем тяжелая и легкая цепи включают SEQ ID NO: 21 и SEQ ID NO: 22 соответственно.
11. Набор по п. 10, в инструкциях которого указывается, что лекарственные средства предназначены для применения в лечении индивидуума, имеющего рак, который дает положительный результат на экспрессию PD-L1 при иммуногистохимическом (IHC) анализе.
12. Набор по п. 10 или 11, в котором индивидуумом является человек.
13. Набор по любому из пп.10-12, в котором антагонистом PD-1 является MK-3475.
14. Набор по любому из пп. 10-13, в котором раком является рак мочевого пузыря, рак молочной железы, светлоклеточный рак почки, плоскоклеточный рак головы/шеи, плоскоклеточный рак легких, злокачественная меланома, немелкоклеточный рак легких (NSCLC), рак яичников, рак поджелудочной железы, рак предстательной железы, почечно-клеточный рак, мелкоклеточный рак легких (SCLC), тройной негативный рак молочной железы, острый лимфобластный лейкоз (ALL), острый миелоидный лейкоз (AML), хронический лимфолейкоз (CLL), хронический миелоидный лейкоз (CML), крупноклеточная диффузная B-клеточная лимфома (DLBCL), фолликулярная лимфома, лимфома Ходжкина (HL), лимфома из клеток мантийной зоны (MCL), множественная миелома (ММ), миелоидная клеточная лейкемия-1 (Mcl-1), миелодиспластический синдром (MDS), неходжкинская лимфома (NHL) или мелкоклеточная лимфоцитарная лимфома (SLL).
| US 2010055111 A1, 04.03.2010 | |||
| US 2010286038 A1, 11.11.2010 | |||
| СПОСОБЫ ЛЕЧЕНИЯ ОПУХОЛЕЙ И МЕТАСТАЗОВ С ИСПОЛЬЗОВАНИЕМ КОМБИНАЦИИ АНТИАНГИОГЕННОЙ ТЕРАПИИ И ИММУНОТЕРАПИИ | 2000 |
|
RU2236251C2 |
| US 2010266617 A1, 21.10.2010. | |||
Авторы
Даты
2019-11-12—Публикация
2014-08-15—Подача