ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к составу, содержащему липосомы.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0002] Эриторан, который также обозначают как “E5564”, представляет собой аналог липополисахарида, содержащий два сахарных фрагмента и четыре представленных длинноцепочечной жирной кислотой фрагмента. Эриторан характеризуется молекулярной массой, составляющей приблизительно 1401. Способы получения эриторана описаны в патентах США №№ 5 530 113; 5 681 824; 5 750 664; 5 935 938 и 6 184 366, а также в WO 96/39411. Эти документы включены в настоящий документ посредством ссылки. По сообщениям, лекарственные составы на основе эриторана с варьирующимися значениями гидродинамического диаметра мицелл были получены путем контролирования значения pH и концентрации противоионов в растворе. Об этом сообщается в патенте США № 6 906 042, который включен в данный документ посредством ссылки.
[0003] Эриторан представляет собой аналог липида A, который действует в качестве антагониста Toll-подобного рецептора 4 (TLR4). Эриторан имеет следующую структуру:
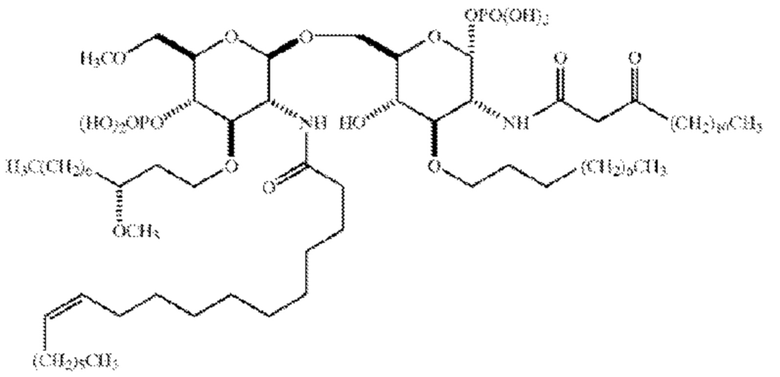 .
.
[0004] Активность аналогов липида A, как сообщается, подвергалась изменению за счет взаимодействий с холестерином липопротеинов. Эти липопротеины, как правило, присутствуют в сыворотке крови человека и включают липопротеины низкой плотности (LDL) и липопротеины высокой плотности (HDL). Исследование постулировало, что изменения липопротеиновых профилей плазмы крови могут изменять как эффективность, так и фармакодинамические профили липофильных лекарственных средств. В частности, в исследовании было отмечено, что связывание эриторана с HDL приводило к зависящей от времени потере активности препарата. См. Daniel P. Rossignol, et al., “Safety, Pharmacokinetics, Pharmacodynamics, and Plasma Lipoprotein Distribution of Eritoran (E5564) during Continuous Intravenous Infusion into Healthy Volunteers” Antimicrobial Agents & Chemotherapy, Sep. 2004, p. 3233-3240, которая включена в данный документ посредством ссылки.
Краткое описание
[0005] Одной из целей настоящего изобретения является обеспечение состава, содержащего эриторан, который характеризуется более высокими показателями для форм активности in vivo или в присутствии HDL (например, HDL человека), предпочтительно форм активности, предусматривающих подавление продуцирования интерлейкина-6 (IL-6), или форм активности, предусматривающих подавление продуцирования TNF-α, чем эриторан сам по себе или мицеллизированный эриторан. Авторы настоящего изобретения обнаружили, что липосома, содержащая эриторан и пегилированный фосфолипид, характеризуется более высокими показателями для форм активности in vivo или в присутствии HDL (например, HDL человека) и что регулирование количеств эриторана и пегилированного фосфолипида обеспечивает для липосом возможность демонстрировать гораздо более высокие показатели для форм активности.
[0006] Настоящее изобретение предусматривает следующие варианты осуществления.
[1] Состав, содержащий липосомы, где липосомы содержат от 0,7 до 3,0 мол. % эриторана или его фармацевтически приемлемой соли и от 0,5 до 3,0 мол. % пегилированного фосфолипида в пересчете на липосому.
[2] Состав по п. [1], где фармацевтически приемлемая соль представляет собой тетранатриевую соль.
[3] Состав по п. [1] или п. [2], где липосомы содержат от 1,0 до 2,5 мол. % эриторана или его фармацевтически приемлемой соли и от 1,0 до 2,5 мол. % пегилированного фосфолипида в пересчете на липосому.
[3-1] Состав по любому из пп [1]-[3], где липосомы содержат 1,0 мол. % эриторана или его фармацевтически приемлемой соли и 1,0 мол. % пегилированного фосфолипида в пересчете на липосому.
[3-2] Состав по любому из пп [1]-[3], где липосомы содержат 1,0 мол. % эриторана или его фармацевтически приемлемой соли и 2,5 мол. % пегилированного фосфолипида в пересчете на липосому.
[3-3] Состав по любому из пп [1]-[3], где липосомы содержат 2,5 мол. % эриторана или его фармацевтически приемлемой соли и 1,0 мол. % пегилированного фосфолипида в пересчете на липосому.
[3-4] Состав по любому из пп [1]-[3], где липосомы содержат 2,5 мол. % эриторана или его фармацевтически приемлемой соли и 2,5 мол. % пегилированного фосфолипида в пересчете на липосому.
[4] Состав по любому из пп [1]-[3], где пегилированный фосфолипид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000].
[5] Состав по п. [4], где липосомы содержат 1,0 мол. % эриторана или его фармацевтически приемлемой соли и 1,0 мол. % 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000] в пересчете на липосому.
[6] Состав по п. [4], где липосомы содержат 1,0 мол. % эриторана или его фармацевтически приемлемой соли и 2,5 мол. % 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000] в пересчете на липосому.
[7] Состав по п. [4], где липосомы содержат 2,5 мол. % эриторана или его фармацевтически приемлемой соли и 1,0 мол. % 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000] в пересчете на липосому.
[8] Состав по п. [4], где липосомы содержат 2,5 мол. % эриторана или его фармацевтически приемлемой соли и 2,5 мол. % 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000] в пересчете на липосому.
[9] Состав по любому из пп [1]-[8], где липосомы дополнительно содержат фосфатидилхолин.
[10] Состав по п. [9], где фосфатидилхолин представляет собой дистеароилфосфатидилхолин.
[11] Состав по любому из пп [1]-[10], где липосомы дополнительно содержат антиоксидант.
[12] Состав по п. [11], где антиоксидант представляет собой бутилированный гидроксианизол.
[13] Состав по любому из пп [1]-[12], где липосомы дополнительно содержат от 0 до 10 мол. % стерола в пересчете на липосому.
[14] Состав по п. [13], где стерол представляет собой холестерин.
[15] Состав по п. [13], где липосомы не содержат стерола.
[16] Состав по любому из пп [1]-[15], где липосомы имеют средний размер частиц от 100 до 120 нм, измеренный с помощью анализа динамического рассеяния света (DLS).
[17] Состав по любому из пп [1]-[16], где липосомы характеризуются коэффициентом полидисперсности, составляющим 0,20 или меньше.
[18] Способ получения состава, содержащего липосомы, включающий получение раствора, содержащего от 0,7 до 3,0 мол. % эриторана или его фармацевтически приемлемой соли, от 0,5 до 3,0 мол. % пегилированного фосфолипида и растворитель в пересчете на все подлежащие использованию компоненты липосом;
выпаривание растворителя из раствора с образованием тонкой пленки;
диспергирование тонкой пленки в буферном растворе с образованием жидкой дисперсии и
экструдирование жидкой дисперсии через фильтр с образованием состава.
[19] Способ по п. [18], где раствор дополнительно содержит фосфатидилхолин и антиоксидант.
[20] Способ по п. [18] или п. [19], где растворитель представляет собой комбинацию хлороформа и метанола.
[21] Способ по любому из пп [18]-[20], где стадию диспергирования осуществляют с помощью обработки ультразвуком.
[22] Способ по любому из пп [18]-[21], где способ дополнительно включает регулирование pH состава, образованного на стадии экструдирования, до 6,2-6,8.
[0007] Настоящее изобретение дополнительно предусматривает следующие варианты осуществления.
[A] Состав согласно любому из вариантов осуществления [1]-[22] для применения в подавлении связывания липополисахаридов с TLR4, для применения в подавлении димеризации TLR4, для применения в подавлении передачи сигналов TLR4, для применения в подавлении продуцирования IL-6, для применения в лечении или предупреждении заболеваний, которые опосредованы активацией TLR4 или продуцированием IL-6, для применения в подавлении продуцирования TNF-α или для применения в лечении или предупреждении заболеваний, которые опосредованы продуцированием TNF-α.
[B] Способ подавлении связывания липополисахаридов с TLR4, подавления димеризации TLR4, подавления передачи сигналов TLR4, подавления продуцирования IL-6, лечения или предупреждения заболеваний, которые опосредованы активацией TLR4 или продуцированием IL-6, для применения в подавлении продуцирования TNF-α или для применения в лечении или предупреждении заболеваний, которые опосредованы продуцированием TNF-α, включающий введение эффективного количества состава согласно любому из вариантов осуществления [1]-[22] нуждающемуся в этом субъекту.
[C] Применение состава согласно любому из вариантов осуществления [1]-[22] для подавлении связывания липополисахаридов с TLR4, для подавлении димеризации TLR4, для подавлении передачи сигналов TLR4, для подавлении продуцирования IL-6, для лечения или предупреждения заболеваний, которые опосредованы активацией TLR4 или продуцированием IL-6, для применения в подавлении продуцирования TNF-α или для применения в лечении или предупреждении заболеваний, которые опосредованы продуцированием TNF-α.
[D] Применение состава в соответствии с любым из вариантов осуществления [1]-[22] в изготовлении лекарственного препарата для подавлении связывания липополисахаридов с TLR4, для подавлении димеризации TLR4, для подавлении передачи сигналов TLR4, для подавлении продуцирования IL-6, для лечения или предупреждения заболеваний, которые опосредованы активацией TLR4 или продуцированием IL-6, для применения в подавлении продуцирования TNF-α или для применения в лечении или предупреждении заболеваний, которые опосредованы продуцированием TNF-α.
[0008] Применительно к вариантам осуществления [A]-[D] могут быть приведены признаки, описанные в разделе <Состав> ниже.
[0009] Согласно настоящему изобретению может быть обеспечен состав, содержащий эриторан, характеризующийся более высокими показателями для форм активности in vivo или в присутствии HDL (например, HDL человека), предпочтительно форм активности, предусматривающих подавление продуцирования IL-6, или форм активности, предусматривающих подавление продуцирования TNF-α, чем эриторан сам по себе или мицеллизированный эриторан.
Краткое описание графических материалов
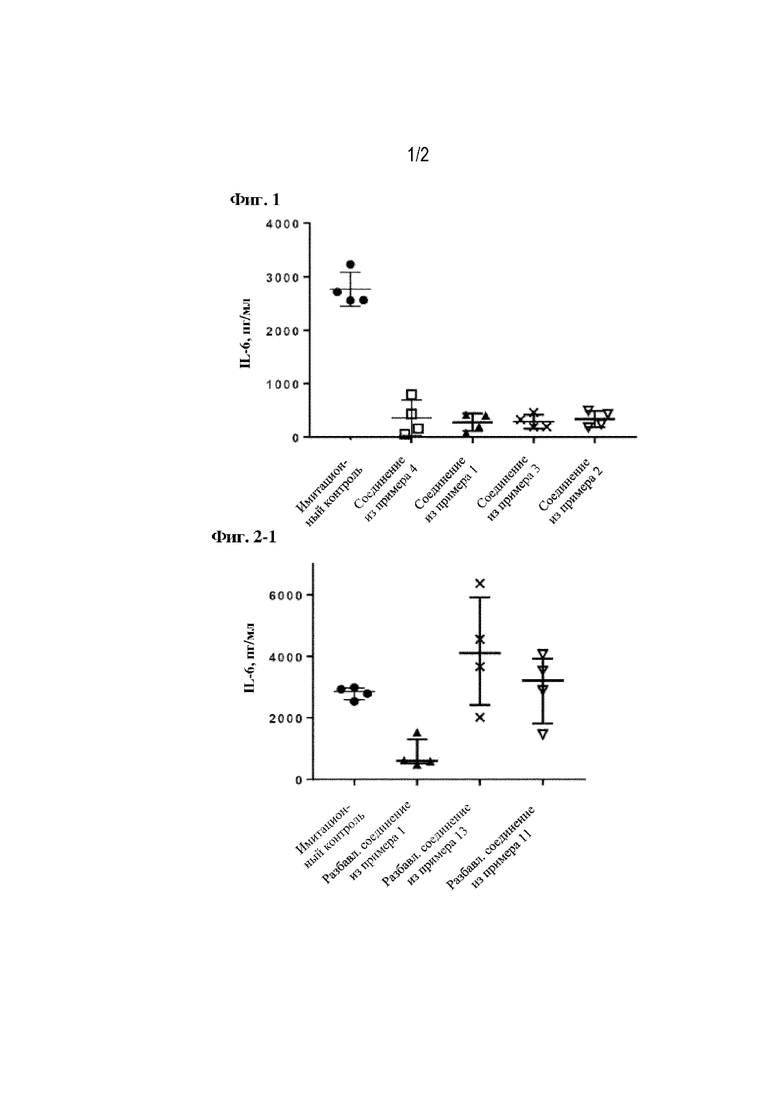
[0010] На фиг. 1 продемонстрирована активность в отношении подавления продуцирования IL-6 in vivo для составов из примеров 1-4.
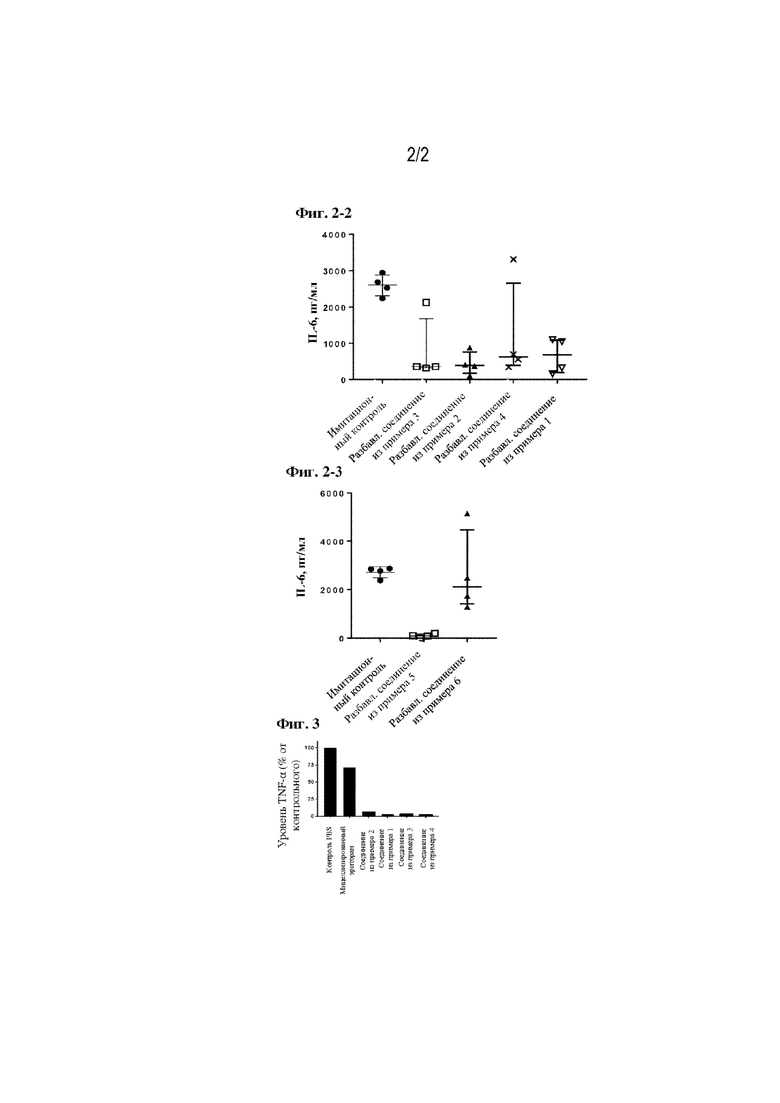
На фиг. 2-1 продемонстрирована активность в отношении подавления продуцирования IL-6 in vivo для составов на основе разбавленных соединений из примеров 1, 11 и 13.
На фиг. 2-2 продемонстрирована активность в отношении подавления продуцирования IL-6 in vivo для составов на основе разбавленных соединений из примеров 1-4.
На фиг. 2-3 продемонстрирована активность в отношении подавления продуцирования IL-6 in vivo для составов на основе разбавленных соединений из примеров 5 и 6.
На фиг. 3 продемонстрирована активность в отношении подавления продуцирования TNF-α для мицеллизированного эриторана и составов из примеров с 1 по 4 в присутствии HDL человека.
ПОДРОБНОЕ ОПИСАНИЕ
[0011] <Определение>
Используемые в данном документе формы единственного числа означают “один или несколько” или “по меньшей мере один”, если не указано иное.
[0012] <Состав>
Один вариант осуществления относится к составу, содержащему липосомы, где липосомы содержат от 0,7 до 3,0 мол. % эриторана или его фармацевтически приемлемой соли и от 0,5 до 3,0 мол. % пегилированного фосфолипида в пересчете на липосому. Было обнаружено, что липосомы, содержащие меньшее количество эриторана или его фармацевтически приемлемой соли, обладают более высокими показателями для форм активности in vivo или в присутствии HDL (например, HDL человека).
[0013] Состав может содержать в дополнение к липосомам диски на основе липидного бислоя. Состав может содержать в дополнение к липосомам липидные бислои. Состав может содержать в дополнение к липосомам диски на основе липидного бислоя и липидные бислои. Используемый в данном документе липидный бислой не образует ни липосому, ни диск на основе липидного бислоя.
[0014] Липосомы содержат эриторан или его фармацевтически приемлемую соль. Термин “фармацевтически приемлемая соль” хорошо известен в данной области техники. Примеры фармацевтически приемлемой соли включают без ограничения соли щелочных металлов, например соли лития, натрия или калия; и соли щелочноземельных металлов, например соли кальция или магния. Фармацевтически приемлемая соль эриторана предпочтительно представляет собой натриевую соль, например тетранатриевую соль.
[0015] Количество эриторана или его фармацевтически приемлемой соли, содержащееся в липосомах, составляет от 0,7 до 3,0 мол. %, предпочтительно от 1,0 до 2,5 мол. % в пересчете на липосому. Регулировка количества эриторана или его фармацевтически приемлемой соли в пределах указанного выше диапазона или до указанной выше точки обеспечивает состав с гораздо более высокими показателями для форм активности.
[0016] Липосомы содержат пегилированный фосфолипид. Пегилированный фосфолипид содержит представленный полиэтиленгликолем фрагмент (“ПЭГ”), ковалентно связанный с фосфолипидом. Молекулярная масса ПЭГ-группы составляет предпочтительно от приблизительно 500 до приблизительно 5000, более предпочтительнее от приблизительно 1000 до приблизительно 3000 и еще более предпочтительнее приблизительно 2000. Пегилированный фосфолипид предпочтительно содержит ацильные группы, содержащие от 14 до 18 атомов углерода, и более предпочтительно ацильные группы, содержащие 18 атомов углерода. Примеры пегилированного фосфолипида включают без ограничения 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000] (DSPE-PEG2000) и 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000] (DMPE-PEG2000). Эти пегилированные фосфолипиды можно использовать отдельно или в комбинации. Пегилированный фосфолипид предпочтительно представляет собой DSPE-PEG2000, имеющий следующую структуру:
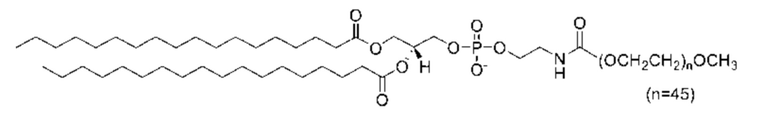 .
.
[0017] Количество пегилированного фосфолипида, содержащегося в липосоме, составляет от 0,5 до 3,0 мол. %, предпочтительно от 1,0 до 2,5 мол. % в пересчете на липосому. Регулировка количества пегилированного фосфолипида в пределах указанного выше диапазона или до указанной выше точки обеспечивает состав с гораздо более высокими показателями для форм активности.
[0018] Предпочтительно количество эриторана или его фармацевтически приемлемой соли и пегилированного фосфолипида в липосоме составляет 1,0 мол. % и 1,0 мол. %, 1,0 мол. % и 2,5 мол. %, 2,5 мол. % и 1,0 мол. % или 2,5 мол. % и 2,5 мол. % соответственно в пересчете на липосому.
[0019] Липосомы могут дополнительно содержать фосфатидилхолин. Примеры фосфатидилхолина включают без ограничения соевый фосфатидилхолин, яичный фосфатидилхолин, диелаидоилфосфатидилхолин (DEPC), диолеоилфосфатидилхолин (DOPC), дистеароилфосфатидилхолин (син. 1,2-дистеароил-sn-глицеро-3-фосфохолин) (DSPC), гидрогенизированный соевый фосфатидилхолин (HSPC), дипальмитоилфосфатидилхолин (DPPC), 1-пальмитоил-2-олеофосфатидилхолин (POPC), дибегеноилфосфатидилхолин (DBPC) и димиристоилфосфатидилхолин (DMPC). Эти разновидности фосфатидилхолина можно использовать отдельно или в комбинации. Фосфатидилхолин предпочтительно представляет собой DSPC, имеющий следующую структуру:
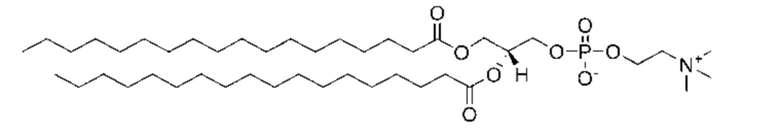 .
.
[0020] Термин “соевый фосфатидилхолин” относится к композиции на основе фосфатидилхолина, содержащей ряд различных моно-, ди-, триненасыщенных и насыщенных жирных кислот. Как правило, соевый фосфатидилхолин предусматривает пальмитиновую кислоту в количестве от приблизительно 12% до приблизительно 33% по весу, стеариновую кислоту в количестве от приблизительно 3% до приблизительно 8% по весу, олеиновую кислоту в количестве от приблизительно 4% до приблизительно 22% по весу, линолевую кислоту в количестве от приблизительно 60% до приблизительно 66% по весу и линоленовую кислоту в количестве от приблизительно 5% до приблизительно 8% по весу.
[0021] Термин “яичный фосфатидилхолин” относится к композиции на основе фосфатидилхолина, содержащей ряд различных насыщенных и ненасыщенных жирных кислот. Как правило, яичный фосфатидилхолин предусматривает пальмитиновую кислоту в количестве приблизительно 34% по весу, стеариновую кислоту в количестве приблизительно 10% по весу, олеиновую кислоту в количестве приблизительно 31% по весу и линолевую кислоту в количестве приблизительно 18% по весу.
[0022] Количество фосфатидилхолина, содержащегося в липосоме, предпочтительно составляет от 86 до 98 мол. %, более предпочтительно от 89 до 97 мол. %, и еще более предпочтительно от 92 до 96 мол. % в пересчете на липосому.
[0023] Липосомы могут дополнительно содержать антиоксидант. Примеры антиоксиданта включают без ограничения бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол, аскорбиновую кислоту, аскорбат натрия, аскорбилпальмитат, сульфит натрия, бисульфит натрия, цистеината гидрохлорид, дитионат натрия, однозамещенный глутамат натрия, глутатион, пропилгаллат, альфа-токоферол, альфа-токоферола гидросукцинат и соли этилендиаминтетрауксусной кислоты. Эти антиоксиданты можно использовать отдельно или в комбинации. Антиоксидант предпочтительно представляет собой ВНА.
[0024] Количество антиоксиданта, содержащегося в липосоме, предпочтительно составляет от 0,02 до 0,12 мол. %, более предпочтительно от 0,04 до 0,10 мол. % и еще более предпочтительно от 0,06 до 0,08 мол. % в пересчете на липосому.
[0025] Липосомы могут дополнительно содержать стерол. Примеры стерола включают без ограничения холестерин, кампестерин, β-ситостерин, стигмастерин и эргостерин. Эти стеролы можно использовать по отдельности или в комбинации. Стерол предпочтительно представляет собой холестерин, имеющий следующую структуру:
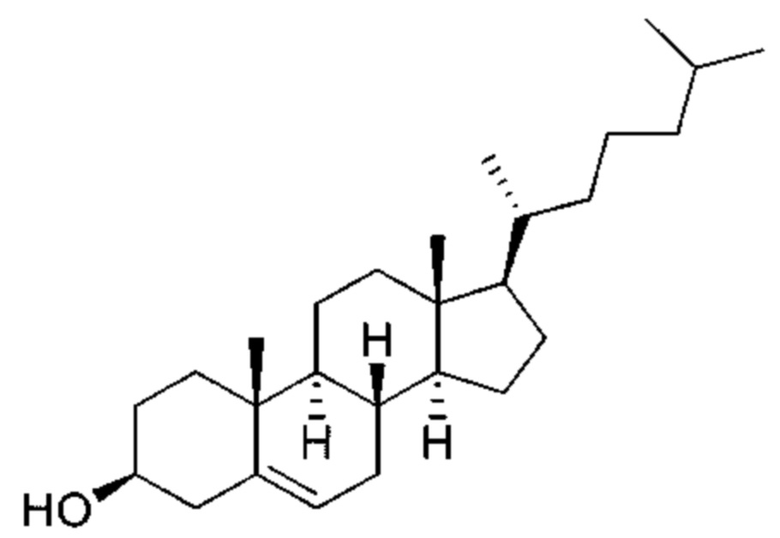 .
.
[0026] Количество стерола, содержащегося в липосоме, предпочтительно составляет от 0 до 30 мол. %, более предпочтительно от 0 до 10 мол. %, еще более предпочтительно от 0 до 6 мол. % и наиболее предпочтительно 0% в пересчете на липосому. Уменьшение количества стерола обеспечивает состав с гораздо более высокими показателями для форм активности.
[0027] Предпочтительно, липосомы состоят только из эриторана или его фармацевтически приемлемой соли, пегилированного фосфолипида, фосфатидилхолина и антиоксиданта. Более предпочтительно липосомы состоят только из эриторана или его фармацевтически приемлемой соли, 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000], дистеароилфосфатидилхолина и бутилированного гидроксианизола. Использование этих компонентов обеспечивает состав с гораздо более высокими показателями для форм активности. Специалисту в данной области будет понятно, что липосомы могут содержать такие материалы, как вода и буфер, в пределах своего внутреннего пространства.
[0028] Компоненты липосом и их количество, которые описаны выше, могут быть применимы по отношению к дискам на основе липидного бислоя и липидным бислоям.
[0029] Состав может дополнительно содержать необязательные компоненты. Примеры необязательного компонента включают без ограничения фармацевтически приемлемые вспомогательные вещества, такие как лактоза, декстроза, сахароза, сорбит, маннит, разновидности крахмала, гуммиарабик, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическая целлюлоза, поливинилпирролидон, целлюлоза, вода, физиологический раствор, сироп, метилцеллюлоза, этилцеллюлоза, гидроксипропилметилцеллюлоза и полиакриловые кислоты; смазывающие средства, такие как тальк, стеарат магния и минеральное масло; смачивающие средства; эмульгаторы; суспендирующие средства; консерванты, такие как метил-, этил- и пропилгидроксибензоаты; средства, регулирующие pH, такие как неорганические и органические кислоты и основания; подсластители и ароматизаторы.
[0030] Хотя средний размер частиц липосом может быть соответствующим образом отрегулирован с помощью общеизвестного способа, липосомы имеют средний размер частиц (Z-ave), составляющий предпочтительно от 80 до 140 нм и более предпочтительно от 100 до 120 нм, измеренный методом динамического рассеяния света (DLS).
[0031] Липосомы характеризуются коэффициентом полидисперсности (PdI), составляющим предпочтительно от 0,20 или меньше, более предпочтительно 0,10 или меньше и еще более предпочтительно 0,05 или меньше. Хотя нижний предел PdI конкретным образом не ограничивается, он составляет, например, 0,01.
[0032] Состав может быть использован для подавления связывания липополисахаридов (LPS) с TLR4. Состав может быть использован для подавления димеризации TLR4. Состав может быть использован для подавления передачи сигнала TLR4. Состав может быть использован для подавлении продуцирования IL-6.
[0033] Состав может быть использован для лечения или предупреждения заболеваний, которые опосредованы активацией TLR4 или продуцированием IL-6. Примеры такого заболевания включают без ограничения сепсис; заболевание, вызванное вирусом Эбола; заболевание, вызванное вирусом Марбург; боль; септицемия, включая без ограничения эндотоксемию; эндотоксемия в результате грамотрицательной бактериемии с сопутствующими ей симптомами лихорадки, генерализованного воспаления, диссеминированного внутрисосудистого свертывания, гипотонии, острой почечной недостаточности, острого респираторного дистресс-синдрома, респираторного дистресс-синдрома взрослых (ARDS), гепатоцеллюлярной деструкции и/или сердечной недостаточности и различные формы септического шока, включая без ограничения эндотоксический шок.
[0034] Состав может быть использован для подавлении продуцирования TNF-α. Состав может использоваться для лечения или предупреждения заболеваний, которые опосредованы продуцированием TNF-α. Примеры такого заболевания включают без ограничения сепсис; заболевание, вызванное вирусом Эбола; заболевание, вызванное вирусом Марбург; боль; ревматоидный артрит; псориаз; сахарный диабет; дислипидемия, включая без ограничения гиперлипидемию, первичную гиперлипидемию, гиперхолестеринемию, семейную комбинированную гиперлипидемию, гиперлипопротеинемию, гиполипопротеинемию и гипертриглицеридемию; и остеопороз.
[0035] Соответствующие дозы и введение состава могут быть определены специалистом в данной области в зависимости от возраста, веса и состояния здоровья субъектов, заболевания, подлежащего лечению или предупреждению, пути введения и т. д.
[0036] Состав предпочтительно вводят парентерально и более предпочтительно вводят внутривенно.
[0037] Лекарственная форма состава может быть инъекционной или инфузионной.
[0038] Количество подлежащего введению состава для инъекции в пересчете на эриторан может составлять от 0,001 до 20 мг эриторана/кг массы тела на дозу, предпочтительно от 0,01 до 10 мг эриторана/кг массы тела на дозу. Состав для инъекции можно вводить от 1 до 6 раз в день, предпочтительно от 1 до 3 раз в день. Состав для инъекции можно вводить в течение периода от 1 до 10 дней, предпочтительно от 1 до 5 дней.
[0039] Количество подлежащего введению состава для инъекции в пересчете на эриторан может составлять от 0,001 до 10 мг эриторана/кг массы тела/час, предпочтительно от 0,003 до 5 мг эриторана/кг массы тела/час. Состав для инфузии можно вводить на протяжении периода от 0,5 до 6 часов/день, предпочтительно от 1 до 3 часов/день. Состав для инфузии можно вводить в течение периода от 1 до 10 дней, предпочтительно от 1 до 5 дней.
[0040] Термин “субъект” относится к животному, предпочтительно млекопитающему и более предпочтительно человеку, которое является объектом лечения или предупреждения. Примеры млекопитающих включают без ограничения мышей, крыс, хомяков, песчанок, кроликов, морских свинок, собак, кошек, овец, коз, коров, лошадей, жирафов, утконосов, приматов, таких как люди, обезьяны, шимпанзе и человекообразные обезьяны. Субъект предпочтительно является человеком.
[0041] <Способ получения>
Один вариант осуществления относится к способу получения состава, содержащего липосомы, как определено выше. В частности, способ включает получение раствора, содержащего от 0,7 до 3,0 мол. % эриторана или его фармацевтически приемлемой соли, от 0,5 до 3,0 мол. % пегилированного фосфолипида и растворитель в пересчете на все подлежащие использованию компоненты липосом; выпаривание растворителя из раствора с образованием тонкой пленки; диспергирование тонкой пленки в буферном растворе с образованием жидкой дисперсии и экструдирование жидкой дисперсии через фильтр с образованием состава.
[0042] Касательно компонентов липосом, подлежащих использованию на стадии получения и их количества, можно обращаться к информации относительно компонентов липосом и их количества, которые описаны в приведенном выше разделе <Состав>.
[0043] На стадии получения можно использовать любой растворитель при условии, что он растворяет компоненты липосомы. Примеры растворителя включают без ограничения галогенированные углеводороды, такие как хлороформ и дихлорметан, и спирты, такие как метанол и этанол. Растворитель предпочтительно представляет собой комбинацию хлороформа и метанола.
[0044] Стадию диспергирования предпочтительно осуществляют с помощью обработки ультразвуком. Буферный раствор предпочтительно содержит сахарид, такой как сахароза. Температура буферного раствора предпочтительно составляет от 50 до 90°C и более предпочтительно от 60 до 80°C.
[0045] Фильтр, используемый на стадии экструдирования, предпочтительно содержит два или более фильтрующих элемента, которые накладываются друг на друга. Количество фильтрующих элементов предпочтительно составляет от 2 до 6, более предпочтительно от 3 до 5 и еще более предпочтительно 4. Фильтрующие элементы предпочтительно имеют разный размер пор соответственно. Размер пор фильтрующих элементов составляет предпочтительно от 0,05 до 1,5 мкм, более предпочтительно от 0,08 до 1,0 мкм и еще более предпочтительно от 0,1 до 0,8 мкм. Когда количество фильтрующих элементов равно 4, размер пор каждого фильтрующего элемента предпочтительно составляет 0,1 мкм, 0,2 мкм, 0,4 мкм и 0,8 мкм соответственно. Фильтрация на стадии экструдирования выполняется предпочтительно два или более раз, более предпочтительно от 3 до 7 раз и еще более предпочтительно от 4 до 6 раз.
[0046] Способ может дополнительно включать регулирование pH состава, который образуется на стадии экструдирования, предпочтительно до значения в диапазоне от 6,2 до 6,8 и более предпочтительно от 6,4 до 6,6. pH можно регулировать с помощью гидроксида щелочного металла, такого как NaOH и КОН, или неорганической кислоты, такой как HCl. Состав, pH которого был отрегулирован, можно стерилизовать через стерилизующий фильтр.
Примеры
[0047] <Получение состава>
(Материалы)
В примерах использовали следующие материалы от указанных поставщиков: эриторан (от Eisai Co., Ltd.); холестерин (холест., от Wako Pure Chemical (Wako)); 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC, от Nippon Pure Chemical); 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000] (DSPE-PEG2000, от Genzyme); бутилированный гидроксианизол (BHA, от Wako); хлороформ (от Wako); метанол (от Wako); сахароза (от Wako); безводный NaH2PO4 (от Wako); 1 н. HCl (от Wako); 1 н. NaOH (от KANTO Chemical) и вода, очищенная с использованием Milli-Q Gradient A10 (Merck Millipore).
[0048] (Аппарат)
В примерах использовали следующее оборудование от указанных поставщиков: Весы: METTLER AT250 и PG503; pH-метр: HORIBA pH/ION METER D-53; ротационный испаритель: EYELA N-1000; водяная баня с цифровым управлением: EYELA SB-1000; вакуумный насос: SATO VACUUM MACHINERY Oil Rotary Vacuum Pump SW-100.
[0049] Пример 1
Получение состава, содержащего компоненты, перечисленные в таблице 1
Таблица 1
*: мг эриторана в виде тетранатриевой соли
[0050] В примере 1 использовали следующие реагенты.
(1) 0,1 н. NaOH
Один мл 1 н. NaOH вносили в мерную колбу объемом 10 мл и затем доводили до объема очищенной водой.
(2) 0,1 н. HCl
Один мл 1 н. HCl вносили в мерную колбу объемом 10 мл и затем доводили до объема очищенной водой.
(3) Буферный раствор сахарозы
Двадцать г сахарозы отвешивали в стеклянный стакан объемом 200 мл и добавляли примерно 180 мл очищенной воды. Затем добавляли 24 мг NaH2PO4 и показатель pH доводили до 6,5 путем добавления 0,1 н. NaOH и 0,1 н. HCl. Раствор вносили в мерную колбу объемом 200 мл и доводили до объема очищенной водой.
(4) Смесь хлороформ/метанол
В стеклянной бутыли смешивали пятьдесят мл хлороформа и 100 мл метанола.
(5) Раствор эриторана
Сорок мг эриторана отвешивали в стеклянную бутыль и добавляли 10 мл смеси хлороформ/метанол. Обеспечивали полное растворение эриторана путем встряхивания.
(6) Раствор DSPC
Две целых пять десятых г DSPC отвешивали в стеклянную бутыль и добавляли 60 мл смеси хлороформ/метанол. Обеспечивали полное растворение DSPC путем встряхивания.
(7) Раствор холестерина
Девяносто мг холестерина отвешивали в стеклянную бутыль и добавляли 30 мл смеси хлороформ/метанол. Обеспечивали полное растворение холестерина путем встряхивания.
(8) Раствор DSPE-PEG2000
Пятьсот мг DSPE-PEG2000 отвешивали в стеклянную бутыль и добавляли 20 мл смеси хлороформ/метанол. Обеспечивали полное растворение DSPE-PEG2000 путем встряхивания.
(9) Раствор BHA
Четыре мг ВНА отвешивали в стеклянную бутыль и добавляли 10 мл смеси хлороформ/метанол. Обеспечивали полное растворение BHA путем встряхивания.
[0051] (1) Получение тонкой пленки
Для получения состава, указанного в таблице 1, в круглодонной колбе объемом 50 мл смешивали 1,75 мл раствора эриторана, 3,37 мл раствора DSPC, 1,55 мл раствора холестерина, 0,56 мл раствора DSPE-PEG2000 и 60 мкл раствора BHA. Убедившись, что все компоненты полностью растворились, растворитель удаляли посредством ротационного испарителя с получением из компонентов тонкой пленки. Круглодонную колбу помещали в вакуумную камеру на ночь для удаления остаточного растворителя.
[0052] (2) Получение жидкой дисперсии
Буферный раствор сахарозы нагревали до 70°C на водяной бане и 5 мл нагретого буферного раствора сахарозы вносили в круглодонную колбу, содержащую тонкую пленку. Смесь подвергали ультразвуковой обработке в ультразвуковой ванне до полного диспергирования тонкой пленки.
[0053] (3) Получение состава
Экструдер монтировали с размещением друг над другом PC-фильтров, имеющих размер пор 0,1 мкм, 0,2 мкм, 0,4 мкм, 0,8 мкм, и устанавливали темперутуру 70°C в водяной бане с циркуляцией. Экструдер присоединяли к баллону N2 с регулятором и предохранительным клапаном. Собранному экструдеру давали нагреться, а затем в него загружали жидкую дисперсию. Экструдер закрывали и жидкой дисперсии давали возможность уравновеситься до 70°C. Трубопровод баллона N2 открывали и давление N2 медленно повышали до тех пор, пока не наблюдался устойчивый поток жидкой дисперсии, выходящей из выпускного шланга. Стадии фильтрации повторяли еще 4 раза. Фильтрат после 5-й фильтрации собирали в чистую пробирку и показатель pH фильтрата доводили до 6,5 с использованием 0,1 н. NaOH и/или 0,1 н. HCl после охлаждения до комнатной температуры. Фильтрат стерилизовали с использованием шприцевого фильтра (фильтрующий материал Whatman PES с полипропиленовым корпусом и размером пор 0,2 мкм) и хранили в холодильнике, не допуская замораживания, до дальнейшего использования в экспериментах. Посредством анализа динамического рассеяния света подтвердили, что полученный таким образом состав содержит липосомы.
[0054] Пример 2
Получение состава, содержащего компоненты, перечисленные в таблице 2
Таблица 2
*: мг эриторана в виде тетранатриевой соли
[0055] В примере 2 использовали следующие реагенты.
(1) 0,1 н. NaOH
Один мл 1 н. NaOH вносили в мерную колбу объемом 10 мл и затем доводили до объема очищенной водой.
(2) 0,1 н. HCl
Один мл 1 н. HCl вносили в мерную колбу объемом 10 мл и затем доводили до объема очищенной водой.
(3) Буферный раствор сахарозы
Двадцать г сахарозы отвешивали в стеклянный стакан объемом 200 мл и добавляли примерно 180 мл очищенной воды. Затем добавляли 24 мг NaH2PO4 и показатель pH доводили до 6,5 путем добавления 0,1 н. NaOH и 0,1 н. HCl. Раствор вносили в мерную колбу объемом 200 мл и доводили до объема очищенной водой.
(4) Смесь хлороформ/метанол
В стеклянной бутыли смешивали пятьдесят мл хлороформа и 100 мл метанола.
(5) Раствор BHA
Шесть мг ВНА отвешивали в стеклянную бутыль и добавляли 10 мл смеси хлороформ/метанол. Обеспечивали полное растворение BHA путем встряхивания.
[0056] (1) Получение тонкой пленки
Для получения состава, указанного в таблице 2, в круглодонную колбу объемом 50 мл отвешивали 6,7 мг эриторана, 368,3 мг DSPC, 11,9 мг холестерина и 34,9 мг DSPE-PEG2000. Добавляли восемь мл хлороформа и 3 мл метанола и колбу осторожно встряхивали. Убедившись, что все компоненты полностью растворились, добавляли 40 мкл раствора BHA. Растворитель удаляли посредством ротационного испарителя с получением из компонентов тонкой пленки. Круглодонную колбу помещали в вакуумную камеру на ночь для удаления остаточного растворителя.
[0057] (2) Получение жидкой дисперсии
Буферный раствор сахарозы нагревали до 70°C на водяной бане и 5 мл нагретого буферного раствора сахарозы вносили в круглодонную колбу, содержащую тонкую пленку. Смесь подвергали ультразвуковой обработке в ультразвуковой ванне до полного диспергирования тонкой пленки.
[0058] (3) Получение состава
Экструдер монтировали с размещением друг над другом PC-фильтров, имеющих размер пор 0,1 мкм, 0,2 мкм, 0,4 мкм, 0,8 мкм, и устанавливали темперутуру 70°C в водяной бане с циркуляцией. Экструдер присоединяли к баллону N2 с регулятором и предохранительным клапаном. Собранному экструдеру давали нагреться, а затем в него загружали жидкую дисперсию. Экструдер закрывали и жидкой дисперсии давали возможность уравновеситься до 70°C. Трубопровод баллона N2 открывали и давление N2 медленно повышали до тех пор, пока не наблюдался устойчивый поток жидкой дисперсии, выходящей из выпускного шланга. Стадии фильтрации повторяли еще 4 раза. Фильтрат после 5-й фильтрации собирали в чистую пробирку и после охлаждения до комнатной температуры показатель pH фильтрата доводили до 6,5 с использованием 0,1 н. NaOH и/или 0,1 н. HCl. Фильтрат стерилизовали с использованием шприцевого фильтра (фильтрующий материал Whatman PES с полипропиленовым корпусом и размером пор 0,2 мкм) и хранили в холодильнике, не допуская замораживания, до дальнейшего использования в экспериментах. Посредством анализа динамического рассеяния света подтвердили, что полученный таким образом состав содержит липосомы.
[0059] Пример 3
Получение состава, содержащего компоненты, перечисленные в таблице 3
Таблица 3
*: мг эриторана в виде тетранатриевой соли
[0060] В примере 3 использовали следующие реагенты.
(1) 0,1 н. NaOH
Один мл 1 н. NaOH вносили в мерную колбу объемом 10 мл и затем доводили до объема очищенной водой.
(2) 0,1 н. HCl
Один мл 1 н. HCl вносили в мерную колбу объемом 10 мл и затем доводили до объема очищенной водой.
(3) Буферный раствор сахарозы
Двадцать г сахарозы отвешивали в стеклянный стакан объемом 200 мл и добавляли примерно 180 мл очищенной воды. Затем добавляли 24 мг NaH2PO4 и показатель pH доводили до 6,5 путем добавления 0,1 н. NaOH и 0,1 н. HCl. Раствор вносили в мерную колбу объемом 200 мл и доводили до объема очищенной водой.
(4) Смесь хлороформ/метанол
В стеклянной бутыли смешивали пятьдесят мл хлороформа и 100 мл метанола.
(5) Раствор эриторана
Шестьдесят мг эриторана отвешивали в стеклянную бутыль и добавляли 10 мл смеси хлороформ/метанол. Обеспечивали полное растворение эриторана путем встряхивания.
(6) Раствор DSPC
Одну целую две десятые г DSPC отвешивали в стеклянную бутыль и добавляли 50 мл смеси хлороформ/метанол. Обеспечивали полное растворение DSPC путем встряхивания.
(7) Раствор холестерина
Пятьдесят мг холестерина отвешивали в стеклянную бутыль и добавляли 25 мл смеси хлороформ/метанол. Обеспечивали полное растворение холестерина путем встряхивания.
(8) Раствор DSPE-PEG2000
Четыреста мг DSPE-PEG2000 отвешивали в стеклянную бутыль и добавляли 20 мл смеси хлороформ/метанол. Обеспечивали полное растворение DSPE-PEG2000 путем встряхивания.
(9) Раствор BHA
Четыре мг ВНА отвешивали в стеклянную бутыль и добавляли 10 мл смеси хлороформ/метанол. Обеспечивали полное растворение BHA путем встряхивания.
[0061] (1) Получение тонкой пленки
Для получения состава, указанного в таблице 3, в круглодонной колбе объемом 50 мл смешивали 1,17 мл раствора эриторана, 12,13 мл раствора DSPC, 5,8 мл раствора холестерина, 0,62 мл раствора DSPE-PEG2000 и 400 мкл раствора BHA. Убедившись, что все компоненты полностью растворились, растворитель удаляли посредством ротационного испарителя с получением из компонентов тонкой пленки. Круглодонную колбу помещали в вакуумную камеру на ночь для удаления остаточного растворителя.
[0062] (2) Получение жидкой дисперсии
Буферный раствор сахарозы нагревали до 70°C на водяной бане и 5 мл нагретого буферного раствора сахарозы вносили в круглодонную колбу, содержащую тонкую пленку. Смесь подвергали ультразвуковой обработке в ультразвуковой ванне до полного диспергирования тонкой пленки.
[0063] (3) Получение состава
Экструдер монтировали с размещением друг над другом PC-фильтров, имеющих размер пор 0,1 мкм, 0,2 мкм, 0,4 мкм, 0,8 мкм, и устанавливали темперутуру 70°C в водяной бане с циркуляцией. Экструдер присоединяли к баллону N2 с регулятором и предохранительным клапаном. Собранному экструдеру давали нагреться, а затем в него загружали жидкую дисперсию. Экструдер закрывали и жидкой дисперсии давали возможность уравновеситься до 70°C. Трубопровод баллона N2 открывали и давление N2 медленно повышали до тех пор, пока не наблюдался устойчивый поток жидкой дисперсии, выходящей из выпускного шланга. Стадии фильтрации повторяли еще 4 раза. Фильтрат после 5-й фильтрации собирали в чистую пробирку и после охлаждения до комнатной температуры показатель pH фильтрата доводили до 6,5 с использованием 0,1 н. NaOH и/или 0,1 н. HCl. Фильтрат стерилизовали с использованием шприцевого фильтра (фильтрующий материал Whatman PES с полипропиленовым корпусом и размером пор 0,2 мкм) и хранили в холодильнике, не допуская замораживания, до дальнейшего использования в экспериментах. Посредством анализа динамического рассеяния света подтвердили, что полученный таким образом состав содержит липосомы.
[0064] Пример 4
Получение состава, содержащего компоненты, перечисленные в таблице 4
Таблица 4
*: мг эриторана в виде тетранатриевой соли
[0065] В примере 4 использовали следующие реагенты.
(1) 0,1 н. NaOH
Один мл 1 н. NaOH вносили в мерную колбу объемом 10 мл и затем доводили до объема очищенной водой.
(2) 0,1 н. HCl
Один мл 1 н. HCl вносили в мерную колбу объемом 10 мл и затем доводили до объема очищенной водой.
(3) Буферный раствор сахарозы
Двадцать г сахарозы отвешивали в стеклянный стакан объемом 200 мл и добавляли примерно 180 мл очищенной воды. Затем добавляли 24 мг NaH2PO4 и показатель pH доводили до 6,5 путем добавления 0,1 н. NaOH и 0,1 н. HCl. Раствор вносили в мерную колбу объемом 200 мл и доводили до объема очищенной водой.
(4) Смесь хлороформ/метанол
В стеклянной бутыли смешивали пятьдесят мл хлороформа и 100 мл метанола.
(5) Раствор эриторана
Пятьдесят мг эриторана отвешивали в стеклянную бутыль и добавляли 10 мл смеси хлороформ/метанол. Обеспечивали полное растворение эриторана путем встряхивания.
(6) Раствор DSPC
Шестьсот мг DSPC отвешивали в стеклянную бутыль и добавляли 10 мл смеси хлороформ/метанол. Обеспечивали полное растворение DSPC путем встряхивания.
(7) Раствор холестерина
Двадцать пять мг холестерина отвешивали в стеклянную бутыль и добавляли 10 мл хлороформа. Обеспечивали полное растворение холестерина путем встряхивания.
(8) Раствор DSPE-PEG2000
Восемьдесят мг DSPE-PEG2000 отвешивали в стеклянную бутыль и добавляли 10 мл смеси хлороформ/метанол. Обеспечивали полное растворение DSPE-PEG2000 путем встряхивания.
(9) Раствор BHA
Шесть мг ВНА отвешивали в стеклянную бутыль и добавляли 10 мл смеси хлороформ/метанол. Обеспечивали полное растворение BHA путем встряхивания.
[0066] (1) Получение тонкой пленки
Для получения состава, указанного в таблице 4, в круглодонной колбе объемом 50 мл смешивали 1,40 мл раствора эриторана, 2,38 мл раствора DSPC, 1,86 мл раствора холестерина, 0,70 мл раствора DSPE-PEG2000 и 40 мкл раствора BHA. Убедившись, что все компоненты полностью растворились, растворитель удаляли посредством ротационного испарителя с получением из компонентов тонкой пленки. Круглодонную колбу помещали в вакуумную камеру на ночь для удаления остаточного растворителя.
[0067] (2) Получение жидкой дисперсии
Буферный раствор сахарозы нагревали до 70°C на водяной бане и 5 мл нагретого буферного раствора сахарозы вносили в круглодонную колбу, содержащую тонкую пленку. Смесь подвергали ультразвуковой обработке в ультразвуковой ванне до полного диспергирования тонкой пленки.
[0068] (3) Получение состава
Экструдер монтировали с размещением друг над другом PC-фильтров, имеющих размер пор 0,1 мкм, 0,2 мкм, 0,4 мкм, 0,8 мкм, и устанавливали темперутуру 70°C в водяной бане с циркуляцией. Экструдер присоединяли к баллону N2 с регулятором и предохранительным клапаном. Собранному экструдеру давали нагреться, а затем в него загружали жидкую дисперсию. Экструдер закрывали и жидкой дисперсии давали возможность уравновеситься до 70°C. Трубопровод баллона N2 открывали и давление N2 медленно повышали до тех пор, пока не наблюдался устойчивый поток жидкой дисперсии, выходящей из выпускного шланга. Стадии фильтрации повторяли еще 4 раза. Фильтрат после 5-й фильтрации собирали в чистую пробирку и после охлаждения до комнатной температуры показатель pH фильтрата доводили до 6,5 с использованием 0,1 н. NaOH и/или 0,1 н. HCl. Фильтрат стерилизовали с использованием шприцевого фильтра (фильтрующий материал Whatman PES с полипропиленовым корпусом и размером пор 0,2 мкм) и хранили в холодильнике, не допуская замораживания, до дальнейшего использования в экспериментах. Посредством анализа динамического рассеяния света подтвердили, что полученный таким образом состав содержит липосомы.
[0069] Примеры 5-8
Получение составов, содержащих компоненты, перечисленные в таблицах 5 и 6.
Таблица 5
*: мг эриторана в виде тетранатриевой соли
Таблица 6
*: мг эриторана в виде тетранатриевой соли
[0070] В примерах 5-8 использовали следующие реагенты.
(1) 0,1 н. NaOH
Один мл 1 н. NaOH вносили в мерную колбу объемом 10 мл и затем доводили до объема очищенной водой.
(2) 0,1 н. HCl
Один мл 1 н. HCl вносили в мерную колбу объемом 10 мл и затем доводили до объема очищенной водой.
(3) Буферный раствор сахарозы
Двадцать г сахарозы отвешивали в стеклянный стакан объемом 200 мл и добавляли примерно 180 мл очищенной воды. Затем добавляли 24 мг NaH2PO4 и показатель pH доводили до 6,5 путем добавления 0,1 н. NaOH и 0,1 н. HCl. Раствор вносили в мерную колбу объемом 200 мл и доводили до объема очищенной водой.
(4) Смесь хлороформ/метанол
В стеклянной бутыли смешивали пятьдесят мл хлороформа и 100 мл метанола.
(5) Раствор эриторана
Пять мг эриторана отвешивали в стеклянную бутыль и добавляли 5 мл смеси хлороформ/метанол. Обеспечивали полное растворение эриторана путем встряхивания.
(6) Раствор DSPC
Семьсот пятьдесят мг DSPC отвешивали в стеклянную бутыль и добавляли 50 мл смеси хлороформ/метанол. Обеспечивали полное растворение DSPC путем встряхивания.
(7) Раствор холестерина
Сорок пять мг холестерина отвешивали в стеклянную бутыль и добавляли 10 мл хлороформа. Обеспечивали полное растворение холестерина путем встряхивания.
(8) Раствор DSPE-PEG2000
Шестьдесят пять мг DSPE-PEG2000 отвешивали в стеклянную бутыль и добавляли 5 мл смеси хлороформ/метанол. Обеспечивали полное растворение DSPE-PEG2000 путем встряхивания.
(9) Раствор BHA
Шесть мг ВНА отвешивали в стеклянную бутыль и добавляли 10 мл смеси хлороформ/метанол. Обеспечивали полное растворение BHA путем встряхивания.
[0071] (1) Получение тонкой пленки
Для получения состава из примера 5, указанного в таблице 5, в круглодонной колбе объемом 50 мл смешивали 1,39 мл раствора эриторана, 10,0 мл раствора DSPC, 1,07 мл раствора DSPE-PEG2000 и 40 мкл раствора BHA.
Для получения состава из примера 6, указанного в таблице 5, в круглодонной колбе объемом 50 мл смешивали 1,39 мл раствора эриторана, 4,98 мл раствора холестерина, 6,84 мл раствора DSPC, 1,07 мл раствора DSPE-PEG2000 и 40 мкл раствора BHA.
Для получения состава из примера 7, указанного в таблице 6, в круглодонной колбе объемом 50 мл смешивали 0,35 мл раствора эриторана, 1,25 мл раствора холестерина, 12,18 мл раствора DSPC, 0,54 мл раствора DSPE-PEG2000 и 50 мкл раствора BHA.
Для получения состава из примера 8, указанного в таблице 6, в круглодонной колбе объемом 50 мл смешивали 0,35 мл раствора эриторана, 1,25 мл раствора холестерина, 11,98 мл раствора DSPC, 1,34 мл раствора DSPE-PEG2000 и 50 мкл раствора BHA.
Убедившись, что все компоненты полностью растворились, в каждой колбе растворитель удаляли посредством ротационного испарителя с получением из компонентов тонкой пленки. Круглодонные колбы помещали в вакуумную камеру на ночь для удаления остаточного растворителя.
[0072] (2) Получение жидкой дисперсии
Буферный раствор сахарозы нагревали до 70°C на водяной бане и 5 мл нагретого буферного раствора сахарозы вносили в каждую круглодонную колбу, содержащую тонкую пленку. Смесь подвергали ультразвуковой обработке в ультразвуковой ванне до полного диспергирования тонкой пленки.
[0073] (3) Получение состава
Экструдер монтировали с размещением друг над другом PC-фильтров, имеющих размер пор 0,1 мкм, 0,2 мкм, 0,4 мкм, 0,8 мкм, и устанавливали темперутуру 70°C в водяной бане с циркуляцией. Экструдер присоединяли к баллону N2 с регулятором и предохранительным клапаном. Собранному экструдеру давали нагреться, а затем в него загружали жидкую дисперсию. Экструдер закрывали и жидкой дисперсии давали возможность уравновеситься до 70°C. Трубопровод баллона N2 открывали и давление N2 медленно повышали до тех пор, пока не наблюдался устойчивый поток жидкой дисперсии, выходящей из выпускного шланга. Стадии фильтрации повторяли еще 4 раза. Фильтрат после 5-й фильтрации собирали в чистую пробирку и после охлаждения до комнатной температуры показатель pH фильтрата доводили до 6,5 с использованием 0,1 н. NaOH и/или 0,1 н. HCl. Фильтрат стерилизовали с использованием шприцевого фильтра (фильтрующий материал Whatman PES с полипропиленовым корпусом и размером пор 0,2 мкм) и хранили в холодильнике, не допуская замораживания, до дальнейшего использования в экспериментах. Посредством анализа динамического рассеяния света подтвердили, что полученные таким образом составы содержат липосомы.
[0074] Примеры 9-26
Получение составов, содержащих компоненты, перечисленные в таблице 7.
Таблица 7
[0075] Составы из примеров 9-26 получали согласно практически по той же методике, которую использовали и в примере 1. Концентрация эриторана в составах из таблицы 7 составляла примерно 1 мМ. Общая концентрация липидов в составах без эриторана (примеры 24-26) составляла примерно 100 мМ.
[0076] <Анализ методом динамического рассеяния света>
Анализ составов из примеров 1-26 проводили с использованием метода динамического рассеяния света (DLS) для определения среднего размера частиц (Z-ave) и коэффициента полидисперсности (PdI). Для анализа DLS использовали следующие настройки.
[0077] (Экспериментальная процедура)
Система: Zetasizer Nano-ZS (Malvern Panalytical)
Условия измерений:
Коэффициент отражения образца: 1,45
Скорость адсорбции образца; 0,01
Дисперсионная среда: вода Milli-Q
Коэффициент отражения дисперсионной среды: 1,330
Вязкость дисперсионной среды (сП): 1,0031
Температура измерения: 20°C
Время до инкубации: 5 мин
Время измерения 60 сек, 3 раза
Точка измерения (расстояние): 4,65 мм
Пробоподготовка:
пятьдесят микролитров образца в 5 мл воды Milli-Q
[0078] (Результат анализа DLS)
Значения Z-ave и PdI для каждого состава сведены в таблице 8. Для составов, которые отличаются от составов из примеров 18-20, показатель Z-ave составлял 100 нм или больше, поэтому считалось, что в данных составах образовались липосомы, содержащие эриторан. Для составов, которые отличаются от составов из примеров 18-22 и 26, показатель PdI составлял 0,2 или меньше, поэтому считалось, что в данных составах распределение частиц по размерам контролируется в достаточной степени. Показатель PdI для составов, содержащих эриторан, из примеров 18-22 (т. е. более 0,2) указывает на возможную проблему с однородностью тонкодисперсного состава на основе эриторана.
Таблица 8
[0079] <Мицеллизированный эриторан и плацебо, используемые в in vivo и in vitro анализах>
Мицеллизированный эриторан и плацебо, использованные в in vivo и in vitro анализах, получали из лиофилизированного порошка во флаконе. Флакон с мицеллизированным эритораном содержит эриторан (в виде основной тетранатриевой соли 4,0 [Na]) 7,46 мг, моногидрат лактозы и бутилированный гидроксианизол. Гидроксид натрия и фосфорная кислота также содержатся в достаточном количестве во флаконе с мицеллизированным эритораном. Флакон с плацебо содержит моногидрат лактозы. Гептагидрат двухосновного фосфата натрия, моногидрат одноосновного фосфата натрия и гидроксид натрия также содержатся в достаточном количестве во флаконе с плацебо. Содержимое каждого флакона повторно восстанавливали путем добавления 3,0 мл стерильной водой для инъекций (концентрация раствора 2,33 мг/мл или 1,66 мМ). Восстановленный мицеллизированный эриторан разбавляли восстановленным раствором плацебо с получением подходящей концентрации.
[0080] <In vivo эффективность составов из примеров>
In vivo эффективность составов, полученных в примерах 1-26, оценивали посредством исследований на мышах. Использовали самок мышей C57BL/6NCrl (Charles River Laboratories) с массой тела у одной мыши, составляющей приблизительно 20 г, по 4 мыши на группу. Животным в/в вводили 9,1 мг/кг мицеллизированного эриторана или составы из примеров за 2 часа до введения и/п введения LPS из Escherichia coli O111:B4 (0,5 мкг/животное. Кат. номер 201, List Biological Laboratories, Inc.). Двум группам мышей инъецировали такой же объем сахарозного буфера и плацебо, в качестве имитационного контроля состава и контроля мицеллизированного эриторана соответственно. Животных отбирали для измерения уровней цитокинов через 2 часа после введения LPS и отбирали плазму крови (из брюшной вены под анестезией) в пробирки с ЭДТА/3K (кат. номер 499388, Greiner Bio-One GmbH). Уровень цитокина IL-6 измеряли в соответствии с протоколом для набора ELISA (Mouse IL-6 ELISA Set, кат. номер 555240; набор реагентов B, pH 9,5, кат. номер 550534, BD Biosciences) за исключением описанных ниже процедур. Связывающее антитело разбавляли в карбонатно-бикарбонатном буфере (1 капсула в 50 мл воды Milli-Q, кат. номер C3041-100CAP, Sigma-Aldrich Corporation) в качестве буфера для иммобилизации. Лунки промывали фосфатно-солевым буферным раствором (кат. номер P3563-10PAK, Sigma-Aldrich Corporation) с использованием устройства для промывания планшетов (ELx405 select, BioTek Instruments, Inc.) на каждой стадии. Для удаления остатков промывочного буфера планшет центрифугировали при 4000 об/мин в течение 1 мин перевернутым вверх дном на каждой стадии (HITACH CF16RXII; ротор: T5S32-0049). Абсорбционный спектрофотометр использовали для определения оптической плотности в каждой лунке (SpectraMax 190, Molecular Devices, LLC). Показатели оптической плотности дублированных лунок усредняли, и стандартную кривую строили путем четырехпараметрического логистического (4-PL) подбора кривой с использованием программы SoftMax Pro 6.5.1 (номер текущего варианта программы 219831, Molecular Devices, LLC). График и медианное значение с межквартильным диапазоном построили с использованием программы GraphPad Prism 7.02 (GraphPad software, Inc.). Часть результатов показана на рисунке 1, также дополнительные результаты показаны в таблице 9. Данные результаты показывают, что липосомы, содержащие эриторан, подавляют продуцирование IL-6 по сравнению с мицеллизированным эритораном.
[0081]
Таблица 9
[0082] <In vivo скрининговый анализ составов из примеров>
Скрининговый анализ для уточнения количества наилучших составов из примеров 1-26 проводили согласно вышеуказанному анализу с частичным изменением его протокола («Эффективность составов из примеров in vivo»). Животным при тех же условиях в/в инъецировали 1,1375 мг/кг составов из примеров, разведенных (8-кратно) сахарозным буфером, а также использовали контроль за 2 часа до и/п введения LPS из Escherichia coli O111:B4. Животных отбирали для измерения уровней цитокинов через 2 часа после введения LPS и отбирали плазму крови (из брюшной вены под анестезией) в пробирки с ЭДТА/3K. Цитокин IL-6 измеряли посредством той же процедуры, как и в вышеупомянутом анализе («In vivo эффективность составов из примеров»). Часть результатов показана на фигурах 2-1, 2-2 и 2-3.
[0083] На фигуре 2-1 показано, что разведенное соединение из примера 1 демонстрировало 78,8% подавление продуцирования IL-6 по сравнению с имитационным контролем (медианные значения концентрации IL-6 в имитационной группе и в группе разведенного соединения из примера 1 составили 2851,8 пг/мл и 606,0 пг/мл соответственно; линией указано медианное значение с межквартильным диапазоном). Активность подавления продуцирования IL-6 не выявляли у разбавленного соединения из примера 11 и разбавленного соединения из примера 13 (средние значения концентрации IL-6 в группах разбавленного соединения из примера 11 и разбавленного соединения из примера 13 составили 3203,0 пг/мл и 4104,6 пг/мл соответственно).
[0084] На фигурах 2-2 и 2-3 показано, что подавление данного состояния также наблюдали в случае с разбавленным соединением из примера 2, разбавленным соединением из примера 3, разбавленным соединением из примера 4 и разбавленным соединением из примера 5 (средние значения концентрации IL-6 в группах имитационного контроля, разбавленного соединения из примера 2, разбавленного соединения из примера 3 и разбавленного соединения из примера 4 составили 2605,8 пг/мл, 390,9 пг/мл, 357,8 пг/мл, 626,3 пг/мл соответственно). Разбавленное соединение из примера 5, модифицированный холестерином состав из примера 1 также показали высокую активность подавления продуцирования IL-6 (96,7%, медианные значения концентрации IL-6 в имитационной группе и в группе соединения из примера 5 составили 2812,1 пг/мл и 92,1 пг/мл соответственно).
[0085] Краткое описание результатов для всех разбавленных составов приведено в таблице 10.
Таблица 10
(% контроля)
[0086] <Анализ инактивации HDL человека>
Влияние липопротеинов высокой плотности (HDL) на составы из примеров оценивали согласно следующему протоколу. Составы разбавляли до 50 пМ физиологическим раствором (кат. номер 3311401A3111, Otsuka Pharmaceutical Co., Ltd.) и смешивали с 1 мг/мл человеческого HDL (кат. номер LP3-5MG, Merck KGaA). Смешанные составы инкубировали при 37°C в течение 18 часов. Цельную кровь здорового человека отбирали в пробирки для исследований ЭДТА/2K (VENOJECT (зарегистрированный товарный знак), кат. номер VP-H100K, TERUMO CORPORATION). Смешанные составы смешивали с 4-кратными объемами цельной крови, содержащей 10 нг/мл LPS в конечной концентрации. После инкубации при 37°C в течение 3 часов супернатант получали центрифугированием (1000 x g в течение 5 мин при 4°C). TNF-α измеряли посредством ELISA (кат. номер STA00C, R&D Systems). Анализ ELISA проводили в соответствии с прилагаемой инструкцией по использованию. Лунки промывали посредством устройства для промывания планшетов (ELx405 select, BioTek Instruments, Inc.) на каждой стадии. Для удаления остатков промывочного буфера планшет центрифугировали при 4000 об/мин в течение 1 мин перевернутым вверх дном на каждой стадии (HITACH CF16RXII; ротор: T5S32-0049). Абсорбционный спектрофотометр использовали для определения оптической плотности в каждой лунке (SpectraMax 190, Molecular Devices, LLC). Показатели оптической плотности дублированных лунок усредняли, и стандартную кривую строили путем четырехпараметрического логистического (4-PL) подбора кривой с использованием программы SoftMax Pro 6.5.1 (номер текущего варианта программы 219831, Molecular Devices, LLC). График и медианное значение с межквартильным диапазоном построили с использованием программы GraphPad Prism 7.02 (GraphPad software, Inc.). Результаты показаны в таблице 11 и на фигуре 3. Данные результаты показывают, что составы из примеров 1-4 сохраняют свою активность даже в присутствии человеческого HDL.
Таблица 11
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕГИЛИРОВАННЫЕ ЛИПОСОМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2796539C2 |
| ЛИПОСОМАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2007 |
|
RU2494729C2 |
| НОВЫЕ КОМПОЗИЦИИ ЛИПОСОМ | 2006 |
|
RU2454229C2 |
| ЛИПОСОМЫ ИРИНОТЕКАНА ИЛИ ЕГО СОЛЕЙ, СПОСОБ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2526114C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2015 |
|
RU2757110C2 |
| ЛИПОСОМНЫЕ КОМПОЗИЦИИ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2005 |
|
RU2574926C2 |
| СРЕДСТВО, УЛУЧШАЮЩЕЕ ПРОТИВООПУХОЛЕВЫЙ ЭФФЕКТ, СОДЕРЖАЩЕЕ ЛИПОСОМАЛЬНОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ОКСАЛИПЛАТИН, И ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ЛИПОСОМАЛЬНОЕ СРЕДСТВО | 2009 |
|
RU2492863C2 |
| ЛИПОСОМАЛЬНЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ СЛАБОКИСЛОТНЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2778886C2 |
| КОМБИНАЦИОННЫЕ ЛИПОСОМАЛЬНЫЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2640934C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ КОНТРОЛИРОВАННОГО ВЫСВОБОЖДЕНИЯ ТРЕПРОСТИНИЛА | 2019 |
|
RU2796305C2 |
Группа изобретений относится к области медицины и фармацевтики. Первое изобретение группы – состав для подавления связывания липополисахаридов с TLR4, содержащий липосомы, где липосомы содержат от 0,7 до 3,0 мол. % эриторана или его фармацевтически приемлемой соли, от 0,5 до 3,0 мол. % пегилированного фосфолипида и от 0 до 10 мол. % стерола в пересчете на липосому, где пегилированный фосфолипид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000]. Второе изобретение группы – способ получения указанного состава, включающий получение раствора, содержащего от 0,7 до 3,0 мол. % эриторана или его фармацевтически приемлемой соли, от 0,5 до 3,0 мол. % пегилированного фосфолипида и растворитель в пересчете на все подлежащие использованию компоненты липосом; выпаривание растворителя из раствора с образованием тонкой пленки; диспергирование тонкой пленки в буферном растворе с образованием жидкой дисперсии и экструдирование жидкой дисперсии через фильтр с образованием состава. Группа изобретений обеспечивает составы с увеличенной активностью в отношении подавления продуцирования IL-6 и/или TNF-α. 2 н. и 18 з.п. ф-лы, 5 ил., 11 табл., 26 пр.
1. Состав для подавления связывания липополисахаридов с TLR4, содержащий липосомы, где липосомы содержат от 0,7 до 3,0 мол. % эриторана или его фармацевтически приемлемой соли, от 0,5 до 3,0 мол. % пегилированного фосфолипида в пересчете на липосому и от 0 до 10 мол. % стерола в пересчете на липосому, где пегилированный фосфолипид представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)-2000].
2. Состав по п. 1, где фармацевтически приемлемая соль представляет собой тетранатриевую соль.
3. Состав по п. 1, где липосомы содержат от 1,0 до 2,5 мол. % эриторана или его фармацевтически приемлемой соли и от 1,0 до 2,5 мол. % пегилированного фосфолипида в пересчете на липосому.
4. Состав по п. 1, где липосомы содержат 1,0 мол. % эриторана или его фармацевтически приемлемой соли и 1,0 мол. % 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000] в пересчете на липосому.
5. Состав по п. 1, где липосомы содержат 1,0 мол. % эриторана или его фармацевтически приемлемой соли и 2,5 мол. % 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000] в пересчете на липосому.
6. Состав по п. 1, где липосомы содержат 2,5 мол. % эриторана или его фармацевтически приемлемой соли и 1,0 мол. % 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000] в пересчете на липосому.
7. Состав по п. 1, где липосомы содержат 2,5 мол. % эриторана или его фармацевтически приемлемой соли и 2,5 мол. % 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоля)-2000] в пересчете на липосому.
8. Состав по п. 1, где липосомы дополнительно содержат фосфатидилхолин.
9. Состав по п. 8, где фосфатидилхолин представляет собой дистеароилфосфатидилхолин.
10. Состав по п. 1, где липосомы дополнительно содержат антиоксидант.
11. Состав по п. 10, где антиоксидант представляет собой бутилированный гидроксианизол.
12. Состав по п. 1, где стерол представляет собой холестерин.
13. Состав по п. 1, где липосомы не содержат стерола.
14. Состав по п. 1, где липосомы имеют средний размер частиц от 100 до 120 нм, измеренный методом динамического рассеяния света (DLS).
15. Состав по п. 1, где липосомы характеризуются коэффициентом полидисперсности, составляющим 0,20 или меньше.
16. Способ получения состава по пп. 1-15, содержащего липосомы, включающий
получение раствора, содержащего от 0,7 до 3,0 мол. % эриторана или его фармацевтически приемлемой соли, от 0,5 до 3,0 мол. % пегилированного фосфолипида и растворитель в пересчете на все подлежащие использованию компоненты липосом;
выпаривание растворителя из раствора с образованием тонкой пленки;
диспергирование тонкой пленки в буферном растворе с образованием жидкой дисперсии и
экструдирование жидкой дисперсии через фильтр с образованием состава.
17. Способ по п. 16, где раствор дополнительно содержит фосфатидилхолин и антиоксидант.
18. Способ по п. 16, где растворитель представляет собой комбинацию хлороформа и метанола.
19. Способ по п. 16, где стадию диспергирования осуществляют с помощью обработки ультразвуком.
20. Способ по п. 16, где способ дополнительно включает регулирование pH состава, образованного на стадии экструдирования, до 6,2-6,8.
| US 2013156845 A1, 20.06.2013 | |||
| OPAL S.M | |||
| et al | |||
| Effect of Eritoran, an Antagonist of MD2-TLR4, on Mortality in Patients With Severe Sepsis: The ACCESS Randomized Trial // JAMA | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Переставная шейка для вала | 1921 |
|
SU309A1 |
| Трепальный станок для льна | 1924 |
|
SU1154A1 |
| US 5013556 A, 07.05.1991 | |||
| ПЕРЦЕВ И.М | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Т | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - Харьков: УкрФА | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Телефонная трансляция | 1922 |
|
SU464A1 |
Авторы
Даты
2022-08-08—Публикация
2019-12-13—Подача