Изобретение относится к медицине, в частности к фармацевтической композиции для доставки фармацевтического агента к очагу заболевания, представляющую собой инъецируемый композитный материал, содержащий антибиотик. Изобретение может быть использовано для регенерации воспалительных заболеваний костной ткани, например, для лечения остеомиелита, в виде гидрогеля, вводимого с помощью инъекций в пораженные участки костного материала человека.
Инъецируемый композитный материал в виде гидрогеля может быть введен с помощью инъекций в пораженные участки костного материала человека. Таким образом, может быть обеспечена доставка требуемого объема антибиотика без потерь в течение всего процесса лечения, что позволит избежать повторного хирургического вмешательства, снизить интоксикацию организма от антибиотической терапии, а также может являться мерой профилактики антибиотикорезистентности у больных остеомиелитом, благодаря чему заявляемый биоразлагаемый композит может найти широкое применение по сравнению с известными токсическими лекарствами, применяемыми в современной терапии.
Технической проблемой заявляемого изобретения является создание нетоксичного биоразлагаемого и биосовместимого инъецируемого композитного материала, содержащего антибиотик и обеспечивающего возможность локального безоперационного лечения мест воспалительных заболеваний костной ткани.
Технический результат - биоразлагаемый и биосовместимый инъецируемый композитный материал для регенерации воспалительных заболеваний костной ткани, содержащий антибиотик и обладающий медленным застыванием, при этом нетоксичный.
Применение заявляемого биоразлагаемого и биосовместимого инъецируемого композитного материала приведет к усовершенствованию безоперационного способа лечения остеомиелита, что в свою очередь приведет к увеличению эффективности и снижению стоимости лечения благодаря возможности точечной доставки лекарства в места поражения. Доставка лекарства в места поражения происходит за счет инъекций. Заявляемый состав композита застывает медленнее по сравнению с известными, благодаря чему возможным введение его с помощью шприца.
Эффективность лечения остеомиелита увеличивается за счет снижения токсического эффекта на организм за счет использования высокомолекулярного поливинилпиролидона, возможности пролонгированного и точечного действия лекарства в течение длительного времени.
Уровень техники:
Известны различные составы композитов для доставки лекарств при лечении заболеваний и дефектов костной ткани.
В патенте RU 2710252 используют антибиотик гентамицин, который высокоактивен в отношении аэробных грамотрицательных бактерий: Escherichia coli. Его эффективность в отношении грамположительных бактерий достаточно низкая. Предлагаемый инъецируемый композитный материал в качестве композита ориентирован на лечение остеомиелита, который вызывается грамположительными бактериями Staphylococcus aureus, поэтому в составе композита используется - ванкомицин.
Также гентамицин используется в патенте RU 2723588, который включен в слишком сложный процесс получения пленки с его содержанием. Получение пленок не только требует специального оборудования, но способ обладает более низкой воспроизводимостью характеристик и свойств продуктов в сравнении с другими методами создания композитов. В предлагаемой разработке используется традиционный процесс получения композита в виде гидрогелей - требует меньших материальных затрат, а также обладает более высокой воспроизводимостью.
Гидрогель также имеет преимущества перед формой цемента. Например, в патенте CN 104511051 описан композит для лечения в форме цемента, хотя у такой формы лучше механические характеристики, но при этом меньше возможностей для заполнения дефектов различной формы и ниже скорость извлечения лекарственного средства, чем в гидрогеле.
В патенте RU 2522977 в составе композиции находится альбумин, в заявляемом же изобретении используются преимущественно белки растительного происхождения, так как они намного доступнее, также они низкомолекулярные и с ними наблюдается высокая биоактивность.
Технический результат достигается за счет заявляемого состава биоразлагаемого и биосовместимого инъецируемого композитного материала для регенерации воспалительных заболеваний костной ткани, содержащий высокомолекулярный поливинилпиролидон, растительный или животный белок, нанокристаллический гидроксиапатит кальция, ванкомицин, дистиллированную воду при следующем соотношении компонентов на 100 г композиции:
высокомолекулярный поливинилпиролидон 0,304 г ± 0,010 г
растительный или животный белок 0,608 г ± 0,050 г
нанокристаллический гидроксиапатит кальция 1,388 г ± 0,100 г
ванкомицин 0,500 г ± 0,500 г
дистиллированная вода 97,2 мл.
В качестве растительного белка может быть использован легумин или зеин.
В качестве животного белка может быть использован овальбумин.
Нанокристаллический гидроксиапатит кальция в составе биоразлагаемого композита предварительно получают с помощью метода соосаждения, заключающегося в получении суспензии гидроксида кальция путем растворения оксида кальция в дистиллированной воде, охлажденной до 4°С, последующим добавлением ортофосфорной кислоты и 0,5±0,1 мл концентрированного раствора аммиака для достижения pH 8-9 к полученной суспензии гидроксида кальция, перемешиванием с помощью магнитной мешалки в течение трех суток при температуре 70°С, затем фильтрованием полученного гидроксиапатита кальция и сушкой при температуре 120-150°С. Частицы нанокристаллического гидроксиапатита кальция должны быть определенного размера (не более 200 нм) и иметь пластинчатую или игольчатую форму микрокристаллов.
Сущность изобретения поясняется фигурой 1, а также другими иллюстрациями:
Фиг. 1 Рентгенограмма синтезированного гидроксиапатита;
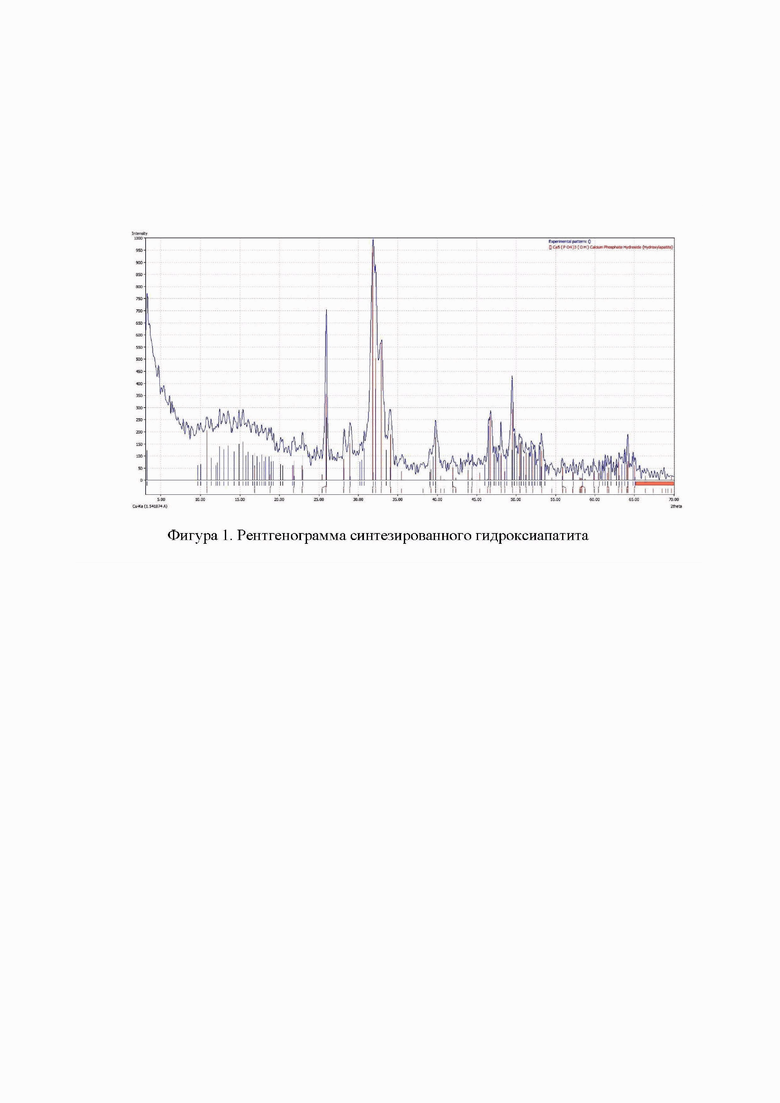
Фиг. 2 Реакция белков с нингидрином;
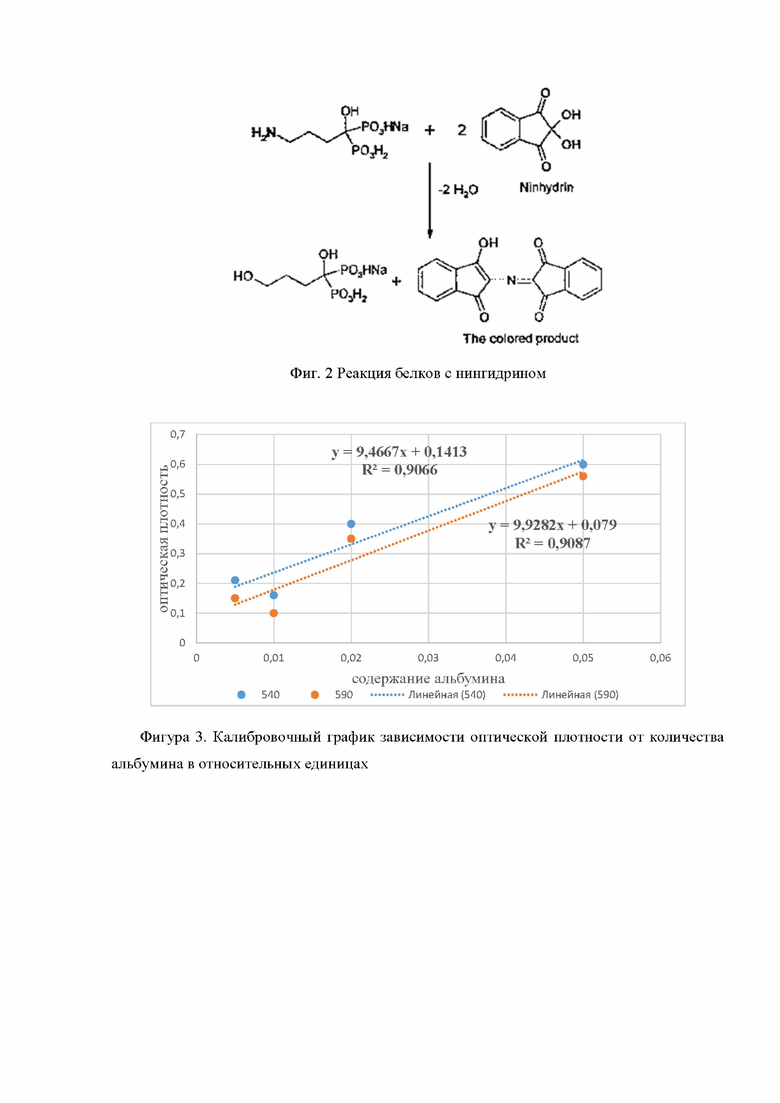
Фиг. 3 Калибровочный график зависимости оптической плотности от количества альбумина в относительных единицах;
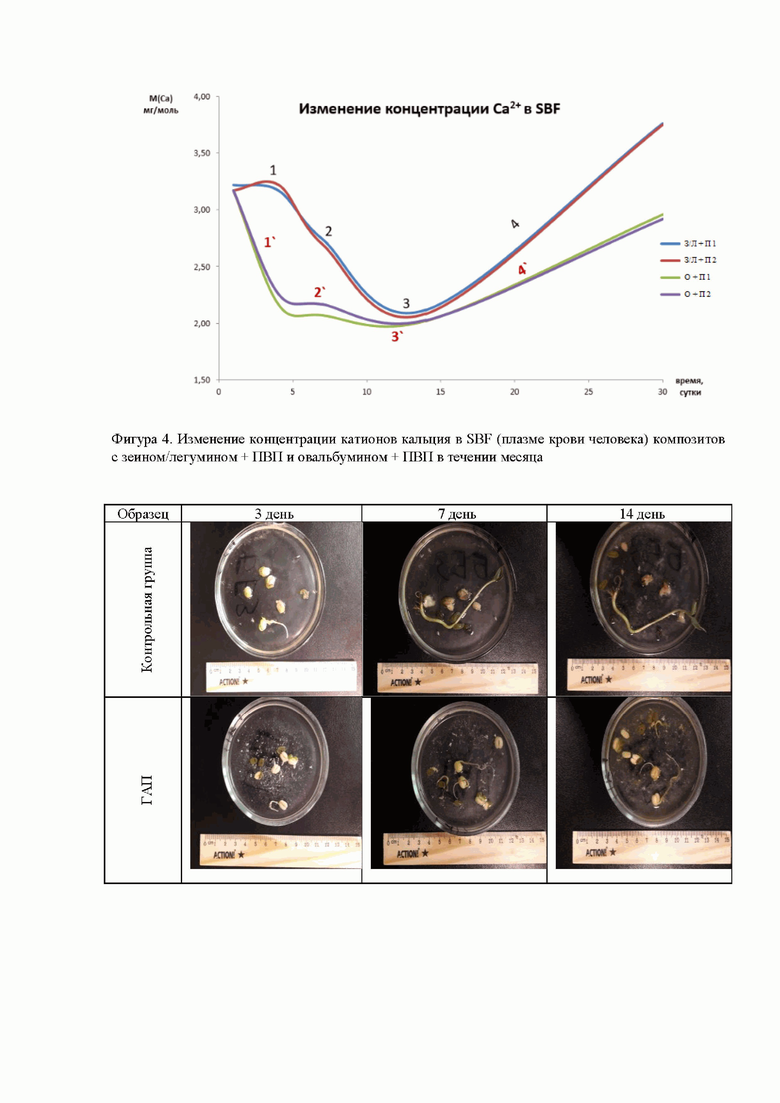
Фиг. 4 Изменение концентрации катионов кальция в SBF (плазме крови человека) композитов с зеином/легумином + PVP и овальбумином + PVP в течении месяца;
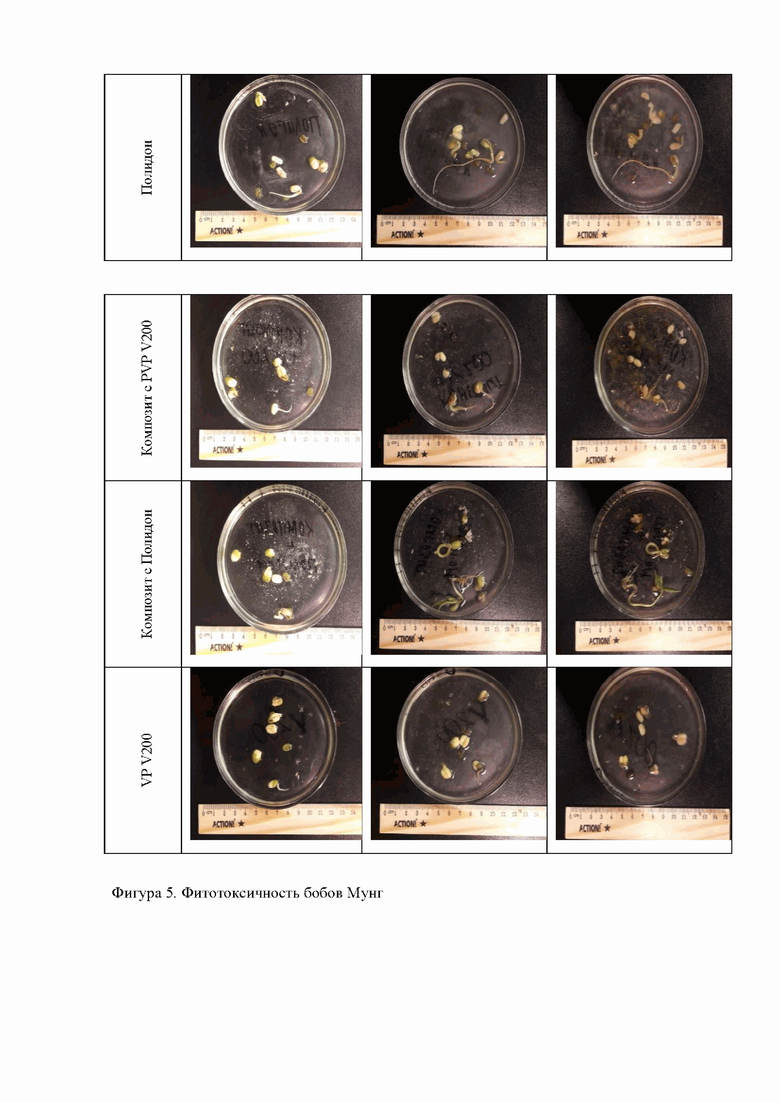
Фиг. 5 Фитотоксичность бобов Мунг;
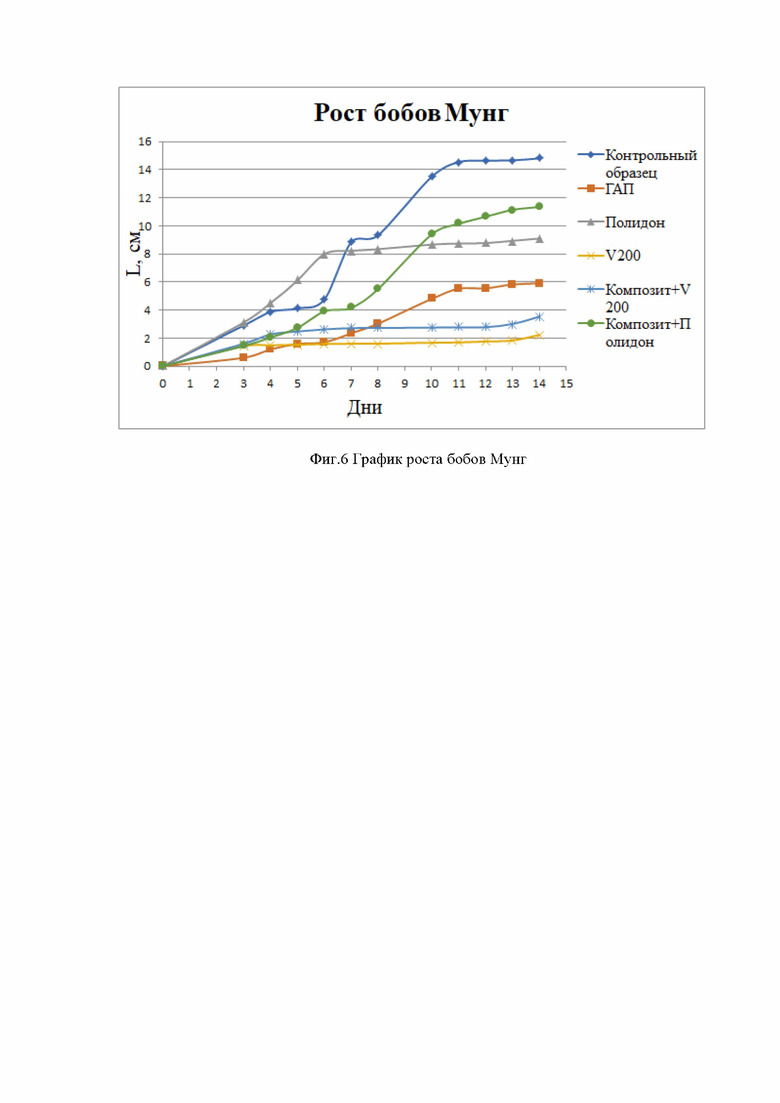
Фиг. 6 График роста бобов Мунг;
Синтез гидроксиапатита (ГАП)
Нанокристаллический гидроксиапатит кальция получают с помощью метода соосаждения:
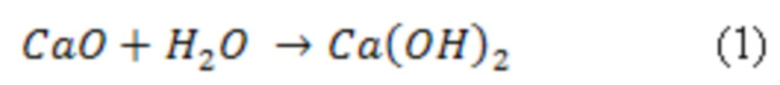
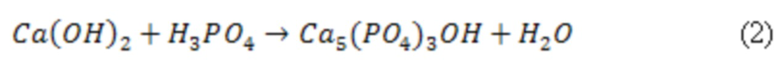
Готовят суспензию гидроксида кальция путем растворения оксида кальция в дистиллированной воде, охлажденной до 4°С. Затем добавляют ортофосфорную кислоту и 0,5±0,1 мл концентрированного раствора аммиака для достижения pH 8-9 к полученной суспензии гидроксида кальция. Полученный раствор перемешивают с помощью магнитной мешалки в течение трех суток при температуре 70°С, затем отфильтровывают полученный гидроксиапатита кальция, выпавший в осадок. Отфильтрованный осадок гидроксиапатита кальция сушат при температуре 120-150°С в сушильном шкафу. Состав полученного ГАП и его чистота оценивается по данным рентгенофазового анализа. Рентгенофазовый анализ проводят с помощью дифрактометра ARLX`TRA в медном Kα излечении. Скорость сканирования 5°/мин при фазовом анализе до 0.5°/мин. Для качественного анализа используется рентгенометрическая картотека PDF2. На фигуре 1 представлена рентгенограмма синтезированного гидроксиапатита.
Выделение и очищение белков происходит по известным методикам.
Выделение белков
Выделение овальбумина
Яичный белок отделяют от желтка. Объем белка определяют мерным цилиндром. На каждые 10 мл образца добавляют 3,6 г NaCl. Аккуратно перемешивают до осаждения овоглобулина. Для фильтрования сначала используют марлю, чтобы избежать смешивания с осадком нерастворенного NaCl. Фильтрат сохраняют для дальнейших действий. Осадок переносят на предварительно взвешенную фильтровальную бумагу и высушивают на воздухе. К фильтрату добавляют 2-3 капли 0,2 М уксусной кислоты и нагревают до кипения, пока не осядет овальбумин. Осадок фильтруют через марлю и помещают на взвешенный фильтр, высушивают на воздухе. Образец взвешивают и рассчитывают выход [1].
Выделение зеина
Зеин готовят путем периодической экстракции 70%-ным этанолом из сушеной, измельченной кукурузы при 60°С в течение 2 часов [2].
Выделение легумина
Навеску гороховой муки 50 г количественно перенесли в мерную колбу. Затем добавили 50 мл дистиллированной воды и 1М раствор NaOH, чтобы довести pH 9.5, перемешивали в течении 1 часа на магнитной мешалке. По окончании времени раствор профильтровали и к фильтрату добавили 1М HCl до выпадения осадка, и вновь повторили процедуру с фильтрацией. Осадок, осевший на фильтре, аккуратно собрали, разлили по формам и поместили в морозильник [3, 4].
Приготовление биоразлагаемого (биосовместимого) инъецируемого композитного материала
1. Используются реактивы: Поливинилпирролидон (ХЧ); растительные белки: зеин и легумин; животный белок: овальбумин, Ванкомицин (Красфарма ПАО, Россия), дистиллированная вода.
2. В лабораторный стакан объемом 100 мл добавляется 20 мл дистиллированной воды.
3. Добавляется 0,28125г ГАП и ставится на магнитную мешалку при комнатной температуре на 5 минут до полного растворения ГАП в воде.
4. Добавляется 0,125 г белка (зеин\овальбумин\легумин) и оставляется на магнитной мешалке на 10 минут до полной гомогенизации раствора.
5. Добавляется 0,0625г PVP и ставится на магнитную мешалку на 30 минут при комнатной температуре.
6. Добавляется 0.1 г Ванкомицина и вновь перемешивается данная гомогенная смесь 15 минут, увеличивая число оборотов на мешалки до максимума.
6.1 Каждые 5 минут проверяется pH системы носителя (pH должен быть в диапазоне 4,5 до 8,0).
7. После перемешивания гомогенный раствор композита аккуратно переносят в силиконовые формы и помещают в морозильную камеру при температуре - 18°С на 2-е суток до полного застывания.
Исследование продолжительности затвердевания и микроструктуры композитов состава «фосфат кальция-полимер - белок» в зависимости от соотношения указанных компонентов
Состав композита: гидроксиапатит - 60%, поливинилпирролидон (PVP) - 20%, ванкомицин - 15%. Для полного застывания полученные образцы композита помещены в холодильник на несколько часов:
На 100 г. композита.
в г на 100 г композиции
2) Рассыпался при извлечении
-
1мл
2) 4,20
-
Не слиплись
2 мл
2) 4,0
+
1мл
2) 2,70
+
2мл
2) 3,76
+
1мл
2) 2,97
+
2мл
2) 3,10
+
Исследование активности композитов и их устойчивости к разрушению в модельных средах, имитирующих плазму крови
Для исследования биоактивности в лаборатории invitro использовалась методика, основанная на изучении деградации/резорбции в модельных жидкостях: SBF (плазма крови), HBSS (Солевой раствор Хэнкса), раствор, имитирующий состав слюны человека, синовиальная жидкость. Способы приготовления модельных жидкостей описаны ниже.
Способ приготовления модельной жидкости SBF (плазма крови)
Для приготовления раствора SBF берутся следующие компоненты:
NaCl - 5.26 г; KCl - 0.373 г; CaCl2*2H2O - 0.368 г; MgCl2*6H2O - 0.305 г; Na2SO4 -0.071 г; NaHCO3 - 2.268 г; Na2HPO4*2H2O - 0.178 г; Молочная кислота - 2,41 мл; Лактат натрия - 3,1мл.
В мерную колбу на 1 л последовательно добавляется с помощью стеклянной ложечки вышеперечисленные компоненты, причем в последнюю - по каплям молочную кислоту и лактат натрия, чтобы избежать выпадения лактатов двухзарядных металлов, после этого доводили раствор до метки дистиллированной водой.
Способ приготовления модельной жидкости HBSS (солевой раствор Хэнкса)
Для приготовления раствора HBSS берутся следующие компоненты:
NaCl - 8 г; KCl - 0.4 г; CaCl2 - 0.14 г; MgSO4*7H2O - 0.2 г; NaHCO3 - 0.342 г; KH2PO4 - 0.06 г; Na2HPO4*2H2O - 0.06 г; глюкоза - 10 г.
В мерную колбу на 1 л последовательно добавляются с помощью стеклянной ложечки вышеперечисленные компоненты и доводятся до метки дистилированной водой.
Способ приготовления раствора, имитирующего состав слюны человека
Для приготовления раствора понадобятся следующие компоненты:
KCl - 0.72 г; CaCl2*2H2O - 0.220 г; NaCl - 0.6 г; K2HPO4 - 0.680 г; NaH2PO4*10H2O - 0.866 г; Na2CO3 - 1.5 г; KSCN - 0.060 г; лимонная кислота - 0,03 г.
В мерную колбу на 1 л добавляется немного дистиллированной воды, затем добавляются с помощью стеклянной ложечки все вышеперечисленные компоненты и доводятся до метки.
Способ приготовления модельной жидкости синовиальной жидкости
Для приготовления раствора понадобились следующие компоненты:
NaCl - 8 г; KCl - 0.2 г; NaH2PO4 - 1.44 г; K2HPO4 - 0.24 г; гиалуроновая кислота - 3 г.
В мерную колбу на 1 л добавляется немного дистиллированной воды, затем добавляется с помощью стеклянной ложечки все вышеперечисленные компоненты и доводятся до метки.
Исследование механических и химических свойств материалов: пористости и сорбции, оценка фитотоксичности композитов - PVP-Полидон.
Извлечение лекарственного средства проводится буферном растворе (солевом растворе Хэнкса). Образцы с лекарственным средством помещаются в пробирки, в каждой из пробирок по 50 мл раствора солей. Пробирки помещены в стаканы, и все это помещено в автоклав. Изъятие 5 миллилитров проводится по времени: через 20 минут, 50 минут, 80 минут и 120 минут. Далее к каждой пробе добавлялось по 20 миллилитров раствора солей.
Для исследования биоактивности в лаборатории invitro используется методика, основанная на изучении деградации/резорбции в модельных жидкостях: SBF, HBSS, раствор, имитирующего состав слюны человека, синовиальная жидкость.
HBSS (Солевой раствор Хэнкса)
Для приготовления раствора HBSS берутся следующие компоненты:
NaCl-8 г; KCl - 0.4 г; CaCl2 - 0.14 г; MgSO4*7H2O - 0.2 г; NaHCO3 -0.342 г; KH2PO4 - 0.06 г; Na2HPO4*2H2O - 0.06 г; глюкоза - 10 г
В мерную колбу на 1л последовательно добавляются с помощью стеклянной ложечки вышеперечисленные компоненты и доводятся до метки дистиллированной водой. Для проявления окраски к раствору добавляется спиртовой раствор нингидрина и нагревается. При этом протекает реакция, проиллюстрированная на фиг 2.
Такую же реакцию дают первичные амины, иминокислоты и аммиак, без выделения СО, аминокислоты пролин и гидроксипролин тоже взаимодействуют с нингидрином, однако, образующийся комплекс имеет желтую окраску. Фиолетовый комплекс обнаруживают на длине 550 нм, а желтый-на 440 нм. Нингидриновая реакция обладает высокой чувствительностью, позволяя обнаруживать микрограммы аминокислот в хроматограммах, а также колончатых фракциях.
Реактивы:
1. 0,5 М ацетатный буфер, рН - 5,5.
2. Нингидриновый реактив: растворить 2 г нингидрина в 30 мл ацетона и добавить 20 мл 0,5 М ацетатного буфера. Готовить перед каждым опытом. Хранить в бутыли из коричневого стекла.
3. Маточный раствор аминокислот: 1 мг/мл в дистиллированной воде.
Порядок выполнения:
1. Отобрать пипеткой 5 мл маточного раствора аминокислот.
2. Довести объем дистиллированной водой.
3. Добавить 1 мл свежеприготовленного нингидринового реактива.
4. Накрыть пробирки алюминиевой фольгой и поставить их на баню с кипящей водой на 10 мин.
5. Охладить до комнатной температуры в емкости с холодной водой и добавить в каждую пробирку по 1 мл 50%-го этанола.
6. Оставить на 5 мин, а после этого снять показания оптической плотности на 550 нм.
Измерения оптической плотности проводилось на Фотоколориметре КФК-2, использовались различные длины волн 540 нм и 590 нм, данные заносились в таблицу и на их основании строился калибровочный график зависимости оптической плотности от количества альбумина в относительных единицах (фигура 3).
На основании калибровочного графика возможно посчитать концентрацию белка в растворе. Расчет производится, опираясь на Закон Бугера - Ламберта - Бера. Для этого используются полученные уравнения:
Сх=((D-0,1413)/9,4667)*2 - уравнение для длины волны 540 нм
Сх=((D-0,079)/9,9282)*2 - уравнение для длины волны 590 нм
З/Л + П1 - Зеин\Легумин + PVP
О + П - Овальбумин PVP
Для того, чтобы оценить поведение образца в более длительной перспективе, проводилось исследование 2-х образцов (с животным и растительным белком) в течении месяца в плазме, имитирующую кровь (SBF). Общим представленных графиков на фиг. 4 является то, что после 12 дней достигается максимальная кристаллизация (точки 3 и 3`), дальше наблюдается резорбция (участки 4 и 4`). До этого момента животный и растительный белок ведут себя несколько отлично, в случае животного белка (овальбумина). Кристаллизация начинается практически сразу, при этом в точке 1` наступает первичная резорбция, которая затем опять сменяется кристаллизацией (2`), поэтому участок 4`можно назвать повторной резорбцией. Растительный белок первоначально не проявляет никакой активности, либо можно говорить о незначительной резорбции до точки 1. В точке 1 начинается кристаллизация с небольшими отклонениями в точке 2, и собственно резорбция начинается только после точки 3.
Исследование механических и химических свойств материалов: пористости и сорбции, оценка фитотоксичности композитов.
Методы фитотоксичности
Фитотоксичность - способность химических веществ, органических и неорганических, подавлять рост и развитие растений [5].
Бобы Мунг были помещены в стакан с обычной водой, T=19°С, даются сутки для того, чтобы бобы раскрылись и начали прорастать. Раскрытые бобы помещаются в чашки Петри с заранее подготовленными веществами, а именно: контрольный образец без реактивов и композитов, гидроксиапатит, PVP-V200, PVP-Полидон, Композит с PVP-V200 и Композит с PVP-Полидон. Так же был отмечен уровень воды в чашках петри. Каждый день делалось фото с каждым из образцов и линейкой. Далее фото переносились на компьютер и в специальной программе ImageJ обрабатывались по инструкции. Таким образом, измерялась длина роста бобов.
Результаты исследования фитотоксичности
Как уже упоминалось ранее, оценка фитотоксичности является удобным инструментом для оценки возможности использования клеток растений в генной инженерии имплантов. На графике на фиг. 4 и на фиг. 5 представлены результаты оценки такой токсичности для двух композитов с PVP-V200, PVP-Полидон, сильно отличающихся по массе. Как видно из полученных данных, V200 оказался более фитотоксичным и практически полностью подавил рост бобов, в отличие от Полидона. Следовательно, именно Полидон можно рекомендовать для использования в системах доставки лекарств с клетками и генами растений. Различие в действии может быть связано как с разной растворимостью PVP разной массы, так и с разной организацией полимера, что требует дальнейших исследований.
По данным эксперимента, как и было ожидаемо, наилучший рост показал контрольный образец, который дал прирост и в стебель, и в корень. Среди исследуемых образцов - PVP-Полидон, у которого значительно вырос корень. Наихудшими результаты оказались у двух образцов: ГАП и PVP-V200. Очень мелкие отростки корней в гидроксиапатите даже один из корней отсоединился от ростка. Образцы, где Полидон и V200 входят в состав композитов, оказались в целом лучше, чем отдельные полимеры, но сохранили прежнюю тенденцию. Первый показал отличный результат в приросте корня и стебля, на уровне контрольного образца, а композит с PVP-V200, который дал малый корневой прирост.
На фиг. 6 показаны результаты измерения всех образцов. Особое внимание следует уделить композиту с Полидоном, который по росту как корней, так и ствола полностью обошел чистый образец, что говорит нам о целесообразности применения данного PVP для генной инженерии и переносе клеток растений в системе доставки лекарств и о нецелесообразности использования PVP-V200 для этой функции. У большинства образцов в начале наблюдался постепенный рост, но все они выходили на плато к концу эксперимента, что говорит нам о замедлении роста.
Источники используемой информации:
[1] Pereira M.M. et al. Single-step purification of ovalbumin from egg white using aqueous biphasic systems // Process Biochem. Elsevier Ltd, 2016. Vol. 51, № 6. P. 781-791;
[2] Parris N., Dickey L.C. Extraction and solubility characteristics of zein proteins from dry-milled corn // J. Agric. Food Chem. 2001. Vol. 49, № 8. P. 3757-3760;
[3] Hoang H.D. EVALUATION OF PEA PROTEIN AND MODIFIED PEA PROTEIN AS EGG REPLACERS, 2012;
[4] Boye J.I. et al. Comparison of the functional properties of pea, chickpea and lentil protein concentrates processed using ultrafiltration and isoelectric precipitation techniques // Food Research International. 2010. Vol. 43, № 2. P. 537-546;
[5] Ross S.S. Using Mung Beans as a Simple, Informative Means To Evaluate the Phytotoxicity of Engineered Nanomaterials and Introduce the Concept of Nanophytotoxicity to Undergraduate Students / Ross S.S., Owen M.J., Pedersen B.P., Liu G., Miller W.J.W. // Journal of Chemical Education - 2016. - Т. 93 - № 8 - С.1428-1433;
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения пористого биокерамического волластонита | 2020 |
|
RU2743834C1 |
| Способ получения остеопластического дисперсного биокомпозита | 2020 |
|
RU2741015C1 |
| Способ получения биорезорбируемого материала на основе магния и гидроксиапатита с защитным многокомпонентным покрытием | 2021 |
|
RU2763138C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИНЕРАЛИЗОВАННЫХ КОМПОЗИТНЫХ МИКРОСКАФФОЛДОВ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2016 |
|
RU2660558C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОСОВМЕСТИМОГО ОРГАНО-НЕОРГАНИЧЕСКОГО КОМПОЗИТА НА ОСНОВЕ ЦЕЛЛЮЛОЗЫ GLUCONACETOBACTER XYLINUS И ГИДРОКСИАПАТИТА | 2015 |
|
RU2583925C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКОВО-МИНЕРАЛЬНОЙ КОМПОЗИЦИИ, СОДЕРЖАЩЕЙ РЕКОМБИНАНТНЫЙ БЕЛОК Collbd-BMP-2 | 2012 |
|
RU2492237C1 |
| Композиционный материал, содержащий альгинат натрия и смеси фосфатов кальция, способ получения композиционного материала | 2019 |
|
RU2725882C1 |
| БИОСОВМЕСТИМЫЙ БИОРАЗЛАГАЕМЫЙ СКАФФОЛД НА ОСНОВЕ ПОЛИМЕРНОГО КОМПОЗИТА, СОДЕРЖАЩЕГО НАНОЧАСТИЦЫ ГИДРОКСИАПАТИТА | 2019 |
|
RU2756551C2 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА, ВЫЗВАННЫХ ГРАМПОЛОЖИТЕЛЬНЫМИ БАКТЕРИЯМИ | 2017 |
|
RU2661613C1 |
| ИМПЛАНТАТ ДЛЯ ЗАМЕЩЕНИЯ КОСТНОЙ ТКАНИ | 2019 |
|
RU2712701C1 |
Изобретение относится к медицине, в частности к инъецируемому композитному материалу для регенерации воспалительных заболеваний костной ткани в виде гидрогеля. Данный материал содержит высокомолекулярный поливинилпирролидон, растительный белок - легумин или зеин или животный белок - овальбумин, нанокристаллический гидроксиапатит кальция, ванкомицин и дистиллированную воду. Осуществление изобретения позволяет получить биоразлагаемый и биосовместимый инъецируемый композитный материал для регенерации воспалительных заболеваний костной ткани, например, для лечения остеомиелита, содержащий антибиотик и обладающий медленным застыванием, при этом нетоксичный. 2 табл., 6 ил.
Инъецируемый композитный материал для регенерации воспалительных заболеваний костной ткани в виде гидрогеля, содержащий высокомолекулярный поливинилпирролидон, растительный или животный белок, нанокристаллический гидроксиапатит кальция, ванкомицин, дистиллированную воду при следующем соотношении компонентов на 100 г композиции:
высокомолекулярный поливинилпирролидон 0,304 ± 0,010 г,
растительный или животный белок 0,608 ± 0,050 г,
нанокристаллический гидроксиапатит кальция 1,388 ± 0,100 г,
ванкомицин 0,500 ± 0,500 г,
дистиллированная вода 97,2 мл,
причем в качестве растительного белка используют легумин или зеин, а в качестве животного белка используют овальбумин.
| US 2017071897 A1, 16.03.2017 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СПОСОБ ЗАМЕЩЕНИЯ КОСТНЫХ ПОЛОСТЕЙ ПРИ ЛЕЧЕНИИ БОЛЬНЫХ ХРОНИЧЕСКИМ ОСТЕОМИЕЛИТОМ | 2019 |
|
RU2710252C1 |
| JOOSTEN U | |||
| et al | |||
| Effectiveness of hydroxyapatite-vancomycin bone cement in the treatment of Staphylococcus aureus induced chronic osteomyelitis | |||
| Biomaterials | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| JIN TAO et al | |||
| Injectable | |||
Авторы
Даты
2022-09-19—Публикация
2022-01-27—Подача