Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет по предварительной заявке на патент США 62/452963, поданной 31 января, 2017; предварительной заявке на патент США 62/503295, поданной 6 мая, 2017; 62/613945, поданной 5 января, 2018, и предварительной заявке на патент США 62/623233, поданной 29 января, 2018. Все вышеупомянутые заявки включены в настоящее описание посредством ссылки в полном объеме.
Область изобретения
Настоящее изобретение относится к композициям Neisseria meningitidis и к способам.
Предпосылки создания изобретения
Neisseria meningitidis представляет собой грамотрицательную инкапсулированную бактерию, которая может вызывать сепсис, менингит и летальный исход. N. meningitidis может быть классифицирована по меньшей мере на 12 серологических групп (включая серологические группы A, B, C, 29E, H, I, K, L, W-135 (в настоящее время часто обозначаемую W), X, Y и Z) исходя из химически и антигенно отличающихся полисахаридных капсул. Штаммы с пятью серологическими группами (A, B, C, Y и W135) ответственны за развитие большинства заболеваний.
Менингококковый менингит представляет собой широко распространенное заболевание, которое может приводить к смерти детей и молодых людей за несколько часов, несмотря на доступность антибиотиков. А поэтому необходимо усовершенствовать иммуногенные композиции против менингококковых серологических групп A, B, C, Y и W135 и/или X.
В настоящее время, вакцина или композиция с перекрестной протективностью, эффективная против широкого ряда MnB и изолятов менингококковых серологических групп A, C, Y и W и/или X, пока еще не являются коммерчески доступными. Так, например, опубликованные в настоящее время данные, относящиеся к лицензированной многокомпонентной композиции для защиты от заболевания, ассоциированного с серологической группой B, не показали прямого бактерицидного иммунного ответа против множества менингококковых штаммов, которые экспрессируют капсулярные полисахариды, не относящиеся к серологической группе B по меньшей мере у подростков. В соответствии с этим, необходимо получить вакцину или композицию с перекрестной протективностью, которая была бы эффективна против различных MnB и изолятов менингококковых серологических групп A, C, Y и W и/или X, и которая была бы апробирована во всем мире как вакцина против панели различных или гетерологичных менингококковых штаммов (например, подходящая для различных географических регионов).
Другим объектом настоящего изобретения является разработка усовершенствованных схем введения менингококковой вакцины, в частности, детям. Хотя заболеваемость инвазивным менингококковым заболеванием (ИМЗ) варьируется с возрастом, однако, в большинстве случаев, она является самой высокой у детей в возрасте от 1 месяца до 1 года и достигает второго пика у молодых людей. В Соединенных Штатах, за период с 1998 по 2007 год, общее число случаев менингококкового заболевания у детей в возрасте менее 2 лет составило 3,9 на 100000. У детей в возрасте от 2 до 10 лет, заболеваемость составляла 0,68 на 100000, причем, 41% случаев заболевания в этой возрастной группе приходилось на детей в возрасте от 2 до 3 лет. Данные Государственного контроля Австралии показали пик заболеваемости у детей в возрасте 4 года или менее, и второй пик у подростков и молодых людей, причем, приблизительно 85% всех случаев относятся к заболеванию, ассоциированному с серологической группой B.
Сущность изобретения
Для удовлетворения этих и других требований, настоящее изобретение относится к композициям Neisseria meningitidis и к способам их применения.
Авторами настоящего изобретения была неожиданно получена композиция, включающая по меньшей мере один белок, связывающийся с фактором H (fHBP) и по меньшей мере один конъюгат капсулярного сахарида N. meningitidis. Эти композиция оказалась неожиданно стабильной и вырабатывала иммунный ответ против штаммов, экспрессирующих варианты fHBP, которые являются гомологичными варианту fHBP в многокомпонентной композиции, и иммунный ответ против штаммов, экспрессирующих варианты fHBP, которые являются гетерологичными варианту fHBP в многокомпонентной композиции.
Композиция содержит первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2; капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с белком-носителем столбнячного токсоида (TT); капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с белком-носителем столбнячного токсоида (TT); капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), конъюгированный с белком-носителем столбнячного токсоида (TT); и капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), конъюгированный с белком-носителем столбнячного токсоида (TT).
В одном из вариантов осуществления изобретения, композиция включает капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с линкером дигидрозидом адипиновой кислоты (ADH) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) посредством карбодиимидного химического метода (конъюгат MenAAH-TT); капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с ADH-линкером посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) посредством карбодиимидного химического метода (конъюгат MenCAH-TT); капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-TT); и капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-TT).
В одном из своих аспектов настоящее изобретение относится к набору, включающему (a) первую композицию, содержащую липидизированный полипептид MenB rLP2086 подсемейства A и липидизированный полипептид MenB rLP2086 подсемейства B; и (b) вторую композицию, содержащую капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с белком-носителем столбнячного токсоида (TT); капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с белком-носителем столбнячного токсоида (TT); капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), конъюгированный с белком-носителем столбнячного токсоида (TT); и капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), конъюгированный с белком-носителем столбнячного токсоида (TT). В одном из вариантов осуществления изобретения, первой композицией является жидкая композиция, а второй композицией является лиофилизованная композиция. В другом варианте осуществления изобретения, этот набор также не включает какой-либо из нижеследующих иммуногенных композиций: MENACTRA(R), MENVEO(R), ADACEL(R), HAVRIX(R), GARDASIL(R), REPEVAX или любых их комбинаций. В одном из вариантов осуществления изобретения, набор включает любой из ибупрофена, парацетамола и амоксициллина.
В одном из своих аспектов настоящее изобретение относится к иммуногенной композиции, включающей жидкую композицию, содержащую: (i) первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; и (ii) второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2; и лиофилизованную композицию, содержащую: капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с линкером дигидрозидом адипиновой кислоты (ADH) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) посредством карбодиимидного химического метода (конъюгат MenAAH-TT); капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с ADH-линкером посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) посредством карбодиимидного химического метода (конъюгат MenCAH-TT); капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-TT); и капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-TT). В одном из вариантов осуществления изобретения, лиофилизованную композицию разводят жидкой композицией.
В другом своем аспекте настоящее изобретение относится к способу индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы X. В некоторых вариантах осуществления изобретения, способ включает введение человеку композиции, включающей белок fHBP. В некоторых вариантах осуществления изобретения, способ включает введение человеку композиции, включающей полипептид, содержащий аминокислотную последовательность, которая по меньшей мере на 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,9% идентична аминокислотной последовательности, представленной в любой из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61 и SEQ ID NO: 62. В некоторых вариантах осуществления изобретения способ включает введение человеку композиции, включающей первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1; и второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 2.
В другом своем аспекте настоящее изобретение относится к способу индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы X. Способ включает введение человеку композиции, которая содержит первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2; капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с белком-носителем столбнячного токсоида (TT); капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с белком-носителем столбнячного токсоида (TT); капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), конъюгированный с белком-носителем столбнячного токсоида (TT); и капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), конъюгированный с белком-носителем столбнячного токсоида (TT).
В одном из своих аспектов настоящее изобретение относится к способу вырабатывания иммунного ответа у пациента любого возраста. Способ включает введение человеку композиции, которая содержит первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2. В одном из вариантов осуществления изобретения, композиция также включает полисорбат-80. В одном из вариантов осуществления изобретения, композиция также включает алюминий. В одном из вариантов осуществления изобретения, композиция также включает гистидин. В одном из вариантов осуществления изобретения, композиция также включает хлорид натрия. В одном из вариантов осуществления изобретения, композиция также включает полисорбат-80, алюминий, гистидин и хлорид натрия. В другом варианте осуществления изобретения, композиция также включает капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с белком-носителем столбнячного токсоида (TT); капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с белком-носителем столбнячного токсоида (TT); капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), конъюгированный с белком-носителем столбнячного токсоида (TT); и капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), конъюгированный с белком-носителем столбнячного токсоида (TT).
Краткое описание чертежей
Фиг. 1 - Совмещенные ИОХ-ВЭХ-хроматограммы для двухвалентной композиции MnB rLP2086 в отсутствие и в присутствии композиции MenACWY-TT, как описано в Примере 6.
Фиг. 2 - Совмещенные ОФ-ЖХВД-хроматограммы, показывающие, что присутствие композиции MenACWY-TT не влияет на оценку чистоты двухвалентной композиции MnB rLP2086, как описано в Примере 7.
Фиг. 3 - Совмещенные ОФ-ЖХВД-хроматограммы, где указано отношение чистоты и пиков белка rLP2086 в комбинированной композиции MenABCWY, как описано в Примере 14.
Фиг. 4A - Первичная аминокислотная последовательность белка MnB rLP2086 подсемейства A A05 и
Фиг. 4B - Первичная структура белка MnB rLP2086 подсемейства A A05.
Фиг. 5A - Первичная аминокислотная последовательность белка MnB rLP2086 подсемейства B B01 и
Фиг. 5B - Первичная структура белка MnB rLP2086 подсемейства B B01.
Фиг. 6A - Аминокислотные последовательности белка, связывающегося с фактором H (fHBP) B16 (SEQ ID NO: 26) штамма N. meningitidis серологической группы A (варианта fHBP B16 (PMB3257, MenA);
Фиг. 6B - fHBP A10 (SEQ ID NO: 27) штамма N. meningitidis серологической группы С (варианта fHBP A10 (PMB5208, MenC и PMB5523, MenW);
Фиг. 6C - fHBP A19 (SEQ ID NO: 28) штамма N. meningitidis серологической группы W (варианта fHBP A19 (PMB5248, MenW);
Фиг. 6D - fHBP A10 (SEQ ID NO: 27) штамма N. meningitidis серологической группы W (варианта A10 (PMB5523, MenW);
Фиг. 6E - fHBP B47 (SEQ ID NO: 29) штамма N. meningitidis серологической группы Y (варианта B47 (PMB5187, MenY);
Фиг. 6F - fHBP B49 (SEQ ID NO: 30) штамма N. meningitidis серологической группы X (варианта B49 (PMB5540, MenX).
Фиг. 7 - Бактерицидная активность сыворотки, коррелят защиты от менингококкового заболевания. Титр ≥1:4 в анализах на бактерицидную активность сыворотки с использованием человеческого комплемента (hSBA) представляет собой установленный коррелят защиты от менингококкового заболевания.
Фиг. 8 - Отбор тестируемых штаммов MenA, C, W, Y и X.
Фиг. 9 - Схематически представлены релевантные группы, участвующие в клиническом испытании, у которых была произвольно отобрана субпопуляция тестируемых сывороток.
Фиг. 10 - Распределение уровней экспрессии поверхностного FHbp (MFI), определенных в экспериментах методом проточной цитометрии с использованием mAb MN 994-11, реагирующего с FHbp. Поверхностная экспрессия FHbp для каждого из штаммов определенной серологической группы показана черными точками, а уровни поверхностной экспрессии FHbp для отобранных тестируемых штаммов каждой серологической группы показаны цветной звездочкой.
Фиг. 11 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenA PMB3257 (B16). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2 и 3 доз MenBFHbp. Геометрическое среднее полученных титров (GMT) составляло 2, 3, 4 и 5, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 3% до вакцинации и 97% через месяц после введения MCV4. GMT для позитивной контрольной группы составляли 2 и 95, соответственно.
Фиг. 12 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenС PMB5208 (А10). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2, и 3 доз MenBFHbp. Полученные GMT составляли 4, 8, 12 и 29, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 20% до вакцинации и 90% через 1 месяц после введения MCV4. GMT для позитивной контрольной группы составляли 3 и 119, соответственно.
Фиг. 13 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenW PMB5248 (А19). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2 и 3 доз MenBFHbp. Полученные GMT составляли 4, 18, 47 и 77, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 40% до вакцинации и 97% через 1 месяц после введения MCV4. GMT для позитивной контрольной группы составляли 5 и 88, соответственно.
Фиг. 14 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenW PMB5523 (А10). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2 и 3 доз MenBFHbp. Полученные GMT составляли 7, 15, 21 и 42, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 55% до вакцинации и 97% через 1 месяц после введения MCV4. GMT для позитивной контрольной группы составляли 8 и 60, соответственно.
Фиг. 15 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenY PMB5187 (В47). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2 и 3 доз MenBFHbp. Полученные GMT составляли 3, 7, 31 и 58, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 13% до вакцинации и 97% через 1 месяц после введения MCV4. GMT для позитивной контрольной группы составляли 3 и 79, соответственно.
Фиг. 16 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenХ PMB5540 (В49). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2 и 3 доз MenBFHbp. Полученные GMT составляли 2, 3, 7 и 20, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 0% до вакцинации и 0% через один месяц после введения MCV4. GMT для позитивной контрольной группы составляли 2 и 2, соответственно
Идентификаторы последовательностей
SEQ ID NO: 1 представляет собой аминокислотную последовательность для рекомбинантного полипептидного антигена N. meningitidis, серологической группы B, варианта 2086 A05.
SEQ ID NO: 2 представляет собой аминокислотную последовательность для рекомбинантного полипептидного антигена N. meningitidis, серологической группы B, варианта 2086 В01.
SEQ ID NO: 3 представляет собой аминокислотные остатки в положениях 1-4 SEQ ID NO: 1 и SEQ ID NO: 2.
SEQ ID NO: 4 представляет собой аминокислотную последовательность N-концевого рекомбинантного полипептида Neisseria подсемейства А LP2086 (rLP2086) (A05).
SEQ ID NO: 5 представляет собой аминокислотную последовательность N-концевого полипептида Neisseria подсемейства А LP2086 M98250771 (A05).
SEQ ID NO: 6 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B153.
SEQ ID NO: 7 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A04.
SEQ ID NO: 8 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A05.
SEQ ID NO: 9 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A12.
SEQ ID NO: 10 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A22.
SEQ ID NO: 11 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B02.
SEQ ID NO: 12 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B03.
SEQ ID NO: 13 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B09.
SEQ ID NO: 14 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B22.
SEQ ID NO: 15 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B24.
SEQ ID NO: 16 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B44.
SEQ ID NO: 17 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B16.
SEQ ID NO: 18 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A07.
SEQ ID NO: 19 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A19.
SEQ ID NO: 20 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A06.
SEQ ID NO: 21 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A15.
SEQ ID NO: 22 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A29.
SEQ ID NO: 23 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B15.
SEQ ID NO: 24 представляет собой аминокислотную последовательность N-концевого рекомбинантного полипептида Neisseria подсемейства А LP2086 (rLP2086) (B01).
SEQ ID NO: 25 представляет собой аминокислотную последовательность N-концевого полипептида Neisseria подсемейства B LP2086 CDC-1573 (B01).
SEQ ID NO: 26 представляет собой аминокислотную последовательность штамма N. meningitidis серологической группы A, экспрессирующего белок, связывающийся с фактором H (fHBP) B16.
SEQ ID NO: 27 представляет собой аминокислотную последовательность штамма N. meningitidis серологической группы С, экспрессирующего fHBP A10. SEQ ID NO: 27 также представляет собой аминокислотную последовательность штамма N. meningitidis серологической группы W, экспрессирующего fHBP A10.
SEQ ID NO: 28 представляет собой аминокислотную последовательность штамма N. meningitidis серологической группы W, экспрессирующего fHBP A19.
SEQ ID NO: 29 представляет собой аминокислотную последовательность штамма N. meningitidis серологической группы Y, экспрессирующего fHBP B47.
SEQ ID NO: 30 представляет собой аминокислотную последовательность штамма N. meningitidis серологической группы Х, экспрессирующего fHBP B49.
SEQ ID NO: 31 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 B16.
SEQ ID NO: 32 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 A07.
SEQ ID NO: 33 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 A19.
SEQ ID NO: 34 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 A06.
SEQ ID NO: 35 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 A15.
SEQ ID NO: 36 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 A29.
SEQ ID NO: 37 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 B15.
SEQ ID NO: 38 представляет собой аминокислотную последовательность нелипидизированного штамма N. meningitidis серологической группы A, экспрессирующего белок, связывающийся с фактором H (fHBP) B16.
SEQ ID NO: 39 представляет собой аминокислотную последовательность нелипидизированного штамма N. meningitidis серологической группы С, экспрессирующего fHBP A10. SEQ ID NO: 39 также представляет собой аминокислотную последовательность нелипидизированного штамма N. meningitidis серологической группы W, экспрессирующего fHBP A10.
SEQ ID NO: 40 представляет собой аминокислотную последовательность нелипидизированного штамма N. meningitidis серологической группы W, экспрессирующего fHBP A19.
SEQ ID NO: 41 представляет собой аминокислотную последовательность нелипидизированного штамма N. meningitidis серологической группы Y, экспрессирующего fHBP B47.
SEQ ID NO: 42 представляет собой аминокислотную последовательность нелипидизированного штамма N. meningitidis серологической группы X, экспрессирующего fHBP B49.
SEQ ID NO: 43 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 B44.
SEQ ID NO: 44 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 B09.
SEQ ID NO: 45 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B09.
SEQ ID NO: 46 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 A05.
SEQ ID NO: 47 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 B01.
SEQ ID NO: 48 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B01, который включает N-концевой Cys в положении аминокислоты 1.
SEQ ID NO: 49 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B15, который включает N-концевой Cys в положении аминокислоты 1.
SEQ ID NO: 50 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B16, который включает N-концевой Cys в положении аминокислоты 1.
SEQ ID NO: 51 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B22.
SEQ ID NO: 52 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A22.
SEQ ID NO: 53 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 A12.
SEQ ID NO: 54 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 A22.
SEQ ID NO: 55 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 А62, который включает N-концевой Cys в положении аминокислоты 1.
SEQ ID NO: 56 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 A62.
SEQ ID NO: 57 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 А29, который включает N-концевой Cys в положении аминокислоты 1.
SEQ ID NO: 58 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 B22.
SEQ ID NO: 59 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 A05.
SEQ ID NO: 60 представляет собой аминокислотную последовательность нелипидизированного N. meningitidis, серологической группы B, варианта 2086 A05.
SEQ ID NO: 61 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B24.
SEQ ID NO: 62 представляет собой аминокислотную последовательность N. meningitidis, серологической группы B, варианта 2086 B24.
Подробное описание изобретения
Авторами настоящего изобретения была неожиданно получена композиция, включающая по меньшей мере один белок, связывающийся с фактором H (fHBP) и по меньшей мере один конъюгат капсулярного сахарида N. meningitidis. Эта композиция оказалась неожиданно стабильной и вырабатывала иммунный ответ против штаммов, экспрессирующих варианты fHBP, которые являются гомологичными варианту fHBP в многокомпонентной композиции, и иммунный ответ против штаммов, экспрессирующих варианты fHBP, которые являются гетерологичными варианту fHBP в многокомпонентной композиции. Авторами настоящего изобретения было также неожиданно обнаружено, что полипептид fHBP эффективно вырабатывает иммунный ответ у детей, например, у детей в возрасте 12 месяцев и выше. Кроме того, авторы неожиданно обнаружили, что полипептид fHBP эффективно вырабатывает иммунный ответ против штамма N. meningitidis серологической группы X.
Авторами настоящего изобретения была неожиданно получена композиция, включающая (a) первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; (b) второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2; (c) капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с линкером дигидразидом адипиновой кислоты (ADH) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) посредством карбодиимидного химического метода (конъюгат MenAAH-TT); (d) капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с ADH-линкером посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) посредством карбодиимидного химического метода (конъюгат MenCAH-TT); (e) капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-TT); (f) капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-TT). Композиция включает лиофилизованную композицию MenACWY-TT, которая, как было неожиданно обнаружено, может быть легко разведена жидкой двухвалентной композицией MnB rLP2086, где такая композиция содержится в одном сосуде. Авторами настоящего изобретения было обнаружено, что лиофилизованная композиция MenACWY-TT и жидкая двухвалентная композиция MnB rLP2086 были совместимыми и стабильными после разведения по меньшей мере в течение 24 часов при комнатной температуре.
Кроме того, авторами настоящего изобретения было также обнаружено, что двухвалентная композиция MnB rLP2086 продуцирует бактерицидные антитела не только против N. meningitidis серологической группы B, но также и против N. meningitidis всех серологических групп, кроме B. Так, например, двухвалентная композиция MnB rLP2086 продуцирует бактерицидные антитела против N. meningitidis серологических групп по меньшей мере A, C, W, Y, и X. Было неожиданно обнаружено, что двухвалентная композиция MnB rLP2086 вырабатывает бактерицидные антитела против N. meningitidis серологической группы X, что указывает на то, что двухвалентная композиция MnB rLP2086 вырабатывает перекрестно-реактивный бактерицидный иммунный ответ широкого ряда у людей против Neisseria meningitidis по меньшей мере двух различных серологических групп.
Кроме того, авторами настоящего изобретения был неожиданно детектирован иммунный ответ, оцененный с помощью анализа на бактерицидную активность сыворотки с использованием человеческого комплемента (hSBA), проведенного с использованием 4 первичных тестируемых штаммов Neisseria meningitidis серологической группы B (MnB), 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства B LP2086, и такой анализ проводили через 1 месяц после третьей вакцинации двухвалентным rLP2086 у здоровых индивидуумов в возрасте от≥24 месяцев до <4 лет на начало исследования. Авторами настоящего изобретения был неожиданно детектирован иммунный ответ, оцененный с помощью анализа с использованием hSBA, проводимого с использованием 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства B LP2086, и такой анализ проводили через 1 месяц после третьей вакцинации двухвалентным rLP2086 у здоровых индивидуумов в возрасте от≥4 лет до <10 лет на начало исследования. Авторами настоящего изобретения также был неожиданно детектирован иммунный ответ, оцененный с помощью hSBA с использованием, проводимого с использованием 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства B LP2086, и такой анализ проводили через 1 месяц после третьей вакцинации двухвалентным rLP2086 у здоровых индивидуумов в возрасте от≥24 месяцев до <10 лет на начало исследования (то есть, в объединенной возрастной стратифицированной группе). Авторами настоящего изобретения также был неожиданно детектирован иммунный ответ, оцененный с помощью hSBA, проводимого с использованием 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства B LP2086, и такой анализ проводили через 1 месяц после второй вакцинации и через 6 месяцев после третьей вакцинации двухвалентным rLP2086, у здоровых индивидуумов в возрасте от≥24 месяцев до <4 лет на начало исследования, у здоровых индивидуумов в возрасте от≥4 лет до <10 лет на начало исследования и в объединенной возрастной стратифицированной группе. Иммунный ответ был также описан по дополнительным конечным точкам, оцененным с помощью hSBA, проводимого с использованием 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства B LP2086, и такой анализ проводили в определенные периоды времени у здоровых индивидуумов в возрасте от≥24 месяцев до <4 лет на начало исследования, у здоровых индивидуумов в возрасте от≥4 лет до <10 лет на начало исследования и в объединенной возрастной стратифицированной группе.
Кроме того, авторами настоящего изобретения был неожиданно детектирован иммунный ответ, оцененный с помощью анализа на бактерицидную активность сыворотки с использованием человеческого комплемента (hSBA), проведенного с использованием 4 первичных тестируемых штаммов Neisseria meningitidis серологической группы B (MnB), 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства B LP2086, и такой анализ проводили через 1 месяц после третьей вакцинации двухвалентным rLP2086 у здоровых детей в возрасте от 12 до <18 месяцев на начало исследования. Авторами настоящего изобретения также был неожиданно детектирован иммунный ответ, оцененный с помощью hSBA, проводимого с использованием 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства B LP2086, и такой анализ проводили через 1 месяц после третьей вакцинации двухвалентным rLP2086 у здоровых детей в возрасте от 18 до <24 месяцев на начало исследования. Авторами настоящего изобретения также был неожиданно детектирован иммунный ответ, оцененный с помощью hSBA, проводимого с использованием 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства B LP2086, и такой анализ проводили через 1 месяц после третьей вакцинации двухвалентным rLP2086 у здоровых детей в возрасте от 12 до <24 месяцев на начало исследования (то есть, в обеих объединенных возрастных стратифицированных группах). Авторами настоящего изобретения также был неожиданно детектирован иммунный ответ, оцененный с помощью hSBA, проводимого с использованием 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства B LP2086, и такой анализ проводили через 1 месяц после второй вакцинации и по меньшей мере через 6 месяцев после третьей вакцинации, у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев на начало исследования и в обеих объединенных возрастных стратифицированных группах. Так, например, hSBA может быть проведен в любое время, включая 12, 24, 36 и 48 месяцев после третьей вакцинации у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев на начало исследования и в обеих объединенных возрастных стратифицированных группах. Иммунный ответ был также описан по дополнительным конечным точкам, оцененным с помощью hSBA, проводимого с использованием 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства B LP2086, и такой анализ проводили через 1 месяц после второй вакцинации и по меньшей мере через 1 месяц после третьей вакцинации двухвалентным rLP2086 у здоровых детей в возрасте от 12 до <18 месяцев на начало исследования и от 18 до <24 месяцев на начало исследования и в обеих объединенных возрастных стратифицированных группах. Так, например, hSBA может быть проведен в любое время, включая 6, 12, 24, 36 и 48 месяцев после третьей вакцинации двухвалентным rLP2086 у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев на начало исследования и в обеих объединенных возрастных стратифицированных группах. Иммунный ответ был также описан по дополнительным конечным точкам, оцененным с помощью hSBA, проводимого с использованием вторичных тестируемых штаммов MnB, экспрессирующих белки подсемейства А и В LP2086, через 1 месяц после второй вакцинации и по меньшей мере через 1 месяц после третьей вакцинации у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев на начало исследования и в обеих объединенных возрастных стратифицированных группах. Так, например, hSBA может быть проведен в любое время, включая 6, 12, 24, 36 и 48 месяцев после третьей вакцинации здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев на начало исследования и в обеих объединенных возрастных стратифицированных группах.
В соответствии с этим, в одном из своих аспектов, настоящее изобретение относится к способу вырабатывания иммунного ответа у пациента любого возраста. В некоторых вариантах осуществления изобретения, возраст человека составляет по меньшей мере 4 недели, 5 недель, 6 недель, 7 недель, 8 недель, 9 недель, 10 недель, 11 недель или 12 недель. Так, например, в предпочтительных вариантах осуществления изобретения, возраст человека составляет по меньшей мере 6 недель. Как известно специалистам, конъюгатная менингококковая вакцина группы A, C, W-135 и Y, такая как NIMENRIX ®, является подходящей для детей в возрасте по меньшей мере шесть недель и может быть введена любому человеку в возрасте шесть недель и выше. В некоторых вариантах осуществления изобретения, возраст человека составляет по меньшей мере 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 12 месяцев. Так, например, в предпочтительном варианте осуществления изобретения, возраст человека составляет по меньшей мере 12 месяцев. В одном из вариантов осуществления изобретения, возраст человека составляет по меньшей мере от 12 до 18 месяцев. В другом своем аспекте, настоящее изобретение относится к способу вырабатывания иммунного ответа у пациента в возрасте по меньшей мере 18 месяцев. В одном из вариантов осуществления изобретения, возраст человека составляет от 18 до 24 месяцев. В другом своем аспекте, настоящее изобретение относится к способу вырабатывания иммунного ответа у пациента в возрасте по меньшей мере 24 месяца. В одном из вариантов осуществления изобретения, возраст человека составляет от 24 до 10 лет. В другом своем аспекте, настоящее изобретение относится к способу вырабатывания иммунного ответа у пациента в возрасте 10 лет и выше. В другом своем аспекте, настоящее изобретение относится к способу вырабатывания иммунного ответа у пациента в возрасте от 10 лет до 25 лет. Способ включает введение человеку композиции, включающий первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; и второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2. В одном из вариантов осуществления изобретения, композиция также включает полисорбат-80. В одном из вариантов осуществления изобретения, композиция также включает алюминий. В одном из вариантов осуществления изобретения, композиция также включает гистидин. В одном из вариантов осуществления изобретения, композиция также включает хлорид натрия. В одном из вариантов осуществления изобретения, композиция также включает полисорбат-80, алюминий, гистидин и хлорид натрия. В другом варианте осуществления изобретения, композиция также включает капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с белком-носителем столбнячного токсоида (TT); капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с белком-носителем столбнячного токсоида (TT); капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), конъюгированный с белком-носителем столбнячного токсоида (TT); и капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), конъюгированный с белком-носителем столбнячного токсоида (TT). Как известно специалистам, конъюгатная менингококковая вакцина группы A, C, W-135 и Y, такая как NIMENRIX®, является подходящей для детей в возрасте по меньшей мере шесть недель и может быть введена любому человеку в возрасте шесть недель и выше.
Дополнительное описание репрезентативных композиций приводится ниже.
Композиция и вакцина
Авторами настоящего изобретения было обнаружено, что композиция, включающая fHBP, вырабатывает эффективный иммунный ответ у человека в возрасте по меньшей мере 12 месяцев. Композиция также вырабатывает иммунный ответ против штамма N. meningitidis серологической группы X. Кроме того, авторами была неожиданно получена композиция, включающая по меньшей мере один полипептид, связывающийся с фактором Н (fHBP), и по меньшей мере один конъюгат капсулярного сахарида N. meningitidis. Эта композиция неожиданно оказалась стабильной и способной вырабатывать иммунный ответ против штаммов, экспрессирующих варианты fHBP, которые являются гомологичными варианту fHBP в многокомпонентной композиции, и иммунный ответ против штаммов, экспрессирующих варианты fHBP, которые являются гетерологичными варианту fHBP в многокомпонентной композиции. В одном из вариантов осуществления изобретения, композиция включает любой fHBP, такой как, например, любой из следующих полипептидов: B24, B16, B44, A22, B03, B09, A12, A19, A05, A07, A06, A15, A29, B01, A62, B15 и любые их комбинации. Предпочтительно, композиция включает комбинацию полипептидов A05 и B01. В другом предпочтительном варианте осуществления изобретения, композиция включает комбинацию полипептидов B24 и A05. В другом варианте осуществления изобретения, композиция включает комбинацию полипептидов A05, A12, B09, и B44. В одном из вариантов осуществления изобретения, композиция включает липидизированный fHBP. В одном из вариантов осуществления изобретения, композиция не включает нелипидизированный fHBP.
В другом варианте осуществления изобретения, композиция включает нелипидизированный fHBP, такой как любой из нелипидизированных fHBP, описанных в публикации Международной патентной заявки No. WO2012/032489, в публикации патента США No. US20120093852, в публикации Международной патентной заявки No. WO2013/132452, и в публикации патента США No. US20160030543, которые включены в настоящее описание посредством ссылки в полном объеме. В одном из вариантов осуществления изобретения, композиция включает по меньшей мере один нелипидизированный fHBP и по меньшей мере один липидизированный fHBP.
В некоторых вариантах осуществления изобретения, композиция включает полипептид, аминокислотная последовательность которого по меньшей мере на 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 99,9% идентична аминокислотной последовательности, представленой в любой из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61 и SEQ ID NO: 62.
Авторами настоящего изобретения было также неожиданно обнаружено, что жидкая двухвалентная композиция MnB rLP2086 может быть легко разведена с получением лиофилизованной композиции MenACWY-TT, и что эта объединенная композиция является совместимой и стабильной.
В одном из своих аспектов, настоящее изобретение относится к композиции против Neisseria meningitidis. Композиция включает (a) первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; (b) второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2; (c) капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с линкером дигидразидом адипиновой кислоты (ADH) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) посредством карбодиимидного химического метода (конъюгат MenAAH-TT); (d) капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с ADH-линкером посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) посредством карбодиимидного химического метода (конъюгат MenCAH-TT); (e) капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-TT); (f) капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-TT).
В другом своем аспекте, настоящее изобретение относится к композиции, включающей комбинацию двухвалентной композиции MnB rLP2086 и композиции MenACWY-TT. Двухвалентная композиция MnB rLP2086 означает композицию, включающую один полипептидный компонент N. meningitidis, который индуцирует эффективный протективный иммунный ответ широкого ряда против множества штаммов N. meningitidis серологической группы B. В частности, в одном варианте осуществления изобретения, двухвалентная композиция MnB rLP2086the включает белок подсемейства А MnB rLP2086 (SEQ ID NO: 1) и белок подсемейства В MnB rLP2086 (SEQ ID NO: 2). В одном из вариантов осуществления изобретения, композиция не включает слитый белок. В одном из вариантов осуществления изобретения, композиция не включает химерный белок. В одном из вариантов осуществления изобретения, композиция не включает гибридный белок. В одном из вариантов осуществления изобретения, композиция также не включает пептидный фрагмент. В другом варианте осуществления изобретения, композиция также не включает полипептид Neisserial, который не является fHBP. Так, например, в одном варианте осуществления изобретения, композиция не включает белок PorA. В другом варианте осуществления изобретения, композиция не включает белок NadA. В другом варианте осуществления изобретения, композиция также не включает гепарин-связывающий антиген Neisserial (NHBA). В другом варианте осуществления изобретения, композиция также не включает внешнюю мембранную везикулу Neisserial (OMV). В предпочтительном варианте осуществления изобретения, композиция также не включает антигены, не являющиеся первым полипептидом и вторым полипептидом. В предпочтительном варианте осуществления изобретения, двухвалентная композиция MnB rLP2086 также включает полисорбат-80. В одном из вариантов осуществления изобретения, двухвалентная композиция MnB rLP2086 также включает гистидиновый буфер. В одном из вариантов осуществления изобретения, двухвалентная композиция MnB rLP2086 также включает хлорид натрия. В одном из вариантов осуществления изобретения, двухвалентная композиция MnB rLP2086 также включает фосфат алюминия. В одном из вариантов осуществления изобретения, двухвалентная композиция MnB rLP2086 также включает полисорбат-80, гистидиновый буфер, хлорид натрия и фосфат алюминия. Предпочтительно, двухвалентная композиция MnB rLP2086 представляет собой жидкую композицию, где полипептиды приготовлены как 120 мкг/мл/подсемейство в 10 мМ гистидинового буфера, pH 6,0, 150 мМ хлорида натрия (NaCl) с 0,5 мг/мл фосфата алюминия (AlPO4), а также включает 0,018 мг полисорбата-80 в дозе 0,5 мл.
Композиция MenACWY-TT означает композицию, которая включает очищенные капсулярные полисахариды Neisseria meningitidis серологической группы A, C, W-135 и Y, каждый из которых независимо конъюгирован с TT в отношениях (TT:полисахарид) ~3, ~3, ~1,5 и ~1,3, соответственно. В частности, композиция включает: (c) капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с линкером дигидразидом адипиновой кислоты (ADH) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) посредством карбодиимидного химического метода (конъюгат MenAAH-TT); (d) капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с ADH-линкером посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) посредством карбодиимидного химического метода (конъюгат MenCAH-TT); (e) капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-TT); (f) капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-TT). Предпочтительно, композиция MenACWY-TT представлена как лиофилизованный порошок.
Конъюгаты MenAAH-TT, MenCAH-TT, MenW-TT и MenY-TT были получены путем проведения следующих стадий: получения промежуточного полисахаридного лекарственного вещества, получения промежуточного лекарственного вещества с TT, микрофлюидизации полисахарида, дериватизации полисахарида (только для способов получения MenAAH-TT и MenCAH-TT), дополнительной очистки TT и конъюгирования отдельных полисахаридов с TT.
Что касается конъюгата MenAAH-TT, то полисахарид MenA сначала подвергают микрофлюидизации для снижения размера и вязкости молекулы, а затем активируют путем цианилирования с тетрафторборатом 1-циано-4-диметиламинопиридиния (CDAP). Активированный MenA дериватизируют дигидразидом адипиновой кислоты (ADH) с образованием MenAAH. MenAAH и столбнячный токсоид (TT) подвергают реакции сочетания посредством конденсации, опосредуемой карбодиимидом (в соответствии с методикой присоединения 1-этил-3-(3-диметиламинопропил)карбодиимида (EDAC)) с получением конъюгата MenAAH-столбнячный токсоид (MenAAH-TT).
Что касается конъюгата MenСAH-TT, то полисахарид MenС сначала подвергают микрофлюидизации для снижения размера и вязкости молекулы, а затем активируют путем цианилирования с CDAP. Активированный MenС дериватизируют дигидразидом адипиновой кислоты (ADH) с образованием MenСAH. MenСAH и TT подвергают реакции сочетания посредством конденсации, опосредуемой карбодиимидом в соответствии с методикой присоединения EDAC с получением конъюгата MenСAH-столбнячный токсоид (MenСAH-TT).
Что касается конъюгата MenW-TT, то полисахарид MenW сначала подвергают микрофлюидизации для снижения размера и вязкости молекулы, а затем активируют путем цианилирования с CDAP. Активированный MenW непосредственно присоединяют к ТТ с получением MenW-столбнячного токсоида (MenW-TT).
Что касается конъюгата MenY-TT, то полисахарид MenY сначала подвергают микрофлюидизации для снижения размера и вязкости молекулы, а затем активируют путем цианилирования с CDAP. Активированный MenY непосредственно присоединяют к ТТ с получением MenY-столбнячного токсоида (MenY-TT).
В соответствии с другим аспектом изобретения, авторами было неожиданно обнаружено, что полипептидные антигены, происходящие максимум от двух штаммов N. meningitidis серологической группы B, индуцируют эффективный протективный иммунный ответ широкого ряда против множества штаммов N. meningitidis серологической группы B. В соответствии с этим, в одном варианте осуществления изобретения, композиция также не включает полипептид, который не происходит от штамма fHBP M98250771 подсемейства А N. meningitidis серологической группы B и/или от штамма fHBP CDC1573 подсемейства В N. meningitidis серологической группы B.
В одном из вариантов осуществления изобретения, композиция также не включает полипептид, последовательность которого менее, чем на 100% идентична SEQ ID NO: 1. В другом варианте осуществления изобретения, композиция также не включает полипептид, последовательность которого менее, чем на 100% идентична SEQ ID NO: 2. Так, например, композиция также не включает полипептид, последовательность которого менее, чем на 100% идентична полноразмерной SEQ ID NO: 1 и/или SEQ ID NO: 2.
В одном из вариантов осуществления изобретения, композиция также включает полисорбат-80, алюминий, гистидин и хлорид натрия. В одном из вариантов осуществления изобретения, композиция включает приблизительно 60 мкг первого липидизированного полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 1, приблизительно 60 мкг второго липидизированного полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 2, полисорбат-80 в молярном отношении 2,8 к каждому полипептиду, 0,5 мг алюминия/мл в виде фосфата алюминия, 10 мМ гистидина и 150 мМ хлорида натрия, где общий объем композиции предпочтительно, составляет приблизительно 0,5 мл.
В другом аспекте изобретения, композиция включает приблизительно 120 мкг/мл первого липидизированного полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 1, приблизительно 120 мкг/мл второго липидизированного полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 2, полисорбат-80 в молярном отношении 2,8 к каждому полипептиду, 0,5 мг алюминия/мл в виде фосфата алюминия, 10 мМ гистидина и 150 мМ хлорида натрия.
В другом аспекте изобретения, композиция включает a) 60 мкг первого липидизированного полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 1; b) 60 мкг второго липидизированного полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 2, c) 18 мкг полисорбата-80; d) 250 мкг алюминия, e) 780 мкг гистидина и f) 4380 мкг хлорида натрия.
В репрезентативном варианте осуществления изобретения, композиция включает приблизительно 60 мкг первого липидизированного полипептида, состоящего из аминокислотной последовательности, представленной в SEQ ID NO: 1, приблизительно 60 мкг второго липидизированного полипептида, состоящего из аминокислотной последовательности, представленной в SEQ ID NO: 2, полисорбата-80 в молярном отношении 2,8 к первому липидизированному полипептиду и ко второму липидизированному полипептиду, 0,5 мг алюминия/мл в виде фосфата алюминия, 10 мМ гистидина и 150 мМ хлорида натрия, где общий объем композиции предпочтительно, составляет приблизительно 0,5 мл. В репрезентативном варианте осуществления изобретения, композиция представляет собой стерильную изотоническую забуференную жидкую суспензию. В репрезентативном варианте осуществления изобретения, композиция имеет рН 6,0. В репрезентативном варианте осуществления изобретения, первый полипептид и второй полипептид адсорбируют на алюминии.
В одном из вариантов осуществления изобретения, композиция включает конъюгат MenAAH-TT, имеющий среднее отношение TT/полисахарида, равное 3; конъюгат MenCAH-TT, имеющий среднее отношение TT/полисахарида, равное 3; конъюгат MenW-TT, имеющий среднее отношение TT/полисахарида, равное 1,5; и конъюгат MenY-TT, имеющий среднее отношение TT/полисахарида, равное 1,3. В предпочтительном варианте осуществления изобретения, композиция включает конъюгат MenAAH-TT, имеющий 5 мкг полисахарида MenA и ~15 мкг TT; конъюгат MenCAH-TT, имеющий 5 мкг полисахарида MenC и ~15 мкг TT; конъюгат MenW-TT, имеющий 5 мкг полисахарида MenW и ~7,5 мкг TT; и конъюгат MenY-TT, имеющий 5 мкг полисахарида MenY и ~6,5 мкг TT. Композиция может также включать Трис-HCl, сахарозу и хлорид натрия.
В другом варианте осуществления изобретения, композиция включает конъюгат MenAAH-TT; конъюгат MenCAH-TT; конъюгат MenW-TT; и конъюгат MenY-TT, которые включают полисахарид MenA; полисахарид MenC; полисахарид MenW; и полисахарид MenY и белок-носитель TT. Композиция может также включать сахарозу и трометанол. Так, например, в одном варианте осуществления изобретения, композиция включает 10 мкг/мл полисахарида MenA; 10 мкг/мл полисахарида MenC; 10 мкг/мл полисахарида MenW; и 10 мкг/мл полисахарида MenY; 88 мкг/мл белка-носителя TT; 164 мМ сахарозы; и 1,6 мМ трометанола.
В одном из вариантов осуществления изобретения, композиция имеет общий объем приблизительно 0,5 мл. В одном из вариантов осуществления изобретения, первая доза композиции имеет общий объем приблизительно 0,5 мл. «Первая доза» означает дозу композиции, вводимую на день 0. «Вторая доза» или «треья доза» означают дозы композиции, вводимые после первой дозы, количество которых может быть, а может и не быть, таким же, как количество первой дозы.
В одном из своих аспектов, настоящее изобретение относится к жидкой иммуногенной композиции, полученной из лиофилизованной композиции MenACWY-TT, разведенной жидкой двухвалентной композицией MnB rLP2086. Разведение означает превращение сухой лиофилизованной композиции в жидкую форму путем добавления жидкого разбавителя. В одном предпочтительном варианте осуществления изобретения, жидкую двухвалентную композицию MnB rLP2086 вводят не одновременно, не вместе и не в комбинации с лиофилизованной композицией MenACWY-TT, где лиофилизованая композиция MenACWY-TT была разведена жидкой композицией, не являющейся жидкой двухвалентной композицией MnB rLP2086. Так, например, в одном предпочтительном варианте осуществления изобретения, лиофилизованную композицию MenACWY-TT не разводят водным разбавителем, состоящим из хлорида натрия и воды, и вводят не одновременно, не вместе и не в комбинации с жидкой двухвалентной композицией MnB rLP2086.
И наоборот, в предпочтительном варианте осуществления изобретения, лиофилизованную композицию MenACWY-TT вводят человеку вместе с двухвалентной композицией MnB rLP2086 сразу, то есть, одним введением. Такое одно введение (например, композиции MenABCWY) может быть осуществлено путем взятия двухвалентной композиции MnB rLP2086 из первого контейнера и ее смешивания с лиофилизованной композицией MenACWY-TT из второго контейнера. Альтернативно, одно введение композиции MenABCWY может быть осуществлено из одного (единственного) контейнера, который включает двухвалентную композицию MnB rLP2086 и лиофилизованную композицию MenACWY-TT. Способы доставки вакцин или иммуногенных композиций известны специалистам. В одном из вариантов осуществления изобретения, композицию MenABCWY вводят одновременно с любым из таких соединений, как ибупрофен, парацетамол и амоксициллин.
Композиция является иммуногенной после введения первой дозы человеку. В одном из вариантов осуществления изобретения, первая доза составляет приблизительно 0,5 мл в общем объеме.
Композиция индуцирует бактерицидный титр сывороточного иммуноглобулина, который, после введения человеку первой дозы, по меньшей мере более, чем в 1 раз, а предпочтительно, по меньшей мере в 2 раза превышает бактерицидный титр сывороточного иммуноглобулина до введения человеку первой дозы, если эти титры измеряют в идентичных условиях в анализе на бактерицидную активность сыворотки с использованием человеческого комплемента (hSBA).
Бактерицидный титр или бактерицидный иммунный ответ направлен против N. meningitidis серологической группы B. В предпочтительном варианте осуществления изобретения, бактерицидный титр или бактерицидный иммунный ответ направлен против штамма fHBP подсемейства А N. meningitidis серологической группы B и против штамма fHBP подсемейства В N. meningitidis серологической группы В. Наиболее предпочтительно, бактерицидный титр или бактерицидный иммунный ответ направлен по меньшей мере против штамма fHBP подсемейства В N. meningitidis серологической группы B, штамма B01.
В одном из вариантов осуществления изобретения, композиция индуцирует бактерицидный титр сывороточного иммуноглобулина, который, после введения человеку дозы композиции по меньшей мере более, чем в 1 раз, например, по меньшей мере в 1,01 раза, 1,1 раза, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз превышает бактерицидный титр сывороточного иммуноглобулина у человека до введения указанной дозы, если эти титры измеряют в идентичных условиях в анализе на бактерицидную активность сыворотки с использованием человеческого комплемента.
В одном из вариантов осуществления изобретения, композиция представляет собой иммуногенную композицию. В одном из вариантов осуществления изобретения, композиция представляет собой иммуногенную композицию для человека. В другом варианте осуществления изобретения, композиция представляет собой вакцину. «Вакцина» означает композицию, включающую антиген, содержащий по меньшей мере один эпитоп, который индуцирует иммунный ответ, специфичный к этому антигену. Вакцина может быть введена индивидууму непосредственно путем подкожного, перорального, ороназального или интраназального введения. Предпочтительно, вакцину вводят внутримышечно. В одном из вариантов осуществления изобретения, композиция представляет собой вакцину для человека. В одном из вариантов осуществления изобретения, композиция представляет собой иммуногенную композицию против N. meningitidis.
В одном из вариантов осуществления изобретения, композиция представляет собой жидкую композицию. В предпочтительном варианте осуществления изобретения, композиция представляет собой жидкую суспензионную композицию. В другом предпочтительном варианте осуществления изобретения, композиция не является лиофилизованной.
Первый полипептид; белок подсемейства А MNB RLP2086 (A05)
В одном из вариантов осуществления изобретения, композиция включает первый полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 1. Полипептид представляет собой модифицированный белок, связывающийся с фактором H (fHBP) штамма N. meningitidis M98250771. Описание fHBP приводится в WO2012032489 и в публикации заявки на патент США 2012/0093852, каждая из которых включена в настоящее описание посредством ссылки в полном объеме. Полипептид липидизирован у N-конца преимущественно тремя жирными кислотами C16:0, C16:1 и C18:1, ковалентно связанными в трех положениях полипептида. Первый полипептид включает всего 258 аминокислот.
Репрезентативная первичная структура белка MnB rLP2086 A05 представлена на фиг. 4. Первичная структура белка проиллюстрирована на фиг. 4 однобуквенными кодами для всех аминокислот, за исключением N-концевого цистеина и глицерильных групп (которые представлены полной химической формулой). Эта структура включает первичную структуру последовательности белка, в которой N-концевой цистеиновый остаток был липидизирован. Аминогруппа N-концевого цистеинового остатка у N-конца белка была присоединена к жирной кислоте (R1) с образованием амидной связи, а цистеинильная сульфгидрильная группа была присоединена к глицериновой группе, содержащей две жирных кислоты, связанных со сложным эфиром (R2). Было установлено, что структура R1 представляет собой гексадекановую кислоту (C16:0), а структуры R2 варьируются в зависимости от изоформ MnB rLP2086.
Первый полипептид включает две модификации, введенные в N-концевую область полипептида по сравнению с соответствующей последовательностью штамма дикого типа N. meningitidis M98250771. Глицин во втором положении был присоединен после введения сайта клонирования. Вторая модификация включает делецию четырех аминокислот. В соответствии с этим, в одном варианте осуществления изобретения, первый полипептид включает последовательность C-G-S-S (SEQ ID NO: 3) у N-конца. См. SEQ ID NO: 1, первые четыре аминокислотных остатка.
N-концевые различия между первой полипептидной последовательностю и последовательностью Neisserial дикого типа представлены ниже. В соответствии с этим, в одном варианте осуществления изобретения, первый полипептид включает по меньшей мере первые 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или более аминокислотных остатков аминокислотной последовательности, представленной в SEQ ID NO: 1. Предпочтительно, первый полипептид включает по меньшей мере первые 4, более предпочтительно, по меньшей мере первые 6, а наиболее предпочтительно, по меньшей мере первые 8 аминокислотных остатков SEQ ID NO: 1.
Сравнение предсказанных N-концевых последовательностей рекомбинантого полипептида и полипептида подсемейства А Neisserial LP2086
>A05 (SEQ ID NO: 1)
CGSSGGGGVAADIGTGLADALTAPLDHKDKGLKSLTLEDSISQNGTLTLSAQGAEKTFKVGDKDNSLNTGKLKNDKISRFDFVQKIEVDGQTITLASGEFQIYKQDHSAVVALQIEKINNPDKIDSLINQRSFLVSGLGGEHTAFNQLPSGKAEYHGKAFSSDDAGGKLTYTIDFAAKQGHGKIEHLKTPEQNVELASAELKADEKSHAVILGDTRYGSEEKGTYHLALFGDRAQEIAGSATVKIREKVHEIGIAGKQ
В одном из вариантов осуществления изобретения, первый полипептид включает аминокислотную последовательность, представленную в SEQ ID NO: 1. В одном из вариантов осуществления изобретения, первый полипептид имеет всего 258 аминокислот. В одном из вариантов осуществления изобретения, первый полипептид не включает аминокислотную последовательность, которая менее, чем на 100% идентична SEQ ID NO: 1. В другом варианте осуществления изобретения, первый полипептид состоит из аминокислотной последовательности, представленной в SEQ ID NO: 1. В другом варианте осуществления изобретения, первый полипептид включает аминокислотную последовательность KDN. См., например, аминокислотные остатки 73-75 SEQ ID NO: 1. В другом варианте осуществления изобретения, первый полипептид включает аминокислотную последовательность, представленную в SEQ ID NO: 3, у N-конца полипептида. В другом варианте осуществления изобретения, первый полипептид включает аминокислотную последовательность, представленную в SEQ ID NO: 4, у N-конца полипептида.
В предпочтительном варианте осуществления изобретения, первый полипептид может быть легко экспрессирован в рекомбинантной клетке-хозяине стандартными методами, известными специалистам. В другом предпочтительном варианте осуществления изобретения, первый полипептид включает бактерициднный эпитоп на N- и/или C-домене SEQ ID NO: 1. В одном из вариантов осуществления изобретения, первый полипептид включает по меньшей мере первые 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной в SEQ ID NO: 1. Предпочтительно, первый полипептид включает по меньшей мере первые 2, более предпочтительно, по меньшей мере первые 4, а наиболее предпочтительно, по меньшей мере первые 8 аминокислотных остатков SEQ ID NO: 1.
В другом варианте осуществления изобретения, первый полипептид включает по меньшей мере последние 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной в SEQ ID NO: 1.
В одном из вариантов осуществления изобретения, композиция включает приблизительно 30 мкг/мл первого полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 1. В одном предпочтительном варианте осуществления изобретения, композиция включает приблизительно 60 мкг/мл первого полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 1. В одном предпочтительном варианте осуществления изобретения, композиция включает приблизительно 60 мкг/мл первого полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 1, где композиция, предпочтительно, имеет общий объем 0,5 мл. В другом варианте осуществления изобретения, композиция включает приблизительно 120 мкг/мл первого полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 1.
Второй полипептид; белок подсемейства B MnB rLP2086 (B01)
В одном из вариантов осуществления изобретения, композиция включает второй полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 2. Полипептид представляет собой белок, связывающийся с фактором H (fHBP) штамма N. meningitidis CDC1573. Описание fHBP приводится в WO2012032489 и в публикации заявки на патент США 2012/0093852, каждая из которых включена в настоящее описание посредством ссылки в полном объеме. Полипептид липидизирован у N-конца преимущественно тремя жирными кислотами C16:0, C16:1 и C18:1, ковалентно связанными в трех положениях полипептида. Первый полипептид включает всего 261 аминокислоту.
Репрезентативная первичная структура белка MnB rLP2086 В01 представлена на фиг. 5. Первичная структура белка проиллюстрирована на фиг. 5 однобуквенными кодами для всех аминокислот, за исключением N-концевого цистеина и глицерильных групп (которые представлены полной химической формулой). Эта структура включает первичную структуру последовательности белка, в которой N-концевой цистеиновый остаток был липидизирован. Аминогруппа N-концевого цистеинового остатка у N-конца белка была присоединена к жирной кислоте (R1) с образованием амидной связи, а цистеинильная сульфгидрильная группа была присоединена к глицериновой группе, содержащей две жирных кислоты, связанных со сложным эфиром (R2). Было установлено, что структура R1 представляет собой гексадекановую кислоту (C16:0), а структуры R2 варьируются в зависимости от изоформ rLP2086.
Второй полипептид включает одну модификацию, введенную в N-концевую область белка подсемейства В rLP2086 по сравнению с соответствующей последовательностью штамма дикого типа N. meningitidis CDC1573. Глицин во втором положении был присоединен после введения сайта клонирования.
N-концевые различия по сравнению с исходными последовательностями Neisseria представлены ниже.
Сравнение предсказанных N-концевых последовательностей рекомбинантого полипептида и полипептида подсемейства В Neisseria LP2086
В одном из вариантов осуществления изобретения, второй полипептид включает последовательность C-G-S-S (SEQ ID NO: 3) у N-конца. См. первые четыре аминокислотных остатка SEQ ID NO: 2.
>B01 (SEQ ID NO: 2)
CGSSGGGGSGGGGVTADIGTGLADALTAPLDHKDKGLKSLTLEDSISQNGTLTLSAQGAEKTYGNGDSLNTGKLKNDKVSRFDFIRQIEVDGQLITLESGEFQVYKQSHSALTALQTEQEQDPEHSEKMVAKRRFRIGDIAGEHTSFDKLPKDVMATYRGTAFGSDDAGGKLTYTIDFAAKQGHGKIEHLKSPELNVDLAVAYIKPDEKHHAVISGSVLYNQDEKGSYSLGIFGEKAQEVAGSAEVETANGIHHIGLAAKQ
В одном из вариантов осуществления изобретения, второй полипептид включает аминокислотную последовательность, представленную в SEQ ID NO: 2. В одном из вариантов осуществления изобретения, второй полипептид имеет всего 261 аминокислоту. В одном из вариантов осуществления изобретения, второй полипептид состоит из аминокислотной последовательности, представленной в SEQ ID NO: 2. В другом варианте осуществления изобретения, второй полипептид также не включает полипептид, последовательность которого менее, чем на 100% идентична SEQ ID NO: 2. В предпочтительном варианте осуществления изобретения, первый полипептид и второй полипептид включают последовательность C-G-S-S (SEQ ID NO: 3) у N-конца соответствующего полипептида.
В предпочтительном варианте осуществления изобретения, второй полипептид может быть легко экспрессирован в рекомбинантной клетке-хозяине стандартными методами, известными специалистам. В другом предпочтительном варианте осуществления изобретения, второй полипептид включает бактерицидный эпитоп на N- и/или C-домене SEQ ID NO: 2. В одном из вариантов осуществления изобретения, второй полипептид включает по меньшей мере первые 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной в SEQ ID NO: 2. Предпочтительно, второй полипептид включает по меньшей мере первые 2, более предпочтительно, по меньшей мере первые 4, а наиболее предпочтительно, по меньшей мере первые 8 аминокислотных остатков SEQ ID NO: 2.
В другом варианте осуществления изобретения, второй полипептид включает по меньшей мере последние 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной в SEQ ID NO: 2.
В одном из вариантов осуществления изобретения, композиция включает приблизительно 30 мкг/мл первого полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 2. В одном предпочтительном варианте осуществления изобретения, композиция включает приблизительно 60 мкг/мл первого полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 2. В одном предпочтительном варианте осуществления изобретения, композиция включает приблизительно 60 мкг/мл второго полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 2, где композиция, предпочтительно, имеет общий объем 0,5 мл. В другом варианте осуществления изобретения, композиция включает приблизительно 120 мкг/мл второго полипептида, содержащего аминокислотную последовательность, представленную в SEQ ID NO: 2.
Сахариды
Используемый здесь термин «сахарид» может означать полисахарид или олигосахарид и включает то и другое. Полисахариды выделяют из бактерий или выделяют из бактерий и корректируют размер до определенной степени известными методами, и необязательно путем микрофлюидизации. Размер полисахаридов может быть скорректирован для снижения вязкости в образцах полисахаридов и/или для улучшения фильтруемости конъюгированных продуктов. Олигосахариды имеют низкое число повторяющихся звеньев (обычно 5-30 повторяющихся звеньев) и обычно представляют собой гидролизованные полисахариды.
Каждый капсулярный сахарид N. meningitidis может быть конъюгирован с белком-носителем, независимо выбранным из группы, состоящей из TT, DT, CRM197, фрагмента C TT и белка D. Хотя один или более капсулярных сахаридов N. meningitidis могут быть конъюгированы с белками-носителями, отличающимися от других белков, однако, в одном варианте осуществления изобретения, все они конъюгированы с одним и тем же белком-носителем. Так, например, все они могут быть конъюгированы с одним и тем же белком-носителем, выбранным из группы, состоящей из TT, DT, CRM197, фрагмента C TT и белка D. В этом контексте, CRM197 и DT могут рассматриваться как один и тот же белок-носитель, поскольку они отличаются только одной аминокислотой. В предпочтительном варианте осуществления изобретения, все присутствующие капсулярные сахариды N. meningitidis конъюгированы с TT.
Если белок-носитель является одним и тем же для 2 или более сахаридов в композиции, то такой сахарид может быть конъюгирован с одной и той же молекулой белка-носителя (молекулами-носителями, имеющими 2 или более различных сахаридов, конъюгированных с ними) [см., например, WO 04/083251; например, один белок-носитель может быть конъюгирован с MenA и MenC; MenA и MenW; MenA и MenY; MenC и MenW; MenC и MenY; Men W и MenY; MenA, MenC и MenW; MenA, MenC и MenY; MenA, MenW и MenY; MenC, MenW и MenY; MenA, MenC, MenW и MenY. Альтернативно, каждый сахарид может быть по отдельности конъюгирован с различными молекулами белка-носителя (каждая молекула белка-носителя имеет только сахарид одного типа, конъюгированный с нею).
В одном из вариантов осуществления изобретения, по меньшей мере 2 различных сахаридных конъюгата конъюгированы по отдельности с белками-носителями одного и того же типа, где один или более сахаридов конъюгированы с белком-носителем посредством химической группы первого типа на белке-носителе, и один или более сахаридов конъюгированы с белком-носителем посредством химической группы второго (другого) типа на белке-носителе.
В одном из вариантов осуществления изобретения, 2 конъюгата включают один и тот же сахарид, связанный с одним и тем же носителем, но с применением различных химических методов конъюгирования. В альтернативном варианте, 2 различных сахарида конъюгированы с различными группами на белке-носителе.
Термин «конъюгированный по отдельности с белком-носителем одного и того же типа» означает, что сахариды конъюгированы по отдельности с одним и тем же носителем (например, MenA конъюгирован со столбнячным токсоидом посредством аминогруппы на столбнячном токсоиде, а MenC конъюгирован со столбнячным токсоидом посредством группы карбоновой кислоты на другой молекуле столбнячного токсоида).
Капсулярный(е) сахарид(ы) может (могут) быть конъюгирован(ы) с одним и тем же белком-носителем, независимо выбранным из группы, состоящей из TT, DT, CRM197, фрагмента C TT и белка D. Более полный список белков-носителей, которые могут быть использованы в конъюгатах согласно изобретению, приводится ниже. В этом контексте, CRM197 и DT могут рассматриваться как один и тот же белок-носитель, поскольку они отличаются только одной аминокислотой. В одном из вариантов осуществления изобретения, все присутствующие капсулярные сахариды конъюгированы с TT.
Сахариды могут включать любой из таких сахаридов, как: капсулярный сахарид N. meningitidis серологической группы A (MenA), капсулярный сахарид N. meningitidis серологической группы C (MenC), капсулярный сахарид N. meningitidis серологической группы Y (MenY), и капсулярный сахарид N. meningitidis серологической группы W (MenW), или любые их комбинации.
Первая и вторая химические группы, присутствующие на белке-носителе, отличаются друг от друга и представляют собой идеальные природные химические группы, которые могут быть с успехом использованы в целях конъюгирования. Эти группы могут быть независимо выбраны из группы, состоящей из: карбоксильных групп, аминогрупп, сульфгидрильных групп, гидроксильных групп, имидазолильных групп, гуанидильных групп и индолильных групп. В одном из вариантов осуществления изобретения, первой химической группой является карбоксил, а второй - амино, или наоборот. Эти группы более подробно объясняются ниже.
В конкретном варианте осуществления изобретения, иммуногенная композиция содержит по меньшей мере 2 различных капсулярных сахарида N. meningitidis, где один или более сахаридов выбраны из первой группы, состоящей из MenA и MenC, которые конъюгированы с белком-носителем посредством химической группы первого типа на белке-носителе (например, карбоксила), а один или более сахаридов выбраны из второй группы, состоящей из MenC, MenY и MenW, которые конъюгированы с белком-носителем посредством химической группы второго типа на белке-носителе (например, аминогруппы).
В другом варианте осуществления изобретения, иммуногенная композиция согласно изобретению содержит MenA, конъюгированный посредством химической группы первого типа (например, карбоксила), и MenC, конъюгированный посредством химической группы второго типа (например, аминогруппы).
В другом варианте осуществления изобретения, иммуногенная композиция содержит MenС, конъюгированный посредством химической группы первого типа (например, карбоксила), и MenY, конъюгированый посредством химической группы второго типа (например, аминогруппы).
В другом варианте осуществления изобретения, иммуногенная композиция содержит MenА, конъюгированный посредством химической группы первого типа (например, карбоксила), и MenC, MenY и MenW, конъюгированые посредством химической группы второго типа (например, аминогруппы).
В другом варианте осуществления изобретения, иммуногенная композиция содержит MenA и MenC, конъюгированные посредством химической группы первого типа (например, карбоксила), и MenY и MenW, конъюгированые посредством химической группы второго типа (например, аминогруппы).
Сахариды согласно изобретению, включенные в фармацевтические (иммуногенные) композиции согласно изобретению, конъюгируют с белком-носителем, таким как столбнячный токсоид (TT), фрагмент столбнячного токсоида C, нетоксические мутанты столбнячного токсоида [следует отметить, что все такие варианты TT рассматриваются как белки-носители одного и того же типа, применяемые в целях осуществления изобретения], дифтерийный токсоид (DT), CRM197, другие нетоксические мутанты дифтерийного токсина [такие как CRM176, CRM 197, CRM228, CRM 45 (Uchida et al J. Biol. Chem. 218; 3838-3844, 1973); CRM 9, CRM 45, CRM102, CRM 103 и CRM107 и другие мутации, описанные Nicholls и Youle в Genetically Engineered Toxins, Ed: Frankel, Maecel Dekker Inc, 1992; делеция или мутация Glu-148 на Asp, Gln или Ser и/или Ala 158 на Gly и другие мутации, описанные в патентах США 4709017 или 4950740; мутация по меньшей мере одного или более остатков Lys 516, Lys 526, Phe 530 и/или Lys 534 и другие мутации, описанные в патентах США 5917017 или 6455673; или фрагмент, описанный в патенте США 5843711] (следует отметить, что все такие варианты DT рассматриваются как белки-носители одного и того же типа, применяемые в целях осуществления изобретения), пневмококковый пневмолизин (Kuo et al (1995) Infect Immun 63; 2706-13), OMPC (менингококковый внешний мембранный белок, обычно экстрагируемый из штамма N. meningitidis серологической группы B - EP0372501), синтетические пептиды (EP0378881, EP0427347), белки теплового шока (WO 93/17712, WO 94/03208), белки вируса коклюша (WO 98/58668, EP0471177), цитокины, лимфокины, факторы роста или гормоны (WO 91/01146), искусственные белки, содержащие множество эпитопов человеческих CD4+-Т-клеток, происходящих от различных патогенных антигенов (Falugi et al (2001) Eur J Immunol 31; 3816-3824), таких как белок N19 (Baraldoi et al (2004) Infect Immun 72; 4884-7), пневмококковый поверхностный белок PspA (WO 02/091998), белки, поглощающие железо (WO 01/72337), токсин A или B C. difficile (WO 00/61761) или белок D (EP594610 и WO 00/56360).
В одном из вариантов осуществления изобретения, в иммуногенной композиции согласно изобретению используются белки-носители одного и того же типа (независимо) по меньшей мере в двух, трех, четырех или в каждом из содержащихся в ней сахаридов.
В одном из вариантов осуществления изобретения, иммуногенная композиция согласно изобретению содержит сахарид N. meningitidis, конъюгированный с белком-носителем, выбранным из группы, состоящей из TT, DT, CRM197, фрагмента C TT и белка D.
Иммуногенная композиция согласно изобретению содержит, но необязательно, по меньшей мере один менингококковый сахаридный конъюгат (например, MenA; MenC; MenW; MenY; MenA и MenC; MenA и MenW; MenA и MenY; MenC и Men W; Men C и MenY; Men W и MenY; MenA, MenC и MenW; MenA, MenC и MenY; MenA, MenW и MenY; MenC, MenW и MenY или MenA, MenC, MenW и MenY), имеющий отношение сахарида Men к белку-носителю от 1:5 до 5:1, от 1:2 до 5:1, от 1:0,5 до 1:2,5 или от 1:1,25 до 1:2,5 (масс/масс). В одном предпочтительном варианте осуществления изобретения, композиция включает MenA, MenC, MenW и MenY, каждый из которых конъюгирован со столбнячным токсоидом в отношениях (токсоид: полисахарид) приблизительно 3, приблизительно 1,5 и приблизительно 1,3, соответственно.
Отношение сахарида к белку-носителю (масс/масс) в конъюгате может быть определено с использованием стерилизованного конъюгата. Количество белка определяют с помощью анализа Лаури (см., например, Lowry et al (1951) J. Biol. Chem. 193, 265-275 или Peterson et al Analytical Biochemistry 100, 201-220 (1979)), а количество сахарида определяют с использованием ICP-OES (индуктивно связанной плазменно-оптической эмиссионной спектроскопии) для MenA, анализа DMAP для MenC и анализа с использованием резорцина для MenW и MenY (Monsigny et al. (1988) Anal. Biochem. 175, 525-530).
В одном из вариантов осуществления изобретения, иммуногенная композиция согласно изобретению содержит сахаридный(е) конъюгат(ы) N. meningitidis, где сахарид(ы) N. meningitidis конъюгирован(ы) с белком-носителем посредством линкера, например, бифункционального линкера. Линкер является, но необязательно, гетеробифункциональным или гомобифункциональным линкером, имеющим, например, реакционноспособную аминогруппу и реакционноспособную группу карбоновой кислоты, 2 реакционноспособных аминогруппы или две реакционноспособных группы карбоновой кислоты. Линкер имеет, например, от 4 до 20, от 4 до 12, от 5 до 10 атомов углерода. Возможным линкером является ADH. Другими линкерами являются B-пропионамидо (WO 00/10599), нитрофенилэтиламин (Gever et al (1979) Med. Microbiol. Immunol. 165; 171-288), галогеналкильные галогениды (US4057685), гликозидные связи (US4673574, US4808700), гександиамин и 6-аминокапроевая кислота (US4459286).
Сахаридные конъюгаты, присутствующие в иммуногенных композициях согласно изобретению, могут быть получены любым известным методом конъюгирования. Метод конъюгирования может быть основан на активации сахарида тетрафторборатом 1-циано-4-диметиламинопиридиния (CDAP) с образованием сложного эфира цианата. Таким образом, активированный сахарид может быть связан непосредственно или посредством спейсерной (линкерной) группы с аминогруппой на белке-носителе. Так, например, спейсером может быть цистамин или цистеамин, который образует тиолированный полисахарид, который может быть присоединен к носителю посредством тиоэфирной связи, образованной после реакции взаимодействия с белком-носителем, активированным малеимидом (например, с использованием GMBS), или к холоацетилированному белку-носителю (например, с использованием иодацетамида или N-сукцинимидил-бромацетобромацетата). Сложный эфир цианата (полученный, но необязательно, с применением химической методики CDAP) присоединяют, но необязательно, к гександиамину или ADH, а амино-дериватизированный сахарид конъюгируют с белком-носителем с применением карбодиимидной химической методики (например, EDAC или EDC) посредством карбоксильной группы на белке-носителе. Такие конъюгаты описаны в опубликованной заявке PCT WO 93/15760 Университета Универсальных Технологий и в WO 95/08348 и WO 96/29094.
В других подходящих методах используются карбииниды, гидразиды, активные сложные эфиры, норборан, п-нитробензойная кислота, N-гидроксисукцинимид, S-NHS, EDC, TSTU. Многие из них описаны в WO 98/42721. Конъюгирование может быть осуществлено с использованием карбонильного линкера, который может образовываться посредством реакции взаимодействия свободной гидроксильной группы сахарида с CDI (Bethell et al J. Biol. Chem. 1979, 254; 2572-4, Hearn et al J. Chromatogr. 1981. 218; 509-18), с последующей реакцией взаимодействия с белком с образованием карбаматной связи. Такая реакция может быть осуществлена посредством восстановления аномерного конца до первичной гидроксильной группы, необязательной реакции защиты/снятия защиты первичной гидроксильной группы с CDI с образованием промежуточного карбамата CDI и связывания промежуточного карбамата CDI с аминогруппой на белке.
Конъюгаты могут быть также получены прямыми методами восстановительного аминирования, описанными в патенте США 4365170 (Jennings) и в патенте США 4673574 (Anderson). Другие методы описаны в EP-0-161-188, EP-208375 и EP-0-477508.
Другой метод включает связывание сахарида, активированного бромцианом (или CDAP) и дериватизированного гидразидом адипиновой кислоты (ADH), с белком-носителем посредством реакции карбодиимидной конденсации (Chu C. et al Infect. Immunity, 1983 245 256), например, с использованием EDAC.
В одном из вариантов осуществления изобретения, гидроксильная группа (необязательно активированная гидроксильная группа, например, гидроксильная группа, активированная сложным эфиром цианата) на сахариде связана с аминогруппой или карбоксильной группой на белке, либо непосредственно, либо опосредованно (посредством линкера). Если присутствует линкер, то гидроксильная группа на сахариде необязательно связана с аминогруппой на линкере, например, посредством конъюгирования с CDAP. Другая аминогруппа в линкере (например, ADH) может быть конъюгирована с группой карбоновой кислоты на белке, например, с применением химической карбодиимидной методики, например, с использованием EDAC. В одном из вариантов осуществления изобретения, капсулярный(е) сахарид(ы) N. meningitidis (или вообще любой сахарид) конъюгируют с линкером до его (их) контактирования с белком-носителем. Альтернативно, линкер может быть конъюгирован с носителем до конъюгирования с сахаридом.
Обычно, для проведения реакции сочетания/конъюгирования могут быть использованы химические группы нижеследующих типов на белке-носителе:
A) Карбоксил (например, посредством аспарагиновой кислоты или глутаминовой кислоты). В одном из вариантов осуществления изобретения, эту группу присоединяют к аминогруппам на сахаридах непосредственно или к аминогруппе на линкере с применением карбодиимидной химической методики, например, с использованием EDAC.
B) Аминогруппа (например, посредством лизина). В одном из вариантов осуществления изобретения, эту группу присоединяют к карбоксильным группам на сахаридах непосредственно или к карбоксильной группе на линкере с применением карбодиимидной химической методики, например, с использованием EDAC. В другом варианте осуществления изобретения, эту группу присоединяют к гидроксильным группам, активированным CDAP или CNBr, на сахаридах непосредственно или к таким гидроксильным группам на линкере; к сахаридам или линкерам, имеющим альдегидную группу; к сахаридам или линкерам, имеющим сукцинимидоэфирную группу.
C) Сульфгидрил (например, посредством цистеина). В одном из вариантов осуществления изобретения, эту группу присоединяют к бром- или хлорацетилированному сахариду или линкеру с применением малеимидной химической методики. В одном из вариантов осуществления изобретения, эту группу активируют/модифицируют бис-диазобензидином.
D) Гидроксильная группа (например, посредством тирозина). В одном из вариантов осуществления изобретения, эту группу активируют/модифицируют бис-диазобензидином.
E) Имидазолильная группа (например, посредством гистидина). В одном из вариантов осуществления изобретения, эту группу активируют/модифицируют бис-диазобензидином.
F) Гуанидильная группа (например, посредством аргинина).
G) Индолильная группа (например, посредством триптофана).
На сахариде, для связывания могут быть использованы, в основном, следующие группы: OH, COOH или NH2. Альдегидные группы могут быть получены после проведения различных обработок, известных специалистам, таких как обработка периодатом, кислотный гидролиз, обработка пероксидом водорода и т.п.
Методы прямого связывания:
Сахарид-OH+CNBr или CDAP -----> сложный эфир цианата+NH2-Prot ----> конъюгат
Сахарид-альдегид+NH2-Prot ----> шиффово основание+NaCNBH3 ----> конъюгат
Сахарид-COOH+NH2-Prot+EDAC ----> конъюгат
Сахарид-NH2+COOH-Prot+EDAC ----> конъюгат
Методы непрямого связывания посредством спейсера (линкера):
Сахарид-OH+CNBr или CDAP ---> сложный эфир цианата+NH2----NH2 ----> сахарид----NH2+COOH-Prot+EDAC -----> конъюгат
Сахарид-OH+CNBr или CDAP ----> сложный эфир цианата+NH2-----SH -----> сахарид----SH+SH-Prot (нативный белок с незащищенным цистеином или полученный после модификациии аминогрупп белка посредством, например, SPDP) -----> сахарид-S-S-Prot
Сахарид-OH+CNBr или CDAP ---> сложный эфир цианата+NH2----SH -------> сахарид----SH+малеимид-Prot (модификация аминогрупп) ----> конъюгат
Сахарид-COOH+EDAC+NH2-----NH2 ---> сахарид------NH2+EDAC+COOH-Prot ----> конъюгат
Сахарид-COOH+EDAC+ NH2----SH -----> сахарид----SH+SH-Prot (нативный белок с незащищенным цистеином или полученный после модификации аминогрупп белка посредством, например, SPDP)-----> сахарид-S-S-Prot
Сахарид-COOH+EDAC+ NH2----SH -----> сахарид----SH+малеимид-Prot (модификация аминогрупп) ----> конъюгат
Сахарид--альдегид+NH2-----NH2 ----> сахарид---NH2+EDAC+COOH-Prot ----> конъюгат
Примечание: вместо вышеописанного EDAC может быть использован любой подходящий карбодиимид.
В целом, химические группы белка-носителя этих типов, которые обычно используются в реакциях сочетания с сахаридом, представляют собой аминогруппы (например, на лизиновых остатках), группы COOH (например, на остатках аспарагиновой и глутаминовой кислоты) и группы SH (если они присутствуют) (например, на цистеиновых остатках).
В одном из вариантов осуществления изобретения, по меньшей мере один капсулярный сахарид N. meningitidis (или вообще любой сахарид) непосредственно конъюгируют с белком-носителем; сахарид(ы) Men W и/или MenY и/или MenC непосредственно конъюгируют, но необязательно, с белком-носителем. Так, например MenW; MenY; MenC; MenW и MenY; MenW и MenC; MenY и MenC; или MenW, MenY и MenC непосредственно присоединяют к белку-носителю. По меньшей мере один из капсулярных сахаридов N. meningitidis непосредственно конъюгируют, но необязательно, с использованием CDAP. Так, например MenW; MenY; MenC; MenW и MenY; MenW и MenC; MenY и MenC; или MenW, MenY и MenC непосредственно присоединяют к белку-носителю с использованием CDAP (см. WO 95/08348 и WO 96/29094). В одном из вариантов осуществления изобретения, все капсулярные сахариды N. meningitidis конъюгируют со столбнячным токсоидом.
В одном из вариантов осуществления изобретения, отношение сахарида Men W и/или Y к белку-носителю составляет от 1:0,5 до 1:2 (масс/масс), и/или отношение сахарида MenС к белку-носителю составляет от 1:0,5 до 1:4 или от 1:0,5 до 1:1,5 (масс/масс), а в частности, если эти сахариды непосредственно связаны с белком, необязательно посредством CDAP.
В одном из вариантов осуществления изобретения, по меньшей мере один из капсулярных сахаридов N. meningitidis (или вообще любой сахарид) конъюгируют с белком-носителем посредством линкера, например, бифункционального линкера. Линкер является, но необязательно, гетеробифункциональным или гомобифункциональным линкером, имеющим, например, реакционноспособную аминогруппу и реакционноспособную группу карбоновой кислоты, 2 реакционноспособных аминогруппы или 2 реакционноспособных группы карбоновой кислоты. Линкер имеет, например, от 4 до 20, от 4 до 12, от 5 до 10 атомов углерода. Линкером может быть ADH.
В одном из вариантов осуществления изобретения, MenA; MenC; или MenA и MenC конъюгируют с белком-носителем (например, со столбнячным токсоидом) посредством линкера.
В одном из вариантов осуществления изобретения, по меньшей мере один сахарид N. meningitidis конъюгируют с белком-носителем посредством линкера с использованием CDAP и EDAC. Так, например, MenA; MenC; или MenA и MenC конъюгируют с белком посредством линкера (например, с двумя гидразино-группами по концам, такими как ADH) с использованием CDAP и EDAC, описанных выше. Так, например, CDAP используют для конъюгирования сахарида с линкером, а EDAC используют для конъюгирования линкера с белком. Необязательно, конъюгирование посредством линкера дает отношение сахарид: белок-носитель от 1:0,5 до 1:6; от 1:1 до 1:5 или от 1:2 до 1:4, для MenA; MenC; или MenA и MenC.
В одном из вариантов осуществления изобретения, капсулярный сахарид MenA, если он присутствует по меньшей мере частично в O-ацетилированной форме, например, имеет по меньшей мере 50%, 60%, 70%, 80%, 90%, 95% или 98% повторяющихся звеньев, является O- ацетилированным по меньшей мере в одном положении. O- ацетилирование, например, достигается по меньшей мере в положении O-3 для по меньшей мере 50%, 60%, 70%, 80%, 90%, 95% или 98% повторяющихся звеньев.
В одном из вариантов осуществления изобретения, капсулярный сахарид MenC, если он присутствует по меньшей мере частично в O-ацетилированной форме, например, имеет по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 98% (α2 → 9)-связанных повторяющихся звеньев NeuNAc, является O-ацетилированным по меньшей мере в одном или двух положениях. O-ацетилирование, например, достигается в положениях O-7 и/или O-8 по меньшей мере для 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 98% повторяющихся звеньев.
В одном из вариантов осуществления изобретения, капсулярный сахарид MenW, если он присутствует по меньшей мере частично в O-ацетилированной форме, например, имеет по меньшей мере 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 98% повторяющихся звеньев, является O-ацетилированным по меньшей мере в одном или двух положениях. O-ацетилирование, например, достигается в положениях O-7 и/или O-9 по меньшей мере для 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 98% повторяющихся звеньев.
В одном из вариантов осуществления изобретения, капсулярный сахарид MenY, если он присутствует по меньшей мере частично в O-ацетилированной форме, например, имеет по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 98% повторяющихся звеньев, является O-ацетилированным по меньшей мере в одном или двух положениях. O-ацетилирование достигается в положениях 7 и/или 9 по меньшей мере для 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 98% повторяющихся звеньев.
Процент O-ацетилирования означает процент повторяющихся звеньев, содержащих O-ацетильную группу. Такой процент может быть определен в сахариде до конъюгирования и/или после конъюгирования.
В одном из вариантов осуществления изобретения, иммуногенную композицию, присутствующий сахарид или каждый присутствующий капсулярный сахарид N. meningitidis конъюгируют с TT. В другом варианте осуществления изобретения, каждый капсулярный сахарид N. meningitidis отдельно конъюгируют с отлельным белком-носителем. В другом варианте осуществления изобретения, каждый конъюгат капсулярного сахарида N. meningitidis имеет отношение сахарид:носитель 1:5-5:1 или 1:1-1:4 (масс/масс). В другом варианте осуществления изобретения, по меньшей мере один, два или три конъюгата капсулярного сахарида N. meningitidis непосредственно конъюгируют с белком-носителем. В другом варианте осуществления изобретения, Men W и/или MenY, MenW и/или MenC, MenY и/или MenC, или MenW и MenC и MenY непосредственно конъюгируют с белком-носителем. В другом варианте осуществления изобретения, меньшей мере один, два или три конъюгата капсулярного сахарида N. meningitidis непосредственно конъюгируют с применением химической CDAP-методики. В другом варианте осуществления изобретения, отношение сахарида Men W и/или Y к белку-носителю составляет от 1:0,5 до 1:2 (масс/масс). В другом варианте осуществления изобретения, отношение сахарида MenС к белку-носителю составляет от 1:0,5 до 1:2 (масс/масс). В другом варианте осуществления изобретения, по меньшей мере один, два или три капсулярных сахарида N. meningitidis конъюгируют с белком-носителем посредством линкера (который может быть бифункциональным, таким как линкер, имеющий две реакционноспособных аминогруппы (таких как ADH) или две реакционноспособных карбоксильных группы, или реакционноспособную аминогруппу у одного конца и реакционноспособную карбоксильную группу у другого конца). Линкер может иметь от 4 до 12 атомов углерода. В другом варианте осуществления изобретения, этот или каждый капсулярный сахарид N. meningitidis, конъюгированный посредством линкера, конъюгируют с линкером с применением химической CDAP-методики. В другом варианте осуществления изобретения, белок-носитель конъюгируют с линкером с применением химической карбодиимидной методики, например, с использованием EDAC. В другом варианте осуществления изобретения, этот или каждый капсулярный сахарид N. meningitidis конъюгируют с линкером до конъюгирования белка-носителя с линкером. В другом варианте осуществления изобретения, MenA конъюгируют с белком-носителем посредством линкера (отношение сахарида MenA к белку-носителю может составлять от 1:2 до 1:5 (масс/масс)). В другом варианте осуществления изобретения, MenC конъюгируют с белком-носителем посредством линкера (отношение сахарида MenС к белку-носителю может составлять от 1:2 до 1:5 (масс/масс)).
С использованием нативных полисахаридных конъюгатов или полисахаридных конъюгатов небольшого размера могут быть достигнуты одно или более из нижеследующих преимуществ: 1) конъюгат имеет высокую иммуногенность и может быть отфильтрован через 0,2-микронный фильтр; 2) иммунная память может быть улучшена (как в Примере 3); 3) отношение полисахарида к белку в конъюгате может быть изменено так, чтобы это отношение полисахарида к белку (масс/масс) было повышенным (это может приводить к снижению эффекта супрессии носителя); 4) иммуногенные конъюгаты, предрасположенные к гидролизу (такие как конъюгаты MenA), могут быть стабилизированы с использованием более крупных полисахаридов для конъюгирования. Использование более крупных полисахаридов может приводить к более эффективному перекрестному связыванию с носителем конъюгата и может уменьшать степень высвобождения свободного сахарида из конъюгата. Конъюгатные вакцины, описанные ранее в литературе, имеют тенденцию к деполимеризации полисахаридов до конъюгирования, что улучшает конъюгирование. Менингококковые (или сахаридные) конъюгатные вакцины, сохраняющие сахарид более крупного размера, могут давать хороший иммунный ответ против менингококкового заболевания.
Таким образом, иммуногенная композиция согласно изобретению может содержать один или более сахаридных конъюгатов, где средний размер каждого сахарида до конъюгирования превышает 50 кДа, 75 кДа, 100 кДа, 110 кДа, 120 кДа или 130 кДа. В одном из вариантов осуществления изобретения, конъюгат после конъюгирования должен легко фильтроваться через 0,2-микронный фильтр так, чтобы выход образца после фильтрации составлял более, чем 50, 60, 70, 80, 90 или 95% по сравнению с выходом образца до фильтрации.
В частности, иммуногенная композиция согласно изобретению включает капсулярные сахариды N. meningitidis по меньшей мере одной, двух, трех или четырех серологических групп A, C, W и Y, конъюгированные с белком-носителем, где средний размер (средневесовая молекулярная масса; Mw) по меньшей мере одного, двух, трех или четырех или каждого сахарида N. meningitidis превышает 50 кДа, 60 кДа, 75 кДа, 100 кДа, 110 кДа, 120 кДа или 130 кДа.
В предпочтительном варианте осуществления изобретения, средняя Mw конъюгата MenAAH-TT составляет по меньшей мере 250 кДа, 260 кДа, 270 кДа, 280 кДа или 290 кДа, наиболее предпочтительно, приблизительно 300 кДа, а максимум 350 кДа или 330 кДа. В предпочтительном варианте осуществления изобретения, средняя Mw конъюгата MenСAH-TT составляет по меньшей мере 150 кДа, 160 кДа, 170 кДа, 180 кДа или 190 кДа, наиболее предпочтительно, приблизительно 200 кДа, а максимум 250 кДа или 230 кДа. В предпочтительном варианте осуществления изобретения, средняя Mw конъюгата MenW-TT составляет по меньшей мере 240, 250 кДа, 260 кДа или 270 кДа, наиболее предпочтительно, приблизительно 280 кДа, а максимум 330 кДа или 310 кДа. В предпочтительном варианте осуществления изобретения, средняя Mw конъюгата MenY-TT составляет по меньшей мере 220 кДа, 230 кДа, 240 кДа или 250 кДа, наиболее предпочтительно, приблизительно 270 кДа, а максимум 320 кДа или 300 кДа.
Иммуногенная композиция может содержать капсулярные сахариды N. meningitidis по меньшей мере одной, двух, трех или четырех серологических групп A, C, W и Y, конъюгированные с белком-носителем, где по меньшей мере один, два, три или четыре сахарида или каждый сахарид N. meningitidis либо представляют собой нативный сахарид, либо имеют размер, измененный в 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз по сравнению со средневесовой молекулярной массой нативного полисахарида.
Используемый в настоящем изобретении термин «нативный полисахарид» означает сахарид, который не был подвергнут обработке в целях снижения размера сахарида. Размер полисахарида может немного уменьшаться во время обычных процедур очистки. Такой сахарид еще являются нативным. И только после проведения процедур по изменению размера, такой полисахарид больше не рассматривается как нативный.
Используемый в настоящем изобретении термин «изменение размера в 2 раза» означает, что сахарид был подвергнут процедуре уменьшения размера, но, при этом, сохраняет размер, составляющий более, чем половину размера нативного полисахарида. ×3, ×4 и т.п. интерпретируется таким же образом, то есть, сахарид был подвергнут процедуре снижения размера полисахарида, но сохранял размер более, чем на треть, четверть и т.п. от размера нативного полисахарида.
В одном из аспектов изобретения, иммуногенная композиция содержит капсулярные сахариды N. meningitidis по меньшей мере одной, двух, трех или четырех серологических групп A, C, W и Y, конъюгированные с белком-носителем, где по меньшей мере один, два, три или четыре сахарида или каждый сахарид N. meningitidis представляют собой нативный полисахарид.
В одном из аспектов изобретения, иммуногенная композиция содержит капсулярные сахариды N. meningitidis по меньшей мере одной, двух, трех или четырех серологических групп A, C, W и Y, конъюгированные с белком-носителем, где по меньшей мере один, два, три или четыре сахарида или каждый сахарид N. meningitidis имеют размер, измененный в 1,5, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз.
Иммуногенные композиции согласно изобретению включают, но необязательно, конъюгаты: капсулярного сахарида N. meningitidis серологической группы C (MenC); капсулярного сахарида серологической группы А (MenA); капсулярного сахарида серологической группы W135 (MenW); капсулярного сахарида серологической группы Y (MenY); капсулярных сахаридов серологической группы C и Y (MenCY); капсулярных сахаридов серологической группы C и A (MenAC); капсулярных сахаридов серологической группы C и W (MenCW); капсулярных сахаридов серологической группы серологической группы A и Y (MenAY); капсулярных сахаридов серологической группы A и W (MenAW); капсулярных сахаридов серологической группы W и Y (Men WY); капсулярных сахаридов серологической группы A, C и W (MenACW); капсулярных сахаридов серологической группы A, C и Y (MenACY); капсулярных сахаридов серологической группы A, W135 и Y (MenAWY), капсулярных сахаридов серологической группы C, W135 и Y (MenCWY); или капсулярных сахаридов серологической группы A, C, W135 и Y (MenACWY). В это определение входит «один, два, три или четыре», или «по меньшей мере один из сахаридов» серологических групп A, C, W и Y, или каждый упомянутый здесь сахарид N. meningitidis.
В одном из вариантов осуществления изобретения, средний размер по меньшей мере одного, двух, трех, четырех сахаридов или каждого сахарида N. meningitidis составляет от 50 кДа до 1500 кДа, от 50 кДа до 500 кДа, от 50 кДа до 300 KDa, от 101 кДа до 1500 кДа, от 101 кДа до 500 кДа, от 101 кДа до 300 кДа, как было определено с помощью MALLS.
В одном из вариантов осуществления изобретения, сахарид MenA, если он присутствует, имеет молекулярную массу 50-500 кДа, 50-100 кДа, 100-500 кДа, 55-90 кДa, 60-70 кДа или 70-80 кДа или 60-80 кДа.
В одном из вариантов осуществления изобретения, сахарид MenС, если он присутствует, имеет молекулярную массу 100-200 кДа, 50-100 кДа, 100-150 кДа, 101-130 кДа, 150-210 кДа или 180-210 кДа.
В одном из вариантов осуществления изобретения, сахарид MenY, если он присутствует, имеет молекулярную массу 60-190 кДа, 70-180 кДа, 80-170 кДа, 90-160 кДа, 100-150 кДа или 110-140 кДа, 50-100 кДа, 100-140 кДа, 140-170 кДа или 150-160 кДа.
В одном из вариантов осуществления изобретения, сахарид MenW, если он присутствует, имеет молекулярную массу 60-190 кДа, 70-180 кДа, 80-170 кДа, 90-160 кДа, 100-150 кДа, 110-140 кДа, 50-100 кДа или 120-140 кДа.
Молекулярная масса или средняя молекулярная масса описанного здесь сахарида означает средневесовую молекулярную массу (Mw) сахарида, определенную до конъюгирования и измеренную с помощью MALLS.
Метод MALLS хорошо известен специалистам и обычно осществляется как описано в Примере 2. Для анализа MALLS менингококковых сахаридов может быть использована комбинация из двух колонок (TSKG6000 и 5000PWxl), и эти сахариды элюируют в воде. Сахариды детектируют на детекторе рассеяния света (например, на Wyatt Dawn DSP, снабженном аргоновым лазером мощностью 10 мВт на 488 нм) и на интерферометрическом рефрактометре (например, Wyatt Otilab DSP, снабженном ячейкой P100 и красным фильтром на 498 нм).
В одном из вариантов осуществления изобретения, сахариды N. meningitidis представляют собой нативные полисахариды или нативные полисахариды, размер которых снижается в стандартном процессе экстракции.
В одном из вариантов осуществления изобретения, сахариды N. meningitidis калибруют по размеру путем механического расщепления, например, путем микрофлюидизации или ультразвуковой обработки. Микрофлюидизация или ультразвуковая обработка имеют то преимущество, что они позволяют снижать размер более крупных нативных полисахаридов до уровня, достаточного для получения фильтруемого конъюгата (например, через 0,2-микронный фильтр). Изменение размера может составлять не более, чем в 20, 10, 8, 6, 5, 4, 3, 2 или 1,5 раза.
В одном из вариантов осуществления изобретения, иммуногенная композиция содержит конъюгаты N. meningitidis, полученные из смеси нативных полисахаридов и сахаридов, размер которых изменен не более, чем в 20 раз. Так, например, сахариды MenC и/или MenA являются нативными. Так, например, сахариды MenY и/или MenW имеют размер, измененный не более, чем в 20, 10, 8, 6, 5, 4, 3 или 2 раза. Так, например, иммуногенная композиция содержит конъюгат, полученный из MenY и/или MenW и/или MenC и/или MenA, имеющий размер, измененный не более, чем в 10 раз, и/или подвергнутый микрофлюидизации. Так, например, иммуногенная композиция содержит конъюгат, полученный из нативных MenA и/или MenC и/или MenW и/или MenY. Так, например, иммуногенная композиция содержит конъюгат, полученный из нативного MenC. Так, например, иммуногенная композиция включает конъюгат, полученный из нативных MenC и MenA, имеющий размер, измененный не более, чем в 10 раз, и/или подвергнутый микрофлюидизации. Так, например, иммуногенная композиция включает конъюгат, полученный из нативных MenC и MenY, имеющий размер, измененный не более, чем в 10 раз и/или подвергнутый микрофлюидизации.
В одном из вариантов осуществления изобретения, полидисперсность сахарида составляет 1-1,5, 1-1,3, 1-1,2, 1-1,1 или 1-1,05, а после конъюгирования с белком-носителем, полидисперсность сахарида составляет 1,0-2,5, 1,0-2,0, 1,0-1,5, 1,0-1,2, 1,5-2,5, 1,7-2,2 или 1,5-2,0. Все измерения полидисперсности проводили с помощью MALLS.
Сахариды имеют, но необязательно, размер, который в 1,5, 2, 4, 6, 8, 10, 12, 14, 16, 18 или 20 раз отличается от размера полисахарида, выделенного из бактерий.
В одном из вариантов осуществления изобретения, каждый сахарид N. meningitidis представляет собой либо нативный полисахарид, либо полисахарид, размер которого отличается не более, чем в 10 раз. В другом варианте осуществления изобретения, каждый капсулярный сахарид N. meningitidis представляет собой нативный полисахарид. В другом варианте осуществления изобретения, по меньшей мере один, два, три или четыре капсулярных сахарида N. meningitidis были откалиброваны по размеру посредством микрофлюидизации. В другом варианте осуществления изобретения, каждый капсулярный сахарид N. meningitidis имеет размер, измененный не более, чем в 10 раз. В другом варианте осуществления изобретения, конъюгаты N. meningitidis получают из смеси нативных полисахаридов и сахаридов, размер которых изменен не более, чем в 10 раз. В другом варианте осуществления изобретения, капсулярный сахарид серологической группы Y имеет размер, измененный не более, чем в 10 раз. В другом варианте осуществления изобретения, капсулярные сахариды серологических групп A и C представляют собой нативные полисахариды, а сахариды серологических групп W135 и Y имеют размер, измененный не более, чем в 10 раз. В другом варианте осуществления изобретения, средний размер каждого капсулярного сахарида N. meningitidis составляет 50 кДа - 300 KDa или 50 кДа - 200 кДа. В другом варианте осуществления изобретения, иммуногенная композиция содержит капсулярный сахарид MenA, имеющий средний размер выше 50 кДа, 75 кДа, 100 кДа или средний размер 50-100 кДа или 55-90 кДа или 60-80 кДа. В другом варианте осуществления изобретения, иммуногенная композиция содержит капсулярный сахарид MenC, имеющий средний размер выше 50 кДа, 75 кДа, 100 кДа или 100-200 кДа, 100-150 кДа, 80-120 кДа, 90-110 кДа, 150-200 кДа, 120-240 кДа, 140-220 кДа, 160-200 кДа или 190-200 кДа. В другом варианте осуществления изобретения, иммуногенная композиция содержит капсулярный сахарид MenY, имеющий средний размер выше 50 кДа, 75 кДа, 100 кДа или 60-190 кДа или 70-180 кДа или 80-170 кДа или 90-160 кДа или 100-150 кДа, 110-145 кДа или 120-140 кДа. В другом варианте осуществления изобретения, иммуногенная композиция содержит капсулярный сахарид MenW, имеющий средний размер выше 50 кДа, 75 кДа, 100 кДа или 60-190 кДа или 70-180 кДа или 80-170 кДа или 90-160 кДа или 100-150 кДа, 140-180 кДа, 150-170 кДа или 110-140 кДа.
В одном из вариантов осуществления изобретения, дозы сахарида каждого из по меньшей мере двух, трех, четырех конъюгатов или каждого конъюгата сахарида N. meningitidis являются, но необязательно, одинаковыми или приблизительно одинаковыми.
В одном из вариантов осуществления изобретения, иммуногенную композицию согласно изобретению доводят до значений или забуферивают при значениях или корректируют до значений pH 7,0-8,0, pH 7,2-7,6 или приблизительно или точно до pH 7,4.
Иммуногенную композицию или вакцины согласно изобретению лиофилизуют, но необязательно, в присутствии стабилизирующего агента, например, полиола, такого как сахароза или трегалоза.
В случае комбинаций сахаридов N. meningitidis, обсуждаемых выше, может оказаться предпочтительным не использовать какой-либо адъювант в виде соли алюминия, либо вообще не использовать адъювант.
Активный агент может присутствовать в фармацевтической композиции или в вакцине согласно изобретению в различных концентрациях. Обычно, минимальная концентрация вещества представляет собой количество, необходимое для его использования в нужных целях, а максимальная концентрация представляет собой максимальное количество, которое будет сохраняться в растворе или гомогенно суспендироваться в исходной смеси. Так, например, минимальное количество терапевтического средства представляет собой, но необязательно, количество, которое обеспечивает одну терапевтически эффективную дозу. В случае биоактивных веществ, минимальная концентрация представляет собой количество, необходимое для достижения биологической активности после разведения, а максимальная концентрация представляет собой количество, при котором не может сохраняться гомогенная суспензия.
В другом варианте осуществления изобретения, композиция включает конъюгат из капсулярного полисахарида Neisseria meningitidis серологической группы X и молекулы-носителя. Структура капсулярного полисахарида группы X состоит из N-ацетилглюкозамин-4-фосфатных остатков, связанных друг с другом посредством α-4-фосфодиэфирных связей без O-ацетильных групп. Молекула-носитель может представлять собой дифтерийный или столбнячный токсоид, CRM 197 или белок D. В предпочтительном варианте осуществления изобретения, как показано в Примерах, композиция не включает конъюгат капсулярного полисахарида N. meningitidis серологической группы X.
Стабильность
Термины «стабильный» и «стабильность» относятся к способности антигена сохранять иммуногенность в течение определенного периода времени. Стабильность может быть оценена по активности в течение определенного периода времени. Термины «стабильный» и «стабильность» также относятся к физической, химической и конформационной стабильности иммуногенной композиции. Нестабильность композиции белка может быть вызвана химическим расщеплением или агрегацией белковых молекул с образованием полимеров высшего порядка; диссоциацией гетеродимеров на мономеры; дегликозилированием; модификацией гликозилирования или любой другой структурной модификацией, которая снижает по меньшей мере одну биологическую активность композиции белка, включенной в настоящее изобретение. Стабильность может быть оценена хорошо известными методами, включая измерение рассеяния света в образце, кажущегося ослабления света (поглощающей способности или оптической плотности), размера (например, с помощью эксклюзионной хроматографии), in vitro или in vivo биологической активности и/или свойств с помощью дифференциальной сканирующей калориметрии (ДСК). Другие методы оценки стабильности известны специалистам и могут быть также применены в соответствии с настоящим изобретением.
В некоторых вариантах осуществления изобретения, антиген в стабильной композиции согласно изобретению может сохранять, по сравнению с эталонным стандартом, по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% активность в течение по меньшей мере 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 9 месяцев, 12 месяцев, 18 месяцев, 24 месяцев, 30 месяцев, 36 месяцев, 42 месяцев, 48 месяцев, 54 месяцев или 60 месяцев. В некоторых вариантах осуществления изобретения, антиген в стабильной композиции согласно изобретению может сохранять, по сравнению с эталонным стандартом, по меньшей мере 50% активность в течение по меньшей мере 1 года, 2 лет, 3 лет, 4 лет или 5 лет. Термины «стабильный» и «стабильность» также относятся к способности антигена сохранять эпитопы или иммунореактивность в течение определенного периода времени. Так, например, антиген стабильной композиции согласно изобретению может сохранять, по сравнению с эталонным стандартом, по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% эпитопов или иммунореактивности, по меньшей мере в течение 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 9 месяцев, 12 месяцев, 18 месяцев, 24 месяцев, 30 месяцев, 36 месяцев, 42 месяцев, 48 месяцев, 54 месяцев или 60 месяцев. В некоторых вариантах осуществления изобретения, стабильность измеряют в зависимости от условий окружающей среды. Неограничивающими примерами условий окружающей среды являются свет, температура, циклы замораживания/оттаивания, перемешивание и pH. Специалист в данной области может определить присутствие антигенных эпитопов или иммунореактивность описанными здесь методами или другими известными методами. В некоторых вариантах осуществления изобретения, стабильность антигена измеряют с момента его получения. В некоторых вариантах осуществления изобретения, стабильность антигена измеряют с момента изменения условий его хранения. Неограничивающими примерами изменения условий хранения являются переход от замороженного состояния в охлажденное, от замороженного состояния до комнатной температуры, от охлажденного состояния до комнатной температуры, от охлажденного состояния в замороженное состояние, от комнатной температуры в замороженное состояние, от комнатной температуры в охлажденное состояние, перенос из света в темноту или начало перемешивания.
В одном из вариантов осуществления изобретения, термины «стабильный» и «стабильность» относятся к способности антигена связываться с алюминием. Так, например, стабильная композиция согласно изобретению включает по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% белка, который связывается с алюминием (например, с фосфатом алюминия) в композиции по сравнению с эталонным стандартом в течение по меньшей мере 1 часа, 6 часов, 12 часов, 18 часов, 24 часов, 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 9 месяцев, 12 месяцев, 18 месяцев, 24 месяцев, 30 месяцев, 36 месяцев, 42 месяцев, 48 месяцев, 54 месяцев или 60 месяцев. См., например, Пример 13. В предпочтительном варианте осуществления изобретения, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, а наиболее предпочтительно, по меньшей мере 99% всего полипептида подсемейства A rLP2086 (например, полипептида, который включает аминокислотную последовательность, представленную в SEQ ID NO: 1) связывается с алюминием в композиции. В предпочтительном варианте осуществления изобретения, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, а наиболее предпочтительно, по меньшей мере 99% всего полипептида подсемейства В rLP2086 (например, полипептида, который включает аминокислотную последовательность, представленную в SEQ ID NO: 2) связывается с алюминием в композиции.
Определение связывания с алюминием. Композицию, содержащую алюминий и по меньшей мере один белковый антиген, центрифугировали так, чтобы это приводило к осаждению алюминия. Центрифугирование белков, абсорбированных на алюминии, известно специалистам. См., например, Egan et al., Vaccine, Vol. 27(24): 3175-3180 (2009). Белок, связанный с алюминием, осаждался, а белок, не связанный с алюминием, оставался в супернатанте. Общий белок в супернатанте и в осадке определяли с помощью анализа Лаури. Процент связанного белка вычисляли путем деления количества общего белка в супернатанте на количество общего белка, добавленного в композицию, и умножения полученного результата на 100%. Аналогичным образом, процент несвязанного белка вычисляли путем деления количества общего белка в супернатанте на количество общего белка, добавленного в композицию, и умножения полученного результата на 100%. Для композиций, содержащих оба антигена подсемейства А и подсемейства B, концентрации отдельных белков подсемейства А и В в супернатанте определяли с помощью ионообменной хроматографии. Разделение и элюирование белков подсемейства А и В осуществляли на колонке с сильным анионом и элюентом с высокой концентрацией соли. Оба белка подсемейства A и B детектировали и количественно оценивали с использованием серии детекторов флуоресценции на длине волны возбуждения=280 нм и длине волны излучения=310 нм. Белки подсемейства А и подсемейства В элюировались с разным временем удерживания и были количественно оценены путем построения стандартной кривой по данным по сравнению с данными для эталонного белка rLP2086. Процент несвязанного белка вычисляли путем деления количества общего белка в супернатанте на количество общего белка, добавленного в композицию, и умножения полученного результата на 100%. Процент связанного белка вычисляли путем вычитания процента несвязанного белка из 100%.
ПОЛИСОРБАТ-80
Полисорбат 80 (PS-80) представляет собой неионное поверхностно-активное вещество. Перспективные исследования стабильности с помощью анализа на активность in vitro на основе моноклонального антитела продемонстрировали настабильность белка подсемейства В в более высоких молярных отношениях PS-80 к белку MnB rLP2086 в конечной композиции. Дополнительные эксперименты с различными отношениями PS-80 показали, что оптимальное молярное отношение PS-80 к белку MnB rLP2086 составляет приблизительно 2,8 ± 1,4, что указывает на сохранение активности.
Концентрация PS-80 в композиции зависит от молярного отношения PS-80 к полипептиду. В одном из вариантов осуществления изобретения, композиция имеет молярное отношение PS-80 к первому полипептиду и ко второму полипептиду, составляющее 2,8±1,4. В одном из вариантов осуществления изобретения, композиция имеет молярное отношение PS-80 к первому полипептиду и ко второму полипептиду, составляющее 2,8±1,1. В одном из вариантов осуществления изобретения, композиция имеет молярное отношение PS-80 к полипептиду, составляющее по меньшей мере 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2 или 3,3. В одном из вариантов осуществления изобретения, композиция имеет молярное отношение PS-80 к полипептиду, составляющее максимум 4,0, 3,9, 3,8, 3,7, 3,6, 3,5, 3,4, 3,3, 3,2, 3,1, 3,0 или 2,9. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала. Предпочтительно, композиция имеет молярное отношение PS-80 к полипептиду, составляющее 2,8.
Молярное отношение PS-80 к полипептиду определяют путем вычисления исходя из измеренной концентрации PS-80 и измеренной концентрации общего полипептида, где обе величины выражены в молях. Так, например, молярное отношение PS-80 к белку определяют путем вычисления отношения измеренной концентрации PS-80 (например, с помощью обращенно-фазовой жидкостной хроматографии высокого давления (ОФ-ЖХВД)) к измеренной концентрации общего белка (например, с помощью ионообменной хроматографии-жидкостной хроматографии высокого давления (ИОХ-ЖХВД)) в конечном лекарственном веществе, где обе величины выражены в молях.
ОФ-ЖХВД проводят для количественной оценки концентрации полисорбата 80 в вакцинных композициях. Концентрацию детергента определяют после омыления группы жирной кислоты, и полисорбат 80 превращают в свободную олеиновую кислоту посредством щелочного гидролиза при 40°C. Образец разделяют с помощью ОФ-ЖХВД на колонке с C18 и количественно оценивают на УФ-детекторе на длине волны 200 нм.
Первый и второй полипептиды разделяют с помощью анионообменной ЖХВД. Белки rLP2086 (fHBP) подсемейства А и В элюировались с разным временем удерживания и были количественно оценены путем построения стандартной кривой по данным по сравнению с данными для эталонного белка rLP2086.
Термин «молярное отношение» и описание иммуногенной композиции, включающей fHBP и PS-80, также раскрывается в WO2012025873 и в публикации заявки на патент США 2013/0171194, которые включены в настоящее описание посредством ссылки в полном объеме.
Используемый здесь термин «молярное отношение» означает отношение числа молей двух различных элементов в композиции. В некоторых вариантах осуществления изобретения, молярное отношение представляет собой отношение молей детергента к молям полипептида. В некоторых вариантах осуществления изобретения, молярное отношение представляет собой отношение молей PS-80 к молям белка. В одном из вариантов осуществления изобретения, исходя из концентраций белка и полисорбата 80, молярное отношение может быть вычислено по следующему уравнению:
Молярное отношение=% PS-80 × 216
мг/мл белка
В одном из вариантов осуществления изобретения, композиция включает молярное отношение PS-80 к белку MnB rLP2086 от 1,4 до 4,2, что указывает на сохранение активности. В одном из вариантов осуществления изобретения, композиция имеет молярное отношение по меньшей мере 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7 или 2,8. В одном из вариантов осуществления изобретения, композиция имеет молярное отношение максимум 4,2, 4,1, 4,0, 3,9, 3,8, 3,7, 3,7, 3,6, 3,5, 3,4, 3,3, 3,2, 3,1, 3,0, 2,9 или 2,8. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала.
В одном из вариантов осуществления изобретения, композиция включает приблизительно 0,0015, 0,0017, 0,0019, 0,0021, 0,0023, 0,0025, 0,0027, 0,0029, 0,0031, 0,0033, 0,0035, 0,0037, 0,0039, 0,0041, 0,0043, 0,0045, 0,0047, 0,0049, 0,0051 мг/мл PS-80. Предпочтительно, композиция включает приблизительно 0,0035 мг/мл PS-80.
В другом варианте осуществления изобретения, композиция включает по меньшей мере 10 мкг, 11 мкг, 12 мкг, 13 мкг, 14 мкг, 15 мкг, 16 мкг, 17 мкг, 18 мкг, 19 мкг, 20 мкг, 21 мкг, 22 мкг, 23 мкг, 24 мкг, или 25 мкг PS-80. В другом варианте осуществления изобретения, композиция включает максимум 30 мкг, 29 мкг, 28 мкг, 27 мкг, 26 мкг, 25 мкг, 24 мкг, 23 мкг, 22 мкг, 21 мкг, 20 мкг, 19 мкг или 18 мкг PS-80. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала. В предпочтительном варианте осуществления изобретения, композиция включает по меньшей мере 10 мкг и максимум 20 мкг PS-80. В наиболее предпочтительном варианте осуществления изобретения, композиция включает приблизительно 18 мкг PS-80.
В другом варианте осуществления изобретения, композиция включает PS-80 в концентрации в пределах от 0,0005% до 1%. Так, например, концентрация PS-80 в композиции может составлять по меньшей мере 0,0005%, 0,005%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,10%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1% или 1,1% PS-80. В одном из вариантов осуществления изобретения, концентрация PS-80 в композиции может составлять максимум 2,0%, 1,9%, 1,8%, 1,7%, 1,6%, 1,5%, 1,4%, 1,3%, 1,2%, 1,1%, 1,0%, 0,9%, 0,8%, или 0,7% PS-80. В предпочтительном варианте осуществления изобретения, композиция включает приблизительно 0,07% PS-80. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала.
Авторами настоящего изобретения было неожиденно обнаружено, что хотя композиция, включающая комбинацию первой композиции и второй композиции, может иметь другое молярное отношение полисорбата-80 к полипептидам MnB rLP2086, по сравнению с молярным отношением полисорбата-80 к полипептидам MnB rLP2086 в первой композиции, однако, дополнительное поверхностно-активное вещество для объединенной композиции неожиданно не является необходимым для сохранения растворимости и стабильности полипептидов MnB rLP2086 в объединенной композиции. В соответствии с этим, в одном варианте осуществления изобретения, набор не содержит более, чем 0,02 мг полисорбата-80.
Алюминий
Композиция включает алюминий в виде фосфата алюминия. AlPO4 добавляют как стабилизатор для улучшения технологических свойств и повышения стабильности. Способ получения фосфата алюминия описан в публикации заявки на патент США 2009/0016946, которая включена в настоящее описание посредством ссылки в полном объеме. В одном из вариантов осуществления изобретения, композиция также не включает поливалентный катион, не являющийся алюминием. В одном из вариантов осуществления изобретения, композиция также не включает Al(OH)3 или Al(SO4)3.
В одном из вариантов осуществления изобретения, композиция включает по меньшей мере 50 мкг, 60 мкг, 70 мкг, 80 мкг, 90 мкг,100 мкг,110 мкг, 120 мкг, 130 мкг, 140 мкг, 150 мкг, 160 мкг, 170 мкг, 180 мкг, 190 мкг, 200 мкг, 210 мкг, 220 мкг, 230 мкг, 240 мкг или 250 мкг алюминия. В одном из вариантов осуществления изобретения, композиция включает максимум 500 мкг, 490 мкг, 480 мкг, 470 мкг, 460 мкг, 450 мкг, 440 мкг, 430 мкг, 420 мкг, 410 мкг, 400 мкг, 390 мкг, 380 мкг, 370 мкг, 360 мкг, 350 мкг, 340 мкг, 330 мкг, 320 мкг, 310 мкг, 300 мкг, 290 мкг, 280 мкг, 270 мкг, 260 мкг или 250 мкг алюминия. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала. В наиболее предпочтительном варианте осуществления изобретения, композиция включает 250 мкг алюминия.
В одном из вариантов осуществления изобретения, композиция включает по меньшей мере 0,005 мг/мл, 0,01 мг/мл, 0,02 мг/мл, 0,03 мг/мл, 0,04 мг/мл, 0,05 мг/мл, 0,06 мг/мл, 0,07 мг/мл, 0,08 мг/мл, 0,09 мг/мл, 0,10 мг/мл, 0,2 мг/мл, 0,3 мг/мл, 0,4 мг/мл или 0,5 мг/мл фосфата алюминия. В одном из вариантов осуществления изобретения, композиция включает максимум 2,0 мг/мл, 1,9 мг/мл, 1,8 мг/мл, 1,7 мг/мл, 1,6 мг/мл, 1,5 мг/мл, 1,4 мг/мл, 1,3 мг/мл, 1,2 мг/мл, 1,1 мг/мл, 1,0 мг/мл, 0,9 мг/мл, 0,8 мг/мл, или 0,7 мг/мл PS-80. В предпочтительном варианте осуществления изобретения, композиция включает приблизительно 0,07 мг/мл PS-80. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала. В предпочтительном варианте осуществления изобретения, композиция включает 0,5 мг/мл фосфата алюминия. В наиболее предпочтительном варианте осуществления изобретения, композиция включает 0,5 мг алюминия/мл в виде фосфата алюминия (AlPO4). Эта концентрация сохраняет связывание (по меньшей мере 90% связывание или выше) белков подсемейства A и B с алюминием.
Авторами настоящего изобретения было неожиданно обнаружено, что хотя композиция, включающая комбинацию первой композиции и второй композиции, может изменять процент полипептидов MnB rLP2086, связанных с алюминием, по сравнению с процентом полипептидов MnB rLP2086, связанных с алюминием в первой композиции, однако, комбинация первой и второй композиций неожиданно сохраняла связывание по меньшей мере 90% всех полипептидов MnB rLP2086 с алюминием. В соответствии с этим, в одном варианте осуществления изобретения, процент всех полипептидов MnB rLP2086 по отношению к алюминию в объединенной композиции составляет по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. Предпочтительно, процент всех полипептидов MnB rLP2086 по отношению к алюминию в объединенной композиции составляет по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, а наиболее предпочтительно, по меньшей мере 100%.
В другом варианте осуществления изобретения, концентрация полипептидов, связанных с алюминием в иммуногенной композиции, не снижалась через 24 часа по сравнению с концентрацией полипептидов, связанных с алюминием в жидкой композиции, до разведения лиофилизованной композиции. В другом варианте осуществления изобретения, концентрация конъюгата MenAAH-TT в иммуногенной композиции не снижалась через 24 часа по сравнению с концентрацией конъюгата MenAAH-TT в лиофилизованной композиции. В одном из вариантов осуществления изобретения, концентрация снижалась максимум на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19% или 20% через 24 часа по сравнению с соответствующей концентрацией в жидкой композиции до разведения.
В другом варианте осуществления изобретения, концентрация конъюгата MenCAH-TT в иммуногенной композиции не снижалась через 24 часа по сравнению с концентрацией конъюгата MenСAH-TT в лиофилизованной композиции. В другом варианте осуществления изобретения, концентрация конъюгата MenW-TT в иммуногенной композиции не снижалась через 24 часа по сравнению с концентрацией конъюгата MenW-TT в лиофилизованной композиции. В другом варианте осуществления изобретения, концентрация конъюгата MenY-TT в иммуногенной композиции не снижалась через 24 часа по сравнению с концентрацией конъюгата MenY-TT в лиофилизованной композиции. В одном из вариантов осуществления изобретения, концентрация снижалась максимум на 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, или 20% через 24 часа по сравнению с соответствующей концентрацией в лиофилизованной композиции до разведения.
Наполнители
В одном из вариантов осуществления изобретения, композиция включает гистидин. В одном из вариантов осуществления изобретения, композиция включает по меньшей мере 650 мкг, 660 мкг, 670 мкг, 680 мкг, 690 мкг, 700 мкг, 710 мкг, 720 мкг, 730 мкг, 740 мкг, 750 мкг, 760 мкг, 770 мкг, 780 мкг, 790 мкг, 800 мкг, 810 мкг, 820 мкг, 830 мкг, 840 мкг или 850 мкг гистидина. В одном из вариантов осуществления изобретения, композиция включает максимум 1560 мкг, 1500 мкг, 1400 мкг, 1300 мкг, 1200 мкг, 1100 мкг, 1000 мкг, 950 мкг, 900 мкг, 890 мкг, 880 мкг, 870 мкг, 860 мкг, 850 мкг, 840 мкг, 830 мкг, 820 мкг, 810 мкг, 800 мкг, 790 мкг или 780 мкг гистидина. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала. Предпочтительно, композиция включает 780 мкг гистидина.
В одном из вариантов осуществления изобретения, композиция включает Трис-буфер, фосфатный буфер или сукцинатный буфер. В предпочтительном варианте осуществления изобретения, композиция не включает Трис-буфер. В предпочтительном варианте осуществления изобретения, композиция не включает фосфатный буфер. В одном предпочтительном варианте осуществления изобретения, композиция не включает сукцинатный буфер. В предпочтительном варианте осуществления изобретения, композиция включает гистидиновый буфер.
В одном из вариантов осуществления изобретения, композиция включает хлорид натрия. Концентрация хлорида натрия в композиции MenABCWY может варьироваться в пределах 160,5-161,1 мМ.
В одном из вариантов осуществления изобретения, pH композиции составляет 5,5-7,5. В предпочтительном варианте осуществления изобретения, pH композиции составляет 5,8-7,0, а наиболее предпочтительно, pH 5,8-6,0. В одном из вариантов осуществления изобретения, pH композиции составляет максимум 6,1. В одном из вариантов осуществления изобретения, pH композиции составляет 5,8.
Наборы
Другим аспектом изобретения является набор для введения дозы композиции для вырабатывания бактерицидных антител против Neisseria meningitidis у млекопитающего.
В одном из аспектов изобретения, набор включает первую композицию, содержащую первый полипептид, описанный выше, и второй полипептид, описанный выше. В предпочтительном варианте осуществления изобретения, первый полипептид включает аминокислотную последовательность, представленную в SEQ ID NO: 1. В другом предпочтительном варианте осуществления изобретения, второй полипептид включает аминокислотную последовательность, представленную в SEQ ID NO: 2. Набор также включает вторую композицию, содержащую конъюгат MenAAH-TT, конъюгат MenCAH-TT, конъюгат MenW-TT и конъюгат MenY-TT. В одном из вариантов осуществления изобретения, набор включает по меньшей мере два контейнера, где первый контейнер содержит первую композицию, а второй контейнер содержит вторую композицию.
В одном из вариантов осуществления изобретения, набор включает жидкую первую композицию и лиофилизованную вторую композицию. Предпочтительно, набор включает жидкую двухвалентную композицию MnB rLP2086 и лиофилизованную композицию MenACWY-TT.
Авторами настоящего изобретения было неожиденно обнаружено, что хотя композиция, включающая комбинацию первой композиции и второй композиции, может иметь другое молярное отношение полисорбата-80 к полипептидам MnB rLP2086 в первой композиции, однако, неожиданным оказалось то, что дополнительное поверхностно-активное вещество для объединенной композиции не является необходимым для сохранения растворимости и стабильности полипептидов MnB rLP2086 в объединенной композиции. В соответствии с этим, в одном варианте осуществления изобретения, набор не содержит более, чем 0,02 мг полисорбата-80.
В одном из вариантов осуществления изобретения, набор также не включает ни одну из следующих коммерчески доступных иммуногенных композиций: MENACTRA(R), MENVEO(R), ADACEL(R), HAVRIX(R), GARDASIL(R), REPEVAX или любых их комбинаций. Так, например, набор также, предпочтительно, не включает композицию конъюгата менингококкового полисахарида A, C, Y и W-135 (MCV4), где белком-носителем является дифтерийный токсоид. В одном из вариантов осуществления изобретения, набор также, предпочтительно, не включает композицию конъюгата менингококкового полисахарида A, C, Y и W-135 (MCV4), где белком-носителем является CRM197. В одном из вариантов осуществления изобретения, набор также не включает вакцину NIMENRIX, где NIMENRIX содержит разбавитель, состоящий из хлорида натрия и воды.
Бактерицидная активность
Заболеваемость MnB составляет приблизительно 1 на 100000, и это означает, что для подтверждения статистически значимой оценки эффективности может потребоваться очень большое число индивидуумов (от 400000 до свыше 6 миллионов). Таким образом, анализ на бактерицидную активность сыворотки, проводимый с использованием человеческого комплемента (hSBA), который представляет собой суррогатный маркер протективного действия вакцины и ее эффективности, проводится для оценки иммуногенности в клинических испытаниях.
Пфайзер, с 2000 по 2006 год, собрал большой набор штаммов MnB (N=по меньшей мере 1263), включающий изоляты, вызывающие ИМЗ. Изоляты MnB систематически собирались специалистами Центров США по лечению и профилактике заболеваний (CDC) и специалистами Лабораторий по охране здоровья и Лабораторий по эталонам в странах Европы.
В одном из вариантов осуществления изобретения, иммунный ответ, индуцированный введением композиции человеку, определяют с помощью анализа на бактерицидную активность сыворотки с использованием человеческого комплемента (hSBA) против четырех штаммов N. meningitidis серологической группы B (MnB). Штаммы MnB, используемые в hSBA, были отобраны из пула штаммов. Пул штаммов представляет собой коллекцию систематически собранных клинически релевантных штаммов N. meningitidis.
Высокий уровень ответа hSBA на все тестируемые штаммы, а в частности, штаммы, экспрессирующие варианты липопротеина 2086 с последовательностями, гомологичными первому полипептиду и второму полипептиду, позволяет предположить, что такая композиция представляет собой протективную вакцину широкого спектра действия, которая является достаточной для сообщения высокого серопротективного действия против штаммов N. meningitidis, экспрессирующих rLP2086 (FHBP) по меньшей мере серологической группы B, включая дополнительные серологические группы, такие как серологическая группа X.
Штаммы подсемейства A
В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий белок подсемейства А LP2086 (fHBP). В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм подсемейства А LP2086 (fHBP), который экспрессирует вариант липопротеина 2086, гетерологичный штамму N. meningitidis, экспрессирующему A05. Так, например, в одном варианте осуществления изобретения, штамм hSBA представляет собой штамм подсемейства А LP2086 (fHBP), который экспрессирует вариант липопротеина 2086, гетерологичный штамму M98250771.
В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий fHBP A10. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий LP2086 (fHBP) A22. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий LP2086 (fHBP) A56. В другом варианте осуществления изобретения, штаммы hSBA представляют собой штаммы LP2086 (fHBP) A22 и LP2086 (fHBP) A56. В другом варианте осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий LP2086 A04. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий LP2086 A05. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий LP2086 A12. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий LP2086 A22. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий LP2086 A12. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий LP2086 A04. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий LP2086 A19. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм N. meningitidis, экспрессирующий LP2086 A07. В другом варианте осуществления изобретения, штамм hSBA включает любой из штаммов, экспрессирующих A22, A12, A19, A05 и A07. В одном из вариантов осуществления изобретения, штаммы hSBA включают любой из штаммов, экспрессирующих A06, A15 и A29.
В одном из вариантов осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства А fHPB N. meningitidis серологической группы B, который является гетерологичным штамму N. meningitidis, экспрессирующему A05. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма A22 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма A56 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма A06 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма A15 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма A29 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма A62 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства А N. meningitidis серологической группы B, который является гетерологичным штамму N. meningitidis M98250771.
В одном из вариантов осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства А N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична первому полипептиду. В другом варианте осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства А N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична белку, связывающемуся с фактором H и экспрессируемому штаммом N. meningitidis M98250771. В предпочтительном варианте осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства А N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая по меньшей мере на 80%, а более предпочтительно, по меньшей мере на 84% идентична белку, связывающемуся с фактором H и экспрессируемому штаммом N. meningitidis M98250771.
В другом варианте осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства А N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая максимум на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична первому полипептиду. В другом варианте осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства А N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая максимум на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична белку, связывающемуся с фактором H и экспрессируемому штаммом N. meningitidis M98250771. В предпочтительном варианте осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства А N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая максимум на 85%, а более предпочтительно, максимум на 99% идентична белку, связывающемуся с фактором H и экспрессируемому штаммом N. meningitidis M98250771. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала.
В одном из вариантов осуществления изобретения, иммунный ответ, вырабатываемый композицией, обладает бактерицидным действием не только против штамма подсемейства А fHPB N. meningitidis серологической группы B, но также и против штамма N. meningitidis, экспрессирующего полипептид подсемейства А fHBP, где такая серологическая группа не является серологической группой B. Так, например, в одном из предпочтительых вариантов осуществления изобретения, иммунный ответ, вырабатываемый композицией, обладает бактерицидным действием против штамма подсемейства А N. meningitidis серологической группы B и против штамма N. meningitidis серологической группы С, которые экспрессируют полипептид подсемейства А fHBP, гетерологичный fHBP A05. Так, например, в одном варианте осуществления изобретения, иммунный ответ направлен против штамма N. meningitidis серологической группы C, экспрессирующего fHBP A10. В другом варианте осуществления изобретения, иммунный ответ направлен против штамма N. meningitidis серологической группы W, экспрессирующего fHBP A19. В одном из вариантов осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма N. meningitidis, который экспрессирует полипептид подсемейства А fHBP, где указанный штамм является гетерлогичным штамму N. meningitidis M98250771.
Штаммы подсемейства B
В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм подсемейства В LP2086 (fHBP). В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм подсемейства В LP2086 (fHBP), экспрессирующий вариант липопротеина 2086, который является гетерологичным штамму N. meningitidis, экспрессирующему B01. Так, например, в одном варианте осуществления изобретения, штамм hSBA представляет собой штамм подсемейства В LP2086 (fHBP), экспрессирующий вариант липопротеина 2086, который является гетерологичным штамму CDC1127. В предпочтительном варианте осуществления изобретения, штамм hSBA представляет собой штамм подсемейства В LP2086 (fHBP), экспрессирующий вариант липопротеина 2086, который является гетерологичным штамму CDC1573.
В одном из вариантов осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства В fHPB N. meningitidis серологической группы B, который является гетерологичным штамму N. meningitidis, экспрессирующему B01. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма B24 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма B44 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма B16 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма B03 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма B09 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма B15 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма B153 N. meningitidis серологической группы B. В одном из вариантов осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства В fHPB N. meningitidis серологической группы B, который является гетерологичным штамму N. meningitidis CDC1573.
В одном из вариантов осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства В N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична второму полипептиду. В другом варианте осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства В N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична белку, связывающемуся с фактором H и экспрессируемому штаммом N. meningitidis CDC1573. В предпочтительном варианте осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства В N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая по меньшей мере на 80%, а более предпочтительно, по меньшей мере на 87% идентична белку, связывающемуся с фактором H и экспрессируемому штаммом N. meningitidis CDC1573. В другом предпочтительном варианте осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства В N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая на 100% идентична белку, связывающемуся с фактором H и экспрессируемому штаммом N. meningitidis CDC1573.
В одном из вариантов осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства В N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая максимум на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична второму полипептиду. В другом варианте осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства А N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая максимум на 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична белку, связывающемуся с фактором H и экспрессируемому штаммом N. meningitidis CDC1573. В предпочтительном варианте осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма подсемейства В N. meningitidis серологической группы B, который экспрессирует белок, связывающийся с фактором Н и включающий аминокислотную последовательность, которая максимум на 88%, а более предпочтительно, по меньшей мере на 99% идентична белку, связывающемуся с фактором H и экспрессируемому штаммом N. meningitidis CDC1573. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала.
В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм B24 LP2086 (fHBP). В другом варианте осуществления изобретения, штамм hSBA представляет собой штамм B44 LP2086 (fHBP). В другом варианте осуществления изобретения, штаммы hSBA включают штаммы B24 LP2086 (fHBP) и B44 LP2086 (fHBP). В одном из вариантов осуществления изобретения, штаммы hSBA включают штаммы A22 LP2086 (fHBP), A56 LP2086 (fHBP), B24 LP2086 (fHBP) и B44 LP2086 (fHBP). В одном из вариантов осуществления изобретения, штамм hSBA включает B15. В одном из вариантов осуществления изобретения, штамм hSBA включает B153. В другом варианте осуществления изобретения, штамм hSBA представляет собой штамм B16 LP2086. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм B03 LP2086. В одном из вариантов осуществления изобретения, штамм hSBA представляет собой штамм B09 LP2086. В другом варианте осуществления изобретения, штаммы hSBA включают B24, B16, B44, B03 и B09, или любую их комбинацию. В другом варианте осуществления изобретения, штаммы hSBA включают B24, B16, B44, A22, B03, B09, A12, A19, A05 и A07 или любую их комбинацию. В другом варианте осуществления изобретения, штаммы hSBA включают A06, A07, A12, A15, A19, A29, B03, B09, B15 и B16 или любую их комбинацию.
В одном из вариантов осуществления изобретения, способ индуцирует иммунный ответ против штамма подсемейства А fHPB N. meningitidis серологической группы B и против штамма подсемейства В fHPB N. meningitidis серологической группы B. Предпочтительно, иммунный ответ обладает бактерицидным действием против штамма подсемейства А fHPB N. meningitidis серологической группы B и против штамма подсемейства В fHPB N. meningitidis серологической группы B.
В одном из вариантов осуществления изобретения, иммунный ответ, вырабатываемый композицией, обладает бактерицидным действием не только против штамма подсемейства В fHPB N. meningitidis серологической группы B, но также и против штамма N. meningitidis, экспрессирующего полипептид подсемейства В fHBP, где такая серологическая группа не является серологической группой B. Так, например, в одном из предпочтительных вариантов осуществления изобретения, иммунный ответ, вырабатываемый композицией, обладает бактерицидным действием против штамма подсемейства В N. meningitidis серологической группы B и против штамма N. meningitidis серологической группы Y, которые экспрессируют полипептид подсемейства В fHBP, гетерологичный fHBP В01. Так, например, в одном варианте осуществления изобретения, иммунный ответ направлен против штамма N. meningitidis серологической группы А, экспрессирующего fHBP В16. В другом варианте осуществления изобретения, иммунный ответ направлен против штамма N. meningitidis серологической группы Y, экспрессирующего fHBP В47. В одном из вариантов осуществления изобретения, иммунный ответ направлен против штамма N. meningitidis серологической группы Х, экспрессирующего fHBP В49. В одном из вариантов осуществления изобретения, иммунный ответ обладает бактерицидным действием против штамма N. meningitidis, который экспрессирует полипептид подсемейства В fHBP, где указанный штамм является гетерологичным штамму N. meningitidis серологической группы В CDC1573.
Титры
В одном из вариантов осуществления изобретения, композиция индуцирует увеличение бактерицидного титра у человека по сравнению с бактерицидным титром у человека до введения ему дозы композиции, где оценку проводят в идентичных условиях в hSBA. В одном из вариантов осуществления изобретения, увеличение бактерицидного титра сравнивают с бактерицидным титром у человека до введения ему первой дозы композиции, если такую оценку проводят в идентичных условиях в hSBA. В одном из вариантов осуществления изобретения, увеличение титра наблюдается после введения второй дозы композиции по сравнению с бактерицидным титром у человека до введения ему второй дозы композиции, если такую оценку проводят в идентичных условиях в hSBA. В другом варианте осуществления изобретения, увеличение титра наблюдается после введения третьей дозы композиции по сравнению с бактерицидным титром у человека до введения ему третьей дозы композиции, если такую оценку проводят в идентичных условиях в hSBA.
В одном из вариантов осуществления изобретения, композиция индуцирует бактерицидный титр у человека после введения дозы, где бактерицидный титр по меньшей мере в 1 раз превышает бактерицидный титр у человека до введения дозы, если такую оценку проводят в идентичных условиях в hSBA. Так, например, бактерицидный титр может по меньшей мере в 1,01 раза, 1,1 раза, 1,5 араза, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз превышать титр у человека после введения дозы композиции по сравнению с бактерицидным титром у человека до введения дозы, если такую оценку проводят в идентичных условиях в hSBA.
В одном из вариантов осуществления изобретения, термин «респондент» относится к человеку, у которого композиция индуцирует бактерицидный титр после введения дозы, и где бактерицидный титр по меньшей мере в 1 раз превышает бактерицидный титр у человека до введения дозы. В предпочтительном варианте осуществления изобретения, у респондента наблюдается увеличение титра hSBA по меньшей мере в ≥ 4 раза по сравнению с бактерицидным титром у человека до введения дозы. Такой респондент может назяваться респондентом, имеющим протективный титр. В некоторых вариантах осуществления изобретения, протективным титром является титр выше, чем 1:4.
В одном из вариантов осуществления изобретения, титр hSBA обратно пропорционален наибольшему разведению образца сыворотки, дающей измеримый эффект. Так, например, в одном варианте осуществления изобретения, титр hSBA обратно пропорционален наибольшему 2-кратному разведению тестируемой сыворотки, которое дает по меньшей мере 50% снижение бактерий MnB (50% выживаемость бактерий) по сравнению с величиной к.о.е. T30 (то есть, число бактерий, выживших после инкубирования в аналитических лунках, содержащих все компоненты анализа, за исключением тестируемой сыворотки; 100% выживаемость бактерий).
В одном из вариантов осуществления изобретения, композиция индуцирует бактерицидный титр у человека после введения первой дозы, который по меньшей мере в 2 раза превышает бактерицидный титр у человека до введения первой дозы (например, превышает бактерицидный титр у человека в отсутствие первой дозы), если такую оценку проводят в идентичных условиях в hSBA. В одном из вариантов осуществления изобретения, композиция индуцирует бактерицидный титр у человека, который по меньшей мере в 4 раза превышает бактерицидный титр у человека до введения первой дозы, если такую оценку проводят в идентичных условиях в анализе на бактерицидную активность человеческой сыворотки, в котором используется человеческий комплемент (hSBA). В одном из вариантов осуществления изобретения, композиция индуцирует бактерицидный титр у человека, который по меньшей мере в 8 раз превышает бактерицидный титр у человека до введения первой дозы, если такую оценку проводят в идентичных условиях в анализе на бактерицидную активность человеческой сыворотки, в котором используется человеческий комплемент (hSBA).
В предпочтительном варианте осуществления изобретения, комплемент человеческой сыворотки происходит от человека с низкой природной бактерицидной активностью против данного тестируемого штамма hSBA. Низкая природная бактерицидная активность означает, например, что бактерицидный титр действует против данного тестируемого штамма в hSBA при разведении по меньшей мере менее, чем 1:4. В одном из вариантов осуществления изобретения, человеческий комплемент происходит от человека, у которого hSBA-титр действует против данного штамма, тестируемого в hSBA при разведении по меньшей мере менее, чем 1:4, например, 1:2, если композицию не вводили человеку.
Человек может иметь hSBA-титр менее, чем 1:4 до введеня композиции, такой как двухвалентная композиция rLP2086, или человек может иметь hSBA-титр ≥1:4 до введения композиции. В соответствии с этим, в предпочтительных вариантах и в примерах, введение по меньшей мере одной дозы композиции человеку будет приводить по меньшей мере к 4-кратному увеличению hSBA-титра по сравнению с титром у человека до введения. В некоторых вариантах осуществления изобретения, введение по меньшей мере одной дозы композиции человеку будет приводить к увеличению hSBA-титра по меньшей мере более, чем 1:4, например, hSBA-титра ≥1:8, hSBA-титра ≥1:16, и hSBA-титра ≥1:32. В представленных здесь Примерах описана оценка соотношения числа индивидуумов, у которых hSBA-титр составлял ≥1:8 и/или ≥1:16, когда человеку была введена двухвалентная композиция rLP2086. В некоторых вариантах осуществления изобретения, 4-кратное увеличение титра у человека после введения композиции по сравнению с титром до введения композиции указывает на то, что такая защита ассоциируется с введением композиции. В некоторых вариантах осуществления изобретения, такая предпочтительная оценка hSBA-титров более, чем 1:4 указывает на то, что протективное действие, то есть, бактерицидный иммунный ответ, индуцируемый у человека, ассоциируется с композицией.
В одном из вариантов осуществления изобретения, человек имеет hSBA-титр, равный или превышающий нижний предел количественной hSBA-оценки (LLOQ) после введения первой дозы композиции. В другом варианте осуществления изобретения, человек имеет hSBA-титр, равный или превышающий LLOQ hSBA после введения второй дозы композиции. В другом варианте осуществления изобретения, человек имеет hSBA-титр, равный или превышающий LLOQ hSBA после введения третьей дозы композиции.
Способы и введение
В одном из своих аспектов, настоящее изобретение относится к способу индуцирования иммунного ответа против N. meningitidis у человека. В другом своем аспекте, настоящее изобретение относится к способу вакцинации человека. В одном из вариантов осуществления изобретения, способ включает введение человеку по меньшей мере одной дозы композиции, описанной выше. В предпочтительном варианте осуществления изобретения, способ включает введение человеку максимум одной дозы композиции, описанной выше. В другом варианте осуществления изобретения, способ включает введение человеку по меньшей мере первой дозы и второй дозы композиции, описанной выше.
В одном из вариантов осуществления изобретения, вторую дозу вводят по меньшей мере через 20, 30, 50, 60, 100, 120, 160, 170 или 180 дней после введения первой дозы и максимум через 250, 210, 200 или 190 дней после введения первой дозы. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала.
В другом варианте осуществления изобретения, вторую дозу вводят приблизительно через 30 дней после введения первой дозы. В другом варианте осуществления изобретения, вторую дозу вводят приблизительно через 60 дней после введения первой дозы, например, по схеме иммунизации 0, 2 месяца. В другом варианте осуществления изобретения, вторую дозу вводят приблизительно через 180 дней после введения первой дозы, например, по схеме иммунизации 0, 6 месяцев. В другом варианте осуществления изобретения, вторую дозу вводят приблизительно через 120 дней после введения первой дозы, например, по схеме иммунизации 2, 6 месяцев.
В одном из вариантов осуществления изобретения, способ включает введение человеку двух доз и максимум двух доз композиции. В одном из вариантов осуществления изобретения, две дозы вводят за период приблизительно в 6 месяцев после введения первой дозы. В одном из вариантов осуществления изобретения, способ не включает дополнительного введения человеку бустер-дозы. Используемый здесь термин «бустер-доза» означает дополнительное введение композиции человеку. Может оказаться предпочтительным введение человеку максимум двух доз композиции. Такими преимуществами являются, например, облегчение полного соблюдения человеком схемы введения и снижение материальных затрат на такую схему введения.
В одном из вариантов осуществления изобретения, человеку вводят первую дозу и вторую дозу в течение периода времени приблизительно 25, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 дней, и максимум 400, 390, 380, 370, 365, 350, 340, 330, 320, 310, 300, 290, 280, 270, 260, 250, 240, 230, 220, 210 или 200 дней после введения первой дозы. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала. Предпочтительно, первую и вторую дозы вводят с перерывами по меньшей мере в 4 недели, например, с перерывом ≥8 недель, с перерывом ≥2 месяца, с перерывом ≥3 месяца, с перерывом ≥6 месяцев и т.п.
В одном из вариантов осуществления изобретения, первую дозу и вторую дозу вводят человеку в течение приблизительно 30 дней. В другом варианте осуществления изобретения, первую дозу и вторую дозу вводят человеку в течение приблизительно 60 дней. В другом варианте осуществления изобретения, первую дозу и вторую дозу вводят человеку в течение приблизительно 180 дней.
Предпочтительно, чтобы первая доза была введена, по существу, одновременно (например, во время одной медицинской консультации или визита к врачу или через 24 часа после введения первой дозы менингококковой вакцины) с введением другой вакцины, такой как вакцина против вируса гепатита В, противодифтерийная вакцина, противостолбнячная вакцина, противококлюшная вакцина (клеточная или, предпочтительно, неклеточная), вакцина на основе вируса Haemophilus influenzae типа b, вакцина на основе Streptococcus pneumoniae и/или полиовакцина (предпочтительно, инактивированная полиовирусная вакцина). Каждая из этих необязательно совместно вводимых вакцин может представлять собой одновалентную вакцину или часть комбинированной вакцины (например, часть вакцины DTP).
Предпочтительно, чтобы вторая доза была введена, по существу, одновременно (например, во время одной медицинской консультации или визита к врачу или через 24 часа после введения первой дозы менингококковой вакцины) с введением другой вакцины, например, одновременно с введением вакцины против вируса гепатита В, противодифтерийной вакцины, противостолбнячной вакцины, противококлюшной вакцины (клеточной или неклеточной), вакцины на основе вируса Haemophilus influenzae типа b, вакцины на основе Streptococcus pneumoniae, полиовакцины (предпочтительно, инактивированной полиовирусной вакцины), вакцины против гриппа, вакцины против куриной оспы, вакцины против кори, вакцины против паротита и/или вакцины против коревой краснухи. Каждая из этих необязательно совместно вводимых вакцин может представлять собой одновалентную вакцину или часть комбинированной вакцины (например, часть вакцины MMR).
Предпочтительно, чтобы третья доза была введена, по существу, одновременно (например, во время одной медицинской консультации или визита к врачу или через 24 часа после введения третьей дозы менингококковой вакцины) с введением другой вакцины, например, одновременно с введением вакцины против вируса гепатита В, противодифтерийной вакцины, противостолбнячной вакцины, противококлюшной вакцины (клеточной или неклеточной), вакцины на основе вируса Haemophilus influenzae типа b, вакцины на основе Streptococcus pneumoniae, полиовакцины (предпочтительно, инактивированной полиовирусной вакцины), вакцины против гриппа, вакцины против куриной оспы, вакцины против кори, вакцины против паротита и/или вакцины против коревой краснухи. Каждая из этих необязательно совместно вводимых вакцин может представлять собой одновалентную вакцину или часть комбинированной вакцины (например, часть вакцины MMR).
Три дозы
В одном из вариантов осуществления изобретения, схема введения композиции в трех дозах индуцирует у человека бактерицидный титр против множества штаммов, экспрессирующих LP2086 (fHBP), гетерологичный первому и/или второму полипептиду, с более высоким процентом, чем схема введения двух доз.
В одном из вариантов осуществления изобретения, способ включает введение человеку трех доз композиции. В другом варианте осуществления изобретения, способ включает введение человеку максимум трех доз композиции. В одном из вариантов осуществления изобретения, три дозы вводят приблизительно в течение 6 месяцев после введения первой дозы. В одном из вариантов осуществления изобретения, способ включает введение человеку бустер-дозы после третьей дозы. В другом варианте осуществления изобретения, способ не включает введение человеку бустер-дозы после третьей дозы. В другом варианте осуществления изобретения, способ также не включает введение человеку четвертной дозы или бустер-дозы композиции. В другом варианте осуществления изобретения, человеку вводят максимум три дозы за период приблизительно 6 месяцев.
В репрезентативном варианте осуществления изобретения, вторую дозу вводят приблизительно через 30 дней после первой дозы, а третью дозу вводят приблизительно через 150 дней после второй дозы, например, по схеме иммунизации 0, 1, 6 месяцев. В другом репрезентативном варианте осуществления изобретения, вторую дозу вводят приблизительно через 60 дней после первой дозы, а третью дозу вводят приблизительно через 120 дней после второй дозы, например, по схеме иммунизации 0, 2, 6 месяцев.
В одном из вариантов осуществления изобретения, первую дозу, вторую дозу и третью дозу вводят человеку в течение приблизительно 150, 160, 170 или 180 дней, и максимум 240, 210 200 или 190 дней. Любое минимальное значение может быть объединено с любым описанным здесь максимальным значением с получением соответствующего интервала. Предпочтительно, первую дозу, вторую дозу и третью дозу вводят человеку в течение приблизительно 180 дней или 6 месяцев. Так, например, вторая доза может быть введена человеку приблизительно через 60 дней после первой дозы, а третья доза может быть введена человеку приблизительно через 120 дней после второй дозы. В соответствии с этим, репрезентативная схема введения включает введение человеку дозы в течение приблизительно 0, 2 и 6 месяцев.
Как описано выше, человеку может быть введено множество доз иммуногенной композиции, и число дней между введением каждой дозы может варьироваться. Преимуществом такого способа является, например, легкость соблюдения человеком таких схем введения.
В одном из вариантов осуществления изобретения, способ включает введение человеку максимум трех доз одной и той же иммуногенной композиции. Так, например, в предпочтительном варианте осуществления изобретения, способ не включает введение человеку первой дозы первой композиции, введение человеку второй дозы второй композиции и введение человеку третьей дозы третьей композиции, где первая, вторая и третья композиции не являются иденитичными. В другом варианте осуществления изобретения, способ включает введение человеку максимум четырех доз одной и той же иммуногенной композиции.
Примеры
Нижеследующие примеры иллюстрируют варианты осуществления изобретения. Если это не оговорено особо, то в нижеследующих Примерах рассматривается двухвалентная композиция MnB rLP2086 в дозе 120 мкг двухвалентного rLP2086, где предпочтительный репрезентативный вариант композиции включает: 60 мкг первого липидизированного полипептида, включающего аминокислотную последовательность, представленную в SEQ ID NO: 1 на дозу 0,5 мл; 60 мкг второго липидизированного полипептида, включающего аминокислотную последовательность, представленную в SEQ ID NO: 2 на дозу 0,5 мл; молярное отношение полисорбата-80 к первому полипептиду, составляющее 2,8; молярное отношение полисорбата-80 ко второму полипептиду, составляющее 2,8; 0,5 мг Al3+/мл композиции; 10 мМ гистидина и 150 мМ хлорида натрия.
Более конкретно, экспериментальная двухвалентная рекомбинантная вакцина rLP2086, вводимая в дозе 120 мкг двухвалентного rLP2086, включает: (a) 60 мкг первого липидизированного полипептида, включающего аминокислотную последовательность, представленную в SEQ ID NO: 1; (b) 60 мкг второго липидизированного полипептида, включающего аминокислотную последовательность, представленную в SEQ ID NO: 2; (c) 18 мкг полисорбата-80; (d) 250 мкг алюминия; (e) 780 мкг гистидина, и (f) 4380 мкг хлорида натрия. Каждая доза составляет 0,5 мл.
Если это не оговорено особо, то в нижеследующих Примерах рассматривается композиция MenACWY-TT, которая представляет собой предпочтительный репрезентативный вариант четырехвалентной композиции, конъюгированной с менингококковым полисахаридом, и которая включает капсулярные полисахариды Neisseria meningitidis A, C, W-135 и Y, каждый из которых связан со столбнячным токсоидом в качестве белка-носителя. Полисахариды Neisseria meningitidis серологических групп A и C конъюгируют со спейсером дигидразидом адипиновой кислоты (AH) и опосредованно конъюгируют со столбнячным токсоидом, а полисахариды W-135 и Y конъюгируют непосредственно со столбнячным токсоидом. Эта композиция не содержит никаких консервантов или адъювантов.
Более конкретно, лиофилизованная композиция MenACWY-TT, описанная ниже в Примерах, включает 5 микрограммов полисахарида Neisseria meningitidis серологической группы A, конъюгированного с белком-носителем столбнячного токсоида; 5 микрограммов полисахарида Neisseria meningitidis серологической группы С, конъюгированного с белком-носителем столбнячного токсоида; 5 микрограммов полисахарида Neisseria meningitidis серологической группы W-135, конъюгированного с белком-носителем столбнячного токсоида; 5 микрограммов полисахарида Neisseria meningitidis серологической группы Y, конъюгированного с белком-носителем столбнячного токсоида; 28 мг сахарозы; 97 мкг трометамола на дозу (0,5 мл).
Пример 1: Композиция MenABCWY
Конечную композицию MenABCWY получают путем разведения лиофилизованного лекарственного продукта MenACWY-TT (описанного ниже в Примере 2) в сосуде 0,67 миллилитрами двухвалентного лекарственного продукта MnB rLP2086 (описанного ниже в Примере 3) с получением 0,5 мл-дозы вакцины MenABCWY для внутримышечной инъекции. Все компоненты, используемые для приготовления вакцины MenABCWY и их функции, описаны ниже в Таблице 1.
(среднее отношение TT/полисахарид: ~3)
~7,5 мкг TT
(среднее отношение TT/полисахарид: ~3)
~7,5 мкг TT
(среднее отношение TT/полисахарид: ~1,5)
~3,75 мкг TT
(среднее отношение TT/полисахарид: ~1,3)
~3,25 мкг TT
Пример 2: Описание и состав двухвалентного лекарственного продукта MnB rLP2086
Двухвалентный лекарственный продукт MnB rLP2086 представляет собой стерильную жидкую композицию, состоящую из белков подсемейства А и В rLP2086 и приготовленную в количестве 120 мкг/мл/подсемейство в 10 мМ гистидинового буфера, 150 мМ хлорида натрия (NaCl) при pH 6,0 с 0,5 мг/мл алюминия в виде фосфата алюминия (AlPO4). Полисорбат 80 (PS-80) добавляют к лекарственному веществу с получением нужного молярного отношения PS-80:белок. Поэтому, PS-80 не добавляют в процессе приготовления лекарственного продукта, но он присутствует в конечном лекарственном продукте в том же самом отношении. Этим лекарственным продуктом заполняют 1 мл-шприцы. Одна доза вакцины составляет 0,5 мл и не содержит консервантов.
b Эквивалентно 0,25 мг алюминия на дозу
Влияние концентрации Полисорбата 80
Полисорбат 80 (PS-80) представляет собой неионное поверхностно-активное вещество. Он используется для стабилизации и солюбилизации белков подсемейства А и В MnB rLP2086 в композиции благодаря предотвращению агрегации и адсорбции, которые могут быть вызваны изменением температуры, фильтрацией, системой трубок, контактированием в контейнере/закрытой системе и смешиванием. Исследования стабильности, проводимые с помощью анализа на активность на основе моноклонального антитела in vitro, продемонстрировали нестабильнось белка подсемейства В в более высоких молярных отношениях PS-80 к белку MnB rLP2086 в конечной композиции. Эксперименты с различными молярными отношениями PS-80 к белку продемонстрировали, что оптимальное молярное отношение PS-80 к белку MnB rLP2086 составляет приблизительно 1,4-4,2, что указывает на сохранение активности.
Пример 3: Описание и состав композиции MenACWY-TT
Лекарственный продукт MenACWY-TT состоит из очищенных полисахаридов Neisseria meningitidis серологических групп A, C, W и Y, каждый из которых конъюгирован со столбнячным токсоидом (TT) в отношениях к полисахариду ~3, ~3, ~1,5 и ~1,3, соответственно.
Лекарственный продукт MenACWY-TT представлен как лиофилизованный порошок, поставляемый в подходящем для лиофилизации стеклянном 3 мл-сосуде с бромбутиловой резиновой пробкой и с алюминиевыми отвинчивающимися крышками. Все компоненты, используемые для приготовления лекарственного продукта MenACWY-TT, и их функции представлены в Таблице 3.
(среднее отношение TT/полисахарид: ~3)
~15 мкг TT
(среднее отношение TT/полисахарид: ~3)
~15 мкг TT
(среднее отношение TT/полисахарид: ~1,5)
~7,5 мкг TT
(среднее отношение TT/полисахарид: ~1,3)
~6,5 мкг TT
Пример 4: Получение композиции MenABCWY
Конечную композицию MenABCWY получали в клинике путем разведения лиофилизованного лекарственного продукта MenACWY-TT в сосуде 0,67 миллилитрами двухвалентного MnB rLP2086. Полученная композиция MenABCWY (жидкий вакцинный лекарственный продукт) содержит белки подсемейства А и В rLP2086 в количестве 120 мкг/мл/подсемейство, очищенные полисахариды Neisseria meningitis типа A, C, W и Y в концентрации 10 мкг/мл/тип, конъюгированые со столбнячным токсоидом в отношениях ~3, ~3, ~1,5 и ~3, соответственно, в 10 мМ гистидина и 1,6 мМ Трис-буфера, содержащего 160,5-161,1 мМ хлорида натрия, 0,5 мг/мл алюминия в виде фосфата алюминия (AlPO4), 0,035 мг/мл полисорбата 80 и 56 мг/мл сахарозы при pH 6,05 для внутримышечной инъекции.
Вакцину MenABCWY получают путем смешивания двух лекарственных продуктов, MenACWY-TT и двухвалентного MnB rLP2086. Забуферивающие компоненты и наполнители были выбраны в зависимости от отдельного способа приготовления каждого компонента и было показано, что они обеспечивают необходимый профиль стабильности для более длительного хранения продукта.
Были проведены исследования по верификации доз для того, чтобы продемонстрировать, что лекарственный продукт MenACWY-TT и двухвалентный лекарственный продукт MnB rLP2086 являются совместимыми при их смешивании для введения вакцины MenABCWY, и что все лекарственные продукты и дозируемые растворы являются совместимыми с вводимыми компонентами, а также, что дозируемые растворы являются стабильными в присутствии вводимых компонентов в течение периода времени, достаточного для приготовления доз и проведения схем введения. Стабильность вакцины MenABCWY, полученной путем разведения лекарственного продукта MenACWY-TT 0,67 миллилитрами двухвалентного лекарственного продукта MnB rLP2086, в течение определенного периода времени при температуре окружающей среды и в условиях освещения, была подтверждена в сосудах для разведения и в шприцах для приготовления доз.
Образцы, представляющие собой дозирующие растворы вакцины MenABCWY, были протестированы методами оценки стабильности, такими как ОФ-ЖХВД на связывание с антигеном и чистоту, анализ на биоплексную активность, ELISA и ICP-MS в соответствии с предварительно определенными критериями допустимости. Результаты этого исследования показали приемлемую стабильность вакцины MenABCWY в течение 24 часов при комнатной температуре и в условиях освещения. Эти данные представлены и описаны ниже в Примерах 5-15.
Пример 5: Оценка вакцины MenABCWY
Исследование проводили для оценки приемлемой физической совместимости и кратковременной стабильности при разведении лиофилизованной композиции MenACWY-TT двухвалентной композицией MnB rLP2086. Лиофилизованную композицию MenACWY-TT и жидкую двухвалентную композицию MnB rLP2086 объединяли и хранили в течение 24 часов в нерегулируемых условиях при комнатной температуре, приближенных к реальным условиям хранения. Было продемонстрировано, что лиофилизованная композиция MenACWY-TT может быть разведена жидкой двухвалентной композицией MnB rLP2086 при легком помешивании вручную, а объединенные pH и осмомоляльность находятся в пределах, типичных для инъекций. Все ключевые признаки конъюгатов и белков были аналогичны контрольным признакам в нерегулируемых условиях при комнатной температуре в течение 24 часов.
Физическая совместимость была оценена путем определения pH, внешнего вида, легкости разведения и осмомоляльности объединенного лекарственного продукта. Стабильность антигенов оценивали путем вычисления концентрации, оценки чистоты и относительной in vitro антигенности (IVRA) белков подсемейства А и подсемейства В rLP2086, а также вычисления концентраций конъюгированых менингококковых полисахаридов A, C, Y и W-135 с помощью ELISA.
В Примерах 5-15 продемонстрировано, что комбинация лиофилизованной композиции MenACWY-TT и жидкой двухвалентной композиции MnB rLP2086, то есть, композиции MenABCWY, является совместимой и стабильной по меньшей мере в течение 24 часов при комнатной температуре.
ELISA для определения концентраций менингококковых полисахаридов A, C, Y и W-135 в композиции MenABCWY - Разработка ELISA для менингококковых A, C, Y и W-135 и скрининг pAb для детектирования
Было отобрано шесть антител для скрининга в целях их использования в ELISA-анализах. Каждую из четырех групп из десяти кроликов иммунизировали конъюгатами полисахарида-ТТ Men A, C, Y или W-135, где у кроликов брали кровь после введения антитела. Каждого кролика отдельно подвергали скринингу с использованием полисахаридов Men A, C, Y или W-135, конъюгированных с белком-носителем CRM197, на связывание и специфичность. Сыворотку кроликов скринировали на позитивный сигнал связывания, который эквивалентен оптической плотности, в три раза превышающей фоновую оптическую плотность. Кроме того, сыворотку кроликов скринировали на низкий уровень неспецифического связывания, который может соответствовать любым данным оптической плотности для комбинации сывороток без антигена, вторых или детектирующих антител, превышающим данные оптической плотности для контроля, а также на низкую перекрестную реактивность, которая представляет собой любые данные оптической плотности для гетеролигичных серотипов, которые превышают фоновую оптическую плотность. Были отобраны группы кроликов, которые удовлетворяли критериям скрининга. Была построена стандартная кривая для определенного интервала данных для конъюгатов CRM, и эта кривая подтвердила разведение лиофилизованной композиции MenACWY-TT. Была построена стандартная кривая для определенного интервала данных для конъюгатов CRM, и эта кривая подтвердила разведение лиофилизованной композиции MenACWY-TT.
Была оценена целесообразность количественной оценки конъюгатов A, C, Y и W в объединенном лекарственном продукте (композиции MenABCWY). Было определено, что одна двухвалентная композиция MnB rLP2086 не детектировалась в этом анализе. Кроме того, если фосфат алюминия был солюбилизирован в образцах композиции MenABCWY, то были получены полные выходы конъюгатов. Следовательно, было определено, что двухвалентная композиция MnB rLP2086 не влияет на количественную оценку конъюгатов MenACWY-TT в ELISA.
Пример 6: Оценка применимости методов оценки двухвалентной композиции MnB rLP2086 в присутствии композиции MenACWY-TT
ИОХ-ЖХВД оценивали на ее применимость для определения активности белков подсемейства А и В в двухвалентной MnB rLP2086 в присутствии композиции MenACWY-TT. Были получены результаты для общего белка и связанного белка в двухвалентной композиции MnB rLP2086 в присутствии и в отсутствие композиции MenACWY-TT. Перекрывающиеся хроматограммы представлены на фиг. 1.
Пример 7: Оценка чистоты и отношения пиков двухвалентной композиции MnB rLP2086 в присутствии композиции MenACWY-TT
ОФ-ЖХВД оценивали на ее применимость для определения чистоты двухвалентной композиции MnB rLP2086 в присутствии композиции MenACWY-TT. Было проведено сравнение результатов оценки чистоты для двухвалентной композиции MnB rLP2086 в присутствии композиции MenACWY-TT и в отсутствие композиции MenACWY-TT. Перекрывающиеся хроматограммы представлены на фиг. 2. Пример интеграции пиков примеси представлен как вставка на фиг. 2. Результаты оценки показали, что присутствие композиции MenACWY-TT не влияет на оценку чистоты двухвалентной композиции MnB rLP2086 с применением метода ОФ-ЖХВД.
Пример 8: Оценка IVRA для двухвалентной композиции MnB rLP2086 в присутствии композиции MenACWY-TT
Метод определения IVRA оценивали на его применимость для определения относительной антигенности двухвалентной композиции MnB rLP2086 in vitro для белков подсемейства А (SEQ ID NO: 1) и подсемейства В (SEQ ID NO: 2) в присутствии композиции MenACWY-TT.
Было проведено сравнение результатов IVRA для белков подсемейства А и подсемейства В в двухвалентной композиции MnB rLP2086 в присутствии и в отсутствие композиции MenACWY-TT. Результаты оценки приемлемости показали, что в случае вариабельности анализа, такие результаты являются сравнимыми, и что присутствие композиции MenACWY-TT не влияет на определение относительной антигенности in vitro.
Пример 9: Разведение композиции MenACWY-TT двухвалентной композицией MnB rLP2086 в сосудах
Лекарственные продукты композиции MenACWY-TT и двухвалентной композиции MnB rLP2086 получали с использованием композиции MenACWY-TT в сосудах, разведенной лекарственным продуктом двухвалентной композиции MnB rLP2086. Содержимое сосудов с композицией MenACWY-TT, разведенное либо физиологическим раствором, либо композицией MenACWY-TT, взятой в качестве плацебо-матрицы, использовали в качестве контроля в зависимости от способа.
Полисахарид группы A
Полисахарид группы C
Полисахарид группы W-135
Полисахарид группы Y
Белок-носитель столбнячного токсоида
Сахароза
Трометанол
10 мкг/мл
10 мкг/мл
10 мкг/мл
88 мкг/мл
Белок подсемейства В rLP2086 (SEQ ID NO: 2)
AlPO4
Гистидин
NaCl
120 мкг/мл
0,5 мг/мл
pH 6,0
Гистидин
NaCl
pH 6,01
Белок подсемейства B rLP2086 (SEQ ID NO: 2)
AlPO4
Гистидин
NaCl
120 мкг/мл
0,5 мг/мл
pH 6,0
Определение объема разведения композиции MenACWY-TT физиологическим раствором
Упаковка коммерчески доступного продукта NIMENRIX® содержит сосуд, включающий лиофилизованную композицию MenACWY-TT, и шприц, содержащий 0,9% физиологический раствор для разведения. Для восстановления конечной концентрации NIMENRIX® в коммерчески доступной вакцине после разведения двухвалентной композицией MnB rLP2086 может быть определено количество физиологического раствора, введенного с использованием шприца из коммерчески доступного продукта. Тот же самый объем двухвалентной композиции MnB rLP2086 может быть затем использован во всех исследованиях по разведению.
Разведение композиции MenACWY-TT двухвалентной композицией MnB rLP2086 в сосудах
Двухвалентную композицию MnB rLP2086The собирали в стеклянный 10 мл-сосуд. Приблизительно 800 мкл раствора забирали в 1 мл-шприц. Скорректированное содержание шприца инъецировали в сосуд, содержащий композицию MenACWY-TT. Сосуд встряхивали для растворения содержимого.
pH и внешний вид композиции MenABCWY определяли в образцах- дубликатах. Осмомоляльность измеряли с тремя повторностями для композиции MenACWY-TT, разведенной физиологическим раствором, и композиции MenACWY-TT, разведенной двухвалентной композицией MnB rLP2086.
Пример 10: SEC-MALLS для оценки стабильности менингококковых полисахаридов A, C, Y и W-135 в матрице DP.
Менингококковые полисахариды A, C, Y и W-135 использовали в качестве суррогатов для того, чтобы определить, можно ли ожидать какой-либо нестабильности конъюгированных менингококковых полисахаридов A, C, Y и W-135 в объединенном лекарственном продукте (композиции MenABCWY).
Обработка менингококковых полисахаридов A, C, Y и W-135
Приготовление реагента («полной буферной матрицы композиции MenABCWY»)
2,24 г сахарозы и 7,8 мг Триса (Трометамина) добавляли к 20 мл 2× буферной матрицы двухвалентной композиции MnB rLP2086 с белками MnB rLP2086 (20 мМ гистидина, pH 6,0, 300 мМ NaCl, 0,07 мг/мл PS-80, 1 мг/мл (8 мМ) AlPO4, белки подсемейства А rLP2086 (SEQ ID NO: 1) и подсемейства B (SEQ ID NO: 2), 240 мкг/мл каждого).
Приготовление образца
Каждый менингококковый полисахарид разводили 1:1 полной буферной матрицей композиции MenABCWY и инкубировали в течение 0, 6 и 24 часов при 5°C, 25°C и 37°C. После инкубирования, суспензию образца центрифугировали в течение 1 минуты при 14000 об/мин. Супернатант анализировали с помощью SEC-MALLS.
Пример 11: Стабильность композиции MenABCWY - Оценка pH, внешнего вида и осмомоляльности комбинации двухвалентной композиции MnB rLP2086 и композиции MenACWY-TT
pH и внешний вид комбинации двухвалентной композиции MnB rLP2086 и композиции MenACWY-TT, то есть, композиции MenABCWY, оценивали сразу после разведения и повторно через 24 часа.
Все результаты были ожидаемыми (Таблица 6).
Средняя осмомоляльность композиции MenACWY-TT, разведенной двухвалентной композицией MnB rLP2086, составляла 3% от средней осмомоляльности композиции MenACWY-TT, разведенной физиологическим раствором.
Пример 12: Концентрации конъюгатов менингококковых полисахаридов A, C, Y и W-135 в объединенном лекарственном продукте
Концентрацию менингококковых конъюгатов A, C, Y и W-135-TT в композиции MenABCWY оценивали сразу и повторно через 24 часа. Концентрации четырех конъюгатов были стабильными в течение 24 часов (Таблица 8).
Пример 13: Оценка стабильности двухвалентных белков MnB rLP2086 в композиции MenABCWY
Концентрации общего и связанного белка подсемейства А (SEQ ID NO: 1) и подсемейства В rLP2086 (SEQ ID NO: 2) в объединенном лекарственном продукте.
Образцы композиции MenABCWY анализировали с помощью ИОХ-ЖХВД для определения концентраций белка. Как показано в Таблице 9, общий белок, связанный (с алюминием) белок и % связанных двухвалентных белков подсемейства А (SEQ ID NO: 1) и подсемейства В (SEQ ID NO: 2) MnB rLP2086 (связанных с алюминием) не изменялись в течение 24 часов, что указывает на то, что белки подсемейства А и подсемейства В rLP2086 были стабильными в течение 24 часов.
Пример 14: Чистота и отношение пиков белка rLP2086 в комбинированной композиции MenABCWY
Образцы композиции MenABCWY анализировали с помощью ОФ-ЖХВД для определения чистоты и отношения пиков белков rLP2086. См., фиг. 3. Пик на время 11,9 минут был исключен из оценки чистоты.
IVRA белков подсемейства А и подсемейства В rLP2086 в комбинированном лекарственном продукте
IVRA образцов композиции MenABCWY оценивали через 24 часа после смешивания. Было определено, что относительная антигенность белков подсемейства А (SEQ ID NO: 1) и подсемейства В (SEQ ID NO: 2) rLP2086 в композиции MenABCWY была стабильной в течение 24 часов.
Пример 15: Стабильность менингококковых полисахаридов A, C, Y и W-135 в полной буферной матрице композиции MenABCWYA, определенная с помощью SEC-MALS
Стабильность менингококкового PS А в полной буферной матрице композиции MenABCWYA, определенная с помощью SEC-MALS после инкубирования в течение 6 и 24 часов при различных температурах
Менингококковые полисахариды A, C, W и Y смешивали с полной буферной матрицей композиции MenABCWYA и оценивали на стабильность с помощью SEC-MALS после инкубирования при 5°C, 25°C и 37°C в течение 24 часов. Все четыре полисахарида были стабильными в течение 24 часов при 5°C и 25°C. Некоторая степень разложения наблюдалась при 37°C для менингококков A и Y. Степень разложения не могла быть определена для менингококковых полисахаридов Y из-за образования агрегатов с высокой молекулярной массой при всех тестируемых условиях, за исключением исходных.
Пример 16: Оценка hSBA-активности, индуцированной двухвалентной композицией MnB rLP2086 и обладающей перекрестным протективным действием против MenACWXY
Двухвалентная композиция TRUMENBA MnB rLP2086 содержит два липидизированных белка, связывающихся с фактором Н (fHBP), один от каждого подсемейства, и обладает протективным действием, направленным против Neisseria meningitides серологической группы B. Было обнаружено, что fHBP экспрессируется на различных уровнях в серологических группах A, C, W, Y и X, что позволяет предположить, что двухвалентная композиция MnB rLP2086 может обеспечивать защиту от этих серологических групп. Авторами была взята сыворотка, использованная в исследовании B1971015, для проверки правильности концепции, что двухвалентная композиция TRUMENBA MnB rLP2086 может сообщать протективное действие, направленное против серологических групп A, C, W, Y и X. Штаммы были собраны со всего мира (включая штаммы MnW, взятые после недавней вспышки заболевания в Великобритании и MnX, который только что появился в Африке). Для сравнения описан способ отбора штамма-кандидата для разработки hSBA и иммунный ответ у субпопуляции индивидуумов, иммунизированных двухвалентной композицией MnB rLP2086, и у индивидуумов, иммунизированных четырехвалентной конъюгатной вакциной на основе менингококковых капсулярных полисахаридов (MCV4).
Сыворотки, используемые для оценки иммуногенности
Субсерии сывороток, полученных в исследовании B1971015, фазы 2, которое представляет собой рандомизированное активно контролируемое исследование слепым методом, в котором две группы индивидуумов получали либо MENACTRA (конъюгатную вакцину на основе менингококкового полисахарида A, C, Y и W-135 [MCV4]) и ADACEL (вакцину на основе столбнячного токсоида, вакцину на основе аттенюированного дифтерийного токсоида, неклеточную противококлюшную вакцину [Tdap]) или двухвалентный rLP2086 (TRUMENBA [вакцину на основе менингококковой серологической группы B], разрешенные к применению в Соединенных Штатах), использовали для оценки иммуногенности в hSBA с использованием штаммов MnACWYX, отобранных как описано ниже.
Базовая оценка показателя серопозитивности
Базовые показатели серопозитивности в hSBA на микроколониях оценивали с использованием неиммунной сыворотки или сыворотки до вакцинации, взятой у подростков в исследовании B1971015. Для этих целей, серопозитивность определяли как hSBA-титр ≥1:8, который был предсказан в анализе LLOQ. Для разработки анализа, штаммы должны иметь низкую базовую серопозитивность (то есть, отношение hSBA-титров ≥ 1:8 с использованием базовой сыворотки приблизительно <40%).
Сыворотки, используемые для определения иммуногенности
Субсерии сывороток, полученных в исследовании B1971015, фазы 2, которое представляет собой рандомизированное активно контролируемое исследование слепым методом, в котором две группы индивидуумов получали либо MENACTRA (конъюгатную вакцину на основе менингококкового полисахарида A, C, Y и W-135 [MCV4]) и ADACEL (вакцину на основе столбнячного токсоида, вакцину на основе аттенюированного дифтерийного токсоида, неклеточную противококлюшную вакцину [Tdap]) или двухвалентный rLP2086 (TRUMENBA [вакцину на основе менингококковой серологической группы B], разрешенные к применению в Соединенных Штатах), оценивали на иммуногенность в hSBA с использованием штаммов MnACWYX, отобранных как описано ниже.
Результаты и обсуждение
Серологическая группа A
Был получен пул штаммов для SBA серологической группы A, в который входили 17 штаммов из Южной Африки, 4 штамма из США и один штаммм из Нидерландов. 73 процента штаммов серологической группы А в этой коллекции экспрессируют B16, а 23% - B22. Преобладающими клональными комплексами в этой коллекции штаммов серологической группы A являются ST-1 и ST-5. Для последующего тестирования было отобрано два штаммма, экспрессирующих B16, и один штамм, экспрессирующий B22 с уровнями экспрессии fHBP выше 1100 MFI. 36 партий C' были использованы для скрининга отношения T30/T0 C'. PMB1546 был исключен, поскольку соответствующие источники комплемента человеческой сыворотки, которые не осуществляли неспецифическое уничтожение штамма, не могли быть идентифицироваы в соответствии со скоростью прохождения C' (Таблица 11). PMB3143 был исключен из-за высоких базовых показателей серопозитивности, составляющих 52%, при использовании неиммунной сыворотки подростков. PMB3257 удовлетворял критериям отбора: были идентифицированы соответствующие источники комплемента; низкие базовые показатели серопозитивности, оцененные с использованием неиммунной сыворотки подростков, составляли, например, 0%, и hSBA были технически осуществимыми.
подгруппа I/II
подгруппа I/II
подгруппа III
Серологическая группа C
Был получен пул штаммов для SBA серологической группы С, в который входили 49 штаммов из США и 10 штаммов из Нидерландов. Последовательность fHBP является более гетерогенной в серологической группе C. Пул штаммов содержит по меньшей мере 17%, а именно, 19% штаммов MenC, которые представляют собой штаммы, экспрессирующие fHBP A10, а 10% штаммов экспрессируют A15. Преобладающими клональными комплексами в этой коллекции штаммов серологической группы С являются комплекс ST-11/ЕТ-37 и ST-103. Для последующего тестирования был отобран один штамм, экспрессирующий А10, и три штамма, экспрессирующих А15 с уровнями экспрессии fHBP выше 1100 MFI. 36 партий C' были использованы для скрининга отношения T30/T0 C'. PMB5180 и PMB5196, экспрессирующие А15 для fHBP, были исключены, поскольку соответствующие источники комплемента человеческой сыворотки, которые не осуществляли неспецифическое уничтожение штамма, не могли быть идентифицироваы в соответствии со скоростью прохождения C' (Таблица 12). Для PMB5043, исходный скрининг-тест на прохождение С' не прошел SBA-анализ из-за отношения T30/T0. PMB5208 удовлетворял критериям отбора: были идентифицированы соответствующие источники комплемента; низкие базовые показатели серопозитивности, оцененные с использованием неиммунной сыворотки подростков, составляли 17%, и hSBA были технически осуществимыми.
Серологическая группа W
Был получен пул штаммов для SBA серологической группы W, в который входили 14 штаммов из США, 9 штаммов из Нидерландов и 6 штаммов из Великобритании после недавней вспышки заболевания. Последовательность fHBP является более гомогенной в этой коллекции штаммов серологической группы W. 45% штаммов в этом пуле экспрессируют вариант fHBP A19, и 45% - fHBP A10. Преобладающим клональным комплексом для штаммов вариантов fHBP A19 в пуле серологической группы W является ST-22, а преобладающим клональным комплексом для штаммов вариантов fHBP A10 является комплекс ST-11/ET-37. Из штаммов США были отобраны один штамм, экспрессирующий А19 и один штамм, экспрессирующий А10. Для последующего тестирования были отобраны два штамма из Великобритании после вспышки заболевания, экспрессирующие А10, где уровни экспрессии fHBP превышали 1100 MFI. 36 партий C' были использованы для скрининга отношения T30/T0 C'. Все четыре штамма прошли этот исходный скрининг-тест С'. Исходя из уровня неиммунного ответа, PMB5524 и PMB5163 были исключены, поскольку показатель серопозитивности в случае неиммунной сыворотки у подростков составлял 74% и 48%, соответственно. PMB5248 и PMB5523 удовлетворяли критериям отбора: были идентифицированы соответствующие источники комплемента; низкие базовые показатели серопозитивности, оцененные с использованием неиммунной сыворотки подростков, составляли, например, 26% и 28%, соответственно, и hSBA были технически осуществимыми (Таблица 13).
Серологическая группа X
Был получен пул штаммов для SBA серологической группы Х, в который входили 8 штаммов из Африки и один штамм из Нидерландов. Пять штаммов из Африки экспрессировали вариант fHBP B49, три штамма имели fHBP нового типа, а один штамм из Нидерландов экспрессировал fHBP B09. Экспрессия fHBP для всех девяти штаммов превышала 1100 MFI. Для последующего тестирования было отобрано три штамма из Африки после вспышки заболевания и один штамм из Нидерландов. 36 партий C' были использованы для скрининга отношения T30/T0 C'. Все четыре штамма прошли этот исходный скрининг-тест С'. Исходя из уровня неиммунного ответа, PMB5467 был исключен, поскольку показатель серопозитивности в случае неиммунной сыворотки у подростков составлял 68%. PMB5537, PMB5540 и PMB5539 удовлетворяли критериям отбора: были идентифицированы соответствующие источники комплемента; низкие базовые показатели серопозитивности, оцененные с использованием неиммунной сыворотки подростков, составляли, например, 0%, и hSBA были технически осуществимыми (Таблица 14). PMB5540 был отобран для оценки.
Серологическая группа Y
Был получен пул штаммов для SBA серологической группы Y, в который входили 87 штаммов из США и 30 штаммов из Нидерландов. Последовательность fHBP является более гомогенной в этой коллекции штаммов серологической группы Y. 66% штаммов серологической группы Y в этом пуле экспрессируют вариант fHBP A15. Преобладающим клональным комплексом для штаммов, экспрессирующих вариант fHBP A15 в этой коллекции штаммов серологической группы Y, является ST-23/кластер А3. И только 15% штаммов серологической группы Y в этой коллекции экспрессируют fHBP на уровне выше 1100 MFI. Для дополнительного тестирования было отобрано три штамма группы варианта А15 с уровнями экспрессии fHBP выше 1100 MFI. 36 партий C' были использованы для скрининга отношения T30/T0 C'. PMB5122, PMB5053 и PMB5050 были исключены, поскольку соответствующие источники комплемента человеческой сыворотки, которые не осуществляли неспецифическое уничтожение штамма, не могли быть идентифицированы в соответствии со скоровтью прохождения C' (Таблица 15). PMB5187 с fHBP B47 были отобраны для скрининга T30/T0 C' и могли быть идентифицированы источники C', которые не могли неспецифически уничтожать штамм (Таблица 15). Даже несмотря на то, что PMB5187 не экспрессировал преобладающий вариант fHBP для серологической группы Y, однако, этот штамм удовлетворял другим критериям отбора: были идентифицированы соответствующие источники комплемента; низкие базовые показатели серопозитивности, оцененные с использованием неиммунной сыворотки подростков, составляли, например, 4% и hSBA были технически осуществимыми.
Штаммы MnACYWX отбирали для разработки hSBA мсходя из преобладающих вариантов fHBP для соответствующей серологической группы, экспрессии fHBP выше 1100 MFI и целесообразности проведения анализа (например, идентификации человеческого комплемента и базовой серопозитивности). Характеристики шести отобранных штаммов MnACYWX, а также медианная экспрессия fHBP для каждой группы вариантов систематизированы в Таблице 16.
Анализ на иммуногенность
Тестируемые штаммы MnACYWX использовали в hSBAs для оценки иммунного ответа, вырабатываемого у подгрупп здоровых подростков в возрасте от 10 до <13 лет, включенных в программу совместного исследования Фазы 2 B1971015. hSBA-ответы, вырабатываемые TRUMENBA, сравнивали с hSBA-ответами, вырабатываемыми MENACTRA (конъюгатной вакциной на основе менингококковых полисахаридов A, C, Y и W-135 [MCV4]) для шести отобранных штаммов (Таблица 17).
Высокие уровни бактерицидных гуморальных ответов наблюдались у большого числа вакцинированных индивидуумов с hSBA-титром ≥1:8, что является более жестким критерием, чем приемлемый коррелят защиты (то есть, hSBA-титр ≥1:4) для штаммов MenCWYX, за исключением MenA у 28% индивидуумов, иммунизированных TRUMENBA по сравнению с 97% индивидуумов, иммунизированных MCV4. TRUMENBA-ответ достигал пика через один месяц после введения дозы 2 для двух штаммов серологической группы W (PMB5248 100%, PMB5523, 97%) и через один месяц после введения дозы 3 для штаммов серологических групп C, Y, X с уровнями ответов 83%-100%. MCV4-ответы достигали пика через один месяц после введения дозы 1, причем ответ на MenX не наблюдался. Антитела, вырабатываемые TRUMENBA, продемонстрировали определенный потенциал защиты против MenX, который не достигался в случае MCV4. Уровни TRUMENBA-ответов (то есть, % ≥1:8) после введения 3 доз против штаммов MnC, W или Y были сравнимы с уровнями MCV4-ответов после введения 1 дозы. Данные иммуногенности, полученные для тестируемых в hSBA штаммов MnACYWX, подтвердили концепцию протективного действия против серологических групп, не относящихся к B.
Выводы: Штаммы MnACYWX отбирали для разработки hSBA исходя из преобладающих вариантов для соответствующей серологической группы, экспрессии fHBP выше пороговой экспрессии fHBP MnB и целесообразности проведения анализа (например, идентификации человеческого комплемента и базовой серопозтивности). С использованием сыворотки, взятой у индивидуумов, иммунизированных Trumenba в hSBA с использованием штаммов MnACYWX, было получено подтверждение концепции, что антитела, вырабатываемые Trumenba, могут оказывать протективное действие против серологических групп, не относящихся к B. Ответы, вырабатываемые двухвалентным rLP2086 (например, процент индивидуумов с титрами ≥1:8) после введения 3 доз, были сравнимы с ответами, вырабатываемыми MCV4 после введения 1 дозы для штаммов серологических групп C, W и Y, но были ниже для штамма серологической группы A. Кроме того, hSBA-титры, вырабатываемые двухвалентным rLP2086 и составляющие ≥1:8 у большого числа индивидуумов, указывают на протективное действие, направленное против MenX, но это действие не наблюдалось в случае MCV4.
Пример 17: Trumenba вырабатывает бактерицидные антитела против менингококков, не принадлежащих к серологической группе B
Введение. Neisseria meningitidis (Men) является главной причиной бактериального менингита и сепсиса у детей, подростков и молодых людей. Существуют 5 основных вызывающих заболевание менингококковых серологических групп A, B, C, Y и W, и шестая серологическая группа X, обнаруженная в Африке. Четырехвалентные менингококковые конъюгатные вакцины (MCV4) используют для защиты от заболевания, вызываемого менингококковыми серологическими группами A, C, Y и W в различных регионах мира. Недавно апробированная вакцина TRUMENBA® (MenB-FHbp, двухвалентный rLP2086, Pfizer Inc, Collegeville, PA), обеспечивает защиту от заболевания, вызываемого серологической группой B, и состоит из 2 рекомбинантных липопротеинов, по 1 от каждого из 2 белков филогенетических подсемейств, связывающихся с фактором H (FHbp). Было обнаружено, что ген, кодирующий FHbp, присутствует почти во всех инвазивных штаммах Men, независимо от классификации серологических групп. Преклинические исследования продемонстрировали возможность вырабатывания протективного действия MenB-FHbp против других серологических групп, вызывающих заболевание. В предварительных исследованиях было обнаружено, что вакцина Men B BEXSERO® (MenB-4C; Novartis Inc, Cambridge, MA), которая включает один антиген варианта FHbp, способна вырабатывать бактерицидный иммунный ответ против штаммов MenX и MenW. Целью этого исследования является расширение наблюдений, полученных с помощью исследовательских анализов, в сторону изучения вырабатывания антителами в ответ на MenB-FHbp бактерицидного действия против штаммов MenA, C, W, Y и X (фиг. 7) у подростков, и тем самым вырабатывания протективного действия против всех серологических групп, вызывающих менингококковое заболевание.
Экспериментальный обзор. Из штаммов-кандидатов (фиг. 8) были отобраны штаммы, которые:
- не были восприимчивыми к уничтожению только человеческого комплемента;
- были уничтожены, как показал hSBA с использованием сыворотки, которая, как было показано, вырабатывает бактерицидные антитела против FHbp, экспрессируемого штаммами MenB;
- имеют низкие базовые титры в случае сыворотки до вакцинации (25 сывороток до вакцинации; см. фиг. 9).
Для отобранных штаммов (Таблица 18, фиг. 10) были разработаны исследовательские hSBA-анализы. См. фиг. 9 для сыворотки, тестируемой в hSBA. Уровень ответа=процент индивидуумов с hSBA-титрами ≥1:8, превышающими установленный коррелят защиты (≥1:4) (фиг. 11-16).
Как показано на фиг. 9, 25 сывороток от Группы A на месяц 0 использовали для исследования первичного иммунного ответа. Сыворотки, взятые у 30 индивидуумов Группы A на месяц 0 и 1 и у Группы B на месяцы 0, 1, 3 и 7, использовали для hSBA-тестирования. Конечной точкой уровня ответа является процент сыворотки с титрами > 1:8.
Фиг. 10 - Распределение уровней экспрессии поверхностного FHbp (MFI), определенных в экспериментах методом проточной цитометрии с использованием mAb MN 994-11, реагирующего с FHbp. Поверхностная экспрессия FHbp для каждого из штаммов определенной серологической группы показана черными точками, а уровни поверхностной экспрессии FHbp для отобранных тестируемых штаммов каждой серологической группы показаны цветной звездочкой.
Фиг. 11 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenA PMB3257 (B16). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2, и 3 доз MenBFHbp. Геометрическое среднее полученных титров (GMT) составляло 2, 3, 4, и 5, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 3% до вакцинации и 97% через месяц после введения MCV4. GMT для позитивной контрольной группы составляли 2 и 95, соответственно.
Фиг. 12 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenС PMB5208 (А10). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2, и 3 доз MenBFHbp. Полученные GMT составляли 4, 8, 12 и 29, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 20% до вакцинации и 90% через 1 месяц после введения MCV4. GMT для позитивной контрольной группы составляли 3 и 119, соответственно.
Фиг. 13 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenW PMB5248 (А19). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2, и 3 доз MenBFHbp. Полученные GMT составляли 4, 18, 47 и 77, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 40% до вакцинации и 97% через один месяц после введения MCV4. GMT для позитивной контрольной группы составляли 5 и 88, соответственно.
Фиг. 14 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenW PMB5523 (А10). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2, и 3 доз MenBFHbp. Полученные GMT составляли 7, 15, 21 и 42, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 55% до вакцинации и 97% через месяц после введения MCV4. GMT для позитивной контрольной группы составляли 8 и 60, соответственно.
Фиг. 15 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenY PMB5187 (В47). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2, и 3 доз MenBFHbp. Полученные GMT составляли 3, 7, 31 и 58, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 13% до вакцинации и 97% через один месяц после введения MCV4. GMT для позитивной контрольной группы составляли 3 и 79, соответственно.
Фиг. 16 - Доля ответов в hSBA (процент индивидуумов с hSBA-титрами ≥1:8) для MenХ PMB5540 (В49). Показаны доли ответов и 95%-ные доверительные интервалы для сыворотки, собранной до иммунизации (месяц 0) и через 1 месяц после введения 1, 2, и 3 доз MenBFHbp. Полученные GMT составляли 2, 3, 7 и 20, соответственно. Доли ответов для индивидуумов позитивной контрольной группы составляли 0% до вакцинации и 0% через один месяц после введения MCV4. GMT для позитивной контрольной группы составляли 2 и 2, соответственно.
Выводы. Доля ответов, вырабатываемых MenB-FHbp, была максимальной через 1 месяц после введения дозы 2 (Месяц 3) для штамма MenW, PMB5248 (100%), и через 1 месяц после введения дозы 3 (Месяц 7) для штаммов MenC, MenY и MenX, а также для второго штамма MenW (доли ответов в пределах 83%-100%).
Доли ответов, измеренных с помощью hSBA для тестируемого штамма MenA, были значительно ниже и достигали пика в 28% после введения 3 доз MenB-FHbp.
Выявленный коррелят защиты от менингококкового заболевания представляет собой hSBA-титр ≥1:4. Способность MenB-FHbp вырабатывать hSBA-титры по меньшей мере 1:8 подтверждает концепцию, что MenB-FHbp может обладать протективным действием против заболевания, вызываемого менингококковыми серологическими группами, не относящимися к В, включая MenX, но это действие не обеспечивается MCV4.
Пример 18: Рандомизированное, контролируемое исследование слепым методом Фазы 2 для описания иммуногенности, безопасности и переносимости двухвалентной вакцины на основе рекомбинантного липопротеина 2086 Neisseria meningitidis серологической группы B (двухвалентного rLP2086, то есть, используемой в настоящее время вакцины TRUMENBA®) у здоровых индивидуумов в возрасте от≥24 месяцев до <10 лет (B1971017-syn).
Протокол исследования: Это исследование представляет собой рандомизированное, контролируемое многоцентровое исследование слепым методом Фазы 2, разработанное для оценки иммуногенности, безопасности и переносимости двухвалентного rLP2086 в дозе 120 мкг, вводимой здоровым индивидуумам в возрасте от≥24 месяцев до <10 лет по схеме введения на месяцы 0, 2 и 6 (Таблица 19). Была разработана программа, по которой приблизительно 400 индивидуумов были произвольно включены в 1 из 2 групп в отношении 3:1. Группа 1 получала двухвалентный rLP2086 на месяц 0 (Визит 1) с последующими вакцинациями на месяцы 2 и 6. Группа 2 получала лицензированную детскую вакцину против вируса гепатита A (HAV) на месяц 0 (Визит 1) и месяц 6 и инъекцию физиологического раствора на месяц 2 для обеспечения исследования слепым методом. Визиты для наблюдения проводились через 1 месяц после каждой вакцинации и через 6 месяцев после третьей вакцинации для сбора данных по безопасности и/или взятия пробы крови. Индивидуумы участвовали в исследовании в течение периода времени до 13 месяцев.
(300 индивидуумов)
(100 индивидуумов
(все индивидуумы)
Вводимые вакцины: Индивидуумам Группы 1 вводили двухвалентный rLP2086 путем внутримышечной инъекции в верхнюю дельтовидную мышцу руки на месяцы 0, 2 и 6. Индивидуумам Группы 2 вводили вакцину против HAV/физиологический раствор/вакцину против HAV в верхнюю дельтовидную мышцу руки на месяцы 0, 2 и 6, соответственно.
Оценки иммуногенности: Для облегчения анализа на иммуногенность, у индивидуумов брали приблизительно 5-10 мл крови (в зависимости от возраста) непосредственно перед первой вакцинацией, через 1 месяц после 2-ой вакцинации и через 1 и 6 месяцев после третьей вакцинации. Для оценки иммунного ответа на двухвалентный rLP2086, функциональные антитела анализировали в hSBA на достоверность с использованием 4 первичных тестируемых штаммов MnB, отобранных с помощью несмещенного алгоритма, и корректировали на эпидемиологическое преобладание исходя из регулируемого исходного значения для пула штаммов MnB в анализе на бактерицидную активность сыворотки Пфайзера (SBA). В hSBA оценивали антитела в человеческой сыворотке, которые инициируют комплемент-зависимую деструкцию менингококкового штамма-мишени. Четыре (4) первичных тестируемых штамма MnB, PMB80 (A22), PMB2001 (A56), PMB2948 (B24) и PMB2707 (B44), каждый из которых экспрессирует вариант белка, связывающегося с фактором H (fHBP) и гетерологичного антигенным компонентам вакцины, использовали в hSBA для определения конечных точек иммуногенности в этом исследовании. В этих анализах использовали сыворотки, полученные от всех индивидуумов до первой экспериментальной вакцинации, через 1 месяц после второй экспериментальной вакцинации и через 1 и 6 месяцев после третьей экспериментальной вакцинации. Для проведения первичных анализов, 2 первичных тестируемых штамма (PMB80 [A22] и PMB2948 [B24]) анализировали в каждый момент забора проб крови для одной половины индивидуумов (в обеих группах), а другие 2 первичных тестируемых штамма (PMB2001 [A56] и PMB2707 [B44]) анализировали в каждый момент забора проб крови для другой половины индивидуумов.
Первичными конечными точками иммуногенности являются: число индивидуумов в возрасте от≥24 месяцев до <4 лет (в начале исследования) с hSBA-титром≥нижнего(му) предела(у) количественной оценки (LLOQ) для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086; и число индивидуумов в возрасте от≥4 лет до <10 лет (в начале исследования) с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086.
Вторичными конечными точками иммуногенности являются:
- У здоровых индивидуумов в возрасте от≥24 месяцев до <10 лет в начале исследования:
- Число индивидуумов с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086.
- У здоровых индивидуумов в возрасте от≥24 месяцев до <4 лет в начале исследования, у здоровых индивидуумов в возрасте от≥4 лет до <10 лет в начале исследования и в объединенной возрастной стратифицированной группе:
- Число индивидуумов с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после второй вакцинации и через 1 и 6 месяцев после третьей вакцинации двухвалентным rLP2086.
- Число индивидуумов, у которых достигались hSBA-титры≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 для каждого из 4 первичных тестируемых штаммов на базовом уровне, через 1 месяц после второй вакцинации и через 1 и 6 месяцев после третьей вакцинации двухвалентным rLP2086.
- GMT в hSBA для каждого из 4 первичных тестируемых штаммов на базовом уровне, через 1 месяц после второй вакцинации и через 1 и 6 месяцев после третьей вакцинации двухвалентным rLP2086.
Вторичные конечные точки иммуногенности систематизировали для для группы, оцениваемой на иммуногенность, и для группы mITT.
Нижеследующие экспериментальные конечные точки иммуногенности были использованы для описания ответов у здоровых индивидуумов в возрасте от≥24 месяцев до <4 лет в начале исследования, у здоровых индивидуумов в возрасте от≥4 лет до <10 лет в начале исследования и в объединенной возрастной стратифицированной группе:
- Число индивидуумов с hSBA-титрами≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 в каждый подходящий момент времени взятия пробы крови.
- GMT в hSBA для каждого из 4 первичных штаммов в каждый подходящий момент времени взятия пробы крови.
- Число индивидуумов, у которых достигалось по меньшей мере 4-кратное увеличение hSBA-титра по сравнению с базовым уровнем через 1 месяц после третьей вакцинации двухвалентным rLP2086 для каждого из 4 первичных тестируемых штаммов:
- Для индивидуумов, у которых базовый hSBA-титр был ниже предела детектирования (LOD) или hSBA-титр <1:4, наблюдался 4-кратный ответ, определенный как hSBA-титр≥1:16 или LLOQ (каким бы высоким этот титр не был).
- Для индивидуумов, у которых базовый hSBA-титр≥LOD (то есть, hSBA-титр≥1:4) и < LLOQ, наблюдался 4-кратный ответ, определенный как hSBA-титр в≥4 раза превышающий LLOQ.
- Для индивидуумов, у которых базовый hSBA-титр≥LLOQ, наблюдался 4-кратный ответ, определенный как hSBA-титр в≥4 раза превышающий базовый титр.
Результаты
Индивидуумы: В это исследование было произвольно включено всего 400 индивидуумов в возрасте от≥24 месяцев до <10 лет. Из всех произвольно отобранных индивидуумов, 294 индивидуума были включены в Группу 1 (двухвалентный rLP2086), а 106 индивидуумов были включены в Группу 2 (HAV/физиологический раствор). В каждую стратифицированную возрастную группу входило 200 индивидуумов, отобранных произвольно и имеющих возраст от≥24 месяцев до <4 лет и от≥4 лет до <10 лет.
Из 400 произвольно отобранных индивидуумов, 390 (97,5%) индивидуумов прошли всю фазу вакцинации (в течение 1 месяца после последней экспериментальной вакцинации) этого исследования. Всего 387 (96,8%) индивидуумов прошли 6-месячное наблюдение путем контакта по телефону. Считается, что все обследование прошли только те индивидуумы, которые завершили фазу вакцинации и прошли 6-месячное наблюдение по телефону. В целом, все процедуры исследования прошли всего 375 (93,8%) индивидуумов и такое завершение было таким же для каждой возрастной стратифицированной группы. В группу оценки иммуногенности был включен всего 371 (92,8%) индивидуум, и из этой группы было исключено 29 (7,3%) индивидуумов. Все 400 произвольно отобранных индивидуумов были включены в группу mITT.
Результаты по иммуногенности: Главной целью этого исследования является описание иммунного ответа у индивидуумов на двухвалентный rLP2086, как было определено с помощью hSBA, против 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства В LP2086, как было определено через 1 месяц после третьей вакцинации у здоровых индивидуумов в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет. Второй целью является описание иммунных ответов для пациентов в объединенной группе, стратифицированной по возрасту (от≥24 месяцев до <10 лет). Конечными точками достижения главной цели является число индивидуумов в каждой возрастной стратифицированной группе, у которых достигались hSBA-титры≥LLOQ для каждого из 4 первичных штаммов MnB через 1 месяц после третьей вакцинации.
Стойкий иммунный ответ наблюдался у детей в возрасте от≥24 месяцев до <10 лет через 1 месяц после введения третьей дозы двухвалентного rLP2086, что подтверждается числом индивидуумов, у которых hSBA-титр составлял≥LLOQ (1:8 для A56, B24 и B44; 1:16 для A22) для каждого из 4 первичных тестируемых штаммов MnB в пределах от 80,0% до 100,0% для индивидуумов в возрасте от≥24 месяцев до <4 лет и от 78,3% до 100,0% для индивидуумов в возрасте от≥4 лет до <10 лет после введения 3 доз. Число индивидуумов в этой в объединенной возрастной стратифицированной группе с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации составляло в пределах от 79,1% до 100,0%. Эти данные были также подтверждены высокими GMT (в пределах от 19,1 до 191) и числом индивидуумов, у которых достигались hSBA-титры≥1:4 (81,5% - 100%) или≥1:16 (75,4% - 100%) против каждого из 4 первичных тестируемых штаммов MnB после введения 3 доз двухвалентного rLP2086 по сравнению с базовыми уровнями для двух возрастных стратифицированных групп. Кроме того, число индивидуумов в объединенной возрастной стратифицированной группе, у которых hSBA-титр был≥4 по сравнению с базовым уровнем через 1 месяц после третьей вакцинации для каждого из 4 первичных тестируемых штаммов MnB, составляло от 76,9% до 93,5%.
Второй целью исследования является описание иммунных ответов через 1 месяц после введения второй дозы двухвалентного rLP2086, как было установлено по ответам≥LLOQ, определенным hSBA-титрам и GMT hSBA для 2 возрастных стратифицированных групп и в объединенной возрастной стратифицированной группе. Для объединенной возрастной стратифицированной группы, число индивидуумов с hSBA-титром≥LLOQ составляло от 48,5% до 100,0%, причем, между стратифицированными группами младшего и более старшего возраста, каких-либо значимых различий не наблюдалось. Эти данные были дополнительно подтверждены для объединенной возрастной стратифицированной группы с увеличением GMT (в пределах от 11,1 до 96,6), и для числа индивидуумов, у которых достигался hSBA-титр≥1:4 (57,7% - 100%) или≥1:16 (43,1% - 100%) после введения 2 доз двухвалентного rLP2086 по сравнению с базовым уровнем против каждого из 4 первичных тестируемых штаммов MnB. GMT были аналогичными для 2 возрастных стратифицированных групп. Кроме того, число индивидуумов в объединенной возрастной стратифицированной группе, у которых hSBA-титр был≥4 по сравнению с базовым уровнем через 1 месяц после второй вакцинации для каждого из 4 первичных тестируемых штаммов MnB, составляло от 42,3% до 91,0%.
Иммуноперсистентность также оценивали через 6 месяцев после введения третьей дозы двухвалентного rLP2086, где число индивидуумов с hSBA-титром≥LLOQ снижалось от 79,1%-100% через 1 месяц после третьей вакцинации до 10,4%-82,4% на 6-й месяц после третьей вакцинации для объединенной возрастной стратифицированной группы. Каких-либо различий между 2 возрастными стратифицированными группами не наблюдалось за исключением A22, где детей более старшего возраста с титром≥LLOQ было больше, чем детей младшего возраста (46%, 95% с ДИ=33,4, 59,1 и 19%, 95% с ДИ=10,2, 30,9). Однако, базовые уровни титров≥LLOQ до вакцинации были выше для A22 в возрастной стратифицированной группе (13,6% и 4,4%). Аналогичная тенденция также наблюдалась для объединенной возрастной стратифицированной группы у индивидуумов с протективным hSBA-титром≥1:4 в пределах 13,3%-84,0%, и GMT в пределах 5,1-31,3 через 6 месяцев после третьей вакцинации.
В целом, двухвалентный rLP2086, вводимый в 3 дозах по схеме введения на месяцы 0, 2 и 6, вырабатывал стойкий иммунный ответ у детей раннего возраста и у детей в возрасте от≥24 месяцев до <10 лет с протективными титрами антител, достигаемыми, как показал hSBA, у большого числа индивидуумов после третьей дозы. Между детьми раннего возраста, то есть, в возрасте от≥24 месяцев до <4 лет и детьми в возрасте от≥4 лет до <10 лет, каких-либо значимых клинических различий не наблюдалось. Гуморальные ответы снижались через 6 месяцев после введения третьей дозы, но оставались выше, чем базовые уровни до вакцинации.
Вывод(ы): В заключение следует отметить, что двухвалентный rLP2086, введенный детям раннего возраста и детям в возрасте от≥24 месяцев до <10 лет по схеме 3 доз на месяцы 0, 2 и 6, вырабатывает стойкий иммунный ответ у большинства детей после второй и третьей дозы, при этом, протективные титры антител достигались после третьей дозы, как было определено с помощью hSBA. hSBA-титры снижались через 6 месяцев после серии из 3 доз. Вакцина, вводимая в этом исследовании, была безопасной и хорошо переносилась с приемлемым профилем безопасности у детей раннего возраста и у детей в возрасте от≥24 месяцев до <10 лет.
Пример 19: Рандомизированное, контролируемое исследование слепым методом Фазы 2 для описания иммуногенности, безопасности и переносимости двухвалентной вакцины на основе рекомбинантного липопротеина 2086 Neisseria meningitidis серологической группы B (двухвалентного rLP2086, то есть, используемой в настоящее время вакцины TRUMENBA®) у здоровых индивидуумов в возрасте от≥24 месяцев до <10 лет (B1971017-CSR).
Исходную композицию двухвалентного rLP2086 (который не включал полисорбат-80) оценивали в исследованиях Фазы 1 у взрослых, подростков, детей и детей раннего возраста с удовлетворительными профилями безопасности, переносимости и иммуногенности, продемонстрированными для этих групп. Было показано, что исходная композиция имеет приемлемый профиль безопасности при дозе до 200 мкг, и является иммуногенной, как было определено с помощью hSBA. У детей в возрасте от 18 до 36 месяцев, исходная композиция была исследована при дозах 20 мкг, 60 мкг и 200 мкг (исследование 6108A1-502-AU). В исследовании 6108A1-502-AU, частота локальных реакций в каждой группе с соответствующей дозой была как правило выше, чем в группе, которой вводили вакцину против гепатита А (HAV)/плацебо-группе, но в большинстве случаев, наблюдались слабые реакции или реакции умеренной тяжести. Случаи повышения температуры имели тенденцию к увеличению с увеличением дозы. Число индивидуумов, у которых наблюдалось любое повышение температуры после введения любой дозы, составляло 36,4% в группе с дозой 20 мкг, 39,1% в группе с дозой 60 мкг и 54,5% в группе с дозой 200 мкг. Частота других системных побочных эффектов в каждой вакцинной группе была, в основном, сравнима с частотой для HAV/плацебо. У большинства индивидуумов наблюдался hSBA-ответ на штаммы MnB после третьей вакцинации.
По сравнению с исходной композицией, способ приготовления лекарственного вещества и состав лекарственного продукта были модифицированы в сторону увеличения (включая добавление полисорбата-80) для повышения масштабности производства и гарантии длительной стабильности конечной композиции вакцины. Данные безопасности для взрослых и подростков, участвующих в исследованиях с использованием конечной композиции двухвалентного rLP2086, соответствовали данным безопасности исходной композиции. Локальные реакции и системные эффекты были, в основном, слабыми или умеренными для всех возрастных групп. Тяжелые побочные эффекты были относительно редкими. Кроме того, данные о побочных эффектах при наблюдении (AE) в исследованиях по иммуноперсистентности 6108A1 1002-AU, 6108A1 2001 и B1971033, проводимых от 6 до 48 месяцев после введения третьей дозы двухвалентного rLP2086, не вызывали каких-либо проблем относительно безопасности. Тяжелые побочные эффекты (SAE) были редкими и, в основном, не ассоциировались с введением экспериментальной вакцины. При этом, было несколько случаев выходов из программы исследований из-за AE.
Было проведено два (2) исследования Фазы 2 (B1971017 и B1971035) для оценки иммуногенности и безопасности вакцины у детей (от 12 месяцев до <10 лет), которым вводили конечную вакцинную композицию. Исследование B1971035 проводится в настоящее время и было разработано для оценки безопасности, переносимости и иммуногенности 2 различных доз (60 мкг и 120 мкг) у здоровых детей в возрасте от 12 месяцев до <24 месяцев. В этом исследовании (B1971017) оценивали иммуногенность, безопасность и переносимость двухвалентного rLP2086 в дозе 120 мкг (конечная композиция), вводимого здоровым индивидуумам в возрасте от≥24 месяцев до <10 лет по схеме введения на месяцы 0, 2 и 6. В соответствии с программой, приблизительно 400 индивидуумов были произвольно включены в 1 из 2 групп в отношении 3:1. Группа 1 получала двухвалентный rLP2086 на месяц 0 (Визит 1) с последующими вакцинациями на месяцы 2 и 6. Группа 2 получала вакцину против HAV на месяц 0 (Визит 1) и на месяц 6 и инъекцию физиологического раствора на месяц 2. Рандомизацию стратифицировали для гарантии включения равного числа индивидуумов в возрастную стратифицированную группу, в которую входили индивидуумы в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет. Это исследование (B1971017) представляет собой рандомизированное, контролируемое многоцентровое исследование слепым методом Фазы 2, в котором, в соответствии с программой, приблизительно 400 индивидуумов были произвольно включены в 1 из 2 групп в отношении 3:1. Группа 1 получала двухвалентный rLP2086 на месяц 0 (Визит 1) с последующими вакцинациями на месяцы 2 и 6. Группа 2 получала лицензированную детскую вакцину против HAV на месяц 0 (Визит 1) и месяц 6 и инъекцию физиологического раствора на месяц 2 для обеспечения исследования слепым методом. Рандомизацию стратифицировали для гарантии включения равного числа индивидуумов в возрастную стратифицированную группу, в которую входили индивидуумы в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет. В соответствии с программой, в это исследование было включено приблизительно 200 индивидуумов в возрасте от≥24 месяцев до <4 лет и приблизительно 200 индивидуумов в возрасте от≥4 лет до <10 лет.
В этом исследовании оценивали иммуногенность, безопасность и переносимость двухвалентного rLP2086 в дозе 120 мкг, вводимой здоровым индивидуумам в возрасте от≥24 месяцев до <10 лет по схеме введения на месяцы 0, 2 и 6. Визиты для наблюдения осуществлялись через 1 месяц после каждой вакцинации и через 6 месяцев после третьей вакцинации для получения данных безопасности и/или взятия пробы крови. Индивидуумы участвовали в исследовании вплоть до 13 месяцев.
Двухвалентный rLP2086 (содержащий 60 мкг каждого очищенного белка подсемейства А и подсемейства В rLP2086, адсорбированного на алюминии в стерильной забуференной изотонической суспензии) был приготовлен в дозе 0,5 мл для инъекции.
Лицензированная детская вакцина против HAV была приготовлена в дозе 0,5 мл для инъекции.
Для Группы 1, 59,31% индивидуумов в возрасте от≥24 месяцев до <4 лет и 57,05% индивидуумов в возрасте от≥4 лет до <10 лет проходили сопутствующее лечение. Для Группы 2, 58,18% индивидуумов в возрасте от≥24 месяцев до <4 лет и 52,94% индивидуумов в возрасте от≥4 лет до <10 лет проходили сопутствующее лечение. Наиболее распространенное сопутствующее лечение, проводимое во время исследования, включает введение ибупрофена, парацетамола и амоксициллина.
Анализ на бактерицидную активность сыворотки с использованием двухвалентного rLP2086 - Первичные тестируемые штаммы
Для оценки иммунного ответа на двухвалентный rLP2086, функциональные антитела анализировали в hSBA на достоверность с использованием 4 первичных тестируемых штаммов MnB, отобранных с использованием несмещенного алгоритма, и корректировали на эпидемиологическое преобладание исходя из регулируемого исходного значения для пула штаммов MnB в анализе на бактерицидную активность сыворотки Пфайзера (SBA). В hSBA оценивали антитела в человеческой сыворотке, которые инициируют комплемент-зависимую деструкцию менингококкового штамма-мишени. Четыре (4) первичных тестируемых штамма MnB, PMB80 (A22), PMB2001 (A56), PMB2948 (B24) и PMB2707 (B44), каждый из которых экспрессирует вариант fHBP, гетерологичный антигенным компонентам вакцины, использовали в hSBA для определения конечных точек иммуногенности в этом исследовании. В этих анализах использовали сыворотки, полученные от всех индивидуумов до первой экспериментальной вакцинации, через 1 месяц после второй экспериментальной вакцинации и через 1 и 6 месяцев после третьей экспериментальной вакцинации.
Для проведения первичных анализов, 2 первичных тестируемых штамма (PMB80 [A22] и PMB2948 [B24]) анализировали в каждый момент забора проб крови для одной половины индивидуумов (в обеих группах), а другие 2 первичных тестируемых штамма (PMB2001 [A56] и PMB2707 [B44]) анализировали в каждый момент забора проб крови для другой половины индивидуумов.
Анализ на иммуногенность
Каких-либо гипотез по тестированию для проведения анализа на иммуногенность не существует. Способ оценки был применен для достижения первой, второй и экспериментальной цели.
Число индивидуумов в каждой группе, у которой достигался hSBA-титр≥нижнего предела количественной оценки (LLOQ) через 1 месяц после второй и третьей вакцинации и через 6 месяцев после третьей вакцинации, рассчитывали для каждого тестируемого штамма вместе с двухсторонним 95% точным доверительным интервалом (ДИ), для каждой возрастной стратифицированной группы и объединенной возрастной стратифицированной группы.
Первичные конечные точки иммуногенности
Первичными конечными точками иммуногенности являются:
- число индивидуумов в возрасте от≥24 месяцев до <4 лет (в начале исследования) с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086.
- Число индивидуумов в возрасте от≥4 лет до <10 лет (в начале исследования) с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086.
Вторичные конечные точки иммуногенности
Вторичными конечными точками иммуногенности являются:
- У здоровых индивидуумов в возрасте от≥24 месяцев до <10 лет в начале исследования:
- Число индивидуумов с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086.
- У здоровых индивидуумов в возрасте от≥24 месяцев до <4 лет в начале исследования, у здоровых индивидуумов в возрасте от≥4 лет до <10 лет в начале исследования и в объединенной возрастной стратифицированной группе:
- Число индивидуумов с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после второй вакцинации и через 1 и 6 месяцев после третьей вакцинации двухвалентным rLP2086.
- Число индивидуумов, у которых достигались hSBA-титры≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 для каждого из 4 первичных тестируемых штаммов на базовом уровне, через 1 месяц после второй вакцинации и через 1 и 6 месяцев после третьей вакцинации двухвалентным rLP2086.
- GMT в hSBA для каждого из 4 первичных тестируемых штаммов на базовом уровне, через 1 месяц после второй вакцинации и через 1 и 6 месяцев после третьей вакцинации двухвалентным rLP2086.
Экспериментальные конечные точки иммуногенности
Для достижения экспериментальных конечных точек, тестирование не проводили длв всех 4 первичных тестируемых штаммов MnB. Вместо этого, 50% индивидуумов тестировали с использованием штаммов PMB2001 (A56) и PMB2707 (B44), но не PMB80 (A22) или PMB2948 (B24). Остальных 50% индивидуумов тестировали с использованием штаммов PMB80 (A22) или PMB2948 (B24), но не PMB2001 (A56) или PMB2707 (B44). Все экспериментальные конечные точки, определенные ниже, могут быть применены для получения результатов hSBA у всех индивидуумов, которые получали двухвалентный rLP2086, и могут быть протестированы на соответствующий штамм в указанный(е) момент(ы) времени.
Нижеследующие экспериментальные конечные точки были использованы для описания ответов у здоровых индивидуумов в возрасте от≥24 месяцев до <4 лет в начале исследования, у здоровых индивидуумов в возрасте от≥4 лет до <10 лет в начале исследования и в объединенной возрастной стратифицированной группе:
- Число индивидуумов с hSBA-титрами≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 в каждый подходящий момент времени взятия пробы крови.
- GMT в hSBA для каждого из 4 первичных тестируемых штаммов в каждый подходящий момент времени взятия пробы крови.
- Число индивидуумов, у которых достигается по меньшей мере 4-кратное увеличение hSBA-титра по сравнению с базовым уровнем через 1 месяц после третьей вакцинации двухвалентным rLP2086 для каждого из 4 первичных тестируемых штаммов:
- Для индивидуумов, у которых базовый hSBA-титр ниже предела детектирования (LOD) или hSBA-титр <1:4, 4-кратный ответ определяют как hSBA-титр≥1:16 или LLOQ (каким бы высоким этот титр не был).
- Для индивидуумов, у которых базовый hSBA-титр≥LOD (то есть, hSBA-титр≥1:4) и < LLOQ, 4-кратный ответ определяют как hSBA-титр, в≥4 раза превышающий LLOQ.
- Для индивидуумов, у которых базовый hSBA-титр≥LLOQ, 4-кратный ответ определяют как hSBA-титр, в≥4 раза превышающий базовый титр.
Методы анализа
Первичный анализ на иммуногенность включает оценку числа индивидуумов в каждой группе, у которой достигался hSBA-титр≥LLOQ через 1 месяц после третьей вакцинации для каждого тестируемого штамма вместе с двухсторонним 95% точным доверительным интервалом, ДИ, для каждой возрастной стратифицированной группы и объединенной возрастной стратифицированной группы.
Все бинарные конечные точки (включая первичные конечные точки) систематизировали по двухстороннему 95% ДИ с применением точного метода. GMT результатов hSBA также систематизировали по 95% ДИ.
LLOQ составляет 1:16 для PMB80 (A22), 1:8 для PMB2001 (A56), 1:8 для PMB2707 (B44) и 1:8 для PMB2948 (B24).
Для вычисления GMT, результаты hSBA ниже LLOQ были представлены как 0,5 × LLOQ для первичного анализа.
Анализ первичных конечных точек
Первичный анализ для достижения первичных целей был проведен для групп, оцениваемых на иммуногенность. Число индивидуумов в каждой группе, у которой достигался hSBA-титр≥LLOQ через 1 месяц после третьей вакцинации, вычисляли для каждого тестируемого штамма вместе с двухсторонним 95% точным ДИ. Для достижения 2 первичных целей, эти данные представлены для 2 возрастных стратифицированных групп: в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет.
Все бинарные конечные точки (включая первичные конечные точки) систематизировали по двухстороннему 95% ДИ с применением точного метода. GMT результатов hSBA также систематизировали по 95% ДИ.
Для подтверждения правильной интерпретации первичных анализов проводили идентичный анализ для группы mITT.
Анализ вторичных и экспериментальных конечных точек
Целью нижеследующих анализов является оценка вторичной и экспериментальной иммуногенности:
- Число индивидуумов, у которых достигается hSBA-титр≥LLOQ для каждого из 4 первичных штаммов через 1 месяц после второй вакцинации и через 6 месяцев после третьей вакцинации, анализировали для двух возрастных стратифицированных групп отдельно и в комбинации в группах, оцениваемых на иммуногенность и в группах mITT.
- Число индивидуумов, у которых достигаются hSBA-титры≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 для каждого из 4 первичных штаммов на базовом уровне, через 1 месяц после второй вакцинации и через 1 и 6 месяцев после третьей вакцинации, анализировали для двух возрастных стратифицированных групп отдельно и в комбинации в группах, оцениваемых на иммуногенность и в группах mITT.
- GMT hSBA для каждого из 4 первичных тестируемых штаммов на базовом уровне через 1 месяц после второй вакцинации и через 1 и 6 месяцев после третьей вакцинации, анализировали для 2 возрастных стратифицированных групп отдельно и в комбинации в группах, оцениваемых на иммуногенность и в группах mITT.
Экспериментальные конечные точки были систематизированы для 2 возрастных стратифицированных групп отдельно и в комбинации в каждый подходящий момент времени для группы, оцениваемой на иммуногенность и в группе mITT.
Кривые обратного кумулятивного распределения
Эмпирические кривые обратного кумулятивного распределения (RCDC) графически анализировали для каждого из 4 первичных штаммов в каждый момент взятия образцов для группы, оцениваемой на иммуногенность.
Оценка иммуногенности
Анализируемые группы
Группа, оцениваемая на иммуногенность, представляет собой группу первичного анализа на иммуногенность. Группа mITT была использована как дополнительная группа для анализа на иммуногенность.
В группу, оцениваемую на иммуногенность, был включен всего 371 (92,8%) индивидуум, а 29 (7,3%) индивидуумов были исключены из этой группы. Индивидуумы могут быть исключены из групп оценки иммуногенности по более, чем 1 причине. Из группы, оцениваемой на иммуногенность, был исключен всего 21 (5,3%) индивидуум, поскольку у них был взят базовый забор крови до введения первой дозы вакцины или после третьей вакцинации, у 15 (3,8%) индивидуумов не было получено достоверных и подтверждающих результатов анализа на любой из визитов, 11 (2,8%) индивидуумов не были включены или не могли быть включены в исследование до вакцинации или через 1 месяц после визита для третьей вакцинации, 11 (2,8%) индивидуумов не получали вакцину, поскольку они произвольно осуществляли все визиты для вакцинации, а 4 (1,0%) индивидуума имели значительные отклонения по протоколу, идентифицированные врачом, осуществляющим наблюдение. В целом, 2 экспериментальных группы и 2 возрастных стратифицированных группы были сравнимыми с точки зрения процента индивидуумов, которые были исключены из группы, оцениваемой на иммуногенность.
Все 400 произвольно отобранных индивидуумов были включены в группу mITT.
Результаты анализа на иммуногенность
Результаты анализов на первичные конечные точки иммуногенности, вторичные конечные точки иммуногенности и экспериментальные конечные точки иммуногенности представлены в нижеследующих разделах.
Первичные и вторичные конечные точки
Число индивидуумов, у которых достигается hSBA-титр≥LLOQ
Первичные конечные точки иммуногенности представляют собой число индивидуумов в возрасте от≥24 месяцев до <4 лет (в начале исследования), и в возрасте от≥4 лет до <10 лет (в начале исследования), с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086. Вторичными конечными точками являются число всех индивидуумов в объединенной возрастной стратифицированной группе (в начале исследования) с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086 вместе с числом индивидуумов в отдельных и объединенных возрастных стратифицированных группах с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после второй вакцинации двухвалентным rLP2086.
Число индивидуумов в каждой возрастной стратифицированной группе с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB представлено в Таблице 20 для группы, оцениваемой на иммуногенность.
Число индивидуумов в возрасте от≥24 месяцев до <4 лет и в возрасте от≥4 лет до <10 лет в Группе 1 с hSBA-титром≥LLOQ на базовом уровне составляет 4,4% и 13,6%, соответственно, для PMB80 (A22); 1,5% и 15,4%, соответственно, для PMB2001 (A56); 3,0% и 7,5%, соответственно, для PMB2948 (B24); и 0,0%, для обеих возрастных стратифицированных групп PMB2707 (B44). В целом, число индивидуумов в объединенной возрастной стратифицированной группе с hSBA-титром≥LLOQ на базовом уровне составляет 9,0% для PMB80 (A22), 8,3% для PMB2001 (A56), 5,2% для PMB2948 (B24), и 0,0% для PMB2707 (B44) в Группе 1.
Число индивидуумов в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет в Группе 1 с hSBA-титром≥LLOQ через 1 месяц после второй вакцинации составляет 59,4% и 78,8%, соответственно, для PMB80 (A22); 100,0% для обеих возрастных стратифицированных групп для PMB2001 (A56); 49,2% и 65,1%, соответственно, для PMB2948 (B24); и 57,1% и 40,3%, соответственно, для PMB2707 (B44).
В целом, число индивидуумов в объединенной возрастной стратифицированной группе с hSBA-титром≥LLOQ через 1 месяц после второй вакцинации составляет 69,2% для PMB80 (A22), 100,0% для PMB2001 (A56), 57,0% для PMB2948 (B24), и 48,5% для PMB2707 (B44) в Группе 1.
Число индивидуумов в возрасте от≥24 месяцев до <4 лет и≥4 лет до <10 лет в Группе 1 с hSBA-титром≥LLOQ через 1 месяц после третьей вакцинации составляет 83,8% и 91,0%, соответственно, для PMB80 (A22); 100,0% для обеих возрастных стратифицированных групп для PMB2001 (A56); 85,7% и 92,1%, соответственно, для PMB2948 (B24); и 80,0% и 78,3%, соответственно, для PMB2707 (B44).
В целом, число индивидуумов в объединенной возрастной стратифицированной группе с hSBA-титром≥LLOQ через 1 месяц после третьей вакцинации составляет 87,4% для PMB80 (A22), 100,0% для PMB2001 (A56), 88,9% для PMB2948 (B24), и 79,1% для PMB2707 (B44) в Группе 1. В общих чертах, число индивидуумов в Группе 2 с hSBA-титром≥LLOQ не изменялось в течение определенного периода времени по сравнению с базовым уровнем. Число индивидуумов в объединенной возрастной стратифицированной группе с hSBA-титром≥LLOQ в любой момент времени составляет в пределах от 4,4% до 8,5% для PMB80 (A22); от 14,9% до 20,9% для PMB2001 (A56); от 0,0% до 8,9% для PMB2948 (B24); и 0,0% в каждый момент времени для PMB2707 (B44).
Результаты для группы mITT были аналогичны результатам для группы, оцениваемой на иммуногенность.
Оценка числа индивидуумов в подгруппах с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB представлена для группы, оцениваемой на иммуногенность в зависимости от пола, расы и страны. Каких-либо клинически значимых различий в анализах для подгрупп не наблюдалось.
Иммуноперсистентность: Число индивидуумов, у которых достигался hSBA-титр≥LLOQ через 6 месяцев после третьей вакцинации
Число индивидуумов в возрасте от≥24 месяцев до <4 лет, от≥4 лет до <10 лет, и в объединенной возрастной стратифицированной группе (от≥24 месяцев до <10 лет), с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 6 месяцев после третьей вакцинации двухвалентным rLP2086 представляет собой вторичную конечную точку иммуногенности. Число индивидуумов с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB в каждой возрастной стратифицированной группе представлено в Таблице 20 для группы, оцениваемой на иммуногенность.
В общих чертах, наблюдалось снижение числа индивидуумов с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB, наблюдаемое у индивидуумов Группы 1 в обеих возрастных стратифицированных группах через 6 месяцев после третьей вакцинации.
Для индивидуумов в возрасте от≥24 месяцев до <4 лет, начиная с 1 месяца после третьей вакцинации и до 6 месяцев после третьей вакцинации, число индивидуумов с hSBA-титром≥LLOQ снижалось с 83,8% до 19,0%, соответственно, для PMB80 (A22); с 100,0% до 80,3%, соответственно, для PMB2001 (A56); с 85,7% до 9,2%, соответственно для PMB2948 (B24); и с 80,0% до 12,1%, соответственно, для PMB2707 (B44).
Для индивидуумов в возрасте от≥4 лет до <10 лет, начиная с 1 месяца после третьей вакцинации и до 6 месяцев после третьей вакцинации, число индивидуумов с hSBA-титром≥LLOQ снижалось с 91,0% до 46,0%, соответственно, для PMB80 (A22); со 100,0% до 84,3%, соответственно, для PMB2001 (A56); с 92,1% до 21,9%, соответственно для PMB2948 (B24); и с 78,3% до 8,7%, соответственно, для PMB2707 (B44).
В целом, для объединенной возрастной стратифицированной группы, начиная с 1 месяца после третьей вакцинации и до 6 месяцев после третьей вакцинации, число индивидуумов с hSBA-титром≥LLOQ снижалось с 87,4% до 32,5% для PMB80 (A22); со 100,0% до 82,4% для PMB2001 (A56); с 88,9% до 15,5% для PMB2948 (B24); и с 79,1% до 10,4% для PMB2707 (B44).
В целом, число индивидуумов Группы 2 с hSBA-титром≥LLOQ не изменялось в течение определенного периода времени по сравнению с базовым уровнем.
Примечание: LLOQ=1:16 для A22; 1:8 для A56, B24, и B44
a. N=число индивидуумов с подтвержденными и определенными hSBA-титрами для данного штамма.
b. n=число индивидуумов с наблюдаемым hSBA-титром ≥ LLOQ для данного штамма в данный момент времени.
c. Точный 2-сторонний ДИ исходя из наблюдаемого числа индивидуумов с применением метода Клоппера и Пирсона.
ID программы: исследование B1971017/CP IMM_LLOQ.SAS. Дата создания отчетной серии базы данных: 01JUN2017. Время прохождения ID: 16 июня 2017 11:22. Файл ID: T_2_2_IMM_LLOQ_EVL.HTM.
GMT hSBA. Вторичной конечной точкой являются GMT hSBA для каждого из 4 первичных тестируемых штаммов на базовом уровне, через 1 месяц после второй вакцинации и через 1 месяц после третьей вакцинации двухвалентным rLP2086. В Таблице 21 представлены GMT hSBA для 4 первичных штаммов MnB в группе, оцениваемой на иммуногенность.
Для индивидуумов Группы 1 в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет, GMT hSBA на базовом уровне составляло 8,3 и 9,1, соответственно, для PMB80 (A22); 4,1 и 5,8, соответственно, для PMB2001 (A56); 4,3 и 4,6, соответственно, для PMB2948 (B24); и 4,0 в обеих возрастных стратифицированных группах для PMB2707 (B44).
Для индивидуумов Группы 1 в возрасте от≥24 месяцев до <10 лет, GMT hSBA на базовом уровне составляло 8,7 для PMB80 (A22), 4,9 для PMB2001 (A56), 4,5 для PMB2948 (B24) и 4,0 для PMB2707 (B44).
Для индивидуумов Группы 1 в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет, GMT hSBA через 1 месяц после вакцинации 2 составляло 17,4 и 23,1, соответственно, для PMB80 (A22); 103,8 и 90,0, соответственно, для PMB2001 (A56); 9,1 и 13,7, соответственно, для PMB2948 (B24); и 17,1 и 8,2, соответственно, для PMB2707 (B44).
Для индивидуумов Группы 1 в возрасте от≥24 месяцев до <10 лет, GMT hSBA через 1 месяц после вакцинации 2 составляло 20,1 для PMB80 (A22), 96,6 для PMB2001 (A56); 11,1 для PMB2948 (B24) и 11,7 для PMB2707 (B44).
Для индивидуумов Группы 1 в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет, GMT hSBA через 1 месяц после вакцинации 3 составляло 33,7 и 38,2, соответственно, для PMB80 (A22); 175,6 и 191,0, соответственно, для PMB2001 (A56); 19,1 и 26,8, соответственно, для PMB2948 (B24); и 43,6 и 36,5, соответственно, для PMB2707 (B44).
Для индивидуумов Группы 1 в возрасте от≥24 месяцев до <10 лет, GMT hSBA через 1 месяц после вакцинации 3 составляло 35,8 для PMB80 (A22), 183,3 для PMB2001 (A56); 22,6 для PMB2948 (B24), и 39,8 для PMB2707 (B44).
В общих чертах, GMT hSBA для индивидуумов в Группе 2 не изменялись в течение определенного периода времени по сравнению с базовым уровнем. Для объединенной возрастной стратифицированной группы, GMT hSBA в любой момент времени составляло в пределах от 8,6 до 8,9 для PMB80 (A22); от 5,6 до 6,0 для PMB2001 (A56); от 4,0 до 4,8 для PMB2948 (B24); и 4,0 в каждый момент времени для PMB2707 (B44).
Примечание: LLOQ=1:16 для A22; 1:8 для A56, B24 и B44. Титры ниже LLOQ означают 0,5 × LLOQ для анализа.
a. N=число индивидуумов с подтвержденными и определенными hSBA-титрами для данного штамма
b. GMT вычисляли для всех индивидуумов с подтвержденными и определенными hSBA-титрами на данный момент времени.
c. ДИ означает обратное преобразование доверительных уровней исходя из распрделения Стьюдента для среднего логарифма hSBA-титров.
Анализы GMT hSBA в подгруппах для каждого из 4 первичных тестируемых штаммов MnB представлены для группы оценки иммуногенности в зависимости от пола, расы и страны, и для группы mITT. Каких-либо клинически значимых различий в анализах для подгрупп не наблюдалось.
Иммуноперсистентность: GMT hSBA
Вторичной конечной точкой являются GMT hSBA для каждого из 4 первичных тестируемых штаммов через 6 месяцев после третьей вакцинации двухвалентным rLP2086. В Таблице 21 представлены GMT hSBA для 4 первичных штаммов MnB для группы, оцениваемой на иммуногенность.
В целом, снижение GMT hSBA наблюдалось в период времени от 1 месяца после третьей вакцинации до 6 месяцев после третьей вакцинации для каждого из 4 первичных тестируемых штаммов у индивидуумов в Группе 1 в обеих возрастных стратифицированных группах.
Для индивидуумов Группы 1 в возрасте от≥24 месяцев до <4 лет, в период времени от 1 месяца после третьей вакцинации до 6 месяцев после третьей вакцинации, GMT hSBA снижалось с 33,7 до 10,9 для PMB80 (A22), c 175,6 до 27,0 для PMB2001(A56), c 19,1 до 5,1 для PMB2948 (B24), и c 43,6 до 5,2 для PMB2707 (B44).
Для индивидуумов Группы 1 в возрасте от≥4 лет до <10 лет, в период времени от 1 месяца после третьей вакцинации до 6 месяцев после третьей вакцинации, GMT hSBA снижалось с 38,2 до 14,2 для PMB80 (A22), c 191,0 до 35,7 для PMB2001 (A56), c 26,8 до 6,2 для PMB2948 (B24), и c 36,5 до 5,0 для PMB2707 (B44).
Для индивидуумов Группы 1 в возрасте от≥24 месяцев до <10 лет, в период времени от 1 месяца после третьей вакцинации до 6 месяцев после третьей вакцинации, GMT hSBA снижалось с 35,8 до 12,4 для PMB80 (A22), c 183,3 до 31,3 для PMB2001(A56), c 22,6 до 5,6 для PMB2948 (B24), и c 39,8 до 5,1 для PMB2707 (B44).
В общих чертах, для индивидуумов Группы 2, GMT hSBA не изменялось в течение определенного периода времени по сравнению с базовым уровнем.
Определенные hSBA-титры
Вторичной конечной точкой иммуногенности является число индивидуумов в возрасте от≥24 месяцев до <4 лет, от≥4 лет до <10 лет, и в объединенной возрастной стратифицированной группе, у которых достигались hSBA-титры≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 для каждого из 4 первичных тестируемых штаммов на базовом уровне, через 1 месяц после второй вакцинации, и через 1 месяц после третьей вакцинации двухвалентным rLP2086.
Число индивидуумов, у которых достигались определенные hSBA-титры для 4 первичных штаммов MnB, оценивали для группы оценки иммуногенности.
Индивидуумы, у которых достигались hSBA-титры ≥1:4 и ≥1:16, описаны ниже. hSBA-титр ≥1:4 широко известен как коррелят защиты против ИМЗ; однако, более консервативный hSBA-титр ≥1:16 рассматривается как уровень, указывающий на 4-кратное действие вакцины для серонегативных индивидуумов до вакцинации.
Число индивидуумов в возрасте от ≥24 месяцев до <4 лет, и от≥4 лет до <10 лет, в Группе 1 с hSBA-титром ≥1:4 на базовом уровне составляет 5,9% и 19,7%, соответственно, для PMB80 (A22); 3,0% и 18,5%, соответственно, для PMB2001 (A56); 4,5% и 9,0%, соответственно, для PMB2948 (B24); и 0,0% и 1,4%, соответственно, для PMB2707 (B44). Число индивидуумов в возрасте от ≥24 месяцев до <4 лет и от≥4 лет до <10 лет в Группе 1 с hSBA-титром ≥1:16 на базовом уровне составляет 4,4% и 13,6%, соответственно, для PMB80 (A22); 1,5% и 15,4%, соответственно, для PMB2001 (A56); 3,0% и 6,0%, соответственно, для PMB2948 (B24); и 0,0% для обеих возрастных стратифицированных групп для PMB2707 (B44).
Число индивидуумов в Группе 1 с объединенной возрастной стратификацией с hSBA-титром≥1:4 и≥1:16 на базовом уровне составляет 12,7% и 9,0%, соответственно, для PMB80 (A22); 10,6% и 8,3%, соответственно, для PMB2001 (A56); 6,7% и 4,5%, соответственно, для PMB2948 (B24); и 0,7% и 0,0%, соответственно, для PMB2707 (B44).
Число индивидуумов в возрасте от ≥24 месяцев до <4 лет и от≥4 лет до <10 лет в Группе 1 с hSBA-титром ≥1:4 через 1 месяц после второй вакцинации составляет 65,6% и 83,3%, соответственно, для PMB80 (A22); 100,0% для обеих возрастных стратифицированных групп для PMB2001 (A56); 53,8% и 68,3%, соответственно, для PMB2948 (B24); и 49,3% и 66,7%, соответственно, для PMB2707 (B44). Число индивидуумов в возрасте от ≥24 месяцев до <4 лет и от≥4 лет до <10 лет, в Группе 1 с hSBA-титром ≥1:16 через 1 месяц после второй вакцинации составляет 59,4% и 78,8%, соответственно, для PMB80 (A22); 98,5% и 100,0%, соответственно, для PMB2001 (A56); 43,1% и 58,7%, соответственно, для PMB2948 (B24); и 31,3% и 55,6%, соответственно, для PMB2707 (B44).
Число индивидуумов в Группе 1 с объединенной возрастной стратификацией и с hSBA-титром ≥1:4 и ≥1:16 через 1 месяц после второй вакцинации составляет 74,6% и 69,2%, соответственно, для PMB80 (A22); 100,0% и 99,2%, соответственно, для PMB2001 (A56); 60,9% и 50,8%, соответственно, для PMB2948 (B24); и 57,7% и 43,1%, соответственно, для PMB2707 (B44).
Число индивидуумов в возрасте от ≥24 месяцев до <4 лет, и от≥4 лет до <10 лет, в Группе 1 с hSBA-титром ≥1:4 через 1 месяц после третьей вакцинации составляет 86,8% и 98,5%, соответственно, для PMB80 (A22); 100,0% для каждой возрастной стратифицированной группы для PMB2001 (A56); 90,5% и 95,2% для PMB2948 (B24); и 81,5% и 82,6%, соответственно для PMB2707 (B44). Число индивидуумов в возрасте от ≥24 месяцев до <4 лет и от≥4 лет до <10 лет, в Группе 1 с hSBA-титром ≥1:16 через 1 месяц после третьей вакцинации составляет 83,8% и 91,0%, соответственно, для PMB80 (A22); 100,0% для каждой возрастной стратифицированной группы для PMB2001 (A56); 81,0% и 88,9%, соответственно, для PMB2948 (B24); и от 81,5% до 82,6% и 80,0% и 75,4%, соответственно, для PMB2707 (B44).
Число индивидуумов в Группе 1 с объединенной возрастной стратификацией и с hSBA-титром ≥1:4 и ≥1:16 через 1 месяц после третьей вакцинации составляет 92,6% и 87,4%, соответственно, для PMB80 (A22); 100,0% и 100,0%, соответственно, для PMB2001 (A56); 92,9% и 84,9%, соответственно, для PMB2948 (B24); и 82,1% и 77,6%, соответственно, для PMB2707 (B44).
В общих чертах, число индивидуумов Группы 2, у которых достигались определнные hSBA-титры, не изменялось в течение определенного периода времени по сравнению с базовым уровнем.
Результаты для группы mITT были аналогичны результатам для группы, оцениваемой на иммуногенность.
Иммуноперсистентность: Определенные hSBA-титры
Вторичной конечной точкой иммуногенности является число индивидуумов в возрасте от≥24 месяцев до <4 лет, от≥4 лет до <10 лет, и в объединенной возрастной стратифицированной группе, у которых достигались hSBA-титры≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64, и≥1:128 для каждого из 4 первичных тестируемых штаммов через 6 месяцев после третьей вакцинации двухвалентным rLP2086. Число индивидуумов, у которых достигались определенные hSBA-титры для 4 первичных штаммов MnB, оценивали для группы, оцениваемой на иммуногенность.
В целом, наблюдалось снижение числа индивидуумов Группы 1 с двумя возрастными стратификациями, у которых достигались определенные hSBA-титры за период времени от 1 месяца после третьей вакцинации до 6 месяцев после третьей вакцинации.
Для индивидуумов Группы 1 в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет, за период времени от 1 месяца после третьей вакцинации до 6 месяцев после третьей вакцинации, число индивидуумов с hSBA-титром≥1:4 снижалось с 86,8% до 25,4% и с 98,5% до 55,6%, соответственно, для PMB80 (A22); с 100,0% до 82,0% и с 100,0% до 85,7%, соответственно для PMB2001 (A56); с 90,5% до 13,8% и с 95,2% до 26,6%, соответственно, для PMB2948 (B24); и с 81,5% до 13,6% и с 82,6% до 13,0%, соответственно, для PMB2707 (B44).
Для индивидуумов Группы 1 с объединенной возрастной стратификацией за период времени от 1 месяца после третьей вакцинации до 6 месяцев после третьей вакцинации, число индивидуумов с hSBA-титром≥1:4 снижалось с 92,6% до 40,5% для PMB80 (A22); с 100,0% до 84,0% для PMB2001 (A56); с 92,9% до 20,2% для PMB2948 (B24); и с 82,1% до 13,3% для PMB2707 (B44).
Для индивидуумов Группы 1 в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет, за период времени от 1 месяца после третьей вакцинации до 6 месяцев после третьей вакцинации, число индивидуумов с hSBA-титром≥1:4 снижалось с 83,8% до 19,0% и с 91,0% до 46,0%, соответственно, для PMB80 (A22); с 100,0% до 77,0% и с 100,0% до 82,9%, соответственно, для PMB2001 (A56); с 81,0% до 9,2% и с 88,9% до 20,3%, соответственно, для PMB2948 (B24); и с 80,0% до 9,1% и с 75,4% до 7,2%, соответственно, для PMB2707 (B44).
Для индивидуумов Группы 1 с объединенной возрастной стратификацией за период времени от 1 месяца после третьей вакцинации до 6 месяцев после третьей вакцинации, число индивидуумов с hSBA-титром≥1:16 снижалось с 87,4% до 32,5% для PMB80 (A22); с 100,0% до 80,2% для PMB2001 (A56); с 84,9% до 14,7% для PMB2948 (B24); и с 77,6% до 8,1% для PMB2707 (B44).
В общих чертах, число индивидуумов Группы 2, у которых достигались определнные hSBA-титры, не изменялось в течение определенного периода времени по сравнению с базовым уровнем.
Экспериментальные конечные точки иммуногенности
Анализ некоторых экспериментальных конечных точек иммуногенности проводили на основе результатов hSBA для штаммов PMB2001 (A56) и PMB2707 (B44) у одной половины индивидуумов и для штаммов PMB80 (A22) и PMB2948 (B24) у другой половины индивидуумов. Анализируемая экспериментальная конечная точка представляет собой hSBA-титр, который в≥4 раза превышает базовый уровень.
hSBA-титр, в 4 раза превышающий базовый уровень
В Таблице 22 представлено число индивидуумов с hSBA-титрами, которые≥4 раза превышают базовый уровень, для 4 первичных тестируемых штаммов.
Число индивидуумов в возрасте от ≥24 месяцев до <4 лет и от≥4 лет до <10 лет, в Группе 1 с hSBA-титром, который в ≥4 раза превышает базовый титр, через 1 месяц после вакцинации 2, составляет 56,3% и 63,6%, соответственно, для PMB80 (A22); 100,0% и 82,1%, соответственно, для PMB2001 (A56); 43,1% и 54,0%, соответственно, для PMB2948 (B24); и 54,0% и 31,3%, соответственно, для PMB2707 (B44).
Число индивидуумов в Группе 1 с объединенной возрастной стратификацией, у которых hSBA-титр в ≥4 раза превышает базовый титр, через 1 месяц после вакцинации 2, составляет 60,0% для PMB80 (A22), 91,0% для PMB2001 (A56), 48,4% для PMB2948 (B24), и 42,3% для PMB2707 (B44).
Число индивидуумов в возрасте от ≥24 месяцев до <4 лет, и от≥4 лет до <10 лет, в Группе 1 с hSBA-титром, который в ≥4 раза превышает базовый титр, через 1 месяц после вакцинации 3, составляет 79,4% и 77,6%, соответственно, для PMB80 (A22); 98,5% и 88,7%, соответственно, для PMB2001 (A56); 77,8% и 82,5%, соответственно, для PMB2948 (B24); и 78,5% и 75,4%, соответственно, для PMB2707 (B44).
Число индивидуумов в Группе 1 с объединенной возрастной стратификацией, у которых hSBA-титр в ≥4 раза превышает базовый титр, через 1 месяц после вакцинации 3, составляет 78,5% для PMB80 (A22), 93,5% для PMB2001 (A56), 80,2% для PMB2948 (B24), и 76,9% для PMB2707 (B44).
Число индивидуумов в возрасте от ≥24 месяцев до <4 лет и от≥4 лет до <10 лет, в Группе 1 с hSBA-титром, который в ≥4 раза превышает базовый титр, в течение периода времени до 6 месяцев после вакцинации 3, составляет 19,0% и 36,5%, соответственно для PMB80 (A22); 75,4% и 64,3%, соответственно, для PMB2001 (A56); 6,2% и 17,2%, соответственно, для PMB2948 (B24); и 7,6% и 7,2%, соответственно, для PMB2707 (B44).
Число индивидуумов в Группе 1 с объединенной возрастной стратификацией, у которых hSBA-титр в ≥4 раза превышает базовый титр, через 6 месяцев после вакцинации 3, составляет 27,8% для PMB80 (A22), 69,5% для PMB2001 (A56), 11,6% для PMB2948 (B24), и 7,4% для PMB2707 (B44).
Аналогичные результаты были получены для группы mITT.
Примечание: LLOQ=1:16 для A22; 1:8 для A56, B24, и B44
. Примечание: 4-кратное увеличение определено следующим образом: (1) Для индивидуумов с базовым hSBA-титром ниже LOD (hSBA-титр <1:4), ответ определен как hSBA-титр ≥1:16 или LLOQ (каким бы высоким этот титр не был). (2) Для индивидуумов с базовым hSBA-титром ≥ LOD и < LLOQ, ответ определен как hSBA -титр, который в ≥4 раза превышает LLOQ. (3) Для индивидуумов с базовым hSBA-титром ≥LLOQ, ответ определен как hSBA -титр, который в ≥4 раза превышает базовый титр.
a. Для hSBA-титра, который в ≥4 раза превышает базовый титр, N=число индивидуумов с подтвержденными и определенными hSBA-титрами для данного штамма в определенный момент времени и на базовом уровне.
b. Для hSBA-титра, который в ≥4 раза превышает базовый титр, n=число индивидуумов, у которых hSBA-титр
в ≥4 раза превышал базовый титр для данного штамма.
c. Точный двухсторонний ДИ исходя из наблюдаемого числа индивидуумов с применением метода Клоппера и Пирсона
d. Базовый уровень определен как время забора крови до вакцинации 1.
Дополнительные анализы на иммуногенность
Оценка исключения данных hSBA для первичных тестируемых штаммов MnB
Во все анализы на иммуногенность были включены только подтвержденные и достоверные результаты hSBA.
Результаты hSBA были исключены из анализов на иммуногенность (или рассматривается их исключение) по следующим причинам:
- Индивидуум отказался от участия в исследовании.
- У индивидуума не были взяты пробы крови для анализа, но он не отказывался от участия в исследовании.
- Количество крови было недостаточным для проведения анализа. Это было зарегистрировано как «недостаточное количество» для получения результатов анализа.
- Образец анализировали, но численное количество титра не могло быть определено. Это было зарегистрировано как «неопределенное количество» для получения результатов анализа.
Кривые обратного кумулятивного распределения
Были оценены RCDC для числа индивидуумов с hSBA-ответом (≥LLOQ) для каждого из 4 первичных штаммов и в каждый момент забора проб крови для объединенной возрастной стратифицированной группы. Также оценивали RCDC для каждого из 4 первичных штаммов и в каждый момент забора проб крови для индивидуумов в возрасте от≥24 месяцев до <4 лет. Также оценивали RCDC для каждого из 4 первичных штаммов и в каждый момент забора проб крови для индивидуумов в возрасте от≥4 лет до <10 лет.
RCDC указывали на то, что у большинства индивидуумов в обеих возрастных стратифицированных группах наблюдался значительный hSBA-ответ на каждый их первичных тестируемых штаммов MnB через 1 месяц после введения второй и третьей дозы двухвалентного rLP2086.
Выводы по иммуногенности
Главной целью этого исследования является описание иммунного ответа у индивидуумов на двухвалентный rLP2086, определяемого с помощью hSBA, против 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства В LP2086, как было определено через 1 месяц после третьей вакцинации у здоровых индивидуумов в возрасте от≥24 месяцев до <4 лет и от≥4 лет до <10 лет. Второй целью является описание иммунных ответов для пациентов объединенной возрастной стратифицированной группы (от≥24 месяцев до <10 лет). Конечными точками достижения главной цели является число индивидуумов в каждой возрастной стратифицированной группе, у которых достигались hSBA-титры≥LLOQ для каждого из 4 первичных штаммов MnB через 1 месяц после третьей вакцинации.
Стойкий иммунный ответ наблюдался у детей в возрасте от≥24 месяцев до <10 лет через 1 месяц после введения третьей дозы двухвалентного rLP2086, что подтверждается числом индивидуумов, у которых hSBA-титр составлял≥LLOQ (1:8 для A56, B24 и B44; 1:16 для A22) для каждого из 4 первичных тестируемых штаммов MnB в пределах от 80,0% до 100,0% для индивидуумов в возрасте от≥24 месяцев до <4 лет и от 78,3% до 100,0% для индивидуумов в возрасте от≥4 лет до <10 лет после введения 3 доз. Число индивидуумов в этой объединенной возрастной стратифицированной группе с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации составляло в пределах от 79,1% до 100,0%. Эти данные были также подтверждены высокими GMT (в пределах от 19,1 до 191) и числом индивидуумов, у которых достигались hSBA-титры≥1:4 (81,5% - 100%) или≥1:16 (75,4% - 100%) против каждого из 4 первичных тестируемых штаммов MnB после введения 3 доз двухвалентного rLP2086 по сравнению с базовыми уровнями для обеих возрастных стратифицированных групп. Кроме того, число индивидуумов в объединенной возрастной стратифицированной группе, у которых hSBA-титр был≥4 по сравнению с базовым уровнем через 1 месяц после третьей вакцинации для каждого из 4 первичных тестируемых штаммов MnB, составляло от 76,9% до 93,5%.
Второй целью исследования является описание иммунных ответов через 1 месяц после введения второй дозы двухвалентного rLP2086, как было установлено по ответам≥LLOQ, определенным hSBA-титрам и GMT hSBA для 2 возрастных стратифицированных групп и объединенной возрастной стратифицированной группе. Для объединенной возрастной стратифицированной группы, число индивидуумов с hSBA-титром≥LLOQ составляло от 48,5% до 100,0%, причем, между стратифицированными группами младшего и более старшего возраста каких-либо значимых различий не наблюдалось. Эти данные были дополнительно подтверждены для объединенной возрастной стратифицированной группы с увеличением GMT (в пределах от 11,1 до 96,6), и для числа индивидуумов, у которых достигался hSBA-титр≥1:4 (57,7% - 100%) или≥1:16 (43,1% - 100%) после введения 2 доз двухвалентного rLP2086 по сравнению с базовым уровнем против каждого из 4 первичных тестируемых штаммов MnB. GMT были аналогичными для 2 возрастных стратифицированных групп. Кроме того, число индивидуумов в объединенной возрастной стратифицированной группе, у которых hSBA-титр был≥4 по сравнению с базовым уровнем через 1 месяц после второй вакцинации для каждого из 4 первичных тестируемых штаммов MnB, составляло от 42,3% до 91,0%.
Иммуноперсистентность также оценивали через 6 месяцев после введения третьей дозы двухвалентного rLP2086, где число индивидуумов с hSBA-титром≥LLOQ снижалось от 79,1%-100% через 1 месяц после третьей вакцинации до 10,4%-82,4% на 6 месяц после третьей вакцинации для объединенной возрастной стратифицированной группы. Каких-либо различий между 2 возрастными стратифицированными группами не наблюдалось, за исключением A22, где детей более старшего возраста с титром≥LLOQ было больше, чем детей младшего возраста (46%, 95% с ДИ=33,4, 59,1 и 19%, 95% с ДИ=10,2, 30,9). Однако, базовые уровни титров≥LLOQ до вакцинации были выше для A22 в возрастной стратифицированной группе (13,6% и 4,4%). Аналогичная тенденция также наблюдалась для объединенной возрастной стратифицированной группы у индивидуумов с протективным hSBA-титром≥1:4, в пределах 13,3%-84,0% и GMT в пределах 5,1-31,3 через 6 месяцев после третьей вакцинации.
В целом, двухвалентный rLP2086, вводимый в 3 дозах по схеме введения на месяцы 0, 2 и 6, вырабатывал стойкий иммунный ответ у детей раннего возраста и у детей в возрасте от≥24 месяцев до <10 лет с протективными титрами антител, достигаемыми, как показал hSBA, у большого числа индивидуумов после третьей дозы. Между детьми раннего возраста, то есть, в возрасте от≥24 месяцев до <4 лет и детьми в возрасте от≥4 лет до <10 лет, каких-либо значимых клинических различий не наблюдалось. Гуморальные ответы снижались через 6 месяцев после введения третьей дозы, но оставались выше, чем базовые уровни до вакцинации.
Обсуждение и общие выводы
Обсуждение иммуногенности
Результаты этого исследования по иммуногенности Фазы 2 по схеме введения 3 доз (по схеме введения на месяцы 0, 2 и 6) двухвалентного rLP2086, вводимого детям раннего возраста и детям в возрасте от≥24 месяцев до <10 лет, соответствуют данным, полученным в предыдущих исследованиях с участием подростков и молодых людей. Иммуногенные ответы на вакцинацию двухвалентным rLP2086 оценивали с помощью hSBA для подтверждения достоверности с использованием 4 первичных тестируемых штаммов MnB, каждый из которых экспрессирует варианты fHBP, гетерологичные антигенам-компонентам вакцины, по более жестким критерям, чем общепринятый коррелят защиты (hSBA-титр≥1:4). Исходя из hSBA-титра≥LLOQ для 4 первичных тестируемых штаммов MnB через 1 месяц после вакцинации 3, у детей раннего возраста и у детей старшего возраста, участвующих в этом исследовании, наблюдались такие же иммунные ответы как и у подростков (от 10 лет до <19 лет), участвующих в исследовании B1971009, где число индивидуумов с hSBA-титром≥LLOQ после третьей вакцинации (по схеме введения на 0, 2 и 6 месяц) составляло в пределах от 79,1% до 100% в этом исследовании и от 87,1% до 99,5% в исследовании B1971009. Каких-либо значимых различий в числе индивидуумов с hSBA-титром≥LLOQ для 4 первичных тестируемых штаммов через 1 месяц после вакцинации 3 в этих 2 исследованиях не наблюдалось, несмотря на то, что в исследование B1971009 входило гораздо большее число подростков с hSBA-титром≥LLOQ до вакцинации по сравнению с титрами у детей раннего возраста и у детей старшего возраста, участвующих в этом исследовании, а в частности, для тестируемых штаммов A22 (33,2% и 9%, соответственно) и A56 (27,5% и 8,3%, соответственно). Двухвалентный rLP2086, очевидно, является в высокой степени иммуногенным у индивидуумов в группе от≥24 месяцев до <10 лет и, очевидно, обладает защитным действием против инфекции MnB, аналогичным действию, ожидаемому для подростков исходя из hSBA коррелята защиты.
Что касается других целей, то иммунные ответы в этом исследовании для объединенной возрастной стратифицированной группы (от≥24 месяцев до <10 лет) через 1 месяц после введения второй дозы двухвалентного rLP2086, были относительно стойкими для 4 первичных тестируемых штаммов MnB, где число индивидуумов, у которых достигался hSBA-титр≥LLOQ, составляло от 48,5% до 100%. За исключением штамма A56, эти ответы были ниже, чем иммунные ответы, наблюдаемые у подростков (от 10 лет до <19 лет), участвующих в исследовании B1971009, которым вводили 2 дозы двухвалентного rLP2086 с перерывом в 2 месяца, и составляли от 64% до 99,1%. Иммуноперсистентность оценивали в этом исследованияи у детей раннего возраста и у детей более старшего возраста путем измерения hSBA-титров через 6 месяцев после вакцинации 3. Число индивидуумов, у которых достигался hSBA-титр≥LLOQ, снижалось с 79,1%-100% через 1 месяц после вакцинации 3 до 10,4%-82,4% через 6 месяцев после вакцинации 3. GMT и число индивидуумов с определенными hSBA-титрами также снижались через 6 месяцев после вакцинации 3. Хотя число индивидуумов, у которых достигался hSBA-титр≥LLOQ через 6 месяцев после вакцинации 3 в этом исследовании (10,4%-82,4%), было ниже, чем число подростков (от 11 лет до <19 лет), участвующих в исследовании 6108A1-2001 (36,7%-89,4%), однако, оно все же было выше, чем число индивидуумов в возрасте от ≥24 месяцев до <10 лет с hSBA-титром≥LLOQ на базовом уровне (0% - 9%). Было точно установлено, что степень колонизации менингококков с возрастом повышается. Различия между индивидуумами в возрастной группе от≥24 месяцев до <10 лет и в группе более старшего возраста могут быть частично обусловлены числом индивидуумов с базовым титром≥LLOQ, который составлял максимум 27,5% (A56) и 33,2% (A22) в исследовании B1971009, и 7,4%-13,4% для штаммов подсемейства A в исследовании 6108A1-2001. Кроме того, недавно проведенное исследование показало, что носителей штаммов серологической группы B, ассоциированной с заболеванием, было больше среди индивидуумов с протективными hSBA-титрами (до вакцинации), и что вакцинация не оказывает какого-либо влияния на последующий перенос этих ассоциированных с заболеванием штаммов. Это позволяет предположить, что такой перенос может влиять на базовые hSBA-титры, и что персистентность или реколонизация после вакцинации могут способствовать повышению числа индивидуумов с hSBA-титром≥LLOQ, наблюдаемым у подростков через 6 месяцев после вакцинации, по сравнению с детьми раннего возраста и детьми более старшего возраста, участвующими в этом исследовании, у которых, как предполагают авторы изобретения, имеется меньшая вероятность колонизации и меньший процент hSBA-титров≥LLOQ на базовом уровне. Исследования иммуноперсистентности с использованием одновалентной конъюгатной вакцины на основе менингококков серологической группы C у младенцев и детей аналогичным образом показали, что протективный иммунитет быстро снижался. Однако, даже в группе детей, у которых процент hSBA-титров >1:8 для серологической группы C составлял лишь 46,9% через 4 года после прекращения введения первой дозы, последующая бустер-доза давала титры >1:8 у 100% индивидуумов через 1 месяц и 1 год после введения бустер-дозы. Это указывает на то, что даже индивидуумы, которые были серонегативными до введения бустер-дозы, имеют сильный анамнестический ответ, который сохранялся вплоть до 1 года после бустер-вакцинации. Поэтому, исследование ответа после введения бустер-дозы и исследование персистентности, которые были проведены у индивидуумов, получавших первую серию двухвалентного rLP2086, а именно у детей раннего возраста и более сташего возраста, позволили иначе взглянуть на ценность введения бустер-дозы для защиты от ИМЗ у подростков и у совершеннолетних.
В целом, двухвалентный rLP2086, вводимый по схеме введения на месяцы 0, 2 и 6, является в высокой степени иммуногенным у детей раннего возраста и у детей в возрасте от≥24 месяцев до <10 лет с протективными иммунными ответами, которые достигались, как показал hSBA, у большого числа индивидуумов после введения 3-й дозы. Иммунные ответы, оцененные в этом исследовании, были, предположительно, аналогичны ответам, наблюдаемым в ранее проводимых исследованиях с участием подростков через 1 месяц после введения второй и третьей доз. Схема введения 3 доз, предположительно, дает высокие уровни протективного иммунитета у детей раннего возраста и у детей в возрасте от≥24 месяцев до <10 лет.
Общие выводы
В заключение следует отметить, что двухвалентный rLP2086, введенный детям раннего возраста и детям в возрасте от≥24 месяцев до <10 лет по схеме 3 доз на месяцы 0, 2 и 6, вырабатывает стойкий иммунный ответ у большинства детей после второй и третьей дозы, при этом протективные титры антител достигались после третьей дозы, как было определено с помощью hSBA. hSBA-титры снижались через 6 месяцев после серии из 3 доз. Вакцина, вводимая в этом исследовании, была безопасной и хорошо переносилась с приемлемым профилем безопасности у детей раннего возраста и у детей в возрасте от≥24 месяцев до <10 лет.
Пример 20: Рандомизированное, контролируемое исследование слепым методом Фазы 2 для описания иммуногенности, безопасности и переносимости двухвалентной вакцины на основе рекомбинантного липопротеина 2086 Neisseria meningitidis серологической группы B (двухвалентного rLP2086), вводимой здоровым детям в возрасте от 12 до <18 месяцев или от 18 до <24 месяцев (B1971017-syn).
Цели
Главные цели анализа на иммуногенность:
- Описание иммунного ответа, оцененного с помощью анализа на бактерицидную активность сыворотки с использованием человеческого комплемента (hSBA), проводимого для 4 первичных штаммов Neisseria meningitidis серологической группы B (MnB), 2 из которых экспрессируют белок подсемейства А LP2086, а 2 экспрессируют белок подсемейства B, как было определено через 1 месяц после третьей вакцинации двухвалентным rLP2086, у здоровых детей в возрасте от 12 до <18 месяцев в начале исследования.
- Описание иммунного ответа, оцененного с помощью hSBA, проводимого для 4 первичных штаммов MnB, 2 из которых экспрессируют белок подсемейства А LP2086, а 2 экспрессируют белок подсемейства B, как было определено через 1 месяц после третьей вакцинации двухвалентным rLP2086, у здоровых детей в возрасте от 18 до <24 месяцев в начале исследования.
Главная цель анализа на безопасность:
Оценка профиля безопасности двухвалентного rLP2086 по сравнению с контролем (вакциной против вируса гепатита A [HAV]), где такую оценку проводили по местным реакциям, системным эффектам, побочным эффектам (AE), серьезными побочным эффектам (SAE), только что дианостированным хроническим патологическим состояниям (NDCMC), эффектам, ассоциированным с лечением (MAE) и внезапным AE у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев в начале исследования и в обеих объединенных возрастных стратифицированных группах.
Другие цели анализа на иммуногенность:
- Описание иммунного ответа, оцененного с помощью анализа hSBA, проводимого для 4 первичных тестируемых штаммов MnB, 2 из которых экспрессируют белок подсемейства А LP2086, а 2 экспрессируют белок подсемейства B, как было определено через 1 месяц после третьей вакцинации двухвалентным rLP2086, у здоровых детей в возрасте от 12 до <24 месяцев в начале исследования (то есть, в обеих объединенных возрастных стратифицированных группах).
- Описание иммунного ответа, оцененного с помощью hSBA, проводимого для 4 первичных тестируемых штаммов MnB, 2 из которых экспрессируют белок подсемейства А LP2086, а 2 экспрессируют белок подсемейства B, как было определено через 1 месяц после второй вакцинации и через 6, 12, 24, 36, и 48 месяцев после третьей вакцинации у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев в начале исследования и в обеих объединенных возрастных стратифицированных группах.
Экспериментальные цели анализа на иммуногенность:
- Дополнительное описание иммунного ответа, оцененного с помощью hSBA, проводимого для 4 первичных тестируемых штаммов MnB, 2 из которых экспрессируют белок подсемейства А LP2086, а 2 экспрессируют белок подсемейства B, как было определено через 1 месяц после второй вакцинации и через 1, 6, 12, 24, 36 и 48 месяцев после третьей вакцинации двухвалентным rLP2086 у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев в начале исследования и в обеих объединенных возрастных стратифицированных группах.
- Дополнительное описание иммунного ответа, оцененного с помощью hSBA, проводимого для вторых тестируемых штаммов MnB, экспрессирующих белки подсемейства А и В LP2086, через 1 месяц после второй вакцинации и через 1, 6, 12, 24, 36 и 48 месяцев после третьей вакцинации у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев в начале исследования и в обеих объединенных возрастных стратифицированных группах.
Методы
Протокол исследования:
Это исследование представляет собой рандомизированное, активно контролируемое многоцентровое исследование Фазы 2, проводимое слепым методом, не известным ни наблюдателю, ни спонсору, в которое было произвольно включено приблизительно 396 здоровых детей раннего возраста, стратифицированных по возрасту, от 12 до <18 месяцев или от 18 до <24 месяцев в отношении 2:1, которые получали двухвалентный rLP2086 (либо 2 дозы [60 мкг или 120 мкг]), либо лицензированную детскую вакцину против HAV(0,5 мл)/стерильный физиологический раствор для инъекции (0,5 мл 0,85% хлорида натрия).
Исследование проводили в 2 стадии. В Стадии 1 оценивали иммуногенность, безопасность и переносимость вакцины в 2 фазы: маркерную фазу включения в испытание и фазу с расширенным участием. В Стадии 2 оценивали продолжительность иммунного ответа на двухвалентный rLP2086.
Для иммуногенности представлены все данные вплоть до 1 месяца после вакцинации 3 (Визит 7), за исключением дополнительных данных для второго тестируемого штамма MnB, относящихся к экспериментальной цели. Конечный отчет включает все данные по иммуногенности, полученные после завершения Стадии 2, и данные по безопасности за период после Визита 8 и до конца исследования (Визит 13, через 48 месяцев после вакцинации 3).
В соответствии с программой испытания, маркерная фаза включения в Стадию 1 включает всего четыре маркерных группы: 2 стратифицированных по возрасту группы для каждой дозы (60 мкг или 120 мкг) двухвалентного rLP2086. Маркерные группы, в которую входили дети раннего возраста, состояли из индивидуумов в возрасте от 12 до <15 месяцев, а маркерные группы, в которую входили дети более старшего возраста, состояли из индивидуумов в возрасте от 18 до <24 месяцев. В соответствии с программой, в каждую из 4 маркерных групп входило приблизительно 33 индивидуума. Маркерная фаза включения в испытание была дополнена данными по IRC в заранее определенные моменты времени, и эту фазу завершали в соответствии с установленными нормами. Дозу 120 мкг детям, входящим в маркерные группы, не вводили до тех пор, пока доза 60 мкг не была оценена IRC как безопасная и переносимая в маркерной группе того же возраста. Дозу 60 мкг детям более младшего возраста, входящим в маркерные группы, не вводили до тех пор, пока эта доза не была оценена IRC как безопасная и переносимая в маркерной группе детей более старшего возраста с дозой 120 мкг.
Перед проведением Стадии 1 фазы расширенного включения, все данные IRC рассматривались после вакцинации 1, и на 7 й день заносились в электронный дневник, а затем у индивидуумов маркерной группы брали данные SAE. Исходя из отчета, данные IRC, отобранные для дозы 120 мкг двухвалентного rLP2086, исследовали в фазе расширенного включения в Стадию 1 для обеих возрастных стратифицированных групп. В группу расширенного включения, в которую входили дети более младшего возраста (дополнительно 132 индивидуума), включали детей в возрасте от 12 до <18 месяцев и стратифицировали по возрасту на две подгруппы: детей от 12 до <15 месяцев и детей от 15 до <18 месяцев. В группу расширенного включения, в которую входили дети более старшего возраста (дополнительно 132 индивидуума), включали детей в возрасте от 18 до <24 месяцев во время проведения фазы расширенного включения. Общая продолжительность исследования индивидуумов, прошедших только Стадию 1, составляла приблизительно 18 месяцев. Схема визитов для Стадии 1 представлена в Таблице 23.
Стадия 2 включает только тех индивидуумов, которые были произвольно распределены и которые получали двухвалентный rLP2086 (независимо от дозы). Общая продолжительность исследования индивидуумов, прошедших Стадию 2, составляла приблизительно 4,5 лет (54 месяца). Схема визитов для Стадии 2 представлена в Таблице 24.
Двухвалентный rLP2086 вводили на месяцы 0, 2 и 6 (Визиты 1, 4 и 6). Детскую вакцину против HAV вводили на месяцы 0 и 6 (Визиты 1 и 6), а физиологический раствор вводили на месяц 2 (Визит 4) с сохранением испытания слепым методом.
1
2
3
a. Визиты 9 и 10 не были включены в этот отчет данных анализа в клиническом исследованияи
b. Относится к вакцинации 3.
c. Инъекция, проводимая осведомленным специалистом; острые реакции, оцененные сторонним наблюдателем. Участок вакцинации указан в источнике, CRF и в электронном дневнике.
d. Кровь брали до вакцинации и только после подтверждения включения в программу исследования.
e. Результаты анализа пробы крови на иммуногенность во время Визита 8 не были включены в отчет первичного анализа в клиническом исследовании.
(24 месяца)
(36 месяцев)
(48 месяцев)
Вводимые вакцины: Двухвалентный rLP2086 (60 мкг или 120 мкг) вводили 3 раза в течение всего курса исследования: путем первой вакцинации на Визит 1 (месяц 0), второй вакцинации на Визит 4 (месяц 2), и третьей вакцинации на Визит 6 (месяц 6). Двухвалентный rLP2086 вводили путем внутримышечной инъекции либо в дельтовидную мышцу, либо в переднюю боковую мышцу бедра. Вакцину против HAV вводили два раза в течение всего курса исследования: путем первой вакцинации на Визит 1 (месяц 0), и третьей вакцинации на Визит 6 (месяц 6). Физиологический раствор вводили во время второй вакцинации (месяц 2). Вакцину против HAV /физиологический раствор вводили путем внутримышечной инъекции либо в дельтовидную мышцу, либо в переднюю боковую мышцу бедра. Исследуемый продукт вводился только квалифицированным медицинским сотрудником, входящим в штат специалистов по проведению исследований и являющимся третьим сторонним лицом. Если мышечная масса дельтовидной мышцы была неподходящей для внутримышечной инъекции, то предпочтительным участком инъекции было выбрано бедро.
Оценка иммуногенности: Для облегчения анализа на иммуногенность, у индивидуумов брали приблизительно 5 мл крови в нижеследующие моменты времени во время проведения Стадии 1: до вакцинации 1 (Визит 1), через 1 месяц после вакцинации 2 (Визит 5), через 1 месяц после вакцинации 3 (Визит 7), через 6 месяцев после вакцинации 3 (Визит 8), и через 12 месяцев после вакцинации 3 (Визит 9). В целом, 25 мл брали за период 18 месяцев. Перед забором крови может быть проведена локальная/местная анестезия.
Для определения продолжительности иммунного ответа, у индивидуумов в Стадии 2 брали приблизительно 5 мл крови в нижеследующие моменты времени: через 2 года после вакцинации 3, через 3 года после вакцинации 3 и через 4 года после вакцинации 3. В целом, 15 мл брали за период приблизительно 2,5 лет.
Для оценки иммунного ответа на двухвалентный rLP2086, функциональные антитела анализировали в hSBA с использованием менингококковых штаммов серологической группы B. В hSBA определяли антитела в человеческой сыворотке, вызывающие комплемент-зависимый цитолиз менингококкового штамма-мишени. Четыре (4) первичных тестируемых штамма MnB, PMB80 (A22), PMB2001 (A56), PMB2948 (B24) и PMB2707 (B44), каждый из которых экспрессирует вариант белка, связывающегося с фактором Н (fHBP) и гетерологичного антигенным компонентам вакцины, использовали в hSBA для определения конечных точек иммуногенности в этом исследовании.
Из-за ограничения объема сыворотки, 2 первичных штамма (PMB80 [A22] и PMB2948 [B24]) были протестированы в каждый момент забора крови у одной половины индивидуумов (в обеих возрастных стратифицированных группах), а другие 2 первичных штамма (PMB2001 [A56] и PMB2707 [B44]) были протестированы в каждый момент забора крови у другой половины индивидуумов.
После включения всех индивидуумов в программу исследования (Визит 1), группа специалистов по статистике независимого статистического центра (ISC), не входящая в программу проведения исследования, представила 2 списка индивидуумов (произвольно отобранных индивидуумов, 50% которых было протестировано на PMB80 [A22]/PMB2948 [B24], и остальных 50% индивидуумов, протестированных на PMB2001 [A56]/PMB2707 [B44]) группе специалистов, занимающихся анализом образцов на средства спонсоров. Оба списка имели такое же отношение рандомизации (2:1) и такое же распределение по возрасту, как и в протоколе исследования. Одна и та же пара штаммов (PMB80 [A22]/PMB2948 [B24] или PMB2001 [A56]/PMB2707 [B44]) была протестирована во все визиты для одних и тех же индивидуумов.
После завершения тестирования для проведения первичных анализов, и если сыворотка присутствовала в достаточном объеме, то могло быть проведено дополнительное тестирование для оценки иммунного ответа на двухвалентный rLP2086: PMB80 (A22) и PMB2948 (B24) могут быть протестированы в пробах сыворотки, взятых у 50% индивидуумов, получавших двухвалентный rLP2086, и эти пробы сыворотки были сначала протестированы на PMB2001 (A56) и PMB2707 (B44). И наоборот, PMB2001 (A56) и PMB2707 (B44) могут быть протестированы в пробах сыворотки, взятых у 50% индивидуумов, получавших двухвалентный rLP2086, и эти пробы сыворотки были сначала протестированы на PMB80 (A22) и PMB2948 (B24). Может быть осуществлено тестирование на вторичные штаммы.
Статистические методы:
Первичными конечными точками иммуногенности являются:
- Число индивидуумов, у которых достигается hSBA-титр≥нижнего(му) предела(у) количественной оценки (LLOQ) через 1 месяц после третьей вакцинации для каждого из 4 первичных тестируемых штаммов MnB у здоровых детей в возрасте от 12 до <18 месяцев в начале исследования.
- Число индивидуумов, у которых достигается hSBA-титр≥LLOQ через 1 месяц после третьей вакцинации для каждого из 4 первичных тестируемых штаммов MnB у здоровых детей в возрасте от 18 до <24 месяцев в начале исследования.
Все вторичные конечные точки иммуногенности для всего исследования описаны в настоящей заявке, но в этом Примере представлены результаты конечных точек иммуногенности, которые были получены только на визиты 1-7. Были проанализированы последующие конечные точки.
Нижеследующая конечная точка относится к результатам, полученным для здоровых индивидуумов в возрасте от 12 до <24 месяцев (то есть, в обеих объединенных возрастных стратифицированных группах) в начале исследования:
- Число индивидуумов с hSBA-титрами≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086 и через 6, 12, 24, 36 и 48 месяцев после третьей вакцинации двухвалентным rLP2016.
Нижеследующие конечные точки относятся к результатам, полученным для здоровых индивидуумов в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев в начале исследования и в обеих объединенных возрастных стратифицированных группах:
- Число индивидуумов с hSBA-титрами≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после второй вакцинации двухвалентным rLP2086.
- Число индивидуумов с hSBA-титрами≥LLOQ, ≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 для каждого из 4 первичных штаммов MnB на каждый подходящий визит для взятия пробы крови.
- Геометрически средние hSBA-титры (GMT) для каждого из 4 первичных тестируемых штаммов MnB на каждый подходящий визит для взятия пробы крови.
Все экспериментальные конечные точки, определенные ниже, относятся к результатам hSBA для всех здоровых индивидуумов в возрасте от 12 до <18 месяцев или от 18 до <24 месяцев в начале исследования и для двух объединенных возрастных стратифицированных групп, где указанные индивидуумы получали двухвалентный rLP2086 и были протестированы на соответствующий штамм в подходящий момент времени:
- Число индивидуумов с hSBA-титрами≥LLOQ, ≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 в каждый подходящий момент взятия пробы крови.
- GMT hSBA для каждого из 4 первичных штаммов MnB на каждый подходящий визит для взятия пробы крови.
- Число индивидуумов, у которых достигалось по меньшей мере 4-кратное увеличение hSBA-титра по сравнению с базовым уровнем через 1 месяц после третьей вакцинации двухвалентным rLP2086 для каждого из 4 первичных тестируемых штаммов:
- Для индивидуумов с базовым hSBA-титром ниже предела детектирования (LOD) или с hSBA-титром <1:4, 4-кратный ответ был определен как hSBA-титр≥1:16.
- Для индивидуумов с базовым hSBA-титром≥LOD (то есть, hSBA-титром≥1:4) и < LLOQ, 4-кратный ответ был определен как hSBA-титр, который в≥4 раза превышает LLOQ.
- Для индивидуумов с базовым hSBA-титром≥LLOQ, 4-кратный ответ был определен как hSBA-титр, который в≥4 раза превышает базовый титр.
Нижеследующие конечные точки были определены, если имелось достаточное количество сыворотки для тестирования каждого индивидуума на все 4 первичных штамма и/или на вторичные штаммы.
- Число индивидуумов, у которых достигался hSBA-титр≥LLOQ для комбинации всех 4 первичных тестируемых штаммов (PMB80 [A22], PMB2948 [B24], PMB2001 [A56] и PMB2707 [B44]) через 1 месяц после третьей вакцинации двухвалентным rLP2086. Это применимо только к тем индивидуумам, у которых были протестированы все 4 первичных штамма.
- Для hSBA на вторичные штаммы MnB были проведены нижеследующие дополнительные экспериментальные анализы:
- GMT hSBA для каждого тестируемого вторичного штамма MnB, через 1 месяц после второй и третьей вакцинации и/или на каждый момент взятия пробы крови.
- Число индивидуумов с hSBA-титром≥LLOQ для каждого вторичного штамма MnB через 1 месяц после второй и третьей вакцинации и/или на каждый момент взятия пробы крови.
Анализ первичных конечных точек
Первичным анализом для достижения главных целей является определение числа индивидуумов с hSBA-титром≥LLOQ через 1 месяц после третьей вакцинации для каждого из 4 первичных тестируемых штаммов MnB у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев, в начале исследования, соответственно. Для достижения этой цели была использована группа, оцениваемая на иммуногенность, и были представлены проценты и доверительные интервалы (ДИ).
Анализ вторичных конечных точек
Все анализы, проводимые для группы mITT, рассматривались как вторичные анализы.
Вторичные анализы также включают проценты индивидуумов с hSBA-титрами≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации для обеих групп, оцениваемых на иммуногенность и для группы mITT.
В этом Примере, процент индивидуумов с hSBA-титрами≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после второй вакцинации и через 1 месяц после третьей вакцинации определяли для группы, оцениваемой на иммуногенность и для группы mITT. В конечном анализе, процент индивидуумов с hSBA-титрами≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 6, 12, 24, 36 и 48 месяцев после третьей вакцинации анализировали для группы, оцениваемой на иммуногенность и для группы mITT.
Процент индивидуумов с hSBA-титрами≥LLOQ 1:4, 1:8, 1:16, 1:32, 1:64, 1:128 для каждого из 4 первичных тестируемых штаммов MnB на каждый подходящий визит для взятия пробы крови анализировали для группы, оцениваемой на иммуногенность и для группы mITT.
GMT для каждого из первичных тестируемых штаммов MnB на каждый подходящий визит для взятия пробы крови систематизировали для группы, оцениваемой на иммуногенность и для группы mITT.
Анализ экспериментальных конечных точек
Число индивидуумов, у которых достигалось по меньшей мере 4-кратное увеличение hSBA-титров по сравнению с базовым уровнем через 1 месяц после второй и третьей вакцинации двухвалентным rLP2086, систематизировали для группы, оцениваемой на иммуногенность и для группы mITT.
Анализ подгрупп
Некоторые конечные точки иммуногенности и безопасности отдельно систематизировали по полу, стране и стратификации возраста.
Результаты
Распределение индивидуумов и демография:
Для этого исследования было отобрано всего 396 индивидуумов в возрасте от 12 до <24 месяцев. Из всех отобранных индивидуумов, 44 индивидуума получали 60 мкг двухвалентного rLP2086, 220 индивидуумов получали 120 мкг двухвалентного rLP2086, а 132 индивидуума получали вакцину против HAV/физиологический раствор. 198 индивидуумов были произвольно распределены по каждой возрастной стратифицированной группе (от 12 до <18 месяцев и от 18 до <24 месяцев).
Из 396 произвольно отобранных индивидуумов, 385 (97,2%) индивидуумов завершили фазу вакцинации (от вакцинации в первом исследовании [Визит 1] вплоть до 1 месяца после вакцинации 3 [Визит 7]) этого исследования. Всего 386 (97,5%) индивидуумов прошли фазу наблюдения (от Визита 7 до 6 месяцев после вакцинации 3 [Визит 8]). В целом, всего 381 (96,2%) индивидуум прошел все визиты исследования вплоть до визита для наблюдения на 6-й месяц (Визит 8) и после завершения исследования, статус был аналогичным для индивидуумов в каждой возрастной стратифицированной группе (189 [95,5%] индивидуумов и 192 [97,0%] индивидуума в возрастной стратифицированной группе от 12 до <18 месяцев и 18 до <24 месяцев, соответственно).
В целом, 52,8% индивидуумов были индивидуумы женского пола, и большинство индивидуумов были индивидуумами индоевропейской расы (94,4%) и не являлись испанцами/латиноамериканцами (99,5%). Средний возраст (SD) индивидуумов при первой вакцинации составлял 17,3 (3,61) месяцев (в пределах от 12 до 23 месяцев). Демографические данные были, в основном, аналогичными для вакцинных групп.
Характеристики групп ITT и mITT были аналогичны характеристикам группы для оценки безопасности.
Результаты по иммуногенности:
Главными целями этого исследования являются описание иммунного ответа у индивидуумов на двухвалентный rLP2086, как было определено с помощью hSBA, против 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства В LP2086, как было определено через 1 месяц после третьей вакцинации у здоровых индивидуумов в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев. Второй целью является описание иммунных ответов для пациентов объединенной возрастной стратифицированной группы (от от 12 до <24 месяцев). Конечными точками достижения главной цели является число индивидуумов в каждой возрастной стратифицированной группе, у которых достигались hSBA-титры≥LLOQ для каждого из 4 первичных штаммов MnB через 1 месяц после третьей вакцинации.
Стойкий иммунный ответ наблюдался при обеих дозах у детей в возрасте от 12 до <18 месяцев и у детей в возрасте от 18 до <24 месяцев, а также для объединенной возрастной стратифицированной группы (от 12 до <24 месяцев) через 1 месяц после введения третьей дозы двухвалентного rLP2086, что подтверждается числом индивидуумов, у которых hSBA-титр составлял≥LLOQ (1:8 для A56, B24 и B44; 1:16 для A22) для каждого из 4 первичных тестируемых штаммов MnB. Для группы, которой вводили 60 мкг, число индивидуумов, у которых достигался hSBA-титр≥LLOQ, составляло от 88,9% до 100,0% для детей более раннего возраста (от 12 до <18 месяцев) и от 81,8% до 100,0% для детей более старшего возраста (от 18 до <24 месяцев) после введения 3 доз. Для группы, которой вводили 120 мкг, число индивидуумов, у которых достигался hSBA-титр≥LLOQ, составляло от 71,1% до 100,0% для детей в возрасте от 12 до <18 месяцев и от 72,0% до 100,0% для детей в возрасте от 18 до <24 месяцев после введения 3 доз. Для объединенной возрастной стратифицированной группы, число индивидуумов с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации составляло в пределах от 85,0% до 100,0% для группы, которой вводили 60 мкг и от 71,6% до 100,0% для группы, которой вводили 120 мкг. Эти данные были также подтверждены высокими GMT (в пределах от 4,0 до 8,5 на базовом уровне до 15,1-171,4 через 1 месяц после вакцинации 3) и числом индивидуумов, у которых достигались hSBA-титры≥1:4 (71,1% - 100%) или≥1:16 (63,6% - 100%) против каждого из 4 первичных тестируемых штаммов MnB после введения 3 доз двухвалентного rLP2086 по сравнению с базовыми уровнями для обеих возрастных стратифицированных групп и для всех доз. Кроме того, число индивидуумов в объединенных возрастных стратифицированных группах, у которых hSBA-титр был≥4 по сравнению с базовым уровнем через 1 месяц после третьей вакцинации для каждого из 4 первичных тестируемых штаммов MnB, составляло от 67,4% до 100,0% для обеих дозозависимых групп. В заключение следует отметить, что 3 дозы 60 мкг или 120 мкг двухвалентного rLP2086, вводимые по схеме введения на месяц 0, 2 и 6, индуцировали стойкие иммунные ответы у детей в возрасте от 12 до <24 месяцев (в отдельной и в объединенной возрастной стратифицированной группе).
Второй целью исследования является описание иммунных ответов через 1 месяц после введения второй дозы двухвалентного rLP2086, как было установлено по ответам≥LLOQ, определенным hSBA-титрам и GMT hSBA для 2 возрастных стратифицированных групп и объединенной возрастной стратифицированной группы. Для объединенной возрастной стратифицированной группы, число индивидуумов с hSBA-титром≥LLOQ после второй дозы двухвалентного rLP2086 (вводимой через 2 месяца после первой дозы) составляло от 57,9% до 94,7% для индивидуумов в группе, которой вводили 60 мкг, и от 33,7% до 100,0% для индивидуумов в группе, которой вводили 120 мкг. Аналогичные результаты были получены для 2 отдельных возрастных стратифицированных групп, причем, между стратифицированными группами младшего и более старшего возраста каких-либо значимых различий не наблюдалось. Эти данные были дополнительно подтверждены увеличением GMT (в пределах от 7,2 до 110,6) по сравнению с базовым уровнем, и числом индивидуумов, у которых достигался hSBA-титр≥1:4 (36,0% - 100%) или≥1:16 (32,6% - 100%) против каждого из 4 первичных тестируемых штаммов MnB после введения 2 доз двухвалентного rLP2086 по сравнению с базовым уровнем для объединенной возрастной стратифицированной группы, которой вводили обе дозы. Аналогичные результаты были получены для 2 отдельных возрастных стратифицированных групп. Кроме того, число индивидуумов в объединенной возрастной стратифицированной группе, у которых hSBA-титр был≥4 раза выше по сравнению с базовым уровнем через 1 месяц после второй вакцинации для каждого из 4 первичных тестируемых штаммов MnB, составляло от 30,2% до 98,9%. В заключение следует отметить, что 2 дозы 60 мкг или 120 мкг двухвалентного rLP2086, вводимые с перерывами в 2 месяца, индуцировали иммунные ответы у детей в возрасте от 12 до <24 месяцев (в отдельной и в объединенной возрастной стратифицированной группе). В целом, при дозах 60 мкг и 120 мкг, двухвалентный rLP2086, вводимый в 3 дозах по схеме введение на месяцы 0, 2 и 6, вырабатывает стойкий иммунный ответ у детей в возрасте от 12 до <24 месяцев с титрами протективных антител, достигаемыми, как было определено с помощью hSBA, у большого числа индивидуумов после введения третьей дозы.
Выводы:
В заключение следует отметить, что при дозах 60 мкг и 120 мкг, двухвалентный rLP2086, вводимый детям в возрасте от 12 до <24 месяцев по схеме введения на месяцы 0, 2 и 6, вырабатывает титры протективных антител после введения третьей дозы, как было определено с помощью hSBA. Вакцина, вводимая в этом исследовании, была безопасной и хорошо переносилась детьми в возрасте от 12 до <24 месяцев с приемлемым профилем безопасности.
Пример 21: Рандомизированное, контролируемое исследование слепым методом Фазы 2 для описания иммуногенности, безопасности и переносимости двухвалентной вакцины на основе рекомбинантного липопротеина 2086 Neisseria meningitidis серологической группы B (двухвалентного rLP2086), вводимой здоровым детям в возрасте от 12 до <18 месяцев или от 18 до <24 месяцев (B1971035-CSR).
Исследование Фазы 2 проводили в 2 стадии. Стадия 1 была разработана и проведена для оценки безопасности, переносимости и иммуногенности двухвалентного rLP2086 у здоровых детей в возрасте от 12 до <24 месяцев в течение 12 месяцев после последней экспериментальной вакцинации (Визит 10). Стадия 1 состояла из маркерной фазы включения в испытание, в которые входили 4 маркерных группы, и фазы с расширенным включением. В маркерной группе, двухвалентный rLP2086 вводили в 2-х дозах (60 мкг или 120 мкг) в 2 возрастных стратифицированных группах (в возрасте от 12 до <15 месяцев и от 18 до <24 месяцев). Выбор дозы для фазы с расширенным включением осуществляли исходя из отчета, представленного Национальным Комитетом по контролю (IRC) для оценки профиля безопасности при 2 дозах. Стадию 2 планировали для оценки продолжительности иммунного ответа вплоть до 4 лет после последней экспериментальной вакцинации.
Главные цели анализа на иммуногенность
- Описание иммунного ответа, оцененного с помощью анализа hSBA, проводимого для 4 первичных штаммов MnB, 2 из которых экспрессируют белок подсемейства А LP2086, а 2 экспрессируют белок подсемейства B LP2086, как было определено через 1 месяц после третьей вакцинации двухвалентным rLP2086, у здоровых детей в возрасте от 12 до <18 месяцев в начале исследования.
- Описание иммунного ответа, оцененного с помощью hSBA, проводимого для 4 первичных штаммов MnB, 2 из которых экспрессируют белок подсемейства А LP2086, а 2 экспрессируют белок подсемейства B LP2086, как было определено через 1 месяц после третьей вакцинации двухвалентным rLP2086, у здоровых детей в возрасте от 18 до <24 месяцев в начале исследования.
Другие цели анализа на иммуногенность:
- Описание иммунного ответа, оцененного с помощью анализа hSBA, проводимого для 4 первичных тестируемых штаммов MnB, 2 из которых экспрессируют белок подсемейства А LP2086, а 2 экспрессируют белок подсемейства B LP2086, как было определено через 1 месяц после третьей вакцинации двухвалентным rLP2086, у здоровых детей в возрасте от 12 до <24 месяцев в начале исследования (то есть, в обеих объединенных возрастных стратифицированных группах).
- Описание иммунного ответа, оцененного с помощью hSBA, проводимого для 4 первичных тестируемых штаммов MnB, 2 из которых экспрессируют белок подсемейства А LP2086, а 2 экспрессируют белок подсемейства B LP2086, как было определено через 1 месяц после второй вакцинации и через 6, 12, 24, 36 и 48 месяцев после третьей вакцинации у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев в начале исследования и в обеих объединенных возрастных стратифицированных группах.
Экспериментальные цели анализа на иммуногенность:
- Дополнительное описание иммунного ответа, оцененного с помощью hSBA, проводимого для 4 первичных тестируемых штаммов MnB, 2 из которых экспрессируют белок подсемейства А LP2086, а 2 экспрессируют белок подсемейства B LP2086, как было определено через 1 месяц после второй вакцинации и через 1, 6, 12, 24, 36 и 48 месяцев после третьей вакцинации двухвалентным rLP2086 у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев в начале исследования и в обеих объединенных возрастных стратифицированных группах.
- Дополнительное описание иммунного ответа, оцененного с помощью hSBA, проводимого для вторых тестируемых штаммов MnB, экспрессирующих белки подсемейства А и В LP2086, через 1 месяц после второй вакцинации и через 1, 6, 12, 24, 36 и 48 месяцев после третьей вакцинации у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев в начале исследования и в обеих объединенных возрастных стратифицированных группах.
План исследования
Общий протокол и план исследования
Это исследование представляет собой рандомизированное, активно контролируемое многоцентровое исследование Фазы 2, проводимое слепым методом, не известным ни наблюдателю, ни спонсору, в которое было произвольно включено приблизительно 396 здоровых детей раннего возраста, стратифицированных по возрасту, от 12 до <18 месяцев или от 18 до <24 месяцев в отношении 2:1, которые получали двухвалентный rLP2086 (2 дозы [60 мкг или 120 мкг]) или лицензированную детскую вакцину против HAV(0,5 мл)/стерильный физиологический раствор для инъекции (0,5 мл 0,85% хлорида натрия). Исследование проводили в 2 стадии. В Стадии 1 оценивали иммуногенность, безопасность и переносимость вакцины в 2 фазы: маркерную фазу включения в испытание и фазу с расширенным включением. В Стадии 2 оценивали продолжительность иммунного ответа на двухвалентный rLP2086.
В соответствии с программой испытания, маркерная фаза включения в Стадию 1 включает всего четыре маркерных группы: 2 возрастных стратифицированных группы для каждой дозы (60 мкг или 120 мкг) двухвалентного rLP2086. Маркерные группы, в которую входили дети более раннего возраста, состояли из индивидуумов в возрасте от 12 до <15 месяцев, а маркерные группы, в которую входили дети более старшего возраста, состояли из индивидуумов в возрасте от 18 до <24 месяцев. В соответствии с программой, в каждую из 4 маркерных групп входило приблизительно 33 индивидуума. Маркерная фаза включения в испытание была дополнена данными по IRC в заранее определенные моменты времени и эту фазу завершали в соответствии с установленными нормами. Маркерной группе с дозой 120 мкг, эту дозу не вводили до тех пор, пока доза 60 мкг не была оценена с помощью IRC как безопасная и переносимая в маркерной группе того же возраста. Маркерным группам детей более младшего возраста с дозой 120 мкг, эту дозу не вводили до тех пор, пока эта доза не была оценена с помощью IRC как безопасная и переносимая в маркерной группе детей более старшего возраста, которым была назначена доза 120 мкг.
Перед проведением Стадии 1 фазы расширенного включения, все данные IRC рассматривались после вакцинации 1 и на 7 й день заносились в электронный дневник, а затем у индивидуумов маркерной группы брали данные SAE. Исходя из отчета, данные IRC, отобранные для дозы 120 мкг двухвалентного rLP2086, исследовали в фазе расширенного включения в Стадию 1 для обеих возрастных стратифицированных групп. В группу расширенного включения, в которую входили дети более младшего возраста (дополнительно 132 индивидуума), включали детей в возрасте от 12 до <18 месяцев и стратифицировали по возрасту на две подгруппы: детей от 12 до <15 месяцев и детей от 15 до <18 месяцев. В группу расширенного включения, в которую входили дети более старшего возраста (дополнительно 132 индивидуума), включали детей в возрасте от 18 до <24 месяцев во время проведения фазы расширенного включения. Общая продолжительность исследования индивидуумов, прошедших только Стадию 1, составляла приблизительно 18 месяцев.
Стадия 2 включает только тех индивидуумов, которые были произвольно распределены, и которые получали двухвалентный rLP2086 (независимо от дозы). Общая продолжительность исследования индивидуумов, прошедших Стадию 2, составляла приблизительно 4,5 лет (54 месяца).
Двухвалентный rLP2086 вводили на месяцы 0, 2 и 6 (Визиты 1, 4 и 6). Детскую вакцину против HAV вводили на месяцы 0 и 6 (Визиты 1 и 6), а физиологический раствор вводили на месяц 2 (Визит 4) с сохранением испытания слепым методом.
Обсуждение протокола исследования, включая выбор контрольных групп
В этом 2-стадийном исследовании оценивали безопасность, переносимость и иммуногенность двухвалентного rLP2086 в 2 дозах (60 мкг и 120 мкг) у здоровых детей в возрасте от 12 до <24 месяцев.
В этом исследовании, вакцина против HAV (вводимая на месяцы 0 и 6) была выбрана в качестве контроля. По сравнению с другими вакцинами, рекомендованными для введения этой возрастной группе, вакцина против HAV имеет лучший профиль переносимости. Кроме того, вакцина против HAV дает преимущество индивидуумам, у которых имеется повышенный риск инфицирования вирусом гепатита А либо во время будущих путешествий, либо в других условиях окружающей среды. Общая рекомендованная схема введения вакцины против HAV включает введение 2 доз на месяцы 0 и 6. В этом исследования, для обеспечения исследования слепым методом вводили физиологический раствор на месяц 2.
Вводимые вакцины
Двухвалентный rLP2086 (60 мкг или 120 мкг) вводили 3 раза в течение всего курса исследования: путем первой вакцинации на Визит 1 (месяц 0), второй вакцинации на Визит 4 (месяц 2), и третьей вакцинации на Визит 6 (месяц 6). Двухвалентный rLP2086 вводили путем внутримышечной инъекции либо в дельтовидную мышцу, либо в переднюю боковую мышцу бедра. Вакцину против HAV вводили два раза в течение всего курса исследования: путем первой вакцинации на Визит 1 (месяц 0) и третьей вакцинации на Визит 6 (месяц 6). Физиологический раствор вводили во время второй вакцинации (месяц 2). Вакцину против HAV/физиологический раствор вводили путем внутримышечной инъекции либо в дельтовидную мышцу, либо в переднюю боковую мышцу бедра. Исследуемый продукт вводился только квалифицированным медицинским сотрудником, входящим в штат специалистов по проведению исследований и являющимся третьим сторонним лицом. Если мышечная масса дельтовидной мышцы была неподходящей для внутримышечной инъекции, то предпочтительным участком инъекции было выбрано бедро. Участок введения (например, левая/правая рука/бедро) был указан в пояснительных документах или в отчете CRF.
Идентичность исследуемого(ых) продукта(ов)
Двухвалентный rLP2086 (содержащий 30 мкг [доза 60 мкг] или 60 мкг [доза 120 мкг] каждого из очищенного белка rLP2086 подсемейства A и подсемейства B, адсорбированного на алюминии в стерильной забуференной изотонической суспензии) приготавливали в дозе 0,5 мл для инъекции.
Лицензированную детскую вакцину против HAV приготавливали в дозе 0,5 мл для инъекции.
Плацебо представляет собой стерильный физиологический раствор для инъекций (0,85% хлорид натрия), поставляемый в дозе 0,5 мл.
Экспериментальные продукты (двухвалентный rLP2086, вакцина против HAV и физиологический раствор) поставлялись спонсором в каждый исследовательский центр. Исследуемые вакцины упаковывали и маркиовали как экспериментальный продукт в соответствии с современными нормами и требованиями, утвержденными местными и судебными регуляторными органами. Каждый экспериментальный продукт был помечен уникальными номером для маркировки наборов.
Выбор схемы вакцинации
Двухвалентный rLP2086 (60 мкг или 120 мкг) вводили по схеме введения на месяц 0, 2 и 6. Контрольная группа индивидуумов получала вакцину против HAV на месяц 0 и месяц 6 и инъекцию физиологического раствора на месяц 2 для обеспечения исследования слепым методом.
Анализ на бактерицидную активность сыворотки с использованием двухвалентного rLP2086 - Первичные тестируемые штаммы
Для оценки иммунного ответа на двухвалентный rLP2086, функциональные антитела анализировали в hSBA с использованием менингококковых штаммов серологической группы B. В hSBA определяли антитела в человеческой сыворотке, вызывающие комплемент-зависимый цитолиз менингококкового штамма-мишени. Четыре (4) первичных тестируемых штамма MnB, PMB80 (A22), PMB2001 (A56), PMB2948 (B24) и PMB2707 (B44), каждый из которых экспрессирует вариант белка, связывающегося с фактором Н (fHBP) и гетерологичного антигенным компонентам вакцины, использовали в hSBA для определения конечных точек иммуногенности в этом исследовании.
Из-за ограничения объема сыворотки, 2 первичных штамма (PMB80 [A22] и PMB2948 [B24]) были протестированы в каждый момент забора крови у одной половины индивидуумов (в обеих возрастных стратифицированных группах), а другие 2 первичных штамма (PMB2001 [A56] и PMB2707 [B44]) были протестированы в каждый момент забора крови у другой половины индивидуумов.
После включения всех индивидуумов в программу исследования (Визит 1), группа специалистов по статистике независимого статистического центра (ISC), не входящая в программу проведения исследования, представила 2 списка индивидуумов (произвольно отобранных индивидуумов, 50% которых было протестировано на PMB80 [A22]/PMB2948 [B24], и остальных 50% индивидуумов, протестированных на PMB2001 [A56]/PMB2707 [B44]) группе специалистов, занимающихся анализом образцов на средства спонсоров. Оба списка имели такое же отношение рандомизации (2:1) и такое же распределение по возрасту, как и в протоколе исследования. Одна и та же пара штаммов (PMB80 [A22]/PMB2948 [B24] или PMB2001 [A56]/PMB2707 [B44]) была протестирована во все визиты для одних и тех же индивидуумов.
Дополнительные анализы
После завершения тестирования для проведения первичных анализов, и если сыворотка присутствовала в достаточном объеме, то могло быть проведено дополнительное тестирование для оценки иммунного ответа на двухвалентный rLP2086: PMB80 (A22) и PMB2948 (B24) могли быть протестированы в пробах сыворотки, взятых у 50% индивидуумов, получавших двухвалентный rLP2086, и эти пробы сыворотки были сначала протестированы на PMB2001 (A56) и PMB2707 (B44). И наоборот, PMB2001 (A56) и PMB2707 (B44) могли быть протестированы в пробах сыворотки, взятых у 50% индивидуумов, получавших двухвалентный rLP2086, и эти пробы сыворотки были сначала протестированы на PMB80 (A22) и PMB2948 (B24). Может быть осуществлено тестирование на вторичные штаммы.
Анализ на иммуногенность
Сравнение представляющих интерес точек и конечных точек - Первичные конечные точки иммуногенности
Первичными конечными точками иммуногенности являются:
- Число индивидуумов, у которых достигается hSBA-титр≥нижнего(му) предела(у) количественной оценки (LLOQ) через 1 месяц после третьей вакцинации для каждого из 4 первичных тестируемых штаммов MnB у здоровых детей в возрасте от 12 до <18 месяцев в начале исследования.
- Число индивидуумов, у которых достигается hSBA-титр≥LLOQ через 1 месяц после третьей вакцинации для каждого из 4 первичных тестируемых штаммов MnB у здоровых детей в возрасте от 18 до <24 месяцев в начале исследования.
Сравнение представляющих интерес точек и конечных точек - Вторичные конечные точки иммуногенности
Все вторичные конечные точки иммуногенности для всего исследования описаны в настоящей заявке, но в этом Примере представлены результаты конечных точек иммуногенности, которые были получены только на визиты 1-7 (Вакцинация через 1-3 месяца после вакцинации 3).
Нижеследующая конечная точка относится к результатам у здоровых индивидуумов в возрасте от 12 до <24 месяцев (то есть, в объединенной возрастной стратифицированной группе) в начале исследования:
- Число индивидуумов с hSBA-титрами≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086 и через 6, 12, 24, 36 и 48 месяцев после третьей вакцинации двухвалентным rLP2016.
Нижеследующие конечные точки относятся к результатам у здоровых индивидуумов в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев в начале исследования и в объединенной возрастной стратифицированной группе:
- Число индивидуумов с hSBA-титрами≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после второй вакцинации двухвалентным rLP2086.
- Число индивидуумов с hSBA-титрами≥LLOQ, ≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 для каждого из 4 первичных штаммов MnB на каждый подходящий визит для взятия пробы крови.
- Геометрически средние hSBA-титры (GMT) для каждого из 4 первичных тестируемых штаммов MnB на каждый подходящий визит для взятия пробы крови.
Экспериментальные конечные точки иммуногенности
Все экспериментальные конечные точки, определенные ниже, относятся к результатам hSBA для всех здоровых индивидуумов в возрасте от 12 до <18 месяцев или от 18 до <24 месяцев в начале исследования и в объединенной возрастной стратифицированной группе, где указанные индивидуумы получали двухвалентный rLP2086 и были протестированы на соответствующий штамм в подходящий момент времени:
- Число индивидуумов с hSBA-титрами≥LLOQ, ≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 в каждый подходящий момент взятия пробы крови.
- GMT hSBA для каждого из 4 первичных штаммов MnB на каждый подходящий визит для взятия пробы крови.
- Число индивидуумов, у которых достигалось по меньшей мере 4-кратное увеличение hSBA-титра по сравнению с базовым уровнем через 1 месяц после третьей вакцинации двухвалентным rLP2086 для каждого из 4 первичных тестируемых штаммов:
- Для индивидуумов с базовым hSBA-титром ниже предела детектирования (LOD) или с hSBA-титром <1:4, 4-кратный ответ был определен как hSBA-титр≥1:16.
- Для индивидуумов с базовым hSBA-титром≥LOD (то есть, hSBA-титром≥1:4) и < LLOQ, 4-кратный ответ был определен как hSBA-титр, который в≥4 раза превышает LLOQ.
- Для индивидуумов с базовым hSBA-титром≥LLOQ, 4-кратный ответ был определен как hSBA-титр, который в≥4 раза превышает базовый титр.
Нижеследующие конечные точки рассматривались в случае, если имелось достаточное количество сыворотки для тестирования каждого индивидуума на все 4 первичных штамма и/или на вторичные штаммы.
- Число индивидуумов, у которых достигался hSBA-титр≥LLOQ для комбинации всех 4 первичных тестируемых штаммов (PMB80 [A22], PMB2948 [B24], PMB2001 [A56], и PMB2707 [B44]), через 1 месяц после третьей вакцинации двухвалентным rLP2086. Это применимо только к тем индивидуумам, у которых были протестированы все 4 первичных штамма.
- Для hSBA на вторичные штаммы MnB были проведены нижеследующие дополнительные экспериментальные анализы:
- GMT hSBA для каждого тестируемого вторичного штамма MnB, через 1 месяц после второй и третьей вакцинации и/или на каждый момент взятия пробы крови.
- Число индивидуумов с hSBA-титром≥LLOQ, для каждого вторичного штамма MnB, через 1 месяц после второй и третьей вакцинации и/или на каждый момент взятия пробы крови.
Анализируемые группы
Модифицированная лечебная группа
Все произвольно отобранные индивидуумы, для которых был получен по меньшей мере 1 достоверный и определенный результат анализа на вероятность, были включены в модифицированную лечебную группу (mITT). Эта серия анализов применялась для проведения анализа на иммуногенность. Индивидуумов тестировали на соответствующий экспериментальный продукт, для анализа которого они были произвольно отобраны в Группу mITT.
Методы анализа
Контрольная группа и каждая группа с определенной дозой, в которые входили различные группы с одинаковой возрастной стратификацией, были объединены для анализа. Все анализы на иммуногенность систематизировали отдельно для каждой возрастной стратифицированной группы, а также для общей группы.
Это исследование не проводилось для проверки какой-либо гипотезы; а поэтому для оценки первичных, вторичных и экспериментальных конечных точек, в этом исследовании применялся метод анализа.
LLOQ составляет 1:16 для PMB80 (A22), 1:8 для PMB2001 (A56), 1:8 для PMB2707 (B44) и 1:8 для PMB2948 (B24).
Для вычисления GMT, результаты hSBA ниже LLOQ были представлены как 0,5 × LLOQ для первичного анализа.
Анализ первичных конечных точек
Первичным анализом для достижения главных целей является определение числа индивидуумов с hSBA-титром≥LLOQ через 1 месяц после третьей вакцинации, для каждого из 4 первичных тестируемых штаммов MnB у здоровых детей в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев, в начале исследования, соответственно. Для достижения этой цели была использована группа, оцениваемая на иммуногенность, и были представлены проценты и доверительные интервалы (ДИ).
Анализ вторичных конечных точек
Все анализы, проводимые для группы mITT, рассматривались как вторичные анализы.
Анализы вторичных конечных точек также включают процент индивидуумов с hSBA-титрами≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации для группы, оцениваемой на иммуногенность и для группы mITT.
В этом Примере, процент индивидуумов с hSBA-титрами≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после второй вакцинации и через 1 месяц после вакцинации 3 определяли для группы, оцениваемой на иммуногенность и для группы mITT, и эти данные представлены в отчете. Тот же самый анализ был запланирован на последующие периоды времени (через 6, 12, 24, 36 и 48 месяцев после третьей вакцинации).
Процент индивидуумов с hSBA-титрами≥LLOQ 1:4, 1:8, 1:16, 1:32, 1:64, 1:128 для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после вакцинации 2 и через 1 месяц после вакцинации 3 определяли для группы, оцениваемой на иммуногенность и для группы mITT, и эти данные представлены в отчете. Тот же самый анализ был запланирован на последующие периоды времени (через 6, 12, 24, 36 и 48 месяцев после вакцинации 3).
GMT для каждого из первичных тестируемых штаммов MnB через 1 месяц после второй вакцинации и через 1 месяц после третьей вакцинации систематизировали для группы, оцениваемой на иммуногенность и для группы mITT, и эти данные представлены в отчете. Тот же самый анализ был запланирован на последующие периоды времени (через 6, 12, 24, 36 и 48 месяцев после вакцинации 3).
Анализ экспериментальных конечных точек
Число индивидуумов, у которых достигалось по меньшей мере 4-кратное увеличение hSBA-титров по сравнению с базовым уровнем через 1 месяц после второй и третьей вакцинации двухвалентным rLP2086, систематизировали для группы, оцениваемой на иммуногенность и для группы mITT.
Кривые обратного кумулятивного распределения
Эмпирические кривые обратного кумулятивного распределения (RCDC) также анализировали для каждого из 4 первичных тестируемых штаммов MnB и через 1 месяц после вакцинации 2 и через 1 месяц после вакцинации 3 для группы, оцениваемой на иммуногенность.
Оценка иммуногенности
Анализируемые группы
Группа, оцениваемая на иммуногенность, представляет собой группу первичного анализа на иммуногенность. Группа mITT была использована как дополнительная группа для анализа на иммуногенность.
В группу, оцениваемую на иммуногенность, было включено всего 348 (87,9%) индивидуумов, а 48 (12,1%) индивидуумов были исключены из этой группы. Индивидуумы могут быть исключены из групп оценки иммуногенности по более, чем 1 причине. Из группы, оцениваемой на иммуногенность, был исключен всего 31 (7,8%) индивидуум, поскольку у них не был проведен забор крови до вакцинации или после вакцинации (включая индивидуумов, у которых не были взяты пробы, и у индивидуумов, у которых пробы были взяты за пределами «окна», специфичного для данного протокола), 13 (3,3%) индивидуумов не были включены или не могли быть включены в исследование до вакцинации или через 1 месяц после вакцинации на визит 3, 11 (2,8%) индивидуумов не получали вакцину, поскольку все визиты для вакцинации они осуществляли выборочно, а 16 (4,0%) индивидуумам было запрещено вводить вакцину или проводить лечение. В целом, в группу, оцениваемую на иммуногенность, было включено всего 84,3% индивидуумов в возрасте от 12 до <18 месяцев и 91,4% индивидуумов в возрасте от 18 до <24 месяцев.
Результаты анализа на иммуногенность
Результаты первичного анализа, включающие все данные по иммуногенности вплоть до 1 месяца после вакцинации 3 (Визит 7), представлены в следующих разделах. Анализ конечных точек иммуногенности проводили на основе результатов hSBA для штаммов PMB2001 (A56) и PMB2707 (B44) у одной половины индивидуумов и для штаммов PMB80 (A22) и PMB2948 (B24) у другой половины индивидуумов.
Первичные и вторичные конечные точки
Число индивидуумов, у которых достигается hSBA-титр≥LLOQ
Первичные конечные точки иммуногенности представляют собой число индивидуумов в возрасте от 12 месяцев до <18 месяцев (в начале исследования) и в возрасте от 18 до <24 месяцев (в начале исследования) с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086. Вторичными конечными точками являются число всех индивидуумов в объединенной возрастной стратифицированной группе с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации двухвалентным rLP2086 вместе с числом индивидуумов в отдельных и объединенных возрастных стратифицированных группах с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после второй вакцинации двухвалентным rLP2086.
Число индивидуумов в каждой возрастной стратифицированной группе с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB представлено в Таблице для группы, оцениваемой на иммуногенность.
Для объединенной возрастной стратифицированной группы, число индивидуумов, у которых достигался hSBA-титр≥LLOQ на базовом уровне, составляло 0,0% и 3,1% для PMB80 (A22); 0,0% и 1,1% для PMB2001 (A56); 4,8% и 2,1% для PMB2948 (B24); и 0,0% и 1,1% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
Через 1 месяц после вакцинации 2, число индивидуумов, у которых достигался hSBA-титр≥LLOQ для индивидуумов с возрастной стратификацией от 12 до <18 месяцев, составляло 90,0% и 64,4% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 70,0% и 23,8% для PMB2948 (B24); и 77,8% и 72,3% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. Для индивидуумов с возрастной стратификацией от 18 до <24 месяцев, число индивидуумов, у которых достигался hSBA-титр≥LLOQ, составляло 66,7% и 84,0% для PMB80 (A22); 90,0% и 100,0% для PMB2001 (A56); 44,4% и 43,2% для PMB2948 (B24); и 60,0% и 63,8% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. В целом, для объединенной возрастной стратифицированной группы, число индивидуумов, у которых достигался hSBA-титр≥LLOQ через 1 месяц после вакцинации 2, составляло 78,9% и 74,7% для PMB80 (A22); 94,7% и 100,0% для PMB2001 (A56); 57,9% и 33,7% для PMB2948 (B24); и 68,4% и 68,1% для PMB2707 (B44), для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
Через 1 месяц после вакцинации 3, число индивидуумов, у которых достигался hSBA-титр≥LLOQ для индивидуумов с возрастной стратификацией от 12 до <18 месяцев, составляло 88,9% и 91,1% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 88,9% и 71,1% для PMB2948 (B24); и 88,9% и 87,2% для PMB2707 (B44), для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. Для индивидуумов с возрастной стратификацией от 18 до <24 месяцев, число индивидуумов, у которых достигался hSBA-титр≥LLOQ, составляло 90,9% и 88,2% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 81,8% и 72,0% для PMB2948 (B24); и 90,0% и 85,1% для PMB2707 (B44), для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. В целом, для объединенной возрастной стратифицированной группы, число индивидуумов, у которых достигался hSBA-титр≥LLOQ через 1 месяц после вакцинации 3, составляло 90,0% и 89,6% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 85,0% и 71,6% для PMB2948 (B24); и 89,5% и 86,2% для PMB2707 (B44), для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
В целом, число индивидуумов в группе, которой вводили HAV/физиологический раствор, и у которой достигался hSBA-титр≥LLOQ не изменялось в течение определенного периода времени по сравнению с базовым уровнем (Таблица 25).
Результаты для группы mITT были аналогичны результатам для группы, оцениваемой на иммуногенность.
Результаты анализов подгрупп для определения числа индивидуумов, у которых достигался hSBA-титр≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB, оценивали для группы оценки иммуногенности с учетом пола и страны. Каких-либо клинически значимых различий в анализах подгрупп не наблюдалось.
Примечание: LLOQ=1:16 для A22; 1:8 для A56, B24, и B44
a. N=число индивидуумов с подтвержденными и определенными hSBA-титрами для данного штамма.
b. n=число индивидуумов с наблюдаемым hSBA-титром ≥ LLOQ для данного штамма в данный момент времени.
c. Точный двухсторонний ДИ исходя из наблюдаемого числа индивидуумов с применением метода Клоппера и Пирсона
GMT hSBA
Вторичной конечной точкой является GMT hSBA для каждого из 4 первичных тестируемых штаммов MnB для индивидуумов в возрасте от 12 до <18 месяцев, от 18 до <24 месяцев и для объединенной возрастной стратифицированной группы на базовом уровне, через 1 месяц после второй вакцинации и через 1 месяц после третьей вакцинации двухвалентным rLP2086. В Таблице 26 представлены GMT hSBA для 4 первичных штаммов MnB для группы, оцениваемой на иммуногенность.
Для объединенной возрастной стратифицированной группы, GMT hSBA на базовом уровне составляло 8,0 и 8,4 для PMB80 (A22); 4,0 и 4,1 для PMB2001 (A56); 4,4 и 4,1 для PMB2948 (B24); и 4,0 и 4,0 для PMB2707 (B44) для для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
Через 1 месяц после вакцинации 2, GMT hSBA возрастной стратифицированной группы от 12 до <18 месяцев составляло 42,2 и 24,6 для PMB80 (A22); 101,6 и 117,2 для PMB2001 (A56); 10,6 и 6,0 для PMB2948 (B24); и 23,5 и 22,1 для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. Для возрастной стратифицированной группы от 18 до <24 месяцев, GMT hSBA составляли 23,5 и 36,8 для PMB80 (A22); 68,6 и 104,6 для PMB2001 (A56); 6,9 и 8,5 для PMB2948 (B24); и 21,1 и 17,0 для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. В целом, через 1 месяц после вакцинации 2, GMT hSBA возрастной стратифицированной группы составляли 32,0 и 30,4 для PMB80 (A22); 82,6 и 110,6 для PMB2001 (A56); 8,6 и 7,2 для PMB2948 (B24); и 22,2 и 19,4 для PMB2707 (B44), которым вводили дозы 60 мкг и 120 мкг, соответственно.
Через 1 месяц после вакцинации 2, GMT hSBA возрастной стратифицированной группы от 12 до <18 месяцев составляло 80,6 и 63,0 для PMB80 (A22); 109,7 и 190,6 для PMB2001 (A56); 20,2 и 15,8 для PMB2948 (B24); и 29,6 и 46,3 для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. Для возрастной стратифицированной группы от 18 до <24 месяцев, GMT hSBA составляли 82,3 и 71,4 для PMB80 (A22); 181,0 и 154,4 для PMB2001 (A56); 17,0 и 14,5 для PMB2948 (B24); и 34,3 и 44,9 для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. В целом, через 1 месяц после вакцинации 3, GMT hSBA возрастной стратифицированной группы составляли 81,6 и 67,3 для PMB80 (A22); 142,8 и 171,4 для PMB2001 (A56); 18,4 и 15,1 для PMB2948 (B24); и 32,0 и 45,6 для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
В целом, GMT hSBA для индивидуумов в группе, которой вводили HAV/физиологический раствор, не изменялись в течение определенного периода времени по сравнению с базовым уровнем.
Примечание: LLOQ=1:16 для A22; 1:8 для A56, B24 и B44. Титры ниже LLOQ означают 0,5 × LLOQ для анализа.
a. N=число индивидуумов с подтвержденными и определенными hSBA-титрами для данного штамма
b. GMT вычисляли для всех индивидуумов с подтвержденными и определенными hSBA-титрами на данный момент времени.
c. ДИ означает обратное преобразование доверительных уровней исходя из распределения Стьюдента для среднего логарифма hSBA-титров
Результаты для группы mITT были аналогичны результатам для группы, оцениваемой на иммуногенность.
Результаты анализов подгрупп для определения GMT hSBA для каждого из 4 первичных тестируемых штаммов MnB оценивали для группы оценки иммуногенности с учетом пола и страны. Каких-либо клинически значимых различий в анализах подгрупп не наблюдалось.
Определенные hSBA-титры
Вторичной конечной точкой иммуногенности является число индивидуумов в возрасте от 12 до <18 месяцев, от 18 до <24 месяцев, и в объединенной возрастной стратифицированной группе, у которых достигались hSBA-титры≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и≥1:128 для каждого из 4 первичных тестируемых штаммов на базовом уровне через 1 месяц после второй вакцинации и через 1 месяц после третьей вакцинации двухвалентным rLP2086.
Число индивидуумов, у которых достигались определенные hSBA-титры для 4 первичных штаммов MnB, представлено в Таблице 27 для группы оценки иммуногенности.
Результаты, полученные для индивидуумов, у которых достигались hSBA-титры ≥1:4 и ≥1:16, описаны ниже. hSBA-титр ≥1:4 широко известен как коррелят защиты против ИМЗ; однако, более консервативный hSBA-титр ≥1:16 рассматривается как уровень, указывающий на 4-кратное действие вакцины для серонегативных индивидуумов до вакцинации.
В целом, число индивидуумов в группе, которой вводили HAV/физиологический раствор, и у которой достигались определенные hSBA-титры, не изменялось в течение определенного периода времени по сравнению с базовым уровнем.
Результаты для группы mITT были аналогичны результатам для группы, оцениваемой на иммуногенность.
hSBA-титр≥1:4
Через 1 месяц после вакцинации 2, число индивидуумов в возрасте от 12 до <18 месяцев, у которых достигался hSBA-титр ≥1:4, составляло 90,0% и 64,4% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 70,0% и 28,6% для PMB2948 (B24); и 77,8% и 72,3% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. Число индивидуумов в возрасте от 18 до <24 месяцев, у которых достигался hSBA-титр ≥1:4, составляло 66,7% и 86,0% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 44,4% и 43,2% для PMB2948 (B24); и 70,0% и 63,8% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. В целом, для объединенной возрастной стратифицированной группы, число индивидуумов, у которых достигался hSBA-титр ≥1:4 через 1 месяц после вакцинации 2, составляло 78,9% и 75,8% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 57,9% и 36,0% для PMB2948 (B24); и 73,7% и 68,1% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
Через 1 месяц после вакцинации 3, число индивидуумов в возрасте от 12 до <18 месяцев, у которых достигался hSBA-титр ≥1:4, составляло 88,9% и 91,1% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 88,9% и 71,1% для PMB2948 (B24); и 88,9% и 87,2% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. Число индивидуумов в возрасте от 18 до <24 месяцев, у которых достигался hSBA-титр ≥1:4, составляло 90,9% и 88,2% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 81,8% и 72,0% для PMB2948 (B24); и 90,0% и 87,2% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. В целом, для объединенной возрастной стратифицированной группы, число индивидуумов, у которых достигался hSBA-титр ≥1:4, через 1 месяц после вакцинации 3, составляло 90,0% и 89,6% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 85,0% и 71,6% для PMB2948 (B24); и 89,5% и 87,2% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
hSBA-титр≥1:16
Через 1 месяц после вакцинации 2, число индивидуумов в возрасте от 12 до <18 месяцев, у которых достигался hSBA-титр ≥1:16, составляло 90,0% и 64,4% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 60,0% и 21,4% для PMB2948 (B24); и 77,8% и 72,3% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. Число индивидуумов в возрасте от 18 до <24 месяцев, у которых достигался hSBA-титр ≥1:16, составляло 66,7% и 86,0% для PMB80 (A22); 90,0% и 100,0% для PMB2001 (A56); 33,3% и 43,2% для PMB2948 (B24); и 60,0% и 61,7% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. В целом, для объединенной возрастной стратифицированной группы, число индивидуумов, у которых достигался hSBA-титр ≥1:16, через 1 месяц после вакцинации 2, составляло 78,9% и 74,7% для PMB80 (A22); 94,7% и 100,0% для PMB2001 (A56); 47,4% и 32,6% для PMB2948 (B24); и 68,4% и 67,0% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
Через 1 месяц после вакцинации 3, число индивидуумов в возрасте от 12 до <18 месяцев, у которых достигался hSBA-титр ≥1:16, составляло 88,9% и 91,1% для PMB80 (A22); 100,0% и 97,9% для PMB2001 (A56); 88,9% и 66,7% для PMB2948 (B24); и 77,8% и 87,2% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. Число индивидуумов в возрасте от 18 до <24 месяцев, у которых достигался hSBA-титр ≥1:16, составляло 90,9% и 88,2% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 63,6% и 68,0% для PMB2948 (B24); и 90,0% и 85,1% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. В целом, для объединенной возрастной стратифицированной группы, число индивидуумов, у которых достигался hSBA-титр ≥1:16, через 1 месяц после вакцинации 3, составляло 90,0% и 89,6% для PMB80 (A22); 100,0% и 98,9% для PMB2001 (A56); 75,0% и 67,4% для PMB2948 (B24); и 84,2% и 86,2% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
a. N=число индивидуумов с подтвержденными и определенными hSBA-титрами для данного штамма.
b. n=число индивидуумов с наблюдаемым hSBA-титром ≥ определенному титру для данного штамма в данный момент времени.
c. Точный двухсторонний ДИ исходя из наблюдаемого числа индивидуумов с применением метода Клоппера и Пирсона
Экспериментальные конечные точки иммуногенности
hSBA-титр, который в ≥4 раз превышает базовый титр
В Таблице 28 представлено число индивидуумов с hSBA-титрами, которые в≥4 раза превышают базовый титр для 4 первичных тестируемых штаммов MnB.
Через 1 месяц после вакцинации 2, число индивидуумов в возрасте от 12 до <18 месяцев, у которых достигался hSBA-титр, в≥4 раза превышающий базовый hSBA-титр, составляло 80,0% и 62,2% для PMB80 (A22); 100,0% и 97,9% для PMB2001 (A56); 60,0% и 19,0% для PMB2948 (B24); и 77,8% и 70,2% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. Для возрастной стратифицированной группы от 18 до <24 месяцев, число индивидуумов, у которых достигался hSBA-титр, в≥4 раза превышающий базовый hSBA-титр, составляло 66,7% и 80,0% для PMB80 (A22); 90,0% и 100,0% для PMB2001 (A56); 33,3% и 40,9% для PMB2948 (B24); и 60,0% и 61,7% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. В целом, для объединенной возрастной стратифицированной группы, число индивидуумов, у которых достигался hSBA-титр, в≥4 раза превышающий базовый hSBA-титр через 1 месяц после вакцинации 2, составляло 73,7% и 71,6% для PMB80 (A22); 94,7% и 98,9% для PMB2001 (A56); 47,4% и 30,2% для PMB2948 (B24); и 68,4% и 66,0% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
Через 1 месяц после вакцинации 3, число индивидуумов в возрасте от 12 до <18 месяцев, у которых достигался hSBA-титр, в≥4 раза превышающий базовый hSBA-титр, составляло 77,8% и 86,7% для PMB80 (A22); 100,0% и 95,7% для PMB2001 (A56); 88,9% и 66,7% для PMB2948 (B24); и 77,8% и 85.1% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. Для возрастной стратифицированной группы от 18 до <24 месяцев, число индивидуумов, у которых достигался hSBA-титр, в≥4 раза превышающий базовый hSBA-титр, составляло 90,9% и 88,2% для PMB80 (A22); 100,0% и 100,0% для PMB2001 (A56); 63,6% и 68,0% для PMB2948 (B24); и 90,0% и 85.1% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно. В целом, для объединенной возрастной стратифицированной группы, число индивидуумов, у которых достигался hSBA-титр, в≥4 раза превышающий базовый hSBA-титр через 1 месяц после вакцинации 3, составляло 85,0% и 87,5% для PMB80 (A22); 100,0% и 97,9% для PMB2001 (A56); 75,0% и 67,4% для PMB2948 (B24); и 84,2% и 85,1% для PMB2707 (B44) для групп, которым вводили дозы 60 мкг и 120 мкг, соответственно.
Число индивидуумов в группе, которым вводили HAV/физиологический раствор (в объединенной возрастной стратифицированной группе), и у которых достигался hSBA-титр, в≥4 раза превышающий базовый hSBA-титр через 1 месяц после вакцинации 3, составляло 5,0% для PMB80 (A22), 1,9% для PMB2001 (A56), 3,3% для PMB2948 (B24), и 0,0% для PMB2707 (B44).
Примечание: LLOQ=1:16 для A22; 1:8 для A56, B24 и B44.
Примечание: 4-кратное увеличение определено следующим образом: (1) Для индивидуумов с базовым hSBA-титром ниже LOD (hSBA-титр <1:4), ответ определен как hSBA-титр ≥1:16 или LLOQ (каким бы высоким титр не был). (2) Для индивидуумов с базовым hSBA-титром ≥ LOD и < LLOQ, ответ определен как hSBA-титр, который в ≥4 раза превышает LLOQ. (3) Для индивидуумов с базовым hSBA-титром r ≥ LLOQ, ответ определен как hSBA-титр, который в ≥4 раза превышает базовый титр.
a. Для hSBA-титра, который в ≥4 раза превышает базовый титр, N=числу индивидуумов с достоверными и определенными hSBA-титрами для данного штамма в конкретный момент времени и на базовом уровне.
b. Для hSBA-титра, который в ≥4 раза превышает базовый, n=числу индивидуумов, у которых hSBA-титр в ≥4 раза превышает базовый титр для данного штамма.
c. Точный двухсторонний ДИ исходя из наблюдаемого числа индивидуумов с применением метода Клоппера и Пирсона
Аналогичные результаты были получены для группы mITT.
Результаты анализов подгрупп для определения числа индивидуумов, у которых достигалось увеличение hSBA-титра в ≥4 раза для каждого из 4 первичных тестируемых штаммов MnB, оценивали для группы оценки иммуногенности с учетом пола и страны. Каких-либо клинически значимых различий в анализах подгрупп не наблюдалось.
Кривые обратного кумулятивного распределения для первичных тестируемых штаммов MnB
RCDC для числа индивидуумов с hSBA-ответом (≥LLOQ) для каждого из 4 первичных штаммов MnB и в каждый момент забора проб крови для объединенной возрастной стратифицированной группы оценивали для PMB80 [A22], PMB2001 [A56], PMB2948 [B24] и PMB2707 [B44]. RCDC показали, что иммунные ответы после вакцинации 2 и вакцинации 3 были выше для групп, получавших двухвалентный rLP2086 по сравнению с группой, которой вводили HAV/физиологический раствор. Иммунные ответы у групп, получавших двухвалентный rLP2086, повышались при каждой вакцинации.
Выводы по иммуногенности
Главной целью этого исследования является описание иммунного ответа на двухвалентный rLP2086, как было определено с помощью hSBA, против 4 первичных тестируемых штаммов MnB, 2 из которых экспрессировали белок подсемейства А LP2086, а 2 экспрессировали белок подсемейства В LP2086, как было определено через 1 месяц после третьей вакцинации у здоровых индивидуумов в возрасте от 12 до <18 месяцев и от 18 до <24 месяцев. Второй целью является описание иммунных ответов для пациентов объединенной возрастной стратифицированной группы (от 12 до <24 месяцев). Конечными точками достижения главной цели является число индивидуумов в каждой возрастной стратифицированной группе, у которых достигались hSBA-титры≥LLOQ для каждого из 4 первичных штаммов MnB через 1 месяц после третьей вакцинации.
Стойкий иммунный ответ наблюдался в случае введения обеих доз у детей в возрасте от 12 до <18 месяцев и у детей в возрасте от 18 до <24 месяцев, а также у детей объединенной возрастной стратифицированной группы (от 12 до <24 месяцев) через 1 месяц после введения третьей дозы двухвалентного rLP2086, что подтверждается числом индивидуумов, у которых hSBA-титр составлял≥LLOQ (1:8 для A56, B24 и B44; 1:16 для A22) для каждого из 4 первичных тестируемых штаммов MnB. Для группы, которой вводили 60 мкг, число индивидуумов, у которых достигался hSBA-титр≥LLOQ, составляло от 88,9% до 100,0% для детей более младшего возраста (от 12 до <18 месяцев) и от 81,8% до 100,0% для детей более старшего возраста (от 18 до <24 месяцев) после введения 3 доз. Для группы, которой вводили 120 мкг, число индивидуумов, у которых достигался hSBA-титр≥LLOQ, составляло от 71,1% до 100,0% для детей в возрасте от 12 до <18 месяцев, и от 72,0% до 100,0% для детей в возрасте от 18 до <24 месяцев после введения 3 доз. Число индивидуумов в этой объединенной возрастной стратифицированной группе с hSBA-титром≥LLOQ для каждого из 4 первичных тестируемых штаммов MnB через 1 месяц после третьей вакцинации составляло в пределах от 85,0% до 100,0%, в группе, которой вводили 60 мкг, и от 71,6% до 100,0%, в группе, которой вводили 120 мкг. Эти данные были также подтверждены высокими GMT (в пределах от 4,0-8,5 на базовом уровне до 15,1-171,4 через 1 месяц после вакцинации 3) и числом индивидуумов, у которых достигался hSBA-титр≥1:4 (71,1% - 100%) или≥1:16 (63,6% - 100%) против каждого из 4 первичных тестируемых штаммов MnB после введения 3 доз двухвалентного rLP2086 по сравнению с базовыми уровнями для обеих возрастных стратифицированных групп и в группах, которым вводили указанные дозы. Кроме того, число индивидуумов в объединенных возрастных стратифицированных группах, у которых hSBA-титр был в≥4 выше по сравнению с базовым уровнем через 1 месяц после третьей вакцинации для каждого из 4 первичных тестируемых штаммов MnB, составляло от 67,4% до 100,0% в обеих группах, которым вводили эти дозы. В заключение следует отметить, что 3 дозы 60 мкг или 120 мкг двухвалентного rLP2086, вводимого по схеме введения на месяцы 0, 2 и 6, индуцировали стойкие иммунные ответы у детей в возрасте от 12 до <24 месяцев (в отдельной и объединенной возрастной стратифицированной группе).
Второй целью исследования является описание иммунных ответов через 1 месяц после введения второй дозы двухвалентного rLP2086, как было установлено по ответам≥LLOQ, определенным hSBA-титрам и GMT hSBA для 2 возрастных стратифицированных групп и объединенной возрастной стратифицированной группы. Для объединенной возрастной стратифицированной группы, число индивидуумов с hSBA-титром≥LLOQ после введения второй дозы двухвалентного rLP2086 (через 2 месяца после первой дозы) составляло от 57,9% до 94,7%, для индивидуумов в группе, которым вводили 60 мкг, и от 33,7% до 100,0% для индивидуумов в группе, которым вводили 120 мкг. Аналогичные результаты были получены для двух отдельных возрастных стратифицированных групп, причем, между стратифицированными группами младшего и более старшего возраста каких-либо значимых различий не наблюдалось. Эти данные были дополнительно подтверждены увеличением GMT (в пределах от 7,2 до 110,6) по сравнению с базовым уровнем, и числом индивидуумов, у которых достигался hSBA-титр≥1:4 (36,0% - 100%) или≥1:16 (32,6% - 100%) против каждого из 4 первичных тестируемых штаммов MnB после введения 2 доз двухвалентного rLP2086 по сравнению с базовым уровнем при введении обеих доз для объединенной возрастной стратифицированной группы. Аналогичные результаты были получены для 2 отдельных возрастных стратифицированных групп. Кроме того, число индивидуумов в объединенной возрастной стратифицированной группе, у которой hSBA-титр был выше в≥4 раз по сравнению с базовым уровнем через 1 месяц после второй вакцинации для каждого из 4 первичных тестируемых штаммов MnB, составляло от 30,2% до 98,9%. В заключение следует отметить, что 2 дозы 60 мкг или 120 мкг двухвалентного rLP2086, вводимого с перерывами в 2 месяца, индуцировали стойкие иммунные ответы у детей в возрасте от 12 до <24 месяцев (в отдельных и объединенных возрастных стратифицированных группах).
В целом, при введении дозы 60 мкг или 120 мкг, двухвалентный rLP2086, вводимый в 3 дозах по схеме введения на месяцы 0, 2 и 6, вырабатывал стойкий иммунный ответ у детей в возрасте от 12 до <24 месяцев с титрами протективного антитела, достигаемыми, как было определено с помощью hSBA, у большого числа индивидуумов после введения третьей дозы.
Обсуждение и общие выводы
Обсуждение иммуногенности. Результаты этого исследования по иммуногенности Фазы 2 по схеме введения 3 доз (по схеме введения на месяцы 0, 2 и 6) двухвалентного rLP2086 (в 2 дозах), вводимого детям в возрасте от 12 до <24 месяцев, соответствуют данным, полученным в предыдущих исследованиях с участием подростков и молодых людей, которым вводили дозу 120 мкг.
Иммуногенные ответы на вакцинацию двухвалентным rLP2086 оценивали с помощью hSBA для подтверждения достоверности с использованием 4 первичных тестируемых штаммов MnB, каждый из которых экспрессирует варианты fHBP, гетерологичные антигенам-компонентам вакцины, по более жестким критериям, чем общепринятый коррелят защиты (hSBA-титр≥1:4). Исходя из hSBA-титра≥LLOQ для 4 первичных тестируемых штаммов MnB через 1 месяц после вакцинации 3, у детей раннего возраста, участвующих в этом исследовании (которым вводили любую из этих доз), наблюдались такие же иммунные ответы как и у подростков (от 10 лет до <19 лет), участвующих в исследовании B1971009, и у детей младшего возраста и более старшего возраста, участвующих в исследовании B1971017 (от≥24 месяцев до <10 лет), где число индивидуумов с hSBA-титром≥LLOQ после третьей вакцинации (по схеме введения на месяцы 0, 2 и 6) составляло в пределах от 71,6% до 100% для группы, которой вводили 120 мкг (в возрасте от 12 до <24 месяцев) в этом исследовании, от 87,1% до 99,5% в исследовании B1971009 и от 79,1% до 100,0% в исследовании B1971017. Каких-либо значимых различий в числе индивидуумов с hSBA-титром≥LLOQ для 4 первичных тестируемых штаммов через 1 месяц после вакцинации 3 в этих 3 исследованиях не наблюдалось, несмотря на то, что в исследование B1971009 входило гораздо большее число подростков с hSBA-титром≥LLOQ до вакцинации по сравнению с титрами у детей раннего возраста в этом исследовании. Двухвалентный rLP2086, очевидно, является в высокой степени иммуногенным у индивидуумов в группе от 12 до <24 месяцев, и очевидно, обладает защитным действием против инфекции MnB, аналогичным действию, ожидаемому для подростков исходя из hSBA коррелята защиты. После введения 3 доз индивидуумам в отдельных возрастных стратифицированных группах и в обеих объединенных возрастных стратифицированных группах, ответы на введение дозы 60 мкг значительно не отличались от ответов на введение дозы 120 мкг.
Что касается других целей, а именно, иммунных ответов в этом исследовании для объединенной возрастной стратифицированной группы (от 12 до <24 месяцев) через 1 месяц после введения второй дозы двухвалентного rLP2086 (любой дозы), то число индивидуумов, у которых достигался hSBA-титр≥LLOQ, составляло в пределах от 33,7% до 100,0% по сравнению с числом подростков (от 10 лет до <19 лет), участвующих в исследовании B1971009 и получавших 2 дозы двухвалентного rLP2086 с перерывом в 2 месяца, которое составляло от 64,2% до 99,1%, и по сравнению с числом детей младшего возраста и более старшего возраста (от≥24 месяцев до <10 лет), которые участвовали в исследовании B1971017, и число которых составляло от 48,5% до 100,0%. Для возрастной стратифицированной группы и объединенной возрастной стратифицированной группы, иммунные ответы после введения 2 доз двухвалентного rLP2086 значительно не отличались от ответов, наблюдаемых после введения 2 доз 120 мкг двухвалентного rLP2086. Следует отметить, что чем меньше размер образца у группы, которой вводили 60 мкг, тем труднее получить точные результаты при сравнении ответов для доз 60 мкг и 120 мкг.
В целом, при введении дозы 60 мкг или 120 мкг, двухвалентный rLP2086, вводимый по схеме введения на месяцы 0, 2 и 6, является в высокой степени иммуногенным у детей в возрасте от 12 до <24 месяцев с протективными иммунными ответами, достигаемыми, как было определено с помощью hSBA, у большого числа индивидуумов после введения третьей дозы. Иммунные ответы, оцененные в этом исследовании, были аналогичны ответам, наблюдаемым в предыдущих исследованиях у подростков и детей через 1 месяц после введения третьей дозы. Схема введения 3 доз обеспечивает высокие уровни протективного иммунитета у детей в возрасте от 12 до <24 месяцев.
Общие выводы. В заключение следует отметить, что двухвалентный rLP2086, введенный детям в возрасте от 12 до <24 месяцев по схеме введения доз 60 мкг или 120 мкг на месяцы 0, 2 и 6, вырабатывает титры протективных антител после введения третьей дозы, как было определено с помощью hSBA. Вакцина, вводимая в этом исследовании, была безопасной и хорошо переносилась с приемлемым профилем безопасности у детей в возрасте от 12 до <24 месяцев.
Пример 22: Оценка иммуногенности пятивалентной вакцины Mn и вакцины Trumenba® Neisseria meningitidis серологической группы B у мышей CBA/J
Иммунный ответ на fHBP Neisseria meningitidis серологической группы B после вакцинации двухвалентной вакциной fHBP MnB, Trumenba или двухвалентной вакциной fHBP MnB, приготовленной с использованием четырехвалентной конъюгатной вакцины на основе полисахарида ACWY (пятивалентной Mn ABCWY), оценивали у мышей CBA/J. Группы мышей CBA/J иммунизировали 3 различными вакцинами: пятивалентной вакциной (ABCYW), Trumenba® (MnB) и Nimenrix® (ACYW) (Таблица 29).
(B)
Для каждой группы, мышей CBA/J (25/группу) подкожно иммунизировали в заднюю часть шеи путем введения дозы соответствующей вакцины с 2-кратным разведением (Таблица 29). Мышей примировали вакциной на время 0 и через 2 недели вводили бустер-дозу. Сыворотку собирали через день (PD2) на неделе 3 для тестирования с помощью двух различных анализов на бактерицидную активность сыворотки, в которых использовали человеческий комплемент (hSBA). В одном hSBA использовали штамм, экспрессирующий fHBP подсемейства A (M98250771), а в другом использовали штамм, экспрессирующий fHBP подсемейства B (CDC1127).
В hSBA определяли антитело-зависимую комплемент-опосредованную бактерицидную активность против штаммов N meningitidis серологической группы B. Вкратце, тестируемую сыворотку в соответствующем разведении смешивали в 96-луночных микротитрационных аналитических планшетах со свежеприготовленными бактериальными культурами штаммов N meningitidis B (подсемейства A или B) и с человеческим комплементом. Аналитические планшеты помещали на орбитальный шейкер и смешивали в течение 30 минут в инкубаторе с повышенной влажностью (37°C/5% CO2). Затем, аликвоты аналитической реакционной смеси из каждой лунки переносили в 96-луночные фильтровальные планшеты для подсчета выживших бактерий.
Уровни ответов на вакцинацию вычисляли как процент мышей в группе для каждой дозы (n=25), которая давала ответ в hSBA. При тестировании с предварительно заданным уровнем разведения, пробы мышиной сыворотки, которые уничтожали≥50% менингококковых бактерий в контрольных лунках T30, рассматривались как респонденты. Контрольные лунки T30 содержали бактерии и комплемент, но не содержали тестируемой сыворотки и оценивались по окончании 30-минутного инкубирования для анализа.
В Таблице 30 и в Таблице 31 показаны сравнимые дозо-зависимые уровни ответов, индуцируемых путем введения TRUMENBA® или пятивалентной Mn для обоих штаммов подсемейства A и подсемейства B N. meningitidis серотипа B. Как и ожимдалось, NIMENRIX™ не индуцировала функциональный иммунный ответ на штаммы MnB.
Нижеследующие пункты описывают дополнительные варианты осуществления изобретения:
С1. Композиция, содержащая полипептид и конъюгат капсулярного сахарида Neisseria meningitidis серологической группы A (MenA); конъюгат капсулярного сахарида Neisseria meningitidis серологической группы C (MenC); конъюгат капсулярного сахарида Neisseria meningitidis серологической группы W135 (MenW); и конъюгат капсулярного сахарида Neisseria meningitidis серологической группы Y (MenY).
C2. Композиция по пункту С1, где капсулярный сахарид MenA конъюгирован с белком-носителем; капсулярный сахарид MenC конъюгирован с белком-носителем; капсулярный сахарид MenW конъюгирован с белком-носителем; и капсульный сахарид MenY конъюгирован с белком-носителем.
C3. Композиция по пункту С1, где композиция дополнительно включает конъюгат капсулярного сахарида Neisseria meningitidis серологической группы Х (MenX).
C4. Композиция по пункту С1, где полипептидом является белок, связывающийся с фактором Н (fHBP).
C5. Композиция по пункту С1, где полипептид включает аминокислотную последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности, представленной в любой из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61 и SEQ ID NO: 62.
С6. Композиция, содержащая:
а. первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:1;
b. второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2; и
с. капсулярный сахарид Neisseria meningitidis серологической группы А (MenA), конъюгированный с белком-носителем.
C7. Композиция, содержащая:
а. первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:1;
b. второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2; и
с. капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с белком-носителем.
C8. Композиция, содержащая:
а. первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:1;
b. второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2; и
с. капсулярный сахарид Neisseria meningitidis серологической группы W-135 (MenW), конъюгированный с белком-носителем.
C9. Композиция, содержащая:
а. первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:1;
b. второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2; и
с. капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), конъюгированный с белком-носителем.
С10. Композиция, содержащая
а. первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:1;
b. второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2; и
с. капсулярный сахарид Neisseria meningitidis серологической группы А (MenА), конъюгированный с белком-носителем.
d. капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с белком-носителем.
е. капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), конъюгированный с белком-носителем.
f. капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), конъюгированный с белком-носителем.
C11. Композиция, содержащая
а. первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:1;
b. второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2; и
с. капсулярный сахарид Neisseria meningitidis серологической группы А (MenА), конъюгированный с белком-носителем столбнячного токсоида (ТТ);
d. капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с белком-носителем столбнячного токсоида (ТТ);
е. капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), конъюгированный с белком-носителем столбнячного токсоида (ТТ); и
f. капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), конъюгированный с белком-носителем столбнячного токсоида (ТТ).
C12. Композиция в соответствии с пунктом С1, где капсулярный сахарид MenA конъюгируют с линкером дигидразидом адипиновой кислоты (ADH) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, и где линкер конъюгируют с белком-носителем столбнячного токсоида (ТТ) карбодиимидным химическим методом (конъюгат MenAАH-TT).
C13. Композиция в соответствии с пунктом С1, где капсулярный сахарид MenС конъюгируют с ADH-линкером посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, и где линкер конъюгируют с белком-носителем столбнячного токсоида (ТТ) карбодиимидным химическим методом (конъюгат MenСАH-TT).
C14. Композиция в соответствии с пунктом С1, где капсулярный сахарид MenW непосредственно конъюгируют с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-TT).
C15. Композиция в соответствии с пунктом С1, где капсулярный сахарид MenY непосредственно конъюгируют с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-TT).
C16. Композиция в соответствии с пунктом С1, также содержащая Трис-HCl.
C17. Композиция в соответствии с пунктом С1, также содержащая хлорид натрия.
С18. Композиция в соответствии с пунктом С1, также содержащая сахарозу.
C19. Композиция в соответствии с пунктом С1, также содержащая гистидин.
C20. Композиция в соответствии с пунктом С1, также содержащая полисорбат 80.
C21. Композиция в соответствии с пунктом С1, также содержащая алюминий.
C22. Композиция в соответствии с пунктом С1, также содержащая фосфат алюминия.
C23. Композиция в соответствии с пунктом С1, где композиция содержит приблизительно 120 мкг/мл первого полипептида; приблизительно 120 мкг/мл второго полипептида; приблизительно 0,5 мг/мл алюминия в виде фосфата алюминия; приблизительно 0,02 мг полисорбата-80; приблизительно 10 мМ гистидина; и приблизительно 150 мМ хлорида натрия.
C24. Композиция в соответствии с пунктом С1, где композиция содержит приблизительно 60 мкг первого полипептида; приблизительно 60 мкг второго полипептида; приблизительно 5 мкг капсулярного сахарида MenA, конъюгированного приблизительно с 7,5 мкг TT; приблизительно 5 мкг капсулярного сахарида MenC, конъюгированного приблизительно с 7,5 мкг TT; приблизительно 5 мкг капсулярного сахарида MenW, конъюгированного приблизительно с 3,75 мкг TT; приблизительно 5 мкг капсулярного сахарида MenY, конъюгированного приблизительно с 3,25 мкг TT; приблизительно 97 мкг Трис-HCl, рН 6,8 ± 0,3; 4,69-4,71 мг хлорида натрия; приблизительно 28 мг сахарозы; приблизительно 0,78 мг L-гистидина; приблизительно 0,02 мг полисорбата-80; приблизительно 0,25 мг алюминия; и также содержит 0,5 мл воды на одну дозу.
C25. Композиция в соответствии с пунктом С1, где композиция является подходящей для введения пациенту в возрасте от 12 до <18 месяцев или от 18 до <24 месяцев.
C26. Композиция в соответствии с пунктом С1, где композиция является подходящей для введения пациенту в возрасте от 18 до <24 месяцев.
C27. Композиция в соответствии с пунктом С1, где композиция является подходящей для введения пациенту в возрасте от≥24 месяцев до <10 лет.
C28. Композиция в соответствии с пунктом С20, где композиция содержит по меньшей мере 0,010 мг полисорбата-80 и максимум 0,018 мг полисорбата-80.
C29. Композиция в соответствии с пунктом С20, где композиция содержит по меньшей мере 0,01 мг полисорбата-80 и максимум 0,02 мг полисорбата-80.
C30. Композиция в соответствии с пунктом С1, где композиция также не содержит полипептид, имеющий последовательность, которая менее, чем на 100% идентична последовательности SEQ ID NO:1.
C31. Композиция в соответствии с пунктом С1, где первый полипептид имеет всего 258 аминокислот.
C32. Композиция в соответствии с пунктом С1, где композиция также не содержит полипептид, имеющий последовательность, которая менее, чем на 100% идентична последовательности SEQ ID NO:2.
C33. Композиция в соответствии с пунктом С1, где второй полипептид имеет всего 261 аминокислоту.
C34. Композиция в соответствии с пунктом С1, где композиция содержит максимум два липидизированных полипептида.
C35. Композиция в соответствии с пунктом С1, где композиция не содержит гибридный белок.
C36. Композиция в соответствии с пунктом С1, где композиция не содержит химерный белок.
C37. Композиция в соответствии с пунктом С1, где композиция не содержит слитый белок.
C38. Композиция в соответствии с пунктом С1, где композиция не является лиофилизованной.
C39. Композиция в соответствии с пунктом С1, где композиция не содержит формальдегид.
C40. Композиция в соответствии с пунктом С1, где композиция не содержит дифтерийный токсоид или CRM.
C41. Композиция в соответствии с пунктом С1, где композиция не содержит капсулярный сахарид MenA в отсутствие линкера дигидразида адипиновой кислоты (ADH).
C42. Композиция в соответствии с пунктом С1, где композиция не содержит капсулярный сахарид MenC в отсутствие линкера дигидразида адипиновой кислоты (ADH).
C43. Композиция в соответствии с пунктом С1, где композиция представляет собой жидкую композицию.
C44. Композиция в соответствии с пунктом С1, где композиция также не содержит любую из нижеследующих иммуногенных композиций: MENACTRA(R), MENVEO(R), ADACEL(R), HAVRIX(R), GARDASIL(R), REPEVAX или любую их комбинацию.
C45. Композиция в соответствии с пунктом С1, где композиция также не содержит конъюгатную композицию менингококкового полисахарида А, С, Y и W-135 (MCV4), где белком-носителем является дифтерийный токсоид.
C46. Композиция в соответствии с пунктом С1, где композиция также не содержит конъюгатную композицию менингококкового полисахарида А, С, Y и W-135 (MCV4), где белком-носителем является CRM197.
C47. Композиция в соответствии с пунктом С1, где композиция также не содержит вакцину NIMENRIX.
C48. Композиция в соответствии с пунктом С1, где композиция также не содержит вакцину NIMENRIX, где NIMENRIX содержит разбавитель, состоящий из хлорида натрия и воды.
C49. Набор, содержащий (а) первую композицию, включающую липидизированный полипептид подсемейства А MenB rLP2086 и липидизированный полипептид подсемейства В MenB rLP2086; и (b) вторую композицию, включающую капсулярный сахарид Neisseria meningitidis серологической группы А (MenА), конъюгированный с белком-носителем столбнячного токсоида (ТТ); капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с белком-носителем столбнячного токсоида (ТТ); капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), конъюгированный с белком-носителем столбнячного токсоида (ТТ); и капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), конъюгированный с белком-носителем столбнячного токсоида (ТТ).
C50. Набор в соответствии с пунктом C49, где первая композиция представляет собой жидкую композицию, а вторая композиция представляет собой лиофилизованную композицию.
C51. Набор в соответствии с пунктом C49, где лиофилизованная композиция не содержит полисорбат 80.
C52. Набор в соответствии с пунктом C49, где набор также не включает любую из нижеследующих иммуногенных композиций: MENACTRA(R), MENVEO(R), ADACEL(R), HAVRIX(R), GARDASIL(R), REPEVAX или любую их комбинацию.
C53. Набор в соответствии с пунктом C49, где набор также не включает конъюгатную композицию менингококкового полисахарида А, С, Y и W-135 (MCV4), где белком-носителем является дифтерийный токсоид.
C54. Набор в соответствии с пунктом C49, где набор также не включает конъюгатную композицию менингококкового полисахарида А, С, Y и W-135 (MCV4), где белком-носителем является CRM197.
C55. Набор в соответствии с пунктом C49, где набор также не включает вакцину NIMENRIX.
C56. Набор в соответствии с пунктом C49, где набор также не включает вакцину NIMENRIX(R), где NIMENRIX(R) содержит разбавитель, состоящий из хлорида натрия и воды.
C57. Набор, включающий:
а. жидкую композицию, содержащую:
i. первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:1; и
ii. второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2; и
b. лиофилизованную композицию, содержащую:
i. капсулярный сахарид Neisseria meningitidis серологической группы А (MenA), конъюгированный с линкером дигидразидом адипиновой кислоты (ADH) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) карбодиимидным химическим методом (конъюгат MenAАH-TT);
ii. капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с ADH-линкером посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) карбодиимидным химическим методом (конъюгат MenСАH-TT);
iii. капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-ТТ); и
iv. капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-ТТ).
C58. Набор в соответствии с пунктом C57, где жидкая композиция также содержит хлорид натрия.
C59. Набор в соответствии с пунктом C57, где жидкая композиция также содержит L-гистидин.
C60. Набор в соответствии с пунктом C57, где жидкая композиция также содержит полисорбат 80.
C61. Набор в соответствии с пунктом C57, где жидкая композиция также содержит фосфат алюминия.
C62. Набор в соответствии с пунктом C57, где жидкая композиция также не содержит Трис-HCl.
C63. Набор в соответствии с пунктом C57, где жидкая композиция также не содержит сахарозу.
C64. Набор в соответствии с пунктом C57, где лиофилизированная композиция также содержит хлорид натрия.
C65. Набор в соответствии с пунктом C57, где лиофилизированная композиция не содержит полисорбат-80.
C66. Набор в соответствии с пунктом С60, где жидкая композиция содержит по меньшей мере 0,010 мг полисорбата-80 и максимум 0,018 мг полисорбата-80.
C67. Набор в соответствии с пунктом С60, где жидкая композиция содержит по меньшей мере 0,010 мг полисорбата-80 и максимум 0,02 мг полисорбата-80.
C68. Иммуногенная композиция, содержащая:
а. жидкую композицию, содержащую: (i) первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1; и (ii) второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 2; и
b. лиофилизованную композицию, содержащую:
i. капсулярный сахарид Neisseria meningitidis серологической группы А (MenA), конъюгированный с линкером дигидразидом адипиновой кислоты (ADH) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) карбодиимидным химическим методом (конъюгат MenAАH-TT);
ii. капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с ADH-линкером посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) карбодиимидным химическим методом (конъюгат MenСАH-TT);
iii. капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-ТТ); и
iv. капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-ТТ).
C69. Иммуногенная композиция в соответствии с пунктом C68, где лиофилизованную композицию разводят жидкой композицией.
C70. Иммуногенная композиция в соответствии с пунктом C68, где жидкая композиция также содержит гистидин.
C71. Иммуногенная композиция в соответствии с пунктом C68, где жидкая композиция также содержит полисорбат-80.
C72. Иммуногенная композиция в соответствии с пунктом C68, где жидкая композиция также содержит фосфат алюминия.
C73. Иммуногенная композиция в соответствии с пунктом C68, где жидкая композиция также содержит хлорид натрия.
C74. Иммуногенная композиция в соответствии с пунктом C68, где композиция является подходящей для введения пациенту в возрасте от 12 до <18 месяцев или от 18 до <24 месяцев.
C75. Иммуногенная композиция в соответствии с пунктом С68, где композиция является подходящей для введения пациенту в возрасте от 18 до <24 месяцев.
C76. Иммуногенная композиция в соответствии с пунктом С68, где композиция является подходящей для введения пациенту в возрасте от≥24 месяцев до <10 лет.
C77. Иммуногенная композиция, содержащая:
а. жидкую композицию, включающую: (i) первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:1; и (ii) второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2; и
b. лиофилизованную композицию, содержащую:
i. капсулярный сахарид Neisseria meningitidis серологической группы А (MenA), конъюгированный с линкером дигидразидом адипиновой кислоты (ADH) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) карбодиимидным химическим методом (конъюгат MenAАH-TT);
ii. капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с ADH-линкером посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния, где линкер конъюгирован с белком-носителем столбнячного токсоида (ТТ) карбодиимидным химическим методом (конъюгат MenСАH-TT);
iii. капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-ТТ); и
iv. капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), непосредственно конъюгированный с белком-носителем столбнячного токсоида (ТТ) посредством химического соединения тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-ТТ),
где лиофилизованную композицию разводят жидкой композицией с получением иммуногенной композиции.
C78. Иммуногенная композиция в соответствии с пунктом С77, где жидкая композиция также содержит алюминий.
C79. Иммуногенная композиция в соответствии с пунктом С77, где жидкая композиция также содержит фосфат алюминия.
C80. Иммуногенная композиция в соответствии с пунктом С77, где лиофилизированная композиция также содержит хлорид натрия.
C81. Иммуногенная композиция в соответствии с пунктом С77, где иммуногенная композиция содержит по меньшей мере 0,010 мг полисорбата-80 и максимум 0,018 мг полисорбата-80.
C82. Иммуногенная композиция в соответствии с пунктом С77, где иммуногенная композиция содержит по меньшей мере 0,01 мг полисорбата-80 и максимум 0,02 мг полисорбата-80.
C83. Иммуногенная композиция в соответствии с пунктом С77, где лиофилизованная композиция не содержит алюминий.
C84. Иммуногенная композиция в соответствии с пунктом С78, где первый полипептид и второй полипептид связаны с алюминием.
C85. Иммуногенная композиция в соответствии с пунктом С78, где первый полипептид и второй полипептид связаны с алюминием в иммуногенной композиции.
C86. Иммуногенная композиция в соответствии с пунктом С78, где концентрация полипептидов, связанных с алюминием в иммуногенной композиции, не снижается через 24 часа по сравнению с концентрацией полипептидов, связанных с алюминием в жидкой композиции до разведения лиофилизированной композиции.
C87. Иммуногенная композиция в соответствии с пунктом С77, где концентрация конъюгата MenААН-ТТ в иммуногенной композиции не снижается через 24 часа по сравнению с концентрацией конъюгата MenААН-ТТ в лиофилизированной композиции.
C88. Иммуногенная композиция в соответствии с пунктом С77, где концентрация конъюгата MenСАН-ТТ в иммуногенной композиции не снижается через 24 часа по сравнению с концентрацией конъюгата MenСАН-ТТ в лиофилизированной композиции.
C89. Иммуногенная композиция в соответствии с пунктом С77, где концентрация конъюгата MenW-TT в иммуногенной композиции не снижается через 24 часа по сравнению с концентрацией конъюгата MenW-TT в лиофилизированной композиции.
C90. Иммуногенная композиция в соответствии с пунктом С77, где концентрация конъюгата MenY-ТТ в иммуногенной композиции не снижается через 24 часа по сравнению с концентрацией конъюгата MenY-ТТ в лиофилизированной композиции.
C91. Иммуногенная композиция в соответствии с пунктом C86, где концентрация снижается максимум на 1% через 24 часа по сравнению с соответствующей концентрацией в жидкой композиции перед разведением.
C92. Иммуногенная композиция в соответствии с пунктом C86, где концентрация снижается максимум на 5% через 24 часа по сравнению с соответствующей концентрацией в жидкой композиции перед разведением.
C93. Иммуногенная композиция в соответствии с пунктом C86, где концентрация снижается максимум на 10% через 24 часа по сравнению с соответствующей концентрацией в жидкой композиции перед разведением.
C94. Иммуногенная композиция в соответствии с пунктами C87-C90, где концентрация снижается максимум на 1% через 24 часа по сравнению с соответствующей концентрацией в лиофилизованной композиции перед разведением.
C95. Иммуногенная композиция в соответствии с пунктами C87-C90, где концентрация снижается максимум на 5% через 24 часа по сравнению с соответствующей концентрацией в лиофилизованной композиции перед разведением.
C96. Иммуногенная композиция в соответствии с пунктами C87-C90, где концентрация снижается максимум на 10% через 24 часа по сравнению с соответствующей концентрацией в лиофилизованной композиции перед разведением.
C97. Иммуногенной композиции в соответствии с пунктом C68 или C77, где рН разведенной иммуногенной композиции меньше, чем рН лиофилизированной композиции при разведении хлоридом натрия.
C98. Композиция, содержащая: а) первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1 и b) второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2.
C99. Композиция в соответствии с пунктом C98, где композиция также содержит полисорбат-80, алюминий, гистидин и хлорид натрия.
C100. Композиция в соответствии с пунктом C98, где композиция содержит 60 мкг первого липидизированного полипептида и 60 мкг второго липидизированного полипептида.
C101. Способ индуцирования бактерицидного иммунного ответа против штамма подсемейства А Neisseria meningitidis серологической группы В и против штамма подсемейства В Neisseria meningitidis серологической группы В у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом С1.
C102. Способ индуцирования бактерицидного иммунного ответа против штамма подсемейства А Neisseria meningitidis серологической группы В и против штамма подсемейства В Neisseria meningitidis серологической группы В у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом C68.
C103. Способ индуцирования бактерицидного иммунного ответа против штамма подсемейства А Neisseria meningitidis серологической группы В и против штамма подсемейства В Neisseria meningitidis серологической группы В у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом С77.
C104. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W и/или Neisseria meningitidis серологической группы Y у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом С1.
C105. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W и/или Neisseria meningitidis серологической группы Y у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом C68.
C106. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W и/или Neisseria meningitidis серологической группы Y у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом С77.
C107. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы В, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W и/или Neisseria meningitidis серологической группы Y у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом С1.
C108. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы В, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W и/или Neisseria meningitidis серологической группы Y у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом C68.
C109. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы В, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W и/или Neisseria meningitidis серологической группы Y у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом С77.
С110. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы В, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W, Neisseria meningitidis серологической группы Y и Neisseria meningitidis серологической группы Х у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом С1.
C111. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы В, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W, Neisseria meningitidis серологической группы Y и Neisseria meningitidis серологической группы Х у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом C68.
С112. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы В, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W, Neisseria meningitidis серологической группы Y и Neisseria meningitidis серологической группы Х у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом С77.
С113. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы В, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W, Neisseria meningitidis серологической группы Y и Neisseria meningitidis серологической группы Х у человека, где указанный способ включает введение человеку эффективного количества композиции в соответствии с пунктом C98.
С114. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы C, экспрессирующего белок А10, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2.
С115. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы W, экспрессирующего белок А10, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1.
С116. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы W, экспрессирующего белок А19, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1.
С117. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы А, экспрессирующего белок В16, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2.
С118. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы Y, экспрессирующего белок В47, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2.
С119. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы С, экспрессирующего белок А10, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO:2.
C120. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы W, экспрессирующего белок А10, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO:2.
C121. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы W, экспрессирующего белок А19, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO:2.
C122. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы A, экспрессирующего белок В16, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO:2.
C123. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы Y, экспрессирующего белок В47, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO:2.
C124. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы X у человека, включающий введение человеку эффективного количества полипептида, который по меньшей мере на 70% идентичен аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, и SEQ ID NO: 62.
C125. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы X у человека, включающий введение человеку эффективного количества композиции в соответствии с пунктом С1.
C126. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы X у человека, включающий введение человеку эффективного количества композиции в соответствии с пунктом C68.
C127. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы X у человека, включающий введение человеку эффективного количества композиции в соответствии с пунктом С77.
C128. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы X у человека, включающий введение человеку эффективного количества композиции в соответствии с пунктом C98.
C129. Способ индуцирования бактерицидного иммунного ответа против штамма Neisseria meningitidis серологической группы X, экспрессирующего белок B49, связывающийся с фактором H у человека, где указанный способ включает введение человеку композиции в соответствии с пунктом C98.
C130. Способ индуцирования бактерицидного иммунного ответа против штамма N. meningitidis серологической группы Х, экспрессирующего белок В49, связывающийся с фактором Н у человека, где указанный способ включает введение человеку композиции, содержащей первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO:2.
C131. Способ в соответствии с любым из пунктов С101-C130, где композиция индуцирует бактерицидный титр сывороточного иммуноглобулина, который по меньшей мере в 2 раза превышает титр у человека после введения первой дозы, по сравнению с бактерицидным титром сывороточного иммуноглобулина у человека до введения первой дозы, как было определено в идентичных условиях в анализе на бактерицидную активность сыворотки с использованием человеческого комплемента.
C132. Способ в соответствии с любым из пунктов С101-C130, где композиция индуцирует бактерицидный титр сывороточного иммуноглобулина, который по меньшей мере в 4 раза превышает титр у человека после введения первой дозы, по сравнению с бактерицидным титром сывороточного иммуноглобулина у человека до введения первой дозы, как было определено в идентичных условиях в анализе на бактерицидную активность сыворотки с использованием человеческого комплемента.
C133. Способ в соответствии с любым из пунктов С101-C130, где композиция индуцирует бактерицидный титр сывороточного иммуноглобулина, который по меньшей мере в 8 раз превышает титр у человека после введения первой дозы, по сравнению с бактерицидным титром сывороточного иммуноглобулина у человека до введения первой дозы, как было определено в идентичных условиях в анализе на бактерицидную активность сыворотки с использованием человеческого комплемента.
C134. Способ в соответствии с любым из пунктов С101-C132, где возраст пациента составляет от 12 до <18 месяцев или от 18 до <24 месяцев.
C135. Способ в соответствии с любым из пунктов С101-C132, где возраст пациента составляет от 18 до <24 месяцев.
C136. Способ в соответствии с любым из пунктов С101-C132, где возраст пациента составляет от≥24 месяцев до <10 лет.
C137. Способ вырабатывания иммунного ответа у пациента, включающий: (а) введение иммуногенной композиции пациенту в возрасте от 12 до 18 месяцев, где указанная иммуногенная композиция включает первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1; и второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2.
C138. Способ вырабатывания иммунного ответа у пациента, включающий: (а) введение иммуногенной композиции пациенту в возрасте от 18 до 24 месяцев, где указанная иммуногенная композиция включает первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1; и второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2.
C139. Способ вырабатывания иммунного ответа у пациента, включающий: (а) введение иммуногенной композиции пациенту в возрасте от 24 месяцев до 10 лет, где указанная иммуногенная композиция включает первый липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1; и второй липидизированный полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2.
C140. Способ в соответствии с любым из пунктов C137-C139, где композиция также содержит полисорбат-80, алюминий, гистидин и хлорид натрия.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2723045C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ ПРОТИВ NEISSERIA MENINGITIDIS (ВАРИАНТЫ) | 2014 |
|
RU2662968C2 |
| Композиции с Neisseria meningitidis и способы их применения | 2020 |
|
RU2839906C1 |
| ВАКЦИНЫ ДЛЯ МЕНИНГОКОККА СЕРОГРУППЫ Х | 2013 |
|
RU2644340C2 |
| СТАБИЛЬНЫЕ КОМПОЗИЦИИ АНТИГЕНОВ Neisseria meningitidis rLP2086 | 2011 |
|
RU2580620C2 |
| КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2665841C2 |
| НАБОР ДЛЯ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ ПРОТИВ Neisseria meningitidis СЕРОЛОГИЧЕСКОЙ ГРУППЫ В | 2008 |
|
RU2498815C2 |
| НЕЛИПИДИЗИРОВАННЫЕ ВАРИАНТЫ АНТИГЕНОВ NEISSERIA MENINGITIDIS ORF2086 | 2011 |
|
RU2546873C2 |
| КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2739504C2 |
| БЕЛОК NMB0928 И ЕГО ПРИМЕНЕНИЕ В ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЯХ | 2004 |
|
RU2335505C2 |
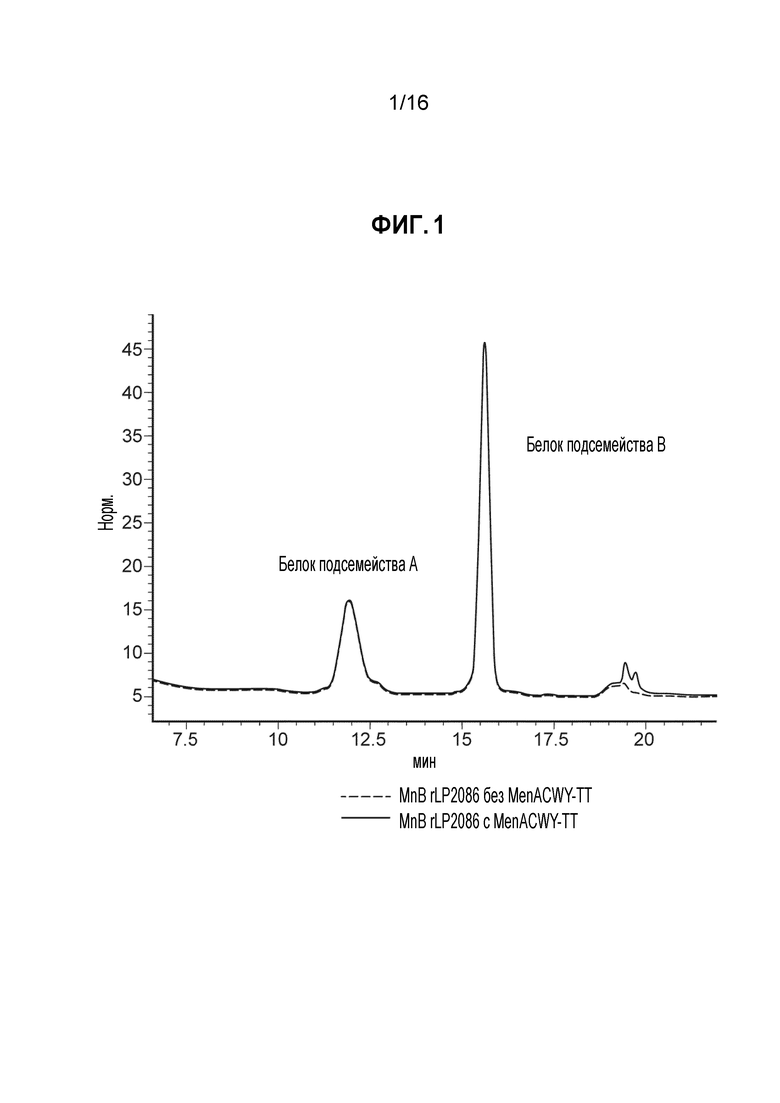
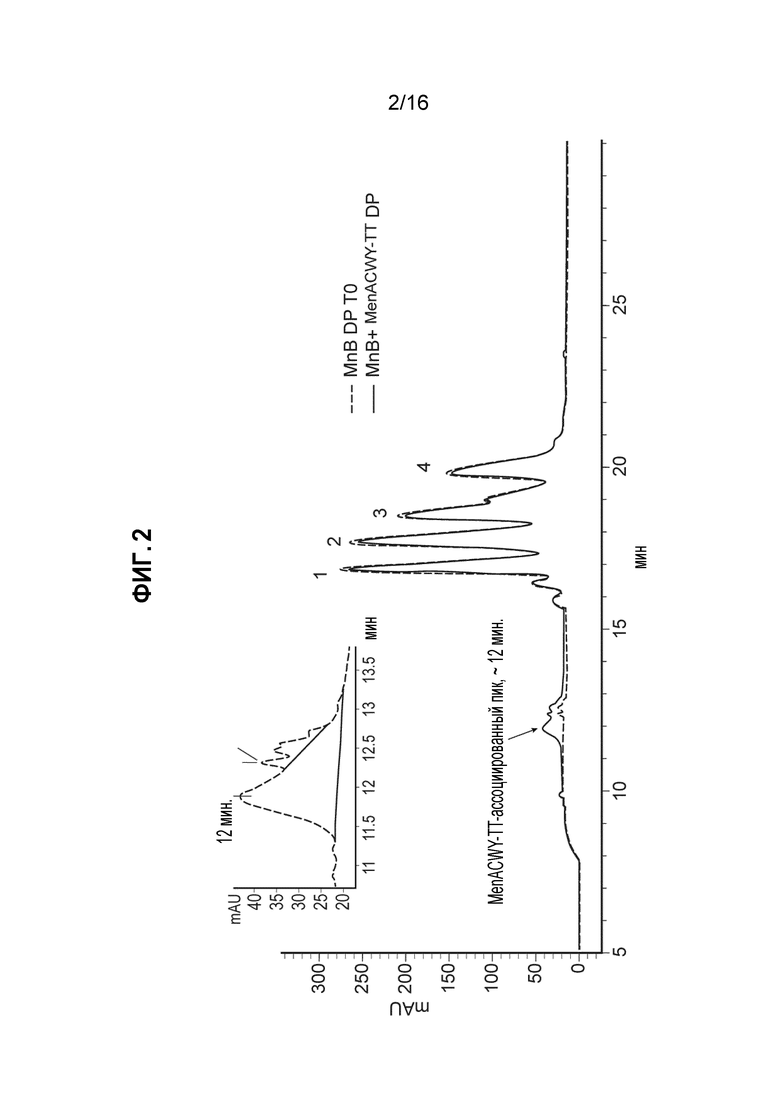
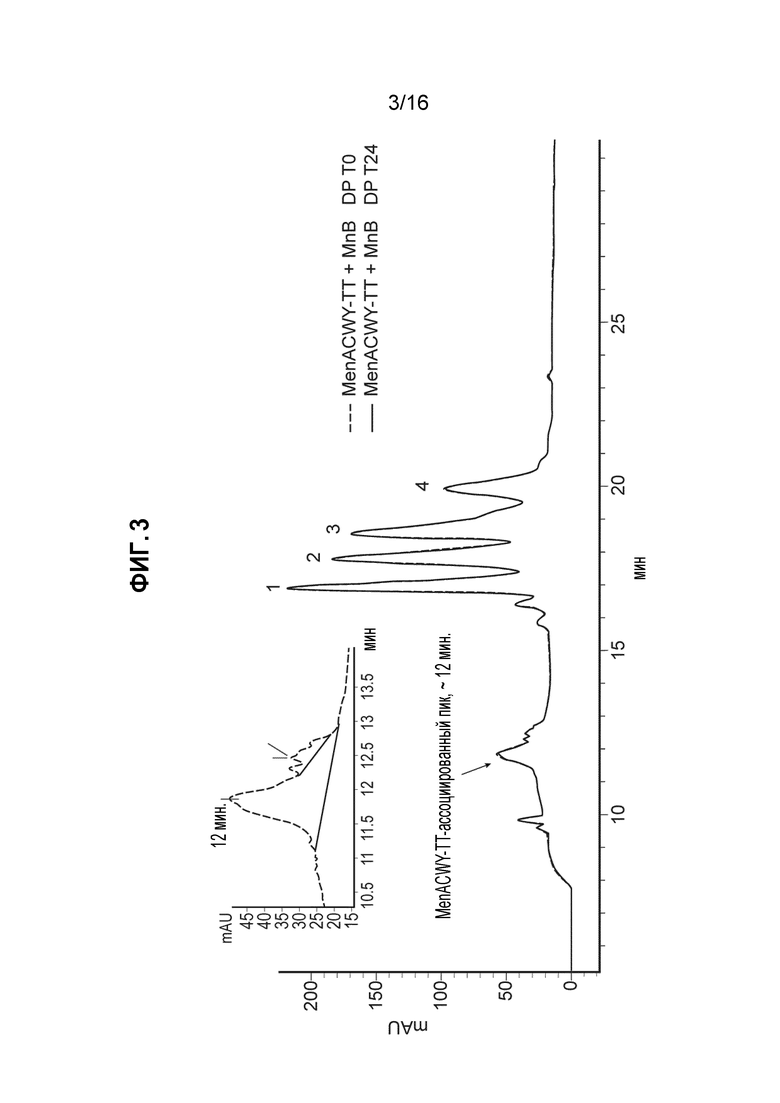
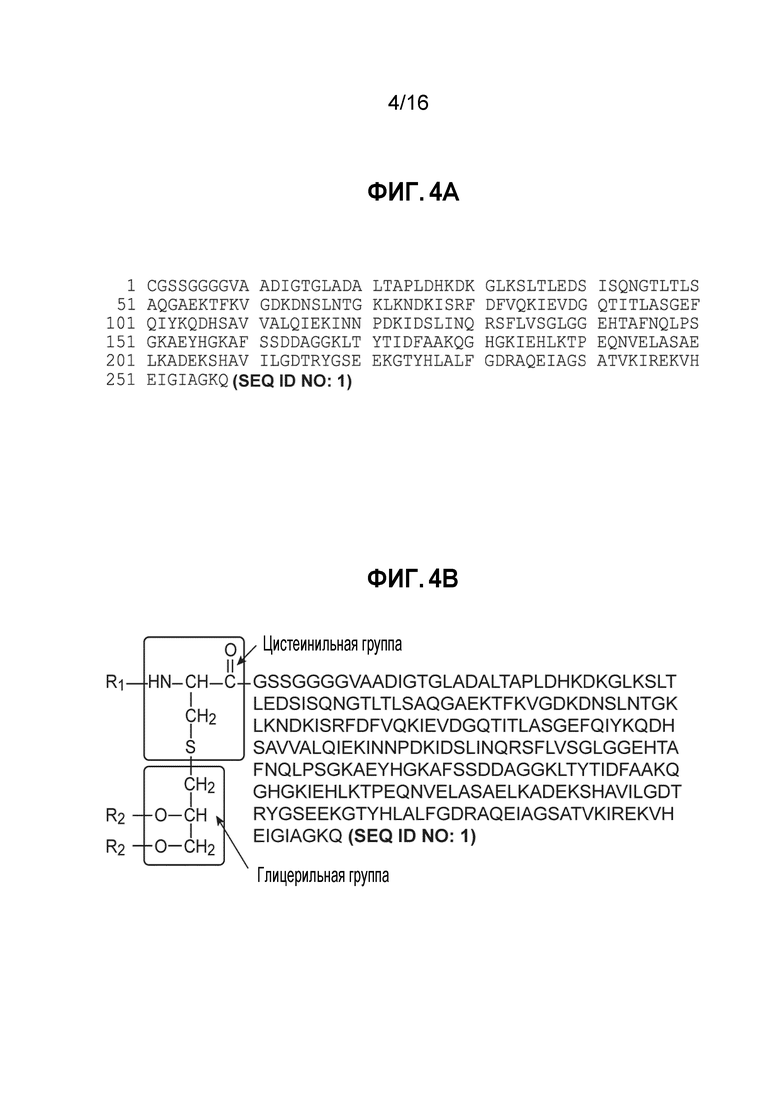
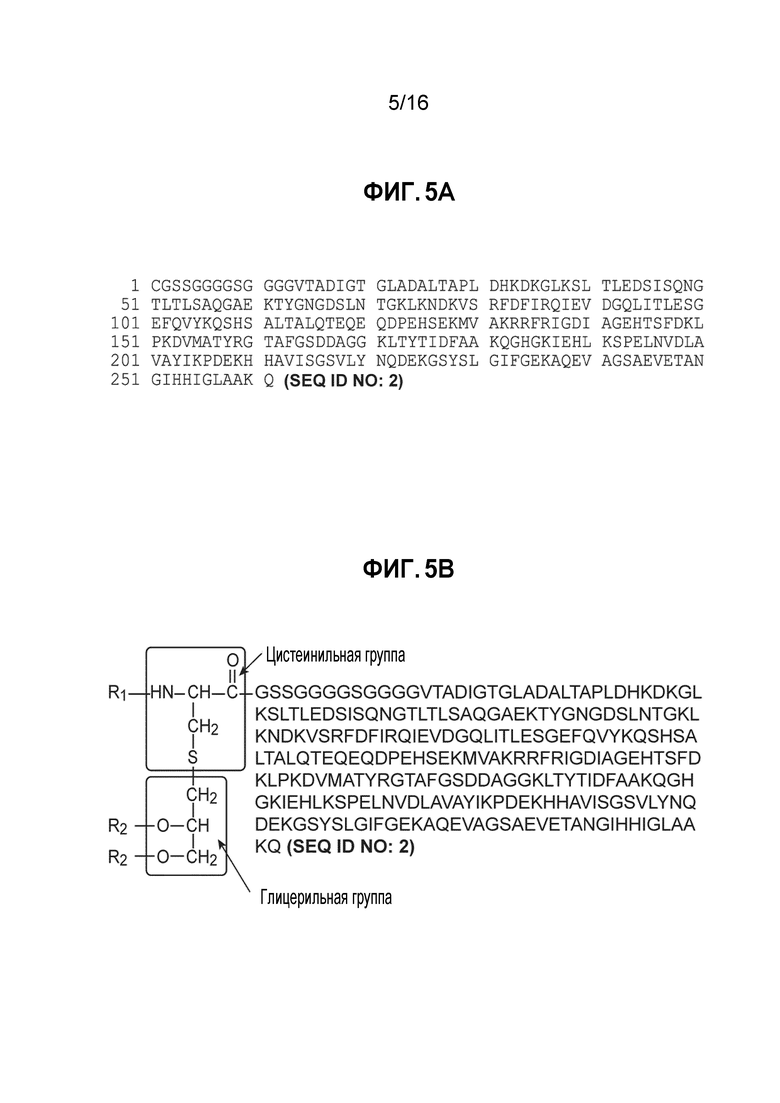

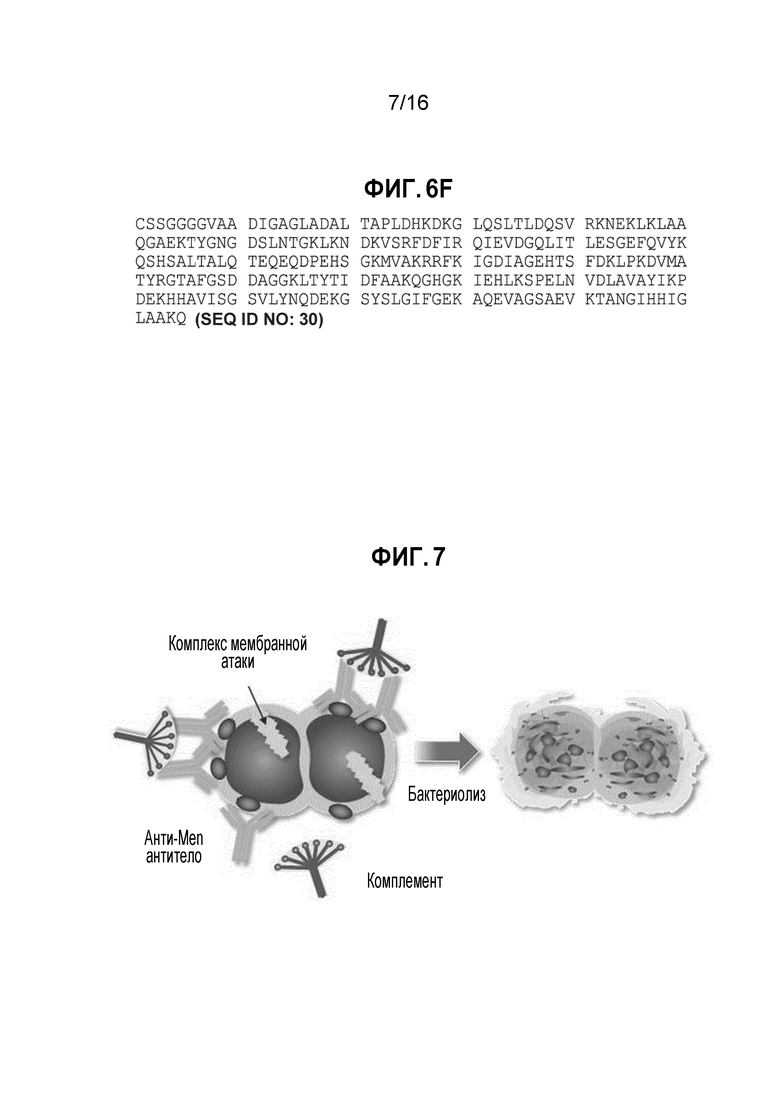
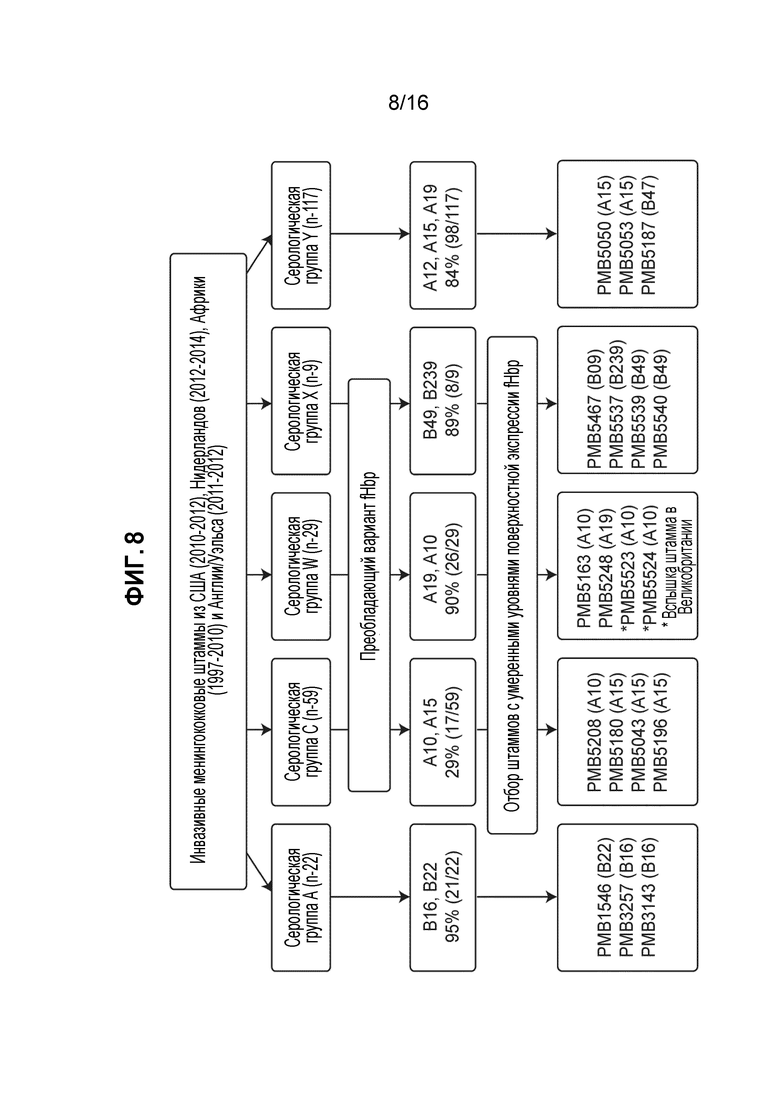
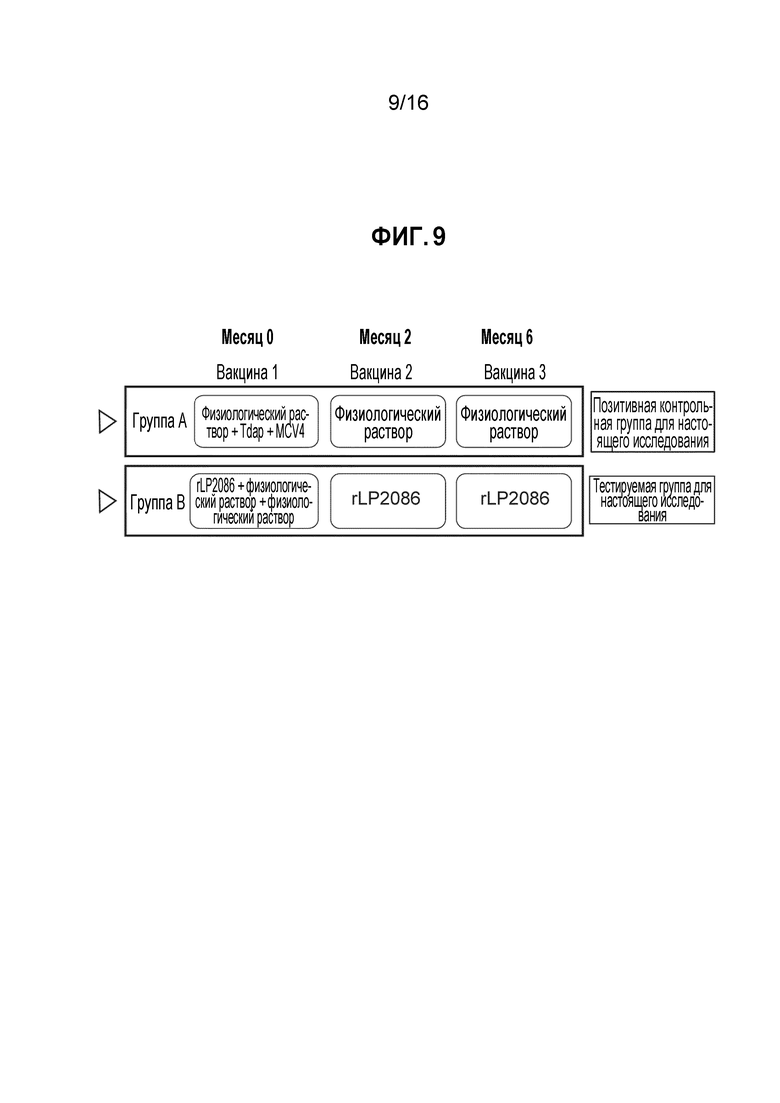
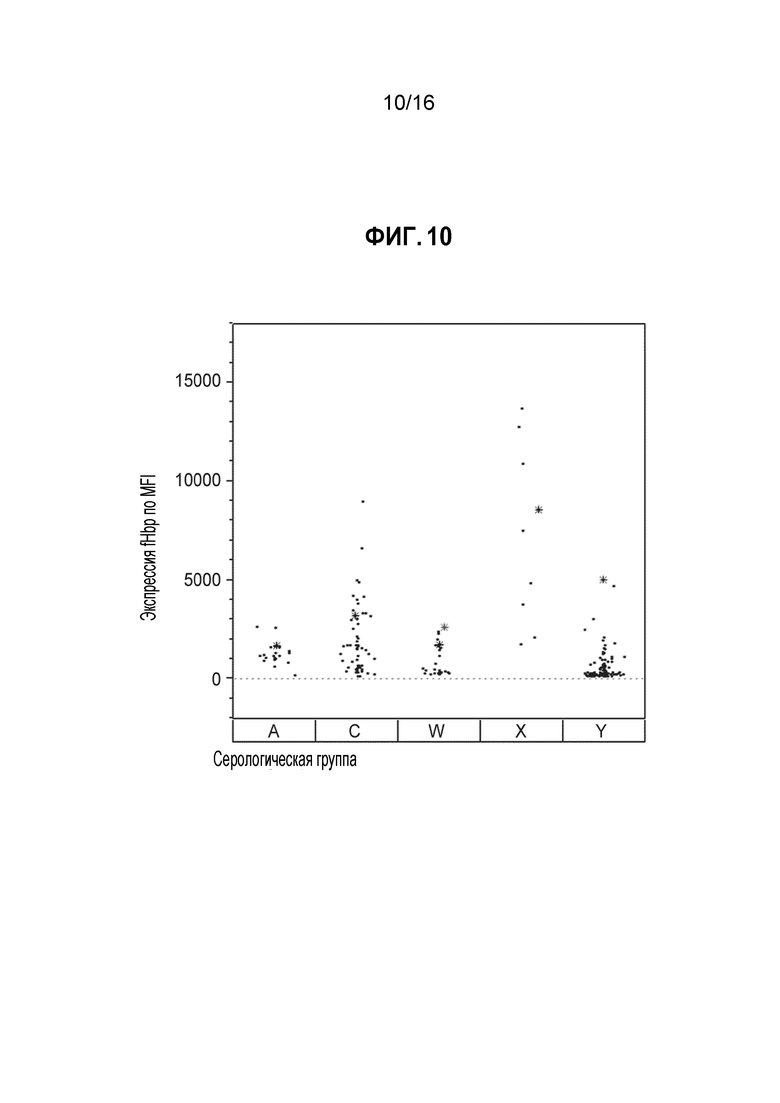
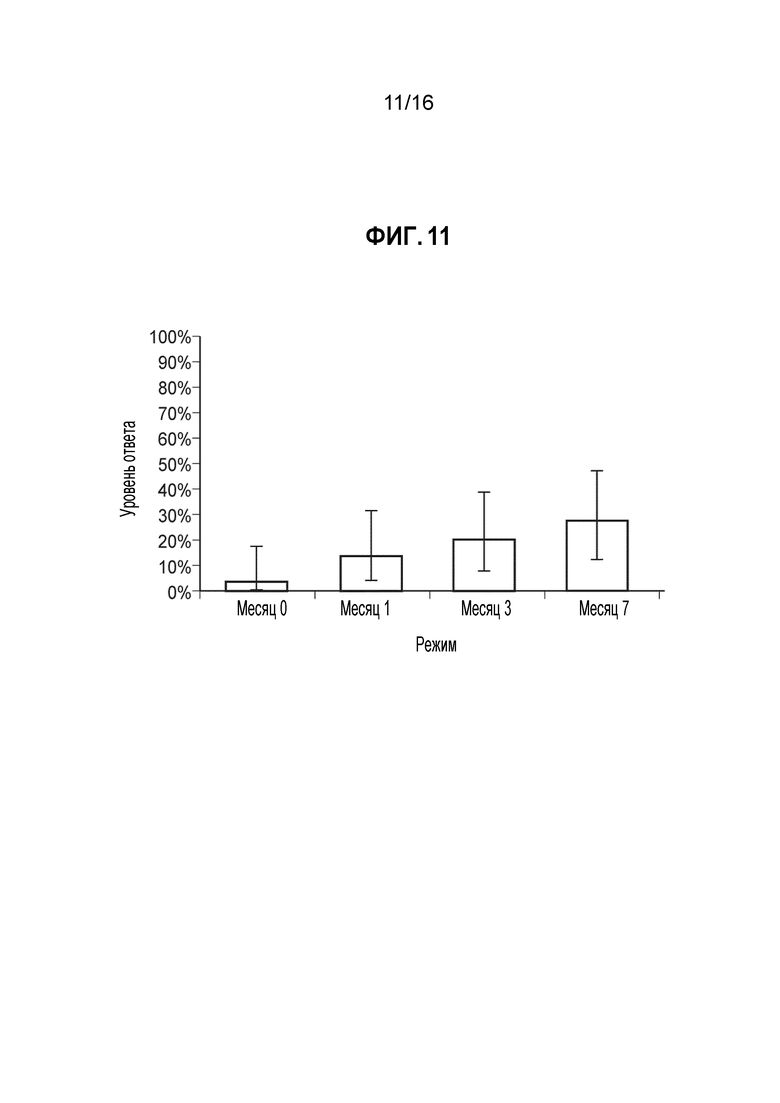
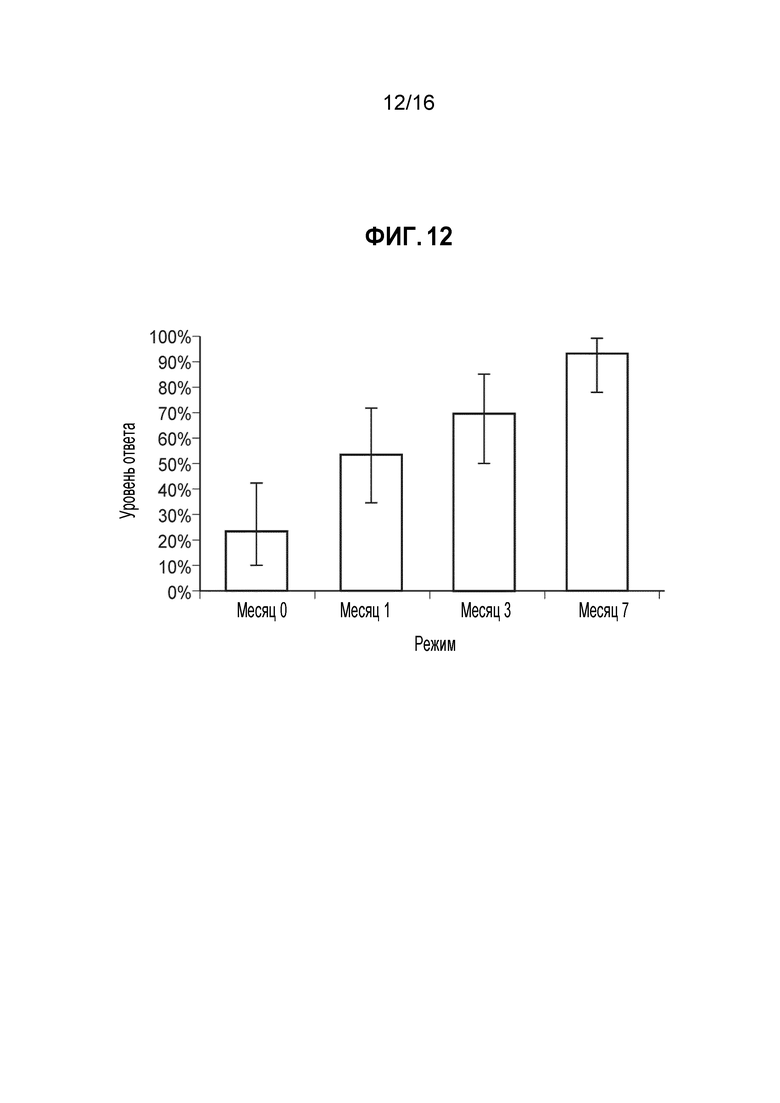
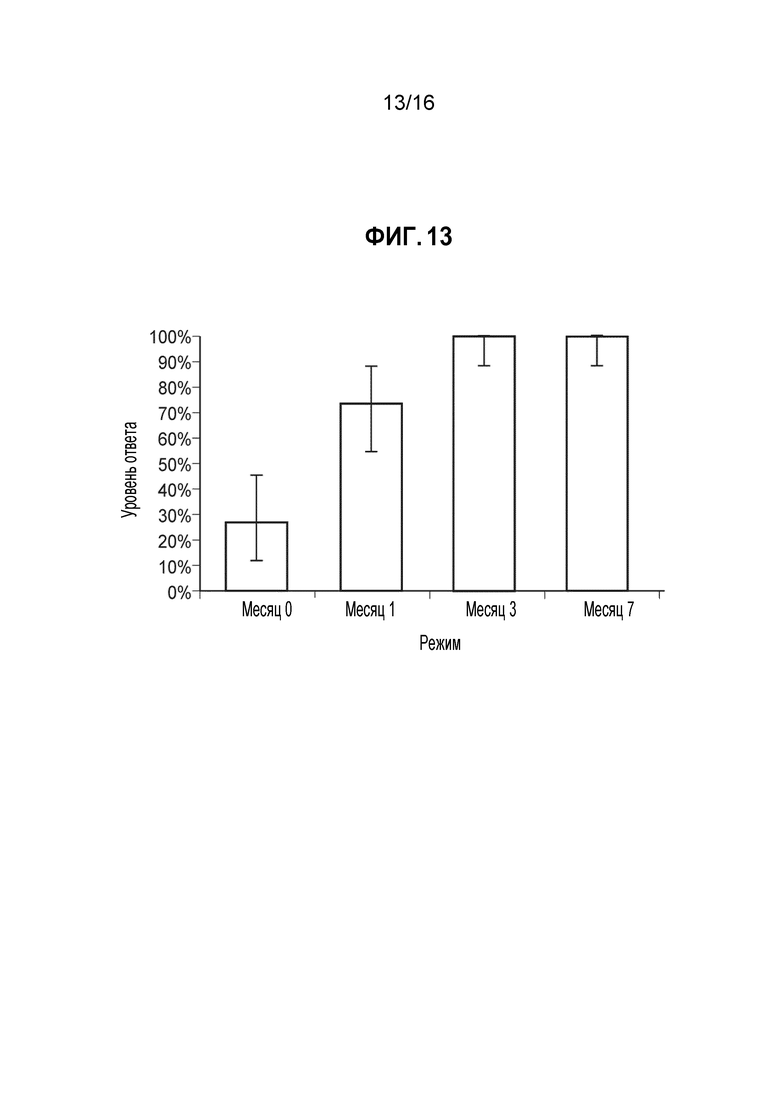
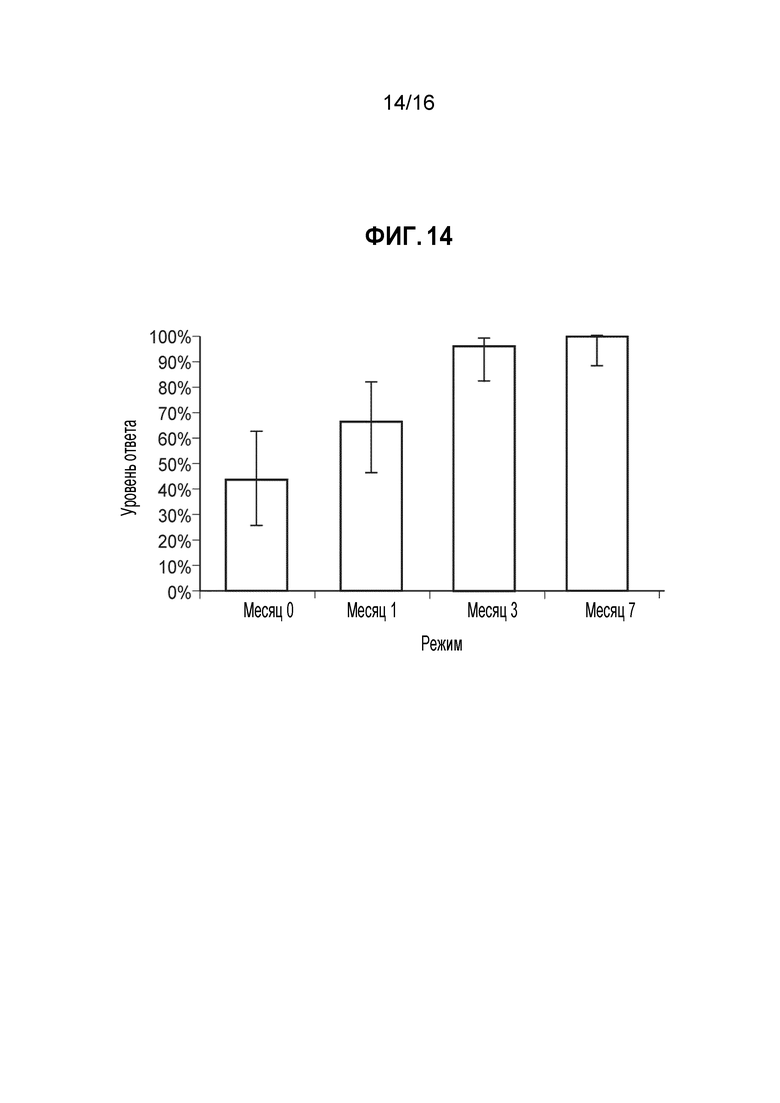
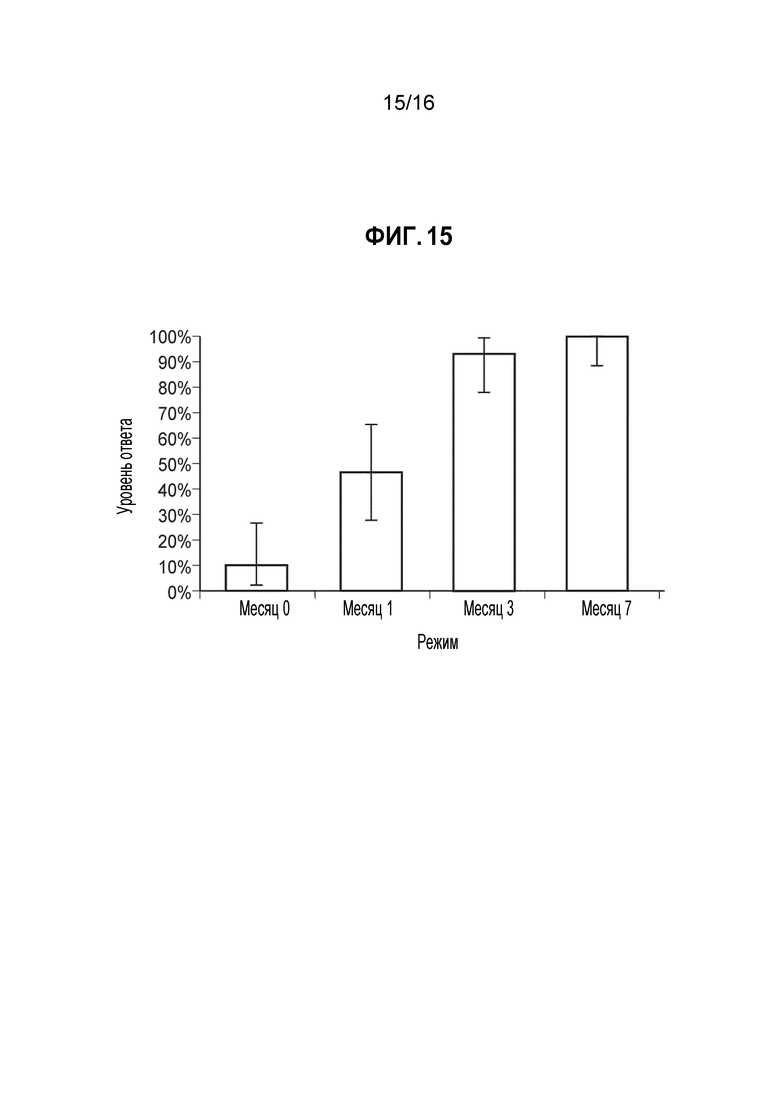
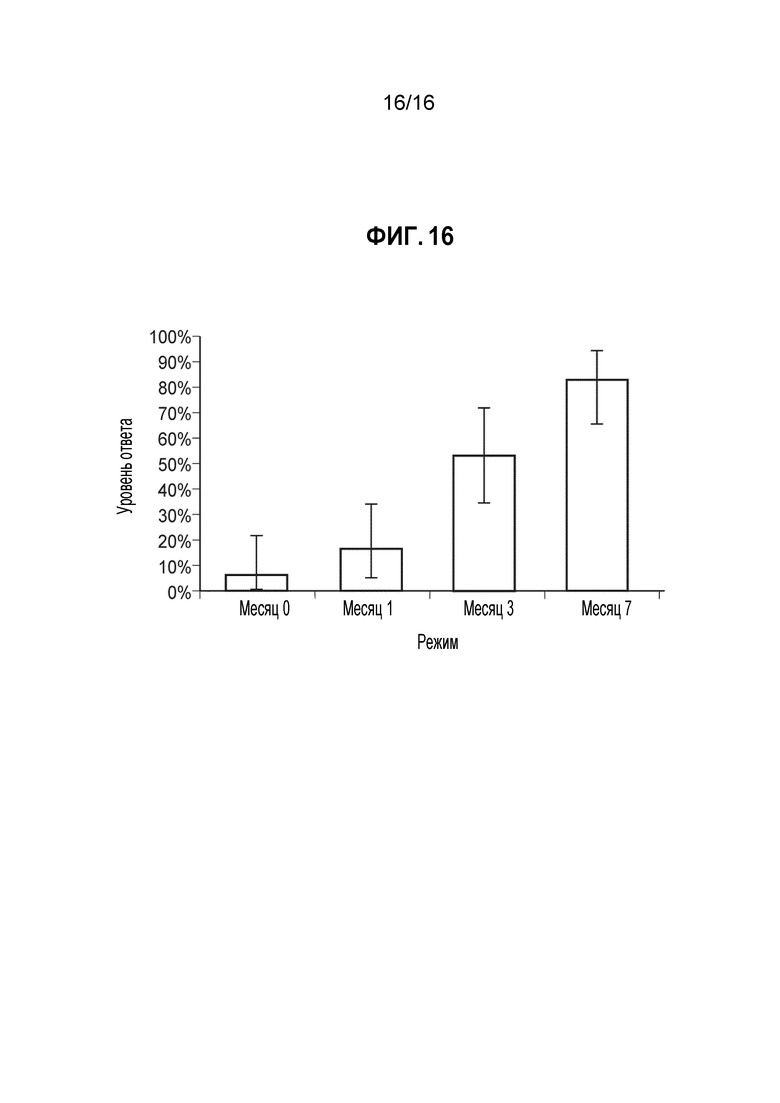
Изобретение относится к биотехнологии и представляет собой иммуногенную композицию, способную вызывать иммунный ответ против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W и Neisseria meningitidis серологической группы Y у человека, содержащую: а) жидкую композицию, содержащую: (i) первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; и (ii) второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2, и алюминий; и b) лиофилизированную композицию, содержащую: i) капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с линкером дигидрозидом адипиновой кислоты (ADH) посредством тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован со столбнячным токсоидом (ТТ) посредством карбодиимидного химического метода (конъюгат MenAAH-TT); ii)капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с ADH-линкером посредством тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован со столбнячным токсоидом (ТТ) посредством карбодиимидного химического метода (конъюгат MenCAH-TT); iii) капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), непосредственно конъюгированный со столбнячным токсоидом (ТТ) посредством тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-TT); и iv) капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), непосредственно конъюгированный со столбнячным токсоидом (ТТ) посредством тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-TT), где лиофилизированную композицию разводят жидкой композицией. Изобретение позволяет эффективно вызывать иммунный ответ против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W и Neisseria meningitidis серологической группы Y у человека. 2 н. и 13 з.п. ф-лы, 16 ил., 31 табл., 22 пр.
1. Иммуногенная композиция, способная вызывать иммунный ответ против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W и Neisseria meningitidis серологической группы Y у человека, содержащая: а) жидкую композицию, содержащую: (i) первый липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 1; и (ii) второй липидизированный полипептид, включающий аминокислотную последовательность, представленную в SEQ ID NO: 2, и алюминий; и b) лиофилизированную композицию, содержащую: i) капсулярный сахарид Neisseria meningitidis серологической группы A (MenA), конъюгированный с линкером дигидрозидом адипиновой кислоты (ADH) посредством тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован со столбнячным токсоидом (ТТ) посредством карбодиимидного химического метода (конъюгат MenAAH-TT); ii) капсулярный сахарид Neisseria meningitidis серологической группы С (MenС), конъюгированный с ADH-линкером посредством тетрафторбората 1-циано-4-диметиламинопиридиния, где указанный линкер конъюгирован со столбнячным токсоидом (ТТ) посредством карбодиимидного химического метода (конъюгат MenCAH-TT); iii) капсулярный сахарид Neisseria meningitidis серологической группы W135 (MenW), непосредственно конъюгированный со столбнячным токсоидом (ТТ) посредством тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenW-TT); и iv) капсулярный сахарид Neisseria meningitidis серологической группы Y (MenY), непосредственно конъюгированный со столбнячным токсоидом (ТТ) посредством тетрафторбората 1-циано-4-диметиламинопиридиния в отсутствие линкера (конъюгат MenY-TT), где лиофилизированную композицию разводят жидкой композицией.
2. Иммуногенная композиция по п. 1, где алюминий содержит фосфат алюминия.
3. Иммуногенная композиция по п. 1, где композиция также содержит полисорбат-80.
4. Иммуногенная композиция по п. 1, где композиция не содержит алюминий.
5. Иммуногенная композиция по п. 1, где первый полипептид и второй полипептид связываются с алюминием.
6. Иммуногенная композиция по п. 1, где композиция также содержит трис-HCl, хлорид натрия, сахарозу, L-гистидин, полисорбат 80 и фосфат алюминия.
7. Иммуногенная композиция по п. 1, где концентрация полипептидов, связанных с алюминием, в иммуногенной композиции снижалась максимум на 10% через 24 часа по сравнению с соответствующей концентрацией полипептидов, связанных с алюминием, в жидкой композиции перед разведением лиофилизированной композиции.
8. Иммуногенная композиция по п. 1, где концентрация конъюгата MenAAH-TT в иммуногенной композиции снижалась максимум на 10% через 24 часа по сравнению с концентрацией конъюгата MenAAH-TT в лиофилизированной композиции.
9. Иммуногенная композиция по п. 1, где концентрация конъюгата MenCAH-TT в иммуногенной композиции снижалась максимум на 10% через 24 часа по сравнению с концентрацией конъюгата MenCAH-TT в лиофилизированной композиции.
10. Иммуногенная композиция по п. 1, где концентрация конъюгата MenW-TT в иммуногенной композиции снижалась максимум на 10% через 24 часа по сравнению с концентрацией конъюгата MenW-TT в лиофилизированной композиции.
11. Иммуногенная композиция по п. 1, где концентрация конъюгата MenY-TT в иммуногенной композиции снижалась максимум на 10% через 24 часа по сравнению с концентрацией конъюгата MenY-TT в лиофилизированной композиции.
12. Способ индуцирования иммунного ответа против штамма Neisseria meningitidis серологической группы А, Neisseria meningitidis серологической группы С, Neisseria meningitidis серологической группы W и Neisseria meningitidis серологической группы Y у человека, где указанный способ включает введение человеку эффективного количества композиции по любому из пп. 1-11.
13. Способ по п. 12, где возраст пациента составляет от 12 до <18 месяцев или от 18 до <24 месяцев.
14. Способ по п. 12, где возраст пациента составляет от 18 до <24 месяцев.
15. Способ по п. 12, где возраст пациента составляет от 24 месяцев до <10 лет.
| WO 2013132452 A2, 12.09.2013 | |||
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ | 2013 |
|
RU2634405C2 |
| ВАКЦИННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ТРАНСФЕРРИН-СВЯЗЫВАЮЩИЙ БЕЛОК И HSF ИЗ ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ | 2003 |
|
RU2359696C2 |
Авторы
Даты
2022-09-23—Публикация
2018-01-30—Подача