ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Представленная заявка испрашивает приоритет по предварительной заявке на патент США №62/118,457, поданной 19 февраля 2015 года, и по предварительной заявке на патент США №62/280,212, поданной 19 января 2016 года. Все перечисленные выше заявки включены в настоящее описание посредством ссылки в полном их объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Представленное изобретение касается композиций Neisseria meningitidis и способов их получения.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Neisseria meningitidis представляет собой грамотрицательную инкапсулированную бактерию, которая может вызвать сепсис, менингит и смерть. N. meningitidis может быть классифицирован, по меньшей мере, на 12 серологических групп (включая серологические группы А, В, С, 29Е, Н, I, K, L, W-135, X, Y и Z) на основе химически и антигенно специфических полисахаридных капсул. Штаммы с пятью серологическими группами (А, В, С, Y и W135) являются ответственными за большинство заболеваний.
Менингококковый менингит представляет собой тяжелое заболевание, которое может убить ребенка и молодого взрослого человека в пределах нескольких часов, несмотря на доступность антибиотиков. Существует необходимость в улучшенных иммуногенных композициях против менингококковых серологических групп А, В, С, Y и W135, и/или X.
В настоящее время, еще не существует коммерчески доступной перекрестной вакцины или композиции, эффективной против широкого спектра MnB изолятов. Например, последние опубликованные результаты, относящиеся к лицензированной многокомпонентной композиции для защиты от заболеваний серологической группы В, не продемонстрировали непосредственный бактерицидный иммунный ответ против нескольких штаммов, экспрессирующих гетерологичные LP2086 (fHBP) варианты, по меньшей мере, у подростков. В большинстве случаев, последние опубликованные результаты, относящиеся к многокомпонентной композиции для защиты от заболеваний серологической группы В, показывают иммуногенность против LP2086 (fHBP) вариантов, которые являются гомологичными варианту LP2086 (fHBP) в многокомпонентной композиции. Соответственно, необходимой является перекрестная вакцина или композиция, эффективная против разнообразных MnB изолятов, поскольку определяется реальный спектр действия вакцины против панели разнообразных или гетерологичных менингококковых штаммов (например, представляющих различные географические регионы).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте, изобретение касается композиции, которая включает приблизительно 120 мкг/мл первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, 120 мкг/мл второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, с молярным соотношением полисорбата-80 к первому полипептиду - приблизительно 2,8, с молярным соотношением полисорбата-80 ко второму полипептиду - приблизительно 2,8, приблизительно 0,5 мг/мл алюминия, приблизительно 10 мМ гистидина, и приблизительно 150 мМ хлорида натрия. В одном варианте осуществления, первая доза составляет приблизительно 0,5 мл общего объема. В одном варианте осуществления, композиция индуцирует бактерицидный иммунный ответ против N. meningitidis серологической группы В. В одном варианте осуществления, композиция может индуцировать бактерицидный иммунный ответ против N. meningitidis серологической группы А, С, 29Е, Н, I, K, L, W-135, X, Y или Z. В одном варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше, чем 100% идентичность последовательности к SEQ ID NO: 1. В одном варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше, чем 100% идентичность последовательности к SEQ ID NO: 2. В одном варианте осуществления, первый полипептид имеет всего 258 аминокислот. В одном варианте осуществления, второй полипептид имеет всего 261 аминокислоту. В одном варианте осуществления, композиция индуцирует бактерицидный титр иммуноглобулина сыворотки против N. meningitidis серологической группы В, который является, по меньшей мере, в 2 раза выше у человека после получения первой дозы, чем бактерицидный титр иммуноглобулина сыворотки против N. meningitidis серологической группы В у человека до получения первой дозы, где увеличение бактерицидного титра измеряют в идентичных условиях в бактерицидном анализе сыворотки с использованием комплемента человека. В одном варианте осуществления, первый липидированный полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 1. В одном варианте осуществления, второй липидированный полипептид состоит из аминокислотной последовательности представленной SEQ ID NO: 2.
В другом аспекте, изобретение касается способ индуцирования иммунного ответа против Neisseria meningitidis серологической группы В у человека. Способ включает введение человеку первой дозы и второй дозы эффективного количества композиции, где указанная композиция включает 120 мкг/мл первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, 120 мкг/мл второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, с молярным соотношением полисорбата-80 к первому полипептиду 2,8, с молярным соотношением полисорбата-80 ко второму полипептиду - 2,8, 0,5 мг/мл алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия. В одном варианте осуществления, доза композиции имеет общий объем 0,5 мл. В одном варианте осуществления, человеку вводят не больше, чем две дозы композиции. В одном варианте осуществления, человеку дополнительно не вводят ревакцинирующую дозу композиции. В одном варианте осуществления, человеку вводят третью дозу композиции. В одном варианте осуществления, человеку дополнительно не вводят ревакцинирующую дозу композиции после третьей дозы. В одном варианте осуществления, человеку дополнительно не вводят четвертую дозу композиции. В одном варианте осуществления, третью дозу вводят человеку в пределах периода приблизительно 6 месяцев после первой дозы. В одном варианте осуществления, вторую дозу вводят, по меньшей мере, через 30 дней после первой дозы. В одном варианте осуществления, способ дополнительно включает введение третьей дозы композиции, при этом третью дозу вводят, по меньшей мере, через 90 дней после второй дозы. В одном варианте осуществления, композиция индуцирует бактерицидный титр иммуноглобулина сыворотки против N. meningitidis серологической группы В, который является, по меньшей мере, в 2 раза выше у человека после получения первой дозы, чем бактерицидный титр иммуноглобулина сыворотки против N. meningitidis серологической группы В у человека до получения первой дозы, который определяют в идентичных условиях в бактерицидном анализе сыворотки с использованием комплемента человека. В одном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства А N. meningitidis серологической группы В, который является гетерологичным к штамму N. meningitidis, экспрессирующему А05. В одном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В N. meningitidis серологической группы В, который является гетерологичным к штамму N. meningitidis, экспрессирующему В01. В одном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства А N. meningitidis серологической группы В, который является гетерологичным к штамму М98250771 N. meningitidis. В одном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В N. meningitidis серологической группы В, который является гетерологичным к штамму CDC1127 N. meningitidis. В предпочтительном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В N. meningitidis серологической группы В, который является гетерологичным к штамму CDC1573 N. meningitidis. В одном варианте осуществления, первый полипептид имеет всего 258 аминокислот. В одном варианте осуществления, второй полипептид имеет всего 261 аминокислоту. В одном варианте осуществления, первый липидированный полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 1. В одном варианте осуществления, второй липидированный полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 2.
В другом аспекте, изобретение касается композиции, которая включает 60 мкг первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, 60 мкг второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, с молярным соотношением полисорбата-80 к первому полипептиду - 2,8, с молярным соотношением полисорбата-80 ко второму полипептиду - 2,8, 0,5 мг/мл алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия, где композиция имеет общий объем приблизительно 0,5 мл.
В одном варианте осуществления, композиция индуцирует бактерицидный иммунный ответ против штамма подсемейства А N. meningitidis серологической группы В, который является гетерологичным к штамму N. meningitidis, экспрессирующему А05. В одном варианте осуществления, композиция индуцирует бактерицидный иммунный ответ против штамма подсемейства В N. meningitidis серологической группы В, который является гетерологичным к штамму N. meningitidis, экспрессирующему В01. В одном варианте осуществления, композиция индуцирует бактерицидный титр иммуноглобулина сыворотки, который является, по меньшей мере, в 2 раза выше у человека после получения первой дозы, чем бактерицидный титр иммуноглобулина сыворотки против N. meningitidis серологической группы В у человека до получения первой дозы, который определяют при идентичных условиях в бактерицидном анализе сыворотки с использованием комплемента человека. В одном варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше, чем 100% идентичность последовательности к SEQ ID NO: 1. В одном варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше, чем 100% идентичность последовательности к SEQ ID NO: 2. В одном варианте осуществления, первый полипептид имеет всего 258 аминокислот. В одном варианте осуществления, второй полипептид имеет всего 261 аминокислоту. В одном варианте осуществления, первый липидированный полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 1. В одном варианте осуществления, второй липидированный полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 2.
В следующем аспекте, изобретение касается способа индуцирования бактерицидного иммунного ответа против штамма подсемейства А N. meningitidis серологической группы В, и против штамма подсемейства В N. meningitidis серологической группы В у человека. Способ включает введение человеку эффективного количества композиции N. meningitidis rLP2086, где указанная композиция содержит а) первый липидированный полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 1, и b) второй липидированный полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 2, где способ дополнительно включает введение человеку, по меньшей мере, одной из следующих иммунологических композиций в пределах 24 часов после введения указанной композиции против N. meningitidis серологической группы В: (i) иммуногенной композиции против штамма Neisseria meningitidis серологической группы А, штамма Neisseria meningitidis серологической группы С, штамма Neisseria meningitidis серологической группы Y, и/или штамма Neisseria meningitidis серологической группы W135; (ii) иммуногенной композиции против дифтерии, столбняка та коклюша; (iii) иммуногенной композиции против вируса гепатита A; (iv) иммуногенной композиции против вируса папилломы человека; (v) иммуногенной композиции против дифтерии, столбняка, коклюша и полиомиелита; или (vi) какой-либо их комбинации. "Иммуногенный" касается способности индуцировать иммунный ответ.
В одном аспекте, изобретение касается способа индуцирования бактерицидного иммунного ответа против штамма подсемейства А N. meningitidis серологической группы В, и против штамма подсемейства В N. meningitidis серологической группы В у человека. Способ включает введение человеку эффективного количества композиции N. meningitidis rLP2086, где указанная композиция включает а) первый липидированный полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 1, и b) второй липидированный полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 2, где способ дополнительно включает сопутствующее введение человеку, по меньшей мере, одной из следующих дополнительных иммуногенных композиций: (i) иммуногенной композиции против штамма N. meningitidis серологической группы А, штамма N. meningitidis серологической группы С, штамма N. meningitidis серологической группы Y и/или штамма N. meningitidis серологической группы W135; (ii) иммуногенной композиции против дифтерии, столбняка, и коклюша; (iii) иммуногенной композиции против вируса гепатита А; (iv) иммуногенной композиции против вируса папилломы человека; (v) иммуногенной композиции против дифтерии, столбняка, коклюша и полиомиелита; или (vi) какой-либо их комбинации.
В другом аспекте, изобретение касается применения эффективного количества композиции N. meningitidis rLP2086 и, по меньшей мере, одной дополнительной иммуногенной композиции, сопутствующей для индуцирования бактерицидного иммунного ответа против штамма подсемейства А N. meningitidis серологической группы В, и против штамма подсемейства В N. meningitidis серологической группы В у человека, где указанная композиция N. meningitidis rLP2086 содержит а) первый липидированный полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 1, и b) второй липидированный полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 2, где, по меньшей мере, одна дополнительная иммуногенная композиция представляет собой: (i) иммуногенную композицию против штамма Neisseria meningitidis серологической группы А, штамма Neisseria meningitidis серологической группы С, штамма Neisseria meningitidis серологической группы Y, и/или штамма Neisseria meningitidis серологической группы W135; (ii) иммуногенной композиции против дифтерии, столбняка и коклюша; (iii) иммуногенной композиции против вируса гепатита A; (iv) иммуногенной композиции против вируса папилломы человека; (v) иммуногенной композиции против дифтерии, столбняка, коклюша и полиомиелита; или (vi) какой-либо их комбинации.
В одном варианте осуществления, композиция N. meningitidis rLP2086 дополнительно включает полисорбат-80. В одном варианте осуществления, композиция N. meningitidis rLP2086 дополнительно включает алюминий. В одном варианте осуществления, композиция N. meningitidis rLP2086 дополнительно включает гистидиновый буфер. В одном варианте осуществления, композиция N. meningitidis rLP2086 дополнительно включает хлорид натрия. В одном варианте осуществления, композиция N. meningitidis rLP2086 включает приблизительно 120 мкг/мл первого полипептида; приблизительно 120 мкг/мл второго полипептида; молярное соотношение полисорбата-80 - приблизительно 2,8; приблизительно 0,5 мг/мл алюминия; приблизительно 10 мМ гистидина; и приблизительно 150 мМ хлорида натрия. В одном варианте осуществления, композиция N. meningitidis rLP2086 включает приблизительно 60 мкг первого полипептида; приблизительно 60 мкг второго полипептида; приблизительно 18 мкг полисорбата-80; приблизительно 250 мкг алюминия; приблизительно 780 мкг гистидина; и приблизительно 4380 мкг хлорида натрия.
В одном варианте осуществления, композиция N. meningitidis rLP2086 индуцирует бактерицидный иммунный ответ против, по меньшей мере, одного из штаммов N. meningitidis серологической группы В: А22, А56, В24, В44, или какой-либо их комбинации. В одном варианте осуществления, композиция N. meningitidis rLP2086 индуцирует бактерицидный иммунный ответ против N. meningitidis серологической группы В - А22. В одном варианте осуществления, композиция N. meningitidis rLP2086 индуцирует бактерицидный иммунный ответ против N. meningitidis серологической группы В - В24. В одном варианте осуществления, композиция N. meningitidis rLP2086 индуцирует бактерицидный иммунный ответ против, по меньшей мере, одного из штаммов N. meningitidis серологической группы В: В24, В16, В44, А22, В03, В09, А12, А19, А05, А07, В153, или какой-либо их комбинации.
В одном варианте осуществления, способ дополнительно включает индуцирование иммунного ответа против, по меньшей мере, одного из штаммов Neisseria meningitidis серологической группы А, штамма Neisseria meningitidis серологической группы С, штамма Neisseria meningitidis серологической группы Y, и/или штамма Neisseria meningitidis серологической группы W135, или какой-либо их комбинации.
В одном варианте осуществления, способ включает введение человеку дополнительной иммуногенной композиции, которая включает смесь из четырех различных и отдельно полученных белково-капсульных полисахаридных конъюгатов, где первый конъюгат включает очищенный N. meningitidis капсульный полисахарид серологической группы W-135, конъюгированный с белком-носителем, второй конъюгат включает очищенный N. meningitidis капсульный полисахарид серологической группы Y, конъюгированный с белком-носителем, третий конъюгат включает очищенный N. meningitidis капсульный полисахарид серологической группы А, конъюгированный с очищенным белком-носителем, и четвертый конъюгат включает очищенный N. meningitidis капсульный полисахарид серологической группы С, конъюгированный с белком-носителем, где белок-носитель выбирают из группы, состоящей из дифтерийного анатоксина, CRM197, и столбнячного анатоксина. В одном варианте осуществления, белок-носитель представляет собой дифтерийный анатоксин.
В одном варианте осуществления, иммуногенная композиция представляет собой жидкую композицию.
В одном варианте осуществления, иммуногенная композиция не является лиофилизированной.
В одном варианте осуществления, способ дополнительно включает индуцирование иммунного ответа против, по меньшей мере, одного из типов вируса папилломы человека - 6, 11, 16, 18, или какой-либо их комбинации. В одном варианте осуществления, способ дополнительно включает индуцирование иммунного ответа против, по меньшей мере, одного из дифтерии, столбняка, коклюша, полиомиелита, или какой-либо их комбинации у человека.
В одном варианте осуществления, эффективное количество композиции N. meningitidis rLP2086 включает одну дозу. В одном варианте осуществления, эффективное количество композиции N. meningitidis rLP2086 включает две дозы. В одном варианте осуществления, эффективное количество композиции N. meningitidis rLP2086 дополнительно включает ревакцинирующую дозу. В одном варианте осуществления, эффективное количество композиции N. meningitidis композиция rLP2086 включает не больше трех доз.
В одном варианте осуществления, композицию N. meningitidis rLP2086 вводят в пределах 24 часов после введения дополнительной композиции. В одном варианте осуществления, композицию N. meningitidis rLP2086 одновременно вводят с дополнительной композицией. В одном варианте осуществления, первую дозу композиции N. meningitidis rLP2086 сопутствующе вводят с дополнительной композицией. В одном варианте осуществления, первую дозу композиции N. meningitidis rLP2086 одновременно вводят с дополнительной композицией.
КОРОТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1 - Доля субъектов, достигающих титров hSBA ≥ LLOQ. hSBA = бактерицидный анализ сыворотки с использованием комплемента человека; LLOQ = нижний предел количественного определения.
ФИГ. 2 - Процент субъектов, достигающих 4х повышение титров hSBA к штаммам вспышки инфекции Princeton University и UCSB штаммам вспышки инфекции индивидуальных субъектов-людей после иммунизации rLP2086 (исследование В1971012 - описанное в примере 5, примере 6). Образцы сыворотки от девяти субъектов-людей, иммунизированных бивалентным rLP2086 в клиническом исследовании В1971012, оценивали в экспериментальной разработке hSBA с использованием MnB штаммов вспышки инфекции из Princeton University и из UCSB. Смотрите пример 9.
ИДЕНТИФИКАТОРЫ ПОСЛЕДОВАТЕЛЬНОСТИ
SEQ ID NO: 1 представляет аминокислотную последовательность для рекомбинантного полипептидного антигена А05 варианта 2086 N. meningitidis, серологической группы В.
SEQ ID NO: 2 представляет аминокислотную последовательность для рекомбинантного полипептидного антигена В01 варианта 2086 N. meningitidis, серологической группы В.
SEQ ID NO: 3 представляет аминокислотные остатки в положениях 1-4 из SEQ ID NO: 1 и SEQID NO: 2.
SEQ ID NO: 4 представляет аминокислотную последовательность N-конца рекомбинантного полипептидного антигена (А05) LP2086 полипептида (rLP2086) подсемейства A Neisserial.
SEQ ID NO: 5 представляет аминокислотную последовательность N-конца полипептидного антигена (А05) LP2086 М98250771 полипептида подсемейства А Neisserial.
SEQ ID NO: 6 представляет аминокислотную последовательность для 2086 варианта В153 N. meningitidis, серологической группы В.
SEQ ID NO: 7 представляет аминокислотную последовательность для 2086 варианта А04 N. meningitidis, серологической группы В.
SEQ ID NO: 8 представляет аминокислотную последовательность для 2086 варианта А05 N. meningitidis, серологической группы В.
SEQ ID NO: 9 представляет аминокислотную последовательность для В 2086 варианта А12 N. meningitidis, серологической группы.
SEQ ID NO: 10 представляет аминокислотную последовательность для 2086 варианта А22 N. meningitidis, серологической группы В.
SEQ ID NO: 11 представляет аминокислотную последовательность для 2086 варианта В02 N. meningitidis, серологической группы В.
SEQ ID NO: 12 представляет аминокислотную последовательность для 2086 варианта В03 N. meningitidis, серологической группы В.
SEQ ID NO: 13 представляет аминокислотную последовательность для 2086 варианта В09 N. meningitidis, серологической группы В.
SEQ ID NO: 14 представляет аминокислотную последовательность для 2086 варианта В22 N. meningitidis, серологической группы В.
SEQ ID NO: 15 представляет аминокислотную последовательность для 2086 варианта В24 N. meningitidis, серологической группы В.
SEQ ID NO: 16 представляет аминокислотную последовательность для 2086 варианта В44 N. meningitidis, серологической группы В.
SEQ ID NO: 17 представляет аминокислотную последовательность для 2086 варианта В16 N. meningitidis, серологической группы В.
SEQ ID NO: 18 представляет аминокислотную последовательность для 2086 варианта А07 N. meningitidis, серологической группы В.
SEQ ID NO: 19 представляет аминокислотную последовательность для 2086 вариантам 9 N. meningitidis, серологической группы В.
SEQ ID NO: 20 представляет аминокислотную последовательность для 2086 варианта А06 N. meningitidis, серологической группы В.
SEQ ID NO: 21 представляет аминокислотную последовательность для 2086 варианта А15 N. meningitidis, серологической группы В.
SEQ ID NO: 22 представляет аминокислотную последовательность для 2086 варианта А29 N. meningitidis, серологической группы В.
SEQ ID NO: 23 представляет аминокислотную последовательность для 2086 варианта В15 N. meningitidis, серологической группы В.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы представленного изобретения неожиданно обнаружили, что композиция rLP2086 включает первый липидированный полипептид, включающий аминокислотную последовательность, представленную SEQ ID NO: 1, и второй липидированный полипептид, включающую аминокислотную последовательность, представленную SEQ ID NO: 2. Композиция имеет приемлемый профиль безопасности у людей, и композиция неожиданно вызывает широко перекрестнореагирующий бактерицидный иммунный ответ у людей, по меньшей мере, против больше, чем двух различных штаммов Neisseria meningitidis.
Авторы представленного изобретения, кроме того, обнаружили, что устойчивые иммунные ответы против N. meningitidis серологической группы В были получены даже после совместного введения композиции rLP2086 и, по меньшей мере, одной из следующих иммунологических композиций: (i) иммуногенной композиции против штамма N. meningitidis серологической группы А, штамма N. meningitidis серологической группы С, штамма N. meningitidis серологической группы Y, и/или штамма N. meningitidis серологической группы W135; (ii) иммуногенной композиции против дифтерии, столбняка и коклюша; (iii) иммуногенной композиции против вируса гепатита A; (iv) иммуногенной композиции против вируса папилломы человека; (v) иммуногенной композиции против дифтерии, столбняка, коклюша и полиомиелита; или (vi) какой-либо их комбинации.
Совместное введение, по меньшей мере, композиции rLP2086 и конъюгатная вакцина полисахарида менингококковых групп А, С, Y и W-135 (MCV4) также неожиданно генерировала иммунный ответ, по меньшей мере, против менингококковых групп А, С, Y и W-135 в дополнение к менингококковой группе В. Иммунные ответы против менингококковых групп А, С, Y и W-135 после совместного введения композиции rLP2086 и композиции MCV4 были не хуже по сравнению с иммунным ответом, генерируемым введением композиции MCV4 в отсутствие композиции rLP2086.
Совместное введение, по меньшей мере, композиции rLP2086, конъюгатной вакцины полисахарида менингококковых групп А, С, Y и W-135 (MCV4), и вакцины против столбняка, дифтерии и ацеллюлярного коклюша (Tdap) также неожиданно генерировало иммунный ответ, по меньшей мере, против столбняка, дифтерии и ацеллюлярного коклюша в дополнение к менингококковым группам А, С, Y и W-135 и к менингококковой группе В. Иммунные ответы против Tdap и менингококковых групп А, С, Y и W-135 после совместного введения композиции rLP2086, композиции MCV4 и композиции Tdap были не хуже по сравнению с иммунным ответом, генерируемым введением композиции MCV4 и композиции Tdap в отсутствие композиции rLP2086.
Кроме того, авторы представленного изобретения обнаружили, что композиция rLP2086 может быть безопасно введена людям одновременно с иммуногенной композицией против вируса гепатита А.
Авторы представленного изобретения, кроме того, обнаружили что 2-дозный режим введения и 3-дозный режим введения неожиданно дали титры hSBA ≥ 8 против исследуемых штаммов N. meningitidis серологической группы В, с вакциной гетерологичной LP2086 (фактор Н связывания белка (fHBP)) подсемейств А и В у значительной части субъектов-людей. 3-дозовый режим введения может обеспечить более широкую защиту у людей от различных клинических штаммов MnB по сравнению с 2-дозовым режимом введения.
Авторы представленного изобретения также неожиданно обнаружили, что устойчивые иммунные ответы против вируса папилломы человека и N. meningitidis серологической группы В были получены после совместного введения композиции rLP2086 и четырехвалентнойной иммуногенной композиции против вируса папилломы человека (HPV4). Например, совместное введение композиции rLP2086 и HPV4 композиции генерировало иммунный ответ, по меньшей мере, против N. meningitidis серологической группы В исследуемых штаммов, экспрессирующих fHBP, которые являются гетерологичными к тем fHBP, которые находятся в композиции rLP2086. Такие гетерологичные исследуемые штаммы включают немутантного типа штаммы N. meningitidis серологической группы В, которые экспрессируют А22 fHBP, A56 fHBP, B24 fHBP, или В44 fHBP, каждый из которых является гетерологичным к fHBP в композиции rLP2086. Смотрите WO/2012/032489, WO/2013/132452, патентную публикацию США № US 20120093852 и патентную публикацию США № US 20130243807, которые описывают вариантные fHBP белки, включая А22 fHBP, A56 fHBP, B24 fHBP, и В44 fHBP, среди прочего. Каждая из данных ссылок включена в качестве ссылки в данный документ во всей своей полноте. Совместное введение также неожиданно генерировало иммунный ответ, по меньшей мере, против HPV типов 6, 11, 16, и/или 18. Иммунные ответы против типов HPV после совместного введения композиции rLP2086 и композиции HPV4 были не хуже по сравнению с иммунным ответом, генерируемым за счет введения композиции HPV4 при отсутствии композиции rLP2086.
Кроме того, авторы представленного изобретения неожиданно обнаружили, что устойчивые иммунные ответы против дифтерии, столбняка, коклюша и полиомиелита и N. meningitidis серологической группы В были получены после совместного введения композиции rLP2086 и иммуногенной композиции против дифтерии, столбняка, коклюша и полиомиелита. Например, совместное введение композиции rLP2086 и композиции REPEVAX генерировало иммунный ответ, по меньшей мере, против исследованных штаммов N. meningitidis серологической группы В, экспрессирующих fHBP, которые являются гетерологичными к тем fHBP, которые находятся в композиции rLP2086. Совместное введение также неожиданно генерировало иммунный ответ, по меньшей мере, против 9 антигенов в REPEVAX: дифтерии, столбняка, коклюшного анатоксина, коклюшного филаментного гемагглютинина, коклюшного пертактина, коклюшных фимбриальных агглютиногенов типа 2+3, полиовируса типа 1, полиовируса типа 2, полиовируса типа 3. Иммунные ответы против REPEVAX антигенов после совместного введения композиции rLP2086 и композиции REPEVAX были не хуже по сравнению с иммунным ответом, генерированным за счет введения композиции REPEVAX в отсутствие композиции rLP2086.
КОМПОЗИЦИЯ И ВАКЦИНА
В одном аспекте, изобретение касается композиции против Neisseria meningitidis. Композиция включает первый липидированный полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 1, и второй липидированный полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 2.
Авторы представленного изобретения неожиданно обнаружили один полипептидный компонент N. meningitidis, который индуцирует эффективный широко защитный иммунный ответ против многочисленных штаммов серологической группы В N. meningitidis. Соответственно, в одном варианте осуществления, композиция не включает слитый белок. В одном варианте осуществления, композиция не включает химерный белок. В одном варианте осуществления, композиция не включает гибридный белок. В одном варианте осуществления, композиция, кроме того, не включает пептидный фрагмент. В другом варианте осуществления, композиция, кроме того, не включает полипептид Neisserial, который не является fHBP. Например, в одном варианте осуществления, композиция не включает PorA белок. В другом варианте осуществления, композиция не включает NadA белок. В другом варианте осуществления, композиция кроме того, не включает связывающий гепарин антиген Neisserial (NHBA). В другом варианте осуществления, композиция, кроме того, не включает везикулу внешней мембраны Neisserial (OMV). В предпочтительном варианте осуществления, композиция, кроме того, не включает антигены, которые не являются первым полипептидом и вторым полипептидом.
В другом аспекте, авторы представленного изобретения неожиданно обнаружили, что полипептидные антигены, полученные не больше, чем из двух штаммов серологической группы В N. meningitidis, индуцируют иммунный ответ против многочисленных штаммов серологической группы В N. meningitidis. Соответственно, в одном варианте осуществления, композиция, кроме того, не включает полипептид, который не получают из штамма М98250771 подсемейства А серологической группы В N. meningitidis и/или штамма CDC1573 подсемейства В серологической группы В N. meningitidis.
В одном варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше чем 100% идентичность последовательности к SEQ ID NO: 1. В другом варианте осуществления, композиция, кроме того, не включает полипептид, имеющий меньше чем 100% идентичность последовательности к SEQ ID NO: 2. Например, композиция, кроме того, не включает полипептид, имеющий меньше чем 100% идентичность последовательности к полной длине SEQ ID NO: 1 и/или SEQ ID NO: 2.
В одном варианте осуществления, композиция дополнительно включает полисорбат-80, алюминий, гистидин и хлорид натрия. В одном варианте осуществления, композиция включает приблизительно 60 мкг первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, приблизительно 60 мкг второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, с молярным соотношением полисорбата-80 к каждому полипептиду - 2,8, 0,5 мг алюминия/мл в виде фосфата алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия, где композиция предпочтительно имеет общий объем приблизительно 0,5 мл.
В другом аспекте, композиция включает приблизительно 120 мкг/мл первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, приблизительно 120 мкг/мл второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, с молярным соотношением полисорбата-80 к каждому полипептиду - 2,8, 0,5 мг алюминия/мл в виде фосфата алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия.
В следующем аспекте, композиция включает а) 60 мкг первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1; b) 60 мкг второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2; с) 18 мкг полисорбата-80; d) 250 мкг алюминия; е) 780 мкг гистидина, и; f) 4380 мкг хлорида натрия.
В иллюстративном варианте осуществления, композиция включает приблизительно 60 мкг первого липидированного полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 1, приблизительно 60 мкг второго липидированного полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID NO: 2, с молярным соотношением полисорбата-80 к первому липидированному полипептиду и ко второму липидированному полипептиду - 2,8, 0,5 мг/мл фосфата алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия, где композиция имеет общий объем приблизительно 0,5 мл. В иллюстративном варианте осуществления, композиция представляет собой стерильную изотоническую буферную жидкую суспензию. В иллюстративном варианте осуществления, композиция имеет рН 6,0. В иллюстративном варианте осуществления, первый полипептид и второй полипептид являются адсорбированными на алюминии.
В одном варианте осуществления, композиция имеет общий объем приблизительно 0,5 мл. В одном варианте осуществления, первая доза композиции имеет общий объем приблизительно 0,5 мл. "Первая доза" относится к дозе композиции, которую вводят в день 0. "Вторая доза" или "третья доза" относится к дозе композиции, которую вводят после первой дозы, которая может или не может составлять такое же количество, что и первая доза.
Композиция является иммуногенной после введения первой дозы человеку. В одном варианте осуществления, первая доза составляет приблизительно 0,5 мл в общем объеме.
Композиция индуцирует бактерицидный титр иммуноглобулина сыворотки против N. meningitidis серологической группы В, который является, по меньшей мере, больше чем в 1 раз выше, предпочтительно, по меньшей мере, в 2 раза выше, у человека после получения первой дозы, чем бактерицидный титр иммуноглобулина сыворотки против N. meningitidis серологической группы В у человека до получения первой дозы, при определении в идентичных условиях в бактерицидном анализе сыворотки с использованием комплемента человека (hSBA).
В предпочтительном варианте осуществления бактерицидный титр или бактерицидный иммунный ответ является против штамма подсемейства А серологической группы В N. meningitidis и против штамма подсемейства В серологической группы В N. meningitidis. Наиболее предпочтительно, бактерицидный титр или бактерицидный иммунный ответ является, по меньшей мере, против штамма В01, подсемейства В, серологической группы В, N. meningitidis.
В другом предпочтительном варианте осуществления, бактерицидный титр или бактерицидный иммунный ответ против является, по меньшей мере, против штамма В24, подсемейства В, серологической группы В, N. meningitidis. В другом предпочтительном варианте осуществления, бактерицидный титр или бактерицидный иммунный ответ против является, по меньшей мере, против штамма А22, подсемейства А, серологической группы В, N. meningitidis.
В одном варианте осуществления, композиция индуцирует бактерицидный титр иммуноглобулина сыворотки против N. meningitidis серологической группы В, который является, по меньшей мере, больше чем в 1 раз, такой как, например, по меньшей мере 1,01 раз, 1,1 раз, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз выше у человека после получения дозы композиции, чем бактерицидный титр иммуноглобулина сыворотки против N. meningitidis серологической группы В у человека до получения указанной дозы, при определении в идентичных условиях в бактерицидном анализе сыворотки с использованием комплемента человека.
В одном варианте осуществления, композиция представляет собой иммуногенную композицию для человека. В другом варианте осуществления, композиция представляет собой вакцину. "Вакцина" относится к композиции, которая включает антиген, который содержит, по меньшей мере, один эпитоп, который индуцирует иммунный ответ, который является специфическим для такого антигена. Вакцина может быть введена непосредственно субъекту с использованием подкожного, перорального, ороназального или интраназального путей введения. Предпочтительно, вакцину вводят внутримышечно. В одном варианте осуществления, композиция представляет собой вакцину для человека. В одном варианте осуществления, композиция представляет собой иммуногенную композицию против N. meningitidis.
В одном варианте осуществления, композиция представляет собой жидкую композицию. В предпочтительном варианте осуществления, композиция представляет собой жидкую суспензионную композицию. В другом предпочтительном варианте осуществления, композиция не является лиофилизированной.
ПЕРВЫЙ ПОЛИПЕПТИД
В одном варианте осуществления, композиция включает первый полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 1. В одном предпочтительном варианте осуществления, композиция включает приблизительно 60 мкг первого полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, где композиция предпочтительно имеет общий объем 0,5 мл. В другом варианте осуществления, композиция включает приблизительно 120 мкг/мл первого полипептид, включающего аминокислотную последовательность, представленную SEQ ID NO: 1. Полипептид представляет собой модифицированный фактор Н связывающий белок (fHBP) из штамма М98250771 N. meningitidis. Описание fHBP раскрывается в WO 2012032489 и публикации патента США US 2012/0093852, каждая из которых является включенной в виде ссылки во всей своей полноте. Полипептид представляет собой N-терминально липидированный тремя предоминирующими жирными кислотами С16:0, С16:1, и С18:1, ковалентно связанными в трех положениях полипептида. Первый полипептид включает всего 258 аминокислот.
Первый полипептид включает две модификации, введенные в N-терминальную область полипептида, по сравнению с соответствующим немутантным типом последовательности из штамма М98250771 N. meningitidis. Глицин во втором положении добавляется как последствие введения сайта клонирования. Вторая модификация включает делецию четырех аминокислот. Соответственно, в одном варианте осуществления, первый полипептид включает C-G-S-S последовательность (SEQ ID NO: 3) на N-конце. Смотрите SEQ ID NO: 1, первые четыре аминокислотные остатки.
N-терминальные различия между первой полипептидной последовательностью и немутантным типом последовательности Neisserial показаны ниже. Соответственно, в одном варианте осуществления, первый полипептид включает, по меньшей мере, первый 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, или больше аминокислотных остатков аминокислотной последовательности, представленной SEQ ID NO: 1. Предпочтительно, первый полипептид включает, по меньшей мере, первые 4, более предпочтительно, по меньшей мере, первые 6, и наиболее предпочтительно, по меньшей мере, первые 8 аминокислотных остатков SEQ ID NO: 1.
Сравнение прогнозированных N-терминальных последовательностей рекомбинантного полипептида и полипептида LP2086 подсемейства A Neisserial rLP2086 М98250771  Neisserial LP2086 М98250771
Neisserial LP2086 М98250771 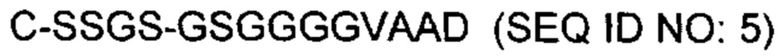 >A05 (SEQ ID NO: 1)
>A05 (SEQ ID NO: 1)

В одном варианте осуществления, первый полипептид включает аминокислотную последовательность, представленную SEQ ID NO: 1. В одном варианте осуществления, первый полипептид имеет всего 258 аминокислот. В одном варианте осуществления, первый полипептид не включает аминокислотную последовательность, имеющую меньше чем 100% идентичность последовательности к SEQ ID NO: 1. В другом варианте осуществления, первый полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 1. В другом варианте осуществления, первый полипептид включает аминокислотную последовательность KDN. Смотрите, например, аминокислотные остатки 73-75 из SEQ ID NO: 1. В другом варианте осуществления, первый полипептид включает аминокислотную последовательность, представленную SEQ ID NO: 3 на N-конце полипептида. В другом варианте осуществления, первый полипептид включает аминокислотную последовательность, представленную SEQ ID NO: 4 на N-конце полипептида.
В предпочтительном варианте осуществления, первый полипептид легко экспрессируется в рекомбинантной клетке-хозяине с использованием стандартных методик, известных в данной области с уровня техники. В другом предпочтительном варианте осуществления, первый полипептид включает бактерицидный эпитоп в N- и/или С-домене SEQ ID NO: 1. В одном варианте осуществления, первый полипептид включает, по меньшей мере, первые 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной SEQ ID NO: 1. Предпочтительно, первый полипептид включает, по меньшей мере, первые 2, более предпочтительно, по меньшей мере, первые 4, и наиболее предпочтительно, по меньшей мере, первые 8 аминокислотных остатков SEQ ID NO: 1.
В другом варианте осуществления, первый полипептид включает, по меньшей мере, последние 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной SEQ ID NO: 1.
ВТОРОЙ ПОЛИПЕПТИД
В одном варианте осуществления, композиция включает второй полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 2. В одном предпочтительном варианте осуществления, композиция включает приблизительно 60 мкг второго полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, где композиция предпочтительно имеет общий объем 0,5 мл. В другом варианте осуществления, композиция включает 120 мкг/мл второго полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2. Полипептид представляет собой фактор Н связывающий белок (fHBP) из штамма CDC1573 N. meningitidis. Описание fHBP раскрывается в WO 2012032489 и публикации патента США US 2012/0093852, каждая из которых включена в виде ссылки во всей своей полноте. Полипептид представляет собой N-терминально липидированный тремя предоминирующими жирными кислотами С16:0, С16:1, и С18:1, ковалентно связанными в трех положениях полипептида. Второй полипептид включает всего 261 аминокислоту. В одном варианте осуществления, второй полипептид включает C-G-S-S последовательность (SEQ ID NO: 3) на N-конце. Смотрите первые четыре аминокислотные остатки SEQ ID NO: 2.
>В01 (SEQ ID NO: 2)

В одном варианте осуществления, второй полипептид включает аминокислотную последовательность, представленную SEQ ID NO: 2. В одном варианте осуществления, второй полипептид имеет всего 261 аминокислоту. В одном варианте осуществления, второй полипептид состоит из аминокислотной последовательности, представленной SEQ ID NO: 2. В другом варианте осуществления, второй полипептид дополнительно не включает полипептид, имеющий меньше чем 100% идентичность последовательности к SEQ ID NO: 2. В предпочтительном варианте осуществления, первый полипептид и второй полипептид включает C-G-S-S (SEQ ID NO: 3) последовательность на N-конце соответствующего полипептида.
В предпочтительном варианте осуществления, второй полипептид легко экспрессируется в рекомбинантной клетке-хозяине с использованием стандартных методик, известных в данной области с уровня техники. В другом предпочтительном варианте осуществления, второй полипептид включает бактерицидный эпитоп в N- и/или С-домене SEQ ID NO: 2. В одном варианте осуществления, второй полипептид включает, по меньшей мере, первые 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной SEQ ID NO: 2. Предпочтительно, второй полипептид включает, по меньшей мере, первые 2, более предпочтительно, по меньшей мере, первые 4, или наиболее предпочтительно, по меньшей мере, первые 8 аминокислотных остатков из SEQ ID NO: 2.
В другом варианте осуществления, первый полипептид включает, по меньшей мере, последние 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100 аминокислотных остатков аминокислотной последовательности, представленной SEQ ID NO: 2.
ПОЛИСОРБАТ-80
Полисорбат-80 (PS-80) представляет собой неионное поверхностно-активное вещество. Исследование ускоренной стабильности с использованием анализа эффективности in vitro на основе моноклонального антитела продемонстрировало нестабильность белка подсемейства В при более высоких молярных соотношениях PS-80 к белку rLP2086 MnB в конечном препарате. Дополнительные эксперименты с различными соотношениями PS-80 продемонстрировали, что оптимальное молярное соотношение PS-80 к белку rLP2086 MnB составляет приблизительно 2,8±1,4 для того, чтобы поддерживать эффективность.
Концентрация PS-80 в композиции зависит от молярного соотношения PS-80 к полипептиду. В одном варианте осуществления, композиция включает молярное соотношение PS-80 к первому полипептиду и ко второму полипептиду 2,8±1,4. В одном варианте осуществления, композиция включает молярное соотношение PS-80 к первому полипептиду и ко второму полипептиду 2,8±1,1. В одном варианте осуществления, композиция включает молярное соотношение, по меньшей мере, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2 или 3,3 PS-80 к полипептиду. Предпочтительно, композиция включает молярное соотношение 2,8 PS-80 к полипептиду.
Молярное соотношение PS-80 к полипептиду определяют с помощью расчетов по измеренной концентрации PS-80 и измеренной общей концентрации полипептида, в которых оба значения выражаются в молях. Например, молярное соотношение PS-80 к белку определяют с помощью расчетов по измеренной концентрации PS-80 (например, с использованием обращено-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ)) к измеренной общей концентрации белка (например, с использованием ионно-обменной высокоэффективной жидкостной хроматографии (ИО-ВЭЖХ)) в конечной субстанции лекарственного средства, где оба значения выражаются в молях.
ОФ-ВЭЖХ используют, чтобы количественно определить концентрацию полисорбата 80 в вакцинных препаратах. Концентрацию детергента определяют с помощью омыления фрагмента жирной кислоты; полисорбат 80 превращают в свободную олеиновую кислоту путем щелочного гидролиза при 40°С. Образец разделяют с помощью ОФ-ВЭЖХ, используя колонку С18, и количественно определяют, используя УФ детектор на длине волны 200 нм.
Первый и второй полипептиды разделяют с использованием анионообменной ВЭЖХ. Белки rLP2086(fHBP) подсемейства А и В элюируют при различных временах удерживания и количественно определяют с использованием стандартной кривой, полученной по отношению к соответствующему референтному материалу белка rLP2086.
Термин "молярное соотношение" и описание иммуногенной композиции, которая включает fHBP и PS-80, кроме того, раскрывается в WO 2012025873 и публикации патента США US 2013/0171194, каждая из которых включена в виде ссылки во всей своей полноте.
Термин "молярное соотношение", как используется в данном документе, касается соотношения количества молей двух различных элементов в композиции. В некоторых вариантах осуществления, молярное соотношение представляет собой соотношение молей детергента к молям полипептида. В некоторых вариантах осуществления, молярное соотношение представляет собой соотношение молей PS-80 к молям белка. В одном варианте осуществления, основываясь на концентрациях белка и полисорбата-80, молярное соотношение может быть рассчитано с использованием следующего уравнения:
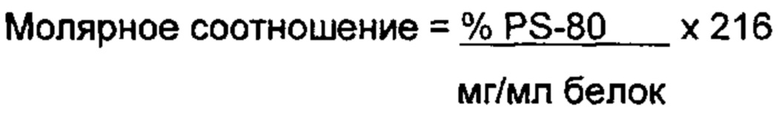
В одном варианте осуществления, композиция включает приблизительно 0,0015, 0,0017, 0,0019, 0,0021, 0,0023, 0,0025, 0,0027, 0,0029, 0,0031, 0,0033, 0,0035, 0,0037, 0,0039, 0,0041, 0,0043, 0,0045, 0,0047, 0,0049, 0,0051 мг/мл PS-80. Предпочтительно, композиция включает приблизительно 0,0035 мг/мл PS-80.
В другом варианте осуществления, композиция включает приблизительно 10 мкг, 11 мкг, 12 мкг, 13 мкг, 14 мкг, 15 мкг, 16 мкг, 17 мкг, 18 мкг, 19 мкг, 20 мкг, 21 мкг, 22 мкг, 23 мкг, 24 мкг или 25 мкг PS-80. В предпочтительном варианте осуществления, композиция включает приблизительно 18 мкг PS-80.
В другом варианте осуществления, композиция включает PS-80 в концентрации, которая находится в диапазоне от 0,0005% до 1%. Например, концентрация PS-80 в композиции может составлять, по меньшей мере, 0,0005%, 0,005%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09%, 0,10%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9%, 1% или 1,1% PS-80. В предпочтительном варианте осуществления, композиция включает приблизительно 0,07% PS-80.
КАКОЕ-ЛИБО МИНИМАЛЬНОЕ ЗНАЧЕНИЕ МОЖЕТ БЫТЬ СКОМБИНИРОВАНО С КАКИМ-ЛИБО МАКСИМАЛЬНЫМ ЗНАЧЕНИЕМ, ОПИСАННЫМ В ДАННОМ ДОКУМЕНТЕ ДЛЯ ОПРЕДЕЛЕНИЯ ДИАПАЗОНА.
АЛЮМИНИЙ
Композиция предпочтительно включает приблизительно 0,5 мг/мл фосфата алюминия. В одном варианте осуществления, композиция включает приблизительно 0,5 мг алюминия/мл в виде фосфата алюминия. AlPO4 0,50 мг/мл добавляют в качестве стабилизатора, чтобы обеспечить повышенную технологичность и стабильность. Данная концентрация поддерживает связывание (90% связывание или лучшее) белков подсемейства А и В с алюминием.
Способ получения фосфата алюминия описывается в публикации патента США US 2009/0016946, которая включена в виде ссылки во всей своей полноте.
В одном варианте осуществления, композиция, кроме того, не включает многовалентный катион, который не является алюминием. В одном варианте осуществления, композиция кроме того, не включает Al(ОН)3 или Al(SO4)3.
НАПОЛНИТЕЛИ
В одном варианте осуществления, композиция включает гистидин. В одном варианте осуществления, композиция включает хлорид натрия. Композиция предпочтительно включает приблизительно 10 мМ гистидина, и приблизительно 150 мМ хлорида натрия. В одном варианте осуществления, композиция включает 10 мМ гистидина и 150 мМ хлорида натрия.
В другом варианте осуществления, композиция включает приблизительно 650 мкг, 660 мкг, 670 мкг, 680 мкг, 690 мкг, 700 мкг, 710 мкг, 720 мкг, 730 мкг, 740 мкг, 750 мкг, 760 мкг, 770 мкг, 780 мкг, 790 мкг, 800 мкг, 810 мкг, 820 мкг, 830 мкг, 840 мкг или 850 мкг гистидина. Предпочтительно, композиция включает приблизительно 780 мкг гистидина. Какое-либо минимальное значение может быть скомбинировано с каким-либо максимальным значением, описанным в данном документе, для определения диапазона.
В одном варианте осуществления, композиция включает трис, фосфатный или сукцинатный буфер. В предпочтительном варианте осуществления, композиция не включает трис буфер. В предпочтительном варианте осуществления, композиция не включает фосфатный буфер. В одном предпочтительном варианте осуществления, композиция не включает сукцинатный буфер. В предпочтительном варианте осуществления, композиция включает гистидиновый буфер.
В предпочтительном варианте осуществления, рН композиции составляет от 6,0 до 7,0, наиболее предпочтительно рН 6,0. В одном варианте осуществления, рН композиции составляет не больше, чем 6,1.
БАКТЕРИЦИДНАЯ АКТИВНОСТЬ
Иммунный ответ, индуцированный за счет введения композиции человеку, определяют, используя сывороточный бактерицидный анализ с использованием комплемента человека (hSBA) против четырех штаммов серологической группы В (MnB) N. meningitidis. Штаммы 4 MnB, использованные в hSBA, были выбраны из пула штамма. Пул штамма представлял собой совокупность систематически собранных клинически значимых штаммов серологической группы В N. meningitidis из США и Европы. Два из 4 штаммов для SBA являются из подсемейства А LP2086 (fHBP) серологической группы В N. meningitidis, и два других из 4 штаммов являются из подсемейства В LP2086(fHBP) серологической группы В N. meningitidis.
Высокое количественное соотношение ответа hSBA ко всем исследуемым штаммам, особенно штаммам, экспрессирующим варианты 2086 липопротеина с последовательностями, гетерологичными к первому полипептиду, свидетельствует о том, что композиция представляет собой широко защитную вакцину, и что две дозы достаточно, чтобы предоставить высокую серологическую защиту, по меньшей мере, против штаммов подсемейства А серологической группы В N. meningitidis.
Высокое количественное соотношение ответа hSBA ко всем исследуемым штаммам, особенно штаммам, экспрессирующим варианты 2086 липопротеина с последовательностями, гетерологичными как к первому полипептиду, так и второму полипептиду, свидетельствует о том, что композиция представляет собой широко защитную вакцину, и что не больше, чем три дозы в пределах приблизительно 6-и месячного периода достаточно для того, чтобы предоставить высокую серологическую защиту против штаммов серологической группы В N. meningitidis, экспрессирующих rLP2086 (FHBP) подсемейства А и/или подсемейства В.
В одном варианте осуществления, штамм hSBA представляет собой штамм LP2086 (fHBP) подсемейства А. В одном варианте осуществления, штамм hSBA представляет собой штамм LP2086 (fHBP) подсемейства А, который экспрессирует вариант 2086 липопротеина, который является гетерологичным к штамму N. meningitidis, экспрессирующему А05. Например, в одном варианте осуществления, штамм hSBA представляет собой штамм LP2086 (fHBP) подсемейства А, который экспрессирует вариант 2086 липопротеина, который является гетерологичным к штамму М98250771. В одном варианте осуществления, штамм hSBA представляет собой штамм А22 LP2086 (fHBP). В другом варианте осуществления, штамм hSBA представляет собой штамм А56 LP2086 (fHBP). В следующем варианте осуществления, hSBA штаммы представляют собой штаммы А22 LP2086 (fHBP) и А56 LP2086 (fHBP). В другом варианте осуществления, штамм hSBA представляет собой штамм А04 LP2086. В одном варианте осуществления, штамм hSBA представляет собой штамм А05 LP2086. В одном варианте осуществления, штамм hSBA представляет собой штамм А12 LP2086. В одном варианте осуществления, штамм hSBA представляет собой штамм А22 LP2086. В одном варианте осуществления, штамм hSBA представляет собой штамм А12 LP2086. В одном варианте осуществления, штамм hSBA представляет собой штамм А04 LP2086. В одном варианте осуществления, штамм hSBA представляет собой штамм А19 LP2086. В одном варианте осуществления, штамм hSBA представляет собой штамм А07 LP2086. В следующем варианте осуществления, hSBA штаммы включают А22, А12, А19, А05 и А07, или какую-либо их комбинацию. В одном варианте осуществления, hSBA штаммы включают А06, А15 и А29, или какую-либо их комбинацию.
В одном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейство А серологической группы В N. meningitidis, которая является гетерологичной к штамму N. meningitidis, экспрессирующему А05. В одном варианте осуществления, иммунный ответ является против штамма А22 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма А56 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма А06 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма А15 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма А29 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма А62 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства А серологической группы В N. meningitidis, который является гетерологичным к штамму М98250771 N. meningitidis. В одном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства А серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, который имеет, по меньшей мере, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность к первому полипептиду. В другом варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейство А серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, которая имеет, по меньшей мере, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность к фактор Н связывающему белку, экспрессированному штаммом М98250771 N. meningitidis. В предпочтительном варианте осуществления, иммунный ответ является бактерицидный против штамма подсемейства А серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, который имеет, по меньшей мере, 80%, более предпочтительно, по меньшей мере, 84%, идентичность к фактор Н связывающему белку, экспрессированному штаммом М98250771 N. meningitidis.
В другом варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства А серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, который имеет не больше, чем 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность к первому полипептиду. В другом варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства А серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, который имеет не больше, чем 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность к фактор Н связывающему белку, экспрессированному штаммом М98250771 N. meningitidis. В предпочтительном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейство А серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, который имеет не больше, чем 99%, более предпочтительно не больше, чем 85%, идентичность к фактор Н связывающему белку, экспрессированному штаммом М98250771 N. meningitidis. Какое-либо минимальное значение может быть скомбинировано с каким-либо максимальным значением, описанным в данном документе, для определения диапазона.
В одном варианте осуществления, штамм hSBA представляет собой штамм LP2086 (fHBP) подсемейства В. В одном варианте осуществления, штамм hSBA представляет собой штамм LP2086 (fHBP) подсемейства В, который экспрессирует вариант 2086 липопротеина, который является гетерологичным к штамму N. meningitidis, экспрессирующему В01. Например, в одном варианте осуществления, штамм hSBA представляет собой штамм LP2086 (fHBP) подсемейства В, который экспрессирует вариант 2086 липопротеина, который является гетерологичным к штамму CDC1127. В предпочтительном варианте осуществления, штамм hSBA представляет собой штамм LP2086 (fHBP) подсемейства В, который экспрессирует вариант 2086 липопротеина, который является гетерологичным к штамму CDC1573.
В одном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В серологической группы В N. meningitidis, который является гетерологичным к штамму N. meningitidis, экспрессирующему В01. В одном варианте осуществления, иммунный ответ является против штамма В24 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма В44 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма В16 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма B03 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма В09 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма В15 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является против штамма В153 серологической группы В N. meningitidis. В одном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В серологической группы В N. meningitidis, который является гетерологичным к штамму CDC1573 N. meningitidis. В одном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, который имеет, по меньшей мере, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность ко второму полипептиду. В другом варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, которая имеет, по меньшей мере, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность к фактор Н связывающему белку, экспрессированному штаммом CDC1573 N. meningitidis. В предпочтительном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, который имеет, по меньшей мере, 80% идентичность, более предпочтительно, по меньшей мере, 87% идентичность, к фактор Н связывающему белку, экспрессированному штаммом CDC1573 N. meningitidis. В другом предпочтительном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, который имеет 100% идентичность к фактор Н связывающему белку, экспрессированному штаммом CDC1573 N. meningitidis.
В другом варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, которая имеет не больше, чем 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность ко второму полипептиду. В другом варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, которая имеет не больше, чем 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность к фактор Н связывающему белку, экспрессированному штаммом CDC1573 N. meningitidis. В предпочтительном варианте осуществления, иммунный ответ является бактерицидным против штамма подсемейства В серологической группы В N. meningitidis, который экспрессирует фактор Н связывающий белок, включающий аминокислотную последовательность, которая имеет не больше, чем 99% идентичность, более предпочтительно, по меньшей мере, 88% идентичность, к фактор Н связывающему белку, экспрессированному штаммом CDC1573 N. meningitidis. Какое-либо минимальное значение может быть скомбинировано с каким-либо максимальным значением, описанным в данном документе, для определения диапазона.
В одном варианте осуществления, hSBA штамм представляет собой штамм В24 LP2086 (fHBP). В другом варианте осуществления, hSBA штамм представляет собой штамм В44 LP2086 (fHBP). В следующем варианте осуществления, hSBA штаммы включают штаммы В24 LP2086 (fHBP) и В44 LP2086 (fHBP). В одном варианте осуществления, hSBA штаммы включают штаммы А22 LP2086 (fHBP), А56 LP2086 (fHBP), В24 LP2086 (fHBP) и В44 LP2086 (fHBP). В одном варианте осуществления, hSBA штамм включает В15. В одном варианте осуществления, hSBA штамм включает В153. В другом варианте осуществления, hSBA штамм представляет собой штамм В16 LP2086. В одном варианте осуществления, hSBA штамм представляет собой штамм В03 LP2086. В одном варианте осуществления, hSBA штамм представляет собой штамм В09 LP2086. В следующем варианте осуществления, hSBA штаммы включают В24, В16, В44, В03 и В09, или какую-либо их комбинацию. В другом варианте осуществления, hSBA штаммы включают В24, В16, В44, А22, В03, В09, А12, А19, А05 и А07, или какую-либо их комбинацию. Например, в одном варианте осуществления, штаммы hSBA включают А22 и В24. В другом варианте осуществления, hSBA штаммы включают А06, А07, А12, А15, А19, А29, В03, В09, В15 и В16, или какую-либо их комбинацию.
В одном варианте осуществления, способ индуцирует иммунный ответ против штамма подсемейства А серологической группы В N. meningitidis и против штамма подсемейства В серологической группы В N. meningitidis. Предпочтительно, иммунный ответ является бактерицидным против штамма подсемейства А серологической группы В N. meningitidis и против штамма подсемейства В серологической группы В N. meningitidis.
В одном варианте осуществления, иммунный ответ против штамма подсемейства А серологической группы В N. meningitidis больше, чем иммунный ответ против штамма подсемейства В серологической группы В N. meningitidis. Например, в одном варианте осуществления, иммуногенная композиция индуцирует более высокие бактерицидные титры против штамма подсемейства А серологической группы В N. meningitides, чем против штамма подсемейства В серологической группы В N. meningitidis, при исследовании в идентичных условиях. В одном варианте осуществления, более высокие бактерицидные титры против штамма подсемейства А серологической группы В N. meningitidis имеют место в пределах 30 дней после второй дозы иммуногенной композиции против N. meningitidis. В одном варианте осуществления, более высокие бактерицидные титры против штамма подсемейства А серологической группы В N. meningitidis имеют место при отсутствии третьей дозы иммуногенной композиции против N. meningitidis.
В другом варианте осуществления, иммунный ответ против штамма подсемейства В серологической группы В N. meningitidis больше, чем иммунный ответ против штамма подсемейства А серологической группы В N. meningitidis. Например, в одном варианте осуществления, иммуногенная композиция индуцирует более высокие бактерицидные титры против штамма подсемейства В серологической группы В N. meningitidis, чем против штамма подсемейства А серологической группы В N. meningitidis, при исследовании в идентичных условиях. В одном варианте осуществления, более высокие бактерицидные титры против штамма подсемейства В серологической группы В N. meningitidis имеют место в пределах 30 дней после второй дозы иммуногенной композиции против N. meningitidis. В одном варианте осуществления, более высокие бактерицидные титры против штамма подсемейства В серологической группы В N. meningitidis имеют место при отсутствии третьей дозы иммуногенной композиции против N. meningitidis.
ТИТРЫ
В одном варианте осуществления, композиция индуцирует повышение бактерицидного титра N. meningitidis серологической группы В у человека, по сравнению с бактерицидным титром N. meningitidis серологической группы В у человека перед введением дозы композиции, при определении в идентичных условиях, например, в hSBA. В одном варианте осуществления, повышение бактерицидного титра сравнивают с бактерицидным титром у человека перед введением первой дозы композиции, по сравнению с бактерицидным титром у человека перед введением первой дозы композиции, при определении в идентичных условиях, например, в hSBA. В одном варианте осуществления, повышение титра наблюдается после второй дозы композиции, по сравнению с бактерицидным титром у человека перед введением второй дозы композиции, при определении в идентичных условиях, например, в hSBA. В другом варианте осуществления, повышение бактерицидного титра наблюдается после третьей дозы композиция, по сравнению с бактерицидным титром у человека перед введением третьей дозы композиции, при определении в идентичных условиях, например, в hSBA.
В одном варианте осуществления, композиция индуцирует бактерицидный титр против N. meningitidis серологической группы В у человека после введения дозы, где бактерицидный титр является, по меньшей мере, больше чем в 1 раз выше, чем бактерицидный титр против N. meningitidis серологической группы В у человека перед введением дозы, при определении в идентичных условиях, например, в hSBA. Например, бактерицидный титр может быть, по меньшей мере, в 1,01 раз, 1,1 раз, 1,5 раза, 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 11 раз, 12 раз, 13 раз, 14 раз, 15 раз или 16 раз выше у человека после введения дозы композиции, по сравнению с бактерицидным титром против N. meningitidis серологической группы В у человека перед введением дозы, при определении в идентичных условиях, например, в hSBA.
В одном варианте осуществления, композиция, когда она используется в комбинации с дополнительной иммуногенной композицией против вируса папилломы человека индуцирует увеличение вирулицидного титра против вируса папилломы человека у человека, по сравнению с вирулицидным титром против вируса папилломы человека у человека перед введением дозы композиции при определении в идентичных условиях. В одном варианте осуществления, увеличение вирулицидного титра сравнивают с вирулицидным титром у человека перед введением первой дозы композиции, по сравнению с вирулицидным титром у человека перед введением первой дозы композиции, при определении в идентичных условиях. В одном варианте осуществления, увеличение титра наблюдается после второй дозы композиции, по сравнению с вирулицидным титром у человека перед введением второй дозы композиции, при определении в идентичных условиях. В другом варианте осуществления, увеличение вирулицидного титра наблюдается после третьей дозы композиции, по сравнению с вирулицидным титром у человека перед введением третьей дозы композиции, при определении в идентичных условиях.
В одном варианте осуществления, композиция, когда она используется в комбинации с дополнительной иммуногенной композицией против вируса папилломы человека, индуцирует вирулицидный титр у человека после введения дозы, при этом вирулицидный титр против вируса папилломы человека является, по меньшей мере, больше, чем в 1-раз выше, чем вирулицидный титр против вируса папилломы человека у человека перед введением дозы, при определении в идентичных условиях. Например, вирулицидный титр против вируса папилломы человека может быть, по меньшей мере, в 1,01 раза, в 1,1 раза, в 1,5 раза, в 2 раза, в 3 раза, в 4 раза, в 5 раз, в 6 раз, в 7 раз, в 8 раз в 9 раз, в 10 раз, в 11 раз, в 12 раз, в 13 раз, в 14 раз, в 15 раз или в 16 раз выше у человека после приема дозы композиции, по сравнению с вирулицидным титром против вируса папилломы человека у человека перед введением дозы, при определении в идентичных условиях.
В одном варианте осуществления, "респондент" касается человека, у которого композиция индуцирует бактерицидный титр против N. meningitidis серологической группы В после введения этому человеку дозы, при которой бактерицидный титр против N. meningitidis серологической группы В является, по меньшей мере, больше чем в 1 раз выше, чем бактерицидный титр у человека перед введением дозы. В предпочтительном варианте осуществления, у респондента достигается, по меньшей мере, в ≥ 4 раза возрастание hSBA титра, по сравнению с бактерицидным титром у человека перед введением дозы. Такой респондент может быть отнесен к тем, которые имеют защитный титр.
В одном варианте осуществления, hSBA титр является обратной величиной наиболее высокого разбавления образца сыворотки, которая вырабатывает поддающийся измерению эффект. Например, в одном варианте осуществления, титр hSBA является обратной величиной наиболее высокого 2-кратного разбавления исследуемой сыворотки, что в результате приводит к, по меньшей мере, 50% снижению бактерий MnB (50% бактериальная выживаемость) по сравнению со значением КОЕ Т30 (то есть, количество бактерий, выживших после инкубирования в анализируемых лунках, содержащих все анализируемые компоненты за исключением исследуемой сыворотки; 100% бактериальная выживаемость).
В одном варианте осуществления, композиция индуцирует бактерицидный титр против N. meningitidis серологической группы В у человека после получения первой дозы, который, по меньшей мере, в 2 раза более высокий, чем бактерицидный титр против N. meningitidis серологической группы В у человека до получения первой дозы (например, более высокий, чем бактерицидный титр у человека при отсутствии первой дозы), при определении в идентичных условиях в hSBA. В одном варианте осуществления, композиция индуцирует бактерицидный титр против N. meningitidis серологической группы В у человека, который, по меньшей мере, в 4 раза более высокий, чем бактерицидный титр против N. meningitidis серологической группы В у человека до получения первой дозы, при определении в идентичных условиях в человеческом сывороточном бактерицидном анализе, который применяет комплемент человека (hSBA). В одном варианте осуществления, композиция индуцирует бактерицидный титр против N. meningitidis серологической группы В у человека, который, по меньшей мере, в 8 раз более высокий, чем бактерицидный титр против N. meningitidis серологической группы В у человека до получения первой дозы, при определении в идентичных условиях в человеческом сывороточном бактерицидном анализе, который применяет комплемент человека (hSBA).
В предпочтительном варианте осуществления, человеческий сывороточный комплемент получают от человека, имеющего низкую наследственную бактерицидную активность для данного SBA исследуемого штамма. Низкая наследственная бактерицидная активность относится к, например, бактерицидному титру, который является, по меньшей мере, меньше чем 1:4 разбавлением против данного исследуемого штамма SBA. В одном варианте осуществления, комплемент человека получают от человека имеющего титр hSBA, который представляет собой, по меньшей мере, меньше чем 1:4, такое как 1:2 разбавление, против данного исследуемого штамма SBA, где композиция не вводилась человеку.
Человек может демонстрировать hSBA титр меньше чем 1:4 перед введением композиции, такой как двухвалентная rLP2086 композиция, или человек может демонстрировать титр hSBA ≥ 1:4 перед введением композиции. Соответственно, в предпочтительных вариантах осуществления и примерах, введение, по меньшей мере, одной дозы композиции человеку в результате приводит к титру hSBA, который, по меньшей мере, больше чем 1:4, такому как, например, титр hSBA ≥ 1:8, титр hSBA ≥ 1:16, и титр hSBA ≥ 1:32. Соответствующие примеры, описанные в данном документе, включают оценивание части субъектов-людей, имеющих титр hSBA ≥ 1:8 и/или ≥: 1:16, в которых двухвалентную rLP2086 композицию вводили человеку. Такие предпочтительные оценивания титров hSBA, больших чем 1:4, показывают, что защита, то есть, бактерицидный иммунный ответ, индуцированный у человека, является связанным с композицией.
В одном варианте осуществления, человек имеет титр hSBA, равный или больше чем нижний предел количественного определения (LLOQ) hSBA после введения первой дозы композиции. В другом варианте осуществления, человек имеет титр hSBA, равный или больше чем LLOQ hSBA после введения второй дозы композиции. В другом варианте осуществления, человек имеет титр hSBA, равный или больше чем LLOQ hSBA после введения третьей дозы композиции.
ДОПОЛНИТЕЛЬНЫЕ ИММУНОГЕННЫЕ КОМПОЗИЦИИ
В одном аспекте, изобретение касается способа индуцирования бактерицидного иммунного ответа против штамма подсемейства А серологической группы В N. meningitidis, и против штамма подсемейства В серологической группы В N. meningitidis у человека, в дополнение к индуцированию иммунного ответа против, по меньшей мере, одного какого-либо из следующих штаммов: штамма N. meningitidis серологической группы А, штамма N. meningitidis серологической группы С, штамма N. meningitidis серологической группы Y и/или штамма N. meningitidis серологической группы W135; дифтерии, столбняка, и/или коклюша; вируса гепатита А; вируса папилломы человека; дифтерии, столбняка, коклюша и/или полиомиелита; или какой-либо их комбинации.
Способ включает введение человеку эффективного количества иммуногенной композиции против N. meningitidis серологической группы В, и сопутствующее введение человеку, по меньшей мере, одной из следующих иммунологических композиций: (i) иммуногенной композиции против штамма N. meningitidis серологической группы А, штамма N. meningitidis серологической группы С, штамма N. meningitidis серологической группы Y и/или штамма N. meningitidis серологической группы W135; (ii) иммуногенной композиции против дифтерии, столбняка, и коклюша; (iii) иммуногенной композиции против вируса гепатита A; (iv) иммуногенной композиции против вируса папилломы человека; (v) иммуногенной композиции против дифтерии, столбняка, коклюша и полиомиелита; или (vi) какой-либо их комбинации.
В одном варианте осуществления, способ включает введение человеку эффективного количества иммуногенной композиции против N. meningitidis серологической группы В, и сопутствующее введение человеку, по меньшей мере, одной из следующих иммунологических композиций: (i) MENACTRA, MENVEO или NIMENRIX; (ii) ADACEL; (iii) HAVRIX; (iv) GARDASIL; (v) REPEVAX; или (vi) какой-либо их комбинации.
Например, в иллюстративном варианте осуществления, способ включает сопутствующее введение человеку, по меньшей мере, одной из следующих комбинаций композиций:
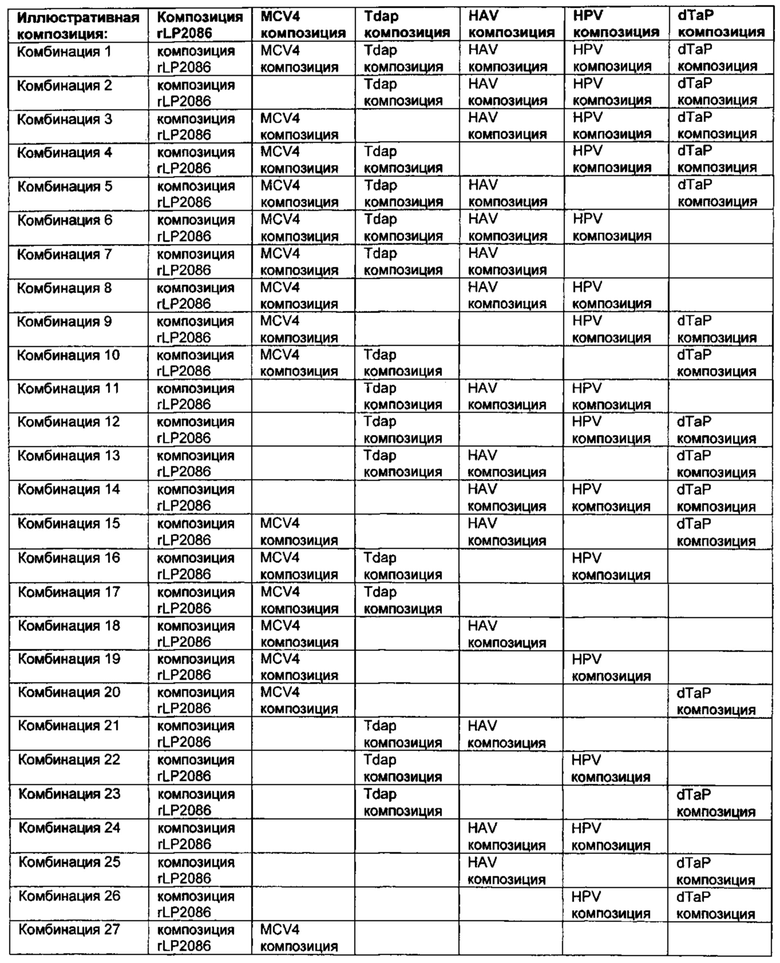
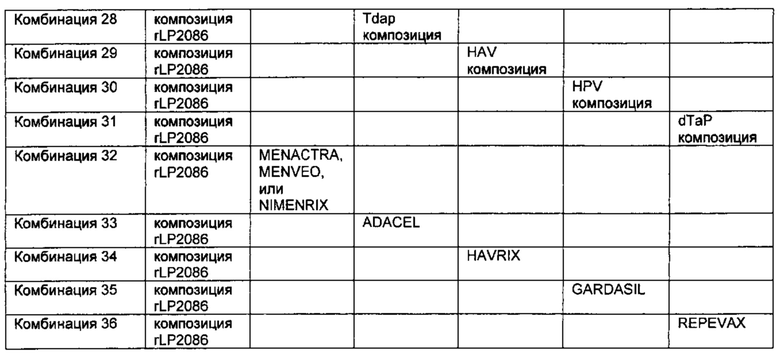
"Конкоменантное" и "сопутствующее" и "совместно введенное" и "совместное введение" как используется в данном документе касаются введения, по меньшей мере, двух композиций человеку одновременно или в пределах периода времени, во время которого действия первой введенной композиции еще остаются эффективными у человека. Если первая композиция представляет собой, например, композицию rLP2086, и второй композиция представляет собой композицию MCV4, совместное введение второй композиция может происходить в пределах от одного до семи дней, предпочтительно в пределах 48 часов, более предпочтительно в пределах 24 часов, от введения первой композиции. В одном варианте осуществления, совместное введение происходит в пределах не более 1 часа, 2 часов, 3 часов, 4 часов, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 24 часов или 48 часов от введения первой композиции. В другом варианте осуществления, совместное введение происходит одновременно с введением первой композиции.
При совместном введении, первая композиция может вводиться перед, после или одновременно с дополнительной(ыми) композицией(ями) в пределах определенного периода времени. Например, в одном варианте осуществления, первую композицию, например, композицию rLP2086, вводят человеку первой, и вторую композицию, например, композицию MCV4, вводят в пределах 24 часов после композиции rLP2086. В другом варианте осуществления, первая композиция, например, композиция MCV4, вводится человеку первой, и вторую композицию, например, композицию rLP2086, вводят человеку в пределах 24 часов после композиции MCV4.
В одном варианте осуществления, дополнительную(ые) композицию(ии) вводят перед, после или одновременно с первой дозой композиции rLP2086 в пределах определенного периода времени. В другом варианте осуществления, дополнительную(ые) композицию(ии) вводят перед, после или одновременно с второй дозой композиции rLP2086 в пределах определенного периода времени. В следующем варианте осуществления, дополнительную(ые) композицию(ии) вводят перед, после или одновременно с третьей дозой композиции rLP2086 в пределах определенного периода времени. В еще другом варианте осуществления, дополнительную(ые) композицию(ии) вводят перед, после или одновременно с ревакцинирующей дозой композиции rLP2086 в пределах определенного периода времени.
Авторы представленного изобретения неожиданно обнаружили, что композиция rLP2086 может вводиться с, по меньшей мере, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дополнительными антигенами без отрицательного влияния на иммунный ответ против N. meningitidis. Например, пример 11 демонстрирует, что наблюдались значительные ответы hSBA на штаммы N. meningitidis и на каждый из, по меньшей мере, 10 MCV4 и Tdap антигенов. Пример 13 демонстрирует, что композиция rLP2086 может совместно вводится с 14 антигенами, включенными в вакцины HPV4, MCV4, и Tdap, при этом индуцируя эффективный иммунный ответ, который может включать бактерицидный и/или вирулицидный иммунный ответ.
Соответственно, в одном аспекте, изобретение касается способа индуцирования иммунного ответа против штамма N. meningitidis серологической группы А, штамма N. meningitidis серологической группы С, штамма N. meningitidis серологической группы Y, штамма N. meningitidis серологической группы W135, и штамма N. meningitidis серологической группы В. В предпочтительном варианте осуществления, иммунный ответ включает бактерицидный иммунный ответ. Способ включает введение человеку эффективного количества композиции rLP2086 N. meningitidis, где указанная композиция включает а) первый липидированный полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 1, и b) второй липидированный полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 2; и дополнительной композиции, включающей смесь из четырех различных и отдельно сделанных белково-капсульных полисахаридных конъюгатов, где первый конъюгат включает очищенный капсульный полисахарид N. meningitidis серологической группы W-135, конъюгированный с белком-носителем, второй конъюгат включает очищенный капсульный полисахарид N. meningitidis серологической группы Y, конъюгированный с белком-носителем, третий конъюгат включает очищенный капсульный полисахарид N. meningitidis серологической группы А, конъюгированный с очищенным белком-носителем, и четвертый конъюгат включает очищенный капсульный полисахарид N. meningitidis серологической группы С, конъюгированный с белком-носителем, где белок-носитель выбирают из группы, состоящей из дифтерийного анатоксина, CRM197, и столбнячного анатоксина.
В одном предпочтительном варианте осуществления, способ включает введение композиции MCV4, где белок-носитель представляет собой дифтерийный анатоксин. В одном варианте осуществления, способ включает введение вакцины MENACTRA.
В другом варианте осуществления, способ включает введение композиции MCV4, где белок-носитель представляет собой CRM197. В одном варианте осуществления, способ включает введение вакцины MENVEO. MENVEO [Менингококковая (группы А, С, Y и W-135) олигосахаридная дифтерийная CRM197 конъюгатная вакцина] представляет собой стерильную жидкую вакцину, вводимую путем внутримышечной инъекции, которая содержит олигосахариды N. meningitidis серологической группы А, С, Y и W-135, индивидуально конъюгированные с белком Corynebacterium diphtheriae CRM197.
В еще другом варианте осуществления, способ включает введение композиции MCV4, в которой белок-носитель представляет собой столбнячный анатоксин. В одном варианте осуществления, способ включает введение вакцины NIMENRIX. NIMENRIX® (менингококковая полисахаридная - групп А, С, W-135 и Y - конъюгатная вакцина) представляет собой четырехвалентную менингококковую полисахаридную конъюгатную вакцину, которая включает N. meningitidis капсульные полисахариды А, С, W-135 и Y, каждый из которых связан со столбнячным анатоксином в качестве белка-носителя. Полисахариды N. meningitidis серологических групп А и С конъюгированы с адипиновым дигидразидным (АН) спейсером и опосредовано конъюгированы со столбнячным анатоксином, в то время как полисахариды W-135 и Y конъюгированы непосредственно со столбнячным анатоксином.
В одном варианте осуществления, способ увеличивает титры против N. meningitidis серологической группы А, С, W-135 и/или Y, по меньшей мере, больше, чем в 1 раз, по меньшей мере, в 2 раза, по меньшей мере, в 3 раза, по меньшей мере, в 4 раза или больше, по сравнению с титрами у человека перед введением иммуногенных композиций. В другом варианте осуществления, способ увеличивает титры против N. meningitidis серологической группы А, С, W-135 и Y, по меньшей мере, больше, чем в 1 раз, по меньшей мере, в 2 раза, по меньшей мере, в 3 раза, по меньшей мере, в 4 раза или больше, по сравнению с титрами у человека перед введением иммуногенных композиций. В другом варианте осуществления, способ увеличивает титры против N. meningitidis серологической группы А, С, W-135 и Y и серологической группы В, по меньшей мере, больше, чем в 1 раз, по меньшей мере, в 2 раза, по меньшей мере, в 3 раза, по меньшей мере, в 4 раза или больше, по сравнению с титрами у человека перед введением иммуногенных композиций.
В другом аспекте, изобретение касается способа индуцирования иммунного ответа против штамма N. meningitidis серологической группы В и против столбняка, дифтерии и коклюша у человека. В предпочтительном варианте осуществления, иммунный ответ включает бактерицидный иммунный ответ. В другом предпочтительном варианте осуществления, иммунный ответ включает вирулицидный иммунный ответ. В другом предпочтительном варианте осуществления, иммунный ответ включает бактерицидный и вирулицидный иммунный ответ. Способ включает введение человеку эффективного количества композиции rLP2086 N. meningitidis, где указанная композиция включает а) первый липидированный полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 1, и b) второй липидированный полипептид, имеющий аминокислотную последовательность, представленную SEQ ID NO: 2; и дополнительной композиции, которая включает столбнячный и дифтерийный анатоксины и коклюшные антигены, предпочтительно адсорбированные на фосфате алюминия. В одном варианте осуществления, способ включает введение вакцины ADACEL.
В одном варианте осуществления, способ увеличивает титры против столбняка, дифтерии и/или коклюша, по меньшей мере, больше, чем в 1 раз, по меньшей мере, в 2 раза, по меньшей мере, в 3 раза, по меньшей мере, в 4 раза, или больше, по сравнению с титрами у человека перед введением иммуногенных композиций. В другом варианте осуществления, способ увеличивает титры против столбняка, дифтерии и коклюша, по меньшей мере, больше, чем в 1 раз, по меньшей мере, в 2 раза, по меньшей мере, в 3 раза, по меньшей мере, в 4 раза или больше, по сравнению с титрами у человека перед введением иммуногенных композиций. В другом варианте осуществления, способ увеличивает титры против столбняка, дифтерии и коклюша, и N. meningitidis серологических групп А, С, W-135 и Y, и серологической группы В, по меньшей мере, больше, чем в 1 раз, по меньшей мере, в 2 раза, по меньшей мере, в 3 раза, по меньшей мере, в 4 раза, или больше, по сравнению с титрами у человека перед введением иммуногенных композиций.
В одном аспекте, изобретение касается способа индуцирования иммунного ответа против штамма N. meningitidis серологической группы В, против штаммов N. meningitidis серологической группы А, С, Y и W135, и против столбняка, дифтерии и коклюша у человека. В предпочтительном варианте осуществления, иммунный ответ включает бактерицидный иммунный ответ. В другом предпочтительном варианте осуществления, иммунный ответ включает вирулицидный иммунный ответ. В другом предпочтительном варианте осуществления, иммунный ответ включает бактерицидный и вирулицидный иммунный ответ. В одном варианте осуществления, способ включает сопутствующее введение композиции rLP2086, вакцин MENACTRA и ADACEL.
В одном аспекте, изобретение касается способа индуцирования иммунный ответ против N. meningitidis серологической группы В штамма, против штаммов N. meningitidis серологических групп А, С, Y, и W135, и против столбняка, дифтерии и коклюша, и дополнительно против вируса папилломы человека у человека. В предпочтительном варианте осуществления, иммунный ответ включает бактерицидный иммунный ответ. В другом предпочтительном варианте осуществления, иммунный ответ включает вирулицидный иммунный ответ. В другом предпочтительном варианте осуществления, иммунный ответ включает бактерицидный и вирулицидный иммунный ответ. В одном варианте осуществления, способ включает сопутствующее введение композиции rLP2086 и вакцин MENACTRA и ADACEL. В одном варианте осуществления, способ включает сопутствующее введение композиции rLP2086 и вакцин MENACTRA, ADACEL, и GARDASIL.
Авторы представленного изобретения неожиданно обнаружили, что иммуногенная композиция против N. meningitidis может вводиться с иммуногенной композицией против вируса папилломы человека (HPV) без отрицательного влияния на бактерицидный ответ против N. meningitidis. Как проиллюстрировано в примере 7 и примере 8, наблюдалось значительные hSBA ответы на исследованные штаммы N. meningitidis среди людей, которым вместе с иммуногенной композицией против N. meningitidis вводили и GARDASIL, и у людей, которым вместе с иммуногенной композицией N. meningitidis вводили и физиологический раствор. Дополнительное увеличение ответов hSBA наблюдалось через приблизительно 1 месяц после третьей дозы иммуногенной композиции против N. meningitidis.
Кроме того, авторы представленного изобретения неожиданно обнаружили, что устойчивые иммунные ответы против как N. meningitidis, так и HPV были получены у человека после введения как иммуногенной композиции против N. meningitidis, так и иммуногенной композиции против HPV, по сравнению с иммунный ответ у человека перед введением композиций. Как проиллюстрировано в примере 7 и пример 8, титры против HPV увеличивались у человека после введения иммуногенной композиции против N. meningitidis и GARDASIL, по сравнению с титрами у человека перед введением иммуногенных композиций. Увеличение титров против HPV были большими, по меньшей мере, чем в 1 раз, по меньшей мере, в 2 раза, по меньшей мере, в 3 раза, по меньшей мере, в 4 раза, или больше.
Соответственно, в одном варианте осуществления, способ включает индуцирование иммунного ответа против N. meningitidis у человека, где способ дополнительно включает введение человеку иммуногенной композиции против вируса папилломы человека. Предпочтительно, иммунный ответ представляет собой бактерицидный ответ против N. meningitidis. В одном варианте осуществления, способ дополнительно включает индуцирование иммунного ответа против HPV. В предпочтительном варианте осуществления, способ дополнительно включает индуцирование иммунного ответа против, по меньшей мере, одного из вирусов папилломы человека типов 6, 11, 16 и 18, или какой-либо их комбинации. В одном варианте осуществления, иммуногенную скомпозицию против HPV вводят человеку в пределах 24 часов после введения указанной композиции против N. meningitidis.
В одном варианте осуществления, способ включает индуцирование иммунного ответа против N. meningitidis у человека, где способ дополнительно включает введение человеку иммуногенной композиции против HPV. Предпочтительно, иммунный ответ представляет собой бактерицидный ответ против N. meningitidis. В одном варианте осуществления, способ дополнительно включает индуцирование иммунного ответа против HPV. В предпочтительном варианте осуществления, способ дополнительно включает индуцирование иммунного ответа против, по меньшей мере, одного из вирусов папилломы человека типов 6, 11, 16, и 18, или какой-либо их комбинации. В одном варианте осуществления, иммуногенную композицию против вируса папилломы человека вводят человеку в пределах 24 часов после введения указанной композиции против N. meningitidis.
В другом аспекте, авторы представленного изобретения неожиданно обнаружили, что иммуногенная композиция против N. meningitidis может вводиться вместе с иммуногенной композицией против дифтерии, столбняка, ацеллюлярного коклюша и инактивированным полиомиелитным вирусом (dTaP) без отрицательного влияния на бактерицидный ответ против N. meningitidis. Как проиллюстрировано в примере 4, значительные hSBA ответы на исследованные штаммы N. meningitidis наблюдались среди людей, которым вводили вместе с иммуногенной композицией против N. meningitidis и REPEVAX. Дополнительное увеличение ответов hSBA наблюдалось через приблизительно 1 месяц после третьей дозы иммуногенной композиции против N. meningitidis.
Кроме того, авторы представленного изобретения неожиданно обнаружили, что устойчивые иммунные ответы против как N. meningitidis, так и dTaP были получены у человека после введения как иммуногенной композиции против N. meningitidis, так и иммуногенной композиции против dTaP, по сравнению с иммунным ответом у человека перед введением композиций. Как проиллюстрировано в примере 4, титры против dTaP увеличивались у человека после введения иммуногенной композиции против N. meningitidis и REPEVAX, по сравнению с титрами у человека перед введением иммуногенных композиций. Увеличение титров против dTaP были большими, по меньшей мере, чем в 1 раз, по меньшей мере, в 2 раза, по меньшей мере, в 3 раза, по меньшей мере, в 4 раза или больше.
СПОСОБЫ И ВВЕДЕНИЕ
В одном аспекте, изобретение касается способа индуцирования иммунного ответа у человека. В предпочтительном варианте осуществления, иммунный ответ включает бактерицидный иммунный ответ. В другом предпочтительном варианте осуществления, иммунный ответ включает вирулицидный иммунный ответ. В другом предпочтительном варианте осуществления, иммунный ответ включает бактерицидный и вирулицидный иммунный ответ. В другом предпочтительном варианте осуществления, иммунный ответ включает инактивирование бактерий и/или вирусов.
В другом аспекте, изобретение касается способа вакцинирования человека. В одном варианте осуществления, способ включает введение человеку, по меньшей мере, одной дозы композиции, описанной выше. В другом варианте осуществления, способ включает введение человеку, по меньшей мере, первой дозы и второй дозы композиции, описанной выше.
Неожиданно, авторы представленного изобретения обнаружили, что двухдозовый режим введения композиции rLP2086 индуцировал бактерицидный титр против разных штаммов гетерологичного подсемейства А и против разных штаммов гетерологичного подсемейства В у человека. Например, процент людей с титром hSBA ≥ 1:8 составлял 90% или больше для SBA исследованных штаммов, экспрессирующих LP2086 (fHBP) A22 или LP2086 (fHBP) A56 после двухдозового режима введения композиции, описанной выше. Смотрите пример 1.
В одном варианте осуществления, вторую дозу вводят через, по меньшей мере, 20, 30, 50, 60, 100, 120, 160, 170 или 180 дней после первой дозы, и не больше, чем через 250, 210, 200 или 190 дней после первой дозы. Какое-либо минимальное значение может быть скомбинировано с каким-либо максимальным значением, описанным в данном документе, для определения диапазона.
В другом варианте осуществления, вторую дозу вводят приблизительно через 30 дней после первой дозы. В другом варианте осуществления, вторую дозу вводят приблизительно через 60 дней после первой дозы, такой как, например, в 0, 2 месячном режиме иммунизации. В другом варианте осуществления, вторую дозу вводят приблизительно через 180 дней после первой дозы, такой как, например, в 0, 6 месячном режиме иммунизации. В еще другом варианте осуществления, вторую дозу вводят приблизительно через 120 дней после первой дозы, такой как, например, в 2, 6 месячном режиме иммунизации.
В одном варианте осуществления, способ включает введение человеку двух доз композиции и не больше, чем двух доз. В одном варианте осуществления, две дозы вводят в пределах периода приблизительно 6 месяцев после первой дозы. В одном варианте осуществления, способ не включает дополнительного введения ревакцинации человеку. "Ревакцинация", как используется в данном документе, касается дополнительного введения композиции человеку. Предпочтительным может быть введение человеку не больше, чем двух доз композиции. Такие преимущества включают, например, облегчение человеку выполнять в полном объеме режим применения и обеспечение эффективности по стоимости режима.
В одном варианте осуществления, первую дозу и вторую дозу вводят человеку в течение периода приблизительно 25, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 дней, и не большего, чем 400, 390, 380, 370, 365, 350, 340, 330, 320, 310, 300, 290, 280, 270, 260, 250, 240, 230, 220, 210 или 200 дней после первой дозы. Какое-либо минимальное значение может быть скомбинировано с каким-либо максимальным значением, описанным в данном документе, для определения диапазона.
В одном варианте осуществления, первую дозу и вторую дозу вводят человеку в течение периода приблизительно 30 дней. В другом варианте осуществления, первую дозу и вторую дозу вводят человеку в течение периода приблизительно 60 дней. В другом варианте осуществления, первую дозу и вторую дозу вводят человеку в течение периода приблизительно 180 дней.
ТРИ ДОЗЫ
Авторы представленного изобретения, кроме того, неожиданно обнаружили, что трехдозованный режим введения композиции индуцировал более широкий бактерицидный титр против штаммов, экспрессирующих гетерологичные LP2086 (fHBP) штаммы подсемейство В у большего процента людей, чем в двухдозованном режиме. Например, процент людей с hSBA титром ≥ 1:8 составлял 65% или больше для SBA исследуемых штаммов LP2086 (fHBP) B24 и LP2086 (fHBP) B44 после двухдозованного режима композиции, описанного выше. Процент людей с hSBA титром ≥ 1:8 составлял 86% или больше для SBA исследуемых штаммов B24 и B44 после трехдозованного режима композиции, описанного выше. Смотрите пример 1.
Соответственно, в одном варианте осуществления, трехдозованный режим композиции индуцирует бактерицидный титр против многочисленных штаммов, экспрессирующих LP2086 (fHBP), гетерологичный к первому и/или второму полипептиду у большего процента людей, чем при двухдозованном режиме.
В одном варианте осуществления, способ включает введение человеку трех доз композиции. В другом варианте осуществления, способ включает введение не больше, чем трех доз композиции. В одном варианте осуществления, три дозы вводят в пределах периода приблизительно 6 месяцев после первой дозы. В одном варианте осуществления, способ включает введение ревакцинирующей дозы человеку после третьей дозы. В другом варианте осуществления, способ не включает введение ревакцинирующей дозы человеку после третьей дозы. В другом варианте осуществления, способ, кроме того, не включает введение четвертой или ревакцинирующей дозы композиции человеку. В следующем варианте осуществления, человеку вводят не больше, чем три дозы в пределах периода приблизительно 6 месяцев.
В иллюстративном варианте осуществления, вторую дозу вводят приблизительно через 30 дней после первой дозы, и третью дозу вводят приблизительно через 150 дней после второй дозы, такой как, например, в 0, 1, 6 месячный режим иммунизации. В другом иллюстративном варианте осуществления, вторую дозу вводят приблизительно через 60 дней после первой дозы, и третью дозу вводят приблизительно через 120 дней после второй дозы, такой как, например, в 0, 2, 6 месячный режим иммунизации.
В одном варианте осуществления, первую дозу, вторую дозу и третью дозу вводят человеку в течение периода приблизительно 150, 160, 170 или 180 дней, и не больше, чем 240, 210 200 или 190 дней. Какое-либо минимальное значение может быть скомбинировано с каким-либо максимальным значением, описанным в данном документе, для определения диапазона. Предпочтительно, первую дозу, вторую дозу и третью дозу вводят человеку в течение периода приблизительно 180 дней или 6 месяцев. Например, вторая доза может вводиться человеку приблизительно через 60 дней после первой дозы, и третья доза может вводиться человеку приблизительно через 120 дней после второй дозы. Соответственно, иллюстративный режим введения включает введение дозы человеку приблизительно через 0, 2 и 6 месяцев.
В одном варианте осуществления, первую дозу, вторую дозу и третью дозу вводят человеку в течение периода приблизительно 150, 160, 170 или 180 дней, и не больше, чем 240, 210 200 или 190 дней. Какое-либо минимальное значение может быть скомбинировано с каким-либо максимальным значением, описанным в данном документе, для определения диапазона. Предпочтительно, первую дозу, вторую дозу и третью дозу вводят человеку в течение периода приблизительно 180 дней или 6 месяцев. Например, вторая доза может вводиться человеку приблизительно через 60 дней после первой дозы, и третья доза может вводиться человеку приблизительно через 120 дней после второй дозы. Соответственно, иллюстративный режим введения включает введение дозы человеку приблизительно через 0, 2 и 6 месяцев.
Как описано выше, человеку могут вводиться многочисленные дозы иммуногенной композиции, и количество дней между каждой дозой может варьировать. Предпочтительный способ включает, например, для человека гибкость выполнения режимов применения.
ПРИМЕРЫ
Следующие примеры иллюстрируют варианты осуществления изобретения. Если не указано другое в данном документе, ссылка делается на следующие примеры исследуемой двухвалентной рекомбинантной вакцины (rLP2086), которая представляет собой предпочтительный иллюстративный вариант осуществления композиции, включающей 60 мкг первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1, на 0,5 мл дозы, 60 мкг второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2, на 0,5 мл дозы, с молярным соотношением полисорбата-80 к первому полипептиду - 2,8, с молярным соотношением полисорбата-80 к второму полипептиду - 2,8, 0,5 мг Al3+/мл композиции, 10 мМ гистидина, и 150 мМ хлорида натрия. Более конкретно, исследуемая двухвалентная рекомбинантная rLP2086 вакцина включает (а) 60 мкг первого липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 1; (b) 60 мкг второго липидированного полипептида, включающего аминокислотную последовательность, представленную SEQ ID NO: 2; (с) 18 мкг полисорбата-80; (d) 250 мкг алюминия; (е) 780 мкг гистидина, и (f) 4380 мкг хлорида натрия. Каждая доза составляла 0,5 мл.
ПРИМЕР 1: Безопасность, переносимость и иммуногенность исследуемой менингококковой серологической группы В двухвалентной (MnB) rLP2086 вакцины у здоровых подростков при введении в режимах из 2 или 3 доз у здоровых субъектов в возрасте от 11 до 18 лет
Общие сведения: Безопасность, переносимость и иммуногенность исследуемой двухвалентной, рекомбинантной вакцины (rLP2086) исследовали на здоровых подростках в возрасте 11-18 лет с использованием 5-ти дозованных режимов, включающих 2 или 3 вакцинации (Таблица 1).
Вакцина представляет собой 0,5-мл дозу, сформулированную таким образом, что содержит 60 мкг каждого rLP2086 белка из очищенного подсемейства А и очищенного подсемейства В, с молярным соотношением к полисорбату-80 -2,8, и 0,25 мг Al3+ в виде AlPO4, 10 мМ гистидинового буферного физиологического раствора с рН 6,0.
Физиологический раствор используют в качестве плацебо, потому что не существует известных доказанных безопасных, иммуногенных и эффективных вакцин против MnB, которые могли бы служить в качестве активного контроля. Нормальный физиологический раствор включает 0,9% хлорида натрия в 0,5 мл дозе.
Способы: Все субъекты в данном 2-х фазном, рандомизированном, плацебо-контролируемом, простом слепом исследовании, сопровождаемом вакцинацией, посещают в 0, 1, 2 и 6 месяцев. Для «слепого», контроль - давали физиологический раствор, когда вакцина не планировалась. Сывороточные бактерицидные анализы с использованием комплемента человека (hSBA) проводили с 4 MnB исследуемыми штаммами, экспрессирующеми LP2086 (fHBP) fHBP варианты А22, А56, В24 и В44 (то есть, 4 "первичными hSBA исследуемыми штаммами" в первичном анализе с конечными критериями оценки), все из которых отличаются от вариантов в вакцине. Оценивались добровольно сообщенные нежелательные явления (АЕ), ожидаемые местные и системные реакции, и применение жаропонижающих средств.
Средние геометрические титры hSBA количественно оценивались для каждого первичного штамма в каждой точке времени взятия проб крови вместе с 2-сторонними 95% доверительными интервалами (д.ин.). Средние геометрические кратные возрастания количественно оценивались вместе с 95% д.ин.
Респондента определяли как субъекта с титром hSBA равным или выше нижнего предела количественного определения (LLOQ) согласно анализам hSBA. LLOQ для каждого из 4 hSBA исследуемых штаммов в первичном анализе с конечными критериями оценки представлял собой титр hSBA, равный 1:8. Предел обнаружения (LOD) для каждого первичного исследуемого штамма представлял собой титр, равный 1:4 (широко рассматриваемое, как соотношение защиты против менингококкового заболевания).
Результаты: через 1 месяц после последней дозы вакцины, 86-99% субъектов (после 3 доз; Р<0,001) и 69-100% субъектов (после 2 доз) имели титры hSBA ≥ 8 к каждому исследуемому штамму MnB. После исследования дозы 1, 19-27% (1,1-4,3% тяжелой) и 23-27% (0,0-1,0% тяжелой) реципиентов, получивших rLP2086, испытывали покраснение и припухлость, соответственно, по группе. Боль в месте инъекции была наиболее распространенной местной реакцией после исследуемой дозы 1 (7,6-13,1% тяжелой). Лихорадку ≥ 38°С после первый исследуемой дозы двухвалентной rLP2086 вакцины испытывали 3,3-6,5% в группе по сравнению с 2,1% в группе получавшей физиологический раствор. Местные и системные реакции, как правило, более часто были после дозы 1, чем после следующей дозы. 43 из 1712 субъектов (2,5%) сообщили о 51 серьезных АЕ; 2 случая рассматривались как связанные (1 случай головокружения, озноба и головной боли и 1 случай лихорадки и рвоты). О смертельных случаях не сообщалось.
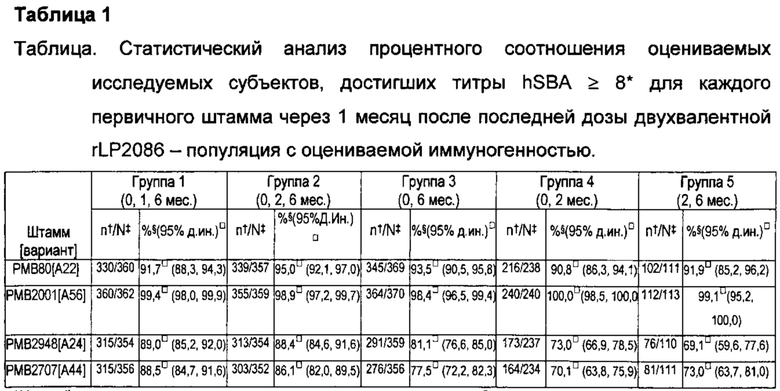
* Нижний предел количественного определения для всех штаммов = 8.
 Количество субъектов с титром hSBA ≥ 8.
Количество субъектов с титром hSBA ≥ 8.
 Количество субъектов с валидными титрами hSBA.
Количество субъектов с валидными титрами hSBA.
§Р<0,001 с использованием одностороннего точного критерия, основываясь на биномиальном распределении; значения < 0,0125 считаются статистически достоверными.
 Точный 2-сторонний доверительный интервал (по методу Клоппера-Пирсона), основанный на наблюдаемом соотношении субъектов.
Точный 2-сторонний доверительный интервал (по методу Клоппера-Пирсона), основанный на наблюдаемом соотношении субъектов.
Выводы: Двухвалентная rLP2086 имела приемлемый профиль безопасности. Все 5 режимов дозирования давали титры hSBA ≥ 8 против всех 4 исследуемых штаммов у значительной части субъектов. Более высокие соотношения против некоторых исследуемых штаммов после 3-х доз по сравнению с 2-мя дозами показывают, что 3 дозы могут обеспечить самую широкую защиту против различных MnB клинических штаммов. Глобальные 3-х фазовые клинические испытания находятся в процессе выполнения с двухвалентной rLP2086 вакциной.
Одной из задач данного исследования было оценить иммунный ответ, если измерять с помощью hSBA, выполненного с MnB штаммами, экспрессирующими белки LP2086 подсемейства А и В, через 1 месяц после третьей вакцинации двухвалентной rLP2086, среди субъектов группы 1 (0-, 1- и 6-месячный режим в качестве рандомизированного) и среди субъектов группы 2 (0-, 2- и 6-месячный режим в качестве рандомизированного). Конечные критерии оценки для анализа иммуногенности представляли собой соотношение субъектов в группах 1 и 2, у которых достигался титр hSBA ≥ LLOQ на месяц 7 (или через 1 месяц после третьей дозы двухвалентной rLP2086) для каждого из 4 первичных MnB исследуемых штаммов (А22, А56, В24 и В44). LLOQ составляло 1:8 для 4 первичных MnB исследуемых штаммов.
Для оцениваемой на иммуногенность популяции, соотношение субъектов в группе 1, у которых достигался титр hSBA ≥ 1:8 после 3 доз двухвалентной rLP2086, составляло 91,7% для А22, 99,4% для А56, 89% для В24 и 88,5% для В44 (смотрите таблицу 1 выше). Поскольку нижний предел 97,5% д.ин. составлял >50% для всех штаммов (87,8%, р<0,001; 97,8%, р<0,001; 84,7%, р<0,001; и 84,1%, р<0,001 для штаммов А22, А56, В24 и В44, соответственно, объективное исследование было выполнено для субъектов в группе 1.
Для группы 2, соотношение субъектов, у которых достигался титр hSBA ≥ 1:8 после 3 доз двухвалентной rLP2086, составляло 95,0% для А22, 98,9% для А56, 88,4% для В24 и 86,1% для В44 (смотрите таблицу 1 выше). Подобно тому, что было замечено для группы 1, нижний предел 97,5% д.ин. составлял >50% для всех штаммов (91,7%, р<0,001; 96,9%, р<0,001; 84,1%, р<0,001; и 81,4%, р<0,001 для штаммов А22, А56, В24, и В44, соответственно, демонстрировавший, что объективное исследование было выполнено для субъектов в группе 2.
Вторичной задачей было оценить иммунный ответ, если измерять с помощью hSBA, выполненного с MnB штаммами, экспрессирующими белки LP2086 подсемейства А и В, через 1 месяц после второй дозы двухвалентной rLP2086, среди субъектов группы 3 (0- и 6-месячного режима в качестве рандомизированного). Данная вторичная задача представляла собой соотношение субъектов в группе 3, у которых достигался титр hSBA ≥ LLOQ (1:8) на месяц 7 (или через 1 месяц после второй дозы двухвалентной rLP2086) для каждого из 4 первичных исследуемых штаммов MnB.
Данная вторичная задача также соответствовала, поскольку соотношение субъектов в группе 3, у которых достигался титр hSBA ≥ 1:8 после 2 доз двухвалентной rLP2086 составляло 93,5%, 98,4%, 81,1% и 77,5% для первичных исследованных штаммов MnB с низшим пределом 97,5% д.ин. >50% для всех штаммов (90,0%, р<0,001; 96,2%, р<0,001; 76,0%, р<0,001; и 72,2%, р<0,001 для штаммов А22, А56, В24 и В44, соответственно, смотрите таблицу 1 выше).
Другой вторичной задачей было соотношение субъектов с титром hSBA ≥ LLOQ для каждого из 4 первичных исследованных штаммов MnB в каждой точке времени взятия проб крови для субъектов в группах 1-5. LLOQ для каждого из 4 первичных hSBA исследованных штаммов составлял титр 1:8. Соотношения субъектов с титром hSBA ≥ 1:8 за время исследования для оцениваемой на иммуногенность популяции показаны в таблице 1 выше.
Соотношение субъектов, которые имели титр hSBA ≥ 1:8 после 1 дозы двухвалентной rLP2086 (группа 5 [2- и 6-месячный режим] через 1 месяц после инъекции 3) составляло 55,9% для А22, 67,6% для А56, 56,9% для В24, и 23,8% для В44.
Соотношение субъектов, которые имели титр hSBA ≥ 1:8 через один месяц после 2 дозы двухвалентной rLP2086, находилось в диапазоне от 74,6% до 100% для штаммов подсемейства А, и от 54,0% до 81,1% для штаммов подсемейства В. После 3 дозы, соотношение возрастало и находилось в диапазоне от 91,7% до 99,4% и от 86,1% до 89,0% для штаммов подсемейства А и В, соответственно.
ПРИМЕР 2: СЫВОРОТОЧНЫЙ БАКТЕРИЦИДНЫЙ АНАЛИЗ С ИСПОЛЬЗОВАНИЕМ КОМПЛЕМЕНТА ЧЕЛОВЕКА (HSBA)
Выведение MnB из кровотока человека в первую очередь достигается за счет комплемент-опосредованного бактериолизиса, и интактная комплементная система является важной для резистентности против инфекций, вызванных MnB. In vivo комплемент-опосредованный бактериолизис MnB имитируется in vitro с помощью сывороточного бактерицидного анализа с использованием комплемента человека (hSBA), функциональный серологический анализ, как показано, является суррогатом защиты для менингококкового заболевания. То есть, демонстрация бактериального уничтожения в сывороточном бактерицидном анализе с использованием комплемента человека (hSBA) коррелирует с защитой против менингококкового заболевания. Иммунитет, вызванный вакциной, определяют с использованием hSBA против 4 штаммов MnB (fHBP варианты А22, А56, В24 и В44).
Четыре первичных MnB исследованных штаммов использовали в hSBA, описанных в примерах для определения конечных критериев оценки. То есть, данные штаммы использовали для того, чтобы оценить эффективность вакцины с использованием hSBA конечных критериев оценки иммуногенности. Данные исследуемые штаммы представляют 4 из 6 fHBP филогенетических подгрупп, которые принимают во внимание для >90% изолятов заболеваний, циркулирующих в США и Европе.
На 29 октября 2014 года TRUMENBA® (двухвалентный рекомбинантный липопротеин 2086 [rLP2086]) был одобрен в Соединенных Штатах для предотвращения инвазивного менингококкового заболевания, вызванного MnB у индивидуумов в возрасте от 10 до 25 лет. Одобрение TRUMENBA® было основано на демонстрации иммунного ответа, как определено с использованием сывороточной бактерицидной активности против четырех штаммов серологической группы В, представленной штаммами IMD в Соединенных Штатах и Европе.

При выборе 4 первичных MnB исследованных штаммов из инвазивных изолятов заболевания, использовали подход, который принимал во внимание популяционное распределение экспрессии по поверхности LP2086 in vitro. Более того, hSBA исследованные штаммы должны показывать низкий исходный уровень hSBA положительного результата, поскольку популяции при риске менингококкового заболевания характеризуются отсутствием или низким исходным уровнем бактерицидной активности большинства штаммов. Кроме того, каждый из 4 первичных MnB исследованных штаммов экспрессирует LP2086 вариант, который отличается от LP2086 варианта в вакцине, таким образом, позволяя объективно оценить функциональную иммуногенность и эффективность к инвазивным штаммам менингококкового заболевания (IMD), циркулирующего в популяции.
hSBA измеряет количество анти-менингококкового антитела серологической группы В (MnB) в сыворотке, способной к инициированию комплемент-опосредованной бактерицидной активности. Коротко говоря, исследуемую сыворотку серийно разбавляют в 2 раза по-стадийно и добавляют в 96-лунковые планшеты для анализа. Добавляют исследуемые штаммы SBA MnB и человеческий сывороточный комплемент, инициируя бактерицидную реакцию. После инкубирования планшетов для анализа при 37°C в течение 30-60 минут (в зависимости от исследуемого штамма SBA; названного Т30), реакционную смесь, содержащую бактерии, выжившие после данного инкубирования, разбавляют и переносят в планшеты с микрофильтрами. После инкубирования в течение ночи, выжившие бактерии, выраженные в колониеобразующих единицах (КОЕ) подсчитывают с использованием анализатора Immunospot. Необработанные данные КОЕ регистрируются в электронном виде и передаются в приложение для анализа данных, которое рассчитывает титр hSBA. Титр hSBA является обратной величиной наиболее высокого 2-х кратного разбавления исследованной сыворотки, которое в результате приводит к, по меньшей мере, 50% уменьшению MnB бактерий (50% бактериальная выживаемость) по сравнению с значением Т30 КОЕ (то есть, количество бактерий, выживших после инкубирования в анализе лунок, содержащих все компоненты анализа, за исключением исследуемой сыворотки; 100% бактериальная выживаемость). Титры могут быть представлены в качестве ступенчатых титров, то есть, 1:4, 1:8, 1:16, и т.д. Образцы сыворотки исследуют два человека, определения повторяют в таком же самом анализе. Окончательный титр, сообщаемый для образцов, в которых повторяемые измерения на являются идентичными, является более низким з двух повторяемых измерений, когда выполняются критерии пригодности системы и пригодности образца (например, повторяющиеся титры должны согласовываться в пределах одного 2 кратного разбавления).
hSBA анализы выполняли после серийного разбавления исследуемых сывороток Дульбекко фосфатным буферным солевым раствором. Бактерии (приблизительно 2000 колониеобразующих единиц) и человеческий сывороточный комплемент (20% по массе конечной концентрации) добавляли к серийно разбавленным сывороткам в 96-лунковых планшетах и инкубировали при 37°C в течение 30-40 мин. (в зависимости от исследуемого штамма hSBA) в орбитальном шейкере малого радиуса при 700 оборотах в минуту. После инкубирования, часть реакционной смеси переносили в планшеты с микрофильтрами. После инкубирования в течение ночи, выжившие бактерии были подсчитаны с использованием анализатора Immunospot (Cellular Technology Limited; Shaker Heights, OH, USA) и титры hSBA анализировали с использованием SAS (версия 9,2). Титр hSBA рассчитывали как обратную величину интерполированного разбавления исследуемой сыворотки, что в результате привело к 50% уменьшению бактерий по сравнению с контролем, который не подвергался действию исследуемой сыворотки (то есть, выжившие бактерии в конце реакции hSBA). hSBA были выполнены по протоколу на основе титра hSBA, который находился на уровне или выше нижнего предела количественного определения анализов hSBA, как установлено во время квалификационной оценки анализов со штаммами, перечисленными в таблице 1 примера 1.
Сыворотка человека представляет собой источник комплемента для SBA. Однако, титры hSBA могут варьировать в зависимости от партии комплемента человека, который использовали. Соответственно, комплемент человека предпочтительно контролируют путем строгого отбора и квалификационной оценки, чтобы обеспечить стабильную работу в hSBA. Для hSBA, человеческий сывороточный комплемент может быть объединен от многочисленных нормальных здоровых взрослых людей или использован от индивидуальных доноров (то есть, не объединенный).
ПРИМЕР 3 - ПОЛИСОРБАТ-80
Три параметра оптимизировали для формуляции продукта лекарственного средства: pH, концентрация алюминия и молярное соотношение полисорбата 80 (PS-80) к белку. В дозе композиции, имеющей общий объем 0,5 мл, оптимальное связывание белка с алюминием достигается при pH приблизительно 6,0 и при концентрации алюминия в виде фосфата алюминия (AlPO4) приблизительно 0,5 мг/мл (которая является эквивалентной 0,25 мг алюминия на дозу). Молярное соотношение PS-80 к белку поддерживается на 2,8±1,4 для того, чтобы стабилизировать препарат по отношению к эффективности in vitro. Полисорбат-80 (PS-80) добавляют к субстанции лекарственного средства, чтобы получить целевое молярное соотношение PS-80 к белку - 2,8. Таким образом, PS-80 предпочтительно не добавляют во время формуляции продукта лекарственного средства.
ПРИМЕР 4
Рандомизированное, плацебо-контролируемое, 2-х фазное исследование на иммуногенность и безопасность REPEVAX®, которую вводят совместно с двухвалентной rLP2086 вакциной у здоровых подростков
Общие сведения / Цели: Исследуемая двухвалентная rLP2086 вакцина, которую разрабатывали для того, чтобы предупредить заболевание Neisseria meningitidis серологической группы В (MnB) у подростков, оценивали за счет совместного введения REPEVAX®, dTaP-инактивированной полно вакцины (которая может быть описана в патенте США №7479283, WO 1990/013313, и ЕР 1666057 В1, и UK регистрационном удостоверении PL06745/0121) в настоящее время использовали в данной популяции.
Способы: Подростки, рандомизированные 1:1 к REPEVAX + rLP2086 или REPEVAX + физиологический раствор, были вакцинированы в 0, 2, и 6 месяцев. Определяли соотношение субъектов, у которых достигались предварительно заданные уровни антитела к 9 антигенам REPEVAX через 30 дней после начальной вакцинации. Иммунные ответы (hSBA) к 4 исследуемым штаммам MnB измеряли через 30 дней после вакцинации 2 и 3. Оценивали нежелательные эффекты (АЕ) и местные/системные реакции.
REPEVAX (Sanofi Pasteur MSD ограничено) представляет собой комбинированную низкодозированную дифтерийную, столбнячную, ацеллюлярно-коклюшную вакцину и вакцину с инактивированным вирусом полиомиелита, содержащую дифтерийный анатоксин (не менее 2 ME), столбнячный анатоксин (не менее 20 ME), коклюшные антигены (коклюшный анатоксин (2,5 микрограмма), филаментный гемагглютинин (5 микрограмм), пертактин (3 микрограмма), и фимбрии типов 2 и 3 (5 микрограмм)), вирус полиомиелита (инактивированный) типа 1 (40 D антигенных единиц), вирус полиомиелита (инактивированный) типа 2 (8 D антигенных единиц), вирус полиомиелита (инактивированный) типа 3 (32 D антигенных единиц), адсорбированный на фосфате алюминия (1,5 мг (0,33 мг алюминия)) на 0,5 мл дозы.
Иммунные ответы на дифтерийный, столбнячный, и коклюшный компоненты REPEVAX (дифтерийный анатоксин, столбнячный анатоксин, коклюшный анатоксин, пертактин, фимбрии типов 2 и 3 и филаментный гемагглютинин) оценивали с использованием мультиплексного LUMINEX анализа. Иммунные ответы на вирус полиомиелита типов 1, 2 и 3 определяли в анализах нейтрализации вируса. Сыворотки, полученные от всех субъектов в обеих группах, использовали в данных анализах.
Для оценки иммунного ответа на двухвалентную rLP2086, функциональные антитела анализировали в hSBA с описанными 4 первичными MnB исследованными штаммами. Выбранными были варианты четырех первичных исследованных штаммов hSBA MnB (А22, А56, В44 и В24), 2 экспрессирующих LP2086 подсемейства А и других 2 экспрессирующих LP2086 подсемейство В. Данные 4 первичные hSBA исследуемые штаммы (4 из 6 fHBP филогенетических подгрупп и представляющих >90% изолятов заболеваний, циркулирующих в США и Европе) использовали для определения конечных критериев оценки первичной иммуногенности в данном исследовании. Кроме того, варианты А22, В24 и В44 являются эпидемиологически соответствующими вариантами в Европе, тогда как в США А22 и В24 являются наиболее соответствующими вариантами, найденными, как такие, что экспрессируются при заболевании, вызванном MnB штаммами. MnB hSBA были валидированы перед исследованием образцов, использованных для первичных и вторичных анализов.
Образцы сыворотки от 50% случайно выбранных субъектов в обеих группах hSBA были выполнены с А22 и В24, и остальные 50% были исследованы с А56 и В44. Данные исследования были выполнены на образцах крови, собранных перед вакцинацией 1, после вакцинации 2 и после вакцинации 3.
Иммуногенность REPEVAX оценивается с использованием предварительно заданных критериев для каждого антигена, определенного в ключевых 3-х фазных клинических исследованиях на подростках, которые легли в основу для выдачи разрешений на REPEVAX. REPEVAX совместные антигены включают дифтерийный, столбнячный, коклюшный анатоксин, коклюшный филаментный гемагглютинин, коклюшный пертактин, коклюшный фимбриальный гемагглютинин type 2+3, вирус полиомиелита типа 1, вирус полиомиелита типа 2, вирус полиомиелита типа 3. Исключение составляет коклюшный фимбриальный гемагглютинин (FIM) типов 2+3, для которого определен титр ≥ 5 ЕЭ/мл в анализе использовали для выдачи разрешений на REPEVAX. В данном исследовании нижний предел количественного определения (LLOQ) коклюшного FIM типов 2+3 анализ составлял ≥ 10,6 ЕЭ/мл, который является выше и, следовательно, более жесткие, чем критерии для выдачи разрешений на REPEVAX.
LLOQ для совместных антигенов составляли 0,037 МЕ/мл для дифтерийного анатоксина; 0,05 МЕ/мл для столбнячного анатоксина; 0,9 ЕЭ/мл для коклюшного анатоксина; 2,9 ЕЭ/мл для коклюшного филаментного гемагглютинина, 3,0 ЕЭ/мл коклюшного пертактина; 10,6 ЕЭ/мл коклюшного фимбриального гемагглютинина типа 2+3; 1:8 для вируса полиомиелита типа 1, вируса полиомиелита типа 2, вируса полиомиелита типа 3.
Дополнительные описательные конечные критерии оценки для первичной задачи представляли собой антитела к антигенам совместной вакцины, измеренные как средний геометрический титр (GMT) или средние геометрические концентрации (GMC) при пост-вакцинации 1 (посещение 2).
Другой конечный критерий оценки представлял собой соотношение субъектов с титром hSBA ≥ LLOQ при пост-вакцинации 3 (посещение 6) для каждого из 4 первичных MnB исследуемых штаммов.
Антигены совместной вакцины. Соотношение субъектов, достигавших предварительно заданных критериев для антигенов совместной вакцины через 1 месяц после вакцинации от дифтерии, столбняка, и ацеллюлярного коклюша (dTaP)-IPV (REPEVAX) рассчитывали с 2-сторонней 95% точностью (или доверительный интервал по методу Клоппера-Пирсона) для группы 1 и группы 2. Различие (двухвалентной rLP2086 / dTaP-IPV - dTaP-IPV, или группы 1 - группы 2) соотношений также рассчитывали вместе с 2-сторонней 95% точностью д.ин. для различия. Не уступающая эффективность декларировалась, если нижний предел 2-стороннего 95% д.ин. для разницы составлял больше, чем -0,10 (-10%) для всех 9 антигенов в dTaP-IPV вакцине.
hSBA с первичными исследуемыми штаммами. Для каждого первичного исследованного штамма hSBA MnB, количество и соотношение субъектов, у которых достигались титры hSBA ≥ LLOQ, ≥1:4, ≥1:8, ≥1:16, и ≥1:128 в каждой точке времени взятия проб крови были описательно просуммированы вместе с точным 2-сторонним 95% д.ин. (или доверительным интервалом по методу Клоппера-Пирсона) для соотношения.
Результаты: Из 749 рандомизированных субъектов, 685 (91,5%) включали оцениваемую на иммуногенность популяцию. Иммунные ответы после REPEVAX + rLP2086 или REPEVAX + физиологический раствор были не уступающими для всех 9 REPEVAX антигенов. Иммунные ответы на двухвалентную rLP2086 вакцину были значительными после 2 доз и дополнительно увеличивались после 3 доз (Таблица 2). От легкой до умеренной боль в месте инъекции была наиболее распространенной местной реакцией; головная боль и утомляемость были наиболее общими системными осложнениями. Соотношение субъектов, у которых сообщались АЕ в пределах 30 дней после вакцинации, было аналогичным (8,8% и 11,4%, для REPEVAX + rLP2086 и REPEVAX + физиологический раствор, соответственно).
Для популяции, для которой оценивалась иммуногенность совместной вакцины, соотношение субъектов, у которых достигался предварительно заданный уровень антител к антигенам совместной вакцины (пороговая величина ответа) через 1 месяц после REPEVAX дозы было аналогичным между группой с двухвалентной rLP2086 + REPEVAX группой и группой с REPEVAX только для антигенов совместной вакцины: дифтерийный анатоксин (99,4% в каждой группе), столбнячный анатоксин (100% в каждой группе), коклюшный анатоксин (94,7% и 96,0%, соответственно), коклюшный филаментный гемагглютинин (100% в каждой группе), коклюшный пертактин (100% в каждой группе), коклюшный фимбриальный гемагглютинин типа 2+3 (97,6% и 98,9%, соответственно), вирус полиомиелита типа 1 (100% в каждой группе), вирус полиомиелита типа 2 (100% в каждой группе), вирус полиомиелита типа 3 (100% в каждой группе).
Не меньшая эффективность достигалась, потому что нижняя граница 2-стороннего 95% д.ин. для разницы в соотношении респондентов между группой с двухвалентной rLP2086 + REPEVAX (Группа 1) и группой с REPEVAX только (группа 2), через 1 месяц после REPEVAX дозы составляла больше чем -0,10 (-10%) для 9 антигенов в REPEVAX (то есть, самая низкая нижняя граница 95% д.ин. при разнице соотношения составляла -4,7% (коклюшный анатоксин). Следовательно, иммунный ответ, индуцированный REPEVAX, данной с двухвалентной rLP2086, был не уступающим иммунному ответу, индуцированному только REPEVAX.
Оценивалось соотношение субъектов с титром hSBA ≥ LLOQ для каждого из 4 первичных исследованных штаммов MnB для оцениваемой на иммуногенность популяции после вакцинации 3. LLOQ для А22 был титром hSBA, равным 1:16, тогда как LLOQ для всех других исследованных штаммов MnB был титр hSBA, равный 1:8.
Для группы 1, соотношение субъектов с титром hSBA ≥ LLOQ при исходном уровне (перед вакцинацией 1) составляло 14,4% для первичного штамма MnB А22, 18,2% для А56, 12,7% для В24, и 6,2% для В44. Для группы 2, соотношение субъектов с титром hSBA ≥ LLOQ при исходном уровне (перед вакцинацией 1) составляло 23,0% для первичного MnB штамма А22, 21,8% для А56, 12,9% для В24, и 6,3% для В44.
Значительные hSBA ответы наблюдались среди группы 1 субъектов после дозы 2 двухвалентной rLP2086, с дополнительными повышениями, наблюдаемыми после 3 дозы через 1 месяц после вакцинации 3. Для группы 1 (двухвалентной rLP2086 + REPEVAX), соотношение субъектов, у которых достигался титр hSBA ≥ LLOQ через 1 месяц после вакцинации 2 и через 1 месяц после вакцинации 3 составляло 81,1% и 95,6% для А22, 97,3% и 100% для А56, 81,0% и 96,8% для В24, и 55,5% и 81,5% для В44. Тогда как значительные ответы hSBA достигались после только двух доз двухвалентной rLP2086, увеличение соотношения субъектов с титром hSBA ≥ LLOQ после 2 дозы (через 1 месяц после вакцинации 2) по сравнению с 3 дозы (через 1 месяц после вакцинации 3) служит примером усиления иммунного ответа после 3 дозы. В контрольной группе (группа 2), соотношения субъектов с титром hSBA ≥ LLOQ для каждого из 4 первичных MnB исследуемых штаммов через 1 месяц после вакцинации 2 и через 1 месяц после вакцинации 3 были аналогичными к результатам hSBA исходного уровня для каждого MnB исследуемого штамма (перед вакцинацией 1).
Для 4 первичных MnB исследуемых штаммов, соотношение субъектов в группе 1, демонстрирующих определенный титр hSBA был больше после 3 дозы, чем после 2 дозы. Описываются субъекты, у которых достигался титр hSBA ≥ 1:16, поскольку данный титр повышается в 4 раза от 1:4 титра (титр ≥ 1:4 широко идентифицируется как такой, который коррелирует с защитой против IMD). Для группы 1, соотношение субъектов с титром hSBA 1:16 через 1 месяц после вакцинации 2 составляло 81,8% для А22, 97,3% для А56, 68,0% для В24, и 53,4% для В44. Через один месяц после вакцинации 3, соотношение субъектов с титром hSBA 1:16 составляло 95,6% для А22, 100% для А56, 87,3% для В24, и 79,5% для В44.
В контрольной группе (группа 2), соотношения субъектов, демонстрирующих определенные титры hSBA для каждого из 4 первичных MnB исследованных штаммов через 1 месяц после вакцинации 2 и через 1 месяц после вакцинации 3, были аналогичными к соотношению субъектов с определенным титром hSBA при исходном уровне (перед вакцинацией 1).
Для группы 1, соотношение субъектов с титром hSBA 1:16 после 3 дозы двухвалентной rLP2086 демонстрировало, что вакцина вызывает сильный иммунный ответ, когда вводили 3 дозы двухвалентной rLP2086.
Средние геометрические титры (GMT) hSBA. Как правило, GMT на исходном уровне были ниже LLOQ hSBA для обеих групп. Для группы 1, GMT hSBA через 1 месяц после вакцинации 2 составляли 35,5 для А22, 91,1 для А56, 15,9 для В24, и 14,6 для В44. GMT hSBA через 1 месяц после вакцинации 3 составляли 63,4 для А22, 151,5 для А56, 28,3 для В24, и 36,5 для В44.
Для группы 1, наблюдаемые GMT после 2 дозы для штаммов подсемейства А, а также после 3 дозы для штаммов подсемейства В, служили признаком сильного иммунного ответа.
Оценивались обратные интегральные кривые распределения (RCDC), показывающие распределение титров hSBA для А22, А56, В24, и В44. Результаты по RCDC в группе 1 показали, что значительные иммунные ответы наблюдались среди группы 1 субъектов после вакцинации 2 двухвалентной rLP2086; однако, фигуры также показали эффективность третьей дозы двухвалентной rLP2086, так как у большего соотношения субъектов достигались более высокие титры против 4 MnB исследованных штаммов. Эффект был наиболее выражен для штамма В44.
Выводы: При совместном введении с двухвалентной rLP2086, REPEVAX индуцировала иммунные ответы, которые были не уступающими тем, которые вызывались только REPEVAX. Двухвалентная rLP2086 вакцина индуцировала сильные бактерицидные ответы к четырем различным MnB исследованным штаммам, особенно к тем, которые представляют подсемейство В, которые были больше после 3 дозы, чем после 2 дозы. Совместное введение было, как правило, безопасным и хорошо переносимым.

ПРИМЕР 5
Иммуногенность исследуемой менингококковой серологической группы В двухвалентной вакцины rLP2086 у здоровых подростков
Общие сведения и цели: Neisseria meningitidis серологической группы В (MnB) вызывает инвазивное заболевание у детей, подростков, и взрослых. Сохраненный, поверхностно-обработанный липопротеин, LP2086 (фактор Н связывающий белок [fHBP]), является перспективной мишенью MnB вакцины. Безопасность и иммуногенность исследуемой двухвалентной, рекомбинантной вакцины (rLP2086) исследовали на здоровых подростках (в возрасте 11-18 лет).
Способы: Субъекты в данном плацебо-контролируемом, простом слепом исследовании были рандомизированы на два 3-дозованых режима и три 2-дозованых режима. Каждая 120-мкг доза содержала 2 rLP2086 антигена, по 1 из каждого LP2086 подсемейства (А и В). Физиологический раствор давали, когда вакцина была не запланирована. Сывороточные бактерицидные анализы с использованием комплемента человека (hSBA) выполняли с 4 MnB исследуемыми штаммами (гетерологичные к вакцине fHBP).
Результаты: 1713 субъектов (средний возраст, 14,4 года) были рандомизированы. Через один месяц после 3 дозы вакцины, титры hSBA ≥ 8 к штаммам подсемейства А и В наблюдались у 95-99% и 86-89% субъектов, соответственно; после 2 дозы, данные количества находились в диапазонах 91-100% и 69-77% субъектов, соответственно. 2-дозованные режимы, в 0 и 6 месяцев индуцировали наиболее высокие ответы антител (таблица 1 из примера 5). GMT hSBA после 2 дозы находились в диапазонах 6,2-125,6, и после 3 дозы находились в диапазонах 25,6-155,6 по всем 4 MnB гетерологичным исследуемым штаммам. Боль в месте инъекции от легкой до умеренной была наиболее распространенной местной реакцией. Лихорадку ≥38°C испытывали 3,3-6,5% и 2,1% получателей rLP2086 и физиологического раствора, соответственно, после дозы 1.
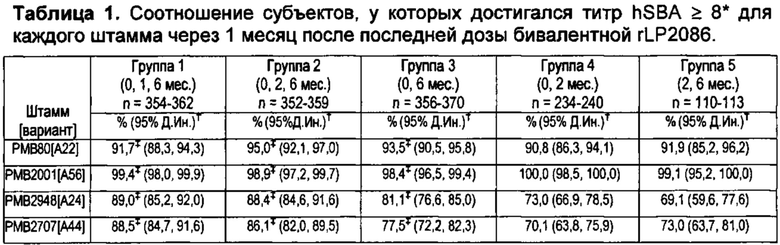
hSBA = сывороточный бактерицидный анализ с использованием комплемента человека
*Нижний предел количественного определения для всех штаммов = 8.
 Точный 2-сторонний доверительный интервал (по методу Клоппера-Пирсона), основанный на наблюдаемом соотношении субъектов.
Точный 2-сторонний доверительный интервал (по методу Клоппера-Пирсона), основанный на наблюдаемом соотношении субъектов.
 Р<0,001; значения <0,0125 считаются статистически достоверными. Р значения применимы только к группам 1, 2 и 3.
Р<0,001; значения <0,0125 считаются статистически достоверными. Р значения применимы только к группам 1, 2 и 3.
GMT = средний геометричный титр; hSBA = сывороточный бактерицидный анализ с использованием комплемента человека
*GMT рассчитывали с использованием всех субъектов с достоверными и определенными титрами hSBA в данной точке времени.
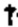 Д.Ин. представляют собой обратные преобразования доверительных интервалов, основанных на распределении t-Стьюдента для среднего логарифма титров hSBA.
Д.Ин. представляют собой обратные преобразования доверительных интервалов, основанных на распределении t-Стьюдента для среднего логарифма титров hSBA.
Выводы: rLP2086 хорошо переносилась. Все режимы дозирования давали сильные бактерицидные ответы, которые были наиболее четко выраженными после 3 дозы.
Таблица 1 примера 5 является такой же, как таблица 1 примера 1, описанного выше. Таблица 2 суммирует GMT hSBA и соответствующий д.ин. в момент исследования для оцениваемой на иммуногенность популяции. GMT увеличивались от исходного уровня (перед инъекцией 1) и продолжали увеличиваться с каждой последующей дозой двухвалентной rLP2086.
Для 4 первичных MnB штаммов, GMT были большими после 3 дозы двухвалентной rLP2086 (группы 1 и 2), чем после 2 дозы (группы 3, 4 и 5). GMT были аналогичными между двумя 3-дозованными группами, и они были аналогичными среди трех 2-дозованных групп.
Перед инъекцией 1 (исходный уровень), GMT hSBA для групп 1, 2, 3, 4 и 5 были следующими: 7,1, 6,3, 6,4, 6,4, и 6,8 для А22, соответственно; 6,8, 6,1, 6,7, 6,3, и 6,2 для А56, соответственно; 5,3, 5,1, 5,0, 4,9, и 5,1 для В24, соответственно; и 4,4, 4,5, 4,5, 4,6, и 4,4 для В44, соответственно.
Для группы 1 (0-, 1- и 6-месяц), происходило значительные увеличение GMT, отмеченных через 1 месяц после дозы 2 для всех 4 первичных MnB штаммов (24,4, 77,3, 13,8, и 13,1 для А22, А56, В24, и В44, соответственно). GMT далее увеличивались после 3 дозы двухвалентной rLP2086 для группы 1 субъектов для 4 первичных MnB исследуемых штаммов; 55,1 (А22); 152,96 (А56); 29,1 (В24); и 40,3 (В44).
Для группы 2, аналогичные увеличения GMT были отмечены после 2 и 3 дозы двухвалентной rLP2086. GMT для группы 2 субъектов после 2 дозы двухвалентной rLP2086 составляли 32,9 для А22; 94,6 для А56; 14,9 для В24; и 15,5 для В44. После 3 дозы, GMT увеличивались до 56,3 для А22; 155,6 для А56; 25,6 для В24; и 35,0 для В44.
Для групп 1 и 2, наблюдаемые GMT после 2 дозы для штаммов подсемейства А, а также после 3 дозы для штаммов подсемейства В, служат признаком сильного иммунного ответа.
Для группы 3, небольшие увеличения GMT были отмечены после 1 доза двухвалентной rLP2086, как следующие: 12,0 для А22; 18,5 для А56; 9,2 для В24; и 5,7 для В44. После 2 дозы GMT увеличивались до 48,4 для А22; 125,6 для А56; 20,6 для В24; и 22,5 для В44.
Для группы 4, GMT составляли 13,3 для А22; 17,7 для А56; 9,8 для В24; и 5,9 для В44 после 1 дозы двухвалентной rLP2086. После 2 дозы двухвалентной rLP2086, GMT составляли 37,1 для А22; 104,9 для А56; 17,7 для В24; и 19,1 для В44.
Для группы 5, GMT после 1 дозы двухвалентной rLP2086 составляли 16,0 для А22; 26,8 для А56; 12,6 для В24; и 6,8 для В44. После 2 доз двухвалентной rLP2086, GMT увеличивались до 39,6 для А22; 111,8 для А56; 14,7 для В24; и 17,8 для В44.
Взятые вместе, для групп 3, 4, и 5, наблюдаемые GMT служат признаком иммунного ответа для штаммов подсемейства А и В после 2 дозы двухвалентной rLP2086.
В заключение, 3 дозы двухвалентной rLP2086 обеспечивали устойчивый и самый широкий иммунный ответ, основанный на титрах hSBA для 4 первичных MnB исследованных штаммов. По сравнению с 2 дозами, более высокое соотношение субъектов, получавших 3 дозы двухвалентной rLP2086, достигали титр hSBA ≥ 1:8 к 4 первичным исследованным штаммам MnB.
Результаты после 0-, 1-, и 6-месяца режима дозирования (группа 1) были аналогичными результатам после 0-, 2-, и 6-месяца режима дозирования (группа 2). Для групп 1 и 2, GMT значения, которые достигались после дозы 3, были более высокими, чем GMT значения после дозы 2. Для групп 1 и 2, значения GMT после дозы 2 находились в диапазоне от 24,4 до 94,6 для штаммов подсемейства А и от 13,1 до 15,5 для штаммов подсемейства В. значения GMT после дозы 3 находились в диапазоне от 55,1 до 155,6 для штаммов подсемейства А и от 25,6 до 40,3 для штаммов подсемейства В. Для групп 1 и 2, достигалось более высокое соотношение субъектов с титром hSBA ≥ 1:8 к 4 первичным MnB исследованным штаммам после 3 доз двухвалентной rLP2086, по сравнению с соотношением субъектов у которых достигался титр hSBA ≥ 1:8 к 4 первичным MnB исследованным штаммам после 2 доз двухвалентной rLP2086.
Кроме того, оценивались субъекты, у которых достигался титр hSBA ≥ 1:16. Для группы 1, процент субъектов, у которых достигался титр hSBA ≥ 1:16 через один месяц после 2 доз двухвалентной rLP2086, составлял 73,5% для А22; 96,3 для А56; 57,6 для В24; и 47,2% для В44. После 3 доз двухвалентной rLP2086, процент субъектов в группе 1, у которых достигался титр hSBA ≥ 1:16, составлял 91,4% для А22; 99,2% для А56; 82,8% для В24; и 84,8% для В44.
Для группы 2, процент субъектов, у которых достигался титр hSBA ≥ 1:16 через один месяц после 2 доз двухвалентной rLP2086, составлял 88,1% для А22; 97,9% для А56; 63,5% для В24; и 58,6% для В44. После 3 доз двухвалентной rLP2086, процент субъектов в группе 2, у которых достигался титр hSBA ≥ 1:16 составлял 95,0% для А22; 98,9% для А56; 83,6% для В24; и 83,8% для В44.
Для групп 1 и 2, процент субъектов, у которых достигался титр hSBA ≥ 1:16 после 3 доз двухвалентной rLP2086, демонстрировал, что вакцина вызывает устойчивый иммунный ответ.
Для группы 3, процент субъектов, у которых достигался титр hSBA ≥ 1:16 после 2 доз двухвалентной rLP2086, составлял 93,2% для А22; 98,4% для А56; 73,8% для В24; и 70,8% для В44.
Для группы 4, процент субъектов, у которых достигался титр hSBA ≥ 1:16 через один месяц после 2 доз двухвалентной rLP2086, составлял 90,8% для А22; 99,2% для А56; 67,1% для В24; и 64,5% для В44.
Для группы 5, процент субъектов, у которых достигался титр hSBA ≥ 1:16 после 2 доз двухвалентной rLP2086, составлял 91,0% для А22; 99,1% для А56; 64,5% для В24; и 66,7% для В44.
Для групп 3, 4, и 5, процент субъектов, у которых достигался титр hSBA ≥ 1:16, демонстрировал, что вакцина вызывает сильный иммунный ответ к штаммам подсемейства А только после 2 дозы. Однако, 3 дозы увеличивает устойчивость ответа к штаммам подсемейства В.
Процент субъектов, у которых достигался титр hSBA ≥ 1:16 после 3 доз двухвалентной rLP2086, показывает, что вакцина вызывает устойчивый и широкий иммунный ответ к штаммам MnB, экспрессирующим LP2086 варианты, которые отличаются от компонентов вакцины.
Обратные интегральные кривые распределения (RCDC), показывающие распределение титров hSBA во времени исследования, кроме того, оценивались для оцениваемых на иммуногенность популяций для каждого штамма по группе. RCDC показывают устойчивые иммунные ответы после 2 доз двухвалентной rLP2086 к штаммам подсемейства А. После третьей дозы двухвалентной rLP2086, площадь под кривыми ответов увеличивалась для всех 4 первичных MnB исследованных штаммов, таким образом, демонстрируя усиление иммунного ответа после 3 доз двухвалентной rLP2086.
Результаты анализов первичных и вторичных конечных критериев оценки иммуногенности показывают, что вакцина может генерировать антитела со значительной hSBA активностью против гетерологичных вариантов подсемейства А и подсемейства В MnB. В то время как соотношение субъектов, у которых достигался титр hSBA ≥ 1:8, было более высоким после 2 или 3 доз двухвалентной rLP2086, достигалось большое соотношение субъектов с титром hSBA ≥ 1:8 через один месяц после 1 дозы двухвалентной rLP2086. Смотрите, например, группу 5.
Для 4 первичных исследованных штаммов MnB, GMT были больше после 3 доз двухвалентной rLP2086 (группы 1 и 2), чем после 2 доз (группы 3, 4 и 5). GMT были аналогичными в двух 3-дозованных группах. GMT также были аналогичными среди трех 2-дозованных групп. Эти данные также демонстрируют сильные hSBA ответы после 3 доз двухвалентной rLP2086, основанные на процентах субъектов, у которых достигался титр hSBA ≥ 1:16.
Эти данные демонстрируют, что конечный препарат двухвалентной rLP2086 генерирует устойчивый иммунный ответ и является безопасным и хорошо переносимым, когда вводится 2-мя или 3-мя дозами. Даже 1 доза двухвалентной rLP2086 обеспечивает значительный иммунный ответ по сравнению с исходным уровнем и также является безопасной и хорошо переносимой. В целом, не существовало никаких клинически значительных различий в профиле безопасности после 2 или 3 доз двухвалентной rLP2086.
ПРИМЕР 6
Безопасность, переносимость и иммуногенность менингококковой серологической группы В двухвалентной rLP2086 вакцины у здоровых подростков в возрасте от 11 до 18 лет в трех 2 фазных, рандомизированных, контролируемых исследованиях
Общие сведения: Neisseria meningitidis серологической группы В (MnB) является главной причиной инвазивного менингококкового заболевания у подростков. Сохраненный, поверхностно-обработанный липопротеин, LP2086 (фактор Н связывающий белок [fHBP]), является перспективной мишенью вакцины, чтобы защитить от инвазивного заболевания, вызванного MnB. Безопасность, переносимость и иммуногенность исследуемой двухвалентной, рекомбинантной MnB вакцины (которая включает SEQ ID NO: 1 и SEQ ID NO: 2, с молярным соотношением полисорбата-80 - 2,8, 0,5 мг/мл алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия, в данном документе называется во всех примерах как "двухвалентная rLP2086") была проверена в трех 2-х фазных, рандомизированных, контролируемых исследованиях у здоровых подростков в возрасте 11-18 лет.
Способы: Исследование 1012 проверило 5 вакцинных режимов двухвалентной rLP2086, в то время как исследования 1010 и 1011 оценивали 3-дозованный режим двухвалентной rLP2086 вакцины, вводимой совместно с TdaP-IPV и HPV-вакцинами, соответственно. Каждая доза двухвалентной rLP2086 содержала 60 мкг rLP2086 варианта А05 подсемейства А и 60 мкг rLP2086 варианта В01 подсемейства В. Для того, чтобы проверить двухвалентную rLP2086 на иммуногенность в каждом из трех исследований, сывороточные бактерицидные анализы с использованием комплемента человека (hSBA) выполняли с 4 MnB исследуемыми штаммами, экспрессирующими гетерологичные fHBP варианты А22, А56, В24 и В44, которые были выбраны для того, чтобы представлять соответствующее разнообразие вариабельности fHBP, а также обеспечить перспективность широты вызванного вакциной иммунного ответа против штамма, экспрессирующего эпидемиологически превалирующие fHBP варианты. Побочные эффекты и навязываемые местные и системные реакции были оценены.
Результаты: у 82-100% субъектов во всех 3 исследованиях достигались титры hSBA выше нижнего предела количественного определения (LLOQ) для каждого из 4 MnB исследуемых штаммов через 1 месяц после дозы 3 (Таблица). По всем трем исследованиям, преобладающее большинство системных осложнений и местных реакций были от легких до умеренных по тяжести; побочные эффекты были, как правило, не серьезными или связанными с вакциной исследования.
Выводы: Титры бактерицидных антител сыворотки выше 1:4 защищают против инвазивного менингококкового заболевания. Демонстрирование титров hSBA ≥ LLOQ к 4 MnB исследуемым штаммам, каждый гетерологичный по отношению к антигену вакцины, в каждой из фаз 2 исследований на данных подростках, свидетельствуют о том, что двухвалентная rLP2086 вакцина обеспечивала функциональный антительный ответ, который может быть широко активен в отношении различных заболеваний, связанных со штаммами MnB. Вакцинации двухвалентной rLP2086, как правило, хорошо переносились.
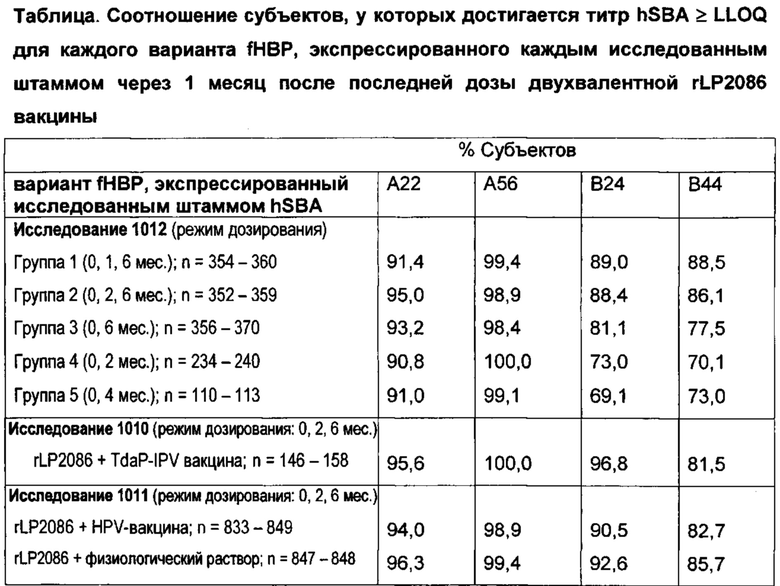
LLOQ = нижний предел количественного определения; fHBP = фактор Н связывающий белок; hSBA = сывороточные бактерицидные анализы с использованием комплемента человека; TdaP-IPV вакцина = вакцина против дифтерии, столбняка, коклюша и полиомиелита.
LLOQ = самое низкое количество аналита в образце, который может быть количественно определен. Титры hSBA ≥ 1:4 являются такими, которые коррелируют с защитой для инвазивного менингококкового заболевания. Титры hSBA ≥ LLOQ являются выше минимального коррелирования. LLOQ составлял 1:16 для А22, и 1:8 для А56, В24 и В44.
ПРИМЕР 7
Иммуногенность менингококковой серологической группы В двухвалентной rLP2086 вакцины у здоровых подростков в возрасте от 11 до 18 при введении совместно с вакциной против вируса папилломы человека
Данное 2 фазное, рандомизированное, контролированное исследование с маскированием данных для наблюдателя оценивало иммуногенность двухвалентной rLP2086 с или без совместного введения с GARDASIL®, которая представляет собой четырехвалентную вакцину против вируса папилломы человека (HPV4) (которая также описана в патенте США No 5,820,870), у здоровых подростков в возрасте ≥11 до <18 лет. GARDASIL содержит белок L1 рекомбинантных антигенов HPV типа 6, 11, 16, и 18 (то есть, HPV-6, HPV-11, HPV-16 и HPV-18). Конечные критерии оценки представляли собой GMT hSBA для каждого из 4 первичных исследованных штаммов MnB в каждом применимом в точку времени отбора образца крови.
Способы: Субъекты получали двухвалентную rLP2086 (включающую SEQ ID NO: 1 и SEQ ID NO: 2, с молярным соотношением полисорбата-80 - 2,8, 0,5 мг/мл алюминия, 10 мМ гистидина, и 150 мМ хлорида натрия) + HPV4 (Группа 1), двухвалентную rLP2086 + физиологический раствор (Группа 2), или HPV4 + физиологический раствор (Группа 3) в месяцы 0, 2, и 6. Сыворотки от субъектов в группах 1 и 2 перед вакцинацией 1, и через 1 месяц после вакцинации 2 и 3, исследовали с помощью сывороточного бактерицидного анализа с использованием комплемента человека (hSBA), используя 4 исследованных штаммов MnB, каждый экспрессирующий fHBP (А22, А56, В44 и В24), который является гетерологичным к компонентам вакцины и представляет широту разнообразия fHBP, а также эпидемиологическую распространенность. Конечные критерии оценки, которые оценивались, включали соотношение субъектов с титрами hSBA ≥ нижнего предела количественного определения (LLOQ; 1:16 [А22] или 1:8 [А56, В44, В24]) и средние геометрические титры (GMT) hSBA.
Для того, чтобы продемонстрировать не меньшую эффективность от введения GARDASIL плюс двухвалентная rLP2086 по сравнению с только GARDASIL, выполняли оценку иммуногенности с 2 hSBA, с использованием 1 первичного исследуемого штамма, представляющего варианты (А22) подсемейства А и 1 первичного исследуемого штамма, представляющего варианты (В24) подсемейства В. Однако, все из 4 первичных MnB исследуемых штаммов использовали для определения экспериментальных конечных критериев оценок дополнительной иммуногенности/эффективности двухвалентной rLP2086.
Для оценки иммунного ответа на двухвалентную rLP2086, функциональные антитела анализировали в hSBA с менингококковыми штаммами серологической группы В, выбранными произвольно из пула фирмы Pfizer типичного штамма SBA MnB, как описано в примере 2. hSBA измерял функциональные антитела в сыворотках человека, которые в комплемент-зависимом способе уничтожает целевой менингококковый штамм.
Результаты: 814 и 812 субъектов были включены в оцениваемые на иммуногенность популяции для групп 1 и 2, соответственно. По сравнению с состоянием перед вакцинацией 1, соотношение субъектов с титром hSBAs ≥ LLOQ против всех 4 исследованных штаммов было более высоким после вакцинации 2 (55%-99%) и 3 (83%-99%; фигура 1). Таблица А примера 7 представляет GMT hSBA для каждого из 4 первичных MnB штаммов и соответствующий д.ин. в точке времени отбора образца для оцениваемой на иммуногенность популяции. GMT на исходном уровне были ниже hSBA LLOQ для обеих групп. GMT находились в диапазоне 11,1-70,6 и 11,9-76,3 после вакцинации 1, и 25,8-117,2 и 28,0-128,2 после вакцинации 2 в группах 1 и 2, соответственно (таблица А ниже).
Для оцениваемой на иммуногенность популяции, GMT hSBA к 2 первичным штаммам MnB через 1 месяц после дозы вакцинации 3 двухвалентной rLP2086 для группы 1 и группы 2 были следующими: 53,3 и 57,8, соответственно, для А22, и 25,8 и 28,0, соответственно, для В24.
Для группы 2 (двухвалентная rLP2086 + физиологический раствор), GMT hSBA через 1 месяц после вакцинации 2 составляли 33,7 для А22, 76,3 для А56, 16,3 для В24 и 11,9 для В44. GMT hSBA через 1 месяц после вакцинации 3 составляли 57,8 для А22, 128,2 для А56, 28,0 для В24 и 31,9 для В44.
Для группы 1 (двухвалентная rLP2086 + GARDASIL), GMT hSBA через 1 месяц после вакцинации 2 составляли 31,9 для А22, 70,6 для А56, 15,0 для В24, и 11,1 для В44. GMT hSBA через 1 месяц после вакцинации 3 составляли 53,3 для А22, 117,2 для А56, 25,8 для В24, и 27,2 для В44.
Обратные интегральные кривые распределения (RCDC), показывающие распределение титров hSBA для А22, А56, В24 и В44 оценивались для группы 1 и группы 2 во все точки времени отбора образцов для оцениваемой на иммуногенность популяции. RCDC показали, что преобладающее большинство субъектов показали ответ после вакцинации 2 и имели дополнительное увеличение титра для 4 первичных исследованных штаммов MnB после вакцинации 3. Иммунные ответы к антигенам были аналогичными для групп 1 и 2.
Выводы: Двухвалентную rLP2086 могут вводить с HPV4 без влияния на бактерицидный ответ, который оценивается с помощью hSBA серологического ответа или GMT. Поскольку титры hSBA ≥ 1:4 коррелируют с защитой против менингококкового заболевания, эти данные показывают, что эффективность защиты подростков против широкого диапазона MnB штаммов после введения двухвалентной rLP2086 на фоне совместного введения HPV вакцины.

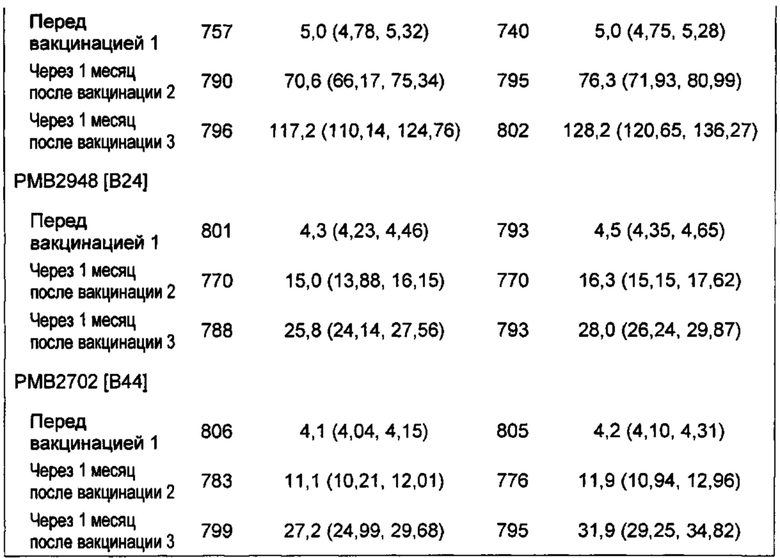
СМТ = средний геометрический титр; HPV4 = четырехвалентная вакцина против вируса папилломы человека; hSBA = сывороточный бактерицидный анализ с использованием комплемента человека.
an = количество субъектов с достоверными и определенными титрами hSBA для данного штамма.
bСредние геометрические титры рассчитывали с использованием всех субъектов с достоверными и определенными титрами hSBA в данный момент времени.
c cДоверительные интервалы представляют собой обратное преобразование доверительного интервала, основанного на распределении t-Стьюдента для среднего логарифма титров hSBA
ПРИМЕР 8
Иммуногенность вакцины против папилломы человека совместно вводимой с двухвалентной rLP2086 вакциной против менингококковой серологической группы В у здоровых подростков
Общие сведения: Данное 2 фазное, рандомизированное исследование оценивало совместное введение четырехвалентной вакцины против вируса папилломы человека (HPV4), с двухвалентной rLP2086, исследуемой вакцины против инвазивного заболевания, которое вызывалось Neisseria meningitidis серологической группой В (MnB), у здоровых подростков от ≥11 до <18 летнего возраста.
Способы: Субъекты получали HPV4 + двухвалентную rLP2086 (Группа 1), двухвалентную rLP2086 + физиологический раствор (Группа 2), или физиологический раствор + HPV4 (Группа 3) в месяцы 0, 2, и 6. Сыворотки собирали на исходном уровне и после доз 2 и 3 во всех группах. Иммунные ответы к HPV4 антигенам (HPV-6, 11, 16, и 18) определяли с помощью конкурентных иммуноанализов (cLIA) LUMINEX. Иммуногенность двухвалентной rLP2086 измеряли с помощью сывороточного бактерицидного анализа с использованием комплемента человека (hSBA) с 2 исследуемыми штаммами MnB, экспрессирующеми вакцина-гетерологичные fHBP варианты (А22 и В24). Конечные критерии оценки иммуногенности, все после дозы 3, включали: средние геометрические титры (GMT) против HPV антигенов в группах 1 и 3; GMT hSBA для штаммов, экспрессирующих варианты А22 и В24, в группах 1 и 2; и индекс сероконверсии для HPV антигенов на исходном уровне серонегативных субъектов в группах 1 и 3. Безопасность двухвалентной rLP2086 также оценивалась после совместного введения с HPV4 или физиологическим раствором.
Оценки иммунного ответа на GARDASIL (белок L1 HPV типа 6, 11, 16, и 18) выполняли с использованием cLIA, основанный на флуоресцентно-меченных микросферах на основе платформы (LUMINEX). Сыворотки, полученные от всех субъектов в группах 1 и 3 перед первой вакцинацией с GARDASIL (Посещение 1) и через 1 месяц после третьей вакцинации GARDASIL (Посещение 5) использовали в данных анализах.
Сравнение GMT с 4 HPV антигенами для группы 1 и группы 3, с их соответствующими GMT соотношениями (GMR) Группы 1 к Группе 3 и 2-сторонними 95% д. ин. соотношений представлено в таблице А ниже представленного примера. Критерий для границы не меньшей эффективности составлял 1,5 раза, который соответствует значению 0,67 для нижнего предела 2-стороннего 95% д. ин. GMR. 1,5 разовый критерий 0,67 был определен для всех исследованных штаммов MnB и HPV антигенов за исключением HPV-18, который имел более низкую границу 95% доверительного интервала (д. ин.) 0,62. В отдельном анализе, ≥99% субъектов, сероконвертированных ко всем 4 HPV антигенам как в группе физиологический раствор + HPV4, так и группе rLP2086 + HPV4.
Другой задачей данного исследования было описать иммунный ответ, индуцированный двухвалентной rLP2086 + GARDASIL (Группа 1) и физиологическим раствором + GARDASIL (Группа 3), если измерять с помощью серологической конверсии в анализах HPV иммуногенности после вакцинации 3 дозой GARDASIL (Посещение 5) в обеих группах.
Индекс серологической конверсии для каждого из 4 HPV антигенов, через 1 месяц после последней дозы GARDASIL для субъектов, которые были HPV-серологически негативными на исходном уровне в группе 1 и группе 3, рассчитывали как соотношение субъектов с cLIA уровнями в анти-HPV сыворотке ≥20 ммасс.ед./мл для HPV-6, ≥16 ммасс.ед./мл для HPV-11, ≥20 ммасс.ед./мл для HPV-16, и ≥24 ммасс.ед./мл для HPV-18.
Количество и соотношение исходного уровня HPV-серологически негативных субъектов, у которых достигались предварительно заданные критерии для серологической конверсии для 4 HPV антигенов с соответствующим 95% д. ин. в каждой группе, процентные разницы (Группа 1 - Группа 3) в соотношении, и 95% д. ин. разниц представлены в таблице В примера 8 для исходного уровня HPV-серологически негативной оцениваемой на иммуногенность популяции.
Результаты: Предварительно заданные не меньшей эффективности критерии, установленные на 1,5 раза (0,67 нижний предел 95% д. ин. для GMR) были определены для 3 из 4 HPV антигенов (не HPV-18) и обоих MnB исследуемых штаммов (Таблица А). Индексы серологической конверсии в группах 1 и 3 составляли ≥99% для всех HPV антигенов (Таблица В). Большая местная реактогенность происходила после rLP2086 по сравнению с физиологическим раствором, но не повышалась с последней дозой; боль в месте инъекции была наиболее распространенной местной реакцией. Системные осложнения во всех 3 группах, как правило, были легкими и умеренными по тяжести.
Для оцениваемой на иммуногенность популяции, GMT антител к 4 HPV антигенам через 1 месяц после GARDASIL дозы при вакцинации 3 для группы 1 и группы 3 были следующими: 451,8 и 550,3, соответственно (HPV-6); 892,9 и 1084,3, соответственно (HPV-11); 3695,4 и 4763,4, соответственно (HPV-16); и 744,0 и 1047,4, соответственно (HPV-18). GMR группы 1 - группы 3 через 1 месяц после GARDASIL дозы при вакцинации 3 составляли 0,82 для HPV-6 (95% д. ин.: 0,72, 0,94), 0,82 для HPV-11 (95% д. ин.: 0,74, 0,91), 0,78 для HPV-16 (95% д. ин.: 0,68, 0,88), и 0,71 для HPV-18 (95% д. ин.: 0,62, 0,81). Таким образом, нижние пределы 2-стороннего 95% д. ин. для анти-HPV GMR для группы 1 по сравнению с группой 3 составляли 0,72 для HPV-6, 0,74 для HPV-11, 0,68 для HPV-16, и 0,62 для HPV-18. 1,5 разовый критерий 0,67 (нижний предел 2-стороннего 95% д. ин. GMR) обеспечивался для всех HPV антигенов, кроме HPV-18, который имел более низкую границу 95% д. ин. 0,62.
GMR группы с двухвалентной rLP2086 + GARDASIL к группе с двухвалентной rLP2086 + физиологическим раствором через 1 месяц после вакцинации 3 дозой двухвалентной rLP2086 составляли 0,92 для А22 (95% д. ин.: 0,85, 1,00), и 0,92 для В24 (95% д. ин.: 0,84, 1,01). Нижние пределы 2-стороннего 95% д. ин. для GMR hSBA для группы 1 по сравнению с группой 2 составляли 0,85 для А22 и 0,84 для В24, оба из которых являются большими, чем 0,67 и, тем самым, обеспечивали не меньшую границу эффективности 1,5 раза.
Данные от введения двухвалентной rLP2086 + GARDASIL (Группа 1) сравнивали с данными от введения двухвалентной rLP2086 + физиологического раствора (Группа 2) за счет анализа титра hSBA 4 кратных показателей ответа для 2 первичных MnB штаммов (А22 и В24) через 1 месяц после вакцинации 3. Соотношения субъектов, у которых достигалось ≥4 кратное увеличение титра hSBA по сравнению с исходным уровнем через 1 месяц после вакцинации 3 для 2 первичных MnB штаммов, были определены как для субъектов группы 1, которые получали двухвалентную rLP2086 + GARDASIL, так и для группы 2 субъектов, которые получали двухвалентную rLP2086 + физиологический раствор. Касательно субъектов в группе 1, 85,3% продемонстрировали ≥4 кратное увеличение титров hSBA против В24. Касательно субъектов в группе 2, 86,4% продемонстрировали ≥4 кратное увеличение титров hSBA против А22, и 84,8% продемонстрировали ≥4 кратное увеличение титров hSBA против В24.
Отличия в соотношении респондентов между группой 1 и группой 2 через 1 месяц после вакцинации 3 составляли - 1,1% для А22 (95% д. ин.: -4,6, 2,3) и -1,4% для В24 (95% д. ин.: -5,1, 2,3). Отличия в 4 раза по показателям ответа были очень близкими значению 1%, с более низкими границами 95% д. ин., где разница соотношения составляла -4,6% А22 и -5,1% В24.
Не меньшая эффективность критериев двухвалентной rLP2086 + GARDASIL по сравнению с физиологическим раствором + GARDASIL или по сравнению с двухвалентной rLP2086 + физиологический раствор требовала, чтобы нижний предел 2-стороннего 95% д. ин. для GMR для антител к HPV для всех 4 HPV антигенов (HPV-6, HPV-11, HPV-16, и HPV-18) и для титров hSBA с использованием 2 первичных MnB исследуемых штаммов (А22 и В24) через 1 месяц после вакцинации 3 был больше, чем 0,67. Этот предварительно заданный критерий был установлен для обоих MnB исследованных штаммов и, по меньшей мере, 3 из 4 HPV антигенов. Для HPV-18, нижний предел 2-стороннего д. ин. для GMR был несколько ниже предварительно заданного порога 0,67, при 0,62.
В 4 раза увеличившиеся ответы к 2 первичным MnB исследованным штаммам (А22 и В24) были аналогичными (находились в диапазоне от 83,4% до 86,4%) с группой, которая получала двухвалентную rLP2086 + GARDASIL и группой, которая получала двухвалентную rLP2086 + физиологический раствор.
Соотношения субъектов в группах 1 и 2 перед вакцинацией (то есть, перед вакцинацией 1) с титрами hSBA ≥ 1:4 составляли 15,2% и 18,8%, соответственно, для штамма А22; 10,4% и 10,5%, соответственно, для штамма А56; 6,1% и 8,4%, соответственно, для штамма В24; и 1,7% и 3,2%, соответственно для штамма В44. Кроме того, соотношения субъектов в группах 2 и 1 перед вакцинацией с титрами hSBA ≥ 1:16 составляли 13,7% и 16,4%, соответственно для штамма А22; 9,0% и 9,1%, соответственно, для штамма А56; 4,1% и 5,4%, соответственно, для штамма В24; и 1,2% и 2,1%, соответственно, для штамма В44.
В группе 2 (двухвалентная rLP2086 + физиологический раствор), соотношение субъектов с титром hSBA ≥ 1:4 через 1 месяц после вакцинации 2 составляло 86,3% для А22, 98,7% для А56, 77,1% для В24, и 60,1% для В44. Через один месяц после вакцинации 3, соотношение субъектов с титром hSBA ≥ 1:4 составляло 96,4% для А22, 99,4% для А56, 92,8% для В24, и 86,5% для В44. В группе 1 (двухвалентная rLP2086 + GARDASIL), соотношение субъектов с титром hSBA ≥ 1:4 через 1 месяц после вакцинации 2 составляло 83,8% для А22, 97,8% для А56, 71,9% для В24, и 57,7% для В44. Через один месяц после вакцинации 3, соотношение субъектов с титром hSBA ≥ 1:4 составляло 94,3% для А22, 99,1% для А56, 91,1% для В24, и 84,4% для В44.
В группе 2 (двухвалентная rLP2086 + физиологический раствор), соотношение субъектов с титром hSBA ≥ 1:16 через 1 месяц после вакцинации 2 составляло 85,8% для А22, 98,4% для А56, 68,8% для В24, и 49,9% для В44. Через один месяц после вакцинации 3, соотношение субъектов с титром hSBA ≥ 1:16 составляло 96,3% для А22, 99,4% для А56, 89,2% для В24, и 82,4% для В44. В группе 1 (двухвалентная rLP2086 + GARDASIL), соотношение субъектов с титром hSBA ≥ 1:16 через 1 месяц после вакцинации 2 составляло 83,0% для А22, 97,2% для А56, 65,2% для В24, и 46,4% для В44. Через один месяц после вакцинации 3, соотношение субъектов с титром hSBA ≥ 1:16 составляло 94,0% для А22, 98,9% для А56, 86,3% для В24, и 78,0% для В44.
Как для группы 1, так и группы 2, достигалось высокое соотношение субъектов с титром hSBA ≥ 1:16 или больше после 2 или 3 дозы двухвалентной rLP2086, в тоже время большинство субъектов не имели никакого измеряемого титра hSBA к какому-либо из первичных MnB исследованных штаммов перед вакцинацией при посещении 1.
Для исходного уровня HPV-серологически негативной оцениваемой на иммуногенность популяции, соотношение субъектов, у которых достигались предварительно заданные критерии для HPV серологической конверсии для HPV антигенов через 1 месяц после GARDASIL дозы при вакцинации 3 для группы - двухвалентная rLP2086 + GARDASIL (Группа 1) и группы - физиологический раствор + GARDASIL (Группа 3) были следующими: HPV-6 (99,4% и 99,3%, соответственно), HPV-11 (99,6% и 99,5%, соответственно), HPV-16 (99,6% и 99,5%, соответственно), и HPV-18 (99,5% и 99,0%, соответственно).
Отличие в соотношении респондентов между группой с двухвалентной rLP2086 + GARDASIL (Группа 1) и группой с физиологическим раствором + GARDASIL (Группа 3) через 1 месяц после GARDASIL дозы составляло 0,1% для HPV-6 (95% д. ин.; -0,9, 1,5), 0,1% для HPV-11 (95% д. ин.: -0,7, 1,3), 0,1% для HPV-16 (95% д. ин.; -0,7, 1,3), и 0,5% для HPV-18 (95% д. ин.; -0,6, 1,9).
Для группы с двухвалентной rLP2086 + GARDASIL (Группа 1) и группы с физиологическим раствором + GARDASIL (Группа 3), отличия индекса серологической конверсии находились в пределах 0,1% и 0,5% по всем 4 HPV антигенам и индексы серологической конверсии были очень похожими по всех группах, с больше, чем 99% серологическим конвертированием субъектов для всех 4 HPV антигенов.
В качестве дополнительной оценки, двухвалентную rLP2086 + GARDASIL (Группа 1) сравнивали с двухвалентной rLP2086 + физиологический раствор (Группа 2), используя анализ показателей 4 кратного ответа титра hSBA для 2 первичных MnB штаммов (А22 и В24) через 1 месяц после вакцинации 3. Соотношения субъектов, у которых достигалось возрастание титра hSBA больше, чем в ≥4 раза от исходного уровня за 1 месяц после вакцинации 3 для 2 первичных MnB штаммов являются следующими: Для субъектов в группе 1, 85,3% продемонстрировали возрастание в ≥4 раза титров hSBA против исследуемого штамма А22, и 83,4% продемонстрировали возрастание в ≥4 раза титров hSBA против исследуемого штамма В24. Для субъектов в группе 2, 86,4% продемонстрировали возрастание в ≥4 раза титров hSBA против исследуемого штамма А22 и 84,8% продемонстрировали возрастание в ≥4 раза титров hSBA против исследуемого штамма В24.
Отличие в соотношении респондентов между группой 1 и группой 2 через 1 месяц после вакцинации 3 составляло -1,1% для А22 (95% д. ин.: -4,6, 2,3) и -1,4% для В24 (95% д. ин.: -5,1, 2,3). Отличия 4 кратного показателя ответа все были близки значению 1%, с более низкими границами 95% д. ин., где отличие в соотношении составляло -4,6% (А22) и -5,1% (В24).
Иммунные ответы к двухвалентной rLP2086. Другой задачей данного исследования было описать иммунный ответ, если измерять с помощью hSBA, выполненного с 4 первичными MnB исследуемыми штаммами, 2 - экспрессирующими белки LP2086 подсемейства А (А22 и А56), и 2 - экспрессирующими белки LP2086 подсемейства В (В24 и В44), которые измеряли через 1 месяц после второго посещения (посещение 3) и третьей (посещение 5) вакцинации двухвалентной rLP2086.
Один из конечных критериев оценки для данной задачи представлял собой соотношение субъектов с титрами hSBA ≥ LLOQ через 1 месяц после вакцинации 2 (Посещение 3) и через 1 месяц после вакцинации 3 (Посещение 5) для каждого из 4 первичных MnB исследованных штаммов. Оценивалось соотношение субъектов с титром hSBA ≥ LLOQ для каждого из 4 первичных MnB исследованных штаммов для оцениваемой на иммуногенность популяции. LLOQ для А22 представлял собой титр hSBA равный 1:16, тогда как LLOQ для всех других MnB исследуемых штаммов представлял собой титр hSBA равный 1:8.
Для группы 2 (двухвалентная rLP2086 + физиологический раствор), соотношение субъектов с титром hSBA ≥ LLOQ при исходном уровне (перед вакцинацией 1) составляло 16,4% для А22, 9,3% для А56, 6,9% для В24 и 2,5% для В44. Для группы 2, соотношения субъектов, у которых достигался титр hSBA ≥ LLOQ через 1 месяц после вакцинации 2 и через 1 месяц после вакцинации 3 составляли 85,8% и 96,3%, соответственно, для А22; 98,5% и 99,4%, соответственно, для А56; 74,2% и 92,6%, соответственно, для В24; и 57,1% и 85,7%, соответственно, для В44.
Для группы 1 (двухвалентная rLP2086 + GARDASIL), соотношение субъектов с титром hSBA ≥ LLOQ при исходном уровне (перед вакцинацией 1) составляло 13,7% для А22, 9,2% для А56, 5,1% для В24, и 1,4% для В44. Для группы 1, соотношения субъектов, у которых достигался титр hSBA ≥ LLOQ через 1 месяц после вакцинации 2 и через 1 месяц после вакцинации 3, составляли 83,0% и 94,0%, соответственно, для А22; 97,5% и 98,9%, соответственно, для А56; 70,6% и 90,5%, соответственно для В24; и 54,5% и 82,7%, соответственно, для В44.
Значительные ответы hSBA к 4 первичным MnB исследуемым штаммам наблюдались среди как группы 1, так и группы 2, субъектов через 1 месяц после вакцинации 2, с наблюдаемыми дополнительными увеличениями через 1 месяц после вакцинации 3.
Оценивалось соотношение субъектов, у которых достигалось возрастание титра hSBA с кратностью ≥4 для каждого из 4 первичных MnB исследованных штаммов, и соотношения субъектов, у которых достигался комбинированный ответ для оцениваемой на иммуногенность популяции. Соотношения субъектов с наблюдаемым титром hSBA ≥ LLOQ для всех 4 MnB штаммов, комбинированных на исходном уровне (перед вакцинацией 1), были аналогичными между группой 1 (0,3%) и группой 2 (0,7%).
Для группы 2 (двухвалентная rLP2086 + физиологический раствор), соотношение субъектов, у которых достигалось возрастание титра hSBA с кратностью ≥4 от исходного уровня за 1 месяц после вакцинации 3, составляло 86,4% для А22, 95,3% для А56, 84,8% для В24, и 80,7% для В44, и 83,9% субъектов достигали комбинированный ответ hSBA (hSBA ≥ LLOQ для всех 4 скомбинированных первичных штаммов). Через 1 месяц после вакцинации 2, соотношение субъектов, у которых достигалось возрастание титра hSBA с кратностью ≥4, от исходного уровня составляло 74,2% для А22, 92,6% для А56, 63,4% для В24, и 47,4% для В44, и 51,9% субъектов достигали комбинированный ответ hSBA.
Для группы 1 (двухвалентная rLP2086 + физиологический раствор), соотношение субъектов, у которых достигалось возрастание титра hSBA с кратностью ≥4 от исходного уровня за 1 месяц после вакцинации 3, составляло 86,4% для А22, 95,3% для А56, 84,8% для В24, и 80,7% для В44, и 83,9% субъектов достигали комбинированный ответ hSBA (hSBA ≥ LLOQ для всех 4 скомбинированных первичных штаммов). Через 1 месяц после вакцинации 2, соотношение субъектов, у которых достигалось возрастание титра hSBA с кратностью ≥4 от исходного уровня, составляло 74,2% для А22, 92,6% для А56, 63,4% для В24, и 47,4% для В44, и 51,9% субъектов достигали комбинированный ответ hSBA.
Дополнительный кратный ответ hSBA. Другие конечные критерии оценки представляли собой соотношение субъектов, у которых достигалось, по меньшей мере, 2 кратное и 3 кратное возрастания титра hSBA по сравнению с исходным уровнем к каждому посещению для отбора образца крови после вакцинации для каждого из 4 первичных MnB штаммом. Отмечалось, что LLOQ для А22 был титр hSBA равный 1:16, тогда как LLOQ для всех других MnB исследуемых штаммов представлял собой титр hSBA, равный 1:8.
Соотношение субъектов, у которых достигалось возрастание с кратностью ≥2 титра hSBA по сравнению с исходным уровнем через 1 месяц после вакцинации 2 для группы 1 и группы 2 для MnB штаммов, составляло 77,3% и 81,1%, соответственно, для А22; 94,4% и 95,3%, соответственно, для А56; 63,0% и 66,0%, соответственно, для В24; и 46,1% и 48,6%, соответственно, для В44. Соотношения субъектов, у которых достигалось возрастание титра hSBA с кратностью ≥2 по сравнению с исходным уровнем через 1 месяц после вакцинации 3 для группы 1 и группы 2 для MnB штаммов, составляли 90,2% и 92,8%, соответственно, для А22; 97,2% и 97,9%, соответственно, для А56; 84,6% и 87,2%, соответственно, для В24; и 77,7% и 81,7%, соответственно, для В44.
Соотношения субъектов, у которых достигалось возрастание титра hSBA кратностью ≥3 по сравнению с исходным уровнем через 1 месяц после вакцинации 2 для группы 1 и группы 2 для MnB штаммов, составляли 73,1% и 74,2%, соответственно, для А22; 92,5% и 92,6%, соответственно, для А56; 61,3% и 63,4%, соответственно, для В24; и 45,7% и 47,4%, соответственно, для В44. Соотношения субъектов, у которых достигалось возрастание титра hSBA с кратностью ≥3 по сравнению с исходным уровнем через 1 месяц после вакцинации 3 для группы 1 и группы 2 для MnB штаммов, составляли 85,3% и 86,4%, соответственно, для А22; 95,0% и 95,3%, соответственно, для А56; 83,4% и 84,8%, соответственно, для В24; и 77,0% и 80,7%, соответственно, для В44.
Подводя итог, следует отметить, что описательные конечные критерии оценки при задачах, преобладающее большинство субъектов достигали титр hSBA ≥ LLOQ как для группы 1 (двухвалентная rLP2086 + GARDASIL), так и группы 2 (двухвалентная rLP2086 + физиологический раствор) для всех 4 первичных MnB исследованных штаммов, тогда как только очень небольшое соотношение субъектов имело измеряемые титры hSBA ≥ LLOQ при исходном уровне (перед вакцинацией, посещение 1). Значительные иммунные ответы с 4 MnB штаммами наблюдались через 1 месяц после вакцинации 2, с дополнительными возрастаниями, наблюдаемыми через 1 месяц после вакцинации 3 как для группы 1 и группы 2 субъектов. Данный вывод подтверждался путем соотношения субъектов с титром hSBA ≥ 1:16 после 3 доз, наблюдаемые GMT достигались после 2 доз и после 3 доз в обеих группах, и RCDC для 4 первичных MnB исследованных штаммов.
Как для группы 1, так и группы 2, у большого процента субъектов достигалось возрастание титра hSBA с кратностью ≥4 для каждого из первичных MnB исследованных штаммов и комбинированный ответ hSBA ≥ LLOQ для всех 4 первичных MnB штаммов после третьей вакцинации исследования.
Кроме того, у преобладающего большинства субъектов достигалось возрастание титра hSBA с кратностью ≥3 и возрастание титра hSBA с кратностью ≥2 для 4 первичных MnB штаммов во всей точках времени отбора образцов как для группы 1 (двухвалентная rLP2086 + GARDASIL), так и группы 2 (двухвалентная rLP2086 + физиологический раствор). Процент субъектов с результатами, устанавливающими данные критерии, было выше после 3 вакцинаций по сравнению с 2 вакцинациями.
Данные результаты подтверждают доказательства того, что иммунный ответ на двухвалентную rLP2086, когда совместно вводятся с HPV вакциной, GARDASIL, дает устойчивый иммунный ответ, который является сопоставимым с иммунным ответом на двухвалентную rLP2086 + физиологический раствор.
GMT HPV. Таблица В примера 8 представляет GMT и соответствующей д. ин. для каждого из 4 HPV антигенов через 1 месяц после вакцинации 3 для группы 1 (двухвалентная rLP2086 + GARDASIL) и группы 3 (физиологический раствор + GARDASIL) в оцениваемой на иммуногенность популяции.
Для группы 3, GMT HPV при исходном уровне (перед вакцинацией 1) и через 1 месяц после вакцинации 3 составляли 6,0 и 550,3, соответственно, для HPV-6; 4,3 и 1084,3, соответственно, для HPV-11; 6,1 и 4763,4, соответственно, для HPV-16; и 5,3 и 1047,4, соответственно, для HPV-18. Для группы 1 (двухвалентная rLP2086 + GARDASIL), GMT HPV при исходном уровне (перед вакцинацией 1) и через 1 месяц после вакцинации 3 составляли 5,8 и 451,8, соответственно для HPV-6; 4,2 и 892,9, соответственно, для HPV-11; 5,8 и 3695,4, соответственно, для HPV-16; и 5,2 и 744,0, соответственно, для HPV-18. В общем, GMT были количественно выше для группы 3 по сравнению с группой 1. Обратные интегральные кривые распределения (RCDC), показывающие распределение титров для HPV-6, HPV-11, HPV-16, и HPV-18 оценивались для группы 1 (двухвалентная rLP2086 + GARDASIL) и группы 3 (физиологический раствор + GARDASIL) во все точки времени отбора проб для оцениваемой на иммуногенность популяции. RCDC показали сильные иммунные ответы среди субъектов после вакцинации 3 как для группы 1, так и группы 3.
Краткое описание иммунного ответа к GARDASIL. GMT к HPV антигенам были количественно выше для группы 3 (физиологический раствор + GARDASIL) по сравнению с группой 1 (двухвалентная rLP2086 + GARDASIL), и наблюдаемые GMT HPV после вакцинации 3 служили признаком сильного иммунного ответа для обеих групп. RCDC также подтверждали сильные иммунные ответы после вакцинации 3 как для группы 1, так и группы 3. Это также подтверждалось соотношением субъектов с серологически положительным статусом для 4 HPV антигенов, которое составляло >99% через 1 месяц после вакцинации 3 для обеих групп. Подгруппа более юного возраста имела более высокие GMT HPV в группе 3 (физиологический раствор + GARDASIL), чем подгруппа более старшего возраста. Данное отличие сохранялось, когда GARDASIL вводили совместно с двухвалентной rLP2086.
Выводы об иммуногенности. Не меньшая эффективность критериев двухвалентной rLP2086 + GARDASIL по сравнению с физиологический раствор + GARDASIL или по сравнению с двухвалентной rLP2086 + физиологический раствор требовала, чтобы нижний предел 2-стороннего 95% д. ин. для средних геометрических соотношений титра (GMR) для антител к HPV для всех 4 HPV антигенов (HPV-6, HPV-11, HPV-16 и HPV-18) и для титров hSBA с использованием 2 первичных MnB исследуемых штаммов (А22 и В24) через 1 месяц после вакцинации 3, был больше чем 0,67. Данный предварительно заданный порог был установлен для обоих MnB штаммов и 3 из 4 HPV антигенов. Для HPV-18, нижний предел 2-стороннего 95% д. ин. для GMR был несколько ниже предварительно заданного порога 0,67, при 0,62.
Серологическая конверсия для всех 4 HPV антигенов достигалась 99% или больше субъектов для групп, которые получали GARDASIL совместно с двухвалентной rLP2086 или с физиологическим раствором. RCDC для всех 4 HPV антигенов показывает, что у преобладающего большинства субъектов достигали ответ выше порога серологической конверсии через 1 месяц после вакцинации 3. Устойчивые GMT по сравнению с исходным уровнем наблюдались для обеих групп, которые получали GARDASIL.
Ответы с 4 кратным увеличением к 2 первичным MnB исследуемым штаммам (А22 и В24) были аналогичными (находились в диапазоне от 83,4% до 86,4%) между группой, которая получала двухвалентную rLP2086 + GARDASIL (85,3% и 83,4%, соответственно) и группой, которая получала двухвалентную rLP2086 + физиологический раствор (86,4% и 84,8%, соответственно).
Дополнительные описательные анализы ответа к двухвалентной rLP2086 выполняли с использованием 4 первичных MnB исследуемых штаммов (А22, А56, В24, и В44). Достигалось высокое соотношение субъектов с возрастанием титра hSBA с кратностью ≥4 и комбинированным ответом (все 4 первичные MnB исследуемые штаммы и такое же определение конечных критериев оценки иммуногенности/эффективности, как использовали в фазе 3 клинической программы) для оцениваемой на иммуногенность популяции для обеих групп, которые получали двухвалентную rLP2086, или совместно с GARDASIL (двухвалентная rLP2086 + GARDASIL), или с физиологическим раствором (двухвалентная rLP2086 + физиологический раствор), через 1 месяц после вакцинации 2 или 3. Данные ответы являются значительно более высокими, чем титр hSBA ≥ 1:4, который продемонстрировал, что коррелирует с защитой против менингококкового заболевания, включающего заболевание серологической группы В. Данные результаты также показывают и подтверждают доказательство сильного иммунного ответа к двухвалентной rLP2086, которую вводили или с физиологическим раствором, или совместно с GARDASIL.
Выводы: Данные показывают, что сильные иммунные ответы к обеим вакцинам были получены после совместного введения rLP2086 + HPV4. Предварительно заданные критерии не меньшей эффективности были установлены для 5 из 6 антигенов. Хотя GMR к HPV-18 близко пропускали критерии не меньшей эффективности, высокое количественное отношение респондентов (≥99%) показывает клиническую эффективность, которая, как ожидается, сохраняется после совместного введения. Двухвалентная rLP2086 хорошо переносилась и вызывала сильный иммунный ответ к исследуемым штаммам, экспрессирующим fHBP гетерологичный к данным в вакцине.
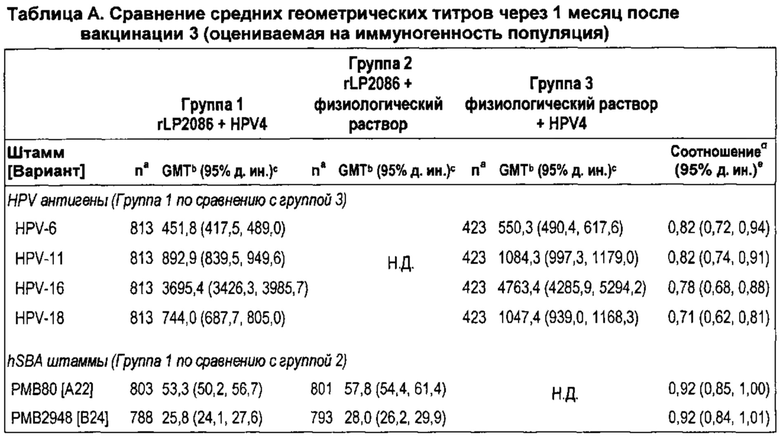
Д. ин. = доверительный интервал; GMT = средний геометрический титр; HPV = вирус папилломы человека; hSBA = сывороточный бактерицидный анализ с использованием комплемента человека; LLOQ = нижний предел количественного определения; Н.Д. = нет данных.
Примечание: LLOQ = 11 ммас.ед./мл для HPV-6, 8 ммас.ед./мл для HPV-11; 11 ммас.ед./мл для HPV-16; и 10 ммас.ед./мл для HPV-18. LLOQ = 1:16 для А22; 1:8 для А56, В24, и В44. Результаты ниже LLOQ представляли 0,5*LLOQ для анализа.
a. n = количество субъектов с достоверными и определенными результатами анализа для данного антигена или штамма.
b. Средние геометрические титры (GMT) рассчитывали с использованием всех субъектов с достоверными и и определенными результатами анализа через 1 месяц после вакцинации 3.
c. Доверительные интервалы (д. ин.) представляет собой обратное преобразование доверительных интервалов, основанных на распределении t-Стьюдента для среднего логарифма результатов анализа.
d. Соотношения GMT (Группа 1/Группа 3 для титров HPV антигена и Группа 1/Группа 2 для титров hSBA штамм).
e. Доверительные интервалы (д. ин.) для соотношение представляют собой обратное преобразование доверительного интервала, основанного на распределении t-Стьюдента для средних логарифмов измерений (Группа 1 - Группа 3 для HPV титров и Группа 1 - Группа 2 для титров hSBA штамма).

Д.Ин. = доверительный интервал; HPV = вирус папилломы человека.
a. N = количество субъектов с серологически негативным статусом на исходном уровне HPV для данного антигена.
b. n = Количество субъектов, у которых достигалась серологическая конверсия (предварительно заданные критерии) через 1 месяц после вакцинации 3 для данного антигена.
c. Точный 2-сторонний доверительный интервал (метод Клоппера-Пирсона), основанный на наблюдаемом соотношении субъектов.
d. Разница в соотношениях, выраженная в процентах.
е. Точный 2-сторонний доверительный интервал (основанный на Chan & Zhang) для разницы в соотношениях, выраженной в процентах.
ПРИМЕР 9: ЭФФЕКТИВНОСТЬ ДВУХВАЛЕНТНОЙ RLP2086 ВАКЦИНЫ
Эффективность двухвалентной rLP2086 предполагалась с использованием hSBA ответов, как суррогат эффективности и демонстрации, бактерицидных антительных ответов сыворотки на инвазивные штаммы N. meningitidis серологической группы В (MnB).
Четыре MnB штамма, типичные представители штаммов, вызывающих инвазивное менингококковое заболевание (IMD) использовали в оценивании. Каждый исследуемый штамм MnB экспрессирует вариант fHBP белка (А22, А56, В24 или В44), который является гетерологичным (отличным) от компонентов вакцины (А05 и В01).
Эффективность двухвалентной rLP2086 оценивали в 3 фазном рандомизированном контролируемом исследовании фазы II, которое проводилось на 4459 подростках в возрасте от 11 до 18 лет в США и Европе. Смотрите также пример 6. Всего 2293 получали, по меньшей мере, 1 дозу 120 мкг двухвалентной rLP2086 согласно режиму вакцинации в 0-, 2-, и 6-месяц. Эффективность оценивали путем оценивания иммунных ответов hSBA у субъектов, вакцинированных двухвалентной rLP2086.
Эффективность предполагали с использованием 5 совместных первичных конечных критериев оценки иммуногенности. Для 4 из 5 совместных первичных конечных критериев оценки, предварительно указанные соотношения субъектов должны достигать 4 кратных увеличений титра hSBA к каждому из 4 MnB исследуемых штаммов после 3 дозы двухвалентной rLP2086. Пятый совместный первичный конечный критерий оценки представлял собой комбинированный конечный критерий оценки, требующий, чтобы каждый ответ предварительно заданного высокого соотношения субъектов по всем 4 hSBA с первичными MnB исследуемыми штаммами после 3 дозы двухвалентной rLP2086. Иммунный ответ также оценивался на основе соотношения субъектов, у которых достигался титр hSBA ≥ нижнего предела количественного определения (LLOQ) через 1 месяц после третьей дозы вакцины. LLOQ определяется как самое низкое количество антитела в образце, которое может измеряться.
Исследование 1 (описанное в примере 7 и примере 8) представляло собой фазу II, рандомизированного, контролируемого по активному препарату, с маскированием данных для наблюдателя, многоцентрового исследования, в котором 2499 субъектов из США, в возрасте от 11 до 17 лет, были рандомизированно распределены (в соотношении 2:2:1) в 1 из 3 групп: Группа 1 получала двухвалентную rLP2086 + HPV4, Группа 2 получала двухвалентную rLP2086 + физиологический раствор, и Группа 3 получала физиологический раствор + HPV4. Все вакцинации проводили с режимом в 0-, 2-, и 6-месяц.
Исследование 2 (описанное в примере 4) представляло собой фазу II, рандомизированного, плацебо-контролируемого, простого слепого исследования, в котором 753 европейских субъектов, в возрасте от 11 до 18 лет, были рандомизированно распределены в соотношении 1:1 на 2 группы: Группа 1 получала двухвалентную rLP2086 в 0-, 2-, и 6-месяц и dTaP-IPV (дифтерии, столбняк, ацеллюлярный коклюш, инактивированный вирус полиомиелита) в месяц 0. Группа 2 получала физиологический раствор в 0-, 2-, и 6-месяц и dTaP-IPV в месяц 0.
Исследование 3 (описанное в примере 5) представляло собой фазу II, рандомизированного, плацебо-контролируемого, простого слепого, многоцентрового исследования, в котором 1713 европейских субъектов, в возрасте от 11 до 18 лет, были рандомизированно распределены в соотношении 3:3:3:2:1 на 5 групп. Субъекты получали 2 или 3 дозы двухвалентной rLP2086, которую вводили в 0-, 1-, и 6-месяц режима (Группа 1); в 0-, 2-, и 6-месяц режима (Группа 2); в 0- и 6-месяц режима (Группа 3); в 0- и 2-месяц режима (Группа 4); или в 0- и 4-месяц режима (Группа 5). Инъекции физиологического раствора (1 или 2 дозы в зависимости от группы) вводили в каждой группе для поддержания слепого исследования.
Результаты исследований 1, 2, и 3 среди субъектов, которые получали серии из 3-доз двухвалентной rLP2086 в 0-, 2-, и 6-месяц описываются выше в соответствующих примерах 4-8. Оценка показателей 4 кратного и комбинированного ответа были экспериментальными конечными критериями оценки для всех исследований. Показатели 4 кратного ответа показали, что более низкие границы 95% доверительного интервала (д. ин.) для всех 4 конечных критериев оценки были аналогичными среди 3 исследований и последовательно устанавливали пороговые пределы для конечных критериев оценки фазы III. Соотношение субъектов, у которых достигался hSBA титр ≥ LLOQ, был аналогичным по 3 исследованиям.
На основе данных hSBA, полученных после 2 введений вакцины, которые давали 1 или 2 месяцами отдельно, 2 дозы вакцины, введенные в течение данных интервалов, могут обеспечить защиту индивидуумам при повышенном риске, благодаря эффективному воздействию в случае менингококкового заболевания серологической группы В. Ответы, наблюдаемые после введений 2 вакцины, которую давали 1 или 2 месяца по частям показали, что соотношение субъектов, у которых экспрессировались уровни hSBA равные или выше значений LLOQ для каждого из 4 первичных исследуемых штаммов (смотрите исследование 1 - результаты для группы 1 и группы 2; смотрите исследование 2 - результаты для группы 1; смотрите исследование 3 - результаты для группы 2). Третья доза вакцины, которую вводили в 6 месяц, может давать опосредованную вакциной защиту.
Совместное введение вакцины. Исследование 1 (описанное в примере 7 и примере 8) оценивало совместное использование двухвалентной rLP2086 и HPV4 у подростков США. Конечные критерии оценки исследования включали оценку не меньшей эффективности иммунного ответа для четырех HPV4 антигенов (на основе среднего геометрического титра [GMT]) и для двухвалентной rLP2086 (на основе hSBA с использованием двух MnB исследуемых штаммов [вариантов А22 и В24]) через 1 месяц после третьей вакцинация. HPV4 иммунный ответ также оценивали с помощью серологической конверсии для каждого из 4 HPV антигенов.
Исследование 1 показывает сравнение средних геометрических титров (GMT) антител к HPV антигенам для группы 1 (двухвалентная rLP2086 + HPV4) и группа 3 (Физиологический раствор + HPV4), с их соответствующим GMT соотношением (GMR) между группой 1 и группой 3 и 2-сторонним 95% д. ин. соотношений. Исследование 1 также предусматривает сравнение GMT hSBA к 2 первичным MnB исследуемым штаммам для группы 1 и группы 2 с их соответствующими GMR между группой 1 и группой 2 и 2-сторонним 95% д. ин. соотношений. Критерий для границы не меньшей эффективности был 1,5 кратным, что соответствует значению 0,67 для нижнего предела 2-стороннего 95% д. ин. GMR. 1,5 кратный критерий 0,67, был установлен для всех MnB исследованных штаммов и HPV антигенов, за исключением для HPV-18, который имел более низкую границу 95% доверительного интервала (д. ин.) 0,62. Хотя, ответ к HPV-18 не соответствовал заранее заданному критерию не меньшей эффективности, разница была незначительной. В отдельном анализе, ≥99% субъектов серологически конвертировались ко всем 4 HPV антигенам в обеих группах - физиологический раствор + HPV4 и двухвалентная rLP2086 + HPV4.
ПРИМЕР 10: Двухвалентная rLP2086 вырабатывает антитела у индивидуумов, которые обеспечивают широкий охват против MnB штаммов, экспрессирующих превалирующие и связанные со вспышками fHBP варианты
Бактерицидные антитела, измеренные в сывороточных бактерицидных анализах с использованием комплемента человека (hSBA), коррелировали с защитой от менингококкового заболевания и ответами hSBA использовали обычно, как суррогаты эффективности вакцины. Общие эпидемиологические исследования разнообразия fHBP показали, что ~80% менингококкового заболевания вызывается штаммами, которые экспрессируют один из 10 превалирующих fHBP вариантов.
Способы: Оценивали hSBA ответы к штаммам серологической группы В Neisseria meningitidis (MnB), экспрессирующим 10 наиболее превалирующих fHBP вариантов в США и Европе (В24, В16, В44, А22, В03, В09, А12, А19, А05 и А07) у отдельных субъектов-людей, иммунизированных двухвалентной rLP2086. MnB штаммы, экспрессирующие данные десять наиболее превалирующих вариантов представляют широту разнообразия fHBP, в том числе 5 из 6 основных подгрупп fHBP, которые являются типичными представителями >98% и 97% штаммов (по подгруппе) в пуле штамма MnB SBA, и подмножество пула штамма MnB SBA США, соответственно. Двадцать три MnB исследуемых штамма получали из пула штамма MnB SBA компании Pfizer (N=1263), который представляет штаммы, систематически собранные из США и Европы между годами 2000 и 2006. Кроме того, изоляты от недавних вспышек MnB заболеваний были включены в анализ. Соответствующие сыворотки перед вакцинацией и после вакцинации (после дозы 2 и после дозы 3) были получены случайным образом от подростков и молодых взрослых пациентов, включенных в клинические исследования В1971005, В1971012 или В1971003.
Для того, чтобы обеспечить дополнительную информацию, поддерживающую потенциальное покрытие, обеспечиваемой с помощью вакцинации двухвалентной rLP2086, hSBA выполняли с вспыхнувшими штаммами и образцами сыворотки от девяти субъектов, иммунизированных двухвалентной rLP2086 (клиническое исследование В1971012, описанное в примере 5 и примере 6. Субъекты (в возрасте от 11 до <19 лет) получали 3 дозы двухвалентной rLP2086 в 0, 2 и 6 месяц. Для того, чтобы обеспечить консервативную оценку hSBA девять субъектов были выбраны по способу без самовозврата из набора субъектов без какого-либо исходного уровня hSBA активности против первичных MnB исследуемых штаммов. Исследовали два из клональных штаммов вспышки Принстонского университета (РМВ5021 и РМВ5025) и двух штаммов вспышки UCSB (по одному от каждого из двух генетических кластеров, РМВ4478 и РМВ4479.
Генетическая характеристика клональных штаммов вспышки Принстонского университета является следующей: данные свидетельствуют о том, что штаммы вспышки Принстонского университета являются клональными. Каждый из штаммов был типичным как СС41/44 (ST 409) и экспрессированным вариантом fHBP В153 (SEQ ID NO: 6). Штаммы имели одинаковые назначения аллелей для NHBA (2), porA (подтип Р1,5-1,2-2) и porB (3-82), все были нулевые по nadA, и все имели один и тот же профиль импульсного поля гель-электрофореза (PFGE) (429).
Генетическая характеристика штаммов вспышки 2013 Калифорнийского университета в Санта-Барбаре является следующей: UCSB штаммы были типичным в виде СС32(ЕТ5; ST32), экспрессированный fHBP вариантом В24, и являются связанными с клоном Орегон, который был связан с гиперэндемической серологической группой В заболевания с 1993. В отличие от Принстонской группы вспышки штаммов, UCSB штаммы генетически сегрегированные в два различные кластеры, дифференцированные по их профилю PFGE (468 или 467) и porB типу (3-461 или 3-24). Штаммы имели одинаковые назначения аллелей для NadA (1), NHBA (5), porA (подтип Р1.7, 16-20).
hSBA титры при исходном уровне для всех субъектов и всех штаммов вспышки были <4, показывая, что субъекты не имели никаких защитных антител к какому-либо из штаммов вспышки перед иммунизацией двухвалентной rLP2086.
Результаты: Все 23 MnB штаммы были чувствительны к hSBA с сыворотками от отдельных субъектов, иммунизированных двухвалентной rLP2086. Штаммы, представляющие все 10 превалирующих fHBP вариантов, а также дополнительные штаммы были все убиты hSBA. Исходный уровень hSBA показатели серологической защиты (соотношения субъектов, у которых достигались титры hSBA ≥1:4), как правило, были низкими. Более низкие показатели серологической защиты, наблюдаемые у субъектов перед иммунизацией двухвалентной rLP2086, иллюстрируют уязвимость невакцинированных подростков или молодого взрослого населения к заболеванию MnB. Однако, показатели сильной серологической защиты наблюдались у подростков и молодых взрослых в сыворотке после вакцинации: показатели серологической защиты >70% наблюдались для 83% данных штаммов в зависимости от исследуемых MnB штаммов и популяции. Показатели серологической защиты после вакцинации для штаммов, экспрессирующих большинство fHBP вариантов В24 и А22, превалирующего подсемейства А и В, находились в диапазоне от 81,0% до 100%, и от 77,8% до 100% для штаммов недавних вспышек, экспрессирующих fHBP варианты В24 и В153. Кроме того, сильные ответы после дозы 2 (по сравнению с исходным уровнем) ко всем штаммам вспышки наблюдались у данных субъектов, которые находились в диапазоне от 56 до 89% в зависимости от штамма вспышки, которые использовали в hSBA. В противоположность этому, серозащитные показатели перед вакцинацией были низкими, или не обнаруживались, для недавних штаммов вспышки США. hSBA ответы к штаммам вспышки Принстонского университета и UCSB показаны на фиг. 2.
Выводы: Двухвалентная rLP2086 вызывает сильный серологически защитные hSBA ответы у индивидуумов к различным инвазивным штаммом MnB, экспрессирующим превалирующий fHBP в США и Европе, а также вновь возникающим вариантам (B153) (SEQ ID NO: 6). Соотношение субъектов, которые показали серологически защитный ответ после иммунизации двухвалентной rLP2086, значительно превышало количество субъектов, которые имели серологическую защиту на исходном уровне. Эти данные подтверждают, что двухвалентная rLP2086 имеет потенциал, чтобы обеспечить широкую защиту подростков и молодых взрослых от инвазивного менингококкового заболевания серологической группы В, включая заболевание от недавних вспышек.

ПРИМЕР 11: Иммуногенность и безопасность двухвалентной rLP2086, менингококковой серологической группы В вакцины, совместно вводимой с Tdap и MCV4 у подростков США
Фаза 2, рандомизированное, контролированное по активному веществу исследование с маскированием данных для наблюдателя для того, чтобы оценить безопасность, переносимость и иммуногенность MCV4, Tdap вакцины и двухвалентной rLP2086 вакцины, при совместном введении у здоровых субъектов в возрасте от ≥10 до <13 лет.
Основные сведения: Совместное введение двухвалентной rLP2086 с вакцинами, рекомендованными в США может улучшить соблюдение режимов вакцинирования.
Цель: Определить были ли иммунные ответы индуцированными совместным введением MENACTRA® [менингококковая А, С, Y и W-135 полисахаридная конъюгатная вакцина (MCV4)] и ADACEL® [столбнячный анатоксин, ослабленный дифтерийный анатоксин, ацеллюлярная коклюшная вакцина (Tdap)] с TRUMENBA® [менингококковая В (MnB) вакцина], одобренная в Соединенных Штатах (двухвалентная rLP2086)] были не уступающими MCV4 + Tdap или только двухвалентной rLP2086.
Дизайн/Способы: Здоровые подростки в возрасте от ≥10 до <13 лет получали MCV4 + Tdap + двухвалентную rLP2086, MCV4 + Tdap, или двухвалентную rLP2086. Иммуногенность двухвалентной rLP2086 оценивали с использованием сывороточного бактерицидного анализа, используя человеческий комплемент (hSBA) с 2 исследованными штаммами MnB, экспрессирующие вакцино-гетерологичные fHBP варианты; мультиплексированные LUMINEX анализы и/или кроличьи SBA оценивали иммуногенность MCV4/Tdap антигенов. Оценивали безопасность.
Результаты: 2648 субъектов получали MCV4 + Tdap + двухвалентную rLP2086, MCV4 + Tdap или двухвалентную rLP2086. Иммунные ответы к MCV4, Tdap, и двухвалентной rLP2086, полученные совместно, были не уступающими иммунным ответам к MCV4 + Tdap или только двухвалентной rLP2086. 62,3-68,0% и 87,5-90% реципиентов, получавших MCV4 + Tdap + двухвалентная rLP2086 после вакцинации 2 и 3, соответственно, имели предварительно заданные серологически защитные hSBA титры к 2 исследованным штаммам MnB; двухвалентная rLP2086 самостоятельно индуцировал подобные ответы. Совместное введение не приводило к значительному увеличению местных реакций или системных осложнений по сравнению с только двухвалентной rLP2086.
Двухвалентная rLP2086, вводимая совместно с MCV4 + Tdap, соответствовала всем критериям иммуногенности с не меньшей эффективностью без клинически значимого увеличения реактогенности. Пригодность, связанная с совместным введением может улучшить соблюдение рекомендованных режимов.
В данном исследовании (В1971015) оценивали иммуногенность четырехвалентной менингококковой полисахаридной конъюгатной (MCV4) вакцины; столбнячной, дифтерийной и ацеллюлярной коклюшной (Tdap) вакцины; и двухвалентной rLP2086 при совместном введении. Кроме того, оценивали безопасность, переносимость и иммуногенность двухвалентной rLP2086 у здоровых субъектов в возрасте от ≥10 до <13 лет в Соединенных Штатах. 2 исследованных штамма MnB использовали в hSBA для того, чтобы оценить не является ли меньшей эффективность иммунного ответа на двухвалентную rLP2086 при введении с или без лицензированных вакцин, экспрессирующих два наиболее распространенных fHBP в Соединенных Штатах, а именно А22 и В24.
Физиологический раствор использовали в качестве плацебо для поддержания слепого исследования, потому что не была доказанной безопасность, иммуногенность и эффективность вакцины против MnB, которая могла бы служить в качестве активного контроля. Кроме того, физиологический раствор был выбран в качестве инертного контроля в отличие от контрольной вакцины с эксципиентами (такими как алюминий), поскольку цель безопасности для описания профиля переносимости исследуемого продукта была выполнена с физиологическим раствором, а не с другой вакциной.
Приблизительно 2625 субъектов должны были принимать участие в данном исследовании приблизительно в 88 местах в Соединенных Штатах (приблизительно 30 субъектов в каждом месте). Субъектов случайным образом были отнесены к 1 из 3 групп в соотношении 1:1:1 (Группа 1 : Группа 2 : Группа 3) (Таблица А). Субъекты получали исследуемые продукты при каждом посещении вакцинации (Посещения 1, 3, и 5).
Субъекты, у которых было представлено какое-либо одно из следующих, не должны включаться в исследование: предыдущая вакцинация какой-либо менингококковой серологической группы В вакциной; вакцинация какой-либо дифтерийной, столбнячной или коклюшной вакциной в течение 5 лет после первой вакцинации исследования; предыдущая вакцинация какой-либо MCV4 вакциной.
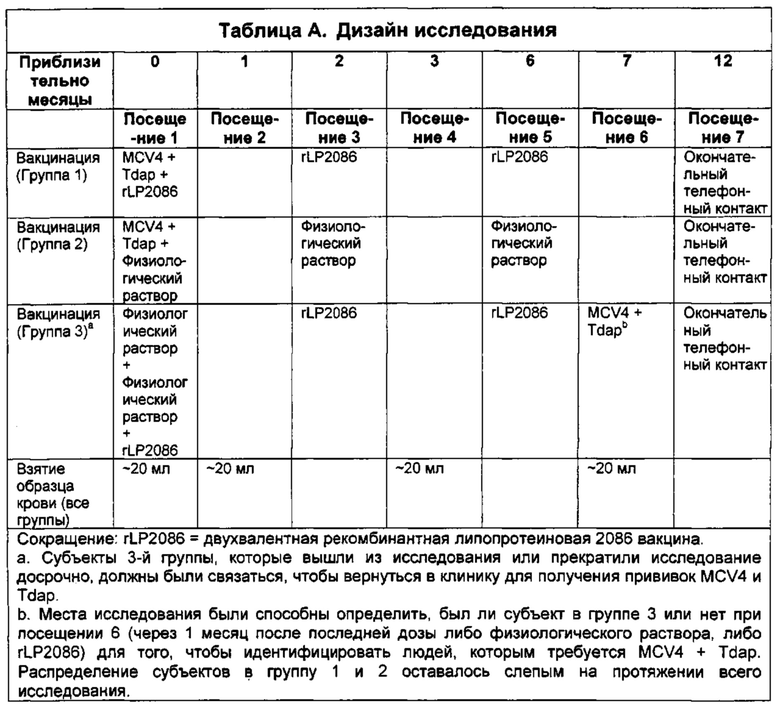
Во время исследования, субъекты в группах 1 и 3 получали двухвалентную rLP2086 приблизительно в 0, 2, и 6 месяцев (Посещения 1, 3 и 5, соответственно) в левую руку. Для субъектов в группе 2, физиологический раствор вводили путем внутримышечной (в.м.) инъекции (0,5 мл) приблизительно в 0, 2, и 6 месяцев (Посещения 1, 3, и 5, соответственно) в левую руку. Субъекты в группе 3 получали 2 в.м. инъекции физиологического раствора в 0 месяцев в правую руку. MCV4 и Tdap вакцины вводили один раз только в виде в.м. инъекции в 0 месяцев (Группы 1 и 2) в правую руку. После последнего взятие образца крови при посещении 6 (после вакцинации 3 - взятие образца крови), субъекты в группе 3 получали MCV4 и Tdap вакцины.
MCV4 и Tdap вакцины вводили один раз только в виде в.м. инъекции в 0 месяцев (Группы 1 и 2) в верхнюю дельтовидную мышцу правой руки. Вакцины вводили, по меньшей мере, на расстоянии 5 см друг от друга. Субъекты в группе 3 получали MCV4 и Tdap вакцины при посещении 6 после последнего взятия у них образца крови.
Образцы крови (приблизительно по 20 мл каждый) собирали непосредственно перед вакцинацией от 1, 28 до 41 дня после вакцинации от 1, 28 до 42 дней после вакцинации от 2, и 28 до 42 дней после вакцинации 3 для анализов на иммуногенность.
Использованная двухвалентная rLP2086 вакцина представляла собой 0,5 мл дозы, сформулированной таким образом, что содержала 60 мкг каждого из очищенного белка подсемейства А rLP2086 (варианта А05, SEQ ID NO: 1) и а очищенного белка подсемейства В rLP2086 (варианта В01, SEQ ID NO: 2), 0,15 М хлорида натрия, молярного соотношения к полисорбату 80 - 2,8, и 0,25 мг Al3+ в виде фосфата алюминия (AlPO4) в виде стабилизатора в 10 мМ гистидинового буферного физиологического раствора с pH 6,0.
Вакцина MCV4 представляла собой MENACTRA® [менингококковая (Группы А, С, Y и W-135) полисахаридная дифтерийно-анатоксиновая конъюгатная вакцина (MCV4)], коммерчески доступная вакцина. MENACTRA представляет собой раствор, поставляемый в виде 0,5 мл дозы для в.м. инъекции. Вакцина содержит капсульный полисахаридный антиген N. meningitidis серологической группы А, С, Y и W-135 индивидуально конъюгированный с белком дифтерийного анатоксина. Четыре менингококковых компонента, присутствующие в виде индивидуальных гликоконъюгатов, специфических к серологическим группам, составляют окончательно сформулированную вакцину. Во время производства не добавляется консервант или адъювант. Каждая доза 0,5 мл может содержать остаточные количества формальдегида менее 2,66 мкг (0,000532%), исходя из расчета. MENACTRA производится в виде стерильной, от прозрачной до слегка мутной жидкости. Каждая доза 0,5 мл вакцины формулируется в натрий фосфатном буферном изотоническом натрий хлоридном растворе, содержащем 4 мкг каждого из менингококковых А, С, Y и W-135 полисахаридов, конъюгированных с приблизительно 48 мкг дифтерийного анатоксинового белкого носителя.
Вакцина Tdap представляла собой ADACEL® (столбнячный анатоксин, ослабленный дифтерийный анатоксин и адсорбированную ацеллюлярную коклюшную вакцину [Tdap]), коммерчески доступную вакцину. ADACEL поставляется в виде 0,5 мл дозы для в.м. инъекция. Вакцина представляет собой стерильную изотоническую суспензию столбнячного и дифтерийного анатоксинов и коклюшные антигены, адсорбированные на фосфате алюминия. Каждые 0,5 мл дозы содержат 5 флокуллирующих единиц токсина (Lf) столбнячного анатоксина, 2 Lf дифтерийного анатоксина и ацеллюлярные коклюшные антигены (2,5 мкг детоксифицированного коклюшного токсина, 5 мкг филаментного гемагглютинина, 3 мкг пертактина [PRN], 5 мкг фимбрии типов 2 и 3). Другие ингредиенты на 0,5 мл дозы включают 1,5 мг фосфата алюминия (0,33 мг алюминия) в качестве адъюванта, ≤5 мкг остаточного формальдегида, <50 нг остаточного глутарового альдегида и 3,3 мг (0,6% об./об.) 2-феноксиэтанол (не в качестве консерванта). ADACEL не содержит консерванта.
Стерильный нормальный физиологический раствор для инъекции (0,9% хлорид натрия) был в 0,5 мл дозы.
Сывороточные бактерицидные анализы двухвалентной rLP2086. Для оценки иммунного ответа на двухвалентную rLP2086 функциональные антитела анализировали в валидированных hSBAs. hSBA измеряет антитела в сыворотке человека, которые приводят к опосредованному комплементом уничтожению мишенного штамма MnB. Сыворотки, полученные от всех субъектов в группах 1 и 3, перед первой вакцинацией двухвалентной rLP2086, приблизительно через 1 месяц после второй вакцинации двухвалентной rLP2086 (Посещение 3), и приблизительно через 1 месяц после третьей вакцинации двухвалентной rLP2086 (Посещение 5), исследовали в hSBA со штаммами РМВ80 [А22] и РМВ2948 [В24].
MCV4 сопутствующая вакцина SBA. Для оценки иммунного ответа на вакцину MCV4 функциональные антитела анализировали в сывороточных бактерицидных анализах с использованием кроличьего комплемента (rSBA) с менингококковыми штаммами, которые являются представителями серологических групп А, С, Y и W-135. Сыворотки, полученные от всех субъектов в группах 1 и 2 перед первой вакцинацией MCV4 (Посещение 1) и через 1 месяц после вакцинации MCV4 (Посещение 2) использовали в данных анализах.
Анализы обнаружения антигена для MCV4 и других сопутствующих вакцин. Оценки ответов на дифтерийные, столбнячные и коклюшные антитела проводили с использованием валидированного и мультиплексированного LUMINEX многоканального анализа (MCV4 LXA). Сыворотки, полученные от всех субъектов в группах 1 и 2 перед первой вакцинацией MCV4 и Tdap (Посещение 1) и через 1 месяц после вакцинации MCV4 и Tdap (Посещение 2), использовали в анализе. Дополнительной оценки ответов на менингококковые серологические группы А, С, Y и W-135 were осуществляли с использованием валидированного мультиплексированного LXA (A,C,Y,W LXA). Сыворотки, полученные от всех субъектов в группах 1 и 2 перед первой вакцинацией MCV4 и Tdap (Посещение 1) и через 1 месяц после вакцинации MCV4 и Tdap (Посещение 2), использовали в данных анализах.
Размер образца. Предполагалось, что ответы на антитела к 10 антигенам в продаваемых вакцинах и 2 штаммах MnB были независимыми. Критерии для разницы не меньшей эффективности составляли 1,5-раза.
Способы анализа. LLOQ для РМВ80 (А22) составлял 1:16, и LLOQ для РМВ2948 (В24) составлял 1:8. LLOQs для Tdap/MCV4 анализы перечислены в таблице В.
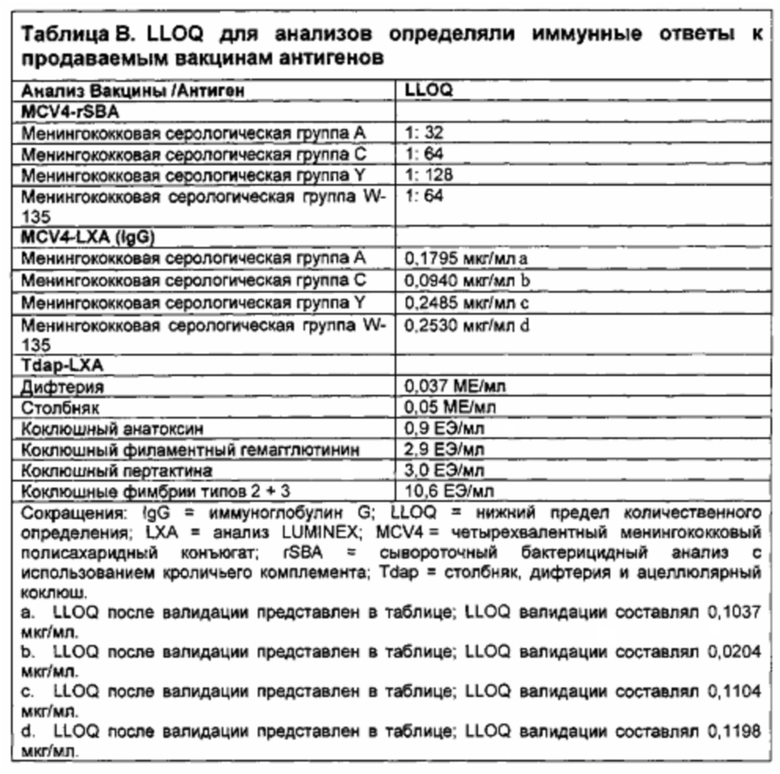
Анализ сопутствующих основных целей (целей не меньшей эффективности)
GMT и GMC. Для штаммов MnB РМВ80 (А22) и РМВ2948 (В24), титры hSBA, измеренные в каждом образце крови, отобранном в определенный момент времени (Посещения 1, 4, и 6) были логарифмически трансформированы для анализа, и GMT были рассчитаны для каждого первичного штамма и для каждой группы в каждой точке времени отбора образца крови вместе с 2-сторонними 95% доверительными интервалами (д. ин.). Д. ин. были построены с использованием обратного преобразования границ доверительных интервалов, рассчитанных для средних логарифмически трансформированных данных анализа на основе распределения Стьюдента. GMT, определенные в rSBA для каждого из 4 антигенов MCV4, и GMC, определенные в LXAsr для каждого из 4 антигенов MCV4, были просуммированы аналогичным образом при посещении 1 и посещении 2. GMC, определенный с помощью LXA для каждого из 6 антигенов в вакцине Tdap, были просуммированы при посещении 1 и посещении 2.
Геометрически средние соотношения. С целью исследования гипотез о не меньшей эффективности использовали геометрически средние соотношения (GMR) между соответствующими группами в каждом подходящем посещении (Группа 1/Группа 3 для титра hSBA при посещении 6 и Группа 1/ Группа 2 для антигенов MCV4/Tdap при посещении 2), вместе с 95% д. ин. Средняя разница логарифмически трансформированных результатов была эквивалентна среднему значения соотношения в логарифмической шкале: log (Группа 1/Группа 2) = log (Группа 1) - log (Группа 2). Для свойственного экспоненциального преобразования использовали расчет GMR. Аналогичным образом, 2-сторонние, 95% д. ин. для соотношений были построены с использованием обратного преобразования д. ин. для средней разности результатов логарифмически трансформированного анализа, рассчитанных с использованием распределения Стьюдента. Статистический вывод основывался на д. ин. GMR (т.е., нижняя граница 95% д. ин. составляла >0,67).
Не является ли продаваемая вакцина меньшей эффективности (Сопервичность для MCV4/Tdap). Для первой сопутствующей основной цели, титры антител или концентрации для каждого из 10 антигенов в продаваемых вакцинах, измеренных через 1 месяц после вакцинации (Посещение 2) были логарифмически трансформированы для анализа, и GM были рассчитаны для Группы 1 и Группы 2. 2-сторонний 95% д. ин. соотношения ([двухвалентная rLP2086+MCV4/Tdap]/[MCV4/Tdap]) GM, были представлены для каждого из 10 антигенов.
Не является ли вакцина rLP2086 меньшей эффективности (Сопервичность для двухвалентной rLP2086). Для второй сопутствующая сопутствующей основной цели, титры hSBA для каждого из 2 первичных штаммов, измеренных при посещении 6, были логарифмически трансформированы для анализа, и GMT были рассчитаны для Группы 1 и Группы 3. 2-сторонний 95% д. ин. GMR ([двухвалентная rLP2086+MCV/4Tdap]/двухвалентная rLP2086) были представлены для каждого из 2 первичных штаммов. Исследование сопутствующих основных целей касательно не меньшей эффективности обеих продаваемых вакцин (MCV4/Tdap) и исследуемого продукта (двухвалентной rLP2086) достигалось при более низких границах 2-стороннего 95% д. ин. для GMR при посещении 2 для ([двухвалентной rLP2086+MCV4/Tdap]/[MCV4/Tdap], и при посещении 6 для [двухвалентной rLP2086+MCV4/Tdap]/двухвалентной rLP2086), составляли больше, чем 0,67 для всех 10 MCV4/Tdap антигенов и каждого из 2 первичных штаммов. GMR (Группа 1/Группа 2) были описательно просуммированы с 2-сторонним 95% д. ин., для концентраций IgG для каждого из 4 антигенов в MCV4 при посещении 2.
Анализ данных hSBA. Количество и проценты субъектов, у которых достигались титры hSBA ≥LLOQ, ≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64, и ≥1:128 в каждой точке времени отбора образца крови, и с увеличением, по меньшей мере, в 2 раза, в 3 раза и в 4 раза титра hSBA по сравнению с исходным уровнем после вакцинации 2 и после вакцинации 3, были описательно просуммированы вместе с точным 2-сторонним 95% д. ин. (или границей доверительного интервала по методу Клоппера-Пирсона) доли для первичных MnB исследованных штаммов РМВ80 (А22) и РМВ2948 (В24) для Группы 1 и Группы 3. Точный д. ин. для соразмерности рассчитывались с использованием распределения F. В качестве дополнительного анализа касательно не меньшей эффективности двухвалентной rLP2086, показатель 4-кратного ответа hSBA для варианта А22 (РМВ80) и варианта В24 (РМВ2948) сравнивали между Группой 1 и Группой 3. Представленными были разница между показателями (двухвалентной rLP2086/MCV4/Tdap - двухвалентной rLP2086 или Группой 1 - Группой 3) и точным 2-сторонним 95% д. ин. при разнице. Точные д. ин. были рассчитаны с использованием статистики стандартизованного теста, и гамма = 0,000001. Это считалось описательным анализом.
Анализ иммуногенности MCV4/Tdap. Часть субъектов, у которых достигался серологический ответ для каждого антигена MCV4/Tdap, и часть субъектов, у которых достигался уровень антител ≥1,0 МЕ/мл к столбнячному и дифтерийному анатоксинам, были просуммированы с точными 2-сторонними 95% д. ин. для Группы 1 и Группы 2. Анализировали, не является ли эффективность меньшей по отношению к показателям серологического ответа для каждого антигена MCV4/Tdap, и процент субъектов, у которых достигался уровень антител ≥1,0 МЕ/мл к столбнячному и дифтерийному анатоксинам (Группа 1 - Группа 2). Иммунный ответ к двухвалентной rLP2086 и антигенам MCV4/Tdap при совместном введении. Анализ касательно не меньшей эффективности геометрически средних концентраций и геометрически средних титров к антигенам Tdap и MCV4. Первая сопутствующая основная цель данного исследования была продемонстрировать, что иммунный ответ, основанный на GMT (или GMC, где это применимо), индуцировался вакциной MCV4 и Tdap, вводимой с двухвалентной rLP2086 (Группа 1), был не уступающим иммунному ответу, индуцированному только вакцинами MCV4 и Tdap (Группа 2), которые были измерены через 1 месяц после первой вакцинации (Посещение 2) в обеих группах. Первичные конечные точки для первой сопутствующей основной цели представляли собой GMT или GMC для каждого из 10 антигенов в продаваемых вакцинах через 1 месяц после первой вакцинации (Посещение 2), среди субъектов в группах 1 и 2.
Сравнение GMT (или GMC, где это применимо) с 10 антигенами MCV4 и Tdap для Группы 1 и Группы 2, с их соответствующими GMT (или GMC, где это применимо) соотношениями (GMRs) Группы 1 к Группе 2, и 2-сторонними 95% д. ин. соотношениями, представлено в таблице С. Критерий степени различия не меньшей эффективности составлял 1,5 раза, который соответствует значению 0,67 для нижнего предела 2-стороннего 95% д. ин. GMR.
Для популяции, оцениваемой на иммуногенность, GMR от Группы 1 до Группы 2 через 1 месяц после вакцинации 1 для антигенов Tdap составляли 0,94 для дифтерийного анатоксина (95% д. ин.: 0,86, 1,03), 0,92 для столбнячного анатоксина (95% д. ин.: 0,85, 0,99), 0,93 для коклюшного анатоксина (95% д. ин.: 0,85, 1,02), 0,91 для коклюшного филаментного гемагглютинина (95% д. ин.: 0,84, 0,98), 0,88 для коклюшного пертактина (95% д. ин.: 0,80, 0,98), 0,90 для коклюшных фимбриальных агглютиногенов типов 2+3 (95% д. ин.: 0,74, 1,08); и GMR для антигенов MCV4 составляли 0,91 для серологической группы А (95% д. ин.: 0,82, 1,01), 1,02 для серологической группы С (95% д. ин.: 0,90, 1,15), 0,99 для серологической группы Y (95% д. ин.: 0,89, 1,09), и 0,93 для серологической группы W-135 (95% д. ин.: 0,83, 1,04). Таким образом, нижние пределы 2-стороннего 95% д. ин. для антигена MCV4 и Tdap GMR для Группы 1 по сравнению с Группой 2 составляли 0,86 для дифтерийного анатоксина, 0,85 для столбнячного анатоксина, 0,85 для коклюшного анатоксина, 0,84 для коклюшного филаментного гемагглютинина, 0,80 для коклюшного пертактина, 0,74 для коклюшных фимбриальных агглютиногенов типов 2+3, 0,82 для серологической группы А, 0,90 для серологической группы С, 0,89 для серологической группы Y, и 0,83 для серологической группы W-135. 1,5-кратный критерий 0,67 (нижний предел 2-стороннего 95% д. ин. GMR) был удовлетворительным для всех антигенов MCV4 и Tdap. Таким образом, первая сопутствующая основная цель соответствовала требованиям.
Иммунный ответ к антигенам Tdap+MCV4, когда данные вакцины вводились совместно с двухвалентной rLP2086, не уступал иммунному ответу, полученному когда они вводились по-отдельности.


Сокращения: ELISA = фермент-связанное иммуносорбентное исследование; EU = ELISA единицы; GM = геометрически среднее; hSBA = сывороточный бактерицидный анализ с использованием человеческого комплемента; LLOQ = нижний предел количественного определения; MCV4 = четырехвалентная менингококковая полисахаридная конъюгатная (вакцина), MnB = Neisseria meningitidis серологической группы В; Н.А. = не анализировалось; rSBA = сывороточный бактерицидный анализ с использованием кроличьего комплемента; Tdap = столбнячная, дифтерийная, и ацеллюлярная коклюшная (вакцина).
Примечание: Для того, чтобы первичная гипотиза исследования была успешной, нижняя граница 95% д. ин. GM соотношения для всех антигенов Tdap/MCV4 и штаммов MnB должна составлять >0,67.
Примечание: Для антигенов Tdap и MCV4, после вакцинации 1 использовали популяцию, оцениваемую на иммуногенность; для штаммов MnB, после вакцинации 3 использовали популяцию, оцениваемую на иммуногенность. Антигены Tdap/MCV4 не исследовались в Группе 3 субъектов, и штаммы MnB не исследовались для Группы 2 субъектов.
Примечание: LLOQ = 0,037 МЕ/мл для дифтерии; 0,05 МЕ/мл для столбняка; 0,9 ЕЭ/мл для коклюшного анатоксина; 2,9 ЕЭ/мл для коклюшного филаментного гемагглютинина; 3,0 ЕЭ/мл для коклюшного пертактина; 10,6 ЕЭ/мл для коклюшных фимбриальных агглютиногенов типов 2+3. LLOQ = 1:32 для MCV4 серологической группы А, 1:64 для серологической группы С, 1:128 для серологической группы Y, и 1:64 для серологической группы W-135. LLOQ = 1:16 для А22; 1:8 для В24. Результаты ниже LLOQ были представлены для 0,5 × LLOQ для анализа.
a. N = количество субъектов с проверенными и определенными разультатами анализа для вводимого антигена или штамма.
b. GM рассчитывали с использованием всех субъектов с проверенными и определенными разультатами анализа через 1 месяц после последней вакцинации (Посещение 6 для hSBA результатов и Посещение 2 для всех других результатов).
c. Доверительные интервалы (д. ин.) представляют собой обратные преобразования доверительных уровней, основанных на Распределение t-критерия Стьюдента для среднего логарифма результатов анализа.
d. Соотношениями GM (Группа 1/Группа 2 для антигенов Tdap/MCV4, и Группа 1/Группа 3 для штаммов MnB).
e. д. ин. для соотношения представляют собой обратные преобразования доверительного интервала, основанного на распределении t-критерия Стьюдента для средней разницы логарифмов измерений (Группа 1 - Группа 2 для антигенов Tdap/MCV4, и Группа 1 - Группа 3 для штаммов MnB).
Анализ касательно не меньшей эффективности для hSBA GMT на двухвалентную rLP2086.
Вторая сопутствующая основная цель данного исследования состояла в том, чтобы продемонстрировать, что ответ hSBA на первичные штаммы РМВ80 (А22) и РМВ2948 (В24) (основанный на GMT), который индуцировался MCV4+Tdap+двухвалентной rLP2086 (Группа 1), был не уступающим иммунному ответу, который индуцировался физиологическим раствором + физиологическим раствором + двухвалентной rLP2086 (Группа 3). hSBA осуществлялся через 1 месяц после третьей вакцинации (Посещение 6) двухвалентной rLP2086 для обеих групп. Первичные конечные точки для второй сопутствующей основной целью представляли собой оценку hSBA GMT для каждого из 2 первичных штаммов (РМВ80 [А22] и РМВ2948 [В24]), измеренных через 1 месяц после третьей дозы двухвалентной rLP2086 (Посещение 6), которая была введена субъектам в группе 1 (MCV4+Tdap+двухвалентная rLP2086) и Группа 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086).
Таблица С представляет сравнение hSBA GMT с 2 первичными MnB исследованными штаммами для Группы 1 и Группы 3 с их соответствующими GMR Группы 1 к Группе 3, и соотношениями 2-сторонних 95% д. ин., для популяции, оцениваемой на иммуногенность. Критерий степени различия не меньшей эффективности составлял 1,5 раза, который соответствует значению 0,67 для нижнего предела 2-стороннего 95% д. ин. GMR.
Для популяции, оцениваемой на иммуногенность, hSBA GMT на 2 первичных штаммах MnB через 1 месяц после вакцинации 3 (двухвалентной rLP2086) для Группы 1 и Группы 3 были следующими: 45,9 и 49,7, соответственно, для РМВ80 (А22), и 24,8 и 27,4, соответственно, для РМВ2948 (В24). GMR группы MCV4+Tdap+двухвалентной rLP2086 к группе, которая получала физиологический раствор + физиологический раствор + двухвалентную rLP2086 через 1 месяц после вакцинации 3 (двухвалентной rLP2086) составляли 0,92 для РМВ80 (А22) (95% д. ин.: 0,84, 1,02) и 0,90 для РМВ2948 (В24) (95% д. ин.: 0,82, 1,00). Нижние пределы 2-стороннего 95% д. ин. для hSBA GMR для Группы 1 по сравнению с Группой 3 составляли 0,84 для РМВ80 (А22) и 0,82 для РМВ2948 (В24), оба из которых являются больше, чем 0,67 и предел разницы не меньшей эффективности 1,5 раза соответствовал требованиям. Таким образом, достигалась вторая сопутствующая основная цель.
Иммунный ответ на двухвалентную rLP2086 вакцину, когда ее вводили совместно с Tdap+MCV4, был не уступающим иммунному ответу, полученному, когда вакцину вводили самостоятельно.
Анализ касательно не меньшей эффективности для сопутствующих основных целей.
Первая сопутствующая основная цель касательно не меньшей эффективности двухвалентной rLP2086, вводимой с вакцинами MCV4 и Tdap по сравнению как с вакциной MCV4, так и Tdap самостоятельно тестировали путем исследования предела разницы не меньшей эффективности, установленной в 1,5 раза, который соответствует значению 0,67 для нижнего предела 2-стороннего 95% д. ин. GMR для каждого из 10 антигенов MCV4 и Tdap для популяции, оцениваемой на иммуногенность после вакцинации 1. Данный критерий был удовлетворительным для всех тестированных антигенов MCV4 и Tdap.
Вторая сопутствующая основная цель касательно не меньшей эффективности двухвалентной rLP2086, вводимой с вакцинами MCV4 и Tdap по сравнению с двухвалентной rLP2086, вводимой самостоятельно, тестировали путем исследования предела разницы не меньшей эффективности, установленной в 1,5 раза, который соответствует значению 0,67 для нижнего предела 2-стороннего 95% д. ин. GMR для каждого из 2 первичных штаммов MnB (варианты А22 и В24) в популяции, оцениваемой на иммуногенность после вакцинации 3, при измерении через 1 месяц после вакцинации 3. Данный критерий соответствовал требованиям для обоих MnB исследованных штаммов РМВ80 (А22) и РМВ2948 (В24).
Таким образом, обе сопутствующих основных цели были достигнуты в 1,5-кратном диапазоне разницы не меньшей эффективности для всех антигенов в вакцинах Tdap, MCV4, и двухвалентной rLP2086.
Описание показателей серологического ответа MCV4/Tdap. Одной из второстепенных целей данного исследования было описание серологических ответов на антигены, содержащиеся в MCV4 и Tdap (Группы 1 и 2) при измерении через 1 месяц после вакцинации MCV4 и Tdap (Посещение 2).
Показатели серологических ответов для 10 антигенов Tdap и MVC4 с соответствующими 95% д. ин. в каждой группе, и процентные различия (Группа 1 - Группа 2), и 95% д. ин. разниц представлены в таблице D для популяции оцениваемой на иммуногенность после вакцинации 1.
Для популяции, оцениваемой на иммуногенность, показатели серологического ответа для 6 антигенов Tdap через 1 месяц после вакцинации 1 для Группы 1 и Группы 2 были следующими: 98,6% и 98,3%, соответственно (дифтерийный анатоксин); 97,7% и 97,4%, соответственно (столбнячный анатоксин); 68,1 и 72,7%, соответственно (коклюшный анатоксин); 85,3% и 89,2%, соответственно (коклюшный филаментный гемагглютинин); 96,0% и 96,2%, соответственно (коклюшный пертактин); и 79,5% и 81,9%, соответственно (коклюшные фимбриальные агглютиногены типов 2+3). Для популяции, оцениваемой на иммуногенность, показатели серологического ответа для 4 антигенов MCV4 через 1 месяц после вакцинации 1 для Группы 1 и Группы 2 были следующими: 85,4% и 88,6%, соответственно (для серологической группы А); 89,3% и 88,9%, соответственно (для серологической группы С); 90,5% и 93,6%, соответственно (для серологической группы Y); и 97,1% и 97,2%, соответственно (для серологической группы W-135). Разницы в показателях серологического ответа Группы 1 - Группы 2 через 1 месяц после вакцинации 1 составляли 0,2% для дифтерийного анатоксина (95% д. ин.: (-1,1, 1,6), 0,2% для столбнячного анатоксина (95% д. ин.: -1,4, 1,8), -4,6% для коклюшного анатоксина (95% д. ин.: -9,1, -0,1), -4,0% для коклюшного филаментного гемагглютинина (95% д. ин.: -7,3, -0,6), -0,2% для коклюшного пертактина (95% д. ин.: -2,1, 1,8), -2,5% для коклюшных фимбриальных агглютиногенов типов 2+3 (95% д. ин.: -6,4, 1,5), -3,2% для серологической группы А (95% д. ин.: -6,7, 0,3), 0,3% для серологической группы С (95% д. ин.: -2,8, 3,5), -3,2% для серологической группы Y (95% д. ин.: -6,0, -0,4), и -0,1% для серологической группы W-135 (95% д. ин.: -1,9, 1,7).
Для группы, получавшей MCV4+Tdap+двухвалентную rLP2086 (Группа 1), и группы, получавшей MCV4+Tdap+физиологический раствор (Группа 2), различия показателей установленного серологического ответа составляли от -4,6% до 0,3% для 6 антигенов Tdap и 4 MCV4, с нижними границами 95% д. ин. разницы показателей -9,1% или больше (то есть, все больше, чем -10%).
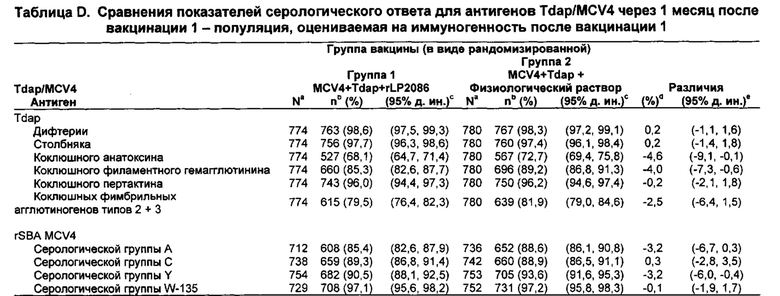
Сокращения: ELISA = фермент-связанное иммуносорбентное исследование; EU = ELISA единицы; LLOQ = нижний предел количественного определения; MCV4 = четырехвалентная менингококковая полисахаридная конъюгатная (вакцина); rSBA = сывороточный бактерицидный анализ с использованием кроличьего комплемента; Tdap = столбнячная, дифтерийная, и ацеллюлярная коклюшная (вакцина).
Примечание: Серологический ответ определяют как: (1) для антигенов Tdap, ≥ в 4 раза возросшая концентрация антител, если концентрация антител предварительной вакцинации является ≤ предельного значения, и ≥ в 2 раза выше возросшая концентрация антител, если концентрация антител предварительной вакцинации является > предельного значения. (2) Для MCV4, серологический ответ определяют как ≥ в 4 раза возрастание титров rSBA, если исходное значение составляет ≥ LLOQ, и после дозовые титры rSBA ≥2×LLOQ, если исходное значение составляет <LLOQ.
Примечание: Предельное значение = 0,1 МЕ/мл для дифтерии; 0,1 МЕ/мл для столбняка; 0,9 ЕЭ/мл для коклюшного анатоксина; 2,9 ЕЭ/мл для коклюшного филаментного гемагглютинина; 3,0 ЕЭ/мл для коклюшного пертактина; 10,6 ЕЭ/мл для коклюшных фимбрильных агглютиногенов типов 2+3. LLOQ = 1:32 для MCV4 серологической группы А, 1:64 для серологической группы С, 1:128 для серологической группы Y, и 1:64 для серологической группы W-135.
a. N = количество субъектов с проверенными и определенными разультатами анализа для вводимого антиген как в конкретной точке времени, так и исходного уровня.
b. n = Количество субъектов с серологическим ответом.
c. Точные 2-сторонние доверительные интервалы (д. ин.), основанные на наблюдаемой части субъектов с использованием метода Клоппера-Пирсона.
d. Различия в частях, выраженные в процентах.
e. Точные 2-сторонние д. ин. (основанные на Chan и Zhang) для разницы в частях, выраженных в процентах.
Описание возрастания в 4 раза титра hSBA. MCV4+Tdap+двухвалентная rLP2086 (Группа 1) по сравнению с физиологическим раствором + физиологическим раствором + двухвалентной rLP2086 (Группа 3), путем анализирования титра hSBA 4 кратных показателей ответа для 2 первичных MnB штаммов (РМВ80 [А22] и РМВ2948 [В24]) через 1 месяц после вакцинации 3. Количество и доля субъектов, у которых достигался титр hSBA ≥4 кратное возрастание по сравнению с исходным уровнем через 1 месяц после вакцинации 3 для 2 первичных MnB штаммов с соответствующими 95% д. ин. в каждой группе, процентные различия (Группа 1 - Группа 3) в части, и 95% д. ин. разниц представлены в таблице Е для популяции, оцениваемой на иммуногенность после вакцинации 3.
Части субъектов, у которых достигалось ≥4 кратное возрастание титра hSBA по сравнению с исходным уровнем через 1 месяц после вакцинации 3 для 2 первичных MnB исследованных штаммов были измеренными как для Группы 1 субъектов, которые получали MCV4+Tdap+двухвалентная rLP2086, и Группы 3 субъектов, которые получали физиологический раствор + физиологический раствор + двухвалентная rLP2086. Из субъектов в группе 1, 84,0% продемонстрировало ≥4 кратное возрастание титра hSBA по сравнению с исследованным штаммом РМВ80 (А22), и 85,7% продемонстрировало ≥4 кратное возрастание титра hSBA по сравнению с исследованным штаммом РМВ2948 (В24). Из субъектов в группе 3, 88,7% продемонстрировало ≥4 кратное возрастание титра hSBA по сравнению с исследованным штаммом РМВ80 (А22), и 87,7% продемонстрировало ≥4 кратное возрастание титра hSBA по сравнению с исследованным штаммом РМВ2948 (В24).
Разница в части субъектов, у которых достигалось ≥4 кратное возрастание титра hSBA между Группой 1 и Группой 3 через 1 месяц после вакцинации 3 составляла -4,7% для РМВ80 (А22) (95% д. ин.: -8,4, -1,1) и -2,1% для РМВ2948 (В24) (95% д. ин.: -5,7,1,6). Оценочные различия показателя ответа в 4 раза были небольшими (<5,0%), с нижними границами 95% д. ин. части, где разница составляет -8,4% (РМВ80 [А22]) и -5,7% (РМВ2948 [В24]).

Сокращения: hSBA = сывороточный бактерицидный анализ с использованием человеческого комплемента; LLOQ = нижний предел количественного определения; LOD = предел обнаружения. Примечание: Исходный уровень определяют в виде образца крови, взятого перед вакцинацией 1. Примечание: 4-кратное увеличение определяют следующим образом: (1) Для субъектов с исходным уровнем титра hSBA<LOD, или титр hSBA<LLOQ, 4-кратный ответ определяют как титр hSBA ≥4 кратному LLOQ. (2) Для субъектов с исходным уровнем титра hSBA ≥LLOQ, 4-кратный ответ определяют как титр hSBA ≥4 кратный титр исходного уровня.
a. N = количество субъектов с проверенными и определенными титрами hSBA в исходном состоянии и через 1 месяц после вакцинации 3 для вводимого штамма.
b. n = Количество субъектов, у которых достигался, по меньшей мере, 4-кратный ответ через 1 месяц после вакцинации 3 для вводимого штамма.
c. Точный 2-сторонний доверительный интервал (д. ин.) основанный на наблюдаемой части субъектов с использованием метода Клоппера-Пирсона.
d. Различия в частях, выраженные в процентах.
e. Точный 2-сторонний д. ин. и соответствующее р-значение (основанный на Chan & Zhang) для разницы в частях, выраженных в процентах.
Обобщенные результаты иммунного ответа на двухвалентную rLP2086 и антигены MCV4 и Tdap при совместном введении. Критерии не меньшей эффективности для двухвалентной rLP2086, вводимой с вакцинами MCV4 и Tdap по сравнению как с вакцинами MCV4 и Tdap самостоятельно или по сравнению с вводимыми физиологический раствор + физиологический раствор + двухвалентная rLP2086, требовали, чтобы нижние пределы 2-стороннего 95% д. ин. для GMR составляли больше, чем 0,67 для каждого из 10 антигенов MCV4/Tdap (через 1 месяц после вакцинации 1) и для каждого из 2 первичных MnB исследованных штаммов (А22 и В24) (через 1 месяц после вакцинации 3). Данный предварительно заданный порог соответствовал требованиям как для MnB исследованных штаммов, так и каждого из 10 антигенов Tdap и MCV4.
Для группы, получавшей MCV4+Tdap+двухвалентную rLP2086 (Группа 1), и группы, получавшей MCV4+Tdap+физиологический раствор (Группа 2), различия показателей установленного серологического ответа составляли от -4,6% до 0,3% для антигенов 6 Tdap и 4 MCV4, с нижними границами показателей разницы 95% д. ин. равными 9,1% или меньше (все различия были больше, чем -10%). Возрастание ответов hSBA ≥ в 4 раза для 2 первичных MnB исследованных штаммов (А22 и В24) были подобными (находились в диапазоне от 84,0% до 88,7%) между группой, которая получала MCV4+Tdap+двухвалентную rLP2086, и группой, которая получала физиологический раствор + физиологический раствор + двухвалентная rLP2086.
Иммунный ответ на двухвалентную rLP2086. Титры hSBA ≥LLOQ (Описательная конечная точка).
Одна из второстепенных целей данного исследования заключалась в описании иммунного ответа, как измерено с помощью hSBA, осуществленной с 2 первичными MnB исследованными штаммами, 1-им экспрессирующим LP2086 подсемейства А (РМВ80 [А22]) и 1-им экспрессирующим LP2086 подсемейства В (РМВ2948 [В24]), измеренными через 1 месяц после второй (Посещение 4) и третьей (Посещение 6) вакцинаций двухвалентной rLP2086.
Одна из описательных вторичных конечных точек для данной вторичной цели представляла собой часть субъектов с титрами hSBA ≥LLOQ через 1 месяц после вакцинации 2 (Посещение 4) и через 1 месяц после вакцинации 3 (Посещение 6) для каждого из 2 первичных MnB исследованных штаммов. Часть субъектов с титром hSBA ≥LLOQ для каждого из 2 первичных MnB исследованных штаммов для популяции, оцениваемой на иммуногенность после вакцинации 3, представлена в таблице F. Обратите внимание, что LLOQ для РМВ80 (А22) был титром hSBA равным 1:16, тогда как LLOQ для РМВ2948 (В24) был титром hSBA равным 1:8.
Для группы 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086), часть субъектов с титром hSBA ≥LLOQ на исходном уровне (перед вакцинацией 1) составляла 5,6% для РМВ80 (А22) и 3,4% для РМВ2948 (В24). Для группы 3 (физиологический раствор + физиологический раствор + двухвалентной rLP2086), части субъектов, у которых достигался титр hSBA ≥LLOQ через 1 месяц после вакцинации 2 и через 1 месяц после вакцинации 3, составляли 68,0% и 91,4%, соответственно, для РМВ80 (А22) и 66,0% и 92,7%, соответственно, для РМВ2948 (В24).
Для группы 1 (MCV4+Tdap+двухвалентная rLP2086), часть субъектов с титром hSBA ≥LLOQ на исходном уровне (перед вакцинацией 1) составляла 4,4% для РМВ80 (А22) и 1,6% для РМВ2948 (В24). Для группы 1 (MCV4+Tdap+двухвалентная rLP2086), части субъектов, у которых достигался титр hSBA ≥LLOQ через 1 месяц после вакцинации 2 и через 1 месяц после вакцинации 3 составляли 68,0% и 87,5%, соответственно, для РМВ80 (А22); и 62,3% и 90,0%, соответственно, для РМВ2948 (В24).
По сравнению с перед вакцинацией 1, существенное увеличение части субъектов с титром hSBA ≥ LLOQ для 2 первичных MnB исследованных штаммов наблюдалось среди как Группы 1, так и Группы 3 субъектов через 1 месяц после вакцинации 2, с дополнительным увеличением, наблюдаемым через 1 месяц после вакцинации 3. Ответы hSBA в группах 1 и 3 популяций, оцениваемых на иммуногенность, были подобные.

Сокращения: hSBA = сывороточный бактерицидный анализ с использованием человеческого комплемента; LLOQ = нижний предел количественного определения.
Примечание: LLOQ = 1:16 для А22; 1:8 для В24.
a. N = количество субъектов с проверенным и определенным титром hSBAы для вводимого штамма.
b. n = Количество субъектов с наблюдаемым титром hSBA ≥LLOQ для вводимого штамма в данной точке времени.
c. Точный 2-сторонний доверительный интервал (д. ин.), основанный на наблюдаемой части субъектов с использованием метода Клоппера-Пирсона.
Титры hSBA, которые достигали определенного уровня
Другой вторичной конечной точкой была доля субъектов с титрами hSBA ≥LLOQ, ≥1:4, ≥1:8, ≥1:16, ≥1:32, ≥1:64 и ≥1:128 для каждого из 2 первичных MnB исследованных штаммов в каждой точке времени отбора образца крови.
Субъекты, у которых достигался титр hSBA ≥1:4 и ≥1:16, описываются ниже. Титр hSBA ≥1:4 широко признается в качестве коррелята защиты против IMD; однако, более консервативный титр hSBA ≥1:16 рассматривался уровнем, свидетельствующим о 4-кратном эффекте вакцины для субъектов серологически негативных при пре-вакцинации.
Соотношения субъектов в Группе 1 (MCV4+Tdap+двухвалентная rLP2086) и Группе 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086) с пре-вакцинацией (то есть, перед вакцинацией 1) титр hSBAы ≥1:4 составляли 6,9% и 7,5%, соответственно, для штамма РМВ80 (А22); и 2,1% и 3,7%, соответственно, для штамма РМВ2948 (В24). Кроме того, части субъектов в группах 1 и 3 с пре-вакцинационными титрами hSBA ≥1:16 составляли 4,4% и 5,6%, соответственно, для штамма РМВ80 (А22); и 1,5% и 2,1%, соответственно, для штамма РМВ2948 (В24).
В группе 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086), часть субъектов с титром hSBA ≥1:4 через 1 месяц после вакцинации 2 составляла 68,6% для РМВ80 (А22) и 68,2% для РМВ2948 (В24). Через один (1) месяц после вакцинации 3, часть субъектов с титром hSBA ≥1:4 составляла 91,7% для РМВ80 (А22) и 93,1% для РМВ2948 (В24). В группе 1 (MCV4+Tdap+двухвалентная rLP2086), часть субъектов с титром hSBA ≥1:4 через 1 месяц после вакцинации 2 составляла 68,2% для РМВ80 (А22) и 64,8% для РМВ2948 (В24). Через один (1) месяц после вакцинации 3, часть субъектов с титром hSBA ≥1:4 составляла 87,8% для РМВ80 (А22) и 90,7% для РМВ2948 (В24).
В группе 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086), часть субъектов с титром hSBA ≥1:16 через 1 месяц после вакцинации 2 составляла 68,0% для РМВ80 (А22) и 60,3% для РМВ2948 (В24). Через один (1) месяц после вакцинации 3, часть субъектов с титром hSBA ≥1:16 составляла 91,4% для РМВ80 (А22) и 88,9% для РМВ2948 (В24). В группе 1 (MCV4+Tdap+двухвалентная rLP2086), часть субъектов с титром hSBA ≥1:16 через 1 месяц после вакцинации 2 составляла 68,0% для РМВ80 (А22) и 57,6% для РМВ2948 (В24). Через один (1) месяц после вакцинации 3, часть субъектов с титром hSBA ≥1:16 составляла 87,5% для РМВ80 (А22) и 86,7% для РМВ2948 (В24).
Для как Группы 1, так и Группы 3, у большинства субъектов достигался титр hSBA 1:16 или больше после 2 или 3 доз двухвалентной rLP2086, тогда как относительно небольшое количество субъектов имело измеряемый титр hSBA к какому-либо из первичных MnB исследованных штаммов в пре-вакцинационное Посещение 1.
hSBA Геометрически средние титры. Другая вторичная конечная точка представляла собой hSBA GMT для каждого из 2 первичных MnB исследованных штаммов в каждой применимой точке времени отбора образца крови. Таблица G представляет hSBA GMT для каждого из 2 первичных MnB исследованных штаммов и соответствующие д. ин. по точке времени отбора образца для Группы 1 и Группы 3 популяции, оцениваемой на иммуногенность, после вакцинации 3. GMT на исходном уровне были ниже LLOQ hSBA для обеих групп. Для группы 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086), hSBA GMT через 1 месяц после вакцинации 2 составляли 23,8 для РМВ80 (А22) и 13,0 для РМВ2948 (В24). hSBA GMT через 1 месяц после вакцинации 3 составляли 49,7 для РМВ80 (А22) и 27,4 для РМВ2948 (В24). Для группы 1 (MCV4+Tdap+двухвалентной rLP2086), hSBA GMT через 1 месяц после вакцинации 2 составляли 23,7 для РМВ80 (А22) и 12,0 для РМВ2948 (В24). hSBA GMT через 1 месяц после вакцинации 3 составляли 45,9 для РМВ80 (А22) и 24,8 для РМВ2948 (В24). hSBA ответы, как измеренные с помощью GMT, были подобными между Группами 1 и 3.
Обратные интегральные кривые распределения для титров hSBA
Обратные интегральные кривые распределения (RCDC), показывающие распределение титра hSBAы для РМВ80 (А22) и РМВ2948 (В24), оценивали для групп 1 и 3 во всех точках времени отбора образцов для популяции, оцениваемой на иммуногенность, после вакцинации 3. RCDC показывали, что большинство субъектов имели ответ после вакцинации 2 и имели дополнительное увеличение титра для 2 первичных MnB исследованных штаммов после вакцинации 3. Иммунные ответы на антигены были подобными для групп 1 и 3.
hSBA ≥4-кратный ответ
Предварительно заданная, исследовательская цель данного исследования представляла собой описание иммунного ответа на двухвалентную rLP2086, как измерено 4-кратным ответом в титре hSBA, осуществленным с 2 первичными MnB исследованными штаммами, 1 экспрессирующим белки LP2086 подсемейства А и 1 экспрессирующим белки LP2086 подсемейства В, измеренные через 1 месяц после второй и третий вакцинаций (Посещение 3 и Посещение 5) с двухвалентной rLP2086.
Конечные точки для исследовательской цели представляли собой часть субъектов, у которых достигалось, по меньшей мере, 4-кратное увеличение титра hSBA к 2 MnB штаммам, РМВ80 (А22) и РМВ2948 (В24), по сравнению с исходным уровнем через 1 месяц после второй и третий вакцинаций с двухвалентной rLP2086. Обратите внимание, что LLOQ для РМВ80 (А22) представлял собой титр hSBA, равный 1:16, в то время как LLOQ для РМВ80 (А22) представлял собой титр hSBA равный 1:8. 4-кратный ответ определяли следующим образом: для субъектов с исходным уровнем титра hSBA ниже предела обнаружения (LOD) или титра hSBA<1:4, 4-кратный ответ определяли как титр hSBA ≥1:16. Для субъектов с исходным уровнем титра hSBA ≥LOD (то есть, титр hSBA ≥1:4) и <LLOQ, 4-кратный ответ определяли как титр hSBA ≥4 кратному LLOQ. Для субъектов с исходным уровнем титра hSBA ≥LLOQ, 4-кратный ответ определяли как титр hSBA ≥4 кратному титру исходного уровня.
Часть субъектов, у которых достигался титр hSBA, возросший в ≥4 раза, для каждого из 2 первичных MnB исследованных штаммов для популяции, оцениваемой на иммуногенность, после вакцинации 3 представлены для Группы 1 (MCV4+Tdap+двухвалентная rLP2086) и Группы 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086) в таблице Н.
Для группы 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086), часть субъектов, у которых достигался титр hSBA возросший в ≥4 раза по сравнению с исходным уровнем через 1 месяц после вакцинации 3, составляла 88,7% для РМВ80 (А22) и 87,7% для РМВ2948 (В24). Через 1 месяц после вакцинации 2, часть субъектов, у которых достигался титр hSBA, возросший в ≥4 раза по сравнению с исходным уровнем, составляла 63,7% для РМВ80 (А22) и 58,4% для РМВ2948 (В24).
Для группы 1 (MCV4+Tdap+двухвалентная rLP2086), часть субъектов, у которых достигался титр hSBA, возросший в ≥4 раза по сравнению с исходным уровнем через 1 месяц после вакцинации 3, составляла 84,0% для РМВ80 (А22) и 85,7% для РМВ2948 (В24). Через 1 месяц после вакцинации 2, часть субъектов, у которых достигался титр hSBA, возросший в ≥4 раза по сравнению с исходным уровнем, составляла 64,3% для РМВ80 (А22) и 56,3% для РМВ2948 (В24).
hSBA ответы, как измерено с помощью 4-кратного ответа титра, были подобными между Группами 1 и 3.
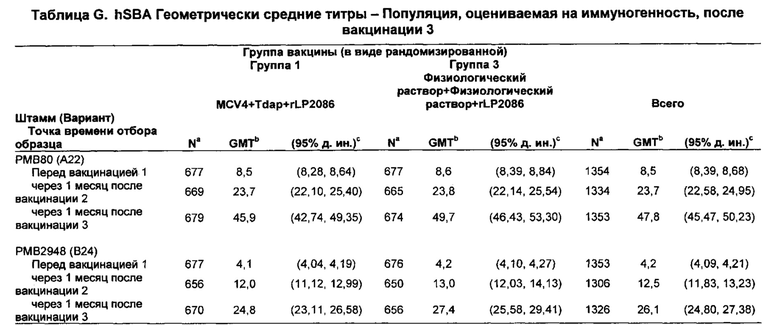
Сокращения: GMT = геометрически средний титр; hSBA = сывороточный бактерицидный анализ с использованием человеческого комплемента; LLOQ = нижний предел количественного определения.
Примечание: LLOQ = 1:16 для А22; 1:8 для В24. Титры ниже LLOQ были представлены до 0,5 × LLOQ для анализа.
a. N = количество субъектов с проверенным и определенным титром hSBAы для вводимого штамма.
b. GMT рассчитывали с использованием всех субъектов с проверенным и определенным титром hSBA в заданной точке времени.
c. Доверительные интервалы (д. ин.) представляют собой обратные преобразования доверительных уровней, основанных на распределении t-критерия Стьюдента для среднего логарифма результатов анализа.

Сокращения: hSBA = сывороточный бактерицидный анализ сиспользованием человеческого комплемента; LLOQ = нижний предел количественного определения; LOD = предел обнаружения.
Примечание: LLOQ = 1:16 для А22; 1:8 для В44.
Примечание: Исходный уровень определяют как взятие образца крови перед вакцинацией 1.
Примечание: 4-кратное увеличение определяют следующим образом: (1) для субъектов с исходным уровнем титра hSBA<LOD (титр hSBA<1:4), ответ определяют как титр hSBA ≥1:16. (2) для субъектов с исходным уровнем титра hSBA ≥LOD (титр hSBA ≥1:4) и <LLOQ, ответ определяют как титр hSBA ≥4 кратному LLOQ. (3) для субъектов с исходным уровнем титра hSBA ≥LLOQ, 4-кратный ответ определяют как титр hSBA ≥4 кратному титру исходного уровня.
a. N = количество субъектов с проверенным и определенным титром hSBAы для вводимого штамма как в конфетный момент времени, так и исходный уровень.
b. n = количество субъектов, у которых достигался титр hSBA возросший в ≥4 раза по сравнению с исходным уровнем для вводимого штамма.
c. Точный 2-сторонний доверительный интервал (д. ин.), основанный на наблюдаемой части субъектов с использованием метода Клоппера-Пирсона.
Дополнительный hSBA кратный ответ
Дополнительная конечная точка представляла собой часть субъектов, у которых достигалось, по меньшей мере, 2 кратное увеличение, и часть субъектов, у которых достигалось, по меньшей мере, 3 кратное увеличение титра hSBA по сравнению с исходным уровнем в каждое посещение для отбора образца крови после вакцинации для каждого из 2 первичных MnB штаммов. Обратите внимание, что LLOQ для РМВ80 (А22) представлял собой титр hSBA, равный 1:16, в то время как LLOQ для РМВ2948 (В24) представлял собой титр hSBA, равный 1:8.
Части субъектов, у которых достигалось ≥2 кратное увеличение титра hSBA по сравнению с исходным уровнем через 1 месяц после вакцинации 2 для Группы 1 и Группы 3 для штаммов MnB, составляли 66,2% и 66,1%, соответственно, для РМВ80 (А22); и 56,8% и 59,7%, соответственно, для РМВ2948 (В24). Части субъектов, у которых достигалось ≥2 кратное увеличение титра hSBA по сравнению с исходным уровнем через 1 месяц после вакцинации 3 для Группы 1 и Группы 3 для штаммов MnB, составляли 86,6% и 90,3%, соответственно, для РМВ80 (А22); и 86,1% и 88,5%, соответственно, для РМВ2948 (В24).
Части субъектов, у которых достигалось ≥3 кратное увеличение титра hSBA по сравнению с исходным уровнем через 1 месяц после вакцинации 2 для Группы 1 и Группы 3 для штаммов MnB, составляли 64,3% и 63,7%, соответственно, для РМВ80 (А22); и 56,3% и 58,4%, соответственно, для РМВ2948 (В24). Части субъектов, у которых достигалось ≥3 кратное увеличение титра hSBA по сравнению с исходным уровнем через 1 месяц после вакцинации 3 для Группы 1 и Группы 3 для штаммов MnB, составляли 84,0% и 88,7%, соответственно, для РМВ80 (А22); и 85,7% и 87,7%, соответственно, для РМВ2948 (В24).
Для субъектов с исходным уровнем титра ниже LOD (1:4) в популяции, оцениваемой на иммуногенность, после вакцинации 3, у большинства субъектов достигался 2-кратный, 3-кратный и 4-кратный ответ как в Группе 1, так и в Группе 3 во всех точках времени отбора образцов крови, находящийся в диапазоне от 56,7% до 66,6% через 1 месяц после вакцинации 2, и от 86,3% до 91,0% через 1 месяц после вакцинации 3.
Обобщенные результаты иммунного ответа на двухвалентную rLP2086
При обобщении результатов описательных конечных точек по вторичным целям, у большинства субъектов достигался титр hSBA ≥LLOQ как для Группы 1 (MCV4+Tdap+двухвалентная rLP2086), так и Группы 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086) к обоим первичным исследованным штаммам MnB, тогда как только очень небольшая часть субъектов имела измеряемые титры hSBA ≥LLOQ на исходном уровне (пре-вакцинация Посещение 1). Значительные иммунные ответы с 2 штаммами MnB наблюдались через 1 месяц после вакцинации 2, с дополнительным увеличением, наблюдаемым через 1 месяц после вакцинации 3 как для Группы 1, так и Группы 3 субъектов. Данный вывод подтверждался частью субъектов с титром hSBA ≥1:16 после 3 доз, наблюдаемые GMT достигались после 2 доз и после 3 доз в обеих группах, и RCDC для 2 первичных исследованных штаммов MnB.
Как для Группы 1 (MCV4+Tdap+двухвалентная rLP2086), так и Группы 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086), у большой части субъектов достигалось возрастание титра hSBA ≥ в 4 раза для каждого из 2 первичных MnB исследованных штаммов.
Кроме того, у большинства субъектов достигалось ≥2-кратное увеличение титра hSBA и ≥3-кратное увеличение титра hSBA для 2 первичных MnB штаммов во всех точках времени отбора образцов как для Группы 1 (MCV4+Tdap+двухвалентной rLP2086), так и Группы 3 (физиологический раствор + физиологический раствор + двухвалентная rLP2086). Часть субъектов с результатами, соответствующими данным критериям, была больше после 3-х вакцинаций по сравнению с 2-мя вакцинациями. Анализ чувствительности также подтвердил устойчивые иммунные ответы, индуцированные 3 дозами для обеих групп.
Данные результаты подтверждают доказательства того, что иммунный ответ на двухвалентную rLP2086 при совместном применении с вакцинами MCV4+Tdap дает устойчивый иммунный ответ, который сопоставим с иммунным ответом на двухвалентную rLP2086+физиологический раствор.
Иммунный ответ на MCV4 и Tdap
Tdap/MCV4 антиген GMT и GMC
Таблица I представляет GMT и GMC и соответствующее д. ин. для каждого из Tdap и MCV4 антигенов на исходном уровне и через 1 месяц после вакцинации 1 для Группы 1 (MCV4+Tdap+двухвалентная rLP2086) и Группы 2 (MCV4+Tdap+физиологический раствор) в популяция, оцениваемой на иммуногенность, после вакцинации 1.
Для группы 2 (MCV4+Tdap+физиологический раствор), GMC Tdap антигена на исходном уровне (перед вакцинацией 1) и через 1 месяц после вакцинации 1 составляли 0,2 и 9,8, соответственно (дифтерийный анатоксин); 0,5 и 10,3, соответственно (столбнячный анатоксин); 3,9 и 14,2, соответственно (коклюшный анатоксин); 21,8 и 122,9, соответственно (коклюшный филаментный гемагглютинин); 16,2 и 228,9, соответственно (коклюшный пертактин); 8,5 и 154,2, соответственно (коклюшные фимбриальные агглютиногены типов 2+3); и GMT MCV4 антигена на исходном уровне (перед вакцинацией 1) и через 1 месяц после вакцинации 1 составляли 436,3 и 5113,0, соответственно (для серологической группы А); 84,3 и 1650,2, соответственно (для серологической группы С); 168,5 и 2244,9, соответственно (для серологической группы Y); и 177,7 и 6367,9, соответственно (для серологической группы W-135). Для группы 1 (MCV4+Tdap+двухвалентная rLP2086), GM Tdap антигена на исходном уровне (перед вакцинацией 1) и через 1 месяц после вакцинации 1 составляли 0,2 и 9,3, соответственно (дифтерийный анатоксин); 0,5 и 9,4, соответственно (столбнячный анатоксин); 3,9 и 13,2, соответственно (коклюшный анатоксин); 21,3 и 112,0, соответственно (коклюшный филаментный гемагглютинин); 15,7 и 202,0, соответственно (коклюшный пертактин); 8,4 и 138,1, соответственно (коклюшные фимбриальные агглютиногены типов 2+3); и GM MCV4 антигена на исходном уровне (перед вакцинацией 1) и через 1 месяц после вакцинации 1 составляли 490,0 и 4647,3, соответственно (для серологической группы А); 87,6 и 1679,2, соответственно (для серологической группы С); 183,3 и 2212,6, соответственно (для серологической группы Y); и 176,7 и 5925,1, соответственно (для серологической группы W-135). В целом, установленные GM были аналогичными между Группой 1 и Группой 2.
GMC IgG MCV4
Исследовательской целью данного исследования было описать иммунный ответ IgG, как измеренный GMC анти-МСМ4 IgG, индуцированный вакциной MCV4 при введении с и без двухвалентной rLP2086, как измеренный GMC анти-MCV IgG. Исследовательские конечные точки иммуногенности в данном исследовании были применены к 4 антигенным компонентам MCV4 у субъектов из Группы 1 (MCV4+Tdap+двухвалентная rLP2086) и Группы 2 (MCV4+Tdap+физиологический раствор). Исследовательские конечные точки представляли собой IgG ответ (измеренные как GMC) на полисахарид серологической группы А, С, Y или W-135. После валидации данного анализа (то есть, после валидации) и перед исследованием образцов, LLOQ были скорректированы в сторону повышения на основании дополнительных данных анализов из стандартных эталонных кривых: 0,1795 мкг/мл для серологической группы А, 0,0940 мкг/мл для серологической группы С, 0,2485 мкг/мл для серологической группы Y, и 0,2530 мкг/мл для серологической группы W-135. Результаты ниже LLOQ были представлены до 0,5×LLOQ для анализа. GMC MCV4 IgG для Группы 1 и Группы 2 в популяции, оцениваемой на иммуногенность, после вакцинации 1 с использованием скорректированного LLOQ после валидаций представлены в таблице J.
Для группы 1 (MCV4+Tdap+rLP2086), GMC MCV4 IgG в исходном состоянии (перед вакцинацией 1) и через 1 месяц после вакцинации 1 составляли: 0,17 и 11,42 мкг/мл, соответственно (для серологической группы А); 0,11 и 5,59 мкг/мл, соответственно (для серологической группы С); 0,14 и 2,49 мкг/мл, соответственно (для серологической группы Y); и 0,13 и 1,79 мкг/мл, соответственно (для серологической группы W-135). Для группы 2 (MCV4+Tdap+физиологический раствор), GMC MCV4 IgG в исходном состоянии (перед вакцинацией 1) и через 1 месяц после вакцинации 1 составляли: 0,15 и 11,38 мкг/мл, соответственно (для серологической группы А); 0,11 и 5,47 μд/мл, соответственно (для серологической группы С); 0,13 и 2,14 мкг/мл, соответственно (для серологической группы Y); и 0,13 и 1,84 мкг/мл, соответственно (для серологической группы W-135).
В целом, GMC MCV4 IgG были численно подобными для Группы 1 и Группы 2. Основанные на первоначальных валидированных данных анализов, LLOQ анализа MCV4 IgG были установлены на 0,1037 мкг/мл для серологической группы А, 0,0204 мкг/мл для серологической группы С, 0,1104 мкг/мл для серологической группы Y, и 0,1198 мкг/мл для серологической группы W-135. GMC MCV4 IgG для Группы 1 и Группы 2 в популяции, оцениваемой на иммуногенность, после вакцинации 1 с использованием LLOQ валидаций также показывали, что GMCS MCV4 IgG были численно подобными для Группы 1 и Группы 2.
Субъекты, у которых достигался предварительно заданный уровень антител для дифтерийного анатоксина/столбнячных антигенов
Описательная вторичная конечная точка исследования представляла собой часть субъектов (Группы 1 и 2), у которых достигался уровень антител ≥1,0 МЕ/мл к столбнячному анатоксину, и часть субъектов (Группы 1 и 2), у которых достигался уровень антител ≥1,0 МЕ/мл к дифтерийному анатоксину.
Часть субъектов, у которых достигался предварительно заданный уровень антител к антигенам дифтерийного анатоксина и столбнячного анатоксина, с соответствующим 95% д. ин. представлен в таблице K для Группы 1 (MCV4+Tdap+двухвалентная rLP2086) и Группы 2 (MCV4+Tdap+физиологический раствор) в популяции, оцениваемой на иммуногенность, после вакцинации 1.
Для группы 1 (MCV4+Tdap+двухвалентная rLP2086), часть субъектов, у которых достигался предварительно заданный уровень антител к антигенам дифтерийного анатоксина и столбнячного анатоксина через 1 месяц после вакцинации 1, составляла 98,1% (95% д. ин.: 96,8, 98,9) и 99,1% (95% д. ин.: 98,2, 99,6), соответственно.
Для группы 2 (MCV4+Tdap+физиологический раствор), часть субъектов, у которых достигался предварительно заданный уровень антител к дифтерийному анатоксину и столбнячному антигену через 1 месяц после вакцинации 1, составляла 99,0% (95% д. ин.: 98,0, 99,6) и 99,0% (95% д. ин.: 98,0, 99,6), соответственно.
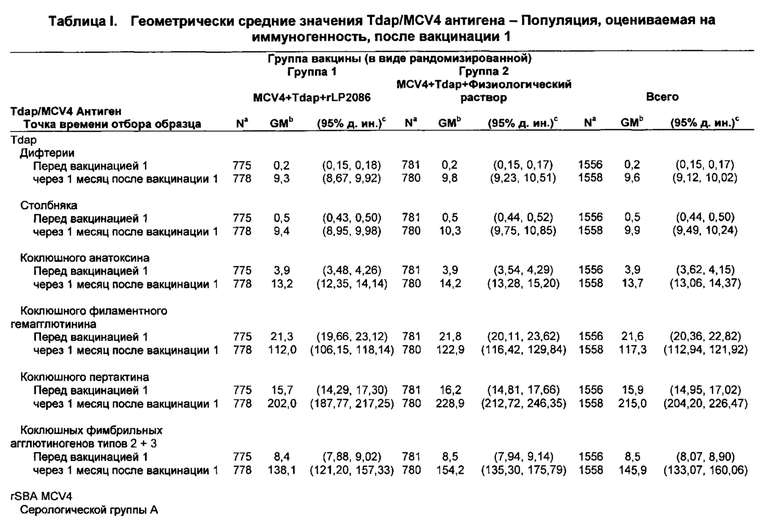
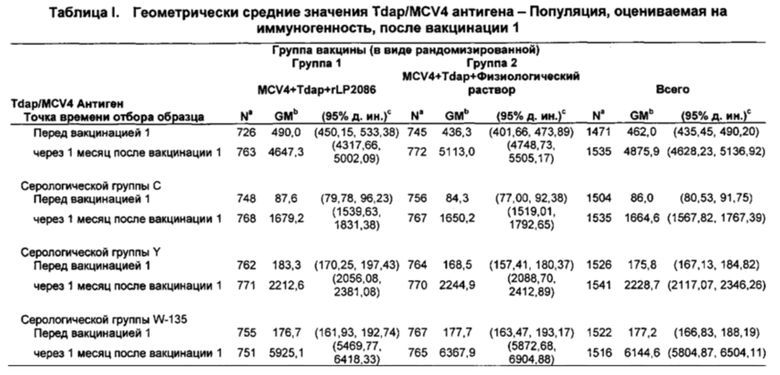
Сокращения: ELISA = фермент-связанное иммуносорбентное исследование; EU = ELISA единицы; GM = геометрически среднее; LLOQ = нижний предел количественного определения; MCV4 = четырехвалентная менингококковая полисахаридная конъюгатная (вакцина); rSBA = сывороточный бактерицидный анализ с использованием кроличьего комплемента; Tdap = против столбняка, дифтерии и ацеллюлярного коклюша (вакцина).
Примечание: LLOQ = 0,037 МЕ/мл для дифтерии; 0,05 МЕ/мл для столбняка; 0,9 ЕЭ/мл для коклюшного анатоксина; 2,9 ЕЭ/мл для коклюшного филаментного гемагглютинина; 3,0 ЕЭ/мл для коклюшного пертактина; 10,6 ЕЭ/мл для коклюшных фимбрильных агглютиногенов типов 2+3. 1:32 для rSBA серологической фуппы А, 1:64 для серологической группы С, 1:128 для серологической группы Y, и 1:64 для серологической группы W-135. Результаты ниже LLOQ были приведены до 0,5 × LLOQ для анализа.
a. N = количество субъектов с проверенными и определенными разультатами анализа для вводимого антигена.
b. GM, рассчитанные с использованием всех субъектов с проверенными и определенными разультатами анализа.
c. Доверительные интервалы (д. ин.) представляют собой обратные преобразования доверительных уровней, основанные на распределении t-критерия Стьюдента для среднего логарифма результатов анализа.
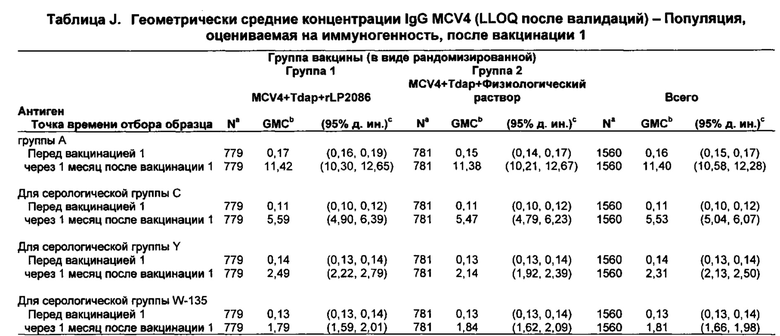
Сокращения: GMC = геометрически средняя концентрация; IgG = иммуноглобулин G; LLOQ = нижний предел количественного определения.
Примечание: LLOQ=0,1795 мкг/мл для IgG MCV4 серологической группы А, 0,0940 мкг/мл для IgG MCV4 серологической группы С, 0,2485 мкг/мл для IgG MCV4 серологической группы Y, и 0,2530 мкг/мл для IgG MCV4 серологической группы W-135. Результаты ниже LLOQ были представлены до 0,5 × LLOQ для анализа.
a. N = количество субъектов с проверенными и определенными разультатами анализа для вводимой серологической группы.
b. GMC рассчитывали с использованием всех субъектов с проверенными и определенными разультатами анализа.
c. Доверительные интервалы (д. ин.) представляют собой обратные преобразования доверительных уровней, основанные на распределении t-критерия Стьюдента для среднего логарифма результатов анализа.
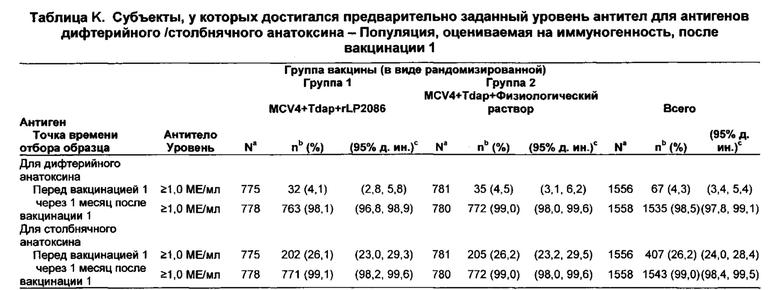
a. N = количество субъектов с проверенными и определенными результатами анализа для вводимого антигена.
b. n = Количество субъектов с концентрацией антител ≥ предварительно заданного уровня для вводимого антигена.
c. Точные 2-сторонние доверительные интервалы (д. ин.), основанные на наблюдаемой части субъектов с использованием метода Клоппера-Пирсона.
RCDC для антигенов MCV4 и Tdap
RCDC, показывающие распределение титров rSBA для серологических групп А, С, Y и W-135 MCV4 для Группы 1 (MCV4+Tdap+двухвалентная rLP2086) и Группы 2 (MCV4+Tdap+физиологический раствор), перед и через 1 месяц после вакцинации 1, для популяции, оцениваемой на иммуногенность, после вакцинации 1 показывали устойчивые иммунные ответы среди субъектов после вакцинации 1 для обеих групп, и кривые были подобными во всем диапазоне титров rSBA.
RCDC, показывающие распределение титров IgG для полисахаридов MCV4 серологической группы А, С, Y и W-135 с использованием LLOQ после валидаций для Группы 1 (MCV4+Tdap+двухвалентная rLP2086) и Группы 2 (MCV4+Tdap+физиологический раствор), перед и через 1 месяц после вакцинации 1, для популяции, оцениваемой на иммуногенность, после вакцинации 1, и RCDC, показывающие распределение титров IgG для серологических групп А, С, Y, и W-135 MCV4 с использованием LLOQ валидаций для Группы 1 (MCV4+Tdap+двухвалентная rLP2086) и Группы 2 (MCV4+Tdap+физиологический раствор), перед и через 1 месяц после вакцинации 1, для популяции, оцениваемой на иммуногенность, после вакцинации 1 показывали устойчивые иммунные ответы среди субъектов после вакцинации 1 для обеих групп с использованием как валидационных, так и после валидационных LLOQ.
RCDC, показывающие распределение титров Tdap для дифтерийного, столбнячного, коклюшного анатоксина, коклюшного филаментного гемагглютинина, коклюшного пертактина и коклюшных фимбриальных агглютиногенов типов 2+3 для группы 1 (MCV4+Tdap+двухвалентная rLP2086) и Группы 2 (MCV4+Tdap+физиологический раствор), перед и через 1 месяц после вакцинации 1, для популяции, оцениваемой на иммуногенность, после вакцинации 1 показывали устойчивые иммунные ответы среди субъектов после вакцинации 1 для обеих групп.
Иммунный ответ на MCV4 и Tdap
GM антител к Tdap/MCV4 антигенам были подобными между Группой 2 (MCV4+Tdap+физиологический раствор) и Группой 1 (MCV4+Tdap+двухвалентная rLP2086), и наблюдаемые GM Tdap/MCV4 антигенов после вакцинации 1 свидетельствовали об устойчивом иммунном ответе для обеих групп. RCDC также подтверждали устойчивые иммунные ответы после вакцинации 1 как для Группы 1, так и для Группы 2.
Критерии не меньшей эффективности для MCV4+Tdap+двухвалентная rLP2086 по сравнению с двухвалентной rLP2086+физиологический раствор + физиологический раствор и MCV4+Tdap+физиологический раствор требовали, чтобы нижний предел 2-стороннего 95% д. ин. для GMR были больше, чем 0,67 для каждого из 10 антигенов MCV4/Tdap (через 1 месяц после вакцинации 1) и для каждого из титров hSBA с использованием 2 первичных MnB исследованных штаммов (РМВ80 [А22] и РМВ2948 [В24]) (через 1 месяц после вакцинации 3). Данный предварительно заданный порог соответствовал требованиям для обоих MnB исследованных штаммов и всех 10 антигенов Tdap и MCV4. Цели сопервичной иммуногенности исследования были выполнены, поскольку они удовлетворяли заранее определенным критериям отсутствия меньшей эффективности.
Иммунный ответ, индуцированный вакциной MCV4 и вакциной Tdap, вводимой совместно с двухвалентной rLP2086, был не уступающим иммунному ответу, индуцированному вакцинами MCV4 и Tdap самостоятельно при измерении через 1 месяц после первой вакцинации в обеих группах. Оценивали иммунный ответ ко всем антигенным компонентам вакцин MCV4 и Tdap.
Иммунный ответ, индуцированный двухвалентной rLP2086, вводимой совместно с вакцинами MCV4 и Tdap, как измерено с помощью hSBA, который осуществляли с использованием 2 MnB исследованных штаммов, был не уступающим иммунному ответу, индуцированному двухвалентной rLP2086 самостоятельно, при измерении через 1 месяц после третьей вакцинация двухвалентной rLP2086 в обеих группах.
Для группы MCV4+Tdap+двухвалентная rLP2086 (Группа 1) и группы MCV4+Tdap+физиологический раствор (Группа 2), установленные различия показателей серологического ответа составляли от -4,6% до 0,3% для антигенов 6 Tdap и 4 MCV4, с нижними границами 95% д. ин. разницы показателей равными 9,1% или меньше. Поскольку д. ин. разниц были все больше, чем -10%; данные различия не были клинически значимыми. RCDC показывали устойчивые иммунные ответы после вакцинации 1 для субъектов в обеих группах. Устойчивые GMT относительно исходного уровня наблюдались для обеих групп, которые получали MCV4+Tdap.
4 кратное увеличение ответов на 2 первичных MnB исследованных штаммов РМВ80 (А22) и РМВ2958 (В24) по сравнению с исходным уровнем через 1 месяц после вакцинации 3 были подобные между группой, которая получала MCV4+Tdap+двухвалентную rLP2086 (84,0% и 85,7%, соответственно), и группой, которая получала двухвалентную rLP2086+физиологический раствор+физиологический раствор (88,7% и 87,7%, соответственно).
Обсуждение иммуногенности
Критерии не меньшей эффективности для MCV4+Tdap+двухвалентной rLP2086 по сравнению с двухвалентной rL2086+физиологический раствор+физиологический раствор и MCV4+Tdap+физиологический раствор требовали, чтобы нижний предел 2-стороннего 95% д. ин. для GMR был больше, чем 0,67 (то есть, в 1,5 пределе разницы не меньшей эффективности) для каждого из 10 антигенов MCV4/Tdap (через 1 месяц после вакцинации 1) и для каждого из титров hSBA с использованием 2 первичных МпВ исследованных штаммов (А22 и В24) (через 1 месяц после вакцинации 3). Данный предварительно заданный порог соответствовал требованиям для обоих MnB исследованных штаммов и 10 антигенов Tdap и MCV4. Таким образом, обе цели сопервичной иммуногенности были выполнены. В частности, эти данные подтверждают, по меньшей мере, следующее: 1) иммунный ответ (основанный на GM), индуцированный вакцинами MCV4 и Tdap, вводимыми с двухвалентной rLP2086, был не уступающим иммунному ответу, индуцированному вакцинами MCV4 и Tdap самостоятельно, при измерении через 1 месяц после первой вакцинации в обеих группах. Оценивали иммунный ответ ко всем компонентам вакцин MCV4 и Tdap.2) Иммунный ответ (основанный на GMT), индуцированный двухвалентной rLP2086, как измеренные с помощью hSBA, который осуществляли с использованием 2 MnB исследованных штаммов, вводимых с вакцинами MCV4 и Tdap, был не уступающим иммунному ответу, индуцированному двухвалентной rLP2086 самостоятельно, при измерении через 1 месяц после третьей вакцинации с двухвалентной rLP2086 в обеих группах.
В данном рандомизированном, контролированном по активному веществу многоцелевом исследовании с маскированием данных для наблюдателя у субъектов в возрасте от ≥10 до <13 лет, иммуногенность как для двухвалентной rLP2086, так и для вакцин MCV4+Tdap оставалась устойчивой при совместном введении вакцин.
В целом, эти данные показывают, что вакцины Tdap, MCV4, MenACWY-CRM, и HPV могут назначаться совместно клинически, и данные вакцины рекомендуется назначать при одном посещении. Данные этого текущего исследования (В1971015) подтверждают этот вывод, а также то, что двухвалентная rLP2086 может вводиться с Tdap и MCV4.
В данном исследовании показано, что, по меньшей мере, 2 дозы двухвалентной rLP2086 вызвали устойчивый иммунный ответ на оба первичных исследованных штамма MnB. В данном исследовании также показано, что 3 дозы двухвалентной rLP2086 вызвали устойчивый иммунный ответ на оба первичных исследованных штамма MnB (А22 и В24). fHBP, экспрессированных на данных исследованных штаммах, являются гетерологичными к антигенам вакцины rLP2086 и представляет собой наиболее распространенные варианты подсемейства А и подсемейства В, идентифицированных среди инвазивных изолятов менингококкового заболевания в США. Данные 2 варианта также являются известными среди изолятов заболеваний в других географических регионах. Оценки иммуногенности для исследования В1971015 использовали для определения 4-кратного увеличения титров hSBA.
LOD для каждого 2 первичных MnB исследованных штаммов представлял собой титр равный 1:4 (признанный в качестве коррелята защиты), и LLOQ валидаций для данных 2 первичных MnB исследованных штаммов представляли собой титры hSBA равные 1:8 для РМВ2948 (В24) и 1:16 для РМВ80 (А22). Перед получением двухвалентной rLP2086, небольшая часть обследованных субъектов имела титры hSBA ≥1:4, что указывает на то, что большинство субъектов в данной популяции могут считаться незащищенными против заболевания MnB. После второй вакцинации исследования, у большой части субъектов достигалось 4 кратное увеличение титров hSBA и демонстрировались после-иммунизационные титры ≥1:4 и ≥LLOQ. Данные показатели ответа были подобными между теми субъектами, которые получали совместное введение двухвалентной rLP2086 с MCV4+Tdap, и теми, которые получали двухвалентную rLP2086 с физиологическим раствором для обоих штаммов MnB. RCDC также показывали, что у большинства субъектов вызывались ответы к 2 первичным штаммам MnB, независимо от того, была ли двухвалентная rLP2086 совместно введена с MCV4+Tdap.
В текущем исследовании (В1971015), 4 кратные показатели ответа (95% д. ин.) после второй и третьей дозы двухвалентной rLP2086 для РМВ80 (А22), при объединении Группы 1 и Группы 2, составляли 64,0% (61,3, 66,5) и 86,3% (84,4, 88,1). Аналогичным образом для В24 4 кратные показатели ответа (95% д. ин.) после второй и третьей дозы двухвалентной rLP2086 для объединенных Группы 1 и Группы 2, составляли 57,4% (54,6, 60,1) и 86,7% (84,8, 88,5).
Следует отметить, что иммунные ответы после второй дозы rLP2086 в исследовании В1971015 были устойчивыми, как было оценено как за счет 4-кратного увеличения титров hSBA по сравнению с исходным уровнем, так и с помощью части субъектов с титрами hSBA после вакцинации ≥LLOQ (1:16 для 22 и 1:8 для В24). Для А22 процент (95% д. ин.) субъектов в объединенных группах 1 и 2, у которых достигался титр hSBA ≥LLOQ (1:16) после второй дозы, составлял 68,0% (65,4, 70,5). Для В24, у 64,2% (61,5, 66,8) субъектов достигался титр hSBA ≥LLOQ (1:8) после второй дозы исследования. Эти данные показывают значительные hSBA ответы на 2 дозы двухвалентной rLP2086.
В целом, данные результаты показывают, что иммунный ответ на MCV4+Tdap и иммунный ответ на двухвалентную rLP2086 остаются устойчивыми при совместном введении двухвалентной rLP2086 и MCV4+Tdap, и удовлетворяют целям совместного первичного исследования.
Эти данные у субъектов в возрасте от ≥10 до <13 лет удовлетворяли целям совместного первичного исследования, подтверждая тезис о том, что двухвалентная rLP2086 может быть вводимой совместно с MCV4+Tdap. Кроме того, у больших частей субъектов достигались hSBA 4-кратные ответы и титры hSBA ≥LLOQ после вакцинации 2 или 3 дозами двухвалентной rLP2086, и на данные устойчивые ответы не влияло совместное использование MCV4+Tdap. При рассмотрении иммуногенности и данных профиля безопасности соотношение польза/риск поддерживает введение двухвалентной rLP2086 или самостоятельно или с MCV4+Tdap.
Пример 12: Фаза 3, рандомизированное, контролированное по активному веществу, исследование с маскированием данных для наблюдателя для того, чтобы оценить безопасность и переносимость менингококковой серологической группы В двухвалентной рекомбинантной липопротеиновой (rLP2086) вакцины, вводимой здоровым субъектам в возрасте от ≥10 до <26 лет
Это была фаза 3 рандомизированного, контролированного по активному веществу, многоцентрового исследования с маскированием данных для наблюдателя, спланированного таким образом, чтобы оценить безопасность и переносимость двухвалентной rLP2086 у здоровых субъектов в возрасте от ≥10 до <26 лет. Приблизительно 5700 субъектов должны быть случайным образом распределены в 1 из 2 групп в соотношении 2:1. Группа 1 получала двухвалентную rLP2086 в месяц 0 (день 1) с последующими более поздними вакцинациями в 2 и 6 месяцев. Группа 2 получала вакцину против вируса гепатита A (HAV) в месяц 0 и месяц 6 и инъекцию физиологического раствора в месяц 2.
Двухвалентная rLP2086 вакцина была сформулирована в 0,5 мл дозы, которая содержит 60 мкг каждого из очищенного белка подсемейства A rLP2086 (варианта А05, SEQ ID NO: 1) и очищенного белка подсемейства В rLP2086 (варианта В01, SEQ ID NO: 2), 0,15 М хлорида натрия, молярное соотношение полисорбат 80 - 2,8, и 0,25 мг Al3+ в виде фосфата алюминия (AlPO4) в 10 мМ гистидиновом буферном физиологическом растворе при рН 6,0.
HAV вакцина (HAVRIX, 0,5-мл доза или 1,0-мл доза) содержала 720 единиц ELISA (EL.U.) или 1440 EL.U. вирусного антигена. В частности, HAVRIX (вакцина против гепатита А) представляет собой стерильную суспензию инактивированного вируса для внутримышечного введения. Вирус (штамм НМ175) размножается в человеческих диплоидных клетках MRC-5. Возраст-специфические дозы HAV вакцины (HAVRIX) поставлялись в соответствии с рекомендациями по конкретным странам. Каждая 1-мл доза вакцины для взрослого субъекта содержит 1440 EL.U. вирусного антигена, адсорбированного на 0,5 мг алюминия в виде гидроксида алюминия. Каждая 0,5-мл педиатрическая доза вакцины содержит 720 EL.U. вирусного антигена, адсорбированного на 0,25 мг алюминия в виде гидроксида алюминия. HAVRIX содержит следующие эксципиенты: аминокислотную добавку (0,3% масс./об.) в фосфатном буферном физиологическом растворе и полисорбат 20 (0,05 мг/мл). Из процесса изготовления, HAVRIX также содержит остаточные клеточные белки MRC-5 (не больше, чем 5 мкг/мл), формалин (не больше, чем 0,1 мг/мл), и неомицина сульфат (не больше, чем 40 нг/мл), аминогликозидный антибиотик, включенный в среду для роста клеток. HAVRIX формулируется без консервантов.
Стерильный нормальный физиологический раствор (0,9% хлорида натрия) для инъекций поставлялся в виде дозы 0,5 мл.
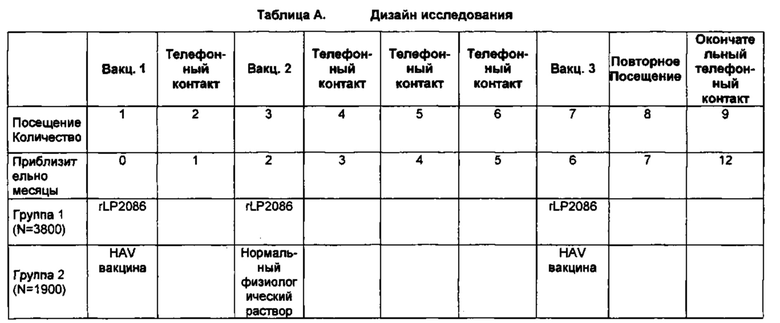
Сокращения: прибл. = приблизительно; Вакц. = вакцинация.
В данном исследовании оценивали безопасность и переносимость двухвалентной rLP2086 на уровне 120-мкг дозы, которую вводят здоровым субъектам в возрасте от ≥10 до <26 лет с использованием 0-, 2-, и 6-месячного режима и являлась важным компонентом для базы данных безопасности для двухвалентной rLP2086.
В качестве контроля в данном исследовании была выбрана вакцина HAV, которую вводили в месяцы 0 и 6, потому что не существовало доказанной безопасной, иммуногенной и эффективной вакцины против MnB, которая могла бы служить в качестве активного контроля. По сравнению с другими рекомендованными вакцинами для данной возрастной группы вакцина HAV имеет хорошо установленный профиль переносимости. Кроме того, вакцина HAV принесла пользу тем, кто может подвергнуться повышенному риску вирусной инфекции гепатита А либо во время будущих путешествий, либо в других случаях. Физиологический раствор вводили в месяц 2 в контрольной группе для поддержания слепого исследования.
Субъекты не были допущены к участию, если они соответствовали какому-либо из критериев исключения, в том числе: предыдущая вакцинация какой-либо менингококковой вакциной серологических группы В; субъекты, получившие предварительную вакцинацию против HAV; противопоказания к вакцинации какой-либо вакциной HAV.
Субъектов получали 1 дозу 120 мкг двухвалентной rLP2086 или HAV вакцина/физиологический раствор/HAV вакцина при каждом посещении вакцинации (Посещения 1, 3, и 7) в соответствии с таблицей А.
Субъектов получали вакцинации с использованием 0-, 2-, 6-месячного режима. Группа 1 получала двухвалентную rLP2086 в месяц 0 (день 1) с последующими более поздними вакцинациями в месяцы 2 и 6. Группа 2 получала HAV вакцину в месяц 0 и месяц 6 и инъекцию физиологического раствора в месяц 2 для поддержания слепого исследования. Возраст-специфические дозы HAV вакцины поставлялись в соответствии с рекомендациями по конкретным странам.
Первичные конечные точки касательно безопасности популяции представляли собой процент субъектов с, по меньшей мере, 1-м серьезным нежелательным явлением (SAE), которое происходило в течение периода времени от первой вакцинации исследования на протяжении 6 месяцев после последней вакцинации исследования и процент субъектов с, по меньшей мере, 1 нежелательным явлением с медицинской точки зрения (АЕ), которое происходило в течение периода времени в пределах 30 дней после каждой вакцинации.
В целом, часть субъектов, сообщивших, по меньшей мере, об 1 SAE в пределах 30 дней после каждой вакцинации составляла ≤3,0% для обеих групп и были аналогичными среди двухвалентной rLP2086 и контроля HAV вакцина/физиологический раствор. На протяжении всего исследования, численно большая часть SAE сообщались субъектами в Группе 2 (HAV вакцина/физиологический раствор), чем в Группе 1 (двухвалентная rLP2086) (2,52% и 1,55%, соответственно). SAE, кроме того, сообщались численно большей частью субъектов в Группе 2 по сравнению с Группой 1 во время вакцинации и последующего наблюдения. В целом, процент АЕ, сообщенных во время фазы вакцинации, был выше в Группе 1 по сравнению с Группой 2. Субъекты в группе 1 сообщали о большей реактогенности АЕ, чем субъекты в группе 2 во время фазы вакцинации. Реактогенность АЕ определялась как какой-либо АЕ с началом в пределах 7 дней после вакцинации и соответствовали предварительно определенному списку предпочтительных терминов. В данном исследовании группы, которая получала двухвалентную rLP2086 не было выявлено никаких новых проблем по безопасности. Данные этого исследования демонстрируют, что двухвалентная rLP2086 является безопасной и хорошо переносится пациентами в возрасте от 10 до <26 лет.
ПРИМЕР 13: Иммуногенность менингококковой серологической группы В двухвалентной rLP2086 вакцины у здоровых подростков, вводимой совместно с другими лицензированными вакцинами
Основные сведения: Двухвалентная rLP2086 (TRUMENBA®) N meningitidis серологической группы В (MnB) фактор Н связывания белка (fHBP) вакцина, одобрена в США для предупреждения инвазивного заболевания MnB в возрасте 10-25 лет. Совместное введение рекомендованных вакцин в данной популяции улучшает соблюдение и максимизирует воздействие общественного здравоохранения.
Цель: Продемонстрировать не меньшую эффективность иммунных ответов (основанных на геометрически средних [GM] титрах), индуцированных GARDASIL® (HPV4), или MENACTRA® (менингококковые группы А, С, Y и W-135, MCV4) и ADACEL® (Tdap), при совместном введении с TRUMENBA.
Дизайн/Способы: Исследование 1: субъекты (11 -< 18 лет) получали TRUMENBA+HPV4, TRUMENBA, или HPV4 в 0, 2 и 6 месяцев. Субъекты, получавшие только TRUMENBA или HPV4, получали инъекции физиологического раствора для поддержания слепого исследования. Исследование 2: субъекты (10 -< 13 лет) получали MCV4+Tdap+TRUMENBA, MCV4+Tdap, или TRUMENBA. TRUMENBA вводили в 0, 2 и 6 месяцев. MCV4 и Tdap вводили в месяц 0. Группы, получавшие только MCV4 и Tdap, или TRUMENBA, получали инъекции физиологического раствора в 0, 2, и 6 месяцев для поддержания слепого исследования. Иммунные ответы оценивали после окончательного введения вакцины. В обоих исследованиях, достигалась не меньшая эффективность, если нижняя граница 95% д. ин. соотношения GM между группами составляла >0,67 (1,5-кратный предел разницы не меньшей эффективности).
Результаты: Критерий не меньшей эффективности был удовлетворительным для всех HPV антигенов за исключением HPV18 (ниже 95% д. ин. = 0,62) и для всех антигенов Tdap и MCV4, когда данные вакцины совместно вводили с TRUMENBA. Показатели серологической конверсии для всех антигенов HPV составляли ≥99%, когда HPV4 применяли самостоятельно или с TRUMENBA. Критерий не меньшей эффективности соответствовал требованиям для ответов hSBA MnB, когда TRUMENBA совместно вводили с лицензированными вакцинами (Таблица).
Данные поддерживают совместное введение TRUMENBA с вакцинами HPV4, MCV4 и Tdap, рекомендованными для подростков США.
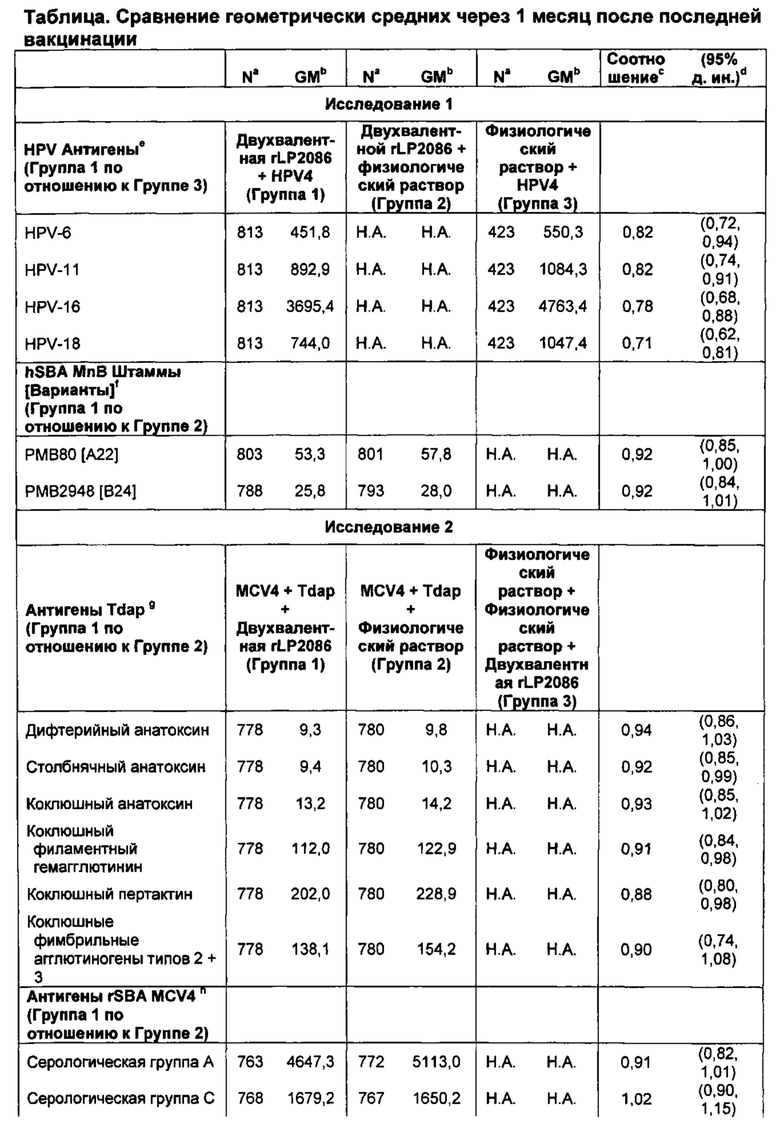
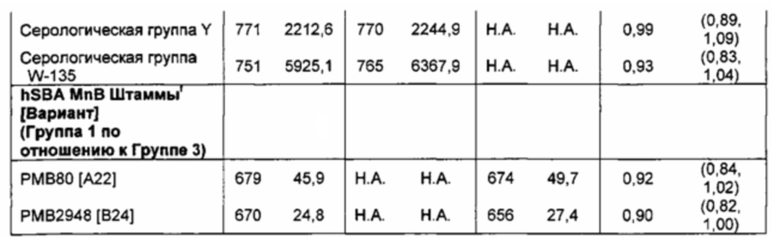
Д. ин. = доверительный интервал; GMT = геометрически средний титр; HPV = вирус папилломы человека; HPV4 = четырехвалентная вакцина вируса папилломы человека; MCV4 = менингококковая (Группы А, С, Y и W-135) полисахаридная с дифтерийным анатоксином конъюгатная вакцина; MnB = Neisseria meningitidis серологической группы В; Н.А. = не анализировалось; Tdap = столбнячный анатоксин, ослабленный дифтерийный анатоксин и ацеллюлярный коклюшная вакцина, адсорбированная.
aN = количество субъектов с проверенными и определенными разультатами анализа для вводимого антигена или штамма.
bГеометрически средние значения рассчитывали с использованием всех субъектов с проверенными и определенными разультатами анализа через 1 месяц после вакцинации 3.
cСоотношения GM.
dДоверительные интервалы (д. ин.) для соотношения представляют собой обратные преобразования доверительного интервала, основанные на распределении t-критерия Стьюдента для средней разницы логарифмов измерений (Группа 1 - Группа 3 для HPV титров; Группа 1 - Группа 2 для Tdap/MCV4 антигенов).
еИммунные ответы на антигены HPV оценивали в конкурентном иммуноанализе LUMINEX через 1 месяц после третьей Gardasil® вакцинации.
fИммунные ответы на антигены MnB оценивали в сывороточном бактерицидном анализе с использованием человеческого комплемента через 1 месяц после третьей вакцинации двухвалентной rLP2086.
gИммунные ответы на дифтерийные, столбнячные и коклюшные антигены оценивали в анализе LUMINEX через 1 месяц после единственной вакцинации ADACEL®.
hИммунные ответы на антигены MCV4 оценивали в сывороточном бактерицидном анализе с использованием кроличьего комплемента через 1 месяц после единственной вакцинации MENACTRA®.
ПРИМЕР 14: ФАЗА 3 ИССЛЕДОВАНИЯ НА ИММУНОГЕННОСТЬ ДВУХВАЛЕНТНОЙ rLP2086, МЕНИНГОКОККОВОЙ СЕРОЛОГИЧЕСКОЙ ГРУППЫ В ВАКЦИНЫ, У ПОДРОСТКОВ: БАКТЕРИЦИДНАЯ АКТИВНОСТЬ ПРОТИВ ПАНЕЛИ АНТИГЕННО РАЗЛИЧНЫХ ШТАММОВ
Основные сведения: Двухвалентная rLP2086, которая нацелена на фактор Н связывающие белки (fHBP), одобрена в США для предупреждения менингококкового серологической группы В (MnB) заболевания в возрасте 10-25-лет. Широкая защита с двухвалентной rLP2086 была первоначально продемонстрирована в hSBA с 4 различными инвазивными штаммами MnB, экспрессирующими fHBP с последовательностями, отличными от антигенов вакцины. В данном базовом клиническом исследовании фазы 3, широкий охват против MnB заболевания дополнительно подтверждается данными hSBA с 10 дополнительными исследованными штаммами MnB, представляющими разнообразие циркулирующих инвазивных штаммов MnB (ClinicalTrials.gov: NCT01830855).
Способы:
Здоровые субъекты в возрасте от 10 до 19 лет были рандомизированы для получения двухвалентной rLP2086 в 0, 2, и 6 месяцев, или вакцины вируса гепатита А в 0 и 6 месяцев и физиологический раствор в 2 месяца. Иммунные ответы оценивали с помощью hSBA с 4 первичными исследованными штаммами MnB (первичная конечная точка; N=1210-1266) и в подмножестве популяции с использованием 10 вторичных исследованных штаммов MnB (вторичная конечная точка; N=266-281). Все штаммы экспрессировали гетерологичный к вакцине fHBP.
Результаты:
hSBA ответы через 1 месяц после доз 2 и 3 среди реципиентов двухвалентной rLP2086 против 4 первичных исследованных штаммов MnB, измеренные по титрам hSBA ≥LLOQ, составляли 64,0%-99,1% и 87,1%-99,5%, соответственно (Таблица). hSBA ответы к 10 вторичным исследованным штаммам MnB составляли 61,1%-100,0% и 75,1%-98,6% через 1 месяц после дозы 2 и 3, соответственно. hSBA GMT для каждого вторичного исследованного штамма возрастали с 4,5-11,4 на исходном уровне до 22,1-93,5 после дозы 3.
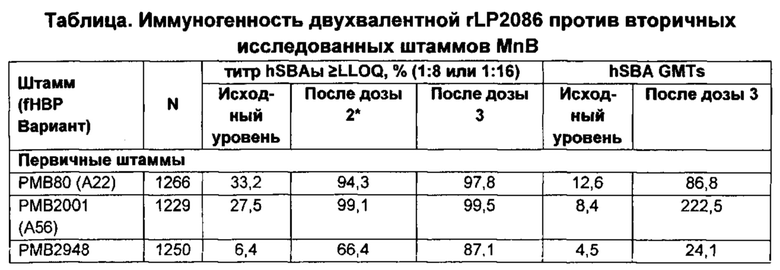
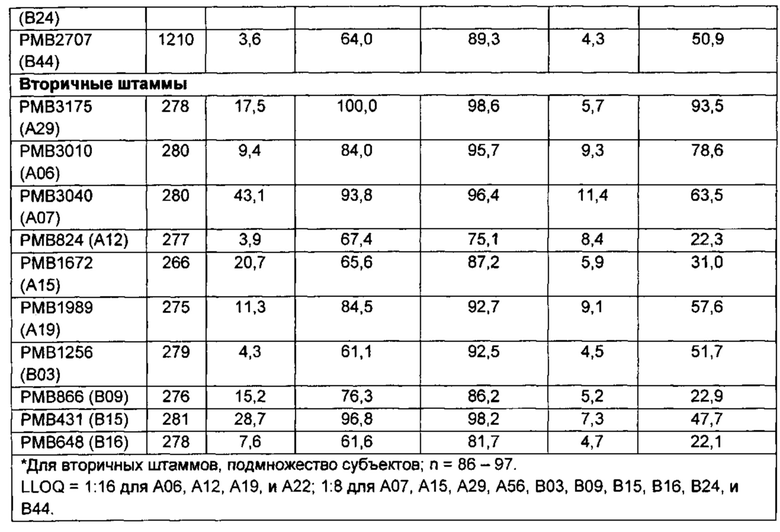
Выводы:
Вакцинация двухвалентной rLP2086 в результате привела к устойчивым иммунным ответам против разных штаммов MnB гетерологичных к антигенам вакцины после 2 и 3 дозы. У большой части индивидуумов развивались защитные титры hSBA превышающие корреляцию защиты (титр hSBA ≥1:4) к 10 дополнительным исследованным штаммам MnB. В совокупности, эти данные по иммуногенности в фазе 3 поддерживают широкую защиту, обеспечиваемую двухвалентной rLP2086 против MnB заболевания у подростков.
ПРИМЕР 15: ФАЗА 3 ИССЛЕДОВАНИЕ НА ИММУНОГЕННОСТЬ ДВУХВАЛЕНТНОЙ rLP2086, МЕНИНГОКОККОВОЙ СЕРОЛОГИЧЕСКОЙ ГРУППЫ В ВАКЦИНЫ, У МОЛОДЫХ ВЗРОСЛЫХ: БАКТЕРИЦИДНАЯ АКТИВНОСТЬ ПРОТИВ ПАНЕЛИ АНТИГЕННО РАЗЛИЧНЫХ ШТАММОВ
Основные сведения: Двухвалентная rLP2086, которая нацелена на фактор Н связывающие белки (fHBP), одобрена в США для предупреждения менингококкового серологической группы В (MnB) заболевания в возрасте 10-25-лет. Широкая защита с двухвалентной rLP2086 была первоначально продемонстрирована в hSBA с 4 различными инвазивными штаммами MnB, экспрессирующими fHBP с последовательностями, отличными от антигенов вакцины. В данном базовом клиническом исследовании фазы 3, широкий охват против MnB заболевания дополнительно подтверждается данными hSBA с 10 дополнительными исследованными штаммами MnB, представляющими разнообразие циркулирующих инвазивных штаммов MnB (ClinicalTrials.gov: NCT01352845).
Способы:
Здоровые субъекты в возрасте от 18 до 26 лет были рандомизированы для получения двухвалентной rLP2086 или физиологического раствора в 0, 2, и 6 месяцев. Иммунные ответы оценивали с помощью hSBA с 4 первичными исследованными штаммами MnB (первичная конечная точка; N=1702-1714) и в подмножестве популяции (N=273-284) с использованием 10 вторичных исследованных штаммов MnB (вторичная конечная точка; N=273-284). Все штаммы экспрессировали гетерологичный к вакцине fHBP.
Результаты:
hSBA ответы через 1 месяц после дозы 2 и 3 среди реципиентов двухвалентной rLP2086 против 4 первичных исследованных штаммов MnB, измеренных по титрам hSBA ≥LLOQ, составляли 68,3%-97,4% и 87,4%-99,4%, соответственно (Таблица). hSBA ответы к 10 вторичным исследованным штаммам MnB составляли 51,6%-97,9% и 71,3%-99,3% через 1 месяц после дозы 2 и 3, соответственно. hSBA GMT для каждого вторичного штамма возрастали с 5,1-13,9 на исходном уровне до 20,6-96,3 после дозы 3.
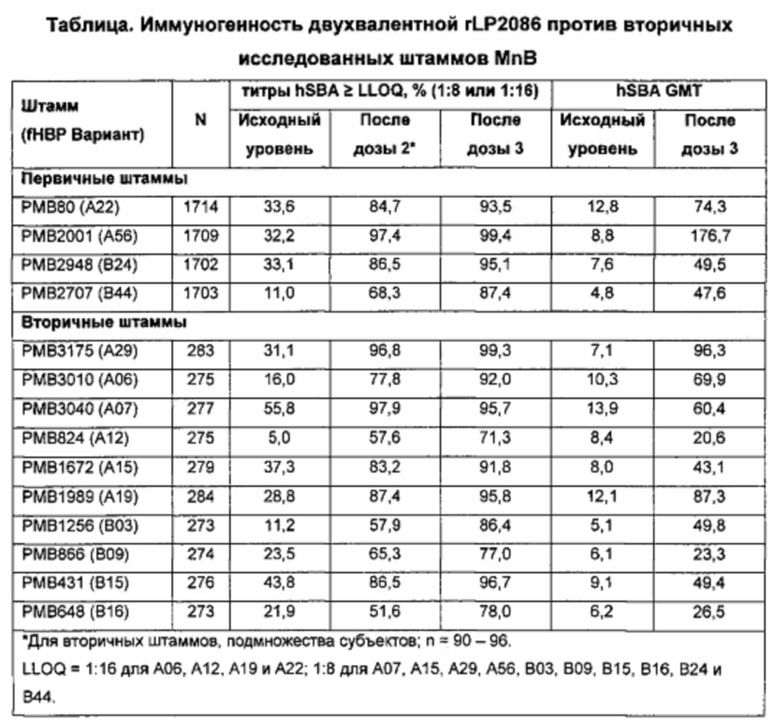
Выводы:
Вакцинация двухвалентной rLP2086 вызывала устойчивые иммунные ответы против разных штаммов MnB, экспрессирующих fHBP варианты, гетерологичные к антигенам вакцины после 2 и 3 доз. У большой части индивидуумов развивались защитные титры hSBA, превышающие корреляцию защиты (титр hSBA ≥1:4) к 10 дополнительным MnB исследованным штаммам. В совокупности, эти данные по иммуногенности в фазе 3 поддерживают широкую защиту, обеспечиваемую двухвалентной rLP2086 против MnB заболевания у подростков.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110>PfizerInc.
<120>КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> PC072198
<150> 62/118457
<151> 2015-02-19
<150> 62/280212
<151> 2016-01-19
<160> 23
<170> PatentIn version 3.5
<210> 1
<211> 258
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая аминокислотная последовательность
<400> 1
Cys Gly Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Thr Gly
1 5 10 15
Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu
20 25 30
Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr Leu Thr
35 40 45
Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly Asp Lys Asp
50 55 60
Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe
65 70 75 80
Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala
85 90 95
Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala
100 105 110
Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile
115 120 125
Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala
130 135 140
Phe Asn Gln Leu Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe
145 150 155 160
Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala
165 170 175
Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln
180 185 190
Asn Val Glu Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His
195 200 205
Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr
210 215 220
Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser
225 230 235 240
Ala Thr Val Lys Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly
245 250 255
LysGln
<210> 2
<211> 261
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая аминокислотная последовательность
<400> 2
CysGlySerSerGlyGlyGlyGlySerGlyGlyGlyGlyValThrAla
1 5 10 15
Asp Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His
20 25 30
Lys Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln
35 40 45
Asn Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Tyr Gly
50 55 60
Asn Gly Asp Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Val Ser
65 70 75 80
Arg Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu Ile Thr
85 90 95
Leu Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser Ala Leu
100 105 110
Thr Ala Leu Gln Thr Glu Gln Glu Gln Asp Pro Glu His Ser Glu Lys
115 120 125
Met Val Ala Lys Arg Arg Phe Arg Ile Gly Asp Ile Ala Gly Glu His
130 135 140
Thr Ser Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr Arg Gly
145 150 155 160
Thr Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile
165 170 175
Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Ser
180 185 190
Pro Glu Leu Asn Val Asp Leu Ala Val Ala Tyr Ile Lys Pro Asp Glu
195 200 205
Lys His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu
210 215 220
Lys Gly Ser Tyr Ser Leu Gly Ile Phe Gly Glu Lys Ala Gln Glu Val
225 230 235 240
Ala Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile His His Ile Gly
245 250 255
Leu Ala Ala Lys Gln
260
<210> 3
<211> 4
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая аминокислотная последовательность
<400> 3
CysGlySerSer
1
<210> 4
<211> 12
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая аминокислотная последовательность
<400> 4
CysGlySerSerGlyGlyGlyGlyValAlaAlaAsp
1 5 10
<210> 5
<211> 15
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая аминокислотная последовательность
<400> 5
Cys Ser Ser Gly Ser Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
<210> 6
<211> 255
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая аминокислотная последовательность
<400> 6
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Tyr Ile Lys Pro Asp Glu Lys His His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Glu Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 7
<211> 259
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 7
Cys Ser Ser Gly Gly Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Thr
1 5 10 15
Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly
20 25 30
Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Pro Gln Asn Gly Thr Leu
35 40 45
Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Ala Gly Asp Lys
50 55 60
Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg
65 70 75 80
Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu
85 90 95
Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val
100 105 110
Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu
115 120 125
Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr
130 135 140
Ala Phe Asn Gln Leu Pro Gly Asp Lys Ala Glu Tyr His Gly Lys Ala
145 150 155 160
Phe Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe
165 170 175
Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu
180 185 190
Gln Asn Val Glu Leu Ala Ala Ala Glu Leu Lys Ala Asp Glu Lys Ser
195 200 205
His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly
210 215 220
Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly
225 230 235 240
Ser Ala Thr Val Lys Ile Gly Glu Lys Val His Glu Ile Gly Ile Ala
245 250 255
Gly Lys Gln
<210> 8
<211> 261
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 8
Cys Ser Ser Gly Ser Gly Ser Gly Gly Gly Gly Val Ala Ala Asp Ile
1 5 10 15
Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp
20 25 30
Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly
35 40 45
Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly
50 55 60
Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile
65 70 75 80
Ser Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile
85 90 95
Thr Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asp His Ser Ala
100 105 110
Val Val Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp
115 120 125
Ser Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu
130 135 140
His Thr Ala Phe Asn Gln Leu Pro Ser Gly Lys Ala Glu Tyr His Gly
145 150 155 160
Lys Ala Phe Ser Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile
165 170 175
Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr
180 185 190
Pro Glu Gln Asn Val Glu Leu Ala Ser Ala Glu Leu Lys Ala Asp Glu
195 200 205
Lys Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu
210 215 220
Lys Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile
225 230 235 240
Ala Gly Ser Ala Thr Val Lys Ile Arg Glu Lys Val His Glu Ile Gly
245 250 255
Ile Ala Gly Lys Gln
260
<210> 9
<211> 254
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 9
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asn His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Asp Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 10
<211> 254
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 10
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Ser Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 11
<211> 263
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 11
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Ala Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Arg Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu
85 90 95
Ile Thr Leu Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser
100 105 110
Ala Leu Thr Ala Leu Gln Thr Glu Gln Val Gln Asp Ser Glu His Ser
115 120 125
Gly Lys Met Val Ala Lys Arg Gln Phe Arg Ile Gly Asp Ile Val Gly
130 135 140
Glu His Thr Ser Phe Asp Lys Leu Pro Lys Asp Val Met Ala Thr Tyr
145 150 155 160
Arg Gly Thr Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr
165 170 175
Thr Ile Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu
180 185 190
Lys Ser Pro Glu Leu Asn Val Asp Leu Ala Ala Ala Asp Ile Lys Pro
195 200 205
Asp Glu Lys His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln
210 215 220
Ala Glu Lys Gly Ser Tyr Ser Leu Gly Ile Phe Gly Gly Gln Ala Gln
225 230 235 240
Glu Val Ala Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile Arg His
245 250 255
Ile Gly Leu Ala Ala Lys Gln
260
<210> 12
<211> 255
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 12
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Glu Gln Asp Pro Glu His Ser Gly Lys Met Val Ala Lys Arg Arg
115 120 125
Phe Lys Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Asp Val Met Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Glu
180 185 190
Leu Ala Thr Ala Tyr Ile Lys Pro Asp Glu Lys His His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile His His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 13
<211> 255
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 13
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Lys Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu Asp Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Lys Gly Gly Ser Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Glu
180 185 190
Leu Ala Thr Ala Tyr Ile Lys Pro Asp Glu Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Asp Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile His His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 14
<211> 255
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 14
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Val Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Ser Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ser Asp Ile Lys Pro Asp Lys Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 15
<211> 255
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 15
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Phe Gln Thr Glu
100 105 110
Gln Ile Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly Asn Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Gly Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 16
<211> 263
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 16
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Ala Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Arg Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Ile Arg Gln Ile Glu Val Asp Gly Gln Leu
85 90 95
Ile Thr Leu Glu Ser Gly Glu Phe Gln Val Tyr Lys Gln Ser His Ser
100 105 110
Ala Leu Thr Ala Leu Gln Thr Glu Gln Val Gln Asp Ser Glu His Ser
115 120 125
Gly Lys Met Val Ala Lys Arg Gln Phe Arg Ile Gly Asp Ile Val Gly
130 135 140
Glu His Thr Ser Phe Gly Lys Leu Pro Lys Asp Val Met Ala Thr Tyr
145 150 155 160
Arg Gly Thr Ala Phe Gly Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr
165 170 175
Thr Ile Asp Phe Ala Ala Lys Gln Gly His Gly Lys Ile Glu His Leu
180 185 190
Lys Ser Pro Glu Leu Asn Val Asp Leu Ala Ala Ala Asp Ile Lys Pro
195 200 205
Asp Glu Lys His His Ala Val Ile Ser Gly Ser Val Leu Tyr Asn Gln
210 215 220
Ala Glu Lys Gly Ser Tyr Ser Leu Gly Ile Phe Gly Gly Gln Ala Gln
225 230 235 240
Glu Val Ala Gly Ser Ala Glu Val Glu Thr Ala Asn Gly Ile Arg His
245 250 255
Ile Gly Leu Ala Ala Lys Gln
260
<210> 17
<211> 255
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 17
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Gly Ser Asp
145 150 155 160
Asp Ala Ser Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ser Asp Ile Lys Pro Asp Lys Lys Arg His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Gln Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Glu Thr Ala Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<210> 18
<211> 254
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 18
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Gly Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 19
<211> 254
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 19
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asp His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Asp Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala Lys Gln Gly
165 170 175
His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ala Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Gly Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 20
<211> 257
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 20
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Lys
20 25 30
Ser Leu Thr Leu Glu Asp Ser Ile Ser Gln Asn Gly Thr Leu Thr Leu
35 40 45
Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Val Gly Asp Lys Asp Asn
50 55 60
Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys Ile Ser Arg Phe Asp
65 70 75 80
Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser
85 90 95
Gly Glu Phe Gln Ile Tyr Lys Gln Asn His Ser Ala Val Val Ala Leu
100 105 110
Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn
115 120 125
Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe
130 135 140
Asn Gln Leu Pro Gly Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser
145 150 155 160
Ser Asp Asp Ala Gly Gly Lys Leu Thr Tyr Thr Ile Asp Phe Ala Ala
165 170 175
Lys Gln Gly His Gly Lys Ile Glu His Leu Lys Thr Pro Glu Gln Asn
180 185 190
Val Glu Leu Ala Ala Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala
195 200 205
Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu Glu Lys Gly Thr Tyr
210 215 220
His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala
225 230 235 240
Thr Val Lys Ile Gly Glu Lys Val His Glu Ile Ser Ile Ala Gly Lys
245 250 255
Gln
<210> 21
<211> 254
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 21
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Thr Pro Leu Asp His Lys Asp Lys Ser Leu Gln
20 25 30
Ser Leu Thr Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Thr Ile Thr Leu Ala Ser Gly Glu Phe
85 90 95
Gln Ile Tyr Lys Gln Asn His Ser Ala Val Val Ala Leu Gln Ile Glu
100 105 110
Lys Ile Asn Asn Pro Asp Lys Ile Asp Ser Leu Ile Asn Gln Arg Ser
115 120 125
Phe Leu Val Ser Gly Leu Gly Gly Glu His Thr Ala Phe Asn Gln Leu
130 135 140
Pro Asp Gly Lys Ala Glu Tyr His Gly Lys Ala Phe Ser Ser Asp Asp
145 150 155 160
Pro Asn Gly Arg Leu His Tyr Ser Ile Asp Phe Thr Lys Lys Gln Gly
165 170 175
Tyr Gly Arg Ile Glu His Leu Lys Thr Pro Glu Gln Asn Val Glu Leu
180 185 190
Ala Ser Ala Glu Leu Lys Ala Asp Glu Lys Ser His Ala Val Ile Leu
195 200 205
Gly Asp Thr Arg Tyr Gly Gly Glu Glu Lys Gly Thr Tyr His Leu Ala
210 215 220
Leu Phe Gly Asp Arg Ala Gln Glu Ile Ala Gly Ser Ala Thr Val Lys
225 230 235 240
Ile Arg Glu Lys Val His Glu Ile Gly Ile Ala Gly Lys Gln
245 250
<210> 22
<211> 262
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 22
Cys Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Val Ala Ala Asp
1 5 10 15
Ile Gly Thr Gly Leu Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys
20 25 30
Asp Lys Gly Leu Lys Ser Leu Thr Leu Glu Asp Ser Ile Pro Gln Asn
35 40 45
Gly Thr Leu Thr Leu Ser Ala Gln Gly Ala Glu Lys Thr Phe Lys Ala
50 55 60
Gly Asp Lys Asp Asn Ser Leu Asn Thr Gly Lys Leu Lys Asn Asp Lys
65 70 75 80
Ile Ser Arg Phe Asp Phe Val Gln Lys Ile Glu Val Asp Gly Gln Thr
85 90 95
Ile Thr Leu Ala Ser Gly Glu Phe Gln Ile Tyr Lys Gln Asn His Ser
100 105 110
Ala Val Val Ala Leu Gln Ile Glu Lys Ile Asn Asn Pro Asp Lys Ile
115 120 125
Asp Ser Leu Ile Asn Gln Arg Ser Phe Leu Val Ser Gly Leu Gly Gly
130 135 140
Glu His Thr Ala Phe Asn Gln Leu Pro Gly Asp Lys Ala Glu Tyr His
145 150 155 160
Gly Lys Ala Phe Ser Ser Asp Asp Pro Asn Gly Arg Leu His Tyr Thr
165 170 175
Ile Asp Phe Thr Asn Lys Gln Gly Tyr Gly Arg Ile Glu His Leu Lys
180 185 190
Thr Pro Glu Leu Asn Val Asp Leu Ala Ser Ala Glu Leu Lys Ala Asp
195 200 205
Glu Lys Ser His Ala Val Ile Leu Gly Asp Thr Arg Tyr Gly Ser Glu
210 215 220
Glu Lys Gly Thr Tyr His Leu Ala Leu Phe Gly Asp Arg Ala Gln Glu
225 230 235 240
Ile Ala Gly Ser Ala Thr Val Lys Ile Gly Glu Lys Val His Glu Ile
245 250 255
Gly Ile Ala Gly Lys Gln
260
<210> 23
<211> 255
<212> PRT
<213> Neisseria meningitidis (группа B)
<400> 23
Cys Ser Ser Gly Gly Gly Gly Val Ala Ala Asp Ile Gly Ala Gly Leu
1 5 10 15
Ala Asp Ala Leu Thr Ala Pro Leu Asp His Lys Asp Lys Gly Leu Gln
20 25 30
Ser Leu Ile Leu Asp Gln Ser Val Arg Lys Asn Glu Lys Leu Lys Leu
35 40 45
Ala Ala Gln Gly Ala Glu Lys Thr Tyr Gly Asn Gly Asp Ser Leu Asn
50 55 60
Thr Gly Lys Leu Lys Asn Asp Lys Val Ser Arg Phe Asp Phe Ile Arg
65 70 75 80
Gln Ile Glu Val Asp Gly Gln Leu Ile Thr Leu Glu Ser Gly Glu Phe
85 90 95
Gln Val Tyr Lys Gln Ser His Ser Ala Leu Thr Ala Leu Gln Thr Glu
100 105 110
Gln Val Gln Asp Ser Glu His Ser Gly Lys Met Val Ala Lys Arg Gln
115 120 125
Phe Arg Ile Gly Asp Ile Ala Gly Glu His Thr Ser Phe Asp Lys Leu
130 135 140
Pro Glu Gly Gly Arg Ala Thr Tyr Arg Gly Thr Ala Phe Ser Ser Asp
145 150 155 160
Asp Ala Gly Gly Lys Leu Ile Tyr Thr Ile Asp Phe Ala Ala Lys Gln
165 170 175
Gly His Gly Lys Ile Glu His Leu Lys Ser Pro Glu Leu Asn Val Asp
180 185 190
Leu Ala Ala Ala Asp Ile Lys Pro Asp Glu Lys His His Ala Val Ile
195 200 205
Ser Gly Ser Val Leu Tyr Asn Gln Ala Glu Lys Gly Ser Tyr Ser Leu
210 215 220
Gly Ile Phe Gly Gly Lys Ala Gln Glu Val Ala Gly Ser Ala Glu Val
225 230 235 240
Lys Thr Val Asn Gly Ile Arg His Ile Gly Leu Ala Ala Lys Gln
245 250 255
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Композиции с Neisseria meningitidis и способы их применения | 2020 |
|
RU2839906C1 |
| КОМПОЗИЦИИ NEISSERIA MENINGITIDIS И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2739504C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ ПРОТИВ NEISSERIA MENINGITIDIS (ВАРИАНТЫ) | 2014 |
|
RU2662968C2 |
| СПОСОБЫ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ВАКЦИНЫ ПУТЕМ ВВЕДЕНИЯ АНТАГОНИСТА IL-4R | 2017 |
|
RU2753869C2 |
| РЕКОМБИНАНТНЫЕ ВАКЦИНЫ ОТ FMDV И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2745373C2 |
| ВАРИАНТЫ ФАКТОР Н-СВЯЗЫВАЮЩЕГО БЕЛКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2714248C2 |
| ВАРИАНТЫ ФАКТОР H-СВЯЗЫВАЮЩЕГО БЕЛКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2811942C2 |
| ВАКЦИНА ПРОТИВ КОШАЧЬЕГО КАЛИЦИВИРУСА | 2018 |
|
RU2792898C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ ГЛИКОПРОТЕИНА G ВИРУСОВ HENDRA И NIPAH | 2012 |
|
RU2787820C2 |
| ВАКЦИНА ПРОТИВ ВИРУСА СВИНОГО ГРИППА, СОДЕРЖАЩАЯ КОНСТРУКЦИЮ НУКЛЕИНОВОЙ КИСЛОТЫ, ИМЕЮЩУЮ ОПРЕДЕЛЕННЫЙ ПОРЯДОК РАСПОЛОЖЕНИЯ ГЕНОВ | 2021 |
|
RU2833693C1 |
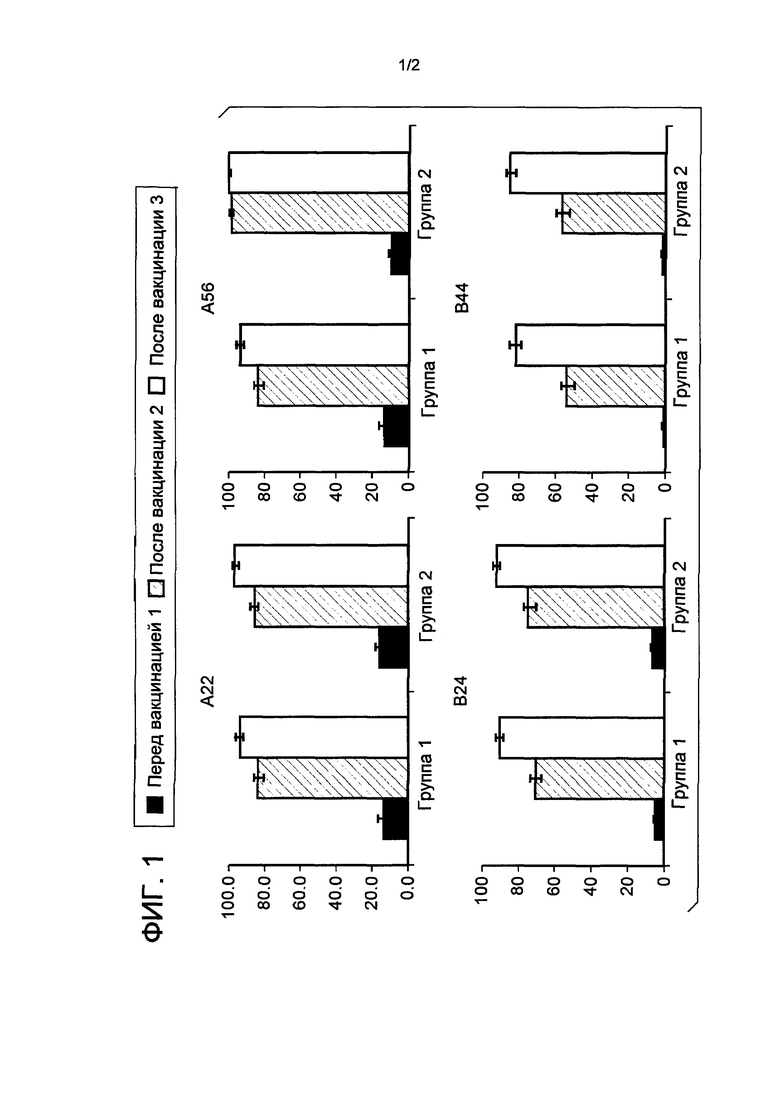
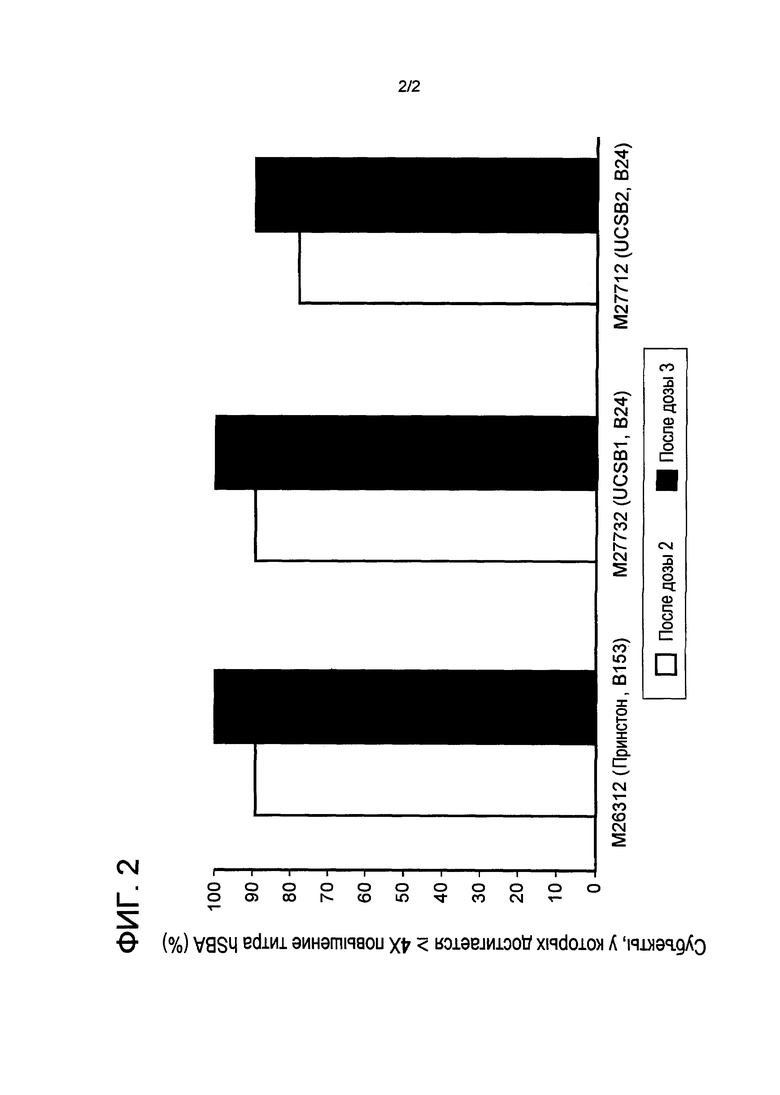
Изобретение относится к области биотехнологии. Описано применение эффективного количества композиции rLP2086 N. meningitidis и трех дополнительных иммуногенных композиций совместно для индуцирования бактерицидного иммунного ответа против штамма подсемейства А N. meningitidis серологической группы В и против штамма подсемейства В N. meningitidis серологической группы В у человека. Указанная композиция rLP2086 N. meningitidis содержит а) первый липидированный полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 1, и b) второй липидированный полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 2. В качестве дополнительной иммуногенной композиции используется (i) иммуногенная композиция против штамма Neisseria meningitidis серологической группы А, штамма Neisseria meningitidis серологической группы С, штамма Neisseria meningitidis серологической группы Y и/или штамма Neisseria meningitidis серологической группы W135; (ii) иммуногенная композиция против дифтерии, столбняка и коклюша; и (iii) иммуногенная композиция против вируса папилломы человека. Изобретение расширяет арсенал способов индуцирования бактерицидного иммунного ответа против штамма подсемейства А N. meningitidis серологической группы В и против штамма подсемейства В N. meningitidis серологической группы В. 25 з.п. ф-лы, 2 ил., 26 табл., 15 пр.
1. Применение эффективного количества композиции rLP2086 N. meningitidis и трех дополнительных иммуногенных композиций совместно для индуцирования бактерицидного иммунного ответа против штамма подсемейства А N. meningitidis серологической группы В и против штамма подсемейства В N. meningitidis серологической группы В у человека, где указанная композиция rLP2086 N. meningitidis содержит а) первый липидированный полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 1, и b) второй липидированный полипептид, содержащий аминокислотную последовательность, представленную SEQ ID NO: 2, где, по меньшей мере, одна дополнительная иммуногенная композиция включает: (i) иммуногенную композицию против штамма Neisseria meningitidis серологической группы А, штамма Neisseria meningitidis серологической группы С, штамма Neisseria meningitidis серологической группы Y и/или штамма Neisseria meningitidis серологической группы W135; (ii) иммуногенную композицию против дифтерии, столбняка и коклюша; и (iii) иммуногенную композицию против вируса папилломы человека.
2. Применение по п. 1, где композиция rLP2086 N. meningitidis дополнительно включает полисорбат-80.
3. Применение по п. 1 или 2, где композиция rLP2086 N. meningitidis дополнительно включает алюминий.
4. Применение по какому-либо одному из пп. 1-3, где композиция rLP2086 N. meningitidis дополнительно включает гистидиновый буфер.
5. Применение по какому-либо одному из пп. 1-4, где композиция rLP2086 N. meningitidis дополнительно включает хлорид натрия.
6. Применение по какому-либо одному из пп. 1-5, где композиция rLP2086 N. meningitidis содержит приблизительно 120 мкг/мл первого полипептида; приблизительно 120 мкг/мл второго полипептида; молярное соотношение полисорбата-80 - приблизительно 2,8; приблизительно 0,5 мг/мл алюминия; приблизительно 10 мМ гистидина; и приблизительно 150 мМ хлорида натрия.
7. Применение по какому-либо одному из пп. 1-6, где композиция rLP2086 N. meningitidis содержит приблизительно 60 мкг первого полипептида; приблизительно 60 мкг второго полипептида; приблизительно 18 мкг полисорбата-80; приблизительно 250 мкг алюминия; приблизительно 780 мкг гистидина; и приблизительно 4380 мкг хлорида натрия.
8. Применение по какому-либо одному из пп. 1-7, где композиция rLP2086 N. meningitidis индуцирует бактерицидный иммунный ответ против, по меньшей мере, одного из штаммов N. meningitidis серологической группы В А22, А56, В24, В44 или какой-либо их комбинации.
9. Применение по какому-либо одному из пп. 1-8, где композиция rLP2086 N. meningitidis индуцирует бактерицидный иммунный ответ против А22 N. meningitidis серологической группы В.
10. Применение по какому-либо одному из пп. 1-8, где композиция rLP2086 N. meningitidis индуцирует бактерицидный иммунный ответ против В24 N. meningitidis серологической группы В.
11. Применение по какому-либо одному из пп. 1-10, где композиция rLP2086 N. meningitidis индуцирует бактерицидный иммунный ответ против, по меньшей мере, одного из штаммов В24, В16, В44, А22, В03, В09, А12, А19, А05, А07, В153 N. meningitidis серологической группы В или какой-либо их комбинации.
12. Применение по какому-либо одному из пп. 1-11, где дополнительная иммуногенная композиция содержит смесь из четырех различных и отдельно полученных белково-капсульных полисахаридных конъюгатов, где первый конъюгат содержит капсульный полисахарид N. meningitidis серологической группы W-135, конъюгированный с белком-носителем, второй конъюгат содержит капсульный полисахарид N. meningitidis серологической группы Y, конъюгированный с белком-носителем, третий конъюгат содержит капсульный полисахарид N. meningitidis серологической группы А, конъюгированный с белком-носителем, и четвертый конъюгат содержит капсульный полисахарид N. meningitidis серологической группы С, конъюгированный с белком-носителем, где белок-носитель выбирают из группы, состоящей из дифтерийного анатоксина, CRM197 и столбнячного анатоксина.
13. Применение по п. 12, где белок-носитель представляет собой дифтерийный анатоксин.
14. Применение по п. 12, где дополнительная иммуногенная композиция представляет собой жидкую композицию.
15. Применение по п. 12, где дополнительная иммуногенная композиция не является лиофилизированной.
16. Применение по какому-либо одному из пп. 12-15, которое индуцирует иммунный ответ против, по меньшей мере, одного из штаммов Neisseria meningitidis серологической группы А, штамма Neisseria meningitidis серологической группы С, штамма Neisseria meningitidis серологической группы Y и/или штамма Neisseria meningitidis серологической группы W135 или какой-либо их комбинации.
17. Применение по какому-либо одному из пп. 1-11, где иммуногенная композиция против папилломавируса человека индуцирует иммунный ответ против, по меньшей мере, одного из вирусов папилломы человека типа 6, 11, 16, 18 или какой-либо их комбинации.
18. Применение по какому-либо одному из пп. 1-11, где дополнительные иммуногенные композиции индуцируют иммунный ответ против, по меньшей мере, одного из штаммов Neisseria meningitidis серологической группы А, штамма Neisseria meningitidis серологической группы С, штамма Neisseria meningitidis серологической группы Y и/или штамма Neisseria meningitidis серологической группы W135 или какой-либо их комбинации и иммунный ответ против дифтерии, столбняка и коклюша.
19. Применение по какому-либо одному из пп. 1-18, где эффективное количество композиции rLP2086 N. meningitidis включает одну дозу.
20. Применение по какому-либо одному из пп. 1-19, где эффективное количество композиции rLP2086 N. meningitidis включает две дозы.
21. Применение по п. 20, где эффективное количество композиции rLP2086 N. meningitidis дополнительно включает ревакцинирующую дозу.
22. Применение по какому-либо одному из пп. 1-21, где эффективное количество композиции rLP2086 N. meningitidis включает не больше трех доз.
23. Применение по какому-либо одному из пп. 1-22, где композиция rLP2086 N. meningitidis применяется в пределах 24 часов от применения, по меньшей мере, одной из трех дополнительных иммуногенных композиций.
24. Применение по какому-либо одному из пп. 1-23, где композиция rLP2086 N. meningitidis применяется одновременно с, по меньшей мере, одной из трех дополнительных иммуногенных композиций.
25. Применение по какому-либо одному из пп. 1-23, где первую дозу композиции rLP2086 N. meningitidis применяют совместно с, по меньшей мере, одной из трех дополнительных иммуногенных композиций.
26. Применение по п. 25, где первую дозу композиции rLP2086 N. meningitidis применяют одновременно с, по меньшей мере, одной из трех дополнительных иммуногенных композиций.
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ ПРОТИВ NEISSERIA MENINGITIDIS (ВАРИАНТЫ) | 2014 |
|
RU2662968C2 |
| СТАБИЛЬНЫЕ КОМПОЗИЦИИ АНТИГЕНОВ Neisseria meningitidis rLP2086 | 2011 |
|
RU2580620C2 |
| WO 2012025873 A2, 01.03.2012 | |||
| Peter C Richmond et | |||
| al | |||
| "Safety, immunogenicity, and tolerability of meningococcal serogroup B bivalent recombinant lipoprotein 2086 vaccine in healthy adolescents: a randomised, single-blind, placebo-controlled, phase 2 trial", The Lancet Infectious Diseases, | |||
Авторы
Даты
2020-06-08—Публикация
2016-02-16—Подача