ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании предварительных заявок США №№ 62/471636, поданной 15 марта 2017 г., и 62/474434, поданной 21 марта 2017 г., содержание которых полностью включено в настоящий документ посредством ссылок.
ОПИСАНИЕ ТЕКСТОВОГО ФАЙЛА, ПОДАННОГО В ЭЛЕКТРОННОМ ВИДЕ
[0002] Содержание текстового файла, поданного в электронном виде с настоящим документом, полностью включено в настоящий документ посредством ссылки. Копия перечня последовательностей в машиночитаемом формате (имя файла: NOVV_058_02WO_SeqList_ST25, дата записи: 13 марта 2018 г., размер файла 187 килобайт).
УРОВЕНЬ ТЕХНИКИ
[0003] Вакцинация против заболеваний с использованием субъединичной вакцины зависит от получения достаточного количества белка-антигена и поддержания стабильности антигена для сохранения активности указанного белка при применении у целевой популяции.
[0004] Осложнения при получении субъединичных вакцин возникают на различных этапах производства. Целевой белок может продуцироваться в малых количествах или может быть нерастворимым, что делает производство экономически невыгодным даже при особенно благоприятном профиле иммуногенности указанного белка.
[0005] Бактериальные инфекции остаются проблемой, угрожающей здоровью. Бактериальные вакцины становятся все более востребованными, поскольку у бактерий развивается устойчивость к часто используемым антибиотикам. Бактериальные субъединичные вакцины основаны на рекомбинантной продукции белка. В то же время бактериальные белки часто сложно продуцировать в больших количествах из-за низкого уровня экспрессии и нерастворимости; кроме того, они могут характеризоваться пониженной стабильностью. Таким образом, улучшенные подходы к производству вакцин, особенно сложных антигенов-мишеней, могут быть полезны с точки зрения здравоохранения во всем мире. В частности, инфекция с участием бактерий-клостридий, в особенности C. Difficile, остается важной проблемой. Инфекция Clostridium difficile (CDI) является основной причиной внутрибольничной диареи, ассоциированной с антибиотиками в развитых странах. Сформировались гипервирулентные штаммы, вызывающие тяжелое заболевание, характеризующиеся повышенной смертностью. Гомологичные гликозилирующие токсины TcdA и TcdB, а также бинарный АДФ-рибозилирующий токсин (CDT) являются основными факторами вирулентности, обуславливающими патогенез. Существует неудовлетворенная потребность в вакцинах, мишенью которых являются эти токсины.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0006] В настоящем документе описаны способы и композиции для индукции иммунного ответа против C. difficile. Композиция содержит полипептиды, содержащие множественные токсины C. difficile, которые при введении субъекту индуцируют желательные иммунные реакции. Кроме того, описаны способы получения полипептидов, содержащих множество токсинов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
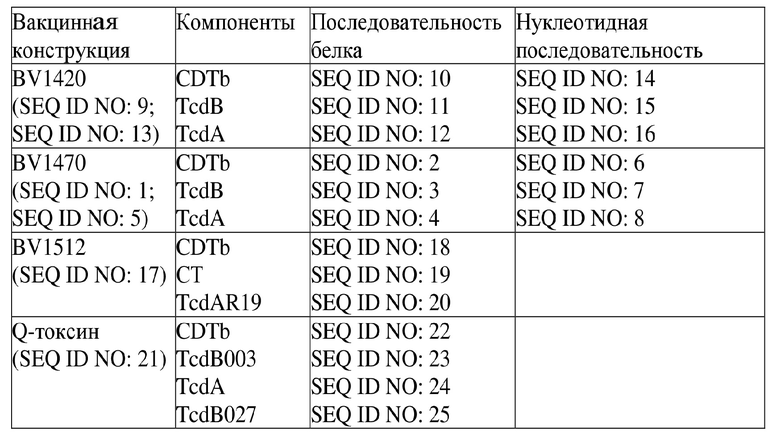
[0007] Фигура 1. Вакцинные конструкции, содержащие три токсина C. difficile. На фигуре показана иллюстрация вакцины на основе трех токсинов C.diff, содержащей связывающие домены CDTb, Tcd B и Tcd A с сайтом расщепления фурином после домена активации CDTb (конструкция 1420) и без него (конструкция 1470).
[0008] Фигура 2. Экспрессия и растворимость трехтоксинных вакцин BV1470 и BV1420. Клетки насекомого Spodoptera frugiperda Sf9 инфицировали при MOI, равной 0,1, рекомбинантными бакуловирусами BV1420 и BV1470, собирали через 48 и 72 часа после инфицирования и анализировали на предмет экспрессии белка посредством электрофореза в ДСН-ПААГ и окрашивания кумасси. Равные объемы общего белка (Т, клетки и среда) и осветленной среды (М) смешивали с 2X буфером для образца для электрофореза в ДСН-ПААГ и анализировали в 4-12% полиакриламидном геле NuPage. Осажденные инфицированные клетки солюбилизировали в буфере, содержащем 1% NP9, 25 мМ трис, 50 мМ NaCl, pH 8,0. Лизированные клетки центрифугировали при 9000 x g в течение 40 мин. Надосадочную жидкость (S, растворимый белок) удаляли, осадок (I, нерастворимый белок) суспендировали в буфере до исходного объема и анализировали посредством электрофореза в ДСН-ПААГ, как описано выше. Местоположение трехтоксинного белка указано стрелкой.
[0009] Фигура 3. Динамика экспрессии трехтоксинных вакцин BV1470 и BV1420. Клетки насекомого Spodoptera frugiperda Sf9 инфицировали рекомбинантными бакуловирусами BV1420 и BV1470, как описано на фигуре 6. Общий белок, среду, растворимый и нерастворимый белок анализировали посредством электрофореза в ДСН-ПААГ и окрашивания кумасси в различные моменты времени после инфицирования. Местоположение трехтоксинного белка указано стрелкой.
[0010] Фигура 4. Очистка трехтоксинной вакцины. Трехтоксинную вакцину очищали от общей клеточной культуры инфицированных клеток Sf9 после добавления NP9 до конечной концентрации 0,2%. Экстракт NP9 дважды осветляли и очищали на последовательных колонках Fractogel EMD TMAE, Phenyl HP и Source 30Q. Тройной токсин элюировали с каждой колонки и загружали на следующую колонку, как показано. Элюируемые фракции с колонки Source 30Q, положительные по трем токсинам, объединяли и стерилизовали фильтрацией через 0,2 мкM фильтр.
[0011] Фигура 5. Очистка трехтоксинной вакцины BV1470 от клеток Sf9. Трехтоксинную вакцину BV1470 очищали от инфицированных клеток, как описано на фигуре 8. Чистоту конечного продукта фильтрации с колонки Source 30Q анализировали посредством электрофореза в ДСН-ПААГ и окрашивания кумасси. Трехтоксинный белок выявляли вестерн-блоттингом с использованием антител против CDTb, TcdB и TcdA.
[0012] Фигура 6. Очистка трехтоксинной вакцины BV1420 от клеток Sf9. Трехтоксинную вакцину BV1420 очищали от инфицированных клеток, как описано на фигуре 8. Чистоту конечного продукта фильтрации с колонки Source 30Q анализировали посредством электрофореза в ДСН-ПААГ и окрашивания кумасси. Трехтоксинный белок выявляли вестерн-блоттингом с использованием антител против TcdB.
[0013] Фигура 7. График гранулометрического состава тройного токсина BV1420 по объему. Размер частиц тройного токсина BV1420 определяли с помощью динамического светорассеяния с использованием Zeta Sizer Nano. Показан график распределения размеров по объему.
[0014] Фигура 8. График гранулометрического состава тройного токсина BV1470 по интенсивности. Размер частиц тройного токсина BV1420 определяли с помощью динамического светорассеяния с использованием Zeta Sizer Nano. Показан график распределения размеров по интенсивности.
[0015] Фигуры 9A-9D Электронные микрофотографии отрицательно окрашенного тройного токсина BV1420. Электронная микрофотография очищенного тройного токсина BV1420, разбавленного до концентрации приблизительно 10 мкг/мл и отрицательно окрашенного уранилацетатом.
[0016] Фигура 10. Исследование 1 по контрольной стимуляции летальной дозой токсина мышей, вакцинированных трехтоксинной вакциной BV1420. Мышей иммунизировали в нулевой день и в 14 день трехтоксинной вакциной BV1420, выполняли контрольную стимуляцию на 35 день летальной дозой Tcd A или CDT и мониторировали в течение 10 дней после контрольной стимуляции. У мышей брали кровь, как показано, и выполняли анализ IgG против токсина и антител, нейтрализующих токсин, в сыворотке. Животных мониторировали на предмет смертности и заболеваемости в течение 10 дней после контрольной стимуляции токсином.
[0017] Фигура 11. Исследование 1 по контрольной стимуляции летальной дозой токсина мышей, вакцинированных трехтоксинной вакциной BV1420 - ответ за счет IgG против токсина в сыворотке. На 42 день выполняли анализ титров IgG против Tcd A, Tcd B и CDT в образцах сыворотки посредством твердофазного ИФА с использованием нативных токсинов, иммобилизованных на планшетах.
[0018] Фигура 12. Исследование 1 по контрольной стимуляции летальной дозой токсина мышей, вакцинированных трехтоксинной вакциной BV1420 - титры антител, нейтрализующих токсин (TNA). Титры антител, нейтрализующих токсин, определяли с использованием колориметрического анализа на основе клеток Vero. Указанный титр представляет собой величину, обратную максимальному разбавлению сыворотки, при котором клетки не погибали.
[0019] Фигура 13. Исследование 1 по контрольной стимуляции летальной дозой токсина мышей, вакцинированных трехтоксинной вакциной BV1420- выживаемость животных. Выживаемость животных определяли через 10 дней после контрольной стимуляции. Животных, демонстрировавших более чем 20% потерю веса, умерщвляли и регистрировали как мертвых.
[0020] Фигура 14. Исследование 2 по контрольной стимуляции летальной дозой токсина мышей, вакцинированных трехтоксинной вакциной BV1420- выживаемость после введения токсина В. Мышей иммунизировали в нулевой день и в 14 день трехтоксинной вакциной BV1420, выполняли контрольную стимуляцию на 35 день летальной дозой Tcd B и мониторировали в течение 10 дней после контрольной стимуляции. У мышей брали кровь, как показано, и выполняли анализ IgG против токсина и антител, нейтрализующих токсин (TNA), в сыворотке. Животных мониторировали на предмет смертности и заболеваемости в течение 10 дней после контрольной стимуляции токсином.
[0021] Фигура 15. Исследование 2 по контрольной стимуляции летальной дозой токсина мышей, вакцинированных трехтоксинной вакциной BV1420 - уровни IgG против токсина. На 42 день выполняли анализ титров IgG против Tcd A, Tcd B и CDT в образцах сыворотки посредством твердофазного ИФА с использованием нативных токсинов, иммобилизованных на планшетах.
[0022] Фигура 16. Исследование 2 по контрольной стимуляции летальной дозой токсина мышей, вакцинированных трехтоксинной вакциной BV1420- титры TNA против токсина В. Титры антител, нейтрализующих токсин, определяли с использованием колориметрического анализа на основе клеток Vero. Указанный титр представляет собой величину, обратную максимальному разбавлению сыворотки, при котором клетки не погибали.
[0023] Фигура 17. Исследование 2 по контрольной стимуляции летальной дозой токсина мышей, вакцинированных трехтоксинной вакциной BV1420- выживаемость после введения токсина В. Выживаемость животных определяли через 10 дней после контрольной стимуляции. Животных, демонстрировавших более чем 20% потерю веса, умерщвляли и регистрировали как мертвых.
[0024] Фигура 18. Показаны дополнительные вакцинные белки с доменом транслокации гена TcdB. BV1512 показан на нижней диаграмме.
[0025] Фигура 19. Экспрессия мультимерного белка: Анализ экспрессии и верстерн-блоттинг мультимерного белка BV1512.
[0026] Фигура 20. Экспрессия четырехвалентного мультимерного белка: На фигуре 25 приведены два четырехвалентных мультимерных белка. В обоих случаях внедрен пептид из второго штамма TcdB для расширения иммунитета против нескольких штаммов. На верхней диаграмме пептид TcdB штамма 027 добавлен к С-концу. На нижней диаграмме пептид внедрен между белком TcdB и белком TcdA(R19) первого штамма (штамма 630).
[0027] Фигура 21. Экспрессия четырехвалентного мультимерного белка: Анализ экспрессии и вестерн-блоттинг четырехвалентного белка показаны на верхней диаграмме фигуры 20.
[0028] Фигура 22. Экспрессия четырехвалентного мультимерного белка: Анализ экспрессии и вестерн-блоттинг четырехвалентного белка показаны на нижней диаграмме фигуры 20.
[0029] Фигура 23. Токсины C. difficile и конструкция химерного трехвалентного (T) и четырехвалентного (Q) гибридных белков токсинов. На фигуре 23A показано изображение функциональных доменов токсина A (TcdA), токсина B (TcdB) и бинарного токсина (CDT) C. difficile, использованных для конструирования химерных трехвалентного и четырехвалентного гибридных белков токсинов. TcdA и TcdB используют общие функциональные домены, включая ферментативный гликозилтрансферазный (GT) домен, автокаталитический домен цистеиновой протеазы (CP), порообразующий транслоцирующий домен (PT) (оранжевый) и рецептор-связывающий домен (RBD). Бинарный токсин (CDT) состоит из ферментативного АДФ-рибозилтрансферазного компонента (CDTa) и рецептор-связывающего компонента (CDTb). CDTb содержит сигнальную последовательность длиной 42 аминокислоты (АК) с двумя сайтами протеолитического расщепления серинового типа (стрелка), которые при расщеплении дают 20-кДа и 75-кДа фрагменты. На фигуре 24B показана иллюстрация химерного трехвалентного гибридного белка токсина (T-токсин) и химерного четырехвалентного гибридного белка токсина (Q-токсин). Гибридный белок T-токсина состоит из полноразмерной кодирующей последовательности CDTb, RBD TcdB(003), содержащий 24 повтора, и укороченный RBD TcdA, содержащий 19 повторов. Экспрессированный гибридный белок T-токсина состоит из 1813 АК, его молекулярная масса (MW) составляет 205 кДа. Гибридный белок Q токсина состоит из полноразмерной кодирующей последовательности CDTb, RBD TcdB(003), содержащий 24 повтора, RBD TcdA, укороченный до 19 повторов, и RBD TcdB(027), содержащий 24 повтора. Экспрессируемый гибридный белок Q-токсина состоит из 2359 АК, его молекулярная масса составляет 268 кДа.
[0030] Фигуры 24A-24C. Экспрессия и очистка гибридных белков Т-токсина и Q-токсина. При электрофорезе в ДСН-ПААГ очищенный T-токсин (дорожки 2 и 3) мигрирует как белок с молекулярной массой 205 кДа, а Q-токсин (дорожки 4 и 5) мигрирует как белок с молекулярной массой 268 кДа. Маркер молекулярной массы (дорожка 1). На фигуре 24A показано, что чистота T-токсина и Q-токсина составляла >90% согласно сканирующей денситометрии при электрофорезе в ДСН-ПААГ. На фигуре 24B показан вестерн-блоттинг с использованием специфических антител кролика против CDTb в качестве зондов. На фигуре 24C показан вестерн-блоттинг с использованием специфических антител курицы против TcdB в качестве зондов. На фигуре 24D показан вестерн-блоттинг с использованием специфических антител курицы против TcdA в качестве зондов.
[0031] Фигуры 25A-25C. Иммуногенность гибридных белков Т-токсина и Q-токсина у мышей. Группы самок мышей C57BL/6 (N = 10/группу) в/м иммунизировали в 0 и 14 дни T-токсином (100 мкг) или Q-токсином (100 мкг) с использованием квасцов в качестве адъюванта (50 мкг) или фосфатно-солевым буфером (ФСБ) (контрольная группа). Сыворотку собирали через 18 дней после второй вакцинации. На фигуре 25А показаны титры IgG против TcdA, TcdB(003) и CDTb в сыворотке при определении посредством твердофазного ИФА. На фигуре 25B показаны титры антител, нейтрализующих токсин, для каждого токсина, при определении посредством анализа на основе клеток Vero. На фигуре 25C мыши получали летальную дозу (MLD100% = 2,0 мкг) TcdB(003), вводимую в/б через 21 день после второй иммунизации. *Значимость определяли с использованием лог-рангового критерия Мантеля-Кокса при сравнении групп T-токсина или Q-токсина с контрольной группой ФСБ.
[0032] Фигуры 26A-26D. Иммуногенность гибридных белков Т-токсина и Q-токсина у хомяков. Самцов хомяков (N = 8/группу) в/м иммунизировали 3 раза с 21-дневным интервалом 30 мкг Q-токсина с использованием 120 мкг квасцов в качестве адъюванта или ФСБ (контрольная группа). Через две недели после третьей дозы собирали и анализировали образцы. На фигуре 26А показаны титры IgG против TcdA, TcdB(003) и CDTb в сыворотке при определении посредством твердофазного ИФА. На фигуре 26B показаны титры антител, нейтрализующих токсин, для каждого токсина, при определении в анализе на основе клеток Vero. На фигурах 26C и 26D через две недели после третьей иммунизации всех животных в/б обрабатывали клиндамицином (10 мг/кг) за один день после контрольного заражения спорами и выполняли контрольное заражение через желудочный зонд 200 КОЕ штамма 630 C. difficile (C) или 500 КОЕ штамма B1/NAP1/027 C. difficile (D). За животными наблюдали в течение 8 дней после контрольного заражения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0033] В настоящем документе термин «адъювант» относится к соединению, которое при использовании в комбинации с иммуногеном усиливает или иным образом изменяет или модифицирует иммунный ответ, индуцированный против иммуногена. Модификация иммунного ответа может включать интенсификацию или расширение специфичности гуморального или клеточного иммунного ответа.
[0034] В настоящем документе термины «иммуноген», «антиген» и «эпитоп» используются взаимозаменяемо и относятся к таким веществам, как белки и пептиды, способным вызывать иммунный ответ.
[0035] В настоящем документе термин «гибридный белок» означает белок, состоящий из двух или более белков или фрагментов белка, непосредственно или опосредованно (посредством связывающего пептида) соединенных или объединенных по N-концу одного белка и С-концу другого белка с образованием единого непрерывного полипептида. В некоторых аспектах гибридный белок может называться «мультивалентным белком». Мультивалентный белок содержит белки или фрагменты двух или более трех отдельных белковых антигенов, объединенные друг с другом.
[0036] В настоящем документе термины «лечить» и «лечение» относятся к подходу для получения благоприятных или желательных результатов, например, клинических результатов. Для целей настоящего изобретения благоприятные или желательные результаты могут включать ингибирование или подавление инициации или прогрессирования инфекции или заболевания; ослабление или уменьшение развития симптомов инфекции или заболевания; или их комбинацию.
[0037] Термин «предотвращение» в настоящем документе используется взаимозаменяемо с термином «профилактика» и может означать полную профилактику инфекции или заболевания или предотвращение развития симптомов этой инфекции или заболевания; задержку начала инфекции или заболевания или его симптомов; или снижение тяжести впоследствии развившейся инфекции или заболевания или его симптомов.
[0038] В настоящем документе термин «эффективная доза» или «эффективное количество» относится к количеству иммуногена, достаточному для индукции иммунного ответа, который ослабляет по меньшей мере один симптом малярии. Эффективную дозу или эффективное количество можно определить, например, путем измерения количества нейтрализующих секреторных и/или сывороточных антител, например, путем нейтрализации бляшек, фиксации комплемента, твердофазного иммуноферментного анализа (твердофазного ИФА) или анализа микронейтрализации.
[0039] В настоящем документе термин «вакцина» относится к препарату, содержащему иммуноген (например, гибридный белок, описанный в настоящем документе), полученный из патогена, который используется для индукции иммунного ответа против этого патогена, что обеспечивает защитный иммунитет (например, иммунитет, защищающий субъекта против инфицирования патогенным организмом и/или снижающий тяжесть заболевания или состояния, вызванного инфицированием патогенным организмом). Защитный иммунный ответ может включать образование антител и/или клеточный ответ. В зависимости от контекста термин «вакцина» может также относиться к суспензии или раствору иммуногена, который вводят позвоночному для получения защитного иммунитета.
[0040] В настоящем документе термин «субъект» включает людей и других животных. В одном варианте реализации субъект является человеком.
[0041] В настоящем документе термин «фармацевтически приемлемый» означает, что он одобрен регулирующим органом федерального правительства или правительства штата или включен в фармакопею США, Европейскую фармакопею или другую общепризнанную фармакопею для применения у млекопитающих и, в частности, у людей. Эти композиции можно применять в качестве вакцинных и/или антигенных композиций для индукции защитного иммунного ответа у позвоночных.
[0042] В настоящем документе термин «приблизительно» означает плюс-минус 10% от указанного численного значения.
Краткий обзор
В настоящем изобретении предложены способы и композиции для достижения высокого уровня экспрессии крупных белков, в частности, мультивалентных белков, содержащих множественные антигены, в клетках насекомых. Продукция большого количества белков, описанная в настоящем документе, особенно неожиданна с учетом предшествующего опыта в данной области техники.
Мультивалентные белки
[0043] Мультивалентные (мультивалентный белок в настоящем документе также может называться мультимером) белки, описанные в настоящем документе, могут защищать от множества патогенных микроорганизмов и/или эффектов, вызванных множеством патогенных белков, полученных из одного и того же организма. Например, некоторые патогены могут продуцировать множество молекул, каждая из которых негативно влияет на субъекта. Более эффективный ответ получают путем индукции реакций против множества отдельных антигенов.
[0044] Мультивалентный белок содержит белковые фрагменты (части) множества бактериальных токсинов. В некоторых аспектах мультивалентный белок содержит или состоит из фрагментов белка из одного и того же организма, например, токсинов. В других аспектах мультивалентный белок содержит или состоит из белков более чем одного организма. В конкретных аспектах любые два белка мультивалентного белка получены не из одного и того же организма. В некоторых аспектах для получения фрагментов можно применять одни и те же белки из разных штаммов (т.е. изологи). Использование одного и того же белка из разных штаммов обеспечивает защиту от нескольких штаммов и особенно полезно в ситуациях, когда возникают новые вирулентные штаммы. Другие примеры включают C. botulinum у которой есть 8 серологических типов A-H. Способы и композиции, описанные в настоящем документе, можно применять для создания единой вакцины против всех 8 серотипов. Другие конкретные примеры включают комбинированные токсинные вакцины для защиты от холеры, дифтерии и шигелл или столбняка, коклюша и дифтерии. Таким образом, в некоторых аспектах мультимерный белок может содержать фрагменты 2, 3, 4, 5, 6, 7, 8, 9 или 10 различных белков. Эти фрагменты можно применять в качестве компонентов для получения мультимерных иммуногенных полипептидов.
[0045] Типичные мультимеры и компоненты, используемые для получения вакцин, описаны ниже в таблице. Нуклеотидные последовательности, кодирующие Q-токсин и BV1512, а также альтернативные нуклеотидные последовательности BV1420 и BV1470, представляют собой последовательности, использующие стандартное преобразование кодонов в соответствующие вырожденные кодоны, кодирующие указанную аминокислоту.
[0046] Дополнительные вакцинные конструкции могут использовать различные вышеприведенные компоненты в различных ориентациях. Кроме того, в качестве компонентов для получения мультимерного белка можно применять белки, характеризующиеся по меньшей мере 90% идентичностью по отношению к каждой из этих описанных последовательностей.
Линкеры
[0047] В некоторых аспектах между одним или более белками в мультивалентных белках можно использовать линкеры. В некоторых аспектах линкер представляет собой поли-(Gly)n линкер, где n равно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 16, 17, 18, 19 или 20. В других аспектах линкер представляет собой GG, GGG или GGGG (SEQ ID NO: 26). В других аспектах линкер выбран из группы, состоящей из дипептидов, трипептидов и тетрапептидов. Предпочтительными дипептидами являются аланин-серин (AS), лейцин-глутаминовая кислота (LE), серин-аргинин (SR).
[0048] Мультивалентные антигены особенно подходят для защиты от организмов, которые выделяют множество токсинов в организм субъекта. Например, известно, что бактерии продуцируют токсины, которые вызывают заболевания у людей. Таким образом, хотя основной целью настоящего изобретения является C. difficile; можно получить мультимерные полипептиды согласно настоящему изобретению с использованием фрагментов белковых токсинов других видов.
[0049] Токсин-продуцирующие виды включают C. perfringes, C. botulinum, C. difficile и C. tetani), Bacillus (например, B. anthracis), Vibrio (например, Vibrio cholerae), Shigella и Corynebacterium. C. difficile выделяет два кишечных токсина, A и B, которые продуцируют токсигенные штаммы. Токсин A представляет собой энтеротоксин с минимальной цитотоксической активностью, в то время как токсин B представляет собой мощный цитотоксин, но обладает ограниченной энтеротоксической активностью. Третий токсин, бинарный токсин, также известный как CDT, также продуцируют бактерии. Известны последовательности, кодирующие токсин A и B (Moncrief et al., Infect. Immun. 65:1105-1108 (1997); Barroso et al., Nucl. Acids Res. 18:4004 (1990); Dove et al. Infect. Immun. 58:480-488 (1990)). Кроме того, известны последовательности, кодирующие бинарный токсин (учетные номера ABS57477, AAB67305, AAF81761).
[0050] Возможность применения настоящего изобретения для защиты от патогенной инфекции показана на примере трехвалентной белковой вакцины против C. difficile. На фигуре 1 показана структура двух типичных мультимерных белков (BV1420 и BV1470). Каждый мультимер содержит фрагменты трех белков-токсинов - токсина A (TcdA), токсина B (TcdB) и бинарного токсина (CDTb) C. difficile. Тройной токсин 1420 также содержит сайт расщепления фурином. Эти белки являются крупными (содержат более 1800 аминокислот), и ранее не ожидалось, что их можно получать в больших количествах при экспрессии в клетках насекомых. Однако, неожиданно, оба белка экспрессируются в больших количествах. См. фигуру 3. Фактически, как продемонстрировано на фигуре 5, выход BV1470 составлял 269 мг/л. Аналогичным образом, выход BV1420 составлял 166 мг/л.
[0051] Анализ очищенных мультимерных белков подтвердил, что они находились в составе структур-наночастиц с максимальным диаметром приблизительно 16 нм для BV1420 и приблизительно 18 нм для BV1470. Примечательно, что распределение диаметров, показанное на фигурах 7 и 8, демонстрирует, что высокий процент мультимерных белков сохранял структуру наночастиц после очистки.
[0052] Введение трехвалентных наночастиц BV1420 мышам демонстрирует получение иммунных реакций на все три белка. Кроме того, как показано на фигуре 3, полученный иммунный ответ защищал 100% мышей от летальной контрольной стимуляции токсином А и бинарным токсином, а также от 67% до 83% мышей от летальной контрольной стимуляции токсином B. В противоположность этому, все мыши в контрольной группе ФСБ погибли, за исключением двух мышей в контрольной группе бинарного токсина.
[0053] Четырехвалентные токсины также являются предпочтительным видом мультимерного иммуногенного пептида. На фигуре 20 показаны два типичных примера с четырьмя последовательно расположенными фрагментами или компонентами. Несмотря на значительную длину мультимера, данный белок продуцировался в больших количествах. Фиг. 22.
[0054] На фигуре 23 показано преобразование трехтоксинного гибридного белка в четырехвалентный токсин путем добавления фрагмента токсина TcdB второго типа. Сравнение этих двух белков показывает, что экспрессия в клетках насекомых способна обеспечить высокий уровень продукции. См. фиг. 24A-D.
[0055] Таким образом, типичные мультимеры включают фрагменты, упорядоченные в различной ориентации. Например, начиная с N-конца, первый фрагмент может представлять собой фрагмент TcdA, фрагмент TcdB или фрагмент CDTb. Второй фрагмент может представлять собой фрагмент TcdA, фрагмент TcdB или фрагмент CDTb. Третий фрагмент может представлять собой фрагмент TcdA, фрагмент TcdB или фрагмент CDTb. Четвертый фрагмент (при его наличии) может представлять собой фрагмент TcdA, фрагмент TcdB или фрагмент CDTb. Таким образом, каждый фрагмент может находиться в каждом положении. Обычно, хотя и не всегда, два соседних фрагмента не являются фрагментами токсина одного и того же типа. В предпочтительных вариантах реализации N-концевой фрагмент является фрагментом CDTb.
Молекулярно-биологические методики
[0056] Мультивалентные белки, описанные в настоящем документе, получают с помощью молекулярно-биологических подходов. Основные тексты, в которых описаны молекулярно-биологические методики, которые можно применять в настоящем изобретении, например, клонирование, мутирование, культивирование клеток и т.п., включают Berger and Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology volume 152 Academic Press, Inc., San Diego, Calif. (Berger); Sambrook et al., Molecular Cloning--A Laboratory Manual (3rd Ed.), Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 2000 («Sambrook») и Current Protocols in Molecular Biology, F. M. Ausubel et al., eds., Current Protocols, a joint venture between Greene Publishing Associates, Inc. and John Wiley & Sons, Inc., («Ausubel»). В этих текстах описан мутагенез, использование векторов, промоторов и многие другие соответствующие темы, связанные, например, с клонированием и мутированием PfCSP и т.д. Таким образом, настоящее изобретение также охватывает применение известных методик белковой инженерии и технологии рекомбинантных ДНК для улучшения или изменения характеристик белков, экспрессируемых на или в составе гибридных белков согласно настоящему изобретению. Для получения и/или выделения вариантных нуклеиновых кислот, кодирующих молекулы белка, и/или для дополнительной модификации/мутации белков на или в составе гибридных белков согласно настоящему изобретению можно использовать различные типы мутагенеза. Они включают сайт-специфический, случайный точечный мутагенез, гомологичную рекомбинацию (перетасовку ДНК), мутагенез с использованием урацилсодержащих матриц, олигонуклеотид-специфический мутагенез, мутагенез ДНК, модифицированной тиофосфатами, мутагенез с использованием двуцепочечной ДНК с разрывом и т.п., но не ограничиваются ими Дополнительные подходящие способы включают репарацию точечных несоответствий, мутагенез с использованием штаммов-хозяев, дефектных по репарации, рестрикционный отбор и рестрикционную очистку, делеционный мутагенез, мутагенез посредством синтеза всего гена, репарацию двуцепочечных разрывов и т.п. Мутагенез, например, включающий химерные конструкции, также включен в настоящее изобретение. В одном варианте реализации при мутагенезе можно использовать известную информацию о природной молекуле или модифицированной или мутированной природной молекуле, например, о последовательности, сравнении последовательностей, физических свойствах, кристаллической структуре и т.п.
[0057] Способы клонирования белков известны в данной области техники. Ген можно клонировать в виде ДНК, вставленной в вектор. Термин «вектор» относится к средствам, с помощью которых можно размножать и/или переносить нуклеиновую кислоту между организмами, клетками или клеточными компонентами. Векторы включают плазмиды, вирусы, бактериофаги, провирусы, фагмиды, транспозоны, искусственные хромосомы и т.п., которые реплицируются автономно или могут встраиваться в хромосому клетки-хозяина. Вектор также может представлять собой депротеинизированный РНК-полинуклеотид, депротеинизированный ДНК-полинуклеотид, полинуклеотид, содержащий как ДНК, так и РНК в одной и той же цепи, ДНК или РНК, конъюгированную с полилизином, ДНК или РНК, конъюгированную с пептидом, ДНК, конъюгированную с липосомами и т.п., не реплицирующиеся автономно. Во многих, но не во всех распространенных вариантах реализации векторы согласно настоящему изобретению являются плазмидами или бакмидами.
[0058] Таким образом, настоящее изобретение включает нуклеотиды, кодирующие белки, в том числе химерные молекулы, клонированные в экспрессирующий вектор, способный экспрессироваться в клетке, индуцирующий образование гибридных белков согласно настоящему изобретению. «Экспрессирующий вектор» представляет собой вектор, например, плазмиду, способную стимулировать экспрессию, а также репликацию нуклеиновой кислоты, внедренной в нее. Обычно экспрессируемая нуклеиновая кислота «функционально связана» с промотором и/или энхансером и подвергается регуляции транскрипции за счет промотора и/или энхансера. В одном варианте реализации нуклеотиды кодируют белок Plasmodium (как обсуждалось выше). В еще одном варианте реализации экспрессирующий вектор представляет собой бакуловирусный вектор.
[0059] В некоторых вариантах реализации настоящего изобретения белки могут содержать мутации, содержащие модификации, приводящие к молчащим заменам, добавлениям или делециям, например, для оптимизации кодонов под экспрессию в конкретном хозяине (замену кодонов в мРНК человека на кодоны, предпочтительные для клеток насекомого, например, клеток Sf9). См., например, публикацию патента США 2005/0118191, полностью включенную в настоящий документ посредством ссылки для всех целей.
[0060] Кроме того, нуклеотиды можно секвенировать для обеспечения клонирования нужных кодирующих областей, не содержащих каких-либо нежелательных мутаций. Нуклеотиды можно субклонировать в экспрессирующий вектор (например, бакуловирус) для экспрессии в любой клетке. Выше приведен лишь один пример способа клонирования белков. Специалист в данной области техники должен понимать, что можно применять дополнительные способы.
Клетки-хозяева
[0061] В системах экспрессии на основе клеток насекомых получали высокий уровень экспрессии. Неограничивающие примеры клеток насекомых представляют собой клетки Spodoptera frugiperda (Sf), например, Sf9, Sf21, клетки Trichoplusia ni, например, клетки High Five, и клетки Drosophila S2.
[0062] Векторы, например, векторы, содержащие полинуклеотиды, кодирующие гибридные белки, можно трансфицировать в клетки-хозяева в соответствии со способами, хорошо известными в данной области техники. Например, нуклеиновые кислоты можно внедрять в эукариотические клетки путем совместного осаждения с фосфатом кальция, электропорации, микроинъекции, липофекции и трансфекции с использованием реагентов для трансфекции с полиаминами. В одном варианте реализации вектор представляет собой рекомбинантный бакуловирус.
Получение наночастиц
[0063] Наночастицы можно получать путем выращивания клеток-хозяев, трансформированных экспрессирующим вектором, в условиях, в которых экспрессируются рекомбинантные белки. В одном аспекте способ получения мультивалентного белка включает трансфекцию векторов, кодирующих белок, в подходящую клетку-хозяина, и экспрессию белка в условиях, обеспечивающих образование наночастиц. В еще одном варианте реализации эукариотическая клетка выбрана из группы, состоящей из клеток дрожжей, насекомого, земноводного, птицы или млекопитающего. Выбор подходящих ростовых условий находится в компетенции специалиста в данной области техники.
[0064] Способы выращивания клеток-хозяев включают способы периодического, полупериодического, непрерывного и перфузионного культивирования клеток, но не ограничиваются ими. Культивирование клеток означает рост и размножение клеток в биореакторе (ферментационной камере), где клетки размножаются и экспрессируют белок (например, рекомбинантные белки) для очистки и выделения. Как правило, культивирование клеток выполняют в стерильных условиях с контролируемой температурой и составом атмосферы в биореакторе. Биореактор представляет собой камеру, используемую для культивирования клеток, в которой можно отслеживать условия среды, например, температуру, состав атмосферы, перемешивание и/или pH. В одном варианте реализации биореактор представляет собой камеру из нержавеющей стали. В еще одном варианте реализации биореактор представляет собой заранее стерилизованный пластмассовый пакет (например, Cellbag®, Wave Biotech, Бриджуотер, штат Нью-Джерси, США). В другом варианте реализации объем заранее стерилизованных пластмассовых пакетов составляет от приблизительно 50 л до 1000 л.
Экстракция (выделение) детергентом и очистка наночастиц
[0065] Наночастицы можно выделить из клеток-хозяев с использованием детергентов. Подходящие детергенты включают неионогенные поверхностно-активные вещества. Например, неионогенное поверхностно-активное вещество может представлять собой бис(полиэтиленгликоль-бис[имидазоилкарбонил]), ноноксинол-9-бис(полиэтиленгликоль-бис[имидазоилкарбонил]), Brij® 35, Brij®56, Brij® 72, Brij® 76 , Brij® 92V, Brij® 97, Brij® 58P, Cremophor® EL, монододециловый эфир декаэтиленгликоля, N-деканоил-N-метилглюкамин, н-децил-альфа-D-глюкопиранозид, децил-бета-D-мальтопиранозид, н-додеканоил-N-метилглюкамид, н-додецил-альфа-D-мальтозид, н-додецил-бета-D-мальтозид, монодециловый эфир гептаэтиленгликоля, монододециловый эфир гептаэтиленгликоля, монотетрадециловый эфир гептаэтиленгликоля, н-гексадецил-бета-D-мальтозид, монододециловый эфир гексаэтиленгликоля, моногексадециловый эфир гексаэтиленгликоля, монооктадециловый эфир гексаэтиленгликоля, монотетрадециловый эфир гексаэтиленгликоля, Igepal СА-630, Igepal СА -630, метил-6-О-(N-гептилкарбамоил)-альфа-D-глюкопиранозид, монододециловый эфир нонаэтиленгликоля, N-нонаноил-N-метилглюкамин, монодециловый эфир октаэтиленгликоля, монододециловый эфир октаэтиленгликоля, моногексадециловый эфир октаэтиленгликоля, монооктадециловый эфир октаэтиленгликоля, монотетрадециловый эфир октаэтиленгликоля, октил-бета-D-гликопиранозид, монодециловый эфир пентаэтиленгликоля, монододециловый эфир пентаэтиленгликоля, моногексадециловый эфир пентаэтиленгликоля, моногексиловый эфир пентэтиленгликоля, монооктадециловый эфир пентаэтиленгликоля, монооктиловый эфир пентаэтиленгликоля, диглицидиловый эфир полиэтиленгликоля, простой эфир полиэтиленгликоля W-1, тридециловый эфир полиоксиэтилена 10, стеарат полиоксиэтилена 100, изогексадециловый эфир полиоксиэтилена 20, олеиловый эфир полиоксиэтилена 20, стеарат полиоксиэтилена 40, стеарат полиоксиэтилена 50 стеарат полиоксиэтилена 8, полиоксиэтилен-бис(имидазолилкарбонил), стеарат полиоксиэтилен-25-пропиленгликоля, сапонин из коры квиллайи, Span® 20, Span® 40, Span® 60, Span® 65, Span® 80, Span® 85, Tergitol 15-S-12, Tergitol 15-S-30, тип Tergitol 15-S-5, Tergitol 15-S-7, Tergitol 15-S-9, Tergitol NP-10, Tergitol NP-4, Tergitol NP-40, Tergitol NP-7, Tergitol NP-9, Tergitol TMN- 10, Tergitol TMN-6, тетрадецил-бета-D-мальтозид, монодециловый эфир тетраэтиленгликоля, монододециловый эфир тетраэтиленгликоля, монотетрадециловый эфир тетраэтиленгликоля, монодециловый эфир триэтиленгликоля, монододециловый эфир триэтиленгликоля, моногексадециловый эфир триэтиленгликоля, монооктиловый эфир триэтиленгликоля, монотетрадециловый эфир триэтиленгликоля, Triton CF-21, Triton CF-32, Triton DF-12, Triton DF-16, Triton GR-5M, Triton QS-15, Triton QS-44, Triton X-100, Triton X-102, Triton Х-15, Triton Х-151, Triton Х-200, Triton Х-207, Triton® Х-100, Triton® Х-114, Triton® Х-165, Triton® Х-305, Triton® Х-405 , Triton® X-45, Triton® X-705-70, TWEEN® 20, TWEEN® 21, TWEEN® 40, TWEEN® 60, TWEEN® 61, TWEEN® 65, TWEEN® 80, TWEEN® 81, TWEEN® 85, тилоксапол, н-ундецил-бета-D-глюкопиранозид, их полусинтетические производные или комбинации. Tergitol NP-9 является предпочтительным детергентом.
[0066] После выращивания клеток-хозяев в течение 48-72 часов клетки выделяют из среды и добавляют раствор, содержащий детергент, для растворения клеточной мембраны и высвобождения наночастиц в экстракт детергента. Детергент можно добавлять до конечной концентрации от приблизительно 0,1% до приблизительно 1,0%. Например, концентрация может составлять приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,5%, приблизительно 0,7%, приблизительно 0,8% или приблизительно 1,0 %. В некоторых аспектах этот диапазон может составлять от приблизительно 0,1% до приблизительно 0,3%. Предпочтительная концентрация составляет приблизительно 0,2%.
[0067] Затем можно выделить наночастицы с использованием способов, сохраняющих их целостность, например, центрифугирования. В некоторых аспектах можно применять градиентное центрифугирование, например, с использованием хлорида цезия, сахарозы и йодиксанола. В качестве альтернативы или дополнения можно применять другие методики, например стандартные методики очистки, включая, например, ионообменную и гель-фильтрационную хроматографию.
[0068] В одном аспекте экстракт детергента последовательно добавляют на несколько колонок. Например, первая колонка может представлять собой колонку для ионообменной хроматографии, например, TMAE, вторая колонка может представлять собой колонку для хроматографии гидрофобного взаимодействия, например, Phenyl HP, а третья колонка может представлять собой колонку для сильной анионообменной хроматографии, например, колонку Source 30Q. Повышенной чистоты можно достичь путем повторения этой трехэтапной процедуры.
[0069] Ниже приведена общая процедура получения и очистки белков. Специалист в данной области техники должен понимать, что существуют ее варианты, которые можно использовать
[0070] Продукцию начинают путем посева клеток Sf9 (неинфицированных) в качалочные колбы, обеспечивая размножение клеток и масштабирование процесса по мере роста и размножения клеток (например, из 125-мл колбы в пакет Wave объемом 50 л). Среду, используемую для роста клеток, составляют для соответствующей линии клеток (предпочтительной является бессывороточная среда, например, среда для клеток насекомых ExCell-420, JRH). Затем клетки инфицируют рекомбинантным бакуловирусом при наиболее эффективной множественности заражения (например, от приблизительно 1 до приблизительно 3 бляшкообразующих единиц на клетку). После инфицирования геном вируса экспрессирует гибридные белки (и, необязательно, другие иммуногены). Обычно инфекция максимально эффективна при использовании клеток в середине логарифмической фазы роста (4-8×106 клеток/мл), жизнеспособных по меньшей мере приблизительно на 90%.
[0071] Белки согласно настоящему изобретению можно собирать приблизительно через 48-96 часов после инфицирования. В некоторых аспектах сбор выполняют приблизительно через 48 часов, приблизительно через 72 часа или между приблизительно 48 и приблизительно 72 часами. Как правило, сбор выполняют при уровне вирусоподобных частиц в культуральной среде, близком к максимальному, но до интенсивного лизиса клеток. Плотность и жизнеспособность клеток Sf9 на момент сбора может составлять от приблизительно 0,5×106 клеток/мл до приблизительно 1,5×106 клеток/мл при по меньшей мере 20% жизнеспособности, согласно анализу с исключением красителя.
[0072] Для солюбилизации частиц непосредственно добавляют Tergitol NP9 к культуре клеток до конечной концентрации 0,2% NP9/25 мМ трис/50 мМ NaCl/pH 8,0. Инкубируют при комнатной температуре в течение 1 часа, затем дважды центрифугируют лизат при 9000 g в течение 30 мин. Собирают надосадочную жидкость, содержащую наночастицы. Затем надосадочную жидкость добавляют в буфер А и элюируют в буфер В (буфер А: 25 мМ трис pH 8,0 /50 мМ NaCl, буфер B: 25 мМ трис pH 8,0/1 M NaCl). Элюат наносят на колонку Phenyl HP (буфер A: 350 мМ цитрата Na/25 мМ трис pH 7,5, буфер B: 5 мМ трис pH 8,0), а затем на колонку Source 30Q (буфер A: 25 мМ трис pH 8,0/250 мМ NaCl, буфер B: 25 мМ трис pH 8,0/1 M NaCl). Объединенные фракции, содержащие продукт, пропускают через 2-микронный фильтр. См. фигуры 8-10.
[0073] Вышеописанные процедуры обеспечивают по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 98% чистоту с выходом от 150 мг/л до приблизительно 300 мг/л. Чистоту можно измерить с помощью подходов с использованием гелей, которые оценивают общий белок.
[0074] При желании интактный бакуловирус можно инактивировать. Инактивацию можно выполнить с помощью химических способов, например, с использованием формалина или β-пропиолактона (BPL). Удаление и/или инактивацию интактного бакуловируса также можно в значительной степени выполнить с использованием способов селективного осаждения и хроматографии, известных в данной области техники, как показано выше. Способы инактивации включают инкубирование образца, содержащего вирусоподобные частицы, в 0,2% BPL в течение 3 часов при температуре от приблизительно 25°C до приблизительно 27°C. Бакуловирус также можно инактивировать инкубированием образца, содержащего вирусоподобные частицы, в 0,05% BPL при 4°C в течение 3 дней, а затем при 37°C в течение часа.
[0075] Вышеприведенные методики можно осуществлять в различном масштабе. Например, от Т-образных колб, качалочных колб, вращающихся колб до биореакторов промышленного размера. Биореакторы могут включать резервуар из нержавеющей стали или заранее стерилизованный пластмассовый пакет (например, система, продаваемая Wave Biotech, Бриджуотер, штат Нью-Джерси, США). Специалист в данной области техники должен знать наиболее предпочтительные варианты для конкретных обстоятельств.
Размер и выход белка
[0076] Выход мультимерных белков с использованием способов, описанных в настоящем документе, является значительным. В некоторых случаях выход составляет от приблизительно 150 мг/л до приблизительно 300 мг/л. В некоторых вариантах реализации выход составляет приблизительно 40 мг/л, приблизительно 60 мг/л, приблизительно 80 мг/л, приблизительно 100 мг/л, приблизительно 150 мг/л, приблизительно 200 мг/л, приблизительно 250 мг/л или приблизительно 300 мг/л. В конкретных аспектах выход составляет от приблизительно 40 мг/л до приблизительно 300 мг/л, от приблизительно 80 мг/л до приблизительно 250 мг/л или от приблизительно 100 мг/л до приблизительно 300 мг/л.
[0077] Размер крупных мультимерных белков, описанных в настоящем документе, обычно составляет от 1500 до 2500 аминокислот. В некоторых аспектах он составляет от приблизительно 1500 до приблизительно 2000 аминокислот. В других аспектах он составляет от приблизительно 1800 до приблизительно 2000 аминокислот.
[0078] Мультимерные белки образуют наночастицы с типичным диаметром от приблизительно 11 нм до приблизительно 35 нм. Диапазон диаметра может составлять от приблизительно 15 нм до приблизительно 25 нм. Типичные примеры наночастиц мультимерного белка в этих диапазонах показаны на Фигуре 9.
[0079] Важно отметить, что несмотря на большой размер белков, они остаются растворимыми. Например, очищенный мультимерный белок может быть приблизительно на 80% растворимым, приблизительно на 85% растворимым, приблизительно на 90% растворимым, приблизительно на 95% растворимым, приблизительно на 97% растворимым или приблизительно на 99% растворимым. В некоторых аспектах растворимость составляет от приблизительно 90% до приблизительно 99% или от приблизительно 90% до приблизительно 95%.
Модифицированные антигены и полипептиды
[0100] Антигены, описанные в настоящем документе, включают варианты и мутанты этих антигенов. В некоторых аспектах антиген может быть частично идентичен описанному антигену. Как правило, если это специально не задано в контексте конкретных указанных антигенов, процентная идентичность может составлять по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 98%. Процент идентичности можно рассчитать с помощью программы выравнивания Clustal Omega, доступной по адресу www.ebi.ac.uk/Tools/msa/clustalo, с использованием параметров по умолчанию.
[0101] В определенных аспектах белок, содержащийся в наночастицах, состоит из указанного белка. В других аспектах белок, содержащийся в наночастицах, содержит указанный белок. Увеличение размеров самого белка можно выполнять для различных целей.
[0102] В некоторых аспектах антиген можно увеличить с N-конца и/или С-конца. В некоторых аспектах присоединенный фрагмент представляет собой метку, которую можно применять в определенных целях, например, для очистки или обнаружения. В некоторых аспектах метка содержит эпитоп. Например, метка может представлять собой полиглутаматную метку, метку FLAG, HA-метку, полигистидиновую метку (содержащую приблизительно 5-10 остатков гистидина), Myc-метку, глутатион-S-трансферазную метку, метку зеленого флуоресцентного белка, мальтозосвязывающую белковую метку, тиоредоксиновую метку или Fc-метку. В других аспектах присоединенный фрагмент может представлять собой N-концевой сигнальный пептид, объединенный с белком для усиления экспрессии. Хотя такие сигнальные пептиды часто отщепляются в ходе экспрессии в клетке, некоторые наночастицы могут содержать антиген с интактным сигнальным пептидом. Таким образом, если наночастица содержит антиген, указанный антиген может содержать присоединенный фрагмент и, следовательно, может представлять собой гибридный белок при включении в наночастицы. Для целей расчета идентичности последовательности присоединенные фрагменты не включают. В некоторых аспектах антиген можно укоротить. Например, N-конец можно укоротить на приблизительно 10 аминокислот, приблизительно 30 аминокислот, приблизительно 50 аминокислот, приблизительно 75 аминокислот, приблизительно 100 аминокислот или приблизительно 200 аминокислот. Например, C-конец можно укоротить на приблизительно 10 аминокислот, приблизительно 30 аминокислот, приблизительно 50 аминокислот, приблизительно 75 аминокислот, приблизительно 100 аминокислот или приблизительно 200 аминокислот.
Фармацевтические композиции
[0103] Фармацевтические композиции, описанные в настоящем документе, содержат мультимерный белок и фармацевтически приемлемый носитель. Фармацевтически приемлемые носители включают любой фармацевтический агент, который при введении субъекту не вызывает чрезмерной токсичности, раздражения или аллергической реакции. Фармацевтически приемлемые носители могут также включать одно или более из фармацевтически приемлемых вспомогательных веществ. Фармацевтически приемлемое вспомогательное вещество представляет собой любое вспомогательное вещество, которое можно применять при получении фармацевтической композиции, и которое является в целом безопасным, нетоксичным и приемлемым как для ветеринарного, так и для фармацевтического применения для лечения людей.
[0080] Фармацевтические композиции, используемые в настоящем документе, содержат фармацевтически приемлемый носитель, включая любой подходящий разбавитель или вспомогательное вещество, включающее любой фармацевтический агент, сам по себе не вызывающий иммунный ответ, вредный для позвоночного, получающего указанную композицию, и при введении не вызывающий чрезмерной токсичности, и иммуноген, например, мультимерный гибридный белок.
[0104] В некоторых аспектах составы могут содержать фармацевтически приемлемый носитель или вспомогательное вещество. Фармацевтически приемлемые носители включают физиологический раствор, забуференный физиологический раствор, декстрозу, воду, глицерин, стерильный изотонический водный буфер и их комбинации, но не ограничиваются ими. Подробное обсуждение фармацевтически приемлемых носителей, разбавителей и других вспомогательных веществ представлено в Remington's Pharmaceutical Sciences (Mack Pub. Co. N.J., текущее издание). Состав можно адаптировать под способ введения. В типичном варианте реализации композиция подходит для введения людям, является стерильной, не содержит частиц и/или является апирогенной.
[0105] Композиция также может содержать увлажнители или эмульгаторы или pH-буферные агенты или их смеси. Композиция может представлять собой твердое вещество, например, лиофилизированный порошок, подходящий для растворения (например, водой или физиологическим раствором), жидкий раствор, суспензию, эмульсию, таблетку, пилюлю, капсулу, состав с замедленным высвобождением или порошок. Составы для перорального применения могут содержать стандартные носители, например, маннит, лактозу, крахмал, стеарат магния, сахарин-натрий, целлюлозу, карбонат магния и т.д. фармацевтической степени чистоты.
Адьюванты
[0106] Иммуногенность конкретной композиции можно усилить путем использования неспецифических стимуляторов иммунного ответа, известных как адъюванты. Адъюванты используют в экспериментах для стимуляции общего иммунитета против антигенов (например, в патенте США № 4877611). Адъюванты используют в протоколах иммунизации для стимуляции ответа в течение многих лет, и сами по себе адъюванты хорошо известны специалисту в данной области техники. Некоторые адъюванты влияют на механизм презентации антигенов. Например, иммунный ответ усиливается при осаждении белковых антигенов квасцами. Эмульгирование антигенов также увеличивает продолжительность презентации антигена. Включение любых адьювантов описано в монографии Vogel et al., «A Compendium of Vaccine Adjuvants and Excipients (2е изд.)», полностью включенной в настоящий документ посредством ссылки для всех целей, и предусмотрено сущностью настоящего изобретения.
[0107] Типичные адъюванты включают полный адъювант Фрейнда (неспецифический стимулятор иммунного ответа, содержащий убитые Mycobacterium tuberculosis), неполные адъюванты Фрейнда и адъювант на основе гидроксида алюминия. Другие адъюванты содержат GMCSP, BCG, соединения MDP, например, thr-MDP и nor-MDP, CGP (MTP-PE), липид A и монофосфориллипид A (MPL), MF-59, RIBI, содержащий три компонента, выделенных из бактерий, MPL, димиколат трегалозы (TDM) и скелет клеточной стенки (CWS) в 2% эмульсии сквалена/Tween® 80. В других предпочтительных аспектах применяют квасцы, например, 2% Alhydrogel (Al(OH)3). В некоторых аспектах адьювант может представлять собой олиголамеллярные липидные везикулы, например, Novasomes®. Novasomes® представляют собой олиголамеллярные нефосфолипидные везикулы размером от приблизительно 100 нм до приблизительно 500 нм. Они содержат Brij 72, холестерин, олеиновую кислоту и сквален. Показано, что Novasomes являются эффективным адьювантом (см. патенты США № 5629021, 6387373 и 4911928.
Сапониновые адьюванты
[0108] Сапонинсодержащие адъюванты также можно объединять с иммуногенами, описанными в настоящем документе. Сапонины представляют собой гликозиды, получаемые из коры дерева Quillaja saponaria Molina. Как правило, сапонины получают с использованием многостадийного процесса очистки, в результате которого получают несколько фракций. В настоящем документе термин «фракция сапонинов Quillaja saponaria Molina» используется в общем смысле для описания полуочищенной или установленной фракции сапонинов Quillaja saponaria или ее по существу чистой фракции.
Фракции сапонинов
[0109] Для получения фракций сапонинов можно использовать несколько подходов. Фракции A, B и C описаны в патенте США № 6352697, и их можно получить следующим образом. Липофильную фракцию Quil A, необработанного водного экстракта Quillaja saponaria Molina, хроматографически разделяют и элюируют 70% ацетонитрилом в воде, восстанавливая липофильную фракцию. Затем липофильную фракцию разделяют полупрепаративной ВЭЖХ с элюированием градиентом от 25% до 60% ацетонитрила в подкисленной воде. Фракция, называемая в настоящем документе «фракцией A» или «QH-A», представляет собой или соответствует фракции, элюируемой при концентрации ацетонитрила приблизительно 39%. Фракция, называемая в настоящем документе «фракцией B» или «QH-B», представляет собой или соответствует фракции, элюируемой при концентрации ацетонитрила приблизительно 47%. Фракция, называемая в настоящем документе «фракцией C» или «QH-C», представляет собой или соответствует фракции, элюируемой при концентрации ацетонитрила приблизительно 49%. Дополнительная информация об очистке фракций находится в патенте США № 5057540. При получении фракций A, B и C Quillaja saponaria Molina согласно описанию в настоящем документе каждая из них представляет собой группы или семейства химически близкородственных молекул с определенными свойствами. Хроматографические условия их получения таковы, что воспроизводимость между партиями с точки зрения профиля элюирования и биологической активности воспроизводится в высокой степени.
[0110] Описаны другие фракции сапонинов. Фракции B3, B4 и B4b описаны в EP 0436620. Фракции QA1-QA22 описаны в EP03632279 B2, Q-VAC (Nor-Feed AS, Дания), Quillaja saponaria Molina Spikoside (lsconova AB,  2B, 756 51 Уппсала, Швеция). Можно использовать фракции QA-1, QA-2, QA-3, QA-4, QA-5, QA-6, QA-7, QA-8, QA-9, QA-10, QA-11, QA-12, QA-13, QA-14, QA-15, QA-16, QA-17, QA-18, QA-19, QA-20, QA-21 и QA-22 EP 0 3632 279 B2, особенно QA-7, QA-17, QA-18 и QA-21. Их получают согласно описанию в EP 0 3632 279 B2, особенно на странице 6 и в примере 1 на странице 8 и 9.
2B, 756 51 Уппсала, Швеция). Можно использовать фракции QA-1, QA-2, QA-3, QA-4, QA-5, QA-6, QA-7, QA-8, QA-9, QA-10, QA-11, QA-12, QA-13, QA-14, QA-15, QA-16, QA-17, QA-18, QA-19, QA-20, QA-21 и QA-22 EP 0 3632 279 B2, особенно QA-7, QA-17, QA-18 и QA-21. Их получают согласно описанию в EP 0 3632 279 B2, особенно на странице 6 и в примере 1 на странице 8 и 9.
[0111] Фракции сапонинов, описанные в настоящем документе и используемые для образования адъювантов, часто являются по существу чистыми фракциями; т.е. эти фракции по существу не загрязнены другими материалами. В определенных аспектах фракция по существу чистого сапонина может содержать до 40 мас.%, до 30 мас.%, до 25 мас.%, до 20 мас.%, до 15 мас.%, до 10 мас.%, до 7 мас.%, до 5 мас.%, до 2 мас.%, до 1 мас.%, до 0,5 мас.% или до 0,1 мас.% других соединений, например, других сапонинов или других адъювантов.
Структуры ISCOM
[0112] Фракции сапонинов можно вводить в виде клеткоподобной частицы, называемой ISCOM (иммуностимулирующий комплекс). ISCOM можно получать, как описано в EP0109942B1, EP0242380B1 и EP0180546 B1. В конкретных вариантах реализации можно использовать транспортный антиген и/или антиген-пассажир, как описано в EP 9600647-3 (PCT/SE97/00289).
Матриксные адьюванты
[0113] В некоторых аспектах ISCOM представляет собой матриксный комплекс ISCOM. Матриксный комплекс ISCOM содержит по меньшей мере одну фракцию сапонинов и липид. Липид представляет собой по меньшей мере стерин, например, холестерин. В конкретных аспектах матриксный комплекс ISCOM также содержит фосфолипид. Матриксные комплексы ISCOM могут также содержать одно или более из других иммуномодулирующих (адъювант-активных) веществ, необязательно гликозид, и их можно получить согласно описанию в EP0436620B1.
[0114] В других аспектах ISCOM представляет собой комплекс ISCOM. Комплекс ISCOM содержит по меньшей мере один сапонин, по меньшей мере один липид и антиген или эпитоп по меньшей мере одного вида. Комплекс ISCOM содержит антиген, ассоциированный путем обработки детергентом, так что фрагмент антигена встраивается в частицу. В отличие от этого, матрикс ISCOM составлен в виде смеси с антигеном, а ассоциация между частицами матрикса ISCOM и антигеном опосредована электростатическими и/или гидрофобными взаимодействиями.
[0115] В соответствии с одним вариантом реализации фракцию сапонинов, встроенную в матриксный комплекс ISCOM или комплекс ISCOM, или по меньшей мере один дополнительный адъювант, который также встроен в ISCOM или матриксный комплекс ISCOM или смешан с ним, выбирают из фракции A, фракции B или фракции С Quillaja saponaria, полуочищенного препарата Quillaja saponaria, очищенного препарата Quillaja saponaria или любой очищенной субфракции, например, QA 1-21.
[0116] В конкретных аспектах каждая частица ISCOM может содержать по меньшей мере две фракции сапонинов. Можно использовать любые комбинации массово-процентных концентраций различных фракций сапонинов. Можно использовать любую комбинацию массово-процентных концентраций любых двух фракций. Например, частица может содержать любую массово-процентную концентрацию фракции А и любую массово-процентную концентрацию другой фракции сапонинов, например, неочищенной фракции сапонинов или фракции С, соответственно. Соответственно, в конкретных аспектах каждая частица матрикса ISCOM или каждая частица комплекса ISCOM может содержать от 0,1 до 99,9 мас.%, от 5 до 95 мас.%, от 10 до 90 мас.%, от 15 до 85 мас.%, от 20 до 80 мас.%, от 25 до 75 мас.%, от 30 до 70 мас.%, от 35 до 65 мас.%, от 40 до 60 мас.%, от 45 до 55 мас.%, от 40 до 60 мас.%, или 50 мас.% одной фракции сапонинов, например, фракции A, и недостающее в каждом случае до 100% количество другого сапонина, например, любой неочищенной фракции или любой другой фракции, например, фракции C. Массу рассчитывают как общую массу фракций сапонинов. Примеры адъювантов на основе матриксного комплекса ISCOM и комплекса ISCOM описаны в опубликованной заявке на патент США № 2013/0129770.
[0117] В конкретных вариантах реализации матрикс ISCOM или комплекс ISCOM содержат от 5 до 99 мас.% одной фракции, например, фракции А, и недостающее до 100 мас.% количество другой фракции, например, неочищенной фракции сапонинов или фракции С. Массу рассчитывают как общую массу фракций сапонинов.
[0118] В еще одном варианте реализации матрикс ISCOM или комплекс ISCOM содержат от 40 мас.% до 99 мас.% одной фракции, например, фракции А, и от 1 мас.% до 60 мас. % другой фракции, например, неочищенной фракции сапонинов или фракции С. Массу рассчитывают как общую массу фракций сапонинов.
[0119] В еще одном варианте реализации матрикс ISCOM или комплекс ISCOM содержат от 70 мас.% до 99 мас.% одной фракции, например, фракции А, и от 30 мас.% до 5 мас.% другой фракции, например, неочищенной фракции сапонинов или фракции С. Массу рассчитывают как общую массу фракций сапонинов. В других в других вариантах реализации фракцию сапонинов Quillaja saponaria Molina выбирают из любой из QA 1-21.
[0120] В дополнение к частицам, содержащим смеси фракций сапонинов, частицы матрикса ISCOM и частицы комплекса ISCOM можно получать с использованием только одной фракции сапонинов. Композиции, описанные в настоящем документе, могут содержать множество частиц, причем каждая частица содержит только одну фракцию сапонинов. Т.е. некоторые композиции могут содержать одну или более из частиц матриксных комплексов ISCOM различного типа и/или одну или более из частиц комплексов ISCOM различного типа, причем каждая отдельная частица содержит одну фракцию сапонинов Quillaja saponaria Molina, причем фракция сапонинов в одном комплексе отличается от фракции сапонинов в других частицах комплекса.
[0121] В конкретных аспектах фракцию сапонинов одного типа или фракцию неочищенных сапонинов можно встроить в один матриксный комплекс или частицу ISCOM, а другую фракцию по существу чистого сапонина или фракцию неочищенных сапонинов можно встроить в другой матриксный комплекс или частицу ISCOM. Композиция или вакцина может содержать по меньшей мере два типа комплексов или частиц, причем каждый из них содержит сапонины одного типа, встроенные в физически разные частицы.
[0122] В композициях можно применять смеси частиц матриксного комплекса ISCOM и/или частиц комплекса ISCOM, причем одна фракция сапонинов Quillaja saponaria Molina и другая фракция сапонинов Quillaja saponaria Molina отдельно встроены в различные частицы матриксного комплекса ISCOM и/или частицы комплекса ISCOM.
[0123] Частицы матрикса ISCOM или частицы комплекса ISCOM, каждая из которых содержит одну фракцию сапонинов, могут присутствовать в композиции в любой комбинации мас.%. В конкретных аспектах композиция может содержать от 0,1 мас.% до 99,9 мас.%, от 5% до 95 мас.%, от 10% до 90 мас.%, от 15% до 85 мас.%, от 20% до 80 мас.%, от 25% до 75 мас.%, от 30% до 70 мас.%, от 35% до 65 мас.%, от 40% до 60 мас.%, от 45% до 55 мас.%, от 40 до 60 мас.% или 50 мас.%, матрикса или комплекса ISCOM, содержащего первую фракцию сапонинов, в то время как оставшаяся часть состоит из матрикса или комплекса ISCOM, содержащего другую фракцию сапонинов. В некоторых аспектах оставшаяся часть представляет собой один или несколько из матриксов или комплексов ISCOM, причем каждая частица матрикса или комплекса содержит только одну фракцию сапонинов. В других аспектах каждая частица матрикса или комплекса ISCOM может содержать более одной фракции сапонинов.
[0124] В предпочтительных композициях фракция сапонинов в первом матриксе ISCOM представляет собой фракцию A («матрикс фракции A»), а фракция сапонинов во второй частице матрикса ISCOM или комплекса ISCOM представляет собой фракцию C («Матрица фракции C»). Таким образом, предпочтительная композиция содержит в качестве адьюванта матриксный адъювант фракции А и матриксный адъювант фракции С. Количество каждого матрикса, присутствующего в композиции, может меняться. Например, количество матрикса фракции A может составлять приблизительно 80% (мас./мас.), приблизительно 85% (мас./мас.), приблизительно 90 (мас./мас.), приблизительно 92% (мас./мас.) или приблизительно 95% (мас./мас.), а остальная часть представляет собой матрикс фракции C. Подходящим примером подходящей комбинации 85:15 матрикса фракции А и матрикса фракции С является Matrix-М™ (Novavax AB, Уппсала, Швеция), смесь матрикса фракции А и матрикса фракции С в соотношении от приблизительно 85 до приблизительно 15,
[0125] Другие фракции сапонинов, например, фракции QS-7 и QS-21, их получение и применение описаны в патентах США № 5057540; 6231859; 6352697; 6524584; 6846489; 7776343 и 8173141. Эти фракции можно применять в способах и композициях, описанных в настоящем документе
Иммуностимуляторы
[0126] Кроме того, композиции согласно настоящему изобретению можно составить с использованием «иммуностимуляторов». Это - собственные химические мессенджеры организма (цитокины), усиливающие ответ иммунной системы. Иммуностимуляторы включают различные цитокины, лимфокины и хемокины с обладающие иммуностимулирующей, усиливающей иммунный ответ и провоспалительной активностями, например, интерлейкины (например, ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-12, ИЛ-13); факторы роста (например, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМКСФ) и другие молекулы-иммуностимуляторы, например, воспалительный фактор макрофагов, лиганд Flt3, B7.1; B7.2 и т. д., но не ограничиваются ими. Иммуностимулирующие молекулы можно вводить в тот же состав, что и композиции согласно настоящему изобретению, или отдельно. Белок или экспрессирующий вектор, кодирующий белок, можно вводить для получения иммуностимулирующего эффекта. Таким образом, в одном варианте реализации настоящее изобретение включает антигенные и вакцинные составы, содержащие адъювант и/или иммуностимулятор.
Способы индукции иммунного ответа
[0081] Кроме того, в настоящем изобретении предложены способы. позволяющие вызывать иммунный ответ против патогенных организмов. Этот способ включает введение субъекту иммунологически эффективного количества композиции, содержащей мультимерный белок. Введение иммунологически эффективного количества композиции согласно настоящему изобретению вызывает иммунный ответ, специфичный по отношению к эпитопам, присутствующим в гибридном белке. Такой иммунный ответ может включать В-клеточный ответ и/или Т-клеточный ответ. При введении субъекту мультимерные белки предпочтительно индуцируют продукцию нейтрализующих антител. Иммунный ответ предпочтительно включает элементы, специфичные по меньшей мере по отношению к одному конформационному эпитопу, представляющему каждый белок, содержащийся в мультимерном белке.
Введение
[0127] Введение можно осуществлять любым удобным путем. Подходящие пути включают парентеральное введение (например, внутрикожное, внутримышечное, внутривенное и подкожное введение), эпидуральное введение и введение через слизистые (например, интраназальный, пероральный или легочный пути, или посредством суппозиториев), трансдермальное или внутрикожное введение. Введение можно осуществлять посредством вливания или болюсной инъекции, всасывания через эпителий или слизистую (например, слизистую полости рта, толстой кишки, конъюнктиву, слизистую носоглотки, ротоглотки, влагалища, мочеиспускательного канала, мочевого пузыря и кишечника и т.д.); можно осуществлять введение вместе с другими биологически активными агентами. В некоторых аспектах интраназальный или другие пути введения через слизистые могут приводить к гуморальному или другому иммунному ответу, значительно превышающему ответ при использовании других путей введения. Введение может быть системным или местным.
[0128] В некоторых аспектах введение можно осуществлять посредством инъекции с использованием иглы и шприца или безыгольного инъекционного устройства. В других аспектах введение осуществляют с использованием капель, аэрозоля с крупными частицами (размером более приблизительно 10 микрон) или спрея в верхние дыхательные пути.
[0129] В некоторых аспектах предложена фармацевтическая упаковка или набор, содержащий один или более из контейнеров, заполненных одним или более компонентами составов. В конкретном аспекте набор может включать два контейнера, причем первый контейнер содержит мультимерный белок, а второй контейнер - адъювант. С таким контейнером(ами) может быть связано уведомление в форме, предписанной правительственным агентством, регулирующим производство, применение или продажу фармацевтических препаратов или биологических продуктов, причем в указанном уведомлении отражено утверждение указанным агентством производства, применения или продажи для введения людям. Кроме того, составы можно упаковать в герметически закрытый контейнер, например, ампулу или саше, с указанием количества композиции.
[0130] В некоторых аспектах введение может быть нацеленным (таргетным). Например, композиции можно вводить таким образом, чтобы их мишенью являлись ткани слизистой, с целью индукции иммунного ответа в области иммунизации. Можно оказывать нацеленное воздействие на ткани слизистых, например, кишечно-ассоциированную лимфоидную ткань (GALT), с целью иммунизации посредством перорального введения композиций, содержащих адъюванты, обладающие свойством специфического адресного воздействия на слизистые. Кроме того, мишенью воздействия могут являться дополнительные ткани слизистых, например, лимфоидная ткань носоглотки (NALT) и лимфоидная ткань, ассоциированная с бронхами (BALT).
[0131] В некоторых аспектах можно вводить множество композиций, каждая из которых содержит свой набор антигенов. При введении более одного мультимерного белка можно вводить указанные белки одновременно в одну и ту же область тела субъекта; например, путем инъекции материала из одного или более контейнеров, содержащих мультимерные белки. В других аспектах их можно последовательно вводить в разные области в течение короткого промежутка времени; например, одно введение можно выполнить в бедро, а второе - в руку, причем оба введения выполняют в течение небольшого времени (например, до 30 минут).
[0132] Специалист в данной области техники может выполнить клинические исследования на людях для определения предпочтительной эффективной дозы для людей. Такие клинические исследования выполняют в рабочем порядке; они хорошо известны в данной области техники. Точная применяемая доза также зависит от пути введения. Эффективную дозу можно экстраполировать на основе кривых доза-ответ, полученных in vitro или в тест-системах на основе in vivo. Дозу можно корректировать на основании, например, возраста, физического состояния, массы тела, пола, диеты, времени введения и других клинических факторов.
[0133] Хотя возможна стимуляция иммунитета посредством разовой дозы, для достижения желательного эффекта можно вводить дополнительные дозы тем же или другим путем. Например, для стимуляции достаточного уровня иммунитета у новорожденных и младенцев может потребоваться многократное введение. При необходимости поддержания достаточного уровня защиты от инфекций введение можно продолжать с интервалами в течение всего детского возраста. Аналогичным образом, взрослым, в особенности подверженным повторяющимся или тяжелым инфекциям, например, медицинским работникам, работникам дневного ухода, родственникам маленьких детей, пожилым людям и людям с нарушениями функции сердца и легких для установления и/или поддержания защитного иммунного ответа может потребоваться многократная иммунизация. Уровень индуцированного иммунитета можно отслеживать, например, измеряя количество нейтрализующих секреторных и сывороточных антител, а также коррекции дозировок или повторения вакцинации при необходимости стимуляции и поддержания желательного уровня защиты.
[0134] Кроме того, вакцинные композиции можно применять для получения антител против токсинов, используемых для пассивной терапии. См. Casadevall. «Passive Antibody Administration (Immediate Immunity) as a Specific Defense Against Biological Weapons», Emerging Infectious Diseases. 2002;8(8):833-841.
ПРИМЕРЫ
ПРИМЕР 1
Вакцинные конструкции, содержащие три токсина C. difficile
[0082] Сконструировали две трехтоксинных конструкции. Диаграмма структуры белка показана на фигуре 1. Тройной токсин 1420 (также называемый BV1420) содержал от N-конца к C-концу пептид домена активации, зрелый пептид CDTb, пептид RBD TcdB и пептид RBD TcdA, содержащий 19 повторов (R19). Сайту расщепления фурином (RARRRKKR; SEQ ID NO:27) располагался между доменом активации и зрелым пептидом CDTb. На фигурах 2 и 3 показаны белковая и генетическая последовательность BV1470, соответственно. Линкер находился на каждом конце пептида TcdB.
ПРИМЕР 2
Экспрессия трехтоксинной вакцины
[0083] Клетки Sf9 трансформировали бакуловирусным вектором, экспрессирующим тройную вакцину в виде единого транскрипта. Данные экспрессии в клетках Sf9 показаны на фигуре 2. На фигуре 2 показана экспрессия каждого белка, собранного через 48 и 72 часа. Примечательно, что, хотя масса каждого белка превышала 200 кДа, достигался высокий уровень продукции. На фигуре 7 показан ход экспрессии каждого белка с 48 до 96 часов. Данные показывают, что оба белка были хорошо растворимы.
ПРИМЕР 3
Очистка трехтоксинной вакцины
[0084] Для солюбилизации и очистки частиц к культуре клеток непосредственно добавляли Tergitol NP9 до конечной концентрации 0,2% NP9/25 мМ трис/50 мМ NaCl/pH 8,0. Инкубировали при комнатной температуре в течение 1 часа, затем дважды центрифугировали лизат при 9000 g в течение 30 мин. Собирали надосадочную жидкость, содержащую наночастицы. Затем надосадочную жидкость добавляли в буфер А и элюировали в буфер В (буфер А: 25 мМ трис pH 8,0 /50 мМ NaCl, буфер B: 25 мМ трис pH 8,0/1 M NaCl). Элюат наносили на колонку Phenyl HP (буфер A: 350 мМ цитрата Na/25 мМ трис pH 7,5, буфер B: 5 мМ трис pH 8,0), а затем на колонку Source 30Q (буфер A: 25 мМ трис pH 8,0/250 мМ NaCl, буфер B: 25 мМ трис pH 8,0/1 M NaCl). Объединенные фракции, содержащие продукт, пропускали через 2-микронный фильтр. См. фигуры 4-6. Выход очистки 1470 из Sf9 составлял 269 мг/титр белка. Выход очистки 1420 из клеток Sf9 составлял 166 мг/титр.
ПРИМЕР 4
Анализ частиц трехтоксинной вакцины
[0085] Распределение размеров частиц тройного токсина BV1420 по объему анализировали с помощью динамического светорассеяния с использованием Zeta Sizer Nano. График распределения размеров по объему показано на фигуре 7. Средний диаметр составлял ~30 нм. На фигуре 8 показан график распределения размеров частиц тройного токсина BV1470 по интенсивности. Средний диаметр составлял ~18 нм.
[0086] На фигуре 9 показаны электронные микрофотографии отрицательно окрашенного тройного токсина BV1420. Электронная микрофотография очищенного тройного токсина BV1420, разбавленного до концентрации приблизительно 10 мкг/мл и отрицательно окрашенного уранилацетатом.
ПРИМЕР 5
Вакцина, содержащая три токсина C. difficile: контрольная стимуляция летальной дозой токсина и выживаемость животных
[0087] На фигуре 10 приведены результаты испытания трехтоксинной вакцины на мышах против токсина A и бинарного токсина. Группам 1-6 вводили антиген BV1420 (30 мкг) или ФСБ, как показано. Группам 1 и 4 вводили 50 мкг квасцов Alum OH; группам 2 и 5 вводили 50 мкг квасцов Alum OH и 50 мкг адьюванта ISCOM Matrix M. Мышей иммунизировали в 0 и 14 день, отбор крови выполняли в 0, 14 и 32 день. Контрольную стимуляцию мышей токсином А и бинарным токсином выполняли на 35 день.
[0088] На фигуре 11 показан ответ IgG в сыворотке. ФСБ не индуцировал образования антител, как и ожидалось. Трехтоксинная вакцина с квасцами Alum OH или как с квасцами Alum OJ, так и с Matrix M, индуцировала титры антител против токсина A, токсина B и CDTb в диапазоне от приблизительно 104 до приблизительно 106. На фигуре 12 установлено, что антитела нейтрализовали как токсин А, так и CTDb. На Фигуре 13 показана выживаемость животных в 6 группах. Группы 1, 2, 4 и 5 демонстрировали 100% выживаемость. За исключением двух мышей при контрольной стимуляции бинарным токсином, все животные в контрольных группах ФСБ погибли. Эти данные позволяют установить, что трехтоксинная вакцина защищает от воздействия токсинов.
[0089] Во втором исследовании контрольной стимуляции токсином B было разработано и протестировано несколько конструкций по отдельности или в комбинации. Мышам 1 группы вводили BV1420 (30 мкг) с квасцами Alum OH. Мышам 2 группы вводили BV1470 (30 мкг) с квасцами Alum OH, 3 группе вводили тандемный белок, содержащий VP6 ротавируса и RBD TcdB (10 мкг) с квасцами Alum OH. Мышам 4 группы вводили BV1470 и VP6/RBD TcdB. 5 группе вводили анатоксин Toxoid B (10 мкг). 6 группа была контрольной и получала ФСБ. IgG-ответ показан на фигуре 15. В каждом случае получили высокие титры антител. В каждой из групп, получившей пептид токсина A, произошла индукция ответа с высоким титром антител против токсина A в диапазоне между 104 и приблизительно 105. Всем группам вводили пептид токсина В, и в каждой из них продемонстрирован высокий титр антител в диапазоне между 104 и приблизительно 106. В каждой из групп, получившей пептид бинарного токсина, произошла индукция ответа с высоким титром антител в диапазоне между 105 и приблизительно 106. На фигуре 16 установлено получение антитела, нейтрализовавших токсин B, при этом для анатоксина B продемонстрированы более высокие уровни.
[0090] Выживаемость мышей в 1-6 группах показана на фигуре 17. Все мыши в контрольной группе ФСБ погибли к 3 дню, причем 5 из 6 погибли в течение суток. Выживаемость после токсина В составила 100%. Для 1-4 групп выживаемость варьировала от 67% до 83%.
ПРИМЕР 6
Дополнительные трехтоксинные вакцины
[0091] Можно получить дополнительные вакцины с высоким уровнем экспрессии. На фигурах 18 и 19 показаны дополнительные трехвалентные вакцинные белки с геном транслокации TcdB. BV1512 показан на нижней диаграмме. На фигуре 18 показана структура дополнительных вакцин: Последовательность мультимерного белка: В последовательности мультимерного вакцинного белка BV1512 показан белок CDTb, отделенный от домена транслокации (TD) A-S-линкером, и TD, отделенный от фрагмента TcdAR19 S-R-линкером. На фигуре 19 показана экспрессия мультимерного белка BV1512 в клетках Sf9.
ПРИМЕР 7
Четырехвалентные вакцины
[0092] Получили мультимерные белки, содержащие четыре пептида. Фиг. 20. В этом примере внедряли пептид TcdB из второго штамма для расширения иммунитета против дополнительного штамма C. difficile. Первый четырехвалентный мультимерный белок (CBAB, или pCDTb/TcdB630/TcdAR19/TcdB027) содержал пептид TcdB штамма 027, добавленный на C-конце (см. фиг. 20, верхняя диаграмма). Во втором четырехвалентном мультимерном пептиде пептид TcdB штамма 027 внедрили между белком TcdB и белком TcdA(R19) первого штамма (штамма 630) (см. фиг. 20, нижнюю диаграмму). На фигуре 21 показана экспрессия четырехвалентного мультимера CBBA в клетках Sf9, как описано выше. Данные показывают, что полученный выход составил 42 мг/л. Второй белок (CBBA, или pCDTb/TcdB630/TcdAR19/TcdB027, показанный на фигуре 26) также продуцировали в системе Sf9 с выходом 40 мг/л. См. Фиг. 22.
ПРИМЕР 8
Конструирование, экспрессия и очистка гибридных белков Т-токсина и Q-токсина
[0093] Сконструировали химерные гибридные белки, содержавшие RBD TcdA C. difficile, TcdB(003), TcdB(027) и CDTb. Аминокислотную последовательность RBD TcdA получили из штамма C. difficile VPI 10463 (ATCC 43255), NCBI P16154 (токсинотип 0, риботип 003); TcdB(003) из штамма VPI 10463 (ATCC 43255), NCBI P18177 (токсинотип 0, риботип 003); TcdB(027) из штамма CD196, NCBI WP_009888442.1 (токсинотип III, риботип 027); а CDTb из штамма CD196, GenBank ABS57477.1 (токсинотип III, риботип 027).
[0094] Кодирующие последовательности RBD TcdA (укороченного до 19 из 38 повторов), RBD TcdB(003) и TcdB(027) (по 24 повтора) и CDTb подвергали оптимизации кодонов для экспрессии в клетках насекомых (GenScript).
[0095] Нуклеотидные последовательности, кодирующие фрагмент гена CDTb (аминокислоты 1-835), RBD TcdA (1314 пар оснований [п.о.], 6816-8130 п.о.) и RBD TcdB(003) (1608 п.о., 5493-7098 п.о.) получали ПЦР-амплификацией из синтезированного гена. ПЦР-амплифицированные фрагменты генов гидролизовали ферментом рестрикции: CDTb с использованием BamHI/NheI; RBD TcdB(003) - NheI/XbaI; а RBD TcdA - XbaI/HindIII. После гидролиза эти три гена лигировали в сайты BamH1 и HindIII pFastBac1 (Invitrogen). Плазмиду, кодировавшую указанные три RBD, использовали для конструирования рекомбинантного бакуловируса множественного ядерного полиэдроза Autographa californica (AcMNPV) с использованием системы экспрессии Bac-to-Bac (Invitrogen) в клетках насекомого Spodoptera frugiperda (Sf9) с целью экспрессии трехвалентного гибридного белка, далее называемого T-токсином (фигура 23B).
[0096] RBD TcdB(027) (1608 п.о, 5493-7098), гидролизованный Spel/HinIII, присоединяли к C-концу трехвалентного гибридного гена с образованием плазмиды и бакуловирусной конструкции, кодирующей RBD всех четырех токсинов, который аналогичным образом экспрессировали в клетках Sf9 для продуцирования четырехвалентного гибридного белка, далее называемого Q-токсином (фигура 23B; SEQ ID NO: 21).
[0097] Таким образом, конструкция содержала pCDTb: 835 аминокислот 1-835; штамм: CD196; токсинотип: III, риботип: 027; GenBank: ABS57477.1;TcdB003: 536 аминокислот 838-1373; NCBI: P18177, ШТАММ=ATCC 4325 / VPI 10463, токсинотип 0, риботип: 087; TcdA: 438 аминокислот 1376-1813; NCBI: P16154, ШТАММ=ATCC 4325 / VPI 10463, токсинотип 0, риботип: 087, и TcdB027: 536 аминокислот 1815-2351; NCBI: 013315, штамм CD196; токсинотип: III, риботип: 027. Каждый из этих фрагментов разделяли двухаминокислотными линкерами: AS между фрагментом pCDTb и фрагментом TcdB003, SR между фрагментом TcdB003 и фрагментом TcdA, TS между фрагментом TcdA и фрагментом TcdB027.
[0098] Гибридные белки экстрагировали путем лизиса с использованием детергентов в буфер, содержащий 0,2% Tergitol NP-9 в 25 мМ трис-буфере (pH 8,0), 250 мМ NaCl и 2 мкг/мл лейпептина. Лизаты очищали центрифугированием, гибридные белки очищали хроматографией на колонках Fractogel EMD TMAE, phenyl HP и 30Q. Очищенные T-токсин и Q-токсин добавляли в буфер, содержащий 25 мМ трис и 250 мМ NaCl (pH 8,0), в концентрации приблизительно 4,0 мг/мл, и хранили при < -60°C. Выход очищенного T-токсина и Q-токсина составил 267 и 154 мг/л, соответственно. T-токсин и Q-токсин мигрировали при электрофорезе в ДСН-ПААГ как белки с молекулярной массой 205 кДа и 268 кДа, соответственно, их чистота составляла > 90% (фигура 23A). Вестерн-блоттинг с токсин-специфичными антителами подтвердил экспрессию CDTb, TcdB и TcdA в каждом гибридном белке (фигура 23B-D).
ПРИМЕР 9
Иммуногенность гибридных белков Т-токсина и Q-токсина у мышей
[0099] Для оценки иммуногенности гибридных белков Т-токсина и Q-токсина выполнили исследования на мышах в соответствии с утвержденными протоколами комитета учреждения по уходу за животными и их использованию (IACUC) Noble Life Sciences. Самок мышей C57BL/6 (в возрасте 6-8 недель) иммунизировали в/м в 0 и 14 дни T-токсином (30 или 100 мкг) или Q-токсином (100 мкг) в составе с 50 мкг гидроксида алюминия (квасцов) или ФСБ (контроль). Сыворотку собирали через 18 дней после второй дозы. У мышей через 3 недели после второй иммунизации выполняли контрольную стимуляцию посредством внутрибрюшинной (в/б) инъекции 100% минимальной летальной дозы (MLD100%) TcdA, TcdB(003) или CDTa и CDTb.
[00100] Оценку содержания антител против токсинов в сыворотке мышей выполняли посредством твердофазного ИФА. На 96-луночных титрационных микропланшетах MaxiSorp (Thermo Scientific) иммобилизовали каждый токсин (2 мкг/мл) в течение ночи при 2-8°C. В планшеты добавляли пятикратные последовательные разведения сыворотки в двух повторностях. Связанные антитела обнаруживали с помощью антител козы против IgG мыши, конъюгированных с пероксидазой хрена (Southern Biotech). В качестве субстрата добавляли 3,3′,5,5′-тетраметилбензидин (TMB) (Sigma) и останавливали реакцию стоп-буфером для TMB (Scytek Laboratories). Планшеты считывали при длине волны 450 нм на планшет-ридере SpectraMax Plus (Molecular Devices), результаты анализировали с помощью программного обеспечения SoftMax Pro. Титры регистрировали в виде величины, обратной разведению, которое позволяло получить показания, составлявшие 50% от максимальной ОП450 нм. Значениям титра, зарегистрированным как «менее нижнего уровня обнаружения» (LLOD), присваивали значение титра 50 для расчета GMT. После иммунизации сыворотка мышей содержала высокие титры IgG против TcdA, TcdB и CDT, которые были сопоставимы для T-токсина и Q-токсина (фигура 25A).
[00101] Клетки Vero (CCL-81, ATCC) поддерживали на DMEM с добавлением 20% термически инактивированной фетальной телячьей сыворотки (FBS) и антибиотиков (Gibco). В 96-луночных плоскодонных планшетах для тканевых культур (Thermo Scientific) получали двукратные последовательные разведения сыворотки мыши. Равный объем (50 мкл) среды для анализа (1x DMEM с 5% термически инактивированной FBS, 1x NEAA, 0,3% декстрозой, 1x пенициллин/стрептомицин/глутамина, 0,006% фенолового красного), содержащей 2x минимальную цитотоксическую дозу TcdA, TcdB или CDT, добавляли к разбавленной сыворотке и инкубировали в течение 1 часа при 37°C. Добавляли клетки Vero (7,5×104 клеток/мл), суспендированные в 50 мкл среды, и 150 мкл стерильного минерального масла (Sigma) и инкубировали планшеты в течение 6-7 дней при 37°C. После инкубирования планшеты просматривали на предмет окрашивания в лунках. Контрольные лунки с добавлением среды и токсина были красными/красно-розовыми; контрольные лунки с клетками были желтыми/желто-оранжевыми. Для каждого разведения образца последнюю лунку, которая была желтой/желто-оранжевой, регистрировали как конечный титр нейтрализующего антитела. Значениям титра, зарегистрированным как < LLOD, присваивали значение титра 5 для расчета GMT. Титры нейтрализующих антител (TNA) против каждого из трех токсинов были сопоставимы для гибридных белков T-токсина и Q-токсина (фигура 25B).
[00102] Через три недели после второй иммунизации у мышей выполняли контрольную стимуляцию TcdB(003). В группах, вакцинированных Q-токсином, выживаемость составляла 80% (p = 0,0043), в то время как в группе Т-токсина после контрольной стимуляции выжили 65% особей (p = 0,018). В противоположность этому, в контрольной группе после контрольной стимуляции токсином выжили лишь 20% особей (фигура 25C).
ПРИМЕР 10
Иммуногенность гибридных белков Т-токсина и Q-токсина у хомяков
[00103] Самцы золотистых сирийских хомяков (HsdHan:Aura; Harlan Laboratories) в возрасте 5-7 недель и массой от 70 до 100 граммов получали 3 иммунизации с 3-недельным интервалом посредством в/м введения 30 кг Q-токсина и 120 мкг квасцов или ФСБ (контроль) в правое и левое бедро попеременно. Через две недели после третьей иммунизации собирали сыворотку и обрабатывали животных 10 мг/кг клиндамицина в/б. Через день у животных выполняли контрольное заражение через желудочный зонд штаммом 630 или NAP1 с последующим наблюдением в течение 8 дней.
[00104] Оценку содержания антител против токсинов в сыворотке хомяков выполняли посредством твердофазного ИФА. На 96-луночных титрационных микропланшетах MaxiSorp (Thermo Scientific) иммобилизовали каждый токсин (2 мкг/мл) в течение ночи при 2-8°C. В планшеты добавляли пятикратные последовательные разведения сыворотки в двух повторностях. Связанные антитела обнаруживали с помощью антител кролика против IgG хомяка, конъюгированных с пероксидазой хрена (Southern Biotech). В качестве субстрата добавляли 3,3′,5,5′-тетраметилбензидин (TMB) (Sigma) и останавливали реакцию стоп-буфером для TMB (Scytek Laboratories). Планшеты считывали при длине волны 450 нм на планшет-ридере SpectraMax Plus (Molecular Devices), результаты анализировали с помощью программного обеспечения SoftMax Pro. Титры регистрировали в виде величины, обратной разведению, которое позволяло получить показания, составлявшие 50% от максимальной ОП450 нм. Значениям титра, зарегистрированным как «менее нижнего уровня обнаружения» (LLOD), присваивали значение титра 50 для расчета GMT. Хомяки, трижды иммунизированные Q-токсином с 3-недельным интервалом, продуцировали высокие титры IgG против токсинов TcdA, TcdB и CDTb (фигура 26A).
[00105] Клетки Vero (CCL-81, ATCC) поддерживали на DMEM с добавлением 20% термически инактивированной фетальной телячьей сыворотки (FBS) и антибиотиков (Gibco). В 96-луночных плоскодонных планшетах для тканевых культур (Thermo Scientific) получали двукратные последовательные разведения сыворотки хомяка. Равный объем (50 мкл) среды для анализа (1x DMEM с 5% термически инактивированной FBS, 1x NEAA, 0,3% декстрозой, 1x пенициллин/стрептомицин/глутамина, 0,006% фенолового красного), содержащей 2x минимальную цитотоксическую дозу TcdA, TcdB или CDT, добавляли к разбавленной сыворотке и инкубировали в течение 1 часа при 37°C. Добавляли клетки Vero (7,5×104 клеток/мл), суспендированные в 50 мкл среды, и 150 мкл стерильного минерального масла (Sigma) и инкубировали планшеты в течение 6-7 дней при 37°C. После инкубирования планшеты просматривали на предмет окрашивания в лунках. Контрольные лунки с добавлением среды и токсина были красными/красно-розовыми; контрольные лунки с клетками были желтыми/желто-оранжевыми. Для каждого разведения образца последнюю лунку, которая была желтой/желто-оранжевой, регистрировали как конечный титр нейтрализующего антитела. Значениям титра, зарегистрированным как < LLOD, присваивали значение титра 5 для расчета GMT. Титры TNA против каждого из трех токсинов были сопоставимы для гибридных белков T-токсина и Q-токсина (фигура 31B).
[00106] После обработки клиндамицином у животных, инфицированных штаммом C. difficile 630, наблюдали 90% выживаемость (фигура 26C), в то время как у животных, инфицированных NAP1, выживаемость составляла 75% (фигура 31D). Все животные в группе плацебо погибли в течение 48-72 часов после инфицирования каждым штаммом.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[00107] Каждый патент или опубликованная заявка, указанные в настоящем документе, включены в настоящий документ для всех целей.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> НОВАВАКС, ИНК.
ТЯНЬ, Цзин-Хуэй
ЛЮ, Е
СМИТ, Гейл
ГЛЕНН, Грегори
ФЛАЙЕР, Дэвид
<120> СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИНДУКЦИИ ИММУННОГО ОТВЕТА ПРОТИВ
CLOSTRIDIUM DIFFICILE
<130> NOVV-058/02WO
<150> US 62/474 434
<151> 21.03.2017
<150> US 62/471 636
<151> 16.03.2017
<160> 28
<170> Версия PatentIn 3.5
<210> 1
<211> 1813
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Трехтоксинная вакцина BV1470
<220>
<221> прочее
<222> (588)..(588)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 1
Met Glu Ile Val Asn Glu Asp Ile Leu Pro Asn Asn Gly Leu Met Gly
1 5 10 15
Tyr Tyr Phe Thr Asp Glu His Phe Lys Asp Leu Lys Leu Met Ala Pro
20 25 30
Ile Lys Asp Gly Asn Leu Lys Phe Glu Glu Lys Lys Val Asp Lys Leu
35 40 45
Leu Asp Lys Asp Lys Ser Asp Val Lys Ser Ile Arg Trp Thr Gly Arg
50 55 60
Ile Ile Pro Ser Lys Asp Gly Glu Tyr Thr Leu Ser Thr Asp Arg Asp
65 70 75 80
Asp Val Leu Met Gln Val Asn Thr Glu Ser Thr Ile Ser Asn Thr Leu
85 90 95
Lys Val Asn Met Lys Lys Gly Lys Glu Tyr Lys Val Arg Ile Glu Leu
100 105 110
Gln Asp Lys Asn Leu Gly Ser Ile Asp Asn Leu Ser Ser Pro Asn Leu
115 120 125
Tyr Trp Glu Leu Asp Gly Met Lys Lys Ile Ile Pro Glu Glu Asn Leu
130 135 140
Phe Leu Arg Asp Tyr Ser Asn Ile Glu Lys Asp Asp Pro Phe Ile Pro
145 150 155 160
Asn Asn Asn Phe Phe Asp Pro Lys Leu Met Ser Asp Trp Glu Asp Glu
165 170 175
Asp Leu Asp Thr Asp Asn Asp Asn Ile Pro Asp Ser Tyr Glu Arg Asn
180 185 190
Gly Tyr Thr Ile Lys Asp Leu Ile Ala Val Lys Trp Glu Asp Ser Phe
195 200 205
Ala Glu Gln Gly Tyr Lys Lys Tyr Val Ser Asn Tyr Leu Glu Ser Asn
210 215 220
Thr Ala Gly Asp Pro Tyr Thr Asp Tyr Glu Lys Ala Ser Gly Ser Phe
225 230 235 240
Asp Lys Ala Ile Lys Thr Glu Ala Arg Asp Pro Leu Val Ala Ala Tyr
245 250 255
Pro Ile Val Gly Val Gly Met Glu Lys Leu Ile Ile Ser Thr Asn Glu
260 265 270
His Ala Ser Thr Asp Gln Gly Lys Thr Val Ser Arg Ala Thr Thr Asn
275 280 285
Ser Lys Thr Glu Ser Asn Thr Ala Gly Val Ser Val Asn Val Gly Tyr
290 295 300
Gln Asn Gly Phe Thr Ala Asn Val Thr Thr Asn Tyr Ser His Thr Thr
305 310 315 320
Asp Asn Ser Thr Ala Val Gln Asp Ser Asn Gly Glu Ser Trp Asn Thr
325 330 335
Gly Leu Ser Ile Asn Lys Gly Glu Ser Ala Tyr Ile Asn Ala Asn Val
340 345 350
Arg Tyr Tyr Asn Thr Gly Thr Ala Pro Met Tyr Lys Val Thr Pro Thr
355 360 365
Thr Asn Leu Val Leu Asp Gly Asp Thr Leu Ser Thr Ile Lys Ala Gln
370 375 380
Glu Asn Gln Ile Gly Asn Asn Leu Ser Pro Gly Asp Thr Tyr Pro Lys
385 390 395 400
Lys Gly Leu Ser Pro Leu Ala Leu Asn Thr Met Asp Gln Phe Ser Ser
405 410 415
Arg Leu Ile Pro Ile Asn Tyr Asp Gln Leu Lys Lys Leu Asp Ala Gly
420 425 430
Lys Gln Ile Lys Leu Glu Thr Thr Gln Val Ser Gly Asn Phe Gly Thr
435 440 445
Lys Asn Ser Ser Gly Gln Ile Val Thr Glu Gly Asn Ser Trp Ser Asp
450 455 460
Tyr Ile Ser Gln Ile Asp Ser Ile Ser Ala Ser Ile Ile Leu Asp Thr
465 470 475 480
Glu Asn Glu Ser Tyr Glu Arg Arg Val Thr Ala Lys Asn Leu Gln Asp
485 490 495
Pro Glu Asp Lys Thr Pro Glu Leu Thr Ile Gly Glu Ala Ile Glu Lys
500 505 510
Ala Phe Gly Ala Thr Lys Lys Asp Gly Leu Leu Tyr Phe Asn Asp Ile
515 520 525
Pro Ile Asp Glu Ser Cys Val Glu Leu Ile Phe Asp Asp Asn Thr Ala
530 535 540
Asn Lys Ile Lys Asp Ser Leu Lys Thr Leu Ser Asp Lys Lys Ile Tyr
545 550 555 560
Asn Val Lys Leu Glu Arg Gly Met Asn Ile Leu Ile Lys Thr Pro Thr
565 570 575
Tyr Phe Thr Asn Phe Asp Asp Tyr Asn Asn Tyr Xaa Ser Thr Trp Ser
580 585 590
Asn Val Asn Thr Thr Asn Gln Asp Gly Leu Gln Gly Ser Ala Asn Lys
595 600 605
Leu Asn Gly Glu Thr Lys Ile Lys Ile Pro Met Ser Glu Leu Lys Pro
610 615 620
Tyr Lys Arg Tyr Val Phe Ser Gly Tyr Ser Lys Asp Pro Leu Thr Ser
625 630 635 640
Asn Ser Ile Ile Val Lys Ile Lys Ala Lys Glu Glu Lys Thr Asp Tyr
645 650 655
Leu Val Pro Glu Gln Gly Tyr Thr Lys Phe Ser Tyr Glu Phe Glu Thr
660 665 670
Thr Glu Lys Asp Ser Ser Asn Ile Glu Ile Thr Leu Ile Gly Ser Gly
675 680 685
Thr Thr Tyr Leu Asp Asn Leu Ser Ile Thr Glu Leu Asn Ser Thr Pro
690 695 700
Glu Ile Leu Asp Glu Pro Glu Val Lys Ile Pro Thr Asp Gln Glu Ile
705 710 715 720
Met Asp Ala His Lys Ile Tyr Phe Ala Asp Leu Asn Phe Asn Pro Ser
725 730 735
Thr Gly Asn Thr Tyr Ile Asn Gly Met Tyr Phe Ala Pro Thr Gln Thr
740 745 750
Asn Lys Glu Ala Leu Asp Tyr Ile Gln Lys Tyr Arg Val Glu Ala Thr
755 760 765
Leu Gln Tyr Ser Gly Phe Lys Asp Ile Gly Thr Lys Asp Lys Glu Met
770 775 780
Arg Asn Tyr Leu Gly Asp Pro Asn Gln Pro Lys Thr Asn Tyr Val Asn
785 790 795 800
Leu Arg Ser Tyr Phe Thr Gly Gly Glu Asn Ile Met Thr Tyr Lys Lys
805 810 815
Leu Arg Ile Tyr Ala Ile Thr Pro Asp Asp Arg Glu Leu Leu Val Leu
820 825 830
Ser Val Asp Ala Ser Met Val Ser Gly Leu Ile Tyr Ile Asn Asp Ser
835 840 845
Leu Tyr Tyr Phe Lys Pro Pro Val Asn Asn Leu Ile Thr Gly Phe Val
850 855 860
Thr Val Gly Asp Asp Lys Tyr Tyr Phe Asn Pro Ile Asn Gly Gly Ala
865 870 875 880
Ala Ser Ile Gly Glu Thr Ile Ile Asp Asp Lys Asn Tyr Tyr Phe Asn
885 890 895
Gln Ser Gly Val Leu Gln Thr Gly Val Phe Ser Thr Glu Asp Gly Phe
900 905 910
Lys Tyr Phe Ala Pro Ala Asn Thr Leu Asp Glu Asn Leu Glu Gly Glu
915 920 925
Ala Ile Asp Phe Thr Gly Lys Leu Ile Ile Asp Glu Asn Ile Tyr Tyr
930 935 940
Phe Asp Asp Asn Tyr Arg Gly Ala Val Glu Trp Lys Glu Leu Asp Gly
945 950 955 960
Glu Met His Tyr Phe Ser Pro Glu Thr Gly Lys Ala Phe Lys Gly Leu
965 970 975
Asn Gln Ile Gly Asp Tyr Lys Tyr Tyr Phe Asn Ser Asp Gly Val Met
980 985 990
Gln Lys Gly Phe Val Ser Ile Asn Asp Asn Lys His Tyr Phe Asp Asp
995 1000 1005
Ser Gly Val Met Lys Val Gly Tyr Thr Glu Ile Asp Gly Lys His
1010 1015 1020
Phe Tyr Phe Ala Glu Asn Gly Glu Met Gln Ile Gly Val Phe Asn
1025 1030 1035
Thr Glu Asp Gly Phe Lys Tyr Phe Ala His His Asn Glu Asp Leu
1040 1045 1050
Gly Asn Glu Glu Gly Glu Glu Ile Ser Tyr Ser Gly Ile Leu Asn
1055 1060 1065
Phe Asn Asn Lys Ile Tyr Tyr Phe Asp Asp Ser Phe Thr Ala Val
1070 1075 1080
Val Gly Trp Lys Asp Leu Glu Asp Gly Ser Lys Tyr Tyr Phe Asp
1085 1090 1095
Glu Asp Thr Ala Glu Ala Tyr Ile Gly Leu Ser Leu Ile Asn Asp
1100 1105 1110
Gly Gln Tyr Tyr Phe Asn Asp Asp Gly Ile Met Gln Val Gly Phe
1115 1120 1125
Val Thr Ile Asn Asp Lys Val Phe Tyr Phe Ser Asp Ser Gly Ile
1130 1135 1140
Ile Glu Ser Gly Val Gln Asn Ile Asp Asp Asn Tyr Phe Tyr Ile
1145 1150 1155
Asp Asp Asn Gly Ile Val Gln Ile Gly Val Phe Asp Thr Ser Asp
1160 1165 1170
Gly Tyr Lys Tyr Phe Ala Pro Ala Asn Thr Val Asn Asp Asn Ile
1175 1180 1185
Tyr Gly Gln Ala Val Glu Tyr Ser Gly Leu Val Arg Val Gly Glu
1190 1195 1200
Asp Val Tyr Tyr Phe Gly Glu Thr Tyr Thr Ile Glu Thr Gly Trp
1205 1210 1215
Ile Tyr Asp Met Glu Asn Glu Ser Asp Lys Tyr Tyr Phe Asn Pro
1220 1225 1230
Glu Thr Lys Lys Ala Cys Lys Gly Ile Asn Leu Ile Asp Asp Ile
1235 1240 1245
Lys Tyr Tyr Phe Asp Glu Lys Gly Ile Met Arg Thr Gly Leu Ile
1250 1255 1260
Ser Phe Glu Asn Asn Asn Tyr Tyr Phe Asn Glu Asn Gly Glu Met
1265 1270 1275
Gln Phe Gly Tyr Ile Asn Ile Glu Asp Lys Met Phe Tyr Phe Gly
1280 1285 1290
Glu Asp Gly Val Met Gln Ile Gly Val Phe Asn Thr Pro Asp Gly
1295 1300 1305
Phe Lys Tyr Phe Ala His Gln Asn Thr Leu Asp Glu Asn Phe Glu
1310 1315 1320
Gly Glu Ser Ile Asn Tyr Thr Gly Trp Leu Asp Leu Asp Glu Lys
1325 1330 1335
Arg Tyr Tyr Phe Thr Asp Glu Tyr Ile Ala Ala Thr Gly Ser Val
1340 1345 1350
Ile Ile Asp Gly Glu Glu Tyr Tyr Phe Asp Pro Asp Thr Ala Gln
1355 1360 1365
Leu Val Ile Ser Glu Ser Arg Met Val Thr Gly Val Phe Lys Gly
1370 1375 1380
Pro Asn Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr His Asn Asn
1385 1390 1395
Asn Ile Glu Gly Gln Ala Ile Val Tyr Gln Asn Lys Phe Leu Thr
1400 1405 1410
Leu Asn Gly Lys Lys Tyr Tyr Phe Asp Asn Asp Ser Lys Ala Val
1415 1420 1425
Thr Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Leu
1430 1435 1440
Asn Thr Ala Glu Ala Ala Thr Gly Trp Gln Thr Ile Asp Gly Lys
1445 1450 1455
Lys Tyr Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr Gly Trp
1460 1465 1470
Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr Phe
1475 1480 1485
Ile Ala Ser Thr Gly Tyr Thr Ser Ile Asn Gly Lys His Phe Tyr
1490 1495 1500
Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro
1505 1510 1515
Asn Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn
1520 1525 1530
Ile Glu Gly Gln Ala Ile Leu Tyr Gln Asn Lys Phe Leu Thr Leu
1535 1540 1545
Asn Gly Lys Lys Tyr Tyr Phe Gly Ser Asp Ser Lys Ala Val Thr
1550 1555 1560
Gly Leu Arg Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn
1565 1570 1575
Thr Ala Val Ala Val Thr Gly Trp Gln Thr Ile Asn Gly Lys Lys
1580 1585 1590
Tyr Tyr Phe Asn Thr Asn Thr Ser Ile Ala Ser Thr Gly Tyr Thr
1595 1600 1605
Ile Ile Ser Gly Lys His Phe Tyr Phe Asn Thr Asp Gly Ile Met
1610 1615 1620
Gln Ile Gly Val Phe Lys Gly Pro Asp Gly Phe Glu Tyr Phe Ala
1625 1630 1635
Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile Arg
1640 1645 1650
Tyr Gln Asn Arg Phe Leu Tyr Leu His Asp Asn Ile Tyr Tyr Phe
1655 1660 1665
Gly Asn Asn Ser Lys Ala Ala Thr Gly Trp Val Thr Ile Asp Gly
1670 1675 1680
Asn Arg Tyr Tyr Phe Glu Pro Asn Thr Ala Met Gly Ala Asn Gly
1685 1690 1695
Tyr Lys Thr Ile Asp Asn Lys Asn Phe Tyr Phe Arg Asn Gly Leu
1700 1705 1710
Pro Gln Ile Gly Val Phe Lys Gly Ser Asn Gly Phe Glu Tyr Phe
1715 1720 1725
Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile
1730 1735 1740
Arg Tyr Gln Asn Arg Phe Leu His Leu Leu Gly Lys Ile Tyr Tyr
1745 1750 1755
Phe Gly Asn Asn Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asn
1760 1765 1770
Gly Lys Val Tyr Tyr Phe Met Pro Asp Thr Ala Met Ala Ala Ala
1775 1780 1785
Gly Gly Leu Phe Glu Ile Asp Gly Val Ile Tyr Phe Phe Gly Val
1790 1795 1800
Asp Gly Val Lys Ala Pro Gly Ile Tyr Gly Met Glu Ile Val Asn Glu
1805 1810 1 5
Asp Ile Leu Pro Asn Asn Gly Leu Met Gly Tyr Tyr Phe Thr Asp Glu
10 15 20
His Phe Lys Asp Leu Lys Leu Met Ala Pro Ile Lys Asp Gly Asn Leu
25 30 35
Lys Phe Glu Glu Lys Lys Val Asp Lys Leu Leu Asp Lys Asp Lys Ser
40 45 50
Asp Val Lys Ser Ile Arg Trp Thr Gly Arg Ile Ile Pro Ser Lys Asp
55 60 65 70
Gly Glu Tyr Thr Leu Ser Thr Asp Arg Asp Asp Val Leu Met Gln Val
75 80 85
Asn Thr Glu Ser Thr Ile Ser Asn Thr Leu Lys Val Asn Met Lys Lys
90 95 100
Gly Lys Glu Tyr Lys Val Arg Ile Glu Leu Gln Asp Lys Asn Leu Gly
105 110 115
Ser Ile Asp Asn Leu Ser Ser Pro Asn Leu Tyr Trp Glu Leu Asp Gly
120 125 130
Met Lys Lys Ile Ile Pro Glu Glu Asn Leu Phe Leu Arg Asp Tyr Ser
135 140 145 150
Asn Ile Glu Lys Asp Asp Pro Phe Ile Pro Asn Asn Asn Phe Phe Asp
155 160 165
Pro Lys Leu Met Ser Asp Trp Glu Asp Glu Asp Leu Asp Thr Asp Asn
170 175 180
Asp Asn Ile Pro Asp Ser Tyr Glu Arg Asn Gly Tyr Thr Ile Lys Asp
185 190 195
Leu Ile Ala Val Lys Trp Glu Asp Ser Phe Ala Glu Gln Gly Tyr Lys
200 205 210
Lys Tyr Val Ser Asn Tyr Leu Glu Ser Asn Thr Ala Gly Asp Pro Tyr
215 220 225 230
Thr Asp Tyr Glu Lys Ala Ser Gly Ser Phe Asp Lys Ala Ile Lys Thr
235 240 245
Glu Ala Arg Asp Pro Leu Val Ala Ala Tyr Pro Ile Val Gly Val Gly
250 255 260
Met Glu Lys Leu Ile Ile Ser Thr Asn Glu His Ala Ser Thr Asp Gln
265 270 275
Gly Lys Thr Val Ser Arg Ala Thr Thr Asn Ser Lys Thr Glu Ser Asn
280 285 290
Thr Ala Gly Val Ser Val Asn Val Gly Tyr Gln Asn Gly Phe Thr Ala
295 300 305 310
Asn Val Thr Thr Asn Tyr Ser His Thr Thr Asp Asn Ser Thr Ala Val
315 320 325
Gln Asp Ser Asn Gly Glu Ser Trp Asn Thr Gly Leu Ser Ile Asn Lys
330 335 340
Gly Glu Ser Ala Tyr Ile Asn Ala Asn Val Arg Tyr Tyr Asn Thr Gly
345 350 355
Thr Ala Pro Met Tyr Lys Val Thr Pro Thr Thr Asn Leu Val Leu Asp
360 365 370
Gly Asp Thr Leu Ser Thr Ile Lys Ala Gln Glu Asn Gln Ile Gly Asn
375 380 385 390
Asn Leu Ser Pro Gly Asp Thr Tyr Pro Lys Lys Gly Leu Ser Pro Leu
395 400 405
Ala Leu Asn Thr Met Asp Gln Phe Ser Ser Arg Leu Ile Pro Ile Asn
410 415 420
Tyr Asp Gln Leu Lys Lys Leu Asp Ala Gly Lys Gln Ile Lys Leu Glu
425 430 435
Thr Thr Gln Val Ser Gly Asn Phe Gly Thr Lys Asn Ser Ser Gly Gln
440 445 450
Ile Val Thr Glu Gly Asn Ser Trp Ser Asp Tyr Ile Ser Gln Ile Asp
455 460 465 470
Ser Ile Ser Ala Ser Ile Ile Leu Asp Thr Glu Asn Glu Ser Tyr Glu
475 480 485
Arg Arg Val Thr Ala Lys Asn Leu Gln Asp Pro Glu Asp Lys Thr Pro
490 495 500
Glu Leu Thr Ile Gly Glu Ala Ile Glu Lys Ala Phe Gly Ala Thr Lys
505 510 515
Lys Asp Gly Leu Leu Tyr Phe Asn Asp Ile Pro Ile Asp Glu Ser Cys
520 525 530
Val Glu Leu Ile Phe Asp Asp Asn Thr Ala Asn Lys Ile Lys Asp Ser
535 540 545 550
Leu Lys Thr Leu Ser Asp Lys Lys Ile Tyr Asn Val Lys Leu Glu Arg
555 560 565
Gly Met Asn Ile Leu Ile Lys Thr Pro Thr Tyr Phe Thr Asn Phe Asp
570 575 580
Asp Tyr Asn Asn Tyr Xaa Ser Thr Trp Ser Asn Val Asn Thr Thr Asn
585 590 595
Gln Asp Gly Leu Gln Gly Ser Ala Asn Lys Leu Asn Gly Glu Thr Lys
600 605 610
Ile Lys Ile Pro Met Ser Glu Leu Lys Pro Tyr Lys Arg Tyr Val Phe
615 620 625 630
Ser Gly Tyr Ser Lys Asp Pro Leu Thr Ser Asn Ser Ile Ile Val Lys
635 640 645
Ile Lys Ala Lys Glu Glu Lys Thr Asp Tyr Leu Val Pro Glu Gln Gly
650 655 660
Tyr Thr Lys Phe Ser Tyr Glu Phe Glu Thr Thr Glu Lys Asp Ser Ser
665 670 675
Asn Ile Glu Ile Thr Leu Ile Gly Ser Gly Thr Thr Tyr Leu Asp Asn
680 685 690
Leu Ser Ile Thr Glu Leu Asn Ser Thr Pro Glu Ile Leu Asp Glu Pro
695 700 705 710
Glu Val Lys Ile Pro Thr Asp Gln Glu Ile Met Asp Ala His Lys Ile
715 720 725
Tyr Phe Ala Asp Leu Asn Phe Asn Pro Ser Thr Gly Asn Thr Tyr Ile
730 735 740
Asn Gly Met Tyr Phe Ala Pro Thr Gln Thr Asn Lys Glu Ala Leu Asp
745 750 755
Tyr Ile Gln Lys Tyr Arg Val Glu Ala Thr Leu Gln Tyr Ser Gly Phe
760 765 770
Lys Asp Ile Gly Thr Lys Asp Lys Glu Met Arg Asn Tyr Leu Gly Asp
775 780 785 790
Pro Asn Gln Pro Lys Thr Asn Tyr Val Asn Leu Arg Ser Tyr Phe Thr
795 800 805
Gly Gly Glu Asn Ile Met Thr Tyr Lys Lys Leu Arg Ile Tyr Ala Ile
810 815 820
Thr Pro Asp Asp Arg Glu Leu Leu Val Leu Ser Val Asp Ala Ser Met
825 830 835
Val Ser Gly Leu Ile Tyr Ile Asn Asp Ser Leu Tyr Tyr Phe Lys Pro
840 845 850
Pro Val Asn Asn Leu Ile Thr Gly Phe Val Thr Val Gly Asp Asp Lys
855 860 865 870
Tyr Tyr Phe Asn Pro Ile Asn Gly Gly Ala Ala Ser Ile Gly Glu Thr
875 880 885
Ile Ile Asp Asp Lys Asn Tyr Tyr Phe Asn Gln Ser Gly Val Leu Gln
890 895 900
Thr Gly Val Phe Ser Thr Glu Asp Gly Phe Lys Tyr Phe Ala Pro Ala
905 910 915
Asn Thr Leu Asp Glu Asn Leu Glu Gly Glu Ala Ile Asp Phe Thr Gly
920 925 930
Lys Leu Ile Ile Asp Glu Asn Ile Tyr Tyr Phe Asp Asp Asn Tyr Arg
935 940 945 950
Gly Ala Val Glu Trp Lys Glu Leu Asp Gly Glu Met His Tyr Phe Ser
955 960 965
Pro Glu Thr Gly Lys Ala Phe Lys Gly Leu Asn Gln Ile Gly Asp Tyr
970 975 980
Lys Tyr Tyr Phe Asn Ser Asp Gly Val Met Gln Lys Gly Phe Val Ser
985 990 995
Ile Asn Asp Asn Lys His Tyr Phe Asp Asp Ser Gly Val Met Lys
1000 1005 1010
Val Gly Tyr Thr Glu Ile Asp Gly Lys His Phe Tyr Phe Ala Glu
1015 1020 1025
Asn Gly Glu Met Gln Ile Gly Val Phe Asn Thr Glu Asp Gly Phe
1030 1035 1040
Lys Tyr Phe Ala His His Asn Glu Asp Leu Gly Asn Glu Glu Gly
1045 1050 1055
Glu Glu Ile Ser Tyr Ser Gly Ile Leu Asn Phe Asn Asn Lys Ile
1060 1065 1070
Tyr Tyr Phe Asp Asp Ser Phe Thr Ala Val Val Gly Trp Lys Asp
1075 1080 1085
Leu Glu Asp Gly Ser Lys Tyr Tyr Phe Asp Glu Asp Thr Ala Glu
1090 1095 1100
Ala Tyr Ile Gly Leu Ser Leu Ile Asn Asp Gly Gln Tyr Tyr Phe
1105 1110 1115
Asn Asp Asp Gly Ile Met Gln Val Gly Phe Val Thr Ile Asn Asp
1120 1125 1130
Lys Val Phe Tyr Phe Ser Asp Ser Gly Ile Ile Glu Ser Gly Val
1135 1140 1145
Gln Asn Ile Asp Asp Asn Tyr Phe Tyr Ile Asp Asp Asn Gly Ile
1150 1155 1160
Val Gln Ile Gly Val Phe Asp Thr Ser Asp Gly Tyr Lys Tyr Phe
1165 1170 1175
Ala Pro Ala Asn Thr Val Asn Asp Asn Ile Tyr Gly Gln Ala Val
1180 1185 1190
Glu Tyr Ser Gly Leu Val Arg Val Gly Glu Asp Val Tyr Tyr Phe
1195 1200 1205
Gly Glu Thr Tyr Thr Ile Glu Thr Gly Trp Ile Tyr Asp Met Glu
1210 1215 1220
Asn Glu Ser Asp Lys Tyr Tyr Phe Asn Pro Glu Thr Lys Lys Ala
1225 1230 1235
Cys Lys Gly Ile Asn Leu Ile Asp Asp Ile Lys Tyr Tyr Phe Asp
1240 1245 1250
Glu Lys Gly Ile Met Arg Thr Gly Leu Ile Ser Phe Glu Asn Asn
1255 1260 1265
Asn Tyr Tyr Phe Asn Glu Asn Gly Glu Met Gln Phe Gly Tyr Ile
1270 1275 1280
Asn Ile Glu Asp Lys Met Phe Tyr Phe Gly Glu Asp Gly Val Met
1285 1290 1295
Gln Ile Gly Val Phe Asn Thr Pro Asp Gly Phe Lys Tyr Phe Ala
1300 1305 1310
His Gln Asn Thr Leu Asp Glu Asn Phe Glu Gly Glu Ser Ile Asn
1315 1320 1325
Tyr Thr Gly Trp Leu Asp Leu Asp Glu Lys Arg Tyr Tyr Phe Thr
1330 1335 1340
Asp Glu Tyr Ile Ala Ala Thr Gly Ser Val Ile Ile Asp Gly Glu
1345 1350 1355
Glu Tyr Tyr Phe Asp Pro Asp Thr Ala Gln Leu Val Ile Ser Glu
1360 1365 1370
Ser Arg Met Val Thr Gly Val Phe Lys Gly Pro Asn Gly Phe Glu
1375 1380 1385
Tyr Phe Ala Pro Ala Asn Thr His Asn Asn Asn Ile Glu Gly Gln
1390 1395 1400
Ala Ile Val Tyr Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys Lys
1405 1410 1415
Tyr Tyr Phe Asp Asn Asp Ser Lys Ala Val Thr Gly Trp Gln Thr
1420 1425 1430
Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Leu Asn Thr Ala Glu Ala
1435 1440 1445
Ala Thr Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn
1450 1455 1460
Leu Asn Thr Ala Glu Ala Ala Thr Gly Trp Gln Thr Ile Asp Gly
1465 1470 1475
Lys Lys Tyr Tyr Phe Asn Thr Asn Thr Phe Ile Ala Ser Thr Gly
1480 1485 1490
Tyr Thr Ser Ile Asn Gly Lys His Phe Tyr Phe Asn Thr Asp Gly
1495 1500 1505
Ile Met Gln Ile Gly Val Phe Lys Gly Pro Asn Gly Phe Glu Tyr
1510 1515 1520
Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala
1525 1530 1535
Ile Leu Tyr Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys Lys Tyr
1540 1545 1550
Tyr Phe Gly Ser Asp Ser Lys Ala Val Thr Gly Leu Arg Thr Ile
1555 1560 1565
Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr Ala Val Ala Val
1570 1575 1580
Thr Gly Trp Gln Thr Ile Asn Gly Lys Lys Tyr Tyr Phe Asn Thr
1585 1590 1595
Asn Thr Ser Ile Ala Ser Thr Gly Tyr Thr Ile Ile Ser Gly Lys
1600 1605 1610
His Phe Tyr Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe
1615 1620 1625
Lys Gly Pro Asp Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp
1630 1635 1640
Ala Asn Asn Ile Glu Gly Gln Ala Ile Arg Tyr Gln Asn Arg Phe
1645 1650 1655
Leu Tyr Leu His Asp Asn Ile Tyr Tyr Phe Gly Asn Asn Ser Lys
1660 1665 1670
Ala Ala Thr Gly Trp Val Thr Ile Asp Gly Asn Arg Tyr Tyr Phe
1675 1680 1685
Glu Pro Asn Thr Ala Met Gly Ala Asn Gly Tyr Lys Thr Ile Asp
1690 1695 1700
Asn Lys Asn Phe Tyr Phe Arg Asn Gly Leu Pro Gln Ile Gly Val
1705 1710 1715
Phe Lys Gly Ser Asn Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr
1720 1725 1730
Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile Arg Tyr Gln Asn Arg
1735 1740 1745
Phe Leu His Leu Leu Gly Lys Ile Tyr Tyr Phe Gly Asn Asn Ser
1750 1755 1760
Lys Ala Val Thr Gly Trp Gln Thr Ile Asn Gly Lys Val Tyr Tyr
1765 1770 1775
Phe Met Pro Asp Thr Ala Met Ala Ala Ala Gly Gly Leu Phe Glu
1780 1785 1790
Ile Asp Gly Val Ile Tyr Phe Phe Gly Val Asp Gly Val Lys Ala
1795 1800 1805
Pro Gly Ile Tyr Gly
1810
<210> 2
<211> 835
<212> БЕЛОК
<213> Clostridium difficile
<220>
<221> прочее
<222> (588)..(588)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 2
Met Glu Ile Val Asn Glu Asp Ile Leu Pro Asn Asn Gly Leu Met Gly
1 5 10 15
Tyr Tyr Phe Thr Asp Glu His Phe Lys Asp Leu Lys Leu Met Ala Pro
20 25 30
Ile Lys Asp Gly Asn Leu Lys Phe Glu Glu Lys Lys Val Asp Lys Leu
35 40 45
Leu Asp Lys Asp Lys Ser Asp Val Lys Ser Ile Arg Trp Thr Gly Arg
50 55 60
Ile Ile Pro Ser Lys Asp Gly Glu Tyr Thr Leu Ser Thr Asp Arg Asp
65 70 75 80
Asp Val Leu Met Gln Val Asn Thr Glu Ser Thr Ile Ser Asn Thr Leu
85 90 95
Lys Val Asn Met Lys Lys Gly Lys Glu Tyr Lys Val Arg Ile Glu Leu
100 105 110
Gln Asp Lys Asn Leu Gly Ser Ile Asp Asn Leu Ser Ser Pro Asn Leu
115 120 125
Tyr Trp Glu Leu Asp Gly Met Lys Lys Ile Ile Pro Glu Glu Asn Leu
130 135 140
Phe Leu Arg Asp Tyr Ser Asn Ile Glu Lys Asp Asp Pro Phe Ile Pro
145 150 155 160
Asn Asn Asn Phe Phe Asp Pro Lys Leu Met Ser Asp Trp Glu Asp Glu
165 170 175
Asp Leu Asp Thr Asp Asn Asp Asn Ile Pro Asp Ser Tyr Glu Arg Asn
180 185 190
Gly Tyr Thr Ile Lys Asp Leu Ile Ala Val Lys Trp Glu Asp Ser Phe
195 200 205
Ala Glu Gln Gly Tyr Lys Lys Tyr Val Ser Asn Tyr Leu Glu Ser Asn
210 215 220
Thr Ala Gly Asp Pro Tyr Thr Asp Tyr Glu Lys Ala Ser Gly Ser Phe
225 230 235 240
Asp Lys Ala Ile Lys Thr Glu Ala Arg Asp Pro Leu Val Ala Ala Tyr
245 250 255
Pro Ile Val Gly Val Gly Met Glu Lys Leu Ile Ile Ser Thr Asn Glu
260 265 270
His Ala Ser Thr Asp Gln Gly Lys Thr Val Ser Arg Ala Thr Thr Asn
275 280 285
Ser Lys Thr Glu Ser Asn Thr Ala Gly Val Ser Val Asn Val Gly Tyr
290 295 300
Gln Asn Gly Phe Thr Ala Asn Val Thr Thr Asn Tyr Ser His Thr Thr
305 310 315 320
Asp Asn Ser Thr Ala Val Gln Asp Ser Asn Gly Glu Ser Trp Asn Thr
325 330 335
Gly Leu Ser Ile Asn Lys Gly Glu Ser Ala Tyr Ile Asn Ala Asn Val
340 345 350
Arg Tyr Tyr Asn Thr Gly Thr Ala Pro Met Tyr Lys Val Thr Pro Thr
355 360 365
Thr Asn Leu Val Leu Asp Gly Asp Thr Leu Ser Thr Ile Lys Ala Gln
370 375 380
Glu Asn Gln Ile Gly Asn Asn Leu Ser Pro Gly Asp Thr Tyr Pro Lys
385 390 395 400
Lys Gly Leu Ser Pro Leu Ala Leu Asn Thr Met Asp Gln Phe Ser Ser
405 410 415
Arg Leu Ile Pro Ile Asn Tyr Asp Gln Leu Lys Lys Leu Asp Ala Gly
420 425 430
Lys Gln Ile Lys Leu Glu Thr Thr Gln Val Ser Gly Asn Phe Gly Thr
435 440 445
Lys Asn Ser Ser Gly Gln Ile Val Thr Glu Gly Asn Ser Trp Ser Asp
450 455 460
Tyr Ile Ser Gln Ile Asp Ser Ile Ser Ala Ser Ile Ile Leu Asp Thr
465 470 475 480
Glu Asn Glu Ser Tyr Glu Arg Arg Val Thr Ala Lys Asn Leu Gln Asp
485 490 495
Pro Glu Asp Lys Thr Pro Glu Leu Thr Ile Gly Glu Ala Ile Glu Lys
500 505 510
Ala Phe Gly Ala Thr Lys Lys Asp Gly Leu Leu Tyr Phe Asn Asp Ile
515 520 525
Pro Ile Asp Glu Ser Cys Val Glu Leu Ile Phe Asp Asp Asn Thr Ala
530 535 540
Asn Lys Ile Lys Asp Ser Leu Lys Thr Leu Ser Asp Lys Lys Ile Tyr
545 550 555 560
Asn Val Lys Leu Glu Arg Gly Met Asn Ile Leu Ile Lys Thr Pro Thr
565 570 575
Tyr Phe Thr Asn Phe Asp Asp Tyr Asn Asn Tyr Xaa Ser Thr Trp Ser
580 585 590
Asn Val Asn Thr Thr Asn Gln Asp Gly Leu Gln Gly Ser Ala Asn Lys
595 600 605
Leu Asn Gly Glu Thr Lys Ile Lys Ile Pro Met Ser Glu Leu Lys Pro
610 615 620
Tyr Lys Arg Tyr Val Phe Ser Gly Tyr Ser Lys Asp Pro Leu Thr Ser
625 630 635 640
Asn Ser Ile Ile Val Lys Ile Lys Ala Lys Glu Glu Lys Thr Asp Tyr
645 650 655
Leu Val Pro Glu Gln Gly Tyr Thr Lys Phe Ser Tyr Glu Phe Glu Thr
660 665 670
Thr Glu Lys Asp Ser Ser Asn Ile Glu Ile Thr Leu Ile Gly Ser Gly
675 680 685
Thr Thr Tyr Leu Asp Asn Leu Ser Ile Thr Glu Leu Asn Ser Thr Pro
690 695 700
Glu Ile Leu Asp Glu Pro Glu Val Lys Ile Pro Thr Asp Gln Glu Ile
705 710 715 720
Met Asp Ala His Lys Ile Tyr Phe Ala Asp Leu Asn Phe Asn Pro Ser
725 730 735
Thr Gly Asn Thr Tyr Ile Asn Gly Met Tyr Phe Ala Pro Thr Gln Thr
740 745 750
Asn Lys Glu Ala Leu Asp Tyr Ile Gln Lys Tyr Arg Val Glu Ala Thr
755 760 765
Leu Gln Tyr Ser Gly Phe Lys Asp Ile Gly Thr Lys Asp Lys Glu Met
770 775 780
Arg Asn Tyr Leu Gly Asp Pro Asn Gln Pro Lys Thr Asn Tyr Val Asn
785 790 795 800
Leu Arg Ser Tyr Phe Thr Gly Gly Glu Asn Ile Met Thr Tyr Lys Lys
805 810 815
Leu Arg Ile Tyr Ala Ile Thr Pro Asp Asp Arg Glu Leu Leu Val Leu
820 825 830
Ser Val Asp
835
<210> 3
<211> 536
<212> БЕЛОК
<213> Clostridium difficile
<400> 3
Met Val Ser Gly Leu Ile Tyr Ile Asn Asp Ser Leu Tyr Tyr Phe Lys
1 5 10 15
Pro Pro Val Asn Asn Leu Ile Thr Gly Phe Val Thr Val Gly Asp Asp
20 25 30
Lys Tyr Tyr Phe Asn Pro Ile Asn Gly Gly Ala Ala Ser Ile Gly Glu
35 40 45
Thr Ile Ile Asp Asp Lys Asn Tyr Tyr Phe Asn Gln Ser Gly Val Leu
50 55 60
Gln Thr Gly Val Phe Ser Thr Glu Asp Gly Phe Lys Tyr Phe Ala Pro
65 70 75 80
Ala Asn Thr Leu Asp Glu Asn Leu Glu Gly Glu Ala Ile Asp Phe Thr
85 90 95
Gly Lys Leu Ile Ile Asp Glu Asn Ile Tyr Tyr Phe Asp Asp Asn Tyr
100 105 110
Arg Gly Ala Val Glu Trp Lys Glu Leu Asp Gly Glu Met His Tyr Phe
115 120 125
Ser Pro Glu Thr Gly Lys Ala Phe Lys Gly Leu Asn Gln Ile Gly Asp
130 135 140
Tyr Lys Tyr Tyr Phe Asn Ser Asp Gly Val Met Gln Lys Gly Phe Val
145 150 155 160
Ser Ile Asn Asp Asn Lys His Tyr Phe Asp Asp Ser Gly Val Met Lys
165 170 175
Val Gly Tyr Thr Glu Ile Asp Gly Lys His Phe Tyr Phe Ala Glu Asn
180 185 190
Gly Glu Met Gln Ile Gly Val Phe Asn Thr Glu Asp Gly Phe Lys Tyr
195 200 205
Phe Ala His His Asn Glu Asp Leu Gly Asn Glu Glu Gly Glu Glu Ile
210 215 220
Ser Tyr Ser Gly Ile Leu Asn Phe Asn Asn Lys Ile Tyr Tyr Phe Asp
225 230 235 240
Asp Ser Phe Thr Ala Val Val Gly Trp Lys Asp Leu Glu Asp Gly Ser
245 250 255
Lys Tyr Tyr Phe Asp Glu Asp Thr Ala Glu Ala Tyr Ile Gly Leu Ser
260 265 270
Leu Ile Asn Asp Gly Gln Tyr Tyr Phe Asn Asp Asp Gly Ile Met Gln
275 280 285
Val Gly Phe Val Thr Ile Asn Asp Lys Val Phe Tyr Phe Ser Asp Ser
290 295 300
Gly Ile Ile Glu Ser Gly Val Gln Asn Ile Asp Asp Asn Tyr Phe Tyr
305 310 315 320
Ile Asp Asp Asn Gly Ile Val Gln Ile Gly Val Phe Asp Thr Ser Asp
325 330 335
Gly Tyr Lys Tyr Phe Ala Pro Ala Asn Thr Val Asn Asp Asn Ile Tyr
340 345 350
Gly Gln Ala Val Glu Tyr Ser Gly Leu Val Arg Val Gly Glu Asp Val
355 360 365
Tyr Tyr Phe Gly Glu Thr Tyr Thr Ile Glu Thr Gly Trp Ile Tyr Asp
370 375 380
Met Glu Asn Glu Ser Asp Lys Tyr Tyr Phe Asn Pro Glu Thr Lys Lys
385 390 395 400
Ala Cys Lys Gly Ile Asn Leu Ile Asp Asp Ile Lys Tyr Tyr Phe Asp
405 410 415
Glu Lys Gly Ile Met Arg Thr Gly Leu Ile Ser Phe Glu Asn Asn Asn
420 425 430
Tyr Tyr Phe Asn Glu Asn Gly Glu Met Gln Phe Gly Tyr Ile Asn Ile
435 440 445
Glu Asp Lys Met Phe Tyr Phe Gly Glu Asp Gly Val Met Gln Ile Gly
450 455 460
Val Phe Asn Thr Pro Asp Gly Phe Lys Tyr Phe Ala His Gln Asn Thr
465 470 475 480
Leu Asp Glu Asn Phe Glu Gly Glu Ser Ile Asn Tyr Thr Gly Trp Leu
485 490 495
Asp Leu Asp Glu Lys Arg Tyr Tyr Phe Thr Asp Glu Tyr Ile Ala Ala
500 505 510
Thr Gly Ser Val Ile Ile Asp Gly Glu Glu Tyr Tyr Phe Asp Pro Asp
515 520 525
Thr Ala Gln Leu Val Ile Ser Glu
530 535
<210> 4
<211> 438
<212> БЕЛОК
<213> Clostridium difficile
<400> 4
Met Val Thr Gly Val Phe Lys Gly Pro Asn Gly Phe Glu Tyr Phe Ala
1 5 10 15
Pro Ala Asn Thr His Asn Asn Asn Ile Glu Gly Gln Ala Ile Val Tyr
20 25 30
Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys Lys Tyr Tyr Phe Asp Asn
35 40 45
Asp Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr
50 55 60
Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr Gly Trp Gln Thr Ile
65 70 75 80
Asp Gly Lys Lys Tyr Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr
85 90 95
Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr
100 105 110
Phe Ile Ala Ser Thr Gly Tyr Thr Ser Ile Asn Gly Lys His Phe Tyr
115 120 125
Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro Asn
130 135 140
Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu
145 150 155 160
Gly Gln Ala Ile Leu Tyr Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys
165 170 175
Lys Tyr Tyr Phe Gly Ser Asp Ser Lys Ala Val Thr Gly Leu Arg Thr
180 185 190
Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr Ala Val Ala Val
195 200 205
Thr Gly Trp Gln Thr Ile Asn Gly Lys Lys Tyr Tyr Phe Asn Thr Asn
210 215 220
Thr Ser Ile Ala Ser Thr Gly Tyr Thr Ile Ile Ser Gly Lys His Phe
225 230 235 240
Tyr Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro
245 250 255
Asp Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile
260 265 270
Glu Gly Gln Ala Ile Arg Tyr Gln Asn Arg Phe Leu Tyr Leu His Asp
275 280 285
Asn Ile Tyr Tyr Phe Gly Asn Asn Ser Lys Ala Ala Thr Gly Trp Val
290 295 300
Thr Ile Asp Gly Asn Arg Tyr Tyr Phe Glu Pro Asn Thr Ala Met Gly
305 310 315 320
Ala Asn Gly Tyr Lys Thr Ile Asp Asn Lys Asn Phe Tyr Phe Arg Asn
325 330 335
Gly Leu Pro Gln Ile Gly Val Phe Lys Gly Ser Asn Gly Phe Glu Tyr
340 345 350
Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile
355 360 365
Arg Tyr Gln Asn Arg Phe Leu His Leu Leu Gly Lys Ile Tyr Tyr Phe
370 375 380
Gly Asn Asn Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asn Gly Lys
385 390 395 400
Val Tyr Tyr Phe Met Pro Asp Thr Ala Met Ala Ala Ala Gly Gly Leu
405 410 415
Phe Glu Ile Asp Gly Val Ile Tyr Phe Phe Gly Val Asp Gly Val Lys
420 425 430
Ala Pro Gly Ile Tyr Gly
435
<210> 5
<211> 5442
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Трехтоксинная вакцина BV1470
<220>
<221> прочее
<222> (1763)..(1763)
<223> n представляет собой a, c, g или t
<400> 5
atggaaatcg tcaacgaaga catcctgccg aacaacggtt tgatgggcta ctacttcacc 60
gatgagcact tcaaggacct gaagctcatg gctcctatca aggacggaaa cctgaagttc 120
gaggaaaaga aggtcgataa gctgctcgac aaggataaga gcgacgttaa gtcaatcagg 180
tggaccggca gaatcatccc atccaaggat ggagagtaca ctctctctac agaccgtgac 240
gatgtcttga tgcaggtgaa caccgaatcg actatctcca acactctgaa ggtgaacatg 300
aagaagggaa aggagtacaa ggtgcgcatc gaactgcaag ataagaacct cggttctatc 360
gacaacctct cctctccaaa cctctactgg gagttggatg gcatgaagaa gatcatcccg 420
gaggaaaact tgttcctgcg tgactacagc aacatcgaaa aggacgatcc cttcatccct 480
aacaacaact tcttcgatcc caagctgatg tctgactggg aggacgaaga tctcgacacc 540
gataacgaca acatccctga cagctacgag cgcaacggat acactatcaa ggatctcatc 600
gctgtgaagt gggaggactc cttcgccgaa cagggttaca agaagtacgt ctcaaactac 660
ttggagtcga acacagctgg tgacccctac accgactacg aaaaggcctc cggctctttc 720
gataaggcta tcaagaccga ggctagggac ccactcgtcg ctgcttaccc catcgtggga 780
gtcggtatgg agaagttgat catcagcact aacgaacacg cttcaactga ccagggcaag 840
acagtttcaa gagccaccac taactcgaag accgagtcca acactgctgg cgtttccgtg 900
aacgtcggct accagaacgg attcaccgcc aacgttacaa ccaactactc gcacactaca 960
gataactcca ccgctgtgca agactctaac ggagagagct ggaacactgg tctgtctatc 1020
aacaagggcg aaagcgctta catcaacgcc aacgtccgct actacaacac tggcacagcc 1080
cccatgtaca aggtgacccc taccactaac ctcgtcttgg atggagacac actgtctacc 1140
atcaaggctc aggagaacca aatcggaaac aacctcagcc ccggtgacac ataccctaag 1200
aagggattgt caccactggc cctcaacact atggaccagt tcagctcaag gttgatcccg 1260
atcaactacg atcaactcaa gaagttggac gctggcaagc agatcaagct ggagacaacc 1320
caagtctccg gtaacttcgg caccaagaac tcgtccggcc agatcgttac tgaaggaaac 1380
agctggtcag attacatctc acaaatcgac tcgatctccg cctctatcat cctggacaca 1440
gagaacgaat cctacgagcg tcgcgtgacc gctaagaact tgcaggaccc cgaggacaag 1500
acaccggaac tgaccatcgg cgaggccatc gaaaaggctt tcggtgccac caagaaggac 1560
ggcttgctgt acttcaacga tatccctatc gacgagtcct gcgttgaact gatcttcgac 1620
gataacactg ctaacaagat caaggattcc ctgaagacac tctctgacaa gaagatctac 1680
aacgtgaagc tcgagagggg tatgaacatc ttgatcaaga cccccactta cttcacaaac 1740
ttcgacgatt acaacaacta ccnttctacc tggagcaacg tcaacactac aaaccaggac 1800
ggactgcaag gttcggccaa caagctcaac ggcgagacca agatcaagat cccaatgagc 1860
gaactgaagc cgtacaagag atacgtgttc tcaggctact cgaaggaccc actcactagc 1920
aactcaatca tcgtgaagat caaggctaag gaggaaaaga ccgactacct ggtccccgag 1980
cagggctaca ctaagttctc ttacgagttc gaaaccactg agaaggactc tagcaacatc 2040
gaaatcaccc tcatcggcag cggaacaacc tacttggaca acctgtcaat caccgagttg 2100
aactcgactc ccgaaatcct ggacgagccc gaagtcaaga tccctaccga tcaggagatc 2160
atggacgctc acaagatcta cttcgccgac ctgaacttca acccctctac tggaaacaca 2220
tacatcaacg gcatgtactt cgctcctaca caaaccaaca aggaggccct ggactacatc 2280
cagaagtacc gtgtcgaagc cactctccaa tactccggtt tcaaggatat cggcacaaag 2340
gacaaggaga tgaggaacta cttgggtgac ccaaaccagc cgaagaccaa ctacgtgaac 2400
ctgagatcat acttcactgg tggcgagaac atcatgacat acaagaagct gcgtatctac 2460
gctatcaccc ctgacgaccg tgaactcttg gttttgtccg tggacgctag catggtcagc 2520
ggtctcatct acatcaacga ctcgttgtac tacttcaagc cccctgtgaa caacctgatc 2580
acaggtttcg ttaccgtggg cgacgataag tactacttca acccaatcaa cggtggcgct 2640
gcctccatcg gcgagaccat catcgacgat aagaactact acttcaacca gagcggagtt 2700
ctccaaactg gtgtgttctc aacagaggac ggtttcaagt acttcgctcc ggccaacacc 2760
ttggacgaaa acctggaggg tgaagccatc gacttcactg gcaagttgat catcgatgag 2820
aacatctact acttcgacga taactaccgc ggtgctgtgg agtggaagga actcgacggc 2880
gagatgcact acttctctcc agaaaccggc aaggccttca agggattgaa ccagatcggt 2940
gactacaagt actacttcaa ctcggatggc gtgatgcaaa agggattcgt ctccatcaac 3000
gacaacaagc actacttcga cgattccggt gttatgaaag tgggctacac agagatcgac 3060
ggcaagcact tctacttcgc tgagaacgga gaaatgcaga tcggtgtctt caacactgaa 3120
gatggtttca agtacttcgc ccaccacaac gaagatttgg gcaacgagga aggagaggaa 3180
atcagctact caggcatcct gaacttcaac aacaagatct actacttcga tgactctttc 3240
accgctgtgg tcggatggaa ggacctggag gatggtagca agtactactt cgacgaggat 3300
actgctgaag cctacatcgg cctgtcgctc atcaacgacg gacagtacta cttcaacgac 3360
gatggcatca tgcaagtcgg attcgttacc atcaacgaca aggtgttcta cttctcggat 3420
tccggtatca tcgagtctgg cgtccagaac atcgacgata actacttcta catcgacgat 3480
aacggaatcg tgcaaatcgg tgtcttcgac acaagcgatg gctacaagta cttcgctccc 3540
gccaacaccg tgaacgacaa catctacgga caggctgtgg agtactcagg cctggtccgt 3600
gttggagaag acgtgtacta cttcggcgag acctacacta tcgaaactgg atggatctac 3660
gacatggaga acgaatctga caagtactac ttcaaccctg agacaaagaa ggcctgcaag 3720
ggtatcaacc tgatcgacga tatcaagtac tacttcgatg aaaagggtat catgcgcacc 3780
ggcctcatct cattcgaaaa caacaactac tacttcaacg agaacggaga aatgcaattc 3840
ggttacatca acatcgagga caagatgttc tacttcggag aagatggtgt catgcagatc 3900
ggtgttttca acactccaga cggcttcaag tacttcgctc accaaaacac actcgacgag 3960
aacttcgagg gagaatccat caactacact ggttggttgg acctggatga gaagaggtac 4020
tacttcaccg acgaatacat cgctgccact ggctccgtca tcatcgacgg agaggaatac 4080
tacttcgacc cggatacagc ccagctggtc atctctgaat ctagaatggt gaccggtgtc 4140
ttcaagggtc ccaacggctt cgagtacttc gctcccgcca acactcacaa caacaacatc 4200
gaaggtcaag ctatcgtcta ccaaaacaag ttcttgaccc tgaacggcaa gaagtattat 4260
tttgacaacg attctaaggc cgttactggc tggcaaacaa tcgacggaaa gaagtattat 4320
ttcaatctga acactgccga ggctgccacc ggttggcaga ctatcgatgg caagaagtac 4380
tactttaacc tcaacactgc cgaagctgcc acaggatggc aaaccatcga cggcaagaag 4440
tactatttta acacaaacac cttcatcgct tctactggct acacaagcat caacggaaag 4500
catttttatt tcaacaccga tggaatcatg cagatcggtg tgttcaaggg accaaacggt 4560
ttcgaatact tcgctccggc taacacagac gctaacaaca tcgagggcca ggctatcttg 4620
taccaaaaca agttcctcac tttgaacggc aagaagtact attttggctc tgacagcaag 4680
gccgtcactg gactgaggac aatcgatggc aagaagtact actttaatac taacacagcc 4740
gttgctgtga ccggctggca gactatcaac ggaaagaagt attatttcaa taccaacact 4800
tcaatcgctt cgaccggtta cactatcatc tctggcaagc atttttattt taacaccgac 4860
ggcatcatgc aaatcggtgt cttcaagggc cccgatggct tcgaatactt cgcccccgct 4920
aacactgatg ctaacaacat cgagggacag gctatccgtt accaaaaccg cttcctgtac 4980
ctccacgaca acatctacta cttcggcaac aactcaaagg ctgccacagg atgggtgacc 5040
atcgatggta accgttacta cttcgagccc aacactgcca tgggtgctaa cggctacaag 5100
acaatcgaca acaagaactt ctacttccgc aacggtctcc cacagatcgg cgtcttcaag 5160
ggatcaaacg gtttcgagta cttcgctcct gccaacaccg acgccaacaa catcgagggc 5220
caagctatca ggtaccaaaa cagattcctg cacctgctcg gcaagatcta ctacttcgga 5280
aacaactcga aggccgttac tggttggcag acaatcaacg gcaaggtgta ctacttcatg 5340
ccagacaccg ctatggctgc cgctggtggc ctcttcgaaa tcgacggcgt gatctacttc 5400
ttcggcgttg atggagtgaa ggctccgggt atctacggct aa 5442
<210> 6
<211> 2505
<212> ДНК
<213> Clostridium difficile
<220>
<221> прочее
<222> (1763)..(1763)
<223> n представляет собой a, c, g или t
<400> 6
atggaaatcg tcaacgaaga catcctgccg aacaacggtt tgatgggcta ctacttcacc 60
gatgagcact tcaaggacct gaagctcatg gctcctatca aggacggaaa cctgaagttc 120
gaggaaaaga aggtcgataa gctgctcgac aaggataaga gcgacgttaa gtcaatcagg 180
tggaccggca gaatcatccc atccaaggat ggagagtaca ctctctctac agaccgtgac 240
gatgtcttga tgcaggtgaa caccgaatcg actatctcca acactctgaa ggtgaacatg 300
aagaagggaa aggagtacaa ggtgcgcatc gaactgcaag ataagaacct cggttctatc 360
gacaacctct cctctccaaa cctctactgg gagttggatg gcatgaagaa gatcatcccg 420
gaggaaaact tgttcctgcg tgactacagc aacatcgaaa aggacgatcc cttcatccct 480
aacaacaact tcttcgatcc caagctgatg tctgactggg aggacgaaga tctcgacacc 540
gataacgaca acatccctga cagctacgag cgcaacggat acactatcaa ggatctcatc 600
gctgtgaagt gggaggactc cttcgccgaa cagggttaca agaagtacgt ctcaaactac 660
ttggagtcga acacagctgg tgacccctac accgactacg aaaaggcctc cggctctttc 720
gataaggcta tcaagaccga ggctagggac ccactcgtcg ctgcttaccc catcgtggga 780
gtcggtatgg agaagttgat catcagcact aacgaacacg cttcaactga ccagggcaag 840
acagtttcaa gagccaccac taactcgaag accgagtcca acactgctgg cgtttccgtg 900
aacgtcggct accagaacgg attcaccgcc aacgttacaa ccaactactc gcacactaca 960
gataactcca ccgctgtgca agactctaac ggagagagct ggaacactgg tctgtctatc 1020
aacaagggcg aaagcgctta catcaacgcc aacgtccgct actacaacac tggcacagcc 1080
cccatgtaca aggtgacccc taccactaac ctcgtcttgg atggagacac actgtctacc 1140
atcaaggctc aggagaacca aatcggaaac aacctcagcc ccggtgacac ataccctaag 1200
aagggattgt caccactggc cctcaacact atggaccagt tcagctcaag gttgatcccg 1260
atcaactacg atcaactcaa gaagttggac gctggcaagc agatcaagct ggagacaacc 1320
caagtctccg gtaacttcgg caccaagaac tcgtccggcc agatcgttac tgaaggaaac 1380
agctggtcag attacatctc acaaatcgac tcgatctccg cctctatcat cctggacaca 1440
gagaacgaat cctacgagcg tcgcgtgacc gctaagaact tgcaggaccc cgaggacaag 1500
acaccggaac tgaccatcgg cgaggccatc gaaaaggctt tcggtgccac caagaaggac 1560
ggcttgctgt acttcaacga tatccctatc gacgagtcct gcgttgaact gatcttcgac 1620
gataacactg ctaacaagat caaggattcc ctgaagacac tctctgacaa gaagatctac 1680
aacgtgaagc tcgagagggg tatgaacatc ttgatcaaga cccccactta cttcacaaac 1740
ttcgacgatt acaacaacta ccnttctacc tggagcaacg tcaacactac aaaccaggac 1800
ggactgcaag gttcggccaa caagctcaac ggcgagacca agatcaagat cccaatgagc 1860
gaactgaagc cgtacaagag atacgtgttc tcaggctact cgaaggaccc actcactagc 1920
aactcaatca tcgtgaagat caaggctaag gaggaaaaga ccgactacct ggtccccgag 1980
cagggctaca ctaagttctc ttacgagttc gaaaccactg agaaggactc tagcaacatc 2040
gaaatcaccc tcatcggcag cggaacaacc tacttggaca acctgtcaat caccgagttg 2100
aactcgactc ccgaaatcct ggacgagccc gaagtcaaga tccctaccga tcaggagatc 2160
atggacgctc acaagatcta cttcgccgac ctgaacttca acccctctac tggaaacaca 2220
tacatcaacg gcatgtactt cgctcctaca caaaccaaca aggaggccct ggactacatc 2280
cagaagtacc gtgtcgaagc cactctccaa tactccggtt tcaaggatat cggcacaaag 2340
gacaaggaga tgaggaacta cttgggtgac ccaaaccagc cgaagaccaa ctacgtgaac 2400
ctgagatcat acttcactgg tggcgagaac atcatgacat acaagaagct gcgtatctac 2460
gctatcaccc ctgacgaccg tgaactcttg gttttgtccg tggac 2505
<210> 7
<211> 1608
<212> ДНК
<213> Clostridium difficile
<400> 7
atggtcagcg gtctcatcta catcaacgac tcgttgtact acttcaagcc ccctgtgaac 60
aacctgatca caggtttcgt taccgtgggc gacgataagt actacttcaa cccaatcaac 120
ggtggcgctg cctccatcgg cgagaccatc atcgacgata agaactacta cttcaaccag 180
agcggagttc tccaaactgg tgtgttctca acagaggacg gtttcaagta cttcgctccg 240
gccaacacct tggacgaaaa cctggagggt gaagccatcg acttcactgg caagttgatc 300
atcgatgaga acatctacta cttcgacgat aactaccgcg gtgctgtgga gtggaaggaa 360
ctcgacggcg agatgcacta cttctctcca gaaaccggca aggccttcaa gggattgaac 420
cagatcggtg actacaagta ctacttcaac tcggatggcg tgatgcaaaa gggattcgtc 480
tccatcaacg acaacaagca ctacttcgac gattccggtg ttatgaaagt gggctacaca 540
gagatcgacg gcaagcactt ctacttcgct gagaacggag aaatgcagat cggtgtcttc 600
aacactgaag atggtttcaa gtacttcgcc caccacaacg aagatttggg caacgaggaa 660
ggagaggaaa tcagctactc aggcatcctg aacttcaaca acaagatcta ctacttcgat 720
gactctttca ccgctgtggt cggatggaag gacctggagg atggtagcaa gtactacttc 780
gacgaggata ctgctgaagc ctacatcggc ctgtcgctca tcaacgacgg acagtactac 840
ttcaacgacg atggcatcat gcaagtcgga ttcgttacca tcaacgacaa ggtgttctac 900
ttctcggatt ccggtatcat cgagtctggc gtccagaaca tcgacgataa ctacttctac 960
atcgacgata acggaatcgt gcaaatcggt gtcttcgaca caagcgatgg ctacaagtac 1020
ttcgctcccg ccaacaccgt gaacgacaac atctacggac aggctgtgga gtactcaggc 1080
ctggtccgtg ttggagaaga cgtgtactac ttcggcgaga cctacactat cgaaactgga 1140
tggatctacg acatggagaa cgaatctgac aagtactact tcaaccctga gacaaagaag 1200
gcctgcaagg gtatcaacct gatcgacgat atcaagtact acttcgatga aaagggtatc 1260
atgcgcaccg gcctcatctc attcgaaaac aacaactact acttcaacga gaacggagaa 1320
atgcaattcg gttacatcaa catcgaggac aagatgttct acttcggaga agatggtgtc 1380
atgcagatcg gtgttttcaa cactccagac ggcttcaagt acttcgctca ccaaaacaca 1440
ctcgacgaga acttcgaggg agaatccatc aactacactg gttggttgga cctggatgag 1500
aagaggtact acttcaccga cgaatacatc gctgccactg gctccgtcat catcgacgga 1560
gaggaatact acttcgaccc ggatacagcc cagctggtca tctctgaa 1608
<210> 8
<211> 1317
<212> ДНК
<213> Clostridium difficile
<400> 8
atggtgaccg gtgtcttcaa gggtcccaac ggcttcgagt acttcgctcc cgccaacact 60
cacaacaaca acatcgaagg tcaagctatc gtctaccaaa acaagttctt gaccctgaac 120
ggcaagaagt attattttga caacgattct aaggccgtta ctggctggca aacaatcgac 180
ggaaagaagt attatttcaa tctgaacact gccgaggctg ccaccggttg gcagactatc 240
gatggcaaga agtactactt taacctcaac actgccgaag ctgccacagg atggcaaacc 300
atcgacggca agaagtacta ttttaacaca aacaccttca tcgcttctac tggctacaca 360
agcatcaacg gaaagcattt ttatttcaac accgatggaa tcatgcagat cggtgtgttc 420
aagggaccaa acggtttcga atacttcgct ccggctaaca cagacgctaa caacatcgag 480
ggccaggcta tcttgtacca aaacaagttc ctcactttga acggcaagaa gtactatttt 540
ggctctgaca gcaaggccgt cactggactg aggacaatcg atggcaagaa gtactacttt 600
aatactaaca cagccgttgc tgtgaccggc tggcagacta tcaacggaaa gaagtattat 660
ttcaatacca acacttcaat cgcttcgacc ggttacacta tcatctctgg caagcatttt 720
tattttaaca ccgacggcat catgcaaatc ggtgtcttca agggccccga tggcttcgaa 780
tacttcgccc ccgctaacac tgatgctaac aacatcgagg gacaggctat ccgttaccaa 840
aaccgcttcc tgtacctcca cgacaacatc tactacttcg gcaacaactc aaaggctgcc 900
acaggatggg tgaccatcga tggtaaccgt tactacttcg agcccaacac tgccatgggt 960
gctaacggct acaagacaat cgacaacaag aacttctact tccgcaacgg tctcccacag 1020
atcggcgtct tcaagggatc aaacggtttc gagtacttcg ctcctgccaa caccgacgcc 1080
aacaacatcg agggccaagc tatcaggtac caaaacagat tcctgcacct gctcggcaag 1140
atctactact tcggaaacaa ctcgaaggcc gttactggtt ggcagacaat caacggcaag 1200
gtgtactact tcatgccaga caccgctatg gctgccgctg gtggcctctt cgaaatcgac 1260
ggcgtgatct acttcttcgg cgttgatgga gtgaaggctc cgggtatcta cggctaa 1317
<210> 9
<211> 1820
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Трехтоксинная вакцина BV1420
<220>
<221> прочее
<222> (595)..(595)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 9
Met Glu Ile Val Asn Glu Asp Ile Leu Pro Asn Asn Gly Leu Met Gly
1 5 10 15
Tyr Tyr Phe Thr Asp Glu His Phe Lys Asp Leu Lys Leu Met Ala Pro
20 25 30
Ile Lys Asp Gly Asn Leu Lys Phe Glu Glu Lys Lys Val Asp Lys Leu
35 40 45
Leu Asp Lys Asp Lys Ser Asp Val Lys Ser Ile Arg Trp Thr Gly Arg
50 55 60
Ile Ile Pro Ser Lys Asp Gly Glu Tyr Thr Leu Ser Thr Asp Arg Asp
65 70 75 80
Asp Val Leu Met Gln Val Asn Thr Glu Ser Thr Ile Ser Asn Thr Leu
85 90 95
Lys Val Asn Met Lys Lys Gly Lys Glu Tyr Lys Val Arg Ile Glu Leu
100 105 110
Gln Asp Lys Asn Leu Gly Ser Ile Asp Asn Leu Ser Ser Pro Asn Leu
115 120 125
Tyr Trp Glu Leu Asp Gly Met Lys Lys Ile Ile Pro Glu Glu Asn Leu
130 135 140
Phe Leu Arg Asp Tyr Ser Asn Ile Glu Lys Asp Asp Pro Phe Ile Pro
145 150 155 160
Asn Asn Asn Phe Phe Asp Pro Lys Leu Arg Ala Arg Arg Arg Lys Lys
165 170 175
Arg Met Ser Asp Trp Glu Asp Glu Asp Leu Asp Thr Asp Asn Asp Asn
180 185 190
Ile Pro Asp Ser Tyr Glu Arg Asn Gly Tyr Thr Ile Lys Asp Leu Ile
195 200 205
Ala Val Lys Trp Glu Asp Ser Phe Ala Glu Gln Gly Tyr Lys Lys Tyr
210 215 220
Val Ser Asn Tyr Leu Glu Ser Asn Thr Ala Gly Asp Pro Tyr Asp Tyr
225 230 235 240
Glu Lys Ala Ser Gly Ser Phe Asp Lys Ala Ile Lys Thr Glu Ala Arg
245 250 255
Asp Pro Leu Val Ala Ala Tyr Pro Ile Val Gly Val Gly Met Glu Lys
260 265 270
Leu Ile Ile Ser Thr Asn Glu His Ala Ser Thr Asp Gln Gly Lys Thr
275 280 285
Val Ser Arg Ala Thr Thr Asn Ser Lys Thr Glu Ser Asn Thr Ala Gly
290 295 300
Val Ser Val Asn Val Gly Tyr Gln Asn Gly Phe Thr Ala Asn Val Thr
305 310 315 320
Thr Asn Tyr Ser His Thr Thr Asp Asn Ser Thr Ala Val Gln Asp Ser
325 330 335
Asn Gly Glu Ser Trp Asn Thr Gly Leu Ser Ile Asn Lys Gly Glu Ser
340 345 350
Ala Tyr Ile Asn Ala Asn Val Arg Tyr Tyr Asn Thr Gly Thr Ala Pro
355 360 365
Met Tyr Lys Val Thr Pro Thr Thr Asn Leu Val Leu Asp Gly Asp Thr
370 375 380
Leu Ser Thr Ile Lys Ala Gln Glu Asn Gln Ile Gly Asn Asn Leu Ser
385 390 395 400
Pro Gly Asp Thr Tyr Pro Lys Lys Gly Leu Ser Pro Leu Ala Leu Asn
405 410 415
Thr Met Asp Gln Phe Ser Ser Arg Leu Ile Pro Ile Asn Tyr Asp Gln
420 425 430
Leu Lys Lys Leu Asp Ala Gly Lys Gln Ile Lys Leu Glu Thr Thr Gln
435 440 445
Val Ser Gly Asn Phe Gly Thr Lys Asn Ser Ser Gly Gln Ile Val Thr
450 455 460
Glu Gly Asn Ser Trp Ser Asp Tyr Ile Ser Gln Ile Asp Ser Ile Ser
465 470 475 480
Ala Ser Ile Ile Leu Asp Thr Glu Asn Glu Ser Tyr Glu Arg Arg Val
485 490 495
Thr Ala Lys Asn Leu Gln Asp Pro Glu Asp Lys Thr Pro Glu Leu Thr
500 505 510
Ile Gly Glu Ala Ile Glu Lys Ala Phe Gly Ala Thr Lys Lys Asp Gly
515 520 525
Leu Leu Tyr Phe Asn Asp Ile Pro Ile Asp Glu Ser Cys Val Glu Leu
530 535 540
Ile Phe Asp Asp Asn Thr Ala Asn Lys Ile Lys Asp Ser Leu Lys Thr
545 550 555 560
Leu Ser Asp Lys Lys Ile Tyr Asn Val Lys Leu Glu Arg Gly Met Asn
565 570 575
Ile Leu Ile Lys Thr Pro Thr Tyr Phe Thr Asn Phe Asp Asp Tyr Asn
580 585 590
Asn Tyr Xaa Ser Thr Trp Ser Asn Val Asn Thr Thr Asn Gln Asp Gly
595 600 605
Leu Gln Gly Ser Ala Asn Lys Leu Asn Gly Glu Thr Lys Ile Lys Ile
610 615 620
Pro Met Ser Glu Leu Lys Pro Tyr Lys Arg Tyr Val Phe Ser Gly Tyr
625 630 635 640
Ser Lys Asp Pro Leu Thr Ser Asn Ser Ile Ile Val Lys Ile Lys Ala
645 650 655
Lys Glu Glu Lys Thr Asp Tyr Leu Val Pro Glu Gln Gly Tyr Thr Lys
660 665 670
Phe Ser Tyr Glu Phe Glu Thr Thr Glu Lys Asp Ser Ser Asn Ile Glu
675 680 685
Ile Thr Leu Ile Gly Ser Gly Thr Thr Tyr Leu Asp Asn Leu Ser Ile
690 695 700
Thr Glu Leu Asn Ser Thr Pro Glu Ile Leu Asp Glu Pro Glu Val Lys
705 710 715 720
Ile Pro Thr Asp Gln Glu Ile Met Asp Ala His Lys Ile Tyr Phe Ala
725 730 735
Asp Leu Asn Phe Asn Pro Ser Thr Gly Asn Thr Tyr Ile Asn Gly Met
740 745 750
Tyr Phe Ala Pro Thr Gln Thr Asn Lys Glu Ala Leu Asp Tyr Ile Gln
755 760 765
Lys Tyr Arg Val Glu Ala Thr Leu Gln Tyr Ser Gly Phe Lys Asp Ile
770 775 780
Gly Thr Lys Asp Lys Glu Met Arg Asn Tyr Leu Gly Asp Pro Asn Gln
785 790 795 800
Pro Lys Thr Asn Tyr Val Asn Leu Arg Ser Tyr Phe Thr Gly Gly Glu
805 810 815
Asn Ile Met Thr Tyr Lys Lys Leu Arg Ile Tyr Ala Ile Thr Pro Asp
820 825 830
Asp Arg Glu Leu Leu Val Leu Ser Val Asp Ala Ser Met Val Ser Gly
835 840 845
Leu Ile Tyr Ile Asn Asp Ser Leu Tyr Tyr Phe Lys Pro Pro Val Asn
850 855 860
Asn Leu Ile Thr Gly Phe Val Thr Val Gly Asp Asp Lys Tyr Tyr Phe
865 870 875 880
Asn Pro Ile Asn Gly Gly Ala Ala Ser Ile Gly Glu Thr Ile Ile Asp
885 890 895
Asp Lys Asn Tyr Tyr Phe Asn Gln Ser Gly Val Leu Gln Thr Gly Val
900 905 910
Phe Ser Thr Glu Asp Gly Phe Lys Tyr Phe Ala Pro Ala Asn Thr Leu
915 920 925
Asp Glu Asn Leu Glu Gly Glu Ala Ile Asp Phe Thr Gly Lys Leu Ile
930 935 940
Ile Asp Glu Asn Ile Tyr Tyr Phe Asp Asp Asn Tyr Arg Gly Ala Val
945 950 955 960
Glu Trp Lys Glu Leu Asp Gly Glu Met His Tyr Phe Ser Pro Glu Thr
965 970 975
Gly Lys Ala Phe Lys Gly Leu Asn Gln Ile Gly Asp Tyr Lys Tyr Tyr
980 985 990
Phe Asn Ser Asp Gly Val Met Gln Lys Gly Phe Val Ser Ile Asn Asp
995 1000 1005
Asn Lys His Tyr Phe Asp Asp Ser Gly Val Met Lys Val Gly Tyr
1010 1015 1020
Thr Glu Ile Asp Gly Lys His Phe Tyr Phe Ala Glu Asn Gly Glu
1025 1030 1035
Met Gln Ile Gly Val Phe Asn Thr Glu Asp Gly Phe Lys Tyr Phe
1040 1045 1050
Ala His His Asn Glu Asp Leu Gly Asn Glu Glu Gly Glu Glu Ile
1055 1060 1065
Ser Tyr Ser Gly Ile Leu Asn Phe Asn Asn Lys Ile Tyr Tyr Phe
1070 1075 1080
Asp Asp Ser Phe Thr Ala Val Val Gly Trp Lys Asp Leu Glu Asp
1085 1090 1095
Gly Ser Lys Tyr Tyr Phe Asp Glu Asp Thr Ala Glu Ala Tyr Ile
1100 1105 1110
Gly Leu Ser Leu Ile Asn Asp Gly Gln Tyr Tyr Phe Asn Asp Asp
1115 1120 1125
Gly Ile Met Gln Val Gly Phe Val Thr Ile Asn Asp Lys Val Phe
1130 1135 1140
Tyr Phe Ser Asp Ser Gly Ile Ile Glu Ser Gly Val Gln Asn Ile
1145 1150 1155
Asp Asp Asn Tyr Phe Tyr Ile Asp Asp Asn Gly Ile Val Gln Ile
1160 1165 1170
Gly Val Phe Asp Thr Ser Asp Gly Tyr Lys Tyr Phe Ala Pro Ala
1175 1180 1185
Asn Thr Val Asn Asp Asn Ile Tyr Gly Gln Ala Val Glu Tyr Ser
1190 1195 1200
Gly Leu Val Arg Val Gly Glu Asp Val Tyr Tyr Phe Gly Glu Thr
1205 1210 1215
Tyr Thr Ile Glu Thr Gly Trp Ile Tyr Asp Met Glu Asn Glu Ser
1220 1225 1230
Asp Lys Tyr Tyr Phe Asn Pro Glu Thr Lys Lys Ala Cys Lys Gly
1235 1240 1245
Ile Asn Leu Ile Asp Asp Ile Lys Tyr Tyr Phe Asp Glu Lys Gly
1250 1255 1260
Ile Met Arg Thr Gly Leu Ile Ser Phe Glu Asn Asn Asn Tyr Tyr
1265 1270 1275
Phe Asn Glu Asn Gly Glu Met Gln Phe Gly Tyr Ile Asn Ile Glu
1280 1285 1290
Asp Lys Met Phe Tyr Phe Gly Glu Asp Gly Val Met Gln Ile Gly
1295 1300 1305
Val Phe Asn Thr Pro Asp Gly Phe Lys Tyr Phe Ala His Gln Asn
1310 1315 1320
Thr Leu Asp Glu Asn Phe Glu Gly Glu Ser Ile Asn Tyr Thr Gly
1325 1330 1335
Trp Leu Asp Leu Asp Glu Lys Arg Tyr Tyr Phe Thr Asp Glu Tyr
1340 1345 1350
Ile Ala Ala Thr Gly Ser Val Ile Ile Asp Gly Glu Glu Tyr Tyr
1355 1360 1365
Phe Asp Pro Asp Thr Ala Gln Leu Val Ile Ser Glu Ser Arg Met
1370 1375 1380
Val Thr Gly Val Phe Lys Gly Pro Asn Gly Phe Glu Tyr Phe Ala
1385 1390 1395
Pro Ala Asn Thr His Asn Asn Asn Ile Glu Gly Gln Ala Ile Val
1400 1405 1410
Tyr Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys Lys Tyr Tyr Phe
1415 1420 1425
Asp Asn Asp Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asp Gly
1430 1435 1440
Lys Lys Tyr Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr Gly
1445 1450 1455
Trp Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Leu Asn Thr
1460 1465 1470
Ala Glu Ala Ala Thr Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr
1475 1480 1485
Tyr Phe Asn Thr Asn Thr Phe Ile Ala Ser Thr Gly Tyr Thr Ser
1490 1495 1500
Ile Asn Gly Lys His Phe Tyr Phe Asn Thr Asp Gly Ile Met Gln
1505 1510 1515
Ile Gly Val Phe Lys Gly Pro Asn Gly Phe Glu Tyr Phe Ala Pro
1520 1525 1530
Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile Leu Tyr
1535 1540 1545
Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys Lys Tyr Tyr Phe Gly
1550 1555 1560
Ser Asp Ser Lys Ala Val Thr Gly Leu Arg Thr Ile Asp Gly Lys
1565 1570 1575
Lys Tyr Tyr Phe Asn Thr Asn Thr Ala Val Ala Val Thr Gly Trp
1580 1585 1590
Gln Thr Ile Asn Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr Ser
1595 1600 1605
Ile Ala Ser Thr Gly Tyr Thr Ile Ile Ser Gly Lys His Phe Tyr
1610 1615 1620
Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro
1625 1630 1635
Asp Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn
1640 1645 1650
Ile Glu Gly Gln Ala Ile Arg Tyr Gln Asn Arg Phe Leu Tyr Leu
1655 1660 1665
His Asp Asn Ile Tyr Tyr Phe Gly Asn Asn Ser Lys Ala Ala Thr
1670 1675 1680
Gly Trp Val Thr Ile Asp Gly Asn Arg Tyr Tyr Phe Glu Pro Asn
1685 1690 1695
Thr Ala Met Gly Ala Asn Gly Tyr Lys Thr Ile Asp Asn Lys Asn
1700 1705 1710
Phe Tyr Phe Arg Asn Gly Leu Pro Gln Ile Gly Val Phe Lys Gly
1715 1720 1725
Ser Asn Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn
1730 1735 1740
Asn Ile Glu Gly Gln Ala Ile Arg Tyr Gln Asn Arg Phe Leu His
1745 1750 1755
Leu Leu Gly Lys Ile Tyr Tyr Phe Gly Asn Asn Ser Lys Ala Val
1760 1765 1770
Thr Gly Trp Gln Thr Ile Asn Gly Lys Val Tyr Tyr Phe Met Pro
1775 1780 1785
Asp Thr Ala Met Ala Ala Ala Gly Gly Leu Phe Glu Ile Asp Gly
1790 1795 1800
Val Ile Tyr Phe Phe Gly Val Asp Gly Val Lys Ala Pro Gly Ile
1805 1810 1815
Tyr Gly
1820
<210> 10
<211> 842
<212> БЕЛОК
<213> Clostridium difficile
<220>
<221> прочее
<222> (595)..(595)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 10
Met Glu Ile Val Asn Glu Asp Ile Leu Pro Asn Asn Gly Leu Met Gly
1 5 10 15
Tyr Tyr Phe Thr Asp Glu His Phe Lys Asp Leu Lys Leu Met Ala Pro
20 25 30
Ile Lys Asp Gly Asn Leu Lys Phe Glu Glu Lys Lys Val Asp Lys Leu
35 40 45
Leu Asp Lys Asp Lys Ser Asp Val Lys Ser Ile Arg Trp Thr Gly Arg
50 55 60
Ile Ile Pro Ser Lys Asp Gly Glu Tyr Thr Leu Ser Thr Asp Arg Asp
65 70 75 80
Asp Val Leu Met Gln Val Asn Thr Glu Ser Thr Ile Ser Asn Thr Leu
85 90 95
Lys Val Asn Met Lys Lys Gly Lys Glu Tyr Lys Val Arg Ile Glu Leu
100 105 110
Gln Asp Lys Asn Leu Gly Ser Ile Asp Asn Leu Ser Ser Pro Asn Leu
115 120 125
Tyr Trp Glu Leu Asp Gly Met Lys Lys Ile Ile Pro Glu Glu Asn Leu
130 135 140
Phe Leu Arg Asp Tyr Ser Asn Ile Glu Lys Asp Asp Pro Phe Ile Pro
145 150 155 160
Asn Asn Asn Phe Phe Asp Pro Lys Leu Arg Ala Arg Arg Arg Lys Lys
165 170 175
Arg Met Ser Asp Trp Glu Asp Glu Asp Leu Asp Thr Asp Asn Asp Asn
180 185 190
Ile Pro Asp Ser Tyr Glu Arg Asn Gly Tyr Thr Ile Lys Asp Leu Ile
195 200 205
Ala Val Lys Trp Glu Asp Ser Phe Ala Glu Gln Gly Tyr Lys Lys Tyr
210 215 220
Val Ser Asn Tyr Leu Glu Ser Asn Thr Ala Gly Asp Pro Tyr Asp Tyr
225 230 235 240
Glu Lys Ala Ser Gly Ser Phe Asp Lys Ala Ile Lys Thr Glu Ala Arg
245 250 255
Asp Pro Leu Val Ala Ala Tyr Pro Ile Val Gly Val Gly Met Glu Lys
260 265 270
Leu Ile Ile Ser Thr Asn Glu His Ala Ser Thr Asp Gln Gly Lys Thr
275 280 285
Val Ser Arg Ala Thr Thr Asn Ser Lys Thr Glu Ser Asn Thr Ala Gly
290 295 300
Val Ser Val Asn Val Gly Tyr Gln Asn Gly Phe Thr Ala Asn Val Thr
305 310 315 320
Thr Asn Tyr Ser His Thr Thr Asp Asn Ser Thr Ala Val Gln Asp Ser
325 330 335
Asn Gly Glu Ser Trp Asn Thr Gly Leu Ser Ile Asn Lys Gly Glu Ser
340 345 350
Ala Tyr Ile Asn Ala Asn Val Arg Tyr Tyr Asn Thr Gly Thr Ala Pro
355 360 365
Met Tyr Lys Val Thr Pro Thr Thr Asn Leu Val Leu Asp Gly Asp Thr
370 375 380
Leu Ser Thr Ile Lys Ala Gln Glu Asn Gln Ile Gly Asn Asn Leu Ser
385 390 395 400
Pro Gly Asp Thr Tyr Pro Lys Lys Gly Leu Ser Pro Leu Ala Leu Asn
405 410 415
Thr Met Asp Gln Phe Ser Ser Arg Leu Ile Pro Ile Asn Tyr Asp Gln
420 425 430
Leu Lys Lys Leu Asp Ala Gly Lys Gln Ile Lys Leu Glu Thr Thr Gln
435 440 445
Val Ser Gly Asn Phe Gly Thr Lys Asn Ser Ser Gly Gln Ile Val Thr
450 455 460
Glu Gly Asn Ser Trp Ser Asp Tyr Ile Ser Gln Ile Asp Ser Ile Ser
465 470 475 480
Ala Ser Ile Ile Leu Asp Thr Glu Asn Glu Ser Tyr Glu Arg Arg Val
485 490 495
Thr Ala Lys Asn Leu Gln Asp Pro Glu Asp Lys Thr Pro Glu Leu Thr
500 505 510
Ile Gly Glu Ala Ile Glu Lys Ala Phe Gly Ala Thr Lys Lys Asp Gly
515 520 525
Leu Leu Tyr Phe Asn Asp Ile Pro Ile Asp Glu Ser Cys Val Glu Leu
530 535 540
Ile Phe Asp Asp Asn Thr Ala Asn Lys Ile Lys Asp Ser Leu Lys Thr
545 550 555 560
Leu Ser Asp Lys Lys Ile Tyr Asn Val Lys Leu Glu Arg Gly Met Asn
565 570 575
Ile Leu Ile Lys Thr Pro Thr Tyr Phe Thr Asn Phe Asp Asp Tyr Asn
580 585 590
Asn Tyr Xaa Ser Thr Trp Ser Asn Val Asn Thr Thr Asn Gln Asp Gly
595 600 605
Leu Gln Gly Ser Ala Asn Lys Leu Asn Gly Glu Thr Lys Ile Lys Ile
610 615 620
Pro Met Ser Glu Leu Lys Pro Tyr Lys Arg Tyr Val Phe Ser Gly Tyr
625 630 635 640
Ser Lys Asp Pro Leu Thr Ser Asn Ser Ile Ile Val Lys Ile Lys Ala
645 650 655
Lys Glu Glu Lys Thr Asp Tyr Leu Val Pro Glu Gln Gly Tyr Thr Lys
660 665 670
Phe Ser Tyr Glu Phe Glu Thr Thr Glu Lys Asp Ser Ser Asn Ile Glu
675 680 685
Ile Thr Leu Ile Gly Ser Gly Thr Thr Tyr Leu Asp Asn Leu Ser Ile
690 695 700
Thr Glu Leu Asn Ser Thr Pro Glu Ile Leu Asp Glu Pro Glu Val Lys
705 710 715 720
Ile Pro Thr Asp Gln Glu Ile Met Asp Ala His Lys Ile Tyr Phe Ala
725 730 735
Asp Leu Asn Phe Asn Pro Ser Thr Gly Asn Thr Tyr Ile Asn Gly Met
740 745 750
Tyr Phe Ala Pro Thr Gln Thr Asn Lys Glu Ala Leu Asp Tyr Ile Gln
755 760 765
Lys Tyr Arg Val Glu Ala Thr Leu Gln Tyr Ser Gly Phe Lys Asp Ile
770 775 780
Gly Thr Lys Asp Lys Glu Met Arg Asn Tyr Leu Gly Asp Pro Asn Gln
785 790 795 800
Pro Lys Thr Asn Tyr Val Asn Leu Arg Ser Tyr Phe Thr Gly Gly Glu
805 810 815
Asn Ile Met Thr Tyr Lys Lys Leu Arg Ile Tyr Ala Ile Thr Pro Asp
820 825 830
Asp Arg Glu Leu Leu Val Leu Ser Val Asp
835 840
<210> 11
<211> 536
<212> БЕЛОК
<213> Clostridium difficile
<400> 11
Met Val Ser Gly Leu Ile Tyr Ile Asn Asp Ser Leu Tyr Tyr Phe Lys
1 5 10 15
Pro Pro Val Asn Asn Leu Ile Thr Gly Phe Val Thr Val Gly Asp Asp
20 25 30
Lys Tyr Tyr Phe Asn Pro Ile Asn Gly Gly Ala Ala Ser Ile Gly Glu
35 40 45
Thr Ile Ile Asp Asp Lys Asn Tyr Tyr Phe Asn Gln Ser Gly Val Leu
50 55 60
Gln Thr Gly Val Phe Ser Thr Glu Asp Gly Phe Lys Tyr Phe Ala Pro
65 70 75 80
Ala Asn Thr Leu Asp Glu Asn Leu Glu Gly Glu Ala Ile Asp Phe Thr
85 90 95
Gly Lys Leu Ile Ile Asp Glu Asn Ile Tyr Tyr Phe Asp Asp Asn Tyr
100 105 110
Arg Gly Ala Val Glu Trp Lys Glu Leu Asp Gly Glu Met His Tyr Phe
115 120 125
Ser Pro Glu Thr Gly Lys Ala Phe Lys Gly Leu Asn Gln Ile Gly Asp
130 135 140
Tyr Lys Tyr Tyr Phe Asn Ser Asp Gly Val Met Gln Lys Gly Phe Val
145 150 155 160
Ser Ile Asn Asp Asn Lys His Tyr Phe Asp Asp Ser Gly Val Met Lys
165 170 175
Val Gly Tyr Thr Glu Ile Asp Gly Lys His Phe Tyr Phe Ala Glu Asn
180 185 190
Gly Glu Met Gln Ile Gly Val Phe Asn Thr Glu Asp Gly Phe Lys Tyr
195 200 205
Phe Ala His His Asn Glu Asp Leu Gly Asn Glu Glu Gly Glu Glu Ile
210 215 220
Ser Tyr Ser Gly Ile Leu Asn Phe Asn Asn Lys Ile Tyr Tyr Phe Asp
225 230 235 240
Asp Ser Phe Thr Ala Val Val Gly Trp Lys Asp Leu Glu Asp Gly Ser
245 250 255
Lys Tyr Tyr Phe Asp Glu Asp Thr Ala Glu Ala Tyr Ile Gly Leu Ser
260 265 270
Leu Ile Asn Asp Gly Gln Tyr Tyr Phe Asn Asp Asp Gly Ile Met Gln
275 280 285
Val Gly Phe Val Thr Ile Asn Asp Lys Val Phe Tyr Phe Ser Asp Ser
290 295 300
Gly Ile Ile Glu Ser Gly Val Gln Asn Ile Asp Asp Asn Tyr Phe Tyr
305 310 315 320
Ile Asp Asp Asn Gly Ile Val Gln Ile Gly Val Phe Asp Thr Ser Asp
325 330 335
Gly Tyr Lys Tyr Phe Ala Pro Ala Asn Thr Val Asn Asp Asn Ile Tyr
340 345 350
Gly Gln Ala Val Glu Tyr Ser Gly Leu Val Arg Val Gly Glu Asp Val
355 360 365
Tyr Tyr Phe Gly Glu Thr Tyr Thr Ile Glu Thr Gly Trp Ile Tyr Asp
370 375 380
Met Glu Asn Glu Ser Asp Lys Tyr Tyr Phe Asn Pro Glu Thr Lys Lys
385 390 395 400
Ala Cys Lys Gly Ile Asn Leu Ile Asp Asp Ile Lys Tyr Tyr Phe Asp
405 410 415
Glu Lys Gly Ile Met Arg Thr Gly Leu Ile Ser Phe Glu Asn Asn Asn
420 425 430
Tyr Tyr Phe Asn Glu Asn Gly Glu Met Gln Phe Gly Tyr Ile Asn Ile
435 440 445
Glu Asp Lys Met Phe Tyr Phe Gly Glu Asp Gly Val Met Gln Ile Gly
450 455 460
Val Phe Asn Thr Pro Asp Gly Phe Lys Tyr Phe Ala His Gln Asn Thr
465 470 475 480
Leu Asp Glu Asn Phe Glu Gly Glu Ser Ile Asn Tyr Thr Gly Trp Leu
485 490 495
Asp Leu Asp Glu Lys Arg Tyr Tyr Phe Thr Asp Glu Tyr Ile Ala Ala
500 505 510
Thr Gly Ser Val Ile Ile Asp Gly Glu Glu Tyr Tyr Phe Asp Pro Asp
515 520 525
Thr Ala Gln Leu Val Ile Ser Glu
530 535
<210> 12
<211> 438
<212> БЕЛОК
<213> Clostridium difficile
<400> 12
Met Val Thr Gly Val Phe Lys Gly Pro Asn Gly Phe Glu Tyr Phe Ala
1 5 10 15
Pro Ala Asn Thr His Asn Asn Asn Ile Glu Gly Gln Ala Ile Val Tyr
20 25 30
Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys Lys Tyr Tyr Phe Asp Asn
35 40 45
Asp Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr
50 55 60
Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr Gly Trp Gln Thr Ile
65 70 75 80
Asp Gly Lys Lys Tyr Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr
85 90 95
Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr
100 105 110
Phe Ile Ala Ser Thr Gly Tyr Thr Ser Ile Asn Gly Lys His Phe Tyr
115 120 125
Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro Asn
130 135 140
Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu
145 150 155 160
Gly Gln Ala Ile Leu Tyr Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys
165 170 175
Lys Tyr Tyr Phe Gly Ser Asp Ser Lys Ala Val Thr Gly Leu Arg Thr
180 185 190
Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr Ala Val Ala Val
195 200 205
Thr Gly Trp Gln Thr Ile Asn Gly Lys Lys Tyr Tyr Phe Asn Thr Asn
210 215 220
Thr Ser Ile Ala Ser Thr Gly Tyr Thr Ile Ile Ser Gly Lys His Phe
225 230 235 240
Tyr Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro
245 250 255
Asp Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile
260 265 270
Glu Gly Gln Ala Ile Arg Tyr Gln Asn Arg Phe Leu Tyr Leu His Asp
275 280 285
Asn Ile Tyr Tyr Phe Gly Asn Asn Ser Lys Ala Ala Thr Gly Trp Val
290 295 300
Thr Ile Asp Gly Asn Arg Tyr Tyr Phe Glu Pro Asn Thr Ala Met Gly
305 310 315 320
Ala Asn Gly Tyr Lys Thr Ile Asp Asn Lys Asn Phe Tyr Phe Arg Asn
325 330 335
Gly Leu Pro Gln Ile Gly Val Phe Lys Gly Ser Asn Gly Phe Glu Tyr
340 345 350
Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile
355 360 365
Arg Tyr Gln Asn Arg Phe Leu His Leu Leu Gly Lys Ile Tyr Tyr Phe
370 375 380
Gly Asn Asn Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asn Gly Lys
385 390 395 400
Val Tyr Tyr Phe Met Pro Asp Thr Ala Met Ala Ala Ala Gly Gly Leu
405 410 415
Phe Glu Ile Asp Gly Val Ile Tyr Phe Phe Gly Val Asp Gly Val Lys
420 425 430
Ala Pro Gly Ile Tyr Gly
435
<210> 13
<211> 5466
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Трехтоксинная вакцина BV1470
<220>
<221> прочее
<222> (1787)..(1787)
<223> n представляет собой a, c, g или t
<400> 13
atggaaatcg tcaacgaaga catcctgccg aacaacggtt tgatgggcta ctacttcacc 60
gatgagcact tcaaggacct gaagctcatg gctcctatca aggacggaaa cctgaagttc 120
gaggaaaaga aggtcgataa gctgctcgac aaggataaga gcgacgttaa gtcaatcagg 180
tggaccggca gaatcatccc atccaaggat ggagagtaca ctctctctac agaccgtgac 240
gatgtcttga tgcaggtgaa caccgaatcg actatctcca acactctgaa ggtgaacatg 300
aagaagggaa aggagtacaa ggtgcgcatc gaactgcaag ataagaacct cggttctatc 360
gacaacctct cctctccaaa cctctactgg gagttggatg gcatgaagaa gatcatcccg 420
gaggaaaact tgttcctgcg tgactacagc aacatcgaaa aggacgatcc cttcatccct 480
aacaacaact tcttcgatcc caagctgcgc gctcgccgcc gcaagaagcg catgtctgac 540
tgggaggacg aagatctcga caccgataac gacaacatcc ctgacagcta cgagcgcaac 600
ggatacacta tcaaggatct catcgctgtg aagtgggagg actccttcgc cgaacagggt 660
tacaagaagt acgtctcaaa ctacttggag tcgaacacag ctggtgaccc ctacaccgac 720
tacgaaaagg cctccggctc tttcgataag gctatcaaga ccgaggctag ggacccactc 780
gtcgctgctt accccatcgt gggagtcggt atggagaagt tgatcatcag cactaacgaa 840
cacgcttcaa ctgaccaggg caagacagtt tcaagagcca ccactaactc gaagaccgag 900
tccaacactg ctggcgtttc cgtgaacgtc ggctaccaga acggattcac cgccaacgtt 960
acaaccaact actcgcacac tacagataac tccaccgctg tgcaagactc taacggagag 1020
agctggaaca ctggtctgtc tatcaacaag ggcgaaagcg cttacatcaa cgccaacgtc 1080
cgctactaca acactggcac agcccccatg tacaaggtga cccctaccac taacctcgtc 1140
ttggatggag acacactgtc taccatcaag gctcaggaga accaaatcgg aaacaacctc 1200
agccccggtg acacataccc taagaaggga ttgtcaccac tggccctcaa cactatggac 1260
cagttcagct caaggttgat cccgatcaac tacgatcaac tcaagaagtt ggacgctggc 1320
aagcagatca agctggagac aacccaagtc tccggtaact tcggcaccaa gaactcgtcc 1380
ggccagatcg ttactgaagg aaacagctgg tcagattaca tctcacaaat cgactcgatc 1440
tccgcctcta tcatcctgga cacagagaac gaatcctacg agcgtcgcgt gaccgctaag 1500
aacttgcagg accccgagga caagacaccg gaactgacca tcggcgaggc catcgaaaag 1560
gctttcggtg ccaccaagaa ggacggcttg ctgtacttca acgatatccc tatcgacgag 1620
tcctgcgttg aactgatctt cgacgataac actgctaaca agatcaagga ttccctgaag 1680
acactctctg acaagaagat ctacaacgtg aagctcgaga ggggtatgaa catcttgatc 1740
aagaccccca cttacttcac aaacttcgac gattacaaca actaccnttc tacctggagc 1800
aacgtcaaca ctacaaacca ggacggactg caaggttcgg ccaacaagct caacggcgag 1860
accaagatca agatcccaat gagcgaactg aagccgtaca agagatacgt gttctcaggc 1920
tactcgaagg acccactcac tagcaactca atcatcgtga agatcaaggc taaggaggaa 1980
aagaccgact acctggtccc cgagcagggc tacactaagt tctcttacga gttcgaaacc 2040
actgagaagg actctagcaa catcgaaatc accctcatcg gcagcggaac aacctacttg 2100
gacaacctgt caatcaccga gttgaactcg actcccgaaa tcctggacga gcccgaagtc 2160
aagatcccta ccgatcagga gatcatggac gctcacaaga tctacttcgc cgacctgaac 2220
ttcaacccct ctactggaaa cacatacatc aacggcatgt acttcgctcc tacacaaacc 2280
aacaaggagg ccctggacta catccagaag taccgtgtcg aagccactct ccaatactcc 2340
ggtttcaagg atatcggcac aaaggacaag gagatgagga actacttggg tgacccaaac 2400
cagccgaaga ccaactacgt gaacctgaga tcatacttca ctggtggcga gaacatcatg 2460
acatacaaga agctgcgtat ctacgctatc acccctgacg accgtgaact cttggttttg 2520
tccgtggacg ctagcatggt cagcggtctc atctacatca acgactcgtt gtactacttc 2580
aagccccctg tgaacaacct gatcacaggt ttcgttaccg tgggcgacga taagtactac 2640
ttcaacccaa tcaacggtgg cgctgcctcc atcggcgaga ccatcatcga cgataagaac 2700
tactacttca accagagcgg agttctccaa actggtgtgt tctcaacaga ggacggtttc 2760
aagtacttcg ctccggccaa caccttggac gaaaacctgg agggtgaagc catcgacttc 2820
actggcaagt tgatcatcga tgagaacatc tactacttcg acgataacta ccgcggtgct 2880
gtggagtgga aggaactcga cggcgagatg cactacttct ctccagaaac cggcaaggcc 2940
ttcaagggat tgaaccagat cggtgactac aagtactact tcaactcgga tggcgtgatg 3000
caaaagggat tcgtctccat caacgacaac aagcactact tcgacgattc cggtgttatg 3060
aaagtgggct acacagagat cgacggcaag cacttctact tcgctgagaa cggagaaatg 3120
cagatcggtg tcttcaacac tgaagatggt ttcaagtact tcgcccacca caacgaagat 3180
ttgggcaacg aggaaggaga ggaaatcagc tactcaggca tcctgaactt caacaacaag 3240
atctactact tcgatgactc tttcaccgct gtggtcggat ggaaggacct ggaggatggt 3300
agcaagtact acttcgacga ggatactgct gaagcctaca tcggcctgtc gctcatcaac 3360
gacggacagt actacttcaa cgacgatggc atcatgcaag tcggattcgt taccatcaac 3420
gacaaggtgt tctacttctc ggattccggt atcatcgagt ctggcgtcca gaacatcgac 3480
gataactact tctacatcga cgataacgga atcgtgcaaa tcggtgtctt cgacacaagc 3540
gatggctaca agtacttcgc tcccgccaac accgtgaacg acaacatcta cggacaggct 3600
gtggagtact caggcctggt ccgtgttgga gaagacgtgt actacttcgg cgagacctac 3660
actatcgaaa ctggatggat ctacgacatg gagaacgaat ctgacaagta ctacttcaac 3720
cctgagacaa agaaggcctg caagggtatc aacctgatcg acgatatcaa gtactacttc 3780
gatgaaaagg gtatcatgcg caccggcctc atctcattcg aaaacaacaa ctactacttc 3840
aacgagaacg gagaaatgca attcggttac atcaacatcg aggacaagat gttctacttc 3900
ggagaagatg gtgtcatgca gatcggtgtt ttcaacactc cagacggctt caagtacttc 3960
gctcaccaaa acacactcga cgagaacttc gagggagaat ccatcaacta cactggttgg 4020
ttggacctgg atgagaagag gtactacttc accgacgaat acatcgctgc cactggctcc 4080
gtcatcatcg acggagagga atactacttc gacccggata cagcccagct ggtcatctct 4140
gaatctagaa tggtgaccgg tgtcttcaag ggtcccaacg gcttcgagta cttcgctccc 4200
gccaacactc acaacaacaa catcgaaggt caagctatcg tctaccaaaa caagttcttg 4260
accctgaacg gcaagaagta ttattttgac aacgattcta aggccgttac tggctggcaa 4320
acaatcgacg gaaagaagta ttatttcaat ctgaacactg ccgaggctgc caccggttgg 4380
cagactatcg atggcaagaa gtactacttt aacctcaaca ctgccgaagc tgccacagga 4440
tggcaaacca tcgacggcaa gaagtactat tttaacacaa acaccttcat cgcttctact 4500
ggctacacaa gcatcaacgg aaagcatttt tatttcaaca ccgatggaat catgcagatc 4560
ggtgtgttca agggaccaaa cggtttcgaa tacttcgctc cggctaacac agacgctaac 4620
aacatcgagg gccaggctat cttgtaccaa aacaagttcc tcactttgaa cggcaagaag 4680
tactattttg gctctgacag caaggccgtc actggactga ggacaatcga tggcaagaag 4740
tactacttta atactaacac agccgttgct gtgaccggct ggcagactat caacggaaag 4800
aagtattatt tcaataccaa cacttcaatc gcttcgaccg gttacactat catctctggc 4860
aagcattttt attttaacac cgacggcatc atgcaaatcg gtgtcttcaa gggccccgat 4920
ggcttcgaat acttcgcccc cgctaacact gatgctaaca acatcgaggg acaggctatc 4980
cgttaccaaa accgcttcct gtacctccac gacaacatct actacttcgg caacaactca 5040
aaggctgcca caggatgggt gaccatcgat ggtaaccgtt actacttcga gcccaacact 5100
gccatgggtg ctaacggcta caagacaatc gacaacaaga acttctactt ccgcaacggt 5160
ctcccacaga tcggcgtctt caagggatca aacggtttcg agtacttcgc tcctgccaac 5220
accgacgcca acaacatcga gggccaagct atcaggtacc aaaacagatt cctgcacctg 5280
ctcggcaaga tctactactt cggaaacaac tcgaaggccg ttactggttg gcagacaatc 5340
aacggcaagg tgtactactt catgccagac accgctatgg ctgccgctgg tggcctcttc 5400
gaaatcgacg gcgtgatcta cttcttcggc gttgatggag tgaaggctcc gggtatctac 5460
ggctaa 5466
<210> 14
<211> 2529
<212> ДНК
<213> Clostridium difficile
<220>
<221> прочее
<222> (1787)..(1787)
<223> n представляет собой a, c, g или t
<400> 14
atggaaatcg tcaacgaaga catcctgccg aacaacggtt tgatgggcta ctacttcacc 60
gatgagcact tcaaggacct gaagctcatg gctcctatca aggacggaaa cctgaagttc 120
gaggaaaaga aggtcgataa gctgctcgac aaggataaga gcgacgttaa gtcaatcagg 180
tggaccggca gaatcatccc atccaaggat ggagagtaca ctctctctac agaccgtgac 240
gatgtcttga tgcaggtgaa caccgaatcg actatctcca acactctgaa ggtgaacatg 300
aagaagggaa aggagtacaa ggtgcgcatc gaactgcaag ataagaacct cggttctatc 360
gacaacctct cctctccaaa cctctactgg gagttggatg gcatgaagaa gatcatcccg 420
gaggaaaact tgttcctgcg tgactacagc aacatcgaaa aggacgatcc cttcatccct 480
aacaacaact tcttcgatcc caagctgcgc gctcgccgcc gcaagaagcg catgtctgac 540
tgggaggacg aagatctcga caccgataac gacaacatcc ctgacagcta cgagcgcaac 600
ggatacacta tcaaggatct catcgctgtg aagtgggagg actccttcgc cgaacagggt 660
tacaagaagt acgtctcaaa ctacttggag tcgaacacag ctggtgaccc ctacaccgac 720
tacgaaaagg cctccggctc tttcgataag gctatcaaga ccgaggctag ggacccactc 780
gtcgctgctt accccatcgt gggagtcggt atggagaagt tgatcatcag cactaacgaa 840
cacgcttcaa ctgaccaggg caagacagtt tcaagagcca ccactaactc gaagaccgag 900
tccaacactg ctggcgtttc cgtgaacgtc ggctaccaga acggattcac cgccaacgtt 960
acaaccaact actcgcacac tacagataac tccaccgctg tgcaagactc taacggagag 1020
agctggaaca ctggtctgtc tatcaacaag ggcgaaagcg cttacatcaa cgccaacgtc 1080
cgctactaca acactggcac agcccccatg tacaaggtga cccctaccac taacctcgtc 1140
ttggatggag acacactgtc taccatcaag gctcaggaga accaaatcgg aaacaacctc 1200
agccccggtg acacataccc taagaaggga ttgtcaccac tggccctcaa cactatggac 1260
cagttcagct caaggttgat cccgatcaac tacgatcaac tcaagaagtt ggacgctggc 1320
aagcagatca agctggagac aacccaagtc tccggtaact tcggcaccaa gaactcgtcc 1380
ggccagatcg ttactgaagg aaacagctgg tcagattaca tctcacaaat cgactcgatc 1440
tccgcctcta tcatcctgga cacagagaac gaatcctacg agcgtcgcgt gaccgctaag 1500
aacttgcagg accccgagga caagacaccg gaactgacca tcggcgaggc catcgaaaag 1560
gctttcggtg ccaccaagaa ggacggcttg ctgtacttca acgatatccc tatcgacgag 1620
tcctgcgttg aactgatctt cgacgataac actgctaaca agatcaagga ttccctgaag 1680
acactctctg acaagaagat ctacaacgtg aagctcgaga ggggtatgaa catcttgatc 1740
aagaccccca cttacttcac aaacttcgac gattacaaca actaccnttc tacctggagc 1800
aacgtcaaca ctacaaacca ggacggactg caaggttcgg ccaacaagct caacggcgag 1860
accaagatca agatcccaat gagcgaactg aagccgtaca agagatacgt gttctcaggc 1920
tactcgaagg acccactcac tagcaactca atcatcgtga agatcaaggc taaggaggaa 1980
aagaccgact acctggtccc cgagcagggc tacactaagt tctcttacga gttcgaaacc 2040
actgagaagg actctagcaa catcgaaatc accctcatcg gcagcggaac aacctacttg 2100
gacaacctgt caatcaccga gttgaactcg actcccgaaa tcctggacga gcccgaagtc 2160
aagatcccta ccgatcagga gatcatggac gctcacaaga tctacttcgc cgacctgaac 2220
ttcaacccct ctactggaaa cacatacatc aacggcatgt acttcgctcc tacacaaacc 2280
aacaaggagg ccctggacta catccagaag taccgtgtcg aagccactct ccaatactcc 2340
ggtttcaagg atatcggcac aaaggacaag gagatgagga actacttggg tgacccaaac 2400
cagccgaaga ccaactacgt gaacctgaga tcatacttca ctggtggcga gaacatcatg 2460
acatacaaga agctgcgtat ctacgctatc acccctgacg accgtgaact cttggttttg 2520
tccgtggac 2529
<210> 15
<211> 1608
<212> ДНК
<213> Clostridium difficile
<400> 15
atggtcagcg gtctcatcta catcaacgac tcgttgtact acttcaagcc ccctgtgaac 60
aacctgatca caggtttcgt taccgtgggc gacgataagt actacttcaa cccaatcaac 120
ggtggcgctg cctccatcgg cgagaccatc atcgacgata agaactacta cttcaaccag 180
agcggagttc tccaaactgg tgtgttctca acagaggacg gtttcaagta cttcgctccg 240
gccaacacct tggacgaaaa cctggagggt gaagccatcg acttcactgg caagttgatc 300
atcgatgaga acatctacta cttcgacgat aactaccgcg gtgctgtgga gtggaaggaa 360
ctcgacggcg agatgcacta cttctctcca gaaaccggca aggccttcaa gggattgaac 420
cagatcggtg actacaagta ctacttcaac tcggatggcg tgatgcaaaa gggattcgtc 480
tccatcaacg acaacaagca ctacttcgac gattccggtg ttatgaaagt gggctacaca 540
gagatcgacg gcaagcactt ctacttcgct gagaacggag aaatgcagat cggtgtcttc 600
aacactgaag atggtttcaa gtacttcgcc caccacaacg aagatttggg caacgaggaa 660
ggagaggaaa tcagctactc aggcatcctg aacttcaaca acaagatcta ctacttcgat 720
gactctttca ccgctgtggt cggatggaag gacctggagg atggtagcaa gtactacttc 780
gacgaggata ctgctgaagc ctacatcggc ctgtcgctca tcaacgacgg acagtactac 840
ttcaacgacg atggcatcat gcaagtcgga ttcgttacca tcaacgacaa ggtgttctac 900
ttctcggatt ccggtatcat cgagtctggc gtccagaaca tcgacgataa ctacttctac 960
atcgacgata acggaatcgt gcaaatcggt gtcttcgaca caagcgatgg ctacaagtac 1020
ttcgctcccg ccaacaccgt gaacgacaac atctacggac aggctgtgga gtactcaggc 1080
ctggtccgtg ttggagaaga cgtgtactac ttcggcgaga cctacactat cgaaactgga 1140
tggatctacg acatggagaa cgaatctgac aagtactact tcaaccctga gacaaagaag 1200
gcctgcaagg gtatcaacct gatcgacgat atcaagtact acttcgatga aaagggtatc 1260
atgcgcaccg gcctcatctc attcgaaaac aacaactact acttcaacga gaacggagaa 1320
atgcaattcg gttacatcaa catcgaggac aagatgttct acttcggaga agatggtgtc 1380
atgcagatcg gtgttttcaa cactccagac ggcttcaagt acttcgctca ccaaaacaca 1440
ctcgacgaga acttcgaggg agaatccatc aactacactg gttggttgga cctggatgag 1500
aagaggtact acttcaccga cgaatacatc gctgccactg gctccgtcat catcgacgga 1560
gaggaatact acttcgaccc ggatacagcc cagctggtca tctctgaa 1608
<210> 16
<211> 1317
<212> ДНК
<213> Clostridium difficile
<400> 16
atggtgaccg gtgtcttcaa gggtcccaac ggcttcgagt acttcgctcc cgccaacact 60
cacaacaaca acatcgaagg tcaagctatc gtctaccaaa acaagttctt gaccctgaac 120
ggcaagaagt attattttga caacgattct aaggccgtta ctggctggca aacaatcgac 180
ggaaagaagt attatttcaa tctgaacact gccgaggctg ccaccggttg gcagactatc 240
gatggcaaga agtactactt taacctcaac actgccgaag ctgccacagg atggcaaacc 300
atcgacggca agaagtacta ttttaacaca aacaccttca tcgcttctac tggctacaca 360
agcatcaacg gaaagcattt ttatttcaac accgatggaa tcatgcagat cggtgtgttc 420
aagggaccaa acggtttcga atacttcgct ccggctaaca cagacgctaa caacatcgag 480
ggccaggcta tcttgtacca aaacaagttc ctcactttga acggcaagaa gtactatttt 540
ggctctgaca gcaaggccgt cactggactg aggacaatcg atggcaagaa gtactacttt 600
aatactaaca cagccgttgc tgtgaccggc tggcagacta tcaacggaaa gaagtattat 660
ttcaatacca acacttcaat cgcttcgacc ggttacacta tcatctctgg caagcatttt 720
tattttaaca ccgacggcat catgcaaatc ggtgtcttca agggccccga tggcttcgaa 780
tacttcgccc ccgctaacac tgatgctaac aacatcgagg gacaggctat ccgttaccaa 840
aaccgcttcc tgtacctcca cgacaacatc tactacttcg gcaacaactc aaaggctgcc 900
acaggatggg tgaccatcga tggtaaccgt tactacttcg agcccaacac tgccatgggt 960
gctaacggct acaagacaat cgacaacaag aacttctact tccgcaacgg tctcccacag 1020
atcggcgtct tcaagggatc aaacggtttc gagtacttcg ctcctgccaa caccgacgcc 1080
aacaacatcg agggccaagc tatcaggtac caaaacagat tcctgcacct gctcggcaag 1140
atctactact tcggaaacaa ctcgaaggcc gttactggtt ggcagacaat caacggcaag 1200
gtgtactact tcatgccaga caccgctatg gctgccgctg gtggcctctt cgaaatcgac 1260
ggcgtgatct acttcttcgg cgttgatgga gtgaaggctc cgggtatcta cggctaa 1317
<210> 17
<211> 2307
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Трехтоксинная вакцина BV1512
<220>
<221> прочее
<222> (588)..(588)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 17
Met Glu Ile Val Asn Glu Asp Ile Leu Pro Asn Asn Gly Leu Met Gly
1 5 10 15
Tyr Tyr Phe Thr Asp Glu His Phe Lys Asp Leu Lys Leu Met Ala Pro
20 25 30
Ile Lys Asp Gly Asn Leu Lys Phe Glu Glu Lys Lys Val Asp Lys Leu
35 40 45
Leu Asp Lys Asp Lys Ser Asp Val Lys Ser Ile Arg Trp Thr Gly Arg
50 55 60
Ile Ile Pro Ser Lys Asp Gly Glu Tyr Thr Leu Ser Thr Asp Arg Asp
65 70 75 80
Asp Val Leu Met Gln Val Asn Thr Glu Ser Thr Ile Ser Asn Thr Leu
85 90 95
Lys Val Asn Met Lys Lys Gly Lys Glu Tyr Lys Val Arg Ile Glu Leu
100 105 110
Gln Asp Lys Asn Leu Gly Ser Ile Asp Asn Leu Ser Ser Pro Asn Leu
115 120 125
Tyr Trp Glu Leu Asp Gly Met Lys Lys Ile Ile Pro Glu Glu Asn Leu
130 135 140
Phe Leu Arg Asp Tyr Ser Asn Ile Glu Lys Asp Asp Pro Phe Ile Pro
145 150 155 160
Asn Asn Asn Phe Phe Asp Pro Lys Leu Met Ser Asp Trp Glu Asp Glu
165 170 175
Asp Leu Asp Thr Asp Asn Asp Asn Ile Pro Asp Ser Tyr Glu Arg Asn
180 185 190
Gly Tyr Thr Ile Lys Asp Leu Ile Ala Val Lys Trp Glu Asp Ser Phe
195 200 205
Ala Glu Gln Gly Tyr Lys Lys Tyr Val Ser Asn Tyr Leu Glu Ser Asn
210 215 220
Thr Ala Gly Asp Pro Tyr Thr Asp Tyr Glu Lys Ala Ser Gly Ser Phe
225 230 235 240
Asp Lys Ala Ile Lys Thr Glu Ala Arg Asp Pro Leu Val Ala Ala Tyr
245 250 255
Pro Ile Val Gly Val Gly Met Glu Lys Leu Ile Ile Ser Thr Asn Glu
260 265 270
His Ala Ser Thr Asp Gln Gly Lys Thr Val Ser Arg Ala Thr Thr Asn
275 280 285
Ser Lys Thr Glu Ser Asn Thr Ala Gly Val Ser Val Asn Val Gly Tyr
290 295 300
Gln Asn Gly Phe Thr Ala Asn Val Thr Thr Asn Tyr Ser His Thr Thr
305 310 315 320
Asp Asn Ser Thr Ala Val Gln Asp Ser Asn Gly Glu Ser Trp Asn Thr
325 330 335
Gly Leu Ser Ile Asn Lys Gly Glu Ser Ala Tyr Ile Asn Ala Asn Val
340 345 350
Arg Tyr Tyr Asn Thr Gly Thr Ala Pro Met Tyr Lys Val Thr Pro Thr
355 360 365
Thr Asn Leu Val Leu Asp Gly Asp Thr Leu Ser Thr Ile Lys Ala Gln
370 375 380
Glu Asn Gln Ile Gly Asn Asn Leu Ser Pro Gly Asp Thr Tyr Pro Lys
385 390 395 400
Lys Gly Leu Ser Pro Leu Ala Leu Asn Thr Met Asp Gln Phe Ser Ser
405 410 415
Arg Leu Ile Pro Ile Asn Tyr Asp Gln Leu Lys Lys Leu Asp Ala Gly
420 425 430
Lys Gln Ile Lys Leu Glu Thr Thr Gln Val Ser Gly Asn Phe Gly Thr
435 440 445
Lys Asn Ser Ser Gly Gln Ile Val Thr Glu Gly Asn Ser Trp Ser Asp
450 455 460
Tyr Ile Ser Gln Ile Asp Ser Ile Ser Ala Ser Ile Ile Leu Asp Thr
465 470 475 480
Glu Asn Glu Ser Tyr Glu Arg Arg Val Thr Ala Lys Asn Leu Gln Asp
485 490 495
Pro Glu Asp Lys Thr Pro Glu Leu Thr Ile Gly Glu Ala Ile Glu Lys
500 505 510
Ala Phe Gly Ala Thr Lys Lys Asp Gly Leu Leu Tyr Phe Asn Asp Ile
515 520 525
Pro Ile Asp Glu Ser Cys Val Glu Leu Ile Phe Asp Asp Asn Thr Ala
530 535 540
Asn Lys Ile Lys Asp Ser Leu Lys Thr Leu Ser Asp Lys Lys Ile Tyr
545 550 555 560
Asn Val Lys Leu Glu Arg Gly Met Asn Ile Leu Ile Lys Thr Pro Thr
565 570 575
Tyr Phe Thr Asn Phe Asp Asp Tyr Asn Asn Tyr Xaa Ser Thr Trp Ser
580 585 590
Asn Val Asn Thr Thr Asn Gln Asp Gly Leu Gln Gly Ser Ala Asn Lys
595 600 605
Leu Asn Gly Glu Thr Lys Ile Lys Ile Pro Met Ser Glu Leu Lys Pro
610 615 620
Tyr Lys Arg Tyr Val Phe Ser Gly Tyr Ser Lys Asp Pro Leu Thr Ser
625 630 635 640
Asn Ser Ile Ile Val Lys Ile Lys Ala Lys Glu Glu Lys Thr Asp Tyr
645 650 655
Leu Val Pro Glu Gln Gly Tyr Thr Lys Phe Ser Tyr Glu Phe Glu Thr
660 665 670
Thr Glu Lys Asp Ser Ser Asn Ile Glu Ile Thr Leu Ile Gly Ser Gly
675 680 685
Thr Thr Tyr Leu Asp Asn Leu Ser Ile Thr Glu Leu Asn Ser Thr Pro
690 695 700
Glu Ile Leu Asp Glu Pro Glu Val Lys Ile Pro Thr Asp Gln Glu Ile
705 710 715 720
Met Asp Ala His Lys Ile Tyr Phe Ala Asp Leu Asn Phe Asn Pro Ser
725 730 735
Thr Gly Asn Thr Tyr Ile Asn Gly Met Tyr Phe Ala Pro Thr Gln Thr
740 745 750
Asn Lys Glu Ala Leu Asp Tyr Ile Gln Lys Tyr Arg Val Glu Ala Thr
755 760 765
Leu Gln Tyr Ser Gly Phe Lys Asp Ile Gly Thr Lys Asp Lys Glu Met
770 775 780
Arg Asn Tyr Leu Gly Asp Pro Asn Gln Pro Lys Thr Asn Tyr Val Asn
785 790 795 800
Leu Arg Ser Tyr Phe Thr Gly Gly Glu Asn Ile Met Thr Tyr Lys Lys
805 810 815
Leu Arg Ile Tyr Ala Ile Thr Pro Asp Asp Arg Glu Leu Leu Val Leu
820 825 830
Ser Val Asp Ala Ser Met Gln Glu Ile Arg Asn Asn Ser Asn Ser Ser
835 840 845
Asp Ile Glu Leu Glu Glu Lys Val Met Leu Thr Glu Cys Glu Ile Asn
850 855 860
Val Ile Ser Asn Ile Asp Thr Gln Ile Val Glu Glu Arg Ile Glu Glu
865 870 875 880
Ala Lys Asn Leu Thr Ser Asp Ser Ile Asn Tyr Ile Lys Asp Glu Phe
885 890 895
Lys Leu Ile Glu Ser Ile Ser Asp Ala Leu Cys Asp Leu Lys Gln Gln
900 905 910
Asn Glu Leu Glu Asp Ser His Phe Ile Ser Phe Glu Asp Ile Ser Glu
915 920 925
Thr Asp Glu Gly Phe Ser Ile Arg Phe Ile Asn Lys Glu Thr Gly Glu
930 935 940
Ser Ile Phe Val Glu Thr Glu Lys Thr Ile Phe Ser Glu Tyr Ala Asn
945 950 955 960
His Ile Thr Glu Glu Ile Ser Lys Ile Lys Gly Thr Ile Phe Asp Thr
965 970 975
Val Asn Gly Lys Leu Val Lys Lys Val Asn Leu Asp Thr Thr His Glu
980 985 990
Val Asn Thr Leu Asn Ala Ala Phe Phe Ile Gln Ser Leu Ile Glu Tyr
995 1000 1005
Asn Ser Ser Lys Glu Ser Leu Ser Asn Leu Ser Val Ala Met Lys
1010 1015 1020
Val Gln Val Tyr Ala Gln Leu Phe Ser Thr Gly Leu Asn Thr Ile
1025 1030 1035
Thr Asp Ala Ala Lys Val Val Glu Leu Val Ser Thr Ala Leu Asp
1040 1045 1050
Glu Thr Ile Asp Leu Leu Pro Thr Leu Ser Glu Gly Leu Pro Ile
1055 1060 1065
Ile Ala Thr Ile Ile Asp Gly Val Ser Leu Gly Ala Ala Ile Lys
1070 1075 1080
Glu Leu Ser Glu Thr Ser Asp Pro Leu Leu Arg Gln Glu Ile Glu
1085 1090 1095
Ala Lys Ile Gly Ile Met Ala Val Asn Leu Thr Thr Ala Thr Thr
1100 1105 1110
Ala Ile Ile Thr Ser Ser Leu Gly Ile Ala Ser Gly Phe Ser Ile
1115 1120 1125
Leu Leu Val Pro Leu Ala Gly Ile Ser Ala Gly Ile Pro Ser Leu
1130 1135 1140
Val Asn Asn Glu Leu Val Leu Arg Asp Lys Ala Thr Lys Val Val
1145 1150 1155
Asp Tyr Phe Lys His Val Ser Leu Val Glu Thr Glu Gly Val Phe
1160 1165 1170
Thr Leu Leu Asp Asp Lys Ile Met Met Pro Gln Asp Asp Leu Val
1175 1180 1185
Ile Ser Glu Ile Asp Phe Asn Asn Asn Ser Ile Val Leu Gly Lys
1190 1195 1200
Cys Glu Ile Trp Arg Met Glu Gly Gly Ser Gly His Thr Val Thr
1205 1210 1215
Asp Asp Ile Asp His Phe Phe Ser Ala Pro Ser Ile Thr Tyr Arg
1220 1225 1230
Glu Pro His Leu Ser Ile Tyr Asp Val Leu Glu Val Gln Lys Glu
1235 1240 1245
Glu Leu Asp Leu Ser Lys Asp Leu Met Val Leu Pro Asn Ala Pro
1250 1255 1260
Asn Arg Val Phe Ala Trp Glu Thr Gly Trp Thr Pro Gly Leu Arg
1265 1270 1275
Ser Leu Glu Asn Asp Gly Thr Lys Leu Leu Asp Arg Ile Arg Asp
1280 1285 1290
Asn Tyr Glu Gly Glu Phe Tyr Trp Arg Tyr Phe Ala Phe Ile Ala
1295 1300 1305
Asp Ala Leu Ile Thr Thr Leu Lys Pro Arg Tyr Glu Asp Thr Asn
1310 1315 1320
Ile Arg Ile Asn Leu Asp Ser Asn Thr Arg Ser Phe Ile Val Pro
1325 1330 1335
Ile Ile Thr Thr Glu Tyr Ile Arg Glu Lys Leu Ser Tyr Ser Phe
1340 1345 1350
Tyr Gly Ser Gly Gly Thr Tyr Ala Leu Ser Leu Ser Gln Tyr Asn
1355 1360 1365
Met Gly Ile Asn Ile Glu Leu Ser Glu Ser Asp Val Trp Ile Ile
1370 1375 1380
Asp Val Asp Asn Val Val Arg Asp Val Thr Ile Glu Ser Asp Lys
1385 1390 1395
Ile Lys Lys Gly Asp Leu Ile Glu Gly Ile Leu Ser Thr Leu Ser
1400 1405 1410
Ile Glu Glu Asn Lys Ile Ile Leu Asn Ser His Glu Ile Asn Phe
1415 1420 1425
Ser Gly Glu Val Asn Gly Ser Asn Gly Phe Val Ser Leu Thr Phe
1430 1435 1440
Ser Ile Leu Glu Gly Ile Asn Ala Ile Ile Glu Val Asp Leu Leu
1445 1450 1455
Ser Lys Ser Tyr Lys Leu Leu Ile Ser Gly Glu Leu Lys Ile Leu
1460 1465 1470
Met Leu Asn Ser Asn His Ile Gln Gln Lys Ile Asp Tyr Ile Gly
1475 1480 1485
Phe Asn Ser Glu Leu Gln Lys Asn Ile Pro Tyr Ser Phe Val Asp
1490 1495 1500
Ser Glu Gly Lys Glu Asn Gly Phe Ile Asn Gly Ser Thr Lys Glu
1505 1510 1515
Gly Leu Phe Val Ser Glu Leu Pro Asp Val Val Leu Ile Ser Lys
1520 1525 1530
Val Tyr Met Asp Asp Ser Lys Pro Ser Phe Gly Tyr Tyr Ser Asn
1535 1540 1545
Asn Leu Lys Asp Val Lys Val Ile Thr Lys Asp Asn Val Asn Ile
1550 1555 1560
Leu Thr Gly Tyr Tyr Leu Lys Asp Asp Ile Lys Ile Ser Leu Ser
1565 1570 1575
Leu Thr Leu Gln Asp Glu Lys Thr Ile Lys Leu Asn Ser Val His
1580 1585 1590
Leu Asp Glu Ser Gly Val Ala Glu Ile Leu Lys Phe Met Asn Arg
1595 1600 1605
Lys Gly Asn Thr Asn Thr Ser Asp Ser Leu Met Ser Phe Leu Glu
1610 1615 1620
Ser Met Asn Ile Lys Ser Ile Phe Val Asn Phe Leu Gln Ser Asn
1625 1630 1635
Ile Lys Phe Ile Leu Asp Ala Asn Phe Ile Ile Ser Gly Thr Thr
1640 1645 1650
Ser Ile Gly Gln Phe Glu Phe Ile Cys Asp Glu Asn Asp Asn Ile
1655 1660 1665
Gln Pro Tyr Phe Ile Lys Phe Asn Thr Leu Glu Thr Asn Tyr Thr
1670 1675 1680
Leu Tyr Val Gly Asn Arg Gln Asn Met Ile Val Glu Pro Asn Tyr
1685 1690 1695
Asp Leu Asp Asp Ser Gly Asp Ile Ser Ser Thr Val Ile Asn Phe
1700 1705 1710
Ser Gln Lys Tyr Leu Tyr Gly Ile Asp Ser Cys Val Asn Lys Val
1715 1720 1725
Val Ile Ser Pro Asn Ile Tyr Thr Asp Glu Ile Asn Ile Thr Pro
1730 1735 1740
Val Tyr Glu Thr Asn Asn Thr Tyr Pro Glu Val Ile Val Leu Asp
1745 1750 1755
Ala Asn Tyr Ile Asn Glu Lys Ile Asn Val Asn Ile Asn Asp Leu
1760 1765 1770
Ser Ile Arg Tyr Val Trp Ser Asn Asp Gly Asn Asp Phe Ile Leu
1775 1780 1785
Met Ser Thr Ser Glu Glu Asn Lys Val Ser Gln Val Lys Ile Arg
1790 1795 1800
Phe Val Asn Val Phe Lys Asp Lys Thr Leu Ala Asn Lys Leu Ser
1805 1810 1815
Phe Asn Phe Ser Asp Lys Gln Asp Val Pro Val Ser Glu Ile Ile
1820 1825 1830
Leu Ser Phe Thr Pro Ser Tyr Tyr Glu Asp Gly Leu Ile Gly Tyr
1835 1840 1845
Asp Leu Gly Leu Val Ser Leu Tyr Asn Glu Lys Phe Tyr Ile Asn
1850 1855 1860
Asn Phe Gly Met Ser Arg Met Val Thr Gly Val Phe Lys Gly Pro
1865 1870 1875
Asn Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr His Asn Asn Asn
1880 1885 1890
Ile Glu Gly Gln Ala Ile Val Tyr Gln Asn Lys Phe Leu Thr Leu
1895 1900 1905
Asn Gly Lys Lys Tyr Tyr Phe Asp Asn Asp Ser Lys Ala Val Thr
1910 1915 1920
Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Leu Asn
1925 1930 1935
Thr Ala Glu Ala Ala Thr Gly Trp Gln Thr Ile Asp Gly Lys Lys
1940 1945 1950
Tyr Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr Gly Trp Gln
1955 1960 1965
Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr Phe Ile
1970 1975 1980
Ala Ser Thr Gly Tyr Thr Ser Ile Asn Gly Lys His Phe Tyr Phe
1985 1990 1995
Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro Asn
2000 2005 2010
Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile
2015 2020 2025
Glu Gly Gln Ala Ile Leu Tyr Gln Asn Lys Phe Leu Thr Leu Asn
2030 2035 2040
Gly Lys Lys Tyr Tyr Phe Gly Ser Asp Ser Lys Ala Val Thr Gly
2045 2050 2055
Leu Arg Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr
2060 2065 2070
Ala Val Ala Val Thr Gly Trp Gln Thr Ile Asn Gly Lys Lys Tyr
2075 2080 2085
Tyr Phe Asn Thr Asn Thr Ser Ile Ala Ser Thr Gly Tyr Thr Ile
2090 2095 2100
Ile Ser Gly Lys His Phe Tyr Phe Asn Thr Asp Gly Ile Met Gln
2105 2110 2115
Ile Gly Val Phe Lys Gly Pro Asp Gly Phe Glu Tyr Phe Ala Pro
2120 2125 2130
Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile Arg Tyr
2135 2140 2145
Gln Asn Arg Phe Leu Tyr Leu His Asp Asn Ile Tyr Tyr Phe Gly
2150 2155 2160
Asn Asn Ser Lys Ala Ala Thr Gly Trp Val Thr Ile Asp Gly Asn
2165 2170 2175
Arg Tyr Tyr Phe Glu Pro Asn Thr Ala Met Gly Ala Asn Gly Tyr
2180 2185 2190
Lys Thr Ile Asp Asn Lys Asn Phe Tyr Phe Arg Asn Gly Leu Pro
2195 2200 2205
Gln Ile Gly Val Phe Lys Gly Ser Asn Gly Phe Glu Tyr Phe Ala
2210 2215 2220
Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile Arg
2225 2230 2235
Tyr Gln Asn Arg Phe Leu His Leu Leu Gly Lys Ile Tyr Tyr Phe
2240 2245 2250
Gly Asn Asn Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asn Gly
2255 2260 2265
Lys Val Tyr Tyr Phe Met Pro Asp Thr Ala Met Ala Ala Ala Gly
2270 2275 2280
Gly Leu Phe Glu Ile Asp Gly Val Ile Tyr Phe Phe Gly Val Asp
2285 2290 2295
Gly Val Lys Ala Pro Gly Ile Tyr Gly
2300 2305
<210> 18
<211> 835
<212> БЕЛОК
<213> Clostridium difficile
<220>
<221> прочее
<222> (588)..(588)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 18
Met Glu Ile Val Asn Glu Asp Ile Leu Pro Asn Asn Gly Leu Met Gly
1 5 10 15
Tyr Tyr Phe Thr Asp Glu His Phe Lys Asp Leu Lys Leu Met Ala Pro
20 25 30
Ile Lys Asp Gly Asn Leu Lys Phe Glu Glu Lys Lys Val Asp Lys Leu
35 40 45
Leu Asp Lys Asp Lys Ser Asp Val Lys Ser Ile Arg Trp Thr Gly Arg
50 55 60
Ile Ile Pro Ser Lys Asp Gly Glu Tyr Thr Leu Ser Thr Asp Arg Asp
65 70 75 80
Asp Val Leu Met Gln Val Asn Thr Glu Ser Thr Ile Ser Asn Thr Leu
85 90 95
Lys Val Asn Met Lys Lys Gly Lys Glu Tyr Lys Val Arg Ile Glu Leu
100 105 110
Gln Asp Lys Asn Leu Gly Ser Ile Asp Asn Leu Ser Ser Pro Asn Leu
115 120 125
Tyr Trp Glu Leu Asp Gly Met Lys Lys Ile Ile Pro Glu Glu Asn Leu
130 135 140
Phe Leu Arg Asp Tyr Ser Asn Ile Glu Lys Asp Asp Pro Phe Ile Pro
145 150 155 160
Asn Asn Asn Phe Phe Asp Pro Lys Leu Met Ser Asp Trp Glu Asp Glu
165 170 175
Asp Leu Asp Thr Asp Asn Asp Asn Ile Pro Asp Ser Tyr Glu Arg Asn
180 185 190
Gly Tyr Thr Ile Lys Asp Leu Ile Ala Val Lys Trp Glu Asp Ser Phe
195 200 205
Ala Glu Gln Gly Tyr Lys Lys Tyr Val Ser Asn Tyr Leu Glu Ser Asn
210 215 220
Thr Ala Gly Asp Pro Tyr Thr Asp Tyr Glu Lys Ala Ser Gly Ser Phe
225 230 235 240
Asp Lys Ala Ile Lys Thr Glu Ala Arg Asp Pro Leu Val Ala Ala Tyr
245 250 255
Pro Ile Val Gly Val Gly Met Glu Lys Leu Ile Ile Ser Thr Asn Glu
260 265 270
His Ala Ser Thr Asp Gln Gly Lys Thr Val Ser Arg Ala Thr Thr Asn
275 280 285
Ser Lys Thr Glu Ser Asn Thr Ala Gly Val Ser Val Asn Val Gly Tyr
290 295 300
Gln Asn Gly Phe Thr Ala Asn Val Thr Thr Asn Tyr Ser His Thr Thr
305 310 315 320
Asp Asn Ser Thr Ala Val Gln Asp Ser Asn Gly Glu Ser Trp Asn Thr
325 330 335
Gly Leu Ser Ile Asn Lys Gly Glu Ser Ala Tyr Ile Asn Ala Asn Val
340 345 350
Arg Tyr Tyr Asn Thr Gly Thr Ala Pro Met Tyr Lys Val Thr Pro Thr
355 360 365
Thr Asn Leu Val Leu Asp Gly Asp Thr Leu Ser Thr Ile Lys Ala Gln
370 375 380
Glu Asn Gln Ile Gly Asn Asn Leu Ser Pro Gly Asp Thr Tyr Pro Lys
385 390 395 400
Lys Gly Leu Ser Pro Leu Ala Leu Asn Thr Met Asp Gln Phe Ser Ser
405 410 415
Arg Leu Ile Pro Ile Asn Tyr Asp Gln Leu Lys Lys Leu Asp Ala Gly
420 425 430
Lys Gln Ile Lys Leu Glu Thr Thr Gln Val Ser Gly Asn Phe Gly Thr
435 440 445
Lys Asn Ser Ser Gly Gln Ile Val Thr Glu Gly Asn Ser Trp Ser Asp
450 455 460
Tyr Ile Ser Gln Ile Asp Ser Ile Ser Ala Ser Ile Ile Leu Asp Thr
465 470 475 480
Glu Asn Glu Ser Tyr Glu Arg Arg Val Thr Ala Lys Asn Leu Gln Asp
485 490 495
Pro Glu Asp Lys Thr Pro Glu Leu Thr Ile Gly Glu Ala Ile Glu Lys
500 505 510
Ala Phe Gly Ala Thr Lys Lys Asp Gly Leu Leu Tyr Phe Asn Asp Ile
515 520 525
Pro Ile Asp Glu Ser Cys Val Glu Leu Ile Phe Asp Asp Asn Thr Ala
530 535 540
Asn Lys Ile Lys Asp Ser Leu Lys Thr Leu Ser Asp Lys Lys Ile Tyr
545 550 555 560
Asn Val Lys Leu Glu Arg Gly Met Asn Ile Leu Ile Lys Thr Pro Thr
565 570 575
Tyr Phe Thr Asn Phe Asp Asp Tyr Asn Asn Tyr Xaa Ser Thr Trp Ser
580 585 590
Asn Val Asn Thr Thr Asn Gln Asp Gly Leu Gln Gly Ser Ala Asn Lys
595 600 605
Leu Asn Gly Glu Thr Lys Ile Lys Ile Pro Met Ser Glu Leu Lys Pro
610 615 620
Tyr Lys Arg Tyr Val Phe Ser Gly Tyr Ser Lys Asp Pro Leu Thr Ser
625 630 635 640
Asn Ser Ile Ile Val Lys Ile Lys Ala Lys Glu Glu Lys Thr Asp Tyr
645 650 655
Leu Val Pro Glu Gln Gly Tyr Thr Lys Phe Ser Tyr Glu Phe Glu Thr
660 665 670
Thr Glu Lys Asp Ser Ser Asn Ile Glu Ile Thr Leu Ile Gly Ser Gly
675 680 685
Thr Thr Tyr Leu Asp Asn Leu Ser Ile Thr Glu Leu Asn Ser Thr Pro
690 695 700
Glu Ile Leu Asp Glu Pro Glu Val Lys Ile Pro Thr Asp Gln Glu Ile
705 710 715 720
Met Asp Ala His Lys Ile Tyr Phe Ala Asp Leu Asn Phe Asn Pro Ser
725 730 735
Thr Gly Asn Thr Tyr Ile Asn Gly Met Tyr Phe Ala Pro Thr Gln Thr
740 745 750
Asn Lys Glu Ala Leu Asp Tyr Ile Gln Lys Tyr Arg Val Glu Ala Thr
755 760 765
Leu Gln Tyr Ser Gly Phe Lys Asp Ile Gly Thr Lys Asp Lys Glu Met
770 775 780
Arg Asn Tyr Leu Gly Asp Pro Asn Gln Pro Lys Thr Asn Tyr Val Asn
785 790 795 800
Leu Arg Ser Tyr Phe Thr Gly Gly Glu Asn Ile Met Thr Tyr Lys Lys
805 810 815
Leu Arg Ile Tyr Ala Ile Thr Pro Asp Asp Arg Glu Leu Leu Val Leu
820 825 830
Ser Val Asp
835
<210> 19
<211> 1030
<212> БЕЛОК
<213> Clostridium difficile
<400> 19
Met Gln Glu Ile Arg Asn Asn Ser Asn Ser Ser Asp Ile Glu Leu Glu
1 5 10 15
Glu Lys Val Met Leu Thr Glu Cys Glu Ile Asn Val Ile Ser Asn Ile
20 25 30
Asp Thr Gln Ile Val Glu Glu Arg Ile Glu Glu Ala Lys Asn Leu Thr
35 40 45
Ser Asp Ser Ile Asn Tyr Ile Lys Asp Glu Phe Lys Leu Ile Glu Ser
50 55 60
Ile Ser Asp Ala Leu Cys Asp Leu Lys Gln Gln Asn Glu Leu Glu Asp
65 70 75 80
Ser His Phe Ile Ser Phe Glu Asp Ile Ser Glu Thr Asp Glu Gly Phe
85 90 95
Ser Ile Arg Phe Ile Asn Lys Glu Thr Gly Glu Ser Ile Phe Val Glu
100 105 110
Thr Glu Lys Thr Ile Phe Ser Glu Tyr Ala Asn His Ile Thr Glu Glu
115 120 125
Ile Ser Lys Ile Lys Gly Thr Ile Phe Asp Thr Val Asn Gly Lys Leu
130 135 140
Val Lys Lys Val Asn Leu Asp Thr Thr His Glu Val Asn Thr Leu Asn
145 150 155 160
Ala Ala Phe Phe Ile Gln Ser Leu Ile Glu Tyr Asn Ser Ser Lys Glu
165 170 175
Ser Leu Ser Asn Leu Ser Val Ala Met Lys Val Gln Val Tyr Ala Gln
180 185 190
Leu Phe Ser Thr Gly Leu Asn Thr Ile Thr Asp Ala Ala Lys Val Val
195 200 205
Glu Leu Val Ser Thr Ala Leu Asp Glu Thr Ile Asp Leu Leu Pro Thr
210 215 220
Leu Ser Glu Gly Leu Pro Ile Ile Ala Thr Ile Ile Asp Gly Val Ser
225 230 235 240
Leu Gly Ala Ala Ile Lys Glu Leu Ser Glu Thr Ser Asp Pro Leu Leu
245 250 255
Arg Gln Glu Ile Glu Ala Lys Ile Gly Ile Met Ala Val Asn Leu Thr
260 265 270
Thr Ala Thr Thr Ala Ile Ile Thr Ser Ser Leu Gly Ile Ala Ser Gly
275 280 285
Phe Ser Ile Leu Leu Val Pro Leu Ala Gly Ile Ser Ala Gly Ile Pro
290 295 300
Ser Leu Val Asn Asn Glu Leu Val Leu Arg Asp Lys Ala Thr Lys Val
305 310 315 320
Val Asp Tyr Phe Lys His Val Ser Leu Val Glu Thr Glu Gly Val Phe
325 330 335
Thr Leu Leu Asp Asp Lys Ile Met Met Pro Gln Asp Asp Leu Val Ile
340 345 350
Ser Glu Ile Asp Phe Asn Asn Asn Ser Ile Val Leu Gly Lys Cys Glu
355 360 365
Ile Trp Arg Met Glu Gly Gly Ser Gly His Thr Val Thr Asp Asp Ile
370 375 380
Asp His Phe Phe Ser Ala Pro Ser Ile Thr Tyr Arg Glu Pro His Leu
385 390 395 400
Ser Ile Tyr Asp Val Leu Glu Val Gln Lys Glu Glu Leu Asp Leu Ser
405 410 415
Lys Asp Leu Met Val Leu Pro Asn Ala Pro Asn Arg Val Phe Ala Trp
420 425 430
Glu Thr Gly Trp Thr Pro Gly Leu Arg Ser Leu Glu Asn Asp Gly Thr
435 440 445
Lys Leu Leu Asp Arg Ile Arg Asp Asn Tyr Glu Gly Glu Phe Tyr Trp
450 455 460
Arg Tyr Phe Ala Phe Ile Ala Asp Ala Leu Ile Thr Thr Leu Lys Pro
465 470 475 480
Arg Tyr Glu Asp Thr Asn Ile Arg Ile Asn Leu Asp Ser Asn Thr Arg
485 490 495
Ser Phe Ile Val Pro Ile Ile Thr Thr Glu Tyr Ile Arg Glu Lys Leu
500 505 510
Ser Tyr Ser Phe Tyr Gly Ser Gly Gly Thr Tyr Ala Leu Ser Leu Ser
515 520 525
Gln Tyr Asn Met Gly Ile Asn Ile Glu Leu Ser Glu Ser Asp Val Trp
530 535 540
Ile Ile Asp Val Asp Asn Val Val Arg Asp Val Thr Ile Glu Ser Asp
545 550 555 560
Lys Ile Lys Lys Gly Asp Leu Ile Glu Gly Ile Leu Ser Thr Leu Ser
565 570 575
Ile Glu Glu Asn Lys Ile Ile Leu Asn Ser His Glu Ile Asn Phe Ser
580 585 590
Gly Glu Val Asn Gly Ser Asn Gly Phe Val Ser Leu Thr Phe Ser Ile
595 600 605
Leu Glu Gly Ile Asn Ala Ile Ile Glu Val Asp Leu Leu Ser Lys Ser
610 615 620
Tyr Lys Leu Leu Ile Ser Gly Glu Leu Lys Ile Leu Met Leu Asn Ser
625 630 635 640
Asn His Ile Gln Gln Lys Ile Asp Tyr Ile Gly Phe Asn Ser Glu Leu
645 650 655
Gln Lys Asn Ile Pro Tyr Ser Phe Val Asp Ser Glu Gly Lys Glu Asn
660 665 670
Gly Phe Ile Asn Gly Ser Thr Lys Glu Gly Leu Phe Val Ser Glu Leu
675 680 685
Pro Asp Val Val Leu Ile Ser Lys Val Tyr Met Asp Asp Ser Lys Pro
690 695 700
Ser Phe Gly Tyr Tyr Ser Asn Asn Leu Lys Asp Val Lys Val Ile Thr
705 710 715 720
Lys Asp Asn Val Asn Ile Leu Thr Gly Tyr Tyr Leu Lys Asp Asp Ile
725 730 735
Lys Ile Ser Leu Ser Leu Thr Leu Gln Asp Glu Lys Thr Ile Lys Leu
740 745 750
Asn Ser Val His Leu Asp Glu Ser Gly Val Ala Glu Ile Leu Lys Phe
755 760 765
Met Asn Arg Lys Gly Asn Thr Asn Thr Ser Asp Ser Leu Met Ser Phe
770 775 780
Leu Glu Ser Met Asn Ile Lys Ser Ile Phe Val Asn Phe Leu Gln Ser
785 790 795 800
Asn Ile Lys Phe Ile Leu Asp Ala Asn Phe Ile Ile Ser Gly Thr Thr
805 810 815
Ser Ile Gly Gln Phe Glu Phe Ile Cys Asp Glu Asn Asp Asn Ile Gln
820 825 830
Pro Tyr Phe Ile Lys Phe Asn Thr Leu Glu Thr Asn Tyr Thr Leu Tyr
835 840 845
Val Gly Asn Arg Gln Asn Met Ile Val Glu Pro Asn Tyr Asp Leu Asp
850 855 860
Asp Ser Gly Asp Ile Ser Ser Thr Val Ile Asn Phe Ser Gln Lys Tyr
865 870 875 880
Leu Tyr Gly Ile Asp Ser Cys Val Asn Lys Val Val Ile Ser Pro Asn
885 890 895
Ile Tyr Thr Asp Glu Ile Asn Ile Thr Pro Val Tyr Glu Thr Asn Asn
900 905 910
Thr Tyr Pro Glu Val Ile Val Leu Asp Ala Asn Tyr Ile Asn Glu Lys
915 920 925
Ile Asn Val Asn Ile Asn Asp Leu Ser Ile Arg Tyr Val Trp Ser Asn
930 935 940
Asp Gly Asn Asp Phe Ile Leu Met Ser Thr Ser Glu Glu Asn Lys Val
945 950 955 960
Ser Gln Val Lys Ile Arg Phe Val Asn Val Phe Lys Asp Lys Thr Leu
965 970 975
Ala Asn Lys Leu Ser Phe Asn Phe Ser Asp Lys Gln Asp Val Pro Val
980 985 990
Ser Glu Ile Ile Leu Ser Phe Thr Pro Ser Tyr Tyr Glu Asp Gly Leu
995 1000 1005
Ile Gly Tyr Asp Leu Gly Leu Val Ser Leu Tyr Asn Glu Lys Phe
1010 1015 1020
Tyr Ile Asn Asn Phe Gly Met
1025 1030
<210> 20
<211> 438
<212> БЕЛОК
<213> Clostridium difficile
<400> 20
Met Val Thr Gly Val Phe Lys Gly Pro Asn Gly Phe Glu Tyr Phe Ala
1 5 10 15
Pro Ala Asn Thr His Asn Asn Asn Ile Glu Gly Gln Ala Ile Val Tyr
20 25 30
Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys Lys Tyr Tyr Phe Asp Asn
35 40 45
Asp Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr
50 55 60
Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr Gly Trp Gln Thr Ile
65 70 75 80
Asp Gly Lys Lys Tyr Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr
85 90 95
Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr
100 105 110
Phe Ile Ala Ser Thr Gly Tyr Thr Ser Ile Asn Gly Lys His Phe Tyr
115 120 125
Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro Asn
130 135 140
Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu
145 150 155 160
Gly Gln Ala Ile Leu Tyr Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys
165 170 175
Lys Tyr Tyr Phe Gly Ser Asp Ser Lys Ala Val Thr Gly Leu Arg Thr
180 185 190
Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr Ala Val Ala Val
195 200 205
Thr Gly Trp Gln Thr Ile Asn Gly Lys Lys Tyr Tyr Phe Asn Thr Asn
210 215 220
Thr Ser Ile Ala Ser Thr Gly Tyr Thr Ile Ile Ser Gly Lys His Phe
225 230 235 240
Tyr Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro
245 250 255
Asp Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile
260 265 270
Glu Gly Gln Ala Ile Arg Tyr Gln Asn Arg Phe Leu Tyr Leu His Asp
275 280 285
Asn Ile Tyr Tyr Phe Gly Asn Asn Ser Lys Ala Ala Thr Gly Trp Val
290 295 300
Thr Ile Asp Gly Asn Arg Tyr Tyr Phe Glu Pro Asn Thr Ala Met Gly
305 310 315 320
Ala Asn Gly Tyr Lys Thr Ile Asp Asn Lys Asn Phe Tyr Phe Arg Asn
325 330 335
Gly Leu Pro Gln Ile Gly Val Phe Lys Gly Ser Asn Gly Phe Glu Tyr
340 345 350
Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile
355 360 365
Arg Tyr Gln Asn Arg Phe Leu His Leu Leu Gly Lys Ile Tyr Tyr Phe
370 375 380
Gly Asn Asn Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asn Gly Lys
385 390 395 400
Val Tyr Tyr Phe Met Pro Asp Thr Ala Met Ala Ala Ala Gly Gly Leu
405 410 415
Phe Glu Ile Asp Gly Val Ile Tyr Phe Phe Gly Val Asp Gly Val Lys
420 425 430
Ala Pro Gly Ile Tyr Gly
435
<210> 21
<211> 2351
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибридный белок Q-токсина
<220>
<221> прочее
<222> (588)..(588)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 21
Met Glu Ile Val Asn Glu Asp Ile Leu Pro Asn Asn Gly Leu Met Gly
1 5 10 15
Tyr Tyr Phe Thr Asp Glu His Phe Lys Asp Leu Lys Leu Met Ala Pro
20 25 30
Ile Lys Asp Gly Asn Leu Lys Phe Glu Glu Lys Lys Val Asp Lys Leu
35 40 45
Leu Asp Lys Asp Lys Ser Asp Val Lys Ser Ile Arg Trp Thr Gly Arg
50 55 60
Ile Ile Pro Ser Lys Asp Gly Glu Tyr Thr Leu Ser Thr Asp Arg Asp
65 70 75 80
Asp Val Leu Met Gln Val Asn Thr Glu Ser Thr Ile Ser Asn Thr Leu
85 90 95
Lys Val Asn Met Lys Lys Gly Lys Glu Tyr Lys Val Arg Ile Glu Leu
100 105 110
Gln Asp Lys Asn Leu Gly Ser Ile Asp Asn Leu Ser Ser Pro Asn Leu
115 120 125
Tyr Trp Glu Leu Asp Gly Met Lys Lys Ile Ile Pro Glu Glu Asn Leu
130 135 140
Phe Leu Arg Asp Tyr Ser Asn Ile Glu Lys Asp Asp Pro Phe Ile Pro
145 150 155 160
Asn Asn Asn Phe Phe Asp Pro Lys Leu Met Ser Asp Trp Glu Asp Glu
165 170 175
Asp Leu Asp Thr Asp Asn Asp Asn Ile Pro Asp Ser Tyr Glu Arg Asn
180 185 190
Gly Tyr Thr Ile Lys Asp Leu Ile Ala Val Lys Trp Glu Asp Ser Phe
195 200 205
Ala Glu Gln Gly Tyr Lys Lys Tyr Val Ser Asn Tyr Leu Glu Ser Asn
210 215 220
Thr Ala Gly Asp Pro Tyr Thr Asp Tyr Glu Lys Ala Ser Gly Ser Phe
225 230 235 240
Asp Lys Ala Ile Lys Thr Glu Ala Arg Asp Pro Leu Val Ala Ala Tyr
245 250 255
Pro Ile Val Gly Val Gly Met Glu Lys Leu Ile Ile Ser Thr Asn Glu
260 265 270
His Ala Ser Thr Asp Gln Gly Lys Thr Val Ser Arg Ala Thr Thr Asn
275 280 285
Ser Lys Thr Glu Ser Asn Thr Ala Gly Val Ser Val Asn Val Gly Tyr
290 295 300
Gln Asn Gly Phe Thr Ala Asn Val Thr Thr Asn Tyr Ser His Thr Thr
305 310 315 320
Asp Asn Ser Thr Ala Val Gln Asp Ser Asn Gly Glu Ser Trp Asn Thr
325 330 335
Gly Leu Ser Ile Asn Lys Gly Glu Ser Ala Tyr Ile Asn Ala Asn Val
340 345 350
Arg Tyr Tyr Asn Thr Gly Thr Ala Pro Met Tyr Lys Val Thr Pro Thr
355 360 365
Thr Asn Leu Val Leu Asp Gly Asp Thr Leu Ser Thr Ile Lys Ala Gln
370 375 380
Glu Asn Gln Ile Gly Asn Asn Leu Ser Pro Gly Asp Thr Tyr Pro Lys
385 390 395 400
Lys Gly Leu Ser Pro Leu Ala Leu Asn Thr Met Asp Gln Phe Ser Ser
405 410 415
Arg Leu Ile Pro Ile Asn Tyr Asp Gln Leu Lys Lys Leu Asp Ala Gly
420 425 430
Lys Gln Ile Lys Leu Glu Thr Thr Gln Val Ser Gly Asn Phe Gly Thr
435 440 445
Lys Asn Ser Ser Gly Gln Ile Val Thr Glu Gly Asn Ser Trp Ser Asp
450 455 460
Tyr Ile Ser Gln Ile Asp Ser Ile Ser Ala Ser Ile Ile Leu Asp Thr
465 470 475 480
Glu Asn Glu Ser Tyr Glu Arg Arg Val Thr Ala Lys Asn Leu Gln Asp
485 490 495
Pro Glu Asp Lys Thr Pro Glu Leu Thr Ile Gly Glu Ala Ile Glu Lys
500 505 510
Ala Phe Gly Ala Thr Lys Lys Asp Gly Leu Leu Tyr Phe Asn Asp Ile
515 520 525
Pro Ile Asp Glu Ser Cys Val Glu Leu Ile Phe Asp Asp Asn Thr Ala
530 535 540
Asn Lys Ile Lys Asp Ser Leu Lys Thr Leu Ser Asp Lys Lys Ile Tyr
545 550 555 560
Asn Val Lys Leu Glu Arg Gly Met Asn Ile Leu Ile Lys Thr Pro Thr
565 570 575
Tyr Phe Thr Asn Phe Asp Asp Tyr Asn Asn Tyr Xaa Ser Thr Trp Ser
580 585 590
Asn Val Asn Thr Thr Asn Gln Asp Gly Leu Gln Gly Ser Ala Asn Lys
595 600 605
Leu Asn Gly Glu Thr Lys Ile Lys Ile Pro Met Ser Glu Leu Lys Pro
610 615 620
Tyr Lys Arg Tyr Val Phe Ser Gly Tyr Ser Lys Asp Pro Leu Thr Ser
625 630 635 640
Asn Ser Ile Ile Val Lys Ile Lys Ala Lys Glu Glu Lys Thr Asp Tyr
645 650 655
Leu Val Pro Glu Gln Gly Tyr Thr Lys Phe Ser Tyr Glu Phe Glu Thr
660 665 670
Thr Glu Lys Asp Ser Ser Asn Ile Glu Ile Thr Leu Ile Gly Ser Gly
675 680 685
Thr Thr Tyr Leu Asp Asn Leu Ser Ile Thr Glu Leu Asn Ser Thr Pro
690 695 700
Glu Ile Leu Asp Glu Pro Glu Val Lys Ile Pro Thr Asp Gln Glu Ile
705 710 715 720
Met Asp Ala His Lys Ile Tyr Phe Ala Asp Leu Asn Phe Asn Pro Ser
725 730 735
Thr Gly Asn Thr Tyr Ile Asn Gly Met Tyr Phe Ala Pro Thr Gln Thr
740 745 750
Asn Lys Glu Ala Leu Asp Tyr Ile Gln Lys Tyr Arg Val Glu Ala Thr
755 760 765
Leu Gln Tyr Ser Gly Phe Lys Asp Ile Gly Thr Lys Asp Lys Glu Met
770 775 780
Arg Asn Tyr Leu Gly Asp Pro Asn Gln Pro Lys Thr Asn Tyr Val Asn
785 790 795 800
Leu Arg Ser Tyr Phe Thr Gly Gly Glu Asn Ile Met Thr Tyr Lys Lys
805 810 815
Leu Arg Ile Tyr Ala Ile Thr Pro Asp Asp Arg Glu Leu Leu Val Leu
820 825 830
Ser Val Asp Ala Ser Met Val Ser Gly Leu Ile Tyr Ile Asn Asp Ser
835 840 845
Leu Tyr Tyr Phe Lys Pro Pro Val Asn Asn Leu Ile Thr Gly Phe Val
850 855 860
Thr Val Gly Asp Asp Lys Tyr Tyr Phe Asn Pro Ile Asn Gly Gly Ala
865 870 875 880
Ala Ser Ile Gly Glu Thr Ile Ile Asp Asp Lys Asn Tyr Tyr Phe Asn
885 890 895
Gln Ser Gly Val Leu Gln Thr Gly Val Phe Ser Thr Glu Asp Gly Phe
900 905 910
Lys Tyr Phe Ala Pro Ala Asn Thr Leu Asp Glu Asn Leu Glu Gly Glu
915 920 925
Ala Ile Asp Phe Thr Gly Lys Leu Ile Ile Asp Glu Asn Ile Tyr Tyr
930 935 940
Phe Asp Asp Asn Tyr Arg Gly Ala Val Glu Trp Lys Glu Leu Asp Gly
945 950 955 960
Glu Met His Tyr Phe Ser Pro Glu Thr Gly Lys Ala Phe Lys Gly Leu
965 970 975
Asn Gln Ile Gly Asp Tyr Lys Tyr Tyr Phe Asn Ser Asp Gly Val Met
980 985 990
Gln Lys Gly Phe Val Ser Ile Asn Asp Asn Lys His Tyr Phe Asp Asp
995 1000 1005
Ser Gly Val Met Lys Val Gly Tyr Thr Glu Ile Asp Gly Lys His
1010 1015 1020
Phe Tyr Phe Ala Glu Asn Gly Glu Met Gln Ile Gly Val Phe Asn
1025 1030 1035
Thr Glu Asp Gly Phe Lys Tyr Phe Ala His His Asn Glu Asp Leu
1040 1045 1050
Gly Asn Glu Glu Gly Glu Glu Ile Ser Tyr Ser Gly Ile Leu Asn
1055 1060 1065
Phe Asn Asn Lys Ile Tyr Tyr Phe Asp Asp Ser Phe Thr Ala Val
1070 1075 1080
Val Gly Trp Lys Asp Leu Glu Asp Gly Ser Lys Tyr Tyr Phe Asp
1085 1090 1095
Glu Asp Thr Ala Glu Ala Tyr Ile Gly Leu Ser Leu Ile Asn Asp
1100 1105 1110
Gly Gln Tyr Tyr Phe Asn Asp Asp Gly Ile Met Gln Val Gly Phe
1115 1120 1125
Val Thr Ile Asn Asp Lys Val Phe Tyr Phe Ser Asp Ser Gly Ile
1130 1135 1140
Ile Glu Ser Gly Val Gln Asn Ile Asp Asp Asn Tyr Phe Tyr Ile
1145 1150 1155
Asp Asp Asn Gly Ile Val Gln Ile Gly Val Phe Asp Thr Ser Asp
1160 1165 1170
Gly Tyr Lys Tyr Phe Ala Pro Ala Asn Thr Val Asn Asp Asn Ile
1175 1180 1185
Tyr Gly Gln Ala Val Glu Tyr Ser Gly Leu Val Arg Val Gly Glu
1190 1195 1200
Asp Val Tyr Tyr Phe Gly Glu Thr Tyr Thr Ile Glu Thr Gly Trp
1205 1210 1215
Ile Tyr Asp Met Glu Asn Glu Ser Asp Lys Tyr Tyr Phe Asn Pro
1220 1225 1230
Glu Thr Lys Lys Ala Cys Lys Gly Ile Asn Leu Ile Asp Asp Ile
1235 1240 1245
Lys Tyr Tyr Phe Asp Glu Lys Gly Ile Met Arg Thr Gly Leu Ile
1250 1255 1260
Ser Phe Glu Asn Asn Asn Tyr Tyr Phe Asn Glu Asn Gly Glu Met
1265 1270 1275
Gln Phe Gly Tyr Ile Asn Ile Glu Asp Lys Met Phe Tyr Phe Gly
1280 1285 1290
Glu Asp Gly Val Met Gln Ile Gly Val Phe Asn Thr Pro Asp Gly
1295 1300 1305
Phe Lys Tyr Phe Ala His Gln Asn Thr Leu Asp Glu Asn Phe Glu
1310 1315 1320
Gly Glu Ser Ile Asn Tyr Thr Gly Trp Leu Asp Leu Asp Glu Lys
1325 1330 1335
Arg Tyr Tyr Phe Thr Asp Glu Tyr Ile Ala Ala Thr Gly Ser Val
1340 1345 1350
Ile Ile Asp Gly Glu Glu Tyr Tyr Phe Asp Pro Asp Thr Ala Gln
1355 1360 1365
Leu Val Ile Ser Glu Ser Arg Met Val Thr Gly Val Phe Lys Gly
1370 1375 1380
Pro Asn Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr His Asn Asn
1385 1390 1395
Asn Ile Glu Gly Gln Ala Ile Val Tyr Gln Asn Lys Phe Leu Thr
1400 1405 1410
Leu Asn Gly Lys Lys Tyr Tyr Phe Asp Asn Asp Ser Lys Ala Val
1415 1420 1425
Thr Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Leu
1430 1435 1440
Asn Thr Ala Glu Ala Ala Thr Gly Trp Gln Thr Ile Asp Gly Lys
1445 1450 1455
Lys Tyr Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr Gly Trp
1460 1465 1470
Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr Phe
1475 1480 1485
Ile Ala Ser Thr Gly Tyr Thr Ser Ile Asn Gly Lys His Phe Tyr
1490 1495 1500
Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro
1505 1510 1515
Asn Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn
1520 1525 1530
Ile Glu Gly Gln Ala Ile Leu Tyr Gln Asn Lys Phe Leu Thr Leu
1535 1540 1545
Asn Gly Lys Lys Tyr Tyr Phe Gly Ser Asp Ser Lys Ala Val Thr
1550 1555 1560
Gly Leu Arg Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn
1565 1570 1575
Thr Ala Val Ala Val Thr Gly Trp Gln Thr Ile Asn Gly Lys Lys
1580 1585 1590
Tyr Tyr Phe Asn Thr Asn Thr Ser Ile Ala Ser Thr Gly Tyr Thr
1595 1600 1605
Ile Ile Ser Gly Lys His Phe Tyr Phe Asn Thr Asp Gly Ile Met
1610 1615 1620
Gln Ile Gly Val Phe Lys Gly Pro Asp Gly Phe Glu Tyr Phe Ala
1625 1630 1635
Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile Arg
1640 1645 1650
Tyr Gln Asn Arg Phe Leu Tyr Leu His Asp Asn Ile Tyr Tyr Phe
1655 1660 1665
Gly Asn Asn Ser Lys Ala Ala Thr Gly Trp Val Thr Ile Asp Gly
1670 1675 1680
Asn Arg Tyr Tyr Phe Glu Pro Asn Thr Ala Met Gly Ala Asn Gly
1685 1690 1695
Tyr Lys Thr Ile Asp Asn Lys Asn Phe Tyr Phe Arg Asn Gly Leu
1700 1705 1710
Pro Gln Ile Gly Val Phe Lys Gly Ser Asn Gly Phe Glu Tyr Phe
1715 1720 1725
Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile
1730 1735 1740
Arg Tyr Gln Asn Arg Phe Leu His Leu Leu Gly Lys Ile Tyr Tyr
1745 1750 1755
Phe Gly Asn Asn Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asn
1760 1765 1770
Gly Lys Val Tyr Tyr Phe Met Pro Asp Thr Ala Met Ala Ala Ala
1775 1780 1785
Gly Gly Leu Phe Glu Ile Asp Gly Val Ile Tyr Phe Phe Gly Val
1790 1795 1800
Asp Gly Val Lys Ala Pro Gly Ile Tyr Gly Thr Ser Met Val Ser
1805 1810 1815
Gly Leu Ile Tyr Ile Asn Asp Ser Leu Tyr Tyr Phe Lys Pro Pro
1820 1825 1830
Val Asn Asn Leu Ile Thr Gly Phe Val Thr Val Gly Asp Asp Lys
1835 1840 1845
Tyr Tyr Phe Asn Pro Ile Asn Gly Gly Ala Ala Ser Ile Gly Glu
1850 1855 1860
Thr Ile Ile Asp Asp Lys Asn Tyr Tyr Phe Asn Gln Ser Gly Val
1865 1870 1875
Leu Gln Thr Gly Val Phe Ser Thr Glu Asp Gly Phe Lys Tyr Phe
1880 1885 1890
Ala Pro Ala Asn Thr Leu Asp Glu Asn Leu Glu Gly Glu Ala Ile
1895 1900 1905
Asp Phe Thr Gly Lys Leu Ile Ile Asp Glu Asn Ile Tyr Tyr Phe
1910 1915 1920
Asp Asp Asn Tyr Arg Gly Ala Val Glu Trp Lys Glu Leu Asp Gly
1925 1930 1935
Glu Met His Tyr Phe Ser Pro Glu Thr Gly Lys Ala Phe Lys Gly
1940 1945 1950
Leu Asn Gln Ile Gly Asp Tyr Lys Tyr Tyr Phe Asn Ser Asp Gly
1955 1960 1965
Val Met Gln Lys Gly Phe Val Ser Ile Asn Asp Asn Lys His Tyr
1970 1975 1980
Phe Asp Asp Ser Gly Val Met Lys Val Gly Tyr Thr Glu Ile Asp
1985 1990 1995
Gly Lys His Phe Tyr Phe Ala Glu Asn Gly Glu Met Gln Ile Gly
2000 2005 2010
Val Phe Asn Thr Glu Asp Gly Phe Lys Tyr Phe Ala His His Asn
2015 2020 2025
Glu Asp Leu Gly Asn Glu Glu Gly Glu Glu Ile Ser Tyr Ser Gly
2030 2035 2040
Ile Leu Asn Phe Asn Asn Lys Ile Tyr Tyr Phe Asp Asp Ser Phe
2045 2050 2055
Thr Ala Val Val Gly Trp Lys Asp Leu Glu Asp Gly Ser Lys Tyr
2060 2065 2070
Tyr Phe Asp Glu Asp Thr Ala Glu Ala Tyr Ile Gly Leu Ser Leu
2075 2080 2085
Ile Asn Asp Gly Gln Tyr Tyr Phe Asn Asp Asp Gly Ile Met Gln
2090 2095 2100
Val Gly Phe Val Thr Ile Asn Asp Lys Val Phe Tyr Phe Ser Asp
2105 2110 2115
Ser Gly Ile Ile Glu Ser Gly Val Gln Asn Ile Asp Asp Asn Tyr
2120 2125 2130
Phe Tyr Ile Asp Asp Asn Gly Ile Val Gln Ile Gly Val Phe Asp
2135 2140 2145
Thr Ser Asp Gly Tyr Lys Tyr Phe Ala Pro Ala Asn Thr Val Asn
2150 2155 2160
Asp Asn Ile Tyr Gly Gln Ala Val Glu Tyr Ser Gly Leu Val Arg
2165 2170 2175
Val Gly Glu Asp Val Tyr Tyr Phe Gly Glu Thr Tyr Thr Ile Glu
2180 2185 2190
Thr Gly Trp Ile Tyr Asp Met Glu Asn Glu Ser Asp Lys Tyr Tyr
2195 2200 2205
Phe Asn Pro Glu Thr Lys Lys Ala Cys Lys Gly Ile Asn Leu Ile
2210 2215 2220
Asp Asp Ile Lys Tyr Tyr Phe Asp Glu Lys Gly Ile Met Arg Thr
2225 2230 2235
Gly Leu Ile Ser Phe Glu Asn Asn Asn Tyr Tyr Phe Asn Glu Asn
2240 2245 2250
Gly Glu Met Gln Phe Gly Tyr Ile Asn Ile Glu Asp Lys Met Phe
2255 2260 2265
Tyr Phe Gly Glu Asp Gly Val Met Gln Ile Gly Val Phe Asn Thr
2270 2275 2280
Pro Asp Gly Phe Lys Tyr Phe Ala His Gln Asn Thr Leu Asp Glu
2285 2290 2295
Asn Phe Glu Gly Glu Ser Ile Asn Tyr Thr Gly Trp Leu Asp Leu
2300 2305 2310
Asp Glu Lys Arg Tyr Tyr Phe Thr Asp Glu Tyr Ile Ala Ala Thr
2315 2320 2325
Gly Ser Val Ile Ile Asp Gly Glu Glu Tyr Tyr Phe Asp Pro Asp
2330 2335 2340
Thr Ala Gln Leu Val Ile Ser Glu
2345 2350
<210> 22
<211> 835
<212> БЕЛОК
<213> Clostridium difficile
<220>
<221> прочее
<222> (588)..(588)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 22
Met Glu Ile Val Asn Glu Asp Ile Leu Pro Asn Asn Gly Leu Met Gly
1 5 10 15
Tyr Tyr Phe Thr Asp Glu His Phe Lys Asp Leu Lys Leu Met Ala Pro
20 25 30
Ile Lys Asp Gly Asn Leu Lys Phe Glu Glu Lys Lys Val Asp Lys Leu
35 40 45
Leu Asp Lys Asp Lys Ser Asp Val Lys Ser Ile Arg Trp Thr Gly Arg
50 55 60
Ile Ile Pro Ser Lys Asp Gly Glu Tyr Thr Leu Ser Thr Asp Arg Asp
65 70 75 80
Asp Val Leu Met Gln Val Asn Thr Glu Ser Thr Ile Ser Asn Thr Leu
85 90 95
Lys Val Asn Met Lys Lys Gly Lys Glu Tyr Lys Val Arg Ile Glu Leu
100 105 110
Gln Asp Lys Asn Leu Gly Ser Ile Asp Asn Leu Ser Ser Pro Asn Leu
115 120 125
Tyr Trp Glu Leu Asp Gly Met Lys Lys Ile Ile Pro Glu Glu Asn Leu
130 135 140
Phe Leu Arg Asp Tyr Ser Asn Ile Glu Lys Asp Asp Pro Phe Ile Pro
145 150 155 160
Asn Asn Asn Phe Phe Asp Pro Lys Leu Met Ser Asp Trp Glu Asp Glu
165 170 175
Asp Leu Asp Thr Asp Asn Asp Asn Ile Pro Asp Ser Tyr Glu Arg Asn
180 185 190
Gly Tyr Thr Ile Lys Asp Leu Ile Ala Val Lys Trp Glu Asp Ser Phe
195 200 205
Ala Glu Gln Gly Tyr Lys Lys Tyr Val Ser Asn Tyr Leu Glu Ser Asn
210 215 220
Thr Ala Gly Asp Pro Tyr Thr Asp Tyr Glu Lys Ala Ser Gly Ser Phe
225 230 235 240
Asp Lys Ala Ile Lys Thr Glu Ala Arg Asp Pro Leu Val Ala Ala Tyr
245 250 255
Pro Ile Val Gly Val Gly Met Glu Lys Leu Ile Ile Ser Thr Asn Glu
260 265 270
His Ala Ser Thr Asp Gln Gly Lys Thr Val Ser Arg Ala Thr Thr Asn
275 280 285
Ser Lys Thr Glu Ser Asn Thr Ala Gly Val Ser Val Asn Val Gly Tyr
290 295 300
Gln Asn Gly Phe Thr Ala Asn Val Thr Thr Asn Tyr Ser His Thr Thr
305 310 315 320
Asp Asn Ser Thr Ala Val Gln Asp Ser Asn Gly Glu Ser Trp Asn Thr
325 330 335
Gly Leu Ser Ile Asn Lys Gly Glu Ser Ala Tyr Ile Asn Ala Asn Val
340 345 350
Arg Tyr Tyr Asn Thr Gly Thr Ala Pro Met Tyr Lys Val Thr Pro Thr
355 360 365
Thr Asn Leu Val Leu Asp Gly Asp Thr Leu Ser Thr Ile Lys Ala Gln
370 375 380
Glu Asn Gln Ile Gly Asn Asn Leu Ser Pro Gly Asp Thr Tyr Pro Lys
385 390 395 400
Lys Gly Leu Ser Pro Leu Ala Leu Asn Thr Met Asp Gln Phe Ser Ser
405 410 415
Arg Leu Ile Pro Ile Asn Tyr Asp Gln Leu Lys Lys Leu Asp Ala Gly
420 425 430
Lys Gln Ile Lys Leu Glu Thr Thr Gln Val Ser Gly Asn Phe Gly Thr
435 440 445
Lys Asn Ser Ser Gly Gln Ile Val Thr Glu Gly Asn Ser Trp Ser Asp
450 455 460
Tyr Ile Ser Gln Ile Asp Ser Ile Ser Ala Ser Ile Ile Leu Asp Thr
465 470 475 480
Glu Asn Glu Ser Tyr Glu Arg Arg Val Thr Ala Lys Asn Leu Gln Asp
485 490 495
Pro Glu Asp Lys Thr Pro Glu Leu Thr Ile Gly Glu Ala Ile Glu Lys
500 505 510
Ala Phe Gly Ala Thr Lys Lys Asp Gly Leu Leu Tyr Phe Asn Asp Ile
515 520 525
Pro Ile Asp Glu Ser Cys Val Glu Leu Ile Phe Asp Asp Asn Thr Ala
530 535 540
Asn Lys Ile Lys Asp Ser Leu Lys Thr Leu Ser Asp Lys Lys Ile Tyr
545 550 555 560
Asn Val Lys Leu Glu Arg Gly Met Asn Ile Leu Ile Lys Thr Pro Thr
565 570 575
Tyr Phe Thr Asn Phe Asp Asp Tyr Asn Asn Tyr Xaa Ser Thr Trp Ser
580 585 590
Asn Val Asn Thr Thr Asn Gln Asp Gly Leu Gln Gly Ser Ala Asn Lys
595 600 605
Leu Asn Gly Glu Thr Lys Ile Lys Ile Pro Met Ser Glu Leu Lys Pro
610 615 620
Tyr Lys Arg Tyr Val Phe Ser Gly Tyr Ser Lys Asp Pro Leu Thr Ser
625 630 635 640
Asn Ser Ile Ile Val Lys Ile Lys Ala Lys Glu Glu Lys Thr Asp Tyr
645 650 655
Leu Val Pro Glu Gln Gly Tyr Thr Lys Phe Ser Tyr Glu Phe Glu Thr
660 665 670
Thr Glu Lys Asp Ser Ser Asn Ile Glu Ile Thr Leu Ile Gly Ser Gly
675 680 685
Thr Thr Tyr Leu Asp Asn Leu Ser Ile Thr Glu Leu Asn Ser Thr Pro
690 695 700
Glu Ile Leu Asp Glu Pro Glu Val Lys Ile Pro Thr Asp Gln Glu Ile
705 710 715 720
Met Asp Ala His Lys Ile Tyr Phe Ala Asp Leu Asn Phe Asn Pro Ser
725 730 735
Thr Gly Asn Thr Tyr Ile Asn Gly Met Tyr Phe Ala Pro Thr Gln Thr
740 745 750
Asn Lys Glu Ala Leu Asp Tyr Ile Gln Lys Tyr Arg Val Glu Ala Thr
755 760 765
Leu Gln Tyr Ser Gly Phe Lys Asp Ile Gly Thr Lys Asp Lys Glu Met
770 775 780
Arg Asn Tyr Leu Gly Asp Pro Asn Gln Pro Lys Thr Asn Tyr Val Asn
785 790 795 800
Leu Arg Ser Tyr Phe Thr Gly Gly Glu Asn Ile Met Thr Tyr Lys Lys
805 810 815
Leu Arg Ile Tyr Ala Ile Thr Pro Asp Asp Arg Glu Leu Leu Val Leu
820 825 830
Ser Val Asp
835
<210> 23
<211> 536
<212> БЕЛОК
<213> Clostridium difficile
<400> 23
Met Val Ser Gly Leu Ile Tyr Ile Asn Asp Ser Leu Tyr Tyr Phe Lys
1 5 10 15
Pro Pro Val Asn Asn Leu Ile Thr Gly Phe Val Thr Val Gly Asp Asp
20 25 30
Lys Tyr Tyr Phe Asn Pro Ile Asn Gly Gly Ala Ala Ser Ile Gly Glu
35 40 45
Thr Ile Ile Asp Asp Lys Asn Tyr Tyr Phe Asn Gln Ser Gly Val Leu
50 55 60
Gln Thr Gly Val Phe Ser Thr Glu Asp Gly Phe Lys Tyr Phe Ala Pro
65 70 75 80
Ala Asn Thr Leu Asp Glu Asn Leu Glu Gly Glu Ala Ile Asp Phe Thr
85 90 95
Gly Lys Leu Ile Ile Asp Glu Asn Ile Tyr Tyr Phe Asp Asp Asn Tyr
100 105 110
Arg Gly Ala Val Glu Trp Lys Glu Leu Asp Gly Glu Met His Tyr Phe
115 120 125
Ser Pro Glu Thr Gly Lys Ala Phe Lys Gly Leu Asn Gln Ile Gly Asp
130 135 140
Tyr Lys Tyr Tyr Phe Asn Ser Asp Gly Val Met Gln Lys Gly Phe Val
145 150 155 160
Ser Ile Asn Asp Asn Lys His Tyr Phe Asp Asp Ser Gly Val Met Lys
165 170 175
Val Gly Tyr Thr Glu Ile Asp Gly Lys His Phe Tyr Phe Ala Glu Asn
180 185 190
Gly Glu Met Gln Ile Gly Val Phe Asn Thr Glu Asp Gly Phe Lys Tyr
195 200 205
Phe Ala His His Asn Glu Asp Leu Gly Asn Glu Glu Gly Glu Glu Ile
210 215 220
Ser Tyr Ser Gly Ile Leu Asn Phe Asn Asn Lys Ile Tyr Tyr Phe Asp
225 230 235 240
Asp Ser Phe Thr Ala Val Val Gly Trp Lys Asp Leu Glu Asp Gly Ser
245 250 255
Lys Tyr Tyr Phe Asp Glu Asp Thr Ala Glu Ala Tyr Ile Gly Leu Ser
260 265 270
Leu Ile Asn Asp Gly Gln Tyr Tyr Phe Asn Asp Asp Gly Ile Met Gln
275 280 285
Val Gly Phe Val Thr Ile Asn Asp Lys Val Phe Tyr Phe Ser Asp Ser
290 295 300
Gly Ile Ile Glu Ser Gly Val Gln Asn Ile Asp Asp Asn Tyr Phe Tyr
305 310 315 320
Ile Asp Asp Asn Gly Ile Val Gln Ile Gly Val Phe Asp Thr Ser Asp
325 330 335
Gly Tyr Lys Tyr Phe Ala Pro Ala Asn Thr Val Asn Asp Asn Ile Tyr
340 345 350
Gly Gln Ala Val Glu Tyr Ser Gly Leu Val Arg Val Gly Glu Asp Val
355 360 365
Tyr Tyr Phe Gly Glu Thr Tyr Thr Ile Glu Thr Gly Trp Ile Tyr Asp
370 375 380
Met Glu Asn Glu Ser Asp Lys Tyr Tyr Phe Asn Pro Glu Thr Lys Lys
385 390 395 400
Ala Cys Lys Gly Ile Asn Leu Ile Asp Asp Ile Lys Tyr Tyr Phe Asp
405 410 415
Glu Lys Gly Ile Met Arg Thr Gly Leu Ile Ser Phe Glu Asn Asn Asn
420 425 430
Tyr Tyr Phe Asn Glu Asn Gly Glu Met Gln Phe Gly Tyr Ile Asn Ile
435 440 445
Glu Asp Lys Met Phe Tyr Phe Gly Glu Asp Gly Val Met Gln Ile Gly
450 455 460
Val Phe Asn Thr Pro Asp Gly Phe Lys Tyr Phe Ala His Gln Asn Thr
465 470 475 480
Leu Asp Glu Asn Phe Glu Gly Glu Ser Ile Asn Tyr Thr Gly Trp Leu
485 490 495
Asp Leu Asp Glu Lys Arg Tyr Tyr Phe Thr Asp Glu Tyr Ile Ala Ala
500 505 510
Thr Gly Ser Val Ile Ile Asp Gly Glu Glu Tyr Tyr Phe Asp Pro Asp
515 520 525
Thr Ala Gln Leu Val Ile Ser Glu
530 535
<210> 24
<211> 438
<212> БЕЛОК
<213> Clostridium difficile
<400> 24
Met Val Thr Gly Val Phe Lys Gly Pro Asn Gly Phe Glu Tyr Phe Ala
1 5 10 15
Pro Ala Asn Thr His Asn Asn Asn Ile Glu Gly Gln Ala Ile Val Tyr
20 25 30
Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys Lys Tyr Tyr Phe Asp Asn
35 40 45
Asp Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr
50 55 60
Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr Gly Trp Gln Thr Ile
65 70 75 80
Asp Gly Lys Lys Tyr Tyr Phe Asn Leu Asn Thr Ala Glu Ala Ala Thr
85 90 95
Gly Trp Gln Thr Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr
100 105 110
Phe Ile Ala Ser Thr Gly Tyr Thr Ser Ile Asn Gly Lys His Phe Tyr
115 120 125
Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro Asn
130 135 140
Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu
145 150 155 160
Gly Gln Ala Ile Leu Tyr Gln Asn Lys Phe Leu Thr Leu Asn Gly Lys
165 170 175
Lys Tyr Tyr Phe Gly Ser Asp Ser Lys Ala Val Thr Gly Leu Arg Thr
180 185 190
Ile Asp Gly Lys Lys Tyr Tyr Phe Asn Thr Asn Thr Ala Val Ala Val
195 200 205
Thr Gly Trp Gln Thr Ile Asn Gly Lys Lys Tyr Tyr Phe Asn Thr Asn
210 215 220
Thr Ser Ile Ala Ser Thr Gly Tyr Thr Ile Ile Ser Gly Lys His Phe
225 230 235 240
Tyr Phe Asn Thr Asp Gly Ile Met Gln Ile Gly Val Phe Lys Gly Pro
245 250 255
Asp Gly Phe Glu Tyr Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile
260 265 270
Glu Gly Gln Ala Ile Arg Tyr Gln Asn Arg Phe Leu Tyr Leu His Asp
275 280 285
Asn Ile Tyr Tyr Phe Gly Asn Asn Ser Lys Ala Ala Thr Gly Trp Val
290 295 300
Thr Ile Asp Gly Asn Arg Tyr Tyr Phe Glu Pro Asn Thr Ala Met Gly
305 310 315 320
Ala Asn Gly Tyr Lys Thr Ile Asp Asn Lys Asn Phe Tyr Phe Arg Asn
325 330 335
Gly Leu Pro Gln Ile Gly Val Phe Lys Gly Ser Asn Gly Phe Glu Tyr
340 345 350
Phe Ala Pro Ala Asn Thr Asp Ala Asn Asn Ile Glu Gly Gln Ala Ile
355 360 365
Arg Tyr Gln Asn Arg Phe Leu His Leu Leu Gly Lys Ile Tyr Tyr Phe
370 375 380
Gly Asn Asn Ser Lys Ala Val Thr Gly Trp Gln Thr Ile Asn Gly Lys
385 390 395 400
Val Tyr Tyr Phe Met Pro Asp Thr Ala Met Ala Ala Ala Gly Gly Leu
405 410 415
Phe Glu Ile Asp Gly Val Ile Tyr Phe Phe Gly Val Asp Gly Val Lys
420 425 430
Ala Pro Gly Ile Tyr Gly
435
<210> 25
<211> 536
<212> БЕЛОК
<213> Clostridium difficile
<400> 25
Met Val Ser Gly Leu Ile Tyr Ile Asn Asp Ser Leu Tyr Tyr Phe Lys
1 5 10 15
Pro Pro Val Asn Asn Leu Ile Thr Gly Phe Val Thr Val Gly Asp Asp
20 25 30
Lys Tyr Tyr Phe Asn Pro Ile Asn Gly Gly Ala Ala Ser Ile Gly Glu
35 40 45
Thr Ile Ile Asp Asp Lys Asn Tyr Tyr Phe Asn Gln Ser Gly Val Leu
50 55 60
Gln Thr Gly Val Phe Ser Thr Glu Asp Gly Phe Lys Tyr Phe Ala Pro
65 70 75 80
Ala Asn Thr Leu Asp Glu Asn Leu Glu Gly Glu Ala Ile Asp Phe Thr
85 90 95
Gly Lys Leu Ile Ile Asp Glu Asn Ile Tyr Tyr Phe Asp Asp Asn Tyr
100 105 110
Arg Gly Ala Val Glu Trp Lys Glu Leu Asp Gly Glu Met His Tyr Phe
115 120 125
Ser Pro Glu Thr Gly Lys Ala Phe Lys Gly Leu Asn Gln Ile Gly Asp
130 135 140
Tyr Lys Tyr Tyr Phe Asn Ser Asp Gly Val Met Gln Lys Gly Phe Val
145 150 155 160
Ser Ile Asn Asp Asn Lys His Tyr Phe Asp Asp Ser Gly Val Met Lys
165 170 175
Val Gly Tyr Thr Glu Ile Asp Gly Lys His Phe Tyr Phe Ala Glu Asn
180 185 190
Gly Glu Met Gln Ile Gly Val Phe Asn Thr Glu Asp Gly Phe Lys Tyr
195 200 205
Phe Ala His His Asn Glu Asp Leu Gly Asn Glu Glu Gly Glu Glu Ile
210 215 220
Ser Tyr Ser Gly Ile Leu Asn Phe Asn Asn Lys Ile Tyr Tyr Phe Asp
225 230 235 240
Asp Ser Phe Thr Ala Val Val Gly Trp Lys Asp Leu Glu Asp Gly Ser
245 250 255
Lys Tyr Tyr Phe Asp Glu Asp Thr Ala Glu Ala Tyr Ile Gly Leu Ser
260 265 270
Leu Ile Asn Asp Gly Gln Tyr Tyr Phe Asn Asp Asp Gly Ile Met Gln
275 280 285
Val Gly Phe Val Thr Ile Asn Asp Lys Val Phe Tyr Phe Ser Asp Ser
290 295 300
Gly Ile Ile Glu Ser Gly Val Gln Asn Ile Asp Asp Asn Tyr Phe Tyr
305 310 315 320
Ile Asp Asp Asn Gly Ile Val Gln Ile Gly Val Phe Asp Thr Ser Asp
325 330 335
Gly Tyr Lys Tyr Phe Ala Pro Ala Asn Thr Val Asn Asp Asn Ile Tyr
340 345 350
Gly Gln Ala Val Glu Tyr Ser Gly Leu Val Arg Val Gly Glu Asp Val
355 360 365
Tyr Tyr Phe Gly Glu Thr Tyr Thr Ile Glu Thr Gly Trp Ile Tyr Asp
370 375 380
Met Glu Asn Glu Ser Asp Lys Tyr Tyr Phe Asn Pro Glu Thr Lys Lys
385 390 395 400
Ala Cys Lys Gly Ile Asn Leu Ile Asp Asp Ile Lys Tyr Tyr Phe Asp
405 410 415
Glu Lys Gly Ile Met Arg Thr Gly Leu Ile Ser Phe Glu Asn Asn Asn
420 425 430
Tyr Tyr Phe Asn Glu Asn Gly Glu Met Gln Phe Gly Tyr Ile Asn Ile
435 440 445
Glu Asp Lys Met Phe Tyr Phe Gly Glu Asp Gly Val Met Gln Ile Gly
450 455 460
Val Phe Asn Thr Pro Asp Gly Phe Lys Tyr Phe Ala His Gln Asn Thr
465 470 475 480
Leu Asp Glu Asn Phe Glu Gly Glu Ser Ile Asn Tyr Thr Gly Trp Leu
485 490 495
Asp Leu Asp Glu Lys Arg Tyr Tyr Phe Thr Asp Glu Tyr Ile Ala Ala
500 505 510
Thr Gly Ser Val Ile Ile Asp Gly Glu Glu Tyr Tyr Phe Asp Pro Asp
515 520 525
Thr Ala Gln Leu Val Ile Ser Glu
530 535
<210> 26
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетически синтезированный пептидный линкер
<400> 26
Gly Gly Gly Gly
1
<210> 27
<211> 8
<212> БЕЛОК
<213> Неизвестно
<220>
<223> последовательность сайта расщепления фурином
<400> 27
Arg Ala Arg Arg Arg Lys Lys Arg
1 5
<210> 28
<211> 24
<212> ДНК
<213> Неизвестно
<220>
<223> последовательность сайта расщепления фурином
<400> 28
cgcgctcgcc gccgcaagaa gcgc 24
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Композиции, относящиеся к мутантному токсину CLOSTRIDIUM DIFFICILE, и способы их применения | 2017 |
|
RU2773880C1 |
| Композиции, относящиеся к мутантному токсину CLOSTRIDIUM DIFFICILE, и способы их применения | 2012 |
|
RU2754446C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ВЫЗЫВАНИЯ ИММУННОГО ОТВЕТА ПРОТИВ CLOSTRIDIUM DIFFICILE | 2018 |
|
RU2773917C2 |
| ВАКЦИННЫЕ КОМПОЗИЦИИ, ХАРАКТЕРИЗУЮЩИЕСЯ УЛУЧШЕННОЙ СТАБИЛЬНОСТЬЮ И ИММУНОГЕННОСТЬЮ | 2016 |
|
RU2730625C2 |
| Слитые молекулы, происходящие от Cholix-токсина, для пероральной доставки биологически активных нагрузок | 2015 |
|
RU2723178C2 |
| ГИБРИДНЫЕ НЕЙРОТОКСИНЫ | 2017 |
|
RU2782382C2 |
| Антитело моноклональное мышиное 1Е10 и антитело рекомбинантное химерное (мышь-человек) xi1E10, нейтрализующие летальный токсин Bacillus anthracis, и штамм гибридных культивируемых клеток животных Mus musculus 1E10 | 2020 |
|
RU2745116C1 |
| ПЕСТИЦИДНЫЕ ГЕНЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2742467C2 |
| ПЕСТИЦИДНЫЕ ГЕНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2727665C2 |
| ПЕСТИЦИДНЫЕ ГЕНЫ И СПОСОБЫ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2746927C2 |
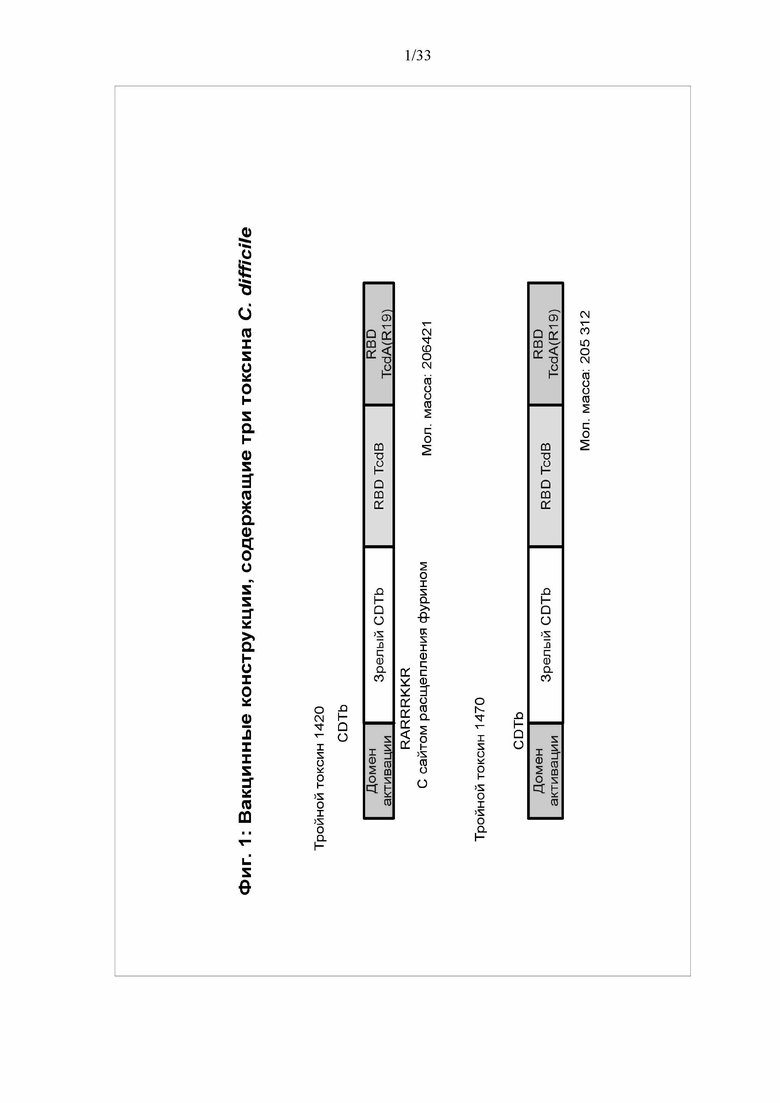

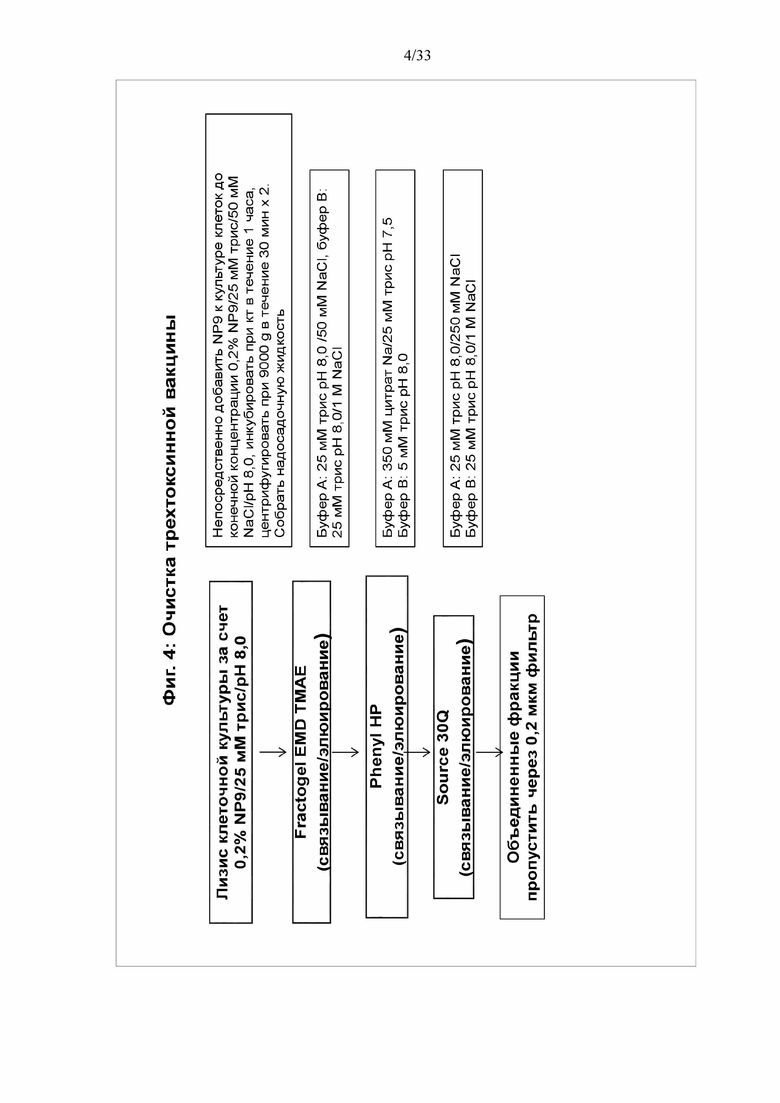
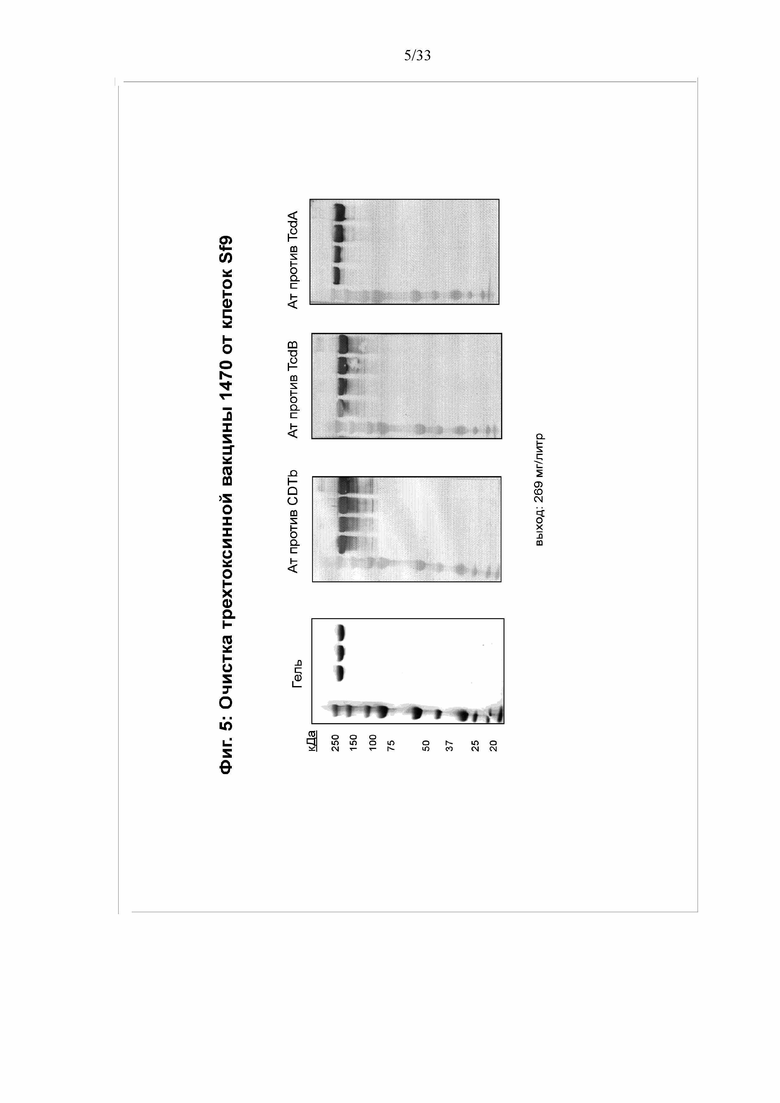
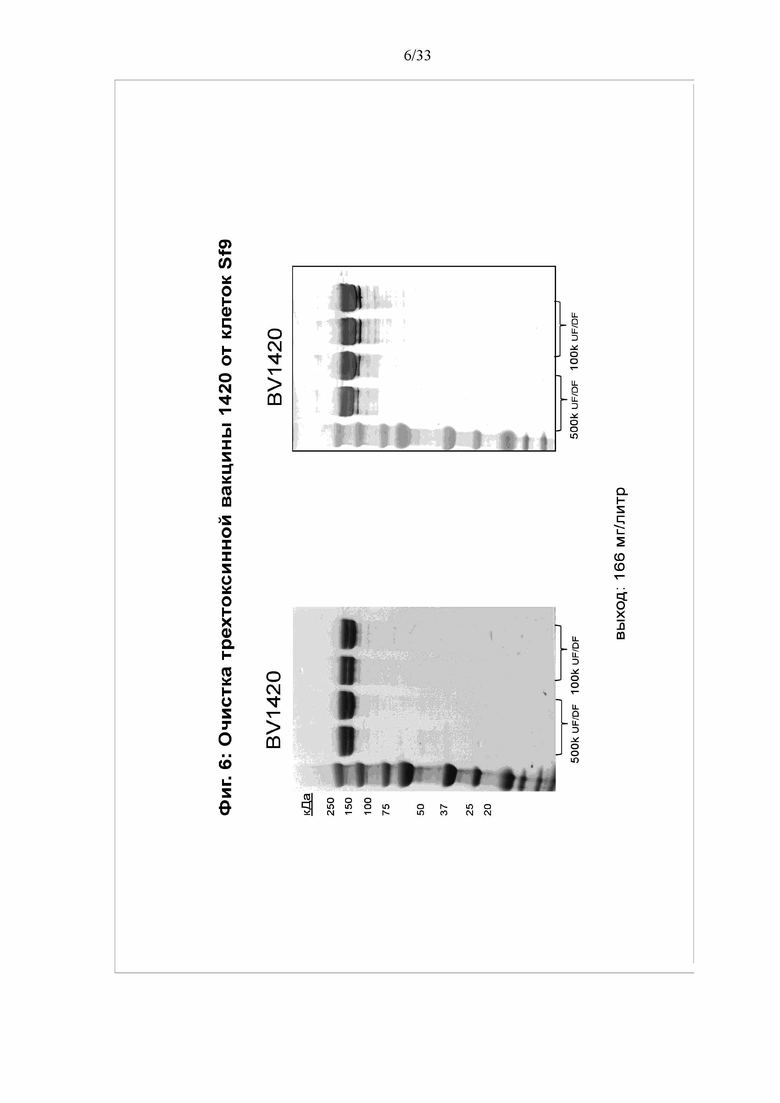
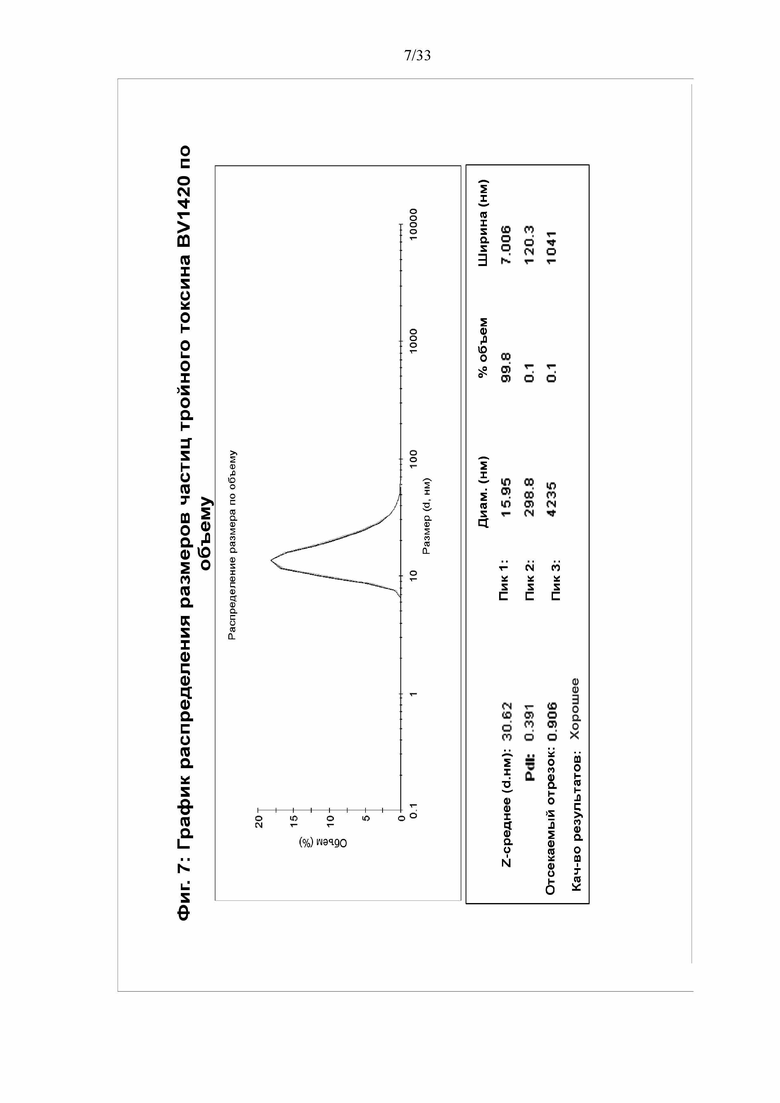

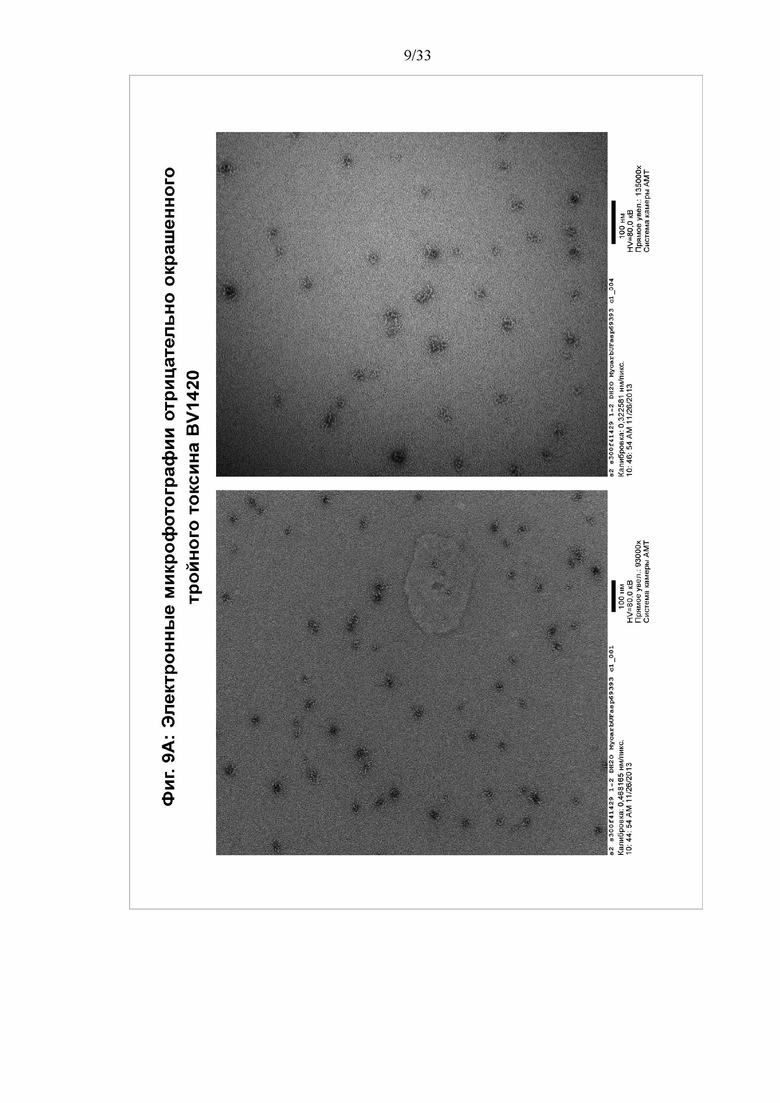
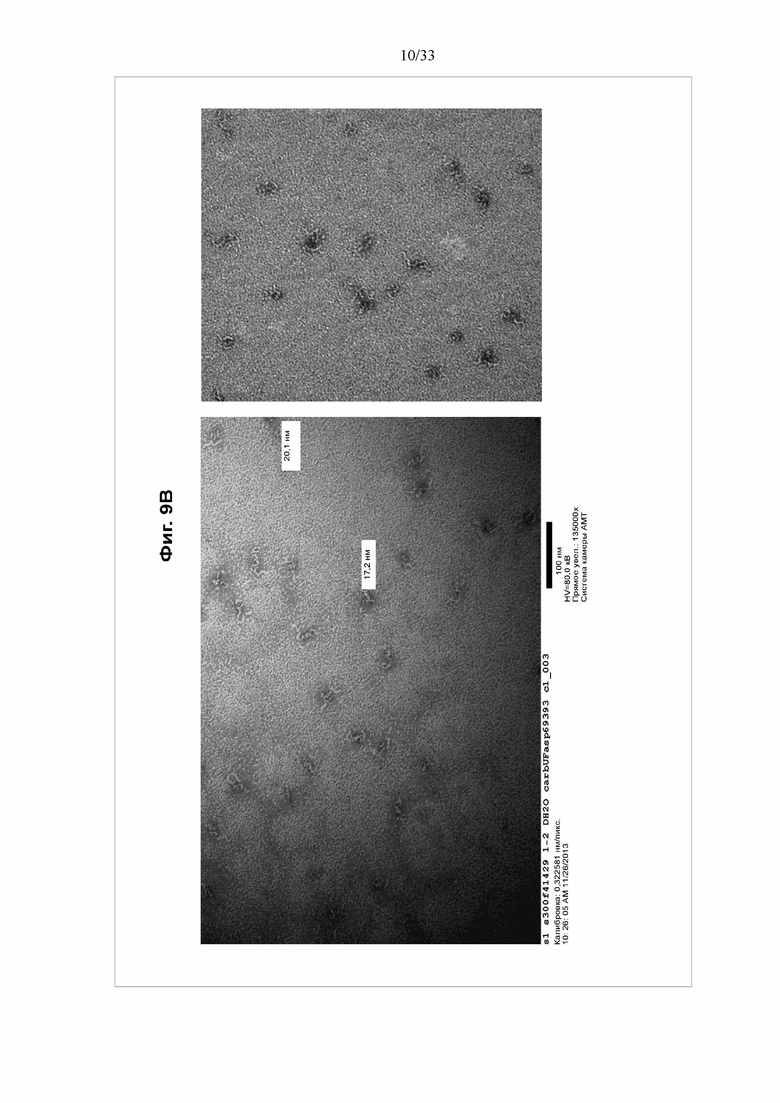
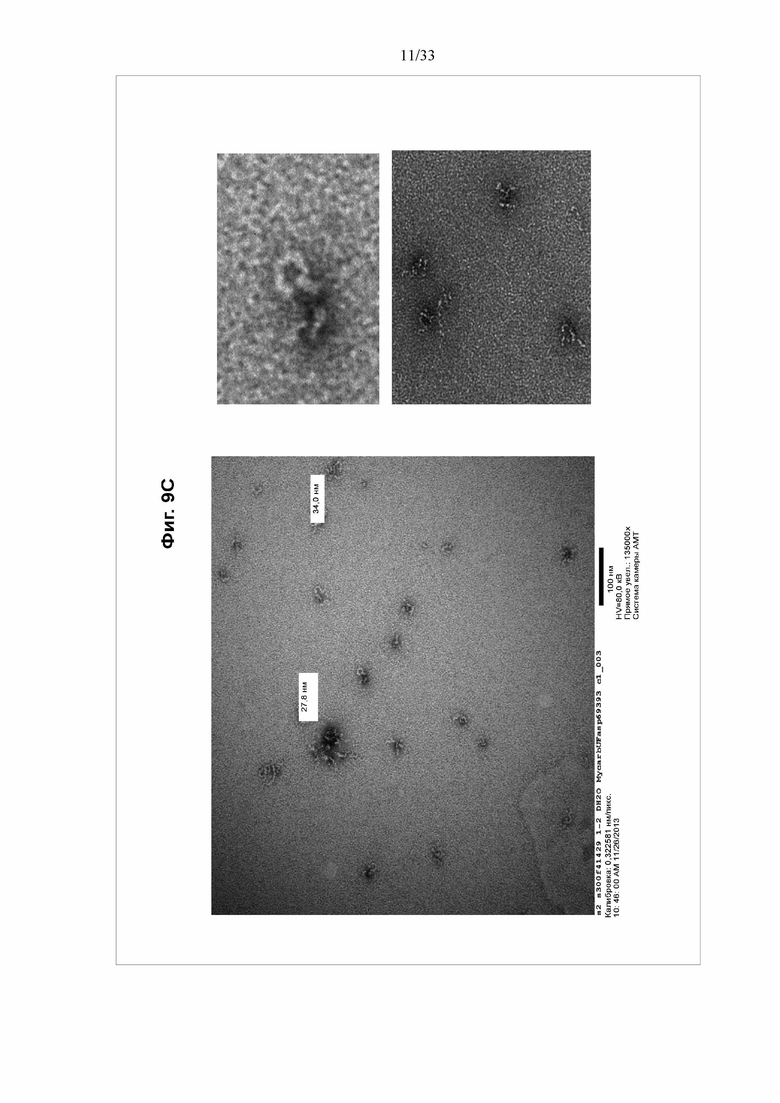
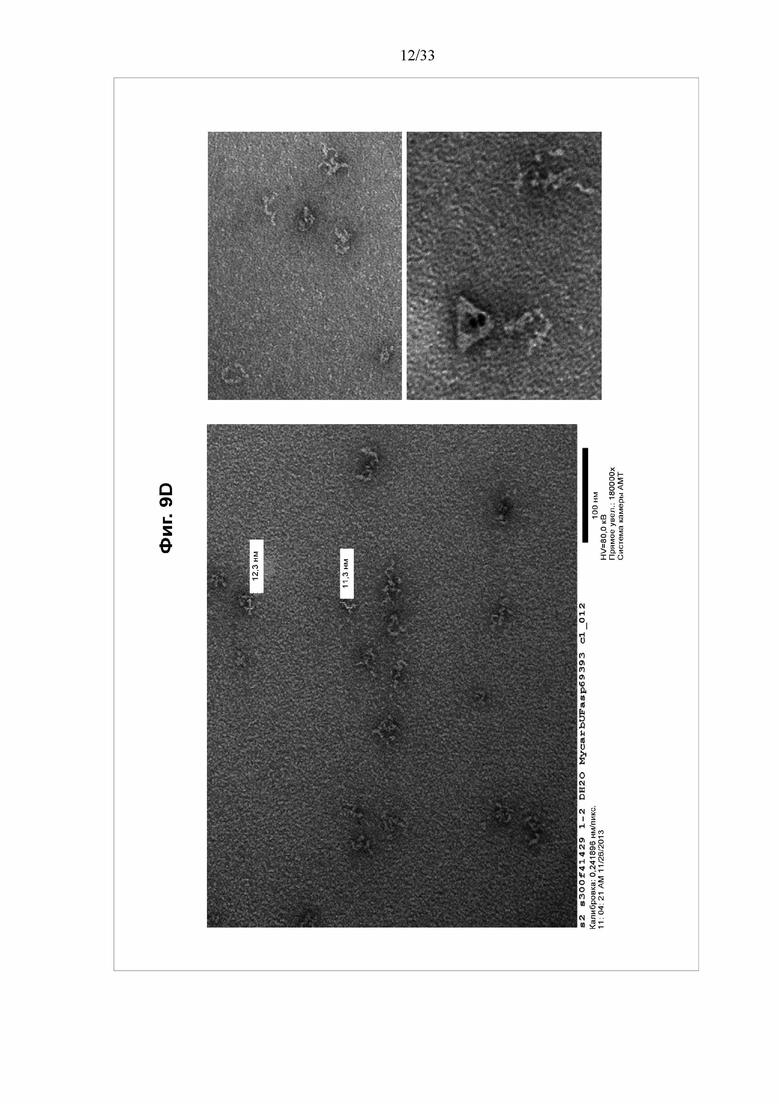
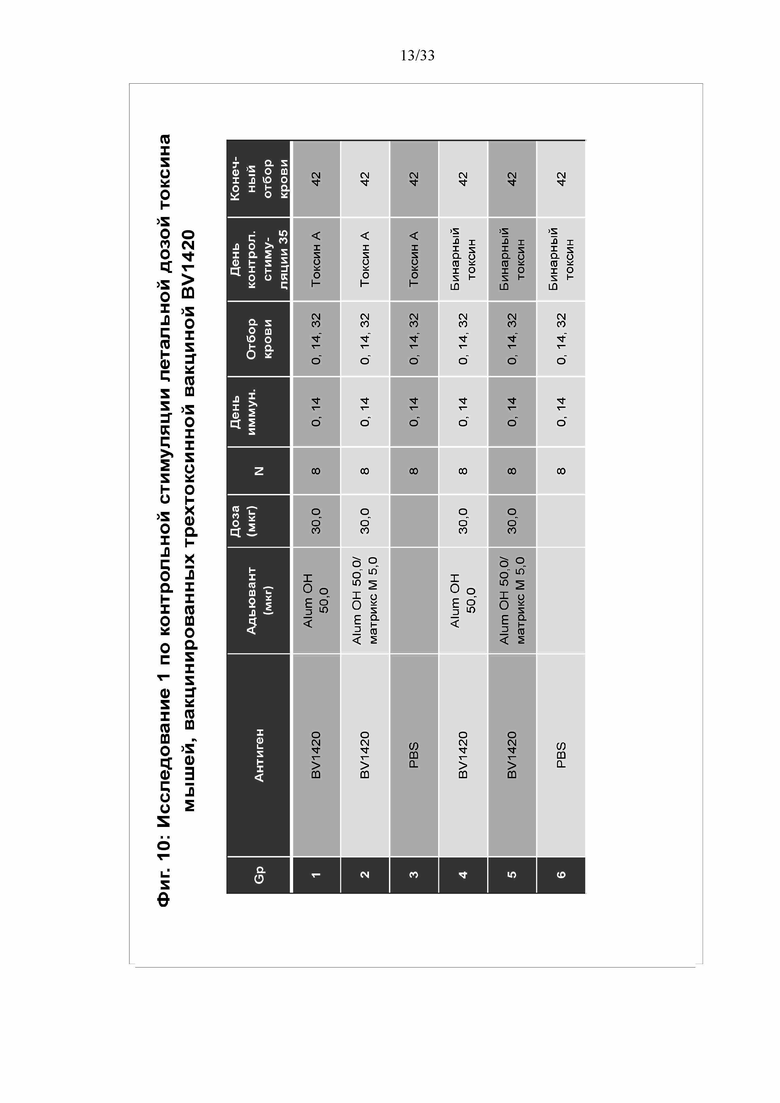
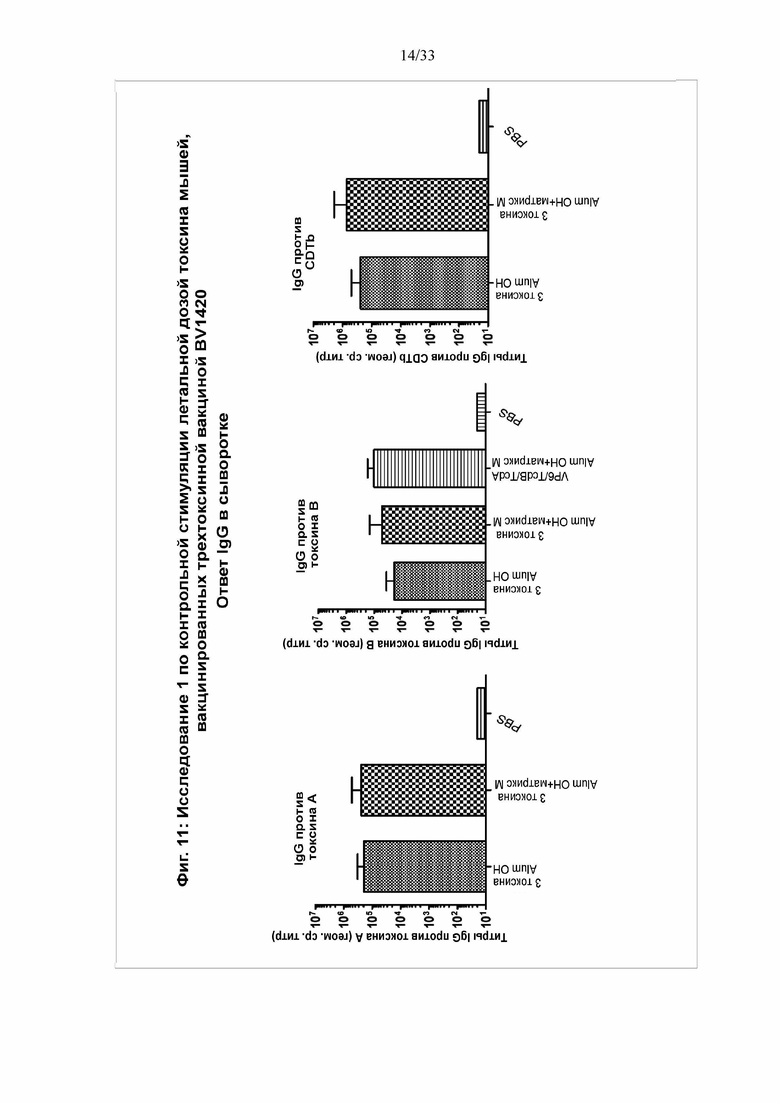

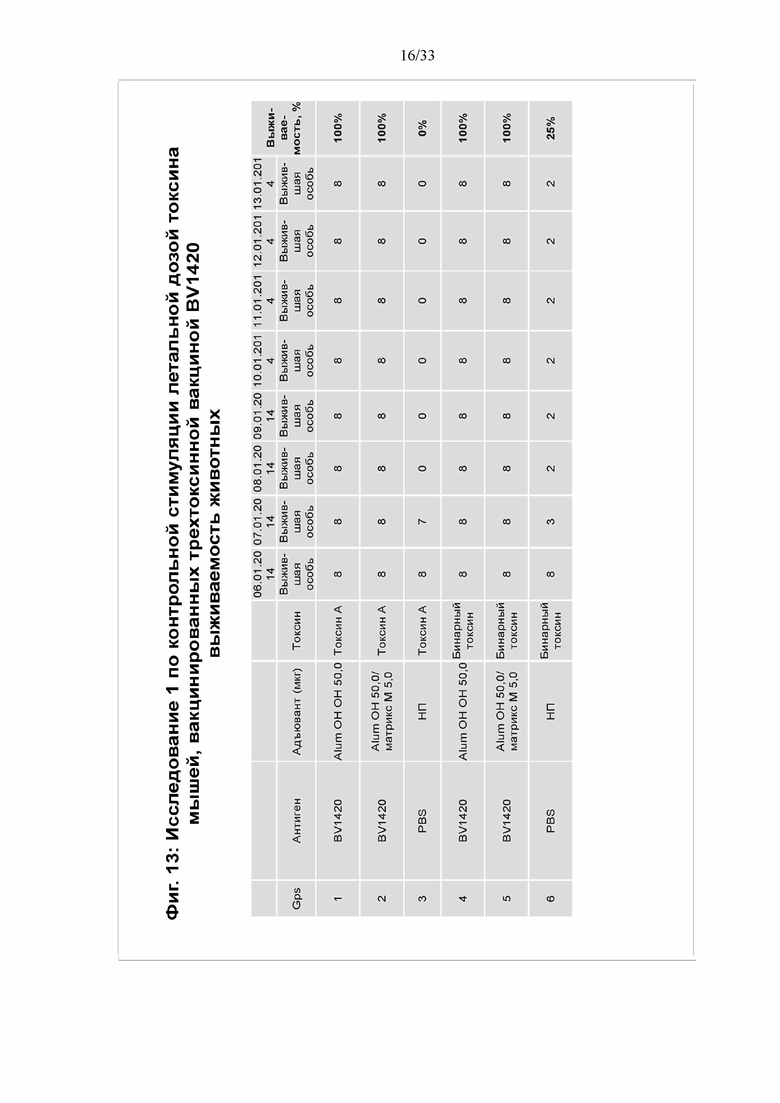
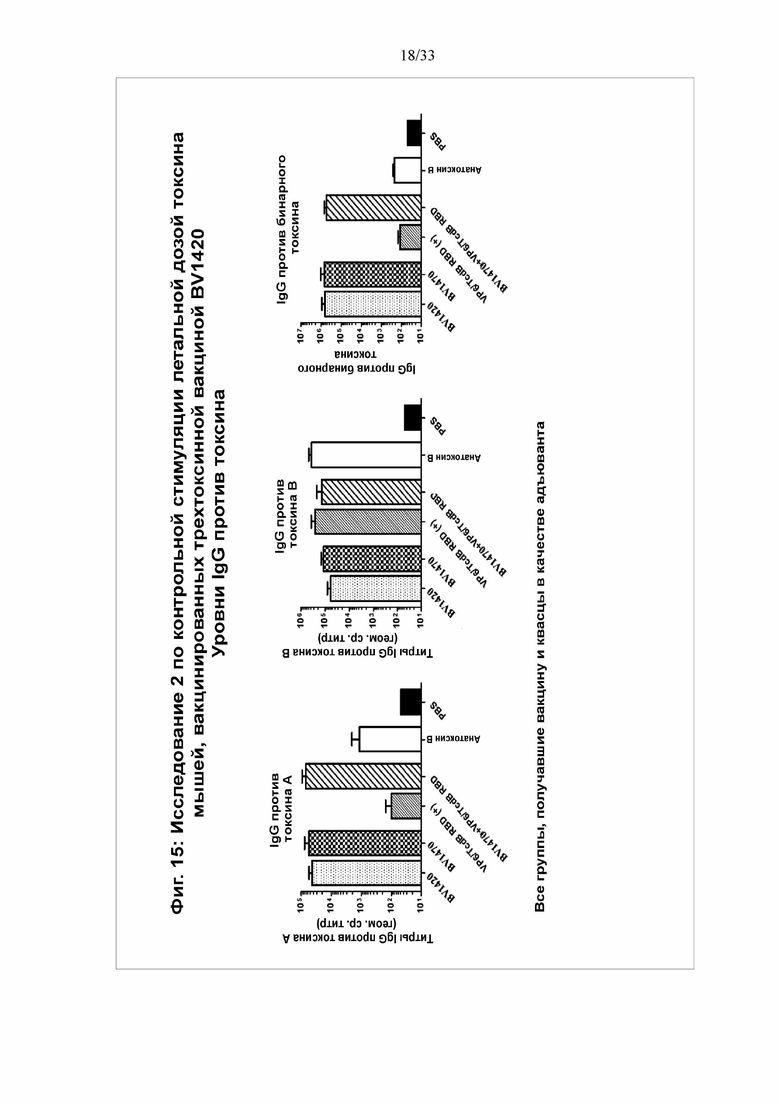

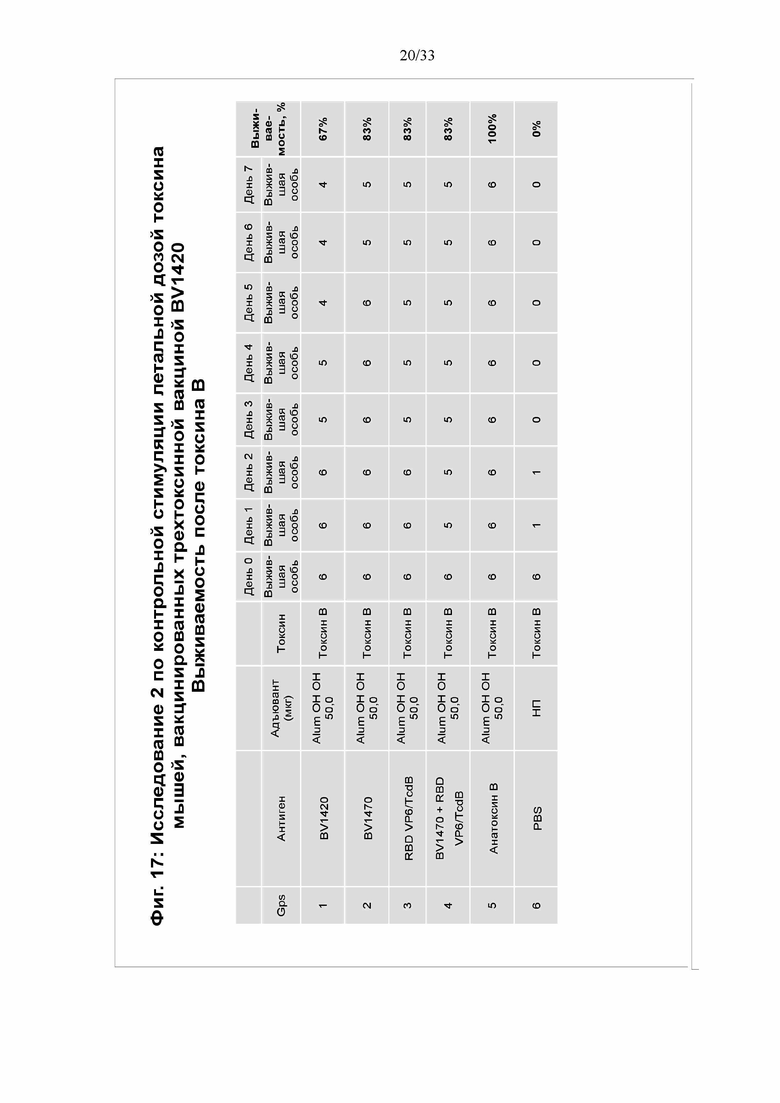
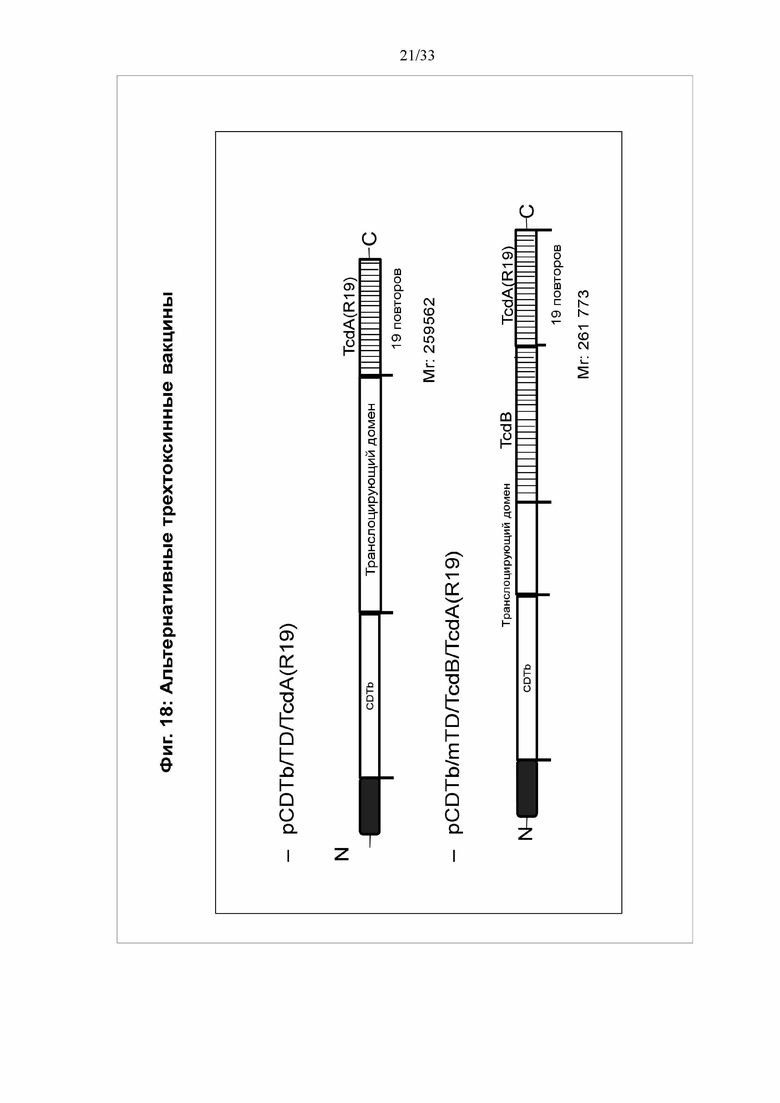


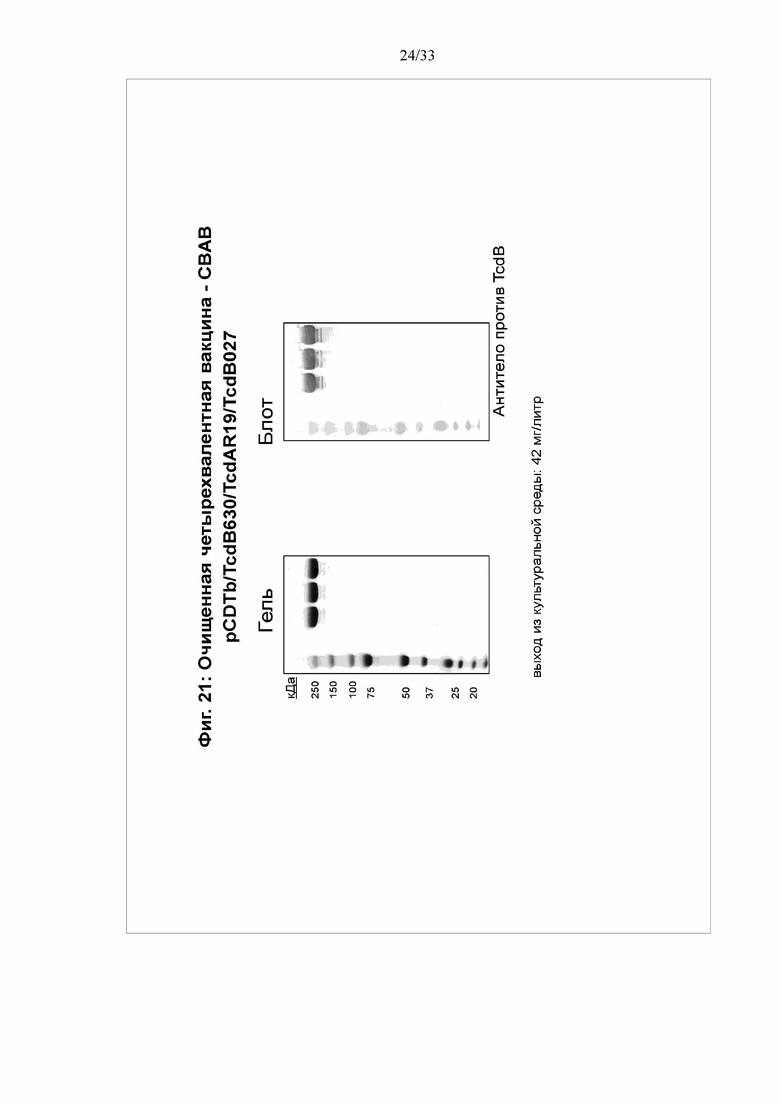
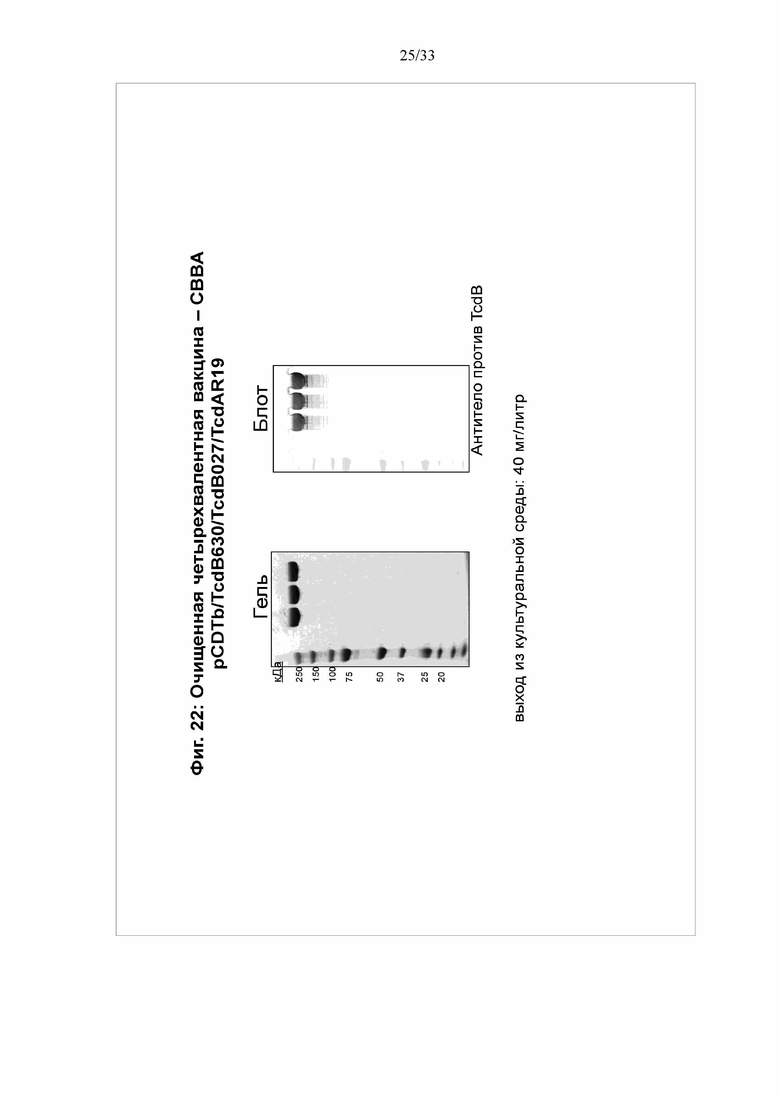
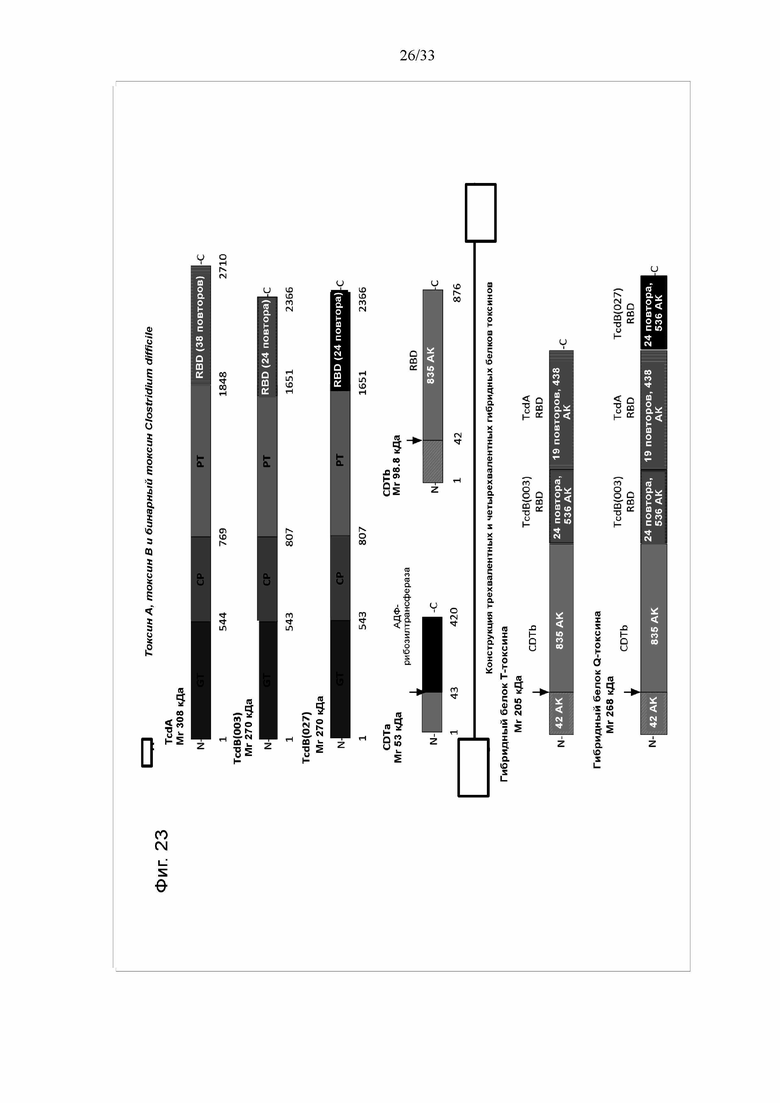
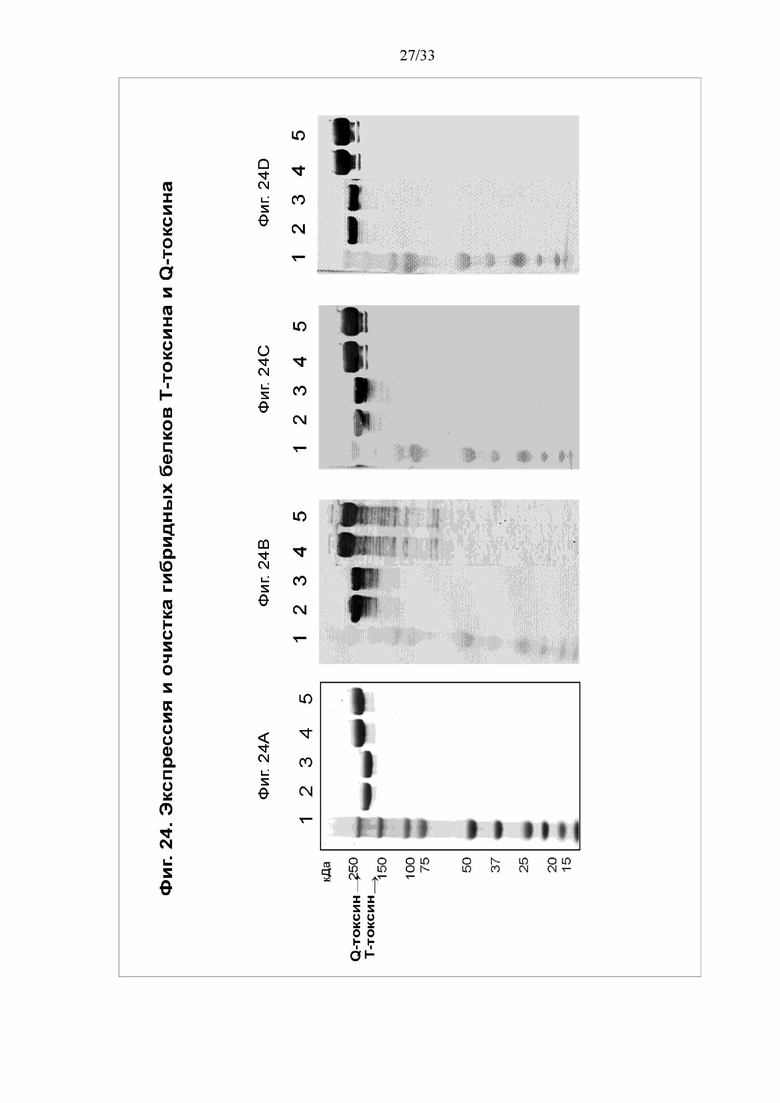
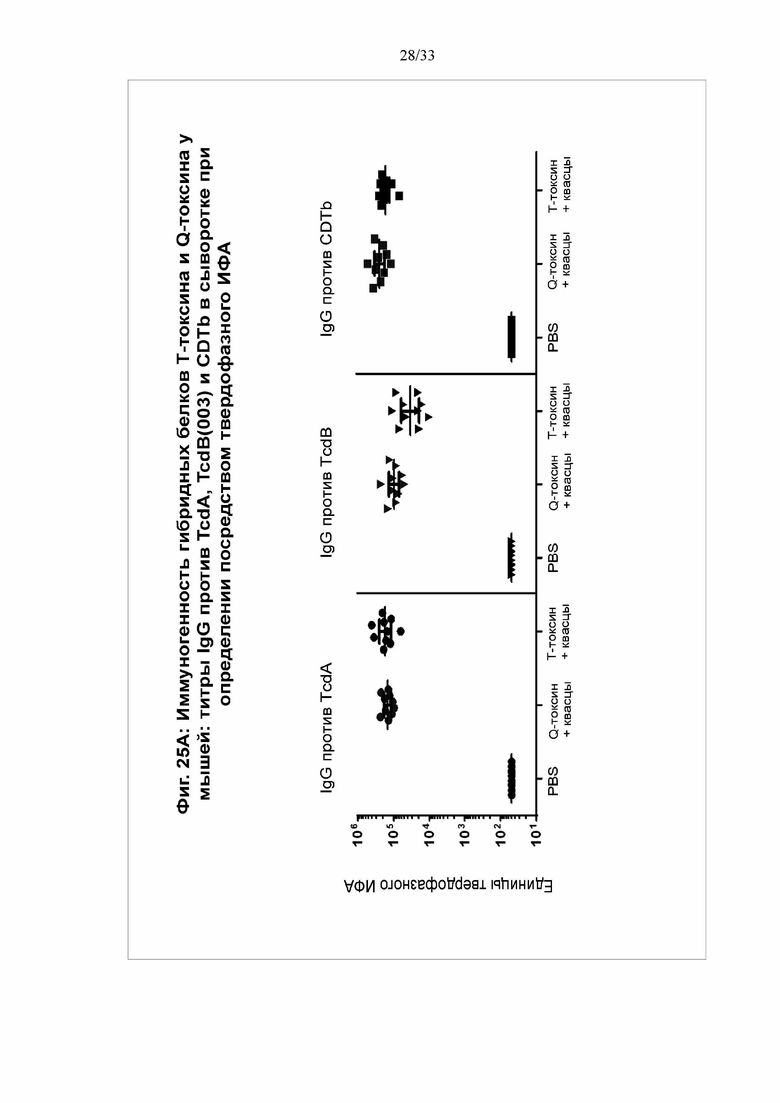
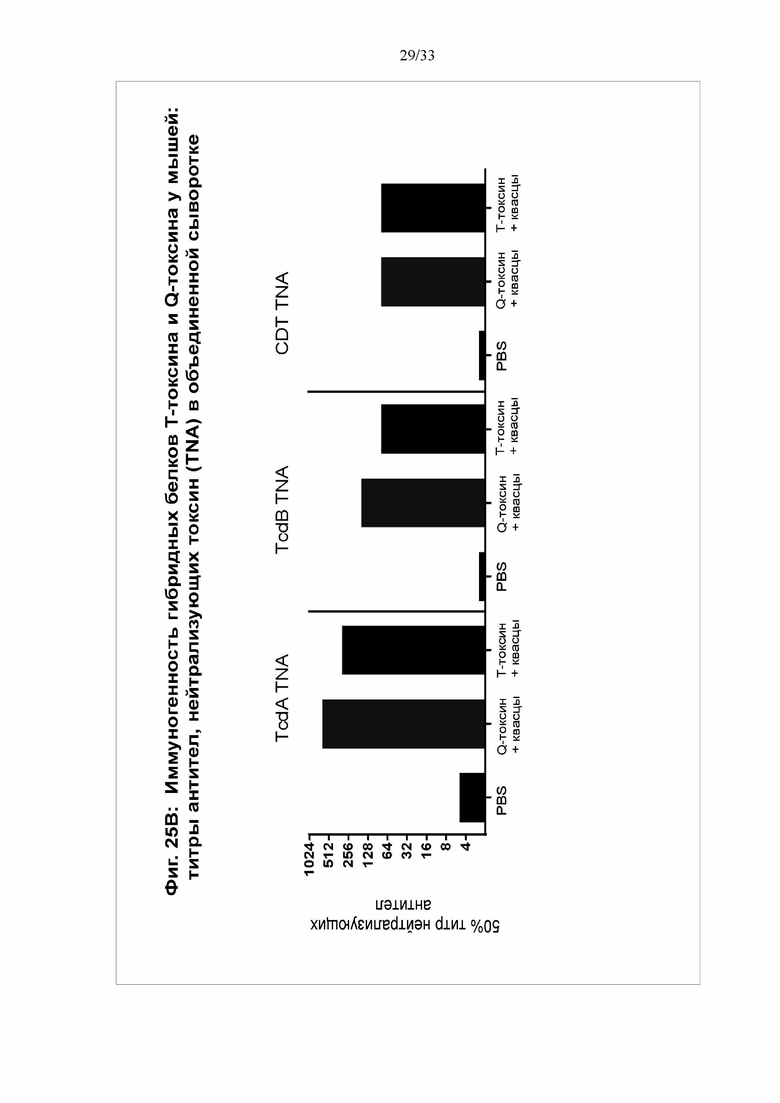
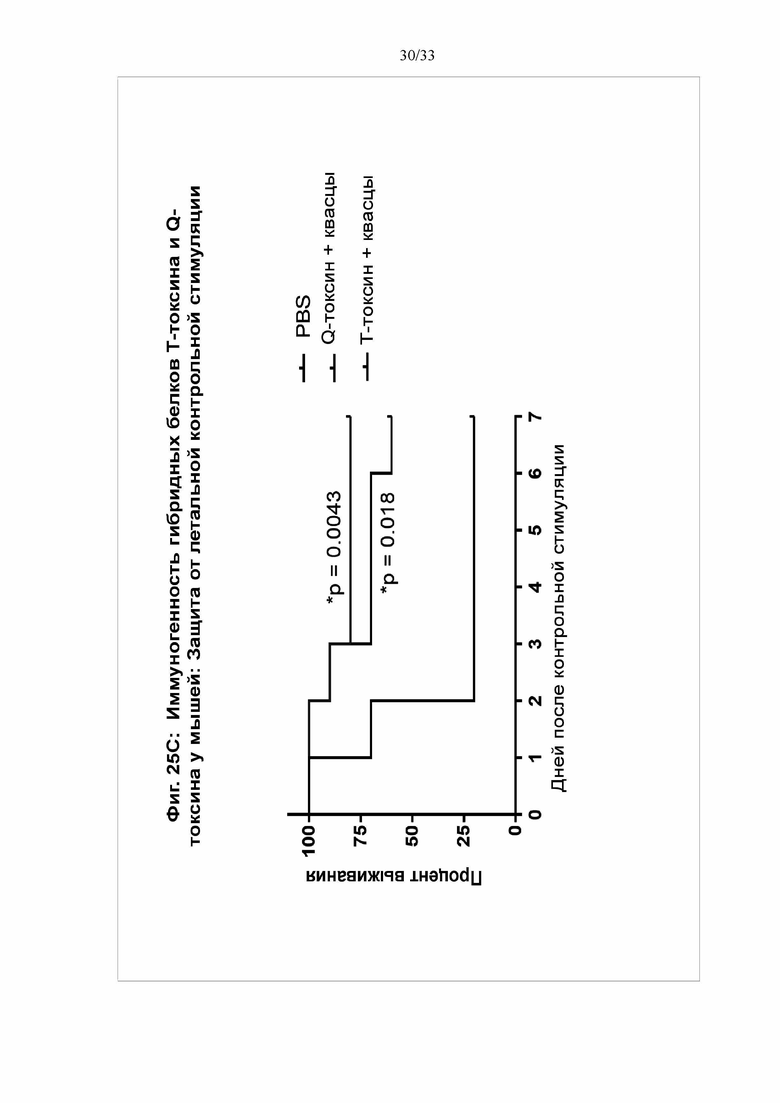
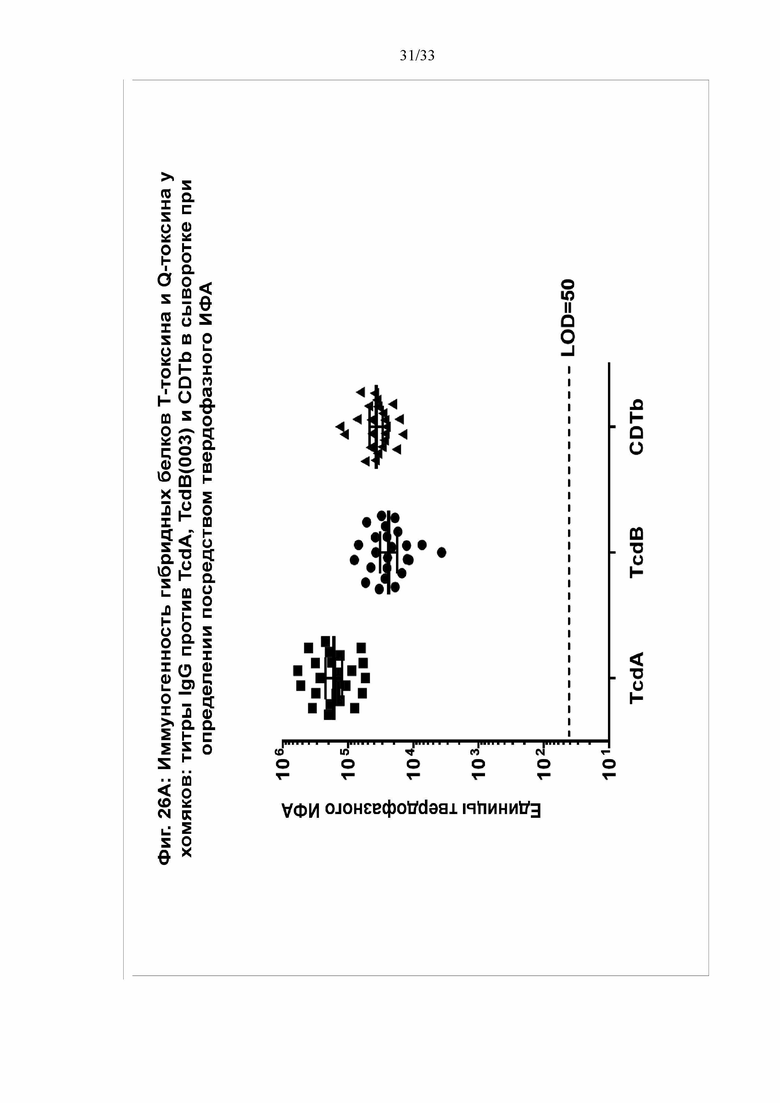
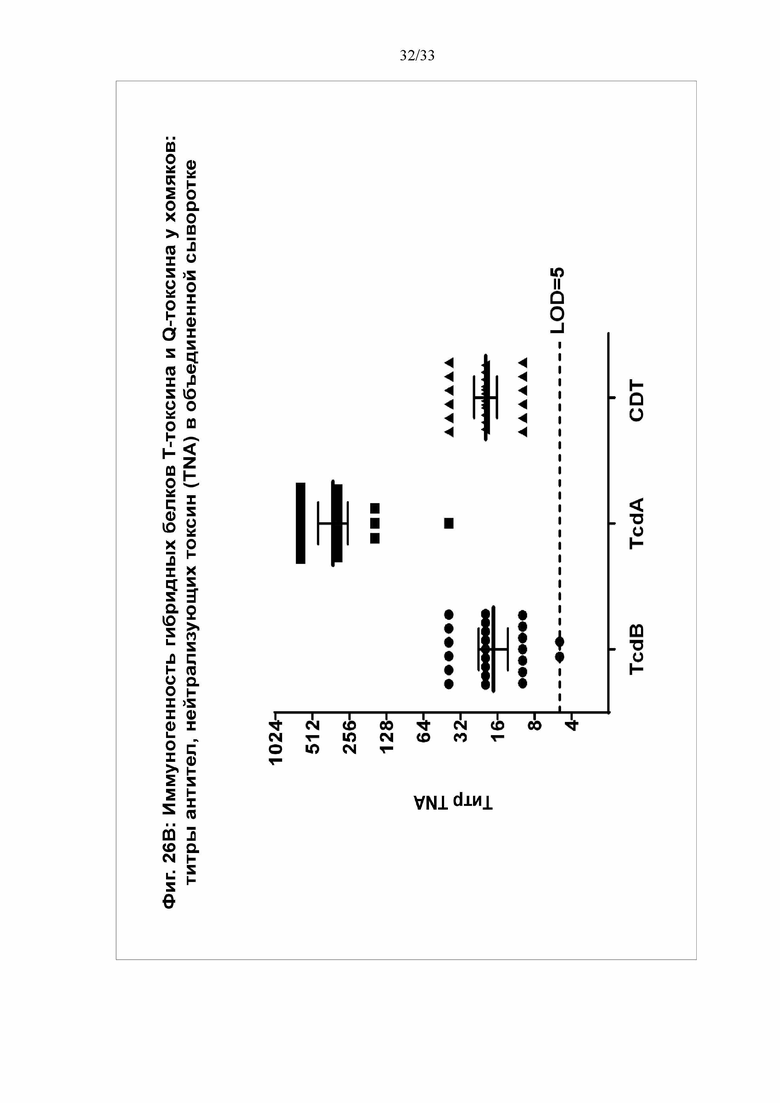
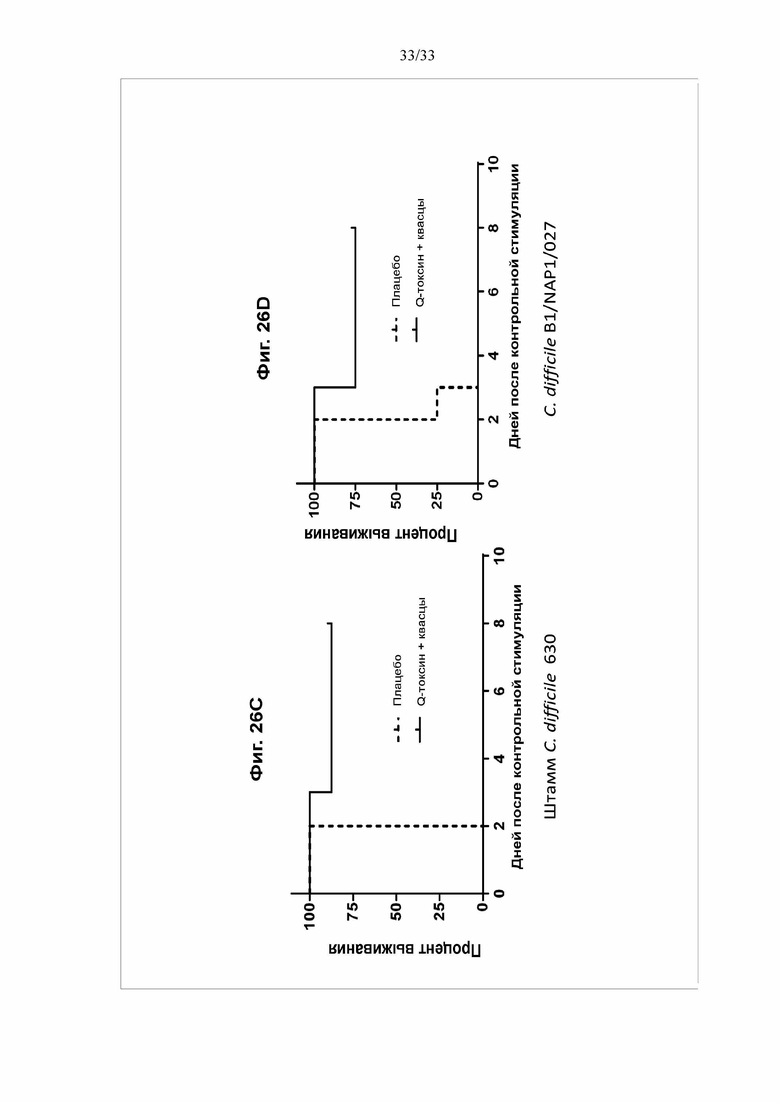
Изобретение относится к способам и композициям для индукции иммунного ответа против C. difficile. В конкретных аспектах композиции представляют собой вакцины, содержащие мультимерные полипептиды, содержащие фрагменты нескольких токсинов бактерии. Эти полипептиды индуцируют эффективный иммунный ответ, тем самым обеспечивая лечение или профилактику инфекции.7 н. и 18 з.п. ф-лы, 1 табл., 26 ил., 10 пр.
1. Мультивалентный иммуногенный полипептид для индукции иммунного ответа против Clostridium difficile (C. difficile), содержащий фрагменты по меньшей мере четырех белков-токсинов C. difficile, при этом фрагменты по меньшей мере четырех белков-токсинов C. difficile представляют собой:
(i) фрагмент бинарного токсина (CDT), содержащий рецептор-связывающий компонент бинарного токсина (CDTb), при этом последовательность фрагмента CDT по меньшей мере на 90% идентична последовательности SEQ ID NO:22;
(ii) фрагмент токсина A, содержащий укороченный рецептор-связывающий домен белка токсина A (TcdA), содержащий 19 повторов, при этом последовательность фрагмента токсина A по меньшей мере на 90% идентична последовательности SEQ ID NO:24;
(iii) первый фрагмент токсина B, содержащий рецептор-связывающий домен первого белка токсина B, при этом последовательность первого фрагмента токсина B по меньшей мере на 90% идентична последовательности SEQ ID 15 NO:23; и
(iv) второй фрагмент токсина B, содержащий рецептор-связывающий домен второго белка токсина B, при этом последовательность второго фрагмента токсина B по меньшей мере на 90% идентична последовательности SEQ ID NO:25;
причем первый белок токсина B и второй белок токсина B получены из разных штаммов C. difficile.
2. Мультивалентный иммуногенный полипептид по п. 1, характеризующийся тем, что по меньшей мере один белок токсина B получен из эпидемического штамма.
3. Мультивалентный иммуногенный полипептид по п. 2, характеризующийся тем, что эпидемический штамм представляет собой штамм NAP1 (TcdB(027)).
4. Мультивалентный иммуногенный полипептид по п. 1, характеризующийся тем, что один из белков токсина B получен из штамма 630 (TcdB(003)).
5. Мультивалентный иммуногенный полипептид по п. 1, характеризующийся тем, что указанные фрагменты ориентированы так, что фрагмент токсина А располагается между двумя фрагментами токсина B.
6. Мультивалентный иммуногенный полипептид по п. 1, характеризующийся тем, что указанный фрагмент CDT располагается со стороны N-конца одного или обоих фрагментов токсина B.
7. Мультивалентный иммуногенный полипептид по п. 1, характеризующийся тем, что фрагмент CDT содержит аминокислотную последовательность, состоящую из SEQ ID NO:22.
8. Мультивалентный иммуногенный полипептид по п. 1, характеризующийся тем, что один из фрагментов токсина В содержит аминокислотную последовательность, состоящую из SEQ ID NO:23.
9. Мультивалентный иммуногенный полипептид по п. 1, характеризующийся тем, что второй фрагмент токсина В содержит аминокислотную последовательность, состоящую из SEQ ID NO:25.
10. Мультивалентный иммуногенный полипептид по п. 1, характеризующийся тем, что фрагмент токсина А содержит аминокислотную последовательность, состоящую из SEQ ID NO:24.
11. Мультивалентный иммуногенный полипептид по п. 1, характеризующийся тем, что каждый из фрагментов разделен линкером из двух аминокислот, линкером из трех аминокислот или линкером из четырех аминокислот.
12. Мультивалентный иммуногенный полипептид по п. 11, характеризующийся тем, что указанные фрагменты разделены линкером из двух аминокислот, и указанный линкер выбран из группы, состоящей из аланина-серина (AS), лейцина-глутаминовой кислоты (LE) и серина-аргинина (SR).
13. Мультивалентный иммуногенный полипептид по п. 1, характеризующийся тем, что указанный полипептид содержит аминокислотную последовательность SEQ ID NO:21.
14. Молекула нуклеиновой кислоты, содержащая полинуклеотид, кодирующий полипептид по любому из пп. 1-13.
15. Способ получения полипептида по п. 1, включающий
(а) экспрессию полипептида в клетке-хозяине насекомого;
(b) очистку полипептида в присутствии неионогенного детергента в форме наночастиц и
(c) суспендирование наночастиц в фармацевтически приемлемом носителе, вспомогательном веществе или разбавителе.
16. Способ по п. 15, характеризующийся тем, что хозяин-насекомое представляет собой клетку Sf9.
17. Способ по п. 15 или 16, характеризующийся тем, что клетку-хозяина насекомого трансфицируют рекомбинантной бакуловирусной конструкцией в 15 подходящих для экспрессии полипептида условиях.
18. Вакцинная композиция для индукции иммунного ответа против Clostridium difficile, содержащая иммуногенный полипептид по любому из пп. 1-13 и фармацевтически приемлемый носитель, вспомогательное вещество или разбавитель.
19. Вакцинная композиция по п. 18, характеризующаяся тем, что указанная композиция содержит адьювант.
20. Вакцинная композиция по п. 18 или 19, характеризующаяся тем, что указанный адьювант представляет собой адьювант на основе сапонина.
21. Вакцинная композиция по любому из пп. 18-20, характеризующаяся тем, что адьювант на основе сапонина содержит матрикс фракции A и матрикс фракции C.
22. Вакцинная композиция по любому из пп. 18-21, характеризующаяся тем, что количество матрикса фракции A составляет от приблизительно 85% до приблизительно 92%, а остальная часть представляет собой матрикс фракции C.
23. Применение полипептида по любому из пп. 1-13 для производства медикамента для профилактики или лечения инфекции Clostridium Difficile.
24. Применение молекулы нуклеиновой кислоты по п. 14 для производства медикамента для профилактики или лечения инфекции Clostridium Difficile.
25. Наночастица, содержащая мультивалентный иммуногенный полипептид по любому из пп. 1-13 и неионогенный детергент.
| WO 2013112867 A1, 01.08.2013 | |||
| WO 2011060431 A2, 19.05.2011 | |||
| WO 2015197737 A1, 30.12.2015 | |||
| RU 2014127714 A, 27.01.2016. |
Авторы
Даты
2022-10-04—Публикация
2018-03-15—Подача