РОДСТВЕННЫЕ ПАТЕНТНЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет предварительной заявки США №61/990,054, поданной 7 мая 2014 г., полностью включенной в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Пероральная доставка биологически активных полипептидов (относящихся к полимерам, состоящим из аминокислотных остатков; как правило, также определяемым как белки или пептиды) представляет долгосрочную цель фармацевтической промышленности. К сожалению, существуют многочисленные физические, физиологические и биологические барьеры желудочно-кишечного (GI) тракта для ингибирования захвата белков и пептидов до тех пор, пока они не претерпевают существенный распад для поглощения посредством переносчиков аминокислот и ди- или трипептидов, и/или для транспорта белков и пептидов внутрь клетки в деструктивные лизосомальные компартменты после эндосомального захвата на поверхности просвета. Как таковая, возможность захвата полипептида из кишечника таким же путем, как достижимый, например, для малых молекул, ограничена, и низкая пероральная биодоступность продолжает оставаться проблемой для большинства полипептидов и белков.
Хотя получены некоторые перспективные результаты клинических исследований, в которых оценивали различные биологически активные полипептиды для лечения заболеваний, таких как рак, воспалительные заболевания, иммунные заболевания, расстройства, ассоциированные с дефицитом роста, и т.д., и несколько терапевтических средств на основе ДНК было одобрено FDA (Управление по контролю за пищевыми продуктами и лекарственными средствами США) для таких применений, эти терапевтические средства часто неспособны фактически достигать своего оптимального потенциала, поскольку их общая эффективность чаще всего крайне мала или неадекватна в связи с присущими им ограничениями, такими как короткий период биологического полувыведения, препятствующий доставке оптимальных терапевтически эффективных дозировок, и/или пагубные побочные и токсические эффекты, наблюдаемые при терапевтически эффективных дозах. Кроме того, для многих таких терапевтических средств требуются схемы многократного дозирования, обусловливающие необходимость в непрерывном внутривенном введении или частых подкожных инъекциях, что обременительно для пациентов и лиц, осуществляющих медицинскую помощь.
Значительную пользу для дальнейших клинических исследований, направленных на оценку перспективных биологически активных полипептидов, могли бы принести новые способы и/или фармацевтические композиции, которые можно было бы применять для перорального введения таких полипептидов субъекту-человеку.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическим композициям, содержащим новые слитые молекулы неприродного происхождения и один или более фармацевтически приемлемых носителей, приготовленным для пероральной доставки и предназначенным для обеспечения усовершенствованных, эффективных видов терапии для лечения, например, воспалительных заболеваний и/или аутоиммунных заболеваний и/или злокачественных опухолей.
Настоящее изобретение отчасти основано на уникальном открытии авторов изобретения, что пероральная доставка фармацевтической композиции, содержащей слитую молекулу, которая включает в себя модифицированный Cholix-токсин, связанный с биологически активной нагрузкой, может среди прочего обеспечить следующие преимущества: а) в воплощениях изобретения, где модифицированный Cholix-токсин связан с биологически активной нагрузкой без линкера или с нерасщепляемым линкером, якорный эффект модифицированного Cholix-токсина посредством его рецептора(ов) на поверхности, например, иммунных клеток, которые также экспрессируют рецептор для биологически активной нагрузки, может дать возможность для большего доступа к биологически активной нагрузке на поверхности клеток-мишеней и обеспечить синергетическое действие за счет связывания как с Cholix-рецептором, так и с рецептором биологически активной нагрузки; б) в воплощениях изобретения, где модифицированный Cholix-токсин связан с биологически активной нагрузкой посредством линкера, расщепляемого ферментом, присутствующим на базолатеральной мембране эпителиальной клетки, или ферментом, присутствующим в плазме крови субъекта, такое расщепление даст возможность высвобождения биологически активной нагрузки от остальной части слитой молекулы вскоре после трансцитоза через эпителиальную мембрану; в) за счет прямой доставки биологически активной нагрузки в подслизистое пространство GI (желудочно-кишечного) тракта и в воротную систему печени можно уменьшить системную токсичность, наблюдаемую при введении нагрузок парентеральными путями, а также обеспечить доступ к подслизистой биологической мишени, которая трудно достигается путями, отличающимися от перорального пути или посредством GI; г) после переноса через GI эпителий слитые молекулы по изобретению будут демонстрировать пролонгированный период полувыведения из сыворотки, то есть биологически активные нагрузки слитых молекул будут демонстрировать пролонгированный период полувыведения из сыворотки по сравнению с биологически активными нагрузками в неслитом состоянии; д) пероральное введение слитой молекулы может доставлять более высокую эффективную концентрацию доставляемой биологически активной нагрузки в печень субъекта по сравнению с наблюдаемой в плазме крови субъекта; е) способность к доставке биологически активной нагрузки субъекту без применения иглы для прокалывания кожи субъекта, что позволяет улучшить качество жизни таких субъектов за счет избегания связанных с этим боли или потенциальных осложнений и, кроме того, повышает удобство и соблюдение режима и схемы лечения пациентом/лицом, осуществляющим медицинскую помощь.
Таким образом, в одном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим слитую молекулу неприродного происхождения и один или более фармацевтически приемлемых носителей, приготовленным для пероральной доставки, где слитая молекула содержит модифицированный Cholix-токсин, связанный с биологически активной нагрузкой для доставки субъекту, где Cholix-токсин является нетоксичным.
В одном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим слитую молекулу неприродного происхождения и один или более фармацевтически приемлемых носителей, приготовленным для пероральной доставки, где слитая молекула содержит модифицированный Cholix-токсин, связанный с биологически активной нагрузкой для доставки субъекту, где Cholix-токсин является нетоксичным, и где слитая молекула обладает способностью к активации рецептора биологически активной нагрузки или к обеспечению каталитического процесса каталитически активного вещества.
В различных воплощениях изобретения слитые молекулы фармацевтических композиций содержат модифицированный Cholix-токсин, усеченный по аминокислотному остатку внутри домена II Cholix-токсина. В различных воплощениях изобретения слитые молекулы содержат усеченный Cholix-токсин, имеющий аминокислотную последовательность, представленную, например, в SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 19, SEQ ID NO: 20, SEQ ID NO: 21, SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40 или SEQ ID NO: 41.
В различных воплощениях изобретения слитые молекулы фармацевтических композиций содержат модифицированный Cholix-токсин, усеченный по аминокислотному остатку внутри домена Ib Cholix-токсина. В различных воплощениях изобретения слитые молекулы содержат усеченный Cholix-токсин, имеющий аминокислотную последовательность, представленную, например, в SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79 или SEQ ID NO: 80.
В различных воплощениях изобретения слитые молекулы фармацевтических композиций содержат модифицированный Cholix-токсин, в котором домен III усечен или мутирован. В различных воплощениях изобретения слитые молекулы содержат мутированный Cholix-токсин, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 81, в которой аминокислотный остаток Е581 SEQ ID NO: 1 делегирован (в настоящем документе обозначена как «Cholix ΔЕ581»).
В различных воплощениях изобретения слитые молекулы фармацевтических композиций содержат модифицированный Cholix-токсин, в котором домен Ia мутирован.
В различных воплощениях изобретения биологически активная нагрузка выбрана из, например, макромолекулы, малой молекулы, пептида, полипептида, нуклеиновой кислоты, мРНК (матричная РНК), микроРНК, кшРНК (короткая шпилечная РНК), миРНК (малая интерферирующая РНК), антисмысловой молекулы, антитела, ДНК, плазмиды, вакцины, полимерной наночастицы или каталитически активного вещества.
В различных воплощениях изобретения биологически активная нагрузка представляет собой фермент, выбранный из гиалуронидазы, стрептокиназы, активатора тканевого плазминогена, урокиназы или PGE(простагландин Е)-аденозиндезаминазы.
В различных воплощениях изобретения биологически активная нагрузка представляет собой полипептид, который представляет собой модулятор воспаления в GI тракте, выбранный из, например, интерлейкина-10, интерлейкина-19, интерлейкина-20, интерлейкина-22, интерлейкина-24 или интерлейкина-26. В различных воплощениях изобретения биологически активный полипептид представляет собой интерлейкин-10, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 82. В различных воплощениях изобретения биологически активный полипептид представляет собой интерлейкин-19, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 83. В различных воплощениях изобретения биологически активный полипептид представляет собой интерлейкин-20, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 84. В различных воплощениях изобретения биологически активный полипептид представляет собой интерлейкин-22, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 85. В различных воплощениях изобретения биологически активный полипептид представляет собой интерлейкин-24, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 86. В различных воплощениях изобретения биологически активный полипептид представляет собой интерлейкин-26, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 87. В различных воплощениях изобретения биологически активная нагрузка представляет собой модулятор воспаления в GI тракте, представляющий собой малую молекулу. В различных воплощениях изобретения биологически активная нагрузка представляет собой модулятор воспаления в GI тракте, который представляет собой антисмысловую молекулу или молекулу миРНК.
В различных воплощениях изобретения биологически активная нагрузка представляет собой ингибитор TNFSF (надсемейства факторов некроза опухоли), представляющий собой антитело или его фрагмент, либо искусственную конструкцию, представляющую собой антитело или его фрагмент, либо искусственную конструкцию, предназначенную для имитации связывания антитела или его фрагмента с его антигеном. В различных воплощениях изобретения биологически активная нагрузка представляет собой ингибитор TNFSF, представляющий собой белок, слитый с рецептором растворимого TNFSF. В различных воплощениях изобретения биологически активная нагрузка представляет собой ингибитор TNFSF, представляющий собой малую молекулу. В различных воплощениях изобретения биологически активная нагрузка представляет собой ингибитор TNFSF, представляющий собой антисмысловую молекулу или молекулу миРНК.
В различных воплощениях изобретения биологически активная нагрузка представляет собой антитело, содержащее аминокислотную последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 88, и аминокислотную последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 89. В различных воплощениях изобретения биологически активная нагрузка представляет собой антитело, содержащее аминокислотную последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 90, и аминокислотную последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 91. В различных воплощениях изобретения биологически активная нагрузка представляет собой димерный белок, слитый с рецептором растворимого TNFSF, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 92.
В одном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим новые слитые молекулы неприродного происхождения и один или более фармацевтически приемлемых носителей, приготовленным для пероральной доставки и предназначенным для обеспечения усовершенствованных, эффективных видов терапии для лечения метаболических расстройств, например диабета 1 типа и диабета 2 типа. Пероральная доставка биологически активных полипептидов (относящихся к полимерам, состоящим из аминокислотных остатков; как правило, также определяемым как белки или пептиды) представляет долгосрочную цель фармацевтической промышленности. К сожалению, существуют многочисленные физические, физиологические и биологические барьеры желудочно-кишечного (GI) тракта для ингибирования захвата белков и пептидов до тех пор, пока они не претерпевают существенный распад для поглощения посредством переносчиков аминокислот и ди- или трипептидов, и/или для транспорта белков и пептидов внутрь клетки в деструктивные лизосомальные компартменты после эндосомального захвата на поверхности просвета. Как таковая, возможность захвата полипептида из кишечника таким же путем, как достижимый, например, для малых молекул, ограничена, и низкая пероральная биодоступность продолжает оставаться проблемой для большинства полипептидов и белков.
В различных воплощениях настоящее изобретение относится к фармацевтическим композициям, содержащим слитую молекулу неприродного происхождения и один или более фармацевтически приемлемых носителей, приготовленным для пероральной доставки, где слитая молекула содержит модифицированный Cholix-токсин, связанный с глюкозоснижающим средством для доставки субъекту.
В различных воплощениях настоящее изобретение отчасти основано на том, что пероральная доставка фармацевтической композиции, содержащей слитую молекулу, которая включает в себя модифицированный Cholix-токсин, связанный с глюкозоснижающим средством, может среди прочего обеспечить следующие преимущества: а) в воплощениях изобретения, где модифицированный Cholix-токсин связан с глюкозоснижающим средством без линкера, якорный эффект модифицированного Cholix-токсина посредством его рецептора(ов) на поверхности клеток, которые также экспрессируют рецептор для глюкозоснижающего средства, может дать возможность для большего доступа к глюкозоснижающему средству на поверхности клеток-мишеней; б) в воплощениях изобретения, где модифицированный Cholix-токсин связан с глюкозоснижающим средством посредством линкера, расщепляемого ферментом, присутствующим на базолатеральной мембране эпителиальной клетки, или ферментом, присутствующим в плазме крови субъекта, такое расщепление даст возможность высвобождения глюкозоснижающего средства от остальной части слитой молекулы вскоре после трансцитоза через эпителиальную мембрану; в) за счет прямой доставки глюкозоснижающего средства в подслизистое пространство GI тракта и в воротную систему печени можно уменьшить системную токсичность, наблюдаемую при введении глюкозоснижающих средств парентеральными путями, а также обеспечить доступ к подслизистой биологической мишени, которая труднодостижима путями, отличающимися от перорального пути или посредством GI; г) за счет прямой доставки глюкозоснижающего средства в подслизистое пространство GI тракта и в воротную систему печени можно обеспечить улучшенные схемы дозирования, включающие менее частые инъекции инсулина; и д) способность к доставке глюкозоснижающего средства субъекту без применения иглы для прокалывания кожи субъекта, что позволяет улучшить качество жизни таких субъектов за счет избегания связанных с этим боли или потенциальных осложнений.
В различных воплощениях изобретения глюкозоснижающее средство выбрано из, например, макромолекулы, малой молекулы, пептида, полипептида, нуклеиновой кислоты, мРНК, микроРНК, кшРНК, миРНК, антисмысловой молекулы, антитела, ДНК, плазмиды, вакцины, полимерной наночастицы или каталитически активного вещества. В различных воплощениях изобретения глюкозоснижающее средство представляет собой инкретин или миметик инкретина. В различных воплощениях изобретения глюкозоснижающее средство представляет собой GLP-1 (глюкагоноподобный пептид-1). В различных воплощениях изобретения глюкозоснижающее средство представляет собой агонист GLP-1. В различных воплощениях изобретения глюкозоснижающее средство представляет собой эксендин. В различных воплощениях изобретения глюкозоснижающее средство представляет агонист рецептора белка-ингибитора глюкозы (GIPR).
В различных воплощениях изобретения глюкозоснижающее средство представляет собой агонист GLP-1, представляющий собой пептид. В различных воплощениях изобретения глюкозоснижающее средство представляет собой агонист GLP-1, представляющий собой малую молекулу. В различных воплощениях изобретения глюкозоснижающее средство представляет собой агонист GLP-1, представляющий собой антисмысловую молекулу или молекулу миРНК. В различных воплощениях изобретения глюкозоснижающее средство представляет собой агонист GLP-1, представляющий собой антитело или его фрагмент, либо искусственную конструкцию, представляющую собой антитело или его фрагмент, либо искусственную конструкцию, предназначенную для имитации связывания антитела или его фрагмента с его антигеном.
В различных воплощениях изобретения биологически активная нагрузка представляет собой глюкозоснижающее средство, представляющее собой пептид-агонист GLP-1, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 93. В различных воплощениях изобретения биологически активная нагрузка представляет собой глюкозоснижающее средство, представляющее собой пептид-агонист GLP-1, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 94.
В одном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим новые слитые молекулы неприродного происхождения и один или более фармацевтически приемлемых носителей, приготовленным для пероральной доставки и предназначенным для обеспечения усовершенствованных, эффективных видов терапии для лечения дефицита гормона роста и подобных расстройств.
В различных воплощениях настоящее изобретение относится к фармацевтическим композициям, содержащим слитую молекулу неприродного происхождения и один или более фармацевтически приемлемых носителей, приготовленным для пероральной доставки, где слитая молекула содержит модифицированный Cholix-токсин, связанный с гормоном роста (GH) для доставки субъекту.
Настоящее изобретение отчасти основано на уникальном открытии авторов изобретения, что пероральная доставка фармацевтической композиции, содержащей слитую молекулу, которая включает в себя модифицированный Cholix-токсин, связанный с гормоном роста, может среди прочего обеспечить следующие преимущества: а) в воплощениях изобретения, где модифицированный Cholix-токсин связан с гормоном роста посредством линкера, расщепляемого ферментом, присутствующим на поверхности базолатеральной мембраны эпителиальной клетки, или ферментом, присутствующим в плазме крови субъекта, такое расщепление даст возможность высвобождения гормона роста от остальной части слитой молекулы вскоре после трансцитоза через эпителиальную мембрану; б) за счет прямой доставки гормона роста в подслизистое пространство GI тракта и в воротную систему печени можно уменьшить системную токсичность, наблюдаемую при введении гормонов роста парентеральными путями, а также обеспечить доступ к подслизистой биологической мишени, которая трудно достигается путями, отличающимися от перорального пути или посредством GI (например, обеспечить более эффективное индуцирование IGF-1 (инсулиноподобный фактор роста 1) по сравнению с системной доставкой посредством подкожной (п/к) инъекции); в) за счет прямой доставки гормона роста в подслизистое пространство GI тракта и в воротную систему печени можно обеспечить улучшенные схемы дозирования; г) за счет пероральной доставки будет достигнут кратковременный импульс гормона роста в печени, который больше согласуется с сывороточным уровнем, наблюдаемым у растущих детей, и данный импульсный профиль не достигается за счет п/к инъекции; и д) способность к доставке гормона роста субъекту без применения иглы для прокалывания кожи субъекта, что позволяет улучшить качество жизни таких субъектов за счет избегания связанных с этим боли или потенциальных осложнений и, кроме того, повышает удобство и соблюдение режима и схемы лечения пациентом/лицом, осуществляющим медицинскую помощь.
В различных воплощениях изобретения гормон роста выбран из, например, макромолекулы, малой молекулы, пептида, полипептида, нуклеиновой кислоты, мРНК, микроРНК, кшРНК, миРНК, антисмысловой молекулы, антитела, ДНК, плазмиды, вакцины, полимерной наночастицы или каталитически активного вещества. В различных воплощениях изобретения гормон роста представляет собой гормон роста человека (или его вариант), гормон роста 2 или рилизинг-фактор гормона роста. В различных воплощениях изобретения гормон роста представляет собой гормон роста человека (соматотропин), содержащий аминокислотную последовательность, представленную в SEQ ID NO: 95.
В различных воплощениях изобретения слитые молекулы содержат модифицированный Cholix-токсин, непосредственно связанный с биологически активной нагрузкой. В различных воплощениях изобретения биологически активная нагрузка непосредственно связана с С-концом Cholix-токсина.
В различных воплощениях изобретения слитые молекулы содержат модифицированный Cholix-токсин, химически связанный с биологически активной нагрузкой.
В различных воплощениях изобретения слитые молекулы содержат модифицированный Cholix-токсин, связанный с биологически активной нагрузкой посредством нерасщепляемого линкера. В различных воплощениях изобретения нерасщепляемый линкер содержит аминокислотную последовательность, например, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98 или SEQ ID NO: 99.
В различных воплощениях изобретения слитые молекулы содержат модифицированный Cholix-токсин, связанный с биологически активной нагрузкой посредством расщепляемого линкера. В различных воплощениях изобретения линкер расщепляется ферментом, присутствующим на базолатеральной мембране поляризованной эпителиальной клетки субъекта. В различных воплощениях изобретения линкер расщепляется ферментом, присутствующим в плазме крови субъекта. В различных воплощениях изобретения расщепляемый линкер содержит аминокислотную последовательность, например, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119 или SEQ ID NO: 120.
В различных воплощениях изобретения слитые молекулы содержат Cholix-токсин, связанный с биологически активной нагрузкой посредством расщепляемого линкера, где расщепляемый линкер содержит аминокислотную последовательность, известную как субстрат для протеазы вируса гравировки табака (TEV). В различных воплощениях изобретения расщепляемый линкер содержит аминокислотную последовательность, например, SEQ ID NO: 121.
В различных воплощениях изобретения слитые молекулы содержат аминокислотную последовательность, представленную в SEQ ID NO: 122. (эта последовательность представляет собой Cholix415-TEV-IL-10).
В различных воплощениях изобретения слитая молекула содержит аминокислотную последовательность, представленную в SEQ ID NO: 123. (эта последовательность представляет собой Cholix415-(G4S)3-IL-10).
В другом аспекте в настоящем изобретении предложен способ лечения воспалительного заболевания у субъекта, включающий пероральное введение субъекту фармацевтической композиции по настоящему изобретению. В различных воплощениях изобретения воспалительное заболевание выбрано из воспалительного заболевания кишечника, псориаза или бактериального сепсиса. В различных воплощениях изобретения воспалительное заболевание кишечника представляет собой болезнь Крона, язвенный колит, коллагенозный колит, лимфоцитарный колит, ишемический колит, диверсионный колит, синдром Бехчета или неопределенный колит.
В другом аспекте в настоящем изобретении предложен способ лечения аутоиммунного заболевания у субъекта, включающий пероральное введение субъекту фармацевтической композиции по настоящему изобретению. В различных воплощениях изобретения аутоиммунное заболевание представляет собой системную красную волчанку (SLE), обыкновенную пузырчатку, тяжелую миастению, гемолитическую анемию, тромбоцитопеническую пурпуру, болезнь Грейвса, болезнь Шегрена, дерматомиозит, болезнь Хасимото, полимиозит, воспалительное заболевание кишечника, рассеянный склероз (MS), сахарный диабет, ревматоидный артрит или склеродермию.
В другом аспекте в настоящем изобретении предложен способ лечения рака у субъекта, включающий пероральное введение субъекту фармацевтической композиции по настоящему изобретению. В различных воплощениях изобретения рак, подлежащий лечению, включает, без ограничений, неходжкинские лимфомы (NHL), лимфому Ходжкина, хронический лимфоцитарный лейкоз, волосатоклеточный лейкоз, острый лимфобластный лейкоз, множественную миелому, карциномы мочевого пузыря, почки, яичника, шейки матки, молочной железы, легкого, носоглотки, злокачественную меланому и ритуксимаб-резистентные NHL и лейкоз.
В другом аспекте в настоящем изобретении предложен способ лечения субъекта, страдающего метаболическим расстройством, включающий пероральное введение слитой молекулы по настоящему изобретению в количестве, достаточном для лечения указанного расстройства, где указанное метаболическое расстройство представляет собой диабет, ожирение, обусловленный ожирением диабет, гипергликемию, дислипидемию, гипертриглицеридемию, синдром X, инсулинорезистентность, нарушенную толерантность к глюкозе (IGT), диабетическую дислипидемию или гиперлипидемию.
В другом аспекте в настоящем изобретении предложен способ лечения субъекта, страдающего жировой болезнью печени (например, неалкогольной жировой болезнью печени (NAFLD); неалкогольным стеатогепатитом (NASH)), желудочно-кишечным заболеванием или нейродегенеративным заболеванием, включающий пероральное введение слитой молекулы по настоящему изобретению в количестве, достаточном для лечения указанного расстройства.
В другом аспекте в настоящем изобретении предложен способ лечения субъекта, страдающего нарушением роста, обусловленным дефицитом GH, включающий пероральное введение слитой молекулы по настоящему изобретению в количестве, достаточном для лечения указанного расстройства, где данное нарушение роста представляет собой дефицит гормона роста (GHD), синдром Тернера (TS), синдром Нунан, синдром Прадера-Вилли, дефицит гена низкорослости, содержащего гомеобокс (SHOX), хроническую почечную недостаточность и синдром короткого кишечника, обусловленный идиопатической низкорослостью, дефицит GH вследствие редких опухолей гипофиза или их лечения и мышечную атрофию, ассоциированную с HIV/AIDS (вирус иммунодефицита человека/синдром приобретенного иммунодефицита).
В другом аспекте настоящее изобретение относится к применению слитой молекулы неприродного происхождения по настоящему изобретению для получения лекарственного средства для лечения, профилактики и/или предупреждения воспалительного заболевания у субъекта, нуждающегося в этом.
В другом аспекте настоящее изобретение относится к применению слитой молекулы неприродного происхождения по настоящему изобретению для получения лекарственного средства для лечения, профилактики и/или предупреждения аутоиммунного заболевания у субъекта, нуждающегося в этом.
В другом аспекте настоящее изобретение относится к применению слитой молекулы неприродного происхождения по настоящему изобретению для получения лекарственного средства для лечения, профилактики и/или предупреждения рака у субъекта, нуждающегося в этом.
В другом аспекте настоящее изобретение относится к применению слитой молекулы неприродного происхождения по настоящему изобретению для получения лекарственного средства для лечения, профилактики и/или предупреждения метаболического расстройства у субъекта, нуждающегося в этом.
В другом аспекте настоящее изобретение относится к применению слитой молекулы неприродного происхождения по настоящему изобретению для получения лекарственного средства для лечения, профилактики и/или предупреждения жировой болезни печени у субъекта, нуждающегося в этом.
В другом аспекте настоящее изобретение относится к применению слитой молекулы неприродного происхождения по настоящему изобретению для получения лекарственного средства для лечения, профилактики и/или предупреждения дефицита нарушения роста, обусловленного дефицитом GH у субъекта, нуждающегося в этом.
В других аспектах в настоящем изобретении предложены полинуклеотиды, кодирующие слитые молекулы «модифицированный Cholix-токсин-биологически активная нагрузка» неприродного происхождения по настоящему изобретению; векторы, содержащие полинуклеотиды, кодирующие слитые молекулы «модифицированный Cholix-токсин-биологически активная нагрузка» неприродного происхождения по изобретению; возможно функционально связанные с контрольными последовательностями, распознаваемыми клеткой-хозяином, трансформированной вектором; клетки-хозяева, содержащие векторы, содержащие полинуклеотиды, кодирующие слитые молекулы «модифицированный Cholix-токсин-биологически активная нагрузка» неприродного происхождения по изобретению; способ получения слитой молекулы «модифицированный Cholix-токсин-биологически активная нагрузка» неприродного происхождения по изобретению, включающий культивирование клеток-хозяев, содержащих векторы, содержащие полинуклеотиды, кодирующие слитые молекулы «модифицированный Cholix-токсин-биологически активная нагрузка» неприродного происхождения по изобретению, так что полинуклеотид экспрессируется; и возможно выделение слитой молекулы «модифицированный Cholix-токсин-биологически активная нагрузка» неприродного происхождения из среды культивирования клеток-хозяев.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГ. 1 изображены генетические конструкции двух иллюстративных слитых молекул Cholix-токсин-IL-10, оцениваемых в настоящем документе. N-конец мономерной последовательности IL-10 человека был генетическим путем присоединен к С-концу модифицированного Cholix-токсина (Cholix415) с использованием стабильной нерасщепляемой линкерной последовательности ((G4S)3) или линкерной последовательности, представляющей собой известный субстрат для протеазы вируса гравировки табака (TEV). Каждая конструкция также содержит N-концевой метионин (М).
На ФИГ. 2 в виде ленточной диаграммы представлена иллюстративная слитая молекула «димер Cholix-токсин-IL-10» после рефолдинга, который должен направляться димеризацией IL-10. Первые 415 аминокислот Cholix-токсина (SEQ ID NO: 1) соединены посредством 16-аминокислотного линкера (не показано) для соединения с последовательностью IL-10 человека. Рассматривают, что результатом димеризации IL-10 является организация, показанная: пурпурным цветом Cholix415 /синим цветом hIL-10 и оранжевым цветом Cholix415 /зеленым цветом.
На ФИГ. 3 представлен окрашенный Кумасси SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) Cholix415-TEV-IL-10 (изображенной как "С") и Cholix415-(G4S)3-IL-10 (изображенной как "N") после индукции и экспрессии из телец включения. Продемонстрировано, что предполагаемый молекулярный размер экспрессированных слитых молекул составляет приблизительно 66 кДа, что сравнимо с расчетной массой 66380,78 и 65958,25 Дальтон соответственно. Показаны предварительно окрашенные стандарты MW (молекулярная масса) SeeBlue® Plus2.
На ФИГ. 4 представлена столбчатая диаграмма, изображающая результаты анализа посредством проточной цитометрии с использованием линии клеток J774.2, источником которой являются макрофаги мыши, обработанной иллюстративными слитыми молекулами Cholix-токсин-IL-10 по настоящему изобретению в двух концентрациях. % пролиферации измеряли через 48 часов после обработки. Значения представляют собой n равно 4 плюс/минус стандартное отклонение. Данные показывают, что для слитой молекулы «димер Cholix415-(G4S)3-IL-10» продемонстрирован биологически активный IL-10.
На ФИГ. 5 представлен линейный график, изображающий результаты анализа, где слитая молекула «димер Cholix415-(G4S)3-IL-10» была исследована на предмет действий на барьерные свойства монослоев клеток Сасо-2 in vitro. На апикальную поверхность этих монослоев добавляли меченый флуоресцеином декстран 70 кДа и изменяющиеся концентрации слитой молекулы «димер Cholix415-(G4S)3-IL-10» и осуществляли мониторинг по времени суммарного количества флуоресценции, выявленного в базальном компартменте, путем отбора объемов 150 μмкл с заменой. Суммарные базальные уровни декстрана (пмоль) нанесены на график против времени. Каждая линия представляет собой средние значения (n равно 4) базальной флуоресценции, измеренные через 0, 15, 30, 45, 60, 90, 120, 180 и 240 мин.
На ФИГ. 6 представлен линейный график, изображающий результаты анализа, где исследовали действия слитой молекулы «димер Cholix415-(G4S)3-IL-10» на барьерные свойства монослоев клеток Сасо-2 in vitro. На апикальную поверхность этих монослоев добавляли меченый флуоресцеином декстран 70 кДа и изменяющиеся концентрации слитой молекулы «димер Cholix415-(G4S)3-IL-10» и осуществляли мониторинг по времени суммарного количества флуоресценции, выявленного в базальном компартменте.
На ФИГ. 7А и 7В представляют собой линейные графики, изображающие результаты анализа методом ELISA (твердофазный иммуноферментный анализ), оценивающие способность слитой молекулы «димер Cholix415-(G4S)3-IL-10» к перемещению через монослои клеток Сасо-2. Суммарное количество слитой молекулы «димер Cholix415-(G4S)3-IL-10», достигающее базального компартмента со временем после апикального добавления при различных концентрациях указано в подписи. Каждая линия представляет собой среднее значение (n равно 4) базальных уровней IL-10, измеренных через 0, 15, 30, 45, 60, 90, 120, 180 и 240 мин. Суммарное количество IL-10, перенесенное со временем, представлено на графике на протяжении диапазона от 6А равно 8000 фмоль IL-10 до 6В равно 1000 фмоль IL-10.
СПОСОБ(Ы) ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Если в настоящем документе не определено иное, научные и технические термины, используемые в связи с настоящим изобретением, имеют значения, обычно понимаемые обычными специалистами в данной области техники. Кроме того, если контекст не требует иного, в термины единственного числа следует включать термины множественного числа, а в термины множественного числа следует включать термины единственного числа. В целом номенклатуры, используемые в связи с методиками, и сами методики культивирования клеток и тканей, молекулярной биологии, иммунологии, микробиологии, генетики, химии и гибридизации белков и нуклеиновых кислот, описанные в настоящем документе, широко используются и хорошо известны в данной области техники. Способы и методы по настоящему изобретению в целом выполняют в соответствии с общепринятыми способами, хорошо известными в данной области техники и описанными в различных общих и более конкретных ссылках, цитируемых и обсуждаемых на протяжении всего настоящего описания, если не указано иное. См., например, Sambrook et al. Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989) и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates (1992), и Harlow and Lane Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1990), включенные в настоящий документ посредством ссылки. Ферментативные реакции и методы очистки выполняют в соответствии со описаниями производителя, как обычно осуществляют в данной области техники, или как описано в настоящем документе. Номенклатура, используемая в связи с процедурами и методиками, и сами процедуры и методики аналитической химии, химии органического синтеза и медицинской и фармацевтической химии, описанные в настоящем документе, широко используются и хорошо известны в данной области техники. Для химических синтезов, химических анализов, фармацевтических композиций, приготовления и доставки и лечения пациентов используют стандартные методики.
Определения
Термины «полипептид», «пептид» и «белок» используют в настоящем документе взаимозаменяемо по отношению к полимеру из аминокислотных остатков. В различных воплощениях изобретения «пептиды», «полипептиды» и «белки» представляют собой цепи из аминокислот, альфа-атомы углерода которых связаны посредством пептидных связей. Концевая аминокислота на одном конце цепи (амино-концевая), таким образом, имеет свободную аминогруппу, тогда как концевая аминокислота на другом конце цепи (карбокси-концевая) имеет свободную карбоксильную группу. При использовании в настоящем документе термин «амино-конец» (сокращенно N-конец) относится к свободной α-аминогруппе на аминокислоте при амино-конце пептида или к α-аминогруппе (иминогруппе при участии в пептидной связи) аминокислоты в любом другом положении внутри пептида. Аналогично, термин «карбокси-конец» относится к свободной карбоксильной группе на карбокси-конце пептида или к карбоксильной группе аминокислоты в любом другом положении внутри пептида. Пептиды также включают по существу любую полиаминокислоту, включая, без ограничений, пептидомиметики, такие как аминокислоты, соединенные эфирной связью в противоположность амидной.
Полипептиды по изобретению включают полипептиды, модифицированные любым путем и по любой причине, например, для: (1) снижения чувствительности к протеолизу, (2) снижения чувствительности к окислению, (3) изменения аффинности связывания для образования белковых комплексов, (4) изменения аффинностей связывания и (5) придания или модификации других физико-химических или функциональных свойств. Например, одиночные или множественные аминокислотные замены (например, консервативные аминокислотные замены) могут быть осуществлены в любой природной последовательности (например, в участке полипептида снаружи от домена(ов), образующего(их) межмолекулярные контакты). «Консервативная аминокислотная замена» относится к замене в полипептиде аминокислоты функционально подобной аминокислотой. Каждая из приведенных ниже шести групп содержит аминокислоты, представляющие собой консервативные замены друг для друга:
1) Аланин (А), серин (S) и треонин (Т)
2) Аспарагиновая кислота (D) и глутаминовая кислота (Е)
3) Аспарагин (N) и глутамин (Q)
4) Аргинин (R) и лизин (K)
5) Изолейцин (I), лейцин (L), метионин (М) и валин (V)
6) Фенилаланин (F), тирозин (Y) и триптофан (W).
«Неконсервативная аминокислотная замена» относится к замене члена одного из этих классов членом другого класса. При осуществлении таких замен в соответствии с различными воплощениями изобретения можно учитывать гидропатический индекс аминокислот. Каждой аминокислоте присвоен гидропатический индекс на основании характеристик ее гидрофобности и заряда. Эти индексы составляют: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2,8); цистеин/цистин (+2,5); метионин (+1,9); аланин (+1,8); глицин (-0,4); треонин (-0,7); серин (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутамат (-3,5); глутамин (-3,5); аспартат (-3,5); аспарагин (-3,5); лизин (-3,9); и аргинин (-4,5).
Значимость гидропатического индекса аминокислоты при придании белку интерактивной биологической функции понятна в данной области техники (см., например, Kyte et al., 1982, J. Mol. Biol. 157:105-131). Известно, что некоторые аминокислоты можно заменять другими аминокислотами, имеющими сходный гидропатический индекс или балл, и при этом сохранять сходную биологическую активность. При создании изменений, основанных на гидропатическом индексе, в различных воплощениях изобретения включена замена аминокислот, гидропатические индексы которых находятся в пределах ±2. В различных воплощениях изобретения включены те аминокислоты, гидропатические индексы которых находятся в пределах ±1, и в различных воплощениях изобретения включены те аминокислоты, гидропатические индексы которых находятся в пределах ±0,5.
В данной области техники также понимают, что замену подобных аминокислот можно эффективно осуществлять на основе гидрофильности, в частности, где биологически функциональный белок или пептид, созданный таким образом, предназначен для применения в иммунологических воплощениях, как описано в настоящем документе. В различных воплощениях изобретения наибольшая локальная средняя гидрофильность белка, которая определяется гидрофильностью примыкающих аминокислот, коррелирует с его иммуногенностью и антигенностью, т.е. с биологическим свойством белка.
Этим аминокислотным остаткам присвоены следующие значения гидрофильности: аргинин (+3,0); лизин (+3,0); аспартат (+3,0, ±0,1); глутамат (+3,0, ±0,1); серин (+0,3); аспарагин (+0,2); глутамин (+0,2); глицин (0); треонин (-0,4); пролин (-0,5, ±0,1); аланин (-0,5); гистидин (-0,5); цистеин (-1,0); метионин (-1,3); валин (-1,5); лейцин (-1,8); изолейцин (-1,8); тирозин (-2,3); фенилаланин (-2,5) и триптофан (-3,4). При создании изменений, основанных на значениях гидрофильности, в различных воплощениях изобретения включена замена аминокислот, значения гидрофильности которых находятся в пределах ±2, в различных воплощениях изобретения включена замена аминокислот, значения гидрофильности которых находятся в пределах ±1, и в различных воплощениях изобретения включена замена аминокислот, значения гидрофильности которых находятся в пределах ±0,5.
Иллюстративные аминокислотные замены приведены в таблице 1.


Специалист в данной области техники способен определить подходящие варианты полипептидов, представленные в настоящем документе, используя хорошо известные методики. В различных воплощениях изобретения специалист в данной области техники может идентифицировать подходящие области молекулы, которые могут быть изменены без нарушения активности, путем нацеливания на участки, считающиеся незначимыми для активности. В других воплощениях изобретения специалист в данной области техники может идентифицировать остатки и участки молекул, консервативные между подобными полипептидами. В других воплощениях изобретения даже области, которые могут быть значимыми для биологической активности или для структуры, можно подвергать консервативным аминокислотным заменам, не нарушая биологическую активность или не оказывая нежелательное влияние на структуру полипептида.
Дополнительно специалист в данной области техники может провести обзор структурно-функциональных исследований, идентифицирующих остатки в подобных полипептидах, значимые для активности или структуры. В свете такого сравнения специалист в данной области техники может прогнозировать значимость аминокислотных остатков в полипептиде, соответствующих аминокислотным остаткам, значимым для активности или структуры, в подобных полипептидах. Для таких прогнозируемых значимых аминокислотных остатков специалист в данной области техники может выбрать химически подобные аминокислотные замены.
Специалист в данной области техники может также проанализировать трехмерную структуру и аминокислотную последовательность в отношении такой структуры в подобных полипептидах. В свете такой информации специалист в данной области техники может прогнозировать выравнивание аминокислотных остатков полипептида по отношению к его трехмерной структуре. В различных воплощениях изобретения специалист в данной области техники может сделать выбор в пользу отсутствия радикальных изменений аминокислотных остатков, расположение которых прогнозируется на поверхности пептида, поскольку такие остатки могут быть вовлечены в важные взаимодействия между молекулами. Кроме того, специалист в данной области техники может создать тестовые варианты, содержащие одиночную аминокислотную замену в каждом желаемом аминокислотном остатке. Затем эти варианты можно подвергать скринингу, используя методы определения активности, известные специалистам в данной области техники. Такие варианты можно использовать, чтобы собрать информацию о подходящих вариантах. Например, если обнаружено, что изменение определенного аминокислотного остатка приводит к нарушенной, нежелательно сниженной или неподходящей активности, вариантом с таким изменением можно избегать. Иными словами, на основании информации, собранной в таких стандартных экспериментах, специалист в данной области техники может легко определить аминокислоты, дальнейших замен которых следует избегать, как отдельно, так и в комбинации с другими мутациями.
Термин «полипептидный фрагмент» и «усеченный полипептид» при использовании в настоящем документе относится к полипептиду, имеющему амино-концевую и/или карбокси-концевую делецию по сравнению с соответствующим полноразмерным белком. В различных воплощениях изобретения длина фрагментов может составлять, например, по меньшей мере 5, по меньшей мере 10, по меньшей мере 25, по меньшей мере 50, по меньшей мере 100, по меньшей мере 150, по меньшей мере 200, по меньшей мере 250, по меньшей мере 300, по меньшей мере 350, по меньшей мере 400, по меньшей мере 450, по меньшей мере 500, по меньшей мере 600, по меньшей мере 700, по меньшей мере 800, по меньшей мере 900 или по меньшей мере 1000 аминокислот. В различных воплощениях изобретения длина фрагментов может составлять, например, максимум 1000, максимум 900, максимум 800, максимум 700, максимум 600, максимум 500, максимум 450, максимум 400, максимум 350, максимум 300, максимум 250, максимум 200, максимум 150, максимум 100, максимум 50, максимум 25, максимум 10 или максимум 5 аминокислот. Фрагмент может дополнительно содержать на любом или на обоих концах одну или более дополнительных аминокислот, например последовательность аминокислот из любого встречающегося в природе белка (например, домен Fc или лейциновую молнию) или искусственную аминокислотную последовательность (например, искусственную линкерную последовательность).
Термины «вариант полипептида» и «мутант полипептида» при использовании в настоящем документе относятся к полипептиду, содержащему аминокислотную последовательность, в которой один или более аминокислотных остатков в аминокислотной последовательности вставлен, делетирован и/или заменен относительно другой аминокислотной последовательности. В различных воплощениях изобретения число вставленных, делегированных или замененных аминокислотных остатков может составлять, например, по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5, по меньшей мере 10, по меньшей мере 25, по меньшей мере 50, по меньшей мере 75, по меньшей мере 100, по меньшей мере 125, по меньшей мере 150, по меньшей мере 175, по меньшей мере 200, по меньшей мере 225, по меньшей мере 250, по меньшей мере 275, по меньшей мере 300, по меньшей мере 350, по меньшей мере 400, по меньшей мере 450 или по меньшей мере 500 аминокислот в длину. Варианты по настоящему изобретению включают слитые белки.
Производное полипептида представляет собой полипептид, который был химически модифицирован, например, путем конъюгирования с другой химической группировкой, такой как, например, полиэтиленгликоль, альбумин (например, человеческий сывороточный альбумин), фосфорилирования и гликозилирования.
Термин «% идентичности последовательности» в настоящем документе используют взаимозаменяемо с термином «% идентичности», и он относится к уровню идентичности аминокислотной последовательности между двумя или более пептидных последовательностей или к уровню идентичности нуклеотидной последовательности между двумя или более нуклеотидных последовательностей при выравнивании с использованием программы выравнивания последовательностей. Например, при использовании в настоящем документе 80% идентичности означает то же, что 80% идентичности последовательности, определенной с помощью заданного алгоритма, и означает, что данная последовательность по меньшей мере на 80% идентична другой длине другой последовательности. В различных воплощениях изобретения % идентичности выбран, например, из по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% или более идентичности последовательности по сравнению с данной последовательностью. В различных воплощениях изобретения % идентичности находится в диапазоне, например, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 85%, от приблизительно 85% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или от приблизительно 95% до приблизительно 99%.
Термин «% гомологии последовательности» в настоящем документе используют взаимозаменяемо с термином «% гомологии», и он относится к уровню гомологии аминокислотной последовательности между двумя или более пептидных последовательностей или к уровню гомологии нуклеотидной последовательности между двумя или более нуклеотидных последовательностей при выравнивании с использованием программы выравнивания последовательностей. Например, при использовании в настоящем документе 80% гомологии означает то же, что 80% гомологии последовательности, определенной с помощью заданного алгоритма, и соответственно гомолог данной последовательности имеет более 80% гомологии последовательности по всей длине данной последовательности. В различных воплощениях изобретения % гомологии выбран, например, из по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% или более гомологии последовательности по сравнению с данной последовательностью. В различных воплощениях изобретения % гомологии находится в диапазоне, например, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 85%, от приблизительно 85% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или от приблизительно 95% до приблизительно 99%.
Иллюстративные компьютерные программы, которые можно использовать для определения идентичности между двумя последовательностями, включают без ограничения пакет программ BLAST, например BLASTN, BLASTX и TBLASTX, BLASTP и TBLASTN, общедоступные в Интернете и на сайте NCBI (Национального центра биотехнологической информации). См. также статьи Altschul et al., 1990, J. Mol. Biol. 215:403-10 (со специальной ссылкой на опубликованную установку параметров по умолчанию, т.е. параметров w равно 4, t равно 17) и Altschul et al., 1997, Nucleic Acids Res., 25:3389-3402. Поиск последовательностей, как правило, осуществляют с использованием программы BLASTP при оценке данной аминокислотной последовательности относительно аминокислотных последовательностей в базе данных белковых последовательностей GenBank и других базах данных общего пользования. Программа BLASTX предпочтительна для поиска нуклеиновокислотных последовательностей, транслированных во всех рамках считывания по сравнению с аминокислотными последовательностями в базе данных белковых последовательностей GenBank и других базах данных общего пользования. Обе программы, BLASTP и BLASTX, выполняют с использованием параметров по умолчанию: штраф на открытие пробела 11,0 и штраф на удлинение пробела 1,0, и применяют матрицу BLOSUM-62. См. те же источники.
Кроме вычисления процента идентичности последовательностей, алгоритм BLAST также выполняет статистический анализ подобия между двумя последовательностями (см., например, Karlin & Altschul, Proc. Nat'l. Acad. Sci. USA, 90:5873-5787 (1993)). Одной из мер подобия, предложенных алгоритмом BLAST, является наименьшая суммарная вероятность (P(N)), обеспечивающая показатель вероятности того, что совпадение между двумя нуклеотидными или двумя аминокислотными последовательностями встречается случайно. Например, нуклеиновую кислоту считают подобной сравнительной последовательности, если наименьшая суммарная вероятность при сравнении исследуемой нуклеиновой кислоты со сравнительной нуклеиновой кислотой составляет, например, максимум 0,1, максимум 0,01 или максимум 0,001.
«Полинуклеотид» относится к полимеру, состоящему из нуклеотидных звеньев. Полинуклеотиды включают природные нуклеиновые кислоты, такие как дезоксирибонуклеиновая кислота («ДНК») и рибонуклеиновая кислота («РНК»), а также аналоги нуклеиновых кислот. Аналоги нуклеиновых кислот включают нуклеиновые кислоты, в которые включены неприродные основания, нуклеотиды, задействованные в связях с другими нуклеотидами, отличающихся от природной фосфодиэфирной связи, или в которые включены основания, присоединенные посредством связей, отличающихся от фосфодиэфирных связей. Так, аналоги нуклеотидов включают, в качестве примера и без ограничений, фосфоротиоаты, фосфородитиоаты, фосфоротриэфиры, фосфорамидаты, боранофосфаты, метилфосфонаты, хиральные метилфосфонаты, 2-O-метилрибонуклеотиды, пептидные нуклеиновые кислоты (ПНК) и тому подобное. Такие полинуклеотиды можно синтезировать, например, с использованием автоматического синтезатора ДНК. Термин «нуклеиновая кислота», как правило, относится к полинуклеотидам большого размера. Термин «олигонуклеотиды», как правило, относится к коротким полинуклеотидам, состоящим обычно не более чем из 50 нуклеотидов. Понятно, что, если нуклеотидная последовательность представлена последовательностью ДНК (т.е. А, Т, G, С), она также включает последовательность РНК (т.е. A, U, G, С), в которой «U» замещает «Т».
В данном документе для описания полинуклеотидных последовательностей используют общепринятые условные обозначения: левый конец однонитевой полинуклеотидной последовательности представляет собой 5'-конец; направление двунитевой полинуклеотидной последовательности влево обозначают как 5'-направление. Направление присоединения нуклеотидов к вновь образующимся транскриптам РНК от 5' к 3' обозначают как направление транскрипции. Нить ДНК, имеющую ту же последовательность, что и мРНК, обозначают как «кодирующая нить»; последовательности на нити ДНК, имеющей ту же последовательность, что и мРНК, транскрибируемая с этой ДНК, расположенные в 5' положении по отношению к 5'-концу транскрипта РНК, обозначают как «лежащие выше по течению последовательности»; последовательности на нити ДНК, имеющей ту же последовательность, что и мРНК, транскрибируемая с этой ДНК, расположенные в 3' положении по отношению к 3'-концу кодирующего транскрипта РНК, обозначают как «лежащие ниже по течению последовательности».
«Комплементарный» относится к топологической совместимости или совпадению друг с другом взаимодействующих поверхностей двух полинуклеотидов. Таким образом, две молекулы могут быть описаны как комплементарные и, кроме того, характеристики поверхности контакта комплементарны друг другу. Первый полинуклеотид комплементарен второму полинуклеотиду, если нуклеотидная последовательность первого полинуклеотида по существу идентична нуклеотидной последовательности полинуклеотидного партнера связывания второго полинуклеотида, или если первый полинуклеотид может гибридизоваться со вторым полинуклеотидом в жестких условиях гибридизации.
«Специфично гибридизующийся с», или «специфичная гибридизация», или «селективно гибридизуется с» относится к связыванию, образованию дуплекса или гибридизации молекулы нуклеиновой кислоты преимущественно с определенной нуклеотидной последовательностью в жестких условиях при наличии этой последовательности в комплексной смеси (например, суммарной клеточной) ДНК или РНК. Термин «жесткие условия» относится к условиям, в которых зонд преимущественно гибридизуется с его подпоследовательностью-мишенью, и в меньшей степени или совсем не гибридизуется с другими последовательностями. «Жесткая гибридизация» или «жесткие условия отмывки при гибридизации» в контексте экспериментов по гибридизации нуклеиновых кислот, таких как Саузерн- и Нозерн-гибридизация, зависят от последовательности и различаются для различных параметров окружающей среды. Подробное руководство по гибридизации нуклеиновых кислот можно найти в Tijssen, 1993, Laboratory Techniques in Biochemistry and Molecular Biology--Hybridization with Nucleic Acid Probes, часть I, глава 2, "Overview of principles of hybridization and the strategy of nucleic acid probe assays", Elsevier, N.Y.; Sambrook et al., 2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, 3.sup.rd ed., NY; и Ausubel et al., eds., Current Edition, Current Protocols in Molecular Biology, Greene Publishing Associates and Wiley Interscience, NY.
Обычно условия гибридизации и отмывки высокой жесткости выбирают как температуру примерно на 5°С ниже температуры плавления (Tm) для конкретной последовательности при заданной ионной силе и рН. Tm представляет собой температуру (при заданной ионной силе и рН), при которой 50% последовательности-мишени гибридизуется с совершенно совпадающим зондом. Очень жесткие условия выбирают как равные Tm для конкретного зонда. Пример жестких условий гибридизации для гибридизации комплементарных нуклеиновых кислот, имеющих более чем приблизительно 100 комплементарных остатков, на фильтре при Саузерн- или Нозерн-блоттинге представляет собой: 50% формалин с 1 мг гепарина при 42°С, при этом гибридизацию проводят в течение ночи. Пример условий отмывки высокой жесткости представляет собой 0,15 М NaCl при 72°С в течение приблизительно 15 минут. Пример жестких условий отмывки представляет собой отмывку в 0,2х SSC при 65°С в течение 15 минут. Описание буфера SSC см. в Sambrook et al. Отмывке высокой жесткости может предшествовать отмывка низкой жесткости для удаления фонового сигнала зонда. Иллюстративная отмывка средней жесткости для дуплекса длиной, например, более чем приблизительно 100 нуклеотидов, представляет собой 1х SSC при 45°С в течение 15 минут. Иллюстративная отмывка низкой жесткости для дуплекса длиной, например, более чем приблизительно 100 нуклеотидов, представляет собой 4-6х SSC при 40°С в течение 15 минут. Как правило, отношение сигнала к шуму 2х (или выше) по сравнению с наблюдаемым для постороннего зонда при конкретном анализе гибридизации указывает на выявление специфичной гибридизации.
«Праймер» относится к полинуклеотиду, способному к специфичной гибридизации с заданной полинуклеотидной матрицей и обеспечивающему точку инициации синтеза комплементарного полинуклеотида. Такой синтез происходит при помещении полинуклеотидного праймера в условия, при которых происходит индуцирование синтеза, т.е. в присутствии нуклеотидов, комплементарной полинуклеотидной матрицы и агента для полимеризации, такого как ДНК-полимераза. Праймер, как правило, является однонитевым, но может быть двунитевым. Как правило, праймеры представляют собой дезоксирибонуклеиновые кислоты, но для многих применений полезен широкий ряд синтетических и природных праймеров. Праймер комплементарен матрице, для гибридизации с которой он предназначен, и служит в качестве сайта инициации синтеза, но необязательно отражает точную последовательность матрицы. В таком случае специфичная гибридизация праймера с матрицей зависит от жесткости условий гибридизации. Праймеры могут быть мечеными, например, хромогенными, радиоактивными или флуоресцентными группировками, и используются в качестве выявляемых группировок.
«Зонд» при использовании по отношению к полинуклеотиду относится к полинуклеотиду, способному к специфичной к гибридизации с предназначенной последовательностью другого полинуклеотида. Зонд специфично гибридизуется с комплементарным полинуклеотидом-мишенью, но необязательно отражает точную комплементарную последовательность матрицы. В таком случае специфичная гибридизация зонда с мишенью зависит от жесткости условий гибридизации. Зонды могут быть мечеными, например, хромогенными, радиоактивными или флуоресцентными группировками, и используются в качестве выявляемых группировок. В тех случаях, когда зонд обеспечивает точку инициации синтеза комплементарного полинуклеотида, зонд может также представлять собой праймер.
«Вектор» представляет собой полинуклеотид, который можно использовать для введения другой связанной с ним нуклеиновой кислоты в клетку. Одним из типов векторов является «плазмида», которая относится к линейной или кольцевой двунитевой молекуле ДНК, внутри которой можно лигировать дополнительные сегменты нуклеиновой кислоты. Другим типом вектора является вирусный вектор (например, дефектные по репликации ретровирусы, аденовирусы и аденоассоциированные вирусы), где дополнительные сегменты ДНК можно вводить в вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую их вводят (например, бактериальные векторы, содержащие бактериальную точку начала репликации, и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) после введения в клетку-хозяина интегрируют в геном клетки-хозяина и, следовательно, реплицируются параллельно с геномом клетки-хозяина. «Экспрессионный вектор» представляет собой тип вектора, который может направлять экспрессию выбранного полинуклеотида.
«Регуляторная последовательность» представляет собой нуклеиновую кислоту, которая влияет на экспрессию (например, уровень, время или локализацию экспрессии) нуклеиновой кислоты, с которой она функционально связана. Регуляторная последовательность может, например, оказывать воздействие непосредственно на регулируемую нуклеиновую кислоту или посредством действия одной или более других молекул (например, полипептидов, которые связываются с регуляторной последовательностью и/или с нуклеиновой кислотой). Примеры регуляторных последовательностей включают промоторы, энхансеры и другие контрольные элементы экспрессии (например, сигналы полиаденилирования). Дополнительные примеры регуляторных последовательностей описаны, например, в Goeddel, 1990, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif, и в статье Baron et al., 1995, Nucleic Acids Res. 23:3605-06. Нуклеотидная последовательность «функционально связана» с регуляторной последовательностью, если регуляторная последовательность влияет на экспрессию (например, уровень, время или локализацию экспрессии) нуклеотидной последовательности.
«Клетка-хозяин» представляет собой клетку, которую можно использовать для экспрессии полинуклеотида по изобретению. Клетка-хозяин может представлять собой клетку прокариот, например, E. coli, или может представлять собой клетку эукариот, например, одноклеточных эукариот (например, дрожжей или других грибов), растительную клетку (например, клетку растения табака или томата), животную клетку (например, клетку человека, клетку обезьяны, клетку хомяка, клетку крысы, клетку мыши или клетку насекомого) или гибридому. Как правило, клетка-хозяин представляет собой культивируемую клетку, которую можно трансформировать или трансфицировать кодирующей полипептид нуклеиновой кислотой, которая может впоследствии экспрессироваться в клетке-хозяине. Выражение «рекомбинантная клетка-хозяин» можно использовать для обозначения клетки-хозяина, трансформированной или трансфицированной нуклеиновой кислотой для ее экспрессии. Клетка-хозяин может также представлять собой клетку, содержащую нуклеиновую кислоту, но не экспрессирующую ее на желаемом уровне, если в клетку-хозяина не введена регуляторная последовательность таким образом, что она становится функционально связанной с нуклеиновой кислотой. Понятно, что термин «клетка-хозяин» относится не только к конкретному субъекту, но к потомству или потенциальному потомству такой клетки. Поскольку в последующих поколениях могут происходить некоторые модификации за счет, например, мутации или влияния окружающей среды, такое потомство фактически может не быть идентичным родительской клетке, но все же включено в объем термина, используемого в настоящем документе.
Термин «выделенная молекула» (где молекула представляет собой, например, полипептид или полинуклеотид) означает молекулу, которая в связи с ее происхождением или источником получения (1) не связана с компонентами, сопутствующими ей в ее нативном состоянии в природе, (2) по существу не содержит других молекул того же вида, (3) экспрессируется клеткой из другого вида или (4) не встречается в природе. Таким образом, молекула, синтезированная химическим путем или экспрессированная в клеточной системе, отличающейся от клетки, из которой она имеет происхождение в природе, «выделена» от ее природных сопутствующих компонентов. Молекулу можно также сделать по существу свободной от природных сопутствующих компонентов путем выделения с использованием методик очистки, хорошо известных в данной области техники. Молекулярную чистоту или гомогенность можно определять с помощью ряда средств, известных в данной области техники. Например, чистоту образца полипептида можно определять с использованием электрофореза в полиакриламидном геле и окрашивания геля для визуализации полипептида с использованием методик, хорошо известных в данной области техники. Для некоторых целей более высокую степень разделения можно обеспечить путем использования HPLC (высокоэффективная жидкостная хроматография) или других средств очистки, хорошо известных в данной области техники.
Белок или полипептид является «по существу чистым», «по существу гомогенным» или «по существу очищенным», когда по меньшей мере примерно 60%-75% образца представляет собой только один вид полипептида. Полипептид или белок может быть мономерным или мультимерным. По существу чистый полипептид или белок, как правило, содержит приблизительно 50%, 60%, 70%, 80% или 90% масс./масс. образца белка, чаще всего приблизительно 95% и, например, имеет более 99% чистоты. Чистоту или гомогенность белка можно показать с помощью ряда средств, хорошо известных в данной области техники, таких как электрофорез в полиакриламидном геле образца белка с последующей визуализацией единственной полосы полипептида после окрашивания геля красителем, хорошо известным в данной области техники. Для некоторых целей более высокую степень разделения можно обеспечить путем использования HPLC или других средств очистки, хорошо известных в данной области техники.
«Линкер» относится к молекуле, который соединяет две другие молекулы, либо ковалентно, либо посредством ионных, ван-дер-ваальсовых или водородных связей, например к молекуле нуклеиновой кислоты, которая гибридизуется с одной комплементарной последовательностью на 5' конце и с другой комплементарной последовательностью на 3' конце, соединяя, таким образом, две некомплементарные последовательности. «Расщепляемый линкер» относится к линкеру, который может распадаться или иным путем разрываться с разделением двух компонентов, соединенных расщепляемым линкером. Расщепляемые линкеры обычно расщепляются ферментами, как правило, пептидазами, протеазами, нуклеазами, липазами и тому подобными ферментами. Расщепляемые линкеры могут также расщепляться за счет внешних стимулов, таких как, например, специфичные ферментативные активности, изменения температуры, рН, концентрации соли и т.д., когда такое изменение в окружающей среде следует за трансцитозом слитых молекул через поляризованную эпителиальную мембрану.
«Фармацевтическая композиция» относится к композиции, подходящей для фармацевтического применения у животного. Фармацевтическая композиция содержит фармакологически эффективное количество действующего вещества и фармацевтически приемлемый носитель. «Фармакологически эффективное количество» относится к количеству действующего вещества, эффективному для обеспечения намеченного фармакологического результата.
«Фармацевтически приемлемый носитель» относится к любому из стандартных фармацевтических носителей, несущих сред, буферов и эксципиентов, таких как забуференный фосфатом физиологический раствор, 5% водный раствор декстрозы и эмульсии, такие как эмульсия масло-в-воде или вода-в-масле, и различных типов увлажняющих агентов и/или адъювантов. Подходящие фармацевтические носители и композиции описаны в Remington's Pharmaceutical Sciences, 21st Ed. 2005, Mack Publishing Co, Easton. «Фармацевтически приемлемая соль» представляет собой соль, которую можно включать в композицию соединения для фармацевтического применения, включающая, например, соли металлов (натрия, калия, магния, кальция и т.д.) и соли аммония или органических аминов.
Термины «лечить», «лечащий» и «лечение» относятся к способу облегчения или подавления биологического расстройства и/или по меньшей мере одного из сопровождающих его симптомов. При использовании в настоящем документе «облегчение» заболевания, расстройства или состояния означает уменьшение тяжести и/или частоты встречаемости симптомов заболевания, расстройства или состояния. Кроме того, в настоящем документе ссылки на «лечение» включают ссылки на терапевтическое, паллиативное и профилактическое лечение.
Модифицированные полипептиды Cholix-токсина
Зрелый Cholix-токсин (Jorgensen, R. et al., J Biol Chem 283(16):10671-10678 (2008)) при использовании в настоящем документе представляет собой белок массой 70,7 кДа из 634 остатков, последовательность которого представлена в SEQ ID NO: 1:

В различных воплощениях изобретения Cholix-токсин имеет аминокислотную последовательность, обладающую наблюдаемой гомологией, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99%, с последовательностью SEQ ID NO: 1.
Иллюстративная нуклеиновая кислота, кодирующая зрелый Cholix-токсин, представлена в SEQ ID NO: 2:

В различных воплощениях изобретения Cholix-токсин содержит нуклеиновокислотную последовательность, обладающую наблюдаемой гомологией, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% с последовательностью SEQ ID NO: 2.
В различных воплощениях изобретения модифицированный Cholix-токсин, используемый при получении слитых молекул, представляет собой усеченный Cholix-токсин, где слитая молекула обладает способностью к активации рецептора биологически активной нагрузки. Усеченный Cholix-токсин, как описано в настоящем документе, идентифицируют по отношению к аминокислотным остаткам, включенным в усеченный Cholix-токсин, например, усеченный Cholix-токсин, состоящий из аминокислотных остатков 1-386 SEQ ID NO: 1, идентифицируют как Cholix386.
В различных воплощениях изобретения модифицированный Cholix-токсин, используемый при получении слитой молекулы, представляет собой мутированный Cholix-токсин. Как описано в настоящем документе, мутированный Cholix-токсин, где мутация включает делецию аминокислотного остатка, идентифицируют по отношению к делетированному аминокислотному остатку, например мутированный Cholix-токсин, где аминокислота Е581 SEQ ID NO: 1 делетирована, идентифицируют как «Cholix ΔЕ581». Мутированный Cholix-токсин, где мутация включает замену аминокислотного остатка, идентифицируют по отношению к конкретной аминокислотной замене в определенном аминокислотном остатке. Так, например, термин «S30A» показывает, что остаток «S» (серин в стандартном однобуквенном коде) в положении 30 в SEQ ID NO: 1 был заменен «А» (аланин в стандартном однобуквенном коде), даже если остаток оказывается в усеченном Cholix-токсине, и модифицированный токсин идентифицируют как «CholixS30A».
Домен Ia Cholix-токсина (аминокислоты 1-265 SEQ ID NO: 1) представляет собой «рецептор-связывающий домен», который функционирует в качестве лиганда для рецептора клеточной поверхности и опосредует связывание слитой молекулы с клеткой, например, домен Ia связывается с рецептором клеточной поверхности, присутствующим на апикальной мембране эпителиальной клетки с достаточной аффинностью для обеспечения возможности эндоцитоза слитой молекулы. Домен 1а может связываться с любым рецептором, присутствие которого на апикальной мембране эпителиальной клетки известно специалистам в данной области техники, без ограничений. Например, рецептор-связывающий домен может связываться с рецептором α2-MR. Консервативные или неконсервативные замены могут быть произведены в аминокислотной последовательности домена Ia, если его способность к посредничеству в связывании слитой молекулы с клеткой по существу не устраняется. В различных воплощениях изобретения слитые молекулы содержат Cholix-токсин, содержащий мутированный домен Ia.
В различных воплощениях изобретения домен Ia включает домен, связывающий рецептор антигенпрезентирующей клетки (АРС). В различных воплощениях изобретения домен, связывающий рецептор АРС, представляет собой домен клеточного распознавания домена Ia Cholix или участок домена Ia Cholix, достаточный для связывания с рецептором клеточной поверхности на АРС.
В различных воплощениях изобретения домен, связывающий рецептор АРС, связывается с рецептором, присутствие которого идентифицировано на дендритной клетке или другой АРС. Примеры рецепторов клеточной поверхности на АРС могут включать без ограничений DEC-205 (CD205), CD207, CD209, CD11a, CD11b, CD11c, CD36, CD14, CD50, CD54, CD58, CD68, CD80, CD83, CD86, CD102, CD3, CD14, CD19, Clec9a, CMFR-44, дектин-1, дектин-2, FLT3, HLA-DR, LOX-1, MHC II, BDCA-1, DC-SIGN, Toll-подобные рецепторы (TLR)-2, -3, -4 и -7 и рецептор α2-макроглобулина («α2-MR»). В различных воплощениях изобретения домен, связывающий рецептор АРС, представляет собой α2-MR.
Домен II Cholix-токсина (аминокислоты 266-386 SEQ ID NO: 1) представляет собой «домен трансцитоза», который опосредует трансцитоз из полости, примыкающей к апикальной поверхности слизистой оболочки, на базолатеральную сторону слизистой оболочки. По отношению к настоящему документу «трансцитоз» относится к миграции слитой молекулы через поляризованную эпителиальную клетку. Такая миграция дает возможность высвобождения биологически активной нагрузки из базолатеральной мембраны поляризованной эпителиальной клетки. Слитые молекулы по настоящему изобретению могут содержать модифицированный Cholix-токсин, содержащий полноразмерную аминокислотную последовательность домена II или содержать участки домена II, если активность трансцитоза по существу не устраняется. Кроме того, в аминокислотной последовательности домена трансцитоза могут быть произведены консервативные или неконсервативные аминокислотные замены, если активность трансцитоза по существу не устраняется. Репрезентативный метод анализа, который специалист в данной области техники может стандартно использовать, чтобы определить, обладает ли домен трансцитоза активностью трансцитоза, описан в настоящем документе. При использовании в настоящем документе активность трансцитоза по существу не устраняется, если активность составляет, например, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% по сравнению с модифицированным Cholix-токсином, содержащим полноразмерную аминокислотную последовательность домена II.
В различных воплощениях изобретения неприродные слитые молекулы содержат модифицированный Cholix-токсин, усеченный по аминокислотному остатку внутри домена II Cholix-токсина, где слитая молекула обладает способностью к активации рецептора для биологически активной нагрузки. В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix386 (SEQ ID NO: 3). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix385 (SEQ ID NO: 4). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix384 (SEQ ID NO: 5). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix383 (SEQ ID NO: 6). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix382 (SEQ ID NO: 7). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix381 (SEQ ID NO: 8). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix380 (SEQ ID NO: 9). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix379 (SEQ ID NO: 10). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix378 (SEQ ID NO: 11). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix377 (SEQ ID NO: 12). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix376 (SEQ ID NO: 13). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix375 (SEQ ID NO: 14). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix374 (SEQ ID NO: 15). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix373 (SEQ ID NO: 16). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix372 (SEQ ID NO: 17). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix371 (SEQ ID NO: 18). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix370 (SEQ ID NO: 19). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix369 (SEQ ID NO: 20). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix368 (SEQ ID NO: 21). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix367 (SEQ ID NO: 22). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix366 (SEQ ID NO: 23). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix365 (SEQ ID NO: 24). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix364 (SEQ ID NO: 25). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix363 (SEQ ID NO: 26). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix362 (SEQ ID NO: 27). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix361 (SEQ ID NO: 28). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix360 (SEQ ID NO: 29). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix359 (SEQ ID NO: 30). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix358 (SEQ ID NO: 31). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix357 (SEQ ID NO: 32). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix356 (SEQ ID NO: 33). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix355 (SEQ ID NO: 34). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix354 (SEQ ID NO: 35). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix353 (SEQ ID NO: 36). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix352 (SEQ ID NO: 37). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix351 (SEQ ID NO: 38). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix350 (SEQ ID NO: 39). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix349 (SEQ ID NO: 40). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix348 (SEQ ID NO: 41).
Домен Ib Cholix-токсина (аминокислоты 387-425 SEQ ID NO: 1) не является существенным для какой-либо известной активности Cholix, включающей активность связывания с клеткой, транслокации, удерживания в ER (эндоплазматический ретикулум) или ADP(аденозиндифосфат)-рибозилирования. В различных воплощениях изобретения неприродные слитые молекулы содержат модифицированный Cholix-токсин, усеченный по аминокислотному остатку внутри домена Ib Cholix-токсина, где слитая молекула обладает способностью к активации рецептора для биологически активной нагрузки. В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix425 (SEQ ID NO: 42). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix424 (SEQ ID NO: 43). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix423 (SEQ ID NO: 44). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix422 (SEQ ID NO: 45). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix421 (SEQ ID NO: 46). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix420 (SEQ ID NO: 47). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix419 (SEQ ID NO: 48). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix418 (SEQ ID NO: 49). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix417 (SEQ ID NO: 50). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix416 (SEQ ID NO: 51). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix415 (SEQ ID NO: 52). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix414 (SEQ ID NO: 53). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix413 (SEQ ID NO; 54). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix412 (SEQ ID NO: 55). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix411 (SEQ ID NO: 56). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix410 (SEQ ID NO: 57). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix409 (SEQ ID NO: 58). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix408 (SEQ ID NO: 59). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix407 (SEQ ID NO: 60). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix406 (SEQ ID NO: 61). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix405 (SEQ ID NO: 62). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix404 (SEQ ID NO: 63). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix403 (SEQ ID NO: 64). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix402 (SEQ ID NO: 65). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix401 (SEQ ID NO: 66). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix400 (SEQ ID NO: 67). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix399 (SEQ ID NO: 68). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix398 (SEQ ID NO: 69). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix397 (SEQ ID NO: 70). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix396 (SEQ ID NO: 71). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix395 (SEQ ID NO: 72). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix394 (SEQ ID NO: 73). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix393 (SEQ ID NO: 74). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix392 (SEQ ID NO: 75). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix391 (SEQ ID NO: 76). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix390 (SEQ ID NO: 77). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix389 (SEQ ID NO: 78). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix388 (SEQ ID NO: 79). В одном воплощении изобретения усеченный Cholix-токсин представляет собой Cholix387 (SEQ ID NO: 80).
Домен III Cholix-токсина (аминокислоты 426-634 SEQ ID NO: 1) ответственен за цитотоксичность и включает последовательность удерживания в эндоплазматическом ретикулуме. Домен III опосредует ADP-рибозилирование фактора элонгации 2 («EF2»), который инактивирует синтез белка. Cholix, в котором «отсутствует эндогенная активность ADP-рибозилирования», или «обезвреженный Cholix» относится к любому Cholix, описанному в настоящем документе (включая модифицированные варианты), не содержащему домен III Cholix или модифицированному внутри домена III таким образом, что молекула обезвреживается. Например, делеция остатка глутаминовой кислоты (Glu) в аминокислотном положении 581 SEQ ID NO: 1 обезвреживает молекулу. Этот обезвреженный Cholix обозначен как «Cholix ΔE581». В различных воплощениях изобретения участок домена III Cholix, отличающийся от сигнала удерживания в ER, может быть заменен другой аминокислотной последовательностью. Данная аминокислотная последовательность сама может быть неиммуногенной, незначительно иммуногенной или в высокой степени иммуногенной. Домен удерживания в ER, обладающий высокой степенью иммуногенности, предпочтителен для применения при запуске гуморального иммунного ответа. Например, сам домен III Cholix обладает высокой иммуногенностью и может использоваться в слитых молекулах, где желателен устойчивый гуморальный иммунный ответ.
При использовании в настоящем документе «обезвреженная последовательность Cholix» может представлять собой полноразмерную последовательность или участок(и) полноразмерной последовательности. В целом обезвреженная последовательность Cholix имеет один или более доменов или участков доменов с определенными биологическими активностями обезвреженного Cholix, таких как домен распознавания клетки, домен транслокации или домен удерживания в эндоплазматическом ретикулуме. Например, обезвреженная последовательность Cholix может включать только домен II и обезвреженный домен III. В другом примере обезвреженная последовательность Cholix может включать только домен Ia, домен II и обезвреженный домен III. В другом примере обезвреженная последовательность Cholix может включать все из доменов Ia, Ib, II и обезвреженный домен III. Таким образом, обезвреженная последовательность Cholix может представлять собой непрерывную последовательность нативного Cholix или может представлять собой последовательность, состоящую из прерванных последовательностей нативного Cholix, в которых отсутствует активность ADP-рибозилирования. В одном воплощении настоящего изобретения неприродная слитая молекула содержит мутированный модифицированный Cholix-токсин, обозначенный в настоящем документе как Cholix-токсин ΔЕ581, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 81.
Биологически активная нагрузка
Кроме полипептида модифицированного Cholix-токсина слитые молекулы по настоящему изобретению дополнительно содержат биологически активную нагрузку для доставки субъекту. «Биологически активная нагрузка» при использовании в настоящем документе включает без ограничений: макромолекулу, малую молекулу, пептид, полипептид, нуклеиновую кислоту, мРНК, микроРНК, кшРНК, миРНК, антисмысловую молекулу, антитело, ДНК, плазмиду, вакцину, полимер, полимерную наночастицу или каталитически активное вещество.
В различных воплощениях изобретения биологически активная нагрузка представляет собой макромолекулу, которая может осуществлять желаемую биологическую активность при введении в кровоток субъекта. Например, биологически активная нагрузка может обладать рецептор-связывающей активностью, ферментативной активностью, активностью мессенджера (т.е. действовать в качестве гормона, цитокина, нейротрансмиттера или другой сигнальной молекулы), люминесцентной или другой выявляемой активностью или регуляторной активностью, либо любой их комбинацией. В некоторых диагностических воплощениях изобретения биологически активная нагрузка может быть конъюгирована с фармацевтически приемлемой гамма-излучающей группировкой или может сама представлять собой такую группировку, включая, без ограничений, индий и технеций, с магнитными частицами, рентгеноконтрастными веществами, такими как воздух или барий, и флуоресцентными соединениями.
В различных воплощениях изобретения биологически активная нагрузка слитой молекулы может оказывать свои эффекты в биологических компартментах субъекта, отличающихся от крови субъекта. Например, в различных воплощениях изобретения биологически активная нагрузка может оказывать свои эффекты в лимфатической системе. В других воплощениях изобретения биологически активная нагрузка может оказывать свои эффекты в органе или ткани, таких как, например, печень, сердце, легкие, поджелудочная железа, почки, головной мозг, костный мозг и т.д. субъекта. В таких воплощениях изобретения биологически активная нагрузка может присутствовать или отсутствовать в крови, лимфе или другой биологической жидкости в выявляемых концентрациях, при этом может все еще накапливаться в сайте ее действия в достаточных концентрациях для оказания биологического эффекта.
В различных воплощениях изобретения биологически активная нагрузка представляет собой белок, содержащий более одной полипептидной субъединицы. Например, белок может представлять собой димер, тример или мультимер более высокого порядка. В различных воплощениях изобретения две или более субъединиц белка могут быть соединены ковалентной связью, такой как, например, дисульфидная связь. В других воплощениях изобретения субъединицы белка могут удерживаться вместе нековалентными взаимодействиями. Специалист в данной области техники может стандартным путем идентифицировать такие белки и определить правильность ассоциирования субъединиц с использованием, например, иммунологического анализа.
В различных воплощениях изобретения биологически активная нагрузка для доставки выбрана, например, из цитокинов и рецепторов цитокинов, таких как интерлейкин-1 (IL-1), IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, 1L-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, ингибиторный фактор лимфокинов, макрофагальный колониестимулирующий фактор, тромбоцитарный фактор роста, фактор стволовых клеток, фактор-β роста опухоли, фактор некроза опухоли, лимфотоксин, Fas, гранулоцитарный колониестимулирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор, интерферон-α, интерферон-β, интерферон-γ, факторов роста и белковых гормонов, таких как эритропоэтин, ангиогенин, фактор роста гепатоцитов, фактор роста фибробластов, фактор роста кератиноцитов, фактор роста нервов, фактор-α роста опухоли, тромбопоэтин, тиреостимулирующий фактор, рилизинг-фактор тиреоидного гормона, нейротропин, эпидермальный фактор роста, VEGF (фактор роста эндотелия сосудов), цилиарный нейротрофический фактор, LDL (липопротеин низкой плотности), соматомедин, инсулиновый фактор роста, инсулиноподобный фактор роста I и II, хемокинов, таких как ENA-78, ELC, GRO-α, GRO-β, GRO-γ, HRG, LEF, IP-10, МСР-1, МСР-2, МСР-3, МСР-4, MIP-1-α, MIP-1-β, MG, MDC, NT-3, NT-4, SCF, LIF, лептин, RANTES, лимфотактин, эотаксин-1, эотаксин-2, TARC, TECK, WAP-1, WAP-2, GCP-1, GCP-2; рецепторов α-хемокинов, например CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6, CXCR7; и рецепторов β-хемокинов, например CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7.
Другие примеры биологически активной нагрузки, которые можно доставлять в соответствии с настоящим изобретением, включают, без ограничений, противоопухолевые соединения, такие как нитрозомочевины, например кармустин, ломустин, семустин, стрептозоцин; метилгидразины, например прокарбазин, дакарбазин; стероидные гормоны, например глюкокортикоиды, эстрогены, прогестины, андрогены, тетрагидродезоксикарикостерон; иммуноактивные соединения, такие как иммуносупрессивные средства, например пириметамин, триметоптерин, пеницилламин, циклоспорин, азатиоприн; и иммуностимуляторы, например левамизол, диэтилдитиокарбамат, энкефалины, эндорфины; антимикробные соединения, такие как антибиотики, например β-лактам, пенициллин, цефалоспорины, карбапенемы и монобактамы, ингибиторы β-лактамазы, аминогликозиды, макролиды, тетрациклины, спектиномицин; противомалярийные средства, амебициды; антипротозойные средства; противогрибковые средства, например амфотерицин β, антивирусные средства, например ацикловир, идоксуридин, рибавирин, трифлуридин, видарбин, ганцикловир; паразитициды; противоглистные средства; радиофармпрепараты; желудочно-кишечные лекарственные средства; гематологические соединения; иммуноглобулины; белки свертывания крови, например антигемофильный фактор, комплекс фактора IX; антикоагулянты, например дикумарол, гепарин Na; ингибиторы фибролизина, например транексамовую кислоту; сердечнососудистые лекарственные средства; антиадренергические лекарственные средства периферического действия; гипотензивные лекарственные средства центрального действия, например метилдопа, метилдопа HCl; антигипертензивные прямые сосудорасширяющие средства, например диазоксид, гидралазин HCl; лекарственные средства, влияющие на ренин-ангиотензиновую систему; периферические сосудорасширяющие средства, например фентоламин; антиангинальные лекарственные средства; сердечные гликозиды; инодилататоры, например амринон, милринон, эноксимон, феноксимон, имазодан, сульмазол; антиаритмические средства; блокаторы кальциевых каналов; лекарственные средства, действующие на липиды крови, например ранитидин, бозентан, резулин; лекарственные средства, действующие на органы дыхания; симпатомиметические лекарственные средства, например албутерол, битолтерол мезилат, добутамин HCl, дофамин HCl, эфедрин So, эпинефрин, фенфлурамин HCl, изопротеренол HCl, метоксамин HCl, норадреналин битартрат, фенилэфрин HCl, ритодрин HCl; лекарственные средства - миметики холина, например ацетилхолин Cl; антихолинэстеразы, например эдрофониум Cl; реактиваторы холинэстеразы; адренергические блокирующие лекарственные средства, например ацебутолол HCl, атенолол, эсмолол HCl, лабеталол HCl, метопролол, надолол, фентоламина мезилат, пропанолол HCl; антимускариновые лекарственные средства, например анизотропии метилбромид, атропин SO4, клинидиум Br, гликопирролат, ипратропия Br, скополамин HBr; нервно-мышечные блокирующие лекарственные средства; деполяризующие лекарственные средства, например атракурия безилат, гексафлуорения Br, метокурина йодид, сукцинилхолин Cl, тубокурарин Cl, векурония Br; миорелаксанты центрального действия, например баклофен; нейротрансмиттеры и нейротрансмиттерные средства, например ацетилхолин, аденозин, аденозинтрифосфат; аминокислотные нейротрансмиттеры, например возбуждающие аминокислоты, GABA (гамма-аминомасляная кислота), глицин; нейротрансмиттеры, представляющие собой биогенные амины, например дофамин, эпинефрин, гистамин, норэпинефрин, октопамин, серотонин, тирамин; нейропептиды, оксид азота, токсины K+ каналов; антипаркинсонические лекарственные средства, например амалтидин HCl, бензтропина мезилат, карбидопа; лекарственные средства - диуретики, например дихлорфенамид, метазоламид, бендрофлуметиазид, политиазид; лекарственные средства против мигрени, например карбопроста трометамина мезилат, метисергида малеат.
Кроме того, другие примеры биологически активной нагрузки, которые можно доставлять в соответствии с настоящим изобретением, включают, без ограничений, гормоны, такие как гормоны гипофиза, например хорионический гонадотропин, косинтропин, менотропины, соматотропин, иортикотропин, протирелин, тиротропин, вазопрессин, липрессин; гормоны надпочечников, например беклометазона дипропионат, бетаметазон, дексаметазон, триамцинолон; гормоны поджелудочной железы, например глюкагон, инсулин; паратиреоидный гормон, например дигидротахистерол; тиреоидные гормоны, например кальцитонина этидроната динатриевая соль, левотироксин Na, лиотиронин Na, лиотрикс, тироглобулин, терипаратида ацетат; антитиреоидные лекарственные средства; эстрогенные гормоны; прогестины и антагонисты; гормональные контрацептивные средства; тестикулярные гормоны; желудочно-кишечные гормоны, например, холецистокинин, энтерогликан, галанин, желудочный ингибиторный полипептид, эпидермальный фактор роста - урогастрон, желудочный ингибиторный полипептид, гастрин-высвобождающий пептид, гастрины, пентагастрин, тетрагастрин, мотилин, пептид YY, секретин, вазоактивный кишечный пептид или синкалид.
Кроме того, другие примеры биологически активной нагрузки, которые можно доставлять в соответствии с настоящим изобретением, включают, без ограничений, ферменты, такие как гиалуронидаза, стрептокиназа, активатор тканевого плазминогена, урокиназа, PGE-аденозиндезаминаза; внутривенные анестетики, такие как дроперидол, этомидат, фентанила цитрат/дроперидол, гексобарбитал, кетамин HCl, метогекситал Na, триамилал Na, тиопентал Na; противоэпилептические средства, например карбамазепин, клоназепам, дивалпроэкс Na, этосуксимид, мефенилоин, параметадион, фенилоин, примидон. В различных воплощениях изобретения биологически активная нагрузка представляет собой фермент, выбранный из гиалуронидазы, стрептокиназы, активатора тканевого плазминогена, урокиназы или PGE-аденозиндезаминазы.
Кроме того, другие примеры биологически активной нагрузки, которые можно доставлять в соответствии с настоящим изобретением, включают, без ограничений, химиотерапевтические средства, такие как химиотерапевтические или противоопухолевые средства, эффективные против различных типов рака человека, включающих лейкоз, лимфомы, карциномы, саркомы, миеломы и т.д., такие как, например, доксорубицин, митомицин, цисплатин, даунорубицин, блеомицин, актиномицин D и неокарциностатин.
Модуляторы воспаления (интерлейкин-10 и родственные цитокины)
Интерлейкин-10 (IL-10) представляет собой важный иммунорегуляторный цитокин, продуцируемый многими популяциями клеток, и его основная биологическая функция, по-видимому, состоит в ограничении и остановке воспалительных ответов и в регуляции дифференцировки и пролиферации нескольких видов иммунных клеток, таких как Т-клетки, В-клетки, клетки-естественные киллеры, антигенпрезентирующие клетки, мастоциты и гранулоциты. Более недавние данные позволяют предположить, что IL-10 также опосредует иммуностимулирующие свойства, которые помогают устранить инфекционные и неинфекционные частицы при ограниченном воспалении; Asadullah et al., Pharmacol Rev, 55:241-269, 2003. Кроме того, многочисленные исследования позволяют предположить значительное влияние IL-10 при воспалительных, злокачественных и аутоиммунных заболеваниях, и гиперэкспрессия IL-10 была обнаружена в некоторых опухолях, таких как меланома, базальноклеточная и плоскоклеточная карцинома и несколько лимфом; Id. Обнаружено пять новых молекул человека, структурно родственных IL-10 - IL-19 (Gallagher et al., Genes Immun., 1:442-450, 2000); IL-20 (Blumberg et al., Cell, 104:9-19, 2001), IL-22 (Dumoutier et al., Genes Immun., 1:488-494, 2000), IL-24 (Jiang et al., Oncogene, 11:2477-2486, 1995) и IL-26 (Knappe et al., J. Virol., 74:3881-3887, 2000), и данные позволяют предположить, что иммунные клетки являются основным источником новых членов семейства IL-10; Wolk et al., J. Immunol., 168:5397-5402, 2002.
Хотя в экспериментальных моделях были получены некоторые перспективные результаты для доставки IL-10 в ходе нескольких воспалительных заболеваний, результаты нескольких клинических исследований по оценке IL-10 в качестве терапевтического средства для лечения воспалительных и/или иммунных расстройств остаются несколько разочаровывающими и содержат многие противоречивые данные; Asadullah et al., Pharmacol Rev, 55:241-269, 2003. В целом данные позволяют предположить, что IL-10 безопасен и в целом хорошо переносится, однако, конечная локальная концентрация IL-10 в кишечнике после системного введения стандартных доз слишком низка, что приводит в результате лишь к незначительной эффективности. Id. К сожалению, способность к достаточному повышению доз ограничена из-за побочных эффектов (например, анемии, головной боли), и есть опасения, что высокие дозы вводимого системно IL-10 могут быть вероятнее пагубными, чем полезными при некоторых показаниях, например при болезни Крона; Herfarth et al, Gut, 50(2): 146-147, 2002.
В различных воплощениях изобретения биологически активная нагрузка представляет собой полипептид, который определен как модулятор воспаления в GI тракте, выбранный из, например, интерлейкина-10, интерлейкина-19, интерлейкина-20, интерлейкина-22, интерлейкина-24 или интерлейкина-26.
Интерлейкин-10 (IL-10) был впервые идентифицирован как продукт хелперных Т-клеток 2 типа, и позднее показано, что он продуцируется другими типами клеток, включая В клетки и макрофаги (Moore et al., Annu Rev Immunol, 19:683-765, 2001). Он также ингибирует синтез нескольких цитокинов, продуцируемых хелперными Т-клетками 1 типа, таких как γ-интерферон, IL-2 и фактор-α некроза опухоли (TNF-α) (Fiorentino et al., J Immunol, 146:3444-3451, 1991). Способность IL-10 к ингибированию модуляторов клеточно-опосредованного иммунного ответа и к подавлению Т-клеточных ответов, зависящих от антигенпрезентирующих клеток, демонстрирует, что IL-10 обладает иммуносупрессивными свойствами. Данный цитокин также ингибирует продуцирование моноцитами/макрофагами других цитокинов, таких как IL-1, IL-6, IL-8, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF) и TNF-α.
Белок IL-10 образует функциональный димер, который становится биологически неактивным при прерывании нековалентных взаимодействий, связывающих две его мономерные субъединицы. По-видимому, N-конец непосредственно не вовлечен в активацию рецептора IL-10. Так, в одном аспекте изобретения слитую молекулу конструируют посредством конъюгирования с участием N-конца белка IL-10 с С-концом модифицированного Cholix-токсина с использованием расщепляемого линкера.
В результате такого конструирования может быть получен растворимый димер в качестве результата взаимодействий IL-10.
В различных воплощениях изобретения биологически активная нагрузка представляет собой интерлейкин-10 человека, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 82:

или его фрагмент или вариант.
В различных воплощениях изобретения биологически активная нагрузка содержит аминокислотную последовательность, имеющую наблюдаемую гомологию, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% с последовательностью SEQ ID NO: 82.
IL-19 представляет собой цитокин, принадлежащий к подсемейству цитокинов IL-10. Обнаружено, что этот цитокин преимущественно экспрессируется в моноцитах. Он может связывать комплекс рецептора IL-20 и приводить к активации преобразователя сигнала и активатора транскрипции 3 (STAT3) (Yamamoto-Furusho JK, et al. Hum Immunol, 72(11):1029-32, 2011). В различных воплощениях изобретения биологически активная нагрузка представляет собой интерлейкин-19 человека, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 83:

или его фрагмент или вариант.
В различных воплощениях изобретения биологически активная нагрузка содержит аминокислотную последовательность, имеющую наблюдаемую гомологию, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% с последовательностью SEQ ID NO: 83.
IL-20 представляет собой цитокин, структурно родственный интерлейкину 10 (IL-10). Показано, что сигнал этого цитокина преобразуется посредством преобразователя сигнала и активатора транскрипции 3 (STAT3) в кератиноцитах. Обнаружено, что специфичный рецептор этого цитокина экспрессируется в коже и претерпевает резкую повышающую регуляцию в псориатической коже, что позволяет предположить роль этого белка в эпидермальной функции и при псориазе (Yamamoto-Furusho JK, et al. Immunol Lett, 149(1-2):50-3 2013). В различных воплощениях изобретения биологически активная нагрузка представляет собой интерлейкин-20 человека, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 84:

или его фрагмент или вариант.
В различных воплощениях изобретения биологически активная нагрузка содержит аминокислотную последовательность, имеющую наблюдаемую гомологию, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% с последовательностью SEQ ID NO: 84.
IL-22 представляет собой цитокин, структурно родственный интерлейкину 10 (IL-10). IL-22-секретирующие клетки CD4(+) T (Th22) и IL-22 вовлечены в патогенез аутоиммунного заболевания и могут играть важную роль в патогенезе NMO (нейромиелит зрительного нерва) и MS (Xu et al., J Neuroimmunol., Aug 15:261 (1-2):87-91, 2013). В различных воплощениях изобретения биологически активная нагрузка представляет собой интерлейкин-22 человека, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 85:
или его фрагмент или вариант.
В различных воплощениях изобретения биологически активная нагрузка содержит аминокислотную последовательность, имеющую наблюдаемую гомологию, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% с последовательностью SEQ ID NO: 85.
IL-24 представляет собой цитокин, структурно родственный интерлейкину 10 (IL-10), который может селективно индуцировать апоптоз в различных раковых клетках. Сверхэкспрессия этого гена приводит к повышенной экспрессии некоторых членов семейства генов GADD (белков-индикаторов прекращения роста и повреждения ДНК), которая коррелирует с индуцированием апоптоза. Обнаружено, что фосфорилирование митоген-активируемой протеинкиназы 14 (MAPK7/Р38) и 27 кДа белка 1 теплового шока (HSPB2/HSP27) индуцируется этим геном в клетках меланомы, но не индуцируется в нормальных иммортализованных меланоцитах (Lin BW, et al., J Korean Med Sci, 28(6):833-9, 2013). В различных воплощениях изобретения биологически активная нагрузка представляет собой интерлейкин-24 человека, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 86:

или его фрагмент или вариант.
В различных воплощениях изобретения биологически активная нагрузка содержит аминокислотную последовательность, имеющую наблюдаемую гомологию, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% с последовательностью SEQ ID NO: 86.
IL-26 был идентифицирован по его специфичной сверхэкспрессии в Т-клетках, трансформированных вирусом герпеса беличьей обезьяны. Кодируемый белок является членом семейства цитокинов IL-10. Он представляет собой секретируемый белок и может функционировать в виде гомодимера. Считают, что этот белок вносит вклад в трансформированный фенотип Т-клеток после инфекции вирусом герпеса беличьей обезьяны (Corvaisier M, et al. PLoS Biol, 10(9):e1001395, 2012). В различных воплощениях изобретения биологически активная нагрузка представляет собой интерлейкин-26 человека, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 87:

или его фрагмент или вариант.
В различных воплощениях изобретения биологически активная нагрузка содержит аминокислотную последовательность, имеющую наблюдаемую гомологию, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% с последовательностью SEQ ID NO: 87.
Важно, что неприродные слитые молекулы, не имеющие расщепляемого линкера, могут обладать преимуществом, заключающимся в том, что якорный эффект модифицированного Cholix-токсина посредством его рецептора(ов) на поверхности, например, иммунных клеток, которые также экспрессируют рецептор IL-10 (но в значительно уменьшенном количестве) может дать возможность большего доступа к IL-10 на поверхности клеток-мишеней и обеспечивает синергетическое действие посредством связывания Cholix с его рецептором и связывания IL-10 с IL-10R.
Надсемейство факторов некроза опухоли
Фактор некроза опухоли представляет собой быстро увеличивающееся надсемейство цитокинов (далее в настоящем документе «TNFSF»), которые взаимодействуют с соответствующим надсемейством рецепторов (далее в настоящем документе «TNFSFR»). С момента открытия фактора некроза опухоли альфа («TNF-α») приблизительно 25 лет назад количество TNFSF возросло до широкого семейства родственных белков, состоящего более чем из 20 членов, которые передают сигнал посредством более чем 30 рецепторов (см., например, "Therapeutic Targets of the TNF Superfamily", под ред. Iqbal S. Grewal, Landes Bioscience/Springer Science+Business Media, LLC dual imprint / Springer series: Advances in Experimental Medicine and Biology, 2009). Члены TNFSF имеют широкое тканевое распределение, и взаимодействие лиганда TNFSF с рецептором вовлечено в многочисленные биологические процессы в диапазоне от гемопоэза до плейотропных клеточных ответов, включая активацию, пролиферацию, дифференцировку и апоптоз. Взаимодействие лиганда TNFSF с рецептором также задействовано в опухолеобразовании, отторжении трансплантата, септическом шоке, репликации вируса, резорбции кости и ауто иммунитете. Конкретный ответ зависит от рецептора, передающего сигнал, от типа клеток и от одновременных сигналов, принимаемых клеткой.
Поскольку на опухолевых клетках экспрессируется ряд членов TNFSF, разрабатываются терапии на основе антител для нацеливания на эти молекулы, и некоторые из них в настоящее время проходят клинические испытания (например, TNF-α для применения при лечении меланом и сарком у человека (Eggermont et al., Lancet Oncol, 4:429-437, 2003; Lans et al., Clin Cancer Res, 7:784-790, 2001). Кроме того, многие из этих молекул также используют в качестве мишеней для конъюгатов антитело-лекарственное средство (например, CD30 и CD70) или используют в радиоиммунотерапии (например, рецепторы BLyS (стимулятор В лимфоцитов), TACI (трансмембранный активатор и партнер кальциевого модулятора и лиганда циклофилина) и BR3) (Buchsbaum et al., J Nucl Med, 44:434-436, 2003).
Аналогично, поскольку ряд членов семейства TNFSF задействован как во врожденном, так и в адаптивном иммунном ответе, таком как защита от патогенов, воспалительный ответ и аутоиммунитет, исследуют подходы к нацеливанию на рецепторы и лиганды TNFSF для лечения аутоиммунитета и других воспалительных заболеваний. Действительно, разработан ряд видов терапии биологического блокирования TNF (далее в настоящем документе «ингибиторы TNF»), включающие гуманизированные/моноклональные человеческие антитела (например, инфликсимаб (РЕМИКАД®) или адалимумаб (ХУМИРА®)) или рекомбинантные слитые белки IgG и растворимые рецепторы TNFSF (например, этанерцепт (ЭНБРЕЛ®)), и в настоящее время их применяют у людей для ингибирования воспаления, обусловленного болезнью Крона и ревматоидным артритом (Mitoma et al., Arthritis Rheum, 58:1248-1257, 2008; Shealy et al., Handb Exp Pharmacol, 181:101-129, 2008). Таким образом, потенциал для доставки таких средств локально, включающий, без ограничений, слизистую оболочку кишечника и легких, обеспечил бы дополнительную пользу для эффективности и безопасности.
Хотя эти различные ингибиторы TNF одобрены для различных видов терапии человека и успешно применяются у пациентов-людей, остаются многочисленные виды токсичности, обусловленные этими ингибиторами TNF, например, гепатотоксичность, тромбоэмболические осложнения и повышенный риск развития туберкулеза и лимфомы (Gardam et al., Lancet Infect Dis, 3:148-155, 2003). Кроме того, хотя эти средства эффективны при остановке прогрессирования заболевания, они являются весьма дорогостоящими, как правило, их вводят внутривенно или подкожно, и они не вылечивают заболевания. Необходимо продолжение изучения передачи сигнала членами TNFSF для разработки подходов к тканеспецифичным вмешательствам, которые могли бы дать возможность для видов направленной терапии, обладающих меньшими побочными эффектами.
В различных воплощениях изобретения биологически активная нагрузка представляет собой ингибитор TNF, представляющий собой выделенное антитело или фрагмент антитела. Выделенные антитела и фрагменты антител, полезные в конструкциях и способах по настоящему изобретению, включают, без ограничений, моноклональные антитела (Ab) (mAb), поликлональные Ab, фрагменты Ab (например, Fab, Fab', F(ab')2, Fv, Fc и т.д.), химерные Ab, мини-Ab или доменные Ab (dAb), Ab двойной специфичности, биспецифичные Ab, гетероконъюгаты Ab, одноцепочечные Ab (SCA), фрагменты одноцепочечного вариабельного участка (ScFv), слитые белки, содержащие участок Ab или многочисленные участки Ab, гуманизированные Ab, полностью человеческие Ab и любую другую модифицированную конфигурацию молекулы иммуноглобулина (Ig), которая включает сайт распознавания антигена необходимой специфичности.
Антитела к TNF-α. Одобренное FDA антитело к TNF-α, Адалимумаб (ХУМИРА® компании Abbvie; DrugBank DB 00051) применяется для лечения людей. В различных воплощениях настоящего изобретения биологически активная нагрузка представляет собой человеческое антитело или его антигенсвязывающий фрагмент, содержащее последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 88:

и последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 89:

или его антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина.
В различных воплощениях в изобретении предложены антитела, содержащие тяжелую цепь и легкую цепь, где тяжелая цепь содержит вариабельную область тяжелой цепи, и где вариабельная область тяжелой цепи содержит последовательность, обладающую по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% идентичности с аминокислотной последовательностью, представленной в SEQ ID NO: 88; и где легкая цепь содержит вариабельную область легкой цепи, и где вариабельная область легкой цепи содержит последовательность, обладающую по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% идентичности с аминокислотной последовательностью, представленной в SEQ ID NO: 89; где антитело специфично связывается с TNF-α человека.
Одобренное FDA антитело к TNF-α, Инфликсимаб (РЕМИКАД® компании Centocor; DrugBank DB 00065) применяется для лечения людей. В различных воплощениях настоящего изобретения биологически активная нагрузка представляет собой человеческое антитело или его антигенсвязывающий фрагмент, содержащее последовательность вариабельной области тяжелой цепи, представленную в SEQ ID NO: 90:

и последовательность вариабельной области легкой цепи, представленную в SEQ ID NO: 91:

или его антигенсвязывающий или иммунологически функциональный фрагмент иммуноглобулина.
В различных воплощениях в изобретении предложены антитела, содержащие тяжелую цепь и легкую цепь, где тяжелая цепь содержит вариабельную область тяжелой цепи, и где вариабельная область тяжелой цепи содержит последовательность, обладающую по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% идентичности с аминокислотной последовательностью, представленной в SEQ ID NO: 90; и где легкая цепь содержит вариабельную область легкой цепи, и где вариабельная область легкой цепи содержит последовательность, обладающую по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% идентичности с аминокислотной последовательностью, представленной в SEQ ID NO: 91; где антитело специфично связывается с TNF-α человека.
В литературе описаны антитела к нескольким другим лигандам TNFSF или TNFSFR, и их оценивали в качестве терапевтических средств-кандидатов при лечении или предупреждении ряда воспалительных заболеваний, аутоиммунных заболеваний и рака. Нуклеотидные и аминокислотные последовательности антител к указанным полипептидам TNFSF или TNFSFR легко доступны в базах данных общего пользования. Исчерпывающий обзор таких антител, а также дополнительных ингибиторов TNF приведен в "Therapeutic Targets of the TNF Superfamily", под редакцией Iqbal S. Grewal, Landes Bioscience/Springer Science+Business Media, LLC dual imprint/Springer series: Advances in Experimental Medicine and Biology, 2009, которая полностью включена в настоящий документ посредством ссылки в целях изучения таких ингибиторов TNF.
В различных воплощениях изобретения биологически активная нагрузка представляет собой ингибитор TNFSF, включающий растворимый рецептор или растворимый солиганд. Термины «растворимый рецептор», «растворимый рецептор цитокина» (SCR) и «иммуноадгезин» используют взаимозаменяемо как относящиеся к растворимым химерным молекулам, содержащим внеклеточный домен рецептора, например, члена семейства рецепторов TNFSF, и последовательность Ig, сохраняющую специфичность связывания рецептора и способную к связыванию члена семейства TNFSF. В различных воплощениях изобретения TNFSFSCR содержит слияние аминокислотной последовательности TNFSFR (или ее участка) из внеклеточного домена члена семейства TNFSF, способной к связыванию члена семейства TNFSF (в некоторых воплощениях аминокислотной последовательности, по существу сохраняющей специфичность связывания TNFSFR) и последовательности Ig. Известно, что существует два отдельных типа TNFSFR: тип I TNFSFR (TNFSFRI) и тип II TNFSFR (TNFSFRII). В различных воплощениях изобретения рецептор TNFSF представляет собой последовательность рецептора TNFSF человека, и слияние осуществляют с последовательностью константного домена Ig. В других воплощениях изобретения последовательность константного домена Ig представляет собой последовательность константного домена тяжелой цепи Ig. В других воплощениях изобретения в результате ассоциации двух слитых молекул TNF рецептор - тяжелая цепь Ig (например, посредством ковалентного связывания посредством дисульфидной(ых) связи(ей)) получают структуру, подобную гомодимерному Ig.
Примером имеющегося в продаже растворимого рецептора, полезного в настоящем изобретении, является ЭНБРЕЛ® (этанерцепт). ЭНБРЕЛ® состоит из димерного слитого белка рекомбинантного TNFR-p75-Fc человека, состоящего из внеклеточного лиганд-связывающего участка 75-килодальтонного (р75) рецептора фактора некроза опухоли человека (TNFR), связанного с участком Fc IgG1 человека. Компонент Fc этанерцепта содержит домен СН2, домен СН3 и шарнирную область, но не содержит домен СН1 IgG1. Этанерцепт продуцируют с помощью технологии рекомбинантных ДНК в экспрессионной системе клеток млекопитающих, представляющей собой клетки яичника китайского хомячка (СНО). Он состоит из 934 аминокислот. Продукт получают путем кодирования ДНК растворимого участка TNFR-p75 человека с участком Fc IgG. В различных воплощениях настоящего изобретения биологически активная нагрузка представляет собой ингибитор TNF, представляющий собой димерный слитый белок, содержащий последовательность, представленную в SEQ ID NO: 92:

или его фрагмент или вариант.
В различных воплощениях изобретения биологически активная нагрузка содержит аминокислотную последовательность, обладающую наблюдаемой гомологией по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% последовательности SEQ ID NO: 92.
Иллюстративный, но не ограничивающий перечень лигандов TNFSF и TNFSFR, из которого получают ингибитор TNF и применяют в качестве биологически активной нагрузки в конструкциях и способах по настоящему изобретению, представлен в таблице 2.

Глюкозоснижающие средства
В различных воплощениях изобретения биологически активная нагрузка представляет собой глюкозоснижающее средство. В различных воплощениях изобретения глюкозоснижающее средство представляет собой пептид, содержащий приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 8, приблизительно 9, приблизительно 10, приблизительно 11, приблизительно 12, приблизительно 13, приблизительно 14, приблизительно 15, приблизительно 16, приблизительно 17, приблизительно 18, приблизительно 19, приблизительно 20, приблизительно 25, приблизительно 30, приблизительно 35, приблизительно 40, приблизительно 45, приблизительно 50, приблизительно 55, приблизительно 60, приблизительно 65, приблизительно 70, приблизительно 75, приблизительно 80, приблизительно 85, приблизительно 90, приблизительно 95, приблизительно 100, приблизительно 150, приблизительно 200, приблизительно 250, приблизительно 300, приблизительно 400, приблизительно 500, приблизительно 600, приблизительно 700, приблизительно 800, приблизительно 900 или приблизительно 1000 аминокислот.
Иллюстративный, но не ограничивающий перечень подходящих белков, связанных с метаболизмом глюкозы, для применения в качестве глюкозоснижающего средства в слитых молекулах по настоящему изобретению, или из которых могут быть получены глюкозоснижающие средства, рассматриваемые для применения в качестве глюкозоснижающего средства, приведены в таблице 3.
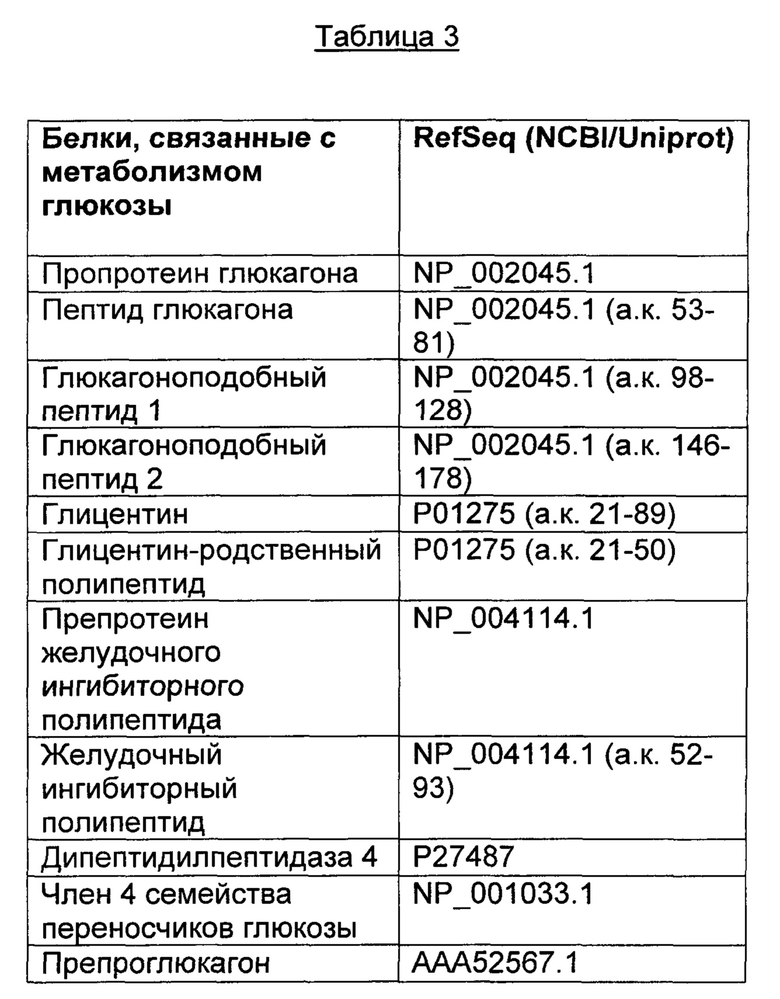

Глюкагоноподобный пептид-1 (GLP-1), представляющий собой член семейства проглюкагоновых инкретинов, синтезирующийся в L-клетках кишечника путем тканецифического посттрансляционного процессинга предшественника глюкагона препроглюкагона, является сильнодействующим глюкозоснижающим средством, задействованным в контроле аппетита и насыщения. GLP-1 действует посредством рецептора GLP-1 (GLP-1R), широко распределенного в тканях, включая головной мозг, поджелудочную железу, тонкий кишечник, легкое, желудок и почки. По-видимому, действия GLP-1 являются как инсулинотропными, так и инсулиномиметическими, в зависимости от концентрации глюкозы в окружающей среде. Благодаря их способности к повышению секреции инсулина из поджелудочной железы, повышению чувствительности к инсулину как в альфа-клетках, так и в бета-клетках и снижению секреции глюкагона из поджелудочной железы GLP-1 и его аналоги привлекли значительное внимание в качестве терапевтической стратегии для лечения диабета.
В нескольких клинических испытаниях исследовано добавление агонистов GLP-1 в сочетании с продолжающейся инсулинотерапией, и несколько агонистов GLP-1 одобрено для лечения T2D (диабета 2 типа), включающих, например, эксенатид (торговое название Биетта®, Amylin/Astrazeneca); лираглутид (торговое название Виктоза®, Novo Nordisk A/S); ликсисенатид (торговое название Ликсумия®, Sanofi); албиглутид (торговое название Танзеум®, GlaxoSmithKline); дилаглутид (торговое название Трулисити®, Eli Lilly). Хотя доказана их эффективность, основным недостатком, связанным с клиническим применением агонистов GLP-1, является короткий период биологического полувыведения, приводящий к необходимости в непрерывном внутривенном введении или в частых подкожных инъекциях, и все лекарственные средства на основе GLP-1, одобренные к настоящему времени, вводят подкожно на основе введения два раза в сутки или раз в неделю. Кроме того, существуют проблемы безопасности, связанные с применением этих агонистов GLP-1, а именно панкреатит и новообразования поджелудочной железы, гипогликемия и нарушение функции почек. Другие побочные эффекты, о которых сообщают, включают желудочно-кишечные расстройства, такие как диспепсия, сниженный аппетит, тошнота, рвота, боль в животе, диарея, головокружение, головная боль и ощущение тревоги. Таким образом, необходимо продолжать интенсивные исследования, направленные на получение аналогов природного GLP-1, обладающих более длительным действием, а также на разработку технологий пролонгированного высвобождения и других родственных технологий для снижения частоты инъекций для пациентов с T2D.
В различных воплощениях изобретения биологически активная нагрузка представляет собой агонист GLP-1, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 93:

или его фрагмент или вариант.
В различных воплощениях изобретения биологически активная нагрузка содержит аминокислотную последовательность, обладающую наблюдаемой гомологией, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% с последовательностью SEQ ID NO: 93.
В различных воплощениях изобретения биологически активная нагрузка представляет собой агонист GLP-1, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 94:

или его фрагмент или вариант.
В различных воплощениях изобретения биологически активная нагрузка содержит аминокислотную последовательность, обладающую наблюдаемой гомологией, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% с последовательностью SEQ ID NO: 94.
Гормон роста человека
Гормон роста (GH) (также известный как соматропин или соматотропин) является основным гормоном в организме человека и синтезируется и секретируется эндокринной системой. Этот гормон контролирует жизненно важные функции, такие как: рост и репликация клеток в различных органах в организме. Некоторые из жизненно важных функций GH включают: регуляцию роста мышц, улучшение минерализации и прочности костей, уменьшение жировых отложений и поддержание надлежащих уровней энергии. Продукция и секреция гормона роста регулируется рилизинг-фактором гормона роста (GHRH), который секретируется гипоталамусом. GHRH стимулирует продукцию гипофизом GH, который непосредственно высвобождается в кровоток. GH, в свою очередь, стимулирует продукцию печенью инсулиноподобного фактора роста (IGF-1), стимулирующего пролиферацию хондроцитов (хрящевых клеток), способствует дифференцировке миобластов и усиливает синтез белка, что, в свою очередь, помогает росту других мышц и тканевых клеток.
В США полученный синтетическим путем гормон роста человека (HGH) применяют в популяции детей для лечения низкорослости, обусловленной дефицитом гормона роста (GHD), синдрома Тернера (TS), синдрома Нунан, синдрома Прадера-Вилли, дефицита гена низкорослости, содержащего гомеобокс (SHOX), хронической почечной недостаточности, идиопатической низкорослости и детей с низкой массой для данного гестационного возраста. У взрослых HGH применяют для лечения синдрома короткого кишечника, состояния, при котором питательные вещества неправильно всасываются вследствие тяжелого заболевания кишечника или хирургического удаления значительной части тонкого кишечника, дефицит GH вследствие редких опухолей гипофиза или их лечения и мышечной дистрофии, ассоциированной с HIV/AIDS (вирус иммунодефицита человека/синдром приобретенного иммунодефицита).
Дефицит гормона роста (GHD) является редким расстройством, включающим группу различных патологий, характеризующихся неадекватной секрецией гормона роста (GH) из передней доли гипофиза, небольшой железы, локализованной в основании головного мозга, которая отвечает за продукцию нескольких гормонов. GHD может встречаться сам по себе или в комбинации с дефицитами других гормонов гипофиза. GHD может присутствовать с рождения (врожденный) или быть приобретенным в результате травмы, инфильтратов, опухоли или радиотерапии. Существует третья категория, имеющая неизвестную причину (идиопатический). GHD с началом в детском возрасте может представлять собой все три вида: врожденный, приобретенный или идиопатический. Его результатом является замедление роста, низкорослость и задержка созревания, отражающаяся в задержке удлинения костей конечностей, несоответствующей хронологическому возрасту ребенка. GHD с началом во взрослом возрасте чаще всего приобретается в результате опухоли гипофиза или травмы головного мозга, но может также быть идиопатическим. Это расстройство характеризуется рядом различных симптомов, включающих сниженные уровни энергии, измененный состав тела, остеопороз (сниженную минеральную плотность кости), уменьшенную мышечную силу, патологические изменения липидов, такие как повышенные уровни LDL или уровни холестерина, инсулинорезистентность и нарушенную функцию сердца. По оценкам GHD взрослых поражает 1 из 100000 человек ежегодно, при этом частота его встречаемости составляет приблизительно 2 случая на популяцию 100000 с учетом пациентов с GHD с началом в детстве. Приблизительно 15-20% случаев представляет собой переход от детского GHD во взрослый (Stochholm K et al., EurJ Endocrinol., 155:61-71, 2006).
Синдром Тернера (или Ульриха-Тернера) (TS) представляет собой хромосомную аномалию, характеризующуюся полным отсутствием X-хромосомы или делецией внутри этой хромосомы, и влияет на развитие у женщин. Наиболее распространенным признаком синдрома Тернера является низкорослость, которая становится очевидной к возрасту 5 лет. Данное состояние встречается у приблизительно 1 из 2500 новорожденных девочек во всем мире, но значительно более распространено среди беременностей, не сохраняющихся до родов (выкидышей и мертворождений). Хромосомное состояние, обусловливающее синдром Тернера, неизлечимо.
Гормон роста человека, полученный методами рекомбинантных ДНК, является единственным лекарственным средством, одобренным специально для лечения GHD и TS. К 2005 году различные рекомбинантные гормоны роста человека (также называемые соматропином [рДНК происхождения] для инъекций), имеющиеся в продаже в США (и их производители) включали НУТРОПИН® (Genentech), ХУМАТРОП® (Lilly), ГЕНОТРОПИН® (Pfizer), НОРДИТРОПИН® (Novo) и САЙЗЕН® (Merck Serono). В 2006 году Управлением по контролю за пищевыми продуктами и лекарственными средствами США (FDA) одобрен вариант rHGH, названный ОМНИТРОП® (Sandoz). Форма гормона роста пролонгированного высвобождения, НУТРОПИН ДЕПО® (Genentech/Alkermes), была одобрена FDA в 1999 г.и дает возможность для меньшего числа инъекций (раз в 2 или 4 недели вместо ежедневного); тем не менее, выпуск продукта был прекращен компанией Genentech/Alkermes в 2004 г.по финансовым причинам. Дополнительные одобренные рекомбинантные препараты HGH включают СЕРОСТИМ® (EMD Serono), ТЕВ-ТРОПИН® (Teva) и ZORBITIVE® (Merck Serono) для лечения синдрома короткого кишечника.
Хотя доказана их наибольшая эффективность как при самостоятельном, так и при управляемом варианте лечения для борьбы с расстройствами роста, такими как GHD, эти инъекционные rHGH обладают несколькими значительными ограничениями, например, (1) осложнениями, связанными с пролонгированным применением и высокими дозировками, которые являются тяжелыми и необратимыми и включают, например, вероятность развития диабета, сердечно-сосудистых расстройств и рака ободочной кишки. Другие частые побочные эффекты включают: боль в суставах, анасарку, тяжелую головную боль, гипогликемию, боль в запястье (карпальный туннельный синдром), повышенный уровень LDL в крови, увеличивающий возможность развития атеросклероза и т.д.; (2) инъекционные HGH отсутствуют в продаже по рецепту, тем не менее, из-за строгих норм FDA распространена продажа на черном рынке. Закупка инъекционных HGH без рецепта врача считается нелегальной и наказуема по закону тюремным заключением и денежным взысканием; и (3) стоимость лечения является чрезмерной. В зависимости от фармацевтической компании стоимость инъекционных HGH на месяц лечения, как правило, находится в диапазоне от $800 до $3000. Наконец, традиционные способы применения rHGH включают многодозовые схемы, в которых HGH вводят путем подкожной инъекции. Неудобство, болезненность и социальная стигмизация, сопутствующие таким способам, могут быть значительными. Особенно затруднительным может быть ведение популяции пациентов-детей для лечения низкорослости, обусловленной дефицитом гормона роста (GHD), синдромом Тернера (TS) и родственными расстройствами в связи с этими высоко инвазивными и многократными видами терапии.
Полноразмерный HGH человека состоит из 191 аминокислот. HGH, полученный с использованием молекулярно-биологических методов, может иметь аминокислотную последовательность, идентичную природному HGH. Альтернативно, применяемый HGH может представлять собой аналог HGH, содержащий одно или более изменений аминокислотной последовательности по отношению к нативному гормону. Эти аминокислотные изменения могут обеспечить повышенную биологическую активность или некоторые другие биологические или логистические преимущества. В различных воплощениях изобретения рекомбинантный HGH содержит аминокислотную последовательность, представленную в базе данных Genbank, № доступа Р01241. Аминокислотная последовательность HGH (без сигнальной последовательности 26 а.к. Р01241) представлена в SEQ ID NO: 95:

HGH по настоящему изобретению относится к HGH из любого источника, имеющему последовательность SEQ ID NO: 95, включающему изолированный, очищенный и/или рекомбинантный HGH, полученный из любого источника или синтезированный химическим путем, например с использованием твердофазного синтеза. В данный документ также включены консервативные аминокислотные замены нативного HGH. Например, могут быть выполнены консервативные изменения аминокислот, которые, хотя могут изменить первичную последовательность белка или пептида, в норме не изменяют его функцию. Консервативные аминокислотные замены, как правило, включают замены в пределах следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глутаминовая кислота; аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин, тирозин. В различных воплощениях изобретения HGH имеет аминокислотную последовательность, обладающую наблюдаемой гомологией, например, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% с последовательностью SEQ ID NO: 95.
В различных воплощениях изобретения HGH, рассматриваемый для применения в слитых молекулах по настоящему изобретению, включают варианты и мутанты гормона роста человека, широко описанные в данной области техники (см., например, патент США 8,637,646 (Wells et al) и цитируемые в нем ссылки и US 20110130331 (Guyon et al), каждый из которых включен в настоящий документ посредством ссылки для конкретной цели предоставления таких вариантов и мутантов гормона роста).
В различных воплощениях изобретения HGH, рассматриваемый для применения в слитых молекулах по настоящему изобретению включает, например, НУТРОПИН® (Genentech), ХУМАТРОП® (Lilly), ГЕНОТРОПИН® (Pfizer), НОРДИТРОПИН® (Novo), САЙЗЕН® (Merck Serono), ОМНИТРОП® (Sandoz), СЕРОСТИМ® (EMD Serono), TEB-ТРОПИН® (Teva) и ZORBITIVE® (Merck Serono).
Иллюстративный, но не ограничивающий перечень подходящих белков гормона роста для применения в качестве гормона роста в слитых молекулах по настоящему изобретению, или из которых могут быть получены гормоны роста, рассматриваемые для применения в качестве гормона роста, приведены в таблице 4.
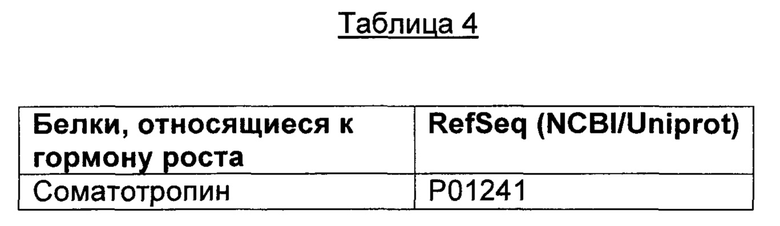

Сайт встраивания для присоединения биологически активной нагрузки
Биологически активная нагрузка слитой молекулы может быть присоединена к остальной части слитой молекулы любым способом, известным специалистам в данной области техники, без ограничений. Биологически активная нагрузка может быть встроена в любой участок слитой молекулы, который не прерывает активность связывания с клеткой или трансцитоза модифицированного Cholix-токсина. В различных воплощениях изобретения биологически активную нагрузку непосредственно связывают с N-концом или с С-концом модифицированного Cholix-токсина. В различных воплощениях изобретения биологически активную нагрузку можно соединять с боковой цепью аминокислоты модифицированного Cholix-токсина. В различных воплощениях изобретения биологически активную нагрузку связывают с модифицированным Cholix с помощью нерасщепляемого пептидного линкера. В различных воплощениях изобретения биологически активную нагрузку связывают с модифицированным Cholix с помощью расщепляемого линкера так, что расщепление в расщепляемом(ых) линкере(ах) отделяет биологически активную нагрузку от остальной части слитой молекулы. В различных воплощениях изобретения биологически активная нагрузка представляет собой полипептид, который может также содержать короткий лидерный пептид, который остается присоединенным к полипептиду после расщепления расщепляемого линкера. Например, биологически активная нагрузка может содержать короткий лидерный пептид более 1 аминокислоты, более 5 аминокислот, более 10 аминокислот, более 15 аминокислот, более 20 аминокислот, более 25 аминокислот, более 30 аминокислот, более 50 аминокислот или более 100 аминокислот. В некоторых случаях биологически активная нагрузка может содержать короткий лидерный пептид менее 100 аминокислот, менее 50 аминокислот, менее 30 аминокислот, менее 25 аминокислот, менее 20 аминокислот, менее 15 аминокислот, менее 10 аминокислот или менее 5 аминокислот. В некоторых случаях биологически активная нагрузка может содержать короткий лидерный пептид 1-100 аминокислот, 5-10 аминокислот, 10-50 аминокислот или 20-80 аминокислот. В нативном Cholix-токсине петля домена Ib имеет протяженность от аминокислоты 387 до 425 и структурно характеризуется дисульфидной связью между двумя цистеинами в положениях 395 и 402. Данный участок домена Ib Cholix-токсина не является существенным для какой-либо известной активности Cholix-токсина, включающей активность связывания с клеткой, транслокации, удерживания в ER или ADP-рибозилирования. Соответственно, домен Ib может быть полностью делетирован или модифицирован таким образом, чтобы содержать биологически активную нагрузку. Таким образом, в различных воплощениях изобретения биологически активная нагрузка может быть встроена в домен Ib Cholix-токсина. При желании биологически активная нагрузка может быть встроена в домен Ib Cholix-токсина между цистеинами в положениях 395 и 402, которые не связаны друг с другом. Это можно осуществить путем восстановления дисульфидной связи между цистеинами, путем полного делетирования одного или обоих цистеинов из домена Ib, путем мутирования одного или обоих цистеинов на другие остатки, например, серин, или другими подобными методами. Альтернативно, биологически активная нагрузка может быть встроена в петлю домена Ib между цистеинами в положениях 395 и 402. В таких воплощениях изобретения дисульфидную связь между цистеинами можно использовать для ограничения домена биологически активной нагрузки.
В воплощениях изобретения, где биологически активная нагрузка экспрессируется совместно с другой частью слитой молекулы в виде слитого белка, биологически активная нагрузка может быть встроена в слитую молекулу любым способом, известным специалистам в данной области техники, без ограничений. Например, аминокислоты, соответствующие биологически активной нагрузке, могут быть непосредственно встроены в слитую молекулу с делетированием или без делетирования нативных аминокислотных последовательностей. В различных воплощениях изобретения домен Ib Cholix-токсина может быть полностью или частично делетирован и заменен биологически активной нагрузкой. В различных воплощениях изобретения остатки цистеина петли Ib делегированы таким образом, чтобы биологически активная нагрузка оставалась не ограниченной. В других воплощениях изобретения остатки цистеина петли Ib связаны дисульфидной связью и ограничивают биологически активную нагрузку.
В воплощениях изобретения, где биологически активная нагрузка не экспрессируется совместно с остальной частью слитой молекулы в виде слитого белка, биологически активная нагрузка может быть соединена с остальной частью слитой молекулы любым подходящим способом, известным специалистам в данной области техники, без ограничений. Более конкретно иллюстративные способы, описанные выше, для соединения рецептор-связывающего домена с остальной частью молекулы в равной степени применимы к соединению биологически активной нагрузки с остальной частью молекулы.
Получение слитых белков
В различных воплощениях изобретения неприродную слитую молекулу синтезируют с использованием методологии рекомбинантных ДНК. Как правило, в это вовлечено создание последовательности ДНК, кодирующей слитую молекулу, помещение ДНК в экспрессионную кассету под контролем конкретного промотора, экспрессию молекулы в хозяине, выделение экспрессированной молекулы и при необходимости ренатурацию молекулы.
ДНК, кодирующая слитые молекулы (например, Cholix415-IL-10), описанные в настоящем документе, могут быть получены любым подходящим способом, включающим, например, клонирование и рестрикцию соответствующих последовательностей или прямой химический синтез способами, такими как фосфотриэфирный способ Narang et al. (1979) Meth. Enzymol. 68: 90-99; фосфодиэфирный способ Brown et al. (1979) Meth. Enzymol. 68: 109-151; диэтилфосфорамидитный способ Beaucage et al. (1981) Tetra. Lett., 22: 1859-1862); способ на твердом носителе по патенту США №4,458,066 и тому подобное.
В результате химического синтеза получают однонитевой олигонуклеотид. Этот олигонуклеотид можно преобразовать в двунитевую ДНК путем гибридизации с комплементарной последовательностью или путем полимеризации ДНК-полимеразой с использованием одной нити в качестве матрицы. Специалистам в данной области техники должно быть понятно, что, хотя химический синтез ДНК ограничен последовательностями приблизительно 100 оснований, более длинные последовательности могут быть получены путем лигирования более коротких последовательностей.
Альтернативно можно клонировать подпоследовательности и расщеплять подходящие подпоследовательности с использованием подходящих ферментов рестрикции. Затем фрагменты можно лигировать с получением желаемой последовательности ДНК.
В различных воплощениях изобретения ДНК, кодирующую слитые молекулы по настоящему изобретению, можно клонировать с использованием способов амплификации ДНК, таких как полимеразная цепная реакция (PCR). Так, например, ген IL-10 амплифицируют с помощью PCR, используя смысловой праймер, содержащий сайт рестрикции, например, для NdeI, и антисмысловой праймер, содержащий сайт рестрикции для HindIII. В результате можно получить нуклеиновую кислоту, кодирующую зрелую последовательность IL-10 и имеющую концевые сайты рестрикции. Модифицированный Cholix-токсин, имеющий «комплементарные» сайты рестрикции, можно аналогично клонировать, а затем лигировать с IL-10 и/или с линкером, присоединенным к IL-10. В результате лигирования нуклеиновокислотных последовательностей и их встраивания в вектор получают вектор, кодирующий IL-10, присоединенный к модифицированному Cholix-токсину.
Нерасщепляемые линкеры
В различных воплощениях изобретения модифицированный Cholix-токсин и биологически активная нагрузка могут быть разделены пептидным спейсером, состоящим из одной или более аминокислот (например, вплоть до 25 аминокислот). Обычно спейсер не обладает специфичной биологической активностью, кроме соединения белков или сохранения некоторого минимального расстояния или других пространственных взаимоотношений между ними. В различных воплощениях изобретения, однако, аминокислоты, составляющие спейсер, могут быть выбраны так, чтобы повлиять на какое-либо свойство молекулы, такое как укладка, суммарный заряд и гидрофобность.
В различных воплощениях изобретения линкер способен к образованию ковалентных связей как с Cholix-токсином, так и с биологически активной нагрузкой. Подходящие линкеры хорошо известны специалистам в данной области техники и включают, без ограничений, прямоцепочечные или разветвленные углеводородные линкеры, гетероциклические углеводородные линкеры или пептидные линкеры. В различных воплощениях изобретения линкер(ы) может(гут) быть соединен(ы) с аминокислотами, составляющими Cholix-токсин и/или биологически активную нагрузку, посредством их боковых групп (например, посредством дисульфидной связи с цистеином). В различных воплощениях изобретения линкеры присоединяют к альфа-атому углерода амино- и/или карбоксильных групп концевых аминокислот Cholix-токсина и/или биологически активной нагрузки.
Для формирования желаемого конъюгата можно использовать бифункциональный линкер, имеющий одну функциональную группу, реагирующую с группой на Cholix-токсине, и другую группу, реагирующую с биологически активной нагрузкой. Альтернативно в дериватизацию может быть вовлечена химическая обработка нацеливающей группировки. Известны методики создания, например, свободных сульфгидрильных групп на полипептидах, таких как антитела или фрагменты антител (см. патент США № 4,659,839).
Известны многие методики и линкерные молекулы для присоединения различных соединений, включая хелаты радионуклидов металлов, токсинов и лекарственных средств с белками, такими как антитела. См., например, Европейскую патентную заявку №188,256; патенты США №№4,671,958, 4,659,839, 4,414,148, 4,699,784; 4,680,338; 4,569,789; and 4,589,071; и статью Borlinghaus et al. (1987) Cancer Res. 47: 4071-4075.
В различных воплощениях изобретения биологически активную нагрузку, доставляемую субъекту, связывают с модифицированным Cholix-токсином, используя один или более нерасщепляемых пептидных линкеров, содержащих, например, аминокислотную последовательность GGGGS (SEQ ID NO: 96), GGGGSGGGGS (SEQ ID NO: 97), GGGGSGGGGSGGGGS (SEQ ID NO: 98) или GGGGSGGG (SEQ ID NO: 99), где модифицированный Cholix-токсин нацеливает указанную биологически активную нагрузку на определенные клетки, включающие, без ограничений, клетки иммунной системы, такие как макрофаги, антигенпрезентирующие клетки и дендритные клетки.
Расщепляемые линкеры
В различных воплощениях изобретения биологически активную нагрузку, доставляемую субъекту, связывают с модифицированным Cholix-токсином, используя один или более расщепляемых линкеров. Число расщепляемых линкеров, присутствующих в слитой молекуле, зависит по меньшей мере частично от расположения биологически активной нагрузки по отношению к модифицированному Cholix-токсину и от природы биологически активной нагрузки. Если биологически активную нагрузку можно отделить от остальной части слитой молекулы путем расщепления в одном линкере, слитые молекулы могут содержать один расщепляемый линкер. Кроме того, если биологически активная нагрузка представляет собой, например, димер или другой мультимер, каждую субъединицу биологически активной нагрузки можно отделить от остальной части слитой молекулы и/или от других субъединиц биологически активной нагрузки путем расщепления в расщепляемом линкере.
В различных воплощениях изобретения расщепляемые линкеры расщепляются расщепляющим ферментом, который присутствует на базолатеральной мембране эпителиальной клетки или вблизи нее. Путем выбора расщепляемого линкера для расщепления такими ферментами биологически активная нагрузка может высвобождаться от остальной части слитой молекулы после трансцитоза через слизистую оболочку и высвобождаться из эпителиальной клетки в клеточный матрикс на базолатеральной стороне мембраны. Кроме того, можно использовать расщепляющие ферменты, присутствующие внутри эпителиальной клетки так, что расщепляемый линкер расщепляется перед высвобождением слитой молекулы из базолатеральной мембраны, если расщепляющий фермент не расщепляет слитую молекулу до того, как слитая молекула поступает в путь миграции в поляризованной эпителиальной клетке, в результате которой происходит высвобождение слитой молекулы и биологически активной нагрузки из базолатеральной мембраны клетки.
В различных воплощениях изобретения фермент, присутствующий на базолатеральной мембране поляризованной эпителиальной клетки, выбран, например, из катепсина GI, химотрипсина I, эластазы I, субтилизина AI, субтилизина AII, тромбина I или урокиназы I. В таблице 5 представлены эти ферменты вместе с аминокислотной последовательностью, которая распознается и расщепляется конкретной пептидазой.
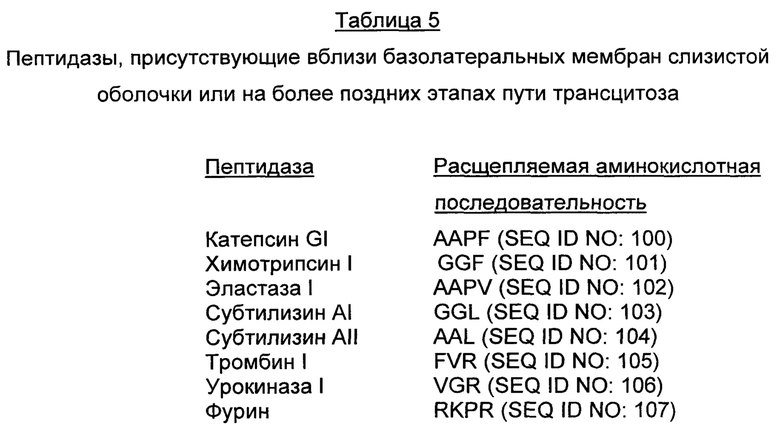
В различных воплощениях изобретения расщепляемый линкер проявляет большую склонность к расщеплению, чем остальная часть доставляемой конструкции. Как понятно специалистам в данной области техники, многие пептидные и полипептидные последовательности могут расщепляться пептидазами и протеазами. В различных воплощениях изобретения расщепляемый линкер выбран так, что он преимущественно расщепляется по сравнению с аминокислотными последовательностями, присутствующими в доставляемой конструкции, во время введения доставляемой конструкции. В различных воплощениях изобретения рецептор-связывающий домен является по существу интактным (например, на приблизительно 99%, приблизительно 95%, приблизительно 90%, приблизительно 85%, приблизительно 80 или на приблизительно 75%) после доставки доставляемой конструкции в кровоток субъекта. В различных воплощениях изобретения домен транслокации является по существу интактным (например, на приблизительно 99%, приблизительно 95%, приблизительно 90%, приблизительно 85%, приблизительно 80 или на приблизительно 75%) после доставки доставляемой конструкции в кровоток субъекта. В различных воплощениях изобретения макромолекула является по существу интактной (например, на приблизительно 99%, приблизительно 95%, приблизительно 90%, приблизительно 85%, приблизительно 80 или на приблизительно 75%) после доставки доставляемой конструкции в кровоток субъекта. В различных воплощениях изобретения расщепляемый линкер по существу расщеплен (например, на приблизительно 99%, приблизительно 95%, приблизительно 90%, приблизительно 85%, приблизительно 80 или на приблизительно 75%) после доставки доставляемой конструкции в кровоток субъекта.
В других воплощениях изобретения расщепляемый линкер расщепляется расщепляющим ферментом, находящимся в плазме крови субъекта. Для расщепления расщепляемого линкера можно использовать любой расщепляющий фермент, известный специалистам в данной области техники как присутстующий в плазме крови субъекта. Использование таких ферментов для расщепления расщепляемых линкеров менее предпочтительно, чем использование расщепляющих ферментов, находящихся вблизи базолатеральной мембраны поляризованной эпителиальной клетки, поскольку считают, что более эффективное расщепление происходит вблизи базолатеральной мембраны. Однако если специалист в данной области техники определяет, что расщепление, опосредованное ферментом плазмы крови, достаточно эффективно, чтобы дать возможность расщепления достаточной доли доставляемых конструкций, чтобы избежать нежелательных эффектов, такие расщепляющие ферменты плазмы можно использовать для расщепления доставляемых конструкций. Соответственно, в различных воплощениях изобретения расщепляемый линкер может расщепляться ферментом, выбранным из группы, состоящей из каспазы-1, каспазы-3, пропротеинконвертазы 1, пропротеинконвертазы 2, пропротеинконвертазы 4, пропротеинконвертазы 4 РАСЕ 4 (фермент, расщепляющий белок в месте спаренных основных аминокислот 4), пролилолигопептидазы, эндотелин-расщепляющего фермента, дипептидилпептидазы IV, сигнальной пептидазы, неприлизина, ренина и эстеразы (см., например, патент США №6,673,574, полностью включенный в настоящий документ посредством ссылки). В таблице 6 представлены эти ферменты вместе с аминокислотной(ыми) последовательностью(ями), распознаваемой(ыми) конкретной пептидазой. Пептидаза расщепляет пептид, содержащий эти последовательности на N-концевой стороне аминокислоты, указанной звездочкой.


Таким образом, в различных воплощениях изобретения расщепляемый линкер может представлять собой любой расщепляемый линкер, известный специалистам в данной области техники как расщепляемый ферментом, присутствующим на базолатеральной мембране эпителиальной клетки. В различных воплощениях изобретения расщепляемый линкер содержит пептид. В других воплощениях изобретения расщепляемый линкер содержит нуклеиновую кислоту, такую как РНК или ДНК. В других воплощениях изобретения расщепляемый линкер содержит углевод, такой как дисахарид или трисахарид.
Альтернативно в различных воплощениях изобретения расщепляемый линкер может представлять собой любой расщепляемый линкер, известный специалистам в данной области техники как расщепляемый ферментом, присутствующим в плазме крови субъекта, которому вводят доставляемую конструкцию. В различных воплощениях изобретения расщепляемый линкер содержит пептид. В других воплощениях изобретения расщепляемый линкер содержит нуклеиновую кислоту, такую как РНК или ДНК. В других воплощениях изобретения расщепляемый линкер содержит углевод, такой как дисахарид или трисахарид.
В различных воплощениях изобретения пептидазы проявляют значительно большее (например, 100%, 200% или большее повышение активности относительно апикальной стороны) повышение на базолатеральной стороне (также называемое базолатеральным). Таким образом, в различных воплощениях изобретения расщепляемый линкер расщепляется ферментом, проявляющим повышенную на 50% активность на базолатеральной стороне мембраны, чем на апикальной стороне мембраны. В различных воплощениях изобретения расщепляемый линкер расщепляется ферментом, проявляющим повышенную на 100% активность на базолатеральной стороне мембраны, чем на апикальной стороне мембраны. В различных воплощениях изобретения расщепляемый линкер расщепляется ферментом, проявляющим повышенную на 200% активность на базолатеральной стороне мембраны, чем на апикальной стороне мембраны. В различных воплощениях изобретения расщепляемый линкер расщепляется ферментом, проявляющим повышенную на 500% активность на базолатеральной стороне мембраны, чем на апикальной стороне мембраны. В различных воплощениях изобретения расщепляемый линкер расщепляется ферментом, проявляющим повышенную на 1000% активность на базолатеральной стороне мембраны, чем на апикальной стороне мембраны.
В различных воплощениях изобретения слитая молекула содержит расщепляемый линкер, имеющий аминокислотную последовательность, выбранную, например, из SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106 или SEQ ID NO: 107 и расщепляется ферментом, проявляющим повышенную активность на базолатеральной стороне поляризованной эпителиальной клетки, чем на апикальной стороне поляризованной эпителиальной клетки, и/или расщепляется ферментом, проявляющим повышенную активность в плазме крови по сравнению с апикальной стороной поляризованной эпителиальной клетки.
В различных воплощениях изобретения расщепляемый линкер может представлять собой расщепляемый линкер, который расщепляется после изменения в окружающей среде слитой молекулы. Например, расщепляемый линкер может представлять собой расщепляемый линкер, который чувствителен к рН и расщепляется в результате изменения рН, которое происходит при высвобождении слитой молекулы из базолатеральной мембраны поляризованной эпителиальной клетки. Например, просвет кишечника является сильно щелочным, тогда как плазма крови по существу нейтральна. Таким образом, расщепляемый линкер может представлять собой группировку, расщепляемую после сдвига рН от щелочного к нейтральному. Изменение в окружающей среде слитой молекулы, которое приводит к расщеплению расщепляемого линкера, может представлять собой любое изменение в окружающей среде, которое происходит при высвобождении слитой молекулы из базолатеральной мембраны поляризованной эпителиальной клетки, известной специалистам в данной области техники, без ограничения.
В различных воплощениях изобретения расщепляемый линкер расщепляется расщепляющим ферментом, находящимся в плазме крови субъекта. Для расщепления расщепляемого линкера можно использовать любой расщепляющий фермент, известный специалистам в данной области техники. Соответственно, в различных воплощениях изобретения расщепляемый линкер может расщепляться ферментом, выбранным, например, из SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119 или SEQ ID NO: 120.
В различных воплощениях изобретения расщепляемый линкер представляет собой линкер, содержащий аминокислотную последовательность, представляющую собой известный субстрат для протеазы вируса гравировки табака (TEV). Соответственно, в различных воплощениях изобретения расщепляемый линкер содержит аминокислотную последовательность, представленную, например, в GGGGSGGGENLYFQS (SEQ ID NO: 121).
Химическое конъюгирование нагрузки с модифицированным Cholix-токсином
В различных воплощениях изобретения биологически активную нагрузку, доставляемую субъекту, конъюгируют с модифицированным Cholix-токсином химическим путем. Средства для химического конъюгирования молекул хорошо известны специалистам в данной области техники.
Методика конъюгирования двух молекул варьирует в зависимости от химической структуры средства. Полипептиды, как правило, содержат ряд функциональных групп; например, группы карбоновой кислоты (СООН) или свободного амина (--NH2), которые доступны для взаимодействия с подходящей функциональной группой на другом пептиде или на линкере для соединения с ним молекул.
Альтернативно антитело и/или биологически активную нагрузку можно дериватизировать для доступа к дополнительным реакционным функциональным группам или для их присоединения. Дериватизация может включать присоединение любой из ряда линкерных молекул, например, доступных от Pierce Chemical Company, Rockford III.
В различных воплощениях изобретения изолированные модифицированные Cholix-токсины получают путем бактериальной ферментации и очищают установленными способами. Затем очищенный модифицированный Cholix-токсин модифицируют на его С-конце, чтобы дать возможность прямого химического сочетания посредством свободного сульфгидрильного остатка, локализованного вблизи С-конца белка. С-концевая модификация включает цистеин-ограниченную петлю, несущую в себе консенсус-последовательность расщепления высоко селективной протеазой вируса гравировки табака (TEV), второй цистеин и гексагистидиновую метку (Hise). Второй Cys включают для образования дисульфидной мостиковой связи с Cys, в перспективе используемого для связывания. Присоединение к белку последовательности His6 упрощает очистку, а последовательность расщепления TEV обеспечивает механизм селективного удаления концевого остатка Cys после мягкого восстановления. Расщепление и мягкое восстановление TEV с 0,1 мМ дитиотрейтолом с последующей экспрессией и выделением конструкций ntCholix дает возможность прямого химического сочетания биологически активной нагрузки посредством взаимодействия на основе малеимида в качестве общего механизма присоединения нагрузки. После расщепления протеазой TEV, восстановления и сочетания нагрузки посредством взаимодействия малеимида со свободным сульфгидрилом удаление высвобожденной С-концевой последовательности было достигнуто в результате второй стадии колоночной хроматографии Ni2+.
В различных воплощениях изобретения слитая молекула содержит частицы, к которым ковалентно присоединен модифицированный Cholix-токсин, и где биологически активная нагрузка интегрирована в частицы. В различных воплощениях изобретения частицы могут быть меньше приблизительно 150 нм в диаметре, меньше приблизительно 100 нм или меньше приблизительно 50 нм.
В различных воплощениях изобретения слитая молекула содержит биологически активную нагрузку, нековалентно связанную с модифицированным Cholix-токсином. Эта слитая молекула может переносить, например, нековалентно связанный IL-10 через эпителий, например поверхностный элемент рецептора IL-10 (Josephson, K., Logsdon, N.J., Walter, M.R., Immunity 15: 35-46, 2001, полностью включенная в настоящий документ посредством ссылки).
Фармацевтические композиции и способы доставки
Фармацевтические композиции по настоящему изобретению относятся к композициям для введения субъекту-человеку. Фармацевтические композиции содержат неприродные слитые молекулы, перечисленные в настоящем документе, отдельно или в комбинации. Фармацевтические композиции могут содержать дополнительные молекулы, способные к изменению характеристик неприродных слитых молекул, например к стабилизации, модулированию и/или активации их функции. Композиция может иметь, например, твердую или жидкую форму и может среди прочего иметь форму порошка(ов), таблетки(ок), раствора(ов) или аэрозоля(ей). Фармацевтическая композиция по настоящему изобретению может возможно и дополнительно содержать фармацевтически приемлемый носитель. «Фармацевтически приемлемый носитель» относится к нетоксичному твердому, полутвердому или жидкому наполнителю, разбавителю, инкапсулирующему материалу и к любому из стандартных фармацевтических носителей, несущих сред, буферов и эксципиентов, таких как забуференный фосфатом физиологический раствор, 5% водный раствор декстрозы и эмульсии, такие как эмульсия масло-в-воде или вода-в-масле, и различных типов увлажняющих агентов и/или адъювантов.
Фармацевтические композиции обычно готовят соответствующим образом для немедленного применения, предназначенного для слитой молекулы. Например, если слитую молекулу не вводят немедленно, слитую молекулу можно включать в композицию, подходящую для хранения. Одна из таких композиций представляет собой лиофилизированный препарат слитой молекулы вместе с подходящим стабилизатором. Альтернативно композицию слитой молекулы можно готовить для хранения в растворе с одним или более подходящих стабилизаторов. Можно использовать любой такой стабилизатор, известный специалистам в данной области техники, без ограничений. Например, стабилизаторы, подходящие для лиофилизированных препаратов, включают, без ограничений, сахара, соли поверхностно-активные вещества, белки, хаотропные агенты, липиды и аминокислоты. Стабилизаторы, подходящие для жидких препаратов, включают, без ограничений, сахара, соли поверхностно-активные вещества, белки, хаотропные агенты, липиды и аминокислоты. Конкретные стабилизаторы, которые можно использовать в композициях, включают, без ограничений, трегалозу, сывороточный альбумин, фосфатидилхолин, лецитин и аргинин. Другие соединения, композиции и способы стабилизации лиофилизированного или жидкого препарата слитых молекул можно найти, например, в патентах США №№6,573,237, 6,525,102, 6,391,296, 6,255,284, 6,133,229, 6,007,791, 5,997,856 и 5,917,021.
В различных воплощениях изобретения фармацевтические композиции по настоящему изобретению включают в композиции для пероральной доставки. Фармацевтические композиции, приготовленные для перорального введения, обладают преимуществом, состоящим в способности модифицированного Cholix-токсина к посредничеству в трансцитозе через желудочно-кишечный (GI) эпителий. Предполагают, что пероральное введение этих фармацевтических композиций приведет в результате к всасыванию слитой молекулы посредством поляризованных эпителиальных клеток слизистой оболочки пищеварительного тракта, например слизистой оболочки кишечника, с последующим высвобождением биологически активной нагрузки на базолатеральной стороне слизистой оболочки. В различных воплощениях изобретения эпителиальная клетка выбрана из группы, состоящей из эпителиальных клеток полости носа, эпителиальных клеток полости рта, эпителиальных клеток кишечника, эпителиальных клеток прямой кишки, эпителиальных клеток влагалища и эпителиальных клеток легких. Фармацевтические композиции по изобретению могут включать добавление усилителя трансцитоза для облегчения переноса слитого белка через GI эпителий. Такие усилители известны в данной области техники. См. статьи Xia et al., (2000) J. Pharmacol. Experiment. Therap., 295:594-600; и Xia et al. (2001) Pharmaceutical Res., 18(2):191-195, каждая из которых полностью включена в настоящий документ посредством ссылки.
Предполагают, что сразу после переноса через GI эпителий слитые молекулы по изобретению проявляют пролонгированный период полувыведения из сыворотки крови, т.е. биологически активная нагрузка слитых молекул проявляет пролонгированный период полувыведения из сыворотки крови по сравнению с биологически активной нагрузкой в ее свободном состоянии. Как таковые, пероральные препараты фармацевтических композиций по настоящему изобретению готовят таким образом, что они подходят для переноса в GI эпителий и защиты слитой молекулы в желудке. В такие композиции можно включать носитель и диспергирующие компоненты, и они могут иметь любую подходящую форму, включая аэрозоли (для пероральной или легочной доставки), сиропы, эликсиры, таблетки, включая жевательные таблетки, твердые или мягкие капсулы, пастилки, лепешки, водные или масляные суспензии, эмульсии, облатки или грануляты пеллет и диспергируемые порошки. В различных воплощениях изобретения фармацевтические композиции применяют в твердых лекарственных формах, например в таблетках, капсулах или тому подобных, подходящих для простого перорального введения точных дозировок.
В различных воплощениях изобретения пероральная композиция содержит слитую молекулу и одно или более соединений, которые могут защищать слитую молекулу при ее нахождении в желудке. Например, защитное соединение должно быть способно к предотвращению кислотного и/или ферментативного гидролиза слитой молекулы. В различных воплощениях изобретения пероральный препарат содержит слитую молекулу и одно или более соединений, которые могут облегчать перенос конструкции из желудка в тонкий кишечник. В различных воплощениях изобретения одно или более соединений, которые могут защищать слитую молекулу от распада в желудке, могут также облегчать перенос конструкции из желудка в тонкий кишечник. Например, включение бикарбоната натрия может быть полезным для облегчения быстрого перемещения внутрижелудочно доставляемых веществ из желудка в двенадцатиперстную кишку, как описано в статье Mrsny et al., Vaccine 17:1425-1433, 1999. Другие способы приготовления композиций, таких, чтобы слитые молекулы могли проходить через желудок и контактировать с поляризованными эпителиальными мембранами в тонком кишечнике, включают, без ограничений, технологии энтеросолюбильного покрытия, как описано в статье DeYoung, Int J Pancreatol, 5 Suppl:31-6, 1989, и способы, предложенные в патентах США №№6,613,332, 6,174,529, 6,086,918, 5,922,680 и 5,807,832, каждый из которых полностью включен в настоящий документ посредством ссылки.
Фармацевтические композиции, предназначенные для перорального применения, могут быть получены в соответствии с любым способом, известным в данной области техники для производства фармацевтических композиций, и такие композиции могут содержать одно или более средств, выбранных из группы, состоящей из подсластителей, для обеспечения фармацевтически приемлемого на вид и вкус препарата. Например, для получения таблеток, которые могут быть доставлены перорально, слитую молекулу смешивают с по меньшей мере одним фармацевтическим эксципиентом, и твердую композицию прессуют с формированием таблетки в соответствии с известными способами для доставки в желудочно-кишечный тракт. Композицию таблеток, как правило, готовят с добавками, например с сахаридным или целлюлозным носителем, связующим веществом, таким как крахмальная паста или метилцеллюлоза, наполнителем, разрыхлителем или другими добавками, как правило, обычно используемыми в производстве лекарственных препаратов. Для получения перорально доставляемых капсул DHEA смешивают по меньшей мере с одним фармацевтическим эксципиентом, и твердую композицию помещают в контейнер в виде капсулы, подходящий для доставки в желудочно-кишечный тракт. Композиции, содержащие слитые молекулы, могут быть получены так, как в целом описано в кн. Remington's Pharmaceutical Sciences, 18th Ed. 1990 (Mack Publishing Co. Easton Pa. 18042) в главе 89, которая включена в настоящий документ посредством ссылки.
В различных воплощениях изобретения фармацевтические композиции готовят в виде перорально доставляемых таблеток, содержащих слитые молекулы в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, подходящими для производства таблеток. Эти эксципиенты могут представлять собой инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и разрыхляющие агенты, например кукурузный крахмал, желатин или аравийская камедь, и смазывающие вещества, например стеарат магния, стеариновую кислоту или тальк. Таблетки могут не содержать покрытия или могут быть покрыты оболочкой известными методиками для задержки разрыхления и всасывания в желудочно-кишечном тракте, за счет чего обеспечивается пролонгированное действие в течение более длительного периода времени. Например, можно использовать вещество, задерживающее время всасывания, такое как глицерилмоностеарат или глицерилдистеарат, отдельно или с воском.
В различных воплощениях изобретения фармацевтические композиции готовят в виде твердых желатиновых капсул, где слитую молекулу смешивают с инертным твердым разбавителем, например с карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где слитую молекулу смешивают с водной или масляной средой, например с арахисовым маслом, ореховым маслом, жидким вазелином или оливковым маслом.
В различных воплощениях изобретения водные суспензии могут содержать слитую молекулу в смеси с эксципиентами, подходящими для производства водных суспензий. Такие эксципиенты представляют собой суспендирующие агенты, например натриевую соль карбоксиметилцеллюлозы, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и аравийскую камедь; диспергирующие или увлажняющие агенты могут представлять собой природный фосфатид, например лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например полиоксиэтиленстеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например с гептадецилэтилоксицетанолом, или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и гексита, такие как моноолеат полиоксиэтиленсорбита, или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и ангидридов гексита, например моноолеат полиоксиэтиленсорбитана. Водные суспензии могут также содержать один или более консервантов, например, этил- или н-пропил-пара-гидроксибензоат, один или более красящих агентов, один или более корригентов и один или более подсластителей, таких как сахароза или сахарин.
В различных воплощениях изобретения композиции в виде масляных суспензий можно готовить путем суспендирования слитой молекулы в растительном масле, например в арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий вазелин. Масляные суспензии могут содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие как представлены выше, и корригенты можно добавлять для получения приемлемого на вкус перорального препарата. Эти композиции можно консервировать путем добавления антиоксиданта, такого как аскорбиновая кислота.
В различных воплощениях изобретения фармацевтические композиции могут быть в форме эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло, например оливковое масло или арахисовое масло, или минеральное масло, например, аравийскую камедь или трагакантовую камедь, природные фосфатиды, например лецитин сои, и сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и ангидридов гексита, например моноолеата сорбитана, и продуктов конденсации таких же частичных сложных эфиров с этиленоксидом, например моноолеата полиоксиэтиленсорбитана. Эмульсии могут также содержать подсластители и корригенты.
В различных воплощениях изобретения, где фармацевтическая композиция имеет форму таблетки или капсулы, таблетку или капсулу покрывают оболочкой или инкапсулируют, чтобы защитить биологически активную нагрузку от ферментативного действия в желудке и гарантировать, что всасывание биологически активной нагрузки субъектом достаточно для получения эффективного ответа. Такие способы покрытия оболочкой или инкапсуирования включают, например, инкапсулирование в наночастицы, состоящие из полимеров с гидрофобным каркасом и гидрофобными боковыми цепями в качестве носителей лекарственного средства, инкапсулирование в микрочастицы, встраивание в липосомы в эмульсиях и конъюгирование с другими молекулами. Примеры наночастиц включают мукоадгезивные наночастицы, покрытые хитозаном и Карбополом (Takeuchi et al., Adv. Drug Deliv. Rev. 47(1):39-54, 2001), и наночастицы, содержащие заряженные комбинированные полиэфиры, поли(2-сульфобутил-виниловый спирт) и поли(D,L-сополимер молочной и гликолевой кислоты) (Jung et al., Eur. J. Pharm. Biopharm. 50(1):147-160, 2000).
Можно использовать инкапсулированные или покрытые оболочкой таблетки, высвобождающие биологически активную нагрузку послойным путем, таким образом, высвобождающие биологически активную нагрузку в течение заданной временной рамки по мере перемещения вдоль желудочно-кишечного тракта. Кроме того, таблетки, содержащие биологически активную нагрузку, могут быть помещены в таблетку большего размера, защищая, таким образом, внутреннюю таблетку от условий окружающей среды и обработки, таких как температура, химические агенты (например, растворители), рН и влага. Внешняя таблетка и оболочки дополнительно служат для защиты биологически активной нагрузки в окружающей среде желудка.
В различных воплощениях изобретения фармацевтические композиции можно готовить для пероральной доставки, используя полиэфирные микросферы, зеиновые микросферы, протеиноидные микросферы, полицианоакрилатные микросферы и системы на основе липидов (см., например, кн. DiBase and Morrel, Oral Delivery of Microencapsulated Proteins, in Protein Delivery: Physical Systems, Sanders and Hendren (ред.), страницы 255-288 (Plenum Press 1997)).
Поверхностно-активные вещества или сурфактанты способствуют всасыванию полипептидов через слизистую оболочку или выстилку. Полезные поверхностно-активные вещества или сурфактанты включают жирные кислоты и их соли, соли желчных кислот, фосфолипид или алкилсахарид. Примеры жирных кислот и их солей включают натриевые, калиевые и лизиновые соли каприлата (С8), капрата (С10), лаурата (C12) и миристата (С14). Примеры солей желчных кислот включают холевую кислоту, хенодезоксихолевую кислоту, гликохолевую кислоту, таурохолевую кислоту, гликохенодезоксихолевую кислоту, таурохенодезоксихолевую кислоту, дезоксихолевую кислоту, гликодезоксихолевую кислоту, тауродезоксихолевую кислоту, литохолевую кислоту и урсодезоксихолевую кислоту. Примеры фосфолипидов включают одноцепочечные фосфолипиды, такие как лизофосфатидилхолин, лизофосфатидилглицерин, лизофосфатидилэтаноламин, лизофосфатидилинозит и лизофосфатидилсерин; или двуцепочечные фосфолипиды, такие как диацилфосфатидилхолины, диацилфосфатидилглицерины, диацилфосфатидилэтаноламины, диацилфосфатидилинозиты и диацилфосфатидилсерины. Примеры алкилсахаридов включают алкилглюкозиды или алкилмальтозиды, такие как децилглюкозид и додецилмальтозид.
В другом аспекте настоящее изобретение относится к способам перорального введения фармацевтических композиций по изобретению. Не желая быть ограниченными какой-либо конкретной теорией или механизмом действия, считают, что пероральное введение слитых молекул приводит в результате к всасыванию слитой молекулы посредством поляризованных эпителиальных клеток слизистой оболочки пищеварительного тракта, например слизистой оболочки кишечника, с последующим расщеплением слитой молекулы и высвобождением биологически активной нагрузки на базолатеральной стороне слизистой оболочки. Таким образом, если биологически активная нагрузка проявляет биологическую активность в печени, такую как, например, активности, опосредованные связыванием IL-10 с его когнатного рецептора, считают, что биологически активная нагрузка проявляет свое действие при избытке, который можно было бы ожидать на основании концентраций в плазме крови, наблюдаемых у субъекта, т.е. пероральное введение слитой молекулы может приводить к доставке более высокой эффективной концентрации доставляемой биологически активной нагрузки в печени субъекта по сравнению с наблюдаемой в плазме субъекта.
В другом аспекте настоящее изобретение относится к способам перорального введения фармацевтических композиций по изобретению. Такие способы могут включать, без ограничения, стадии перорального введения композиций пациентом или лицом, осуществляющим медицинскую помощь. Такие стадии введения могут включать введение через интервалы, такие как раз в сутки или два раза в сутки, в зависимости от слитой молекулы, заболевания или состояния пациента или от индивидуального пациента. Такие способы также включают введение различных дозировок отдельной слитой молекулы. Например, начальная дозировка фармацевтической композиции может находиться на более высоком уровне, чтобы вызвать желаемый эффект, такой как снижение уровней глюкозы в крови. Затем последующие дозировки можно снижать, как только достигнут желаемый эффект. Эти изменения или модификации протоколов введения могут быть выполнены лечащим врачом или медицинским работником.
Эти фармацевтические композиции можно вводить субъекту в подходящей дозе. Схема дозирования будет определяться лечащим врачом и клиническими факторами. В области медицины хорошо известно, что дозировки для любого пациента зависят от многих факторов, включающих размер пациента, площадь поверхности тела, возраст, конкретное вводимое соединение, пол, время и путь введения, общее состояние здоровья и другие лекарственные средства, вводимые одновременно. Терапевтически эффективное количество для данной ситуации легко определить путем стандартных экспериментов, что находится в пределах компетенции и мнения обычного клинициста или врача. Специалисту в данной области техники известно, что эффективное количество фармацевтической композиции, вводимое индивиду, среди прочего зависит от природы биологически активной нагрузки. Длительность лечения, необходимая для наблюдения изменений, и интервал после лечения, необходимый для появления ответов, изменяется в зависимости от желаемого эффекта. Конкретные количества могут быть определены с помощью традиционных тестов, хорошо известных специалистам в данной области техники.
Количество биологически активной нагрузки представляет собой количество, эффективное для осуществления цели конкретного активного агента. Количество в композиции, как правило, представляет собой фармакологически, биологически, терапевтически и химически эффективное количество. Однако количество может быть меньшим, чем фармакологически, биологически, терапевтически и химически эффективное количество, при применении композиции в форме единичной дозы, такой как капсула, таблетка или жидкость, поскольку форма единичной дозы может содержать совокупность композиций носителя/биологически или химически активного агента, либо может содержать разделенное фармакологически, биологически, терапевтически и химически эффективное количество. Таким образом, суммарные эффективные количества, вводимые в объединенных единицах, в сумме содержат фармакологически, биологически, терапевтически и химически эффективное количество биологически активной нагрузки.
В различных воплощениях изобретения количество слитой молекулы, вводимое субъекту, составляет максимум 0,001 пг, максимум 1 пг, максимум 2 пг, максимум 3 пг, максимум 4 пг, максимум 5 пг, максимум 10 пг, максимум 50 пг, максимум 100 пг, максимум 1 мкг, максимум 2 мкг, максимум 3 мкг, максимум 4 мкг, максимум 5 мкг, максимум 10 мкг, максимум 50 мкг, максимум 100 мкг, максимум 1 мг, максимум 2 мг, максимум 3 мг, максимум 4 мг, максимум 5 мг, максимум 10 мг, максимум 50 мг, максимум 100 мг или максимум 1 г.
В различных воплощениях изобретения количество слитой молекулы, вводимое субъекту, составляет по меньшей мере 0,001 пг, по меньшей мере 1 пг, по меньшей мере 2 пг, по меньшей мере 3 пг, по меньшей мере 4 пг, по меньшей мере 5 пг, по меньшей мере 10 пг, по меньшей мере 50 пг, по меньшей мере 100 пг, по меньшей мере 1 мкг, по меньшей мере 2 мкг, по меньшей мере 3 мкг, по меньшей мере 4 мкг, по меньшей мере 5 мкг, по меньшей мере 10 мкг, по меньшей мере 50 мкг, по меньшей мере 100 мкг, по меньшей мере 1 мг, по меньшей мере 2 мг, по меньшей мере 3 мг, по меньшей мере 4 мг, по меньшей мере 5 мг, по меньшей мере 10 мг, по меньшей мере 50 мг, по меньшей мере 100 мг или по меньшей мере 1 г.
В различных воплощениях изобретения количество слитой молекулы, вводимое субъекту, составляет от 0,001 пг до приблизительно 1 г, от 1 пг до 10 пг, от 50 пг до 100 пг, от 1 мкг до 5 мкг, от 10 мкг до 20 мкг, от 10 мкг до 500 мг, от 10 мкг до 100 мг, от 10 мкг до 1000 мкг, от 10 мкг до 250 мкг, от 10 мкг до 100 мкг, от 10 мкг до 50 мкг, от 1 мг до 5 мг или от 10 мг до 100 мг.
Вводимый объем композиции, содержащей слитую молекулу, в целом зависит от концентрации слитой молекулы и от формы препарата композиции. В различных воплощениях изобретения единичная доза композиции слитой молекулы составляет от 0,001 мкг до 1 мл, от 1 мкл до 100 мкл, от 50 мкл до 500 мкл, от 0,01 мл до 1 мл, от 1 мл до 100 мл, от 0,05 мл до 1 мл. Например, единичная доза композиции слитой молекулы может составлять приблизительно 0,5 мл.
В некоторых воплощениях изобретения единичная доза композиции слитой молекулы составляет максимум приблизительно 0,001 мкл, максимум 1 мкл, максимум 10 мкл, максимум 50 мкл, максимум 200 мкл, максимум 0,01 мл, максимум 0,05 мл, максимум 0,1 мл, максимум 0,2 мл, максимум 0,5 мл или максимум 1 мл.
В некоторых воплощениях изобретения единичная доза композиции слитой молекулы составляет по меньшей мере 0,001 мкл, по меньшей мере 1 мкл, по меньшей мере 10 мкл, по меньшей мере 50 мкл, по меньшей мере 200 мкл, по меньшей мере 0,01 мл, по меньшей мере 0,05 мл, по меньшей мере 0,1 мл, по меньшей мере 0,2 мл, по меньшей мере 0,5 мл или по меньшей мере 1 мл.
Композиции слитой молекулы можно готовить в дозированных формах, содержащих от 1 до 50 доз (например, от 0,5 мл до 25 мл), чаще от 1 до 10 доз (например, от 0,5 мл до 5 мл).
Композиции слитой молекулы по изобретению можно вводить в одной дозе или во множественных дозах. За дозой может следовать одна или более доз, разделенных промежутком от приблизительно 1 до приблизительно 6 часов, от приблизительно 6 до приблизительно 12 часов, от приблизительно 12 до приблизительно 24 часов, от приблизительно 1 суток до приблизительно 3 суток, от приблизительно 1 суток до приблизительно 1 недели, от приблизительно 1 недели до приблизительно 2 недель, от приблизительно 2 недель до приблизительно 1 месяца, от приблизительно 4 до приблизительно 8 недель, от приблизительно 1 до приблизительно 3 месяцев или от приблизительно 1 до приблизительно 6 месяцев.
В различных воплощениях изобретения фармацевтические композиции, содержащие слитые молекулы, можно, хотя и необязательно, вводить ежедневно в количестве, эффективном для облегчения симптома. Как правило, суммарную суточную дозировку можно вводить в количестве по меньшей мере приблизительно 0,001 пг, меньшей мере приблизительно 0,1 мг, меньшей мере приблизительно 1 мг, меньшей мере приблизительно 10 мг, меньшей мере приблизительно 50 мг, меньшей мере приблизительно 100 мг, меньшей мере приблизительно 150 мг, меньшей мере приблизительно 200 мг, меньшей мере приблизительно 250 мг, меньшей мере приблизительно 300 мг, меньшей мере приблизительно 350 мг, меньшей мере приблизительно 400 мг, меньшей мере приблизительно 450 мг, меньшей мере приблизительно 500 мг в сутки или меньшей мере приблизительно 1000 мг в сутки. Например, дозировку можно включать в композицию для перорального введения в капсулах или таблетках, например в 4 капсулах или таблетках, каждая из которых содержит 50 мг слитой молекулы. Капсулы или таблетки для пероральной доставки для удобства могут содержать вплоть до суточной пероральной дозы, например, 200 мг или более в сутки.
В различных воплощениях изобретения фармацевтические композиции, содержащие слитые молекулы, можно, хотя и необязательно, вводить ежедневно в количестве, эффективном для облегчения симптома. Как правило, суммарную суточную дозу можно вводить в количестве максимум 50 мг в сутки, максимум 100 мг в сутки, максимум 150 мг в сутки, максимум 200 мг в сутки, максимум 250 мг в сутки, максимум 300 мг в сутки, максимум 350 мг в сутки, максимум 400 мг в сутки, максимум 450 мг в сутки, максимум 500 мг в сутки или максимум 1000 мг в сутки.
При использовании в настоящем документе «совместное введение», «совместно вводимый» и «в комбинации с» по отношению к слитым молекулам по изобретению и одному или более других терапевтических средств предназначены для обозначения, относят и включают следующее: одновременное введение такой комбинации слитых молекул по изобретению и терапевтического(их) средства(в) пациенту, нуждающемуся в лечении, при совместном включении таких компонентов в композицию в форме однократной дозы, которая высвобождает указанные компоненты по существу в одно и то же время для данного пациента; по существу одновременное введение такой комбинации слитых молекул по изобретению и терапевтического(их) средства(в) пациенту, нуждающемуся в лечении, при включении таких компонентов в композицию отдельно друг от друга в отдельных дозированных формах, которые данный пациент принимает по существу в одно и то же время, при этом данные компоненты высвобождаются у данного пациента по существу одновременно; последовательное введение такой комбинации слитых молекул по изобретению и терапевтического(их) средства(в) пациенту, нуждающемуся в лечении, при включении таких компонентов в композицию отдельно друг от друга в отдельных дозированных формах, которые данный пациент принимает в последовательные моменты времени со значительным интервалом времени между каждым введением, при этом данные компоненты высвобождаются у данного пациента в существенно различающиеся моменты времени; и последовательное введение такой комбинации слитых молекул по изобретению и терапевтического(их) средства(в) пациенту, нуждающемуся в лечении, при включении таких компонентов в композицию совместно в одну дозированную форму, в которой эти компоненты высвобождаются контролируемо, при этом они высвобождаются у данного пациента одновременно, последовательно, и/или их высвобождение перекрывается по времени и/или в различное время, где каждую часть можно вводить либо одним и тем же, либо различными путями.
В различных воплощениях изобретения фармацевтические композиции, содержащие слитые молекулы, можно вводить совместно со вторым компонентом, где второй компонент представляет собой гормон, токсин или биологически активный агент, способный к связыванию с рецептором GM-1 (моносиалотетрагексозилганглиозида) (Hakomori, Advances in Exp. Medicine and Biology, 174:333-339, 1984). В различных воплощениях изобретения второй компонент представляет собой вирус SV40, вирус полиомы или токсин, такой как холерный токсин, или экзотоксин А из Pseudomonas aeruginosa (PE).
При использовании в настоящем документе термины «холерный токсин» или «СТ» относится к одноименному вирулентному агенту бактерии Vibrio cholerae, который может вызывать острую, угрожающую жизни, тяжелую водянистую диарею. СТ представляет собой белковый комплекс, состоящий из одной субъединицы А, организованной с пентамером из субъединиц В, который связывается с ганглиозидными структурами GM1 клеточной поверхности на апикальной поверхности эпителия. СТ секретируется V. cholera после горизонтального переноса генов вирулентными штаммами V. cholerae, несущими вариант лизогенного бактериофага, называемого CTXf или СТХϕ. Недавние вспышки холеры, однако, позволяют предположить, что штаммы некоторых серогрупп (не-O1, не-O139) не экспрессируют СТ, но, вероятнее, используют другие факторы вирулентности. Подробные анализы экологических и клинических данных не-O1, не-O139 позволяют предположить присутствие нового предполагаемого секретируемого экзотоксина с некоторым подобием РЕ (экзотоксин Pseudomonas). Последовательность СТ известна и описана (Mekalanos J. J. et al Nature 306, страница 551 (1983)).
При использовании в настоящем документе термины «экзотоксин А из Pseudomonas aeruginosa», «экзотоксин A Pseudomonas» или «РЕ» относятся к крайне активному мономерному белку (молекулярная масса 66 кДа), секретируемому Pseudomonas aeruginosa, который ингибирует синтез белка в эукариотических клетках. Последовательность РЕ из 613 остатков хорошо известна в данной области техники и приведена, например, в патенте США №5,602,095. Домен Ia (аминокислоты 1-252) опосредует связывание с клеткой. Домен II (аминокислоты 253-364) отвечает за транслокацию в цитозоль, и домен III (аминокислоты 400-613) опосредует ADP-рибозилирование фактора элонгации 2. Функция домена Ib (аминокислоты 365-399) остается неопределенной, хотя известно, что большая его часть, аминокислоты 365-380, может быть делетирована без потери цитотоксичности. См. Siegall et al., J Biol Chem, 264:14256-61 (1989).
Некоторые цитотоксические фрагменты РЕ известны в данной области техники, и их часто обозначают по молекулярной массе фрагмента, которая означает конкретную композицию фрагмента РЕ для специалистов в данной области техники. Например, РЕ40 был одним из первых фрагментов, которые были исследованы и использованы в качестве токсического участка иммунотоксинов. Термин означает усеченную форму РЕ, в котором отсутствует домен Ia, ответственный за неспецифическое связывание. См., например, Pai et al., Proc. Nat'l Acad. Sci. USA, 88:3358-3362 (1991); и Kondo et al., J. Biol. Chem., 263:9470-9475 (1988). Устранение неспецифического связывания, однако, также может быть достигнуто за счет мутирования некоторых остатков домена Ia. Например, в патенте США №5,512,658 раскрыто, что мутированный РЕ, в котором присутствует домен Ia, но в котором основные остатки домена Ia в положениях 57, 246, 247 и 249 заменены кислыми остатками (глутаминовой кислотой или Е)), проявляет значительно уменьшенную неспецифическую цитотоксичность. Эту мутантную форму РЕ иногда называют РЕ4Е.
В различных воплощениях изобретения комбинированная терапия включает введение композиции изолированной слитой молекулы и композиции второго средства одновременно, либо в одной и той же фармацевтической композиции, либо в отдельных фармацевтических композициях. В различных воплощениях изобретения композицию изолированной слитой молекулы и композицию второго средства вводят последовательно, т.е. композицию изолированной слитой молекулы вводят либо до, либо после введения композиции второго средства.
В различных воплощениях изобретения введение композиции изолированной слитой молекулы и композиции второго средства осуществляют одновременно, т.е. периоды введения композиции изолированной слитой молекулы и композиции второго средства перекрываются друг с другом.
В различных воплощениях изобретения введение композиции изолированной слитой молекулы и композиции второго средства осуществляют не одновременно. Например, в различных воплощениях изобретения введение композиции изолированной слитой молекулы прекращают до введения композиции второго средства. В различных воплощениях изобретения введение композиции второго средства прекращают до введения композиции изолированной слитой молекулы. В различных воплощениях изобретения введение слитой молекулы по изобретению, либо отдельно, либо в комбинации с терапевтическим средством, можно осуществлять с едой, например перед едой, во время еды или после еды.
В некоторых воплощениях изобретения введение слитой молекулы по изобретению, либо отдельно, либо в комбинации с терапевтическим средством, можно осуществлять перед едой. В различных воплощениях изобретения слитую молекулу по изобретению, либо отдельно, либо в комбинации с терапевтическим средством, можно вводить более чем за 12 часов, более чем за 11 часов, более чем за 10 часов, более чем за 9 часов, более чем за 8 часов, более чем за 7 часов, более чем за 6 часов, более чем за 5 часов, более чем за 4 часа, более чем за 3 часа, более чем за 2 часа, более чем за 1 час, более чем за 50 минут, более чем за 40 минут, более чем за 30 минут, более чем за 20 минут, более чем за 10 минут, более чем за 5 минут или более чем за 1 минуту до еды. В различных воплощениях изобретения слитую молекулу по изобретению, либо отдельно, либо в комбинации с терапевтическим средством, можно вводить менее чем за 12 часов, менее чем за 11 часов, менее чем за 10 часов, менее чем за 9 часов, менее чем за 8 часов, менее чем за 7 часов, менее чем за 6 часов, менее чем за 5 часов, менее чем за 4 часа, менее чем за 3 часа, менее чем за 2 часа, менее чем за 1 час, менее чем за 50 минут, менее чем за 40 минут, менее чем за 30 минут, менее чем за 20 минут, менее чем за 10 минут, менее чем за 5 минут или менее чем за 1 минуту до еды. В различных воплощениях изобретения слитую молекулу по изобретению, либо отдельно, либо в комбинации с терапевтическим средством, можно вводить от приблизительно 1 минуты до приблизительно 10 минут, от приблизительно 5 минут до приблизительно 30 минут, от приблизительно 20 минут до приблизительно 60 минут, от приблизительно 1 часа до приблизительно 3 часов, от приблизительно 2 часов до приблизительно 10 часов или от приблизительно 5 часов до приблизительно 12 часов до еды.
В некоторых воплощениях изобретения введение слитой молекулы по изобретению, либо отдельно, либо в комбинации с терапевтическим средством, можно осуществлять после еды. В различных воплощениях изобретения слитую молекулу по изобретению, либо отдельно, либо в комбинации с терапевтическим средством, можно вводить более чем через 12 часов, более чем через 11 часов, более чем через 10 часов, более чем через 9 часов, более чем через 8 часов, более чем через 7 часов, более чем через 6 часов, более чем через 5 часов, более чем через 4 часа, более чем через 3 часа, более чем через 2 часа, более чем через 1 час, более чем через 50 минут, более чем через 40 минут, более чем через 30 минут, более чем через 20 минут, более чем через 10 минут, более чем через 5 минут или более чем через 1 минуту после еды. В некоторых воплощениях изобретения слитую молекулу по изобретению, либо отдельно, либо в комбинации с терапевтическим средством, можно вводить менее чем через 12 часов, менее чем через 11 часов, менее чем через 10 часов, менее чем через 9 часов, менее чем через 8 часов, менее чем через 7 часов, менее чем через 6 часов, менее чем через 5 часов, менее чем через 4 часа, менее чем через 3 часа, менее чем через 2 часа, менее чем через 1 час, менее чем через 50 минут, менее чем через 40 минут, менее чем через 30 минут, менее чем через 20 минут, менее чем через 10 минут, менее чем через 5 минут или менее чем через 1 минуту после еды. В различных воплощениях изобретения слитую молекулу по изобретению, либо отдельно, либо в комбинации с терапевтическим средством, можно вводить менее чем за 12 часов, менее чем за 11 часов, менее чем за 10 часов, менее чем за 9 часов, менее чем за 8 часов, менее чем за 7 часов, менее чем за 6 часов, менее чем за 5 часов, менее чем за 4 часа, менее чем за 3 часа, менее чем за 2 часа, менее чем за 1 час, менее чем за 50 минут, менее чем за 40 минут, менее чем за 30 минут, менее чем за 20 минут, менее чем за 10 минут, менее чем за 5 минут или менее чем за 1 минуту до еды. В различных воплощениях изобретения слитую молекулу по изобретению, либо отдельно, либо в комбинации с терапевтическим средством, можно вводить от приблизительно 1 минуты до приблизительно 10 минут, от приблизительно 5 минут до приблизительно 30 минут, от приблизительно 20 минут до приблизительно 60 минут, от приблизительно 1 часа до приблизительно 3 часов, от приблизительно 2 часов до приблизительно 10 часов или от приблизительно 5 часов до приблизительно 12 часов после еды.
Способы применения
В другом аспекте изобретения фармацевтические композиции, включенные в композицию для пероральной доставки, применяют для лечения некоторых классов заболеваний или медицинских состояний, которые особенно поддаются лечению пероральным препаратом и доставкой. Такие классы заболеваний или состояний включают, например, вирусные заболевания или инфекции, рак, метаболические заболевания, ожирение, аутоиммунные заболевания, воспалительные заболевания, аллергию, болезнь трансплантат против хозяина, системную микробную инфекцию, анемию, сердечнососудистое заболевание, психоз, наследственные заболевания, нейродегенеративные заболевания, расстройства гемопоэтических клеток, заболевания эндокринной системы или репродуктивных систем, желудочно-кишечные заболевания. При многих хронических заболеваниях пероральные препараты слитых молекул по изобретению особенно полезны, поскольку они дают возможность долгосрочного ухода за пациентом и его терапии посредством перорального введения на дому при отсутствии зависимости от протоколов инъекционной терапии или введения лекарственных средств.
В различных воплощениях настоящего изобретения фармацевтические композиции, содержащие слитые молекулы по изобретению, предложены для применения при лечении и/или профилактике воспалительных заболеваний. «Воспалительные заболевания» включают все заболевания, ассоциированные с острым или хроническим воспалением. Острое воспаление представляет собой начальный ответ организма на поражающие стимулы и является результатом усиленного перемещения плазмы крови и лейкоцитов (таких как, например, гранулоциты) из крови к поврежденным тканям. К распространению и созреванию воспалительного ответа приводит ряд биохимических событий, в которые вовлечена локальная сосудистая система, иммунная система и различные клетки внутри поврежденной ткани. Пролонгированное воспаление называют хроническим воспалением, которое приводит к прогрессирующему смещению типа клеток, присутствующих в сайте воспаления, и характеризуется одновременной деструкцией и заживлением ткани в результате воспалительного процесса. Воспалительные заболевания могут быть вызваны, например, ожогами, химическими раздражителями, обморожением, токсинами, инфекцией патогенами, физическим повреждением, иммунными реакциями в связи с гиперчувствительностью, ионизирующим излучением или инородными телами, такими как, например, занозы, грязь и осколки. Примеры воспалительных заболеваний хорошо известны в данной области техники.
В различных воплощениях изобретения воспалительное заболевание выбрано из группы, состоящей из воспалительного заболевания кишечника, псориаза и бактериального сепсиса. Термин «воспалительное заболевание кишечника» при использовании в настоящем документе относится к группе воспалительных состояний ободочной кишки и тонкого кишечника, включающих, например, болезнь Крона, язвенный колит, коллагенозный колит, лимфоцитарный колит, ишемический колит, диверсионный колит, синдром Бехчета и неопределенный колит.
«Болезнь Крона» в соответствии с настоящим изобретением представляет собой воспалительное заболевание кишечника с Т-хелперами 1 типа (Th 1), которое имеет паттерн иммунного ответа, включающий повышенную продукцию интерлейкина-12, фактора некроза опухоли (TNF) и интерферона-γ (Romagnani. Inflamm Bowel Dis 1999; 5:285-94), и которое оказывает разрушительное влияние на образ жизни пораженного им пациента. Частые симптомы болезни Крона включают диарею, спазмы, боль в животе, лихорадку и даже ректальное кровотечение. Болезнь Крона и ассоциированные с ней осложнения часто приводят к необходимости операции для пациента, чаще более чем однократной. Известного лечения болезни Крона не существует, и долгосрочные эффективные варианты лечения ограничены. Задачи лечения состоят в контроле воспаления, коррекции дефицита питательных веществ и облегчении симптомов, таких как боль в животе, диарея и ректальное кровотечение. Хотя лечение может помочь контролировать заболевание путем уменьшения числа переносимых пациентом рецидивов, излечение не происходит. Лечение может включать лекарственные средства, пищевые добавки, операцию или комбинацию этих вариантов. Распространенные виды лекарственных средств, которые можно вводить для лечения, включают противовоспалительные лекарственные средства, включающие сульфасалазин, кортизон или стероиды, включая преднизон, средства, подавляющие иммунную систему, такие как 6-меркаптопурин или азатиоприн, и антибиотики.
«Псориаз» в соответствии с настоящим изобретением представляет собой заболевание, поражающее кожу и суставы. Обычно он вызывает появление на коже чешуйчатых бляшек красного цвета. Чешуйчатые бляшки, вызванные псориазом, называемые псориатическими бляшками, представляют собой области воспаления и избыточной кожной секреции. Кожа быстро аккумулируется в этих участках и приобретает серебристо-белый вид. Бляшки часто встречаются на коже локтей и коленей, но могут поражать любую область, включая кожу головы и половые органы. Существует гипотеза, что псориаз опосредован иммунитетом и не является заразным. Это расстройство представляет собой хроническое рецидивирующее состояние, изменяющееся по тяжести от незначительных локализованных бляшек до покрытия всей поверхности тела. Часто поражаются ногти на пальцах рук и ног (псориатическая дистрофия ногтей) - и может казаться изолированным патологическим изменением. Псориаз может также вызывать воспаление суставов, известное как псориатический артрит. Псориатическим артритом страдает от десяти до пятнадцати процентов людей.
Термин «бактериальный сепсис» при использовании в настоящем документе относится к угрожающим жизни состояниям в результате циркуляции бактерий в кровотоке. Результатом сепсиса является генерализованная системная продукция провоспалительных цитокинов, приводящая в результате к повреждению ткани и, в итогне, к септическому шоку в связи с недостаточностью микроциркуляции.
Другой аспект настоящего изобретения относится к способам лечения, профилактики и/или предупреждения аутоиммунного заболевания, включающим введение данному пациенту терапевтически эффективного количества (либо в виде монотерапии, либо по схеме комбинированной терапии) слитой молекулы, описанной в настоящем документе, в фармацевтически приемлемом носителе.
Аутоиммунное заболевание по отношению к настоящему изобретению представляет собой заболевание или расстройство, возникающее в собственных тканях индивида и направленное против них, или сопутствующее ему состояние, либо его проявление, либо состояние, возникающее в результате этого заболевания или расстройства. В различных воплощениях изобретения аутоиммунное заболевание выбрано из группы, состоящей из системной красной волчанки (SLE), обыкновенной пузырчатки, тяжелой миастении, гемолитической анемии, тромбоцитопенической пурпуры, болезни Грейвса, болезни Шегрена, дерматомиозита, болезни Хасимото, полимиозита, воспалительного заболевания кишечника, рассеянного склероза (MS), сахарного диабета, ревматоидного артрита и склеродермии.
«Ревматоидный артрит» в соответствии с настоящим изобретением представляет собой аутоиммунное расстройство, которое вызывает атаку иммунной системы организма на суставы костей (Muller В et al., Springer Semin Immunopathol., 20:181-96, 1998). Ревматоидный артрит представляет собой хроническое системное воспалительное расстройство, которое может влиять на многие ткани и органы, но в основном атакует синовиальные суставы. Этот процесс производит воспалительный ответ синовиальной оболочки (синовит), вторичный по отношению к гиперплазии синовиальных клеток, избытку синовиальной жидкости и к развитию паннуса в синовиальной оболочке. Патология болезненного процесса часто приводит к деструкции суставного хряща и к анкилозу суставов. Ревматоидный артрит может также приводить к диффузному воспалению в легких, перикарде, плевре и склере, а также к узловым очагам поражения, наиболее распространенным в подкожной ткани под кожей.
В различных воплощениях настоящего изобретения фармацевтические композиции, содержащие слитые молекулы по изобретению, предложены для применения в лечении, профилактике и/или предупреждении рака, включающее введение данному пациенту терапевтически эффективного количества (либо в виде монотерапии, либо по схеме комбинированной терапии) слитой молекулы, описанной в настоящем документе, в фармацевтически приемлемом носителе. Виды рака, подлежащие лечению, включают, без ограничений, неходжкинские лимфомы, лимфому Ходжкина, хронический лимфоцитарный лейкоз, волосатоклеточный лейкоз, острый лимфобластный лейкоз, множественную миелому, карциномы поджелудочной железы, ободочной кишки, желудка, кишечника, предстательной железы, мочевого пузыря, почки, яичника, шейки матки, молочной железы, легкого, носоглотки, злокачественную меланому и ритуксимаб-резистентные NHL и лейкоз.
В различных воплощениях изобретения терапевтически эффективное количество слитой молекулы, описанное в настоящем документе, вводят в комбинации с одним или более других терапевтических средств. Такие терапевтические средства могут быть приняты в данной области техники в качестве стандарта лечения для конкретного болезненного состояния, как описано в настоящем документе, такого как воспалительное заболевание, аутоиммунное заболевание или рак. Иллюстративные рассматриваемые терапевтические средства включают, без ограничений, цитокины, факторы роста, стероиды, NSAID (нестероидные противовоспалительные лекарственные средства), DMARD (противоревматические лекарственные средства, модифицирующие течение болезни), противовоспалительные средства, химиотерапевтические средства, радиотерапевтические средства или другие активные и вспомогательные средства.
В различных воплощениях изобретения предложен способ лечения субъекта, страдающего метаболическим расстройством, включающий пероральное введение слитой молекулы по настоящему изобретению в количестве, достаточном для лечения указанного расстройства, где указанное метаболическое расстройство представляет собой диабет, ожирение, обусловленный ожирением диабет, гипергликемию, дислипидемию, гипертриглицеридемию, синдром X, инсулинорезистентность, нарушенную толерантность к глюкозе (IGT), диабетическую дислипидемию или гиперлипидемию.
В другом аспекте в настоящем изобретении предложен способ лечения субъекта, страдающего жировой болезнью печени (например, неалкогольной жировой болезнью печени (NAFLD); неалкогольным стеатогепатитом (NASH)), желудочно-кишечным заболеванием или нейродегенеративным заболеванием, включающий пероральное введение слитой молекулы по настоящему изобретению в количестве, достаточном для лечения указанного расстройства.
В другом аспекте настоящее изобретение относится к применению слитой молекулы неприродного происхождения по настоящему изобретению для получения лекарственного средства для лечения, профилактики и/или предупреждения нарушений роста, обусловленных дефицитом GH, у субъекта, нуждающегося в этом.
В другом аспекте в настоящем изобретении предложен способ лечения субъекта, страдающего расстройством, обусловленным дефицитом GH, где способ включает пероральное введение слитой молекулы по настоящему изобретению в количестве, достаточном для лечения указанного расстройства, где указанное расстройство представляет собой дефицит гормона роста (GHD), синдром Тернера (TS), синдром Нунан, синдром Прадера-Вилли, дефицит гена низкорослости, содержащего гомеобокс (SHOX), хроническую почечную недостаточность и синдром короткого кишечника, обусловленный идиопатической низкорослостью, дефицит GH вследствие редких опухолей гипофиза или их лечения и мышечную дистрофию, ассоциированую с HIV/AIDS.
Полинуклеотиды, кодирующие слитые молекулы
В другом аспекте в изобретении предложены полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую неприродные слитые молекулы. Эти полинуклеотиды полезны, например, для получения слитых молекул. Еще в одном другом аспекте в изобретении предложена экспрессионная система, содержащая рекомбинантную полинуклеотидную последовательность, кодирующую модифицированный Cholix-токсин, и полилинкерный сайт встраивания для полинуклеотидной последовательности, кодирующей биологически активную нагрузку. Полилинкерный сайт встраивания может находиться в любом месте полинуклеотидной последовательности, если встраивание полилинкера не прерывает рецептор-связывающий домен или домен трансцитоза модифицированного Cholix-токсина. В различных воплощениях изобретения экспрессионная система может содержать полинуклеотидную последовательность, кодирующую расщепляемый линкер, так что расщепление в расщепляемом линкере отделяет биологически активную нагрузку, кодируемую нуклеиновой кислотой, встроенной в полилинкерный сайт встраивания, от остальной части кодируемой слитой молекулы. Таким образом, в воплощениях изобретения, где полилинкерный сайт встраивания находится на конце кодируемой конструкции, полинуклеотид содержит одну нуклеотидную последовательность, кодирующую расщепляемый линкер, между полилинкерным сайтом встраивания и остальной частью полинуклеотида. В воплощениях изобретения, где полилинкерный сайт встраивания находится не на конце кодируемой конструкции, полилинкерный сайт встраивания может быть фланкирован нуклеотидными последовательностями, каждая из которых кодирует расщепляемый линкер.
Различные способы in vitro, которые можно использовать для получения полинуклеотида, кодирующего модифицированный Cholix-токсин, полезный в слитых молекулах по изобретению, включают без ограничений обратную транскрипцию, полимеразную цепную реакцию (PCR), лигазную цепную реакцию (LCR), систему транскрипционно-опосредованную амплификации (TAS), систему самоподдерживающейся репликации последовательностей (3SR) и амплификационную систему с QP репликазой (QB). Можно использовать любой такой метод, известный специалистам в данной области техники как полезный при конструировании рекомбинантных нуклеиновых кислот. Например, полинуклеотид, кодирующий белок или его участок, можно выделить с помощью полимеразной цепной реакции кДНК (комплементарная ДНК) с использованием праймеров на основе последовательности ДНК модифицированного Cholix-токсина или нуклеотида, кодирующего, например, рецептор-связывающий домен.
Руководство по применению этих методологий клонирования и амплификации in vitro описано, например, в патенте США №4,683,195; в статье Mullis et al., 1987, Cold Spring Harbor Symp. Quant. Biol. 51:263; и в кн. Erlich, ed., 1989, PCR Technology, Stockton Press, NY. Полинуклеотиды, кодирующие слитую молекулу или ее участок, также можно выделить путем скрининга геномных или кДНК библиотек зондами, выбранными из последовательностей желаемого полинуклеотида, в жестких, умеренно жестких или высоко жестких условиях гибридизации.
Конструирование нуклеиновых кислот, кодирующих слитые молекулы по изобретению, можно облегчить путем введения сайта встраивания для нуклеиновой кислоты, кодирующей биологически активную нагрузку, в конструкции. В различных воплощениях изобретения сайт встраивания для биологически активной нагрузки можно ввести между нуклеотидами, кодирующими остатки цистеина домена Ib модифицированного Cholix-токсина. В других воплощениях изобретения сайт встраивания можно ввести в любом месте нуклеиновой кислоты, кодирующей конструкцию, если встраивание не прерывает кодируемые ею функциональные домены. В различных воплощениях изобретения сайт встраивания может находиться в домене удерживания в ER.
Кроме того, полинуклеотиды могут также кодировать секреторную последовательность на амино-конце кодируемой слитой молекулы. Такие конструкции полезны для продуцирования слитых молекул в клетках млекопитающих, поскольку они упрощают выделение иммуногена.
Кроме того, полинуклеотиды по изобретению также охватывают производные варианты полинуклеотидов, кодирующие слитую молекулу. Такие производные могут быть получены любым способом, известным специалистам в данной области техники, без ограничений. Например, производные могут быть получены с помощью сайт-специфичного мутагенеза, включая замену, инсерцию или делецию одного, двух, трех, пяти, десяти или более нуклеотидов полинуклеотидов, кодирующих слитую молекулу. Альтернативно производные могут быть получены путем случайного мутагенеза. Один из способов случайного мутагенеза нуклеиновой кислоты включает амплификацию нуклеиновой кислоты в реакции PCR в присутствии 0,1 мМ MnCl2 и несбалансированных концентраций нуклеотидов. Эти условия повышают частоту неточности включения полимеразы, используемой в реакции PCR, и приводят к случайному мутагенезу амплифицируемой нуклеиновой кислоты.
Соответственно, в различных воплощениях в изобретении предложен полинуклеотид, кодирующий слитую молекулу. Слитая молекула содержит модифицированный Cholix-токсин и биологически активную нагрузку, доставляемую субъекту; и возможно нерасщепляемый или расщепляемый линкер. Расщепление в расщепляемом линкере может отделить биологически активную нагрузку от остальной части слитой молекулы. Расщепляемый линкер может быть расщеплен ферментом, присутствующим на базолатеральной мембране поляризованной эпителиальной клетки субъекта или в плазме крови субъекта.
В различных воплощениях изобретения полинуклеотид гибридизуется в жестких условиях гибридизации с любым полинуклеотидом по данному изобретению. В дополнительных воплощениях изобретения полинуклеотид гибридизуется в жестких условиях с нуклеиновой кислотой, кодирующей любую слитую молекулу по изобретению.
В еще одном аспекте в изобретении предложены экспрессионные векторы для экспрессии слитых молекул. Как правило, экспрессионные векторы представляют собой рекомбинантные полинуклеотидные молекулы, содержащие контрольные последовательности экспрессии, функционально связанные с нуклеотидной последовательностью, кодирующей полипептид. Экспрессионные векторы можно легко приспособить к функционированию к прокариотах или эукариотах путем включения соответствующих промоторов, последовательностей репликации, селективных маркеров и т.д., которое приводит в результате к стабильной транскрипции и трансляции мРНК. Методы конструирования экспрессионных векторов и экспрессии генов в клетках, содержащих экспрессионные векторы, хорошо известны в данной области техники. См., например, Sambrook et al., 2001, Molecular Cloning - A Laboratory Manual, 3rd edition, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., и Ausubel et al., eds., Current Edition, Current Protocols in Molecular Biology, Greene Publishing Associates and Wiley Interscience, NY.
Полезные промоторы для использования в экспрессионных векторах включают, без ограничений, металлотионеиновый промотор, конститутивный главный поздний промотор аденовируса, дексаметазон-индуцибельный промотор MMTV (вирус опухоли молочной железы мышей), промотор SV40, промотор MRP pol III, конститутивный промотор MPSV, тетрациклин-индуцибельный промотор CMV (цитомегаловирус) (такой как немедленно-ранний промотор CMV человека) и конститутивный промотор CMV.
Экспрессионные векторы должны содержать сигналы экспрессии и репликации, совместимые с клеткой, в которой экспрессируют слитые молекулы. Экспрессионные векторы, полезные для экспрессии слитых молекул, включают вирусные векторы, такие как ретровирусы, аденовирусы и аденоассоциированные вирусы, плазмидные векторы, космиды и тому подобное. Вирусные и плазмидные векторы предпочтительны для трансфекции экспрессионных векторов в клетки млекопитающих. Например, экспрессионный вектор pcDNAI (Invitrogen, San Diego, Calif.), в котором контрольная последовательность экспрессии содержит промотор CMV, обеспечивает высокие частоты трансфекции и экспрессии в таких клетках.
Экспрессионные векторы можно вводить в клетки для экспрессии слитых молекул любым способом, известным специалистам в данной области техники, без ограничений. Такие способы включают, без ограничения, например, прямой захват молекулы клеткой из раствора; облегченный захват посредством липофекции с использованием, например, липосом или иммунолипосом; трансфекции, опосредованной частицами; и т.д. см., например, патент США №5,272,065; Goeddel et al., eds, 1990, Methods in Enzymology, vol. 185, Academic Press, Inc., CA; Krieger, 1990, Gene Transfer and Expression-A Laboratory Manual, Stockton Press, NY; Sambrook et al., 1989, Molecular Cloning-A Laboratory Manual, Cold Spring Harbor Laboratory, NY; и Ausubel et al., eds., Current Edition, Current Protocols in Molecular Biology, Greene Publishing Associates and Wiley Interscience, NY.
Экспрессионные векторы могут также содержать группировку для очистки, которая упрощает выделение слитой молекулы. Например, на амино-конце белка может быть включена полигистидиновая группировка, например, шесть остатков гистидина. Эта полигистидиновая группировка дает возможность удобного выделения белка в одну стадию с помощью никель-хелатной хроматографии. В различных воплощениях изобретения группировку очистки можно отщеплять от остальной части слитой молекулы после очистки. В других воплощениях изобретения эта группировка не препятствует функции функциональных доменов слитой молекулы и, следовательно, ее необязательно отщеплять.
В еще одном аспекте в изобретении предложена клетка, содержащая экспрессионный вектор для экспрессии слитых молекул или их участков. Клетку выбирают по ее способности к экспрессии высоких концентраций слитой молекулы для облегчения очистки белка. В различных воплощениях изобретения клетка представляет собой прокариотическую клетку, например, Е. coli. Как описано в примерах, слитые молекулы правильно уложены и содержат соответствующие дисульфидные связи при экспрессии в Е. coli.
В других воплощениях изобретения клетка представляет собой эукариотическую клетку. Полезные эукариотические клетки включают дрожжевые клетки и клетки млекопитающих. Для экспрессии слитых молекул можно использовать любую клетку млекопитающих, известную специалистам в данной области техники как полезная для экспрессии рекомбинантных полипептидов, без ограничений. Например, для экспрессии слитых молекул можно использовать клетки яичника китайского хомячка (СНО).
Слитые молекулы по изобретению могут быть получены путем рекомбинации, как описано ниже. Однако слитые молекулы могут быть также получены путем химического синтеза, с использованием способов, хорошо известных специалистам в данной области техники.
Способы экспрессии и очистки слитых молекул по изобретению широко описаны ниже в примерах. Как правило, эти способы основаны на введении экспрессионного вектора, кодирующего слитую молекулу, в клетку, которая может экспрессировать слитую молекулу с вектора. Затем слитую молекулу можно очистить для введения субъекту.
Тестирование трансцитоза
Функцию домена трансцитоза можно тестировать как функцию способности слитой молекулы к прохождению через эпителиальную мембрану. Поскольку для трансцитоза сначала требуется связывание с клеткой, эти анализы также можно использовать для оценки функции домена распознавания клетки.
Активность трансцитоза слитой молекулы можно тестировать любым способом, известным специалистам в данной области техники, без ограничений. В различных воплощениях изобретения активность трансцитоза можно тестировать путем оценки способности слитой молекулы к проникновению в неполяризованную клетку, с которой она связывается. Не желая быть ограниченными какой-либо теорией механизма действия, считают, что то же свойство, которое дает возможность прохождения домена трансцитоза через поляризованную эпителиальную клетку, также позволяет молекулам, несущим домен трансцитоза, проникать в неполяризованные клетки. Таким образом, способность слитой молекулы к проникновению в клетку можно оценивать, например, путем выявления физического присутствия конструкции внутри клетки. Например, слитую молекулу можно пометить, например, флуоресцентным маркером и обеспечить доступ слитой молекулы к клетке. Затем клетки можно промывать, удаляя какую-либо слитую молекулу, не проникшую в клетку, и определить количество оставшейся метки. Обнаружение метки в данной фракции указывает на то, что слитая молекула проникла в клетку.
В других воплощениях изобретения способность слитой молекулы к трансцитозу можно тестировать путем оценки способности слитой молекулы к прохождению через поляризованную эпителиальную клетку. Например, слитую молекулу можно пометить, например, флуоресцентным маркером и привести в контакт с апикальными мембранами слоя эпителиальных клеток. Флуоресценция, обнаруженная на базолатеральной стороне мембраны, образованной эпителиальными клетками, указывает на правильное функционирование домена трансцитоза.
Тестирование расщепления расщепляемого линкера
Функцию расщепляемого линкера можно, как правило, тестировать в анализе расщепления. Для тестирования расщепляемых линкеров можно использовать любой подходящий анализ расщепления, известный специалистам в данной области техники, без ограничений. Для тестирования способности фермента к расщеплению расщепляемых линкеров можно использовать анализы как на клеточной, так и на бесклеточной основе.
Иллюстративный бесклеточный анализ для тестирования расщепления расщепляемых линкеров включает приготовление экстрактов поляризованных эпителиальных клеток и обеспечения доступа меченой слитой молекулы, несущей расщепляемый линкер, к фракции экстракта, соответствующей мембраносвязанным ферментам. В таких анализах метка может быть присоединена либо к биологически активной нагрузке для доставки, либо к остальной части слитой молекулы. Среди этих ферментов находятся ферменты расщепления, обнаруживаемые вблизи базолатеральной мембраны поляризованной эпителиальной клетки, как описано выше. Расщепление можно обнаружить, например, путем связывания слитой молекулы, например, с антителом и отмывки несвязанных молекул. Если метку присоединяют к биологически активной нагрузке для доставки, на молекуле, связанной с антителами, обнаружится небольшое количество или отсутствие метки. Альтернативно, связывающий агент, используемый в анализе, может обладать специфичностью к биологически активной нагрузке, а остальная часть конструкции может быть меченой. В любом случае можно оценивать расщепление.
Расщепление можно также тестировать, используя анализы на клеточной основе, в которых тестируют расщепление поляризованными эпителиальными клетками, собранными в мембраны. Например, меченую слитую молекулу или часть слитой молекулы, содержащую расщепляемый линкер, можно приводить в контакт либо с апикальной, либо с базолатеральной стороной монослоя подходящих эпителиальных клеток, таких как, например, клетки Сосо-2, в условиях, дающих возможность для расщепления линкера. Расщепление можно выявлять путем выявления присутствия или отсутствия метки с использованием реагента, специфично связывающегося со слитой молекулой или ее участком. Например, можно использовать антитело, специфичное к слитой молекуле, для связывания слитой молекулы, содержащей метку, дистальную к расщепляемому линкеру по отношению к участку слитой молекулы, связанному антителом. Затем расщепление можно оценивать путем выявления присутствия метки на молекулах, связанных с антителом. Если расщепление произошло, на молекулах, связанных с антителом, должно обнаруживаться небольшое количество или отсутствие метки. Путем проведения таких экспериментов можно идентифицировать ферменты, которые преимущественно расщепляют на базолатеральной мембране, а не на апикальной мембране, и, кроме того, подтвердить способность таких ферментов к расщеплению расщепляемого линкера в слитой молекуле.
Кроме того, расщепление можно также тестировать с использованием анализа с использованием флуоресцентного репортера, как описано в патенте США №6,759,207. Кратко, в таких анализах флуоресцентный репортер приводят в контакт с базолатеральной стороной монослоя подходящих эпителиальных клеток в условиях, дающих возможность расщепления репортера расщепляющим ферментом. Расщепление репортера изменяет структуру флуоресцентного репортера, изменяя ее с нефлуоресцентной конфигурации на флуоресцентную конфигурацию. Количество наблюдаемой флуоресценции указывает на активность расщепляющего фермента, присутствующего на базолатеральной мембране.
Кроме того, расщепление можно также тестировать с использованием молекулярного зонда, подвергаемого внутримолекулярному гашению, как описано в патенте США №6,592,847. Такие зонды, как правило, содержат флуоресцентную группировку, которая испускает фотоны при возбуждении светом соответствующей длины волны, и группировку гасителя, которая поглощает такие фотоны при нахождении в тесном приближении к флуоресцентной группировке. Расщепление зонда отделяет группировку гасителя от флуоресцентной группировки, так что флуоресценцию можно выявить, что, таким образом, указывает на то, что расщепление произошло. Таким образом, такие зонды можно использовать для идентификации и оценки расщепления конкретными расщепляющими ферментами путем приведения базолатеральной стороны монослоя подходящих эпителиальных клеток в контакт с зондом в условиях, дающих возможность расщепления зонда расщепляющим ферментом. Количество наблюдаемой флуоресценции указывает на активность тестируемого расщепляющего фермента.
Иллюстративные слитые молекулы Cholix-токсин-биологически активная нагрузка
Воплощения настоящего изобретения включают, без ограничений, слитые молекулы, описанные в таблице 7.


В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 80, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 82.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 70, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 82.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 42, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 82.
В различных воплощениях изобретения слитая молекула содержит аминокислотную последовательность, представленную в SEQ ID NO: 114.
В различных воплощениях изобретения слитая молекула содержит аминокислотную последовательность, представленную в SEQ ID NO: 115.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 52, и биологически активную нагрузку, которая представляет собой антитело, содержащее вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 88, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 89.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 52, и биологически активную нагрузку, которая представляет собой антитело, содержащее вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 90, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 91.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 52, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 92.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 52, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 93.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 52, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 94.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 52, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 95.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 80, и биологически активную нагрузку, которая представляет собой антитело, содержащее вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 88, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 89.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 80, и биологически активную нагрузку, которая представляет собой антитело, содержащее вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 90, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 91.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 80, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 92.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 80, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 93.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 80, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 94. В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 80, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 95.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 70, и биологически активную нагрузку, которая представляет собой антитело, содержащее вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 88, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 89.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 70, и биологически активную нагрузку, которая представляет собой антитело, содержащее вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 90, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 91.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 70, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 92.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 70, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 93.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 70, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 94.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 70, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 95.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 42, и биологически активную нагрузку, которая представляет собой антитело, содержащее вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 88, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 89.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 42, и биологически активную нагрузку, которая представляет собой антитело, содержащее вариабельную область тяжелой цепи, имеющую аминокислотную последовательность SEQ ID NO: 90, и вариабельную область легкой цепи, имеющую аминокислотную последовательность SEQ ID NO: 91.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 42, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 92.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 42, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 93.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 42, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 94.
В различных воплощениях изобретения слитая молекула содержит модифицированный Cholix-токсин, имеющий аминокислотную последовательность SEQ ID NO: 42, и биологически активную нагрузку, имеющую аминокислотную последовательность SEQ ID NO: 95.
Приведенные ниже примеры только иллюстрируют изобретение и никоим образом не предназначены для ограничения изобретения.
Пример 1
В данном примере в целом описано получение неприродной слитой молекулы в виде единой аминокислотной последовательности и содержащей последовательность модифицированного Cholix-токсина, расщепляемую линкерную последовательность и биологически активную нагрузку.
Конструируют семь иллюстративных экспрессионных векторов слитой молекулы для доставки полипептидов интерлейкина-10 (SEQ ID NO: 82), интерлейкина-19 (SEQ ID NO: 83), интерлейкина-20 (SEQ ID NO: 84), интерлейкина-22 (SEQ ID NO: 85), интерлейкина-24 (SEQ ID NO: 86) или интерлейкина-26 (SEQ ID NO: 87), как в целом описано ниже. Сначала гены полипептидов амплифицируют с помощью PCR, включая пары сайтов ферментов рестрикции NdeI и EcoRI, PstI и PstI, AgeI и EcoRI или PstI и EcoRI на двух концах продуктов PCR. После расщепления ферментом рестрикции продукты PCR клонируют в соответствующую плазмиду для клеточной экспрессии, которую расщепляют соответствующими парами ферментов рестрикции. Полученные в результате конструкции включают модифицированный Cholix-токсин, содержащий аминокислотную последовательность, кодирующую аминокислоты 1-386 SEQ ID NO: 1 (Cholix386) и соответствующие полипептиды, а также являются меченными мотивом 6-His на N-конце полипептида для облегчения очистки. Конечные плазмиды проверяют посредством расщепления ферментами рестрикции и секвенирования ДНК.
Также была получена неприродная слитая молекула, содержащая Cholix415 (SEQ ID NO: 52), расщепляемую линкерную последовательность, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 121, и биологически активную нагрузку, представляющую собой полипептид IL-10, состоящий из аминокислотных остатков 20-178 SEQ ID NO: 82 (эта слитая молекула обозначена Cholix415-TEV-IL-10, см. ФИГ. 1 (SEQ ID NO: 122)), и неприродная слитая молекула, содержащая Cholix415 (SEQ ID NO: 52), нерасщепляемую линкерную последовательность, имеющую аминокислотную последовательность, представленную в SEQ ID NO: 98, и биологически активную нагрузку, представляющую собой полипептид IL-10, состоящий из аминокислотных остатков 20-178 SEQ ID NO: 82 (данная слитая молекула обозначена как "Cholix415-(G4S)3-IL-10", см. ФИГ. 1 (SEQ ID NO: 123)).
Экспрессионные векторы, содержащие нерасщепляемые или расщепляемые линкеры, конструируют путем введения последовательностей, кодирующих соответствующую аминокислотную последовательность. Для этого синтезируют олигонуклеотиды, кодирующие последовательности, комплементарные соответствующим сайтам рестрикции, и аминокислотную последовательность желаемого линкера, затем лигируют в вектор экспрессии, полученный, как описано выше, между модифицированной последовательностью Cholix и полипептидной последовательностью.
В различных воплощениях изобретения слитые молекулы экспрессируют, как описано ниже: Компетентные клетки Е. coli BL21(DE3) pLysS (Novagen, г. Мэдисон, Висконсин) трансформируют, используя стандартный способ теплового шока, в присутствии соответствующей плазмиды для образования клеток, экспрессирующих слитую молекулу, отбрирают на среде, содержащей ампициллин, и выделяют и выращивают в бульоне Лурия-Бертани (Difco; Becton Dickinson, Франклин-Лейке, N.J.) с антибиотиком, затем экспрессию белка индуцируют добавлением 1 мМ изопропил-D-тиогалактопиранозида (IPTG) при OD (оптическая плотность) 0,6. Через два часа после индуцирования IPTG клетки собирают центрифугированием при 5000 об/мин в течение 10 мин. После лизиса клеток выделяют тельца включения, и белки солюбилизируют в буфере, содержащем 100 мМ Трис-HCl (рН 8,0), 2 мМ EDTA (этилендиаминтетрауксусная кислота), 6 М гуанидин HCl и 65 мМ дитиотрейтол. Солюбилизированную слитую молекулу подвергают рефолдингу в присутствии 0,1 М Трис, рН 7,4, 500 мМ L-аргинина, 0,9 мМ GSSG (окисленный глутатион), 2 мМ EDTA. Белки после рефолдинга очищают ионообменной хроматографией на Q сефарозе и гель-фильтрационной хроматографией на колонке Superdex 200 (Amersham Biosciences, Inc., Швеция). Чистоту белков оценивают с помощью SDS-PAGE и аналитической HPLC (Agilent, Inc. г. Пало-Альто, штат Калифорния, США).
На ФИГ. 2 в виде ленточной диаграммы представлена иллюстративная слитая молекула, например Cholix415-TEV-IL-10, после рефолдинга, который должен направляться димеризацией IL-10. Рассматривают, что результатом димеризации IL-10 является организация, показанная: пурпурным цветом Cholix415 /синим цветом hIL-10 и оранжевым цветом Cholix415 /зеленым цветом.
Cholix415-TEV-IL-10 и Cholix415-(G4S)3-IL-10 оценивали, чтобы проверить правильную укладку в отношении их предполагаемого молекулярного размера. После индуцирования экспрессированный белок собирали из телец включения. Степень экспрессии Cholix415-TEV-IL-10 (изображенной как «С» на геле) и экспрессии Cholix415-(G4S)3-IL-10 (изображенной как «N» на геле) в тельцах включения показала видимую молекулярную массу приблизительно 66 кДа, которая была сравнима с расчетной массой 66380,78 и 65958,25 Дальтон соответственно. См. ФИГ. 3. Показано, что отсутствие этих белков в средах супернатанта после удаления телец включения для линкера TEV (С) и линкера не-TEV (N) демонстрирует степень и специфичность индуцирования химеры. Показаны предварительно окрашенные стандарты MW (молекулярной массы) SeeBlue® Plus2.
Пример 2
В данном примере описаны способы проверки правильной укладки in vitro слитых молекул в отношении их способности к переносу биологически активной нагрузки через интактный эпителий.
Линию клеток J774 макрофагов мыши можно использовать в качестве линии клеток, отвечающих на IL-10 (O'Farrell AM, et al., EMBO J, 17(4): 1006-18, 1998). IL-10 в естественных условиях образует димер, который требуется для его оптимальной активности. Cholix415-(G4S)3-IL-10, экспрессируемый Е coli, собирали из телец включения и подвергали фолдингу, используя буферную систему перекрестного дисульфидного обмена. Полученное в результате вещество очищали посредством ионообменной и эксклюзионной хроматографии с выделением в результате белка приблизительно 130 кДа, предполагаемого размера димера IL-10, соединенного с двумя молекулами Cholix415 (далее в настоящем документе слитой молекулы «димер Cholix415-IL-10»). Чистота белка в композициюе составляла приблизительно 85-90% на основании SDS-PAGE. Культуры линии клеток J774.2 обрабатывали в течение 48 ч димерной слитой молекулой Cholix415-IL-10, при концентрациях 25 нМ и 250 нМ. По сравнению с соответствующими необработанными клетками димерная слитая молекула Cholix415-IL-10 приводила к дозозависимому снижению числа клеток, оцениваемого с помощью проточной цитометрии живых/мертвых клеток (см. ФИГ. 4). Значения представляют собой n равно 4 плюс/минус стандартное отклонение.
Альтернативно можно совместно культивировать клетки, отвечающие на IL-10, в базальном компартменте клеточных монослоев, используемых для апикально-базолатерального трансцитоза (Rubas W, et al., Pharm Res. 13(1):23-6, 1996).
Пример 3
В данном примере оценивали действие димерной слитой молекулы Cholix415-(G4S)3-IL-10 на барьерные свойства клеточных монослоев Сасо-2 in vitro. Из клеток Сасо-2 (линия клеток рака из ободочной кишки человека) со средами из базолатерального компартмента периодически отбирали пробы в течение нескольких часов (Rubas W, et al., J Pharm Sci., 85(2): 165-9, 1996). Клетки Сасо-2 (АТСС НТВ-37™) поддерживали при 5% CO2 при 37°С в полной среде: модифицированная Дульбекко среда Игла F12 (DMEM F12) с добавлением 10% фетальной бычьей сыворотки, 2,5 мМ глутамина, 100 ед. пенициллина/мл и 100 мкг стрептомицина/мл (Gibco BRL, г. Гранд-Айленд, N.Y.). Клетки подпитывают каждые 2-3 суток этой средой (обозначенной как полная среда) и пересевают каждые 5-7 суток. Для анализов клетки высевают в 24- или 96-луночные планшеты и выращивают до конфлюэнтности.
Устойчивые монослои Сасо-2, используемые для этих исследований, имели значения трансэпителиального электрического сопротивления (TER) приблизительно 450-600 Ом⋅см2 (среднее значение 579 Ом⋅см2), измеренного с помощью вольтметра с парными стержневыми электродами MilliceII-ERS® (Millipore). На апикальную поверхность этих монослоев добавляли меченный флуоресцеином декстран 70 кДа и изменяющиеся концентрации (4,7 нМ, 23,6 нМ и 236 нМ) димерной слитой молекулы Cholix415-(G4S)3-IL-10 и проводили мониторинг по времени суммарного количества флуоресценции, выявленного в базальном компартменте, путем отбора объемов 150 мкл с заменой. Как изображено на ФИГ. 5 и ФИГ. 6, в отсутствие клеток Сасо-2 на фильтровальной подложке декстран быстро перемещался из апикального в базальный компартмент. Для сравнения степень переноса декстрана 70 кДа через монослои Сасо-2 была значительно меньше, и различные димерные слитые молекулы Cholix415-IL-10, были неспособны к какому-либо дозозависимому действию на степень переноса декстрана 70 кДа через эти монослои Сасо-2, и результаты резко не отличались от результатов, полученных с монослоями Сасо-2, не подвергавшимися воздействию димерных слитых молекул Cholix415-IL-10. Димерная слитая молекула Cholix415-(G4S)3-IL-10 не оказывает явного влияния на барьерные свойства монослоев клеток Сасо-2 in vitro.
Пример 4
В данном примере проводят количественное определение методом ELISA для оценки способности димерной слитой молекулы Cholix415-(G4S)3-IL-10 к перемещению через монослои клеток Сасо-2. Клетки А549 (АТСС CCL-185™), L929 (АТСС CRL-2148™) и Сасо-2 (АТСС НТВ-37™) поддерживают при 5% CO2 при 37°С в полной среде: модифицированная Дульбекко среда Игла F12 (DMEM F12) с добавлением 10% фетальной бычьей сыворотки, 2,5 мМ глутамина, 100 ед. пенициллина/мл и 100 мкг стрептомицина/мл (Gibco BRL, г. Гранд-Айленд, N.Y.). Клетки подпитывают каждые 2-3 суток этой средой (обозначенной как полная среда) и пересевают каждые 5-7 суток. Для анализов клетки высевают в 24- или 96-луночные планшеты и выращивают до конфлюэнтности.
Клетки Сасо-2 выращивают в виде конфлюэнтных монослоев на подложках системы Трансвелл из поликарбонатной мембраны с размером пор 0,4-мкм, на которые нанесен коллаген (Corning-Costar, Cambridge, MA), и используют через 18-25 суток после достижения ими трансэпителиального электрического сопротивления (TER) более 250 Ом⋅см2, измеренного с помощью вольтметра с парными стержневыми электродами Millicell-ERS® (Millipore). Апикально-базолатеральный перенос (А→В) димерной слитой молекулы Cholix415-(G4S)3-IL-10 через этот монослой определяют путем измерения количества перенесенного белка через 4 ч после нанесения 4,7 нМ, 23,6 нМ и 236 нМ при 37°С. Измерения TER и степени флуоресцентного декстрана 10 кДа (измеренной с использованием протокола эксклюзионной HPLC) используют для проверки барьерных свойств монослоя в ходе исследования. Степень переноса Cholix определяют путем титрования собранных сред в анализе цитотоксичности на клеточной основе. Перенесенную димерную слитую молекулу Cholix415-(G4S)3-IL-10 измеряют с помощью твердофазного иммуносорбентного ферментного анализа (ELISA) с использованием антитела к IL-10 для захвата и поликлональной сыворотки к Cholix для выявления. Как изображено на ФИГ. 7 (А и В), димерная слитая молекула Cholix415-(G4S)3-IL-10 перемещается через монослои клеток Сасо-2.
Пример 5
В данном примере описано получение неприродной слитой молекулы, в которой отсутствует расщепляемая последовательность. Эти слитые молекулы предназначены для специфичного нацеливания в подслизистое/GI пространство и ограничения действий биологически активной нагрузки этим пространством.
Получают плазмидную конструкцию, кодирующую нетоксичную мутантную форму Cholix-токсина, Cholix-токсин ΔЕ581 (SEQ ID NO: 81). Экспрессия белка достигается с использованием клеток Е. coli DH5α (Invitrogen, г. Карлсбад, СА) после трансформации с помощью теплового шока (1 мин при 42°С) с соответствующей плазмидой. Трансформированные клетки, отобранные на среде, содержащей антибиотик, выделяют и выращивают в бульоне Лурия-Бертани (Difco). Экспрессию белка индуцируют добавлением 1 мМ изопропил-D-тиогалактопиранозида (IPTG). Через два часа после индуцирования IPTG клетки собирают центрифугированием при 5000 об/мин в течение 10 мин при 4°С. После лизиса клеток выделяют тельца включения, и белки солюбилизируют в 6 М гуанидин HCl и 2 мМ EDTA (рН 8,0) с добавлением 65 мМ дитиотрейтола. После рефолдинга и очистки белки хранят при приблизительно 5 мл/мл в PBS (рН 7,4) без Са2+ и Mg2+ при -80°С. Подтверждают чистоту всех белков, используемых в этих исследованиях, как более 90% на основании эксклюзионной хроматографии.
Затем белок Cholix-токсин ΔЕ581 модифицируют на его С-конце, чтобы дать возможность прямого химического сочетания посредством свободного сульфгидрильного остатка, расположенного вблизи С-конца белка. С-концевая модификация включает цистеин-ограниченную петлю, несущую в себе консенсус-последовательность расщепления высоко селективной протеазой вируса гравировки табака (TEV), второй цистеин и гексагистидиновую метку (His6). Второй Cys включают для образования дисульфидного мостика с Cys, в конечном счете используемого для связывания. Присоединение к белку последовательности His6 упрощает очистку, а последовательность расщепления TEV обеспечивает механизм селективного удаления концевого остатка Cys после мягкого восстановления. Расщепление и мягкое восстановление TEV с 0,1 мМ дитиотрейтолом с последующей экспрессией и выделением конструкций ntCholix дает возможность прямого химического сочетания биологически активной нагрузки посредством взаимодействия на основе малеимида в качестве общего механизма присоединения нагрузки. После расщепления протеазой TEV, восстановления и сочетания нагрузки посредством взаимодействия малеимида со свободным сульфгидрилом удаление высвобожденной С-концевой последовательности было достигнуто в результате второй стадии колоночной хроматографии Ni2+.
Пример 6
Трансэпителиальный перенос Cholix-токсин ΔЕ581-нагрузка оценивают с использованием монослоев Сасо-2 in vitro. Клетки Сасо-2 (пассаж номер 25-35) выращивают до конфлюэнтных монослоев, как описано ранее; Rubas, W. et al., Pharm Res, 10:113-118 (1993). Кратко, клетки поддерживают при 37°С в среде DMEM/обогащенной среде, обогащенной 2 мМ L-глутамином, 10% фетальной бычьей сывороткой и с добавлением 100 ед. пенициллина/стрептомицина в атмосфере 5% CO2 и при влажности 90%. Клетки пересевают каждую неделю при отношении разделения 1:3 во флаконах на 75 см2 и высевают на предварительно увлажненные проницаемые поликарбонатные фильтрующие подложки (размер пор 0,4 мкм) (системы Трансвелл™), на которые нанесен коллаген, Corning Costar (г. Кембридж, МА) при плотности 63000 клеток/см2. Ростовые среды заменяли через сутки. Консрлюэнтные монослои, определенные на основании приобретения значительного трансэпителиального сопротивления (TEER), определяемое с использованием вольт-омметра (World Precision Instruments, г. Сарасота, FL), используют через 20-26 суток после посева.
Скорости потока трансэпителиального переноса измеряют in vitro в направлениях от апикального (Ар) к базолатеральному (BI) и от BI к Ар, используя поляризованные монослои клеток Сасо-2 для описания событий потока от слизистого к серозному и от серозного к слизистому соответственно. Непосредственно перед началом исследования переноса измеряют трансэпителиальное сопротивление (TEER) каждого фильтра; показания TEER монослоев менее 200 Ом⋅см2 исключают из исследования. Среды Ар и BI отбирают из включенных монослоев, и эти поверхности промывают один раз забуференным фосфатом физиологическим раствором (PBS). Затем на одну серию монослоев Ар (донор) наносят 100 мкл PBS, содержащего 10 мкг Cholix-токсин ΔЕ581-нагрузка и 10 мкг TRITC(тетраметилродаминизотиоцианат)-декстрана или 10 мкг BSA(бычий сывороточный альбумин)-нагрузка и 10 мкг TRITC-декстрана. Затем в приемные (BI) компартменты наносят 500 мкл PBS до установления Т0 для исследования переноса. Как из донорного, так и из приемного компартментов отбирают пробы после 4 ч инкубации при 37°С для определения количества материала, перенесенного через монослой, и количества, удерживаемого на апикальной поверхности, соответственно.
Пример 7
В данном примере описаны получение и экспрессия в Е. coli, слитой молекулы, включающей модифицированный Cholix-токсин, содержащий последовательность, кодирующую аминокислоты 1-415 SEQ ID NO: 1, непосредственно слитый на его С-конце с полипептидом IL-10 (обозначенной как слитая молекула «Cholix415-IL-10»). Экспрессия белка достигается с использованием клеток Е. coli DH5α (Invitrogen, г. Карлсбад, СА) после трансформации с помощью теплового шока (1 мин при 42°С) соответствующей плазмидой. Трансформированные клетки, отобранные на среде, содержащей антибиотик, выделяют и выращивают в бульоне Лурия-Бертани (Difco). Экспрессию белка индуцируют добавлением 1 мМ изопропил-D-тиогалактопиранозида (IPTG). Через два часа после индуцирования IPTG клетки собирают центрифугированием при 5000 об/мин в течение 10 мин при 4°С. После лизиса клеток выделяют тельца включения, и белки солюбилизируют в 6 М гуанидин HCl и 2 мМ EDTA (рН 8,0) с добавлением 65 мМ дитиотрейтола. После рефолдинга и очистки белки хранят при приблизительно 5 мл/мл в PBS (рН 7,4) без Ca2+ и Mg2+ при -80°С. Подтверждают чистоту всех белков, используемых в этих исследованиях, как более 90% на основании эксклюзионной хроматографии.
Полистирольные гранулы (диаметр 10 нм), содержащие ковалентно интегрированный красный флуоресцентный краситель со свойствами возбуждения/испускания 468/508 нм и имеющий поверхностные альдегидные функциональные группы (XPR-582), получают от компании Duke Scientific (г. Пало-Альто, CA). Сто мкл гранул XPR-582 (при 2% твердых веществ) смешивают с приблизительно 2,5 нмоль IL-10 или слитой молекулы Cholix415-IL-10 в конечном объеме 200 мкл в нейтральном (рН 7,0) забуференном фосфатом физиологическом растворе (PBS). После 2 ч мягкого качания при комнатной температуре добавляют 20 мкл раствора 2 мг/мл бычьего сывороточного альбумина (BSA; Sigma, St. Louis, МО) в PBS. Затем препараты подвергают диализу с помощью трех циклов разведения PBS и концентрирования, используя фильтрующее устройство с предельным значением молекулярной массы 100000 Microcon от компании Millipore (г. Бедфорд, МА). Конечные препараты покрытых гранул имели содержание твердого вещества 1%.
Пример 8
В данном примере получают неприродные изолированные слитые молекулы, содержащие последовательность модифицированного Cholix-токсина SEQ ID NO: 52 (Cholix415), расщепляемую линкерную последовательность (SEQ ID NO: 121) или нерасщепляемый линкер (SEQ ID NO: 98) и биологически активную нагрузку, представляющую собой ингибитор TNFSF, как описано в примере 1, и оценивают, как описано в приведенных выше примерах, для подтверждения правильной укладки и правильного размера.
Было получено шесть иллюстративных векторов, несущих слитые молекулы (3 для каждого линкера), для тестирования способности слитых молекул к апикально-базальному переносу через эпителиальные клетки ингибитора TNFSF, выбранного из: 1) ингибитора TNF, представляющего собой антитело, содержащее последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи SEQ ID NO: 88 и 89; 2) ингибитора TNF, представляющего собой антитело, содержащее последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи SEQ ID NO: 90 и 91; и 3) ингибитора TNFSF, представляющего собой димер растворимого TNFR-p75 человека с участком Fc IgG, содержащим последовательность SEQ ID NO: 92.
Пример 9
В данном примере получают неприродные изолированные слитые молекулы, содержащие последовательность модифицированного Cholix-токсина SEQ ID NO: 52 (Cholix415), расщепляемую линкерную последовательность (SEQ ID NO: 121) или нерасщепляемый линкер (SEQ ID NO: 98) и биологически активную нагрузку, представляющую собой глюкозоснижающее средство, как описано в примере 1, и оценивают, как описано в приведенных выше примерах, для подтверждения правильной укладки и правильного размера.
Было получено четыре иллюстративных вектора, несущих слитые молекулы (2 для каждого линкера), для тестирования способности слитых молекул к апикально-базальному переносу через эпителиальные клетки глюкозоснижающего средства, выбранного из: 1) агониста GLP-1, содержащего последовательность SEQ ID NO: 93; и 2) агониста GLP-1, содержащего последовательность SEQ ID NO: 94.
Пример 10
В данном примере получают неприродные изолированные слитые молекулы, содержащие последовательность модифицированного Cholix-токсина SEQ ID NO: 52 (Cholix415), расщепляемую линкерную последовательность (SEQ ID NO: 121) или нерасщепляемый линкер (SEQ ID NO: 98) и биологически активную нагрузку, представляющую собой гормон роста, как описано в примере 1, и оценивают, как описано в приведенных выше примерах, для подтверждения правильной укладки и правильного размера.
Было получено два иллюстративных вектора, несущих слитые молекулы (один для каждого линкера), для тестирования способности слитых молекул к апикально-базальному переносу через эпителиальные клетки гормона роста человека, содержащего последовательность SEQ ID NO: 95.
Пример 11
В данном примере описано гистологическое выявление в тканях репрезентативной биологически активной нагрузки слитых молекул, полученных в примере 1. После введения слитой молекулы животных подвергали эвтаназии путем асфиксии CO2 и обескровливали путем пункции сердца. Определенные ткани (лимфатические узлы, трахею, головной мозг, селезенку, печень, GI тракт) извлекали, кратковременно промывали в PBS для удаления какой-либо остаточной крови и замораживали в OCT. Срезы (толщиной 5 мкм) помещают на покровные стекла. Стекла фиксируют в ацетоне в течение 10 мин и промывают PBS. Стекла инкубируют с 3% пероксидазой в течение 5 мин. Затем стекла блокируют белком в течение дополнительных 5 мин. Первичное антитело к соответствующей биологически активной нагрузке инкубируют на покровных стеклах в течение 30 мин при разведении 1:100 с последующими отмывками PBS. Затем меченное биотином вторичное антитело инкубировали в течение приблизительно 15 минут с последующими отмывками PBS. Метку стрептавидин-HRP (пероксидаза хрена) инкубируют на стеклах в течение 15 мин с последующими отмывками PBS. Наносят HRP Chromagen в течение 5 мин с последующими несколькими отмывками дистиллированной Н2О. Наконец, стекла контрастно окрашивают гематоксилином в течение 1 мин, закрывают покровными стеклами и исследуют на предмет присутствия биологически активной нагрузки.
Слитые молекулы по изобретению обеспечивают несколько преимуществ по сравнению с традиционными методами локальной или системной доставки макромолекул субъекту. Самым важным из этих преимуществ является способность к доставке биологически активной нагрузки субъекту без использования иглы для прокалывания кожи субъекта. Многим субъектам требуются многократные регулярные дозы макромолекул. Например, диабетики должны делать инъекцию инсулина несколько раз в сутки для контроля концентраций сахара в крови. Качество жизни таких субъектов значительно улучшилось бы, если бы доставку макромолекулы можно было осуществлять без инъекций, за счет избегания связанных с ними боли или потенциальных осложнений.
Кроме того, связывание биологически активной нагрузки с остальной частью слитой молекулы линкером, который расщепляется ферментом, присутствующим на базолатеральной мембране эпителиальной клетки, дает возможность высвобождения биологически активной нагрузки из слитой молекулы, и высвобождения от остальной части слитой молекулы вскоре после трансцитоза через эпителиальную мембрану. Такое высвобождение уменьшает вероятность индуцирования иммунного ответа против биологически активной нагрузки. Оно также дает возможность для взаимодействия биологически активной нагрузки, не содержащей остальной части молекулы, с ее мишенью.
Кроме того, неприродные слитые молекулы, не имеющие расщепляемого линкера, могут обладать преимуществом, заключающимся в том, что якорный эффект модифицированного Cholix-токсина посредством его рецептора(ов) на поверхности, например, иммунных клеток, которые также экспрессируют рецептор для биологически активной нагрузки (но в значительно уменьшенном количестве) может дать возможность большего доступа к биологически активной нагрузке на поверхности клеток-мишеней и обеспечивает синергетическое действие посредством связывания Cholix с его рецептором и, например, связывания IL-10 с IL-10R.
Кроме того, после их переноса через GI эпителий слитые молекулы по изобретению проявляют пролонгированный период полувыведения из сыворотки крови, таким образом, биологически активная нагрузка слитых молекул будет проявлять пролонгированный период полувыведения из сыворотки крови по сравнению с биологически активной нагрузкой в ее неслитом состоянии, и в результате перорального введения слитой молекулы можно доставлять более высокую эффективную концентрацию доставляемой биологически активной нагрузки в печень субъекта по сравнению с наблюдаемой в плазме крови субъекта.
Кроме того, воплощения слитых молекул можно конструировать и экспрессировать в рекомбинантных системах. Рекомбинантная технология позволяет получить слитую молекулу, имеющую сайт встраивания, предназначенный для введения любой подходящей биологически активной нагрузки. Такие сайты встраивания позволяют специалисту в данной области техники быстро и легко получать слитые молекулы для доставки новой биологически активной нагрузки при возникновении такой необходимости.
Все изделия и способы, раскрытые и заявленные в настоящем документе, могут быть получены и выполнены без чрезмерного экспериментирования в свете настоящего изобретения. Хотя изделия и способы по данному изобретению описаны в отношении воплощений, специалистам в данной области техники должно быть очевидно, что в эти изделия и способы могут быть внесены изменения без отклонения от сущности и объема изобретения. Все такие изменения и эквиваленты, очевидные специалистам в данной области техники, либо существующие в настоящее время, либо разработанные впоследствии, считают находящимися в пределах сущности и объема изобретения, как определено в прилагаемой формуле изобретения. Все патенты, заявки на патенты и публикации, упомянутые в описании, являются показателями уровней обычных специалистов в области техники, к которой принадлежит изобретение. Все патенты, заявки на патенты и публикации полностью включены в настоящий документ посредством ссылки для всех целей и в такой же степени, как если бы каждая индивидуальная публикация была конкретно и индивидуально указана как полностью включенная посредством ссылки для любой и для всех целей. Изобретение, иллюстративно описанное в настоящем документе, можно подходящим образом осуществлять на практике в отсутствие любого(ых) элемента(ов), конкретно не раскрытого(ых) в настоящем документе. Так, например, в каждом случае в настоящем документе любой из терминов «содержащий», «состоящий по существу из» и «состоящий из» может быть заменен любым из двух других терминов. Используемые термины и выражения используют в качестве описательных и не для ограничения, и использование таких терминов и выражений не предназначено для исключения каких-либо эквивалентов представленных и описанных признаков или их частей, но понятно, что возможны различные модификации в пределах объема заявленного изобретения. Таким образом, должно быть понятно, что, хотя настоящее изобретение конкретно раскрыто воплощениями и возможными признаками, специалисты в данной области техники могут прибегать к модификации и изменению раскрытых в настоящем документе концепций, и такие модификации и вариации рассматривают как находящиеся в пределах объема данного изобретения, определенного прилагаемой формулой изобретения.
Перечни последовательностей
Аминокислотные последовательности, приведенные в сопроводительном перечне последовательностей, показаны с использованием стандартного трехбуквенного кода для аминокислот, как определено в 37 C.F.R. 1.822.
SEQ ID NO: 1 представляет собой 634-аминокислотную последовательность зрелого Cholix-токсина Vibrio cholera.
SEQ ID NO: 2 представляет собой нуклеиновокислотную последовательность, кодирующую 634-аминокислотную последовательность зрелого Cholix-токсина V. cholera.
SEQ ID NO: 3-80 представляют собой аминокислотные последовательности различных усеченных Cholix-токсинов, полученных из последовательности зрелого Cholix-токсина, представленной в SEQ ID NO: 1.
SEQ ID NO: 81 представляет собой аминокислотную последовательность мутированного Cholix-токсина где аминокислотный остаток Е581 SEQ ID NO: 1 делетирован.
SEQ ID NO: 82 представляет собой аминокислотную последовательность интерлейкина-10 человека (IL-10).
SEQ ID NO: 83 представляет собой аминокислотную последовательность интерлейкина-19 человека (IL-19).
SEQ ID NO: 84 представляет собой аминокислотную последовательность интерлейкина-20 человека (IL-20).
SEQ ID NO: 85 представляет собой аминокислотную последовательность интерлейкина-22 человека (IL-22).
SEQ ID NO: 86 представляет собой аминокислотную последовательность интерлейкина-24 человека (IL-24).
SEQ ID NO: 87 представляет собой аминокислотную последовательность интерлейкина-26 человека (IL-26).
SEQ ID NO: 88 - последовательность вариабельной области тяжелой цепи антитела к TNF-альфа.
SEQ ID NO: 89 - последовательность вариабельной области легкой цепи антитела к TNF-альфа.
SEQ ID NO: 90 - последовательность вариабельной области тяжелой цепи антитела к TNF-альфа.
SEQ ID NO: 91 - последовательность вариабельной области легкой цепи антитела к TNF-альфа.
SEQ ID NO: 92 - аминокислотная последовательность димерного слитого белка TNFR-p75-Fc человека.
SEQ ID NO: 93 - аминокислотная последовательность пептида - агониста GLP-1 (эксенатида).
SEQ ID NO: 94 - аминокислотная последовательность пептида - агониста GLP-1 (лираглутида).
SEQ ID NO: 95 - аминокислотная последовательность гормона роста человека (соматотропина).
SEQ ID NO: 96-121 представляют собой аминокислотные последовательности различных пептидных линкеров.
SEQ ID NO: 122 представляет собой аминокислотную последовательность слитой молекулы Cholix415-TEV-IL-10.
SEQ ID NO: 123 представляет собой аминокислотную последовательность слитой молекулы Cholix415-(G4S)3-IL-10.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 - аминокислотная последовательность зрелого Cholix-токсина Vibrio cholera

SEQ ID NO: 2 - нуклеиновокислотная последовательность, кодирующая зрелый Cholix-токсин V. cholera


SEQ ID NO: 3 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix386

SEQ ID NO: 4 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix385

SEQ ID NO: 5 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix384

SEQ ID NO: 6 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix383


SEQ ID NO: 7 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix382

SEQ ID NO: 8 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix381

SEQ ID NO: 9 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix380

SEQ ID NO: 10 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix379

SEQ ID NO: 11 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix378

SEQ ID NO: 12 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix377

SEQ ID NO: 13 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix376

SEQ ID NO: 14 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix375

SEQ ID NO: 15 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix374


SEQ ID NO: 16 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix373

SEQ ID NO: 17 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix372

SEQ ID NO: 18 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix371

SEQ ID NO: 19 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix370

SEQ ID NO: 20 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix369

SEQ ID NO: 21 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix368

SEQ ID NO: 22 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix367

SEQ ID NO: 23 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix366

SEQ ID NO: 24 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix365


SEQ ID NO: 25 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix364

SEQ ID NO: 26 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix363

SEQ ID NO: 27 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix362

SEQ ID NO: 28 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix361

SEQ ID NO: 29 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix360

SEQ ID NO: 30 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix359

SEQ ID NO: 31 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix358

SEQ ID NO: 32 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix357

SEQ ID NO: 33 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix356


SEQ ID NO: 34 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix355

SEQ ID NO: 35 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix354

SEQ ID NO: 36 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix353

SEQ ID NO: 37 - аминокислотная последовательность модифицированного-Cholix-токсина Vibrio cholera Cholix352

SEQ ID NO: 38 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix351

SEQ ID NO: 39 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix350

SEQ ID NO: 40 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix349

SEQ ID NO: 41 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix348

SEQ ID NO: 42 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix425


SEQ ID NO: 43 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix424

SEQ ID NO: 44 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix423

SEQ ID NO: 45 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix422

SEQ ID NO: 46 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix421


SEQ ID NO: 47 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix420

SEQ ID NO: 48 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix419

SEQ ID NO: 49 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix418

SEQ ID NO: 50 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix417


SEQ ID NO: 51 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix416

SEQ ID NO: 52 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix415

SEQ ID NO: 53 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix414

SEQ ID NO: 54 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix413

SEQ ID NO: 55 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix412

SEQ ID NO: 56 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix411

SEQ ID NO: 57 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix410

SEQ ID NO: 58 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix409

SEQ ID NO: 59 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix408

SEQ ID NO: 60 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix407

SEQ ID NO: 61 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix406

SEQ ID NO: 62 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix405

SEQ ID NO: 63 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix404

SEQ ID NO: 64 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix403

SEQ ID NO: 65 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix402

SEQ ID NO: 66 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix401

SEQ ID NO: 67 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix400

SEQ ID NO: 68 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix399

SEQ ID NO: 69 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix398

SEQ ID NO: 70 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix397

SEQ ID NO: 71 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix396

SEQ ID NO: 72 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix395

SEQ ID NO: 73 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix394

SEQ ID NO: 74 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix393

SEQ ID NO: 75 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix392

SEQ ID NO: 76 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix391

SEQ ID NO: 77 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix390

SEQ ID NO: 78 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix389

SEQ ID NO: 79 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix388

SEQ ID NO: 80 - аминокислотная последовательность модифицированного Cholix-токсина Vibrio cholera Cholix387

SEQ ID NO: 81 - модифицированная аминокислотная последовательность Cholix-токсина Vibrio cholera Cholix Δ581

SEQ ID NO: 82 - аминокислотная последовательность интерлейкина-10 человека

SEQ ID NO: 83 - аминокислотная последовательность интерлейкина-19 человека

SEQ ID NO: 84 - аминокислотная последовательность интерлейкина-20 человека

SEQ ID NO: 85 - аминокислотная последовательность интерлейкина-22 человека

SEQ ID NO: 86 - аминокислотная последовательность интерлейкина-24 человека

SEQ ID NO: 87 - аминокислотная последовательность интерлейкина-26 человека

SEQ ID NO: 88 - последовательность вариабельной области тяжелой цепи антитела к TNF-альфа

SEQ ID NO: 89 - последовательность вариабельной области легкой цепи антитела к TNF-альфа

SEQ ID NO: 90 - последовательность вариабельной области тяжелой цепи антитела к TNF-альфа
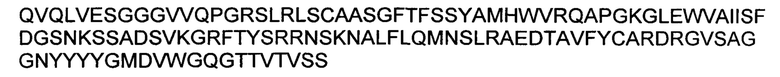
SEQ ID NO: 91 - последовательность вариабельной области легкой цепи антитела к TNF-альфа

SEQ ID NO: 92 - аминокислотная последовательность димерного слитого белка TNFR-p75-Fc человека

SEQ ID NO: 93 - аминокислотная последовательность пептида - агониста GLP-1 (эксенатида)

SEQ ID NO: 94 - аминокислотная последовательность пептида - агониста GLP-1 (лираглутида)

SEQ ID NO: 95 - аминокислотная последовательность гормона роста человека (соматотропина).

SEQ ID NO: 96 - аминокислотная последовательность пептидного линкера
GGGGS
SEQ ID NO: 97 - аминокислотная последовательность пептидного линкера
GGGGSGGGGS
SEQ ID NO: 98 - аминокислотная последовательность пептидного линкера
GGGGSGGGGSGGGGS
SEQ ID NO: 99 - аминокислотная последовательность пептидного линкера
GGGGSGGG
SEQ ID NO: 100 - аминокислотная последовательность пептидного линкера
AAPF
SEQ ID NO: 101 - аминокислотная последовательность пептидного линкера
GGF
SEQ ID NO: 102 - аминокислотная последовательность пептидного линкера
AAPV
SEQ ID NO: 103 - аминокислотная последовательность пептидного линкера
GGL
SEQ ID NO: 104 - аминокислотная последовательность пептидного линкера
AAL
SEQ ID NO: 105 - аминокислотная последовательность пептидного линкера
FVR
SEQ ID NO: 106 - аминокислотная последовательность пептидного линкера
VGR
SEQ ID NO: 107 - аминокислотная последовательность пептидного линкера
RKPR
SEQ ID NO: 108 - аминокислотная последовательность пептидного линкера
Y V A D Хаа Хаа = любая аминокислота
SEQ ID NO: 109 - аминокислотная последовательность пептидного линкера
D Хаа Хаа D Хаа Хаа = любая аминокислота
SEQ ID NO: 110 - аминокислотная последовательность пептидного линкера
R (Xaa)n R Хаа Хаа = любая аминокислота n = 0, 2, 4 или 6
SEQ ID NO: 111 - аминокислотная последовательность пептидного линкера
K (Xaa)n R Хаа Хаа = любая аминокислота n = 0, 2, 4 или 6
SEQ ID NO: 112 - аминокислотная последовательность пептидного линкера
Е R Т K R Хаа Хаа = любая аминокислота
SEQ ID NO: 113 - аминокислотная последовательность пептидного линкера
R V R R Хаа Хаа = любая аминокислота
SEQ ID NO: 114 - аминокислотная последовательность пептидного линкера
Деканоил-R V R R Хаа Хаа = любая аминокислота
SEQ ID NO: 115 - аминокислотная последовательность пептидного линкера
Р Хаа W V Р Хаа Хаа = любая аминокислота
SEQ ID NO: 116 - аминокислотная последовательность пептидного линкера
W V А Хаа Хаа = любая аминокислота
SEQ ID NO: 117 - аминокислотная последовательность пептидного линкера
Хаа F Хаа Хаа Хаа = любая аминокислота
SEQ ID NO: 118 - аминокислотная последовательность пептидного линкера
Хаа Y Хаа Хаа Хаа = любая аминокислота n = 0, 2, 4 или 6
SEQ ID NO: 119 - аминокислотная последовательность пептидного линкера
Xaa W Хаа Хаа Хаа = любая аминокислота n = 0, 2, 4 или 6
SEQ ID NO: 120 - аминокислотная последовательность пептидного линкера
D R W I P F H L L в комбинации с (V, А или P)-Y-(S, P или А)
SEQ ID NO: 121 - аминокислотная последовательность пептидного линкера
GGGGSGGGENLYFQS
SEQ ID NO: 122 - аминокислотная последовательность слитой молекулы Cholix415-TEV-IL-10

SEQ ID NO: 123 - аминокислотная последовательность слитой молекулы Cholix415-(G4S)3-IL-10

--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЭППЛАЙД МОЛЕКЬЮЛАР ТРАНСПОРТ ЭлЭлСи
<120> СЛИТЫЕ МОЛЕКУЛЫ, ПРОИСХОДЯЩИЕ ОТ CHOLIX-ТОКСИНА, ДЛЯ ПЕРОРАЛЬНОЙ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНЫХ НАГРУЗОК
<130> CACAM1.0002WO
<160> 123
<170> PatentIn версия 3.5
<210> 1
<211> 634
<212> ПРТ
<213> Vibreo cholerae
<400> 1
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser Gly Arg Ser Tyr Leu Pro Glu Asn Arg Ala Val Ile Thr Pro Gln
420 425 430
Gly Val Thr Asn Trp Thr Tyr Gln Glu Leu Glu Ala Thr His Gln Ala
435 440 445
Leu Thr Arg Glu Gly Tyr Val Phe Val Gly Tyr His Gly Thr Asn His
450 455 460
Val Ala Ala Gln Thr Ile Val Asn Arg Ile Ala Pro Val Pro Arg Gly
465 470 475 480
Asn Asn Thr Glu Asn Glu Glu Lys Trp Gly Gly Leu Tyr Val Ala Thr
485 490 495
His Ala Glu Val Ala His Gly Tyr Ala Arg Ile Lys Glu Gly Thr Gly
500 505 510
Glu Tyr Gly Leu Pro Thr Arg Ala Glu Arg Asp Ala Arg Gly Val Met
515 520 525
Leu Arg Val Tyr Ile Pro Arg Ala Ser Leu Glu Arg Phe Tyr Arg Thr
530 535 540
Asn Thr Pro Leu Glu Asn Ala Glu Glu His Ile Thr Gln Val Ile Gly
545 550 555 560
His Ser Leu Pro Leu Arg Asn Glu Ala Phe Thr Gly Pro Glu Ser Ala
565 570 575
Gly Gly Glu Asp Glu Thr Val Ile Gly Trp Asp Met Ala Ile His Ala
580 585 590
Val Ala Ile Pro Ser Thr Ile Pro Gly Asn Ala Tyr Glu Glu Leu Ala
595 600 605
Ile Asp Glu Glu Ala Val Ala Lys Glu Gln Ser Ile Ser Thr Lys Pro
610 615 620
Pro Tyr Lys Glu Arg Lys Asp Glu Leu Lys
625 630
<210> 2
<211> 1905
<212> ДНК
<213> Vibreo cholerae
<400> 2
atggtcgaag aagctttaaa catctttgat gaatgccgtt cgccatgttc gttgaccccg 60
gaaccgggta agccgattca atcaaaactg tctatcccta gtgatgttgt tctggatgaa 120
ggtgttctgt attactcgat gacgattaat gatgagcaga atgatattaa ggatgaggac 180
aaaggcgagt ccattatcac tattggtgaa tttgccacag tacgcgcgac tagacattat 240
gttaatcaag atgcgccttt tggtgtcatc catttagata ttacgacaga aaatggtaca 300
aaaacgtact cttataaccg caaagagggt gaatttgcaa tcaattggtt agtgcctatt 360
ggtgaagatt ctcctgcaag catcaaaatc tccgttgatg agctcgatca gcaacgcaat 420
atcatcgagg tgcctaaact gtatagtatt gatctcgata accaaacgtt agagcagtgg 480
aaaacccaag gtaatgtttc tttttcggta acgcgtcctg aacataatat cgctatctct 540
tggccaagcg tgagttacaa agcagcgcag aaagagggtt cacgccataa gcgttgggct 600
cattggcata caggcttagc actgtgttgg cttgtgccaa tggatgctat ctataactat 660
atcacccagc aaaattgtac tttaggggat aattggtttg gtggctctta tgagactgtt 720
gcaggcactc cgaaggtgat tacggttaag caagggattg aacaaaagcc agttgagcag 780
cgcatccatt tctccaaggg gaatgcgatg agcgcacttg ctgctcatcg cgtctgtggt 840
gtgccattag aaactttggc gcgcagtcgc aaacctcgtg atctgacgga tgatttatca 900
tgtgcctatc aagcgcagaa tatcgtgagt ttatttgtcg cgacgcgtat cctgttctct 960
catctggata gcgtatttac tctgaatctt gacgaacaag aaccagaggt ggctgaacgt 1020
ctaagtgatc ttcgccgtat caatgaaaat aacccgggca tggttacaca ggttttaacc 1080
gttgctcgtc agatctataa cgattatgtc actcaccatc cgggcttaac tcctgagcaa 1140
accagtgcgg gtgcacaagc tgccgatatc ctctctttat tttgcccaga tgctgataag 1200
tcttgtgtgg cttcaaacaa cgatcaagcc aatatcaaca tcgagtctcg ttctggccgt 1260
tcatatttgc ctgaaaaccg tgcggtaatc acccctcaag gcgtcacaaa ttggacttac 1320
caggaactcg aagcaacaca tcaagctctg actcgtgagg gttatgtgtt cgtgggttac 1380
catggtacga atcatgtcgc tgcgcaaacc atcgtgaatc gcattgcccc tgttccgcgc 1440
ggcaacaaca ctgaaaacga ggaaaagtgg ggcgggttat atgttgcaac tcacgctgaa 1500
gttgcccatg gttatgctcg catcaaagaa gggacagggg agtatggcct tccgacccgt 1560
gctgagcgcg acgctcgtgg ggtaatgctg cgcgtgtata tccctcgtgc ttcattagaa 1620
cgtttttatc gcacgaatac acctttggaa aatgctgagg agcatatcac gcaagtgatt 1680
ggtcattctt tgccattacg caatgaagca tttactggtc cagaaagtgc gggcggggaa 1740
gacgaaactg tcattggctg ggatatggcg attcatgcag ttgcgatccc ttcgactatc 1800
ccagggaacg cttacgaaga attggcgatt gatgaggagg ctgttgcaaa agagcaatcg 1860
attagcacaa aaccacctta taaagagcgc aaagatgaac ttaag 1905
<210> 3
<211> 386
<212> ПРТ
<213> Vibreo cholerae
<400> 3
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala
385
<210> 4
<211> 385
<212> ПРТ
<213> Vibreo cholerae
<400> 4
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln
385
<210> 5
<211> 384
<212> ПРТ
<213> Vibreo cholerae
<400> 5
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
<210> 6
<211> 383
<212> ПРТ
<213> Vibreo cholerae
<400> 6
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly
370 375 380
<210> 7
<211> 382
<212> ПРТ
<213> Vibreo cholerae
<400> 7
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala
370 375 380
<210> 8
<211> 381
<212> ПРТ
<213> Vibreo cholerae
<400> 8
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser
370 375 380
<210> 9
<211> 380
<212> ПРТ
<213> Vibreo cholerae
<400> 9
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr
370 375 380
<210> 10
<211> 379
<212> ПРТ
<213> Vibreo cholerae
<400> 10
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln
370 375
<210> 11
<211> 378
<212> ПРТ
<213> Vibreo cholerae
<400> 11
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu
370 375
<210> 12
<211> 377
<212> ПРТ
<213> Vibreo cholerae
<400> 12
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro
370 375
<210> 13
<211> 376
<212> ПРТ
<213> Vibreo cholerae
<400> 13
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr
370 375
<210> 14
<211> 375
<212> ПРТ
<213> Vibreo cholerae
<400> 14
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu
370 375
<210> 15
<211> 374
<212> ПРТ
<213> Vibreo cholerae
<400> 15
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly
370
<210> 16
<211> 373
<212> ПРТ
<213> Vibreo cholerae
<400> 16
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro
370
<210> 17
<211> 372
<212> ПРТ
<213> Vibreo cholerae
<400> 17
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His
370
<210> 18
<211> 371
<212> ПРТ
<213> Vibreo cholerae
<400> 18
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His
370
<210> 19
<211> 370
<212> ПРТ
<213> Vibreo cholerae
<400> 19
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr
370
<210> 20
<211> 369
<212> ПРТ
<213> Vibreo cholerae
<400> 20
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val
<210> 21
<211> 368
<212> ПРТ
<213> Vibreo cholerae
<400> 21
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
<210> 22
<211> 367
<212> ПРТ
<213> Vibreo cholerae
<400> 22
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp
355 360 365
<210> 23
<211> 366
<212> ПРТ
<213> Vibreo cholerae
<400> 23
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn
355 360 365
<210> 24
<211> 365
<212> ПРТ
<213> Vibreo cholerae
<400> 24
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr
355 360 365
<210> 25
<211> 364
<212> ПРТ
<213> Vibreo cholerae
<400> 25
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile
355 360
<210> 26
<211> 363
<212> ПРТ
<213> Vibreo cholerae
<400> 26
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln
355 360
<210> 27
<211> 362
<212> ПРТ
<213> Vibreo cholerae
<400> 27
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg
355 360
<210> 28
<211> 361
<212> ПРТ
<213> Vibreo cholerae
<400> 28
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala
355 360
<210> 29
<211> 360
<212> ПРТ
<213> Vibreo cholerae
<400> 29
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val
355 360
<210> 30
<211> 359
<212> ПРТ
<213> Vibreo cholerae
<400> 30
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr
355
<210> 31
<211> 358
<212> ПРТ
<213> Vibreo cholerae
<400> 31
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu
355
<210> 32
<211> 357
<212> ПРТ
<213> Vibreo cholerae
<400> 32
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val
355
<210> 33
<211> 356
<212> ПРТ
<213> Vibreo cholerae
<400> 33
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln
355
<210> 34
<211> 355
<212> ПРТ
<213> Vibreo cholerae
<400> 34
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr
355
<210> 35
<211> 354
<212> ПРТ
<213> Vibreo cholerae
<400> 35
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val
<210> 36
<211> 353
<212> ПРТ
<213> Vibreo cholerae
<400> 36
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met
<210> 37
<211> 352
<212> ПРТ
<213> Vibreo cholerae
<400> 37
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
<210> 38
<211> 351
<212> ПРТ
<213> Vibreo cholerae
<400> 38
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro
340 345 350
<210> 39
<211> 350
<212> ПРТ
<213> Vibreo cholerae
<400> 39
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn
340 345 350
<210> 40
<211> 349
<212> ПРТ
<213> Vibreo cholerae
<400> 40
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn
340 345
<210> 41
<211> 348
<212> ПРТ
<213> Vibreo cholerae
<400> 41
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu
340 345
<210> 42
<211> 425
<212> ПРТ
<213> Vibreo cholerae
<400> 42
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser Gly Arg Ser Tyr Leu Pro Glu Asn
420 425
<210> 43
<211> 424
<212> ПРТ
<213> Vibreo cholerae
<400> 43
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser Gly Arg Ser Tyr Leu Pro Glu
420
<210> 44
<211> 423
<212> ПРТ
<213> Vibreo cholerae
<400> 44
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser Gly Arg Ser Tyr Leu Pro
420
<210> 45
<211> 422
<212> ПРТ
<213> Vibreo cholerae
<400> 45
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser Gly Arg Ser Tyr Leu
420
<210> 46
<211> 421
<212> ПРТ
<213> Vibreo cholerae
<400> 46
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser Gly Arg Ser Tyr
420
<210> 47
<211> 420
<212> ПРТ
<213> Vibreo cholerae
<400> 47
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser Gly Arg Ser
420
<210> 48
<211> 419
<212> ПРТ
<213> Vibreo cholerae
<400> 48
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser Gly Arg
<210> 49
<211> 418
<212> ПРТ
<213> Vibreo cholerae
<400> 49
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser Gly
<210> 50
<211> 417
<212> ПРТ
<213> Vibreo cholerae
<400> 50
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser
<210> 51
<211> 416
<212> ПРТ
<213> Vibreo cholerae
<400> 51
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
<210> 52
<211> 415
<212> ПРТ
<213> Vibreo cholerae
<400> 52
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser
405 410 415
<210> 53
<211> 414
<212> ПРТ
<213> Vibreo cholerae
<400> 53
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu
405 410
<210> 54
<211> 413
<212> ПРТ
<213> Vibreo cholerae
<400> 54
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile
405 410
<210> 55
<211> 412
<212> ПРТ
<213> Vibreo cholerae
<400> 55
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn
405 410
<210> 56
<211> 411
<212> ПРТ
<213> Vibreo cholerae
<400> 56
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile
405 410
<210> 57
<211> 410
<212> ПРТ
<213> Vibreo cholerae
<400> 57
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn
405 410
<210> 58
<211> 409
<212> ПРТ
<213> Vibreo cholerae
<400> 58
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala
405
<210> 59
<211> 408
<212> ПРТ
<213> Vibreo cholerae
<400> 59
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln
405
<210> 60
<211> 407
<212> ПРТ
<213> Vibreo cholerae
<400> 60
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp
405
<210> 61
<211> 406
<212> ПРТ
<213> Vibreo cholerae
<400> 61
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn
405
<210> 62
<211> 405
<212> ПРТ
<213> Vibreo cholerae
<400> 62
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn
405
<210> 63
<211> 404
<212> ПРТ
<213> Vibreo cholerae
<400> 63
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser
<210> 64
<211> 403
<212> ПРТ
<213> Vibreo cholerae
<400> 64
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala
<210> 65
<211> 402
<212> ПРТ
<213> Vibreo cholerae
<400> 65
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val
<210> 66
<211> 401
<212> ПРТ
<213> Vibreo cholerae
<400> 66
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys
<210> 67
<211> 400
<212> ПРТ
<213> Vibreo cholerae
<400> 67
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
<210> 68
<211> 399
<212> ПРТ
<213> Vibreo cholerae
<400> 68
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys
385 390 395
<210> 69
<211> 398
<212> ПРТ
<213> Vibreo cholerae
<400> 69
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp
385 390 395
<210> 70
<211> 397
<212> ПРТ
<213> Vibreo cholerae
<400> 70
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala
385 390 395
<210> 71
<211> 396
<212> ПРТ
<213> Vibreo cholerae
<400> 71
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp
385 390 395
<210> 72
<211> 395
<212> ПРТ
<213> Vibreo cholerae
<400> 72
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro
385 390 395
<210> 73
<211> 394
<212> ПРТ
<213> Vibreo cholerae
<400> 73
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys
385 390
<210> 74
<211> 393
<212> ПРТ
<213> Vibreo cholerae
<400> 74
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe
385 390
<210> 75
<211> 392
<212> ПРТ
<213> Vibreo cholerae
<400> 75
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu
385 390
<210> 76
<211> 391
<212> ПРТ
<213> Vibreo cholerae
<400> 76
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser
385 390
<210> 77
<211> 390
<212> ПРТ
<213> Vibreo cholerae
<400> 77
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu
385 390
<210> 78
<211> 389
<212> ПРТ
<213> Vibreo cholerae
<400> 78
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile
385
<210> 79
<211> 388
<212> ПРТ
<213> Vibreo cholerae
<400> 79
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp
385
<210> 80
<211> 387
<212> ПРТ
<213> Vibreo cholerae
<400> 80
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala
385
<210> 81
<211> 633
<212> ПРТ
<213> Vibreo cholerae
<220>
<223> зрелый Cholix-токсин с делецией при аминокислотном остатке 581
<400> 81
Val Glu Asp Glu Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys Ser
1 5 10 15
Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile Pro
20 25 30
Ser Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr Ile
35 40 45
Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser Ile
50 55 60
Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr Val
65 70 75 80
Asn Gln Asp Ala Pro Phe Gly Val Ile His Leu Asp Ile Thr Thr Glu
85 90 95
Asn Gly Thr Lys Thr Tyr Ser Tyr Asn Arg Lys Glu Gly Glu Phe Ala
100 105 110
Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile Lys
115 120 125
Ile Ser Val Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val Pro
130 135 140
Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp Lys
145 150 155 160
Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn Ile
165 170 175
Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu Gly
180 185 190
Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu Cys
195 200 205
Trp Leu Val Pro Met Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln Asn
210 215 220
Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val Ala
225 230 235 240
Gly Thr Pro Lys Val Ile Thr Val Lys Gln Gly Ile Glu Gln Lys Pro
245 250 255
Val Glu Gln Arg Ile His Phe Ser Lys Gly Asn Ala Met Ser Ala Leu
260 265 270
Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg Ser
275 280 285
Arg Lys Pro Arg Asp Leu Thr Asp Asp Leu Ser Cys Ala Tyr Gln Ala
290 295 300
Gln Asn Ile Val Ser Leu Phe Val Ala Thr Arg Ile Leu Phe Ser His
305 310 315 320
Leu Asp Ser Val Phe Thr Leu Asn Leu Asp Glu Gln Glu Pro Glu Val
325 330 335
Ala Glu Arg Leu Ser Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro Gly
340 345 350
Met Val Thr Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp Tyr
355 360 365
Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly Ala
370 375 380
Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys Ser
385 390 395 400
Cys Val Ala Ser Asn Asn Asp Gln Ala Asn Ile Asn Ile Glu Ser Arg
405 410 415
Ser Gly Arg Ser Tyr Leu Pro Glu Asn Arg Ala Val Ile Thr Pro Gln
420 425 430
Gly Val Thr Asn Trp Thr Tyr Gln Glu Leu Glu Ala Thr His Gln Ala
435 440 445
Leu Thr Arg Glu Gly Tyr Val Phe Val Gly Tyr His Gly Thr Asn His
450 455 460
Val Ala Ala Gln Thr Ile Val Asn Arg Ile Ala Pro Val Pro Arg Gly
465 470 475 480
Asn Asn Thr Glu Asn Glu Glu Lys Trp Gly Gly Leu Tyr Val Ala Thr
485 490 495
His Ala Glu Val Ala His Gly Tyr Ala Arg Ile Lys Glu Gly Thr Gly
500 505 510
Glu Tyr Gly Leu Pro Thr Arg Ala Glu Arg Asp Ala Arg Gly Val Met
515 520 525
Leu Arg Val Tyr Ile Pro Arg Ala Ser Leu Glu Arg Phe Tyr Arg Thr
530 535 540
Asn Thr Pro Leu Glu Asn Ala Glu Glu His Ile Thr Gln Val Ile Gly
545 550 555 560
His Ser Leu Pro Leu Arg Asn Glu Ala Phe Thr Gly Pro Glu Ser Ala
565 570 575
Gly Gly Glu Asp Thr Val Ile Gly Trp Asp Met Ala Ile His Ala Val
580 585 590
Ala Ile Pro Ser Thr Ile Pro Gly Asn Ala Tyr Glu Glu Leu Ala Ile
595 600 605
Asp Glu Glu Ala Val Ala Lys Glu Gln Ser Ile Ser Thr Lys Pro Pro
610 615 620
Tyr Lys Glu Arg Lys Asp Glu Leu Lys
625 630
<210> 82
<211> 178
<212> ПРТ
<213> Homo sapiens
<400> 82
Met His Ser Ser Ala Leu Leu Cys Cys Leu Val Leu Leu Thr Gly Val
1 5 10 15
Arg Ala Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His
20 25 30
Phe Pro Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe
35 40 45
Ser Arg Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu
50 55 60
Leu Leu Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys
65 70 75 80
Gln Ala Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro
85 90 95
Gln Ala Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu
100 105 110
Gly Glu Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg
115 120 125
Phe Leu Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn
130 135 140
Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu
145 150 155 160
Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile
165 170 175
Arg Asn
<210> 83
<211> 177
<212> ПРТ
<213> Homo sapiens
<400> 83
Met Lys Leu Gln Cys Val Ser Leu Trp Leu Leu Gly Thr Ile Leu Ile
1 5 10 15
Leu Cys Ser Val Asp Asn His Gly Leu Arg Arg Cys Leu Ile Ser Thr
20 25 30
Asp Met His His Ile Glu Glu Ser Phe Gln Glu Ile Lys Arg Ala Ile
35 40 45
Gln Ala Lys Asp Thr Phe Pro Asn Val Thr Ile Leu Ser Thr Leu Glu
50 55 60
Thr Leu Gln Ile Ile Lys Pro Leu Asp Val Cys Cys Val Thr Lys Asn
65 70 75 80
Leu Leu Ala Phe Tyr Val Asp Arg Val Phe Lys Asp His Gln Glu Pro
85 90 95
Asn Pro Lys Ile Leu Arg Lys Ile Ser Ser Ile Ala Asn Ser Phe Leu
100 105 110
Tyr Met Gln Lys Thr Leu Arg Gln Cys Gln Glu Gln Arg Gln Cys His
115 120 125
Cys Arg Gln Glu Ala Thr Asn Ala Thr Arg Val Ile His Asp Asn Tyr
130 135 140
Asp Gln Leu Glu Val His Ala Ala Ala Ile Lys Ser Leu Gly Glu Leu
145 150 155 160
Asp Val Phe Leu Ala Trp Ile Asn Lys Asn His Glu Val Met Ser Ser
165 170 175
Ala
<210> 84
<211> 176
<212> ПРТ
<213> Homo sapiens
<400> 84
Met Lys Ala Ser Ser Leu Ala Phe Ser Leu Leu Ser Ala Ala Phe Tyr
1 5 10 15
Leu Leu Trp Thr Pro Ser Thr Gly Leu Lys Thr Leu Asn Leu Gly Ser
20 25 30
Cys Val Ile Ala Thr Asn Leu Gln Glu Ile Arg Asn Gly Phe Ser Glu
35 40 45
Ile Arg Gly Ser Val Gln Ala Lys Asp Gly Asn Ile Asp Ile Arg Ile
50 55 60
Leu Arg Arg Thr Glu Ser Leu Gln Asp Thr Lys Pro Ala Asn Arg Cys
65 70 75 80
Cys Leu Leu Arg His Leu Leu Arg Leu Tyr Leu Asp Arg Val Phe Lys
85 90 95
Asn Tyr Gln Thr Pro Asp His Tyr Thr Leu Arg Lys Ile Ser Ser Leu
100 105 110
Ala Asn Ser Phe Leu Thr Ile Lys Lys Asp Leu Arg Leu Cys His Ala
115 120 125
His Met Thr Cys His Cys Gly Glu Glu Ala Met Lys Lys Tyr Ser Gln
130 135 140
Ile Leu Ser His Phe Glu Lys Leu Glu Pro Gln Ala Ala Val Val Lys
145 150 155 160
Ala Leu Gly Glu Leu Asp Ile Leu Leu Gln Trp Met Glu Glu Thr Glu
165 170 175
<210> 85
<211> 179
<212> ПРТ
<213> Homo sapiens
<400> 85
Met Ala Ala Leu Gln Lys Ser Val Ser Ser Phe Leu Met Gly Thr Leu
1 5 10 15
Ala Thr Ser Cys Leu Leu Leu Leu Ala Leu Leu Val Gln Gly Gly Ala
20 25 30
Ala Ala Pro Ile Ser Ser His Cys Arg Leu Asp Lys Ser Asn Phe Gln
35 40 45
Gln Pro Tyr Ile Thr Asn Arg Thr Phe Met Leu Ala Lys Glu Ala Ser
50 55 60
Leu Ala Asp Asn Asn Thr Asp Val Arg Leu Ile Gly Glu Lys Leu Phe
65 70 75 80
His Gly Val Ser Met Ser Glu Arg Cys Tyr Leu Met Lys Gln Val Leu
85 90 95
Asn Phe Thr Leu Glu Glu Val Leu Phe Pro Gln Ser Asp Arg Phe Gln
100 105 110
Pro Tyr Met Gln Glu Val Val Pro Phe Leu Ala Arg Leu Ser Asn Arg
115 120 125
Leu Ser Thr Cys His Ile Glu Gly Asp Asp Leu His Ile Gln Arg Asn
130 135 140
Val Gln Lys Leu Lys Asp Thr Val Lys Lys Leu Gly Glu Ser Gly Glu
145 150 155 160
Ile Lys Ala Ile Gly Glu Leu Asp Leu Leu Phe Met Ser Leu Arg Asn
165 170 175
Ala Cys Ile
<210> 86
<211> 207
<212> ПРТ
<213> Homo sapiens
<400> 86
Met Asn Phe Gln Gln Arg Leu Gln Ser Leu Trp Thr Leu Ala Ser Arg
1 5 10 15
Pro Phe Cys Pro Pro Leu Leu Ala Thr Ala Ser Gln Met Gln Met Val
20 25 30
Val Leu Pro Cys Leu Gly Phe Thr Leu Leu Leu Trp Ser Gln Val Ser
35 40 45
Gly Ala Gln Gly Gln Glu Phe His Phe Gly Pro Cys Gln Val Lys Gly
50 55 60
Val Val Pro Gln Lys Leu Trp Glu Ala Phe Trp Ala Val Lys Asp Thr
65 70 75 80
Met Gln Ala Gln Asp Asn Ile Thr Ser Ala Arg Leu Leu Gln Gln Glu
85 90 95
Val Leu Gln Asn Val Ser Asp Ala Glu Ser Cys Tyr Leu Val His Thr
100 105 110
Leu Leu Glu Phe Tyr Leu Lys Thr Val Phe Lys Asn Tyr His Asn Arg
115 120 125
Thr Val Glu Val Arg Thr Leu Lys Ser Phe Ser Thr Leu Ala Asn Asn
130 135 140
Phe Val Leu Ile Val Ser Gln Leu Gln Pro Ser Gln Glu Asn Glu Met
145 150 155 160
Phe Ser Ile Arg Asp Ser Ala His Arg Arg Phe Leu Leu Phe Arg Arg
165 170 175
Ala Phe Lys Gln Leu Asp Val Glu Ala Ala Leu Thr Lys Ala Leu Gly
180 185 190
Glu Val Asp Ile Leu Leu Thr Trp Met Gln Lys Phe Tyr Lys Leu
195 200 205
<210> 87
<211> 171
<212> ПРТ
<213> Homo sapiens
<400> 87
Met Leu Val Asn Phe Ile Leu Arg Cys Gly Leu Leu Leu Val Thr Leu
1 5 10 15
Ser Leu Ala Ile Ala Lys His Lys Gln Ser Ser Phe Thr Lys Ser Cys
20 25 30
Tyr Pro Arg Gly Thr Leu Ser Gln Ala Val Asp Ala Leu Tyr Ile Lys
35 40 45
Ala Ala Trp Leu Lys Ala Thr Ile Pro Glu Asp Arg Ile Lys Asn Ile
50 55 60
Arg Leu Leu Lys Lys Lys Thr Lys Lys Gln Phe Met Lys Asn Cys Gln
65 70 75 80
Phe Gln Glu Gln Leu Leu Ser Phe Phe Met Glu Asp Val Phe Gly Gln
85 90 95
Leu Gln Leu Gln Gly Cys Lys Lys Ile Arg Phe Val Glu Asp Phe His
100 105 110
Ser Leu Arg Gln Lys Leu Ser His Cys Ile Ser Cys Ala Ser Ser Ala
115 120 125
Arg Glu Met Lys Ser Ile Thr Arg Met Lys Arg Ile Phe Tyr Arg Ile
130 135 140
Gly Asn Lys Gly Ile Tyr Lys Ala Ile Ser Glu Leu Asp Ile Leu Leu
145 150 155 160
Ser Trp Ile Lys Lys Leu Leu Glu Ser Ser Gln
165 170
<210> 88
<211> 224
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> последовательность вариабельной области тяжелой цепи антитела к TNF-альфа
<400> 88
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Arg Gly Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
<210> 89
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> последовательность вариабельной области легкой цепи антитела к TNF-альфа
<400> 89
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 90
<211> 126
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> последовательность вариабельной области тяжелой цепи антитела к TNF-альфа
<400> 90
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Ser Phe Asp Gly Ser Asn Lys Ser Ser Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Tyr Ser Arg Arg Asn Ser Lys Asn Ala Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Phe Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Val Ser Ala Gly Gly Asn Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 91
<211> 108
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> последовательность вариабельной области легкой цепи антитела к TNF-альфа
<400> 91
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Arg Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Leu
100 105
<210> 92
<211> 467
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность димерного слитого белка TNFR-p75-Fc человека
<400> 92
Leu Pro Ala Gln Val Ala Phe Thr Pro Tyr Ala Pro Glu Pro Gly Ser
1 5 10 15
Thr Cys Arg Leu Arg Glu Tyr Tyr Asp Gln Thr Ala Gln Met Cys Cys
20 25 30
Ser Lys Cys Ser Pro Gly Gln His Ala Lys Val Phe Cys Thr Lys Thr
35 40 45
Ser Asp Thr Val Cys Asp Ser Cys Glu Asp Ser Thr Tyr Thr Gln Leu
50 55 60
Trp Asn Trp Val Pro Glu Cys Leu Ser Cys Gly Ser Arg Cys Ser Ser
65 70 75 80
Asp Gln Val Glu Thr Gln Ala Cys Thr Arg Glu Gln Asn Arg Ile Cys
85 90 95
Thr Cys Arg Pro Gly Trp Tyr Cys Ala Leu Ser Lys Gln Glu Gly Cys
100 105 110
Arg Leu Cys Ala Pro Leu Arg Lys Cys Arg Pro Gly Phe Gly Val Ala
115 120 125
Arg Pro Gly Thr Glu Thr Ser Asp Val Val Cys Lys Pro Cys Ala Pro
130 135 140
Gly Thr Phe Ser Asn Thr Thr Ser Ser Thr Asp Ile Cys Arg Pro His
145 150 155 160
Gln Ile Cys Asn Val Val Ala Ile Pro Gly Asn Ala Ser Met Asp Ala
165 170 175
Val Cys Thr Ser Thr Ser Pro Thr Arg Ser Met Ala Pro Gly Ala Val
180 185 190
His Leu Pro Gln Pro Val Ser Thr Arg Ser Gln His Thr Gln Pro Thr
195 200 205
Pro Glu Pro Ser Thr Ala Pro Ser Thr Ser Phe Leu Leu Pro Met Gly
210 215 220
Pro Ser Pro Pro Ala Glu Gly Ser Thr Gly Asp Glu Pro Lys Ser Cys
225 230 235 240
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
245 250 255
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
260 265 270
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
275 280 285
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
290 295 300
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
305 310 315 320
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
325 330 335
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
340 345 350
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
355 360 365
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
370 375 380
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
385 390 395 400
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
405 410 415
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
420 425 430
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
435 440 445
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
450 455 460
Pro Gly Lys
465
<210> 93
<211> 39
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность пептида – агониста GLP-1 (эксенатида)
<400> 93
His Gly Glu Gly Thr Phe Thr Ser Asp Leu Ser Lys Gln Met Glu Glu
1 5 10 15
Glu Ala Val Arg Leu Phe Ile Glu Trp Leu Lys Asn Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser
35
<210> 94
<211> 33
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность пептида – агониста GLP-1 (лираглутида)
<400> 94
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Glu Phe Ile Ile Ala Trp Leu Val Lys Gly Arg
20 25 30
Gly
<210> 95
<211> 191
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> гормон роста человека (соматотропин)
<400> 95
Phe Pro Thr Ile Pro Leu Ser Arg Leu Phe Asp Asn Ala Met Leu Arg
1 5 10 15
Ala His Arg Leu His Gln Leu Ala Phe Asp Thr Tyr Gln Glu Phe Glu
20 25 30
Glu Ala Tyr Ile Pro Lys Glu Gln Lys Tyr Ser Phe Leu Gln Asn Pro
35 40 45
Gln Thr Ser Leu Cys Phe Ser Glu Ser Ile Pro Thr Pro Ser Asn Arg
50 55 60
Glu Glu Thr Gln Gln Lys Ser Asn Leu Glu Leu Leu Arg Ile Ser Leu
65 70 75 80
Leu Leu Ile Gln Ser Trp Leu Glu Pro Val Gln Phe Leu Arg Ser Val
85 90 95
Phe Ala Asn Ser Leu Val Tyr Gly Ala Ser Asp Ser Asn Val Tyr Asp
100 105 110
Leu Leu Lys Asp Leu Glu Glu Gly Ile Gln Thr Leu Met Gly Arg Leu
115 120 125
Glu Asp Gly Ser Pro Arg Thr Gly Gln Ile Phe Lys Gln Thr Tyr Ser
130 135 140
Lys Phe Asp Thr Asn Ser His Asn Asp Asp Ala Leu Leu Lys Asn Tyr
145 150 155 160
Gly Leu Leu Tyr Cys Phe Arg Lys Asp Met Asp Lys Val Glu Thr Phe
165 170 175
Leu Arg Ile Val Gln Cys Arg Ser Val Glu Gly Ser Cys Gly Phe
180 185 190
<210> 96
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 96
Gly Gly Gly Gly Ser
1 5
<210> 97
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 97
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 98
<211> 15
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 98
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 99
<211> 8
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 99
Gly Gly Gly Gly Ser Gly Gly Gly
1 5
<210> 100
<211> 4
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 100
Ala Ala Pro Phe
1
<210> 101
<211> 3
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 101
Gly Gly Phe
1
<210> 102
<211> 4
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 102
Ala Ala Pro Val
1
<210> 103
<211> 3
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 103
Gly Gly Leu
1
<210> 104
<211> 3
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 104
Ala Ala Leu
1
<210> 105
<211> 3
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 105
Phe Val Arg
1
<210> 106
<211> 3
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 106
Val Gly Arg
1
<210> 107
<211> 4
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> пептид
<400> 107
Arg Lys Pro Arg
1
<210> 108
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 5
<223> Xaa = Любая аминокислота
<400> 108
Tyr Val Ala Asp Xaa
1 5
<210> 109
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 2, 3, 5
<223> Xaa = Любая аминокислота
<400> 109
Asp Xaa Xaa Asp Xaa
1 5
<210> 110
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 2, 5
<223> Xaa = Любая аминокислота
<400> 110
Arg Xaa Asn Arg Xaa
1 5
<210> 111
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 2, 5
<223> Xaa = Любая аминокислота
<400> 111
Lys Xaa Asn Arg Xaa
1 5
<210> 112
<211> 6
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 6
<223> Xaa = Любая аминокислота
<400> 112
Glu Arg Thr Lys Arg Xaa
1 5
<210> 113
<211> 5
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 5
<223> Xaa = Любая аминокислота
<400> 113
Arg Val Arg Arg Xaa
1 5
<210> 114
<211> 6
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 6
<223> Xaa = Любая аминокислота
<400> 114
Asp Arg Val Arg Arg Xaa
1 5
<210> 115
<211> 6
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 2, 6
<223> Xaa = Любая аминокислота
<400> 115
Pro Xaa Trp Val Pro Xaa
1 5
<210> 116
<211> 4
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 4
<223> Xaa = Любая аминокислота
<400> 116
Trp Val Ala Xaa
1
<210> 117
<211> 4
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 1, 3, 4
<223> Xaa = Любая аминокислота
<400> 117
Xaa Phe Xaa Xaa
1
<210> 118
<211> 4
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 1, 3, 4
<223> Xaa = Любая аминокислота
<400> 118
Xaa Tyr Xaa Xaa
1
<210> 119
<211> 4
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<220>
<221> Вариант
<222> 1, 3, 4
<223> Xaa = Любая аминокислота
<400> 119
Xaa Trp Xaa Xaa
1
<210> 120
<211> 16
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 120
Asp Arg Tyr Ile Pro Phe His Leu Leu Val Ala Pro Tyr Ser Pro Ala
1 5 10 15
<210> 121
<211> 15
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Пептид
<400> 121
Gly Gly Gly Gly Ser Gly Gly Gly Glu Asn Leu Tyr Phe Gln Ser
1 5 10 15
<210> 122
<211> 590
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность слитой молекулы Cholix415-TEV-IL-10
<400> 122
Met Val Glu Glu Ala Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys
1 5 10 15
Ser Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile
20 25 30
Pro Gly Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr
35 40 45
Ile Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser
50 55 60
Ile Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr
65 70 75 80
Val Ser Gln Asp Ala Pro Phe Gly Val Ile Asn Leu Asp Ile Thr Thr
85 90 95
Glu Asn Gly Thr Lys Thr Tyr Ser Phe Asn Arg Lys Glu Ser Glu Phe
100 105 110
Ala Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile
115 120 125
Lys Ile Ser Ile Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val
130 135 140
Pro Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp
145 150 155 160
Lys Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn
165 170 175
Ile Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu
180 185 190
Gly Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu
195 200 205
Cys Trp Leu Val Pro Ile Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln
210 215 220
Asn Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val
225 230 235 240
Ala Gly Thr Pro Lys Ala Ile Thr Val Lys Gln Gly Ile Glu Gln Lys
245 250 255
Pro Val Glu Gln Arg Ile His Phe Ser Lys Lys Asn Ala Met Glu Ala
260 265 270
Leu Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg
275 280 285
Ser Arg Lys Pro Arg Asp Leu Pro Asp Asp Leu Ser Cys Ala Tyr Asn
290 295 300
Ala Gln Gln Ile Val Ser Leu Phe Leu Ala Thr Arg Ile Leu Phe Thr
305 310 315 320
His Ile Asp Ser Ile Phe Thr Leu Asn Leu Asp Gly Gln Glu Pro Glu
325 330 335
Val Ala Glu Arg Leu Asp Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro
340 345 350
Gly Met Val Ile Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp
355 360 365
Tyr Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly
370 375 380
Ala Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys
385 390 395 400
Ser Cys Val Ala Ser Asn Ser Asp Gln Ala Asn Ile Asn Ile Glu Ser
405 410 415
Gly Gly Gly Gly Ser Gly Gly Gly Glu Asn Leu Tyr Phe Gln Ser Pro
420 425 430
Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro Gly Asn
435 440 445
Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg Val Lys
450 455 460
Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu
465 470 475 480
Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser
485 490 495
Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala Glu Asn
500 505 510
Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu Asn Leu
515 520 525
Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu Pro Cys
530 535 540
Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe Asn Lys
545 550 555 560
Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe
565 570 575
Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
580 585 590
<210> 123
<211> 590
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> аминокислотная последовательность слитой молекулы Cholix415-(G4S)3-IL-10
<400> 123
Met Val Glu Glu Ala Leu Asn Ile Phe Asp Glu Cys Arg Ser Pro Cys
1 5 10 15
Ser Leu Thr Pro Glu Pro Gly Lys Pro Ile Gln Ser Lys Leu Ser Ile
20 25 30
Pro Gly Asp Val Val Leu Asp Glu Gly Val Leu Tyr Tyr Ser Met Thr
35 40 45
Ile Asn Asp Glu Gln Asn Asp Ile Lys Asp Glu Asp Lys Gly Glu Ser
50 55 60
Ile Ile Thr Ile Gly Glu Phe Ala Thr Val Arg Ala Thr Arg His Tyr
65 70 75 80
Val Ser Gln Asp Ala Pro Phe Gly Val Ile Asn Leu Asp Ile Thr Thr
85 90 95
Glu Asn Gly Thr Lys Thr Tyr Ser Phe Asn Arg Lys Glu Ser Glu Phe
100 105 110
Ala Ile Asn Trp Leu Val Pro Ile Gly Glu Asp Ser Pro Ala Ser Ile
115 120 125
Lys Ile Ser Ile Asp Glu Leu Asp Gln Gln Arg Asn Ile Ile Glu Val
130 135 140
Pro Lys Leu Tyr Ser Ile Asp Leu Asp Asn Gln Thr Leu Glu Gln Trp
145 150 155 160
Lys Thr Gln Gly Asn Val Ser Phe Ser Val Thr Arg Pro Glu His Asn
165 170 175
Ile Ala Ile Ser Trp Pro Ser Val Ser Tyr Lys Ala Ala Gln Lys Glu
180 185 190
Gly Ser Arg His Lys Arg Trp Ala His Trp His Thr Gly Leu Ala Leu
195 200 205
Cys Trp Leu Val Pro Ile Asp Ala Ile Tyr Asn Tyr Ile Thr Gln Gln
210 215 220
Asn Cys Thr Leu Gly Asp Asn Trp Phe Gly Gly Ser Tyr Glu Thr Val
225 230 235 240
Ala Gly Thr Pro Lys Ala Ile Thr Val Lys Gln Gly Ile Glu Gln Lys
245 250 255
Pro Val Glu Gln Arg Ile His Phe Ser Lys Lys Asn Ala Met Glu Ala
260 265 270
Leu Ala Ala His Arg Val Cys Gly Val Pro Leu Glu Thr Leu Ala Arg
275 280 285
Ser Arg Lys Pro Arg Asp Leu Pro Asp Asp Leu Ser Cys Ala Tyr Asn
290 295 300
Ala Gln Gln Ile Val Ser Leu Phe Leu Ala Thr Arg Ile Leu Phe Thr
305 310 315 320
His Ile Asp Ser Ile Phe Thr Leu Asn Leu Asp Gly Gln Glu Pro Glu
325 330 335
Val Ala Glu Arg Leu Asp Asp Leu Arg Arg Ile Asn Glu Asn Asn Pro
340 345 350
Gly Met Val Ile Gln Val Leu Thr Val Ala Arg Gln Ile Tyr Asn Asp
355 360 365
Tyr Val Thr His His Pro Gly Leu Thr Pro Glu Gln Thr Ser Ala Gly
370 375 380
Ala Gln Ala Ala Asp Ile Leu Ser Leu Phe Cys Pro Asp Ala Asp Lys
385 390 395 400
Ser Cys Val Ala Ser Asn Ser Asp Gln Ala Asn Ile Asn Ile Glu Ser
405 410 415
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Pro
420 425 430
Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro Gly Asn
435 440 445
Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg Val Lys
450 455 460
Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu
465 470 475 480
Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser
485 490 495
Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala Glu Asn
500 505 510
Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu Asn Leu
515 520 525
Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu Pro Cys
530 535 540
Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe Asn Lys
545 550 555 560
Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe
565 570 575
Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
580 585 590
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИВАЛЕТНЫЕ И ПОЛИСПЕЦИФИЧНЫЕ GITR-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2016 |
|
RU2753439C2 |
| КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С КОМПЛЕМЕНТОМ | 2019 |
|
RU2824402C2 |
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
| БИСПЕЦИФИЧНЫЙ СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2801528C2 |
| IL-12 ГЕТЕРОДИМЕРНЫЕ СЛИТЫЕ БЕЛКИ FC | 2019 |
|
RU2819097C2 |
| НОВЫЕ СЛИТЫЕ БЕЛКИ, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ CD137 И GPC3 | 2020 |
|
RU2814653C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746550C2 |
| Выделенная нуклеиновая кислота, которая кодирует слитый белок на основе FVIII-BDD и гетерологичного сигнального пептида, и ее применение | 2022 |
|
RU2818229C2 |
| КОМПОЗИЦИИ И СПОСОБЫ РЕДАКТИРОВАНИЯ ГЕНОВ | 2019 |
|
RU2804665C2 |
| ГЛИКОЗИЛИРОВАННЫЕ СЛИТЫЕ БЕЛКИ VWF С УЛУЧШЕННОЙ ФАРМАКОКИНЕТИКОЙ | 2017 |
|
RU2782212C2 |


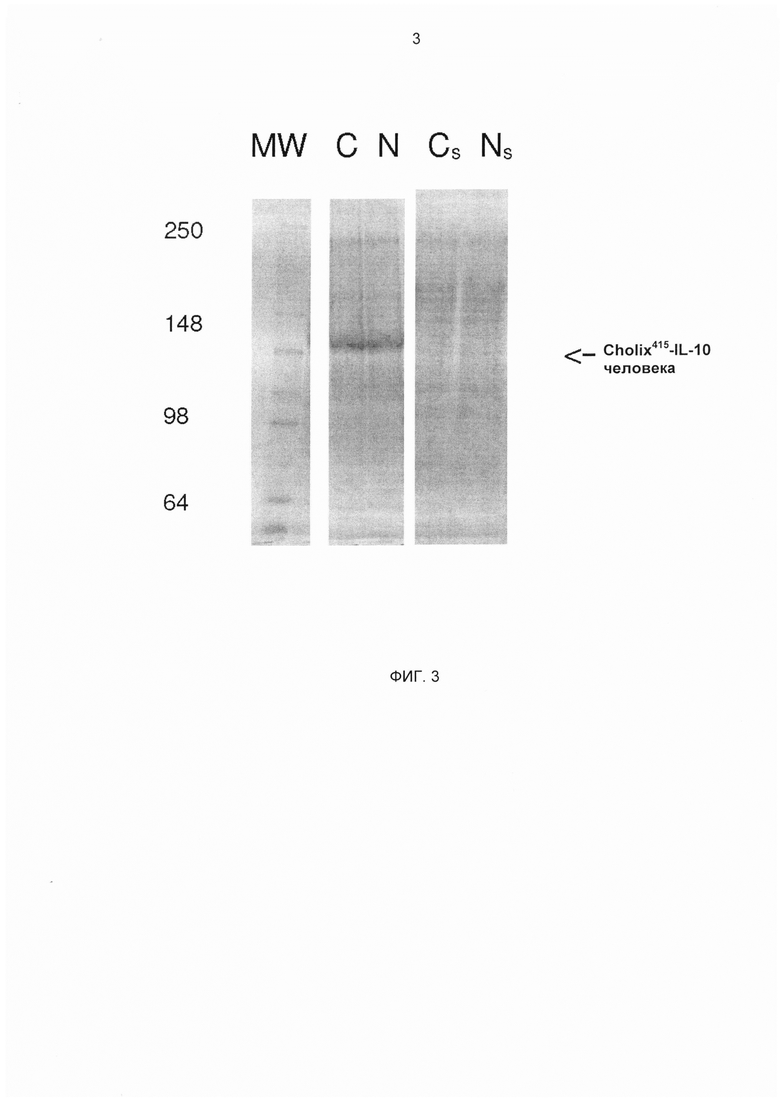

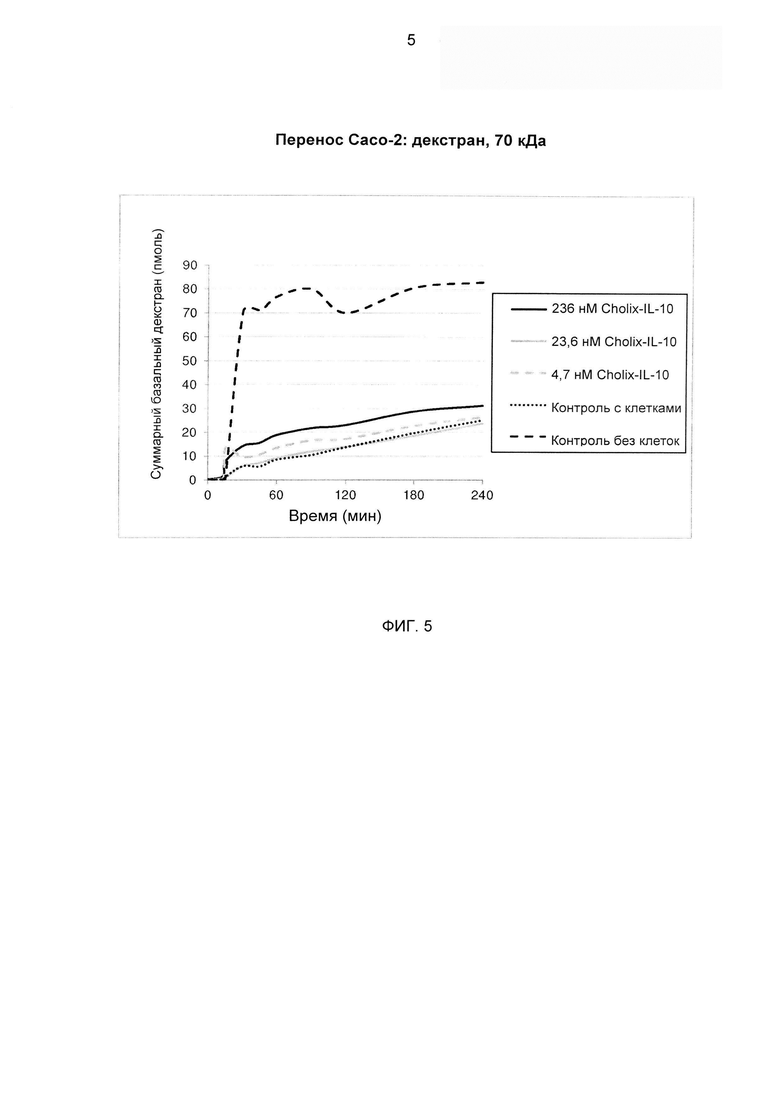

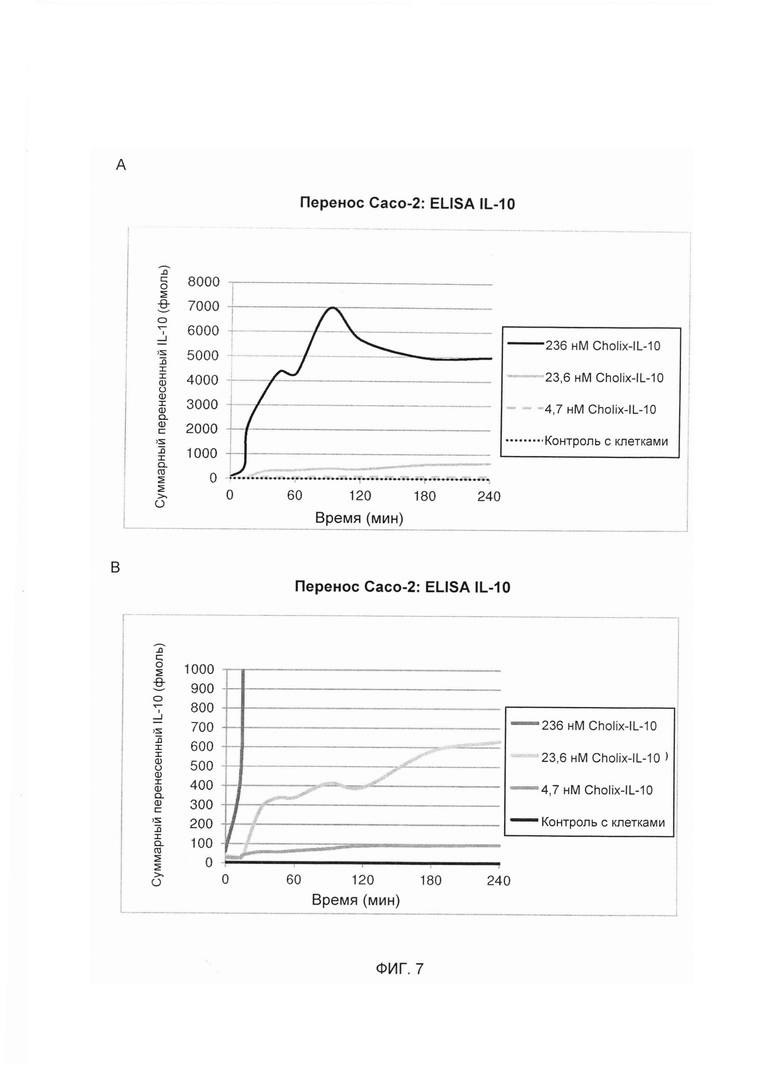
Настоящее изобретение относится к области биотехнологии, конкретно к фармацевтическим композициям, обладающим противовоспалительной активностью, и может быть использовано для доставки интерлейкина-10 субъекту, имеющему воспалительное заболевание. Композиция содержит слитую молекулу неприродного происхождения на основе Cholix-токсина, включающую интерлейкин-10 в качестве биологической нагрузки. Изобретение обеспечивает эффективность противовоспалительной композиции при пероральной доставке субъекту. 2 н. и 39 з.п. ф-лы, 7 ил., 7 табл., 11 пр.
1. Пероральная фармацевтическая композиция, обладающая противовоспалительной активностью, содержащая слитую молекулу неприродного происхождения в фармацевтически эффективном количестве, где слитая молекула содержит (1) полипептид, состоящий из аминокислотной последовательности, имеющей по меньшей мере 99% идентичность последовательности, представленной в SEQ ID NO: 1, или по меньшей мере 99% идентичность ее фрагменту, где фрагмент аминокислотной последовательности, представленной в SEQ ID NO: 1, состоит из аминокислотной последовательности, представленной в одной из SEQ ID NO: 3, 42, 52, 70 или 80, и где полипептид связан, непосредственно или через линкер, с (2) биологически активной нагрузкой, и где биологическая нагрузка представляет собой интерлейкин-10, состоящий из аминокислотной последовательности, имеющей по меньшей мере 90% идентичность последовательности, представленной в SEQ ID NO: 82, или ее фрагменту; и возможно включает (3) N-концевой метионин.
2. Пероральная фармацевтическая композиция по п. 1, приготовленная в твердой лекарственной форме для пероральной доставки.
3. Пероральная фармацевтическая композиция по п. 2, где твердая лекарственная форма представляет собой капсулу.
4. Пероральная фармацевтическая композиция по п. 2, где твердая лекарственная форма представляет собой таблетку.
5. Пероральная фармацевтическая композиция по п. 2, которая имеет энтеросолюбильное покрытие.
6. Пероральная фармацевтическая композиция по п. 1, которая содержит вплоть до 200 мг слитой молекулы.
7. Пероральная фармацевтическая композиция по п. 1, где полипептид состоит из аминокислотной последовательности, имеющей по меньшей мере 99% идентичность аминокислотной последовательности, представленной в SEQ ID NO: 3.
8. Пероральная фармацевтическая композиция по п. 1, где интерлейкин-10 состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность последовательности, представленной в SEQ ID NO: 82, или ее фрагменту.
9. Пероральная фармацевтическая композиция по п. 1, где интерлейкин-10 состоит из аминокислотной последовательности, имеющей по меньшей мере 99% идентичность последовательности, представленной в SEQ ID NO: 82, или ее фрагменту.
10. Пероральная фармацевтическая композиция по п. 1, где интерлейкин-10 состоит из аминокислотной последовательности, представленной в SEQ ID NO: 82, или ее фрагмента.
11. Пероральная фармацевтическая композиция по п. 1, где полипептид ковалентно связан с интерлейкином-10.
12. Пероральная фармацевтическая композиция по п. 1, где полипептид нековалентно связан с интерлейкином-10.
13. Пероральная фармацевтическая композиция по п. 1, где полипептид связан с интерлейкином-10 посредством линкера.
14. Пероральная фармацевтическая композиция по п. 13, где линкер содержит любую аминокислотную последовательность из SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98 или SEQ ID NO: 99.
15. Пероральная фармацевтическая композиция по п. 14, где линкер содержит аминокислотную последовательность SEQ ID NO: 97.
16. Пероральная фармацевтическая композиция по п. 1, где слитая молекула содержит N-концевой метионин.
17. Пероральная фармацевтическая композиция по п. 1, где интерлейкин-10 состоит из аминокислот 20-178 последовательности SEQ ID NO: 82.
18. Пероральная фармацевтическая композиция по п. 15, где линкер представляет собой SEQ ID NO: 98.
19. Пероральная фармацевтическая композиция по п. 1, где слитая молекула содержит N-концевой метионин, где полипептид состоит из аминокислотной последовательности, имеющей по меньшей мере 99% идентичность аминокислотной последовательности, представленной в SEQ ID NO: 3, где полипептид ковалентно связан с интерлейкином-10 посредством линкера, где линкер состоит из аминокислотной последовательности, представленной в SEQ ID NO: 98, и где интерлейкин-10 состоит из аминокислот 20-178 последовательности SEQ ID NO: 82.
20. Пероральная фармацевтическая композиция по п. 1, где слитая молекула образует гомодимер.
21. Способ доставки интерлейкина-10 субъекту, имеющему воспалительное заболевание, включающий пероральную доставку субъекту фармацевтической композиции, содержащей слитую молекулу, содержащую (1) полипептид, состоящий из аминокислотной последовательности, имеющей (a) по меньшей мере 99% идентичность аминокислотной последовательности, представленной в SEQ ID NO: 1, или (б) по меньшей мере 99% идентичность ее фрагменту, где фрагмент аминокислотной последовательности, представленной в SEQ ID NO: 1, состоит из аминокислотной последовательности, представленной в одной из SEQ ID NO: 3, 42, 52, 70 или 80, и где полипептид связан, непосредственно или через линкер, с (2) интерлейкином-10, состоящим из аминокислотной последовательности, имеющей по меньшей мере 90% идентичность аминокислотной последовательности, представленной в SEQ ID NO: 82, или ее фрагменту; и возможно включает (3) N-концевой метионин.
22. Способ по п. 21, где полипептид состоит из аминокислотной последовательности, имеющей по меньшей мере 99% идентичность аминокислотной последовательности, представленной в SEQ ID NO: 3.
23. Способ по п. 21, где интерлейкин-10 состоит из аминокислотной последовательности, имеющей по меньшей мере 95% идентичность последовательности, представленной в SEQ ID NO: 82, или ее фрагменту.
24. Способ по п. 21, где интерлейкин-10 состоит из аминокислотной последовательности, имеющей по меньшей мере 99% идентичность последовательности, представленной в SEQ ID NO: 82, или ее фрагменту.
25. Способ по п. 21, где интерлейкин-10 состоит из аминокислот 20-178 последовательности SEQ ID NO: 82.
26. Способ по п. 21, где полипептид ковалентно связан с интерлейкином-10.
27. Способ по п. 21, где полипептид нековалентно связан с интерлейкином-10.
28. Способ по п. 21, где полипептид связан с интерлейкином-10 посредством линкера.
29. Способ по п. 28, где линкер содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 96-99.
30. Способ по п. 29, где линкер содержит аминокислотную последовательность, представленную в SEQ ID NO: 97.
31. Способ по п. 29, где линкер содержит аминокислотную последовательность, представленную в SEQ ID NO: 98.
32. Способ по п. 21, где полипептид связан с интерлейкином-10 посредством расщепляемого линкера.
33. Способ по п. 32, где расщепляемый линкер содержит аминокислотную последовательность, представленную в одной из SEQ ID NO: 100-120.
34. Способ по п. 21, где слитая молекула дополнительно содержит N-концевой остаток метионина.
35. Способ по п. 21, где воспалительное заболевание представляет собой воспалительное заболевание кишечника.
36. Способ по п. 21, где воспалительное заболевание кишечника представляет собой язвенный колит.
37. Способ по п. 21, где фармацевтическую композицию вводят субъекту раз в сутки.
38. Способ по п. 21, где слитую молекулу вводят субъекту в суммарной суточной дозировке по меньшей мере 0,1 мг и максимум 350 мг.
39. Способ по п. 21, где фармацевтическая композиция приготовлена в виде таблетки или капсулы.
40. Способ по п. 39, где таблетка или капсула имеют энтеросолюбильное покрытие.
41. Способ по п. 21, где слитая молекула дополнительно содержит N-концевой метиониновый остаток, где полипептид состоит из аминокислотной последовательности, имеющей по меньшей мере 99% идентичность аминокислотной последовательности, представленной в SEQ ID NO: 3, где полипептид ковалентно связан с интерлейкином-10 посредством линкера, где линкер состоит из аминокислотной последовательности, представленной в SEQ ID NO: 98, и где интерлейкин-10 состоит из аминокислот 20-178 последовательности SEQ ID NO: 82.
| US 2013172229 A1, 04.07.2013 | |||
| WO 2012101235 A1, 02.08.2012 | |||
| US 2011250199 A1, 13.10.2011 | |||
| US 2008317761 A1, 25.12.2008 | |||
| US 2009148401 A1, 11.06.2009 | |||
| Приспособление к гидравлическому, производящему ошиновку колес, прессу для запрессовывания колец на ступицах колес крестьянского хода | 1928 |
|
SU12984A1 |
Авторы
Даты
2020-06-09—Публикация
2015-05-07—Подача