Изобретение относится к живой аттенуированной культуральной вакцине на основе вируса осповакцины и способам ее получения и применения и может быть использовано в медицине, в частности иммунологии, для специфической профилактики натуральной оспы и других ортопоксвирусных инфекций.
Натуральная оспа - одно из наиболее опасных и смертоносных, высоко контагиозных инфекционных заболеваний человека, а также единственное заболевание человека, которое было ликвидировано в результате кампании глобальной вакцинации и противоэпидемического надзора. Это достижение остается одним из величайших триумфов медицинской науки. Учитывая тяжелые поствакцинальные осложнения при использовании классической живой вакцины и подтверждение ликвидации натуральной оспы, в 1980 г. вакцинацию против данной инфекции Всемирная организация здравоохранения рекомендовала в дальнейшем не проводить [Wiser I., Balicer R.D., Cohena D. An update on smallpox vaccine candidates and their role in bioterrorism related vaccination strategies. // Vaccine. - 2007. - V. 25. - P. 976-984].
Угроза заражения человека вирусом натуральной оспы или близкородственными вирусами других видов рода Orthopoxvirus продолжает существовать. В настоящее время этот возбудитель заболевания рассматривается зарубежными экспертами в качестве одного из наиболее вероятных объектов применения в биотеррористических акциях [Henderson D.A., Inglesby T.V., Bartlett J.G., Ascher M.S., Eitzen E., Jahrling P.B., Hauer J., Layton M., McDade J., Osterholm M.T., O'Toole Т., Parker G., Perl Т., Russell P.K., Tonat K. Smallpox as a biological weapon: medical and public health management. Working Group on Civilian Biodefense. // JAMA. - 1999. - V. 281(22). - P. 2127-2137; Онищенко Г.Г., Сандахчиев Л.С., Нетесов C.B., Мартынюк Р.А. Биотерроризм: национальная и глобальная угроза. // Вестник Российской Академии Наук. - 2003. - Т. 73, №3. - С. 195-204]. Кроме этого, существует реальная угроза появления оспоподобного заболевания, о чем свидетельствуют многочисленные вспышки заболевания людей оспой обезьян (Центральная и Западная Африка), оспой буйволов (Индийский субконтинент), вакцинией (Южная Америка) [Маренникова С.С., Щелкунов С.Н. Патогенные для человека ортопоксвирусы. - M.: KMK Scientific Press Ltd., 1998. - 386 с.; Щелкунов С.Н., Щелкунова Г.А. Нужно быть готовыми к возврату оспы. // Вопросы вирусологии. - 2019. - Т. 64, №5. - С. 206-214]. Особую тревогу мирового сообщества вызывает распространение заболевания людей оспой обезьян по всем континентам, зафиксированное в мае-июне 2022 г. Ортопоксвирусные заболевания попадают в разряд возобновляющихся опасных инфекций.
Противооспенную вакцинацию с помощью живого вируса осповакцины (ВОВ) применяли во всем мире без единой общепринятой международной стандартизации вакцинных препаратов более 160 лет до начала глобальной программы по ликвидации оспы в 1958 г. когда были определены четкие критерии. За это время в мире использовали разнообразные штаммы ВОВ, различающиеся по пассажной истории, биологическим свойствам и тяжести побочных реакций.
Живая противооспенная вакцина первого поколения представляла собой препарат ВОВ, полученный размножением вируса на коже телят или других животных. В настоящее время в Российской Федерации противооспенная вакцина первого поколения, на основе штамма Л-ИВП, выпускается ФГУП «НПО «Микроген» Минздрава России [Перекрест В.В., Мовсесянц А.А., Мухачева А.В., Шевцов В.А., Шведов Д.В., Борисевич И.В. Препараты для специфической профилактики натуральной оспы, зарегистрированные в Российской Федерации. // Биопрепараты. - 2013. - №2. - С. 4-13]. В США от вакцины первого поколения, Dryvax, отказались более 10 лет назад. Используемая методика получения вакцинных препаратов не позволяет получать препарат ВОВ, надежно свободный от других инфекционных агентов, что может вносить свой вклад в наблюдаемые побочные эффекты противооспенной вакцины первого поколения.
Вакцины второго поколения с целью стандартизации методики получения и контроля возможной бактериальной и вирусной контаминации нарабатывают на линиях клеток млекопитающих и/или развивающихся куриных эмбрионах (РКЭ). В настоящее время в Российской Федерации противооспенная вакцина второго поколения «ТЭОВак», нарабатываемая на РКЭ, выпускается ФГБУ «48 ЦНИИ МО РФ».
В США с 2007 года производство противооспенной вакцины второго поколения АСАМ2000 осуществляется в биореакторах с бессывороточной средой на клеточной линии Vero на микроносителях. Для национального запаса США наработано 209 млн. доз этой вакцины. Следует отметить, что, несмотря на сниженную нейровирулентность вакцины АСАМ2000, среди вакцинируемых наблюдали высокие проценты побочных эффектов аналогичные использованию вакцины первого поколения Dryvax, включая развитие миокардита. Наблюдаемые побочные эффекты противооспенной вакцины второго поколения могут объясняться тем, что природные варианты ВОВ кодируют весь спектр факторов вирулентности, позволяющих вирусу снижать развитие иммунного ответа организма-хозяина, что приводит к повышенной вирусной нагрузке и возможности инфицировать органы, расположенные удаленно от места вакцинации, включая сердце и головной мозг.
Аттенуированные противооспенные вакцины третьего поколения создают в процессе множественных пассажей определенного штамма ВОВ в культуре клеток гетерологичного хозяина. Например, самая изученная противооспенная вакцина третьего поколения MVA получена в результате большого числа пассажей штамма Ankara ВОВ на культуре куриных фибробластов. В геноме штамма MVA возникли множественные мутации и протяженные делеции относительно ДНК исходного штамма BOB. MVA утратил способность формировать инфекционное потомство на большинстве культур клеток млекопитающих, включая клетки человека. В этих культурах клеток наблюдается экспрессия многих генов MVA, но образуются только незрелые вирионы. MVA сохранил свои иммуногенные свойства как противооспенная вакцина, но для достижения достаточного иммунного ответа необходимо вводить вирус в более высоких дозах по сравнению с классической вакциной и многократно [Sánchez-Sampedro L., Perdiguero В., Mejías-Pérez E., García-Arriaza J., Di Pilato M., Esteban M. The evolution of poxvirus vaccines. // Viruses. - 2015. - V. 7(4). - P 1726-1803].
К настоящему времени вакцина на основе штамма MVA (Imvanex/Imvamune) прошла многочисленные клинические испытания, включая пациентов с атопическим дерматитом и ВИЧ-инфицированных. Показана индукция профиля антител аналогичного профилю, индуцируемому классической вакциной первого поколения, и продемонстрирована защита от зоонозных ортопоксвирусов на различных видах лабораторных животных. Imvanex/Imvamune лицензирована в странах Европы, Канаде и США, и, прежде всего, предназначена для первичной вакцинации пациентов с противопоказаниями к противооспенным вакцинам первого и второго поколений.
Противооспенная вакцина третьего поколения LC16m8, лицензированная в Японии, была получена на основе ВОВ штамм Lister путем множественных пассажей на первичной культуре клеток почки кролика при пониженной температуре (30°С). Клинические исследования показали значительное снижение побочных эффектов в сравнении с традиционной вакциной на основе штамма Lister. В клоновом варианте VAC LC16m8 аттенуация обусловлена однонуклеотидной делецией в гене B5R, кодирующем белок оболочки внеклеточных вирионов, приводящей к сбою рамки трансляции этого белка. LC16m8 продуцирует в клетках млекопитающих инфекционные вирусные частицы, но со сниженной способностью к распространению как в культурах клеток, так и в инфицированном/вакцинированном организме. LC16m8 является менее аттенуированной по сравнению с MVA, но репликативно компетентной вакциной [Sánchez-Sampedro L., Perdiguero В., Mejías-Pérez E., García-Arriaza J., Di Pilato M., Esteban M. The evolution of poxvirus vaccines. // Viruses. - 2015. - V. 7(4). - P 1726-1803; Albarnaz J.D., Torres A.A. and Smith G.L. Modulating Vaccinia Virus Immunomodulators to Improve Immunological Memory. // Viruses. - 2018. - V. 10. - P. 101-134]. Показана сравнимая с родительским штаммом Lister протективная эффективность LC16m8 в экспериментах на различных животных моделях.
В Российской Федерации противооспенных вакцин третьего поколения нет. Новый подход к получению аттенуированных противооспенных вакцин четвертого поколения состоит во введении методами генетической инженерии направленных делеций/инсерций, нарушающих гены, контролирующие защитные реакции организма против вирусной инфекции, круг чувствительных хозяев вируса и др.
Известен рекомбинантный штамм Copenhagen BOB NYVAC и вакцина NYVAC против оспы на его основе (международная заявка № W092/15672, МПК C12N 7/00, опубл. 17.09.1992 г.), разработанные компанией Virogenetics Corporation (США). В этот штамм ВОВ были введены делеции по шести областям генома патогена через рекомбинацию специально созданных плазмид с вирусным геномом. Вакцина против натуральной оспы содержит штамм ВОВ с делециями по шести областям генома патогена и носитель, представляющий собой стабилизатор лиофилизации, содержащий смесь аминокислот. Однако в рекомбинантном штамме, наряду с делециями индивидуальных генов, произошло нарушение еще 12 генов вируса, что привело к снижению способности ВОВ реплицироваться на разных линиях человеческих клеток, снижая, тем самым, его технологические возможности при производстве вакцины. Последующие исследования показали, что штамм NYVAC индуцирует у человека значительно более низкий противооспенный иммунитет в сравнении с классической вакциной на основе штамма Lister или Dryvax, включая невозможность индуцировать А27-специфичные антитела, необходимые для эффективной нейтрализации преобладающей инфекционной формы ВОВ - внутриклеточного зрелого вируса. В итоге, комбинация генов вирулентности в рекомбинантном штамме отличается от заявляемого технического решения. Кроме того, этот мутантный штамм ВОВ и вакцина на ее основе не аттестованы и не используются для производства противооспенной вакцины.
Наиболее близким аналогом (прототипом) является вакцина против натуральной оспы на основе аттенуированного вируса осповакцины и способ получения указанной вакцины против натуральной оспы с использованием культуры клеток (международная заявка WO 2008072903, МПК А61К 39/42, опубл. 19.06.2008 г.). Способ получения противооспенной вакцины в форме аттенуированного ВОВ, включает:
• получение монослоя клеток, полученных от человека, с конфлюэнтностью от 80 до 100%;
• инокуляцию в клетки MRC-5, полученные от человека, аттенуированного ВОВ штамм NYCBOH (Нью-Йоркский совет здравоохранения - NYCBOH), полученный из CJ-основного банка вирусов MVB-SPX, с множественностью заражения от 0,001 до 0,1;
• культивирование инфицированных клеток MRC-5 в бессывороточной среде для пролиферации аттенуированного ВОВ при температуре +37°С в течение 46-48 часов;
• замораживание и оттаивание клеток MRC-5, выделенных из культуры, и обработку полученного продукта ультразвуком для высвобождения и выделения аттенуированного ВОВ;
• концентрирование полученной вирусной суспензии путем центрифугирования;
• введение в очищенную вируссодержащую суспензию стабилизирующего состава в виде водного раствора натрия хлорида, калия хлорида, (NaHPO4)12(HO2), сахарозы, желатина, желатина гидролизованного, L-глутамата натрия и тринатриевой соли ЭДТА;
• лиофильную сушку полученной смеси указанных компонентов с получением вакцины в сухой форме.
Вакцина-прототип против оспы в сухой лиофилизированной форме включает аттенуированный ВОВ штамм NYCBOH, полученный с использованием выше указанного способа, и стабилизирующую добавку. Зарубежная вакцина-прототип и способ ее получения созданы на основе аттенуированного штамма NYCBOH ВОВ.
Техническим результатом заявляемого изобретения является расширение номенклатуры живых более высокоаттенуированных и безопасных вакцин против натуральной оспы и других ортопоксвирусных инфекций человека с высокой иммуногенной и протективной активностью на основе отечественного аттестованного рекомбинантного штамма VACΔ6 ВОВ с шестью направленно нарушенными генами вирулентности, нарабатываемого на аттестованной перевиваемой культуре клеток 4647 почки африканской зеленой мартышки.
В России в ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора в рамках разработки противооспенной вакцины четвертого поколения на основе штамма Л-ИВП ВОВ последовательным введением направленных делеций/инсерций создан рекомбинантный штамм VACΔ6 с нарушением шести генов вирулентности, кодирующих гемагглютинин (A56R), γ-интерферонсвязывающий белок (B8R), тимидинкиназу (J2R), комплементсвязывающий белок (C3L), Bcl-2-подобный ингибитор апоптоза (N1L) и ингибитор презентации антигенов главным комплексом гистосовместимости класса II (A35R), депонированный в государственной коллекции ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным № V-696 (патент РФ №2621868, опубл. 07.06.2017 г.).
На основе данного штамма Л-ИВП с шестью нарушенными генами вирулентности (C3L/N1L/J2R/A35R/A56R/B8R) разработана кандидатная вакцина против натуральной оспы и других ортопоксвирусных инфекций живая культуральная (вакцина ОртопоксВак), которая представляет собой лиофилизат для приготовления раствора для внутрикожного введения (рабочее наименование вакцины «Вакцина VACΔ6»).
Указанный выше технический результат достигается созданием живой аттенуированной культуральной вакцины для профилактики натуральной оспы и других ортопоксвирусных инфекций, содержащая аттенуированный вирус осповакцины и стабилизатор, включающий сахарозу, желатин и натрия хлорид, согласно изобретению, стабилизатор дополнительно содержит пептон из сои, а в качестве аттенуированного ВОВ вакцина содержит рекомбинантный штамм VACΔ6 ВОВ с шестью нарушенными генами вирулентности C3L, N1L, J2R, A35R, A56R и B8R, депонированный в государственной коллекции ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным № V-696, при следующем содержании указанных компонентов готовой формы препарата после лиофильной сушки, масс. %:
• пептон из сои - 30,3,
• сахароза - 30,3,
• желатин - 30,3,
• смесь лиофилизата рекомбинантного штамма VACΔ6 ВОВ с титром около 107 оспинообразующих единиц (ООЕ) и натрия хлорида - 9,1.
Указанный технический результат достигается также созданием способа получения живой аттенуированной культуральной вакцины для профилактики натуральной оспы и других ортопоксвирусных инфекций, включающего заражение монослоя культуры клеток смесью питательной среды с посевным материалом аттенуированного ВОВ, инкубирование вируса в клеточном монослое в бессывороточной питательной среде при температуре +37°С до получения примерно 100%-ного цитопатического эффекта (ЦПД), замораживание полученной вируссодержащей суспензии на стадии ее сбора и накопления, очистку и концентрирование полученной вирусной суспензии путем обработки ее ультразвуком и центрифугированием, введение в очищенную вируссодержащую суспензию стабилизирующего состава в виде водного раствора натрия хлорида, сахарозы и желатина и лиофильную сушку полученной смеси указанных компонентов с получением вакцины в сухой форме. Согласно изобретению, в качестве аттенуированного ВОВ используют рекомбинантный штамм VACΔ6 ВОВ с шестью нарушенными генами вирулентности (C3L, N1L, J2R, A35R, A56R и B8R), депонированный в государственной коллекции ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным № V-696, в качестве культуры клеток для наработки вируса используют перевиваемую линию клеток 4647 почки африканской зеленой мартышки, а в качестве бессывороточной питательной среды используют среду ДМЕМ, содержащую дополнительно 10 ед./мл бензоназы эндонуклеазы и 1,5 mM MgCl2, причем стабилизирующий состав дополнительно содержит пептон из сои, а в полученную очищенную вируссодержащую суспензию вводят стерильный инфузионный физиологический раствор NaCl и компоненты стабилизирующего состава из расчета 27,6 мл 25% водного раствора желатина, 27,6 мл 25% водного раствора пептона и 13,7 мл 50% водного раствора сахарозы на 160 мл инфузионного физиологического раствора натрия хлорида с получением титра вируссодержащей суспензии не менее 5*107 бляшкообразующих единиц (БОЕ)/мл при следующем содержании указанных компонентов вакцины VACΔ6 по п. 1 перед лиофильной сушкой:
• пептон из сои - 0,006 г/0,2 мл,
• сахароза - 0,006 г/0,2 мл,
• желатин - 0,006 г/0,2 мл,
• суспензия рекомбинантного штамма VACΔ6 ВОВ с титром около 108 ООЕ в инфузионном физиологическом растворе натрия хлорида - остальное до 0,2 мл.
Бензоназа эндонуклеазы (бензонуклеаза) гидролизует как ДНК, так и РНК (одноцепочечные, двухцепочечные, линейные и кольцевые), поэтому фермент эффективен для очистки вирусных вакцин от примесей нуклеиновый кислот клеточной культуры 4647. Для улучшения условий функционирования фермента добавляют 1,5 mM MgCl2.
Указанный технический результат достигается также разработкой способа применения живой аттенуированной культуральной вакцины для профилактики натуральной оспы и других ортопоксвирусных инфекций, согласно изобретению, для вакцинации используют лиофилизированную вакцину, имеющую состав по п. 1 и полученную в соответствии со способом по п. 2 на основе рекомбинантного штамма VACΔ6 ВОВ с шестью нарушенными генами вирулентности C3L, N1L, J2R, A35R, A56R, B8R, которую приготавливают следующим образом:
- при однократной схеме вакцинации одну дозу препарата в количестве около 107 ООЕ растворяют в 0,2 мл воды для инъекций или раствора натрия хлорида для инфузий в течение 3 мин, слегка встряхивают и наполняют инсулиновый шприц в объеме 0,2 мл с титром около 107 ООЕ;
- при двукратной схеме вакцинации содержимое ампулы - 10 доз - в количестве около 107 ООЕ растворяют в 2,0 мл воды для инъекций или раствора натрия хлорида для инфузий в течение 3 мин, слегка встряхивают и наполняют инсулиновый шприц в объеме 0,2 мл с титром около 106 ООЕ.
Препарат вводят внутрикожно в верхнюю треть наружной поверхности плеча в область дельтовидной мышцы по следующим схемам:
- однократная вакцинация: внутрикожное введение препарата в дозе 1×107 ООЕ;
- двукратная вакцинация: внутрикожное введение препарата в дозе 1×106 ООЕ с интервалом 28 дней; причем вакцину вводят в разовой дозе 0,2 мл взрослым в возрасте от 18 до 60 лет.
Изобретение иллюстрируется следующими графическими материалами. На фиг. 1 представлена динамика гибели животных при разных путях иммунизации их штаммом VACΔ6 ВОВ после заражения мышей вирусом эктромелии (ВЭ) в дозе 140 ЛД50. На фиг. 2 приведены уровни вируснейтрализующих антител при разных способах иммунизации мышей штаммом VACΔ6 ВОВ. На фиг. 3 изображена динамика гибели мышей-сосунков, интрацеребрально инфицированных вакцинным штаммом VACΔ6 ВОВ (группы VACΔ6-1, VACΔ6-2, VACΔ6-3) в сравнении с отраслевым стандартным образцом (ОСО) оспенной вакцины в дозе 102 БОЕ/мышь. На фиг. 4 приведены среднегеометрические значения титров ВОВ в мозге мышей-сосунков на 3 сут после интрацеребрального заражения вакцинным штаммом VACΔ6 (группы VACΔ6-1, VACΔ6-2, VACΔ6-3) в дозе 102 БОЕ/мл в сравнении с инфекцией в той же дозе ОСО оспенной вакцины (данные приведены в виде среднего значения log10 БОЕ/г органа ± стандартное отклонение). На фиг. 5 представлены обратные титры антител, нейтрализующих образование 50% бляшек (БНТ50) ВОВ штамм Л-ИВП на культуре клеток Vera, после иммунизации кроликов вакциной VACΔ6 однократно в дозе 107 или двукратно в дозе 106 БОЕ, а также ОСО оспенной вакцины в дозе 107 БОЕ. Указано время взятия сывороток крови после начала иммунизации. На фиг. 6 приведены обратные титры антител, нейтрализующих образование 50% бляшек (БНТ50) вируса натуральной оспы (ВНО) штаммы Ind-3а (А) или Butler (Б) на культуре клеток Vero, после иммунизации кроликов вакциной VACΔ6 однократно в дозе 107 или двукратно в дозе 106 БОЕ, а также ОСО оспенной вакцины в дозе 107 БОЕ. Указано время взятия сывороток крови после начала иммунизации.
Пример 1. Способ получения живой аттенуированной культуральной вакцины для профилактики натуральной оспы и других ортопоксвирусных инфекций.
Конструирование мутантного варианта ВОВ. В работе был использован ранее полученный штамм 1421ABJCN ВОВ с последовательно нарушенными пятью генами (C3L, N1L, J2R, A56R и B8R), что было достигнуто разработкой и использованием плазмид интеграции pΔC3L, pΔN1L, pΔJ2R, pΔA56R, pΔB8R, а также применением методики временной доминантной селекции [Якубицкий С.Н., Колосова И.В., Максютов Р.А., Щелкунов С.Н. Аттенуация вируса осповакцины. // Acta Naturae. - 2015. - №27. - С. 125-134]. Штамм 1421ABJCN ВОВ депонирован в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным № V-653 и имеет патентную защиту (патент РФ №2588388, опубл. 27.06.2016 г.).
Для получения варианта ВОВ с делецией дополнительного, шестого гена A35R также была использована методика временной доминантной селекции. Для этого была проведена серия экспериментов по трансфекции зараженных ВОВ штамм 1421ABJCN клеток CV-1 (перевиваемая культура клеток почки африканской зеленой мартышки) плазмидой интеграции pΔA35R. После четырех пассажей в условиях селекции, вирус был клонирован под агарозным покрытием методом бляшек. Далее выделенные клоны предполагаемых делеционных мутантов были подращены в неселективных условиях и реклонированы. После проведенных процедур была выделена ДНК реклонов и проводен их анализ методом ПЦР. Были выявлены реклоны, полученные фрагменты которых показали соответствие длин теоретически расчетным. Далее был отобран стабильно реплицирующийся реклон, который был наработан, расфасован на отдельные аликвоты, оттитрован методом бляшек, заморожен и использован для дальнейшей работы.
Таким образом, был получен аттенуированный ВОВ штамм Л-ИВП с шестью нарушенными генами вирулентности: делеции генов C3L, N1L, A35R, A56R, B8R и встройка в ген J2R - VACΔ6. Штамм депонирован в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным № V-696 от 26.10.2015 г. и имеет патентную защиту (патент РФ №2621868, опубл. 07.06.2017 г.).
Культура клеток. Для работ с вирусом была использована культура клеток 4647 (коллекционный шифр ФБУН ГНЦ ВБ «Вектор» №184). В коллекцию ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора линия клеток 4647 (перевиваемая линия клеток почки африканской зеленой мартышки) поступила в апреле 1987 г. из коллекции Института полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН.
Посевной и рабочий банки культуры клеток 4647 аттестованы ГИСК им. Л.А. Тарасевича в соответствии с требованиями РД 42-28-10-89 и рекомендованы для приготовления и производства профилактических МИБП (протокол №14 от 28.10.03 г. заседания Ученого Совета ГИСК им. Л.А. Тарасевича; протокол №9 от 20.11.03 г. Комитета МИБП).
Для наработки культуры клеток 4647 используют ростовую питательную среду, состоящую из питательной среды ДМЕМ, 10% эмбриональной сыворотки коров и 100 мкг/мл гентамицина. Рассев и частоту пассирования производят согласно паспорту [Радаева И.Ф., Нечаева Е.А., Дроздов И.Г. Коллекция культур клеток ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора. -Новосибирск: Издательство «ЦЭРИС», 2009 г. - 251 с.].
Клеточная культура должна удовлетворять следующим требованиям: среда роста прозрачна, клетки образуют монослой на 3-4 сутки культивирования, границы клеток различимы, отсутствует ярко выраженная зернистость в клетках, клетки имеют морфологию, типичную для данной культуры.
Вакцинный штамм. Для производства вакцинного штамма ВОВ VACΔ6 был использован штамм VACΔ6 (регистрационный № V-696). Наработка вируса была проведена на культуре клеток 4647 в поддерживающей среде, состоящей из питательной среды ДМЕМ, 2% эмбриональной сыворотки коров и 100 мкг/мл гентамицина с множественностью заражения 0,1 БОЕ/кл. Вирус растили 48-72 ч до достижения полного ЦПД, трехкратным замораживанием-размораживанием получали криолизат, очищали и концентрировали центрифугированием, смешивали со стабилизатором, ампулировали, лиофильно высушивали и хранили при минус (75±5)°С [Вирусология. Методы. / Под ред. Б. Мейхи. - М.: Мир, 1988 г. - 298 с.].
Вакцинный штамм вируса осповакцины VACΔ6 депонирован в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» под регистрационным № V-812 от 10.09.2015 г. с инфекционным титром (1,03±0,29)*107 БОЕ/ампула.
Производственный штамм. Для получения производственного штамма BOB VACΔ6 был использован вакцинный штамм (регистрационный № V-812). Производство вируса было проведено по выше указанной схеме для вакцинного штамма. Штамм депонирован в Государственной коллекции возбудителей вирусных инфекций, риккетсиозов ФБУН ГНЦ ВБ «Вектор» под регистрационным № V-849 от 27.05.2016 г. с инфекционным титром (8,53±0,38)*106 БОЕ/ампула.
Посевной материал Вакцины VACΔ6. Для получения посевного материала Вакцины VACΔ6 был использован производственный штамм (регистрационный № V-849), которым инфицировали монослой культуры клеток 4647 с множественностью заражения 0,1 БОЕ/кл., и нарабатывали вирус в питательной среде ДМЕМ в течение 48-72 ч до достижения полного ЦПД. Затем двухкратным замораживанием-размораживанием получали криолизат вирусного материала, обрабатывали его с помощью ультразвукового гомогенизатора мощностью 20 кГц в течение 20 с на льду, расфасовывали по 10 мл в стеклянные флаконы, которые закрывали резиновыми медицинскими пробками, укупоривали алюминиевыми колпачками и закатывали. Посевной материал Вакцины VACΔ6 хранили при минус (75±5)°С.
Получение готовой лекарственной формы (ГЛФ) вакцины VACΔ6.
Для получения ГЛФ Вакцины VACΔ6 была использована питательная среда ДМЕМ, в которую была добавлена бензоназа эндонуклеаза (бензонуклеаза) в концентрации 10 ед./мл для достижения минимального уровня остаточной клеточной ДНК в конечном препарате. Бензонуклеаза гидролизует как ДНК, так и РНК (одноцепочечные, двухцепочечные, линейные и кольцевые) и не имеет протеолитической активности. Для оптимальной работы бензонуклеазы в среду дополнительно был введен 1,5 mM MgCl2. Для инфицирования монослоя культуры клеток 4647 был использован посевной материал Вакцины VACΔ6.
Наработка BOB VACΔ6. Для производства серии препарата объемом около 1000 ампул требуется 100 культуральных флаконов с ростовой площадью 150 см2 со сформировавшимся 90-100% монослоем клеточной культуры 4647.
Из культуральных флаконов сливали кондиционную среду, а клеточный монослой перед заражением отмывали 4-6 раз питательной среды ДМЕМ в объеме 20 мл/культуральный флакон/отмывка. Затем в культуральные флаконы вносили по 29 мл поддерживающей питательной среды, состоящей из питательной среды ДМЕМ с 10 ед./мл бензонуклеазы и дополнительным 1,5 mM MgCl2, и по 1 мл посевного материала вакцины VACΔ6. Культивирование вируса проводили в термостате при (36±0,5)°С в течение 48-72 ч до появления полного ЦПД.
Вирусную суспензию, полученную в культуральных флаконах, помещали в морозильную камеру при минус 18°С на 1-2 ч. Далее культуральные флаконы с замороженным вирусным материалом помещали в термостат при температуре 37°С на 10-15 мин. Повторяли вышеуказанные операции еще раз. Полученные криолизаты вирусного материала (суммарно около 3000 мл) объединяли по 1000 мл и за один этап очистки вируса работали с данным объемом, впоследствии обрабатывая весь объем вируссодержащей жидкости.
Очистка BOB VACΔ6. Объединенный криолизат (около 1000 мл) обрабатывали с помощью ультразвукового гомогенизатора мощностью 20 кГц в течение 30 с на льду. Далее в 1/3 от общего объема вирусной суспензии проводили осаждение клеточного дебриса в центрифуге при частоте вращения ротора 5000 об./мин и температуре 4°С в течение 15 мин. Полученный супернатант переливали в другие центрифужные стаканы, а осадок клеточного дебриса растворяли в новой порции 1/3 от общего объема вирусной суспензии, обрабатывали с помощью ультразвукового гомогенизатора мощностью 16 кГц в течение 30 с на льду и проводили осаждение клеточного дебриса как описано выше. Повторяли процедуру для оставшейся 1/3 от общего объема вирусной суспензии.
Полученные надосадочные жидкости объединяли, а «общий» осадок растворяли в 100 мл физиологического раствора, дважды обрабатывали ультразвуком мощностью 16 кГц в течение 30 с на льду и проводили осаждение клеточного дебриса как описано выше. Далее супернатант объединяли с имеющимися, а осадок вновь растворяли в 100 мл физиологического раствора, дважды обрабатывали ультразвуком мощностью 20 кГц в течение 30 с на льду и проводили процедуру осаждения клеточного дебриса при описанных выше условиях.
В итоге надосадочные жидкости объединяли (около 1200 мл) и проводили осаждение вирусных частиц в центрифуге при 14000 об./мин, 4°С в течение 2 ч. Полученный осадок вируса растворяли в 30 мл инфузионного физиологического раствора натрия хлорида, а центрифужные стаканы дополнительно обмывали новыми 15 мл раствора натрия хлорида, вирусные суспензии объединяли (около 45 мл) и хранили при минус 75°С до окончания очистки вируса из всего объема вируссодержащей жидкости.
В конце этапа очистки BOB VACΔ6 все полученные очищенные вирусные суспензии объединяли (около 135 мл), трижды гомогенизировали при мощности 12 кГц в течение 20 с на льду. У приготовленного вирусного материала определяли инфекционный титр методом бляшек на культуре клеток 4647, доводили его до не менее 108 БОЕ/мл инфузионным физиологическим раствором натрия хлорида, дважды обрабатывали с помощью ультразвукового гомогенизатора мощностью 16 кГц в течение 20 с на льду и хранили при минус (75±5)°С до сведения со стабилизатором.
Приготовление жидкого полуфабриката вакцины со стабилизатором. Стабилизатор представляет собой смесь растворов желатозы, пептона и сахарозы, конечные концентрации которых в жидком полуфабрикате составляют по 3% каждый. Для этого предварительно готовят водные растворы 25% желатозы, 25% пептона из сои и 50% сахарозы.
В стерильных условиях в бутылку с жидкой вирусной суспензией добавляют стабилизатор из расчета 27,6 мл 25% раствора желатозы, 27,6 мл 25% раствора пептона, 13,7 мл 50% раствора сахарозы на 160 мл суспензии рекомбинантного штамма VACΔ6 ВОВ в инфузионном физиологическом растворе натрия хлорида.
Содержание компонентов вакцины перед лиофильной сушкой составляло:
• пептон из сои - 0,006 г/0,2 мл,
• сахароза - 0,006 г/0,2 мл,
• желатин - 0,006 г/0,2 мл,
• суспензия рекомбинантного штамма VACΔ6 ВОВ с титром около 108 ООЕ в инфузионном физиологическом растворе натрия хлорида - остальное до 0,2 мл.
Далее промежуточную продукцию Вакцины VACΔ6 разливали по (0,200±0,005) мл в ампулы 1-го гидролитического класса (или аналогичные) с помощью дозирующего насоса.
Лиофилизация жидкого полуфабриката вакцины VACΔ6. Процедуру проводили на установке для сублимационной сушки TG-16.50 (Германия) в соответствии с инструкцией по эксплуатации. Предварительно кассеты с разлитой в ампулы вакциной закрывали стерильными безворсовыми салфетками, крышками и помещали при температуре минус (49±4)°С на (16,0±0,2) ч, затем замороженные кассеты с вакциной вынимали и быстро, в течение 1 мин, загружали в сушильную камеру установки для сублимационной сушки на лиофилизацию. Регистрацию процесса лиофилизации производили с помощью системы «Метакон». Отработанные условия сушки позволяют выпускать вакцину со значением по показателю потери массы при высушивании в пределах 1-2%.
После завершения процесса сушки кассеты с ампулами закрывали стерильными металлическими крышками и передавали на запайку. Вакцину хранят при температуре 2-8°С в течение 12 месяцев.
Пример 2. Состав живой аттенуированной культуральной вакцины для профилактики натуральной оспы и других ортопоксвирусных инфекций.
Живую аттенуированную культуральную вакцину для профилактики натуральной оспы и других ортопоксвирусных инфекций получают в соответствии с примером 1, которая имеет следующий состав компонентов готовой формы препарата после лиофильной сушки, масс. %:
• пептон из сои - 30,3,
• сахароза - 30,3,
• желатин - 30,3,
• смесь лиофилизата рекомбинантного штамма VACΔ6 ВОВ с титром около 107 ООЕ и натрия хлорида - 9,1.
Пример 3. Способ применения (схема иммунизации) живой аттенуированной культуральной вакцины для профилактики натуральной оспы и других ортопоксвирусных инфекций.
Для вакцинации используют лиофилизированную вакцину, имеющую состав, приведенный в примере 2, которая получена в соответствии с технологией, описанной в примере 1, на основе рекомбинантного штамма VACΔ6 ВОВ с шестью нарушенными генами вирулентности: C3L, N1L, J2R, A35R, A56R, B8R, которую приготавливают следующим образом:
- при однократной схеме вакцинации одну дозу сухого препарата с титром около 107 ООЕ растворяют в 0,2 мл воды для инъекций или раствора натрия хлорида для инфузий в течение 3 мин, слегка встряхивают и наполняют инсулиновый шприц в объеме 0,2 мл с титром около 107 ООЕ;
- при двукратной схеме вакцинации содержимое ампулы - 10 доз сухого препарата с титром около 107 ООЕ растворяют в 2,0 мл воды для инъекций или раствора натрия хлорида для инфузий в течение 3 мин, слегка встряхивают и наполняют инсулиновый шприц в объеме 0,2 мл с титром около 106 ООЕ.
Препарат вводят внутрикожно в верхнюю треть наружной поверхности плеча в область дельтовидной мышцы по следующим схемам:
- однократная вакцинация: внутрикожное введение препарата в дозе 1×107 ООЕ;
- двукратная вакцинация: внутрикожное введение препарата в дозе 1×106 ООЕ с интервалом 28 дней. Вакцину вводят в разовой дозе 0,2 мл взрослым в возрасте от 18 до 60 лет.
Пример 4. Результаты сравнительного изучения эффективности штамма VACΔ6 вируса осповакцины при разных способах введения вируса.
Изучение протективного иммунного ответа. Для сравнения протективных свойств штамма VACΔ6 ВОВ при разных способах вакцинации, мышей линии BALB/c с массой тела 13-16 г (по 6 животных на группу) двукратно иммунизировали подкожно или внутрикожно исследуемым вирусом (с интервалом 28 сут между вакцинациями) в дозе 5*105 или 5*106 БОЕ/животное. При этом объем введенной вирусной суспензии составлял 20 мкл при внутрикожной инъекции и 200 мкл - при подкожной; содержимое ампул восстанавливали в необходимом объеме стерильного физиологического раствора. Группу отрицательного контроля (5 мышей) составили животные, которым вводили подкожно 200 мкл стерильного физиологического раствора. Группа отрицательного контроля была продублирована, а опытные группы были представлены в трех повторах.
На 28 сут. после второй иммунизации VACΔ6 ВОВ всех мышей интраназально заразили высокопатогенным для них ВЭ, используя для наилучшего разрешения между группами дозу в 140 ЛД50/животное. Для этого мышам, предварительно введенным в состояние легкого наркоза с помощью диэтилового эфира, интраназально вводили по 15 мкл в каждую ноздрю суспензии ВЭ согласно методике [Martinez M.J., Bray М.Р., Huggins J.W. A mouse model of aerosol-transmitted orthopoxviral disease: morphology of experimental aerosol-transmitted orthopoxviral disease in a cowpox virus-BALB/c mouse system. // Arch. Pathol. Lab. Med. - 2000. - V. 124, №3. - P. 362-377]. После заражения животных регистрировали их гибель в группах в течение 14 сут., определяя динамику гибели и эффективность защитного действия исследуемого вируса при разных способах иммунизации.
Для определения ЛД50 ВЭ мышей с массой тела 18-20 г подвергали интраназальной инокуляции ВЭ, как описано выше, используя по 10 животных на группу и четыре десятикратных разведения штамма K-1 ВЭ в дозе 10-104 БОЕ/20 мкл/животное. Наблюдение за мышами вели в течение 14 сут., учитывая гибель животных и исключая погибших в первые двое суток, как умерших от манипуляций. Расчет летальной дозы, вызывающей гибель 50% животных (ЛД50), выполняли в соответствии с [Миронов А.Н., Бунатян Н.Д. и др. Руководство по проведению доклинических исследований лекарственных средств (Иммунобиологические лекарственные препараты). Часть вторая. -М.: Гриф и К, 2012.-536 с.].
Измерение титра вируснейтрализующих антител. На 26 сут. после первой и второй иммунизаций проводили оценку гуморального иммунного ответа путем определения титров противооспенных антител в сыворотках крови животных в реакции нейтрализации. Для этого у мышей, предварительно наркотизированных диэтиловым эфиром, забирали образцы крови из ретроорбитального венозного сплетения. Для формирования фибринового сгустка кровь инкубировали при 4°С в течение 24 ч с последующим центрифугированием в течение 10 мин при 5000 g для отделения сыворотки. Препараты сывороток подвергали инактивации при 56°С в течение 30 мин и хранили при минус 20°С до анализа.
Титр вируснейтрализующих антител определяли на 90-100% монослое культуры клеток 4647 по методике, описанной в [Leparc-Goffart I., Poirier В., Garin D., Tissier M-H, Fuchs F., Crance J-M. Standardization of a neutralizing anti-vaccinia antibodies titration method: an essential step for titration of vaccinia immunoglobulins and smallpox vaccines evaluation. // Journal of Clinical Virology. - 2005. - V. 32. - P. 47-52.], используя последовательные пятикратные разведения исследуемых сывороток, которые были смешаны с рабочим разведением ВОВ штамм Л-ИВП (50 БОЕ/лунку). Эффективность нейтрализации рассчитывали относительно числа бляшек в лунках с неиммунной сывороткой, как -lg от наибольшего разведения сыворотки, при котором достигается 50% нейтрализация ВОВ, используя метод Спирмена-Кербера [Закс Л. Статистическое оценивание. Пер. с нем. В.Н. Варыгина. Под ред. Ю.П. Адлера, В.Г. Горского. М.: «Статистика», 1976 - 598 с.].
Анализ данных. Статистическую обработку экспериментальных данных проводили с помощью программы Excel из пакета Microsoft Office 2010 (Microsoft Corp., USA). С использованием t-критерия Стьюдента оценивали обнаруженные межгрупповые различия. Расчет ЛД50 осуществляли по методу Кербера в соответствии с [Миронов А.Н., Бунатян Н.Д. и др. Руководство по проведению доклинических исследований лекарственных средств (Иммунобиологические лекарственные препараты). Часть вторая. - М.: Гриф и К, 2012. - 536 с.]. Статистически значимыми результатами эксперимента считали значения при уровне значимости Р<0,05 [Ашмарин И.П., Воробьев А.А. Статистические методы в микробиологических исследованиях. - Л.: Издательство медицинской литературы, 1962. - 180 с.].
Титры антител рассчитывали как среднее геометрическое в предположении, что элементы выборки распределены по логнормальному закону, и определяли его как -lg от наибольшего разведения сыворотки, при котором достигается 50% нейтрализация ВОВ ± стандартное отклонение [Ашмарин И.П., Воробьев А.А. Статистические методы в микробиологических исследованиях. - Л.: Издательство медицинской литературы, 1962. - 180 с.].
Результаты исследования. В рамках решения задачи сравнительного изучения протективных и иммуногенных свойств штамма VACΔ6 ВОВ при разных способах иммунизации и выбора наиболее эффективного пути введения вируса при вакцинации нами были проведены лабораторные эксперименты по исследованию протективности и определению титра вируснейтрализующих антител в сыворотках животных, инфицированных штаммом VACΔ6 ВОВ при различных путях заражения.
Ранее нами была показана 100% защита мышей после вакцинации штаммом VACΔ6 ВОВ при последующем инфицировании ВЭ в дозе 10 ЛД50/животное. Поэтому с целью лучшего разрешения между опытными группами в данном эксперименте была выбрана принципиально большая разрешающая доза ВЭ в размере 140 ЛД50/мышь.
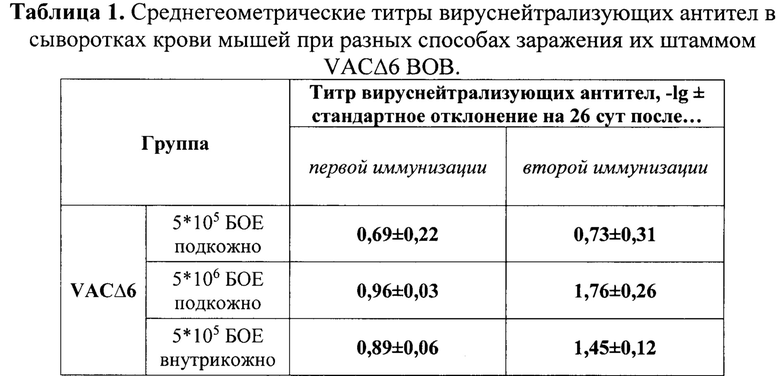
Было показано, что при использовании дозы 5*105 БОЕ/животное защитный эффект наблюдался только для группы мышей, иммунизированных внутрикожно указанной дозой исследуемого вируса. При этом эффективность штамма VACΔ6 ВОВ в указанной группе была почти в два раза выше по сравнению с результатом, полученным в группе, зараженной подкожно исследуемым вирусом в дозе 5*106 БОЕ/животное (81% против 47%) (на фиг. 1 приведена динамика гибели животных при разных путях иммунизации их штаммом VACΔ6 ВОВ после заражения мышей ВЭ в дозе 140 ЛД50). Отсутствие 100% защиты может объясняться использованием слишком высокой дозы гетерологичного для ВОВ вируса эктромелии.
Нами были определены титры вируснейтрализующих антител в сыворотках крови мышей, полученных на 26 сут. после первой и второй иммунизаций животных штаммом VACΔ6 ВОВ при разных способах вакцинации.
В результате проведенных экспериментов было установлено, что иммунизация мышей штаммом VACΔ6 ВОВ при обоих путях введения вируса и обеих использованных дозах индуцирует наработку вируснейтрализующих антител (таблица 1). Было показано, что значения нейтрализующей активности сывороток носят дозозависимый характер: с увеличением титра вводимого вируса увеличивается титр нейтрализующих антител, а также двукратная иммунизация вызывает более высокий рост титров вируснейтрализующих антител по сравнению с однократной вакцинацией на конец эксперимента.
Кроме этого, при одинаковой дозе исследуемого вируса (5*105 БОЕ/животное) внутрикожный путь иммунизации стимулирует гуморальный иммунитет значительно сильнее, чем подкожный способ введения (почти в два раза после второй вакцинации). Также стоит отметить, что титры ВОВ-нейтрализующих антител в сыворотках крови мышей, вакцинированных подкожно в дозе 5*106 БОЕ/животное, лишь немного выше, чем титры, полученные при использовании дозы в десять раз меньше, но введенной внутрикожно. На фиг. 2 приведены уровни вируснейтрализующих антител при разных способах иммунизации мышей штаммом VACΔ6 ВОВ. На диаграмме представлены среднегеометрические значения, рассчитанные как -lg от наибольшего разведения сыворотки, при котором достигается 50% нейтрализация ВОВ±стандартное отклонение.
ВЫВОДЫ
1. Показано, что только при внутрикожной вакцинации мышей линии BALB/c штаммом VACΔ6 ВОВ в дозе 5*105 БОЕ/животное формируется защитный иммунитет против высоковирулентного для них ВЭ (140 ЛД50/мышь), по сравнению с той же дозой, введенной подкожно. При этом эффективность вируса в данной группе почти в два раза выше таковой, полученной при подкожной вакцинации мышей в дозе в десять раз превышающей предыдущую.
2. Продемонстрировано, что значительно большие уровни вируснейтрализующей активности сывороток крови, при одинаковой заражающей дозе, выявлены в группе с внутрикожным введением вируса по сравнению с группой, вакцинированной подкожно (почти в два раза после второй иммунизации).
3. Исходя из полученных сравнительных данных по эффективности штамма VACΔ6 ВОВ при разных способах введения вируса, наиболее эффективным путем вакцинации является внутрикожное введение.
Пример 5. Доклинические исследования вакцины VACΔ6.
Готовая лекарственная форма (ГЛФ) Вакцины VACΔ6 (пример 2) была аттестована в ОБТК ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора в соответствии с проектом ФСП, разработанным с учетом требований Руководства по проведению доклинических исследований лекарственных средств (Иммунобиологические лекарственные препараты), ГФ XIII и Европейской Фармакопеи 7.0.
Исследование безвредности серий ГЛФ вакцины VACΔ6. Изучение аномальной токсичности (безвредности) трех серий препарата «Вакцина VACΔ6» на животных проводили в соответствии с требованиями ГФ XIII (том 1, с. 947, ОФС.1.2.4.0004.15 «Аномальная токсичность») и Руководства по проведению доклинических исследований лекарственных средств (Иммунобиологические лекарственные препараты), часть вторая (с. 121 и 488).
Для определения аномальной токсичности каждой серии ГЛФ Вакцины VACΔ6 использовали пять белых мышей ICR весом 18-20 г и двух морских свинок массой 250-300 г. Содержимое ампул растворяли в 1 мл 0,9% раствора натрия хлорида (использовано по 7 ампул каждой серии вакцины).
Препарат по 1 мл вводили мышам внутрибрюшинно, а морским свинкам - подкожно. Наблюдение за животными осуществляли ежедневно в течение 7 сут. с регистрацией всех изменений состояния здоровья каждого животного.
При изучении аномальной токсичности в течение всего срока наблюдения не выявлено гибели, заболеваний, уменьшения массы тела, развития некроза или абсцесса ни у одного животного, что свидетельствует об отсутствии аномальной токсичности у исследуемых серий Вакцины VACΔ6.
Исследование пирогенности серий ГЛФ вакцины VACΔ6. Исследование проводили в соответствии с требованиями, изложенными в ГФ XIII, том 1, с. 951, ОФС.1.2.4.0005.15 «Пирогенность». Тест-доза препарата-1 прививочная доза/животное.
Исследование пирогенности проводили на здоровых кроликах массой 2,5-2,8 кг, ранее не использованных в работе. В течение 3 сут. перед опытом у каждого подопытного кролика ежедневно утром до дачи корма измеряли температуру и массу тела. В результате были отобраны 9 кроликов, которые в течение этого срока не теряли в массе тела, и температура тела которых не превышала 39,5°С. Согласно требованиям ГФ, на каждую серию использовали по 3 кролика.
Вечером накануне испытания у животных отбирали остаток корма, до и во время опыта корм животные не получали, воду давали без ограничения.
В день испытания перед введением вакцины каждого кролика взвешивали и, с интервалом 30 мин, дважды измеряли температуру тела. Различия в показаниях температуры у одного и того же животного не превышали 0,2°С. За исходную температуру принимали величину последнего результата измерения перед введением препарата. Содержимое ампулы ГЛФ растворяли в 1,0 мл изотонического раствора натрия хлорида для инъекций (ФС.2.2.0014.15) и вводили в ушную вену не позднее, чем через 15-30 мин после последнего измерения температуры. Измерения температуры после введения препарата осуществляли с интервалом 30 мин в течение 3 ч.
Индивидуальное повышение температуры ни у одного из кроликов не превысило 0,4°С, что свидетельствует об отсутствии пирогенных свойств у исследованных серий Вакцины VACΔ6.
Изучение стабильности вакцины VACΔ6 при хранении. Изучение стабильности лиофильно высушенного производственного штамма ВОВ VACΔ6 оценивали при помощи стандартного теста ускоренного хранения, рекомендованного «Руководством по проведению доклинических исследований лекарственных средств (Иммунобиологические лекарственные препараты)», при температуре (37±1)°С в течение 28 сут. с последующим определением инфекционной активности, а также при длительном хранении при температуре от 2 до 8°С с периодической оценкой инфекционной активности через каждые 3 месяца хранения.
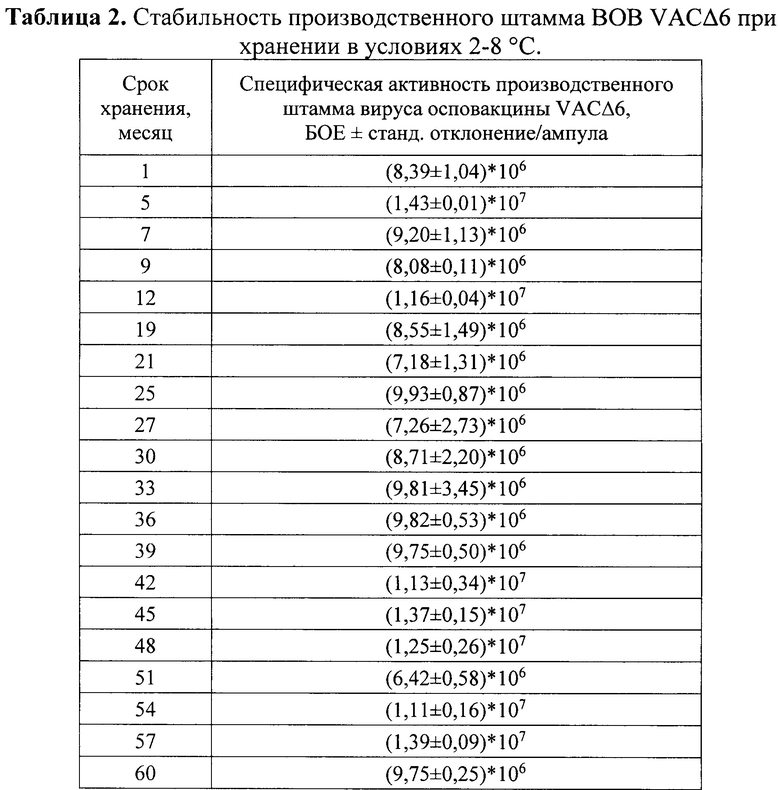
Инфекционную активность оценивали путем титрования в каждой временной точке содержимого трех ампул производственного штамма, хранившихся при разных температурных условиях. Для этого содержимое ампулы растворяли в 1 мл стерильного физиологического раствора, после этого готовили последовательные 10-кратные разведения вируссодержащей жидкости на среде DMEM и титровали на монослое культуры клеток 4647 методом бляшек.
Тест ускоренного хранения показал, что титр производственного штамма ВОВ VACΔ6 после прогревания при температуре 37°С в течение 28 сут. снизился с исходного (1,11±0,32)×107 БОЕ/мл до (0,16±0,01)×107 БОЕ/мл. Во время хранения при температуре 2-8°С в течение 5 лет (60 месяцев) (таблица 2) титр препарата практически оставался на одном уровне.
На основании полученных результатов можно заключить, что производственный штамм ВОВ VACΔ6 высоко стабилен при температуре хранения от 2 до 8°С.
Специфическая активность серий ГЛФ вакцины VACΔ6 на ХАО РКЭ. Инфекционный титр ГЛФ Вакцины VACΔ6 в ампулах каждой серии также определяли путем заражения жизнеспособных 11-12 суточных развивающихся куриных эмбрионов (РКЭ) с предварительно отслоенными хорион-аллантоисными оболочками (ХАО) и последующим подсчетом специфичных поражений (оспин) на них, вызванных ВОВ. Для этого содержимое 3-х ампул каждой серии ГЛФ Вакцины VACΔ6 растворяли в 3 мл раствора Хэнкса с добавлением 100 мкг/мл гентамицина. Из исходного образца вируссодержащей жидкости готовили последовательные 10-кратные разведения в 1 мл раствора Хенкса с антибиотиком. Отраслевой стандартный образец активности, специфичности и некротической активности оспенной вакцины (ОСО) готовили согласно инструкции по применению. В РКЭ вводили с помощью автоматической пипетки через отверстие в скорлупе по 100 мкл приготовленных разведений ГЛФ Вакцины VACΔ6 и ОСО на предварительно отслоенные ХАО. Обработанные таким способом РКЭ инкубировали при температуре 37°С и относительной влажности 80-90% в течение 3 сут. По завершению срока инкубации проводили исследование ХАО на наличие оспин, вызванных ВОВ, подсчитывали их количества. Морфология оспин на ХАО РКЭ для VACΔ6 и ОСО была одинакова.
Концентрация ВОВ составила для ГЛФ Вакцины VACΔ6 с. 01-05.17 - (1,0±0,3)×107 ООЕ/ампула, с. 02-05.17 - (0,9±0,3)×107 ООЕ/ампула и с. 03-05.17 - (1,0±0,6)×107 ООЕ/ампула.
Нейровирулентные свойства вакцинного штамма BOB VACΔ6 при интрацеребральном введении мышам-сосункам. Многообразные формы осложнений при оспопрививании классической живой вакциной можно объединить в три большие группы: осложнения со стороны ЦНС (неврологические), осложнения с поражениями на коже и слизистых и осложнения со стороны других органов и систем. Поскольку к наиболее тяжелым побочным реакциям при иммунизации классической живой оспенной вакциной относятся неврологические осложнения, важно было провести оценку нейровирулентности вакцинного штамма BOB VACΔ6. Наиболее чувствительным тестом нейровирулентности ВОВ является интрацеребральное инфицирование мышей-сосунков.
Трем группам мышей-сосунков линии BALB/c (по 10 животных/группа) интрацеребрально вводили по 10 мкл вакцинного штамма BOB VACΔ6 в дозе 102 БОЕ/мышь. В качестве препарата сравнения использовали ОСО в той же дозе. Через 3 сут. после введения вируса, трех мышей из каждой группы подвергали эвтаназии методом цервикальной дислокации, стерильно извлекали пробы головного мозга, помещали в пробирки и хранили при минус 80°С до титрования. Непосредственно перед титрованием пробы размораживали, гомогенизировали с последующим приготовлением 10% тканевой суспензии на среде DMEM со 100 мкг/мл гентамицина, затем после трех актов замораживания-оттаивания проводили обработку на ультразвуковом дезинтеграторе и осветление полученного гомогената центрифугированием (5000 об./мин, 10 мин, 4°С). В полученных супернатантах определяли концентрации вирусов титрованием методом бляшек на монослое культуры клеток 4647.
За оставшимися мышами (7 животных/группа) наблюдали в течение двух недель, учитывая количество выживших и погибших животных. Для трех независимых групп мышей, инфицированных вакцинным штаммом ВОВ VACΔ6, были выявлены сравнимые показатели нейровирулентности - выжило 40-50% мышей, в то время как для ОСО в той же дозе наблюдалась полная гибель животных (фиг. 3). Полученные результаты согласуются со среднегеометрическими значениями вирусной нагрузки в мозге инфицированных мышей на 3 сут. после инфицирования (фиг. 4).
Таким образом, выполненные эксперименты показали значительно сниженную нейровирулентность вакцины четвертого поколения VACΔ6 по сравнению с классической оспенной живой вакциной первого поколения, разрешенной для использования в России.
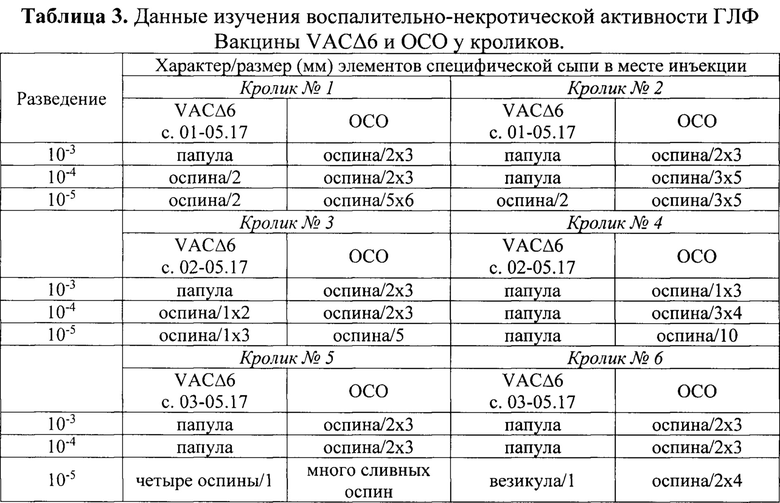
Воспалительно-некротические свойства ГЛФ вакцины VACΔ6 при внутрикожном введении кроликам. Осложнения с поражениями на коже после противооспенной вакцинации является важным параметром, который необходимо контролировать при разработке новых поколений безопасных вакцин на основе ВОВ. Испытание трех серий ГЛФ Вакцины VACΔ6 (01-05.17, 02-05.17 и 03-05.17) проводили на 6-ти белокожих кроликах породы Шиншилла массой 2,5-3,5 кг. На предварительно депилированных участках кожи боковой поверхности тела кроликов площадью около 5 см2 внутрикожно вводили по 100 мкл вакцины в разведениях 10-3, 10-4 и 10-5. Для разведения использовали 0,9% раствор натрия хлорида. На симметричные участки боковой поверхности тела животных аналогично испытуемому образцу наносили разведения ОСО.
Через 5 сут. у животных обеих групп визуально оценивали образование в местах инъекции типичных вакцинальных поражений (папула, везикула, оспина). Было показано (таблица 3), что в местах введения разведений серий ГЛФ Вакцины VACΔ6 образуются вакцинальные поражения, аналогичные вызываемым введением разведений ОСО, но элементы специфического поражения кожных покровов, индуцируемые Вакциной VACΔ6, менее интенсивны и имеют меньшие размеры, чем поражения, вызываемые ОСО, что указывает на снижение воспалительно-некротических свойств Вакцины VACΔ6 относительно классической вакцины оспенной живой.
Иммуногенность вакцины VACΔ6 при внутрикожном введении кроликам. При массовой вакцинации важное значение имеют выбор оптимальной минимальной дозы и схемы введения вакцины для достижения долговременного иммунитета против соответствующего инфекционного агента. На модели кроликов провели сравнение уровней ВОВ-специфичных вируснейтрализующих антител на 42 сут., 6 и 12 мес. после однократной внутрикожной инъекции Вакцины VACΔ6 в дозе 107 БОЕ/животное или двукратной внутрикожной инъекции с интервалом 21 сут в дозе 106 БОЕ/животное. В качестве контроля сравнения использовали препарат ОСО. Содержимое ампулы ОСО растворяли в 2 мл растворителя для оспенной вакцины, 0,1 мл полученного препарата наносили на предварительно подготовленный участок депилированной кожи кролика одной каплей. В месте нанесения вирусной суспензии стерильным медицинским скарификатором (сквозь каплю) делали одиночный некровоточащий надрез (царапину) длиной 0,5 см и втирали вакцину в место надреза плоской стороной того же скарификатора. При этом вакцинирующая доза была не менее 107 БОЕ/животное.
Результаты этих экспериментов, представленные на фиг. 5, показали, что двукратная иммунизация кроликов Вакциной VACΔ6 в дозе 106 БОЕ обеспечивает более напряженный иммунный ответ в течение длительного периода времени по сравнению с однократной внутрикожной инъекцией вакцины в дозе 107 БОЕ. При этом уровень вируснейтрализующих антител, индуцируемых разработанной аттенуированной Вакциной VACΔ6, не имел достоверных отличий от аналогичного показателя для ОСО.
Важным тестом на соответствие по иммуногенности новой Вакцины VACΔ6 классической противооспенной вакцине первого поколения является сравнение уровней вируснейтрализующих антител, синтезированных в организме иммунизированных кроликов, относительно ВНО. Результаты таких исследований с использованием штаммов ВНО Ind-3а и Butler, представленные на фиг. 6, показывают, что живая аттенуированная вакцина четвертого поколения VACΔ6 после двукратной иммунизации кроликов в дозе 106 БОЕ индуцирует ВНО-нейтрализующие антитела на уровне, характерном для вакцины оспенной живой первого поколения.
Изучение защитной эффективности серий ГЛФ вакцины VACΔ6 на мышах. Для изучения протективного иммунного ответа, самок мышей линии BALB/c с массой тела 15-18 г дважды внутрикожно иммунизировали сериями ГЛФ Вакцины VACΔ6 (с интервалом 21 сут. между иммунизациями; по 8 животных/серия) в дозе 106 ООЕ/животное. При этом каждому животному вводили 0,01 мл (1 доза) вакцины из ампулы, содержимое которой предварительно восстанавливали в 0,1 мл физиологического раствора (по 2 ампулы каждой серии на обе вакцинации). Контрольную группу (8 животных) иммунизировали двукратно внутрикожно в дозе 106 ООЕ/0,01 мл/животное препаратом ОСО. Группу отрицательного контроля (12 животных) составили интактные мыши.
Для определения уровня защиты вакцинированных животных использовали интраназальную инокуляцию летального для мышей штамма K-1 ВЭ. Для определения ЛД50 разрешающего вируса использовали самок мышей линии BALB/c с массой тела 21-23 г, которым после предварительной наркотизации диэтиловым эфиром интраназально вводили десятикратные разведения ВЭ в дозах 3×101-3×105 БОЕ/0,03 мл/животное, используя по 10 животных на разведение вируса. После заражения животных в течение 21 сут. учитывали их гибель, исключая погибших в первые двое суток, как умерших от манипуляций. Величина ЛД50 для ВЭ составила 1,3 lg БОЕ/животное.
Через 21 сут. после второго введения вакцины животных интраназально заражали десятикратными разведениями препарата штамма K-1 ВЭ в объеме 0,03 мл, используя по 4 животных на дозу, после предварительной наркотизации их парами диэтилового эфира. После инфицирования мышей регистрировали их гибель в группах в течение 21 сут.
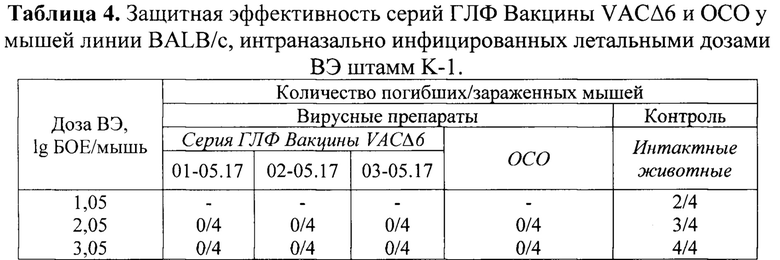
Результаты этого эксперимента (таблица 4) показали, что двукратная внутрикожная вакцинация вакциной VACΔ6 в дозе 106 ООЕ/мышь для всех трех исследованных серий ГЛФ обеспечивает 100% защитный эффект против интраназального инфицирования мышей штаммом K-1 ВЭ в дозе 56 ЛД50 (3,05 lg БОЕ), демонстрируя протективные свойства на уровне ОСО.
Кроме того, на 19 сут. после второй иммунизации тремя сериями исследуемой вакцины проводили оценку гуморального иммунного ответа. Для этого у всех животных, предварительно наркотизированных диэтиловым эфиром, прижизненно забирали образцы крови из ретроорбитального венозного синуса, из которых после формирования фибринового сгустка и последующего центрифугирования отбирали сыворотки, в которых после тепловой обработки определяли титры ВОВ-нейтрализующих антител на культуре клеток 4647.
Оценку титров противооспенных антител проводили в реакции нейтрализации с применением штамма Л-ИВП ВОВ, используя последовательные пятикратные разведения исследуемых сывороток, которые смешивали с рабочим разведением ВОВ (50 БОЕ/лунку). Полученную смесь инкубировали в течение 1 ч при 37°С, после чего наносили на монослой культуры клеток 4647, предварительно выращенный в 24-луночных культуральных планшетах. Титр сыворотки, подавляющий образование 50% БОЕ ВОВ по сравнению с количеством БОЕ в лунках с неиммунной сывороткой, рассчитывали по методу Спирмена-Кербера и выражали в виде 50% бляшкоподавляющего нейтрализующего титра в 1 мл сыворотки (БНТ50/мл). Для групп образцов сывороток рассчитывали средний геометрический титр противооспенных антител. Результаты исследования приведены в таблице 5.
Проведенные исследования показали, что уровни ВОВ-нейтрализующих антител в периферической крови животных, вакцинированных испытуемыми сериями ГЛФ Вакцины VACΔ6, не имели достоверных отличий от аналогичных показателей в группе, иммунизированной ОСО.
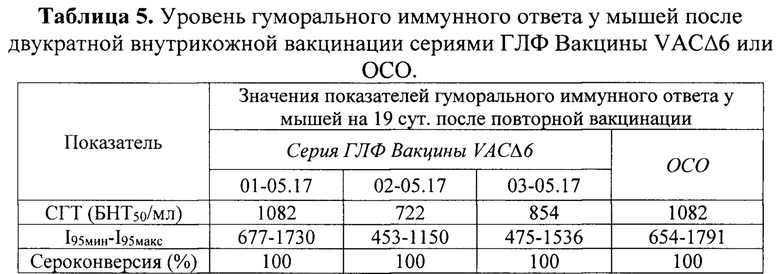
Примечание:
СГТ - средний геометрический титр;
БНТ50 - 50% бляшкоредуцирующий нейтрализующий титр;
I95мин-I95макс - диапазон значений с доверительной вероятностью 95%;
Сероконверсия - доля сывороток с титром, превышающим пороговое значение 150 БНТ50/мл, измеренное для группы отрицательного контроля (при р<0,05).
На основании полученных результатов можно заключить, что двукратная внутрикожная вакцинация ГЛФ Вакцины VACΔ6 в дозе 106 ООЕ/мышь обеспечивает 100% защитный эффект против интраназального инфицирования мышей штаммом K-1 ВЭ в дозе 56 ЛД50, демонстрируя протективные свойства на уровне противооспенной вакцины первого поколения.
Изучение эффективности серий ГЛФ вакцины VACΔ6 на кроликах. Изучение протективного иммунного ответа проводили на кроликах породы Шиншилла массой 2,5-3,5 кг (12 животных/серия). Животных дважды внутрикожно иммунизировали ГЛФ Вакцины VACΔ6 в дозе 106 ООЕ/0,05 мл/животное с интервалом 21 сут. между иммунизациями. Контрольную группу (12 кроликов) иммунизировали ОСО двукратно внутрикожно в дозе 106 ООЕ/животное в объеме 0,05 мл. Группе отрицательного контроля (12 кроликов) дважды внутрикожно вводили физиологический раствор в объеме 0,05 мл с интервалом 21 сут. Через 20 сут. после второго введения, у всех животных отбирали образцы крови из краевой вены уха для получения сыворотки (как описано выше при изучении эффективности серий вакцины на мышиной модели) с последующим определением титров противооспенных антител в реакции нейтрализации на культуре клеток 4647.
Для определения уровня защиты вакцинированных животных использовали интраназальную инокуляцию летального для кроликов штамма НВ-92 ВОВ. Величина ЛД50 в эксперименте для штамма НВ-92 составила 1,6 lg БОЕ/животное.
Через 21 сут. после второго введения вакцины животных интраназально заражали разными дозами ВОВ штамм НВ-92 в объеме 1,0 мл, используя по 4 животных на дозу, после предварительной наркотизации животных парами диэтилового эфира. После заражения кроликов регистрировали их гибель в группах в течение 21 сут. Результаты эксперимента, представленные в таблице 6, позволяют заключить, что двукратная внутрикожная вакцинация ГЛФ Вакцины VACΔ6 в дозе 106 ООЕ/кролик обеспечивает 100% защитный эффект против интраназального инфицирования кроликов штаммом НВ-92 ВОВ в дозе 1995 ЛД50, демонстрируя протективные свойства на уровне противооспенной вакцины первого поколения.

На 21 сут. после второй иммунизации кроликов проводили оценку гуморального иммунного ответа. Оценку титров противооспенных антител в сыворотках крови животных проводили в реакции нейтрализации с применением штамма Л-ИВП ВОВ. Разведения исследуемой сыворотки смешивали с рабочим разведением ВОВ, содержащим 400-600 БОЕ/мл. Полученную смесь инкубировали в течение 1 ч при 37°С, после чего наносили на монослой культуры клеток 4647, предварительно выращенный в 24-луночных культуральных планшетах. Титр сыворотки, подавляющий образование 50% БОЕ по сравнению с количеством БОЕ в контрольных лунках, рассчитывали по методу Спирмена-Кербера и выражали в виде 50% бляшкоподавляющего нейтрализующего титра в 1 мл сыворотки (БНТ50/мл). Для групп образцов сывороток рассчитывали средний геометрический титр противооспенных антител. Результаты исследования приведены в таблице 7.
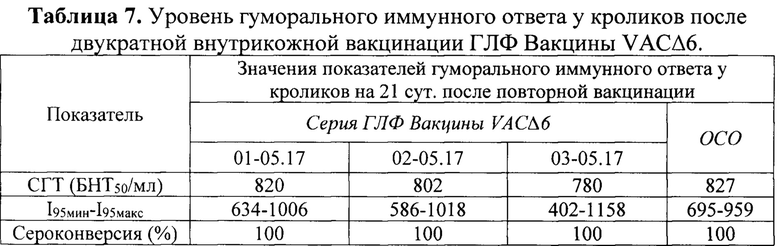
Примечание:
СГТ - средний геометрический титр;
БНТ50 - 50% бляшкоредуцирующий нейтрализующий титр;
I95мин-I95макс - диапазон значений с доверительной вероятностью 95%;
Сероконверсия (%) - доля сывороток с титром, превышающим пороговое значение 40 БНТ50/мл, измеренное для группы отрицательного контроля (при р<0,05).
Проведенные исследования показали, что уровни ВОВ-нейтрализующих антител в периферической крови кроликов, вакцинированных испытуемыми сериями ГЛФ Вакцины VACΔ6, не имели достоверных отличий от аналогичных показателей в группах животных, вакцинированных ОСО.
ВЫВОДЫ
Вакцинный штамм BOB VACΔ6 демонстрирует на модели внутримозгового введения мышам-сосункам значительно уменьшенную нейровирулентность, а на модели внутрикожного введения кроликам - сниженную воспалительно-некротическую активность по сравнению с классической оспенной живой вакциной первого поколения, разрешенной для использования в России.
Доклинические исследования трех серий ГЛФ Вакцины VACΔ6 показали:
• подлинность вакцины, так как на поверхности ХАО 11-12-суточных РКЭ формируются специфические патологические образования (оспины), схожие по своей морфологии с патологическими образованиями, характерными для штамма Л-ИВП ВОВ. Показана идентичность кожных поражений, вызванных введением кроликам ГЛФ и препарата сравнения (ОСО);
• термостабильность;
• апирогенность;
• безвредность;
• специфическую активность (при двукратной вакцинации кроликов в дозе 106 ООЕ/животное), обеспечивающую 100% защитный эффект против интраназального инфицирования кроликов ВОВ штамм НВ-92 в дозе 1995 ЛД50;
• специфическую активность (при двукратной вакцинации мышей в дозе 106 ООЕ/животное), обеспечивающую 100% защитный эффект против интраназального инфицирования мышей ВЭ штамм K-1 в дозе 56 ЛД50.
Таким образом, на основании проведенного комплекса исследований можно заключить, что созданная вакцина четвертого поколения VACΔ6 является более безопасной по сравнению с вакциной оспенной живой первого поколения и не уступает ей по иммуногенным и протективным свойствам.
Пример 6. Клинические исследования вакцины VACΔ6.
Название исследования: Двойное слепое сравнительное рандомизированное плацебо-контролируемое клиническое исследование иммуногенности, реактогенности и безопасности вакцины против натуральной оспы и других ортопоксвирусных инфекций на основе вируса осповакцины живой культуральной (Вакцина VACΔ6) на добровольцах в возрасте 18-60 лет.
Фаза исследования: II-III.
Цель: изучение иммуногенности, подтверждение безопасности и переносимости различных схем применения препарата «Вакцина против натуральной оспы и других ортопоксвирусных инфекций на основе вируса осповакцины живая культуральная (Вакцина VACΔ6)» с помощью комплекса клинических и лабораторно-инструментальных методов.
Задачи исследования:
1) Изучить иммунологическую активность вакцины при однократном применении Вакцины VACΔ6 в дозе 1×107 ООЕ.
2) Изучить иммунологическую активность вакцины при двукратном применении (с интервалом 28 дней) Вакцины VACΔ6 в дозе 1×106 ООЕ.
3) Оценить безопасность различных схем применения препарата «Вакцина VACΔ6» с помощью комплекса клинических и лабораторно-инструментальных методов (термометрия, регистрации артериального давления, аускультации сердца и легких, ЭКГ, общего анализа крови и мочи, биохимического, иммунологического и вирусологического исследований).
4) Оценить реактогенность различных схем применения препарата «Вакцина VACΔ6» (учет количества местных и общих реакций, процент привитых с различными степенями выраженности общих и местных реакций).
5) Выявить развитие нежелательных реакций на введение препарата «Вакцина VACΔ6».
6) Оценить показатели клеточно-опосредованного иммунитета при применении различных схем препарата «Вакцина VACΔ6».
7) Определить наличие вируса в специфических кожных образованиях (корочки, пустулы), слюне, крови и моче.
8) Оценить эффективность защиты исследуемой Вакцины VACΔ6 при однократном и двукратном применении.
Исследуемый препарат, доза и способ применения: «Вакцина против натуральной оспы и других ортопоксвирусных инфекций на основе вируса осповакцины живая культуральная (Вакцина VACΔ6)».
Дозировка: внутрикожно однократно 107 ООЕ ВОВ; внутрикожно двукратно с интервалом 28 дней по 106 ООЕ ВОВ.
Продолжительность исследования: 3 месяца.
Плацебо: натрия хлорид буфус, растворитель для приготовления лекарственной формы для инъекций 0,9%.
Критерии оценки:
Эффективность:
1) Процент привитых с титром вируснейтрализующих антител к ВОВ в реакции нейтрализации на РКЭ ≥1:40.
2) Определение титров антител в ИФА.
3) Исследования клеточно-опосредованного иммунитета.
4) Эффективность защиты Вакцины VACΔ6.
Безопасность:
1) Витальные показатели: температура, артериальное давление, частота сердечных сокращений (пульс), частота дыхательных движений.
2) Клинический (общий) анализ крови: содержание эритроцитов, лейкоцитов, гемоглобина, тромбоцитов, палочкоядерных нейтрофилов, сегментоядерных нейтрофилов, эозинофилов, базофилов, моноцитов, лимфоцитов, СОЭ.
3) Биохимический анализ крови: активность ферментов аланинтрансаминазы, аспартатрансаминазы, лактатдегидрогеназы, щелочной фосфатазы, β-липопротеины, холестерин, общий белок, общий билирубин, глюкоза, креатинин, мочевина, тимоловая проба, СРБ, содержание иммуноглобулинов классов Е.
4) Общий анализ мочи: прозрачность, удельный вес, белок, глюкоза, лейкоциты, эритроциты, цилиндры, соли, бактерии.
5) Наличие ВОВ в крови, моче, слюне, специфических кожных образованиях (корочки, пустулы).
Реактогенность:
1) Учет количества местных реакций - образование вакцинальных элементов (покраснение, припухлость и узелок-папула, пустула, везикула, эритема, уплотнение).
2) Учет количества общих реакций (недомогание, головная боль, повышение температуры, слабость, потливость, нарушение сна и аппетита, тошнота, рвота, боли в животе и др.).
3) Учет процента привитых с различными степенями выраженности общих и местных реакций.
ЭТАП 1. Результаты первого этапа исследования «Исследование реактогенности, безопасности, иммуногенности и эффективности защиты вакцины VACΔ6»
Основой целью 1-го этапа клинического исследования являлось изучение эффективности защиты вакцины VACΔ6. Эффективность защиты определяли путем проведения накожной прививки живой оспенной вакциной через 1-2 месяца после вакцинации вакциной VACΔ6. Также на этом этапе осуществляли дальнейшее изучение реактогенности, безопасности и иммуногенности Вакцины VACΔ6.
На первом этапе клинического исследования приняли участие 30 добровольцев обоего пола в возрасте от 18 до 60 лет, соответствующих критериям включения и не имеющих критериев невключения. Средний возраст для мужчин составил (34,1±2,5) года и для женщин (36,2±3,3) года.
Добровольцы были распределены в две группы: группа 1 - 15 добровольцев, привитых двукратно внутрикожно Вакциной VACΔ6 в дозе 1×106 ООЕ (с интервалом 28 дней). Через 1 месяц после полного курса вакцинации была проведена накожная прививка живой оспенной вакциной. Группа 2 - 15 добровольцев, привитых однократно внутрикожно Вакциной VACΔ6 в дозе 1×107 ООЕ. Через 2 месяца после вакцинации была проведена накожная прививка живой оспенной вакциной.
После накожного применения живой оспенной вакциной осуществляли наблюдение за развитием местных поствакцинальных реакций в течение первых 14 дней, при необходимости наблюдение продолжали до полного исчезновения вакцинальных знаков. По выраженности местной специфической кожной реакции судили о напряженности иммунитета. Немедленная реакция, характеризующаяся появлением папул, окруженных зоной гиперемии или без нее, или эритемы и уплотнения на 2-3 день после ревакцинации, свидетельствует о наличии напряженного иммунитета. Ускоренная вакцинальная реакция проявляется появлением везикул, окруженных зоной гиперемии и инфильтрации тканей или без них, которые на 4 день более выражены.
После ревакцинации на 2-3 день у 13 добровольцев (86,7%), двукратно привитых VACΔ6, было установлено появление папул, окруженных зоной гиперемии (таблица 8). Местная реакция была оценена как немедленная специфическая кожная реакция, что характеризует напряженный иммунитет. У 2 (13,3%) двух добровольцев было выявлено снижение иммунного ответа, о чем свидетельствует ускоренная вакцинальная местная специфическая реакция.
Однократное внутрикожное применение Вакцины VACΔ6 в дозе 107 ООЕ также вызывает наработку напряженного противооспенного иммунитета, о чем свидетельствуют результаты накожного применения вакцины оспенной живой. Так у 93,3% добровольцев зарегистрирована немедленная реакция. У одного добровольца (6,7%) кожная реакция после ревакцинации протекала по ускоренной вакцинальной реакции, что свидетельствует о сниженном противооспенном иммунитете.
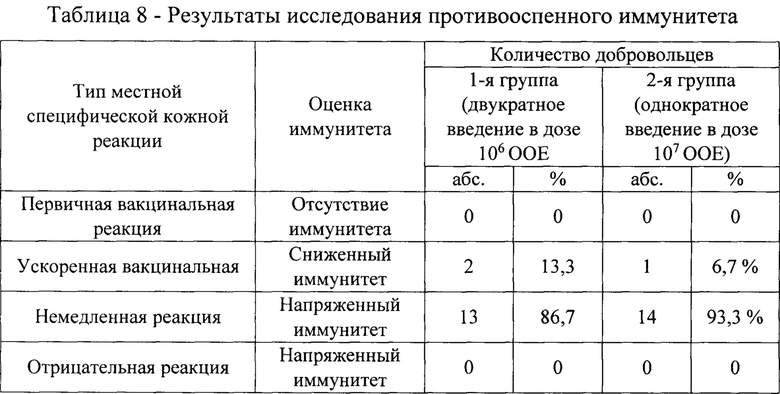
Результаты 1 этапа исследования свидетельствуют о низкой реактогенности препарата. Однократное внутрикожное применение Вакцины VACΔ6 в дозе 107 ООЕ характеризуется развитием допустимых местных реакций, характерных для оспенной вакцины, в 84% случаев. Все местные реакции имели слабую степень проявления.
Двукратное внутрикожное применение Вакцины VACΔ6 в дозе 106 ООЕ характеризуется развитием допустимых местных реакций, характерных для оспенной вакцины, в 80% случаев после первой вакцинации. Все местные реакции имели слабую степень проявления. Местные реакции после второго введения вакцины характеризуются появлением гиперемии и единичных оспенных элементов у 67% добровольцев.
Вакцина VACΔ6 не вызывает развития общих реакций в виде повышения температуры, головной боли ни у одного добровольца.
Однократное применение вакцины в дозе 107 ООЕ у 11% добровольцев сопровождалось умеренным кратковременным увеличением подмышечной группы лимфатических узлов.
Вакцина VACΔ6 обладает высоким профилем безопасности. Анализ данных физикального обследования, клинического и биохимического анализов крови и анализов мочи не выявил патологических изменений.
Иммунологическая перестройка организма добровольцев, привитых вакциной, характеризуется изменениями гуморального и клеточного иммунитета.
Анализ средних значений активности специфических ГЗТ-эффекторов по индексу миграции (ИМ), характеризующему миграционную активность лейкоцитов, выявил однотипные изменения данного показателя в крови привитых вакциной не зависимо от схемы применения. Через месяц после вакцинации отмечается повышение значения ИМ на 33% в первой группе, на 31% во второй. Через два месяца отмечается дальнейшее повышение значение ИМ до 37% в первой группе, до 35% во второй. Реакция считается положительной, если опытные и контрольные показатели различаются более чем на 20%. Таким образом, можно сделать заключении о стимулирующем действии вакцины на уровень ГЗТ-эффекторов.
Не установлено статистически значимых различий значения ИИМ, являющийся показателем способности Т-клеток продуцировать ФТМ. Эти данные свидетельствуют об отсутствии влияния вакцинации на активность ГЗТ-эффекторов, заключающемся в достоверном повышении их способности продуцировать ФТМ.
Не установлено зависимости ИМ и ИИМ от дозы препарата. По мнению ряда авторов, средние значения ускорения и торможения МАЛ возрастали при уменьшении дозы препарата in vitro, что свидетельствует о важности определения оптимальной дозы препарата для адекватного иммунного ответа.
Анализ индекса миграции лейкоцитов показал, что как в начале, так и в конце наблюдения отличий между группами добровольцев, вакцинированных двукратно и однократно, не обнаружено. Регрессионный анализ продемонстрировал, что коэффициент миграции достоверно изменялся по времени; влияние пола пациентов и группы не являлось значимым.
Анализ показателя ПЭФ выявил, что в каждой группе наблюдались статистически значимые изменения между визитами (р<0,00055). Регрессионный анализ показал, что достоверным влиянием на показатель индекс ПЭФ обладал к фактору времени (визит). Влияние пола пациентов не являлось значимым.
Анализ индекса стимуляции ФГА свидетельствует, что в начале исследования и в конце отличий между группами выявлено не было, р=0,868 и р=0,407 соответственно.
Результаты проведенного исследования показали, что применение Вакцины VACΔ6 сопровождается образованием специфических антител к ортопоксвирусам в сыворотках крови добровольцев, независимо от дозы и схемы применения.
Специфическую активность препарата, обусловленную активным компонентом - вирусом осповакцины (штамм Л-ИВП с шестью нарушенными генами вирулентности C3L, N1L, J2R, A35R, A56R и B8R), оценивали по способности вызывать у вакцинированных образование вируснейтрализующих антител к ВОВ. При исследовании сывороток крови привитых однократно в дозе 107 ООЕ установлено, что процент лиц, ответивших выработкой специфических антител в РН составил 100% к 60 дню наблюдения. При этом значение среднегеометрического титра вируснейтрализующих антител в РН составил 56,33 [46,36; 68,44] lg.
При анализе результатов образования противооспенных антител при двукратной схеме вакцинации установлено, что через месяц после второй вакцинации уровень антител равный защитному определялся в 66,7% случаев (10 добровольцев), при этом значение среднегеометрического титра специфических антител составило 32,80 [27,37; 39,30] lg.
Таким образом, вакцина против натуральной оспы и других ортопоксвирусных инфекций на основе вируса осповакцины живая культуральная (Вакцина VACΔ6) является безопасным препаратом, хорошо переносится добровольцами, не вызывает развития аллергических реакций. Не вызывает чрезмерного усиления неспецифических клеточных реакций, что подтверждают данные, полученные при исследовании показателей ГЗТ-эффекторов к специфическому антигену.
Применение Вакцины VACΔ6 вызывает формировании напряженного иммунитета, что проявляется развитием местной специфической кожной реакцией немедленного типа после ревакцинации «Вакциной оспенной живой».
При исследовании крови, слюны, мочи наличия ВОВ в пробах не зарегистрировано. ВОВ выявлен в образцах специфических кожных образованиях (пустулы, корочки).
ЭТАП 2. Второй этап клинического исследования «Исследование иммуногенности, реактогенности и безопасности вакцины против натуральной оспы и других ортопоксвирусных инфекций на основе вируса осповакцины живой культуральной (вакцина VACΔ6)»
Проведено двойное слепое сравнительное рандомизированное плацебо-контролируемое исследование иммуногенности, реактогенности и безопасности вакцины против натуральной оспы и других ортопоксвирусных инфекций на основе вируса осповакцины живой культуральной (Вакцина VACΔ6) на добровольцах в возрасте от 18 до 60 лет.
Протокол № VACΔ6-01/20 (Версия 3 от 20.07.2020 г).
Цель настоящего исследования: изучение иммуногенности, подтверждение безопасности и переносимости различных схем применения препарата «Вакцина против натуральной оспы и других ортопоксвирусных инфекций на основе вируса осповакцины живая культуральная (Вакцина VACΔ6)» с помощью комплекса клинических и лабораторно-инструментальных методов.
В клиническом исследовании на втором этапе приняли участие 304 добровольца, из которых 158 мужчин и 146 женщин, в возрасте от 18 до 60 лет, соответствующих критериям включения и не имеющих критериев невключения. Распределение добровольцев по клиническим центрам осуществлялось следующим образом:
1) ФГБУЗ МСЧ-163 ФМБА России - 272 добровольца, которые были рандомизированы в четыре группы:
1-я группа - 76 добровольцев, вакцинированных двукратно с интервалом 28 дней внутрикожно Вакциной VACΔ6 в дозе 106 ООЕ/0,2 мл;
2-я группа - 76 добровольцев, вакцинированных двукратно с интервалом 28 дней внутрикожно Плацебо в дозе 0,2 мл;
3-я группа - 60 добровольцев, вакцинированных однократно внутрикожно Вакциной VACΔ6 в дозе 107 ООЕ/0,2 мл;
4-я группа - 60 добровольцев, вакцинированных однократно внутрикожно Плацебо в дозе 0,2 мл.
2) Государственное бюджетное учреждение здравоохранения Новосибирской области «Городская инфекционная клиническая больница №1» - 32 добровольца, которые были рандомизированы в две группы:
5-я группа - 16 добровольцев, вакцинированных однократно внутрикожно Вакциной VACΔ6 в дозе 107 ООЕ/0,2 мл;
6-я группа - 16 добровольцев, вакцинированных однократно внутрикожно Плацебо в дозе 0,2 мл.
Продолжительность клинического исследования составила 90 дней.
За время проведения клинического исследования оценена реактогенность двух схем применения препарата «Вакцина VACΔ6» (учет количества местных и общих реакций, процент привитых с различными степенями выраженности общих и местных реакций).
Внутрикожное применение Вакцины VACΔ6 вызывает развитие местных поствакцинальных реакций, которые характеризуются последовательным развитием вакцинальных элементов: на 2-3 день после вакцинации появляется покраснение, припухлость и узелок-папула, который увеличивается; на 4-6 день папула трансформируется в везикулу - пузырек с прозрачным содержимым. К 6-8 дню везикула превращается в пустулу, максимального размера она достигает к 8-10 дню, после чего происходит угасание реакции, возможно образование корочки.
При применении двукратной схемы вакцинации Вакциной VACΔ6 в дозе 106 ООЕ местные поствакцинальные реакции по типу первичной наблюдались у 80% добровольцев после первой вакцинации и у 67% добровольцев - после второй. В большинстве случаев местная реакция проявлялась в виде гиперемии.
Местная специфическая кожная реакция протекает по типу первичной при однократной вакцинации в дозе 1×107 ООЕ в 88% случаев. У большинства добровольцев (95%) местные реакции были оценены как слабые (1 балл), оспенные высыпания были не обильными, слабо выраженными, безболезненными. Лишь в 3,3% случаев местная реакция была оценена как средняя (диаметр гиперемии превысил 50 мм).
Болезненность в месте инъекции зарегистрирована в 2,2% случаев.
Одновременно с развитием кожных элементов осуществляли наблюдение за развитием общей реакции организма: недомогание, головная боль, повышение температуры, локальный лимфаденит. В процессе проведения исследования ни у одного добровольца (304 человека) не было зарегистрировано повышения температуры тела, появления головной боли и др. У 10 добровольцев (11%), вакцинированных вакциной в дозе 1×107 ООЕ, течение вакцинального процесса сопровождалось умеренным кратковременным увеличением подмышечной группы лимфатических узлов. В соответствии с классификацией ВОЗ частота развития нежелательных реакций оценена как «частые» (более 1/100, но менее 1/10).
У добровольцев, получивших однократно и двукратно Плацебо местных реакций не зарегистрировано.
Таким образом, на основании полученных данных можно сделать заключение о низкой реактогенности двух исследуемых доз вакцины VACΔ6 (106 ООЕ и 107 ООЕ). Применение вакцины сопровождается развитием слабых местных реакций. Увеличение дозы препарата до 107 ООЕ не вызывает повышения реактогенности.
Безопасность двух схем применения препарата Вакцина VACΔ6 оценена с помощью комплекса клинических и лабораторно-инструментальных методов (термометрия, регистрации артериального давления, аускультация сердца и легких, ЭКГ, общего анализа крови и мочи, биохимического, иммунологического и вирусологического исследований). Проведенные сравнительные исследования свидетельствуют, что введение Вакцины VACΔ6, независимо от дозы и схемы, не вызывает статистически значимых изменений гематологических (количество эритроцитов, лейкоцитов, тромбоцитов, уровень гемоглобина, СОЭ, лейкоцитарная формула) и биохимических показателей крови (активность ферментов аланинтрансаминазы, аспартатрансаминазы, содержание общего белка, билирубина, мочевины, триглицеридов, креатинина, глюкозы, СРБ, показателя тимоловой пробы) добровольцев во все сроки наблюдения.
Субъективных данных о непереносимости препарата, о побочных негативных, аллергических или каких-либо других нежелательных явлений зафиксировано не было.
Имеющие место колебания исследуемых показателей хоть и выходили за пределы физиологической нормы, носили физиологический характер и были сравнимы с изменениями в группе добровольцев, получивших Плацебо.
Результаты исследования общего анализа мочи не показали патологических изменений исследуемых показателей в динамике как при однократном, так и двукратном введении вакцины.
Одной из целей данного клинического исследования явилось изучение показатели специфической активности препарата при однократной и двукратной вакцинации. Исследование иммунологической эффективности вакцины осуществляли в реакции нейтрализации на культуре клеток Vero.
При однократном введении Вакцины VACΔ6 в дозе 107 ООЕ на 30 сутки процент лиц с защитным уровнем вируснейтрализующих антител (1:40) составил - 55%. Максимальные значения уровня специфических вируснейтрализующих антител наблюдались на 60 день наблюдения. Процент добровольцев с защитным уровнем антител составил 96%, при этом среднее значение титра специфических антител составило у мужчин (53,94±22,07), у женщин (57,67±20,1). Через 90 дней после вакцинации число лиц с защитным титром составило 98,7%, при этом средние значения вируснейтрализующих антител составили (60,61±20,3) и (57,21±20,74) у мужчин и женщин соответственно.
Двукратное применение вакцины в дозе 106 ООЕ также вызывает наработку специфических противооспенных антител, так через месяц после второй вакцинации уровень антител равный защитному определялся у 72% добровольцев, при этом значение титра специфических антител составило у мужчин (34,74±11,09), у женщин (32,63±9,78). Через 60 дней после второй вакцинации процент добровольцев с защитным уровнем специфических антител составил 93,4%, а значение титра специфических антител составило у мужчин (46,32±21,36), у женщин (48,95±19,56).
Исследование проб (везикулы, пустулы, корочки, соскоб со дна пузырьков) свидетельствует о наличие ВОВ в специфических кожных образованиях. Во избежание инфицирования вирусом вакцины окружающих (особенно при наличии лиц с кожными заболеваниями и иммунодефицитными состояниями), начиная со второго-третьего дня и до момента отпадения корочек (14-21 день) добровольцы должны место прививки закрывать помимо длинного рукава одежды из мягкой ткани еще и стерильной воздухопроницаемой повязкой. Ни в одном случае, ни при однократной, ни при двукратной вакцинации добровольцев Вакциной VACΔ6 не зарегистрировано наличие вакцинного вируса в исследуемых пробах крови, слюны, мочи.
ВЫВОДЫ
1. Однократное внутрикожное применение Вакцины VACΔ6 в дозе 107 ООЕ характеризуется развитием допустимых местных реакций, характерных для оспенной вакцины, в 84% случаев. Все местные реакции имели слабую степень проявления.
2. Двукратное внутрикожное применение Вакцины VACΔ6 в дозе 106 ООЕ характеризуется развитием допустимых местных реакций, характерных для оспенной вакцины, в 80% случаев после первой вакцинации. Все местные реакции имели слабую степень проявления. Местные реакции после второго введения вакцины характеризуются появлением гиперемии и единичных оспенных элементов у 67% добровольцев.
3. Вакцина VACΔ6 не вызывала развития общих реакций в виде повышения температуры, головной боли ни у одного добровольца.
4. Однократное применение вакцины в дозе 107 ООЕ у 11% добровольцев сопровождалось умеренным кратковременным увеличением подмышечной группы лимфатических узлов.
5. Вакцина VACΔ6 обладает высоким профилем безопасности. Анализ данных физикального обследования, клинического и биохимического анализов крови и анализов мочи не выявил патологических изменений. Зарегистрированные изменения исследуемых показателей были сравнимы с изменения, выявленными в группе, принимавших Плацебо.
6. Независимо от дозы и схемы применения не зарегистрировано наличие вакцинного вируса в исследуемых пробах крови, слюны, мочи.
7. При внутрикожном применении вакцины зарегистрировано наличие вируса вакцины в специфических кожных образованиях (пустулы, корочки).
8. Вакцина VACΔ6 индуцирует наработку специфических антител к ортопоксвирусам в сыворотках крови добровольцев, не зависимо от дозы и схемы применения. Через два месяца после полного курса вакцинации выявлены вируснейтрализующие антитела в защитных титрах (≥1:40) у 98,7% добровольцев, вакцинированных однократно в дозе 107 ООЕ, и у 93,4% - двукратно в дозе 106 ООЕ.
9. Вакцина VACΔ6 формирует напряженный иммунный ответ у 93,3% добровольцев, вакцинированных однократно в дозе 107 ООЕ, и у 86,7% -двукратно (с интервалом 28 дней) в дозе 106 ООЕ, после накожного применения «Вакцины оспенной живой».
10. Ускоренная кожная вакцинальная реакция после ревакцинации «Вакциной оспенной живой», которая свидетельствует о сниженном противооспенном иммунитете, наблюдалась у одного добровольца (6,7%) при однократной вакцинации Вакциной VACΔ6 в дозе 107 ООЕ и у двух добровольцев (13,3%) при двукратной в дозе 106 ООЕ.
11. Вакцина VACΔ6 не вызывает развития аллергических реакций.
12. Вакцина VACΔ6 оказывает стимулирующее действие на ГЗТ-эффекторы.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ КУПИРОВАНИЯ НЕЖЕЛАТЕЛЬНЫХ ПОСТВАКЦИНАЛЬНЫХ РЕАКЦИЙ И ОСЛОЖНЕНИЙ ПРИ ПЕРВИЧНОМ ОСПОПРИВИВАНИИ ОСПЕННЫМИ ВАКЦИНАМИ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2013 |
|
RU2542490C1 |
| Рекомбинантный штамм VACΔ6 вируса осповакцины с нарушенными генами вирулентности C3L, N1L, J2R, A35R, A56R, B8R для получения живой культуральной аттенуированной вакцины против натуральной оспы и других ортопоксвирусных инфекций человека | 2016 |
|
RU2621868C1 |
| ШТАММ GPA ВИРУСА ОСПОВАКЦИНЫ ДЛЯ ИССЛЕДОВАНИЯ ЭФФЕКТИВНОСТИ ПРОТИВОВИРУСНЫХ ПРЕПАРАТОВ in vivo И ОЦЕНКИ СХЕМ КУПИРОВАНИЯ НЕЖЕЛАТЕЛЬНЫХ ПОСТВАКЦИНАЛЬНЫХ РЕАКЦИЙ ПРИ ПЕРВИЧНОМ ОСПОПРИВИВАНИИ | 2013 |
|
RU2542400C1 |
| НАБОР ТАБЛЕТИРОВАННОЙ ЖИВОЙ РЕКОМБИНАНТНОЙ ОРАЛЬНОЙ БИВАКЦИНЫ ПРОТИВ НАТУРАЛЬНОЙ ОСПЫ И ГЕПАТИТА B И СПОСОБ ВАКЦИНАЦИИ С ИСПОЛЬЗОВАНИЕМ УКАЗАННОГО НАБОРА | 2005 |
|
RU2302259C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ Л-ИВП 1421ABJCN ВИРУСА ОСПОВАКЦИНЫ С НАРУШЕННЫМИ ГЕНАМИ ВИРУЛЕНТНОСТИ A56R, B8R, J2R, C3L, N1L ДЛЯ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ АТТЕНУИРОВАННОЙ ВАКЦИНЫ ПРОТИВ НАТУРАЛЬНОЙ ОСПЫ И ДРУГИХ ОРТОПОКСВИРУСОВ, ПАТОГЕННЫХ ДЛЯ ЧЕЛОВЕКА | 2015 |
|
RU2588388C1 |
| ЖИВАЯ РЕКОМБИНАНТНАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ГЕПАТИТА В И НАТУРАЛЬНОЙ ОСПЫ ДЛЯ НАКОЖНОГО ПРИМЕНЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1992 |
|
RU2073524C1 |
| Пероральная лекарственная форма препарата в капсулах для лечения и профилактики заболеваний, вызываемых ортопоксвирусами | 2019 |
|
RU2716709C1 |
| ВАКЦИНА ПРОТИВ ОСПЫ ОВЕЦ | 1989 |
|
RU1614201C |
| Вакцина и способ повышения иммуногенности и специфической активности средств профилактики инфекций | 2020 |
|
RU2741834C1 |
| ВИРУСНЫЕ ВАКЦИНЫ | 2017 |
|
RU2778312C2 |
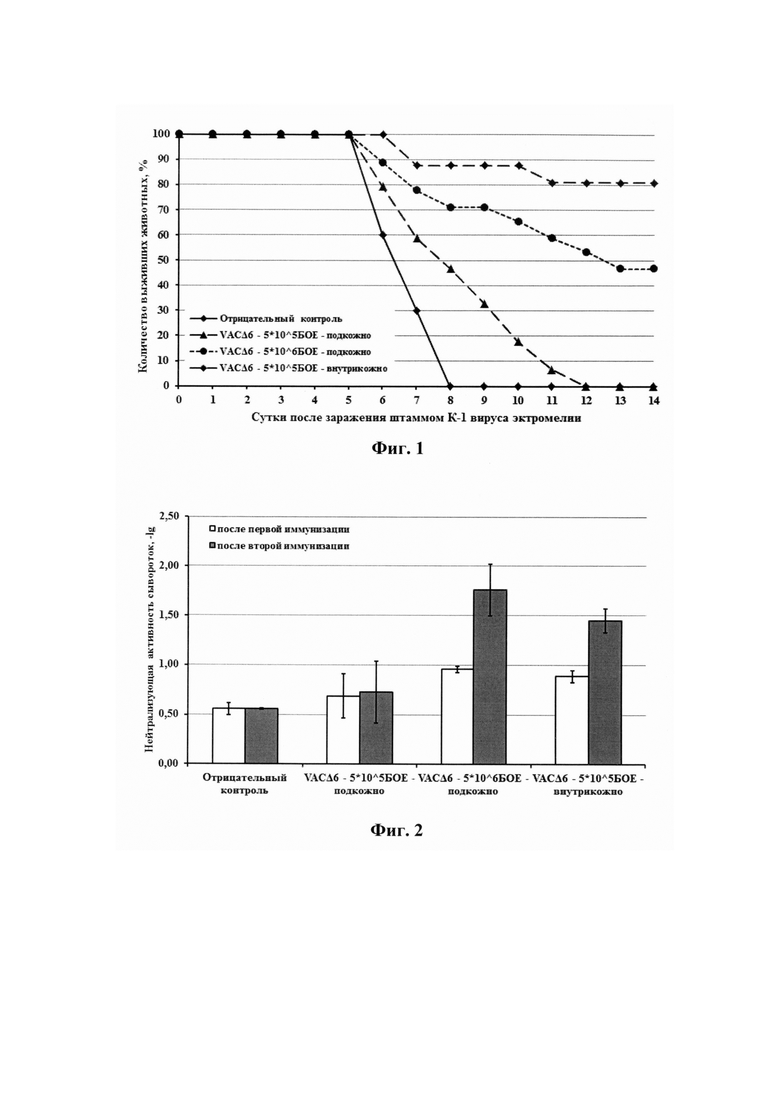
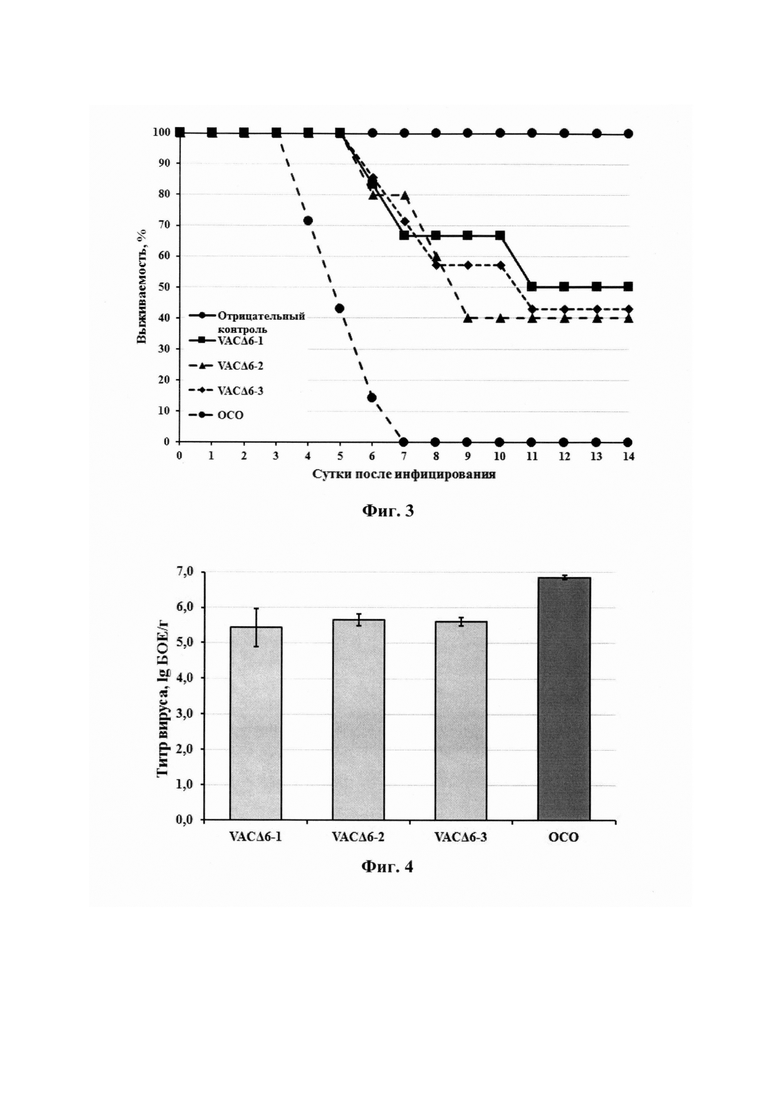
Изобретение относится к биотехнологии. Представленная вакцина содержит штамм VACΔ6 вируса осповакцины с шестью нарушенными генами вирулентности C3L, N1L, J2R, A35R, A56R, B8R и стабилизатор, включающий сахарозу, желатин, пептон из сои и натрия хлорид при следующем содержании указанных компонентов готовой формы препарата после лиофильной сушки, масс. %: пептон из сои - 30,3, сахароза - 30,3, желатин - 30,3, смесь лиофилизата рекомбинантного штамма VACΔ6 вируса осповакцины с титром около 107 ООЕ и натрия хлорида - 9,1. Способ получения вакцины включает заражение монослоя культуры клеток посевным материалом аттенуированного вируса осповакцины - рекомбинантного штамма VACΔ6 вируса осповакцины с шестью нарушенными генами вирулентности, инкубирование вируса в клеточном монослое в бессывороточной питательной среде при температуре 37°С до получения примерно 100% цитопатического эффекта, замораживание полученной вируссодержащей суспензии на стадии ее сбора и накопления, очистку и концентрирование полученной вирусной суспензии путем обработки ее ультразвуком и центрифугирования, введение в очищенную вируссодержащую суспензию стабилизирующего состава в виде водных растворов натрия хлорида, пептона из сои, сахарозы и желатина и лиофильную сушку полученной смеси указанных компонентов с получением вакцины в сухой форме. В качестве культуры клеток для наработки вируса используют перевиваемую культуру клеток 4647 почки африканской зеленой мартышки, а в качестве бессывороточной питательной среды используют питательную среду ДМЕМ, содержащую дополнительно 10 ед./мл бензоназы эндонуклеазы и 1,5 мM MgCl2. В очищенную вируссодержащую суспензию вводят стерильный инфузионный физиологический раствор NaCl и компоненты стабилизирующего состава из расчета 27,6 мл 25% водного раствора желатина, 27,6 мл 25% водного раствора пептона из сои, 13,7 мл 50% водного раствора сахарозы на 160 мл инфузионного физиологического раствора натрия хлорида с получением титра вируссодержащей суспензии не менее 5×107 БОЕ/мл при следующем содержании указанных компонентов вакцины перед лиофильной сушкой: пептон - 0,006 г/0,2 мл; сахароза - 0,006 г/0,2 мл; желатин - 0,006 г/0,2 мл; суспензия рекомбинантного штамма VACΔ6 вируса осповакцины с титром 108 ООЕ в инфузионном физиологическом растворе натрия хлорида - остальное до 0,2 мл. Способ применения вакцины, характеризующийся тем, что для вакцинации используют вакцину, полученную на основе рекомбинантного штамма VACΔ6 вируса осповакцины с шестью нарушенными генами вирулентности, которую приготавливают следующим образом: при однократной схеме вакцинации одну дозу сухого препарата с титром 107 ООЕ растворяют в 0,2 мл воды для инъекций или раствора натрия хлорида для инфузий и наполняют инсулиновый шприц в объеме 0,2 мл с титром 107 ООЕ, а при двукратной схеме вакцинации содержимое ампулы - 10 доз сухого препарата с титром 107 ООЕ - растворяют в 2,0 мл воды для инъекций или раствора натрия хлорида для инфузий и наполняют инсулиновый шприц в объеме 0,2 мл с титром 106 ООЕ. Препарат вводят при однократной вакцинации внутрикожно в дозе 1×107 ООЕ, а при двукратной вакцинации - внутрикожно в дозе 1×106 ООЕ с интервалом 28 дней. Техническим результатом изобретения является расширение номенклатуры живых высокоаттенуированных и безопасных вакцин против натуральной оспы и других ортопоксвирусных инфекций человека. 3 н.п. ф-лы, 6 ил., 8 табл., 6 пр.
1. Живая аттенуированная культуральная вакцина для профилактики натуральной оспы и других ортопоксвирусных инфекций, содержащая аттенуированный вирус осповакцины и стабилизатор, включающий сахарозу, желатин и натрия хлорид, отличающаяся тем, что стабилизатор дополнительно содержит пептон из сои, а в качестве аттенуированного вируса осповакцины вакцина содержит рекомбинантный штамм VACΔ6 вируса осповакцины с шестью нарушенными генами вирулентности C3L, N1L, J2R, A35R, A56R и B8R, депонированный в государственной коллекции ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным № V-696, при следующем содержании указанных компонентов готовой формы препарата после лиофильной сушки, масс. %:
2. Способ получения живой аттенуированной культуральной вакцины для профилактики натуральной оспы и других ортопоксвирусных инфекций, включающий заражение монослоя культуры клеток посевным материалом аттенуированного вируса осповакцины, инкубирование вируса в клеточном монослое в бессывороточной питательной среде при температуре 37°С до получения 100% цитопатического эффекта, замораживание полученной вируссодержащей суспензии на стадии ее сбора и накопления, очистку и концентрирование полученной вирусной суспензии путем обработки ее ультразвуком и центрифугирования, введение в очищенную вируссодержащую суспензию стабилизирующего состава в виде водного раствора натрия хлорида, сахарозы и желатина и лиофильную сушку полученной смеси указанных компонентов с получением вакцины в сухой форме, отличающийся тем, что в качестве посевного материала аттенуированного вируса осповакцины используют рекомбинантный штамм VACΔ6 вируса осповакцины с шестью нарушенными генами вирулентности C3L, N1L, J2R, A35R, A56R и B8R, депонированный в государственной коллекции ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным № V-696 с титром 2×107 БОЕ/мл, в качестве культуры клеток для наработки вируса используют перевиваемую культуру клеток 4647 почки африканской зеленой мартышки, а в качестве бессывороточной питательной среды используют питательную среду ДМЕМ, содержащую дополнительно 10 ед./мл бензоназы эндонуклеазы и 1,5 мM MgCl2, причем стабилизирующий состав дополнительно содержит пептон из сои, а в полученную очищенную вируссодержащую суспензию вводят стерильный инфузионный физиологический раствор NaCl и компоненты стабилизирующего состава из расчета 27,6 мл 25% водного раствора желатина, 27,6 мл 25% водного раствора пептона из сои и 13,7 мл 50% водного раствора сахарозы на 160 мл инфузионного физиологического раствора натрия хлорида с получением титра вируссодержащей суспензии не менее 5×107 БОЕ/мл при следующем содержании указанных компонентов вакцины VACΔ6 по п. 1 перед лиофильной сушкой:
3. Способ применения живой аттенуированной культуральной вакцины для профилактики натуральной оспы и других ортопоксвирусных инфекций, характеризующийся тем, что для вакцинации используют лиофилизированную вакцину по п. 1, полученную способом по п. 2, на основе рекомбинантного штамма VACΔ6 вируса осповакцины с шестью нарушенными генами вирулентности C3L, N1L, J2R, A35R, A56R и B8R, которую приготавливают следующим образом:
- при однократной схеме вакцинации одну дозу сухого препарата с титром 107 ООЕ растворяют в 0,2 мл воды для инъекций или раствора натрия хлорида для инфузий в течение 3 мин, слегка встряхивают и наполняют инсулиновый шприц в объеме 0,2 мл с титром 107 ООЕ;
- при двукратной схеме вакцинации содержимое ампулы - 10 доз сухого препарата с титром 107 ООЕ - растворяют в 2,0 мл воды для инъекций или раствора натрия хлорида для инфузий в течение 3 мин, слегка встряхивают и наполняют инсулиновый шприц в объеме 0,2 мл с титром 106 ООЕ; препарат вводят внутрикожно в верхнюю треть наружной поверхности плеча в область дельтовидной мышцы по следующим схемам:
- однократная вакцинация: внутрикожное введение препарата в дозе 1×107 ООЕ;
- двукратная вакцинация: внутрикожное введение препарата в дозе 1×106 ООЕ с интервалом 28 дней; причем вакцину вводят в разовой дозе 0,2 мл взрослым в возрасте от 18 до 60 лет.
| Рекомбинантный штамм VACΔ6 вируса осповакцины с нарушенными генами вирулентности C3L, N1L, J2R, A35R, A56R, B8R для получения живой культуральной аттенуированной вакцины против натуральной оспы и других ортопоксвирусных инфекций человека | 2016 |
|
RU2621868C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ Л-ИВП 1421ABJCN ВИРУСА ОСПОВАКЦИНЫ С НАРУШЕННЫМИ ГЕНАМИ ВИРУЛЕНТНОСТИ A56R, B8R, J2R, C3L, N1L ДЛЯ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ АТТЕНУИРОВАННОЙ ВАКЦИНЫ ПРОТИВ НАТУРАЛЬНОЙ ОСПЫ И ДРУГИХ ОРТОПОКСВИРУСОВ, ПАТОГЕННЫХ ДЛЯ ЧЕЛОВЕКА | 2015 |
|
RU2588388C1 |
| Контактный термометр для передачи показаний температуры на расстояние | 1929 |
|
SU23851A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИВОЙ КУЛЬТУРАЛЬНОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА ГРИППА | 2009 |
|
RU2420314C1 |
| WO 2008072903 A1, 19.06.2008 | |||
| Bertram L Jacobs, Jeffrey O Langland et al | |||
| Vaccinia virus vaccines: past, present and future, Antiviral Res | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2022-10-05—Публикация
2022-07-06—Подача