Область техники
[0001]
Настоящее изобретение относится к катионному липиду, который позволяет введение нуклеиновых кислот в качестве активного ингредиента во многие типы клеток, тканей или органов. Кроме того, настоящее изобретение относится к липидной частице, содержащей катионный липид, и к композиции, содержащей липидную частицу и нуклеиновую кислоту.
[0002]
Уровень техники, к которому относится изобретение
В последние годы было проведено тщательное исследование и разработка лекарственных средств на основе нуклеиновых кислот, которые содержат нуклеиновую кислоту в качестве активного ингредиента. Например, был проведен ряд испытаний лекарственных средств на основе нуклеиновых кислот, имеющих эффект расщепления или эффект ингибирования функции в отношении мРНК-мишени, включающих такие нуклеиновые кислоты, как миРНК, мкРНК, миметики мкРНК и антисмысловые нуклеиновые кислоты. Кроме того, были проведены испытания лекарственных средств на основе нуклеиновых кислот, содержащих мРНК и т.п., кодирующую представляющий интерес белок, для экспрессии представляющего интерес белка в клетках. Для такого исследования и разработки, были разработаны способы введения нуклеиновых кислот в клетки, ткани или органы, с высокой эффективностью в качестве способов на основе системы доставки лекарственных средств (DDS).
[0003]
Обычно в качестве такого способа DDS выступает такой способ, в котором нуклеиновую кислоту и липид смешивают для формирования комплекса и клеткам позволяют включить нуклеиновую кислоту через этот комплекс. Обычно в качестве липидов для применения для формирования комплекса известны катионные липиды, гидрофильные полимерные липиды, липиды-помощники и т.п. В качестве таких катионных липидов известны соединения, описанные в документах уровня техники, как показано ниже.
[0004]
В патентном документе 1 описано соединение, соответствующее следующей формуле, или его соль, и т.д.
[0005]
[Формула 1]
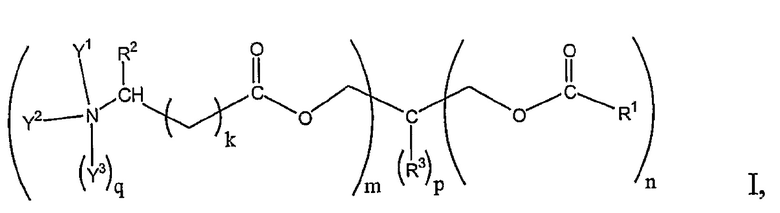
В этой формуле R1 независимо выбран из группы, состоящей из необязательно замещенного C8-C24 алкила и необязательно замещенного C8-C24 алкенила; каждый R2 и R3 независимо выбран из группы, состоящей из водорода, необязательно замещенного C1-C8 алкила, необязательно замещенного арилалкила и т.д.; каждый Y1 и Y2 независимо выбран из группы, состоящей из водорода, необязательно замещенного C1-C6 алкила, необязательно замещенного арилалкила и т.д.; каждый Y3, если присутствует, независимо выбран из группы, состоящей из водорода, необязательно замещенного C1-C8 алкила, необязательно замещенного арилалкила и т.д.; m представляет собой любое целое число от 1 до 4; n представляет собой любое целое число от 0 до 3; p равен 0 или 1; сумма m, n и p равна 4; k представляет собой любое целое число от 1 до 5; и q равен 0 или 1.
[0006]
В патентном документе 2 описано соединение, соответствующее следующей формуле, или его соль, и т.д.
[0007]
[Формула 2]
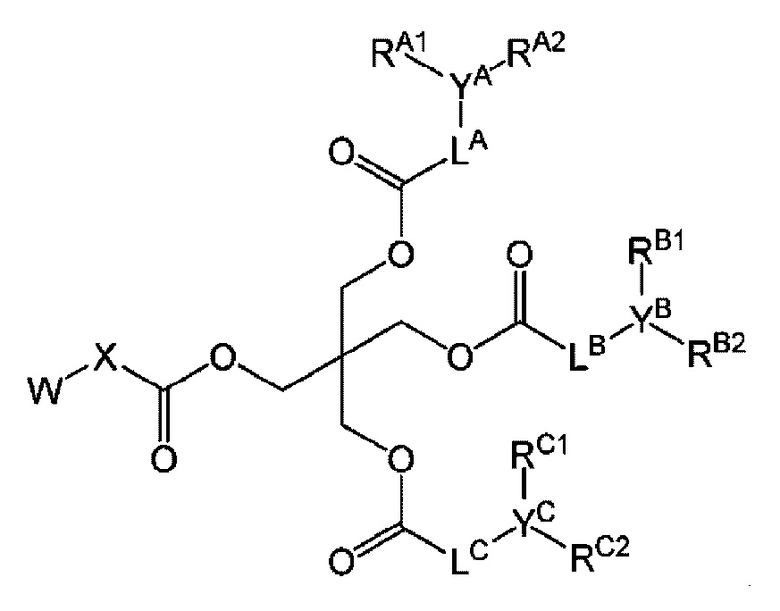
В этой формуле W обозначает формулу -NR1R2 или формулу -N+R3R4R5(Z-); R1 и R2 обозначают, каждый независимо, C1-4 алкильную группу или атом водорода; R3, R4 и R5 обозначают, каждый независимо, C1-4 алкильную группу; Z- обозначает отрицательный ион; X обозначает C1-6 алкиленовую группу, которая может быть замещенной; YA, YB и YC обозначают, каждый независимо, метиновую группу, которая может быть замещенной; LA, LB и LC обозначают, каждый независимо, метиленовую группу, которая может быть замещенной, или связь; RA1, RA2, RB1, RB2, RC1 и RC2 обозначают, каждый независимо, C4-10 алкильную группу, которая может быть замещенной.
Список литературы
Патентные документы
[0008]
Патентный документ 1: Международная публикация № WO 2003/102150
Патентный документ 2: Международная публикация № WO 2016/021683
Сущность изобретения
Техническая проблема
[0009]
Ожидается, что катионные липиды, которые позволяют введение нуклеиновых кислот в клетки с высокой эффективностью, внесут вклад в создание лекарственных средств на основе нуклеиновых кислот, которые являются лучшими с точки зрения проявления действия лекарственного вещества, безопасности (низкая токсичность) и т.д., и будут демонстрировать лучший эффект. Ожидается, что катионные липиды, которые позволяют введение нуклеиновых кислот в различные клетки, позволят получить лекарственные средства на основе нуклеиновых кислот, против заболеваний, которые возникают в различных тканях. Однако в настоящее время не было выявлено катионного липида, который в достаточной степени удовлетворяет этим требованиям.
[0010]
Задачей настоящего изобретения является предоставление способа, который позволяет вводить нуклеиновые кислоты в клетки с более высокой эффективностью; и катионных липидов и т.д. для применения в этом способе. С другой точки зрения, задачей настоящего изобретения является предоставление способа, который позволяет вводить нуклеиновые кислоты в различные клетки; и соединений и т.д. для применения в этом способе.
Решение проблемы
[0011]
Авторы настоящего изобретения провели тщательное исследование для решение данной проблемы и обнаружили, что проблема успешно решается с использованием соединения, соответствующего формуле, приведенной ниже, или его соли, таким образом, осуществив настоящее изобретение.
[0012]
В частности, настоящее изобретение относится по меньшей мере к следующим.
[1] Соединение, соответствующее формуле (I):
[Формула 3]
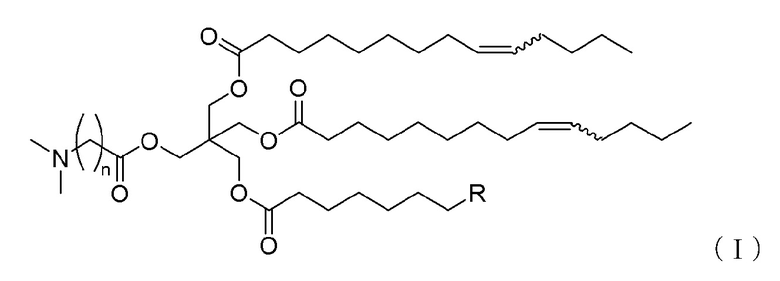
где
n обозначает целое число от 2 до 5,
R обозначает линейную C1-5 алкильную группу, линейную C7-11 алкенильную группу или линейную C11 алкадиенильную группу, и
каждая из волнистых линий независимо обозначает цис-связь или транс-связь,
или его соль.
[2] 3-((4-(диметиламино)бутаноил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноат или его соль.
[3] 3-((5-(диметиламино)пентаноил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноат или его соль.
[4] 3-((6-(диметиламино)гексаноил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноат или его соль.
[5] Липидная частица, содержащая соединение или его соль согласно положению 1.
[6] Композиция для введения нуклеиновой кислоты, содержащая нуклеиновую кислоту и липидную частицу согласно положению 5.
[7] Композиция согласно положению 6, где нуклеиновая кислота представляет собой РНК.
[7a] Композиция согласно положению 6, где нуклеиновая кислота представляет собой ДНК.
[8] Композиция согласно положению 7, где РНК представляет собой мРНК или миРНК.
[0013]
В рамках настоящего описания "соединение, соответствующее формуле (I)" иногда указывают как "соединение (I)". "Соединение, соответствующее формуле (I), или его соль" иногда называют "соединением по настоящему изобретению". "Липидную частицу, содержащую соединение, соответствующее формуле (I), или его соль (соединение по настоящему изобретению)" иногда называют "липидной частицей по настоящему изобретению". "Композицию для введения нуклеиновой кислоты, содержащую нуклеиновую кислоту и липидную частицу по настоящему изобретению" иногда называют "композицией по настоящему изобретению".
Преимущественные эффекты изобретения
[0014]
Настоящее изобретение позволяет введение нуклеиновых кислот в клетки, ткани или органы с лучшей эффективностью. Настоящее изобретение позволяет введение нуклеиновых кислот в различные типы клеток, тканей или органов (например, злокачественные клетки). Настоящее изобретение позволяет получение лекарственных средств или реагентов для исследования для введения нуклеиновой кислоты в различные типы клеток, тканей или органов. Более того, если нуклеиновую кислоту вводят в клетки, ткань или орган в соответствии с настоящим изобретением, эффективность проявления активности (например, лекарственное действие), которой обладает нуклеиновая кислота, является высокой.
[0015]
(Подробное описание изобретения)
[0016]
Ниже подробно описаны определения заместителей, использованных в настоящей заявке. Заместители имеют следующие определения, если нет иных указаний.
[0017]
Примеры "линейной C1-5 алкильной группы" в рамках настоящего изобретения включают метил, этил, пропил, бутил и пентил.
[0018]
Примеры "линейной C7-11 алкенильной группы" в рамках настоящего изобретения включают 1-гептенил, 2-гептенил, 3-гептенил, 4-гептенил, 5-гептенил, 6-гептенил, 1-октенил, 2-октенил, 3-октенил, 4-октенил, 5-октенил, 6-октенил, 7-октенил, 1-ноненил, 2-ноненил, 3-ноненил, 4-ноненил, 5-ноненил, 6-ноненил, 7-ноненил, 8-ноненил, 1-деценил, 2-деценил, 3-деценил, 4-деценил, 5-деценил, 6-деценил, 7-деценил, 8-деценил, 9-деценил, 1-ундеценил, 2-ундеценил, 3-ундеценил, 4-ундеценил, 5-ундеценил, 6-ундеценил, 7-ундеценил, 8-ундеценил, 9-ундеценил и 10-ундеценил. Хотя каждая из этих линейных C7-11 алкенильных групп имеет одну углерод-углеродную двойную связь, и, таким образом, углерод-углеродная двойная связь может образовывать цис-структуру и транс-структуру, углерод-углеродная двойная связь может образовывать любую из структур.
[0019]
Примеры "линейной C11 алкадиенильной группы" в рамках настоящего изобретения включают 1,3-ундекадиенил, 1,4-ундекадиенил, 1,5-ундекадиенил, 1,6-ундекадиенил, 1,7-ундекадиенил, 1,8-ундекадиенил, 1,9-ундекадиенил, 1,10-ундекадиенил, 2,4-ундекадиенил, 2,5-ундекадиенил, 2,6-ундекадиенил, 2,7-ундекадиенил, 2,8-ундекадиенил, 2,9-ундекадиенил, 2,10-ундекадиенил, 3,5-ундекадиенил, 3,6-ундекадиенил, 3,7-ундекадиенил, 3,8-ундекадиенил, 3,9-ундекадиенил, 3,10-ундекадиенил, 4,6-ундекадиенил, 4,7-ундекадиенил, 4,8-ундекадиенил, 4,9-ундекадиенил, 4,10-ундекадиенил, 5,7-ундекадиенил, 5,8-ундекадиенил, 5,9-ундекадиенил, 5,10-ундекадиенил, 6,8-ундекадиенил, 6,9-ундекадиенил, 6,10-ундекадиенил, 7,9-ундекадиенил, 7,10-ундекадиенил и 8,10-ундекадиенил. Хотя каждая из этих линейных C11 алкадиенильных групп имеет две углерод-углеродных двойных связи, и, таким образом, углерод-углеродная двойная связь может образовывать цис-структуру и транс-структуру, углерод-углеродная двойная связь может образовывать любую из структур.
[0020]
Предпочтительные примеры n и волнистых линий в формуле (I) являются следующими.
n предпочтительно представляет собой целое число от 3 до 5, и более предпочтительно 3.
Каждая волнистая линия предпочтительно представляет собой цис-связь.
[0021]
Конкретные предпочтительные примеры соединения (I) являются следующими.
Соединение (A): такое соединение, в котором n представляет собой целое число от 3 до 5, R представляет собой линейную C7-11 алкенильную группу в цис-структуре и каждая волнистая линия представляет собой цис-связь.
Соединение (B): такое соединение, в котором n равен 4, R представляет собой линейную C11 алкадиенильную группу, в которой две углерод-углеродных двойных связи образуют цис-структуру, и каждая из волнистых линий представляет собой цис-связь.
Соединение (C): такое соединение, в котором n равен 2 или 3, R представляет собой линейную C1-5 алкильную группу, и каждая из волнистых линий представляет собой цис-связь.
[0022]
Конкретные более предпочтительные примеры соединения (I) являются следующими.
Соединение (A1): такое соединение, в котором n представляет собой целое число, равное 3-5, R представляет собой 5-гептенил, 7-ноненил или 9-ундеценил в цис-структуре, и каждая из волнистых линий представляет собой цис-связь.
Соединение (B1): такое соединение, в котором n равен 4, R представляет собой 2,5-ундекадиенил, в котором каждая из двух углерод-углеродных двойных связей образует цис-структуру, и каждая из волнистых линий представляет собой цис-связь.
Соединение (C1): такое соединение, в котором n равен 2 или 3, R представляет собой метил, пропил или пентил, и каждая из волнистых линий представляет собой цис-связь.
[0023]
Соль соединения (I) предпочтительно представляет собой фармакологически приемлемую соль, и ее примеры включают соли с неорганическим основанием, соли с органическим основанием, соли с неорганической кислотой, соли с органической кислотой и соли с основной или кислотной аминокислотой.
[0024]
Предпочтительные примеры солей с неорганическим основанием включают соли щелочных металлов, такие как соли натрия и соли калия; соли щелочноземельных металлов, такие как соли кальция и соли магния; соли алюминия и соли аммония. Предпочтительными являются соли натрия, соли калия, соли кальция и соли магния, и более предпочтительными являются соли натрия и соли калия.
[0025]
Предпочтительные примеры солей с органическим основанием включают соли с триметиламином, триэтиламином, пиридином, пиколином, этаноламином, диэтаноламином, триэтаноламином, трометамин[трис(гидроксиметил)метиламином], трет-бутиламином, циклогексиламином, бензиламином, дициклогексиламином и N, N-дибензилэтилендиамином.
[0026]
Предпочтительные примеры солей с неорганической кислотой включают соли с фтористоводородной кислотой, хлористоводородной кислотой, бромистоводородной кислотой, йодистоводородной кислотой, азотной кислотой, серной кислотой и фосфорной кислотой. Предпочтительными являются соли с хлористоводородной кислотой и соли с фосфорной кислотой.
[0027]
Предпочтительные примеры солей с органической кислотой включают соли с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фталевой кислотой, фумаровой кислотой, щавелевой кислотой, виннокаменной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой и п-толуолсульфоновой кислотой.
[0028]
Предпочтительные примеры солей с основной аминокислотой включают соли с аргинином, лизином и орнитином.
[0029]
Предпочтительные примеры солей с кислотной аминокислотой включают соли с аспарагиновой кислотой и глутаминовой кислотой.
[0030]
В рамках настоящего изобретения соединение по настоящему изобретению можно использовать в качестве катионного липида. Катионный липид может образовывать комплекс с множеством молекул в растворителе или дисперсионной среде. Комплекс может содержать дополнительный компонент в дополнение к соединению по настоящему изобретению. Примеры дополнительного компонента включают дополнительный липидный компонент и нуклеиновую кислоту.
[0031]
Примеры дополнительного липидного компонента включают структурные липиды, способные образовывать липидную частицу. В качестве такого структурного липида можно использовать, например, по меньшей мере один, выбранный из группы, состоящей из следующих:
стерины (например, холестерин, холестериловый эфир, холестерилгемисукцинат);
фосфолипиды (например, фосфатидилхолин (например, дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, лизофосфатидилхолин, диолеилфосфатидилхолин, пальмитоилолеоилфосфатидилхолин, дилиноленоилфосфатидилхолин, MC-1010 (NOF CORPORATION), MC-2020 (NOF CORPORATION), MC-4040 (NOF CORPORATION)), фосфатидилсерин (например, дипальмитоилфосфатидилсерин, дистеароилфосфатидилсерин, диолеилфосфатидилсерин, пальмитоилолеоилфосфатидилсерин), фосфатидилэтаноламин (например, дипальмитоилфосфатидилэтаноламин, дистеароилфосфатидилэтаноламин, диолеилфосфатидилэтаноламин, пальмитоилолеоилфосфатидилэтаноламин, лизофосфатидилэтаноламин), фосфатидилинозитол, фосфатидная кислота); и
липиды с полиэтиленгликолем (PEG-липиды) (например, PEG-DAA, PEG-DAG, конъюгат PEG-фосфолипид, PEG-Cer, PEG-холестерин, PEG-C-DOMG, 2KPEG-CMG, GM-020 (NOF CORPORATION), GS-020 (NOF CORPORATION), GS-050 (NOF CORPORATION)). В рамках настоящего изобретения в качестве структурного липида предпочтительно использовать все три из них, а именно, стерин (в частности, холестерин), фосфолипид (в частности, фосфатидилхолин), и липид с полиэтиленгликолем.
[0032]
Соотношение между соединением по настоящему изобретению и структурным липидом в смешанном липидном компоненте, составляющем липидную частицу по настоящему изобретению, можно надлежащим образом контролировать в зависимости от назначения или применения. Например, доля структурного липида, как правило, составляет от 0,008 до 4 моль и предпочтительно от 0,4 до 1,5 моль на моль соединения по настоящему изобретению. В соответствии с другим определением соотношений в смешанном липидном компоненте, количество соединения по настоящему изобретению, как правило, составляет от 1 до 4 моль, количество стерина, как правило, составляет от 0 до 3 моль, количество фосфолипида, как правило, составляет от 0 до 2 моль, и количество липида с полиэтиленгликолем, как правило, составляет от 0 до 1 моль. В более предпочтительном варианте осуществления при использовании смеси соединения по настоящему изобретению и дополнительных липидных компонентов, в отношении соотношений, количество соединения по настоящему изобретению составляет от 1 до 1,5 моль, количество стерина составляет от 0 до 1,25 моль, количество фосфолипида составляет от 0 до 0,5 моль и количество липида с полиэтиленгликолем составляет от 0 до 0,125 моль.
[0033]
Соединение по настоящему изобретению можно использовать для получения липидной частицы по настоящему изобретению. Липидная частица по настоящему изобретению относится к комплексу, описанному выше, но не содержащему нуклеиновую кислоту. Форма липидной частицы по настоящему изобретению не ограничивается конкретной формой, и диапазон включает комплекс, в котором соединение по настоящему изобретению и т.д. собраны с образованием сферы; комплекс, в котором соединение по настоящему изобретению и т.д. собраны без образования конкретной формы; комплекс, котором соединение по настоящему изобретению и т.д. растворено в растворителе; и комплекс, в котором соединение по настоящему изобретению и т.д. однородно или гетерогенно диспергировано в дисперсионной среде.
[0034]
Липидную частицу по настоящему изобретению (например, липидная частица, состоящая из соединения по настоящему изобретению и структурных липидов, отличных от соединения) можно использовать, например, для получения композиции по настоящему изобретению, содержащей липидную частицу и нуклеиновую кислоту (в частности, нуклеиновую кислоту в качестве вещества, пригодного для фармацевтических применений или применений для исследований). Композицию по настоящему изобретению можно использовать в качестве лекарственного средства или реагента. Для композиции по настоящему изобретению предпочтительно, чтобы нуклеиновая кислота была инкапсулирована в липидной частице в настолько высоком соотношении, насколько это возможно (т.е. в высоком соотношении инкапсулирования).
[0035]
"Нуклеиновая кислота" может представлять собой любую молекулу, в которой молекулы нуклеотида или молекулы имеющие функции, эквивалентные функциям нуклеотида, полимеризованы, и их примеры включают РНК, которая представляет собой полимер из рибонуклеотидов; ДНК, которая представляет собой полимер из дезоксирибонуклеотидов; полимерные смеси рибонуклеотидов и дезоксирибонуклеотидов; и нуклеотидный полимер, включающий нуклеотидный аналог. Кроме того, нуклеиновая кислота может представлять собой нуклеотидный полимер, включающий производное нуклеиновой кислоты. Нуклеиновая кислота может представлять собой одноцепочечную нуклеиновую кислоту или двухцепочечную нуклеиновую кислоту. Концепция двухцепочечной нуклеиновой кислоты охватывает двухцепочечную нуклеиновую кислоту таким образом, что одна цепь гибридизована с другой цепью в жестких условиях.
[0036]
Нуклеотидный аналог может представлять собой любую молекулу, получаемую путем модификации рибонуклеотида, дезоксирибонуклеотида, РНК или ДНК для повышения резистентности к нуклеазам, для стабилизации, для повышения аффинности в отношении нуклеиновой кислоты комплементарной цепи и для повышения клеточной проницаемости по сравнению с РНК или ДНК, или для визуализации. Нуклеотидный аналог может представлять собой встречающуюся в природе молекулу или неприродную молекулу, и его примеры включают нуклеотидный аналог с модифицированным сахаром и нуклеотидный аналог с модифицированной фосфодиэфирной связью.
[0037]
Нуклеотидный аналог с модифицированным сахаром может представлять собой любой нуклеотидный аналог, полученный присоединением или замещением веществом, имеющий произвольную химическую структуру, части или целой химической структуры сахара нуклеотида. Его конкретные примеры включают нуклеотидный аналог, замещенный 2'-O-метилрибозой, нуклеотидный аналог, замещенный 2'-O-пропилрибозой, нуклеотидный аналог, замещенный 2'-метоксиэтоксирибозой, нуклеотидный аналог, замещенный 2'-O-метоксиэтилрибозой, нуклеотидный аналог, замещенный 2'-O-[2-(гуанидиний)этил]рибозой, нуклеотидный аналог, замещенный 2'-O-фторрибозой, сшитую искусственную нуклеиновую кислоту, предоставленную с двумя циклическими структурами путем внесения сшитой структуры в сахарную часть (мостиковая нуклеиновая кислота) (BNA), более конкретно, замкнутую искусственную нуклеиновую кислоту, в которой атом кислорода в положении 2' и атом углерода в положении 4' сшиты через метилен (замкнутая нуклеиновая кислота) (LNA) и сшитую этиленом искусственную нуклеиновую кислоту (нуклеиновая кислота с этиленовым мостиком) (ENA) [Nuleic Acid Research, 32, e175 (2004)], кроме того, пептидную нуклеиновую кислоту (PNA) [Acc. Chem. Res., 32, 624 (1999)], оксипептидную нуклеиновую кислоту (OPNA) [J. Am. Chem. Soc., 123, 4653 (2001)] и пептидно-рибонуклеиновую кислоту (PRNA) [J. Am. Chem. Soc., 122, 6900 (2000)].
[0038]
Нуклеотидный аналог с модифицированной фосфодиэфирной связью может представлять собой любой нуклеотидный аналог, полученный присоединением или замещением произвольным химическим веществом части или целой химической структуры фосфодиэфирной связи нуклеотида. Его конкретные примеры включают нуклеотидный аналог, замещенный фосфоротиоатной связью, и нуклеотидный аналог, замещенный N3'-P5' фосфорамидатной связью [Saibo Kogaku (на японском, переведенное название: Cell Engineering), 16, 1463-1473 (1997)] [RNAi and Antisense Strategies, KODANSHA LTD. (2005)].
[0039]
Производное нуклеиновой кислоты может представлять собой любую молекулу, полученную присоединением к нуклеиновой кислоте другого химического вещества для повышения устойчивости к нуклеазам, для стабилизации, для повышения аффинности в отношении нуклеиновой кислоты комплементарной цепи и для усиления клеточной проницаемости по сравнению с исходной нуклеиновой кислотой, или для визуализации. Его конкретные примеры включают производное с присоединенным 5'-полиамином, производное с присоединенным холестерином, производное с присоединенным стероидом, производное с присоединенной желчной кислотой, производное с присоединенным витамином, производное с присоединенным Cy5, производное с присоединенным Cy3, производное с присоединенным 6-FAM и производное с присоединенным биотином.
[0040]
Нуклеиновая кислота в рамках настоящего изобретения не ограничивается конкретной нуклеиновой кислотой и может представляет собой нуклеиновую кислоту, например, для облегчения заболевания, симптома, нарушения или недомогания, и смягчения заболевания, симптома, нарушения или патологического состояния, или для предупреждения их возникновения (в рамках настоящего писания иногда упоминается как "лечение и т.п. заболевания"), или нуклеиновую кислоту для регуляции экспрессии желаемого белка, который пригоден для исследования, даже несмотря на то, что белок не вносит вклад в лечение и т.п. заболевания.
[0041]
Гены или полинуклеотиды, связанные с заболеваниями (в настоящем описании иногда указываются как "связанные с заболеванием гены") доступны, например, от McKusick-Nathans Institute of Genetic Medicine, Johns Hopkins University (Baltimore, Md.) и National Center for Biotechnology Information, National Library of Medicine (Bethesda, Md.).
[0042]
Конкретные примеры нуклеиновой кислоты в рамках настоящего изобретения включают миРНК, кшРНК, мкРНК, миметики мкРНК, антисмысловые нуклеиновые кислоты, рибозимы, мРНК, нуклеиновые кислоты-ловушки, аптамеры, плазмидные ДНК, космидные ДНК и ДНК BAC. Предпочтительно нуклеиновая кислота представляет собой РНК, такую как миРНК и мРНК, или аналог или производное, полученное посредством искусственной модификации РНК.
[0043]
В рамках настоящего изобретения "миРНК" относится к двухцепочечной РНК или родственной ей молекуле, состоящей из 10-30 нуклеотидов, предпочтительно 15-25 нуклеотидов, и включающей комплементарные последовательности. миРНК включает выступающие нуклеотиды, предпочтительно содержащие от одного до трех нуклеотидов, более предпочтительно два нуклеотида, на 3'-конце. Часть комплеменатрных последовательностей может быть полностью комплементарной или может включать некомплементарные нуклеотиды, однако предпочтительно они являются полностью комплементарными.
[0044]
миРНК в рамках настоящего изобретения не ограничивается конкретной миРНК, и, например, можно использовать миРНК для нокдауна экспрессии связанного с заболеванием гена. Связанный с заболеванием ген относится к любому гену или полинуклеотиду, обеспечивающему продукт транскрипции или трансляции на аномальном уровне или в аномальной форме в клетках, происходящих из ткани пациента, по сравнению с тканью или клетками от свободного от заболевания контроля. Для миРНК по настоящему изобретению можно использовать миРНК для регуляции экспрессии желаемого белка, пригодного для исследований.
[0045]
В рамках настоящего изобретения "мРНК" относится к РНК, включающей нуклеотидную последовательность, которая может транслироваться в белок. мРНК в рамках настоящего изобретения не ограничивается конкретной мРНК и может представлять собой любую мРНК, способную экспрессировать желаемый белок в клетках. Предпочтительно мРНК представляет собой мРНК, пригодную для фармацевтических применений (например, применения для лечения заболевания) и/или применений для исследований, и примеры таких мРНК включают мРНК для экспрессии маркерного белка, такого как люцифераза, в клетках.
[0046]
Заболевание не ограничивается конкретным заболеванием, и примеры заболевания включают заболевания, приведенные ниже. Содержимое каждых "()" является примерами соответствующего связанного с заболеванием гена, за исключением случая, когда приведены конкретные примеры заболеваний. Другим примером нуклеиновой кислоты в рамках настоящего изобретения является нуклеиновая кислота, которая регулирует уровень экспрессии любого из связанных с заболеванием генов (или белка, кодируемого связанным с заболеванием геном).
(1) Заболевания кровеносной системы [анемия (CDAN1, CDA1, RPS19, DBA, PKLR, PK1, NT5C3, UMPH1, PSN1, RHAG, RH50A, NRAMP2, SPTB, ALAS2, ANH1, ASB, ABCB7, ABC7, ASAT), синдром голых лимфоцитов (TAPBP, TPSN, TAP2, ABCB3, PSF2, RING11, MHC2TA, C2TA, RFX5), геморрагические заболевания (TBXA2R, P2RX1, P2X1), дефицит фактора H и белка 1, подобного фактору H (HF1, CFH, HUS), дефицит фактора V и фактора VIII (MCFD2), дефицит фактора VII (F7), дефицит фактора X (F10), дефицит фактора XI (F11), дефицит фактора XII (F12, HAF), дефицит фактора XIIIA (F13A1, F13A), дефицит фактора XIIIB (F13B), анемию Фанкони (FANCA, FACA, FA1, FA, FAA, FAAP95, FAAP90, FLJ34064, FANCB, FANCC, FACC, BRCA2, FANCD1, FANCD2, FANCD, FACD, FAD, FACE, FACE, FANCF, XRCC9, FANCG, BRIP1, BACH1, FANCJ, PHF9, FANCL, FANCM, KIAA1596), гемофагоцитарный лимфогистиоцитоз (PRF1, HPLH2, UNC13D, MUNC13-4, HPLH3, HLH3, FHL3), гемофилия A (F8, F8C, HEMA), гемофилия B (F9, HEMB), геморрагические нарушения (PI, ATT, F5), дефицит лейкоцитов (ITGB2, CD18, LCAMB, LAD, EIF2B1, EIF2BA, EIF2B2, EIF2B3, EIF2B5, LVWM, CACH, CLE, EIF2B4), серповидно-клеточная анемия (HBB), талассемия (HBA2, HBB, HBD, LCRB, HBA1) и т.д];
(2) воспалительные/иммунологические заболевания [СПИД (KIR3DL1, NKAT3, NKB1, AMB11, KIR3DS1, IFNG, CXCL12, SDF1), аутоиммунный лимфопролиферативный синдром (TNFRSF6, APT1, FAS, CD95, ALPS1A), комбинированный иммунодефицит (IL2RG, SCIDX1, SCIDX, IMD4), ВИЧ-инфекция (CCL5, SCYA5, D17S135E, TCP228, IL10, CSIF, CMKBR2, CCR2, DMKBR5, CCCKR5, CCR5), иммунодефицит (CD3E, CD3G, AICDA, AID, HIGM2, TNFRSF5, CD40, UNG, DGU, HIGM4, TNFSF5, CD40LG, HIGM1, IGM, FOXP3, IPEX, AIID, XPID, PIDX, TNFRSF14B, TACI), воспаление (IL10, IL-1, IL-13, IL-17, IL-23, CTLA4), тяжелый комбинированный иммунодефицит (JAK3, JAKL, DCLRE1C, ATREMIS, SCIDA, RAG1, RAG2, ADA, PTPRC, CD45, LCA, IL7R, CD3D, T3D, IL2RG, SCIDX1, SCIDX, IMD4), ревматоидный артрит, псориаз, воспалительные заболевания кишечника (например, болезнь Крона, язвенный колит), синдром Шегрена, болезнь Бехчета, рассеянный склероз, системная красная волчанка, волчаночный нефрит, дискоидная красная волчанка, болезнь Кастлмана, анкилозирующий спондилит, полимиозит, дерматомиозит, узелковый полиартериит, смешанную болезнь соединительной ткани, дерматосклероз, волчанка глубокая, хронический тиреоидит, болезнь Грэйвса, аутоиммунный гастрит, сахарный диабет типа I и типа II, аутоиммунная гемолитическая анемия, аутоиммунная нейтропения, тромбоцитопения, атопический дерматит, хронический активный гепатит, миастения, реакция трансплантат против хозяина, болезнь Аддисона, аномальный иммунный ответ, артрит, дерматит, радиодерматит, первичный билиарный цирроз и т.д.];
(3) метаболические заболевания/заболевания печени/заболевания почек [амилоидная невропатия (TTR, PALB), амилоидоз (APOA1, APP, AAA, CVAP, AD1, GSN, FGA, LYZ, TTR, PALB), неалкогольный стеатогепатит и фиброз печени (COL1A1), цирроз (KRT18, KRT8, CIRH1A, NAIC, TEX292, KIAA1988), кистозный фиброз (CFTR, ABCC7, CF, MRP7), болезнь накопления гликогена (SLC2A2, GLUT2, G6PC, G6PT, G6PT1, GAA, LAMP2, LAMPB, AGL, GDE, GBE1, GYS2, PYGL, PFKM), печеночно-клеточная аденома (TCF1, HFN1A, MODY3), печеночная недостаточность (SCOD1, SCO1), дефицит печеночной липазы (LIPC), гепатобластома (CTNNB1, PDFGRL, PDGRL, PRLTS, AXIN1, AXIN, TP53, P53, LFS1, IGF2R, MPRI, MET, CASP8, MCH5), медуллярное кистозное заболевание почек (UMOD, HNFJ, FJHN, MCKD2, ADMCKD2), фенилкетонурия (PAH, PKU1, QDPR, DHPR, PTS), поликистоз почек и заболевания печени (FCYT, PKHD1, APRKD, PDK1, PDK2, PDK4, PDKTS, PRKCSH, G19P1, PCLD, SEC63), и т.д.];
(4) заболевания нервной системы [ALS (SOD1, ALS2, STEX, FUS, TARDBP, VEGF), болезнь Альцгеймера (APP, AAA, CVAP, AD1, APOE, AD2, PSEN2, AD4, STM2, APBB2, FE65L1, NOS3, PLAU, URK, ACE, DCP1, ACE1, MPO, PACIP1, PAXIP1L, PTIP, A2M, BLMH, BMH, PSEN1, AD3), аутизм (BZRAP1, MDGA2, GLO1, MECP2, RTT, PPMX, MRX16, MRX79, NLGN3, NLGN4, KIAA1260, AUTSX2), синдром ломкой Х-Хромосомы (FMR2, FXR1, FXR2, mGLUR5), болезнь Гентингтона (HD, IT15, PRNP, PRIP, JPH3, JP3, HDL2, TBP, SCA17), болезнь Паркинсона (NR4A2, NURR1, NOT, TINUR, SNCAIP, TBP, SCA17, SNCA, NACP, PARK1, PARK4, DJ1, DBH, NDUFV2), синдром Ретта (MECP2, RTT, PPMX, MRX16, MRX79, CDKL5, STK9), шизофрения (GSK3, 5-HTT, COMT, DRD, SLC6A3, DAOA, DTNBP1), связанное с секретазой нарушение (APH-1) и т.д.];
(5) заболевания глаз [связанная со старением дегенерация желтого пятна (Abcr, Ccl2, cp, Timp3, катепсин D, Vldlr, Ccr2), катаракта (CRYAA, CRYA1, CRYBB2, CRYB2, PITX3, BFSP2, CP49, CP47, PAX6, AN2, MGDA, CRYBA1, CRYB1, CRYGC, CRYG3, CCL, LIM2, MP19, CRYGD, CRYG4, BSFP2, CP49, CP47, HSF4, CTM, MIP, AQP0, CRYAB, CRYA2, CTPP2, CRYBB1, CRYGD, CRYG4, CRYA1, GJA8, CX50, CAE1, GJA3, CX46, CZP3, CAE3, CCM1, CAM, KRIT1), помутнение роговицы (APOA1, TGFB1, CSD2, CDGG1, CSD, BIGH3, CDG2, TASTD2, TROP2, M1S1, VSX1, RINX, PPCD, PPD, KTCN, COL8A2, FECD, PPCD2, PIP5K3, CFD), врожденное наследственное уплощение роговицы (KERA, CNA2), глаукома (MYOC, TIGR, GLC1A, JOAG, GPOA, OPTN, GLC1E, FIP2, HYPL, NRP, CYP1B1, GLC3A, OPA1, NTG, NPG, CYP1B1, GLC3A), врожденный амавроз Лебера (CRB1, RP12, CRX, CORD2, CRD, RPGRIP1, LCA6, CORD9, RPE65, RP20, AIPL1, LCA4, GUCY2D, GUC2D, LCA1, CORD6, RDH12, LCA3), макулодистрофия (ELOVL4, ADMD, STGD2, STGD3, RDS, RP7, PRPH2, PRPH, AVMD, AOFMD, VMD2) и т.д.]; и
(6) неопластические заболевания [злокачественная опухоль, неоваскулярная глаукома, инфантильная гемангиома, множественная миелома, хроническая саркома, метастазирующая меланома, саркома Капоши, ангиопролиферация, кахексия, метастазы и т.п. рака молочной железы, рак (например, рак ободочной и прямой кишки (например, семейный рак ободочной и прямой кишки, наследственный неполипозный рак ободочной и прямой кишки, желудочно-кишечная стромальная опухоль), рак легкого (например, немелкоклеточный рак легкого, мелкоклеточный рак легкого, злокачественная мезотелиома), мезотелиома, рак поджелудочной железы (например, карцинома протоков поджелудочной железы), рак желудка (например, папиллярная аденокарцинома, муцинозная аденокарцинома, плоскоклеточная аденокарцинома), рак молочной железы (например, инвазивная карцинома протоков молочной железы, неинвазивная карцинома протоков молочной железы, воспалительная карцинома молочной железы), рак яичника (например, эпителиальный рак яичника, внегонадная герминогенная опухоль, эмбрионально-клеточная опухоль яичников, низкозлокачественная опухоль яичников), рак предстательной железы (например, гормон-зависимый рак предстательной железы, гормон-независимый рак предстательной железы), рак печени (например, первичный рак печени, рак внепеченочных желчных протоков), рак щитовидной железы (например, медуллярный рак щитовидной железы), рак почки (например, почечноклеточный рак, переходно-клеточная карцинома почечной лоханки и мочеточника), рак тела матки, опухоль головного мозга (например, пинеальная астроцитома, пилоцитарная астроцитома, диффузная астроцитома, анапластическая астроцитома), меланома, саркома, рак мочевого пузыря, гематологическая злокачественная опухоль и т.п., включая множественную миелому, аденома гипофиза, глиома, неврилеммома слухового нерва, ретинальная саркома, фарингеальный рак, рак гортани, рак языка, тимома, карцинома пищевода, рак двенадцатиперстной кишки, рак толстого кишечника, рак прямой кишки, печеночно-клеточная карцинома, эндокринная опухоль поджелудочной железы, рак желчных протоков, рак желчного пузыря, рак полового члена, рак мочеточника, рак яичка, карцинома вульвы, рак шейки матки, рак тела матки, саркома матки, трофобластическое заболевание, рак влагалища, рак кожи, фунгоидный микоз, базалиома, саркома мягких тканей, злокачественная лимфома, болезнь Ходжкина, миелодиспластический синдром, взрослый T-клеточный лейкоз, хроническое миелопролиферативное заболевание, эндокринная опухоль поджелудочной железы, фиброзная гистиоцитома, лейомиосаркома, рабдомиосаркома, карцинома неизвестного происхождения), лейкоз (например, острый лейкоз (например, острый лимфоцитарный лейкоз, острый миелоидный лейкоз), хронический лейкоз (например, хронический лимфоцитарный лейкоз, хронический миелоидный лейкоз), миелодиспластический синдром), саркома матки (например, мезодермальная смешанная саркома матки, лейомиосаркома матки, опухоль стромы эндометрия), миелофиброз и т.д].
[0047]
Композицию по настоящему изобретению в качестве лекарственного средства можно получать с использованием способа, известного в области составления лекарственных средств, с фармацевтически приемлемым носителем. Примеры дозированной формы для лекарственного средства включают составы для парентерального введения (например, жидкость, такая как жидкость для инъекций), смешанные с общепринятыми вспомогательными веществами, такими как буферное вещество и/или стабилизатор; и составы для местного введения, такие как мазь, крем, жидкость и пластырь, смешанные с общепринятым фармацевтическим носителем.
[0048]
Композицию по настоящему изобретению можно использовать для введения активного ингредиента в различные типы клеток, тканей или органов. Примеры клеток, в которые можно вводить композицию по настоящему изобретению, включают мезенхимные стволовые клетки, нервные стволовые клетки, стволовые клетки кожи, спленоциты, нервные клетки, глиальные клетки, панкреатические B-клетки, клетки костного мозга, мезангиальные клетки, клетки Лангерганса, эпидермальные клетки, эпителиальные клетки, эндотелиальные клетки, фибробласты, волокнистые клетки, мышечные клетки (например, скелетно-мышечные клетки, кардиомиоциты, миобласты, сателлитные клетки, гладкомышечные клетки), жировые клетки, клетки крови (например, макрофаги, T-клетки, B-клетки, натуральные киллеры, тучные клетки, лейкоциты, нейтрофилы, базофилы, эозинофилы, моноциты, мегакариоциты, гемопоэтические стволовые клетки), синовиоциты, хондроциты, остеоциты, остеобласты, остеокласты, клетки молочной железы, гепатоциты или стромальные клетки, яйцеклетки, сперматиды или клетки предшественники, способные к индукции дифференцировки в эти клетки, стволовые клетки (например, включая индуцированные плюрипотентные стволовые клетки (клетки iPS), эмбриональные стволовые клетки (клетки ES)), примордиальные клетки, ооциты и оплодотворенные яйцеклетки. Примеры тканей или органов, в которые можно вводить композицию по настоящему изобретению, включают все ткани или органы, в которых присутствуют описанные выше клетки, например, головной мозг, области головного мозга (например, обонятельная луковица, миндалевидное тело, базальный ганглий, гиппокамп, таламус, гипоталамус, субталамическое ядро, кора головного мозга, продолговатый мозг, мозжечок, затылочная доля, передняя доля, височная доля, путамен, хвостатое ядро, мозолистое тело, черное вещество), спинной мозг, гипофиз, желудок, поджелудочную железу, почку, печень, гонаду, щитовидную железу, желчный пузырь, костный мозг, надпочечник, кожу, легкое, пищеварительный тракт (например, толстый кишечник, тонкий кишечник), кровеносный сосуд, сердце, тимус, селезенку, поднижнечелюстную железу, периферическую кровь, клетки периферической крови, предстательную железу, плаценту, матку, кости, суставы и мышцы (например, скелетная мышца, гладкая мышца, сердечная мышца). Эти клетки, ткани или органы могут представлять собой злокачественные клетки, злокачественные ткани и т.п., которые претерпели озлокачествление.
[0049]
Композиция по настоящему изобретению, в частности, является лучшей в отношении эффективности введения нуклеиновой кислоты в злокачественные клетки.
[0050]
Соединение, липидная частица и композиция по настоящему изобретению являются стабильными и имеют низкую токсичность, и их можно использовать безопасно. При использовании композиции по настоящему изобретению in vivo, или при использовании композиции в качестве лекарственного средства, композицию подходящим образом вводят индивидууму (например, человеку или не являющемуся человеку млекопитающему (предпочтительно, человеку)), чтобы в клетки-мишени можно было доставить эффективное количество нуклеиновой кислоты.
[0051]
При использовании композиции по настоящему изобретению in vivo или при использовании композиции в качестве лекарственного средства, композицию можно вводить перорально или парентерально (например, местное, ректальное или внутривенное введение) безопасным образом в форме фармацевтического состава, такого как таблетки (включая таблетки с сахарным покрытием, таблетки с пленочным покрытием, подъязычные таблетки, перорально дезинтегрирующие таблетки), порошки, гранулы, капсулы (включая мягкие капсулы, микрокапсулы), жидкости, лепешки, сиропы, эмульсии, суспензии, инъекционные формы (например, подкожные инъекции, внутривенные инъекции, внутримышечные инъекции, внутрибрюшинные инъекции), составы для местного применения (например, составы для назального введения, составы для трансдермального введения, мази), суппозитории (например, ректальные суппозитории, вагинальные суппозитории), гранулы, назальные составы, легочные составы (ингаляции) и инфузии. Каждый состав может представлять собой состав контролируемого высвобождения, такой как состав быстрого высвобождения и состав замедленного высвобождения (например, микрокапсула замедленного высвобождения).
[0052]
Далее описан способ получения соединения по настоящему изобретению.
[0053]
Каждый из исходных материалов и реагентов, используемых на каждой стадии способа получения, и полученного соединения может образовывать соль. Примерами таких солей являются упомянутые выше соли соединения по настоящему изобретению.
[0054]
Когда соединение, полученное на каждой стадии, представляет собой свободное соединение, соединение можно конвертировать в предполагаемую соль с использованием известного способа. Напротив, когда соединение, полученное на каждой стадии, представляет собой соль, соединение можно конвертировать в свободную форму или другую предполагаемую соль с использованием известного способа.
[0055]
Соединение, полученное на каждой стадии, можно использовать для последующей реакции непосредственно в качестве реакционного раствора, или из него можно получать неочищенный продукт и использовать для дальнейшей реакции. Альтернативно соединение, полученное на каждой стадии, можно выделять и/или очищать из реакционной смеси общепринятым способом с использованием способов разделения, таких как концентрирование, кристаллизация, перекристаллизация, перегонка, экстракция растворителем, фракционная перегонка и хроматография.
[0056]
Если соединение в качестве исходного материала или реагент на каждой стадии является коммерчески доступным, можно непосредственно использовать коммерчески доступный продукт.
[0057]
Время реакции для каждой реакции на каждой стадии, которое может варьироваться в зависимости от используемых реагентов и растворителей, как правило, составляет от 1 минуты до 48 часов, и предпочтительно от 10 минут до 8 часов, если нет иных указаний.
[0058]
Температура реакции для реакции на каждой стадии, которая может варьироваться в зависимости от используемых реагентов и растворителей, как правило, составляет от -78°C до 300°C, и предпочтительно от -78°C до 150°C, если нет иных указаний.
[0059]
Давление для реакции на каждой стадии, которое может варьироваться в зависимости от используемых реагентов и растворителей, как правило, составляет от 1 атм до 20 атм, и предпочтительно от 1 до 3 атм, если нет иных указаний.
[0060]
На стадии реакции иногда используют микроволновое устройство для синтеза, такое как Initiator, изготавливаемое Biotage. Температура реакции, которая может варьироваться в зависимости от используемых реагентов и растворителей, как правило, представляет собой температуру от комнатной температуры до 300°C, предпочтительно от комнатной температуры до 250°C, и более предпочтительно от 50°C до 250°C, если нет иных указаний. Время реакции, которое может варьироваться в зависимости от используемых реагентов и растворителей, как правило, составляет от 1 минуты до 48 часов, и предпочтительно от 1 минуты до 8 часов, если нет иных указаний.
[0061]
На каждой стадии реакции реагент используют в количестве от 0,5 эквивалента до 20 эквивалентов, предпочтительно в количестве от 0,8 эквивалента до 5 эквивалентов, относительно количества субстрата, если нет иных указаний. Когда в качестве катализатора используют реагент, реагент используют в количестве от 0,001 эквивалента до 1 эквивалента, предпочтительно в количестве от 0,01 эквивалента до 0,2 эквивалента, относительно количества субстрата, если нет иных указаний. Если реагент служит в качестве растворителя реакции в комбинации с его собственной функцией, реагент используют в количестве, соответствующем количеству растворителя.
[0062]
На каждой стадии реакции реакцию проводят без растворителя или в соответствующем растворителе, растворяющим или суспендирующим участвующие в реакции вещества, если нет иных указаний. Примеры растворителей включают растворители, описанные в примерах, и следующие растворители.
[0063]
Спирты: метанол, этанол, изопропанол, изобутанол, трет-бутиловый спирт, 2-метоксиэтанол и т.д.;
простые эфиры: диэтиловый эфир, диизопропиловый эфир, дифениловый эфир, тетрагидрофуран, 1,2-диметоксиэтан и т.д.;
ароматические углеводороды: хлорбензол, толуол, ксилол и т.д.;
насыщенные углеводороды: циклогексан, гексан, гептан и т.д.;
амиды: N, N-диметилформамид, N-метилпирролидон, и т.д.;
галогенированные углеводороды: дихлорметан, тетрахлорметан и т.д.;
нитрилы: ацетонитрил и т.д.;
сульфоксиды: диметилсульфоксид и т.д.;
ароматические органические основания: пиридин и т.д.;
ангидрид кислоты: уксусный ангидрид и т.д.;
органические кислоты: муравьиная кислота, уксусная кислота, трифторуксусная кислота, и т.д.;
неорганические кислоты: хлористоводородная кислота, серная кислота и т.д.;
сложные эфиры: этилацетат, изопропилацетат и т.д.;
кетоны: ацетон, метилэтилкетон и т.д.; и
воды.
Два или более из этих растворителей можно использовать для применения в подходящем соотношении.
[0064]
Когда в реакции на каждой стадии используют основание, используют, например, любое из оснований, приведенных ниже, или основания, описанные в примерах.
[0065]
Неорганические основания: гидроксид натрия, гидроксид калия, гидроксид магния и т.д.; Неорганические основания: гидроксид натрия, гидроксид калия, гидроксид магния и т.д.;
основные соли: карбонат натрия, карбонат кальция, гидрокарбонат натрия и т.д.;
органические основания: триэтиламин, диэтиламин, пиридин, 4-диметиламинопиридин, N, N-диметиланилин, 1,4-диазабицикло[2.2.2]октан, 1,8-диазабицикло[5.4.0]-7-ундецен, имидазол, пиперидин и т.д.;
алкоксиды металлов: этоксид натрия, трет-бутоксид калия, трет-бутоксид натрия и т.д.;
гидриды щелочных металлов: гидрид натрия и т.д.;
амиды металлов: амид натрия, диизопропиламид лития, гексаметилдисилазид лития и т.д.; и
литийорганические соединения: н-бутиллитий, втор-бутиллитий и т.д.
[0066]
Когда в реакции на каждой стадии используют кислоту или кислотный катализатор, используют, например, любую из кислот и кислотных катализаторов, приведенных ниже, и кислот и кислотных катализаторов, описанных в примерах.
[0067]
Неорганические кислоты: хлористоводородная кислота, серная кислота, азотная кислота, бромистоводородная кислота, фосфорная кислота и т.д.;
органические кислоты: уксусная кислота, трифторуксусная кислота, лимонная кислота, п-толуолсульфоновая кислота, 10-камфорсульфоновая кислота и т.д.; и
Кислоты Льюиса: комплексс трифторид бора-диэтиловый эфир, йодид цинка, безводный хлорид алюминия, безводный хлорид цинка, безводный хлорид железа и т.д.
[0068]
Если нет иных указаний, реакцию на каждой стадии проводят в соответствии с известным способом, таким как способ, описанный в The Fifth Series of Experimental Chemistry, Vol. 13 to 19 (The Chemical Society of Japan (ed.)); Shin Jikken Kagaku Koza (на японском, перевод названия: New Experimental Chemistry), Vol. 14 и 15 (The Chemical Society of Japan (ed.)); Seimitsu Yuki Kagaku (на японском, перевод названия: Precise Organic Chemistry, оригинальное название: Reaktionen und Synthesen im organisch-chemischen Praktikum und Forschungslaboratorium) Revised 2nd Edition (L. F. Tietze, Th. Eicher, Nankodo Co., Ltd.); Organic Name Reaction; The Reaction Mechanism and Essence Revised Edition (TOGO, Hideo, KODANSHA LTD.); ORGANIC SYNTHESES Collective Volume I to VII (John Wiley & Sons Inc.); Modern Organic Synthesis in the Laboratory A Collection of Standard Experimental Procedures (Jie Jack Li, Oxford University Pres); Comprehensive Heterocyclic Chemistry III, Vol. 1 to Vol. 14 (Elsevier Japan K.K.); Strategic Applications of Named Reactions in Organic Synthesis (руководитель перевода: TOMIOKA, Kiyoshi, publisher: Kagaku-Dojin Publishing Company, INC.); Comprehensive Organic Transformations (VCH Publishers Inc.) (1989); и т.п., или в соответствии со способом, описанным в примерах.
[0069]
Реакцию внесения или удаления защитной группы для функциональной группы на каждой стадии проводят в соответствии с известным способом, таким как способ, описанный в "Protective Groups in Organic Synthesis, 4th Ed." (Theodora W. Greene, Peter G. M. Wuts), опубликованной Wiley-Interscience Publication, 2007; "Protective groups 3rd Ed." (P. J. Kocienski), опубликованной Thieme Medical Publishers, 2004; и т.п., или в соответствии со способом, описанным в примерах.
[0070]
Примеры защитных групп для гидроксигруппы спиртов и т.п. и фенольных гидроксигрупп включают защитные группы типа простого эфира, такие как метоксиметиловый эфир, бензиловый эфир, п-метоксибензиловый эфир, трет-бутилдиметилсилиловый эфир, трет-бутилдифенилсилиловый эфир и тетрагидропираниловый эфир; защитные группы типа карбоксилата, такие как ацетат; сложные эфиры типа сульфоната, такие как метансульфонат; и защитные группы типа карбоната, такие как трет-бутилкарбонат.
[0071]
Примеры защитных групп для карбонильной группы альдегидов включают защитные группы типа ацеталя, такие как диметилацеталь; и защитные группы типа циклического ацеталя, такие как циклический 1,3-диоксан.
[0072]
Примеры защитных групп для карбонильной группы кетонов включают защитные группы типа кеталя, такие как диметилкеталь; защитные группы типа циклического кеталя, такие как циклический 1,3-диоксан; защитные группы типа оксима, такие как O-метилоксим; и защитные группы типа гидразона, такие как N, N-диметилгидразон.
[0073]
Примеры защитных групп для карбоксигруппы включают защитные группы типа сложного эфира, такие как метиловый эфир; и защитные группы типа амида, такие как N, N-диметиламид.
[0074]
Примеры защитных групп для тиола включают защитные группы типа простого эфира, такие как бензиловый тиоэфир; и защитные группы типа сложного эфира, такие как тиоацетат, тиокарбонат и тиокарбамат.
[0075]
Примеры защитных групп для аминогруппы и ароматических гетероциклов, таких как имидазол, пиррол и индол, включают защитные группы типа карбамата, такие как бензилкарбамат; защитные группы типа амида, такие как ацетамид; защитные группы типа алкиламина, такие как N-трифенилметиламин; и защитные группы типа сульфонамида, такие как метансульфонамид.
[0076]
Удаление защитной группы можно проводить с использованием известного способа, такого как способ с использованием кислоты, основания, ультрафиолетового света, гидразина, фенилгидразина, N-метилдитиокарбамата натрия, фторида тетрабутиламмония, ацетата палладия или триалкилсилилгалогенида (например, триметилсилилйодид, триметилсилилбромид), или с использованием способа восстановления.
[0077]
Примеры восстановителей для применения, когда проводят реакцию восстановления, на каждой стадии включают гидриды металлов, такие как алюмогидрид лития, триацетоксиборгидрид натрия, цианоборгидрид натрия, гидрид диизобутилалюминия (DIBAL-H), боргидрид натрия и триацетоксиборгидрид тетраметиламмония; боргидриды, такие как комплекс боргидрид-тетрагидрофуран; никель Ренея; кобальт Ренея; водород и муравьиную кислоту. Например, никель Ренея или кобальт Ренея можно использовать в присутствии водорода или муравьиной кислоты. Когда восстанавливают углерод-углеродную двойную связь или тройную связь, можно использовать способ с использованием катализатора, такого как палладий на угле и катализатор Линдлара.
[0078]
Примеры окислителей для применения, когда проводят реакцию окисления, на каждой стадии включают перкислоты, такие как м-хлорпербензойная кислота (MCPBA), пероксид водорода и трет-бутилгидропероксид; перхлораты, такие как перхлорат тетрабутиламмония; хлораты, такие как хлорат натрия; хлориты, такие как хлорит натрия; перйодаты, такие как перйодат натрия; гипервалентные йодные реагенты, такие как йодозилбензол; содержащие марганец реагенты, такие как диоксид марганца и перманганат калия; соединения свинца, такие как тетраацетат свинца; содержащие хром реагенты, такие как хлорхромат пиридиния (PCC), дихромат пиридиния (PDC) и реагент Джонса; соединения галогенов, такие как N-бромсукцинимид (NBS); кислород; озон; комплекс триоксид серы-пиридин; тетроксид осмия; диоксид селена; и 2,3-дихлор-5,6-дициано-1,4-бензохинон(DDQ).
[0079]
Примеры инициаторов радикалов для применения, когда проводят реакцию радикальной циклизации, на каждой стадии включают азосоединения, такие как азобисизобутиронитрил (AIBN); растворимые в воде инициаторы радикалов, такие как 4-4'-азобис-4-цианопентановая кислота (ACPA); триэтилбор в присутствии воздуха или кислорода; и бензоилпероксид. Примеры реагентов радикальной реакции для применения включают трибутилстаннан, тристриметилсилилсилан, 1,1,2,2-тетрафенилдисилан, дифенилсилан и йодид самария.
[0080]
Примеры реагентов Виттига для применения, когда проводят реакцию Виттига, на каждой стадии включают алкилиденфосфораны. Алкилиденфосфораны можно получать с использованием известного способа, такого как реакция соли фосфония и сильного основания.
[0081]
Примеры реагентов для применения, когда проводят реакцию Хорнера-Эммонса, на каждой стадии включают фосфоноацетаты, такие как метилдиметилфосфоноацетат и этилдиэтилфосфоноацетат; и основания, такие как гидриды щелочных металлов и литийорганические соединения.
[0082]
Примеры реагентов для применения, когда проводят реакцию Фриделя-Крафтса, на каждой стадии включают кислоту Льюиса с хлорангидридом кислоты или алкилирующим средством (например, галогенированный алкил, спирт, олефин). Альтернативно вместо кислоты Льюиса можно использовать органическую кислоту или неорганическую кислоту, и можно использовать ангидрид кислоты, такой как уксусный ангидрид, вместо хлорангидрида кислоты.
[0083]
Когда проводят реакцию ароматического нуклеофильного замещения, на каждой стадии в качестве реагентов используют нуклеофил (например, амин, имидазол) и основание (например, основная соль, органическое основание).
[0084]
Примеры оснований, используемых для получения карбаниона, когда проводят реакцию нуклеофильного присоединения с карбанионом, реакцию нуклеофильного 1,4-присоединения с карбанионом (реакция присоединения Майкла) или реакцию нуклеофильного замещения с карбанионом, включают литийорганические соединения, алкоксиды металлов, неорганические основания и органические основания.
[0085]
Примеры реагентов Гриньяра для применения, когда проводят реакцию Гриньяра, на каждой стадии включают галогениды арилмагния, такие как бромид фенилмагния; и галогениды алкилмагния, такие как бромид метилмагния и бромид изопропилмагния. Реагенты Гриньяра можно получать с использованием известного способа, такого как реакция галогенированного алкила или галогенированного арила и металлического магния в растворителе из простого эфира или тетрагидрофурана.
[0086]
Когда проводят реакцию конденсации Кневенагеля, на каждой стадии в качестве реагентов используют активное соединение метилена, находящееся между двумя электроноакцепторными группами (например, малоновая кислота, диэтилмалонат, малононитрил) и основанием (например, органическое основание, алкоксид металла, неорганическое основание).
[0087]
Когда проводят реакцию Вильсмейера-Хаака, на каждой стадии в качестве реагентов используют фосфорилхлорид и производное амида (например, N, N-диметилформамид).
[0088]
Примеры азидирующих агентов для применения, когда проводят реакцию азидирования для спирта, алкилгалогенида или сульфоната на каждой стадии включают дифенилфосфорилазид (DPPA), триметилсилилазид и азид натрия. Когда азидируют спирт, можно использовать, например, способ с использованием дифенилфосфорилазида и 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU) или способ с использованием триметилсилилазида и кислоты Льюиса.
[0089]
Примеры восстановителей для применения, когда проводят реакцию восстановительного аминирования, на каждой стадии включают триацетоксиборгидрид натрия, цианоборгидрид натрия, водород и муравьиную кислоту. Примеры карбонильных соединений для применения, когда субстратом является аминосоединение, включают альдегиды, такие как параформальдегид, а также ацетальдегид, и кетоны, такие как циклогексанон. Примеры аминов для применения, когда субстратом является карбонильное соединение, включают аммиак; первичные амины, такие как метиламин; и вторичные амины, такие как диметиламин.
[0090]
Когда проводят реакцию Мицунобу, на каждой стадии в качестве реагентов используют азодикарбоксилат (например, диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD)) и трифенилфосфин.
[0091]
Примеры реагентов для применения, когда проводят реакцию этерификации, реакцию амидирования или реакцию образования мочевины, на каждой стадии включают галогенированные формы ацилов, такие как хлорангидриды и бромангидриды; и активированные карбоновые кислоты, такие как ангидриды кислот, активированные формы сложных эфиров и формы сульфатов. Примеры активаторов для карбоновых кислот включают карбодиимидные конденсирующие агенты, такие как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (WSCD); конденсирующие агенты на основе триазина, такие как хлорид-н-гидрат 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния (DMT-MM); карбонатные конденсирующие агенты, такие как 1,1-карбонилдиимидазол (CDI); дифенилфосфорилазид (DPPA); соль бензотриазол-1-илокси-трисдиметиламинофосфония (реагент BOP); йодид 2-хлор-1-метилпиридиния (реагент Мукаямы); тионилхлорид; низшие алкилгалогенформиаты, такие как этилхлорформиат; гексафторфосфат O-(7-азабензотриазол-1-ил)-N, N,N',N'-тетраметилурония (HATU); серную кислоту и любую их комбинацию. Когда используют карбодиимидный конденсирующий агент, в реакционную смесь можно дополнительно добавлять добавку, такую как 1-гидроксибензотриазол (HOBt), N-гидроксисукцинимид (HOSu) и диметиламинопиридин (DMAP).
[0092]
Примеры металлических катализаторов для применения, когда проводят реакцию сочетания, на каждой стадии включают соединения палладия, такие как ацетат палладия(II), тетракис(трифенилфосфин)палладий(0), дихлорбис(трифенилфосфин)палладий(II), дихлорбис(триэтилфосфин)палладий(II), трис(дибензилиденацетон)дипалладий(0), хлорид 1,1'-бис(дифенилфосфино)ферроценпалладия(II) и ацетат палладия(II); соединения никеля, такие как тетракис(трифенилфосфин)никель(0); соединения родия, такие как хлорид трис(трифенилфосфин)родия(III); соединения кобальта; соединения меди, такие как оксид меди и йодид меди(I); и соединения платины. В реакционную смесь, кроме того, можно добавлять основание, и примеры основания включают неорганические основания и основные соли.
[0093]
Когда проводят реакцию тиокарбонилирования, на каждой стадии, как правило, в качестве агента тиокарбонилирования используют пентасульфид дифосфора; однако можно использовать не только пентасульфид дифосфора, но также реагент, имеющий структуру 1,3,2,4-дитиадифосфетан-2,4-дисульфида, такую как 2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфид (реагент Лавессона).
[0094]
Примеры галогенирующих агентов для применения, когда проводят реакцию Воль-Циглер, на каждой стадии включают N-йодсукцинимид, N-бромсукцинимид (NBS), N-хлорсукцинимид (NCS), бром и сульфурилхлорид. Кроме того, реакцию можно ускорять с использованием нагревания, света или инициатора радикалов, такого как бензоилпероксид и азобисизобутиронитрил.
[0095]
Примеры галогенирующих агентов для применения, когда проводят реакцию галогенирования, для гидроксигруппы на каждой стадии включают галогенводородные кислоты и галогенангидриды неорганических кислот, в частности, хлористоводородную кислоту, тионилхлорид, оксихлорид фосфора для хлорирования и 48% бромистоводородную кислоту для бромирования. Можно использовать способ, в котором форму галогенированного алкила получают из спирта под действием трифенилфосфина и тетрахлорметана, тетрабромида углерода и т.п. Альтернативно можно использовать способ, в котором форму галогенированного алкила синтезируют посредством двухстадийной реакции, так чтобы спирт конвертировался в сульфат, а затем реакции с бромидом лития, хлоридом лития или йодидом натрия.
[0096]
Примеры реагентов для применения, когда проводят реакцию Арбузова, на каждой стадии включают галогенированные алкилы, такие как бромэтилацетат; и фосфиты, такие как триэтилфосфит и три(изопропил)фосфит.
[0097]
Примеры сульфонирующих агентов для применения, когда проводят реакцию сульфонирования, на каждой стадии включают метансульфонилхлорид, п-толуолсульфонилхлорид, метансульфоновый ангидрид, п-толуолсульфоновый ангидрид и трифторметансульфоновый ангидрид.
[0098]
Когда проводят реакцию гидролиза, на каждой стадии в качестве реагента используют кислоту или основание. Когда проводят реакцию кислотного гидролиза для трет-бутилового эфира, в некоторых случаях добавляют муравьиную кислоту или триэтилсилан для восстановительного улавливания трет-бутиловых катионов, продуцированных в качестве побочных продуктов.
[0099]
Примеры дегидратирующих агентов для применения, когда проводят реакцию дегидратации, на каждой стадии включают серную кислоту, пентоксид дифосфора, оксихлорид фосфора, N, N'-дициклогексилкарбодиимид, оксид алюминия и полифосфорную кислоту.
[0100]
Соединение (I) можно получать, например, с использованием способа получения, показанного ниже. Среди соединений (I), соединение, в котором каждая из волнистых линий образует цис-структуру, и соединение, в котором одна или обе из волнистых линий образуют транс-структуру, можно в обоих случаях получать с использованием того же способа получения, что и способ получения, показанный ниже. В рамках настоящего изобретения соединение (I) с желаемой структурой можно синтезировать с использованием подходящего исходного материала для предполагаемой структуры соединения (I), в частности, при этерификации. Соль соединения (I) можно получать путем подходящего смешения с неорганическим основанием, органическим основанием, органической кислотой или основной или кислотой аминокислотой.
[0101]
[Формула 4]
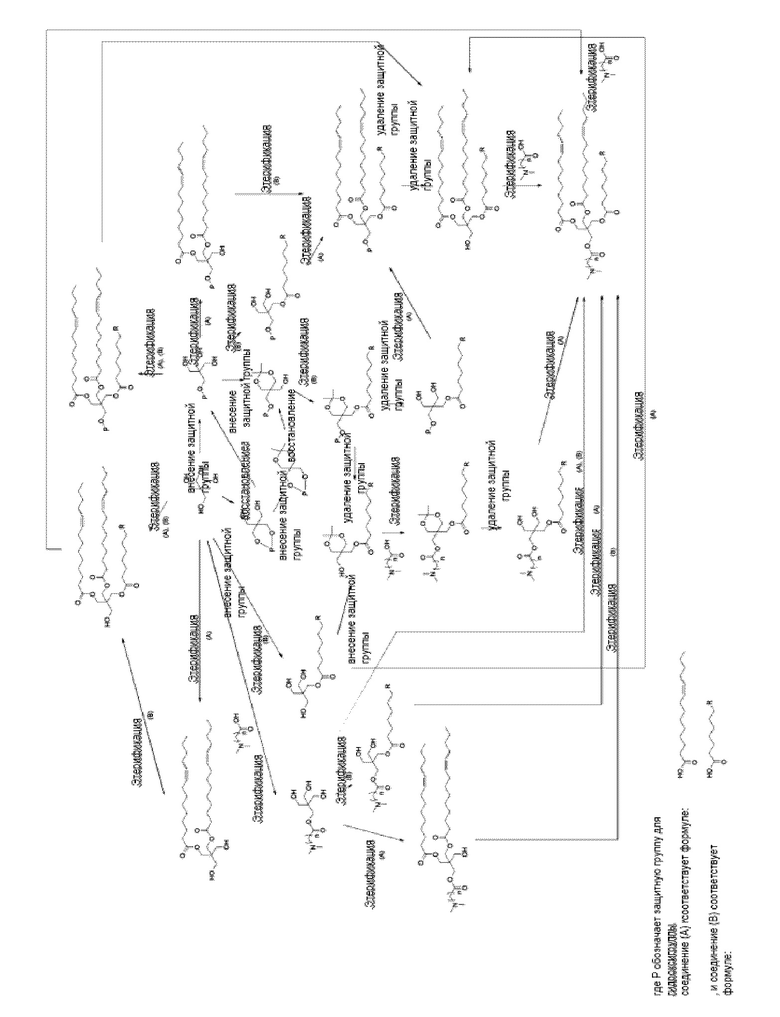
[0102]
Далее описан способ получения липидной частицы, содержащей соединение по настоящему изобретению, и способ получения композиции, содержащей липидную частицу и нуклеиновую кислоту для введения нуклеиновой кислоты.
[0103]
Липидную частицу по настоящему изобретению можно получать путем смешения соединения по настоящему изобретению (катионный липид) и при необходимости дополнительного липидного компонента, а затем применения способа для получения липидной частицы из липидного компонента. Например, липидную частицу можно получать в качестве дисперсии липидных частиц путем растворения (смешанного) липидного компонента в органическом растворителе и смешения полученного раствора в органическом растворителе с водой или буфером (например, способом эмульгации). Смешение можно проводить с использованием микрофлюидный смесительной системы (например, устройство NanoAssemblr (Precision NanoSystems)). Полученную липидную частицу можно подвергать обессоливанию или диализу и стерилизации фильтрованием. При необходимости можно проводить коррекцию pH или коррекцию осмотического давления.
[0104]
Соединение (I) может образовывать различные структуры в зависимости от комбинации определений n, R и волнистых линий формулы (I). Для получения липидной частицы в качестве соединения (I) можно использовать одно соединение, имеющее конкретную структуру, отдельно, и в качестве соединения (I) можно использовать смесь множества соединений различных структур.
[0105]
Примеры "дополнительного липидного компонента" включают упомянутые выше структурные липиды, такие как стерины, фосфолипиды и липиды с полиэтиленгликолем. "Дополнительный липидный компонент" используют, например, в количестве от 0,008 до 4 моль на моль соединения по настоящему изобретению. Соединение по настоящему изобретению предпочтительно используют в качестве смеси с дополнительным липидным компонентом (в частности, холестерин, фосфатидилхолин и липид с полиэтиленгликолем). В предпочтительном варианте осуществления при использовании смеси соединения по настоящему изобретению и дополнительного липидного компонента смесь представляет собой смесь от 1 до 4 моль соединения по настоящему изобретению, от 0 до 3 моль стерина, от 0 до 2 моль фосфолипида, и от 0 до 1 моль липида с полиэтиленгликолем. В более предпочтительном варианте осуществления при использовании смеси соединения по настоящему изобретению и дополнительного липидного компонента смесь представляет собой смесь от 1 до 1,5 моль соединения по настоящему изобретению, от 0 до 1,25 моль стерина, от 0 до 0,5 моль фосфолипида, и от 0 до 0,125 моль липида с полиэтиленгликолем.
[0106]
Концентрация соединения по настоящему изобретению или смеси соединения по настоящему изобретению и дополнительного липидного компонента в растворе органического растворителя предпочтительно составляет от 0,5 до 100 мг/мл.
[0107]
Примеры органического растворителя включают метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, трет-бутанол, ацетон, ацетонитрил, N, N-диметилформамид, диметилсульфоксид и их смеси. Органический растворитель может содержать от 0 до 20% воды или буфера.
[0108]
Примеры буфера включают кислотные буферы (например, ацетатный буфер, цитратный буфер, 2-морфолиноэтансульфонатный (MES) буфер, фосфатный буфер) и нейтральные буферы (например, 4-(2-гидроксиэтил)-1-пиперазинэтансульфонатный (HEPES) буфер, буфер на основе трис(гидроксиметил)аминометана (Tris), фосфатнвый буфер, фосфатно-солевой буфер (PBS)).
[0109]
Если смешение проводят с использованием микрофлюидной системы смешения, предпочтительно смешивать от 1 до 5 частей по объему воды или буфера на часть по объему раствора органического растворителя. Скорость потока смешиваемого раствора (смешиваемый раствор раствора органического растворителя и воды или буфера) в системе предпочтительно составляет от 0,1 до 10 мл/мин, и температура предпочтительно составляет от 15 до 45°C.
[0110]
Композицию по настоящему изобретению можно получать в качестве дисперсии липидных частиц, содержащей активный ингредиент, путем добавления заранее нуклеиновой кислоты в качестве активного ингредиента в воду или буфер для получения липидной частицы или дисперсии липидных частиц. Активный ингредиент предпочтительно добавляют так, чтобы концентрация активного ингредиента в воде или буфере достигала от 0,05 до 2,0 мг/мл.
[0111]
Кроме того, композицию по настоящему изобретению можно получать в качестве дисперсии липидных частиц, содержащей активный ингредиент, путем смешения липидной частицы или дисперсии липидных частиц и активного ингредиента или водного раствора активного ингредиента известным способом. Дисперсию липидных частиц можно получать путем диспергирования липидных частиц в соответствующей дисперсионной среде. Водный раствор активного ингредиента можно получать путем растворения активного ингредиента в соответствующем растворителе.
[0112]
Содержание соединения по настоящему изобретению в композиции по настоящему изобретению, не включая дисперсионную среду и растворитель, предпочтительно составляет от 40 до 70% по массе.
[0113]
Содержание активного ингредиента в композиции по настоящему изобретению, не включая дисперсионную среду и растворитель, предпочтительно составляет от 1 до 20% по массе.
[0114]
Дисперсионную среду дисперсии липидных частиц или дисперсии, содержащей композицию, можно заменять водой или буфером посредством диализа. Диализ проводят с использованием мембраны ультрафильтрации, имеющей пороговое значение молекулярной массы от 10 до 20K при от 4°C до комнатной температуры. Диализ можно проводить неоднократно. Для замены дисперсионной среды можно использовать проточную фильтрацию вдоль потока (TFF). После замены дисперсионной среды при необходимости можно проводить коррекцию pH или коррекцию осмотического давления.
[0115]
Далее описаны способы анализа липидной частицы, содержащей соединение по настоящему изобретению, и композиции, содержащий липидную частицу и нуклеиновую кислоту в качестве активного ингредиента.
[0116]
Размер частиц липидной частицы (в композиции) можно определять с использованием известных способов. Например, Zetasizer Nano ZS (Malvern Instruments Limited), анализатор размера частиц на основе NIBS (технология неинвазивного обратного рассеяния), можно использовать для вычисления размера частиц в качестве z-среднего размера частиц посредством кумулянтного анализа автокорреляционной функции. Размер частиц (средний размер частиц) для липидной частицы (в композиции) предпочтительно составляет 10 до 200 нм.
[0117]
Концентрация и доля нуклеиновой кислоты при инкапсулировании (например, миРНК, мРНК) в качестве активного ингредиента в композиции по настоящему изобретению можно определять с использованием известных способов. Например, после флуоресцентного мечения нуклеиновой кислоты посредством Quant-iT (TM) RiboGreen (R) (Invitrogen), концентрацию и долю при инкапсулировании можно определять путем определения интенсивности флуоресценции. Концентрацию нуклеиновой кислоты в композиции можно вычислять с использованием стандартной кривой, полученной для водных растворов нуклеиновой кислоты с известными концентрациями и долю при инкапсулировании можно вычислять, исходя из разности интенсивности флуоресценции, в зависимости от наличия или отсутствия Triton-X100 (поверхностно-активное вещество для дезинтеграции липидной частицы). Концентрация нуклеиновой кислоты в композиции относится к общей концентрации молекул нуклеиновых кислот, инкапсулированных в липидную молекул, и молекул нуклеиновых кислот, не инкапсулированных в липидную частицу, и доля при инкапсулировании относится к отношению молекул нуклеиновых кислот, инкапсулированных в липидную частицу, ко всем молекулам нуклеиновых кислот в композиции.
Примеры
[0118]
Настоящее изобретение далее подробно описано с помощью примеров, примеров тестирования и примеров составления; однако они не ограничивают настоящее изобретение и можно вносить модификацию без отклонения от объема настоящего изобретения.
[0119]
"Комнатная температура" в примерах ниже, как правило, указывает на от приблизительно 10°C до приблизительно 35°C. Каждое соотношение, показанное для смешенного растворителя, указывает на объемное соотношение, если нет иных указаний. % указывает на % по массе, если нет иных указаний.
[0120]
Элюирование в колоночной хроматографии проводили под наблюдением при помощи TLC (тонкослойная хроматография), если не указано иное. При наблюдении при помощи TLC, 60 F254, продуцируемый Merck KGaA, использовали в качестве пластины TLC, и растворитель, использованный в качестве растворителя для элюирования в колоночной хроматографии, использовали в качестве элюента. Для детекции использовали УФ-детектор и наблюдение при необходимости проводили с использованием реагента для окрашивания TLC. При описании колоночной хроматографии на силикагеле NH указывает на то, что использовали силикагель, связанный с аминопропилсиланом, и диол указывает на то, что использовали силикагель, связанный с 3-(2,3-дигидроксипропокси)пропилсиланом. При описании препаративной ВЭЖХ (высокоэффективная жидкостная хроматография), C18 указывает на то, что использовали октадецил-связанный силикагель. Каждое соотношение, показанное для растворителя элюирования, указывает на объемное соотношение, если нет иных указаний.
[0121]
1H-ЯМР проводили с использованием ЯМР с преобразованием Фурье. Для анализа с использованием 1H-ЯМР использовали программное обеспечение ACD/SpecManager (наименование продукта) и т.д. Иногда для пиков для гидроксигруппы, аминогруппы и т.д. с очень широким протонным пиком описание отсутствует.
[0122]
MS измеряли посредством LC/MS и MALDI/TOFMS. Для способа ионизации использовали способ ESI, способ APCI или способ MALDI. Для матрикса использовали CHCA. Измеренные величины (найденные) указаны в качестве данных. В типичных случаях некоторые молекулярные ионные пики наблюдают в качестве фрагментных ионов. В случае соли, как правило, наблюдают молекулярный ионный пик для свободной форы или катионные, анионные или фрагментные ионные пики.
[0123]
В приведенных ниже примерах используются следующие сокращенные обозначения.
MS: Спектр масс
M: молярная концентрация
N: нормальность
CDCl3: дейтерированный хлороформ
DMSO-d6: дейтерированный диметилсульфоксид
1H-ЯМР: протонный ядерный магнитный резонанс
LC/MS: жидкостной хроматограф/масс-спектрометр
ESI: электрораспылительная ионизация
APCI: химическая ионизация при атмосферном давлении
MALDI: матрично-активированная лазерная десорбция/ионизация
TOFMS: времяпролетная масс-спектрометрия
CHCA: α-циано-4-гидроксикоричная кислота
DMF: N, N-диметилформамид
THF: Тетрагидрофуран
DMAP: 4-Диметиламинопиридин
TBAF: Фторид тетрабутиламмония
[0124]
[Пример 1] 3-((4-(диметиламино)бутаноил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноат
A) 2-(((трет-бутилдиметилсилил)окси)метил)-2-(гидроксиметил)пропан-1,3-диол
К смеси 2,2-бис(гидроксиметил)пропан-1,3-диола (5,45 г), 1H-имидазола (2,72 г) и DMF (190 мл), добавляли раствор трет-бутилхлордиметилсилана (3,01 г) в DMF (10 мл) при комнатной температуре. После перемешивания в течение 24 часов реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли этилацетатом, промывали три раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (2,25 г).
1H-ЯМР (300 МГц, CDCl3) δ м.д. 0,08 (6H, с), 0,90 (9H, с), 2,53 (3H, т, J=5,5 Гц), 3,66 (2H, с), 3,73 (6H, д, J=5,5 Гц)
[0125]
B) 3-((трет-бутил(диметил)силил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноат
К раствору 2-(((трет-бутилдиметилсилил)окси)метил)-2-(гидроксиметил)пропан-1,3-диола (258 мг), (9Z)-тетрадец-9-еновой кислоты (769 мг) и DMAP (126 мг) в DMF (3 мл), добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (790 мг) при комнатной температуре. После перемешивания в течение 18 часов реакционную смесь разбавляли этилацетатом, промывали два раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (860 мг).
1H-ЯМР (300 МГц, CDCl3) δ м.д. 0,03 (6H, с), 0,81-0,96 (18H, м), 1,18-1,41 (36H, м), 1,53-1,67 (6H, м), 1,91-2,10 (12H, м), 2,29 (6H, т, J=7,6 Гц), 3,58 (2H, с), 4,08 (6H, с), 5,27-5,43 (6H, м).
[0126]
C) 3-гидрокси-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноат
К раствору 3-((трет-бутил(диметил)силил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноата (5,91 г) в THF (120 мл) добавляли смесь раствора TBAF в THF (1 M, 14,85 мл) и уксусной кислоты (4,91 мл) при комнатной температуре. После перемешивания в течение 3 суток, реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли этилацетатом, промывали один раз насыщенным водным раствором гидрокарбоната натрия и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (4,96 г).
1H-ЯМР (300 МГц, CDCl3) δ м.д. 0,82-0,97 (9H, м), 1,16-1,42 (36H, м), 1,52-1,68 (6H, м), 1,90-2,12 (12H, м), 2,32 (6H, т, J=7,6 Гц), 2,52 (1H, т, J=7,0 Гц), 3,49 (2H, д, J=7,0 Гц), 4,11 (6H, с), 5,26-5,42 (6H, м).
[0127]
D) 3-((4-(диметиламино)бутаноил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноат
К раствору 3-гидрокси-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноата (4,96 г), DMAP (796 мг) и гидрохлорида 4-(диметиламино)бутановой кислоты (2,19 г) в DMF (20 мл), добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (2,50 г) при комнатной температуре. После перемешивания в течение 18 часов реакционную смесь разбавляли этилацетатом, промывали один раз насыщенным водным раствором гидрокарбоната натрия и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (5,31 г).
1H-ЯМР (300 МГц, CDCl3) δ м.д. 0,82-0,94 (9H, м), 1,20-1,42 (36H, м), 1,50-1,66 (6H, м), 1,69-1,83 (2H, м), 1,90-2,10 (12H, м), 2,20 (6H, с), 2,23-2,41 (10H, м), 4,11 (8H, с), 5,23-5,44 (6H, м).
[0128]
[Пример 4] 3-((4-(диметиламино)бутаноил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-гексадец-9-еноат
A) 2-(((трет-бутил(дифенил)силил)окси)метил)-2-(гидроксиметил)пропан-1,3-диол
К смеси 2,2-бис(гидроксиметил)пропан-1,3-диола (5,0 г), 1H-имидазола (2,5 г) и DMF (200 мл), добавляли раствор трет-бутилхлордифенилсилана (5,1 г) в DMF (10 мл) при комнатной температуре. После перемешивания в течение 18 часов реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли этилацетатом, промывали три раза водой и один раз насыщенным рассолом, и сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (6,4 г).
1H-ЯМР (500 МГц, CDCl3) δ м.д. 1,07 (9H, с), 2,34 (3H, т, J=5,5 Гц), 3,67 (2H, с), 3,74 (6H, д, J=5,5 Гц), 7,39-7,48 (6 H, м), 7,63-7,67 (4H, м).
[0129]
B) (5-(((трет-бутил(дифенил)силил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метанол
К раствору 2-(((трет-бутил(дифенил)силил)окси)метил)-2-(гидроксиметил)пропан-1,3-диола (3,5 г) и 2,2-диметоксипропана (1,5 г) в ацетоне (35 мл), добавляли моногидрат п-толуолсульфоновой кислоты (88,9 мг) при комнатной температуре. После перемешивания в течение 2 часов к реакционной смеси добавляли водный аммиак для нейтрализации реакционной смеси, а затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (2,7 г).
1H-ЯМР (500 МГц, CDCl3) δ м.д. 1,07 (9H, с), 1,27 (3H, с), 1,41 (3H, с), 2,12-2,18 (1 H, м), 3,69-3,78 (8H, м), 7,38-7,47 (6H, м), 7,65-7,69 (4H, м).
[0130]
C) (5-(((трет-бутил(дифенил)силил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метил (9Z)-гексадец-9-еноат
К раствору (5-(((трет-бутил(дифенил)силил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метанола (910 мг), DMAP (215 мг) и (9Z)-гексадец-9-еновой кислоты (838 мг) в DMF (10 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (757 мг) при комнатной температуре. После перемешивания в течение 6 часов к реакционной смеси добавляли этилацетат, полученный материал промывали два раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,43 г).
1H-ЯМР (500 МГц, CDCl3) δ м.д. 0,84-0,91 (3 H, м), 1,03-1,07 (9 H, м), 1,22-1,35 (16 H, м), 1,40 (6 H, д, J=17,0 Гц), 1,49-1,63 (2 H, м), 2,01 (4 H, кв., J=6,5 Гц), 2,24 (2 H, т, J=7,6 Гц), 3,65 (2 H, с), 3,73 (2 H, д, J=11,7 Гц), 3,80 (2 H, д, J=12,0 Гц), 4,17 (2 H, с), 5,29-5,39 (2 H, м), 7,35-7,46 (6 H, м), 7,65 (4 H, д, J=6,9 Гц).
[0131]
D) (5-(гидроксиметил)-2,2-диметил-1,3-диоксан-5-ил)метил (9Z)-гексадец-9-еноат
К раствору (5-(((трет-бутил(дифенил)силил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метил (9Z)-гексадец-9-еноата (1,43 г) в THF (4 мл), добавляли TBAF (1 M, 2,64 мл) в THF при комнатной температуре. После перемешивания в течение 3 часов реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли этилацетатом, промывали один раз насыщенным водным раствором гидрокарбоната натрия и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (0,82 г).
1H-ЯМР (500 МГц, CDCl3) δ м.д. 0,85-0,91 (3 H, м), 1,24-1,36 (16 H, м), 1,42 (6 H, с), 1,58-1,66 (2 H, м), 2,01 (4 H, q, J=6,5 Гц), 2,30 (1 H, т, J=6,6 Гц), 2,35 (2 H, т, J=7,6 Гц), 3,48 (2 H, д, J=6,6 Гц), 3,69-3,75 (4 H, м), 4,25 (2 H, с), 5,31-5,38 (2 H, м).
[0132]
E) (5-(((4-(диметиламино)бутаноил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метил (9Z)-гексадец-9-еноат
К раствору (5-(гидроксиметил)-2,2-диметил-1,3-диоксан-5-ил)метил (9Z)-гексадец-9-еноата (410 мг), DMAP (97 мг) и гидрохлорида 4-(диметиламино)масляной кислоты (250 мг) в DMF (4 мл), добавляли гидрхлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (343 мг) при 50°C. После перемешивания в течение 4 часов к реакционной смеси добавляли этилацетат, полученный материал промывали два раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (430 мг).
1H-ЯМР (500 МГц, CDCl3) δ м.д. 0,86-0,91 (3 H, м), 1,24-1,36 (16 H, м), 1,42 (6 H, с), 1,53-1,69 (2 H, м), 1,78 (2 H, м), 1,98-2,04 (4 H, м), 2,21 (6 H, с), 2,29 (4 H, м), 2,37 (2 H, т, J=7,6 Гц), 3,74 (4 H, с), 4,11 (4 H, д, J=5,7 Гц), 5,31-5,38 (2 H, м).
[0133]
F) 3-((4-(диметиламино)бутаноил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-гексадец-9-еноат
К (5-(((4-(диметиламино)бутаноил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метил (9Z)-гексадец-9-еноату (430 мг), добавляли уксусную кислоту (2 мл) и воду (1 мл) и полученный материал перемешивали при 75°C в течение 2 часов, а затем растворитель отгоняли при пониженном давлении. К остатку добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия, и полученный материал перемешивали в течение 2 часов. После промывания водой два раза полученный материал сушили над безводным сульфатом натрия, а затем растворитель отгоняли при пониженном давлении. К раствору полученного остатка, DMAP (201 мг) и (9Z)-тетрадец-9-еновой кислоты (466 мг) в DMF (4 мл), добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (458 мг) при 50°C. После перемешивания в течение 4 часов в реакционную смесь добавляли этилацетат, полученный материал промывали два раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (604 мг).
1H-ЯМР (500 МГц, CDCl3) δ м.д. 0,85-0,92 (9 H, м), 1,24-1,36 (40 H, м), 1,55-1,64 (6 H, м), 1,73-1,80 (2 H, м), 1,98-2,05 (12 H, м), 2,20 (6 H, с), 2,24-2,33 (8 H, м), 2,36 (2 H, т, J=7,6 Гц), 4,09-4,13 (8 H, м), 5,31-5,38 (6 H, м).
[0134]
[Пример 8] 2-(((N, N-диметил-β-аланил)окси)метил)-2-((октаноилокси)метил)пропан-1,3-диил (9Z,9'Z)бис-тетрадец-9-еноат
A) (2-(4-метоксифенил)-1,3-диоксан-5,5-диил)диметанол
Раствор 2,2-бис(гидроксиметил)пропан-1,3-диола (506 г) в воде (2,0 л) перемешивали при 50°C. К нему добавляли концентрированную хлористоводородную кислоту (18 мл), к которой капельно добавляли п-метоксибензальдегид (474 мл) при приблизительно 30°C в течение 3 часов. После этого температуру реакционного раствора доводили до 25°C, и реакционный раствор перемешивали в течение 5 часов. К нему добавляли 2 Н водный раствор гидроксида натрия (120 мл) и полученный материал перемешивали в течение 1 часа. Кристаллы собирали фильтрацией и промывали водой, а затем проводили перекристаллизацию с использованием этилацетата/гексана с получением указанного в заголовке соединения (769 г).
1H-ЯМР (500 МГц, DMSO-d6) δ м.д.3,24 (2H, д, J=5,0 Гц), 3,67 (2H, д, J=5,4 Гц), 3,74 (3H, с), 3,77 (2H, д, J=11,3 Гц), 3,88 (2H, т, J=11,3 Гц), 4,53 (1H, т, J=5,4 Гц), 4,62 (1H, т, J=5,0 Гц), 5,34 (1H, с), 6,90 (2H, д, J=8,9 Гц), 7,33 (2H, д, J=8,9 Гц).
[0135]
B-1) 2-(гидроксиметил)-2-(((4-метоксибензил)окси)метил)пропан-1,3-диол
К суспензии (2-(4-метоксифенил)-1,3-диоксан-5,5-диил)диметанола (10,0 г) в толуоле (100 мл) капельно добавляли 1,5 M раствор DIBAL-H (105 мл) при комнатной температуре, и полученный материал перемешивали в течение 5 часов. К нему добавляли метанол (30 мл), а затем к нему добавляли 2 Н хлористоводородную кислоту (20 мл) и 4 Н водный раствор гидроксида натрия (240 мл), и полученный материал перемешивали в течение 2 часов, и после этого слой толуола удаляли. Водный слой нейтрализовывали хлористоводородной кислотой, а затем проводили экстракцию этилацетатом и экстракт промывали два раза насыщенным рассолом и фильтровали через целит. Растворитель отгоняли при пониженном давлении и остаток перекристализовывали с использованием смеси этилацетат/гексан с получением указанного в заголовке соединения (6,6 г).
1H-ЯМР (500 МГц, DMSO-d6) δ м.д. 3,32 (2H, с), 3,39 (6H, д, J=5,4 Гц), 3,74 (3H, с), 4,21 (3H, т, J=5,4 Гц), 4,36 (2H, с), 6,90 (2H, д-подобный, J=7,8 Гц), 7,23 (2H, д-подобный, J=7,8 Гц).
[0136]
C-1) (5-(((4-метоксибензил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метанол
К раствору 2-(гидроксиметил)-2-(((4-метоксибензил)окси)метил)пропан-1,3-диола (1,00 г) и 2,2-диметоксипропана (1,22 г) в DMF (5 мл), добавляли п-толуолсульфонат пиридиния (10 мг) при комнатной температуре. После перемешивания в течение 2 часов к реакционной смеси добавляли этилацетат, полученный материал промывали один раз насыщенным водным раствором гидрокарбоната натрия и два раза 5% солевым раствором, а затем сушили над безводным сульфатом натрия, и растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (426 мг).
1H-ЯМР (500 МГц, DMSO-d6) δ м.д. 1,29 (3H, с), 1,29 (3H, с), 3,35 (2H, с), 3,39 (2H, д, J=5,1 Гц), 3,61 (4H, с), 3,74 (3H, с), 4,38 (2H, с), 4,59 (1H, т, J=5,1 Гц), 6,90 (2H, d-подобный, J=7,5 Гц), 7,24 (2H, d-подобный, J=7,5 Гц).
[0137]
B-2) 9-(4-метоксифенил)-3,3-диметил-2,4,8,10-тетраоксаспиро[5.5]ундекан
К раствору (2-(4-метоксифенил)-1,3-диоксан-5,5-диил)диметанола (2,00 г) и 2,2-диметоксипропана (2,46 г) в DMF (8 мл), добавляли п-толуолсульфонат пиридиния (20 мг) при комнатной температуре. После перемешивания в течение 4 часов реакционную смесь разбавляли этилацетатом, промывали два раза насыщенным водным раствором гидрокарбоната натрия и два раза насыщенным рассолом, а затем сушили над безводным сульфатом магния, а затем растворитель отгоняли при пониженном давлении. Осадок перекристализовывали с использованием смеси этилацетат/гексан с получением указанного в заголовке соединения (1,62 г).
1H-ЯМР (500 МГц, DMSO-d6) δ м.д. 1,34 (6H, с), 3,33 (2H, с), 3,63 (2H, д, J=11,7 Гц), 3,74 (3H, с), 3,99 (2H, с), 4,12 (2H, д, J=11,7 Гц), 5,37 (1H, с), 6,90 (2H, д, J=8,8 Гц), 7,34 (2H, д, J=8,8 Гц).
[0138]
C-2) (5-(((4-метоксибензил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метанол
К суспензии 9-(4-метоксифенил)-3,3-диметил-2,4,8,10-тетраоксаспиро[5.5]ундекана (22,0 г) в толуоле (200 мл), капельно добавляли 1,5 M раствор DIBAL-H (60 мл) при 5-20°C, и полученный материал перемешивали при 15°C в течение 3 часов. К нему капельно добавляли метанол (22 мл) и 2 Н водный раствор гидроксида натрия (100 мл) и 4 Н водный раствор гидроксида натрия (200 мл) в указанном порядке. После перемешивания в течение 1,5 часов слой толуола отделяли и промывали 5% солевым раствором. Растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (14,7 г).
1H-ЯМР (500 МГц, DMSO-d6) δ м.д. 1,29 (3H, с), 1,29 (3H, с), 3,35 (2H, с), 3,39 (2H, д, J=5,1 Гц), 3,61 (4H, с), 3,74 (3H, с), 4,38 (2H, с), 4,59 (1H, т, J=5,1 Гц), 6,90 (2H, d-подобный, J=7,5 Гц), 7,24 (2H, d-подобный, J=7,5 Гц).
[0139]
D) (5-(((4-метоксибензил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метилоктаноат
К раствору (5-(((4-метоксибензил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метанола (2,00 г), DMAP (412 мг) и октановой кислоты (1,27 г) в DMF (20 мл), добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,94 г) при 50°C. После перемешивания в течение 4 часов к реакционной смеси добавляли этилацетат, полученный материал промывали два раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (2,78 г).
1H-ЯМР (500 МГц, CDCl3) δ 0,84-0,91 (3 H, м), 1,22-1,33 (8 H, м), 1,40 (6 H, с), 1,53-1,61 (2 H, м), 2,26 (2 H, т, J=7,6 Гц), 3,39 (2 H, с), 3,68-3,74 (2 H, м), 3,76-3,80 (2 H, м), 3,80 (3 H, с), 4,15 (2 H, с), 4,42 (2 H, с), 6,87 (2 H, д, J=7,8 Гц), 7,20-7,24 (2 H, м).
[0140]
E) (5-(гидроксиметил)-2,2-диметил-1,3-диоксан-5-ил)метилоктаноат
К раствору (5-(((4-метоксибензил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метилоктаноата (2,78 г) в этаноле (30 мл) добавляли Pd-уголь (840 мг) при комнатной температуре, и полученный материал перемешивали в атмосфере водорода в течение 5 часов. После реакции Pd-уголь удаляли посредством фильтрации, а затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,35 г).
1H-ЯМР (500 МГц, CDCl3) δ 0,85-0,91 (3 H, м), 1,23-1,34 (8 H, м), 1,38-1,44 (6 H, м), 1,63 (2 H, м), 2,30-2,38 (3 H, м), 3,48 (2 H, д, J=6,6 Гц), 3,68-3,75 (4 H, м), 4,25 (2 H, с).
[0141]
F) (5-(((N, N-диметил-β-аланил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метилоктаноат
К раствору (5-(гидроксиметил)-2,2-диметил-1,3-диоксан-5-ил)метилоктаноата (400 мг), DMAP (129 мг) и гидрохлорида 3-(диметиламино)пропионовой кислоты (305 мг) в DMF (4 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (456 мг) при комнатной температуре. После перемешивания в течение 4 часов к реакционной смеси добавляли этилацетат, полученный материал промывали два раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (320 мг).
1H-ЯМР (500 МГц, CDCl3) δ 0,84-0,92 (3 H, м), 1,21-1,33 (8 H, м), 1,42 (6 H, с), 1,61 (2 H, br), 2,23 (6 H, с), 2,32 (2 H, т, J=7,6 Гц), 2,47-2,51 (2 H, м), 2,57-2,61 (2 H, м), 3,75 (4 H, с), 4,13 (4 H, д, J=11,7 Гц).
[0142]
G) 2-(((N, N-диметил-β-аланил)окси)метил)-2-((октаноилокси)метил)пропан-1,3-диил (9Z,9'Z)бис-тетрадец-9-еноат
К (5-(((N, N-диметил-β-аланил)окси)метил)-2,2-диметил-1,3-диоксан-5-ил)метилоктаноату (320 мг), добавляли уксусную кислоту (1,6 мл) и воду (0,8 мл) и полученный материал перемешивали при 65°C в течение 3,5 часов, а затем растворитель отгоняли при пониженном давлении. К остатку добавляли этилацетат и насыщенный водный раствор гидрокарбоната натрия, и полученный материал перемешивали в течение 2 часов. После промывания два раза водой и один раз насыщенным рассолом полученный материал сушили над безводным сульфатом натрия, а затем растворитель отгоняли при пониженном давлении. К раствору полученного остатка (150 мг), DMAP (101 мг) и (9Z)-тетрадец-9-еновой кислоты (235 мг) в DMF (4,5 мл), добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (231 мг) при 50°C. После перемешивания в течение 8 часов к реакционной смеси добавляли этилацетат, полученный материал промывали два раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (230 мг).
1H-ЯМР (500 МГц, CDCl3) δ 0,84-0,93 (9 H, м), 1,24-1,36 (30 H, м), 1,53-1,65 (8 H, м), 1,98-2,05 (8 H, м), 2,22 (6 H, с), 2,30 (6 H, т, J=7,6 Гц), 2,48 (2 H, т, J=6,9 Гц), 2,58 (2 H, т, J=6,8 Гц), 4,06-4,22 (8 H, м), 5,31-5,38 (4 H, м).
[0143]
[Пример 11] 2-(((4-(диметиламино)бутаноил)окси)метил)-2-((додеканоилокси)метил)пропан-1,3-диил (9Z,9'Z)бис-тетрадец-9-еноат
A) 3-гидрокси-2,2-бис(гидроксиметил)пропилдодеканоат
К раствору 2,2-бис(гидроксиметил)пропан-1,3-диола (5,00 г), DMAP (2,24 г) и лауриновой кислоты (3,68 г) в DMF (150 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (7,04 г) при комнатной температуре. После перемешивания в течение 20 часов к реакционной смеси добавляли этилацетат, полученный материал промывали два раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,79 г).
1H-ЯМР (500 МГц, CDCl3) δ 0,85-0,91 (3 H, м), 1,22-1,33 (16 H, м), 1,59-1,66 (3 H, м), 2,36 (2 H, т, J=7,6 Гц), 2,51 (2 H, т, J=5,8 Гц), 3,65 (6 H, д, J=5,7 Гц), 4,23 (2 H, с).
[0144]
B) 2-((додеканоилокси)метил)-2-(гидроксиметил)пропан-1,3-диил (9Z,9'Z)бис-тетрадец-9-еноат
К раствору 3-гидрокси-2,2-бис(гидроксиметил)пропилдодеканоата (400 мг), DMAP (153 мг) и (9Z)-тетрадец-9-еновой кислоты (569 мг) в DMF (4 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (602 мг) при комнатной температуре. После перемешивания в течение 8 часов к реакционной смеси добавляли этилацетат, полученный материал промывали два раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (230 мг).
1H-ЯМР (500 МГц, CDCl3) δ 0,85-0,93 (9 H, м), 1,22-1,36 (40 H, м), 1,58-1,65 (6 H, м), 1,99-2,05 (8 H, м), 2,32 (6 H, т, J=7,6 Гц), 2,52 (1 H, т, J=7,1 Гц), 3,48 (2 H, д, J=6,9 Гц), 4,09-4,14 (6 H, м), 5,31-5,38 (4 H, м).
[0145]
C) 2-(((4-(диметиламино)бутаноил)окси)метил)-2-((додеканоилокси)метил)пропан-1,3-диил (9Z,9'Z)бис-тетрадец-9-еноат
К раствору 2-((додеканоилокси)метил)-2-(гидроксиметил)пропан-1,3-диил (9Z,9'Z)бис-тетрадец-9-еноата (230 мг), DMAP (38 мг) и гидрохлорида 4-(диметиламино)масляной кислоты (105 мг) в DMF (4 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (150 мг) при комнатной температуре. После перемешивания в течение 3 часов к реакционной смеси добавляли этилацетат, полученный материал промывали два раза водой и один раз насыщенным рассолом, а затем сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (100 мг).
1H-ЯМР (500 МГц, CDCl3) δ 0,85-0,93 (9 H, м), 1,23-1,35 (40 H, м), 1,55-1,67 (6 H, м), 1,77 (2 H, м), 1,98-2,05 (8 H, м), 2,20 (6 H, с), 2,24-2,33 (8 H, м), 2,36 (2 H, т, J=7,6 Гц), 4,09-4,13 (8 H, м), 5,31-5,38 (4 H, м).
[0146]
Соединения примеров 2 и 3, 5-7, и 9 и 10 в таблице ниже получали в соответствии любыми из способов, представленных в примерах выше, и способов, согласующихся с ними. В таблице 1 представлены названия, структуры и массовые числа соединений, наблюдаемые при продуцировании (указаны в качестве MS в таблице) для этих примеров вместе с примерами 1, 4, 8 и 11.
[0147]
[Таблица 1]
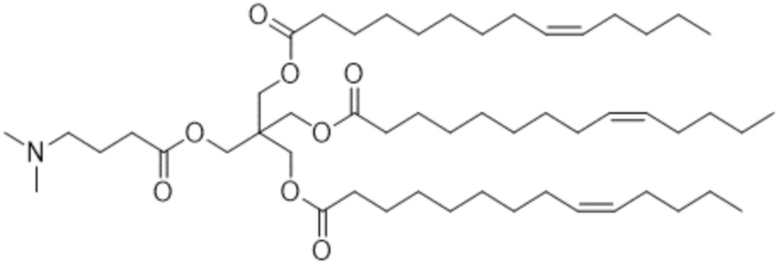
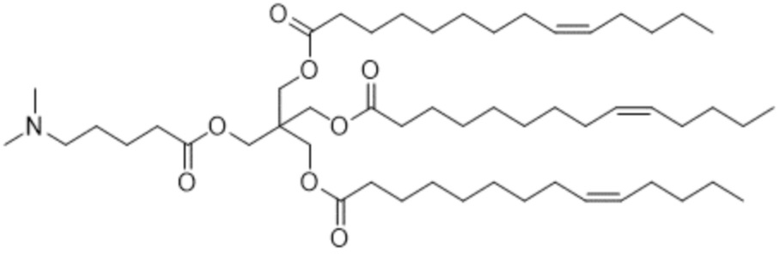
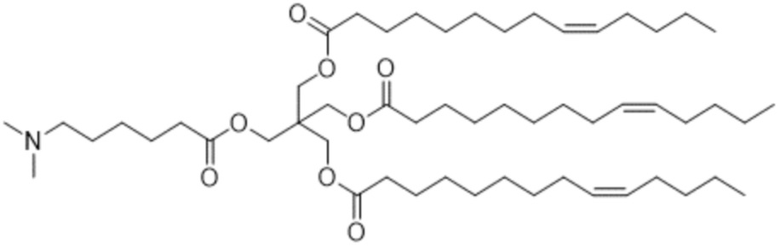
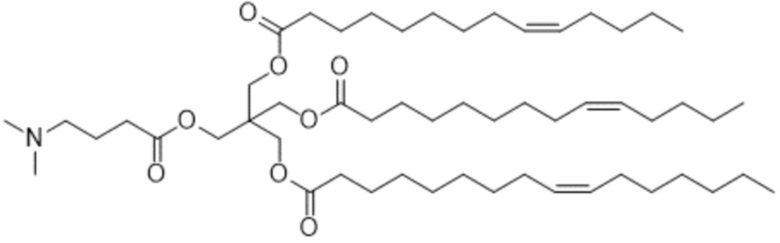
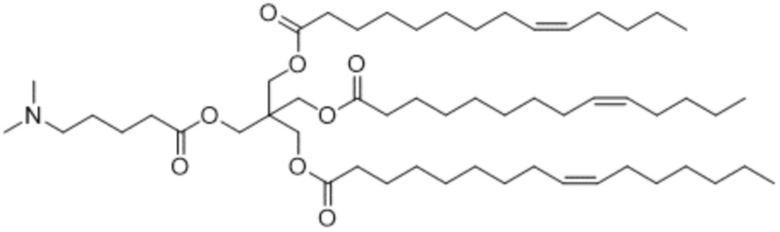
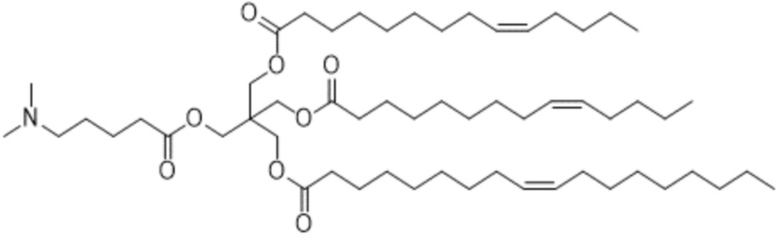
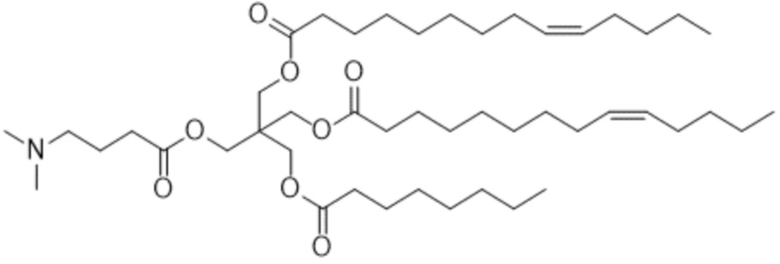
[0148]
[Пример получения и пример тестирования для композиции, содержащей липидную частицу по настоящему изобретению и нуклеиновую кислоту, для введения нуклеиновой кислоты]
[Пример получения 1]
Смесь липидов (катионный липид, полученный согласно примерам:DPPC:холестерин:GM-020=60:10,6:28:1,4, в молярном соотношении) растворяли в 90% EtOH/10% свободной от РНКаз воде с получением раствора липидов 8,5 мг/мл. мРНК люциферазы (TriLink Bio Technologieс) растворяли в буфере на основе 10 мМ 2-морфолиноэтансульфоната (MEС) при pH 4,0 с получением раствора нуклеиновой кислоты 0,22 мг/мл. Полученный раствор липидов и раствор нуклеиновых кислот смешивали с использованием устройства NanoAssemblr (Precision Nanosystemс) при комнатной температуре с соотношением скоростей потоков 3 мл/мин:6 мл/мин с получением дисперсии, содержащей липидные частицы, в которые инкапсулирована нуклеиновая кислота. С использованием Slyde-A-Lyzer (пороговое значение молекулярной массы: 20k, Thermo Fisher Scientific), полученную дисперсию подвергали диализу с водой при комнатной температуре в течение 1 часа и с PBS при 4°C в течение 48 часов. Затем проводили фильтрование с использованием 0,2-мкм шприцевого фильтра (IWAKI CO., LTD.) с получением композиции для введения нуклеиновой кислоты, и после этого композицию хранили при 4°C. Размер липидных частиц измеряли с использованием Zetasizer Nano ZS (Malvern Instruments Limited). Концентрацию мРНК и долю при инкапсулировании для липидных частиц определяли с использованием Quant-iT (TМ) RiboGreen (R) (Invitrogen). В таблице 2 представлены результаты анализа.
[0149]
[Таблица 2]
[0150]
[Пример испытания 1] Испытание трансфекции мРНК в культивируемые клетки
Клетки клеточной линии HCT116, происходящей из рака ободочной и прямой кишки человека, культивировали в 96-луночном планшете при плотности клеток 6000 клеток/лунка, и через 24 часа после этого в среду добавляли 10 мкл композиции, содержащей 10 нг мРНК люциферазы для введения нуклеиновой кислоты (раствор, полученный разбавлением продукта согласно примеру получения 1 до концентрации мРНК 10 нг/10 мкл). Уровень люциферазы, экспрессированной в HCT116 через 24 часа после добавления мРНК, определяли с использованием набора Picagene LT2.0 (TOYOBO CO., LTD.). В таблицах 3 и 4 представлены результаты измерения.
[0151]
[Таблица 3]
[0152]

[0153]
[Пример получения и пример тестирования для композиции, содержащей липидную частицу по настоящему изобретению и нуклеиновую кислоту, для введения нуклеиновой кислоты]
[Пример получения 2]
Смесь липидов (катионный липид, продуцированный согласно примерам:DPPC:холестерин:GM-020=60:10,6:28:1,4, в молярном соотношении) растворяли в 90% EtOH/10% свободной от РНКаз воде с получением раствора липидов 7 мг/мл. Равные количества миРНК для Col1a1 и миРНК для фактора VII (FVII) смешивали вместе и смесь растворяли в 25 мМ ацетатном буфере при pH 4,0 с получением раствора нуклеиновой кислоты 0,2 мг/мл. Информация о последовательности миРНК представлена в таблице ниже. Полученный раствор липидов и раствор нуклеиновых кислот смешивали с использованием устройства NanoAssemblr (Precision Nanosystemс) при комнатной температуре с соотношением скоростей потоков 3 мл/мин:9 мл/мин с получением дисперсии, содержащей липидные частицы, в которые включена нуклеиновая кислота. С использованием Slyde-A-Lyzer (пороговое значение молекулярной массы: 20k, Thermo Fisher Scientific), полученную дисперсию подвергали диализу с водой при комнатной температуре в течение 1 часа и с PBS при 4°C в течение 48 часов. Затем проводили фильтрование с использованием 0,2-мкм шприцевого фильтра (IWAKI CO., LTD.) с получением композиции для введения нуклеиновой кислоты, и после этого композицию хранили при 4°C. Размер липидных частиц измеряли с использованием Zetasizer Nano ZS (Malvern Instruments Limited). Концентрацию мРНК и долю при инкапсулировании для липидных частиц определяли с использованием Quant-iT (TМ) RiboGreen (R) (Invitrogen). В таблице 6 представлены результаты анализа.
[0154]

[0155]
[Таблица 6]
[0156]
[Пример тестирования 2] Тестирование доставки миРНК в звездчатые клетки печени у модельных мышей с нарушением печени, вызванным тетрахлорметаном
Дисперсию липидных частиц, включающих миРНК Col1a1 и миРНК FVII, в PBS разбавляли PBS до соответствующих концентраций миРНК 40 мкг/мл и 120 мкг/мл и вводили в орбитальную пазуху каждой мыши Balb/c для достижения соответствующих доз миРНК 0,2 мг/кг и 0,6 мг/кг. Через три часа после введения миРНК перорально вводили тетрахлорметан для достижения дозы 0,1 мл/кг. Через четыре дня после введения тетрахлорметана каждую мышь умерщвляли путем кровопускания под анестезией с изофлураном и печень извлекали. Из полученной печени экстрагировали тотальную РНК с использованием набора RNeasy Mini Kit (QIAGEN) и уровни мРНК Col1a1, мРНК FVII и мРНК GAPDH определяли способом количественной ПЦР. Уровни снижения экспрессии мРНК Col1a1 и мРНК FVII, приведенные к уровню мРНК GAPDH, вычисляли относительно мышей без введения миРНК, и в таблице ниже представлены результаты вычисления.
[0157]
[Таблица 7]
Промышленная применимость
[0158]
Соединение, липидная частица или композиция по настоящему изобретению позволяет введение нуклеиновых кислот в различные типы клеток, тканей или органов. Таким образом, соединение, липидная частица или композиция по настоящему изобретению доступны в качестве способа DDS для лекарственных средств на основе нуклеиновых кислот. Кроме того, соединение, липидная частиц или композиция по настоящему изобретению доступны в качестве реагента для введения нуклеиновой кислоты для исследования.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ:
<110> TAKEDA PHARMACEUTICAL COMPANY LIMITED
<120> Катионные соединения
<130> PT38-9027WO
<150> JP 2017-254667
<151> 2017-12-28
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> миРНК против Col1a1 (смысловая)
<220>
<221> дополнительный признак
<222> (1)..(21)
<223> Последовательность содержит основания как РНК, так и ДНК,
некоторые из которых являются модифицированными основаниями.
<220>
<221> модифицированное основание
<222> (2)..(2)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> модифицированное основание
<222> (3)..(3)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (4)..(4)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> модифицированное основание
<222> (8)..(8)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (10)..(10)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> модифицированное основание
<222> (12)..(12)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> модифицированное основание
<222> (12)..(12)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (13)..(13)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> модифицированное основание
<222> (14)..(14)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (17)..(17)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (18)..(18)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> дополнительный признак
<222> (20)..(21)
<223> Нуклеозиды (t и t) связаны фосфоротиоатом.
<400> 1
gucuagacau guucagcuut t 21
<210> 2
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> миРНК против Col1a1 (антисмысловая)
<220>
<221> дополнительный признак
<222> (1)..(21)
<223> Последовательность содержит основания как РНК, так и ДНК,
некоторые из которых являются модифицированными основаниями.
<220>
<221> модифицированное основание
<222> (9)..(9)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (15)..(15)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> дополнительный признак
<222> (20)..(21)
<223> Нуклеозиды (t и t) связаны фосфоротиоатом.
<400> 2
aagcugaaca ugucuagact t 21
<210> 3
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> миРНК против фактора VII (смысловая)
<220>
<221> дополнительный признак
<222> (1)..(21)
<223> Последовательность содержит основания как РНК, так и ДНК,
некоторые из которых являются модифицированными основаниями.
<220>
<221> модифицированное основание
<222> (1)..(1)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (2)..(2)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> модифицированное основание
<222> (4)..(4)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (10)..(10)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (12)..(12)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> модифицированное основание
<222> (13)..(13)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (14)..(14)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (15)..(15)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> модифицированное основание
<222> (16)..(16)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> модифицированное основание
<222> (17)..(17)
<223> "c" означает 2'-O-метилцитидин (cm)
<220>
<221> модифицированное основание
<222> (19)..(19)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> дополнительный признак
<222> (20)..(21)
<223> Нуклеозиды (t и t) связаны фосфоротиоатом.
<400> 3
cuacgaaagc auccuucaut t 21
<210> 4
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> миРНК против фактора VII (антисмысловая)
<220>
<221> дополнительный признак
<222> (1)..(21)
<223> Последовательность содержит основания как РНК, так и ДНК,
некоторые из которых являются модифицированными основаниями.
<220>
<221> модифицированное основание
<222> (17)..(17)
<223> "u" означает 2'-O-метилуридин (um)
<220>
<221> дополнительный признак
<222> (20)..(21)
<223> Нуклеозиды (t и t) связаны фосфоротиоатом.
<400> 4
augaaggaug cuuucguagt t 21
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КАТИОННЫЙ ЛИПИД | 2019 |
|
RU2784335C2 |
| ТРИАЛКИЛОВЫЕ КАТИОННЫЕ ЛИПИДЫ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2013 |
|
RU2718053C2 |
| КАТИОННЫЙ ЛИПИД | 2017 |
|
RU2740921C2 |
| ЛИПИДЫ ДЛЯ КОМПОЗИЦИЙ ДЛЯ ДОСТАВКИ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ | 2013 |
|
RU2658007C2 |
| СПОСОБ АКТИВАЦИИ/ПРОЛИФЕРАЦИИ T-КЛЕТОК | 2019 |
|
RU2806549C2 |
| ИОНИЗИРУЕМЫЕ ЛИПИДЫ И ИХ КОМПОЗИЦИИ В ФОРМЕ НАНОЧАСТИЦ | 2020 |
|
RU2836646C1 |
| СОЕДИНЕНИЯ ДЛЯ НАЦЕЛЕННОЙ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА И УСИЛЕНИЯ АКТИВНОСТИ siPHK | 2012 |
|
RU2769872C2 |
| ПРОТИВОРАКОВЫЕ РНК-ВАКЦИНЫ | 2017 |
|
RU2768829C2 |
| СОЕДИНЕНИЯ ДЛЯ НАЦЕЛЕННОЙ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА И УСИЛЕНИЯ АКТИВНОСТИ siPHK | 2012 |
|
RU2632888C2 |
| ПОЛИНУКЛЕОТИДЫ, КОДИРУЮЩИЕ ИНТЕРЛЕЙКИН-12 (IL12), И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2769316C2 |
Настоящее изобретение относится способу, который позволяет введение активных ингредиентов, в частности нуклеиновых кислот, в клетки с лучшей эффективностью; и к катионным липидам и т.д. для применения в этом способе. Новое соединение соответствует формуле (I), в которой n обозначает целое число от 2 до 5, R обозначает линейную C1-5 алкильную группу, линейную C7-11 алкенильную группу или линейную C11 алкадиенильную группу, и волнистые линии в каждом случае независимо обозначат цис-связь или транс-связь, или его фармацевтически приемлемая соль.
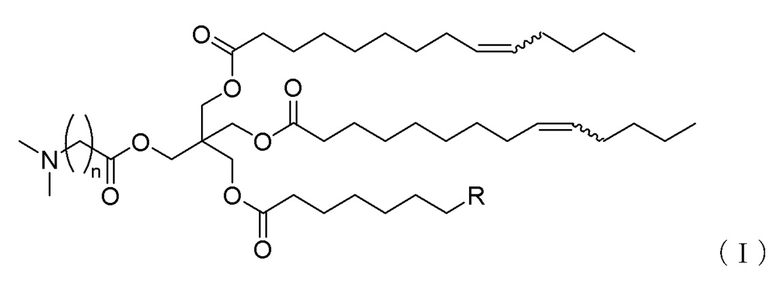
6 н. и 2 з.п. ф-лы, 7 табл., 11 пр.
1. Соединение, соответствующее формуле (I):
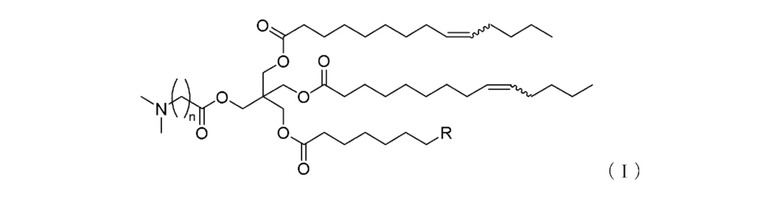
где
n обозначает целое число от 2 до 5,
R обозначает линейную C1-5 алкильную группу, линейную C7-11 алкенильную группу или линейную C11 алкадиенильную группу, и
волнистые линии в каждом случае независимо обозначат цис-связь или транс-связь,
или его фармацевтически приемлемая соль.
2. 3-((4-(диметиламино)бутаноил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноат или его фармацевтически приемлемая соль.
3. 3-((5-(диметиламино)пентаноил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноат или его фармацевтически приемлемая соль.
4. 3-((6-(диметиламино)гексаноил)окси)-2,2-бис(((9Z)-тетрадец-9-еноилокси)метил)пропил (9Z)-тетрадец-9-еноат или его фармацевтически приемлемая соль.
5. Липидная частица для введения нуклеиновой кислоты в качестве активного ингредиента, содержащая соединение или его фармацевтически приемлемую соль по п.1.
6. Композиция для введения нуклеиновой кислоты, содержащая нуклеиновую кислоту и липидную частицу по п.5.
7. Композиция по п.6, где нуклеиновая кислота представляет собой РНК.
8. Композиция по п.7, где РНК представляет собой мРНК или миРНК.
| WO 03102150 A2, 11.12.2003 | |||
| WO 2016021683 A1, 11.02.2016 | |||
| СОДЕРЖАЩИЕ НУКЛЕИНОВЫЕ КИСЛОТЫ ЛИПИДНЫЕ ЧАСТИЦЫ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2010 |
|
RU2573409C2 |
Авторы
Даты
2022-10-24—Публикация
2018-12-27—Подача