ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По этой заявке испрашивается приоритет на основании предварительной заявки на патент США No. 61/280510, поданной 4 ноября 2009 г., полное содержание которой включено в настоящий документ во всей полноте путем ссылки.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
Липидные наночастицы (LNP) являются наиболее клинически усовершенствованными системами доставки лекарственного средства, при этом семь основанных на LNP лекарственных средств получили разрешение регуляторного органа. Эти одобренные лекарственные средства содержат малые молекулы, такие как противораковые лекарственные средства и демонстрируют повышенную эффективность и/или уменьшенную токсичность по сравнению со "свободным" лекарственным средством. Технология LNP носителя также была применена для доставки "генетических" лекарственных средств, таких как плазмиды для экспрессии терапевтических белков или олигонуклеотидов (OGN) малых интерферирующих РНК (миРНК) для сайленсинга генов, способствующих развитию заболевания. Разработка способов для эффективной in vivo доставки OGN миРНК и других генетических лекарственных средств является главной проблемой, препятствующей революционной возможности этих веществ в качестве терапевтических средств.
Современные достижения в LNP технологии и разработке катионных липидов, необходимых для инкапсуляции и доставки генетических лекарственных средств, подчеркивают возможности LNP систем для решения задачи in vivo доставки. Было продемонстрировано, что LNP-миРНК системы индуцируют сайленсинг терапевтически значимых целевых генов в животных моделях, включая приматов, кроме человека, после внутривенной (i.v.) инъекции, и они в настоящее время проходят различные клинические испытания.
Было разработано множество способов приготовления LNP систем, содержащих генетические лекарственные средства. Эти способы включают смешивание заранее приготовленных LNP с OGN в присутствии этанола или смешивание липида, растворенного в этаноле, с водными средами, содержащими OGN, и результатом являются LNP диаметрами 100 нм или менее и эффективность инкапсуляции OGN 65-95%. Оба этих способа основаны на наличии катионных липидов для достижения инкапсуляции OGN и поли(этиленгликолевых) (PEG) липидов для замедления агрегирования и формирования крупных струтур. Свойства произведенных LNP систем, включая размер и эффективность OGN инкапсуляции, чувствительны к ряду параметров приготовления, таких как ионная сила, концентрация липида и этанола, pH, концентрация OGN и скорости перемешивания. В целом, параметры, такие как относительные концентрации липида и OGN во время смешивания, а также скорости смешивания тяжело контролировать с использованием существующих процедур приготовления, что приводит к изменяемости характеристик произведенных LNP, как в пределах одного, так и между разными препаратами.
Микрожидкостные устройства обеспечивают возможность контролируемо и быстро смешивать жидкости в нанолитровом масштабе с точным контролем температуры, времени контакта и концентраций растворов. Контролируемое и быстрое микрожидкостное смешивание применяли ранее в синтезе неорганических наночастиц и микрочастиц, и оно может превосходить крупномасштабные системы в крупномасштабном производстве наночастиц. Микрожидкостные двухфазные капельные технологии были применены для производства монодисперсных полимерных микрочастиц для доставки лекарственного средства или для производства крупных везикул для инкапсуляции клеток, белков или других биомолекул. Было продемонстрировано применение гидродинамической фокусировки потока, распространенной микрожидкостной технологии для обеспечения быстрого смешивания реагентов для формирования монодисперсных липосом контролируемого размера. Также было доказано, что эта технология пригодна для производства полимерных наночастиц, при этом были получены более мелкие, более монодисперсные частицы с более высокой инкапсуляцией малых молекул по сравнению со способами массового производства.
Несмотря на прогресс в развитии способов LNP систем, содержащих генетические лекарственные средства, существует необходимость в устройствах и способах приготовления липидных наночастиц, содержащих терапевтические вещества, а также в усовершенствованных липидных наночастицах, содержащих терапевтические вещества. Настоящее изобретение направлено на удовлетворение необходимости и предоставляет дополнительные связанные с этим преимущества.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте изобретение предоставляет липидные частицы, содержащие нуклеиновые кислоты.
В одном варианте осуществления липидная частица содержит (a) один или более катионных липидов, (b) один или более вторичных липидов и (c) одну или более нуклеиновых кислот, где липидная частица содержит практически твердое ядро, как указано в данном документе.
В одном варианте осуществления катионным липидом является DLin-KC2-DMA. В некоторых вариантах осуществления частица содержит от приблизительно 30 до приблизительно 95 мольных процентов катионного липида.
В одном варианте осуществления вторичным липидом является PEG-c-DMA. В одном варианте осуществления вторичным липидом является 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC). В некоторых вариантах осуществления частица содержит от приблизительно 1 до приблизительно 10 мольных процентов вторичного липида.
Нуклеиновыми кислотами могут быть ДНК, РНК, замкнутая нуклеиновая кислота, аналог нуклеиновых кислот или плазмида, допускающая экспрессирование ДНК или РНК.
В другом варианте осуществления липидная частица содержит (a) один или более катионных липидов, (b) один или более нейтральных липидов, (c) один или более PEG-липидов, (d) один или более стеролов и (e) одну или более нуклеиновых кислот, где липидная частица содержит практически твердое ядро, как указано в данном документе. В одном варианте осуществления катионным липидом является DLin-KC2-DMA. В одном варианте осуществления PEG-липидом является PEG-c-DMA. В одном варианте осуществления нейтральным липидом является 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC). В одном варианте осуществления стерин является холестерином. В одном варианте осуществления нуклеиновой кислотой является миРНК.
В дополнительном варианте осуществления липидная частица состоит из одного или более катионных липидов и одной или более нуклеиновых кислот. В одном варианте осуществления липидная частица содержит практически твердое ядро, как указано в данном документе. В одном варианте осуществления катионным липидом является DLin-KC2-DMA. В одном варианте осуществления нуклеиновой кислотой является миРНК.
В других аспектах изобретение предоставляет способы использования липидных частиц.
В одном варианте осуществления изобретение предоставляет способ введения нуклеиновой кислоты в субъект, содержащий введение липидной частицы по изобретению в субъект, нуждающийся в этом.
В одном варианте осуществления изобретение предоставляет способ введения нуклеиновой кислоты в клетку, содержащий приведение клетки в контакт с липидной частицей по изобретению.
В одном варианте осуществления изобретение предоставляет способ модуляции экспрессии целевого полинуклеотида или полипептида, содержащий приведение клетки в контакт с липидной частицей по изобретению, где нуклеиновая кислота способна к модуляции экспрессии целевого полинуклеотида или полипептида.
В одном варианте осуществления изобретение предоставляет способ лечения заболевания или расстройства, характеризуемого сверхэкспрессией полипептида в субъекте, содержащий введение в субъект липидной частицы изобретения, где нуклеиновая кислота способна к сайленсингу или снижению экспрессии полипептида.
В другом аспекте изобретение предоставляет способ создания липидных частиц.
В одном варианте осуществления изобретение предоставляет способ создания липидных частиц, включающих нуклеиновую кислоту, содержащий:
введение первого потока, содержащего нуклеиновую кислоту в первом растворителе, в микрожидкостное устройство; где устройство имеет первый отдел, приспособленный для протекания одного или более потоков, введенных в устройство, и второй отдел для смешивания содержимого одного или более потоков микрожидкостным смесителем;
введение второго потока, содержащего образующие липидную частицу вещества во втором растворителе, в устройство для обеспечения протекания первого и второго потоков в условиях ламинарного протекания, где устройство имеет первый отдел, приспособленный для протекания одного или более потоков, введенных в микроканал, и второй отдел для смешивания содержимых одного или более потоков, где образующие липидную частицу вещества содержат катионный липид, и где первый и второй растворители не являются одинаковыми;
протекание одного или более первых потоков и одного или более вторых потоков из первого отдела устройства во второй отдел устройства и
смешивание содержимых одного или более первых потоков и одного или более вторых потоков, протекающих в условиях ламинарного протекания, во втором отделе устройства для обеспечения третьего потока, содержащего липидные наночастицы с инкапсулированной нуклеиновой кислотой.
В другом варианте осуществления изобретение предоставляет способ приготовления липидных частиц, включающих нуклеиновую кислоту, содержащий:
введение первого потока, содержащего нуклеиновую кислоту в первом растворителе в канал; где устройство имеет первый отдел, приспособленный для протекания одного или более потоков, введенных в канал, и второй отдел для смешивания содержимых одного или более потоков;
введение второго потока, содержащего образующие липидную частицу вещества во втором растворителе; где канал имеет первый отдел, приспособленный для протекания одного или более потоков, введенных в канал, и второй отдел для смешивания содержимых одного или более потоков;
протекание одного или более первых потоков и одного или более вторых потоков из первого отдела канала во второй отдел канала с сохранением при этом физического разделения двух потоков, где один или более первых потоков и один или более вторых потоков не смешиваются, пока они не попадают во второй отдел канала и
смешивание содержимых одного или более первых потоков и одного или более вторых потоков, протекающих в условиях ламинарного протекания, во втором отделе микроканала, для обеспечения третьего потока, содержащего липидные наночастицы с инкапсулированной нуклеиновой кислотой.
В некоторых вариантах осуществления вышеупомянутых способов смешивание содержимых одного или более первых потоков и одного или более вторых потоков содержит варьирование концентрации или относительных скоростей смешивания одного или более первых потоков и одного или более вторых потоков.
В некоторых вариантах осуществления вышеупомянутых способов способы дополнительно содержат разбавление третьего потока водным буфером. В некоторых вариантах осуществления разбавление третьего потока содержит протекание третьего потока и водного буфера во второе смешивающее устройство.
В некоторых вариантах осуществления вышеупомянутых способов способы дополнительно содержат диализирование водного буфера, содержащего липидные частицы с инкапсулированной нуклеиновой кислотой для снижения количества второго растворителя.
В некоторых вариантах осуществления вышеупомянутых способов первый растворитель представляет собой водный буфер. В некоторых вариантах осуществления вышеупомянутых способов второй растворитель представляет собой водный спирт.
В некоторых вариантах осуществления вышеупомянутых способов смешивание содержимых первого и второго потоков содержит беспорядочную адвекцию. В некоторых вариантах осуществления вышеупомянутых способов смешивание содержимых первого и второго потоков содержит смешивание с помощью микросмесителя.
В некоторых вариантах осуществления вышеупомянутых способов эффективность инкапсуляции нуклеиновой кислоты составляет от приблизительно 90 до приблизительно 100%.
В некоторых вариантах осуществления вышеупомянутых способов смешивание одного или более первых потоков и одного или более вторых потоков предотвращено в первом отделе посредством перегородки. В некоторых вариантах осуществления перегородка представляет собой стенку канала, проточную жидкость или концентрическую трубку.
В другом аспекте изобретения предоставлены устройства для изготовления липидных частиц. В одном варианте осуществления изобретение предоставляет устройство для производства липидной частицы с инкапсулированной нуклеиновой кислотой, содержащее:
первое впускное отверстие для приема первого раствора, содержащего нуклеиновую кислоту в первом растворителе;
микроканал первого впускного отверстия в жидкостном сообщении с первым впускным отверстием для обеспечения первого потока, содержащего нуклеиновую кислоту в первом растворителе;
второе впускное отверстие для приема второго раствора, содержащего образующие липидную частицу вещества во втором растворителе;
микроканал второго впускного отверстия в жидкостном сообщении со вторым впускным отверстием для обеспечения второго потока, содержащего образующие липидную частицу вещества во втором растворителе и
третий микроканал для приема первого и второго потоков, где третий микроканал имеет первый отдел, приспособленный для протекания первого и второго потоков, введенных в микроканал в условиях ламинарного протекания, и второй отдел, приспособленный для смешивания содержимых первого и второго потоков, для обеспечения третьего потока, содержащего липидные частицы с инкапсулированной нуклеиновой кислотой.
В одном варианте осуществления устройство дополнительно содержит средство для разбавления третьего потока для обеспечения разбавленного потока, содержащего стабилизированные липидные частицы с инкапсулированной нуклеиновой кислотой. В некоторых вариантах осуществления средство для разбавления третьего потока содержит микросмеситель.
В одном варианте осуществления микроканал имеет гидродинамический диаметр от приблизительно 20 до приблизительно 300 мкм.
В одном варианте осуществления второй отдел микроканала содержит рельефные конструкции. В одном варианте осуществления второй отдел микроканала имеет главное направление потока, и при этом одна или более поверхностей имеет по меньшей мере одну выемку или выступ, расположенные на них, при этом выемка или выступ имеют ориентацию, которая образует угол с главным направлением. В одном варианте осуществления второй отдел содержит микросмеситель.
В некоторых вариантах осуществления устройство дополнительно содержит средство для варьирования скоростей потока первого и второго потоков.
В некоторых вариантах осуществления устройство дополнительно содержит перегородку, эффективную для физического разделения одного или более первых потоков от одного или более вторых потоков в первом отделе.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Предшествующие аспекты и многие сопутствующие преимущества этого изобретения станут в большей степени оценены по достоинству, после того как они станут более понятны на основе следующего подробного описания вместе с сопутствующими чертежами.
Фиг. 1 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения.
Фиг. 2 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, которое является усовершенствованием устройства изображенного на Фиг. 1.
Фиг. 3 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, которое представляет собой усовершенствование устройства, изображенного на Фиг. 2.
Фиг. 4 представляет собой схематическое изображение иллюстративного жидкостного устройства и способа изобретения.
Фиг. 5 представляет собой схематическое изображение иллюстративной компоновки изобретения, содержащей десять жидкостных устройств, проиллюстрированных на Фиг. 4.
Фиг. 6 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения.
Фиг. 7 представляет собой схематическое изображение иллюстративной компоновки изобретения, содержащей десять иллюстративных жидкостных устройств, проиллюстрированных на Фиг.6.
Фиг. 8 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего три впускных отверстия и одно выпускное отверстие (устройство 800 включает в себя смешивающий канал 810).
Фиг. 9 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего два впускных отверстия и одно выпускное отверстие (устройство 900 включает в себя смешивающий канал 910).
Фиг. 10 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего несколько (n) последовательных впускных отверстий и одно выпускное отверстие (устройство 1000 включает в себя смешивающие каналы 1010a, 1010b, 1010c и 1010d).
Фиг. 11 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего три впускных отверстия и одно выпускное отверстие (устройство 1100 включает в себя смешивающие каналы 1110a, 1110b и 1110c).
Фиг. 12 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего семь впускных отверстий и одно выпускное отверстие (устройство 1200 включает в себя смешивающие каналы 1210a, 1210b, 1210c и 1210d).
Фиг. 13 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего многопластинчатый смеситель (устройство 1300 включает в себя смешивающий канал 1310).
Фиг. 14 представляет собой крупный план многопластинчатого смесителя, изображенного на Фиг. 14.
Фиг. 15A представляет собой схематическое изображение иллюстративного микрожидкостного (MF) способа изготовления липидных наночастиц (LNP) по изобретению: липид-этанольный и миРНК-водный растворы подаются во впускные отверстия микрожидкостного смешивающего устройства; елочные структуры в устройстве индуцируют беспорядочную адвекцию ламинарного потока и приводят к быстрому смешиванию липидных групп с водным потоком и образованию липидных наночастиц. Смешивающий канал имеет размеры 200 мкм в ширину и 79 мкм в высоту. Елочные структуры имеют размеры 31 мкм в высоту и 50 мкм в толщину.
Фиг. 15B представляет собой схематическое изображение способа изготовления липидных наночастиц (LNP) с предварительно сформированной везикулой (PFV): (a) липид-этанольный раствор добавляется в водный раствор, pH 4,0, что приводит в результате к образованию частиц везикулярного типа; (b) экструзия через 80 нм поликарбонатую мембрану (Nuclepore) при комнатной температуре с использованием Lipex Extruder обеспечивает более равномерное распределение частиц; и (c) добавление раствора миРНК при взбалтывании и инкубировании при 35°C в течение 30 минут способствует инкапсуляции миРНК.
Фиг. 16A-16C иллюстрируют влияние скорости потока в микрожидкостном устройстве на смешивание и размер LNP частиц. Два 10 мкМ раствора флюоресцеина (флюоресцирующий при pH 8,8, нефлюоресцирующий при pH 5,15) смешивают для получения полностью флюоресцирующего раствора. Фиг. 16A сравнивает степени смешивания (%), установленные по средней интенсивности флюоресценции вдоль ширины канала в качестве функции от времени смешивания (мс), рассчитанного из средней скорости жидкости и длины перемещения (0,2, 0,8, 1,4 и 2 мл/мин). Фиг. 16B и 16C сравнивают средний диаметр частиц LNP, состоящих из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1, соотношение миРНК/общий липид 0,06 масс./масс., с 10 мМ липид-этанольной фазой, смешанной с 25 мМ ацетатным буфером, pH4, содержащим миРНК. Фиг. 16B сравнивает средний диаметр частиц (нм) LNP в качестве функции от скорости потока (мл/мин). Фиг. 16C сравнивает средний диаметр частиц (нм) LNP в качестве функции от соотношения скоростей этанольного и водного потоков. Планки погрешностей отображают стандартное отклонение среднего диаметра частиц, измеренного с помощью динамического рассеяния света.
Фиг. 17 иллюстрирует влияние липидной концентрации на размер LNP частицы посредством сравнения среднего диаметра частиц (нм) в качестве функции от концентрации липида в этаноле (мМ). Повышение концентрации липида приводит к увеличению среднего диаметра частицы. Общее липидное содержание в этанольной фазе, которое подвергалось смешиванию в микрожидкостном чипе, варьировалось от 10 мМ до 50 мМ. LNP была составлена из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1, соотношение миРНК/общий липид 0,06 масс./масс. Общая скорость протекания внутри микрожидкостного смесителя поддерживалась при 2 мл/мин. Планки погрешностей отображают стандартное отклонение среднего диаметра частиц, измеренного при помощи динамического рассеяния света.
Фиг. 18A и 18B иллюстрируют влияние PEG-липида и катионного липида на системы LNP. Фиг. 18A сравнивает средний диаметр частиц (нм) в качестве функции от PEG-c-DMA содержания (мол.% в LNP) для LNP, приготовленных PFV и MF способами. Содержание PEG-липида варьировалось от 1 мол.% до 10 мол.% в LNP композиции. Изменение содержания PEG-липида компенсировалось корректировкой содержания холестерина. LNP были составлены из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1 (-x):l (+x), (где x=1-9), соотношение миРНК/общий липид составляло 0,06 масс./масс. Фиг. 18B сравнивает средний диаметр частиц (нм) как функцию DLin-KC2-DMA содержания (мол.%) для LNP, приготовленных посредством PFV и MF способов. Содержание катионного липида варьировалось от 40 мол.% до 70 мол.%. PEG-c-DMA поддержилось постоянным при 1 мол.% и поддерживалось молярное соотношение 0,25 для DSPC-холестерина. Общая скорость протекания внутри микрожидкостного смесителя поддерживалась при 2 мл/мин. 10 мМ липид-этанольный фазы смешивали с 25 мМ ацетатным буфером, pH 4, включающим миРНК. Планки погрешностей отображают стандартное отклонение среднего диаметра частиц, измеренного с помощью динамического рассеяния света.
Фиг. 19 иллюстрирует влияние соотношения миРНК/липид на размер частиц и инкапсуляцию посредством сравнения среднего диаметра частиц (нм) и инкапсуляции (%) в зависимости от соотношения миРНК/липид (масс./масс.) (также выраженного как нуклеотид/фосфат (N/P)). Инкапсуляцию определяли посредством отделения LNP суспензии от свободной миРНК с использованием анион-обменной спин колонки. LNP была составлена из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1, соотношение миРНК/общий липид составляло 0,06 масс./масс. Общая скорость протекания внутри микрожидкостного смесителя поддерживалась при 2 мл/мин. 10 мМ липид-этанольной фазы смешивали с 25 мМ ацетатным буфером, pH 4, включающим миРНК. Планки погрешностей отображают стандартное отклонение среднего диаметра частиц, измеренного с помощью динамического рассеяния света.
Фиг. 20A и 20B иллюстрируют морфологию PEG-липидных и катионных липидных LNP систем, приготовленных посредством микрожидкостного смесителя с использованием крио-трансмиссионной электронной микроскопии (ТЕМ). LNP были отображены с увеличением 29K с помощью Крио-ТЭМ. Фиг. 20A представляет собой изображение пустых LNP, состоящих из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1. Фиг. 20B представляет собой изображение LNP, наполненных миРНК, состоящих из Dlin-KC2-DMA/DSPC/Холестерин/PEG-c-DMA в молярных соотношениях 40:11,5:47,5:1, соотношение миРНК/общий липид составляло 0,06 масс./масс. Приготовление было выполнено с использованием микрожидкостного смесителя при 20 мМ липида в этанольной фазе. Наполненные LNP-миРНК и пустые частицы, включающие 1 мол.% PEG-c-DOMG, проявляли идентичную морфологию и весьма гомогенную по составу структуру. Длина масштабной полоски 100 нм.
Фиг. 21 иллюстрирует активность in vivo сайленсинга произведенной микрожидкостным способом LNP в модели Фактора VII мыши посредством сравнения относительного уровня протеина FVII (%) в зависимости от дозировки миРНК (мг/кг) с варьированием содержания DLin-KC2-DMA в LNP от 40 мол.% до 60 мол.%. Состав LNP, включающий 1 мол.% PEG-c-DOMG и 60 мол.% DLin-KC2-DMA, обеспечивает сайленсинг FVII, сходный с тем, о котором раннее сообщали при использовании альтернативных подходов. Генный сайленсинг постепенно повышается для LNP, включающих DLin-KC2-DMA в интервале от 40 мол.% до 60 мол.%. Системная инъекция LNP-миРНК мышам была выполнена инъекцией в хвостовую вену (n=3 на уровень дозы). Отбор крови был выполнен через 24 ч после инъекции и уровни фактора VII были определены посредством колориметрического анализа. В LNP поддерживалось соотношение DSPC/Холестерин при 0,2 масс./масс. и содержалось 1 мол.% PEG-c-DOMG. Соотношение миРНК/липид в LNP составляло 0,06 масс./масс.
Фиг. 22A-22C иллюстрируют крио-электронную микроскопию липидных наночастиц, приготовленных микрогидродинамическим способом. Пустые липидные наночастицы, приготовленные посредством микрогидродинамики (40% DLinKC2-DMA, 11,5% DSPC, 47,5% холестерина, 1% PEG-c-DMA) продемонстрировали электрон-плотную внутреннюю область, что указывает на структуру твердого ядра (Фиг. 22A). Образец, составленный из POPC, продемонстрировал менее плотную внутреннюю область, что соотносится с везикулами с водным ядром (Фиг. 22B). Системы, содержащие POPC/триолеин, который имеет гидрофобное ядро из триолеина, окруженного монослоем POPC, продемонстрировали электрон-плотную внутреннюю область, сходную с образцом (Фиг. 22C).
Фиг. 23 иллюстрирует LNP предельного размера, приготовленные с DLinKC2-DMA/PEG-липидной системой (90/10, мол.%/мол.%) с использованием микрожидкостного смешивания, посредством сравнения среднего диаметра частиц (нм) в зависимости от соотношения скорости этанол/водного потока для LNP, произведенных в присутствии миРНК (N/P=1) и в отсутствии миРНК (без миРНК). Приготовление было выполнено с использованием 10 мМ липид-этанольной фазы, смешанной с 25 мМ ацетатным буфером, pH 4. Размер частиц был определен при помощи динамического рассеяния света, и приведены средневзвешенные по размеру диаметры.
Фиг. 24A-24C иллюстрируют 31P ЯМР миРНК, инкапсулированной в 50% DLinKC2-DMA, 45% холестерин и 5% PEG-c-DMA с использованием микрожидкостного смешивания. DSPC не было включено для избежания противоречивого сигнала от фосфора, содержащегося в фосфолипиде. 31P сигнал от миРНК не может быть обнаружен для интактных LNP (Фиг. 24A) или после добавления 150 мМ ацетата аммония (Фиг. 24B). Сигнал может быть обнаружен только после добавления 1% SDS для солюбилизации частицы (Фиг. 24C).
Фиг. 25, представляющая собой электрофоретический гель, иллюстрирует результаты анализа защиты от РНКазы. миРНК была инкапсулирована с использованием или микрожидкостного способа (MF) или PFV подхода или была оставлена неинкапсулированной. Тритон Х-100 был добавлен для полной солюбилизации и лизирования липидных частиц. Гель-электрофорез был выполнен на 20% нативном полиакриламидном геле и миРНК визуализирована окрашиванием CYBR-Safe.
Фиг. 26 иллюстрирует результаты анализа слияния при липидном смешивании, представленные в виде процентного содержания липидного смешивания в зависимости от времени (секунды). Для определения величины доступного катионного липидного процентного содержания в крайнем слое LNP, были приготовлены три LNP системы: в отсутствии миРНК (без миРНК), при N/P=4 и N/P=1. Липидный анализ был выполнен при pH 5,5 для обеспечения почти полной ионизации катионного липида, и реакция была инициирована внесением LNP в кювету, содержащую крайне анионные везикулы DOPS/NBD-PE/Rh-PE (молярное соотношение 98:1:1).
Фиг. 27 представляет собой схематической отображение миРНК LNP системы с твердым ядром, образованной микрожидкостным смешиванием в соответствии со способом изобретения.
Фиг. 28A и 28B иллюстрируют средний диаметр частиц (нм) и дзета-потенциал (мВ), соответственно, в виде функции от последовательностный композиции липидной наночастицы, приготовленной с использованием микрожидкостного смесителя.
Фиг. 29 представляет собой схематическое изображение иллюстративного устройства и способа изобретения для последовательной сборки липидных наночастиц.
Фиг. 30 представляет собой схематическое изображение иллюстративного устройства и способа изобретения.
Фиг. 31 представляет собой схематическое изображение иллюстративного устройства и способа изобретения.
Фиг. 32 представляет собой схематическое изображение иллюстративного устройства и способа изобретения.
Фиг. 33 представляет собой схематическое изображение иллюстративного устройства и способа изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет липидные частицы, включающие терапевтический реагент, способы и устройства для изготовления липидных частиц, включающих терапевтический реагент, и способы доставки терапевтического реагента с использованием липидных частиц.
Липидные частицы
В одном аспекте изобретение предоставляет липидные частицы, включающие терапевтический реагент. Липидные частицы включают в себя один или более катионных липидов, один или более вторичных липидов и одну или более нуклеиновых кислот.
Катионный липид. Липидные частицы включают катионный липид. В используемом в данном документе значении термин "катионный липид" относится к липиду, который является катионным или становится катионным (протонированным) по мере того, как рН понижается ниже рК ионизируемой группы липида, но становится постепенно более нейтральным при более высоких значениях рН. При значениях рН ниже рК липид способен ассоциироваться с отрицательно заряженной нуклеиновой кислотой (например, олигонуклеотидами). В используемом в данном документе значении термин "катионный липид" включает в себя цвиттеронные липиды, которые приобретают положительный заряд при снижении рН.
Термин "катионный липид" относится к любому набору разновидностей липидов, которые несут результирующий положительный заряд при выбранном рН, таком как физиологическое
pH. Такие липиды включают, но не ограничены ими, хлорид N,N-диолеил-N,N-диметиламмония (DODAC); хлорид N-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTMA); бромид N,N-дистеарил-N,N-диметиламмония (DDAB); хлорид N-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTAP); 3-(N-(N',N'-диметиламиноэтан)- карбамоил)холестерин (DC-Chol) и бромид N-(1,2-димиристилоксипроп-3-ил)-N,N-диметил-N-гидроксиэтил аммония (DMRIE). Дополнительно в данном изобретении может быть использован ряд коммерчески доступных препаратов катионных липидов. Они включают, например, LIPOFECTIN® (коммерчески доступные катионные липосомы, содержащие DOTMA и 1,2-диолеил-sn-3-фосфоэтаноламин (DOPE), от GIBCO/BRL, Grand Island, NY); LIPOFECTAMIN® (коммерчески доступные катионные липосомы, содержащие трифторацетат N-(1-(2,3-диолеилокси)пропил)-N-(2-(сперминкарбоксамидо) этил)-N,N-диметиламмония (DOSPA) и (DOPE), от GIBCO/BRL) и TRANSFECTAM® (коммерчески доступные катионные липиды, содержащие диоктадециламидоглицил карбоксиспермин (DOGS) в этаноле от Promega Corp.,Madison, WI). Следующее липиды являются катионными и имеют положительный заряд при pH ниже физиологического: DODAP, DODMA, DMDMA, 1,2-дилинолеилокси-N,N-диметиламинопропан (DLinDMA), 1,2-дилиноленилокси-N,N-диметиламинопропан (DLenDMA).
В одном варианте осуществления катионный липид представляет собой аминолипид. Подходящие аминолипиды, пригодные для изобретения включают описанные в WO 2009/096558, включенные в данный документ во всей полноте посредством ссылки. Иллюстративные аминолипиды включают в себя 1,2-дилинолейокси-3-(диметиламино) ацетоксипропан (DLin-DAC), 1,2-дилинолейокси-3-морфолинопропан (DLin-MA), 1,2-дилинолеоил-3-диметиламинопропан (DLinDAP), 1,2-дилинолеилтио-3-диметиламинопропан (DLin-S-DMA), 1-линолеоил-2-линолеилокси-3-диметиламинопропан (DLin-2-DMAP), соль хлорида 1,2-дилинолеилокси-3-триметиламинопропана (DLin-TMA-Cl), соль хлорида 1,2-дилинолеоил-3-триметиламинопропана (DLin-TAP-Cl), 1,2-дилинолеилокси-3-(N-метилпиперазино)пропан (DLin-MPZ), 3-(N,N-дилинолеиламино)-1,2-пропандиол (DLinAP), 3-(N,N-диолеиламино)-1,2-пропандиол (DOAP), 1,2-дилинолеилоксо-3-(2-N,N-диметиламино)этоксипропан(DLin-EG-DMA) и 2,2-дилинолеил-4-диметиламинометил-[1,3]-диоксолан (DLin-K-DMA).
Пригодные аминолипиды включают в себя имеющие формулу:

где R1 и R2 являются или одинаковым или различным и необязательно независимо замещенным C10-C24 алкилом, необязательно замещенным C10-C24 алкенилом, необязательно замещенным C10-C24 алкинилом или необязательно замещенным C10-C24 ацилом;
R3 и R4 являются или одинаковым или различным и необязательно независимо замещенным C1-C6 алкилом, необязательно замещенным C2-C6 алкенилом или необязательно замещенным С2-С6 алкинилом, или R3 и R4 могут быть связаны с образованием необязательно замещенного гетероциклического кольца из от 4 до 6 атомов углерода и 1 или 2 гетероатомов, выбранных из азота и кислорода;
R5 или присутствует или отсутствует, когда присутствует, то является водородом или С1-С6 алкилом;
m, n и p являются или одинаковым, или различным и независимо или 0 или 1 при условии, что m, n и p не является одновременно 0;
q является 0, 1, 2, 3 или 4 и
Y и Z являются или одинаковым, или различным и независимо O, S или NH.
В одном варианте осуществления каждый из R1 и R2 являются линолеилом, и аминолипид представляет собой дилинолеил аминолипид. В одном варианте осуществления аминолипид представляет собой дилинолеил аминолипид.
Иллюстративный пригодный дилинолеил аминолипид имеет формулу:

где n представляет собой 0, 1, 2, 3 или 4.
В одном варианте осуществления катионный липид представляет собой DLin-K-DMA. В одном варианте осуществления катионный липид представляет собой DLin-KC2-DMA (вышеприведенный DLin-K-DMA, где n представляет собой 2).
Другие пригодные катионные липиды включают катионные липиды, которые несут суммарный положительный заряд при приблизительно физиологическом pH, в добавление к описанным выше, хлорид N,N-диолеил-N,N-диметиламмония (DODAC); хлорид N-(2,3-диолеилокси)пропил-N,N-N-триэтиламмония (DOTMA); бромид N,N-дистеарил-N,N-диметиламмония (DDAB); хлорид N-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония (DOTAP); соль хлорида 1,2-диолеилокси-3-триметиламинопропана (DOTAP-Cl); 3β-(N-(N',N'-диметиламиноэтан)карбамоил)холестерин (DC-Chol), трифторацетат N-(1-(2,3-диолеилокси)пропил)-N-2-(сперминкарбоксамидо)этил)-N,N-диметиламмония (DOSPA), диоктадециламидоглицил карбоксиспермин (DOGS), 1,2-диолеил-3-диметиламмоний пропан (DODAP), N,N-диметил-2,3-диолеилокси)пропиламин (DODMA) и бромид N-(1,2-димиристилоксипроп-3-ил)-N,N-диметил-N-гидроксиэтил аммония (DMRIE). Дополнительно может быть использован ряд коммерчески доступных препаратов катионных липидов, таких как, например, LIPOFECTIN (содержащий DOTMA и DOPE, доступный от GIBCO/BRL) и LIPOFECTAMIN (содержащий DOSPA и DOPE, доступный от GIBCO/BRL).
Катионный липид представлен в липидной частице в количестве от приблизительно 30 до приблизительно 95 мольных процентов. В одном варианте осуществления катионный липид представлен в липидной частице в количестве от приблизительно 30 до приблизительно 70 мольных процентов. В одном варианте осуществления катионный липид представлен в липидной частице в количестве от приблизительно 40 до приблизительно 60 мольных процентов.
В одном варианте осуществления липидная частица включает в себя (состоит из) только один или более катионных липидов и одну или более нуклеиновых кислот. Приготовление и характеризация липидной частицы по изобретению, состоящей из катионного липида и нуклеиновой кислоты, описаны в примере 5.
Вторичные липиды. В некоторых вариантах осуществления липидные частицы включают один или более вторичных липидов. Пригодные вторичные липиды стабилизируют образование частиц во время их образования.
Термин "липид" относится к группе органических соединений, которые являются сложными эфирами жирных кислот и характеризуются тем, что они нерастворимы в воде, но растворимы во многих органических растворителях. Обычно выделяют три класса липидов: (1) "простые липиды", которые включают в себя жиры и масла, а также воски; (2) "сложные липиды", которые включают в себя фосфолипиды и гликолипиды; и (3) "производные липиды", такие как стероиды.
Пригодные стабилизирующие липиды включают в себя нейтральные липиды и анионные липиды.
Нейтральный липид. Термин "нейтральный липид" относится к любому из ряда разновидностей липидов, который существует или в незаряженной, или нейтральной цвиттеронной форме при физиологическом рН. Иллюстративные нейтральные липиды включают в себя диацилфосфадилхолины, диацилфосфадилэтаноламины, церамиды, сфингомиелины, дегидросфингомиелины, кефалины и цереброзиды.
Показательные липиды включают в себя, например, дистеароилфосфадилхолин (DSPC), диолеилфосфадилхолин (DOPC), дипальмитоилфосфадилхолин (DPPC), диолеилфосфадилглицерин (DOPG), дипальмитоилфосфадилглицерин (DPPG),диолеилфосфадилэтаноламин (DOPE), пальмитоилолеилфосфадилхолин (POPC), пальмитоил олеилфосфадилэтаноламин (POPE) и диолеилфосфадилэтаноламин 4-(N-малеимидметил)-циклогексан-1-карбоксилат (DOPE-mal), дипальмитоилфосфадилэтаноламин (DPPE), димиристоилфосфоэтаноламин (DMPE), дистеароилфосфадилэтаноламин (DSPE), 16-O-монометил PE, 16-O-диметил PE, 18-1-транс PE, 1-стеароил-2-олеоилфосфатидилэтаноламин (SOPE) и 1,2-диэлаидоил-sn-глицеро-3-фосфоэтаноламин (transDOPE).
В одном варианте осуществления нейтральным липидом является 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC).
Анионный липид. Термин "анионный липид" относится к любому липиду, который отрицательно заряжен при физиологическом pH. Эти липиды включают в себя фосфадилглицерин, кардиолипин, диацилфосфадилсерин, диацилфосфатидную кислоту, N-додеканоилфосфадилэтаноламины, N-сукцинилфосфадилэтаноламины, N-глутарилфосфадилэтаноламины, лизилфосфадилглицерины, пальмитоилолеиолфосфадилглицерин (POPG) и другие анионные модифицирующие группы, присоединенные к нейтральным липидам.
Другие пригодные липиды включают в себя гликолипиды (например, моносиалоганглиозид GMi). Другие пригодные вторичные липиды включают стеролы, такие как холестерин.
Полиэтиленгликоль-липиды. В некоторых вариантах осуществления второй липид представляет собой полиэтиленгликоль-липид. Пригодные полиэтиленгликоль-липиды включают PEG-модифицированный фосфадилэтаноламин, PEG-модифицированную фосфатидную кислоту, PEG-модифицированные церамиды (например, PEG-CerC14 или PEG-CerC20), PEG-модифицированные диалкиламины, PEG-модифицированные диацилглицерины, PEG-модифицированные диалкилглицерины. Иллюстративные полиэтиленгликоль-липиды включают PEG-c-DOMG, PEG-c-DMA и PEG-s-DMG. В одном варианте осуществления полиэтиленгликоль-липид представляет собой N-[(метокси поли(этиленгликоль)2000)карбамил]-1,2-димиристилоксипропил-3-амин (PEG-c-DMA). В одном варианте осуществления полиэтиленгликоль-липид представляет собой PEG-c-DOMG).
В некоторых вариантах осуществления вторичный липид представлен в липидной частице в количестве от приблизительно 1 до приблизительно 10 мольных процентов. В одном варианте осуществления вторичный липид представлен в липидной частице в количестве от приблизительно 1 до приблизительно 5 мольных процентов. В одном варианте осуществления вторичный липид представлен в липидной частице в количестве приблизительно 1 мольного процента.
Нуклеиновые кислоты. Липидные частицы настоящего изобретения пригодны для системной или местной доставки нуклеиновых кислот. Как описано в данном документе, нуклеиновая кислота встраивается в липидную частицу во время ее образования.
В используемом в данном документе значении подразумевается, что термин "нуклеиновая кислота" включает любой олигонуклеотид или полинуклеотид. Фрагменты, включающие до 50 нуклеотидов, обычно обозначаются олигонуклеотиды и более длинные фрагменты называются полинуклеотиды. В отдельных вариантах осуществления олигонуклеотиды настоящего изобретения являются нуклеотидами длиной 20-50. В контексте данного изобретения термины "полинуклеотид" и "олигонуклеотид" относятся к полимеру или олигомеру нуклеотидных или нуклеозидных мономеров, состоящему из оснований природного происхождения, сахаров и связей между сахарами (остов). Термины "полинуклеотид" и "олигонуклеотид" также включают полимеры или олигомеры, содержащие неприродные мономеры или их участки, которые функционируют аналогичным образом. Такие модифицированные или замещенные олигонуклеотиды часто являются предпочтительными по сравнению с природными формами из-за свойств, таких как, например, увеличенное клеточное поглощение и повышенная устойчивость в присутствии нуклеаз. Олигонуклеотиды классифицируются на дезоксирибоолигонуклеотиды или рибоолигонуклеотиды. Дезоксирибоолигонуклеотид состоит из 5-углеродного сахара, называемого дезоксирибиза, ковалентно присоединенного к фосфату по 5' и 3' атомам углеродам этого сахара с образованием антисимметрического, неразветвленного полимера. Рибоолигонуклеотид состоит из сходной повторяющейся структуры, где 5-углеродный сахар является рибозой. Нуклеиновая кислота, которая присутствует в липидной частице в соответствии с данным изобретением включает в себя любую известную форму нуклеиновой кислоты. Нуклеиновая кислота, используемая в данном документе, может быть одноцепочечной ДНК или РНК, или двухцепочечной ДНК или РНК, или ДНК-РНК гибридами. Примеры двухцепочечной ДНК включают в себя структурные гены, гены, заключающие регуляторные и терминационные области и самовоспроизводящиеся самореплицирующиеся системы, такие как вирусная или плазмидная ДНК. Примеры двухцепочечной РНК включают миРНК и другие реагенты РНК-интерференции. Одноцепочечная нуклеиновая кислота содержит антисмысловые олигонуклеотиды, рибозимы, микроРНК и образующие триплекс олигонуклеотиды.
В одном варианте осуществления полинуклеиновая кислота является антисмысловым олигонуклеотидом. В некоторых вариантах осуществления нуклеиновая кислота является антисмысловой нуклеиновой кислотой, рибозимом, тРНК, мяРНК, миРНК, кшРНК, нкРНК, микроРНК, предварительно конденсированной ДНК или аптамером.
Термин "нуклеиновые кислоты" также относится к рибонуклеотидам, диоксинуклеотидам, модифицированным рибонуклеотидам, модифицированным дезоксирибонуклеотидам, олигонуклеотидам с модифицированным сахарнофосфатным остовом, другим нуклеотидам, нуклеотидным аналогам и их комбинациям и может быть одноцепочечной, двухцепочечной или, при необходимости, содержать участки как двухцепочечной, так и одноцепочечной последовательности.
Термин "нуклеотид", в используемом в данном документе значении, в общем охватывает следующее термины, определения которым даны ниже: нуклеотидное основание, нуклеозид, нуклеотидный аналог и универсальный нуклеотид.
Термин "нуклеотидное основание", в используемом в данном документе значении, относится к замещенному или незамещенному родоначальному ароматическому кольцу или кольцам. В некоторых вариантах осуществления ароматическое кольцо или кольца содержат по меньшей мере один атом азота. В некоторых вариантах осуществления нуклеотидное основание способно образовывать водородные по Уотсону-Крику и/или по Хугстену с соответствующим комплементарным нуклеотидным основанием. Показательные нуклеотидные основания и их аналоги включают в себя, но не ограничены ими, пурины, такие как 2-аминопурин, 2,6-диаминопурин, аденин (A), этеноаденин, N6-2-изопентениладенин (6iA), N6-2-изопентенил-2-метилтиоаденин (2мs6iA), N6-метиладенин, гуанин (G), изогуанин, N2-диметилгуанин (dmG), 7-метилгуанин (7mG), 2-тиопиримидин, 6-тиогуанин (6sG) гипоксантин и O6-метилгуанин; 7-деазапурины, такие как 7-деазааденин (7-деаза-A) и 7-деазагуанин (7-деаза-G); пиримидины, такие как цитозин (C), 5-пропинилцитозин, изоцитозин, тимин (T), 4-тиотимин (4sT), 5,6-дегидротимин, O4-метилтимин, урацил (U), 4-тиоурацил (4sU) и 5,6-дегидроурацил (дегидроурацил; D); индолы, такие как нитроиндол и 4-метилиндол; пирролы, такие как нитропиррол; небуларин; основание (Y); В некоторых вариантах осуществления нуклеотидные основания являются универсальными нуклеотидными основаниями. Дополнительные показательные нуклеотидные основания приведены в Fasman, 1989, Practical Handbook of Biochemistry and Molecular Biology, pp. 385-394, CRC Press, Boca Raton, Fla. и цитируемых там материалах. Дополнительные примеры универсальных оснований приведены, например, в Loakes, N. A. R. 2001, vol 29:2437-2447 и Seela N. A. R. 2000, vol 28:3224-3232.
Термин "нуклеозид", в используемом в данном документе значении, относится к соединению, у которого нуклеотидное основание ковалентно связано c С-1' атомом углерода пепентозного сахара. В некоторых вариантах осуществления связь осуществляется через азот гетероароматического кольца. Иллюстративные пентозные сахара включают в себя, но не ограничены ими, те пентозы, у которых один или более атомов углерода каждый независимо замещены одной или более одинаковых или различных -R, -OR, -NRR или галогеновых группы, где каждый R независимо является водородом, (C1-C6) алкилом или (C5-C14) арилом. Пентозный сахар может быть насыщенным или ненасыщенным. Показательные пентозные сахара и их аналоги включают в себя, но не ограничены ими, рибозу, 2'-дезоксирибозу, 2'-(C1-C6)алкоксирибозу, 2'-(C5-C14)арилоксирибозу, 2',3'-дидезоксирибозу, 2',3'-дидегидрорибозу, 2'-дезокси-3'-галорибозу, 2'-дезокси-3'-фторрибозу, 2'-дезокси-3'-хлоррибозу, 2'-дезокси-3'-аминорибозу, 2'-дезокси-3'-(C1-C6)алкилрибозу, 2-дезокси-3'-(C1-C6)алкоксирибозу и 2'-дезокси-3'-(C5-C14)арилоксирибозу. Также см., например, 2'-O-метил, 4'-.альфа.-аномерные нуклеотиды, 1'-.альфа.-аномерные нуклеотиды (Asseline (1991) Nucl. Acids Res. 19:4067-74), 2'-4'- и 3'-4'-связанные и другие "блокированные" или "LNA", бициклические сахарные модификации (WO 98/22489; WO 98/39352; WO 99/14226). "LNA" или "блокированная нуклеиновая кислота" представляет собой ДНК аналог, который конформационно блокирован так, что рибозное кольцо ограничено метиленовой связью между 2'-атомом кислорода и 3'- или 4'-атомом углерода. Конформационное ограничение, налагаемое связью, часто увеличивает связывающее сродство к комплементарным последовательностям и увеличивает термическую устойчивость таких дуплексов.
Сахара включают модификации в 2'- или 3'-положении, такие как метокси, этокси, аллилокси, изопропокси, бутокси, изобутокси, метоксиэтил, алкокси, фенокси, азидо, амино, алкиламино, фтор, хлор и бром. Нуклеозиды и нуклеотиды включают природный D конфигурационный изомер (D-форма), а также L конфигурационный изомер (L-форма) (Beigelman, Патент США No. 6251666; Chu, Патент США No. 5753789; Shudo, EP0540742; Garbesi (1993) Nucl. Acids Res. 21:4159-65; Fujimori (1990) J. Amer. Chem. Soc. 112:7435; Urata, (1993) Nusleic Acids Symposium Ser. No. 29:69-70). Если нуклеиновое основание является пурином, например, A или G, то рибозный сахар, присоединен к N9-положению нуклеинового основания. Если нуклеиновое основание является пиримидином, например, С, T или U, то пентозный сахар присоединен к N1-положению нуклеинового основания (Kornberg и Baker, (1992) DNA Replication, 2.sup.nd Ed., Freeman, San Francisco, Calif.).
Один или более пентозных атомов углерода нуклеозида могут быть замещены фосфатным эфиром. В некоторых вариантах осуществления фосфатный эфир присоединен к 3'- или 5'-атому углерода пентозы. В некоторых вариантах осуществления нуклеотидным основанием в нуклеозидах является пурин, 7-деазапурин, пиримидин, универсальное нуклеотидное основание, необычное нуклеотидное основание или их аналог.
Термин "нуклеотидный аналог", в используемом в данном документе значении, относится к вариантам осуществления, в которых пентозный сахар и/или нуклеотидное основание и/или один или более фосфорных эфиров нуклеозида могут быть замещены их соответствующим аналогом. В некоторых вариантах осуществления показательными аналогами пентозного сахара являются описанные выше. В некоторых вариантах осуществления нуклеотидные аналоги имеют аналог нуклеотидного основания, как описано выше. В некоторых вариантах осуществления показательные аналоги фосфорного эфира включают в себя, но не ограничены ими, алкилфосфонаты, метилфосфонаты, фосфорамидаты, фосфотриэфиры, фосфоротиоаты, фосфородитиоаты, фосфороселеноаты, фосфородиселеноаты, фосфороанилотиоаты, фосфороанилидаты, фосфороамидаты, боронофосфаты и могут включать ассоциированные противоионы. Другие аналоги нуклеиновой кислоты и основания включают, например, интеркалирующие нуклеиновые кислоты (INA, как описано в Christensen и Pedersen, 2002) и AEGIS основания (Eragen, Патент США No. 5432272). Дополнительные описания различных аналогов нуклеиновой кислоты приведены, например, в


Другие нуклеиновые аналоги содержат фосфородитионаты (Briu et al., J. Am. Chem. Soc. 111:2321 (1989), O-метилфосфорамидитные связи (Eckstein, Oligonucleotides and Analogs: Practical Approach, Oxford University Press), аналоги с положительными остовами (Denpcy et al., Proc. Natl. Acad. Sci. USA 92:6097 (1995); неионными остовами

и нерибозные остовы, включая описанные в патентах США No. 5235033 и 5034506 и главах 6 и 7, ASC Symposium Series 580, "Carbohydrate Modifications in Antisense Research", Ed. Y. S. Sanghui и P. Dan Cook. Нуклеиновые кислоты, содержащие один или более карбоциклических сахаров, также включены в рамки определения нуклеиновых кислот (Jenkins et al., Chem. Soc. Rev. (1995) pp169-176). Некоторые аналоги нуклеиновых кислот также описаны в Rawls, С & E News June 2, 1997 page 35.
Термин "универсальное нуклеотидное основание" или "универсальное основание", в используемом в данном документе значении, относится к виду ароматического кольца, которое может содержать или не содержать атомы азота. В некоторых вариантах осуществления универсальное основание может быть ковалентно присоединено к C-1' атому углерода пентозного сахара для создания универсального нуклеотида. В некоторых вариантах осуществления универсальное нуклеотидное основание не имеет водородной связи специфически с другим нуклеотидным основанием. В некоторых вариантах осуществления водород универсального нуклеотидного основания связывает нуклеотидное основание, в пределах и включая все нуклеотидные основания в определенном целевом полинуклеотиде. В некоторых вариантах осуществления нуклеотидное основание может взаимодействовать с соседними нуклеотидными основаниями в одной цепи нуклеиновой кислоты посредством гидрофобной укладки. Универсальные нуклеотиды включают в себя, но не ограничены ими, дезокси-7-азаиндол трифосфат (d7AITP), дезоксиизокарбостирил трифосфат (dICSTP), дезоксипропинилизокарбостирил трифосфат (dPICSTP), дезоксиметил-7-азаиндол трифосфат (dM7AITP), дезоксиImPy трифосфат (dImPyTP), дезоксиPP трифосфат (dPPTP) или дезоксипропинил-7-азаиндол трифосфат (dP7AITP). Дополнительные примеры таких универсальных оснований приведены, в том числе, в опубликованной заявке США No. 10/290672 и Патенте США No. 6433134.
В используемом в данном документе значении термины "полинуклеотид" и "олигонуклеотид" используются взаимозаменяемо и означают одноцепочечный и двухцепочечный полимеры из нуклеотидных мономеров, включая 2'-дезоксирибонуклеотиды (ДНК) и рибонуклеотиды (РНК), связанные межнуклеотидными фосфодиэфирными связями, например, 3'-5' и 2'-5', обратнонаправленными связями, например, 3'-3' и 5'-5', разветвленными структурами или межнуклеотидными аналогами. Полинуклеотиды имеют ассоциированные противоионы, такие как H+, NH4+, триалкиламмоний, Mg2+, Na+ и тому подобные. Полинуклеотид может быть составлен исключительно из дезоксирибонуклеотидов, исключительно рибонуклеотидов или их химерных смесей. Полинуклеотиды могут состоять из межнуклеотидной связи, нуклеинового основания и/или аналогов сахаров. Полинуклеотиды, как правило, различаются по размеру от нескольких мономерных звеньев, например, 3-40, при этом их в данной области наиболее часто называют олигонуклеотиды, до нескольких тысяч мономерных звеньев. Если особым образом не указано иное, всякий раз, когда отображена полинуклеотидная последовательность, будет подразумеваться, что нуклеотиды написаны в порядке от 5' к 3' слева направо и что "A" обозначает деоксиаденозин, "C" обозначает деоксицитозин, "G" обозначает деоксигуанозин и "T" обозначает тимидин, если не указано иное.
В используемом в данном документе значении "нуклеиновое основание" означает гетероциклические молекулы природного происхождения и неприродного происхождения, общеизвестные для тех, кто использует технологию нуклеиновых кислот или использует технологию пептидных нуклеиновых кислот, для того чтобы, таким образом, произвести полимеры, которые могут специфично в отношении последовательности связываться с нуклеиновыми кислотами. Неограничивающие примеры пригодных нуклеиновых оснований включают в себя: аденин, цитозин, гуанин, тимин, урацил, 5-пропинилурацил, 2-тио-5-пропинилурацил, 5-метилцитозин, псевдоизоцитозин, 2-тиоурацил и 2-тиотимин, 2-аминопурин, N9-(2-амино-6-хлорпурин), N9-(2,6-диаминопурин), гипоксантин, N9-(7-деазагуанин), N9-(7-деаза-8-азагуанин) и N8-(7-деаза-8-азааденин). Другие неограничивающие примеры пригодного нуклеинового основания включают нуклеиновые основания, проиллюстрированные на Фиг. 2(A) и 2(B) в Buchardt et al. (W092/20702 или W092/20703).
В используемом в данном документе значении "последовательность нуклеинового основания" означает любой сегмент или совокупность двух или более сегментов (например, составная последовательность нуклеинового основания из двух или более олигомерных блоков), полимера, который содержит содержащие нуклеиновое основание субъединицы. Неограничивающие примеры пригодных полимеров или полимерных сегментов включают в себя олигодиоксинуклеотиды (например, ДНК), олигорибонуклеотиды (например, РНК), пептидные нуклеиновые кислоты (PNA), PNA химеры, PNA комбинированные олигомеры, аналоги нуклеиновой кислоты и/или имитаторы нуклеиновых кислот.
В используемом в данном документе значении "цепь полинуклеинового основания" означает полную отдельную полимерную цепь, содержащую нуклеиновые основания в качестве субъединиц. Например, отдельная цепь нуклеиновой кислоты двухцепочечной нуклеиновой кислоты представляет собой цепь полинуклеинового основания.
В используемом в данном документе значении "нуклеиновая кислота" представляет собой полимер, содержащий последовательность нуклеинового основания, или сегмент полимера, имеющий остов, образованный из нуклеотидов или их аналогов.
Предпочтительной нуклеиновыми кислотами являются ДНК и РНК.
В используемом в данном документе значении нуклеиновые кислоты могут также относиться к "пептидной нуклеиновой кислоте" или "PNA", что означает любой олигомер или полимерный сегмент (например, блоколигомер), содержащий две или более PNA субъединиц (остатка), но не субъединицы нуклеиновой кислоты (или их аналоги), включая, но не ограничиваясь ими, любые олигомерные или полимерные сегменты, называемые или заявленные как пептидные нуклеиновые кислоты в патентах США No. 5539082, 5527675, 5623049, 5714331, 5718262, 5736336, 5773571, 5766855, 5786461, 5837459, 5891625, 5972610, 5986053 и 6107470; все из которых включены в данный документ путем ссылки. Термин "пептидная нуклеиновая кислота" или "PNA" будет также использоваться для любого олигомерного или полимерного сегмента, содержащего две или более субъединиц имитаторов нуклеиновой кислоты, описанных в следующих публикациях:

как описано в W096/04000.
Характеристики липидной частицы
Морфология. Липидная частица изобретения отличается от других аналогичным образом образованных частиц своей морфологией и характеризуется наличием практически твердого ядра. Липидная частица, имеющая практически твердое ядро, является частицей, которая не имеет протяженной водной области во внутренней части и которая имеет внутреннюю часть, которая по существу является липидом. В одном варианте осуществления протяженная область является непрерывной водной областью с объемом большим, чем половина объема частицы. В другом варианте осуществления протяженная водная область составляет более 25% объема частицы. Протяженность внутренней водной области может быть определена с помощью электронной микроскопии и является участком низкой электронной плотности. Дополнительно, из-за того, что внутренняя часть твердого ядра наночастицы по существу является липидом, водное содержание частицы ("захваченный объем") в расчете на липид, составляющий частицу, меньше, чем ожидаемое для моноламеллярной бислойной липидной везикулы с таким же радиусом. В одном варианте осуществления захваченный объем составляет менее 50% ожидаемого для моноламеллярной бислойной везикулы с таким же радиусом. Во втором варианте осуществления захваченный объем составляет менее 25% ожидаемого для моноламеллярной бислойной везикулы с таким же радиусом. В третьем варианте осуществления захваченный объем составляет менее 20% общего объема частицы. В одном варианте осуществления захваченный объем в расчете на липид составляет менее 2 микролитров на микромоль липида. В другом варианте осуществления захваченный объем составляет менее 1 микролитра на микромоль липида. Кроме того, несмотря на то, что захваченный объем в расчете на липид значительно увеличивается для бислойной липидной везикулы по мере того, как увеличивается радиус везикулы, захваченный объем в расчете на липид не увеличивается значительно по мере того, как увеличивается радиус наночастиц с твердым ядром. В одном варианте осуществления захваченный объем в расчете на липид увеличивается менее чем на 50%, по мере увеличения среднего размера от диаметра 20 нм до диаметра 100 нм. Во втором варианте осуществления захваченный объем в расчете на липид увеличивается менее чем на 25% по мере увеличения среднего размера от диаметра 20 нм до диаметра 100 нм. Захваченный объем может быть измерен с использованием ряда технологий, описанных в литературе. Так как системы с твердым ядром содержат липид внутри частицы, то общее количество частиц данного радиуса, полученных в расчете на моль липида, меньше, чем ожидаемое для бислойной везикулярной системы. Количество частиц, полученных в расчете на моль липида, может быть измерено среди прочего с помощью флюоресцентных технологий.
Липидные частицы изобретения могут также быть охарактеризованы с помощью электронной микроскопии. Частицы изобретения, имеющие практически твердое ядро, имеют электрон-плотное ядро, как это видно с помощью электронной микроскопии. Электронная плотность определяется так, что усредненная по площади электронная плотность 50% внутренней части предполагаемой площади частицы с твердым ядром (как видно в 2-D изображении Крио-ЭМ) составляет не менее x% (x=20%, 40%, 60%) максимальной электронной плотности на периферии частицы. Электронная плотность рассчитывается как абсолютное значение разницы между интенсивностью изображения участка, представляющего интерес, и фоновой интенсивностью в участке, не содержащем наночастицы.
Частица размер. Липидная частица по изобретению имеет диаметр (средний диаметр частицы) от приблизительно 15 до приблизительно 300 нм. В некоторых вариантах осуществления липидная частица имеет диаметр приблизительно 300 нм или менее, 250 нм или менее, 200 нм или менее, 150 нм или менее, 100 нм или менее или 50 нм или менее. В одном варианте осуществления липидная частица имеет диаметр от приблизительно 15 до приблизительно 100 нм. Эти частицы в целом проявляют повышенную циркуляторную продолжительность существования in vivo по сравнению с крупными частицами. В одном варианте осуществления липидная частица имеет диаметр от приблизительно 15 до приблизительно 50 нм. Эти частицы способны предпочтительно выводится из сосудистой системы. В одном варианте осуществления липидная частица имеет диаметр от приблизительно 15 до приблизительно 20 нм. Размер этих частиц приближается к предельному размеру частиц, которые содержат нуклеиновую кислоту; такие частицы могут включать полинуклеотид (например, миРНК).
Липидные частицы изобретения практически гомогенны в отношении их распределения по размерам. В некоторых вариантах осуществления липидные частицы изобретения имеют стандартное отклонение среднего диаметра частиц от приблизительно 65 до приблизительно 25%. В одном варианте осуществления липидные частицы изобретения имеют стандартное отклонение среднего диаметра частиц приблизительно 60, 50, 40, 35 или 30%.
Эффективность инкапсуляции. Липидные частицы изобретения могут дополнительно различаться по эффективности инкапсуляции. Как описано ниже, липидные частицы изобретения приготовлены с помощью процесса, посредством которого почти 100% нуклеиновой кислоты, использованной в процессе составления, становятся инкапсулированными в частицы. В одном варианте осуществления липидные частицы приготовлены с помощью процесса, посредством которого от приблизительно 90 до приблизительно 95% нуклеиновой кислоты, использованной в процессе составления, становятся инкапсулированными в частицы.
Микрожидкостные способы создания липидных частиц
В одном аспекте изобретение предоставляет способ создания липидных частиц, содержащих терапевтический реагент. В одном варианте осуществления способ включает в себя
введение первого потока, содержащего терапевтический реагент (например, полинуклеиновую кислоту) в первом растворителе в микроканал; где микроканал имеет первый отдел, приспособленный для протекания одного или более потоков, введенных в микроканал, и второй отдел для смешивания содержимых одного или более потоков;
введение второго потока, содержащего образующие липидную частицу вещества во втором растворителе в микроканал, для обеспечения протекания первого и второго потоков в условиях ламинарного протекания, где образующие липидную частицу вещества содержат ионизируемый липид и где первый и второй растворители не являются одинаковыми;
протекание одного или более первых потоков и одного или более вторых потоков из первого отдела микроканала во второй отдел микроканала и
смешивание содержимых одного или более первых потоков и одного или более вторых потоков, протекающих в условиях ламинарного протекания, во втором отделе микроканала для обеспечения третьего потока, содержащего липидные частицы с инкапсулированными терапевтическими реагентами.
Содержимые первого и второго потоков могут быть смешаны посредством беспорядочной адвекции. В одном варианте осуществления смешивание содержимых одного или более первых потоков и одного или более вторых потоков содержит варьирование концентрации или относительных скоростей смешивания одного или более первых потоков и одного или более вторых потоков. В вышеприведенном варианте осуществления в отличие от известных способов, способ не включает разбавление после смешивания.
Для дополнительной стабилизации третьего потока, включающего липидные частицы с инкапсулированными терапевтическими реагентами, способ может, но необязательно, дополнительно включать разбавление третьего потока водным буфером. В одном варианте осуществления разбавление третьего потока включает в себя протекание третьего потока и водного буфера во второе смешивающее устройство. В другом варианте осуществления водный буфер, содержащий липидные частицы с инкапсулированными терапевтическими реагентами, подвергается диализу для снижения количества второго растворителя.
Первый поток включает в себя терапевтический реагент в первом растворителе. Пригодные первые растворители включают растворители, в которых растворимы терапевтические реагенты и которые поддаются смешиванию со вторым растворителем. Пригодные первые растворители включают водные буфера. Иллюстративные первые растворители включают цитратный и ацетатный буферы.
Второй поток включает в себя образующие липидную частицу вещества во втором растворителе. Пригодные вторые растворители содержат растворители, в которых растворимы ионизируемые липиды и которые поддаются смешиванию с первым растворителем. Пригодные вторые растворители содержат 1,4-диоксан, тетрагидрофуран, ацетон, ацетонитрил, диметилсульфоксид, диметилформамид, кислоты и спирты. Иллюстративные вторые растворители включают водный этанол 90%.
Способы изобретения отличаются от других микрожидкостных способов смешивания несколькими особенностями. В то время как некоторые известные способы требуют одинакового или практически одинакового соотношения водного и органического растворителей (т.е., 1:1), способ изобретения обычно использует соотношение водного и органического растворителя, которое превышает 1:1. В некоторых вариантах осуществления соотношение водного и органического растворителя составляет приблизительно 2:1. В некоторых вариантах осуществления соотношение водного и органического растворителя составляет приблизительно 3:1. В некоторых вариантах осуществления соотношение водного и органического растворителя составляет приблизительно 4:1. В некоторых других вариантах осуществления соотношение водного и органического растворителя составляет приблизительно 5:1, приблизительно 10:1, приблизительно 50:1, приблизительно 100:1 или больше.
Липидные частицы по изобретению предпочтительно образуются в микрожидкостном процессе, в котором используется относительно быстрое смешивание и высокие скорости потоков. Быстрое смешивание обеспечивает то, что липидные частицы имеют предпочтительные свойства, приведенные выше, включая размер, гомогенность, эффективность инкапсуляции. Скорости смешивания, применяемые при практическом осуществлении способа изобретения, находятся в пределах от приблизительно 100 мкс до приблизительно 10 мс. Иллюстративные скорости смешивания включают от приблизительно 1 до приблизительно 5 мс. В то время как способы гидродинамической фокусировки протекания функционируют при относительно низких скоростях протекания (например, от 5 до 100 мкл/минуту) с относительно низкими объемами липида, способ изобретения функционирует при относительно высоких скоростях протекания и относительно больших объемах липида. В некоторых вариантах осуществления для способов, которые включают единственный отдел для смешивания (т.е. смеситель), скорость протекания составляет приблизительно 1 мл/мин. Для способов изобретения, которые используют набор смесителей (например, 10 смесителей), применяются скорости протекания 40 мл/минуту (для 100 смесителей скорость протекания 400 мл/мин). Таким образом, способы изобретения могут быть легко масштабированы для обеспечения количеств липидных частиц, необходимых для удовлетворения требований производства. Наряду достижением предпочтительного размера частицы, гомогенности и эффективности инкапсуляции, способ изобретения исключает недостатки известных микрожидкостных способов производства липидных частиц. Одно преимущество способов изобретения для изготовления липидных частиц заключается в том, что способы являются масштабируемыми, что означает, что способы не изменяются при масштабировании и превосходно подходят для масштабирования.
Микрожидкостные устройства для создания липидных частиц
В другом аспекте изобретение обеспечивает устройства для производства липидной частицы с инкапсулированной нуклеиновой кислотой. В одном варианте осуществления устройство включает в себя:
первое впускное отверстие для приема первого раствора, содержащего нуклеиновую кислоту в первом растворителе;
первый впускной микроканал в жидкостном сообщении с первым впускным отверстием для обеспечения первого потока, содержащего нуклеиновую кислоту в первом растворителе;
второй впускное отверстие для приема второго раствора, содержащего образующие липидную частицу вещества во втором растворителе;
микроканал второго впускного отверстия в жидкостном сообщении со вторым впускным отверстием для обеспечения второго потока, содержащего образующие липидную частицу вещества во втором растворителе;
третий микроканал для приема первого и второго потоков, где третий микроканал имеет первый отдел, приспособленный для протекания первого и второго потоков, введенных в микроканал в условиях ламинарного протекания, и второй отдел, приспособленный для смешивания содержимых первого и второго потоков для обеспечения третьего потока, содержащего липидные частицы с инкапсулированной нуклеиновой кислотой.
В одном варианте осуществления устройство дополнительно включает в себя средство для разбавления третьего потока для обеспечения разбавленного потока, содержащего стабилизированные липидные частицы с инкапсулированным терапевтическим реагентом.
Устройство изобретения представляет собой микрожидкостное устройство, содержащее один или более микроканалов (т.е. канал, имеющий минимальное измерение менее 1 миллиметра). В одном варианте осуществления микроканал имеет гидродинамический диаметр от приблизительно 20 до приблизительно 300 мкм. Как указано выше, микроканал имеет два отдела: первый отдел для приема и протекания по меньшей мере двух потоков (например, одного или более первых потоков и одного или более вторых потоков) в условиях ламинарного протекания. Содержимые первого и второго потоков смешиваются во втором отделе микроканала. В одном варианте осуществления второй отдел микроканала имеет главное направление потока и одну или более поверхностей, имеющих по меньшей мере одну выемку или выступ, расположенные там, при этом выемка или выступ имеют ориентацию, которая образует угол с главным направлением (например, ступенчатый елочный смеситель), как описано в опубликованной заявке США No. 2004/0262223, включенной в данный документ во всей полноте путем ссылки. В одном варианте осуществления второй отдел микроканала содержит рельефные структуры. Для достижения максимальных скоростей смешивания, предпочтительно избегать чрезвычайного жидкостного сопротивления перед смешивающим отделом. Таким образом, один вариант осуществления изобретения представляет собой устройство, в котором для доставки жидкостей в единственный смешивающий канал используются немикрожидкостные каналы, имеющие размеры больше 1000 микрон.
В других аспектах изобретения первый и второй потоки смешиваются другими микросмесителями. Пригодные микросмесители включают капельные смесители, T-образные смесители, зигзагообразные смесители, многопластинчатые смесители или другие активные смесители.
Смешивание первого и второго потоков может также быть выполнено со средством для варьирования концентрации и относительных скоростей протекания первого и второго потоков.
В другом варианте осуществления устройство для производства липидной частицы с инкапсулированной нуклеиновой кислотой включает в себя микроканал для приема первого и второго потоков, где микроканал имеет первый отдел, приспособленный для протекания первого и второго потоков, введенных в микроканал в условиях ламинарного протекания, и второй отдел, приспособленный для смешивания содержимых первого и второго потоков, для обеспечения третьего потока, содержащего липидные частицы с инкапсулированным терапевтическим реагентом. В этом варианте осуществления первый и второй поток вводятся в микроканал с помощью средства, отличного от первого и второго микроканалов как отмечалось выше.
Для достижения максимальной скорости смешивания предпочтительно предотвращать чрезмерное жидкостное сопротивление перед смешивающим отделом. Таким образом, один вариант осуществления изобретения представляет собой устройство, в котором для доставки жидкостей в один смешивающий канал используются немикрожидкостные каналы, имеющие размеры больше 1000 микрон. Это устройство для производства липидной частицы с инкапсулированной нуклеиновой кислотой включает в себя:
один впускной микроканал для приема как первого раствора, содержащего нуклеиновую кислоту в первом растворителе, так и второго раствора, содержащего образующие липидную частицу вещества во втором растворителе;
второй отдел, приспособленный для смешивания содержимых первого и второго потоков для обеспечения третьего потока, содержащего липидные частицы с инкапсулированной нуклеиновой кислотой.
В таком варианте осуществления первый и второй потоки вводятся в микроканал с помощью одного впускного отверстия или одного или двух каналов, не имеющих микроразмеры, например, канал или каналы, имеющие размеры больше 1000 мкм (например, 1500 или 2000 мкм или более). Эти каналы могут быть введены в впускной микроканал с использованием соединенных смежных или соосных макроразмерных каналов.
Фиг. 1 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения. На Фиг. 1 устройство 100 включает в себя отдел для приема первого потока, содержащего терапевтический реагент в первом растворителе, и отдел В для приема потока, содержащего образующие липидную частицу вещества во втором растворителе. Первый и второй потоки вводятся в отдел C, протекая при ламинарных условиях протекания, в отдел D, где происходит быстрое смешивание и после этого в отдел E, где конечный продукт, липидные частицы, содержащие терапевтический реагент, покидают устройство.
Фиг. 2 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, которое представляет собой усовершенствование устройства и способа, изображенного на Фиг. 1. На Фиг. 2 устройство 200 включает в себя отдел для приема первого потока, содержащего терапевтический реагент в первом растворителе, в микроканал, где микроканал имеет первый отдел, приспособленный для протекания одного или более потоков (A-a), введенных (A-b) и смешанных(A-c); отдел В для приема второго потока, содержащего образующие липидную частицу вещества во втором растворителе, где микроканал имеет первый отдел, приспособленный для протекания одного или более потоков (B-a), введенных (B-b) и смешанных (B-c); отдел С,куда вводятся потоки из отдела A и отдела В при ламинарных условиях протекания (C-a) и быстро перемешиваются (C-b); и отдел D, где состав подготовлен для дополнительной обработки, такой как разбавление, корректировка pH или других процессов, необходимых для синтеза наночастиц, или где конечный продукт, липидные частицы, содержащие терапевтический реагент, покидают устройство
Фиг. 3 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, которое представляет собой усовершенствование устройства и способа, изображенного на Фиг. 2. На Фиг. 3 устройство 300 включает в себя отдел для приема первого потока, содержащего терапевтический реагент в первом растворителе, в микроканал, где микроканал имеет первый отдел, приспособленный для протекания одного или более потоков (A-a), введенных (A-b) и смешанных (A-c); отдел В для приема второго потока, содержащего образующие липидную частицу вещества во втором растворителе, где микроканал имеет первый отдел, приспособленный для протекания одного или более потоков (B-a), введенных (B-b) и перемешанных (B-c); отдел С, куда вводится потоки отдела A и отдела В при ламинарных условиях протекания (C-a) и быстро перемешиваются (C-b); отдел D для приема третьего потока, состоящего из любого количества веществ, содержащих дополнительные образующие частицы вещества, разбавители, регулирующие pH вещества или других процедур, необходимых для синтеза наночастиц; отдел E, куда вводятся потоки отдела С и отдела D при ламинарных условиях протекания (E-a) и быстро смешиваются (E-b); отдел F, где состав подготовлен для дополнительной обработки, такой как разбавление, регулирование pH или других процедурах, необходимых для синтеза наночастиц, или где конечный продукт, липидные частицы, содержащие реагент, покидают устройство.
Фиг. 4 представляет собой схематическое изображение другого иллюстративного жидкостного устройства (400) изобретения. Фиг. 5 представляет собой схематическое изображение иллюстративной компоновки иллюстративного жидкостного устройства, изображенного на Фиг. 4.
Фиг. 6 представляет собой схематическое изображение другого иллюстративного жидкостного устройства (600) изобретения. На Фиг. 6 устройство 600 включает в себя смешивающие каналы 610a, 610b и 610c. Фиг. 7 представляет собой схематическое изображение иллюстративной схемы компоновки иллюстративного жидкостного устройства, изображенного на Фиг. 6.
Образование наночастиц в микрожидкостном устройстве ограничено объемами реагентов, которые участвуют в процессе смешивания, и ограниченным противодавлением, которое устройства могут выдерживать перед тем, как произойдет утечка. Отдельные элементы шевронного или многопластинчатого смесителя обеспечивают 100-1000 кратное увеличение скорости потока по сравнению с капельным подходом или фокусировкой потока. Для того чтобы достигнуть производственного масштаба производительности, могут быть скомпонованы многочисленные смесительные элементы. В одном варианте осуществления каждый реагент распределяется к отдельным смешивающим элементам с использованием шинного канала с низким импердасом. Если импенданс шинного канала незначителен по сравнению с импендансом смесительного элемента, то индивидуальные скорости потоков во впускном отверстии каждого смесителя будут идентичны. Так как многочисленные смешивающие элементы задействованы паралельно, то импенданс системы снижается, приводя в результате более высокой объемной производительности.
Преимущество этого заключается в том, что характеристики смешивания, которые наблюдаются при использовании одного смешивающего элемента, могут сохраняться в компоновке смесителей. В одном варианте осуществления смешивание в каждом элементе системы смесителей достигается введением многочисленных потоков в микроканал. В этом случае потоки будут смешиваться посредством диффузии. Ширина линий тока может быть изменена посредством регулирования относительных скоростей протекания через инжекторные каналы (например, корректировкой размеров этих каналов (Фиг. 5)). В другом варианте осуществления смешивание достигается посредством беспорядочной адвекции (ступенчатый елочный смеситель, SHM). Как показано на Фиг. 7, каждый смесительный элемент системы может состоять из последовательностей смесителей. Посредством добавления элементов к каждой подсовокупности системы в микрожидкостное устройство могут быть интегрированы дополнительные функциональные возможности. Такие функциональные возможности могут включать встроенное разбавление, диализ, регулирование pH или другие процессы, которые требуются для переплетенных линий тока, потоков, распределенных в одном канале, или потоков, которые отделены друг от друга пористым материалом. В одном варианте осуществления 10 мМ POPC растворен в 100% этаноле и смешан с забуференным фосфатом физиологическим раствором (PBS), pH 7,4 в первом смесительном элементе каждой подсовокупности системы. LNP, которые образованы после смешивания, подвергаются стабилизации посредством разбавления смеси в 2 раза с использованием PBS.
Таблица 1 сравнивает распределение по размерам частиц, образованных в одном смесителе и системе смесителей, состоящей из десяти отдельных смесителей. Общая скорость протекания через один смеситель может быть 4 мл/мин с соотношением смешивания 50:50 в каждом месте пересечения. Объемная производительность может быть повышена в десять раз посредством параллельного функционирования десяти смесителей, приводя в результате к общей объемной скорости потока 40 мл/мин. Несмотря на то, что производительность системы пригодна для синтеза в производственном масштабе, размеры LNP сохраняются.
Распределение по размерам частиц, образованных в одном смесителе и системе смесителей, состоящей из десяти отдельных смесителей
Любая комбинация любого количества параллельных впускных отверстий для реагентов, последовательные смесительные камеры и разветвляющиеся конструкции могут быть использованы для оптимизации процесса приготовления наночастиц. Преимущество заключается в том, что другой процесс приготовления может быть точно контролируемым, и могут быть интегрированы многочисленные этапы процесса приготовления наночастиц. Примеры включают в себя, но не ограничены ими, следующее: (a) введение двух или более впускных потоков, состоящих из комбинаций различных (Фиг. 8) или одинаковых (Фиг. 9) реагентов, для того чтобы обеспечить независимый входной контроль (применения включают в себя независимый контроль скорости потока вводимых реагентов, варьирование соотношений между вводимыми реагентами и прочее); (b) два или более смесителя в последовательности, для того чтобы позволить последовательное добавление реагентов для образования наночастиц или этапы обработки составов (Фиг. 10) (применения включают в себя добавление вводимых реагентов в последовательности для контролируемой восходящей сборки наночастиц, объединение процессов приготовления, подобных разбавлению, регулированию pH или других процессов, необходимых для синтеза наночастиц и прочее); или (c) любая комбинация вводов, смешивающих камер и разветвляющихся структур, Фиг. 11 и Фиг. 12 иллюстрируют двухэтапный и трехэтапный смесители с варьирующимся количеством параллельных вводов реагентов и разветвляющимися микрожидкостными конструкциями (применения включают в себя объединение многочисленных этапов процесса приготовления, которое включает в себя встроенное смешивание реагентов для образования наночастиц, образование ядра и рост наночастиц, встроенное разбавление, диализ, регулирование pH или другие процессы, необходимые для синтеза наночастиц.
Фиг. 13 представляет собой схематическое изображение иллюстративного жидкостного устройства изобретения, имеющего многопластинчатый смеситель. На фиг. 13, устройство 1300 включает в себя смешивающие каналы 1310. Фиг. 14 представляет собой крупный план многопластинчатого смесителя, изображенного на Фиг. 14.
Как описано выше, способы создания липидных микро/наночастиц традиционно представляли собой "нисходящие" подходы, где более крупные структуры образуются посредством диспергирования липидов в воде, с последующим разрушением многослойных везикул (размером порядка микрона) посредством поликарбонатных фильтров с размером пор, например, 100 нм или, альтернативно, с использованием концевой обработки ультразвуком.
Недостатком таких периодических процессов является отсутствие возможности точно контролировать структуру и сборку каждого компонента липидной смеси. Это особенно важно, если некоторые составляющие легко разрушаются при подвергании условиям окружающей среды или если некоторые лиганды должны находиться в наружной части частицы в целях направления. Например, для терапевтических средств может быть важно сперва произвести частицу, которая имеет общий суммарный положительный или отрицательный поверхностный заряд для ассоциации с некоторым терапевтическим лекарственным средством. Может быть необходима дополнительная обработка для завершения сборки посредством инкапсулирования такой частицы в другое липидное вещество или для модификации поверхностных характеристик. Это может, например, включать добавление липидов для выработки в общем нейтральной частицы или добавление направляющих молекул, которые должны быть расположены на наружной части частицы для функциональных целей.
В одном варианте осуществления способ изготовления липидных наночастиц включает в себя последовательную сборку и наращивание липидных наночастиц посредством ассоциации на основе заряда и дополнительно может обеспечивать инкапсуляцию терапевтических малых интерферирующих РНК (миРНК). Этот способ может быть использован для полного изменения параметров поверхностного заряда с общего положительного на общий отрицательный и наоборот.
Липидная наночастица с инкапсулированной миРНК (отрицательно заряженная) была приготовлена с соотношением зарядов около 2 (положительный заряд/отрицательный заряд). Липиды содержали 90 мол.% DLin-KC2-DMA (положительно заряженный) и 10 мол.% PEG-c-DMA. В результате была получена частица 23 нм в диаметре (Фиг. 28A), которая имела положительный дзета-потенциал приблизительно 7 мВ (Фиг. 28B). После этого был введен анионный липид в 4-кратном избытке избыток по отношению к катионному липиду посредством микрожидкостного смешивания. Это привело к увеличению размера частицы до 33 нм и сдвигу в сторону отрицательного дзета-потенциала -14 мВ. Дальнейшее введение дополнительного катионного липида (в 4-кратном избытке по отношению к предшествующему DOPS) и последующее введение DOPS привело к дальнейшему увеличению размера частицы и изменению общего положительного и общего отрицательного дзета-потенциалов.
Результаты были получены посредством смешивания в одном микрожидкостном смесителе, извлечены и после этого повторно инжектированы в микросмеситель для добавления следующего липидного компонента. Тем не менее, может быть разработано одно микрожидкостное устройство для производства таких частиц непрерывным способом (Фиг. 29).
Нижеследующие устройства минимизируют жидкостные импендансы и взаимодействие между липидной и водной жидкостями перед введением в микросмеситель.
Фиг. 30 представляет собой схематическое изображение иллюстративного устройства 3000 и способа изобретения. На Фиг. 30, устройство 3000 включает в себя отдел A с первым потоком, содержащим полинуклеиновую кислоту в первом растворителе в широком канале (>2 мМ), и отдел B с потоком, содержащим образующие липидную частицу вещества во втором растворителе в широком канале (>2 мМ). Потоки вводятся в отдел C, где происходит быстрое смешивание в микросмесителе и потом, в конечном счете, в отдел D с конечным продуктом.
Фиг. 31 представляет собой схематическое изображение иллюстративного устройства и способа изобретения. На Фиг. 31 устройство 3100 включает в себя отдел A с первым потоком, содержащим полинуклеиновую кислоту в первом растворителе в широком канале (>2 мМ), и отдел B с потоком, содержащим образующие липидную частицу вещества во втором растворителе в широком канале (>2 мМ). Потоки вводятся в отдел C, где происходит быстрое смешивание в микросмесителе и, в конечном счете, в отдел D с конечным продуктом.
Фиг. 32 представляет собой схематическое изображение иллюстративного устройства и способа изобретения. На Фиг. 32 устройство 3200 включает в себя отдел A с первым потоком, содержащим полинуклеиновую кислоту в первом растворителе в широком канале (>2 мМ); отдел B со вторым потоком, содержащим первый растворитель в качестве проточной жидкости для течения в отделе A; отдел C с потоком, содержащим образующие липидную частицу вещества во втором растворителе в широком канале (>2 мМ); и отдел D со вторым потоком, содержащим второй растворитель в качестве проточной жидкости для течения в отделе C. Потоки вводятся в отдел E, где происходит быстрое смешивание в микросмесителе и после этого, в конечном счете, в отдел F с конечным продуктом. Пунктирные линии изображают поверхность раздела слоев жидкости.
Фиг. 33 представляет собой схематическое изображение иллюстративного устройства и способа изобретения. На Фиг. 33 устройство 3300 включает в себя отдел A, где первый поток, содержащий полинуклеиновую кислоту в первом растворителе, и второй поток, содержащий образующие липидную частицу вещества во втором растворителе, подвергаются концентрическому течению в канале, вводятся в отдел В, где происходит быстрое смешивание в микросмесителе и после этого, в конечном счете, в отдел С, где получается конечный продукт. Две жидкости в отделе могут быть разделены физическим барьером или проточной жидкостью, как показано на виде в поперечном разрезе
Способ доставки терапевтических реагентов с использованием липидных частиц
Липидные частицы по настоящему изобретению могут быть применены для доставки терапевтического реагента в клетку in vitro или in vivo. В частных вариантах осуществления терапевтический реагент представляет собой нуклеиновую кислоту, которая доставляется в клетку с использованием липидных частиц с нуклеиновой кислотой по настоящему изобретению. Способы и композиции могут быть легко адаптированы для доставки какого-либо пригодного терапевтического реагента для лечения какого-либо заболевания или расстройства, по отношению к которому такое лечение выгодно.
В некоторых вариантах осуществления настоящее изобретение предоставляет способы введения нуклеиновой кислоты в клетку. Предпочтительными нуклеиновыми кислотами для введения в клетки являются миРНК, микроРНК, иммуностимулирующие олигонуклеотиды, плазмиды, антисенсы и рибозимы. Эти способы могут быть осуществлены посредством контактирования частиц или композиций по настоящему изобретению с клетками в течение промежутка времени, достаточного для того, чтобы произошла внутриклеточная доставка.
Иллюстративные применения включают использование общеизвестных процедур для обеспечения внутриклеточной доставки миРНК для выключения или подавления специфических клеточных мишеней. Альтернативные применения включают доставку ДНК или мРНК последовательностей, которые кодируют терапевтически полезные полипептиды. Таким образом, предоставлена терапия генетических заболеваний обеспечением недостаточных или отсутствующих генных продуктов. Способы по настоящему изобретению могут быть осуществлены на практике in vitro, ex vivo или in vivo. Например, композиции по настоящему изобретению могут быть использованы для доставки нуклеиновой кислоты в клетки in vivo с использованием способов, которые известны специалисту в данной области.
Доставка миРНК посредством липидной частицы по изобретению и ее эффективность в сайленсинге генной экспрессии описана ниже.
При in vivo введении фармацевтические композиции предпочтительно вводятся парентерально (например, внутрисуставно, внутривенно, внутрибрюшинно, подкожно или внутримышечно). В частных вариантах осуществления фармацевтические композиции вводятся внутривенно или внутрибрюшинно болюсной инъекцией. Другие пути введения включают местный (кожа, глаза, слизистые оболочки), оральный, пульмональный, интраназальный, сублингвальный, ректальный и вагинальный.
В одном варианте осуществления настоящее изобретение предоставляет способ модуляции экспрессии целевого полинуклеотида или полипептида. Эти способы обычно содержат приведение клетки в контакт с липидной частицей по настоящему изобретению, которая ассоциирована с нуклеиновой кислотой, способной к модуляции экспрессии целевого полинуклеотида или полипептида. В используемом в данном документе значении термин "модуляция" относится к изменению экспрессии целевого полинуклеотида или полипептида. Модуляция может означать повышение или увеличение или может означать повышение уменьшение или снижение.
В связанном с этим вариантах осуществления настоящее изобретение предоставляет способ лечения заболевания или расстройства, характеризуемый сверхэкспрессией полипептида в субъекте, содержащий предоставление субъекту фармацевтической композиции по настоящему изобретению, где терапевтический реагент выбран из миРНК, микроРНК, антисмыслового олигонуклеотида и плазмиды, позволяющей экспрессию миРНК, микроРНК или антисмыслового олигонуклеотида, и где миРНК, микроРНК или антисмысловые РНК содержат полинуклеотид, который специфически связывается с полинуклеотидом, который кодирует полипептид или его компонент.
В дополнительном аспекте изобретение предоставляет фармацевтическую композицию, содержащую липидную частицу по изобретению и фармацевтически пригодный носитель или разбавитель. Иллюстративные фармацевтически пригодные носители или разбавители включают в себя растворы для внутривенной инъекции (например, физиологический раствор или декстроза). Композиция может иметь форму крема, мази, геля, суспензии или эмульсии.
Последующее представляет собой описание иллюстративной LNP системы, устройства и способа изготовления LNP системы и способа для использования LNP для доставки терапевтических реагентов.
Быстрое микрожидкостное смешивание предоставляет возможность производства монодисперсных липидных наночастиц.
Приготовление липидных наночастиц было выполнено посредством быстрого смешивания липид-этанольного раствора с водным буфером внутри микрожидкостного смесителя (Фиг. 15B), предназначенного для индуцирования беспорядочной адвекции и обеспечения управлямых условий смешивания с промежуточным числом Рейнольдса (24<Re<240). Микрожидкостной канал содержит елочные структуры, которые могут генерировать беспорядочный поток посредством изменения ориентации елочных структур между полупериодами, приводя к периодическому изменению центров местного ротационного и экстенсионального протекания.
Для определения эффективности смешивания внутри устройства была использована чувствительность флюоресцеина к pH, при этом были смешаны два 10 мкМ потока флюоресцеина, один флюоресцирующий при pH 8,88 и другой нефлюоресцирующий при pH 5,15. Было обнаружено, что длина канала, необходимая для того, чтобы произошло смешивание (степень смешивания >95%), составляет значение между 0,8 см и 1,0 см. Это привело к временам смешивания приблизительно 45 мс, 10 мс и 5 мс и 3 мс для скоростей потоков 0,1 мл/мин, 0,4 мл/мин, 0,7 мл/мин и 1,0 мл/мин, соответственно. При беспорядочном протекании предполагается небольшое различие в продолжительности смешивания, которое возрастает логарифмически с числом Пекле (Pe=Ul/D, где U является скоростью жидкости, l является поперечной длиной канала и D является диффузионной способностью молекулы).
Следующие иллюстративные составы включают в себя ионизируемый катионный липид DLin-KC2-DMA, имеющий наблюдаемое pKa 6,7, предоставляя липид, пригодный для инкапсуляции миРНК при низком pH и обеспечивая почти нейтральную плотность поверхности катионного заряда при физиологическом pH. Было определено влияние скорости потока на образование LNP с использованием этой LNP-миРНК схемы в качестве модельной системы. Так как время смешивания значительно снижается при повышенной скорости потока, то предполагалось, что скорость, при которой липиды вводятся в водную фазы, влияла на их конечный размер и дисперсность. Фиг. 16B демонстрирует средний диаметр частиц LNP-миРНК систем, произведенных микрожидкостным смесителем при использовании идентичных скоростей потоков от 0,1 мл/мин до 1 мл/мин на канал. Буфер содержал миРНК для достижения соотношения миРНК/общий липид 0,06 (масс./масс.), и LNP смесь была растворена непосредственно в буфере для снижения содержания этанола приблизительно до 22 об.%. Размер частицы значительно снизился при повышении общей скорости потока от 0,2 мл/мин до 2 мл/мин. Размер частицы был наибольшим при скорости потока 0,2 мл/мин, и LNP достигала предельного размера приблизительно 40 нм, как это определено по средневзвешенному по размеру диаметру частицы. Альтернативно, время смешивания также было отрегулировано изменением соотношения этанольного и водного потоков. Повышение скорости протекания водного потока в результате обеспечивает более быстрое разбавление липидов водным потоком. При поддерживании скорости липид-этанольного потока постоянной при 0,5 мл/мин, увеличение скорости водного потока приводило к снижению размера частицы (Фиг. 16C). Существенное сокращение размера частицы, от приблизительно 70 нм до 35 нм при трехкратном повышении скорости водного потока, что подчеркивает существенность быстрого снижения содержания этанола.
Так как предполагается, что эти LNP образуются спонтанно, когда липид сталкивается с водным окружением, также было важно важный исследовать влияние концентрации липида. Предполагается, что по мере того как концентрация липида повышается, количество липидов, способных включаться в состав LNP, будет повышаться или иным способом будут образовываться дополнительные частицы. Это наблюдалось при повышении концентрации липида от 10 мМ до 50 мМ в этанольном потоке. После этого повышения концентрации липида наблюдалось увеличение среднего диаметра частиц от приблизительно 40 нм до 70 нм (Фиг. 17).
Быстрое микрожидкостное смешивание обеспечивает широкий спектр составов LNP-миРНК систем. Несмотря на то, что недавние усовершенствования в области катионных липидов повысили действенность LNP в несколько раз, также стало очевидным, то что могу быть обеспечены дополнительные усовершенствования посредством оптимизации LNP композиции. Так, в частности, это может быть влиянием на емкость их дестабилизирующего бислоя и эндосомолитический потенциал или может влиять на их циркуляционные функциональные возможности при физиологическом pH. Например, составы с уменьшенным содержанием PEG-липида и повышенным содержанием катионного липида продемонстрировали значительное повышение in vivo эффективности LNP систем, направленных на гепатоциты печени. Это наблюдалось в недавнем сообщении для модели мышинного Фактора VII, которая обеспечила дополнительное пятикратное снижение ED50 для оптимизированных LNP. Несмотря на то, что PEG-липид необходим для дисперсной устойчивости, он может также снижать свойство дестабилизирования мембран для этих LNP систем. С использованием способа предварительно сформированной везикулы (PFV) возникли сложности при попытке получить LNP системы с менее 5 мол.% PEG-липида; предположительно, это происходило из-за более низкого содержания PEG во внешней части везикул, что увеличивает слияние между LNP. Дополнительно для инкубационного этапа, необходимого для реорганизации предварительно сформированных липидных частицы и инкапсуляции миРНК, требуются этанольные растворы в пределах 30% (об./об.). Эта повышенная текучесть липида может способствовать неустойчивости и вести к дополнительному агрегированию и слиянию предварительно сформированных липидных частиц.
При использовании PEG-c-DMA была исследована возможность микрожидкостного (MF) способа (быстрое время смешивания и короткая длительность пребывания перед разбавлением LNP до содержания этанола ниже 25% (об./об.)) продуцировать LNP-миРНК системы с варьирующимся PEG-липид содержанием. Исходная композиция DLin-KC2-DMA, DSPC, холестерин и PEG-c-DMA (40: 11,5: 38,5: 10 мол.%/мол.%) была использована с соотношением миРНК/общий липид 0,06 (масс./масс.). Дополнительный холестерин был использован для компенсирования пониженного количества PEG-c-DMA. Титрование PEG-c-DMA до 2 мол.% привело только к незначительному повышению размера частиц с использованием микрожидкостного подхода. Дополнительное снижение до 1 мол.% PEG привело к увеличению диаметра от приблизительно 20 нм до приблизительно 40 нм (Фиг. 18A). В отличие от этого, для среднего диаметра частиц при использовании PFV способа было продемонстрировано постоянное увеличение диаметра частиц от 20 нм до 70 нм, в то время как содержание PEG-липида снижалось до 1 мол.%. Кроме того, представляет интерес возможность изменять количество катионного липида для продуцирования LNP с небольшими количествами PEG-липида. При увеличении содержания DLin-KC2-DMA от 40 мол.% до 70 мол.% наблюдалось общее увеличение размера частиц от приблизительно 40 нм до 70 нм, для частиц, произведенных посредством микрожидкостного подхода (Фиг. 18B).
Самосборка в микрожидкостном устройстве может продуцировать LNP с почти полной инкапсуляцией. В производстве LNP-миРНК системы функциональный процесс обязательно будет обеспечивать высокий процент инкапсуляции OGN продукта. Инкапсуляция миРНК была оценена с помощью изменяющегося соотношения миРНК/общий липид от 0,01 до 0,2 (масс./масс.) с использованием LNP-миРНК состава с 1 мол.% PEG. Для LNP составов был достигнут процент инкапсуляции, приближающийся к 100 процентам на протяжении этого интервала (Фиг. 19). При достижении соотношения миРНК/общий липид 0,21 (масс./масс.), соответствующего изменению баланса заряда между катионным липидом и анионной миРНК (N/P=1), наблюдалось снижение инкапсуляции (данные не приведены). Предполагалось, что эта последняя тенденция была обусловлена недостаточным катионным зарядом, требуемым для связывания миРНК в комплекс и инкапсулирования в LNP.
Морфология. LNP, произведенные микрожидкостным способом и способом предварительно сформированной везикулы, были визуализированы крио-ТЭМ. Размеры частиц LNP были сходными с размерами, измеренными с помощью динамического рассеяния света. LNP-миРНК системы, включающие DLin-KC2-DMA/DSPC/Холестерин/PEG-c-DOMG в 40/11,5/47,5/1 мол.% с соотношением миРНК/липид 0,06 масс./масс., показаны на Фиг. 20A. Кроме того, пустые LNP образцы такой же композиции показаны на Фиг. 20B. Произведенные частицы являются в преобладающем количестве сферическими и гомогенными по размеру. Также было получено изображение LNP, приготовленных с использованием предварительно сформированного подхода и идентичной композиции. Они имели сходные с микрожидкостными LNP свойства, и при этом также наблюдались другие свойства, такие как структуры типа кофейного зерна. Эти LNP были также больше по размеру, как и можно было ожидать по результатам динамического рассеяния света.
миРНК LNP системы, произведенные с помощью микрогидродинамики, могут быть крайне действенными агентами для генного сайленсинга in vivo. Способность миРНК LNP систем индуцировать генный сайленсинг in vivo после внутривенной инъекции была исследована с использованием модели мышиного Фактора VII. С использованием микрожидкостного подхода были созданы составы, включающие DLin-KC2-DMA/DSPC/Холестерин/PEG-c-DOMG с соотношением миРНК/липид 0,06 (масс./масс.). Введение LNP-миРНК было осуществлено посредством инъекции в хвостовую вену. Содержание катионного липида, DLin-KC2-DMA, варьировалось от 30 мол.% до 60 мол.%, при этом поддерживалось соотношение DSPC/Холестерин 0,2 масс./масс. Повышение содержания катионного липида в LNP приводило к прогрессивному улучшению FVII сайленсинга. Реализованные наилучшим образом LNP содержали 60 мол.% DLin-KC2-DMA, при этом эффективная доза для 50% FVII сайленсинга составляла около 0,03 мг/кг (Фиг. 21). Интересно отметить, что дополнительный увеличение до 70 мол.% не привело к заметному повышению эффективности по сравнению с 60 мол.% DLin-KC2-DMA LNP.
Результаты демонстрируют, что микрожидкостное устройство, включающее ступенчатый елочный смеситель, может быть использовано для создания LNP с разнообразными липидными композициями, может быть использовано эффективной инкапсуляции OGN, таких как миРНК, и что произведенные миРНК LNP системы проявляют превосходные возможности для генного сайленсинга как in vitro, так и in vivo.
Микрожидкостное устройство и система изобретения позволяют образование LNP и LNP, включающих OGN размером 100 нм или меньше, и обеспечивают 100% OGN инкапсуляцию. Скорость и соотношение смешивания, безусловно, являются важными параметрами с точки зрения образования LNP. Быстрое смешивание этанол-липидного раствора с водным буфером приводит к увеличенной полярности среды, что снижает растворимость растворенных липидов, приводя к их осаждению из раствора и образованию наночастиц. Быстрое смешивание приводит к тому, что раствор быстро достигает состояния сверхперенасыщения липидных юнимеров по всему объему смешивания, приводя в результате к быстрой и гомогенной нуклеации наночастиц. Увеличенная нуклеация и рост наночастиц истощают окружающую жидкость в отношении свободного липида, тем самым ограничивая последующий рост посредством агрегирования свободного липида. Этот предполагаемый механизм согласуется с тем наблюдением, что более низкие концентрации липида в этаноле (восстановленный свободный липид) приводят к более мелким LNP (Фиг. 17), что более высокие скорости потока, приводящие к более быстрому и более гомогенному подходу к перенасыщению, приводят к образованию более мелких LNP и что повышение относительного соотношения водного компонента и компонентов органического растворителя также приводит к более мелким частицам (Фиг. 17).
LNP OGN системы изобретения, составленные микрогидродинамическим способом проявляют эффективности OGN инкапсуляции приближающиеся к 100%. Предыдущие крио-ТЭМ исследования с использованием PFV технологии для антисмысловых OGN выявили присутствие небольших многослойных везикул, приводящее к возможности того, что инкапсуляция включает в себя OGN адсорбцию предварительно сформированной везикулой, которая служит в качестве точки нуклеации для ассоциации с дополнительными предварительно сформированными везикулами, которые окружают исходную везикулу. Напротив, крио-ТЭМ исследования OGN LNP, произведенного микрогидродинамическим способом показывают, что большинство LNP систем являются "твердо ядерными" структурами и предполагают, что различные механизмы OGN инкапсуляции являются действенными. В частности, эти структуры согласуются с ассоциацией миРНК с мономерами катионного липида перед или одновременно с образованием наночастиц. Способность микрогидродинамического способа способствовать эффективности инкапсуляции антисмысловых и OGN миРНК, приближающейся к 100% независимо от композиции нуклеиновой кислоты, является главным преимуществом над ранее описанными способами.
Микрогидродинамический способ обеспечивает преимущество над тремя альтернативными технологиями синтеза LNP, содержащими процедуры традиционной экструзии для производства LNP, способ предварительно сформированной везикулы и способы спонтанного образования везикулы для OGN инкапсуляции. Микрогидродинамический способ обеспечивает LNP в пределах размера 100 нм или меньше и, когда присутствует катионный липид, позволяет то, что LNP образуются с низкими уровнями стабилизирующего PEG-липида. Недостатки микрогидродинамического способа относятся к необходимости удалять этанол после приготовления, при том, что некоторые липиды относительно нерастворимы в этаноле, и возможным ограничениям масштабирования. Микрогидродинамический способ предлагает преимущества в эффективностях инкапсуляции, применение высоко катионных липидных содержимых и низких PEG-липидных уровней, которые затруднительно применять с использованием PFV процесса, устранение необходимости образовывать предварительно сформированные везикулы и возможность вырабатывать мелкомасштабные партии с использованием всего 150 мкг олигонуклеотида с небольшими потерями из-за небольшого мертвого объема (мкл) устройства.
Преимущества микрожидкостного способа по сравнению с процедурой SVF "тройника" для создания LNP систем, наполненных OGN, являются сходными с показанными для PFV процесса, за исключением того, что не требуются предварительно сформированные везикулы. Отверстие тройника составляет приблизительно 1,5 мм в диаметре, при этом требуется высокие скорости потока (>1 мл/с) для достижения скоростей, необходимых для осуществления для быстрого смешивания. Микросмеситель позволяет образование LNP OGN при точно определенных, воспроизводимых условия при гораздо более низких скоростях потоков и сниженных потерях из-за мертвых объемов, при этом позволяя более прямолинейное приготовление маломасштабных партий для оптимизации LNP и in vitro тестирования.
LNP OGN системы могут быть увеличены в масштабе. Несмотря на то, что устройство, которое имеет максимальную скорость протекания 1 мл/мин, может быть недостаточным, один микрожидкостной чип может содержать 10 или более микросмесителей для достижения общих скоростей потоков около 10 мл/мин. Учитывая относительную недороговизну этой технологии, осуществимо на практике то, что набор таких чипов может быть использован параллельно, потенциально позволяя скорости потоков 100 мл/мин или выше от одного прибора с одной рабочей поверхностью. Кроме того, жидкостное управление против потока могло бы легко быть включено в состав такого устройства для того, чтобы позволить точно задаваемые составы из многочисленных компонентов, свойство которое крайне предпочтительно для проверки и оптимизации синтеза составов и параметров.
Твердое ядро LNP
Некоторые модели миРНК LNP составов предполагают структуру бислойной везикулы e LNP с миРНК внутри водной внутренней части. Тем не менее ряд наблюдений предполагает, что такие модели некорректны, по меньшей мере для миРНК LNP систем, выработанных подходом микрожидкостого смешивания. Например, крио-электронная микроскопия миРНК LNP систем, произведенных микрожидкостным смешиванием, указывает на наличие плотных электронных ядер в большей степени чем водных ядер, что соотносится с везикулярной структурой. Как указано выше, составление миРНК LNP систем может регулярно приводить в результате к эффективности инкапсуляции миРНК, приближающейся к 100%, наблюдение, которое не соотносится с бислойными структурами, где ожидаемый максимум эффективности инкапсуляции составляет 50%.
Структура миРНК LNP систем была оценена с использованием разнообразных физических и ферментативных анализов. Полученные результаты указывают на то, что эти миРНК LNP системы имеют внутреннюю часть с твердым ядром, состоящую из миРНК мономеров, связанных в комплекс с катионным липидом, а также липидом, упорядоченным в обращенную мицеллярную или в родственные структуры.
LNP системы проявляют структуру электронного твердого ядра, как показано Крио-ЭМ, в присутствии и отсутствие инкапсулированной миРНК. LNP системы, произведенные посредством микрожидкостного смешивания, проявляют плотные электронные ядра, как это визуализировано Крио-ЭМ, что соотносится с твердыми ядрами, в отличие от структур с водным ядром, предположенных для миРНК LNP систем, созданных альтернативными способами. Это было подтверждено как показано на Фиг. 22A для миРНК LNP состава, состоящего из DLin-KC2-DMA/DSPC/Chol/PEG-липид (40/11,5/47,5/1; мол.%/мол.%), включающего миРНК с содержанием 0,06 миРНК/липид (масс./масс.), что соответствует соотношению отрицательного заряда (на миРНК) и положительного заряда (на полностью протонированном катионном липиде) N/P=4. В результате приблизительно 75% катионного липида не связано в комплексе с миРНК в LNP. Структура твердого плотного электронного ядра контрастирует с менее плотной внутренней областью везикулярной системы, состоящей из POPC (Фиг. 22B) и визуально сходна с плотной электронной внутренней областью POPC/триолеин (POPC/TO) LNP (Фиг. 22C). POPC/TO LNP, произведенные с помощью микрожидкостного смешивания состоят из гидрофобного ядра из TO, окруженного монослоем из POPC.
Интересной особенностью Фиг. 22A является то, что 75% ионизируемого катионного липида не связано в комплекс с миРНК, но миРНК LNP частица как целое демонстрирует внутренняя часть в виде твердого ядра. Это предполагает, что катионный липид может вносить вклад в образование внутренней части в виде твердого ядра, даже когда он не связан в комплекс с миРНК. LNP системы с одинаковой липидной композицией, но без миРНК были составлены с использованием микрожидкостного процесса и охарактеризованы с помощью Крио-ЭМ. Как показано на Фиг. 22B, плотное электронное ядро наблюдалось в отсутствии миРНК, что указывает на то, что ионизируемые катионные липиды, такие как DLin-KC2-DMA, возможно в комбинации с DSPC и холестерином, могут принимать неламелярные плотные электронные структуры во внутренней части LNP.
LNP структуры демонстрируют предельные размеры, указывающие на то, что ионизируемый катионный липид образует обращенные мицеллярные структуры во внутренней части LNP. Вклад катионного липида в плотное элекронное ядро LNP приводит к вопросу, какой может быть молекулярная структура таких LNP систем. Логично предположить, что катионный липид вместе с противоином принимает обращенную структуру, такую как обращенная мицелла, что соотносится с предрасположенностью этих липидов к образованию обращенных структур, таких как гексагональная HH фаза в смесях с анионными липидами. В свою очередь, это бы предполагало, что LNP системы, состоящие из чистого катионного липида должны демонстрировать предельные размеры с диаметрами в пределах 10 нм, что по существу является толщиной двух бислоев, окружающих внутреннюю часть обращенной мицеллы с диаметром 2-3 нм. Диаметр водных каналов, обнаруженных для фосфадилэтаноламина в HH фазе, составляет 2,6 нм. Микрожидкостной процесс приготовления обеспечивает быструю кинетику смешивания, которая приводит к образованию систем с предельным размером для LNP систем. Была проведена оценка предельного размера, который может быть достигнут для системы DLin-KC2-DMA/PEG-липид (90/10, мол.%/мол.%). Как показано на Фиг. 23, измерения с помощью динамического рассеяния света этих LNP, образованных с помощью микрожидкостного способа, подтверждают, что размер частицы составляет приблизительно 10 нм в диаметре, при этом это открытие не соотносится со значительным водным ядром или захваченным объемом.
Схожий вопрос касается структуры комплекса катионный липид-миРНК. Логично также предположить, что он состоит из деформированной обращенной мицеллы катионного липида, окружающего миРНК олигонуклеотид. В свою очередь, это бы привело к предположению, что предельный размер лежит в пределах 15-20 нм, при условии, что миРНК, содержащаяся в этой обращенной мицелле, окружена внутренней частью монослоя катионного липида и, следовательно, внешим монослоем остающегося липида, и что размеры миРНК составляют 2,6 нм в диаметре и 4,8 нм в длину. Для того, чтобы определить соотносится ли это с экспериментом, был определен предельный размер миРНК LNP систем, состоящих из DLin-KC2-DMA и PEG-липида (90/10; мол.%/мол.%) с высокими уровнями уровни миРНК, соответствующими N/P соотношению один. Как показано на Фиг. 23, включение в состав миРНК привело к предельному размеру систем приблизительно 21 нм в диаметре, что соотносится с гипотезой.
Инкапсулированная миРНК иммобилизована в LNP. Если миРНК связана в комплекс с катионным липидом и локализована в твердом ядре внутри LNP, то предполается, что она будет менее подвижной, чем при свободном вращении в водной внутренней части бислойной везикулярной системы. Подвижность миРНК может быть определена с использованием технологии 31P ЯМР. В частности, можно было бы предположить, что для связанной в комплекс миРНК будет возможно ограниченное двигательное усреднение, что приведет к очень обширным резонансам 31P ЯМР "твердого состояния" из-за большой анизотропии химического сдвига фосфатного фосфора. При применяемых условиях такие резонансы были бы недетектируемы. С другой стороны, если миРНК может свободно перемещаться в водном окружении, быстрое двигательное усреднение, по-видимому, привело бы к узким легко детектируемым 31P ЯМР спектрам. Для того чтобы исключить сложности, возникающие из 31P ЯМР сигналов, возникающих из фосфолипидных фосфоров, DSPC был исключен из составов LNP для проверки этой гипотезы. Как показано на Фиг. 24A, для миРНК LNP систем с липидной композицией DLin-KC2-DMA/Chol/PEG-липид (50/45/5 мол.%) и включающей миРНК (0,06 миРНК/липид; масс./масс.) 31P ЯМР сигнал не наблюдался для инкапсулированной миРНК, что соотносится с иммобилизацией внутри ядра LNP. При добавлении в качестве детергента додецилсульфата натрия (1%) для солюбилизации LNP и высвобождения инкапсулированной миРНК был детектирован узкий 31P ЯМР сигнал, как показано на Фиг. 24C.
Инкапсулированная миРНК полностью защищена от разрушения внешней РНКазой А. Проверка интернализаци миРНК заключается в том, что если миРНК изолированы в ядре LNP, то они должны быть полностью защищены от разрушения вносимой извне РНКазой. миРНК LNP системы с липидной композицией DLin-KC2-DMA/DSPC/Chol/PEG-липид (40/11/44/5 мол.%) были инкубированы с РНКазой для определения того, могла ли быть расщеплена инкапсулированная миРНК. Как показано на геле, представленном на Фиг. 25, свободная миРНК разрушена, в то время как миРНК, ассоциированная внутри LNP частиц, приготовленных микрожидкостным способом, полностью защищена (Фиг. 25, стрелка). Как также показано на Фиг. 25, добавление детергента Тритон Х-100 к LNP приводит к разжижению LNP, высвобождению миРНК и разрушению в присутствии РНКазы.
Инкапсулированная миРНК связана в комплекс с интернализированным катионным липидом. Твердое ядро миРНК LNP систем состоит из инкапсулированной миРНК, связанной в комплекс с катионным липидом, и остальной липид (катионный липид, холестерин и PEG-липид) или присутствует в ядре в виде обращенных мицелл или подобных структур, или находится во внешней части LNP. Для высоких содержаний миРНК, где весь катионный липид главным образом связан в комплекс с интернализированной миРНК, было бы резонно предположить, что небольшое количество катионного липида будет расположено во внешней части LNP. Для определения внешнего катионного липида был разработан анализ резонансного переноса энергии флюоресценции (FRET). Для анализа требовалось приготовление отрицательно заряженных везикулярных LNP, состоящих из диолеилфосфадилсерина (DOPS), который содержал FRET пару, NBD-PE/Rh-PE в высоких (самогасящихся) концентрациях. После этого отрицательно заряженные DOPS LNP были инкубированы с миРНК LNP системами, состоящими из DLin-KC2-DMA/DSPC/Chol/PEG-липид (40/11,5/47,5/1 мол.%) при pH 5,5. pKa DLin-KC2-DMA составляет 6,7 и, таким образом, почти все DLin-KC2-DMA вне LNP должны были иметь заряд при pH 5,5, стимулируя взаимодействие и потенциальное слияние с отрицательно заряженными DOPS LNP. Слияние фиксируется как увеличение NBD-PE флюоресценции при 535 нм по мере того как NBD-PE и Rh-PE пробы становятся растворенными после липидного смешивания.
Как показано на Фиг. 26, когда LNP системы не содержали миРНК, то наблюдалось существенное слияние, что соотносится со значительным процентом DLin-KC2-DMA, находящимся на внешнем монослое LNP системы. Когда LNP системы содержали миРНК в соотношении миРНК/липид 0,06 (масс./масс.), что соответствует соотношению положительного (катионные липид) заряда и отрицательного (миРНК) N/P заряда 4, тем не менее, слияние было значительно снижено (Фиг. 26), в то время как для миРНК LNP систем, приготовленных с N/P 1 наблюдалось слабое слияние или его отсутствие, что указывает на то, что во внешней части миРНК LNP было представлено небольшое количество DLin-KC2-DMA или он отсутствовал. Это подтверждает гипотезу, что при высоком содержании миРНК по существу весь катионный липид связан в комплекс с миРНК и изолирован во внутренней части LNP.
Результаты обеспечивают подтверждение того, что внутренняя часть систем миРНК LNP состоит из твердого ядра, состоящего из миРНК мономеров, связанных в комплекс с катионным липидом, а также липида, организованного обращенную мицеллу или родственные структуры. Эти результаты предполагают модель миРНК LNP структуры, обеспечивают логическое обоснование для высокой эффективности инкапсуляции миРНК, которая может быть достигнута, и предлагают способы производства миРНК LNP систем со свойствами, подходящими для специфического применения.
Модель миРНК LNP структур на основании результатов показана на Фиг. 27. Модель предполагает то, что инкапсулированная миРНК находится в деформированной обращенной мицелле, окруженной катионным липидом, и что остальной липид организован в обращенные мицеллы, окружающие анионные противоионы и также составляет крайний монослой.
Модель обеспечивает понимание того, как могут быть достигнуты эффективности инкапсуляции миРНК, приближающиеся к 100%, во время процесса составления с помощью микрожидкостного смешивания. Это является главной проблемой для миРНК инкапсуляции в бислойные системы, потому что, с учетом того, что катионный липид в одинаковой степени распределен на обеих сторонах бислоя, ожидаемый максимум интернализации миРНК составит 50%. Модель предполагает два пути, по которым размер, композиция и поверхностный заряд миРНК LNP могут быть без труда отрегулированы. Что касается размера, то структура предельного размера, безусловно, является такой, которая содержит один миРНК мономер на частицу, что предполагает предельный размер приблизительно 15-20 нм. Такие миРНК LNP частицы легко достигаются с использованием микрожидкостного способа изобретения. Система миРНК LNP предельного размера, состоящая из мономера миРНК, потенциально может быть использована в качестве строительного блока для получения миРНК LNP систем разной композиции и поверхностного заряда с использованием технологии микрожидкостного смешивания. Можно предполагать, что быстрое смешивание предварительно сформированных миРНК LNP предельного размера с раствором этанола, содержащим отрицательно заряженные липиды, может, например, привести в результате к взаимодействию с избытком катионных липидов с продуцированием структур внутреннего обращенного мицеллярного ядра и отрицательно заряженной поверхности.
Липидные частицы изобретения, описанные в данном документе включают (т.е., содержат) перечисленные компоненты. В некоторых вариантах осуществления частицы изобретения включают перечисленные компоненты и другие дополнительные компоненты, которые не воздействуют на характеристики частиц (т.е. частицы главным образом состоят из перечисленных компонентов). Дополнительные компоненты, которые воздействуют на характеристики частиц включают компоненты, такие как дополнительные терапевтические реагенты, которые неблагоприятно изменяют или воздействуют на терапевтический профиль и эффективность частиц, дополнительные компоненты, которые неблагоприятно изменяют или воздействуют на способность частиц к солюбилизации перечисленных терапевтических компонентов и дополнительные компоненты, которые неблагоприятно изменяют или воздействуют на способность частиц к увеличению биодоступности перечисленных терапевтических компонентов. В других вариантах осуществления частицы по изобретению включают только (т.е. состоят из) перечисленные компоненты.
Следующие примеры предоставлены в иллюстративных целях, не ограничивая заявленное изобретение.
ПРИМЕРЫ
Вещества
1,2-диолеил-sn-глицеро-3-фосфохолин (DOPC), 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC), 1,2-диолеил-sn-глицеро-3-фосфосерин (DOPS), 1,2-диолеил-sn-глицеро-3-фосфоэтаноламин-N-(7-нитро-2-l,3-бензоксадиазол-4-ил) (NBD-PE), 1,2-диолеил-sn-глицеро-3-фосфоэтаноламин-N-(лиссамин родамин В сульфонил) (Rh-PE) были получены у Avanti Polar Lipids (Alabaster, AL). 4-(2-Гидроксиэтил)пиперазин-1-этансульфоновая кислота (HEPES) и холестерин были получены у Sigma (St Louis, MO). N-[(метоксиполи(этиленгликоль)2000)карбамил]-1,2-димиристилоксипропил-3-амин (PEG-C-DMA) были синтезированы AlCana Technologies. 2-(N-морфолино)этансульфоновая кислота (MES) была получена у BDH. Аммоний, ацетат натрия и хлорид натрия были получены у Fisher Scientific (Fair Lawn, NJ). РНКаза была получена у Applied Biosystems/Ambion (Austin, TX). Фактор VII (FVII) и отрицательный контроль миРНК с низким содержанием GC были приобретены у Invitrogen (Carlsbad, CA). миРНК фактора VII: (SEQ ID NO: 1) 5'-GGAUCAUCUCAAGUCUUACTT-3' (FVII смысловой) и (SEQ ID NO: 2) 5'-GUAAGACUUGAGAUGAUCCTT-3' (FVII антисмысловой). DLin-KC2-DMA были получены у AlCana Technologies Inc. (Vancouver, ВС).
Пример 1
Приготовления LNP систем: способ предварительно сформированной везикулы
В примере описано приготовление LNP-миРНК системы с использованием способа предварительно сформированной везикулы.
LNP-миРНК системы готовили с использованием способа предварительно сформированной везикулы, как изображено на Фиг. 15A и как описано в
 Катионный липид, DSPC, холестерин и PEG-липид сначала солюбилизировали в этаноле в подходящем молярном соотношении. После этого липидную смесь по каплям добавили в водный буфер (цитратный или ацетатный буфер, pH 4) при взбалтывании до конечной концентрации этанола и липида 30% (об./об.). Гидратированные липиды после этого пять раз пропускали через дважды сложенные фильтры с размером пор 80 нм (Nuclepore) при комнатной температуре с использованием Lipex Extruder (Northern Lipids, Vancouver, Canada). миРНК (солюбилизированные в идентичном водном растворе, содержащем 30% этанола) добавляли к суспензии везикулы перемешивая. Обычно использовали целевое соотношение миРНК/липид 0,06 (масс./масс.). Эту смесь инкубировали в течение 30 минут при 35°C для того, чтобы позволить реорганизацию везикулы и инкапсуляцию миРНК. После этого этанол удаляли, и внешний буфер замещали забуференным фосфатом физиологическим раствором (PBS) с помощью диализа (12-14k MW cut-off, Spectrum medical instruments), затем 50 мМ цитратным буфером, pH 4,0 и после этого диализом на PBS, pH 7,4.
Катионный липид, DSPC, холестерин и PEG-липид сначала солюбилизировали в этаноле в подходящем молярном соотношении. После этого липидную смесь по каплям добавили в водный буфер (цитратный или ацетатный буфер, pH 4) при взбалтывании до конечной концентрации этанола и липида 30% (об./об.). Гидратированные липиды после этого пять раз пропускали через дважды сложенные фильтры с размером пор 80 нм (Nuclepore) при комнатной температуре с использованием Lipex Extruder (Northern Lipids, Vancouver, Canada). миРНК (солюбилизированные в идентичном водном растворе, содержащем 30% этанола) добавляли к суспензии везикулы перемешивая. Обычно использовали целевое соотношение миРНК/липид 0,06 (масс./масс.). Эту смесь инкубировали в течение 30 минут при 35°C для того, чтобы позволить реорганизацию везикулы и инкапсуляцию миРНК. После этого этанол удаляли, и внешний буфер замещали забуференным фосфатом физиологическим раствором (PBS) с помощью диализа (12-14k MW cut-off, Spectrum medical instruments), затем 50 мМ цитратным буфером, pH 4,0 и после этого диализом на PBS, pH 7,4.
Пример 2
Приготовление LNP систем: микрожидкостной ступенчатый елочный смеситель
В примере описана иллюстративная LNP-миРНК система изобретения с использованием микрожидкостного елочного смесителя.
Приготовление LNP-миРНК. Раствор олигонуклеотида (миРНК) готовили в 25 мМ ацетатном буфере при pH 4,0.В зависимости от требуемого соотношения олигонуклеотид/липид и концентрации состава, растворы были приготовлены в целевой концентрации от 0,3 мг/мл до 1,9 мг/мл общего липида. Липидный раствор, включающий DLin-KC2-DMA, DSPC, холестерин и PEG-липид в подходящем молярном соотношении готовили в этаноле и разбавляли 25 мМ ацетатным буфером для достижения концентрации этанола 90% (об./об.). Фиг. 15B представляет собой схематическое изображение микрожидкостного устройства, использованного в этом примере. Устройство имеет два впускных отверстия, одно для каждого из растворов, приготовленных ранее, и одно выпускное отверстие. Микрожидкостное устройство производили мягкой литографией, при этом реплика производили опрессовкой оригинала эластомером. Свойства устройства 200 мкм в ширину и 79 мкм в высоту для смешивающего канала с елочными структурами с размерами 31 мкм в высоту и 50 мкм в толщину, расположенных в верхней части канала. Жидкостные соединения изготавливали из 1/32" I.D., 3/32" O.D. трубки, которая была присоединена к иглам 21G1 для соединения со шприцами. 1 мл шприцы обычно использовали для обоих впускных потоков. Двойной шприцевой насос (KD200, KD Scientific) использовали для управления скоростью потока внутри устройства. Скорость протекания каждого потока варьировалась от 0,1 мл/мин до 1 мл/мин. Шприцевой насос вводит два раствора в микрожидкостное устройство (впускное отверстие и впускное отверстие b на Фиг. 15B), где они вводятся в контакт с Y-образным ответвителем. На этой стадии происходит несущественное смешивание при ламинарном протекании посредством диффузии, тогда как два раствора становятся смешанными, по мере того как они проходят через елочные структуры.
Смешивание происходит в этих структурах посредством беспорядочной адвекции, вызывая то, что характерное разделение многослойных потоков все в большей степени принимает низкое значение, тем самым стимулируя быструю диффузию. Это смешивание происходит в миллисекундной шкале времени и приводит к тому, что липиды постепенно переносятся в более водное окружение, что снижает их растворимость и приводит в результате к спонтанному образованию LNP. Посредством включения катионных липидов липидную композицию, происходит удерживание олигонуклеотидных образцов посредством ассоциации положительно заряженной липидной концевой группы и отрицательно заряженного олигонуклеотида. После смешивания в микрожидкостном устройстве LNP обычно смесь вводили в стеклянную пробирку, содержащую два объема размешанного буфера. В заключение этанол замещали посредством диализа на 50 мМ цитратный буфер, pH 4,0 и после этого диализом на PBS, pH 7,4. Пустые везикулы производили аналогичным образом в отсутствии олигонуклеотида в растворе.
Анализ изображения LNP. Времена смешивания измеряли с помощью флюоресцентной визуализации смеси растворов флюоресцеина с различными значениями pH. Изображения были получены с использованием обращенного конфокального микроскопа Olympus с использованием объектива 10x и режима фильтра Калмана с 2 сканированиями на линию. Двадцать пять равномерно расположенных срезов получали вдоль высоты канала и совмещены для определения общих профилей интенсивности. Для каждой отображенной позиции, десять прилегающих рядов элементов изображения вдоль направления потока усредняли для получения профиля интенсивности вдоль ширины канала и использовали для определения степени смешивания. Эксперименты смешивания выполняли с двумя 10 мкМ растворами флюоресцеина, дополненными 0,5 M NaCl для подавления образования жидкостной контактной разности потенциалов из-за большой разницы концентраций ионов натрия и фосфата. Один раствор содержал 14 мМ фосфатного буфера при pH 8,88, а другой содержал 1 мМ фосфатного буфера при pH 5,15. Увеличение флюоресценции раствора первоначально при pH 5,15 будет поглощать небольшое изменение флюоресценции в основном растворе, приводя в результате к увеличению общей интенсивности флюоресценции в два раза. Степень смешивания определяли приблизительно в 2,1 мм, 6,2 мм и 10,1 мм вдоль длины канала с использованием скоростей протекания отдельных потоков 0,1 мл/мин, 0,4 мл/мин, 0,7 мл/мин и 1,0 мл/мин.
Характеризация LNP. Размер частицы определяли с помощью динамического рассеяния света с использованием Nicomp model 370 Submicron Particle Sizer (Particle Sizing Systems, Santa Barbara, CA). Использовали данные распределения средневзвешенного по размерам и средневзвешенного интенсивности. Концентрации липидов проверяли измерением общего холестерина с использованием ферментативного анализа Холестерин E от Wako Chemicals USA (Richmond, VA). Удаление свободной миРНК выполняли с использованием колонок VivaPureD MiniH (Sartorius Stedim Biotech GmbH, Goettingen, Germany). После этого элюенты лизировали в 75% этаноле и определяли количество миРНК посредством измерения абсорбции при 260 нм. Эффективность инкапсуляции определяли из соотношения олигонуклеотида перед и после удаления свободного олигонуклеотидного содержимого, приведенного к липидному содержанию.
LNP низкотемпературная трансмиссионная электронная микроскопия. Образцы готовили посредством нанесения 3 мкл PBS, содержащего LNP с содержанием 20-40 мг/мл общего липида на стандартный грид для электронной микроскопии, перфорированный слоем углерода. Избыток жидкости удаляли с помощью Vitrobot system (FEI, Hillsboro, OR), и после этого LNP суспензию подвергали резкой заморозке жидком этане для быстрой заморозки везикул в виде тонкой пленки аморфного льда. Изображения получали при криогенных условиях при увеличении 29K с камерой с боковым креплением AMT HR CCD. Образцы наполняли Gatan 70 degree holder для крио переноса в FEI G20 Lab6 200kV ТЭМ при условиях низкой дозы с субфокусировкой 5-8um для увеличения контраста изображения.
In vivo активность LNP-миРНК по отношению к FVII активности. Шести-восьми недельных самок мышей C57B1/6 получали у Charles River Laboratories. LNP-миРНК, содержащие миРНК Фактора VII, фильтровали через 0,2 мкм фильтр и разбавляли до требуемых концентраций в стерильном забуференном фосфатом физиологическом растворе перед использованием. Составы были введены внутривенно через латеральную хвостовую вену в объеме 10 мл/кг. Через 24 ч животных анестезировали Кетамин/Ксилазином, и кровь собирали пункцией сердца. Образцы перерабатывали в сыворотку (Microtainer Serum Separator Tubes; Becton Dickinson, NJ) и подвергали анализу немедленно или хранили при -70°C для последующего анализа уровней Фактора VII сыворотки. Все процедуры выполняли в соответствии с местными правилами, регулированиями властей штата и федеральными правилами в соответствии с и как это одобрено Institutional Animal Care и Use Committee (IACUC).
Уровни Фактора VII в сыворотке определяли с использованием колориметрического набора для анализов Biophen VII (Anaira). Контрольную сыворотку объединяли и последовательно разводили (200%-3,125%) для получения калибрационной кривой для расчета FVII уровней в обрабатываемых животных. Соответствующим образом разбавленные образцы плазмы из обрабатываемых животных (n=3 на дозировку) и из контрольной группы, обрабатываемой физиологическим раствором (n=4), анализировали с использованием набора Biophen VII в соответствии с инструкциями производителя. Анализ выполняли в 96-луночном плоскодонных несвязывающих полистирольных аналитических планшетах (Corning, Corning, NY) и абсорбцию измеряли при 405 нм. Уровни фактора VII в обрабатываемых животных определяли по калибрационной кривой, полученной с последовательно разведенной контрольной сывороткой.
Пример 3
LNP системы: твердое ядро
В примере описана структура иллюстративной LNP-миРНК системы изобретения, имеющей твердое ядро.
Приготовление липидных наночастиц. LNP приготавливали посредством смешивания требуемых объемов стоковых растворов липидов в этаноле с водной фазой с применением описанного выше микросмесителя. Для инкапсуляции миРНК требуемое количество миРНК смешивали с 25 мМ натрий-ацетатного буфера при pH 4. Равные объемы липид/этанольной фазы и миРНК/водной фаза объединяли в микросмесителе, содержащем елочную структуру для осуществления смешивания. Содержание этанола быстро доводили до 25% натрий-ацетатным буфером после выхода из микро-смесителя. Скорость протекания во время микро-смешивания регулировали с использованием двойного шприцевого насоса (Kd Scientific). После этого липидную смесь подвергали диализу в течение 4 часов против 50 мМ MES/натрий-цитратного буфера (pH 6,7) с последующим диализом в течение ночи против забуференного фосфатом физиологического раствора (pH 7,4).
Крио-ЭМ. Образцы приготавливали посредством внесения 3 мкл PBS, содержащего LNP в 20-40 мг/мл общего липида, на стандартный грид для электронной микроскопии с перфорированной углеродной пленкой. Избыток жидкости удаляли с помощью Vitrobot system (FEI, Hillsboro, OR) и после этого резким замораживанием суспензии LNP в жидком этане для быстрого замораживания везикул в виде пленки из аморфного стекловидного льда. Изображения получали при криогенных условиях с увеличением 29K с помощью камеры с боковым креплением AMT HR CCD. Образцы наполняли Gatan 70 degree holder для крио переноса в FEI G20 Lab6 200kV ТЕМ в условиях низкой дозы с фокусировкой 5-8um для увеличения контраста изображения.
Анализ защита от РНКазы. Фактор VII миРНК инкапсулировали с 40% DLinKC2-DMA, 11% DSPC, 44% холестерина и 5% PEG-c-DMA с использованием способа микрожидкостного смешивания. 1 мкг миРНК инкубировали с 0,05 мкг РНКазы (Ambion, Austin, TX) в 50 мкл 20 мМ HEPES (pH 7,0) при 37°C в течение 1 часа. По окончанию инкубирования 10 мкл аликвотной пробы реакционной смеси добавляли к 30 мкл красителя FA (деионизированный формамид, TBE, PBS, ксиленцианол, бромфеноловый синий, дрожжевая тРНК) для оставновки реакции РНКазного расщеления. Гель-электрофорез выполняли с использованием 20% нативного полиакриламидного геля и нуклеиновые кислоты визуализировали окрашиванием CYBR-Safe (Invitrogen, Carlsbad, CA).
31P-ЯМР исследования. Расщепленные по протону 31P ЯМР спектры получали с использованием Bruker AVII 400 спектрометра, работающего при 162 МГц. Спады свободной индукции (FID), соответствующие приблизительно 104 сканированиям, получали с 15 мкс, 55-градусным импульсом с межимпульсной задержкой 1 с и спектральной шириной 64 кГц. Экспоненциальное мультиплицирование, соответствующее уширению линий 50 Гц, применяли к FID перед преобразованием Фурье. Температуру образца регулировали с использованием температурного блока Bruker BVT 3200. Измерения выполняли при 25°C.
Исследования мембранного слияния с помощью FRET. Слияние между наночастицами миРНК LNP и анионными везикулами DOPS было выполнено анализом липидного смешивания с применением резонансного переноса энергии флюоресценции. Меченные DOPS везикулы, содержащие NBD-PE и Rh-PE (1 молярный % каждый), приготавливали посредством прямой регидратации липидной пленки с подходящим буфером, за которой следовало 10 экструзий через поликарбонатную мембрану с размером пор 100 нм с использованием Lipex Extruder. LNP, состоящую из 40% DLinKC2-DMA, 11,5% DSPC, 47,5% холестерина, 1% PEG-c-DMA, приготавливали с миРНК/липид соотношением (D/L соотношение, масс./масс.) 0, 0,06 и 0,24. D/L=0,24 представляет эквимолярное соотношение положительных (катионный липид) и отрицательных (миРНК) зарядов (N/P=1). Проводили эксперименты липидного смешивания. Меченные DOPS везикулы и немеченые LNP смешаны с соотношением 1:2 мол.% в кювете для размешивания, содержащей 2 мл 10 мМ ацетата, 10 мМ MES, 10 мМ HEPES, 130 мМ NaCl с pH 5,5. За флюоресценцией NBD-PE наблюдали с использованием возбуждения при 465 нм и эмиссии при 535 нм с использованием флюориметра LS-55 Perkin Elmer с использованием 1x1 см кюветы при постоянно низкой скорости размешивания. За липидным смешиванием наблюдали в течение приблизительно 10 мин, после чего добавляли 20 мкл 10% Тритон Х-100 для разрушения всех липидных везикул, что представляет собой бесконечное разбавление пробы. Липидное смешивание как процент от бесконечного разбавления пробы определяли с использованием уравнения: % липидного смешивания = (F-F0)/(Fmax-F0)x100, где F является интенсивностью флюоресценции при 535 нм во время анализа, F0 является исходной интенсивностью флюоресценции и Fmax является максимумом интенсивности флюоресценции пробы с бесконечным разбавлением после добавления Тритон Х-100.
Пример 4
Последовательная сборка липидных наночастиц
В этом примере, описан иллюстративный способ изобретения для изготовления липидных наночастиц - последовательная сборка.
Олигонуклеотидный (миРНК) раствор готовили в концентрации 1,31 мг/мл в 25 мМ ацетатном буфере при pH 4,0. Липидную смесь готовили так, чтобы она содержала 90 мол.% катионного липида (DLin-KC2-DMA) и 10 мол.% PEG-c-DMA (10 мМ общего липида, растворенного в этаноле). Два раствора были смешаны с использованием микрожидкостного смесителя при общей скорости потока 2 мл/мин и разбавлены в 2 раза 25 мМ ацетатным буфером, pH 4,0, для того, чтобы снизить содержание этанола до приблизительно 23 об.%, с образованием исходной или внутренней наночастицы. Последовательная сборка была выполнена смешиванием суспензии исходной липидной частицы с другим липидным раствором, содержавшим анионный липид диолеилфосфадилсерин (DOPS), растворенный в метаноле, и дополнительным разбавлением до приблизительно 25 об.% растворителя (метанол и этанол). Вторичный липид DOPS добавляли приблизительно в 4-х кратном молярном избытке по отношению к катионному липиду. Процесс последовательной сборки повторяли с помощью чередования катионного липида и анионного липида.
Размер частицы определяли с помощью динамического рассеяния света с использованием Malvern Zetasizer Nano-ZS (Malvern Instruments Ltd, Malvern, Worcestershire, UK). Использовали данные средневзвешенного по размерам распределения. Дзета-потенциал, который обеспечивает измерение поверхностного заряда LNP систем, измеряли с Malvern Zetasizer с использованием одноразовых капиллярных ячеек (DTS1060, Malvern Instruments Ltd.). LNP системы разбавляли приблизительно до 0,3 мг/мл общего липида в 25 мМ ацетатном буфере, pH 4,0.
Пример 5
Состав и характеристики иллюстративной липидной частицы
В этом примере описана иллюстративная липидная частица по изобретению, состоящая только из катионного липида и нуклеиновой кислоты (DLin-KC2-DMA - миРНК).
Раствор миРНК готовили в концентрации 0,38 мг/мл в 25 мМ ацетатном буфере, pH 4,0. Липидный раствор готовили так, чтобы он содержал DLin-KC2-DMA в концентрации 10 мМ в этаноле. Соотношение миРНК/липид составляло 0,06 (масс./масс.). Каждый раствор вводили в микрожидкостной смеситель с одинаковой скоростью протекания и общей скоростью протекания 2 мл/мин. Образец дополнительный разбавляли 25 мМ ацетатным буфером, pH 4,0, для того, чтобы довести содержание этанола до 25 об.%.
Размер частиц определяли с помощью динамического рассеяния света с использованием Nicomp model 370 Submicron Particle Sizer (Particle Sizing Systems, Santa Barbara, CA, USA). Измерение образца выполняли в 25 мМ ацетатном буфере и были использованы данные средневзвешенного по размерам распределения. Частицы имели средний диаметр частиц 14,2 нм, коэффициент отклонения 0,487 и χ2 1,93.
Несмотря на то, что были проиллюстрированы и описаны показательные варианты осуществления, необходимо иметь ввиду, что в них могут быть внесены различные изменения без отклонения основной идеи и объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ЛИПИДНЫХ НАНОЧАСТИЦ, ЗАГРУЖЕННЫХ мРНК | 2020 |
|
RU2832672C2 |
| ТРИАЛКИЛОВЫЕ КАТИОННЫЕ ЛИПИДЫ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2013 |
|
RU2718053C2 |
| НОВЫЕ НИЗКОМОЛЕКУЛЯРНЫЕ КАТИОННЫЕ ЛИПИДЫ ДЛЯ ДОСТАВКИ ОЛИГОНУКЛЕОТИДОВ | 2011 |
|
RU2617641C2 |
| ЛИПИДНЫЕ НАНОЧАСТИЦЫ | 2021 |
|
RU2837542C1 |
| ЛИПИДНЫЕ НАНОЧАСТИЦЫ ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА IN VIVO И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2799045C1 |
| РНК-ЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ ПОЛИСАРКОЗИН | 2019 |
|
RU2792644C2 |
| ОДНОРАЗОВАЯ СИСТЕМА ДЛЯ СТЕРИЛЬНОГО ПОЛУЧЕНИЯ ЧАСТИЦ ИЗ ЛИПИДОВ И НУКЛЕИНОВЫХ КИСЛОТ | 2012 |
|
RU2642640C2 |
| Катионный липид для доставки нуклеиновых кислот в клетки млекопитающих, способ его получения и его применение. | 2024 |
|
RU2836309C1 |
| СПОСОБ АКТИВАЦИИ/ПРОЛИФЕРАЦИИ T-КЛЕТОК | 2019 |
|
RU2806549C2 |
| ОПОСРЕДУЕМОЕ РНК-ИНТЕРФЕРЕНЦИЕЙ ИНГИБИРОВАНИЕ ЭКСПРЕССИИ ГЕНОВ ВИРУСА ГЕПАТИТА B (HBV) С ПРИМЕНЕНИЕМ МАЛОЙ ИНТЕРФЕРИРУЮЩЕЙ НУКЛЕИНОВОЙ КИСЛОТЫ (миНК) | 2011 |
|
RU2624045C2 |



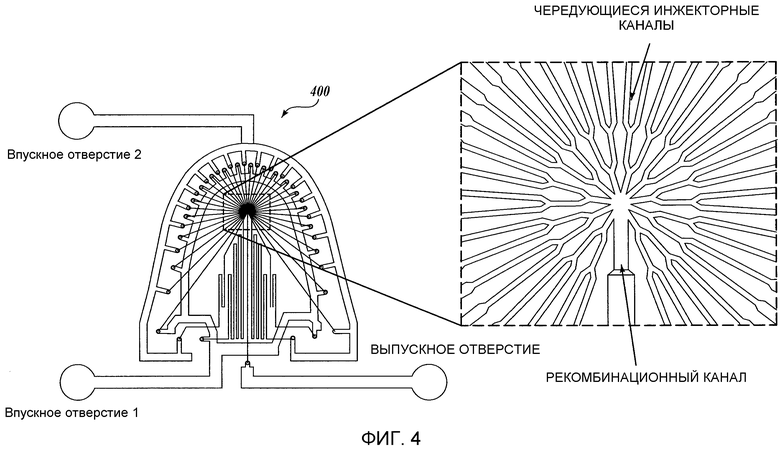
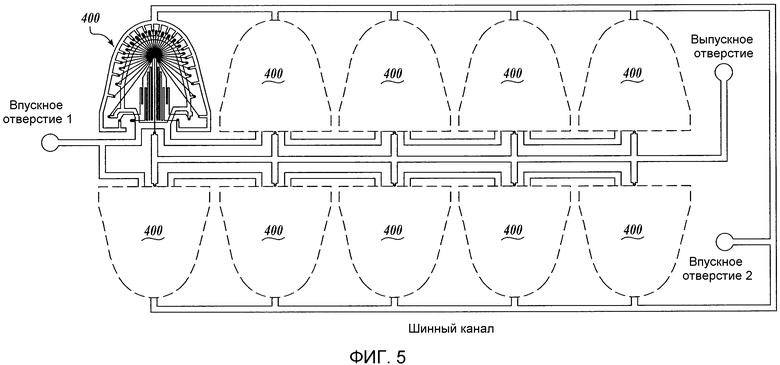
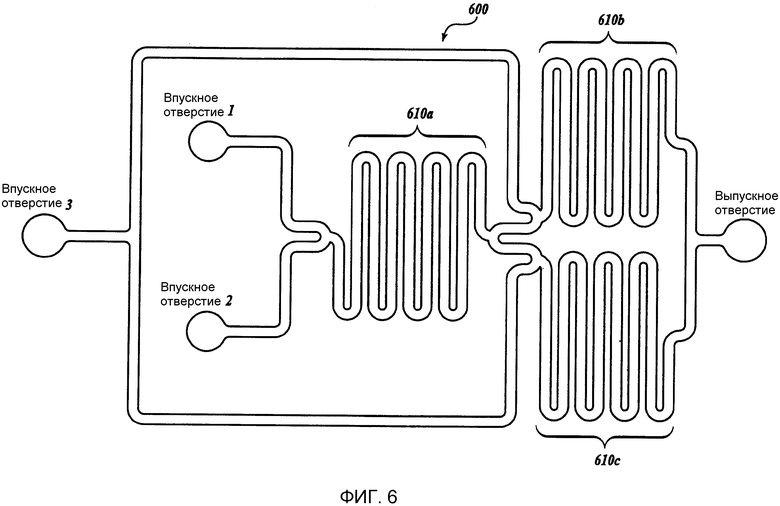
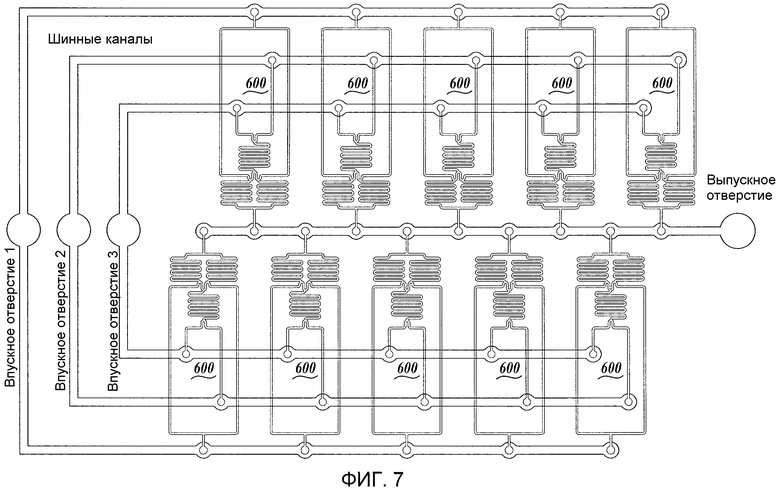

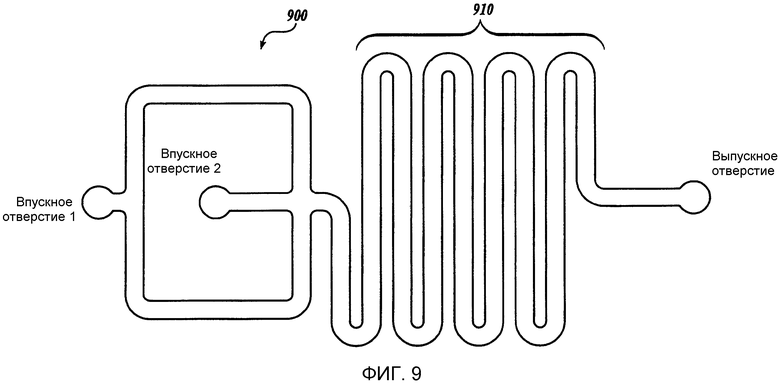
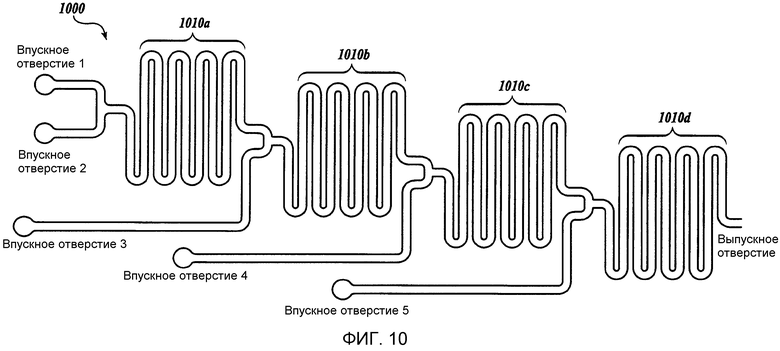

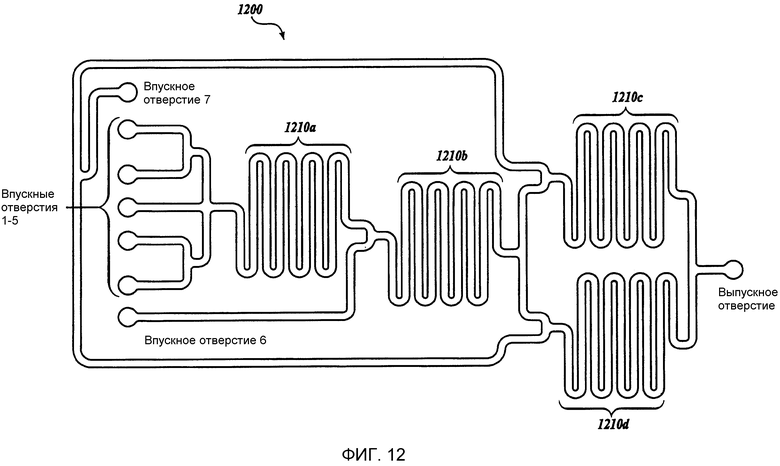
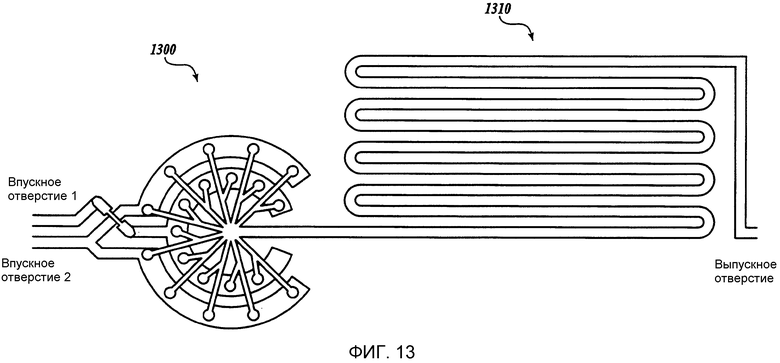

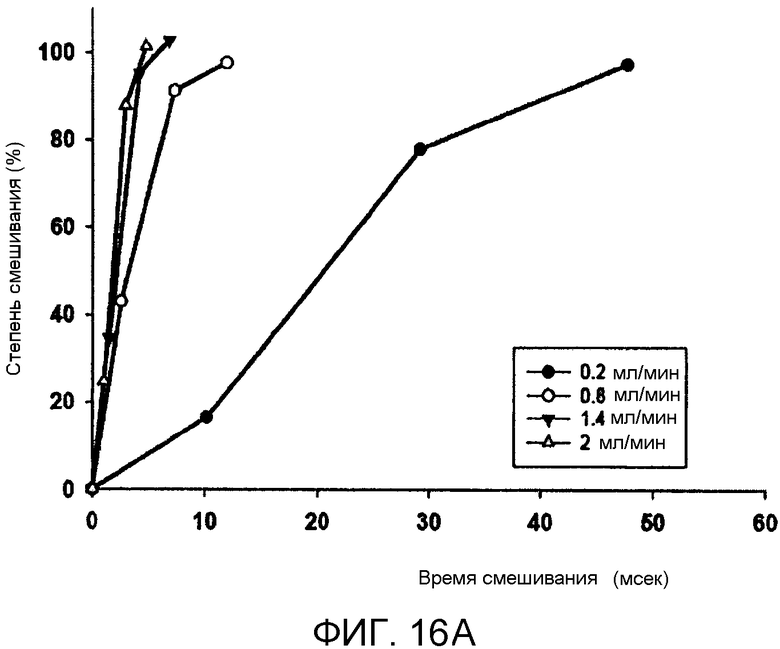

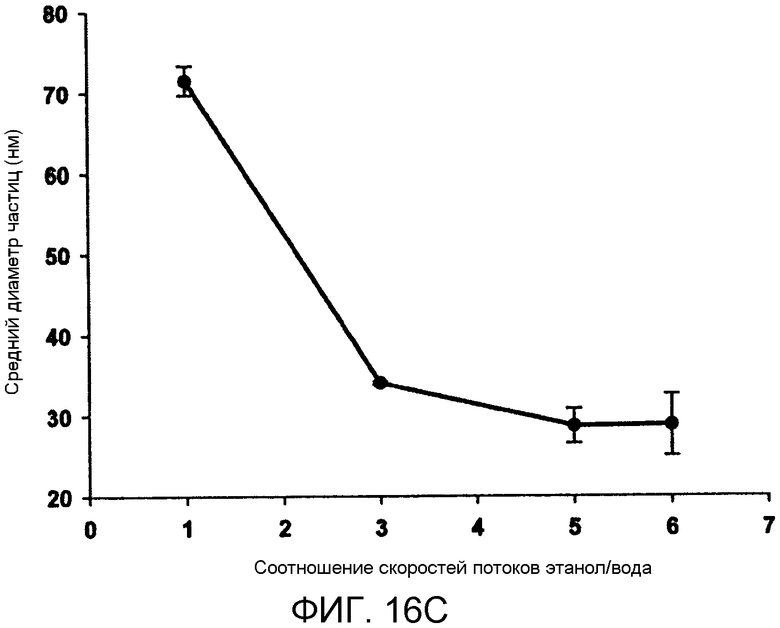

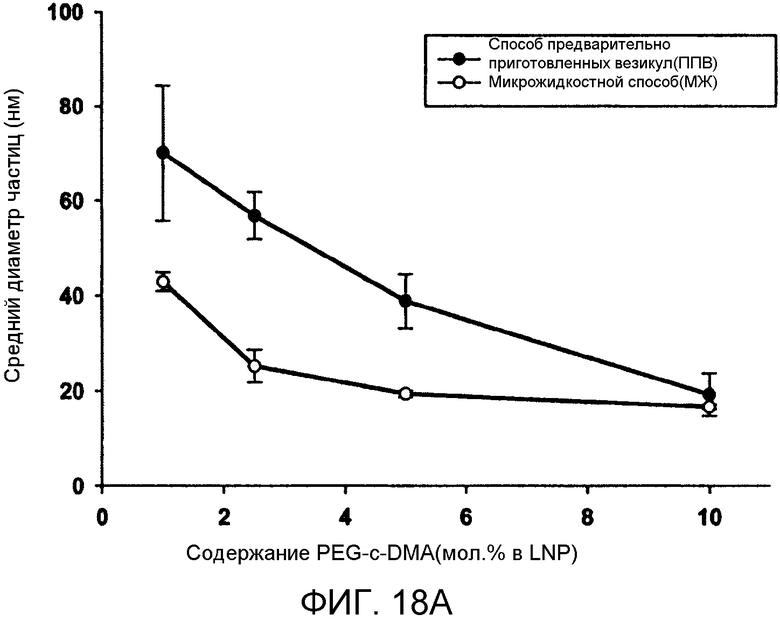
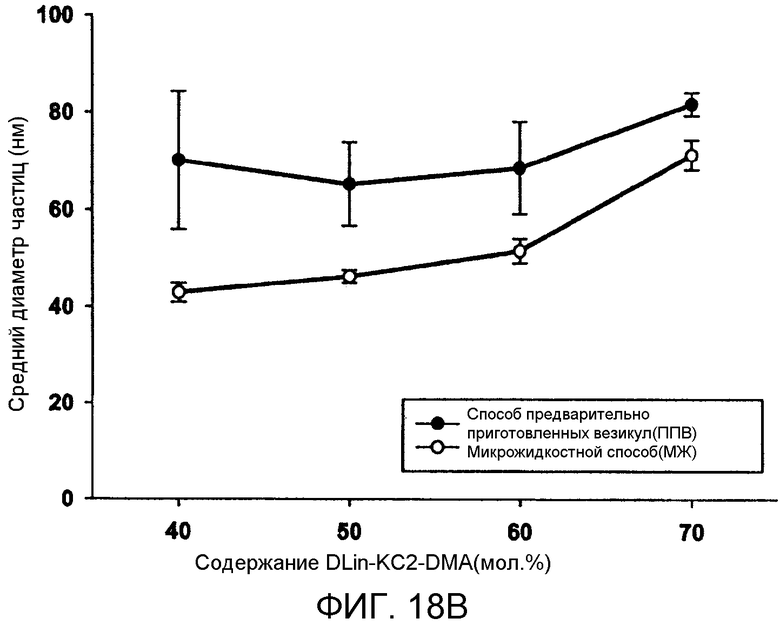
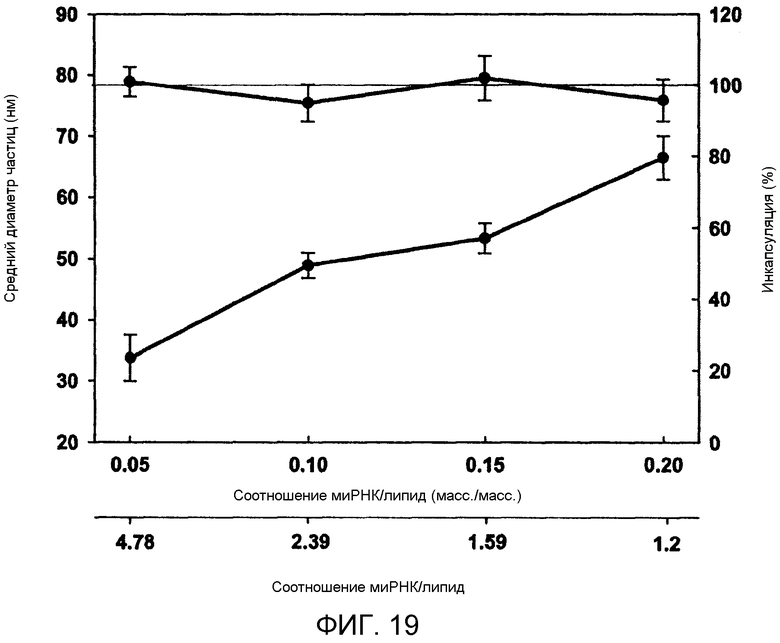
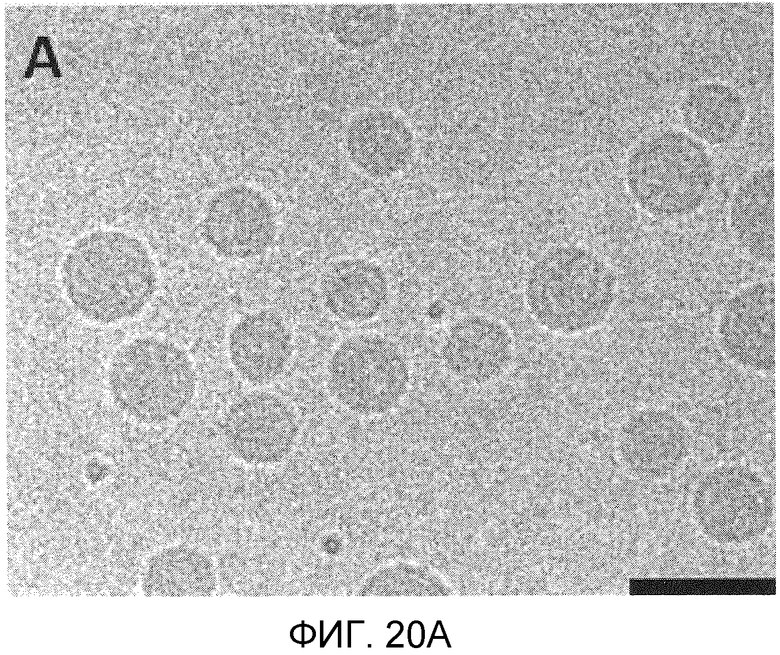
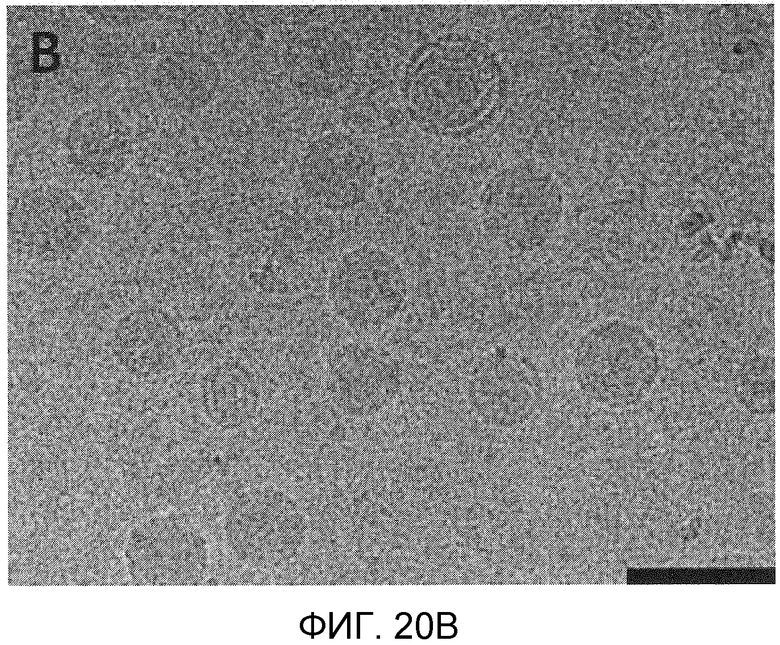





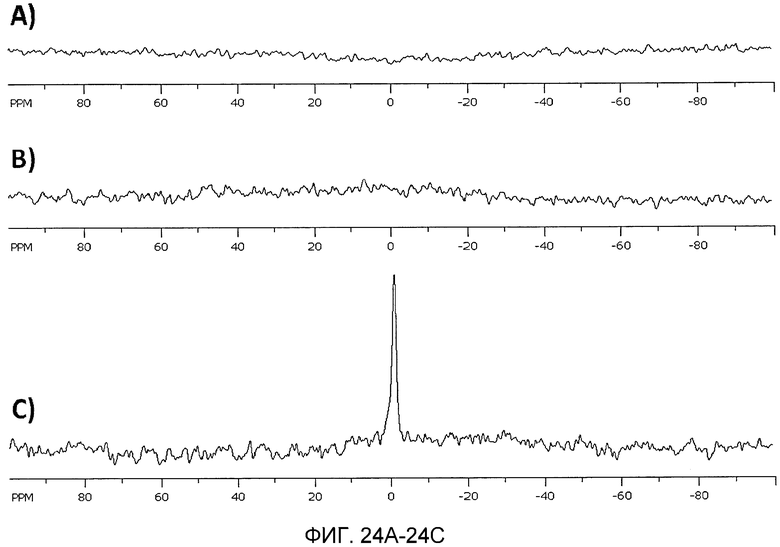
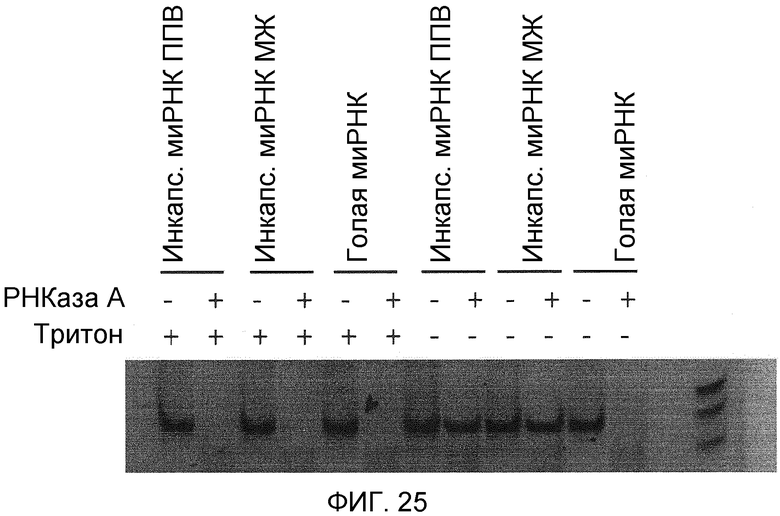
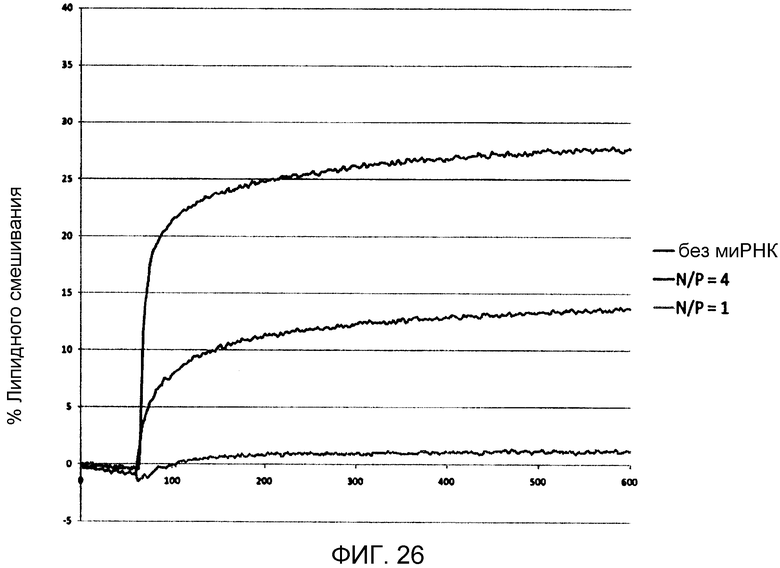
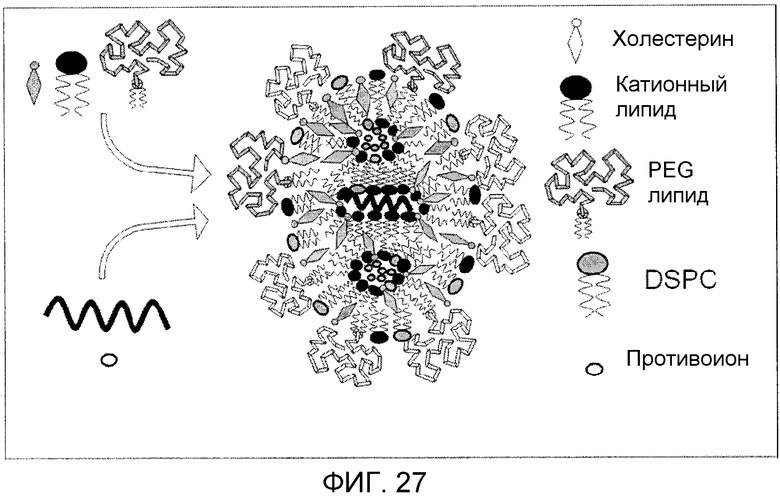
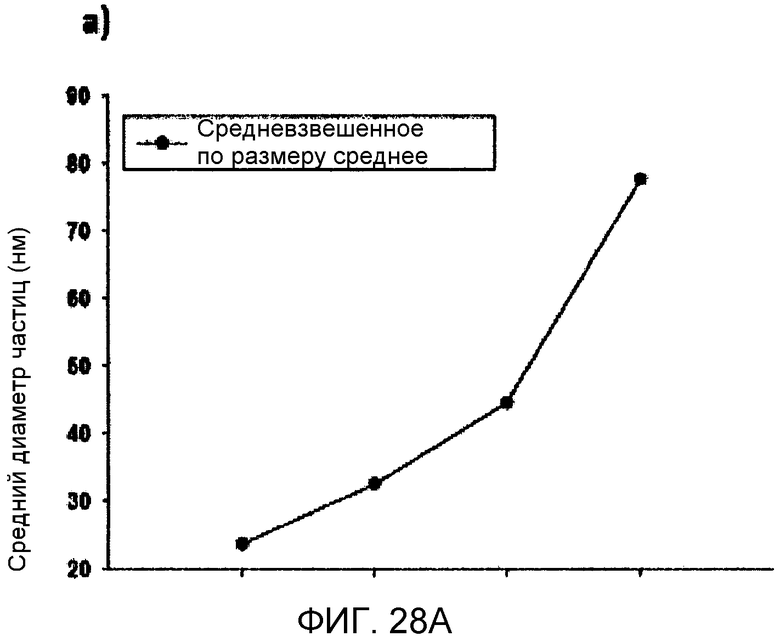

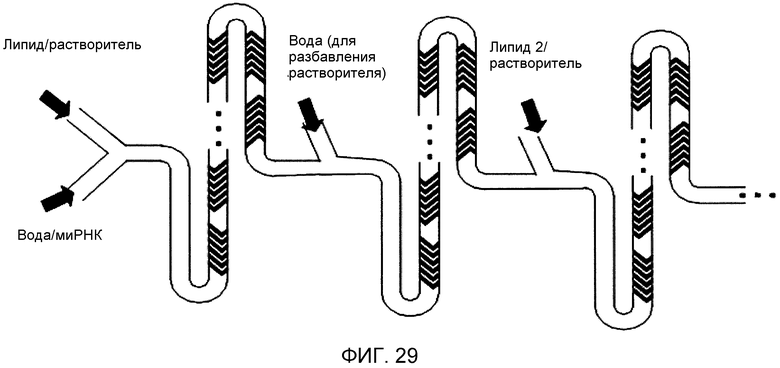



Группа изобретений относится к биохимии. Предложена липидная частица для доставки нуклеиновой кислоты (варианты), способ введения нуклеиновой кислоты в клетку, способ изготовления липидных частиц, включающих нуклеиновую кислоту. Липидная частица содержит ядро, состоящее из нуклеиновой кислоты и катионного липида, и вторичные липиды, окружающие указанное ядро. В другом варианте липидная частица содержит ядро, состоящее из нуклеиновой кислоты, катионного липида и вторичных липидов, и вторичные липиды, окружающие указанное ядро. Способ введения нуклеиновой кислоты в клетку включает приведение клетки в контакт с вышеуказанными липидными частицами. Способ изготовления липидных частиц, содержащих нуклеиновую кислоту, включает введение первого потока, содержащего нуклеиновую кислоту, и введение второго потока, содержащего образующие липидную частицу вещества, в устройство для обеспечения протекания первого и второго потоков, протекание первого и второго потоков из первого отдела устройства во второй отдел устройства, смешивание потоков во втором отделе устройства для обеспечения третьего потока, содержащего липидные частицы. Изобретения обеспечивают усовершенствование липидных частиц, содержащих терапевтическое средство, повышение эффективности инкапсулирования нуклеиновых кислот в липидную частицу. 4 н. и 14 з.п. ф-лы, 33 ил., 1 табл., 5 пр.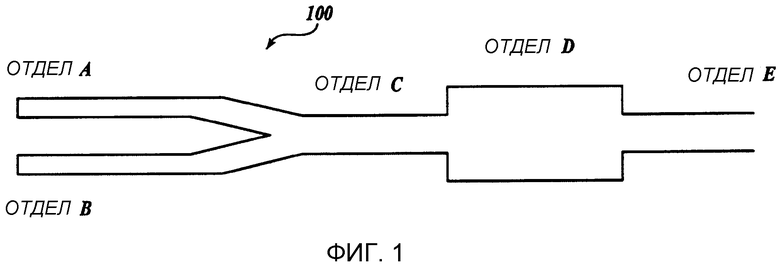
1. Липидная частица для доставки нуклеиновой кислоты, содержащая:
(a) ядро, состоящее из нуклеиновой кислоты и катионного липида; и
(b) вторичные липиды, окружающие указанное ядро;
где указанные вторичные липиды выбраны из нейтральных липидов, анионных липидов, стеролов и PEG-липидов; и
где спектр 31Р ядерного магнитного резонанса указанной липидной частицы, измеренный в растворе, не показывает резонанса от указанной нуклеиновой кислоты.
2. Липидная частица для доставки нуклеиновой кислоты, содержащая:
(a) ядро, состоящее из нуклеиновой кислоты, катионного липида и вторичных липидов; и
(b) вторичные липиды, окружающие указанное ядро;
где указанные вторичные липиды выбраны из нейтральных липидов, анионных липидов, стеролов и PEG-липидов; и
где спектр 31Р ядерного магнитного резонанса указанной липидной частицы, измеренный в растворе, не показывает резонанса от указанной нуклеиновой кислоты.
3. Частица по п. 1 или 2, содержащая от приблизительно 30 до приблизительно 95 мольных процентов катионного липида.
4. Частица по п. 1 или 2, где вторичный липид выбран из группы, состоящей из PEG-липида, цвиттеронного липида и стерола.
5. Частица по п. 1 или 2, содержащая от приблизительно 1,0 до приблизительно 10 мольных процентов вторичного липида.
6. Частица по п. 1 или 2, имеющая диаметр от приблизительно 15 нм до приблизительно 300 нм.
7. Частица по п. 1 или 2, где катионный липид представляет собой ионизируемый липид.
8. Частица по п. 1 или 2, где катионный липид представляет собой аминолипид.
9. Частица по п. 4, где PEG-липид выбран из группы, состоящей из PEG-модифицированных фосфадилэтаноламинов, PEG-модифицированных фосфатидных кислот, PEG-модифицированных церамидов, PEG-модифицированных диалкиламинов, PEG-модифицированных диацилглицеринов, PEG-модифицированных диалкилглицеринов.
10. Частица по п. 1 или 2, где указанная нуклеиновая кислота представляет собой ДНК, РНК, блокированную нуклеиновую кислоту, аналог нуклеиновой кислоты или плазмиду, допускающую экспрессирование ДНК или РНК.
11. Частица по п. 1 или 2, где указанная нуклеиновая кислота представляет собой мРНК, миРНК или микроРНК.
12. Способ введения нуклеиновой кислоты в клетку, включающий приведение клетки в контакт с липидной частицей по п. 1 или 2.
13. Способ изготовления липидных частиц, включающих нуклеиновую кислоту, включающий:
(а) введение первого потока, содержащего нуклеиновую кислоту в первом растворителе, в микрожидкостное устройство, где указанное устройство имеет первый отдел, приспособленный для протекания одного или более потоков, введенных в данное устройство, и второй отдел для смешивания содержимого одного или более потоков с помощью смесителя;
(b) введение второго потока, содержащего образующие липидную частицу вещества во втором растворителе, в устройство для обеспечения протекания первого и второго потоков в условиях ламинарного протекания, где образующие липидную частицу вещества включают катионный липид и один или более вторичных липидов, выбранные из нейтральных липидов, анионных липидов, PEG-липидов и стеролов, и где первый растворитель представляет собой водный растворитель, и второй растворитель содержит органический растворитель и поддается смешиванию с первым растворителем;
(c) протекание одного или более первых потоков и одного или более вторых потоков из первого отдела устройства во второй отдел устройства, и
(d) смешивание одного или более первых потоков и одного или более вторых потоков во втором отделе устройства для обеспечения третьего потока, содержащего липидные частицы по п. 1 или 2.
14. Способ по п. 13, где концентрация образующих липидную частицу компонентов составляет от приблизительно 10 мМ до приблизительно 50 мМ.
15. Способ по п. 13, где нуклеиновая кислота инкапсулирована в липидную частицу с эффективностью от приблизительно 90 до приблизительно 100%.
16. Способ по п. 13, где первый растворитель представляет собой водный буфер и второй растворитель представляет собой водный спирт.
17. Способ по п. 13, где протекание одного или более первых потоков и одного или более вторых потоков из первого отдела устройства во второй отдел устройства содержит соотношение объемов между одним или более первых потоков и одним или более вторых потоков, превышающее 1:1.
18. Способ по п. 17, где указанное соотношение объемов составляет 3:1.
| KON C.G | |||
| AND ET Al, Delivery of antisense oligodeoxyribonucleotide lipopolyplex nanoparticles assembled by microfluidic hydrodynamic focusing // Journal of Controlled Release, стр.62-69 | |||
| WO 2008120152, 22.11.2005 | |||
| СИСТЕМА ДОСТАВКИ НУКЛЕИНОВЫХ КИСЛОТ | 2002 |
|
RU2294192C2 |
| EA 200500644 A1, 29.12.2005 | |||
| WO 2008053988 A1, 08.05.2010. | |||
Авторы
Даты
2016-01-20—Публикация
2010-11-04—Подача