[Область техники]
[0001]
Настоящее изобретение относится к носителю для доставки нуклеиновых кислот с лигандом, активирующим Т-клетки, прикрепленным к поверхности, к способу активации и/или пролиферации T-клеток с использованием носителя для доставки нуклеиновых кислот, к способу доставки нуклеиновой кислоты в T-клетки, и т.п. Настоящее изобретение также относится к способу активации и/или пролиферации T-клеток и способу доставки нуклеиновой кислоты в T-клетки, каждый из них, что характерно включает приведение лиганда, активирующего Т-клетки, и носителя для доставки нуклеиновой кислоты в одновременный контакт с T-клетками.
[0002]
(Предшествующий изобретению уровень техники)
Быстро прогрессируют исследование и разработка иммунотерапии злокачественных опухолей с использованием CAR-T-клеток или TCR-T-клеток, в которые был введен ген химерного рецептора антигена (CAR) или Т-клеточного рецептора (TCR), полученных из специфической к антигену злокачественной опухоли T-клетки-киллера. Современная CAR-T-клеточная терапия, такая как Kymriah (торговое название) и Yescarta (торговое название), которые были одобрены в США, в основном, включает получение CAR-T-клеток путем введения генов CAR в T-клетки, полученные от пациентов ex vivo, с помощью вируса, такого как лентивирусный вектор, и введение CAR-T-клеток пациентам. Однако у этого способа есть проблема, заключающаяся в том, что стоимость производства становится высокой из-за стоимости клеточной культуры и получения вирусных векторов, потому что необходимо несколько этапов в течение длительного периода времени, таких как активация/пролиферация Т-клеток, получение вирусов, перенос генов в T-клетки, и т.п.
[0003]
Сообщалось, что в качестве способа введения CAR в Т-клетки без использования вирусного вектора, для трансфекции CAR ex vivo или in vivo в Т-клетки используют наночастицы, содержащие агрегаты плазмидной ДНК, кодирующей CAR, и катионный полимер, который покрывают не-катионным полимером, конъюгированным с фрагментами антител к CD3 (патентный документ 1, непатентный документ 1), или наноноситель, содержащий мезопористый диоксид кремния, инкапсулирующий ДНК, кодирующую CAR, в порах, и покрытый липидом, имеющим поверхность, модифицированную антителом к CD3 (патентный документ 2).
Помимо этого, сообщалось о методах доставки миРНК к клетке-мишени путем инкапсуляции представляющих интерес миРНК в «липидные наночастицы (LNP)», которые не имеют структуры внутренних пор и состоят из катионного липида, некатионного липида-помощника и лиганда для доставки в клетку-мишень. Например, сообщалось о трансфекции миРНК для CD45 ex vivo или in vivo в Т-клетки с использованием фрагмента антитела к CD4 в качестве нацеливающего лиганда (патентный документ 3, непатентный документ 2).
Кроме того, патентный документ 4 описывает катионный липид для введения активного ингредиента, такого как нуклеиновая кислота или т.п. в различные клетки, включая T-клетку, ткани и органы.
[0004]
С другой стороны, в качестве способа активации/пролиферации Т-клеток сообщалось о способе активации/пролиферации Т-клеток с использованием гранул, на которых иммобилизовано антитело к CD3/CD28, матрицы с гранулами наноразмера (патентные документы 5 и 6).
[0005]
Однако до сих пор не сообщалось о способе, в котором этап активации/пролиферации Т-клеток и этап введения гена в Т-клетки можно было проводить одновременно в одном контейнере.
[Список документов]
[Патентные документы]
[0006]
патентный документ 1: US 2017/0296676
патентный документ 2: US 2016/0145348
патентный документ 3: WO 2016/189532
патентный документ 4: WO 2016/021683
патентный документ 5: US 6352694
патентный документ 6: US 2014/0087462
[Непатентные документы]
[0007]
непатентный документ 1: Nature Nanotechnology 12, 813-820 (2017)
непатентный документ 2: ACS Nano, 2015, 9(7), 6706-6716
[Сущность изобретения]
[Техническая задача]
[0008]
Целью настоящего изобретения является сокращение и упрощение способа получения агента для иммунной клеточной терапии, такой как CAR-T-терапия и т.п., для получения агента для иммунной клеточной терапии в короткий период времени с низкими производственными затратами, и обеспечение более безопасного способа получения агента иммунной клеточной терапии, который устраняет потенциальный риск канцерогенности из-за вирусного вектора.
[Решение задачи]
[0009]
Авторы настоящего изобретения провели интенсивные исследования в попытке достичь вышеуказанной цели и преуспели в одновременном выполнении этапа активации/пролиферации Т-клеток и этапа введения генов в Т-клетки в одном контейнере с использованием носителя для доставки нуклеиновой кислоты, с добавленным на его поверхность лигандом, активирующим Т-клетки. Авторы настоящего изобретения неожиданно обнаружили, что активация/пролиферация Т-клеток и введение нуклеиновой кислоты в Т-клетки могут быть эффективно достигнуты путем простого приведения лиганда, активирующего Т-клетки, и носителя для доставки нуклеиновой кислоты в одновременный контакт с Т-клеткой, и завершили настоящее изобретение.
[0010]
Таким образом, настоящее изобретение относится к следующему:
[1] Способ активации/пролиферации Т-клеток, включающий этап контакта клеточной популяции, содержащей T-клетки, с носителем для доставки нуклеиновой кислоты, имеющим на своей поверхности, по меньшей мере, один тип лиганда, активирующего Т-клетку.
[2] Способ по [1], где указанный выше лиганд, активирующий Т-клетку, включает антитело к CD3 и/или антитело к CD28.
[3] Способ по [1] или [2], где указанный выше носитель для доставки нуклеиновой кислоты имеет на своей поверхности два или более типов лиганда, активирующего Т-клетку.
[4] Способ по любому из [1]-[3], где указанный выше носитель для доставки нуклеиновой кислоты представляет собой липидную наночастицу или липосому.
[5] Способ по любому из [1]-[4], где указанный выше носитель для доставки нуклеиновой кислоты содержит внутри нуклеиновую кислоту, которая подавляет экспрессию фактора, ингибирующего активацию T-клетки, и/или нуклеиновую кислоту, кодирующую фактор, способствующий активации T-клетки.
[6] Способ по любому из [1]-[5], где указанный выше носитель для доставки нуклеиновой кислоты содержит нуклеиновую кислоту, кодирующую CAR или TCR.
[7] Способ по любому из [1]-[6], где способ проводят ex vivo.
[8] Способ доставки нуклеиновой кислоты в T-клетки, включающий этап контакта клеточной популяции, содержащей T-клетки, с носителем для доставки нуклеиновой кислоты, имеющим на своей поверхности, по меньшей мере, один тип лиганда, активирующего Т-клетку, и содержащим внутри нуклеиновую кислоту.
[9] Способ по [8], где указанный выше лиганд, активирующий Т-клетку, включает антитело к CD3 и/или антитело к CD28.
[10] Способ по [8] или [9], где указанный выше носитель для доставки нуклеиновой кислоты имеет на своей поверхности два или более типов лигандов, активирующих Т-клетку.
[11] Способ по любому из [8]-[10], где указанный выше носитель для доставки нуклеиновой кислоты представляет собой липидную наночастицу или липосому.
[12] Способ по любому из [8]-[11], где указанная выше нуклеиновая кислота включает нуклеиновую кислоту, которая подавляет экспрессию фактора, ингибирующего активацию T-клетки, и/или нуклеиновую кислоту, кодирующую фактор, способствующий активации T-клетки.
[13] Способ по любому из [8]-[12], где указанная выше нуклеиновая кислота включает нуклеиновую кислоту, кодирующую CAR или TCR.
[14] Способ по любому из [8]-[13], где способ проводят ex vivo.
[15] Способ доставки нуклеиновой кислоты в T-клетки, включающий этап контакта клеточной популяции, содержащей T-клетки, одновременно, по меньшей мере, с одним типом лиганда, активирующего Т-клетку, и носителем для доставки нуклеиновой кислоты, содержащим внутри нуклеиновую кислоту и без лиганда, активирующего Т-клетку, добавленного на поверхность.
[16] Способ по [15], где указанный выше лиганд, активирующий Т-клетку, включает антитело к CD3 и/или антитело к CD28.
[17] Способ по [15] или [16], где приводят в контакт два или более типов лигандов, активирующих Т-клетку.
[18] Способ по любому из [15]-[17], где указанный выше носитель для доставки нуклеиновой кислоты представляет собой липидную наночастицу или липосому.
[19] Способ по любому из [15]-[18], где указанная выше нуклеиновая кислота включает нуклеиновую кислоту, которая подавляет экспрессию фактора, ингибирующего активацию T-клетки, и/или нуклеиновую кислоту, кодирующую фактор, способствующий активации T-клетки.
[20] Способ по любому из [15]-[19], где указанная выше нуклеиновая кислота включает нуклеиновую кислоту, кодирующую CAR или TCR.
[21] Способ по любому из [15]-[20], где способ проводят ex vivo.
[22] Способ получения лекарственного средства, содержащего T-клетки, включающий этап контакта клеточной популяции, содержащей T-клетки, с носителем для доставки нуклеиновой кислоты, имеющим на своей поверхности, по меньшей мере, один тип лиганда, активирующего Т-клетку, и содержащим внутри нуклеиновую кислоту.
[23] Способ по [22], где указанный выше лиганд, активирующий Т-клетку, включает антитело к CD3 и/или антитело к CD2828.
[24] Способ по [22] или [23], где указанный выше носитель для доставки нуклеиновой кислоты имеет на своей поверхности два или более типов лигандов, активирующих Т-клетку.
[25] Способ по любому из [22]-[24], где указанный выше носитель для доставки нуклеиновой кислоты представляет собой липидную наночастицу или липосому.
[26] Способ по любому из [22]-[25], где указанный выше носитель для доставки нуклеиновой кислоты содержит нуклеиновую кислоту, которая подавляет экспрессию фактора, ингибирующего активацию T-клетки, и/или нуклеиновую кислоту, кодирующую фактор, способствующий активации T-клетки.
[27] Способ по любому из [22]-[26], где указанная выше нуклеиновая кислота включает нуклеиновую кислоту, кодирующую CAR или TCR.
[28] Способ по любому из [22]-[27], где способ проводят ex vivo.
[29] Способ получения лекарственного средства, содержащего T-клетки, включающий этап контакта клеточной популяции, содержащей T-клетки, одновременно, по меньшей мере, с одним типом лиганда, активирующего Т-клетку, и носителем для доставки нуклеиновой кислоты, содержащим внутри нуклеиновую кислоту и без лиганда, активирующего Т-клетку, добавленного на поверхность.
[30] Способ по [29], где указанный выше лиганд, активирующий Т-клетку, включает антитело к CD3 и/или антитело к CD2828.
[31] Способ по[29] или [30], где приводят в контакт два или более типов лигандов, активирующих Т-клетку.
[32] Способ по любому из [29]-[31], где указанный выше носитель для доставки нуклеиновой кислоты представляет собой липидную наночастицу или липосому.
[33] Способ по любому из [29]-[32], где указанный выше носитель для доставки нуклеиновой кислоты содержит нуклеиновую кислоту, которая подавляет экспрессию фактора, ингибирующего активацию T-клетки, и/или нуклеиновую кислоту, кодирующую фактор, способствующий активации T-клетки.
[35] Способ по любому из [29]-[34], где способ проводят ex vivo.
[36] Носитель для доставки нуклеиновой кислоты, имеющий на поверхности, по меньшей мере, один тип лиганда, активирующего Т-клетку.
[37] Носитель для доставки нуклеиновой кислоты по [36], где указанный выше лиганд, активирующий Т-клетку, включает антитело к CD3 и/или антитело к CD2828.
[38] Носитель для доставки нуклеиновой кислоты по [36] или [37], где указанный выше носитель для доставки нуклеиновой кислоты имеет на своей поверхности два или более типов лигандов, активирующих Т-клетку.
[39] Носитель для доставки нуклеиновой кислоты по любому из [36]-[38], где указанный выше носитель для доставки нуклеиновой кислоты представляет собой липидную наночастицу или липосому.
[40] Носитель для доставки нуклеиновой кислоты по любому из [36]-[39], содержащий внутри нуклеиновую кислоту, которая подавляет экспрессию фактора, ингибирующего активацию T-клетки, и/или нуклеиновую кислоту, кодирующую фактор, способствующий активации T-клетки.
[41] Носитель для доставки нуклеиновой кислоты по любому из [36]-[40], содержащий внутри нуклеиновую кислоту, кодирующую CAR или TCR.
[42] Лекарственное средство, содержащее носитель для доставки нуклеиновой кислоты по любому из [36]-[41].
[43] T-клетка, в которую была доставлена нуклеиновая кислота способом по любому из [15]-[21].
[44] Лекарственное средство, содержащее T-клетку по [43].
[45] Клеточная культура, содержащая клеточную популяцию, включающую T-клетки, по меньшей мере, один тип лиганда, активирующего Т-клетку, носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, и среду.
[46] Композиция для доставки нуклеиновой кислоты к T-клеткам, содержащая, по меньшей мере, один тип лиганда, активирующего Т-клетку, и носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность.
[47] Набор для доставки нуклеиновой кислоты в T-клетки, содержащий, по меньшей мере, один тип лиганда, активирующего Т-клетку, и носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность.
[48] T-клетка, в которую была доставлена нуклеиновая кислота способом по любому из [8]-[14].
[49] Лекарственное средство, содержащее T-клетку по [48].
[50] Клеточная культура, которая содержит клеточную популяцию, включающую T-клетки, носитель для доставки нуклеиновой кислоты, имеющий на поверхности, по меньшей мере, один тип лиганда, активирующего Т-клетку, и содержащий внутри нуклеиновую кислоту, и среду.
[51] Композиция для доставки нуклеиновой кислоты к T-клеткам, содержащая носитель для доставки нуклеиновой кислоты имеющий на поверхности, по меньшей мере, один тип лиганда, активирующего Т-клетку, и содержащий внутри нуклеиновую кислоту.
[52] Набор для доставки нуклеиновой кислоты в T-клетки, включающий носитель для доставки нуклеиновой кислоты, имеющий на поверхности, по меньшей мере, один тип лиганда, активирующего Т-клетку, и содержащий внутри нуклеиновую кислоту.
[Полезные эффекты по изобретению]
[0011]
По настоящему изобретению, этап активации/пролиферации T-клеток и этап введения гена в T-клетки можно проводить одновременно в одном контейнере без использования вирусного вектора. В результате агент для иммунной клеточной терапии может быть предоставлен в короткий период времени с низкими производственными затратами.
[Краткое описание чертежей]
[0012]
На фиг. 1 представлено сравнение эффективности переноса генов в T-клетки при помощи липидных наночастиц с антителом к CD3, добавленным на их поверхность, и содержащих различные катионные липиды (соединения 7, 11, 12, 21, 31 и 35).
На фиг. 2 представлено сравнение эффективности переноса генов в T-клетки при помощи липидных наночастиц с антителом к CD3 и/или антителом к CD28, добавленным на их поверхность.
На фиг. 3 показано, что перенос генов (I) в Т-клетки и активация (II) Т-клеток одновременно достигаются посредством липидных наночастиц, имеющих антитело к CD3 и антитело к CD28, добавленные на их поверхности. В (I) и (II) числовое значение на верхней панели показывает концентрацию (мкг/мл) инкапсулированной мРНК, а числовое значение на нижней панели показывает концентрацию (мкг/мл) антитела. Для сравнения, (III) показывает эффективность активации Т-клеток гранулами, на поверхности которых добавлены традиционно известные антитело к CD3 и антитело к CD28.
На фиг. 4 показано, что мРНК luc эффективно вводят в CD3-положительные пан-T-клетки периферической крови человека путем совместного добавления стимулятора активации и липидных наночастиц.
На фиг. 5 представлено выживание и скорость пролиферации T-клеток, трансфицированных мРНК luc при помощи липидных наночастиц.
На фиг. 6 показано, что мРНК luc эффективно вводят в CD4/CD8-положительные T-клетки человека путем совместного добавления стимулятора активации и липидных наночастиц (слева), и что выживание и скорость пролиферации T-клеток поддерживаются на высоком уровне (справа).
[0013]
(Подробное описание изобретения)
1. Носитель для доставки нуклеиновой кислоты по настоящему изобретению
Настоящее изобретение относится к носителю для доставки нуклеиновой кислоты, имеющему на поверхности, по меньшей мере, один тип лиганда, активирующего Т-клетку, (далее в настоящем документе также обозначаемому как «носитель для доставки нуклеиновой кислоты по настоящему изобретению»).
Как применяют в настоящем документе, «носитель для доставки нуклеиновой кислоты» означает носитель, способный поддерживать нуклеиновую кислоту и доставлять нуклеиновую кислоту в клетку. «Способный доставлять нуклеиновую кислоту в клетку» означает, что переносимую нуклеиновую кислоту можно доставить, по меньшей мере, в цитоплазму клетки.
[0014]
1-1. Носитель для доставки нуклеиновой кислоты
Носитель для доставки нуклеиновой кислоты, используемый в настоящем изобретении, конкретно не ограничен в отношении структуры, составляющих его молекул, и формы для переноса нуклеиновой кислоты, при условии, что он может поддерживать нуклеиновую кислоту и может доставлять нуклеиновую кислоту в клетку, как описано выше. Типичной лекарственной системой доставки (DDS) нуклеиновой кислоты является, например, комплекс, использующий положительно заряженные катионные липосомы, катионные полимеры и т.п. в качестве носителей, и образующийся на основе электростатического взаимодействия между ними и нуклеиновой кислотой. Комплекс связывается с отрицательно заряженной клеточной мембраной и затем включается в клетку при помощи адсорбционного эндоцитоза.
[0015]
Более конкретно, примеры носителя для доставки нуклеиновой кислоты, применяемого в настоящем изобретении, в качестве неограничивающих примеров включают липидные наночастицы (LNP), липосомы (например, катионная липосома, ПЭГ-модифицированная липосома, и т.д.), и катионные полимеры (например, полиэтиленимин, полилизин, полиорнитин, хитозан, ателоколлаген, протамин и т.д.), те, в которых катионный полимер инкапсулирован в липосомы, и т.п. Альтернативно, также можно использовать экзосому, которая представляет собой компонент, полученный из живых организмов. Предпочтительной является липидная наночастица или липосома, более предпочтительной является липидная наночастица.
[0016]
1-1-1. Липидная наночастица (LNP)
В настоящем описании «липидная наночастица (LNP)» означает частицу со средним диаметром менее 1 мкм и без крупнопористой структуры (например, липосома) или мелкопористой структуры (например, мезопористый материал) внутри внешней оболочки липидного агрегата, содержащего катионный липид и некатионный липид.
Компоненты липидной наночастицы описаны далее.
[0017]
(a) Катионный липид
В настоящем описании «катионный липид» означает липид, который имеет суммарный положительный заряд в среде с низким pH, такой как при физиологическом pH, в эндосоме и т.п. Катионные липиды, используемые в липидной наночастице, применяемой в настоящем изобретении, конкретно не ограничены. Например, можно упомянуть катионные липиды и т.п., описанные в WO 2016/021683, WO 2015/011633, WO 2011/153493, WO 2013/126803, WO 2010/054401, WO 2010/042877, WO 2016/104580, WO 2015/005253, WO 2014/007398, WO 2017/117528, WO 2017/075531, WO 2017/00414, WO 2015/199952, US 2015/0239834, WO2019/131839, и т.п.
Альтернативно, можно упомянуть синтетические катионные липиды (например, K-E12, H-A12, Y-E12, G-O12, K-A12, R-A12, cKK-E12, cPK-E12, PK1K-E12, PK500-E12, cQK-E12, cKK-A12, KK-A12, PK-4K-E12, cWK-E12, PK500-O12, PK1K-O12, cYK-E12, cDK-E12, cSK-E12, cEK-E12, cMK-E12, cKK-O12, cIK-E12, cKK-E10, cKK-E14, и cKK-E16, предпочтительно, cKK-E12, cKK-E14), описанные в Dong et al. (Proc Natl Acad Sci USA. 2014 Apr 15; 111(15):5753), и синтетические катионные липиды (например, C14-98, C18-96, C14-113, C14-120, C14-120, C14-110, C16-96 и C12-200, предпочтительно C14-110, C16-96 и C12-200), описанные в Love KT et al. (Proc Natl Acad Sci USA. 2010 May 25; 107(21):9915).
[0018]
В одном предпочтительном варианте осуществления можно упомянуть катионный липид, представленный следующей общей формулой и описанный в WO 2016/021683.
[0019]

[0020]
где
W представляет собой формулу -NR1R2 или формулу -N+R3R4R5(Z-),
R1 и R2 каждый независимо представляет собой алкильную группу C1-4 или атом водорода,
R3, R4 и R5 каждый независимо представляет собой алкильную группу C1-4,
Z- представляет собой анион,
X представляет собой необязательно замещенную алкиленовую группу C1-6,
YA, YB и YC каждый независимо представляет собой необязательно замещенную метиновую группу,
LA, LB и LC каждый независимо представляет собой необязательно замещенную метиленовую группу или связь, и
RA1, RA2, RB1, RB2, RC1 и RC2 каждый независимо представляет собой необязательно замещенную алкильную группу C4-10,
или его соль.
[0021]
Более предпочтительно, можно упомянуть катионные липиды, представленные следующими структурными формулами.
[0022]
(соединение 1)
[0023]

(соединение 2)
(соединение 2)
[0024]
(соединение 3)
[0025]
(соединение 4)
(соединение 4)
[0026]

(соединение 5)
[0027]
(соединение 6)
[0028]
(соединение 7)
[0029]

(соединение 8)
[0030]
(соединение 9) и
[0031]

(соединение 10)
[0032]
и их соли.
[0033]
Среди указанных выше катионных липидов наиболее предпочтительные катионные липиды представлены следующими структурными формулами.
[0034]

(соединение 1)
[0035]

(соединение 7) и
[0036]

(соединение 8)
[0037]
и их соли.
[0038]
В другом предпочтительном варианте осуществления можно упомянуть катионный липид, представленный следующей структурной формулой и описанный в WO 2019/131839.
[0039]
Соединение, представленное формулой
[0040]
где
n представляет собой целое число от 2 до 5,
R представляет собой линейную алкильную группу C1-5, линейную алкенильную группу C7-11 или линейную алкадиенильную группу C11, и
волнистая линия каждая независимо показывают связь цис-типа или транс-типа,
или его соль.
[0041]
Более предпочтительно, можно упомянуть катионные липиды, представленные следующими структурными формулами.
[0042]
(соединение 11)
[0043]
(соединение 12)
[0044]
(соединение 13)
[0045]
(соединение 14)
[0046]
(соединение 15)
[0047]
(соединение 16)
[0048]
(соединение 17)
[0049]
(соединение 18)
[0050]
(соединение 19)
[0051]
(соединение 20) и
[0052]
(соединение 21)
[0053]
и их соли.
[0054]
Среди указанных выше катионных липидов наиболее предпочтительные катионные липиды представлены следующими структурными формулами.
[0055]

(соединение 11)
[0056]

(соединение 12) и
[0057]

(соединение 21)
[0058]
и их соли.
[0059]
В другом предпочтительном варианте осуществления можно упомянуть катионный липид, представленный следующей общей формулой (III).
[0060]
Соединение, представленное формулой
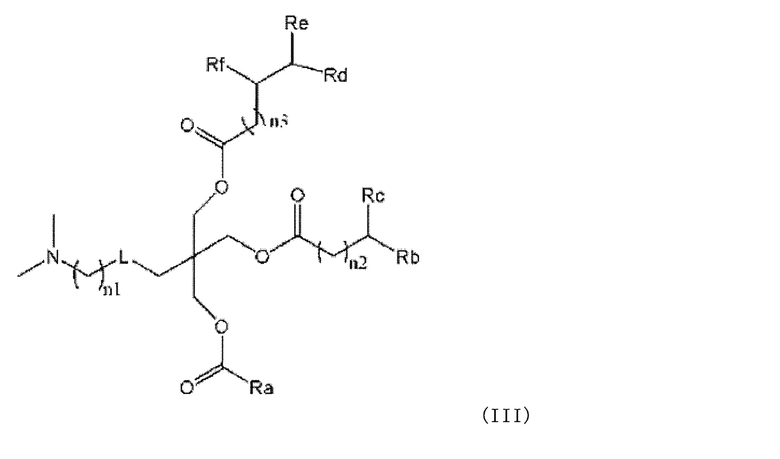
[0061]
где
n1 представляет собой целое число от 2 до 6,
n2 представляет собой целое число от 0 до 2,
n3 представляет собой целое число от 0 до 2,
L представляет собой -C(O)O- или -NHC(O)O-,
Ra представляет собой линейную алкильную группу C5-13, линейную алкенильную группу C13-17 или линейную алкадиенильную группу C17,
Rb представляет собой линейную алкильную группу C2-9,
Rc представляет собой атом водорода или линейную алкильную группу C2-9,
Rd представляет собой атом водорода или линейную алкильную группу C2-9,
Re представляет собой линейную алкильную группу C2-9, и
Rf представляет собой линейную алкильную группу C2-9,
или его соль.
[0062]
Более предпочтительно, можно упомянуть катионные липиды, представленные следующими структурными формулами.
[0063]
(соединение 22)
[0064]
(соединение 23)
[0065]

(соединение 24)
[0066]
(соединение 25)
[0067]

(соединение 26)
[0068]
(соединение 27)
[0069]

(соединение 28)
[0070]
(соединение 29)
[0071]

(соединение 30)
[0072]

(соединение 31)
[0073]

(соединение 32)
[0074]
(соединение 33)
[0075]

(соединение 34)
[0076]
(соединение 35)
[0077]

(соединение 36)
[0078]
(соединение 37)
[0079]

(соединение 38) и
[0080]
(соединение 39)
[0081]
и их соли.
[0082]
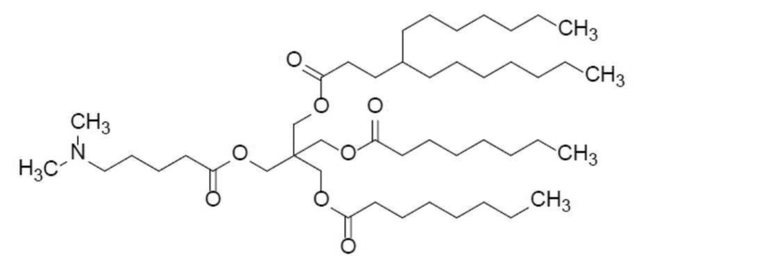
Среди указанных выше катионных липидов наиболее предпочтительные катионные липиды представлены следующими структурными формулами.
[0083]

(соединение 31) и
[0084]

(соединение 35)
[0085]
и их соли.
[0086]
Соединение (III) можно получать, например, с помощью следующего способа получения. В частности, соединение (I) с желаемой структурой может быть синтезировано с использованием соответствующих исходных веществ в соответствии со структурой желаемого соединения (III) в процессе этерификации. Соль соединения (III) можно получать соответствующим образом путем смешивания с неорганическим основанием, органическим основанием, органической кислотой, основной или кислой аминокислотой.
[0087]
Способ производства А (L представляет собой -С(О)О-)
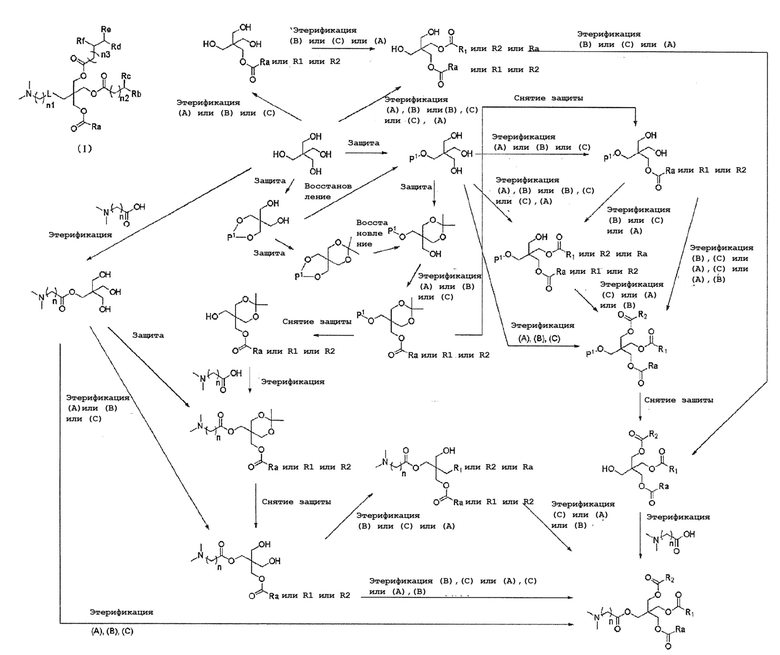
[0088]
Способ производства В (L представляет собой-NHC(O)O-)
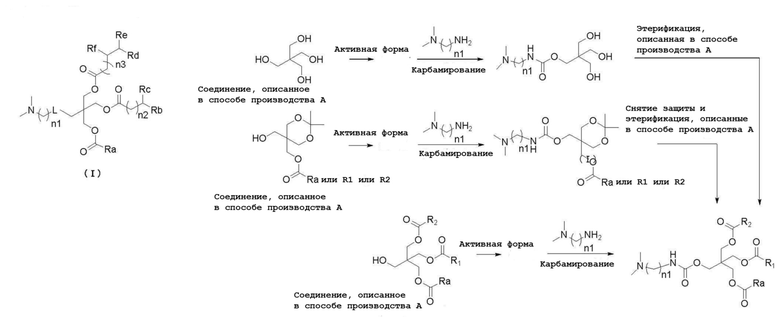
[0089]
Способ производства С

[0090]
В вышеуказанных формулах P1, P2, P3, P4, P5 and P6 каждый независимо представляет собой защитную группу,
соединение (А) представляет собой формулу 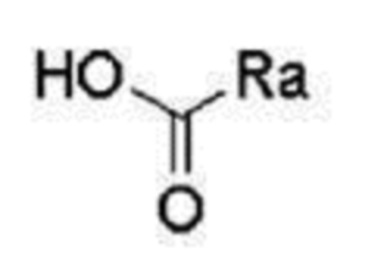 ,
,
соединение (B) представляет собой формулу  ,
,
R1 представляет собой 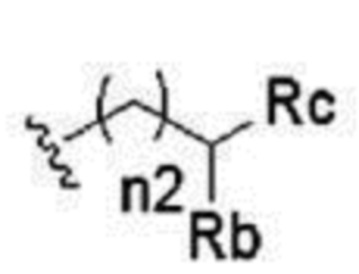 ,
,
соединение (С) представляет собой формулу 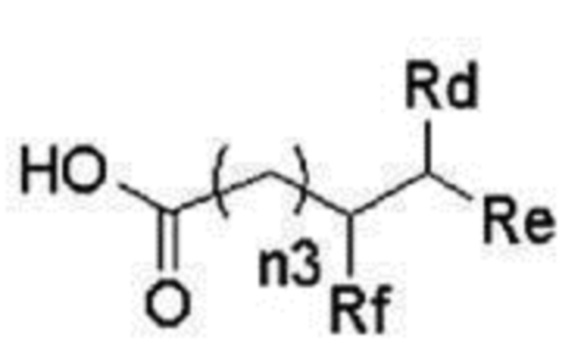 ,
,
и R2 представляет собой  .
.
[0091]
Исходное вещество или реагент, используемые на каждом этапе в указанном выше способе производства, а также полученное соединение могут образовывать соль.
[0092]
Когда соединение, полученное на каждом этапе, является свободным соединением, это соединение можно превратить в представляющую интерес соль с помощью способа, хорошо известного в данной области. Напротив, когда соединение, полученное на каждом этапе, представляет собой соль, эта соль может быть преобразована в свободную форму или другой тип представляющей интерес соли способом, хорошо известным в данной области.
[0093]
Соединение, полученное на каждом этапе, можно использовать в следующей реакции непосредственно в форме его реакционного раствора или после получения в виде неочищенного продукта. Альтернативно, соединение, полученное на каждом этапе, может быть выделено и/или очищено из реакционной смеси с помощью подхода разделения, такого как концентрирование, кристаллизация, перекристаллизация, дистилляция, экстракция растворителем, фракционирование или хроматография в соответствии с обычным способом.
[0094]
Если исходный материал или реагент для каждого этапа коммерчески доступен, можно использовать непосредственно коммерчески доступный продукт.
[0095]
В реакции на каждом этапе, время реакции может отличаться в зависимости от используемого реагента или растворителя, и, как правило, составляет от 1 минуты до 48 часов, предпочтительно от 10 минут до 8 часов, если не указано иное.
[0096]
В реакции на каждом этапе, температура реакции может отличаться в зависимости от используемого реагента или растворителя, и, как правило, составляет от -78°C до 300°C, предпочтительно от -78°C до 150°C, если не указано иное.
[0097]
В реакции на каждом этапе, давление может отличаться в зависимости от используемого реагента или растворителя, и, как правило, составляет от 1 атм до 20 атм, предпочтительно от 1 атм до 3 атм, если не указано иное.
[0098]
В реакции на каждом этапе, например, можно использовать устройство для микроволнового синтеза, такое как Biotage Initiator. Температура реакции может отличаться в зависимости от используемого реагента или растворителя и, как правило, составляет от комнатной температуры до 300°C, предпочтительно, от комнатной температуры до 250°C, более предпочтительно, от 50°C до 250°C, если не указано иное. Время реакции может отличаться в зависимости от используемого реагента или растворителя и, как правило, составляет от 1 минуты до 48 часов, предпочтительно, от 1 минуты до 8 часов, если не указано иное.
[0099]
В реакции на каждом этапе, реагент применяют в количестве от 0,5 эквивалента до 20 эквивалентов, предпочтительно, от 0,8 эквивалентов до 5 эквивалентов относительно субстрата, если не указано иное. В случае использования реагента в качестве катализатора, реагент применяют в количестве от 0,001 эквивалента до 1 эквивалента, предпочтительно, от 0,01 эквивалента до 0,2 эквивалента относительно субстрата. Когда реагент также служит в реакции растворителем, реагент применяют в количестве для растворителя.
[0100]
На каждом этапе реакции, реакцию проводят без растворителя или путем растворения или суспендирования в соответствующем растворителе, если не указано иное. Конкретные примеры растворителя включают следующие:
[0101]
спирты: метанол, этанол, изопропанол, изобутанoл, трет-бутиловый спирт, 2-метоксиэтанол и т.п.;
простые эфиры: диэтиловый эфир, диизопропиловый эфир, дифениловый эфир, тетрагидрофуран, 1,2-диметоксиэтан и т.п.;
ароматические углеводороды: хлорбензол, толуол, ксилол и т.п.;
насыщенные углеводороды: циклогексан, гексан, гептан и т.п.;
амиды: N, N-диметилформамид, N-метилпирролидон и т.п.;
галогенированные углеводороды: дихлорметан, тетрахлорид углерода и т.п.;
нитрилы: ацетонитрил и т.п.;
сульфоксид: диметилсульфоксид и т.п.;
ароматические органические основания: пиридин и т.п.;
кислые ангидриды: уксусный ангидрид и т.п.;
органические кислоты: муравьиная кислота, уксусная кислота, трифторуксусная кислота и т.п.;
неорганические кислоты: соляная кислота, серная кислота и т.п.;
сложные эфиры: этилацетат, изопропилацетатный сложный эфир и т.п.;
кетоны: ацетон, метилэтилкетон и т.п.;
вода.
Два или более из этих растворителей можно использовать в виде смеси в соответствующем соотношении.
[0102]
Для каждого этапа реакции, использующего основания, примеры оснований, которые можно использовать, перечислены далее:
[0103]
неорганические основания: гидроксид натрия, гидроксид калия, гидроксид магния и т.п.;
основные соли: карбонат натрия, карбонат кальция, гидрокарбонат натрия и т.п.;
органические основания: триэтиламин, диэтиламин, пиридин, 4-диметиламинопиридин, N, N-диметиланилин, 1,4-диазабицикло[2.2.2]октан, 1,8- диазабицикло [5.4.0]-7-ундецен, имидазол, пиперидин и т.п.;
алкоксиды металлов: этоксид натрия, трет-бутоксид калия, трет-бутоксид натрия и т.п.;
гидриды щелочных металлов: гидрид натрия и т.п.;
амиды металлов: амид натрия, диизопропиламид лития, гексаметилдисилазид лития и т.п.;
органические производные лития: н-бутиллитий, s-бутиллитий и т.п.
[0104]
На каждом реакционном этапе, использующем кислоту или кислотный катализатор, применяют следующие кислоты или кислотные катализаторы:
[0105]
неорганические кислоты: соляная кислота, серная кислота, азотная кислота, бромистоводородная кислота, фосфорная кислота и т.п.;
органические кислоты: уксусная кислота, трифторуксусная кислота, лимонная кислота, п-толуолсульфоновая кислота, 10-камфорсульфоновая кислота и т.п.;
кислота Льюиса: комплекс бортрифторида диэтилового эфира, йодид цинка, безводный хлорид алюминия, безводный хлорид цинка, безводный хлорид железа и т.п.
[0106]
Если не указано иначе, каждый реакционный этап можно проводить в соответствии со способом, хорошо известным в данной области, таким как способы, описанные в Jikken Kagaku Koza (Encyclopedia of Experimental Chemistry in English), 5th Ed., Vol. 13 to Vol. 19 (под редакцией Химического общества Японии); Shin Jikken Kagaku Koza (New Encyclopedia of Experimental Chemistry in English), Vol. 14 to Vol. 15 (под редакцией Химического общества Японии); Fine Organic Chemistry, 2nd Ed. Revised (L. F. Tietze, Th. Eicher, Nankodo); Organic Name Reactions; The Reaction Mechanism and Essence, Revised (Hideo Togo, Kodansha); Organic Syntheses Collective Volume I-VII (John Wiley & Sons, Inc.); Modern Organic Synthesis in the Laboratory: A Collection of Standard Experimental Procedures (Jie Jack Li, Oxford University Press); Comprehensive Heterocyclic Chemistry III, Vol. 1 to Vol. 14 (Elsevier Japan KK); Strategic Applications of Named Reactions in Organic Synthesis (translated by Kiyoshi Tomioka, Kagaku-Dojin Publishing); Comprehensive Organic Transformations (VCH Publishers, Inc.), 1989; и т.д.
[0107]
На каждом этапе, реакцию защиты или снятия защиты функциональной группы можно проводить в соответствии со способом, хорошо известным в данной области, например, способом, описанным в «Protective Groups in Organic Synthesis, 4th Ed.» (Theodora W. Greene, Peter G. M. Wuts), Wiley-Interscience, 2007; «Protecting Groups, 3rd Ed.» (P.J. Kocienski) Thieme, 2004); и т.д.
[0108]
Примеры защитной группы для гидроксигруппы или фенольной гидроксигруппы в спиртах или т.п. включают защитные группы на основе простого эфира, такого как метоксиметильный эфир, бензильный эфир, п-метоксибензильный эфир, трет-бутилдиметилсилильный эфир, трет-бутилдифенилсилильный эфир, и тетрагидропиранильный эфир; защитные группы на основе сложных эфиров карбоновых кислот, такие как сложный эфир уксусной кислоты; защитные группы на основе сложных эфиров сульфоновой кислоты, такие как сложный эфир метансульфоновой кислоты; и защитные группы на основе сложных эфиров угольной кислоты, такие как трет-бутил карбонат.
[0109]
Примеры защитной группы для карбонильной группы в альдегидах включают ацетальные защитные группы, такие как диметилацеталь; и циклические ацетальные защитные группы, такие как циклический 1,3-диоксан.
[0110]
Примеры защитной группы для карбонильной группы в кетонах включают кетальные защитные группы, такие как диметилкеталь; циклические кетальные защитные группы, такие как циклический 1,3-диоксан; оксимные защитные группы, такие как O-метилоксим; и гидразоновые защитные группы, такие как N, N-диметилгидразон.
[0111]
Примеры защитной группы для карбоксильной группы включают сложноэфирные защитные группы, такие как метиловый сложный эфир; и амидные защитные группы, такие как N, N-диметиламид.
[0112]
Примеры защитной группы для тиола включают эфирные защитные группы, такие как бензиловый тиоэфир; и сложноэфирные защитные группы, такие как сложный эфир тиоуксусной кислоты, тиокарбонат и тиокарбамат.
[0113]
Примеры защитной группы для аминогруппы или ароматического гетероцикла, такого как имидазол, пиррол или индол, включают карбаматные защитные группы, такие как бензилкарбамат; амидные защитные группы, такие как ацетамид; алкиламиновые защитные группы, такие как N-трифенилметиламин; и сульфонамидные защитные группы, такие как метансульфонамид.
[0114]
Защитные группы можно удалять с использованием способа, хорошо известного в данной области, например, способа с использованием кислоты, основания, ультрафиолета, гидразина, фенилгидразина, N-метилдитиокарбамата натрия, фторида тетрабутиламмония, ацетата палладия или триалкилилгалогенов (например, триметилсилилйодида или триметилсилилбромида), или способа восстановления.
[0115]
На каждом этапе с использованием реакции восстановления, примеры восстановителей, которые можно использовать, включают гидриды металлов, такие как алюмогидрид лития, триацетоксиборогидрид натрия, цианоборогидрид натрия, диизобутилгидрид алюминия (DIBAL-H), борогидрид натрия и триацетоксиборогидрид тетраметиламмония; бораны, такие как комплекс боран-тетрагидрофуран; никель Ренея; кобальт Ренея; водород; и муравьиную кислоту. Например, никель Ренея или кобальт Ренея можно использовать в присутствии водорода или муравьиной кислоты. В случае восстановления двойной связи углерод-углерод или тройной связи, можно использовать способ с катализатором, таким как палладированный уголь или катализатор Линдлара.
[0116]
На каждом этапе с использованием реакции окисления, примеры окислителей, которые можно использовать, включают пероксикислоты, такие как m-хлорпербензойная кислота (MCPBA), пероксид водорода и трет-бутил гидропероксид; перхлораты, такие как тетрабутиламмония перхлорат; хлораты, такие как хлорат натрий; хлориты, такие как хлорит натрия; перйодаты, такие как перйодат натрия; высоковалентные реагенты с йодом, такие как йодозилбензол; реагенты с марганцем, такие как диоксид марганца и перманганат калия; реагенты со свинцом, такие как тетраацетат свинца; реагенты с хромом, такие как хлорхромат пиридиния (PCC), дихромат пиридиния (PDC) и реагент Джонса; галогеновые соединения, такие как N-бромосукцинимид (NBS); кислород; озон; комплекс сера триоксид-пиридин; тетроксид осмия; диоксид селена; и 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ).
[0117]
На каждом этапе с использованием реакции радикальной циклизации примеры инициаторов радикальной полимеризации, которые можно использовать, включают азосоединения, такие как азобисизобутиронитрил (AIBN); водорастворимый инициатор радикальной полимеризации, такой как 4-4'-азобис-4-цианопентановая кислота (ACPA); триэтилбор в присутствии воздуха или кислород; и бензоилпероксид. Примеры инициаторов радикальной полимеризации, которые следует использовать, включают трибутилстаннан, тристриметилсилилсилан, 1,1,2,2-тетрафенилдисилан, дифенилсилан и йодид самария.
[0118]
На каждом этапе с использованием реакции Виттига, примеры реагентов Виттига, которые можно использовать, включают алкилиденфосфораны. Алкилиденфосфораны можно получать способом, хорошо известным в данной области, например, реакцией между солью фосфония и сильным основанием.
[0119]
На каждом этапе с использованием реакции Хорнера-Эммонса, примеры реагентов, которые можно использовать, включают сложные эфиры фосфоноуксусной кислоты, такие как метилдиметилфосфоноацетат и этилдиэтилфосфоноацетат, и основания, такие как гидриды щелочных металлов и органический литий.
[0120]
На каждом этапе с использованием реакции Фриделя-Крафтса, примеры реагентов, которые можно использовать, включают кислоту Льюиса и хлорангидрид или алкилирующее средство (например, алкилгалоиды, спирты и олефины). Альтернативно, вместо кислоты Льюиса можно использовать органическую или неорганическую кислоту, и вместо хлорангидрида можно использовать кислые ангидриды, такие как уксусный ангидрид.
[0121]
На каждом этапе с использованием реакции ароматического нуклеофильного замещения, в качестве реагентов можно использовать нуклеофил (например, амин или имидазол) и основание (например, основные соли или органические основания).
[0122]
На каждом этапе с использованием нуклеофильной реакции присоединения с использованием карбаниона, нуклеофильной 1,4-реакции присоединения (реакция присоединения Михаэля) с использованием карбаниона, или реакции нуклеофильного замещения с использованием карбаниона, примеры оснований, которые можно использовать для получения карбаниона включают реагенты с органическим литием, алкоксиды металлов, неорганические основания и органические основания.
[0123]
На каждом этапе с использованием реакции Гриньяра примеры реагентов Гриньяра включают арилгалогены магния, такие как фенилбромид магния, и алкилгалогены магния, такие как метилбромид магния, изопропилбромид магния. Реагент Гриньяра можно получать способом, хорошо известным в данной области, например, реакцией между алкилгалогеном или арилгалогеном и металлическим магнием в простом эфире или тетрагидрофуране в качестве растворителя.
[0124]
На каждом этапе с использованием реакции конденсации Кневенагеля в качестве реагентов можно использовать активное соединение метилена, фланкированное двумя группами, притягивающими электроны, (например, малоновая кислота, диэтилмалонат или малононитрил) и основание (например, органические основания, алкоксиды металлов или неорганические основания).
[0125]
На каждом этапе с использованием реакции Висмейера-Хааса в качестве реагентов можно использовать фосфорилхлорид и амидное производное (например, N, N-диметилформамид).
[0126]
На каждом этапе с использованием реакции азидирования спиртов, алкилгалогенов или сложных эфиров сульфоновой кислоты, примеры азидирующих агентов, которые можно использовать, включают дифенилфосфорилазид (DPPA), триметилсилилазид и азид натрия. В случае азидирования, например, спиртов, можно использовать способ с дифенилфосфорилазидом и 1,8-диазабицикло[5,4,0]ундек-7-еном (DBU), способ с триметилсилилазидом и кислотой Льюиса, или т.п.
[0127]
На каждом этапе с использованием реакции восстановительного аминирования, примеры восстановителей, которые можно использовать, включают триацетоксиборогидрид натрия, цианоборогидрид натрия, водород и муравьиную кислоту. Когда субстрат представляет собой аминное соединение, примеры карбонильных соединений, которые можно использовать, включают п-формальдегид, а также альдегиды, такие как ацетальдегид и кетоны, такие как циклогексанон. Когда субстрат представляет собой карбонильное соединение, примеры аминов, которые можно использовать, включают первичные амины, такие как аммиак и метиламин, и вторичные амины, такие как диметиламин.
[0128]
На каждом этапе с использованием реакции Мицунобу, в качестве реагентов можно использовать сложные эфиры азодикарбоновой кислоты (например, диэтилазодикарбоксилат (DEAD) и диизопропилазодикарбоксилат (DIAD)) и трифенилфосфин.
[0129]
На каждом этапе, использующем реакцию этерификации, амидирования или реацию введения мочевины, примеры реагентов, которые можно использовать, включают ацилгалогены, такие как хлорангидриды или кислотные бромиды, и активированные карбоновые кислоты, такие как кислотные ангидриды, активные сложные эфиры или сульфатные сложные эфиры. Примеры активаторов карбоновых кислот включают карбодиимидные конденсирующие средства, такие как 1-этил-3- (3-диметиламинопропил) карбодиимид гидрохлорид (WSCD); триазиновые конденсирующие средства, такие как 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид-н-гидрат (DMT-MM); конденсирующие средства на основе сложного эфира угольной кислоты, такие как 1,1-карбонилдиимидазол (CDI); дифенилфосфорилазид (DPPA); соль бензотриазол-1-илокси-трисдиметиламинофосфония (реагент BOP); йодид 2-хлор-1-метил-пиридиния (реагент Мукаямы); тионилхлорид; галоформиаты низших алкилов, такие как этилхлороформат; О-(7-азабензотриазол-1-ил)-N, N, N ', N'-тетраметилуроний гексафторфосфат (HATU); серная кислота; и их сочетания. В случае использования карбодиимидного конденсирующего средства может быть полезным добавление в реакцию добавки, такой как 1-гидроксибензотриазол (HOBt), N-гидроксисукцинимид (HOSu) или диметиламинопиридин (DMAP).
[0130]
На каждом этапе с использованием реакции сочетания, примеры металлических катализаторов, которые можно использовать, включают соединения палладия, такие как ацетат палладия (II), тетракис(трифенилфосфин)палладий (0), дихлорбис(трифенилфосфин)палладий (II), дихлорбис(триэтилфосфин)палладий (II), трис(дибензилиденацетон)дипалладий (0), хлорид 1,1'-бис(дифенилфосфино)ферроцен палладия (II) и ацетат палладия(II); соединения никеля, такие как тетракис(трифенилфосфин)никель (0); соединения родия, такие как хлорид трис(трифенилфосфин)родия (III); соединения кобальта; соединения меди, такие как оксид меди и йодид меди (I); и соединения платины. Также может быть полезным добавление основания к реакции. Примеры таких оснований включают неорганические основания и основные соли.
[0131]
На каждом этапе с использованием реакции тиокарбонилирования, дифосфорный пентасульфид, как правило, используют в качестве агента для тиокарбонилирования. Реагент со структурой 1,3,2,4-дитиодифосфетан-2,4-дисульфида, такой как 2,4-бис(4-метоксифенил-1,3,2,4- дитиодифосфетан -2,4-дисульфид (реагент Лавессона) можно использовать вместо дифосфорного пентасульфида.
[0132]
На каждом этапе с использованием реакции Воль-Циглера, примеры галогенирующих средств, которые можно использовать, включают N-йодосукцинимид, N-бромосукцинимид (NBS), N- хлорсукцинимид (NCS), бром и сульфурилхлорид. Реакцию можно ускорить дополнительным добавлением инициатора радикальной полимеризации, такого как нагревание, свет, бензоилпероксид или азобисизобутиронитрил.
[0133]
На каждом этапе с использованием реакции галогенирования гидроксигруппы, примеры галогенирующих средств, которые можно использовать, включают галогенводородную кислоту или галогенангидрид неорганической кислоты; примеры включают соляную кислоту, тионилхлорид, и оксихлорид фосфора для хлорирования и 48% бромистоводородную кислоту для бромирования. Кроме того, также можно использовать способ получения алкилгалогена из спирта под действием трифенилфосфина и тетрахлорида углерода или тетрабромида углерода, и т.д. Альтернативно, также можно использовать способ для синтезирования алкилгалогена путем двухэтапной реакции, включающей превращение спирта в сложный эфир сульфоновой кислоты и последующую реакцию с бромидом лития, хлоридом лития или йодидом натрия.
[0134]
На каждом этапе с использованием реакции Арбузова, примеры реагентов, которые можно использовать, включают алкилгалогены, такие как этилбромацетат, и фосфиты, такие как триэтилфосфит и три(изопропил)фосфит.
[0135]
На каждом этапе с использованием реакции сульфоновой этерификации, примеры используемых агентов для сульфонирования включают метансульфонилхлорид, п-толуолсульфонилхлорид, метансульфоновый ангидрид и п-толуолсульфоновый ангидрид, и трифторметансульфоновый ангидрид.
[0136]
На каждом этапе с использованием реакции гидролиза, в качестве реагента можно использовать кислоту или основание. В случае проведения реакции кислотного гидролиза трет-бутилового сложного эфира, можно добавлять такие реагенты, так как муравьиная кислота, триэтилсилан или т.п. для восстановительного улавливания побочного продукта трет-бутилового катиона.
[0137]
На каждом этапе с использованием реакции дегидратации, примеры дегидратирующих агентов, которые можно использовать, включают серную кислоту, дифосфорный пентоксид, фосфорный оксихлорид, N, N'-дициклогексилкарбодиимид, оксид алюминия и полифосфорную кислоту.
[0138]
Соль соединения, представленного посредством любой вышеуказанной структурной формулы, предпочтительно является фармакологически приемлемой солью. Примеры включают соли с неорганическими основаниями (например, соли щелочных металлов, такие как натриевая соль, калиевая соль и т.п.; соли щелочноземельных металлов, такие как кальциевая соль, магниевая соль и т.п.; соль алюминия, аммонийная соль), соли с органическими основаниями (например, соли с триметиламином, триэтиламином, пиридином, пиколином, этаноламином, диэтаноламином, триэтаноламином, трометамин[трис(гидроксиметил)метиламином], трет-бутиламином, циклогексиламином, бензиламином, дициклогексиламином, N, N-дибензилэтилендиамином), соли с неорганическими кислотами (например, соли с гидрофосфорной кислотой, соляной кислотой, бромистоводородной кислотой, йодистоводородной кислотой, азотной кислотой, серной кислотой, фосфорной кислотой), соли с органическими кислотами (соли с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фталевой кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой), соли с основными аминокислотами (соли с аргинином, лизином, орнитином) или соли с кислыми аминокислотами (соли с аспарагиновой кислотой, глутаминовой кислотой).
[0139]
Соотношение (моль%) катионного липида с общим количеством липидов, присутствующих в липидной наночастице, составляет, например, приблизительно от 10% до приблизительно 80%, предпочтительно приблизительно от 20% до приблизительно 70%, более предпочтительно приблизительно от 40% до приблизительно 60%; однако, соотношение не ограничено этими количествами.
Также можно использовать только один тип вышеуказанного катионного липида или два или более типов в комбинации. Когда используют несколько типов катионных липидов, предпочтительным является соотношение всех катионных липидов, указанное выше.
[0140]
(b) Некатионный липид
В настоящем описании, «некатионный липид» означает липид, иной чем катионный липид, и представляет собой липид, который не имеет суммарного положительного заряда при выбранном pH, таком как физиологическ pH и т.п. Примеры некатионного липида, используемого в липидной наночастице по настоящему изобретению, включают фосфолипид, стероиды, ПЭГ-липид и т.п.
[0141]
Для улучшения доставки нуклеиновой кислоты, например, в T-клетку, фосфолипид конкретно не ограничен при условии, что он стабильно поддерживает нуклеиновую кислоту и не ингибирует слияние с клеточными мембранами (плазматическая мембрана и мембрана органелл). Например, можно упомянуть фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидную кислоту, пальмитоилолеоилфосфатидилхолин, лизофосфатидилхолин, лизофосфатидилэтаноламин, дипальмитоилфосфатидилхолин, диолеоилфосфатидилхолин, дистеароилфосфатидилхолин, дилиноленоилфосфатидилхолин и т.п.
[0142]
Предпочтительные фосфолипиды включают дистеароилфосфатидилхолин (DSPC), диолеоилфосфатидилхолин (DOPC), дипальмитоилфосфатидилхолин (DPPC), диолеоилфосфатидил глицерин (DOPG), пальмитоилолеоилфосфатидил глицерин (POPG), дипальмитоилфосфатидил глицерин (DPPG), диолеоил-фосфатидил этаноламин (DOPE), пальмитоилолеоилфосфатидилхолин (POPC), пальмитоилолеоил-фосфатидил этаноламин (POPE), и диолеоилфосфатидил этаноламин 4-(N-малеинимид метил)-циклогексан-1-карбоксилат (DOPE-mal), более предпочтительно DOPC, DPPC, POPC, и DOPE.
[0143]
Соотношение (моль%) фосфолипида с общим количеством липидов, присутствующих в липидной наночастице, может составлять, например, приблизительно от 0% до приблизительно 90%, предпочтительно приблизительно от 5% до приблизительно 30%, более предпочтительно приблизительно от 8% до приблизительно 15%.
Можно использовать только один тип вышеуказанного фосфолипида или два или более типов в комбинации. Когда используют несколько типов фосфолипидов, предпочтительным является соотношение всех фосфолипидов, указанное выше.
[0144]
В качестве стероидов можно упомянуть холестерин, 5α-ъолестанол, 5β-копростанол, холестерил-(2'-гидрокси)-этилэфир, холестерил-(4'-гидрокси)-бутилэфир, 6-кетохолестанол, 5α-холестан, холестенон, 5α-холестанон, 5β-холестанон, и холестерилдеканоат, предпочтительно холестерин.
[0145]
Соотношение (моль%) стероидов с общим количеством липидов, присутствующих в липидной наночастице, когда присутствуют стероиды, может составлять, например, приблизительно от 10% до приблизительно 60%, предпочтительно приблизительно от 12% до приблизительно 58%, более предпочтительно приблизительно от 20% до приблизительно 55%.
Можно использовать только один тип вышеуказанного стероида или два или более типов в комбинации. Когда используют несколько типов фосфолипидов, предпочтительным является соотношение всех стероидов, указанное выше.
[0146]
В настоящем описании, «ПЭГ-липид» означает любой комплекс полиэтиленгликоля (ПЭГ) и липида. ПЭГ-липид конкретно не ограничен при условии, что он обладает эффектом подавления агрегации липидных наночастиц. Например, можно упомянуть ПЭГ, конъюгированный с диалкилоксипропилом (PEG-DAA), ПЭГ, конъюгированный с диацилглицерином (PEG-DAG) (например, SUNBRIGHT GM-020 (NOF CORPORATION)), ПЭГ, конъюгированный с фосфолипидами, такими как фосфатидилэтаноламин (PEG-PE), ПЭГ, конъюгированный с церамидом (PEG-Cer), ПЭГ, конъюгированный с холестерином (ПЭГ-холестерин), или их производные, или их смеси, mPEG2000-1,2-ди-O-алкил-sn3-карбомоилглицерид (PEG-C-DOMG), 1-[8'-(1,2-димиристоил-3-пропанокси)-карбоксаамид-3',6-диоксаоктанил]карбамоил-ω-метил-поли(этиленгликоль) (2KPEG-DMG) и т.п. Предпочтительный ПЭГ-липид включает PEG-DGA, PEG-DAA, PEG-PE, PEG-Cer, и их смесь, более предпочтительно, конъюгат PEG-DAA, выбранный из группы, состоящей из конъюгата PEG-дидецилоксипропил, конъюгата PEG-дилаурилоксипропил, конъюгата PEG-димиристилоксипропил, конъюгата PEG-дипальмитилоксипропил, конъюгата PEG-дистеарилоксипропил, и их смеси.
В дополнение к метоксигруппе, в качестве свободного конца ПЭГ можно использовать малеинимидную группу, N-гидроксисукцинимидильную группу и т.п. для связывания лиганда, активирующего Т-клетку. Например, SUNBRIGHT DSPE-0201MA (NOF) можно использовать в качестве ПЭГ-липида с функциональной группой для связывания лиганда, активирующего Т-клетку (иногда обозначаемого в настоящем описании как «концевой реактивный ПЭГ-липид»).
[0147]
Соотношение (моль%) ПЭГ-липид с общим количеством липидов, присутствующих в липидной наночастице по настоящему изобретению, может составлять, например, приблизительно от 0% до приблизительно 20%, предпочтительно приблизительно от 0,1% до приблизительно 5%, более предпочтительно приблизительно от 0,7% до приблизительно 2%.
Соотношение (моль%) концевого реактивного ПЭГ-липида с общим количеством вышеуказанных ПЭГ-липидов может составлять, например, приблизительно от 10% до приблизительно 100%, предпочтительно приблизительно от 30% до приблизительно 100%, более предпочтительно приблизительно от 40% до приблизительно 100%.
Можно использовать только один тип вышеуказанного ПЭГ-липида или два или более типов в комбинации. Когда используют несколько типов ПЭГ-липидов, предпочтительным является соотношение всех фосфолипидов, указанное выше.
[0148]
1-1-2. Липосома
В качестве другого предпочтительного носителя для доставки нуклеиновой кислоты для использования в настоящем изобретении можно упомянуть липосому. В качестве липосомы могут быть аналогичным образом использованы вещества, обычно применяемые в системах для доставки лекарственных средств для доставки нуклеиновых кислот к клеткам. Например, широко используются липосомы, полученные путем смешивания различных катионных липидов (например, DOTMA, DOTAP, DDAB, DMRIE и т.д.), разработанных в качестве реагентов для трансфекции, и слитых с мембраной нейтральных липидов (например, DOPE, холестерин и т.д.), которые способствуют высвобождению из эндосомы. Также можно использовать липосомы, в которых на поверхность липосомы добавляют функциональные молекулы, такие как ПЭГ, пептид слияния с pH-чувствительными мембранами, пептид, способствующий проницаемости мембраны, и т.п.
[0149]
1-2. Лиганд, активирующий Т-клетку
В носителе для доставки нуклеиновой кислоты по настоящему изобретению, лиганд, активирующий Т-клетку, добавляют на поверхность указанного выше носителя для доставки нуклеиновой кислоты.
Лиганд, активирующий Т-клетку, для использования в настоящем изобретении, конкретно не ограничен при условии, что он представляет собой молекулу, которая взаимодействует с поверхностными молекулами Т-клеток, способствуя активации и/или пролиферации Т-клеток. Например, можно упомянуть молекулы, обладающие функцией специфического связывания с CD3, который связан с TCR и отвечает за передачу сигнала через TCR, и с поверхностными молекулами CD28, ICOS, CD137, OX40, CD27, GITR, BAFFR, TACI, BMCA, CD40L и т..п., которые известны как факторы костимуляции активации Т-клеток, и передающие сигналы активации/пролиферации и сопутствующие сигналы в Т-клетках или антигенпрезентирующих клетках. Такая молекула может быть физиологическим лигандом (или рецептором) для указанной выше молекулы клеточной поверхности или может быть не физиологическим лигандом (или рецептором), обладающим агонистической активностью. В качестве нефизиологического лиганда можно предпочтительно упомянуть антитело-агонист.
[0150]
Более предпочтительно, лиганд, активирующий Т-клетку, для использования в настоящем изобретении относится к антителу против CD3 и/или антителу против CD28. Антитело против CD3 и антитело против CD28, каждое из которых специфически связывается с CD3 и CD28, экспрессируемыми на Т-клетках-мишенях, которые индуцируют для активации и/или пролиферации (например, когда Т-клетка-мишень происходит из человека, антитело против CD3 и антитело против CD28 предпочтительно являются антителом к CD3 человека и антителом к CD28 человека, соответственно), и может быть полным антителом или его фрагментом (например, Fab, F(ab')2, Fab', scFv, Fv, восстановленное антитело (rIgG), dsFv, sFv, диатело, триотело и т.д.), при условии, что они обладают способностью стимулировать эти поверхностные молекулы T-клетки и передавать сигналы в T-клетки. Подкласс антитела также конкретно не ограничен, но предпочтительно представляет собой антитело IgG.
[0151]
Когда антитело-агонист, такое как антитело против CD3 или антитело против CD28, используют в качестве лиганда, активирующего Т-клетку, также можно использовать коммерчески доступное антитело к CD3, антитело к CD28 или т.п. при условии, что это молекула полного антитела, или антитело также может быть выделено из среды для культивирования клеток, продуцирующих антитело. С другой стороны, когда лиганд представляет собой какой-либо из указанных выше фрагментов антител за счет обработки полного антитела восстановителем (например, 2-меркаптоэтанолом, дитиотрейтолом) или пептидазой (например, папаином, пепсином, фицином) или путем выделения нуклеиновой кислоты, кодирующей фрагменты антитела к CD3, антитела к CD28 и т.п. таким же образом, как в получении нуклеиновой кислоты для инкапсуляции в носитель для доставки нуклеиновой кислоты, как будет описано позже, фрагмент антитела может быть получен рекомбинантно с использованием того же самого способа.
[0152]
В качестве лиганда, активирующего Т-клетку, можно использовать только один тип, или два или более типов можно использовать в комбинации. Предпочтительно сочетать два или более типов. Когда два или более типов лигандов, активирующих Т-клетку, применяют в комбинации, по меньшей мере, один тип предпочтительно является антителом к CD3 или антителом к CD28, более предпочтительно, антителом к CD3. В частности, предпочтительно, оба антитела, против CD3 и против CD28, можно использовать в качестве лигандов, активирующих Т-клетку.
[0153]
Когда, по меньшей мере, антитело к CD3 и антитело к CD28 применяют в комбинации в качестве лигандов, активирующих Т-клетку, молярное соотношение двух лигандов, добавленных на поверхность носителя для доставки нуклеиновой кислоты по настоящему изобретению, составляет 1:4-4:1, предпочтительно 1:2-2:1.
[0154]
Когда два или более типов лигандов, активирующих Т-клетку, применяют в комбинации, лиганды, активирующие Т-клетку, можно добавлять раздельно на поверхность носителя для доставки нуклеиновой кислоты, или их можно добавлять на поверхность носителя для доставки нуклеиновой кислоты в виде комплекса при условии, что сохраняется способность каждого из них активвировать T-клетку. Например, два типа лигандов, активирующих Т-клетку, представляют собой антитела (например, антитело к CD3 и антитело к CD28), их можно предоставлять в виде биспецифических антител, известных как таковые.
[0155]
В носителе для доставки нуклеиновой кислоты по настоящему изобретению лиганд, активирующий Т-клетку, может быть связан с внешней оболочкой любым способом при условии, что он присутствует на поверхности носителя для доставки нуклеиновой кислоты. Например, когда липидные наночастицы, содержащие концевой реактивный ПЭГ-липид в качестве некатионного липида, применяют в качестве носителя для доставки нуклеиновой кислоты, лиганд можно добавлять к концу ПЭГ. Например, липидные наночастицы, меченные лигандом (антителом), можно получать путем реакции ПЭГ-липида с малеинимидной группой, вставленной в конец (например, SUNBRIGHT DSPE-0200MA), с тиоловой группой указанного выше восстановленного антитела. Даже когда липосому, модифицированную ПЭГ, используют в качестве носителя для доставки нуклеиновой кислоты, лиганд, активирующий Т-клетку, можно добавлять на поверхность липосомы таким же образом.
[0156]
1-3. Нуклеиновая кислота, содержащаяся в носителе для доставки нуклеиновой кислоты по настоящему изобретению
Носитель для доставки нуклеиновой кислоты по настоящему изобретению в форме, свободной от нуклеиновой кислоты также можно использовать для индуцирования активации и/или пролиферации T-клеток. В одном предпочтительном варианте осуществления, активацию и/или пролиферацию T-клеток и доставку нуклеиновой кислоты в T-клетки можно проводить одновременно на одном этапе с инкапсулированной нуклеиновой кислотой. Таким образом, в одном предпочтительном варианте осуществления, носитель для доставки нуклеиновой кислоты по настоящему изобретению дополнительно содержит нуклеиновую кислоту для доставки в T-клетки.
[0157]
Когда носитель для доставки нуклеиновой кислоты по настоящему изобретению содержит внутри нуклеиновую кислоту, нуклеиновая кислота конкретно не ограничена при условии, что нуклеиновая кислота сама по себе или продукт ее транскрипции или трансляции внутри Т-клеток имеет функцию изменения T-клеток до желаемого состояния.
[0158]
1-3-1. Нуклеиновая кислота, подавляющая экспрессию фактора, ингибирующего активацию T-клетокт
В одном предпочтительном варианте осуществления, носитель для доставки нуклеиновой кислоты по настоящему изобретению содержит внутри нуклеиновую кислоту, подавляющую экспрессию фактора, ингибирующего активацию Т-клеток. Фактор, ингибирующий активацию Т-клеток, и являющийся мишенью, конкретно не ограничен при условии, что он подавляет активацию T-клеток. Например, можно упомянуть факторы иммунных контрольных точек (например, CTLA-4, PD-1, TIM-3, LAG-3, TGIT, BTLA, VISTA(PD-1H) и т.д.), которые представляют собой молекулы клеточной поверхности, которые передают негативные сигналы относительно активации и/или пролиферации T-клеток при получении стимуляции от антигенпрезентирующих клеток или опухолевых клеток, CD160, Cbl-b, эндогенного TCR и т.п..
[0159]
Нуклеиновая кислота, подавляющая экспрессию фактора, ингибирующего активацию Т-клеток, может действовать на любом уровне: от уровня транскрипции гена, кодирующего фактор, уровня посттранскрипционной регуляции, уровня трансляции белка, уровня посттрансляционной модификации и т.п. Таким образом, примеры нуклеиновой кислоты, подавляющей экспрессию фактора, ингибирующего активацию Т-клеток, включают нуклеиновую кислоту (например, антиген), ингибирующую транскрипцию гена, кодирующего фактор, нуклеиновую кислоту, ингибирующую процессинг от начальных транскриптов до мРНК, нуклеиновую кислоту, ингибирующую трансляцию из мРНК в белок (например, антисмысловая нуклеиновая кислота, мкРНК) или разрушающую мРНК (например, миРНК, рибозим, мкРНК) и т.п. Хотя предпочтительно используют вещества, действующие на любом из этих уровней, предпочтительным является вещество, которое комплементарно связывается с мРНК, чтобы ингибировать трансляцию в белок или разрушать мРНК. В качестве нуклеиновой кислоты можно упомянуть
(a) нуклеиновую кислоту с активностью РНКи против мРНК, кодирующей фактор, или ее предшественник,
(b) антисмысловую нуклеиновую кислоту против мРНК, кодирующей фактор,
(c) рибозимную нуклеиновую кислоту против мРНК, кодирующей фактор,
и т.п.
Нуклеотидная последовательность мРНК (кДНК), кодирующей каждый из факторов, ингибирующих активацию T-клеток, известна, и информацию о последовательностях можно получать, например, из общедоступных баз данных (например, NCBI, EMBL, DDBJ и т.д.).
[0160]
(a) Нуклеиновая кислота с активностью РНКи против мРНК, кодирующей фактор, или ее предшественник
В качестве нуклеиновой кислоты, обладающей активностью РНКи против мРНК, кодирующей фактор, ингибирующий активацию Т-клеток, можно упомянуть двухцепочечную РНК, состоящую из олиго-РНК, комплементарной мРНК-мишени, и ее комплементарной цепи, т.е. можно упомянуть миРНК. миРНК может быть сконструирована на основе информации о последовательности кДНК целевого гена, например, в соответствии с правилами, предложенными Elbashir et al. (Genes Dev., 15, 188-200 (2001)). Короткошпилечная РНК (кшРНК), которая является предшественником миРНК, может быть сконструирована соответствующим образом путем выбора любой линкерной последовательности (например, приблизительно 5-25 оснований), способной образовывать петлевую структуру, и связывания смысловой цепи и антисмысловой цепи миРНК через линкерную последовательность.
[0161]
Последовательности миРНК и/или кшРНК можно искать с использованием программ для поиска, которые предоставляются бесплатно на различных веб-сайтах. Примеры такого сайта в качестве неограничивающих примеров включают, siDESIGN Center, предоставленный Dharmacon (http://dharmacon.horizondiscovery.com/jp/design-center/?rdr=true&LangType=1041&pageid=17179928204), miRNA Target Finder, предоставленный GenScript (https://www.genscript.com/tools/sirna-target-finder) и т.п.
[0162]
В настоящем описании, микроРНК (мкРНК), которая нацелена на мРНК кодирующую фактор, ингибирующий активацию Т-клеток, также определяют как включенную в нуклеиновую кислоту с активностью РНКи против мРНК. Для мкРНК, первичная микроРНК (при-мкРНК), которая представляет собой первичный транскрипт, исходно транскрибируется из гена, кодирующего мкРНК, затем процессируется ферментом Drosha в предшественник микроРНК (пре-мкРНК) длиной приблизительно 70 пар оснований схарактерной шпилечной структурой, транспортируется из ядра в цитоплазму, и дополнительно процессируется при помощи белка Dicer для получения зрелой мкРНК, которая захватывается RISC и воздействует на мРНК-мишень. Таким образом, пре-мкРНК или при-мкРНК, предпочтительно пре-мкРНК, также можно использовать в качестве предшественника мкРНК.
[0163]
мкРНК можно искать с использованием программ для предсказания мишеней, которые предоставляются бесплатно на различных веб-сайтах. Примеры такого сайта в качестве неограничивающих примеров включают, TargetScan (http://www.targetscan.org/vert_72/), опубликованный Whitehead Institute, USA, DIANA-micro-T-CDS(http://diana.imis.athena-innovation.gr/DianaTools/index.php?r=microT_CDS/index), опубликованный Alexander Fleming Biomedical Sciences Research Centre, Greece, и т.п. Альтернативно, мкРНК, нацеленную на мРНК, кодирующую фактор, ингибирующий активацию Т-клеток, можно также искать с использованием TarBase (http://carolina.imis.athena-innovation.gr/diana_tools/file/index.php?r=tarbasev8/index, который представляет собой базу данных, относящуюся к мкРНК, для которых было экспериментально доказано воздействие на мРНК-мишень, и опубликованную University of Thessaly, Pasteur Institute и т.п.
[0164]
Нуклеотидные молекулы, которые составляют миРНК и/или кшРНК, или мкРНК и/или пре-мкРНК могут быть нативной РНК или ДНК. Для уулучшения стабильности (химической и/или против фермента) и специфической активности (аффинность к РНК), можно включать различные известные химические модификации.
[0165]
миРНК можно получать в соответствии со способом, включающим синтез смысловой цепи и антисмысловой цепи целевой последовательности каждой мРНК с помощью автоматического синтезатора ДНК/РНК, денатурацию в подходящем растворе буфера для отжига при приблизительно от 90 до 95°C в течение приблизительно 1 минуты и отжиг при приблизительно от 30 до 70°C в течение приблизительно от 1 до 8 часов. Кроме того, миРНК также можно получать путем синтеза кшРНК, который является предшественником миРНК, и расщепления кшРНК с использованием фермента Dicer. мкРНК и пре-мкРНК могут быть синтезированы автоматическим синтезатором ДНК/РНК на основе информации об их последовательностях.
[0166]
В настоящем описании нуклеиновую кислоту, предназначенную для продуцирования миРНК или мкРНК против мРНК, кодирующей ингибитор активации T-клеток in vivo также определяют как включенную в нуклеиновую кислоту с активностью РНКи против мРНК. Примеры такой нуклеиновой кислоты включают экспрессирующие векторы, сконструированные так, чтобы экспрессировать указанные выше кшРНК, или миРНК, или мкРНК или пре-мкРНК, и т.п. В качестве промотора, можно использовать промотор polII (например, немедленно-ранний промотор CMV). Обычной практикой является использование промотора polIII для обеспечения точной транскрипции короткой РНК. Примеры промотора polIII включают промоторы U6-мяРНК мыши и человека, РНК-промотор H1-РНКазы P человека, промотор валин-тРНК человека и т.п. Кроме того, последовательность, в которой четыре или более T являются непрерывными, используют в качестве сигнала терминации транскрипции. Экспрессирующую кассету мкРНК и пре-мкРНК также можно получать таким же образом, как и кшРНК.
[0167]
(b) Антисмысловая нуклеиновая кислота против мРНК, кодирующей фактор, ингибирующий активацию Т-клеток
Антисмысловая нуклеиновая кислота против мРНК, кодирующей фактор, ингибирующий активацию Т-клеток, представляет собой нуклеиновую кислоту, содержащую нуклеотидную последовательность, комплиментарную нуклеотидной последовательности мРНК или ее части, которая имеет функцию ингибирования синтеза белка за счет специфического связывания с мРНК-мишенью для формирования стабильного дуплекса. Антисмысловая нуклеиновая кислота может быть ДНК/РНК или химерой ДНК или РНК. Когда антисмысловая нуклеиновая кислота представляет собой ДНК, гибрид РНК:ДНК, образованный РНК-мишенью и антисмысловой ДНК распознается эндогенной РНКазой H, тем самым вызывая селективную деградацию РНК-мишени. Длина целевой области антисмысловой нуклеиновой кислоты конкретно не ограничена при условии, что гибридизация антисмысловой нуклеиновой кислоты в конечном итоге ингибирует трансляцию в белок, и может представлять собой полную последовательность мРНК, кодирующую белок или ее частичную последовательность. Короткая последовательность может составлять приблизительно 10 оснований, а длинная может быть всей последовательностью мРНК или исходным транскриптом. Кроме того, антисмысловая нуклеиновая кислота может быть нуклеиновой кислотой, которая ингибирует трансляцию в белок путем гибридизации с мРНК-мишенью или исходным транскриптом, а также может быть нуклеиновой кислотой, способной образовывать триплекс путем связывания с этими генами, которые являются двухцепочечными ДНК, и ингибировать транскрипцию в РНК (анти-ген).
[0168]
Нуклеотидную молекулу, составляющую антисмысловую нуклеиновую кислоту можно также модифицировать таким же образом, как в случаях с вышеуказанной миРНК и т.п. для того, чтобы улучшить стабильность, специфическую активность и т.п.
Антисмысловой олигонуклеотид можно получать, определяя целевую последовательность мРНК или исходного транскрипта на основании последовательности кДНК или последовательности геномной ДНК целевого гена, и синтезируя комплементарную последовательность при помощи коммерчески доступного автоматического синтезатора ДНК/РНК.
[0169]
В настоящем описании нуклеиновую кислоту, разработанную, чтобы быть способной генерировать антисмысловую РНК для мРНК, кодирующей фактор, ингибирующий активацию Т-клеток, in vivo, также определяют как включенную в антисмысловую нуклеиновую кислоту для мРНК. Примером такой нуклеиновой кислоты может служить экспрессирующий вектор, сконструированный так, чтобы экспрессировать вышеуказанную антисмысловую РНК, или т.п. В качестве промотора, промотор polII или промотор polIII можно соответствующим образом выбрать и использовать в соответствии с длиной транскрибируемой антисмысловой РНК.
[0170]
(c) Рибозимная нуклеиновая кислота для мРНК, кодирующей фактор, ингибирующий активацию Т-клеток
Рибозимную нуклеиновую кислоту, способную специфически расщеплять внутреннюю кодирующую область мРНК, кодирующей фактор, ингибирующий активацию Т-клеток, также можно использовать в качестве нуклеиновой кислоты, подавляющей экспрессию фактора. «Рибозим» узко определяют как РНК, обладающую ферментативной активностью для расщепления нуклеиновой кислоты, но настоящее описание также включает ДНК при условии, что существует специфическая по последовательности ферментативная активность для расщепления нуклеиновой кислоты. Рибозимная нуклеиновая кислота с наиболее широким применением включает самосплайсирующуюся РНК, которую можно найти в патогенной РНК, такой как вироид, вирусоид и т.д., и известны тип головки молотка или тип шпильки. Когда рибозим применяют в форме экспрессирующего вектора, имеющего ДНК, которая кодирует рибозим, рибозим может быть гибридным рибозимом, дополнительно связанным с последовательностью модифицированной тРНК, чтобы способствовать переносу транскрипта в цитоплазму.
[0171]
(d) Нуклеиновая кислота, подавляющая экспрессию фактора, ингибирующего активацию Т-клеток, путем редактирования генома
В предпочтительном варианте осуществления, отличном от указанных выше (a)-(c), нуклеиновая кислота, подавляющая экспрессию фактора, ингибирующего активацию Т-клеток, может быть нуклеиновой кислотой, которая может инактивировать (нокаутировать) ген, кодирующий фактор. В качестве такой нуклеиновой кислоты можно упомянуть нуклеиновую кислоту, кодирующую искусственную нуклеазу, состоящую из модуля распознавания последовательности нуклеиновой кислоты (например, CRISPR/Cas9, ZFmotif, эффектор TAL и т.д.), способного специфически распознавать частичную нуклеотидную последовательность в гене в качестве мишени, и нуклеазы, которая вводит двухцепочечный разрыв (DSB) в ген внутри или рядом с целевой последовательностью. После введения DSB ген может быть выведен из строя путем мутации в виде вставки или делеции из-за ошибки репарации негомологичного соединения концов (NHEJ). Альтернативно, нокаут генов с помощью репарации путем гомологичной рекомбинации (HR) также может осуществляться путем объединения с нацеливающим вектором, в котором маркерный ген (например, репортерный ген, такой как ген флуоресцентного белка и т.п., ген селективного маркера, такой как ген устойчивости к лекарственному средству и т.п.) вставлен в последовательность гена. Кроме того, эндогенный ген TCR также может быть нокаутирован путем репарации HR экзогенным геном TCR.
[0172]
1-3-2. Нуклеиновая кислота, кодирующая фактор, способствующий активации T-клеток
В другом предпочтительном варианте осуществления носитель для доставки нуклеиновой кислоты по настоящему изобретению содержит внутри нуклеиновую кислоту, кодирующую фактор, способствующий активации Т-клеток. Интересующий фактор, способствующий активации Т-клеток, включает, например, молекулы T-клеточной поверхности (например, CD28, ICOS, CD137, OX40, CD27, GITR, BAFFR, TACI, BMCA, CD40L и т.д.), с которыми связывается вышеуказанный лиганд, активирующий Т-клетку, для передачи сигналов активации и/или пролиферации в T-клетки, и т.п.
Нуклеотидная последовательность мРНК (кДНК), кодирующей любой из факторов, способствующих активации Т-клеток известна, и информацию о последовательности можно получать, например, из общедоступных баз данных (например, NCBI, EMBL, DDBJ и т.д.).
[0173]
Нуклеиновую кислоту, кодирующую фактор, способствующий активации Т-клеток, можно инкапсулировать в форме экспрессирующего вектора, содержащего мРНК или ДНК, кодирующую фактор, в носитель для доставки нуклеиновой кислоты по настоящему изобретению. мРНК, кодирующую фактор, способствующий активации Т-клеток, можно выделять хорошо известным способом, с использованием в качестве матрицы РНК, выделенной из T-клеток, и использования зонда или парймера, приготовленного на основании информации о ее последовательности. Полученную мРНК можно инкапсулировать как есть в носитель для доставки нуклеиновой кислоты по настоящему изобретению, или можно конвертировать в кДНК и амплифицировать путем ОТ-ПЦР.
[0174]
Полученную ДНК, кодирующую фактор, способствующий активации Т-клеток, можно вставлять в экспрессирующий вектор, предпочтительно плазмидный вектор, содержащий функциональный промотор в Т-клетках, либо как есть, либо после добавления подходящего линкера и/или сигнала ядерной транслокации и т.п. Примеры функционального промотора в T-клетках в качестве неограничивающих примеров включают конститутивный промотор SRα, промотор SV40, промотор LTR, промотор CMV (цитомегаловирус), промотор RSV (вирус саркомы Рауса), LTR MoMuLV (вирус саркомы мыши Малоуни), промотор HSV-TK (тимидинкиназа вируса простого герпеса) и т.п. в клетках млекопитающих. Кроме того, промоторы генов, таких как CD3, CD4 и CD8, которые направляют специфическую экспрессию в T-клетках, также можно использовать.
[0175]
мРНК, кодирующую фактор, способствующий активации Т-клеток, можно получать путем транскрипции в мРНК в известной системе транскрипции in vitro, с использованием экспрессирующего вектора, содержащего в качестве матрицы ДНК, кодирующую фактор.
[0176]
1-3-3. Нуклеиновая кислота, кодирующая химерный антигенный рецептор (CAR) или экзогенный T-клеточный рецептор (TCR)
Как указано выше, носитель для доставки нуклеиновой кислоты по настоящему изобретению, инкапсулирующий нуклеиновую кислоту, позволяет осуществлять активацию и/или пролиферацию Т-клеток и доставку нуклеиновой кислоты в Т-клетки одновременно за один этап. Таким образом, инкапсулируя нуклеиновую кислоту, кодирующую CAR или TCR в носитель для доставки нуклеиновой кислоты по настоящему изобретению, этап активации/пролиферации T-клеток и этап переноса генов в T-клетки можно проводить одновременно в одном контейнере.
[0177]
То есть, в одном предпочтительном варианте осуществления, носитель для доставки нуклеиновой кислоты по настоящему изобретению содержит внутри нуклеиновую кислоту, кодирующую CAR или TCR.
[0178]
(a) Нуклеиновая кислота, кодирующая CAR
CAR представляет собой искусственно созданный гибридный белок, содержащий антигенсвязывающий домен (например, scFv) антитела, связанный с Т-клеточным доменом передачи сигнала. CAR характеризуется способностью использовать антигенсвязывающее свойство моноклонального антитела для перенаправления специфичности и чувствительности Т-клеток к выбранной мишени без ограничения по MHC. Неограниченное по MHC распознавание антигена наделяет CAR-экспрессирующие Т-клетки способностью распознавать антигены независимо от процессинга антигена, тем самым обходя основной механизм, при помощи которого опухоль избегает иммунной системы. Кроме того, при экспрессии в Т-клетках CAR преимущественно не димеризуется с α-цепями и β-цепями эндогенного TCR.
[0179]
CAR, который должен быть инкапсулирован в носитель для нуклеиновой кислоты по настоящему изобретению, относится к антигенсвязывающему домену антитела, который может специфически распознавать поверхностные антигены (например, пептид антигена злокачественной опухоли, поверхностный рецептор, демонстрирующий повышенную экспрессию в злокачественных клетках и т.д.), которые должна распознавать целевая T-клетка, внеклеточному шарнирному домену, трансмембранному домену, и внутриклеточному домену для передачи сигнала в Т-клетках.
[0180]
Примеры поверхностных антигенов, специфически распознаваемых антигенсвязывающими доменами, в качестве неограничивающих примеров включают поверхностные рецепторы, демонстрирующие усиленную экспрессию в различных злокачественных опухолях (например, острая лимфоцитарная злокачественная опухоль, альвеолярная рабдомиосаркома, рак мочевого пузыря, рак костей, рак мозга (например, медуллобластома), рак молочной железы, рак ануса, рак анального канала или аноректальный рак, рак глаза, рак межпеченочного желчного протока, рак сустава, рак шейки матки, желчного пузыря или плевры, рак носа, назальной полости или среднего уха, рак полости рта, рак вульвы, хроническая миелогенная злокачественная опухоль, колоректальный рак, рак пищевода, рак шейки матки, фибросаркома, желудочно-кишечная карциноидная опухоль, рак головы и шеи (например, плоскоклеточная карцинома головы и шеи), гипофарингеальный рак, рак почки, рак гортани, лейкоз (например, острый лимфобластный лейкоз, острый лимфоцитарный лейкоз, хронический лимфоцитарный лейкоз, острый миелогенный лейкоз), опухоль жидких тканей, рак печени, рак легких (например, немелкоклеточный рак легких), лимфома (например, лимфома Ходжкина, неходжкинская лимфома, диффузная крупноклеточная B-клеточная лимфома, фолликулярная лимфома), злокачественная мезотелиома, мастоцитома, меланома, множественная миелома, назофарингеальная злокачественная опухоль, рак яичников, рак поджелудочной железы; рак брюшины, сальника и брыжейки; рак глотки, рак предстательной железы, ректальный рак, рак почки, рак кожи, рак тонкого кишечника, рак желудка, рак яичка, рак щитовидной железы, рак мочеточника и т.п.), например, CD19, рецептор EGF, BCMA, CD30, Her2, ROR1, MUC16, CD20, мезотелин, антиген мутации В-клеток, CD123, CD3, специфический мембранный антиген предстательной железы (PSMA), CD33, MUC-1, CD138, CD22, GD2, PD-L1, CEA, хондроитинсульфат протеогликан-4, α-цепь рецептора IL-13, легкая цепь κ IgG, и пептиды антигенов злокачественной опухоли (например, пептиды, полученные из WT1, GPC3, MART-1, gp100, NY-ESO-1, MAGE-A4 и т.д.).
[0181]
Антигенсвязывающий домен, используемый в настоящем изобретении, конкретно не ограничен при условии, что это фрагмент антитела, который может специфически распознавать целевой антиген. Учитывая легкость получения CAR, желательным является одноцепочечное антитело (scFv), в котором вариабельная область легкой цепи и вариабельная область тяжелой цепи связаны через линкерный пептид. Конфигурация вариабельной области легкой цепи и вариабельной области тяжелая цепь в одноцепочечном антителе конкретно не ограничены при условии, что они могут восстанавливать функциональный антигенсвязывающий домен. В основном, они могут быть сконструированы в следующем порядке цепи со стороны N-конца: вариабельная область легкой цепи, линкерный пептид и вариабельная область тяжелой цепи. В качестве линкерного пептида, можно использовать известный линкерный пептид, как правило, используемый для производства одноцепочечных антител. Например, ДНК, кодирующую вариабельную область легкой цепи, и ДНК, кодирующую вариабельную область тяжелой цепи, можно получить путем клонирования генов легкой цепи и генов тяжелой цепи соответственно из антитело-продуцирующих клеток и выполнения ПЦР с использованием их в качестве матриц или т.п., или путем химического синтеза по информации о последовательностях существующих антител. ДНК, кодирующую одноцепочечное антитело, можно получить путем лигирования каждого полученного фрагмента ДНК с ДНК, кодирующей линкерный пептид, при помощи подходящего способа. К N-концевой стороне антигенсвязывающего домена предпочтительно дополнительно добавляют лидерную последовательность, чтобы представить CAR на поверхность T-клетки.
[0182]
В качестве подходящего внеклеточного шарнирного домена и трансмембранного домена, можно использовать домены, полученные из молекул поверхности Т-клетки, как правило, применяемые в соответствующей области техники. Например, они в качестве неограничивающих примеров включают домены, полученные из CD8α и CD28.
[0183]
Примеры домена внутриклеточной передачи сигнала включают, но не ограничиваются указанными, домены с цепью CD3ζ, которые дополнительно имеют костимуляторный мотив, такие как CD28, CD134, CD137, Lck, DAP10, ICOS, 4-1BB, и т.п., между трансмембранным доменом и цепью CD3ζ, которые имеют два и более костимуляторных мотивов и т.п. Любые домены, обычно используемые в соответствующей области техники, можно использовать в комбинации.
[0184]
Информация о последовательностях нуклеиновых кислот, кодирующих внеклеточный шарнирный домен, трансмембранный домен, и домен внутриклеточного сигнала, хорошо известны в соответствующей области техники. Специалисты в данной области могут легко получить фрагменты ДНК, кодирующие каждый домен из T-клеток, на основании такой информации.
ДНК, кодирующую CAR можно получать, связывая при помощи общепринятого способа фрагменты ДНК, соответственно кодирующие таким образом полученные антигенсвязывающий домен, внеклеточный шарнирный домен, трансмембранный домен, и домен внутриклеточной передачи сигнала.
[0185]
Полученную ДНК, кодирующую CAR, можно вставлять в экспрессирующий вектор, предпочтительно плазмидный вектор, содержащий функциональный промотор в Т-клетках, либо как есть, либо после добавления подходящего линкера и/или сигнала ядерной транслокации и т.п. Примеры функционального промотора в T-клетках в качестве неограничивающих примеров включают конститутивный промотор SRα, промотор SV40, промотор LTR, промотор CMV (цитомегаловирус), промотор RSV (вирус саркомы Рауса), LTR MoMuLV (вирус саркомы мыши Малоуни), промотор HSV-TK (тимидинкиназа вируса простого герпеса) и т.п. в клетках млекопитающих. Кроме того, промоторы генов, таких как CD3, CD4 и CD8, которые направляют специфическую экспрессию в T-клетках, также можно использовать.
[0186]
РНК, кодирующую CAR, предпочтительно мРНК, можно получать путем транскрипции в мРНК в известной системе транскрипции in vitro, с использованием экспрессирующего вектора, содержащего в качестве матрицы ДНК, кодирующую указанный выше CAR.
[0187]
(b) Нуклеиновая кислота, кодирующая экзогенный TCR
В настоящем описании «T-клеточный рецептор (TCR)» означает рецептор, который состоит из димеров цепи TCR (α-цепь, β-цепь) и распознает антиген или антиген-HLA (лейкоцитарный антиген человека) (MHC; главный комплекс гистосовместимости) и передает стимулирующий сигнал Т-клеткам. Каждая цепь TCR состоит из вариабельной области и константной области, и вариабельная область содержит три определяющие комплементарность области (CDR1, CDR2, CDR3). TCR, используемый в настоящем изобретении, относится не только к тем рецепторам, в которых α и β цепи TCR составляют гетеродимер, но также и к тем, в которых они составляют гомодимер. Кроме того, TCR включает те рецепторы, у которых удалена часть или все константные области, те, которые имеют рекомбинированную последовательность аминокислот, и те, которые содержат растворимый TCR и т.п.
«Экзогенный TCR» означает являющийся экзогенным для T-клетки, которая представляет собой клетку-мишень для носителя для доставки нуклеиновой кислоты по настоящему изобретению. Аминокислотная последовательность экзогенного TCR может быть такой же, как и аминокислотная последовательность эндогенного TCR, экспрессируемого T-клеткой, которая представляет собой клетку-мишень для носителя для доставки нуклеиновой кислоты по настоящему изобретению.
[0188]
Нуклеиновая кислота, кодирующая TCR и инкапсулированная в носитель для доставки нуклеиновой кислоты по изобретению, представляет собой нуклеиновую кислоту, кодирующую α-цепь и β-цепь TCR, которые могут специфически распознавать поверхностные антигены (пептид антигена злокачественной опухоли и т.д.), которые должны распознаваться при помощи целевой Т-клетки.
Нуклеиновую кислоту можно получать хорошо известным способом. Если известны аминокислотная последовательность или последовательность нуклеиновой кислоты желаемого TCR, можно сконструировать ДНК, кодирующую полноразмерный TCR или часть TCR по настоящему изобретению, на основе последовательности, например, путем химического синтеза цепи ДНК или цепи РНК или соединения синтезированной, частично перекрывающейся короткой цепи олиго-ДНК посредством способа ПЦР или способа сборки Гибсона.
[0189]
Когда, например, последовательность желаемого TCR неизвестна, интересующую T-клетку выделяют из популяции клеток, содержащих T-клетку, экспрессирующую интересующий TCR, и нуклеиновую кислоту, кодирующую TCR, можно получать из T-клетки. Конкретно, клеточную популяцию (например, PBMC), содержащую T-клетки, собирают из живого организма (например, человека), клеточную популяцию культивируют в присутствии эпитопов антигенов клеточной поверхности, распознаваемых интересующим TCR при стимуляции клеточной популяции, и T-клетку, которая специфически распознает клетки, экспрессирующие антиген клеточной поверхности, можно выбирать из клеточной популяции известным способом, используя в качестве показателей специфичность к клеткам, экспрессирующим антиген клеточной поверхности, и антигены клеточной поверхности, такие как CD8 и CD4. Специфичность клеток, экспрессирующих антиген клеточной поверхности T-клеток, можно измерять, например, с помощью анализа Dextromer, анализа ELISPOT, цитотоксического анализа и т.п. Вышеуказанную клеточную популяцию, содержащую T-клетки, обычно собирают, например, из организма, имеющего большое количество клеток, экспрессирующих антиген клеточной поверхности, распознаваемый интересующим TCR (например, у пациента с заболеванием, таким как злокачественная опухоль, или из популяции, содержащей T-клетки, контактировавшей с эпитопом антигена или дендритными клетками, обработанными эпитопом).
[0190]
Нуклеиновая кислота по настоящему изобретению может быть получена путем выделения ДНК из указанной выше выделенной Т-клетки общепринятым способом, амплификацией и клонированием генов TCR на основе последовательности нуклеиновой кислоты константной области TCR с использованием ДНК в качестве матрицы. Ее также можно получить, выделяя РНК из клетки и синтезируя кДНК общепринятым способом, и проводя 5'-RACE (быструю амплификацию концов кДНК) с кДНК в качестве матриц с использованием антисмысловых праймеров, комплементарных нуклеиновым кислотам, соответственно кодирующим константные области α-цепи и β-цепи TCR. 5'-RACE можно проводить известными способами, например, используя коммерчески доступный набор, такой как SMART PCR cDNA Synthesis Kit (производится Clontech). ДНК, кодирующую α-цепь и β-цепь полученного TCR, можно вставлять в соответствующий экспрессирующий вектор таким же образом, как ДНК, кодирующую указанный выше CAR. ДНК, кодирующая α-цепь и ДНК, кодирующая β-цепь, может быть вставлена в тот же вектор или в отдельные векторы. При вставке в один и тот же вектор, экспрессирующий вектор может экспрессировать обе цепи полицистронным или моноцистронным образом. В первом случае между ДНК, кодирующими обе цепи, вставляется промежуточная последовательность, которая допускает полицистронную экспрессию, такая как IRES или FMV 2A.
Кроме того, РНК, кодирующую каждую нить TCR, предпочтительно мРНК, можно получать таким же образом, как вышеуказанную РНК, кодирующую CAR, например, используя экспрессирующий вектор в качестве матрицы.
[0191]
1-4. Лиганд, нацеленный на Т-клетку
Носитель для доставки нуклеиновой кислоты по настоящему изобретению желательно использовать для активации и/или пролиферации T-клеток предпочтительно ex vivo. Также включен вариант осуществления введения индивидууму in vivo. В этом случае лиганд, способный нацеливать носитель для доставки нуклеиновой кислоты к T-клеткам (также обозначаемый в настоящем документе, как «лиганд, нацеленный на Т-клетку»), дополнительно добавляют на поверхность носителя для доставки нуклеиновой кислоты по настоящему изобретению, благодаря чему может быть увеличена эффективность нацеливания на Т-клетки.
[0192]
Лиганд, нацеленный на Т-клетку, конкретно не ограничен при условии, что он может специфически распознавать поверхностные молекулы, которые специфически или высоко экспрессируются в Т-клетках. Предпочтительно, он включает лиганд, содержащий антигенсвязывающий домен антитела против CD3, CD4 или CD8, более предпочтительно, антитела к CD3. Здесь «антигенсвязывающий домен» является синонимом антигенсвязывающего домена, который составляет указанный выше CAR. Однако, поскольку CAR необходимо получать в виде нуклеиновой кислоты, кодирующей его, возникают ограничения, и, в основном, во многих случаях используют одноцепочечные антитела. Поскольку антигенсвязывающий домен в качестве лиганда, нацеленного на Т-клетку содержится в липидных наночастицах по настоящему изобретению в состоянии белка, предпочтительно также можно использовать не только одноцепочечные антитела, но и любые другие фрагменты антител, такие как молекулы полного антитела, Fab, F(ab')2, Fab', Fv, восстановленное антитело (rIgG), dsFv, sFv, диатело, триотело и т.п. Эти фрагменты антител можно получить, обработав полное антитело (например, IgG) восстановительным агентом (например, 2-меркаптоэтанолом, дитиотрейтолом) или пептидазой (например, папаином, пепсином, фицином), или используя способ генетической рекомбинации.
[0193]
Когда лиганд, нацеленный на Т-клетку, представляет собой молекулу полного антитела, можно использовать коммерчески доступные антитела к CD3, CD4, CD8 и т.д., или лиганд может быть выделен из культуры клеток, продуцирующих антитело. С другой стороны, когда лиганд представляет собой любой из указанных выше антигенсвязывающих доменов (фрагмент антитела), нуклеиновую кислоту, кодирующую антигенсвязывающий домен, такой как в антителах к CD3, CD4, CD8 и т.д., выделяют таким же образом, как и нуклеиновую кислоту кодирующую антигенсвязывающий домен, составляющий указанный CAR, и антигенсвязывающий домен может быть рекомбинантно получен с использованием того же самого способа.
[0194]
2. Получение носителя для доставки нуклеиновой кислоты по настоящему изобретению
В качестве типичного примера носителя для доставки нуклеиновой кислоты по настоящему изобретению ниже объяснен пример получения носителя для доставки нуклеиновой кислоты по настоящему изобретению с использованием в качестве носителя липидных наночастиц (далее в настоящем документе также обозначаемых как «липидные наночастицы по настоящему изобретению»). Даже когда применяют другие носители, такие как липосомы и т.п., носитель для доставки нуклеиновой кислоты по настоящему изобретению можно получить таким же образом, соответствующим образом внося изменения в соответствии с используемым носителем.
[0195]
Липидные наночастицы по настоящему изобретению можно получить, например, путем образования липидных наночастиц способом, описанным в US9404127, и химически связывая лиганд, активирующий Т-клетку. Альтернативно, как описано в WO 2016/021683, например, получают раствор органического растворителя, растворяющего катионный липид и некатионный липид, для получения липидных наночастиц раствор органического растворителя смешивают с водой или буферным раствором, растворяющим нуклеиновую кислоту, которая инкапсулируется в липидные наночастицы, и химически связывают лиганд, активирующий Т-клетку (дополнительно, лиганд, нацеленный на Т-клетку, по мере необходимости, когда липидные наночастицы по настоящему изобретению применяют in vivo), тем самым получая липидные наночастицы. Коэффициент смешения (молярное соотношение) катионного липида, фосфолипида, холестерина и ПЭГ-липида составляет, например, от 40 до 60:0, до 20:0,до 50:0, до 5, но это соотношение не ограничивается этим. Когда ПЭГ-липид смешивают в качестве некатионного липида и активирующий Т-клетку лиганд добавляют к концу ПЭГ, коэффициент смешения (молярное соотношение) ПЭГ-липида и лиганда может быть, например, от 20:1 до 1:20. Указанный выше ПЭГ-липид может содержать концевой реактивный ПЭГ в соотношении (моль%) приблизительно от 10% до приблизительно 100%. Вышеуказанное смешивание можно проводить с помощью пипетки, микрожидкостной системы смешивания (например, Asia microfluidic system (Syrris)). Полученные липидные частицы могут подвергаться очистке гель-фильтрацией, диализом или стерильной фильтрацией.
Концентрация общего липидного компонента в растворе органического растворителя составляет предпочтительно от 0,5 до 100 мг/мл.
[0196]
В качестве органического растворителя, например, можно использовать метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, трет-бутанол, ацетон, ацетонитрил, N, N-диметилформамид, диметилсульфоксид или их смесь. Органический растворитель может содержать от 0 до 20% воды или буферного раствора. В качестве буферного раствора можно перечислить кислотные буферные растворы (например, ацетатный буферный раствор, цитратный буферный раствор) или нейтральные буферные растворы (например, 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота, (HEPE) буферный раствор, трис(гидроксиметил)аминометан(Трис) буфер, фосфатный буфер, фосфатно-солевой буфер (PBS)).
[0197]
В случае, если для смешивания используется микрожидкостная система, предпочтение отдается смешиванию 1 объемной части раствора органического растворителя с 1-5 объемными частями воды или буферного раствора. Кроме того, в указанной системе, скорость потока смеси (смеси раствора органического растворителя и воды или буферного раствора) предпочтительно составляет от 0,1 до 10 мл/мин, и температура предпочтительно составляет от 15 до 45°C.
[0198]
Когда получают дисперсию липидных частиц, как описано выше, дисперсия, содержащая катионный липид, некатионный липид, нуклеиновую кислоту и лиганд, активирующий Т-клетку, может быть получена путем добавления нуклеиновой кислоты, которая инкапсулируется в липидные наночастицы в водном буфере. Предпочтительным является добавление нуклеиновой кислоты в воде или буферном растворе в концентрации от 0,05 до 2,0 мг/мл.
Кроме того, липидную наночастицу также можно получать, смешивая дисперсию липидных частиц с нуклеиновой кислотой хорошо известным способом.
В липидной наночастице по настоящему изобретению содержание нуклеиновой кислоты составляет предпочтительно 1-20% масс. Содержимое можно измерить с помощью Quant-iTTMRibogreen® (Invitrogen). В липидной наночастице по настоящему изобретению коэффициент инкапсуляции нуклеиновой кислоты можно рассчитать на основе разницы в интенсивности флуоресценции в присутствии или отсутствии добавления поверхностно-активного вещества (например, Triton-X100).
[0199]
Диспергирующая среда может быть заменена водой или буферным раствором путем диализа. Для диализа, применяют мембрану для ультрафильтрации с порогом молекулярной массы от 10 до 20K и проводят при температуре от 4°C до комнатной. Диализ можно проводить повторно. Для диализа можно использовать тангенциальную фильтрацию потока.
[0200]
Соотношение (массовое отношение) нуклеиновой кислоты и липида в липидных наночастицах по настоящему изобретению, полученных как указано выше, составляет приблизительно от 0,01 до приблизительно 0,2.
[0201]
Средний размер частиц липидной наночастицы по настоящему изобретению составляет примерно от 10 до 200 нм. Средний размер частиц у липидных частиц можно рассчитать с помощью, например, Zetasizer Nano ZS (Malvern Instruments) по кумулянтному анализу автокорреляционной функции.
[0202]
3. Способ активации/пролиферации T-клеткок, способ доставки нуклеиновой кислоты в T-клетки, и способ получения лекарственного средства, содержащего T-клетки, с использованием лиганда, активирующего Т-клетку, и носителя для доставки нуклеиновой кислоты
Настоящее изобретение также относится к способу активации и/или пролиферации T-клеток с использованием носителя для доставки нуклеиновой кислоты по настоящему изобретению, полученного, как указано выше (в настоящем документе также обозначаемого как «способ активации/пролиферации по настоящему изобретению»). Способ включает этап контактирования клеточной популяции, содержащей Т-клетки, с носителем для доставки нуклеиновой кислоты по настоящему изобретению. Как применяют в настоящем документе, T-клетка может быть T-клеткой, полученной из живого организма (также обозначаемой в настоящем описании как «T-клетка ex vivo»), или T-клеткой в живом организме (также обозначаемой в настоящем описании как «T-клетка in vivo»), причем предпочтение отдается T-клетке ex vivo.
[0203]
В отличающемся аспекте, когда носитель для доставки нуклеиновой кислоты по настоящему изобретению содержит нуклеиновую кислоту внутри, способ активации/пролиферации по настоящему изобретению может одновременно доставлять нуклеиновую кислоту в Т-клетки. Таким образом, настоящее изобретение также относится к способу доставки нуклеиновой кислоты в Т-клетки, включающему этап контактирования клеточной популяции, содержащей Т-клетки, с носителем для доставки нуклеиновой кислоты по настоящему изобретению. В другом варианте осуществления настоящее изобретение относится к способу доставки нуклеиновой кислоты в T-клетки, включающему этап контактирования клеточной популяции, содержащей T-клетки, одновременно, по меньшей мере, с одним видом лиганда, активирующего Т-клетку, и любым из вышеуказанных носителей для доставки нуклеиновой кислоты, без лиганда, активирующего Т-клетку, добавленного на поверхность (далее в настоящем документе вышеуказанные два варианта осуществления также совместно обозначаются как «способ доставки нуклеиновой кислоты по настоящему изобретению»). В настоящем описании, когда используют свободный лиганд, активирующий Т-клетку, который не связан с носителем для доставки нуклеиновой кислоты, лиганд можно использовать отдельно или в виде комплекса, в котором лиганд связан с носителем (например, Dynabeads (R) (компания Thermo Fisher Scientific)). В качестве такого комплекса, также можно использовать коммерчески доступный продукт (например, TransAct (компания Milteny Biotech), Dynabeads Human T-Activator CD3/CD28 (компания ThermoFisher Scientific)).
[0204]
В другом отличающемся аспекте T-клетки активированы и/или пролиферируют с использованием носителя для доставки нуклеиновой кислоты по настоящему изобретению, или T-клетки, в которые доставляют нуклеиновую кислоту, можно использовать в качестве агента для иммунной клеточной терапии. Таким образом, настоящее изобретение также относится к способу получения лекарственного средства, содержащего Т-клетки, включающему этап контактирования клеточной популяции, содержащей Т-клетки, с носителем для доставки нуклеиновой кислоты по настоящему изобретению. В другом варианте осуществления настоящее изобретение относится к способу получения лекарственного средства, содержащего Т-клетки, включающему этап контактирования клеточной популяции, содержащей Т-клетки, одновременно, по меньшей мере, с одним видом лиганда, активирующего Т-клетку и любым из вышеуказанных носителей для доставки нуклеиновой кислоты, без лиганда, активирующего Т-клетку, добавленного на поверхность.
[0205]
Популяция клеток, содержащая Т-клетки, которая должна контактировать с носителем для нуклеиновой кислоты по настоящему изобретению, или лигандом, активирующим Т-клетку, и носителем для нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, может быть изолированной T-клеткой или, например, неоднородной клеточной популяцией, такой как клетки-предшественники лимфоцитов, включая лимфоциты и плюрипотентные клетки, при условии, что это клеточная популяция, содержащая T-клетку или ее клетку-предшественник. В настоящем изобретении, «лимфоцит» означает один из подтипов лейкоцита в иммунной системе позвоночных. Примеры лимфоцита включают T-клетку, B-клетку, клетку-естественного киллера (NK-клетка), предпочтительно, изолированную и очищенную T-клетку. В настоящем изобретении «Т-клетка» является одним из типов лейкоцитов, обнаруженных в лимфатических органах, периферической крови и т.п., и относится к одной категории лимфоцитов, характеризующихся дифференцировкой и созреванием, в основном в тимусе, и экспрессией TCR. . Примеры T-клетки, которую можно использовать в настоящем изобретении, включают цитотоксическую T-клетку (CTL), которая представляет собой CD8-положительную клетку, хелперную T-клетку, которая представляет собой CD4-положительную клетку, регуляторную T-клетку и эффекторную T-клетку, и предпочтительно, цитотоксическую T-клетку.
[0206]
Вышеуказанный лимфоцит может быть получен, например, из периферической крови, костного мозга и крови пуповины человека или не относящегося к человеку млекопитающего. Когда T-клетку ex vivo, контактировавшую с носителем для доставки нуклеиновой кислоты по настоящему изобретению, применяют для лечения заболеваний, таких как злокачественная опухоль, клеточную популяцию предпочтительно собирают у человека, которого нужно лечить, или у донора с типом HLA, совпадающим с типом HLA у индивидуума, подлежащего лечению.
[0207]
Популяция клеток, содержащая Т-клетки, которая должна контактировать с носителем для доставки нуклеиновой кислоты по настоящему изобретению, или лигандом, активирующим Т-клетку, и носителем для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, может быть клеточной популяцией Т-клеток, полученных индукцией дифференцировки из клеток-предшественников лимфоцитов, содержащих плюрипотентные клетки. Примеры лимфоцитарной клетки-предшественника, в том числе плюрипотентной клетки, включают эмбриональную стволовую клетку (ES-клетка), индуцированную плюрипотентную стволовую клетку (iPS-клетку), эмбриональную злокачественную клетку (ECC), эмбриональную половую клетку (EG-клетку), гематопоэтическую стволовую клетку, клетку-предшественника, утратившую потенциал самоподдержания (мультипотентный предшественник: MMP), общую миелолимфоидную клетку-предшественника (MLP), миелоидную клетку-предшественника (MP), клетку-предшественника мононуклеарных гранулоцитов (GMP), макрофаг-дендритную клетку-предшественника (MDP), клетку-предшественника дендритных клеток (DCP) и т.п. Недифференцированные клетки, такие как плюрипотентная клетка и т.п., можно дифференцировать в T-клетку с помощью хорошо известного способа.
[0208]
Нет конкретных ограничений по способу контакта носителя для доставки нуклеиновой кислоты по настоящему изобретению или лиганда, активирующего Т-клетку, и носителя для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность с Т-клетками ex vivo, и, например, носитель для доставки нуклеиновой кислоты по настоящему изобретению, или лиганд, активирующий Т-клетку, и носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, можно добавлять в типичную среду для T-клеток. Таким образом, в другом аспекте настоящее изобретение также относится к клеточной культуре, содержащей клеточную популяцию, содержащую T-клетки, носитель для доставки нуклеиновой кислоты по настоящему изобретению, или, по меньшей мере, один из видов лиганда, активирующего Т-клетку, и носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, и среду.
В способе доставки нуклеиновой кислоты по настоящему изобретению для повышения эффективности доставки нуклеиновой кислоты можно использовать в комбинации, например, способ со-осаждения с фосфатом кальция, способ с ПЭГ, способ электропорации, способ микроинъекции, способ липофекции и т.п.
[0209]
В способе доставки нуклеиновой кислоты по настоящему изобретению, когда носитель для доставки нуклеиновой кислоты по настоящему изобретению, или носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, в частности, внутри содержит нуклеиновую кислоту, кодирующую экзогенный TCR, экспрессия α-цепи и β-цепи эндогенного TCR, которые по своей природе экспрессируются T-клеткой, может подавляться миРНК с точки зрения увеличения экспрессии экзогенного TCR, ингибирования появления ошибочно спаренных TCR или ингибирования самореактивности. Когда в способе используют вышеуказанную нуклеиновую кислоту, чтобы избежать воздействия миРНК на экзогенный TCR, базовая последовательность нуклеиновой кислоты, кодирующая TCR, является предпочтительно последовательностью (последовательность с преобразованием кодонов), отличающейся от базовой последовательности, соответствующей РНК, на которую воздействует миРНК, подавляющая экспрессию эндогенных цепей TCRα и TCRβ. Способ для этого описан, например, в WO 2008/153029. Вышеуказанную базовую последовательность можно получать путем введения молчащей мутации в полученную естественным путем нуклеиновую кислоту, кодирующую TCR, или путем химического синтеза искусственно созданной нуклеиновой кислоты. Альтернативно, чтобы избежать ошибочного спаривания с эндогенной цепью TCR, часть или все константные области нуклеиновой кислоты, кодирующая экзогенная TCR могут быть заменены константной областью, полученной от животного, отличного от человека, например, мыши.
Альтернативно, как указано выше, эндогенный ген TCR также может быть отключен с использованием способа редактирования геномов.
[0210]
4. Система доставки нуклеиновой кислоты, содержащая в комбинации, по меньшей мере, один тип лиганда, активирующего Т-клетку, носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность
Как указано выше, нуклеиновая кислота может быть доставлена в Т-клетки путем взаимодействия клеточной популяции, содержащей Т-клетки, одновременно, по меньшей мере, с одним из типов лиганда, активирующего Т-клетку, и носителем для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность. Таким образом, изобретение также относится к системе доставки нуклеиновой кислоты, содержащей в комбинации, по меньшей мере, один тип лиганда, активирующего Т-клетку, и носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность. В системе доставки нуклеиновой кислоты лиганд, активирующий Т-клетку, и носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, могут быть представлены в виде композиции, содержащей оба компонента, или в форме набора, содержащего их как отдельные компоненты. В дополнение к указанным выше обоим компонентам набор для доставки нуклеиновой кислоты может дополнительно содержать, например, среду, которая будет использоваться для контактирования клеточной популяции, содержащей Т-клетки, с такими компонентами и т.п., хотя и не ограничивается этим.
[0211]
5. Лекарственное средство, содержащее Т-клетки ex vivo , которые были активированы или пролиферируют за счет лиганда, активирующего Т-клетку, и носителя для доставки нуклеиновой кислоты, или в которые была доставлена нуклеиновая кислота
Настоящее изобретение также относится к T-клеткам ex vivo, активированным и/или пролиферирующим за счет способа активации/пролиферации по настоящему изобретению, к T-клеткам ex vivo, имеющим нуклеиновую кислоту, доставляемую способом доставки нуклеиновой кислоты по настоящему изобретению (включая клеточную культуру, содержащую среду), и к содержащему их лекарственному средству.
[0212]
Т-клетки ex vivo, активированные и/или пролиферирующие посредством способа активации/пролиферации по настоящему изобретению специфически распознают клетки, экспрессирующие поверхностный антиген, специфически распознаваемый TCR, экспрессируемым в Т-клетках, и убивают их (например, индукцией апоптоза). Кроме того, Т-клетки ex vivo, в которые доставлена нуклеиновая кислота, кодирующая CAR или экзогенный TCR, при помощи способа доставки нуклеиновой кислоты по настоящему изобретению, экспрессируют CAR или экзогенный TCR, специфически распознают клетки, экспрессирующие поверхностный антиген, специфически распознаваемый CAR или экзогенным TCR и могут убить их (например, индукцией апоптоза). Таким образом, активируются и/или пролиферируют Т-клетки ex vivo, среди которых Т-клетки, экспрессирующие TCR, распознают поверхностную молекулу, которая специфически экспрессируется как поверхностный антиген или проявляет повышенную экспрессию в больных клетках, таких как злокачественная клетка и т.п., и Т-клетки ex vivo, в которые введена нуклеиновая кислота, кодирующая CAR или экзогенный TCR, который распознает поверхностную молекулу, можно использовать для профилактики или лечения заболеваний, таких как злокачественная опухоль и т.п. и можно безопасно вводить млекопитающим (человеку или другому млекопитающему (например, мыши, крысе, хомяку, кролику, кошке, собаке, быку, овце, обезьяне, предпочтительно человеку)).
[0213]
В лекарственном средстве, содержащем в качестве активного ингредиента Т-клетки ex vivo, контактировавшие с носителем для доставки нуклеиновой кислоты по настоящему изобретению, или лигандом, активирующим Т-клетку, и носителем для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, Т-клетки можно культивировать с использованием подходящей среды перед введением индивидууму. Кроме того, активацию и/или пролиферацию Т-клеток также можно поддерживать или продлевать путем добавления в среду стимулирующих молекул. Кроме того, можно добавлять в среду сыворотку или плазму. Хотя количество добавок к этим средам конкретно не ограничено, можно указать 0% по объему - 20% по объему. Кроме того, количество используемой сыворотки или плазмы может быть изменено в зависимости от этапа культивирования. Например, концентрацию сыворотки или плазмы можно поэтапно снижать. Происхождение сыворотки или плазмы может быть аутологичным или неаутологичным, причем аутологичное является предпочтительным с точки зрения безопасности.
[0214]
Лекарственное средство, содержащее в качестве активного ингредиента Т-клетки ex vivo, контактировавшие с носителем для доставки нуклеиновой кислоты по настоящему изобретению, или лигандом, активирующим Т-клетку, и носителем для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, предпочтительно используют для парентерального введения индивидууму. Примеры способов парентерального введения включают внутривенное, внутриартериальное, внутримышечное, интраперитонеальное и подкожное введение и т.п. Хотя дозу соответствующим образом подбирают в соответствии с состоянием, массой тела, возрастом и т.п. индивидуума, лекарственное средство в основном вводят так, что число клеток в основном составляет 1×106-1×1010 клеток, предпочтительно 1×107-1×109 клеток, более предпочтительно 5×107-5×108 клеток на дозу индивидууму с массой тела 60 кг. Лекарственное средство можно вводить один раз или несколькими частями. Лекарственное средство, содержащее в качестве активного ингредиента Т-клетки ex vivo, контактировавшие с носителем для доставки нуклеиновой кислоты по настоящему изобретению, можно формулировать в известной форме, подходящей для парентерального введения, например, средства для инъекции или инфузии. Лекарственное средство по настоящему изобретению содержит при необходимости фармакологически приемлемые эксципиенты. Фармакологически приемлемый эксципиент включает эксципиенты, описанные выше. Лекарственное средство может содержать физиологический раствор, фосфатно-солевой буфер (PBS), среду и т.п. для поддержания стабильности клеток. Примеры среды в качестве неограничивающих примеров включают среды, такие как RPMI, AIM-V, X-VIVO10 и т.п. Лекарственное средство может быть дополнено фармацевтически приемлемым носителем (например, сывороточным альбумином человека), консервантом и т.п. для стабилизации.
[0215]
Лекарственное средство, содержащее в качестве активного ингредиента Т-клетки ex vivo, контактировавшие с носителем для доставки нуклеиновой кислоты по настоящему изобретению, или лигандом, активирующим Т-клетку, и носителем для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность может быть профилактическим или терапевтическим лекарственным средством для злокачественной опухоли. Злокачественная опухоль, которая является мишенью для применения лекарственного средства по настоящему изобретению, конкретно не ограничена. Примеры злокачественных опухолей в качестве неограничивающих примеров включают острую лимфоцитарную злокачественную опухоль, альвеолярную рабдомиосаркому, рак мочевого пузыря, рак костей, рак мозга (например, медуллобластома), рак молочной железы, рак ануса, рак анального канала или аноректальный рак, рак глаза, рак межпеченочного желчного протока, рак сустава, рак шейки матки, желчного пузыря или плевры, рак носа, назальной полости или среднего уха, рак полости рта, рак вульвы, хроническую миелогенную злокачественную опухоль, колоректальный рак, рак пищевода, рак шейки матки, фибросаркома, желудочно-кишечную карциноидную опухоль, рак головы и шеи (например, плоскоклеточная карцинома головы и шеи), гипофарингеальный рак, рак почки, рак гортани, лейкоз (например, острый лимфобластный лейкоз, острый лимфоцитарный лейкоз, хронический лимфоцитарный лейкоз, острый миелогенный лейкоз), опухоль жидких тканей, рак печени, рак легких (например, немелкоклеточный рак легких), лимфому (например, лимфома Ходжкина, неходжкинская лимфома, диффузная крупноклеточная B-клеточная лимфома, фолликулярная лимфома), злокачественную мезотелиому, мастоцитому, меланому, множественную миелому, назофарингеальную злокачественную опухоль, рак яичников, рак поджелудочной железы; рак брюшины, сальника и брыжейки; рак глотки, рак предстательной железы, ректальный рак, рак почки, рак кожи, рак тонкого кишечника, рак желудка, рак яичка, рак щитовидной железы, рак мочеточника и т.п.
[0216]
6. Лекарственное средство, содержащее носитель для доставки нуклеиновой кислоты по настоящему изобретению
Носитель для доставки нуклеиновой кислоты по настоящему изобретению может вызывать активацию и/или пролиферацию Т-клеток в живых организмах путем введения in vivo млекопитающим, таким как человек и т.п. Кроме того, путем введения in vivo носителя для доставки нуклеиновой кислоты по настоящему изобретению, содержащего внутри нуклеиновую кислоту, кодирующую CAR или экзогенный TCR, млекопитающим, таким как человек и т.п., нуклеиновая кислота доставляется и экспрессируется в Т-клетках в живом организме, что в свою очередь придает Т-клеткам способность специфически распознавать клетки (например, злокачественные клетки), экспрессирующие поверхностный антиген (например, антиген злокачественной опухоли), специфически распознаваемый CAR или экзогенным TCR, и убивать их (например, индукцией апоптоза). Таким образом, настоящее изобретение также относится к лекарственному средству, содержащему носитель для доставки нуклеиновой кислоты по настоящему изобретению.
[0217]
Лекарственное средство, содержащее носитель для доставки нуклеиновой кислоты по настоящему изобретению, обычно получают в виде фармацевтической композиции путем смешивания носителя для доставки нуклеиновой кислоты с известными фармацевтически приемлемыми носителями (включая эксципиент, разбавитель, наполнитель, связывающее средство, смазочное средство, добавка для повышения текучести, дезинтегрант, поверхностно-активное вещество и т.п.) и общепринятые добавки, и т.п. Эксципиенты хорошо известны специалистам в данной области и включают, например, фосфатно-солевой буфер (например, 0,01M фосфат, 0,138M NaCl, 0,0027M KCl, pH 7,4), водные растворы, содержащие минеральную кислую соль, такую как гидрохлорид, гидробромат, фосфат, сульфат, и т.п., физиологические растворы, растворы гликоля, этанола, и т.п., и соль органических кислот, такую как ацетат, пропионат, малонат, бензоат, и т.п. Кроме того, также можно использовать такие адъюванты, как увлажнитель или эмульгатор и средства для буферирования pH. Кроме того, также можно использовать препараты адъювантов, такие как средство для суспендирования, консервант, стабилизатор и диспергирующее средство. Альтернативно, вышеуказанная фармацевтическая композиция может быть в сухой форме, которую перед использованием разбавляют подходящей стерильной жидкостью. Фармацевтическая композиция может вводиться перорально или парентерально системно или местно, в зависимости от формы, в которой она принимается (пероральные агенты, такие как таблетка, пилюля, капсула, порошок, гранула, сироп, эмульсия, суспензия и т.п ; парентеральные агенты, такие как инъекции, капельное вливание, препарат для наружного применения, суппозиторий и т.п.). Для парентерального введения доступны внутривенное введение, интрадермальное введение, подкожное введение, ректальное введение, трансдермальное введение и т.п. При использовании в инъекционной форме также можно добавлять буферное средство, солюбилизатор, средство для придания изотоничности и т.п.
[0218]
Дозировка лекарственного средства по настоящему изобретению, содержащего носитель для доставки нуклеиновой кислоты по настоящему изобретению, находится, например, в диапазоне от 0,001 мг до 10 мг в виде количества нуклеиновой кислоты, кодирующей CAR или экзогенный TCR, на 1 кг массы тела на дозу. Например, при введении пациенту-человеку, дозировка составляет в диапазоне от 0,0001 до 50 мг для пациента с массой тела 60 кг. Вышеуказанная дозировка является примером, и дозировка может быть соответствующим образом выбрана в соответствии с типом используемой нуклеиновой кислоты, способом введения, возрастом, массой, симптомами и т.д. индивидуума для введения или пациента.
[0219]
За счет введения млекопитающему (например, человеку или другому млекопитающему (например, мыши, крысе, хомяку, кролику, кошке, собаке, быку, овце, обезьяне), предпочтительно, человеку)), лекарственное средство, содержащее носитель для доставки нуклеиновой кислоты по настоящему изобретению, может индуцировать экспрессию CAR или экзогенного TCR в T-клетке (T-клетка in vivo) в организме животного. Т-клетки in vivo убивают пораженные клетки, такие как злокачественные клетки и т.п., экспрессирующие поверхностностный антиген, на который нацелен CAR или экзогенный TCR, тем самым демонстрируя профилактический или терапевтический эффект против заболевания.
[0220]
Лекарственное средство, содержащее носитель для доставки нуклеиновой кислоты по настоящему изобретению может быть профилактическим или терапевтическим лекарственным средством для злокачественной опухоли. Злокачественная опухоль, которая является мишенью для применения лекарственного средства по настоящему изобретению, конкретно не ограничена. Примеры злокачественных опухолей в качестве неограничивающих примеров включают острую лимфоцитарную злокачественную опухоль, альвеолярную рабдомиосаркому, рак мочевого пузыря, рак костей, рак мозга (например, медуллобластома), рак молочной железы, рак ануса, рак анального канала или аноректальный рак, рак глаза, рак межпеченочного желчного протока, рак сустава, рак шейки матки, желчного пузыря или плевры, рак носа, назальной полости или среднего уха, рак полости рта, рак вульвы, хроническую миелогенную злокачественную опухоль, колоректальный рак, рак пищевода, рак шейки матки, фибросаркома, желудочно-кишечную карциноидную опухоль, рак головы и шеи (например, плоскоклеточная карцинома головы и шеи), гипофарингеальный рак, рак почки, рак гортани, лейкоз (например, острый лимфобластный лейкоз, острый лимфоцитарный лейкоз, хронический лимфоцитарный лейкоз, острый миелогенный лейкоз), опухоль жидких тканей, рак печени, рак легких (например, немелкоклеточный рак легких), лимфому (например, лимфома Ходжкина, неходжкинская лимфома, диффузная крупноклеточная B-клеточная лимфома, фолликулярная лимфома), злокачественную мезотелиому, мастоцитому, меланому, множественную миелому, назофарингеальную злокачественную опухоль, рак яичников, рак поджелудочной железы; рак брюшины, сальника и брыжейки; рак глотки, рак предстательной железы, ректальный рак, рак почки, рак кожи, рак тонкого кишечника, рак желудка, рак яичка, рак щитовидной железы, рак мочеточника и т.п.
[0221]
Настоящее изобретение объясняется более подробно ниже со ссылкой на Примеры, которые являются простыми примерами и не ограничивают настоящее изобретение.
[Примеры]
[0222]
1. Восстановительная обработка антитела
Растворы антитела к CD3 и антитела к CD28 9,21 мг/мл (компания Bio X Cell) (каждый 111 мкл) смешивали с водным раствором 10 мМ DTT (12,3 мкл). Смесь каждого антитела и DTT смешивали на вортексе для проведения реакции при комнатной температуре в течение 30 минут. Реакционную смесь фракционировали ВЭЖХ (колонка: TSKgel G2000SWXL 7,8 мм × 30 см, TOSOH, подвижная фаза: PBS) с получением раствора фракции, содержащей восстановленное антитело. Раствор фракции концентрировали путем ультрафильтрации с использованием Amicon 0,5 мл-10K. Концентрации белка антитела и тиоловой группы в концентратах измеряли по оптической плотности при 230 нм и по флуоресценции колориметрической реакции с N-(7-диметиламино-4-метилкумарин-3-ил)малеинимидом (DACM), соответственно.
[0223]
2. Получение малеинимид-липидных наночастиц
Смесь липидов, содержащая соединения 7, 11, 12, 21, 31 или 35 в виде катионного липида (катионный липид:DPPC:холестерин:SUNBRIGHT GM-020:SUNBRIGHT DSPE-020MA=60:10,6:28:1,4:1, молярное соотношение) растворяли в 90% EtOH, 10% воды с получением 7,0 мг/мл липидного раствора. С другой стороны, мРНК люциферазы (компания TriLink) растворяли в буфере с 2-морфолиноэтансульфоновой кислотой (MES) (pH 5,0) с получением 0,2 мг/мл раствора мРНК. Полученный липидный раствор и раствор мРНК смешивали при комнатной температуре с помощью устройства Nanoassemblr (Precision Nanosystems) при скорости потока 3 мл/мин: 6 мл/мин с получением дисперсии, содержащей композицию. Полученную дисперсию диализовали с использованием Slyde-A-Lyzer (фракция с молекулярной массой 20000, Thermo Scientific) против воды при комнатной температуре в течение 1 часа и против PBS при 4°C в течение 48 часов. Затем, диализат фильтровали через шприц-фильтр 0,2 мкм (Iwaki) и хранили при 4°C.
[0224]
3. Реакция связывания восстановленного антитела и малеинимид-липидных наночастиц
Дисперсию малеинимид-липидных наночастиц смешивали с раствором восстановленного антитела таким образом, чтобы молярное содержание восстановленного антитела составляло 1/20 от молярного содержания малеинимида, и оставляли при комнатной температуре в течение 4 часов. После этого смесь хранили при 4°C до этапа очистки.
[0225]
4. Очистка липидных наночастиц с антителом путем гель-фильтрации
Реакционная смесь восстановленного антитела и малеинимид-липидных наночастиц была загружена в колонку для гель-фильтрации Sepharose CL-4B (Каталожный номер 17-0150-01/GE Healthcare) и фракционирована с D-PBS (-) в качестве подвижной фазы. Затем измеряли концентрацию белка каждой фракции для идентификации фракции, содержащей представляющие интерес липидные наночастицы с антителом, посредством чего получали исходный раствор липидных наночастиц с антителом. Липидные наночастицы с антителом фильтровали через шприц-фильтр 0,2 мкм и хранили при 4°C.
[0226]
5. Измерение размера частиц липидных наночастиц с антителом
К 1 мкл исходного раствора липидных наночастиц с антителом добавляли 99 мкл фосфатно-солевого буфера (137 мМ NaCl, 7,99 мМ Na2HPO4, 2,7 мМ KCl, 1,47 мМ KH2PO4, pH 7,4). Полученная дисперсия была подвергнута измерению динамического светорассеяния с помощью Zetasizer Nano ZS (Malvern instruments) и кумулянтному анализу автокорреляционной функции для измерения среднего размера частиц Z и индекса полидисперсности (PDI).
[0227]
6. Измерение электрического потенциала ζ липидных наночастиц с антителом
К 50 мкл исходного раствора липидных наночастиц с антителом добавляли 700 мкл буфера HEPES (10 мМ HEPES-NaOH, pH 7,3). Полученная дисперсия была подвергнута измерению электрофоретического светорассеяния с использованием Zetasizer Nano ZS (Malvern instruments) для измерения электрического потенциала ζ.
[0228]
7. Измерение уровня инкапсуляции и концентрации мРНК для липидных наночастиц с антителом
Исходный раствор липидных наночастиц с антителом разбавляли буфером TE для коррекции концентрации мРНК приблизительно до 4 мкг/мл. В качестве раствора со стандартом концентрации мРНК, «голую» мРНК разбавляли буфером TE до 4 мкг/мл. Разбавленные липидные наночастицы с антителом и стандартный раствор мРНК (каждый по 60 мкл) смешивали каждый с 60 мкл буфера TE или буфера TE, содержащего 2% Triton-X100. Смеси давали постоять при комнатной температуре в течение 5 минут, смешивали с 120 мкл Quant-iTTM RiboGreen (зарегистрированная торговая марка), и смесь оставляли стоять в течение 5 минут. Интенсивность флуоресценции смеси измеряли с помощью микроспектрофотометра Envision для чтения планшетов (компания Perkin-Elmer). Уровень инкапсуляции мРНК и концентрацию мРНК рассчитывали по следующим формулам.
[0229]
% уровня инкапсуляции мРНК = (1-FTE/FTriton)×100
Концентрация мРНК = (FTритон- b)×d/m
(где FTE показывает интенсивность флуоресценции RiboGreen липидных наночастиц в смеси с буфером TE, FTriton показывает интенсивность флуоресценции RiboGreen липидных наночастиц в смеси с буфером TE, содержащим 2% Triton-X100, b и m показывают y-пересечение и наклон, полученные из калибровочной кривой стандарта концентрации мРНК, и d - степень разведения липидных наночастиц)
[0230]
Список результатов анализа приготовленных липидных наночастиц с антителом показан в последующей таблице.
[0231]
(нм)
(мкг/мл)
[0232]
8. Трансфекция мРНК в первичные культивированные T-клетки человека при помощи липидных наночастиц, связанных с антителом к CD3
CD3-положительные пан-T-клетки периферической крови человека (Precision Bioservices) высевали в круглодонный 96-луночный планшет (Corning) при плотности клеток 1×105 клеток/лунку. В качестве среды использовали не содержащую сыворотку клеточную среду X-VIVO10 для гематопоэтических клеток (Lonza) с добавлением 30 нг/мл рекомбинантного IL-2 (Thermo Fisher Scientific). Затем, к среде добавляли антитело к CD3, связанное с липидными наночастицами, инкапсулирующими мРНК люциферазы (TriLink), так, чтобы концентрация мРНК люциферазы в среде составляла 1 мкг/мл, и смесь оставляли в инкубаторе с 5% CO2 при 37°C в течение 72 часов. Люциферазу, экспрессируемую в T-клетках, измеряли с использованием набора Bright-Glo Luciferase Assay System (Promega). Относительная интенсивность люминесценции люциферазы в Т-клетках, дополненных антителом к CD3-липидной наночастицей, показана на фиг. 1.
[0233]
9. Трансфекция мРНК в первичные культивированные T-клетки человека при помощи липидных наночастиц, связанных с антителом к CD3 и/или антителом к CD28
CD3-положительные пан-T-клетки периферической крови человека (Precision Bioservices) высевали в круглодонный 96-луночный планшет (Corning) при плотности клеток 1×105 клеток/лунку. В качестве среды использовали не содержащую сыворотку клеточную среду X-VIVO10 для гематопоэтических клеток (Lonza) с добавлением 30 нг/мл рекомбинантного IL-2 (Thermo Fisher Scientific). Затем, к среде добавляли антитело к CD3, связанное с липидными наночастицами, инкапсулирующими мРНК люциферазы (TriLink), антитело к CD28, связанное с липидными наночастицами, смесь антитела к CD3, связанного с липидными наночастицами, и антитела к CD28, связанного с липидными наночастицами, и липидные наночастицы, связанные со смесью антител к CD3 и CD28, так, чтобы концентрация мРНК люциферазы в среде составляла 1 мкг/мл, и смесь оставляли в инкубаторе с 5% CO2 при 37°C в течение 72 часов. Люциферазу, экспрессируемую в T-клетках, измеряли с использованием набора Bright-Glo Luciferase Assay System (Promega). Относительная интенсивность люминесценции люциферазы в Т-клетках, дополненных антитело-липидной наночастицей, показана на фиг. 2.
[0234]
10. Трансфекция мРНК в первичные культивированные T-клетки человека при помощи липидных наночастиц, связанных с антителом к CD3/антителом к CD28 и стимуляция активации T-клеток
CD3-положительные пан-T-клетки периферической крови человека (Precision Bioservices) высевали в круглодонный 96-луночный планшет (Corning) при плотности клеток 1×105 клеток/лунку. В качестве среды использовали не содержащую сыворотку клеточную среду X-VIVO10 для гематопоэтических клеток (Lonza) с добавлением 30 нг/мл рекомбинантного IL-2 (Thermo Fisher Scientific). Затем липидные наночастицы, инкапсулирующие мРНК люциферазы (TriLink) и связанные с антителом к CD3 и антителом к CD28, добавляли в среду таким образом, чтобы концентрация мРНК люциферазы в среде составляла 0,3 или 1 мкг/мл, и смесь оставляли в инкубаторе с 5% CO2 при 37°C в течение 72 часов. В качестве контрольного образца стимуляции активации Т-клеток также были приготовлены Т-клетки с добавлением TransAct (компания Miltenyi Biotec) и Dynabeads (компания Thermo Fisher Scientific). Люциферазу, экспрессируемую в T-клетках, измеряли с использованием набора Bright-Glo Luciferase Assay System (Promega). Количество жизнеспособных Т-клеток измеряли с помощью набора CellTiter-Glo (Promega). Уровень экспрессии люциферазы показан на Фиг. 3 (I), и число выживших Т-клеток показано на Фиг. 3 (II) и (III).
[0235]
11. Получение липидных наночастиц, инкапсулирующих мРНК Luc
Липидную смесь, содержащую соединение 35 в виде катионного липида (соединение 35:DPPC:холестерин:SUNBRIGHT GM-020:SUNBRIGHT=60:10,6:28:1,4, молярное соотношение) растворяли в 90% EtOH, 10% воды с получением липидного раствора 8,1 мг/мл. С другой стороны, мРНК люциферазы (компания TriLink) растворяли в буфере с 2-морфолиноэтансульфоновой кислотой (MES) (pH 5,0) с получением 0,18 мг/мл раствора мРНК. Полученный липидный раствор и раствор мРНК смешивали при комнатной температуре с помощью устройства Nanoassemblr (Precision Nanosystems) при скорости потока 3 мл/мин: 6 мл/мин с получением дисперсии липидных наночастиц, инкапсулирующих мРНК Luc. Полученную дисперсию диализовали с использованием Slyde-A-Lyzer (фракция с молекулярной массой 20000, Thermo Scientific) против воды при комнатной температуре в течение 1 часа и против PBS при 4°C в течение 48 часов. Затем, диализат фильтровали через шприц-фильтр 0,2 мкм (Iwaki) и хранили при 4°C.
[0236]
12. Измерение размера частиц липидных наночастиц, инкапсулирующих мРНК Luc
К 1 мкл исходного раствора липидных наночастиц, инкапсулирующих мРНК Luc, добавляли 99 мкл фосфатно-солевого буфера (137 мМ NaCl, 7,99 мМ Na2HPO4, 2,7 мМ KCl, 1,47 мМ KH2PO4, pH 7,4). Полученная дисперсия была подвергнута измерению динамического светорассеяния с помощью Zetasizer Nano ZS (Malvern instruments) и кумулянтному анализу автокорреляционной функции для измерения среднего размера частиц Z и индекса полидисперсности.
[0237]
13. Измерение потенциала ζ липидных наночастиц, инкапсулирующих мРНК Luc
К 50 мкл исходного раствора наночастиц, инкасулирующих мРНК Luc, добавляли 700 мкл буфера HEPES (10 мМ HEPES-NaOH, pH 7,3). Полученная дисперсия была подвергнута измерению электрофоретического светорассеяния с использованием Zetasizer Nano ZS (Malvern instruments) для измерения потенциала ζ.
[0238]
14. Измерение скорости инкапсуляции и концентрации мРНК для липидных наночастиц, инкапсулирующих мРНК Luc
Исходный раствор наночастиц, инкапсулирующих мРНК Luc, разбавляли буфером TE для коррекции концентрации мРНК приблизительно до 4 мкг/мл. В качестве раствора со стандартом концентрации мРНК, «голую» мРНК разбавляли буфером TE до 4 мкг/мл. Разбавленные наночастицы, инкапсулирующие мРНК Luc, и раствор «голой» мРНК со стандартом концентрации (каждый по 60 мкл) смешивали каждый с 60 мкл буфера TE или буфера TE, содержащего 2% Triton-X100. Смеси давали постоять при комнатной температуре в течение 5 минут, смешивали с 120 мкл Quant-iTTM RiboGreen (зарегистрированная торговая марка), и смесь дополнительно оставляли стоять в течение 5 минут. Интенсивность флуоресценции смеси измеряли с помощью микроспектрофотометра Envision для чтения планшетов (компания Perkin-Elmer). Уровень инкапсуляции мРНК и концентрацию мРНК рассчитывали по следующим формулам.
[0239]
% уровня инкапсуляции мРНК = (1-FTE/FTriton)×100
Концентрация мРНК = (FTритон-b)×d/m
(где FTE показывает интенсивность флуоресценции RiboGreen липидных наночастиц в смеси с буфером TE, FTriton показывает интенсивность флуоресценции RiboGreen липидных наночастиц в смеси с буфером TE, содержащим 2% Triton-X100, b и m показывают y-пересечение и наклон, полученные из калибровочной кривой стандарта концентрации мРНК, и d - степень разведения липидных наночастиц)
[0240]
Результаты анализа липидных наночастиц, инкапсулирующих мРНК Luc, показаны в таблице 2.
[0241]
размер частиц Z
[0242]
15. Высокоэффективная трансфекция мРНК в CD3-положительные пан-T-клетки периферической крови человека путем совместного добавления стимулятора активации и липидных наночастиц
CD3-положительные пан-T-клетки периферической крови человека (Precision Bioservices) высевали в круглодонный 96-луночный планшет (Corning) при плотности клеток 1×105 клеток/лунку. В качестве среды использовали не содержащую сыворотку клеточную среду X-VIVO10 для гематопоэтических клеток (Lonza) с добавлением 30 нг/мл рекомбинантного IL-2 (Thermo Fisher Scientific) или Dynabeads Human T-Activator CD3/CD28 (ThermoFisher Scientific), который стимулирует активацию Т-клеток, согласно протоколу, рекомендованному каждым производителем. Затем, к среде добавляли липидные наночастицы «соединение 35-мРНК Luc», инкапсулирующие мРНК люциферазы (TriLink), так, чтобы концентрация мРНК люциферазы в среде составляла 0,1, 0,3 или 1 мкг/мл, и смесь оставляли в инкубаторе с 5% CO2 при 37°C в течение 72 часов. Люциферазу, экспрессируемую в T-клетках, измеряли с использованием набора Bright-Glo Luciferase Assay System (Promega). Выживаемость и скорость пролиферации Т-клеток измеряли с использованием набора CellTiter-Glo Luminescent Cell Viability Analysis (Promega KK). Полученные результаты представлены на рис. 4 и 5. Показано, что добавление липидных наночастиц, инкапсулирующих мРНК Luc, к Т-клеткам при стимуляции активации резко улучшает трансфекцию (фиг. 4). Кроме того, выживаемость и пролиферация Т-клеток поддерживалась на высоком уровне (фиг. 5).
[0243]
16. Высокоэффективная трансфекция luc мРНК в CD4/CD8-положительные T-клетки человека путем совместного добавления стимулятора активации и липидных наночастиц
Фракцию лейкоцитов периферической крови человека Leukopak (HemaCare) отмывали с помощью LOVO Cell Processing System (Fresenius), а CD4- и CD8-положительные клетки собирали с помощью системы обработки клеток CliniMACS (Milteny Biotec). Полученные CD4/CD8-положительные клетки высевали в плоскодоннный 96-луночный планшет (Corning) при плотности клеток 1×105 клеток/лунку. Для клеточной культуры использовали среду с добавлением 26 мл добавки для наращивания Т-клеток OPTmizer CTS, 20 мл CTS Immune SR, 10 мл 200 мМ L-Глутамина (все ThermoFischer Scientific), 10 мл стрептомицина сульфата 10 мг/мл ( Компания MEIJI), и 4,2 нг/мл рекомбинантного человеческого IL-2 MACS GMP (Milteny Biotec), на 1 л минимальной среды для наращивания Т-клеток OPTmizer CTS. Кроме того, в качестве стимулятора активации Т-клеток добавляли TransAct (Milteny Biotech) по протоколу, рекомендованному производителем. Затем, к среде добавляли липидные наночастицы «соединение 35-мРНК Luc», инкапсулирующие мРНК люциферазы (TriLink), так, чтобы концентрация мРНК люциферазы в среде составляла 0,1, 0,3 или 1 мкг/мл, и смесь оставляли в инкубаторе с 5% CO2 при 37°C в течение 72 часов. Люциферазу, экспрессируемую в T-клетках, измеряли с использованием набора Bright-Glo Luciferase Assay System (Promega). Выживаемость и скорость пролиферации Т-клеток измеряли с использованием набора CellTiter-Glo Luminescent Cell Viability Analysis (Promega KK). Полученные результаты представлены на Фиг. 6. Показано, что добавление липидных наночастиц, инкапсулирующих мРНК Luc, к Т-клеткам при стимуляции активации резко улучшает трансфекцию. Кроме того, выживаемость и пролиферация Т-клеток поддерживалась на высоком уровне.
[Промышленная применимость]
[0244]
С использованием носителя для доставки нуклеиновой кислоты по настоящему изобретению или способа доставки нуклеиновой кислоты по настоящему изобретению, этап активации/пролиферации Т-клеток и этап введения генов в Т-клетки можно проводить одновременно в одном контейнере. В результате агент для иммунной клеточной терапии может быть предоставлен в течение короткого периода времени с низкой стоимостью производства, и настоящее изобретение чрезвычайно полезно, поскольку иммуноклеточная терапия может быть предоставлена по более низкой цене.
[0245]
Эта заявка основана на патентной заявке № 2018-197069, поданной 18 октября 2018 года и патентной заявке № 2019-124629, поданной 3 июля 2019 года, содержание которых, таким образом, включено в виде ссылки в настоящий документ во всей своей полноте.
| название | год | авторы | номер документа |
|---|---|---|---|
| МНОГОЦЕПОЧЕЧНЫЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР И ЕГО ПРИМЕНЕНИЯ | 2013 |
|
RU2663725C2 |
| СПОСОБЫ ЭКСПАНДИРОВАНИЯ АНТИГЕНСПЕЦИФИЧЕСКИХ CAR-T-КЛЕТОК, КОМПОЗИЦИИ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2019 |
|
RU2800920C2 |
| СПОСОБ СОЗДАНИЯ Т-КЛЕТОК, ПРИГОДНЫХ ДЛЯ АЛЛОГЕННОЙ ТРАНСПЛАНТАЦИИ | 2015 |
|
RU2752933C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С МУТИРОВАННЫМИ КОСТИМУЛЯТОРНЫМИ ДОМЕНАМИ CD28 | 2018 |
|
RU2800922C2 |
| Модифицированные клетки с химерным антигеновым рецептором для лечения рака, экспрессирующего CLDN6 | 2020 |
|
RU2826058C2 |
| МОДИФИЦИРОВАННЫЕ МОНОЦИТЫ/МАКРОФАГИ, ЭКСПРЕССИРУЮЩИЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2766690C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2708032C2 |
| УЛУЧШЕННЫЕ СПОСОБЫ ПРОИЗВОДСТВА СРЕДСТВ АДОПТИВНОЙ КЛЕТОЧНОЙ ТЕРАПИИ | 2015 |
|
RU2741899C2 |
| ИММУННЫЕ КЛЕТКИ, ДЕФЕКТНЫЕ ПО Suv39h1 | 2018 |
|
RU2784531C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЭКСПРЕССИРУЮЩИХ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР КЛЕТОК | 2015 |
|
RU2751362C2 |

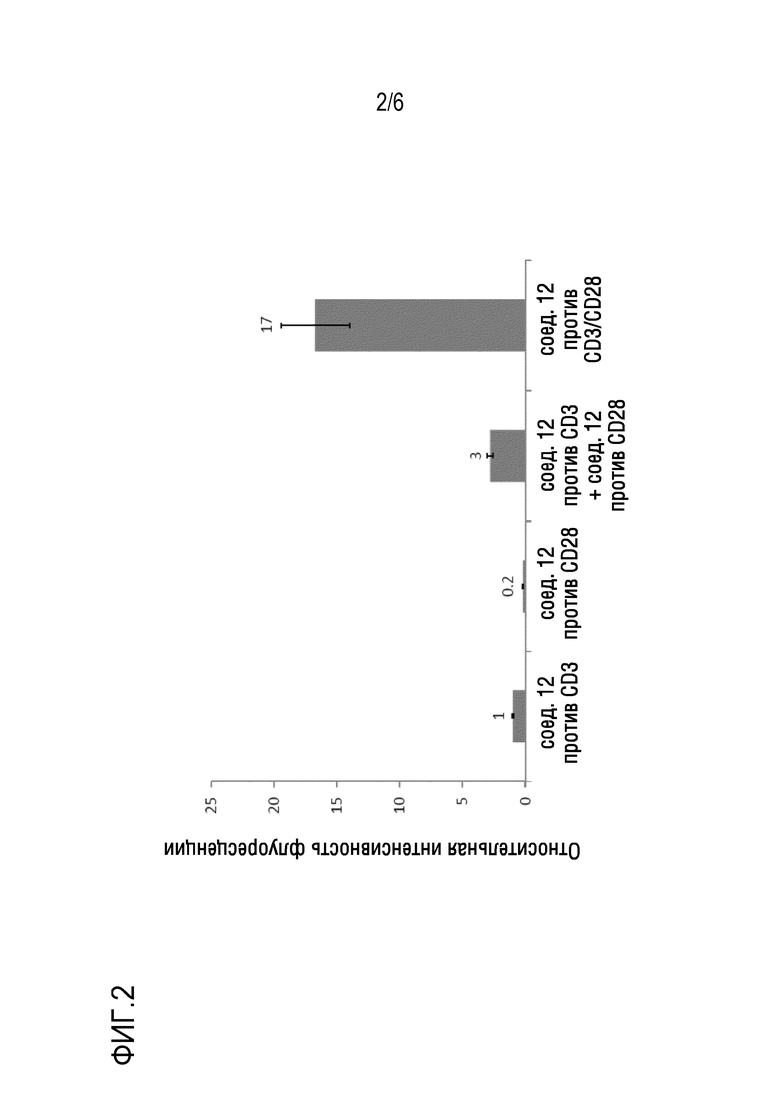
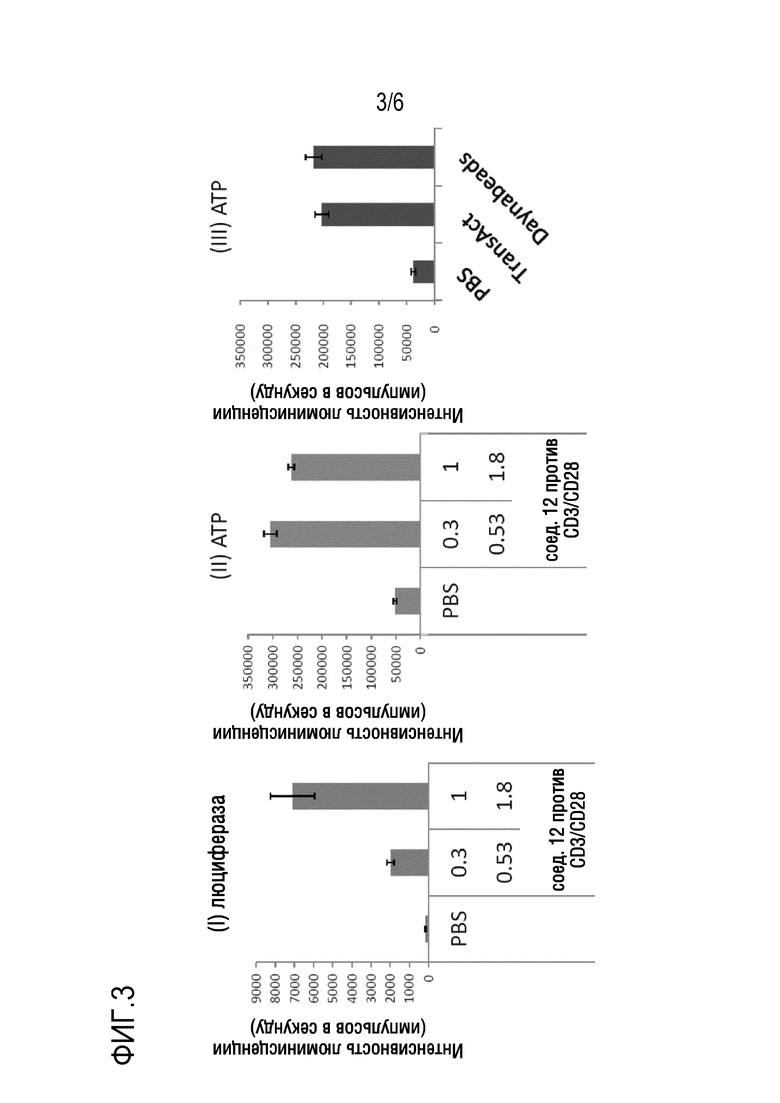
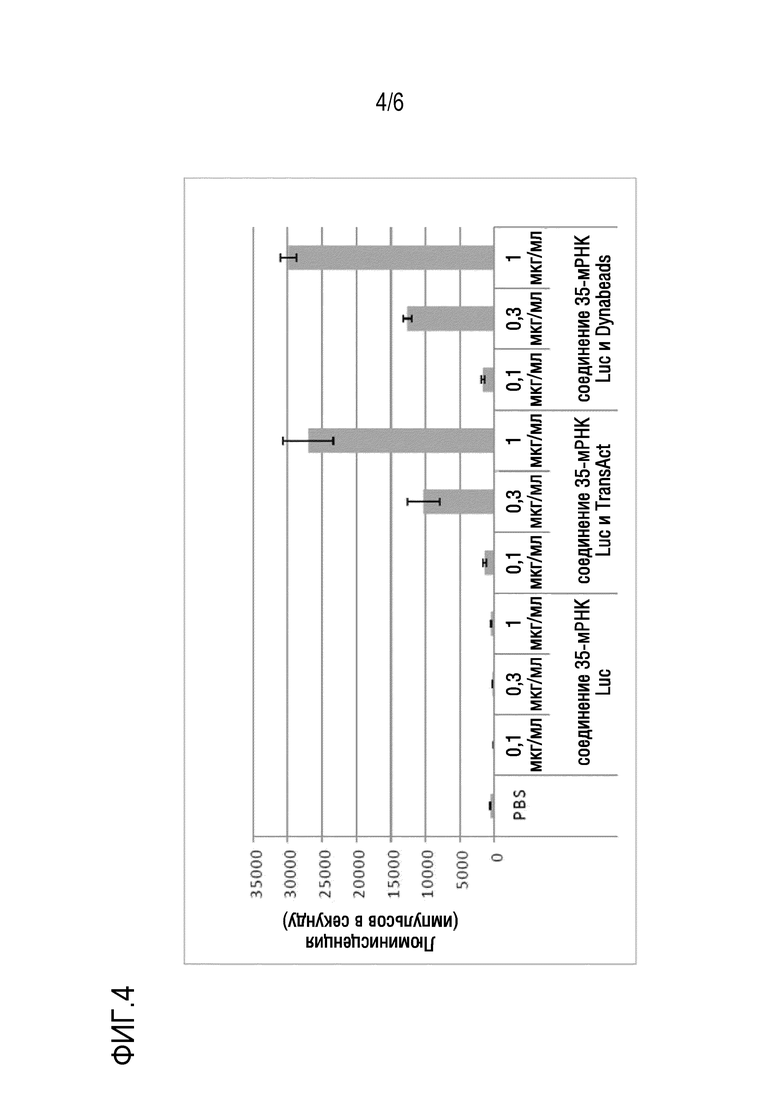

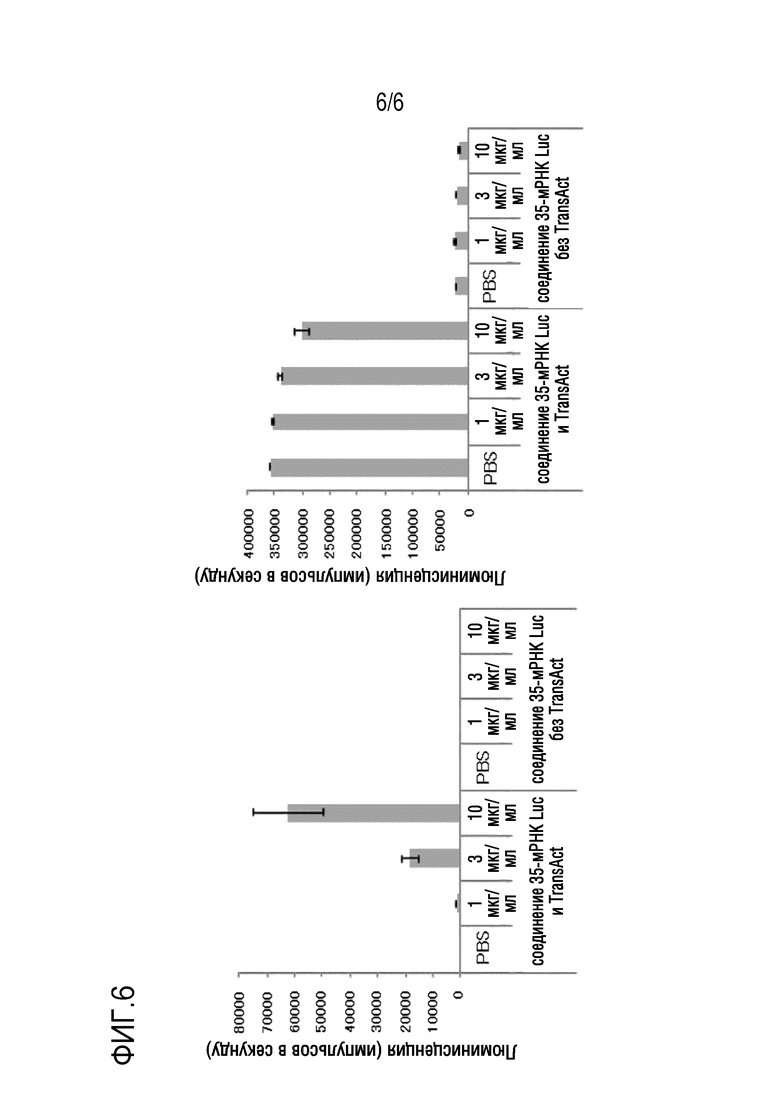
Изобретение относится к области биотехнологии, в частности, к способу активации/пролиферации Т-клеток, включающему контактирование клеточной популяции, содержащей T-клетки с носителем для доставки нуклеиновой кислоты, имеющим, по меньшей мере, один тип лиганда, активирующего Т-клетку, добавленный на его поверхность. Также раскрыты способы доставки нуклеиновой кислоты в T-клетки, включающие этап контактирования клеточной популяции, содержащей T-клетки, с носителем для доставки нуклеиновой кислоты, имеющим, по меньшей мере, один тип лиганда, активирующего Т-клетку, добавленный на его поверхность, а также клеточная культура, композиция и набор для осуществления указанных способов. Изобретение позволяет эффективно получать лекарственное средство, содержащее T-клетки. 7 н. и 23 з.п. ф-лы, 6 ил., 2 табл., 16 пр.
1. Способ активации/пролиферации Т-клеток, включающий этап контактирования клеточной популяции, содержащей T-клетки с носителем для доставки нуклеиновой кислоты, имеющим, по меньшей мере, один тип лиганда, активирующего Т-клетку, добавленный на его поверхность, где лиганд, активирующий Т-клетку, выбран из физиологических лигандов или рецепторов факторов костимуляции Т-клеток, выбранных из группы, состоящей из CD28, ICOS, CD137, OX40, CD27, GITR, BAFFR, TACI, BMCA и CD40L, и антител-агонистов против CD3 или CD28.
2. Способ по п. 1, где указанный выше лиганд, активирующий Т-клетку, включает антитело к CD3 и/или антитело к CD28.
3. Способ по п. 1, где указанный выше носитель для доставки нуклеиновой кислоты имеет на своей поверхности два или более типов лигандов, активирующих Т-клетку.
4. Способ по п. 1, где указанный выше носитель для доставки нуклеиновой кислоты представляет собой липидную наночастицу или липосому.
5. Способ по п. 1, где указанный выше носитель для доставки нуклеиновой кислоты содержит внутри нуклеиновую кислоту, которая подавляет экспрессию фактора, ингибирующего активацию Т-клеток, и/или нуклеиновую кислоту, кодирующую фактор, способствующий активации Т-клеток.
6. Способ по п. 1, где указанный выше носитель для доставки нуклеиновой кислоты содержит нуклеиновую кислоту, кодирующую CAR или TCR.
7. Способ по п. 1, где способ проводят ex vivo.
8. Способ доставки нуклеиновой кислоты в T-клетки, включающий этап контактирования клеточной популяции, содержащей T-клетки, с носителем для доставки нуклеиновой кислоты, имеющим, по меньшей мере, один тип лиганда, активирующего Т-клетку, добавленный на его поверхность, и содержащим внутри нуклеиновую кислоту, где нуклеиновая кислота не включает нуклеиновую кислоту, кодирующую CAR или TCR, и где лиганд, активирующий Т-клетку, выбран из физиологических лигандов или рецепторов факторов костимуляции Т-клеток, выбранных из группы, состоящей из CD28, ICOS, CD137, OX40, CD27, GITR, BAFFR, TACI, BMCA и CD40L, и антител-агонистов против CD3 или CD28.
9. Способ по п. 8, где указанный выше лиганд, активирующий Т-клетку, включает антитело к CD3 и/или антитело к CD28.
10. Способ по п. 8, где указанный выше носитель для доставки нуклеиновой кислоты имеет на своей поверхности два или более типов лигандов, активирующих Т-клетку.
11. Способ по п. 8, где указанный выше носитель для доставки нуклеиновой кислоты представляет собой липидную наночастицу или липосому.
12. Способ по п. 8, где указанная выше нуклеиновая кислота включает нуклеиновую кислоту, которая подавляет экспрессию фактора, ингибирующего активацию Т-клеток, и/или нуклеиновую кислоту, кодирующую фактор, способствующий активации Т-клеток.
13. Способ по п. 8, где способ проводят ex vivo.
14. Способ доставки нуклеиновой кислоты в T-клетки, включающий этап контактирования клеточной популяции, содержащей T-клетки, одновременно, по меньшей мере, с одним типом лиганда, активирующего Т-клетку, и носителем для доставки нуклеиновой кислоты, содержащим внутри нуклеиновую кислоту и без лиганда, активирующего Т-клетку, добавленного на его поверхность, где лиганд, активирующий Т-клетку, выбран из физиологических лигандов или рецепторов факторов костимуляции Т-клеток, выбранных из группы, состоящей из CD28, ICOS, CD137, OX40, CD27, GITR, BAFFR, TACI, BMCA и CD40L, и антител-агонистов против CD3 или CD28.
15. Способ по п. 14, где указанный выше лиганд, активирующий Т-клетку, включает антитело к CD3 и/или антитело к CD28.
16. Способ по п. 14, где приводят в контакт два или более типов лигандов, активирующих Т-клетку.
17. Способ по п. 14, где указанный выше носитель для доставки нуклеиновой кислоты представляет собой липидную наночастицу или липосому.
18. Способ по п. 14, где указанная выше нуклеиновая кислота включает нуклеиновую кислоту, которая подавляет экспрессию фактора, ингибирующего активацию Т-клеток, и/или нуклеиновую кислоту, кодирующую фактор, способствующий активации Т-клеток.
19. Способ по п. 14, где указанная выше нуклеиновая кислота включает нуклеиновую кислоту, кодирующую CAR или TCR.
20. Способ по п. 14, где способ проводят ex vivo.
21. Способ получения лекарственного средства, содержащего T-клетки, включающий (1) этап контакта клеточной популяции, содержащей T-клетки, одновременно, по меньшей мере, с одним типом лиганда, активирующего Т-клетку, и носителем для доставки нуклеиновой кислоты, содержащим внутри нуклеиновую кислоту и без лиганда, активирующего Т-клетку, добавленного на его поверхность, где лиганд, активирующий Т-клетку, выбран из физиологических лигандов или рецепторов факторов костимуляции Т-клеток, выбранных из группы, состоящей из CD28, ICOS, CD137, OX40, CD27, GITR, BAFFR, TACI, BMCA и CD40L, и антител-агонистов против CD3 или CD28, и где нуклеиновая кислота включает по меньшей мере нуклеиновую кислоту, подавляющую экспрессию фактора, ингибирующего активацию Т-клеток, нуклеиновую кислоту, кодирующую фактор, способствующий активации Т-клеток, или нуклеиновую кислоту, кодирующую CAR или TCR; и
(2) этап получения лекарственного средства путем смешивания клеточной популяции, содержащей Т-клетки, полученной на стадии (1), в качестве активного ингредиента с известным фармацевтически приемлемым носителем.
22. Способ по п. 21, где указанный выше лиганд, активирующий Т-клетку, включает антитело к CD3 и/или антитело к CD28.
23. Способ по п. 21, где приводят в контакт два или более типов лигандов, активирующих Т-клетку.
24. Способ по п. 21, где указанный выше носитель для доставки нуклеиновой кислоты представляет собой липидную наночастицу или липосому.
25. Способ по п. 21, где указанный выше носитель для доставки нуклеиновой кислоты содержит нуклеиновую кислоту, которая подавляет экспрессию фактора, ингибирующего активацию T-клетки, и/или нуклеиновую кислоту, кодирующую фактор, способствующий активации T-клетки.
26. Способ по п. 21, где указанная выше нуклеиновая кислота включает нуклеиновую кислоту, кодирующую CAR или TCR.
27. Способ по п. 21, где способ проводят ex vivo.
28. Клеточная культура для доставки нуклеиновой кислоты в T-клетки, содержащая клеточную популяцию, включающую T-клетки, по меньшей мере, один тип лиганда, активирующего Т-клетку, носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, и среду, где лиганд, активирующий Т-клетку, выбран из физиологических лигандов или рецепторов факторов костимуляции Т-клеток, выбранных из группы, состоящей из CD28, ICOS, CD137, OX40, CD27, GITR, BAFFR, TACI, BMCA и CD40L, и антител-агонистов против CD3 или CD28.
29. Композиция для доставки нуклеиновой кислоты в T-клетки, включающая, по меньшей мере, один тип лиганда, активирующего Т-клетку, и носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, где лиганд, активирующий Т-клетку, выбран из физиологических лигандов или рецепторов факторов костимуляции Т-клеток, выбранных из группы, состоящей из CD28, ICOS, CD137, OX40, CD27, GITR, BAFFR, TACI, BMCA и CD40L, и антител-агонистов против CD3 или CD28.
30. Набор для доставки нуклеиновой кислоты в T-клетки, включающий, по меньшей мере, один тип лиганда, активирующего Т-клетку, и носитель для доставки нуклеиновой кислоты без лиганда, активирующего Т-клетку, добавленного на поверхность, где лиганд, активирующий Т-клетку, выбран из физиологических лигандов или рецепторов факторов костимуляции Т-клеток, выбранных из группы, состоящей из CD28, ICOS, CD137, OX40, CD27, GITR, BAFFR, TACI, BMCA и CD40L, и антител-агонистов против CD3 или CD28.
| WO2014153114 A1, 25.09.2014 | |||
| US2017296676 A1, 19.10.2017 | |||
| WO2010042876 A1, 15.04.2010 | |||
| RU2015139874 A, 24.03.2017. |
Авторы
Даты
2023-11-01—Публикация
2019-10-17—Подача