ОБЛАСТЬ ТЕХНИКИ
[1] Данное изобретение относится к комбинированным продуктам, содержащим дициклоплатин, применению комбинированных продуктов для лечения и/или предотвращения боли, воспаления и заболеваний, связанных с вирусной инфекцией, и к способам получения комбинированных продуктов.
УРОВЕНЬ ТЕХНИКИ
[2] Поскольку был обнаружен противоопухолевый эффект цис-дихлордиамин платины (Rosenberg et al. Nature, 1965, 205: 698; Nature, 1972, 222: 385), цисплатин широко используется в качестве противоопухолевого лекарственного средства в клинической медицине. Хотя эти лекарственные средства оказывают терапевтическое воздействие на такие виды рака, как рак мочеполовой системы, рак носоглотки, рак, вызванный цефалоспорином, и рак легких, эти лекарственные средства токсичны и могут вызывать серьезные побочные эффекты. В последние несколько десятилетий поиск высокоэффективных противоопухолевых лекарственных средств с низкой токсичностью и широким спектром противоопухолевой активности из аналогов платины был предметом исследований в области противоопухолевых препаратов.
Структура дициклоплатина
[3] Дициклоплатин (DCP) представляет собой сокристаллическое соединение, образованное карбоплатином (CBP) и 1,1-циклобутан-дикарбоновой кислотой (CBDCA) посредством водородных связей. Согласно CN1311183A и соответствующим академическим отчетам, дицилоплатин обладает широким спектром противоопухолевой активности, высокой эффективностью, низкой токсичностью, низкой резистентностью, низкой перекрестной резистентностью, хорошей проникающей способностью и т.д. Китайская патентная заявка CN00124864.2 показывает, что дициклоплатин оказывает значительное влияние на рак головы и шеи, рак носоглотки, рак молочной железы, рак легкого, рак печени, рак поджелудочной железы, рак желудка, рак кишечника, лимфому и т.д. В то же время он оказывает хорошее влияние на множественные признаки, такие как доброкачественная гиперплазия предстательной железы, воспаление предстательной железы и ревматоидный артрит (PCT/US2016/028720).
[4] Постоянная и прорывная боль является основной проблемой для пациентов с раком. Более половины всех пациентов с раком будут испытывать сильную, неконтролируемую боль во время течения их заболеваний, и лечение боли является основной проблемой для пациентов с раком и лечащих онкологов (List MA, Stracks J, Colangelo L, et al. J. Clin. Oncol (2000) 18: 877-884). Хотя раковая боль представляет собой сложный патологический процесс и серьезную клиническую проблему, достигнут значительный прогресс в понимании основных неврологических механизмов, ответственных за возникновение раковой боли. Симптомы, которые испытывают пациенты с раком, являются следствием клеточных, тканевых и системных изменений, которые происходят во время пролиферации, инвазии и метастазирования. Отвечающая иммунная система также играет очевидную роль в раковой боли. Раковая клетка продуцирует медиаторы, которые влияют на другие клетки в микроокружении рака, такие как иммунные клетки.
[5] Раковые и иммунные клетки в области опухолевых масс высвобождают несколько нейроиммунных медиаторов, которые взаимодействуют с различными рецепторами на периферических ноцицептивных нервных окончаниях, способствуя аномальным выделениям и повышенной возбудимости. Кроме того, опухоли, растущие вблизи периферических нервов, могут нарушать целостность нерва, вызывая нейропатическое состояние, сопровождающееся постоянной болью, гипералгезией или аллодинией. Оба этих действия опухолей на периферический нерв могут привести к центральной сенсибилизации, которая может еще больше повысить эффективность ноцицептивной передачи через задний рог спинного мозга и восприятие спонтанной и прорывной боли (Hamamoto DT, Khasabov SG, Cain DM, Simone DA. J. Neurophysiol ( 2008) 100: 2300-2311, Sabino MA, Luger NM, Mach DB, Rogers SD, Schwei MJ, Mantyh PW. Int. J. Cancer (2003) 104: 550-558).
[6] Лекарственные средства на основе платины редко используются в качестве антивирусных лекарственных средств. В US 8247445 B2 сообщается об активности нового комплекса платины, используемого для профилактики или лечения вирусных и бактериальных инфекций. В US 5922689 сообщается об использовании производных цисплатина для лечения СПИДа. Jiajiu Shaw и др. в патентной литературе (US 6297245 B1) сообщили, что цисплатин добавляли с фолиевой кислотой и коэнзимом Q10 в качестве промотера для лечения СПИДа. Jiajiu Shaw и др. также раскрыли, что новые препараты платины используют для лечения и блокирования новых заболеваний, вызываемых вирусами, бактериями и паразитами, а также для лечения хронических и воспалительных заболеваний. Yang Xuqing и др. раскрыли применение дициклоплатина в антивирусных или антибактериальных целях.
[7] Однако остается потребность в препаратах с хорошей стабильностью и высокой эффективностью при лечении и/или профилактике боли, воспаления или заболеваний, связанных с вирусными инфекциями.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[8] В первом аспекте в данном изобретении предложен комбинированный продукт, содержащий дициклоплатин и кислоту. В некоторых вариантах осуществления кислоту выбирают из одной или более из следующих кислот: 1,1-циклобутандикарбоновая кислота, лимонная кислота, хлорогеновая кислота, феруловая кислота, малеиновая кислота, салициловая кислота, фолиевая кислота и галловая кислота. В некоторых вариантах осуществления соотношение дициклоплатина к кислотам составляет от 1:0,01 до 1:99. В некоторых вариантах осуществления комбинированный продукт необязательно содержит дициклоплатин и один или более из следующих дополнительных компонентов: коэнзим Q10, куркумин, глутатион, оризанол, лимонную кислоту, витамин С и антоцианины. В некоторых вариантах осуществления комбинированный продукт может присутствовать в форме композиции или фармацевтической композиции, или дициклоплатин, кислоты или другие ингредиенты комбинированного продукта могут независимо присутствовать в виде отдельных составов.
[9] Во втором аспекте в данном изобретении предложен комбинированный продукт, содержащий дициклоплатин и один или более из следующих дополнительных компонентов: коэнзим Q10, куркумин, глутатион, оризанол, лимонную кислоту, витамин С и антоцианины.
[10] В третьем аспекте в данном изобретении предложено применение комбинированного продукта, раскрытого ранее в данном документе, в производстве лекарственного средства, причем лекарственное средство предназначено для применения при лечении и/или предотвращении боли, воспаления и заболевания, связанного с вирусной инфекцией. В некоторых вариантах осуществления боль выбирают из болей, вызванных раком или причиной, отличной от рака (например, гепатитом B, гепатитом C или ревматоидным артритом), воспаление выбирают из воспалений, вызванных раком или причиной, отличной от рака (например, ревматоидным артритом), заболевание, связанное с вирусной инфекцией, выбирают из заболеваний, связанных с инфекцией вирусом гепатита В, вирусом гепатита С, вирусом Эбола или вирусом иммунодефицита человека.
[11] В четвертом аспекте в данном изобретении предложен способ лечения и/или предотвращения боли, воспаления и заболевания, связанного с вирусной инфекцией, который включает применение комбинированного продукта, описанного выше, нуждающимся в этом пациентами. В некоторых вариантах осуществления боль выбирают из болей, вызванных раком или причиной, отличной от рака (например, гепатитом B, гепатитом C или ревматоидным артритом), а воспаление выбирают из воспалений, вызванных раком или причиной, отличной от рака (например, ревматоидным артритом) заболевание, связанное с вирусной инфекцией, выбирают из заболеваний, связанных с инфекцией вирусом гепатита В, вирусом гепатита С, вирусом Эбола или вирусом иммунодефицита человека. В некоторых вариантах осуществления доза дициклоплатина в комбинированном продукте составляет от 0,01 до 10 мг/кг массы тела пациента, предпочтительно от 0,01 до 5 мг/кг массы тела пациента. В некоторых вариантах осуществления комбинированный продукт можно вводить следующим путем: перорально, в ротовую полость, ингаляционным спреем, сублингвально, ректально, трансдермально, через слизистую влагалища, трансмукозально, местно, посредством назального или энтерального введения, посредством инъекции, такой как внутримышечная инъекция, подкожная инъекция, интрамедуллярная инъекция и интратекально, посредством прямого введения в головной мозг, посредством введения in situ, подкожно, внутрибрюшинно, внутривенно, внутрисуставно синовиально, внутрижелудочно, внутрипеченочно, внутриочагово, посредством внутричерепного введения, внутрибрюшинно, посредством назальной или интраокулярной инъекции или посредством других способов доставки лекарственных средств. В некоторых вариантах осуществления комбинированный продукт может находиться в форме композиции или фармацевтической композиции, или дициклоплатин, кислота или другие ингредиенты комбинированного продукта могут независимо присутствовать в виде отдельных составов, которые можно вводить одновременно, непрерывно или интервально. Интервал времени включает, без ограничения, целочисленное значение от 1 до 24 часов, например, 1 час, 2 часа или 3 часа; и целочисленное значение от 1 до 30 суток, например, 1 сутки, 2 суток или 3 суток.
[12] В пятом аспекте в данном изобретение предложен способ получения комбинированного продукта, который включает 1) добавление дициклоплатина в качестве активного ингредиента или в качестве единственного активного ингредиента и 2) необязательно добавление кислоты для образования смеси, причем соотношение дициклоплатина к кислоте составляет от 1:0,01 до 1:99, предпочтительно от 1:3 до 1:10, а кислоту выбирают из одной или более из следующих: 1,1-циклобутандикарбоновая кислота, лимонная кислота, хлорогеновая кислота, феруловая кислота, малеиновую кислота, салициловая кислота, фолиевая кислота и галловая кислота, и, 3) необязательно, добавление одного или более дополнительных ингредиентов, выбранных из следующих: коэнзим Q10, куркумин, глутатион (GSH), оризанол, лимонная кислота, витамин С и антоцианины.
[13] В пятом аспекте в данном изобретении также предложен способ получения композиции, содержащей дициклоплатин или дициклоплатин и 1,1-циклобутандикарбоновую кислоту, включающий: 1) перемешивание карбоплатина и 1,1-циклобутандикарбоновой кислоты в молярном соотношении от 1:1,05 до 1:99, в подходящем растворителе, при комнатной температуре или при нагревании в течение соответствующего периода времени для получения смеси, содержащей дициклоплатин и 1,1-циклобутандикарбоновую кислоту; и, необязательно, 2) непосредственную лиофилизацию смеси, концентрирование смеси, добавление подходящего количества воды для полного растворения и затем лиофилизацию смеси или обеспечивают смесь в виде желаемого водного раствора, получая таким образом композицию, содержащую дициклоплатин и 1,1-циклобутандикарбоновую кислоту.
[14] В шестом аспекте в данном изобретении предложено применение дициклоплатина в качестве единственного активного ингредиента при изготовлении лекарственного средства, причем лекарственное средство предназначено для применения при лечении и/или предотвращении боли или воспаления, при этом боль вызвана раком или другой причиной (такой как вирус гепатита В, вирус гепатита С или ревматоидный артрит), а воспаление представляет собой воспаление, вызванное раком или причиной, отличной от рака (например, ревматоидным артритом).
[15] В седьмом аспекте в данном изобретении предложено применение комбинированного продукта, описанного выше, для лечения и/или предотвращения боли, воспаления и заболевания, связанного с вирусной инфекцией.
[16] В восьмом аспекте в данном изобретении предложена композиция, содержащая дициклоплатин в качестве единственного активного ингредиента, и способ получения такой смеси, причем способ включает добавление дициклоплатина в качестве активного ингредиента.
[17] В девятом аспекте в данном изобретении предложено применение дициклоплатина в качестве единственного активного ингредиента при производстве лекарственного средства, причем лекарственное средство предназначено для применения при лечении и/или предотвращении боли или воспаления. В некоторых вариантах осуществления боль представляет собой боль, вызванную раком или причиной, отличной от рака, а воспаление представляет собой воспаление, вызванное раком или причиной, отличной от рака (например, ревматоидным артритом).
[18] В десятом аспекте в данном изобретении предложена композиция, содержащая дициклоплатин в качестве единственного активного ингредиента, для применения при лечении и/или профилактике боли или воспаления. В некоторых вариантах осуществления боль представляет собой боль, вызванную раком, или боль, вызванную другой причиной, отличной от рака (например, гепатитом B, гепатитом C или ревматоидным артритом), а воспаление вызывается раком или причиной, отличной от рака (например, ревматоидным артритом).
Фигуры и описание
[19] На Фиг. 1 показан эффект дициклоплатина или рибавирина отдельно на вирус гепатита С (HCV).
[20] На Фиг. 2 показан эффект дициклоплатина на вирус гепатита B (HBV).
[21] На Фиг. 3 показан эффект дициклоплатина или зидовудина на ВИЧ.
[22] На Фиг. 4 показан эффект дициклоплатина на вирус Эбола.
[23] На Фиг. 5 показан эффект AA011, VK021 и положительных лекарственных средств на вирус.
[24] На Фиг. 6 показан противовирусный эффект комбинированной композиции MD36792, AA011 (A на Фиг. 6) и VK021 (V на Фиг. 6).
[25] На Фиг. 7 показан обезболивающий эффект MD36792.
ОПРЕДЕЛЕНИЕ
[26] Используемый в данном документе термин «субъект» подразумевает под собой людей и животных, например собак, кошек, кроликов, кур, обезьян и т.д.
[27] Используемый в данном документе термин «дозировка» относится к количеству используемого активного ингредиента, например, миллиграммов (мг) на килограмм (кг) массы тела субъекта.
[28] Используемый в данном документе термин «отношение» обычно относится к молярному соотношению. Например, мольное соотношение дициклоплатина к кислоте составляет от 1:0,01 до 1:99. Процентное содержание дициклоплатина относится к массовому проценту.
[29] Используемый в данном документе термин «заболевание, связанное с вирусной инфекцией» относится к заболеванию, вызываемому вирусной инфекцией, или заболеванию, сопровождающему вирусную инфекцию. Вирусная инфекция включает, без ограничения, инфекцию, вызванную вирусом гепатита (например, вирусом гепатита А, вирусом гепатита В, вирусом гепатита С и т.д.), вирусом Эбола или вирусом иммунодефицита человека.
[30] Используемый в данном документе термин «боль» относится к боли, вызванной опухолью (например, раком), или боли, вызванной другой причиной (например, гепатитом B, гепатитом C или ревматоидным артритом).
[31] Используемые в данном документе термины «MD36792, AA011 и VK021» относятся к дициклоплатину, глутатиону и витамину С соответственно.
[32] Используемый в данном документе термин «комнатная температура» означает 25±1°С. И, если экспериментальная температура не указана, она относится к комнатной температуре.
[33] Используемый в данном документе термин «около» относится к ±10 % значения, модифицированного этим термином, более предпочтительно ±5 % и наиболее предпочтительно ±2 %, поэтому специалистам в данной области техники следует четко определить область применения термина «около» в соответствии с установленным значением.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[34] Авторы данной заявки обнаружили, что заявленный в данной заявке дициклоплатин в качестве основного активного ингредиента проявляет значительную эффективность при лечении и/или предотвращении боли, особенно боли у пациентов с раком. Среди пациентов с раком, особенно у пациентов с прогрессирующим раком печени, раком почки, метастазами в кости и раком кости, выбор заключается в использовании инъекции дициклоплатина или пероральных композиций в качестве единственного способа лечения. Авторы изобретения обнаружили, что определенное количество пациентов с прогрессирующим раком не проявляло чувствительности к дициклоплатину, и при этом не наблюдалось эффективности подавления опухоли. Тем не менее, дициклоплатин по-прежнему проявлял очевидное влияние на обезболивание при раке и даже вызывал исчезновение боли. Некоторые пациенты использовали дициклоплатин для определенного курса лечения, а затем прекратили лечение, эти пациенты больше не страдали от боли, даже после того, как они прекратили использовать дициклоплатин.
[35] При клиническом лечении пациентов с опухолью было обнаружено, что дициклоплатин оказывает хорошее влияние на вызванный опухолью отек и воспаление тканей. Во многих случаях пациенты с раком легких с метастазами в головной мозг принимали дициклоплатин перорально или путем инъекций. Было обнаружено, что у этих пациентов после использования дициклоплатина в течение одной-двух недель отек тканей головного мозга, вызванный метастазированием рака, был в основном устранен. Это показывает, что дициклоплатин обладает хорошим противовоспалительным действием. Во многих случаях пациентов с раком печени с отеком ткани печени, после инфузии дициклиоплатина или перорального приема в течение определенного периода времени, отек ткани значительно исчезал или уменьшился.
[36] В первом аспекте в данном изобретении предложен комбинированный продукт, содержащий дициклоплатин и кислоту или состоящий из дициклоплатина и кислоты. В некоторых вариантах осуществления кислоту выбирают из одной или более из следующих кислот: 1,1-циклобутандикарбоновая кислота, лимонная кислота, хлорогеновая кислота, феруловая кислота, малеиновая кислота, салициловая кислота, фолиевая кислота и галловая кислота. В некоторых вариантах осуществления соотношение дициклоплатина к кислоте составляет от 1:0,01 до 1:99, предпочтительно около 1:1, около 1:1,08, около 1:2, около 1:3, около 1:4, около 1:5, около 1:6, около 1:7, около 1:8, около 1:9, около 1:10, около 1:20, около 1:30, около 1:40, около 1:50, около 1:60, около 1:70, около 1:80, около 1:90, а диапазон соотношений между коэффициентами включает, без ограничения, от около 1:1 до около 1:2, от около 1,08 до около 1:2, от около 1:3 до около 1:10, и так далее. В некоторых вариантах осуществления комбинированный продукт необязательно содержит дициклоплатин и один или более из следующих дополнительных компонентов: коэнзим Q10, куркумин, глутатион, оризанол, лимонную кислоту, витамин С и антоцианины. В некоторых вариантах осуществления соотношение дициклоплатина к дополнительным другим компонентам составляет от около 0,1:1 до около 100:1, предпочтительно около 0,1:1, около 0,2:1, около 0,3:1, около 0,4:1, около 0,43:1, около 0,5:1, около 0,6:1, около 0,7:1, около 0,8:1, около 0,9:1, около 1:1, около 1:1,25, около 1,02:1, около 2:1, около 3:1, около 4:1, около 5:1, около 6:1, около 7:1, около 8:1, около 9:1, около 10:1, около 20:1, около 30:1, около 40:1, около 50:1, около 60:1, около 70:1, около 80:1, около 90:1, а диапазон соотношений среди соотношений включает, без ограничения, от около 0,1:1 до 10:1, от около 0,4:1 до около 8:1, от около 0,43:1 до около 5:1, от около 0,43:1 до около 1:1,25, от около 0,43:1 до около 1:1,02, и тому подобное. Предпочтительно соотношение дициклоплатина к описанным дополнительным другим компонентам (коэнзиму Q10, куркумину, глутатиону, оризанолу, лимонной кислоте, витамину С и антоцианинам) составляет: от около 0,1:1 до 10:1, от около 0,4:1 до около 8:1 от около 0,43:1 до около 5:1, от около 0,43:1 до около 1:1,25, от около 0,43:1 до около 1:1,02. Более предпочтительно, соотношение дициклоплатина к витамину С составляет около 0,43:1, соотношение дициклоплатина к глутатиону составляет около 1:1,25, соотношение дициклоплатина к коферменту Q10 составляет около 1,02:1. Кроме того, массовый процент дициклоплатина в композициях составляет около 5 %, около 10 %, около 15 %, около 16,64 %, около 18,29 %, около 19,11 %, около 19,87 %, около 20 %, около 20 %, около 25 %, приблизительно 30 %, приблизительно 35 %, приблизительно 40 %, приблизительно 44,46 %, приблизительно 45 %, приблизительно 50 %, приблизительно 55 %, приблизительно 60 %, приблизительно 60,5 %, приблизительно 65 %, приблизительно 70 %, приблизительно 75 %, около 80 %, около 85 %, около 90 %, около 95 %, около 96,2 %, около 99 %, и находится в диапазоне между соответствующими процентами, включая, без ограничения, от около 5 % до 99 %, от 16,64 % до 60,5 %, от около 18,29 % до 44.46 % и от около 19,11 % до около 35 %.
[37] В некоторых вариантах осуществления комбинированный продукт может присутствовать в форме композиции или фармацевтической композиции, или дициклоплатин, кислота или другие ингредиенты комбинированного продукта могут независимо присутствовать в виде отдельных составов. В некоторых вариантах осуществления комбинированный продукт может представлять собой пероральные составы, такие как капсулы, таблетки, гранулы, лиофилизированный состав или водная инъекция, состав для ингалятора или другие составы.
[38] Во втором аспекте в данном изобретении предложен комбинированный продукт, содержащий дициклоплатин и один или более из следующих дополнительных компонентов: коэнзим Q10, куркумин, глутатион, оризанол, цитрат, витамин С и антоцианины. В некоторых вариантах осуществления комбинированный продукт необязательно содержит кислоту (кислоты), которую выбирают из одной или более из следующих: 1,1-циклобутандикарбоновая кислота, лимонная кислота, хлорогеновая кислота, феруловая кислота, малеиновая кислота, салициловая кислота, фолиевая кислота и галловая кислота. В некоторых вариантах осуществления соотношение дициклоплатина к кислоте составляет от 1:0,01 до 1:99, предпочтительно около 1:1, около 1:1,08, около 1:2, около 1:3, и около 1:4, около 1:5, около 1:6, около 1:7, около 1:8, около 1:9, около 1:10, около 1:20, около 1:30, около 1:40, около 1:50, около 1:60, около 1:70, около 1:80, около 1:90, а диапазон соотношений среди соотношений включает, без ограничения, от около 1:1 до около 1:2, от около 1,08 до около 1:2, от около 1:3 до около 1:10, и так далее. В некоторых вариантах осуществления соотношение дициклоплатина к дополнительным другим компонентам составляет от около 0,1:1 до около 100:1, предпочтительно около 0,1:1, около 0,2: 1, около 0,3:1, около 0,4:1, около 0,43: 1, около 0,5:1, около 0,6:1, около 0,7:1, около 0,8:1, около 0,9:1, около 1:1, около 1:1,25, около 1,02:1, около 2:1, около 3:1, около 4:1, около 5:1, около 6:1, около 7:1, около 8:1, около 9:1, около 10:1, около 20:1, около 30:1, около 40:1, около 50:1, около 60:1, около 70:1, около 80:1, около 90:1, а диапазон соотношений среди соотношений включает, без ограничения, от около 0,1:1 до 10:1, от около 0,4:1 до около 8:1, от около 0,43:1 до около 5:1, от около 0,43:1 до около 1:1,25, от около 0,43:1 до около 1:1,02, и тому подобное. Предпочтительно соотношение дициклоплатина к описанным дополнительным другим компонентам (коэнзиму Q10, куркумину, глутатиону, оризанолу, лимонной кислоте, витамину С и антоцианинам) составляет: от около 0,1:1 до 10:1, от около 0,4:1 до около 8:1 от около 0,43:1 до около 5:1, от около 0,43:1 до около 1:1,25, от около 0,43:1 до около 1:1,02. Более предпочтительно, соотношение дициклоплатина к витамину С составляет около 0,43:1, соотношение дициклоплатина к глутатиону составляет около 1:1,25, соотношение дициклоплатина к коферменту Q10 составляет около 1,02:1. Кроме того, массовый процент дициклоплатина в композициях составляет около 5 %, около 10 %, около 15 %, около 16,64 %, около 18,29 %, около 19,11 %, около 19,87 %, около 20 %, около 20 %, около 25 % по массе, приблизительно 30 %, приблизительно 35 %, приблизительно 40 %, приблизительно 44,46 %, приблизительно 45 %, приблизительно 50 %, приблизительно 55 %, приблизительно 60 %, приблизительно 60,5 %, приблизительно 65 %, приблизительно 70 %, приблизительно 75 %, около 80 %, около 85 %, около 90 %, около 95 %, около 96,2 %, около 99 %, и находится в диапазоне между соответствующими процентами, включая, без ограничения, от около 5 % до 99 %, от 16,64 % до 60,5 %, от около 18,29 % до 44.46 % и от около 19,11 % до около 35 %.
[39] В некоторых вариантах осуществления комбинированный продукт может представлять собой пероральные составы, такие как капсулы, таблетки, гранулы, лиофилизированный состав или водная инъекция, состав для ингалятора или другие составы.
[40] В третьем аспекте в данном изобретении предложено применение дициклоплатина, такого как комбинированный продукт, раскрытый ранее в данном документе, в производстве лекарственного средства, причем лекарственное средство предназначено для применения при лечении и/или предотвращении боли, воспаления и заболевания, связанного с вирусной инфекцией. В некоторых вариантах осуществления боль выбирают из болей, вызванных раком или причиной, отличной от рака (например, гепатитом B, гепатитом C или ревматоидным артритом), воспаление выбирают из воспалений, вызванных раком или причиной, отличной от рака (например, ревматоидным артритом) заболевание, связанное с вирусной инфекцией, выбирают из заболеваний, связанных с инфекцией вирусом гепатита В, вирусом гепатита С, вирусом Эбола или вирусом иммунодефицита человека.
[41] В четвертом аспекте в данном изобретении предложен способ лечения и/или предотвращения боли, воспаления и заболевания, связанного с вирусной инфекцией, который включает введение дициклоплатина, такого как комбинированный продукт, описанный выше, нуждающимся в этом пациентам. В некоторых вариантах осуществления боль выбирают из болей, вызванных раком или причиной, отличной от рака (например, гепатитом B, гепатитом C или ревматоидным артритом), а воспаление выбирают из воспалений, вызванных раком или причиной, отличной от рака (например, ревматоидным артритом) заболевание, связанное с вирусной инфекцией, выбирают из заболеваний, связанных с инфекцией вирусом гепатита В, вирусом гепатита С, вирусом Эбола или вирусом иммунодефицита человека. В некоторых вариантах осуществления доза дициклоплатина в комбинированном продукте составляет от 0,01 до 10 мг/кг массы тела пациента, предпочтительно от 0,01 до 5 мг/кг массы тела пациента. В некоторых вариантах осуществления комбинированный продукт можно вводить следующим путем: перорально, в ротовую полость, ингаляционным спреем, сублингвально, ректально, трансдермально, через слизистую влагалища, трансмукозально, местно, посредством назального или энтерального введения, посредством инъекции, такой как внутримышечная инъекция, подкожная инъекция, интрамедуллярная инъекция и интратекальное, посредством прямого введения в головной мозг, посредством введения in situ, подкожно, внутрибрюшинно, внутривенно, внутрисуставно синовиально, внутрижелудочно, внутрипеченочно, внутриочагово, посредством внутричерепного введения, внутрибрюшинно, посредством назальной или интраокулярной инъекции или посредством других способов доставки лекарственных средств. В некоторых вариантах осуществления комбинированный продукт может находиться в форме композиции или фармацевтической композиции, или дициклоплатин, кислота или другие ингредиенты комбинированного продукта могут независимо присутствовать в виде отдельных составов, которые можно вводить одновременно, непрерывно или интервально. Интервал времени включает, без ограничения, целочисленное значение от 1 до 24 часов, например, 1 час, 2 часа или 3 часа; и целочисленное значение от 1 до 30 суток, например, 1 сутки, 2 суток или 3 суток.
[42] В пятом аспекте в данном изобретении предложен способ получения комбинированного продукта, который включает 1) добавление дициклоплатина в качестве активного ингредиента или в качестве единственного активного ингредиента и 2) необязательно добавление кислоты для образования смеси, причем соотношение дициклоплатина к кислоте составляет от 1: 0,01 до 1:99, предпочтительно около 1:1, около 1:1,08, около 1:2, около 1:3, около 1:4, около 1:5, около 1:6, около 1:7, около 1:8, около 1:9, около 1:10, около 1:20, около 1:30, около 1:40, около 1:50, около 1:60, около 1:70, около 1:80, около 1:90, а диапазон соотношений среди соотношений включает, без ограничения, от около 1:1 до около 1:2, от около 1,08 до около 1:2, от около 1:3 до около 1:10, а кислоты выбирают из одного или более из следующих, 1,1-циклобутандикарбоновая кислота, лимонная кислота, хлорогеновая кислота, феруловая кислота, малеиновая кислота, салициловая кислота, фолиевая кислота и галловая кислота; а также 3) необязательно, добавление одного или более дополнительных ингредиентов, выбранных из следующих: коэнзим Q10, куркумин, глутатион (GSH), оризанол, лимонная кислота, витамин С и антоцианы, при этом соотношение дициклоплатина к дополнительным другим компонентам составляет от около 0,1:1 до около 100:1, предпочтительно около 0,1:1, около 0,2:1, около 0,3:1, около 0,4:1, около 0,43:1, около 0,5:1, около 0,6:1, около 0,7:1, около 0,8:1, около 0,9:1, около 1:1, около 1:1,25, около 1,02:1, около 2:1, около 3:1, около 4:1, около 5:1, около 6:1, около 7:1, около 8:1, около 9:1, около 10:1, около 20:1, около 30:1, около 40:1, около 50:1, около 60:1, около 70:1, около 80:1, около 90:1, а диапазон соотношений среди соотношений включает, без ограничения, от около 0,1:1 до 10:1, от около 0,4:1 до около 8:1, от около 0,43: 1 до около 5:1, от около 0,43:1 до около 1:1,25, от около 0,43:1 до около 1:1,02, и т.д.; предпочтительно соотношение дициклоплатина к другим компонентам (коэнзиму Q10, куркумину, глутатиону, оризанолу, лимонной кислоте, витамину С и антоцианам) составляет от около 0,1:1 до 10:1, от около 0,4:1 до около 8:1, от около 0,43:1 до около 5:1, от около 0,43:1 до около 1:1,25, от около 0,43:1 до около 1:1,02; более предпочтительно соотношение дициклоплатина к витамину С составляет около 0,43:1, соотношение дициклоплатина к глутатиону составляет около 1:1,25, соотношение дициклоплатина к коэнзиму Q10 составляет около 1,02:1.
[43] Как описано в данном документе, водный раствор, содержащий дициклоплатин и 1,1-циклобутандикарбоновую кислоту (с соотношением в диапазоне от 1:1,2 до 1:20), является стабильным при 40°C в течение семи недель. Водный раствор дициклоплатина с галловой кислотой, салициловой кислотой, лимонной кислотой, феруловой кислотой и т.д. Является стабильным при 40°С, но дициклоплатин начинает разлагаться через две недели. Предпочтительно, указанная выше кислота представляет собой 1,1-циклобутандикарбоновую кислоту, и предпочтительно соотношение дициклоплатина к 1,1-циклобутандикарбоновой кислоте составляет от 1:1,2 до 1:20.
[44] В некоторых вариантах осуществления в данном изобретении предложен способ получения композиции, содержащей дициклоплатин или дициклоплатин и 1,1-циклобутандикарбоновую кислоту, включающий: 1) перемешивание карбоплатина и 1,1-циклобутандикарбоновой кислоты в молярном соотношении от 1:1,05 до 1:99 (таком как, 1:1,2, 1:1,5, 1:3, 1:5, 1:10, 1:20 и любое соотношение между этими соотношениями, включая, без ограничения, от 1:1,2 до 1:20, или это соотношение может быть выбрано в соответствии с фактическими потребностями, например, в пропорции, описанной в данном документе выше), в подходящем растворителе (предпочтительно в воде), при комнатной температуре или при нагревании (предпочтительно 40 ℃), в течение соответствующего периода времени, такого как 0,5-24 часа (предпочтительно 0,5 часа, 1 час, 2 часа, 3 часа, 4 часа, 5 часов, 6 часов, 7 часов, 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 13 часов, 14 часов, 15 часов, 16 часов, 17 часов, 18 часов, 19 часов, 20 часов, 21 час, 22 часа, 23 часа, 24 часа, или любой интервал между ними), чтобы получить смесь, содержащую дициклоплатин и 1,1-циклобутандикарбоновую кислоту; и необязательно 2) непосредственно лиофилизацию смеси, концентрирование смеси, добавление подходящего количества воды для полного растворения и затем лиофилизацию смеси или обеспечение смеси в виде желаемого водного раствора, получая таким образом композицию, содержащую дициклоплатин и 1,1-циклобутандикарбоновую кислоту. По сравнению со способами, о которых сообщалось ранее, данное изобретение имеет много преимуществ, таких как более простой процесс эксплуатации, более высокий выход дициклоплатина и полное потребление карбоплатина. Кроме того, полученная лиофилизированная смесь состояла из дициклоплатина и 1,1-циклобутандикарбоновой кислоты, а остатка карбоплатина не было обнаружено.
[45] В шестом аспекте в данном изобретении предложено применение дициклоплатина в качестве активного ингредиента или единственного активного ингредиента при изготовлении лекарственного средства, причем лекарственное средство предназначено для применения при лечении и/или предотвращении боли или воспаления, при этом боль вызвана раком или другой причиной (такой как вирус гепатита В, вирус гепатита С или ревматоидный артрит), а воспаление представляет собой воспаление, вызванное раком или причиной, отличной от рака (например, ревматоидным артритом).
[46] В седьмом аспекте в данном изобретении предложен комбинированный продукт, содержащий дициклоплатин и кислоту или состоящий из дициклоплатина и кислоты, для лечения и/или предотвращения боли, вызванной раком или другой причиной, отличной от рака, например гепатитом B, гепатитом C или ревматоидным артритом; воспаления, вызванного раком, или другой причиной, не связанной с раком, например ревматоидным артритом, и заболеванием, связанным с вирусной инфекцией, причем заболевание, связанное с вирусной инфекцией, выбирают из заболевания, связанного с инфекцией вирусом гепатита В, вирусом гепатита С, вирусом Эбола или вирусом иммунодефицита человека. В некоторых вариантах осуществления кислоту выбирают из одной или более из следующих: 1,1-циклобутандикарбоновая кислота, лимонная кислота, хлорогеновая кислота, феруловая кислота, малеиновая кислота, салициловая кислота, фолиевая кислота и галловая кислота. В некоторых вариантах осуществления композиция содержит дициклоплатин и один или более из следующих других дополнительных компонентов: коэнзим Q10, куркумин, глутатион, оризанол, лимонную кислоту, витамин С и антоцианины.
[47] В качестве альтернативы комбинированный продукт содержит дициклоплатин и один или более из следующих дополнительных компонентов: коэнзим Q10, куркумин, глутатион, оризанол, лимонную кислоту, витамин С и антоцианины. В некоторых вариантах осуществления композиции необязательно содержат кислоту, которую выбирают из одной или более из следующих: 1,1-циклобутандикарбоновая кислота, лимонная кислота, хлорогеновая кислота, феруловая кислота, малеиновая кислота, салициловая кислота, фолиевая кислота и галловая кислота.
[48] В некоторых вариантах осуществления соотношение дициклоплатина к кислоте составляет от около 1:0,01 до около 1:99, предпочтительно около 1:1, около 1:1,08, около 1:2, около 1:3, около 1:4, около 1:5, около 1:6, около 1:7, около 1:8, около 1:9, около 1:10, около 1:20, около 1:30, около 1:40, около 1:50, около 1:60, около 1:70, около 1:80, около 1:90, а диапазон соотношений между коэффициентами включает, без ограничения, от около 1:1 до около 1:2, от около 1,08 до около 1:2, от около 1:3 до около 1:10, и так далее. В некоторых вариантах осуществления соотношение дициклоплатина к дополнительным другим компонентам составляет от около 0,1:1 до около 100:1, предпочтительно около 0,1:1, около 0,2: 1, около 0,3:1, около 0,4:1, около 0,43: 1, около 0,5:1, около 0,6:1, около 0,7:1, около 0,8:1, около 0,9:1, около 1:1, около 1:1,25, около 1,02:1, около 2:1, около 3:1, около 4:1, около 5:1, около 6:1, около 7:1, около 8:1, около 9:1, около 10:1, около 20:1, около 30:1, около 40:1, около 50:1, около 60:1, около 70:1, около 80:1, около 90:1, а диапазон соотношений среди соотношений включает, без ограничения, от около 0,1:1 до 10:1, от около 0,4:1 до около 8:1, от около 0,43:1 до около 5:1, от около 0,43:1 до около 1:1,25, от около 0,43:1 до около 1:1,02, и тому подобное. Предпочтительно соотношение дициклоплатина к описанным дополнительным другим компонентам (фолату, коэнзиму Q10, куркумину, глутатиону, оризанолу, лимонной кислоте, галловой кислоте, витамину С и антоцианинам) составляет: от около 0,1:1 до около 10:1, от около 0,4:1 до около 8:1 от около 0,43:1 до около 5:1, от около 0,43:1 до около 1:1,25, от около 0,43:1 до около 1:1,02. Более предпочтительно, соотношение дициклоплатина к витамину С составляет около 0,43:1, соотношение дициклоплатина к глутатиону составляет около 1:1,25, соотношение дициклоплатина к коэнзиму Q10 составляет около 1,02:1. В некоторых вариантах осуществления комбинированный продукт может присутствующие в форме композиции или фармацевтической композиции, или дициклоплатин, кислота или другие ингредиенты комбинированного продукта могут независимо присутствовать в виде отдельных составов.
[49] В восьмом аспекте в данном изобретении предложена композиция, содержащая дициклоплатин в качестве единственного активного ингредиента, причем композиция содержит эксципиент, выбранный из следующих: стеарат магния, гидроксипропилцеллюлоза, прежелатинизированный крахмал, хитозан, в-циклодекстрин, и поливинилпирролидон, а способ получения такой смеси включает добавление дициклоплатина в качестве единственного активного ингредиента с необязательным эксципиентом, описанным выше.
[50] В девятом аспекте в данном изобретении предложено применение дициклоплатина в качестве активного ингредиента или единственного активного ингредиента при производстве лекарственного средства, причем лекарственное средство предназначено для применения при лечении и/или предотвращении боли или воспаления. В некоторых вариантах осуществления боль представляет собой боль, вызванную раком, или боль, вызванную другой причиной, отличной от рака (например, гепатитом B, гепатитом C или ревматоидным артритом), а воспаление представляет собой воспаление, вызванное раком или воспаление, вызванное причиной, отличной от рака (например, ревматоидным артритом).
[51] В десятом аспекте в данном изобретении предложены композиции, содержащей дициклоплатин в качестве активного ингредиента или единственного активного ингредиента, для применения при лечении и/или профилактике боли или воспаления. В некоторых вариантах осуществления боль представляет собой боль, вызванную раком, или боль, вызванную другой причиной, отличной от рака (например, гепатитом B, гепатитом C или ревматоидным артритом), а воспаление вызывается раком или причиной, отличной от рака (например, ревматоидным артритом).
[52] В других аспектах в данном изобретении предложен способ лечения и/или предотвращения боли, включающий введение эффективной дозы дициклоплатина нуждающемуся в этом пациенту. В некоторых вариантах осуществления пациент представляет собой пациента с раком, предпочтительно пациента, страдающего от рака печени, рака почки, метастазов в кости, метастазов в головной мозг или рака кости, более предпочтительно пациента с прогрессирующим раком, или пациента, который уже развил устойчивость к противораковому препарату на основе платины, наиболее предпочтительно к пациенту с прогрессирующим раком печени. Кроме того, эффективная доза дициклоплатина может быть ниже, чем эффективная противораковая доза дициклоплатина у больного раком, или в некоторых вариантах осуществления эффективная доза дициклоплатина может быть равна эффективной дозе противоракового средства, используемого больным с раком. Например, дициклоплатин можно использовать как единственное лекарственное средство для лечения рака и боли. В некоторых вариантах осуществления дициклоплатин можно использовать в качестве единственного активного вещества для лечения и/или предотвращения боли. В некоторых вариантах осуществления способ лечения дополнительно включает применение одного или более других активных веществ, обладающих обезболивающим эффектом. В некоторых вариантах осуществления способ дополнительно включает применение одного или более активных веществ, обладающих противораковым эффектом, при этом активное вещество, обладающее противораковым эффектом, предпочтительно представляет собой противораковые лекарственные средства не на основе платины. В некоторых вариантах осуществления дициклоплатин присутствует в форме фармацевтической композиции. Кроме того, дициклоплатин содержится в комбинированном продукте, как определено в данном документе выше.
[53] В других аспектах изобретения эффективная доза дициклоплатина для лечения и/или предотвращения боли может быть ниже, чем эффективная противораковая доза, а дициклоплатин обладает обезболивающим эффектом у пациентов с раком, которые уже устойчивы к противоопухолевой активности препаратов платины. Следовательно, способы или применения дициклоплатина для лечения и/или профилактики боли не ограничиваются пациентами с раком, и дициклоплатин продемонстрировал значительный обезболивающий эффект, сравнимый с положительным контролем лекарственным средством ротунидин в экспериментах на модели боли у животных, показанных в данном документе. Как показано в данном документе, дициклоплатин может оказывать обезболивающий эффект на боль, вызванную раком или не связанной с раком причиной, включая, без ограничения, гепатит B, гепатит C и ревматоидный артрит. В некоторых вариантах осуществления в указанных выше способе и применении для лечения и/или предотвращения боли нуждающийся в этом пациент, не является пациентом с раком. В некоторых вариантах осуществления в указанных выше способе и применении для лечения и/или предотвращения боли нуждающийся в этом пациент, является пациентом с раком, у которого развилась устойчивость к противораковому лекарственному средству на основе платины.
[54] В других аспектах данное изобретение относится к способу лечения и/или предотвращения отека тканей (например, отека печени, отека головного мозга и т.д.) или воспаления, причем способ включает введение эффективной дозы дициклоплатина нуждающемуся в этом пациенту. В некоторых вариантах осуществления пациент представляет собой пациента с раком, предпочтительно пациента с раком печени, раком почки, метастазами в кости, метастазами в головном мозге или раком кости, более предпочтительно пациента с прогрессирующим раком, наиболее предпочтительно пациента с прогрессирующим раком печени или пациента, который обладает устойчивостью к противораковому лекарственному средству на основе платины. В некоторых вариантах осуществления эффективная доза дициклоплатина может быть ниже, чем эффективная противораковая доза дициклоплатина у больного раком, или в некоторых вариантах осуществления эффективная доза дициклоплатина может быть равна эффективной дозе противоракового средства, используемого больным с раком. В некоторых вариантах осуществления способ дополнительно включает применение пациентом одного или более активных веществ, обладающих противораковым эффектом, причем активные вещества, обладающие противораковым эффектом, предпочтительно представляют собой противораковое лекарственное средство не на основе платины. В некоторых вариантах осуществления пациент не является пациентом с раком. В некоторых вариантах осуществления дициклоплатин присутствует в форме фармацевтической композиции. Кроме того, дициклоплатин содержится в комбинированном продукте, как определено в данном документе выше.
[55] В других аспектах, в данном изобретении предложен способ лечения и/или предотвращения заболевания, связанного с вирусной инфекцией, такой как способ снижения вирусного индекса, включающий введение эффективной дозы фармацевтической композиции нуждающемуся в этом пациенту, причем фармацевтическая композиция содержит дициклоплатин и глутатион. В некоторых вариантах осуществления вирусная инфекция представляет собой инфекцию вирусом гепатита В, вирусом гепатита С, вирусом Эбола и/или вирусом иммунодефицита человека. В некоторых вариантах осуществления вирусная инфекция представляет собой инфекцию вирусом гепатита В. В некоторых вариантах осуществления вирусная инфекция представляет собой инфекцию вирусом гепатита C. В некоторых вариантах осуществления вирусная инфекция представляет собой инфекцию вирусом Эбола. В некоторых вариантах осуществления вирусная инфекция представляет собой инфекцию вирусом иммунодефицита человека. В некоторых вариантах осуществления способ включает введение пациентам эффективной дозы фармацевтических композиций 1-3 раза в сутки. В некоторых вариантах осуществления способ включает введение пациенту эффективной дозы фармацевтической композиции в течение по меньшей мере 7 суток, предпочтительно, от 1 месяца до 1 года, например, 1, 2, 3, 4, 5, 6, 7. 8, 9, 10, 11, 12 месяцев, предпочтительно от 1 до 6 месяцев, например, 1, 2, 3, 4, 5, 6 месяцев. В некоторых вариантах осуществления пациент не лечится каким-либо другим противовирусным лекарственным средствами и/или не получал никакого другого противовирусного лекарственного лечения. В некоторых вариантах осуществления способ также включает введение пациенту других противовирусных лекарственных средств. В некоторых вариантах осуществления фармацевтическая композиция необязательно содержит дициклоплатин и один или более из следующих других дополнительных компонентов: коэнзим Q10, куркумин, оризанол, лимонную кислоту, витамин С и антоцианины. Предпочтительно, соотношение дициклоплатина к глутатиону составляет от около 0,1:1 до около 100:1, предпочтительно около 0,1:1, около 0,2: 1, около 0,3:1, около 0,4:1, около 0,43: 1, около 0,5:1, около 0,6:1, около 0,7:1, около 0,8:1, около 0,9:1, около 1:1, около 1:1,25, около 1,02:1, около 2:1, около 3:1, около 4:1, около 5:1, около 6:1, около 7:1, около 8:1, около 9:1, около 10:1, около 20:1, около 30:1, около 40:1, около 50:1, около 60:1, около 70:1, около 80:1, около 90:1, а диапазон соотношений среди соотношений включает, без ограничения, от около 0,1:1 до 10:1, от около 0,4:1 до около 8:1, от около 0,43:1 до около 5:1, от около 0,43:1 до около 1:1,25, от около 0,43:1 до около 1:1,02, и тому подобное. Отношение дициклоплатина к глутатиону составляет от около 0,1:1 до 10:1, от около 0,4:1 до около 8:1, от около 0,43:1 до около 5:1, от около 0,43:1 до около 1:1,25, от около 0,43:1 до около 1:1,02. Более предпочтительно соотношение дициклоплатина к глутатиону составляет около 1:1,25. Предпочтительно, дициклоплатин и глутатион присутствуют в одной и той же фармацевтической композиции при лечении заболеваний, связанных с вирусными инфекциями. Однако в некоторых вариантах осуществления дициклоплатин и глутатион могут независимо присутствовать в виде отдельных составов, которые можно вводить одновременно, непрерывно или через равные интервалы.
[56] В некоторых вариантах осуществления в вышеописанном способе лечения и/или предотвращения боли, воспаления и заболеваний, связанных с вирусными инфекциями, дициклоплатин или фармацевтические композиции могут присутствовать в форме пероральных составов, таких как капсулы, таблетки, гранулы или замороженные сухие составы, или водные инъекции, или составы для ингаляторов, или другие составы. В некоторых вариантах осуществления в вышеописанном способе лечения и/или предотвращения боли, воспаления и заболеваний, связанных с вирусными инфекциями, дициклоплатин или фармацевтическую композицию можно вводить следующим образом: перорально, в ротовую полость, ингаляционным спреем, сублингвально, ректально, трансдермально, через слизистую влагалища, трансмукозально, посредством местного применения, посредством назального или кишечного введения, посредством инъекционного введения, такого как внутримышечное, подкожное, интрамедуллярное и интратекальное, посредством прямого введения в головной мозг, посредством ортотопического введения, подкожно, внутрибрюшинно, внутривенно, внутрисуставно синовиально, внутрижелудочно, внутрипеченочно, внутриочагово, посредством внутричерепного введения, внутрибрюшинно, посредством назальной или интраокулярной инъекции или посредством других способов доставки лекарственных средств. Предпочтительно дициклоплатин или фармацевтическую композицию можно вводить перорально или посредством инъекции.
ПОДРОБНОЕ ОПИСАНИЕ
[57] Данное изобретение дополнительно описано ниже со ссылкой на фигуры и конкретные варианты осуществления. Следует понимать, что следующие примеры используются только для иллюстрации данного изобретения и не используются для ограничения объема, охватываемого формулой данного изобретения.
[58] Дициклоплатин, упомянутый в примерах, может быть приобретен коммерчески или получен способами, описанными в данном документе. Другие соединения или кислоты и другие компоненты, описанные в данном документе, хорошо известны специалистам в данной области техники, могут быть приобретены коммерчески или получены с помощью известных методов синтеза.
МЕТОДЫ ОБНАРУЖЕНИЯ
[59] Методы обнаружения, использованные в примерах в данной статье, являются следующими:
(1) Рентгеновская порошковая дифрактометрия (XRPD)
[60] Аналитический прибор: Panalytical Empyrean.
[61] Рентгеновскую порошковую дифрактометрию проводили, устанавливая образец кристаллического материала на кремниевом (Si) низкофоновом держателе для монокристаллов распределяя образец в тонкий слой с помощью предметного стекла микроскопа. Положение 2и было откалибровано по порошковому стандарту Panalytical 640 Si. Образец облучали рентгеновскими лучами, генерируемыми медной трубкой с длинной тонкой фокусировкой, работающей при 45 кВ и 40 мА с длиной волны Kα1 = 1,540589 ангстрем и Kα2=1,544426 ангстрем (отношение интенсивностей Kα1/Kα2 составляет 0,50). Коллимированный источник рентгеновского излучения пропускали через запрограммированную щель расходимости, установленную на 10 мм, и отраженное излучение направляли через 5,5 мм антирассеивающую щель. Образец экспонировали в течение 16,3 секунды с шагом 2-тета 0,013° (режим непрерывного сканирования) в диапазоне от 3 градусов до 40 градусов 2-тета в режиме тета-тета. Время работы составило 3 минуты 57 секунд. Прибор был оснащен RTMS-детектором (XʹCelerator). Управление и сбор данных осуществлялся с помощью Dell Optiplex 780 XP, работающего с программным обеспечением для сбора данных.
[62] Как известно, на относительную интенсивность пиков могут влиять следующие факторы, например, зерна размером более 30 микрон и неунитарные соотношения сторон, которые могут повлиять на анализ образцов. Кроме того, на положение отражений может влиять точная высота, на которой образец находится в дифрактометре, и калибровка нуля дифрактометра. Плоскостность поверхности образца также может оказывать небольшое влияние. Следовательно, представленные данные дифракционной картины не должны восприниматься как абсолютные значения.
(2) Дифференциальная сканирующая калориметрия (DSC)
[63] В качестве метода термического анализа DSC используется для измерения количества тепла, необходимого для нагревания образцов, и также измерения эталонного значения как функции температуры. Общая процедура измерения DSC известна. Конкретные инструменты и условия, используемые в описанных примерах, являются следующими:
Аналитический прибор: TA Instruments Q2000 DSC.
Скорость нагрева: 10°С в минуту.
Газ для продувки: азот
Термогравиметрический анализ (TGA)
[64] TGA используется для измерения изменения физических и химических свойств образца в зависимости от повышенной температуры, обычно при постоянной скорости нагрева или в зависимости от времени (при постоянной температуре и/или постоянной потере массы). Общая процедура измерения TGA известна. Конкретные инструменты и условия, используемые в описанных примерах, являются следующими:
Аналитический прибор: TA Instruments Q5000 TGA.
Скорость нагрева: 10°С в минуту.
Газ для продувки: азот.
Пример 1. Получение композиций дициклоплатина
[65] 1) 5,0 г карбоплатина (13,47 ммоль) и 2,232 г 1,1-циклобутандикарбоновой кислоты (15,50 ммоль) добавляли в стеклянную колбу объемом 20 мл.
2) 15 мл деионизированной воды добавляли в вышеупомянутый стеклянный флакон и перемешивали при комнатной температуре для образования однородной суспензии, сохраняя флакон вдали от источника света.
3) Охлаждали до 20°С, полученную смесь переносили в реакционную колбу объемом 500 мл и промывали 50 мл деионизированной воды.
4) Добавляли еще 175 мл деионизированной воды, хорошо перемешивали и выдерживали при 20°С в течение 2 часов с образованием однородного раствора.
5) Смесь фильтровали. Фильтрат лиофилизировали и сушили в вакууме.
6) Было получено 7,21 г смеси дициклоплатина и 1,1-циклобутандикарбоновой кислоты.
7) Путем измерения установили, что дициклоплатин составлял 96,20 % массы. отношение DCP/1,1-циклобутандикарбоновой кислоты составляло 1:0,15.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше.
Пример 2. Получение композиций дициклоплатина
[66] 1) 5,0 г карбоплатина (13,47 ммоль) и 22,32 г 1,1-циклобутандикарбоновой кислоты (155,0 ммоль) добавляли в стеклянную колбу объемом 200 мл.
2) 125 мл деионизированной воды добавляли в вышеупомянутый стеклянный флакон и перемешивали при комнатной температуре для образования однородной суспензии, сохраняя флакон вдали от источника света.
3) Охлаждали до 20°С, полученную смесь переносили в реакционную колбу объемом 500 мл и промывали 150 мл деионизированной воды..
4) Добавляли еще 2000 мл деионизированной воды, хорошо перемешивали и выдерживали при 20°С в течение 2 часов с образованием однородного раствора.
5) Смесь фильтровали. Фильтрат лиофилизировали и сушили в вакууме.
6) Было получено 72,1 г смеси дициклоплатина и 1,1-циклобутандикарбоновой кислоты.
7) Путем измерения установили, что дициклоплатин составлял 96,22 % массы отношение DCP/1,1-циклобутандикарбоновой кислоты составляло 1:10,15.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше.
Пример 3 Получение комбинированного продукта, содержащего 1,1-циклобутандикарбоновую кислоту, лимонную кислоту и дициклоплатин
[67] 1) 5,0 г карбоплатина (13,47 ммоль) и 3,879 г 1,1-циклобутандикарбоновой кислоты (26,94 ммоль) добавляли в стеклянную колбу объемом 50 мл.
2) 25 мл деионизированной воды добавляли в вышеупомянутый стеклянный флакон и перемешивали при комнатной температуре для образования однородной суспензии, сохраняя флакон вдали от источника света.
3) Охлаждали до 20°С, полученную смесь переносили в реакционную колбу объемом 500 мл и промывали 50 мл деионизированной воды.
4) Добавляли еще 225 мл деионизированной воды, хорошо перемешивали и выдерживали при 20°С в течение 2 часов с образованием однородного раствора.
5) 2,588 г (13,47 ммоль) лимонной кислоты добавляли к вышеуказанному раствору и перемешивали до образования гомогенного раствора.
6) Смесь фильтровали. Фильтрат лиофилизировали и сушили в вакууме.
7) Было получено 11,462 г смеси дициклоплатина и 1,1-циклобутандикарбоновой кислоты.
8) Путем измерения установили, что дициклоплатин составлял 60,50 % массы. отношение DCP/1,1-циклобутандикарбоновая кислота/лимонная кислота: 1:1:1.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше.
Пример 4 Получение комбинированного продукта, содержащего 1,1-циклобутандикарбоновую кислоту, лимонную кислоту, GSH и дициклоплатин
[68] 1) 5,0 г карбоплатина (13,47 ммоль) и 3,879 г 1,1-циклобутандикарбоновой кислоты (26,94 ммоль) добавляли в стеклянную колбу объемом 50 мл.
2) 25 мл деионизированной воды добавляли в вышеупомянутый стеклянный флакон и перемешивали при комнатной температуре для образования однородной суспензии, сохраняя флакон вдали от источника света.
3) Охлаждали до 20°С, полученную смесь переносили в реакционную колбу объемом 500 мл и промывали 50 мл деионизированной воды.
4) Добавляли еще 225 мл деионизированной воды, хорошо перемешивали и выдерживали при 20°С в течение 2 часов с образованием однородного раствора.
5) 2,588 г (13,47 ммоль) лимонной кислоты и 4,135 г глутатиона (GSH, 13,47 ммоль) добавляли к вышеуказанному раствору и перемешивали до образования гомогенного раствора.
6) Смесь фильтровали. Фильтрат лиофилизировали и сушили в вакууме.
7) Было получено 15,60 г смеси дициклоплатина, глутатиона и 1,1-циклобутандикарбоновой кислоты.
8) Путем измерения установили, что дициклоплатин составлял 44,46 % массы. отношение DCP/1,1-циклобутандикарбоновая кислота/лимонная кислота/GSH: 1:1:1:1.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше.
Пример 5 Получение комбинированного продукта, содержащего 1,1-циклобутандикарбоновую кислоту, хлорогеновую кислоту, глутатион, витамин С и дициклоплатин
[69] 1) 5,15 г дициклоплатина (13,47 ммоль), 2,232 г 1,1-циклобутандикарбоновой кислоты (15,50 ммоль), 4,77 г хлорогеновой кислоты (13,47 ммоль), 4,135 г глутатиона (GSH, 13,47 ммоль)), 11,862 г витамин С хорошо перемешивали.
2) Затем получали 28,15 г дициклоплатинсодержащего комбинированного продукта.
7) Содержание дициклоплатина составляло до 18,29 % массы.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше.
Пример 6 Получение комбинированного продукта, содержащего хлорогеновую кислоту, глутатион, витамин С и дициклоплатин
[70] 1) 5,15 г дициклоплатина (13,47 ммоль), 4,77 г хлорогеновой кислоты (13,47 ммоль), 4,135 г глутатиона (GSH, 13,47 ммоль) и 11,862 г витамин С тщательно перемешивали.
2) Получали 25,92 г комбинированных продуктов с дициклоплатином.
7) Содержание дициклоплатина составило 19,87 %.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше.
Пример 7 Получение комбинированного продукта, содержащего глутатион, витамин С и дициклоплатин
[71] 1) 5,15 г дициклоплатина (13,47 ммоль), 4,135 г глутатиона (GSH, 13,47 ммоль) и 11,862 г витамин С тщательно перемешивали.
2) Получали 21,147г дициклоплатинсодержащего комбинированного продукта.
7) Масса дициклоплатина составила 24,35 %.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше. Пример 8 Получение комбинированного продукта, содержащего фолиевую кислоту, хлорогеновую кислоту, глутатион, витамин С и дициклоплатин
[72] 1) 5,15 г дициклоплатина (13,47 ммоль), 1,03 г фолиевой кислоты, 4,77 г хлорогеновой кислоты (13,47 ммоль), 4,135 г глутатиона (GSH, 13,47 ммоль) и 11,862 г витамин С тщательно перемешивали.
2) Получали 26,95г дициклоплатинсодержащего комбинированного продукта.
7) Масса дициклоплатина составила 19,11 %.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше.
Пример 9 Получение комбинированного продукта, содержащего коэнзим Q10, хлорогеновую кислоту, глутатион, витамин С и дициклоплатин
[73] 1) 5,15 г дициклоплатина (13,47 ммоль), 5,03 г коэнзима Q10, 4,77 г хлорогеновой кислоты (13,47 ммоль), 4,135 г глутатиона (GSH, 13,47 ммоль) и 11,862 г витамин С тщательно перемешивали.
2) Получали 30,95 г дициклоплатинсодержащего комбинированного продукта.
7) Масса дициклоплатина составила 16,64 %.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше.
Пример 10 Получение комбинированного продукта, содержащего коэнзим Q10, лимонную кислоту, хлорогеновую кислоту, глутатион, витамин С и дициклоплатин
[74] 1) 5,15 г дициклоплатина (13,47 ммоль), 5,03 г коэнзима Q10, 4,77 г лимонной кислоты, 4,135 г глутатиона (GSH, 13,47 ммоль) и 11,862 г витамин С тщательно перемешивали.
2) Получали 30,95 г дициклоплатинсодержащего комбинированного продукта.
7) Масса дициклоплатина составила 16,64 %.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше.
Пример 11 Получение комбинированного продукта, содержащего оризанол, лимонную кислоту, глутатион, витамин С и дициклоплатин
[75] 1) 5,15 г бициклической платины (13,47 ммоль), 5,03 г оризанола, 4,77 г лимонной кислоты, 4,135 г глутатиона (GSH, 13,47 ммоль) и 11,862 г витамин С тщательно перемешивали.
2) Получали 30,95 г дициклоплатинсодержащего комбинированного продукта.
7) Масса дициклоплатина составила 16,64 %.
Продукт анализировали с помощью XRPD (порошковая рентгеновская дифракция), DSC (дифференциальная сканирующая калориметрия) и 1H ЯМР, как описано выше.
Пример 12 Исследование активности in vitro MD36792 (дициклоплатин) в отношении вируса гепатита С (HCV)
[76] (I) Экспериментальные материалы:
1. Соединения: MD36792 (дициклоплатин) и рибавирин (коммерчески доступный).
2. Клетка: Huh7.5.1 cells.
3. Вирус: Вирус гепатита С (HCV тип 2a, штамм вируса JFH1-Luc).
4. Экспериментальные реагенты: среда DMEM, набор alamarBlue® (Invitrogen), набор Luciferase Assay System (Promega) и другие экспериментальные реагенты.
[77] (II) Экспериментальные методы
1. Тест на цитотоксичность MD36792
[78] Принцип эксперимента: в эксперименте используется набор alamarBlue® (Invitrogen) для определения токсического действия лекарственных средств на клетки. alamarBlue® представляет собой окислительно-восстановительный индикатор, который изменяется в поглощении и флуоресцентных сигналах на основе клеточной метаболической активности. alamarBlue® легко растворяется в воде. После того, как его окисленная форма проникает в клетки, за ней следует восстановление митохондриальными ферментами, чтобы вызвать измеримую флуоресценцию и изменение цвета. Он используется для количественного анализа жизнеспособности и пролиферации клеток, а также для исследований цитотоксичности in vitro. Этот анализ основан на способности клеток с метаболической активностью превращать реагенты в флуоресцентные и колориметрические показатели. Поврежденные и неактивные клетки имеют более низкую естественную метаболическую активность и более низкие соответствующие сигналы, поэтому сила флуоресцентного сигнала может отражать уровень активности клеток.
[79] Этапы метода: клетки Huh7.5.1 высевали в 96-луночный планшет для культивирования клеток, и прикрепляли после использования. ДМСО использовали для непрерывного разбавления лекарственного средства от 200-кратной начальной концентрации до 3-кратного градиента на 6 градиентов, а затем использовали полную среду DMEM для разбавления содержащего лекарственное средство культурального раствора, и каждую лунку тестировали в двух повторностях. После 72 часов инкубации культуральный супернатант сливали и добавляли среду, содержащую alamarBlue®. После инкубации при 37°С в течение 4 часов показания флуоресценции детектировали при 570 нм и 595 нм.
Формула расчета: жизнеспособность клетки (%) = (лунка для пробы-холостой контроль) / (контрольная клетка-холостой контроль) * 100 %
2. Эксперимент MD36792 в отношении вируса гепатита С (HCV)
[80] Принцип эксперимента: после того, как штамм HCV JFH1-Luc, содержащий репортерный ген Rluc, инфицировал клетки Huh7.5.1, Rluc был экспрессирован как реплицированный вирус, а уровень экспрессии репортерного гена Rluc мог отражать уровень репликации вируса HCV.
Экспериментальные этапы: (1) Посев клеток: клетки Huh7.5.1 высевали в 96-луночные планшеты для культивирования клеток, и клетки прикрепляли к стенке для последующего использования. (2) Вирусная инфекция: лекарственное средство серийно разводили от 2 раз в качестве начальной концентрации и в 3 раза от градиента до 9 градиентов в культуральной среде. Каждая концентрация находилась в 2 повторяющихся лунках. 100 мкл содержащего лекарственное средство культурального раствора добавляли в лунки с клетками и затем инфицировали 100 мкл культуральной среды вируса JFH1-luc. (3) Обнаружение: культивировали в течение 72 часов после заражения вирусом. Показания Rluc определяли с использованием набора Renilla Luciferase Assay.
[81] В эксперименте были выбраны рибавирин-положительная лекарственная контрольная группа, вирусная контрольная группа и клеточная контрольная группа.
[82] Формула расчета: коэффициент ингибирования (%) = 100% - (группа лекарственного средства-клеточная контрольная группа) / (вирусная контрольная группа-клеточная контрольная группа) * 100 %
[83] Экспериментальные результаты: как показано на Фиг. 1, MD36792 имеет EC50 (50 % ингибирование) HCV, равную 121,1 мкМ, поэтому индекс выбора SI (SI = CC50 / EC50) MD36792 составляет 1,54. Поскольку репликация HCV в этой модели требует высокого клеточного статуса, когда лекарственное средство оказывает цитотоксический эффект, это серьезно повлияет на репликацию вируса. Поэтому мы полагаем, что ингибирующий эффект 333 мкМ и 111 мкМ в отношении HCV вызван токсическими эффектами. Следовательно, MD36792 не оказывает ингибирующего действия на HCV. Контрольное лекарственное средство рибавирин оказывает значительное ингибирующее действие на HCV.
Пример 13 Исследование активности in vitro MD36792 (дициклоплатин) в отношении вируса гепатита B (HBV)
[84] (I) Экспериментальные материалы:
1. Соединение: MD36792.
2. Клетка: клетки HepAD38.
3. Вирус: вирус гепатита В (HBV).
4. Экспериментальные реагенты: среда DMEM/F12, набор для обнаружения CellTiter-Glo (Promega), набор для обнаружения антигена HBeAg (Kehua), набор для обнаружения антигена HBsAg (Kehua) и другие экспериментальные реагенты.
[85] (II) Экспериментальные методы
1. Тест на цитотоксичность MD36792
[86] Принцип эксперимента: набор CellTiter-Glo (Promega) использовали для выявления токсического действия лекарственных средств на клетки. Набор CellTiter-Glo определяет количество живых клеток в культуре путем количественного определения АТФ. Дыхание метаболически активных клеток и другие жизненные активности могут продуцировать АТФ. Стабильный тип свечения, продуцируемый люциферазой, используется в наборе Signaling, в то время как люцифераза требует АТФ в процессе эмиссии света. Равный объем реагента CellTiter-Glo добавляли к среде для культивирования клеток для измерения величины люминесценции. Световой сигнал пропорционален количеству АТФ в системе, а АТФ положительно коррелирует с количеством живых клеток. Следовательно, значение светового сигнала может отражать количество живых клеток.
[87] Этапы метода: клетки HepAD38 высевали в 96-луночный планшет для культивирования клеток, и прикрепляли к стенке для последующего использования. Лекарственное средство серийно разводили от 1 мМ до 9 градиентов в 9 градиентах с 2 повторностями на градиент. Лекарственное средство добавляли к клеткам и культивировали в инкубаторе CO2 при 37°C. После 3 суток добавления лекарственного средства и культивирования цитопатический эффект (CPE), вызванный лекарственным средством, наблюдали под световым микроскопом, и для определения выживаемости клеток добавляли CellTiter-Glo. Токсичность лекарственного средства в отношении клеток выражается в виде активности клеток.
[88] Формула расчета: активность клетки (%) = (группа лекарственного средства-холостой контроль) / (контрольная клетка-холостой контроль) * 100 %
2. Эксперимент MD36792 в отношении вируса гепатита B (HBV)
[89] Принцип эксперимента: репликация HBV в клеточной линии HepAD38 может регулироваться тетрациклином. После удаления dox интегрированный геном HBV может транскрибироваться с образованием пгРНК (прегеномной РНК), и пгРНК продолжает обратную транскрипцию в окДНК (открытую кольцевую ДНК). Синтезированная окДНК повторно войдет в ядро с образованием кнкДНК (ковалентнонепрерывной кольцевой ДНК). HBeAg может экспрессироваться только из кнкДНК, а экспрессия HBeAg может отражать количество синтеза кнкДНК. Поэтому мы используем ИФА для определения содержания HBeAg и определения ингибирующего действия лекарственного средства на HBV. В этой клетке HBsAg может непрерывно транскрибироваться и транслироваться из интегрированной ДНК HBV. Мы также проверили содержание HBsAg, чтобы определить влияние лекарственного средства на репликацию HBV.
[90] Экспериментальные стадии: (1) Посев клеток: клетки HepAD38 с Dox, удаленным в течение 3 суток, высевали в 96-луночные планшеты и культивировали в инкубаторе CO2 при 37°C в течение 24 часов. (2) Обработка дозами: MD36792 разводили полной средой DMEM / F12 (10 % ФБС) от 333 мкМ, разбавляли 9 градиентами 3 раза подряд и 2 по две повторные лунки на градиент. Разведенный препарат добавляли к клеткам и культивировали в инкубаторе CO2 при 37°C в течение 72 часов. (3) Обнаружение: возьмите супернатант и используйте набор для обнаружения антигена HBeAg и набор для обнаружения антигена HBsAg для определения экспрессии HBeAg и HBsAg соответственно. Формула расчета: степень ингибирования антигена (%) = 100 % - (группа лекарственного средства-холостой контроль) / (клеточная контрольная группа-холостой контроль) * 100 %
[91] Результаты эксперимента. Как показано на Фиг. 2, MD36792 не оказывал ингибирующего действия на экспрессию HBeAg (антиген е) и HBsAg (поверхностный антиген) HBV.
Пример 14 Исследование активности in vitro MD36792 (дициклоплатин) в отношении вируса иммунодефицита человека (HIV)
[92] (I) Экспериментальные материалы:
1 Соединения: MD36792 и зидовудин (AZT) (коммерчески доступный).
2. Клетка: MT4 cells.
3. Вирус: вирус иммунодефицита человека (HIV).
4. Экспериментальные реагенты: среда RPMI-1640, набор для обнаружения CellTiter-Glo (Promega) и другие экспериментальные реагенты.
[93] (II) Экспериментальные методы
1. Тест на цитотоксичность MD36792
[94] Принцип эксперимента: набор CellTiter-Glo (Promega) использовали для выявления токсического действия лекарственных средств на клетки. Набор CellTiter-Glo определяет количество живых клеток в культуре путем количественного определения АТФ. Дыхание метаболически активных клеток и другие жизненные активности могут продуцировать АТФ. Стабильный тип свечения, продуцируемый люциферазой, используется в наборе Signaling, в то время как люцифераза требует АТФ в процессе эмиссии света. Равный объем реагента CellTiter-Glo добавляли к среде для культивирования клеток для измерения величины люминесценции. Световой сигнал пропорционален количеству АТФ в системе, а АТФ положительно коррелирует с количеством живых клеток. Следовательно, значение светового сигнала может отражать количество живых клеток.
[95] Этапы метода: клетки MT4 высевали в 96-луночный планшет для культивирования клеток, и прикрепляли к стенке для последующего использования. Лекарственное средство серийно разводили от 1 мМ до 9 градиентов в 9 градиентах с 2 повторностями на градиент. Лекарственное средство добавляли к клеткам и культивировали в инкубаторе CO2 при 37°C. Цитопатический эффект (CPE), вызванный лекарственным средством, наблюдали под световым микроскопом, а для определения выживаемости клеток добавляли CellTiter-Glo. Токсичность лекарственного средства в отношении клеток выражается в виде активности клеток.
[96] Формула расчета: активность клетки (%) = (группа лекарственного средства-холостой контроль) / (контрольная клетка-холостой контроль) * 100
2. Эксперименты MD36792 в отношении вируса иммунодефицита человека (HIV)
[97] Принцип эксперимента: эксперименты по защите клеток МТ-4 были использованы для обнаружения противовирусных соединений.
[98] Экспериментальные этапы: 3-х кратно разведенное лекарственное средство добавляли в 96-луночный планшет, в котором инкубировали вирус LAI и клетки MT-4, и их (клетки) инокулировали в планшете с лунками. После культивирования, когда вирус заражал контрольные лунки, появлялся значительный CPE. Реагент CellTiter-Glo добавляли и смешивали, затем детектировали сигнал хемилюминесценции.
[99] В эксперименте выделяли клеточный контроль (контроль неинфицированных клеток), вирусный контроль и положительный контроль лекарственного средства (зидовудин, AZT).
[100] Коэффициент ингибирования (%) = (группа лекарственного средства-вирусный контроль) / (клеточный контроль-вирусный контроль) * 100 % Результаты эксперимента: как показано на Фиг. 3, MD36792 не оказывает ингибирующего эффекта на ВИЧ-инфекцию, в то время как контрольный препарат зидовудин оказывает значительный ингибирующий эффект на ВИЧ.
Пример 15 Исследование in vitro активности MD36792 (бициклическая платина) в отношении вируса Эбола
[101] (I) Экспериментальные материалы
1. Соединение: MD36792.
2. Клетки: клетки MDCK.
3. Вирус: вирус Эбола.
4. Экспериментальные реагенты: среда DMEM, набор alamarBlue® (Invitrogen), набор Luciferase Assay System (Promega) и другие экспериментальные реагенты.
[102] (II) Экспериментальные методы
1. Тест на цитотоксичность MD36792
[103] Принцип эксперимента: в эксперименте используется набор alamarBlue® (Invitrogen) для определения токсического действия лекарственных средств на клетки. alamarBlue® представляет собой окислительно-восстановительный индикатор, который изменяется в поглощении и флуоресцентных сигналах на основе клеточной метаболической активности. alamarBlue® легко растворяется в воде. После того, как его окисленная форма проникает в клетки, за ней следует восстановление митохондриальными ферментами, чтобы вызвать измеримую флуоресценцию и изменение цвета. Он используется для количественного анализа жизнеспособности и пролиферации клеток, а также для исследований цитотоксичности in vitro. Этот анализ основан на способности клеток с метаболической активностью превращать реагенты в флуоресцентные и колориметрические показатели. Поврежденные и неактивные клетки имеют более низкую естественную метаболическую активность и более низкие соответствующие сигналы, поэтому сила флуоресцентного сигнала может отражать уровень активности клеток.
[104] Экспериментальная процедура. Клетки MDCK высевали в 96-луночный планшет для культивирования клеток, и прикрепляли для ожидания. Лекарственное средство серийно разводили от 1 мМ до 9 градиентов в 9 градиентах с 2 повторностями на градиент. Лекарственное средство добавляли к клеткам и культивировали в инкубаторе CO2 при 37°C. После 2 суток дозирования и инкубации наблюдение за цитопатическим эффектом (СРЕ), вызванным лекарственным средством, проводили под световым микроскопом. Затем добавляли среду alamarBlue® и инкубировали при 37°C в течение 4 часов, затем показания флуоресценции определяли при 570 нм и 595 нм. Токсичность лекарственного средства в отношении клеток выражается в виде активности клеток.
[105] Формула расчета: активность клетки (%) = (группа лекарственного средства-холостой контроль) / (контрольная клетка-холостой контроль) * 100 %
2. Эксперимент: MD36792 против вируса Эбола
[106] Принцип эксперимента: после того, как вирус Эбола, содержащий репортерный ген Rluc, заражает клетки, Rluc экспрессируется при репликации вируса. Уровень экспрессии репортерного гена Rluc может отражать уровень аденовирусной инфекции.
[107] Этапы метода: (1) Посев клеток: клетки MDCK высевали в 96-луночный планшет для культивирования клеток и использовали после прикрепления. (2) Обработка дозами: лекарственное средство постепенно разводили 3 раза на 9 групп, согласно концентрации лекарственного средства, с поддерживающей средой (2 % ФБС), и объединяли его в культуральный раствор, содержащий 2-х кратную дозу лекарственного средства с 2 повторностями на градиент. После того как клетки выросли в монослой, добавили 100 мкл 2х содержащей DMEM культуральной среды, затем 100 мкл DMEM-разведенного вируса Эбола и инкубировали при 37°C. (3) Обнаружение: после культивирования в течение 48 часов после заражения вирусом показания Rluc определяли с использованием набора для анализа люциферазы.
[108] В эксперименте выделяли вирусную контрольную группу и клеточную контрольную группу.
[109] Формула расчета: коэффициент ингибирования (%) = 100% - (группа лекарственного средства-клеточная контрольная группа) / (вирусная контрольная группа-клеточная контрольная группа) * 100 %
[110] Результаты эксперимента. Как показано на Фиг. 4, MD36792 не оказывает ингибирующего действия на инфекцию, вызванную вирусом Эбола.
Пример 16 Изучение активности in vivo дициклоплатина отдельно (перорально или посредством инъекции) у пациентов с гепатитом B, гепатитом C, инфекцией ВИЧ и вирусом Эбола.
[111] Водную инъекцию дициклоплатина приобретали у Beijing Xingda Technology System Co., Ltd., и ее концентрация составляла 50 мг/5 мл. Дициклоплатин, используемый в пероральных препаратах, готовят со ссылкой на US2016/0297842, и получают путем растворения дициклоплатина в деионизированной воде.
[112] Экспериментальные методы: (1) Двенадцати пациентам с HBV давали дициклоплатин отдельно в течение 1-3 месяцев, наблюдали вирусный индекс и индекс функции печени. Шесть из них вводили посредством внутривенного капельного введения, и 150 мг водного раствора дициклоплатина растворяли в 250 мл 5 % водного раствора декстрозы один раз каждые двое суток; 6 из них вводили перорально, и 150 мг водного раствора дициклоплатина растворяли в 250 мл 5 % водного раствора декстрозы. Раз в двое суток. (2) Дициклоплатин давали 9 пациентам с гепатитом С отдельно в течение 1-3 месяцев. Наблюдение за вирусным индексом и функцией печени проводили посредством внутривенного капельного введения. 150 мг водного раствора дициклоплатина растворяли в 250 мл 5 % водного раствора глюкозы. Его принимали один раз каждые двое суток; 6 из них принимали перорально, и 150 мг водного раствора дициклоплатина растворяли в 250 мл 5 % водного раствора глюкозы. Его принимали один раз каждые двое суток. (3) Дициклоплатин давали только 8 ВИЧ-инфицированным (вирусный индекс >> 100000 МЕ/мл) в течение 1-3 месяцев (перорально и посредством инъекции у четырех пациентов) для наблюдения вирусного индекса и функции печени; дициклоплатин (ссылка на вышеуказанный метод, внутривенный водный раствор глюкозы) давали отдельно 20 людям, инфицированным вирусом Эбола (Африка), в течение 1-3 недель, и наблюдали вирусный индекс и функцию печени.
[113] Результаты эксперимента: (1) Дициклоплатин давали 12 пациентам с гепатитом В в течение 1-3 месяцев. Ни у одного из пациентов не было тенденции к снижению вирусного индекса, в то время как вирусный индекс продолжал расти, а функция печени не улучшалась; дициклоплатин отдельно давали 9 пациентам с гепатитом С в течение 1-3 месяцев. Ни у одного из пациентов не было тенденции к снижению вирусного индекса, в то время как вирусный индекс продолжал расти, а функция печени не улучшалась; (3) 8 доз дициклоплатина отдельно давали 8 ВИЧ-инфицированным пациентам (вирусный индекс >> 100000 МЕ/мл). После 1-3 месяцев использования (перорально и посредством инъекции у четырех пациентов) ни у одного пациента не было тенденции к снижению вирусного индекса, в то время как вирусный индекс продолжал увеличиваться, а функция печени не улучшалась; дициклоплатин назначали 20 пациентам, инфицированным вирусом Эбола, в течение 1-3 недель. Ни у одного из пациентов не было тенденции к снижению вирусного индекса, и при этом вирусный индекс продолжал расти, без какого-либо контроля или ремиссии.
Пример 17 Изучение активности in vivo комбинированных продуктов, содержащих дициклоплатин, у пациентов с гепатитом B, гепатитом C и инфекцией ВИЧ.
[114] Экспериментальные методы: (1) комбинированный продукт применяли к 15 пациентам с гепатитом В (без приема каких-либо других противовирусных препаратов), и через 1-3 месяца лечения наблюдали вирусный индекс и индекс функции печени; 6 из них были протестированы путем приема капсул, содержащих комбинированные продукты, полученные в эксперименте 4, которые можно изготовить в соответствии с обычной технологией, известной специалистам в данной области техники. Что касается количества дициклоплатина, его принимали один раз каждые двое суток в дозе 150 мг дициклоплатина; в 9 случаях принимали комбинированный продукт, полученный в эксперименте 10. Что касается количества дициклоплатина, его принимали один раз каждые двое суток в капсулах в дозе 150 мг дициклоплатина; (2) комбинированный препарат использовали у 13 пациентов с гепатитом С (без какого-либо противовирусного лечения). Через 1-3 месяца лечения проводили наблюдение за вирусным индексом и показателями функции печени; 5 из них принимали комбинированный продукт, полученный в эксперименте 7. Что касается количества дициклоплатина, его принимали три раза в сутки в капсулах в дозе 50 мг дициклоплатина; 8 из них использовали комбинированный продукт, полученный в эксперименте 11. Что касается количества дициклоплатина, его принимали три раза в сутки в капсулах в дозе 50 мг дициклоплатина; (3) комбинированный продукт использовали у 8 ВИЧ-инфицированных пациентов (без приема каких-либо других противовирусных лекарственных средств), проводили наблюдение за вирусным индексом и показателями функции печени; 2 из них использовали комбинированный продукт, полученный в эксперименте 4, три раза в сутки. Что касается количества дициклоплатина, доза в капсулах составляет 50 м; 6 из них использовали комбинированный продукт, полученный в эксперименте 11. Что касается количества дициклоплатина, они использовали три раза в сутки в капсулах в дозе 50 мг дициклоплатина.
[115] Результаты эксперимента. В данном изобретении было раскрыто, что комбинированные продукты, содержащие дициклоплатин, использовали у 15 пациентов с гепатитом В (без приема каких-либо других противовирусных лекарственных средств). Через 1-3 месяца лечения вирусный индекс значительно снизился, а функции печени были в основном нормальными; комбинированный препарат, содержащий дициклоплатин, использовали у 13 пациентов с гепатитом С (без приема других противовирусных лекарственных средств). Через 1-3 месяца лечения вирусный индекс значительно снизился. В 2 случаях вирусный индекс упал ниже предела обнаружения, а индекс функции печени был в основном нормальным. Комбинированный продукт, содержащий дициклоплатин, раскрытый в данном изобретении, использовали у 8 пациентов с инфекцией ВИЧ (без приема каких-либо других противовирусных лекарственных средств). Во время лечения вирусный индекс значительно снизился, индекс CD4 значительно увеличился, а показатели функции печени были в основном нормальными.
Пример 18 Изучение активности in vivo комбинированного продукта, содержащего дициклоплатин, у пациентов с гепатитом C и инфекцией ВИЧ.
[116] В следующих случаях (1) и (2) использовали комбинированный продукт в капсулах, полученный в эксперименте 6, в котором капсулы могут быть приготовлены в соответствии с традиционными методиками, известными специалистам в данной области техники в сутки принимали 150 мг дициклоплатина в капсулах; в следующих случаях (3), (4) использовали комбинированный продукт в капсулах, полученный в эксперименте 10, в котором капсулы могут быть получены в соответствии с традиционными методиками, известными специалистам в данной области техники. Что касается дозировки дициклоплатина, в сутки принимали капсулы по 150 мг.
[117] Экспериментальные методы: (1) Пациент с гепатитом С мистер Хе, 61 год, не реагировал на антиинтерфероновые и другие противовирусными лекарственные средства. Индекс РНК-вируса продолжал расти. Индекс РНК-вируса составлял 472000 МЕ/мл. Он страдал от типичной боли в печени. Через месяц после перорального приема комбинированного продукта, содержащего дициклоплатин, пациенту проводили определение индекса РНК-вируса и показателей функции печени; (2) пациент с гепатитом С мистер Ван, 51 год, без какого-либо лечения, имеет гепатит С типа III, у которого количественный индекс РНК-вируса составлял 932000 МЕ/мл, а его печень демонстрировала типичные боль и давление. После приема комбинированного препарата, содержащего дициклоплатин, в течение одного месяца пациенту проводили наблюдение за болью и давлением в печени. Затем через два месяца проверяли индекс РНК-вируса и индекс функции печени; (3) Пациентка, 43 года, прошла вирусологический тест и у нее подтвердили наличие инфекции ВИЧ и клинического типа С2. Результаты испытаний показали, что количество лимфоцитов CD4 составляло 312, клеток CD4 составляло 319, а CD4 / CD8 = 0,58:1. Через четыре месяца после перорального приема комбинированного продукта, содержащего дициклоплатин, обнаруживали клетки CD4, CD8 и их соотношения; (4) Пациентка, 28 лет, прошла вирусологический тест и у нее подтвердили ВИЧ, 190 клеток CD4, 815 клеток CD8, а CD4 / CD8 = 0,23:1. Через шесть месяцев после перорального приема комбинированного продукта, содержащего дициклоплатин, обнаруживали клетки CD4, CD8 и их соотношения.
[118] Результаты эксперимента: (1) пациент с гепатитом С, 61-летний мистер Хе, принимал комбинированный продукт, содержащий дициклоплатин, в течение одного месяца, а количественный индекс РНК-вируса уменьшился с 472000 МЕ/мл до 4520 МЕ/мл. Основные показатели функции печени существенно не изменились, и боль пациента исчезла; (2) У больного гепатитом С мистера Вана, 51 год, после приема комбинированного продукта, содержащего дициклоплатин в течение одного месяца, боль и давление исчезли, и он продолжал принимать его в течение двух месяцев. Его индекс РНК-вируса снизился до уровня ниже 1000 МЕ/мл, а функция печени в основном была нормальной; (3) Пациентка, 43 года, указанная ранее, по данным вирусологического теста была ВИЧ-положительна и имела клинический тип C2. Результаты испытаний показали, что количество лимфоцитов CD4 составляло 312, клеток CD4 составляло 319, а CD4 / CD8 = 0,58:1. Через четыре месяца после перорального введения комбинированного продукта, содержащего дициклоплатин, результаты теста показали следующее: кол-во клеток CD4 составляло 568, CD8 составляло 606, а CD4 / CD8 = 0,92 1. (4) Пациентка 28 лет была ВИЧ-положительна при вирусологическом исследовании, а кол-во ее клеток CD4 составляло 190, CD8 составляло 815, а CD4/CD8 = 0,23:1. После шести месяцев перорального введения комбинированного продукта, содержащего дициклоплатин, вирусологический тест был негативным, кол-во CD4 составляло 563, CD8 составляло 575, а CD4/CD8 = 0,97:1.Приведенные выше результаты показывают, что дициклоплатин обладает низкой прямой противовирусной активностью. Результаты использования дициклоплатина или комбинированного продукта с дициклоплатином отдельно, полученные от пациентов, инфицированных множественными вирусами, показывают, что дициклоплатин отдельно не проявляет клинической эффективности при противовирусном лечении у пациентов. Комбинированный продукт дициклоплатина используют для лечения людей, инфицированных HCV, HBV и ВИЧ, и эффект является замечательным.
Пример 19 Исследование стабильности комбинированных продуктов, содержащих дициклоплатин.
[119] В данном изобретении раскрыта комбинация, полученная путем смешивания дициклоплатина с различными кислотами. Чтобы достичь большей стабильности дициклоплатина и попытаться улучшить его растворимость, в данном изобретении раскрыто соотношение дициклоплатина и различных кислот для образования смеси, и способы ее получения.
(1) Способ получения смеси дициклоплатина и 1,1-циклобутандикарбоновой кислоты
[120] Используя обычный способ получения, смеси могут быть получены путем смешивания дициклоплатина и определенной доли 1,1-циклобутандикарбоновой кислоты, в противном случае путем лиофилизации водной смеси дициклоплатина и определенной доли 1,1-циклобутандикарбоновой кислоты, оба полностью растворены в воде.
Отсутствие изменения стабильности дициклоплатина после смешивания определяют путем XRPD характеристики и 1H-ЯМР.
[121] Комбинированные смеси могут быть получены из карбоплатина и определенной доли 1,1-циклобутандикарбоновой кислоты в воде в качестве среды. Смеси перемешивают при 0-40°С в течение от 1 до 24 часов, затем непосредственно лиофилизируют и равномерно перемешивают, получая желаемые смеси. Или смеси могут быть получены посредством прямой лиофилизации прозрачного раствора, полученного путем добавления соответствующего количества воды к вышеуказанным смесям. Структура XRPD и 1H-ЯМР демонстрируют, что смесь состояла из дициклоплатина и 1,1-циклобутандикарбоновой кислоты. Остатка карбоплатина обнаружено не было. Этот способ получения значительно улучшает выход дициклоплатина и позволяет полностью потреблять сырье карбоплатина.
(2) Получение смеси дициклоплатина и лимонной кислоты, хлорогеновой кислоты, лимонной кислоты, галловой кислоты и т.д.
[122] Комбинированные продукты могут быть получены обычными способами. Его модно приготовить путем смешивания дициклоплатина и определенной пропорции одной или более кислот из 1,1-циклобутандикарбоновой кислоты, лимонной кислоты, хлорогеновой кислоты, лимонной кислоты, галловой кислоты, феруловой кислоты, малеиновой кислоты, салициловой кислоты и т.д.. Или его можно приготовить путем тщательного растворения дициклоплатина и определенной пропорции одной или более кислот в воде и последующей лиофилизации, при этом кислоты представляют собой 1,1-циклобутан-дикарбоновую кислоту, лимонную кислоту, хлорогеновую кислоту, лимонную кислоту, галловую кислоту, феруловую кислоту и малеиновую кислоту, салициловую кислоту и т.д. Отсутствие изменения стабильности дициклоплатина после смешивания определяют путем XRPD характеристики и 1H-ЯМР.
(3) Приготовление дициклоплатина или продуктов его комбинации с другими компонентами.
[123] Дополнительные другие компоненты включают коэнзим Q10, куркумин, глутатион (GSH), оризанол, витамин С и антоцианины.
[124] Как показано в примерах 5-10, приготовление комбинированных продуктов с использованием дициклоплатина в качестве основного активного ингредиента может осуществляться либо обычными способами, либо специальным способом приготовления для конкретной ситуации.
[125] Во многих примерах дициклоплатин получают в виде лиофилизированного порошка и водной инъекции с использованием воды в качестве носителя. Эксперименты по стабильности показывают, что состав сохраняет хорошую стабильность. Во многих примерах дициклоплатин обладает хорошей совместимостью и стабильностью с соответствующими фармацевтическими наполнителями и, таким образом, из него изготавливают соответствующие пероральные препараты.
Пример 20 Исследование стабильности дициклоплатина с 1,1-циклобутандикарбоновой кислотой и эксципиентами
[126] Стабильность комбинированного продукта, содержащего дициклоплатин, в течение восьми недель подряд показана в Таблицах 1-4 ниже.
[127] 1. Твердый продукт и продукт в виде раствора, образованный дициклоплатином и 1,1-циклобутандикарбоновой кислотой (от 1:1,2 до 1:20 дициклоплатина в кислоте), являются стабильными при 40°C. Указанный выше твердый продукт исследовали в течение восьми последовательных недель в/на свету, и результаты показали, что он был стабильным.
Таблица 1. Исследование стабильности дициклоплатина с 1,1-циклобутандикарбоновой кислотой и эксципиентами
свойство
DCP( %)
DCP( %)
DCP( %)
DCP( %)
На свету
[128] 2. Твердый продукт, образованный дициклоплатином и кислотами, такими как витамин С, галловая кислота, салициловая кислота, лимонная кислота, феруловая кислота и т.д., являлся стабильным при 40 °C.
Таблица 2. Стабильность твердых композиций, образованных дициклоплатином и кислотами, такими как витамин С, галловая кислота, салициловая кислота, лимонная кислота, феруловая кислота и т.д.
DCP( %)
сутки
DCP( %)
суток
DCP( %)
суток DCP( %)
[129] 3. Продукт в виде раствора, образованный дициклоплатином и галловой кислотой, салициловой кислотой, лимонной кислотой, феруловой кислотой и т.д., начинает разлагаться при 40°C в основном через две недели.
Таблица 3. Стабильность продукта в виде водного раствора, образованного дициклоплатином и галловой кислотой, салициловой кислотой, лимонной кислотой, феруловой кислотой,
DCP( %)
DCP( %)
[130] 4. Эксперименты по стабильности смешивания дициклоплатина с соответствующими наполнителями доказывают, что смеси с одним или более эксципиентами являются стабильными в течение 8 последовательных недель при 40°C.
Таблица 4. Эксперименты по стабильности смешивания дициклоплатина с соответствующими эксципиентами
Микроскопический порошковый кремний
Примечания:
1. MD36792 относится к дициклоплатину;
2. Соотношение относится к молярному соотношению дициклоплатина (DCP) к 1,1-циклобутандикарбоновой кислоте;
3. Экспериментальные условия высокой температуры T=40°;
4. Условия эксперимента по освещению представляли собой 2000 лк;
5. Концентрация раствора: 1 мг/мл;
6. Ошибка находится в диапазоне 2 % вверх и вниз.
Пример 21 Влияние дициклоплатина на боль и воспаление
[131] Авторы данной заявки обнаружили, что дициклоплатин, в качестве основного активного ингредиента, проявляет значительный эффект при лечении боли у пациентов с раком. Среди пациентов с раком он особенно подходит пациентам с прогрессирующим раком печени, раком почки, метастазами в кости, метастазами в головном мозге и раком кости. Пациенты могут принимать лечение с использованием инъекции дициклоплатина или пероральных препаратов в качестве единственного метода лечения, как показано в таблице 5. Авторы изобретения также обнаружили, что у определенного количества пациентов с прогрессирующим раком не проявлялась чувствительность к дициклоплатину и не проявлялись эффекты подавления опухоли. Однако очевидное облегчающее действие дициклоплатина на боль при раке все еще очевидно, и боль даже исчезает. Некоторые пациенты прекратили использование дициклоплатина после определенного курса лечения дициклоплатином, и боль не возникала снова.
Таблица 5. Влияние дициклоплатина на боль как основного действующего вещества
( без использования DCP)
5 случаев
2 случаев
1 случай: в определенной степени эффективный
1 случай
[132] Дозу вышеуказанные пациенты с раком принимали один раз в двое суток, посредством внутривенного капельного введения 150 мг/5 % водного раствора глюкозы. Используемая инъекция дициклоплатина была приобретена у Beijing Xingda Technology System Co., Ltd. Концентрация составляла 50 мг/5 мл.
[133] При клиническом лечении пациентов с опухолью было обнаружено, что дициклоплатин оказывает хорошее влияние на вызванный опухолью отек и воспаление тканей. Во многих случаях пациентов с метастазами в головном мозге от рака легкого, которые принимали дициклоплатин перорально или посредством инъекции, было обнаружено, что после одной-двух недель лечения дициклоплатином отек тканей, вызванный метастазированием рака в головной мозг, был в основном устранен. Это показывает, что дициклоплатин обладает хорошим противовоспалительным действием при воспалении. Во многих случаях пациентов с раком печени с отеком ткани печени, после инфузии дициклиоплатина или перорального приема в течение определенного периода времени, отек ткани значительно исчезал или уменьшился.
Пример 22 Антивирусные эффекты других компонентов AA011 и VK021 отдельно
[134] Информация AA011 и VK021 представлена в Таблице 6.
( мг)
[135] Как показано на Фиг. 5, антивирусные эффекты AA011, VK021 и положительных лекарственных средств представлены на фигуре ниже. Положительное лекарственное средство 2ʹCMC обладает хорошим антивирусным эффектом, а антивирусный эффект лучше с увеличением дозы лекарственного средства. Добавка AA011 обладает определенным антивирусным эффектом при концентрации 1000 мкМ и 250 мкМ, а при 1000 мкМ нет очевидной цитотоксичности. Добавка VK021 также обладает определенным антивирусным эффектом при концентрации 1000 мкМ и 250 мкМ, но обладает слабой цитотоксичностью при концентрации 1000 мкМ.
Пример 23 Эффективность in vitro MD36792 и комбинированных композиций, содержащих MD36792, AA011 и VK021 в отношении вируса HCV
[136] Образец MD36792, AA011 и VK021 и их тестирование, как показано в таблице 7.
[137] Антивирусный эффект MD36792, AA011 и VK021 был показан на Фиг.6.
[138] Антивирусный эффект комбинации MD36792 и AA011 был показан как A на Фиг.6, тогда как MD36792 и VK021 были показаны как V на Фиг.6. EC50 для одного MD36792 составляет 15,62 мкг/мл, токсическая CC50 для клеток составляет 69,4, а индекс отбора SI антивирусного эффекта составляет 4,44. Индекс отбора относительно низок, что можно считать определенным противовирусным эффектом, но токсичность для клеток относительно велика. Антивирусные эффекты MD36792 в сочетании с AA011 и VK021 составляют EC50, равная 4,43 мкг/мл, CC50, равная 24,82 и SI равный 5,6. Смешанное использование трех образцов более токсично для клеток, а индекс отбора не очень велик. Антивирусный эффект от комбинированного применения MD36792 отдельно на клеточном уровне значительно не улучшился.
Пример 24 Исследование обезболивающего эффекта MD36792
[139] (I) Экспериментальные материалы, животные и оборудование
Животные: 50 мышей ICR, 18-22 г (Changsha Sleck Jingda Experimental Animal Company)
Реагент: ротундин (производство Guangzhou Baiyunshan Pharmaceutical).
инструмент: стеклянный колпак
Лекарственное средство: MD36792
[140] (II) Экспериментальные методы и экспериментальные результаты
[141] Экспериментальный метод: животных кормили адаптивно в течение 5 суток и измеряли массу тела мышей. Используя стратифицированное случайное разделение на группы, 50 мышей были случайным образом разделены на 5 групп, дистиллированную воду использовали в качестве группы холостого контроля, т.е. модельной группы, Ротундин, использованный для группы положительного контроля, относился к 100 мг/кг, 1 мг/мл; водный раствор MD36792, используемый для группы с низкой дозой, относился к 10 мг/кг, 2 мг/мл; водный раствор MD36792, используемый для группы со средней дозой, относился к 20 мг/кг и 4 мг/мл; водный раствор MD36792, используемый для группы с высокими дозами, относился к 40 мг/кг. Мышам, отнесенным к группе MD36792 и группе положительного контроля, давали соответствующие препараты. Через 1 час после введения мышам в каждой группе внутрибрюшинно вводили 0,8 % уксусную кислоту (0,2 мл/особь). Количество скручивания мышей наблюдали и регистрировали в течение 15 минут.
Таблица 8.
* По сравнению с модельной группой (то есть группой холостого контроля) существует статистически значимая разница, P <0,05 **
* По сравнению с модельной группой (то есть группой холостого контроля) существует статистически значимая разница, P <0,01
[142] В течение 15 минут после внутрибрюшинной инъекции 0,8 % уксусной кислоты среднее количество скручиваний в модельной группе достигало 19 раз. По сравнению с модельной группой, группа с высокими дозами MD36792 (40 мг/кг) и группа положительного контроля (ротундин, 100 мг/кг) статистически достоверно подавляли количество скручиваний у мышей (P = 0,009 или P = 0,000 соответственно) ). MD36792 не зависит от дозы с точки зрения обезболивающих эффектов, что показано на Фиг. 7.
[143] Поэтому для оценки обезболивающего эффекта лекарственных средств была использована классическая модель, индуцированная уксусной кислотой. Приведенные выше данные, полученные из модели, показали, что как MD36792, так и лекарственное средство положительного контроля Ротундин обладают значительными обезболивающими эффектами.
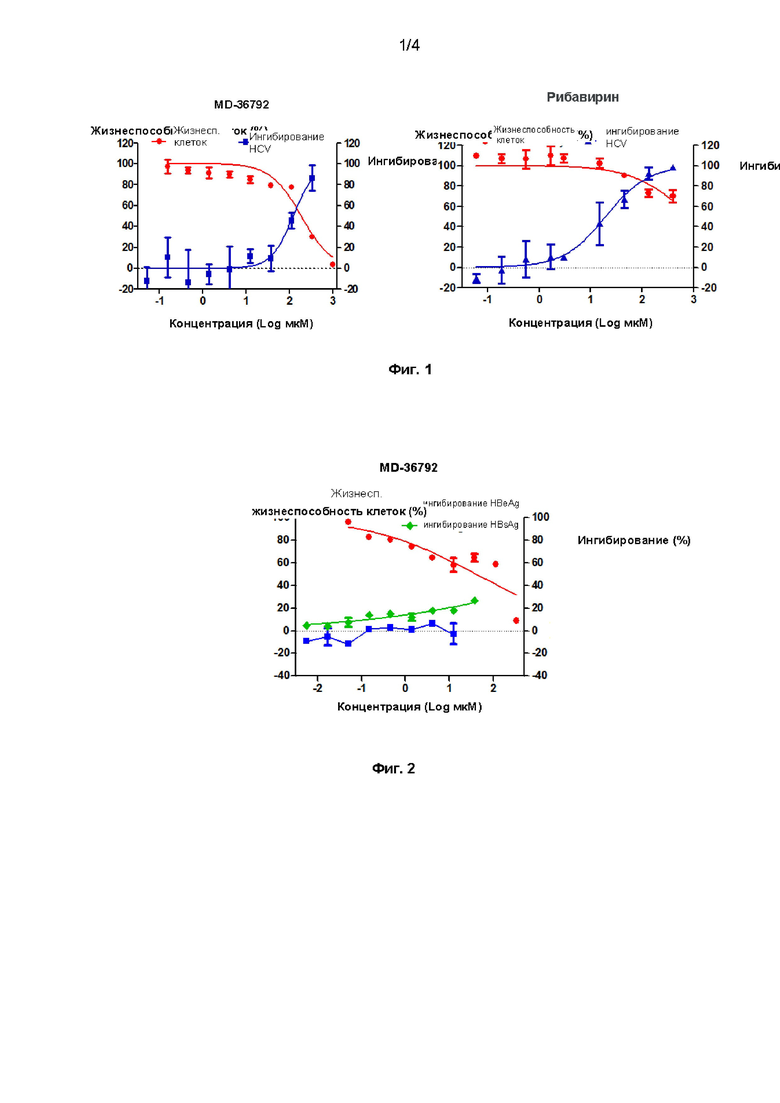
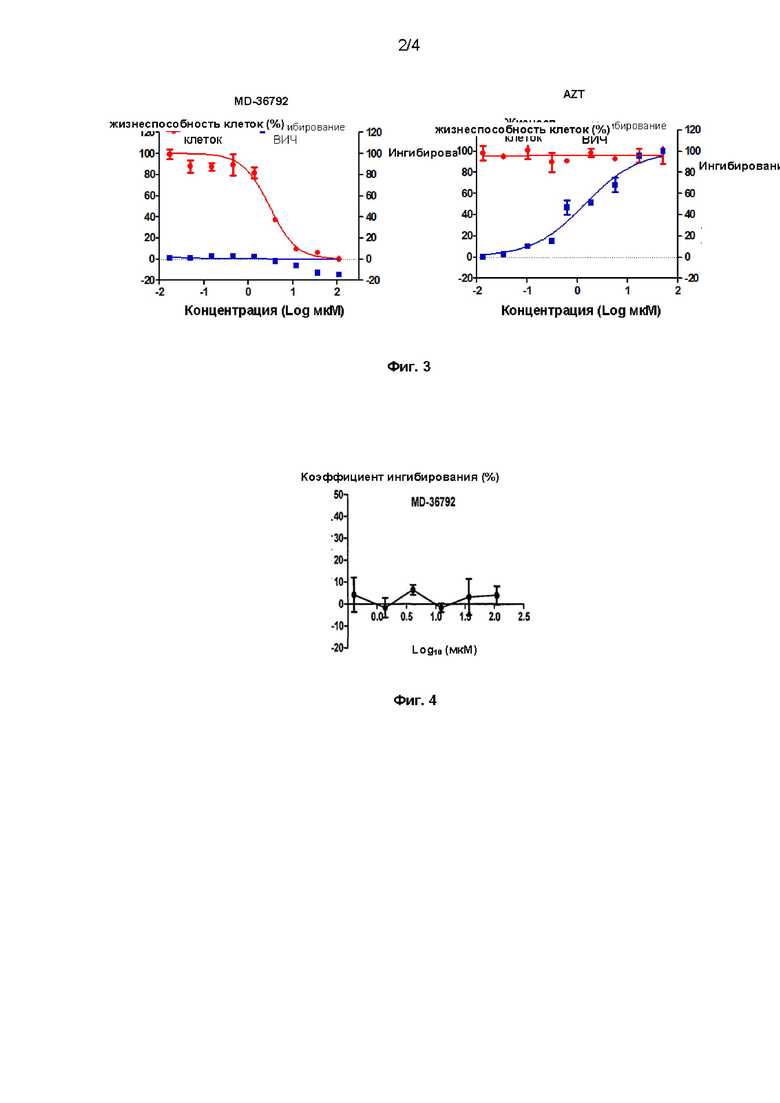
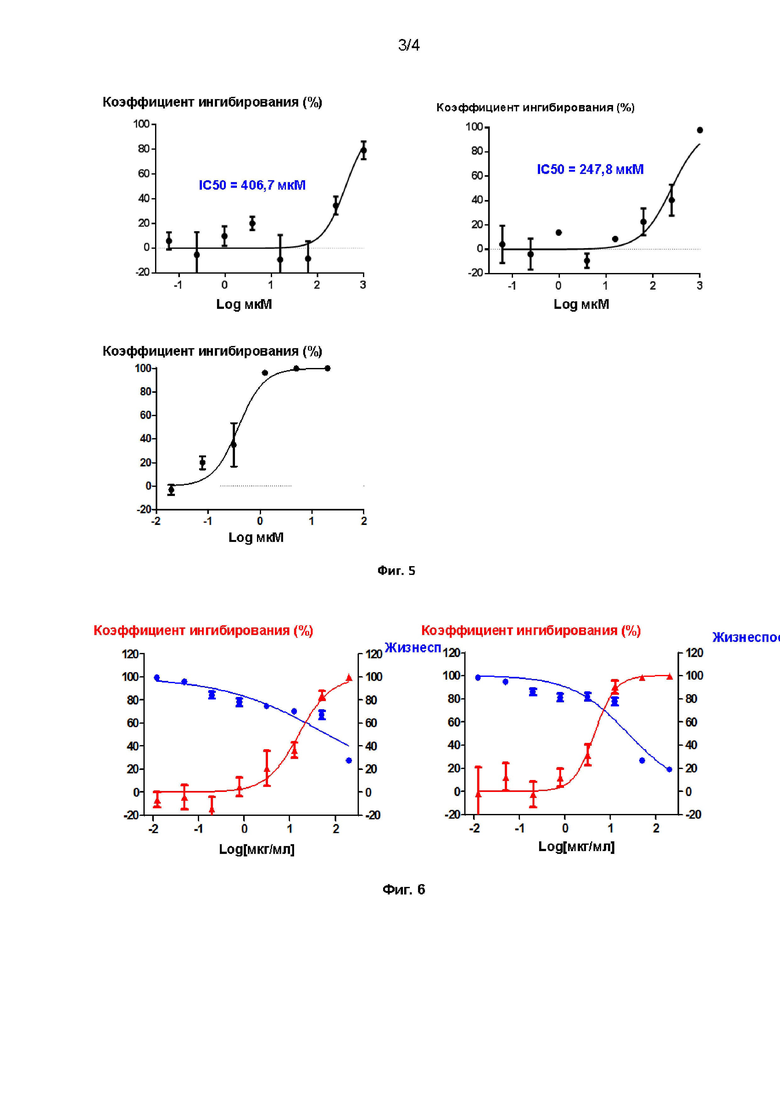

Изобретение относится к области медицины, а именно к неврологии и терапии, и предназначено для лечения и/или предотвращения боли. Способ лечения и/или предотвращения боли включает введение эффективной дозы дициклоплатина нуждающемуся в этом пациенту. Использование изобретения позволяет со значительной эффективностью предотвращать и/или устранять на длительный период времени боль. 12 з.п. ф-лы, 7 ил., 8 табл., 24 пр.
1. Способ лечения и/или предотвращения боли, включающий введение эффективной дозы дициклоплатина нуждающемуся в этом пациенту.
2. Способ по п. 1, в котором пациент представляет собой пациента с раком.
3. Способ по п. 1, в котором пациент представляет собой пациента с раком печени, пациента с раком почки, пациента с метастазами в кости, пациента с метастазами в головном мозге или пациента с раком кости.
4. Способ по п. 1, в котором пациент представляет собой пациента с прогрессирующим раком.
5. Способ по п. 1, в котором пациент представляет собой пациента, который уже развил устойчивость к противораковому препарату на основе платины.
6. Способ по п. 1, в котором пациент представляет собой пациента с прогрессирующим раком печени.
7. Способ по любому из пп. 1-6, в котором эффективная доза дициклоплатина для лечения и/или предотвращения боли ниже, чем эффективная доза дициклоплатина для лечения рака у указанного пациента.
8. Способ по любому из пп. 1-7, в котором дициклоплатин является единственным активным ингредиентом для лечения и/или предотвращения боли.
9. Способ по любому из пп. 1-7, дополнительно включающий введение пациенту одного или более дополнительных активных ингредиентов, обладающих анальгетическим эффектом.
10. Способ по любому из пп. 1-9, дополнительно включающий введение пациенту одного или более активных ингредиентов, обладающих противораковым эффектом, причем один или более активных ингредиентов, обладающих противораковым эффектом, выбраны из противораковых лекарственных средств не на основе платины.
11. Способ по п. 1, в котором пациент не является пациентом с раком.
12. Способ по п. 11, в котором дициклоплатин является единственным активным ингредиентом для лечения и/или предотвращения боли.
13. Способ по п. 11, дополнительно включающий введение пациенту одного или более дополнительных активных ингредиентов, обладающих анальгетическим эффектом.
| WO 2008059126 A1, 22.05.2008 | |||
| WO 2016205782 A1, 22.12.2016 | |||
| WO 2016172393 A1, 27.10.2016 | |||
| JING JIE YU et al | |||
| Dicycloplatin, a novel platinum analog in chemotherapy: synthesis of chinese pre-clinical and clinical profile and emerging mechanistic studies | |||
| Anticancer Res., 2014, 34(1):455-63. |
Авторы
Даты
2022-11-29—Публикация
2018-11-19—Подача