Изобретение относится к области органической химии, а именно к структуре, противомикробной активности и способу получения новых индивидуальных соединений класса 2-тиоксо-1,2,3,3а-тетрагидро-6Н-пирроло[2',3':3,4]фуро[2,3-d]имидазол-6,7(8Н)-дионов, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии.
Ранее получение соединений, содержащих трициклический фрагмент 2-тиоксо-1,2,3,3а-тетрагидро-6Н-пирроло[2',3':3,4]фуро[2,3-d]имидазол-6,7(8Н)-диона, в литературе описано не было.
Получение 8-гидрокси-1,3,6-триазаспиро[4.4]нон-8-ен-2,4,7-трионов, являющихся структурными аналогами заявляемого соединения, возможно при спиробисгетероциклизации пирролобензоксазинтрионов (1) с дициклогексилмочевиной (Khramtsova Е.Е., Lystsova Е.А., Khokhlova E.V., Dmitriev M.V., Maslivets A.N.. Amination of 5-Spiro-Substituted 3-Hydroxy-l, 5-dihydro-2H-pyrrol-2-ones // Molecules. - 2021. - V. 26. - №. 23. - P. 7179. doi: 10.3390/molecules26237179) по схеме:
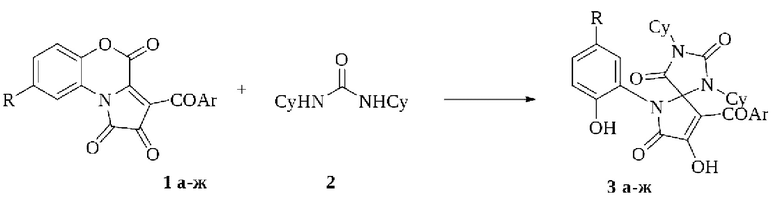
1, 3 - Ar = Ph, R = H (a); Ar = C6H4OMe-4, R = H (б); Ar - CeH4OMe-4, R = H (в); Ar= Ph, R=Cl (r); Ar = C6H4Me-4, R = H (д); Ar = C6H4NO2-4, R = H (e);
Ar = C6H4Cl-4, R=H (ж).
Получение иных структурных аналогов заявляемого соединения - 6,6а-дигидро-1Н-фуро[3,4-b]пиррол-2,3-дионов - возможно при взаимодействии 4-бензоилпиррол-2,3-дионов (4) с изонитрилами (Moroz A.A., Zhulanov V.E., Dmitriev M.V., Maslivets A.N. Diversity-oriented synthesis of three skeletally diverse iminolactones from isocyanides, activated acetylenes and 1H-pyrrole-2,3-diones via [3+2] and [4+1] cycloaddition reactions // Tetrahedron. -2020. - V. 76. - №. 5. - P. 130880. doi: 10.1016/j.tet.2019.130880) по схеме:
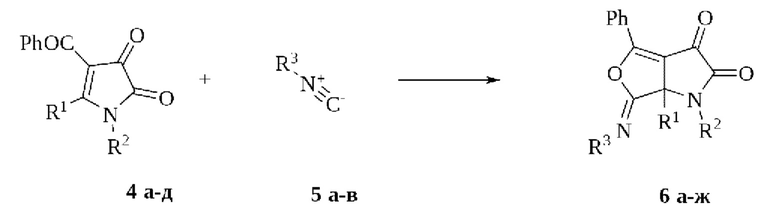
4: R1 = COOMe, R2 = C6H4Cl-4 (a); R1= COOMe, R2 = Ph (б); R1 = COOEt, R2 =- Ph (в); R1 = COOMe, R2 = C6H4OMe-4 (r); R1 = Ph, R2=- Ph (д);
5: R3 = CH2Ts (a); R3 - Cy (б); R3 - Adamantyl-l (в);
6: R1 = COOMe, R2=- C6H4Cl-4, R3 = CH2Ts (a); R1 = COOMe, R2 = Ph, R3 = CH2Ts (б); R1 = COOEt, R2 = Ph, R3 = CH2Ts (в); R1 = COOMe, R2 = C6H4OMe-4, R3 = CH2Ts (r); R1 = Ph, R2=- Ph, R3 = CH2Ts (д); R1 = Ph, R2 = Ph, R3 = Cy (e); R1=Ph, R2=Ph, R3=Adamantyl-1 (ж).
К недостаткам данных способов относится невозможность получить 3-метил-8-(4-метоксифенил)-2-тиоксо-3а,5-ди(4-толил)-1,2,3,3а-тетрагидро-6Н-пирроло[2',3':3,4]фуро[2,3-d]имидазол-6,7(8Н)-дион, обладающий противомикробной активностью.
Задачей изобретения является разработка простого способа синтеза неописанного в литературе 3-метил-8-(4-метоксифенил)-2-тиоксо3,5-ди(4-толил)-1,2,3,3а-тетрагидро-6Н-пирроло[2',3':3,4]фуро[2,3-d]имидазол-6,7(8Н)-диона (7) и расширение арсенала средств воздействия на живой организм.
Поставленная задача осуществляется путем осуществления взаимодействия 4,5-бис(4-метилбензоил)-1H-пиррол-2,3-диона с метилтиомочевиной в среде растворителя с последующим выделением целевого продукта по следующей схеме:
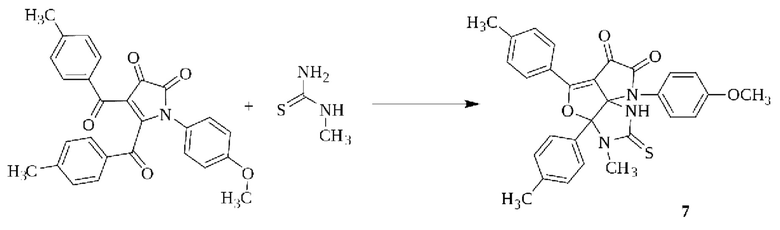
Процесс ведут при температуре 100-102°С, а в качестве растворителя используют 1,4-диоксан.
Из патентной и технической литературы не были выявлены сведения о структуре и способах получения 3-метил-8-(4-метоксифенил)-2-тиоксо-3а,5-ди(4-толил)-1,2,3,3а-тетрагидро-6Н-пирроло[2',3':3,4]фуро[2,3-а]имидазол-6,7(8Н)-диона, раскрывающие признаки, сходные с заявляемым изобретением, а именно, не использовались исходные продукты, растворители, в которых проходит реакция, и интервал температур.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение 3-метил-8-(4-метоксифенил)-2-тиоксо-3а,5-ди(4-толил)-1,2,3,3а-тетрагидро-6Н-пирроло[2',3':3,4]фуро[2,3-d]имидазол-6,7(8Н)-дион (7).
Смесь 10 ммоль 4,5-бис(4-метилфенил)-1Н-пиррол-2,3-диона и 10 ммоль метилтиомочевины в 20 мл 1,4-диоксана кипятили 10 ч (до исчезновения оранжевой окраски пирролдиона), растворитель удаляли, остаток перекристаллизовывали из ацетона. Выход 25%, т.пл. 216-219°С (ацетон).
Соединение (7) C29H25N3O4S.
Найдено, %: С 68.38; Н 5.25; N 7.95; S 6.01
Вычислено, %: С 68.08; Н 4.93; N 8.21; S 6.27
Соединение (7) - бледно-желтое кристаллическое вещество труднорастворимое в хлороформе, алканах и воде, растворимое в ДМСО, Устойчиво при хранении в обычных условиях.
Спектр ЯМР:1Н, ДМСО-d6, δ, м.д.: 2.34 с (3Н), 2.49 с (3Н), 3.07 с (3Н), 3.77 с (3Н), 6.36-6.47 м (2Н), 6.71 д (2Н, J 8.0 Гц), 6.77-6.86 м (2Н), 7.15 д (2Н, J 8.0 Гц), 7.55 д (2H, J 8.1 Гц). 8.22 д (2Н, J 8.1 Гц), 10.27 с (1H). Спектр ЯМР 13С, ДМСО-d6, δ, м.д.: 20.6, 21.5, 31.4, 55.3, 88.2, 107.3, 109.6, 113.8 (2С), 122.8, 126.2, 126.2, 126,7 (2С)3 128.0 (2С), 129.4 (2С), 1.29.6 (2С), 1.30.0 (2С), 140.4, 146.3, 158.8, 162.7, 164.5, 173.9, 1.83.2.
Пример 2. Фармакологическое исследование соединения (7) на наличие противомикробной активности,
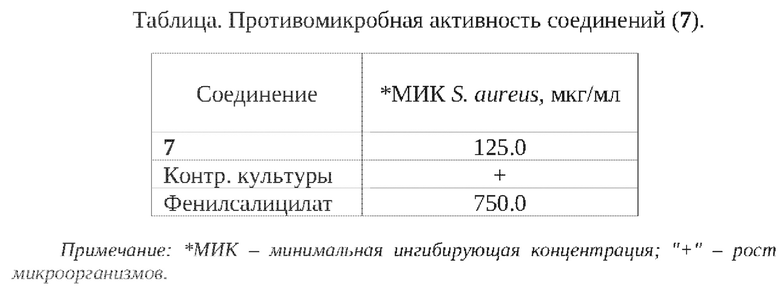
Противомикробные свойства химического вещества изучали на коллекционном условно-патогенном штамме микроорганизмов Staphylococcus aureus (штамм 906).
Противомикробное действие выявляли методом двукратных серийных разведений в соответствии с методическими указаниями по изучению противомикробной активности препаратов [Хабриев Р.У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. - М.: И-во Медицина, 2005, - 832 с.]. Готовили исходные разведения микроорганизмов в физиологическом растворе из суточной агаровой культуры по оптическому стандарту мутности (ОСО) на 5 ME с использованием денситометра. После ряда разведений конечная концентрация клеток в опыте составляла 2.5×105 клеток/мл. В лунках стерильного 96 луночного плоскодонного микропланшета готовили два. параллельных ряда двукратных серийных разведений химических соединений в бульоне РПБ. В каждой лунке содержалось 100 мкл определенной концентрации испытуемого вещества и 100 мкл инокулята культуры. В последних рядах содержалась питательная среда и культура в равных объемах (контроль). Максимально испытанная концентрация соответствовала 1000.0 мкг/мл, минимальная - 2.0 мкг/мл. Микропланшет помещали в термостат спектрофотометра Epoch и замеряли оптическую плотности (ОП) при длине волны 540 нм. Через 24 часа вновь регистрировали ОП культуральной жидкости.
Результаты оценивали с помощью программного обеспечения Gen 5 спектрофотометра для микропланшет Epoch. Последняя лунка ряда с задержкой роста и показателями ОП равной оптической плотности контрольной лунки соответствует минимальной подавляющей концентрацией соединения.
Противомикробную активность оценивали по минимально действующей концентрации. Эталоном сравнения служил известный в медицинской практике фенилсалицилат.
Проведенные исследования показали (см. таблицу), что соединение (7) проявляет ингибирующее действие относительно штамма Staphylococcus aureus в концентрации - 125,0 мкг/мл.
Предлагаемый способ прост в осуществлении, одностадиен и позволяет получить неописанный в литературе 3-метил-8-(4-метоксифенил)-2-тиоксо-3а,5-ди(4-толил)-1,2,3,3а-тетрагидро-6Н-Пирроло[2',3':3,4]фуро[2,3-d]имидазол-6,7(8Н)-дион (7), который может найти применение в качестве исходного продукта для синтеза гетероциклических систем и в качестве потенциального лекарственного средства в фармакологии.
Группа изобретений относится к органической химии и включает 3-метил-8-(4-метоксифенил)-2-тиоксо-3а,5-ди(4-толил)-1,2,3,3а-тетрагидро-6Н-пирроло[2',3':3,4]фуро[2,3-d]имидазол-6,7(8Н)-дион формулы
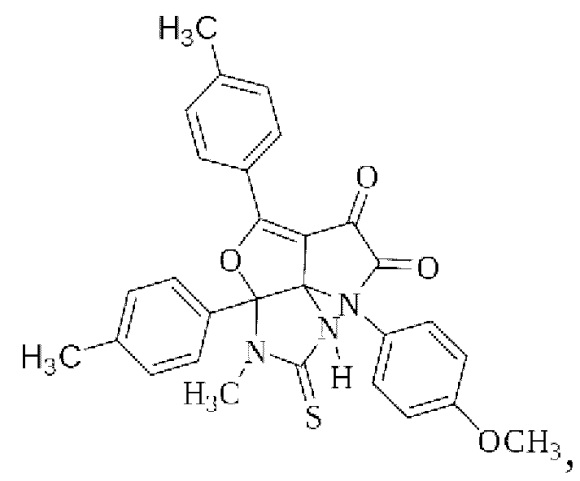
а также способ его получения. Технический результат - 3-метил-8-(4-метоксифенил)-2-тиоксо-3а,5-ди(4-толил)-1,2,3,3а-тетрагидро-6Н-пирроло[2',3':3,4]фуро[2,3-d]имидазол-6,7(8Н)-дион, обладающий противомикробной активностью, который может быть использован в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии. 2 н.п. ф-лы, 1 табл., 2 пр.
1. 3-Метил-8-(4-метоксифенил)-2-тиоксо-3а,5-ди(4-толил)-1,2,3,3а-тетрагидро-6Н-пирроло[2',3':3,4]фуро[2,3-d]имидазол-6,7(8Н)-дион
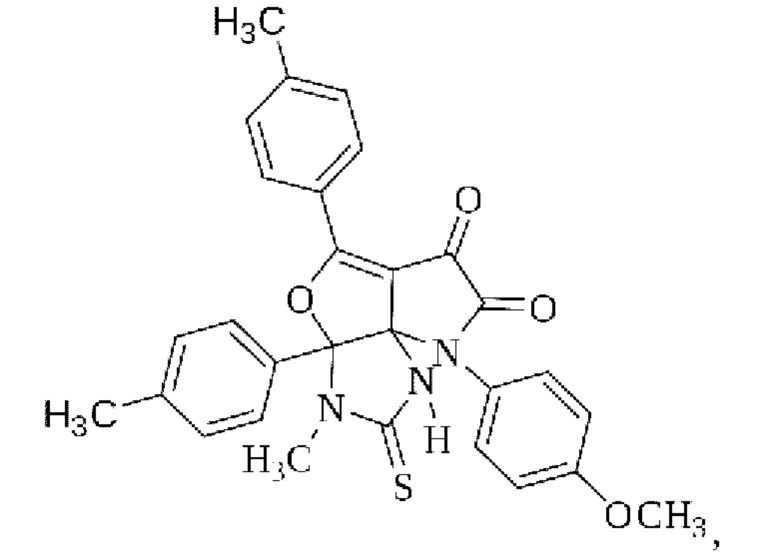
обладающий противомикробной активностью.
2. Способ получения 3-метил-8-(4-метоксифенил)-2-тиоксо-3а,5-ди(4-толил)-1,2,3,3а-тетрагидро-6Н-пирроло[2',3':3,4]фуро[2,3-d]имидазол-6,7(8Н)-диона по п. 1, при котором осуществляют взаимодействие 4,5-бис(4-метилбензоил)-1H-пиррол-2,3-диона с метилтиомочевиной в растворителе - 1,4-диоксане - при температуре 100-102°С в течение 10 часов по следующей схеме:
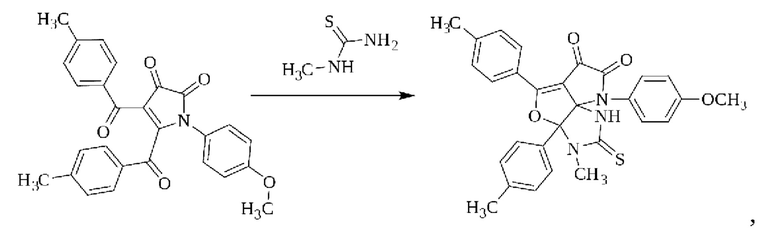
с последующим выделением целевого продукта.
| N-(4-Метоксифенил)-3,4-ди(4-метилбензоил)-1Н-пиразол-5-карбоксамид, обладающий противомикробной активностью, и способ его получения | 2021 |
|
RU2767658C1 |
| (Z)-5-замещенные-3-(гидрокси(арил)метилен)-3а-(фенилтио)-3,3а-дигидропирроло[1,2-a]хиноксалин-1,2,4(5H)-трионы, обладающие противомикробной активностью | 2021 |
|
RU2759006C1 |
| Дмитриев Е.В | |||
| и др., Синтез и противомикробная активность нафто[2',3':4,5]фуро[3,2-b]пирролов | |||
| Исследование биологической активности гетероциклов с целью создания инновационных лекарственных препаратов | |||
| Материалы Международного симпозиума | |||
| Пермь, 2017, с.24-25 | |||
| US 4180580 A1, 25.12.1979. | |||
Авторы
Даты
2022-12-05—Публикация
2022-04-28—Подача