Изобретение относится к области ветеринарной микробиологии, иммунологии и биотехнологии и может быть использовано при производстве инактивированных иммунобиологических средств в виде моно- и поливалентных препаратов, предназначенных для профилактики инфекции птиц, вызванной Gallibacterium anatis. Штамм депонирован во Всероссийской государственной коллекции патогенных и вакцинных штаммов микроорганизмов-возбудителей инфекционных болезней животных Федерального научного центра - Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко Российской академии наук под номером В-1364.
Галлибактериоз - является инфекционным заболеванием птицы, проявляющийся поражением респираторной и/или репродуктивной системы. Возбудителем галлибактериоза является микроорганизм рода Gallibacterium anatis, относящийся к семейству Pasteurellaceae, впервые был выделен от птицы Mushin в 1980. Данный патоген провоцирует широкий спектр инфекционных поражений: пневмонию, гепатит, перикардит, оофорит, сальпингит, дегенерацию фолликулов, энтерит, перитонит, бактериемию и септимицию, совместно ведущим к снижению яичной продуктивности, а также к выбраковке и/или гибели птицы.
Gallibacterium anatis - это грамотрицательные биполярная неподвижная коккобацилла, не способная образовывать споры. Как известно из литературных источников, Gallibacterium anatis является нормальным обитателем нижних и верхних дыхательных путей, а также органов репродуктивной системы у птиц. При этом микроорганизм не является первичным возбудителем, а протекает как вторичная инфекция, вызывающая такие патологии как: пневмонию, перикардит, гепатит, оофорит, сальпингит, дегенерацию фолликулов, энтерит, перитонит, бактериемию и септицемию, совместно влекущими к существенному снижению яичной продуктивности. К галлибактериозу восприимчив ремонтный молодняк, а также родительское стадо. Разница в заболеваемости при разных типах содержания и выращивания не наблюдается. Основным путем распространения инфекции является горизонтальный путь передачи.
Ввиду развития и распространения резистентности бактерий к антибиотикам и дезинфицирующим средствам борьба с обозначенным заболеванием зачастую малоэффективна. Большей эффективностью обладает специфическая профилактика инфекций. Именно на решение этой задачи направленно данное изобретение.
Уровень техники
В настоящее время известны следующие штаммы Gallibacterium anatis, предназначенные, в том числе, для получения иммуногенных композиций и профилактики галлибактериоза сельскохозяйственных птиц:
Штамм G. anatis - 12646-12 и 12654-12, предложенные авторами для изучения патогенных свойств на цыплятах. У цыплят, подвергшихся внутрибрюшинному заражению G. anatis или через яйцевод, развивается перитонит. При этом, были доказательства бактериальной инвазии селезенки и печени птицы, демонстрирующее способность возбудителя провоцировать системные инфекции. Таким образом данные культуры являются перспективными для использования в виде штаммов «пробойников» в рамках контроля иммуногенной активности иммунобиологических средств против галлибактериоза [Anders Miki Bojesen, Ole Lerberg Nielsen, Jens Peter Christensen, Magne Bisgaard. In vivo studies of Gallibacterium anatis infection in chickens. Avian Pathology 2010. 145-152]. Помимо этого, штамм Gallibacterium anatis 12656-12, был предложен в качестве кандидатной культуры при производстве вакцин против галлибактериоза птиц. По мнению авторов данный штамм обладает хорошей протективной активностью за счет наличия у него субъединичного белка FlfA [Ragnhild J. Bager, Barbara Nesta, Susanne E. Pors, Marco Soriani, Laura Serino, John D. Boyce, Ben Adler, Anders M. Bojesen. The Fimbrial Protein FlfA from Gallibacterium anatis Is a Virulence Factor and Vaccine Candidate. Infectiom and Immunity. 2013, 1964-1973].
Ввиду обозначенного штамм Gallibacterium anatis 12656-12 может являться наиболее близким прототипом заявляемому изобретению.
Технической проблемой, на решение которой направлено данное изобретение, является получение новых культур Gallibacterium anatis, отвечающих требованиям, предъявляемым к производственным штаммам (по культуральным, ростовым, морфологическим, тинкториальным, биологическим, антигенным, иммуногенным и т.д. свойствам) и пригодных для конструирования и производства высокоэффективных иммунобиологических средств, в частности моно- и поливалентных вакцин против галлибактериоза сельскохозяйственных птиц.
Раскрытие сущности изобретения
Технический результат изобретения заключается в стандартизации технологии производства иммунобиологических средств специфической профилактики галлибактериоза сельскохозяйственных птиц за счет использования изученного и охарактеризованного штамма Gallibacterium anatis, отвечающего требованиям, предъявляемым к производственным культурам (по культуральным, ростовым, морфологическим, тинкториальным, биологическим, антигенным, иммуногенным и т.д. свойствам). Изобретение служит средством расширения арсенала моно- и поливалентных вакцин, направленных на специфическую профилактику инфекционных болезней сельскохозяйственных птиц, с высокой стабильностью, антигенной, иммуногенной и протективной активностью.
Для производства иммунобиологических средств против галлибактериоза сельскохозяйственных птиц предлагается новый хорошо изученный и охарактеризованный штамм Gallibacterium anatis, депонированный во Всероссийской государственной коллекции патогенных и вакцинных штаммов микроорганизмов-возбудителей инфекционных болезней животных ФГБНУ ФНЦ ВИЭВ РАН под номером В-1364. Использование предложенного штамма при производстве иммунобиологических средств позволит повысить уровень эпизоотического благополучия по галлибактериозу сельскохозяйственных птиц на территории страны.
Осуществление изобретения
Приведенные ниже примеры являются иллюстративными и тем самым не ограничивают рамки настоящего изобретения.
Пример №1. Авторский штамм микроорганизма Gallibacterium anatis - №1630 ВИЭВ
1. Номер штамма во «Всероссийской государственной коллекции патогенных и вакцинных штаммов микроорганизмов-возбудителей инфекционных болезней животных»: В-1364
2. Дата депонирования: 01.03.2021
3. Вид микроорганизма: Gallibacterium anatis
4. Основание для депонирования: предназначен для изготовления и контроля вакцин против галлибактериоза птиц
5. Патогенность: в соответствии с классификацией микроорганизмов-возбудителей инфекционных заболеваний человека, простейших, гельминтов и ядов биологического происхождения по группам патогенности санитарных правил 1.3.2322-08 «Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителями паразитарных болезней» бактерия вида Gallibacterium anatis не относится ни одной из четырех групп патогенности
6. Дата, источник и место выделения: из легких павшей птицы, поступившей из Республики Удмуртия в декабре 2019 г.
7. Где идентифицирована культура: лаборатория диагностики и контроля антибиотикорезистентности возбудителей наиболее значимых инфекционных болезней животных ФГБНУ ФНЦ ВИЭВ РАН
8. Методы идентификации: посредством изучения культуральных, морфологических, ферментативные свойств, а также метода MALDI-ToF
9. Морфологические признаки: мелкие грамотрицательные коккобациллы или короткие палочки, расположенные одиночно или парами, неподвижные, спор не образуют. В мазках из крови и органов окрашиваются биполярно. Нити и другие инволюционные формы отсутствуют
10. Культуральные особенности: на кровяном агаре колонии гладкие, приподнятые серо-белые колонии, маслянистой консистенции в диаметре 1-2 мл с проявлением зоны β-гемолиза в размере 1-1,5 мм вокруг всей колонии. На мясопептонном агаре бактерии демонстрируют мелкий рост, прозрачные колонии размерами 1-2 мм, легко снимающихся бактериальной петлей или пастеровской пипеткой. В бульонных средах, т.е. мясопептонном бульоне, триптон-соевом бульоне, а также в сердечно-мозговом бульоне, наблюдается равномерное помутнение среды спустя 12 часов культивирования
11. Биохимические свойства: штамм Gallibacterium anatis В-1364 обладает следующими свойствами: оксидаза- и каталаза- положительны, ферментирует маннит, сахарозу, аргинин, маннозу, трегалозу, фруктозу, декстрин; не ферментирует арабинозу, лактозу, раффинозу, сорбит, уреазу, щелочную фосфатазу, глюкозу, мальтозу. Штамм демонстрирует В-гемолиз вокруг колонии, а также гидролиз эскулина и тест Фогес-Проскауэра имеют отрицательный результат
12. Вирулентность для лабораторных животных: величина LD 50 - 3,3 * 108 м.к. для белых мышей при внутрибрюшинном заражении
13. Устойчивость к антибактериальным препаратам: штамм имеет устойчивость к амоксиклаву, оксациллину, рифампицину, стрептомицину, ампициллину, тетрациклину, тилозину, цефепиму, цефиксиму, цефотаксиму, цефтазидиму, ципрофлоксацину, цефтриаксону, энрофлоксацину, эритромицину, клиндамицину, пефлоксацину, а также штамм демонстрирует чувствительность к азитромицину, азтреонаму, амоксициллину, бензилпенициллину, гентамицину, канамицину, кларитромицину, неомицину, офлоксацину, бацитрацину, доксициклину, карбенициллину, норфлоксацину, триметоприму, цефалексину, цефаперазону
14. Условия культивирования: растет на большинстве бульонных питательных сред, используемых в биопроизводстве, в частности: сердечно-мозговом, триптон-соевом бульоне, и т.д., а также агаризированных средах (МПА, М-144 (HiMedia) с добавлением 10% стерильной дефибринированной крови барана, при рН-7,2 и температуре 37°С в течении 18-24 часов
15. Условия хранения: в лиофилизированном виде в ампулах. Среда высушивания - декстриновый стабилизатор. Объем лиофилизата составляет 1 см3. Температура хранения (4-8)°С. Перезакладка через 5 лет
16. Организация-депозитор: Федеральное государственное бюджетное учреждение «Федеральный научный центр - Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени К.И. Скрябина и Я.Р. Коваленко Российской академии наук», (ФГБНУ ФНЦ ВИЭВ РАН). 109428, г. Москва, Рязанский проспект д. 24, корпус 1. Тел./факс +7 (495) 970-03-69. E-mail: admin@viev.ru
17. Авторы: Лаишевцев А.И., Петкович Д.Д.
Пример №2. Получение бульонной культуры Gallibacterium anatis для последующей лиофилизации
Для промышленного использования производственного штамма Gallibacterium anatis важно обеспечить его сохранность в лиофилизированном виде. Данный подход дает возможность стандартизировать качество производимой продукции при этом позволяет обеспечивать возможность его длительного хранения культуры без пассажа. Для лиофилизации предложенного, штамма галлибактерии предварительно получали бульонную культуру. Для этого с поверхности агара в чашках Петри, на которых поддерживалась живая нативная культура, производился отсев отдельных колоний на пробирки с сердечно-мозговым бульоном (возможно использование триптон-соевого бульона, Эугоник бульона, бульона Хоттингера и т.д.). После пересева пробирки с бульоном культивировались при 37-38°С в течение 24 часов. По окончании культивирования, проводился. контроль бульонной культуры на типичность роста, морфологические и тинкториальные свойства клеток галлибактерии, а также отсутствие роста посторонней микрофлоры. Все обозначенные свойства соответствовали паспортным данным. В течение 24 часов культивирования в пробирках концентрация клеток достигает - 2-3 млрд. м.к/см3. Следующим этапом работы являлся пересев бульонной культуры из пробирки во флакон с 250 мл сердечно-мозгового или триптон-соевого бульона. Данный этап позволяет одновременно получить большое количество бульонной культуры с идентичными свойствами. Культивирование флаконов производилось при 37-38°С в течении 24 часов. По окончании культивирования, проводился контроль бульонной культуры на типичность роста, морфологические и тинкториальные свойства клеток галлибактерий, а также отсутствие роста посторонней микрофлоры. Все обозначенные свойства полностью соответствовали паспортным данным.
После того как мы получили бульонную культуру во флаконе, в него вносился декстриновый стабилизатор в объеме 30%. Так, к 250 мл бульонной культуры Gallibacterium anatis добавлялся стабилизатор в количестве 75 мл, после чего полученную суспензию тщательно размешивали. Суспензию расфасовывали в ампулы в объеме 1 мл и подвергали замораживанию.
Пример №3. Лиофилизация производственного штамма Gallibacterium anatis
Полученную смесь культуры штамма Gallibacterium anatis со стабилизатором (полученные согласно примеру №2) расфасовывали по 1,0 мл в стеклянные флаконы вместимостью 3 мл., по ТУ 10.09.202 и ГОСТ 10782 вручную с использованием автоматических дозаторов. Фасовку проводили в ламинарном потоке стерильного воздуха с соблюдением правил асептики. Емкость с расплодкой перед розливом обтирали салфеткой, смоченной 2%-ным раствором хлорамина. Перед разливом и в его процессе фасуемый материал периодически перемешивался.
Флаконы с расплодкой штамма укупоривали стерильными резиновыми пробками на ножке до соответствующей риски по ТУ 38-006-108. При розливе в ампулы их горлышко закрывали стерильной ватой. Флаконы и ампулы после фасовки распределялись на специальные металлические кассеты, которые помещали в морозильные камеры с температурой не выше минус 45°С.
После замораживания кассеты помещали в сублимационный аппарат, вынимая поддоны так, чтобы дно флаконов соприкасалось с греющими поверхностями сублиматора. Использовали сублимационные установки модели Christ epsilon 1-4.
Технология сублимации включает в себя два основных этапа: замораживание и сушку (первичную и вторичную). Сублимационное высушивание проводили в асептических условиях, согласно инструкции к соответствующей сублимационной установке. Управление процессом вели в зависимости от сублимационного аппарата в ручном или автоматическом режиме.
Во время сушки контролировали следующие параметры:
а) температуру в материале;
б) температуру греющих поверхностей;
в) температуру конденсатора;
г) давление в сублимационной камере;
д) относительное электрическое сопротивление материала.
Изменение этих параметров во времени фиксировалось на ленте самописца и/или на мониторе компьютера.
Основные контрольные точки процесса сублимационной сушки штаммов:
а) температура замораживания материала - не выше минус 45°С;
б) время достижения температуры полного замораживания для всей партии жидкого материала - не менее 5 часов при скорости охлаждения 1 градус в минуту;
в) при сублимации (первичная сушка) длительность поддержания температуры плит на уровне минус 22°С составляет не менее 55 часов, без учета длительности нагрева плит.
Величина массоудаления характеризует качество проведения процесса по показателю удаленной влаги. Стандартность величины этого показателя гарантирует надежное воспроизведение приемлемого уровня влажности в готовом продукте.
Параметры контроля после процесса сублимационной сушки.
После процесса сушки и укупоривания флаконов оценивали следующие параметры качества сухого препарата:
а) внешний вид таблетки;
б) величина массоудаления;
в) наличие вакуума;
г) полнота и скорость растворения сухой таблетки;
д) величина остаточной влажности.
Обкатка алюминиевыми колпачками, поклейка этикеток.
После сублимационного высушивания флаконы с сухим компонентом вручную подвергались обкатке алюминиевыми колпачками по ГОСТ Р 51314-99.
При изготовлении лиофилизированных ампул в ампулах, их запаивали в день разгрузки в вакуумных коллекторах при остаточном давлении в пределах 0,1-0,25 мкм рт.ст.
В запаянных ампулах проверяли наличие вакуума аппаратом типа Д'Арсонваль. Ампулы без вакуума выбраковывали с последующим автоклавированием.
Первичный визуальный контроль и отбор брака.
Расфасованную и укупоренную расплодку штамма подвергали визуальному контролю. Отбраковывали флаконы/ампулы с посторонними включениями, трещинами, измененным цветом, несоответствующим объемом фасовки, нарушением укупорки.
Этикетированную расплодку укладывали в контейнеры для последующего хранения. Производился визуальный контроль физических свойств и отбирались образцы для проведения контрольных испытаний и закладки в коллекцию ФГБНУ ФНЦ ВИЭВ РАН на хранение.
Процесс фасовки и этикетирования материала регистрировали в журнале учета изготовления и движения штаммов, где записывали дату, объем расфасованной продукции, количество флаконов, номер серии.
Пример №4. Контроль внешнего вида, цвета, наличия посторонних примесей, полученной расплодки производственного штамма галлибактерии
Внешний вид, цвет, наличие посторонней примеси, плесени, следов оттаивания, трещин определяли визуально по каждому флакону/ампуле всей серии штамма. Одновременно проверяли качество запайки ампул, наличие во флаконах/ампулах вакуума, правильность маркировки.
Лиофилизированные посевные материалы по внешнему виду представляли собой однородную сухую мелкопористую массу белого или светло-желтого цвета без посторонней примеси. Все несоответствующие по данному параметру ампулы/флаконы подвергались выбраковке методом автоклавирования.
Пример №5. Определение наличия вакуума в ампулах
Сущность метода испытания заключается в способности высокочастотного электрического тока при большом напряжении вызывать в газах свечение. Для проведения испытания используется аппарат типа «Д'Арсонваль». Перед использованием аппарата его выдерживали в течение 10 минут после включения. Испытуемые ампулы устанавливались в штативе, после чего к ним подводили электроды на расстоянии 1 см, с экспозицией искрового разряда у каждой ампулы не более 1 с.
Наличие вакуума в ампулах подтверждали по наличию свечения внутри ампулы и характерному потрескиванию при подведении к ним электродов. В ходе выполнения данного исследования ампулы, не содержащие вакуум, были выбракованы с последующим автоклавированием.
Пример №6. Определение растворимости лиофилизата
Для испытания использовали 3 флакона/ампулы с полученным лиофилизатом, в который вносили стерильный физиологический раствор (рН 7,2) в объеме, соответствующем объему культуры штамма до высушивания (1 см3), после чего флаконы/ампулы встряхивали. В течение не более 4 минут должна образоваться равномерная взвесь без хлопьев, комочков и осадка. Произведенная расплодка (полученная согласно примерам №2, №3, №4) соответствовала данному параметру.
Пример №7. Определение массовой доли влаги в ампуле
Исследование данного параметра проводят согласно ГОСТ 24061-2012 «Средства лекарственные биологические лиофилизированные для ветеринарного применения». Сущность метода заключается в определении уменьшения массы пробы препарата после ее высушивания в течение 1 ч при температуре (105±1)°С. Определение массовой доли влаги проводили в трех повторностях, для каждого из которых использовалось по 3 флакона/ампулы. Отобранные пробы помещали в фарфоровые ступки и с помощью пестика их доводили до равномерного порошкообразного состояния, после чего данный порошок помещали ровным слоем в предварительно взвешенные с крышкой бюксы. Бюксы с пробами закрывали крышками, взвешивали, снимали с них крышки и устанавливали в сушильный шкаф на полку. Начало сушки считали с момента достижения 105°С в соответствии с контрольным термометром. Продолжительность сушки составляла 60 минут. После окончания сушки бюксы быстро закрывали крышками и переносили в эксикатор для охлаждения до комнатной температуры в течении 30 минут, после чего бюксы взвешивали, а результаты взвешивания записывали в журнал с точностью до четвертого десятичного знака. Массовая доля влаги в образце должна быть в пределах 1,0-4,0%.
В результате испытания массовая доля влаги лиофилизированного штамма галлибактерий, подготовленного согласно примеру №2, составляла 2,4%.
Пример №8. Определение контаминации ампул посторонней микрофлорой
Контаминацию посторонней микрофлорой определяли в соответствии с ГФ XIV ОФС.1.2.4.0002.15 «Микробиологическая чистота» методом прямого посева.
Для получения первичного разведения использовалось три ампулы лиофилизированной культуры. Содержимое флакона разводили стерильным 0,9% раствором натрия хлорида из расчета 1 мл на 1 флакон. Затем объединяли полученную суспензию из 3 флаконов, перемешивали 8-10 раз и получали исходное разведение.
Исходное разведение культуры использовалось для посева на агаризированные питательные среды (кровяной агар, мясопептонный агар (МПА), методом Дригальского. Для этого чашки Петри с питательной средой визуально делили на 4 сектора, посев из исходного разведения испытуемого образца начинали в первом секторе, тщательно втирая взвесь петлей в агар. Затем этой же петлей продолжали посевы во втором и последующих секторах. Данная манипуляция позволяла получать в последних секторах изолированные колонии Gallibacterium anatis, и зафиксировать возможные контаминирующие колонии на агаре. Инкубирование посевов на кровяном и мясопептонном агаре производили в течение 24 часов при температуре 37°С.
В результате проведения обозначенного испытания было определено, что в лиофилизированных ампулах (полученных согласно примерам №2 и 3) со штаммами галлибактерии отсутствует рост посторонней микрофлоры.
Пример №9. Определение культуральных и морфологических свойств, а также подтверждение типичного роста на питательных средах
Для подтверждения культуральных и морфологических свойств после проведенной лиофилизации проводился отбор ампул/флаконов от каждой расплодки. Затем все содержимое суспендировали в 9 мл стерильного физиологического раствора, затем проводили посев методом Дригальского на кровяной агар (основа колумбийский, триптон-соевый агар, сердечно-мозговой агар). Культивирование посевов проводилось в течение 27 часов при 37°С. На кровяном агаре микроорганизм формирует круглые, гладкие, маслянистой консистенции, слегка приподнятые серо-белые колонии диаметром до 2,0 мм. В мазках окрашенных по Граму, выявлялись грамотрицательные коккобациллы или короткие палочки, расположенные в мазках одиночно или парами.
Оценка типичности роста галлибактерии на бульонных средах проводится путем пересева отдельных суточных колоний с кровяного агара в пробирки с сердечно-мозговым бульоном или триптон-соевым бульоном. Культивирование пробирок проводилось в течении 24 часов при 37°С. В результате культивирования в пробирках образовалась равномерная взвесь бактериальных клеток. Средняя концентрация выращенных клеток при таком культивировании составило 2,0-3,0*109 м.к./см3.
Пример №10. Определение биохимических свойств штамма Gallibacterium anatis
Определение биохимических свойств штаммов позволяет определить видовую принадлежность галлибактерии. Данное исследование проводится с использованием рутинных бактериологических методов. Для изучения биохимических свойств культуры Gallibacterium anatis были использованы коммерческие тест системы: API® NH, API® 20Е с сопутствующими расходными материалом и электронной базой для интерпретации полученного результата. Помимо коммерческих биохимических тест-систем были использованы углеводы в дисках для определения сахаролитических свойств: глюкоза, ксилоза, маннит, сорбитол, фруктоза, манноза, мальтоза, трегалоза, грицерина, рамноза, целлобиоза, лактоза, мелибиоза, сахароза, раффиноза, инулин, эскулин производства ООО «Himedia». Испытание проводили согласно инструкции на набор и углеводы.
В результате данного исследования культура предложенного штамма галлибактерии обладает следующими свойствами: оксидаза- и каталаза- положительны, штамм ферментирует маннит, сахарозу, аргинин, маннозу, трегалозу, фруктозу, декстрин; не ферментирует арабинозу, лактозу, раффинозу, сорбит, уреазу, щелочную фосфатазу, глюкозу, мальтозу. Штамм демонстрирует В-гемолиз вокруг колонии, а также гидролиз эскулина и тест Фогес-Проскауэра имеют отрицательный результат.
Пример №11. Определение концентрации живых бактерий в 1,0 см3 сухой культуры галлибактерии после лиофилизации
Определение количества живых микробных клеток штамма Gallibacterium anatis проводили в трехкратной повторности (использовали по 3 ампулы/флакона). Вскрытие ампул/флаконов проводили в стерильных условиях, в каждую вносили стерильный физиологический раствор до первоначального объема (1,0 см3). После восстановления лиофилизата, суспензию тщательно перемешивали. Из полученных первичных разведений (каждый флакон отдельно) готовили последовательные десятикратные разведения штамма в 8 пробирках от 10-1 до 10-8. Для каждого разведения культуры использовалась отдельная пипетка.
Для высева использовали три последних разведения штамма: 10-6, 10-7, 10-8. Из каждого разведения проводили посевы по 0,1 см3 на поверхность 3 чашек Петри с кровяным агаром, предварительно выдержанных при температуре 37±1°С в течение часа (для полного удаления конденсата). Для получения равномерного газона культуры использовался шпатель (отдельный на каждую чашку).
Посевы инкубировали при температуре 37±1°С в Течение 72 ч. в условиях 5-10% СО2, проводя учет результатов каждые 24 часа. Затем подсчитывали количество выросших колоний и определяли концентрацию живых бактерий в 1 см3 по формуле (1):
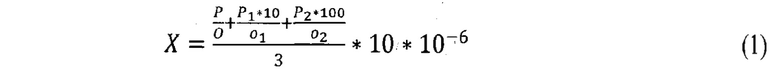
Где:
X - число живых бактерий в 1 см3;
Р - количество колоний на всех чашках из разведения 10-6;
о - количество чашек с разведением 10-6;
P1 - количество колоний во всех чашках из разведения 10-7;
10 - перерасчет на разведение 10-6;
o1 - количество чашек с разведением 10-7;
Р2 - количество колоний во всех чашках из разведения 10-8;
100 - перерасчет на разведение 10-6;
o2 - количество чашек с разведением 10-8;
10 - перерасчет количества живых бактерий на 1 см3;
10-6 - степень разведения штамма.
Количество живых бактерий в 1,0 см3 сухой культуры штамма галлибактерий должна быть не менее 150 млн микробных клеток. При сравнении результатов исследования, количество живых бактерий в каждом флаконе не должно различаться более чем на 15%.
В результате проведенного испытания установлено, что концентрация жизнеспособных клеток во флаконах, полученных согласно примеру №3, составило 1,8* 109 м.к./см3.
Пример №12. Определение вирулентности штамма Gallibacterium anatis
При определении вирулентности культуры галлибактерий, выраженном в значении показателя LD50, использовали белых мышей массой 22-25 гр. в количестве 24 голов. Для исследования подготавливался ряд десятикратных разведений бактериальной суспензии клеток галлибактерий на основе физиологического раствора, а именно ~3×109 м.к., ~3×108 м.к., ~3×107 м.к., ~3×106 м.к. Мышей заражали внутрибрюшинно по 1 см3, срок наблюдения составлял 10 суток. Параллельно, для точного определения дозы (концентрации живых клеток) возбудителя в заражающей культуры проводили раститровку и высев на чашки с ростообеспечивающими средами (чашечный метод Коха) аналогично примеру №11. Срок наблюдения за инфицированными животными составлял 10 дней. Статистическую обработку результатов осуществляли в программах BioStat 2009 («AnalystSoft, Inc.», США) и Microsoft Excel. Расчет LD50 проводили посредством пробит-анализа. Результаты испытаний приведены в таблице №1.

Сразу после гибели проводили патологоанатомическое вскрытие мышей с последующим бактериологическим исследованием образцов внутренних органов. В ходе исследования из всех исследованных проб были выделены культуры заражающего штамма возбудителя галлибактериоза птиц. Полученные результаты свидетельствуют, что предлагаемый производственный штамм является вирулентным и способен вызывать гибель лабораторных животных, что в дальнейшем будет использовано для контроля иммуногенной активности средств специфической профилактики галлибактериоза.
Пример №13. Изготовление экспериментальной серии вакцины против галлибактериоза птиц
Экспериментальная серия вакцины против галлибактериоза птиц изготовлена в лабораторных условиях ФГБНУ ФНЦ ВИЭВ РАН, при условиях глубинного метода культивирования в стерильных флаконах. Для культивирования штамма галлибактерий использовали сердечно-мозговой бульон и колумбийский агар («HiMedia Laboratories Pvt Ltd», Индия), с добавлением 10% дефибринированной крови барана. Культивирование проводилось в течение 24 часов при температуре 37°С. После культивирования проводится оценку типичности культуральных, морфологических и тинкториальных свойств штамма, при соответствии с типичностью, культуральных свойств, а также при отсутствии отсутствие посторонней микрофлоры на посевах. Концентрация бактериальных клеток возбудителя 3,2 млрд. м.к./см3. Инактивировали культуру путем добавления 0,3% формалина к общему объему бактериальной суспензии. Продолжительность инактивации бактериальных антигенов составляла 3-х суток при температуре 21±1°С. Концентрирование бактериальной массы проводили центрифугированием на установке MPW-380R в течении 1 ч при 3 тыс. оборотах, при относительном центробежном ускорении RCF - 1861. После получения концентрата бактериального антигена было проведено составление серии препарата на основе адъюванта полиэтиленгликоль (ПЭГ-6000, ООО «Норкем», Россия) - 10%; консервант - мертиолят натрия (из расчета 1:10000 v/v); концентрацию водородных ионов регулировали с использованием раствора щелочи до значения 7,2-7,6. Концентрация бактериальных клеток в вакцине составила 3*109 м.к./см3. Концентрацию водородных ионов полученного лекарственного средства регулировали с использованием раствора щелочи до значения 7,2 ед.
Пример №14. Контроль иммуногенной активности экспериментальной серии вакцины против галлибактериоза птиц
Исследование иммуногенной активности экспериментальной вакцины (полученной согласно примеру №13) проводили в условиях вивария опытной базы ФГБНУ ФНЦ ВИЭВ РАН с использованием белых мышей. Таким образом была сформирована 1 опытная группа животных (n=10), и 1 контрольная группа (n=10). Иммунизация животных опытной группы проводилась внутримышечно, в объеме 0,5 мл, двукратно с интервалом 14 дней. Животным контрольных групп внутримышечно вводился стерильный физиологический раствор в объеме 0,5 мл. Спустя 14 дней после второй вакцинации, животные опытной и контрольной групп были подвергнуты инфицированию штаммом В-1364 в дозе 5Ld50. Срок наблюдения за животными составлял 10 дней. В результате эксперимента было установлено, что 10 из 10 животных в контрольной группе пали в течении 3 дней, а 100% животных из опытной группы оставались живы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ БАКТЕРИЙ HISTOPHILUS SOMNI, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНО- И ПОЛИВАЛЕНТНЫХ ИММУНОГЕННЫХ КОМПОЗИЦИЙ, НАПРАВЛЕННЫХ НА СПЕЦИФИЧЕСКУЮ ПРОФИЛАКТИКУ ГИСТОФИЛЕЗА (СТАДНОГО БЕСПЛОДИЯ) РОГАТОГО СКОТА | 2020 |
|
RU2754005C1 |
| Штамм бактерий Corynebacterium pseudotuberculosis, предназначенный для получения моно- или поливалентных иммуногенных композиций, направленных на специфическую профилактику казеозного лимфаденита (псевдотуберкулеза) мелкого рогатого скота | 2023 |
|
RU2815387C1 |
| ПОЛИВАЛЕНТНАЯ ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ РИЕМЕРЕЛЛЁЗА, ПАСТЕРЕЛЛЁЗА И САЛЬМОНЕЛЛЁЗА ИНДЕЕК, УТОК И ГУСЕЙ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2020 |
|
RU2750865C1 |
| Контрольно-производственный штамм Actinobacillus rossii, предназначенный для производства и контроля иммунобиологических лекарственных средств ветеринарного применения | 2023 |
|
RU2824492C1 |
| ВАКЦИНА ПРОТИВ МАНХЕЙМИОЗА, БИБЕРШТЕЙНИОЗА И ПАСТЕРЕЛЛЁЗА КРУПНОГО И МЕЛКОГО РОГАТОГО СКОТА АССОЦИИРОВАННАЯ ИНАКТИВИРОВАННАЯ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2020 |
|
RU2744744C1 |
| Штамм бактерии Actinobacillus pleuropneumoniae 8 серотипа, предназначенный для получения моно- и поливалентных иммуногенных композиций, направленных на специфическую профилактику актинобациллезной плевропневмонии свиней | 2023 |
|
RU2824493C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННЫХ МАСТИТОВ И ЭНДОМЕТРИТОВ КОРОВ ИНАКТИВИРОВАННАЯ, СПОСОБ ЕЁ ПОЛУЧЕНИЯ | 2024 |
|
RU2840041C1 |
| Штамм бактерий Actinobacillus pleuropneumoniae 2 серотипа, предназначенный для получения моно- и поливалентных иммуногенных композиций, направленных на специфическую профилактику актинобациллезной плевропневмонии свиней | 2023 |
|
RU2827226C1 |
| Штаммы бактерий Actinobacillus pleuropneumoniae 11 серотипа, предназначенный для получения моно- и поливалентных иммуногенных композиций, направленных на специфическую профилактику актинобациллезной плевропневмонии свиней | 2023 |
|
RU2831240C1 |
| Штаммы бактерий Actinobacillus pleuropneumoniae 5 серотипа, предназначенный для получения моно- и поливалентных иммуногенных композиций, направленных на специфическую профилактику актинобациллезной плевропневмонии свиней | 2023 |
|
RU2831089C1 |
Изобретение относится к области биотехнологии и может быть использовано при производстве инактивированных иммунобиологических средств в виде моно- и поливалентных препаратов, предназначенных для профилактики инфекции птиц, вызванной Gallibacterium anatis. Изобретение представляет собой штамм бактерий Gallibacterium anatis, предназначенный для получения моно- и поливалентных иммуногенных композиций, направленных на специфическую профилактику галлибактериоза сельскохозяйственных птиц, депонирован во «Всероссийской государственной коллекции патогенных и вакцинных штаммов микроорганизмов-возбудителей инфекционных болезней животных» (Федеральный научный центр - Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко Российской Академии Наук) под номером В-1364. Технический результат изобретения заключается в стандартизации технологии производства иммунобиологических средств специфической профилактики галлибактериоза сельскохозяйственных птиц за счет использования изученного и охарактеризованного штамма Gallibacterium anatis, отвечающего требованиям, предъявляемым к производственным культурам (по культуральным, ростовым, морфологическим, тинкториальным, биологическим, антигенным, иммуногенным и т.д. свойствам). Изобретение служит средством расширения арсенала моно- и поливалентных вакцин, направленных на специфическую профилактику инфекционных болезней сельскохозяйственных птиц, с высокой стабильностью, антигенной, иммуногенной и протективной активностью. 1 табл., 5 пр.
Штамм бактерий Gallibacterium anatis, предназначенный для получения моно- и поливалентных иммуногеных композиций, направленных на специфическую профилактику галлибактериоза сельскохозяйственных птиц, депонирован в ФГБНУ ФНЦ ВИЭВ РАН под номером В-1364.
| ЧАНТЕС-ГУЕРА АЛЬБЕРТО и др | |||
| АППАРАТ ДЛЯ ВНУТРИВЕННОГО ВЛИВАНИЯ | 1927 |
|
SU12656A1 |
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ANDERS MIKI BOJESEN, et al | |||
| In vivo studies of Gallibacterium anatis infection in chickens | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Заслонка для русской печи | 1919 |
|
SU145A1 |
Авторы
Даты
2023-01-09—Публикация
2022-04-18—Подача