ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к способу получения эпоксидных соединений из органических соединений, содержащих углеродную двойную связь, хлоргидринным методом. В частности, настоящее изобретение относится к способу получения эпоксидных соединений с применением фторированного третичного спирта и соответствующему применению фторированного третичного спирта для получения эпоксидных соединений.
УРОВЕНЬ ТЕХНИКИ
Эпоксидные соединения, в частности, оксиды олефинов имеют широкое применение в промышленной практике. Основными направлениями применения оксидов олефинов являются производства гликолей и их алкиловых эфиров, а также неионогенных поверхностно-активных веществ.
В уровне техники известен ряд методов получения эпоксидных соединений. Одним из важных и распространенных методов получения эпоксидных соединений, в частности, оксидов олефинов является так называемый хлоргидринный метод получения, при котором газообразный алкен и хлор пропускают через воду с образованием соответствующего алкенхлоргидрина с последующим омылением алкенхлоргидрина щёлочью с получением оксида олефина.
Из US4443620 (опубл. 17.04.1984, МПК C07D301/26, C07D301/26) известен способ получения оксидов олефина хлоргидринным методом, при котором хлор и третичный алканол, растворенные в инертном органическом растворителе, приводят в контакт с оксидом кальция в водном растворе хлорида кальция с образованием третичного алкилгипохлорита, который взаимодействует с водой и олефиновым ненасыщенным соединением с образованием хлоргидрина и третичного алканола. Хлоргидрин и третичный алканол затем приводят в контакт с оксидом кальция в водном растворе хлорида кальция для получения оксидов олефина. Недостатком указанного способа получения оксидов олефина хлоргидринным методом является необходимость применения инертного органического растворителя, что ведет к сниженной эффективности получения результирующего оксида олефина на единицу массы алканола. Также, применение алканола, например, третбутанола ведет к образованию множества побочных продуктов в результате реакции с хлором.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В основу настоящего изобретения положена задача создания способа получения эпоксидных соединений, в частности, оксидов олефинов и других органических соединений, содержащих углеродную двойную связь, который бы имел высокую эффективность получения результирующего эпоксидного соединения, например, оксида олефина и сниженное образование побочных продуктов, таких как, например, дихлоролефиновые соединения.
Одним из технических результатов настоящего изобретения является обеспечение способа получения эпоксидных соединений, в частности, оксидов олефинов с высокой эффективностью, где под эффективностью понимается количество целевого продукта (например, оксида олефина) на единицу объёма фторированного третичного спирта.
Другим техническим результатом настоящего изобретения является уменьшение количества побочных продуктов, образующихся в результате проведения процесса в целом, и, в частности, образующихся в результате проведения процесса хлоргидринирования и омыления.
Также, один из технических результатов настоящего изобретения заключается в обеспечении высокой селективности получения эпоксидных соединений, в частности, оксидов олефинов.
Указанная задача решается, а технические результаты достигаются посредством способа получения эпоксидных соединений и применения по настоящему изобретению.
Настоящее изобретение относится к способу получения эпоксидного соединения, включающему:
а) барботаж Cl2 через суспензию, содержащую концентрированный водный раствор CaCl2, фторированный третичный С4-С16 спирт и гипохлорирующий агент, выбранный из группы, состоящей из Ca(OCl)2, CaCl(OCl), Ca(OH)(OCl) и их комбинаций, с получением первой смеси,
b) отделение органической части первой смеси, включающей фторированный С4-С16спирт и фторированный алкил С4-С16 гипохлорит от водной части первой смеси, включающей концентрированный раствор CaCl2,
с) удаление из отделённой органической части первой смеси растворённого Cl2 посредством продувки воздухом или обработки суспензией Ca(OH)2 в растворе CaCl2, с получением органической части первой смеси, свободной от растворённого Cl2,
d) добавление алкена С2-С18 или иного органического соединения с двойной связью углерод-углерод в органическую часть первой смеси, свободной от растворённого Cl2, с получением второй смеси, содержащей соответствующее алкену С2-С18 или иному органическому соединению с двойной связью углерод-углерод хлоргидринное соединение,
е) омыление второй смеси в присутствии Ca(OH)2и/или CaO с получением соответствующего эпоксидного соединения.
Согласно одному варианту осуществления соответствующее эпоксидное соединение соответствует относительно количества атомов углерода хлоргидринному соединению, полученному на этапе d).
Согласно одному варианту осуществления предложен способ, в котором на этапе а) значение pH водной фазы суспензии составляет от 4 до 8, предпочтительно от 5 до 6.
Согласно одному варианту осуществления предложен способ, в котором фторированный третичный С4-С16 спирт включает в себя фрагмент
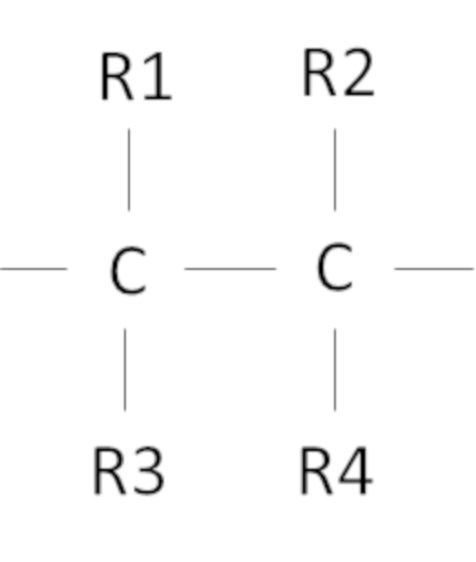 ,
,
где R1, R2, R3, R4 независимо выбраны из группы, состоящей из H, CH3 и F, при условии, что по меньшей мере один из R1, R2, R3, R4 представляет собой F, предпочтительно R1, R2, R3, R4 представляют собой F.
Согласно одному варианту осуществления предложен способ, в котором фторированный третичный С4-С16 спирт представляет собой тетрафторированный третичный С4-С16 спирт.
Согласно одному варианту осуществления предложен способ, в котором фторированный третичный С4-С16 спирт включает в себя фрагмент, выбранный из группы, состоящей из CH3(CF2CF2)-, CHF2CF2-.
Согласно одному варианту осуществления предложен способ, в котором фторированный третичный С4-С16 спирт представляет собой соединение следующей формулы:
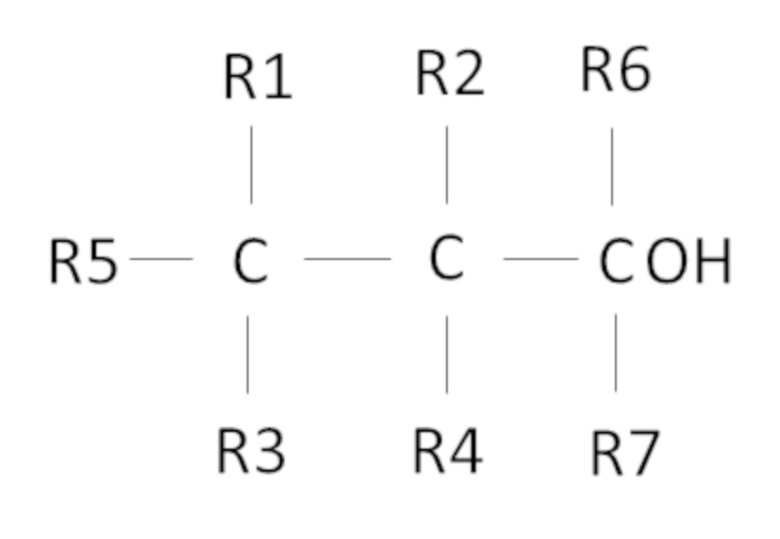 ,
,
где R1, R2, R3, R4 независимо выбраны из группы, состоящей из H, CH3 и F, при условии, что по меньшей мере один из R1, R2, R3, R4 представляет собой F, предпочтительно R1, R2, R3, R4 представляют собой F,
где R5 представляет собой H или С1-С11 алкил, R6 и R7 независимо выбраны из CH3 и C2H5, предпочтительно R6 и R7 представляют собой CH3,
причем сумма атомов углерода у R1, R2, R3, R4, R5, R6 и R7 составляет от 1 до 11.
Согласно одному варианту осуществления предложен способ, в котором фторированный третичный С4-С16 спирт представляет собой фторированный третичный С5-С6 спирт, предпочтительно, тетрафторированный третичный С5-С6 спирт.
Согласно одному варианту осуществления предложен способ, в котором на этапе с) дополнительно получают дополнительный поток, содержащий фторированный третичный С4-С16 спирт и CaCl2, причем дополнительный поток направляют на этап а) способа.
Согласно одному варианту осуществления предложен способ, в котором этап с) проводят с нагревом второй смеси при дополнительном присутствии CaCl2 в количестве не более 30 вес.%, предпочтительно, от 20 до 30 вес.%, более предпочтительно, от 20 до менее 30 вес.%.
Согласно одному варианту осуществления предложен способ, в котором на этапе а) концентрированный водный раствор CaCl2 включает CaCl2 в количестве от 30 вес.% до 42 вес.%.
Настоящее изобретение также относится к применению фторированного третичного С4-С16 спирта, как описано выше, для получения эпоксидных соединений.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
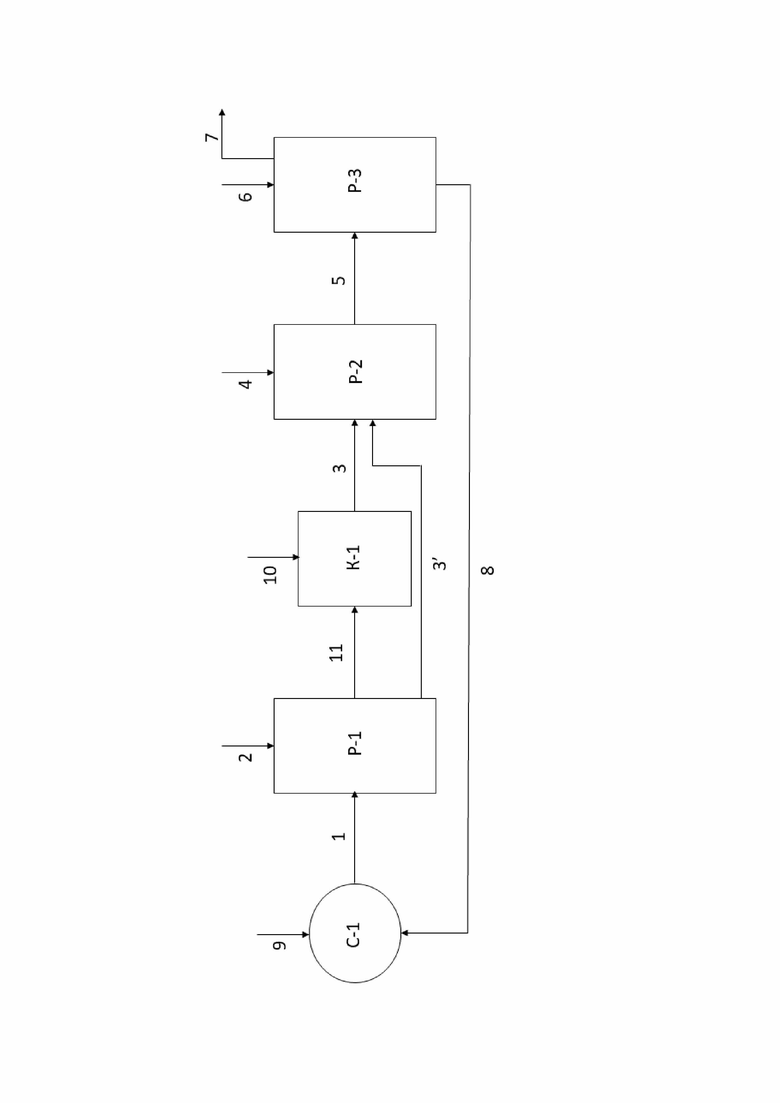
Фигура иллюстрирует упрощенную блок-схему способа получения эпоксидных соединений по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу получения эпоксидных соединений, в частности, оксидов олефинов хлоргидринным методом. В целом, хлоргидринный метод является широко известным в уровне техники (см., например, документ US4443620). Согласно хлоргидринному методу получают эпоксидные соединения из ненасыщенных олефинов, в частности, алкенов.
В настоящем изобретении под эпоксидными соединениями в основном понимают оксиды олефинов следующей формулы
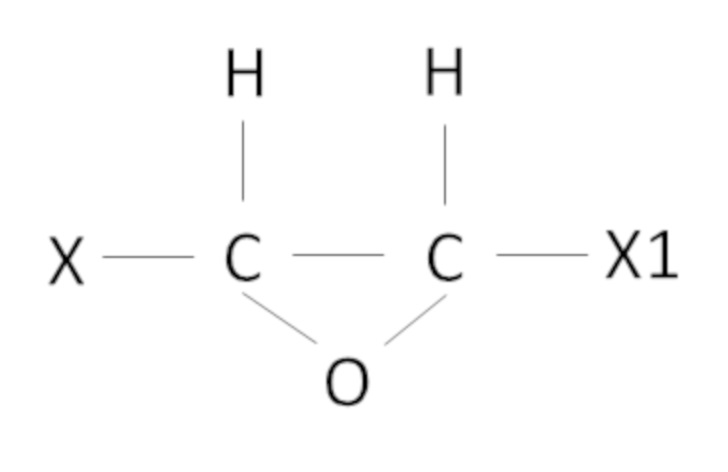 ,
,
где X, X1 независимо представляют собой H или алкил, в частности, СН3. Однако алкил, в частности, метил также может быть замещенным, например, галогенами, такими как Cl, F. неограничивающие примеры оксидов олефинов представляют собой замещенные или незамещенные указанными выше заместителями этиленоксид, пропиленоксид, бутиленоксид. Однако настоящее изобретение не ограничивается оксидами олефинов, и в рамках настоящего изобретения эпоксидные соединения могут представлять собой различные эпоксидные соединения, получаемые хлоргидринным методом.
В настоящем изобретении под алкенами понимают в основном алкены следующей формулы
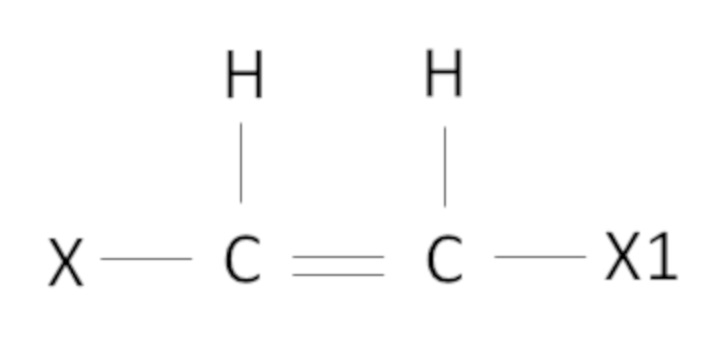 ,
,
где X, X1 такие как определено выше.
Способ по настоящему изобретению включает этап, в частности, этап а), на котором обеспечивают суспензию, содержащую фторированный третичный С4-С16 спирт, гипохлорирующий агент, выбранный из группы, состоящей из Ca(OCl)2, CaCl(OCl), Ca(OH)(OCl) и их комбинаций, и водный концентрированный раствор CaCl2 с последующим пропусканием/барботированием через данную суспензию газообразного Cl2. В одном из вариантов осуществления изобретения, этап а) включает обеспечение суспензии посредством смешения фторированного третичного С4-С16 спирта, Ca(OCl)2 или другого гипохлорирующего агента и концентрированного раствора CaCl2. Указанная суспензия подвергается перемешиванию при осуществлении этапа а). В результате осуществления этапа а) получают первую смесь, имеющую высокое содержание ионов Cl+ в органической фазе/части.
Авторы настоящего изобретения обнаружили, что применение фторированного третичного С4-С16 спирта обеспечивает высокую эффективность экстракции активного хлора, в частности, ионов Cl+ при осуществлении этапа а), которые впоследствии принимают участие в хлоргидринировании алкена или другого органического соединения с двойной связью углерод-углерод с обеспечением высокой эффективности как процесса хлоргидринирования, так и процесса получения эпоксидных соединений в целом. Не желая быть связанными теорией, авторы настоящего изобретения полагают, что применение фторированного третичного спирта обеспечивает высокую устойчивость процесса, что в свою очередь обеспечивает высокую эффективность процесса получения эпоксидных соединений. Авторы настоящего изобретения полагают, что фторированный третичный спирт не расходуется на осуществления побочных реакций, тем самым обеспечивая по существу только целевое расходование фторированного третичного спирта на экстракцию активного хлора, в частности, ионов Cl+, что обеспечивает высокую эффективность процесса получения эпоксидных соединений и низкое образование побочных продуктов, негативным образом влияющих на эффективность процесса. Таким образом, можно обеспечить высокий выход эпоксидных соединений на единицу массы сырья. Под экстракцией в настоящем изобретении понимается получение/обеспечение высокой концентрации Cl+ в третичном фторированном спирте, за счёт перераспределения Cl+ между водной и органической фазами.
Под фторированным третичным спиртом в настоящем изобретении понимается третичный спирт, содержащий по меньшей мере один атом F в своей структуре.
С точки зрения обеспечения высокой эффективности процесса получения эпоксидных соединений и низкого образования побочных продуктов является преимущественным применение фторированного третичного спирта как описано ниже.
Согласно одному варианту осуществления настоящего изобретения фторированный третичный спирт имеет от 4 до 16 атомов углерода. В целом, авторы настоящего изобретения отмечают, что существенным является применение именно фторированного третичного спирта, т.е. спирта, содержащего по меньшей мере один атом F и третичный атом C, имеющий связь с/замещенный OH группой. В целом, множество различных соединений, подпадающих под указанное выше определение и указанное ниже описание могут быть применены в рамках настоящего изобретения, при условии, что они содержат по меньшей мере один атом F и третичный атом C, имеющий связь с/замещенный OH группой.
Согласно одному варианту осуществления настоящего изобретения фторированный третичный спирт С4-С16 включает в себя фрагмент
 ,
,
где R1, R2, R3, R4 независимо выбраны из группы, состоящей из H, CH3 и F, при условии, что по меньшей мере один из R1, R2, R3, R4 представляет собой F. Множество различных спиртов, имеющих указанный выше фрагмент, могут быть применены в рамках настоящего изобретения. Авторы настоящего изобретения также обнаружили, что предпочтительно, чтобы R1, R2, R3, R4 представляли собой F, так как фторированный, например, тетрафторированный спирт проявляет и обеспечивает наибольшую устойчивость процесса с получением преимуществ, как было описано выше.
В неограничивающих вариантах осуществления настоящего изобретения фторированный третичный С4-С16 спирт, предпочтительно, представляет собой полифторированный, например, тетрафторированный третичный С4-С16 спирт, еще более предпочтительно, фторированный третичный С4-С16 спирт включает в себя фрагмент, выбранный из группы, состоящей из CH3(CF2CF2)-, CHF2CF2-, что дополнительно обеспечивает устойчивость процесса с получением преимуществ, как было описано выше.
Также, в одном неограничивающем варианте осуществления настоящего изобретения фторированный третичный С4-С16 спирт представляет собой соединение следующей формулы:
 ,
,
где R1, R2, R3, R4 независимо выбраны из группы, состоящей из H, CH3 и F, при условии, что по меньшей мере один из R1, R2, R3, R4 представляет собой F, предпочтительно R1, R2, R3, R4 представляют собой F,
где R5 представляет собой H или С1-С11 алкил, R6 и R7 независимо выбраны из CH3 и C2H5, предпочтительно R6 и R7 представляют собой CH3,
причем сумма атомов углерода у R1, R2, R3, R4, R5, R6 и R7 составляет от 1 до 11.
Соединения, подпадающие под указанное выше определение, являются преимущественными с точки зрения того, что дополнительно обеспечивают устойчивость процесса с получением преимуществ, как было описано выше.
Наиболее предпочтительными являются фторированные третичные С5-С6 спирты, в частности, тетрафторированные третичные С5-С6 спирты. Неограничивающими примерами спиртов по настоящему изобретению могут выступать тетрафтордиметилпропанол и тетрафтордиметилбутанол, в частности, соединения CH3(CF2CF2)C(CH3)2OH, CHF2CF2C(CH3)2OH.
В неограничивающем варианте настоящего изобретения, первая смесь и/или её органическая часть, в частности, отделенная от водной части органическая часть может содержать соответствующий третичному фторированному С4-С16 спирту третичный алкил С4-С16 гипохлорит, в частности, фторированный/тетрафторированный третичный алкил С4-С16 гипохлорит, образующийся в результате реакций, проходящих на этапе а) в водном растворе/первой смеси, который впоследствии может вступать в реакцию с алкеном или иным органическим соединением с двойной связью углерод-углерод на этапе d) хлоргидринирования. В частности, указанный третичный алкил С4-С16 гипохлорит может образовываться при реакции третичного фторированного С4-С16 спирта с HOCl, которая в свою очередь образуется при взаимодействии Cl2 с водой и взаимодействии гипохлорирующего агента, выбранного из группы, состоящей из Ca(OCl)2, CaCl(OCl), Ca(OH)(OCl) и их комбинаций, с HCl, образующейся при взаимодействии газообразного Cl2 с водой, в частности, при барботаже Cl2 через суспензию/водный раствор этапа а).
Авторы настоящего изобретения также обнаружили, что при проведении этапа а) важным является поддержание pH водного раствора/первой смеси, в частности, водной фазы суспензии со значениями от 4 до 8, предпочтительно от 5 до 6, так как если значение pH находится вне указанных диапазонов, в водном растворе/первой смеси на этапе а) могут присутствовать нежелательная HCl, которая негативным образом сказывается на получении активного хлора (HClO, алкилгипохлорита) с последующим негативным влиянием на эффективность получения эпоксидных соединений. Использование гипохлорирующего агента, выбранного из группы, состоящей из Ca(OCl)2, CaCl(OCl), Ca(OH)(OCl) и их комбинаций, в частности, Ca(OCl)2 является преимущественным с точки зрения обеспечения указанных значений pH, так как гипохлорирующего агент, в частности, Ca(OCl)2 нейтрализует HCl с получением хлорноватистой кислоты.
В неограничивающем варианте осуществления, этап а) может включать или этапу а) может предшествовать предварительный этап получения водного раствора этапа а), заключающийся в том, что указанные фторированный третичный С4-С16 спирт, Ca(OCl)2 или другой гипохлорируюший агент и дополнительно CaCl2 смешиваются с образованием водного раствора этапа а).
Полученная на этапе а) первая смесь подвергается разделению на водную часть первой смеси и органическую часть первой смеси. Подобное разделение может быть осуществлено с помощью центрифуги, т.е. центрифугированием, декантированием или другими способами сепарации. Органическая часть первой смеси включает фторированный третичный С4-С16 спирт и фторированный алкил С4-С16 гипохлорит. Водная часть первой смеси включает концентрированный раствор CaCl2.
В неограничивающем варианте осуществления настоящего изобретения, органическую часть первой смеси с этапа b) подвергают обработке суспензией Ca(OH)2 в воде, или продувкой воздухом, или иным инертным по отношению к используемым компонентам газом, в частности, это может быть осуществлено перед этапом d) с получением органической части первой смеси, свободной от растворённого Cl2. В результате подобной обработки может быть сформирована промежуточная смесь. Далее, возможно проведение дополнительного разделения/сепарации промежуточной смеси с получением органической фазы и водной фазы, которые, в целом, соответствуют определению фаз, указанному выше. Авторы настоящего изобретения неожиданно обнаружили, что применение указанной обработки суспензией Ca(OH)2 может дополнительным образом способствовать уменьшению образования побочных продуктов, в частности, дихлорорганических соединений, при хлоргидринировании органической части первой смеси.
В неограничивающем варианте осуществления настоящего изобретения, органическую часть первой смеси с этапа b) подвергают обработке посредством продувки воздухом, в частности, это может быть осуществлено перед этапом d), с получением органической части первой смеси, свободной от растворённого Cl2. Авторы настоящего изобретения обнаружили, что применение указанной обработки посредством продувки воздухом может дополнительным образом способствовать уменьшению образования побочных продуктов, в частности, дихлорорганических соединений, при хлоргидринировании органической части первой смеси.
В неограничивающем варианте осуществления настоящего изобретения, этап а) проводят в присутствии водного раствора CaCl2 с концентрацией от 30 вес.% до 42 вес.%.
Способ по настоящему изобретению включает этап, в частности, этап d), на котором добавляют в/пропускают/барботируют алкен С2-С18 или иное органическое соединение с двойной связью углерод-углерод, в частности, С2-С16 алкен через органическую часть первой смеси, свободной от растворённого Cl2, с получением второй смеси, содержащей соответствующее алкену С2-С18 или иному органическому соединению с двойной связью углерод-углерод хлоргидринное соединение. На этапе хлоргидринирования и в целом на этапе d) может использоваться как вся первая смесь, так и органическая часть первой смеси, свободная от растворённого Cl2, выделенная из первой смеси, как описано выше. Соответствующее хлоргидринное соединение может, например, представлять собой С2-С18 алкил хлоргидрин, например, С2-С18 хлоралканол, например, хлорэтанол, хлорпропанол, хлорбутанол. Указанные хлоргидринные соединения также могут быть замещены функциональными группами, как указано выше в отношении получаемых эпоксидных соединений. Хлоргидринное соединение может быть образовано взаимодействием С2-С18 алкена или галогензамещённого алкена с третичным алкил С4-С16 гипохлоритом, описанным выше. Вторая смесь, получаемая на этапе d) хлоргидринирования, также может быть разделена на водную часть/фазу и органическую часть/фазу, так как описано выше в отношении первой смеси. В данном случае, существенным отличием водной части/фазы и органической части/фазы второй смеси является большее содержание хлоргидринного соединения(ий) в органической части/фазе. Ввиду чего, использование именно органической части/фазы второй смеси является преимущественным с точки зрения обеспечения большей эффективности процесса получения эпоксидных соединений.
Этап d) также может быть осуществлен в присутствии Ca(CO)3, применение которого является преимущественным с точки зрения поддержания значений pH, как указано выше, во второй смеси с получением преимуществ, как указано выше относительно значений pH водного раствора/первой смеси, в частности, водной фазы суспензии этапа а).
Дополнительно, этап d) может содержать дополнительный этап, осуществляемый непосредственно перед добавлением в/пропусканием/барботированием алкена С2-С18 или иного органического соединения с двойной связью углерод-углерод через первую смесь, в частности, органическую часть первой смеси. Дополнительный этап включает в себя охлаждение первой смеси, в частности, органической части первой смеси до температуры от 5ºС до 15ºС, в частности, от 5ºС до 10ºС. Охлаждение может быть осуществлено любыми подходящими в данной области техники средствами. Данный этап охлаждения является преимущественным с точки зрения проведения надлежащего процесса хлоргидринирования, так как при добавлении/пропускании/барботировании алкена С2-С18 или иного органического соединения с двойной связью углерод-углерод первая смесь, в частности, органическая часть первой смеси может нагреваться, что является нежелательным с точки зрения проведения процесса.
Способ по настоящему изобретению включает этап, в частности, этап e), на котором вторую смесь, не ограничиваясь, органическую часть/фазу второй смеси омыляют в присутствии Ca(OH)2 и/или CaO с получением эпоксидного соединения, соответствующего алкену С2-С18 или иному органическому соединению с двойной связью углерод-углерод. Омылению может подвергаться как вся вторая смесь, так и органическая часть/фаза, выделенная из второй смеси, как описано выше. Способ по настоящему изобретению также может предусматривать применение раствора CaCl2 на этапе e). Авторы настоящего изобретения обнаружили, что при применении раствора CaCl2 на этапе e) его концентрация преимущественно должна составлять не выше 30 вес.% CaCl2, предпочтительно, от 20 до 30 вес.% CaCl2, более предпочтительно, от 20 до менее 30 вес.% CaCl2. Применение CaCl2 на этапе e) в указанных диапазонах количеств способствует увеличению селективности процесса в отношении получения эпоксидных соединений, что также способствует уменьшению количества побочных продуктов процесса. Ввиду чего, в результате проведения процесса образуется лишь небольшое количество нежелательных солевых стоков или по существу не образуются нежелательные солевые стоки, а также обеспечивается возможность достичь высокой эффективности процесса получения эпоксидных соединений.
Этап e) проводят при нагреве второй смеси, не ограничиваясь, органической части/фазы второй смеси. В целом, могут использоваться любые подходящие для процесса омыления температуры, однако желательным с точки зрения описанных выше преимуществ является применение температуры, составляющей от 75ºС до 120ºС, в частности, от 95ºС до 120ºС, от 100ºС до 115ºС.
Дополнительно, следует отметить, что для дополнительной интенсификации процесса и достижения высокой эффективности этапы а)-e) можно проводить при интенсивном перемешивании растворов/смесей. Первая и вторая смеси могут представлять собой растворы, в частности, водные растворы.
После/при проведении этапа e) может быть получен дополнительный поток, содержащий указанный выше фторированный третичный спирт и CaCl2. Авторы настоящего изобретения обнаружили, что с точки зрения проведения эффективного процесса получения эпоксидных соединений данный поток может быть направлен на этап а) для применения в нем. В частности, данный поток может быть смешан с Ca(OCl)2 или другим гипохлорирующим агентом, как описано выше, для осуществления этапа а).
Полученное при омылении эпоксидное соединение, в частности, оксид олефина может быть отделен от реакционной/третьей смеси этапа e) посредством любых подходящих средств и методов. Например, эпоксидное соединение, в частности, оксид олефина может быть отделен отгонкой или любым другим пригодным методом разделения. Отделенное эпоксидное соединение, в частности, оксид олефина может быть далее направлен для хранения/использования как конечный продукт процесса или подвергнут дополнительным стадиям обработки/очистки.
В настоящем описании понятия «этап b)», «этап c)», «этап хлоргидринирования», «этап омыления», «хлоргидринирование», «омыление» могут использоваться взаимозаменяемо соответствующим образом.
Фиг. иллюстрирует упрощенную блок-схему способа получения эпоксидных соединений по настоящему изобретению.
Последующее ниже описание схемы на фиг. является лишь кратким иллюстративным описанием процесса. Таким образом, все вышеуказанные сведения, описывающие способ по настоящему изобретению, в частности, этапы а)-e) и соответствующие дополнительные этапы и средства осуществления способа во всем объеме относятся и к описанию схемы на фиг. и дополняют её, и специалист в данной области техники без труда сможет дополнить сведения, описывающие схему с фиг., сведениями, представленными выше.
На фиг. представлены первая реакционная зона Р-1 для проведения этапа а), вторая реакционная зона Р-2 для проведения этапа d) и третья реакционная зона Р-3 для проведения этапа e). Данный реакционным зонам соответствуют любые подходящие для проведения указанных этапов средства, например, емкости, резервуары, реакторы, колонны, аппараты с мешалками и т.д. Единственным ограничением в выборе соответствующих средств является обеспечение возможности выполнения соответствующих стадий/действий этапов. В частности, средства реакционных зон Р-1 и Р-2 должны быть выполнены с возможностью подачи, соответственно, газообразного Cl2 и алкена С2-С18 или иного органического соединения с двойной связью углерод-углерод в них для обеспечения добавления/пропускания/барботирования газообразного Cl2 и алкена С2-С18 или иного органического соединения с двойной связью углерод-углерод через, соответственно, водный раствор/суспензию/смесь, используемые на этапе а), и первую смесь с этапа а), органическую часть первой смеси с этапа b)-c).
На фиг. представлены линии подачи реагентов, например, линия 1 подачи водного раствора, используемого на этапе а) и содержащего фторированный третичный С4-С16 спирт и Ca(OCl)2 или другой гипохлорирующий агент, как описано выше. Указанные линии могут представлять собой любое пригодное средство подачи/доставки/перемещения реагентов, например, трубопроводы для подачи/доставки/перемещения текучих сред, конвейеры для подачи/доставки/перемещения твердых, в том числе, сыпучих твердых материалов.
Суспензию, содержащую фторированный третичный С4-С16 спирт, Ca(OCl)2, и концентрированный водный раствор CaCl2 подают по линии 1 подачи суспензии в реакционную зону Р-1, например, реактор Р-1 или любое другое подходящее средство, как описано выше. Для удобства описания процесса, проиллюстрированного на фиг., реакционные зоны Р-1, Р-2 и Р-3 будут обозначаться как реакторы Р-1, Р-2 и Р-3. Однако, как уже было указано выше, реакционные зоны Р-1, Р-2 и Р-3 могут быть представлены любыми подходящими средствами. В реактор Р-1 при перемешивании суспензии также подают газообразный Cl2 по линии 2 подачи Cl2 с проведением пропускания/барботирования Cl2 через суспензию с получением первой смеси. В реакторе Р-1 осуществляют взаимодействие суспензии с газообразным Cl2 с осуществлением реакций, как описано выше относительно этапа а). В результате данного взаимодействия получают первую смесь, которая может содержать третичный алкил С4-С16 гипохлорит. Первая смесь из реактора Р-1 может подвергаться разделению на органическую часть и водную часть первой смеси посредством соответствующего средства (не показано), например, центрифуги, сепаратора, предпочтительно, центрифуги.
Далее, первая смесь, в частности, органическая часть первой смеси может подаваться по линиям 3, 3’ подачи первой смеси в реактор Р-2 для проведения хлоргидринирования. Здесь и далее, под первой смесью подразумевается как первая смесь в целом, так и отделенная органическая часть первой смеси. Таким образом, например, линия 3 подачи первой смеси также может представлять собой линию 3 подачи органической части первой смеси. На фиг. также представлены линии 11, 10 и средство К-1, которые предназначены для проведения обработки первой смеси суспензией Ca(OH)2 в воде или продувкой воздухом, как указано выше. Данные этапы будут более подробным образом объяснены ниже. Несмотря на то, что на фиг. представлены указанные выше линии 11, 10 и средство К-1, в целом, способ может быть осуществлен и без применения указанных средств и соответствующих этапов. Другими словами, первая смесь может напрямую подаваться по линии 3’ подачи первой смесив реактор Р-2.
После подачи первой смеси в реактор Р-2, в реактор Р-2 при перемешивании первой смеси подают алкен С2-С18 или иное органическое соединение с двойной связью углерод-углерод, не ограничиваясь, газообразный С2-С4 алкен по линии 4 подачи С2-С4 алкена и пропускают/газообразный С2-С4 алкен через первую смесь с получением второй смеси, содержащей соответствующее указанному алкену С2-С4 хлоргидринное соединение. Несмотря на то, что здесь и далее линия 4 указана как линия 4 подачи С2-С4 алкена, и то что, хлоргидринирование и омыление описывается относительно С2-С4 алкена, линия 4 может относится к любому алкену С2-С18 или иному органическому соединению с двойной связью углерод-углерод, как описано выше, а С2-С4 алкен может быть заменен указанными выше соединениями. Это также относится и к соответствующим хлоргидринным и эпоксидным соединениям. В реакторе Р-2 при указанных выше действиях осуществляют хлоргидринирование С2-С4 алкена с получением С2-С4 алкил хлоргидрина. В реактор Р-2 также дополнительно подают (не показано) воду и Ca(CO)3 при проведении хлоргидринирования.
Перед подачей в реактор Р-2, первая смесь может также подвергаться охлаждению в или с помощью соответствующего средства, например, теплообменного средства/устройства.
Вторая смесь после реактора Р-2 может также подвергаться (не показано) разделению на органическую и водную части/фазы, как описано выше. Далее, под второй смесью подразумевается как вторая смесь в целом, так и отделенная органическая часть/фаза второй смеси с этапа d).
Вторая смесь затем по линии 5 подачи второй смеси подается в реактор Р-3 для проведения омыления С2-С4 хлоргидринного соединения с получением эпоксидного соединения, в частности, оксида олефина. После подачи второй смеси в реактор Р-3, в реактор Р-3 при перемешивании второй смеси по линии 6 подачи Ca(OH)2 и/или CaO подают Ca(OH)2 и/или CaO для проведения омыления. Ca(OH)2 и CaO могут быть поданы по линии 6 в виде твердого, в частности, сыпучего твердого материала или в виде раствора, в частности, водного раствора. Омыление С2-С4 хлоргидринного соединения, содержащегося во второй смеси, проводят при нагреве с температурными диапазонами как указано выше. Нагрев может быть осуществлен любыми подходящими средствами. В реактор Р-3 также может быть подан (не показано) CaCl2 при концентрациях указанных выше для способствования проведению процесса омыления. Из реактора Р-3 эпоксидное соединение, образовавшиеся в результате омыления С2-С4 хлоргидринного соединения, может быть отогнано/перемещено по линии 7 отвода эпоксидного соединения для дальнейшего использования/обработки.
После/при проведении омыления в реакторе Р-3 может быть получен дополнительный поток, содержащий описанный выше фторированный третичный спирт и CaCl2. Данный поток может быть направлен/рециркулирован в смесительное средство С-1 по линии 8 подачи дополнительного потока или напрямую в реактор Р-1 (не показано).
Смеситель С-1 может представлять собой любое подходящее для проведения смешения в текучих средах средство/устройство, например, может представлять собой смеситель С-1. Смеситель С-1 предназначен для предварительного получения суспензии этапа а) способа, в частности, содержащего фторированный третичный С4-С16 спирт, Ca(OCl)2 и/или другой гипохлорирующий агент и CaCl2. В смеситель С-1 по линии 9 подачи гипохлорита кальция или другого гипохлорирующего агента подают Ca(OCl)2 или другой гипохлорирующий агент для смешения с фторированным третичным С4-С16спиртом, а также с CaCl2 для получения водного раствора. В целом, суспензия этапа а) может также быть сформирована непосредственно в реакторе Р-1 перед подачей газообразного Cl2. Как было указано выше, дополнительный поток из реактора Р-3 после омыления, который содержит описанный выше фторированный третичный спирт и CaCl2, может быть подан по линии подачи 8 дополнительного потока в смеситель С-1 для смешивания с Ca(OCl)2 или другим гипохлорирующим агентом и получения суспензии для осуществления этапа а).
Первая смесь из реактора Р-1 может подаваться в средство K-1 обработки по линии 11 подачи первой смеси. Средство K-1 обработки предназначено для осуществления обработки первой смеси суспензией Ca(OH)2 в воде. В целом, средство K-1 обработки может представлять собой любое подходящее устройство, например, емкость, резервуар, реактор, аппарат с мешалкой, в частности, средство K-1 обработки может представлять собой колонну К-1. По линии 10 подачи гидроксида кальция при перемешивании в колонну К-1 и, соответственно, в первую смесь подают суспензию Ca(OH)2 в воде для обработки первой смеси. Первую смесь с внесенным в нее Ca(OH)2 перемешивают до достижения полного или по существу полного растворения Ca(OH)2 и отстаивают. Далее, полученную обработанную Ca(OH)2 первую смесь можно дополнительно обработать центрифугированием для отделения оставшегося Ca(OH)2. Полученную обработанную Ca(OH)2 первую смесь затем подают по линии 3 подачи первой смеси в реактор Р-2 для проведения хлоргидринирования. В средство К-1 также может подаваться поток воздуха (не показано) для осуществления обработки первой смеси продувкой воздухом, после чего обработанная продувкой воздухом первая смесь может быть подана в реактор Р-2 по линии 3. Однако обработку воздухом, в рамках настоящего изобретения, также можно осуществлять вне средства K-1, например, обработку воздухом можно осуществлять в любом подходящем устройстве выше по потоку от реактора Р-2.
Далее, настоящее изобретение будет продемонстрировано неограничивающими примерами, которые представлены лишь для подтверждения того, что настоящее изобретения может быть осуществлено, и не должны трактоваться в качестве ограничивающих.
ПРИМЕРЫ
Пример 1
К 100 г раствора CaCl2 (38 вес.%) добавлено 2,0 г Ca(OCl)2, 60 г CH3(CF2CF2)C(CH3)2OH с получением водного раствора и при интенсивном перемешивании барботировали Cl2. Смесь, в частности, водная фаза смеси, имела pH 6,5. По окончании процесса органическую часть, насыщенную Сl+, отделяли на центрифуге. Концентрация Cl+ в органической части составляла 18810 мг/л, концентрация Cl+ в водной части 16680 мг/л.
К органической части добавляли воду, перемешивали и барботировали через неё пропилен. Прохождение реакции определяли по обесцвечиванию смеси, исчезновению запаха.
Был проведен анализ ЯМР, который показал, что в смеси содержится хлоргидрин пропилена, при этом не было обнаружено дихлорида пропилена.
Смесь после барботирования пропилена подвергали сепарации с отделением органической фазы от водной. Органическую фазу смешивали с раствором CaCl2 (33 вес.%), добавляли CaO и перегоняли при кипении (атмосферное давление).
Смешивали 40 мл органической фазы и 25 мл раствора CaCl2 (концентрация 25%), добавляли Ca(OН)2 – 2,0 г, нагревали при интенсивном перемешивании до кипения при температуре 110-115 oC и отгоняли образующийся оксид пропилена. Дистиллят – ОФ – 6 мл, ВФ – 1,5 мл. Кубовый остаток – ОФ 34 мл, ВФ – 23 мл.
Смешивали 40 мл органической фазы и 25 мл раствора CaCl2 (концентрация 25%), добавляли Ca(OН)2 – 2,0 г, нагревали при интенсивном перемешивании до кипения при температуре 110-115 oC и отгоняли образующийся оксид пропилена.
Проводили дистилляцию результирующей смеси.
Таблица 1 Содержание соединений в дистилляте и кубовом остатке после омыления
0,40 вес%
0,17 вес%
0,51 вес.%
0,29 вес%
Общий вес оксида в дистилляте– 125 мг, общий вес хлоргидринов пропилена в кубовом остатке 75 мг.
Степень превращения пропилена в оксид пропилена составила 72%.
Пример 2
К 360 г раствора CaCl2 (39вес.%) и CHF2CF2C(CH3)2OH добавляют 15,6 г гипохлорита кальция Ca(OCl)2. Через раствор барботируют Cl2. pH результирующей смеси 5,4.
Органическая часть отделяется от смеси на делительной воронке и центрифугируется для удаления остатков водной части. Концентрация Cl+ в органической фазе составляла 0,85 г-ион/л, концентрация Cl+ в водной фазе 0,25 г-ион/л.
Насыщенная Cl+ органическая часть делилась на 3 части:
1) Первая часть подвергалась хлоргидринированию пропилена без предварительной обработки после отделения органической фазы.
Остальные части перед хлоргидринированием (барботажем пропилена) предварительно обрабатываются:
2) суспензией Ca(OH)2 в воде: вес органической части 31,5 г, вес воды 1,7 г, Ca(OH)2 0,03 г. Проводили интенсивное перемешивание до полного растворения Ca(OH)2, отстаивали и центрифугировали.
3) органическая часть продувалась воздухом около 3-4 минут через фильтр Шотта 100 мкм.
Хлоргидринирование проводили барботажем этилена через смесь органической части, воды и мела (CaCO3). Вес органической части 30 г, вес воды 10 г и CaCO3 0,5г
Состав органической части определялся с помощью ЯМР H1, C13
1)Хлоргидринирование без предварительной обработки Ca(OH)2
Перед барботажем смесь охлаждается до 8,8оС. Во время барботажа пропилена происходит саморазогрев до +19,3о С (реактор находится в водяной бане со льдом).
2)Хлоргидринирование с предварительной обработкой органической частиводной суспензией Ca(OH)2
Перед барботажем смесь охлаждается до 9,3оС. Во время барботажа пропилена происходит саморазогрев до +18,1о С (реактор находится в водяной бане со льдом)
3)Хлоргидринирование с предварительной продувкой органической части воздухом
Перед барботажем смесь охлаждается до 10,2оС. Во время барботажа пропилена происходит саморазогрев до +15о С (реактор находится в водяной бане со льдом)
Таблица 2 Содержание соединений в органической части после барботажа пропилена (ЯМР)
Объединённый продукт хлоргидринирования (без разделения на водную и органическую фазы после хлоргидринирования) подвергают процессу омыления:
К объединённому продукту добавляли 2,0 г Ca(OH)2. Смесь нагревали при перемешивании с температурой 75оС-96оС. Проводили дистилляцию результирующей смеси.
Таблица 3 Содержание соединений в дистилляте и кубовом остатке после омыления
Из результатов анализа видно, что в отсутствии предварительной обработки органической части после барботажа Cl2 суспензией Ca(OH)2 в процессе барботажа этилена на 9-12 молей хлоргидринов образуется 1 моль дихлорэтана (10 мол%).
При введении предварительной обработки доля дихлорэтана в продуктах реакции резко падает ниже предела обнаружения.
Наилучший результат получен при обработке суспензией Ca(OH)2. После хлоргидринирования концентрация хлоргидринов приблизительно равна концентрации полученной для органической части не прошедшей обработку, но при этом не обнаружен дихлорэтан (данные ЯМР).
Пример 3
К раствору CaCl2 (40вес.%) и CHF2CF2C(CH3)2OH добавляют Ca(OCl)2 как указано выше для Примера 2. Через суспензию медленно при перемешивании барботируют Cl2. pH результирующей смеси рН= 5,85-6.
Органическую часть отделяют на делительной воронке. Для отделения взвеси остатков твёрдой фазы в органической части использовали центрифугирование. Концентрация Cl+ в органической фазе1,2 г-ион/л.
Органическую часть, насыщенную Cl+, обрабатывали суспензией Ca(OH)2 (35 г воды + 2,22 г Ca(OH)2). После перемешивания и отделения органической фазы, последнюю направляли на хлоргидринирование. Центрифугирования не проводилось.
К органической фазе добавлено 30,4 г воды и 1,80 г мела (0,018 моля). При интенсивном перемешивании и охлаждении на водяной бане с температурой 10оС барботировали пропилен.
Для омыления хлоргидрина полученной смеси использовали 8,2 г Ca(OH)2. Омыление проводили при температуре 85оС-100оС. Проводили дистилляцию смеси.
Таблица 4 Содержание соединений в органической фазе после хлоргидринирования
Таблица 5 Содержание соединений в дистилляте и кубовом остатке после омыления
Из представленных примеров следует, что благодаря способу по настоящему изобретению можно получать эпоксидные соединения с большой эффективностью и селективностью процесса, а также с уменьшенным образованием подобных продуктов при процессах хлоргидринирования и омыления.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРГИДРИННОГО СОЕДИНЕНИЯ | 2022 |
|
RU2788109C1 |
| СОСТАВ, СПОСОБНЫЙ К ПОЛИМЕРИЗАЦИИ | 1995 |
|
RU2168518C2 |
| КОМПОЗИЦИЯ ДЛЯ ЗАЩИТЫ ИЗДЕЛИЙ ИЗ НАТУРАЛЬНОЙ И ИСКУССТВЕННОЙ ГЛАДКОЙ И ВОРСОВОЙ КОЖИ ОТ ДЕЙСТВИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ АНТИГОЛОЛЕДНЫХ РЕАГЕНТОВ | 2014 |
|
RU2553652C1 |
| СПОСОБ ПОЛУЧЕНИЯ β -ФЕНИЛИЗОСЕРИНА И ЕГО АНАЛОГОВ, ПРОИЗВОДНЫХ α -ФЕНИЛИЗОСЕРИНА, ПРОИЗВОДНЫЕ АЗЕТИДИНОНА | 1993 |
|
RU2103258C1 |
| СОСТАВ ДЛЯ ПОЛУЧЕНИЯ МЕТАТЕЗИСНЫХ ПОЛИМЕРИЗАТОВ | 1995 |
|
RU2171815C2 |
| КОМПОЗИЦИИ ДЛЯ КОНДИЦИОНИРОВАНИЯ ВОЛОС | 2007 |
|
RU2443409C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕТИЧНЫХ АМИНОВ, СОДЕРЖАЩИХ ЭТЕНИЛБЕНЗИЛЬНЫЕ ЗАМЕСТИТЕЛИ | 2015 |
|
RU2732296C2 |
| 6,7-ОКИСЛЕННЫЕ СТЕРОИДЫ | 1997 |
|
RU2196143C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ЭПЛЕРЕНОНА | 2003 |
|
RU2339642C9 |
| ПРОИЗВОДНЫЕ 6-АМИНО-МОРФИНАНА И ИХ ПРИМЕНЕНИЕ | 2002 |
|
RU2306314C2 |
Настоящее изобретение относится к области получения эпоксидных соединений хлоргидринным методом с применением фторированного третичного С4-С16 спирта. Описан способ получения эпоксидного соединения, включающий: а) барботаж Cl2 через суспензию, содержащую концентрированный водный раствор CaCl2, фторированный третичный С4-С16 спирт и гипохлорирующий агент, выбранный из группы, состоящей из Ca(OCl)2, CaCl(OCl), Ca(OH)(OCl) и их комбинаций, с получением первой смеси, b) отделение органической части первой смеси, включающей фторированный третичный С4-С16 спирт и фторированный алкил С4-С16 гипохлорит, от водной части первой смеси, включающей концентрированный раствор CaCl2, с) удаление из отделённой органической части первой смеси растворённого Cl2 посредством продувки воздухом или обработки суспензией Ca(OH)2 в растворе CaCl2 с получением органической части первой смеси, свободной от растворённого Cl2, d) добавление алкена С2-С18 или иного органического соединения с двойной связью углерод-углерод в органическую часть первой смеси, свободной от растворённого Cl2, с получением второй смеси, содержащей соответствующее алкену С2-С18 или иному органическому соединению с двойной связью углерод-углерод хлоргидринное соединение, e) омыление второй смеси в присутствии Ca(OH)2 и/или CaO с получением соответствующего эпоксидного соединения. Технический результат – высокая эффективность и селективность получения эпоксидного соединения и сниженное образование побочных продуктов. 2 н. и 16 з.п. ф-лы, 2 ил., 5 табл., 3 пр.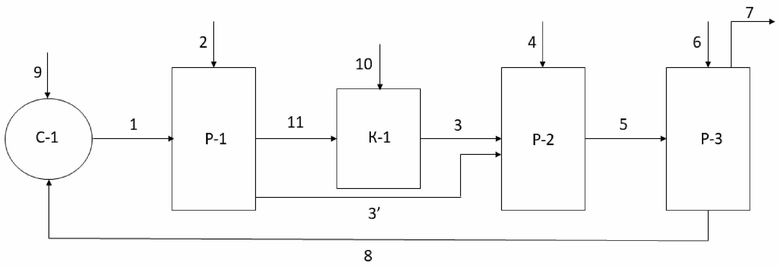
1. Способ получения эпоксидного соединения, включающий:
а) барботаж Cl2 через суспензию, содержащую концентрированный водный раствор CaCl2, фторированный третичный С4-С16 спирт и гипохлорирующий агент, выбранный из группы, состоящей из Ca(OCl)2, CaCl(OCl), Ca(OH)(OCl) и их комбинаций, с получением первой смеси,
b) отделение органической части первой смеси, включающей фторированный третичный С4-С16 спирт и фторированный алкил С4-С16 гипохлорит, от водной части первой смеси, включающей концентрированный раствор CaCl2,
с) удаление из отделённой органической части первой смеси растворённого Cl2 посредством продувки воздухом или обработки суспензией Ca(OH)2 в растворе CaCl2 с получением органической части первой смеси, свободной от растворённого Cl2,
d) добавление алкена С2-С18 или иного органического соединения с двойной связью углерод-углерод в органическую часть первой смеси, свободной от растворённого Cl2, с получением второй смеси, содержащей соответствующее алкену С2-С18 или иному органическому соединению с двойной связью углерод-углерод хлоргидринное соединение,
e) омыление второй смеси в присутствии Ca(OH)2 и/или CaO с получением соответствующего эпоксидного соединения.
2. Способ по п.1, в котором на этапе а) значение pH водной фазы суспензии составляет от 4 до 8, предпочтительно от 5 до 6.
3. Способ по п.1, в котором фторированный третичный С4-С16 спирт включает в себя фрагмент
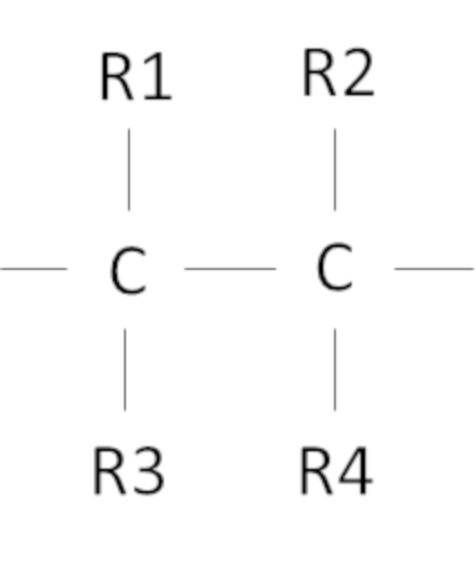 ,
,
где R1, R2, R3, R4 независимо выбраны из группы, состоящей из H, CH3 и F, при условии, что по меньшей мере один из R1, R2, R3, R4 представляет собой F, предпочтительно R1, R2, R3, R4 представляют собой F.
4. Способ по п.1, в котором фторированный третичный С4-С16 спирт представляет собой тетрафторированный третичный С4-С16 спирт.
5. Способ по п.1, в котором фторированный третичный С4-С16 спирт включает в себя фрагмент, выбранный из группы, состоящей из CH3(CF2CF2)-, CHF2CF2-.
6. Способ по п.1, в котором фторированный третичный С4-С16 спирт представляет собой соединение следующей формулы:
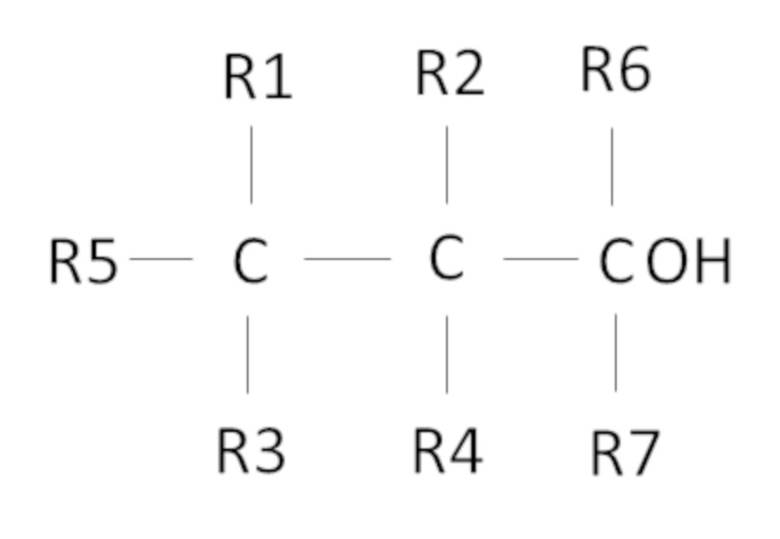 ,
,
где R1, R2, R3, R4 независимо выбраны из группы, состоящей из H, CH3 и F, при условии, что по меньшей мере один из R1, R2, R3, R4 представляет собой F, предпочтительно R1, R2, R3, R4 представляют собой F,
где R5 представляет собой H или С1-С11 алкил, R6 и R7 независимо выбраны из CH3 и C2H5, предпочтительно R6 и R7 представляют собой CH3,
причем сумма атомов углерода у R1, R2, R3, R4, R5, R6 и R7 составляет от 1 до 11.
7. Способ по п.1, в котором фторированный третичный С4-С16 спирт представляет собой фторированный третичный С5-С6 спирт.
8. Способ по п.7, в котором фторированный третичный С5-С6 спирт представляет собой тетрафторированный третичный С5-С6 спирт.
9. Способ по п.1, в котором на этапе с) дополнительно получают дополнительный поток, содержащий водный раствор CaCl2, причем дополнительный поток направляют на этап а) способа.
10. Способ по п.1, в котором этап e) проводят с нагревом второй смеси при дополнительном присутствии CaCl2 в количестве не более 30 вес.%, предпочтительно, от 20 до 30 вес.%, более предпочтительно, от 20 до менее 30 вес.%.
11. Способ по п.1, в котором на этапе а) концентрированный водный раствор CaCl2 включает CaCl2 в количестве от 30 до 40 вес.%.
12. Применение фторированного третичного С4-С16 спирта для получения эпоксидных соединений способом по п.1.
13. Применение по п.12, в котором фторированный третичный С4-С16 спирт включает в себя фрагмент
 ,
,
где R1, R2, R3, R4 независимо выбраны из группы, состоящей из H, CH3 и F, при условии, что по меньшей мере один из R1, R2, R3, R4 представляет собой F, предпочтительно R1, R2, R3, R4 представляют собой F.
14. Применение по п.12, в котором фторированный третичный С4-С16 спирт представляет собой тетрафторированный третичный С4-С16 спирт.
15. Применение по п.12, в котором фторированный третичный С4-С16 спирт включает в себя фрагмент, выбранный из группы, состоящей из CH3(CF2CF2)-, CHF2CF2-.
16. Применение по п.12, в котором фторированный третичный С4-С16 спирт представляет собой соединение следующей формулы:
 ,
,
где R1, R2, R3, R4 независимо выбраны из группы, состоящей из H, CH3 и F, при условии, что по меньшей мере один из R1, R2, R3, R4 представляет собой F, предпочтительно R1, R2, R3, R4 представляют собой F,
где R5 представляет собой H или С1-С11 алкил, R6 и R7 независимо выбраны из CH3 и C2H5, предпочтительно R6 и R7 представляют собой CH3,
причем сумма атомов углерода у R1, R2, R3, R4, R5, R6 и R7 составляет от 1 до 11.
17. Применение по п.12, в котором фторированный третичный С4-С16 спирт представляет собой фторированный третичный С5-С6 спирт.
18. Применение по п.17, в котором фторированный третичный С5-С6 спирт представляет собой тетрафторированный третичный С5-С6 спирт.
| US 4443620 A, 17.04.1984 | |||
| US 4496752 A, 29.01.1985 | |||
| US 4410714 A, 18.10.1983 | |||
| СПОСОБ ПОЛУЧЕНИЯ ОКИСИ БУТИЛЕНА | 0 |
|
SU389088A1 |
Авторы
Даты
2023-01-16—Публикация
2021-11-29—Подача