Данное изобретение касается класса соединений 6-аминоморфинана, которые могут применяться в качестве высокоактивных анальгетиков. Данное изобретение также относится к их фармацевтически приемлемым солям и легкодоступным производным (например, сложным эфирам или амидам производных аминокислоты), к способу их получения и их применению в получении фармацевтических продуктов.
Существование опиоидных рецепторов в качестве рецепторов центральной нервной системы (ЦНС), которые переносят анальгезирующее действие, четко доказано. Эти рецепторы подразделяются на три подтипа: m, k и d. Активация данных рецепторов опиоидами дает анальгезирующее действие. Активация m-рецепторов дает наибольшее анальгезирующее действие, при этом в качестве эффективных анальгетиков применяют определенные морфинаны с функциональной группой кислорода в положении 6 (морфин, оксиморфон, гидроморфон и т.д.). В последнее время проводились значительные исследования взаимоотношений структура-активность в данном классе веществ.
В Journal of Medical Chemistry 1984, 27, стр. 1575-1579 описаны различные 14-метоксиморфинан-6-оны с различными заместителями в положении 3. Эти производные демонстрируют наивысшее анальгезирующее действие по сравнению с их 14-гидрокси аналогами.
Подробное изучение 5-метилоксиморфона (= 14-гидрокси-5-метилдигидроморфинона) описано в Helvetica Chimica Acta (1988, 71, стр. 1801-1804), показало, что введение 5-метильной группы снижает агонистические к опиоиду характеристики оксиморфона.
Дальнейшее изучение 14-алкоксиморфинан-6-онов описано в Helvetica Chimica Acta 1989, 72, стр. 1233-1239, в нем оценивают влияние различных заместителей в положении 3 и азота аминогруппы.
В описании DE 3412727 представлены 14-алкокси-N-метилморфинан-6-оны (14-О-алкилоксиморфоны) c более высокой активностью по сравнению с их 14-гидрокси аналогами.
Недавно было обнаружено существование опиоидных рецепторов в периферийной системе (например, в костях, суставах, хрящах, мышцах и т.д.). Показано, что обезболивание также может осуществляться через такие периферийные опиоидные рецепторы (C. Stein, New Engl. J. Med. 1995, 332, стр. 1685-1690). Для этого необходима только незначительная доза опиоида (например, морфина), которую вводят непосредственно в поврежденную ткань инъекцией. Такая незначительная доза не вызывает каких-либо побочных эффектов в центральной нервной системе. Анальгезирующее действие наблюдали особенно во время лечения воспаления и невропатической боли (R. Likar et al., Brit. J. Anaesth. 1999, 83, стр. 241-244; V. Kayser et al., Neurosci. 1995, 64, 537-545). Способ введения (инъекция) является значительным недостатком лечения. Повторные инъекции в поврежденную ткань или сустав связаны с риском кровотечения, инфекции или повреждения хряща. Анальгетически эффективные вещества, которые имеют только ограниченный доступ к центральной нервной системе (из-за того, что они не могут преодолевать, или преодолевают только в незначительной степени, гематоэнцефалический барьер) и которые могут вводиться системно или перорально, представляют большой интерес.
Объектом данного изобретения является получение высокоактивных анальгетиков, которые предпочтительно обладают ограниченным доступом к ЦНС и которые предпочтительно действуют периферически, а не центрально, и которые могут, предпочтительно, вводиться системно или перорально. Вещества, которые являются многообещающими в свете вышеперечисленного, представляют собой вещества, оказывающие исключительно периферийное анальгезирующее действие, без побочных эффектов, которые возникают при центральном действии.
Данное изобретение решает поставленную выше задачу посредством объектов независимых пунктов. Предпочтительные варианты даны в зависимых пунктах.
Данное изобретение представляет высокоактивные соединения формулы (I)

в которой заместители имеют следующее значение: R1: водород; С1-С6 алкил; С2-С6 алкенил; С2-С6 алкинил; С1-С6 моногидроксиалкил; С2-С6 дигидроксиалкил; С3-С6 тригидроксиалкил; С4-С16 циклоалкилалкил, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенил, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинил, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкил, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенил, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинил, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил.
Азот, присоединенный к R1, также может быть кватернизирован двумя заместителями R1, которые могут быть одинаковыми или разными и которые имеют представленное выше определение, и где второй, кватернизирующий заместитель также может иметь значение гидроксил, оксил (N оксид), а также алкоксил.
R2, при условии представленных ниже определений Х: водород; С1-С6 алкил; С2-С6 алкенил; С2-С6 алкинил; С1-С6 моногидроксиалкил; С2-С6 дигидроксиалкил; С3-С6 тригидроксиалкил; С4-С16 циклоалкилалкил, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенил, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинил, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкил, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенил, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинил, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; С2-С6 алканоил; С3-С6 алкеноил; С3-С6 алкиноил; С7-С16 арилалканоил, где арилом является С6-С10 арил и алканоилом является С1-С6 алканоил; С9-С16 арилалкеноил, где арилом является С6-С10 арил и алкеноилом является С3-С6 алкеноил; С9-С16 арилалкиноил, где арилом является С6-С10 арил и алкиноилом является С3-С6 алкиноил.
R3: С1-С6 алкил; С2-С6 алкенил; С7-С16 арилалкил, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенил, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; алкоксиалкил, где алкокси является С1-С6 алкокси и алкилом является С1-С6 алкил; CO2(С1-С6 алкил); СО2Н; СН2ОН.
R4, при условии представленных ниже определений Y: водород; С1-С6 алкил; С2-С6 алкенил; С2-С6 алкинил; С4-С16 циклоалкилалкил, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенил, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинил, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкил, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенил, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинил, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; С2-С6 алканоил; С3-С6 алкеноил; С3-С6 алкиноил; С7-С16 арилалканоил, где арилом является С6-С10 арил и алканоилом является С1-С6 алканоил; С9-С16 арилалкеноил, где арилом является С6-С10 арил и алкеноилом является С3-С6 алкеноил; С9-С16 арилалкиноил, где арилом является С6-С10 арил и алкиноилом является С3-С6 алкиноил; иминометил, формамидинил, С1-С6-N-алкил- и N,N'-диалкилформамидинил; С2-С6-N-алкенил- и N,N'-диалкенилформамидинил; С2-С6-N-алкинил- и N,N'-диалкинилформамидинил; С4-С16-N-циклоалкилалкил- и N,N'-дициклоалкилалкилформамидинил, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16-N-циклоалкилалкенил- и N,N'-дициклоалкилалкенилформамидинил, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16-N-циклоалкилалкинил- и N,N'-дициклоалкилалкинилформамидинил, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16-N-арилалкил- и N,N'-диарилалкилформамидинил, где арилом является С6-С10 арил и алкилом является С1-С6 алкил.
R5 и R6, которые могут быть одинаковыми или разными: водород; С1-С6 алкил; С2-С6 алкенил; С2-С6 алкинил; С4-С16 циклоалкилалкил, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенил, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинил, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкил, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенил, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинил, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; далее, R5 и R6, которые могут быть одинаковыми или разными, CH(A)CO2B, где А является водородом; гидроксилом; С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; амино; С1-С6 алкиламино; гуанидино; С1-С6 алкил-СО2В; и где В является водородом; С1-С30-, предпочтительно С1-С6 алкилом; С2-С30-, предпочтительно С2-С6 алкенилом; С2-С30-, предпочтительно С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; фенилом; замещенным фенилом; СН2ОСО-С1-С6 алкилом; СН(С1-С6 алкил)ОСО-С1-С6 алкилом; СН2ОСОО-С1-С6 алкилом; СН(С1-С6 алкил)ОСОО-С1-С6 алкилом; СН2CON(С1-С6 алкилом)2; СН(С1-С6 алкил)CON(С1-С6 алкилом)2; фталидилом, (5-метил-2-оксо-1,3-диоксол-4-ил)метилом; далее, СН(А)SO3B, где А и В такие, как определены выше; также R5 и R6, которые могут быть одинаковыми или разными, могут являться иминометилом, формамидинилом, С1-С6-N-алкил- и N,N'-диалкилформамидинилом; С2-С6-N-алкенил- и N,N'-диалкенилформамидинилом; С2-С6-N-алкинил- и N,N'-диалкинилформамидинилом; С4-С16-N-циклоалкилалкил- и N,N'-дициклоалкилалкилформамидинилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С3-С16-N-циклоалкилалкенил- и N,N'-дициклоалкилалкенилформамидинилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16-N-циклоалкилалкинил- и N,N'-дициклоалкилалкинилформамидинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16-N-арилалкил- и N,N'-диарилалкилформамидинилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16-N-арилалкенил- и N,N'-диарилалкенилформамидинилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16-N-арилалкинил- и N,N'-диарилалкинилформамидинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; С2-С7-N-алкилоксикарбонил- и N,N'-бис(алкилоксикарбонил)формамидинилом; С3-С8-N-алкенилоксикарбонил- и N,N'-бис(алкенилоксикарбонил)формамидинилом; С3-С8-N-алкинилоксикарбонил- и N,N'-бис(алкинилоксикарбонил)формамидинилом; С8-С17-N-арилалкилоксикарбонил- и N,N'-бис(арилалкилоксикарбонил)формамидинилом, где арилом является С6-С10 арил и алкилокси является С1-С6 алкилокси; С9-С17-N-арилалкенилоксикарбонил- и N,N'-бис(арилалкенилоксикарбонил)формамидинилом, где арилом является С6-С10 арил и алкенилокси является С2-С6 алкенилокси; С9-С17-N-арилалкинилоксикарбонил- и N,N'-бис(арилалкинилоксикарбонил) формамидинилом, где арилом является С6-С10 арил и алкинилокси является С2-С6 алкинилокси; С2-С7-N-алканоил- и N,N'-диалканоилформамидинилом; С3-С8-N-алкеноил- и N,N'-диалкеноилформамидинилом; С3-С8-N-алкиноил- и N,N'-диалкиноилформамидинилом; С8-С16-N-арилалканоил- и N,N'-диарилалканоилформамидинилом, где арилом является С6-С10 арил и алканоилом является С2-С6 алканоил; С9-С16-N-арилалкеноил- и N,N'-диарилалкеноилформамидинилом, где арилом является С6-С10 арил и алкеноилом является С3-С6 алкеноил; С9-С16-N-арилалкиноил- и N,N'-диарилалкиноилформамидинилом, где арилом является С6-С10 арил и алкиноилом является С3-С6 алкиноил; также R5 и R6, которые могут быть одинаковыми или разными, могут быть 4,5-дигидро-1Н-имидазол-2-илом, 1,4,5,6-тетрагидропиридимин-2-илом, 4,5,6,7-тетрагидро-1Н-[1,3]диазепин-2-илом.
Х является кислородом, серой или метиленом, или группа (X-R2) является Н.
Y является кислородом или группа (Y-R4) является Н.
Данное изобретение также включает фармацевтически приемлемые кислотно-аддитивные соли и легкодоступные производные (например, сложные эфиры или амиды производных аминокислоты) соединений формулы (I).
В данном изобретении термины алкил, алкенил и алкинил включают как разветвленные, так и неразветвленные алкильные, алкенильные и алкинильные группы, а также моно-, ди- и тригидроксизамещенные разветвленные и неразветвленные алкильные, алкенильные и алкинильные группы. Арил может быть не замещен или моно-, ди- или тризамещен, где заместители могут быть независимо выбраны из гидрокси, галогена, нитро, циано, тиоцианат, трифторметила, С1-С3 алкила, С1-С3 алкокси, CO2H, CONH2, CO2(С1-С3 алкила), CONH(С1-С3 алкила), CON(С1-С3 алкила)2, СО(С1-С3 алкила); амино; (С1-С3-моноалкил)амино, (С1-С3-диалкил)амино, С5-С6 циклоалкиламино; (С1-С3 алканоил)амидо, SH, SO3H, SO3(С1-С3 алкила), SO2(С1-С3 алкила), SO(С1-С3 алкила), С1-С3 алкилтио или С1-С3 алканоилтио. Определения, перечисленные выше для алкила, алкенила, алкинила и арила, действительны для всех заместителей в данном описании.
Соединения в соответствии с данным изобретением включают фармацевтически и фармакологически приемлемые соли соединений формулы (I). В соответствии с данным изобретением подходящими являются как неорганические, так и органические соли. Примеры подходящих неорганических солей в соответствии с данным изобретением включают гидрохлориды, гидробромиды, сульфаты, фосфаты и тетрафторбораты. Возможными органическими солями являются, например, ацетаты, тартраты, лактаты, бензоаты, стеараты, памоаты, метансульфонаты, салицилаты, фумараты, малеинаты, сукцинаты, аспартаты, цитраты, оксалаты, трифторацетаты и оротаты.
В качестве обычных фармацевтически приемлемых аддитивных солей предпочтительны кислотно-аддитивные соли, особенно предпочтительны гидрохлориды, гидробромиды, тетрафторбораты и трифторацетаты. Х и Y предпочтительно являются кислородом. Предпочтительно R1 является алкилом, таким как определено выше, в частности метилом или этилом, где предпочтительным является метил, или циклоалкилалкилом, предпочтительно циклопропилметилом. R2 предпочтительно не является Н и не является группой, которая образует сложный эфир с Х. Наоборот, предпочтительны другие определения для R2, такие как даны в пункте 1, где особенно предпочтительным является алкил, такой как определено выше, особенно предпочтительными являются метил, этил и пропил, не обязательно замещенные, например, фенильной группой, например, с получением 3-фенилпропильной группы (например, иначе, предпочтительным R2 также является арилалкильная группа, в частности 3-фенилпропил). Особенно предпочтительно, чтобы оба R1 и R2 одновременно являлись алкилом, в частности либо оба одновременно являлись метилом, либо метилом (R1) и этилом (R2). Еще более предпочтительным сочетанием R1 и R2 является циклоалкилалкил, в частности циклопропилметил для R1 и арилалкил, предпочтительно фенилпропил для R2. R3 и R4 в каждом случае предпочтительно являются водородом или алкилом, где особенно предпочтительной алкильной группой является метил. Кроме того, предпочтительным R4 является C(N-Boc)(NH-Boc). R5 и R6 предпочтительно выбирают таким образом, чтобы один являлся Н и другой был отличен от Н, где данный радикал, отличный от Н, предпочтительно является не галогенированным. R5 и R6 предпочтительно выбирают, независимо друг от друга, из водорода, CH2COOC(CH3)3, CH2COOH, CH(CH3)COOC(CH3), CH(CH3)COOH, CH(CH2Ph)COOC(CH3)3, CH(CH2Ph)COOH, C(N-Boc)NH-BOC и C(NH)NH2, где R6 предпочтительно является Н и R5 предпочтительно является одной из групп, указанных выше или является Н. Также предпочтительно, когда R5 и R6 оба являются Н.
В особенно предпочтительном варианте Х и Y являются кислородом. Тогда, предпочтительно, R1 является метилом и циклопропилметилом, и R2 является алкилом и арилалкилом, в частности метилом и 3-фенилпропилом, и R3, R4 и R6 являются водородом. Предпочтительно R5 тогда выбирают из трет-бутоксикарбонилметила, гидроксикарбонилметила, 2-(трет-бутоксикарбонилэтила), 2-(гидроксикарбонилэтила), 2-(трет-бутоксикарбонил-1-фенилэтила), 2-(гидроксикарбонил-2-фенилэтила), водорода, бензила (в этом случае R6 также является бензильной группой), N,N'-бис-(трет-бутоксикарбонил)формамидинила и формамидинила.
Особенно предпочтительным вариантом данного изобретения является соединение формулы I, выбранное из:
трет-бутиловый эфир (4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-уксусной кислоты
трет-бутиловый эфир (4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-уксусной кислоты
(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-уксусная кислота
(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-уксусная кислота
трет-бутиловый эфир (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-пропионовой кислоты
трет-бутиловый эфир (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-пропионовой кислоты
(2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-пропионовая кислота
(2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-пропионовая кислота
трет-бутиловый эфир (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-3'-фенилпропионовой кислоты
трет-бутиловый эфир (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-3'-фенилпропионовой кислоты
(2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-3'-фенилпропионовая кислота
(2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-3'-фенилпропионовая кислота
6a-амино-4,5a-эпокси-14b-метокси-17-метилморфинан-3-ол
6b-дибензиламино-4,5a-эпокси-14b-метокси-17-метилморфинан-3-ол
6b-амино-4,5a-эпокси-14b-метокси-17-метилморфинан-3-ол
4,5a-эпокси-6b-[N,N'-бис(трет-бутоксикарбонил)гуанидинил]-14b-метокси-17-метилморфинан-3-ол
4,5a-эпокси-6b-гуанидинил-14b-метокси-17-метилморфинан-3-ол
4,5a-эпокси-6a-[N,N'-бис(трет-бутоксикарбонил)гуанидинил]-14b-метокси-17-метилморфинан-3-ол
4,5a-эпокси-6a-гуанидинил-14b-метокси-17-метилморфинан-3-ол
1,3-бис(трет-бутоксикарбонил)-2-{4,5a-эпокси-6b-[N,N'-бис(трет-бутоксикарбонил)гуанидинил]-14b-метокси-17-метилморфинан-3-ил}-изомочевина
1,3-бис(трет-бутоксикарбонил)-2-{4,5a-эпокси-6a-[N,N'-бис(трет-бутоксикарбонил)гуанидинил]-14b-метокси-17-метилморфинан-3-ил}-изомочевина
дигидрохлорид этилового эфира (4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-уксусной кислоты
дигидрохлорид этилового эфира (4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-уксусной кислоты
трет-бутиловый эфир (4,5a-эпокси-3-гидрокси-14b-этокси-17-метилморфинан-6a-иламино)-уксусной кислоты
трет-бутиловый эфир (4,5a-эпокси-3-гидрокси-14b-этокси-17-метилморфинан-6b-иламино)-уксусной кислоты
бис(тетрафторборат) (4,5a-эпокси-3-гидрокси-14b-этокси-17-метилморфинан-6a-иламино)-уксусной кислоты
бис(тетрафторборат) (4,5a-эпокси-3-гидрокси-14b-этокси-17-метилморфинан-6b-иламино)-уксусной кислоты
трет-бутиловый эфир (2'S)-2'-(17-циклопропилметил-4,5a-эпокси-3,14b-дигидроксиморфинан-6b-иламино)-3-фенилпропионовой кислоты
бис(тетрафторборат) (2'S)-2'-(17-циклопропилметил-4,5a-эпокси-3,14b-дигидроксиморфинан-6b-иламино)-3-фенилпропионовой кислоты
трет-бутиловый эфир {17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[(3-фенилпропил)окси]-морфинан-6a-иламино}-уксусной кислоты
трет-бутиловый эфир {17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[(3-фенилпропил)окси]-морфинан-6a-иламино}-уксусной кислоты
трет-бутиловый эфир (2'S)-2'-(17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[(3-фенилпропил)окси]-морфинан-6a-иламино)-3-фенилпропионовой кислоты
дигидрохлорид {17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[(3-фенилпропил)окси]-морфинан-6b-иламино}-уксусной кислоты.
Было обнаружено, что соединения в соответствии с данным изобретением являются эффективными лигандами опиоидного рецептора типа 6-аминоморфинана и демонстрируют высокий потенциал терапевтического применения в качестве анальгетиков, в качестве иммуномодуляторов с иммуностимулирующим или иммунодепрессивным действием, в качестве лекарственных противораковых средств, ингибиторов воспаления, в качестве противоревматических агентов, мочегонных средств, средств, снижающих аппетит, в качестве противодиарейного агента, анестетиков или в качестве нейропротективных активных веществ.
Соединения, представленные в формуле изобретения, являются потенциально полезными для лечения боли, функциональных кишечных заболеваний, таких как боли в брюшной полости, непроходимость кишечника (илеус) или стойкий запор, для лечения млекопитающих, в частности человека, для лечения болезни Рейно, для лечения расстройств, вызванных сужением кровеносных сосудов, для лечения дисменореи, стенокардии, инфаркта миокарда, эмфиземы, бронхиальных спазмов, хронического закупоривающего бронхита, ревматических расстройств, нефропатии, нефрита в сочетании с ревматической болезнью, для лечения опухолей, фаэхромоцитомы, болезни Аддисона, цирроза печени, хронического воспаления тонкого и толстого кишечника (например, синдрома раздраженной толстой кишки - раздраженной толстой кишки, язвенного колита, болезни Крона), синдрома отмены, например, опиатов, кокаина или алкоголя, или для лечения психических заболеваний, таких как дисфория или шизофрения.
Соединения в соответствии с данным изобретением подходят для применения для получения лекарственных средств для лечения боли, включая острую и хроническую боль, или боли в опорно-двигательном аппарате, такой как боль в шее, спине, бедре, колене, плече или миолицевой боли, для лечения синдромов комплексной периферийной боли, фантомной боли, лицевой невралгии, ревматалгии, раковой боли, боли от ожогов, боли после несчастного случая, боли вследствие хронического воспаления, висцералгии, головных болей, таких как, например, тянущая головная боль, цервикально связанной головной боли или мигрени, боли после центральных повреждений, таких как, например, параплегия или таламическое повреждение, невралгической боли, такой как невралгия при опоясывающем лишае, невралгия после опоясывающего лишая, ишемической боли, такой как стенокардия или закупоривание периферийных артерий, послеоперационной боли, невропатической боли, такой как боль при диабетической невропатии, боль после вирусной инфекции или боль после повреждения нервов.
Фармацевтические композиции в соответствии с данным изобретением, которые содержат соединение в соответствии с данным изобретением и/или его фармацевтически приемлемую соль в качестве активного ингредиента вместе с фармацевтически приемлемым носителем, подходят для лечения состояний, указанных в данном описании.
Применение в соответствии с данным изобретением включает применение в качестве анальгетика, иммуномодулятора, противоопухолевого агента, антипролиферативного агента, противовоспалительного агента, противоревматического агента, мочегонного, средства, снижающего аппетит, противодиарейного средства, анестетика, нейропротективного активного вещества, и в качестве активного вещества для профилактики и лечения непроходимости кишечника (илеуса).
Предпочтительным применением является получением лекарственного средства для лечения боли, функциональных кишечных заболеваний, болезни Рейно, для лечения расстройств, вызванных сужением кровеносных сосудов, стенокардии, инфаркта миокарда, эмфиземы, бронхиальных спазмов, хронического закупоривающего бронхита, ревматических расстройств (включая ревматоидный артрит, артроз, остеоартрит, спондилоз, люмбаго, красную волчанку, спондиартропатию), нефропатии, нефрита в сочетании с ревматической болезнью для лечения опухолей, рака, фаэхромоцитомы, болезни Аддисона, цирроза печени, хронического воспаления тонкого и толстого кишечника (например, синдрома раздраженной толстой кишки - раздраженной толстой кишки, язвенного колита, болезни Крона), для лечения злоупотребления лекарственными средствами, психических заболеваний, дисфункции эрекции и/или для подавления отторжения трансплантатов после трансплантации млекопитающим, особенно человеку.
Неожиданно было обнаружено, что соединения в соответствии с данным изобретением не способны преодолевать гематоэнцефалический барьер или преодолевают его в незначительной степени, поэтому они представляют особенный интерес для применения в качестве периферически эффективных терапевтических средств, например лекарственных средств для лечения боли, ревматической терапии, подавления отторжения органов после трансплантации у млекопитающих, предпочтительно человека, а также для лечения расстройств эрекции. Ограниченный доступ к центральной нервной системе обеспечивает значительно сниженный риск побочных эффектов, относящихся к центральным побочным эффектам, таким как, например, тошнота, рвота, седативный эффект, головокружение, спутанность сознания, угнетение дыхания и мания.
Кроме того, неожиданно было обнаружено, что соединения в соответствии с данным изобретением имеют довольно долгий анальгетически эффективный период. Это позволяет снизить дозу и вводить препарат менее часто, что приводит к меньшему риску возникновения побочных эффектов и пониженной токсичности, а также дает большую готовность пациента к принятию лекарственного средства.
Получение соединений
Соединения в соответствии с данным изобретением, которые представлены формулой (I), могут быть получены следующими способами.
Исходя из тебаина формулы (II)

данное соединение взаимодействует с диалкилсульфатами, алкилэфирами фторсульфокислоты, алкилэфирами алкилсульфокислоты, алкилэфирами арилсульфокислоты, алкилгалогенидами, аралкилгалогенидами, аралкилэфирами алкилсульфокислоты, аралкилэфирами арилсульфокислоты, арилалкенилгалогенидами, сложными эфирами хлормуравьиной кислоты или подобными соединениями в растворителях, таких как тетрагидрофуран, 1,2-диметоксиэтан, диэтиловый эфир или подобные, в присутствии сильного основания, такого как н-бутиллитий, диэтиламид лития, диизопропиламид лития или подобные, при низких температурах (от -20 до -80°С) (см. Boden et al., J. Org. Chem., том 47, стр. 1347-1349, 1982; Schmidhammer et al., Helv. Chim. Acta, том 71, стр. 642-647, 1988; Gates et al., J. Org. Chem., том 54, стр. 972-975, 1984) с получением соединений формулы (III) где R3 является С1-С6 алкилом; С2-С6 алкенилом; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; алкоксиалкилом, где алкокси является С1-С6 алкокси и алкилом является С1-С6 алкил; CO2(С1-С6 алкилом); СО2Н.

Соединения формулы (III) или тебаин (формула (II)) могут быть превращены в соответствующие 14-гидроксикодеиноны формулы (IV),

где R3 является водородом; С1-С6 алкилом; С2-С6 алкенилом; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; алкоксиалкилом, где алкокси является С1-С6 алкокси и алкилом является С1-С6 алкил; CO2(С1-С6 алкилом). Эту реакцию проводят с пермуравьиной кислотой (см. H. Schmidhammer et al., Helv. Chim. Acta, том 71, стр. 1801-1804, 1988), м-хлорпербензойной кислотой или подобной кислотой при температурах от 0 до 60°С. Предпочтительным способом является реакция с пермуравьиной кислотой при температуре от 0 до 40°С.
Такие 14-гидроксикодеиноны формулы (IV) далее подвергают взаимодействию с диалкилсульфатами, алкилгалогенидами, алкенилгалогенидами, алкинилгалогенидами, арилалкилгалогенидами, арилалкенилгалогенидами, арилалкинилгалогенидами или хлорформиатами, в растворителях, таких как N,N-диметилформамид (ДМФ) или тетрагидрофуран (ТГФ) в присутствии сильного основания, такого как гидрид натрия, гидрид калия или амид натрия, с получением соединений формулы (V),
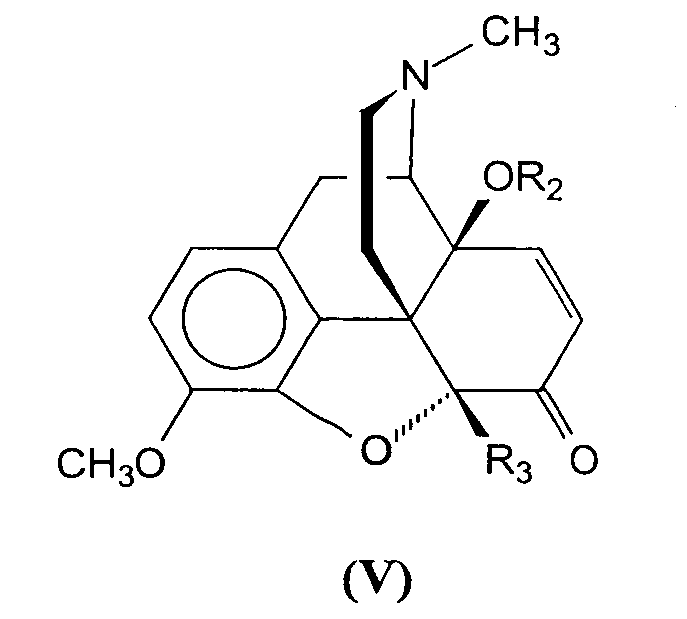
где R3 такой, как определен выше; и R2 является водородом; С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; С2-С6 алканоилом; С3-С6 алкеноилом; С3-С6 алкиноилом; С7-С16 арилалканоилом, где арилом является С6-С10 арил и алканоилом является С1-С6 алканоил; С9-С16 арилалкеноилом, где арилом является С6-С10 арил и алкеноилом является С3-С6 алкеноил; С9-С16 арилалкиноилом, где арилом является С6-С10 арил и алкиноилом является С3-С6 алкиноил.
Эти соединения затем восстанавливают до соединений формулы (VI), используя каталитическое гидрирование с катализатором, таким как Pd/C, PdO, Pd/Al2O3, Pt/C, PtO2, Pt/Al2O3 или подобным, в растворителях, таких как спирты, смеси спирт/вода, ледяная уксусная кислота или подобные,

где R2 и R3 такие, как определены выше.
Дальнейшее N-деметилирование проводят с хлорформиатами или бромцианогенами в растворителях, таких как 1,2-дихлорметан, хлороформ или подобные, с получением соединений формулы (VII),

где R1 является CO2CH(Cl)CH3, CO2CH=CH2, CO2CH2CCl3, CO2CH2CH3, CO2Ph, CN или подобным; и R2 и R3 такие, как определены выше.
Карбаматы формулы (VII) разделяют либо нагреванием при температуре кипения с обратным холодильником в спиртах (для 1-хлорэтилкарбаматов) или добавлением галогенводородов или галогенов с последующим нагреванием при температуре кипения с обратным холодильником в спиртах (для винилкарбаматов), с получением цианамидов формулы (VII) кислотным или щелочным гидролизом, с получением N-Nor соединений формулы (VIII),

в которой R2 и R3 такие, как определены выше.
N-алкилирование соединений формулы (VIII) проводят с алкилгалогенидами, диалкилсульфатами, алкенилгалогенидами, алкинилгалогенилами, циклоалкилгалогенилами, циклоалкенилалкилгалогенидами, арилалкилгалогенидами, арилалкенилгалогенидами, арилалкинилгалогенидами или подобными, в растворителях, таких как дихлорметан, хлороформ или N,N-диметилформамид, в присутствии основания, такого как бикарбонат натрия, карбонат калия, триэтиламин или подобные, и получением соединений формулы (IX),

где R2 и R3 такие, как определены выше; и R1 является водородом; С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил.
Разделение этих соединений формулы (IX) трибромидом бора (в растворителе с дихлорметаном или хлороформом) при температуре 0°С, 48% бромистоводородной кислотой (нагревание при температуре кипения с обратным холодильником), с алкантиолатами натрия (в растворителе, таком как N,N-диметилформамид) или с другими хорошо известными реагентами для разделения в эфире, дает фенольные соединения формулы (Х),

где R1, R2 и R3 такие, как определены выше.
3-О алкилирование соединений формулы (Х) проводят с алкилгалогенидами, диалкилсульфатами, алкенилгалогенидами, алкинилгалогенидами, циклоалкилалкилгалогенидами, циклоалкилалкенилгалогенидами, арилалкилгалогенидами, арилалкенилгалогенидами, арилалкинилгалогенидами или подобными, в растворителях, таких как дихлорметан, хлороформ, ацетон или N,N-диметилформамид, в присутствии основания, такого как бикарбонат натрия, карбонат калия, триэтиламин или подобные; 3-О ацилирование соединений формулы (Х) проводят галогенидами карбоновой кислоты, ангидридами карбоновой кислоты или подобными, в присутствии растворителей, таких как дихлорметан, хлороформ, ацетон или N,N-диметилформамид, пиридин или подобные, с получением соединений формулы (XI),

где R1, R2 и R3 такие, как определены выше; R4 является С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; С1-С6 алканоилом; С3-С6 алкеноилом; С3-С6 алкиноилом; С7-С16 арилалканоилом, где арилом является С6-С10 арил и алканоилом является С1-С6 алканоил; С9-С16 арилалкеноилом, где арилом является С6-С10 арил и алкеноилом является С3-С6 алкеноил и С9-С16 арилалкиноилом, где арилом является С6-С10 арил и алкиноилом является С3-С6 алкиноил.
Соединения формулы (XI) подвергают взаимодействию с ацетатом аммония, первичными и вторичными аминами, гидрохлоридом гидроксиамина, аминокислотами, сложными эфирами аминокислоты или подобными, в растворителях, таких как спирты, N,N-диметилформамид или толуол, с получением иминов формулы (XII) и солей иминия формулы (XIII),

в которых R1, R2, R3 и R4 такие, как определены выше; и R5 и R6, которые могут быть одинаковыми или разным, являются водородом, гидроксилом, С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; CH(A)CO2B, где А является водородом; гидроксилом; С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; амино; С1-С6 алкиламино; гуанидино; С1-С6 алкилгуанидино; С1-С6 алкил-СО2В; и где В является водородом; С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил.
Восстановление иминов и солей иминия проводят гидридами комплексов металлов, такими как алюмогидрид лития, боргидрид лития, боргидрид натрия и цианоборгидрид натрия или подобными, в спиртах, с борантетрагидрофураном или подобными в тетрагидрофуране (ТГФ), с циклогексеном или циклогексадиеном или подобными в присутствии катализатора гидрирования, такого как Pd/C, с водородом в присутствии катализатора гидрирования, такого как Pd/C, PdO, Pd/Al2O3, Pt/C, Pt/C (сульфидизированная), PtO2, Pt/Al2O3, Rh/C, Rh/Al2O3 или подобными, в растворителях, таких как спирты, ледяная уксусная кислота или подобных, с получением соответствующих аминов формулы (XIV),

в которых R1, R2, R3 и R4 такие, как определены выше; и R5 и R6, которые могут быть одинаковыми или разным, являются водородом, С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; CH(A)CO2B, где А является водородом; гидроксилом; С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; амино; С1-С6 алкиламино; гуанидино; С1-С6 алкилгуанидино; С1-С6 алкил-СО2В; и где В является водородом; С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил. Эти соединения соответствуют соединениям формулы (I) в соответствии с данным изобретением,

где R1, R2, R3, R4, R5 и R6 такие, как определены выше, и Х и Y являются кислородом.
Если R5 и R6 в соединениях формулы (I) в соответствии с данным изобретением являются водородом и Х и Y являются кислородом, то 6-амино соединения формулы (XV),

в которой R1, R2, R3 и R4 такие, как определены выше, могут быть подвергнуты взаимодействию с агентами гуанидинирования, такими как N,N'-бис-(трет-бутоксикарбонил)-S-метилизотиомочевина, в присутствии солей, таких как хлорид ртути(II), нитрат серебра или подобные, а также оснований, таких как триэтиламин, N-этилдиизопропиламин или подобные, в растворителях, таких как N,N-диметилформамид или подобные, и, в зависимости от количества применяемого агента гуанидинирования, с получением либо соединений формулы (XVI), либо соединений формулы (XVIa),

в которых R1, R2, R3 и R4 такие, как определены выше; и R5 и R6, которые могут быть одинаковыми или разным, являются водородом; защитной группой, такой как, например, трет-бутоксикарбонил (Boc) или бензилоксикарбонил (Z); С2-С7-алкилоксикарбонилом; С3-С8-алкенилоксикарбонилом; С3-С8-алкинилоксикарбонилом; С8-С17-арилалкилоксикарбонилом, где арилом является С6-С10 арил и алкилокси является С1-С6 алкилокси; С9-С17-арилалкенилоксикарбонилом, где арилом является С6-С10 арил и алкенилокси является С2-С6 алкенилокси; С9-С17-арилалкинилоксикарбонилом, где арилом является С6-С10 арил и алкинилокси является С2-С6 алкинилокси; С2-С7-алканоилом; С8-С17-аралканоилом, где арилом является С6-С10 арил и алкилом является С2-С7 алкил; С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил.
Последующее отщепление защитных групп (R5, R6) кислотами, такими как галогенистоводородные кислоты, трифторуксусная кислота, тетрафторборная кислота или подобные, в растворителях, таких как дихлорметан, диэтиловый эфир, спирты, смеси спирт/вода или подобные, дает соединения 6-гуанидинила формулы (XVII),

в которой R1, R2, R3 и R4 такие, как определены выше. Эти соединения соответствуют соединениям формулы (I) в соответствии с данным изобретением, в которых R1, R2, R3 и R4 такие, как определены выше и R5 является формамидинилом, R6 является водородом, Х и Y являются кислородом.
Если R5 и R6 в соединениях формулы (I) в соответствии с данным изобретением являются водородом и Х и Y являются кислородом, то 6-амино соединения формулы (XV),

в которой R1, R2, R3 и R4 такие, как определены выше, могут подвергаться взаимодействию с, например, N-ацил-2-(метилмеркапто)-2-имидазолином (который может быть легко представлен коммерчески доступным гидройодидом 2-(метилмеркапто)-2-имидазолина; см. Mundla et al., Tetrahedron Lett., том 41, стр. 6563, 2000) или подобными, в растворителях, таких как уксусная кислота, уксусная кислота/этанол 1:10; уксусная кислота/изопропанол 1:10 или подобных, с получением соединений формулы (XVIII),

в которой R1, R2, R3 и R4 такие, как определены выше; и R5 является водородом; защитной группой, такой как, например, трет-бутоксикарбонил (Boc) или бензилоксикарбонил (Z); С2-С7-алкилоксикарбонилом; С3-С8-алкенилоксикарбонилом; С3-С8-алкинилоксикарбонилом; С8-С17-арилалкилоксикарбонилом, где арилом является С6-С10 арил и алкилокси является С1-С6 алкилокси; С9-С17-арилалкенилоксикарбонилом, где арилом является С6-С10 арил и алкенилокси является С2-С6 алкенилокси; С9-С17-арилалкинилоксикарбонилом, где арилом является С6-С10 арил и алкинилокси является С2-С6 алкинилокси; С2-С7-алканоилом; С8-С17-аралканоилом, где арилом является С6-С10 арил и алкилом является С2-С7 алкил; С1-С6 алкилом; С2-С6 алкенилом; С2-С6 алкинилом; С4-С16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является С1-С6 алкил; С5-С16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; С5-С16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; С7-С16 арилалкилом, где арилом является С6-С10 арил и алкилом является С1-С6 алкил; С8-С16 арилалкенилом, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; С8-С16 арилалкинилом, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; n равно числу от 2 до 4.
Последующее отщепление защитной группы (R5) проводят нагреванием при температуре кипения с обратным холодильником соединений формулы (XVIII в растворителях, таких как уксусная кислота/этанол 1:10, уксусная кислота/изопропанол 1:10, метанол/вода 3:1 или подобных, с получением соединений формулы (XIX),
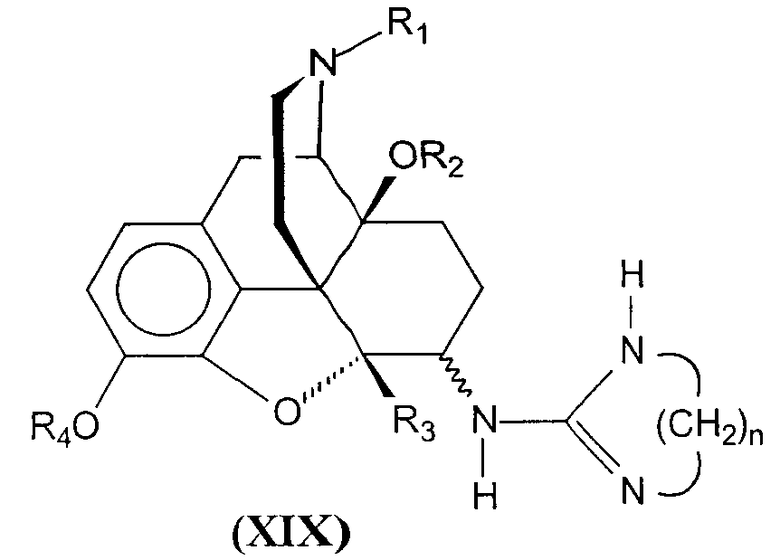
в которой R1, R2, R3 и R4 такие, как определены выше; n равно числу от 2 до 4. Эти соединения соответствуют соединениям формулы (I) в соответствии с данным изобретением, в которых R1, R2, R3 и R4 такие, как определены выше, и R5 является 4,5-дигидро-1Н-имидазол-2-илом (n=2), 1,4,5,6-тетрагидропиримидин-2-илом (n=3) или 4,5,6,7-тетрагидро-1Н-[1,3]диазепин-2-илом (n=4), R6 является водородом и Х и Y являются кислородом.
Альтернативный способ начинают с соединений формулы (XX), в которых R1 и R3 такие, как определены выше (см., например, формулу IX) (см. Weiss et al., J. Amer. Chem Soc., том 77, стр. 5891, 1955; Lijima et al., J. Med. Chem., том 21, стр. 398-400, 1978; Coop et al., J. Org. Chem., том 63, стр. 4392-4396, 1988; Schmidhammer et al., Helv. Chim Acta, том 71, стр. 1801-1804, 1988; Schmidhammer et al., Helv. Chim Acta, том 73, стр. 1986-1990, 1990).

Кетоны формулы (ХХ) подвергают взаимодействию в присутствии кислоты, такой как метансульфокислота или подобные, с этиленгликолем (в качестве реагента и растворителя) с получением соединений формулы (XXI),

в которой R1 и R3 такие, как определены выше.
Введение 3-О защитной группы в соединения формулы (XXI) осуществляют, например, с помощью бензилгалогенидов или триалкилгалогенсиланов, в растворителях, таких как дихлорметан, хлороформ, ацетон или N,N-диметилформамид или подобных, в присутствии основания, такого как бикарбонат натрия, карбонат калия, триэтиламин или подобные, с получением соединения формулы (XXII),

в которой R1 и R3 такие, как определены выше; R4 является защитной группой, такой как бензил, три(С1-С6-алкил)силил или Трис(С7-С16-арилалкил)силил, где арилом является С6-С10 арил и алкилом является С1-С6 алкил.
Эти 14-гидроксисоединения далее подвергают взаимодействию с диалкилсульфатами, алкилгалогенидами, алкенилгалогенидами, алкинилгалогенидами, арилалкилгалогенидами, арилалкенилгалогенидами, арилалкинилгалогенидами или хлорформиатами в растворителях, таких как N,N-диметилформамид (ДМФ) или тетрагидрофуран (ТГФ) в присутствии сильного основания, такого как гидрид натрия, гидрид калия или амид натрия, с получением соединений формулы (XXIII),

в которой R1, R2 и R3 такие, как определены выше (см., например, формулу (IX)), R4 такой, как определен в формуле (XXII). Если R2 и R4 являются бензилом, соединения формулы (XXI) могут быть непосредственно подвергнуты реакции с двумя эквивалентами бензилбромида в ДМФ в присутствии гидрида натрия, с получением 3,14-О-дибензильных производных формулы (XXIII), в которых R2 и R4 являются бензилом и R1 и R3 такие, как определены выше.
Кислотное отщепление 3-О защитной группы и кетальной функциональной группы соединений формулы (XXIII) проводят в одну стадию с кислотой, такой как хлористоводородная кислота в метаноле, тетрафторборная кислота в дихлорметане, трифторуксусная кислота, с получением соединений формулы (Х) (см. 1-й способ),

в которой R1, R2 и R3 такие, как определены выше.
Альтернативно этому, если R4 в соединениях формулы (XXIII) является бензилом, то можно гидрогенолизом 3-О-бензильной связи газообразным водородом, в присутствии катализатора, такого как Pd/C, PdO, Pd/Al2O3, Pt/C, PtO2, Pt/Al2O3 или подобных, в растворителях, таких как спирты, смеси спирт/вода, ледяная уксусная кислота или подобных, с последующим кислотным гидролизом кетальной функциональной группы в положении 6, например метанолом и концентрированной хлористоводородной кислотой, получить соединения формулы (Х).
Соединения формулы (Х) подвергают взаимодействию в соответствии с первым способом, через соединения формул (XI)-(XIV), с получением соединений формулы (I) в соответствии с данным изобретением.
В представленных ниже примерах подробно описано получение соединений в соответствии с данным изобретением.
Пример 1
Синтез трет-бутилового эфира (4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-уксусной кислоты (соединение 1) и трет-бутилового эфира (4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-уксусной кислоты (соединение 2)
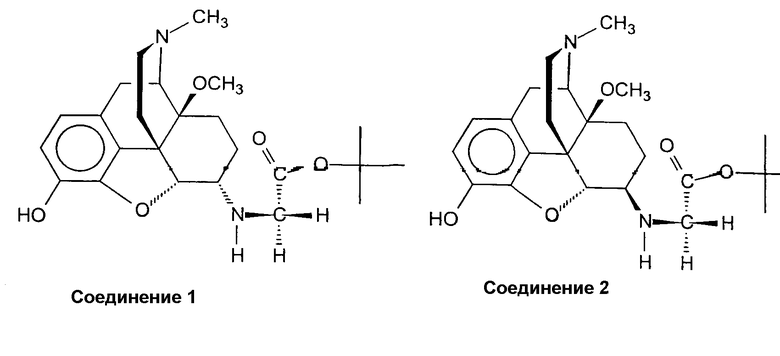
Раствор гидробромида 14-О-метилоксиморфона (H. Schmidhammer et al., Helv. Chim Acta 1990, том 71, стр. 1779-1783) (2,36 г, 5,96 ммоль) и гидрохлорида глицин-трет-бутилового эфира (1,11 г, 6,62 ммоль) в абсолютном МеОН (100 мл) перемешивают в течение 1 часа в атмосфере N2 при комнатной температуре. Затем по каплям добавляют раствор NaCNBH3 (0,55 г, 8,75 ммоль) в МеОН (50 мл) в течение 20 мин, и раствор перемешивают в атмосфере N2 при комнатной температуре. Через 19 ч добавляют Н2О (20 мл) и смесь выпаривают. Остаток смешивают с Н2О (400 мл), подщелачивают концентрированным аммиаком, насыщают NaCl и экстрагируют Et2O (1 х 100 мл, 3 х 50 мл). Объединенные органические фазы промывают Н2О (1 х 200 мл) и насыщенным раствором NaCl (1 х 200 мл), сушат (Na2SO4) и выпаривают. Водную фазу экстрагируют CH2Cl2/изо-PrOH 4:1 (1 х 100 мл, 3 х 50 мл). Объединенные органические фазы обрабатывают так, как описано выше для эфирных фаз. После первой экстракции (Et2O) получают 1,05 г желтого масла, содержащего два продукта (соединение 1 и соединение 2). После второй экстракции (CH2Cl2/изо-PrOH) получают 0,72 г желтого масла, содержащего, кроме двух продуктов, также соответствующие 6-гидроксипроизводные. Два продукта отделяют и очищают ВЭЖХ (р=5 бар, силикагель 60, CH2Cl2/MeOH 10:1).
Соединение 1: выход 0,28 г (11%) оранжевая пенистая смола. ИК (KBr): 3407 (OH), 1731 (C=O) см-1; 1H-ЯМР (CDCl3): δ 6,66 (д, J=8,1, 1 аром. H); 6,48 (д, J=8,1, 1 аром. H); 5,05 (с, ш, OH-C(3), -NH-C(6)); 4,65 (д, J=3,6, H-C(5)); 3,42 (с, C(6)-NH-CH2-); 3,21 (с, CH3O-C(14)); 2,36 (с, CH3N); 1,43 (с, -COOC(CH3)3); CI-М: m/z 431 (M++1).
Соединение 2: выход 0,63 г (24%) желтая пенистая смола. ИК (KBr): 3421 (OH), 1729 (C=O) см-1; 1H-ЯМР (CDCl3): δ 6,68 (д, J=8,0, 1 аром. H); 6,53 (д, J=8,0, 1 аром. H); 4,71 (с, ш, OH-C(3), C(6)-NH-); 4,47 (д, J=7,0, H-C(5)); 3,48 (д, J=17,3, 1H, C(6)-NH-CH2-); 3,32 (д, J=17,3, 1H, C(6)-NH-CH2-); 3,19 (с, CH3O-C(14)); 2,42 (с, CH3N); 1,42 (с, -COOC(CH3)3); CI-МС: m/z 431 (M++1).
Пример 2
Синтез полуторного трифторацетата (4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-уксусной кислоты (соединение 3 · 1,5 ТФА)
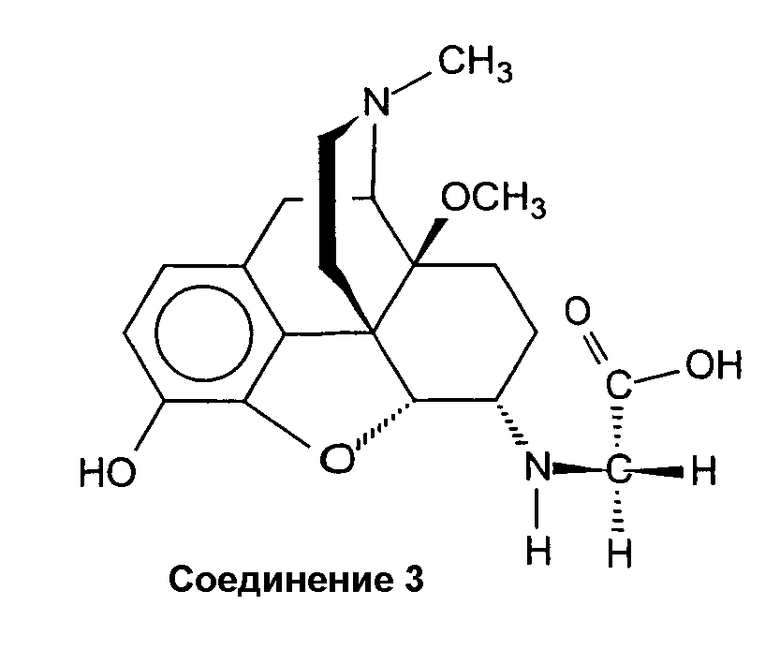
Смесь соединения 1 (0,18 г, 0,42 ммоль) и 30% трифторуксусной кислоты (ТФК) в CH2Cl2 (7 мл) перемешивают при комнатной температуре в течение 9 ч и выпаривают. Остаток (0,26 г оранжевой пенистой смолы) кристаллизуют из изо-PrOH/Et2O/MeOH. Ожидаемый бис(трифторацетат) не получают, но вместо этого получают полуторный трифторацетат, который подтверждают несколькими элементными анализами. Выход 0,13 г (57%) бежевого соединения 3 · 1,5 ТФА: Т.пл. > 190°С (разл.); ИК (KBr): 3428 (OH), 1677 (C=O) см-1; 1H-ЯМР (D2О): δ 6,90 (д, J=8,4, 1 аром. H); 6,81 (д, J=8,4, 1 аром. H); 4,47 (дд, 3J=3,0, 4J=1,0, H-C(5)); 3,87 (д, J=1,4, C(6)-NH-CH2-); 3,35 (с, CH3O-C(14)); 2,94 (с, CH3N); ESI-МС: m/z 375 (M++1).
Пример 3
Синтез полуторного трифторацетата (4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-уксусной кислоты (соединение 4 · 1,5 ТФА)
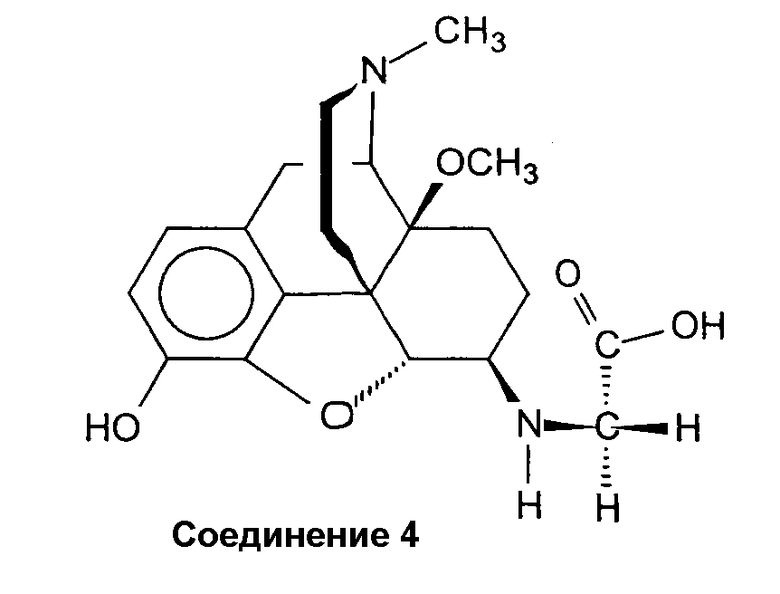
Смесь соединения 2 (0,30 г, 0,70 ммоль) и 30% трифторуксусной кислоты (ТФК) в CH2Cl2 (11 мл) перемешивают при комнатной температуре в течение 5 ч и выпаривают. Остаток (0,43 г оранжевой пенистой смолы) кристаллизуют из изо-PrOH/Et2O/MeOH. Ожидаемый бис(трифторацетат) не получают, но вместо этого получают полуторный трифторацетат, который подтверждают несколькими элементными анализами. Выход 0,21 г (55%) бежевого соединения 4 · 1,5 ТФА: Т.пл. > 210°С (разл.); ИК (KBr): 3419 (OH), 1677 (C=O) см-1; 1H-ЯМР (D2О): δ 6,89 (д, J=8,6, 1 аром. H); 6,83 (д, J=8,6, 1 аром. H); 4,90 (д, J=7,8, H-C(5)); 4,04 (с, C(6)-NH-CH2-); 3,32 (с, CH3O-C(14)); 2,91 (с, CH3N); ESI-МС: m/z 375 (M++1).
Пример 4
Синтез трет-бутилового эфира (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-пропионовой кислоты (соединение 5) и трет-бутиловогго эфира (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-пропионовой кислоты (соединение 6)

Смесь гидробромида 14-О-метилоксиморфона (H. Schmidhammer et al., Helv. Chim. Acta 1990, том 71, стр. 1779-1783) (2,54 г, 6,41 ммоль) и гидрохлорида L-аланин-трет-бутилового эфира (1,75 г, 9,63 ммоль) в абсолютном EtOH (100 мл), N-этилдиизопропиламина (2,8 мл, 16,07 ммоль) и молекулярных сит (2,8 г) перемешивают в течение 5 часов в атмосфере N2 при комнатной температуре. Затем по каплям добавляют раствор NaCNBH3 (0,51 г, 8,12 ммоль) в EtOH (20 мл) в течение 20 мин, и раствор перемешивают в атмосфере N2 при комнатной температуре. Через два дня добавляют Н2О (5 мл) и смесь выпаривают. Остаток смешивают с Н2О (200 мл) и экстрагируют Et2O (2 х 100 мл, 2 х 50 мл). Объединенные органические фазы промывают насыщенным раствором NaCl (1 х 200 мл), сушат (Na2SO4) и выпаривают. Водную фазу экстрагируют CH2Cl2 (2 х 100 мл, 2 х 50 мл). Объединенные органические фазы обрабатывают так, как описано выше для эфирных фаз. Из первой экстракции (Et2O) получают 1,34 г желтого масла, содержащего два продукта (соединение 5 и соединение 6). Из второй экстракции (CH2Cl2) получают 0,68 г желтого масла, содержащего, кроме двух продуктов, также соответствующие 6-гидроксипроизводные. Два продукта отделяют и очищают ВЭЖХ (р=5 бар, силикагель 60, CH2Cl2/MeOH 10:1). Соединение 5 кристаллизуют из метанола, и только аналитическое количество (50 мг) соединения 6 может быть кристаллизовано из изо-PrOH, остаток (0,75 г) получают в виде белой пенистой смолы.
Соединение 5: выход 0,32 г (11%) бесцветные кристаллы. Т.пл. 196-200°С; ИК (KBr): 3203 (OH), 1729 (C=O) см-1; 1H-ЯМР (CDCl3): δ 6,69 (д, J=8,2, 1 аром. H); 6,47 (д, J=8,2, 1 аром. H); 4,70 (д, J=3,2, H-C(5)); 3,55 (кв, J=6,8, C(6)-NH-CH(CH3)-); 3,19 (с, CH3O-C(14)); 2,35 (с, CH3N); 1,47(с, -COOC(CH3)3); 1,26 (д, J=6,8, C(6)-NH-CH(CH3)-); CI-МС: m/z 445 (M++1).
Соединение 6: выход 0,80 г (24%) бесцветные кристаллы и белая пенистая смола. Т.пл. 235-240°С (разл.); ИК (KBr): 3423 (OH), 1722 (C=O) см-1; 1H-ЯМР (CDCl3): δ 6,69 (д, J=8,0, 1 аром. H); 6,54 (д, J=8,2, 1 аром. H); 4,39 (д, J=7,2, H-C(5)); 3,32 (кв, J=7,0, C(6)-NH-CH(CH3)-); 3,20 (с, CH3О-C(14)); 2,39 (с, CH3N); 1,41 (с, -COOC(CH3)3); 1,26 (д, J=6,8, C(6)-NH-CH(CH3)-); CI-МС: m/z 445 (M++1).
Пример 5
Синтез бис(тетрафторбората) (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-пропионовой кислоты (соединение 7 · 2 HBF4)

Раствор соединения 5 (0,30 г, 0,70 ммоль) в CH2Cl2 (3 мл) перемешивают с 54% тетрафторборной кислотой (HBF4) в Et2O (0,33 мл, 2,39 ммоль) и смесь обрабатывают ультразвуком в течение 1 часа при комнатной температуре. Полученный осадок отфильтровывают и сушат. Выход 0,21 г (79%) белого соединения 7 · 2 HBF4: Т.пл. > 290°С (разл.); ИК (KBr): 3423 (OH), 1741 (C=O), 1064 (B-F) см-1; 1H-ЯМР (D2О): δ 6,90 (д, J=8,0, 1 аром. H); 6,81 (д, J=8,0, 1 аром. H); 5,02 (д, J=2,8, H-C(5)); 4,24 (кв, J=7,0, C(6)-NH-CH(CH3)-); 3,35 (с, CH3O-C(14)); 2,94 (с, CH3N); 1,63 (д, J=7,0, C(6)-NH-CH(CH3)-).
Пример 6
Синтез бис(тетрафторбората) (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-пропионовой кислоты (соединение 8 · 2 HBF4)

Раствор соединения 6 (0,25 г, 0,56 ммоль) в CH2Cl2 (4 мл) перемешивают с 54% тетрафторборной кислотой (HBF4) в Et2O (0,39 мл, 2,85 ммоль) и смесь обрабатывают ультразвуком в течение 1 часа при комнатной температуре. Полученный осадок отфильтровывают и сушат. Выход 0,28 г (89%) белого соединения 8 · 2 HBF4: Т.пл. > 290°С (разл.); ИК (KBr): 3423 (OH), 1720 (C=O), 1083 (B-F) см-1; 1H-ЯМР (D2О): δ 6,87 (с, 2 аром. H); 4,86 (д, J=7,6, H-C(5)); 4,31 (кв, J=7,0, C(6)-NH-CH(CH3)-); 3,33 (с, CH3О-C(14)); 2,92 (с, CH3N); 1,58 (д, J=7,0, C(6)-NH-CH(CH3)-).
Пример 7
Синтез трет-бутилового эфира (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-3'-фенилпропионовой кислоты (соединение 9) и трет-бутилового эфира (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-3'-фенилпропионовой кислоты (соединение 10)

Смесь гидробромида 14-О-метилоксиморфона (H. Schmidhammer et al., Helv. Chim. Acta 1990, том 71, стр. 1779-1783) (2,70 г, 6,81 ммоль) и гидрохлорида L-фенилаланин-трет-бутилового эфира (2,74 г, 10,63 ммоль) в абсолютном EtOH (150 мл), N-этилдиизопропиламина (3,04 мл, 17,49 ммоль) и молекулярных сит (3,0 г) перемешивают в течение 2,5 часов в атмосфере N2 при комнатной температуре. Затем по каплям добавляют раствор NaCNBH3 (0,47 г, 7,48 ммоль) в EtOH (20 мл) в течение 20 мин и раствор перемешивают в атмосфере N2 при комнатной температуре. Через три дня добавляют Н2О (10 мл) и смесь выпаривают. Остаток смешивают с Н2О (300 мл) и экстрагируют CH2Cl2 (1 х 100 мл, 4 х 50 мл). Объединенные органические фазы фильтруют через Целит, промывают насыщенным раствором NaCl (1 х 200 мл), сушат (Na2SO4) и выпаривают. Получают 3,96 г желтого масла, из которого каждый из двух продуктов получают в чистом виде с применением ВЭЖХ (р=5 бар, силикагель 60, CH2Cl2/MeOH 10:1). 0,68 г исходного соединения (14-О-метилоксиморфона) восстанавливают в виде коричневой пенистой смолы.
Соединение 9: выход 0,34 г (10%) оранжевая пенистая смола: ИК (KBr): 3336 (OH), 1725 (C=O) см-1; 1H-ЯМР (CDCl3): δ 7,31-7,17 (м, 5 аром. H); 6,71 (д, J=8,0, 1 аром. H); 6,47 (д, J=8,0, 1 аром. H); 4,71 (д, J=3,2, H-C(5)); 3,77-3,69 (м, C(6)-NH-CH(CH2Ph)-); 3,12 (с, CH3О-C(14)); 2,94-2,90 (м, C(6)-NH-CH(CH2Ph)-); 2,35 (с, CH3N); 1,32 (с, -COOC(CH3)3); CI-МС: m/z 521 (M++1).
Соединение 10: выход 0,81 г (23%) оранжевая пенистая смола: ИК (KBr): 3409 (OH), 1724 (C=O) см-1; 1H-ЯМР (CDCl3): δ 7,29-7,17 (м, 5 аром. H); 6,70 (д, J=8,0, 1 аром. H); 6,54 (д, J=8,0, 1 аром. H); 4,39 (д, J=7,4, H-C(5)); 3,51-3,43 (м, C(6)-NH-CH(CH2Ph)-); 3,20 (с, CH3О-C(14)); 2,98-2,78 (м, C(6)-NH-CH(CH2Ph); 2,44 (с, CH3N); 1,28 (с, -COOC(CH3)3); CI-МС: m/z 521 (M++1).
Пример 8
Синтез бис(тетрафторбората) (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-3'-фенилпропионовой кислоты (соединение 11 · 2 HBF4)

Раствор соединения 9 (0,16 г, 0,31 ммоль) в CH2Cl2 (3 мл) перемешивают с 54% тетрафторборной кислотой (HBF4) в Et2O (0,25 мл, 1,81 ммоль) и смесь обрабатывают ультразвуком в течение 30 мин при комнатной температуре. Затем смесь выпаривают, остаток (0,21 г оранжевого масла) растворяют в Н2О и сушат вымораживанием. Выход 0,18 г (90%) белого лиофилизата: 1H-ЯМР (D2О): δ 7,46-7,35 (м, 5 аром. H); 6,86 (д, J=8,2, 1 аром. H); 6,77 (д, J=8,2, 1 аром. H); 4,90 (д, J=3,4, H-C(5)); 4,46 (т, J=6,8, C(6)-NH-CH(CH2Ph)-); 3,35 (д, J=6,8, C(6)-NH-CH(CH2Ph)-); 3,25 (с, CH3О-C(14)); 2,90 (с, C3N).
Пример 9
Синтез бис(тетрафторбората) (2'S)-2'-(4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-3'-фенилпропионовой кислоты (соединение 12 · 2 HBF4)

Раствор соединения 10 (0,41 г, 0,79 ммоль) в CH2Cl2 (5 мл) перемешивают с 54% тетрафторборной кислотой (HBF4) в Et2O (0,60 мл, 4,35 ммоль) и смесь обрабатывают ультразвуком в течение 30 мин при комнатной температуре. Затем смесь выпаривают, остаток (0,54 г оранжевого масла) растворяют в Н2О и сушат вымораживанием. Выход 0,46 г (90%) белого лиофилизата: 1H-ЯМР (D2О): δ 7,28 (с, 5 аром. H); 6,88 (д, J=8,4, 1 аром. H); 6,81 (д, J=8,4, 1 аром. H); 4,83 (д, J=7,6, H-C(5)); 4,54 (т, J=7,0, C(6)-NH-CH(CH2Ph)-); 3,25 (с, CH3О-C(14)); 2,86 (с, CH3N).
Пример 10
Синтез 6a-амино-4,5a-эпокси-14b-метокси-17-метилморфинан-3-ола (соединение 13)
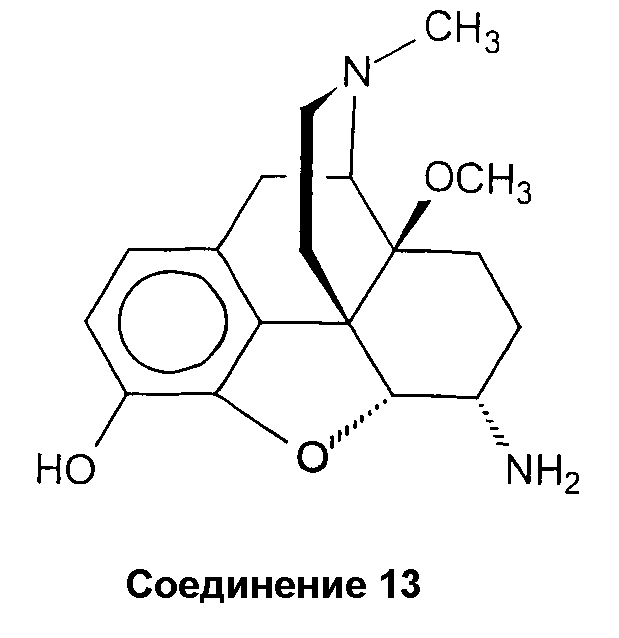
Смесь гидробромида 14-О-метилоксиморфона (H. Schmidhammer et al., Helv. Chim Acta 1990, том 71, стр. 1779-1783) (6,22 г, 15,70 ммоль), ацетата аммония (12,00 г, 156 ммоль), NaCNBH3 (0,81 г, 7,64 ммоль) и абсолютного МеОН (100 мл) перемешивают в течение 23 ч в атмосфере N2 при комнатной температуре. Затем раствор подкисляют (бежевый осадок) концентрированной HCl и смесь выпаривают. Остаток растворяют в Н2О (550 мл) и экстрагируют CH2Cl2 (1 х 200 мг) для удаления компонентов, нерастворимых в воде. Водную фазу подщелачивают концентрированным аммиаком, насыщают NaCl и экстрагируют CH2Cl2/изо-PrOH 4:1 (2 х 250 мл, 3 х 125 мл). Объединенные органические фазы промывают насыщенным раствором NaCl (1 х 200 мл), сушат (Na2SO4) и выпаривают. Остаток после выпаривания (бежевые кристаллы) перекристаллизовывают из метанола. Выход 1,95 г (39%) белого порошка: Т.пл. > 300°С (разл.); ИК (KBr): 3421 (OH) см-1; 1H-ЯМР (Me2SO-d6): δ 6,55 (д, J=8,0, 1 аром. H); 6,29 (д, J=8,0, 1 аром. H); 4,33 (дд, 3J=4,0, 4J=0,8, H-C(5)); 3,38 (с, ш, OH-C(3), NH2-C(6)); 3,13 (с, CH3O-C(14)); 2,24 (с, CH3N); CI-МС: m/z 317 (M++1).
Пример 11
Синтез 6b-дибензиламино-4,5a-эпокси-14b-метокси-17-метилморфинан-3-ола (соединение 14)

Смесь гидробромида 14-О-метилоксиморфона (H. Schmidhammer et al., Helv. Chim Acta 1990, том 71, стр. 1779-1783) (2,00 г, 5,05 ммоль) в МеОН/Н2О 9:1 (80 мл) смешивают с бензоатом серебра (1,17 г, 5,11 ммоль) и перемешивают в течение 90 мин при температуре 40°С. Полученный осадок бромида серебра отфильтровывают и фильтрат выпаривают. Остаток смешивают с EtOH/толуолом 2:3 (50 мл) и растворитель отсасывают. Таким образом, получают 2,35 г 14-О-метилоксиморфона в виде желтой пенистой смолы. Его смешивают с толуолом (250 мл), бензойной кислотой (0,93 г, 7,62 ммоль), дибензиламином (1,49 г, 7,54 ммоль) и моногидратом п-толуолсульфокислоты на кончике шпателя, и смесь нагревают при температуре кипения с обратным холодильником в течение 20 ч при применением водоотделителя. Затем раствор уменьшают до объема 50 мл, добавляют абсолютный EtOH (220 мл), NaCNBH3 (0,30 г, 4,77 ммоль) и молекулярные сита, и раствор перемешивают в течение 6 ч в атмосфере N2 при комнатной температуре. Смесь разбавляют МеОН (100 мл), фильтруют и фильтрат выпаривают. Остаток смешивают с Н2О (550 мл), подщелачивают концентрированным аммиаком и экстрагируют CH2Cl2 (1 х 200 мл, 3 х 100 мл). Объединенные органические фазы промывают Н2О (5 х 300 мл) и насыщенным раствором NaCl (1 х 200 мл), сушат (Na2SO4) и выпаривают. Остаток после выпаривания (2,42 г коричневого масла) перекристаллизовывают из метанола. Выход 1,43 г (57%) бежевых кристаллов: Т.пл. 124-128°С; ИК (KBr): 3178 (OH) см-1; 1H-ЯМР (CDCl3): δ 7,45-7,20 (м, 10 аром. H); 6,56 (д, J=8,1, 1 аром. H); 6,44 (д, J=8,1, 1 аром. H); 4,72 (д, J=6,8, H-C(5)); 3,87 (д, J=14,0, 2H, (PhCH2)2N-C(6)); 3,61 (д, J=14,0, 2 H, (PhCH2)2N-C(6)); 3,20 (с, CH3О-C(14)); 2,34 (с, CH3N); CI-МС: m/z 497 (M++1).
Пример 12
Синтез 6b-амино-4,5a-эпокси-14b-метокси-17-метилморфинан-3-ола (соединение 15).

Смесь соединения 14 (1,02 г, 2,05 ммоль), 10% катализатора Pd/C (0,52 г), циклогексена (30 мл) и абсолютного МеОН (30 мл) нагревают при температуре кипения с обратным холодильником в течение 16 ч в атмосфере N2. Затем катализатор отфильтровывают и фильтрат выпаривают. Остаток (0,66 г белой пенистой смолы) кристаллизуют из изо-PrOH/Et2O 1:1 (2 мл). Выход: 0,33 г (42%) бежевые кристаллы: Т.пл. > 235-239°С; ИК (KBr): 3348 (OH) см-1; 1H-ЯМР (CDCl3): δ 6,62 (д, J=8,0, 1 аром. H); 6,54 (д, J=8,0, 1 аром. H); 4,26 (д, J=7,0, H-C(5)); 3,22 (с, CH3О-C(14)); 2,36 (с, CH3N); CI-МС: m/z 317 (M++1).
Пример 13
Синтез 4,5a-эпокси-6b-[N,N'-бис(трет-бутоксикарбонил) гуанидинил]-14b-метокси-17-метилморфинан-3-ола (соединение 16)

Раствор соединения 15 (0,94 г, 2,97 ммоль), N,N'-бис-(трет-бутоксикарбонил)-S-метилизомочевины (0,92 г, 3,17 ммоль) и N-этилдиизопропиламина (0,58 мл, 3,33 ммоль) в абсолютном N,N-диметилформамиде (40 мл) смешивают с нитратом серебра (0,54 г, 3,18 ммоль) и смесь перемешивают в течение 4 часов. Затем меркаптан серебра отфильтровывают через Целит и промывают CH2Cl2 (4 х 50 мл). Фильтрат промывают Н2О (10 х 150 мл) и насыщенным раствором NaCl (2 х 150 мл), сушат (Na2SO4) и выпаривают. Таким образом, получают 1,46 г желтой пенистой смолы, которую очищают ВЭЖХ (р=5 бар, силикагель 60, CH2Cl2/MeOH/конц. аммиак 95:4,5:0,5). Выход: 0,77 г (46%) зеленой пенистой смолы: 1H-ЯМР (CDCl3): δ 11,49 (с, ш, NH-COO(CH3)3); 8,59 (д, J=8,0, C(6)-NH-); 6,71 (д, J=8,4, 1 аром. H); 6,56 (д, J =8,4, 1 аром. H); 4,41 (д, J=7,2, H-C(5)); 3,22 (с, CH3О-C(14)); 2,38 (с, CH3N); 1,51 (с, С(СН3)3), 1,47 (с, C(CH3)3).
Пример 14
Синтез дигидрохлорида 4,5a-эпокси-6b-гуанидинил-14b-метокси-17-метилморфинан-3-ола (соединение 17 · 2 HCl)
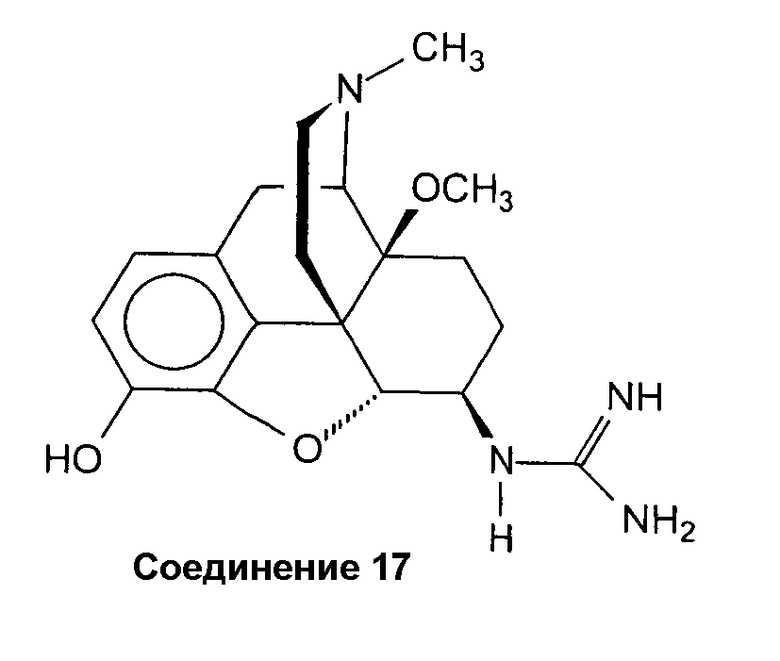
Раствор соединения 16 (50 мг, 0,089 ммоль) в Et2O (3 мл) смешивают через прозрачную кислую реакционную смесь с эфирной HCl и 4 каплями Н2О. Смесь обрабатывают ультразвуком в течение одного часа при комнатной температуре и затем выпаривают. Остаток (40 мг белой пенистой смолы) растворяют в Н2О и сушат вымораживанием. Выход: 30 мг (79%) соединения 17 · 2 HCl в виде белого лиофилизата: 1H-ЯМР (CDCl3): δ 9,59 (с, OH-C(3)); 9,29 (с, ш, NH+); 8,53 (д, J=8,0, C(6)-NH-); 7,29 (с, ш, C(6)-NH-C(NH2)2 +), 6,78 (д, J=8,1, 1 аром. H); 6,69 (д, J=8,1, 1 аром. H); 4,49 (д, J=7,2, H-C(5)); 3,26 (с, CH3О-C(14)); 2,84 (с, CH3N).
Пример 15
Синтез 4,5a-эпокси-6a-[N,N'-бис(трет-бутоксикарбонил)-гуанидинил]-14b-метокси-17-метилморфинан-3-ола (соединение 18)

Раствор соединения 13 (1,00 г, 3,16 ммоль), N,N'-бис-(трет-бутоксикарбонил)-S-метилизомочевины (1,00 г, 3,44 ммоль) и N-этилдиизопропиламина (0,60 мл, 3,44 ммоль) в абсолютном N,N-диметилформамиде (60 мл) смешивают с нитратом серебра (0,55 г, 3,24 ммоль) и смесь перемешивают в течение 1,5 часов. Затем соль меркаптана и серебра отфильтровывают через Целит и промывают CH2Cl2 (4 х 50 мл). Фильтрат промывают Н2О (6 х 200 мл) и насыщенным раствором NaCl (1 х 200 мл), сушат (Na2SO4) и выпаривают. Таким образом, получают 1,85 г желтого масла, которое очищают ВЭЖХ (р=5 бар, силикагель 60, CH2Cl2/MeOH 10:1). Выход: 0,67 г (38%) белой пенистой смолы: 1H-ЯМР (CDCl3): δ 11,53 (с, ш, NH-COO(CH3)3); 8,81 (д, J=8,0, C(6)-NH-); 6,73 (д, J=8,2, 1 аром. H); 6,56 (д, J=8,2, 1 аром. H); 4,66 (дд, 3J=2,6, 4J=1,6, H-C(5)); 3,25 (с, CH3О-C(14)); 2,35 (с, CH3N); 1,50 (с, 2 x С(СН3)3).
Пример 16
Синтез дигидрохлорида 4,5a-эпокси-6a-гуанидинил-14b-метокси-17-метилморфинан-3-ола (соединение 19 · 2 HCl)

Раствор соединения 18 (50 мг, 0,089 ммоль) в Et2O (3 мл) смешивают через прозрачную кислую реакционную смесь с эфирной HCl и 4 каплями Н2О. Смесь обрабатывают ультразвуком в течение 1,5 часов при комнатной температуре и затем выпаривают. Остаток (40 мг белой пенистой смолы) растворяют в Н2О и сушат вымораживанием. Выход: 35 мг (92%) соединения 19 · 2 HCl в виде белого лиофилизата: 1H-ЯМР (CDCl3): δ 9,29 (с, ш, NH+); 9,20 (с, OH-C(3)); 7,57 (д, J=8,8, C(6)-NH-); 7,46 (с, ш, С(6)-NH-C(NH2)2 +), 6,76 (д, J=8,1, 1 аром. H); 6,62 (д, J=8,1, 1 аром. H); 4,70 (д, J=4,0, H-C(5)); 3,36 (с, CH3О-C(14)); 2,88 (с, CH3N).
Пример 17
Синтез 1,3-бис(трет-бутоксикарбонил)-2-{4,5a-эпокси-6b-[N,N'-бис(трет-бутоксикарбонил)гуанидинил]-14b-метокси-17-метилморфинан-3-ил}-изомочевины (соединение 20)

Раствор соединения 15 (0,12 г, 0,38 ммоль), N,N'-бис-(трет-бутоксикарбонил)-S-метилизомочевины (0,24 г, 0,83 ммоль) и триэтиламина (0,12 мл, 0,86 ммоль) в абсолютном N,N-диметилформамиде (4 мл) смешивают с нитратом серебра (0,14 г, 0,82 ммоль) и смесь перемешивают в течение 17 часов. Затем соль меркаптана и серебра отфильтровывают через Целит и промывают CH2Cl2 (4 х 50 мл). Фильтрат промывают Н2О (5 х 200 мл) и насыщенным раствором NaCl (1 х 200 мл), сушат (Na2SO4) и выпаривают. Таким образом, получают 0,10 г желтой пенистой смолы, которую очищают ВЭЖХ (р=5 бар, силикагель 60, CH2Cl2/MeOH/конц. аммиак 100:5:0,5). Выход: 45 мг (15%) белой пенистой смолы: 1H-ЯМР (CDCl3): δ 11,54 (с, NH-COO(СН3)3; 10,44 (с, ш, NH-COO(CH3)3); 8,59 (д, J=8,8, C(6)-NH-); 6,91 (д, J=8,0, 1 аром. H); 6,64 (д J=8,0, 1 аром. H); 4,51 (д, J=4,4, H-C(5)); 3,28 (с, CH3О-C(14)); 2,37 (с, CH3N); 1,51 (с, 2 x C(СН3)3, 1,47(с, 2 x С(СН3)3). FAB-МС: m/z 801 (M++1).
Пример 18
Синтез 1,3-бис(трет-бутоксикарбонил)-2-{4,5a-эпокси-6a-[N,N'-бис(трет-бутоксикарбонил)гуанидинил]-14b-метокси-17-метилморфинан-3-ил}-изомочевины (соединение 21)

Раствор соединения 13 (0,50 г, 1,58 ммоль), N,N'-бис-(трет-бутоксикарбонил)-S-метилизомочевины (1,00 г, 3,54 ммоль) и триэтиламина (0,5 мл, 4,94 ммоль) в абсолютном N,N-диметилформамиде (15 мл) смешивают с нитратом серебра (0,58 г, 3,12 ммоль) и смесь перемешивают в течение 20 часов. Затем соль меркаптана и серебра отфильтровывают через Целит и промывают CH2Cl2 (5 х 50 мл). Фильтрат промывают Н2О (5 х 200 мл) и насыщенным раствором NaCl (1 х 200 мл), сушат (Na2SO4) и выпаривают. Таким образом, получают 1,14 г желтой пенистой смолы, которую очищают ВЭЖХ (р=5 бар, силикагель 60, CH2Cl2/MeOH,конц. аммиак 100:5:0,5). Выход: 0,75 г (62%) белой пенистой смолы: 1H-ЯМР (CDCl3): δ 11,56 (с, NH-COO(CH3)3; 10,69 (с, ш, NH-COO(CH3)3); 8,68 (д, J=8,8, C(6)-NH-); 6,87 (д, J=8,0, 1 аром. H); 6,66 (д, J=8,0, 1 аром. H); 4,63 (д, J=3,6, H-C(5)); 3,27 (с, CH3О-C(14)); 2,36 (с, CH3N); 1,51 (с, 4 x C(CH3)3), ESI-МС: m/z 801 (M++1).
Пример 19
Синтез дигидрохлорида этилового эфира (4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6a-иламино)-уксусной кислоты (соединение 22 · 2 HCl) и дигидрохлорида этилового эфира (4,5a-эпокси-3-гидрокси-14b-метокси-17-метилморфинан-6b-иламино)-уксусной кислоты (соединение 23 · 2 HCl)

Смесь гидробромида 14-О-метилоксиморфона (H. Schmidhammer et al., Helv. Chim. Acta 1990, том 71, стр. 1779-1783) (2,00 г, 5,05 ммоль), гидрохлорида этилового эфира глицина (1,06 г, 7,59 ммоль), абсолютного EtOH (100 мл), триэтиламина (1,8 мл, 12,91 ммоль) и молекулярных сит (2,5 г) перемешивают в течение 3,5 часов в атмосфере N2 при комнатной температуре. Затем несколькими порциями добавляют NaCNBH3 (0,49 г, 7,80 ммоль) и раствор перемешивают в атмосфере N2 при комнатной температуре. Через 4 дня добавляют Н2О (5 мл) и смесь выпаривают. Остаток смешивают с Н2О (200 мл) и экстрагируют CH2Cl2 (2 х 100 мл, 2 х 50 мл). Объединенные органические фазы промывают насыщенным раствором NaCl (2 х 100 мл), сушат (Na2SO4) и выпаривают с получением 0,76 г коричневого масла. Два продукта разделяют и очищают с помощью ВЭЖХ (р=4 бар, силикагель 60, CH2Cl2/MeOH 10:2). Затем их растворяют в небольшом количестве МеОН и превращают в дигидрохлориды добавлением эфирной HCl. Так как не происходит кристаллизации соединения 22 · 2 HCl, растворитель отсасывают, остаток растворяют в Н2О и сушат вымораживанием. Маточный раствор соединения 23 · 2 HCl также выпаривают, остаток растворяют в Н2О и сушат вымораживанием.
Соединение 22 · 2 HCl: выход 0,20 г (8%) желтый лиофилизат: ИК (KBr): 3423 (OH), 1743 (C=O) см-1; 1H-ЯМР (ДМСО-d6): δ 9,81, 9,50, 9,34 (3с, 4H, OH, NH+, NH2 +), 6,81 (д, J=8,1, 1 аром. H); 6,64 (д, J =8,1, 1 аром. H); 4,50 (д, J=3,6, H-C(5)); 4,23 (кв, J=6,9, -COOCH2CH3); 3,13 (с, CH3О-C(14)); 2,88 (д, J=4,4, CH3N); 1,26 (т, J=6,9, -COOCH2CH3).
Соединение 23 · 2 HCl: выход 0,20 г (8%) белые кристаллы (0,11 г) и желтый лиофилизат (0,09 г): Т.пл. > 200°С (разл.); ИК (KBr): 3413 (OH), 1745 (C=O) см-1; 1H-ЯМР (ДМСО-d6): δ 10,02, 9,61, 9,51 (3с, 4H, OH, NH+, NH2 +), 6,82 (д, J=8,0, 1 аром. H); 6,70 (д, J=8,0, 1 аром. H); 4,95 (д, J=7,4, H-C(5)); 4,22 (кв, J=7,0, -COOCH2CH3); 3,26 (с, CH3O-C(14)); 2,85 (с, CH3N); 1,25 (т, J=7,0, -COOCH2CH3).
Пример 20
Синтез трет-бутилового эфира (4,5a-эпокси-3-гидрокси-14b-этокси-17-метилморфинан-6a-иламино)-уксусной кислоты (соединение 24) и трет-бутилового эфира (4,5a-эпокси-3-гидрокси-14b-этокси-17-метилморфинан-6b-иламино)-уксусной кислоты (соединение 25)

Смесь 14-О-этилоксиморфона (H. Schmidhammer, R. Krassnig, Sci. Pharm. 1990, том 58, стр. 255-257) (1,02 г, 3,09 ммоль), гидрохлорида глицин-трет-бутилового эфира (0,7 г, 4,63 ммоль), абсолютного EtOH (100 мл), N-этилдиизопропиламина (0,9 мл, 5,0 ммоль) и молекулярных сит (2 г) перемешивают в течение 3 часов в атмосфере N2 при комнатной температуре. Затем по каплям добавляют раствор NaCNBH3 (0,25 г, 3,98 ммоль) в этаноле (20 мл) и раствор перемешивают в атмосфере N2 при комнатной температуре. Через 2 дня добавляют Н2О (5 мл), фильтруют через Целит и смесь выпаривают. Остаток смешивают с Н2О (150 мл) и экстрагируют Et2O (2 х 100 мл, 1 х 80 мл, 2 х 50 мл). Объединенные органические фазы промывают насыщенным раствором NaCl (3 х 100 мл), сушат (Na2SO4) и выпаривают. Водную фазу экстрагируют CH2Cl2/изо-PrOH 4:1 (2 х 100 мл). Объединенные органические фазы обрабатывают так, как описано выше для эфирных фаз. Из первой экстракции (Et2O) получают 1,05 г желтой пенистой смолы и из второй экстракции (CH2Cl2/изо-PrOH) получают 0,17 г белой пенистой смолы. Два продукта отделяют и очищают ВЭЖХ (р=5 бар, силикагель 60, CH2Cl2/MeOH 10:1).
Соединение 24: выход 0,09 г (7%) белая пенистая смола: ИК (KBr): 3425 (OH), 1735 (C=O) см-1; 1H-ЯМР (CDCl3): δ 6,66 (д, J=8,0, 1 аром. H); 6,47 (д, J=8,0, 1 аром. H); 4,68 (д, J=2,6, H-C(5)); 3,43 (с, C(6)-NH-CH2-); 2,32 (с, CH3N); 1,45 (с, -COOC(CH3)3); 1,15 (т, J=7,0, C(14)-OCH2CH3); CI-МС: m/z 445 (M++1).
Соединение 25: выход 0,19 г (14%) белая пенистая смола: ИК (KBr): 3440 (OH), 1734 (C=O) см-1; 1H-ЯМР (CDCl3): δ 6,67 (д, J=8,0, 1 аром. H); 6,53 (д, J=8,0, 1 аром. H); 4,48 (д, J=7,0, H-C(5)); 3,50 (д J=17,2, 1H, C(6)-NH-CH2-); 3,23 (д, J=17,2, 1H, C(6)-NH-CH2-); 2,33 (с, CH3N); 1,44 (с, -COOC(CH3)3); 1,19 (т, j=7,0, C(14)-OCH2CH3); CI-МС: m/z 445 (M++1).
Пример 21
Синтез бис(тетрафторбората) (4,5a-эпокси-3-гидрокси-14b-этокси-17-метилморфинан-6a-иламино)-уксусной кислоты (соединение 26 · 2 HBF4)

Раствор соединения 24 (0,05 г, 0,11 ммоль) в CH2Cl2 (3 мл) перемешивают с 54% тетрафторборной кислотой (HBF4) в Et2O (0,08 мл) и смесь обрабатывают ультразвуком в течение 15 минут при комнатной температуре. Полученный осадок отфильтровывают и сушат. Выход 0,03 г (53%) белого соединения 3 · 2 HBF4: Т.пл. > 286°С (разл.); ИК (KBr): 3466 (OH), 1735 (C=O), 1067 (B-F) см-1; 1H-ЯМР (D2O): δ 6,90 (д, J=8,0, 1 аром. H); 6,81 (д, J=8,0, 1 аром. H); 5,07 (д, J=3,6, H-C(5)); 4,02 (с, C(6)-NH-CH2-); 2,96 (с, CH3N); 1,24 (т, J=7,0, C(14)-OCH2CH3); ESI-МС: m/z 389 (M++1).
Пример 22
Синтез бис(тетрафторбората) (4,5a-эпокси-3-гидрокси-14b-этокси-17-метилморфинан-6b-иламино)-уксусной кислоты (соединение 27 · 2 HBF4)

Раствор соединения 25 (0,10 г, 0,22 ммоль) в CH2Cl2 (6 мл) перемешивают с 54% тетрафторборной кислотой (HBF4) в Et2O (0,16 мл) и смесь обрабатывают ультразвуком в течение 15 минут при комнатной температуре. Полученный осадок отфильтровывают и сушат. Выход 0,09 г (73%) белого соединения 3 · 2 HBF4: Т.пл. > 280°С (разл.); ИК (KBr): 3426 (OH), 1758 (C=O), 1064 (B-F) см-1; 1H-ЯМР (D2O): δ 6,90 (д, J=8,0, 1 аром. H); 6,85 (д, J=8,0, 1 аром. H); 4,92 (д, J=7,6, H-C(5)); 4,03 (с, C(6)-NH-CH2-); 2,94 (с, CH3N); 1,29 (т, J=6,8, C(14)-OCH2CH3); ESI-МС: m/z 389 (M++1).
Пример 23
Синтез трет-бутилового эфира (2'S)-2'-(17-циклопропилметил-4,5a-эпокси-3,14b-дигидроксиморфинан-6b-иламино)-3-фенилпропионовой кислоты (соединение 28)

Смесь гидрохлорида налтрексона (патент Великобритании GB 1119270, 1968) (5,46 г, 13,23 ммоль) и гидрохлорида L-фенилаланин-трет-бутилового эфира (5,46 г, 21,18 ммоль) в абсолютном EtOH (250 мл), N-этилдиизопропиламина (6 мл, 43,4 ммоль) и молекулярных сит (5 г) перемешивают в течение 6 часов в атмосфере N2 при комнатной температуре. Затем добавляют NaCNBH3 (0,91 г, 14,48 ммоль) и раствор перемешивают в атмосфере N2 при комнатной температуре. Через 6 дней добавляют Н2О (20 мл), фильтруют и фильтрат выпаривают. Остаток смешивают с Н2О (300 мл), подщелачивают конц. аммиаком и экстрагируют CH2Cl2 (1 х 100 мл, 4 х 50 мл). Объединенные органические фазы промывают Н2О (2 х 200 мл), сушат (Na2SO4) и выпаривают. Из полученного после выпаривания остатка (8,44 г) 2 г очищают циркулярной хроматографией (силикагель 60, CH2Cl2/MeOH/конц. аммиак 250:1:0,1 до 150:2,5:0,2). Выход 0,33 г (19% по отношению ко всему неочищенному продукту) чистого соединения 28 в виде белой пенистой смолы: 1H-ЯМР (ДМСО-d6): δ 8,98 (с, OH-C(3)), 7,22 (м, 5 аром. H), 6,56 (д, J=8,0, 1 аром. H); 6,46 (д, J=8,0, 1 аром. H); 4,78 (с, OH-C(14)); 4,14 (д, J=6,0, H-C(5)); 1,20 (с, -COOC(CH3)3); 0,84 (м, CH (циклопропил)); 0,47 (м, CH2 (циклопропил)); 0,09 (м, CH2 (циклопропил)); CI-МС: m/z 547(М++1).
Пример 24
Синтез бис(тетрфторбората) (2'S)-2'-(17-циклопропилметил-4,5a-эпокси-3,14b-дигидроксиморфинан-6b-иламино)-3-фенилпропионовой кислоты (соединение 29 · 2 HBF4)

Раствор соединения 28 (0,18 г, 0,33 ммоль) в CH2Cl2 (5 мл) перемешивают с 54% тетрафторборной кислотой (HBF4) в Et2O (0,22 мл) и смесь перемешивают в течение 1 ч при температуре 0оС. Полученный осадок отфильтровывают и сушат. Неочищенный продукт очищают циркулярной хроматографией (силикагель 60, CH2Cl2/MeOH от 7:3 до 3:7, затем только МеОН). Выход 0,06 г (27%) чистого соединения 29 · 2 HBF4 в виде желтой пенистой смолы: 1H-ЯМР (ДМСО-d6): δ 7,17 (м, 5 аром. H), 6,45 (д, J=8,2, 1 аром. H); 6,35 (д, J=8,2, 1 аром. H); 4,73 (с, OH-C(14)); 4,08 (д, J=7,4, H-C(5)); 0,80 (м, CH (циклопропил)); 0,44 (м, CH2 (циклопропил)); 0,09 (м, CH2 (циклопропил)); HR-FAB-МС: m/z рассчитано для C29Н35N5О5 (М++1): 491,2536, найдено 491,2540.
Пример 25
Синтез 3-бензилокси-17-циклопропилметил-4,5a-эпокси-14b-гидроксиморфинан-6-спиро-2'-1,3-диоксолана (соединение 30)
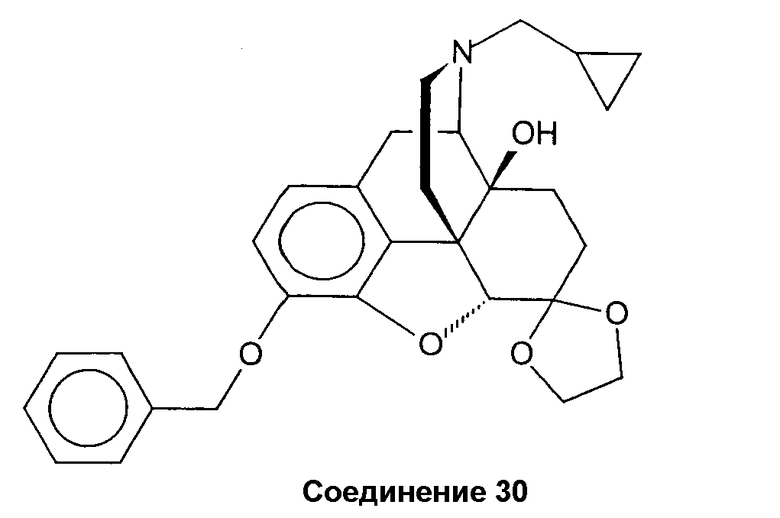
Смесь 17-циклопропил-4,5a-эпокси-3,14b-дигидроксиморфинан-6-спиро-2'-диоксолана (H. Schmidhammer et al., Heterocycles 1998, том 49, стр. 489-497) (6,90 г, 17,90 ммоль), К2СО3 (6,70 г, 48,48 ммоль), бензилбромида (2,34 мл, 19,66 ммоль) и абсолютного ДМФ (70 мл) перемешивают в течение 21 ч в атмосфере N2 при комнатной температуре. Неорганические вещества отфильтровывают, промывают CH2Cl2 и фильтрат выпаривают. Остаток (желтые кристаллы) перекристаллизовывают из МеОН. Выход 7,37 г (87%) чистого соединения 30 в виде желтых кристаллов. Т.пл. 130-131°С; ИК (KBr): 3352 (OH) см-1; 1H-ЯМР (CDCl3): δ 7,42-7,27 (м, 5 аром. H); 6,75 (д, J=8,3, 1 аром. H); 6,54 (д, J=8,3, 1 аром. H); 5,17 (д, J=11,7, OCH2Ph), 5,10 (д, J=11,7, OCH2Ph), 4,58 (с, H-C(5)); 4,19-3,73 (м, C(6)-0-CH2-CH2-0-C(6)); CI-МС: m/z 476 (M++1).
Пример 26
Синтез гидрохлорида 3-бензилокси-17-циклопропилметил-4,5a-эпокси-14b-{[(Е)-3-фенилпроп-2-енил]окси}мрфинан-6-спиро-2'-1,3-диоксолана (соединение 31 · HCl)
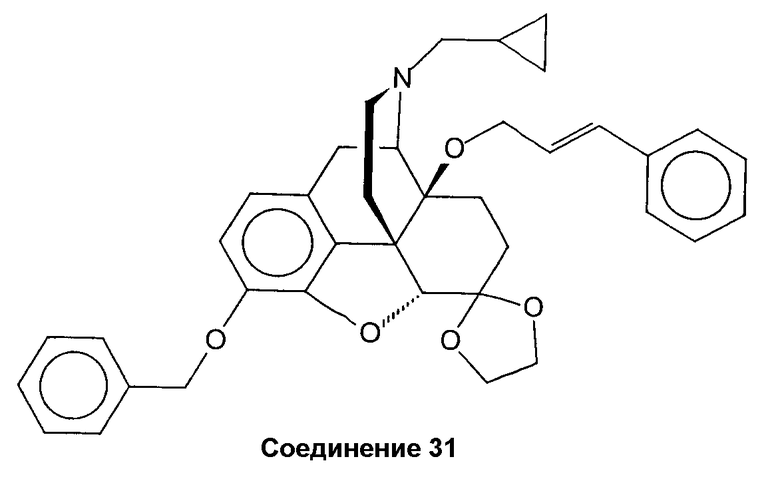
Смесь соединения 30 (4,00 г, 8,41 ммоль), абсолютного ДМФ (50 мл), NaH (0,60 г, 25,23 ммоль, из 1,00 г 60% дисперсии NaH после многократного промывания петролейным эфиром) перемешивают в течение 20 мин. в атмосфере N2 при температуре 0°С. Затем по каплям добавляют раствор циннамилбромида (2,15 г, 10,93 ммоль) в ДМФ (20 мл) и смесь перемешивают в течение 3 ч при комнатной температуре в атмосфере N2. После разложения избытка NaH осторожным добавлением небольших кусков льда смесь выливают в 400 мл Н2О и экстрагируют CH2Cl2 (4 х 75 мл). Объединенные органические фазы промывают Н2О (5 х 300 мл) и насыщенным раствором NaCl (1 х 100 мл), сушат (Na2SO4) и выпаривают. Остаток после выпаривания (5,25 г оранжевого масла) очищают хроматографией на колонке (силикагель 60, CH2Cl2/MeOH/конц. аммиак 250:2:0,5). Выход 1,86 г (37%) чистого соединения 31. Для аналитических целей 0,2 г растворяют в эфире и соединение 31 · HCl осаждают в виде охряного порошка добавлением эфирного раствора HCl. Т.пл. 133-136°С; 1H-ЯМР (ДМСО-d6): δ 8,33 (ш.с, NH+); 7,53-7,24 (м, 10 аром. H); 6,93 (д, J=8,4, 1 аром. H); 6,72-6,68 (м, 1 аром. H, 2 олеф., H); 5,15 (с, OCH2Ph); 4,65 (с, H-C(5)); 4,31-4,21 (м, C(6)-О-CH2-CH2-О-C(6)); 1,09 (м, CH (циклопропил)); 0,72-0,44 (м, 2 x CH2 (циклопропил)); CI-МС: m/z 592 (М++1).
Пример 27
Синтез гидрохлорида 17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[3-(фенилпропил)окси]морфинан-6-спиро-2'-1,3-диоксолана (соединение 32 · HCl)

Смесь соединения 31 (0,89 г, 1,51 ммоль), МеОН (50 мл), ТГФ (15 мл) и 10% Pd/C (90 мг) гидрируют при комнатной температуре и давлении 30 фунт/дюйм2 (206,8 кПа) в течение 2 часов. Затем катализатор отфильтровывают и фильтрат выпаривают. Остаток после выпаривания (1,0 г желтого масла) очищают хроматографией на колонке (силикагель 60, CH2Cl2/MeOH/конц. аммиак 250:5:0,5). Выход 0,41 г (53%) чистого соединения 32. Для аналитических целей 70 мг растворяют в эфире и соединение 32 · HCl осаждают в виде белого порошка добавлением эфирной HCl. Т.пл. 158-162°С; 1H-ЯМР (ДМСО-d6): δ 9,24 (с, OH); 7,79 (ш.с, NH+); 7,35-7,19 (м, 5 аром. H); 6,68 (д, J=8,0, 1 аром. H); 6,57 (д, J=8,0, 1 аром. H); 4,51 (с, H-C(5)); 4,31-4,21 (м, C(6)-О-CH2-CH2-О-C(6)); CI-МС: m/z 504 (M++1).
Пример 28
Синтез гидрохлорида 17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[3-(фенилпропил)окси]морфинан-6-она (соединение 33 · HCl)
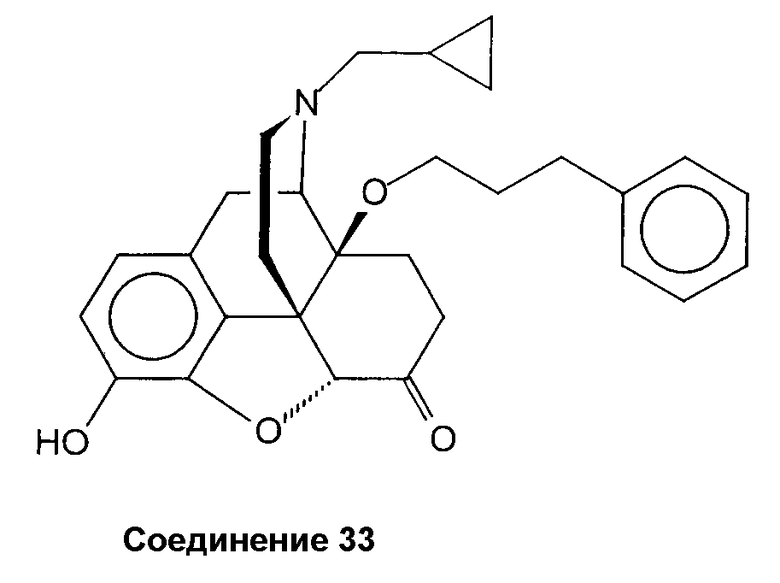
Раствор соединения 32 (4,00 г, 7,94 ммоль) в 28 мл МеОН и 12 мл конц. HCl нагревают при температуре кипения с обратным холодильником в течение 1,5 ч, затем выливают в 100 мл льда/воды и подщелачивают конц. аммиаком. Смесь экстрагируют CH2Cl2 (4 х 100 мл), объединенные органические фазы промывают водой (2 х 100 мл) и насыщенным раствором NaCl (2 х 100 мл), сушат (Na2SO4) и выпаривают. Остаток после выпаривания (3,98 г коричневого масла) очищают хроматографией на колонке (силикагель 60, CH2Cl2/MeOH/конц. аммиак 250:3:0,5). Выход 3,05 г (83%) чистого соединения 33. Для аналитических целей 90 мг растворяют в эфире и соединение 33 · HCl осаждают в виде бесцветных кристаллов добавлением эфирной HCl. Т.пл. 220-230°С; 1H-ЯМР (ДМСО-d6): δ 9,52 (с, OH); 8,20 (с, NH+); 7,30-7,18 (м, 5 аром. H); 6,71 (д, J=8,0, 1 аром. H); 6,64 (д, J=8,0, 1 аром. H); 4,89 (с, H-C(5)); CI-МС: m/z 460 (M++1).
Пример 29
Синтез трет-бутилового эфира {17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[(3-фенилпропил)окси]-морфинан-6a-иламино}-уксусной кислоты (соединение 34) и трет-бутилового эфира {17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[(3-фенилпропил)окси]-морфинан-6b-иламино}-уксусной кислоты (соединение 35)
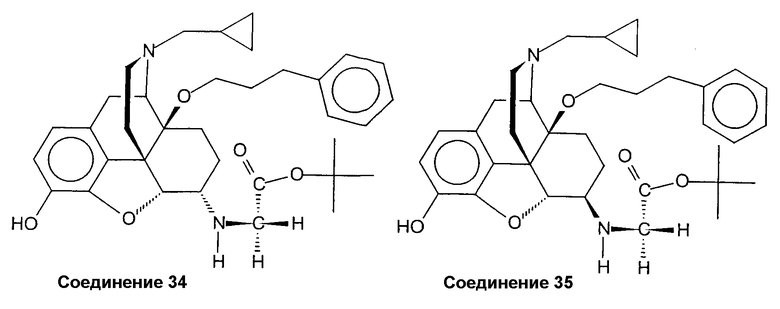
Смесь соединения 33 (0,7 г, 1,41 ммоль), гидрохлорида глицин-трет-бутилового эфира (0,26 г, 1,55 ммоль), абсолютного EtOH (20 мл), триэтиламина (0,49 мл, 3,53 ммоль) и молекулярных сит (0,7 г) перемешивают в течение 23 часов в атмосфере N2 при комнатной температуре. Затем добавляют NaCNBH3 (0,13 г, 2,07 ммоль) и раствор перемешивают в атмосфере N2 при комнатной температуре. Через 3 дня добавляют Н2О (5 мл), фильтруют и фильтрат выпаривают. Остаток смешивают с Н2О (20 мл), подщелачивают концентрированным аммиаком и экстрагируют CH2Cl2 (1 х 50 мл, 3 х 30 мл). Объединенные органические фазы промывают насыщенным раствором NaCl (3 х 200 мл), сушат (Na2SO4) и выпаривают. Остаток после выпаривания (0,62 г коричневого масла) отделяют и очищают хроматографией на колонке (силикагель 60, CH2Cl2/MeOH/конц. аммиак 250:2:0,5).
Соединение 34: выход 70 мг (9%). 1H-ЯМР (CDCl3): δ 7,28-7,16 (м, 5 аром. H); 6,67 (д, J=8,1, 1 аром. H); 6,45 (д, J=8,1, 1 аром. H); 4,70 (д, J=3,4, H-C(5)); 1,44 (с, -COOC(СН3)3); CI-МС: m/z 575 (М++1).
Соединение 35: выход 40 мг (5%). 1H-ЯМР (ДМСО-d6): δ 8,96 (с, OH); 7,31-7,16 (м, 5 аром. H); 6,54 (д, J=8,3, 1 аром. H); 6,45 (д, J=8,3, 1 аром. H); 4,25 (д, J=6,6, H-C(5)); 1,39 (с, -COOC(CH3)3); CI-МС: m/z 575 ((M++1).
Пример 30
Синтез трет-бутилового эфира (2'S)-2'-(17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[(3-фенилпропил)окси]морфинан-6a-иламино)-3-фенилпропионовой кислоты (соединение 36) и трет-бутилового эфира (2'S)-2'-(17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[(3-фенилпропил)окси]морфинан-6b-иламино)-3-фенилпропионовой кислоты (соединение 37)
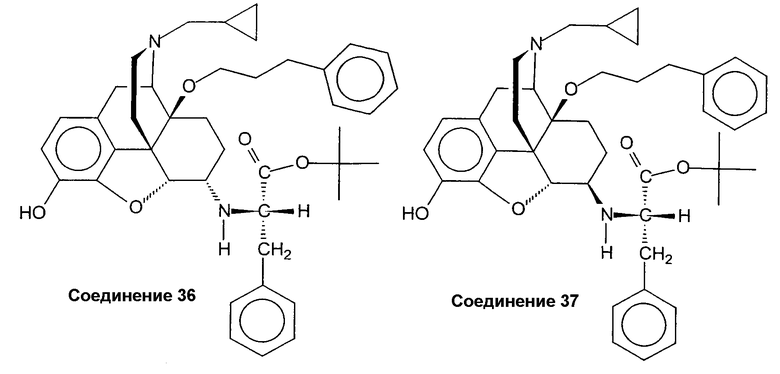
Смесь соединения 33 (0,7 г, 1,41 ммоль), гидрохлорида L-фенилаланин-трет-бутилового эфира (0,55 г, 2,13 ммоль), абсолютного EtOH (20 мл), триэтиламина (0,49 мл, 3,53 ммоль) и молекулярных сит (0,7 г) перемешивают в течение 23 часов в атмосфере N2 при комнатной температуре. Затем добавляют NaCNBH3 (0,13 г, 2,07 ммоль) и раствор перемешивают в атмосфере N2 при комнатной температуре. Через 4 дня добавляют Н2О (5 мл), фильтруют, и фильтрат выпаривают. Остаток смешивают с Н2О (20 мл), подщелачивают конц. аммиаком и экстрагируют CH2Cl2 (1 х 50 мл, 3 х 30 мл). Объединенные органические фазы промывают насыщенным раствором NaCl (3 х 100 мл), сушат (Na2SO4) и выпаривают. Остаток после выпаривания (коричневое масло) отделяют и очищают хроматографией на колонке (силикагель 60, CH2Cl2/MeOH/конц. аммиак 250:2:0,5).
Соединение 36: выход 70 мг (7%). 1H-ЯМР (ДМСО-d6): δ 8,90 (с, OH); 7,31-7,12 (м, 5 аром. H); 6,56 (д, J=8,2, 1 аром. H); 6,40 (д, J=8,2, 1 аром. H); 4,52 (д, J=3,6, H-C(5)); 1,22 (с, -COOC(CH3)3); CI-МС: m/z 665 (M++1).
Соединение 37: выход 0,33 г (35%). 1H-ЯМР (ДМСО-d6): δ 8,98 (с, OH); 7,27-7,13 (м, 5 аром. H); 6,54 (д J=8,0, 1 аром. H); 6,44 (д, J=8,0, 1 аром. H); 4,21 (д, J=7,0, H-C(5)); 1,20 (с, -COOC(CH3)3); CI-МС: m/z 665 (M++1).
Пример 31
Синтез дигидрохлорида {17-циклопропилметил-4,5a-эпокси-3-гидрокси-14b-[(3-фенилпропил)окси]-морфинан-6b-иламино}-уксусной кислоты (соединение 38 · 2 HCl)
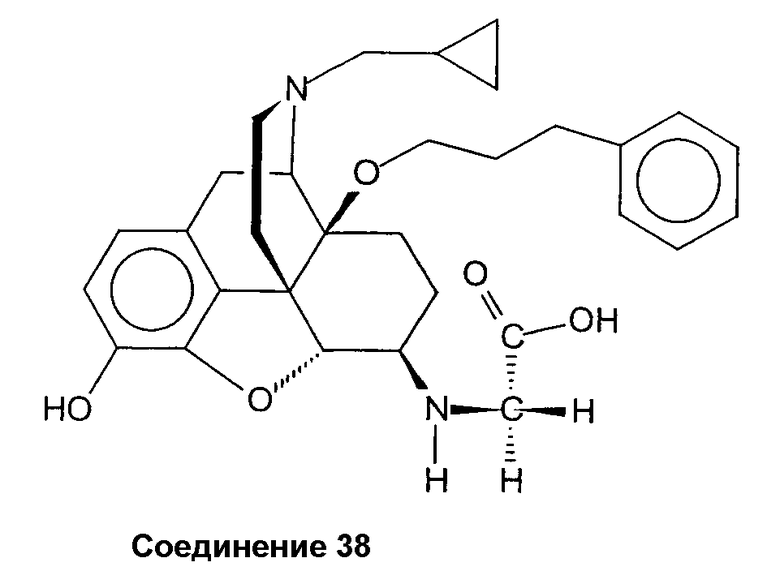
Смесь соединения 35 (40 мг, 0,07 ммоль) и 4М HCl в диоксане (2 мл) нагревают при температуре кипения с обратным холодильником в течение 6 ч. Осадок отфильтровывают и сушат. Выход 10 мг (24%) белого соединения 38 · 2 HCl: 1H-ЯМР (D2O): δ 7,38-7,26 (м, 5 аром. H); 6,89 (д, J=8,0, 1 аром. H); 6,83 (д, J=8,0, 1 аром. H); 4,91 (д, J=7,4, H-C(5)); 4,00 (с C(6)-NH-CH2-).
Пример 32
Исследования связывания с опиоидными рецепторами
Исследования связывания с опиоидными рецепторами проводят на гомогенизатах мозга крысы, используя [3H]DAMGO (агонист m-рецептора) в качестве радиолиганда, в строгом соответствии с более ранней публикацией (M. Spetea et al., Neurochemical Research 1998, том, 23, стр. 1213-1218).
Соединения 1-4, 7, 8, 11, 16, 17, 22, 23 и 38 показывают очень высокое сродство к m-опиоидным рецепторам, которые главным образом ответственны за аналгезию (таблица 1). По сравнению с ними морфин ясно показывает более низкое сродство к m-опиоидным рецепторам.
Исследования связывания с опиоидными рецепторами соединений 1-4, 7, 8, 11, 16, 17, 22, 23 и 38 и морфина
Пример 33
Тест на аналгезию
Тестирование проводят на крысах («тест на отдергивание хвоста крысы»). Этот тест проводят как описано в литературе (Zs. Fürst et al., Eur. J. Pharmacol. 1993, том 236, стр. 209-215).
Соединения 3, 4, 7 и 8 показали очень высокое анальгезирующее действие. Соединение 4 в 68 раз активнее чем морфин при подкожном введении (пк) и в 238 раз активнее чем морфин при интрацеребровентрикулярном введении (ивц) (таблица 2). Высокие показатели для пк/ивц соотношения для соединений 3, 4, 7 и 8 показывают, что, по сравнению с морфином, эти соединения преимущественно распространяются в периферической системе, а также преимущественно оказывают анальгезирующее действие на периферию. Эти цифры означают, что соединение 3 может преодолевать гематоэнцефалический барьер только в очень ограниченном количестве, и его эффективность, поэтому, в первую очередь очевидна на периферии (вне центральной нервной системы). Это значительно сокращает количество побочных эффектов, которые относятся к центральным побочным эффектам, таким как, например, тошнота, рвота, седативный эффект, головокружение, спутанность сознания, угнетение дыхания и мания.
Соединения 3 и 4 демонстрируют значительно более долгий анальгезирующий эффективный период по сравнению с морфином. В то время как соединения 3 (0,5 мкг/крысу) и 4 (0,25 мкг/крысу) показывают 100% анальгезирующее действие даже через 120 минут, действие морфина (50 мкг/крысу) снижается до 20% через 120 минут (таблица 3). Соединения 3 и 4 все еще демонстрируют 90% анальгезирующее действие даже через 180 минут.
«Тест на движение хвоста крысы» для соединений 3, 4, 7, 8 и морфина
Анальгезирующее действие (в процентах) соединения 3, 4 и морфина через 10, 20, 30, 60, 120 и 180 минут в «тесте на отдергивание хвоста крысы» после интрацеребровентрикулярного введения
bНО = не определено
Пример 34
Тест Randall-Selitto
Тест Randall-Selitto (L.O. Randall and J.J. Selitto, Arch. Int. Pharmacodyn. 1957, том 111, стр. 409-419) применяют для изучения анальгезирующего действия на вызванную каррагеном гипералгезию правой задней лапы крысы. Таким образом, измеряют «латентный период абстиненции задней лапы» (ЛАЗ, латентный период абстиненции правой задней лапы) при механическом стимулировании (например, I. Bileviciute-Ljungar and M. Spetea, Br. J. Pharmacol. 2001, том 132, стр. 252-258).
Соединения 4 и ссылочное соединение с центральным действием, 14-метоксиметопон (Zs. Fürst et al., Eur. J. Pharmacol. 1993, том 236, стр. 209-215), показывают значительное анальгезирующее действие при дозировке в каждом случае 20 мкг/кг после подкожного введения (увеличения периода латентности для отдергивания задней лапы (ОЗЛ), по крайней мере, 100% принимают как значительное анальгезирующее действие). В то время как соединение 4 демонстрирует продолжительное действие (приблизительно 14 часов), действие 14-метоксиметопона значительно короче и составляет 2 часа.
Исключительное периферическое анальгезирующее действие соединения 4 доказано следующим тестированием. Анальгезирующее действие соединения 4 (20 мкг/кг) полностью нейтрализуется подкожным введением селективного антагониста опиоида периферического действия метийодида налоксона (эквивалент), в то время как на анальгезирующее действие 14-метокситметопона (20 мкг/кг) подкожное введение селективного антагониста опиоида периферического действия метийодида налоксона (эквивалент) не влияет. Это является доказательством того, что анальгезирующее действие соединения 14 достигается через периферийные опиоидные рецепторы, в то время как анальгезирующее действие 14-метокситметопона достигается через опиоидные рецепторы центральной нервной системы. Следовательно, можно сделать вывод, что соединение 4 не может преодолевать гематоэнцефалический барьер и, следовательно, не может приводить к возникновению побочных эффектов, возникающих в центральной нервной системе (например, угнетение дыхания, головокружение, спутанность сознания, седативный эффект, сонливость и мания).
Пример 35
Тест на угнетение дыхания у крыс
В данном тесте измеряют объем дыхания и частоту дыхания у анестезированных крыс.
Соединения 3 и 4 исследуют на предмет способности вызывать угнетение дыхания (см. таблицу 4). При подкожном введении (пк) соединений 3 и 4 для того, чтобы началось угнетение дыхания, необходимы очень высокие дозы. В то время как при интрацеребровентрикулярном введении (ицв) угнетение дыхания возникает при значительно меньших дозах, для соединений 3 и 4 характерны очень высокие соотношения пк/ицв (1205 соотв. 1190). Пк/ицв соотношения для морфина и фентанила значительно ниже (34 соотв. 0,2).
В то время как анальгетические значения ED50 («тест на отдергивание хвоста крысы») очень похожи на значения ED50 в тесте на угнетение дыхания после интрацеребровентрикулярного введения, эти значения значительно отличаются при подкожном введении. Если высокие значения ED50 при тестировании на угнетение дыхания после подкожного введения соединений 3 и 4 сравнимы с низкими значениями ED50 в «тесте на отдергивание хвоста крысы», то можно понять, что для инициации угнетения дыхания необходима доза соединения 3, в 12 раз большая, чем для достижения анальгезирующего действия. Для соединения 4 необходима доза выше в 18 раз. Поэтому дозы соединений 3 и 4, необходимые для достижения анальгезирующего действия, не могут вызывать угнетение дыхания.
«Тест на угнетение дыхания у крыс» для соединений 3 и 4, морфина и фентанила
Пример 36
Определение противоаллодинического действия
На крысах проводят два теста:
а) тест фон Фрея (механическая аллодиния)
b) тест на аллодинию в холодной воде (термальная аллодиния)
Тесты включают модели для тестирования действия вещества на невропатическую боль. В обоих тестах вокруг ишиасного нерва перевязывали сосуды (G.J. Bennett and Y.K. Xie, Pain 1988, том 33, 87-107).
а) тест фон Фрея (механическая аллодиния)
Незначительное давление (от 2 до 60 г) прилагают к задней лапе крысы (200-250 г), используя волоски фон Фрея и исследуют период латентности отдергивания задней лапы в различные интервалы времени (5, 15, 30 и 60 минут после введения вещества). Исследуемое вещество вводит через интраплант (ипл).
Соединение 4 показывает значительное противоаллодиническое действие в дозе 100 мкг/крысу при подкожном введении (увеличение периода латентности отдергивания задней лапы, по крайней мере, на 100% принимают в качестве значительного противоаллодинического действия). Антагонист опиоида периферического действия метийодид налоксона (ипл) практически нейтрализует противоаллодиническое действие соединения 4.
b) тест на аллодинию в холодной воде (термальная аллодиния)
Термальное стимулирование (холодная вода) применяют для инициации отдергивания задней лапы крысы (200-300 г). Через 5, 15 и 30 мин (после введения вещества) измеряют период латентности отдергивания задней лапы (J.C. Hunter et al., Eur. J. Pharmacol., 1997, том 324, 153-160). Исследуемое вещество вводит через интраплант (ипл).
Соединение 4 показывает значительное противоаллодиническое действие в дозе 100 мкг/крысу при подкожном введении (увеличение периода латентности отдергивания задней лапы, по крайней мере, на 100% принимают в качестве значительного противоаллодинического действия). Антагонист опиоида периферического действия метийодид налоксона (ипл) практически нейтрализует противоаллодиническое действие соединения 4.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРОИЗВОДНЫЕ 6-АМИНОМОРФИНАНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНАЛЬГЕТИКОВ | 2006 |
|
RU2485124C2 |
| 3-ФЕНИЛ-БЕНЗОФУРАН-2-ОНОВЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ФОСФОР, В КАЧЕСТВЕ СТАБИЛИЗАТОРОВ | 2016 |
|
RU2722188C2 |
| ЗАМЕЩЕННОЕ АРОМАТИЧЕСКОЕ СОЕДИНЕНИЕ С КОНДЕНСИРОВАННЫМ КОЛЬЦОМ, СПОСОБ ПОЛУЧЕНИЯ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И ЕЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2828176C1 |
| ПОЛУЧЕНИЕ ДИГИДРОТИЕНО[3,2-d]ПИРИМИДИНОВ И ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ, ПРИМЕНЯЮЩИХСЯ ДЛЯ ИХ СИНТЕЗА | 2008 |
|
RU2528340C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ДИОКСИДА ТИАЗОЛБЕНЗОИЗОТИАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2350613C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛИДИНА, СПОСОБ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1998 |
|
RU2239641C2 |
| АНТИБИОТИКИ ГРУППЫ КАРБАМАТКЕТОЛИДОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2000 |
|
RU2188827C2 |
| СОЕДИНЕНИЕ, НАЦЕЛЕННОЕ НА БЕЛОК И ЕГО ДЕГРАДАЦИЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2829459C1 |
| ИНСЕКТИЦИДНЫЕ АНТРАНИЛАМИДЫ | 2001 |
|
RU2278852C2 |
| ЗАМЕЩЕННЫЕ БИАРИЛЬНЫЕ СОЕДИНЕНИЯ ИЛИ ЗАМЕЩЕННЫЕ ПИРИДИНЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 1997 |
|
RU2195443C2 |
Изобретение относится к новым производным 6-амино-морфинана формулы 1

где R1-R6 и Х имеют значения, указанные в описании, к композиции на их основе, обладающей анальгетическим действием и их применению в качестве высокоактивных анальгетиков. 7 н. и 2 з.п. ф-лы., 4 табл.

в которой заместители имеют следующее значение:
R1: водород; C1-С6 алкил; С2-С6 алкенил; С2-С6 алкинил; C1-С6 моногидроксиалкил; С2-С6 дигидроксиалкил; С3-С6 тригидроксиалкил; C4-C16 циклоалкилалкил, где циклоалкилом является С3-С10 циклоалкил и алкилом является C1-С6 алкил; C5-C16 циклоалкилалкенил, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; C5-C16 циклоалкилалкинил, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил;
R2: C1-С6 алкил; C1-С6 моногидроксиалкил; С2-С6 дигидроксиалкил; С3-С6 тригидроксиалкил; С2-С6 алкенил; С2-С6 алкинил; C4-C16 циклоалкилалкил, где циклоалкилом является С3-С10 циклоалкил и алкилом является C1-С6 алкил; C5-C16 циклоалкилалкенил, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; C5-C16 циклоалкилалкинил, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; C7-C16 арилалкил, где арилом является С6-С10 арил и алкилом является C1-C6 алкил;
R3: водород;
R4: водород; C1-C6-N-алкил- и N,N'-диалкилформамидинил;
R5 и R6, которые могут быть одинаковыми или разными: водород; СН(А)CO2 В, где А является водородом; гидроксил; C1-C6 алкил; С2-С6 алкенил; С2-С6 алкинил; C4-C16 циклоалкилалкил, где циклоалкилом является С3-С10 циклоалкил и алкилом является C1-C6 алкил; C5-C16 циклоалкилалкенил, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; C5-C16 циклоалкилалкинил, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; C7-C16 арилалкил, где арилом является С6-С10 арил и алкилом является C1-C6 алкил; C8-C16 арилалкенил, где арилом является С6-С10 арил и алкенилом является С2-С6 алкенил; C8-C16 арилалкинил, где арилом является С6-С10 арил и алкинилом является С2-С6 алкинил; гуанидино; и где В является водородом; C1-С30-, предпочтительно C1-C6 алкилом; С2-С30-, предпочтительно С2-С6 алкенилом; С2-С30-, предпочтительно С2-С6 алкинилом; C4-C16 циклоалкилалкилом, где циклоалкилом является С3-С10 циклоалкил и алкилом является C1-C6 алкил; C5-C16 циклоалкилалкенилом, где циклоалкилом является С3-С10 циклоалкил и алкенилом является С2-С6 алкенил; C5-C16 циклоалкилалкинилом, где циклоалкилом является С3-С10 циклоалкил и алкинилом является С2-С6 алкинил; формамидинилом, C1-C6-N-алкил- и N,N'-диалкилформамидинилом;
Х является кислородом, и Y является кислородом;
и их фармацевтически приемлемые кислотно-аддитивные соли.
третбутиловый эфир (4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6α-иламино)-уксусной кислоты
третбутиловый эфир (4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6β-иламино)-уксусной кислоты
(4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6α-иламино)-уксусную кислоту
(4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6β-иламино)-уксусную кислоту
третбутиловый эфир (2'S)-2'-(4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6α-иламино)-пропионовой кислоты
третбутиловый эфир (2'S)-2'-(4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6β-иламино)-пропионовой кислоты
(2'S)-2'-(4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6α-иламино)-пропионовую кислоту
(2'S)-2'-(4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6β-иламино)-пропионовую кислоту
третбутиловый эфир (2'S)-2'-(4,5α-эпокси-3 -гидрокси-14β-метокси-17-метилморфинан-6α-иламино)-3'-фенилпропионовой кислоты
третбутиловый эфир (2'S)-2'-(4,5α-эпокси-3 -гидрокси-14β-метокси-17-метилморфинан-6β-иламино)-3' -фенилпропионовой кислоты
(2'S)-2'-(4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6α-иламино)-3'-фенилпропионовую кислоту
(2'S)-2'-(4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6β-иламино)-3'-фенилпропионовую кислоту
6α-амино-4,5α-эпокси-14β-метокси-17-метилморфинан-3-ол
6α-дибензиламино-4,5α-эпокси-14β-метокси-17-метилморфинан-3-ол
6β-амино-4,5α-эпокси-14β-метокси-17-метилморфинан-3-ол
4,5α-эпокси-6β-[N,N'-бис(трет-бутоксикарбонил)гуанидинил]-14β-метокси-17-метилморфинан-3-ол
4,5α-эпокси-6β-гуанидинил-14β-метокси-17-метилморфинан-3-ол
4,5α-эпокси-6α-[N,N'-бис(трет-бутоксикарбонил)гуанидинил]-14β-метокси-17-метилморфинан-3-ол
4,5α-эпокси-6α-гуанидинил-14β-метокси-17-метилморфинан-3-ол
1,3-бис(трет-бутоксикарбонил)-2-{4,5α-эпокси-6β-[N,N'-бис(трет-бутоксикарбонил)гуанидинил]-14β-метокси-17-метилморфинан-3-ил}-изомочевину
1,3-бис(трет-бутоксикарбонил)-2-{4,5α-эпокси-6α-[N,N'-бис(трет-бутоксикарбонил)гуанидинил]-14β-метокси-17-метилморфинан-3-ил}-изомочевину
дигидрохлорид этилового эфира (4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6α-иламино)-уксусной кислоты
дигидрохлорид этилового эфира (4,5α-эпокси-3-гидрокси-14β-метокси-17-метилморфинан-6β-иламино)-уксусной кислоты
третбутиловый эфир (4,5α-эпокси-3-гидрокси-14β-этокси-17-метилморфинан-6α-иламино)-уксусной кислоты
третбутиловый эфир (4,5α-эпокси-3-гидрокси-14β-этокси-17-метилморфинан-6β-иламино)-уксусной кислоты
бис(тетрафторборат) (4,5α-эпокси-3-гидрокси-14β-этокси-17-метилморфинан-6α-иламино)-уксусной кислоты
бис(тетрафторборат) (4,5α-эпокси-3-гидрокси-14β-этокси-17-метилморфинан-6β-иламино)-уксусной кислоты
третбутиловый эфир (2'S)-2'-(17-циклопропилметил-4,5α-эпокси-3,14β-дигидроксиморфинан-6β-иламино)-3-фенилпропионовой кислоты
бис(тетрафторборат) (2'S)-2'-(17-циклопропилметил-4,5α-эпокси-3,14β-дигидроксиморфинан-6β-иламино)-3-фенилпропионовой кислоты
третбутиловый эфир {17-циклопропилметил-4,5α-эпокси-3-гидрокси-14β-[(3-фенилпропил)окси]-морфинан-6α-иламино}-уксусной кислоты
третбутиловый эфир {17-циклопропилметил-4,5α-эпокси-3-гидрокси-14β-[(3-фенилпропил)окси]-морфинан-6α-иламино}-уксусной кислоты
третбутиловый эфир (2'S)-2'-(17-циклопропилметил-4,5α-эпокси-3-гидрокси-14β-[(3-фенилпропил)окси]-морфинан-6α-иламино)-3-фенилпропионовой кислоты
дигидрохлорид{17-циклопропилметил-4,5α-эпокси-3-гидрокси-14β-[(3-фенилпропил)окси]-морфинан-6β-иламино}-уксусной кислоты,
или любой их фармацевтически приемлемой соли.
| RU 2000100062 А, 10.09.2001 | |||
| Щитовая опалубка | 1979 |
|
SU846694A1 |
| Дифференциальный манометр | 1977 |
|
SU661283A1 |
Авторы
Даты
2007-09-20—Публикация
2002-12-16—Подача