Область техники
[1] Настоящее изобретение относится, главным образом, к видам T-клеточной терапии и более конкретно, к видам комбинированной терапии с видами иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками, содержащими химерный рецептор антигена (CAR), и агонистом 4-1BB (CD137).
Уровень техники
[2] Злокачественные опухоли человека по своей природе являются содержащими здоровые клетки, которые подверглись генетическому или эпигенетическому превращению, чтобы стать аномальными клетками злокачественных опухолей. При этом, клетки злокачественных опухолей начинают экспрессировать белки и другие антигены, отличные от белков и антигенов, экспрессируемых здоровыми клетками. Эти измененные антигены опухолей могут быть использованы врожденной иммунной системой организма для специфического нацеливания на клетки злокачественных опухолей и их уничтожения. Однако, клетки злокачественных опухолей используют различные механизмы для предотвращения успешного нацеливания иммуноцитов, таких как T- и B-лимфоциты, на клетки злокачественных опухолей.
[3] Химерные рецепторы антигенов (CAR), содержащие связывающие домены, способные взаимодействовать с конкретным антигеном опухоли, позволяют T-клеткам, индуцированным для их экспрессии, нацеливание на клетки и уничтожение клеток злокачественных опухолей, экспрессирующих конкретный антиген опухоли, который они узнают.
[4] 4-1BB (также обозначенный как CD137, TNFRSF9 и т.д.), представляет собой трансмембранный белок из суперсемейства рецепторов фактора некроза опухоли (TNFRS). 4-1BB стимулирует усиленную пролиферацию клеток, выживаемость и продукцию цитокинов (Croft, 2009, Nat Rev Immunol 9:271-285).
Сущность изобретения
[5] Как подробно описано ниже, настоящее изобретение основано, частично, на неожиданном обнаружении, что способы введения, описанные в настоящем описании, приводят к улучшенной иммунотерапии T-клетками с CAR против CD19.
[6] Любой аспект или вариант осуществления, описанный в настоящем описании, можно комбинировать с любым другим аспектом или вариантом осуществления, как описано в настоящем описании, если контекст не указывает на иное. В то время как настоящее изобретение описано в сочетании с его подробным описанием, вышеупомянутое описание предназначено для иллюстрации, а не ограничения объема настоящего изобретения, который определен объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации включены в объем следующей ниже формулы изобретения.
[7] В одном аспекте, настоящее изобретение относится к способу лечения B-клеточной лимфомы или лейкоза у нуждающегося в этом пациента, включающему иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137).
[8] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками, включает генетическую модификацию для экспрессии химерного рецептора антигена (CAR), где указанный CAR содержит одноцепочечный вариабельный фрагмент (scFv) антитела против CD19, связанный с костимулирующими доменами CD28 и CD3-дзета.
[9] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аутологичную иммунотерапию.
[10] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аллогенную иммунотерапию.
[11] В некоторых вариантах осуществления, T-клетки генетически модифицируют ex vivo. В некоторых вариантах осуществления, T-клетки генетически модифицируют посредством вирусной трансдукции. В некоторых вариантах осуществления, T-клетки генетически модифицируют посредством ретровирусной трансдукции. В некоторых вариантах осуществления, T-клетки генетически модифицируют посредством лентивирусной трансдукции.
[12] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аксикабтаген цилолейкел.
[13] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой антигенсвязывающую молекулу или ее фрагмент.
[14] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащую три CDR из аминокислотной последовательности области VH, как указано в SEQ ID NO:1, и три CDR из аминокислотной последовательности области VL, указанной в SEQ ID NO: 3.
[15] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие: (a) H-CDR1, как указано в SEQ ID NO:5; (b) H-CDR2, как указано в SEQ ID NO:6; (c) H-CDR3, как указано в SEQ ID NO:7; (d) L-CDR1, как указано в SEQ ID NO:8; (e) L-CDR2, как указано в SEQ ID NO:9; и (f) L-CDR3, как указано в SEQ ID NO:10.
[16] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой полностью человеческое моноклональное антитело.
[17] В некоторых вариантах осуществления, агонист 4-1BB (CD137) содержит аминокислотную последовательность области VH, как указано в SEQ ID NO:1, и аминокислотную последовательность области VL, как указано в SEQ ID NO: 3.
[18] В некоторых вариантах осуществления, агонист 4-1BB (CD137) содержит аминокислотную последовательность тяжелой цепи, как указано в SEQ ID NO:2, и аминокислотную последовательность легкой цепи, как указано в SEQ ID NO:4, при условии, что C-концевой остаток лизина из SEQ ID NO:2, необязательно, отсутствует.
[19] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой утомилумаб.
[20] В некоторых вариантах осуществления, B-клеточная лимфома или лейкоз выбраны из группы, состоящей из острого лимфобластного лейкоза (ALL), связанной со СПИД лимфомы, положительной по ALK крупноклеточной B-клеточной лимфомы, лимфомы Беркитта, хронического лимфоцитарного лейкоза (CLL), классической лимфомы Ходжкина, диффузной крупноклеточной B-клеточной лимфомы (DLBCL), первичной медиастинальной крупноклеточной B-клеточной лимфомы (PMBCL), фолликулярной лимфомы, внутрисосудистой крупноклеточной B-клеточной лимфомы, крупноклеточной B-клеточной лимфомы, возникающей при ассоциированной с HHV8 многоочаговой болезни Кастлмана, лимфогранулематоза, лимфоплазматической лимфомы, лимфомы из клеток мантийной зоны (MCL), B-клеточной лимфомы из клеток маргинальной зоны (MZL), лимфомы лимфоидной ткани слизистых оболочек (MALT), узловой B-клеточной лимфомы из клеток маргинальной зоны (NMZL), нодулярной лимфомы Ходжкина с лимфоидным преобладанием, неходжскинской лимфомы, плазмобластной лимфомы, первичной лимфомы центральной нервной системы, первичной выпотной лимфомы, лимфомы маргинальной зоны селезенки (SMZL) и макроглобулинемии Вальденстрема, рецидивирующей или невосприимчивой крупноклеточной B-клеточной лимфомы, диффузной крупноклеточной B-клеточной лимфомы (DLBCL), неуточненной, B-клеточной лимфомы на поздних стадиях и DLBCL, развивающейся из фолликулярной лимфомы.
[21] В некоторых вариантах осуществления, B-клеточная лимфома выбрана из группы, состоящей из рецидивирующей или невосприимчивой крупноклеточной B-клеточной лимфомы, диффузной крупноклеточной B-клеточной лимфомы (DLBCL), неуточненной, первичной медиастинальной крупноклеточной B-клеточной лимфомы (PMBCL), B-клеточной лимфомы на поздних стадиях и DLBCL, развивающейся из фолликулярной лимфомы. Различные дополнительные типы лимфомы описаны в редакции 2016 г. классификации лимфоидных неоплазий Всемирной организации здравоохранения, обнаруженной в Swerdlow et al., Blood 2016 127:2375-2390; doi: https://doi.org/10.1182/blood-2016-01-643569.
[22] В некоторых вариантах осуществления, B-клеточная лимфома представляет собой рецидивирующую или невосприимчивую диффузную крупноклеточную B-клеточную лимфому.
[23] В некоторых вариантах осуществления, иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) проводят после двух или более линий системной терапии у пациента. В некоторых вариантах осуществления, иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) подвергают наивных по отношению к лечению пациентов. В некоторых вариантах осуществления, иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) подвергают пациентов, которых не подвергали другой системной терапии до проведения иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137).
[24] В некоторых вариантах осуществления, иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками подвергают пациента посредством внутривенной инфузии в дозе между приблизительно 1×106 и приблизительно 2×106 положительных по CAR жизнеспособных T-клеток на кг массы тела, вплоть до максимальной дозы приблизительно 1×108 положительных по CAR жизнеспособных T-клеток.
[25] В некоторых вариантах осуществления, иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками проводят только один раз.
[26] В некоторых вариантах осуществления, иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками проводят более одного раза.
[27] В некоторых вариантах осуществления, агонист 4-1BB (CD137) вводят посредством внутривенной инфузии.
[28] В некоторых вариантах осуществления, агонист 4-1BB (CD137) вводят в дозе, лежащей в диапазоне от приблизительно 1 мг до приблизительно 200 мг.
[29] В некоторых вариантах осуществления, агонист 4-1BB (CD137) вводят в дозе приблизительно 1 мг, приблизительно 10 мг, приблизительно 100 мг или приблизительно 200 мг. В некоторых вариантах осуществления, агонист 4-1BB (CD137) вводят в дозе, лежащей в диапазоне от приблизительно 1-200 мг, приблизительно 1-150 мг, приблизительно 1-125 мг, приблизительно 1-100 мг, приблизительно 10-200 мг, приблизительно 10-150 мг, приблизительно 10-125 мг, приблизительно 10-100 мг, приблизительно 25-200 мг, приблизительно 25-150 мг, приблизительно 25-125 мг, приблизительно 25-100 мг, приблизительно 30-200 мг, приблизительно 30-150 мг, приблизительно 30-125 мг, приблизительно 30-100 мг, приблизительно 50-200 мг, приблизительно 50-150 мг, приблизительно 50-125 мг, 50-100 мг или приблизительно 100-200 мг.
[30] В некоторых вариантах осуществления, иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) проводят одновременно.
[31] В некоторых вариантах осуществления, иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками проводят до введения агониста 4-1BB (CD137)).
[32] В некоторых вариантах осуществления, первую дозу агониста 4-1BB (CD137) вводят на сутки после инфузии иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками.
[33] В некоторых вариантах осуществления, иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками проводят после введения агониста 4-1BB (CD137).
[34] В некоторых вариантах осуществления, дозирование агониста 4-1BB (CD137) продолжают, пока для пациентов не покажут полную ремиссию, отсутствие ответа/прогрессирующее заболевание. В некоторых вариантах осуществления, агонист 4-1BB (CD137)) вводят в течение приблизительно 1 года.
[35] В некоторых вариантах осуществления, агонист 4-1BB (CD137) вводят приблизительно каждые 4 недели. В некоторых вариантах осуществления, агонист 4-1BB (CD137) вводят ежемесячно. В некоторых вариантах осуществления, агонист 4-1BB (CD137) вводят приблизительно каждые 28 суток. В некоторых вариантах осуществления, агонист 4-1BB (CD137) вводят приблизительно каждые 30 суток.
[36] В некоторых вариантах осуществления, пациента подвергают режиму подготовительной химиотерапии до проведения иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137).
[37] В одном аспекте настоящее изобретение относится a иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) для использования в способе лечения B-клеточной лимфомы или лейкоза у нуждающегося в этом пациента.
[38] В одном аспекте настоящее изобретение относится к способу лечения B-клеточной лимфомы или лейкоза у нуждающегося в этом пациента, включающему: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) мониторирование у пациента после введения признаков и симптомов неблагоприятной реакции.
[39] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аутологичную иммунотерапию.
[40] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аллогенную иммунотерапию.
[41] В некоторых вариантах осуществления, T-клетки генетически модифицируют ex vivo.
[42] В некоторых вариантах осуществления, T-клетки генетически модифицируют посредством вирусной трансдукции.
[43] В некоторых вариантах осуществления, T-клетки генетически модифицируют посредством ретровирусной трансдукции.
[44] В некоторых вариантах осуществления, T-клетки генетически модифицируют посредством лентивирусной трансдукции.
[45] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками включает генетическую модификацию для экспрессии химерного рецептора антигена (CAR), где указанный CAR содержит одноцепочечный вариабельный фрагмент (scFv) антитела против CD19, связанный с костимулирующими доменами CD28 и CD3-дзета.
[46] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аксикабтаген цилолейкел.
[47] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой антигенсвязывающую молекулу или ее фрагмент.
[48] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие три CDR из аминокислотной последовательности области VH, как указано в SEQ ID NO:1, и три CDR из аминокислотной последовательности области VL, указанной в SEQ ID NO: 3.
[49] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие: (a) H-CDR1, как указано в SEQ ID NO:5; (b) H-CDR2, как указано в SEQ ID NO:6; (c) H-CDR3, как указано в SEQ ID NO:7; (d) L-CDR1, как указано в SEQ ID NO:8; (e) L-CDR2, как указано в SEQ ID NO:9; и (f) L-CDR3, как указано в SEQ ID NO:10.
[50] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой полностью человеческое моноклональное антитело.
[51] В некоторых вариантах осуществления, агонист 4-1BB (CD137) содержит аминокислотную последовательность области VH, как указано в SEQ ID NO:1, и аминокислотную последовательность области VL, как указано в SEQ ID NO: 3.
[52] В некоторых вариантах осуществления, агонист 4-1BB (CD137) содержит аминокислотную последовательность тяжелой цепи, как указано в SEQ ID NO:2, и аминокислотную последовательность легкой цепи, как указано в SEQ ID NO:4, при условии, что C-концевой остаток лизина из SEQ ID NO:2, необязательно, отсутствует.
[53] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой утомилумаб.
[54] В некоторых вариантах осуществления, B-клеточная лимфома или лейкоз выбраны из группы, состоящей из острого лимфобластного лейкоза (ALL), связанной со СПИД лимфомы, положительной по ALK крупноклеточной B-клеточной лимфомы, лимфомы Беркитта, хронического лимфоцитарного лейкоза (CLL), классической лимфомы Ходжкина, диффузной крупноклеточной B-клеточной лимфомы (DLBCL), первичной медиастинальной крупноклеточной B-клеточной лимфомы (PMBCL), фолликулярной лимфомы, внутрисосудистой крупноклеточной B-клеточной лимфомы, крупноклеточной B-клеточной лимфомы, возникающей при ассоциированной с HHV8 многоочаговой болезни Кастлмана, лимфогранулематоза, лимфоплазматической лимфомы, лимфомы из клеток мантийной зоны (MCL), B-клеточной лимфомы из клеток маргинальной зоны (MZL), лимфомы лимфоидной ткани слизистых оболочек (MALT), узловой B-клеточной лимфомы из клеток маргинальной зоны (NMZL), нодулярной лимфомы Ходжкина с лимфоидным преобладанием, неходжскинской лимфомы, плазмобластной лимфомы, первичной лимфомы центральной нервной системы, первичной выпотной лимфомы, лимфомы маргинальной зоны селезенки (SMZL) и макроглобулинемии Вальденстрема, рецидивирующей или невосприимчивой крупноклеточной B-клеточной лимфомы, диффузной крупноклеточной B-клеточной лимфомы (DLBCL), неуточненной, B-клеточной лимфомы на поздних стадиях и DLBCL, развивающейся из фолликулярной лимфомы.
[55] В некоторых вариантах осуществления, B-клеточная лимфома выбрана из группы, состоящей из рецидивирующей или невосприимчивой крупноклеточной B-клеточной лимфомы, диффузной крупноклеточной B-клеточной лимфомы (DLBCL), неуточненной, первичной медиастинальной крупноклеточной B-клеточной лимфомы, B-клеточной лимфомы на поздних стадиях и DLBCL, развивающейся из фолликулярной лимфомы.
[56] В некоторых вариантах осуществления, B-клеточная лимфома представляет собой невосприимчивую диффузную крупноклеточную B-клеточную лимфому.
[57] В некоторых вариантах осуществления, неблагоприятная реакция выбрана из группы, состоящей из синдрома высвобождения цитокинов (CRS), неврологической токсичности, реакции гиперчувствительности, серьезной инфекции, цитопении и гипогаммаглобулинемии.
[58] В одном аспекте настоящее изобретение относится a иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) для использования в способе лечения B-клеточной лимфомы или лейкоза у нуждающегося в этом пациента, включающем: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) мониторирование у пациента после введения признаков и симптомов неблагоприятной реакции.
[59] В одном аспекте настоящее изобретение относится к способу лечения невосприимчивой диффузной крупноклеточной B-клеточной лимфомы у нуждающегося в этом пациента, включающему: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) мониторирование у пациента после введения изменений маркеров фенотипа и активации мононуклеарных клеток периферической крови (PBMC) пациента.
[60] В одном аспекте настоящее изобретение относится к способу лечения невосприимчивой диффузной крупноклеточной B-клеточной лимфомы после двух или более линий системной терапии у нуждающегося в этом пациента, включающему: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) мониторирование у пациента после введения изменений маркеров фенотипа и активации мононуклеарных клеток периферической крови (PBMC) пациента.
[61] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аутологичную иммунотерапию.
[62] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аллогенную иммунотерапию.
[63] В некоторых вариантах осуществления, T-клетки генетически модифицируют ex vivo.
[64] В некоторых вариантах осуществления, T-клетки генетически модифицируют посредством ретровирусной трансдукции.
[65] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками, включает генетическую модификацию для экспрессии химерного рецептора антигена (CAR), где указанный CAR содержит одноцепочечный вариабельный фрагмент (scFv) антитела против CD19, связанный с костимулирующими доменами CD28 и CD3-дзета.
[66] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аксикабтаген цилолейкел.
[67] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой антигенсвязывающую молекулу или ее фрагмент.
[68] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие три CDR из аминокислотной последовательности области VH, как указано в SEQ ID NO:1, и три CDR из аминокислотной последовательности области VL, указанной в SEQ ID NO: 3.
[69] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие: (a) H-CDR1, как указано в SEQ ID NO:5; (b) H-CDR2, как указано в SEQ ID NO:6; (c) H-CDR3, как указано в SEQ ID NO:7; (d) L-CDR1, как указано в SEQ ID NO:8; (e) L-CDR2, как указано в SEQ ID NO:9; и (f) L-CDR3, как указано в SEQ ID NO:10.
[70] В некоторых вариантах осуществления, агонист 4-1BB (CD137)) представляет собой полностью человеческое моноклональное антитело.
[71] В некоторых вариантах осуществления, агонист 4-1BB (CD137) содержит аминокислотную последовательность области VH, как указано в SEQ ID NO:1, и аминокислотную последовательность области VL, как указано в SEQ ID NO: 3.
[72] В некоторых вариантах осуществления, агонист 4-1BB (CD137) содержит аминокислотную последовательность тяжелой цепи, как указано в SEQ ID NO:2, и аминокислотную последовательность легкой цепи, как указано в SEQ ID NO:4, при условии, что C-концевой остаток лизина из SEQ ID NO:2, необязательно, отсутствует.
[73] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой утомилумаб.
[74] В некоторых вариантах осуществления, маркеры фенотипа и активации PBMC пациента включают маркер пан-T-клеток, маркер цитотоксических T-клеток, маркер дифференцировки T-клеток, маркер дифференцировки, рецептор IL-2, маркер активации, PD1, 4-1BB, маркер T-клеток-помощников, маркер гранулоцитов, маркер B-клеток, маркер моноцитов/макрофагов, маркер клеток NK и/или идентификацию аксикабтаген цилолейкел.
[75] В некоторых вариантах осуществления, маркеры фенотипа и активации PBMC пациента мониторируют посредством панели, содержащей антитела против CD3, CD8, CD45RA, CCR7, CD122, CD27, CD28, CD95 и/или CAR против CD19.
[76] В некоторых вариантах осуществления, маркеры фенотипа и активации PBMC пациента мониторируют посредством панели, содержащей антитела против CD3, CD8, CD45RA, CCR7, CD57, CD107α, CD279 и/или CAR против CD19.
[77] В некоторых вариантах осуществления, маркеры фенотипа и активации PBMC пациента мониторируют посредством панели, содержащей антитела против CD3, CD8, CD45RA, CCR7, CD25, CD69, CD137 и/или CAR против CD19.
[78] В некоторых вариантах осуществления, маркеры фенотипа и активации PBMC пациента мониторируют посредством панели, содержащей антитела против CD3, CD4, CD8, CD66b, CD19, CD14, CD56 и/или CAR против CD19.
[79] В некоторых вариантах осуществления, маркеры определяют посредством анализа проточной цитометрии.
[80] В одном аспекте настоящее изобретение относится к иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) для использования в способе лечения невосприимчивой диффузной крупноклеточной B-клеточной лимфомы у нуждающегося в этом пациента, включающем: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) мониторирование у пациента после введения изменений маркеров фенотипа и активации мононуклеарных клеток периферической крови (PBMC) пациента.
[81] В одном аспекте настоящее изобретение относится a иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) для использования в способе лечения невосприимчивой диффузной крупноклеточной B-клеточной лимфомы после двух или более линий системной терапии у нуждающегося в этом пациента, включающем: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) мониторирование в сыворотке пациента после введения уровней хемокинов, цитокинов и/или иммунных эффекторов.
[82] В одном аспекте настоящее изобретение относится к способу лечения невосприимчивой диффузной крупноклеточной B-клеточной лимфомы у нуждающегося в этом пациента, включающему: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) мониторирование в сыворотке пациента после введения уровней хемокинов, цитокинов и/или иммунных эффекторов.
[83] В одном аспекте настоящее изобретение относится к способу лечения невосприимчивой диффузной крупноклеточной B-клеточной лимфомы после двух или более линий системной терапии у нуждающегося в этом пациента, включающему: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) мониторирование в сыворотке пациента после введения уровней хемокинов, цитокинов и/или иммунных эффекторов.
[84] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аутологичную иммунотерапию.
[85] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аллогенную иммунотерапию.
[86] В некоторых вариантах осуществления, T-клетки генетически модифицируют ex vivo.
[87] В некоторых вариантах осуществления, T-клетки генетически модифицируют посредством ретровирусной трансдукции.
[88] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками включает генетическую модификацию для экспрессии химерного рецептора антигена (CAR), где указанный CAR содержит одноцепочечный вариабельный фрагмент (scFv) антитела против CD19, связанный с костимулирующими доменами CD28 и CD3-дзета.
[89] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аксикабтаген цилолейкел.
[90] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой антигенсвязывающую молекулу или ее фрагмент.
[91] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие три CDR из аминокислотной последовательности области VH, как указано в SEQ ID NO:1, и три CDR из аминокислотной последовательности области VL, указанной в SEQ ID NO: 3.
[92] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие: (a) H-CDR1, как указано в SEQ ID NO:5; (b) H-CDR2, как указано в SEQ ID NO:6; (c) H-CDR3, как указано в SEQ ID NO:7; (d) L-CDR1, как указано в SEQ ID NO:8; (e) L-CDR2, как указано в SEQ ID NO:9; и (f) L-CDR3, как указано в SEQ ID NO:10.
[93] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой полностью человеческое моноклональное антитело.
[94] В некоторых вариантах осуществления, агонист 4-1BB (CD137) содержит аминокислотную последовательность области VH, как указано в SEQ ID NO:1, и аминокислотную последовательность области VL, как указано в SEQ ID NO: 3.
[95] В некоторых вариантах осуществления, агонист 4-1BB (CD137) содержит аминокислотную последовательность тяжелой цепи, как указано в SEQ ID NO:2, и аминокислотную последовательность легкой цепи, как указано в SEQ ID NO:4, при условии, что C-концевой остаток лизина из SEQ ID NO:2, необязательно, отсутствует.
[96] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой утомилумаб.
[97] В некоторых вариантах осуществления, в сыворотке пациента мониторируют IL-15, IL-7, IL-2, IL-6, IL1α, IL-1β, IL-17α, TNFα, TNFβ, GM-CSF, CRP, SAA, IL-13, IL-4, IL-5, IL-10, IFNγ, IL-12p40, IL-12p70, IL-16, IL-8, MCP-1, MCP-4, MIP-1α, MIP-1β, IP-10, TARC, эотаксин, эотаксин-3, MDC, гранзим A, гранзим B, sFASL, перфорин, FGF-2, sICAM-1, sVCAM-1, VEGF, VEGF-C, VEGF-D, PLGF, IL1Rα, IL1Rβ и/или ферритин.
[98] В некоторых вариантах осуществления, уровни хемокинов, цитокинов и/или иммунных эффекторов определяют с использованием мультиплексного анализа.
[99] В одном аспекте настоящее изобретение относится к иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) для использования в способе лечения невосприимчивой диффузной крупноклеточной B-клеточной лимфомы после двух или более линий системной терапии у нуждающегося в этом пациента, включающем: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) мониторирование в сыворотке пациента после введения уровней хемокинов, цитокинов и/или иммунных эффекторов.
[100] В одном аспекте настоящее изобретение относится к способу лечения невосприимчивой диффузной крупноклеточной B-клеточной лимфомы у нуждающегося в этом пациента, включающему: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) анализ ответа пациента после введения по регрессии [полному ответу (CR) или частичному ответу (PR)], невосприимчивости к лечению [прогрессирующему заболеванию (PD)], рецидиву или персистенции без доказательств прогрессирования или полной регрессии [длительному PR или стабильному заболеванию (SD)].
[101] В одном аспекте настоящее изобретение относится к способу лечения невосприимчивой диффузной крупноклеточной B-клеточной лимфомы после двух или более линий системной терапии у нуждающегося в этом пациента, включающему: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) анализ ответа пациента после введения по регрессии [полному ответу (CR) или частичному ответу (PR)], невосприимчивости к лечению [прогрессирующему заболеванию (PD)], рецидиву или персистенции без доказательств прогрессирования или полной регрессии [длительному PR или стабильному заболеванию (SD)].
[102] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аутологичную иммунотерапию.
[103] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аллогенную иммунотерапию.
[104] В некоторых вариантах осуществления, T-клетки генетически модифицируют ex vivo.
[105] В некоторых вариантах осуществления, T-клетки генетически модифицируют посредством ретровирусной трансдукции.
[106] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками, включает генетическую модификацию для экспрессии химерного рецептора антигена (CAR), где указанный CAR содержит одноцепочечный вариабельный фрагмент (scFv) антитела против CD19, связанный с костимулирующими доменами CD28 и CD3-дзета.
[107] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аксикабтаген цилолейкел.
[108] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой антигенсвязывающую молекулу или ее фрагмент.
[109] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие три CDR из аминокислотной последовательности области VH, как указано в SEQ ID NO:1, и три CDR из аминокислотной последовательности области VL, указанной в SEQ ID NO: 3.
[110] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие: (a) H-CDR1, как указано в SEQ ID NO:5; (b) H-CDR2, как указано в SEQ ID NO:6; (c) H-CDR3, как указано в SEQ ID NO:7; (d) L-CDR1, как указано в SEQ ID NO:8; (e) L-CDR2, как указано в SEQ ID NO:9; и (f) L-CDR3, как указано в SEQ ID NO:10.
[111] В некоторых вариантах осуществления, агонист 4-1BB (CD137)) представляет собой полностью человеческое моноклональное антитело.
[112] В некоторых вариантах осуществления, агонист 4-1BB (CD137) содержит аминокислотную последовательность области VH, как указано в SEQ ID NO:1 и аминокислотной последовательности области VL, как указано в SEQ ID NO: 3.
[113] В некоторых вариантах осуществления, агонист 4-1BB (CD137) содержит аминокислотную последовательность тяжелой цепи, как указано в SEQ ID NO:2, и аминокислотную последовательность легкой цепи, как указано в SEQ ID NO:4, при условии, что C-концевой остаток лизина из SEQ ID NO:2, необязательно, отсутствует.
[114] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой утомилумаб.
[115] В некоторых вариантах осуществления, анализ ответа пациента после введения по регрессии [полному ответу (CR) или частичному ответу (PR)], невосприимчивости к лечению [прогрессирующему заболеванию (PD)], рецидиву или персистенции без доказательств прогрессирования или полной регрессии [длительному PR или стабильному заболеванию (SD)], включает мониторирование маркеров фенотипа и активации PBMC пациента, включающих маркер пан-T-клеток, маркер цитотоксических T-клеток, маркер дифференцировки T-клеток, маркер дифференцировки, рецептор IL-2, маркер активации, PD1, 4-1BB, маркер T-клеток-помощников, маркер гранулоцитов, маркер B-клеток, маркер моноцитов/макрофагов, маркер клеток NK и/или идентификацию аксикабтаген цилолейкел.
[116] В некоторых вариантах осуществления, маркеры фенотипа и активации PBMC пациента мониторируют посредством панели, содержащей антитела против CD3, CD8, CD45RA, CCR7, CD122, CD27, CD28, CD95 и/или CAR против CD19.
[117] В некоторых вариантах осуществления, маркеры фенотипа и активации PBMC пациента мониторируют посредством панели, содержащей антитела против CD3, CD8, CD45RA, CCR7, CD57, CD107α, CD279 и/или CAR против CD19.
[118] В некоторых вариантах осуществления, маркеры фенотипа и активации PBMC пациента мониторируют посредством панели, содержащей антитела против CD3, CD8, CD45RA, CCR7, CD25, CD69, CD137 и/или CAR против CD19.
[119] В некоторых вариантах осуществления, маркеры фенотипа и активации PBMC пациента мониторируют посредством панели, содержащей антитела против CD3, CD4, CD8, CD66b, CD19, CD14, CD56 и/или CAR против CD19.
[120] В некоторых вариантах осуществления, маркеры определяют посредством анализа проточной цитометрии.
[121] В некоторых вариантах осуществления, в сыворотке пациента мониторируют IL-15, IL-7, IL-2, IL-6, IL1α, IL-1β, IL-17α, TNFα, TNFβ, GM-CSF, CRP, SAA, IL-13, IL-4, IL-5, IL-10, IFNγ, IL-12p40, IL-12p70, IL-16, IL-8, MCP-1, MCP-4, MIP-1α, MIP-1β, IP-10, TARC, эотаксин, эотаксин-3, MDC, гранзим A, гранзим B, sFASL, перфорин, FGF-2, sICAM-1, sVCAM-1, VEGF, VEGF-C, VEGF-D, PLGF, IL1Rα, IL1Rβ и/или ферритин.
[122] В некоторых вариантах осуществления, уровни хемокинов, цитокинов и/или иммунных эффекторов определяют с использованием мультиплексного анализа.
[123] В одном аспекте настоящее изобретение относится к иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) для использования в способе лечения невосприимчивой диффузной крупноклеточной B-клеточной лимфомы после двух или более линий системной терапии у нуждающегося в этом пациента, включающем: (a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками; (b) введение пациенту агониста 4-1BB (CD137); и (c) анализ ответа пациента после введения по полному ответу (CR), частичному ответу (PR), стабильному заболеванию (SD) или прогрессирующему заболеванию (PD).
[124] Настоящее изобретение также относится к иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) для использования в описанных способах лечения; а также к использованию иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) в изготовлении лекарственного средства для использования в описанных способах лечения.
[125] Другие признаки и преимущества описания станут очевидными из следующего подробного описания, включая примеры, и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[126] Чертежи предназначены только для целей иллюстрации, а не ограничения.
[127] На ФИГ. 1. проиллюстрирован дизайн исследования, оценивающего безопасность и эффективность KTE-C19 (аксикабтаген цилолейкел) в комбинации с утомилумабомом у субъектов с невосприимчивой крупноклеточной B-клеточной лимфомой или невосприимчивой диффузной крупноклеточной B-клеточной лимфомой (DLBCL).
[128] На ФИГ. 2A-2C. показана взаимосвязь между уровнями CAR против CD19 в крови в течение первых 28 суток после инфузии (AUC0-28) с A. частотой объективных ответов (ORR) (полной ремиссией (CR) или частичной ремиссией (PR)), B. (NE) и развитием неврологической токсичности степени ≥3 или C. синдромом высвобождения цитокинов (CRS).
[129] ФИГ. 3 Результаты противолимфоцитарной химиотерапии и введения T-клеток с CAR против CD19 для индукции ключевых иммунных программ в течение первых 28 суток после инфузии. Уровни показанных аналитов были увеличены у ≥50% пациентов с ≥ 2-кратной индукцией выше исходного значения в панели из 44 измеренных. Аналиты в сыворотке измеряли с использованием MSD®, Luminex® и ELISA Quantikine®. CRP, C-реактивный белок; GM-CSF, гранулоцитарно-макрофагальный колониестимулирующий фактор; IFN, интерферон; IL, интерлейкин; MCP-1, моноцитарный хемоаттрактантный белок-1; SAA, сывороточный амилоид A.
[130] На ФИГ. 4 показаны биомаркеры, ассоциированные как с CRS степени ≥3, так и с неврологической токсичностью степени ≥3. Показана ассоциация между пиковыми уровнями аналитов в сыворотке и ассоциация с неврологической токсичностью или CRS степени ≥3. Пиковые уровни после инфузии Axi-cel™ использовали для сравнения. AUC, площадь под кривой; CRS, синдром высвобождения цитокинов; IFN, интерферон; IL, интерлейкин, MCP, моноцитарный хемоаттрактантный белок; NE, неврологические события.
[131] ФИГ. 5A-5H Для T-клеток с CAR против CD19 показана широкая полифункциональность в совместной культуре с CD 19+ клетками опухолей. A-D. Цитокины: A. IL-2, B. IL-4, C. Гранзим B, D. IFNγ, E-H. Поверхностные маркеры: E. CD69, F. CD107α, G. CD137, H. PD1.
[132] На ФИГ. 6 показано предполагаемое расписание сбора биоптатов, чтобы позволять анализ образцов, попадающих в четыре общие категории ответа: 1) регрессия [полный ответ (CR) или частичный ответ (PR)], 2) невосприимчивость к лечению [прогрессирующее заболевание (PD)], 3) рецидив или 4) персистенция без доказательства прогрессирования или полной регрессии [длительный PR или стабильное заболевание (SD)].
[133] На ФИГ. 7 показано иллюстративное расписание сбора образцов биомаркеров. Axi-cel: аксикабтаген цилолейкел; CAR: химерный рецептор антигена; ELISA: твердофазный иммуноферментный анализ; qПЦР: количественная полимеразная цепная реакция.
[134] На ФИГ. 8 показано иллюстративное расписание сбора парных биоптатов.
[135] На ФИГ. 9 проиллюстрированы схемы переработки образцов для толстоигольной биопсии.
[136] На ФИГ. 10 показан схематический вид маркеров и способов анализа для оценки образцов биоптатов пациентов.
[137] На ФИГ. 11 показана последовательность антитела (тяжелая цепь: SEQ ID NO: 2, легкая цепь: SEQ ID NO: 4) и структурные признаки утомилумаба.
[138] На ФИГ. 12 показан механизм действия утомилумаба.
[139] На ФИГ. 13 проиллюстрирован другой дизайн исследования, оценивающего безопасность и эффективность KTE-C19 (аксикабтаген цилолейкел) в комбинации с утомилумабом у субъектов с невосприимчивой крупноклеточной B-клеточной лимфомой или с невосприимчивой диффузной крупноклеточной B-клеточной лимфомой (DLBCL).
[140] ФИГ. 14A - 14B. Продукция IL-2 T-клетками с CAR против CD19. Клетки инкубировали со средством на основе антитела (0,33 мкг/мл) в присутствии контрольного антитела (A) или утомилумаба (B) в течение 16 часов. Первая точка данных на оси X представляет собой только средство на основе антитела. Данные представляют собой среднее для трех повторов лунок.
ПОДРОБНОЕ ОПИСАНИЕ
[141] Настоящее изобретение относится к способу лечения заболевания или нарушения у пациента, включающему введение аксикабтаген цилолейкел (KTE-C19) в комбинации с утомилумабом (PF-05082566), агонистическим полностью человеческим моноклональным антителом IgG2 против 4-1BB (CD137). Аксикабтаген цилолейкел представляет собой нацеленную на CD19 клеточную суспензию генетически модифицированных аутологичных T-клеток для иммунотерапии, содержащую собственные T-клетки пациента, собранные и генетически модифицированные ex vivo посредством ретровирусной трансдукции для экспрессии химерного рецептора антигена (CAR), содержащего одноцепочечный вариабельный фрагмент (scFv) антитела против CD19FMC63, связанный с костимулирующими доменами CD28 и CD3-дзета. См., например, Neelapu et al., Clin. Adv. Hem. Onc., Vol. 15, Issue 2 (2017). В некоторых вариантах осуществления, заболевание или нарушение представляет собой лимфому, такую как невосприимчивая диффузная крупноклеточная B-клеточная лимфома (DLBCL), или лейкоз, такой как острый лимфобластный лейкоз (ALL).
[142] Для подготовки иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками, собственные T-клетки пациента можно собирать и генетически модифицировать ex vivo посредством ретровирусной трансдукции для экспрессии химерного рецептора антигена (CAR), содержащего мышиный одноцепочечный вариабельный фрагмент (scFv) антитела против CD19, связанный с костимулирующими доменами CD28 и CD3-дзета. В некоторых вариантах осуществления, CAR содержит мышиный одноцепочечный вариабельный фрагмент (scFv) антитела против CD19, связанный с костимулирующими доменами 4-1BB и CD3-дзета. T-клетки с CAR против CD19 можно размножать и вводить посредством инфузии обратно пациенту, где они могут узнавать и уничтожать экспрессирующие CD19 клетки-мишени. YESCARTATM (Axi-celTM; аксикабтаген цилолейкел) является одним примером такой нацеленной на CD19 генетически модифицированной аутологичной T-клетки для иммунотерапии. См. Kochenderfer, et al., (J Immunother 2009;32:689 702). Дополнительные виды терапии с использованием нацеленного на CD19 CAR включают JCAR017, JCAR015, JCAR014, Kymriah (тизагенлеклейкел). См. Sadelain et al., Nature Rev. Cancer Vol. 3 (2003), Ruella et al., Curr Hematol Malig Rep., Springer, NY (2016) и Sadelain et al. Cancer Discovery (Apr 2013).
[143] Нацеленные на CD19 генетически модифицированные аутологичные T-клетки для иммунотерапии можно получать из мононуклеарных клеток периферической крови пациента, которые, как правило, получают посредством стандартного способа лейкафереза. Мононуклеарные клетки можно обогащать по T-клеткам и активировать с использованием антитела против CD3 в присутствии IL-2, затем трансдуцировать с использованием некомпетентного по репликации ретровирусного вектора, содержащего трансген CAR против CD19. Трансдуцированные T-клетки можно размножать в культуре клеток, промывать, составлять в суспензию и/или криоконсервировать. Как правило, продукт, содержащий генетически модифицированные аутологичные T-клетки, должен проходить тест на стерильность перед выпуском для транспортировки в форме замороженной суспензии в специфическом для пациента контейнере для инфузии, таком как пакет для инфузии. Как правило, продукт размораживают до инфузии.
[144] В дополнение к T-клеткам, иммунотерапия с использованием нацеленных на CD19 генетически модифицированных аутологичных T-клеток может включать клетки NK и NK-T-клетки. В некоторых вариантах осуществления, состав для иммунотерапии с использованием нацеленных на CD19 генетически модифицированных аутологичных T-клеток содержит приблизительно 5% диметилсульфоксида (DMSO) и приблизительно 2,5% альбумина (человека) (об./об.).
[145] Нацеленные на CD19 генетически модифицированные аутологичные и/или аллогенные T-клетки могут связываться с экспрессирующими CD19 клетками злокачественных опухолей и нормальными B-клетками. Конкретные исследования показали, что после привлечения T-клеток с CAR против CD19 с использованием экспрессирующих CD19 клеток-мишеней, костимулирующий домен CD28 и активирующий домен CD3-дзета запускают нижестоящие каскады передачи сигналов, приводящие к активации T-клеток, их пролиферации, приобретению эффекторных функций и секреции провоспалительных цитокинов и хемокинов. Эта последовательность событий приводит к уничтожению экспрессирующих CD19 клеток.
[146] Антигенсвязывающая молекула или ее фрагмент, связывающие 4-1BB и пригодные по настоящему изобретению, представляют собой антитело против 4-1BB. В некоторых вариантах осуществления, антитело представляет собой агонистическое антитело против 4-1BB. В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие три CDR из аминокислотной последовательности области VH, как указано в SEQ ID NO:1, и три CDR из аминокислотной последовательности области VL, указанной в SEQ ID NO: 3. В некоторых вариантах осуществления, антитело связывается с 4-1BB человека. В некоторых вариантах осуществления, антитело против 4-1BB содержит (a) H-CDR1, как указано в SEQ ID NO:5; (b) H-CDR2, как указано в SEQ ID NO:6; (c) H-CDR3, как указано в SEQ ID NO:7; (d) L-CDR1, как указано в SEQ ID NO:8; (e) L-CDR2, как указано в SEQ ID NO:9; и (f) L-CDR3, как указано в SEQ ID NO:10. В некоторых вариантах осуществления, антитело против CD137 (4-1BB) содержит (1) аминокислотную последовательность области VH, как указано в SEQ ID NO:1, и (2) аминокислотную последовательность области VL, как указано в SEQ ID NO:3. В некоторых вариантах осуществления, антитело против 4-1BB содержит аминокислотную последовательность тяжелой цепи, как указано в SEQ ID NO:2, и аминокислотную последовательность легкой цепи, как указано в SEQ ID NO:4, при условии, что C-концевой остаток лизина из SEQ ID NO:2, необязательно, отсутствует. В некоторых вариантах осуществления, антитело против 4-1BB представляет собой полностью человеческое моноклональное антитело. Утомилумаб является одним из примеров такого полностью человеческого моноклонального антитела, связывающего 4-1BB человека.
[147] Агонизм 4-1BB на поверхности T-клеток со сконструированным CAR против CD19 может усиливать противоопухолевую активность аксикабтаген цилолейкел посредством следующих механизмов: (1) увеличения жизнеспособности T-клеток с CAR против CD19 посредством повышающей регуляции антиапоптотических белков, (2) усиления размножения и пролиферации T-клеток с CAR против CD19, и 3) внесения вклада в T-клеточный иммунный ответ.
ОПРЕДЕЛЕНИЯ
[148] Для более простого понимания настоящего изобретения, определенные термины впервые определены ниже. Дополнительные определения для следующих терминов и других терминов указаны на протяжении описания.
[149] Как используют в настоящем описании и прилагаемой формуле изобретения, формы единственного числа включают объекты ссылки множественного числа, если контекст явно не требует иного.
[150] Если иное не указано конкретно или не очевидно из контекста, в рамках изобретения, термин «или» понимают как включительный и охватывающий как «или», так и «и».
[151] Термин «и/или», в рамках изобретения, следует принимать как конкретное описание каждого из двух указанных признаков или компонентов, в присутствии или в отсутствие другого. Таким образом, термин «и/или», как используют в такой фразе, как «A и/или B», в настоящем описании предназначен для включения A и B; A или B; A (отдельно); и B (отдельно). Подобным образом, термин «и/или», как используют в такой фразе, как «A, B и/или C», предназначен для включения каждого из следующих аспектов: A, B и C; A, B или C; A или C; A или B; B или C; A и C; A и B; B и C; A (отдельно); B (отдельно); и C (отдельно).
[152] Термины «например» и «т.е»., в рамках изобретения, используют просто в качестве примера, без намеренного ограничения, и их не следует рассматривать как относящиеся только к пунктам, явно перечисленным в описании.
[153] Термины «или более», «по меньшей мере», «более, чем» и т.п., например, «по меньшей мере один» понимают как включающие, но без ограничения, по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149 или 150, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000 или более, чем указанное значение. Включено также любое большее количество или дробь между ними.
[154] И наоборот, термин «не более, чем» включает каждое значение менее указанного значения. Например, «не более, чем 100 нуклеотидов» включает 100, 99, 98, 97, 96, 95, 94, 93, 92, 91, 90, 89, 88, 87, 86, 85, 84, 83, 82, 81, 80, 79, 78, 77, 76, 75, 74, 73, 72, 71, 70, 69, 68, 67, 66, 65, 64, 63, 62, 61, 60, 59, 58, 57, 56, 55, 54, 53, 52, 51, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 и 0 нуклеотидов. Включено также любое меньшее количество или дробь между ними.
[155] Термины «множество», «по меньшей мере два», «два или более», «по меньшей мере второй» и т.п., понимают как включающие, но без ограничения, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149 или 150, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000 или более. Включено также любое большее количество или дробь между ними.
[156] На протяжении описания, слово «содержание» или варианты, такие как «содержит» или «содержащий», следует понимать как подразумевающие включение указанного элемента, целого числа или стадии, или группы элементов, целых чисел или стадий, но не исключение любого другого элемента, целого числа или стадии, или группы элементов, целых чисел или стадий. Понятно, что во всех случаях, когда аспекты описаны в настоящем описании с использованием выражения «содержащий», представлены также аналогичные в ином отношении аспекты, описанные в отношении «состоящий из» и/или «в основном состоящий из».
Если иное не указано конкретно или не очевидно из контекста, в рамках изобретения, термин «приблизительно» относится к значению или составу, лежащих в приемлемом диапазоне ошибки для конкретного значения или композиции, как определено специалистом в данной области, который может частично зависеть от того, каким образом значение или состав измеряют или определяют, т.е., от ограничений системы измерения. Например, «около» или «приблизительно» может обозначать в пределах одного или более одного стандартного отклонения, согласно практике в данной области. «Около» или «приблизительно» может обозначать диапазон вплоть до 10% (т.е., ±10%). Таким образом, «приблизительно» можно понимать как лежащее в пределах 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,5%, 0,1%, 0,05%, 0,01% или 0,001% более или менее, чем указанное значение. Например, приблизительно 5 мг может включать любое значение между 4,5 мг и 5,5 мг. Кроме того, в частности, применительно к биологическим системам или процессам, термины могут означать вплоть до одного порядка величины или вплоть до 5-кратного значения. Когда конкретные значения или составы представлены в настоящем описании, если не указано иное, значение «около» или «приблизительно» следует понимать, как лежащее в пределах приемлемого диапазона ошибки для этого конкретного значения или состава.
[158] Как описано в настоящем описании, любой диапазон концентраций, диапазон процентов, диапазон соотношений или диапазон целых чисел следует понимать как включающий значение любого целого числа в пределах указанного диапазона и, где это применимо, их доли (такие как одна десятая и одна сотая от целого числа), если не указано иное.
[159] Единицы, приставки и символы, используемые в настоящем описании, представлены с использованием их формы, принятой в международной системе СИ (Système International de Unites (SI)). Числовые диапазоны включают числа, определяющие диапазон.
[160] Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, которое является общепринятым для специалиста в области, к которой относится настоящее изобретение. Например, Juo, «The Concise Dictionary of Biomedicine and Molecular Biology», 2nd ed., (2001), CRC Press; «The Dictionary of Cell & Molecular Biology», 5th ed., (2013), Academic Press; и «The Oxford Dictionary Of Biochemistry And Molecular Biology», Cammack et al. eds., 2nd ed., (2006), Oxford University Press, обеспечивают специалиста в данной области общим словарем для множества терминов, используемых в этом описании.
[161] «Введение» относится к физическому введению средства субъекту, с использованием любого из различных способов и систем для доставки, известных специалистам в данной области. Иллюстративные способы введения для составов, описанных в настоящем описании, включают внутривенный, внутримышечный, подкожный, внутрибрюшинный, спинальный или другие парентеральные способы введения, например, посредством инъекции или инфузии. Фраза «парентеральное введение», в рамках изобретения, обозначает способы введения, отличные от энтерального и местного введения, обычно посредством инъекции, и включает, без ограничения, внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрилимфатическую, внутриочаговую, интракапсулярную, интраорбитальную, интракардиальную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, подкутикулярную, внутрисуставную, подкапсулярную, субарахноидальную, интраспинальную, эпидуральную и интрастернальную инъекцию и инфузию, так же как электропорацию in vivo. В некоторых вариантах осуществления, состав вводят непарентеральным способом, например, перорально. Другие непарентеральные способы включают местный, эпидермальный способ введения или способ введения на слизистую оболочку, например, интраназально, вагинально, ректально, подъязычно или местно. Введение можно также проводить, например, один раз, множество раз и/или в течение одного или нескольких длительных периодов.
[162] Термин «агонист» относится к антигенсвязывающей молекуле, как определено в настоящем описании, которая при связывании с 4-1BB, (1) стимулирует или активирует 4-1BB, (2) усиливает, увеличивает, стимулирует, индуцирует или продлевает активность, функцию или присутствие 4-1BB, или (3) усиливает, увеличивает, стимулирует или индуцирует экспрессию 4-1BB.
[163] Термин «антитело» (Ab) включает, без ограничения, гликопротеин иммуноглобулин, который специфически связывается с антигеном. Как правило, антитело может содержать по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, соединенные между собой дисульфидными связями, или антигенсвязывающую молекулу из них. Каждая цепь H содержит вариабельную область тяжелой цепи (сокращенно обозначенную в настоящем описании как VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три константных домена, CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно обозначенную в настоящем описании как VL) и константную область легкой цепи. Константная область легкой цепи содержит один константный домен, CL. Области VH и VL можно далее подразделять на области гипервариабельности, названные определяющими комплементарность областями (CDR), перемежающиеся областями, которые являются более консервативными, названными каркасными областями (FR). Каждая из VH и VL содержит три CDR и четыре FR, расположенные от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Вариабельные области тяжелых и легких цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области Ab могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента.
[164] Антитела могут включать, например, моноклональные антитела, полученные рекомбинантным способом антитела, моноспецифические антитела, мультиспецифические антитела (включая биспецифические антитела), человеческие антитела, сконструированные антитела, гуманизированные антитела, химерные антитела, иммуноглобулины, синтетические антитела, тетрамерные антитела, содержащие две молекулы тяжелой цепи и две молекулы легкой цепи, мономер легкой цепи антитела, мономер тяжелой цепи антитела, димер легкой цепи антитела, димер тяжелой цепи антитела, пару легкая цепь антитела - тяжелая цепь антитела, интраантитела, слитые с антителом белки (иногда обозначенные в настоящем описании как «конъюгаты антител»), гетероконъюгированные антитела, однодоменные антитела, моновалентные антитела, одноцепочечные антитела или одноцепочечные Fv (scFv), камелизированные антитела, аффитела, фрагменты Fab, фрагменты F(ab’)2, связанные дисульфидными мостиками Fv (sdFv), антиидиотипические (анти-Id) антитела (включая, например, анти-анти-Id антитела), миниантитела, доменные антитела, синтетические антитела (иногда обозначенные в настоящем описании как «миметики антител»), и антигенсвязывающие фрагменты любого из вышеуказанных. В некоторых вариантах осуществления, антитела, описанные в настоящем описании, относятся к поликлональной популяции антител.
[165] «Антигенсвязывающая молекула», «антигенсвязывающая часть» или «фрагмент антитела» относится к любой молекуле, которая содержит антигенсвязывающие части (например, CDR) антитела, из которого происходит молекула. Антигенсвязывающая молекула может включать определяющие комплементарность к антигену области (CDR). Примеры фрагментов антител включают, но без ограничения, фрагменты Fab, Fab', F(ab')2 и Fv, dAb, линейные антитела, антитела scFv и мультиспецифические антитела, сформированные из антигенсвязывающих молекул. Пептидные антитела (т.е., слитые с Fc молекулы, содержащие связывающие пептидные домены) являются другим примером пригодных антигенсвязывающих молекул. В некоторых вариантах осуществления, антигенсвязывающая молекула связывается с антигеном на клетке опухоли. В некоторых вариантах осуществления, антигенсвязывающая молекула связывается с антигеном на клетке, вовлеченным в гиперпролиферативное заболевание, или с вирусным или бактериальным антигеном. В некоторых вариантах осуществления, антигенсвязывающая молекула связывается с CD19. В некоторых вариантах осуществления, антигенсвязывающая молекула связывается с 4-1BB (CD137). В следующих вариантах осуществления, антигенсвязывающая молекула представляет собой фрагмент антитела, который специфически связывается с антигеном, включающий одну или несколько из его определяющих комплементарность областей (CDR). В следующих вариантах осуществления, антигенсвязывающая молекула представляет собой одноцепочечный вариабельный фрагмент (scFv). В некоторых вариантах осуществления, антигенсвязывающая молекула содержит авимеры или состоит из них.
[166] «Антиген» относится к любой молекуле, которая вызывает иммунный ответ или может быть связана антителом или антигенсвязывающей молекулой. Иммунный ответ может включать либо продукцию антитела, либо активацию специфических иммунологически компетентных клеток, либо и то, и другое. Специалисту в данной области ясно понятно, что любая макромолекула, включая фактически все белки или пептиды, может служить антигеном. Антиген может являться эндогенно экспрессированным, т.е., экспрессированным с геномной ДНК, или может являться экспрессированным рекомбинантным способом. Антиген может являться специфическим для конкретной ткани, такой как клетка злокачественной опухоли, или может быть широко экспрессированным. Кроме того, фрагменты более крупных молекул могут действовать в качестве антигенов. В некоторых вариантах осуществления, антигены представляют собой антигены опухолей.
[167] Термин «производное антитела» или «производное» антитела относится к молекуле, способной связываться с тем же антигеном (например, 4-1BB), с которым связывается антитело, и содержит аминокислотную последовательность антитела, связанную с дополнительной молекулярной группой. Аминокислотная последовательность антитела, содержащаяся в производном антитела, может представлять собой полноразмерную тяжелую цепь, полноразмерную легкую цепь, любую часть или части полноразмерной тяжелой цепи, любую часть или части полноразмерной легкой цепи антитела, любой другой фрагмент(ы) антитела, или полное антитело. Дополнительная молекулярная группа может представлять собой химическую или биологическую молекулу. Примеры дополнительных молекулярных групп включают химические группы, аминокислоты, пептиды, белки (такие как ферменты, антитела) и химические соединения. Дополнительная молекулярная группа может иметь любую применимость, например, для использования в качестве средства для детекции, метки, маркера, фармацевтического или терапевтического средства. Аминокислотную последовательность антитела можно соединять или связывать с дополнительной молекулярной группой посредством химического соединения, генетического слияния, нековалентной ассоциации, или иным способом. Термин «производное антитела» также включает химерные антитела, гуманизированные антитела и молекулы, полученные в результате модификаций аминокислотных последовательностей антитела против 4-1BB, таких как консервативные замены, добавления и вставки аминокислот.
[168] Термин «человеческое антитело» относится к антителам, имеющим вариабельные и константные области (если они присутствуют), происходящие из человеческих зародышевых последовательностей иммуноглобулинов. Человеческое антитела по настоящему изобретению могут включать аминокислотные остатки, не кодированные человеческими зародышевыми последовательностями (например, мутации, введенные посредством случайного или сайт-специфического мутагенеза in vitro или посредством соматической мутации in vivo). Термин «человеческое антитело» не предназначен для включения химерных или гуманизированных антител, содержащих не относящиеся к человеку антигенсвязывающие остатки.
[169] «Нацеленные на CD19 генетически модифицированные аутологичные T-клетки для иммунотерапии» относится к суспензии положительных по химерному рецептору антигена (CAR) T-клеткам. Примером такой иммунотерапии является аксикабтаген цилолейкел (также известный как Axi-cel™, YESCARTA™), разработанный в Kite Pharmaceuticals, Inc.
[170] Термин «нейтрализующий» относится к антигенсвязывающей молекуле, scFv, антителу или его фрагменту, который связывается с лигандом и предотвращает или уменьшает биологический эффект этого лиганда. В некоторых вариантах осуществления, антигенсвязывающая молекула, scFv, антитело или его фрагмент, напрямую блокируют участок связывания на лиганде или иным образом изменяют способность лиганда к связыванию посредством непрямых способов (таких как структурные или энергетические изменения лиганда). В некоторых вариантах осуществления, антигенсвязывающая молекула, scFv, антитело или его фрагмент предотвращают выполнение биологической функции белка, с которым они связаны.
[171] Термин «моноклональные антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т.е., индивидуальные антитела, составляющие популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифическими, являясь нацеленными против одного антигенного участка. Кроме того, в отличие от препаратов поликлонального антитела, включающих различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на антигене. В дополнение к их специфичности, моноклональные антитела обеспечивают то преимущество, что их можно синтезировать без контаминации другими антителами. Определение «моноклональное» не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела можно получать способом гибридомы или можно получать с использованием способов рекомбинантной ДНК в клетках бактерий, эукариотических животных или растений (см., например, Патент США No. 4816567). Моноклональные антитела можно также выделять из фаговых библиотек антител с использованием способов, описанных, например, в Clackson et al., Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol., 222:581-597 (1991).
[172] Термин «аутологичный» относится к любому материалу, полученному от того же индивидуума, которому его надлежит повторно ввести позднее. Например, способ терапии модифицированными аутологичными клетками (eACT™), описанный в настоящем описании, включает сбор от пациента лимфоцитов, которые затем модифицируют для экспрессии, например, конструкции CAR, и затем вводят обратно тому же самому пациенту.
[173] Термин «аллогенный» относится к любому материалу, полученному от одного индивидуума, который затем вводят другому индивидууму того же вида, например, при аллогенной трансплантации T-клеток.
[174] Термины «трансдукция» и «трансдуцированный» относятся к способу введения чужеродной ДНК в клетку посредством вирусного вектора (см. Jones et al., «Genetics: principles and analysis», Boston: Jones & Bartlett Publ. (1998)). В некоторых вариантах осуществления, вектор представляет собой ретровирусный вектор, ДНК-вектор, РНК-вектор, аденовирусный вектор, бакуловирусный вектор, вектор на основе вируса Эпштейна-Барр, паповавирусный вектор, вектор на основе вируса осповакцины, вектор на основе вируса простого герпеса, ассоциированный с аденовирусом вектор, лентивирусный вектор или любую их комбинацию.
[175] «Злокачественная опухоль» относится к широкой группе различных заболеваний, характеризующихся неконтролируемым ростом аномальных клеток в организме. Деление и рост клеток с нарушенной регуляцией приводят к образованию злокачественных опухолей, которые проникают в соседние ткани и могут также метастазировать в отдаленные участки организма через лимфатическую систему или кровоток. «Злокачественная опухоль» или «ткань злокачественной опухоли» может включать опухоль. Примеры злокачественных опухолей, которые можно лечить способами, описанными в настоящем описании, включают, но без ограничения, злокачественные опухоли иммунной системы, включая лимфому, лейкоз, миелому и другие злокачественные новообразования лейкоцитов. В некоторых вариантах осуществления, способы, описанные в настоящем описании, можно использовать для уменьшения размера опухоли, происходящей, например, из злокачественной опухоли кости, рака поджелудочной железы, рака кожи, рака головы или шеи, кожной или внутриглазной злокачественной меланомы, рака тела матки, рака яичника, рака прямой кишки, рака анальной области, рака желудка, рака яичка, рака тела матки, карциномы фаллопиевых труб, карциномы эндометрия, карциномы шейки матки, карциномы влагалища, карциномы вульвы, множественной миеломы, болезни Ходжкина, неходжскинской лимфомы (NHL), первичной медиастинальной крупноклеточной B-клеточной лимфомы (PMBC), диффузной крупноклеточной B-клеточной лимфомы (DLBCL), фолликулярной лимфомы (FL), трансформированной фолликулярной лимфомы, лимфомы маргинальной зоны селезенки (SMZL), рака пищевода, рака тонкого кишечника, злокачественной опухоли эндокринной системы, рака щитовидной железы, рака паращитовидной железы, рака надпочечников, саркомы мягких тканей, рака мочеиспускательного канала, рака полового члена, хронического или острого лейкоза, острого миелоидного лейкоза, хронического миелоидного лейкоза), хронического лимфоцитарного лейкоза (CLL), солидных опухолей у детей, лимфоцитарной лимфомы, рака мочевого пузыря, рака почки или мочеточника, карциномы почечной лоханки, неоплазии центральной нервной системы (ЦНС), первичной лимфомы ЦНС, ангиогенеза опухолей, опухоли оси позвоночика, глиомы ствола головного мозга, аденомы гипофиза, саркомы Капоши, эпидермоидного рака, плоскоклеточного рака, T-клеточной лимфомы, индуцированных условиями внешней среды злокачественных опухолей, включая злокачественные опухоли, индуцированные асбестом, другие B-клеточные злокачественные новообразования и комбинации указанных злокачественных опухолей. В некоторых вариантах осуществления, злокачественная опухоль представляет собой множественную миелому. Конкретная злокачественная опухоль может являться отвечающей на химио- или радиотерапию, или злокачественная опухоль может являться невосприимчивой. Невосприимчивая злокачественная опухоль относится к злокачественной опухоли, не поддающейся хирургическому вмешательству, и злокачественная опухоль либо является изначально неотвечающей на химио- или радиотерапию, либо злокачественная опухоль становится неотвечающей с течением времени.
[176] «Опухоль», в рамках изобретения, относится к аномальной массе ткани, возникающей, когда клетки делятся больше, чем они должны, или не умирают, кода они должны. Опухоли могут являться доброкачественными (не онкогенными), или злокачественными (рак). Опухоли также обозначают как «неоплазия». «Солидная опухоль» представляет собой аномальную массу ткани, которая обычно не содержит кист или жидких областей. Солидная опухоли могут являться доброкачественными (не онкогенными), или злокачественными (рак). Различные типы солидных опухолей названы по типу клеток, формирующих их. Примерами солидных опухолей являются саркомы, и карциномы. И напротив, «жидкие опухоли», например, лимфомы и лейкозы (также обозначенные как злокачественные опухоли крови), как правило, не образуют солидных опухолей.
[177] «Противоопухолевый эффект», в рамках изобретения, относится к биологическому эффекту, который может быть представлен как уменьшение объема опухоли, уменьшение количества клеток опухоли, уменьшение пролиферации клеток опухоли, уменьшение количества метастазов, увеличение общей выживаемости или выживаемости без прогрессирования, увеличение ожидаемой продолжительности жизни, или облегчение различных физиологических симптомов, ассоциированных с опухолью. Противоопухолевый эффект может относится к предотвращению возникновения опухоли, например, для вакцины.
[178] «Цитокин», в рамках изобретения, относится к не являющемуся антителом белку, который высвобождается одной клеткой в ответ на контакт со специфическим антигеном, где цитокин взаимодействует с второй клеткой для опосредования ответа второй клетки. «Цитокин», в рамках изобретения, понимают как обозначающий белки, высвобожденные одной популяцией клеток, которые действуют на другую клетку как межклеточные медиаторы. Цитокин может являться эндогенно экспрессированным клеткой или введенным субъекту. Цитокины могут высвобождать иммуноциты, включая макрофаги, B-клетки, T-клетки и тучные клетки, для распространения иммунного ответа. Цитокины могут индуцировать различные ответы в клетке реципиента. Цитокины могут включать гомеостатические цитокины, хемокины, провоспалительные цитокины, эффекторы и белки острой фазы. Например, гомеостатические цитокины, включая интерлейкин (IL) 7 и IL-15, стимулируют выживаемость и пролиферацию иммуноцитов, и провоспалительные цитокины могут стимулировать воспалительный ответ. Примеры гомеостатических цитокинов включают, но без ограничения, IL-2, IL-4, IL-5, IL-7, IL-10, IL-12p40, IL-12p70, IL-15 и интерферон (IFN) гамма. Примеры провоспалительных цитокинов включают, но без ограничения, IL-1a, IL-1b, IL-6, IL-13, IL-17a, фактор некроза опухоли (TNF)-альфа, TNF-бета, фактор роста фибробластов (FGF) 2, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), растворимую молекулу межклеточной адгезии 1 (sICAM-1), растворимую молекулу адгезии эндотелия сосудов 1 (sVCAM-1), фактор роста эндотелия сосудов (VEGF), VEGF-C, VEGF-D и плацентарный фактор роста (PLGF). Примеры эффекторов включают, но без ограничения, гранзим A, гранзим B, растворимый лиганд Fas (sFasL) и перфорин. Примеры белков острой фазы включают, но без ограничения, C-реактивный белок (CRP) и сывороточный амилоид A (SAA).
[179] «Хемокины» представляют собой тип цитокинов, который опосредует хемотаксис клеток, или направленное движение. Примеры хемокинов включают, но без ограничения, IL-8, IL-16, эотаксин, эотаксин-3, макрофагальный хемокин (MDC или CCL22), моноцитарный хемотактический белок 1 (MCP-1 или CCL2), MCP-4, воспалительный белок макрофагов 1α (MIP-1α, MIP-1a), MIP-1β (MIP-1b), индуцированный гамма-интерфероном белок 10 (IP-10), и хемокин, регулируемый тимусом и активацией (TARC или CCL17).
[180] «Терапевтически эффективное количество», «эффективная доза», «эффективное количество» или «терапевтически эффективная доза» лекарственного средства, например, модифицированных T-клеток с CAR, представляет собой любое количество, которое, при использовании отдельно или в комбинации с другим лекарственным средством, защищает субъекта против начала заболевания или стимулирует регрессию заболевания, доказанную по уменьшению тяжести симптомов заболевания, увеличению частоты и длительности периодов без симптомов заболевания или предотвращению нетрудоспособности или инвалидности из-за поражения заболеванием. Способность лекарственного средства стимулировать регрессию заболевания можно оценивать с использованием множества способов, известных специалисту в данной области, например, у субъектов-людей в ходе клинических исследований, в модельных системах на животных, прогностических для эффективности у человека, или посредством анализа активности средства в анализах in vitro.
[181] Термин «лимфоцит», в рамках изобретения, включает клетки естественные киллеры (NK), T клетки или B-клетки. Клетки NK представляют собой тип цитотоксического (токсичного для клеток) лимфоцита, представляющий собой главный компонент врожденной иммунной системы. Клетки NK отторгают опухоли и клетки, инфицированые вирусами. Они действуют посредством процесса апоптоза или программируемой гибели клеток. Они названы «естественными киллерами», поскольку они не требуют активации, чтобы уничтожать клетки. T-клетки играют главную роль в опосредованном клетками иммунитете (без вовлечения антител). Их T-клеточные рецепторы (TCR) сами отличают их от других типов лимфоцитов. Тимус, специализированный орган иммунной системы, является в первую очередь ответственным за созревание T-клеток. Существует шесть типов T-клеток, а именно: T-клетки-помощники (например, CD4+ клетки), цитотоксические T-клетки (также известные как TC, цитотоксический T-лимфоцит, CTL, T-клетка-киллер, цитолитическая T-клетка, CD8+ T-клетки или T-клетки-киллеры), T-клетки памяти ((i) стволовые T-клетки памяти TSCM, подобно наивным клеткам, являются CD45RO-, CCR7+, CD45RA+, CD62L+ (L-селектин), CD27+, CD28+ и IL-7Rα+, но они также экспрессируют большие количества CD95, IL-2Rβ, CXCR3 и LFA-1, и имеют многочисленные функциональные атрибуты, отличительные для клеток памяти); (ii) клетки центральной памяти TCM экспрессируют L-селектин и CCR7, они секретируют IL-2, но не IFNγ или IL-4, и (iii) эффекторные клетки памяти TEM, однако, не экспрессируют L-селектин или CCR7, но продуцируют эффекторные цитокины, подобные IFNγ и IL-4), регуляторные T-клетки (T-рег, супрессорные T-клетки, или CD4+CD25+ регуляторные T-клетки), T-клетки естественные киллеры (NKT) и гамма-дельта-T-клетки. B-клетки, с другой стороны, играют принципиальную роль в гуморальном иммунитете (с вовлечением антитела). Они образуют антитела и антигены и исполняют роль антигенпредставляющих клеток (APC) и превращаются в B-клетки памяти после активации посредством взаимодействия с антигеном. У млекопитающих, незрелые B-клетки образуются в костном мозге, откуда происходит их название.
[182] Термин «генетически модифицированный», «полученный способом генной инженерии» или «сконструированный» относится к способу модификации генома клетки, включая, но без ограничения, делецию кодирующей или некодирующей области или ее части, или вставку кодирующей области или ее части. В некоторых вариантах осуществления, клетка, подвергаемая модификации, представляет собой лимфоцит, например, T-клетку, которую можно получать либо от пациента, либо от донора. Клетку можно модифицировать для экспрессии экзогенной конструкции, например, такой как химерный рецептор антигена (CAR) или T-клеточный рецептор (TCR), вставленной в геном клетки.
[183] «Иммунный ответ» относится к действию клетки иммунной системы (например, T-лимфоцитов, B-лимфоцитов, клеток естественных киллеров (NK), макрофагов, эозинофилов, тучных клеток, дендритных клеток и нейтрофилов) и растворимых макромолекул, продуцируемых любыми из этих клеток или печенью (включая Ab, цитокины и комплемент), которое приводит к избирательному нацеливанию, связыванию, повреждению, разрушению и/или выведению из организма позвоночного проникающих патогенов, клеток или тканей, инфицированных патогенами, злокачественных или других аномальных клеток, или, в случае аутоиммунитета или патологического воспаления, нормальных клеток или тканей человека.
[184] Термин «избирательно связывает» или «избирательно связывается с», или «избирательное нацеливание», применительно к взаимодействию связывающей молекулы, как определено в настоящем описании, (например, антитела) с ее партнером по связыванию (например, антигеном), относится к способности связывающей молекулы устанавливать различия между представляющим интерес антигеном из вида животного (таким как 4-1BB человека) и другим антигеном из того же самого вида животного (таким как CD40 человека) в данном наборе условий. Говорят, что связывающая 4-1BB молекула избирательно связывается с 4-1BB человека, если она связывается с 4-1BB человека с EC50, составляющей ниже 10 процентов от EC50, с которой она связывается с CD40 человека или CD134 человека, как определено в анализе in vitro.
[185] Термин «иммунотерапия» относится к лечению субъекта, пораженного заболеванием или подверженного риску приобретения заболевания, или страдающего от рецидива заболевания, способом, включающим индукцию, усиление, супрессию или модификацию иным образом иммунного ответа. Примеры иммунотерапии включают, но без ограничения, виды T-клеточной терапии. T-клеточная терапия может включать адоптивную T-клеточную терапию, иммунотерапию инфильтрующими опухоль лимфоцитами (TIL), терапию аутологичными клетками, терапию модифицированными аутологичными клетками (eACT™) и трансплантацию аллогенных T-клеток. Однако, специалисту в данной области известно, что способы предварительной подготовки, описанные в настоящем описании, могут увеличивать эффективность терапии любыми трансплантированными T-клетками. Примеры видов T-клеточной терапии описаны в Публикациях патентов США No. 2014/0154228 и 2002/0006409, Патенте США No. 7741465, Патенте США No. 6319494, Патенте США No. 5728388 и Публикации PCT No. WO 2008/081035.
[186] T-клетки в иммунотерапии могут происходить из любого источника, известного в данной области. Например, T-клетки можно получать посредством дифференцировки in vitro из популяции гематопоэтических стволовых клеток, или T-клетки можно получать от субъекта. T-клетки можно получать, например, из мононуклеарных клеток периферической крови (PBMC), костного мозга, ткани лимфатического узла, пуповинной крови, ткани тимуса, ткани из участка инфекции, асцитов, плеврального выпота, ткани селезенки и опухолей. Кроме того, T-клетки можно получать из одной или нескольких линий T-клеток, доступных в данной области. T-клетки можно также получать из дозы крови, собранной от субъекта с использованием любого количества способов, известных специалисту в данной области, таких как разделение на фиколле™ и/или аферез. Дополнительные способы выделения T-клеток для T-клеточной терапии, описаны в Публикации патента США No. 2013/0287748, полное содержание которой приведено в настоящем описании в качестве ссылки.
[187] Термин «терапия модифицированными аутологичными клетками», который можно сокращенно обозначать как «eACT™», также известный как адоптивный перенос клеток, представляет собой способ, посредством которого собственные T-клетки пациента собирают и затем генетически изменяют для узнавания и нацеливания на один или несколько антигенов, экспрессированных на клеточной поверхности одной или нескольких специфических клеток опухолей или злокачественных новообразований. T-клетки можно модифицировать для экспрессии, например, химерных рецепторов антигена (CAR). Положительные (+) по CAR T-клетки модифицируют для экспрессии внеклеточного одноцепочечного вариабельного фрагмента (scFv) со специфичностью для конкретного антигена опухоли, связанного с частью для передачи внутриклеточных сигналов, содержащей по меньшей мере один костимулирующий домен и по меньшей мере один активирующий домен. scFv CAR можно конструировать для нацеливания, например, на CD19, представляющий собой трансмембранный белок, экспрессируемый клетками в линии B-клеток, включая все нормальные B-клетки и B-клеточные злокачественные новообразования, включая, но без ограничения, диффузную крупноклеточную B-клеточную лимфому (DLBCL), неуточненную, первичную медиастинальную крупноклеточную B-клеточную лимфому, B-клеточную лимфому на поздних стадиях, и DLBCL, развивающуюся из фолликулярной лимфомы, NHL, CLL и не T-клеточный ALL. Примеры терапии и конструкций T-клеток с CAR описаны в Публикациях патентов США No. 2013/0287748, 2014/0227237, 2014/0099309 и 2014/0050708, и полное содержание этих ссылок приведено в настоящем описании в качестве ссылки.
[188] «Пациент», в рамках изобретения, включает любого человека, пораженного злокачественной опухолью (например, лимфомой или лейкозом). Термины «субъект» и «пациент» используют взаимозаменяемо в настоящем описании.
[189] В рамках изобретения, термин «клетка in vitro» относится к любой клетке, которую культивируют ex vivo. В частности, клетка in vitro может включать T-клетку.
[190] Термины «пептид», «полипептид» и «белок» используют взаимозаменяемо, и они относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид содержит по меньшей мере две аминокислоты, и не существует ограничения по максимальному количеству аминокислот, которые может содержать последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислоты, соединенные друг с другом пептидными связями. В рамках изобретения, термин относится как к коротким цепям, которые также общепринятым образом обозначают в данной области, например, как пептиды, олигопептиды и олигомеры, и к более длинным цепям, которые общепринятым образом обозначают в данной области как белки, которых существует множество типов. «Полипептиды» включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки, среди прочих. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды или их комбинацию.
[191] «Стимуляция», в рамках изобретения, относится к первичному ответу, индуцированному посредством связывания стимулирующей молекулы с ее родственным лигандом, где связывание опосредует событие передачи сигнала. «Стимулирующая молекула» представляет собой молекулу на T-клетке (например, комплекс T-клеточного рецептора (TCR)/CD3), который специфически связывается с родственным стимулирующим лигандом, присутствующим на антигенпредставляющей клетке. «Стимулирующий лиганд» представляет собой лиганд, который, когда присутствует на антигенпредставляющей клетке (например, APC, дендритной клетке, B-клетке и т.п.), может специфически связываться со стимулирующей молекулой на T-клетке, таким образом, опосредуя первичный ответ T-клетки, включая, но без ограничения, активацию, инициацию иммунного ответа, пролиферацию и т.п. Стимулирующие лиганды включают, но без ограничения, антитело против CD3, молекулу MHC класса I, нагруженную пептидом, суперагонистическое антитело против CD2 и суперагонистическое антитело против CD28.
[192] «Костимулирующий сигнал», в рамках изобретения, относится к сигналу, который, в комбинации с первичным сигналом (сигналом 1), таким как связывание и/или активация TCR/CD3, приводит к ответу T-клеток, такому как, но без ограничения, пролиферация и/или повышающая регуляция или понижающая регуляция ключевых молекул.
[193] «Костимулирующий лиганд», в рамках изобретения, включает молекулу на антигенпредставляющей клетке, которая специфически связывает родственную костимулирующую молекулу на T-клетке. Связывание костимулирующего лиганда обеспечивает сигнал, опосредующий ответ T-клеток, включая, но без ограничения, пролиферацию, активацию, дифференцировку и т.п. Костимулирующий лиганд индуцирует сигнал, который, в дополнение к первичному сигналу, предоставленному стимулирующей молекулой, например, посредством связывания комплекса T-клеточный рецептор (TCR)/CD3 с молекулой главного комплекса гистосовместимости (MHC), нагруженной пептидом. Костимулирующий лиганд может включать, но без ограничения, 3/TR6, лиганд 4-1BB, агонист или антитело, связывающие рецептор Toll-лиганда, B7-1 (CD80), B7-2 (CD86), лиганд CD30, CD40, CD7, CD70, CD83, медиатор проникновения вируса герпеса (HVEM), человеческий лейкоцитарный антиген G (HLA-G), ILT4, иммуноглобулиноподобный транскрипт (ILT) 3, индуцируемый костимулирующий лиганд (ICOS-L), молекулу межклеточной адгезии (ICAM), лиганд, специфически связывающий B7-H3, рецептор лимфотоксина бета, родственный цепи MHC класса I белок A (MICA), родственный цепи MHC класса I белок B (MICB), лиганд OX40, PD-L2 или лиганд программируемой гибели (PD) L1. Костимулирующий лиганд включает, без ограничения, антитело, специфически связывающее костимулирующую молекулу, присутствующую на T-клетке, такую как, но без ограничения, 4-1BB, B7-H3, CD2, CD27, CD28, CD30, CD40, CD7, ICOS, лиганд, специфически связывающий CD83, ассоциированный с функцией лимфоцитов антиген-1 (LFA-1), рецептор C клетки естественного киллера (NKG2C), OX40, PD-1 или член 14 суперсемейства фактора некроза опухоли (TNFSF14 или LIGHT).
[194] «Костимулирующая молекула» является способной опосредовать костимулирующий ответ T-клеток, такой как, но без ограничения, пролиферация. Костимуляцию часто обозначают как «сигнал 2». Костимулирующие молекулы включают, но без ограничения, 4-1BB/CD137, B7-H3, BAFFR, BLAME (SLAMF8), BTLA, CD 33, CD 45, CD100 (SEMA4D), CD103, CD134, CD137, CD154, CD16, CD160 (BY55), CD18, CD19, CD19a, CD2, CD22, CD247, CD27, CD276 (B7-H3), CD28, CD29, CD3 (альфа; бета; дельта; эпсилон; гамма; дзета), CD30, CD37, CD4, CD4, CD40, CD49a, CD49D, CD49f, CD5, CD64, CD69, CD7, CD80, CD83 лиганд, CD84, CD86, CD8-альфа, CD8-бета, CD9, CD96 (Tactile), CDl-la, CDl-lb, CDl-lc, CDl-ld, CDS, CEACAM1, CRT AM, DAP-10, DNAM1 (CD226), рецептор Fc гамма, GADS, GITR, HVEM (LIGHTR), IA4, ICAM-1, ICAM-1, ICOS, Ig альфа (CD79a), IL2R бета, IL2R гамма, IL7R альфа, интегрин, ITGA4, ITGA4, ITGA6, ITGAD, ITGAE, ITGAL, ITGAM, ITGAX, ITGB2, ITGB7, ITGBl, KIRDS2, LAT, LFA-1, LFA-1, LIGHT, LIGHT (член 14 суперсемейства фактора некроза опухоли; TNFSF14), LTBR, Ly9 (CD229), ассоциированный с функцией лимфоцитов антиген-1 (LFA-1 (CDl la/CD18), молекулу MHC класса I, NKG2C, NKG2D, NKp30, NKp44, NKp46, NKp80 (KLRF1), OX40, PAG/Cbp, PD-1, PSGL1, SELPLG (CD162), сигнальную молекулу активации лимфоцитов, SLAM (SLAMF1; CD150; IPO-3), SLAMF4 (CD244; 2B4), SLAMF6 (NTB-A; Lyl08), SLAMF7, SLP-76, TNF, TNFr, TNFR2, рецептор Toll-лиганда, TRANCE/RANKL, VLA1 или VLA-6, или их фрагменты, укороченные варианты или комбинации.
[195] «Костимулирующий домен», в рамках изобретения, относится к всей или части (фрагменту, укороченным вариантам) или их комбинациям, костимулирующей молекулы, сконструированной в составе CAR. В некоторых вариантах осуществления, костимулирующий домен происходит из 4-1BB/CD137, B7-H3, BAFFR, BLAME (SLAMF8), BTLA, CD 33, CD 45, CD100 (SEMA4D), CD103, CD134, CD137, CD154, CD16, CD160 (BY55), CD18, CD19, CD19a, CD2, CD22, CD247, CD27, CD276 (B7-H3), CD28, CD29, CD3 (альфа; бета; дельта; эпсилон; гамма; дзета), CD30, CD37, CD4, CD4, CD40, CD49a, CD49D, CD49f, CD5, CD64, CD69, CD7, CD80, лиганда CD83, CD84, CD86, CD8-альфа, CD8-бета, CD9, CD96 (Tactile), CDl-la, CDl-lb, CDl-lc, CDl-ld, CDS, CEACAM1, CRT AM, DAP-10, DNAM1 (CD226), рецептора Fc гамма, GADS, GITR, HVEM (LIGHTR), IA4, ICAM-1, ICAM-1, ICOS, Ig альфа (CD79a), IL2R бета, IL2R гамма, IL7R альфа, интегрина, ITGA4, ITGA4, ITGA6, ITGAD, ITGAE, ITGAL, ITGAM, ITGAX, ITGB2, ITGB7, ITGBl, KIRDS2, LAT, LFA-1, LFA-1, LIGHT, LIGHT (члена 14 суперсемейства фактора некроза опухоли; TNFSF14), LTBR, Ly9 (CD229), ассоциированного с функцией лимфоцитов антигена-1 (LFA-1 (CDl la/CD18), молекулы MHC класса I, NKG2C, NKG2D, NKp30, NKp44, NKp46, NKp80 (KLRF1), OX40, PAG/Cbp, PD-1, PSGL1, SELPLG (CD162), сигнальной молекулы активации лимфоцитов, SLAM (SLAMF1; CD150; IPO-3), SLAMF4 (CD244; 2B4), SLAMF6 (NTB-A; Lyl08), SLAMF7, SLP-76, TNF, TNFr, TNFR2, рецептора Toll-лиганда, TRANCE/RANKL, VLA1 или VLA-6, или их фрагментов, укороченных вариантов или комбинаций. В некоторых вариантах осуществления, костимулирующий домен происходит из CD28, 4-1BB, CD8, CD16, ICOS.
[196] Термины «снижение» и «уменьшение» используют взаимозаменяемо в настоящем описании, и они показывают любое изменение, меньшее исходного. «Снижение» и «уменьшение» представляют собой относительные термины, требующие сравнения между измерениями до и после. «Снижение» и «уменьшение» включают случаи полного истощения.
[197] «Лечение» или «обработка» субъекта относится к любому типу вмешательства или процесса, которому подвергают субъекта, или к введению действующего вещества субъекту, с целью обращения, облегчения, смягчения, ингибирования, замедления или предотвращения начала, прогрессирования, развития, тяжести или рецидива симптома, осложнения или состояния, или биохимических показателей, ассоциированных с заболеванием. В некоторых вариантах осуществления, «лечение» или «обработка» включает частичную ремиссию. В другом варианте осуществления, «лечение» или «обработка» включает полную ремиссию.
[198] Термины «антитело против 4-1BB», «антитело против CD137» и «антитело против 4-1BB (CD137)» используют взаимозаменяемо, и они относятся к антителу, как определено в настоящем описании, способному связываться с рецептором 4-1BB (CD137) человека. Термины «4-1BB» и «рецептор 4-1BB» используют взаимозаменяемо в настоящем описании, и они включают рецептор 4-1BB человека, так же как его варианты, изоформы и видовые гомологи. Соответственно, связывающая молекула, как определено и описано в настоящем описании, может также связывать 4-1BB из вида, отличного от человека. В других случаях, связывающая молекула может являться полностью специфической для 4-1BB человека и может не иметь межвидовой или других типов перекрестной реакционной способности. Одним примером такого антитела против 4-1BB является утомилумаб (PF-05082566), разработанный Pfizer Inc. Другим примером антитела против 4-1BB является урелумаб (BMS-663513).
[199] В рамках изобретения, следуют общепринятому использованию двадцати общепринятых аминокислот и их сокращенных обозначений. См. Immunology-A Synthesis (2nd Edition, E. S. Golub и D. R. Gren, Eds., Sinauer Associates, Sunderland, Mass. (1991)).
[200] Различные аспекты изобретения описаны более подробно в следующих подразделах.
Химерные рецепторы антигенов
[201] Химерные рецепторы антигенов (CAR или CAR-T) представляют собой генетически модифицированные рецепторы. Эти сконструированные рецепторы можно легко вставлять в иммуноциты и экспрессировать в иммуноцитах, включая T-клетки, в соответствии со способами, известными в данной области. С использованием CAR, один рецептор можно программировать как для узнавания специфического антигена, так и, после связывания с этим антигеном, для активации иммуноцита для атаки и разрушения клетки, несущий этот антиген. Когда эти антигены существуют на клетках опухолей, иммуноцит, экспрессирующий CAR, может нацеливаться на клетку опухоли и уничтожать ее.
Модифицированные T-клетки и их применение
[202] Настоящее изобретение относится к иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками для лечения пациентов с рецидивирующей или невосприимчивой крупноклеточной B-клеточной лимфомой после двух или более линий системной терапии, включая диффузную крупноклеточную B-клеточную лимфому (DLBCL), неуточненную, первичную медиастинальную крупноклеточную B-клеточную лимфому, B-клеточную лимфому на поздних стадиях, и DLBCL, развивающуюся из фолликулярной лимфомы. В некоторых вариантах осуществления, нацеленная на CD19 иммунотерапия является аутологичной. В некоторых вариантах осуществления, нацеленная на CD19 иммунотерапия является аллогенной. В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными аутологичными T-клетками представляет собой аксикабтаген цилолейкел (Axi-cel™, YESCARTA™).
[203] Клетку по настоящему изобретению можно получать посредством T-клеток, полученных от субъекта. T-клетки можно получать, например, из мононуклеарных клеток периферической крови, костного мозга, ткани лимфатического узла, пуповинной крови, ткани тимуса, ткани из участка инфекции, асцитов, плеврального выпота, ткани селезенки и опухолей. Кроме того, T-клетки можно получать из одной или нескольких линий T-клеток, доступных в данной области. T-клетки можно также получать из дозы крови, собранной от субъекта, с использованием любого количества способов, известных специалисту в данной области, таких как разделение на фиколле™ и/или аферез. В некоторых вариантах осуществления, клетки, собранные посредством афереза, промывают для удаления фракции плазмы и для помещения клеток в подходящий буфер или среду для последующих стадий переработки. В некоторых вариантах осуществления, клетки промывают с использованием PBS. Как известно, можно использовать стадию промывки, например, с использованием полуавтоматической проточной центрифуги, например, устройства для переработки клеток CobeTM 2991, Baxter CytoMateTM, или т.п. В некоторых вариантах осуществления, промытые клетки ресуспендируют в одном или нескольких биосовместимых буферах, или другом солевом растворе, с буфером или без. В некоторых вариантах осуществления, нежелательные компоненты из образца после афереза удаляют. Дополнительные способы выделения T-клеток для T-клеточной терапии описаны в Публикации патента США No. 2013/0287748, полное содержание которой приведено в настоящем описании в качестве ссылки.
[204] В некоторых вариантах осуществления, T-клетки выделяют из PBMC посредством лизиса эритроцитов и истощения моноцитов, например, с использованием центрифугирования в градиенте плотности перколлаTM. В некоторых вариантах осуществления, специфическую субпопуляцию T-клеток, например, CD4+, CD8+, CD28+, CD45RA+, и CD45RO+, далее выделяют посредством способов положительного или отрицательного отбора, известных в данной области. Например, обогащение популяции T-клеток посредством отрицательного отбора можно осуществлять с использованием комбинации антител, нацеленных на поверхностные маркеры, уникальные для подвергаемых отрицательному отбору клеток. В некоторых вариантах осуществления, можно использовать сортировку и/или отбор клеток посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, в которых используют коктейль моноклональных антител, нацеленных на маркеры клеточной поверхности, присутствующие на подвергаемых отрицательному отбору клетках. Например, для обогащения CD4+ клеток посредством отрицательного отбора, коктейль моноклональных антител, как правило, включает антитела против CD8, CD11b, CD14, CD16, CD20 и HLA-DR. В некоторых вариантах осуществления, проточную цитометрию и сортировку клеток используют для выделения представляющих интерес популяций клеток для использования по настоящему изобретению.
[205] В некоторых вариантах осуществления, PBMC используют непосредственно для генетической модификации с использованием иммуноцитов (таких как CAR), с использованием способов, как описано в настоящем описании. В некоторых вариантах осуществления, после выделения PBMC, далее выделяют T-лимфоциты, и как цитотоксические T-лимфоциты, так и T-лимфоциты-помощники, сортируют на субпопуляции наивных T-клеток, T-клеток памяти и эффекторных T-клеток либо до, либо после генетической модификации и/или размножения.
[206] В некоторых вариантах осуществления, CD8+ клетки далее сортируют на наивные клетки, клетки центральной памяти и эффекторные клетки посредством идентификации антигенов клеточной поверхности, ассоциированных с каждым из этих типов CD8+ клеток. В некоторых вариантах осуществления, экспрессия фенотипических маркеров T-клеток центральной памяти включает CCR7, CD3, CD28, CD45RO, CD62L и CD127, и они являются отрицательными по гранзиму B. В некоторых вариантах осуществления, T-клетки центральной памяти представляют собой CD8+, CD45RO+, и CD62L+ T-клетки. В некоторых вариантах осуществления, эффекторные T-клетки являются отрицательными по CCR7, CD28, CD62L и CD127, и положительными по гранзиму B и перфорину. В некоторых вариантах осуществления, CD4+ T-клетки далее сортируют на субпопуляции. Например, CD4+ T-клетки-помощники можно сортировать на наивные клетки, клетки центральной памяти и эффекторные клетки посредством идентификации популяций клеток, имеющих антигены клеточной поверхности.
[207] Подходящую последовательность для использования по изобретению можно обнаружить в GenBank под no. депозита HM852952.1 (https://www.ncbi.nlm.nih.gov/nuccore/305690546). Кроме того, способы получения и/или промышленного получения T-клеток, экспрессирующих химерные рецепторы антигенов, описаны, например, в Публикации PCT No. WO2015120096, полное содержание которой приведено в настоящем описании в качестве ссылки. В некоторых вариантах осуществления, иммуноциты, например, T-клетки, генетически модифицируют после выделения с использованием известных способов, или иммуноциты подвергают активации и размножению (или дифференцировке, в случае предшественников) in vitro до генетической модификации. В другом варианте осуществления, иммуноциты, например, T-клетки, генетически модифицируют с использованием химерных рецепторов антигенов, описанных в настоящем описании (например, трансдуцируют с использованием вирусного вектора, содержащего одну или несколько нуклеотидных последовательностей, кодирующих CAR), и затем активируют и/или размножают in vitro. Дополнительные способы активации и размножения T-клеток известны в данной области и описаны, например, в Патентах США No. 6905874; 6867041; и 6797514; и Публикации PCT No. WO 2012/079000, полное содержание которых приведено в настоящем описании в качестве ссылки. Как правило, такие способы включают приведение PBMC или выделенных T-клеток в контакт со стимулирующим средством и костимулирующим средством, такими как антитела против CD3 и против CD28, как правило, связанными с бусиной или другой поверхностью, в среде для культивирования с соответствующими цитокинами, такими как IL-2. Антитела против CD3 и против CD28, связанные с одной и той же бусиной, служат в качестве «суррогатной» антигенпредставляющей клетки (APC). Одним примером является система Dynabeads®, система активатора/стимулятора CD3/CD28 для физиологической активации T-клеток человека. В других вариантах осуществления, T-клетки подвергают активации и стимуляции пролиферации с использованием фидерных клеток и подходящих антител и цитокинов, с использованием таких способов, как описанные в Патентах США No. 6040177 и 5827642 и Публикации PCT No. WO 2012/129514, полное содержание которых приведено в настоящем описании в качестве ссылки.
[208] В некоторых вариантах осуществления, T-клетки получают от субъекта-донора. В некоторых вариантах осуществления, субъект-донор представляет собой пациента-человека, пораженного злокачественной опухолью или опухолью. В некоторых вариантах осуществления, субъект-донор представляет собой пациента-человека, не пораженного злокачественной опухолью или опухолью.
[209] В некоторых вариантах осуществления, композиция содержит фармацевтически приемлемый носитель, разбавитель, солюбилизатор, эмульгатор, консервант и/или адъювант. В некоторых вариантах осуществления, композиция содержит наполнитель.
[210] В некоторых вариантах осуществления, композицию выбирают для парентеральной доставки, для ингаляции или для доставки через пищеварительный тракт, например, перорально. Получение таких фармацевтически приемлемых композиций находится в компетенции специалиста в данной области. В некоторых вариантах осуществления, буферы используют для поддержания композиции при физиологическом pH или при немного более низком pH, как правило, в диапазоне pH от приблизительно 5 до приблизительно 8. В некоторых вариантах осуществления, когда предусмотрено парентеральное введение, композиция находится в форме апирогенного, парентерально приемлемого водного раствора, содержащего композицию, описанную в настоящем описании, с дополнительными лекарственными средствами или без них, в фармацевтически приемлемом носителе. В некоторых вариантах осуществления, носитель для парентеральной инъекции представляет собой стерильную дистиллированную воду, в которой композицию, описанную в настоящем описании, с по меньшей мере одним дополнительным лекарственным средством или без них, составляют в форме стерильного, изотонического раствора, соответствующим образом консервированного. В некоторых вариантах осуществления, получение препарата включает составление желательной молекулы с полимерными соединениями (такими как полимолочная кислота или полигликолевая кислота), бусинами или липосомами, обеспечивающими контролируемое или замедленное высвобождение продукта, который затем подлежит доставке посредством инъекции-депо. В некоторых вариантах осуществления, имплантируемые устройства для доставки лекарственных средств используют для введения желательной молекулы.
[211] В некоторых вариантах осуществления, способы лечения злокачественной опухоли у нуждающегося в этом субъекта включают T-клеточную терапию. В некоторых вариантах осуществления, T-клеточная терапия, описанная в настоящем описании, представляет собой терапию модифицированными аутологичными клетками (eACT™). В соответствии с этим вариантом осуществления, способ может включать сбор клеток крови от пациента. Выделенные клетки крови (например, T-клетки) можно затем модифицировать для экспрессии CAR или TCR, описанных в настоящем описании. В конкретном варианте осуществления, T-клетки с CAR или T-клетки с TCR вводят пациенту. В некоторых вариантах осуществления, T-клетки с CAR или T-клетки с TCR лечат опухоль или злокачественную опухоль у пациента. В некоторых вариантах осуществления T-клетки с CAR или T-клетки с TCR уменьшают размер опухоли или злокачественной опухоли.
[212] В некоторых вариантах осуществления, донорские T-клетки для использования в T-клеточной терапии получают от пациента (например, для аутологичной T-клеточной терапии). В других вариантах осуществления, донорские T-клетки для использования в T-клеточной терапии получают от субъекта, не являющегося пациентом. T-клетки можно вводить в терапевтически эффективном количестве. Например, терапевтически эффективное количество T-клеток может составлять по меньшей мере приблизительно 104 клеток, по меньшей мере приблизительно 105 клеток, по меньшей мере приблизительно 106 клеток, по меньшей мере приблизительно 107 клеток, по меньшей мере приблизительно 108 клеток, по меньшей мере приблизительно 109 или по меньшей мере приблизительно 1010. В другом варианте осуществления, терапевтически эффективное количество T-клеток составляет приблизительно 104 клеток, приблизительно 105 клеток, приблизительно 106 клеток, приблизительно 107 клеток или приблизительно 108 клеток. В некоторых вариантах осуществления, терапевтически эффективное количество T-клеток с CAR составляет приблизительно 2 × 106 клеток/кг, приблизительно 3 × 106 клеток/кг, приблизительно 4 × 106 клеток/кг, приблизительно 5 × 106 клеток/кг, приблизительно 6 × 106 клеток/кг, приблизительно 7 × 106 клеток/кг, приблизительно 8 × 106 клеток/кг, приблизительно 9 × 106 клеток/кг, приблизительно 1 × 107 клеток/кг, приблизительно 2 × 107 клеток/кг, приблизительно 3 × 107 клеток/кг, приблизительно 4 × 107 клеток/кг, приблизительно 5 × 107 клеток/кг, приблизительно 6 × 107 клеток/кг, приблизительно 7 × 107 клеток/кг, приблизительно 8 × 107 клеток/кг или приблизительно 9 × 107 клеток/кг. В некоторых вариантах осуществления, терапевтически эффективное количество положительных по CAR жизнеспособных T-клеток составляет между приблизительно 1 × 106 и приблизительно 2 × 106 положительных по CAR жизнеспособных T-клеток на кг массы тела, вплоть до максимальной дозы приблизительно 1×108 положительных по CAR жизнеспособных T-клеток.
Способы лечения
[213] Способы, описанные в настоящем описании, можно использовать для лечения злокачественной опухоли у субъекта, уменьшения размера опухоли, уничтожения клеток опухоли, предотвращения пролиферации клеток опухоли, предотвращения роста опухоли, выведения опухоли из организма пациента, предотвращения рецидива опухоли, предотвращения метастазирования опухоли, индукции ремиссии у пациента или любой их комбинации. В некоторых вариантах осуществления, способы индуцируют полный ответ. В других вариантах осуществления, способы индуцируют частичный ответ.
[214] Настоящее изобретение также относится к иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) для использования в описанных способах лечения; а также к использованию иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) в изготовлении лекарственного средства для использования в описанных способах лечения.
[215] Злокачественные опухоли, которые можно лечить, включают опухоли, которые являются не васкуляризированными, еще не в основном васкуляризированными или васкуляризированными. Злокачественная опухоль может также включать солидные или несолидные опухоли. В некоторых вариантах осуществления, злокачественная опухоль представляет собой гематологическую злокачественную опухоль. В некоторых вариантах осуществления, злокачественная опухоль состоит из белых кровяных клеток. В других вариантах осуществления, злокачественная опухоль состоит из плазматических клеток. В некоторых вариантах осуществления, злокачественная опухоль представляет собой лейкоз, лимфому или миелому. В некоторых вариантах осуществления, злокачественная опухоль представляет собой острый лимфобластный лейкоз (ALL) взрослых и/или детей (включая не T-клеточный ALL), связанную со СПИД лимфому, положительную по ALK крупноклеточную B-клеточную лимфому, острый лифмоидный лейкоз (ALL), и гемофагоцитарный лимфогистиоцитоз (HLH)), B-клеточный пролимфоцитарный лейкоз, B-клеточный острый лифмоидный лейкоз («BALL»), неоплазию бластных плазмоцитоидных дендритных клеток, лимфому Беркитта, хронический лимфоцитарный лейкоз (CLL), хронический миелогенный лейкоз (CML), хронический миелоидный лейкоз (CML), хронический или острый гранулематоз, хронический или острый лейкоз, классическую лимфому Ходжкина, невосприимчивую диффузную крупноклеточную B-клеточную лимфому, диффузную крупноклеточную B-клеточную лимфому (DLBCL), фолликулярную лимфому, фолликулярную лимфому (FL), волосатоклеточный лейкоз, гемофагоцитарный синдром (синдром активации макрофагов (MAS), болезнь Ходжкина, внутрисосудистую крупноклеточную B-клеточную лимфому, крупноклеточную гранулему, крупноклеточную B-клеточную лимфому, возникающую при ассоциированной с HHV8 многоочаговой болезни Кастлмана, лимфогранулематоз, лимфоплазматическую лимфому, нарушение адгезии лейкоцитов, злокачественные лимфопролиферативные состояния, лимфому лимфоидной ткани слизистых оболочек (MALT), лимфому из клеток мантийной зоны (MCL), лимфому из клеток маргинальной зоны (MZL), моноклональную гаммапатию неустановленной этиологии (MGUS), множественную миелому, миелодисплазию и миелодиспластический синдром (MDS), миелоидные заболевания, включая, но без ограничения, острый миелоидный лейкоз (AML), узловую B-клеточную лимфому из клеток маргинальной зоны (NMZL), нодулярную лимфому Ходжкина с лимфоидным преобладанием, неходжскинскую лимфому (NHL), нарушения пролиферации плазматических клеток (например, бессимптомную миелому (вялотекущую множественную миелому или невыраженную миелому), плазмобластную лимфому, неоплазию плазмацитоидных дендритных клеток, плазмацитомы (например, дискразию плазматических клеток; солитарную миелому; солитарную плазмацитому; экстрамедуллярную плазмацитому; и множественную плазмацитому), синдром POEMS (синдром Кроу-Фукаса; болезнь Такатсуки; синдром PEP), первичную лимфому центральной нервной системы, первичную выпотную лимфому, первичную медиастинальную крупноклеточную B-клеточную лимфому (PMBCL), мелкоклеточную или крупноклеточную фолликулярную лимфому, лимфому маргинальной зоны селезенки (SMZL), системный амилоидный амилоидоз легкой цепи, T-клеточный острый лифмоидный лейкоз («TALL»), T-клеточную лимфому, трансформированную фолликулярную лимфому, макроглобулинемию Вальденстрема или их комбинацию.
[216] В некоторых вариантах осуществления, злокачественная опухоль представляет собой острый лимфобластный лейкоз (ALL), связанную со СПИД лимфому, положительную по ALK крупноклеточную B-клеточную лимфому, лимфому Беркитта, хронический лимфоцитарный лейкоз, CLL), классическую лимфому Ходжкина, диффузную крупноклеточную B-клеточную лимфому (DLBCL), первичную медиастинальную крупноклеточную B-клеточную лимфому (PMBCL), Фолликулярную лимфому, внутрисосудистую крупноклеточную B-клеточную лимфому, крупноклеточную B-клеточную лимфому, возникающую при ассоциированной с HHV8 многоочаговой болезни Кастлмана, лимфогранулематоз, лимфоплазматическую лимфому, лимфому из клеток мантийной зоны (MCL), B-клеточную лимфому из клеток маргинальной зоны (MZL), лимфому лимфоидной ткани слизистых оболочек (MALT), узловую B-клеточную лимфому из клеток маргинальной зоны (NMZL), нодулярную лимфому Ходжкина с лимфоидным преобладанием, неходжскинскую лимфому, плазмобластную лимфому, первичную лимфому центральной нервной системы, первичную выпотную лимфому, лимфому маргинальной зоны селезенки (SMZL) и макроглобулинемию Вальденстрема, рецидивирующую или невосприимчивую крупноклеточную B-клеточную лимфому, диффузную крупноклеточную B-клеточную лимфому (DLBCL), неуточненную, B-клеточную лимфому на поздних стадиях и DLBCL, развивающуюся из фолликулярной лимфомы.
[217] В некоторых вариантах осуществления, злокачественная опухоль представляет собой миелому. В некоторых вариантах осуществления, злокачественная опухоль представляет собой множественную миелому. В некоторых вариантах осуществления, злокачественная опухоль представляет собой лейкоз. В некоторых вариантах осуществления, злокачественная опухоль представляет собой острый миелоидный лейкоз.
[218] Связывающие молекулы и фармацевтические композиции, представленные по настоящему изобретению, можно использовать для терапевтических, диагностических или других целей, таких как усиление иммунного ответа, лечение злокачественной опухоли, усиление эффективности комбинированной терапии, усиление эффективности вакцины или лечение аутоиммунных заболеваний. В некоторых аспектах, настоящее описание относится к способу лечения нарушения у млекопитающего, включающему введение нуждающемуся в лечении человеку терапевтически эффективного количества нацеленных на CD19 генетически модифицированных T-клеток для иммунотерапии и агониста 4-1BB.
[219] В некоторых вариантах осуществления, нарушение представляет собой злокачественную опухоль. Множество злокачественных опухолей, в которые вовлечен 4-1BB, независимо от того, злокачественные они или доброкачественные и первичные они или вторичные, можно лечить или предотвращать с использованием способа, представленного в настоящем описании. Примеры таких злокачественных опухолей включают злокачественные опухоли легкого, такие как бронхогенная карцинома (например, плоскоклеточная карцинома, мелкоклеточная карцинома, крупноклеточная карцинома, и аденокарцинома), альвеолярноклеточная карцинома, аденома бронха, хондроматозная гамартома (незлокачественная) и саркома (злокачественная); злокачественные опухоли сердца, такие как миксома, фибромы и рабдомиомы; злокачественные опухоли кости, такие как остеохондромы, хондромы, хондробластомы, хондромиксоидные фибромы, остеоидные остеомы, гигантоклеточные опухоли, хондросаркома, множественная миелома, остеосаркома, фибросаркомы, злокачественная фиброзные гистиоцитомы, опухоль Юинга (саркома Юинга) и ретикулоклеточная саркома; злокачественную опухоль мозга, такую как глиомы (например, мультиформная глиобластома), анапластические астроцитомы, астроцитомы, олигодендроглиомы, медуллобластомы, хордома, шванномы, эпендимомы, менингиомы, аденома гипофиза, пинеалома, остеомы, гемангиобластомы, краниофарингиомы, хордомы, герминомы, тератомы, дермоидные кисты и ангиомы; злокачественные опухоли пищеварительной системы, такие как лейомиома, эпидермоидная карцинома, аденокарцинома, лейомиосаркома, аденокарциномы желудка, липомы кишечника, нейрофибромы кишечника, фибромы кишечника, полипы толстого кишечника и колоректальные злокачественные опухоли; злокачественные опухоли печени, такие как печеночноклеточные аденомы, гемангиома, печеночноклеточная карцинома, фиброламеллярная карцинома, холангиокарцинома, гепатобластома и ангиосаркома; злокачественные опухоли почки, такие как аденокарцинома почки, почечноклеточный рак, гипернефрома и переходноклеточная карцинома почечной лоханки; злокачественные опухоли мочевого пузыря; гематологические злокачественные опухоли, такие как острый лимфоцитарный (лимфобластный) лейкоз, острый миелоидный (миелоцитарный, миелогенный, миелобластный, миеломоноцитарный) лейкоз, хронический лимфоцитарный лейкоз (например, синдром Сезари и волосатоклеточный лейкоз), хронический миелоцитарный (миелоидный, миелогенный, гранулоцитарный) лейкоз, лимфома Ходжкина, неходжскинская лимфома, B-клеточная лимфома, фунгоидный микоз и миелопролиферативные нарушения (включая такие миелопролиферативные нарушения, как истинная полицитемия, миелофиброз, тромбоцитемия и хронический миелоцитарный лейкоз); злокачественные опухоли кожи, такие как базальноклеточная карцинома, плоскоклеточная карцинома, меланома, саркома Капоши и болезнь Педжета; злокачественные опухоли головы и шеи; офтальмологические злокачественные опухоли, такие как ретинобластома и внутриглазная меланокарцинома; злокачественные опухоли мужской репродуктивной системы, такие как доброкачественная гиперплазия предстательной железы, рак предстательной железы и рак яичка (например, семинома, тератома, эмбриональная карцинома и хориокарцинома); рак молочной железы; злокачественные опухоли женской репродуктивной системы, такие как рак тела матки (карцинома эндометрия), рак шейки матки (цервикальная карцинома), злокачественная опухоль яичника (карцинома яичника), карцинома вульвы, карцинома влагалища, злокачественная опухоль фаллопиевых труб и пузырный занос; рак щитовидной железы (включая папиллярный, фолликулярный, анапластический или медуллярный рак); феохромоцитомы (надпочечника); незлокачественный рост паращитовидных желез; злокачественные опухоли поджелудочной железы; и гематологические злокачественные опухоли, такие как лейкозы, миеломы, неходжскинские лимфомы и лимфома Ходжкина.
[220] В некоторых вариантах осуществления, способы дополнительно включают введение одного или нескольких химиотерапевтических средств. В некоторых вариантах осуществления, химиотерапевтическое средство или средства представляют собой избранное противолимфоцитарное химиотерапевтическое средство (для предварительной подготовки). Преимущественные режимы подготовительного лечения указаны например, в Патенте США No. 9855298, вместе с коррелирующими преимущественными биомаркерами, описанными в Патентной заявке PCT PCT/US2016/034885, полное содержание которой приведено в настоящем описании в качестве ссылки. В ней описаны, например, способы предварительной подготовки нуждающегося в этом пациента для T-клеточной терапии, включающие введение пациенту указанных преимущественных доз циклофосфамида (ЦИТОКСАНАTM) (между приблизительно 200 мг/м2/сутки и приблизительно 2000 мг/м2/сутки) и указанных доз флударабина (ФЛУДАРАTM) (между приблизительно 20 мг/м2/сутки и приблизительно 900 мг/м2/сутки). Один такой предпочтительный режим дозирования включает лечение пациента, включающее введение пациенту ежесуточно приблизительно 500-600 мг/м2/сутки циклофосфамида и приблизительно 30 мг/м2/сутки флударабина в течение трех суток до введения терапевтически эффективного количества модифицированных T-клеток пациенту. Предпочтительные дозы клеток включают, но без ограничения, от 1×106 до приблизительно 5×106 модифицированных CART-клеток/кг.
[221] В некоторых вариантах осуществления, каждое из антигенсвязывающей молекулы (такой как агонист 4-1BB (CD137)), трансдуцированных (или иным образом модифицированных) клеток (например, с CAR) и химиотерапевтического средства вводят в количестве, эффективном для лечения заболевания или состояния у субъекта.
[222] В некоторых вариантах осуществления, композиции, содержащие экспрессирующие CAR иммуноэффекторные клетки, описанные в настоящем описании, можно вводить в сочетании с любым количеством химиотерапевтических средств. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин ресум; азотистые иприты, такие как хлорамбуцил, хлолрнафазин, хлорофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид мехлорэтаминоксида, мелфалан, новэмбихин, фенестерин, преднемустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, сактиномицин, калихеамицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марселломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калюстерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; средства, подавляющие функции надпочечников, такие как аминоглутетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демекольцин; диазиквон; элформитин; ацетат эллиптиния; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK®; разоксан; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2, 2',2''-трихлортриэтиламин; уретан; виндезин; декарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепа; таксоиды, например, паклитаксел (ТАКСОЛTM, Bristol-Myers Squibb) и доксетаксел (ТАКСОТЕР®, Rhone-Poulenc Rorer); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митомицин C; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; CPT-11; ингибитор топоизомеразы RFS2000; дифторметилорнитин (DMFO); производные ретиноевой кислоты, такие как таргретинTM (бексаротен), панретинTM, (алитретиноин); ОНТАКTM (денилейкин дифтитокс); эсперамицины; капецитабин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных. В некоторых вариантах осуществления, композиции, содержащие экспрессирующие CAR и/или TCR иммуноэффекторные клетки, описанные в настоящем описании, можно вводить в сочетании с антигормональным средством, которое действует для регуляции или ингибирования действия гормонов на опухоли, таким как антиэстрогены, включая, например, тамоксифен, ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (фарестон); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, леупролид и гозерелин; и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанных. Комбинации химиотерапевтических средств также вводят, когда это целесообразно, включая, но без ограничения, CHOP, т.е., циклофосфамид (цитоксан®), доксорубицин (гидроксидоксорубицин), винкристин (онковин®) и преднизон.
[223] В некоторых вариантах осуществления, химиотерапевтическое средство вводят одновременно, последовательно в любом порядке или отдельно с проведением иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и/или агонистом 4-1BB. В некоторых вариантах осуществления, химиотерапевтическое средство вводят одновременно или в пределах одной недели после проведения иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и/или агонистом 4-1BB. В других вариантах осуществления, химиотерапевтическое средство вводят от приблизительно 1 до приблизительно 4 недель или от приблизительно 1 недели до приблизительно 1 месяца, от приблизительно 1 недели до приблизительно 2 месяцев, от приблизительно 1 недели до приблизительно 3 месяцев, от приблизительно 1 недели до приблизительно 6 месяцев, от приблизительно 1 недели до приблизительно 9 месяцев или от приблизительно 1 недели до приблизительно 12 месяцев после проведения иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и/или агонистом 4-1BB. В некоторых вариантах осуществления, химиотерапевтическое средство вводят по меньшей мере за 1 месяц до проведения иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и/или агонистом 4-1BB. В некоторых вариантах осуществления, способы дополнительно включают введение двух или более химиотерапевтических средств.
[224] Множество дополнительных лекарственных средств можно использовать в сочетании с композициями, описанными в настоящем описании. Например, потенциально полезные дополнительные лекарственные средства включают ингибиторы PD-1, такие как ниволумаб (опдиво®), пембролизумаб (кейтруда®), пембролизумаб, пидилизумаб (CureTech) и атезолизумаб (Roche).
[225] Дополнительные лекарственные средства, пригодные для использования в комбинации с композициями и способами, описанными в настоящем описании, включают, но без ограничения, ибрутиниб (ИМБРУВИКА®), офатумумаб (АРЗЕРРА®), ритуксимаб (РИТУКСАН®), бевацизумаб (АВАСТИН®), трастузумаб (ГЕРЦЕПТИН®), трастузумаб эмтанзин (КАДСИЛА®), иматиниб (ГЛИВЕК®), цетуксимаб (ЭРБИТУКС®), панитумумаб (ВЕКТИБИКС®), катумаксомаб, ибритумомаб, офатумумаб, тозитумомаб, брентуксимаб, алемтузумаб, гемтузумаб, эрлотиниб, гефитиниб, вандетаниб, афатиниб, лапатиниб, нератиниб, акситиниб, маситиниб, пазопаниб, сунитиниб, сорафениб, тоцераниб, лестауртиниб, акситиниб, цедираниб, ленватиниб, нинтеданиб, пазопаниб, регорафениб, семаксаниб, сорафениб, сунитиниб, тивозаниб, тоцераниб, вандетаниб, энтректиниб, кабозантиниб, иматиниб, дазатиниб, нилотиниб, понатиниб, радотиниб, бозутиниб, лестауртиниб, руксолитиниб, пакритиниб, кобиметиниб, селуметиниб, траметиниб, биниметиниб, алектиниб, церитиниб, кризотиниб, афлиберцепт, адипотид, денилейкин дифтитокс, ингибиторы mTOR, такие как эверолимус и темсиролимус, ингибиторы hedgehog, такие как сонидегиб и висмодегиб, ингибиторы CDK, такие как ингибитор CDK (палбоциклиб).
[226] В некоторых вариантах осуществления, композицию, содержащую иммуноциты с CAR, вводят с противовоспалительным средством. Противовоспалительные средства или лекарственные средства могут включать, но без ограничения, стероиды и глюкокортикоиды (включая бетаметазон, будезонид, дексаметазон, гидроацетат кортизона, гидрокортизон, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон), нестероидные противовоспалительные лекарственные средства (NSAIDS), включая аспирин, ибупрофен, напроксен, метотрексат, сульфасалазин, лефлуномид, лекарственные средства против TNF, циклофосфамид и микофенолят. Иллюстративные NSAID включают ибупрофен, напроксен, напроксен натрия, ингибиторы Cox-2 и сиалилаты. Иллюстративные анальгетики включают ацетаминофен, оксикодон, гидрохлорид трамадола пропорксифена. Иллюстративные глюкокортикоиды включают кортизон, дексаметазон, гидрокортизон, метилпреднизолон, преднизолон или преднизон. Иллюстративные модификаторы биологических ответов включают молекулы, нацеленные против поверхностных маркеров клеток (например, CD4, CD5 и т.д.), ингибиторы цитокинов, такие как антагонисты TNF, (например, этанерцепт (ЭНБРЕЛ®), адалимумаб (ХУМИРА®) и инфликсимаб (РЕМИКЕЙД®), ингибиторы хемокинов и ингибиторы молекул адгезии. Модификаторы биологических ответов включают моноклональные антитела, так же как рекомбинантные формы молекул. Иллюстративные DMARD включают азатиоприн, циклофосфамид, циклоспорин, метотрексат, пеницилламин, лефлуномид, сульфасалазин, гидроксихлороквин, золото (пероральное (ауранофин) и внутримышечное) и миноциклин.
[227] В некоторых вариантах осуществления, композиции, описанные в настоящем описании, вводят в сочетании с цитокином. Примерами цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. В цитокины включены гормоны роста, такие как человеческий гормон роста, человеческий N-метионил-гормон роста и бычий гормон роста; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреостимулирующий гормон (TSH) и лютеинизирующий гормон (LH); фактор роста гепатоцитов (HGF); фактор роста фибробластов (FGF); пролактин; плацентарный лактоген; Мюллерова ингибирующая субстанция; пептид мыши, связанный с гонадотропином; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоэтин (TPO); факторы роста нервов (NGF), такие как NGF-бета; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO, эпоген®, прокрит®); остеоиндуктивные факторы; интерфероны, такие как интерферон-альфа, бета и гамма; колониестимулирующие факторы (CSF), такие как макрофагальный CSF (M-CSF); гранулоцитарно-макрофагальный CSF (GM-CSF); и гранулоцитарный CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1-альфа, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; IL-15, фактор некроза опухоли, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, включая LIF и лиганд kit (KL). в рамках изобретения, термин цитокин включает белки из природных источников или из рекомбинантной культуры клеток и биологически активные эквиваленты природной последовательности цитокинов.
Введение аксикабтаген цилолейкел и утомилумаба
Фармакодинамика и фармакокинетика после инфузии Axi-cel™
[228] YESCARTA™ (аксикабтаген цилолейкел; Axi-cel™; KTE-C19) представляет собой терапию нацеленными на CD19 генетически модифицированными аутологичными T-клетками с химерным рецептором антигена (CAR), одобренную Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) для лечения взрослых пациентов с рецидивирующей или невосприимчивой (r/r) крупноклеточной B-клеточной лимфомой после двух или более линий системной терапии. Одобренные показания включают диффузную крупноклеточную B-клеточную лимфому (DLBCL), неуточненную, первичную медиастинальную крупноклеточную B-клеточную лимфому (PMBCL), B-клеточную лимфому на поздних стадиях и DLBCL, развивающуюся из фолликулярной лимфомы.
[229] В опорном клиническом исследовании ZUMA-1 Axi-cel™ для лечения r/r крупноклеточной B-клеточной лимфомы выявляли ключевые фармакокинетические (PK) и фармакодинамические (PD) взаимосвязи, описывающие взаимосвязь между размножением T-клеток с CAR против CD19 (PK) и уровнями в сыворотке цитокинов (PD) во взаимосвязи с клиническим исходом (Locke et al. CT019 - Primary results from ZUMA-1: a pivotal trial of axicabtagene ciloleucel (axicel; KTE-C19) in patients with refractory aggressive non-Hodgkin lymphoma (NHL). In: Proceedings of the 107th Annual Meeting of the American Association for Cancer Research; 2017 Apr 1-5; Washington, DC. Philadelphia (PA):AACR; 2017. Abstract 4292). На Фигуре 2 показана взаимосвязь между уровнями CAR против CD19 в крови в течение первых 28 суток после инфузии (AUC0-28) и объективным ответом (CR или PR), и развитием неврологической токсичности степени ≥3 или синдромом высвобождения цитокинов (CRS). Размножение T-клеток с CAR было ассоциировано с объективным ответом и неврологической токсичностью степени ≥3, но не CRS степени ≥3.
[230] На фигуре 3 показана индукция посредством противолимфоцитарной химиотерапии и T-клеток с CAR против CD19 ключевых иммунных программ в течение первых 28 суток после инфузии. Уровни различных биомаркеров достигали пика в течение 7 суток после лечения Axi-cel™. Показанные аналиты оценивали у ≥ 50% пациентов с ≥ 2- кратной индукцией выше исходного значения в панели из 44 измеренных. Аналиты в сыворотке измеряли с использованием MSD®, Luminex® и ELISA Quantikine™.
[231] На фигуре 4 показаны биомаркеры, ассоциированные как с CRS степени ≥3, так и с неврологической токсичностью степени ≥3. Показана ассоциация между пиковыми уровнями аналитов в сыворотке и ассоциация с неврологической токсичностью или CRS степени ≥3. Пиковые уровни после инфузии Axi-cel™ использовали для сравнения. Для T-клеток с CAR против CD19 показана широкая полифункциональность в совместной культуре (фигура 5). Оценивали совместную регуляцию маркеров активации для T-клеток, отобранных по CD8+ клеткам, среди всех оцениваемых продуктов. Для CD4+ T-клеток показан сходный паттерн (данные не представлены). См. Perez et al, ASH 2015, «Pharmacodynamic Profile and Clinical Response in Patients with B-Cell Malignancies of Anti-CD19 CAR T Cell Therapy» (также как Abstract No. 2042).
Дозирование и введение аксикабтаген цилолейкел
[232] В некоторых вариантах осуществления, иммунотерапию нацеленными на CD19 генетически модифицированными аутологичными T-клетками, предписанную для лечения взрослых пациентов с невосприимчивой крупноклеточной B-клеточной лимфомой, проводят после двух или более линий системной терапии. В некоторых вариантах осуществления, пакет для инфузии иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками содержит суспензию положительных по химерному рецептору антигена (CAR) T-клеток в приблизительно 68 мл. Целевая доза может составлять между приблизительно 1 × 106 и приблизительно 2 × 106 положительных по CAR жизнеспособных T-клеток на кг массы тела, с максимумом 2 × 108 положительных по CAR жизнеспособных T-клеток. В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными аутологичными T-клетками представляет собой Axi-cel™ (YESCARTA™, аксикабтаген цилолейкел).
[233] В некоторых вариантах осуществления, иммунотерапия нацеленными на CD19 генетически модифицированными аутологичными T-клетками предназначена для аутологичного использования. Идентичность пациента должна совпадать с идентификаторами пациента на кассете и пакете для инфузии для иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками. Если информация на специфической для пациента этикетке не совпадает с намеченным пациентом, иммунотерапию нацеленными на CD19 генетически модифицированными аутологичными T-клетками невозможно проводить.
[234] В некоторых вариантах осуществления, доступность иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками должна быть подтверждена до начала противолимфоцитарного режима.
[235] В некоторых вариантах осуществления, пациента подвергают подготовительному лечению до инфузии иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками, с использованием проведения противолимфоцитарной химиотерапии. В некоторых вариантах осуществления, режим противолимфоцитарной химиотерапии из циклофосфамида приблизительно 500 мг/м2 IV и флударабина приблизительно 30 мг/м2 IV проводят на пятые, четвертые и третьи сутки до инфузии иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками.
[236] В некоторых вариантах осуществления, пациента подвергают медикаментозной подготовке до инфузии иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками посредством введения ацетаминофена при приблизительно 650 мг перорально и дифенгидрамина при приблизительно 12,5 мг внутривенно или перорально приблизительно за 1 час до инфузии иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками.
[237] В некоторых вариантах осуществления, профилактическое использование системных стероидов исключают, поскольку оно может создавать помехи для активности иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками.
Подготовка инфузии иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками
[238] Расписание размораживания и инфузии нацеленных на CD19 генетически модифицированных аутологичных T-клеток для иммунотерапии координируют. В некоторых вариантах осуществления, время инфузии подтверждают заранее, и время начала размораживания нацеленных на CD19 генетически модифицированных аутологичных T-клеток для иммунотерапии корректируют таким образом, чтобы они были доступны для инфузии, когда пациент будет готов.
[239] В некоторых вариантах осуществления, идентичность пациента подтверждают до размораживания нацеленных на CD19 генетически модифицированных аутологичных T-клеток для иммунотерапии. До подготовки иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками, устанавливают совпадение идентичности пациента с идентификаторами пациента на кассете для иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками. В некоторых вариантах осуществления, пакет с продуктом нацеленных на CD19 генетически модифицированных аутологичных T-клеток для иммунотерапии не извлекают из кассеты, если информация на специфической для пациента этикетке не совпадает с намеченным пациентом.
[240] В некоторых вариантах осуществления, после подтверждения идентификации пациента, пакет с продуктом нацеленных на CD19 генетически модифицированных аутологичных T-клеток для иммунотерапии извлекают из кассеты, и подтверждают совпадение информации о пациенте на этикетке кассеты с этикеткой пакета.
[241] В некоторых вариантах осуществления, способ включает проверку пакета с продуктом на любые нарушения целостности контейнера, такие как разрывы или трещины, перед размораживанием. В некоторых вариантах осуществления, пакет для инфузии помещают внутрь второго стерильного пакета по местным требованиям.
[242] В некоторых вариантах осуществления, способ включает размораживание нацеленных на CD19 генетически модифицированных аутологичных T-клеток для иммунотерапии при приблизительно 37°C с использованием либо водяной бани, либо способа сухого размораживания, до исчезновения видимого льда в пакете для инфузии. В некоторых вариантах осуществления, способ включает перемешивание или встряхивание содержимого пакета для диспергирования сгустков клеточного материала. В некоторых вариантах осуществления, содержимое пакета осторожно перемешивают или встряхивают. В некоторых вариантах осуществления, способ включает проверку пакета на присутствие оставшихся видимых сгустков клеток и продолжение перемешивания или встряхивания. Небольшие сгустки клеточного материала следует диспергировать с использованием осторожного перемешивания вручную. В некоторых вариантах осуществления, способ не включает промывку, осаждение центрифугированием и/или повторное суспендирование нацеленных на CD19 генетически модифицированных аутологичных T-клеток для иммунотерапии в новых средах до инфузии.
[243] В некоторых вариантах осуществления, после размораживания, нацеленные на CD19 генетически модифицированные аутологичные T-клетки для иммунотерапии можно хранить при комнатной температуре (20°C - 25°C) в течение вплоть до 3 часов.
Введение
[244] В некоторых вариантах осуществления, описанные в настоящее время способы проведения иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками включают одно или несколько из следующего, в качестве стадий или в качестве факторов, которые необходимо учитывать:
Убедиться, что тоцилизумаб и реанимационное оборудование являются доступными до инфузии и в ходе периода восстановления.
НЕ использовать фильтр для уменьшения количества лейкоцитов.
Центральный венозный доступ рекомендован для инфузии иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками.
Подтвердить, что идентичность пациента совпадает с идентификаторами пациента на пакете продукта для иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками.
Закачать в трубки нормальный солевой раствор до инфузии.
Вводить посредством инфузии все содержимое пакета для иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками в течение 30 минут либо под действием силы тяжести, либо с использованием перистальтического насоса. Нацеленные на CD19 генетически модифицированные аутологичные T-клетки для иммунотерапии являются стабильными при комнатной температуре в течение вплоть до 3 часов после размораживания.
Осторожно встряхивать пакет с продуктом во время инфузии иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками для предотвращения образования сгустков клеток.
После инфузии полного содержимого пакета с продуктом, промыть трубки нормальным солевым раствором с такой же скоростью инфузии, чтобы обеспечить доставку всего продукта.
Иммунотерапия нацеленными на CD19 генетически модифицированными аутологичными T-клетками включает клетки крови человека, генетически модифицированные некомпетентным по репликации ретровирусным вектором. Следовать универсальным мерам предосторожности и местным руководствам по биологической безопасности при манипуляции и утилизации, чтобы избегать потенциального переноса инфекционных заболеваний.
Мониторирование
[245] В некоторых вариантах осуществления, проведение иммунотерапии нацеленными на CD19 генетически модифицированными аутологичными T-клетками проводят в сертифицированном медицинском учреждении. В некоторых вариантах осуществления, способы, описанные в настоящем описании, включают мониторирование пациентов по меньшей мере ежесуточно в течение 7 суток в сертифицированном медицинском учреждении после инфузии по признакам и симптомам CRS и неврологической токсичности. В некоторых вариантах осуществления, пациентов инструктируют находиться поблизости от сертифицированного медицинского учреждения в течение по меньшей мере 4 недель после инфузии.
Управление течением серьезных неблагоприятных реакций
[246] В некоторых вариантах осуществления, способ включает управление течением неблагоприятных реакций. В некоторых вариантах осуществления, неблагоприятная реакция выбрана из группы, состоящей из синдрома высвобождения цитокинов (CRS), неврологической токсичности, реакции гиперчувствительности, серьезной инфекции, цитопении и гипогаммаглобулинемии.
[247] В некоторых вариантах осуществления, признаки и симптомы неблагоприятных реакций выбраны из группы, состоящей из лихорадки, гипотензии, тахикардии, гипоксии и озноба, включают сердечные аритмии (включая фибрилляцию предсердий и желудочковую тахикардию), остановку сердца, сердечную недостаточность, почечную недостаточность, синдром повышенной проницаемости капилляров, гипотензию, гипоксию, токсичность для органа, синдром гемофагоцитарного лимфогистиоцитоза/активации макрофагов (HLH/MAS), судороги, энцефалопатию, головную боль, дрожь, головокружение, афазию, делирий, бессонницу, тревожность, анафилаксию, фебрильную нейтропению, тромбоцитопению, нейтропению и анемию.
Агонисты белкового рецептора 4-1BB (CD-137)
[248] Белковый рецептор 4-1BB (CD-137) обнаружен на определенных T-клетках (в первую очередь на CD8+, но также на CD4+ T-клетках памяти) и клетках естественных киллерах (NK). (Fisher, T.S., Kamperschroer, C., Oliphant, T. et al. Cancer Immunol Immunother (2012) 61: 1721. https://doi.org/10.1007/s00262-012-1237-1; Westwood JA, Potdevin Hunnam TCU, Pegram HJ, Hicks RJ, Darcy PK, Kershaw MH (2014) Routes of Delivery for CpG and Anti-CD137 for the Treatment of Orthotopic Kidney Tumors in Mice. PLoS ONE 9(5): e95847. https://doi.org/10.1371/journal.pone.0095847). 4-1BB может быть также обозначен как TNFRSF9; суперсемейство рецепторов фактора некроза опухоли, член 9; ILA; 4-1BB; CD137; CDw137; член 9 суперсемейства рецепторов фактора некроза опухоли; антиген CD137. Связывающие 4-1BB молекулы, включая утомилумаб, дополнительно описаны в Патенте США No. 8337850, полное содержание которого, таким образом, приведено в качестве ссылки.
[249] Утомилумаб представляет собой непатентованное наименование PF-05082566, исследовательского средства для иммунотерапии и полностью человеческого моноклонального антитела (mAb) IgG2. Как показано на фигуре 12, когда утомилумаб (PF-05082566) связывается с 4-1BB, наблюдают, что он стимулирует и увеличивает количество иммуноцитов. Комбинация утомилумаба (PF-05082566) с ингибитором контрольной точки, таким как антитело против PD-1/против PD-L1, или другими иммунотерапевтическими средствами может усиливать иммунный ответ. (Gopal A, Barlett N, Levy R, et al. A Phase I study of PF-05082566 (anti-4-1BB)+rituximab in patients with CD20+ NHL. J Clin Oncol 33, 2015 DOI: 10.1200/jco.2015.33.15_suppl.3004; Tolcher MD, Anthony W. Phase 1b trial investigating utomilumab (a 4-1BB agonist) in combination with a checkpoint inhibitor. Устная презентация на 52nd Annual Meeting of the American Society of Clinical Oncology 2016 (ASCO). http://meetinglibrary.asco.org/content/125783?media=sl. Доступ открыт 27 февраля 2017 г.; A Study of PF-05082566 as a Single Agent and in Combination with Rituximab. https://clinicaltrials.gov/ct2/show/NCT01307267?term=PF-05082566&rank=3. Доступ открыт 27 февраля 2017 г.)
[250] В некоторых вариантах осуществления, агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие три CDR из аминокислотной последовательности области VH, как указано в SEQ ID NO:1, и три CDR из аминокислотной последовательности области VL, указанной в SEQ ID NO: 3.
[251] В некоторых вариантах осуществления, агонист 4-1BB представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие: (a) H-CDR1, как указано в SEQ ID NO:5; (b) H-CDR2, как указано в SEQ ID NO:6; (c) H-CDR3, как указано в SEQ ID NO:7; (d) L-CDR1, как указано в SEQ ID NO:8; (e) L-CDR2, как указано в SEQ ID NO:9; и (f) L-CDR3, как указано в SEQ ID NO:10.
[252] В некоторых вариантах осуществления, агонист 4-1BB представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие аминокислотную последовательность области VH, как указано в SEQ ID NO:1. В некоторых вариантах осуществления, антитело или антигенсвязывающая часть содержит аминокислотную последовательность области VL, как указано в SEQ ID NO:3.
[253] В некоторых вариантах осуществления, агонист 4-1BB представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие аминокислотную последовательность области VH, как указано в SEQ ID NO:1, и аминокислотную последовательность области VL, как указано в SEQ ID NO:3.
[254] В некоторых вариантах осуществления, выделенное агонистическое антитело против 4-1BB представляет собой IgG2. В некоторых вариантах осуществления, агонист 4-1BB представляет собой полностью человеческое антитело.
[255] В некоторых аспектах, настоящее изобретение относится к фармацевтической композиции, содержащей антитело или его антигенсвязывающую часть, описанные в настоящем описании, и фармацевтически приемлемый носитель.
[256] В некоторых вариантах осуществления, выделенное агонистическое антитело против 4-1BB содержит аминокислотную последовательность тяжелой цепи, как указано в SEQ ID NO:2, и аминокислотную последовательность легкой цепи, как указано в SEQ ID NO:4, при условии, что C-концевой остаток лизина из SEQ ID NO:2, необязательно, отсутствует.
Дозирование и введение утомилумаба
[257] Термин «терапевтически эффективное количество» или «терапевтически эффективная доза» связывающей молекулы относится к количеству, которое является эффективным для намеченной терапевтической цели. Например, при лечении злокачественной опухоли, примеры желательных или благоприятных эффектов включают ингибирование дополнительного роста или распространения клеток злокачественной опухоли, гибель клеток злокачественной опухоли, ингибирование повторного возникновения злокачественной опухоли, уменьшение боли, ассоциированной с злокачественной опухолью, или улучшение выживаемости млекопитающего. Терапевтически эффективное количество антитела против 4-1BB обычно лежит в диапазоне от приблизительно 0,001 до приблизительно 500 мг/кг, и более обычно, от приблизительно 0,01 до приблизительно 200 мг/кг массы тела млекопитающего. Например, количество может составлять приблизительно 0,3 мг/кг, приблизительно 1 мг/кг, приблизительно 3 мг/кг, приблизительно 5 мг/кг, приблизительно 10 мг/кг, приблизительно 50 мг/кг, приблизительно 100 мг/кг, или приблизительно 200 мг/кг массы тела млекопитающего. В некоторых вариантах осуществления, терапевтически эффективное количество антитела против 4-1BB лежит в диапазоне приблизительно 0,01-30 мг/кг массы тела млекопитающего. В некоторых других вариантах осуществления, терапевтически эффективное количество антитела против 4-1BB лежит в диапазоне приблизительно 0,05-15 мг/кг массы тела млекопитающего. Точный уровень дозы, подлежащий введению, может легко определить специалист в данной области, и он зависит от ряда таких факторов, как тип и тяжесть нарушения, подлежащего лечению, конкретная используемая связывающая молекула, способ введения, время введения, длительность лечения, конкретная используемая дополнительная терапия, возраст, пол, масса, состояние, общее состояние здоровья и предшествующий анамнез пациента, подвергаемого лечению, и подобные факторы, хорошо известные в области медицины.
[258] В некоторых вариантах осуществления, терапевтически эффективная доза антитела против 4-1BB составляет между приблизительно 1 и приблизительно 200 мг. В некоторых вариантах осуществления, терапевтически эффективная доза антитела против 4-1BB составляет между приблизительно 1 и приблизительно 100 мг. Связывающую молекулу или композицию обычно вводят за несколько раз. Интервалы между однократными дозами могут составлять, например, еженедельно, ежемесячно, каждые три месяца или ежегодно. Иллюстративный режим лечения включает введение один раз в неделю, один раз в каждые две недели, один раз в каждые три недели, один раз в каждые четыре недели, один раз в месяц, один раз в каждые три месяца или один раз в каждые три-шесть месяцев. Режимы дозирования для антитела против 4-1BB могут включать приблизительно 1 мг/кг массы тела или приблизительно 3 мг/кг массы тела посредством внутривенного введения, с использованием одного из следующих расписаний дозирования: (i) каждые четыре недели в течение шести дозирований, затем каждые три месяца; (ii) каждые три недели; (iii) приблизительно 3 мг/кг массы тела один раз, затем приблизительно 1 мг/кг массы тела каждые три недели.
[259] В некоторых вариантах осуществления, агонистическое полностью человеческое моноклональное антитело против 4-1BB вводят в дозе приблизительно 1 мг, приблизительно 2 мг, приблизительно 3 мг, приблизительно 4 мг, приблизительно 5 мг, приблизительно 7,5 мг, приблизительно 10 мг, приблизительно 15 мг, приблизительно 20 мг, приблизительно 25 мг, приблизительно 30 мг, приблизительно 40 мг, приблизительно 50 мг, приблизительно 75 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 150 мг, приблизительно 175 мг, приблизительно 200 мг. В некоторых вариантах осуществления, дозирование агонистического полностью человеческого моноклонального антитела против 4-1BB продолжают, пока для пациентов не покажут полную ремиссию, отсутствие ответа/прогрессирующее заболевание, или в течение приблизительно 1 года. В некоторых вариантах осуществления, агонистическое полностью человеческое моноклональное антитело против 4-1BB вводят приблизительно каждые 4 недели. В некоторых вариантах осуществления, агонистическое полностью человеческое моноклональное антитело против 4-1BB вводят ежемесячно.
[260] Настоящее описание далее проиллюстрировано следующими примерами, которые не следует рассматривать как дополнительно ограничивающие. Полное содержание всех фигур и всех ссылок, патентов и опубликованных патентных заявок, процитированных на протяжении этого описания, приведено в настоящем описании в качестве ссылки.
ПРИМЕРЫ
Пример 1: Клинические исследования невосприимчивой крупноклеточной B-клеточной Лимфомы
[261] Комбинированную терапию с использованием аксикабтаген цилолейкел в комбинации с утомилумабомом можно использовать для эффективного лечения пациентов с злокачественными опухолями. Этот пример иллюстрирует многоцентровое исследование, оценивающее безопасность и эффективность KTE-C19 (аксикабтаген цилолейкел) в комбинации с утомилумабомом у субъектов с невосприимчивой крупноклеточной B-клеточной лимфомой или невосприимчивой диффузной B-клеточной лимфомой (DLBCL) после по меньшей мере 2 предшествующих линий системной терапии. Это исследование разделено на две отдельные фазы, обозначенные как фаза 1 и фаза 2.
[262] В ходе фазы 1, приблизительно 3-9 или 3-24 субъектов с невосприимчивой крупноклеточной B-клеточной лимфомой или невосприимчивой DLBCL регистрируют в дизайне 3+3 в вплоть до 3 или 4 из 6 когорт для оценки безопасности комбинированных режимов KTE-C19 и утомилумаба. KTE-C19 вводят в фиксированной или однократной дозе, и дозу утомилумаба вводят в увеличивающихся дозах или увеличивают последовательно в каждой из 3 когорт. Первичной целью фазы 1 является оценка безопасности комбинированных режимов KTE-C19 и утомилумаба, и идентификация наиболее подходящих дозы и расписания введения утомилумаба для перехода в фазу 2. Частота возникновения неблагоприятных событий, определенная как ограничивающая дозу токсичность (DLT) является первичной конечной точкой.
[263] В фазе 2, приблизительно 22 или 24 субъектов регистрируют для проведения комбинированного лечения KTE-C19 и утомилумабом, на основании дозы и расписания, выбранных после обзора данных из части фазы 1. Первичной целью фазы 2 является оценка эффективности KTE-C19 и утомилумаба, как измерено по частоте полного ответа (CR) у субъектов с невосприимчивой крупноклеточной B-клеточной лимфомой или невосприимчивой DLBCL. Вторичные цели включают оценку безопасности и переносимости KTE-C19 в комбинации с утомилумабомом и оценку дополнительных конечных точек эффективности. Первичной конечной точкой фазы 2 является частота полного ответа (полный ответ [CR] по уточненным критериям ответа злокачественной лимфомы Международной рабочей группы [IWG]) (Cheson et al. J Clin Oncol 25:579-586 (2007)) или классификации Лугано (Cheson et al., 2014), как определено исследователем.
[264] Независимо от когорты или фазы исследования, каждый субъект проходит через следующие периоды исследования:
Скрининг
Регистрация/Лейкаферез
Переходная терапия, если применимо
Подготовительная химиотерапия
Комбинированное лечение (KTE-C19 и утомилумаб)
Оценка после лечения
Долгосрочное отслеживание
[265] Как показано на фигуре 1 и фигуре 13, пациентов сначала подвергают регистрации и лейкаферезу, с последующей подготовительной противолимфоцитарной химиотерапией на сутки -5, -4 и -3 до начала комбинированного лечения KTE-C19 и утомилумабом. Пациентов подвергают режиму подготовительной химиотерапии, состоящему из флударабина 30 мг/м2/сутки и циклофосфамида 500 мг/м2/сутки, вводимых в течение 3 суток. На сутки 0, лечение KTE-C19 включает однократную инфузию трансдуцированных CAR аутологичных T-клеток, введенных внутривенно в целевой дозе 2×106 T-клеток с CAR против CD19/кг. В условиях, когда субъекты первоначально отвечают и затем испытывают рецидив, субъекты могут являться подходящими для второго курса подготовительной химиотерапии и KTE-C19.
[266] Лечение утомилумабом включает внутривенную инфузию, вводимую приблизительно каждые четыре недели. Первую дозу вводят на сутки после инфузии KTE-C19, и дозирование продолжают, пока для пациентов не покажут полную ремиссию, отсутствие ответа/прогрессирующее заболевание, или в течение приблизительно 1 года, в зависимости от того, что наступит раньше. В одном дизайне исследования, показанном на фигуре 1, субъектам из когорты 1 вводят приблизительно 1 мг утомилумаба, субъектам из когорты 2 вводят приблизительно 10 мг утомилумаба, и субъектам из когорты 3 вводят приблизительно 100 мг утомилумаба. В другом дизайне исследования, показанном на фигуре 13, введение утомилумаба начинают в фиксированной дозе 10 мг на сутки 1 в когорте 1, и режимы введения утомилумаба описаны в таблице 1 ниже.
[267] В указанных временных точках, субъектов подвергают следующим процедурам: сбору информированного согласия, общего анамнеза, включая предшествующее лечение NHL, физическое обследование, включая жизненно важные показатели и функциональный статус, и неврологические оценки. Субъектов также подвергают отборам крови для общего анализа крови (CBC), анализа химических панелей, цитокинов, C-реактивного белка, подгрупп лимфоцитов, антител против KTE-C19, оценки ADA, анализа компетентного по репликации ретровируса (RCR) и T-клеток с CAR против CD19. Женщин с потенциалом к деторождению подвергают тестированию на беременность по моче или сыворотке.
[268] Субъектов в исходной точке подвергают также электрокардиограмме (ECG), эхокардиограмме (ECHO), магнитно-резонансная томографии головного мозга (MRI), позитронной эмиссионной томографии-компьютерной томографии (PET-CT) и лейкаферезу.
[269] Частоту объективных ответов (CR+PR) следует определять по уточненным критериям ответа злокачественной лимфомы IWG (Cheson, 2007) и определять по критериям ответа злокачественной лимфомы IWG или классификации Лугано (Cheson et al. Journal of Clinical Oncology 32, no. 27 (September 2014) 3059-3067). Оценивают длительность ответа. Выживаемость без прогрессирования (PFS) оценивает исследователь по критериям классификации ответа Лугано (Cheson et al., 2014).
[270] Определения фармакокинетики включают PK параметры утомилумаба, насколько позволяют данные: максимальная концентрация в плазме (Cмакс), время до достижения максимальной концентрации в плазме (Tмакс), площадь под кривой зависимости концентрации в плазме от времени от 0 до τ часов после дозирования (AUC0 τ, где τ зависит от аналита) кажущийся клиренс из плазмы (CL/F) или общий клиренс (CL), и кажущийся объем распределения (V/F) или объем распределения в равновесном состоянии (Vss) каждого аналита после однократного и множественного дозирования.
[271] Оценивают молекулярные, клеточные и растворимые маркеры в периферической крови и/или ткани опухоли, и/или фекалиях, которые могут иметь отношение к механизму действия исследуемого лечения или ответа на него/устойчивости к нему, включая получение молекулярных профилей для клеток ABC/GBC из исходных подтипов DLBCL.
[272] Определяют общую выживаемость и частоту возникновения неблагоприятных событий, и клинически значимых изменений лабораторных значений безопасности. Кроме того, оценивают частоту возникновения антител против KTE-C19 и проводят оценки иммуногенности по антителам против лекарственного средства (ADA) и нейтрализующим антителам (Nab) против утомилумаба.
[273] Уровни экспрессии PD L1 в клетках опухолей и клетках из микроокружения опухоли в исходной точке, уровни KTE-C19 в крови и уровни цитокинов и других маркеров в сыворотке также можно оценивать в ходе исследования.
[274] Кроме того, проводят поисковые исследования для выявления в исходной точке и после лечения молекулярных, клеточных и растворимых маркеров (например, но без ограничения, исходного профиля мутаций, исходного профиля микробиома, исходного профиля и изменений профиля экспрессии генов, уровней инфильтрующих лимфоцитов и цитокинов) в периферической крови и/или ткани опухоли, и/или в фекалиях, которые могут иметь отношение к механизму действия исследуемого лекарственного средства или ответа на него/устойчивости к нему.
[275] Оценивают также частоты задержек дозирования утомилумаба из-за текущей острой токсичности после KTE-C19. В этом исследовании используют дизайн одной группы для оценки истинной частоты полного ответа у пациентов с невосприимчивой крупноклеточной B-клеточной лимфомой или рецидивирующей или невосприимчивой DLBCL, подвергнутых лечению с использованием комбинации утомилумаба и KTE-C19. При общем размере выборки 25 или 27 пациентов при любом данном расписании дозирования, из которой по меньшей мере 3 пациентов подвергают лечению в части фазы 1, наблюдаемая частота CR 60% дает 95% значимость того, что оценка истинной частоты CR находится между 39% и 79%, или что максимальная половина ширины 95% доверительного интервала, оценивающего истинную частоту CR, не превышает 21%.
[276] Критерии пригодности для исследования описаны ниже:
В одном аспекте, ключевые критерии включения включают:
Гистологически доказанная крупноклеточная B-клеточная лимфома, включая следующие типы, определенные в (Swerdlow et al, 2016):
DLBCL, неуточненная (ABC/GCB)
HGBCL с реаранжировкой MYC и BCL2 и/или BCL6, или без нее
DLBCL, возникающая из FL
Крупноклеточная B-клеточная лимфома с высоким содержанием T-клеток/гистиоцитов
DLBCL, ассоциированная с хроническими воспалением
Первичная кожная DLBCL, ножной тип
Вирус Эпштейна-Барр (EBV)+DLBCL
Невосприимчивое к химиотерапии заболевание, определенное как одно или несколько из следующего:
Отсутствие ответа на вторую или следующие линии терапии
PD как наилучший ответ на самый недавний режим терапии
SD как наилучший ответ после по меньшей мере 2 циклов последней линии терапии с длительностью SD не дольше 6 месяцев от последней дозы терапии
ИЛИ
Невосприимчивое после ASCT
Заболевание прогрессирующее или рецидивирующее ≤ 12 месяцев после ASCT (необходимо наличие подтвержденного по биопсии рецидива у имеющих рецидив субъектов)
если терапию спасения проводят после ASCT, субъект не должен иметь ответа или должен иметь рецидив после последней линии терапии
По меньшей мере 1 поддающийся измерению очаг, в соответствии с классификацией Лугано (Cheson et al. 2014). Очаги, ранее подвергнутые облучению, можно считать поддающимися измерению, только если прогрессирование документировано после завершения радиотерапии
Субъект должен быть подвергнут адекватной предшествующей терапии, включающей, как минимум:
Моноклональное антитело против CD20, если исследователь не определит, что опухоль является отрицательной по CD20, и
Включающий антрациклин режим химиотерапии
Отсутствие доказательств, подозрения и/или анамнеза поражения лимфомой центральной нервной системы (ЦНС)
По меньшей мере 2 недели или 5 периодов времени полужизни, в зависимости от того, что короче, должно истечь после любой предшествующей системной терапии на время того, как у субъекта запланирован лейкаферез
Случаи токсичности из-за предшествующей терапии должны являться стабильными и восстановленными до ≤ степени 1 (за исключением случаев клинически не значимой токсичности, такой как алопеция)
Возраст 18 лет или старше
Функциональный статус 0 или 1, согласно критериям Восточной объединенной онкологической группы США (ECOG)
Абсолютное количество нейтрофилов (ANC) ≥1000/ мкл
Количество тромбоцитов ≥75000/ мкл;
Абсолютное количество лимфоцитов ≥100/ мкл
Адекватная функция почек, печени, легких и сердца, определенная как:
Клиренс креатинина (как определено по формуле Кокрофта-Гаулта) ≥60 мл/мин
Соотношение в сыворотке аланин-аминотрансферазы/аспартат-аминотрансферазы ALT/AST ≤ 2,5 верхнего предела нормы (ULN)
Общий билирубин ≤ 1,5 мг/дл, за исключением субъектов с синдром Жильбера.
Фракция сердечного выброса ≥ 50% и отсутствие доказательства перикардиального выпота в пределах 180 суток, при условии, что субъекта не подвергали лечению на основе антрациклина, или он не испытывал кардиологического события или изменения функционального статуса
Отсутствие клинически значимого плеврального выпота
Исходное насыщение кислородом > 92% в помещении
Женщины с детородным потенциалом должны иметь отрицательный тест на беременность по сыворотке или моче (женщин, подвергнутых хирургической стерилизации или находящиеся в периоде после менопаузы в течение по меньшей мере 2 лет, не рассматривают как имеющих детородный потенциал)
В другом аспекте, ключевые критерии включения включают:
Гистологически подтвержденная DLBCL
Документирование того, что заболевание является невосприимчивым после по меньшей мере 2 линий системной терапии
Документирование исходного поддающегося измерению заболевания
Биоптат (архивный или при скриниге/недавний) должен быть собран на время скрининга
Ожидаемая продолжительность жизни ≥3 месяца
Возраст по меньшей мере 18 лет
Функциональный статус (PS) 0 или 1, согласно критериям Восточной объединенной онкологической группы США (ECOG)
Пациенты должны иметь адекватную функцию костного мозга, включая:
Абсолютное количество нейтрофилов (ANC) ≥1,5×109/л;
Количество тромбоцитов ≥100×109/л;
Гемоглобин ≥8 г/дл.
Пациенты должны иметь адекватную функцию печени, включая:
Общий уровень билирубина ≤1,5 × верхнего предела нормы (ULN);
Соотношение аспартат-аминотрансферазы (AST) и аланин-аминотрансферазы (ALT) ≤2,5 x ULN.
Пациенты должны иметь адекватную функцию почек, как доказано по клиренсу креатинина ≥60 мл/мин, как рассчитано по формуле Кокрофта-Гаулта.
В одном аспекте, ключевые критерии исключения включают:
Гистологически доказанная PMBCL
Трансформация Рихтера CLL в анамнезе
Предшествующая немедикаментозная противораковая терапия, включающая терапию T-клетками с химерным рецептором антигена (CAR) (CART-клетками) или терапию другими генетически модифицированными T-клетками
Тяжелая, немедленная реакция гиперчувствительности, приписанная аминогликозидам, в анамнезе
Присутствие или подозрение присутствия грибковой, бактериальной, вирусной, или другой инфекции, которая является неконтролируемой или требует IV противомикробные средства для управления течением. Простые UTI и неосложненный бактериальный фарингит допустимы, если отвечают на активное лечение, и после консультации с медицинским наблюдателем, назначенным спонсором
Инфекция HIV, или острая или хроническая активная инфекция гепатитом B или C в анамнезе. Субъекты с инфекцией гепатитом в анамнезе должны испытывать клиренс инфекции, как определено посредством стандартного серологического и генетического тестирования, согласно текущему руководству Американского общества инфекционных болезней (IDSA) или приемлемому государственному руководству
Присутствие любых постоянных линий или дренажа (например, трубки для чрескожной нефростомии, постоянного катетера Фолея, оборудования для холангиостомии или плеврального/перитонеального/перикардиального катетера). Специально предназначенные для центрального венозного доступа катетеры, такие как катетер Port-a-Cath или Хикмана, допустимы
Субъекты с поддающимися детекции злокачественными клетками в спинномозговой жидкости, метастазами в головном мозге или лимфомой центральной нервной системы (ЦНС) в анамнезе, на основании клинической оценки
Анамнез или присутствие нарушения ЦНС, такого как нарушение с наличием судорог, цереброваскулярная ишемия/геморрагия, деменция, заболевание мозжечка или любое аутоиммунное заболевание с вовлечением ЦНС
Субъекты с поражением лимфомой предсердий сердца или желудочков сердца
Инфаркт миокарда, коронарная ангиопластика или стентирование, нестабильная стенокардия, или другое клинически значимое заболевание сердца в анамнезе в пределах 12 месяцев от регистрации
Необходимость неотложной терапии из-за эффектов опухолевой массы (например, сжатия кровеносных сосудов, непроходимости кишечника или трансмуральное повреждение желудка)
Первичный иммунодефицит
Аутоиммунное заболевание (например, болезнь Крона, ревматоидный артрит, системная волчанка) в анамнезе, приводящие к повреждению органа-мишени или требующее системной иммуносупрессии/системных модифицирующих течение заболевания средств в пределах последних 2 лет. Пациенты с аутоиммунным гипотиреозом в анамнезе на стабильной дозе замещающих гормонов щитовидной железы и пациенты с контролируемым сахарным диабетом типа 1 на стабильном режиме введения инсулина могут являться подходящими для этого исследования
Симптоматический тромбоз глубоких вен или эмболия легочной артерии в анамнезе в пределах 6 месяцев от регистрации
Любое медицинское состояние с вероятностью создания помех для оценки безопасности или эффективности исследуемого лечения
Тяжелая немедленная реакция гиперчувствительности на любое из средств, используемых в этом исследовании, в анамнезе
Живая вакцина ≤ 6 недель до запланированного начала подготовительной химиотерапии
Женщины с детородным потенциалом, которые являются беременными или кормящими, из-за потенциально опасных эффектов подготовительной химиотерапии на плод или грудного ребенка. Женщин, подвергнутых хирургической стерилизации или находящиеся в периоде после менопаузы в течение по меньшей мере 2 лет, не рассматривают как имеющих детородный потенциал.
Субъекты обоего пола, не желающие принимать противозачаточные меры со времени согласия до 90 суток после последней дозы утомилумаба, и по меньшей мере 6 месяцев после завершения подготовительной химиотерапии
Анамнез злокачественных новообразований, отличных от немеланомного рака кожи in situ (например, шейки матки, мочевого пузыря, молочной железы) или рака предстательной железы низкой степени злокачественности (индекс Глиссона ≤ 6), или наблюдение без планов на лечение, за исключением отсутствия заболевания в течение по меньшей мере 3 лет
Аутологичная трансплантация стволовых клеток в пределах 6 недель от запланированной регистрации
Предшествующая трансплантация органа, включая предшествующую трансплантацию аллогенных стволовых клеток (SCT)
Предшествующая нацеленная на CD19 терапия, за исключением субъектов, подвергнутых введению аксикабтаген цилолейкел (KTE-C19) в этом исследовании и подходящих для повторного лечения
Использование любой стандартной или экспериментальной противораковой терапии в пределах 2 недель до регистрации, включая циторедуктивную терапию и радиотерапию, иммунотерапию, или терапию цитокинами (за исключением эритропоэтина)
Предшествующее лечение с использованием ингибитора PD-L1, ингибитора PD-1, антитела против CTLA4, антитела против CD137 (4-1BB), антитела против OX40 или терапии другим блокатором или активатором иммунной контрольной точки
Лечение с использованием системных иммуностимулирующих средств (включая, но без ограничения, интерферон и IL-2) в пределах 6 недель или 5 периодов времени полужизни лекарственного средства, в зависимости от того, что короче, до первой дозы утомилумаба
Анамнез пульмонарного фиброза, организующейся пневмонии (например, облитерирующего бронхиолита), индуцированного лекарственным средством пневмонита, идиопатического пневмонита, или доказательство острого пневмонита по сканированию CT грудной клетки при скрининге. Анамнез радиационного пневмонита в облученном поле (фиброза) допустим
По решению исследователя, субъект, с небольшой вероятностью могущий завершить все требуемые протоколом исследования осмотры или процедуры, включая осмотры для отслеживания, или придерживаться требований исследования для участия.
В другом аспекте, ключевые критерии исключения включают:
Симптоматическая лимфома центральной нервной системы (ЦНС), на основании клинической оценки
Предшествующая трансплантация органа, включая предшествующую аллогенную SCT
Предшествующая терапия с использованием агониста 4-1BB
Использование любой стандартной или экспериментальной противораковой терапии в пределах 2 недель до регистрации, включая циторедуктивную терапию и радиотерапию, иммунотерапию, или терапию цитокинами (за исключением эритропоэтина)
Аутологичная трансплантация стволовых клеток в пределах 3 недель от регистрации
Предшествующая нацеленная на CD19 терапия, за исключением субъектов, подвергнутых введению KTE-C19 в этом исследовании и подходящих для повторного лечения
Использование любой немедикаментозной противораковой терапии, включающая терапию T-клетками с химерным рецептором антигена (CAR) (CART-клетками).
Анамнез аутоиммунного заболевания, требующего системной иммуносупрессии в пределах последних 2 лет.
Диагноз любого злокачественного новообразования ≤3 лет до первой дозы исследуемого лечения, за исключением: (i) подвергнутого адекватному лечению базальноклеточного или плоскоклеточного рака кожи, (ii) карциномы in situ молочной железы или шейки матки, или (iii) рака предстательной железы низкой степени злокачественности (индекс Глиссона ≤6) при наблюдении без планов на какое-либо вмешательство для лечения (например, хирургию, радиотерапию или кастрацию).
Пример 2: План оценки аксикабтаген цилолейкел (KTE-C19, Axi-cel™) и утомилумаба
[277] Конкретные аспекты устойчивости к KTE-C19 будут оценены далее. План оценки лечения, включающий оценку фармакокинетики, фармакодинамики, биомаркеров опухоли и иммунитета, а также характеристик продукта, поддерживает многоцентровое исследование, оценивающее безопасность, эффективность и механизм действия Axi-cel™ в комбинации с агонистом 4-1BB (CD137) антителом утомилумабом у субъектов с невосприимчивой крупноклеточной B-клеточной лимфомой или невосприимчивой DLBCL, описанное в примере 1. Посредством анализа трансляции, план оценки определяет, приводит ли быстрая повышающая регуляция уровней CD137 на поверхности T-клеток с CAR против CD19 к способности отвечать на управляемую агонистом активацию, приводящую к увеличенным размножению и клинической активности. Механизм действия устойчивости в микроокружении опухолей (TME) и механизмы неврологической токсичности (CSF) также можно исследовать.
[278] Анализ проводят на парных (до и после дозирования) образцах толстоигольной биопсии опухолей, собранных во временных точках, совместимых с пиком размножения периферических T-клеток с CAR против CD19, для лучшего понимания биологии T-клеток с CAR в TME и возможного вклада утомилумаба. Толстоигольную биопсию проводят с использованием процедуры направляемой компьютерной томографией (CT) или ультразвуком с использованием иглы калибра либо 18G, либо 20G проводят в соответствии с институциональным руководством для получения 3-6 образцов сердцевины опухолей. Анализ иммуногистохимии (IHC) и анализ профиля транскриптов РНК проводят на фиксированных формалином погруженных в парафин (FFPE) или замороженных образцах ткани опухоли после толстоигольной биопсии до и после дозирования от пациентов с невосприимчивой крупноклеточной B-клеточной лимфомой или r/r DLBCL. Способы проточной цитометрии также используют для анализа криоконсервированного BM.
[279] План оценки может включать агрессивный способ сбора для сбора спинномозговой жидкости (CSF) у субъектов, у которых наблюдается развитие неврологической токсичности степени 2 или выше, для понимания механизма действия устойчивости в TME, а также механизмов неврологической токсичности (CSF).
[280] Стратегии сбора образцов и анализа могут обеспечивать прямое доказательство миграции T-клеток с CAR в микроокружение опухоли, так же как активации, специфического разрушения клеток и персистенции. Оценка характеристик клеток опухоли и микроокружения может обосновать эффективность CAR в связи с молекулярными и гистологическими признаками заболевания.
[281] Стратегия сбора биомаркеров (фигура 6) создает банк образцов, полученных от подвергнутых лечению пациентов, попадающих в четыре широких категории ответа, определенных по признакам объективного ответа: 1) регрессия [полный ответ (CR) или частичный ответ (PR)], 2) невосприимчивость к лечению [прогрессирующее заболевание (PD)], 3) рецидив или 4) персистенция без доказательств прогрессирования или полной регрессии [длительный PR или стабильное заболевание (SD)]. Оценка персистирующего заболевания (длительный PR или SD) обеспечивает понимание механизмов, применительно к иммунному ограничению очагов опухоли. Кроме того, данные, полученные для материала после парной биопсии, могут прояснять потенциальные механизмы устойчивости или рецидива, что позволяет как рациональный дизайн продуктов CAR следующего поколения, так и клинические исследования, разработанные для использования комбинаторных способов, служащих для усиления иммунного ответа.
[282] Обобщенное расписание сбора для архивированных образцов опухоли, крови [мононуклеарных клеток периферической крови (PBMC), сыворотки/плазмы] и CSF, предназначенных для анализа, показано на фигуре 7. Стратегия сбора образцов крови включает отборы образцов в исходной точке, на сутки 7, 14, 28 и месяцы 3, 6, 9, 12, 15, 18, 24, а также на сутки 2 и 6 после каждого введения утомилумаба. Образцы крови используют для определения уровней T-клеток с CAR против CD19 и биомаркеров сыворотки (цитокинов).
[283] Анализы проточной цитометрии проводят для оценки подгрупп лейкоцитов, присутствующих до трансдукции/размножения, а также статуса активации T-клеток в материале от пациента после афереза. Криоконсервированный материал от пациента после афереза оценивают с использованием панелей афереза 1 и 2, обобщенных в таблице 2.
[284] Анализы проточной цитометрии проводят для оценки эффективности трансдукции, а также для оценки фенотипа и статуса активации T-клеток для образцов продукта KTE-C19, выпущенного для инфузии пациенту. Криоконсервированный продукт до инфузии оценивают с использованием панелей продукта 1-3, обобщенных в таблице 3.
(4-1BB)
[285] Анализы проточной цитометрии используют для оценки поверхностной экспрессии нескольких ключевых маркеров, поскольку они связаны с фенотипом и активацией Собранных за длительный период времени PBMC пациентов, с использованием панелей PBL 1-4, показанных в таблице 4. Эти данные используют для мониторирования размножения, персистенции и фенотипа KTE-C19 после инфузии. В дополнение к мониторированию уровня CAR, панель 4 (таблица 4) разработана для проверки уровней популяций PBMC, подвергающихся воздействию подготовительной терапии и целевой активности CAR вне опухолей (т.е., нормальных B-клеток).
[286] Собранные за длительный период времени образцы крови пациента перерабатывают в криоконсервированные PBMC. Криоконсервированные собранные за длительный период времени PBMC пациента собирают на сутки 5, сутки 0, сутки 7, нед. 2, нед. 4 (на нед. 4 до введения утомилумаба, затем на сутки 30 и сутки 36). Для выравнивания с введением утомилумаба, дополнительный сбор крови включает отборы каждые 4 недели до введения утомилумаба, 2 и 6 суток после каждого введения утомилумаба. При длительном отслеживании, кровь отбирают каждые 3 месяца в течение вплоть до 2 лет для мониторирования восстановления иммунитета.
[287] Анализ количественной полимеразной цепной реакции (qПЦР) можно использовать для длительного мониторирования присутствия, размножения и персистенции в периферической крови T-клеток с CAR против CD19. После инфузии криоконсервированные PBMC используют для мониторирования уровней и клиренса имеющих генетические маркеры клеток с течением времени. Криоконсервированные собранные за длительный период времени PBMC пациента собирают на сутки -5, сутки 0, сутки 7, нед. 2, нед. 4 (на нед. 4 до введения утомилумаба, затем на сутки 30 и сутки 36). Для выравнивания с введением утомилумаба, дополнительный сбор крови включает отборы каждые 4 недели до введения утомилумаба, 2 и 6 суток после каждого введения утомилумаба. При длительном отслеживании, кровь отбирают каждые 3 месяца в течение вплоть до 2 лет для мониторирования присутствия персистирующих T-клеток с CAR против CD19.
[288] Анализ совместного культивирования используют для детальной характеризации продукта CAR против CD19. Нацеленный на 44 аналита способ MSD®, Luminex® и ELISA Quantikine®, вместе с многопараметрической проточной цитометрией используют для оценки продукции цитокинов и статуса активации T-клеток (таблица 5). Типы образцов включают криоконсервированный продукт, клетки K562, модифицированные для экспрессии CD19 (мишени CAR), и клетки K562, модифицированные для экспрессии NGFR (доказательство неспецифической активности). T-клетки, собранные из совместной культуры, анализируют с использованием панели характеризации продукта, описанной в таблице 3.
[289] Многопараметрические анализы можно использовать для оценки собранных за длительный период времени уровней в сыворотке хемокинов, цитокинов и иммунных эффекторов для мониторирования изменений экспрессии аналита в сыворотке в контексте размножения, фенотипа и персистенции T-клеток с CAR против CD19. Признаки объективного ответа и корреляцию с безопасностью необходимо оценивать в связи с наблюдаемыми изменениями аналитов в сыворотке. Собранные за длительный период времени образцы сыворотки пациента перерабатывают и криоконсервируют. Собранные за длительный период времени образцы сыворотки (сутки -5, сутки 0, Q3D, начиная на сутки 1 и затем каждые вторые сутки во время госпитализации, нед. 2, нед. 4) и дополнительный сбор крови включает отборы каждые 4 недели до введения утомилумаба, 2 и 6 суток после каждого введения утомилумаба, для выравнивания с введением утомилумаба. Оценка может включать аналиты, описанные в таблице 6.
[290] Образцы сыворотки пациента оценивают до инфузии (исходно), на сутки 28 и через 3 месяца после инфузии по антителам против KTE-C19 или против утомилумаба. Образцы сыворотки, для которых показано доказательство образования антитела против KTE-C19 и/ или против утомилумаба, оценивают по присутствию образования нейтрализующего антитела.
[291] Спинномозговую жидкость (CSF), так же как любые дополнительные образцы от субъектов (например, плевральный выпот) можно собирать у пациентов, у которых развивается неврологическая токсичность или CRS, чтобы позволять оценку уровней провоспалительных цитокинов и хемокинов, и уровней и фенотипов инфильтрующих T-клеток с CAR против CD19. Панели проточной цитометрии и MSD/Luminex, описанные ранее, эффективно используют для этой оценки.
[292] Обобщение анализов образцов, подлежащих проведению, представлены в таблице 7.
ПЦР; Собранные за длительный период времени PBMC
Биопсия в исходной точке и после дозирования
Пример 3: Анализ биопсии парных образцов ткани
[293] Сбор образцов толстоигольной биопсии опухолей проводят в исходной точке (до предварительной подготовки) и после инфузии продукта T-клеток, на сутки или около суток 7-14 и по большей части совмещают с пиком размножения продукта в крови. Расписание сбора парных образцов биопсии показано на фигуре 8. FFPE образцы толстоигольной биопсии получают в 120 мл банках, содержащих 60 мл нейтрального забуференного формалина (фиксатора для FFPE), 1,5 мл криоампулах (FFT) и с соответствующими этикетками. Материал толстоигольной биопсии помещают в фиксатор (3-4 иглы) для переработки в FFPE. Оставшиеся иглы (1-2) помещают непосредственно в 1,5 мл криоампулу для мгновенного замораживания в жидком азоте (LN2) или взвеси сухого льда/этанола. Образцы можно хранить при -80°C. На фигуре 9 обобщены схемы переработки образцов для толстоигольной биопсии.
[294] Следующий анализ проводят для парных образцов биопсии для оценки противоопухолевого эффекта продуктов в контексте невосприимчивой крупноклеточной B-клеточной лимфомы или r/r DLBCL:
IHC - иммунный инфильтрат
Детекция CAR против CD19 (способ гибридизации in situ, FISH и ISH)
CD25 и CD107α (доказательство активации CAR и дегрануляции)
Ki-67 (доказательство размножения CAR внутри опухоли)
PD-1 (доказательство истощения CAR)
IHC - Опухоль
CD19 (антиген-мишень для CAR)
CD22 (преобладание в отрицательных по CD19 очагах)
PD-L1/2 (обусловленная контрольной точкой устойчивость)
Каспаза 3 (доказательство направляемого CAR уничтожения клеток опухоли)
Дополнительный IHC анализ/цели
Оценка близости T-клетки с CAR/ клетка опухоли
проявление детекции продукта CAR
Разработка корреляционной визуализации у партнера по ресурсам
[295] Кроме того, анализы транскриптов и секвенирование опухолей можно проводить с использованием NanoString (Immunosign™) для анализа экспрессии генов с использованием форматов либо фиксированных (т.е., FFPE), либо свежих образцов. Разработаны коммерчески доступные наборы кодов для определения паттернов экспрессии в иммунном инфильтрате (панель PanCancer Immune - состав инфильтрата, доказательство регуляции посредством контрольной точки), а также маркеров воспаления (панель Human Inflammation - дополнительные маркеры для обеспечения доказательства активации). Можно разрабатывать получение «соответствующих целевому назначению» панелей по заказу. Альтернативно, можно осуществлять микромассив с более высоким содержанием для увеличения объема генов, анализированных по экспрессии (т.е., платформы микромассивов с высоким содержанием Almac или Agilent). На фигуре 10 показан схематический вид маркеров и способов анализа, которые можно использовать для оценки образцов биопсии пациентов.
[296] Анализ IHC используют для определения присутствия, фенотипа и функции продуктов T-клеток, экспрессии в ткани опухоли мишени продукта, и их относительной локализации в микроокружении. Продленное присутствие активированных T-клеток в ткани опухоли может указывать на долгосрочную, локализованную иммунную реакцию или иммуноопосредованную изоляцию опухоли, в качестве первичного механизма действия для длительных PR. Присутствие отрицательных по CAR T-клеток внутри таких очагов может предполагать потенциальное применение эндогенных T-клеток, узнающих неродственные мишени опухолей.
[297] Присутствие противовоспалительного микроокружения опухоли (присутствие T-рег, повышающую регуляцию экспрессии в опухоли PD-L1/2 и т.д.) можно оценивать посредством анализа биоптатов из обостряющихся или новых очагов. Можно осуществлять анализ экспрессии мишени, вместе с другими маркерами (т.е., CD22 или другими важными антигенами CD), так же как полный алгоритм Hans, включающий мониторирование дисрегуляции c-myc, bcl-2, bcl-6 (важных для признаков NHL), для документации эволюции опухоли, потенциальной потери мишени и экспрессии других мишеней. Кроме того, можно проводить анализ присутствия продукта T-клеток и определять фенотип внутри очагов опухоли.
[298] Можно проводить анализ транскриптов в отдельных клетках с использованием продукта до инфузии (наивного по отношению к антигену и испытавшего его воздействие) и криоконсервированных собранных за длительный период времени PBL пациента (например, за сутки -5, сутки 0, сутки 7, нед. 2, нед. 4, мес. 3, мес. 6, мес. 9, мес. 12, мес. 15, мес. 18, мес. 24, мес. 36, мес. 48, мес. 60, мес. 72 и затем ежегодно, где это применимо). Продукт до инфузии и собранные за длительный период времени PBL анализируют на уровне отдельных клеток по паттернам экспрессии транскриптов РНК с использованием полученной способом рационального дизайна панели для анализа. Дизайн панели включает маркеры для идентификации T-клетки с CAR, а также маркеры линии, активации и истощения.
Пример 4: Мониторирование минимального остаточного заболевания (MRD) и BCR/TCR
Минимальное остаточное заболевание (MRD)
[299] Технологию ClonoSIGHT® от Adaptive Biotechnologies используют для измерения MRD высоко чувствительным образом. Оценку циркулирующей опухолевой ДНК (ctДНК) при постановке диагноза и в ходе терапии с использованием платформы высокопроизводительного секвенирования от Adaptive для идентификации и измерения специфических для опухоли генов иммуноглобулинов проводят в образце до лечения, с последующим мониторированием собранных за длительный период времени образцов. Оценка генетических маркеров заболевания имеет чувствительность 10e-6, и ее проводят с использованием периферической крови пациента. Для этого способа может быть показано превосходящее мониторирование заболеваний, по сравнению с визуализацией посредством CT, а также молекулярный клиренс заболевания при определении CR.
Образцы (периферической крови) для Adaptive, собранные в период регистрации (калибровка), аспирата, начиная с времени оценки OR, собранные за длительный период времени каждые 3 месяца вплоть до 1 года, месяца 18 и месяца 24, используют для подтверждения MRD у субъектов, как определено, имеющих полный ответ (CR).
Мониторирование BCR/TCR
[300] Технологию ImmunoSEQ® от Adaptive Biotechnologies используют для характеризации разнообразия B-клеточного рецептора (BCR) в серийных биоптатах невосприимчивой крупноклеточной B-клеточной лимфомы или DLBCL (до инфузии, после инфузии и при рецидиве). Оценку разнообразия BCR можно использовать для идентификации или подтверждения злокачественных клонов в ходе терапии, так же как для подтверждения рецидива исходной опухоли, в отличие от вторичных злокачественных новообразований. Во-вторых, секвенирование BCR лимфоцитов периферической крови используют для подтверждения нормального репертуара B-клеток.
[301] Оценку разнообразия TCR в продукте до инфузии, в крови после инфузии и серийных биоптатах используют для понимания изменений разнообразия T-клеток в ходе лечения. Мониторирование размножения специфических для T-клеток с CAR последовательностей TCR, исходно присутствующих в продукте, который размножается и становится доминантным в крови или очагах опухолей, может давать информацию о присутствии и характере реакционноспособных клонов T-клеток, играющих значительную роль в клиренсе опухоли. Данные об этом характере можно использовать для идентификации клонов T-клеток, которые предпочтительно размножаются и уничтожают клетки опухолей посредством механизмов «распространения эпитопов», включающих реакционную способность против неродственных эпитопов, таких как эпитопы, ассоциированные с неоантигенами.
[302] Типы и расписание сбора образцов, необходимых для доказательства MRD у субъектов, как определено, имеющих полный ответ (CR), для секвенирования BCR включают биоптат опухоли до инфузии, биоптат опухоли после инфузии (сутки 7-14), биоптат опухоли при рецидиве, собранные за длительный период времени PBMC (где это применимо, на мес. 3, мес. 6, мес. 12, мес. 18, мес. 24).
[303] Типы и расписание сбора образцов, необходимых для доказательства MRD у субъектов, как определено, имеющих полный ответ (CR), для секвенирования TCR, включают биоптат опухоли до инфузии, биоптат опухоли после инфузии (сутки 7-14), биоптат опухоли при рецидиве, продукты T-клеток с CAR, T-клетки после афереза, собранные за длительный период времени PBMC (сут. 14, сут. 28, мес. 3, мес. 6 и мес. 12).
Пример 5:
[304] В этом исследовании исследовали эффект утомилумаба на T-клетки с CAR против CD19. В этом исследовании, клетки инкубировали со средством на основе антитела, которое, как показано ранее, стимулирует или активирует T-клетки с CAR; в присутствии или в отсутствие утомилумаба. Продукцию или уровни нескольких цитокинов, хемокинов и эффекторных молекул (аналитов) использовали для оценки потенциальных эффектов. T-клетки с CAR после CD19 получали из мононуклеарных клеток периферической крови от здоровых субъектов (A, B, C, D и E). T-клетки с CAR против CD19 в средах R10 (1×106 клеток/мл) инкубировали в течение ночи при 37°C и 5% CO2. 96-луночные планшеты покрывали средством на основе антитела (0,33 мкг/мл), утомилумабом (концентрация титрования от 0 до 100 мкг/мл посредством 3-кратного разведения) или контрольным антителом, которое не связывает 4-1BB (концентрация титрования от 0 до 100 мкг/мл посредством 3-кратного разведения) в течение ночи при 4°C. Покрытые планшеты промывали дважды с использованием сред R10 (RPMI 1640 с 10% FBS) и добавляли 1×105 T-клеток с CAR против CD19. Общий конечный объем в каждой лунке доводили до 200 мкл с использованием сред R10. После инкубации в течение ночи при 37°C и 5% CO2, супернатанты собирали и анализировали с использованием панели предварительно смешанных магнитных бусин для мультиплексного анализа CD8+ T-клеток человека (MILLIPLEX MAP Human CD8+ T Cell Magnetic Bead Panel Premixed 17 Plex - Immunology Multiplex Assay). Кратность изменения пика рассчитывали посредством деления выхода аналита в присутствии утомилумаба на выход аналита в присутствии контрольного антитела в соответствующей концентрации. Различия кратности изменения пика на протяжении титрования концентрации для каждого аналита показаны в таблице 8.
[305] Результаты показали, что в присутствии утомилумаба, уровни продукции нескольких цитокинов, хемокинов и эффекторных молекул, посредством T-клеток с CAR против CD19 (стимулированными средством на основе антитела), были увеличены (таблица 8). Уровни продукции IL-2 были увеличены в 1,9-25,9 раза, по сравнению с уровнями продукции в присутствии контрольного антитела, за исключением субъекта E, у которого наблюдали неспецифическое увеличение продукции IL-2 (ФИГ. 14). Продукция IL-2 была ниже предела количественного определения в клетках, которые инкубировали только с утомилумабом или только с контрольным антителом, в каждом случае без средства на основе антитела (в трех повторах, данные не представлены). Это показывает, что только утомилумаб не стимулирует T-клетки с CAR против CD19 для продукции IL-2.
[306] Содержание всех публикаций, патентов, патентных заявок, последовательностей под процитированными номерами доступа в базах данных, и ссылки, включая указания по применению препарата, упомянутых в настоящем описании, приведено в настоящем описании в такой же степени, как если бы было конкретно и индивидуально указано, что содержание каждой индивидуальной публикации, патента или патентной заявки приведено в качестве ссылки. Однако, цитирование ссылки в настоящем описании не следует рассматривать как признание того, что такая ссылка составляет предшествующий уровень техники для настоящего изобретения. В той степени, в которой любые из определений или терминов, представленные в ссылках, приведенных в качестве ссылки, отличаются от терминов и обсуждения, представленных в настоящем описании, термины и определения в настоящем описании имеют преимущество.
ПОСЛЕДОВАТЕЛЬНОСТИ И SEQ ID НОМЕРА
[307] Настоящее описание содержит ряд полипептидных последовательностей. Для удобства, в Таблице 9 ниже приведена корреляция каждой последовательности с соответствующими ей описанием и SEQ ID NO.
H-CDR1
H-CDR2
H-CDR3
L-CDR1
L-CDR2
L-CDR3
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> PFIZER INC.
GILEAD SCIENCES, INC.
<120> Способы проведения иммунотерапии химерным рецептором антигена
в комбинации с агонистом 4-1BB
<130> 36991
<150> 62/617562
<151> 2018-01-15
<160> 10
<170> PatentIn версии 3.5
<210> 1
<211> 116
<212> PRT
<213> Homo sapiens
<400> 1
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Ser Thr Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Lys Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Gly Ile Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 2
<211> 442
<212> PRT
<213> Homo sapiens
<400> 2
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Ser Thr Tyr
20 25 30
Trp Ile Ser Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Lys Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Gly Ile Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe
180 185 190
Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro
210 215 220
Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
340 345 350
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 3
<211> 108
<212> PRT
<213> Homo sapiens
<400> 3
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Ile Gly Asp Gln Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Lys Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Ala Thr Tyr Thr Gly Phe Gly Ser Leu
85 90 95
Ala Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 4
<211> 214
<212> PRT
<213> Homo sapiens
<400> 4
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Asn Ile Gly Asp Gln Tyr Ala
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Lys Asn Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Ala Thr Tyr Thr Gly Phe Gly Ser Leu
85 90 95
Ala Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Thr Glu Cys Ser
210
<210> 5
<211> 6
<212> PRT
<213> Homo sapiens
<400> 5
Ser Thr Tyr Trp Ile Ser
1 5
<210> 6
<211> 17
<212> PRT
<213> Homo sapiens
<400> 6
Lys Ile Tyr Pro Gly Asp Ser Tyr Thr Asn Tyr Ser Pro Ser Phe Gln
1 5 10 15
Gly
<210> 7
<211> 8
<212> PRT
<213> Homo sapiens
<400> 7
Arg Gly Tyr Gly Ile Phe Asp Tyr
1 5
<210> 8
<211> 11
<212> PRT
<213> Homo sapiens
<400> 8
Ser Gly Asp Asn Ile Gly Asp Gln Tyr Ala His
1 5 10
<210> 9
<211> 7
<212> PRT
<213> Homo sapiens
<400> 9
Gln Asp Lys Asn Arg Pro Ser
1 5
<210> 10
<211> 11
<212> PRT
<213> Homo sapiens
<400> 10
Ala Thr Tyr Thr Gly Phe Gly Ser Leu Ala Val
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| CAR-T-КЛЕТКИ, СПЕЦИФИЧЕСКИ НАЦЕЛЕННЫЕ НА АНТИГЕН CD19 | 2020 |
|
RU2826298C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР С КОСТИМУЛИРУЮЩИМ ДОМЕНОМ 4-1BB | 2020 |
|
RU2830540C2 |
| УЛУЧШЕННЫЕ ИММУННЫЕ КЛЕТКИ С ДВОЙНОЙ кшРНК И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2019 |
|
RU2793922C2 |
| ИЗДЕЛИЯ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ АДОПТИВНОЙ КЛЕТОЧНОЙ ТЕРАПИИ | 2018 |
|
RU2795984C2 |
| ХИМЕРНЫЕ РЕЦЕПТОРЫ, СОДЕРЖАЩИЕ TRAF-6-ИНДУЦИРУЮЩИЕ ДОМЕНЫ, И СВЯЗАННЫЕ С НИМИ КОМПОЗИЦИИ И СПОСОБЫ | 2016 |
|
RU2773159C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С MND-ПРОМОТОРОМ | 2015 |
|
RU2799573C2 |
| МЕЧЕНЫЕ ХИМЕРНЫЕ ЭФФЕКТОРНЫЕ МОЛЕКУЛЫ И ИХ РЕЦЕПТОРЫ | 2014 |
|
RU2729463C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С MND-ПРОМОТОРОМ | 2015 |
|
RU2708311C2 |
| СПОСОБЫ МОДУЛИРОВАНИЯ CART-КЛЕТОК | 2017 |
|
RU2774232C2 |
| СПОСОБЫ ЭКСПАНДИРОВАНИЯ АНТИГЕНСПЕЦИФИЧЕСКИХ CAR-T-КЛЕТОК, КОМПОЗИЦИИ И ПРИМЕНЕНИЯ, СВЯЗАННЫЕ С НИМИ | 2019 |
|
RU2800920C2 |
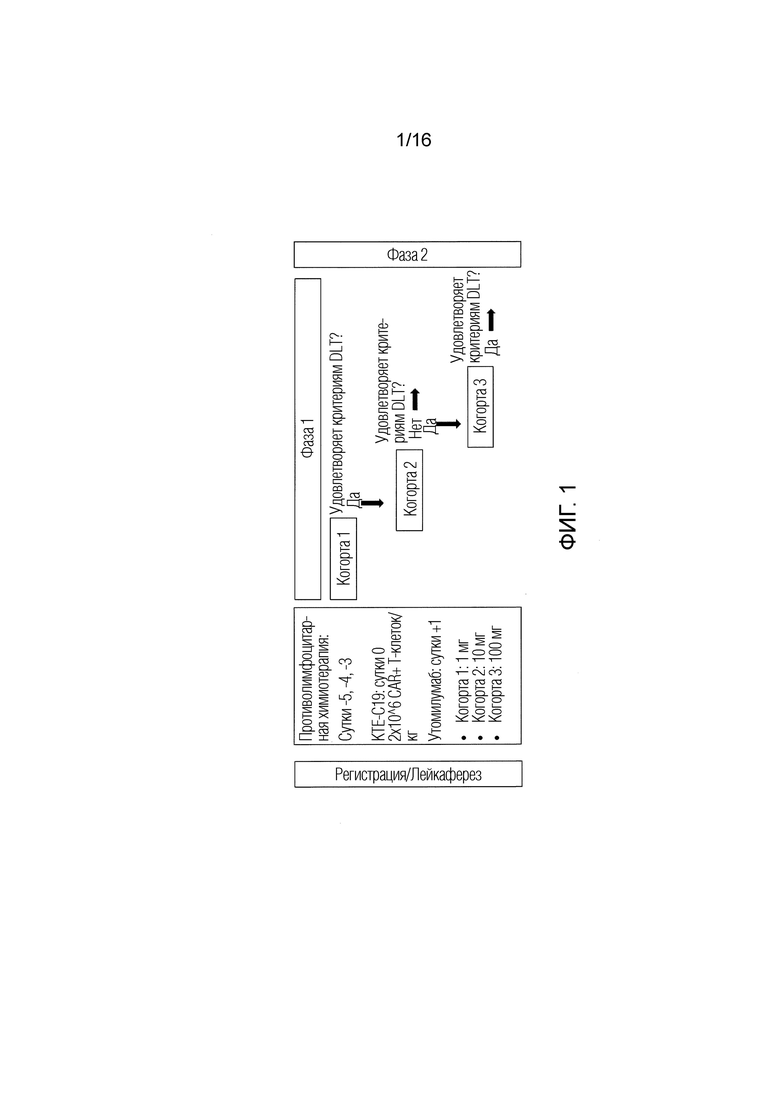

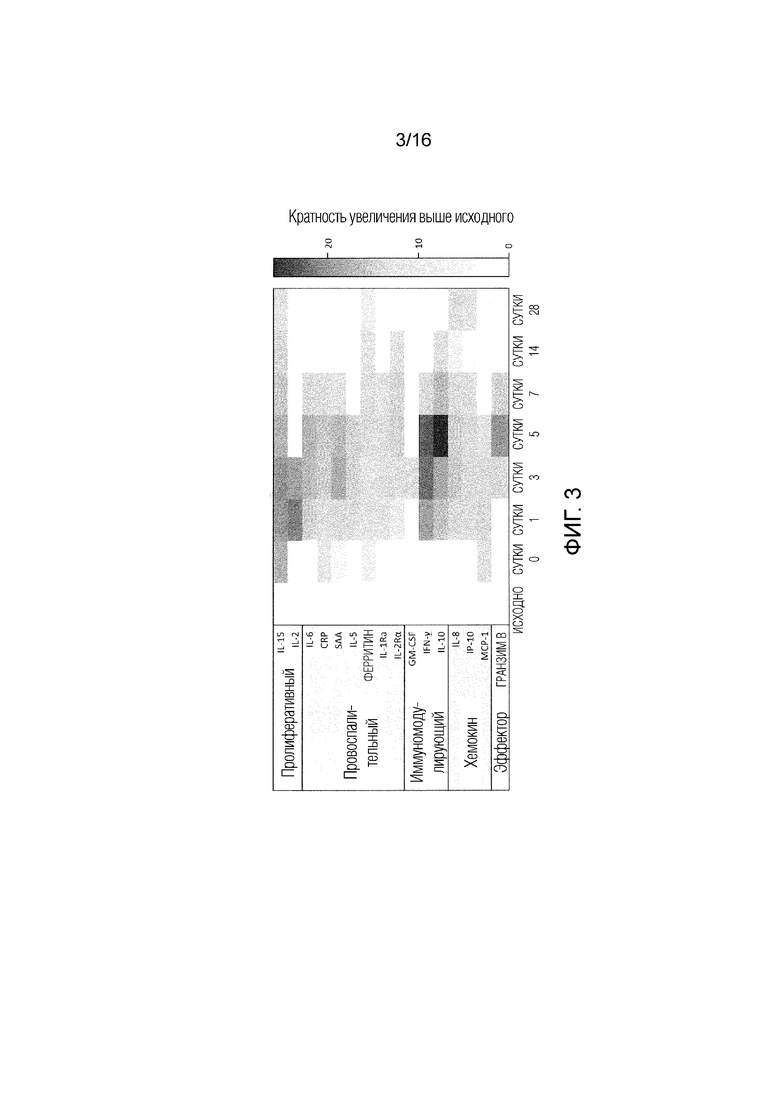


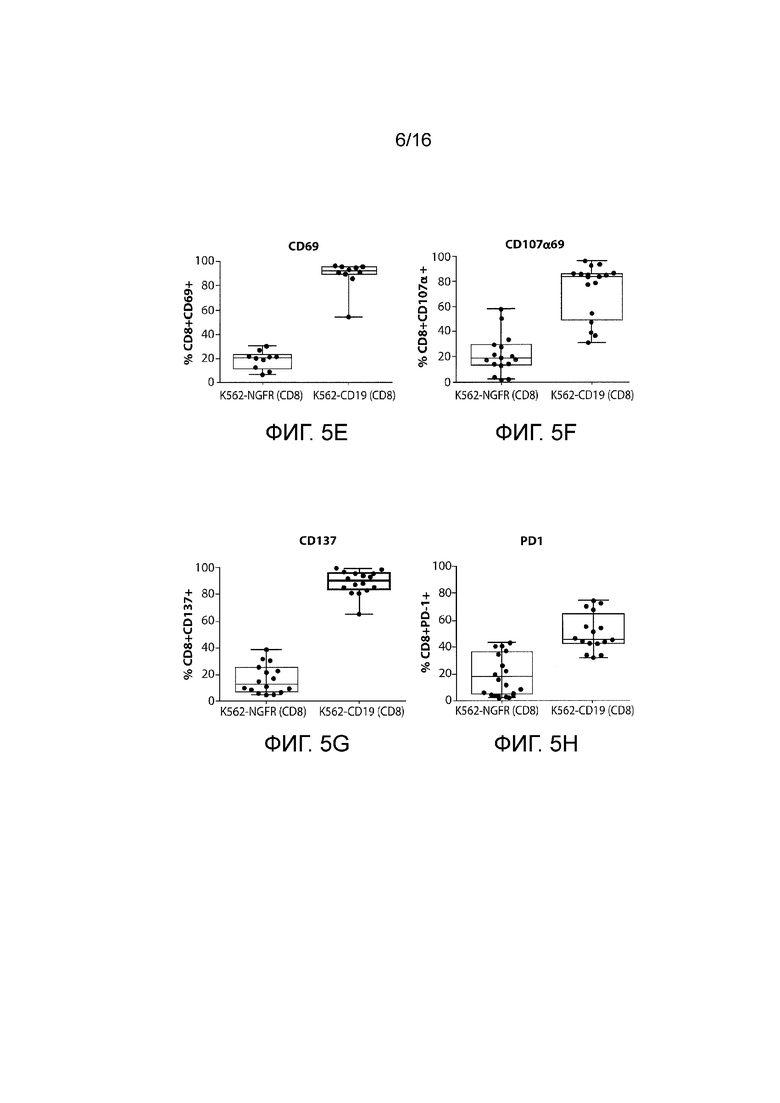
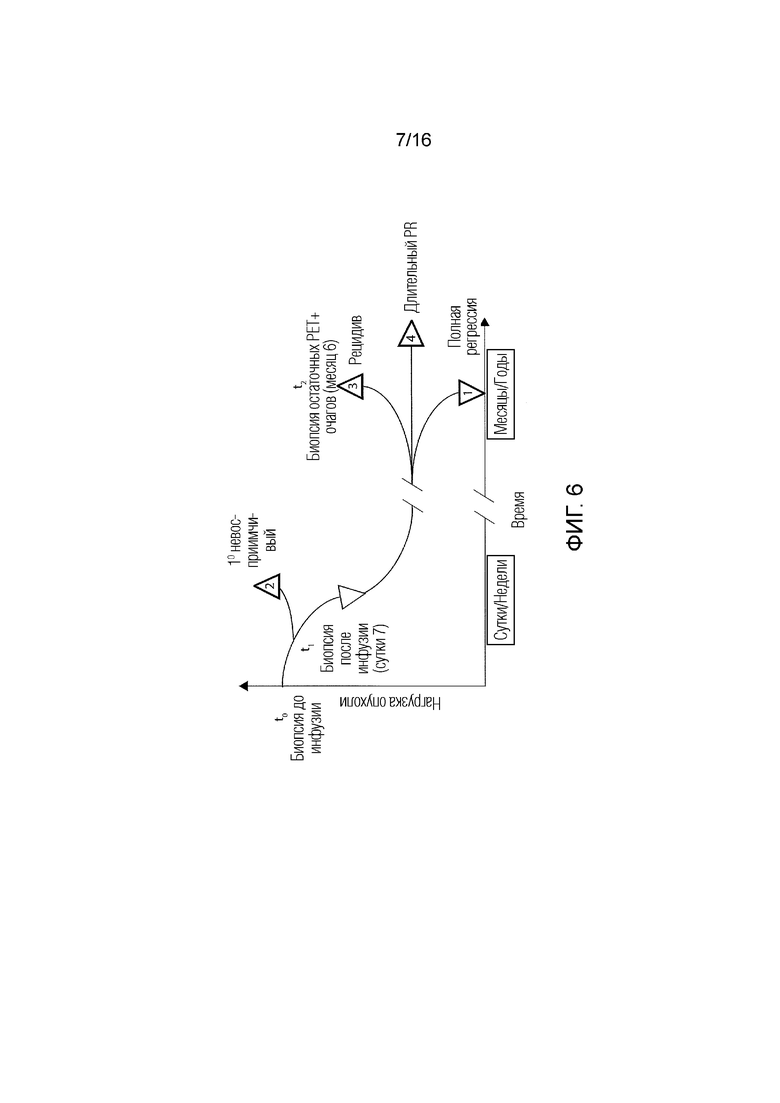
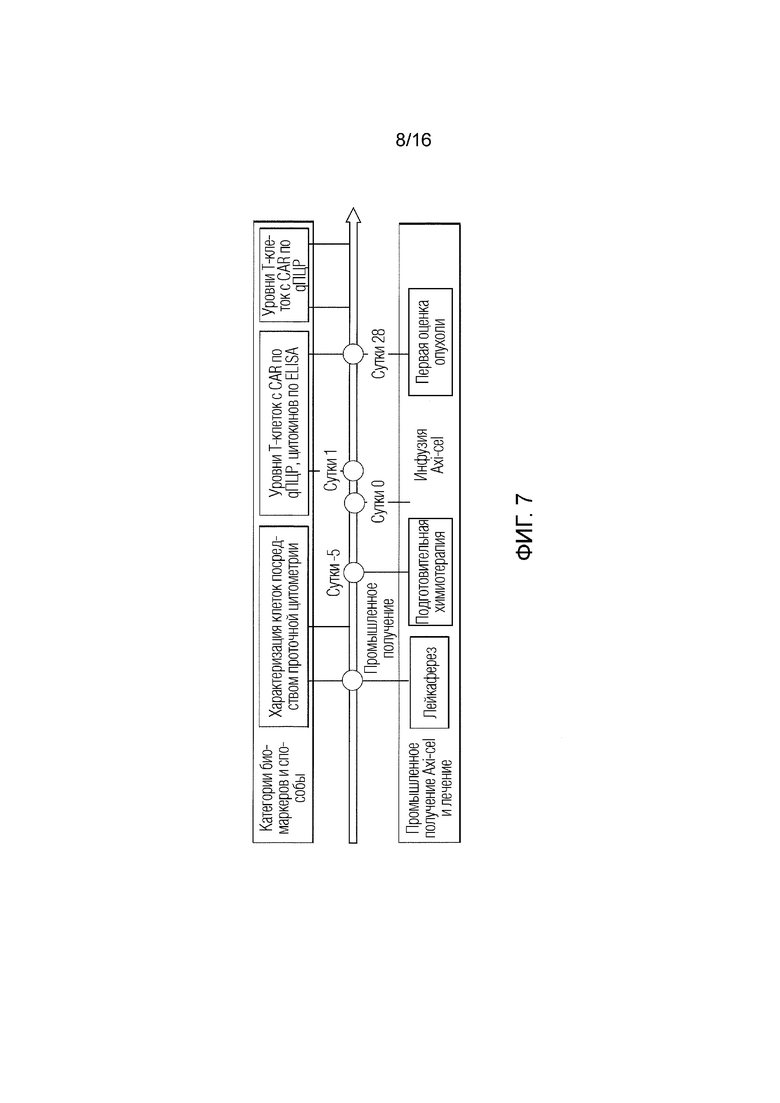
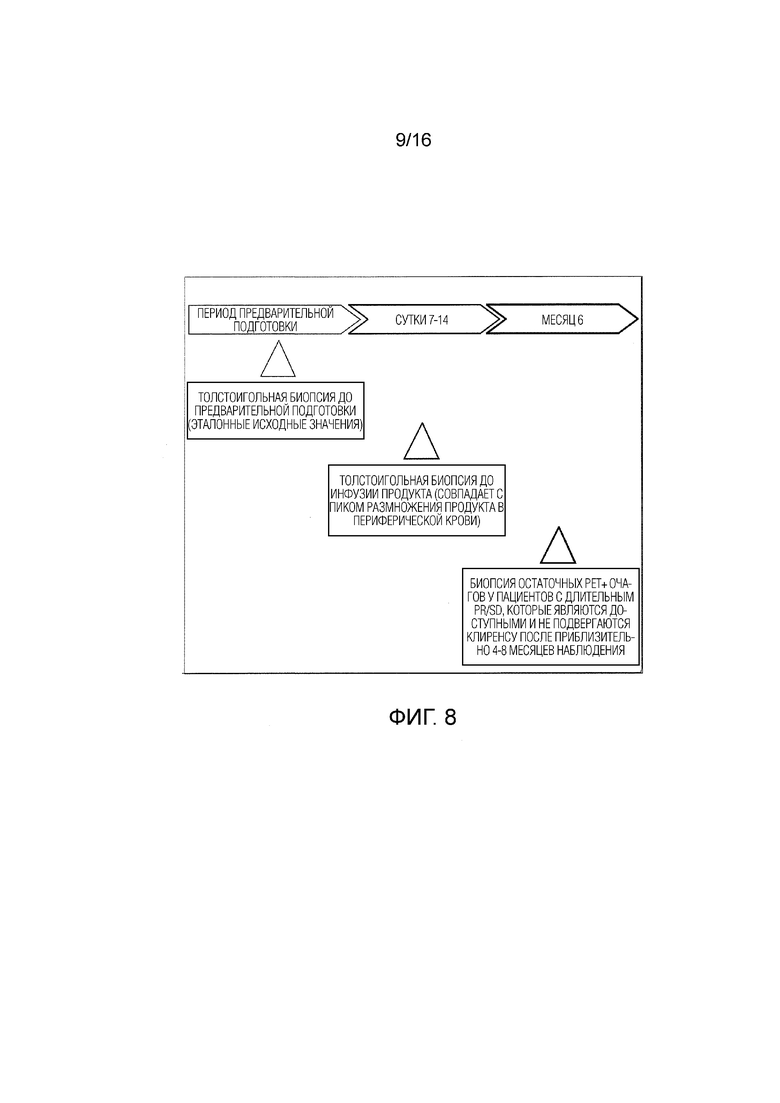
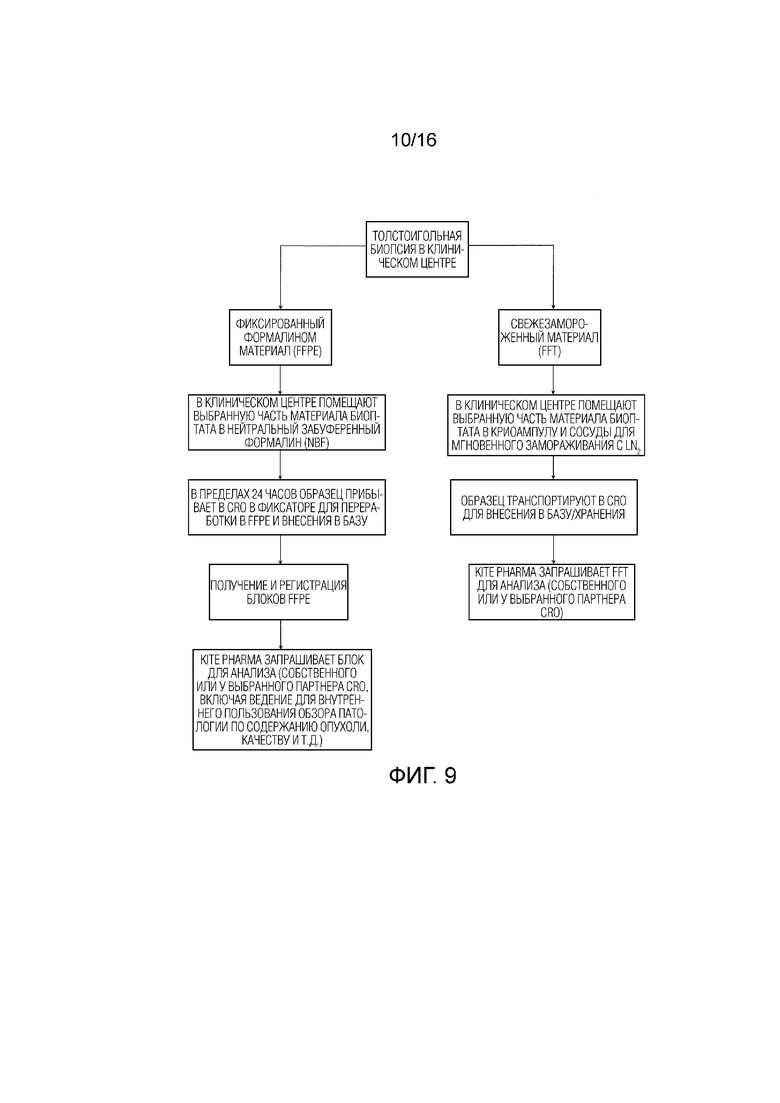
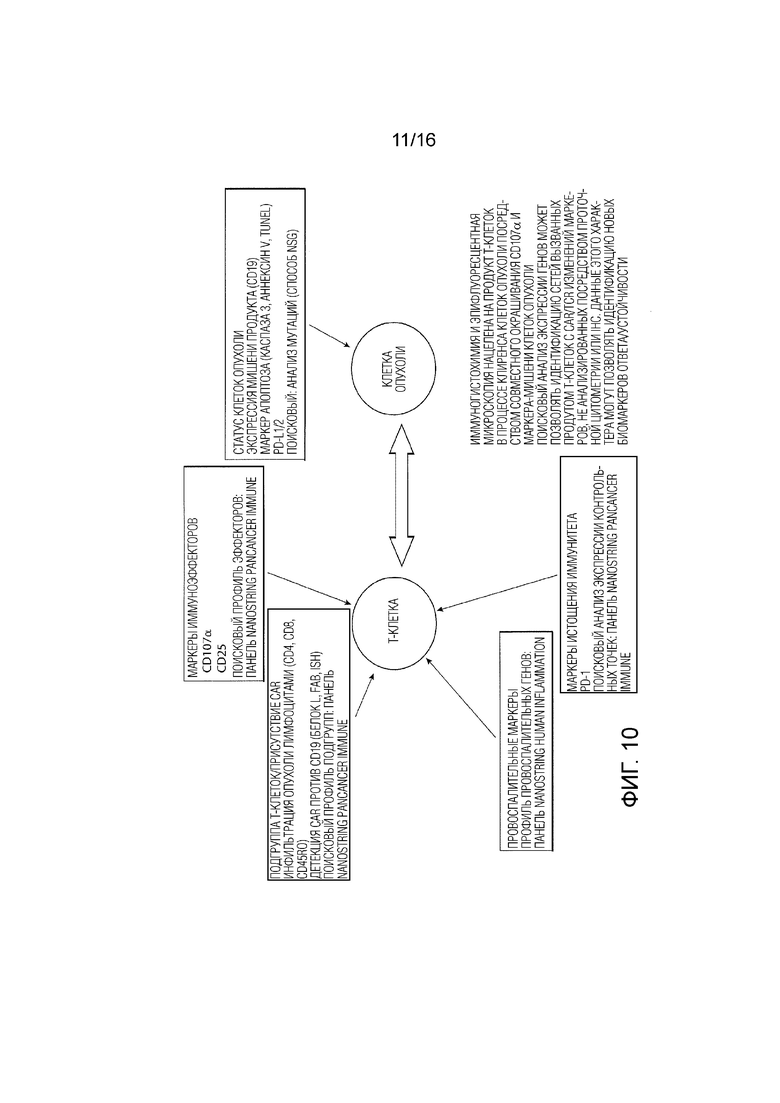



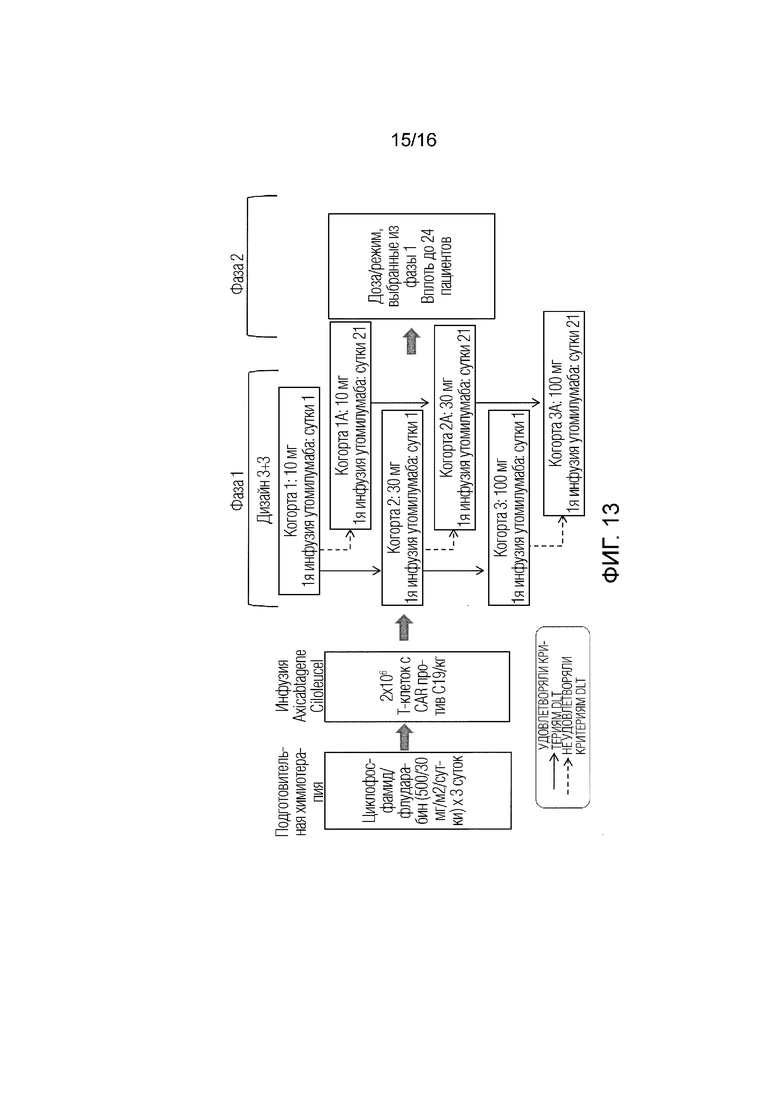
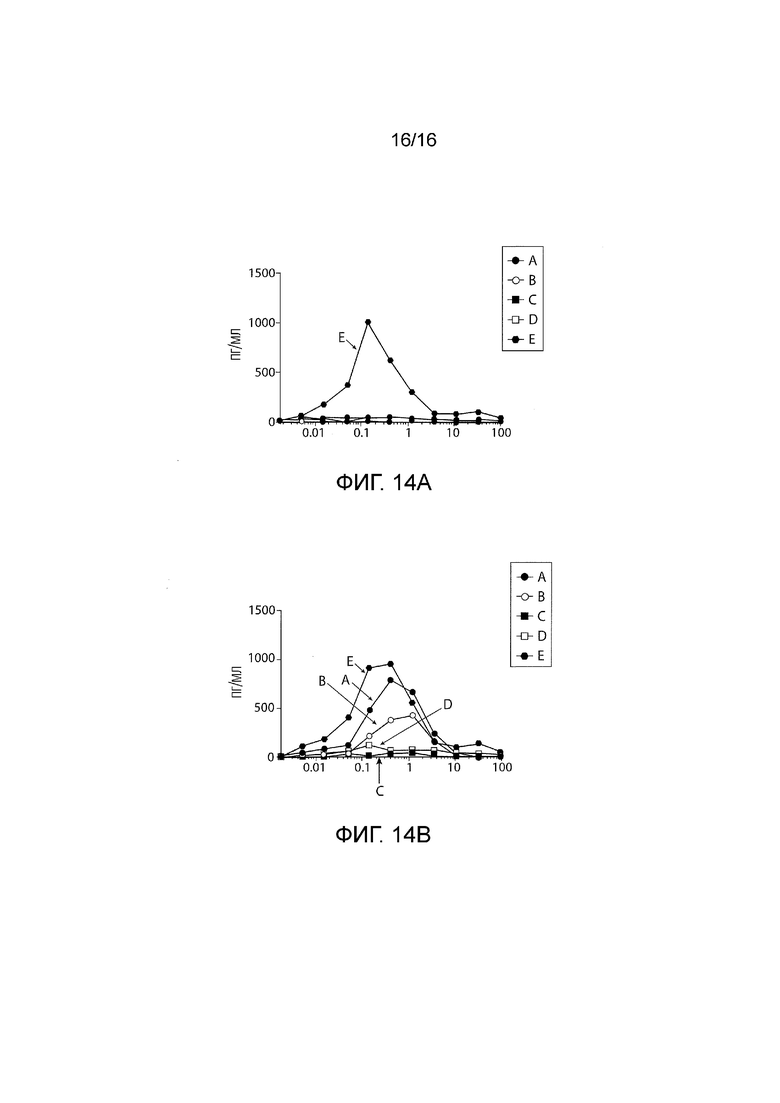
Группа изобретений относится к биотехнологии. Представлены способы лечения B-клеточной лимфомы. При этом способ включает иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками в комбинации с агонистом 4-1BB (CD137). Изобретение может применяться для эффективного лечения B-клеточной лимфомы, включая диффузную крупноклеточную B-клеточную лимфому. 2 н. и 45 з.п. ф-лы, 14 ил., 9 табл., 5 пр.
1. Способ лечения B-клеточной лимфомы у нуждающегося в этом пациента, включающий проведение иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137).
2. Способ по п. 1, где иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аутологичную или аллогенную иммунотерапию.
3. Способ по любому из пп. 1-2, где T-клетки генетически модифицируют ex vivo.
4. Способ по любому из пп. 1-3, где T-клетки генетически модифицируют посредством вирусной трансдукции, ретровирусной трансдукции или лентивирусной трансдукции.
5. Способ по любому из предшествующих пунктов, где иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками включает генетическую модификацию для экспрессии химерного рецептора антигена (CAR), где указанный CAR содержит одноцепочечный вариабельный фрагмент (scFv) антитела против CD19, связанный с костимулирующими доменами CD28 и CD3-дзета.
6. Способ по любому из предшествующих пунктов, где иммунотерапия нацеленными на CD19 генетически модифицированными T-клетками представляет собой аксикабтаген цилолейкел.
7. Способ по любому из предшествующих пунктов, где агонист 4-1BB (CD137) представляет собой антигенсвязывающую молекулу или ее фрагмент.
8. Способ по любому из предшествующих пунктов, где агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие три CDR из аминокислотной последовательности области VH, как указано в SEQ ID NO: 1, и три CDR из аминокислотной последовательности области VL, указанной в SEQ ID NO: 3.
9. Способ по любому из предшествующих пунктов, где агонист 4-1BB (CD137) представляет собой выделенное антитело или его антигенсвязывающую часть, содержащие: (a) H-CDR1, как указано в SEQ ID NO: 5; (b) H-CDR2, как указано в SEQ ID NO: 6; (c) H-CDR3, как указано в SEQ ID NO: 7; (d) L-CDR1, как указано в SEQ ID NO: 8; (e) L-CDR2, как указано в SEQ ID NO: 9; и (f) L-CDR3, как указано в SEQ ID NO: 10.
10. Способ по любому из предшествующих пунктов, где агонист 4-1BB (CD137) представляет собой полностью человеческое моноклональное антитело.
11. Способ по любому из предшествующих пунктов, где агонист 4-1BB (CD137) содержит аминокислотную последовательность области VH, как указано в SEQ ID NO: 1, и аминокислотную последовательность области VL, указанной в SEQ ID NO: 3.
12. Способ по любому из предшествующих пунктов, где агонист 4-1BB (CD137) содержит аминокислотную последовательность тяжелой цепи, как указано в SEQ ID NO: 2, и аминокислотную последовательность легкой цепи, как указано в SEQ ID NO: 4, при условии, что C-концевой остаток лизина из SEQ ID NO: 2, необязательно, отсутствует.
13. Способ по любому из предшествующих пунктов, где агонист 4-1BB (CD137) представляет собой утомилумаб.
14. Способ по любому из предшествующих пунктов, где B-клеточная лимфома выбрана из группы, состоящей из связанной со СПИД лимфомы, положительной по ALK крупноклеточной B-клеточной лимфомы, лимфомы Беркитта, классической лимфомы Ходжкина, диффузной крупноклеточной B-клеточной лимфомы (DLBCL), первичной медиастинальной крупноклеточной B-клеточной лимфомы (PMBCL), фолликулярной лимфомы, внутрисосудистой крупноклеточной B-клеточной лимфомы, крупноклеточной B-клеточной лимфомы, возникающей при ассоциированной с HHV8 многоочаговой болезни Кастлмана, лимфогранулематоза, лимфоплазмоцитарной лимфомы, лимфомы из клеток мантийной зоны (MCL), B-клеточной лимфомы из клеток маргинальной зоны (MZL), лимфомы лимфоидной ткани слизистых оболочек (MALT), узловой B-клеточной лимфомы из клеток маргинальной зоны (NMZL), нодулярной лимфомы Ходжкина с лимфоидным преобладанием, неходжскинской лимфомы, плазмобластной лимфомы, первичной лимфомы центральной нервной системы, первичной выпотной лимфомы, лимфомы маргинальной зоны селезенки (SMZL) и макроглобулинемии Вальденстрема, рецидивирующей или невосприимчивой крупноклеточной B-клеточной лимфомы, неуточненной диффузной крупноклеточной B-клеточной лимфомы (DLBCL), B-клеточной лимфомы на поздних стадиях и DLBCL, развивающейся из фолликулярной лимфомы.
15. Способ по любому из предшествующих пунктов, где B-клеточная лимфома выбрана из группы, состоящей из рецидивирующей или невосприимчивой крупноклеточной B-клеточной лимфомы, неуточненной диффузной крупноклеточной B-клеточной лимфомы (DLBCL), первичной медиастинальной крупноклеточной B-клеточной лимфомы (PMBCL), B-клеточной лимфомы на поздних стадиях и DLBCL, развивающейся из фолликулярной лимфомы.
16. Способ по любому из предшествующих пунктов, где B-клеточная лимфома представляет собой невосприимчивую диффузную крупноклеточную B-клеточную лимфому.
17. Способ по любому из предшествующих пунктов, где иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137)) проводят после двух или более линий системной терапии у пациента.
18. Способ по любому из предшествующих пунктов, где нацеленные на CD19 генетически модифицированные T-клетки для иммунотерапии вводят пациенту посредством внутривенной инфузии в дозе между приблизительно 1×106 и приблизительно 2×106 положительных по CAR жизнеспособных T-клеток на кг массы тела, вплоть до максимальной дозы приблизительно 1×108 положительных по CAR жизнеспособных T-клеток.
19. Способ по любому из предшествующих пунктов, где иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками проводят только один раз.
20. Способ по любому из пп. 1-19, где иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками проводят более одного раза.
21. Способ по любому из предшествующих пунктов, где агонист 4-1BB (CD137) вводят посредством внутривенной инфузии.
22. Способ по любому из предшествующих пунктов, где агонист 4-1BB (CD137) вводят в дозе, лежащей в диапазоне от приблизительно 1 мг до приблизительно 200 мг.
23. Способ по п. 22, где агонист 4-1BB (CD137) вводят в дозе приблизительно 1 мг, приблизительно 10 мг, приблизительно 30 мг, приблизительно 100 мг или приблизительно 200 мг.
24. Способ по любому из предшествующих пунктов, где иммунотерапию нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137) проводят одновременно.
25. Способ по любому из пп. 1-23, где нацеленные на CD19 генетически модифицированные T-клетки вводят до агониста 4-1BB (CD137).
26. Способ по п. 25, где первую дозу агониста 4-1BB (CD137) вводят за сутки до инфузии иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками.
27. Способ по любому из пп. 1-24, где нацеленные на CD19 генетически модифицированные T-клетки для иммунотерапии вводят после агониста 4-1BB (CD137).
28. Способ по любому из предшествующих пунктов, где дозирование агониста 4-1BB (CD137) продолжают, пока для пациентов не покажут полную ремиссию, отсутствие ответа/прогрессирующее заболевание или в течение приблизительно 1 года.
29. Способ по любому из предшествующих пунктов, где агонист 4-1BB (CD137) вводят приблизительно каждые 4 недели.
30. Способ по любому из предшествующих пунктов, где пациента подвергают режиму подготовительной химиотерапии до проведения иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками и агонистом 4-1BB (CD137).
31. Способ по любому из предшествующих пунктов, дополнительно включающий мониторирование у пациента после введения признаков и симптомов неблагоприятной реакции.
32. Способ по п. 31, где неблагоприятная реакция выбрана из группы, состоящей из синдрома высвобождения цитокинов (CRS), неврологической токсичности, реакции гиперчувствительности, серьезной инфекции, цитопении и гипогаммаглобулинемии.
33. Способ по любому из предшествующих пунктов, дополнительно включающий мониторирование у пациента после введения изменений маркеров фенотипа и активации мононуклеарных клеток периферической крови (PBMC) пациента.
34. Способ по п. 33, где маркеры фенотипа и активации PBMC пациента включают маркер пан-T-клеток, маркер цитотоксических T-клеток, маркер дифференцировки T-клеток, маркер дифференцировки, рецептор IL-2, маркер активации, PD1, 4-1BB, маркер T-клеток-помощников, маркер гранулоцитов, маркер B-клеток, маркер моноцитов/макрофагов, маркер клеток NK и/или идентификацию аксикабтаген цилолейкел.
35. Способ по п. 33 или 34, где маркеры фенотипа и активации PBMC пациента мониторируют посредством панели, содержащей антитела против CD3, CD4, CD8, CD45RA, CCR7, CD122, CD27, CD28, CD95, CD57, CD107α, CD279, CD25, CD69, CD137, CD66b, CD19, CD14, CD56 и/или CAR против CD19.
36. Способ по любому из пп. 33-35, где маркеры определяют посредством анализа проточной цитометрии.
37. Способ по любому из предшествующих пунктов, дополнительно включающий мониторирование в сыворотке пациента после введения уровней хемокинов, цитокинов и/или иммунных эффекторов.
38. Способ по п. 37, где в сыворотке пациента мониторируют IL-15, IL-7, IL-2, IL-6, IL1α, IL-1β, IL-17α, TNFα, TNFβ, GM-CSF, CRP, SAA, IL-13, IL-4, IL-5, IL-10, IFNγ, IL-12p40, IL-12p70, IL-16, IL-8, MCP-1, MCP-4, MIP-1α, MIP-1β, IP-10, TARC, эотаксин, эотаксин-3, MDC, гранзим A, гранзим B, sFASL, перфорин, FGF-2, sICAM-1.
39. Способ по п. 37, где уровни хемокинов, цитокинов и/или иммунных эффекторов определяют с использованием мультиплексного анализа.
40. Способ по любому из предшествующих пунктов, дополнительно включающий анализ ответа пациента после введения по регрессии [полному ответу (CR) или частичному ответу (PR)], невосприимчивости к лечению [прогрессирующему заболеванию (PD)], рецидиву или персистенции без доказательств прогрессирования или полной регрессии [длительному PR или стабильному заболеванию (SD)].
41. Способ по п. 40, где анализ ответа пациента после введения включает анализ маркеров фенотипа и активации PBMC пациента, включающий маркер пан-T-клеток, маркер цитотоксических T-клеток, маркер дифференцировки T-клеток, маркер дифференцировки, рецептор IL-2, маркер активации, PD1, 4-1BB, маркер T-клеток-помощников, маркер гранулоцитов, маркер B-клеток, маркер моноцитов/макрофагов, маркер клеток NK, и/или идентификацию аксикабтаген цилолейкел.
42. Способ по п. 41, где маркеры фенотипа и активации PBMC пациента мониторируют посредством панели, содержащей антитела против CD3, CD4, CD8, CD45RA, CCR7, CD122, CD27, CD28, CD95, CD57, CD107α, CD279, CD25, CD69, CD137, CD66b, CD19, CD14, CD56 и/или CAR против CD19.
43. Способ по любому из пп. 40-42, где в сыворотке пациента мониторируют IL-15, IL-7, IL-2, IL-6, IL1α, IL-1β, IL-17α, TNFα, TNFβ, GM-CSF, CRP, SAA, IL-13, IL-4, IL-5, IL-10, IFNγ, IL-12p40, IL-12p70, IL-16, IL-8, MCP-1, MCP-4, MIP-1α, MIP-1β, IP-10, TARC, эотаксин, эотаксин-3, MDC, гранзим A, гранзим B, sFASL, перфорин, FGF-2, sICAM-1, sVCAM-1, VEGF, VEGF-C, VEGF-D, PLGF, IL1Rα, IL1Rβ и/или ферритин.
44. Способ по п. 1, дополнительно включающий
(c) мониторирование у пациента после введения изменений маркеров фенотипа и активации мононуклеарных клеток периферической крови (PBMC) пациента, где B-клеточная лимфома является невосприимчивой диффузной крупноклеточной B-клеточной лимфомой.
45. Способ по п. 1, дополнительно включающий
(c) мониторирование в сыворотке пациента после введения уровней хемокинов, цитокинов и/или иммунных эффекторов, где B-клеточная лимфома является невосприимчивой диффузной крупноклеточной B-клеточной лимфомой.
46. Способ по п. 1, дополнительно включающий
(c) анализ ответа пациента после введения по регрессии [полному ответу (CR) или частичному ответу (PR)], невосприимчивости к лечению [прогрессирующему заболеванию (PD)], рецидиву или персистенции без доказательств прогрессирования или полной регрессии [длительному PR или стабильному заболеванию (SD)], где B-клеточная лимфома является невосприимчивой диффузной крупноклеточной B-клеточной лимфомой.
47. Способ лечения B-клеточной лимфомы у нуждающегося в этом пациента, включающий:
(a) подвергание пациента иммунотерапии нацеленными на CD19 генетически модифицированными T-клетками;
(b) введение пациенту агониста 4-1BB (CD137); и
(c) мониторирование у пациента после введения признаков и симптомов неблагоприятной реакции.
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Спускная труба при плотине | 0 |
|
SU77A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| WO 2017028374 A1, 23.02.2017 | |||
| МЕТОД ИММУНОТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ОСНОВЕ ОНКОЛИТИЧЕСКОГО ВИРУСА СЕНДАЙ | 2012 |
|
RU2519763C9 |
Авторы
Даты
2023-01-23—Публикация
2019-01-15—Подача