Область техники
[0001] Настоящее изобретение относится к анализам активности для использования в тестировании возможности использования композиции в воспалительных состояний.
УРОВЕНЬ ТЕХНИКИ
[0002] Законодательные акты во многих юрисдикциях требуют, чтобы фармацевтические препараты, содержащие множество активных соединений, точный состав которых может быть даже не полностью известен, были оценены по их активности перед выпуском на рынок. Обычно каждую полученную партию необходимо оценивать по ее активности с использованием соответствующих анализов активности.
[0003] Анализы активности можно использовать, чтобы показать, что специфический продукт имеет биологическую активность, важную для лечения заболеваний или нарушений. От анализов активности не требуют отражения всех биологических функций продукта, но они должны показывать одну или несколько важных биологических функций. Существует настоятельная необходимость в идентификации тех параметров, которые являются критическими для эффективности терапевтических продуктов и для их контроля (например, посредством тестирования активности), так чтобы являлось возможным изготовление продуктов постоянного качества. Главным преимуществом анализов активности является тот факт, что с использованием идентификации и/или количественной оценки небольшого количества «репортерных» белков или видов активности ферментов (например, 2, 3, 4 или 5, в идеале только 1) в комплексных фармацевтических препаратах, можно определять терапевтическую пригодность указанного препарата.
[0004] Известно, что клетки, в частности клетки млекопитающих, секретируют множество веществ в ходе культивирования в среде для культивирования клеток. Полученные таким образом кондиционированные культуральные среды можно использовать для лечения и/или предотвращения заболеваний и нарушений. Например, в WO 2010/070105 и WO 2010/079086 описаны кондиционированные культуральные среды («супернатанты»), которые получены посредством культивирования мононуклеарных клеток периферической крови (PBMC) и которые можно использовать в лечении различных воспалительных состояний.
Сущность изобретения
[0005] Бесклеточная или содержащая клетки кондиционированная культуральная среда, которую можно получать посредством культивирования PBMC, подвергнутых, до или во время культивирования, воздействию индуцирующих стресс условий, оказалась эффективной в лечении различных заболеваний, ассоциированных, среди прочего, с воспалением (см. WO 2010/070105 и WO 2010/079086). Поскольку такая кондиционированная культуральная среда содержит, среди прочего, множество веществ, секретированных или высвобожденных PBMC, которые могут влиять на биологическую активность кондиционированной среды, является важным наличие анализа, показывающего, имеет ли указанная среда желательную активность.
[0006] Таким образом, целью настоящего изобретения является предоставление анализа, позволяющего определение того, имеет ли кондиционированная культуральная среда, которую можно получать посредством культивирования PBMC, активность для лечения заболеваний и нарушений, ассоциированных с воспалением. Такой анализ является полезным, чтобы показать постоянную активность среди различных лотов продуктов кондиционированной культуральной среды, приемлемых для фармацевтического использования.
[0007] Авторы изобретения обнаружили анализ активности для измерения биологической активности и терапевтической эффективности кондиционированных культуральных сред посредством мониторирования экспрессии специфических белков и/или регуляции конкретных промоторов. Неожиданно оказалось, что кондиционированная культуральная среда, которую можно получать посредством культивирования PBMC и которая имеет активность для лечения заболеваний и нарушений, ассоциированных с воспалением, является способной индуцировать экспрессию фосфорилированного белка теплового шока 27 (HSP27) в эукариотических клетках, когда эти клетки инкубируют в указанной кондиционированной культуральной среде. Кроме того, кондиционированная культуральная среда активирует по меньшей мере один промотор выбранный из группы, состоящей из промотора активирующего белка 1 (AP-1), промотора ядерного фактора энхансера гена легкой цепи каппа в активированных В-клетках, (NF-κB), промотора бокса 2 области определения пола Y (Sox2), промотора передатчика сигнала и активатора транскрипции 3 (STAT3), промотора белка 1 ответа роста на ранних стадиях (EGR-1) и промотора элемента ответа на сыворотку (SRE) в эукариотических клетках. Таким образом, увеличенная экспрессия фосфорилированного HSP27 и активация промоторов AP-1, NF-κB, Sox2, STAT3, EGR-1 и/или SRE показывает, что кондиционированную культуральную среду, которую можно получать посредством культивирования PBMC, можно использовать в лечении заболеваний и нарушений, ассоциированных с воспалением.
[0008] Таким образом, настоящее изобретение относится к способу определения активности супернатанта культуры клеток млекопитающих для использования в лечении воспалительного состояния, включающему стадии
a) инкубации эукариотических клеток в культуральной среде, содержащей или состоящей из указанного супернатанта,
b) измерения промоторной активности по меньшей мере одного промотора, выбранного из группы, состоящей из промотора активирующего белка 1 (AP-1), промотора ядерного фактора энхансера гена легкой цепи каппа в активированных В-клетках (NF-κB), промотора бокса 2 области определения пола Y (Sox2), промотора передатчика сигнала и активатора транскрипции 3 (STAT3), промотора белка 1 ответа роста на ранних стадиях (EGR-1) и промотора элемента ответа на сыворотку (SRE), и/или измерения количества фосфорилированного белка теплового шока 27 (HSP27) высвобожденного эукариотическими клетками в культуральную среду со стадии a),
где супернатант культуры клеток млекопитающих имеет потенциал для использования в лечении воспалительного состояния, если промоторная активность по меньшей мере одного промотора по меньшей мере на 50% выше, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта, и/или если количество фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), по меньшей мере на 20% выше, по сравнению с количеством фосфорилированного HSP27, высвобожденного в культуральную среду, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта.
[0009] Способ определения активности супернатанта культуры клеток млекопитающих для использования в лечении воспалительного состояния, включающий стадии
a) инкубации эукариотических клеток в культуральной среде, содержащей или состоящей из указанного супернатанта,
b) измерения промоторной активности по меньшей мере одного промотора, выбранного из группы, состоящей из промотора активирующего белка 1 (AP-1), промотора ядерного фактора энхансера гена легкой цепи каппа в активированных В-клетках (NF-κB), промотора бокса 2 области определения пола Y (Sox2), промотора передатчика сигнала и активатора транскрипции 3 (STAT3), промотора белка 1 ответа роста на ранних стадиях (EGR-1) и промотора элемента ответа на сыворотку (SRE) и/или измерения количества фосфорилированного белка теплового шока 27 (HSP27) высвобожденного эукариотическими клетками в культуральную среду со стадии a),
где супернатант культуры клеток млекопитающих имеет потенциал для использования в лечении воспалительного состояния, если промоторная активность по меньшей мере одного промотора на вплоть до 25% выше или ниже, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, содержащей эталонный супернатант клеток млекопитающих, который можно использовать в лечении воспалительного состояния, и/или если количество фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), на вплоть до 25% выше или ниже, по сравнению с количеством фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), содержащую эталонный супернатант клеток млекопитающих, который можно использовать в лечении воспалительного состояния.
[0010] В одном варианте осуществления настоящего изобретения, супернатант культуры клеток млекопитающих представляет собой супернатант культуры мононуклеарных клеток периферической крови (PBMC).
[0011] В другом варианте осуществления настоящего изобретения, культура клеток млекопитающих содержит T-клетки, B-клетки и/или клетки NK.
[0012] В следующем варианте осуществления настоящего изобретения, клетки млекопитающих в культуре клеток млекопитающих культивируют в среде для культивирования клеток, выбранной из группы, состоящей из среды для роста клеток, предпочтительно, среды CellGro (CellGenix, Freiburg, Germany), более предпочтительно, среды Cellgro GMP DC (также известной как «среда CellGenix GMP DC»; CellGenix, Freiburg, Germany), RPMI, DMEM, X-vivo и Ultraculture.
[0013] В одном варианте осуществления настоящего изобретения, клетки млекопитающих подвергают воздействию одного или нескольких индуцирующих стресс условий до или во время культивирования.
[0014] В другом варианте осуществления настоящего изобретения, индуцирующее стресс условие выбрано из группы, состоящей из облучения, в частности, ионизирующего излучения или облучения УФ, гипоксии, озона, нагревания, осмотического давления и сдвига pH.
[0015] В одном варианте осуществления настоящего изобретения, клетки млекопитающих подвергают воздействию ионизирующего излучения в дозе по меньшей мере 10 Гр, предпочтительно, по меньшей мере 20 Гр, более предпочтительно, по меньшей мере 40 Гр.
[0016] В следующем варианте осуществления настоящего изобретения, клетки млекопитающих культивируют в течение по меньшей мере 4 час, предпочтительно, в течение по меньшей мере 6 час, более предпочтительно, в течение по меньшей мере 12 час, до выделения их супернатанта.
[0017] В одном варианте осуществления настоящего изобретения, воспалительное состояние представляет собой состояние, ассоциированное с ишемией, предпочтительно, состояние кожи или внутреннее воспалительное состояние.
[0018] В следующем варианте осуществления настоящего изобретения, состояние кожи выбрано из группы, состоящей из ран, ишемии ткани, хронических ран, диабетических ран, кожной язвы, ожогов кожи, кожных лоскутов при пластической хирургии и регенерации ткани после стоматологической имплантации.
[0019] В одном варианте осуществления настоящего изобретения, внутреннее воспалительное состояние выбрано из группы, состоящей из ишемии миокарда, ишемии конечностей, ишемии ткани, ишемически-реперфузионного повреждения, стенокардии, болезни коронарных артерий, заболевания периферических сосудов, заболевания периферических артерий, инсульта, ишемического инсульта, инфаркта миокарда, застойной сердечной недостаточности, травмы, заболевания кишечника, инфаркта брыжейки, инфаркта легкого, перелома кости, регенерации ткани после стоматологической имплантации, аутоиммунных заболеваний, ревматических заболеваний, трансплантации аллотрансплантата и отторжения аллотрансплантата.
[0020] В другом варианте осуществления настоящего изобретения, эукариотические клетки со стадии a) выбраны из группы, состоящей из базальных эпителиальных клеток пораженных аденокарциномой альвеол человека, предпочтительно, клеток A549, анеуплоидных иммортализованных клеток кератиноцитов (HaCaT), клеток эмбриональной почки человека (клеток HEK), предпочтительно, клеток HEK293, и клеток нейробластомы, предпочтительно, клеток SH-SY5Y.
[0021] В следующем варианте осуществления настоящего изобретения, эукариотические клетки со стадии a) инкубируют в среде для культивирования клеток в течение по меньшей мере 2 часов, предпочтительно, по меньшей мере 4 часов, более предпочтительно, по меньшей мере 6 часов, более предпочтительно, по меньшей мере 12 часов, более предпочтительно, по меньшей мере 18 часов, более предпочтительно, по меньшей мере 24 часов.
[0022] В одном варианте осуществления настоящего изобретения, культуральная среда содержит по меньшей мере 20%, предпочтительно по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%, более предпочтительно, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, указанного супернатанта.
[0023] В другом варианте осуществления настоящего изобретения, среда для культивирования клеток со стадии a) представляет собой среду Игла в модификации Дульбекко (DMEM), среду Хэма F12 (F12), минимальную эссенциальную среду или комбинацию одной или нескольких из этих сред.
[0024] В одном варианте осуществления настоящего изобретения, среда для культивирования клеток со стадии a) содержит 2-20%, предпочтительно, 5-15%, эмбриональной бычьей сыворотки(FBS) и/или L-аланил-L-глутамина.
[0025] В следующем варианте осуществления настоящего изобретения, эукариотические клетки содержат по меньшей мере одну экспрессирующую кассету, содержащую промотор, выбранный из группы, состоящей из промотора AP-1, промотора NF-κB, промотора Sox2, промотора STAT3, промотора EGR-1 и промотора SRE, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0026] В одном варианте осуществления настоящего изобретения, репортерный белок выбран из группы, состоящей из люциферазы, предпочтительно, люциферазы светляка, и флуоресцентного белка, предпочтительно, зеленого флуоресцентного белка.
[0027] В другом варианте осуществления настоящего изобретения, количество белка, высвобожденного клетками в культуральную среду, определяют посредством иммунологического способа, предпочтительно, посредством твердофазного иммуноферментного анализа (ELISA), посредством фотометрического способа или посредством флуоресцентного способа.
[0028] В одном варианте осуществления настоящего изобретения, эукариотические клетки со стадии a) представляют собой базальные эпителиальные клетки пораженных аденокарциномой альвеол человека, предпочтительно, клетки A549, клетки HaCaT или HEK, предпочтительно, клетки HEK293, и определяют количество фосфорилированного HSP27.
[0029] В следующем варианте осуществления настоящего изобретения, промоторная активность по меньшей мере одного промотора по меньшей мере на 80%, предпочтительно, по меньшей мере на 100%, более предпочтительно, по меньшей мере на 150%, более предпочтительно, по меньшей мере на 200%, выше, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта.
[0030] В одном варианте осуществления настоящего изобретения, эукариотические клетки со стадии a) представляют собой базальные эпителиальные клетки пораженных аденокарциномой альвеол человека, предпочтительно, клетки A549, клетки HaCaT или клетки HEK, предпочтительно, клетки HEK293, когда измеряют количество фосфорилированного HSP27, высвобожденного в культуральную среду.
[0031] В другом варианте осуществления настоящего изобретения, эукариотические клетки со стадии a) представляют собой клетки нейробластомы, предпочтительно, клетки SH-SY5Y, или клетки HaCaT, содержащие по меньшей мере одну экспрессирующую кассету, содержащую промотор AP-1, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0032] В одном варианте осуществления настоящего изобретения, эукариотические клетки со стадии a) представляют собой базальные эпителиальные клетки пораженных аденокарциномой альвеол человека, предпочтительно, клетки A549, содержащие по меньшей мере одну экспрессирующую кассету, содержащую промотор NF-κB или Sox2, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0033] В следующем варианте осуществления настоящего изобретения, эукариотические клетки со стадии a) представляют собой клетки HEK, предпочтительно, клетки HEK293, содержащие по меньшей мере одну экспрессирующую кассету, содержащую промотор EGR-1, SRE, AP-1 или STAT3, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
Краткое описание чертежей
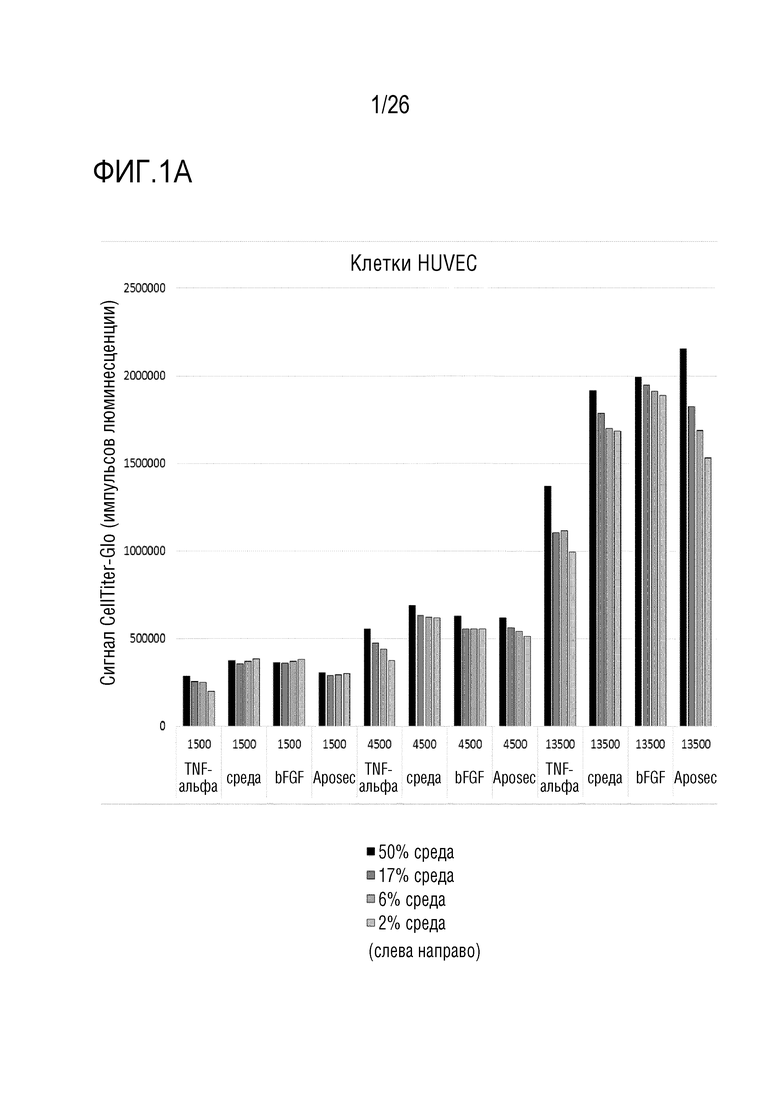
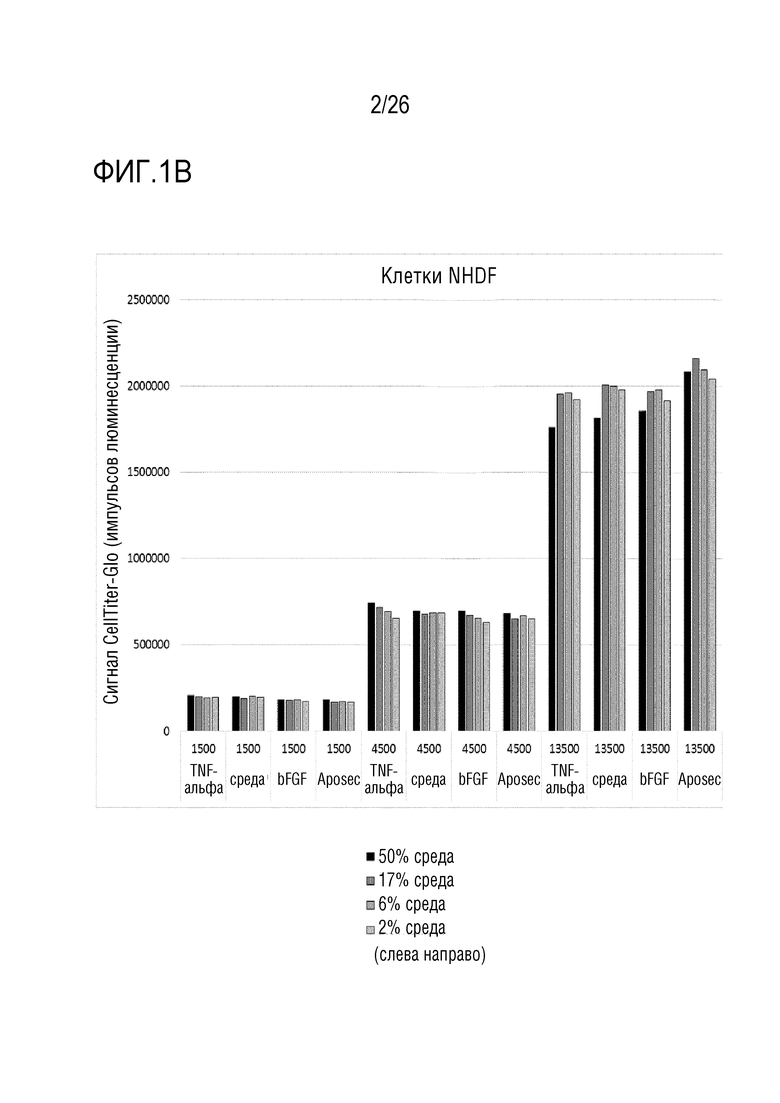
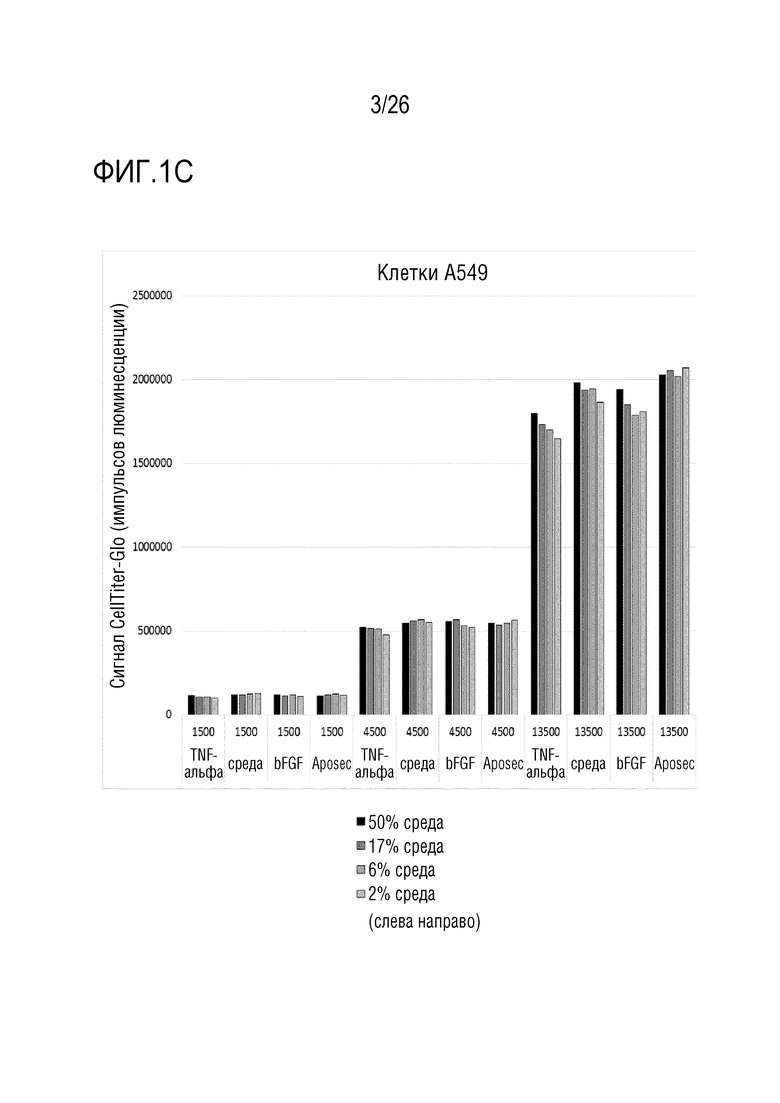
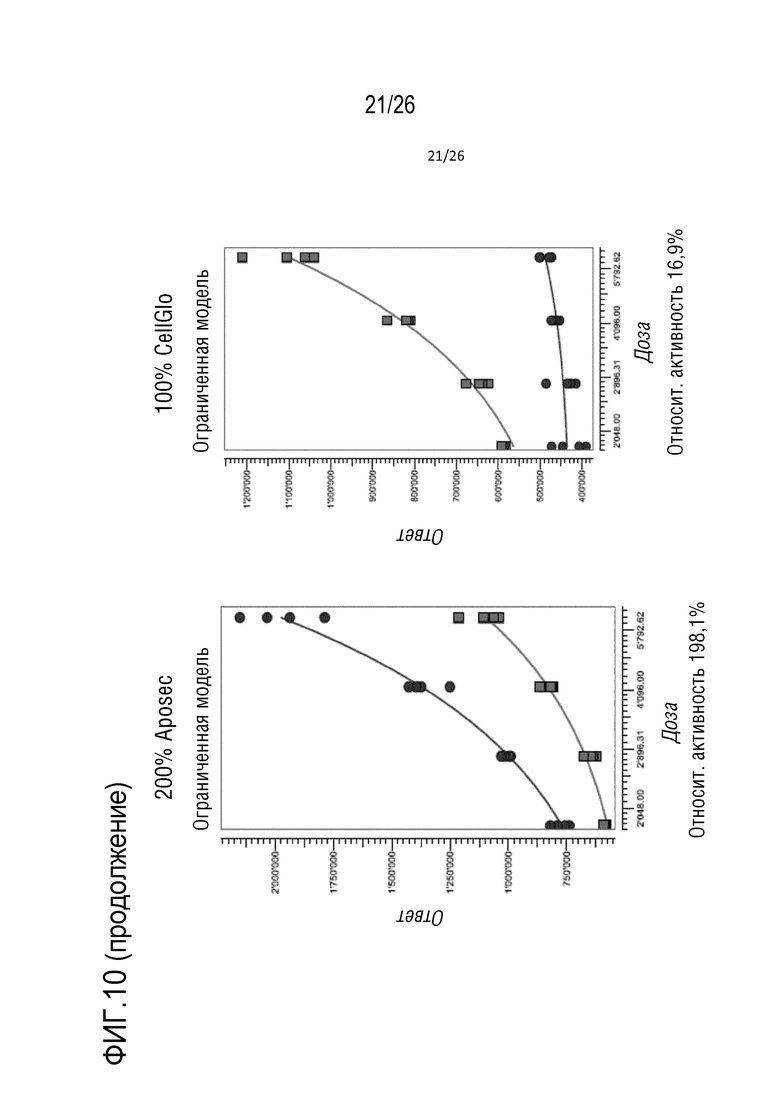
[0034] На фиг. 1 показаны результаты анализа пролиферации (пример 1). На графиках указаны количества клеток при пролиферации в течение ночи (сигнал CellTiter-Glo). A. клетки HUVEC; B: клетки NHDF; C: клетки A549.
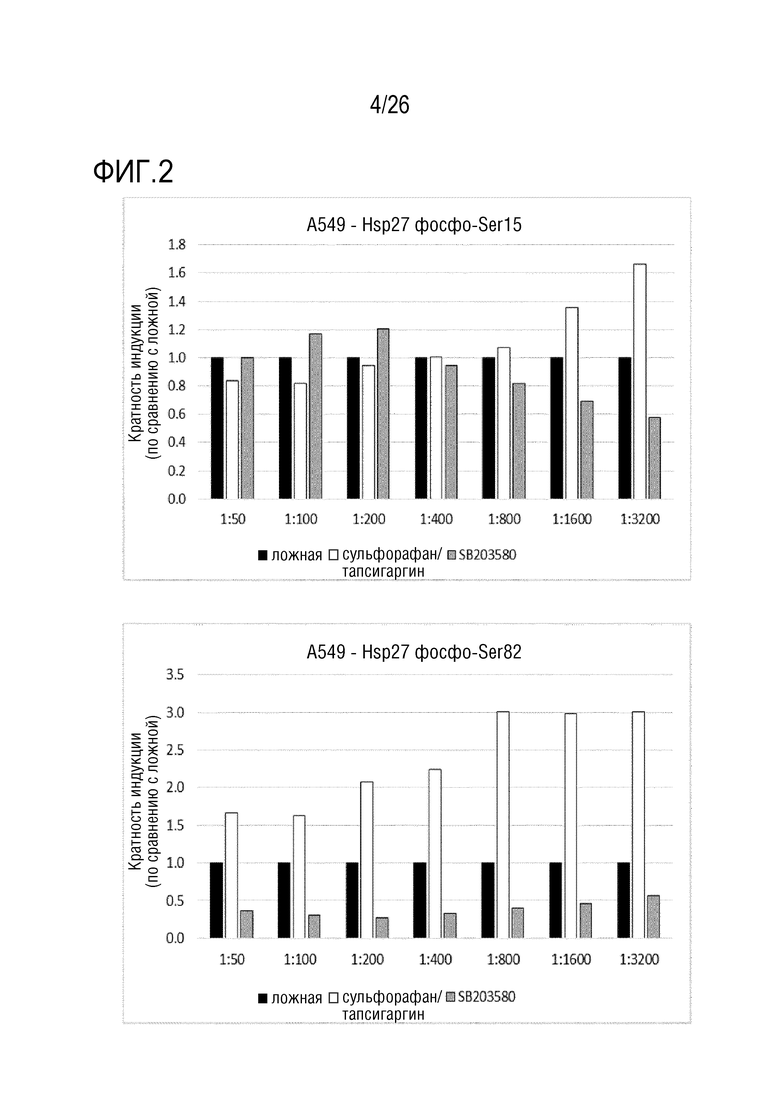
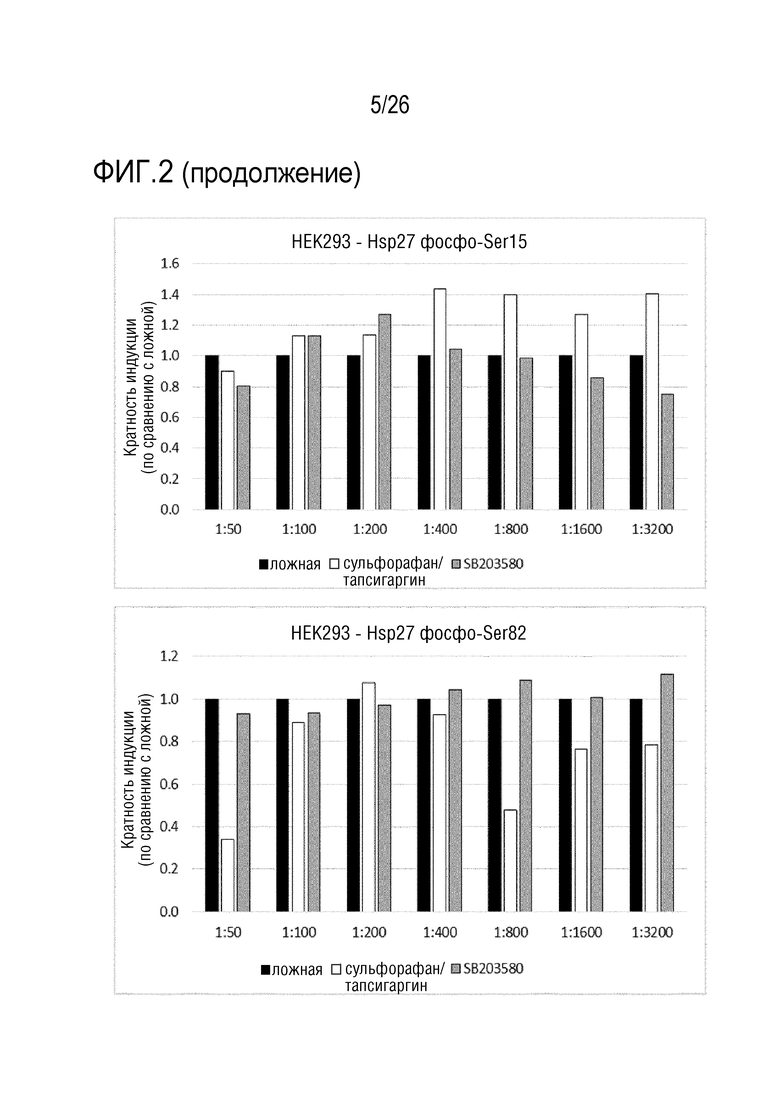
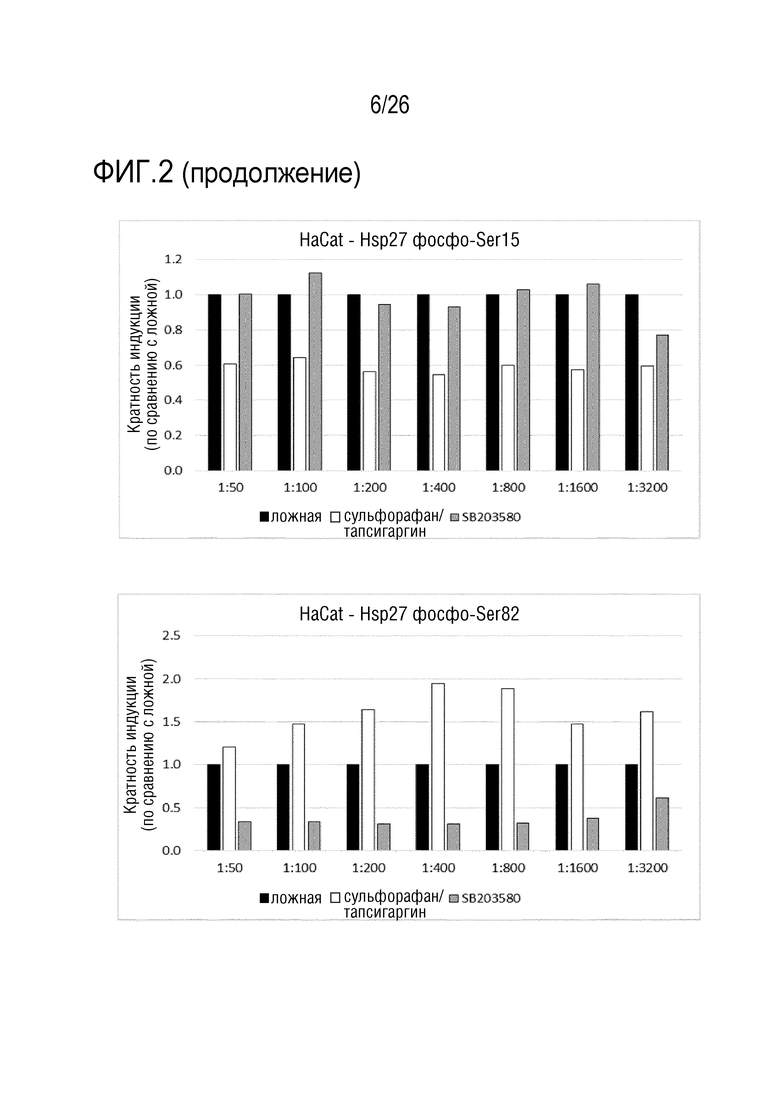
[0035] На фиг. 2 показаны результаты анализа 1 ELISA клеточного Hsp27 (см. пример 3)
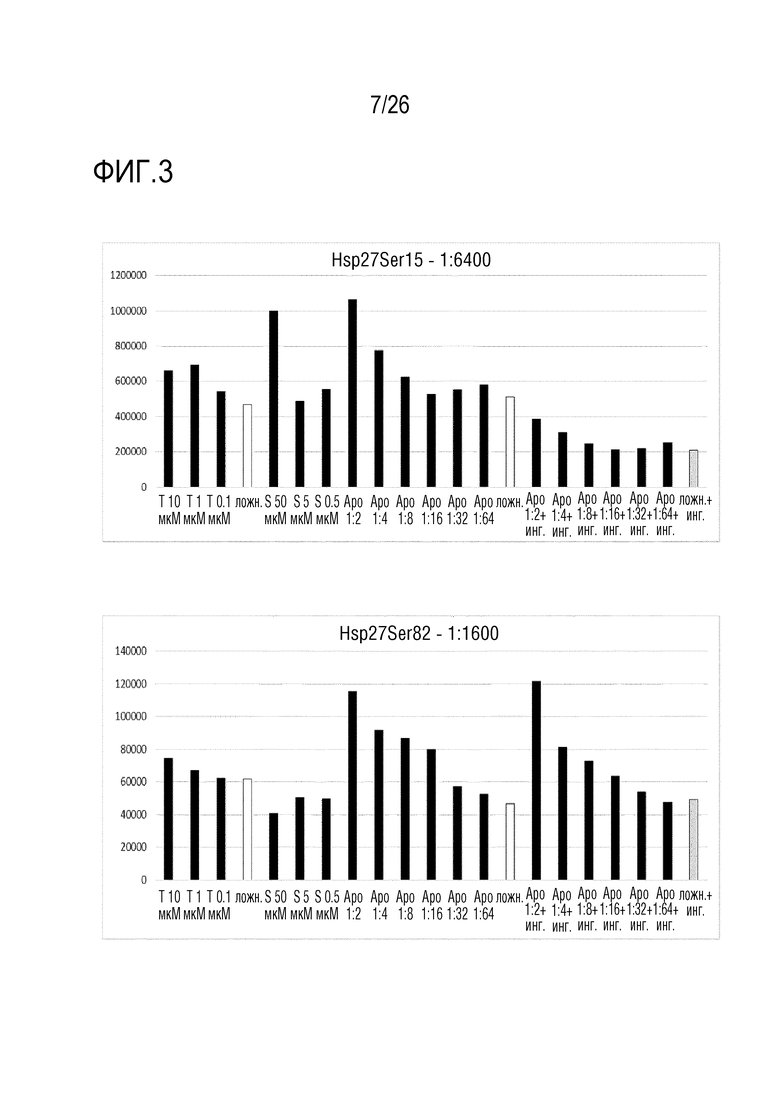
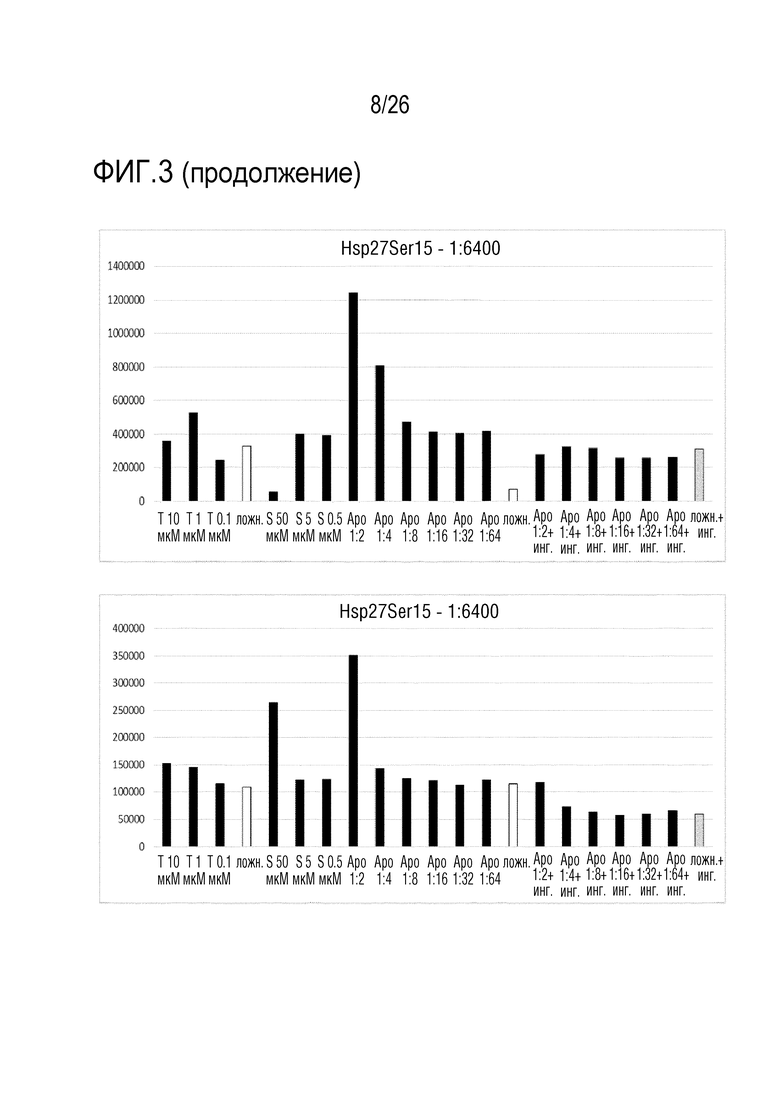
[0036] На фиг. 3 показаны результаты анализа 2 ELISA клеточного Hsp27 (см. пример 3).
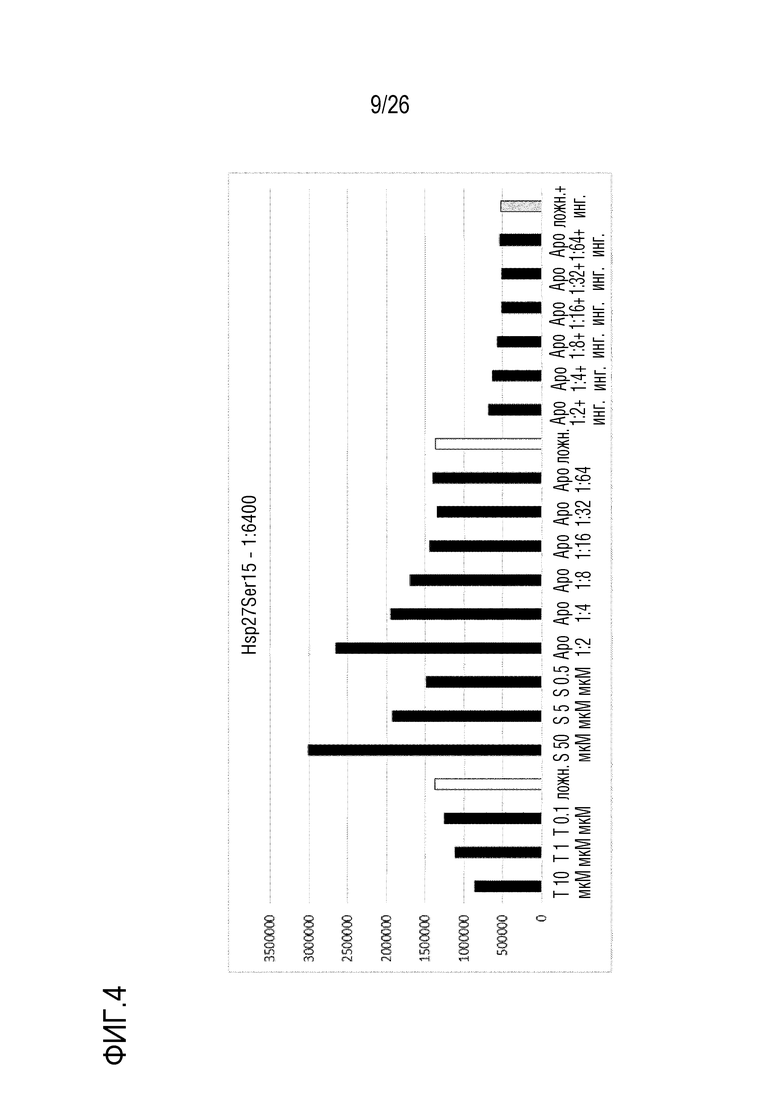
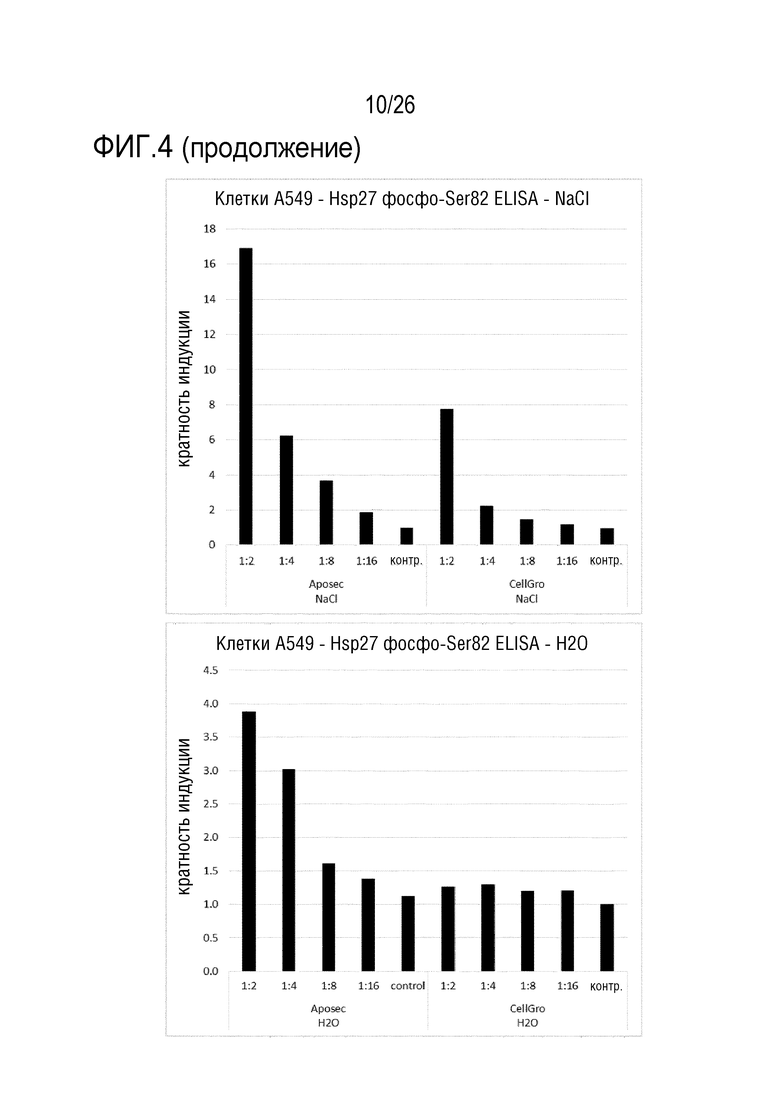
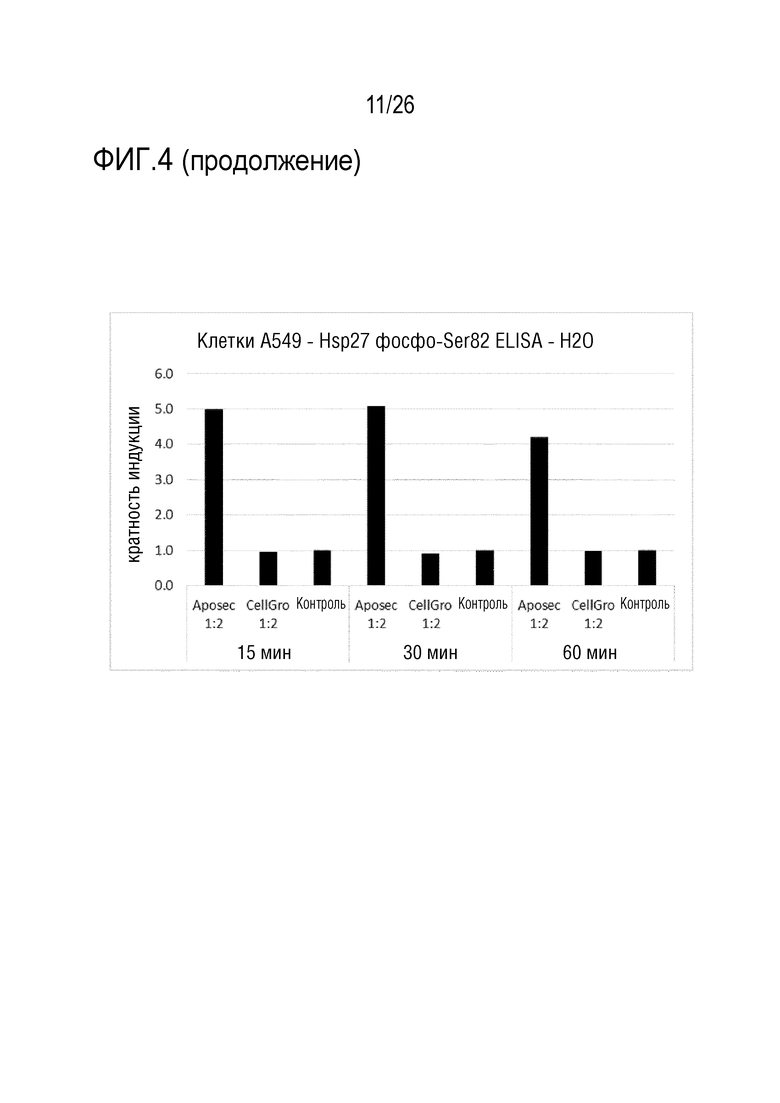
[0037] На фиг. 4 показаны результаты анализа 3 ELISA клеточного Hsp27 (см. пример 3).
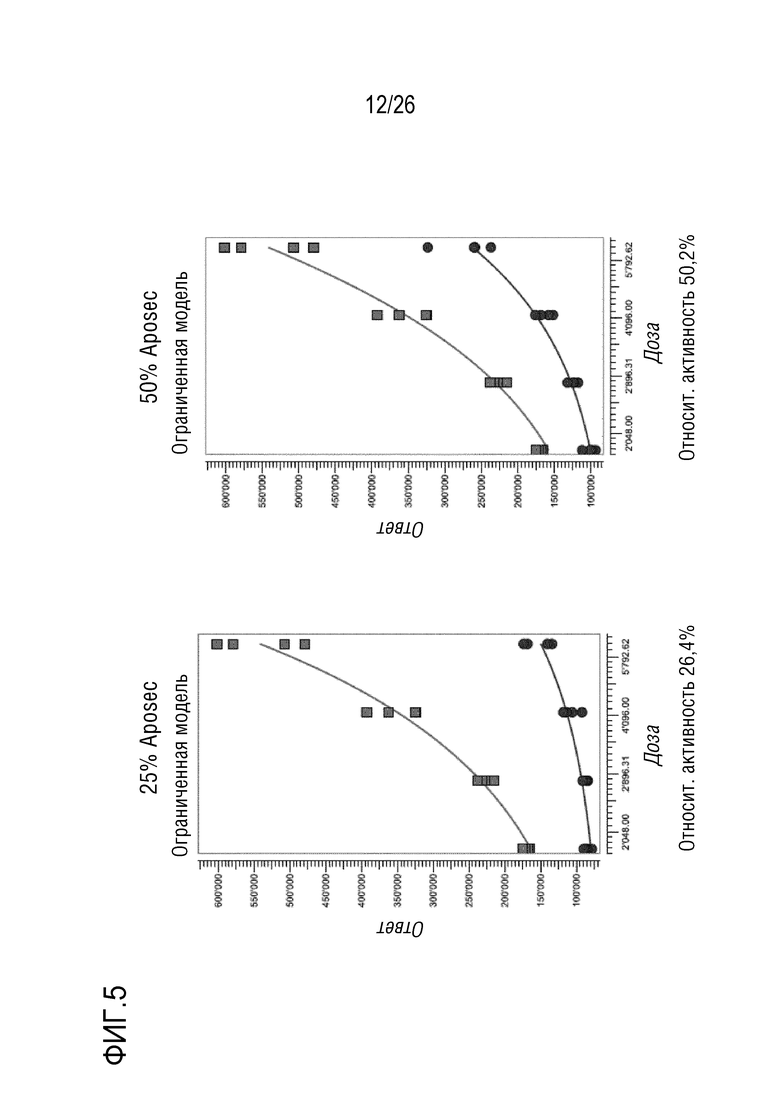
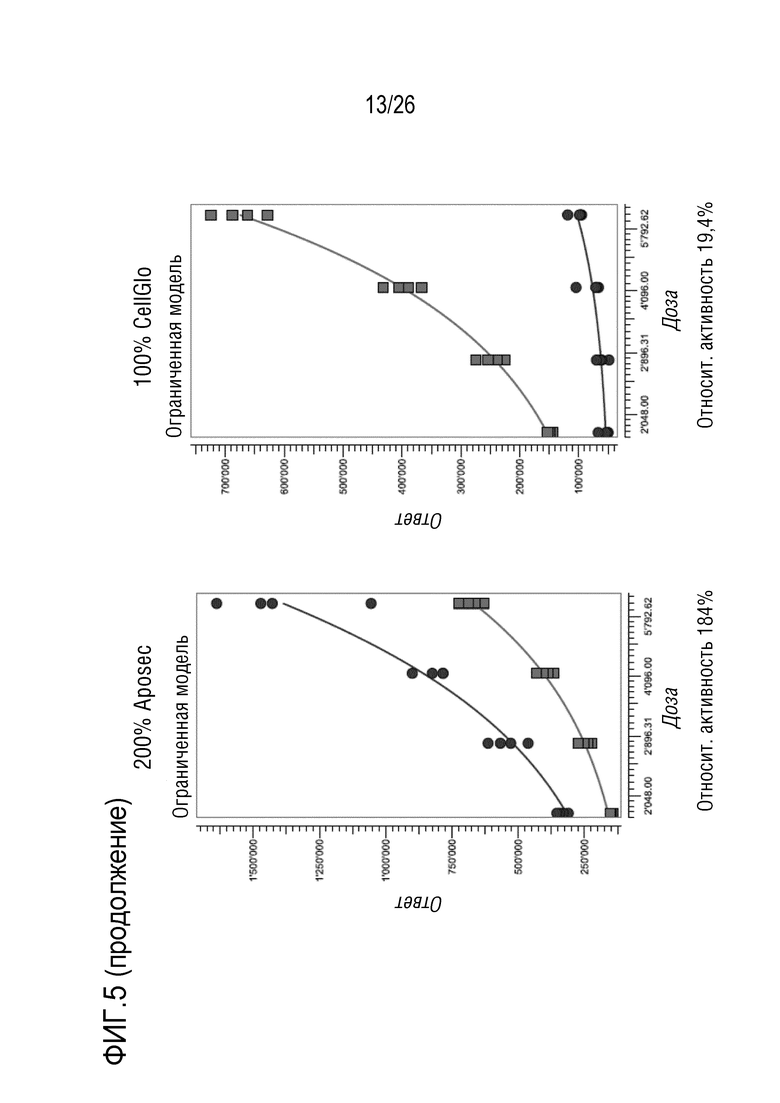
[0038] На фиг. 5 показана относительная активность различных концентраций Aposec в отношении 100% среды CellGro с использованием анализа фосфорилированного HSP27, как описано в примере 3.
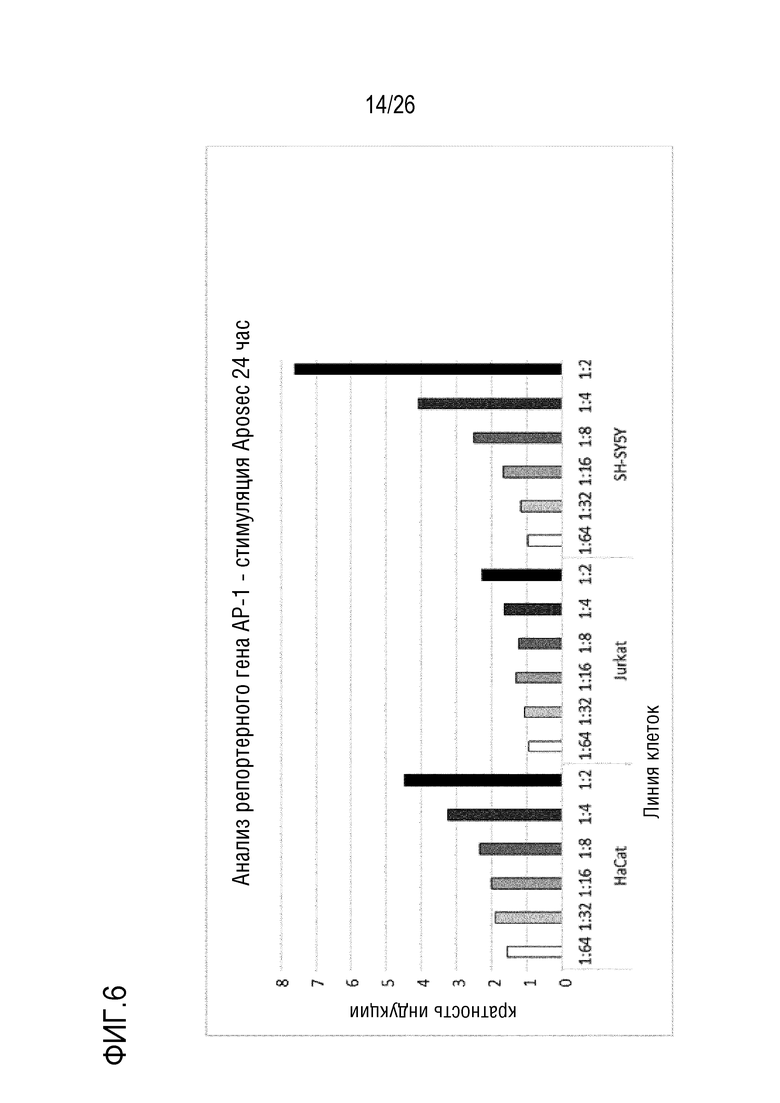
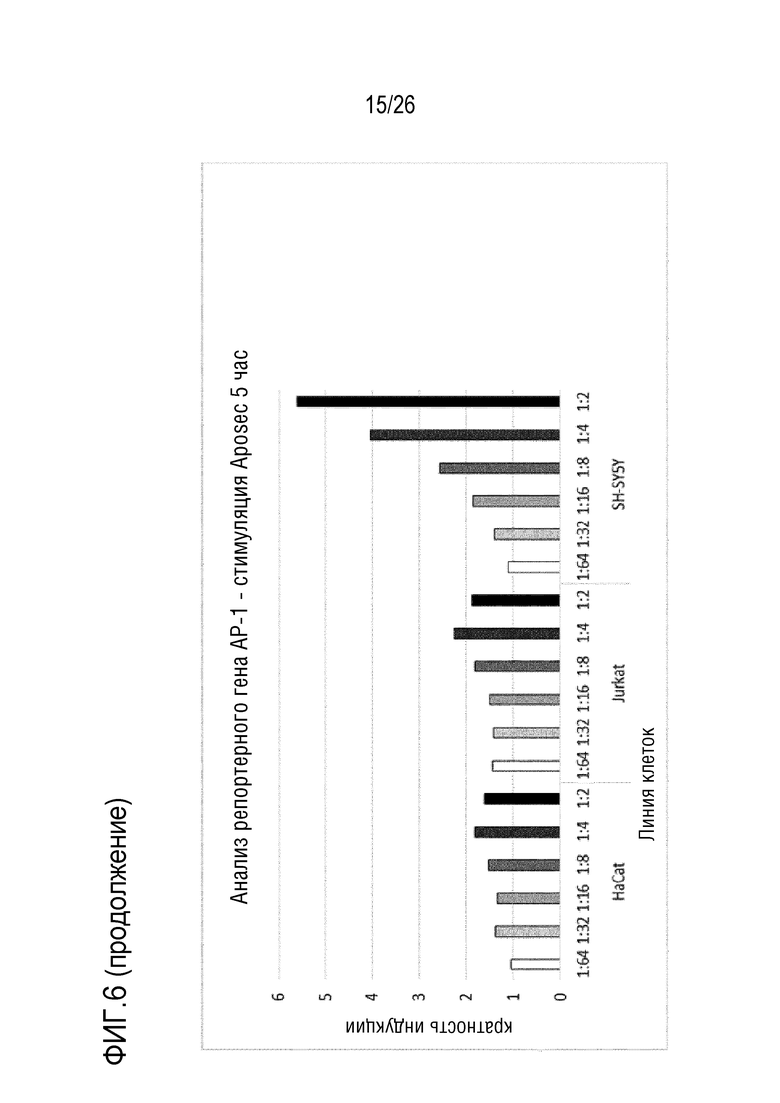
[0039] На фиг. 6 показан сигнал репортера AP-1 в эукариотических клетках, стимулированных с использованием Aposec, через 5 и 24 часа.
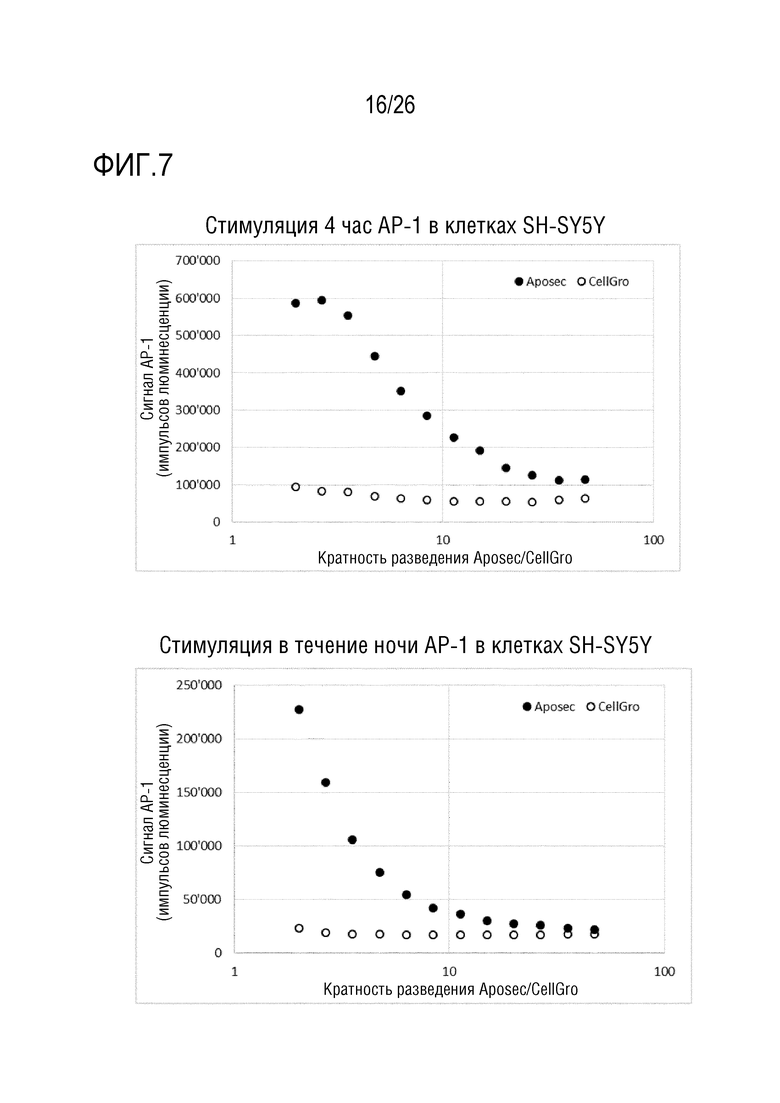
[0040] На фиг. 7 показана зависимость от времени и дозы для анализа RGA AP-1.
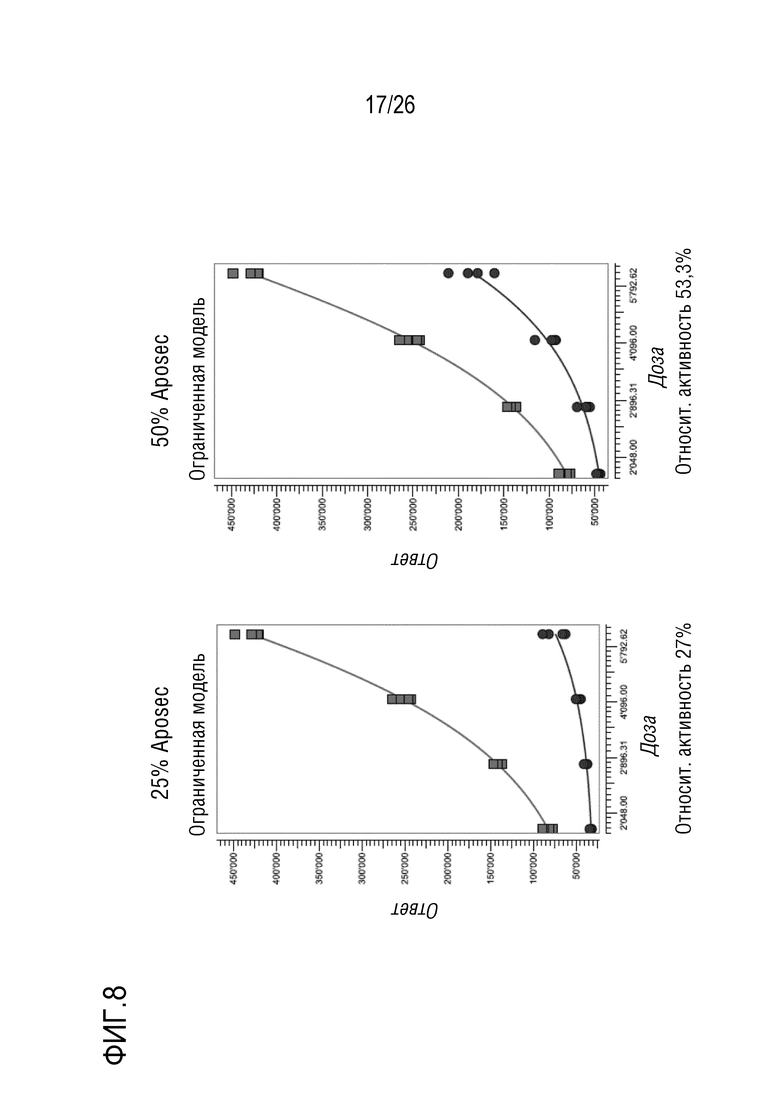
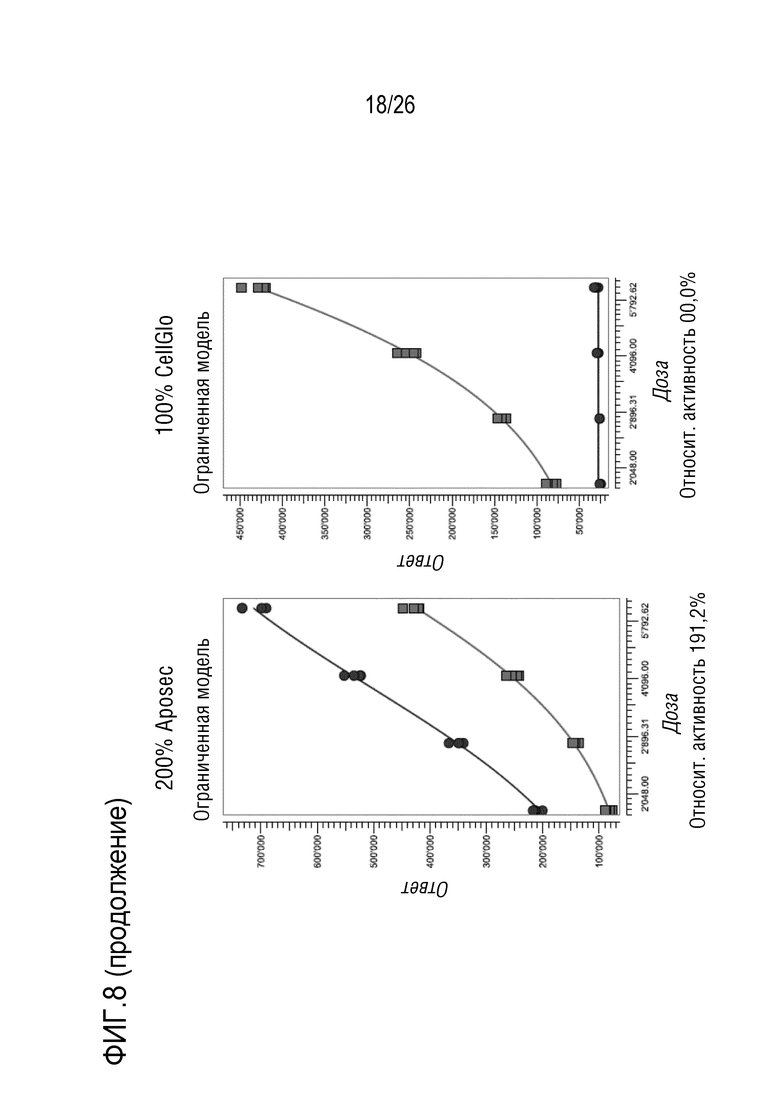
[0041] На фиг. 8 показана относительная активность различных концентраций Aposec, относительно 100% среды CellGro, с использованием анализа RGA фосфорилированного AP-1, как описано в примере 3.
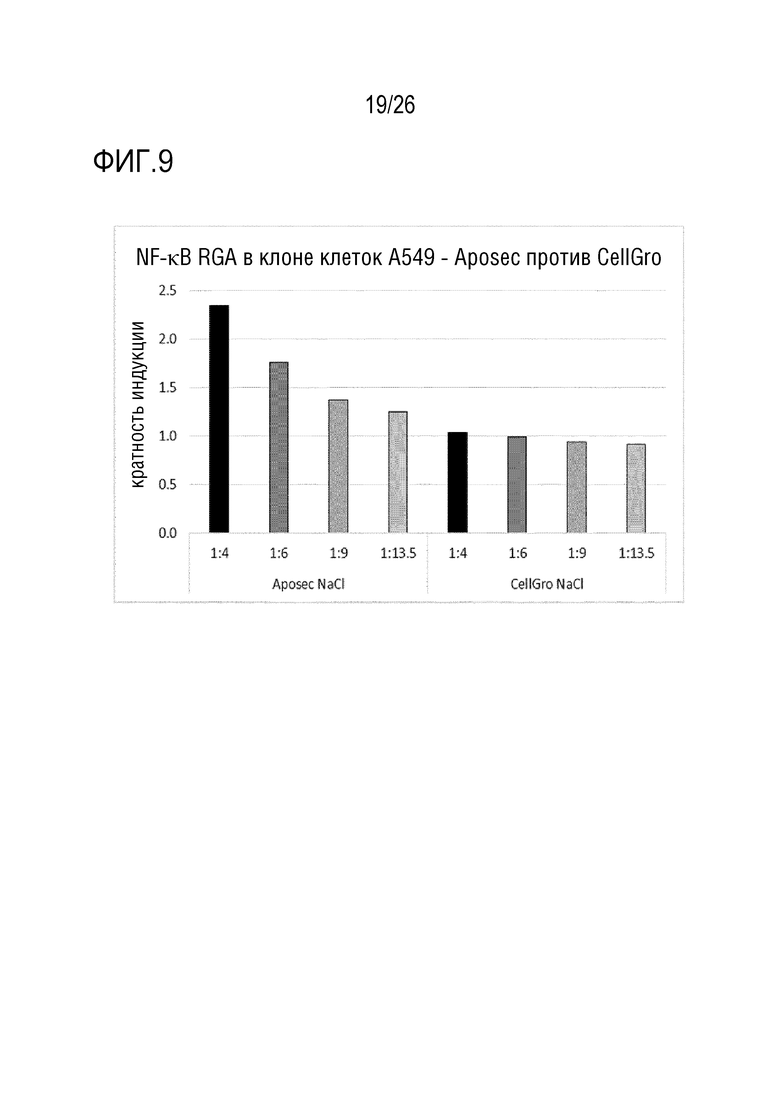
[0042] На фиг. 9 показано сравнение индукции промотора NF-κB с использованием Aposec и среды CellGro.
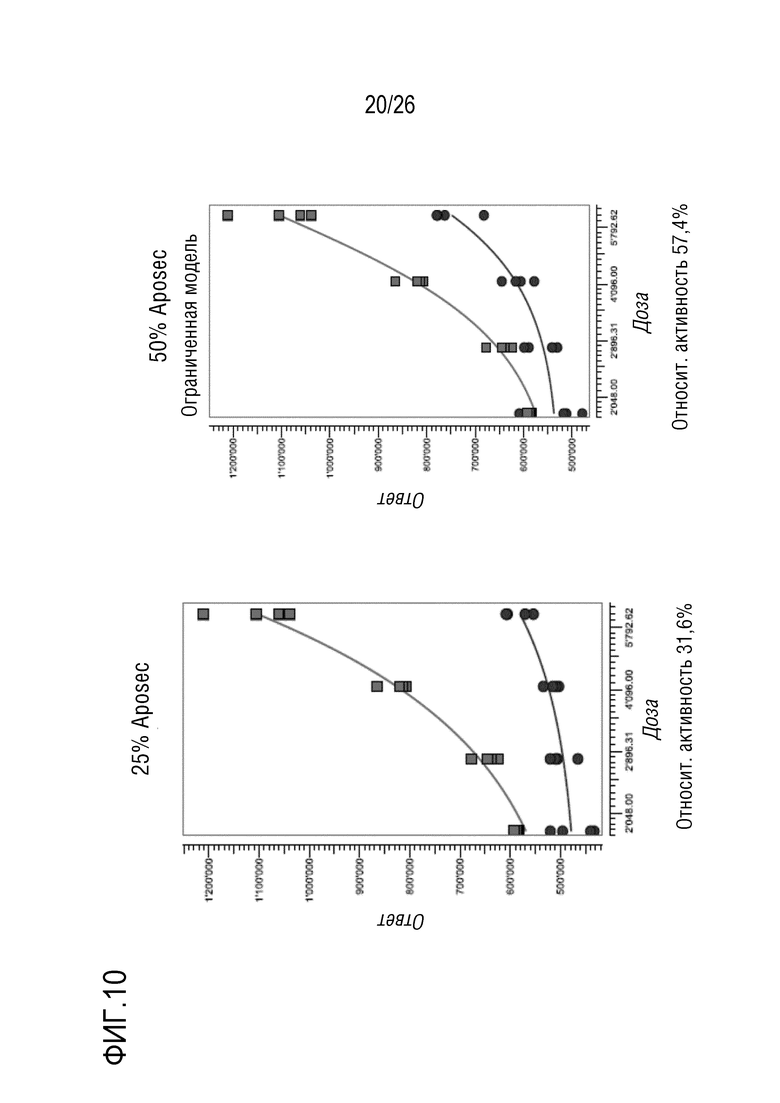
[0043] На фиг. 10 показана относительная активность различных концентраций Aposec, относительно 100% среды CellGro, с использованием анализа RGA NF-κB, как описано в примере 5.
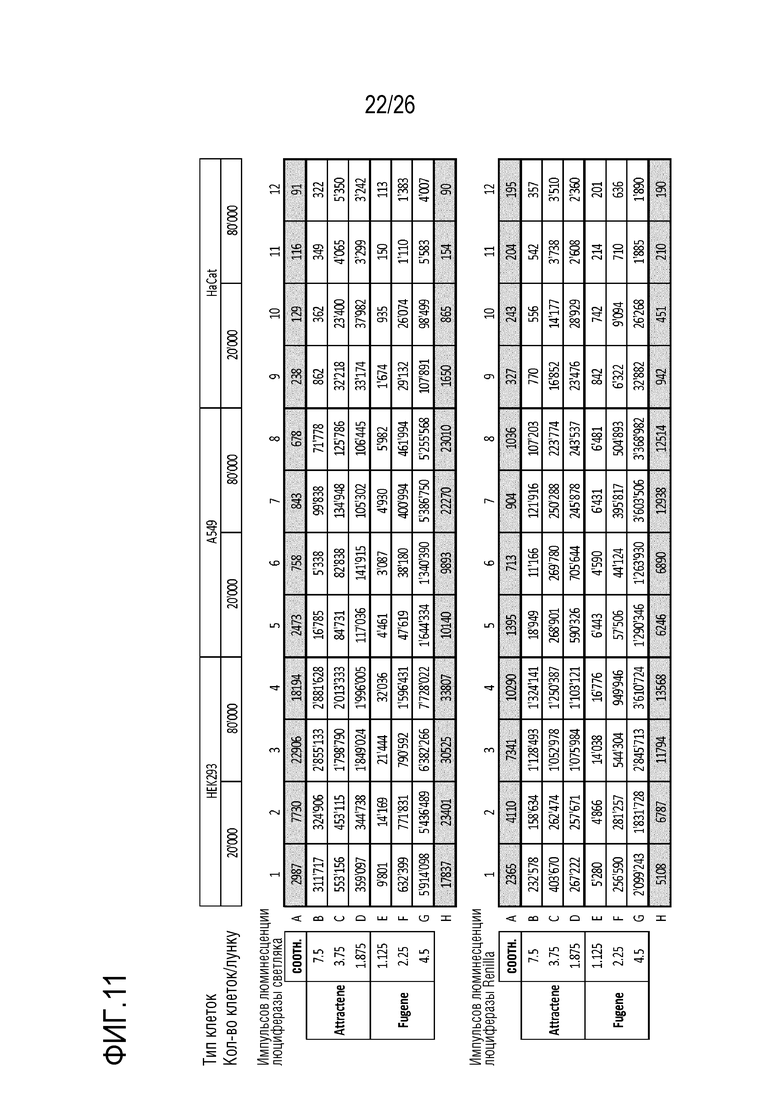
[0044] На фиг. 11 показана таблица, обобщающая результаты теста эффективности трансфекции из примера 7.
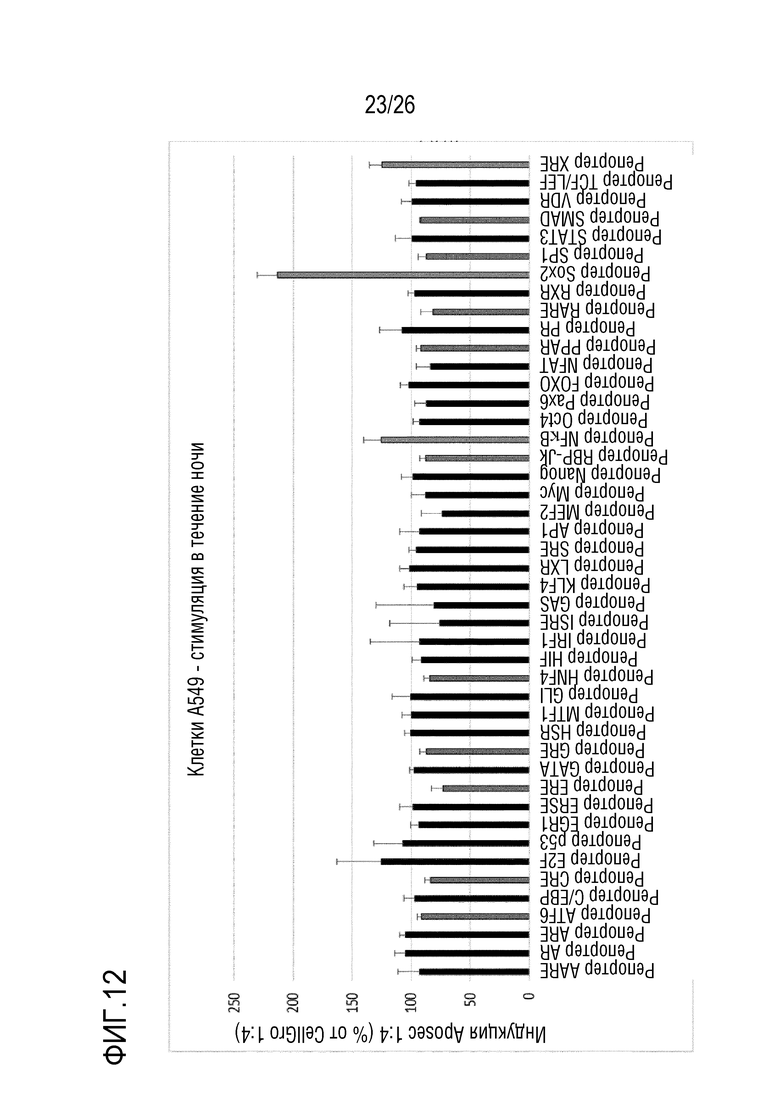
[0045] На фиг. 12 показаны результаты для массива репортеров передачи сигналов из примера 7.2.
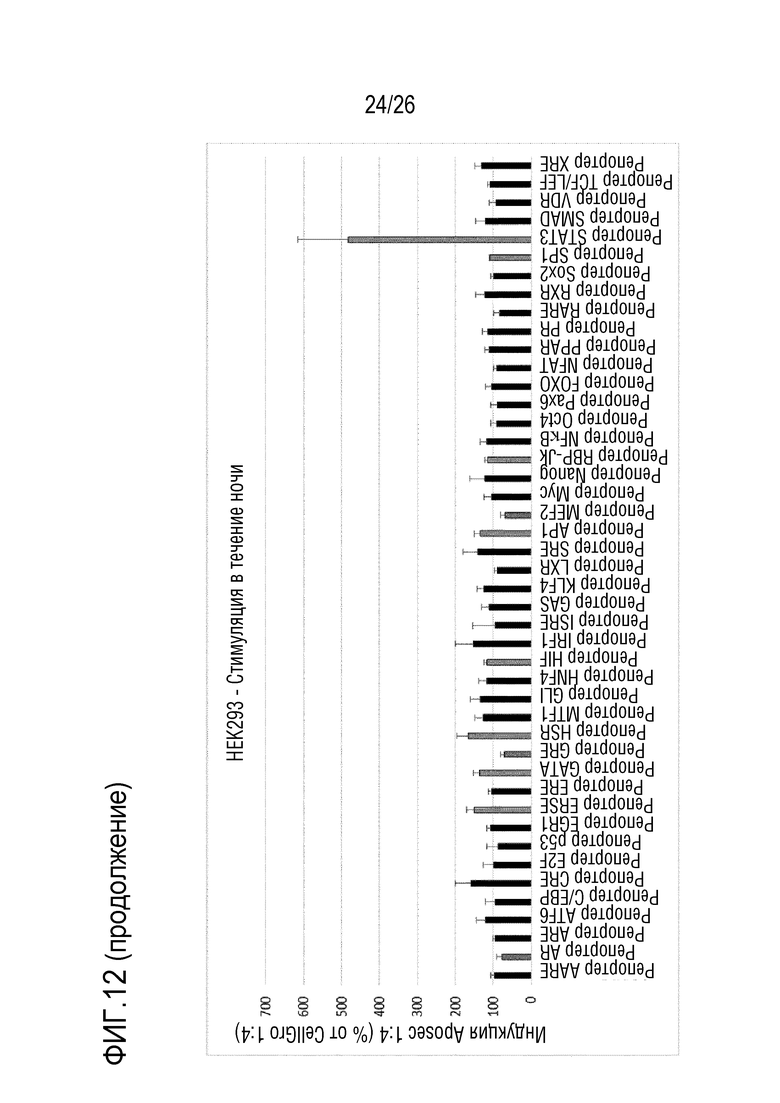
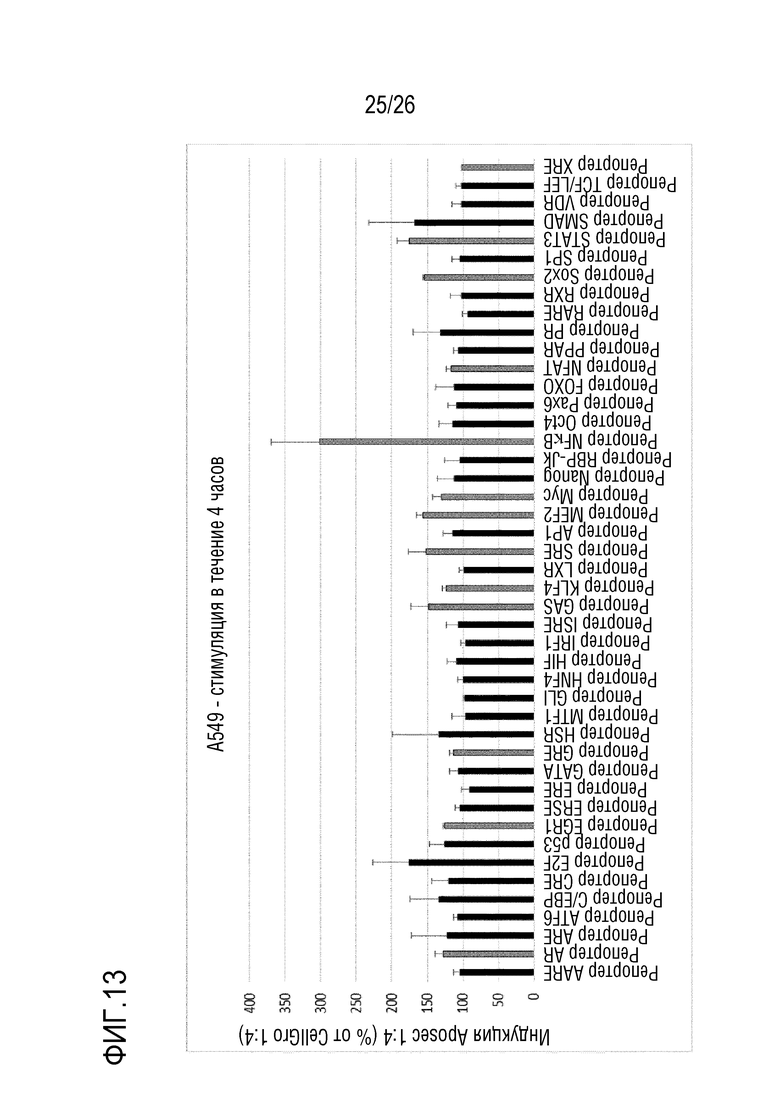
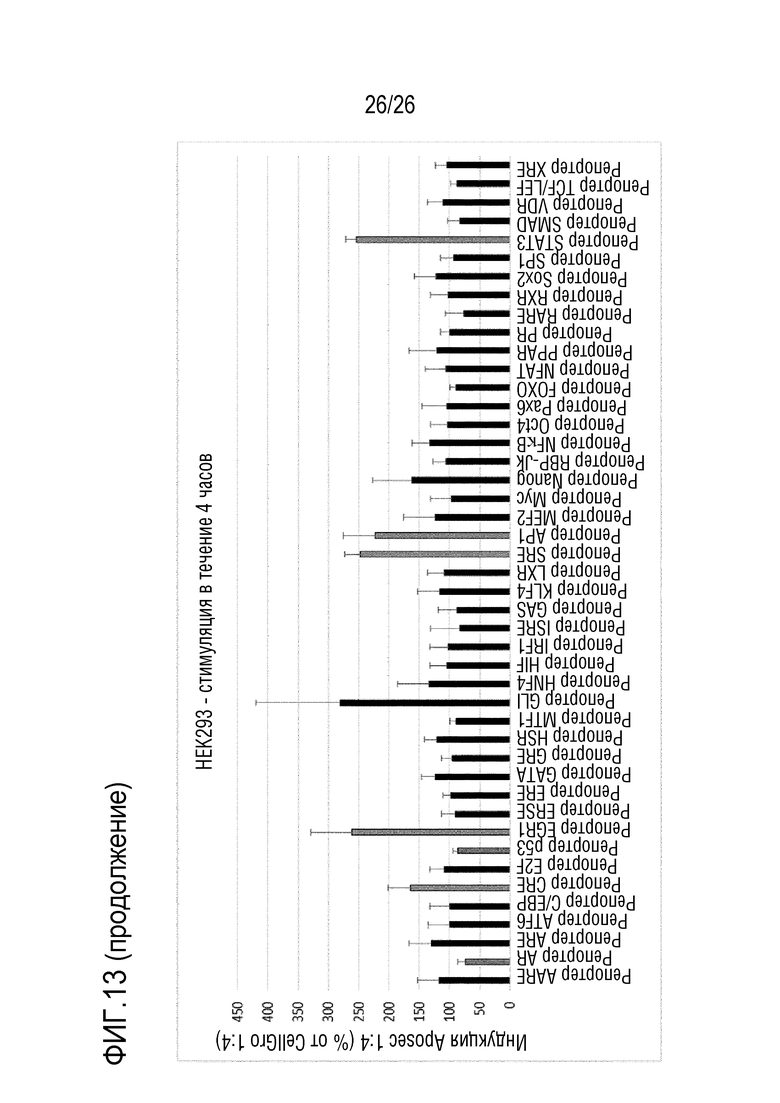
[0046] На фиг. 13 показаны результаты для массива репортеров передачи сигналов из примера 7.3.
Описание вариантов осуществления
[0047] Настоящее изобретение относится к способу определения активности супернатанта культуры клеток млекопитающих для использования в лечении воспалительных состояний.
[0048] «Активность», в рамках изобретения, определяют как биологическую активность композиции (например, супернатанта культуры клеток), необходимую для лечения или предотвращения заболеваний, нарушений или состояний, в частности заболеваний, нарушений или состояний, включающих воспаление.
[0049] «Анализ активности», в рамках изобретения, относится к способу определения активности композиции. Анализ активности измеряет, напрямую или опосредованно, присутствие или количество специфического вещества или специфической композиции веществ в образце, т.е. в супернатанте культуры клеток млекопитающих. Присутствие или количество специфического вещества или специфической композиции веществ в образце показывает, можно ли использовать супернатант для лечения воспалительного состояния. Таким образом, супернатант, как известно, эффективный для лечения воспалительного состояния, можно использовать в качестве эталона. В таком случае промоторную активность по меньшей мере одного промотора, выбранного из группы, состоящей из промотора активирующего белка 1 (AP-1), промотора ядерного фактора энхансера гена легкой цепи каппа в активированных В-клетках (NF-κB), промотора бокса 2 области определения пола Y (Sox2), промотора передатчика сигнала и активатора транскрипции 3 (STAT3), промотора белка 1 ответа роста на ранних стадиях (EGR-1) и промотора элемента ответа на сыворотку (SRE), и/или количество фосфорилированного белка теплового шока 27 (HSP27) высвобожденного эукариотическими клетками в культуральную среду со стадии a), содержащую образец из другой партии супернатанта, измеряют и затем сравнивают с эффектом, вызванным эталонным супернатантом, как определено выше. Любое изменение промоторной активности или количества белка в диапазоне +/- 25% (т.е. на вплоть до 25% выше или ниже), предпочтительно, +/- 20%, более предпочтительно, +/- 15%, более предпочтительно, +/- 10%, более предпочтительно, +/- 5%, относительно эталонного супернатанта, показывает, что партию супернатанта можно использовать для лечения воспалительного состояния. То же самое применимо также для количества фосфорилированного HSP27.
[0050] Таким образом, другой аспект настоящего изобретения относится к способу определения активности супернатанта культуры клеток млекопитающих для использования в лечении воспалительного состояния, включающему стадии
a) инкубации эукариотических клеток в культуральной среде, содержащей или состоящей из указанного супернатанта,
b) измерения промоторной активности по меньшей мере одного промотора, выбранного из группы, состоящей из промотора активирующего белка 1 (AP-1), промотора ядерного фактора энхансера гена легкой цепи каппа в активированных В-клетках (NF-κB), промотора бокса 2 области определения пола Y (Sox2), промотора передатчика сигнала и активатора транскрипции 3 (STAT3), промотора белка 1 ответа роста на ранних стадиях (EGR-1) и промотора элемента ответа на сыворотку (SRE), и/или измерения количества фосфорилированного белка теплового шока 27 (HSP27), высвобожденного эукариотическими клетками в культуральную среду со стадии a),
где супернатант культуры клеток млекопитающих имеет потенциал для использования в лечении воспалительного состояния, если промоторная активность по меньшей мере одного промотора на вплоть до 25% выше или ниже, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, содержащей эталонный супернатант клеток млекопитающих, который можно использовать в лечении воспалительного состояния, и/или если количество фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), на вплоть до 25% выше или ниже по сравнению с количеством фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), содержащую эталонный супернатант клеток млекопитающих, который можно использовать в лечении воспалительного состояния.
[0051] «Воспалительные состояния», в рамках изобретения, относится к нарушениям, заболеваниям и состояниям, ассоциированным, по меньшей мере частично, с воспалением.
[0052] Как описано выше, супернатанты культур клеток млекопитающих являются способными влиять на экспрессию белка для конкретных белков в эукариотических клетках. В дополнение к этому, эти супернатанты также являются способными регулировать (активировать или ингибировать) активность промоторов, присутствующих в эукариотических клетках. Оба эффекта можно использовать для определения активности супернатантов культур клеток млекопитающих для использования в лечении воспалительных состояний.
[0053] «Промотор», в рамках изобретения, относится к обозначению фрагмента нуклеиновой кислоты, как правило, локализованному выше молекулы нуклеиновой кислоты, кодирующей функциональный полипептид или белок. Промотор является функциональным в клетках-хозяевах и регулирует транскрипцию фрагментов нуклеиновой кислоты, обнаруженных ниже промотора. Промотор содержит участки связывания факторов транскрипции, так же как область инициации транскрипции.
[0054] Оказалось, что супернатант культуры клеток млекопитающих увеличивает уровень экспрессии фосфорилированного белка теплового шока 27 (HSP27) эукариотических клеток, когда последние клетки инкубируют с указанным супернатантом. Если эукариотические клетки представляют собой клетки человека, HSP27 человека (UniProt P04792) может являться фосфорилированным по меньшей мере в одном положении, выбранном из аминокислотных остатков 15, 26, 65, 78, 82, 83, 86, 98, 174, 176 и 199 HSP27, где предпочтительные фосфорилированные аминокислотные остатки находятся в положении 15 и 82 HSP27.
[0055] Для определения и/или количественной оценки фосфорилированного HSP27 в культуральной среде, в соответствии со стадией b), можно использовать различные способы. Наиболее предпочтительные способы включают использование антител или их антигенсвязывающих фрагментов, включая фрагменты Fab или другие фрагменты, содержащие вариабельные антигенсвязывающие области таких антител. Эти антитела и фрагменты можно использовать в иммуноанализе, предпочтительно, твердофазном иммуноферментном анализе (ELISA), для определения фосфорилированного HSP27.
[0056] Влияние супернатанта культуры клеток млекопитающих (т.е. кондиционированной культуральной среды) на активность специфических промоторов можно тестировать с использованием различных способов. Один способ включает измерение природного белка, кодированного нуклеиновой кислотой, функционально связанной с соответствующим промотором. Это можно осуществлять с использованием антител или их функциональных фрагментов, связывающихся с указанным белком, или посредством определения количества мРНК, транскрибированной и кодирующей указанный белок. Альтернативно, промоторы, на которые влияет супернатант культуры клеток млекопитающих, можно функционально связывать с молекулой нуклеиновой кислоты, кодирующей репортерный белок, с использованием рекомбинантных способов, известных в данной области. Также, эти репортерные белки можно оценивать количественно с использованием антител или их антигенсвязывающих фрагментов в иммуноанализе. Альтернативно, такие репортерные белки могут иметь ферментную активность или флуоресцентные свойства. Если репортерные белки имеют ферментную активность, анализы можно использовать для определения количества превращенного субстрата, для выведения заключения о промоторной активности.
[0057] В соответствии с настоящим изобретением, предпочтительными промоторами являются промотор активирующего белка 1 (AP-1), промотор ядерного фактора энхансера гена легкой цепи каппа в активированных В-клетках (NF-κB), промотор бокса 2 области определения пола Y (Sox2), промотор передатчика сигнала и активатора транскрипции 3 (STAT3), промотор белка 1 ответа роста на ранних стадиях (EGR-1) и промотор элемента ответа на сыворотку (SRE).
[0058] Оказалось, что супернатант культуры клеток млекопитающих имеет потенциал для использования в лечении воспалительного состояния, если количество фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), по меньшей мере на 20% выше по сравнению с количеством фосфорилированного HSP27, высвобожденного в культуральную среду, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта, и/или если промоторная активность по меньшей мере одного промотора по меньшей мере на 50% выше, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта.
[0059] Как упомянуто выше, промоторная активность промоторов по меньшей мере на 50%, предпочтительно по меньшей мере на 60%, более предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 80%, более предпочтительно, по меньшей мере на 90%, более предпочтительно, по меньшей мере на 100%, более предпочтительно по меньшей мере на 150%, более предпочтительно, по меньшей мере на 200%, выше, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта. «Отсутствие указанного супернатанта» означает, что эукариотические клетки инкубируют в культуральной среде, не содержащей кондиционированной культуральной среды (т.е. супернатанта культуры клеток млекопитающих).
[0060] Количество фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), по меньшей мере на 20%, предпочтительно, по меньшей мере на 30%, более предпочтительно, по меньшей мере на 50%, более предпочтительно, по меньшей мере на 70%, более предпочтительно, по меньшей мере на 100%, выше, по сравнению с количеством фосфорилированного HSP27, высвобожденного в культуральную среду, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта.
[0061] В другом аспекте настоящего изобретения, используют эталонный супернатант культуры клеток млекопитающих, который, как уже показано, является способным лечить воспалительные состояния. В таком случае, промоторная активность по меньшей мере одного промотора на вплоть до 25% выше или ниже, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, содержащей указанный эталонный супернатант, и/или если количество фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), на вплоть до 25% выше или ниже по сравнению с количеством фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), содержащую указанный эталонный супернатант.
[0062] На первой стадии способа по настоящему изобретению эукариотические клетки культивируют/инкубируют в культуральной среде, содержащей или состоящей из супернатанта культуры клеток млекопитающих. Условия культивирования представляют собой условия, которые обычно используют для культивирования эукариотических клеток в стандартной культуральной среде. Как правило, эукариотические клетки культивируют/инкубируют при температуре 35°C-39°C, предпочтительно, 36°C-38°C, в частности, приблизительно 37°C.
[0063] В предпочтительном варианте осуществления настоящего изобретения, супернатант культуры клеток млекопитающих представляет собой супернатант культуры мононуклеарных клеток периферической крови (PBMC). Супернатант культивированных PBMC можно использовать для лечения воспалительных состояний (см., например, WO 2010/070105 и WO 2010/079086). PBMC, в рамках изобретения, содержат или состоят из T-клеток, B-клеток и/или клеток NK.
[0064] В соответствии с особенно предпочтительным вариантом осуществления настоящего изобретения, клетки млекопитающих по настоящему изобретению культивируют в индуцирующих стресс условиях. В данной области известно, что клетки млекопитающих способны секретировать вещества в культуральную среду в ходе культивирования. Этот эффект может быть даже более усилен, если клетки млекопитающих подвергают, во время или до культивирования, воздействию индуцирующих стресс условий. В частности, оказалось, что подвергнутые стрессу клетки млекопитающих секретируют вещества, которые являются особенно преимущественными для лечения воспалительных состояний.
[0065] Термин «индуцирующие стресс условия», в рамках изобретения, относится к условиям культивирования, приводящим к стрессу клеток. Условия, вызывающие стресс клеток, включают, среди прочего, нагревание, химические вещества, облучение, гипоксию, осмотическое давление и т.д.
[0066] Индуцирующие стресс условия включают гипоксию, озон, нагревание (например, более чем на 2°C, предпочтительно, более чем на 5°C, более предпочтительно, более чем на 10°C, выше, чем оптимальная температура культивирования клеток млекопитающих, т.е. 37°C), облучение (например, облучение УФ, ионизирующее излучение, гамма-излучение), химические вещества, осмотическое давление (т.е. условия осмоса, увеличенного, по меньшей мере по сравнению с условиями осмоса, обычно встречающегося в жидкости организма, в частности, в крови) или их комбинации.
[0067] Если облучение используют для подвергания стрессу клеток млекопитающих по настоящему изобретению, клетки, предпочтительно, облучают с использованием по меньшей мере 10 Гр, предпочтительно, по меньшей мере 20 Гр, более предпочтительно, по меньшей мере 40 Гр, где в качестве источника, предпочтительно, используют цезий Cs-137.
[0068] В соответствии с предпочтительным вариантом осуществления настоящего изобретения, клетки млекопитающих культивируют в течение по меньшей мере 4 час, предпочтительно, в течение по меньшей мере 6 час, более предпочтительно, в течение по меньшей мере 12 час, до выделения их супернатанта.
[0069] В соответствии с настоящим изобретением, эукариотические клетки со стадии a) предпочтительно, выбраны из группы, состоящей из базальных эпителиальных клеток пораженных аденокарциномой альвеол человека, предпочтительно, клеток A549, анеуплоидных иммортализованных клеток кератиноцитов (HaCaT), клеток эмбриональной почки человека (клеток HEK), предпочтительно, клеток HEK293, и клеток нейробластомы, предпочтительно, клеток SH-SY5Y. Оказалось, что, в частности, эти эукариотические клетки можно использовать для определения активности супернатантов культур клеток млекопитающих для использования в лечении воспалительных состояний.
[0070] Эукариотические клетки со стадии a) инкубируют (т.е. культивируют) в среде для культивирования клеток в течение по меньшей мере 2 часов, предпочтительно, по меньшей мере 4 часов, более предпочтительно, по меньшей мере 6 часов, более предпочтительно, по меньшей мере 12 часов, более предпочтительно, по меньшей мере 18 часов, более предпочтительно, по меньшей мере 24 часов. Время культивирования по меньшей мере 2 часа является достаточным, чтобы позволить веществам, присутствующим в культуральной среде, содержащей или состоящей из супернатанта культуры клеток млекопитающих, увеличивать экспрессию и, необязательно, секрецию фосфорилированного HSP27 и/или активировать промоторы, упомянутые выше.
[0071] Культуральная среда, использованная на стадии a), содержит по меньшей мере 20%, предпочтительно, по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%, более предпочтительно, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, или состоит из супернатанта культуры клеток млекопитающих.
[0072] В предпочтительном варианте осуществления настоящего изобретения, культуральная среда со стадии a) представляет собой среду Игла в модификации Дульбекко (DMEM), среду Хэма F12 (F12), минимальную эссенциальную среду, или комбинацию одной или нескольких из этих сред.
[0073] В другом варианте осуществления настоящего изобретения, культуральная среда со стадии a) содержит 2-20%, предпочтительно 5-15%, эмбриональной бычьей сыворотки (FBS) и/или L-аланил-L-глутамина.
[0074] Для определения промоторной активности вышеупомянутых промоторов в эукариотических клетках, клетки, предпочтительно, генетически модифицируют для содержания по меньшей мере одной экспрессирующей кассеты, содержащей промотор, выбранный из группы, состоящей из промотора AP-1, промотора NF-κB, промотора Sox2, промотора STAT3, промотора EGR-1 и промотора SRE, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0075] «Экспрессирующая кассета», в рамках изобретения, относится к фрагменту нуклеиновой кислоты, который содержит ген (т.е. молекулу нуклеиновой кислоты, кодирующую белок или полипептид), функционально связанный с регуляторными последовательностями, необходимыми для экспрессии гена.
[0076] «Функционально связанный» относится к связи нуклеотидных областей, кодирующих специфическую генетическую информацию, такой что нуклеотидные области являются непрерывными, функциональность области сохраняется, и она действует по отношению к другим областям как часть функциональной единицы.
[0077] Экспрессирующая кассета, введенная в эукариотические клетки, может быть предоставлена в качестве части вектора. «Вектор» рассматривают как носитель, посредством которого фрагменты нуклеиновой кислоты можно вводить в организмы-хозяева, подобные эукариотическим клеткам. «Экспрессирующий вектор» представляет собой носитель, посредством которого фрагменты нуклеиновой кислоты и в частности, экспрессирующие кассеты, содержащие достаточную генетическую информацию, можно вводить в эукариотические клетки и можно, таким образом, экспрессировать в этих клетках.
[0078] Репортерный белок, кодируемый экспрессирующей кассетой, может представлять собой полипептид или белок, который может быть связан антителом или его антигенсвязывающим фрагментом, фермент или флуоресцентный белок или полипептид. Репортерный белок, предпочтительно, выбран из группы, состоящей из люциферазы, предпочтительно, люциферазы светляка, флуоресцентного белка, предпочтительно, зеленого флуоресцентного белка.
[0079] «Люциферазы» представляют собой окислительные ферменты, способные вызывать биолюминесценцию в присутствии люциферина, кислорода и АТФ. «Флуоресцентные белки» представляют собой белки, имеющие флуоресцентные свойства.
[0080] Количество белков (например, фосфорилированного HSP27, репортерных белков), высвобожденных эукариотическими клетками в культуральную среду, определяют посредством иммунологического способа, предпочтительно, посредством твердофазного иммуноферментного анализа (ELISA), посредством фотометрического способа или посредством флуоресцентного способа.
[0081] Базальные эпителиальные клетки пораженных аденокарциномой альвеол человека, предпочтительно, клетки A549, клетки HaCaT или HEK, предпочтительно, клетки HEK293, оказались особенно пригодными для определения количества фосфорилированного HSP27.
[0082] Если промоторная активность по меньшей мере одного промотора, предпочтительно, по меньшей мере на 80%, предпочтительно, по меньшей мере на 100%, более предпочтительно, по меньшей мере на 150%, более предпочтительно, по меньшей мере на 200%, выше, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта, супернатант культуры клеток млекопитающих можно использовать для лечения воспалительного состояния.
[0083] Эукариотические клетки со стадии a) представляют собой, предпочтительно, базальные эпителиальные клетки пораженных аденокарциномой альвеол человека, предпочтительно, клетки A549, клетки HaCaT или клетки HEK, предпочтительно, клетки HEK293, когда измеряют количество фосфорилированного HSP27, высвобожденного в культуральную среду.
[0084] Эукариотические клетки со стадии a) представляет собой, предпочтительно, клетки нейробластомы, предпочтительно, клетки SH-SY5Y или клетки HaCaT, содержащие по меньшей мере одну экспрессирующую кассету, содержащую промотор AP-1, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0085] Эукариотические клетки со стадии a) представляют собой, предпочтительно, базальные эпителиальные клетки пораженных аденокарциномой альвеол человека, предпочтительно, клетки A549, содержащие по меньшей мере одну экспрессирующую кассету, содержащую промотор NF-κB или Sox2, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0086] Эукариотические клетки со стадии a) представляют собой, предпочтительно, клетки HEK, предпочтительно, клетки HEK293, содержащие по меньшей мере одну экспрессирующую кассету, содержащую промотор EGR-1, SRE, AP-1 или STAT3, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0087] Настоящее изобретение дополнительно проиллюстрировано посредством следующих вариантов осуществления и примеров, однако, без ограничения ими.
[0088] Варианты осуществления изобретения:
[0089] 1. Способ определения активности супернатанта культуры клеток млекопитающих для использования в лечении воспалительного состояния, включающий стадии
[0090] a) инкубации эукариотических клеток в культуральной среде, содержащей или состоящей из указанного супернатанта,
[0091] b) измерения промоторной активности по меньшей мере одного промотора, выбранного из группы, состоящей из промотора активирующего белка 1 (AP-1), промотора ядерного фактора энхансера гена легкой цепи каппа в активированных В-клетках (NF-κB), промотора бокса 2 области определения пола Y (Sox2), промотора передатчика сигнала и активатора транскрипции 3 (STAT3), промотора белка 1 ответа роста на ранних стадиях (EGR-1) и промотора элемента ответа на сыворотку (SRE), и/или измерения количества фосфорилированного белка теплового шока 27 (HSP27), высвобожденного эукариотическими клетками в культуральную среду со стадии a),
[0092] где супернатант культуры клеток млекопитающих имеет потенциал для использования в лечении воспалительного состояния, если промоторная активность по меньшей мере одного промотора по меньшей мере на 50% выше, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта, и/или если количество фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), по меньшей мере на 20% выше по сравнению с количеством фосфорилированного HSP27, высвобожденного в культуральную среду, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта.
[0093] 2. Способ определения активности супернатанта культуры клеток млекопитающих для использования в лечении воспалительного состояния, включающий стадии
[0094] a) инкубации эукариотических клеток в культуральной среде, содержащей или состоящей из указанного супернатанта,
[0095] b) измерения промоторной активности по меньшей мере одного промотора, выбранного из группы, состоящей из промотора активирующего белка 1 (AP-1), промотора ядерного фактора энхансера гена легкой цепи каппа в активированных В-клетках (NF-κB), промотора бокса 2 области определения пола Y (Sox2), промотора передатчика сигнала и активатора транскрипции 3 (STAT3), промотора белка 1 ответа роста на ранних стадиях (EGR-1) и промотора элемента ответа на сыворотку (SRE), и/или измерения количества фосфорилированного белка теплового шока 27 (HSP27), высвобожденного эукариотическими клетками в культуральную среду со стадии a),
[0096] где супернатант культуры клеток млекопитающих имеет потенциал для использования в лечении воспалительного состояния, если промоторная активность по меньшей мере одного промотора на вплоть до 25% выше или ниже, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, содержащей эталонный супернатант клеток млекопитающих, который можно использовать в лечении воспалительного состояния, и/или если количество фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a) на вплоть до 25% выше или ниже, по сравнению с количеством фосфорилированного HSP27, высвобожденного в культуральную среду со стадии a), содержащую эталонный супернатант клеток млекопитающих, который можно использовать в лечении воспалительного состояния.
[0097] 3. Способ в соответствии с вариантом осуществления 1 или 2, где супернатант культуры клеток млекопитающих представляет собой супернатант культуры мононуклеарных клеток периферической крови (PBMC).
[0098] 4. Способ в соответствии с любым из вариантов осуществления 1-3, где культура клеток млекопитающих содержит T-клетки, B-клетки и/или клетки NK.
[0099] 5. Способ в соответствии с любым из вариантов осуществления 1-4, где клетки млекопитающих в культуре клеток млекопитающих культивируют в среде для культивирования клеток, выбранной из группы, состоящей из среды для роста клеток, предпочтительно, среды CellGro, более предпочтительно, среды Cellgro GMP DC, RPMI, DMEM, X-vivo и Ultraculture.
[0100] 6. Способ в соответствии с любым из вариантов осуществления 1-5, где клетки млекопитающих подвергают воздействию одного или нескольких индуцирующих стресс условий до или во время культивирования.
[0101] 7. Способ в соответствии с вариантом осуществления 6, где индуцирующее стресс условие выбрано из группы, состоящей из облучения, в частности, ионизирующего излучения или облучения УФ, гипоксии, озона, нагревания, осмотического давления и сдвига pH.
[0102] 8. Способ в соответствии с вариантом осуществления 7, где клетки млекопитающих подвергают воздействию ионизирующего излучения в дозе по меньшей мере 10 Гр, предпочтительно, по меньшей мере 20 Гр, более предпочтительно, по меньшей мере 40 Гр.
[0103] 9. Способ в соответствии с любым из вариантов осуществления 1-8, где клетки млекопитающих культивируют в течение по меньшей мере 4 час, предпочтительно, в течение по меньшей мере 6 час, более предпочтительно, в течение по меньшей мере 12 час, до выделения их супернатанта.
[0104] 10. Способ в соответствии с любым из вариантов осуществления 1-9, где воспалительное состояние представляет собой состояние, ассоциированное с ишемией, предпочтительно, состояние кожи или внутреннее воспалительное состояние.
[0105] 11. Способ в соответствии с любым из вариантов осуществления 1-10, где эукариотические клетки со стадии a) выбраны из группы, состоящей из базальных эпителиальных клеток пораженных аденокарциномой альвеол человека, предпочтительно, клеток A549, анеуплоидных иммортализованных клеток кератиноцитов (HaCaT), клеток эмбриональной почки человека (клеток HEK), предпочтительно, клеток HEK293, и клеток нейробластомы, предпочтительно, клеток SH-SY5Y.
[0106] 12. Способ в соответствии с любым из вариантов осуществления 1-11, где эукариотические клетки со стадии a) инкубируют в среде для культивирования клеток в течение по меньшей мере 2 часов, предпочтительно, по меньшей мере 4 часов, более предпочтительно, по меньшей мере 6 часов, более предпочтительно, по меньшей мере 12 часов, более предпочтительно, по меньшей мере 18 часов, более предпочтительно по меньшей мере 24 часов.
[0107] 13. Способ в соответствии с любым из вариантов осуществления 1-12, где культуральная среда содержит по меньшей мере 20%, предпочтительно, по меньшей мере 50%, более предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%, более предпочтительно, по меньшей мере 90%, более предпочтительно, по меньшей мере 95%, указанного супернатанта.
[0108] 14. Способ в соответствии с любым из вариантов осуществления 1-13, где среда для культивирования клеток со стадии a) представляет собой среду Игла в модификации Дульбекко (DMEM), среду Хэма F12 (F12), минимальную эссенциальную среду или комбинацию одной или нескольких из этих сред.
[0109] 15. Способ в соответствии с любым из вариантов осуществления 1-14, где среда для культивирования клеток со стадии a) содержит 2-20%, предпочтительно, 5-15%, эмбриональной бычьей сыворотки (FBS) и/или L-аланил-L-глутамина
[0110] 16. Способ в соответствии с любым из вариантов осуществления 1-15, где эукариотические клетки содержат по меньшей мере одну экспрессирующую кассету, содержащую промотор, выбранный из группы, состоящей из промотора AP-1, промотора NF-κB, промотора Sox2, промотора STAT3, промотора EGR-1 и промотора SRE, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0111] 17. Способ в соответствии с вариантом осуществления 16, где репортерный белок выбран из группы, состоящей из люциферазы, предпочтительно, люциферазы светляка, и флуоресцентного белка, предпочтительно, зеленого флуоресцентного белка.
[0112] 18. Способ в соответствии с любым из вариантов осуществления 1-17, где количество белка, высвобожденного клетками в культуральную среду, определяют посредством иммунологического способа, предпочтительно, посредством твердофазного иммуноферментного анализа (ELISA), посредством фотометрического способа или посредством флуоресцентного способа.
[0113] 19. Способ в соответствии с любым из вариантов осуществления 1-18, где эукариотические клетки со стадии a) представляют собой базальные эпителиальные клетки пораженных аденокарциномой альвеол человека, предпочтительно, клетки A549, HaCaT или клетки HEK, предпочтительно, клетки HEK293, и определяют количество фосфорилированного HSP27.
[0114] 20. Способ в соответствии с любым из вариантов осуществления 1-19, где промоторная активность по меньшей мере одного промотора по меньшей мере на 80%, предпочтительно, по меньшей мере на 100%, более предпочтительно, по меньшей мере на 150%, более предпочтительно, по меньшей мере на 200% выше, по сравнению с промоторной активностью, измеренной, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта.
[0115] 21. Способ в соответствии с любым из вариантов осуществления 1-20, где эукариотические клетки со стадии a) представляют собой базальные эпителиальные клетки пораженных аденокарциномой альвеол человека, предпочтительно, клетки A549, клетки HaCaT или клетки HEK, предпочтительно, клетки HEK293, когда измеряют количество фосфорилированного HSP27, высвобожденного в культуральную среду.
[0116] 22. Способ в соответствии с любым из вариантов осуществления 1-21, где эукариотические клетки со стадии a) представляют собой клетки нейробластомы, предпочтительно, клетки SH-SY5Y, или клетки HaCaT, содержащие по меньшей мере одну экспрессирующую кассету, содержащую промотор AP-1, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0117] 23. Способ в соответствии с любым из вариантов осуществления 1-22, где эукариотические клетки со стадии a) представляют собой базальные эпителиальные клетки пораженных аденокарциномой альвеол человека, предпочтительно, клетки A549, содержащие по меньшей мере одну экспрессирующую кассету, содержащую промотор NF-κB или Sox2, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0118] 24. Способ в соответствии с любым из вариантов осуществления 1-23, где эукариотические клетки со стадии a) представляют собой клетки HEK, предпочтительно, клетки HEK293, содержащие по меньшей мере одну экспрессирующую кассету, содержащую промотор EGR-1, SRE, AP-1 или STAT3, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок.
[0119] ПРИМЕРЫ:
[0120] Пример 1: Получение Aposec
[0121] «Aposec» представляет собой супернатант культуры клеток млекопитающих, который можно получать посредством культивирования клеток млекопитающих, в частности, PBMC, с использованием индуцирующих стресс условий, подобных облучению, гипоксии и т.д., до или во время культивирования указанных клеток. Способы описаны выше, в WO 2010/079086 и в WO 2010/070105 и в частности, в Lichtenauer M et al (Basic Res Cardiol. 2011;106: 1283-1297).
[0122] Подробно, PBMC человека получали от молодых здоровых добровольцев. Клетки разделяли посредством градиента плотности фиколл-пак (GE Healthcare Bio-Sciences AB, Sweden), как описано в Ankersmit HJ et al. (Eur J Clin Invest. 2009;39:445-456). Апоптоз PBMC индуцировали посредством облучения цезием-137 при 60 Грей (Гр). Индукцию апоптоза измеряли посредством совместного окрашивания аннексином-V/иодидом пропидия (FITC/PI) (Becton-Dickinson, Franklin Lakes, NJ, USA) в проточном цитометре. Облученные и не обученные клетки ресуспендировали в бессывороточной среде UltraCulture (Lonza, Switzerland) или среде Cellgro GMP DC (CellGenix, Freiburg, Germany), и культивировали в течение 24 час при различной плотности клеток (1 × 106, 2,5 × 106 и 25 × 106 клеток/мл, n=5). Через 24 час супернатанты собирали, и они служили экспериментальными объектами для следующих экспериментов (см. ниже), или их лиофилизировали следующим образом: супернатанты подвергали диализу против ацетата аммония (в концентрации 50 мМ) в течение 24 час при 4°C. Полученную жидкость подвергали стерильной фильтрации (фильтр Whatman 0,2 мкм FP30/o,2 Ca-S, Germany), замораживали и лиофилизировали в течение ночи (в лиофилизаторе Christ alpha 1-4, Martin Christ Gefriertrocknungsanlagen GmbH, Germany).
[0123] Пример 2: Анализ пролиферации
[0124] Клетки HUVEC (эндотелиальные клетки пупочной вены человека), NHDF (нормальные фибробласты кожи человека) и A549 (эпителиоподобные клетки карциномы человека) рассевали при трех различных плотностях клеток в 96-луночные планшеты и обрабатывали Aposec (2,5 ед./мл), bFGF (20 нг/мл) и TNFa (4 нг/мл). В дополнение к количеству клеток и обработкам, клетки культивировали с различными процентами среды для роста. После инкубации в течение ночи в CO2-инкубаторе, количество клеток определяли с использованием люминесцентного анализа жизнеспособности клеток CellTiter-Glo (CellTiterGlo), представляющего собой гомогенный способ определения количества жизнеспособных клеток в культуре на основании количественной оценки присутствующего АТФ (он является показателем метаболически активных клеток) (см. Technical Bulletin, CellTiter-Glo Luminescent Cell Viability Assay, TB288, Revised 3/15).
[0125] Явно зависимое от плотности клеток количество клеток наблюдали при инкубации в течение ночи. Невозможно было наблюдать признаков индукции пролиферации посредством Aposec (см. фиг. 1).
[0126] Пример 3: Определение фосфорилированного HSP27
[0127] В этом примере исследовали, является ли Aposec способным индуцировать фосфорилирование Hsp27 in vitro.
[0128] В общем, различные антитела, специфические для Hsp27 человека, фосфо-Ser15-Hsp27 человека и фосфо-Ser82-Hsp27 человека, оценивали в клеточном ELISA с использованием различных линий клеток человека (клеток A549, HaCat и HEK293). Клеточный ELISA был основан на следующем принципе: клетки выращивали в 96-луночных планшетах и в конце периода обработки/стимуляции, клетки фиксировали и пермеабилизовывали. Фосфорилирование можно было количественно оценивать посредством последовательного добавления антитела, детектирующего фосфорилированный Hsp27 (например, фосфо-Hsp27(Ser82)), затем конъюгированного с пероксидазой антитела против IgG кролика (антитела для детекции) и хемилюминесцентного субстрата пероксидазы.
[0129] В таблице ниже перечислены оцененные антитела, специфические для Hsp27 человека:
поликлональные
Invitrogen
[0130] 3.1 Анализ 1 ELISA клеточного Hsp27
[0131] Клетки A549, HEK293 и HaCaT обрабатывали в течение 2 часов с использованием комбинации сульфорафана (20 мкМ) и тапсигаргина (1 мкМ) для индукции фосфорилирования Hsp27 и с использованием ингибитора MAPK SB203580 (20 мкМ). Фиксированные, пермеабилизованные и блокированные клетки инкубировали в течение ночи при 4°C с различными концентрациями антител.
[0132] Зависимые от обработки и концентрации антитела сигналы выражают относительно клеток после ложной инкубации, которые инкубировали с такой же концентрацией антитела (см. фиг. 2).
[0133] Для антитела против фосфо-Ser82-Hsp27 показан ожидаемый паттерн в клетках A549 и HaCaT. Совместная обработка с использованием сульфорафана/тапсигаргина приводит к ожидаемому увеличению сигнала фосфо-Ser82-Hsp27, в то время как ингибитор MAPK уменьшает сигнал: MAPK стоит выше Hsp27. В клетках A549, более высокие разведения антитела (меньшее количество антитела) приводят к более высокой относительной индукции, наиболее вероятно, из-за уменьшения неспецифического сигнала.
[0134] 3.2 Анализ 2 ELISA клеточного Hsp27
[0135] Клетки A549, HEK293, HaCat и SHSY5Y обрабатывали в течение 2 часов с использованием различных концентраций Aposec, сульфорафана и тапсигаргина, в отсутствие или в присутствии ингибитора MAPK SB203580. Фиксированные, пермеабилизованные и блокированные клетки инкубировали в течение ночи при 4°C с двумя различными концентрациями антитела против фосфо-Ser15-Hsp27 (1:3200 и 1:6400) и фосфо-Ser82-Hsp27 (1:800 и 1:1600).
[0136] Сравнение двух тестированных концентраций антитела выявило для обоих антител, что более высокое разведение приводит к лучшему соотношению сигнал-шум. В клетках A549, наблюдали зависимую от дозы индукцию фосфо-Ser15-Hsp27 и фосфо-Ser82-Hsp27. Индукцию фосфо-Ser15-Hsp27, но не индукцию фосфо-Ser82-Hsp27, предотвращали посредством ингибитора MAPK SB203580 в клетках A549. В трех других тестированных линиях клеток (HEK293, HaCat и SH-SY5Y), фосфо-Ser15-Hsp27 был индуцирован посредством Aposec (см. фиг. 3).
[0137] 3.3 Анализ 3 ELISA клеточного Hsp27
[0138] В этой части примера 3 исследуют, является ли наблюдаемая до настоящего времени индукция фосфо-Ser15-Hsp27 и фосфо-Ser82-Hsp27 после обработки Aposec специфической для Aposec.
[0139] Клетки A549 обрабатывали в течение 1 час с использованием различных концентраций Aposec и CellGro. Использованные лиофилизаты разводили с использованием либо 0,9% NaCl, либо H2O, для оценки эффекта концентрации NaCl в Aposec и CellGro. Фиксированные, пермеабилизованные и блокированные клетки инкубировали в течение ночи при 4°C с одной концентрацией антитела против фосфо-Ser82-Hsp27. Помимо сравнения Aposec против CellGro и 0,9% NaCl или H2O, кроме того, оценивали обработку в течение 15, 30 или 60 минут для Aposec и CellGro (разведенных в H2O).
[0140] Сравнение индукции фосфо-Ser82-Hsp27 посредством Aposec и CellGro, разведенных либо в H2O, либо в 0,9% NaCl, показывает, что CellGro, разведенный в H2O, не индуцирует фосфо-Ser82-Hsp27, и что CellGro, разведенный с использованием 0,9% NaCl, индуцирует намного меньше фосфо-Ser82-Hsp27, по сравнению с Aposec, разведенным с использованием 0,9% NaCl. Кинетика показывает, что стимуляция в течение 15 и 30 минут с использованием Aposec приводит к сравнимой индукции (5-кратной), в то время как индукция является приблизительно 4-кратной при стимуляции в течение 1 час (см. фиг. 4).
[0141] 3.4 Анализ ELISA клеточного Hsp27 -диапазон анализа
[0142] В этой части примера 3 исследовали, какой диапазон анализа для Aposec можно оценивать количественно с использованием анализа фосфо-Ser82-Hsp27.
[0143] Образцы 25%, 50% и 200% Aposec, и 100% CellGro использовали для обработки клеток A549, и данные анализировали в PLA с использованием 4PL модели сплошной кривой.
[0144] Подобранные по PLA кривые показаны на фиг. 5, и полученные значения относительной активности записаны ниже графиков.
[0145] Анализ позволяет количественную оценку значений относительной активности Aposec от 25% до 200%. Относительная активность CellGro лежит в диапазоне 20%. Эта активность CellGro отражает неспецифический эффект, вызванный разведением лиофилизата с использованием 0,9% NaCl.
[0146] Пример 4: Анализ репортерного гена AP-1
[0147] В этом примере исследуют вопрос, индуцирует ли Aposec
промотор AP-1 in vitro.
[0148] Клетки для анализа репортерного гена (RGA) AP-1 (Brasier AR, et al. Methods Enzymol. 1992; 216:386-97) получали с использованием лентивирусных частиц (QIAGEN, No. для заказа CLS-011L), экспрессирующих отвечающий на фактор транскрипции AP-1 (активирующий белок 1) - репортерный ген (люциферазы светляка) (QIAGEN, Cignal Lenti Reporter Handbook For lentiviral-based cell signaling activity assays, Document No. 1073762;08/2012). Клетки для RGA AP-1 стимулируют с использованием различных количеств Aposec. Если Aposec стимулирует промотор AP-1, люцифераза светляка экспрессируется. В конце периода стимуляции с использованием APOSEC, клетки лизируют, и активность люциферазы определяют с использованием реагента для люциферазы типа затухающего свечения.
[0149] 4.1 Анализ 1 RGA AP-1
[0150] В этой части примера 4 исследуют, является ли Aposec способным стимулировать промотор AP-1 в различных линиях клеток.
[0151] Три различных линии клеток, стабильно трансформированные репортерной конструкцией с промотором AP-1, стимулировали с использованием различных разведений Aposec в течение 5 или 24 часов.
[0152] Сигнал репортера AP-1 выражают относительно специфического для линии клеток фонового сигнала (кратность индукции). Зависимую от дозы стимуляцию AP-1 можно наблюдать через 25 часов в клетках Ha-Cat, Jurkat и SH-SY5Y. Через 5 часов, выраженную индукцию AP-1 можно наблюдать только в клетках SH-SY5Y (см. фиг. 6).
[0153] 4.2 Анализ 2 RGA AP-1
[0154] В этой части примера 4 исследуют, можно ли использовать период стимуляции с использованием Aposec в течение ночи или например, в течение 4 часов в анализе активности, и какой диапазон доз Aposec следует использовать.
[0155] Клетки SH-SY5Y для RGA AP-1 обрабатывали либо в течение ночи, либо в течение 4 часов, с использованием широкого диапазона доз Aposec. Диапазон доз из 12 различных разведений, лежащих в диапазоне от 1:2 до 1:47,5, тестировали при стимуляции в течение 4 часов и в течение ночи.
[0156] Сигнал репортера AP-1 (необработанные данные=импульсы люминесценции) показаны на фиг. 7, с логарифмической осью x. Для стимуляции в течение 4 часов показан предпочтительный паттерн зависимости ответа от дозы с подобной плато ситуацией для наивысших концентраций Aposec, почти линейным паттерном для промежуточных концентраций Aposec. Зависимую от CellGro индукцию невозможно было наблюдать в обеих временных точках.
[0157] 4.3 Анализ 3 RGA AP-1
[0158] В этой части примера 4 исследовали, какой диапазон анализа для Aposec можно количественно оценивать с использованием анализа RGA AP-1.
[0159] Образцы 25%, 50% и 200% Aposec, и 100% CellGro использовали для обработки клеток SH-SY5Y с AP-1 в течение 4 часов, и данные анализировали в PLA с использованием 4PL модели сплошной кривой.
[0160] Подобранные по PLA кривые показаны на фиг. 8, и полученные значения относительной активности записаны ниже графиков.
[0161] Анализ позволяет количественную оценку значений относительной активности Aposec от 25% до 200%. Относительная активность CellGro лежит в диапазоне 20%. Эта активность CellGro отражает неспецифический эффект, вызванный разведением лиофилизата с использованием 0,9% NaCl (см. фиг. 8).
[0162] Пример 5: Анализ репортерного гена NF-κB
[0163] В этом примере оценивают, индуцирует ли Aposec промотор NF-κB (т.е. NF-κB; ядерного фактора энхансера гена легкой цепи каппа в активированных В-клетках) in vitro.
[0164] Клетки для RGA NF-κB получали с использованием лентивирусных частиц (QIAGEN, No. для заказа CLS-013L), как описано выше для RGA AP-1 в клетках. Клетки для RGA NF-κB стимулируют с использованием различных количеств Aposec. Если Aposec стимулирует промотор NF-κB, люцифераза светляка экспрессируется со стабильно интегрированной экспрессирующей кассеты, кодирующей люциферазу светляка под контролем транскрипции посредством зависимого от NF-κB (ядерного фактора энхансера гена легкой цепи каппа в активированных В-клетках) промотора. В конце периода стимуляции с использованием APOSEC, клетки лизируют, и активность люциферазы определяют с использованием реагента для люциферазы типа затухающего свечения.
[0165] 5.1 Анализ 1 RGA NF-κB
[0166] В этой части примера 5 оценивают, имеют ли клетки A549 для RGA NF-κB способность отвечать зависимым от дозы образом на стимуляцию Aposec.
[0167] Клетки A549 для RGA NF-κB стимулировали в течение 4 час с использованием различных разведений Aposec и CellGro (оба разведенные в NaCl), перед считыванием сигнала RGA NF-κB.
[0168] Сигнал репортера NF-κB выражают относительно специфического для клона клеток фонового сигнала (кратность индукции). Зависимую от дозы стимуляцию NF-κB можно наблюдать через 4 час стимуляции, в то время как зависимую от CellGro индукцию невозможно было наблюдать (см. фиг. 9).
[0169] 5.2 Анализ 2 RGA NF-κB
[0170] В этой части примера 5 определяют диапазон анализа для Aposec с использованием анализа RGA NF-κB.
[0171] Образцы 25%, 50% и 200% Aposec, и 100% CellGro использовали для обработки клеток A549 с NF-κB в течение 4 часов, и данные анализировали в PLA с использованием 4PL модели сплошной кривой.
[0172] Подобранные по PLA кривые показаны ниже, и полученные значения относительной активности записаны на фиг. 10).
[0173] Пример 6: Анализ репортерного гена APOSEC NFkB
[0174] Активность APOSEC можно определять посредством его способности активировать промотор NF-κB в клетках A549 (базальных эпителиальных клеток пораженных аденокарциномой альвеол человека). Подробно, стимуляция клеток A549 для RGA NF-κB с использованием предопределенных количеств APOSEC приводит к экспрессии люциферазы светляка со стабильно интегрированной экспрессирующей кассеты, кодирующей люциферазу светляка под контролем транскрипции зависимого от NF-κB («ядерного фактора энхансера гена легкой цепи») промотора.
[0175] Клетки культивировали в DMEM/F12+Glutamax+10% FBS+пуромицин. 20000 клеток на лунку рассевали в 50 мкл среды для стимуляции (OptiMEM+Glutamax+5% FBS) в каждую лунку планшета для анализа. Планшет для анализа инкубировали в течение ночи в увлажненном CO2-инкубаторе при 37°C. различные концентрации рабочего стандарта APOSEC (R) и тестируемых образцов (A, B, C и D) подготавливали в планшете для разведения в среде для анализа. Подробно, образцы предварительно разводили до 12,5 ед./мл с использованием среды для стимуляции: например, добавляли 500 мкл образца (25 ед./мл) к 500 мкл среды для стимуляции. После переноса 50 мкл APOSEC из планшета для разведения в планшет для анализа, конечные концентрации в анализе составляли: 6,25 (#1), 4,17 (#2), 2,78 (#3) и 1,85 (#4) ед./мл. Через 4 час стимуляции с использованием APOSEC, клетки лизировали, и активность люциферазы определяли с использованием реагента для люциферазы типа затухающего свечения.
[0176] Функциональную активность тестируемых образцов APOSEC определяли посредством сравнения с определенной партией APOSEC, используемой в качестве эталонного материала, анализированного в таком же анализе. Тестируемые образцы нормализовали на основании количества PMBC, использованного для получения APOSEC. Затем относительную активность рассчитывали с использованием программного обеспечения PLA.
[0177] Пример 7: Массив репортеров передачи сигналов
[0178] В этом примере оценивали, действительно ли Aposec специфически индуцирует конкретные пути передачи сигналов.
[0179] Массив «Cignal 45-Pathway Reporter Array» (Qiagen, no. для заказа CCA-901L) использовали для идентификации путей передачи сигналов, специфически индуцируемых после стимуляции Aposec. Массив репортеров передачи сигналов позволяет параллельный анализ 45 различных конструкций репортерных генов после временной трансфекции выбранной линии клеток.
[0180] 7.1 Тест 1 и 2 эффективности трансфекции
[0181] Клетки A549, HEK293 и HaCaT трансфицировали с использованием контрольного вектора с люциферазой (положительный контроль Cignal (luc), QIAGEN, No. для заказа 336881), сравнимого с векторами с люциферазой, присутствующими в массиве репортеров, вместе с 2 различными реагентами для трансфекции (Attractene (QIAGEN, No. для заказа 301005) и Fugene HD (PROMEGA Order No. E2311)). Различные соотношения ДНК:реагент для трансфекции оценивали при 2 различных количествах клеток на линию клеток (20000 и 80000 клеток/лунку).
[0182] Для эффективности и надежности трансфекции показаны хорошие результаты для Fugene HD, которые были немного выше, по сравнению с Attractene (в общем выше импульсов люминесценции для Fugene). Количество импульсов люминесценции для клеток HaCaT было ниже, по сравнению с клетками HEK293 и A549. Известно, что клетки HaCaT трудно трансфицировать (см. фиг. 11).
[0183] Второй тест эффективности трансфекции проводили только для клеток HEK293 и A549. Снова использовали реагенты Fugene HD и Attractene. Помимо эффективности трансфекции (импульсов для люциферазы светляка и renilla), жизнеспособность клеток анализировали с использованием CellTiterGlo, для исключения отрицательного эффекта на жизнеспособность клеток из-за трансфекции. Первоначальные результаты, применительно к эффективности трансфекции, можно было воспроизвести, и невозможно было наблюдать очевидного эффекта на жизнеспособность клеток. На основании этих результатов, Fugene HD с соотношением «Fugene к ДНК» 3,375 выбрали для использования в будущих экспериментах с массивом репортеров.
[0184] 7.2 Массив репортеров передачи сигналов - анализ 1
[0185] В этой части примера 7 исследовали, какие пути передачи сигналов (конструкций репортерных генов) специфически активируются после стимуляции Aposec в течение ночи в клетках A549 и HEK293.
[0186] Вышеописанный массив «Cignal 45-Pathway Reporter Array» использовали в клетках HEK293 и A549 при 20000 клеток/лунку, с Fugene HD и стимуляцией в течение ночи. Клетки стимулировали с использованием Aposec (при разведении 1:4 или 6,25 ед./мл). CellGro (при разведении 1:4 или 6,25 ед./мл) использовали в качестве контрольной стимуляции. Оба использованных Aposec и CellGro разводили в 0,9% NaCl.
[0187] Активность репортерных генов нормализовали по контролю CellGro, и количество импульсов люминесценции нормализовали по эффективности трансфекции (импульсов для люциферазы светляка/renilla). Некоторые репортерные гены/пути подвергались значимой повышающей регуляции (например, Stat3, Sox2, NF-κB, XRE), другие - значимой понижающей регуляции (например, RARE, ERE, MEF2) (см. фиг. 12).
[0188] 7.3 Массив репортеров передачи сигналов - анализ 2
[0189] В этой части примера 7 исследовали, какие пути передачи сигналов (конструкций репортерных генов) специфически активируются после стимуляции Aposec в течение 4 часов в клетках A549 и HEK293.
[0190] Вышеописанный анализ (см. 7.2), в котором клетки стимулировали в течение ночи, повторяли с использованием стимуляции Aposec в течение 4 часов.
[0191] Активность репортерных генов нормализовали по контролю CellGro, и количество импульсов люминесценции нормализовали по эффективности трансфекции (импульсов для люциферазы светляка/renilla). Некоторые репортерные гены/пути подвергались значимой повышающей регуляции, другие - значимой понижающей регуляции.
[0192] Результаты вышеописанных анализов репортерных генов, по-видимому, являются надежными, поскольку стандартные отклонения являются довольно низкими, и большинство генов не подвергаются повышающей или понижающей регуляции. Кроме того, некоторые из подвергавшихся повышающей или понижающей регуляции репортерных генов/путей обнаружены в более, чем одном анализе, например, NF-κB, AP-1, STAT3 и Sox-2.
[0193] Пример 8: Модель ожога на свиньях
[0194] Для оценки того, оказывает ли секретом культур PBMC терапевтический эффект, сравнимый со стандартным препаратом APOSEC, в соответствии с примером 1, терапевтическую эффективность которого уже тестировали, получали четыре различных препарата супернатанта PBMC, следуя протоколу из примера 1. PBMC, использованные для получения указанных четырех супернатантов (A, B, C и D) выделяли от четырех различных индивидуумов. В качестве терапевтической модели, использовали модель ожога на свиньях, которая подробно описана в Hacker S et al. (Sci Rep 6(2016):25168).
[0195] На первой стадии, эксперименты, описанные в примерах 3.3, 4.2 и 5.1, повторяли с вышеупомянутым стандартным препаратом APOSEC и четырьмя супернатантами A, B, C и D. Количество фосфоSer15-Hsp27 измеряли после инкубации в течение 60 мин, и сигнал репортерной активности AP-1 и NF-κB определяли через 4 часа. Оказалось, что для супернатантов A и D показана изменчивость, применительно к уровням фосфо-Ser15-Hsp27 и AP-1, и активности NF-κB, по сравнению с APOSEC, менее 5%. Результаты для супернатантов B и C были приблизительно на 35% и 50%, соответственно, ниже, применительно к уровням фосфо-Ser15-Hsp27 и AP-1 и активности NF-κB, по сравнению с APOSEC.
[0196] Все четыре супернатанта A, B, C и D, так же как APOSEC, объединяли с гидрогелем для формирования композиции, которую можно наносить на рану. Способ получения этих препаратов описан в Hacker S et al. Раны на коже свиньи также получали, как описано в Hacker S et al. В отличие от Hacker S et al., в настоящем примере оценивали только среднюю толщину эпидермиса в ранах, подвергнутых лечению с использованием APOSEC и четырех супернатантов. Оказалось, что для APOSEC и супернатантов A и D показана сравнимая средняя толщина эпидермиса (125,1±23,8 мкм). В отличие от этого, нанесение препаратов, содержащих супернатанты B и C, приводило к толщине эпидермиса 97,6±23,8 мкм и 92,6±18,6 мкм, соответственно, что было немного выше, по сравнению с препаратом, содержащим только среду CellGro (88,3±14,2 мкм).
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ АЛЛЕРГИИ ИЛИ АЛЛЕРГИЧЕСКОЙ РЕАКЦИИ | 2020 |
|
RU2827897C1 |
| ЛЕЧЕНИЕ РУБЦОВ НА КОЖЕ | 2022 |
|
RU2832135C2 |
| Индуцибельный промотор, вектор и клетка-хозяин на его основе | 2021 |
|
RU2820059C2 |
| ЛИНИЯ КЛЕТОК PIGAS, СОДЕРЖАЩАЯ СТАБИЛЬНО ИНТЕГРИРОВАННЫЙ В ГЕНОМ САЙТ СВЯЗЫВАНИЯ ТРАНСКРИПЦИОННОГО ФАКТОРА STAT-1 | 2015 |
|
RU2619643C1 |
| ТЕСТ-СИСТЕМА ДЛЯ АНАЛИЗА ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ АНТИТЕЛ ПРОТИВ PD-1 И АНТИТЕЛ ПРОТИВ PD-L1 | 2019 |
|
RU2731896C1 |
| НОВЫЕ ЭУКАРИОТИЧЕСКИЕ КЛЕТКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ ДЛЯ РЕКОМБИНАНТНОЙ ЭКСПРЕССИИ ПРЕДСТАВЛЯЮЩЕГО ИНТЕРЕС ПРОДУКТА | 2014 |
|
RU2712507C2 |
| КОМПОЗИЦИИ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ КАЛЬЦИНОЗА КЛАПАНА, СОДЕРЖАЩИЕ DPP-4 ИНГИБИТОР | 2015 |
|
RU2680527C1 |
| ЭУКАРИОТИЧЕСКИЕ ЭКСПРЕССИОННЫЕ ВЕКТОРЫ, СОДЕРЖАЩИЕ РЕГУЛЯТОРНЫЕ ЭЛЕМЕНТЫ КЛАСТЕРОВ ГЕНА ГЛОБИНА | 2016 |
|
RU2716974C2 |
| МОДИФИЦИРОВАННЫЕ ОНКОЛИТИЧЕСКИЕ АДЕНОВИРУСЫ | 2019 |
|
RU2788638C2 |
| УЛУЧШЕННЫЙ ВЕКТОР, ЭКСПРЕССИРУЮЩИЙ TOLL-ПОДОБНЫЙ РЕЦЕПТОР И АГОНИСТ, И ПРИМЕНЕНИЕ В ТЕРАПИИ РАКА | 2014 |
|
RU2682762C2 |
Настоящее изобретение относится к клеточной биологии и медицине, в частности к способам определения активности супернатанта культуры клеток млекопитающих для использования в лечении воспалительного состояния. Для осуществления указанных способов сначала инкубируют клетки SH-SY5Y, содержащие экспрессионную кассету, содержащую промотор активирующего белка 1 (AP-1), функционально связанный с молекулой нуклеиновой кислоты, кодирующей репортерный белок, в культуральной среде, содержащей или состоящей из указанного супернатанта, и измеряют промоторную активность промотора AP-1. Затем инкубируют клетки A549, содержащие экспрессионную кассету, содержащую промотор NF-kB, функционально связанный с молекулой нуклеиновой кислоты, кодирующей репортерный белок, в культуральной среде, содержащей или состоящей из указанного супернатанта, и измеряют промоторную активность промотора NF-kB. Далее инкубируют клетки A549, HEK293, Ha-Cat и/или SH-SY5Y в культуральной среде, содержащей или состоящей из указанного супернатанта, и измеряют количество фосфорилированного белка теплового шока 27 (HSP27), высвобожденного эукариотическими клетками в культуральную среду. При этом вывод о том, что супернатант культуры клеток млекопитающих имеет потенциал для применения в лечении воспалительного состояния, делают в том случае, если промоторная активность по меньшей мере одного из промоторов AP-1 и NF-kB по меньшей мере на 50% выше по сравнению с промоторной активностью промоторов AP-1 и NF-kB, измеренной, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта, и если количество HSP27, высвобожденное в культуральную среду, по меньшей мере на 20% выше по сравнению с количеством фосфорилированного HSP27, высвобожденным в культуральную среду, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта. Настоящее изобретение позволяет расширить арсенал способов анализа активности для измерения биологической активности и терапевтической эффективности кондиционированных культуральных сред посредством мониторирования экспрессии специфических белков и/или регуляции конкретных промоторов. 2 н. и 8 з.п. ф-лы, 13 ил., 1 табл., 8 пр.
1. Способ определения активности супернатанта культуры клеток млекопитающих для применения в лечении воспалительного состояния, включающий стадии
a) инкубации клеток SH-SY5Y, содержащих по меньшей мере одну экспрессионную кассету, содержащую промотор активирующего белка 1 (AP-1), функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок, в культуральной среде, содержащей или состоящей из указанного супернатанта, и измерения промоторной активности промотора AP-1,
b) инкубации клеток A549, содержащих по меньшей мере одну экспрессионную кассету, содержащую промотор NF-kB, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок, в культуральной среде, содержащей или состоящей из указанного супернатанта, и измерения промоторной активности промотора NF-kB, и
c) инкубации клеток A549, HEK293, Ha-Cat и/или SH-SY5Y в культуральной среде, содержащей или состоящей из указанного супернатанта, и измерения количества фосфорилированного белка теплового шока 27 (HSP27), высвобожденного эукариотическими клетками в культуральную среду,
где супернатант культуры клеток млекопитающих имеет потенциал для применения в лечении воспалительного состояния, если промоторная активность по меньшей мере одного из промоторов AP-1 и NF-kB по меньшей мере на 50% выше по сравнению с промоторной активностью промоторов AP-1 и NF-kB, измеренной, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта, и если количество фосфорилированного белка теплового шока 27 (HSP27), высвобожденное в культуральную среду на стадии a), по меньшей мере на 20% выше по сравнению с количеством фосфорилированного HSP27, высвобожденным в культуральную среду, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта.
2. Способ определения активности супернатанта культуры клеток млекопитающих для применения в лечении воспалительного состояния, включающий стадии
a) инкубации клеток SH-SY5Y, содержащих по меньшей мере одну экспрессионную кассету, содержащую промотор активирующего белка 1 (AP-1), функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок, в культуральной среде, содержащей или состоящей из указанного супернатанта, и измерения промоторной активности промотора AP-1,
b) инкубации клеток A549, содержащих по меньшей мере одну экспрессионную кассету, содержащую промотор NF-kB, функционально связанный по меньшей мере с одной молекулой нуклеиновой кислоты, кодирующей репортерный белок, в культуральной среде, содержащей или состоящей из указанного супернатанта, и измерения промоторной активности промотора NF-kB, и
c) инкубации клеток A549, HEK293, Ha-Cat и/или SH-SY5Y в культуральной среде, содержащей или состоящей из указанного супернатанта, и измерения количества фосфорилированного белка теплового шока 27 (HSP27), высвобожденного эукариотическими клетками в культуральную среду,
где супернатант культуры клеток млекопитающих имеет потенциал для применения в лечении воспалительного состояния, если промоторная активность по меньшей мере одного из промоторов AP-1 и NF-kB на вплоть до 10% выше или ниже по сравнению с промоторной активностью промоторов AP-1 и NF-kB, измеренной, когда эукариотические клетки культивируют в культуральной среде, содержащей эталонный супернатант клеток млекопитающих, который можно применять в лечении воспалительного состояния, и если количество фосфорилированного белка теплового шока 27 (HSP27), высвобожденное в культуральную среду на стадии a), по меньшей мере на 25% выше или ниже по сравнению с количеством фосфорилированного HSP27, высвобожденным в культуральную среду на стадии а), содержащей эталонный супернатант клеток млекопитающих, который можно применять в лечении воспалительного состояния.
3. Способ по любому из пп. 1, 2, где супернатант культуры клеток млекопитающих представляет собой супернатант культуры мононуклеарных клеток периферической крови (PBMC).
4. Способ по любому из пп. 1-3, где воспалительное состояние представляет собой состояние, выбранное из группы, состоящей из состояния, ассоциированного с ишемией, состояния кожи или внутреннего воспалительного состояния.
5. Способ по любому из пп. 1-4, где эукариотические клетки со стадии a) инкубируют в среде для культивирования клеток в течение времени, выбранного из группы, состоящей из по меньшей мере 2 часов, по меньшей мере 4 часов, по меньшей мере 6 часов, по меньшей мере 12 часов, по меньшей мере 18 часов, по меньшей мере 24 часов.
6. Способ по любому из пп. 1-5, где культуральная среда содержит указанный супернатант в количестве, выбранном из группы, состоящей из по меньшей мере 20%, по меньшей мере 50%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%.
7. Способ по любому из пп. 1-6, где среда для культивирования клеток со стадии a) представляет собой среду Игла в модификации Дульбекко (DMEM), среду Хэма F12 (F12), минимальную эссенциальную среду или комбинацию одной или нескольких из этих сред.
8. Способ по любому из пп. 1-7, где среда для культивирования клеток со стадии a) содержит эмбриональную бычью сыворотку (FBS) и/или L-аланил-L-глутамин в количестве, выбранном из группы, состоящей из 2-20% или 5-15%.
9. Способ по любому из пп. 1-8, где репортерный белок выбран из группы, состоящей из люциферазы, люциферазы светляка и флуоресцентного белка, зеленого флуоресцентного белка.
10. Способ по любому из пп. 1-9, где активность промоторов AP-1 и NF-kB по меньшей мере на 80%, по меньшей мере на 100%, по меньшей мере на 150%, по меньшей мере на 200% выше по сравнению с активностью промоторов AP-1 и NF-kB, измеренной, когда эукариотические клетки культивируют в культуральной среде, не содержащей указанного супернатанта.
| US 2016256444 A1, 08.09.2016 | |||
| LICHTENAUER M., et al., Secretome of apoptotic peripheral blood cells (APOSEC) confers cytoprotection to cardiomyocytes and inhibits tissue remodelling after acute myocardial infarction: a preclinical study, Basic Res Cardiol., 2011, 106(6), pp | |||
| Телефонный коммутатор без переговорно-вызывных ключей | 1924 |
|
SU1283A1 |
| US 2015352092 A1, 10.12.2015 | |||
Авторы
Даты
2023-02-27—Публикация
2018-12-19—Подача